Это изобретение выполнено при поддержке правительства США по HR0011-12-C-0007, выданному в Defense Advanced Research Projects Agency. Правительство США обладает определенными правами на это изобретение.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам или наборам для очистки нуклеиновых кислот с использованием одного буферного раствора для промывания и элюирования и более конкретно к миниатюризированной ситуации. Настоящее изобретение дополнительно относится к использованию буферного раствора, имеющего низкую концентрацию соли и относительно высокий pH, для очистки нуклеиновых кислот.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Нуклеиновые кислоты играют важную роль во многих различных областях исследований. В промышленной ситуации нуклеиновые кислоты можно обнаруживать при контроле качества продукции и в клинической ситуации нуклеиновые кислоты можно использовать для диагностики и/или терапии. Перед их использованием во многих из указанных выше применений, нуклеиновые кислоты требуют очистки.
Очистка нуклеиновых кислот обычно включает несколько стадий, таких как экспонирование образца, содержащего нуклеиновые кислоты, и избирательное связывание нуклеиновых кислот со связывающей нуклеиновые кислоты фазой, очистка связанных нуклеиновых кислот от примесей и получение очищенных нуклеиновых кислот. Различные буферы широко используют во время стадий получения образца, связывания нуклеиновых кислот, промывания и элюирования.
В наиболее широко используемых способах очистки связывания/промывания и последующего элюирования нуклеиновых кислот достигают на основании изменения pH или на основании изменения концентраций солей с использованием различных буферов.
Например, технология Qiagen's ChargeSwitch® основана на связывании и промывании отрицательно заряженных нуклеиновых кислот на связывающей нуклеиновые кислоты фазе, которую заряжают положительно, когда погружают в буферный раствор с pH < 6,5. Для элюирования нуклеиновых кислот используют буферный раствор с pH 8,5, что ведет к увеличению pH и нейтрализации положительного заряда связывающей нуклеиновые кислоты фазы, что, таким образом, ведет к высвобождению связанных нуклеиновых кислот.
Другой широко используемый способ, который разработан Boom et al. (EP 0 389 063), основан на лизисе и связывании нуклеиновых кислот со связывающей нуклеиновые кислоты фазой, например, диатомовыми глинами, стеклом или диоксидом кремния в присутствии высоких концентраций хаотропной соли, например, тиоцианата гуанидиния, что позволяет положительно заряженным ионам формировать солевые мостики между отрицательно заряженными нуклеиновыми кислотами и отрицательно заряженной связывающей фазой. Связанные нуклеиновые кислоты изначально промывают в присутствии высокосолевых буферных растворов, затем в водно-спиртовых растворах и элюируют посредством перехода на низкосолевой неспиртовой буферный раствор, такой как TE буфер.
Как изложено выше, существующие способы очистки нуклеиновых кислот включают несколько стадий промывания, после чего следует стадия элюирования с использованием нескольких буферов, которые отличаются различными концентрациям солей и/или различными pH, что делает эти способы дорогостоящими и требующими времени.
Кроме того, остатки буферных растворов для связывания и промывания иногда трудно удалять во время конечной стадии элюирования, и впоследствии они могут препятствовать последующих процедур, таких как ПЦР анализ или реакции секвенирования.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, существует потребность в усовершенствованных средствах и способах для простой, быстрой, низкозатратной и эффективной очистки нуклеиновых кислот.
Существующие способы очистки нуклеиновых кислот являются трудоемкими и требующими времени, поскольку они включают несколько стадий промывания, часто с использованием различных буферов для промывания, после чего следует конечная стадия элюирования связанных нуклеиновых кислот с использованием буфера для элюирования.
Настоящее изобретение решает эту проблему посредством предоставления способа очистки нуклеиновых кислот, включающего стадии
(i) экспонирования образца, содержащего нуклеиновые кислоты, для связывающей нуклеиновые кислоты фазы и предоставления возможности связывания нуклеиновых кислот со связывающей нуклеиновые кислоты фазой,
(ii) промывания нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой, по меньшей мере один раз буферным раствором, содержащим буферное средство,
(iii) элюирования нуклеиновых кислот из связывающей нуклеиновые кислоты фазы с использованием буферного раствора со стадии (ii).
Цель настоящего изобретения состоит в том, чтобы добиться упрощенной и быстрой очистки нуклеиновых кислот в высоких количествах. В частности, эти высокие количества в целом усовершенствуют существующие способы очистки нуклеиновых кислот, которые в целом разработаны для осуществления в больших объемах (объемы элюирования ≥50 мкл), что может быть недостатком для определенных применений.
В соответствии с настоящим изобретением, этого можно достичь посредством способа с использованием одного буферного раствора для промывания нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой, и затем элюирования этих нуклеиновых кислот из связывающей нуклеиновые кислоты фазы.
Преимущество способа в соответствии с настоящим изобретением состоит в том, что только один буфер нужно предоставлять для того, чтобы осуществлять способ, в противоположность различным буферам для промывания и для элюирования образца, как описано в известном уровне техники. В противоположность известному уровню техники, в свою очередь, это ведет к более упрощенному и, таким образом, более экономичному и более воспроизводимому способу.
В соответствии с настоящим изобретением, этого также можно достичь с использованием одного буферного раствора для промывания и элюирования нуклеиновых кислот, который отличается относительно низкой концентрацией соли ≤100 мМ и относительно высоким pH ≥7,5.
Преимущество одного буфера в соответствии с настоящим изобретением состоит в том, что возможно достигать высокой эффективности элюирования с использованием очень малых объемов указанного буфера; кроме того, используя всего один буфер, можно достигать более быстрой обработки нуклеиновых кислот, что особенно благоприятно в миниатюризированном окружении.
В одном из вариантов осуществления на стадии (ii) нуклеиновые кислоты, связанные со связывающей нуклеиновые кислоты фазой, промывают по меньшей мере один раз, предпочтительно два раза буферным раствором.
В одном из вариантов осуществления нуклеиновые кислоты представляют собой ДНК или РНК, предпочтительно вирусную ДНК или вирусную РНК.
Кроме того, в одном из вариантов осуществления образец содержит эукариотические клетки, предпочтительно клетки человека, более предпочтительно эпителиальные клетки.
В одном из вариантов осуществления образец дополнительно содержит бактерии и/или вирусы.
В соответствии с настоящим изобретением, этой упрощенной и быстрой очистки нуклеиновых кислот дополнительно можно достичь с помощью набора, содержащего
- связывающую нуклеиновые кислоты фазу,
- буферный раствор, содержащий буферное средство для промывания
- ≤50 мкл буферного раствора для элюирования нуклеиновых кислот, где буферный раствор для промывания и для элюирования представляет собой один и тот же раствор,
- средство обнаружения очищенных нуклеиновых кислот.
В одном из вариантов осуществления набор для очистки нуклеиновых кислот содержит окружение в формате миниатюризованной лаборатории на чипе.
В одном из вариантов осуществления набор адаптируют для использования в качестве диагностического теста, предпочтительно для использования в качестве ручного интегрированного теста для молекулярной диагностики.
В соответствии с настоящим изобретением, этой упрощенной и быстрой очистки нуклеиновых кислот дополнительно можно достичь с помощью картриджа, содержащего
- первую камеру, содержащую связывающую нуклеиновые кислоты фазу,
- вторую камеру, соединенную с первой камерой, которая содержит буферный раствор, содержащий буферное средство для промывания, и содержит ≤50 мкл того же буферного раствора для элюирования нуклеиновых кислот,
- третью камеру, соединенную со второй камерой, которая содержит буферный раствор, содержащую буферный раствор из второй камеры или сухую форму указанного буферного раствора.
В одном из вариантов осуществления связывающая нуклеиновые кислоты фаза содержит магнитные частицы.
В одном из вариантов осуществления картридж адаптируют для использования в микроструйном устройстве.
Кроме того, в одном из вариантов осуществления картридж содержит магнито-капиллярный клапан.
В одном из вариантов осуществления картридж содержит четвертую камеру, соединенную с третьей камерой, которая содержит буферный раствор, который содержит буферный раствор из второй камеры, или сухую форму указанного буферного раствора.
Набор и картридж в соответствии с настоящим изобретением благоприятны в сравнении с известным уровнем техники в том отношении, что их легче получать и, таким образом, они более экономичны, в частности, для крупномасштабного производства. Кроме того, уменьшая число различных ингредиентов, содержащихся в наборе или в картридже, также существенно снижают внутреннюю вариабельность.
Цель настоящего изобретения состоит в том, чтобы достигать промывания и элюирования нуклеиновых кислот из связывающей нуклеиновые кислоты фазы с использованием буферного раствора по настоящему изобретению, который сделает возможной непосредственную и незамедлительную дополнительную обработку очищенных нуклеиновых кислот после элюирования, например, в реакциях амплификации или секвенирования.
Сложно уменьшать масштаб существующих способов очистки нуклеиновых кислот в миниатюризированном окружении, таком как микроструйные устройства.
Следовательно, цель настоящего изобретения состоит в том, чтобы достигать эффективной очистки нуклеиновых кислот в миниатюризированном окружении, например, с использованием микроструйных устройств или магнито-капиллярных клапанов, где стадии промывания и элюирования осуществляют в ≤500 мкл или ≤50 мкл, соответственно.
Эти и другие аспекты изобретения видны и разъяснены со ссылкой на вариант(ы) осуществления, описанный далее в настоящем описании.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1. Картридж с магнито-капиллярными клапанами. Слева: схема картриджа с магнито-капиллярными клапанами в разобранном виде (сверху) и в виде в сборе (снизу), номера 1-4 обозначают различные камеры; справа: собранный картридж.
Фиг. 2. Сравнение выхода ivRNA с использованием MCV. Черный столбец: выход РНК, достигаемый с помощью эталонного способа; серый столбец: выход РНК, достигаемый с помощью способа с одним буферным раствором.
Фиг. 3. Сравнение выхода ivRNA с использованием пробирок Eppendorf. (a) черный столбец: выход РНК, достигаемый с помощью эталонного способа с использованием бус NucliSENS®; серый столбец: выход РНК, достигаемый с помощью способа с одним буферным раствором с использованием бус NucliSENS®; (b) процентная доля РНК, обнаруживаемой в различных фракциях, указанных на оси x, при использовании бус NucliSENS® в эталонном способе (черные столбцы) или способе с одним буфером (серые столбцы); (c) черный столбец: выход РНК, достигаемый с помощью эталонного способа с использованием частиц диоксида кремния MagPrep®; серый столбец: выход РНК, достигаемый с помощью способа с одним буферным раствором с использованием частиц диоксида кремния MagPrep®; (d) процентная доля РНК, обнаруживаемой в различных фракциях, указанных на оси x, при использовании частиц диоксида кремния MagPrep® в эталонном способе (черные столбцы) или способе с одним буфером (серые столбцы);
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
В настоящем изобретении описаны буферные растворы, а также способы и наборы, в которых используют один буферный раствор для промывания и элюирования и, таким образом, для высоко эффективной очистки молекул нуклеиновой кислоты.
Несмотря на то, что настоящее изобретение описано в отношении конкретных вариантов осуществления, это описание не следует толковать в ограничивающем смысле.
Перед подробным описанием образцовых вариантов осуществления настоящего изобретения, приведены определения, важные для понимания настоящего изобретения.
Как используют в этом описании и формуле изобретения, форма единственного числа также включает соответствующее множественное число, пока контекст явно не указывает на иное.
Кроме того, следует понимать, что термины «содержащий», «например» и «такой как» не являются ограничивающими. Термин «мочь» не следует понимать ни как обязывающий, ни как ограничивающий.
Термин «необязательно» следует понимать в качестве альтернативы или описания. Термин «в частности» следует рассматривать как предпочтительный вариант осуществления настоящего изобретения.
Термин «один буферный раствор» или «один буфер для промывания и элюирования», как используют в настоящем описании, относится к буферным растворам, имеющим одни и те же композицию, соотношение компонентов и характеристики.
Термины «экспонировать/экспонирование» и «связывать/связывание» относятся к приведению образца в контакт со связывающей нуклеиновые кислоты фазой в условиях, в которых нуклеиновые кислоты образца способны к связыванию со связывающей нуклеиновые кислоты фазой. В определенных вариантах осуществления настоящего изобретения «связывать/связывание» обозначает, что связывают ≥25% нуклеиновых кислот, присутствующих в образце, или связывают ≥50% или ≥75% или ≥85% или ≥95% нуклеиновых кислот, присутствующих в образце.
Термины «промывать/промывание» или «стадия промывания» относятся к ситуации, следующей за связыванием, в которой примеси, такие как дебрис, например, органеллы, части клеточных стенок или бактериальные или вирусные частицы, белки и/или остатки, например, соль или детергент из процедур лизиса или связывания, в значительной степени удаляют из нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой. В определенных вариантах осуществления настоящего изобретения «промывать/промывание» или «стадия промывания» обозначает, что удаляют ≤25% нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой, или удаляют ≤20% или ≤15% или ≤10% или ≤5% нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой.
Термины «элюировать/элюирование» или «стадия элюирования» относятся к условиям, при которых связанные нуклеиновые кислоты наконец высвобождают из связывающей нуклеиновые кислоты фазы. В определенных вариантах осуществления настоящего изобретения «элюировать/элюирование» или «стадия элюирования» обозначает, что элюируют ≥25% нуклеиновых кислот, изначально связанных со связывающей нуклеиновые кислоты фазой, или элюируют ≥35% или ≥45% или ≥55% или ≥65% или ≥75% или ≥85% или ≥95% нуклеиновых кислот, изначально связанных со связывающей нуклеиновые кислоты фазой.
В определенных вариантах осуществления настоящего изобретения «промывать/промывание» или «стадия промывания» обозначают, что удаляют ≤25% нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой, или удаляют ≤20% или ≤15% или ≤10% или ≤5% нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой, и «элюировать/элюирование» или «стадия элюирования» обозначают, что элюируют ≥25% нуклеиновых кислот, изначально связанных со связывающей нуклеиновые кислоты фазой, или элюируют ≥35% или ≥45% или ≥55% или ≥65% или ≥75% или ≥85% или ≥95% нуклеиновых кислот, изначально связанных со связывающей нуклеиновые кислоты фазой.
«Комнатная температура», как используют в настоящем описании, относится к температурам от 18 до 26°C, предпочтительно от 20 до 23°C.
Знак «~», как используют в настоящем описании, обычно обозначает отклонение от указанного числового значения ±20%, предпочтительно ±15%, более предпочтительно ±10% и даже более предпочтительно ±5%.
Настоящее изобретение предусматривает способ очистки нуклеиновых кислот, включающий стадии
(i) экспонирования образца, содержащего нуклеиновые кислоты, для связывающей нуклеиновые кислоты фазы и предоставления нуклеиновым кислотам возможности связываться со связывающей нуклеиновые кислоты фазой,
(ii) промывания нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой, по меньшей мере один раз буферным раствором, содержащим буферное средство,
(iii) элюирования нуклеиновых кислот из связывающей нуклеиновые кислоты фазы с использованием буферного раствора со стадии (ii).
В одном из вариантов осуществления настоящего изобретения, способ очистки нуклеиновых кислот содержит стадии
(i) экспонирования образца, содержащего нуклеиновые кислоты, для связывающей нуклеиновые кислоты фазы и предоставления нуклеиновым кислотам возможности связываться со связывающей нуклеиновые кислоты фазой,
(ii) промывания нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой, по меньшей мере один раз буферным раствором,
(iii) элюирования нуклеиновых кислот из связывающей нуклеиновые кислоты фазы с использованием буферного раствора со стадии (ii),
где не осуществляют дополнительную стадию или стадии между стадиями (i) и (ii).
В другом варианте осуществления настоящего изобретения способ очистки нуклеиновых кислот включает стадии
(i) экспонирования образца, содержащего нуклеиновые кислоты, для связывающей нуклеиновые кислоты фазы и предоставления нуклеиновым кислотам возможности связываться со связывающей нуклеиновые кислоты фазой,
(ii) промывания нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой, по меньшей мере один раз буферным раствором, содержащим буферное средство,
(iii) элюирования нуклеиновых кислот из связывающей нуклеиновые кислоты фазы с использованием буферного раствора со стадии (ii),
где не осуществляют дополнительную стадию или стадии между стадиями (ii) и (iii).
В дополнительном варианте осуществления настоящего изобретения способ очистки нуклеиновых кислот включает стадии
(i) экспонирования образца, содержащего нуклеиновые кислоты, для связывающей нуклеиновые кислоты фазы и предоставления нуклеиновым кислотам возможности связываться со связывающей нуклеиновые кислоты фазой,
(ii) промывания нуклеиновых кислот, связанны со связывающей нуклеиновые кислоты фазой, по меньшей мере один раз буферным раствором, содержащим буферное средство,
(iii) элюирования нуклеиновых кислот из связывающей нуклеиновые кислоты фазы с использованием буферного раствора со стадии (ii),
где не осуществляют дополнительные стадии между стадиями (i) и (ii) и между стадиями (ii) и (iii).
В одном из вариантов осуществления настоящего изобретения способ очистки нуклеиновых кислот состоит из стадий
(i) экспонирования образца, содержащего нуклеиновые кислоты, для связывающей нуклеиновые кислоты фазы и предоставления нуклеиновым кислотам возможности связываться со связывающей нуклеиновые кислоты фазой,
(ii) промывания нуклеиновых кислот, связанны со связывающей нуклеиновые кислоты фазой, по меньшей мере один раз буферным раствором, содержащим буферное средство,
(iii) элюирования нуклеиновых кислот из связывающей нуклеиновые кислоты фазы с использованием буферного раствора со стадии (ii).
В контексте настоящего изобретения использование буферного раствора со стадии (ii) на стадии (iii) способа по изобретению обозначает использование буферных растворов, имеющих одни и те же композицию, соотношение компонентов и характеристики, на стадиях (ii) и (iii) способа по изобретению. Для упрощения, термин «один буферный раствор» или «один буферный раствор для промывания и элюирования» используют на всем протяжении заявки, чтобы обозначать буферный раствор, используемый на стадии (ii) и (iii) способа по изобретению.
Использование одного буферного раствора для промывания и элюирования нуклеиновых кислот, необязательно в способе, как описано в вариантах осуществления изобретения или как предусмотрено набором по изобретению, делает очистку нуклеиновых кислот быстрой, простой и экономически эффективной.
Экспонирования образца, содержащего нуклеиновые кислоты, и связывания нуклеиновых кислот со связывающей нуклеиновые кислоты фазой можно добиваться, добавляя образца к связывающей нуклеиновые кислоты фазе и необязательно позволяя образцу проходить или протекать через связывающую нуклеиновые кислоты фазу. Экспонирования также можно добиваться посредством погружения, ресуспендирования или смешивания образца со связывающей нуклеиновые кислоты фазой. Образец можно инкубировать на или со связывающей нуклеиновые кислоты фазой в течение от 1 до 30 минут при комнатной температуре и pH от 4 до 8 с использованием любого подходящего буферного раствора для связывания. Нуклеиновые кислоты можно связывать в присутствии или в отсутствии хаотропных веществ, например, (изо)тиоцианата гуанидиния, гидрохлорида гуанидина, йодида натрия, йодида калия, (изо)тиоцианата натрия, мочевины или их сочетаний.
В одном из вариантов осуществления настоящего изобретения, образец инкубируют на или со связывающей нуклеиновые кислоты фазой в течение от 1 до 30 минут при комнатной температуре и pH ~4.
В другом варианте осуществления настоящего изобретения, нуклеиновые кислоты связывают со связывающей нуклеиновые кислоты фазой с использованием буферного раствора, содержащего изотиоцианат гуанидиния.
В дополнительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают со связывающей нуклеиновые кислоты фазой с использованием буферного раствора, содержащего изотиоцианат гуанидиния, в течение от 1 до 30 минут при комнатной температуре и pH 4.
В одном из вариантов осуществления настоящего изобретения стадию (i) способа по изобретению осуществляют в присутствии высоких концентраций солей, например, концентраций солей в молярном и верхнем миллимолярном диапазоне.
В предпочтительном варианте осуществления настоящего изобретения стадию (i) способа по изобретению осуществляют в присутствии высоких концентраций солей от 1 M до 6 M.
В идеале, буферные растворы для промывания удаляют нежелательные клеточные компоненты, такие как клеточный, бактериальный, вирусный дебрис; белки, а также остаточные количеств, например, детергента и хаотропных солей, которые могут быть начало из предыдущих стадий лизиса или связывания.
Связанные нуклеиновые кислоты можно промывать и элюировать с использованием буферного раствора, имеющего концентрацию соли ≤500 мМ, ≤400 мМ, ≤300 мМ, ≤200 мМ, ≤100 мМ, ≤75 мМ, ≤50 мМ, ≤40 мМ, ≤30 мМ, ≤20 мМ, ≤10 мМ, ≤7,5 мМ, ≤5 мМ, ≤2,5 мМ.
В предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрации солей ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ.
Связанные нуклеиновые кислоты дополнительно можно промывать и элюировать с использованием буферного раствора, имеющего pH ≥7,5, ≥8, ≥8,5, ≥9, ≥9,5 или ≥10.
В предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет значение pH ≥7,5 или ≥9.
В одном из вариантов осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9.
В другом варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию соли ≤30 мМ и pH ≥7,5.
В другом варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию соли ≤30 мМ и pH ≥9.
В дополнительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию соли ≤10 мМ и pH ≥7,5.
В предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию соли ≤10 мМ и pH ≥9.
В более предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию соли 10 мМ и pH ≥7,5.
В наиболее предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию соли 10 мМ и pH 9.
Связанные нуклеиновые кислоты дополнительно можно промывать и элюировать с использованием буферных растворов, содержащих буферные средства, например, цитрат, малат, формиат, цитрат, сукцинат, ацетат, пропионат, малат, пиридин, какодилат, сукцинат, гистидин, bis-tris, этаноламин, ADA, ACES, PIPES, MOPSP, имидазол, BIS-TRIS пропан, BES, MOPS, HEPES, TES, MOBS, DIPSO, TAPSO, триэтиламин (TEA), пирофосфат, HEPPSO, Tris-HCl, POPSO, трицин, гидразин, глицилглицин, Trizma, EPPS, HEPPS, BICINE HEPBS, TAPS, 2-амино-2-метил-1,3-пропандиол (AMPD), TABS, AMPSO, таурин (AES), борат, CHES, 2-амино-2-метил-1-пропанол (AMP), глицин, гидроксид аммония, CAPSO, карбонат, метиламин, пиперазин, CAPS и фосфат.
Связанные нуклеиновые кислоты предпочтительно можно промывать и элюировать с использованием буферных растворов, содержащих буферные средства, например, DIPSO, TAPSO, триэтиламин (TEA), пирофосфат, HEPPSO, Tris-HCl, POPSO, трицин, гидразин, глицилглицин, Trizma, EPPS, HEPPS, BICINE HEPBS, TAPS, 2-амино-2-метил-1,3-пропандиол (AMPD), TABS, AMPSO, таурин (AES), борат, CHES, 2-амино-2-метил-1-пропанол (AMP), глицин, гидроксид аммония, CAPSO, карбонат, метиламин, пиперазин, CAPS и фосфат, MES (2-(N-морфолино)этансульфоновая кислота) или TE (Tris-EDTA).
Связанные нуклеиновые кислоты наиболее предпочтительно можно промывать и элюировать с использованием буферных растворов, содержащих буферные средства с буферным диапазоном pH от 7 до 11, например, DIPSO, TAPSO, триэтиламин (TEA), пирофосфат, HEPPSO, Tris-HCl, POPSO, трицин, гидразин, глицилглицин, Trizma, EPPS, HEPPS, BICINE HEPBS, TAPS, 2-амино-2-метил-1,3-пропандиол (AMPD), TABS, AMPSO, таурин (AES), борат, CHES, 2-амино-2-метил-1-пропанол (AMP), глицин, гидроксид аммония, CAPSO, карбонат, метиламин, пиперазин, CAPS, фосфат и TE.
В одном из вариантов осуществления настоящего изобретения буферное средство в буферном растворе, используемом на стадиях (ii) и (iii) способа по изобретению, представляет собой TE или Tris-HCl.
В другом варианте осуществления настоящего изобретения буферное средство в буферном растворе, используемом на стадиях (ii) и (iii) способа по изобретению, представляет собой Tris-HCl.
В другом варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию Tris-HCl ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ.
В дополнительном варианте осуществления настоящего изобретения буферное средство буферного раствора, используемого на стадиях (ii) и (iii) способа по изобретению, представляет собой Tris-HCl и буферный раствор имеет pH ≥7,5 или предпочтительно ≥9.
В предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию Tris-HCl ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или предпочтительно ≥9.
В другом предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию Tris-HCl ≤30 мМ и pH ≥7,5.
В дополнительном предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию Tris-HCl ≤30 мМ и pH ≥9.
В более предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию Tris-HCl ≤10 мМ и pH ≥7,5.
В еще более предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию Tris-HCl ≤10 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию Tris-HCl 10 мМ и pH ≥7,5.
В наиболее предпочтительном варианте осуществления настоящего изобретения буферный раствор, используемый на стадиях (ii) и (iii) способа по изобретению, имеет концентрацию Tris-HCl 10 мМ и pH 9.
В одном из вариантов осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл буферного раствора.
В другом варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤50 мкл или ≤20 мкл буферного раствора.
В дополнительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤50 мкл или ≤20 мкл буферного раствора, имеющего концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ.
В другом варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤50 мкл или ≤20 мкл буферного раствора, имеющего pH ≥7,5 или ≥9.
В предпочтительном варианте осуществления стадию (ii) способа по изобретению осуществляют в ≤50 мкл или ≤20 мкл буферного раствора, имеющего концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9.
В другом предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл буферного раствора.
В дополнительном предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл буферного раствора, имеющего концентрацию соли ≤30 мМ и pH ≥7,5.
В другом предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл буферного раствора, имеющего концентрацию соли ≤30 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл буферного раствора, имеющего концентрацию соли ≤10 мМ и pH ≥7,5.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл буферного раствора, имеющего концентрацию соли ≤10 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл буферного раствора, имеющего концентрацию соли 10 мМ и pH 9.
В соответствии с одним из вариантов осуществления настоящего изобретения, буферное средство буферного раствора из вариантов осуществления, приведенных непосредственно выше, представляет собой Tris-HCl.
В одном из вариантов осуществления настоящего изобретения связанные нуклеиновые кислоты промывают по меньшей мере один раз на стадии (ii) способа по изобретению.
В предпочтительном варианте осуществления связанные нуклеиновые кислоты промывают по меньшей мере два раза, предпочтительно два раза на стадии (ii) способа по настоящему изобретению.
В более предпочтительном варианте осуществления настоящего изобретения связанные нуклеиновые кислоты промывают два раза на стадии (ii) способа, где стадию (ii) осуществляют в ≤20 мкл буферного раствора, имеющего концентрацию соли ≤10 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения связанные нуклеиновые кислоты промывают два раза на стадии (ii), где стадию (ii) осуществляют в ≤20 мкл буферного раствора, имеющего концентрацию соли 10 мМ и pH 9.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения связанные нуклеиновые кислоты промывают два раза на стадии (ii), где стадию (ii) осуществляют в ≤20 мкл буферного раствора, имеющего концентрацию Tris-HCl 10 мМ и pH 9.
В одном из вариантов осуществления настоящего изобретения стадию (iii) способа по изобретению осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл буферного раствора.
В другом варианте осуществления настоящего стадию (iii) способа по изобретению осуществляют в ≤5 мкл буферного раствора.
В одном из вариантов осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) способа по изобретению осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл, ≤5 мкл буферного раствора.
В другом варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ.
В дополнительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет pH ≥7,5 или ≥9.
В одном из вариантов осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9.
В предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9.
В другом предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤30 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥7,5.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли 10 мМ и pH 9.
В дополнительном предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤30 мМ и pH ≥7,5.
В другом предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤30 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤10 мМ и pH ≥7,5.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤10 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl 10 мМ и pH 9.
В соответствии с одним из вариантов осуществления настоящего изобретения, связанные нуклеиновые кислоты промывают по меньшей мере два раза, предпочтительно два раза на стадии (ii) любого из приведенных непосредственно выше вариантов осуществления изобретения.
В соответствии с одним из вариантов осуществления настоящего изобретения, стадию (i) способа по изобретению можно осуществлять в присутствии высоких концентраций солей, где связанные нуклеиновые кислоты промывают и элюируют как описано в приведенных выше вариантах осуществления.
В одном из вариантов осуществления настоящего изобретения по меньшей мере 25%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% нуклеиновых кислот, присутствующих в образце, содержащем нуклеиновые кислоты, получают в элюате со стадии (iii) способа по изобретению, используя буферный раствор по настоящему изобретению или набор по настоящему изобретению.
В другом варианте осуществления настоящего изобретения различные нуклеиновые кислоты очищают одновременно. Обыкновенный способ получения, например, РНК или ДНК состоит в добавлении РНКаз или ДНКаз, соответственно, в очищенные нуклеиновые кислоты.
В дополнительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению. Для использования в изобретении пригодны известные способы лизиса клеток, такие как физическое разрушение, например, посредством измельчения, перемалывания, через усилия сдвига, посредством обработки звуком, ультразвуком, приложения давления, шарового помола или заморозки и оттаивания; или химическое разрушение, например, посредством хаотропных или космотропных солей, детергентов, таких как Triton X, NP40, Tween или SDS; или ферментативное разрушение, например, с помощью лизоцима, протеиназы K или субтилизина.
В одном из вариантов осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, не лизируют с помощью хаотропных солей или детергентов.
В другом варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты лизируют с помощью космотропных солей.
В предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению; стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) способа по изобретению осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл буферного раствора.
В другом предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению; стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ.
В дополнительном предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению; стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет pH ≥7,5 или ≥9.
В более предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению; стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9.
В еще более предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению; стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤30 мМ и pH ≥7,5.
В другом более предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению; стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤30 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению; стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥7,5.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению; стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥9.
В наиболее предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, лизируют перед стадией (i) способа по изобретению; стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли 10 мМ и pH 9.
В соответствии с одним из вариантов осуществления настоящего изобретения, буферное средство в буферном растворе из вариантов осуществления, приведенных непосредственно выше, представляет собой Tris-HCl.
В соответствии с другим вариантом осуществления настоящего изобретения, связанные нуклеиновые кислоты промывают по меньшей мере два раза, предпочтительно два раза на стадии (ii) способа по изобретению в любом из вариантов осуществления изобретения, приведенных непосредственно выше.
В соответствии с еще одним другим вариантом осуществления настоящего изобретения стадию (i) способа по изобретению осуществляют в присутствии высоких концентраций солей, где связанные нуклеиновые кислоты промывают (стадия (ii)) и элюируют (стадия (iii)), как описано в приведенных выше вариантах осуществления.
Образцы, содержащие нуклеиновые кислоты, как используют в настоящем описании, включают биологические образцы, например, бактерии, дрожжи, вирусы, эукариотические клетки, клетки животного, клетки млекопитающих, клетки человека, цельную кровь, сыворотку крови, богатую тромбоцитами плазму, лейкотромбоцитарный слой, образцы из назальны, оральных, вагинальных или ректальных мазков, назофарингеальные или бронхиальные аспираты и смывы, цереброспинальную жидкость, слюну, фекалии, мочу, семя и ткань. Образцы, содержащие нуклеиновые кислоты, также могут представлять собой лабораторные образцы, такие как смеси реакций амплификации и пробы (расплавленного) агарозного геля. Образцы, содержащие нуклеиновые кислоты, кроме того, могут представлять собой образцы пищи или почвы. Если применимо, образцы могут быть растворены, частично осветлены или очищены, например, посредством центрифугирования, преципитации и/или фильтрования.
В одном из вариантов осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, содержит эукариотические клетки, предпочтительно клетки человека, более предпочтительно эпителиальные клетки.
В предпочтительном варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, содержит эпителиальные клетки.
В другом варианте осуществления настоящего изобретения образец, содержащий нуклеиновые кислоты, дополнительно содержит бактерии и/или вирусы.
Бактерии, например, могут содержать Bacillus, Bartonella, Bordetella, Borrelia, Brucella, Campylobacter, Chlamydia, Clostridium, Corynebacterium, например, Corynebacterium diptheriae, Enterococcus, Escherichia, Francisella, Haemophilus, Heliobacter, Legionella, Leptospira, Listeria, Mycobacterium, Mycoplasma, Neisseria, Pseudomonas, Rickettsia, Staphylococcus, Salmonella, Shigella, Streptococcus, Treponema, Ureaplasma, Vibrio или Yersinia. Вирусы, например, могут содержать вирус Эпштейна-Барр, вирус гепатита, вирус герпеса, вирус иммунодефицита человека, папилломавирус человека, Filovirus, вирус гриппа или вирус бешенства.
Нуклеиновые кислоты, подлежащие очистке способом по изобретению, включают дезоксирибонуклеиновую кислоту (ДНК), рибонуклеиновую кислоту (РНК) и их гибриды. ДНК и РНК могут быть одно- и двухцепочечными.
ДНК может присутствовать в виде геномной ДНК, кДНК или в кольцевой форме, такой как сверхспиральная, спиральная и релаксированная плазмидная ДНК, и, кроме того, может присутствовать в виде A-ДНК, B-ДНК или Z-ДНК.
Термин «РНК» включает бактериальную РНК, вирусную РНК, ретровирусную РНК, информационную РНК (мРНК), рибосомную РНК (rRNA), рибозимы, аптамеры, РНК-переключатели, транспортную РНК (тРНК), малую интерферирующую РНК (миРНК), антисмысловую РНК, малую ядерную РНК (snRNA), малую ядрышковую РНК (snoRNA), микроРНК (мкРНК), Piwi-взаимодействующую (piRNA), CRISPR РНК и иммуностимулирующую РНК. ДНК и РНК могут существовать при различной длине, например, от ≤0,05 т. о. до ≥100 т. о.
Нуклеиновые кислоты подлежащие очистке, также включают нуклеиновые кислоты, модифицированные по фрагменту сахара, фосфатному остову или фрагменту основания.
Нуклеиновые кислоты, подлежащие очистке, дополнительно включают синтезированные нуклеиновые кислоты, например, РНК, транскрибированную in vitro (in vitro РНК), необязательно флуоресцентно или радиоактивно меченную.
В предпочтительном варианте осуществления изобретения нуклеиновые кислоты, подлежащие очистке, представляют собой вирусную ДНК или вирусную РНК.
Связывающие нуклеиновые кислоты фазы, как используют в способе по настоящему изобретению, включают растворимые или твердые, пористые или не пористые подложки, способные связывать нуклеиновые кислоты.
Указанные выше подложки могут содержать функциональные химические группы, например, аминогруппы или группы, функционализированные аминами. Предпочтительными подложками являются диатомовые глины, стекло, силикон, диоксид кремния и подложки, покрытые силаном, необязательно содержащие функциональные группы, например, полиэтиленгликоль, амин, эпоксид, изотиоцианат, а также подложки, покрытые поли-L-лизином или полимерами, например, нитроцеллюлозой, полистиролом, сополимерами циклических олефинов (COC), полимерами циклических олефинов (COP), полипропиленом, полиэтиленом или поликарбонатом. Функционализированные силаны могут быть разветвленными или не разветвленными.
Один из вариантов осуществления настоящего изобретения предусматривает связывающую нуклеиновые кислоты фазу, содержащую диоксид кремния.
Дополнительный вариант осуществления настоящего изобретения предусматривает связывающую нуклеиновые кислоты фазу, содержащую силан.
Примером твердой связывающей нуклеиновые кислоты подложки являются магнитные частицы, которые являются особенно благоприятными в отношении манипуляций, поскольку их можно использовать в небольших количествах и извлекать легко и количественно (US 14/0272999). Магнитные частицы могут состоять из железа, оксида железа, диоксида кремния, оксида кремния, включая аморфный оксид кремния, стеклянного порошка, кварца, диатомовой земли, диоксида алкилкремния, цеолита, латексных частиц или полимеров, например, нитроцеллюлозы, полистирола, сополимеров циклических олефинов (COC), полимеров циклических олефинов (COP), полипропилена, полиэтилена или поликарбоната, или могут быть покрыты силаном, необязательно содержащим функциональные группы, например, полиэтиленгликоль, амин, эпоксид или изотиоцианат, или покрыты L-лизином.
В одном из вариантов осуществления настоящего изобретения магнитные частицы могут содержать железо, оксид железа, диоксид кремния, оксид кремния, включая аморфный оксид кремния, стеклянный порошок, кварц, диатомовую землю, диоксид алкилкремния, цеолит, латексные частицы, или могут быть покрыты силаном, необязательно содержащим функциональные группы, например, полиэтиленгликоль, амин, эпоксид или изотиоцианат, или покрыты L-лизином.
Размер магнитных частиц может находиться в диапазоне между 0,05 мкм и 500 мкм. Предпочтительные размеры частицы находятся в диапазоне между 1 мкм и 200 мкм.
В предпочтительном варианте осуществления настоящего изобретения связывающая нуклеиновые кислоты фаза содержит магнитные частицы. В еще более предпочтительном варианте осуществления настоящего изобретения эти магнитные частицы покрывают диоксидом кремния. В варианте осуществления настоящего изобретения, предпочтительном в равной мере, магнитные частицы покрывают силаном.
В предпочтительном варианте осуществления настоящего изобретения связывающая нуклеиновые кислоты фаза содержит отрицательно заряженные частицы, более предпочтительно магнитные отрицательно заряженные частицы, где частицы могут содержать стекло, диоксид кремния, производные диоксида кремния или могут быть покрыты диоксидом кремния, и нуклеиновые кислоты связывают связывающую нуклеиновые кислоты фазу в присутствии высоких концентраций хаотропной соли.
Миниатюризированное окружение в значении по настоящему изобретению относится к субмиллилитровому пространству. Примером такого миниатюризированного окружения является микроструйное устройство, которое отличается тем, что спроектировано для манипуляций текучими веществами в субмиллилитровом пространстве, что делает возможными точные контроль и манипуляцию этими текучими веществами. Обычно в микроструйном устройстве реализуют небольшие объемы, например, в микролитровом диапазоне, и/или в нем можно реализовать малый общий размер. Кроме того, микроструйное устройство в соответствии с настоящим изобретением может быть одноразовым или повторно используемым и потреблять малое количество энергии. В микроструйном устройстве можно реализовать такие эффекты, как ламинарный поток, удельное поверхностное натяжение, электросмачивание, быстрая тепловая релаксация, присутствие электрических поверхностных зарядов и диффузия. В определенных вариантах осуществления микроструйное устройство может иметь соединения с внешними источниками или внешними элементами, например, отделением или резервуарами или сосудами в целях повторного использования. Кроме того, микроструйное устройство может содержать электронный или компьютерный интерфейс, который делает возможными контроль и манипуляции активностями в устройстве и/или обнаружение или определение исходов или продуктов реакций. Микроструйные устройства можно приводить в действие вручную или автоматически, например, в качестве части подхода «лаборатория на чипе», когда все реактивы уже присутствуют в устройстве.
Микроструйные устройства включают термины «магнито-капиллярный клапан» или «картридж с магнито-капиллярными клапанами», которые состоят из двух плоских поверхностей на взаимном расстоянии с тем, чтобы с помощью капиллярной силы можно было ограничивать дискретные единицы жидкости в фиксированных положениях в устройстве. Единицы жидкости внутри устройства можно разделять с помощью газа или материалом с фазовым переходом, таким как парафин, который можно плавить и отверждать на основании приложенной температуры. Магнитные частицы, например, можно переносить из одной единицы жидкости в другую с помощью магнитных сил (den Dulk, Lab Chip, 2013).
Один из вариантов осуществления настоящего изобретения предусматривает, что способ по изобретению осуществляют с использованием микроструйного устройства.
В дополнительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) способа по изобретению осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл буферного раствора с использованием микроструйного устройства.
В другом варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ, с использованием микроструйного устройства.
В дополнительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет pH ≥7,5 или ≥9, с использованием микроструйного устройства.
В предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9, с использованием микроструйного устройства.
В дополнительном предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤30 мМ и pH ≥7,5, с использованием микроструйного устройства.
В другом предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤30 мМ и pH ≥9, с использованием микроструйного устройства.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥7,5, с использованием микроструйного устройства.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥9, с использованием микроструйного устройства.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли 10 мМ и pH 9, с использованием микроструйного устройства.
В соответствии с одним из вариантов осуществления настоящего изобретения буферное средство в буферном растворе из вариантов осуществления, представленных непосредственно выше, представляет собой Tris-HCl.
В соответствии с одним из вариантов осуществления настоящего изобретения, способ по изобретению включает стадию лизиса перед стадией (i) способа по изобретению в любом из приведенных выше вариантов осуществления.
В соответствии с одним из вариантов осуществления настоящего изобретения, связанные нуклеиновые кислоты промывают по меньшей мере два раза, предпочтительно два раза на стадии (ii) способа по изобретению в любом из вариантов осуществления изобретения, приведенных непосредственно выше.
В предпочтительном варианте осуществления настоящего изобретения способ по изобретению осуществляют с использованием магнито-капиллярного клапана.
В дополнительном варианте осуществления настоящего изобретения стадию (ii) связанных нуклеиновых кислот способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) способа по изобретению осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл буферного раствора с использованием магнито-капиллярного клапана.
В другом варианте осуществления настоящего изобретения связанные нуклеиновые кислоты представляют собой стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ, с использованием магнито-капиллярного клапана.
В дополнительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет pH ≥7,5 или ≥9, с использованием магнито-капиллярного клапана.
В предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9, с использованием магнито-капиллярного клапана.
В предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9, с использованием магнито-капиллярного клапана.
В дополнительном предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤30 мМ и pH ≥7,5, с использованием магнито-капиллярного клапана.
В другом предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤30 мМ и pH ≥9, с использованием магнито-капиллярного клапана.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥7,5, с использованием магнито-капиллярного клапана.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥9, с использованием магнито-капиллярного клапана.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли 10 мМ и pH 9, с использованием магнито-капиллярного клапана.
В предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) способа по изобретению осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9, с использованием магнито-капиллярного клапана.
В дополнительном предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤30 мМ и pH ≥7,5, с использованием магнито-капиллярного клапана.
В другом предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤30 мМ и pH ≥9, с использованием магнито-капиллярного клапана.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤10 мМ и pH ≥7,5, с использованием магнито-капиллярного клапана.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤10 мМ и pH ≥9, с использованием магнито-капиллярного клапана.
В наиболее предпочтительном варианте осуществления настоящего изобретения стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl 10 мМ и pH 9, с использованием магнито-капиллярного клапана.
В соответствии с одним из вариантов осуществления настоящего изобретения способ по изобретению включает стадию лизиса перед стадией (i) способа по изобретению в любом из приведенных выше вариантов осуществления.
В соответствии с одним из вариантов осуществления настоящего изобретения связанные нуклеиновые кислоты промывают по меньшей мере два раза, предпочтительно два раза на стадии (ii) способа по изобретению в любом из вариантов осуществления изобретения, приведенных непосредственно выше.
В дополнительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) способа по изобретению осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл буферного раствора с использованием магнито-капиллярного клапана.
В другом варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ, с использованием магнито-капиллярного клапана.
В дополнительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤500 мкл, ≤400 мкл, ≤300 мкл, ≤200 мкл, ≤100 мкл, ≤50 мкл или ≤20 мкл и стадию (iii) осуществляют в ≤50 мкл, ≤40 мкл, ≤30 мкл, ≤20 мкл, ≤15 мкл, ≤10 мкл или ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет pH ≥7,5 или ≥9, с использованием магнито-капиллярного клапана.
В предпочтительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5 или ≥9, с использованием магнито-капиллярного клапана.
В дополнительном предпочтительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤30 мМ и pH ≥7,5, с использованием магнито-капиллярного клапана.
В другом предпочтительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤30 мМ и pH ≥9, с использованием магнито-капиллярного клапана.
В наиболее предпочтительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥7,5, с использованием магнито-капиллярного клапана.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли ≤10 мМ и pH ≥9, с использованием магнито-капиллярного клапана.
В наиболее предпочтительном варианте осуществления настоящего изобретения связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию соли 10 мМ и pH 9, с использованием магнито-капиллярного клапана.
В дополнительном предпочтительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤30 мМ и pH ≥7,5, с использованием магнито-капиллярного клапана.
В другом предпочтительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤30 мМ и pH ≥9, с использованием магнито-капиллярного клапана.
В наиболее предпочтительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤10 мМ и pH ≥7,5, с использованием магнито-капиллярного клапана.
В другом наиболее предпочтительном варианте осуществления настоящего изобретения нуклеиновые кислоты связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl ≤10 мМ и pH ≥9, с использованием магнито-капиллярного клапана.
В наиболее предпочтительном варианте осуществления настоящего изобретения связывают с магнитными частицами, покрытыми диоксидом кремния, стадию (ii) способа по изобретению осуществляют в ≤20 мкл и стадию (iii) осуществляют в ≤5 мкл, где буферный раствор, используемый на стадиях (ii) и (iii), имеет концентрацию Tris-HCl 10 мМ и pH 9, с использованием магнито-капиллярного клапана.
В соответствии с одним из вариантов осуществления настоящего изобретения, способ по изобретению включает стадию лизиса перед стадией (i) способа по изобретению в любом из вариантов осуществления, приведенных непосредственно выше.
В соответствии с одним из вариантов осуществления настоящего изобретения, связанные нуклеиновые кислоты промывают по меньшей мере два раза, предпочтительно два раза на стадии (ii) способа по изобретению в любом из вариантов осуществления изобретения, приведенных непосредственно выше.
В соответствии с одним из вариантов осуществления настоящего изобретения, стадии с (i) до (iii) способа по изобретению осуществляют при комнатной температуре.
В соответствии с другим вариантом осуществления настоящего изобретения стадии (i) и (ii) способа по изобретению осуществляют при комнатной температуре и стадию (iii) осуществляют при температуре ≥40°C.
В предпочтительном варианте осуществления стадии (i) и (ii) способа по изобретению осуществляют при комнатной температуре и стадию (iii) осуществляют при температуре от 50° до 70°C.
В более предпочтительном варианте осуществления стадии (i) и (ii) способа по изобретению осуществляют при комнатной температуре и стадию (iii) осуществляют при 60-70°C.
В наиболее предпочтительном варианте осуществления стадии (i) и (ii) способа по изобретению осуществляют при комнатной температуре и стадию (iii) способа по изобретению осуществляют при 65°C.
Дополнительный вариант осуществления настоящего изобретения предусматривает дополнительную стадию обнаружения нуклеиновых кислот, очищенных с использованием способа по изобретению. Обнаружение очищенных нуклеиновых кислот, как используют в настоящем описании, включает ферментативный рестрикционный анализ очищенных нуклеиновых кислот, амплификацию, например, через ПЦР, такую как количественная ПЦР в реальном времени, гнездовая ПЦР и другие варианты амплификации, известные специалисту в данной области, обратную транскрипцию, гибридизацию, например, Саузерн, нозерн-блоттинг, микрочиповый анализ или секвенирование, например, пиросеквенирование, секвенирование Illumina или Solexa, технологию SOLiD (Applied Biosystems), технологию Heliscope (Helicos) или FTIR (Magnotech).
Другой аспект настоящего изобретения относится к использованию буферного раствора для очистки нуклеиновых кислот, где буферный раствор, содержащий буферное средство, имеет концентрацию соли ≤500 мМ, ≤400 мМ, ≤300 мМ, ≤200 мМ, ≤100 мМ, ≤75 мМ, ≤50 мМ, ≤40 мМ, ≤30 мМ, ≤20 мМ, ≤10 мМ, ≤7,5 мМ, ≤5 мМ, ≤2,5 мМ и pH ≥7,5, ≥8, ≥8,5, ≥9, ≥9,5 или ≥10.
В одном из вариантов осуществления настоящего изобретения используемый буферный раствор имеет концентрацию соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ и pH ≥7,5, ≥8, ≥8,5, ≥9, ≥9,5 или ≥10.
В предпочтительном варианте осуществления настоящего изобретения используемый буферный раствор имеет концентрацию соли ≤10 мМ и pH ≥9.
В более предпочтительном варианте осуществления настоящего изобретения используемый буферный раствор имеет концентрацию соли 10 мМ и pH 9.
В дополнительном варианте осуществления настоящего изобретения описанные выше буферные растворы используют для промывания и элюирования нуклеиновых кислот.
В другом варианте осуществления настоящего изобретения буферное средство в описанных выше буферных растворах представляет собой Tris-HCl.
В предпочтительном варианте осуществления настоящего изобретения используемый Tris-HCl буферный раствор имеет концентрацию соли ≤10 мМ и pH ≥9.
В более предпочтительном варианте осуществления настоящего изобретения используемый Tris-HCl буферный раствор имеет концентрацию соли 10 мМ и pH 9.
В дополнительном варианте осуществления настоящего изобретения нуклеиновые кислоты, очищенные с использованием описанных выше буферных растворов, представляют собой ДНК или РНК.
В другом варианте осуществления настоящего изобретения нуклеиновые кислоты представляют собой бактериальную ДНК или бактериальную РНК.
В предпочтительном варианте осуществления настоящего изобретения очищенные нуклеиновые кислоты представляют собой вирусную ДНК или вирусную РНК.
Дополнительный аспект настоящего изобретения относится к набору для очистки нуклеиновых кислот, содержащему:
- связывающую нуклеиновые кислоты фазу,
- буферный раствор для промывания и элюирования нуклеиновых кислот или сухую форму указанного буферного раствора, содержащего буферное средство,
- средство обнаружения очищенных нуклеиновых кислот.
Буферный раствор из набора предпочтительно представляет собой буферный раствор по настоящему изобретению, как описано в вышеуказанных вариантах осуществления изобретения.
Обнаружение очищенных нуклеиновых кислот, как используют в настоящем описании, включает ферментативный рестрикционный анализ очищенных нуклеиновых кислот, амплификацию, например, через ПЦР, такую как количественная ПЦР в реальном времени, гнездовая ПЦР и другие варианты амплификации, известные специалисту в данной области, обратную транскрипцию, гибридизацию, например, Саузерн, нозерн-блоттинг, микрочиповый анализ и секвенирование, например, посредством пиросеквенирования, секвенирование Illumina или Solexa, технологию SOLiD (Applied Biosystems), технологию Heliscope (Helicos) или FTIR (Magnotech).
В другом варианте осуществления настоящего изобретения набор дополнительно содержит миниатюризированное окружение, как определено выше.
В дополнительном варианте осуществления настоящего изобретения миниатюризированное окружение содержит
- связывающую нуклеиновые кислоты фазу,
- буферный раствор для промывания и элюирования нуклеиновых кислот или сухую форму указанного буферного раствора, содержащего буферное средство,
- средство обнаружения очищенных нуклеиновых кислот.
В другом варианте осуществления настоящего изобретения миниатюризированное окружение содержится в картридже.
В предпочтительном варианте осуществления настоящего изобретения набор дополнительно содержит микроструйное устройство.
В другом варианте осуществления настоящего изобретения набор содержит картридж.
В более предпочтительном варианте осуществления настоящего изобретения набор содержит картридж с магнито-капиллярными клапанами.
В дополнительном варианте осуществления настоящего изобретения набор дополнительно может содержать лизирующий реактив, такой как хаотропные или космотропные соли, детергенты, например, Triton X, NP40, Tween или SDS, или ферменты, такие как лизоцим, протеиназа K или субтилизин.
В другом варианте осуществления настоящего изобретения набор дополнительно содержит лизирующий реактив, который не представляет собой хаотропную соль или детергент.
В другом варианте осуществления настоящего изобретения набор дополнительно содержит лизирующий реактив, который представляет собой сульфат аммония или хлорид лития.
В дополнительном варианте осуществления настоящего изобретения набор по изобретению может содержать инструкции по осуществлению очистки нуклеиновых кислот с использованием компонентов набора.
Один из вариантов осуществления предусматривает набор по изобретению с отдельно упакованными компонентами набора или хранимыми в отдельных отсеках контейнера, в котором предоставляют набор.
Другой вариант осуществления настоящего изобретения предусматривает набор по изобретению для применения в качестве диагностического теста. Диагностические тесты могут содержать тесты для того, чтобы обнаруживать заболевания, обусловленные, или связанные с, патогенами, например, бактериями, дрожжами или вирусами, или генетические тесты, например, для генетических нарушений, пренатального тестирования или установления родителя.
В предпочтительном варианте осуществления настоящего изобретения набор по изобретению используют в качестве ручного интегрированного теста для молекулярной диагностики. Ручной тест для молекулярной диагностики может представлять собой небольшой одноразовый набор или прибор, который является портативным и подходит для тестирования на стороне пациента.
ПРИМЕРЫ
Способы по изобретению для очистки нуклеиновых кислот подтверждены и проиллюстрированы со ссылкой на следующие примеры. Следует подчеркнуть, что эти примеры не следует никаким образом толковать в качестве ограничения объема изобретения.
Пример 1: сравнение выход нуклеиновых кислот после очистки с помощью эталонного способа или способа с одним буферным раствором с использованием магнито-капиллярных клапанов (MCV)
In vitro РНК очищали или с помощью эталонного способа или с помощью способа с одним буферным раствором по настоящему изобретению для того, чтобы сравнивать выход нуклеиновой кислоты/РНК. Следующие протоколы использовали для эталонного способа или способа с одним буферным раствором, соответственно (обзор см. в таблице 1).
Таблица 1
Эталонный способ в MCV
5 мкл in vitro РНК добавляли в 995 мкл лизирующего буфера, содержащего 3,3 M изотиоцианат гуанидиния (GITC), Tris-HCl, Triton-X100 и EDTA, в 2 мл пробирку Eppendorf. Образец смешивали на вортексе в течение 10 с для лизиса. К образцу добавляли 20 мкл NucliSENS®, после чего следовала стадия смешивания, переворачивание пробирки Eppendorf один раз вверх и вниз, и инкубировали при комнатной температуре в течение от 3 до 5 минут для связывания нуклеиновых кислот с магнитными бусами.
После инкубации образца с лизирующим буфером и магнитными бусами, образец пипетировали в картридж с магнито-капиллярным клапаном (MCV), как описано в den Dulk et al., 2013 и как показано на фиг. 1. MCV картридж предварительно заполняли с использованием 20 мкл буфера для промывания 2, в первой и второй камере для промывания. Третью камеру заполняли с использованием 20 мкл буфера для промывания 3 и камеру для элюирования с использованием 3,5 мкл, содержащих низкую концентрацию соли 10 мМ Tris-HCl и содержащих высокий pH 9.
Магнитные бусы собирали и перемещали с использованием магнита, как описано в den Dulk et al., 2013. Сначала бусы NucliSENS® собирали в концентраторной части, где располагали образец. Затем магнитом переносили магнитные бусы через клапан в первую камеру для промывания. В этой камере магнитные бусы промывали с использованием магнита. Этот процесс повторяли во второй и третьей камере. В камере для элюирования нуклеиновые кислоты элюировали из бус посредством повышения температуры до 65°C в течение 2 минут и последующего перемешивания с использованием магнита.
Способ с одним буфером в MCV
Способ схож с «эталонным способом в MCV», как описано выше. Единственное различие состояло в композиции буферов, которая является одной и той же для обеих стадий промывания и конечной стадии элюирования (10 мМ Tris-HCl с pH 9)
Как следует из фиг. 2, выход РНК, достигаемый с помощью способа с одним буферным раствором с использованием MCV, значительно выше, чем выход, достигаемый с помощью эталонного способа, причем усредненный выход РНК составляет 64% РНК, изначально связанной с магнитными бусами, которую получали способом с одним буферным раствором, против 26% РНК, изначально связанной с магнитными бусами, которую получали эталонным способом.
Пример 2: сравнение выхода нуклеиновых кислот после очистки с помощью эталонного способа или способа с одним буферным раствором с использованием пробирок Eppendorf
In vitro РНК очищали или эталонным способом или способом с одним буферным раствором по настоящему изобретению для того, чтобы сравнивать выход нуклеиновой кислоты/РНК. Использовали следующие протоколы для эталонного способа или способа с одним буферным раствором, соответственно (обзор см. в таблице 2).
Таблица 2
Эталонный способ
5 мкл in vitro РНК добавляли к 995 мкл лизирующего буфера, содержащего 3,3 M изотиоцианата гуанидиния (GITC), Tris-HCl, Triton-X100 и EDTA, в 2 мл пробирку Eppendorf. Образец перемешивали на вортексе в течение 10 с для лизиса. К образцу добавляли 20 мкл бус NucliSENS® или 8 мкл частиц диоксида кремния MagPrep® (та же конечная концентрация) после чего следовала стадия смешивания, переворачивание пробирки Eppendorf один раз вверх и вниз, и инкубировали при комнатной температуре в течение от 3 до 5 минут для связывания нуклеиновых кислот с бусами или частицами, соответственно.
После инкубации образца с лизирующим буфером и магнитными бусами или частицами пробирку помещали на магнитную подставку, чтобы притягивать бусы или частицы со связанными нуклеиновыми кислотами к одной стороне пробирки. Удаляя жидкость с использованием пипетки, удаляли примеси, такие как дебрис и белки.
Затем магнитные частицы промывали при комнатной температуре с использованием 50 мкл буфера для промывания 2, содержащего соль MES гидрата, pH 4, чтобы разводить/замещать определенное количество GITC, при этом сохраняя нуклеиновые кислоты связанными с магнитными бусами или частицами. На каждой стадии промывания в пробирку добавляли промывающую жидкость, затем магнитные бусы или частицы смешивали с жидкостью, пробирку помещали на магнитную подставку, чтобы притягивать бусы или частицы с связанными нуклеиновыми кислотами к одной стороне пробирки, и, наконец, удаляли жидкость.
Вторую стадию промывания осуществляли при комнатной температуре с использованием 50 мкл буфера для промывания 3, содержащего Tris-HCl при pH 7, чтобы разводить/замещать определенное количество соли MES гидрата и увеличивать pH для улучшения элюирования.
Наконец, добавляли 50 мкл раствора буфера для элюирования, содержащего Tris-HCl, pH 7, инкубировали с магнитными бусами или частицами в течение 5 минут при 65°C на термонагревателе Eppendorf и впоследствии перемешивали на вортексе в течение 10 с для того, чтобы элюировать нуклеиновые кислоты из магнитных бус или частиц.
Способ с одним буферным раствором
5 мкл in vitro РНК добавляли к 995 мкл лизирующего буфера, содержащего 3,3 M изотиоцианат гуанидиния (GITC), Tris-HCl, Triton-X100 и EDTA в 2 мл пробирке Eppendorf. Образец перемешивали на вортексе в течение 10 с для лизиса. К образцу добавляли 20 мкл бус NucliSENS® или 8 мкл частиц диоксида кремния MagPrep® (та же конечная концентрация), после чего следовала стадия смешивания, переворачивание пробирки Eppendorf один раз вверх и вниз, и инкубировали при комнатной температуре в течение от 3 до 5 минут для связывания нуклеиновых кислот с бусами или частицами, соответственно.
После инкубации образца с лизирующим буфером и магнитными бусами или частицами, пробирку помещали на магнитную подставку для того, чтобы притягивать бусы или частицы со связанными нуклеиновыми кислотами к одной стороне пробирки. Удаляя жидкость с использованием пипетки, удаляли примеси, такие как дебрис и белки.
Затем магнитные частицы промывали два раза при комнатной температуре с использованием 50 мкл буферного раствора, содержащего Tris-HCl, pH 9, чтобы разводить/замещать определенное количество GITC и увеличивать pH для последующего элюирования, при этом все еще сохраняя нуклеиновые кислоты связанными с магнитными бусами или частицами. На каждой стадии промывания в пробирку добавляли промывающую жидкость, затем магнитные бусы или частицы перемешивали с жидкостью, пробирку помещали на магнитную подставку для того, чтобы притягивать бусы или частицы со связанными нуклеиновыми кислотами к одной стороне пробирки, и удаляли жидкость.
Наконец, добавляли 50 мкл буферного раствора, содержащего Tris-HCl, pH 9, инкубировали с магнитными бусами или частицами в течение 5 минут при 65°C на термонагревателе Eppendorf и затем перемешивали на вортексе в течение 10 с для того, чтобы элюировать нуклеиновые кислоты из магнитных бус или частиц.
Как следует из фиг. 3a и фиг. 3c, выход РНК, достигаемый с помощью эталонного способа (черный столбец) и способа с одним буфером (серый столбец) схож при использовании промывания и объема элюирования 50 мкл. При использовании бус NucliSENS®, приблизительно 99% количества РНК, присутствующего в образце перед очисткой, получали в очищенной форме (фиг. 3a), и при использовании частиц диоксида кремния MagPrep® приблизительно 82% количества РНК, присутствующего в образце перед очисткой, получали в очищенной форме (фиг. 3c).
На фиг. 3b и 3d в различных фракциях обнаруживали процентную долю от количества РНК, присутствующего в образце перед очисткой (Sup LB, 1-е промывание, 2-е промывание и фракция элюирования).
Процентная доля РНК, которую можно обнаруживать во фракции супернатанта после лизиса и связывания с магнитными бусами или частицами (Sup LB), была схожа при использовании эталонного способа и способа с одним буферным раствором, используя как бусы NucliSENS® (фиг. 3b), так и частицы диоксида кремния MagPrep® (фиг. 3d). Следовательно, процентные количества не связанной РНК почти идентичны для обоих способов при использовании различных связывающих нуклеиновые кислоты фаз.
Также показано, что какую-либо связанную РНК вряд ли теряли из бус NucliSENS® или частиц диоксида кремния MagPrep® во время первой и второй стадий промывания с использованием любого способа (см. средние столбцы на фиг. 3b и фиг. 3d).
Как результат, большинство РНК, изначально связанной с магнитными бусами или частицами, приблизительно 99% для бус NucliSENS® и приблизительно 80% для частиц диоксида кремния MagPrep®, обнаруживали во фракциях элюирования (см. крайние правые столбцы на фиг. 3b и фиг. 3d).
Вкратце, приведенные выше результаты показывают, что, несмотря на использование одного буфера для промывания и элюирования, способом с одним буферным раствором в пробирках Eppendorf достигают выхода нуклеиновых кислот, схожего с эталонными способами, когда используют идентичные небольшие объемы промывания и элюирования.
СПИСОК ЛИТЕРАТУРЫ
1. Boom et al., 1990, ʺRapid and Simple Method for Purification of Nucleic Acidsʺ, Journal of Clinical Microbiology, 28, 495-503;
2. EP 0 389 063;
3. US 14/0272999;
4. den Dulk et al., 2013, ʺMagneto-capillary valve for integrated purification and enrichment of nucleic acids and proteinsʺ, Lab Chip, 13, 106-118.
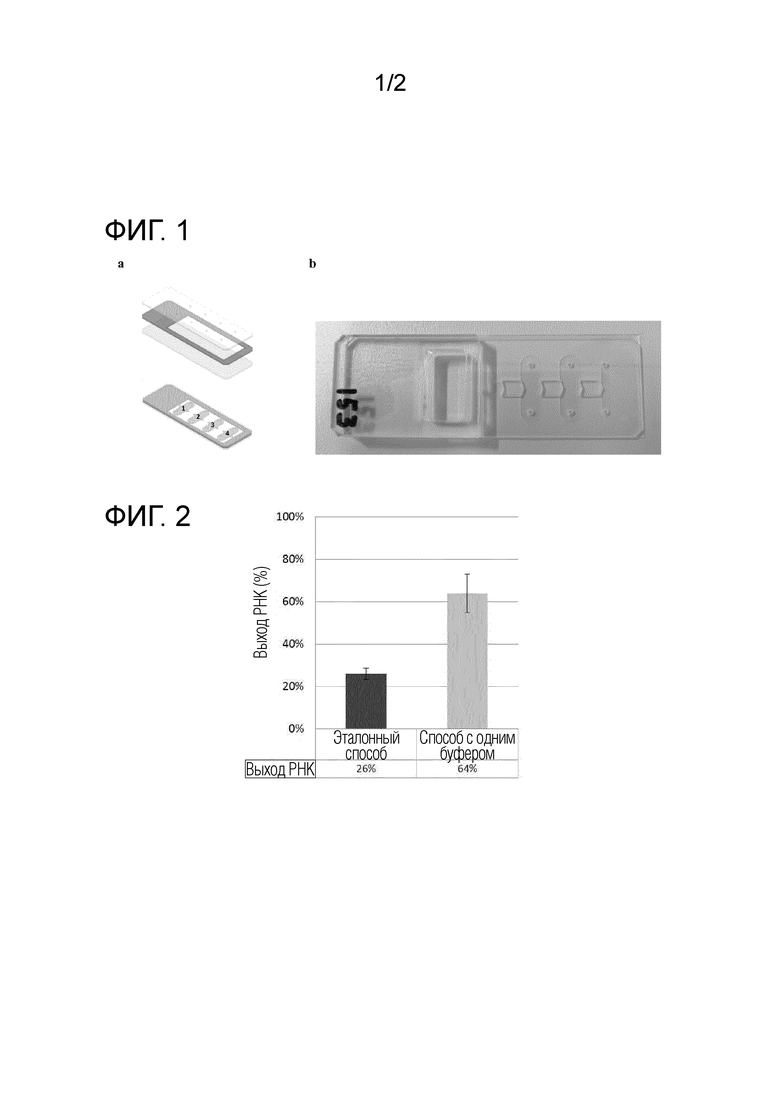
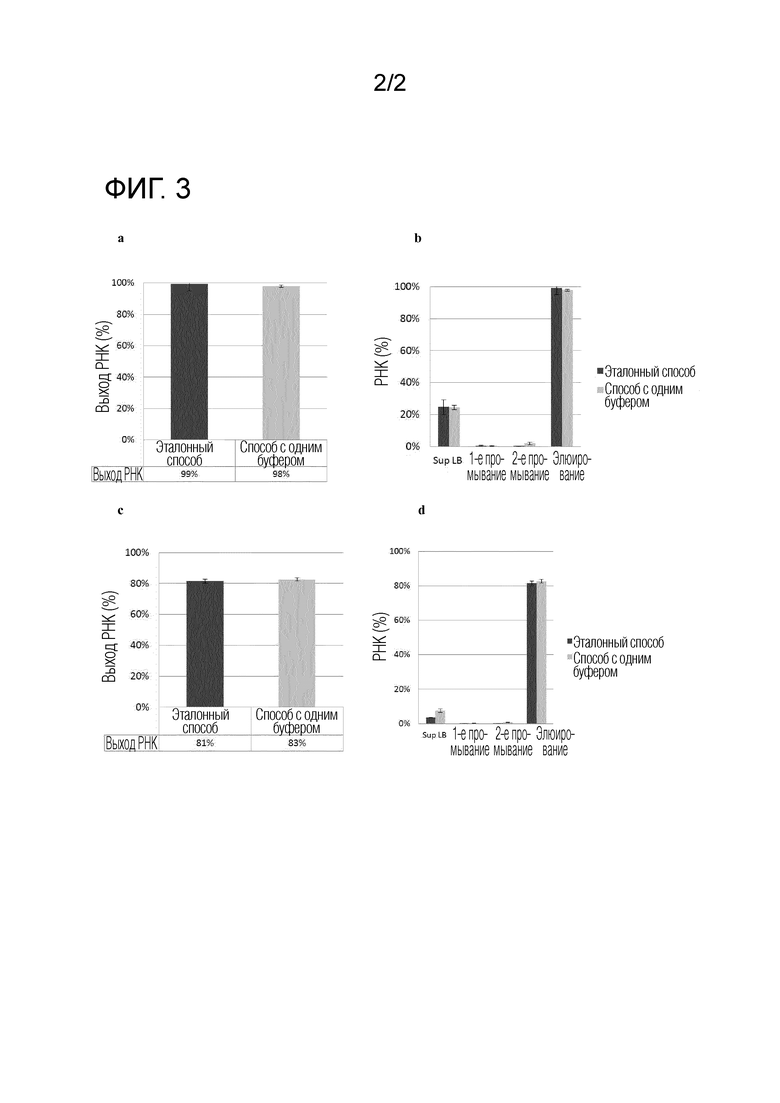
Настоящее изобретение относится к очистке нуклеиновых кислот эффективным и экономичным способом, а именно к способу очистки нуклеиновых кислот, который включает стадии воздействия на образец, промывания нуклеиновых кислот и элюирования, причем для промывания и элюирования используется один буферный раствор при различных температурах. Также изобретение содержит набор для очистки нуклеиновых кислот в соответствии с предложенным способом и картридж для осуществления предложенного способа. 3 н. и 12 з.п. ф-лы, 3 ил., 2 табл., 2 пр.
1. Способ очистки нуклеиновых кислот, включающий стадии
(i) воздействия на образец, содержащий нуклеиновые кислоты, связывающую нуклеиновые кислоты фазу, и предоставления нуклеиновым кислотам возможности связываться со связывающей нуклеиновые кислоты фазой,
(ii) промывания нуклеиновых кислот, связанных со связывающей нуклеиновые кислоты фазой, по меньшей мере один раз буферным раствором, содержащим буферное средство,
(iii) элюирования нуклеиновых кислот из связывающей нуклеиновые кислоты фазы с использованием ≤50 мкл буферного раствора со стадии (ii), при этом стадии (i) и (ii) осуществляют при комнатной температуре, а стадию (iii) осуществляют при температуре ≥40°С.
2. Способ по п. 1, в котором буферный раствор со стадий (ii) и (iii) характеризуется концентрацией соли ≤100 мМ, предпочтительно ≤50 мМ, более предпочтительно ≤30 мМ, наиболее предпочтительно ≤10 мМ.
3. Способ по любому из пп. 1 или 2, в котором буферный раствор со стадий (ii) и (iii) характеризуется pH ≥7,5, предпочтительно pH ≥9.
4. Способ по любому из пп. 1-3, в котором буферное средство в буферном растворе со стадий (ii) и (iii) представляет собой Tris-HCl.
5. Способ по любому из пп. 1-4, в котором стадию (ii) осуществляют в ≤200 мкл, предпочтительно ≤100 мкл, более предпочтительно ≤50 мкл, а наиболее предпочтительно ≤20 мкл буферного раствора.
6. Способ по любому из пп. 1-5, в котором стадию (iii) осуществляют в ≤15 мкл, предпочтительно ≤10 мкл, наиболее предпочтительно ≤5 мкл буферного раствора.
7. Способ по любому из пп. 1-6, в котором образец содержит клетки, которые лизируют перед стадией (i).
8. Способ по любому из пп. 1-7, в котором связывающая нуклеиновые кислоты фаза содержит диоксид кремния.
9. Способ по любому из пп. 1-8, в котором связывающая нуклеиновые кислоты фаза содержит магнитные частицы.
10. Способ по любому из пп. 1-9, причем способ осуществляют с использованием микроструйного устройства.
11. Способ по любому из пп. 1-10, причем способ осуществляют с использованием магнитокапиллярного клапана.
12. Способ по п. 1, в котором стадии (i) и (ii) осуществляют при комнатной температуре, а стадию (iii) осуществляют при температуре от 50 до 70°C, предпочтительно от 60 до 70°C, наиболее предпочтительно 65°C.
13. Набор для очистки нуклеиновых кислот в соответствии со способом по любому из пп. 1-12 при объеме элюирования ≤50 мкл, содержащий
- связывающую нуклеиновые кислоты фазу,
- содержащий буферное средство буферный раствор для промывания,
- ≤50 мкл буферного раствора для элюирования нуклеиновых кислот, причем буферный раствор для промывания и для элюирования представляют собой один и тот же раствор,
- средство обнаружения очищенных нуклеиновых кислот.
14. Набор для очистки нуклеиновых кислот по п. 13, причем набор дополнительно содержит лизирующий реактив.
15. Картридж для осуществления способа по любому из пп. 1-12, содержащий
- первую камеру, содержащую связывающую нуклеиновые кислоты фазу,
- соединенную с первой камерой вторую камеру, содержащую содержащий буферное средство буферный раствор для промывания и содержащую ≤50 мкл того же буферного раствора для элюирования нуклеиновых кислот,
- соединенную со второй камерой третью камеру, содержащую буферный раствор, содержащий буферный раствор из второй камеры, или сухую форму указанного буферного раствора.
| WO 2008000343 А1, 03.01.2008 | |||
| US 6111096 A, 03.01.2000 | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| DULK R.C | |||
| et al., Magneto-capillary valve for integrated purification and enrichment of nucleic acids and proteins, Lab Chip, 2013, 13, p.106-118 | |||
| Ротор неявнополюсной электрической машины | 1990 |
|
SU1767621A1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ | 1996 |
|
RU2119954C1 |
Авторы
Даты
2022-02-07—Публикация
2016-12-27—Подача