Изобретение относится к аналитической химии, а именно к способу определения концентрации гидрохлорида полигексаметиленгуанидина (ПГМГ) в водах, и может быть использовано в практике лабораторий промышленных предприятий, а также санитарно-эпидемиологических станциях для контроля содержания гидрохлорида ПГМГ.
Полигексаметиленгуанидин - эффективный дезинфектант, нетоксичный для теплокровных, но уничтожающий одноклеточные организмы и потому нормируемый в водах на довольно низком уровне (ПДК в воде водоемов и водных объектов хозяйственно-питьевого и культурно-бытового водопользования - 0,1 мг/л (Постановление Министерства здравоохранения РФ от 30 апреля 2003 г. №78; Кротов Ю.А., Карелин А.О., Лойт А.О. Предельно допустимые концентрации химических веществ в окружающей среде (под редакций Ю.А. Кротова). Справочник. - СПб.: Мир и семья, 2000. 360 с); в воде водоемов рыбохозяйственного назначения - 0,01 мг/л (Приказ Государственного Комитета Российской Федерации по рыболовству от 28 апреля 1999 г. №96 «О рыбохозяйственных нормативах»).
Известен титриметрический способ определения ПГМГ методом двухфазного (вода-хлороформ) титрования в щелочной среде по Эптону в присутствии лаурилсульфата натрия в качестве индикатора при добавлении смеси катионного красителя димидиум-бромида и анионного красителя дисульфина голубого VN 150 (Инструкция №26-БМ/08 по применению средства дезинфицирующего «Тетрамин» фирмы ЗАО «Петроспирт», Россия, для дезинфекции биологического материала). При этом одновременно оттитровывают четвертичные аммониевые соединения, N,N-бис(3-аминопропил)додециламин и ПГМГ. Способ не требует градуировки, однако неселективен, дорог, многоэтапен, длителен и пригоден только для концентрированных растворов ПГМГ.
Известен способ определения ПГМГ, основанный на эффекте метахромазии при образовании ассоциатов с красителями, из которых наиболее эффективен эозин (Пат. РФ №2252413, кл. G01N 21/78, 2005 г.).
Процедура определения проста и сводится к добавлению в анализируемый раствор буферного раствора (смесь растворов цитрата натрия и соляной кислоты), натриевой соли эозина и фотометрированию раствора через 15 мин при 545 нм. Нижняя граница определяемых концентраций - 0,05 мг/л. Для определения меньших концентраций ПГМГ (от 0,005 мг/л) пробу анализируемой воды (300 мл) упаривают на водяной бане до объема 25 мл.
Недостатком известного решения является недостаточный диапазон определяемых концентраций.
Наиболее близким решением к предлагаемому является способ определения концентрации ПГМГ, основанный на агрегации наночастиц золота катионами ПГМГ (Пат. РФ №2460998, кл. G01N 33/18, 2012 г. ). В этом способе в качестве реагента используют водный раствор наночастиц золота, продукт взаимодействия которых с ПГМГ концентрируют на пенополиуретане и затем проводят анализ концентрата с помощью спектрофотометра непосредственно в матрице пенополиуретана при длине волны светопоглощения агрегатов. При этом можно использовать мини-спектрофотометр, например калибратор мониторов Eye-One. Способ прост и удобен, не требует сложного оборудования и специально обученного персонала.
Недостатки прототипа: диапазон определяемых концентраций (0,05-0,2 мг/л ПГМГ) довольно узок, при этом не достигается предельно допустимая концентрация ПГМГ в воде рыбохозяйственного водоема - 0,01 мг/л (Приказ Государственного Комитета Российской Федерации по рыболовству от 28 апреля 1999 г. №96 «О рыбохозяйственных нормативах»).
Технической задачей предлагаемого изобретения является расширение диапазона определяемых концентраций ПГМГ, в том числе понижение нижней границы определяемых концентраций ПГМГ ниже ПДК для воды водоемов рыбохозяйственного назначения, при сохранении простоты метода.
Для достижения поставленной задачи в способе количественного определения концентрации гидрохлорида полигексаметиленгуанидина в водном растворе, включающем внесение в анализируемый раствор реагента, вызывающее взаимодействие реагента с гидрохлоридом полигексаметиленгуанидина, и последующий анализ полученного продукта, в качестве реагента используют коллоидный раствор наночастиц серебра в цитратном буфере, а анализ полученного продукта проводят методом спектроскопии рэлеевского рассеяния путем построения градуировочных графиков в диапазоне 0,07-2,2 мг/л при определении ПГМГ в водопроводной воде и в диапазоне 0,007-0,7 мг/л или 0,7-2,2 мг/л при определении ПГМГ в сточной воде.
Сущность изобретения поясняется следующим образом.
Получение реагента (раствора наночастиц серебра). Наночастицы серебра (НЧС) получали в две стадии. На первой стадии применяли методику, предложенную для получения зародышей наночастиц (Jana N.R., Gearheart L., Murphy C.J. Wet chemical synthesis of silver nanorods and nanowires of controllable aspect ratio. // Chem. Commun. 2001. V. 7. P. 617-618; Богатырев B.A., Дыкман Л.А., Хлебцов Н.Г. Методы синтеза наночастиц с плазмонным резонансом. Саратов, 2009. С. 22.). На этой стадии нитрат серебра восстанавливали боргидридом натрия, используя в качестве стабилизатора трехзамещенный цитрат натрия. В результате получали раствор НЧС диаметром 4±2 нм. На второй стадии синтеза раствор, полученный на первой стадии, нагревали с избытком цитрата натрия. Максимум спектра поглощения получаемых при этом НЧС - 392-396 нм (в среднем 394 нм).
Принцип определения концентрации ПГМГ.
При взаимодействии катионов ПГМГ с отрицательно заряженными наночастицами серебра образуются агрегаты, усиливающие рэлеевское рассеяние раствора. Оптимальное значение pН измеряемого раствора лежит в области 8,2-8,8. Это значение задается цитратным буфером, в котором готовят раствор наночастиц серебра. Оптимальная концентрация наночастиц - 1·10-6 М. Для построения градуировочного графика предварительно готовят разбавленные растворы ПГМГ (1·10-6, 1·10-5, 1·10-4 и 1·10-3 М) и выдерживают их для дезагрегации полимера при комнатной температуре не менее 24 ч, но не более 12 суток. Растворы меньших концентраций готовят из этих растворов разбавлением. Для измерения интенсивности рассеянного света используют спектрофлуориметр, на котором записывают синхронные спектры флуоресценции растворов, полученных смешением пробы и реагента (разбавленного раствора НЧС). Сканирование осуществляют при нулевой разнице длин волн падающего и рассеянного света (Δλ=0).
Селективность определения ПГМГ.
Определение ПГМГ заявляемым способом весьма селективно. При изучении мешающего влияния посторонних веществ реагент добавляли к содержащей мешающий компонент чистой воде (Millipore) и отдельно - к содержащему мешающий компонент раствору ПГМГ (4·10-7 М, или 0,07 мг/л). За порог мешающего влияния принимали такую концентрацию мешающего вещества, при которой ни фоновый сигнал, ни сигнал 4·10-7 М ПГМГ не изменялся более чем на 5%. Наиболее сильно влияют на сигнал полиэтиленимин (ПЭИ), являющийся, как и ПГМГ, катионным полиэлектролитом (не мешает 0,0025 мг/л ПЭИ, или 6·10-8 М), а также катионное ПАВ - н-цетилтриметиламмония бромид (см. табл. 1). Катионы металлов способны агрегировать наночастицы, поэтому их влияние изучали в присутствии динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА); не мешают 5 мМ солей жесткости (200 мг/л Сa2+, 120 мг/л Mg2+).
Влияние солевого фона на аналитический сигнал изучали на примере хлорида натрия. На сигнал 4·10-7 М ПГМГ не влияет 0,05 М NaCl; сигнал контрольного образца систематически снижается с ростом концентрации NaCl. Отсутствие влияния 0,05 М NaCl на сигнал 3,7·10-7 М ПГМГ и снижение фонового сигнала 0,001 М NaCl до 10% должно позволить строить градуировочные зависимости для определения ПГМГ на фоне солесодержащих растворов.
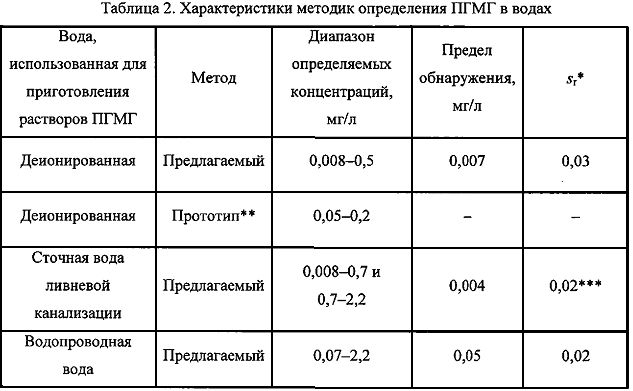
Определение ПГМГ в водах. Характеристики методик определения ПГМГ в сточной воде ливневой канализации и водопроводной воде, а также характеристики градуировочного графика, построенного на депонированной воде, приведены в табл. 2. При определении ПГМГ в сточной воде предел обнаружения составляет 2·10-8 М (0,004 мг/л), а линейность градуировочных зависимостей наблюдается в двух диапазонах: 0,007-0,7 мг/л (4·10-8-4·10-6 М) и 0,7-2,2 мг/л (4·10-6-1,2·10-5 М). При определении ПГМГ в водопроводной воде диапазон определяемых концентраций составляет 0,07-2,2 мг/л (4·10-7-1,3·10-5 М).
Для сопоставления характеристик заявляемого метода и прототипа в табл. 2 приведены значения пределов обнаружения и диапазоны определяемых концентраций ПГМГ.
Как видно из табл. 2, диапазоны определяемых концентраций ПГМГ во всех случаях шире, чем в прототипе. Нижние границы определяемых концентраций ПГМГ в депонированной и сточной водах в 6 раз ниже, чем в прототипе.
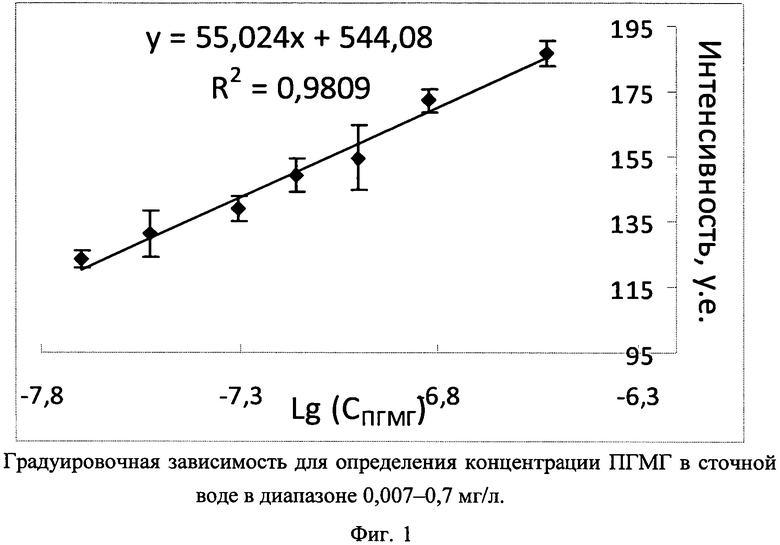
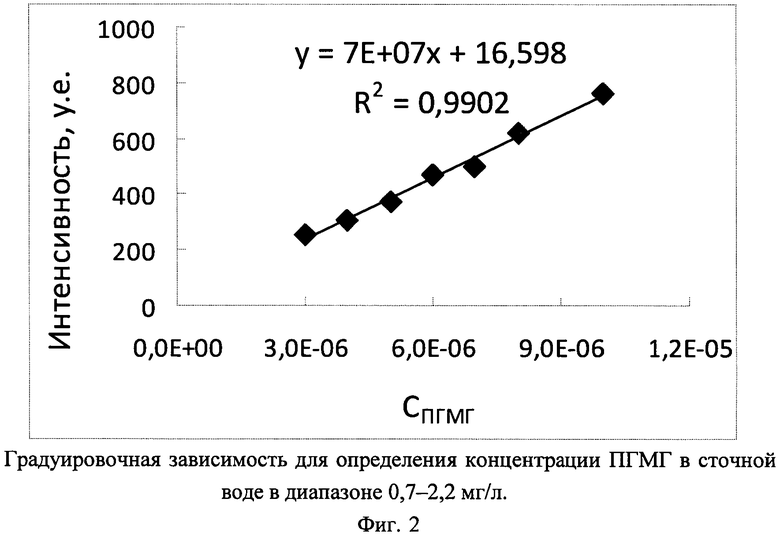
На фиг. 1 в качестве иллюстрации приведен градуировочный график для определения ПГМГ в сточной воде в диапазоне 0,007-0,7 мг/л, представляющий собой зависимость интенсивности рэлеевского рассеяния от логарифма концентрации ПГМГ. Для высоких концентраций ПГМГ (0,7-2,2 мг/л) интенсивность рассеяния пропорциональна концентрации ПГМГ; соответствующий градуировочный график приведен на фиг. 2.
Таким образом, для решения технической задачи предлагается способ, в котором предварительно полученный раствор наночастиц серебра используют в качестве реагента, образующего агрегаты с ПГМГ, присутствие которых фиксируют методом спектроскопии рэлеевского рассеяния с помощью спектрофлуориметра. Способ позволяет определять ПГМГ в сточной и водопроводной воде ниже предельно допустимых концентраций.
Пример 1 (получения реагента - раствора наночастиц серебра).
В работе следует использовать деионизованную воду, предпочтительно полученную на установке компании Millipore.
Первая стадия синтеза НЧС.
В стеклянный стакан вместимостью 50 мл помещают 19 мл воды. При комнатной температуре и интенсивном перемешивании на магнитной мешалке (воронка должна доходить до 2/3 глубины раствора) последовательно добавляют дозатором: 500 мкл 0,01 М водного раствора AgNO3, 500 мкл 0,01 М водного раствора цитрата натрия, 600 мкл 0,01 М водного раствора NaBH4 и включают секундомер. Через 30 с прекращают перемешивание (бесцветный раствор при этом приобретет желто-коричневую окраску). Закрывают стакан пленкой типа Parafilm. Избегают попадания на раствор прямых солнечных лучей. Полученный раствор зародышей можно использовать на следующей стадии не ранее чем через 2 ч после приготовления (должен окислиться избыток боргидрида). При хранении в темном месте при комнатной температуре раствор устойчив по крайней мере в течение месяца.
Вторая стадия синтеза НЧС. Стеклянный флакон вместимостью 15 мл, содержащий 5 мл раствора зародышей, при интенсивном перемешивании на магнитной мешалке (воронка должна доходить почти до дна сосуда) нагревают до кипения (при этом раствор должен изменить окраску с желто-коричневой на светло-желтую), при перемешивании добавляют 1,33 мл (2 раза дозатором по 665 мкл) 0,01 М раствора трехзамещенного цитрата натрия и кипятят 2,5 мин, после чего выключают нагрев мешалки, охлаждают раствор до комнатной температуры, не допуская попадания на раствор прямого солнечного света, и закрывают флакон крышкой. Таким образом получают концентрированный раствор НЧС (концентрация 0,00025 М по серебру). Хранят при комнатной температуре в темном месте.
Пример 2 (построения градуировочного графика на деионизованной воде).
При построении градуировочного графика в качестве реагента используют разбавленный раствор НЧС, приготовленный из концентрированного раствора НЧС разбавлением в 50 раз (4,9 мл деионизованной воды на 100 мкл концентрированного раствора НЧС). В пластиковые пробирки вместимостью 2 мл, предпочтительно типа Эппендорф с крышками, вводят по 1,5 мл деионизованной воды, от 12 до 100 мкл водного раствора ПГМГ (1·10-6, 1·10-5, 1·10-4 или 1·10-3 М), доводят деионизованной водой до 1,6 мл (0-80 мкл). Приготовление растворов подробно описано в табл. 3. Затем во все пробирки добавляют по 400 мкл разбавленного раствора НЧС, закрывают пробирки крышками и быстро переворачивают 3 раза, после чего выдерживают при комнатной температуре в течение 20 мин. Непосредственно перед измерением раствор перемешивают переворачиванием, переносят содержимое в кювету и записывают синхронный спектр флуоресценции при Δλ=0 на спектрофлуориметре (например, «Сагу Eclipse» компании Agilent) в диапазоне 400-600 нм. Предпочтительно использовать следующие параметры: ширина щелей - 5 нм, чувствительность детектора - «средняя» (напряжение на детекторе 600 В), скорость записи спектра - 600 нм/мин, шаг записи - 1 нм, время усреднения - 0,1 с.
Для каждого образца спектр записывают минимум три раза; если при этом один из спектров существенно отличается от других, записывают дополнительные спектры до совпадения по крайней мере трех спектров. За аналитический сигнал принимают интенсивность рассеянного света согласующихся между собой спектров при 485 нм. Измерение проводят предпочтительно в одноразовых пластиковых (полистирольных) кюветах размером 1×1×4 см. Учитывают тот факт, что ПГМГ сорбируется на стенках кюветы, поэтому измерения начинают с контрольного раствора (фон) и ведут от низких концентраций ПГМГ к более высоким. При переходе от более высоких концентраций ПГМГ к более низким или контрольному раствору используют новую кювету.
Пример 3 (анализа сточной воды ливневой канализации или водопроводной воды).
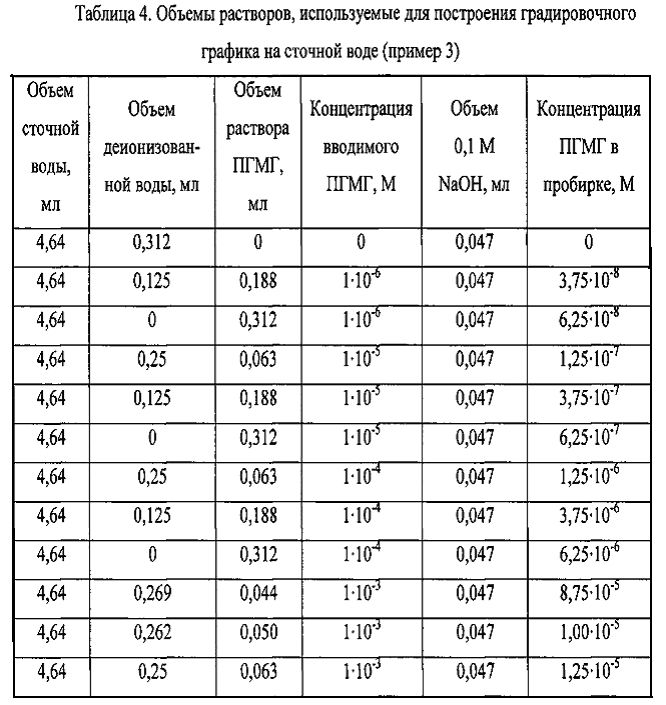
В пластиковую пробирку на 15 мл наливали 4,64 мл воды, от 44 до 312 мкл водного раствора ПГМГ (1·10-6, 1·10-5, 1·10-4 или 1·10-3 М), доводили водой Millipore до 4,95 мл. Приготовление растворов подробно описано в табл. 4. Затем в пробирки добавляли по 47 мкл 0,1 М водного раствора NaOH и центрифугировали 10 мин при скорости 2700 об/мин для удаления компонентов, повышающих фоновый сигнал. Значение pН получаемого раствора - 8,5-8,8. Из полученных растворов отбирали аликвоты объемом 1,6 мл, которые переносили в пластиковые пробирки вместимостью 2 мл и добавляли по 400 мкл раствора наночастиц серебра. Через 20 мин записывали спектр контрольного образца, как описано в примере 2, и затем - всех последующих проб в порядке увеличения концентрации ПГМГ. Градуировочные графики для определения концентрации ПГМГ в сточной воде приведены на фиг. 1 - для низких концентраций ПГМГ (0,007-0,7 мг/л) и на фиг. 2 - для высоких концентраций ПГМГ (0,7-2,2 мг/л).
* В образцы дополнительно вводили 5-10 М ЭДТА в качестве маскирующего агента
* Относительное стандартное отклонение для 3 параллельных определений.
** По данным (Апяри В.В., Дмитриенко С.Г., Золотов Ю.А. Способ определения полигексаметиленгуанидина гидрохлорида. Пат. РФ №2460998).
*** Для нижнего диапазона концентраций.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБНАРУЖЕНИЯ И ОПРЕДЕЛЕНИЯ ДНК С ЗАДАННОЙ ПОСЛЕДОВАТЕЛЬНОСТЬЮ МЕТОДОМ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕЯНИЯ | 2019 |
|
RU2723160C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЛЕНОЧНОГО МАТЕРИАЛА ПИЩЕВОГО НАЗНАЧЕНИЯ НА ОСНОВЕ ХИТОЗАНА | 2020 |
|
RU2754738C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЦИНКА (II) | 2012 |
|
RU2518967C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОЛИГЕКСАМЕТИЛЕНГУАНИДИНА ГИДРОХЛОРИДА | 2011 |
|
RU2460998C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АНАВИДИНА МЕТОДОМ ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ | 2008 |
|
RU2381501C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ГИДРОХЛОРИДА ПОЛИГЕКСАМЕТИЛЕНГУАНИДИНА В ВОДЕ | 2004 |
|
RU2252413C1 |
| ЛАКОКРАСОЧНЫЙ МАТЕРИАЛ С БИОЦИДНЫМИ СВОЙСТВАМИ | 2002 |
|
RU2195473C1 |
| Способ определения меди (I) | 2021 |
|
RU2768614C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА (II) | 2014 |
|
RU2555483C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ СЕРЕБРА | 2013 |
|
RU2526390C1 |
Изобретение относится к аналитической химии, а именно к способу определения концентрации гидрохлорида полигексаметиленгуанидина (ПГМГ) в водах различных типов. Способ основан на взаимодействии катионов ПГМГ с реагентом, представляющим собой предварительно полученный коллоидный раствор отрицательно заряженных наночастиц серебра в цитратном буфере. В ходе определения образуются агрегаты наночастиц, рэлеевское рассеяние которых измеряют путем синхронного сканирования спектра флуоресценции с нулевой разностью длин волн эмиссии и регистрации, сигнал измеряют при 485 нм. В водопроводной воде линейность градуировочной зависимости наблюдается в диапазоне 0,07-2,2 мг/л, в сточной воде ливневой канализации - в диапазонах 0,007-0,7 и 0,7-2,2 мг/л, относительное стандартное отклонение составляет 0,02-0,03. Использование способа позволяет расширить диапазон определяемых концентраций ПГМГ в воде, в частности определять концентрации ПГМГ в сточной воде на уровне ПДК для воды водоемов рыбохозяйственного назначения (0,01 мг/мл) и ниже. При этом определению ПГМГ (4·10-7 М ПГМГ в чистой воде) не мешает наличие примесей в количестве не более: 0,05 М NaCl, 200 мг/л ионов кальция, 120 мг/л ионов магния, 0,5 мг/л ионов меди (II), 0,14 мг/л н-додецилсульфата натрия, 0,1 мг/л гуминовых кислот, 0,25 мг/л неионных поверхностно-активных веществ, 0,025 мг/л катионных поверхностно-активных веществ, 0,1 мг/л бычьего сывороточного альбумина, 2,5 мкг/л полиэтиленимина. 4 табл., 3 пр., 2 ил.
Способ количественного определения концентрации гидрохлорида полигексаметиленгуанидина в водном растворе, включающий внесение в анализируемый раствор реагента, вызывающее взаимодействие реагента с гидрохлоридом полигексаметиленгуанидина, и последующий анализ полученного продукта, отличающийся тем, что в качестве реагента используют коллоидный раствор наночастиц серебра в цитратном буфере, а анализ полученного продукта проводят методом спектроскопии рэлеевского рассеяния путем построения градуировочных графиков в диапазоне 0,07-2,2 мг/л при определении ПГМГ в водопроводной воде и в диапазоне 0,007-0,7 мг/л или 0,7-2,2 мг/л при определении ПГМГ в сточной воде.
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОЛИГЕКСАМЕТИЛЕНГУАНИДИНА ГИДРОХЛОРИДА | 2011 |
|
RU2460998C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОЛИГЕКСАМЕТИЛЕНГУАНИДИН ГИДРОХЛОРИДА В ДЕЗИНФИЦИРУЮЩЕМ СРЕДСТВЕ | 2012 |
|
RU2479839C1 |
| CN 103163129 A, 19.06.2013 | |||
| Зажим для кишек | 1931 |
|
SU27303A1 |
| 0 |
|
SU401588A1 | |
| Термитная смесь | 1947 |
|
SU77895A1 |
Авторы
Даты
2015-07-27—Публикация
2014-06-04—Подача