Настоящее изобретение относится к полипептиду или полипептидному комплексу, содержащему по меньшей мере две аминокислотных последовательности, скомпонованных так, чтобы обеспечивать специфическое связывание с "рецептором конечных продуктов гликирования" (RAGE), к одной или нескольким нуклеиновой кислоте(ам), кодирующей полипептид или полипептидный комплекс, к клетке, продуцирующей антитело против RAGE, к фармацевтической композиции, содержащей по меньшей мере один полипептид или нуклеиновую кислоту, как определено выше, необязательно, для лечения связанного с RAGE заболевания или нарушения, и к способу диагностики связанного с RAGE заболевания или нарушения.
Рецептор конечных продуктов гликирования (RAGE) представляет собой трансмембранный рецептор массой 35 кДа из суперсемейства иммуноглобулинов, который впервые был охарактеризован в 1992 году Neeper et al. (Neeper et al., 1992, J.Biol.Chem. 267: 14998-15004). Он является представителем суперсемейства иммуноглобулинов, находящимся на клеточной поверхности, с множеством лигандов. RAGE состоит из внеклеточного домена, одного проходящего через мембрану домена и цитозольной хвостовой части. Внеклеточный домен рецептора состоит из домена иммуноглобулинов V-типа, за которым следуют два домена иммуноглобулинов C-типа. Цитозольный домен отвечает за передачу сигнала, а трансмембранный домен заякоривает рецептор на клеточной мембране. Вариабельный домен связывает лиганды RAGE. RAGE также существует в растворимой форме (sRAGE).
Название RAGE вытекает из его способности связывать конечные продукты гликирования (AGE), гетерогенную группу неферментативно измененных белков, которые образуются при длительных гипергликемических состояниях. Однако AGE могут быть только случайными патогенным лигандами. Помимо AGE, RAGE также способен связывать другие лиганды и, таким образом, его часто называют образ-распознающим рецептором. Однако RAGE представляет собой необычный образ-распознающий рецептор, который связывает несколько различных классов эндогенных молекул, ведущих к различным клеточным ответам, включая секрецию цитокинов, увеличение клеточного окислительно-восстановительного стресса, рост нейритов и миграцию клеток. Известные лиганды RAGE включают белки, имеющие нити из β-слоев, которые являются характерными для отложений амилоида и провоспалительных медиаторов, включая S100/кальгранулины, сывороточный амилоид (SAA) (фибриллярная форма), β-амилоидный белок (Aβ), и высокоподвижный хромосомный белок 1 группы бокс-1 (HMGB1, также известный как амфотерин). На двух моделях сепсиса у мышей было показано, что HMGB-1 является поздним медиатором летальности, и полагают, что взаимодействие между RAGE и лигандами, такими как HMGB1, играет важную роль в патогенезе сепсиса и других воспалительных заболеваний.
RAGE экспрессируется во многих типах клеток, например, в эндотелиальных и гладкомышечных клетках, макрофагах и лимфоцитах, во многих различных тканях, включая легкие, сердце, почку, скелетную мышцу и головной мозг. Экспрессия возрастает при хронических воспалительных состояниях, таких как ревматоидный артрит и диабетическая нефропатия.
Ряд важных нарушений у человека связан с увеличенной продукцией лигандов для RAGE или с увеличенной продукцией самого RAGE. Вследствие увеличенного уровня лигандов RAGE при диабете или других хронических нарушениях этот рецептор предположительно имеет этиологический эффект при ряде воспалительных заболеваний, таких как осложнения диабета, болезнь Альцгеймера и даже некоторые опухоли.
Кроме того, RAGE связывали с некоторыми хроническими заболеваниями, которые, как полагают, являются результатом повреждения сосудов. Полагают, что патогенез включает связывание лиганда, при котором RAGE передает сигнал на активацию ядерного фактора каппа-B (NF-κB). NF-κB контролирует несколько генов, которые вовлечены в воспаление. Интересно, что RAGE также активируется NF-κB. В случае состояний, где имеется большое количество лигандов RAGE (например, AGE при диабете или белок амилоида β при болезни Альцгеймера), это формирует цикл с положительной обратной связью, который приводит к хроническому воспалению. Полагают, что затем это хроническое состояние фатальным образом изменяет микрососуды и макрососуды, что приводит к повреждению органа или даже недостаточности органа. Заболеваниями, которые связывают с RAGE, являются многие хронические воспалительные заболевания, включая ревматоидный и псориатический артрит и заболевание кишечника, злокачественные опухоли, диабет и диабетическую нефропатию, амилоидозы, сердечно-сосудистые заболевания, сепсис, атеросклероз, болезнь периферических сосудов, инфаркт миокарда, застойную сердечную недостаточность, диабетическую ретинопатию, диабетическую невропатию, диабетическую нефропатию и болезнь Альцгеймера.
Соответственно, от многих из этих заболеваний эффективные лекарственные средства не доступны. Было бы полезным наличие безопасных и эффективных способов лечения таких связанных с RAGE нарушений. Один из подходов включает использование полипептидов, например, антител, связывающихся с RAGE.
Неожиданно, теперь идентифицирован ряд моноклональных антител (mAB), которые обеспечивают преимущественные характеристики. В частности, моноклональные антитела против RAGE были идентифицированы на основе набора экспериментальных данных, включающих константы связывания, перекрестную реактивность, картирование доменов и данные о функциональности in vitro (конкурентный ELISA). Исходя из указанных выше данных было отобрано 23 mAb, удовлетворяющих следующим критериям:
Константы связывания KD ≤ 1,0×10-9 M и koff ≤ 2,0×10-3 c-1.
Как известно квалифицированному специалисту, характеристики связывания антител опосредуются вариабельными доменами. Для связывания с антигеном необходимо, чтобы присутствовали подходящий вариабельный домен из тяжелой цепи и совместно действующий вариабельный домен из легкой цепи и они были расположены в порядке, позволяющем совместное действие. Вариабельный домен также называют FV-областью, и он является наиболее важной областью для связывания с антигенами. Более конкретно, за связывание с антигеном ответственны вариабельные петли, по три на легкой (VL) и тяжелой (VH) цепях. Эти петли называют определяющими комплементарность областями (CDR). Эти три петли называют L1, L2 и L3 для VL, и H1, H2 и H3 для VH. Однако в данной области известно многообразие различных компоновок вариабельного домена из тяжелой цепи и действующего совместно с ним вариабельного домена из легкой цепи. Таким образом, идентификация подходящего домена из тяжелой цепи и действующего совместно с ним вариабельного домена из легкой цепи является необходимой для настоящего изобретения. Таким образом, их последовательности были идентифицированы для 23 антител, указанных выше.
Таким образом, в первом аспекте настоящее изобретение относится к полипептиду или полипептидному комплексу, содержащему по меньшей мере две аминокислотных последовательности или их функционально активных варианта, где по меньшей мере две аминокислотных последовательности представляют собой:
- SEQ ID NO:1 и SEQ ID NO:24,
- SEQ ID NO:2 и SEQ ID NO:25,
- SEQ ID NO:3 и SEQ ID NO:26,
- SEQ ID NO:4 и SEQ ID NO:27,
- SEQ ID NO:5 и SEQ ID NO:28,
- SEQ ID NO:6 и SEQ ID NO:29,
- SEQ ID NO:7 и SEQ ID NO:30,
- SEQ ID NO:8 и SEQ ID NO:31,
- SEQ ID NO:9 и SEQ ID NO:32,
- SEQ ID NO:10 и SEQ ID NO:33,
- SEQ ID NO:11 и SEQ ID NO:34,
- SEQ ID NO:12 и SEQ ID NO:35,
- SEQ ID NO:13 и SEQ ID NO:36,
- SEQ ID NO:14 и SEQ ID NO:37,
- SEQ ID NO:15 и SEQ ID NO:38,
- SEQ ID NO:16 и SEQ ID NO:39,
- SEQ ID NO:17 и SEQ ID NO:40,
- SEQ ID NO:18 и SEQ ID NO:41,
- SEQ ID NO:19 и SEQ ID NO:42,
- SEQ ID NO:20 и SEQ ID NO:43,
- SEQ ID NO:21 и SEQ ID NO:44,
- SEQ ID NO:22 и SEQ ID NO:45, и/или
- SEQ ID NO:23 и SEQ ID NO:46,
где эти последовательности расположены так, чтобы обеспечить специфическое связывание с "рецептором конечных продуктов гликирования" (RAGE).
В соответствии с настоящим изобретением полипептид или полипептидный комплекс содержит по меньшей мере две аминокислотные последовательности или их функционально активных варианта, как определено выше. Последовательности SEQ ID NO:1-23 представляют собой вариабельные домены легких цепей, и последовательности SEQ ID NO:24-46 представляют собой вариабельные домены тяжелых цепей идентифицированных антител (как определено с помощью анализа последовательности). SEQ ID NO вариабельного домена тяжелой цепи, соответствующего преобладающему вариабельному домену легкой цепи, можно определять добавлением 23 к SEQ ID NO указанного вариабельного домена легкой цепи. Например, SEQ ID NO вариабельного домена тяжелой цепи, соответствующего вариабельному домену легкой цепи SEQ ID NO:5, представляет собой SEQ ID NO:28 (5+23).
Для настоящего изобретения необходимо, чтобы полипептид или полипептидный комплекс содержал две совместно действующих аминокислотных последовательности или их функционально активных варианта, как определено выше. Если они скомпонованы подходящим образом, компоновка позволяет специфическое связывание с RAGE. К настоящему времени разработано и идентифицировано множество различных форматов антител. Для полипептида или полипептидного комплекса по настоящему изобретению можно использовать любую из этих или других пригодных компоновок, при условии что формат или компоновка позволяют специфическое связывание с RAGE.
Две последовательности, как определено в указанных выше SEQ ID NO или их вариантах, могут быть скомпонованы в один полипептид или в пептидный комплекс. Если они скомпонованы в один полипептид, две последовательности могут быть соединены линкерной последовательностью, предпочтительно, пептидным линкером, например, таким как слитый белок. Если они скомпонованы в полипептидный комплекс, два или более полипептида связаны друг с другом нековалентной связью, включая водородные связи, ионные связи, ван-дер-ваальсовы силы и гидрофобные взаимодействия. Описанные выше последовательности или их функционально активные варианты могут формировать полипептид или полипептидный комплекс или могут быть их частью.
Полипептид (также известный как белки) представляет собой органическое соединение, образованное из α-аминокислот, расположенных в виде линейной цепи. Аминокислоты в полимерной цепи связаны друг с другом пептидными связями между карбоксильной и аминогруппами соседних аминокислотных остатков. Как правило, генетический код определяет 20 стандартных аминокислот. После синтеза или даже в процессе синтеза остатки в белке могут подвергаться химической модификации путем посттрансляционной модификации, которая изменяет физические и химические свойства, укладку, стабильность активность, и, в конечном итоге, функцию белков.
Полипептиды или их комплексы, как определено в настоящем документе, селективно распознают и специфично связываются с RAGE. Использование в настоящем документе терминов "селективный" или "специфичный" относится к тому факту, что описанные полипептиды или их комплексы не демонстрируют существенного связывания со структурами, отличными от RAGE, за исключением тех конкретных случаев, когда полипептид/комплекс дополнены так, чтобы они обеспечивали дополнительную отличающуюся специфичность специфичному к RAGE связывающему белку (как например, в биспецифических или бифункциональных молекулах, где молекула сконструирована так, чтобы связывать две структуры или выполнять две функции, по меньшей мере одной из которых является специфичное связывание RAGE). В конкретных вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 1,2×10-6 или менее. В конкретных вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 5×10-7 или менее, 2×10-7 или менее, или 1×10-7 или менее. В дополнительных вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 1×10-8 или менее. В других вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 5×10-9 или менее, или 1×10-9 или менее. В следующих вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 1×10-10 или менее, KD 1×10-11 или мене, или KD 1×10-12 или менее. В конкретных вариантах осуществления специфичные к RAGE полипептиды или их комплексы не связываются с другими белками с более высокими KD.
KD относится к константе диссоциации, получаемой из отношения kd (скорость диссоциации для конкретного взаимодействия связывающая молекула - белок-мишень; также называемая koff) к ka (скорость ассоциации для конкретного взаимодействия связывающая молекула - белок-мишень; также называемая kon), или kd/ka, которую выражают в молярной концентрации (M). Величины KD можно определять с использованием способов, общепринятых в данной области. Предпочтительный способ определения KD связывающей молекулы представляет собой способ с использованием поверхностного плазмонного резонанса, например, биосенсорной системы, такой как система Biacore(TM) (GE Healthcare Life Sciences) (см. пример 5 и таблицу 2). Другой способ представлен на фиг. 2 и в примере 2.
Было показано, что специфичные к RAGE полипептиды или их комплексы зависимым от дозы образом ингибируют взаимодействие RAGE/лиганд (см. фиг. 4, пример 3 и 4 и таблицу 1). Таким образом, специфичные к RAGE полипептиды или их комплексы могут быть охарактеризованы их способностью противодействовать связыванию лиганда с RAGE. Степень ингибирования любым специфичным к RAGE полипептидом или его комплексом можно количественно определять путем статистического сравнения с контролем, или любым альтернативным способом, доступным в данной области. В конкретных вариантах осуществления ингибирование представляет собой по меньшей мере приблизительно 10% ингибирование. В других вариантах осуществления ингибирование составляет по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95%.
Полипептид или его комплекс также может содержать функционально активный вариант указанных выше последовательностей. Функционально активный вариант по изобретению характеризуется наличием биологической активности, сходной с активностью, которую проявляет полный белок, включая способность связываться с RAGE и необязательно ингибировать RAGE. Вариант является функционально активным в контексте настоящего изобретения, если активность (например, активность связывания, необязательно выраженная в качестве KD) варианта составляет по меньшей мере 10%, предпочтительно, по меньшей мере 25%, более предпочтительно, по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, особенно по меньшей мере 90%, в частности по меньшей мере 95%, наиболее предпочтительно, по меньшей мере 99% от активности пептида/комплекса без изменения последовательности. Подходящие способы определения активности связывания с RAGE приведены в “Примерах”. Функционально активный вариант можно получать с путем ограниченного количества аминокислотных замен, делеций и/или вставок.
В предпочтительном варианте осуществления настоящего изобретения функционально активный вариант любой последовательности из SEQ ID NO:1-23 содержит определяющую комплементарность область L3 (CDR L3), предпочтительно, CDR L1, CDR L2 и CDR L3, соответствующей последовательности SEQ ID NO:1-23; и/или функционально активный вариант любой из последовательностей SEQ ID NO:24-46 содержит определяющую комплементарность область H3 (CDR H3), предпочтительно, CDR H1, CDR H2 и CDR H3, соответствующей последовательности SEQ ID NO:24-46. В наиболее предпочтительном варианте осуществления функционально активный вариант любой из последовательностей SEQ ID NO:1-23 содержит CDR L1, CDR L2 и CDR L3 соответствующей последовательности SEQ ID NO:1-23; и функционально активный вариант любой из последовательностей SEQ ID NO:24-46 содержит CDR H1, CDR H2 и CDR H3 соответствующей последовательности SEQ ID NO:24-46. Альтернативно одна из последовательностей может представлять собой SEQ ID NO:1-46 без каких-либо изменений последовательности, а другой вариант может быть таким, как определено в настоящем документе.
Описаны различные способы идентификации CDR в последовательности вариабельной области. Кроме того, известен ряд программ, которые можно использовать для этой цели. Однако следующий набор правил применим к последовательностям SEQ ID NO:1-46 для идентификации CDR в этих последовательностях (также см. www.bioinf.org.uk; MacCallum et al., 1996, J. Mol. Biol. 262 (5): 732-745; Antibody Engineering Lab Manual, Chapter "Protein Sequence and Structure Analysis of Antibody Variable Domains", Ed.: Duebel, S. and Kontermann, R., Springer-Verlag, Heidelberg). Последовательности с указанными CDR представлены на фигуре 1.
Как подробно описано выше, в VH и VL имеются гипервариабельные области, которые демонстрируют наибольшую вариабельность последовательностей от одного антитела к другому, и каркасные области, которые являются менее вариабельными. Укладка обеспечивает сближение гипервариабельных областей с образованием антигенсвязывающих карманов. Эти участки наиболее тесного контакта между антителом и антигеном представляют собой CDR антитела, которая опосредует специфичность антитела. Таким образом, они имеют особое значение для связывания антигена. Хотя предпочтительно, чтобы функционально активный вариант содержал три CDR, было выявлено, что для некоторых антител для обеспечения специфичности являются достаточными CDR-L3 и CDR-H3. Таким образом, в одном из вариантов осуществления обязательным является только присутствие CDR-L3 и CDR-H3. В любом случае CDR должны быть расположены так, чтобы обеспечивать специфическое связывание антигена, в данном случае RAGE.
В предпочтительном варианте осуществления настоящего изобретения CDR (CDR-L3 и -H3; или CDR-L1, -L2, -L3, -H1, -H2 и -H3) расположены в каркасной области преобладающего вариабельного домена, т.е. L1, L2 и L3 в каркасной области VL, и H1, H2 и H3 в каркасной области VH. Это означает, что CDR, идентифицированные любым подходящим способом или представленные на фиг. 1, можно удалять из представленных соседних областей и переносить в другой (второй) вариабельный домен, тем самым заменяя CDR второго вариабельного домена. Для иллюстрации CDR SEQ ID NO:1 и 24 можно использовать для замены CDR SEQ ID NO:2 и 27. Кроме того, можно использовать каркасную область вариабельного домена, которая не представлена на фиг. 1. Множество вариабельных доменов или последовательностей антител известны в данной области и их можно использовать для этой цели. Например, вариабельные домены, в которые встроены представляющие интерес CDR, можно получать из любого вариабельного домена эмбрионального типа или подвергнутого реаранжировке вариабельного домена человека. Вариабельные домены также можно получать синтетически. Области CDR можно встраивать в соответствующие вариабельные домены с использованием технологии рекомбинантных ДНК. Один из способов достижения этого описан в Marks et al., 1992, Bio/Technology 10:779-783. Вариабельный домен тяжелой цепи может образовывать пару с вариабельным доменом легкой цепи с образованием антигенсвязывающего центра. Кроме того, для связывания антигена можно использовать независимые области (например, вариабельный домен тяжелой цепи отдельно).
Наконец, в другом варианте осуществления CDR можно переносить в соседнюю область не вариабельного домена, при условии, что CDR в соседней области располагается так, чтобы обеспечивалось специфическое связывание с RAGE.
В предпочтительном варианте осуществления полипептида или полипептидного комплекса по настоящему изобретению аминокислотная последовательность SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 и/или SEQ ID NO:23 или ее функционально активный вариант представляет собой вариабельный домен легкой цепи (VL).
Альтернативно или дополнительно, аминокислотная последовательность SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45 и/или SEQ ID NO:46 или ее функционально активный вариант представляет собой вариабельный домен тяжелой цепи (VH).
В предпочтительном варианте осуществления настоящего изобретения полипептид или полипептидный комплекс представляет собой антитело.
Природные антитела представляют собой глобулярные белки плазмы (~150 кДа), которые также известны как иммуноглобулины, которые обладают общей основной структурой. Поскольку они имеют цепи сахаров, присоединенные к аминокислотным остаткам, они представляют собой гликопротеины. Основным функциональным элементом каждого антитела является мономер иммуноглобулина (Ig) (содержащий только один элемент Ig); секретируемые антитела также могут быть димерными с двумя элементами Ig, как в случае IgA, тетрамерными с четырьмя элементами Ig, такими как IgM костистых рыб, или пентамерными с пятью элементами Ig, такими как IgM млекопитающих. В настоящем изобретении примеры подходящих форматов включают формат природных антител, включая изотипы антител, известные как IgA, IgD, IgE, IgG и IgM.
Мономер Ig представляет собой молекулу в форме "Y", которая состоит из четырех полипептидных цепей; две идентичных тяжелых цепи и две идентичных легких цепи связаны дисульфидными связями между остатками цистеина. Каждая тяжелая цепь имеет длину приблизительно 440 аминокислот; каждая легкая цепь имеет длину приблизительно 220 аминокислот. Каждая из тяжелой и легкой цепей содержит дисульфидные связи внутри цепей, которые стабилизируют их укладку. Каждая цепь состоит из структурных доменов, называемых Ig-доменами. Эти домены содержат приблизительно 70-110 аминокислот и их подразделяют на различные категории (например, вариабельные или V, и константные или C) согласно их размеру и функции. Они имеют характерную укладку иммуноглобулинов, в которой два бета-слоя образуют форму "сэндвича", удерживаются вместе взаимодействиями между консервативными остатками цистеина и другими заряженными аминокислотами.
Существует пять типов тяжелых цепей Ig млекопитающих, обозначаемых как α, δ, ε, γ и μ. Тип присутствующей тяжелой цепи определяет изотип антитела; эти цепи встречаются в антителах IgA, IgD, IgE, IgG и IgM, соответственно.
Различные тяжелые цепи отличаются по размеру и составу; α и γ содержат приблизительно 450 аминокислот и δ содержит приблизительно 500 аминокислот, в то время как μ и ε имеют приблизительно 550 аминокислот. Каждая тяжелая цепь имеет две области, константную область (CH) и вариабельную область (VH). У одного вида константные области идентичны во всех антителах одного и того же изотипа, но отличаются в антителах отличающихся изотипов. Тяжелые цепи γ, α и δ имеют константную область, состоящую из трех тандемных Ig-доменов и шарнирной области для дополнительной гибкости; тяжелые цепи μ и ε имеют константную область, состоящую из четырех доменов иммуноглобулинов. Вариабельные области тяжелой цепи отличаются в антителах, продуцируемых различными B-клетками, но являются одинаковыми для всех антител, продуцируемых единичной B-клеткой или клоном B-клеток. Вариабельная область каждой тяжелой цепи имеет длину приблизительно 110 аминокислот и состоит из одного Ig-домена.
У млекопитающих существует два типа легких цепей иммуноглобулинов, обозначаемых как λ и κ. Легкая цепь имеет два последовательно расположенных домена: один константный домен (CL) и один вариабельный домен (VL). Приблизительная длина легкой цепи составляет 211-217 аминокислот. Каждое антитело содержит две легкие цепи, которые всегда идентичны; у млекопитающих на антитело присутствует только один тип легкой цепи, κ или λ. У низших позвоночных, таких как Chondrichthyes и Teleostei встречаются другие типы легких цепей, такие как ι.
В дополнение к природным антителам, были разработаны искусственные форматы антител, включая фрагменты антител. Некоторые из них описаны далее. Однако также настоящее изобретение охватывает любой другой формат антител, содержащий или состоящий из описанного выше полипептида(ов) и позволяющий специфическое связывание с RAGE.
Хотя основанная структура всех антител является высоко сходной, уникальное свойство данного антитела определяется вариабельными (V) областями, как подробно описано выше. Более конкретно, вариабельные петли, по три на каждую легкую цепь (VL) и три на каждую тяжелую цепь (VH), отвечают за связывание с антигеном, т.е. за его антигенную специфичность. Эти петли называют определяющими комплементарность областями (CDR). Поскольку CDR из обоих доменов VH и VL вносят вклад в антигенсвязывающей центр, конечная антигенная специфичность определяется комбинацией тяжелой и легкой цепей, но не какой-либо из них отдельно.
Таким образом, термин "антитело", как используют в настоящем документе, означает любой полипептид, который обладает структурным сходством с природным антителом и способен специфично связываться с RAGE, где специфичность связывания определяется CDR в SEQ ID NO:1-46, например, как представлено на фиг. 1. Таким образом, "антитело" относится к происходящей из иммуноглобулина структуре со специфическим связыванием с RAGE, включая, но не ограничиваясь ими, полноразмерное или целое антитело, антигенсвязывающий фрагмент (фрагмент, происходящий, физически или по существу, из структуры антитела), производное любого из вышесказанных, химерную молекулу, слитую молекулу любого из вышесказанных с другим полипептидом, или любую альтернативную структуру/композицию, которая селективно связывается с RAGE и необязательно ингибирует функцию RAGE. Антитело может представлять собой любой полипептид, который содержит по меньшей мере один антигенсвязывающий фрагмент. Антигенсвязывающие фрагменты состоят по меньшей мере из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи, расположенных так, чтобы оба домена вместе были способны связываться со специфическим антигеном.
"Полноразмерные" или "полные" антитела относятся к белкам, которые содержат две тяжелых (H) и две легких (L) цепи, связанных друг с другом дисульфидными связями, которые содержат: (1) в контексте тяжелых цепей: вариабельную область и константную область тяжелой цепи, которая содержит три домена: CH1, CH2 и CH3; и (2) в контексте легких цепей: вариабельную область легкой цепи и константную область легкой цепи, которая содержит один домен CL. Что касается термина "полное антитело", подразумевают, что любое антитело имеет типичную общую доменную структуру природного антитела (т.е. содержащую тяжелую цепь с тремя или четырьмя константными доменами и легкую цепь с одним константным доменом, а также с соответствующими вариабельными доменами), даже несмотря на то, что каждый домен может содержать другие модификации, такие как мутации, делеции или вставки, которые не изменяют общую доменную структуру.
"Фрагмент антитела" также содержит по меньшей мере один антигенсвязывающий фрагмент, как определено выше, и проявляет по существу ту же функцию и специфичность, что и полное антитело, из которого фрагмент происходит. Ограниченное протеолитическое расщепление папаином приводит к расщеплению прототипа Ig на три фрагмента. Два идентичных N-концевых фрагмента, каждый из которых содержит одну целую L-цепь и приблизительно половину H-цепи, представляют собой антигенсвязывающие фрагменты (Fab). Третий фрагмент, сходный по размеру, но содержащий C-концевую половину обеих тяжелых цепей с их дисульфидной связью между цепями, представляет собой кристаллизующийся фрагмент (Fc). Fc содержит углеводы, участки связывания комплемента и участки связывания FcR. Ограниченное расщепление пепсином приводит к одному F(ab')2-фрагменту, содержащему как оба Fab-фрагмента, так и шарнирную область, включая дисульфидную связь между цепями H-H. F(ab')2 является двухвалентным в отношении связывания антигена. Дисульфидную связь F(ab')2 можно расщеплять с получением Fab'. Более того, вариабельные области тяжелой и легкой цепей можно подвергать слиянию с образованием одноцепочечного вариабельного фрагмента (scFv).
Поскольку первое поколение полноразмерных антител имеет некоторые проблемы, многие из антител второго поколения содержат только фрагменты антител. Вариабельные домены (Fv) представляют собой наименьшие фрагменты с интактным антигенсвязывающим доменом, состоящие из одного VL и одного VH. Такие фрагменты только со связывающими доменами, можно получать с помощью ферментативных подходов или экспрессии соответствующих фрагментов генов, например, в бактериальных и эукариотических клетках. Можно использовать различные подходы, например, либо Fv-фрагмент отдельно, либо или "Fab"-фрагменты, содержащие одно из верхних плеч "Y", которое включает Fv вместе с первыми константными доменами. Эти фрагменты обычно стабилизируют внесением полипептидной связи между двумя цепями, что приводит к образованию одноцепочечного Fv (scFv). Альтернативно можно использовать связанные дисульфидной связью Fv-фрагменты (dsFv). Связывающие домены фрагментов можно комбинировать с любым константным доменом с получением полноразмерных антител или их можно подвергать слиянию с другими белками и полипептидами.
Рекомбинантный фрагмент антитела представляет собой одноцепочечный Fv-фрагмент (scFv). Как правило, он обладает высокой аффинностью к его антигену и может экспрессироваться в различных хозяевах. Эти и другие свойства делают scFv-фрагменты не только используемыми в медицине, но также имеющими потенциал для биотехнологических применений. Как подробно описано выше, в scFv-фрагменте VH- и VL-домены связаны гидрофильным и гибким пептидным линкером, который повышает эффективность экспрессии и укладки. Обычно используют линкеры приблизительно из 15 аминокислот, среди которых наиболее часто используют линкер (Gly4Ser)3. Молекулы scFv можно легко протеолитически деградировать, в зависимости от используемого линкера. С развитием способов генетической инженерии эти ограничения смогли быть практически преодолены с помощью исследований, сфокусированных на повышении функции и стабильности. Примером является получение стабилизированных дисульфидами (или связанных дисульфидами) Fv-фрагментов, где димер VH-VL стабилизирован дисульфидной связью между цепями. На поверхности контакта доменов VL и VH встраивают остатки цистеина, формируя дисульфидные связи, которые удерживают два домена вместе.
Диссоциация scFv приводит к мономерным scFv, которые могут образовывать комплексы с формированием димеров (диател), тримеров (триател) или более крупных агрегатов, таких как TandAb и Flexibody.
Антитела с двумя связывающими доменами можно получать либо путем связывания двух scFv с простой полипептидной связью (scFv)2, либо путем димеризации двух мономеров (диател). Наиболее простыми конструкциями являются диатела, которые имеют два функциональных антигенсвязывающих домена, которые могут быть одинаковыми, сходными (двухвалентные диатела) или обладают специфичностью к различным антигенам (биспецифические диатела). Эти биспецифические антитела позволяют, например, дополнение новыми эффекторными функциями (таких как функции цитотоксических T-клеток) в отношении клеток-мишеней, что делает их высоко пригодными для применения в медицине.
Недавно были разработаны форматы антител, содержащие четыре вариабельных домена тяжелых цепей и четыре вариабельных домена легких цепей. Их примеры включают четырехвалентные биспецифические антитела (TandAb и Flexibody, Affimed Therapeutics AG, Heidelberg. Германия). В противоположность биспецифическому диателу, биспецифическое TandAb представляет собой гомодимер, состоящий только из одного полипептида. Вследствие двух различных цепей диатело может быть сформировано тремя различными димерами, только один из которых является функциональным. Таким образом, проще и дешевле получать и очищать этот гомогенный продукт. Более того, TandAb обычно демонстрирует лучшие связывающие свойства (наличие удвоенного количества участков связывания) и увеличенную стабильность in vivo. Flexibody представляют собой комбинацию scFv с мультимерным мотивом диатела с образованием поливалентной молекулы с высокой степенью гибкости для связывания двух молекул, которые достаточно удалены друг от друга на клеточной поверхности. Если присутствует более двух функциональных антигенсвязывающих домена и если они обладают специфичностью к различным антигенам, антитело является полиспецифическим.
В общих словах, специфические иммуноглобулины, в которые можно встраивать конкретные описанные последовательности или, альтернативно, формируют их неотъемлемую часть, включают но не ограничиваются ими, следующие молекулы антител, которые формируют конкретные варианты осуществления настоящего изобретения: Fab (одновалентный фрагмент с вариабельным доменом легкой цепи (VL), вариабельным доменом тяжелой цепи (VH), константным доменом легкой цепи (CL) и константным доменом тяжелой цепи 1 (CH1)), F(ab')2 (двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидной связью или альтернативно в шарнирной области), Fv (домены VL и VH), scFv (одноцепочечный Fv, где VL и VH связаны линкером, например, пептидным линкером), молекула биспецифического антитела (молекула антитела, содержащая полипептид, как описано в настоящем документе, связанный со второй функциональной частью, имеющей отличающуюся специфичность связывания, чем антитело, включая, но не ограничиваясь ими, другой пептид или белок, такой как антитело или лиганд рецептора), биспецифический одноцепочечный димер Fv, диатело, триатело, тетратело, минитело (scFv, связанный с CH3).
Определенные молекулы антител, включая, но не ограничиваясь ими, Fv, scFv, молекулы диател или доменные антитела (Domantis) могут быть стабилизированы внесением дисульфидных мостиков для связывания VH- и VL-доменов. Биспецифические антитела можно получать с использованием общепринятых технологий, конкретные способы которых включают получение химически, или с помощью гибридных (гибридомы) и других технологий, включая, но не ограничиваясь ими, технологию BiTETM (молекулы, обладающие антигенсвязывающими областями с различной специфичностью с пептидным линкером) и конструирование "выступов в полостях".
Таким образом, антитело может представлять собой Fab, Fab', F(ab')2, Fv, связанный дисульфидной связью Fv, scFv, (scFv)2, двухвалентное антитело, биспецифическое антитело, полиспецифическое антитело, диатело, триатело, тетратело или минитело.
В другом предпочтительном варианте осуществления антитело представляет собой моноклональное антитело, химерное антитело или гуманизированное антитело. Моноклональные антитела представляют собой моноспецифические антитела, которые идентичны, поскольку они продуцируются одним типом иммунной клетки, все из которых являются клонами одной родительской клетки. Химерное антитело представляет собой антитело, в котором по меньшей мере одна область иммуноглобулина одного вида слита с другой областью иммуноглобулина другого вида способами генетической инженерии для снижения его иммуногенности. Например, VL- и VH-области можно подвергать слиянию с остальной частью иммуноглобулина человека. Конкретным типом химерных антител являются гуманизированные антитела. Гуманизированные антитела получают объединением ДНК, которая кодирует CDR не являющегося человеческим антитела, с продуцирующей антитело ДНК человека. Затем полученную конструкцию ДНК можно использовать для экспрессии и продуцирования антител, которые обычно не являются настолько же иммуногенными, как не являющееся человеческим исходное антитело или как химерное антитело, поскольку только CDR являются не человеческими.
В предпочтительном варианте осуществления настоящего изобретения полипептид или полипептидный комплекс содержит константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из: константного домена IgM человека, константного домена IgG1 человека, константного домена IgG2 человека, константного домена IgG3 человека, домена, константного домена IgG4 человека, константного домена IgE человека и константного домена IgA человека.
Как подробно описано выше в контексте антитела по настоящему изобретению, каждая тяжелая цепь природного антитела имеет две области: константную область и вариабельную область. Существует пять типов тяжелых цепей иммуноглобулинов млекопитающих: γ, δ, α, μ и ε, каждый из которых определяет классы иммуноглобулинов IgM, IgD, IgG, IgA и IgE, соответственно.
У человека существует четыре подкласса IgG (IgG1, 2, 3 и 4), названные по порядку их содержания в сыворотке (IgG1 содержится в наибольшем количестве). Даже несмотря на то, что существует приблизительно 95% сходство между Fc-областями подклассов IgG, структуры шарнирных областей являются относительно отличающимися. Эта область между плечами Fab (антигенсвязывающий фрагмент) и двумя С-концевыми доменами CH2 и CH3 обеих тяжелых цепей определяет гибкость молекулы. Верхний (в направлении N-конца) шарнирный сегмент позволяет вариабельность угла между плечами Fab (гибкость Fab-Fab), а также гибкость при вращении каждого отдельного Fab. Гибкость более низкой (в направлении С-конца) шарнирной области прямо определяет положение Fab-плеч относительно Fc-области (гибкость Fab-Fc). Зависимая от шарнирной области гибкость Fab-Fab и Fab-Fc может быть важной для запуска дальнейших эффекторных функций, таких как активация комплемента и связывание Fc-рецептора. Таким образом, структура шарнирных областей придает каждому из четырех классов IgG их уникальный биологический профиль.
Длина и гибкость шарнирной области варьирует среди подклассов IgG. Шарнирная область IgG1 охватывает аминокислоты 216-231 и, поскольку она является неограниченно гибкой, Fab-фрагменты могут вращаться вокруг их осей симметрии и передвигаться в пределах сферы с центром в первой из двух дисульфидных связей между тяжелыми цепями. IgG2 имеет более короткую шарнирную область, чем IgG1, с 12 аминокислотными остатками и четырьмя дисульфидными связями. Шарнирная область IgG2 лишена остатка глицина, она является относительно короткой и содержит жесткую полипролиновую двойную спираль, стабилизированную дополнительными дисульфидными связями между тяжелыми цепями. Эти свойства ограничивают гибкость молекулы IgG2. IgG3 отличается от других подклассов его уникальной расширенной шарнирной областью (приблизительно в четыре раза более длинной, чем шарнирная область IgG1), содержащей 62 аминокислоты (включая 21 остатка пролина и 11 остатков цистеина), формируя негибкую полипролиновую двойную спираль. В IgG3 Fab-фрагменты относительно удалены от Fc-фрагмента, что придает молекуле увеличенную гибкость. Удлиненная шарнирная область в IgG3 также ответственна за ее более высокую молекулярную массу по сравнению с другими подклассами. Шарнирная область IgG4 короче, чем шарнирная область IgG1, и ее гибкость является промежуточной между IgG1 и IgG2.
В предпочтительном варианте осуществления настоящего изобретения вместо указанной последовательности можно использовать функционально активный вариант любой из указанных выше последовательностей SEQ ID NO:1-46. Например, вариант может определяться тем, что этот вариант
a) представляет собой функционально активный фрагмент, состоящий из по меньшей мере 60%, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, еще более предпочтительно, по меньшей мере 95%, наиболее предпочтительно, 99% аминокислотной последовательности любой из SEQ ID NO:1-46;
b) представляет собой функционально активный вариант, обладающий по меньшей мере 60%, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, еще более предпочтительно, по меньшей мере 95%, наиболее предпочтительно, 99% последовательность идентичностью с аминокислотной последовательностью любой из SEQ ID NO:1-46; или
с) состоит из аминокислотной последовательности любой из SEQ ID NO:1-46 и 1-50 дополнительного аминокислотного остатка(ов), предпочтительно, 1-40, более предпочтительно, 1-30, еще более предпочтительно, не более чем 1-25, еще более предпочтительно, не более чем 1-10, наиболее предпочтительно, 1, 2, 3, 4 или 5 дополнительного аминокислотного остатка(ов).
Фрагмент, как определено в a), характеризуется тем, что он происходит из любой последовательности SEQ ID NO: 1-46 путем одной или нескольких делеций. Делеция(и) может быть C-концевой, N-концевой и/или внутренней. Предпочтительно, фрагмент получают посредством 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, более предпочтительно, 1, 2, 3, 4 или 5, еще более предпочтительно, 1, 2 или 3, еще более предпочтительно, 1 или 2, наиболее предпочтительно, 1 делеции(ий). Функционально активный фрагмент по изобретению характеризуется наличием биологической активности, сходной с активностью, которую проявляет полный белок, включая способность связываться с RAGE, и необязательно, ингибировать RAGE. Фрагмент антигена является функционально активным в контексте настоящего изобретения, если активность фрагмента составляет по меньшей мере 10%, предпочтительно, по меньшей мере 25%, более предпочтительно, по меньшей мере 50%, еще более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, особенно по меньшей мере 90%, в частности по меньшей мере 95%, наиболее предпочтительно, по меньшей мере 99% активности антигена без изменения последовательности. Подходящие способы определения активности связывания с RAGE приведены в разделе "Примеры".
Вариант, как определено в b), характеризуется тем, что он происходит из любой последовательности SEQ ID NO: 1-46 путем одной или нескольких модификаций аминокислот, включая делеции, вставки и/или замены. Модификация(и) может быть C-концевой, N-концевой и/или внутренней. Предпочтительно, фрагмент получают путем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, более предпочтительно, 1, 2, 3, 4 или 5, еще более предпочтительно, 1, 2 или 3, еще более предпочтительно, 1 или 2, наиболее предпочтительно, 1 модификации(ий). Функционально активный вариант по изобретению характеризуется наличием биологической активности, сходной с активностью, которую проявляет полный белок, включая способность связываться с RAGE, и необязательно ингибировать RAGE. Фрагмент антигена является функционально активным в контексте настоящего изобретения, если активность фрагмента составляет по меньшей мере 10%, предпочтительно, по меньшей мере 25%, более предпочтительно, по меньшей мере 50%, еще более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, особенно по меньшей мере 90%, в частности по меньшей мере 95%, наиболее предпочтительно, по меньшей мере 99% активности антигена без изменения последовательности.
Вариант, как определено в c), характеризуется тем, что он состоит из аминокислотной последовательности любой из SEQ ID NO:1-46 и 1-50 дополнительного аминокислотного остатка(ов). Вставка(и) может быть C-концевой, N-концевой и/или внутренней. Предпочтительно, вариант получают посредством 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, более предпочтительно, 1, 2, 3, 4 или 5, еще более предпочтительно, 1, 2 или 3, еще более предпочтительно, 1 или 2, наиболее предпочтительно, 1 вставки(вставок). Функционально активный вариант, кроме того, определяется, как описано выше (см. вариант b)).
Дополнительный аминокислотный остаток(и) согласно (b) и/или (c) может представлять собой любую аминокислоту, которая может быть либо L- и/или D-аминокислотой, природной и иной. Предпочтительно, аминокислота представляет собой любую природную аминокислоту, такую как аланин, цистеин, аспарагиновая кислота, глутаминовая кислота, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан или тирозин.
Однако аминокислота также может представлять собой модифицированную или необычную аминокислоту. Их примерами являются 2-аминоадипиновая кислота, 3-аминоадипиновая кислота, бета-аланин, 2-аминомасляная кислота, 4-аминомасляная кислота, 6-аминокапроновая кислота, 2-аминогептановая кислота, 2-аминоизомасляная кислота, 3-аминоизомасляная кислота, 2-аминопимелиновая кислота, 2,4-диаминомасляная кислота, десмосин, 2,2'-диаминопимелиновая кислота, 2,3-диаминопропионовая кислота, N-этилглицин, N-этиласпарагин, гидроксилизин, аллогидроксилизин, 3-гидроксипролоин, 4-гидроксипролоин, изодесмосин, аллоизолейцин, N-метилглицин, N-метилизолейцин, 6-N-метиллизин, N-метилвалин, норвалин, норлейцин или орнитин. Кроме того, аминокислоту можно подвергать модификациям, таким как посттрансляционные модификации. Примеры модификаций включают ацетилирование, амидацию, блокирование, формилирование, гидроксилирование карбоксиглутаминовой кислоты, гликозилирование, метилирование, фосфорилирование и сульфатацию. Если в пептиде присутствует более одного дополнительного или гетерологичного аминокислотного остатка, аминокислотные остатки могут быть одинаковыми или могут отличаться друг от друга.
Процентную идентичность последовательностей можно определять, например, выравниванием последовательностей. Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны, например, в Smith and Waterman, Adv. Appl. Math. 2: 482, 1981 или Pearson and Lipman, Proc. Natl. Acad. Sci.US. A. 85: 2444, 1988.
NCBI Basic Local Alignment Search Tool (BLAST) (Altschul et al., J. Mol. Biol. 215: 403-410, 1990) доступен из нескольких источников, включая National Center for Biotechnology Information (NCBI, Bethesda, MD) и через Интернет, для использования применительно к программам для анализа последовательностей blastp, blastn, blastx, tblastn и tblastx. Варианты любой из последовательностей SEQ ID NO:1-46, как правило, охарактеризовывают с использованием NCBI Blast 2.0, blastp с пропусками с параметрами по умолчанию. Для сравнения аминокислотных последовательностей по меньшей мере 30 аминокислот используют функцию 2 последовательностей Blast с использованием матрицы BLOSUM62, установленной на параметры по умолчанию, (штраф за продолжение пропуска 11, и штраф за внесение пропуска 1). При выравнивании коротких пептидов (менее чем приблизительно 30 аминокислот), выравнивание проводят с использованием функции 2 последовательностей Blast, используя матрицу PAM30, установленную на параметры по умолчанию (штраф за внесение пропуска 9, штраф за продолжение пропуска 1). Способы определение идентичности последовательностей на протяжении таких коротких окон, таких как 15 аминокислот или менее, описаны на web-сайте, поддерживаемом National Center for Biotechnology Information, Bethesda, Maryland.
В более предпочтительном варианте осуществления функционально активный вариант, как определено выше, происходит из аминокислотной последовательности любой из SEQ ID NO:1-46 путем одной или нескольких консервативных аминокислотных замен.
Консервативные аминокислотные замены, как будет понятно специалисту в данной области, представляют собой замены, которые заменяют аминокислотный остаток остатком, обеспечивающим сходные или улучшенные (для предполагаемой цели) функциональные и/или химические характеристики. Например, консервативные аминокислотные замены часто представляют собой замены, когда аминокислотный остаток заменен аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Такие модификации не снижают или не изменяют существенно характеристики связывания или функциональные характеристики ингибирования у полипептида (комплекса), хотя они могут улучшить такие свойства. Цель внесения замены не является существенной и может включать, но не ограничиваться этим, замену остатка остатком, лучше способным поддерживать или усиливать структуру молекулы, заряд или гидрофобность молекулы или размер молекулы. Например, может быть желательным просто заменить менее желаемый остаток остатком с той же полярностью или зарядом. Такие модификации можно вносить стандартными способами, известными в данной области, такими как сайт-направленный мутагенез и ПЦР-опосредуемый мутагенез. Одним конкретным способом, с помощью которого специалисты в данной области проводят консервативные аминокислотные замены, является сканирующий аланином мутагенез. Затем измененные полипептиды тестируют на наличие сохраненной или улучшенной функции с использованием функциональных анализов, доступных в данной области или описанных в разделе "Примеры". В более предпочтительном варианте осуществления настоящего изобретения количество консервативных замен в любой из последовательностей SEQ ID NO:1-46 составляет не более чем 20, 19, 18, 27, 26, 15, 14, 13, 12 или 11, предпочтительно, не более чем 10, 9, 8, 7 или 6, особенно, не более чем 5, 4, 3, в частности 2 или 1.
Другой аспект настоящего изобретения относится к одной или нескольким нуклеиновой кислоте(ам), кодирующей полипептид или полипептидный комплекс в соответствии с настоящим изобретением. Молекулы нуклеиновых кислот по настоящему изобретению могут быть в форме РНК, такой как мРНК или кРНК, или в форме ДНК, включая, например, кДНК и геномную ДНК, например, полученную клонированием или продуцируемую химическими способами синтеза или их комбинацией. ДНК может быть трехцепочечной, двухцепочечной или одноцепочечной. Одноцепочечная ДНК может представлять собой кодирующую цепь, также известную как смысловая цепь, или она может представлять собой некодирующую цепь, также обозначаемую как антисмысловая цепь. Молекула нуклеиновой кислоты, как используют в настоящем документе, также относится, среди прочих, к одноцепочечной или двухцепочечной ДНК, ДНК, которая представляет собой смесь одноцепочечной и двухцепочечной РНК, и РНК, которая представляет собой смесь одноцепочечных и двухцепочечных участков, гибридным молекулам, содержащим ДНК и РНК, которые могут быть одноцепочечными или, более конкретно, двухцепочечными или трехцепочечными, или могут представлять собой смесь одноцепочечных и двухцепочечных участков. Кроме того, молекула нуклеиновой кислоты, как используют в настоящем документе, относится к трехцепочечным участкам, содержащим РНК или ДНК или как РНК, так и ДНК.
Нуклеиновая кислота также включает последовательности, которые являются результатом вырожденности генетического кода. Существует 20 природных аминокислот, большинство из которых определяются более чем одним кодоном. Таким образом, в изобретение включаются все нуклеотидные последовательности, которые приводят к пептиду(ам), как определено выше.
Кроме того, нуклеиновая кислота может содержать одно или несколько модифицированных оснований. Такие нуклеиновые кислоты также могут содержать модификации, например, в рибозофосфатном остове для увеличения стабильности и времени полужизни таких молекул в физиологической окружающей среде. Таким образом, ДНК или РНК с остовами, модифицированными для придания стабильности или для других целей, представляют собой "молекулу нуклеиновой кислоты", поскольку этот признак подразумевается в настоящем документе. Более того, в контексте настоящего изобретения молекулой нуклеиновой кислоты является ДНК или РНК, содержащая необычные основания, такие как инозин, или модифицированные основания, такие как тритилированные основания, в качестве только двух примеров. Понятно, что в ДНК и РНК вносят широкое множество модификаций, которые служат для многих пригодных целей, известных специалистам в данной области. Термин "молекула нуклеиновой кислоты", как его используют в настоящем документе, охватывает такие химически, ферментативно или метаболически модифицированные формы молекулы нуклеиновой кислоты, а также химические формы ДНК и РНК, характерные для вирусов и клеток, включая, среди прочих, простые и комплексные клетки. Например, можно вносить нуклеотидные замены, которые не влияют на полипептид, кодируемый нуклеиновой кислотой, и, таким образом, настоящее изобретение охватывает любую молекулу нуклеиновой кислоты, которая кодирует антиген или его фрагмент или функциональный активный вариант, как определено в настоящем документе.
Более того, любую из молекул нуклеиновых кислот, кодирующих один или несколько полипептидов по изобретению, включая их фрагменты или функционально активные варианты, можно функционально связывать, с использованием стандартных способов, таких как стандартные способы клонирования, с любой желательной регуляторной последовательностью, лидерной последовательностью, гетерологичной маркерной последовательностью или гетерологичной кодирующей последовательностью, с получением слитого белка.
Нуклеиновая кислота по изобретению может быть исходно сформирована in vitro или в клетке в культуре, как правило, путем манипулирования нуклеиновыми кислотами с помощью эндонуклеаз, и/или экзонуклеаз, и/или полимераз, и/или лигаз, и/или рекомбиназ, или других способов, известных специалисту в данной области, для получения нуклеиновых кислот.
В предпочтительном варианте осуществления нуклеиновая кислота находится в векторе. Вектор может дополнительно включать последовательности нуклеиновых кислот, которые позволяют ему реплицироваться в клетке-хозяине, такие как ориджин репликации, один или несколько терапевтических генов и/или генов селективных маркеров и других генетических элементов, известных в данной области, таких как регуляторные элементы, направляющие транскрипцию, трансляцию и/или секрецию кодируемого белка. Вектор можно использовать для трансдукции, трансформации или инфицирования клетки, тем самым обеспечивая экспрессию в клетке нуклеиновых кислот и/или белков, отличных от нуклеиновых кислот и/или белков, являющихся нативными для клетки. Вектор необязательно включает материалы, способствующие обеспечению проникновения нуклеиновой кислоты в клетку, такие как вирусная частица, липосома, белковое покрытие и т.п. В данной области для экспрессии белка стандартными способами молекулярной биологии известны многочисленные типы подходящих векторов экспрессии. Такие векторы выбирают среди общепринятых типов векторов, включая векторы насекомых, например, бакуловирсные экспрессирующие системы или экспрессирующие системы грибов, бактерий или вирусов. Также для этой цели можно использовать другие подходящие векторы экспрессии, многочисленные типы которых известны в данной области. Способы получения таких векторов экспрессии хорошо известны (см., например, Sambrook et al, Molecular Cloning. A Laboratory Manual, 2nd edition, Cold Spring Harbor Laboratory, New York (1989)). В одном из вариантов осуществления вектор представляет собой вирусный вектор. Вирусные векторы включают, но не ограничиваются ими, ретровирусные и аденовирусные векторы.
Подходящие клетки-хозяева или клеточные линии для трансфекции этим способом включают бактериальные клетки. Например, в области биотехнологии в качестве клеток-хозяев используют хорошо известные различные штаммы E. coli. Также в этом способе можно использовать различные штаммы B. subtilis, Pseudomonas, Streptomyces и другие бациллы и т.п. Также для экспрессии пептидов по настоящему изобретению в качестве клеток-хозяев доступны многие штаммы дрожжевых клеток, известные специалистам в данной области. Также в качестве экспрессирующих систем можно использовать другие клетки грибов или клетки насекомых, такие как клетки Spodoptera frugipedera (Sf9). Альтернативно можно использовать клетки млекопитающих, такие как клетки человека 293, клетка яичника китайского хомячка (CHO), клеточная линия обезьяны COS-1 или клетки мыши 3T3, происходящие из мышей Swiss, BALB/c или NIH. Другие подходящие клетки-хозяева, а также способы трансфекции, культивирования, амплификации, скрининга, продукции и очистки известны в данной области.
Полипептид(ы) или полипептидный комплекс по изобретению можно получать путем экспрессии нуклеиновой кислоты по изобретению в подходящей клетке-хозяине. Клетки-хозяева можно трансфицировать, например, общепринятыми способами, такими как электропорация, по меньшей мере одним вектором экспрессии, содержащим нуклеиновую кислоту по изобретению, под контролем регулирующей транскрипцию последовательности. Затем трансфицированную или трансформированную клетку-хозяина культивируют в условиях, которые обеспечивают экспрессию белка. Экспрессированный белок извлекают, выделяют и необязательно очищают из клетки (или из культуральной среды в случае внеклеточной экспрессии) подходящими способами, известными специалисту в данной области. Например, белки выделяют в растворимой форме после лизиса клеток или экстрагируют с использованием известных способов, например, в гуанидинхлориде. Если желательно полипептид(ы) по изобретению получают в качестве слитого белка. Такие слитые белки представляют собой слитые белки, описанные выше. Альтернативно, например, может быть желательным получение слитых белков для усиления экспрессии белка в выбранной клетке-хозяине или для улучшения очистки. Молекулы, содержащие полипептиды по этому изобретению, кроме того, можно очищать с использованием любого из множества общепринятых способов, включая, но не ограничиваясь ими: жидкостную хроматографию, такую как нормально-фазовая и обращенно-фазовая, с использованием ВЭЖХ, FPLC и т.п.; аффинную хроматографию (такую как с неорганическими лигандами или моноклональными антителами); эксклюзионную хроматографию; хроматографию с иммобилизованными хелатами металлов; гель-электрофорез; и т.п. Специалист в данной области может выбрать наиболее подходящие способы выделения и очистки без отклонения от объема этого изобретения. Такая очистка обеспечивает антиген в форме, по существу свободной от других белковых и небелковых материалов микроорганизма.
Другой аспект настоящего изобретения относится к клетке, продуцирующей антитело в соответствии с настоящим изобретением.
Как и другие белки, полипептиды по настоящему изобретению можно продуцировать in vitro в серии клеточных экспрессирующих систем. Они могут включать клетки CHO (происходящие из яичника китайского хомячка), дрожжи (Saccharomyces или Pichia), нитчатые грибы, трансгенные растения и E. coli.
Первоначально использование экспрессирующих систем E. coli было ограничено, главным образом, продуцированием фрагментов антител. Эти фрагменты успешно экспрессировались и секретировались в E. coli. Fab часто используют в диагностике, в лекарственных средствах и при тестировании вариабельных областей, предназначенных для повторного включения в полноразмерные моноклональные антитела. Другим успешным использованием продуцирования в E. coli является слияние функционального белка с Fab. Нацеленную на антиген специфическую область Fab подвергают слиянию с функциональной белковой последовательностью. Одним из применений этого подхода является создание нацеленных лекарственных средств с усиленным уничтожением клеток. Другие стратегии, вовлекающие фрагменты антител, включают слияние специфичных к мишеням доменов белков, таких как фрагменты рецепторов, с Fc-областями (рецептор-связывающий фрагмент). Fc-фрагмент антитела отвечает за длительное время полужизни в сыворотке, а также за активацию иммунной системы. Использование слитых белков Fc зависит от комбинирования связывающей активности партнера по слиянию с активацией Fc-области. Однако продуцирование Fc-области в E. coli может быть проблематичным вследствие трудности эффективной экспрессии Fc-фрагмента в бактериях. Это может объяснить, почему продуцирование полного моноклонального антитела в E. coli также осталось труднодостижимой целью. Как описано ниже, были разработаны усовершенствованные способы экспрессии обоих фрагментов и полных моноклональных антител в E. coli. Хотя аппарат клеток млекопитающих является решающим для характеристик продуцирования антитела, таких как гликозилирование, существует множество возможностей для эффективной системы продуцирования антител в E. coli. Для эффективной экспрессии антител и фрагментов антител в E. coli использовали инженерию трансляции для оптимизации генов. Инженерия трансляции включает стандартные в данной отрасли способы, такие как удаление редких кодонов, разравнивание вторичной структуры РНК, идентификация и манипулирование с сигналами перерыва трансляции, которые влияют на пошаговую кинетику рибосомы, в то время как она транслирует мРНК антитела. После манипулирования геном, кодирующим представляющее интерес антитело, переконструированную конструкцию гена помещают в соответствующий вектор, который может включать компоненты как тяжелой, так и легкой цепей.
В другом варианте осуществления клетка представляет собой гибридомную клеточную линию, экспрессирующую желаемые моноклональные антитела, которую получают хорошо известными общепринятыми способами. В контексте настоящего изобретения клетка гибридомы способна продуцировать антитело, специфично связывающееся с RAGE. Клетку гибридомы можно получать путем слияния нормальной активированной продуцирующей антитело B-клетки с клеткой миеломы. В частности, клетку гибридомы можно получать следующим образом: B-клетки извлекают из селезенки животного, иммунизированного соответствующим антигеном. Затем эти B-клетки подвергают слиянию с опухолевыми клетками миеломы, которые могут расти в культуре неограниченно. Это слияние проводят, делая мембраны клеток более проницаемыми. Слитые гибридные клетки (называемые гибридомами), предоставляющие собой злокачественные клетки, быстро и неограниченно размножаются и продуцируют большие количества желаемых антител. Их необходимо отбирать, а затем клонировать способом лимитирующих разведений. Для этой стадии обычно необходимы дополнительные среды, содержащие интерлейкин-6 (такие как briclone). Селекция происходит путем культивирования вновь слитых первичных клеток гибридомы в селективной среде, в частности, в среде, содержащей 1 x концентрацию HAT, в течение приблизительно 10-14 суток. После использования HAT часто желательно использовать среду, содержащую HT. Клонирование проводят после идентификации положительных первичных клеток гибридомы.
Другой аспект настоящего изобретения относится к связывающей молекуле, способной связываться с RAGE и содержащей полипептид или полипептидный комплекс согласно изобретению. Полипептиды (или их комплексы) и антитела по настоящему изобретению можно использовать во многих применениях, включая медицину, терапию, диагностику, а также науку и научные исследования, например, для детекции, очистки, мечения и т.д.
Таким образом, может быть необходимо добавить дополнительный компонент к полипептиду (комплексу) по настоящему изобретению. В частности, может быть желательно добавить к молекуле маркер для ее детекции. Подходящие маркеры включают, но не ограничиваются ими, метку (например, 6 His-метка (или HexaHis), Strep-метка, HA-метка, c-myc-метка или метка глутатион-S-трансферазы (GST)), флуоресцентный маркер (например, FITC, флуоресцеин, родамин, красители Cy или Alexa), ферментную метку (например, пенициллиназу, пероксидазу хрена и щелочную фосфатазу), радиоактивную метку (например, 3H, 32P, 35S, 125I или 14C). Кроме того, полипептид (комплекс) можно добавлять на подложку, в частности, твердую подложку, такую как матрица, гранулы (например, стеклянные или магнитные), волокно, пленка и т.д. Квалифицированный специалист способен адаптировать связывающую молекулу, содержащую полипептид или полипептидный комплекс по настоящему изобретению и дополнительный компонент, для предполагаемого применения путем выбора пригодного дополнительного компонента.
Другой аспект настоящего изобретения относится к композиции для применения в качестве лекарственного средства, причем композиция содержит по меньшей мере один полипептид по изобретению и/или по меньшей мере одну нуклеиновую кислоту по изобретению.
Фармацевтическая композиция по настоящему изобретению, кроме того, может содержать фармацевтически приемлемые носители и/или эксципиенты. Фармацевтически приемлемые носители и/или эксципиенты, подходящие для этого изобретения, являются общепринятыми и могут включать буферы, стабилизаторы, разбавители, консерванты и солюбилизаторы. В Remington's Pharmaceutical Sciences, E. W. Martin, Mack Publishing Co., Easton, PA, 15th Edition (1975), описаны композиции и составы, подходящие для фармацевтической доставки полипептидов/нуклеиновых кислот, описанных в настоящем документе. Содержание активного ингредиента (полипептида или нуклеиновой кислоты) в фармацевтической композиции не ограничено, при условии, что оно пригодно для лечения или профилактики, но, предпочтительно, составляет 0,0000001-10% по массе от всей композиции.
Как правило, природа носителя или эксципиентов зависит от конкретного используемого способа введения. Например, исходные составы в качестве носителя обычно содержат инъецируемые жидкости, которые включают фармацевтически и физиологически приемлемые жидкости, такие как вода, физиологический раствор, сбалансированные солевые растворы, водный раствор декстрозы, глицерин или сходные с ними. Для твердых композиций (например, форм порошка, пилюли, таблетки или капсулы), общепринятые нетоксичные твердые носители могут включать, например, маннит, лактозу, крахмал или стеарат магния фармацевтической категории. В дополнение к биологически нейтральным носителям, фармацевтические композиции, подлежащие введению, могут содержать небольшие количества нетоксичных дополнительных веществ, таких как смачивающие средства или эмульгаторы, консерванты, и pH-буферные средства и т.п., например, ацетат натрия или монолаурат сорбитана.
Как правило, для того, чтобы сделать состав изотоническим в носителе используют подходящее количество фармацевтически приемлемой соли. Примеры носителя включают, но не ограничиваются ими, физиологический раствор, раствор Рингера и раствор декстрозы. Предпочтительно, приемлемые эксципиенты, носители или стабилизаторы, предпочтительно, являются нетоксичными в используемых дозировках и концентрациях, включая буферы, такие как цитрат, фосфат и другие органические кислоты; солеобразующие противоионы, например, натрий и калий; низкомолекулярные (> 10 аминокислотных остатков) полипептиды; белки, например, сывороточный альбумин или желатин; гидрофильные полимеры, например, поливинилпирролидон; аминокислоты, такие как гистидин, глутамин, лизин, аспарагин, аргинин, или глицин; углеводы, включая глюкозу, маннозу или декстрины; моносахариды; дисахариды; другие сахара, например, сахарозу, маннит, трегалозу или сорбит; хелатирующие агенты, например, ЭДТА; неионные поверхностно-активные вещества, например, Tween, Pluronics или полиэтиленгликоль; антиоксиданты, включая метионин, аскорбиновую кислоту и токоферол; и/или консерванты, например, хлорид октадецилдиметилбензиламмония; хлорид гексаметэтония; хлорид бензалконий, хлорид бензэтония; фенол, бутил или бензиловый спирт; алкил парабены, например, метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол).
В предпочтительном варианте осуществления фармацевтическая композиция, кроме того, содержит иммуностимулирующее вещество, такое как адъювант. Адъювант можно выбирать, исходя из способа введения, и он может включать адъюванты на основе минерального масла, такие как полный и неполный адъювант Фрейнда, неполный адъювант Montanide Seppic, такой как ISA, адъюванты на основе эмульсии типа "масло-в-воде", такие как система адъювантов Ribi, адъювантный состав syntax, содержащих мурамилдипептид, или адъюванты на основе солей алюминия. Предпочтительно, адъювант представляет собой адъювант на основе минерального масла, наиболее предпочтительно, ISA206 (SEPPIC, Paris, Франция). В более предпочтительном варианте осуществления иммуномодулирующее вещество выбрано из группы, содержащей поликатионные полимеры, особенно поликатионные пептиды, такие как полиаргинин, иммуностимулирующие дезоксинуклеотиды (ODN), пептиды, содержащие по меньшей мере два мотива LysLeuLys, особенно KLKLLLLLKLK (SEQ ID NO:51), нейроактивные соединения, особенно гормоны роста человека, квасцы, адъюванты или их комбинации. Предпочтительно, комбинация представляет собой либо поликатионный полимер и иммуностимулирующие дезоксинуклеотиды, либо пептид, содержащий по меньшей мере два мотива LysLeuLys, и иммуностимулирующие дезоксинуклеотиды. В еще более предпочтительном варианте осуществления поликатионный полимер представляет собой поликатионный пептид. В еще более предпочтительном варианте осуществления изобретения иммуностимулирующее вещество представляет собой по меньшей мере одну иммуностимулирующую нуклеиновую кислоту. Иммуностимулирующие нуклеиновые кислоты представляют собой, например, нейтральные или искусственные содержащие CpG нуклеиновые кислоты, короткие участки нуклеиновых кислот, происходящие из не позвоночных или в форме коротких олигонуклеотидов (ODN), содержащих неметилированные цитозин-гуанин-динуклеотиды (CpG) в определенном окружении оснований (например, как описано в WO 96/02555). Альтернативно в качестве иммуностимулирующих нуклеиновых кислот для настоящего изобретения также можно использовать нуклеиновые кислоты на основе инозина и цитидина, как описано, например, в WO 01/93903, или дезоксинуклеиновые кислоты, содержащие остатки дезоксиинозина и/или дезоксиуридина (описанные в WO 01/93905 и WO 02/095027). Предпочтительно, в настоящем изобретении используют смеси различных иммуностимулирующих нуклеиновых кислот. Кроме того, указанные выше поликатионные соединения можно комбинировать с любыми из иммуностимулирующих нуклеиновых кислот, как описано выше. Предпочтительно, такие комбинации представляют собой комбинации согласно комбинациям, описанным в WO 01/93905, WO 02/32451, WO 01/54720, WO 01/93903, WO 02/13857 и WO 02/095027 и в патентной заявке Австралии A 1924/2001.
Фармацевтическая композиция содержит по меньшей мере один полипептид или нуклеиновую кислоту по изобретению; однако она также может содержать коктейль (т.е. простую смесь), содержащий различные полипептиды и/или нуклеиновые кислоты по изобретению. Полипептид(ы) по настоящему изобретению также можно использовать в форме фармацевтически приемлемой соли. Подходящие кислоты и основания, которые способны образовывать соли с пептидами по настоящему изобретению, хорошо известны специалистам в данной области, и включают неорганические и органические кислоты и основания.
В предпочтительном варианте осуществления настоящего изобретения композиция предназначена или используется для лечения связанного с RAGE заболевания или нарушения, как известно квалифицированному специалисту или как определено в настоящем документе, предпочтительно, выбранного из группы, состоящей из сепсиса, септического шока, листериоза, воспалительного заболевания, включая ревматоидный и псориатический артрит и заболевание кишечника, злокачественной опухоли, артрита, болезни Крона, хронического и острого воспалительного заболевания, сердечно-сосудистого заболевания, эректильной дисфункции, диабета, осложнения диабета, васкулита, нефропатии, ретинопатии, невропатии, амилоидозов, атеросклероза, болезни периферических сосудов, инфаркта миокарда, застойной сердечной недостаточности, диабетической ретинопатии, диабетической невропатии, диабетической нефропатии и болезни Альцгеймера, особенно диабета и/или воспалительного нарушения.
Другой аспект настоящего изобретения относится к способу диагностики связанного с RAGE заболевания или нарушения, как определено выше, предусматривающему стадии:
(a) приведения в контакт образца, полученного от индивидуума, с полипептидом или полипептидным комплексом или связывающей молекулой в соответствии с настоящим изобретением; и
(b) детекцию количества RAGE,
где измененное количество рецептора RAGE относительно контроля указывает на связанное с RAGE заболевание или нарушение.
Также настоящее изобретение относится к диагностическим анализам, таким как количественные и диагностические анализы для детекции RAGE или уровней RAGE с помощью полипептидов или связывающих молекул по настоящему изобретению в клетках и тканях или жидкостях организма, включая определение нормальных и ненормальных уровней. Способы анализа, которые можно использовать для определения уровней полипептида или антитела в образце, происходящего из хозяина, хорошо известны специалистам в данной области. Такие способы анализа включают радиоиммунные анализы, конкурентные анализы связывания, вестерн-блот-анализы и анализы ELISA. Среди них часто предпочтительными являются ELISA. Анализ ELISA первоначально включает получение антитела, специфичного к полипептиду, в частности, RAGE, предпочтительно, моноклонального антитела. Кроме того, обычно получают репортерное антитело, которое связывается с моноклональным антителом. Репортерное антитело связывают с поддающимся детекции реагентом, таким как радиоактивный, флуоресцентный или ферментативный реагент, такой как фермент пероксидаза хрена.
Изобретение не ограничивается конкретными методиками, протоколами и реагентами, описанными в настоящем документе, поскольку они могут варьировать. Кроме того, терминология, используемая в настоящем документе, предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения объема настоящего изобретения. Как используют в настоящем документе и в прилагаемой формуле изобретения, форма единственного числа включает множественное число, если контекст явно не указывает на иное. Аналогично, слова "содержит", "включает" и "охватывает" следует интерпретировать включительно, а не исключительно.
Если не определено иначе, все технические и научные термины и любые сокращения, используемые в настоящем документе, имеют те же значения, которые обычно понимает специалист в области, к которой относится изобретение. Хотя для применения этого изобретения на практике можно использовать любые способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящем документе, предпочтительные способы и материалы описаны в настоящем документе.
Изобретение далее проиллюстрировано с помощью следующих примеров, хотя понятно, что примеры включены только для иллюстрации и не предназначены для ограничения объема изобретения, если конкретно не указано иное.
ФИГУРЫ:
Фигура 1: Вариабельные области легкой цепи (слева) и тяжелой цепи (справа) с CDR.
Фигура 2: ka/kd для гибридом против Rage, протестированных с LP08062 (Rage) при 15 нМ.
Фигура 3: Диапазоны Kd для выбранных моноклональных антител против RAGE.
Фигура 4: Ингибирование взаимодействия RAGE с S100A6.
Фигура 5: Анализ Biacore для RAGE 513_LP08062 (сверху) и 501-4 RAGE-1 050908 b
ПРИМЕРЫ:
ПРИМЕР 1: Получение и идентификация антител
Получение и идентификацию антител проводили способами, хорошо известными специалисту в данной области. Такие способы описаны, например, в (i) Handbook of therapeutic antibodies Wiley-VCH, Weinheim; ISBN-10:3-527-31453-9; ISBN-13:978-3-527-31453-9-; и/или в (ii) Therapeutic monoclonal antibodies: from bench to clinic; ISBN: 978-0-470-11791-0; и/или in (iii) Current protocols in Immunology; John Wiley и Sons, Inc.; последнее дополнение от 1 октября 2009 года.
ПРИМЕР 2: Селекция предпочтительных антител
Среди доступных антител были идентифицированы и отобраны "лучшие 23" антитела, исходя из
- констант связывания (KD ≤ 1,0 E-9 M и koff ≤ 2,0 E-3 с-1) и
- перекрестной видовой реактивности с RAGE крысы, мыши и яванского макака
Были определены следующие аминокислотные последовательности для вариабельных областей моноклональных антител против RAGE:
Белок 56 RAGE-1
VL 56: вариабельная область для легкой цепи; полная длина молекулы: 107 а.к.; SEQ ID NO:1
1 divmtqsqkf mstsvgdrvs vtckasqnvg invawyqqkp gqspkaliys
51 asyrysgvpd rftgsgsgtd ftliisnvqs edlaeyfcqq ynnyprtfgg
101 gtkleik
VH 56: вариабельная область для тяжелой цепи; полная длина молекулы: 115 а.к.; SEQ ID NO:24
1 qvqlqqsgpe lvkpgasvri sckasgytft syfihwvkqr pgqglewigw
51 iypgnvntky nekfkdkatl tadkssstay mqlsnltsed savyfcvrgq
101 lgdywgqgit ltvss
Белок 95 RAGE-1
VL 95: вариабельная область для легкой цепи; полная длина молекулы: 109 а.к.; SEQ ID NO:2
1 qavvtqesal ttspgetvtl tcrsstgavt tsnyanwvqe kpdhlftglt
51 ggtnnrapgv parfsgslig dkaaltitga qtedeaiyfc alwysnhwvf
101 gggtkltvl
VH 95: вариабельная область для тяжелой цепи; полная длина молекулы: 115 а.к.; SEQ ID NO:25
1 qvqlqqpgae lvkpgasvkl sckasgytft sywmhwvkqr pgqglewige
51 snpsngrtny nekfknkatl tvdkssstay mqlssltsed savyycarap
101 yygfdywgqg ttltvss
Белок 130 RAGE-1
VL 130: вариабельная область для легкой цепи; полная длина молекулы: 106 а.к.; SEQ ID NO:3
1 qivltqspai msaspgekvt mtcsasssvs ymhwyqqksg tspkrwisdt
51 sklasgvpar fsgsgsgtsy sltissmeae daatyycqqw ssnpptfggg
101 tkleik
VH 130: вариабельная область для тяжелой цепи; полная длина молекулы: 119 а.к.; SEQ ID NO:26
1 evqlvesggg lvkpggslkl scaasgftfs syvmswvrqs pekrlewvae
51 issggsytyy pdtvtgrfti srdndkntly lemsslrsed tamyycarpp
101 ygkdamdywg qgtsvtvss
Белок 140 RAGE-1
VL 140: вариабельная область для легкой цепи; полная длина молекулы: 108 а.к.; SEQ ID NO:4
1 qivltqspai msaspgekvt iscsasssvs ymywyqqkpg sspkpwiyrt
51 snlasgvpar fsgsgsgtsy sltissmeae daatyycqqy hsyppmytfg
101 ggtkleik
VH 140: вариабельная область для тяжелой цепи; полная длина молекулы: 121 а.к.; SEQ ID NO: 27
1 qvqlqqpgae lvkpgasvrl sckasgytft sywmhwvkqr pgqglewige
51 inpsngrtny nekfkskatl tvdkssstay mqlssltsed savyycardg
101 lgyrpiamdy wgqgtsvtvs s
Белок 152 RAGE-1
VL 152: вариабельная область для легкой цепи; полная длина молекулы: 110 а.к.; SEQ ID NO:5
1 divltqspas lavslgqrat iscrasksvg tsdssymhwy qqkpgqppkl
51 liylasnles gvparfsgsg sgtdftlnih pveeedaaty ycqhsrelyt
101 fgggtkleik
VH 152: вариабельная область для тяжелой цепи; полная длина молекулы: 115 а.к.; SEQ ID NO:28
1 dvqlqesgpd lvkpsqslsl tctvtgysit sgyswhwirq fpgnklewmg
51 yihysgstny npslksrisi trdtsknqff lqlnsvtted tatyycargg
101 dfaywgqgtl vtvsa
Белок 158 RAGE-1
VL 158: вариабельная область для легкой цепи; полная длина молекулы: 113 а.к.; SEQ ID NO:6
1 sdvvltqtpl slpvnigdqa sisckstksl lnsdgftyld wylqkpgqsp
51 qlliylvsnr fsgvpdrfsg sgsgtdftlk isrveaedlg vyycfqsnyl
101 pltfgggtkv eik
VH 158: вариабельная область для тяжелой цепи; полная длина молекулы: 119 а.к.; SEQ ID NO:29
1 qiqlvqsgpe lkkpgetvki sckasgytft dysmhwvkqa pgkglkwmgw
51 intetgepty addfkgrfaf sletsastay llinnlkted tatyfcardy
101 lyyyamdywg qgtsvtvss
Белок 164 RAGE-1
VL 164: вариабельная область для легкой цепи; полная длина молекулы: 107 а.к.; SEQ ID NO:7
1 nivmtqspks msmsvgervt lsckasenvg tyvswyqqkp eqspklliyg
51 asnrytgvpd rftgsgsatd ftltissvqa edladyhcgq sytypytfgg
101 gtkleik
VH 164: вариабельная область для тяжелой цепи; полная длина молекулы: 116 а.к.; SEQ ID NO:30
1 qvqlqqpgse lvrpgasvkl sckasgytft nywmhwvkqr pgqglewign
51 iypgsgstny dekfkskatl tvdtssstay mqlssltsed savyyctrlr
101 rgiaywgqgt lvtvsa
Белок 166 RAGE-1
VL 166: вариабельная область для легкой цепи; полная длина молекулы: 112 а.к.; SEQ ID NO:8
1 nimmtqspss lavsagekvt msckssqsvl yssnqknyla wyqqkpgqsp
51 klliywastr esgvpdrftg sgsgtdftlt issvqaedla vyychqylss
101 ytfgggtkle ik
VH 166: вариабельная область для тяжелой цепи; полная длина молекулы: 119 а.к.; SEQ ID NO:31
1 qvqlqqsgpe lvkpgtsvri sckasgytft syyihwvkqr pgqglewigw
51 iypgnvitny hekfkgkasl tadkssstay mqlssltsed savyfcared
101 pfaywgqgtl vtvsa
Белок 173 RAGE-1
VL 173: вариабельная область для легкой цепи; полная длина молекулы: 107 а.к.; SEQ ID NO:9
1 divmtqsqkf mstsvgdrvs vtckasqnvg tnvawyqqkp gqspkaliys
51 asyrysgvpd rftgsgsgtd ftltisnvqs edlaeyfcqq ynsypltfga
101 gtklelk
VH 173: вариабельная область для тяжелой цепи; полная длина молекулы: 120 а.к.; SEQ ID NO:32
1 evkleesggg lvqpggsmkl scvasgftfs nywmnwvrqs pekglewvae
51 irlksnnyat hyaesvkgrf tisrddskss vylqmndlra edpgiyycir
101 dygnyamdhw gqgtsvtvss
Белок 183 RAGE-1
VL 183: вариабельная область для легкой цепи; полная длина молекулы: 107 а.к.; SEQ ID NO:10
1 nivmtqspks msmsvgervt lsckasenvg tyvswyqqkp eqspklliyg
51 asnrytgvpd rftgsgsatd ftltissvqa edladyhcgq sysypytfgg
101 gtkleik
VH 183: вариабельная область для тяжелой цепи; полная длина молекулы: 116 а.к.; SEQ ID NO:33
1 evqlqqsgtv larpgasvkm sckasgysft sywmhwvkqr pgqglewiga
51 ifpgnsdtty nqkfkgkakl tavtsastay melssltned savyyctglr
101 rgfpywgqgt lvtvsv
Белок 184 RAGE-1
VL 184: вариабельная область для легкой цепи; полная длина молекулы: 111 а.к.; SEQ ID NO:11
1 divltqspas lavslgqrat iscrasksvs tsgysymhwy qqkpgqppkl
51 liylashles gvparfsgsg sgtdfslnih pveeedaaty ycqhsrelpw
101 tfgggtklei k
VH 184: вариабельная область для тяжелой цепи; полная длина молекулы: 120 а.к.; SEQ ID NO:34
1 qvqlqqsgae lvrpgtsvkv sckasgyaft nyliewvkqr pgqglewigm
51 inpgsggtny nekfkgkatl tadkssstay mqlssltsdd savyfcargr
101 gghyryfdvw gagttvtvss
Белок 210 RAGE-1
VL 210: вариабельная область для легкой цепи; полная длина молекулы: 110 а.к.; SEQ ID NO:12
1 qavvtqesal ttspgetvtl tcrsstgavt tsnyanwvqe kpdhlftgli
51 ggtnnrapgv parfsgslig dkaaltitga qtedeaiyfc alwysnhfwv
101 fgggtkltvl
VH 210: вариабельная область для тяжелой цепи; полная длина молекулы: 119 а.к.; SEQ ID NO:35
1 hseiqlqqtg pelvkpgasv kisckasgys ftdyimvwvk qshgkslewi
51 gtinpyygst synlkfkgka tltvdkssst anmqlnslts edsavyycar
101 lrlyamdywg qgtsvtvss
Белок 240 RAGE-1
VL 240: вариабельная область для легкой цепи; полная длина молекулы: 113 а.к.; SEQ ID NO: 13
1 sdvvltqtpl slpvsigdqa sisckstksl lnsdgftyld wylqkpgqsp
51 qlliylvsnr fsgvpdsfsg sgsgtdftlk isrveaedlg vyycfqsnyf
101 pltfgggttl eik
VH 240: вариабельная область для тяжелой цепи; полная длина молекулы: 119 а.к.; SEQ ID NO: 36
1 qiqlvqsgpe lkkpgetvki sckasgytft dysmhwvkqa pgkglkwmgw
51 intetgepty addfkgrfaf sletsastay lqinnlkned tatyfcardy
101 lyyyamdywg qgtsvtvss
Белок 250 RAGE-1
VL 250: вариабельная область для легкой цепи; полная длина молекулы: 107 а.к.; SEQ ID NO: 14
1 divmtqsqkf mstsvgdrvs vtckasqnvg tnvawyqqkp gqspkaliys
51 asyrysgvpd rftgsgsgtd ftltisnvqs edlaeffcqq ynsypltfga
101 gtklelk
VH 250: вариабельная область для тяжелой цепи; полная длина молекулы: 120 а.к.; SEQ ID NO:37
1 evkleesggg lvqpggsmkl scvasgftfs nywmnwvrqs pekglewvae
51 irlksnnyat hyaesvkgrf tisrddskss vylqmnnlra edtgiyfcir
101 dygnyamdyw gqgtsvtvss
Белок 253 RAGE-1
VL 253: вариабельная область для легкой цепи; полная длина молекулы: 113 а.к.; SEQ ID NO: 15
1 divmsqspss lavsvgekvt msckssqtll yssnqknyla wyqqkpgqsl
51 klliywastr esgvpdrfag sgsgtdftlt issvkaedla vyycqqyfgy
101 pytfgggtkl eik
VH 253: вариабельная область для тяжелой цепи; полная длина молекулы: 118 а.к.; SEQ ID NO: 38
1 qvqlqqsgpe lvkpgasvri sckasgytft dyyihwvkqr pgqglewigw
51 iypgnvitky nekfkgkatl tadkssstay mqlssltsed savyfcaryd
101 ydyamdywgq gtsvtvss
Белок 259 RAGE-1
VL 259: вариабельная область для легкой цепи; полная длина молекулы: 109 а.к.; SEQ ID NO:16
1 qavvtqesal ttspgetvtl tcrsstgavt tsnyanwvqe kpdhlftgli
51 ggtnnrapgv parfsgslig dkaaltitga qtedeaiyfc alwysnhwvf
101 gggtkltvl
VH 259: вариабельная область для тяжелой цепи; полная длина молекулы: 117 а.к.; SEQ ID NO: 39
1 qvqlqqsgae lvrpgtsvkv sckasgyaft nylidwvnqr pgqglewigv
51 inpgsggtny nekftgkatl tadkssstay mqlssltsdd savyfcarrr
101 vdtmdywgqg tsvtvss
Белок 283 RAGE-1
VL 283: вариабельная область для легкой цепи; полная длина молекулы: 109 а.к.; SEQ ID NO: 17
1 qavvtqesal ttspgetvtl tcrsstgavt tsnyanwvqe kpdhlftgli
51 rgtnnrapgv parfsgslig dkaaltitga qtedeaiyfc alwysnhwvf
101 gggtkltvl
VH 283: вариабельная область для тяжелой цепи; полная длина молекулы: 118 а.к.; SEQ ID NO: 40
1 qvqlqqsgae lvrpgtsvkv sckasgyaft nyliewvkqr pgqglewigv
51 inpgsggtny serfkgkatl tadkssstay mqlssltsdd savyfcasyr
101 ydggmdywgq gtsvtvss
Белок 316 RAGE-1
VL 316: вариабельная область для легкой цепи; полная длина молекулы: 111 а.к.; SEQ ID NO: 18
1 divltqspas lavslgqrat iscrasksvs isgysylhwn qqkpgqspkl
51 liylasnles gvparfsgsg sgtdftlnih pveeedaaty ycqhsrelpy
101 tfgggtklei k
VH 316: вариабельная область для тяжелой цепи; полная длина молекулы: 118 а.к.; SEQ ID NO: 41
1 qvqlqqsgpe lvrpgasvkm sckasgytft sywmhwvkqr pgqglewigm
51 idpsnsetrl nqkfkdkatl nvdkssntay mqlssltsed savyycarnf
101 ygsslrvwga gttvtvss
Белок 326 RAGE-1
VL 326: вариабельная область для легкой цепи; полная длина молекулы: 108 а.к.; SEQ ID NO: 19
1 divmtqsqkf mstsvgdrvs itckasqnvg tavawyqqkp gqspklliys
51 asnrytgvpd rftgsgsgtd ftltisnmqs edladyfcqq yssyplltfg
101 agtklelk
VH 326: вариабельная область для тяжелой цепи; полная длина молекулы: 119 а.к.; SEQ ID NO: 42
1 evklvesggg lvkpggslkl scaasgfafs sydmswvrqt pekrlewvat
51 issggsytsy pdsvqgrfti srДНКrntly lqmsslrsed talyycassq
101 lppyamdywg qgtsvtvss
Белок 347 RAGE-1
VL 347: вариабельная область для легкой цепи; полная длина молекулы: 107 а.к.; SEQ ID NO: 20
1 diqmtqsssy lsvslggrvt itckasdrin ywlawyqqkp gnaprllisg
51 attletgvps rfsgsgsgkd ytlsitslqt edvatyycqq ywstpytfgg
101 gtklelk
VH 347: вариабельная область для тяжелой цепи; полная длина молекулы: 118 а.к.; SEQ ID NO: 43
1 qvqlqqsgae lakpgasvkm scrasgytft dywmhwvkqr pgqglewigf
51 inpstvytey ipkfkdkatl tadkssstay mqlssltsed savyycarsd
101 ggwyfdvwga gttvtvss
Белок 499 RAGE-1
VL 499: вариабельная область для легкой цепи; полная длина молекулы: 107 а.к.; SEQ ID NO: 21
1 divmtqshkf mstsvgdrvs itckasqdvs tavawyqqkp gqspklliys
51 asyrytgvpd rftgsgsgtd ftftissvqa edlavyycqq hyntprtfgg
101 gtkleik
VH 499: вариабельная область для тяжелой цепи; полная длина молекулы: 113 а.к.; SEQ ID NO: 44
1 evqlqqsgtv larpgasvkm sckasgytft sywmhwvkqr pgqglewiga
51 iypgdsdtyy nqkfkgkakl tavtststay melssltned savyyctrnw
101 dywgqgttlt vss
Белок 501-4 RAGE-1
VL 501-4: вариабельная область для легкой цепи; полная длина молекулы: 109 а.к.; SEQ ID NO: 22
1 qavvtqesal ttspgetvtl tcrsstgavt tsnyanwvqe kpdhlftgli
51 ggtnnrapdv parfsgslig dkaaltitga qtedeaiyfc alwysnhwvf
101 gggtkltvl
VH 501-4: вариабельная область для тяжелой цепи; полная длина молекулы: 120 а.к.; SEQ ID NO: 45
1 evmlvdsggg lvkpggslkl scaasgftfr syamswvrqt pekrlewvat
51 issggsytyy pdsvrgrftt srdngkntly lqmsslrsed tamyycarhg
101 gnysawftyw gqgtlvtvsa
Белок 529 RAGE-1
VL 529: вариабельная область для легкой цепи; полная длина молекулы: 109 а.к.; SEQ ID NO: 23
1 qavvtqesal ttspgetvtl tcrsstgavt tsnyanwvqe kpdhlftgli
51 ggtnnrspgv parfsgslig dkaaltitga qtedeaiyfc alwysnhlvf
101 gggtkltvl
VH 529: вариабельная область для тяжелой цепи; полная длина молекулы: 119 а.к.; SEQ ID NO: 46
1 hseiqlqqtg pelvkpgasv kisckasgys ftdyimlwvk qshgkslewi
51 gninpyygst fynlkfkgka tltvdkssst aymqlnslts edsavyycar
101 sdywyfdvwg agttvtvss
ПРИМЕР 3: Охарактеризация выбранных mAb в конкурентном ELISA с S100A12 и S100A6
Для конкурентного анализа ELISA для S100A12 лунки покрывали S100A12 в количестве 0,5 мкг/лунка. Затем RAGE-Fc в концентрации 10 мкг/мл и конкурирующее mAb в концентрации 10 мкг/мл предварительно инкубировали при комнатной температуре в течение 30 мин. Смесь переносили в покрытые S100A12 планшеты и инкубировали при встряхивании при комнатной температуре в течение 2 часов. Детекцию связанного RAGE-Fc проводили с помощью Fc-специфического антитела против hIgG-POD с использованием TMB (3,3',5,5'-тетраметилбензидин) при 450 нм. Ни одно из 27 протестированных антител не продемонстрировало активность антагониста при взаимодействии RAGE-Fc/S100A12.
Для конкурентного анализа ELISA для S100A6 лунки покрывали S100A6 в концентрации 0,5 мкг/лунка. Затем RAGE-Fc в концентрации 10 мкг/мл и конкурирующее mAb в концентрации 10 мкг/мл предварительно инкубировали при комнатной температуре в течение 30 мин. Смесь переносили в покрытые S100A6 планшеты и инкубировали при встряхивании при комнатной температуре в течение 2 часов. Детекцию связанного RAGE-Fc проводили с помощью Fc-специфического антитела против hIgG-POD с использованием TMB (3,3',5,5'-тетраметилбензидин) при 450 нм. Можно было показать, что 7 из 27 антител были способны препятствовать взаимодействию RAGE-Fc/S100A6 (ингибирование 15-35%).
Для 5 mAb (демонстрирующих ингибиторный эффект >20%; LP08103; LP08104; LP08105; LP08108 и LP08122D) тестировали зависимость ингибирования связывания RAGE-S100A6 от дозы (IC50). Для этого нанесение S100A6 проводили, как подробно описано выше. RAGE-Fc в концентрации 10 мкг/мл инкубировали с конкурирующим mAb (2-кратные серийные разведения, начиная с концентрации 100 мкг/мл) при комнатной температуре в течение 2 часов. Детекцию связывания проводили с помощью конъюгата Fc-специфического антитела против IgG с пероксидазой с использованием HRP с компонентом TMB1 при 450 нм.
Для протестированных антител были получены следующие величины IC50 (также см. фиг. 4):
56 RAGE-1 (LP08103): IC50 = 1,16 [0,47; 2,80] мкг/мл (7,73 нМ)
240 RAGE-1 (LP08108): IC50=6,66 [4,33; 10,20] мкг/мл (44,4 нМ)
166 RAGE-1 (LP08122): IC50=8,33 [6,20; 11,20] мкг/мл (55,5 нМ)
158 RAGE-1 (LP08105): IC50=6,79 [5,01; 9,21] мкг/мл (45,3 нМ)
Контроль XT-M4 (LP08130): IC50=5,20 [3,18; 8,53] мкг/мл (34,6 нМ)
Для 152 RAGE-1 эффект дозы не был получен (LP08104).
В целом, 4 mAb препятствуют взаимодействию hRAGE-S100A6 с максимальным ингибиторным эффектом 50%.
ПРИМЕР 4: Охарактеризация mAb, идентифицированных в конкурентном анализе
Конкурентные анализы проводили согласно технологиям, хорошо известным специалисту в данной области. Такие технологии представлены в справочниках, как указано в примере 1. Результаты конкурентных анализов обобщенно представлены в таблице 1.
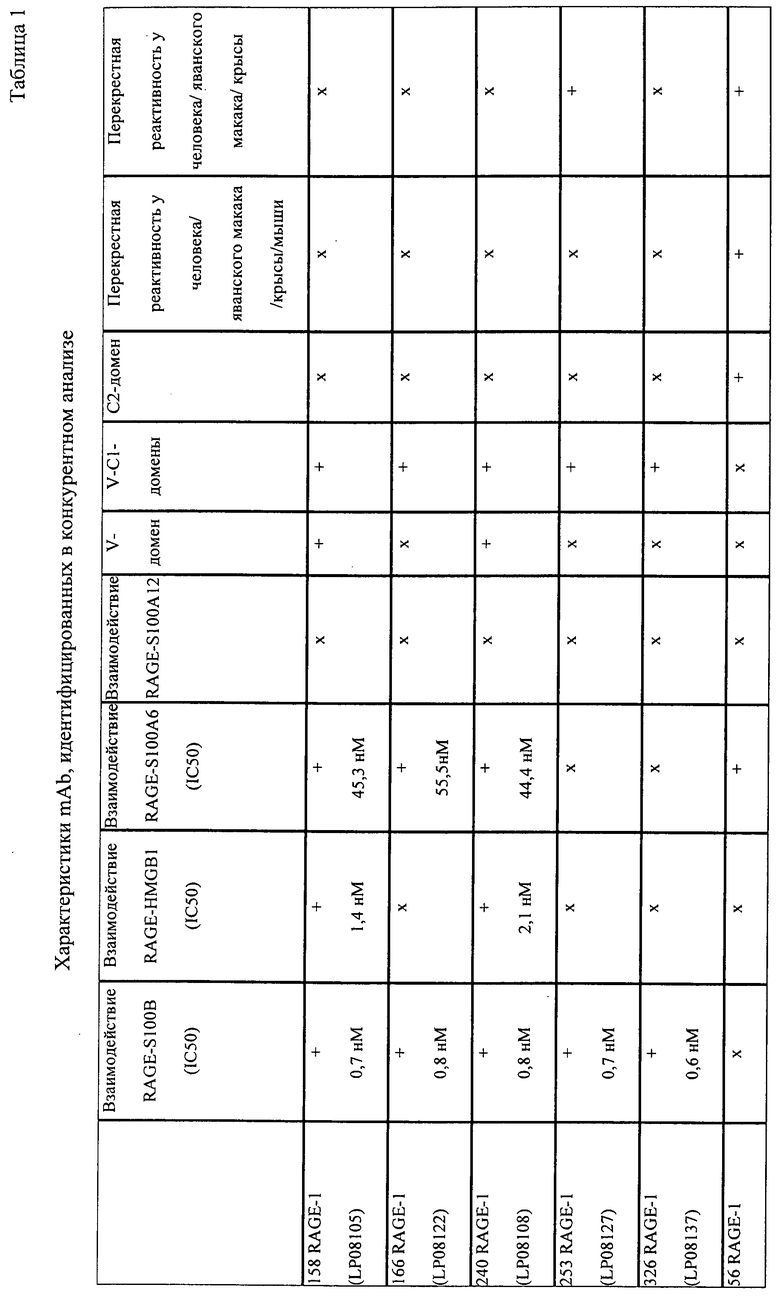
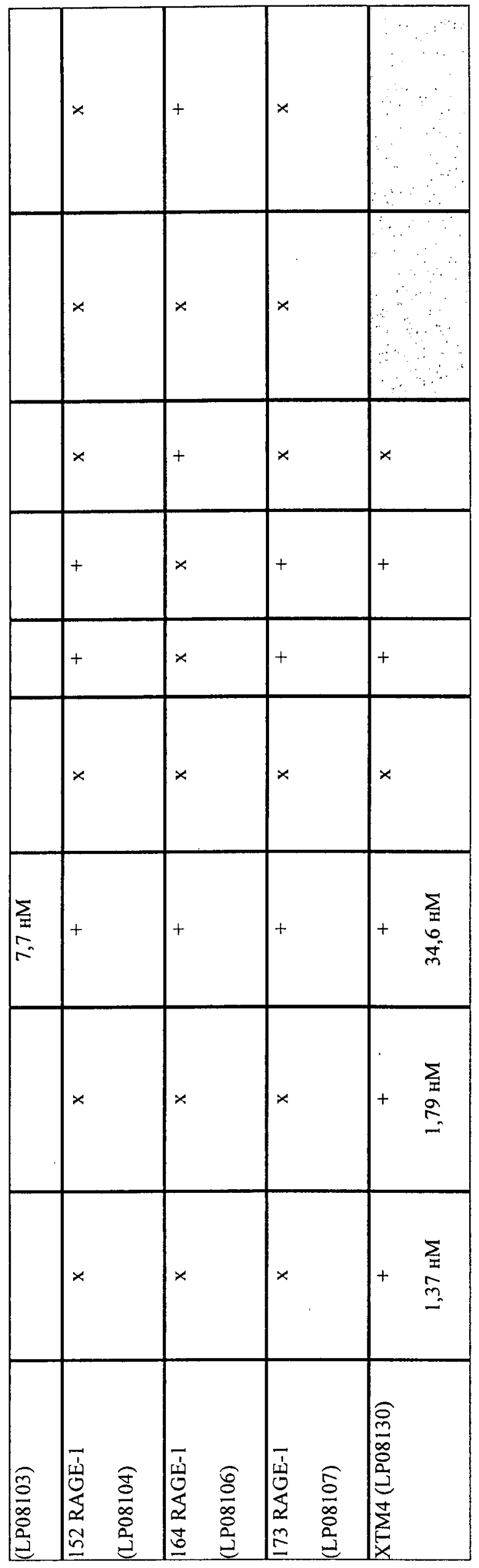
Конкурентный анализ ELISA показал, что
- 5 mAb в высокой степени блокируют взаимодействие hRAGE-S100B, а именно
158 RAGE-1 (LP08105) с IC50 = 0,109 [0,071; 0,166] мкг/мл (0,72 нМ)
240 RAGE-1 (LP08108) с IC50 = 0,123 [0,073; 0,204] мкг/мл (0,82 нМ)
166 RAGE-1 (LP08122) с IC50 = 0,128 [0,093; 0,176] мкг/мл (0,85 нМ)
253 RAGE-1 (LP08127) с IC50 = 0,108 [0,082; 0,131] мкг/мл (0,72 нМ)
326 RAGE-1 (LP08137) с IC50 = 0,097 [0,064; 0,148] мкг/мл (0,64 нМ)
XT-M4 (LP08130) с IC50 = 0,208 [0,117; 0,368] мкг/мл (1,37 нМ)
- 2 mAb блокируют взаимодействие hRAGE-HMGB1, а именно
158 RAGE-1 (LP08105) с IC50 = 0,290 [0,189; 0,447] мкг/мл (1,39 нМ)
240 RAGE-1 (LP08108) с IC50 = 0,310 [0,270; 0,463] мкг/мл (2,06 нМ)
XT-M4 (LP08130) c IC50 = 0,272 [0,168; 0,439] мкг/мл (1,79 нМ)
- 4 mAb препятствуют взаимодействию hRAGE-S100A6, а именно
56 RAGE-1 (LP08103): IC50 = 1,16 [0,47; 2,80] мкг/мл (7,73 нМ)
240 RAGE-1 (LP08108) с IC50 = 6,66 [4,33; 10,20] мкг/мл (44,4 нМ)
166 RAGE-1 (LP08122) с IC50 = 8,33 [6,20; 11,20] мкг/мл (55,5 нМ)
158 RAGE-1 (LP08105) с IC50 = 6,79 [5,01; 9,21] мкг/мл (45,3 нМ)
XT-M4 (LP08130) с IC50 = 5,20 [3,18; 8,53] мкг/мл (34,6 нМ)
ПРИМЕР 5: Охарактеризация mAb в анализе Biacore
Анализ основан на улавливающем анализе с использованием иммобилизованного антитела против Fc IgG мыши на чипе CM5. Для иммобилизации антитела против Fc в качестве рабочего буфера использовали HBS-EP. Стандартное присоединение аминов к чипу CM5 проводили при времени контакта 11 мин и скорости потока 10 мкл/мин. В качестве буфера для иммобилизации использовали 10 мМ ацетат натрия, pH 5,0. Концентрация белка (антитело против Fc мыши, Biacore BR-1008-38) составляла 100 мкг/мл.
Для анализа связывания SN mAb против RAGE, разбавленное в рабочем буфере 1/10 (скорость потока 5 мкл/мин) и sRAGE (V-C1-C2), партия LP08062, разбавленный в рабочем буфере до концентрации 15 нМ (скорость потока 50 мкл/мин) использовали в качестве анализируемого соединения и лиганда, соответственно (рабочий буфер: HBS-P + BSA 12 мг/мл + CM декстран 12 мг/мл и регенерирующий раствор: 10 мМ глицин pH 1,7). Анализ Ленгмюра 1:1 использовали в качестве модели аппроксимации. Результаты обобщенно представлены в таблице 2.
Связывание RAGE человека с иммобилизованными mAb против hRAGE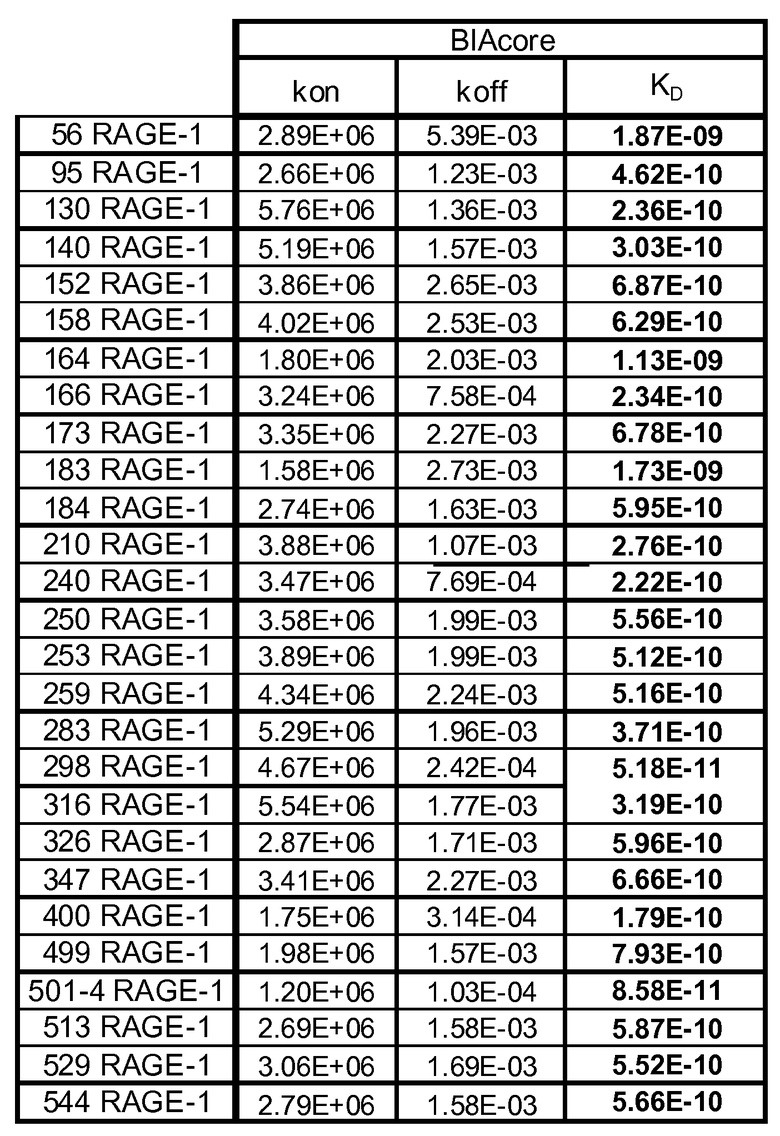
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К РЕЦЕПТОРУ КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ (RAGE) И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2518351C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ IL-4 И/ИЛИ IL-13, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2580049C2 |
| АНТИТЕЛО ПРОТИВ PDL-1, ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2693661C2 |
| АНТИТЕЛА, ОБЛАДАЮЩИЕ СПЕЦИФИЧНОСТЬЮ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2794996C2 |
| ИММУНОГЛОБУЛИН С ДВОЙНЫМИ ВАРИАБЕЛЬНЫМИ ДОМЕНАМИ И ЕГО ПРИМЕНЕНИЯ | 2006 |
|
RU2515108C2 |
| АНТИТЕЛА ПРОТИВ G-CSFR И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2605595C2 |
| АНТИТЕЛО К SIRPα И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2822496C1 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2010 |
|
RU2570639C2 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2011 |
|
RU2605928C2 |
| АНТИТЕЛА ПРОТИВ CD19 ЧЕЛОВЕКА, ОБЛАДАЮЩИЕ ВЫСОКОЙ АФФИННОСТЬЮ | 2016 |
|
RU2761077C1 |




















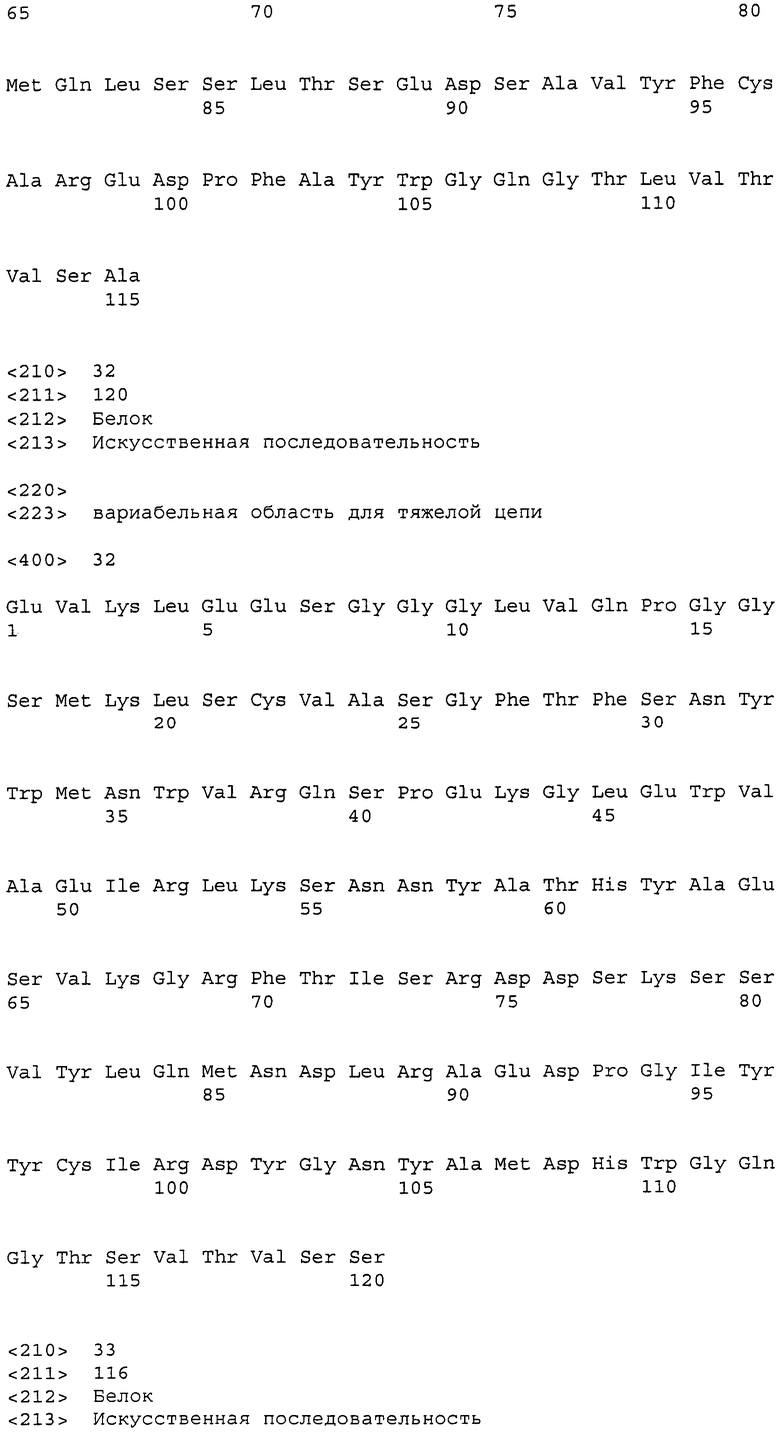



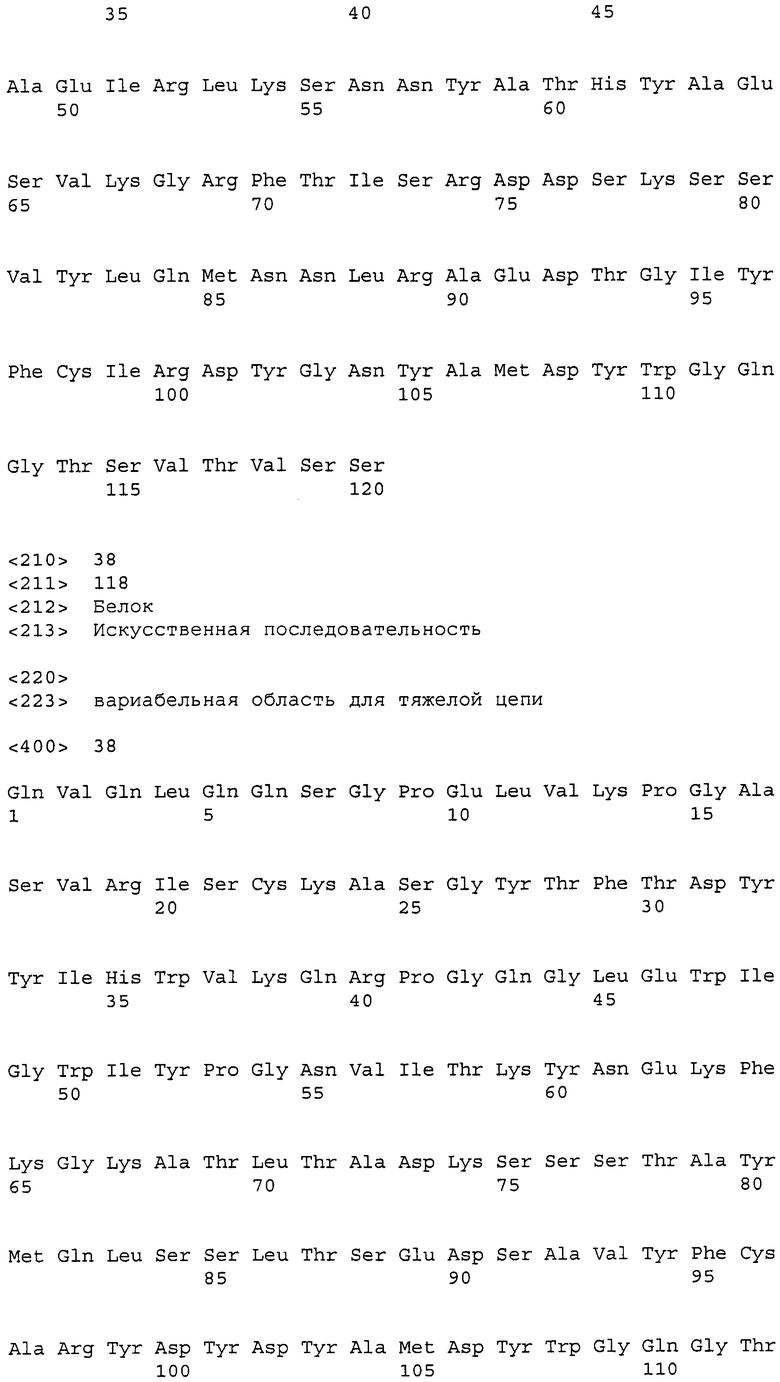












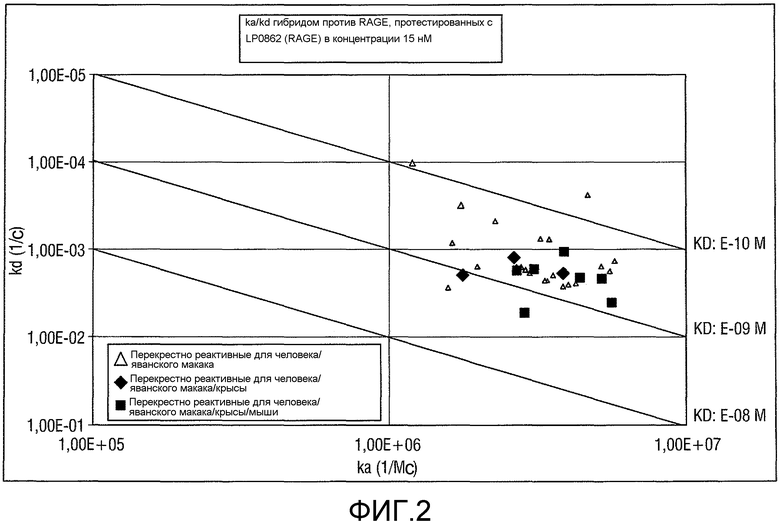
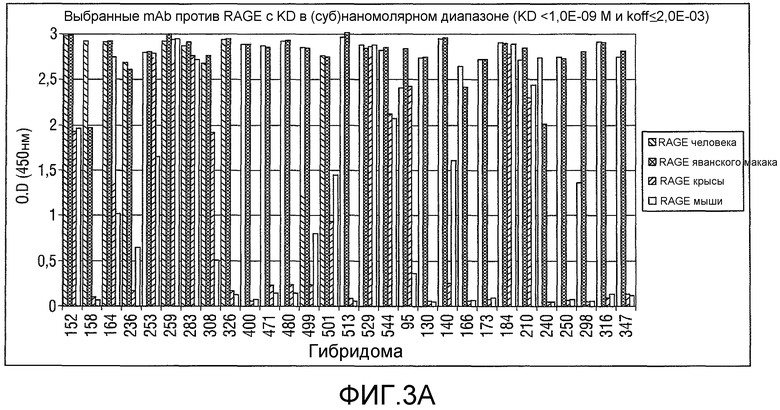
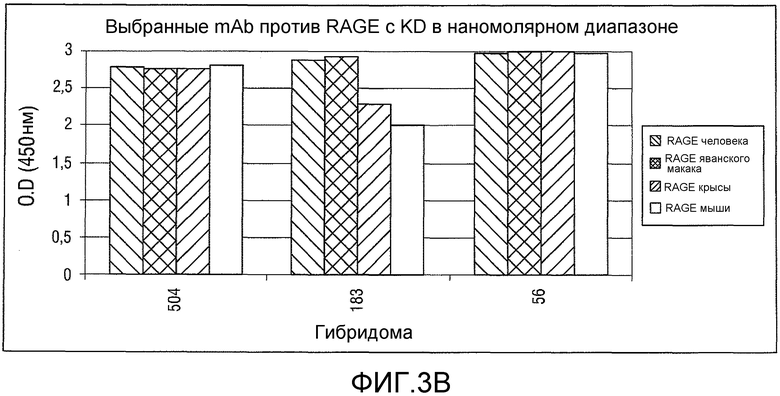
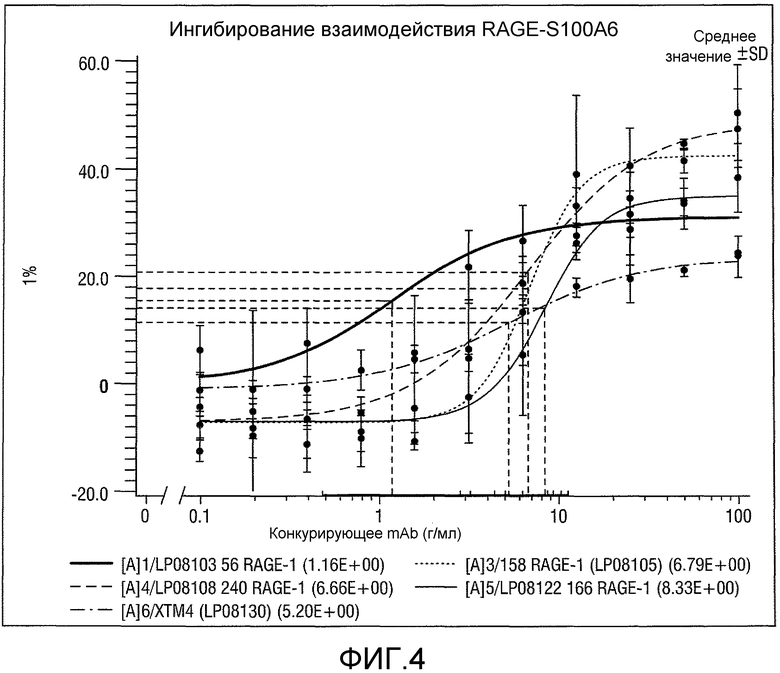
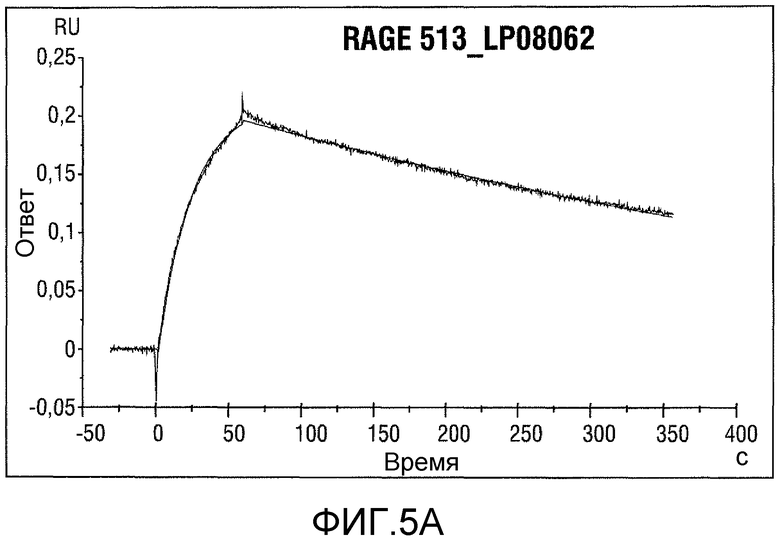
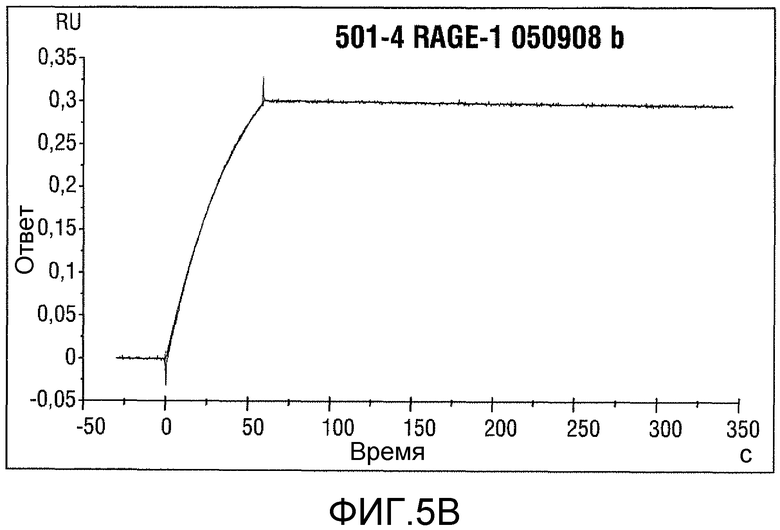
Изобретение относится к биохимии. Описано антитело, специфически связывающееся с «рецептором конечных продуктов гликирования» (RAGE). Представлены нуклеиновая кислота, кодирующая описанное антитело, композиция для применения в качестве лекарственного средства для лечения связанного с RAGE заболевания или нарушения. Также представлен способ диагностики связанного с RAGE заболевания или нарушения. Изобретение расширяет арсенал средств для лечения и диагностики заболеваний, связанных с RAGE. 4 н. и 8 з.п. ф-лы, 5 ил., 2 табл., 5 пр.
1. Антитело, специфически связывающееся с "рецептором конечных продуктов гликирования" (RAGE), содержащее по меньшей мере вариабельные области, выбранные из:
- SEQ ID NO: 1 и SEQ ID NO: 24,
- SEQ ID NO: 2 и SEQ ID NO: 25,
- SEQ ID NO: 3 и SEQ ID NO: 26,
- SEQ ID NO: 4 и SEQ ID NO: 27,
- SEQ ID NO: 5 и SEQ ID NO: 28,
- SEQ ID NO: 6 и SEQ ID NO: 29,
- SEQ ID NO: 7 и SEQ ID NO: 30,
- SEQ ID NO: 8 и SEQ ID NO: 31,
- SEQ ID NO: 9 и SEQ ID NO: 32,
- SEQ ID NO: 10 и SEQ ID NO: 33,
- SEQ ID NO: 11 и SEQ ID NO: 34,
- SEQ ID NO: 12 и SEQ ID NO: 35,
- SEQ ID NO: 13 и SEQ ID NO: 36,
- SEQ ID NO: 14 и SEQ ID NO: 37,
- SEQ ID NO: 15 и SEQ ID NO: 38,
- SEQ ID NO: 16 и SEQ ID NO: 39,
- SEQ ID NO: 17 и SEQ ID NO: 40,
- SEQ ID NO: 18 и SEQ ID NO: 41,
- SEQ ID NO: 19 и SEQ ID NO: 42,
- SEQ ID NO: 20 и SEQ ID NO: 43,
- SEQ ID NO: 21 и SEQ ID NO: 44,
- SEQ ID NO: 22 и SEQ ID NO: 45, или
- SEQ ID NO: 23 и SEQ ID NO: 46,
или их варианты, содержащие по меньшей мере определяющие комплементарность области CDR L1, CDR L2 и CDR L3 аминокислотной последовательности SEQ ID NO: 1-23, и определяющие комплементарность области CDR H1, CDR Н2 и CDR Н3 аминокислотной последовательности SEQ ID NO: 24-46.
2. Антитело по п. 1,
i) где аминокислотная последовательность SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22 или SEQ ID NO: 23 или ее вариант представляет собой вариабельный домен легкой цепи (VL); и
ii) где аминокислотная последовательность SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45 или SEQ ID NO: 46 или ее вариант представляет собой вариабельный домен тяжелой цепи (VH).
3. Антитело по п. 1, где антитело представляет собой моноклональное антитело, химерное антитело, гуманизированное антитело, Fab, Fab′, F(ab′)2, Fv, связанный дисульфидной связью Fv, scFv, (scFv)2, двухвалентное антитело, биспецифическое антитело, полиспецифическое антитело, диатело, триатело, тетратело и/или минитело.
4. Антитело по п. 1, где полипептид или полипептидный комплекс содержит константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из: константного домена IgM человека, константного домена IgG1 человека, константного домена IgG2 человека, константного домена IgG3 человека, константного домена IgG4 человека, константного домена IgE человека и константного домена IgA человека.
5. Антитело по п. 1, состоящее из:
a) по меньшей мере 60%, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, еще более предпочтительно, по меньшей мере 95%, наиболее предпочтительно, 99% любой аминокислотной последовательности из аминокислотной последовательности SEQ ID NO: 1-23 и аминокислотной последовательности SEQ ID NO: 24-46;
b) любой аминокислотной последовательности, которая по меньшей мере на 60%, предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 80%, еще более предпочтительно, по меньшей мере на 90%, еще более предпочтительно, по меньшей мере на 95%, наиболее предпочтительно, на 99% идентична аминокислотной последовательности SEQ ID NO: 1-23 и аминокислотной последовательности SEQ ID NO: 24-46; или
c) любой аминокислотной последовательности из аминокислотной последовательности SEQ ID NO: 1-23 и аминокислотной последовательности SEQ ID NO: 24-46 и 1-50 дополнительного(ых) аминокислотного(ых) остатка(ов), предпочтительно, 1-40, более предпочтительно, 1-30, еще более предпочтительно, не более чем 1-25, еще более предпочтительно, не более чем 1-10, наиболее предпочтительно, 1, 2, 3, 4 или 5 дополнительного(ых) аминокислотного(ых) остатка(ов).
6. Антитело по п. 1, происходящее из любой аминокислотной последовательности SEQ ID NO: 1-23 и SEQ ID NO: 24-46 путем одной или нескольких консервативных аминокислотных замен.
7. Нуклеиновая кислота, кодирующая антитело по любому из пп. 1-6.
8. Нуклеиновая кислота по п. 7, где нуклеиновая кислота находится в векторе.
9. Композиция для применения в качестве лекарственного средства для лечения связанного с RAGE заболевания или нарушения, где композиция содержит эффективное количество по меньшей мере одного антитела по любому из пп. 1-6 и/или эффективное количество по меньшей мере одной нуклеиновой кислоты по п. 7.
10. Композиция для применения по п. 9, где указанное связанное с RAGE заболевание или нарушение выбрано из группы, состоящей из сепсиса, септического шока, листериоза, воспалительного заболевания, включая ревматоидный и псориатический артрит и заболевание кишечника, злокачественной опухоли, артрита, болезни Крона, хронического и острого воспалительного заболевания, сердечно-сосудистого заболевания, эректильной дисфункции, диабета, осложнения диабета, васкулита, нефропатии, ретинопатии, невропатии, амилоидозов, атеросклероза, болезни периферических сосудов, инфаркта миокарда, застойной сердечной недостаточности, диабетической ретинопатии, диабетической невропатии, диабетической нефропатии и болезни Альцгеймера, особенно диабета и/или воспалительного нарушения.
11. Композиция для применения по п. 10, где указанное связанное с RAGE нарушение представляет собой воспалительное нарушение.
12. Способ диагностики связанного с RAGE заболевания или нарушения, включающий стадии:
(a) приведения в контакт образца, полученного у индивидуума, с антителом по любому из пп. 1-6; и
(b) детекции количества RAGE,
где изменение количества рецептора RAGE по сравнению с контролем указывает на связанное с RAGE заболевание или нарушение.
| СИНЕРГИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ ЛЕЧЕНИЯ СОСТОЯНИЙ НЕОПЛАСТИЧЕСКОГО ИЛИ ЗЛОКАЧЕСТВЕННОГО РОСТА И ВОССТАНОВЛЕНИЯ ИЛИ УСИЛЕНИЯ ГЕМОПОЭЗА | 1998 |
|
RU2219947C2 |
| WO 2008137552 A3, 13.11.2008 | |||
Авторы
Даты
2015-07-27—Публикация
2010-10-08—Подача