Область техники, к которой относится изобретение
Настоящее изобретение относится к гуманизированным антителам против CD 19 человека (anti-human CD 19 антителам), способам их получения, фармацевтическим композициям, включающим такие антитела, и способам их применения.
Предпосылки создания изобретения
CD 19 человека является трансмембранным белком массой 95 кДа (ко-рецептором В-клеток), экспрессируемым исключительно на В-клетках и на фолликулярных дендритных клетках. CD 19 находится в ассоциации с CD21 и CD81. CD 19 и CD21 необходимы для нормальной дифференцировки В-клеток (Carter R.H. с соавт., Immunol. Res., 26, 2002, сс.45-54). Антитела против CD 19 применяют в нескольких клинических испытаниях (см., например, Hekman А. с соавт., Cancer Immunol. Immunother, 32(191), сс.364-372, Vlasfeld L.T. с соавт., Cancer Immunol. Immunother. 40, 1995, сс.37-47, Conry R.M. с соавт., J. Immunother. Emphasis Tumor Immunol, 18, 1995, cc. 231-241, Manzke О. с соавт., Int. J. Cancer 91, 2001, cc. 516- 522).
Антитела против CD 19 могут оказывать ингибирующее или стимулирующее действие на активацию В-клеток. Связывание антител CD 19 с В-клетками после стимуляции митогеном ингибирует последующее повышение Са и, в результате, активацию и пролиферацию этих клеток, и пролиферацию и дифференциацию В-клеток можно либо ингибировать, либо усиливать антителом против CD 19 в зависимости от используемого митогенного стимула и степени сшивания антителом. К раковым заболеваниям, подлежащим лечению антителами против CD 19, относят, например, злокачественные заболевания В-клеток, например, лимфомы В-клеток или лейкозы В-клеток, включая, но ими не ограничиваясь, неходжкинскую лимфому, хронический лимфоцитарный лейкоз и острый лимфобластный лейкоз. Антитела против CD 19 могут также применяться для лечения аутоиммунных заболеваний, ревматоидного артрита, волчанки, псориаза или заболеваний костей.
В WO 2011/147834 описывают антитела против CD19 и их применение. Однако было обнаружено, что эти антитела имеют в последовательности определенные горячие точки дезамидирования. Описанным в настоящем изобретении антителам свойственны не только последовательности, лишенные этих горячих точек дезамидирования, но и проявляющие повышенную аффинность к мишени CD 19.
Краткое описание изобретения
Одним из объектов настоящего изобретения являются антитела против CD19 человека (anti-human CD19 антитела) с высокой аффинностью.
Объектом настоящего изобретения является антитело, которое специфически связывается с CD19 человека с повышенной аффинностью по сравнению с антителом, включающим вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 113, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 114.
В одном из вариантов осуществления настоящего изобретения предусматривают антитело, которое специфически связывается с CD19 человека, причем это антитело включает области, определяющие комплементарность (CDR):
(а) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 43,
(б) CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 44,
(в) CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 45,
(г) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 46,
(д) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 47,
(е) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 48.
В другом варианте осуществления настоящего изобретения антителом является моноклональное антитело. В еще одном из вариантов осуществления настоящего изобретения антитело является антителом человека, гуманизированным или химерным антителом. В другом варианте осуществления настоящего изобретения антитело является фрагментом антитела, который специфически связывается с CD 19 человека.
В еще одном из вариантов осуществления настоящего изобретения предусматривают антитело, которое содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 99, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 100.
В еще одном из вариантов осуществления настоящего изобретения предусматривают антитело, описанное в настоящем изобретении, которое представляет антитело IgG1 полной длины.
В другом варианте осуществления настоящего изобретения предусматривают антитело по настоящему изобретению, которое является антителом IgG1 полной длины с мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Rabat).
В еще одном варианте осуществления настоящего изобретения предусматривают антитело по настоящему изобретению, которое обладает перекрестной реакционной способностью в отношении CD19 человека и макака крабоеда.
В другом варианте осуществления настоящего изобретения предусматривают биспецифичное антитело, которое специфически связывается с CD19 человека и со второй антигенсвязывающей частью молекулы, причем антитело включает:
(а) CDR-L1, включающую аминокислотную последовательность SEQ ID NO: 43,
(б) CDR-L2, включающую аминокислотную последовательность SEQ ID NO: 44,
(в) CDR-L3, включающую аминокислотную последовательность SEQ ID NO: 45,
(г) CDR-H1, включающую аминокислотную последовательность SEQ ID NO: 46,
(д) CDR-H2, включающую аминокислотную последовательность SEQ ID NO: 47,
(е) CDR-H3, включающую аминокислотную последовательность SEQ ID NO: 48.
В другом варианте осуществления настоящего изобретения предусматривают отдельный полинуклеотид, кодирующий описанное выше антитело по настоящему изобретению. Кроме того, в изобретении предусматривают вектор, в частности экспрессирующий вектор, содержащий отдельный полинуклеотид по настоящему изобретению и клетку-хозяина, содержащую отдельный полинуклеотид или вектор по настоящему изобретению. В некоторых вариантах осуществления настоящего изобретения клетка-хозяин представляет эукариотическую клетку, в частности клетку млекопитающего.
В еще одном варианте осуществления настоящего изобретения предусматривают способ получения антитела по настоящему изобретению, включающий стадии (i) культивирования клеток-хозяев по настоящему изобретению в условиях, пригодных для экспрессии антигенсвязывающей молекулы, и (ii) выделения антигенсвязывающей молекулы. Настоящее изобретение также охватывает антитело, полученное способом по настоящему изобретению.
Настоящее изобретение также предусматривает фармацевтическую композицию, включающую антитело по настоящему изобретению и, по меньшей мере, один фармацевтически приемлемый эксципиент.
Также объектом настоящего изобретения является антитело по настоящему изобретению или фармацевтическая композиция по настоящему изобретению для применения в качестве лекарственного средства. Один из вариантов осуществления настоящего изобретения предусматривает антитело по настоящему изобретению или фармацевтическую композицию по настоящему изобретению для применения в лечении заболевания индивидуума, нуждающегося в таком лечении. В еще одном из вариантов осуществления настоящего изобретения предусматривают антитело по настоящему изобретению или фармацевтическую композицию по настоящему изобретению для использования в лечении рака. В другом варианте осуществления настоящего изобретения предусматривают антитело по настоящему изобретению или фармацевтическая композиция по настоящему изобретению для использования в лечении аутоиммунных заболеваний, ревматоидного артрита, волчанки, псориаза или заболевания костей.
Также предусматривают применение антитела по настоящему изобретению для получения лекарственного средства для лечения заболевания у индивидуума, нуждающегося в этом, в частности для получения лекарственного средства для лечения рака, а также способ лечения заболевания у индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества композиции, содержащей антитело, в фармацевтически приемлемой форме. В одном из вариантов осуществления настоящего изобретения заболеванием является рак. В другом варианте осуществления настоящего изобретения заболевание выбрано из группы, состоящей из аутоиммунных заболеваний, ревматоидного артрита, волчанки, псориаза или заболевания костей. В каком-либо из вышеприведенных вариантов осуществления настоящего изобретения индивидуумом является млекопитающее, в частности человека.
Краткое описание фигур
Фиг. 1. Стратегия рандомизации областей CDR исходного клона 8 В8. Показаны вариабельные домены исходного клона 8В8 и областей CDR (в рамках) в соответствии с нумерацией Kabat. Последовательность VL соответствует SEQ ID NO: 114, а последовательность VH соответствует SEQ ID NO: 113. (X) означает рандомизированные позиции.
Фиг. 2. Схематическое описание стратегий получения библиотеки. Показана стратегия ПЦР амплификации и клонирования, используемая для получения библиотеки на основе 8В8 с А) рандомизированными областями CDR1 и CDR2 в рандомизированных областях CDR1 и CDR3 в легкой и тяжелой цепи или Б) рандомизированными областями CDR1 и CDR3 в легкой цепи и области CDR3 в тяжелой цепи. Указаны соответствующие ферменты, используемые для клонирования в фагмиде.
Фиг. 3. Выравнивание исходного анти-CD19-клона 8В8 с выбранными связующими со сформированной аффинностью. Показаны последовательности клона 8В8 и всех выбранных связующих со сформированной аффинностью. CDR тяжелых и легких цепей взяты в рамки.
Фиг. 4 (А-3). Анализ SPR исходного клона 8В8 и его вариантов со сформированной аффинностью. Показаны сенсограммы клона 8В8 и его производных вариантов со сформированной аффинностью, которые не содержат горячих точек LCDR1 N27d и N28.
Фиг. 5. Связывание разных клонов CD19 IgG1 с опухолевыми клетками, экспрессирующими CD19 человека (клетками WSU-DLCL2). Определяют связывание с помощью РЕ-конъюгированного аффинночистого козьего фрагмента F(ab')2, специфичного в отношении F(ab')2 фрагмента IgG человека (AffiniPure anti-human IgG F(ab')2-fragment-specific goat F(ab')2 fragment). Показана средняя интенсивность флуоресценции (median of fluorescence intensity - MFI) относительно концентрации исследуемых клонов.
Подробное описание изобретения
Определения
Если не указано иное, технические и научные термины, используемые в настоящем изобретении, имеют значение, которое обычно используется в области техники, к которой относится это изобретение. Для понимания настоящего описания применяют приводимые ниже понятия и, в соответствующих случаях, используемые в единственном числе понятия также могут означать множественное число и наоборот.
В контексте настоящего изобретения понятие «антигенсвязывающая молекула» относится в самом широком смысле к молекуле, которая специфически связывает антигенный детерминант. Примерами антигенсвязывающих молекул являются антитела, фрагменты антител и белки, связывающие каркасный антиген.
Понятие «антигенсвязывающая часть молекулы» относится к молекуле полипептида, которая специфически связывается с антигенным детерминантом. В одном из вариантов осуществления настоящего изобретения антигенсвязывающая часть молекулы способна активировать передачу сигнала через антиген клетке-мишени. В еще одном из вариантов осуществления настоящего изобретения антигенсвязывающая часть молекулы способна направлять объект, к которому она прикреплена, к сайту-мишени. Антигенсвязывающие части молекулы включают антитела и их фрагменты, способные специфически связываться с антигеном клеток-мишеней. Кроме того, антигенсвязывающие части молекулы, способные к специфическому связыванию с антигеном клеток-мишеней, включают каркасные антигенсвязывающие белки согласно описанному ниже, например, связывающие домены, которые основаны на сконструированных повторяющихся белках или на сконструированных повторяющихся доменах, например, сконструированных анкириновых повторяющихся белках (designed ankyrin repeat proteins - DARPins) (см., например, WO 2002/020565) или липокалинах (антикалин).
Понятие «антитело» в контексте настоящего изобретения применяют в самом широком смысле, охватывая различные по структуре антитела, в том числе включая, но ими не ограничиваясь, моноклональные антитела, поликлональные антитела, моноспецифичные и мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, при условии, что они проявляют требуемую антигенсвязывающую активность.
В контексте настоящего изобретения понятие «моноклональное антитело» относится к антителу, полученному из популяции в высокой степени гомогенных антител, то есть индивидуальных антител в популяции, которые идентичны и/или связывают один и тот же эпитоп, за исключением возможных вариантов антител, например, содержащих природные мутации или возникающие при получении препарата моноклональных антител, причем такие варианты обычно присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело препарата моноклонального антитела направлено против одного детерминанта на антигене.
В контексте настоящего изобретения понятие «моноспецифичное» антитело означает антитело, которое имеет один или несколько сайтов связывания, каждый из которых связывается с одним и тем же эпитопом одного и того же антигена. Термин «биспецифичный» означает, что антигенсвязывающая молекула может специфически связываться, по меньшей мере, с двумя различными антигенными детерминантами. Обычно биспецифичная антигенсвязывающая молекула содержит два антигенсвязывающих сайта, каждый из которых специфичен для другой антигенной детерминанты. В некоторых вариантах осуществления настоящего изобретения биспецифичная антигенсвязывающая молекула способна одновременно связывать два антигенных детерминанта, в частности два антигенных детерминанта, экспрессируемых в двух разных клетках.
Понятие «валентность» в настоящем изобретении означает наличие определенного числа сайтов связывания в антигенсвязывающей молекуле. Таким образом, понятия «двухвалентный», «четырехвалентный» и «шестивалентный» означают наличие двух сайтов связывания, четырех сайтов связывания и шести сайтов связывания, соответственно, в антигенсвязывающей молекуле.
В контексте настоящего изобретения понятия «антитело полной длины», «интактное антитело» и «целое антитело» используют взаимозаменяемо по отношению к антителу, имеющему структуру, по существу, сходную с нативной структурой антитела. «Нативные антитела» относятся к природным молекулам иммуноглобулина с различными структурами. Например, природные антитела класса IgG представляют гетеротетрамерные гликопротеины размером около 150000 дальтон и состоящие из двух легких цепей и двух тяжелых цепей, которые объединены дисульфидной связью. От N- к С-концу каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следуют три константных домена (CH1, СН2 и СН3), также называемых константной областью тяжелой цепи. Аналогично, от N- к С-концу каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL), константной областью легкой цепи. Тяжелая цепь антитела может быть отнесена к одному из пяти типов, которые называются α (IgA), δ (IgD), ε (IgE), γ (IgG) или ц (IgM), некоторые из которых могут быть далее разделены на подтипы, например γ1 (IgGl), γ2 (IgG2), γ3 (IgG3), γ4 (IgG4), α1 (IgAl) и α2 (IgA2). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена.
Понятие «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающую антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваются ими, Fv, Fab, Fab', Fab'-SH, F(ab')2, диантитела, триантитела, тетрантитела, фрагменты кросс-Fa, линейные антитела, молекулы одноцепочечных антител (например, scFv) и однодоменные антитела. Для обзора некоторых фрагментов антител см. публикацию Hudson с соавт., Nat Med 9, 2003, 129-134. Для обзора фрагментов scFv см., например, Plilckthun в кн.: «The Pharmacology of Monoclonal Antibodies», Т. 113, 1994, под ред. Rosenburg и Moore, изд-во Springer-Verlag, Нью-Йорк, 1994, 269-315, см. также WO 93/16185, US 5571894, US 5587458. Для обсуждения фрагментов Fab и F (ab') 2, содержащих остатки эпитопов, связывающих рецептор реутилизации и имеющих увеличенный период полужизни in vivo, см. US 5869046. Диантитела являются фрагментами антител с двумя сайтами связывания антигена, которые могут быть двухвалентными или биспецифическими, см., например, ЕР 404097, WO 1993/01161, Hudson с соавт., Nat Med 9, 2003, 129-134, Hollinger с соавт., Proc Natl Acad Sci USA 90, 1993, 6444-6448. Триантитела и тетрантитела также описаны в публикации Hudson с соавт., Nat Med 9, 2003, 129-134. Однодоменными антителами являются фрагменты антител, содержащие все или часть вариабельного домена тяжелой цепи или все или часть вариабельного домена легкой цепи антитела. В некоторых вариантах осуществления настоящего изобретения однодоменное антитело представляет однодоменное антитело человека (фирма Domantis, Inc., Waltham, Массачусетс, см., например, US 6248516). Фрагменты антител могут быть получены разными методами, включая, но ими не ограничиваясь, протеолитическое расщепление интактного антитела, а также с помощью рекомбинантных клеток-хозяев (например, Е. coli или фага), согласно описанию настоящего изобретения.
Расщепление папаином интактных антител приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых фрагментами Fab, каждый из которых содержит вариабельные домены тяжелой и легкой цепей, а также константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. В настоящем изобретении понятие «фрагмент Fab» относится к фрагменту антитела, включающему фрагмент легкой цепи, который содержит домен VL и константный домен легкой цепи (CL), а также домен VH и первый константный домен (СН1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков с карбоксильного конца домена СН1 тяжелой цепи, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH представляют фрагменты Fab', в которых остаток (остатки) цистеина константных доменов несут свободную тиольную группу. Обработка пепсином приводит к образованию фрагмента F(ab')2, который имеет два антигенсвязывающих сайта (два фрагмента Fab) и часть области Fc.
Понятие «кроссоверный фрагмент Fab», или «фрагмент xFab», или «кросс-Fab фрагмент» относится к фрагменту Fab, в котором либо вариабельные области, либо константные области тяжелой и легкой цепей обменены. Возможны два разных состава цепей кроссоверной молекулы Fab, которые входят в биспецифические антитела по настоящему изобретению: с одной стороны, вариабельные области тяжелой и легкой цепи Fab заменяются, т.е. кроссоверная молекула Fab содержит пептидную цепь, состоящую из вариабельную область легкой цепи (VL) и константной области тяжелой цепи (СН1), и пептидную цепь, состоящую из вариабельную область тяжелой цепи (VH) и константной области легкой цепи (CL). Такую кроссоверную молекулу Fab также обозначают CrossFab (VLVH). С другой стороны, когда константные области тяжелой и легкой цепей Fab обменивают, кроссоверная молекула Fab содержит пептидную цепь, состоящую из вариабельной области тяжелой цепи (VH) и константной области легкой цепи (CL), и пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и константной области тяжелой цепи (СН1). Такую кроссоверную молекулу Fab также обозначают CrossFab (CLCH1).
«Одноцепочечный Fab-фрагмент» или «scFab» представляет полипептид, состоящий из вариабельного домена тяжелой цепи антитела (VH), константного домена 1 антитела (СН1), вариабельного домена легкой цепи антитела (VL), константного домена легкой цепи антитела домен (CL) и линкера, причем указанные домены антител и указанный линкер имеют один из следующих порядков в направлении от N-конца к С-концу: а) VH-CH1-линкер-VL-CL, б) VL-CL-линкер-VH-СН1, в) VH-CL-линкер-VL-СН1 или г) VL-CH1-линкер-VH-CL, где указанный линкер представляет собой полипептид, по меньшей мере, из 30 аминокислот, предпочтительно от 32 до 50 аминокислот. Указанные одноцепочечные Fab-фрагменты стабилизируют через естественную дисульфидную связь между доменом CL и доменом СН1. Кроме того, такие одноцепочечные молекулы Fab могут быть дополнительно стабилизированы путем формирования межцепочечных дисульфидных связей путем инсерции остатков цистеина (например, в положение 44 в вариабельной тяжелой цепи и положение 100 в вариабельной легкой цепи в соответствии с нумерацией по Kabat).
«Кроссоверный одноцепочечный фрагмент Fab» или «x-scFab» представляет полипептид, состоящий из вариабельного домена тяжелой цепи антитела (VH), константного домена 1 антитела (СН1), вариабельного домена легкой цепи (VL) антитела, константного домена легкой цепи антитела (CL) и линкера, причем указанные домены антитела и указанный линкер имеют один из следующих порядков расположения от N-конца к С-концу: а) VH-CL-линкер-VL-CH1 и 6) VL-CH1- линкер-VH-CL, причем VH и VL образуют вместе антигенсвязывающий сайт, который специфически связывается с антигеном и в котором указанный линкер представляет собой полипептид, по меньшей мере, из 30 аминокислот. Кроме того, эти молекулы x-scFab могут быть дополнительно стабилизированы за счет образования межцепочечных дисульфидных связей путем введения остатков цистеина (например, положение 44 в вариабельной тяжелой цепи и в положение 100 в вариабельной легкой цепи в соответствии с нумерацией по Kabat).
«Одноцепочечный вариабельный фрагмент (single-chain variable fragment - scFv)» означает гибридный белок вариабельных областей тяжелой (VH) и легкой (VL) цепей антитела, соединенных коротким пептидным линкером, включающим от 10 до примерно 25 аминокислот. Линкер обычно обогащен глицином для гибкости, а также серином или треонином для растворимости, и может соединять N-конец VH с С-концом VL, или наоборот. Этот белок сохраняет специфичность исходного антитела, несмотря на удаление константных областей и введение линкера. Антитела scFv описаны, например, в публикации Houston J.S., Methods in Enzymol. 203, 1991, 46-96. Кроме того, фрагменты антител включают одноцепочечные полипептиды, обладающие свойствами домена VH, а именно способностью объединяться с доменом VL или с доменом VL, а именно, способностью объединяться с доменом VH в функциональный антигенсвязывающий сайт и тем самым обеспечивать антигенсвязывающее свойство антител полной длины.
Известные в данной области техники «каркасные антигенсвязывающие белки», например, фибронектин и сконструированные анкириновые повторяющиеся белки (designed ankyrin repeat proteins - DARPins) используют в качестве альтернативных каркасов для антигенсвязывающих доменов, см., например, публикации Gebauer и Skerra, Curr Opin Chem Biol 13, 2009, 245-255, и Stumpp с соавт., Drug Discovery Today 13, 2008, 695-701. В одном из вариантов осуществления настоящего изобретения каркасный антигенсвязывающий белок выбран из группы, включающей CTLA-4 (Evibody), липокалины (Anticalin), производные от белка А молекулы, например, Z-домен белка A (Affibody), А-домен (Avimer/Maxibody), сывороточный трансферрин (транс-тело), сконструированный анкириновый повторяющийся белок (DARPin), вариабельный домен легкой цепи антитела или тяжелой цепи антитела (однодоменное антитело, single-domain antibody - sdAb), вариабельный домен тяжелой цепи антитела (нанотело, aVH), фрагменты VNAR, фибронектин (AdNectin), лектин С-типа домена (тетранектин), вариабельный домен нового антигенного рецептора бета-лактамазы (фрагменты VNAR), гамма-кристаллин человека или убиквитин (молекулы аффилина), домен типа домена Куница ингибиторов протеазы человека, микротела, например, белки семейства ноттин, пептидные аптамеры и фибронектин (аднектин).
Цитотоксический связанный с Т-лимфоцитами антиген 4 (CTLA-4 - Cytotoxic Т Lymphocyte-associated Antigen 4) является рецептором семейства CD28, экспрессируемым преимущественно на CD4+ Т-клетках. Его внеклеточный домен обладает складчатостью наподобие складчатости вариабельного домена Ig. Петли, соответствующие CDR антител, могут быть замещены гетерологичной последовательностью для придания различных связующих свойств. Молекулы CTLA-4, сконструированные для придания различных связующих свойств, также называют эвителами (Evibodies; см., например, US 7166697 В1). Эвитела примерно такого же размера, что и выделенная область антитела (например, доменного антитела). Подробнее см. Journal of Immunological Methods 248 (1-2), 2001, 31-45.
Липокалины представляют семейство внеклеточных белков, которые транспортируют малые гидрофобные молекулы, например, стероиды, билины, ретиноиды и липиды. Они имеют жесткую вторичную бета-структуру с несколькими петлями на открытом конце конической структуры, которые могут быть сконструированы для связывания с различными целевыми антигенами. Антикалины содержат от 160 до 180 аминокислот и получены из липокалинов. Подробнее см. Biochim Biophys Acta 1482, 2000, 337-350, US 7250297 B1 и US 20070224633.
Аффитело - это каркас, производный от белка A Staphylococcus aureus, который может быть сконструирован для связывания с антигеном. Домен представляет трехспиральный пучок примерно из 58 аминокислот. Библиотеки получают путем рандомизации остатков на поверхности. Подробнее см. Protein Eng. Des. Sel. 17, 2004, 455-462 и ЕР 1641818 А1.
Авимеры являются мультидоменными белками, полученными из семейства А-доменного каркаса. Нативные домены длиной примерно 35 аминокислот принимают определенную связанную дисульфидом структуру. Разнообразие создается путем перетасовки природной вариации, представляемой семейством А-доменов. Подробнее см. Nature Biotechnology 23(12), 2005, 1556-1561 и Expert Opinion on Investigational Drugs 16(6), 2007, 909-917.
Трансферин является мономерным транспортным сывороточным гликопротеином. Трансферины могут быть сконструированы для связывания различных целевых антигенов путем инсерции пептидных последовательностей в дополнительную поверхностную петлю. Примеры инженерных каркасов трансферрина включают транс-тело. Подробнее см. J. Biol. Chem 274, 1999, 24066-24073.
Сконструированные белки с анкириновым повтором (Designed Ankyrin Repeat Proteins - DARPins) являются производными от анкирина, который относится к семейству белков, опосредующих присоединение интегральных мембранных белков к цитоскелету. Единичный анкириновый повтор является мотивом из 33 остатков, состоящим из двух альфа-спиралей и бета-витка. Они могут быть сконструированы для связывания различных целевых антигенов путем рандомизации остатков в первой альфа-спирали и бета-витке каждого повтора. Их связывающая поверхность может быть увеличена за счет повышения числа модулей (метод созревания аффинности). Подробнее см. J. Mol. Biol. 332, 2003, 489-503, PNAS 100(4), 2003, 1700-1705, J. Mol. Biol. 369, 2007, 1015-1028, US 20040132028 A1.
Однодоменное антитело является фрагментом антитела, состоящим из одиночного мономерного вариабельного домена антитела. Первый одиночный домен получают из вариабельного домена тяжелой цепи антител верблюдов (нанотел или фрагментов VHH). Кроме того, понятие «однодоменное антитело» включает в себя автономный вариабельный домен тяжелой цепи человека (aVH) или фрагменты VNAR, полученные из акул.
Фибронектин - это каркас, который может быть сконструирован для связывания с антигеном. Аднектины состоят из основы природной аминокислотной последовательности 10-го домена из 15 повторяющихся звеньев фибронектина человека III типа (FN3). Три петли на одном конце β-сэндвича могут быть сконструированы таким образом, чтобы аднектин мог специфически распознавать требуемую терапевтическую мишень. Подробнее см. Protein Eng. Des. Sel. 18, 2005, 435-444, US 20080139791, WO 2005056764, US 6818418 B1.
Пептидные аптамеры представляют комбинаторные молекулы распознавания, которые состоят из константного белка каркаса, обычно тиоредоксина (TrxA), который содержит напряженную вариабельную пептидную петлю, инсертированную в активный сайт. Подробнее см. Expert Opin. Biol. Ther. 5, 2005, 783-797.
Микротела получают из встречающихся в природе микропротеинов длиной 25-50 аминокислот, которые содержат 3-4 цистеиновых мостика. К примерам микропротеинов относятся KalataBI и конотоксин и ноттины. Микропротеины имеют петлю, которая может быть сконструирована таким образом, что включает до 25 аминокислот, не влияя на общую укладку микропротеина. Более подробную информацию о сконструированных доменов ноттина см. в WO 2008098796.
Понятие «антигенсвязывающая молекула, которая связывается с тем же эпитопом» в качестве контрольной молекулы относится к антигенсвязывающей молекуле, которая блокирует связывание контрольной молекулы с ее антигеном в конкурентном анализе на 50% или более и, наоборот, контрольная молекула блокирует связывание антигенсвязывающей молекулы с ее антигеном в конкурентном анализе на 50% или более.
Понятие «антигенсвязывающий домен» относится к части антигенсвязывающей молекулы, которая включает область, которая специфически связывается и комплементарна части или всему антигену. При большом размере антигена антигенсвязывающая молекула может связываться только с определенной частью антигена, эта часть называется эпитопом. Антигенсвязывающий домен может быть снабжен, например, одним или несколькими вариабельными доменами (также называемыми вариабельными областями). Предпочтительно, антигенсвязывающий домен содержит вариабельную область легкой цепи антитела (VL) и вариабельную область тяжелой цепи антитела (VH).
В контексте настоящего изобретения понятие «антигенный детерминант» является синонимом понятий «антиген» и «эпитоп» и относится к сайту (например, к смежному отрезку аминокислот или конформационной конфигурации, состоящей из разных областей несмежных аминокислот) в полипептидной макромолекуле, с которой связывается антигенсвязывающая часть молекулы, образуя комплекс антигенсвязывающей части молекулы с антигеном. Полезные антигенные детерминанты можно найти, например, на поверхностях опухолевых клеток, поверхностях зараженных вирусом клеток, поверхностях других поврежденных клеток, на поверхности иммунных клеток, в свободном состоянии в сыворотке крови и/или во внеклеточном матриксе (extracellular matrix - ЕСМ). В настоящем изобретении белки, используемые в качестве антигенов, могут быть какими-либо нативными белками, происходящими от позвоночных животных, включая млекопитающих, например, приматов (например, людей) и грызунов (например, мышей и крыс), если не указано иное. В конкретном варианте осуществления настоящего изобретения антигеном является белок человека. В тех случаях, когда в настоящем изобретении упоминают определенный белок, это понятие охватывает не подвергавшийся изменениям белок полной длины, а также какую-либо форму белка, которая возникает в результате процессирования в клетке. Термин также охватывает природные варианты белка, например, варианты сплайсинга или аллельные варианты.
Понятие «специфическое связывание» означает, что связывание является селективным для антигена и может отличаться от нежелательных или неспецифических взаимодействий. Способность антигенсвязывающей молекулы связываться с определенным антигеном может быть измерена либо с помощью иммуноферментного анализа (enzyme-linked immunosorbent assay - ELISA), либо другими методами, известными специалистам в данной области техники, например, методом поверхностного плазмонного резонанса (Surface Plasmon Resonance - SPR) (для анализа используют прибор BIAcore) (Liljeblad с соавт., Glyco J 17, 2000, 323-329) и традиционными методами связывания (Heeley, Endocr Res 28, 2002, 217-229). В одном из вариантов осуществления настоящего изобретения степень связывания антигенсвязывающей молекулы с другим белком составляет примерно менее 10% от степени связывания антигенсвязывающей молекулы с соответствующим антигеном, например, по результату SPR. В некоторых вариантах осуществления настоящего изобретения молекула, которая связывается с антигеном, имеет константу диссоциации (Kd) <1 мкМ, <100 нМ, <10 нМ, <1 нМ, <0,1 нМ, <0,01 нМ или <0,001 нМ (например, 10~8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
Понятие «аффинность» или «связывающее сродство» относится к силе общего числа нековалентных взаимодействий между одним сайтом связывания в молекуле (например, в антителе) и ее связывающим партнером (например, антигеном). Если не указано иное, в контексте настоящего изобретения понятие «связывающее сродство» относится к аффинности, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X в отношении партнера Y обычно может быть представлена константой диссоциации (Kd), которая означает отношение констант скорости диссоциации и константы скорости ассоциации (koff и коп, соответственно). Таким образом, эквивалентные аффинности могут представлять разные константы скорости, если отношение констант скорости остается неизменным. Аффинность может быть измерена обычными методами, известными в данной области, включая методы, описанные в настоящем изобретении. Таким методом измерения аффинности является поверхностный плазмонный резонанс (SPR).
Понятие «CD19» относится к антигену CD19 В-лимфоцитов, также называемому поверхностным антигеном В4 В-лимфоцитов или к поверхностному антигеном Leu-12 Т-клеток, а также относится к какому-либо нативному CD19 от какого-либо позвоночного животного, в том числе от млекопитающих, например, от приматов (например, людей), от обезьян (например, макак крабоедов) и грызунов (например, мышей и крыс), если не указано иное. Аминокислотная последовательность CD19 человека показана в базе Uniprot no. Р15391 (версия 160, SEQ ID NO: 115). Данное понятие охватывает непроцессированный «полной длины» CD19 человека, а также какую-либо форму CD19 человека, которая является результатом процессирования в клетке, при условии, что антитело согласно описанию настоящего изобретения связывается с ним. CD19 представляет структурно отличающийся рецептор клеточной поверхности, экспрессируемый на поверхности В-клеток человека, включая, но, не ограничиваясь ими, предшественников В-клеток, В-клетки на ранней стадии развития (т.е. незрелые В-клетки), зрелые В-клетки до итоговой дифференциации в клетки плазмы и злокачественные В-клетки. CD19 экспрессируется большинством предшественников В-клеток при остром лимфобластном лейкозе (acute lymphoblastic leukemias - ALL), неходжинской лимфоме, В-клеточном хроническом лимфоцитарном лейкозе (chronic lymphocytic leukemias - CLL), про-лимфоцитарных лейкозах, волосатоклеточном лейкозе, общем остром лимфоцитарном лейкозе, а также при остром лимфобластном лейкозе с нулевым фенотипом. Экспрессия CD19 на клетках плазмы также предполагает, что он может быть экспрессирован на дифференцированных злокачественных В-клетках, например, при множественной миеломе. Поэтому антиген CD19 является мишенью для иммунотерапии при лечении неходжкинской лимфомы, хронического лимфоцитарного лейкоза и/или острого лимфобластного лейкоза.
Понятие «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, которая участвует в связывании антигенсвязывающей молекулы с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют сходные структуры, причем каждый домен состоит из четырех консервативных каркасных областей (framework regions - FR) и трех гипервариабельных областей (hypervariable regions - HVR). См., например, кн.: Kindt с соавт.«Kuby Immunology», 6-е изд., изд-во W.H. Freeman and Co., 2007, 91 с. Один домен VH или VL может быть достаточным для определения антигенсвязывающей специфичности.
В контексте настоящего изобретения понятие «гипервариабельная область» или «HVR» относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными в последовательности и/или образуют петли определенной структуры («гипервариабельные петли»). Как правило, нативные четырехцепочечные антитела включают шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). HVR обычно содержат аминокислотные остатки из гипервариабельных петель и/или из «областей, определяющих комплементарность» (complementarity determining regions - CDR), причем последние имеют наибольшую вариабельность последовательности и/или участвуют в распознавании антигена. Примерами гипервариабельных петель являются петли по аминокислотным остаткам 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia и Lesk, J. Mol. Biol., 196, 1987, 901-917). Примерами CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) являются области CDR по аминокислотным остаткам 24-34 L1, 50-56 L2, 89-97 L3, 31-35 HI, 50-65 Н2, и 95-102 Н3 (кн.: Kabat с соавт., Sequences of oteins of Immunological Interest, 5e изд., 1991, изд-во Public Health Service, Национальный Институт Здоровья, Бетесда, Мериленд). Гипервариабельные области (Hypervariable regions - HVR) также называют областями, определяющими комплементарность (complementarity determining regions - CDR), и эти понятия применяют в настоящем изобретении взаимозаменяемо по отношению к частям вариабельной области, которые образуют области связывания антигена. Эта конкретная область была описана Kabat с соавт. в кн. U.S. Dept. of Health and Human Services «Sequences of Proteins of Immunological Interest)) 1983, и Chothia с соавт., J. Mol. Biol. 196, 1987, 901-917, где определения включают перекрывающиеся или подмножества аминокислотных остатков при сравнении друг с другом. Тем не менее, применение какого-либо определения для обозначения CDR антитела или его вариантов предназначено для охвата понятия, определенного и используемого в настоящем документе. Соответствующие аминокислотные остатки, которые входят в CDR, что определено в каждой из приведенных выше ссылок, указаны ниже в таблице А для сравнения. Точные номера остатков, которые охватывают конкретную CDR, могут варьировать в зависимости от последовательности и размера CDR. Специалисты в данной области могут определить, какие остатки представляют конкретную CDR данной аминокислотной последовательности вариабельной области антитела.
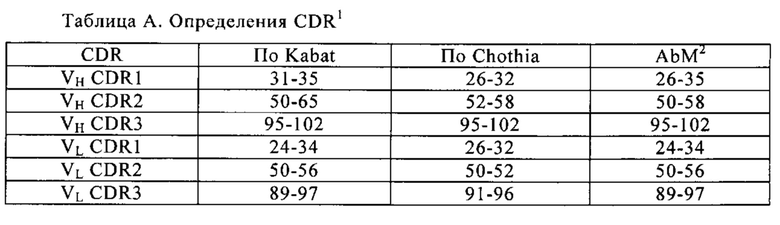
1Нумерация всех CDR в таблице А соответствует принятому правилам нумерации, изложенным в публикации Kabat с соавт. (см. ниже);
2Обозначение «AbM» с прописной буквой «b», используемое в табл.А, соответствует обозначению CDR согласно программному обеспечению по моделированию Oxford  "AbM".
"AbM".
В работе Kabat с соавт. также определена система нумерации последовательностей вариабельной области, которую применяют к какому-либо антителу. Специалист в данной области может однозначно применить эту систему «нумерации по Kabat» к какой-либо последовательности вариабельной области, не полагаясь на какие-либо экспериментальные данные за пределами самой последовательности. В контексте настоящего изобретения понятие «нумерация по Kabat» относится к системе нумерации, изложенной Kabat с соавт. в кн. U.S. Dept. of Health and Human Services «Sequences of Proteins of Immunological Interest)), 1983. Если не указано иное, ссылки на нумерацию позиций определенных аминокислотных остатков в вариабельной области антитела соответствуют системе нумерации по Kabat.
За исключением CDR1 в VH, CDR обычно содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR также содержат «остатки, определяющие специфичность» или «specificity determining residues - SDR», которые являются остатками, контактирующими с антигеном. SDR содержатся в областях CDR, называемых укороченными CDR (abbreviated CDR-a-CDR). Примеры a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) находятся по аминокислотным остаткам 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35 В в H1, 50-58 в Н2 и 95-102 в Н3. (См. Almagro и Fransson, Front, Biosci, 13, 2008, 1619-1633). Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) в настоящем изобретении нумеруют в соответствии с публикацией Kabat с соавт.(см. выше).
В настоящем изобретении понятие «созревание аффинности» в контексте антигенсвязывающих молекул (например, антител) относится к антигенсвязывающей молекуле, которая производна от контрольной антигенсвязывающей молекулы, например, в результате мутации, и связывается с тем же антигеном, предпочтительно связывается с тем же эпитопом, что и контрольное антитело; такая молекула имеет более высокое сродство с антигеном, чем контрольная антигенсвязывающая молекула. Созревание аффинности обычно включает модификацию одного или нескольких аминокислотных остатков в одной или более CDR антигенсвязывающей молекулы. Обычно антигенсвязывающая молекула с формировавшейся аффинностью связывается с тем же эпитопом, что и исходная контрольная антигенсвязывающая молекула.
Понятие «каркасный участок» или «framework - FR» относится к остаткам вариабельного домена, отличающихся от остатков гипервариабельной области (hypervariable region - HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно возникают в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
«Акцепторный каркасный участок человека» в контексте настоящего изобретения является каркасным участком, включающим аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасного участка вариабельного домена тяжелой цепи (VH), являющимся производным каркасного участка иммуноглобулина человека или консенсусного каркасного участка человека согласно описанному ниже. Акцепторный каркасный участок человека, который «является производным» каркасного участка иммуноглобулина человека или консенсусного каркасного участка человека, может содержать одну и ту же аминокислотную последовательность или может содержать измененные аминокислотные последовательности. В некоторых вариантах осуществления настоящего изобретения количество аминокислотных изменений составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее.
8 некоторых вариантах осуществления настоящего изобретения акцепторный каркасный участок человека VL идентичен последовательности каркасного участка иммуноглобулина человека или последовательности консенсусного каркасного участка человека.
В настоящем изобретении понятие «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи производна от конкретного источника или вида, тогда как остальная часть тяжелой и/или легкой цепи получена от другого источника или вида.
Понятие «класс» антитела относится к типу константного домена или константной области, которая присуща тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть далее разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, называются α, δ, ε, γ и соответственно.
Понятие «гуманизированное» антитело относится к химерному антителу, включающему аминокислотные остатки от HVR, не принадлежащих человеку, и аминокислотные остатки от FR человека. В некоторых вариантах осуществления настоящего изобретения гуманизированное антитело может включать по существу все из, по меньшей мере, одного, обычно двух вариабельных доменов, в которых все или по существу все из HVR (например, CDR) соответствуют HVR антитела, не являющегося антителом человека, и все или по существу все из FR соответствуют тем FR, которые, которые соответствуют антителу человеку. Гуманизированное антитело необязательно может содержать, по меньшей мере, часть константной области антитела, производной от антитела человека. «Гуманизированная форма» антитела, например антитела, отличного от антитела человека, относится к антителу, которое подверглось гуманизации. Другие формы «гуманизированных антител», предусмотренных в настоящем изобретении, являются теми формами, в которых константная область дополнительно модифицирована или изменена по сравнению с исходным антителом для получения свойств, предусмотренных в настоящем изобретении, особенно в отношении связывания Clq и/или связывания рецептора Fc (Fc receptor - FcR).
Понятие «антитело человека» означает антитело, которое имеет аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, вырабатываемого в организме человека или клетками человека, или происходящим из другого источника, не являющегося человеком, который использует репертуары антител человека или другие последовательности, кодирующие антитела человека. Такое определение антитела человека исключает гуманизированное антитело, содержащее не связанные с антигеном человека остатки.
Понятие «область Fc» или «домен Fc» в настоящем изобретении используют для определения С-концевой области тяжелой цепи антитела, которая содержит, по меньшей мере, часть константной области. Понятие включает области Fc нативной последовательности и варианты областей Fc. Область Fc IgG содержит домен СН2 IgG и домен СН3 IgG. Понятие «домен СН2» области Fc IgG человека обычно простирается от аминокислотного остатка примерно в положении 231 до аминокислотного остатка примерно в положении 340. В одном варианте осуществления настоящего изобретения углеводная цепь присоединена к домену СН2. Домен СН2 в одном из вариантов осуществления настоящего изобретения может быть доменом СН2 нативной последовательности или вариантом домена СН2. Понятие «домен СН3» означает отрезок остатков с С-конца до домена С2 в области Fc (т.е. от аминокислотного остатка в положении 341 до аминокислотного остатка в положении 447 IgG). Область СН3 в настоящем изобретении может быть нативной последовательностью СН3 или вариантом домена СН3 (например, доменом СН3 с введенным «выступом» в одной цепи и соответствующей введенной «впадиной» в другой цепи, см. US 5821333, включенный в настоящее описание в качестве ссылки). Такие варианты доменов СНЗ могут быть использованы для индукции гетеродимеризации двух неидентичных тяжелых цепей антител согласно описанию настоящего изобретения. В одном варианте осуществления настоящего изобретения область Fc тяжелой цепи человека IgG занимает отрезок от Cys226 или от Pro230 до карбоксильных концов тяжелой цепи. Однако С-концевой лизин (Lys447) области Fc может присутствовать или отсутствовать. Если не указано иное, нумерация аминокислотных остатков в области Fc или в константной области соответствует системе нумерации EU, также называемой индексом EU, согласно описанию в кн.: Kabat с соавт., Sequences of Proteins of Immunological Interest, 5e изд., 1991, изд-во Public Health Service, Национальный Институт Здоровья, Бетесда, Мериленд).
Технология «выступ-во-впадину» описана в US 5731168, US 7695936, Ridgway с соавт., Prot Eng 9, 1996, 617-621, Carter, J Immunol Meth 248, 2001, 7-15, в кн.: Kabat с соавт., Sequences of Proteins of Immunological Interest, 5e изд., 1991, изд-во Public Health Service, Национальный Институт Здоровья, Бетесда, Мериленд). Обычно метод включает интродукцию «выступа» на поверхности первого полипептида и соответствующей «впадины» на поверхности второго полипептида таким образом, что располагаясь в полости выступ, может индуцировать формирование гетеродимера и препятствовать формированию гомодимера. Выступы могут формироваться путем замещения небольших боковых цепей аминокислот на поверхности первого полипептида на более крупные боковые цепи (например, тирозина или триптофана). На поверхности второго полипептида создают компенсирующие полости равного или сходного размера с выступами путем замены больших боковых цепей аминокислот на более мелкие (например, аланина или треонина). Выступы и полость могут быть получены путем изменения нуклеиновой кислоты, кодирующей полипептиды, например, сайт-специфическим мутагенезом или пептидным синтезом. В одном из вариантов осуществления настоящего изобретения выступ включает аминокислотное замещение T366W в одной из двух субъединиц домена Fc, а модификация впадины включает аминокислотные замещения T366S, L368A и Y407V в другой из двух субъединиц домена Fc. В еще одном из вариантов осуществления настоящего изобретения субъединица домена Fc, содержащая модификацию выступа, дополнительно содержит аминокислотное замещение S354C, а субъединица домена Fc, включающая модификацию впадины, дополнительно включает аминокислотное замещение Y349C. Интродукция таких двух остатков цистеина приводит к формированию дисульфидного мостика между двумя субъединицами области Fc, что приводит к дальнейшей стабилизации димера (Carter, J Immunol Methods 248, 2001, 7-15).
Понятие «область, эквивалентная области Fc иммуноглобулина» относится к природным аллельным вариантам области Fc иммуноглобулина, а также к вариантам, которые имеют изменения в результате замещений, добавлений или делеций, но которые существенно не уменьшают способности иммуноглобулина опосредовать эффекторные функции (например, антителозависимую клеточную цитотоксичность). Например, одна или несколько аминокислот могут быть делетированы с N-конца или С-конца области Fc иммуноглобулина без существенной потери биологической функции. Такие варианты могут быть выбраны в соответствии с общими правилами, принятыми в данной области, чтобы иметь минимальное влияние на активность (см., например, Bowie J. U. С соавт., Science 247, 1990, 1306-1310).
Понятие «эффекторные функции» относится к тем биологическим активностям, которые связаны с областью Fc антитела, которые варьируют в зависимости от изотипа антитела. К примерам эффекторных функций антител относят: C1q-связывание и комплементарная цитотоксичность (complement dependent cytotoxicity - CDC), связывание рецептора Fc, антителозависимая клеточно-опосредованная цитотоксичность (antibody-dependent cell-mediated cytotoxicity - ADCC), зависимый от антител клеточный фагоцитоз (antibody-dependent cellular phagocytosis - ADCP), секреция цитокинов, опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, снижение регуляции рецепторов на клеточной поверхности (например, рецептора В-клеток) и активация В-клеток.
Понятие «активирующий рецептор Fc» означает рецептор Fc, который после взаимодействия с областью Fc антитела вызывает сигналы, которые стимулируют клетку, несущую рецептор, выполнять эффекторные функции. К активирующим рецепторам Fc относятся рецепторы FcγRIIIa (CD 16а), FcγRI (CD64), FcγRIIa (CD32) и FcaRI (CD89). Одним из активирующих рецепторов Fc является рецептор FcγRIIIa человека (см. UniProt №Р08637, версия 141).
Понятие «эктодомен» означает домен мембранного белка, который находится во внеклеточном пространстве (т.е. вне целевой клетки). Эктодомены обычно являются частями белков, которые инициируют контакт с поверхностями, что приводит к сигнальной трансдукции.
Термин «пептидный линкер» относится к пептиду, содержащему одну или несколько аминокислот, обычно от 2 до 20 аминокислот. Пептидные линкеры известны в данной области, а также описаны в настоящем изобретении. Подходящими неиммуногенными линкерными пептидами являются, например, (G4S)n, (SG4)n или G4(SG4)n пептидные линкеры, где «n» обычно означает число от 1 до 10, обычно от 1 до 4, в частности 2.
Понятие «аминокислота» в контексте настоящего изобретения означает группу природных карбокси-а-аминокислот, а именно аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновая кислота (asp, D), цистеин (cys, С), глутамин (gln, Q), глутаминовая кислота (glu, Е), глицин (гликоль, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, K), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серии (ser, S), треонин (thr, Т), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
Понятие «гибридный» или «присоединенный» означает, что компоненты связаны пептидными связями либо непосредственно, либо через один или несколько пептидных линкеров.
«Идентичность аминокислотной последовательности, выраженная в процентах (%),» по отношению к контрольной полипептидной (белковой) последовательности означает процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в контрольной полипептидной последовательности после выравнивания последовательностей и интродукции гэпов при необходимости для достижения максимальной процентной идентичности последовательности и без учета каких-либо консервативных замещений в качестве части идентичности последовательности. Выравнивание для определения процента идентичности аминокислотной последовательности может быть достигнуто различными способами, которые известны в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN, SAWI или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для выравнивания последовательностей, включая какие-либо алгоритмы, необходимые для достижения максимального выравнивание по всей длине сопоставляемых последовательностей. Однако для целей настоящего изобретения процент идентичности аминокислотной последовательности определяют, используя компьютерную программу сравнения последовательностей ALIGN-2. Компьютерная программа сравнения последовательностей ALIGN 2 разработана Genentech, Inc., а исходный код зарегистрирован с документацией для пользователей в Бюро по защите авторских прав США, Вашингтон, округ Колумбия, 20559, в соответствии с правилами регистрации США TXU510087. Программа ALIGN-2 общедоступна от фирмы Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть скомпилирована из исходного кода. Программа ALIGN-2 должна быть составлена для применения в операционной системе UNIX, включая цифровой UNIX V4.0D. Все параметры сравнения последовательностей задаются программой ALIGN-2 и их не меняют.В ситуациях, когда ALIGN-2 используют для сравнения аминокислотных последовательностей, процент идентичность данной аминокислотной последовательности А по отношению к данной аминокислотной последовательности В (которая иным образом может быть выражена в качестве данной аминокислотной последовательности А, которая имеет или представляет определенную аминокислотную последовательность, идентичную с данной аминокислотной последовательностью В), рассчитывают следующим образом:
фракция X/Y ×100,
где X означает количество аминокислотных остатков, оцененных в качестве идентично совпадающих по программе выравнивания ALIGN-2 в последовательностях А и В, и где Y означает общее количество аминокислотных остатков в В. Следует учесть, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то процент идентичности аминокислотной последовательности А по отношению к аминокислотной последовательности В не будет равен проценту аминокислотной идентичности В к А. Если конкретно не указано иное, все данные по процентам аминокислотной идентичности последовательностей в настоящем изобретении получают согласно описанию предыдущего раздела, используя компьютерную программу ALIGN-2.
Понятие «варианты аминокислотной последовательности» представляет существенные варианты, в которых имеются аминокислотные замещения в одном или более остатках гипервариабельной области исходной антигенсвязывающей молекулы (например, гуманизированного антитела или антитела человека). Обычно полученный вариант (варианты), выбранный для дальнейшего изучения, может иметь модификации (например, улучшения) определенных биологических свойств (например, повышенную аффинность, уменьшенную иммуногенность) относительно исходной антигенсвязывающей молекулы и/или может иметь по существу неизменные определенные биологические свойства исходной антигенсвязывающей молекулы. Примером замещающего варианта является антитело со сформировавшейся аффинностью, которое может быть получено, например, с использованием методов созревания аффинности на основе фагового дисплея, например, описанных в настоящем изобретении. Вкратце, мутируют один или несколько остатков HVR, и варианты антигенсвязывающих молекул проявляются на фаге и подвергаются скринингу для выявления определенной биологической активности (например, связывающего сродства). В некоторых вариантах осуществления настоящего изобретения замещения, вставки или делеции могут осуществляться в пределах одной или нескольких HVR до тех пор, пока такие изменения существенно не уменьшат способности антигенсвязывающей молекулы связывать антиген. Например, консервативные изменения (например, консервативные замещения по настоящему изобретению), которые существенно не уменьшают связывающего сродства, могут быть произведены в HVR. Полезный метод идентификации остатков или областей антитела, которые могут быть мишенью мутагенеза, называют «аланиновым сканирующим мутагенезом», который описан в статье Cunningham и Wells, Science, 244, 1989, 1081-1085. В этом методе остаток или группу целевых остатков (например, заряженных остатков, например, Arg, Asp, His, Lys и Glu) идентифицируют и замещают нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином), чтобы определить, оказано ли влияние на взаимодействие антитела с антигеном.
Дальнейшие замещения могут быть введены в места расположения аминокислот, демонстрирующих функциональную чувствительность к исходным замещениям. В другом варианте или дополнительно кристаллическую структуру антигена с антигенсвязывающей молекулой усложняют, чтобы идентифицировать точки контакта между антителом и антигеном. Такие контактные остатки и соседние остатки могут быть нацелены или исключены в качестве кандидатов для замещения. Варианты могут быть подвергнуты скринингу, чтобы определить, обладают ли они требуемыми свойствами.
Инсерции аминокислотной последовательности включают амино- и/или карбокси-концевые гибриды, длина которых варьирует от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции внутрь последовательности одного или нескольких аминокислотных остатков.
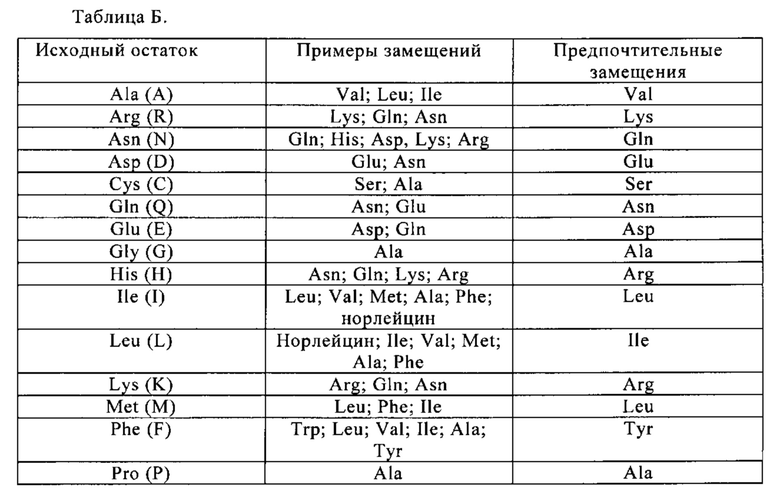
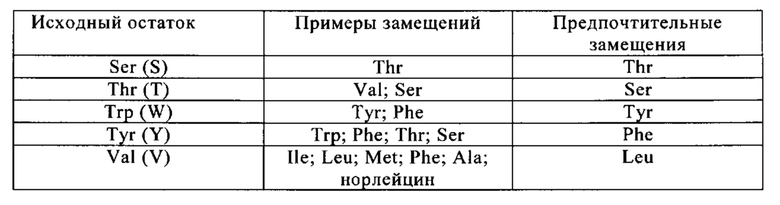
«Консервативные замены» приведены в табл. Б под заголовком «Предпочтительные замещения», а также описаны ниже по отношению к классам аминокислот (1) - (6), построенным на основании боковых цепей аминокислот. Аминокислотные замещения могут быть интродуцированы в исследуемую молекулу и продукты, поиск которых проводится по требуемой активности, например, по сохранению/улучшению связывания антигена, снижению иммуногенности или улучшению ADCC или CDC.
Аминокислоты могут быть разделены на группы на основании общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замещения влекут за собой обмен представителя одной из этих групп на представителя другой группы.
В некоторых вариантах осуществления настоящего изобретения антигенсвязывающие молекулы по настоящему изобретению изменены для увеличения или уменьшения степени гликозилирования антитела. Варианты гликозилирования молекул могут быть получены путем изменения аминокислотной последовательности таким образом, чтобы был создан или удален один или несколько сайтов гликозилирования. Если антигенсвязывающая молекула содержит область Fc, углевод, присоединенный к нему, может быть изменен. Нативные антитела, вырабатываемые клетками млекопитающих, обычно включают разветвленный с двумя ветвями (биантеннарный) олигосахарид, который обычно присоединен N-связью к Asn297 домена СН2 области Fc. См., например, публикацию Wright с соавт., TIBTECH 15, 1997, 26-32. Олигосахарид может включать в себя различные углеводы, например маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стебле» биантеннарной олигосахаридной структуры. В некоторых вариантах осуществления настоящего изобретения модификации олигосахарида в антигенсвязывающих молекулах могут быть осуществлены для того, чтобы создать варианты с некоторыми улучшенными свойствами. В одном из вариантов осуществления настоящего изобретения предусматривают такие модификации антигенсвязывающих молекул, имеющих углеводную структуру, которые утратили фукозу, присоединенную (прямо или опосредованно) к области Fc. Такие варианты фукозилирования могут иметь улучшенную функцию ADCC, см., например, US 2003/0157108 или US 2004/0093621. К другим вариантам антигенсвязывающих молекул по настоящему изобретению относят молекулы с разделенными пополам олигосахаридами, например, у которых 2-антенарный олигосахарид, присоединенный к области Fc, разделен пополам GlcNAc. У таких вариантов может быть пониженное фукозилирование и/или улучшенная функция ADCC. См., Например, WO 2003/011878, US 6602684 и US 2005/0123546. Также предусмотрены варианты, по меньшей мере, с одним остатком галактозы в олигосахариде, присоединенным к области Fc. Такие варианты антител могут иметь улучшенную функцию CDC и описаны, например, в WO 1997/30087, WO 1998/58964 и WO 1999/22764.
В некоторых вариантах осуществления настоящего изобретения может быть потребность в создании сконструированных цистеиновых вариантов антигенсвязывающей молекулы по настоящему изобретению, например моноклональных антител с тиольной группой («thioMAb»), в которых один или несколько остатков молекулы замещены остатками цистеина. В некоторых вариантах осуществления настоящего изобретения замещенные остатки находятся в доступных местах молекулы. Путем замещения остатков в таких местах на цистеин, реакционноспособные тиольные группы располагаются в доступных местах антитела и могут быть использованы для конъюгации антитела с другими частями молекулы, например, частями молекулы лекарственного средства или частями молекулы линкер-лекарственное средство, для создания иммуноконъюгата. В некоторых вариантах осуществления настоящего изобретения какой-либо один или несколько из следующих остатков могут быть замещены цистеином: V205 (нумерация Kabat) легкой цепи; А118 (нумерация EU) тяжелой цепи; и S400 (нумерация EU) области Fc тяжелой цепи. Сконструированные антигенсвязывающие молекулы с замещениями цистеином получены согласно описанию в патенте US 7521541.
В некоторых вариантах осуществления настоящего изобретения антигенсвязывающие молекулы, предусмотренные в настоящем изобретении, могут быть дополнительно модифицированы для дополнительного включения небелковых частей молекулы, которые известны в данной области и доступны. К частям молекул, пригодным для получения производных антител, относятся, но ими перечень не ограничивается, водорастворимые полимеры. К примерам водорастворимых полимеров относятся, но ими перечень не ограничивается, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (гомополимеры или статистические сополимеры), а также декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропиональдегид полиэтиленгликоля может иметь преимущества в производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, прикрепленных к антителу, может изменяться, и если присоединено более одного полимера, они могут быть одинаковыми или разными. В общем, число и/или тип полимеров, используемых для получения производных, могут быть определены, основываясь на определенных свойствах или функциях улучшаемого антитела, но ими не ограничиваясь, независимо от того, будет ли производное антитела использоваться в лечении при определенных условиях, и т.д. В другом варианте осуществления настоящего изобретения конъюгатами антитела и небелковыми частями молекулы могут быть те, которые избирательно нагреваться под воздействием радиации. В одном из вариантов осуществления настоящего изобретения небелковыми частями молекулы являются углеродные нанотрубки (Kam N.W. с соавт., Proc. Natl. Acad. Sci. USA 102, 2005, 11600-11605). Радиация может иметь какую-либо длину волны, к примерам относятся, но ими перечень не ограничивается, длины волн, которые не наносят вреда обычным клеткам, но которые нагревают небелковые части молекул до температуры, при которой погибают клетки, находящиеся в непосредственной близости к небелковым частям молекул. В еще одном из вариантов осуществления настоящего изобретения могут быть получены иммуноконъюгаты антигенсвязывающих молекул по настоящему изобретению.
Понятие «иммуноконъюгат» означает антитело, конъюгированное с одной или несколькими гетерологичными молекулами, включая, но, не ограничиваясь ими, цитотоксические агенты.
Понятие «полинуклеотид» относится к выделенной молекуле нуклеиновой кислоты или конструкции, например, к матричной РНК (мРНК), производной от вирусной РНК или плазмидной ДНК (пДНК). В полинуклеотиде может быть обычная фосфодиэфирная связь или необычная связь (например, амидная связь, например, обнаруженная в пептидных нуклеиновых кислотах (peptide nucleic acids - PNA). Понятие «молекула нуклеиновой кислоты» относится к какому-либо одному или нескольким сегментам нуклеиновой кислоты, например ДНК или фрагментов РНК, присутствующим в полинуклеотиде.
Понятие «выделенная» молекула нуклеиновой кислоты или полинуклеотида означает молекулу нуклеиновой кислоты, ДНК или РНК, которая выделена из природной среды. Например, рекомбинантный полинуклеотид, кодирующий полипептид, содержащийся в векторе, рассматривают в качестве выделенного в контексте настоящего изобретения. К другим примерам выделенных полинуклеотидов относятся рекомбинантные полинуклеотиды, поддерживаемые в гетерологичных клетках-хозяевах, или очищенные (частично или в существенной степени) полинуклеотиды в растворе. Выделенный полинуклеотид представляет молекулу полинуклеотида, содержащуюся в клетках, которые обычно содержат молекулу полинуклеотида, но такая выделенная молекула полинуклеотида присутствует внехромосомно или в хромосомной локализации, отличающейся от ее естественной хромосомной локализации. К молекулам выделенных РНК относят транскрипты РНК in vivo или in vitro по настоящему изобретению, а также формы положительной и отрицательной цепей и двухцепочечные формы. Выделенные полинуклеотиды или нуклеиновые кислоты в соответствии с настоящим изобретением дополнительно включают такие молекулы, полученные путем синтеза. Кроме того, полинуклеотид или нуклеиновая кислота могут представлять регуляторный элемент или включать его, например, промотор, сайт связывания рибосом или терминатор транскрипции.
Если нуклеиновую кислоту или полинуклеотид, в которых нуклеотидную последовательность рассматривают в качестве, по меньшей мере, например, на 95% «идентичной» контрольной нуклеотидной последовательности по настоящему изобретению, это означает, что нуклеотидная последовательность полинуклеотида идентична контрольной последовательности, за исключением того, что полинуклеотидная последовательность может включать до пяти точечных мутаций на каждые 100 нуклеотидов контрольной нуклеотидной последовательности. Иначе говоря, чтобы получить полинуклеотид, имеющий нуклеотидную последовательность, которая, по меньшей мере, на 95% идентична контрольной нуклеотидной последовательности, до 5% нуклеотидов в контрольной последовательности могут быть делетированы или замещены другим нуклеотидом, или до 5% от общего количества нуклеотидов в контрольной последовательности могут быть инсертированы в контрольную последовательность. Эти изменения контрольной последовательности могут быть в 5'- или З'-концевых положениях контрольной нуклеотидной последовательности или где-либо между этими конечными положениями, чередующимися либо по отдельности среди остатков в эталонной последовательности, либо в одной или нескольких смежных группах в контрольной последовательности. На практике какая-либо определенная полинуклеотидная последовательность, которая, по меньшей мере, на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична нуклеотидной последовательности по настоящему изобретению, может быть определена с помощью известных компьютерных программ, например, рассмотренных выше для полипептидов (например, ALIGN-2).
Понятие «кассета экспрессии» относится к полинуклеотиду, получаемому рекомбинантно или синтезом, с серией определенных элементов нуклеиновых кислот, которые допускают транскрипцию определенной нуклеиновой кислоты в клетке-мишени. Кассета рекомбинантной экспрессии может быть включена в плазмиду, хромосому, митохондриальную ДНК, пластидную ДНК, вирус или фрагмент нуклеиновой кислоты. Обычно часть кассеты рекомбинантной экспрессии вектора экспрессии включает наряду с другими последовательностями последовательность нуклеиновой кислоты, подлежащую транскрибированию, и промотор. В некоторых вариантах осуществления настоящего изобретения кассета экспрессии по настоящему изобретению включает полинуклеотидные последовательности, кодирующие биспецифические антигенсвязывающие молекулы по настоящему изобретению или их фрагменты.
Понятие «вектор» или «вектор экспрессии» является синонимом понятия «конструкция экспрессии» и относится к молекуле ДНК, которую применяют для интродукции и направления экспрессии конкретного гена, с которым она функционально связана в клетке-мишени. Это понятие включает вектор в качестве самовоспроизводящейся структуры нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он был интродуцирован. Вектор экспрессии по настоящему изобретению представляет кассету экспрессии. Векторы экспрессии допускают транскрипцию больших количеств стабильной мРНК. После того, как только вектор экспрессии оказывается внутри клетки-мишени, молекула рибонуклеиновой кислоты или белка, кодируемого геном, вырабатывается по механизму клеточной транскрипции и/или трансляции в клетке. В одном из вариантов осуществления настоящего изобретения вектор экспрессии по настоящему изобретению содержит кассету экспрессии, которая включает полинуклеотидные последовательности, которые кодируют биспецифические антигенсвязывающие молекулы по настоящему изобретению или их фрагменты.
Понятия «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» применяют взаимозаменяемо и относят к клеткам, в которые была интродуцирована экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева также бывают «трансформантами» и «трансформированными клетками», к которым относят первично трансформированные клетки и полученное от них потомство независимо от числа пассажей клеток. Потомство не может быть полностью идентичным по содержанию нуклеиновой кислоты в родительской клетке и может содержать мутации. Мутантное потомство, обладающее той же функцией или биологической активностью, что и полученная в результате скрининга или отбора первоначально трансформированная клетка, также соответствует данным понятиям в контексте настоящего изобретения. Клетка-хозяин относится к какому-либо типу клеточной системы, который может быть применен для получения антигенсвязывающих молекул по настоящему изобретению. Клетки-хозяева включают культивируемые клетки, например, культивируемые клетки млекопитающих, например, клетки СНО, клетки BHK, клетки NS0, клетки SP2/0, клетки миеломы YO, клетки миеломы мыши Р3Х63, клетки PER, клетки PER.C6 или клетки гибридом, дрожжевые клетки, клетки насекомых и клетки растений (это только несколько возможных примеров), а также клетки трансгенного животного, трансгенного растения или культивированной растительной или животной ткани.
Понятие «эффективное количество» агента относится к количеству, которое необходимо для того, чтобы привести к физиологическому изменению в клетке или ткани, в которые оно вводится.
Понятие «терапевтически эффективное количество» агента, например, фармацевтической композиции, относится к эффективному количеству, а именно к дозам и к длительности применения, которые необходимы для достижения желаемого терапевтического или профилактического результата. Терапевтически эффективное количество агента, например, устраняет, уменьшает, задерживает, минимизирует или предотвращает неблагоприятные проявления заболевания.
Понятие «индивидуум» или «субъект» означает млекопитающее. К млекопитающим относят, но ими перечень не ограничивают, домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и обезьян), кроликов и грызунов (например, мышей и крыс). В частности, индивидуумом или субъектом является человек.
Понятие «фармацевтическая композиция» относится к препарату, который находится в форме, обеспечивающей биологическое действие активного ингредиента, содержащегося в композиции, и который не содержит дополнительных компонентов, которые неприемлемо токсичны для субъекта, которому будут вводить данную композицию.
Понятие «фармацевтически приемлемый эксципиент» относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который нетоксичен для субъекта. Фармацевтически приемлемый эксципиент включает, но ими перечень не ограничивается, буфер, стабилизатор или консервант.
Понятие «вкладыш» применяют по отношению к инструкциям, обычно включаемым в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, использовании, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях относительно использования таких терапевтических средств.
В настоящем изобретении понятие «лечение» (и его грамматические вариации, например, «обработка») относится к клиническому вмешательству в попытке изменить состояние подвергающегося лечению пациента, которое может быть выполнено либо для профилактики, либо при состоянии имеющейся клинической патологии. Желательные эффекты лечения включают, но ими перечень не ограничивается, предотвращение возникновения или рецидива заболевания, облегчение симптомов, уменьшение степени проявления каких-либо прямых или косвенных патологических последствий заболевания, предотвращение метастазов, снижение скорости прогрессирования заболевания, улучшение или ослабление состояние болезни, ремиссию или улучшение прогноза. В некоторых вариантах осуществления настоящего изобретения молекулы по настоящему изобретению используют для отсрочки развития заболевания или замедления прогрессирования заболевания.
Понятие «рак» в настоящем изобретении применяют в отношении пролиферативных заболеваний, например, лимфом, лимфоцитарного лейкоза, рака легкого, немелкоклеточного рака легкого (non-small cell lung - NSCL), бронхиолоальвеолярного рака легкого, рака кости, рака поджелудочной железы, рака кожи, рака головы или шеи, кожной или внутриглазной меланомы, рака матки, рака яичников, рака прямой кишки, рака анальной области, рака желудка, рака толстой кишки, рака молочной железы, рака матки, карциномы фаллопиевых труб, карциномы эндометрия, рака шейки матки, карциномы влагалища, карциномы вульвы, болезни Ходжкина, рака пищевода, рака тонкой кишки, рака эндокринной системы, рака щитовидной железы, рака паращитовидной железы, рака надпочечника, саркомы мягких тканей, рака уретры, рака пениса, рака предстательной железы, рака мочевого пузыря, рака почки или мочеточника, почечно-клеточной карциномы, карциномы почечной лоханки, мезотелиомы, гепатоцеллюлярного рака, билиарного рака, опухоли центральной нервной системы (ЦНС), опухоли позвоночника, глиомы ствола мозга, мультиформной глиобластомы, астроцитомы, шванномы, эпендидомы, медуллобластомы, менингиомы, плоскоклеточного рака, аденомы гипофиза и саркомы Юинга, в том числе рефракторных версий какого-либо из вышеуказанных видов рака или комбинации одного или нескольких из вышеуказанных видов рака.
Антитела по настоящему изобретению
В настоящем изобретении предусматривают новые антитела против CD 19 человека (anti-human CD19) с определенными предпочтительными свойствами, например, продуктивностью, стабильностью, связывающей аффинностью, биологической активностью, эффективностью направленной доставки и сниженной токсичностью.
В одном из вариантов осуществления настоящего изобретения предусматривают антитела против CD19 человека с высокой степенью аффинности.
В другом варианте осуществления настоящего изобретения предусматривают антитело, которое специфически связывается с CD19 человека с высокой степенью аффинности по сравнению с антителом, включающим вариабельную тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 113, и вариабельную легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 114.
В другом варианте осуществления настоящего изобретения предусматривают антитело, которое специфически связывается с CD19 человека, причем антитело включает:
(а) CDR-L1, включающую аминокислотную последовательность SEQ ID NO: 43,
(б) CDR-L2, включающую аминокислотную последовательность SEQ ID NO: 44,
(в) CDR-L3, включающую аминокислотную последовательность SEQ ID NO: 45,
(г) CDR-H1, включающую аминокислотную последовательность SEQ ID NO: 46,
(д) CDR-H2, включающую аминокислотную последовательность SEQ ID NO: 47,
(е) CDR-H3, включающую аминокислотную последовательность SEQ ID NO: 48.
В одном из вариантов осуществления настоящего изобретения антитело включает область (a) CDR-L1, включающую аминокислотную последовательность SEQ ID NO: 43, (б) CDR-L2, включающую аминокислотную последовательность SEQ ID NO: 44, (в) CDR-L3, включающую аминокислотную последовательность SEQ ID NO: 45, (г) CDR-H1, включающую аминокислотную последовательность SEQ ID NO: 46, (д) CDR-H2, включающую аминокислотную последовательность SEQ ID NO: 47, и (e) CDR-H3, включающую аминокислотную последовательность SEQ ID NO: 48, и специфически связывается с CD19 человека с повышенной аффинностью по сравнению с антителом, включающим вариабельную тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 113, и вариабельную легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 114.
В другом варианте осуществления настоящего изобретения антитело является моноклональным антителом. В другом варианте осуществления настоящего изобретения антитело является антителом, человека, гуманизированным или химерным антителом. В еще одном из вариантов осуществления настоящего изобретения антитело является гуманизированным антителом. В другом варианте осуществления настоящего изобретения антитело является фрагментом антитела, который специфически связывается с CD19 человека.
В другом варианте осуществления настоящего изобретения предусматривают антитело, которое специфически связывается с CD19. В еще одном из вариантов осуществления настоящего изобретения антитело, описанное в настоящем изобретении, специфически связывается с CD19 человека. В еще одном из вариантов осуществления настоящего изобретения антитело, описанное в настоящем изобретении, специфически связывается с CD19 макака крабоеда. Еще в одном из вариантов осуществления настоящего изобретения антитела, описанные в настоящем изобретении, обладают перекрестной видовой реакционной способностью.
В некоторых вариантах осуществления настоящего изобретения антитело, описанное в настоящем изобретении, имеет равновесную константу диссоциации (equilibrium dissociation constant - Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ, от 10-8 М до 10-13 М или от 10-9 М до 10-13 М. В одном из вариантов осуществления настоящего изобретения антитело, описанное в настоящем изобретении, связывается с CD19 с равновесной константой диссоциации (Kd) 1 нМ или менее, согласно определению методом поверхностного плазмонного резонанса (Surface Plasmon Resonance - SPR).
В еще одном варианте осуществления настоящего изобретения предусматривают антитело против CD 19 по настоящему изобретению с константой диссоциации (kd) ≤10-2/сек, ≤10-3/сек, ≤10-4/сек, ≤10-5/сек, ≤10-6/сек, ≤10-7/сек или ≤10-8/сек, от 10-4/сек до 10-9/сек, или от 10-5/сек до 10-11/сек. В одном из вариантов осуществления изобретения антитело по настоящему изобретению специфически связывается с CD19 и характеризуется дополнительно константой диссоциации (kd) 10-4/сек или менее, согласно определению методом SPR.
В другом варианте осуществления настоящего изобретения предусматривают антитело, которое специфически связывается с CD19, причем антитело содержит меньше сайтов дезаминирования по сравнению с антителом, содержащим вариабельную тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 113, и вариабельную легкую цепь, включающую аминокислоту последовательность SEQ ID NO: 114. В другом варианте осуществления настоящего изобретения предусматривают антитело, которое специфически связывается с CD19, причем антитело содержит меньше аспарагиновых остатков по сравнению с антителом, содержащим вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 113, и вариабельную легкую цепь, содержащую аминокислоту последовательность SEQ ID NO: 114.
В еще одном варианте осуществления настоящего изобретения предусматривают антитело, которое содержит вариант вариабельной легкой цепи и/или вариант вариабельной тяжелой цепи, включающее, по меньшей мере, одно аминокислотное замещение относительно антитела, содержащего вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 113, и вариабельную легкую цепью, содержащую аминокислотную последовательность SEQ ID NO: 114, причем, по меньшей мере, один остаток аспарагина замещен. В предпочтительных вариантах осуществления настоящего изобретения, по меньшей мере, два, по меньшей мере, три или, по меньшей мере, четыре остатка аспарагина замещены.
В одном из вариантов осуществления настоящего изобретения предусматривают антитело, включающее домен VH, содержащий аминокислотную последовательность SEQ ID NO: 99, и домен VL, включающий аминокислотную последовательность SEQ ID NO: 100.
В другом варианте осуществления настоящего изобретения предусматривают антитело, которое специфически связывается с CD19 человека, где антитело выбрано из группы, включающей:
(i) антитело, содержащее область CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 25, CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 26, CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 27, CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 28, CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 29, и CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 30,
(ii) антитело, содержащее область CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 31, CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 32, CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 33, CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 34, CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 35, и CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 36,
(iii) антитело, содержащее область CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 37, CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 38, CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 39, CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 40, CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 41, и CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 42,
(iv) антитело, содержащее область CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 43, CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 44, CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 45, CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 46, CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 47, и CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 48,
(v) антитело, содержащее область CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 49, CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 50, CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 51, CDR-H1, включающую аминокислотную последовательность SEQ ID NO: 52, CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 53, и CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 54,
(vi) антитело, содержащее область CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 55, CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 56, CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 57, CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 58, CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 59, и CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 60, и
(vii) антитело, содержащее область CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 61, CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 62, CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 63, CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 64, CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 65 и CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 66.
В другом варианте осуществления настоящего изобретения предусматривают антитело, специфически связывающееся с CD19, причем указанное антитело включает:
(i) домен VH, включающий аминокислотную последовательность SEQ ID NO: 111, и домен VL, включающий аминокислотную последовательность SEQ ID NO: 112,
(ii) домен VH, включающий аминокислотную последовательность SEQ ID NO: 101, и домен VL, включающий аминокислотную последовательность SEQ ID NO: 102,
(iii) домен VH, включающий аминокислотную последовательность SEQ ID NO: 103, и домен VL, включающий аминокислотную последовательность SEQ ID NO: 104,
(iv) домен VH, включающий аминокислотную последовательность SEQ ID NO: 99, и домен VL, включающий аминокислотную последовательность SEQ ID NO: 100,
(v) домен VH, включающий аминокислотную последовательность SEQ ID NO: 105, и домен VL, включающий аминокислотную последовательность SEQ ID NO: 106,
(vi) домен VH, включающий аминокислотную последовательность SEQ ID NO: 107, и домен VL, включающий аминокислотную последовательность SEQ ID NO: 108, или
(vii) домен VH, включающий аминокислотную последовательность SEQ ID NO: 109, и домен VL, включающий аминокислотную последовательность SEQ ID NO: 110.
В другом варианте осуществления настоящего изобретения описанное выше антитело содержит домен Fc, состоящий из первой и второй субъединиц, способных к стабильной ассоциации.
В еще одном из вариантов осуществления настоящего изобретения домен Fc является доменом IgG, предпочтительно доменом Fc IgG1 или доменом Fc IgG4. Точнее, домен Fc является доменом Fc IgG1. В конкретном объекте домен Fc содержит модификацию, способствующую объединению первой и второй субъединиц домена Fc.
Модификации домена Fc, снижающие связывание рецептора Fc и/или эффекторную функцию
Домен Fc антигенсвязывающих молекул по настоящему изобретению состоит из пары полипептидных цепей, содержащих домены тяжелой цепи молекулы иммуноглобулина. Например, домен Fc молекулы иммуноглобулина G (IgG) является димером, каждая субъединица которого включает константные домены СН2 и СН3 тяжелой цепи IgG. Две субъединицы домена Fc способны к устойчивой ассоциации друг с другом.
Домен Fc обеспечивает благоприятные фармакокинетические свойства антигенсвязывающим молекулам по настоящему изобретению, включая длительное время полужизни в сыворотке, что способствует хорошему накоплению в ткани-мишени и благоприятному коэффициенту распределения в ткани и крови. Однако в то же время он может преимущественно приводить к нежелательному нацеливанию антител по настоящему изобретению на клетки, экспрессирующие рецепторы Fc, а не на предпочтительные антигеннесущие клетки. Соответственно, в некоторых вариантах осуществления настоящего изобретения домен Fc антигенсвязывающей молекулы по настоящему изобретению проявляет пониженную аффинность с рецептором Fc и/или пониженную эффекторную функцию по сравнению с нативным доменом Fc IgG1. В одном из вариантов осуществления настоящего изобретения Fc по существу не связывается с рецептором Fc и/или не индуцирует эффекторную функцию. В одном из вариантов осуществления настоящего изобретения рецептор Fc является рецептором Fcγ. В одном из вариантов осуществления настоящего изобретения рецептор Fc является рецептором Fey человека. В еще одном из вариантов осуществления настоящего изобретения рецептор Fc является рецептором Fc человека. В конкретном варианте осуществления настоящего изобретения рецептор Fc является активирующим рецептором Fcγ человека, точнее рецептором FcγRIIIa, FcγRI или FcγRIIa человека, особенно рецептором FcyRIIIa человека. В одном из вариантов осуществления настоящего изобретения домен Fc не индуцирует эффекторную функцию. Пониженная эффекторная функция может включать одну или несколько из следующих функций, которыми, однако, перечень не ограничивается: уменьшенную комплемент-зависимую цитотоксичность (complement dependent cytotoxicity - CDC), пониженную антитело-зависимую клеточно-опосредованную цитотоксичность (antibody-dependent cell-mediated cytotoxicity - ADCC), пониженный антителозависимый клеточный фагоцитоз (antibody-dependent cellular phagocytosis - ADCP), пониженную секрецию цитокинов, пониженное опосредованное иммунным комплексом потребление антигена антигенпрезентирующими клетками, пониженное связывание с клетками NK, пониженное связывание с макрофагами, пониженное связывание с моноцитами, пониженное связывание с полиморфноядерными клетками, пониженную прямую передачу сигнала индукции апоптоза, пониженное созревание дендритных клеток, пониженное примирование Т-клеток.
В некоторых вариантах осуществления настоящего изобретения одна или несколько модификаций аминокислот могут быть введены в область Fc антитела, предусмотренного в настоящем изобретении, тем самым получая вариант области Fc. Вариант области Fc может содержать последовательность область Fc человека (например, область Fc IgG1, IgG2, IgG3 или IgG4 человека), включающую аминокислотную модификацию (например, замещение) в одном или нескольких положениях аминокислот.
В одном из вариантов осуществления настоящее изобретение относится к антителу, в котором домен Fc содержит одно или несколько аминокислотных замещений, которые уменьшают связывание с рецептором Fc, в частности, с рецептором Fcγ.
В одном из вариантов осуществления настоящего изобретения домен Fc антитела по настоящему изобретению содержит одну или несколько мутаций аминокислот, которые уменьшает аффинность домена Fc по связыванию с рецептором Fc и/или эффекторную функцию. Обычно одна и та же одна или несколько аминокислотных мутаций присутствует в каждой из двух субъединиц домена Fc. В частности, домен Fc содержит аминокислотное замещение в положениях Е233, L234, L235, N297, Р331 и Р329 (нумерация EU). В частности, домен Fc включает аминокислотные замещения в положениях 234 и 235 (нумерация EU) и/или 329 (нумерация EU) тяжелых цепей IgG. Более конкретно, предусмотрено антитело в соответствии с настоящим изобретением, которое включает домен Fc с аминокислотными замещениями L234A, L235A и P329G («P329G LALA», нумерация EU) в тяжелых цепях IgG. Замещения аминокислот L234A и L235A относятся к так называемой мутации LALA. Комбинация «P329G LALA» аминокислотных замещений практически полностью отменяет связывание рецептора Fey домена Fc IgGl человека, что описано в заявке WO 2012/130831 А1, в которой также описывают способы получения таких мутантных доменов Fc и способы определения их свойств, например, связывание рецептора Fc или эффекторные функции.
К доменам Fc с пониженным связыванием рецептора Fc и/или с пониженной эффекторной функцией также относятся те домены, в которых замещены один или несколько остатков домена Fc 238, 265, 269, 270, 297, 327 и 329 (US 6737056). Такие мутанты Fc включают мутантов Fc с замещениями по двум или нескольким положениям аминокислот 265, 269, 270, 297 и 327, включая так называемый мутант Fc «DANA» с замещением остатков 265 и 297 на аланин (US 7332581).
В другом варианте осуществления настоящего изобретения домен Fc является доменом Fc IgG4. Антитела IgG4 проявляют сниженную аффинность связывания с рецепторами Fc и сниженные эффекторные функции по сравнению с антителами IgG1. В более предпочтительном варианте осуществления настоящего изобретения доменом Fc является домен Fc IgG4, содержащий аминокислотное замещение в положении S228 (нумерация по Kabat), в частности аминокислотное замещение S228P. В более предпочтительном варианте осуществления настоящего изобретения доменом Fc является домен Fc IgG4, содержащий аминокислотные замещения L235E и S228P и P329G (нумерация EU). Свойства таких мутантов домена Fc IgG4 и их связывающие рецепторы Fey также описаны в WO 2012/130831.
В другом варианте осуществления настоящего изобретения предусматривают антитело, которое специфически связывается с CD19 человека, причем антитело включает области:
(а) CDR-L1, включающую аминокислотную последовательность SEQ ID NO: 43,
(б) CDR-L2, включающую аминокислотную последовательность SEQ ID NO: 44,
(в) CDR-L3, включающую аминокислотную последовательность SEQ ID NO: 45,
(г) CDR-H1, включающую аминокислотную последовательность SEQ ID NO: 46,
(д) CDR-H2, включающую аминокислотную последовательность SEQ ID NO: 47,
(е) CDR-H3, включающую аминокислотную последовательность SEQ ID NO: 48,
причем антитело включает домен Fc с аминокислотными остатками 234А, 235А и 329G (нумерация EU) в тяжелых цепях IgG.
Мутантные домены Fc могут быть получены путем делеции, замещения, инсерции или модификации аминокислот с использованием генетических или химических методов, известных в данной области. Генетические методы могут включать сайт-специфический мутагенез кодирующей последовательности ДНК, ПЦР, синтез гена и другие. Правильность изменения нуклеотидов можно проверить, например, путем секвенирования.
Связывание с рецепторами Fc может быть легко определено, например, с использованием метода ELISA или методом поверхностного плазмонного резонанса (SPR) с использованием стандартного приборного обеспечения, например, BIAcore (фирма GE Healthcare), и рецепторов Fc, которые могут быть получены рекомбинантной экспрессией. В другом варианте аффинность доменов Fc или активирующие клетку антитела, содержащие домен Fc для рецепторов Fc, можно оценить с использованием линий клеток, известных для экспрессии специфических рецепторов Fc, например, клеток NK человека, экспрессирующих рецептор Fcyllla.
Эффекторную функцию домена Fc или антител по настоящему изобретению, содержащих домен Fc, можно измерить способами, известными в данной области. В настоящем изобретении описан анализ для измерения ADCC, применимый в настоящем изобретении. Другие примеры анализов in vitro для оценки активности ADCC молекул, представляющих интерес, описаны в US5500362, Hellstrom с соавт., Proc Natl Acad Sci USA 83, 1986, 7059-7063, Hellstrom с соавт., Proc Natl Acad Sci USA 82, 1985, 1499-1502, US5821337, Bruggemann с соавт., J Exp Med 166, 1987, 1351-1361. В другом варианте могут быть использованы методы нерадиоактивного анализа (см., например, нерадиоактивный метод определения цитотоксичности ACTI™ для жидкостной цитометрии (фирма CellTechnology, Inc. Mountain View, Калифорния) и нерадиоактивный метод определения цитотоксичности CytoTox 96® (фирма Promega, Мэдисон, Висконсин)). К применимым для таких анализов эффекторным клеткам относятся клетки мононуклеарных клеток периферической крови (МКПК) и природные клетки-киллеры (Natural Killer -NK). В другом варианте или дополнительно активность ADCC представляющей интерес молекулы может быть оценена in vivo, например, на животной модели, например, описанной в работе Clynes с соавт., Proc Natl Acad Sci USA 95, 1998, 652-656.
В некоторых вариантах осуществления настоящего изобретения связывание домена Fc с компонентом комплемента, в частности к C1q, уменьшается. Соответственно, в некоторых вариантах осуществления настоящего изобретения, где домен Fc сконструирован таким образом, чтобы уменьшить эффекторную функцию, указанная уменьшенная эффекторная функция включает сниженную CDC. Анализы связывания Clq могут быть проведены, чтобы определить, способны ли биспецифические антитела по настоящему изобретению связывать C1q и, следовательно, обладают ли они активностью CDC. См., например, связывание C1q и С3с ELISA в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента может быть проведен анализ CDC (см., например, Gazzano-Santoro с соавт., J Immunol Methods 202, 1996, 163, Cragg с соавт., Blood 101, 2003, 1045-1052, Cragg и Glennie, Blood 103, 2004, 2738-2743).
Полинуклеотиды
Настоящее изобретение также предусматривает выделенные полинуклеотиды, кодирующие антитело, описанное в настоящем изобретении, или его фрагмент.
Выделенные полинуклеотиды, кодирующие антитела по настоящему изобретению, могут быть экспрессированы в виде одного полинуклеотида, который кодирует всю антигенсвязывающую молекулу или в виде нескольких (например, двух или нескольких) полинуклеотидов, которые экспрессируются совместно. Полипептиды, кодируемые полинуклеотидами, которые совместно экспрессируются, могут связываться, например, через дисульфидные связи или другими средствами для образования функциональной антигенсвязывающей молекулы. Например, часть легкой цепи иммуноглобулина может кодироваться отдельным полинуклеотидом из части тяжелой цепи иммуноглобулина. При совместной экспрессии полипептиды тяжелой цепи могут ассоциировать с полипептидами легкой цепи для образования иммуноглобулина.
В некоторых вариантах осуществления настоящего изобретения выделенный полинуклеотид кодирует все антитело в соответствии с настоящим изобретением. В других вариантах осуществления настоящего изобретения выделенный полинуклеотид кодирует полипептид, содержащийся в антителе по настоящему изобретению.
В некоторых вариантах осуществления настоящего изобретения полинуклеотидом или нуклеиновой кислотой является ДНК. В других вариантах осуществления настоящего изобретения полинуклеотидом по настоящему изобретению является РНК, например, в форме матричной РНК (мРНК). РНК по настоящему изобретению может быть одноцепочечной или двухцепочечной.
Методы рекомбинации
Антитела по настоящему изобретению могут быть получены, например, твердофазным пептидным синтезом (например, твердофазным синтезом Меррифилда) или путем рекомбинации. Для получения продукта рекомбинации один или несколько полинуклеотидов, кодирующих антитело или его полипептидные фрагменты, например, описанные выше полинуклеотиды, выделяют и инсертируют в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такой полинуклеотид можно легко выделить и секвенировать с использованием обычных процедур. В одном из вариантов осуществления настоящего изобретения предусматривают вектор, предпочтительно вектор экспрессии, включающий один или несколько полинуклеотидов по настоящему изобретению. Методы, известные специалистам в данной области, могут быть применены для конструирования векторов экспрессии, содержащих кодирующую последовательность антитела (фрагмента) наряду с соответствующими сигналами контроля транскрипции/трансляции. Эти методы включают методики рекомбинации ДНК in vitro, синтеза и рекомбинации in vivo/генетической рекомбинации. См., например, методы, описанные Maniatis с соавт. в кн. «MOLECULAR CLONING: A LABORATORY MANUAL», 1989, изд-во Cold Spring Harbor Laboratory, Нью-Йорк; Ausubel с соавт.в кн. «CURRENT PROTOCOLS IN MOLECULAR BIOLOGY», 1989, изд-во Greene Publishing Associates and Wiley Interscience, Нью-Йорк. Вектор экспрессии включает кассету экспрессии, в которой полинуклеотид, кодирующий антитело или его полипептидные фрагменты (т.е. кодирующую область), клонируют в оперативной связи с промотором и/или другими элементами контроля транскрипции или трансляции. В контексте настоящего изобретения понятие «кодирующая область» представляет часть нуклеиновой кислоты, которая состоит из кодонов, транслируемых в аминокислоты. Хотя «стоп-кодон» (TAG, TGA или ТАА) не транслируется в аминокислоту, при наличии его можно рассматривать в качестве части кодирующей области, если присутствует, в отличие от каких-либо фланкирующих последовательностей, например, промоторов, сайтов связывания рибосомы, терминаторов транскрипции, интронов, 5'- и 3'-нетранслируемых областей и других, которые не являются частью кодирующей области. Две или несколько кодирующих областей могут присутствовать в одной полинуклеотидной конструкции, например, в одном векторе или в разных полинуклеотидных конструкциях, например, на отдельных (разных) векторах. Кроме того, какой-либо вектор может содержать одну кодирующую область или может содержать две или более кодирующих областей, например, вектор настоящего изобретения может кодировать один или несколько полипептидов, которые после трансляции или одновременно в ходе трансляции разделяются в конечные белки посредством протеолитического расщепления. Кроме того, вектор, полинуклеотид или нуклеиновая кислота по настоящему изобретению могут кодировать гетерологичные кодирующие области, которые либо гибридизированы, либо не гибридизированы в полинуклеотид, кодирующий антитело по настоящему изобретению, или его полипептидные фрагменты, или их варианты, или их производные. К гетерологичным кодирующим областям относятся, но ими не ограничиваются, специализированные элементы или мотивы, например, секреторный сигнальный пептид или гетерологичный функциональный домен. Оперативная связь имеется в тех случаях, когда кодирующая область для генного продукта, например полипептида, связана с одной или несколькими регуляторными последовательностями таким образом, чтобы экспрессировать продукт гена под воздействием или контролем регуляторной последовательности (последовательностей). Два фрагмента ДНК (например, область кодирования полипептида и связанный с ним промотор) являются «оперативно связанными», если индукция промоторной функции приводит к транскрипции мРНК, кодирующей требуемый продукт гена, и если природа связи между двумя фрагментами ДНК не препятствует способности регулирующих экспрессию последовательностей направлять экспрессию продукта гена или способности матрицы ДНК транскрибироваться. Таким образом, область промотора может быть оперативно связана с нуклеиновой кислотой, кодирующей полипептид, если промотор способен осуществлять транскрипцию такой нуклеиновой кислоты. Промотор может быть клеточноспецифичным промотором, который направляет реальную транскрипцию ДНК только в предопределенных клетках. Другие элементы контроля транскрипции, помимо промотора, например, энхансеры, операторы, репрессоры и сигналы терминации транскрипции, могут быть оперативно связаны с полинуклеотидом для прямой клеточноспецифичной транскрипции.
Соответствующие промоторы и другие области контроля транскрипции описаны в настоящем изобретении. Специалистам в данной области известно множество областей контроля транскрипции. К ним относятся, но ими перечень не ограничивается, области контроля транскрипции, которые функционируют в клетках позвоночных, например, сегменты промотора и энхансера из цитомегаловирусов (например, немедленно-ранний промотор в сочетании с интроном А), вируса обезьян 40 (например, ранний промотор) и ретровирусов (например, вируса саркомы Рауша). К другим областям контроля транскрипции относятся области, которые получены из генов позвоночных, например, генов белка теплового шока, гена гормона роста крупного рогатого скота и гена  - глобина кролика, а также другие последовательности, способные контролировать экспрессию генов в эукариотических клетках. Дополнительные применимые области контроля транскрипции включают тканеспецифичные промоторы и энхансеры, а также индуцируемые промоторы (например, контролируемые тетрациклинами промоторы). Аналогичным образом, специалистам в данной области известно множество элементов контроля трансляцией. К ним относятся, но ими не ограничиваются, сайты связывания рибосомы, кодоны инициации и терминации трансляции и элементы, производные от вирусных систем (в частности, участок внутренней посадки рибосомы (internal ribosome entry site - IRES), также обозначаемый «последовательность С1ТЕ»). Кассета экспрессии также может обеспечивать другие свойства, например, начало репликации и/или элементы интеграции хромосомы, например, ретровирусные длинные концевые повторы (long terminal repeats - LTR) или аденоассоциированные вирусные (adeno-associated viral -AAV) инвертированные концевые повторы (inverted terminal repeats - ITR).
- глобина кролика, а также другие последовательности, способные контролировать экспрессию генов в эукариотических клетках. Дополнительные применимые области контроля транскрипции включают тканеспецифичные промоторы и энхансеры, а также индуцируемые промоторы (например, контролируемые тетрациклинами промоторы). Аналогичным образом, специалистам в данной области известно множество элементов контроля трансляцией. К ним относятся, но ими не ограничиваются, сайты связывания рибосомы, кодоны инициации и терминации трансляции и элементы, производные от вирусных систем (в частности, участок внутренней посадки рибосомы (internal ribosome entry site - IRES), также обозначаемый «последовательность С1ТЕ»). Кассета экспрессии также может обеспечивать другие свойства, например, начало репликации и/или элементы интеграции хромосомы, например, ретровирусные длинные концевые повторы (long terminal repeats - LTR) или аденоассоциированные вирусные (adeno-associated viral -AAV) инвертированные концевые повторы (inverted terminal repeats - ITR).
Кодирующие области полинуклеотида и нуклеиновой кислоты по настоящему изобретению могут быть связаны с дополнительными кодирующими областями, которые кодируют секреторные или сигнальные пептиды, направляющие секрецию полипептида, кодируемого полинуклеотидом по настоящему изобретению. Например, если желательна секреция антитела или его полипептидных фрагментов, ДНК, кодирующая сигнальную последовательность, может быть помещена выше по цепи перед нуклеиновой кислотой, кодирующей антитело по настоящему изобретению или его полипептидные фрагменты. Согласно гипотезе сигнала, белки, секретируемые клетками млекопитающих, имеют сигнальный пептид или секреторную лидерную последовательность, которая отщепляется от зрелого белка после начала экспорта растущей белковой цепи через шероховатую эндоплазматическую сеть. Специалистам в данной области известно, что полипептиды, секретируемые клетками позвоночных, обычно имеют сигнальный пептид, гибридизированный с N-конца полипептида, который отщепляется от транслированного полипептида для получения секретируемой или «зрелой» формы полипептида. В некоторых вариантах осуществления настоящего изобретения нативный сигнальный пептид, например, используемый сигнальный пептид тяжелой цепи или легкой цепи иммуноглобулина, или функциональное производное этой последовательности, которое сохраняет способность направлять секрецию оперативно связанного с ним полипептида. В другом варианте осуществления настоящего изобретения может быть применен гетерологичный сигнальный пептид млекопитающих или его функциональное производное. Например, лидерная последовательность дикого типа может быть заменена лидерной последовательностью тканевого активатора плазминогена человека (tissue plasminogen activator - TPA) или β-глюкуронидазы мыши.
ДНК, кодирующая короткую последовательность белка, которая может быть использована для облегчения последующей очистки (например, кодирующая гистидиновую метку) или для облегчения нанесения метки для гибридного белка, может быть включена внутрь или на концах полинуклеотида, кодирующего антитело по настоящему изобретению или его полипептидные фрагменты.
В другом варианте осуществления настоящего изобретения предусматривают клетку-хозяина, содержащую один или несколько полинуклеотидов по настоящему изобретению. В некоторых вариантах осуществления настоящего изобретения предусматривают клетку-хозяина, содержащую один или несколько векторов по настоящему изобретению. Полинуклеотиды и векторы могут обеспечивать какой-либо из признаков, отдельно или в комбинации, описанных в настоящем изобретении в отношении полинуклеотидов и векторов, соответственно. В одном из вариантов осуществления настоящего изобретения клетка-хозяин содержит (например, если клетка трансформирована или трансфицирована) вектор, содержащий полинуклеотид, который кодирует (часть) антитело по настоящему изобретению. В контексте настоящего изобретения понятие «клетка-хозяин» относится к какому-либо типу клеточной системы, который может быть сконструирован для получения гибридных белков по настоящему изобретению или их фрагментов. Клетки-хозяева, которые могут быть применимы для репликации и для поддержки экспрессии антигенсвязывающих молекул, известны в данной области. Такие клетки могут быть трансфицированы или трансдуцированы соответствующим образом определенным вектором экспрессии, и большие количества вектор-содержащих клеток можно выращивать для засева крупномасштабных ферментеров для получения достаточного количества антигенсвязывающей молекулы для клинических применений. К соответствующим клеткам-хозяевам относят прокариотические микроорганизмы, например, Е. coli, или различные эукариотические клетки, например, клетки яичника китайского хомячка (Chinese hamster ovary cells - CHO), клетки насекомых или другие. Например, полипептиды могут быть выработаны в бактериях, в частности, когда гликозилирование не требуется. После экспрессии полипептид может быть выделен из биомассы бактериальных клеток в растворимую фракцию и может быть дополнительно очищен. В дополнение к прокариотам эукариотические микроорганизмы, например, мицелиальные грибы или дрожжи, являются подходящими клонирующими или экспрессирующими хозяевами для векторов, кодирующих полипептид, включая штаммы грибов и дрожжей, у которых пути гликозилирования «гуманизированы», что приводит к выработке полипептида с гликозилированием, частично или полностью соответствующим гликозилированию у человека. См. Gerngross, Nat Biotech 22, 2004, 1409-1414, и Li с соавт., Nat Biotech 24, 2006, 210-215.
Подходящие клетки-хозяева для экспрессии (гликозилированных) полипептидов также получены из многоклеточных организмов (беспозвоночных и позвоночных). Помимо клеток беспозвоночных, в частности насекомых, также используют клетки растений. Были идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать в сочетании с клетками насекомых, особенно для трансфекции клеток Spodoptera frugiperda. Культуры клеток растений также могут быть использованы в качестве хозяев. См. US 5959177, US 6040498, US 6420548, US 7125978 и US 6417429 (описывающие технологию PLANTIBODIESTM для наработки антител в трансгенных растениях). Клетки позвоночных могут также использоваться в качестве хозяев. Например, могут быть применены линии клеток млекопитающих, которые приспособлены для роста в суспензии. Другими примерами полезных линий клеток млекопитающих являются: линия клеток CV1 почки обезьяны, трансформированных SV40 (COS-7), эмбриональные клетки почки человека (клетки 293 или 293Т описаны, например, в статье Graham с соавт., J Gen Virol 36, 1977, 59), клетки почки новорожденного хомяка (baby hamster kidney - BHK), клетки Сертоли мыши (клетки ТМ4, описанные, например, в статье Mather, Biol Reprod 23, 1980, 243-251), клетки почки обезьяны (CV1), клетки почки африканской зеленой мартышки (VERO-76), клетки карциномы шейки матки человека (human cervical carcinoma cells - HELA), клетки почки собак (MDCK), клетки печени серой крысы (buffalo rat liver cells - BRL 3А), клетки легкого человека (W138), клетки печени человека (Hep G2), опухолевые клетки молочной железы мыши (mouse mammary tumor cells - MMT 060562), клетки TRI (описанные, например, в статье Mather с соавт., Annals NY Acad Sci 383, 1982, 44-68), клетки MRC 5 и клетки FS4. К другим линиям клеток-хозяев млекопитающих, которые могут быть применены, относятся: клетки яичника китайского хомячка (СНО), включая клетки dhfr - СНО (Urlaub с соавт., Proc Natl Acad Sci USA 77, 1980, 4216), и линии клеток миеломы, например, YO, NS0, Р3Х63 и Sp2/0. Обзор линий клеток-хозяев млекопитающих, которые могут быть применены для получения белка, см., например, в кн. Yazaki и Wu «Methods in Molecular Biology», Т. 248 (под ред. В.K.С.Lo, изд-во Humana Press, Totowa, Нью-Джерси), 2003, 255-268 (2003). К клеткам-хозяевам относятся культивируемые клетки, например, культивируемые клетки млекопитающих, дрожжевые клетки, клетки насекомых, бактериальные клетки и растительные клетки, а также клетки трансгенного животного, трансгенного растения или культивируемой растительной или животной ткани. В одном из вариантов осуществления настоящего изобретения клетка-хозяин является эукариотической клеткой, предпочтительно клеткой млекопитающего, например, клеткой яичника китайского хомячка (СНО), эмбриональной клеткой почки человека (HEK) или лимфоидной клеткой (например, клетки Y0, NS0, Sp20). Стандартные технологии известны в данной области и применимы для экспрессии генов в этих системах. Клетки, экспрессирующие полипептид, представляющий либо тяжелую, либо легкую цепь иммуноглобулина, могут быть сконструированы таким образом, чтобы также экспрессировать другие цепи иммуноглобулина, в результате экспрессируемый продукт представляет иммуноглобулин, который имеет как тяжелую, так и легкую цепь.
В одном из вариантов осуществления настоящего изобретения предусматривают способ получения антитела по настоящему изобретению или его полипептидных фрагментов, причем способ включает культивирование клеток-хозяев, содержащих полинуклеотиды, кодирующие антитело по настоящему изобретению или их полипептидные фрагменты, в условиях, подходящих для экспрессии антитела по настоящему изобретению или его полипептидных фрагментов, и извлечение антитела по настоящему изобретению или его полипептидных фрагментов из клеток-хозяев (или культуральной среды клеток-хозяев).
В некоторых вариантах осуществления настоящего изобретения части молекул, способные специфически связываться с антигеном целевых клеток (например, фрагментами Fab), формируя часть антигенсвязывающей молекулы, содержат, по меньшей мере, вариабельный участок иммуноглобулина, способный связываться с антигеном. Вариабельные области могут формировать часть и быть производными природных или искусственных антител и их фрагментов. Методы получения поликлональных антител и моноклональных антител известны в данной области (см., например, кн. Harlow и Lane «Antibodies, a laboratory manual», 1988, изд-во Cold Harbor Laboratory). Искусственные антитела могут быть сконструированы методом твердофазного пептидного синтеза, могут быть получены рекомбинантно (например, согласно описанию US 4186567) или могут быть получены, например, путем скрининга комбинаторных библиотек, содержащих вариабельные тяжелые цепи и вариабельные легкие цепи (см., например, патент US 5969108).
В настоящем изобретении могут быть применены иммуноглобулины каких-либо видов животных. Примерами иммуноглобулинов, используемых в настоящем изобретении, могут быть иммуноглобулины мыши, приматов или людей. Если гибридный белок предназначен для использования человеком, может быть использована химерная форма иммуноглобулина, в которой константные области иммуноглобулина происходят от человека. Гуманизированную форму иммуноглобулина или иммуноглобулина, в полной мере являющегося иммуноглобулином человека, также можно получить методами, известными в данной области (см., например, US 5565332). Гуманизация может быть достигнута различными методами, включая (но ими не ограничиваясь) (а) пересадку CDR, не являющихся CDR человека (например, от антитела донора) в каркас антитела человека (например, реципиентного антитела) и каркасные области с сохранением или без сохранения крайне важных остатков каркасной области (например, важных для сохранения хорошего антигенсвязывающего сродства или функций антител), (б) пересадку только определяющих специфичность областей (specificity-determining region - SDR или a-CDR; остатки, крайне важные для взаимодействия антитело-антиген), не являющихся областями человека, в каркасную область человека и константные области, или (в) трансплантацию полностью вариабельных доменов, не являющихся доменами человека, но их «маскировку» участком, подобным участку от человека, путем замены поверхностных остатков. Гуманизированные антитела и методы их получения рассматривают, например, в обзоре Almagro и Fransson, Front Biosci 13, 2008, 1619-1633, а также описывают, например, в публикациях Riechmann с соавт., Nature 332, 1988, 323-329, Queen с соавт., Proc Natl Acad Scl USA 86, 1989, 10029-10033, US 5821337, US 7527791, US 6982321, US 7087409, Jones с соавт., Nature 321, 1986, 522-525, Morrison с соавт., Proc Natl Acad Sci 81, 1984, 6851-6855, Morrison и Oi, Adv Immunol 44, 1988, 65-92, Verhoeyen с соавт., Science 239, 1988, 1534-1536, Padlan, Molec Immun 31(3), 1994, 169-217, Kashmiri с соавт., Methods 36, 2005, 25-34 (описание пересадки SDR (a-CDR)), Padlan, Mol Immunol 28, 1991, 489-498 (описание «перетасовки»);  с соавт., Methods 36, 2005, 43-60 (описание «перетасовки FR»), Osbourn с соавт., Methods 36, 2005, 61-68, Klimka с соавт., Br J Cancer 83, 2000, 252-260 (описание «направленной селекции» применительно к перетасовке FR). Конкретными иммуноглобулинами в соответствии с настоящим изобретением являются иммуноглобулины человека. Антитела человека и вариабельные области антител человека могут быть получены различными методами, известными в данной области. Антитела человека описаны в основном в работах van Dijk и van de Winkel, Curr Opin Pharmacol 5, 2001, 368-74, Lonberg, Curr Opin Immunol 20, 2008, 450-459. Вариабельные области антител человека могут быть получены из моноклональных антител человека, полученных гибридомным методом (см., например, кн. «Monoclonal Antibody Production Techniques and Applications)), 1987, изд-во Marcel Dekker, Inc., Нью-Йорк, 51-63). Антитела человека и вариабельные области антител человека могут быть получены путем введения иммуногена трансгенному животному, которое было модифицировано для получения интактных антител человека или интактных антител с вариабельными областями человека в ответ на антигенный вызов (см., например, Lonberg, Nat Biotech 23, 2005, 1117-1125). Антитела человека и вариабельные области антител человека также могут быть получены путем выделения последовательностей вариабельной области клона Fv, выбранных из производных от библиотек фагового дисплея человека (см., например, Hoogenboom с соавт., Methods in Molecular Biology 178, 1-37 (
с соавт., Methods 36, 2005, 43-60 (описание «перетасовки FR»), Osbourn с соавт., Methods 36, 2005, 61-68, Klimka с соавт., Br J Cancer 83, 2000, 252-260 (описание «направленной селекции» применительно к перетасовке FR). Конкретными иммуноглобулинами в соответствии с настоящим изобретением являются иммуноглобулины человека. Антитела человека и вариабельные области антител человека могут быть получены различными методами, известными в данной области. Антитела человека описаны в основном в работах van Dijk и van de Winkel, Curr Opin Pharmacol 5, 2001, 368-74, Lonberg, Curr Opin Immunol 20, 2008, 450-459. Вариабельные области антител человека могут быть получены из моноклональных антител человека, полученных гибридомным методом (см., например, кн. «Monoclonal Antibody Production Techniques and Applications)), 1987, изд-во Marcel Dekker, Inc., Нью-Йорк, 51-63). Антитела человека и вариабельные области антител человека могут быть получены путем введения иммуногена трансгенному животному, которое было модифицировано для получения интактных антител человека или интактных антител с вариабельными областями человека в ответ на антигенный вызов (см., например, Lonberg, Nat Biotech 23, 2005, 1117-1125). Антитела человека и вариабельные области антител человека также могут быть получены путем выделения последовательностей вариабельной области клона Fv, выбранных из производных от библиотек фагового дисплея человека (см., например, Hoogenboom с соавт., Methods in Molecular Biology 178, 1-37 ( с соавт., изд-во «Нитап Press», Totowa, NJ, 2001) и McCafferty с соавт., Nature 348, 552-554, Clackson с соавт., Nature 352, 1991, 624-628). Фаг обычно отображает фрагменты антител либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab.
с соавт., изд-во «Нитап Press», Totowa, NJ, 2001) и McCafferty с соавт., Nature 348, 552-554, Clackson с соавт., Nature 352, 1991, 624-628). Фаг обычно отображает фрагменты антител либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab.
В некоторых вариантах осуществления настоящего изобретения антитела сконструированы таким образом, чтобы иметь улучшенное связывающее сродство, в соответствии, например, со способами, описанными в публикации РСТ WO 2012/020006 (см. примеры, относящиеся к созреванию аффинности) или в US 2004/0132066. Способность антигенсвязывающих молекул по настоящему изобретению связываться со специфическим антигенным детерминантом может быть измерена либо с помощью иммуноферментного анализа (ELISA), либо другими методами, известными специалисту в данной области, например, методом поверхностного плазмонного резонанса (Liljeblad с соавт., Glyco J 17, 2000, 323-329) и традиционными методами анализа связывания (Heeley, Endocr Res 28, 2002, 217-229). Конкурентные анализы могут быть применены для идентификации антигенсвязывающей молекулы, которая конкурирует с контрольным антителом за связывание с определенным антигеном. В некоторых вариантах осуществления настоящего изобретения такая конкурирующая антигенсвязывающая молекула связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается контрольная антигенсвязывающая молекула. Подробное описание примеров методов картирования эпитопа, с которым связывается антигенсвязывающая молекула, приведено Morris в «Epitope Mapping Protocols)), 1996, в кн. «Methods in Molecular Biology», 66, изд-во Humana Press, Totowa, Нью-Джерси). В примере конкурентного анализа иммобилизованный антиген инкубируют в растворе, содержащем первую меченую антигенсвязывающую молекулу, которая связывается с антигеном, и вторую немеченую антигенсвязывающую молекулу, которую тестируют по способности конкурировать с первой антигенсвязывающей молекулой за связывание с антигеном. Вторая антигенсвязывающая молекула может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный антиген инкубируют в растворе, содержащем первую меченую антигенсвязывающую молекулу, но не вторую антигенсвязывающую молекулу без метки. После инкубирования в условиях, допускающих связывание первого антитела с антигеном, избыточное несвязанное антитело удаляют и измеряют количество метки, связанной с иммобилизованным антигеном. Если количество метки, ассоциированной с иммобилизованным антигеном, существенно уменьшается в тестируемом образце относительно контрольного образца, это указывает на то, что вторая антигенсвязывающая молекула конкурирует с первой антигенсвязывающей молекулой за связывание с антигеном. См. Harlow и Lane, в кн. «Antibodies: А Laboratory Manual», глава 14, 1988, изд-во Cold Spring Harbor Laboratory, Cold Spring Harbor, Нью-Йорк).
Антитела по настоящему изобретению, полученные согласно описанному в настоящем изобретении, могут быть очищены известными методами, например, высокоэффективной жидкостной хроматографией, ионообменной хроматографией, гель-электрофорезом, аффинной хроматографией, эксклюзионной хроматографией и другими. Фактические условия, используемые для очистки конкретного белка, частично могут зависеть от таких факторов, как общий заряд, гидрофобность, гидрофильность и т.п., что известно специалистам в данной области. Для очистки аффинной хроматографией можно использовать антитело, лиганд, рецептор или антиген, с которым связывается антигенсвязывающая молекула, содержащая тримерный лиганд TNF. Например, для очистки аффинной хроматографией гибридных белков по настоящему изобретению может быть использована матрица с белком А или белком G. Аффинную хроматографию с белком А или G и эксклюзионную хроматографию можно применять для выделения антигенсвязывающей молекулы, что описано в примерах. Чистота антигенсвязывающей молекулы, содержащей тримерный лиганд TNF, или ее фрагментов может быть определена каким-либо из различных известных аналитических методов, включая гель-электрофорез, жидкостную хроматографию высокого давления и другие. Например, интактность и должным образом произведенная сборка антигенсвязывающих молекул, экспрессированных согласно описанию в примерах, показана с помощью метода восстанавливающего и невосстанавливающего электрофореза в полиакриламидном геле SDS-PAGE ((PolyAcrylamide Gel Electrophoresis) в присутствии додецилсульфата натрия (Sodium Dodecyl Sulfate)).
Методы
Антигенсвязывающие молекулы по настоящему изобретению могут быть идентифицированы, подвергнуты скринингу или охарактеризованы по физико-химических свойствам и/или биологической активности различными методами, известными в данной области.
1. Определение связывающего сродства (аффинности)
Аффинность антигенсвязывающей молекулы с антигеном клетки-мишени также может быть определена поверхностным плазменным резонансом (surface plasmon resonance - SPR) с использованием стандартной аппаратуры, например, прибора BIAcore (фирма GE Healthcare), и рецепторов или целевых белков, например тех, которые могут быть получены с помощью рекомбинантной экспрессии. Конкретный пример варианта осуществления настоящего изобретения для измерения аффинности описан в примере 4. В соответствии с одним из вариантов настоящего изобретения KD определяют методом поверхностного плазмонного резонанса, используя прибор BIACORE® Т100 (фирма GE Healthcare) при 25°С.
2. Определение связывания и другие анализы
В одном из вариантов осуществления настоящего изобретения антитело по настоящему изобретению тестируют на антигенсвязывающую активность, например, известными методами, например, иммуноферментным методом (ELISA) или вестерн-блоттингом.
3. Определение активности
В одном из вариантов осуществления настоящего изобретения предусматривают методы идентификации антител против CD19 человека, обладающих биологической активностью. К биологической активности могут относиться, например, ингибирование пролиферации В-клеток или уничтожение В-клеток. Также предусматривают антитела, обладающие такой биологической активностью in vivo и/или in vitro.
В некоторых вариантах осуществления настоящего изобретения антитело по настоящему изобретению исследуют на подобную биологическую активность.
Фармацевтические композиции, составы и способы введения
В другом варианте осуществления настоящего изобретения предусматривают фармацевтические композиции, содержащие какие-либо из антител, описанных в настоящем изобретении, например, для применения в каком-либо из указанных ниже терапевтических методов. В одном из вариантов осуществления настоящего изобретения фармацевтическая композиция содержит антитело, предусмотренное в настоящем изобретении, и, по меньшей мере, один фармацевтически приемлемый эксципиент. В другом варианте осуществления настоящего изобретения фармацевтическая композиция включает антитело, предусмотренное в настоящем изобретении, и, по меньшей мере, один дополнительный терапевтический агент, например, из числа описанных ниже.
Фармацевтические композиции по настоящему изобретению содержат терапевтически эффективное количество одного или нескольких антител, растворенных или диспергированных в фармацевтически приемлемом эксципиенте. Понятие «фармацевтически или фармакологически приемлемые» относится к молекулам и композициям, которые обычно нетоксичны для реципиентов в используемых дозах и концентрациях, то есть не вызывают вредную, аллергическую или другую неблагоприятную реакцию при необходимости введения животному, например, в частности человеку. Получение фармацевтической композиции, которая содержит, по меньшей мере, одно антитело и необязательно дополнительный действующий ингредиент, может быть известно специалистам в данной области в свете настоящего описания, например, из кн. « Pharmaceutical Sciences)), 1990, 18-е изд., изд-во Mack Printing Company, включенной в настоящее изобретение в качестве ссылки. В частности, композиции представляют лиофилизированные составы или водные растворы. В контексте настоящего изобретения понятие «фармацевтически приемлемый эксципиент» включает какие-либо растворители, буферы, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые средства), изотонические агенты, соли, стабилизаторы и их комбинации, известные специалистам в данной области.
Pharmaceutical Sciences)), 1990, 18-е изд., изд-во Mack Printing Company, включенной в настоящее изобретение в качестве ссылки. В частности, композиции представляют лиофилизированные составы или водные растворы. В контексте настоящего изобретения понятие «фармацевтически приемлемый эксципиент» включает какие-либо растворители, буферы, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые средства), изотонические агенты, соли, стабилизаторы и их комбинации, известные специалистам в данной области.
К парентеральным относят композиции, предназначенные для введения путем инъекции, например, подкожной, внутрикожной, внутрираневой, внутривенной, внутриартериальной, внутримышечной, интратекальной или внутрибрюшинной инъекции. Для инъекций антигенсвязывающие молекулы по настоящему изобретению, могут быть приготовлены в водных растворах, предпочтительно в физиологически совместимых буферах, например, в растворе Хэнкса, растворе Рингера или физиологическом растворе. Раствор может содержать вспомогательные соединения, например, суспендирующие, стабилизирующие и/или диспергирующие агенты. В другом варианте перед применением гибридные белки могут быть в виде порошка для соединения с соответствующим носителем, например стерильной апирогенной водой. При необходимости стерильные растворы для инъекций получают путем включения гибридных белков по настоящему изобретению в требуемом количестве в подходящий растворитель с различными другими ингредиентами, перечисленными ниже. Стерильность может быть легко достигнута, например, путем фильтрации через стерильные фильтрующие мембраны. Обычно дисперсии получают путем включения различных стерилизованных действующих ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и/или другие ингредиенты. В случае стерильных порошков для приготовления стерильных растворов для инъекций, суспензий или эмульсий предпочтительными методами получения являются способы вакуумной сушки или лиофилизации, которые позволяют получать порошок активного ингредиента плюс какой-либо дополнительный требуемый ингредиент из заранее стерилизованной фильтрацией жидкой среды. Жидкая среда при необходимости должна быть соответствующим образом забуферена, а жидкий разбавитель перед инъекцией перерабатывают в изотоническую форму за счет достаточного количества солевого раствора или глюкозы. Композиция должна быть стабильной в условиях получения и хранения, а также должна быть предохранена от контаминации такими микроорганизмами, как бактерии и грибы. Очевидно, что загрязнение эндотоксином допустимо на минимальном безопасном уровне, например, менее 0,5 нг/мг белка. К фармацевтически приемлемым эксципиентам относятся, но ими перечень не ограничивается: буферы, например, на основе фосфата, цитрата и других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (например, октадецилдиметилбензиламмоний хлорид, хлорид гексаметония, хлорид бензалкония, хлорид бензетония, фенол, бутиловый или бензиловый спирт; алкилпарабены, например, метил- или пропилпарабен, катехол, резорцин, циклогексанол, 3-пентанол и м-крезол); низкомолекулярные полипептиды (менее 10 остатков); белки, например, сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, например, поливинилпирролидон; аминокислоты, например, глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, например, ЭДТА; сахара, например, сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, например, натрий; комплексы с металлами (например, Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, например, полиэтиленгликоль (ПЭГ). Водные инъекционные суспензии могут содержать соединения, которые увеличивают вязкость суспензии, например, натриевую соль карбоксиметилцеллюлозы, сорбит, декстран и другие. Необязательно суспензия также может содержать соответствующие стабилизаторы или агенты, которые увеличивают растворимость соединений, чтобы обеспечить получение высококонцентрированных растворов. Кроме того, суспензии активных соединений могут быть получены в виде соответствующих масляных суспензий для инъекций. К применимым липофильным растворителям или носителям относятся жирные масла, например, кунжутное масло, или синтетические сложные эфиры жирных кислот, например, этиловые или триглицериды, или липосомы.
Действующие ингредиенты могут быть захвачены в микрокапсулы, которые получают, например, методами коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозными или желатиновыми микрокапсулами и поли- (метилметакрилатными) микрокапсулами, соответственно, в коллоидных системах доставки лекарственных средств (например, в липосомах, микросферах альбумина, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методы описаны в кн.: « Pharmaceutical Sciences)) (18-е изд., изд-во Mack Printing Company, 1990). Можно приготовить препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих полипептид, причем матрицы находятся в виде изделий определенной формы, например, пленок или микрокапсул. В некоторых вариантах осуществления настоящего изобретения абсорбция инъекционной композиции может быть достигнута путем использования в композициях агентов, замедляющих абсорбцию, например, моностеарата алюминия, желатина или их комбинации.
Pharmaceutical Sciences)) (18-е изд., изд-во Mack Printing Company, 1990). Можно приготовить препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих полипептид, причем матрицы находятся в виде изделий определенной формы, например, пленок или микрокапсул. В некоторых вариантах осуществления настоящего изобретения абсорбция инъекционной композиции может быть достигнута путем использования в композициях агентов, замедляющих абсорбцию, например, моностеарата алюминия, желатина или их комбинации.
К примерам фармацевтически приемлемых эксципиентов в настоящем изобретении также относят инстерстициальные лекарственные диспергирующие агенты, например, растворимые нейтрально активные гиалуронидазные гликопротеины (soluble neutral-active hyaluronidase glycoproteins - sHASEGP), например, растворимые гиалуронидазные гликопротеины РН-20 человека, например, rHuPH20 (HYLENEX®, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и способы их применения, включая rHuPH20, описаны в US 2005/0260186 и US 2006/0104968. В одном из объектов настоящего изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликанами, например, с хондроитиназой.
Примеры лиофилизированных составов антител описаны в US 6267958. К водным составам антител относят составы, описанные в US 6171586 и WO 2006/044908, последние составы включают гистидин-ацетатный буфер.
Помимо ранее описанных композиций гибридные белки также могут быть переработаны в депо-препараты. Такие препараты длительного действия можно вводить путем имплантации (например, подкожно или внутримышечно) или внутримышечной инъекции. Таким образом, например, гибридные белки могут быть переработаны с использованием соответствующих полимерных или гидрофобных материалов (например, эмульсии в пригодном для этой цели масле) или ионообменных смол, или в качестве умеренно растворимых производных, например, в виде умеренно растворимой соли.
Фармацевтические композиции, содержащие гибридные белки по настоящему изобретению, могут быть получены с помощью обычных процессов смешивания, растворения, эмульгирования, инкапсулирования, захвата или лиофилизации. Фармацевтические композиции могут быть переработаны обычным способом с использованием одного или нескольких физиологически приемлемых носителей, разбавителей, эксципиентов или вспомогательных веществ, которые облегчают обработку белков в препараты, которые могут быть использованы в качестве фармацевтических средств. Правильный состав зависит от выбранного способа введения.
Антитело по настоящему изобретению может быть переработано в составе композиции в виде свободной кислоты или основания, в нейтральной форме или в форме соли. Фармацевтически приемлемыми солями являются соли, которые по существу сохраняют биологическую активность свободной кислоты или основания. К ним относятся кислые аддитивные соли, например, соли, которые образованы со свободными аминогруппами белковой композиции или которые образованы с неорганическими кислотами, например, с хлористоводородной или фосфорной кислотой, или с органическими кислотами, например, с уксусной, щавелевой, винной или миндальной кислотами. Соли, образованные с помощью свободных карбоксильных групп, также могут быть получены с применением неорганических оснований, например, гидроксида натрия, калия, аммония, кальция или трехвалентного железа; или с применением органических оснований, например, изопропиламина, триметиламина, гистидина или прокаина. Фармацевтические соли обычно более растворимы в водных и других протонных растворителях, чем соответствующие формы свободного основания.
Композиция по настоящему изобретению при необходимости также может содержать более одного действующего ингредиента для конкретного случая заболевания, которое подвергают лечению, предпочтительно такие ингредиенты имеют дополнительные активности, которые не оказывают неблагоприятного воздействия друг на друга. Такие действующие ингредиенты соответствующим образом присутствуют в комбинации в количествах, которые являются эффективными для намеченной цели.
Составы для введения in vivo обычно стерильны. Стерильность может быть легко достигнута, например, фильтрацией через стерилизующие мембраны.
Терапевтические методы и композиции
Какие-либо из антител против CD19 человека, предусмотренных в настоящем изобретении, можно применять в терапевтических методах, отдельно или в комбинации, или в качестве моноспецифического антитела, или в качестве мультиспецифичного антитела.
CD19 экспрессируется на большинстве В-клеток (маркер пан-В-клеток), за исключением стволовых клеток и плазматических клеток, и часто экспрессируется на большинстве злокачественных В-клеток человека (ассоциированный с опухолью антиген), например, лимфомы и лейкоза, за исключением множественной миеломы, например, при неходжкинской лимфоме и остром лимфобластном лейкозе.
Биспецифические антитела, распознающие два белка на поверхности клеток в разных популяциях, могут перенаправить цитотоксические иммунные клетки для разрушения патогенных клеток-мишеней.
В одном из вариантов осуществления настоящего изобретения предусматривают антитело против CD19 человека для применения в качестве лекарственного средства. В других вариантах осуществления настоящего изобретения предусматривают антитело против CD19 человека для применения в лечении рака В-клеток. В некоторых вариантах осуществления настоящего изобретения предусматривают антитело против CD19 человека для применения в лечении. В некоторых вариантах осуществления настоящего изобретения предусматривают антитело против CD19 человека для применения в способе лечения индивидуума с раком В-клеток, включающим введение индивидууму эффективного количества антитела против CD19 человека. В некоторых подобных вариантах осуществления настоящего изобретения способ дополнительно включает введение индивидууму эффективного количества, по меньшей мере, одного дополнительного терапевтического агента. В других вариантах осуществления настоящего изобретения предусматривают антитело против CD19 человека для применения в истощении В-клеток. В некоторых вариантах осуществления настоящего изобретения предусматривают антитело против CD19 человека для применения в способе истощения В-клеток индивидуума, включающем введение эффективного количества антитела против CD19 человека для истощения В-клеток. Предпочтительно «индивидуумом» по какому-либо из указанных выше вариантов осуществления является человек. В одном из вариантов осуществления настоящего изобретения рак В-клеток - это неходжкинская лимфома или острый лимфобластный лейкоз.
В других вариантах осуществления настоящего изобретения предусматривают антитело против CD19 человека для применения в иммунотерапии рака. В некоторых вариантах осуществления настоящего изобретения предусматривают антитело против CD19 человека для применения в способе иммунотерапии рака. Понятие «индивидуум» в соответствии с каким-либо из указанных выше вариантов осуществления настоящего изобретения предпочтительно означает человека.
В другом варианте осуществления настоящего изобретения предусматривают применение антитела против CD19 человека для получения или приготовления лекарственного средства. В одном из вариантов осуществления настоящего изобретения лекарственное средство предназначено для лечения рака В-клеток. В другом варианте осуществления настоящего изобретения лекарственное средство предназначено для применения в способе лечения рака В-клеток, включающем введение индивидууму с раком В-клеток эффективного количества лекарственного средства. В другом подобном варианте осуществления настоящего изобретения способ дополнительно включает введение индивидууму эффективного количества, по меньшей мере, одного дополнительного терапевтического агента, например, согласно описанному ниже. В другом варианте осуществления настоящего изобретения лекарственное средство предназначено для истощения В-клеток. В другом варианте осуществления настоящего изобретения лекарственное средство предназначено для применения в способе истощения В-клеток у индивидуума, включающем введение индивидууму количества лекарственного средства, эффективного для истощения В-клеток. Понятие «индивидуум» в каком-либо из вариантов осуществления настоящего изобретения может относиться к человеку. В одном из вариантов осуществления настоящего изобретения злокачественное заболевание В-клеток является лимфомой В-клеток или лейкозом В-клеток. В одном из вариантов осуществления настоящего изобретения рак В-клеток является неходжкинской лимфомой или острым лимфобластным лейкозом.
В другом варианте осуществления настоящего изобретения предусматривают способ лечения рака В-клеток. В одном из вариантов осуществления настоящего изобретения способ включает введение индивидууму с раком В-клеток эффективного количества антитела против CD19 человека. В одном подобном варианте осуществления настоящего изобретения способ дополнительно включает введение индивидууму эффективного количества, по меньшей мере, одного дополнительного терапевтического агента, согласно описанному ниже. Понятие «индивидуум» в каком-либо из указанных выше вариантов осуществления настоящего изобретения может относиться к человеку. В одном из вариантов осуществления настоящего изобретения раком В-клеток является лимфома В-клеток или лейкоз В-клеток. В одном из вариантов осуществления настоящего изобретения раком В-клеток является неходжкинская лимфома или острый лифобластный лейкоз.
В другом варианте осуществления настоящего изобретения предусматривают способ истощения В-клеток у индивидуума. В одном из вариантов осуществления настоящего изобретения способ включает введение индивидууму эффективного количества антитела против CD19 для истощения В-клеток. В одном из вариантов осуществления настоящего изобретения «индивидуумом» является человек. В одном из вариантов осуществления настоящего изобретения раком В-клеток является лимфома В-клеток или лейкоз В-клеток. В одном из вариантов осуществления настоящего изобретения раком В-клеток является неходжкинская лимфома или острый лифобластный лейкоз.
В другом варианте осуществления настоящего изобретения предусматривают фармацевтические составы, включающие какое-либо из антител против CD человека по настоящему изобретению, например, для применения в каком-либо из описанных выше терапевтических способов. В одном из вариантов осуществления настоящего изобретения фармацевтический состав включает какое-либо из антител против CD19 человека по настоящему изобретению и фармацевтически приемлемый носитель. В другом варианте осуществления настоящего изобретения фармацевтический состав включает какое-либо из антител против CD19 человека по настоящему изобретению и, по меньшей мере, один дополнительный терапевтический агент.
Антитела по настоящему изобретению могут применять для лечения отдельно или в комбинации с другими агентами. Например, описанное в настоящем изобретении антитело может быть введено одновременно, по меньшей мере, с одним дополнительным терапевтическим агентом.
Такие комбинированные терапии, отмеченные выше, включают комбинированное введение (при котором два или более терапевтических агентов включены в один общий или в отдельные составы) и раздельное введение, причем в последнем случае введение антитела может производиться до, одновременно и/или после введения дополнительного терапевтического агента или агентов. В одном из вариантов осуществления настоящего изобретения введение антитела против CD19 человека и введение дополнительного терапевтического агента происходит на протяжении одного месяца, или примерно одной, двух или трех недель, или примерно одного, двух, трех, четырех, пяти или шести суток.
Антитело по настоящему изобретению (и какое-либо дополнительное терапевтическое средство) можно вводить какими-либо приемлемыми способами, включая парентеральное, внутрилегочное и интраназальное, и, при необходимости местного и внутрираневого введения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может осуществляться каким-либо соответствующим способом, например, путем инъекций, например, внутривенных или подкожных инъекций, в частности в зависимости от того, является ли введение кратковременным или постоянным. В настоящем изобретении рассматривают различные схемы дозирования, включая, но не ограничиваясь ими, однократное или множественное введение в различные моменты времени, болюсное введение и пульсовую инфузию.
Антитела, описанные в настоящем изобретении, могут быть переработаны, дозированы и введены в соответствии с надлежащей медицинской практикой. Факторы для рассмотрения в этом контексте включают конкретное подлежащее лечению расстройство, конкретное рассматриваемое млекопитающее, клиническое состояние отдельного пациента, причину расстройства, место доставки агента, способ введения, схема введения и другие факторы, известные практикующим врачам. Антитело необязательно должно быть переработано дополнительно с одним или несколькими агентами, которые в настоящее время используют для предотвращения или лечения рассматриваемого расстройства. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в препарате, типа расстройства или лечения и других факторов, рассмотренных выше. Их обычно используют в тех же дозах и с помощью тех же способов введения, которые описаны в настоящем изобретении, или в дозах, составляющих примерно от 1 до 99% описанных в настоящем изобретении доз, или в какой-либо доз и каким-либо способом, который эмпирически/клинически определяют в качестве применимого.
Для предупреждения или лечения заболевания соответствующая доза антитела по настоящему изобретению (при использовании отдельно или в сочетании с одним или несколькими другими дополнительными терапевтическими агентами) может зависеть от типа заболевания, подлежащего лечению, типа антитела, тяжести и течения заболевания, независимо от того, вводятся ли антитело в профилактических или терапевтических целях, от предыдущей терапии, клинической истории пациента и реакции на антитело, а также от решения лечащего врача. Антитело соответствующим образом вводят пациенту одномоментно или в виде серии введений. В зависимости от типа и тяжести заболевания приблизительно от 1 мкг/кг до 15 мг/кг (например, 0,5 мг/кг - 10 мг/кг) антитела могут быть исходной дозой для введения пациенту, независимо от того, вводят однократно или в виде нескольких отдельных введений или путем непрерывной инфузии. Одна типичная суточная доза может варьировать примерно от 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, указанных выше. При повторных введениях в течение нескольких суток или дольше, в зависимости от состояния, лечение обычно должно поддерживаться до тех пор, пока не произойдет желаемое подавление симптомов болезни. Одна примерная доза антитела может быть в диапазоне примерно от 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту могут вводить одну или несколько доз, составляющих примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг кг (или какую-либо их комбинацию). Такие дозы можно вводить с перерывами, например, раз в неделю или каждые три недели (например, чтобы пациент получал примерно от двух до примерно двадцати или, например, около шести доз антитела). Можно вводить начальную более высокую нагрузочную дозу, за которой следует одна или несколько более низких доз. Однако могут быть полезны другие режимы дозирования. Прогресс этой терапии легко контролируется с помощью обычных методов и анализов.
В настоящем изобретении дополнительно предусматривают способы лечения воспалительного заболевания, аутоиммунного заболевания, ревматоидного артрита, волчанки, псориаза и заболеваний костей, включающие введение пациенту, у которого диагностировано такое заболевание (и, следовательно, нуждающегося в таком лечении), антитела, специфически связывающегося с CD19 человека, согласно описанному в настоящем изобретении. Антитело может быть введено отдельно, в фармацевтической композиции или, в другом варианте, в комбинации с другими лекарственными средствами для лечения воспалительного заболевания, аутоиммунного заболевания, ревматоидного артрита, волчанки, псориаза или заболевания костей. Антитело вводят в фармацевтически эффективном количестве.
В настоящем изобретении дополнительно предусматривают применение антитела по настоящему изобретению для лечения воспалительного заболевания, аутоиммунного заболевания, ревматоидного артрита, волчанки, псориаза или заболевания костей, а также для получения фармацевтической композиции, содержащей антитело, согласно описанному в настоящем изобретении. Кроме того, в настоящем изобретении предусматривают способ получения фармацевтической композиции, содержащей антитело по настоящему изобретению.
В настоящем изобретении дополнительно предусматривают антитело по настоящему изобретению для лечения воспалительного заболевания, аутоиммунного заболевания, ревматоидного артрита, волчанки, псориаза или заболевания костей.
Кроме того, в настоящем изобретении предусматривают применение антитела по настоящему изобретению для получения фармацевтической композиции для лечения воспалительного заболевания, аутоиммунного заболевания, ревматоидного артрита, волчанки, псориаза или заболевания костей. Антитело применяют в фармацевтически эффективном количестве.
В настоящем изобретении дополнительно предусматривают применение антитела по настоящему изобретению для получения фармацевтической композиции для лечения воспалительного заболевания, аутоиммунного заболевания, ревматоидного артрита, волчанки, псориаза или заболевания костей. Антитело применяют в фармацевтически эффективном количестве.
Очевидно, что какой-либо из вышеуказанных составов или терапевтических способов может быть осуществлен с использованием иммуноконъюгата по настоящему изобретению вместо или в дополнение к антителу против CD19 человека.
Другие агенты и способы лечения
Антигенсвязывающие молекулы по настоящему изобретению для лечения можно вводить в комбинации с одним или несколькими другими агентами. Например, антигенсвязывающая молекулу по настоящему изобретению можно вводить совместно, по меньшей мере, с одним дополнительным терапевтическим агентом. Понятие «терапевтический агент» относится к какому-либо агенту, который можно вводить для лечения симптома или заболевания у индивидуума, нуждающегося в таком лечении. Такой дополнительный терапевтический агент может содержать какие-либо действующие ингредиенты, применимые для конкретного показания, подвергаемого лечению, предпочтительно дополнительные терапевтические агенты оказывают дополнительное действие и не проявляют неблагоприятного воздействия друг на друга. В некоторых вариантах осуществления настоящего изобретения дополнительным терапевтическим агентом является другой противоопухолевый агент.
Такие другие агенты соответствующим образом включают в комбинации в количествах, эффективных для намеченной цели. Эффективное количество таких других агентов зависит от количества используемых антигенсвязывающих молекул, типа расстройства или способа лечения, а также от других факторов, рассмотренных выше. Антигенсвязывающие молекулы обычно применяют в тех же дозах и при тех способах введения, описанных в настоящем изобретении, или примерно от 1 до 99% доз, описанных в настоящем изобретении, или в какой-либо дозе и каким-либо способом, которые эмпирически/клинически определяют как приемлемые.
Такие комбинированные терапии, описанные выше, включают комбинированное введение (где два или более терапевтических агентов включены в одну и ту же или отдельные композиции) и отдельное введение, и в этом случае введение антигенсвязывающей молекулы по настоящему изобретению может происходить до, одновременно и/или после введения дополнительного терапевтического агента и/или адъюванта.
Получение продукта
В другом варианте осуществления настоящего изобретения предусматривают получение продукта, содержащего материалы, применимые для лечения, предупреждения и/или диагностики расстройств, описанных выше. Полученный продукт включает, например, контейнер и этикетку или вкладыш, расположенный на контейнере или вложенный в него. Подходящими контейнерами являются, например, пузырьки, флаконы, шприцы, пакеты с раствором для внутривенного введения и т.п. Контейнеры могут быть из разных материалов, например, из стекла или пластика. Контейнер содержит композицию, которая сама по себе или в сочетании с другой композицией, эффективна для лечения, профилактики и/или диагностики состояния, и может иметь стерильный порт доступа (например, контейнер может быть пакетом или флаконом с пробкой с раствором для внутривенного введения, которую прокалывают иглой для подкожной инъекции). По меньшей мере, один действующий агент в композиции является антигенсвязывающей молекулой, содержащей тримерный лиганд TNF, по настоящему изобретению.
Этикетка или вкладыш указывают, что композиция предназначена для лечения определенного состояния. Кроме того, продукт может включать (а) первый контейнер с композицией, включающей антигенсвязывающую молекулу по настоящему изобретению; (б) второй контейнер с композицией, включающей дополнительный цитотоксический или иной терапевтический агент. Полученный продукт в таком варианте осуществления настоящего изобретения может дополнительно включать вкладыш, указывающий, для лечения какого состояния данная композиция может применяться.
В другом варианте или дополнительно продукт может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, например, бактериостатическую воду для инъекций (bacteriostatic water for injection - BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он может также включать другие материалы, желательные с коммерческой точки зрения и желательные для пользователей, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
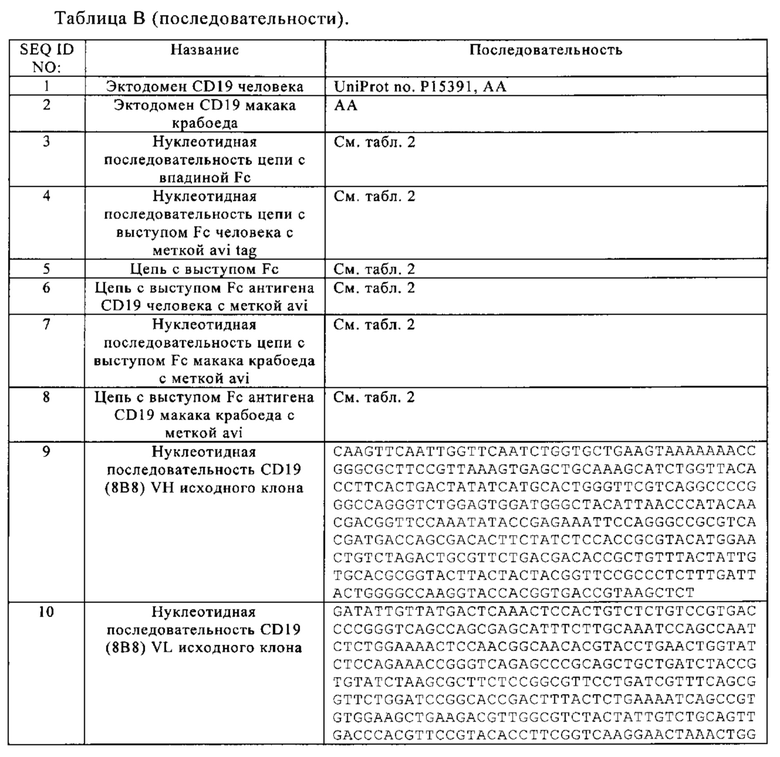


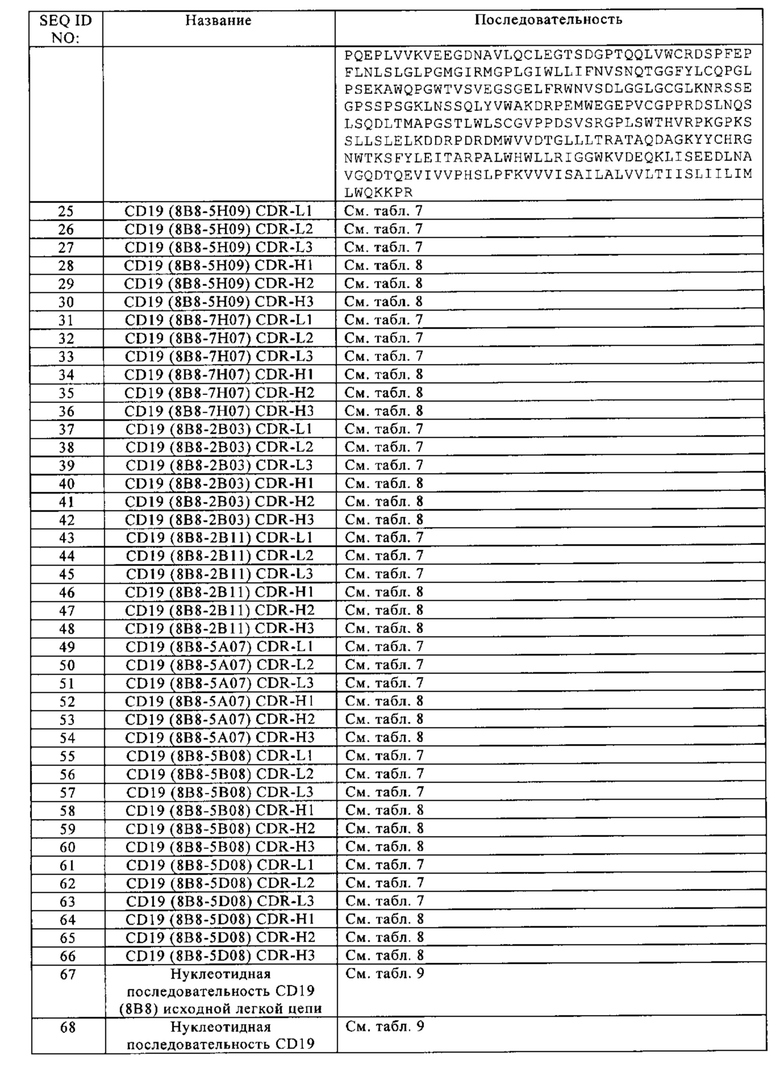
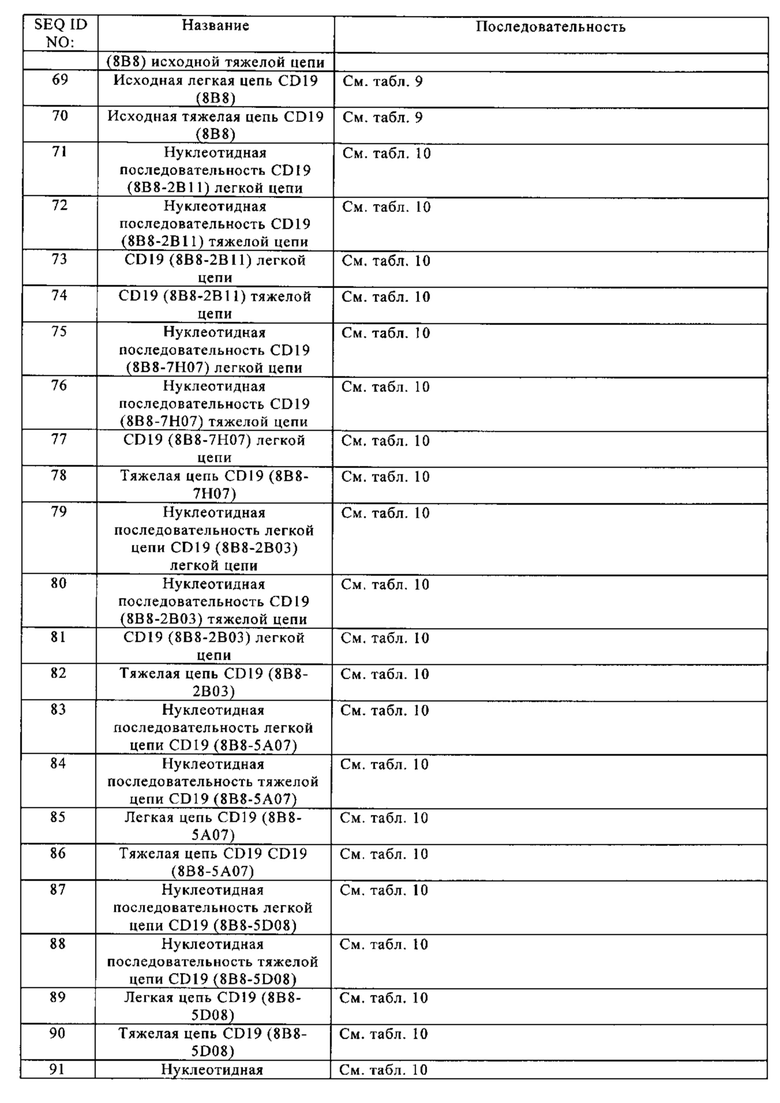

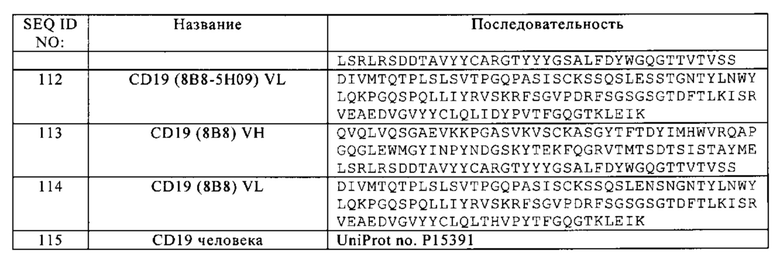
Общая информация, касающаяся нуклеотидных последовательностей легких и тяжелых цепей иммуноглобулинов, приведена в кн.: Kabat с соавт., «Sequences of Proteins of Immunological Interest)), 5e изд., 1991, изд-во Public Health Service, Национальный Институт Здоровья, Бетесда, Мериленд). Аминокислоты цепей антител нумеруют и обозначают по системе нумерации, описанной в кн.: Kabat с соавт., «Sequences of Proteins of Immunological Interest)), 5e изд., 1991, изд-во Public Health Service, Национальный Институт Здоровья, Бетесда, Мериленд).
Примеры
Ниже приведены примеры способов и композиций настоящего изобретения. Очевидно, что возможны различные другие варианты осуществления настоящего изобретения, исходя из приведенного выше общего описания.
Методы рекомбинации ДНК
Для работы с ДНК применяют стандартные методы согласно описанию в кн. Sambrook с соавт.«Molecular cloning: A laboratory manual)), изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, Нью-Йорк, 1989. Реагенты для методов молекулярной биологии используют в соответствии с инструкциями производителя. Общая информация о нуклеотидных последовательностях легких и тяжелых цепей иммуноглобулина человека приведена в кн. Kabat Е.А. с соавт., «Sequences of Proteins of Immunological Interest)), 5-е изд., NIH Publication, No 91-3242, 1991.
Определение последовательности ДНК (сиквенс)
Последовательности ДНК определяют двухцепочечным секвенированием.
Генный синтез
Необходимые генные сегменты получают методом ПЦР с применением соответствующих матриц или синтезируют на фирме Geneart AG (Регенсбург, Германия) из синтетических олигонуклеотидов и ПЦР-продуктов путем автоматизированного генного синтеза. В случаях, когда отсутствует достоверная генная последовательность, олигонуклеотидные праймеры создают на основе последовательностей ближайших гомологов, а также гены получают с помощью РВ-ПЦР из РНК, происходящей из соответствующей ткани. Сегменты генов, фланкированные исключительными сайтами расщепления эндонуклеазы рестрикции, клонируют в стандартные векторы клонирования/секвенирования. Плазмидную ДНК очищают из трансформированных бактерий и определяют концентрацию с помощью УФ-спектроскопии. Последовательность ДНК субклонированных генных фрагментов подтверждают секвенированием ДНК. Сегменты генов конструируют с требуемыми сайтами рестрикции, чтобы обеспечить субклонирование в соответствующие векторы экспрессии. Все конструкции разрабатывают с 5'-конца последовательности ДНК, кодирующей лидерный пептид, который нацеливает белки на секрецию в эукариотических клетках.
Методы работы с культурами клеток
Применяют стандартные методы работы с культурами клеток, описанные в кн. «Current Protocols in Cell Biology», под ред. Bonifacino J.S., Dasso M., Harford J.В., Lippincott-Schwartz J., Yamada K.M. 2000. Изд-во John Wiley & Sons, Inc.
Очистка белка
Белки очищают из отфильтрованных супернатантов культуры клеток по стандартным протоколам. Вкратце, антитела вносят в колонку Protein А Sepharose column (фирма GE healthcare) и промывают в ФСБ. Элюируют антитела при рН 2,8, после чего сразу нейтрализуют образец. Агрегированный белок отделяют от мономерных антител с помощью эксклюзионной хроматографии (Superdex 200, фирма GE Healthcare) в ФСБ или в 20 мМ гистидине, 150 мМ NaCl при рН 6,0. Фракции мономерных антител собирают, концентрируют (при необходимости), например, центрифужным концентратором MILLIPORE Amicon Ultra (30 MWCO), замораживают и хранят при -20°С или -80°С. Часть образцов в последующем используют для анализа белка и аналитического описания, например, электрофорезом в полиакриламидом геле в присутствии додецилсульфата натрия (SDS-PAGE), эксклюзионной хроматографией (size exclusion chromatography - SEC) или масс-спектрометрией.
Электрофорез в полиакриламидом геле в присутствии додецилсульфата натрия (SDS-PAGE)
Работу с гель-системой NuPAGE® Pre-Cast gel (фирма Invitrogen) осуществляют в соответствии с инструкциями производителя. В частности, применяют 10% или 4-12% NuPAGE® Novex® Bis-TRIS Pre-Cast гели (pH 6,4) и NuPAGE® MES (восстановленные гели с добавкой антиоксидантного подвижного буфера NuPAGE®) или подвижные буферы MOPS (невосстановленные гели).
Аналитическая эксклюзионная хроматография
Эксклюзионную хроматографию (Size exclusion chromatography - SEC) для определения агрегированного и олигомерного состояния антител осуществляют с помощью ВЭЖХ-хроматографии. Вкратце, очищенные с помощью белка А антитела вносят в колонку Tosoh TSKgel G3000SW в 300 мМ NaCl, 50 мМ KH2PO4/K2HPO4, рН 7,5 в систему Agilent HPLC 1100 или в колонку Superdex 200 (фирма GE Healthcare) в 2×ФСБ ВЭЖХ-системы Dionex. Количество элюированного белка определяют по поглощению в УФ и интеграции областей пиков. В качестве стандарта применяют BioRad Gel Filtration Standard 151-1901.
Определение связывания и связывающего сродства антител с соответствующими антигенами методом поверхностного плазмонного резонанса (SPR) (прибор BIACORE)
Связывание полученных антител с соответствующими антигенами исследуют поверхностным плазмонным резонансом (surface plasmon resonance - SPR) с помощью прибора BIACORE (фирма GE Healthcare Biosciences АВ, Уппсала, Швеция). Вкратце, для измерения сродства (аффинности) козьего антитела против IgG человека (Goat-Anti-Human IgG), антитела JIR 109-005-098 иммобилизуют на чипе СМ5 через аминовую связь для презентации антител против соответствующего антигена. Связывание измеряют в буфере HBS (HBS-P (10 мМ HEPES, 150 мМ NaCl, 0,005% Твин 20, рН 7,4), 25°С (или в другом варианте при 37°С). Антиген (R&D Systems или очищенный самостоятельно) вносят в различных концентрациях в раствор. Ассоциацию измеряют путем введения антигена на протяжении от 80 сек до 3 мин, диссоциацию определяют путем промывки поверхности чипа буфером HBS в течение 3-10 мин, и оценивают значение KD с использованием модели связывания Ленгмюра 1:1. Данные отрицательного контроля (например, кривые буфера) вычитаются из кривых образцов для коррекции внутреннего дрейфа базовой линии и уменьшения шума. Соответствующее программное обеспечение Biacore Evaluation используют для анализа сенсограмм и для расчета данных по аффинности.
Пример 1. Получение, очистка и описание антигенного гибрида Fc для осуществления фагового дисплея
Для экспрессии и чистоты эктодоменов CD19 человека и макака крабоеда (табл. 1) в мономерном состоянии соответствующий фрагмент ДНК гибридизируют с сегментом гена Fc IgGl человека, содержащим мутации типа «выступ» (человека: SEQ ID NO: 4; макака крабоеда: SEQ ID NO: 7), и трансфецируют противоположной составляющей «Fc-впадина» (SEQ ID NO: 3) (Merchant с соавт., Nat Biotechnol 16, 1998, 677-681). Сайт расщепления IgA (РТРРТР) интродуцируют между эктодоменом антигена и цепью Fc с выступом. Метку Avi для прямого биотинилирования интродуцируют с С-конца цепи антиген-цепь Fc с выступом и мутации H435R и Y436F интродуцируют в цепь Fc с впадиной с целью очистки (Jendeberg L. с соавт, J. Immunological methods, 1997). Комбинирование антигена-цепи Fc с выступом, содержащей мутации S354C/T366W (человека: SEQ ID NO: 6; макака крабоеда: SEQ ID NO: 8), с цепью Fc со впадиной, содержащей мутации Y349C/T366S/L368A/ Y407V (SEQ ID NO: 5), позволяет получать гетеродимерный Fc гибридный фрагмент, который включает одну копию эктодомена CD 19. Табл. 2 представляет кДНК и аминокислотные последовательности конструкции антигенного гибрида Fc.


Для получения мономерных гибридных молекул антигена/Fc суспензию клеток СНО на стадии экспоненциального роста трансфицируют стандартными методами одновременно двумя плазмидами, кодирующими два компонента гибридного белка (цепи с выступом и цепи с впадиной).
Секретируемый белок очищают от супернатанта клеточной культуры с помощью аффинной хроматографии с использованием белка А с последующей эксклюзионной хроматографией. Для аффинной хроматографии супернатант загружают в колонку MabSelect Sure объемом (column volume - CV) 5-15 мл, смола от фирмы GE Healthcare, уравновешенную фосфатом натрия (20 мМ), цитратом натрия (20 мМ), 0,5 М хлоридом натрия (рН 7,5). Несвязанный белок удаляют промыванием, по меньшей мере, 6 объемами колонок того же буфера. Связанный белок элюируют с использованием линейного градиента; стадия 1,10 CV элюирующего буфера в концентрации от 0 до 60% (20 мМ цитрат натрия, 500 мМ хлорид натрия (рН 2,5)); стадия 2, 2 CV элюирующего буфера в концентрации от 60 до 100%. Для линейного градиента дополнительно элюируют 2 объемами колонки 100% буфером для элюции.
Величину рН отобранных фракций регулируют добавлением 1/40 (об./об.) 2 М Tris, рН 8,0. Белок концентрируют и фильтруют перед загрузкой в колонку HiLoad Superdex 200 (фирма GE Healthcare), уравновешенную 2 мМ MOPS, 150 мМ хлоридом натрия, 0,02% (мае./об.) азидом натрия, рН 7,4.

Часть очищенного антигена биотинилизируют in vitro, используя набор для осуществления стандартной реакции биотин-протеин лигазы BirA (фирма Avidity, номер в каталоге BirA500) по инструкциям производителя. Степень биотинилирования гибрида, содержащего CD19 человека, составляет 94%, для соответствующей конструкции CD19 макака крабоеда - 100%. Биотинилизированный белок затем применяют для отбора, скрининга и описания 8В8-производных клонов со зрелой аффинностью, избежавших дезаминирования горячих точек N27d и N28.
Пример 2. Отбор CD19-специфических антител со зрелой аффинностью
Дезаминирование остатков аспарагина в положениях 27d и 28, локализованных в CDR1 легкой цепи гуманизированного клона 8В8 (описание в WO 2011/147834), приводит к существенному снижению биологической активности. Таким образом, создают 2 библиотеки фагового дисплея, в которых а) удалены аспарагиновые остатки в двух положениях - 27d и 28, б) рандомизируют дополнительные CDR тяжелой и легкой цепей для отбора вариантов 8В8 с улучшенной аффинностью.
2.1 Получение библиотек 8В8 со сформированной аффинностью без горячих точек LCDR1
Выработку производных от 8В8 антител со зрелой (сформированной) аффинностью без сайтов деаминирования N27d и N28, расположенных в LCDR1, осуществляют по стандартным протоколам методом фагового дисплея (Silacci с соавт., 2005). На первом этапе последовательности ДНК VL и VH гуманизированного исходного клона 8 В8 (SEQ ID NO: 9 и SEQ ID NO: 10) клонируют в фагмиду, которую затем используют в качестве матрицы для рандомизации. На следующем этапе создают две библиотеки для отбора предпочтительных клонов методом фагового дисплея. Чтобы элиминировать вышеупомянутые горячие точки, для обеих библиотек применяют метод случайных праймер LCDR1 (SEQ ID NO: 11), который допускал только аминокислоты STQE в положениях 27d и 28. Библиотеку созревания 1 рандомизируют в CDR1 и 2 как легкой, так и тяжелой цепи, тогда как библиотека созревания 2 была рандомизирована в CDR1 и 3 легкой цепи и в CDR3 тяжелой цепи. Рандомизированные положения в соответствующих областях CDR показаны на фиг. 1. Для генерации библиотеки созревания 1, рандомизированной в CDR1 и 2 как легкой, так и тяжелой цепи, три фрагмента собирают «сплансированием путем перекрывающегося расширения» (SOE) ПЦР и клонируют в фаговый вектор (фиг. 2). Следующие комбинации праймеров используют для генерации библиотеки фрагментов: фрагмент 1 (LMB3 (SEQ ID NO: 16) и CD19 L1 обратный случайный (SEQ ID NO: 11), фрагмент 2 (CD19 L2 прямой случайный (SEQ ID NO: 12) и CD19 H1 обратный случайный (SEQ ID NO: 13) и фрагмент 3 (CD19 Н2 прямой случайный (SEQ ID NO: 14) и обратный константный CD19 Н3 (SEQ ID NO: 15) (табл. 4). После сборки достаточных количеств рандомизированного фрагмента полной длины, его расщепляют NcoI/NheI вместе с идентично обработанным акцепторным фагмидным вектором. 3-кратный мольный избыток инсерта из библиотеки лигируют с 10 мкг вектора фагмида. Очищенные лигаты применяют для 20 трансформаций, что приводит к формированию 2×109 трансформантов. Частицы фагмид, отображающие библиотеку созревания аффинности 8В8, сохраняют и очищают с помощью PEG/NaCl, которые будут применять для отбора.
Аналогичным образом получают вторую библиотеку, рандомизированную в CDR1 и 3 легкой цепи и в CDR3 тяжелой цепи. Последующие комбинации праймеров применяют для получения фрагментов библиотек: фрагмент 1 (LMB3 (SEQ ID NO: 16) и CD19 L1 обратный случайный (SEQ ID NO: 11), фрагмент 2 (CD19 L1 обратный константный (SEQ ID NO 223) и CD19 L3 обратный случайный (SEQ ID NO 224), фрагмент 3 (CD19 L3 прямой константный (SEQ ID NO: 225) и CD19 Н3 обратный случайный (SEQ ID NO: 226) (табл. 5). После сборки достаточных количеств рандомизированного фрагмента полной длины его расщепляют NcoI/KpnI наряду с идентично обработанным акцепторным фагмидным вектором. Трехкратный мольный избыток инсерта из библиотеки лигируют с 20 мкг фагмидного вектора. Очищенные лигаты используют для 40 трансформаций, приводящих к получению 2×109 трансформантов. Частицы фагмид, отображающие библиотеку созревания аффинности 8В8, сохраняют и очищают с помощью очистки PEG/NaCl, применяемой для отбора.
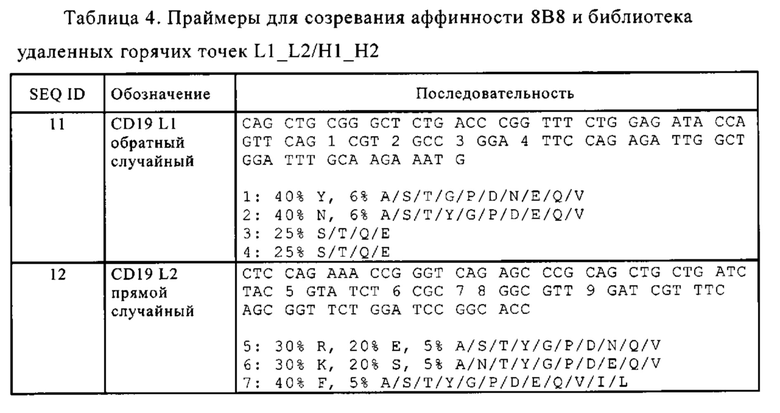
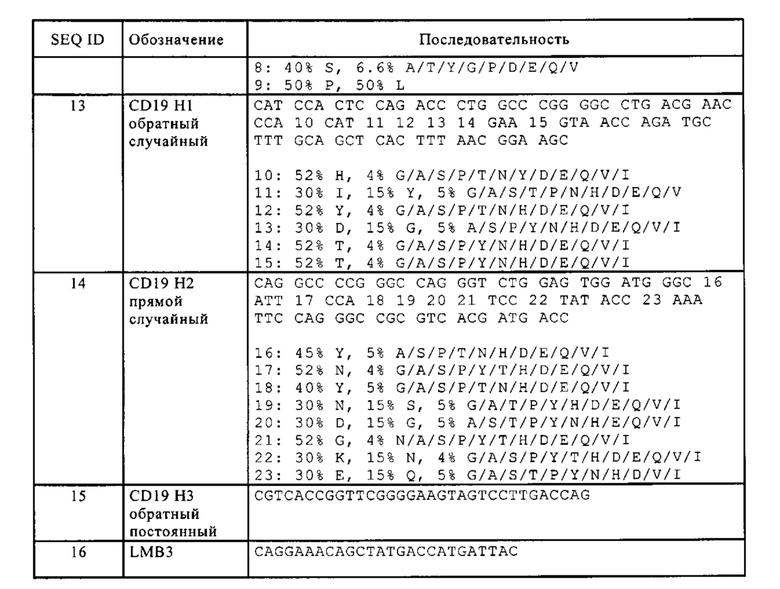


2.2 Отбор 8В8-производных клонов со зрелой аффинностью, не несущих горячих точек LCDR1 N27d и N28
Для отбора клонов со зрелой аффинностью, не несущих горячих точек LCDR1 N27d и N28, применяют два подхода методом фагового дисплея:
При первом подходе отбор осуществляют на гибридном белке человека CD19-Fc, используя библиотеки фагового дисплея. Циклы пэннинга осуществляют в растворе по следующей схеме: 1. Связывание ~1012 фагмидных частиц с 30 нМ биотинилированным белком CD19-Fc в течение 0,5 ч в общем объеме 1 мл, 2. Захват биотинилированного белка CD19-Fc и специфически связанных фаговых частиц добавлением 5,4×107 покрытых стрептавидином магнитных гранул в течение 10 мин, 3. Промывка гранул 5×ФСБ, используя 5×1 мл ФСБ/Tween20 и 5×1 мл ФСБ, 4. Элюция фаговых частиц добавлением 1 мл 100 мМ TEA в течение 10 мин и нейтрализация путем добавления 500 мкл 1М Tris/HCl рН 7.4, 5. Повторное инфицирование экспоненциально растущей бактерией Е. coli TG1, и 6. Инфицирование хэлперным фагом VCSM13 с последующим осаждением PEG/NaCl фагмидных частиц, которые будут использовать в последующих циклах отбора. Отбор проводят на протяжении трех циклов, используя понижающиеся концентрации антигена (30×10-9 М, 10×10-9 М и 3×10-9 М). Во 2 и 3 циклах захват комплексов антиген : фаг проводят с использованием планшетов с нейтравидином вместо гранул стрептавидина. Планшеты с нейтравидином промывают 5ХФСБ/Tween20 и 5×ФСБ. В третьем цикле планшет с нейтравидином инкубируют в течение ночи в 2 л ФСБ для отбора «скорости диссоциации» перед элюцией фага с планшета. Кроме того, белок CD19-Fc макака крабоеда используют во втором цикле для обогащения кросс-реактивных связующих.
На втором цикле отбора фаговый пэннинг выполняют на клетках, временно экспрессирующих ECD CD19 человека или макака крабоеда на поверхности клетки. Для временной трансфекции клеток HEK получают экспрессирующие плазмиды, которые несут последовательности ДНК (от 5' к 3') для следующих сегментов белка: метки Flag, метки SNAP, ECD CD19, происходящих либо от человека, либо от макака крабоеда, и трансмембранной области рецептора фактора роста тромбоцитов (Platelet-derived growth factor receptor - PDGFR) (SEQ ID NO: 21 и 22). Экспрессию соответствующих белков (SEQ ID NO: 23 и 24) на поверхности клетки подтверждают проточной цитометрией с использованием для обнаружения антитела против Flag. Обе библиотеки на первом цикле отбора тестируют на клетках, которые экспрессируют содержащий ECD CD19 либо человека, либо макака крабоеда. Для последующих циклов пэннинга разные виды ECD CD19 чередуют. Клетки, временно трансфецированные посторонним мембранным белком, используют для предварительной очистки.
Циклы пэннинга осуществляют по следующей схеме: 1. Трансфекция клеток НЕК конструкциями, экспрессирующими либо CD19 ECD, либо несоответствующий трансмембранный белок, по стандартной процедуре, описанной ранее, 2. Инкубация клеток в течение 48 ч при 37°С в инкубаторе в атмосфере 5% СО2, 3. Выделение клеток центрифугированием (3 мин в режиме 250×g) и ресуспендирование 1×107 CD19 ECD-положительных клеток и 1×107 ECD-отрицательных клеток в ФСБ/5% БСА, соответственно, 3. Предварительная очистка неспецифического фага путем инкубирования фаговой библиотеки с 1×107 CD19-отрицательными клетками в течение 60 мин при 4°С, используя центрифугирование в мягком режиме, 4. Центрифугирование клеток в режиме 250×g в течение 3 мин и перенос в новую пробирку. Добавление 1×107 CD19-положительных клеток и инкубирование в течение 60 мин при 4°С, используя центрифугирование в мягком режиме, 5. Промывание клеток центрифугированием в течение 1 мин в режиме 250×g, удаление супернатанта и ресуспендирование в 1 мл ФСБ (8 раз), 6. Элюирование фага 1 мл 100 мМ TEA, инкубирование в течение 5 мин при комнатной температуре и нейтрализация элюата 500 мкл 1М Tris-HCl, рН 7,6, 7. Повторное инфицирование экспоненциально растущих бактерий Е. coli TG1, и 8. Инфицирование хэлперным фагом VCSM13 и последующее осаждение PEG/NaCl фагмидных частиц в последующих циклах отбора. Отбор проводят на протяжении 3 циклов.
Для обоих типов отбора выявляют специфические связующие методом ELISA следующим образом: наносят по 100 мкл 30 нМ биотинилизированного CD19-Fc белка на лунку в планшеты с нейтравидином. Добавляют Fab-содержащие бактериальные супернатанты и определяют связывание Fab за счет их меток Flag, используя анти-Flag/HRP вторичное антитело.
Клоны, являющиеся ELISA-положительными по рекомбинантному CD19 человека, затем тестируют методом ELISA на основе клеток, используя клетки, которые были временно трансфицированы экспрессирующей плазмидой, содержащей ECD CD19 человека (SEQ ID NO: 227). Этот анализ проводят следующим образом: через 48 ч после трансфекции клетки HEK собирают и центрифугируют в режиме 250×g в течение 5 мин. Затем клетки ресуспендируют в ледяном ФСБ БСА 2% до густоты суспензии 4×106 клеток/мл и инкубируют в течение 20 мин на льду для блокировки неспецифических сайтов связывания. По 4×105 клеток в 100 мкл вносят в каждую лунку 96-луночного планшета и центрифугируют в режиме 250×g при 4°С в течение 3 мин. Супернатант удаляют и 50 мкл бактериального супернатанта, содержащего растворимые фрагменты Fab, разбавляют 50 мкл ледяного ФСБ/БСА 2%, вносят в планшет, смешивают с клетками и инкубируют в течение 1 ч при 4°С. Затем клетки промывают 3 раза ледяным ФСБ перед внесением по 100 мкл ФСБ БСА 2% на лунку, содержащую антитела против Fab-HRP в разведении 1:2000. После инкубирования в течение 1 ч клетки снова промывают трижды ледяным ФСБ. Для процесса в лунки добавляют по 100 мкл субстрата «1-step ultra ТМВ-ELISA» («1-ступенчатый ультра ТМВ-ELISA»). После 10 мин инкубирования супернатант переносят в новый 96-луночный планшет, содержащий по 40 мкл 1М H2SO4 в лунках, и измеряют оптическую плотность при 450 нм. Клоны, проявляющие существенные сигналы на общем фоне, подвергают кинетическому скринингу с помощью SPR-анализа с использованием ProteOn XPR36.
2.3 Идентификация вариантов клона 8В8 со зрелой аффинностью методом SPR
Для дополнительного описания ELISA-положительных клонов, скорость диссоциации измеряют методом поверхностного плазмонного резонанса (SPR) с использованием системы для изучения молекулярных взаимодействий на основе поверхностного плазмонного резонанса ProteOn XPR36 и сравнивают с исходным гуманизированным клоном 8В8.
Для такого эксперимента иммобилизуют 7000 RU поликлонального антитела против Fab человека на всех 6 каналах чипа GLM с помощью связывания с амином (NaAcetate рН 4,5, 25 мкл/мин, 240 сек) (вертикальная ориентация). Каждый содержащий антитело бактериальный супернатант фильтруют и в 2 раза разбавляют ФСБ, после чего вводят в течение 360 сек со скоростью 25 мкл/мин для достижения уровней иммобилизации от 100 до 400 единиц ответа (response units - RU) в вертикальной ориентации. Инъекция мономерного CD19-Fc: для одноточечных измерений кинетики направление впрыскивания заменяют на горизонтальную ориентацию, трехкратные серийные разведения очищенного мономерного CD19-Fc (варьирование уровней концентраций от 150 до 6 нМ) одновременно вводят в количестве 50 мкл/мин по отдельным каналам 1-4, со временем ассоциации 180 сек и временем диссоциации 300 сек. Фрагмент Fc IgG человека (150 нМ) вводят по каналу 5 в качестве отрицательного контроля к специфическому связыванию с мономерным CD19-Fc. Буфер (PBST) вводят инъекцией по шестому каналу, чтобы обеспечить «внутренний» пустой контроль. Регенерацию проводят двумя впрыскиваниями 10 мМ глицина с рН 1,5 и 50 мМ NaOH в течение 30 сек при 90 об/мин (горизонтальная ориентация). Константы скорости диссоциации (koff) рассчитывают с использованием простой модели связывания Ленгмюра 1:1 (программное обеспечение ProteOn Manager v3.1) путем одновременной установки сенсограмм. Были идентифицированы клоны, экспрессирующие Fab с наименьшей константой скорости диссоциации (табл. 6). Следует отметить, что константы скорости диссоциации клонов 5А07 и 5 В08 не могут быть определены из-за неадекватной установки. Тем не менее оба клона были отобраны, потому что полученные результаты свидетельствуют об очень медленной диссоциации. Вариабельные домены соответствующих фагмид были секвенированы. Важно отметить, что оба аспарагиновых остатка в LCDR1 (положения 27d и 28) были заменены серином или треонином, что свидетельствует о том, что оба сайта дезаминирования удалены. Выравнивание показано на фиг. 3. CDR лучших клонов приведены в табл.7 (вариабельные области легкой цепи) и в табл.8 (вариабельные области тяжелой цепи) (клон 5Н09: (SEQ ID NO: 25-30), клон 7Н07: (SEQ ID NO: 31-36), клон 2B03: (SEQ ID NO: 37-42), клон 2B11: (SEQ ID NO: 43-48), клон 5A07: (SEQ ID NO: 49-54), клон 5B08: (SEQ ID NO: 55-60), клон 5D08: (SEQ ID NO: 61-66).


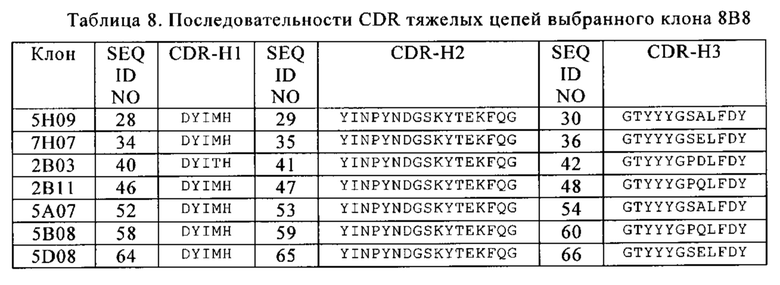
Пример 3. Описание аффинности зрелых 8В8-производных антител 3.1 Клонирование вариабельных доменов антитела в векторах экспрессии Вариабельные области последовательностей ДНК тяжелой и легкой цепей выбранных анти-CD19 связующих субклонируют в рамке либо с константной тяжелой цепью, либо с константной легкой цепью IgG 1 человека. В тяжелую цепь вводят мутации Pro329Gly, Leu234Ala и Leu235Ala, чтобы аннулировать связывание с гамма-рецепторами Fc в соответствии со способом, описанным в WO 2012/130831 А1.
Последовательности кДНК и аминокислотные последовательности анти-CD19 IgG показаны в табл. 9 и табл. 10, соответственно. Все кодирующие антитела последовательности клонируют в векторе экспрессии, который управляет транскрипцией инсерта с химерным промотором MPSV и содержит синтетическую сигнальную последовательность polyA, расположенную на 3'-конце CDS. Кроме того, вектор содержит последовательность EBP ЕВР для эписомального поддержания плазмиды.
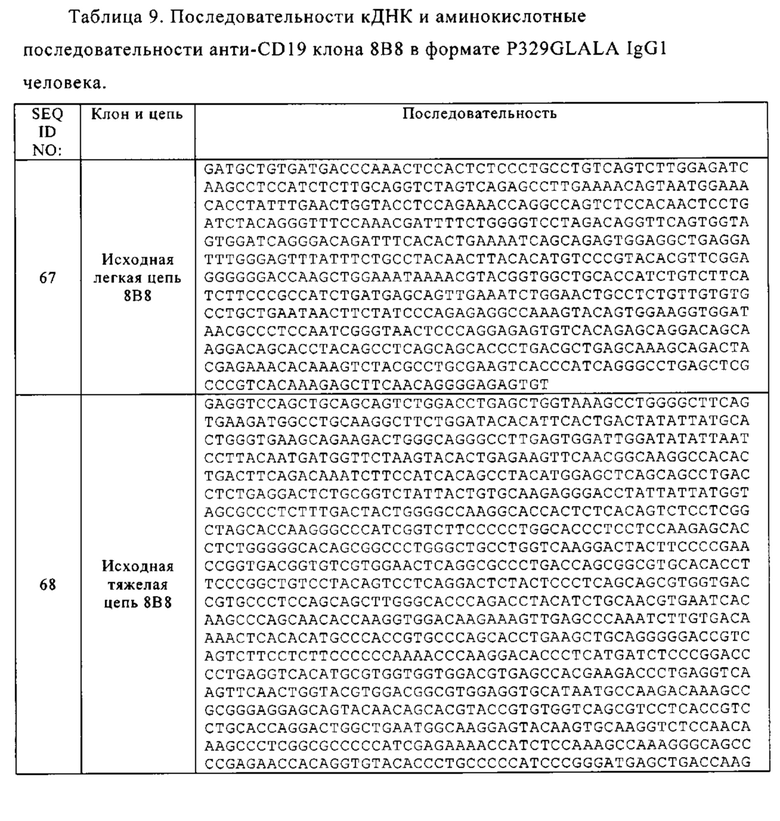

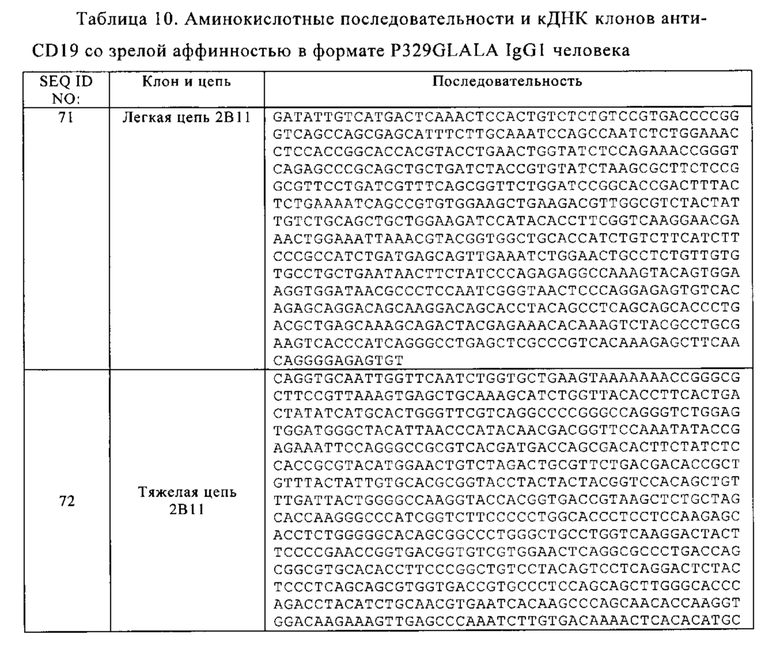






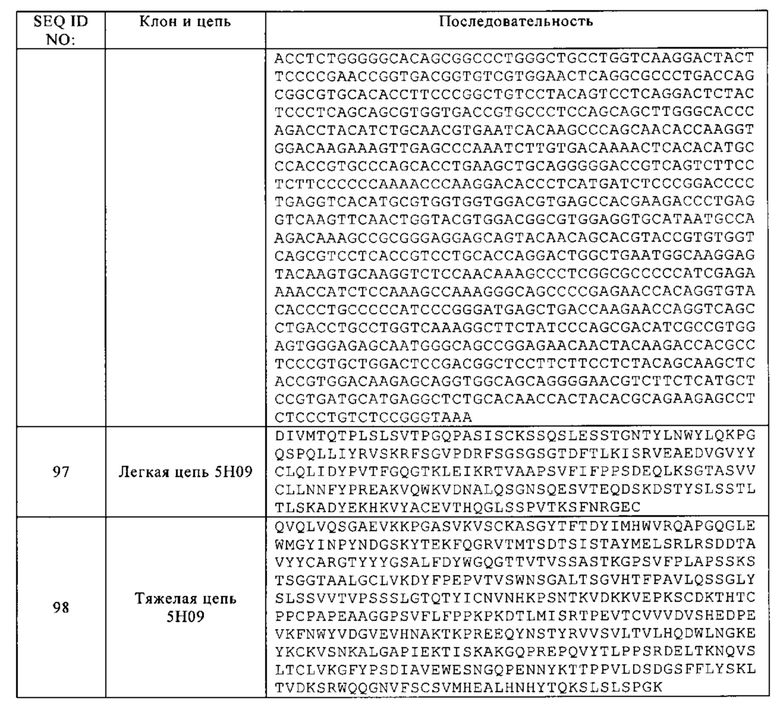
3.2 Определение аффинности отобранных антител методом поверхностного плазмонного резонанса (SPR)
Для точного определения аффинности методом SPR отобранные анти-CD19-антитела получают путем совместной трансфекции клеток HEK293-EBNA векторами экспрессии млекопитающих с использованием полиэтиленимина. Клетки трансфицируют соответствующими векторами экспрессии в соотношении 1:1 («вектор тяжелой цепи»:«вектор легкой цепи») в соответствии со стандартной процедурой. Через 7 суток после трансфекции измеряют титры антител в супернатанте и все титры выравнивают до концентрации 10 мкг/мл.
Аффинность (KD) исходного антитела 8В8 и его производных измеряют с помощью SPR с использованием прибора ProteOn XPR36 (фирма Biorad) при 25°С. По 7000 RU поликлональных антител против Fab человека иммобилизуют по всем 6 каналам чипа GLM с помощью связывания амина (NaAcetate рН 4,5, 25 мкл/мин, 240 сек) (вертикальная ориентация). Каждый супернатант НЕК, содержащий антитела, фильтруют, разбавляют PBST (10 мМ фосфат, 150 мМ хлорид натрия, рН 7,4, 0,005% Твин 20) до концентрации 10 мкг/мл, и затем вводят в течение 360 сек со скоростью 25 мкл/мин для достижения уровней иммобилизации от 500 до 800 единиц ответа (RU) в вертикальной ориентации. Инъекция мономерного CD19-Fc: для одноточечных измерений кинетики направление впрыскивания заменяют на горизонтальную ориентацию, трехкратные серийные разведения очищенного мономерного CD19-FC (варьирование уровней концентраций от 150 до 6 нМ) одновременно вводят со скоростью 50 мкл/мин по отдельным каналам 1-4, со временем ассоциации 180 сек и временем диссоциации 300 сек. Фрагмент Fc IgG человека (150 нМ) вводят инъекцией по каналу 5 в качестве отрицательного контроля к специфическому связыванию с мономерным CD19-Fc. Буфер (PBST) вводят инъекцией по шестому каналу, чтобы обеспечить «внутренний» пустой контроль. Обзор соответствующих сенсограмм показан на фиг. 4А-43. Регенерацию проводят двумя импульсами 10 мМ глицина с рН 1,5 и 50 мМ NaOH в течение 30 с при 90 об / мин (вертикальная ориентация). Константы констант константы (коп) и константы диссоциации (koff) были рассчитаны с использованием простой индивидуальной модели привязки Ленгмюра в программном обеспечении ProteOn Manager v3.1 путем одновременной установки сенсорных диаграмм ассоциации и диссоциации. Константа равновесной диссоциации (KD) рассчитывалась как отношение koff / kon. Краткий обзор кинетических и термодинамических данных показан в табл.11. Константа диссоциации всех родственных клонов была улучшена по сравнению с их родительским клоном 8 В8. Регенерацию проводят двумя впрыскиваниями 10 мМ глицина с рН 1,5 и 50 мМ NaOH в течение 30 сек со скоростью 90 об/мин (вертикальная ориентация). Константы скорости ассоциации (kon) и константы скорости диссоциации (koff) рассчитывают с использованием простой модели связывания Ленгмюра 1:1 (программное обеспечение ProteOn Manager v3.1) путем одновременной установки сенсограмм ассоциации и диссоциации. Константу равновесной диссоциации (KD) рассчитывают в виде соотношение koff/kon. Общий обзор кинетических и термодинамических данных показан в табл.11. Константа
диссоциации всех клонов со зрелой аффинностью улучшена по сравнению с исходным для них клоном 8В8.
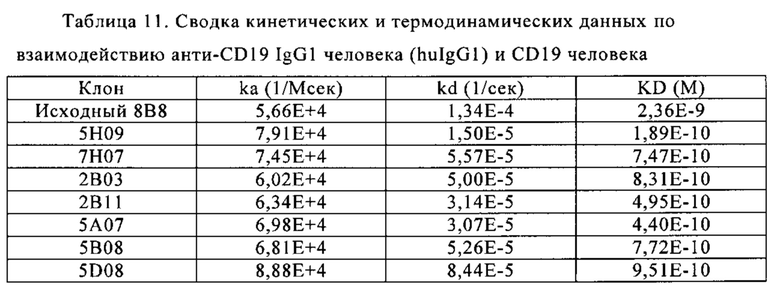
Пример 4
Получение и очистка анти-CD19 IgG1 P329G LALA
Отобранные анти-CD19 антитела получают путем совместной трансфекции клеток HEK293-EBNA векторами экспрессии млекопитающих, используя полиэтиленимин. Клетки трансфицируют соответствующими векторами экспрессии в соотношении 1:1 («вектор тяжелой цепи»: «вектор легкой цепи»).
Для получения таких антител в качалочные колбы объемом 500 мл высевают 400 миллионов клеток за 24 ч до трансфекции. Перед трансфекцией клетки центрифугируют в течение 5 мин в режиме 210×g и надосадочную жидкость заменяют предварительно подогретой средой CD СНО. Векторы экспрессии (200 мкг суммарной ДНК) смешивают в 20 мл среды CD СНО. После добавления 540 мкл PEI раствор встряхивают на вортексе в течение 15 сек и инкубируют в течение 10 мин при комнатной температуре. Затем клетки смешивают с ДНК/раствором PEI, переносят в колбу для встряхивания объемом 500 мл и инкубируют в течение 3 ч при 37°С в инкубаторе в атмосфере 5% СО2. После инкубирования добавляют 160 мл среды F17 и культивируют клетки в течение 24 ч. Через сутки после трансфекции добавляют 1 мМ вальпроевой кислоты и 7% питания с добавками. После культивирования в течение 7 суток супернатант собирали центрифугированием в течение 15 мин в режиме 210×g. Раствор стерилизуют фильтрацией (фильтр с порами 0,22 мкм), добавляют азид натрия до конечной концентрации 0,01% (мас./об.) и хранят при 4°С.
Очистку молекул антител из супернатантов культур клеток проводят аффинной хроматографией с использованием белка А согласно описанному выше для очистки гибридов Fc антигена. Белок концентрируют и фильтруют перед загрузкой в колонку HiLoad Superdex 200 (фирма GE Healthcare), уравновешенную 20 мМ гистидина, 140 мМ раствором NaCl с рН 6,0.
Концентрацию белка очищенных антител определяют путем измерения оптической плотности (ОП) при 280 нм, используя коэффициент мольной экстинкции, рассчитанный на основе аминокислотной последовательности. Чистоту и молекулярную массу антител анализируют с помощью CE-SDS в присутствии восстанавливающего агента (фирма Invitrogen, США) или без него, используя LabChipGXII (фирма Caliper). Совокупное содержание образцов антител анализируют, используя аналитическую ионообменную колонку TSKgel G3000 SW XL (фирма Tosoh), уравновешенную подвижным буфером 25 мМ K2HPO4, 125 мМ NaCl, 200 мМ L-аргинин моногидрохлорид, 0,02% (мас./об.) NaN3, рН 6,7, при 25°С (табл. 12).

Для получения биспецифических конструкций выбирают клон 2В11, поскольку он утратил три горячие точки дезамидирования.
Пример 5. Связывание на опухолевых клетках, экспрессирующих CD19
Для определения связывания клонов IgG1 с CD19-экспрессирующими клетками применяют клетки WSU-DLCL2 (фирма DSMZ, номер в каталоге АСС 575), полученные из плеврального выпота мужчины европеоидной расы в возрасте 41 года с В-клеточной неходжкинской лимфомой. Опухолевые клетки в количестве 0,1×106 ресуспендируют в DPBS (Gibco by Life Technologies, номер в каталоге 14190326) и полученную суспензию вносят в каждую лунку 96-луночного круглодонного планшета (планшет для культуры клеток greiner bio-one, фирма Cellstar, номер в каталоге 650185). Клетки однократно промывают 200 мкл DPBS. Клетки ресуспендируют в 100 мкл/лунку охлажденного буфера DPBS (4°С), содержащего разведенный 1:5000 краситель прижизненной фиксации клеток Fixable Viability Dye eFluor 660 (фирма eBioscience, номер в каталоге 65-0864-18), и планшеты инкубируют в течение 30 мин при 4°С. Клетки однократно промывают 200 мкл/лунку охлажденного буфера DPBS (4°С) и ресуспендируют в 50 мкл/лунку охлажденного буфера FACS (4°С) (DPBS, обогащенного 2% ФСБ, 5 мМ EDTA рН 8 (фирма Amresco, номер в каталоге Е177) и 7,5 мМ азидом натрия (фирма Sigma-Aldrich S2002)), содержащего связующие CD19 в серии концентраций, с последующим инкубированием в течение 1 ч при 4°С. После интенсивной промывки клетки дополнительно окрашивают 50 мкл/лунку 4°С холодного буфера FACS, содержащего 5 мкг/мл РЕ-конъюгированного аффинночистого козьего фрагмента F(ab'')2, специфичного в отношении F(ab'')2 фрагмента IgG человека (AffiniPure anti-human IgG F(ab')2-fragment-specific goat F(ab')2 fragment) (фирма Jackson ImmunoResearch, номер в каталоге 109116098) в течение 30 мин при 4°С. Затем клетки дважды промывают 200 мкл/лунку буфера FACS при температуре 4°С и клетки фиксируют в 50 мкл/лунку буфера DPBS, содержащего 1% формальдегида (фирма Sigma, НТ501320-9.5L). Клетки ресуспендируют в 100 мкл/лунку буфера FACS и получают, используя цитометр FACS LSR II (фирма BD Biosciences). Данные исследуют, используя программное обеспечение FlowJo V10 (фирма FlowJo, LLC) и GraphPad Prism 6.04 (фирма GraphPad Software, Inc).
На фиг. 5 показано связывание клонов CD19 IgG1 с клетками WSU-DLCL2, экспрессирующими CD19 человека. Табл. 13 показывает данные измерение ЕС50.

| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ АНТИ-CD19-АНТИТЕЛА | 2018 |
|
RU2791445C2 |
| АНТИТЕЛА К ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРАМ, ПОЛУЧЕННЫМ ИЗ 4G7 | 2020 |
|
RU2826051C2 |
| АНТИТЕЛА ПРОТИВ PD-1 И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2788616C2 |
| НОВЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ СПЕЦИФИЧЕСКИ СВЯЗЫВАТЬСЯ С CD40 И FAP | 2018 |
|
RU2766234C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2019 |
|
RU2797268C2 |
| АНТИТЕЛА И ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, СПЕЦИФИЧНЫЕ К CD19 | 2015 |
|
RU2741105C2 |
| УЛУЧШЕННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ РЕЦЕПТОРЫ | 2018 |
|
RU2825816C2 |
| НОВЫЕ БИСПЕЦИФИЧНЫЕ ПОЛИПЕПТИДНЫЕ КОМПЛЕКСЫ ПРОТИВ CD3/CD19 | 2018 |
|
RU2788127C2 |
| АНТИИДИОТИПИЧЕСКИЕ АНТИТЕЛА И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2017 |
|
RU2773355C2 |
| АНТИТЕЛА ПРОТИВ БЕЛКА РЕЦЕПТОРА С-МЕТ | 2011 |
|
RU2608644C2 |



















































































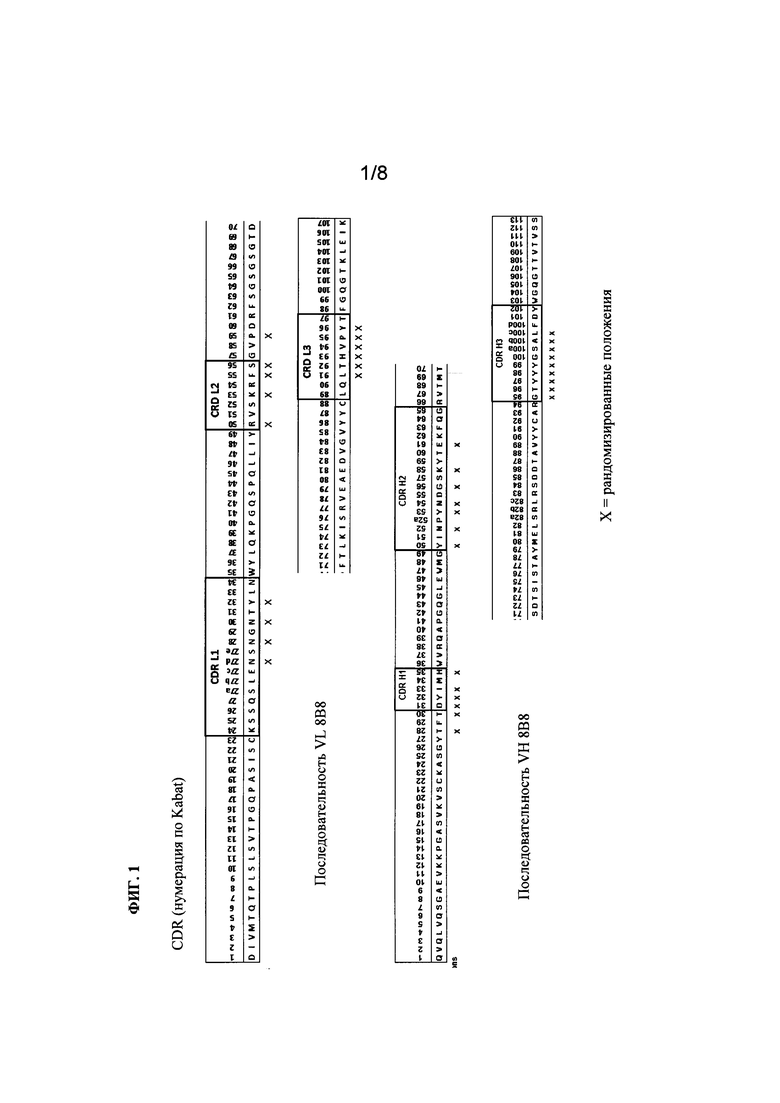
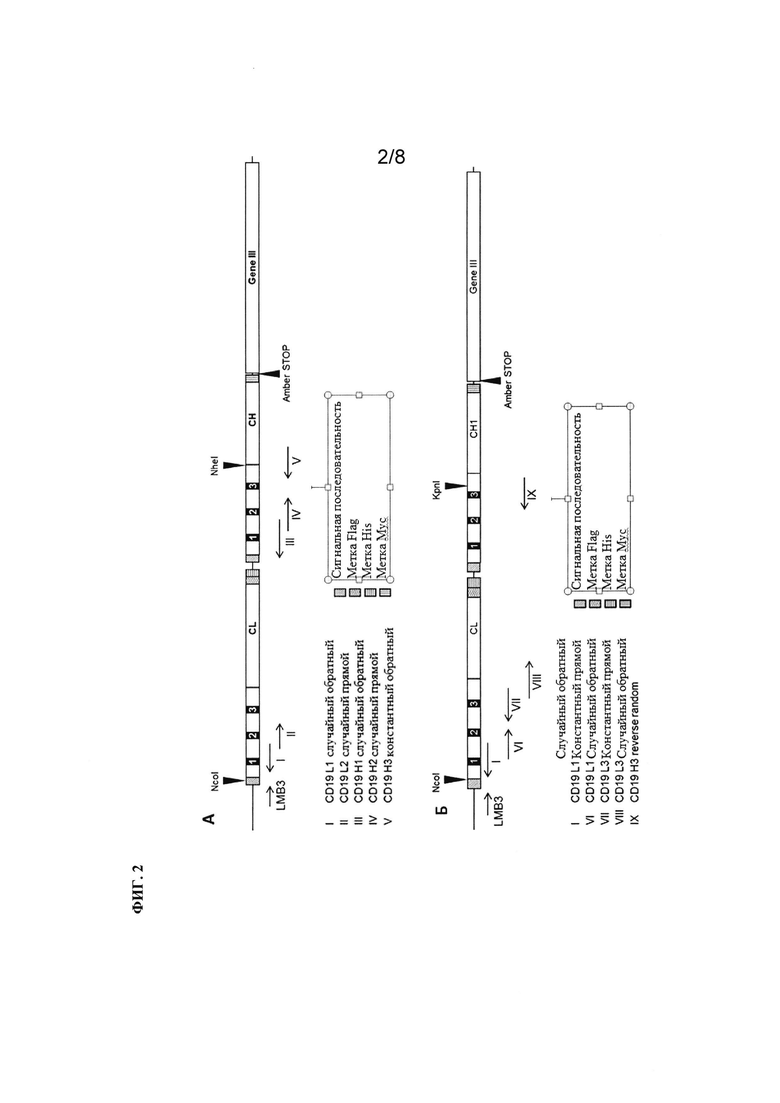
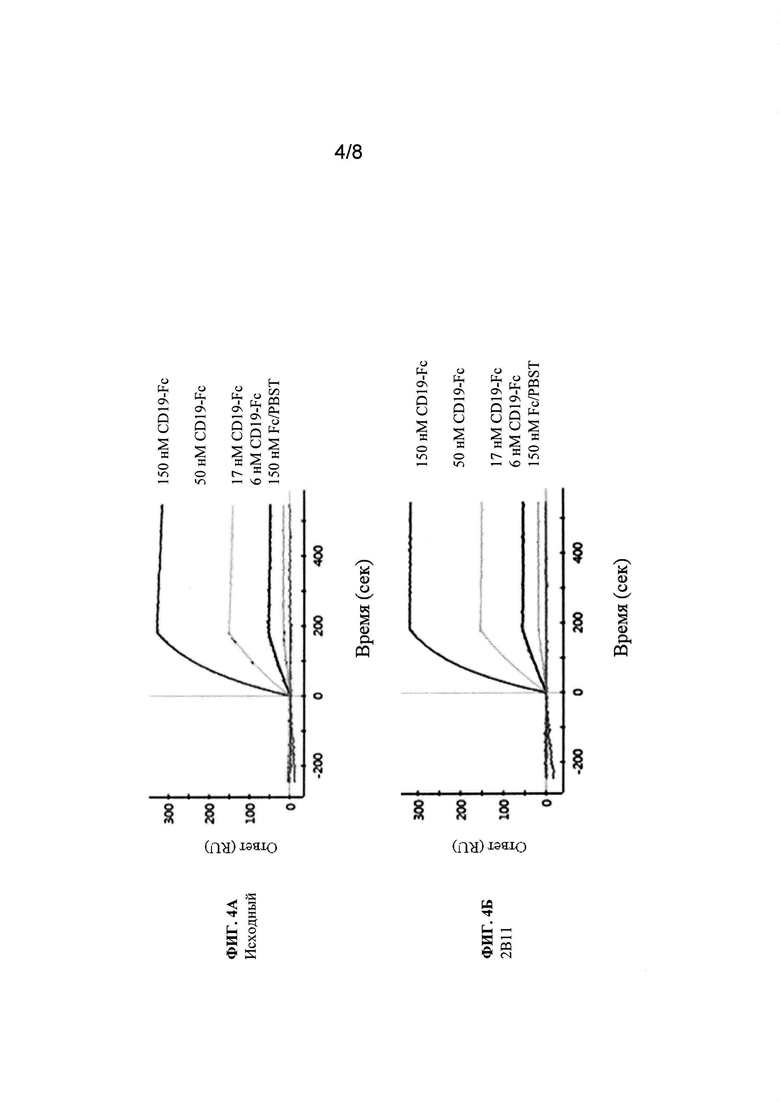
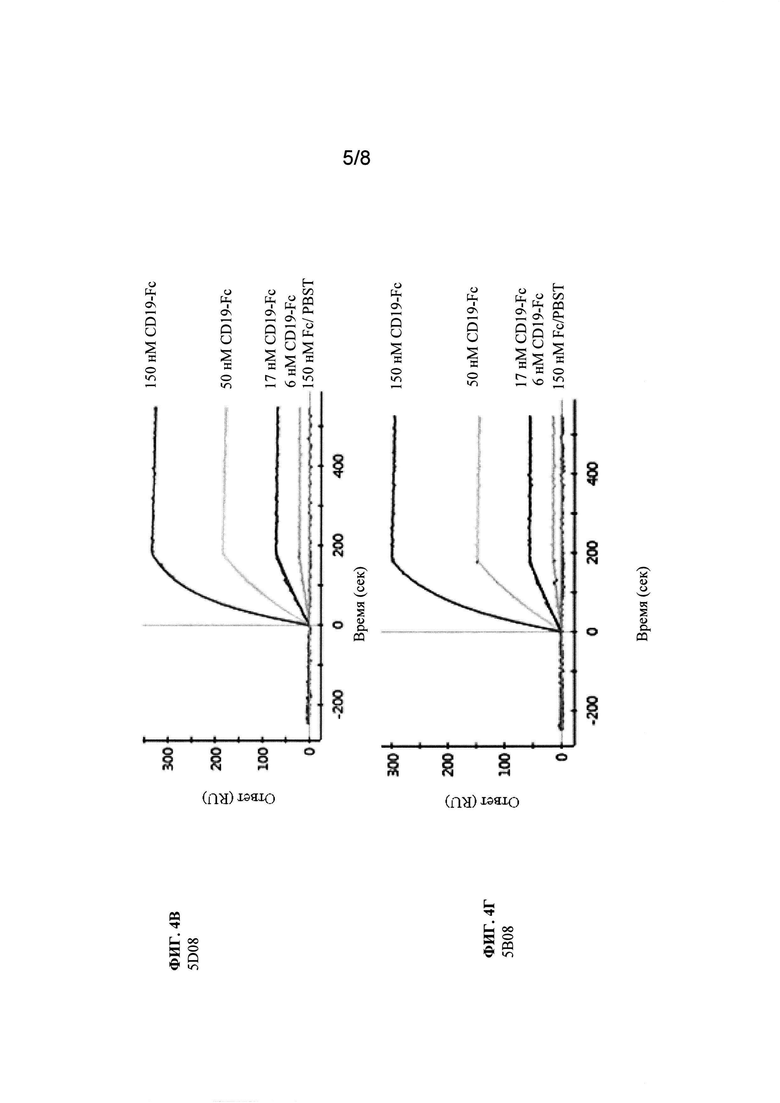
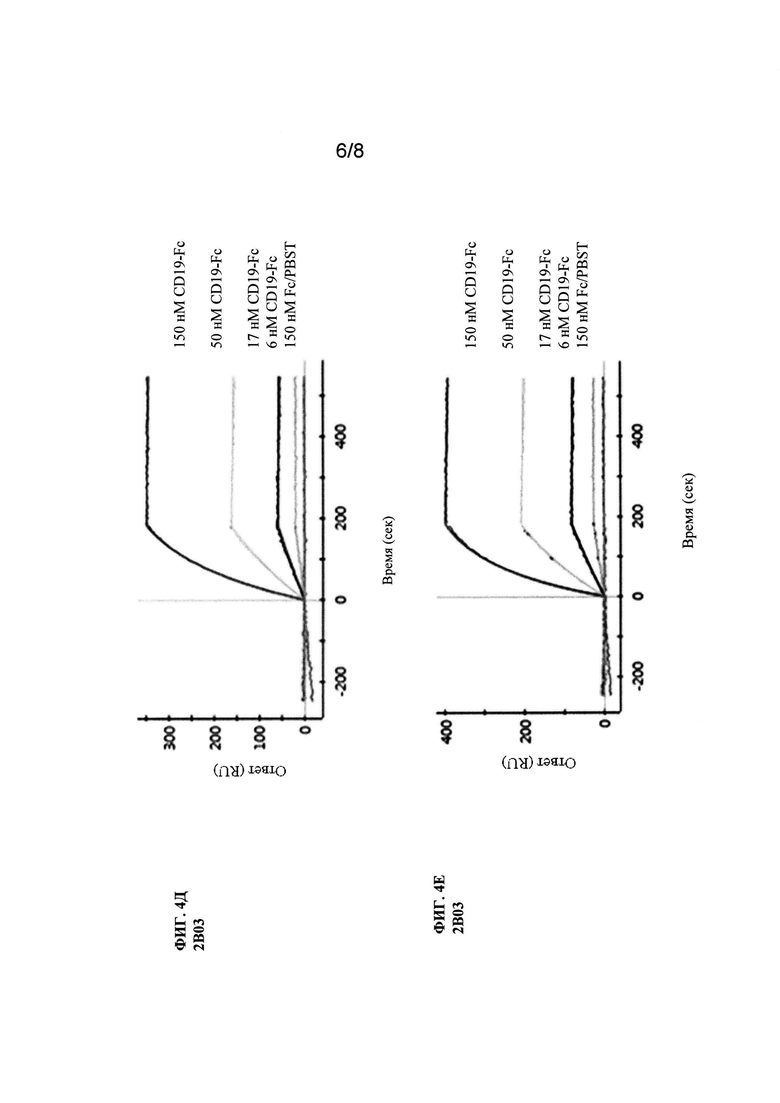
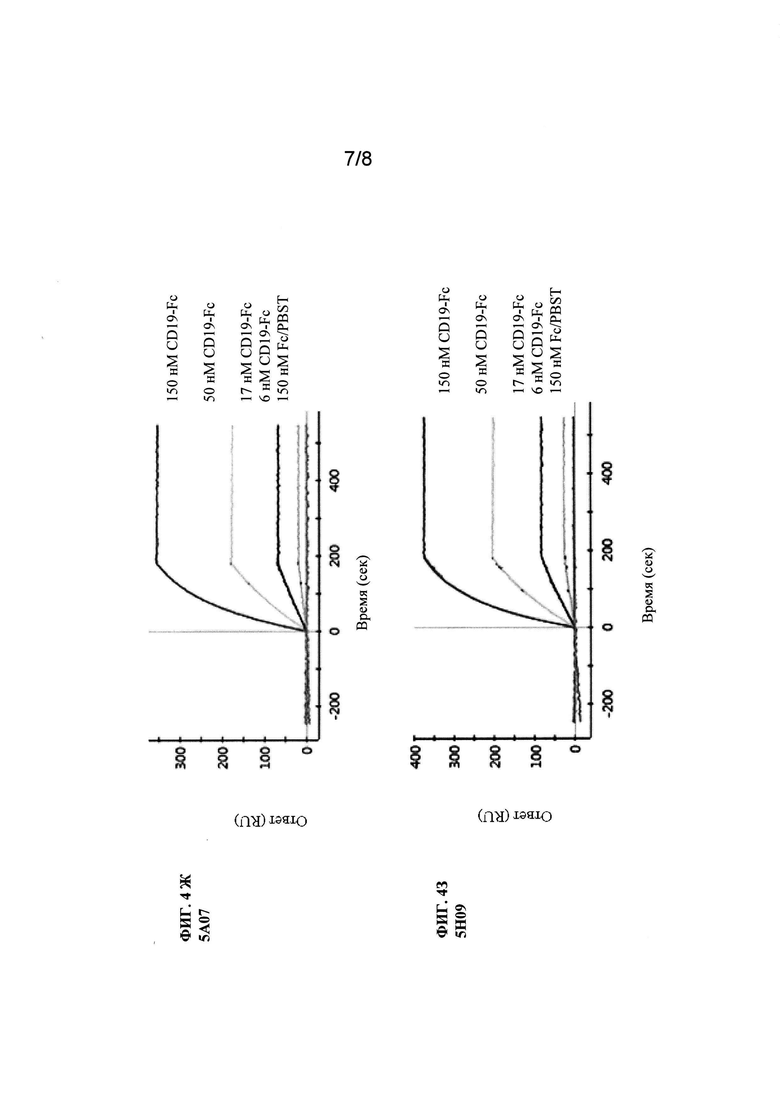

Изобретение относится к биотехнологии и представляет собой антитела против CD19 человека (anti-human CD19), способы их получения, фармацевтические композиции, содержащие указанные антитела, и способы их применения. Изобретение позволяет расширить ассортимент антител против CD19 человека. 9 н. и 8 з.п. ф-лы, 5 ил., 16 табл., 5 пр.
1. Антитело, которое специфически связывается с CD19 человека, включающее области
(а) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 43,
(б) CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 44,
(в) CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 45,
(г) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 46,
(д) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 47, и
(е) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 48.
2. Антитело по п. 1, где антитело специфически связывается с CD19 человека с более высокой аффинностью по сравнению с антителом, включающим вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 113, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 114.
3. Антитело по п. 1 или 2, где антитело является моноклональным антителом.
4. Антитело по любому из пп. 1-3, где антитело является антителом человека, гуманизированным или химерным.
5. Антитело по любому из пп. 1-4, где антитело является фрагментом антитела, который специфически связывается с CD 19 человека.
6. Антитело по любому из пп. 1-5, где антитело включает домен VH, содержащий аминокислотную последовательность SEQ ID NO:99, и домен VL, содержащий аминокислотную последовательность SEQ ID NO:100.
7. Антитело по любому из пп. 1-6, где антитело является антителом IgG1 полной длины.
8. Антитело по любому из пп. 1-7, где антитело является антителом IgG1 полной длины с мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Kabat).
9. Антитело по любому из пп. 1-8, где антитело обладает перекрестной реакционной способностью в отношении CD19 человека и макака крабоеда.
10. Полинуклеотид, кодирующий антитело по любому из пп. 1-9.
11. Вектор экспрессии, включающий полинуклеотид по п. 10.
12. Клетка-хозяин для получения антитела по одному из пп. 1-9, содержащая полинуклеотид по п. 10 или вектор по п. 11.
13. Способ получения антитела по любому из пп. 1-9, включающий стадии (i) трансформации клетки-хозяина векторами, содержащими полинуклеотиды, кодирующие указанное антитело, (ii) культивирования клеток-хозяев в условиях, пригодных для экспрессии антитела, и (iii) выделение антитела из культуры.
14. Фармацевтическая композиция для лечения заболевания, пригодного для лечения антителами против CD19, содержащая антитело по любому из пп. 1-9 и фармацевтически приемлемый носитель.
15. Применение антитела по любому из пп. 1-9 в лечении В-клеточного рака.
16. Применение антитела по любому из пп. 1-9 для истощения В-клеток.
17. Применение антитела по любому из пп. 1-9 в лечении аутоиммунных заболеваний, ревматоидного артрита, волчанки, псориаза или болезни костей.
| WO 2008022152 A2, 21.02.2008 | |||
| KR 101335798 B1, 02.12.2013 | |||
| CN 101233156 B, 27.06.2012 | |||
| WO 2003048209 А1, 12.06.2003 | |||
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО, СВЯЗАННОГО С ТРАНСПЛАНТАЦИЕЙ И АУТОИММУННОГО ЗАБОЛЕВАНИЯ | 2007 |
|
RU2495882C2 |
Авторы
Даты
2021-12-03—Публикация
2016-09-28—Подача