Изобретение относится к области органической химии, в частности к способу получения 5- и 6-нитро-1-(4-нитрофенил)-1,3,3-триметилинданов или динитрофенилинданов.
Динитрофенилинданы используются в качестве исходных соединений при синтезе 5- и 6-амино-1-(4-аминофенил)-1,3,3-триметилинданов, которые служат мономерами для получения полиимидных материалов, применяемых в газоразделительных мембранах [1. Isaac V. Farr. Synthesis and characterization of novel polyimide gas separation membrane material systems. Blacksburg, Virginia, July 26, 1999].
В основе промышленных способов получения нитроароматических соединений лежит реакция жидкофазного нитрования аренов и их производных смесью концентрированных HNO3 и H2SO4. Нитрующая смесь, используемая в промышленных процессах нитрования, содержит около 30% HNO3, 60% H2SO4 и 10% H2O [2. Горелик М.В., Эфрос Л.С. Основы химии и технологии ароматических соединений. М.: Химия, 1992. 640 с.].
Процесс проводят до тех пор, пока концентрация H2SO4 не снизится до предельной величины, после чего процесс останавливают, поскольку при большем разбавлении серной кислоты процесс идет менее эффективно.
Обязательной стадией жидкофазного нитрования нитрующей смесью является регенерация отработанной H2SO4. Для регенерации отработанной H2SO4, которая, кроме воды, содержит также соединения азота и органические вещества, требуется специальная аппаратура и большой расход энергии. Кроме того, образование больших объемов сточных вод, содержащих разбавленную H2SO4, а также растворенные оксиды азота и фенольные примеси, создает серьезную угрозу для окружающей среды. Необходимость регенерации H2SO4 и утилизации больших количеств сернокислотных отходов является основным недостатком жидкофазного нитрования [3. Sheldon R.A., Downing R.S. // Appl. Catal., A: General, 1999, v.189, p.163-183].
Все это стимулирует поиск альтернативных способов нитрования, которые позволили бы резко сократить или даже полностью исключить использование в процессах нитрования H2SO4. Одним из решений данной проблемы является нитрование на гетерогенных катализаторах.
В литературе широко описаны способы газо- и жидкофазного нитрования бензола, толуола, ксилолов и нафталина на гетерогенных катализаторах.
Данный метод имеет несомненные преимущества, т.к. не требует применения серной кислоты, и, следовательно, исключает необходимость ее регенерации для последующего возвращения в процесс. В литературных источниках [4-21] катализаторы, применяемые в процессе нитрования бензола и толуола, представлены весьма широко. Если исходить из природы каталитического действия, особенностей состава и строения, то все катализаторы, предлагаемые для процессов нитрования ароматических углеводородов, можно условно разделить на три группы.
В первую группу входят катализаторы, представляющие собой различные твердые носители, пропитанные неорганическими кислотами. Данный тип катализаторов можно рассматривать как модификацию жидкофазного процесса, направленную на уменьшение количества H2SO4 за счет нанесения ее на твердый носитель. Подобные каталитические системы подробно описаны в [4. US Patent 5030776, 1991.; 5. Smith А.С., Narvaez L.D., Akins B.G. e. a. Synth. Commun., v.29, №23, p.4187-4192].
Для нитрования бензола предлагается [6. US Patent 3928476, 1975] использовать Al2O3 и некоторые алюмосиликаты с нанесенными на них H2SO4 или H3PO4. Подобные каталитические системы описаны также в [7. Kogelbauer A., Vassena D., Prince R., Armor J.N. // Catal. Today, v.55, p.151-160; 8. Riego J.M., Sedin Z., Zaldivar J.M. e. a. // Tetrahedron Lett., 1996, v.37, №4, p.513-516].
Носитель пропитывают H2SO4 с последующим вакуумированием и сушкой при 130°C. В готовом катализаторе содержится до 70% H2SO4. Нитрование ведут при 25°C в растворе CH2Cl2, нитрующим агентом служит 70-90%-ная HNO3. В выбранных условиях бензол и толуол превращаются в соответствующие нитросоединения с выходом 98-100%; столь высокие выходы продуктов достигаются не более, чем за 1 ч. Процесс высокоселективен
Известен вариант нитрования толуола HNO3 в паровой фазе при 80-180°C и пониженном давлении [9. US Patent 4112006, 1978]. Здесь в качестве катализаторов выступают SiO2 или Al2O3, пропитанные H2SO4 или H3PO4 и содержащие также добавки солей этих кислот. Выход нитротолуола составляет 76,6%, причем отношение паро-нитротолуол:орто-нитротолуол достигает 1,84. Скорость нитрования замещенных аренов (толуол, ксилолы) удается повысить путем введения в систему небольшого количества безводного CaSO4 или CaO.
Для парофазного нитрования бензола диоксидом азота используют силикагель, пропитанный бензолсульфоновой кислотой (170°C, выход нитробензола составляет 15-11%) [10. Jap. Patent 1-213256, 1989].
Однако данные катализаторы пока недостаточно пригодны для крупномасштабного применения. Одной из причин является низкая стабильность используемых каталитических систем, которую авторы объясняет вымыванием серной кислоты с поверхности носителя, вследствие чего даже лучшие катализаторы теряют активность в процессе работы.
Ко второй группе относятся катализаторы, основу которых составляют различные оксидные системы. Многие из этих контактов содержат оксиды переходных металлов IV-VI групп периодической системы.
В качестве катализатора парофазного нитрования ароматических углеводородов диоксидом азота (150-225°C) в патенте [11. US Patent 4347389, 1982] предлагается использовать оксидную фосфорнованадиевую систему. Атомное соотношение фосфора и ванадия в катализаторе варьируется в достаточно широких пределах, от 1:2 до 2:1. При нитровании толуола на этом катализаторе удается получить отношение пара-нитротолуол : отро-нитротолуол = 1:2.
В работе [12. Sato Н., Hirose К., Nagai К. е. a. // Appl. Catal., A: Chemical, v. 175, p.201-207. 13. Sato H., Hirose К. // Appl. Catal., A: Chemical, 1998, v. 174, p.77-81. 14. US Patent 4551568, 1985. 15. US Patent 5004846, 1991] в качестве катализаторов парофазного нитрования бензола азотной кислотой была протестирована серия бинарных систем: TiO2-WO3, TiO2-MO3, TiO2-ZnO, TiO2-ZrO2, TiO2-Al2O3, TiO2-SnO2, ZrO-WO3. Из всех катализаторов наибольшую активность показали контакты, в которых основными составляющими являются оксиды TO2 или ZrO2, в частности такие, как TiO2-WO3, ZrO2-WO3, TiO2-MoO3, TO2-ZnO. На них удалось получить конверсию HNO3 64,3-82,7% (при 160°C), тогда как на катализаторах TO2-ZrO2, TO2-Al2O3, TO2-SnO2 конверсия HNO3 не превышала 51%. Различие в активности катализаторов авторы связывают с различием в их кислотности.
В работе [16. Sato Н., Nagai К, Yoshioka., Nagaoka // Appl. Catal., A: Chemical, 1998, v.175, p.209-213] показано, что высокой активностью в парофазном нитровании бензола азотной кислотой (67%-ной) обладают сульфатированные оксиды металлов. Их готовили, обрабатывая соответствующие оксиды серной кислотой с последующим прокаливанием при 500°C. Полученные таким образом катализаторы 

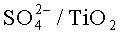

Общим недостатком смешанных оксидов переходных металлов является высокая стоимость и сложность приготовления, а также сложность регулирования пористой структуры.
Третью группу составляют катализаторы на основе различных цеолитов и алюмосиликатов, природных и синтетических [17. US Patent 4754083, 1988]. В этом случае речь чаще всего идет о газофазном нитровании аренов, где в качестве нитрующих веществ выступают оксиды азота, в частности NO2. Более того, такие цеолиты как H-морденит, H-Y, H-ZSM-5 и H-эрионит, были исследованы даже в газофазном нитровании нитробензола. Правда, они показали сравнительно низкую активность и невысокую стабильность, а продолжительность их непрерывной работы измерялась несколькими часами.
Высокоэффективные катализаторы для парофазного нитрования бензола разбавленной HNO3 получаются из модифицированных цеолитов Y [18. Bertea L.E., Kouwenhoven H.W., Prins R. // Studies in Surface Science and Catalysis., 1993, v.78, p.607-614] и морденита [19. Bertea L.E., Kouwenhoven H.W., Prins R. // Appl. Catal., A: Chemical, 1995, v.129, p.229-250]. Последний позволяет получать нитробензол при 170°C с выходом до 80-85% и производительностью 0,6 г/г·ч при стабильной работе в течение 120 ч.
Наиболее активным и стабильным в парофазном нитровании бензола оказался катализатор на основе природного цеолита клиноптилолита [20. Bertea L.E., Kouwenhoven H.W., Prins R. // Stud. Surf. Sci. Catal., 1994, v.84, p.1973-1980]. На нем производительность по нитробензолу составила 0,65 г/г·ч.
Японские исследователи [21. Sato Н., Hirose K., Nagai K. е.a. // Appl. Catal., A: Chemical, 1998, v.175, p.201-207.; 22. EP 0343048 A1, B1, 1993.; 23. Sato H., Hirose K. // Appl. Catal., A: Chemical, 1998, v.174, p.77-81] изучили парофазное нитрование бензола разбавленной HNO3 на катализаторах, полученных из монтмориллонита. Оказалось, что каталитическая активность исходного Н-монтмориллонита сравнительно мала, но после ионного обмена Н-монтмориллонита с многовалентными катионами металлов (группы IIA-IIIA и IB-IVB периодической таблицы) его активность резко повышалась, при этом увеличивалась и кислотность монтмориллонита. Степень повышения нитрующей активности катализатора зависит от типа вводимого в него катиона. Наибольшая конверсия HNO3 (93,4%) достигается на А1-монтмориллоните (160°C): селективность по нитробензолу составляет 97,8%, а производительность катализатора равна 3,65 г/г·ч.
Существенным недостатком для цеолитов и модифицированных глин является наличие микропористости, что делает невозможным их применение для каталитических превращений объемных молекул с диаметром d≥0.1 нм.
Синтез 5- и 6-нитро-1-(4-нитрофенил)-1,3,3-триметилинданов в присутствии гетерогенных катализаторов, в том числе цеолитов и аморфных алюмосиликатов, в литературе не описан.
Известные способы получения 5- и 6-нитро-1-(4-нитрофенил)-1,3,3-триметилинданов [24. US Patent 1470705, 1974; 25. US Patent 3856752, 1974; 26. US Patent 3983092, 1976; 27. US Patent 1492511, 1976] предусматривают проведение жидкофазного нитрования 1,1,3-триметил-3-фенилиндана (фенилиндан) нитрующей смесью. Как указано в патенте [26.US Patent 3983092, 1976], нитрующая смесь содержит около 25% HNO3 и 75% H2SO4, при этом мольное отношение фенилиндан : HNO3 составляет 1:8. Процесс проводят при 5°C в течение 4 ч. Выход динитрофенилинданов составляет ~70%. В ходе реакции азотная кислота полностью или частично расходуется, а образующаяся вода должна быть тем или иным способом отделена от серной кислоты, служащей катализатором и средой, с целью ее возвращения в процесс нитрования. Возникающий таким образом «кислотооборот» обусловливает существенные аппаратурно-технологические, экономические и экологические недостатки жидкофазного способа нитрования фенилиндана.
Задачей настоящего изобретения является разработка более эффективного способа получения динитрофенилинданов, основанного на использовании гетерогенного катализатора, который позволяет отказаться от применения серной кислоты и избежать значительной части недостатков процесса нитрования.
Решение указанной задачи достигается тем, что способ получения 5- и 6-нитро-1-(4-нитрофенил)-1,3,3-триметилинданов осуществляют, согласно изобретению, нитрованием 1,1,3-триметил-3-фенилиндана в присутствии аморфного мезопористого алюмосиликата при 100-130°C при мольном соотношении фенилиндан : HNO3 = 1:6÷14, в течение 8 ч, в присутствии 2-4 мас.% (в расчете на реакционную смесь) катализатора.
Сравнительный анализ заявляемого решения с прототипом показывает, что заявляемый способ отличается от прототипа тем, что в процессе синтеза динитрофенилинданов вместо серной кислоты используют гетерогенный катализатор, представляющий собой мезопористый алюмосиликат. Процесс осуществляют при 100-130°C, при мольном соотношении фенилиндан : HNO3 = 1:6÷14, в течение 8 ч, в присутствии 2-4 мас.% (в расчете на реакционную смесь) катализатора. Конверсия фенилиндана достигает 100%, выход динитрофенилинданов - 50-95%. После окончания реакции катализатор отделяют фильтрацией. Его можно использовать многократно.
Реакцию можно проводить как в растворителях (дихлорбензол, алканы), так и без них.
Реакция проходит по схеме:

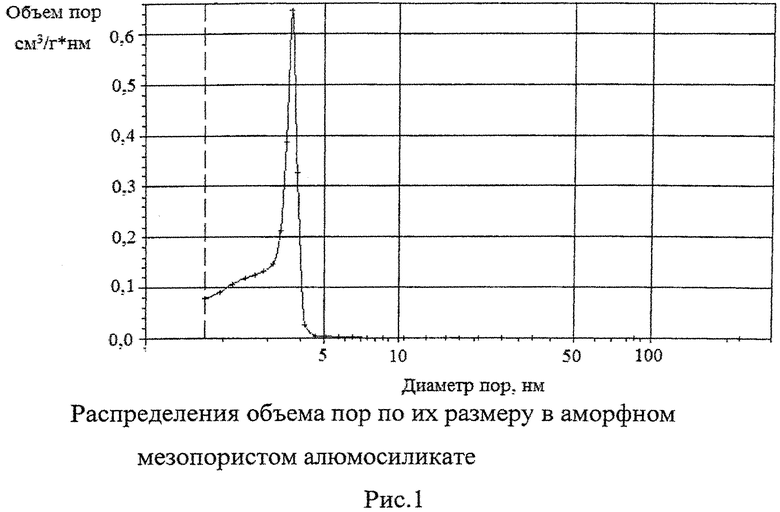
Мезопористый алюмосиликат, использованный в изобретении - это аморфный алюмосиликатный материал с развитой пористой структурой. Мезопористый алюмосиликат синтезировали смешением олигомерных эфиров ортокремниевой кислоты с водно-спиртовым раствором Al(NO3)·9H2O при 20-25°C в течение 25-30 мин с последующим нагреванием до 60°C при перемешивании. Полученный гель обрабатывали аммиачным раствором, сушили в атмосфере воздуха при 150°C в течение 8 ч, затем прокаливали в муфельной печи при 650°C в течение 5 ч. Прокаленный аморфный мезопористый алюмосиликат размалывали до порошка с фракционным составом <100 мкм. Пористая структура аморфного алюмосиликата характеризуется наличием мезопор, имеющих широкое распределение объема пор размеру (в интервале 2-5 нм, рис.1). Удельная поверхность мезопористого алюмосиликата по БЭТ составляет 550 м2/г, удельный объем пор 0,9 см3/г. Мольное соотношение SiO2/Al2O3 равно 20. Суммарная кислотность, измеренная методом термопрограммированной десорбции аммиака, составляет 550 мкмоль/г.
Предлагаемый способ осуществляют следующим образом.
Нитрование фенилиндана проводят в периодическом изотермическом реакторе при температуре 100-130°C, атмосферном давлении, в присутствии 2-4 мас.% (в расчете на реакционную смесь) катализатора. Мольное отношение фенилиндан : азотная кислота составляет 1:6÷14. Для экспериментов используют 67%-ную азотную кислоту, чистота фенилиндана составляет 99,8%, в качестве растворителя используют дихлорбензол. Начальная концентрация фенилиндана в реакционной массе составляет 0,44 моль/л. По окончании синтеза реакционную массу отфильтровывают от катализатора и отмывают от избытка азотной кислоты. Непрореагировавший фенилиндан и мононитрофенилинданы выделяют из реакционной массы перегонкой при пониженном давлении. Остаток - динитрофенилинданы перекристаллизовывают из CCl4.
Количественный анализ реакционной массы осуществляют методом газожидкостной хроматографии на приборе HRGS 5300 Mega Series "Carlo Erba" с пламенно-ионизационным детектором; условия анализа: стеклянная капиллярная колонка 25 м, фаза SE-30, программирование температуры 50-280°C (8°C/мин), температура детектора 250°C, температура испарителя 300°C, газ-носитель-гелий - 30 мл/мин.
Идентификацию продуктов осуществляют методом ЯМР и масс-спектрометрией высокого разрешения.
ЯМР спектры регистрировали на спектрометре «Bruker AVANCE-400» с рабочими частотами 400,13 (1H) и 100,62 МГц (13C) в CDCl3.
Масс-спектры высокого разрешения получали на приборе фирмы «Fisons» Trio 1000 с капиллярной колонкой DB-5; программирование температуры от: 50 до 320°С со скоростью 4°C/мин; 70 eV.
Предлагаемый способ иллюстрируется следующими примерами.
ПРИМЕР 1. В стеклянный обогреваемый реактор с мешалкой, обратным холодильником и термометром загружают 0.5 г фенилиндана (2.1 ммоль), растворенного в 3.5 мл дихлорбензола, 0.85 мл (12,71 ммоль) 67%-ной азотной кислоты, 0.16 г катализатора (аморфный мезопористый алюмосиликат). Реакцию проводят при постоянном перемешивании при температуре 110°C в течение 8 ч. Реакционную массу отфильтровывают от катализатора, непрореагировавший фенилиндан и мононитрофенилинданы выделяют перегонкой в вакууме. Динитрофенилинданы выделяют перекристаллизацией из CCl4. Получают 0.47 г продукта. Конверсия фенилиндана составляет 100 мол.%, селективность по 5(6)-нитро-1-(4-нитрофенила)-1,3,3-триметилиндану - 66 мол.%.
ПРИМЕРЫ 2-10. Аналогично примеру 1. Условия и результаты примеров представлены в таблице.

Время реакции 8 ч.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 5(6)-НИТРО-1-(4-НИТРОФЕНИЛ)-1,3,3-ТРИМЕТИЛИНДАНОВ | 2014 |
|
RU2551672C1 |
| СПОСОБ НИТРОВАНИЯ БЕНЗОЛА НА ЦЕОЛИТНЫХ КАТАЛИЗАТОРАХ | 1995 |
|
RU2095342C1 |
| СПОСОБ НИТРОВАНИЯ БЕНЗОЛА | 1994 |
|
RU2087463C1 |
| СПОСОБ КАТАЛИТИЧЕСКОГО ЖИДКОФАЗНОГО НИТРОВАНИЯ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2002 |
|
RU2226187C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ТИТАН-СИЛИКАТНОГО КАТАЛИЗАТОРА И СПОСОБ ЖИДКОФАЗНОГО ОКИСЛЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | 2003 |
|
RU2229930C1 |
| СПОСОБ КАТАЛИТИЧЕСКОГО НИТРОВАНИЯ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ АЗОТНОЙ КИСЛОТОЙ | 2010 |
|
RU2473536C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОНОНИТРОТОЛУОЛА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ П-ИЗОМЕРА | 2007 |
|
RU2346930C1 |
| СПОСОБ ПОЛУЧЕНИЯ НИТРОБЕНЗОЛА | 2010 |
|
RU2451008C2 |
| СПОСОБ НЕПРЕРЫВНОГО ПОЛУЧЕНИЯ НИТРОБЕНЗОЛА | 2008 |
|
RU2496767C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕНОЛА И АЦЕТОНА ИЗ ГИДРОПЕРЕКИСИ КУМОЛА | 2007 |
|
RU2335487C1 |
Изобретение относится к области органической химии, конкретно к способу получения 5- и 6-нитро-1-(4-нитрофенил)-1,3,3-триметилинданов взаимодействием 1,1,3-триметил-3-фенилиндана с азотной кислотой. Согласно предлагаемому способу нитрование 1,1,3-триметил-3-фенилиндана проводят в присутствии катализатора - аморфного мезопористого алюмосиликата. Реакцию осуществляют при 100-130°C при мольном соотношении фенилиндан:HNO3=1:6÷14 в течение 8 ч в присутствии 2-4 мас.% (в расчете на реакционную смесь) катализатора. Данный способ позволяет отказаться от применения серной кислоты при нитровании, а также упростить и удешевить процесс. 1 ил., 1 табл., 10 пр.
Способ получения 5- и 6-нитро-1-(4-нитрофенил)-1,3,3-триметилинданов взаимодействием 1,1,3-триметил-3-фенилиндана с азотной кислотой, отличающийся тем, что нитрование 1,1,3-триметил-3-фенилиндана проводят в присутствии катализатора - аморфного мезопористого алюмосиликата - при 100-130°C при мольном соотношении фенилиндан:HNO3=1:6÷14 в течение 8 ч в присутствии 2-4 мас.% (в расчете на реакционную смесь) катализатора.
| C.T | |||
| VIJAYAKUMAR et al., Synthesis and Polymerization of Bismaleimide Derived from 5(6)-amino-1(4'-aminophenyl)-1,3,3'-trimethyl indane, POLYMER-PLASTICS TECHNOLOGY AND ENGINEERING, 2009, 48(2), 141-151 | |||
| US 3983092, 28.09.1976 | |||
| СПОСОБ КАТАЛИТИЧЕСКОГО ЖИДКОФАЗНОГО НИТРОВАНИЯ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2002 |
|
RU2226187C1 |
Авторы
Даты
2015-08-10—Публикация
2014-01-09—Подача