Область техники, к которой относится изобретение
Настоящее изобретение, в общем, касается новых рекомбинантных полипептидов, обладающих свойствами цитокинов птиц, и кодирующих их генетические последовательности. В частности, настоящее изобретение касается рекомбинантных полипептидов интерферона III типа птиц и кодирующих их генетических последовательностей, вместе с клеточными системами для их экспрессии и применения. Более конкретно, настоящее изобретение касается λ-интерферона (IFN-λ) птиц и его функциональных производных, гомологов и фрагментов, а также способов их применения. Молекулы и клетки настоящего изобретения полезны в широком круге применений, в том числе в обеспечении средства для лечения и профилактики заболеваний, в частности заболеваний птиц, или в качестве модулятора иммунитета. Также предусмотрены диагностические средства для скрининга иммунного ответа и средства скрининга для идентификации модуляторов функциональности белка или нуклеиновой кислоты IFN-λ.
Уровень техники
Библиографические детали публикаций, ссылки на которые приводятся по авторам в настоящем описании, собраны в алфавитном порядке в конце описания.
Ссылка в настоящем описании на любую предшествующую публикацию (либо полученную из нее информацию) или на то, что уже известно, не является и не должна восприниматься как признание или подтверждение или иное предположение того, что предшествующая публикация (либо полученная из нее информация) или известный факт составляет часть общеизвестных сведений в той области техники, к которой относится настоящее описание.
Все возрастающее совершенствование технологии рекомбинантной ДНК сильно облегчает исследования в области медицины и ветеринарии. Особое значение имеет исследование цитокинов, в особенности потому, что эти молекулы регулируют пролиферацию, дифференцировку и функционирование широкого круга клеток, как-то клеток, участвующих в реализации иммунитета. Введение рекомбинантных цитокинов или регулирование функции и/или синтеза цитокинов все больше становится темой медицинских исследований при лечении ряда заболеваний у человека и животных.
Интерфероны (IFNs) составляют группу цитокинов, вызывающих разнообразные клеточные эффекты у позвоночных путем регулирования сотен генов, известных как IFN-стимулируемые гены (ISG). Интерфероны проявляют множественные функции, включая модулирование клеточного цикла роста и запуск и регуляцию воспалительных реакций, которые в большой степени определяют общий иммунный ответ. Одним из наиболее признанных свойств IFNs является их способность вызывать устойчивость клеток к вирусам (Hwang et al., 1995, PNAS).
Интерфероны позвоночных состоят из трех типов, которые классифицируют по их молекулярной структуре, специфичности к рецепторам и тем путям, которые они индуцируют (Smith et al., 2005; Theophilopoulos et al., 2005).
Интерфероны I типа включают IFN-α, у которого есть множественные представители в геномах позвоночных (Meager, 2002), и IFN-β, который обычно представлен одним единственным геном (Schultz et al., 2004). Интерфероны I типа активируются при появлении многих вирусов (Jacobs and Langland 1996; Majde 2000), а после активации взаимодействуют со своим рецептором - рецептором IFN-α/β (IFNα/βR) и индуцируют одну подгруппу ISG, что вызывает IFN-специфичную антивирусную защиту (de Veer et al., 2001; Takaoka and Yanai 2006). Терапевтическое применение IFN I типа оказалось успешным при защите млекопитающих от вирусов, включая вирусы гриппа (Beilharz et al., 2007; Koemer et al., 2007), гепатита С (Marcello et al., 2006) и несколько других вирусов (Kotenko et al., 2003; Sheppard et al., 2003; Meager et al., 2005).
Интерфероны II типа состоят из единственного представителя - IFN-y (Schroder et al., 2004). IFN-γ активирует антивирусную активность и клеточный иммунитет через рецептор IFN-γ (IFNγR) (Kamijo et al., 1994; Schroder et al., 2004). Этот IFN также проявляет антивирусную активность, включая защиту от вируса ящура (PMD) (Moraes et al., 2007), вируса полиомы (Abend et al., 2007) и других вирусов (Chesler et al., 2003), а также он применялся как лечебное средство против ряда патогенов (Schroder et al., 2004).
Недавно у млекопитающих было описано третье семейство IFN - Интерфероны III типа, из которых сейчас известно три подтипа, а именно IFN-λ1 (также известен как IL29), IFN-λ2 (также известен как IL28A) и IFN-λ3 (также известен как IL28B) (Sheppard et al., 2003). Представители IFN-λ у млекопитающих взаимодействуют с особым рецепторным комплексом, состоящим из рецептора-1 IFN-λ (IFNλR1) и β-рецептора IL10 (IL10Rβ) (Donnely et al., 2004). Эти субъединичные рецепторы подвергаются димеризации при связывании лиганда, вызывая фосфорилирование передатчика сигналов и активатора факторов трансрипции (STAT) (Kotenko et al., 2003; Donnely et al., 2004), что приводит к активации специфичного к IFN-λ набора генов (Ank et al., 2006; Marcello et al., 2006). Несмотря на его IL10-подобный сигнальный комплекс (Sheppard et al., 2003; Donnely et al., 2004), IFN-λ млекопитающих проявляет антивирусные свойства, близкие к IFN I типа (Meager et al., 2005). Поэтому возможно, что IFN-λ, индуцирует подгруппу близких к IFN I типа генов через альтернативный рецепторный комплекс (Marcello et al., 2006).
Некоторые исследования IFN-λ человека (huIFN-λ) показали, что IFN-λ способен ингибировать вирусы. Так, было показано, что huIFN-λII ингибирует вирус гепатита С в культуре клеток млекопитающих (Robek et al., 2005; Marcello et al., 2006). Эта защита была сравнима с IFN I типа, но каждый IFN индуцировал отдельную подгруппу генов (Marcello et al., 2006). Таким образом, защита от вирусов может запускаться из различных наборов стимулируемых генов (Rio et al., 1998; Stohr and Esveld, 2004; Meager et al., 2005; Annibali et al., 2007). Кроме того, сравнение антивирусных свойств IFN-λ и IFN I типа показало, что оба типа IFN способны ингибировать EMCV. Однако эти эффекты сильно отличались по величине (Meager et al., 2005). Аналогичные результаты наблюдались в исследованиях на VSV (Kotenko et al., 2003). Это означает, что реагирующий на IFN-λ путь может быть нужен для специфической функциональной роли при некоторых вирусных инфекциях.
Недавно высказывалась большая озабоченность по поводу вирусов домашних птиц при наблюдавшихся вспышках птичьего гриппа, которые могут быстро распространяться и вызывать большую смертность, как у домашних птиц, так и у людей (Stohr and Esveld, 2004). Трудная задача укрощения вызывающих проблемы вирусов у домашних птиц в сочетании с тем, что при терапии с помощью IFN I типа и II типа могут наблюдаться иммунотоксические эффекты (Kotenko et al., 2003; Stohr and Esveld, 2004; Meager et al., 2005), требует проведения исследований для новых и альтернативных антивирусных стратегий. Соответственно, существует потребность в улучшении контроля за вирусами домашних птиц, что могло бы оказать пользу птицеводству, а также уменьшить риск переноса этих вирусов на человека (Chen et al., 2007). Более того, в свете большого значения птицеводства для экономики и поставок продуктов по всему миру решающее значение имеет разработка новых средств регулирования и улучшения иммуномодуляции.
В работе, приведшей к настоящему изобретению, был выделен и просеквенирован IFN-λ курицы (в дальнейшем именуется "chIFNλ"). Были получены и экспрессированы в трансформированных клетках рекомбинантные генетические конструкции, включающие выделенную молекулу нуклеиновой кислоты по настоящему изобретению, тем самым, позволяя выделение и секвенирование chIFNλ. Эти результаты теперь дают возможность альтернативной терапии с помощью IFN.
Раскрытие изобретения
По всему описанию и последующей формуле изобретения, если по контексту не требуется иначе, подразумевается, что слово "включать" или такие варианты, как "включает" или "включающий", означает включение указанного элемента или числа либо группы элементов или чисел, но не исключение какого-либо иного элемента или числа либо группы элементов или чисел.
По всему описанию и последующей формуле изобретения, если по контексту не требуется иначе, подразумевается, что слово "включать" и такие варианты, как "включает" и "включающий", означает включение указанного числа или стадии либо группы чисел или стадий, но не исключение какого-либо иного числа или стадии либо группы чисел или стадий.
В настоящем изобретении термин "происходит из" служит для обозначения того, что определенное число или группа чисел происходит из указанного вида, но необязательно была получена непосредственно из указанного источника. Более того, в настоящем изобретении формы единственного числа охватывают и множественное число, если по контексту явно не требуется иное.
Если не указано иначе, все технические и научные термины, используемые в настоящем изобретении, имеют такое же значение, как это обычно понимается рядовыми специалистами в той области, к которой относится изобретение.
Настоящая заявка содержит информацию об аминокислотных и нуклеотидных последовательностях, полученную с помощью программы Patentin версии 3.1, которая приведена после библиографии. Каждая аминокислотная и нуклеотидная последовательность в перечне последовательностей идентифицирована с помощью цифрового идентификатора <210>, после которого идет идентификатор последовательности (напр., <210>1, <210>2 и т.д.). Для каждой последовательности указаны длина, тип последовательности (аминокислотная, ДНК и т.п.) и исходный организм с помощью информации, приведенной в полях цифровых идентификаторов <211>, <212> и <213>, соответственно. Приведенные в описании аминокислотные и нуклеотидные последовательности идентифицированы с помощью указателя SEQ ID NO:с последующим идентификатором последовательности (напр., SEQ ID NO:1, SEQ ID NO:2 и т.д.). Приведенный в описании идентификатор последовательности соотносится с информацией, представленной в поле цифрового идентификатора<400>в перечне последовательностей, после которого идет идентификатор последовательности (напр., <400>1, <400>2 и т.д.). Таким образом, приведенная в описании SEQ ID NO:1 соответствует последовательности, указанной как <400>1 в перечне последовательностей.
Однобуквенные и трехбуквенные сокращения, используемые по всему описанию, приведены в табл.1.
Один из аспектов настоящего изобретения касается молекулы нуклеиновой кислоты, которая кодирует или комплементарна молекуле нуклеиновой кислоты, кодирующей полипептид цитокина птиц либо его функциональный фрагмент или производное, причем данный полипептид представляет собой интерферон III типа.
В другом аспекте настоящего изобретения предусмотрена молекула нуклеиновой кислоты либо ее функциональный фрагмент или производное, которые кодируют или комплементарны молекуле нуклеиновой кислоты, кодирующей полипептид цитокина птиц либо его функциональный фрагмент или производное, причем данный полипептид представляет собой интерферон III типа, а вид птицы выбирается из списка, включающего кур, уток, гусей, индеек, бентамок, перепелов и цесарок.
В следующем аспекте данный полипептид интерферона III типа представляет собой полипептид IFN-λ курицы (chIFNλ) или слитую молекулу, включающую его самого либо его функциональный фрагмент, производное или птичий гомолог.
В следующем аспекте предусмотрена молекула нуклеиновой кислоты либо ее функциональный фрагмент или производное, которые кодируют или комплементарны молекуле нуклеиновой кислоты, кодирующей полипептид IFN-λ курицы либо его функциональный фрагмент или производное.
Следующий аспект настоящего изобретения касается выделенной нуклеиновой кислоты, выбранной из списка, состоящего из:
(i) выделенной молекулы нуклеиновой кислоты либо ее функционального фрагмента, производного или птичьего гомолога, включающих нуклеотидную последовательность, кодирующую или комплементарную последовательности, кодирующей аминокислотную последовательность, практически такую же, как приведенная в SEQ ID NO:2 или 4, либо ее функциональное производное, фрагмент или птичий гомолог, либо аминокислотную последовательность, по меньшей мере, на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или больше идентичную SEQ ID NO:2 или 4 по всей длине последовательности, либо последовательность нуклеиновой кислоты, способной гибридизироваться с данной молекулой нуклеиновой кислоты в условиях низкой строгости;
(ii) выделенной молекулы нуклеиновой кислоты либо ее функционального фрагмента, производного или птичьего гомолога, включающих нуклеотидную последовательность или комплементарную данной последовательности, причем данная нуклеотидная последовательность практически такая же, как приведенная в SEQ ID NO:1 или 3, либо нуклеотидную последовательность, по меньшей мере, на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или больше идентичную SEQ ID NO:1 или 3 по всей длине последовательности, либо нуклеотидную последовательность, способную гибридизироваться с SEQ ID NO:1 или 3 или с комплементарной ей в условиях низкой строгости;
(iii) выделенной молекулы нуклеиновой кислоты либо ее функционального фрагмента, производного или птичьего гомолога, включающих нуклеотидную последовательность, приведенную в SEQ ID NO:1 или 3.
В следующем аспекте настоящего изобретения предусмотрен полипептид интерферона III типа птиц либо его функциональный фрагмент или производное.
Следующий аспект настоящего изобретения касается выделенного белка, приведенного в SEQ ID NO:2 или 4 либо, по меньшей мере, на 60%, 65%, 75%, 80% или больше идентичного SEQ ID NO:2 или 4 по всей длине последовательности, либо его функционального производного, фрагмента или птичьего гомолога.
Следующий аспект настоящего изобретения касается выделенного белка, кодируемого нуклеотидной последовательностью, приведенной в SEQ ID NO:1 или 3, или последовательностью, комплементарной последовательности, способной гибридизироваться с SEQ ID NO:1 или 3 в условиях низкой строгости и кодирующей аминокислотную последовательность, приведенную в SEQ ID NO:2 или 4 либо, по меньшей мере, на 60%, 65%, 70%, 75%, 80% или больше идентичную SEQ ID NO:2 или 4 по всей длине последовательности.
В следующем аспекте изобретения предусмотрен способ получения рекомбинантных молекул интерферона III типа птиц в клетках, который включает экспрессирование в данных клетках молекулы нуклеиновой кислоты, кодирующей или комплементарной молекуле нуклеиновой кислоты, кодирующей данный интерферон III типа птиц.
В следующем аспекте изобретения предусмотрены выделенные клетки, которые экспрессируют эндогенный или рекомбинантный интерферон III типа птиц либо его функциональный фрагмент, производное или гомолог.
В связанном с этим аспекте настоящего изобретения предусмотрен способ получения рекомбинантного интерферона III типа птиц в клетках, который включает стадии:
(i) введения в данные клетки генетической конструкции, включающей молекулу нуклеиновой кислоты, кодирующей или комплементарной молекуле нуклеиновой кислоты, кодирующей данный интерферон III типа птиц, которая поставлена под контроль соответствующей последовательности промотора;
(ii) культивирования данных клеток в течение времени и в условиях, достаточных для экспрессирования данной молекулы нуклеиновой кислоты; и
(iii) выделения данного продукта экспрессии.
В следующем аспекте настоящего изобретения предусмотрен и способ получения слитой молекулы интерферона III типа птиц в клетках, который включает введение в данные клетки генетической конструкции, включающей молекулу нуклеиновой кислоты, кодирующей или комплементарной молекуле нуклеиновой кислоты, кодирующей полипептид интерферона III типа птиц либо его функциональный фрагмент, производное или птичий гомолог, причем данный полипептид представляет собой слитый полипептид между первым интерфероном III типа и вторым интерфероном III типа либо первым интерфероном III типа и вторым интерфероном I типа или II типа, выбранным из списка, включающего, среди прочего, IFN-α, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ.
В следующем аспекте настоящего изобретения предусмотрен и рекомбинантный слитый полипептид между первым интерфероном III типа и вторым интерфероном III типа либо первым интерфероном III типа и вторым интерфероном I типа или II типа, выбранным из списка, включающего, среди прочего, IFN-α, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ.
В следующем аспекте настоящего изобретения предусмотрена генетическая конструкция, включающая молекулу нуклеиновой кислоты, кодирующую или комплементарную молекуле нуклеиновой кислоты, кодирующей слитый полипептид интерферона III типа птиц либо его функциональный фрагмент или производное, причем данный полипептид представляет собой слитый полипептид между интерфероном III типа и вторым интерфероном III типа либо первым интерфероном III типа и вторым интерфероном I типа или II типа, выбранным из списка, включающего, среди прочего, IFN-α, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ.
В следующем аспекте настоящего изобретения предусмотрен способ идентификации генетической последовательности интерферона III типа птиц либо его функционального фрагмента или производного.
В следующем аспекте настоящего изобретения предусмотрен способ детектирования присутствия полипептида интерферона III типа птиц либо его функционального фрагмента, производного или гомолога.
В следующем аспекте настоящего изобретения предусмотрен способ лечения или профилактики птиц, который включает введение данным птицам эффективного количества полипептида интерферона III типа птиц либо его функционального фрагмента, производного или гомолога в течение времени и в условиях, достаточных для поддержания, стимуляции или усиления иммунореактивности данных птиц.
В следующем аспекте настоящего изобретения предусмотрен способ лечения или профилактики птиц, подвергавшихся воздействию или зараженных патогенным организмом, который включает введение данным птицам эффективного количества полипептида интерферона III типа птиц либо его функционального фрагмента, производного или гомолога.
Следующий аспект настоящего изобретения касается полипептида интерферона III типа птиц для применения при лечении или профилактике птиц.
Следующий аспект настоящего изобретения касается применения полипептида интерферона III типа птиц при производстве медикамента для модулирования иммунного ответа у птиц и/или для лечения или профилактики птиц.
В следующем аспекте настоящего изобретения предусмотрен адъювант, включающий молекулу цитокина птиц, причем данный цитокин представляет собой интерферон III типа либо слитую молекулу между молекулой интерферона III типа и второй молекулой цитокина, а также, необязательно, фармацевтически приемлемый носитель, наполнитель или разбавитель.
Следующий аспект настоящего изобретения касается ветеринарной фармацевтической композиции, включающей эффективное иммуномодулирующее количество интерферона III типа птиц либо слитой молекулы между интерфероном III типа птиц и вторым цитокином либо генетической последовательности, способной экспрессировать его же, а также один или несколько носителей и/или разбавителей, пригодных для ветеринарного применения.
Краткое описание фигур
На фиг.1 представлен анализ экспрессии транскриптов chIFN методом ОТ-ПЦР в спленоцитах курицы, обработанных поли(I:С) (50 мкг/мл) в течение 2 ч. ChIFN-α, -β или -γ подвергали амплификации с помощью IFN-специфичных праймеров для секвенирования и разгоняли в 1% агарозном геле. В качестве отрицательного контроля использовали воду. В качестве внутреннего контроля использовали экспрессию GAPDH.
На фиг.2 схематически представлено совмещение выведенных аминокислотных последовательностей chIFN-λ и IFN-λII из различных видов позвоночных, созданное с помощью программы ClustalW (BioManage). Предполагаемую последовательность белка chIFN-λ совмещали с hulFN-λII (номер доступа NM_172138), mIFN-XII (номер доступа AY869695) и IFN-λ рыб (номер доступа АВ093588). Идентичные аминокислотные остатки отмечены звездочкой (*), а консервативные и полуконсервативные остатки - значками (:) и (.), соответственно. Черточкой обозначены пробелы, введенные в последовательность для оптимизации совмещения. Были идентифицированы сигнальные пептиды, которые представлены в рамках, однако для IFN-λ. рыб не было предсказано сигнального пептида.
На фиг.3 схематически представлена нуклеотидная последовательность chIFN-λ, и ожидаемая трансляция аминокислот. Подвергали анализу последовательность ORF chIFN-λ и представили ожидаемую трансляцию аминокислот. Предполагаемый сигнальный пептид подчеркнут, а сайты сплайсинга интронов указаны стрелками.
На фиг.4 схематически представлено бескорневое филогенетическое древо, показывающее взаимные отношения аминокислотных последовательностей chIFN-λ, некоторых IFN-λ других позвоночных и отдельных других цитокинов курицы с использованием полной кодирующей последовательности. Номер доступа Genebank для каждого гена приведен в табл.4.
На фиг.5 представлен анализ экспрессированных в Е.coli рекомбинантных IFN методом SDS-PAGE. Экспрессированные в Е.coli рекомбинантные белки chIFN-α, chIFN-β и chIFN-λ очищали методом металлоаффинной хроматографии Ni-NTA после индукции с помощью IPTG. Затем эти рекомбинантные белки разгоняли в 12% SDS-PAGE и анализировали по окрашиванию Coomassie Brilliant Blue. Для сравнения включали маркеры широкого диапазона молекулярных весов (Markers).
На фиг.6 представлен график стимулируемой IFN курицы продукции нитрита. Макрофагоподобные клетки HD11 курицы культивировали в присутствии chIFN-λ и chIFN-β в течение 24 ч, а затем тестировали супернатант на наличие индуцированной продукции нитрита. Представлены средние значения из каждого опыта, проводившегося в трех повторах. Приведены результаты из 2 независимых опытов.
На фиг.7 представлен график, показывающий защиту от SFV в клетках СЕР после обработки IFN. Клетки CEF культивировали с различными chIFN в течение 18 ч, а затем инфицировали SFV. Затем измеряли цитолиз по окрашиванию нейтральным красным и измерению поглощения (OD540) через 24 ч после инфицирования. Представлены средние значения из каждого опыта, проводившегося в трех повторах. Приведены результаты из 2 независимых опытов.
На фиг.8 представлен график, показывающий снижение вируса гриппа в куриных макрофагах HD11 после предварительной обработки IFN. Клетки HD11 обрабатывали chIFN-α, chIFN-β, chIFN-λ, или только средой в течение 6 ч, а затем инфицировали гриппом (PR8). Через различные промежутки времени после инфицирования измеряли титр вируса методом НА. Представлены средние значения из каждого опыта, проводившегося в четырех повторах. Приведены результаты из 2 независимых опытов.
На фиг.9 представлен график, показывающий индуцирование поли(1:С) экспрессии мРНК IFN. Клетки мононуклеаров селезенки курицы культивировали в присутствии 30 мкг/мл поли(I:С) в течение 2 и 4 ч. После этого клетки собирали и измеряли уровень мРНК chIFN-α, chIFN-β и chIFN-λ методом кОТ-ПЦР. Данные представляют экспрессию различных IFN относительно нестимулированных контролей. Представлены средние значения, а планки погрешностей означают SE. Опыты проводились в трех повторах, приведены результаты из 2 независимых опытов.
На фиг.10 представлен график, показывающий индуцирование IFN экспрессии мРНК TLR3. Клетки мононуклеаров селезенки курицы культивировали в присутствии chIFN-α, chIFN-β и chIFN-λ в различных концентрациях в течение 3 ч, а затем измеряли уровень мРНК TLR3 методом кОТ-ПЦР. В качестве "бытового" гена для стандартизации результатов использовали GAPDH. Представлена экспрессия относительно нестимулированных контролей. Представлены средние значения, а планки погрешностей означают SE. Опыты проводились в трех повторах, приведены результаты из 2 независимых опытов.
На фиг.11 представлен график, показывающий, что IFN-λ индуцируется при заражении H5N1 (птичьим гриппом). Цитокин IFN-λ измеряли методом кОТ-ПЦР в легких, селезенке и мозге курицы до и после инфицирования H5N1 (V1203). Данные представляют изменения по сравнению с неинфицированными контрольными птицами. Данные представлены средними значениями (n=7), а планки погрешностей означают SE.
На фиг.12 представлен график, показывающий, что IFN-X защищает от заражения гриппом и до, и после инфицирования. Клетки HD11 обрабатывали chIFN-α, -β и -λ, в трех концентрациях либо до (В), либо после (А) заражения вирусом гриппа (PR8). Столбиками показан относительный уровень вируса при измерении методом НА через 24, 40, 48, 60 и 72 часа. Вирус не обнаруживался через 24 и 40 часов. В каждой точке брали по несколько образцов.
На фиг.13 представлен график, показывающий ингибирование активности IFN-λ антителами против IFN-λ. Антитела против chIFN-λ при введении in ovo вместе с вирусом гриппа повышали титр вируса гриппа при определении методом НА. Данные представлены средними значениями из вплоть до 7 опытов ±SE. Статистическая значимость представлена звездочками: одна звездочка (*): р 0,05, две звездочки (**): р 0,005, три звездочки (***): р=0,001.
На фиг.14 представлен график, показывающий, что IFN-λ повышает выработку антител после иммунизации. Свободных от специфических патогенов (SPF) цыплят (n=7) вакцинировали внутрибрюшинно с помощью 0,2 мл осажденных эритроцитов овцы (SRBC) в присутствии или в отсутствие цитокинов. Птиц повторно иммунизировали с помощью одних лишь SRBC на 15-й день после иммунизации. У всех птиц брали кровь каждую неделю и измеряли титры НА. Титры антител в сыворотке, которые определяли методом полной агглютинации, выражали в виде среднего значения для каждой группы.
На фиг.15 представлен график, показывающий, что rchIFN-λ ингибирует вызванную Con А пролиферацию спленоцитов. Спленоциты культивировали в присутствии серийных разведении экспрессированных в Е.coli rchIFN-α, -β и -λ и субоптимальной концентрации Con A (5 мкг/мл) в течение 48 ч. Затем добавляли [3H]-тимидин и культивировали клетки еще 24 ч. Для определения пролиферации клеток измеряли радиоактивность, которую выражали в виде среднего значения ±SE из четырех повторов. Клетки, обработанные одним лишь Con А, представлены средним значением из четырех повторов.
Осуществление изобретения
Настоящее изобретение основывается, отчасти, на выделении и секвенировании молекул нуклеиновой кислоты, соответствующей гену нового интерферона III типа птиц, более точно гена IFN-X, курицы. Этот факт обеспечивает новые молекулы белков и нуклеиновых кислот для применения, среди прочего, в иммуномодуляции. В обработанных вирусом клетках наблюдается защита от вызванного вирусом цитолиза при культивировании клеток в присутствии продукта экспрессии гена IFN-λ курицы. Соответственно, идентификация этого нового гена цитокина птиц особенно способствовала разработке препаратов и способов для применения при лечении, профилактике и диагностике/мониторинге, среди прочего, заболеваний птиц, связанных с воздействием или заражением патогенным организмом.
Соответственно, один из аспектов настоящего изобретения касается молекулы нуклеиновой кислоты, которая кодирует или комплементарна молекуле нуклеиновой кислоты, кодирующей полипептид цитокина птиц либо его функциональный фрагмент или производное, причем данный полипептид представляет собой интерферон III типа.
Термин "птичий" служит для обозначения представителей класса позвоночных, которых обычно именуют птицами. Следует иметь в виду, что в настоящем изобретении термин "птичий" охватывает оба пола и все онтогенетические стадии домашних птиц, комнатных птиц и охотничье-промысловых птиц, выбранных из списка, включающего кур, индеек, бентамок, перепелов, цесарок, уток, гусей, страусов, эму, голубей, канареек, волнистых попугайчиков, попугаев и зябликов, среди прочего.
В настоящем изобретении термин "полипептид цитокина" служит для обозначения молекулы полипептида, составляющего, по меньшей мере, одну субъединицу биологически активного белка, который обладает одним или несколькими характерными биологическими признаками интерферона III типа, в частности способностью к модулированию функциональных возможностей иммунных клеток птиц, как-то лимфоцитов (В- или Т-клеток), гранулоцитов (эозинофилов, базофилов или нейтрофилов) либо других неспецифических иммунных клеток (напр., макрофагов, моноцитов, NK-клеток и др.).
Не ограничивая настоящее изобретение какой-либо одной теорией или механизмом действия, было установлено, что интерфероны III типа проявляют биологические свойства, похожие на свойства интерферона I типа. Соответственно, ссылки на биологическую активность интерферона III типа следует понимать как включающие и антивирусное, и иммуномодулирующее действие, такое, к примеру, как индуцированная вирусом экспрессия, ведущая к передаче сигналов через путь киназы Janus (Jak)-STAT и активации IFN-стимулируемой регулируемой экспрессии (ISRE) генов, усилению экспрессии антигенов класса I главного комплекса гистосовместимости (МНС) и защите от цитопатических эффектов, вызванных вирусной инфекцией.
Соответственно, другой аспект настоящего изобретения предусматривает молекулу нуклеиновой кислоты либо ее функциональный фрагмент или производное, которые кодируют или комплементарны молекуле нуклеиновой кислоты, кодирующей полипептид цитокина птиц либо его функциональный фрагмент или производное, причем данный полипептид представляет собой интерферон III типа, а вид птицы - курица, индейка, бентамка, перепел, цесарка, утка, гусь, страус, эму, голубь, канарейка, волнистый попугайчик, попугай или зяблик.
Наиболее предпочтительно молекула нуклеиновой кислоты по настоящему изобретению происходит из курицы.
Не ограничивая настоящее изобретение какой-либо одной теорией или механизмом действия, а также как изложено в настоящем изобретении, интерфероны относятся к трем семействам, исходя из молекулярной структуры, типа рецепторов и тех функциональных путей, которые они индуцируют. Это семейства IFN I, IFN II и IFN III. Интерфероны III типа охватывают группу лямбда-IFN (IFN-λ), в которой у млекопитающих имеется три подтипа: IFN-λ1 (IL29), IFN-λ2 (IL28A) и IFN-λ3 (IL28B). Хотя группа IFN-λ у курицы как будто содержит лишь одного представителя, следует иметь в виду, что ссылки на IFN-λ птиц охватывают ссылки на все формы этих молекул и на их функциональные фрагменты, производные и птичьи гомологи, включая изомерные формы, которые могут возникать при альтернативном сплайсинге мРНК IFN-λ, полиморфные формы, аллельные формы и на формы, существующие в виде димеров, мультимеров и слитых белков.
Не ограничивая настоящее изобретение какой-либо одной теорией или механизмом действия, ген IFN-λ предпочтительно содержит 5 экзонных участков на хромосоме 7, которые кодируют полипептид из 186 аминокислот с молекулярным весом 21 кДа, который только на 36% идентичен huIFN-λII на уровне нуклеотидов. Продукт экспрессии гена IFN-λ, предпочтительно проявляет антивирусное и иммуномодулирующее действие, как описано выше.
В предпочтительном воплощении данный полипептид интерферона III типа представляет собой полипептид IFN-λ курицы (chIFN-λ) или слитую молекулу, содержащую его самого или его функциональный фрагмент, производное или птичий гомолог.
В соответствии с этим предпочтительным воплощением предусмотрена молекула нуклеиновой кислоты либо ее функциональный фрагмент или производное, которые кодируют или комплементарны молекуле нуклеиновой кислоты, кодирующей полипептид IFN-λ курицы либо его функциональный фрагмент, птичий гомолог или производное.
Следующий аспект настоящего изобретения касается выделенной нуклеиновой кислоты, выбранной из списка, состоящего из:
(i) выделенной молекулы нуклеиновой кислоты либо ее функционального фрагмента, производного или птичьего гомолога, включающих нуклеотидную последовательность, кодирующую или комплементарную последовательности, кодирующей аминокислотную последовательность, практически такую же, как приведенная в SEQ ID NO:2 или 4, либо ее функциональное производное, фрагмент или птичий гомолог, либо аминокислотную последовательность, по меньшей мере, на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или больше идентичную SEQ ID NO:2 или 4 по всей длине последовательности, либо последовательность нуклеиновой кислоты, способной гибридизироваться с данной молекулой нуклеиновой кислоты в условиях низкой строгости;
(ii) выделенной молекулы нуклеиновой кислоты либо ее функционального фрагмента, производного или птичьего гомолога, включающих нуклеотидную последовательность или комплементарную данной последовательности, причем данная нуклеотидная последовательность практически такая же, как приведенная в SEQ ID NO:1 или 3, либо нуклеотидную последовательность, по меньшей мере, на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или больше идентичную по всей длине последовательности, либо нуклеотидную последовательность, способную гибридизироваться с SEQ ID NO:1 или 3 или с комплементарной ей в условиях низкой строгости;
(iii) выделенной молекулы нуклеиновой кислоты либо ее функционального производного, фрагмента или птичьего гомолога, включающих нуклеотидную последовательность, приведенную в SEQ ID NO:1 или 3, либо функциональный фрагмент данной молекулы.
Предусматривается, что настоящее изобретение распространяется и на геномную форму ДНК нуклеотидных последовательностей кДНК, приведенных выше. При этом SEQ ID NO:1 соответствует кДНК chIFN-λ, включая последовательность, кодирующую сигнальный пептид. SEQ ID NO:3 соответствует последовательности кДНК, кодирующей открытую рамку считывания зрелого белка chIFN-λ, т.е. белка без сигнального пептида. SEQ ID NO:2 соответствует белку chIFN-λ, содержащему сигнальный пептид, a SEQ ID NO:4 соответствует белку chIFN-λ, не содержащему сигнального пептида.
Ссылки на геномные формы и кДНК chIFN-λ, следует понимать в самом широком смысле, включающем:
(i) классический геномный ген, состоящий из регулирующих транскрипцию и/или трансляцию последовательностей и/или кодирующей области и/или не подлежащих трансляции последовательностей (т.е. интронов, 5'- и 3'-нетранслируемых последовательностей);
(ii) мРНК или кДНК, соответствующую кодирующим участкам (т.е. экзонам), необязательно содержащую 5'- или 3'-нетранслируемые последовательности гена; и/или
(iii) мРНК или кДНК, соответствующую кодирующей области без или вместе с последовательностями, связанными с такими формами предшественников белка, как сигнальные последовательности, и необязательно 5'- или 3'-нетранслируемыми последовательностями.
Как описано выше, chIFN-λ соответствует молекуле прежде неизвестного интерферона птиц. Предусматривается, что настоящее изобретение распространяется и на продукты экспрессии молекулы нуклеиновой кислоты, приведенной выше.
Соответственно, следующий аспект настоящего изобретения касается полипептида цитокина птиц либо его функционального фрагмента или производного, причем данный полипептид является интерфероном III типа.
Предпочтительно данный полипептид интерферона III типа представляет собой полипептид IFN-X, птиц либо его функциональный фрагмент или производное.
Более предпочтительно данный полипептид IFN-λ представляет собой chIFN-λ.
Следующий аспект настоящего изобретения касается выделенного белка, приведенного в SEQ ID NO:2 или 4 либо, по меньшей мере, на 60%, 65%, 75%, 80% или больше идентичного SEQ ID NO:2 или 4 по всей длине последовательности, либо его функционального производного, фрагмента или птичьего гомолога.
Предусматривается, что термин "белок" охватывает пептиды, полипептиды и белки. Нужно иметь в виду, что эти термины применяются взаимозаменяемым образом. Белок может быть гликозилирован или не гликозилирован и/или может содержать ряд других молекул, слитых, присоединенных, связанных или иным образом соединенных с белком, как-то аминокислоты, липиды, углеводы либо другие пептиды, полипептиды или белки. В дальнейшем ссылки на "белок" включают и белки, содержащие последовательность аминокислот, и белки, связанные с другими молекулами, такими как аминокислоты, липиды, углеводы либо другие пептиды, полипептиды или белки.
Предпочтительно указанное сходство на 60% и более означает сходство на 65%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%.
Белок настоящего изобретения предпочтительно находится в выделенном виде. Под "выделенным" имеется в виду белок, прошедший как минимум одну стадию очистки, что легко определяется, к примеру, тем, что композиция содержит, по меньшей мере, 10% рассматриваемого белка, предпочтительно, по меньшей мере, 20%, более предпочтительно, по меньшей мере, 30%, еще более предпочтительно, по меньшей мере, 40-50%, даже еще более предпочтительно, по меньшей мере, 60-70% и еще даже более предпочтительно, по меньшей мере, 80-90% или больше рассматриваемого белка относительно других компонентов при определении по молекулярному весу, аминокислотной последовательности или иным удобным способом. Белок настоящего изобретения также может считаться, в предпочтительном воплощении, биологически чистым.
В настоящем изобретении в отношении и заявленных белков, и нуклеиновых кислот термин "выделенный" означает, что материал изъят из своей исходной среды (напр., естественной среды, если он встречается в природе). Например, встречающийся в природе полинуклеотид или белок, находящийся в живом организме, не является выделенным, но тот же самый полинуклеотид или белок, отделенный от некоторых или всех сосуществующих материалов в природной системе, является выделенным. Такие полинуклеотиды могли бы входить в состав вектора и/или такие полинуклеотиды или белки могли бы входить в состав композиции и все-таки быть выделенными в том смысле, что такой вектор или композиция не является частью естественной среды. В настоящем изобретении выделенный материал или композиция также может представлять собой и "очищенную" композицию, т.е. абсолютная чистота не требуется, скорее это служит в качестве относительного определения. Индивидуальные нуклеиновые кислоты, полученные из библиотеки, могут легко быть очищены до электрофоретичесой однородности. В альтернативных аспектах изобретения предусмотрены нуклеиновые кислоты, которые были очищены из геномной ДНК или из других последовательностей в библиотеке или иной среды, по меньшей мере, на 1, 2, 3, 4, 5 или больше порядков.
Белки по изобретению могут быть выделены из природных источников, синтезированы или получены как полипептиды рекомбинантным способом. Пептиды и белки можно экспрессировать рекомбинантным способом in vitro или in vivo. Белки по изобретению можно получать и выделять любым известным методом. Белки по изобретению также можно синтезировать, полностью или частично, используя хорошо известные химические методы. Напр., см. Caruthers et al. (1980) Nucleic Acids Res. Symp. Ser. 215-223; Horn et al. (1980) Nucleic Acids Res. Symp. Ser. 225-232; Banga A.K., Therapeutic Peptides and Proteins: Formulation, Processing and Delivery Systems (1995) Technomic Publishing Co., Lancaster, PA. Например, можно проводить синтез пептидов, используя различные твердофазные методы (напр., см. Roberge et al. (1995) Science 269: 202; Merrifield (1997) Methods Enzymol. 289: 3-13), и можно проводить автоматический синтез, напр., с помощью синтезатора пептидов ABI 431А (Perkin Elmer) в соответствии с инструкциями изготовителя.
Белки по изобретению также можно синтезировать и экспрессировать в виде слитых белков с одним или несколькими добавочными доменами, присоединенными к ним, напр., для того, чтобы облегчить выделение синтезированных рекомбинантным способом пептидов, идентифицировать и выделять антитела и экспрессирующие их В-клетки и т.д. Способствующие детектированию и очистке домены включают, напр., хелатирующие металлы пептиды, такие как полигистидиновые отрезки и гистидин-триптофановые модули, способствующие очистке на иммобилизованных металлах; домены белка А, способствующие очистке на иммобилизованном иммуноглобулине; и домен, используемый в системе наращивания/аффинной очистки FLAGS (Immunex Corp., Seattle, WA). Способствует очистке и включение последовательностей расщепляемых линкеров типа фактора Ха или энтерокиназы (Invitrogen, San Diego, CA) между доменом очистки и содержащим мотив белком. Например, экспрессирующий вектор может включать кодирующую эпитоп последовательность нуклеиновой кислоты, присоединенную к 6 остаткам гистидина, за которыми следуют тиоредоксин и сайт расщепления энтерокиназой (напр., см. Williams et al. (1995) Biochemistry 34: 1787-1797; Dobeli et al. (1998) Protein Expr. Purif. 12: 404-414). Остатки гистидина способствуют детектированию и очистке, тогда как сайт расщепления энтерокиназой служит средством для очистки какого-то участка от остального слитого белка. Технология, касающаяся векторов, кодирующих слитые белки, и применение слитых белков хорошо описаны в научной и патентной литературе, напр., см. Kroll et al. (1993) DNA Cell. Biol. 12: 441-453.
Несмотря на то, что настоящее изобретение охватывает рекомбинантные белки, при синтезе рассматриваемых белков предусмотрены и методы химического синтеза.
При химическом синтезе полипептидов по настоящему изобретению их удобно синтезировать на основе молекул, выделенных из птиц. Выделение молекул из птиц может осуществляться любым подходящим способом, как-то методом хроматографического разделения, например, методом ионообменной хроматографии на СМ-целлюлозе с последующей гель-фильтрацией на сефадексе (напр., на колонке G-50). Существует много других методов, в том числе HPLC, PAGE, среди прочего.
Предпочтительно при химическом синтезе полипептидов настоящего изобретения их обычно синтезируют на основе молекул, выделенных из курицы.
Рассматриваемые полипептиды можно синтезировать методом твердофазного синтеза по методике F-moc, как описано в Carpino et al. (1991), а также полипептиды и их фрагменты можно синтезировать по альтернативной методике, в том числе методике t-Вос, как описано в Stewart et al. (1985), или классическими методами жидкофазного синтеза пептидов.
Следующий аспект настоящего изобретения касается белка, кодируемого нуклеотидной последовательностью, приведенной в SEQ ID NO:1 или 3, либо последовательностью, комплементарной последовательности, способной гибридизироваться с SEQ ID NO:1 или 3 в условиях низкой строгости и кодирующей аминокислотную последовательность, приведенную в SEQ ID NO:2 или 4 либо, по меньшей мере, на 60%, 65%, 70%, 75%, 80% или больше идентичную SEQ ID NO:2 или 4 по всей длине последовательности.
В настоящем изобретении четко предусмотрены родственные или гомологичные гены или белки интерферона III типа, происходящие из других птиц, чем куры, в том числе из любых видов домашних птиц, комнатных птиц или охотничье-промысловых птиц, выбранных из списка, включающего индеек, бентамок, перепелов, цесарок, уток, гусей, страусов, эму, голубей, канареек, волнистых попугайчиков, попугаев и зябликов, среди прочего. Настоящее изобретение также распространяется на гены интерферона III типа данных птиц, полученные из эмбриональных тканей или культуры клеток.
Ссылки на "интерферон III типа" в настоящем изобретении следует понимать как относящиеся к молекулам нуклеиновых кислот и белков, описанных выше.
Выражения "нуклеиновая кислота" или "последовательность нуклеиновой кислоты" в настоящем изобретении относятся к олигонуклеотидам, нуклеотидам, полинуклеотидам или к их фрагментам, к ДНК или РНК (напр., мРНК, рРНК, тРНК) геномного или синтетического происхождения, которые могут быть одноцепочечными или двухцепочечными и могут представлять смысловую или антисмысловую нить, к пептидонуклеиновой кислоте (ПНК) или к любому ДНК-подобному или РНК-подобному материалу природного или синтетического происхождения, включая, напр., иРНК, рибонуклеопротеиды (напр., иРНП). Термин охватывает нуклеиновые кислоты, напр., олигонуклеотиды, содержащие известные аналоги природных нуклеотидов, Термин также охватывает нуклеиноподобные структуры с синтетическим остовом, напр., см. Mata (1997) Toxicol. Appl. Pharmacol. 144: 189-197; Straus-Soukup et al. (1997) Biochemistry 36: 8692-8698; Samstag et al. (1996) Antisense Nucleic Acid Drug. Dev. 6: 153-156.
При этом следует иметь в виду, что настоящее изобретение распространяется на антисмысловые молекулы нуклеиновых кислот, которые направлены на приведенные в настоящем изобретении молекулы нуклеиновых кислот цитокинов птиц,
"Продукт экспрессии" включает и молекулы РНК типа транскриптов мРНК, и белки. Некоторые гены не кодируют белки и вырабатывают мРНК или иные молекулы РНК, которые участвуют в регуляции посредством взаимодействия РНК:ДНК, РНК:РНК или РНК:белок. РНК (напр., мРНК) может действовать непосредственно или посредством индуцирования других молекул типа иРНК или продуктов, возникающих при явлениях сплайсинга (напр., экзонов или интронов). Настоящим изобретением также предусмотрена короткая вставочная РНК (квРНК). Другие гены кодируют транскрипты мРНК, которые затем транслируются в белки. Белки включают и полипептиды. Таким образом, подлежащие дифференциальной экспрессии молекулы нуклеиновых кислот могут кодировать лишь только мРНК или еще и белки. И мРНК, и белки представляют собой формы "продуктов экспрессии".
В следующем аспекте изобретения предусмотрен способ получения рекомбинантных молекул интерферона III типа птиц в клетках, который включает экспрессирование в данных клетках молекулы нуклеиновой кислоты, кодирующей или комплементарной молекуле нуклеиновой кислоты, кодирующей данный интерферон III типа птиц.
Молекула нуклеиновой кислоты по настоящему изобретению предпочтительно находится в выделенном виде или лигирована с вектором типа экспрессирующего вектора. Под "выделенной" имеется в виду молекула нуклеиновой кислоты, прошедшая как минимум одну стадию очистки, что легко определяется, к примеру, тем, что композиция содержит, по меньшей мере, 10% рассматриваемой молекулы нуклеиновой кислоты, предпочтительно, по меньшей мере, 20%, более предпочтительно, по меньшей мере, 30%, еще более предпочтительно, по меньшей мере, 40-50%, даже еще более предпочтительно, по меньшей мере, 60-70% и еще даже более предпочтительно, по меньшей мере, 80-90% или больше рассматриваемой молекулы нуклеиновой кислоты относительно других компонентов при определении по молекулярному весу, нуклеотидной последовательности или иным удобным способом. Молекула нуклеиновой кислоты по настоящему изобретению также может считаться, в предпочтительном воплощении, биологически чистой.
Нуклеиновые кислоты по изобретению можно получать, выделять и/или обрабатывать, напр., посредством клонирования и экспрессирования библиотек кДНК, амплификации матричной или геномной ДНК методом ПЦР и т.п. При применении способов изобретения на практике можно модифицировать гомологичные гены путем обработки матричной нуклеиновой кислоты, как описано в изобретении. Изобретение можно применять на практике вместе с любым известным методом, методикой или устройством, хорошо описанным в научной и патентной литературе.
Нуклеиновые кислоты, используемые при применении настоящего изобретения, будь-то РНК, иРНК, антисмысловая нуклеиновая кислота, кДНК, геномная ДНК, векторы, вирусы или их гибриды, можно выделять из различных источников, получать методами генетической инженерии, амплифицировать и/или экспрессировать/создавать рекомбинантным способом. Рекомбинантные полипептиды, полученные из этих нуклеиновых кислот, можно индивидуально выделять или клонировать и тестировать на наличие требуемой активности. Можно использовать любые системы рекомбинантной экспрессии, включая системы экспрессии в клетках бактерий, млекопитающих, дрожжей, насекомых или растений.
С другой стороны, эти нуклеиновые кислоты можно синтезировать in vitro хорошо известными методами химического синтеза, как описано, напр., в Adams (1983) J. Am. Chem. Soc. 105: 661; Belousov et al. (1997) supra; Frenkel et al. (1995) supra; Blommers et al. (1994) supra; Narang et al. (1979) Meth. Enzymol. 68: 90; Brown et al. (1979) Meth. Enzymol. 68: 109; Beaucage (1981) Tetra. Lett. 22:1859; U.S. Patent No.4,458,066.
Изобретением предусмотрены олигонуклеотиды, содержащие последовательности по изобретению, напр., подпоследовательности типичных последовательностей по изобретению. Олигонуклеотиды могут включать, к примеру, одноцепочечные полидезоксинуклеотиды или две комплементарные нити полидезоксинуклеотидов, которые можно синтезировать химическим способом.
Методы обработки нуклеиновых кислот, такие, к примеру, как субклонирование, включение меченых зондов (напр., включение метки методом случайных праймеров с помощью полимеразы Klenow, при ник-трансляции, амплификации), секвенирование, гибридизация и другие хорошо описаны в научной и патентной литературе, напр., см. Sambrook, ed., Molecular Cloning: A Laboratory Manual (2nd ed.), vol. 1-3, Cold Spring Harbor Laboratory (1989); Current Protocols in Molecular Biology, Ausubel, ed. John Wiley & Sons, Inc., New York (1997); Laboratory Techniques in Biochemistry and Molecular Biology: Hybridization with Nucleic Acid Probes, Part I. Theory and Nucleic Acid Preparation, Tijssen, ed. Elsevier, N.Y.(1993).
Нуклеиновые кислоты, векторы, капсиды, полипептиды и др. можно анализировать и определять количественно любым из целого ряда способов, известных специалистам. Они включают, к примеру, такие методы биохимического анализа, как ЯМР, спектрофотометрия, радиография, электрофорез, капиллярный электрофорез, высокоэффективная жидкостная хроматография (HPLC), тонкослойная хроматография (TLC) и гипердиффузионная хроматография, различные иммунологические методы, напр., реакции преципитации в жидкости или геле, иммунодиффузия, иммуноэлектрофорез, радиоиммуноанализ (RIA), ферментный иммуносорбентный анализ (ELISA), иммунофлуо-ресцентные методы, анализ по Southern, Northern, точечный блоттинг, гель-электрофорез (напр., SDS-PAGE), методы амплификации нуклеиновых кислот, мишеней или сигналов, введение радиоактивных меток, сцинтилляционные счетчики и аффинная хроматография.
Клонирование и обработка нуклеиновых кислот, используемых при применении способов изобретения, может проводиться путем клонирования из геномных образцов и, если нужно, скрининга и повторного клонирования вставок, выделенных или амплифицированных, напр., из геномных клонов или клонов кДНК. Источники нуклеиновых кислот, используемых в способах изобретения, включают геномные библиотеки или библиотеки кДНК, содержащиеся, к примеру, в искусственных хромосомах млекопитающих (MAC), напр., см. U.S. Patent Nos. 5,721,118; 6,025,155; искусственных хромосомах дрожжей (YAC); искусственных хромосомах бактерий (ВАС); искусственных хромосомах Р1, напр., см. Woon et al. (1998) Genomics 50: 306-316; происходящих из Р1 векторах (РАС), напр., см. Кет (1997) Biotechniques 23: 120-124; космидах, рекомбинантных вирусах, фагах или плазмидах.
Нуклеиновые кислоты по изобретению могут быть функционально связаны с промотором. Промотор может представлять собой один мотив либо набор контрольных последовательностей нуклеиновых кислот, управляющих транскрипцией нуклеиновой кислоты. Промотор может включать необходимые последовательности нуклеиновой кислоты возле сайта инициации транскрипции, как в случае промотора полимеразы II - элемент ТАТА. Промотор также необязательно включает отдаленные элементы энхансера или репрессора, которые могут находиться на расстоянии нескольких тысяч пар оснований от сайта инициации транскрипции. "Конститутивным" является такой промотор, который активен при большинстве условий окружающей среды или онтогенеза. "Индуцибельным" является такой Промотор, который подвергается регуляции окружающей средой или онтогенетической регуляции. "Тканеспецифический" промотор активен в некоторых типах тканей организма, но не в других типах тканей того же организма. Термин "функционально связан" относится к функциональной связи между последовательностью, контролирующей экспрессию нуклеиновой кислоты (типа промотора или набора мест связывания факторов транскрипции), и второй последовательностью нуклеиновой кислоты, причем контролирующая экспрессию последовательность управляет транскрипцией нуклеиновой кислоты, соответствующей второй последовательности.
Изобретением предусмотрены экспрессирующие и клонирующие векторы, содержащие нуклеиновые кислоты по изобретению, напр., последовательности, кодирующие белки по изобретению, экспрессирующие и клонирующие векторы по изобретению могут включать вирусные частицы, бакуловирусы, фаги, плазмиды, фагемиды, космиды, фосмиды, искусственные хромосомы бактерий, ДНК вирусов (напр., коровьей оспы, аденовирусов, поксвирусов, псевдобешенства и производных SV40), искусственные хромосомы на основе Р1, дрожжевые плазмиды, искусственные хромосомы дрожжей и любые другие векторы, специфичные к определенным организмам хозяина (как-то бациллам, клеткам Aspergillus и дрожжам). Векторы по изобретению могут включать хромосомные, нехромосомные и синтетические последовательности ДНК. Специалистам известно большое число подходящих векторов, которые коммерчески доступны.
Нуклеиновые кислоты по изобретению можно клонировать, если нужно, в любой из целого ряда векторов, используя обычные методы молекулярной биологии; методы клонирования амплифицированных in vitro нуклеиновых кислот описаны, напр., в U.S. Patent No.5,426,039. Чтобы облегчить клонирование амплифицированных последовательностей, можно встроить сайты рестрикционных ферментов в пару праймеров для ПЦР.
Изобретением предусмотрены библиотеки экспрессионных векторов, кодирующих полипептиды и пептиды изобретения. Эти нуклеиновые кислоты можно ввести в геном или в цитоплазму или ядро клетки и подвергнуть экспрессии различными стандартными методами, хорошо описанными в научной и патентной литературе. Напр., см. Roberts et al. (1997) Nature 328: 731; Schneider (1995) Protein Expr. Purif. 6435: 10; Sambrook, Tijssen или Ausubel. Вектора можно выделять из природных источников, получать из таких источников, как библиотеки АТСС или GenBank либо получать методами синтеза или рекомбинантными методами. Например, нуклеиновые кислоты по изобретению можно экспрессировать в экспрессирующих кассетах, векторах или вирусах, которые устойчиво или кратковременно экспрессируются в клетках (напр., эписомных системах экспрессии). В экспрессионные кассеты и вектора можно вставлять селективные маркеры, придающие селективный фенотип трансформированным клеткам и последовательностям. Например, селективные маркеры могут кодировать сохранение и репликацию эписом, так что встраивание их в геном хозяина не потребуется.
В одном аспекте нуклеиновые кислоты по изобретению вводятся in vivo для экспрессии in situ пептидов или полипептидов изобретения. Нуклеиновые кислоты можно вводить в виде "голой ДНК" (напр., см. U.S. Patent No.5,580,859) либо в виде экспрессионного вектора, напр., рекомбинантного вируса. Нуклеиновые кислоты можно вводить любым способом, в том числе пери- или интратуморально, как описано ниже. Вектора, вводимые in vivo, могут происходить из вирусных геномов, включая модифицированные рекомбинантным способом оболочечные или безоболочечные ДНК- и РНК-содержащие вирусы, предпочтительно из числа бакуловирусов, парвовирусов, пикорновирусов, герпесвирусов, поксвирусов, аденовирусов или пикорнавирусов. Также можно использовать химерные вектора, в которых сочетаются преимущества свойств каждого из исходных векторов (напр., см. Peng et al. (1997) Nature Biotechnology 15: 866-870). Такие вирусные геномы можно модифицировать методами рекомбинантной ДНК для включения нуклеиновых кислот по изобретению и дополнительно подвергнуть инженерии, чтобы сделать их дефектными по репликации, условно реплицирующимися или компетентными к репликации. В альтернативных аспектах вектора происходят из геномов аденовирусов (напр., некомпетентные к репликации вектора из генома аденовируса человека, напр., см. U.S. Patent Nos.6,096,718; 6,110,458; 6,113,913; 5,631,236); аденоассоциированных вирусов и ретровирусов. Ретровирусные вектора могут включать вектора на основе вируса лейкемии мышей (MuLV), вируса лейкемии гиббона (GaLV), вируса иммунодефицита обезьян (SIV), вируса иммунодефицита человека (HIV) и их комбинаций, напр., см. U.S. Patent Nos.6,117,681; 6,107,478; 5,658,775; 5,449,614; Buchscher and Panganiban (1992) J. Virol. 66: 2731-2739; Johann et al. (1992) J. Virol. 66: 1635-1640. Вектора на основе аденоассоциированных вирусов (AAV) можно применять для трансдукции клеток заданной нуклеиновой кислотой, напр., при получении in vitro нуклеиновых кислот и пептидов и при процедурах генной терапии in vivo и ex vivo; напр., см. U.S. Patent Nos.6,110,456; 5,474,935; Okada et al. (1996) Gene Ther. 3: 957-964.
Термин "экспрессионная кассета" в настоящем изобретении обозначает такую последовательность нуклеотидов, которая способна осуществлять экспрессию структурного гена (т.е. последовательности, кодирующей белок типа полипептида по изобретению) в организме хозяина, совместимого с такими последовательностями. Экспрессионные кассеты включают как минимум промотор, функционально связанный с колирующей полипептид последовательностью, и необязательно с другими последовательностями, напр., сигналами терминации транскрипции. Могут использоваться и другие факторы, необходимые или полезные при осуществлении экспрессии, напр., энхансеры, "Функционально связан" в настоящем изобретении означает связь с вышележащим от последовательности ДНК промотором с тем, что промотор обеспечивает транскрипцию последовательности ДНК. Таким образом, экспрессионные кассеты также включают плазмиды, экспрессионные вектора, рекомбинантные вирусы, любые формы несущих "голую ДНК" рекомбинантных векторов и т.п.
"Вектор" содержит нуклеиновую кислоту, которая может инфицировать, трансфецировать, кратковременно или постоянно трансдуцировать клетки. Нужно иметь в виду, что вектор может представлять собой голую нуклеиновую кислоту либо нуклеиновую кислоту в комплексе с белком или липидом. Вектор необязательно содержит вирусные или бактериальные нуклеиновые кислоты и/или белки и/или мембраны (напр., клеточную мембрану, липидную оболочку вируса и т.п.). Вектора охватывают репликоны (напр., РНК-репликоны, бактериофаги), к которым могут прикрепляться фрагменты ДНК и подвергаться репликации. Таким образом, к векторам относятся РНК, автономно реплицирующаяся кольцевая или линейная ДНК или РНК (напр., плазмиды, вирусы и т.п., напр., см. U.S. Patent No.5,217,879), а также экспрессирующие и не экспрессирующие плазмиды. Если рекомбинантный организм или клеточная культура описывается как содержащая "экспрессионный вектор", то это означает и внехромосомную кольцевую и линейную ДНК, и ДНК, встроенную в хромосомы хозяина. Если вектор сохраняется в клетках хозяина, то он может либо устойчиво реплицироваться клетками во время митоза как автономная структура, либо встраиваться в геном хозяина.
Для оптимальной экспрессии в определенной ткани или в заданных условиях молекула нуклеиновой кислоты может быть функционально поставлена под контроль последовательности промотора типа тех, что обсуждались выше. Подходящие клетки и вирусные частицы для этой цели также обсуждались выше. Последовательности промоторов и условия культивирования для клеток и вирусных частиц, дающих высокий уровень экспрессии, должны быть хорошо известны специалистам в соответствующей области.
Изобретением также предусмотрены трансформированные клетки, содержащие последовательность нуклеиновой кислоты по изобретению, напр., последовательность, кодирующую полипептид по изобретению либо вектор по изобретению. Клетки хозяина могут представлять собой любые клетки, известные специалистам, включая прокариотические клетки, эукариотические клетки, как-то бактериальные клетки, грибковые клетки, дрожжевые клетки, клетки млекопитающих, клетки насекомых или растительные клетки. Типичными бактериальными клетками являются Е. coli, Steptomyces, Bacillus subtilis. Salmonella typhimurium и различные виды из родов Pseudomonas, Steptomyces и Staphylococcus. Типичными клетками насекомых являются Drosophila S2 и Spodoptera Sf9. Типичными клетками животных являются клетки СНО, COS или меланомы Bowes либо любые линии клеток мыши или человека. Выбор надлежащего хозяина находится в компетенции специалистов в этой области.
Вектор можно ввести в клетки хозяина любым из целого ряда методов, включая трансформацию, трансфекцию, трансдукцию, вирусную инфекцию, генную пушку или опосредованный Ti перенос генов. Конкретные методы включают трансфекцию с помощью фосфата кальция, трансфекцию с помощью DEAE-декстрана, липофекцию или электропорацию.
Подвергнутые инженерии клетки хозяина можно культивировать в стандартных питательных средах, модифицированных соответствующим образом для активирования промоторов, отбора трансформантов или амплификации генов по изобретению. После трансформации подходящего штамма хозяина и культивирования штамма хозяина до надлежащей плотности клеток можно индуцировать выбранный промотор надлежащим образом (напр., скачком температуры или химическим способом) и культивировать клетки дополнительное время, чтобы они стали вырабатывать нужный полипептид или его фрагмент.
Клетки можно собрать центрифугированием, разрушить физическим или химическим способом, а полученный неочищенный экстракт сохранить для дальнейшей очистки. Микробные клетки, использовавшиеся для экспрессии белков, можно разрушить любым удобным способом, включая несколько циклов замораживания-оттаивания, ультразвуковую обработку, механическое разрушение или с помощью вызывающих лизис клеток веществ. Такие методы хорошо известны специалистам. Экспрессируемый полипептид или фрагмент можно выделить и очистить из культуры рекомбинантных клеток методами, в числе которых осаждение сульфатом аммония или этанолом, экстрагирование кислотой, анионо- или катионообменная хроматография, хроматография на фосфоцеллюлозе, гидрофобная хроматография, аффинная хроматография, хроматография на гидроксиапатите и лектиновая хроматография. При необходимости для восстановления конфигурации полипептида можно использовать стадию ренатурации белка. Если нужно, то для окончательной стадии очистки можно использовать высокоэффективную жидкостную хроматографию (HPLC).
Соответственно, в следующем аспекте изобретения предусмотрены выделенные клетки, которые экспрессируют эндогенный или рекомбинантный интерферон III типа птиц либо его функциональный фрагмент, производное или гомолог.
В наиболее предпочтительном воплощении молекула интерферона III типа птиц в соответствии с данным аспектом изобретения представляет собой IFN-λ птиц, в частности chIFN-λ.
С другой стороны, выделенные клетки могут представлять собой трансформированные эукариотические клетки, которые экспрессируют молекулы интерферона III типа посредством генетической конструкции типа тех, что изложены выше. Способы введения генетических конструкций в клетки приведены в настоящем изобретении и должны быть хорошо известны специалистам.
Способы выделения клеток, экспрессирующих эндогенный или рекомбинантный интерферон III типа птиц, также были изложены выше и должны быть хорошо известны специалистам.
Термины "сходство" и "идентичность" в настоящем изобретении включают полную тождественность между сравниваемыми последовательностями на уровне нуклеотидов или аминокислот. Если имеется неидентичность на уровне нуклеотидов, то "сходство" включает отличия между последовательностями, которые могут кодировать разные аминокислоты, но тем не менее родственны друг другу на структурном, функциональном, биохимическом и/или конформационном уровне. В особенно предпочтительном воплощении сравнение нуклеотидных последовательностей проводится на уровне идентичности, а не сходства.
Термины, применяемые для описания взаимных отношений последовательностей между двумя или несколькими полинуклеотидами, включают "эталонная последовательность", "окно сравнения", "сходство последовательностей", "идентичность последовательностей", "сходство последовательностей в процентах", "идентичность последовательностей в процентах", "существенное сходство" и "практически идентичны". "Эталонная последовательность" состоит, по меньшей мере, из 12, часто из 15-18 и зачастую, по меньшей мере, 25 и выше, как-то 30 штук мономеров в длину. Поскольку каждый из двух полинуклеотидов может содержать (1) последовательность (т.е. лишь часть полной последовательности полинуклеотида), которая является сходной между двумя полинуклеотидами, и (2) последовательность, которая отличается между двумя полинуклеотидами, то сравнение последовательностей между двумя (или несколькими) полинуклеотидами обычно проводится путем сравнения последовательностей двух полинуклеотидов по "окну сравнения", чтобы установить и сравнить локальные участки сходства последовательностей. "Окно сравнения" обозначает концептуальный сегмент, обычно из 12 смежных остатков, который сравнивают с эталонной последовательностью. Окно сравнения может включать добавления или делеции (т.е. пропуски) примерно на 20% или меньше в сравнении с эталонной последовательностью (которая не содержит добавлений или делеции) для оптимального совмещения двух последовательностей. Оптимальное совмещение последовательностей на отрезке окна сравнения может проводиться путем компьютерной реализации алгоритмов (GAP, BESTFIT, PASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics Software Package, выпуск 7.0, Genetics Computer Group, 575 Science Drive, Madison, WI, США) или путем осмотра и наилучшего совмещения (т.е. дающего самый высокий процент гомологичности на отрезке окна сравнения), полученного каким-либо из различных методов. Также можно обратиться к семейству программ BLAST, как изложено, к примеру, в Altschul et al. (Nucl. Acids Res. 25: 338, 1997). Подробное обсуждение анализа последовательностей приведено в Unit 19.3 ofAusubel et al. ("Current Protocols in Molecular Biology", John Wiley & Sons Inc., Chapter 15, 1994-1998). Можно использовать и ряд других алгоритмов для сравнения нуклеотидных и аминокислотных последовательностей, как-то PILEUP, CLUSTALW, SEQUENCHER или VectorNTI.
Термины "сходство последовательностей" и "идентичность последовательностей" в настоящем изобретении относятся к той степени, в которой последовательности являются идентичными либо функционально или структурно подобными нуклеотид за нуклеотидом на отрезке окна сравнения. Так, "идентичность последовательностей в процентах", к примеру, рассчитывается путем сравнения двух оптимально совмещенных последовательностей на отрезке окна сравнения, определения числа положений, в которых встречаются идентичные основания нуклеиновых кислот (напр., А, Т, С, G, I) в обоих последовательностях, получая число совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнения (т.е. размер окна) и умножения результата на 100, получая процент идентичности последовательностей. В рамках настоящего изобретения "идентичность последовательностей" будет пониматься как "процент совпадений", рассчитанный с помощью компьютерной программы DNASIS (версия 2.5 для Windows; доступна от Hitachi Software Engineering Co., Ltd., South San Francisco, Калифорния, США) с использованием стандартных параметров по умолчанию, приведенных в руководстве по применению, прилагаемому к программе. Аналогичные замечания применимы и в отношении сходства последовательностей.
Как изложено выше, в частности, идентичность (гомологичность) последовательностей белов и/или нуклеиновых кислот можно оценивать с помощью целого ряда известных алгоритмов и программ сравнения последовательностей. Степень идентичности (гомологичности) последовательностей можно определять с помощью какой-либо компьютерной программы и сопутствующих параметров, включая те, что описаны в настоящем изобретении, как-то BLAST 2.2.2 или PASTA версии 3.0t78 с параметрами по умолчанию. Например, алгоритм сравнения последовательностей представляет собой алгоритм версии BLAST. В одном аспекте, для анализа идентичности последовательностей нуклеиновых кислот, параметры BLAST по нуклеотидам составляют: размер слова=11, ожидание=10, фильтр для низкой сложности - DUST, цена за наличие пробела=5, цена за расширение пробела=2, штраф за несовпадение=-3, награда за совпадение=1, выброс (X) для расширения BLAST в битах=20, окончательное значение выброса Х для совмещения с пробелами=50, а все остальные опции - по умолчанию. В одном аспекте, для анализа идентичности последовательностей полипептидов, алгоритм сравнения последовательностей представляет собой алгоритм версии BLAST, напр., при этом параметры BLAST по аминокислотам составляют: размер слова=3, ожидание=10, фильтр для низкой сложности - SBG, цена за наличие пробела=11, цена за расширение пробела=1, матрица подобия - Blosum62, выброс (X) для расширения BLAST в битах=7, значение выброса Х для совмещения с пробелами (в битах)=15, окончательное значение выброса Х для совмещения с пробелами=25.
Типичными алгоритмами и программами являются TBLASTN, BLASTP, FASTA, TFASTA и CLUSTALW (Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85(8): 2444-2448, 1988; Altschul et al., J. Mol. Biol. 215 (3): 403-410, 1990; Thompson et al.. Nucleic Acids Res. 22 (2): 4673-4680, 1994; Higgins et al., Methods Enzymol. 266: 383-402, 1996; Altschul et al., Nature Genetics 3: 266-272, 1993). Гомологичность или идентичность можно измерить с помощью программы анализа последовательностей (напр., Sequence Analysis Software Package от Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, WI 53705). Такие программы сопоставляют сходные последовательности, присваивая степень гомологичности различным делециям, заменам и другим модификациям.
Для практического применения изобретения также используются алгоритмы BLAST, BLAST 2.0 и BLAST 2.2.2. Они описаны, к примеру, в Altschul et al. (1990), supra. Программное обеспечение для проведения BLAST-анализа является общедоступным через Национальный центр информации по биотехнологии (NCBI). Этот алгоритм включает идентифицирование сначала дающих высокие баллы пар последовательностей (HSPs) путем выявления коротких слов длиною W во введенной последовательности, которые либо совпадают, либо удовлетворяют какому-то имеющему положительное значение пороговому показателю Т при сопоставлении со словом такой же длины в последовательности из базы данных. Величина Т именуется порогом показателя близости слов (Altschul et al. (1990), supra)). Эти начальные попадания действуют как затравки для запуска поисков содержащих их более длинных HSPs. Встреченные слова наращиваются в обоих направлениях вдоль каждой последовательности до тех пор, пока кумулятивный показатель совмещения будет повышаться. Для нуклеотидных последовательностей кумулятивный показатель вычисляется с помощью параметра М (награды за каждую пару совпадающих остатков; она всегда >0). Для аминокислотных последовательностей при расчете кумулятивного показателя используется матрица баллов. Наращивание встреченных слов в каждом направлении останавливается, если кумулятивный показатель совмещения падает на величину Х от своего максимального достигнутого значения;
кумулятивный показатель снижается до нуля или меньше нуля вследствие накопления совмещений одного или нескольких остатков с отрицательными показателями; либо оно доходит до конца одной из последовательностей. Параметры W, Т и Х алгоритма BLAST определяют чувствительность и скорость совмещения. В программе BLASTN (для нуклеотидных последовательностей) по умолчанию используется длина слова (W)=11, ожидание (Е)=10, М=5, N=-4 и сравнение обеих нитей. Для аминокислотных последовательностей в программе BLASTP по умолчанию используется длина слова (W)=3, ожидание (Е)=10 и матрица баллов Blosum62 (см. Henikoff & Henikoff (1989) Proc. Natl. Acad. Sci. USA 89: 10915). Алгоритм BLAST также проводит статистический анализ сходства между двумя последовательностями (напр., см. Karlin & Altschul (1993) Proc. Natl. Acad. Sci. USA 90: 5873). Мерой сходства в алгоритме BLAST служит наименьшая сумма вероятностей (P(N)), которая служит показателем того, с какой вероятностью совпадение между двумя нуклеотидными или аминокислотными последовательностями могло бы произойти случайным образом. Например, нуклеиновая кислота считается сходной с эталонной последовательностью, если наименьшая сумма вероятностей при сравнении исследуемой нуклеиновой кислоты с эталонной нуклеиновой кислотой составляет менее 0,2, более предпочтительно менее 0,01 и наиболее предпочтительно менее 0,001. В одном аспекте оценка гомологичности последовательностей белков и нуклеиновых кислот проводится с помощью Основного средства поиска локальных совмещений ("BLAST"). Так, можно использовать 5 специфических программ BLAST для выполнения следующих задач: (1) BLASTP и BLAST3 сравнивают введенную аминокислотную последовательность с базой данных по последовательностям белков; (2) BLASTN сравнивает введенную нуклеотидную последовательность с базой данных по последовательностям нуклеиновых кислот; (3) BLASTX сравнивает концептуальные продукты трансляции введенной нуклеотидной последовательности в 6 рамках считывания (обе нити) с базой данных по последовательностям белков; (4) TBLASTN сравнивает введенную последовательность белка с базой данных по нуклеотидным последовательностям при трансляции во всех 6 рамках считывания (обе нити); и (5) TBLASTX сравнивает продукты трансляции введенной нуклеотидной последовательности в 6 рамках считывания с продуктами трансляции в 6 рамках считывания из базы данных по нуклеотидным последовательностям. Программы BLAST идентифицируют гомологичные последовательности путем выявления сходных сегментов, которые в дальнейшем именуются "парами сегментов с высокими показателями", между введенной аминокислотной или нуклеотидной последовательностью и заданной последовательностью, которую предпочтительно получают из базы данных по последовательностям белков или нуклеиновых кислот. Пары сегментов с высокими показателями предпочтительно идентифицируют (т.е. совмещают) при помощи матрицы баллов, многие из которых хорошо известны. Предпочтительно в качестве матрицы баллов используется матрица Blosum62 (Gonnet et al., Science 256: 1443-1445, 1992; Henikoff and Henikoff, Proteins 17: 49-61, 1993). Менее предпочтительно можно использовать и матрицы РАМ или РАМ250 (напр., см. Schwartz and Dayhoff, eds, 1978, Matrices for Detecting Distance Relationships: Atlas of Protein Sequence and Structure, Washington: National Biomedical Research Foundation).
В одном аспекте изобретения для определения того, обладает ли нуклеиновая кислота требуемой идентичностью последовательности, чтобы попасть в сферу действия изобретения, используется программа BLAST 2.2.2 от NCBI с параметрами по умолчанию. В программе BLAST 2.2.2 имеется около 38 параметров настройки. В данном типичном аспекте изобретения используются все значения по умолчанию, за исключением параметра фильтрования (т.е. все параметры по умолчанию, кроме фильтрования, которое устанавливается на OFF (отключено); вместо него устанавливается "-F F", при котором отключается фильтрование. Использование фильтрования по умолчанию зачастую ведет к нарушениям по Karlin-Altschul вследствие короткой длины последовательности.
Значения по умолчанию, используемые в данном типичном аспекте изобретения, включают:
фильтр для низкой сложности: ON (включен)
размер слова: 3
матрица: Blosum62
цена за наличие пробела: 11
цена за расширение пробела: 1.
Другие параметры по умолчанию: фильтр для низкой сложности: OFF (отключен), размер слова=3 для белков, матрица Blosum62, штраф за наличие пробела=-11 и штраф за расширение пробела=-1.
Термины "гомологичность" и "идентичность" в контексте двух или нескольких последовательностей нуклеиновых кислот или полипептидов означают то, что две или несколько последовательностей или подпоследовательностей являются одинаковыми либо имеют заданный процент одинаковых аминокислотных остатков или нуклеотидов при сравнении и совмещении по максимальному соответствию на отрезке окна сравнения или на заданном участке, при измерении по любому из числа алгоритмов сравнения последовательностей либо при совмещении вручную и визуальной оценке. При сравнении последовательностей одна последовательность может действовать как эталонная, с которой сравнивается исследуемая последовательность. При использовании алгоритма сравнения последовательностей в компьютер вводится исследуемая и эталонная последовательность, задаются координаты подпоследовательностей, если это нужно, и задаются параметры программы алгоритма сравнения. Можно использовать параметры программы по умолчанию или же задать альтернативные параметры. Затем алгоритм сравнения последовательностей рассчитывает процент идентичности для исследуемой последовательности относительно эталонной последовательности, исходя из параметров программы.
"Окно сравнения" в настоящем изобретении означает сегмент из любого числа смежных остатков. Например, в альтернативных аспектах изобретения смежные остатки, составляющие примерно от 20 до полной длины типичного полипептида или последовательности нуклеиновой кислоты по изобретению, сравнивают с эталонной последовательностью из того же числа смежных положений после оптимального совмещения двух последовательностей. Если исследуемая последовательность обладает требуемой идентичность с последовательностью белка или нуклеиновой кислоты по изобретению, то эта последовательность попадает в сферу действия изобретения.
Выражение "практически идентичны" в контексте двух нуклеиновых кислот или полипептидов означает то, что две последовательности имеют, напр., по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или больше идентичных нуклеотидов или аминокислотных остатков (последовательности) при сравнении и совмещении по максимальному соответствию, при измерении по любому известному алгоритму сравнения последовательностей, как подробно изложено ниже, либо при визуальной оценке. В альтернативных аспектах изобретения предусмотрены последовательности нуклеиновых кислот и полипептидов, практически идентичных типичной последовательности по изобретению. Последовательности нуклеиновых кислот по изобретению могут быть практически идентичными по всей длине кодирующей полипептид области.
Мотивы, которые можно выявить с помощью вышеприведенных программ, включают последовательности, кодирующие лейциновые застежки, мотивы типа спираль-изгиб-спираль, сайты гликозилирования, сайты убиквитинирования, альфа-спирали и бета-складки, сигнальные последовательности, кодирующие сигнальные пептиды, которые направляют секрецию кодируемых белков, последовательности, участвующие в регуляции транскрипции, как-то гомеорамки, кислотные отрезки, активные центры ферментов, сайты связывания субстратов и сайты энзиматического расщепления.
Для определения и установления идентичности последовательностей, структурной гомологии, мотивов и т.п. in silico последовательность по изобретению можно хранить, записывать и обрабатывать на любом носителе, который считывается и доступен для компьютера. Соответственно, изобретением предусмотрены компьютеры, компьютерные системы, считываемые компьютером носители, компьютерные программные продукты, на которых записаны и хранятся последовательности нуклеиновых кислот и полипептидов по изобретению. В настоящем изобретении слова "записаны" и "хранятся" относятся к процессу хранения информации на компьютерном носителе. Специалист легко сможет заимствовать известные методы записывания информации на считываемый компьютером носитель для создания изделий, содержащих одну или несколько последовательностей нуклеиновых кислот и/или полипептидов по изобретению.
Следующий аспект изобретения составляют считываемые компьютером носители, на которых записана, по меньшей мере, одна последовательность нуклеиновой кислоты и/или полипептида по изобретению. Считываемые компьютером носители включают магнитные носители, оптические носители, электронные носители и магнитные/оптические носители. Например, считываемые компьютером носители могут представлять собой жесткий диск, дискеты, магнитные ленты, CD-ROM, универсальный цифровой диск (DVD), запоминающее устройство с произвольной выборкой (RAM) или постоянное запоминающее устройство (ROM), а также и другие типы носителей, известные специалистам.
В настоящем изобретении термины "компьютер", "компьютерная программа" и "процессор" применяются в самом широком и общем смысле и охватывают все такие устройства.
Изобретением предусмотрены выделенные или рекомбинантные нуклеиновые кислоты, которые гибридизируются в строгих условиях с типичной последовательностью по изобретению. В альтернативных аспектах строгие условия составляют условия высокой строгости, условия средней строгости или условия низкой строгости, известные в этой области и описанные в настоящем изобретении. Эти методы могут применяться для выделения нуклеиновых кислот по изобретению.
В альтернативных аспектах нуклеиновые кислоты по изобретению, которые определяются по их способности гибридизироваться в строгих условиях, могут составлять от 5 остатков до полной длины нуклеиновой кислоты по изобретению, напр., они могут составлять в длину, по меньшей мере, 5, 10, 15, 20, 25, 30, 35, 40, 50, 55, 60, 65, 70, 75, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800 или больше остатков либо полную длину гена или кодирующей последовательности, напр., кДНК. Также включены нуклеиновые кислоты, более короткие, чем полная длина. Эти нуклеиновые кислоты могут быть полезными, напр., в качестве зондов для гибридизации, зондов для включения метки, олигонуклеотидных зондов для ПЦР, иРНК, антисмысловых или смысловых последовательностей, кодирующих связывающие пептиды антител (эпитопы), мотивы, активные центры и др.
"Гибридизация" означает процесс, в котором одна нить нуклеиновой кислоты соединяется с комплементарной нитью посредством спаривания оснований. Реакции гибридизации могут быть чувствительными и селективными, так что можно идентифицировать определенную последовательность даже в тех образцах, в которых она присутствует в низкой концентрации. Строгие условия могут определяться, к примеру, концентрацией соли или формамида в растворе для прегибридизации или гибридизации либо температурой гибридизации, которые хорошо известны. Например, строгость можно повысить уменьшением концентрацию соли, повышением концентрации формамида или повышением температуры гибридизации, изменением продолжительности гибридизации, как подробно описано ниже. В альтернативных аспектах нуклеиновые кислоты по изобретению определяются по их способности гибридизироваться в условиях различной строгости (напр., высокой, средней и низкой), как изложено в настоящем изобретении.
Условия низкой строгости включают и охватывают от 0 до 15% об. формамида и от 1 М до 2 М соли для гибридизации и от 1 М до 2 М соли для отмывки. Обычно низкая строгость соответствует температуре от 25-30°С до 42°С. Температуру можно изменить и использовать более высокие температуры, чтобы заменить формамид и/или получить альтернативные условия строгости. При необходимости можно использовать альтернативные условия строгости, как-то средней строгости, которые включают и охватывают от 16 до 30% об. формамида и от 0,5 М до 0,9 М соли для гибридизации и от 0,5 М до 0,9 М соли для отмывки, либо высокой строгости, которые включают и охватывают от 31 до 50% об. формамида и от 0,01 М до 0,5 М соли для гибридизации и от 0,01 М до 0,15 М соли для отмывки. В общем, отмывка проводится Tm=69,3+0,41(G+C)% (Marmur and Doty, J. Mol. Biol. 5: 109, 1962). Однако Tm двойной спирали ДНК уменьшается на 1°С при каждом повышении на 1% числа несовпадающих пар оснований (Bonner and Laskey, Eur. J. Biochem. 46:83, 1974). При этих условиях гибридизации оптимальным является формамид. Соответственно, особенно предпочтительные уровни строгости определяются следующим образом: низкая строгость - буфер 6×SSC, 0,1% SDS при 25-42°С; средняя строгость - буфер 2×SSC, 0,1% SDS при температуре от 20°С до 65°С; высокая строгость - буфер 0,1×SSC, 0,1% SDS при температуре не менее 65°С.
Если нуклеиновые кислоты по изобретению определяются по их способности гибридизироваться в условиях высокой строгости, то эти условия включают около 50% формамида при температуре от 37°С до 42°С. В одном аспекте нуклеиновые кислоты по изобретению определяются по их способности гибридизироваться в условиях меньшей строгости, включающих от 35% до 25% формамида при температуре от 30°С до 35°С. В качестве альтернативы нуклеиновые кислоты по изобретению определяются по их способности гибридизироваться в условиях высокой строгости, включающих 50% формамида при 42°С, 5×SSPE, 0,3% SDS в присутствии блокирующей повторяющиеся последовательности нуклеиновой кислоты, как-то cot-1 или ДНК из молок лосося (напр., 200 нг/мл нарезанной и денатурированной ДНК из молок лосося). В одном аспекте нуклеиновые кислоты по изобретению определяются по их способности гибридизироваться в условиях пониженной строгости, включающих 35% формамида при пониженной температуре в 35°С.
После гибридизации можно промывать фильтр 6×SSC, 0,5% SDS при 50°С. Эти условия считаются "средними" - более 25% формамида, а менее 25% формамида - "низкой строгости". Конкретный пример "средних" условий гибридизации - когда она проводится при 30% формамида. Конкретный пример условий гибридизации "низкой строгости" - когда она проводится при 10% формамида.
Температурный интервал, соответствующий определенному уровню строгости, можно еще больше сузить путем вычисления отношения пиринькпиримидины у данной нуклеиновой кислоты и соответствующего корректирования температуры. Нуклеиновые кислоты по изобретению также определяются по их способности гибридизироваться в условиях высокой, средней и низкой строгости, как изложено в Ausubel и Sambrook. Варьирование вышеприведенных интервалов и условий хорошо известно в этой области. Условия гибридизации дополнительно обсуждаются ниже.
Вышеописанная процедура может быть модифицирована для идентификации нуклеиновых кислот с пониженным уровнем гомологии к последовательности зонда. Например, чтобы получить нуклеиновые кислоты с пониженной гомологией к детектируемому зонду, можно использовать менее строгие условия. К примеру, можно снижать температуру гибридизации ступеньками по 5°С с 68°С до 42°С в буфере для гибридизации с концентрацией Na+ примерно в 1 М. После гибридизации можно промывать фильтр 2×SSC, 0,5% SDS при температуре гибридизации. Эти условия считаются "средними" - выше 50°С, а ниже 50°С - "низкой строгости". Конкретный пример "средних" условий гибридизации - когда она проводится при 55°С. Конкретный пример условий гибридизации "низкой строгости" - когда она проводится при 45°С.
В качестве альтернативы гибридизация может проводиться в таких буферах, как 6×SSC, содержащих формамид, при температуре 42°С. В этом случае концентрацию формамида в буфере для гибридизации можно снижать ступеньками по 5% с 50% до 0%, чтобы идентифицировать клоны с пониженным уровнем гомологии к зонду. После гибридизации можно промывать фильтр 6×SSC, 0,5% SDS при 50°С. Эти условия считаются "средними" - более 25% формамида, а менее 25% формамида - "низкой строгости". Конкретный пример "средних" условий гибридизации - когда она проводится при 30% формамида. Конкретный пример условий гибридизации "низкой строгости" - когда она проводится при 10% формамида.
Однако выбор формата гибридизации не является решающим - именно строгость условий отмывки задает условия, которые определяют, попадет ли нуклеиновая кислота в сферу действия изобретения. Условия отмывки, используемые для идентификации нуклеиновых кислот, попадающих в сферу действия изобретения, к примеру, включают концентрацию соли в 0,02 М при рН 7 и температуре не менее 50°С или от 55°С до 60°С; либо концентрацию соли в 0,15 М NaCl при 72°С в течение 15 минут; либо концентрацию соли в 0,2×SSC при температуре не менее 50°С или от 55°С до 60°С в течение от 15 до 20 минут; либо гибридизационный комплекс дважды отмывают раствором с концентрацией соли в 2×SSC, содержащем 0,1% SDS, при комнатной температуре в течение 15 минут, а затем дважды отмывают раствором 0,1×SSC, содержащем 0,1% SDS, при 68°С в течение 15 минут; либо эквивалентные условия. См. описание буфера SSC и эквивалентных условий в Sambrook, Tiissen или Ausubel.
В связанном с этим воплощении настоящего изобретения предусмотрен способ получения рекомбинантного интерферона III типа птиц в клетках, который включает стадии:
(i) введения в данные клетки генетической конструкции, включающей молекулу нуклеиновой кислоты, кодирующей или комплементарной молекуле нуклеиновой кислоты, кодирующей данный интерферон III типа птиц, которая поставлена под контроль соответствующей последовательности промотора;
(ii) культивирования данных клеток в течение времени и в условиях, достаточных для экспрессирования данной молекулы нуклеиновой кислоты; и
(iii) выделения данного продукта экспрессии.
В следующем родственном воплощении настоящего изобретения предусмотрен и способ получения слитой молекулы интерферона III типа птиц в клетках, который включает введение в данные клетки генетической конструкции, включающей молекулу нуклеиновой кислоты, кодирующей или комплементарной молекуле нуклеиновой кислоты, кодирующей полипептид интерферона III типа птиц либо его функциональный фрагмент, производное или птичий гомолог, причем данный полипептид представляет собой слитый полипептид между первым интерфероном III типа и вторым интерфероном III типа либо первым интерфероном III типа и вторым интерфероном I типа или II типа, выбранным из списка, включающего, среди прочего, IFN-α, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ.
Соответственно, в следующем родственном воплощении настоящего изобретения предусмотрен и рекомбинантный слитый полипептид между первым интерфероном III типа и вторым интерфероном III типа либо первым интерфероном III типа и вторым интерфероном I типа или II типа, выбранным из списка, включающего, среди прочего, IFN-αa, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ.
В соответствии с вышеприведенными воплощениями, описанными в этом аспекте изобретения, рекомбинантный интерферон III типа птиц предпочтительно представляет собой молекулу полипептида IFN-λ птиц или содержащую его слитую молекулу. В особенно предпочтительном воплощении интерферон III типа представляет собой полипептид chIFN-λ.
В альтернативном воплощении настоящего изобретения предусмотрена генетическая конструкция, включающая молекулу нуклеиновой кислоты, приведенной выше, либо молекулу нуклеиновой кислоты, кодирующую или комплементарную молекуле нуклеиновой кислоты, кодирующей слитый полипептид интерферона III типа птиц либо его функциональный фрагмент или производное, причем данный полипептид представляет собой слитый полипептид между интерфероном III типа и вторым интерфероном III типа либо первым интерфероном III типа и вторым интерфероном I типа или II типа, выбранным из списка, включающего, среди прочего, IFN-α, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ.
Предпочтительно данный интерферон III типа представляет собой IFN-λ, в особенности chIFN-λ.
Для того, чтобы получить слитый полипептид, молекулу нуклеиновой кислоты, кодирующую первую кодирующую область, включающую полипептид интерферона III типа птиц либо его функциональный фрагмент или производное, клонируют рядом со второй кодирующей областью, необязательно отделенной молекулой нуклеиновой кислоты-счпейсера таким образом, что первая кодирующая область и вторая кодирующая область находятся в одной и той же рамке считывания, без промежуточных стоп-кодонов между двумя кодирующими областями. При трансляции полученный при этом полипептид составляет слитый полипептид между продуктами первой и второй кодирующей области. Генетическая конструкция, кодирующая слитый полипептид, дополнительно содержит, по меньшей мере, один старт-кодон и один стоп-кодон, которые распознаются аппаратом трансляции тех клеток, в которых намечается экспрессия. Способы получения слитых полипептидов хорошо известны специалистам.
Следующий аспект настоящего изобретения касается антител к молекулам белков и нуклеиновых кислот, приведенных выше. Такие антитела могут быть моноклональными или поликлональными и могут быть выбраны из встречающихся в природе антител или выработаны специально. В последнем случае антиген - полипептид или нуклеиновую кислоту chIFN-λ нужно сначала ассоциировать с молекулой носителя для выработки иммуногенности. Антитела настоящего изобретения применимы в качестве лечебных или диагностических средств. Антитела "к" какой-либо молекуле включают антитела, специфичные к этой молекуле.
Эти антитела могут применяться для выделения, идентификации или количественного определения полипептида по изобретению или родственных полипептидов.
Термин "антитело" охватывает пептиды или полипептиды, происходящие из, созданные на основе или существенно кодируемые геном иммуноглобулина или генами иммуноглобулинов, либо их фрагменты, которые способны специфически связываться с антигеном или эпитопом, напр., см. Fundamental Immunology, 3rd edition, W.E. Paul, ed., Raven Press, N.Y. (1993); Wilson et al. (1994) J. Immunol. Methods 175: 267-273; Yarmush et al. (1992) J. Biochem. Biophys. Methods 25 (4); 285-297. Термин "антитело" включает антиген-связывающие части, т.е. "антиген-связывающие сайты" (напр., фрагменты, подпоследовательности, участки комплементарности (CDR)), сохраняющие способность к связыванию антигена, в том числе (i) Fab-фрагменты - одновалентные фрагменты, состоящие из доменов VL, VH, CL и СН1; (ii) F(ab')2-фрагменты - двухвалентные фрагменты, содержащие два Fab-фрагмента, соединенные дисульфидным мостиком на шарнирном участке; (iii) Fd-фрагменты, состоящие из доменов VH и СН1; (iv) Fv-фрагменты, состоящие из доменов VL и VH одного плеча антитела; (v) dAb-фрагменты которые состоят из домена VH; и (vi) выделенные участки, определяющие комплементарность (CDR). Одноцепочечные антитела также охватываются термином "антитело".
Антитела к молекулам настоящего изобретения могут быть моноклональньши или поликлональными и могут быть выбраны из встречающихся в природе антител или выработаны специально к этим полипептидам и продуктам генов. Настоящее изобретение распространяется и на рекомбинантные и синтетические антитела и на гибриды антител. К "синтетическим антителам" в настоящем изобретении относятся фрагменты и гибриды антител. Антитела по этому аспекту настоящего изобретения особенно полезны для иммунотерапии, а также могут применяться как инструменты диагностики или средства для очистки рассматриваемых молекул полипептидов или нуклеиновых кислот.
Методы иммунизации, получения и выделения антител (поликлональных и моноклональных) известны специалистам и описаны в научной и патентной литературе, напр., см. Coligan, Current Protocols in Immunology, Wiley/Greene, NY (1991); Stites (eds.) Basic and Clinical Immunology (7th ed.) Lange Medical Publications, Los Altos, CA ("Stites"); Goding, Monoclonal Antibodies: Principles and Practice (2nd ed.) Academic Press, New York, NY (1986); Kohler (1975) Nature 256: 495; Harlow (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Publications, New York. Антитела также могут быть созданы in vitro, напр., с помощью библиотек фагового дисплея, экспрессирующих рекомбинантные связывающие сайты антител, вдобавок к традиционным методам in vivo на животных, напр., см. Hoogenboom (1997) Trends Biotechnol. 15: 62-70; Katz (1997) Annu. Rev. Biophys. Biomol. Struct. 26: 27-45.
Поликлональные антитела против полипептидов изобретения могут быть получены непосредственно путем инъекции полипептидов животному либо введения полипептидов животному, а не человеку. Полученные при этом антитела будут связываться с самим полипептидом. Таким образом, можно использовать даже последовательность, кодирующую лишь фрагмент полипептида, для выработки антител, которые могут связываться с целым нативным полипептидом. Такие антитела можно затем использовать для выделения полипептида из клеток, экспрессирующих этот полипептид.
Для получения моноклональных антител можно использовать любой метод, который дает антитела, вырабатываемые непрерывной культурой линии клеток. Примеры включают метод гибридомы, метод триомы, метод гибридомы В-клеток человека и метод EBV-гибридомы (напр., см. Cole (1985) in Monoclonal Antibodies and Cancer Therapy, Alan. Liss, Inc., pp.77-96).
Методы, описанные для получения одноцепочечных антител (напр., см. U.S. Patent No.4,946,778), можно адаптировать для получения одноцепочечных антител к полипептидам изобретения, В качестве альтернативы можно использовать трансгенных мышей для экспрессирования гуманизованных антител к этим полипептидам или их фрагментам.
Термин "производное" в настоящем изобретении охватывает участки, фрагменты и части молекулы нуклеиновой кислоты или продукта ее трансляции. Производное также может представлять собой единственную или множественную замену, делецию и/или добавление нуклеотидов или аминокислот. Производные молекул нуклеиновой кислоты настоящего изобретения также включают молекулы нуклеиновых кислот, способных гибридизироваться с нуклеотидной последовательностью, приведенной в SEQ ID NO:1 или 3, в условиях, по меньшей мере, низкой строгости. Производные молекул нуклеиновой кислоты настоящего изобретения, приведенных в настоящем изобретении, также включают олигонуклеотиды, праймеры для ПЦР, антисмысловые молекулы, молекулы, предназначенные для совместной супрессии, и слитые молекулы нуклеиновых кислот. Также предусмотрены некоторые молекулы, способные регулировать экспрессию гена chIFN-λ.
Производные молекул полипептидов, приведенных в настоящем изобретении, включают фрагменты, части, участки, мутанты, варианты из природных, синтетических или рекомбинантных источников, включая слитые белки. Производные включают фрагменты с определенными эпитопами или части целого белка, слитые с пептидами, полипептидами либо иными белковыми или небелковыми молекулами. Части или фрагменты включают, к примеру, активные участки полипептида chIFN-λ. Производные могут возникать при вставке, делеции или замене аминокислот. Обычно их получают путем введения одиночных или множественных замен, делеции и/или добавлений нуклеотидов в кодирующую нуклеиновую кислоту. С другой стороны, если известна аминокислотная последовательность, то можно добавлять аминокислоты общепризнанными методами и в любой последовательности, необходимой для получения нужного мутанта. Все такие производные охватываются настоящим изобретением.
Производные интерферона III типа птиц со вставками аминокислот по настоящему изобретению включают слияния по N- и/или С-концам, а также вставки одиночных или множественных аминокислот внутри последовательности. Варианты последовательности со вставками аминокислот представляют собой такие варианты, у которых в белок в заданное место введен один или несколько остатков аминокислот, хотя возможна и случайная вставка при соответствующем скрининге образующегося продукта. Варианты с делениями аминокислот характеризуются удалением одной или нескольких аминокислот из последовательности. Варианты с заменами аминокислот представляют собой такие варианты, у которых по меньшей мере, один остаток в последовательности был удален, а на его место вставлен другой остаток. Типичные замены осуществляются в соответствии с таблицей 2.
Если производное интерферона III типа птиц получают путем замены аминокислот, то аминокислоты обычно заменяют другими аминокислотами с похожими свойствами, как-то гидрофобность, гидрофильность, электроотрицательность, объемистые боковые цепи и др. Замены аминокислот обычно относятся к одиночным остаткам. Вставки аминокислот обычно составляют порядка 1-10 аминокислотных остатков, а делеции составляют 1-20 остатков. Предпочтительно делеции или вставки делаются смежными парами, напр., делеция двух остатков и соответствующая вставка двух остатков.
Варианты с заменами аминокислот представляют собой такие варианты, у которых, по меньшей мере, один остаток в последовательности был удален, а на его место вставлен другой остаток. Примером вариантов с заменами аминокислот являются консервативные замены аминокислот. Как правило, консервативные замены аминокислот включают замены внутри следующих групп: глицин и аланин; валин, изолейцин и лейцин; аспарагиновая кислота и глутаминовая кислота; аспарагин и глутамин; серин и треонин; лизин и аргинин; фенилаланин и тирозин. Добавления к последовательностям аминокислот включают слияния с другими пептидами, полипептидами или белками.
Другие примеры рекомбинантных или синтетических мутантов и производных полипептида интерферона III типа птиц по настоящему изобретению включают одиночные или множественные замены, делеции и/или добавления в любой молекуле, связанной с полипептидом, как-то углеводах, липидах и/или белках или полипептидах.
Для удобства и в качестве краткого обозначения в настоящем изобретении ссылки на интерферон III типа птиц типа IFN-λ, chIFN-λ или на подобный интерферону птиц полипептид включают ссылки и на их производные, как предусмотрено выше.
Ссылки на "фрагменты" включают ссылки и на части и участки из природных, синтетических или рекомбинантных источников, в том числе слитые белки. Части или фрагменты включают, к примеру, активные участки chIFN-λ.
В настоящем изобретении "птичьи гомологи" последовательности нуклеотидов следует понимать как обозначение таких выделенных молекул нуклеиновой кислоты, которые практически такие же, как молекула нуклеиновой кислоты настоящего изобретения или комплементарная ей последовательность нуклеотидов, несмотря на то, что в данной последовательности встречается одна или несколько замен, вставок, делеции или перестановок нуклеотидов. Гомологи также следует понимать как молекулы нуклеиновой кислоты или белка, выделенные из или же соответствующие молекулам, встречающимся у других видов птиц, чем куры. "Гомолог" означает такую последовательность (нуклеотидов или белка) в другом эукариотическом организме, которая, по меньшей мере, на 60% и предпочтительно на 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%) или 99% идентична эталонной последовательности.
Ссылки на "функциональный" фрагмент, производное или птичий гомолог следует понимать как относящиеся к молекуле, которая способна выполнять одну или несколько активностей IFN-γ птиц, как изложено выше. В частности, ссылки на функциональный фрагмент, производное или птичий гомолог следует понимать как относящиеся к полипептиду, белку или иному веществу, которое способно вызывать или модулировать иммунный ответ у птиц на такой антиген или возбудитель инфекции, как вирус инфекционного бронхита, вирус инфекционного ларинготрахеита птиц, вирус болезни Newcastle, вирус болезни Марека, вирус анемии кур, вирус птичьего гриппа, Е.coli, Salmonella ssp., Eimeria ssp. или Mycoplasma ssp., среди прочего.
В следующем аспекте настоящего изобретения предусмотрен способ идентификации генетической последовательности интерферона III типа птиц либо его функционального фрагмента или производного.
В одном воплощении данный способ включает контактирование образца нуклеиновой кислоты с эффективным для гибридизации количеством зонда на интерферон III типа птиц, а затем детектирование данной гибридизации.
Такой образец нуклеиновой кислоты может включать, к примеру, геномную ДНК, мРНК или кДНК.
Генетическая последовательность может находиться в рекомбинантном виде, в частицах вируса, частицах бактериофага, дрожжевых клетках, клетках животных или клетках растений. Предпочтительно генетическая последовательность происходит из вида птиц, выбранного из списка, включающего кур, индеек, бентамок, перепелов, цесарок, уток, гусей, страусов, эму, голубей, канареек, волнистых попугайчиков, попугаев и зябликов, среди прочего. В особенно предпочтительном воплощении генетическая последовательность происходит из кур.
Предпочтительно зонд на интерферон III типа птиц содержит последовательность нуклеотидов, по меньшей мере, из 10, 20, 30, 40 или 50 нуклеотидов, хотя в настоящем изобретении также предусмотрено использование и больших зондов, происходящих из или относящихся к нуклеотидной последовательности, приведенной в SEQ ID NO:1 или 3, или комплементарной ей, либо ее функционального фрагмента или производного. Предпочтительно эта последовательность помечена молекулой репортера, способного издавать различимый сигнал (напр., такого радиоизотопа, как Р или S, либо биотинилированной молекулой).
В альтернативном воплощении настоящего изобретения предусмотрен способ идентификации генетической последовательности интерферона III типа птиц либо его функционального фрагмента или производного, который включает контактирование двух некомплементарных "молекул праймеров" из нуклеиновой кислоты длиной, по меньшей мере, в 12 нуклеотидов, происходящих из последовательности нуклеотидов гена цитокина III типа птиц, с матричной молекулой нуклеиновой кислоты, содержащей нуклеотидные последовательности, родственные последовательностям молекул праймеров, и амплифицирование специфических копий матричной молекулы нуклеиновой кислоты в реакции амплификации.
В одном примере молекула первого праймера предпочтительно направлена на смысловую нить гена IFN-λ птиц, как-то гена chIFNλ, в частности нуклеотидной последовательности, приведенной в SEQ ID NO:1 или 3, либо его гомолога или производного, а молекула второго праймера предпочтительно направлена на антисмысловую нить гена IFN-λ птиц, как-то гена chIFNλ, в частности комплементарную нуклеотидной последовательности, приведенной в SEQ ID NO:1 или 3, либо его гомолога или производного. Соответственно, оба праймера гибридизируются с данной матричной молекулой таким образом, что в присутствии фермента ДНК-полимеразы, кофактора и соответствующего субстрата происходит синтез ДНК в направлении 5'-3' из каждой молекулы праймера к тому положению в ДНК, в котором гибридизируется молекула другого праймера, при этом происходит амплификация расположенной между ними ДНК.
Молекула нуклеиновой кислоты праймера может при этом состоять из комбинации нуклеотидов из числа аденина, цитозина, гуанина, тимидина и инозина либо их функциональных аналогов или производных, способных встраиваться в молекулу полинуклеотида при условии, что она способна гибридизироваться в условиях, по меньшей мере, низкой строгости с молекулой нуклеиновой кислоты, приведенной в SEQ ID NO:1 или 3.
Молекулы нуклеиновых кислот праймеров при этом могут содержаться в водном пуле, включающем молекулы нуклеиновых кислот других праймеров. Более предпочтительно молекулы нуклеиновых кислот праймеров находятся в практически чистом виде.
Матричная молекула нуклеиновой кислоты может находиться в рекомбинантном виде, в частицах вируса, частицах бактериофага, дрожжевых клетках, клетках животных или клетках растений. Предпочтительно соответствующая генетическая последовательность происходит из клеток, ткани или органа птиц. Более предпочтительно соответствующая генетическая последовательность происходит из клеток, ткани или органа курицы.
Как должно быть известно специалистам, экспрессию гена или модулирование экспрессии гена-мишени in vitro можно определить по измерению изменений уровня продукта экспрессии данного гена.
Соответственно, в следующем воплощении изобретения предусмотрен способ детектирования присутствия полипептида интерферона III типа птиц либо его функционального фрагмента, производного или гомолога.
Для прямого или косвенного определения уровня полипептидов можно использовать целый ряд хорошо известных методов. К таким методам относятся иммунохимические методы, как-то westem-гибридизация, ELISA, иммунопреципитация и RIA, методы гель-электрофореза, включая одно- и двумерные гели, методы на основе хроматографического разделения белков и пептидов, методы с использованием слитых с белком конструкций репортеров и колориметрических реакций, методы на основе изучения активности транслируемой на полисомах мРНК и масс-спектрометрические методы.
При применении способов скрининга по изобретению тестируемое соединение можно контактировать с полипептидом изобретения in vitro либо ввести в клетки по изобретению или организм птицы in vivo. He ограничивая настоящее изобретение какой-либо теорией или механизмом действия, ссылки на тестируемое соединение относятся и к иммунореактивным молекулам типа "антител", приведенных в настоящем изобретении.
Методы иммуноанализа применимы для анализа наличия цитокина в организме птиц, в частности выявления иммунного ответа, при котором меняется уровень данного цитокина птиц, к примеру, после заражения патогеном. Поэтому такой иммуноанализ имеет особенное применение при определении того, подвергалась ли птица воздействию патогена либо она еще и сейчас заражена патогеном или долгое время страдает слабовыраженной патогенной инфекцией. Методы иммуноанализа также применимы для количественного определения цитокинов, в частности при скрининге генетических пород на наличие хорошо экспрессирующих цитокины линий с улучшенной устойчивостью к вызывающему заболевание патогену. Настоящее изобретение распространяется на все случаи такого применения иммунореактивных молекул и диагностические анализы, для проведения которых требуются данные методы иммуноанализа.
Методы иммуноанализа в широком смысле могут быть такими, как описанные в U.S. Patent Nos.4,016,043, 4,424,279 и 4,018,653. Эти методы могут использоваться для выявления интерферон III типа. Только в качестве примера: антитело против chIFN-λ иммобилизируют на твердом субстрате с образованием первого комплекса и в контакт со связавшимися молекулами приводят биологический образец из животного, подлежащего тестированию на присутствие цитокина. После соответствующего периода инкубации в течение времени, достаточного для образования вторичного комплекса антитело-цитокин, добавляют второе антитело против chIFN-λ, меченное молекулой репортера, способного издавать детектируемый сигнал, и инкубируют в течение времени, достаточного для образования третичного комплекса антитело-цитокин-меченное антитело. Непрореагировавший материал отмывают и определяют наличие третичного комплекса, регистрируя сигнал, издаваемый молекулой репортера. Результаты могут быть либо качественными, просто путем наблюдения видимого сигнала, либо могут быть выражены количественно путем сравнения с контрольным образцом, содержащим известное количество гаптена. Варианты этого метода включают одновременный метод, в котором и образец, и меченое антитело добавляют к фиксированному антителу одновременно, либо обратный метод, в котором меченое антитело и тестируемый образец сначала смешивают, инкубируют, а затем одновременно добавляют к фиксированному антителу. Эти методы хорошо известны специалистам, а возможность небольших изменений вполне очевидна. Используемые выше антитела могут быть моноклональными или поликлональньми.
Твердым субстратом, как правило, служит стекло или полимер, причем чаще всего используются такие полимеры, как целлюлоза, полиакриламид, нейлон, полистирен, поливинилхлорид или полипропилен. Твердые подложки могут иметь вид пробирок, зерен, дисков либо микропланшетов или любой иной поверхности, пригодной для проведения иммуноанализа. Процессы связывания хорошо известны и обычно заключаются в сшивании, ковалентном связывании или физической адсорбции молекулы на нерастворимом носителе.
Под "молекулой-репортером" в настоящем описании имеется в виду молекула, которая, по своей химической природе, издает аналитически определяемый сигнал, что позволяет детектировать связанное с антигеном антитело. Детектирование может быть либо качественным, либо количественным. Чаще всего при анализе этого типа в качестве молекул-репортеров используются ферменты, флуорофоры или молекулы, содержащие радионуклиды (т.е. радиоизотопы). В случае ферментного иммуноанализа фермент конъюгируют со вторым антителом, обычно с помощью глутаральдегида или периодата. Однако вполне понятно, что существует большое разнообразие различных методов конъюгирования, которые легко доступны специалистам. Обычно используются такие ферменты, как пероксидаза хрена, глюкозоксидаза, β-галактозидаза и щелочная фосфатаза, среди прочего. Субстраты для конкретных ферментов обычно выбираются по появлению, при гидролизе соответствующим ферментом, детектируемого изменения окраски. Также можно использовать флуорогенные субстраты, дающие флуоресцентный продукт.
С другой стороны, такие флуоресцентные соединения, как флуоресцеин и родамин, можно химически конъюгировать с антителами без изменения их связывающей способности. При активации при освещении светом определенной длины волны меченное флуорохромом антитело поглощает энергию света, что индуцирует у молекулы состояние возбудимости с последующим светоизлучением характерного цвета, который визуально различим под световым микроскопом. Как и в методе EIA, флуоресцентно меченное антитело связывается с комплексом первое антитело-гаптен. После отмывки несвязавшегося реагента оставшийся комплекс освещают светом соответствующей длины волны, при этом флуоресценция указывает на присутствие данного гаптена. Методы иммунофлуоресценции и EIA очень хорошо утвердились в этой области и они особенно предпочтительны для настоящего способа. Однако можно использовать и другие молекулы-репортеры, как-то радиоизотопные, хемилюминесцентные или биолюминесцентные молекулы. Специалисту должно быть вполне очевидно, как видоизменить методику с тем, чтобы она соответствовала требуемой цели,
Вышеприведенные антитела также применимы при очистке рекомбинантного цитокина птиц по настоящему изобретению. Методы аффинной очистки белков с помощью антител хорошо известны специалистам.
Идентификация и секвенирование интерферона III типа птиц, раскрытого в настоящем изобретении, должно способствовать разработке ряда методик диагностики и профилактики/лечения в отношении заболеваний птиц. Оно также способствует разработке реагентов для них. Соответственно, настоящее изобретение распространяется и на применение раскрытого в нем полипептида интерферона III типа птиц или его функционального фрагмента, производного или гомолога при терапевтическом и/или профилактическом лечении птиц.
Так, настоящее изобретение особенно полезно при терапевтическом и/или профилактическом лечении птиц, зараженных патогенным организмом. Однако нужно иметь в виду, что ссылки на профилактическое лечение в настоящем изобретении также распространяются на профилактику или лечение здоровых птиц с тем, чтобы обеспечить защиту от инфекции или иной благоприятный исход.
Соответственно, в одном аспекте предусмотрен способ индуцирования или усиления иммунного ответа у птиц, который включает введение данным птицам эффективного количества вышеприведенного полипептида или молекул нуклеиновой кислоты в течение времени и в условиях, достаточных для индуцирования, усиления или иного поддержания иммунного ответа.
В следующем аспекте настоящего изобретения предусмотрен способ лечения или профилактики птиц, который включает введение данным птицам эффективного количества вышеприведенного полипептида или молекул нуклеиновой кислоты интерферона III типа птиц либо его функционального фрагмента, производного или гомолога в течение времени и в условиях, достаточных для поддержания, стимуляции или усиления иммунореактивности данных птиц.
В следующем аспекте настоящего изобретения предусмотрен способ лечения или профилактики птиц, подвергавшихся воздействию или инфицированных патогенным организмом, который включает введение данным птицам эффективного количества вышеприведенного полипептида или молекул нуклеиновой кислоты интерферона III типа птиц либо его функционального фрагмента, производного или гомолога.
В предпочтительном воплощении настоящего изобретения данные птицы включают домашних птиц, комнатных птиц и охотничье-промысловых птиц.
Термин "птицы" в настоящем изобретении распространяется на кур, индеек, бентамок, перепелов, цесарок, уток, гусей, страусов, эму, голубей, канареек, волнистых попугайчиков, попугаев и зябликов, среди прочего. Особенно предпочтительными птицами являются домашние птицы, комнатные птицы или охотничье-промысловые птицы, более предпочтительно куры.
В соответствии с вышеприведенным воплощением особенно предпочтительно данный цитокин птиц представляет собой молекулу интерферона III типа, в частности IFN-λ.
В наиболее предпочтительном воплощении данный цитокин птиц представляет собой chIFN-λ.
Настоящее изобретение особенно применимо при лечении или профилактике птиц от заражения такими патогенами, как бактерии, вирусы или паразиты. Примеры таких патогенов включают вирус птичьего гриппа, вирус инфекционного бурсита, вирус инфекционного бронхита птиц, вирус инфекционного ларинготрахеита птиц, вирус болезни Newcastle, вирус болезни Марека, вирус анемии кур, вирус птичьего гриппа, Е.coli, Salmonella ssp., Eimeria ssp. или Mycoplasma ssp., среди прочего.
Ссылки на "лечение" и "профилактику" в настоящем изобретении следует понимать в самом широком смысле. Термин "лечение" не обязательно означает, что млекопитающее подвергается лечению до полного выздоровления. Аналогичным образом и "профилактика" не обязательно означает, что субъект впоследствии не приобретет заболевание. Соответственно, лечение и профилактика включают улучшение симптомов определенного заболевания либо предотвращение или иное снижение риска появления определенного заболевания. Термин "профилактика" можно понимать как уменьшение тяжести или срока возникновения определенного заболевания. "Лечение" также может уменьшить тяжесть существующего заболевания.
"Эффективное количество" означает количество, необходимое, по крайней мере, частично, для достижения требуемой реакции или замедления возникновения или торможения прогрессирования или полной задержки возникновения или прогрессирования определенного заболевания у подлежащего лечению индивидуума с учетом его таксономической группы, требуемой степени защиты, рецептуры вакцины, оценки медицинской ситуации и других уместных факторов. Предполагается, что это количество попадет в относительно широкий интервал, который можно определить посредством рутинных тестов.
В альтернативном воплощении настоящего изобретения предусмотрен способ лечения или профилактики птиц, подвергавшихся воздействию или зараженных патогенным организмом, который включает введение данным птицам эффективного количества первого цитокина птиц, включающего интерферон III типа, в сочетании со второй молекулой цитокина птиц, в течение времени и в условиях, достаточных для поддержания, стимуляции или усиления иммунореактивности данных животных.
Данные первый и второй цитокины могут вводиться совместно в виде двух молекул либо они могут вводиться в виде слитой молекулы. Предпочтительно второй цитокин птиц выбирается из таких интерферонов I типа или II типа, как IFN-α, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ, среди прочего, а также интерферона III типа или любого другого цитокина птиц.
В наиболее предпочтительном воплощении данный первый цитокин птиц и данный второй цитокин птиц представляет собой слитую молекулу.
В соответствии с этим воплощением изобретения первый и второй цитокины птиц взаимодействуют с иммунной системой животного, чтобы стимулировать, усиливать или иным образом модулировать иммунореактивность иммунной системы против поражения патогеном.
Следующий аспект настоящего изобретения касается полипептида интерферона III типа птиц или кодирующей его молекулы нуклеиновой кислоты для применения при лечении или профилактике птиц.
Следующий аспект настоящего изобретения касается применения полипептида или молекулы нуклеиновой кислоты интерферона III типа птиц при производстве медикамента для модулирования иммунного ответа у птиц и/или для лечения или профилактики птиц.
Предпочтительно данная молекула интерферона III типа птиц представляет собой IFN-λ, в частности chIFN-λ.
Интерферон III типа по настоящему изобретению можно вводить в течение всего жизненного цикла тех птиц, для которых предназначается лечение или профилактика. Стадия развития птиц, на которой лечение или профилактика наиболее эффективны, зависит от природы того патогена, против которого нужна защита, включая способ его передачи и период наибольшей инфективности. Под "периодом наибольшей инфективности" имеется в виду стадия развития хозяина, на которой он наиболее подвержен поражению определенным патогеном и/или на которой имеется наибольшая вероятность возникновения потерь скота или снижения продуктивности в результате заражения патогеном. Параметры, затрагивающие оптимальные стадии развития животных для введения рассматриваемых цитокинов, должны быть хорошо известны специалистам.
Соответственно, способ лечения или профилактики по настоящему изобретению распространяется на введение рассматриваемого цитокина птиц на любой стадии развития в жизненном цикле тех домашних, комнатных или охотничье-промысловых птиц, для которых предназначается лечение или профилактика.
Цитокин или молекулу нуклеиновой кислоты по изобретению можно вводить любым способом, в том числе, к примеру, посредством инъекции in ovo или после вылупливания, как-то введения внутрибрюшинно, интрадермально, внутримышечно, интраокулярно, внутривенно, подкожно либо иным способом инъекции; посредством приема внутрь в виде лекарственного продукта питания или терапевтического продукта питания; либо посредством введения птицам выделенной молекулы нуклеиновой кислоты, кодирующей или комплементарной молекуле нуклеиновой кислоты, кодирующей данный цитокин, или же вектора, содержащего генетическую конструкцию, способную экспрессировать данный цитокин in vivo или in ovo, к примеру, живого рекомбинантного вирусного вектора, живого рекомбинантного бактериального вектора.
Если цитокин по изобретению вводится посредством введения выделенной молекулы нуклеиновой кислоты, кодирующей данный цитокин, как-то молекулы ДНК или РНК, либо вектора, содержащего генетическую конструкцию, способную экспрессировать данный цитокин, то молекула нуклеиновой кислоты или генетическая конструкция должна транскрибироваться и транслироваться с образованием биологически активной молекулы цитокина после их введения соответствующим птицам.
Другое важное применение цитокинов настоящего изобретения - в качестве природных адъювантов для вакцин, в особенности для субъединичных или синтетических пептидных вакцин, получаемых по технологии рекомбинантной ДНК.
Термин "адъювант" в настоящем изобретении служит для обозначения вещества, которое при введении животному в сочетании со вторым веществом или антигеном повышает продукцию иммунореактивных молекул типа антител, которые распознают второе вещество или молекулу антигена. Адъювант может применяться в терапии для выработки антител против небольшого количества антигена или для продления периода продукции антител или для повышения количества вырабатываемых антител. Не стремясь ограничиваться какой-либо теорией или механизмом действия, адъюванты действуют, вызывая локальный приток вырабатывающих антитела клеток к месту введения.
Соответственно, в следующем аспекте настоящего изобретения предусмотрен адъювант, включающий молекулу цитокина птиц, причем данный цитокин представляет собой интерферон III типа либо слитую молекулу между молекулой интерферона III типа и второй молекулой цитокина, а также, необязательно, фармацевтически приемлемый носитель, наполнитель или разбавитель.
Предпочтительно данная молекула интерферона III типа птиц представляет собой IFN-λ, в частности chIFN-λ.
Если данный цитокин птиц представляет собой слитую молекулу, то вторым цитокином может быть любая молекула цитокина, которая функционирует у птиц, в частности IFN-α, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ, либо молекула интерферона III типа или любого другого цитокина.
В соответствии с настоящим изобретением, цитокин птиц типа интерферона III типа, в частности chIFN-λ, применяется в вакцинах для повышения иммуногенности антигенов, особенно в субъединичных вакцинах, что ведет к повышению титра антител у индивидуальных птиц, усилению защиты птиц, иммунизированных против конкретного антигена (т.е. повышению у них иммунитета), и/или возрастанию продолжительности существования защитных антител у иммунизированных птиц. Дополнительным преимуществом, которое обеспечивает настоящее изобретение, является уменьшение количества специфического антигена, необходимого для эффективной иммунизации животных, что ведет к снижению производственных затрат.
Цитокин или вакцину, описанную в этих воплощениях изобретения, можно вводить любым способом, в том числе, к примеру, посредством инъекции in ovo или после вылупливания, как-то введения внутрибрюшинно, интрадермально, внутримышечно, интраокулярно, внутривенно, подкожно либо иным способом инъекции; путем приема внутрь в виде лекарственного продукта питания или терапевтического продукта питания.
Прогресс в технологии замедленного высвобождения и разработка живых непатогенных бактерий и вирусов в качестве векторов для доставки этих молекул должны обеспечить их рентабельность при введении домашним, комнатным или охотничье-промысловым птицам. Их также можно использовать при вакцинации нуклеиновой кислотой. Соответственно, цитокин птиц или вакцину настоящего изобретения можно доставлять и генетическим способом. Например, рекомбинантный chIFN-λ птиц может кодироваться генетической конструкцией, находящейся в системе доставки типа вируса, дрожжевых клеток, бактерий, простейших, клеток насекомых, птиц или млекопитающих. Экспрессия такой системы доставки в организме животного обеспечит доставку рекомбинантного цитокина птиц.
В соответствии с этим воплощением предусмотрена генетическая конструкция, включающая: (i) последовательность нуклеотидов, кодирующую интерферон III типа птиц либо слитую молекулу цитокина между данным интерфероном III типа и вторым цитокином, поставленную функционально под контроль первой последовательности промотора; (ii) вторую последовательность нуклеотидов, задающую антиген, против которого нужна иммунизация, поставленную функционально под контроль второй последовательности промотора; и (iii) средство доставки, содержащее генетические последовательности, способствующие репликации данной генетической конструкции в осуществляющих доставку клетках, как-то бактериальных, дрожжевых клетках, клетках насекомых, простейших или млекопитающих.
Предпочтительно данный интерферон III типа представляет собой IFN-λ, в частности chIFN-λ. К тому же предпочтительно второй цитокин выбирается из списка, включающего IFN-α, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ, а также интерферон III типа или любой другой цитокин.
В соответствии с этим воплощением средство доставки при нормальном применении не должно быть вредным или патогенным для животного-мишени. Обычно используются ослабленные средства доставки. Особенно полезными средствами доставки являются такие векторы, как ослабленные вирусы и рекомбинантные вирусные и бактериальные векторы.
Например, ослабленный вирусный вектор используется в качестве живой вакцины. Генетическую последовательность, кодирующую цитокин птиц типа chIFN-λ или его производное, клонируют в вирусную последовательность, а рекомбинантный вирус используют для инфицирования искомых животных. Рекомбинантный вирус вызывает инфекцию и реплицируется в клетках животного, что приводит к продукции рекомбинантного цитокина. Инфицирующий рекомбинантный вирус впоследствии может элиминироваться после выработки эффективного иммуномодулирующего количества рекомбинантного цитокина. Аналогичная методика применяется с живыми бактериальными носителями. С другой стороны, можно использовать нереплицирующийся, неинфекционный вирусный вектор. Нереплицирующийся вирусный вектор служит средством введения генетической последовательности, обладающей способностью кратковременно экспрессировать требуемый цитокин, поскольку нереплицирующийся вирусный вектор не может переходить из одной клетки в другую.
Настоящее изобретение дает возможность усилить иммунный ответ у животных, в частности у домашних, комнатных и охотничье-промысловых птиц (как-то описанных выше), путем введения цитокина птиц, в частности интерферона III типа, как-то chIFN-λ или его производного, непосредственно либо путем экспрессии рекомбинантных генетических последовательностей. Это имеет особое значение, так как большинство субъединичных и синтетических пептидных вакцин являются лишь слабо антигенными. Введение цитокинов может осуществляться поодиночке, в сочетании с антигеном или в виде слитой молекулы. Введение может осуществляться с помощью ослабленного вирусного вектора, рекомбинантного вирусного вектора или бактериального вектора, либо при введении цитокина, к примеру, посредством инъекции или приема внутрь (напр., а лекарственном продукте питания).
Настоящее изобретение распространяется и на ветеринарные фармацевтические композиции, предназначенные для птиц, например, домашних, комнатных или охотничье-промысловых птиц, с тем, чтобы усилить иммунную систему или улучшить ее иммунокомпетентность или облегчить иммуномодуляцию у данных птиц, причем композиции содержат рекомбинантный интерферон III типа птиц или слитую молекулу между интерфероном III типа и вторым цитокином, слитым с антигеном, либо кодирующую его генетическую последовательность, а также один или несколько носителей и/или разбавителей, пригодных для ветеринарного применения.
Предпочтительно, если композиция содержит вышеприведенный рекомбинантный цитокин птиц, то композиция вводится посредством инъекции in ovo или после вылупливания либо вводится с помощью аэрозоля или путем приема внутрь. Если композиция содержит генетический материал, то он вводится в составе вирусного вектора, бактериального вектора либо в виде молекул нуклеиновой кислоты.
Заболевания домашних, комнатных или охотничье-промысловых птиц, при которых может потребоваться лечение, включают инфекционные заболевания, вызванные каким-либо вирусным, бактериальным или паразитарным возбудителем типа тех, что изложены выше, рак, иммунодепрессию, аллергию, а также для усиления или подавления репродуктивной системы. Заболевания также включают ситуации, при которых животные находятся в состоянии ослабленного иммунитета, как-то при или после стресса, из-за переполненности помещений и транспорта, перемены климата.
Молекулы настоящего изобретения могут применяться в гомологическом смысле, когда они происходят из того же вида, либо в гетерогическом смысле, когда интерферон III типа оказывает действие у другого вида птиц, чем тот, из которого он был получен. Композиции могут содержать и другие активные молекулы, как-то антибиотики или молекулы антигенов. Комбинирование молекул цитокинов с молекулами антигенов может повысить эффективность вакцин.
Итак, настоящее изобретение распространяется на ветеринарные фармацевтические композиции, содержащие эффективное иммуномодулирующее количество интерферона III типа птиц либо слитой молекулы между интерфероном III типа птиц и вторым цитокином либо генетической последовательности, способной экспрессировать его же, а также один или несколько носителей и/или разбавителей, пригодных для ветеринарного применения.
В предпочтительном воплощении данный интерферон III типа представляет собой IFN-λ, в частности chIFN-λ.
Если фармацевтическая композиция содержит слитую молекулу, то слияние предпочтительно означает слияние между chIFN-λ, либо его функциональным фрагментом, производным или гомологом и вторым цитокином, выбранным из списка, включающего такие интерфероны I типа, как IFN-α, IFN-β, IFN-γ, chIFN-α, chIFN-β, chIFN-γ, такие интерфероны II типа, как IRN-α, а также интерфероны III типа или любые другие цитокины.
Предусматривается, что активные ингредиенты фармацевтической композиции проявляют активность в стимулировании, усилении или ином облегчении иммунного ответа у животных, в частности у домашних, комнатных и охотничье-промысловых птиц, при введении в таком количестве, которое зависит от конкретного случая. Вариации зависят, к примеру, от цитокина, а в некоторых случаях и антигена, задействованного в стимулировании иммунного ответа. Например, может потребоваться от 0,5 мкг до 20 мг определенного цитокина, который можно комбинировать с другими цитокинами, на кг массы тела в день. Дозовый режим можно регулировать для получения оптимальной терапевтической реакции. Например, можно вводить несколько дробных доз за один или несколько раз в день, неделю или месяц либо иной подходящий промежуток времени, или пропорционально уменьшать дозу в соответствии с требованиями ситуации. Активное соединение может вводиться посредством инъекции in ovo или после вылупливания либо путем приема внутрь любым традиционным способом, либо через генетическую последовательность, как-то в вирусном или бактериальном векторе.
Активные соединения также могут вводиться в виде дисперсий в глицерине, жидком полиэтиленгликоле и/или их смеси, а также в масле. При обычных условиях хранения и применения эти препараты содержат консервант, предотвращающий рост микроорганизмов.
Фармацевтические формы, пригодные для парентерального введения, включают стерильные водные растворы (если они водорастворимы) или дисперсии и стерильные порошки для приготовления в нужное время стерильных растворов или дисперсий для инъекций. Во всех случаях форма должна быть стерильной и жидкой до такой степени, чтобы она легко выходила из шприца. Она должна быть устойчивой в условиях производства и хранения и должна быть защищенной от загрязняющего действия таких микроорганизмов, как бактерии и грибы. Носителем может быть растворитель или среда для диспергирования, содержащая, к примеру, воду, этанол, полиоль (к примеру, глицерин, пропиленгликоль, жидкий полиэтиленгликоль), их подходящие смеси, а также растительное масло. Надлежащая текучесть может поддерживаться, к примеру, с помощью такого покрытия, как лецитин, соблюдением требуемого размера частиц в случае дисперсий и с помощью поверхностно-активных веществ. Защита от действия микроорганизмов может обеспечиваться с помощью различных антибактериальных и противогрибковых средств, к примеру, антибиотиков, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросаля и др. Во многих случаях предпочтительно следует включать изотонические вещества, к примеру, сахара или хлорид натрия. Продолжительное всасывание композиций для инъекций может обеспечиваться включением в них средств, замедляющих всасывание, к примеру.
Стерильные растворы для инъекций готовят путем внесения активных соединений в требуемом количестве в соответствующий растворитель вместе с различными другими ингредиентами, перечисленными выше, по необходимости, с последующей стерилизацией фильтрованием. Обычно дисперсии готовят путем внесения различных стерилизованных активных соединений в стерильный носитель, содержащий основную среду для диспергирования и другие необходимые ингредиенты из числа перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами приготовления являются вакуумная сушка и метод лиофилизации, которые дают порошок активного ингредиента вместе с любым другим нужным ингредиентом из предварительно стерилизованного фильтрованием раствора.
Носители и/или разбавители, пригодные для ветеринарного применения, включают всевозможные растворители, среды для диспергирования, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание вещества и др. Применение таких сред и средств для фармацевтически активных субстанций хорошо известно. За исключением того, когда какая-либо стандартная среда или вещество несовместимы с активным ингредиентом, их применение в композиции предусмотрено. В композиции также можно включать вспомогательные активные ингредиенты. Последнее особенно предпочтительно, поскольку настоящее изобретение распространяется на мультивалентные вакцины или мультикомпонентные молекулы цитокинов.
Фармацевтические ветеринарные композиции настоящего изобретения могут содержать, наряду с интерфероном III типа птиц или содержащей его слитой молекулой, еще одно или несколько других активных соединений типа антигенов и/или иммуностимулирующих соединений.
Цитокин также может вводиться при помощи живой системы доставки типа использования бактериальной системы экспрессии для экспрессирования белка цитокина в бактериях, которые могут быть включены в кишечную микрофлору. С другой стороны, можно использовать вирусную систему экспрессии или включить ее в рекомбинантную вакцину, В этом отношении одной из форм вирусной экспрессии является введение живого вектора, обычно путем распыления, с кормом или водой, при этом животное получает эффективное инфицирующее количество живого вектора (напр., вируса или бактерии). Другой формой вирусной системы экспрессии является вектор на основе нереплицирующегося вируса, который способен инфицировать клетки, но не может в них реплицироваться. Нереплицирующийся вирусный вектор служит средством введения в клетки генетического материала для кратковременной экспрессии цитокина. Способ введения такого вектора является таким же, как и живого вирусного вектора.
Настоящее изобретение дополнительно описано на следующих неограничивающих фигурах и примерах.
Пример 1. Клонирование, экспрессирование и характеристика интерферона III типа курицы
Материалы и методы
Выделение лимфоцитов и культивирование клеток
Извлекали селезенку у 4-недельных свободных от специфических патогенов (SPF) цыплят и получали одноклеточные суспензии лейкоцитов из индивидуальных селезенок пропусканием их через сито на 70 мкм в чашки Петри, содержащие среду DMEM. Суспензии наслаивали на Lymphoprep (Nicomed Pharma AS, Oslo) и центрифугировали при 1500×gmax в течение 15 мин. Собирали мононуклеары на границе фаз, промывали, ресуспендировали и культивировали в DMEM с добавлением 10% PCS. Непрерывную линию макрофагоподобных клеток HD11 курицы содержали в среде RPMI с добавлением 6% PCS, 2 мМ глутамина, пенициллина (100 ед./мл) и стрептомицина (100 мкг/мл). Клетки HD11 пересеивали по потребности и подращивали в течение ночи до конфлюэнтности 80% перед обработкой IFN.
Реагенты
Синтетический аналог днРНК - поли(I:С) (Invitrogen) и аналог онРНК - полиС (Invitrogen) получали и хранили согласно инструкциям производителей. IL6 курицы (chIL6) (Asifet al., рукопись готовится к печати) и chIFN-γ курицы (Digby and Lowenthal, 1995) были получены в нашей лаборатории. Нуклеиновые кислоты хранили при -80°С, а цитокины хранили при 4°С.
Культивирование вируса
Вирус гриппа A/PR/8/34 (PR8) (Talon et al., 2000) типа H1N1 культивировали в течение 48 ч в полости аллантоиса 10-дневных куриных яиц с зародышами. Затем отбирали содержащую вирус аллантоисную жидкость, разделяли на порции и хранили при -80°С. После этого вирус пересеивали 5 раз в куриных макрофагах HD11 и титровали инфективность на монослоях этих клеток путем определения точки 50% инфицирующей тканевую культуру дозы (TCID50).
Выделение РНК и обратная транскрипция
РНК выделяли с помощью Tri-reagent (Sigma-Aldrich) согласно инструкциям производителя. После экстракции РНК подвергали обработке ДНКазой с помощью ДНКазы 1 (Sigma-Aldrich) согласно инструкциям производителя. Затем обработанную ДНКазой РНК подвергали обратной транскрипции в комплементарную ДНК (кДНК) с помощью набора для обратной транскрипции (Promega).
Клонирование и экспрессирование
Были разработаны IFN-специфичные праймеры для амплификации chIFN-λ, chIFN-α и chIFN-β полной длины, которые представлены в табл.3. Синтезированную кДНК использовали вместе с геноспецифичными праймерами при стандартной ПЦР-амплификации, проводившейся с использованием 35 циклов по 1 мин при 94°С, по 1 мин при 55°С и по 1 мин при 72°С с дополнительным наращиванием 15 мин при 72°С после последнего цикла. Представляющие интерес препараты ДНК выделяли из гелей с помощью набора для экстракции гелей (Qiagen), а затем дотировали в вектор pGemT-Easy (Promega) для анализа последовательности. Эти вектора были обозначены как pGemIFNλ, pGemIFNα и pGemIFNβ.
Конструирование экспрессионных векторов pQE50IFNλ, pQE30IFNα и pET32IFNβ
Праймеры λ3 и λ4 (табл.3) содержали рестрикционные сайты BamH1 и HindIII, соответственно, и использовались для амплификации зрелого ORF chIFN-λ из pGemIFNλ в стандартной реакции ПЦР. ПЦР-фрагмент очищали и расщепляли рестрикционными ферментами, а затем дотировали ниже последовательности 6×Н18-метки по сайтам BamH1 и HindIII расщепленного экспрессионного вектора pQE50 (Qiagen), получая pQESOIFNλ. Аналогичным образом субклонировали chIFN-α в экспрессионный вектор pQE50 (Qiagen) с помощью праймеров α3 и α4 (табл.3), получая pQE30IFNα. Аналогичным образом субклонировали chIFN-β в экспрессионный вектор рЕТ32 (Novagen) с помощью праймеров β3 и β4 (табл.3), получая pET32IFNβ. Для проверки всех трех экспрессионных векторов использовали расщепление рестрикционными ферментами BamH1 и HindIII, а также секвенирование ДНК.
Экспрессирование и очистка рекомбинантного chIFN-λ, -α и -β
Каждый из IFN курицы экспрессировали по стандартным методикам экспрессии (Qiagen, 1997). Культуры штаммов Е. coli TOP10F' (pQE30IFNα), TOP10F' (pET32IFNβ) или TOP10F' (pQE50IFNλ) культивировали и индуцировали с помощью β-В-тиогалактозида (IPTG), а затем собирали центрифугированием. Обработанные ультразвуком лизаты клеток обрабатывали Triton Х-100 и иммобилизировали белок методом металлоаффинной хроматографии, а затем элюировали имидазолом. На каждой стадии очистки брали образцы для анализа и разгоняли в 12% геле методом SDS-PAGE. Образцы подвергали детоксификации с помощью Detoxi-gel (Pierce, США), чтобы удалить LPS из очищенных образцов.
Активность IFN методом биопробы с вирусом Semliki Forest (SFV)
Активность IFN определяли по его способности ингибировать эффекты вызванного SFV цитолиза, как описано ранее (Lowenthal et aL, 1995). Фибробласты зародышей кур (CEF) высеивали на 96-луночные планшеты при 5×104 клеток на лунку и инкубировали при 37°С в течение ночи в среде DMEM с добавлением 10% FCS. Затем среду удаляли и добавляли образцы в двух повторах. Клетки инкубировали с образцами в течение 18 ч, а затем заменяли среду на 100 мкл DMEM, содержащую SFV (103 ТСГО50/мл), и инкубировали в течение ночи при 37°С. Жизнеспособность клеток определяли по захвату красителя нейтрального красного и измерению поглощения (OD540).
Анализ продукции нитрата
Использовали линию клеток курицы (HD11) для определения продукции оксида азота по накоплению нитрита (Green et al., 1982; Sung et al., 1991) при определении методом Грейсса (Migliorini et al., 1991) и измерению поглощения (OD540).
Активность IFN по ингибированию PR8
Клетки HD11 выращивали до конфлюэнтности 80%, а затем добавляли IFN. PR8 вносили в среду RPMI, содержащую трипсин (5 мкг/мл), затем добавляли в лунки и инкубировали в течение 1 ч. Среду, содержащую вирус, заменяли на RPMI с добавлением 1% FCS и 5 мкг/мл трипсина и инкубировали при 37°С вплоть до 90 ч. Затем супернатант тестировали на наличие вируса по активности гемагглютинации.
Метод гемагглютинации
Метод гемагглютинации (НА) выполняли в микропланшетах (Thermo). Серийные 2-кратные разведения образцов вируса в PBS смешивали с равным объемом 0,5% об. суспензии свежих эритроцитов курицы, выделенных из цыплят SPF. Смесь вируса и эритроцитов оставляли инкубироваться при комнатной температуре в течение 30 мин. Лунки, содержащие однородный адгерентный слой эритроцитов, считались агглютинировавшими и оценивались как положительные. Отмечали наименьшее разведение вируса, дававшее положительную агглютинацию, в единицах НА на мл (HAU) (Li et al., 2005).
Полуколичественный метод ОТ-ПЦР
Относительное измерение экспрессии генов после обработки проводили на системе детектирования последовательностей ABI Prism 7700, используя метод сравнительного циклового порога (Ct) для получения изменений экспрессии генов согласно инструкциям производителя (Applied Biosystems). Относительную экспрессию генов рассчитывали по средним значениям, полученным по арифметической формуле ΔΔCt (Applied Biosystems), как описано ранее (Karpala et al., в печати).
Результаты
Молекулярное клонирование и биоинформатический анализ chIFN-λ
В качестве матрицы для ПЦР-амплификации IFN-λ курицы использовали кДНК, полученную из селезеночных лейкоцитов курицы, стимулированных с помощью поли(I:С) в течение 2 ч. Была идентифицирована полоса в 561 пару оснований (п.о.) (данные не приводятся). Аналогичным образом получали полосы ДНК в 582 и 612 п.о. для клонирования chIFN-α и chIFN-β, соответственно (данные не приводятся). Были получены последовательности всех 3 интерферонов. Последовательности chIFN-α и -β были описаны ранее Sekellick et al., 1994). Поэтому новоидентифицированный ген курицы обозначили как chIFNλ. Геномная структура chIFNλ, видимо, состоит из 5 экзонных участков и дает предполагаемый белок из 186 а.к. с молекулярной массой 21 кДа (фиг.3). Анализ сигнального пептида (Bendtsen et al., 2004) chIFNλ выявил сайт расщепления между остатками 21 и 22 (фиг.3). ChIFNλ проявляет сравнительно высокую идентичность по аминокислотам с huIFN-λII (36%), тогда как при сравнении с другими цитокинами курицы отмечалась сравнительно меньшая идентичность (табл.4). При сравнении транслируемого chIFN-λ с несколькими другими ранее установленными IFN-λII были идентифицированы консервативные остатки (фиг.2).
Филогенетический анализ дополнительно показал, что chIFN-λ попадает в кластер рядом с huIFN-λII (IL28A) и подтвердил, что chIFN-λ по структуре ближе всего к huIFN-λ, (фиг.4).
Экспрессия рекомбинантного chIFN-α, -β и -λ
Все ORF, кодирующие зрелые белки каждого chIFN, субклонировали в свой экспрессирующий вектор, экспрессировали и очищали, а затем анализировали методом SDS-PAGE. Ожидаемая молекулярная масса экспрессированного chIFN-α и chIFN-λ составила примерно 22 кДа (фиг.5А и С). Система экспрессии рЕТ32а, использовавшаяся для chIFN-β, дала ожидаемую молекулярную массу в 34 кДа (фиг.5В).
chIFN-λ стимулирует продукцию оксида азота аналогично chIFN-β в макрофагоподобных клетках HD11 курицы
Продукция химически активных молекул кислорода и азота (ROS) является важным клеточным механизмом подавления вирусов (Schroder et al., 2004). Было показано, что chIFN-γ стимулирует продукцию метаболитов, влияющих на уровень оксида азота (Lowenthal et al., 1995). Для проверки повышающего оксид азота действия chIFN-λ клетки HD11 обрабатывали 2-кратными разведениями рекомбинантного (r) chIFN-λ и сравнивали с rchIFN-γ и rchIFN-β. Как и rchIFN-β, rchIFN-λ повышал продукцию оксида азота (фиг.6). Из всех протестированных IFN самую высокую активность по оксиду азота проявлял rchIFN-γ (фиг.6).
Биоактивность chIFN-λ in vitro ниже, чем у chIFN-α
Для оценки ингибирующих вирусы свойств chIFN-y проводили сравнение с rchIFN-α и rchIFN-λ, методом биопробы с вирусом SFV. При этом каждый rchIFN снижал вызванный вирусом лизис клеток CEF (фиг.7).
chIFN-λ, оказывает ингибирующее действие на вирус гриппа (PR8)
Поскольку chIFN-λ проявлял эффект ингибирования против вируса SFV, было предпринято исследование ингибирующих эффектов в отношении вируса гриппа. Клетки HD11, предварительно обработанные rchIFN-α, rchIFN-β или rchIFN-λ, а затем инфицированные PR8, проявляли различные уровни зависимой от концентрации защиты от PR8 при определении методом НА (фиг.8). При высокой дозе rchIFN-λ (100 нг/мл) титр вируса снижался по сравнению с необработанными клетками во все моменты времени, варьируя от отсутствия вируса через 40 ч после инфицирования (п.и.) до 320 HAU через 90 ч п.и. (фиг.8). Наименьшая доза (25 нг/мл) давала некоторую защиту, а промежуточная доза (50 нг/мл) давала промежуточный эффект (фиг.8). Это четко показывает, что IFN-λ подавляет вирус гриппа в макрофагах курицы. Применение rchIFN-α оказывало наибольший защитный эффект, варьирующий от отсутствия вируса при самой высокой дозе (100 нг/мл) до 1280 HAU/мл при наименьшей дозе (25 нг/мл) через 90 ч п.и. (фиг.8). ChIFN-β также оказывал защиту, варьирующую от отсутствия вируса при высокой дозе (100 нг/мл) до 5120 HAU/мл при наименьшей дозе (25 нг/мл) через 90 ч п.и. (фиг.8). В целом все исследованные IFN ингибировали титр вируса гриппа дозозависимым образом.
Лейкоциты курицы повышают уровень IFN-λ, аналогично IFN I типа
Поскольку очевидно, что IFN-λ действует аналогично IFN I типа в отношении антивирусной реакции, то исследовали, может ли chIFN-λ индуцироваться подобно IFN I типа - chIFN-α и chIFN-β. При этом для стимуляции селезеночных лейкоцитов использовали поли(I:С), а уровень мРНК для chIFN-α, chIFN-β и chIFN-λ, измеряли методом кОТ-ПЦР. Все 3 chIFN подвергались повышающей регуляции через 2 ч после стимуляции (фиг.9). Уровень мРНК chIFN-α повысился в 86 раз, chIFN-β - в 52 раза и chIFN-λ - в 15 раз (фиг.9). Повышающая регуляция chIFN-λ, оказалась меньшей, чем у chIFN-α или chIFN-β.
TLR3 индуцируется под действием IFN I типа. но не IFN-λ
Исследовали, могут ли гены, индуцируемые IFN I типа, также индуцироваться под действием chIFN-λ. Ранее было показано, что ген антивирусного рецептора TLR3 является IFN-стимулируемым геном (ISG) I типа (Tissari et al., 2005). Поэтому селезеночные лейкоциты курицы культивировали в присутствии rchIFN-α, rchIFN-β или rchIFN-λ, при этом оказалось, что только IFN I типа (rchIFN-α, rchIFN-β) существенно индуцировали TLR3 (фиг.10). rchIFN-α и rchIFN-β вызывали повышение TLR3 в 6,6 и 7,5 раз, соответственно, после применения 50 нг/мл в течение 2 ч, и в 11,3 и 12,3 раз при высокой дозе в 100 нг/мл (фиг.10), тогда как rchIFN-λ, мало влиял на индукцию TLR3.
Пример 2
Методы
Вирус гриппа A/Vietnam/I 203/04 (V/1203) типа H5N1 пересеивали в аллантоисной жидкости 10-дневных свободных от специфических патогенов (SPF) куриных яиц с зародышами. Затем отбирали аллантоисную жидкость, разделяли на порции и хранили при -80°С для инокуляции. Цыплятам SPF породы белый леггорн (4-недельным) вводили интраокулярно 50 яичных инфекционных доз (EID50) вируса V/1203. Через 24 ч после инфицирования (п.и.) цыплят забивали и сразу же брали образцы ткани для экстракции РНК и последующего анализа IFNλ методом кОТ-ПЦР.
Защиту от вируса с помощью IFN-λ проводили в соответствии с методикой, описанной в Karpala A.J., K.R.Morris, M.M.Broadway, P.G.McWaters, Т.Е.O'Neil, K.E.Goosens, J.W.Lowenthal, and A.G.Bean. 2008. Molecular cloning, expression, and characterization of chicken IFN-lambda. J Interferon Cytokine Res 28: 341-50.
Инокулирование вируса гриппа и антисывороток in ovo провдили путем разведения очищенных антител против chIFN-λ из расчета 1000 мкг или 20 мкг на яйцо. В полость аллантоиса каждого яйца вводили 200 мкл антител против chIFN с 200 мкл вируса вакцины. Через 48 ч из каждого яйца отбирали 5 мл аллацтоисной жидкости и определяли титры вируса методом гемагглютинации (Karpala et al., 2008).
Адъювантную активность IFN-λ определяли введением эритроцитов овцы (SRBC) вместе с или без IFN-λ. Четырем группам цыплят SPF вводили по 0,01 мл SRBC с соответствующим адъювантом в день 0, а затем еще вводили только SRBC в день 15. Через различные промежутки времени у цыплят брали кровь и определяли общий уровень антител методом НА по методике Van der Zijpp and Leenstre, Poultry Sci. 59: 1363-1369.
Результаты
У цыплят после инфицирования вирусом H5N1 (птичьего гриппа) индуцируется экспрессия IFN-λ, (фиг.11). Было установлено, что введение IFN-λ давало защиту от гриппа in vitro и до, и после инфицирования, однако защита еще больше усиливалась при введении IFN-λ до инфицирования (фиг.12). Эти результаты согласуются с тем, что ингибирование активности chIFN-λ (антителом против IFN-λ) увеличивало рост вируса гриппа в яйцах (фиг.13).
Было установлено, что IFN-λ проявляет адъювантный потенциал, так как он стимулировал продукцию антител после инокуляции антигена (эритроцитов овцы) (фиг.14). Введение IFN-λ ингибировало вызванную Con А пролиферацию лимфоцитов (фиг.15).
Специалисты в этой области должны понимать, что описанное здесь изобретение допускает вариации и модификации помимо тех, что описаны специально. Следует иметь в виду, что изобретение охватывает все такие вариации и модификации. Изобретение также охватывает все стадии, особенности, композиции и соединения, упомянутые или указанные в настоящем описании, поодиночке или все вместе, и всевозможные комбинации любых двух или нескольких таких стадий или особенностей.
БИБЛИОГРАФИЯ
Abend J.R., Low J.A. and Imperiale M.J. (2007) Inhibitory effect of gamma interferon on BK vims gene expression and replication. J Virol. 81, 272-9.
Ank N., West H., Bartholdy C., Eriksson K., Thomsen A.R. and Paludan S.. (2006) Lambda interferon (IFN-lambda), a type III IFN, is induced by viruses and IFNs and displays potent antiviral activity against select virus infections in vivo. J Virol. 80, 4501-9.
Annibali V., Giovanni S.D., Cannoni S., Giugni E., Bomprezzi R., Mattel C., Elkahloun A., Coccia E.M., Alfo M., Orzi P., Ristori G. and Salvetti M. (2007) Gene expression profiles reveal homeostatic dynamics during interferon-beta therapy in multiple sclerosis. Autoimmunity 40, 16-22.
Beilharz M.W., Cummins J.M. and Bennett A.L. (2007) Protection from lethal influenza virus challenge by oral type I interferon. Biochem Biophys Res Commun 355, 740-4.
Bracci L., Canini I., Puzelli S., Sestili P., Venditti M., Spada M., Donatelli I., Belardelli F. and Proietti E. (2005) Type I IFN is a powerful mucosal adjuvant for a selective intranasal vaccination against influenza virus in mice and affects antigen capture at mucosal level. Vaccine 23, 2994-3004.
Chen J.M., Chen J.W., Dai J.J. and Sun Y.X. (2007) A survey of human cases of H5N1 avian influenza reported by the WHO before June 2006 for infection control. Am J Infect Control 16, 351-3.
Chesler D.A., Minoz-Jordan J.L., Donelan N., Garcia-Sastre A. and Reiss C.S. (2003) PKR is not required for interferon-gamma inhibition of VSV replication in neurons. Viral Immunol 16, 87-96.
de Veer M.J., Hoiko M., Frevel M., Walker E., Der S., Paranjape J.M., Silverman R.H. and Williams B.R. (2001) Functional classification of interferon-stimulated genes identified using microarrays. J Leukoc Biol 69, 912-20.
Digby M.R. and Lowenthal J.W. (1995) Cloning and expression of the chicken interferon-gamma gene. J Interferon Cytokine Res 15, 939-45.
Donnelly R.P., Sheikh F., Kotenko S.V. and Dickensheets H. (2004) The expanded family of class II cytokines that share the IL-10 receptor-2 (IL-10R2) chain. J Leukoc Biol 76, 314-21.
Dimoutier L., Tounsi A., Michiels Т., Sommereyns C., Kotenko S.V. and Renauld J.C. (2004) Role of the interleukin (IL)-28 receptor tyrosine residues for antiviral and antiproliferative activity of IL-29/interferon-lambda 1: similarities with type I interferon signaling. J Biol Chem 279, 32269-74.
Green L.C., Wagner D.A., Glogowski J., Skipper P.L., Wishnok J.S. and Tannenbaum S.R. (1982) Analysis of nitrate, nitrite, and. Anal Biochem 126, 131-8.
Jacobs B.L. and Langland J.O. (1996) When two strands are better than one: the mediators and modulators of the cellular responses to double-stranded RNA. Virology 219, 339-49.
Kaiser P., Poh T.Y., Rothwell L., Avery S., Balu S., Pathania U.S., Hughes S., Goodchild M., Morell S., Watson M., Bumstead N., Kaufman J and Young J.R. (2005) A genomic analysis of chicken cytokines and chemokines. J Interferon Cytokine Res 25, 467-84.
Kamijo R., Shapiro D., Gerecitano J., Le J., Bosland M. and Vilcek J. (1994) Biological functions of IFN-gamma and IFN-alpha/beta: lessons from studies in gene knockout mice. Hokkaido Igaku Zasshi 69, 1332-8.
Karpala A.J., K.R. Morris, M.M. Broadway, P.O. McWaters, Т.Е. O'Neil, K.E. Goossens, J.W. Lowenthal and A.G. Bean. 2008. Molecular cloning, expression, and characterization of chicken IFN-lambda. J Interferon Cytokine Res 28: 341-50.
Koemer I., Kochs G., Kalinke U., Weiss S. and Staeheli P. (2007) Protective role of beta interferon in host defense against influenza A virus. J Virol 81, 2025-30.
Kotenko S.V., Gallagher G., Baurin V.V., Lewis-Antes A., Shen M., Shah N.K., Langer J.A., Sheikh F., Dickensheets H. and Donnelly R.P. (2003) IFN-lambdas mediate antiviral protection through a distinct class II cytokine receptor complex. Nat Immunol 4, 69-77.
Li Y.C., Kong L.H., Cheng B.Z. and Li K.S. (2005) Construction of influenza virus siRNA expression vectors and their inhibitory effects on multiplication of influenza virus. Avian Dis 49, 562-73.
Lowenthal J.W., Digby M.R. and York J.J. (1995) Production of interferon-gamma by chicken Т cells. J Interferon Cyrokine Res 15, 933-8.
Majde J.A. (2000) Viral double-stranded RBA, cytokines, and the flu. J Interferon Cytokine Res 20, 259-72.
Marcello Т., Grakoui A., Barba-Spaeth G., Machlin E.S., Kotenko S.V., McDonald M.R. and Rice C.M. (2006) Interferons alpha and lambda inhibit hepatitis С virus replication with distinct signal transduction and gene regulation kinetics. Gastroenterology 131, 1887-98.
Meager A., Visvalingam K., Dilger P., Bryan D. and Wadhwa M. (2005) Biological activity of interleukins-28 and -29: comparison with type I interferons. Cytokine 31, 109-18.
Meager A. (2002) Biological assays for interferons. J Immunol Methods 261, 21-36.
Migliorini P., Corradin G. and Corradin S.B. (1991) Macrophage NO2 - production as a sensitive and rapid assay for the quantitation ofmurine IFN-gamma. J Immunol Methods 139, 107-14.
Moraes M.P., de Los Santos Т., Koster M., Turecek Т., Wang H., Andreyev V.G. and Grubman M.J. (2007) Enhanced antiviral activity against foot-and-mouth disease virus by a combination of type I and II porcine interferons. J Virol 81, 7124-35.
Rio J., Nos C., Marzo M.E., Tintore M. and Montalban X. (1998) Low-dose steroids reduce flu-like symptoms at the initiation of the IFNbeta-1b in relapsing-remitting MS. Neurology 50, 1910-2.
Robek M.D., Boyd B.S. and Chisari F.V. (2005) Lambda interferon inhibits hepatitis В and С virus replication. J Virol 79, 3851-4.
Schroder К., Hertzog P.J., Ravasi T. and Hume D.A. (2004) Interferon-gamma: an overwiew of signals, mechanisms and functions. J Leukoc Biol 75, 163-89.
Schultz U., Kaspers B. and Staeheli P. (2004) The interferon system of non-mammalian vertebrates. Dev Comp Immunol 28, 499-508.
Sekellick M.J., Ferrandino A.F., Hopkins D.A. and Marcus P.I. (1994) Chicken interferon gene: cloning, expression, and analysis. J Interferon Res 14, 71-9.
Sheppard P., Kindsvogel W., Xu W., Henderson K., Schlutsmeyer S., Whitmore Т.Е., Kuestner R., Garrigues U., Birks C., Roraback J., Ostrander C., Dong D., Shin J., Presnell S., Fox В., Haldeman В., Cooper E., Taft D., Gilbert Т., Grant F.J., Tackett M., Krivan W., McKnight G., Clegg C., Foster D. and Klucher K.M. (2003) IL-28, IL-29 and their class II cytokine receptor IL-28R. Nat Immunol 4, 63-8.
Smith C.A., McClive P.J., Western P.S., Reed K.J. and Sinclair A.H. (1999) Conservation of a sex-determining gene. Nature 402, 601-2.
Smith P.L., Lombardi G. and Foster G.R. (2005) Type I interferons and the innate immune response - more than just antiviral cytokines. Mol Immunol 42, 869-77.
Stohr К and Esveld M. (2004) Public health. Will vaccines be available for the next influenza pandemic? Science 306, 2195-6.
Sung Y.J., Hotchkiss J.H., Austic R.E. and Dietert R.R. (1991) L-arginine-dependent production of a reactive nitrogen intermediate by macrophages of a uricotelic species. J Leukoc Biol 50, 49-56.
Takaoka A. and Yanai H. (2006) Interferon signalling network in innate defence. Cell Microbiol 8, 907-22.
Tanabe M., Kurita-Taniguchi M., Takeuchi K., Takeda M., Ayata M,, Ogura H., Matsumoto M. and Seya T. (2003) Mechanism of up-regulation of human Toll-like receptor 3 secondary to infection of measles virus-attenuated strains. Biochem Biophys Res Commun 311, 39-48.
Theofilopoulos A.N., Baccala R., Beutler B. and Kono D.H. (2005) Type I interferons (alpha/beta) in immunity and autoimmunity. Annu Rev Immunol 23, 307-36.
Tissari J., Siren J., Men S., Julkunen I. and Matikainen S. (2005) IFN-alpha enhances TLR3-mediated antiviral cytokine expression in human endothelial and epithelial cells by up-regulating TLR3 expression. J Immunol 174, 4289-94.
Zoller В., Redman-Muller I., Nanda I., Guttenbach M., Dosch E., Schmid M., Zoorob R. and Jungwirth C. (2000) Sequence comparison of avian interferon regulatory factors and identification of the avian CEC-32 cell as a quail cell line. J Interferon Cytokine Res 20, 711-7.







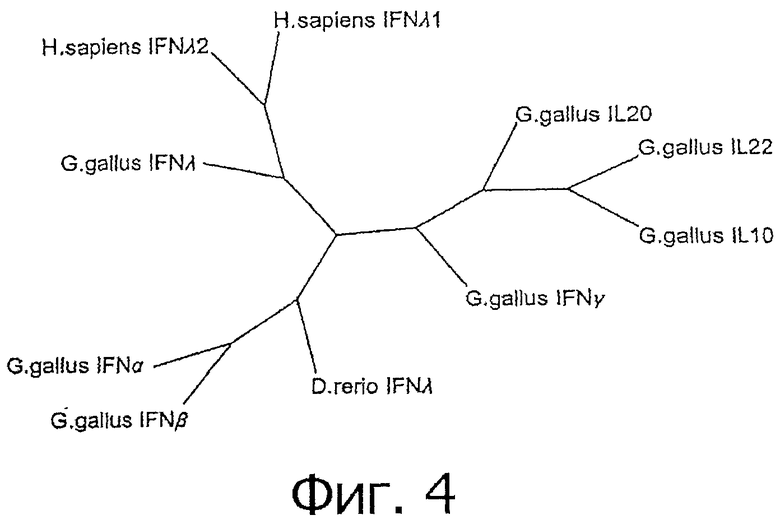
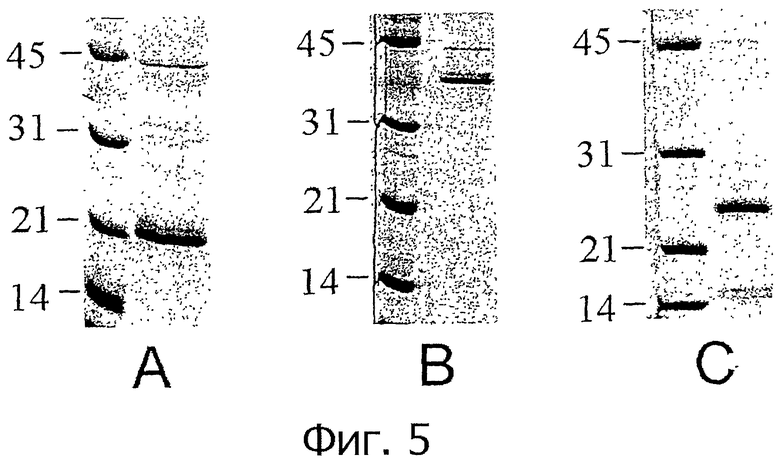
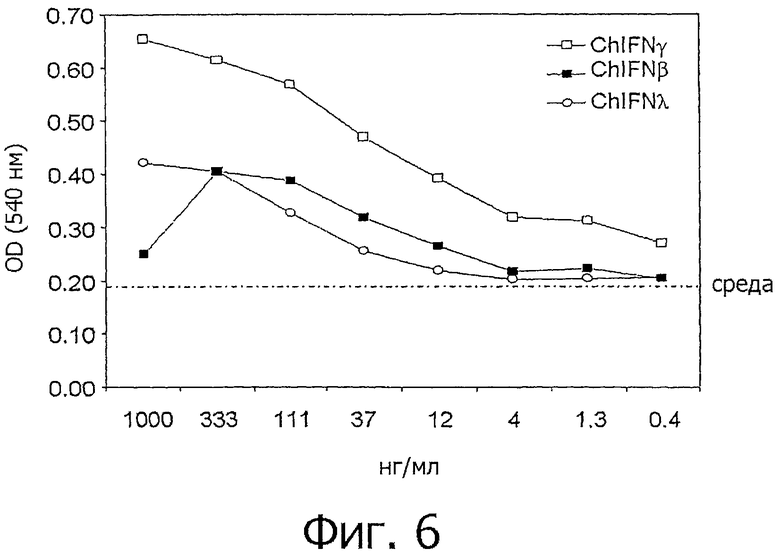
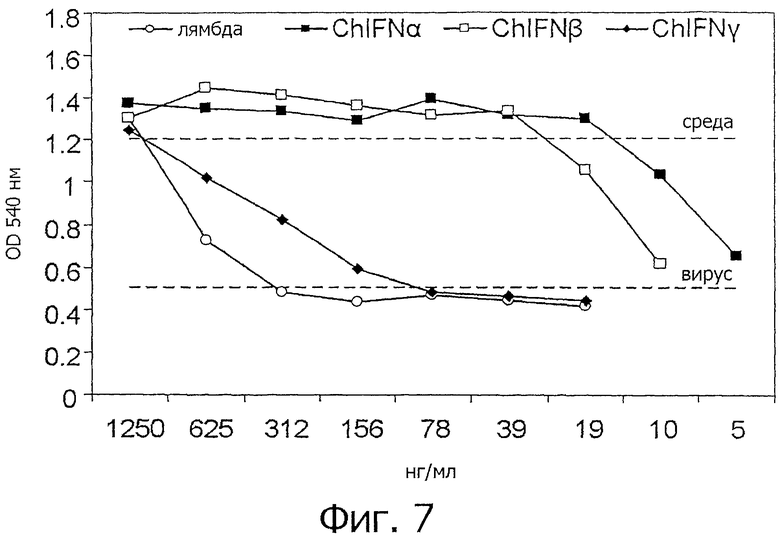
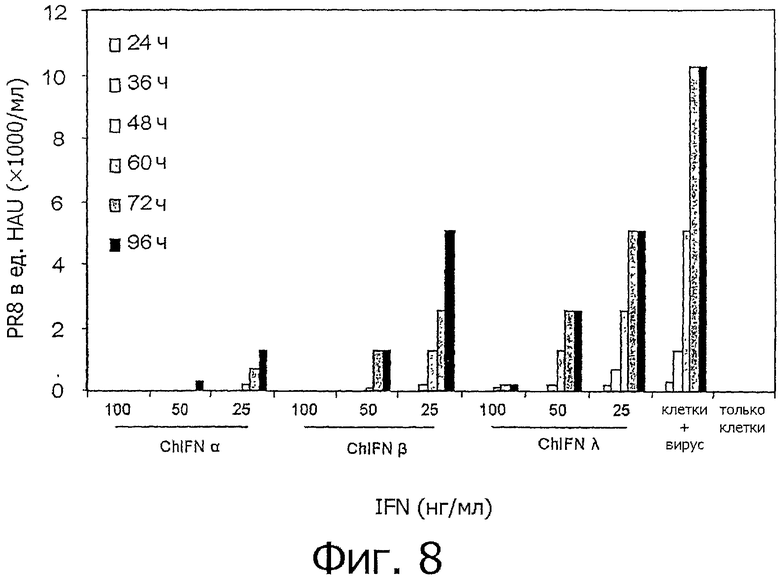
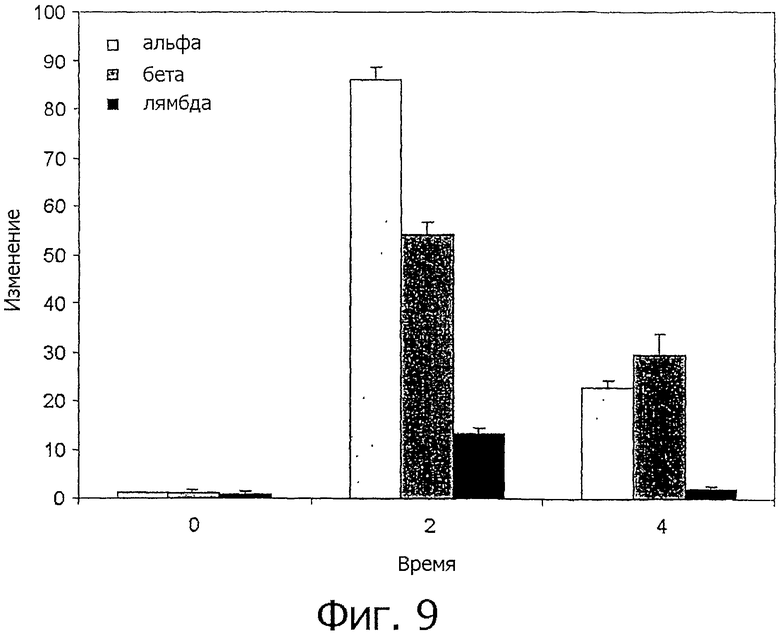
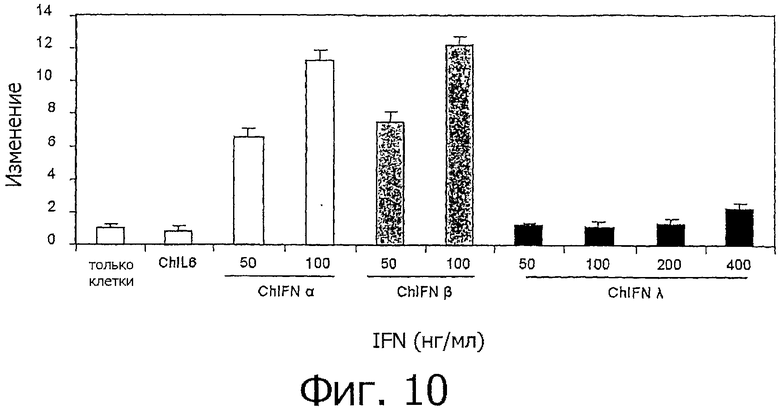
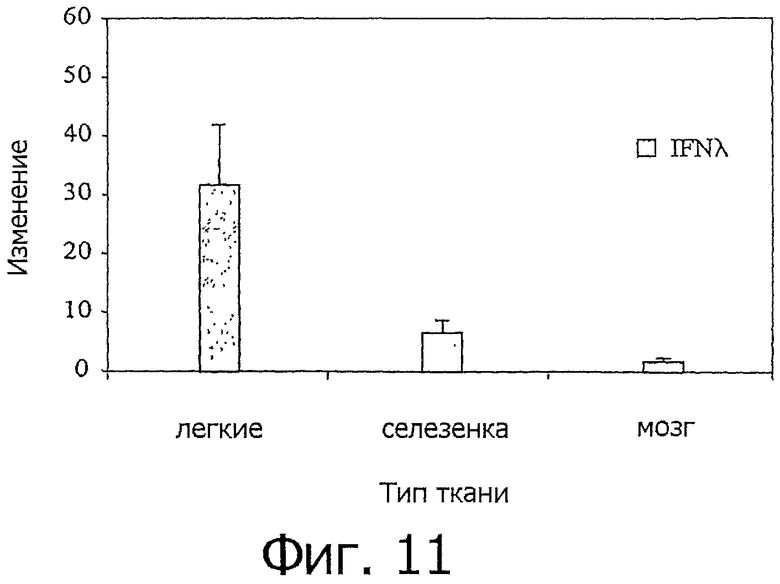
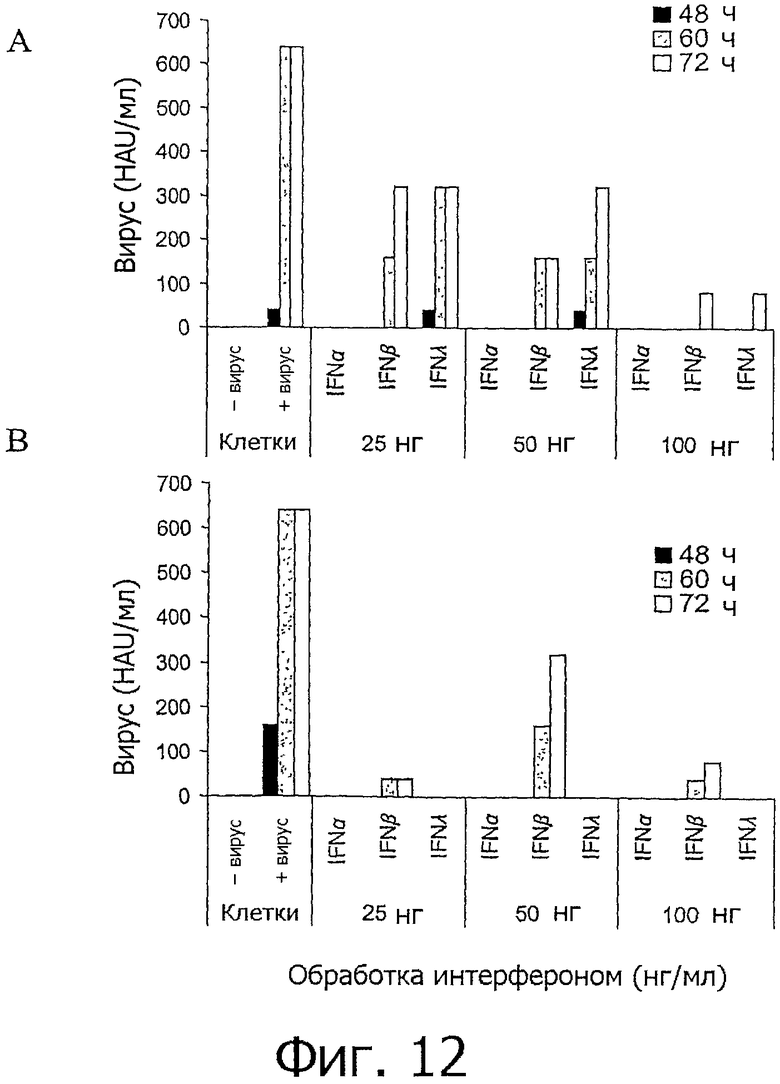
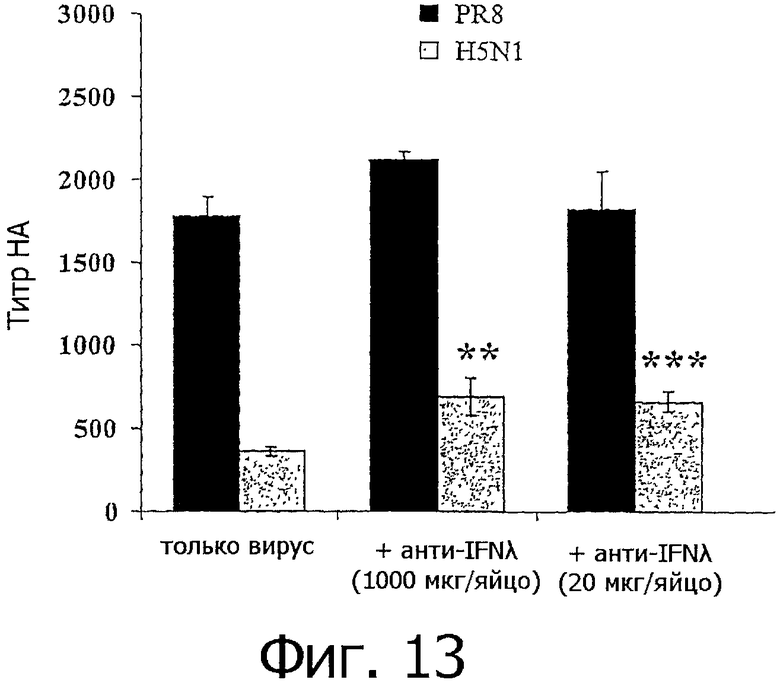
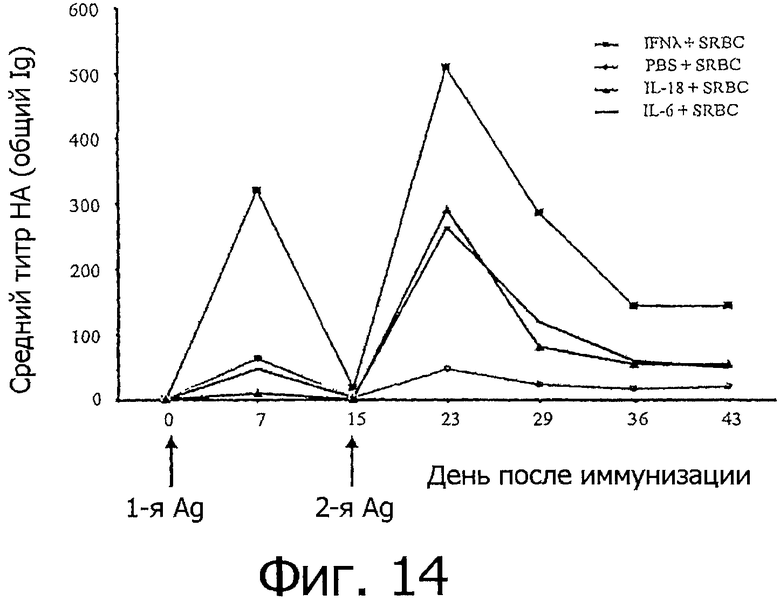
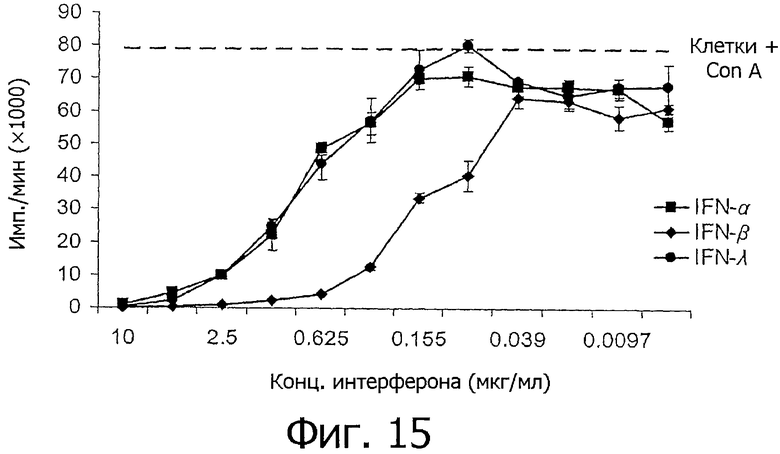
Изобретение относится к области генетической инженерии. Предложена выделенная молекула нуклеиновой кислоты для терапии кур или для поддержания, стимуляции или усиления у них иммунного ответа, выбранная из числа молекул, кодирующих лямбда-интерферон (IFN-λ) кур, представленных в SEQ ID NO: 1 или 3, или молекул, представляющих собой нуклеотидную последовательность, кодирующую аминокислотную последовательность, приведенную в SEQ ID NO: 2 или 4, либо последовательность нуклеиновой кислоты, способной гибридизоваться с SEQ ID No: 1 или 3 в строгих условиях, а также предложены выделенный полипептид, терапевтический способ и применение для терапии кур. Изобретение позволяет осуществлять терапию и диагностику кур. 5 н. и 8 з.п. ф-лы, 4 табл., 15 ил., 2 пр.
1. Выделенная молекула нуклеиновой кислоты для терапии кур или для поддержания, стимуляции или усиления у них иммунного ответа, выбранная из числа:
(i) нуклеотидной последовательности, представленной в SEQ ID NO: 1 или 3;
(ii) молекул, представляющих собой нуклеотидную последовательность, кодирующую аминокислотную последовательность, приведенную в SEQ ID NO: 2 или 4, либо последовательность нуклеиновой кислоты, способной гибридизоваться с SEQ ID NO: 1 или 3 в строгих условиях.
2. Выделенная молекула нуклеиновой кислоты по п. 1, которая представляет собой последовательность кДНК или геномную последовательность.
3. Выделенная молекула нуклеиновой кислоты по п. 1 или 2, которая находится в форме, пригодной для введения путем приема внутрь либо посредством инъекции in ovo или после вылупливания: внутрибрюшинно, интрадермально, внутримышечно, интраокулярно, внутривенно или подкожно.
4. Выделенный полипептид для терапии кур или для поддержания, стимуляции или усиления у них иммунного ответа, выбранный из числа:
(i) полипептидов лямбда-интерферона (IFN-λ) кур, представленных в SEQ ID NO: 2 или 4;
(ii) полипептидов, кодируемых последовательностью нуклеиновой кислоты, приведенной в п. 1.
5. Выделенный полипептид по п. 4, который находится в форме, пригодной для введения путем приема внутрь либо посредством инъекции in ovo или после вылупливания: внутрибрюшинно, интрадермально, внутримышечно, интраокулярно, внутривенно или подкожно.
6. Терапевтический способ для поддержания, стимуляции или усиления иммунного ответа у кур, включающий обработку птиц, которые подвергались воздействию антигена или заражены таким патогеном, как вирус, бактерия или паразит: вирус куриного гриппа, вирус инфекционного бурсита, вирус инфекционного бронхита кур, вирус инфекционного ларинготрахеита кур, вирус болезни Newcastle, вирус болезни Марека, вирус анемии кур, Е. coli, Salmonella ssp., Eimeria ssp. или Mycoplasma ssp., выделенной молекулой нуклеиновой кислоты по пп. 1-3 или выделенным полипептидом по п. 4 или 5.
7. Способ по п. 6, в котором полипептид вводится в комбинации со второй молекулой цитокина кур из числа интерферона III типа, интерферона I типа, интерферона II типа, IFN-α, IFN-β, IFN-γ, Ch IFN-α, Ch IFN-β или Ch IFN-γ.
8. Способ по п. 6 или 7, в котором нуклеиновая кислота по пп. 1-3 или полипептид по п. 4 или 5 находится в форме, пригодной для введения путем приема внутрь либо посредством инъекции in ovo или после вылупливания: внутрибрюшинно, интрадермально, внутримышечно, интраокулярно, внутривенно или подкожно.
9. Применение выделенной молекулы нуклеиновой кислоты для терапии кур или для поддержания, стимуляции или усиления у них иммунного ответа, при котором выделенная молекула нуклеиновой кислоты выбрана из числа:
(i) нуклеотидной последовательности, представленной в SEQ ID NO: 1 или 3;
(ii) молекул, представляющих собой нуклеотидную последовательность, кодирующую аминокислотную последовательность, приведенную в SEQ ID NO: 2 или 4, либо последовательность нуклеиновой кислоты, способной гибридизоваться с SEQ ID NO: 1 или 3 в строгих условиях.
10. Применение по п. 9, при котором выделенная молекула нуклеиновой кислоты представляет собой последовательность кДНК или геномную последовательность.
11. Применение по п. 9 или 10, при котором нуклеиновая кислота по пп. 1-3 находится в форме, пригодной для введения путем приема внутрь либо посредством инъекции in ovo или после вылупливания: внутрибрюшинно, интрадермально, внутримышечно, интраокулярно, внутривенно или подкожно.
12. Применение выделенного полипептида для терапии кур или для поддержания, стимуляции или усиления у них иммунного ответа, при котором полипептид выбран из числа:
(i) полипептидов лямбда-интерферона (IFN-λ) кур, представленных в SEQ ID NO: 2 или 3;
(ii) полипептидов, кодируемых последовательностью нуклеиновой кислоты, приведенной в п. 1.
13. Применение по п. 12, при котором полипептид находится в форме, пригодной для введения путем приема внутрь либо посредством инъекции in ovo или после вылупливания: внутрибрюшинно, интрадермально, внутримышечно, интраокулярно, внутривенно или подкожно.
| WO 2007041713 A1, 12.04.2007 | |||
| US 0007220822 B2, 22.05.2007 | |||
| WO 2005023862 A2, 17.03.2005 | |||
| US 0005985614 A1, 16.11.1999 | |||
| ПОЛИПЕПТИД, СПОСОБ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ДНК (ВАРИАНТЫ), ВЕКТОР (ВАРИАНТЫ), КЛЕТКА, ПРИМЕНЕНИЕ ПОЛИПЕПТИДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 1993 |
|
RU2177480C2 |
Авторы
Даты
2015-09-10—Публикация
2008-09-19—Подача