Область техники, к которой относится изобретение
Настоящее изобретение относится к производным 3-(гетероариламино)-1,2,3,4-тетрагидро-9H-карбазол-9-ил)уксусной кислоты формулы (I) и к их применению в качестве модуляторов простагландиновых рецепторов, в особенности, в качестве модуляторов рецепторов простагландина D2 («рецептор DP»), в лечении различных заболеваний и расстройств, опосредованных простагландинами, к фармацевтическим композициям, содержащим эти соединения, и к способам их получения. В частности, подобные производные могу применяться по отдельности или в составе фармацевтических композиций для лечения как хронических, так и острых аллергических/иммунных заболеваний/расстройств, таких как астма, аллергическая астма, эозинофильная астма, тяжелая астма, ринит, аллергический ринит, отек Квинке, аллергия на яд насекомых, аллергии на лекарственные средства, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атонический дерматит, бронхиальная астма, аллергия на продукты питания, системные тучноклеточные расстройства, анафилактический шок, крапивница, экзема, язвенный колит, хронические обструктивное заболевание легких (ХОЗЛ), воспалительное заболевание кишечника и ревматоидный артрит; заболеваний, связанных с эозинофилами, включающих васкулит малых сосудов, такой как синдром Чарга-Стросса, гранулематоз Вегенера, микроскопический полиангиит (и его орган-специфичные варианты), гиперэозинофильные синдромы, такие как эфозинофильная пневмония, эозинофильный эзофагит, рефлюксный эзофагит, эозинофильный эндокардит (эндокардит Леффлера), синдром эозинофилии-миалгии, эозинофильный фасциит, эозинофильный пустулезный фолликулит (болезнь Офуджи), эозинофильные язвы, ангиолимфоидная гиперплазия с эозинофилией (АЛГЭ), эозинофильный целлюлит (синдром Уэллса), хроническая эозинофильная лейкемия и DRESS-синдром (синдром гиперчувствительности с лекарственной сыпью, эозинофилией и системными симптомами); а также заболевания, связанные с базофилами, включающих базофильную лейкемию и базофильный лейкоцитоз.
Предпосылки к созданию изобретения
В качестве реакции на контакт с аллергеном при аллергических состояниях происходит активация тучных клеток, которые выделяют медиаторы, такие как дофамин, тромбоксан А2 (ТхА2), цистеинил-лейкотриены (Цис-ЛТ) и простагландин D2 (ПГД2). Эти медиаторы взаимодействуют со своими ответствующими рецепторами и вызывают физиологические эффекты, такие как повышенная проницаемость сосудов, отеки, прурит, заложенность носа и застой в легких, бронхоспазм и выделение мокроты. Повышенная проницаемость сосудов приводит, например, к избыточному проникновению эозинофильных и базофильных лейкоцитов в ткани, усиливая тем самым аллергическую реакцию.
Современные способы лечения аллергических заболеваний включают средства, способные блокировать подобные взаимодействия или прерывать их иным образом, например, антигистаминные средства (антагонисты Н1-гистаминовых рецепторов), антагонисты лейкотриеновых рецепторов, агонисты бета-адренергических рецепторов и кортикостероиды. Как правило, способы лечения антигистаминными средствами и лейкотриеновыми антагонистами характеризуются ограниченной эффективностью, а длительное применение кортикостероидов часто связано с нежелательными побочными эффектами.
ПГД2 известен как агонист, действующий на два рецептора, связанных с G-белком, на рецептор ПГД2 DP1 и на недавно обнаруженный рецептор CRTH2 (хемоаттрактантный рецептор, гомологичный молекуле, экспрессируемой на клетках Th2) (также известный как «рецептор DP2»).
Повышенные уровни ПГД2 полагают причиной воспалений, наблюдаемых при таких аллергических заболеваниях, как аллергический ринит, аллергическая астма, аллергический конъюнктивит, атопический дерматит и им подобные. Таким образом, блокирование взаимодействий ПГД2 с его рецепторами рассматривается как полезная терапевтическая стратегия для лечения подобных заболеваний.
В международной заявке на изобретение WO 01/79169 описываются производные(тетрагидрокарбазол-1-ил)уксусной кислоты в качестве антагонистов рецепторов ПГД2.
В патенте Великобритании GB 2388540 описывается применение раматробана ((3R)-3-(4-фторбензолсульфонамидо)-1,2,3,4-тетрагидрокарбазол-9-пропионовой кислоты), антагониста рецептора ТхА2 (также известного как «рецептор ТР»), проявляющего дополнительную антагонистическую активность в отношении CRTH2, для профилактики и лечения аллергических заболеваний, таких как астма, аллергический ринит или аллергический конъюнктивит.В статье Т. Ishizuka и др., Cardiovascular Drug Rev. 2004, 22(2), 71-90, описано действие раматробана на воспаления в поздней фазе. Кроме того, была описана биодоступность раматробана при пероральном введении и его способность ингибировать вызываемую простагландином D2 миграцию эозинофилов in vitro (Journal of Pharmacology and Experimental Therapeutics, 305(1), стр.347-352 (2003)).
В международных заявках на изобретение WO 03/097598 и WO 03/097042 описываются аналоги раматробана, обладающие антагонистической активностью в отношении CRTH2. Ulven и др., J. Med. Chem. 2005, 48(4), 897-900, описывают дальнейшие аналоги раматробана.
В международной заявке на изобретение WO 08/017989 описываются производные (3-амино-1,2,3,4-тетрагидро-9Н-карбазол-9-ил)уксусной кислоты, обладающие антагонистической активностью в отношении CRTH2.
Описание изобретения
1) Объектом настоящего изобретения являются производные 3-(гетероариламино)-1,2,3,4-тетрагидро-9H-карбазола формулы (I),
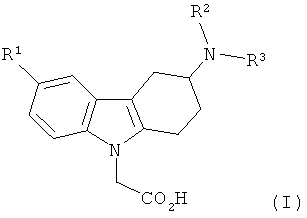 ,
,
в которых
R1 представляет собой водород, (С1-С4)алкил, (С1-С4)алкоксигруппу, галоид, трифторметоксигруппу или трифторметил,
R2 представляет собой водород, (С1-С4)алкил, (С1-С2)алкокси(С2-С3)алкил, (С1-С4)фторалкил или (С3-С6)пиклоалкил(С1-С2)алкил, а
R3 представляет собой гетероарильную группу, которая является незамещенной или моно-, ди- или тризамещенной, где заместители независимо выбраны из группы, включающей галоид, (С1-С4)алкил, (С3-С6)циклоалкил, (С1-С4)алкоксигруппу, (С1-С4)фторалкил и фенил, а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
Соединения формулы (I) согласно варианту осуществления 1) могут содержать один или несколько стереогенных или асимметрических центров, как, например, один или несколько асимметрических атомов углерода. Заместители при двойной связи могут находиться в (Z)- или (E)-конфигурации, если не оговорено противное. Соединения формулы (I) могут, таким образом, существовать в виде смесей стереоизомеров или, предпочтительно, в виде чистых стереоизомеров. Смеси стереоизомеров могут быть разделены известным специалисту в соответствующей области образом.
В нижеследующих абзацах даны определения различных химических остатков для соединений по настоящему изобретению. Их следует относить в равной степени ко всему настоящему описанию и к формуле изобретения, за исключением тех случаев, когда в явном виде изложено иное определение, подразумевающее более широкое или более узкое определение
Термин «алкил», употребляемый отдельно или в сочетании, относится к алкильной группе с неразветвленной или разветвленной цепью, содержащей от одного до четырех атомов углерода. Термин «(Cx-Cy)алкил» (где x и y оба являются целыми числами), относится к алкильной группе, как она определена выше, содержащей от x до y атомов углерода. Например, (С1-С4)алкильная группа содержит от одного до четырех атомов углерода. Характерные примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
В том случае, если R1 представляет собой (С1-С4)алкил, данный термин означает (С1-С4)алкильные группы, как они определены выше. Примерами таковых групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и mpem-бутил. Предпочтительным является метил.
В том случае, если R2 представляет собой (С1-С4)алкил, данный термин означает (С1-С4)алкильные группы, как они определены выше. Примерами таковых групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Предпочтительными являются метил, этил и н-пропил, наиболее предпочтительным является метил.
В том случае, если R представляет собой гетероарил, замещенный (С1-С4)алкилом, термин «(С1-С4)алкил» означает (С1-С4)алкильные группы, как они определены выше. Примерами таковых групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и mpem-бутил. Предпочтительным является метил.
Термин «алкоксигруппа», употребляемый отдельно или в сочетании, относится к группе алкил-O-, где алкильная группа отвечает приведенному выше определению. Термин «(Cx-Cy)алкоксигруппа» (где x и y оба являются целыми числами) относится к алкоксигруппе, как она определена выше, содержащей от x до y атомов углерода. Например, (С1-С4)алкоксигруппа содержит от одного до четырех атомов углерода. Характерные примеры алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу.
В том случае, если R1 представляет собой (С1-С4)алкоксигруппу, данный термин означает (С1-С4)алкоксигруппы, как они определены выше. Примерами таковых групп являются метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа и трет-бутоксигруппа. Предпочтительной является метоксигруппа.
В том случае, если R представляет собой гетероарил, замещенный (С1-С4)алкоксигруппой, термин «(С1-С4)алкоксигруппа» означает (C1-С4)алкоксигруппы, как они определены выше. Примерами таковых групп являются метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа и трет-бутоксигруппа. Предпочтительной является метоксигруппа.
Термин «(С1-С2)алкокси(С2-С3)алкил» относится к (С2-С3)алкильной группе, как она определена выше, в которой один из атомов водорода заменен на (С1-С2)алкоксигруппу, как она определена выше. Примерами (С1-С2)алкокси(С2-Сз)алкильных групп являются метоксиэтил (в особенности, 2-метоксиэтил), метоксипропил (в особенности, 2-метоксипропил и 3-метоксипропил), этоксиэтил (в особенности, 2-этоксиэтил) и этоксипропил (в особенности, 2-этоксипропил и 3-этоксипропил). Предпочтительным является 2-метоксиэтил.
Термин «(С3-С6)циклоалкил», употребляемый отдельно или в сочетании, означает циклоалкильную группу, содержащую от 3 до 6 атомов углерода. Примерами (С3-С6)пиклоалкильных групп являются циклопропил, циклобутил, циклопентил и циклогексил. Предпочтительным является циклопропил.
Термин «(С3-С6)пиклоалкил(С1-С2)алкил» относится к (С1-С2)алкильной группе, как она определена выше, в которой один из атомов водорода заменен на (С3-С6)пиклоалкильную группу, как она определена выше. Примерами (С3-С6)циклоалкил(С1-С2)алкильных групп являются циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклопропилэтил (в особенности, 1-циклопропилэтил и 2-циклопропилэтил), циклобутилэтил (в особенности, 1-циклобутилэтил и 2-циклобутилэтил), циклопентилэтил (в особенности, 1-циклопентилэтил и 2-циклопентилэтил) и циклогексилэтил (в особенности, 1-циклогекстилэтил и 2-циклогексилэтил). Предпочтительным является циклопропилметил.
Термин «(Cx-Cy)фторалкил» (где x и y оба являются целыми числами) относится к алкильной группе, как она определена выше, содержащей от x до y атомов углерода, в которой один или более (и возможно все) атомы водорода заменены фтором. Например, (С1-С4)фторалкильная группа содержит от одного до четырех атомов углерода, и от одного до девяти атомов водорода заменены в ней фторами.
В том случае, если R2 представляет собой (С1-С4)фторалкил, данный термин означает (С1-С4)фторалкильную группу, как она определена выше. Примерами таковых групп являются дифторметил, трифторметил, 2,2-дифторэтил и 2,2,2-трифторэтил. Предпочтительными примерами являются 2,2-дифторэтил и 2,2,2-трифторэтил. Наиболее предпочтительным является 2,2-дифторэтил.
В том случае, если R3 представляет собой гетероарил, замещенный (С1-С4)фторалкилом, термин «(С1-С4)фторалкил» означает (C1-С4)фторалкильную группу, как она определена выше. Примерами таковых групп являются дифторметил, трифторметил, 2,2-дифторэтил и 2,2,2-трифторэтил. Предпочтительными примерами являются дифторметил и трифторметил. Наиболее предпочтительным является трифторметил.
Термин «галоид» означает фтор, хлор, бром или иод.
В том случае, если R1 представляет собой галоид, данный термин предпочтительно означает фтор и хлор, наиболее предпочтительно - фтор.
В том случае, если R3 представляет собой гетероарил, замещенный галоидом, термин «галоид» предпочтительно обозначает фтор, хлор и бром, более предпочтительно - фтор и хлор, наиболее предпочтительно - хлор.
Термин «гетероарил», употребляемый отдельно или в сочетании, означает 5-10-членный моноциклический или бициклический ароматический цикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из кислорода, азота и серы. Предпочтительно, термин «гетероарил» означает 5-10-членный моноциклический или бициклический ароматический цикл, содержащий один атом азота и, необязательно, один дополнительный гетероатом, выбранный из кислорода, азота и серы. Наиболее предпочтительными являются шестичленные моноциклические ароматические циклические системы, содержащие один или два атома азота. Примерами подобных гетероарильных групп являются фуранил, оксазолил, изоксазолил, оксадиазолил, тиенил, тиазолил, изотиазолил, тиадиазолил, пирролил, имидазолил, пиразолил, триазолил, пиридил, пиримидил, пиридазинил, пиразинил, индолил, изоиндолил, бензофуранил, изобензофуранил, бензотиофенил, индазолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензоизотиазолил, бензотриазолил, бензо[2,1,3]оксадиазолил, бензо[2,1,3]тиадиазолил, бензо[1,2,3]тиадиазолил, хинолинил, изохинолинил, циннолинил, хиназолинил, хиноксалинил и фталазинил. Предпочтительными примерами подобных гетероарильных групп являются пиридил (в особенности, пиридин-2-ил), пиримидил (в особенности, пиримидин-2-ил), бензоксазолил (в особенности, бензоксазол-2-ил), бензотиазолил (в особенности, бензотиазол-2-ил) и хиназолинил (в особенности, хиназолин-2-ил и хиназолин-4-ил). Также предпочтительными примерами являются изоксазолил (в особенности, изоксазол-3-ил), тиазолил (в особенности, тиазол-2-ил), тиадиазолил (в особенности, тиадиазол-2-ил), пиразолил (в особенности, пиразол-3-ил) и хиноксалинил (в особенности, хиноксалин-2-ил). Более предпочтительными являются пиримидил (в особенности, пиримидин-2-ил), бензоксазолил (в особенности, бензоксазол-2-ил) и бензотиазолил (в особенности, бензотиазол-2-ил). Наиболее предпочтительным является пиримидил (в особенности, пиримидин-2-ил). Гетероарильная группа может быть незамещенной или моно-, ди- или тризамещенной (предпочтительно, незамещенной или монозамещенной, наиболее предпочтительно -монозамещенной), причем заместители независимо выбраны из группы, включающей галоид, (С1-С4)алкил, (С3-С6)циклоалкил, (С1-С4)алкоксигруппу, (С1-С4)фторалкил и фенил (в особенности, галоид, (С1-С4)алкил, (С1-С4)алкоксигруппу, (С1-С4)фторалкил и фенил). Примерами подобных незамещенных, моно-, ди- или тризамещенных гетероарильных групп являются 5-фторпиридин-2-ил, 5-хлорпиридин-2-ил, 5-трифторметилпиридин-2-ил, пиримидин-2-ил, 5-фторпиримидин-2-ил, 5-хлорпиримидин-2-ил, 4-метилпиримидин-2-ил, 4,6-диметилпиримидин-2-ил, 5-метоксипиримидин-2-ил, 4-трифторметилпиримидин-2-ил, 5-трифторметилпиримидин-2-ил, 5-фенилпиримидин-2-ил, бензоксазол-2-ил, 5-фторбензоксазол-2-ил, 5-хлорбензоксазол-2-ил, 6-хлорбензоксазол-2-ил, бензотиазол-2-ил, 5-фторбензотиазол-2-ил, 6-фторбензотиазол-2-ил, 5-хлорбензотиазол-2-ил, 6-хлорбензотиазол-2-ил, хиназолин-2-ил, хиназолин-4-ил, 2-метилхиназолин-4-ил и 2-трифторметилхиназолин-4-ил. Другими примерами являются изоксазол-3-ил, 5-метилизоксазол-3-ил, 5-трет-бутилизоксазол-3-ил, 4-метилтиазол-2-ил, 4-трет-бутилтиазол-2-ил, 4-трифторметилтиазол-2-ил, 5-метилтиадиазол-2-ил, 1-метилпиразол-3-ил, 5-циклопропилпиримидин-2-ил, 6-фторбензоксазол-2-ил и хиноксалин-2-ил. Предпочтительными примерами являются 5-фторпиридин-2-ил, 5-хлорпиридин-2-ил, 5-фторпиримидин-2-ил, 5-хлорпиримидин-2-ил, 5-трифторметилпиримидин-2-ил, 5-фторбензоксазол-2-ил, 5-хлорбензоксазол-2-ил, 5-хлорбензотиазол-2-ил и 6-хлорбензотиазол-2-ил. Также предпочтительными примерами являются 6-фторбензоксазол-2-ил, 5-фторбензотиазол-2-ил и 6-фторбензотиазол-2-ил. Наиболее предпочтительным является 5-хлорпиримидин-2-ил.
2) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно варианту осуществления 1), в которых
R1 представляет собой водород, (С1-С4)алкил, (С1-С4)алкоксигруппу, галоид, трифторметоксигруппу или трифторметил,
R2 представляет собой водород, (С1-С4)алкил, (С1-С2)алкокси(С2-С3)алкил, (С1-С4)фторалкил или (С3-С6)пиклоалкил(С1-С2)алкил, а
R3 представляет собой гетероарильную группу, которая является незамещенной или моно-, ди- или тризамещенной, где заместители независимо выбраны из группы, включающей галоид, (С1-С4)алкил, (C1-С4)алкоксигруппу, (С1-С4)фторалкил и фенил, а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
3) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно варианту осуществления 1), в которых
R1 представляет собой водород, метил, метоксигруппу, галоид (в особенности, фтор или хлор) или трифторметил,
R2 представляет собой водород, (С1-С4)алкил, (С1-С2)алкокси(С2-С3)алкил, (С1-С4)фторалкил или (С3-С6)циклоалкил(С1-С2)алкил, а
R3 представляет собой гетероарильную группу, которая является незамещенной или моно- или дизамещенной (в особенности, незамещенной или монозамещенной), где заместители независимо выбраны из группы, включающей галоид, (С1-С4)алкил, (С3-С6)циклоалкил, (С1-С4)алкоксигруппу, (С1-С4)фторалкил и фенил,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
4) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1) или 2), в которых
R1 представляет собой водород, галоид (в особенности, фтор) или трифторметил,
R2 представляет собой водород, (С1-С4)алкил, (С1-С2)алкокси(С2-С3)алкил, (С1-С4)фторалкил или (С3-С6)циклоалкил(С1-С2)алкил, а
R3 представляет собой гетероарильную группу, которая является незамещенной или моно- или дизамещенной, где заместители независимо выбраны из группы, включающей галоид, (С1-С4)алкил, (C1-С4)алкоксигруппу, (С1-С4)фторалкил и фенил, а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
5) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-4), в которых
R1 представляет собой галоид (в особенности, фтор),
R2 представляет собой водород, метил, этил, н-пропил, 2-метоксиэтил, 2,2-дифторэтил или циклопропилметил, а
R3 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной галоидом (в особенности, фтором или хлором), метоксигруппой, трифторметилом или фенилом,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
6) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-4), в которых
R1 представляет собой фтор, хлор или трифторметил,
R2 представляет собой водород, метил, 2-метоксиэтил или циклопропилметил, а
R3 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной фтором или хлором, а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
7) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-6), в которых
R1 представляет собой фтор,
R2 представляет собой метил или 2-метоксиэтил, а
R3 представляет собой гетероарильную группу, которая является монозамещенной фтором или хлором, а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
8) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-6), в которых
R1 представляет собой фтор,
R2 представляет собой водород или метил, а
R3 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной фтором, хлором или трифторметилом (в особенности, фтором или хлором),
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
9) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-4), в которых
R1 представляет собой водород, галоид (в особенности, фтор) или трифторметил,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
10) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-6), в которых
R1 представляет собой галоид (в особенности, фтор),
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
11) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-4), 9) или 10), в которых
R2 представляет собой водород, (С1-С4)алкил, (С1-С2)алкокси(С2-С3)алкил или (С3-С6)циклоалкил(С1-С2)алкил,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
12) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-5) или 9)-10), в которых
R2 представляет собой водород, метил, этил, н-пропил, 2-метоксиэтил, 2,2-дифторэтил или циклопропилметил, а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
13) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-6) или 8)-10), в которых
R2 представляет собой водород или метил,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
14) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-10), в которых
R2 представляет собой (С1-С4)алкил (в особенности, метил),
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
15) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-4) или 9)-14), в которых
R3 представляет собой гетероарильную группу, которая является незамещенной или моно- или дизамещенной, где заместители независимо выбраны из группы, включающей галоид, (С1-С4)алкил, (C1-С4)алкоксигруппу, (С1-С4)фторалкил и фенил,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
16) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-5) или 9)-14), в которых
R3 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной галоидом (в особенности, фтором или хлором), метоксигруппой, трифторметилом или фенилом,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
17) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1), 3), или 9)-14), в которых
R3 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной галоидом, (С3-С6)циклоалкилом или (С1-С4)фторалкилом (и, в особенности, фтором, хлором, циклопропилом или трифторметилом),
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
18) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-5) или 8)-14), в которых
R3 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной фтором, хлором или трифторметилом, а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
19) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-14), в которых
R3 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной фтором, хлором или трифторметилом (в особенности, монозамещенной фтором или хлором) и в которой гетероарил выбран из группы, включающей пиримидил (в особенности, пиримидин-2-ил), бензоксазолил (в особенности, бензоксазол-2-ил) и бензотиазолил (в особенности, бензотиазол-2-ил),
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
20) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-5) или 8)-14), в которых
R3 представляет собой пиримидин-2-ил, который является незамещенным или монозамещенным галоидом, метоксигруппой, трифторметилом или фенилом (и, в особенности, незамещенным или монозамещенным по положению 5 фтором, хлором или трифторметилом),
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
21) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-14), в которых
R3 представляет собой 5-хлорпиримидин-2-ил,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
22) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-14), в которых
R3 представляет собой бензоксазол-2-ильную или бензотиазол-2-ильную группу, каковые группы необязательно монозамещены фтором или хлором, а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
23) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-22), в которых абсолютная конфигурация стереогенного центра соответствует изображаемой формулой ISt1
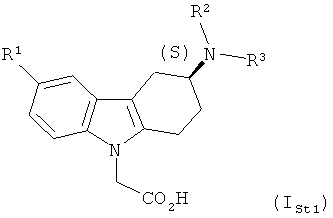 ,
,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
24) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно любому из вариантов осуществления 1)-22), в которых абсолютная конфигурация стереогенного центра соответствует изображаемой формулой ISt2
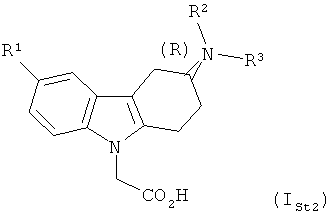 ,
,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
25) В еще одном варианте осуществления настоящего изобретения его объектом являются соединения согласно варианту осуществления 1), которые одновременно являются соединениями формулы 1§п
 ,
,
в которых
R1 представляет собой фтор или хлор (в особенности, фтор),
R2 представляет собой водород или метил (в особенности, метил), а
R3 представляет собой пиримидин-2-ил, монозамещенный по положению 5 фтором или хлором, бензоксазол-2-ил, монозамещенный по положению 5 или 6 фтором, или бензотиазол-2-ил, монозамещенный по положению 5 или 6 фтором,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
26) Предпочтительные соединения формулы (I), как они определены в варианте осуществления 1), выбраны из группы, включающей:
(3S)-2-(6-фтор-3-((5-фторпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((5-фторпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-хлорпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((5-хлорпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((5-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((4-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-фторпиримидин-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((5-фторпиримидин-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3R)-2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(5-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-(метил(5-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(4-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-(метил(4-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(пиримидин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((4,6-диметилпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(4-метилпиримидин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорбензо[^оксазол-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-(бензо[d]оксазол-2-ил(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-(бензо[d]тиазол-2-ил(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(хиназолин-4-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(2-(трифторметил)хиназолин-4-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(2-метилхиназолин-4-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(этил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(пропил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(изопропил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(циклопропилметил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(хиназолин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(5-фенилпиримидин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-метоксипиримидин-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((6-хлорбензо[d]тиазол-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорбензо[d]тиазол-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(2-метоксиэтил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(5-(трифторметил)пиридин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-фторпиридин-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиридин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((6-фторбензо[d]тиазол-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-фторбензо[d]тиазол-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((6-хлорбензо[d]оксазол-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту и
(3S)-2-(3-((5-хлорпиримидин-2-ил)(2,2-дифторэтил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений.
27) Другие предпочтительные соединения формулы (I), как они определены в варианте осуществления 1), выбраны из группы, включающей:
(3S)-2-(3-((5-циклопропилпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((6-фторбензо[d]оксазол-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(хиноксалин-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(4-метилтиазол-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(3-((4-(трет-бутил)тиазол-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(4-(трифторметил)тиазол-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(3-((5-(трет-6утил)изоксазол-3-ил)(метил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(1-метил-1Н-пиразол-3-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(5-метил-1,3,4-тиадиазол-2-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(6-фтор-3-(изоксазол-3-ил(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(5-метилизоксазол-3-ил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(6-хлор-3-((5-хлорпиримидин-2-ил)(метил)амино)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-метил-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-(трифторметокси)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-метокси-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту и
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-(трифторметил)-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусную кислоту,
а также соли (в особенности, фармацевтически приемлемые соли) данных соединений, причем следует понимать в отношении любого из вышеперечисленных соединений, что стереогенный центр, конфигурация которого явно не указано, может находиться в абсолютной (R)- или абсолютной (S)-конфигурации.
Если иное не оговорено специально явным образом, общие термины и названия, употребляемые здесь выше или ниже, принимают в контексте данного описания следующие значения:
В тех случаях, когда для соединений, солей, фармацевтических композиций, заболеваний и тому подобного употребляется форма множественного числа, здесь также подразумевается и отдельное соединение, соль и тому подобное.
Термин «фармацевтически приемлемые соли» относится к нетоксичным аддитивным солям с неорганическими или органическими кислотами и/или с основаниями. Здесь следует сослаться на статью "Salt selection for basic drugs" (Выбор солей для основных лекарственных средств). Int. J. Pharm. (1986), 33, 201-217.
Соединения формулы (I) согласно любому из вариантов осуществлений 1)-27) или их фармацевтически приемлемые соли могут быть применены в изготовлении лекарственного средства и применимы в профилактике и/или лечении заболеваний, выбранных из группы, включающей хронические и острые аллергические/иммунные заболевания/расстройства, включающие астму, аллергическую астму, эозинофильную астму, тяжелую астму, ринит, аллергический ринит, отек Квинке, аллергию на яд насекомых, аллергии на лекарственные средства, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атонический дерматит, бронхиальную астму, аллергию на продукты питания, системные тучноклеточные расстройства, анафилактический шок, крапивницу, экзему, язвенный колит, хронические обструктивное заболевание легких (ХОЗЛ), воспалительное заболевание кишечника и ревматоидный артрит; заболевания, связанные с эозинофилами, включающие васкулит малых сосудов, такой как синдром Чарга-Стросса, гранулематоз Вегенера, микроскопический полиангиит (и его орган-специфичные варианты), гиперэозинофильные синдромы, такие как эфозинофильная пневмония, эозинофильный эзофагит, рефлюксный эзофагит, эозинофильный эндокардит (эндокардит Леффлера), синдром эозинофилии-миалгии, эозинофильный фасциит, эозинофильный пустулезный фолликулит (болезнь Офуджи), эозинофильные язвы, ангиолимфоидная гиперплазия с эозинофилией (АЛГЭ), эозинофильный целлюлит (синдром Уэллса), хроническая эозинофильная лейкемия и DRESS-синдром (синдром гиперчувствительности с лекарственной сыпью, эозинофилией и системными симптомами); а также заболевания, связанные с базофилами, включающие базофильную лейкемию и базофильный лейкоцитоз.
В предпочтительном варианте осуществления настоящего изобретения соединения формулы (I) согласно любому из вариантов осуществления 1)-27) или их фармацевтически приемлемые соли могут быть применены в изготовлении лекарственного средства и применимы в профилактике и/или лечении заболеваний, выбранных из группы, включающей астму, аллергическую астму, эозинофильную астму, тяжелую астму, ринит, аллергический ринит, отек Квинке, аллергию на яд насекомых, аллергии на лекарственные средства, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атопический дерматит, бронхиальную астму, аллергию на продукты питания, системные тучноклеточные расстройства, анафилактический шок, крапивницу и экзему.
В другом предпочтительном варианте осуществления настоящего изобретения соединения формулы (I) согласно любому из вариантов осуществления 1)-27) или их фармацевтически приемлемые соли могут быть применены в изготовлении лекарственного средства и применимы в профилактике и/или лечении заболеваний, выбранных из группы, включающей заболевания, связанные с эозинофилами, включающие васкулит малых сосудов, такой как синдром Чарга-Стросса, гранулематоз Вегенера, микроскопический полиангиит (и его орган-специфичные варианты), гиперэозинофильные синдромы, такие как эфозинофильная пневмония, эозинофильный эзофагит, рефлюксный эзофагит, эозинофильный эндокардит (эндокардит Леффлера), синдром эозинофилии-миалгии, эозинофильный фасциит, эозинофильный пустулезный фолликулит (болезнь Офуджи), эозинофильные язвы, ангиолимфоидная гиперплазия с эозинофилией (АЛГЭ), эозинофильный целлюлит (синдром Уэллса), хроническая эозинофильная лейкемия и DRESS-синдром (синдром гиперчувствительности с лекарственной сыпью, эозинофилией и системными симптомами).
В еще одном предпочтительном варианте осуществления настоящего изобретения соединения формулы (I) согласно любому из вариантов осуществления 1)-27) или их фармацевтически приемлемые соли могут быть применены в изготовлении лекарственного средства и применимы в профилактике и/или лечении заболеваний, выбранных из группы, включающей заболевания, связанные с базофилами, включающие базофильную лейкемию и базофильный лейкоцитоз.
Объектом настоящего изобретения также является применение соединения формулы (I) согласно любому из вариантов осуществления 1)-27) для изготовления фармацевтических композиций для лечения и/или профилактики вышеупомянутых заболеваний.
Объектом настоящего изобретения также являются фармацевтически приемлемые соли и фармацевтические композиции и препараты соединений формулы (I) согласно любому из вариантов осуществления 1)-27).
Фармацевтическая композиция согласно настоящему изобретению содержит, по крайней мере, одно соединение формулы (I) согласно любому из вариантов осуществления 1)-27) (или его фармацевтически приемлемую соль) в качестве действующего начала и, необязательно, носители и/или разбавители и/или адъюванты.
Соединения формулы (I) согласно любому из вариантов осуществления 1)-27) и их фармацевтически приемлемые соли могут быть применены в качестве лекарственных средств, например, в форме фармацевтических композиций для энтерального (такого как, в особенности, пероральное) или парэнтерального (включая местное применение или ингаляцию) введения.
Изготовление фармацевтических композиций может быть осуществлено известным любому специалисту в соответствующей области способом (см., например, справочник Remington, The Science and Practice of Pharmacy (Научные основы и практика фармакологии), 21-е издание (2005), часть 5, "Pharmaceutical Manufacturing" (Изготовление фармацевтических средств) [издательство Lippincott Williams & Wilkins]) посредством переведения описанных соединений формулы (I) или их фармацевтически приемлемых солей в необязательном сочетании с другими терапевтически ценными веществами, в галенову форму для введения совместно с подходящими нетоксичными инертными терапевтически совместимыми твердыми или жидкими веществами носителями и, если то требуется, обычными фармацевтическими адъювантами.
Объектом настоящего изобретения также является способ профилактики или лечения заболевания или расстройства, упомянутого в настоящем описании, включающий введение пациенту фармацевтически активного количества соединения формулы (I) согласно любому из вариантов осуществления 1)-27) или его фармацевтически приемлемой соли.
Объектом настоящего изобретения также является изотопно меченые, в особенности, меченые 2Н (дейтерием) соединения формулы (I), каковые соединения идентичны соединениям формулы (I) за тем исключением, что в них заменены один или более атомов, каждый из них на атом с тем же атомным номером, но с атомной массой, отличающейся от атомной массы, обычно встречаемой в природе. Изотопно меченые, в особенности, меченые 2Н (дейтерием), соединения формулы (I) и их соли входят в объем настоящего изобретения. Замещение водорода более тяжелым изотопом 2Н (дейтерием) может приводить к более высокой метаболической устойчивости, обеспечивая, например, повышенный период полувыведения in vivo или пониженные требования к дозировке, или же может приводить к снижению ингибирования ферментов цитохром Р450, обеспечивая, например, улучшенный профиль безопасности. В одном из вариантов осуществления настоящего изобретения соединения формулы (I) не являются изотопно мечеными или являются мечеными лишь одним или несколькими атомами дейтерия. В подварианте данного варианта осуществления соединения формулы (I) вообще не являются изотопно мечеными. Изотопно меченые соединения формулы (I) могут быть получены аналогично описываемым ниже способам, но с использованием соответствующих изотопных вариантов подходящих реагентов или исходных веществ.
Любую ссылку на соединение формулы (I), (IST1) нли (IST2) в настоящем описании следует понимать как относящуюся также и к солям (и, в особенности, к фармацевтически приемлемым солям) подобных соединений, буде то уместно и целесообразно. Предпочтения, указанные для соединений формулы (I), относятся, конечно, с необходимыми оговорками, к соединениям формулы (IST1) и соединениям формулы (IST2), равно как и к солям и фармацевтически приемлемым солям соединений формулы (I), формулы (IST1) нли формулы (IST2). То же самое относится к данным соединениям в качестве лекарственных средств, к фармацевтическим композициям, содержащим данные соединения в качестве действующих начал, или к применениям данных соединений для изготовления лекарственного средства для лечения заболеваний согласно настоящему изобретению.
Если речь идет не о температурах, термин «около» (или, альтернативно «примерно» или «приблизительно»), помещенный перед численным значением "X", указывает в настоящей заявке на интервал, простирающийся от Х минус 10% от Х до Х плюс 10% от X, и, предпочтительно, на интервал, простирающийся от Х минус 5% от Х до Х плюс 5% от X. В отдельном же случае температур, термин «около» (или, альтернативно «примерно» или «приблизительно»), помещенный перед температурой "Y" указывает в настоящей заявке на интервал, простирающийся от температуры Y минус 10°С до Y плюс 10 С, и, предпочтительно, на интервал, простирающийся от Y минус 5 С до Y плюс 5 С.Помимо этого, термин «комнатная температура» (КТ), как он употребляется в контексте, относится к температуре около 25°С.
Во всех случаях, когда для описания численного интервала употребляется слово «между», следует понимать, что крайние точки указанного интервала явным образом включены в интервал. Например, если температурный интервал описывается к заключенный между 40°С и 80°С, это означает, что конечные точки 40°С и 80°С включены в интервал, а если переменная определена как целое число между 1 и 4, это означает, что переменная является целым числом 1, 2, 3 или 4.
Как было упомянуто ранее, соединения формулы (I) модулируют активацию ПГД2 рецептора CRTH2. Биологический эффект подобных соединений может быть исследован в разнообразных анализах in vitro, ex vivo и in vivo. Способность соединения формулы (I) связываться с рецептором CRTH2 может быть измерена с помощью способов, сходных с описанными в литературе (Arimura А. и др., J. Pharmacol. Exp. Ther. 2001, 298(2), 411-419; и Sawyer N. и др., Br. J. Pharmacol, 2002, 137, 1163-1172, соответственно), и посредством анализов, описанных ниже в экспериментальной части.
В еще одном варианте осуществления настоящего изобретения его объектом является способ получения соединений формулы (I). Соединения согласно формуле (I) по настоящему изобретению могут быть получены, следуя последовательности взаимодействий, вкратце описанных нижеприведенными схемами, в которых R1, R2 и R3 соответствуют определения для формулы (I). Другие употребляемые сокращения определены в экспериментальной части. В некоторых случаях типичные группы R1, R2 и R3 могут быть несовместимы с синтезом, иллюстрируемым нижеприведенными схемами, вследствие чего они потребуют применения защитных групп (PG). Например, может оказаться необходимо снабдить защитой реакционноспособные функциональные группы, такие как гидроксигруппы, аминогруппы, иминогруппы, тиогруппы или карбоксигруппы, если их присутствие желательно в конечном продукте, чтобы избежать их нежелательного участия в реакциях. Применение защитных групп хорошо известно в соответствующей области (см., например, "Protective Groups in Organic Synthesis" (Защитные группы в органическом синтезе), T.W. Greene, P.G.M. Wuts, Wiley-Interscience, 1999). Следует понимать, что подобные защитные группы присутствуют там, где это необходимо. Например, в нижеследующем описании PG, если она применяется в качестве защитной группы для аминогруппы, предпочтительно означает такую группу, как трет-бутоксикарбонильная группа, бензилоксикарбонильная группа или аллилоксикарбонильная группа, наиболее предпочтительно, трет-бутоксикарбонильная группа. Кроме того, L означает уходящую группу, такую как активированная гидроксигруппа (например, мезилат, тозилат или трифлат) или галоид, в частности, хлор или бром. Наконец, R означает(С1-С4)алкильную группу, предпочтительно метил, этил или трет-бутип, наиболее предпочтительно - этил.
Как правило, все химические превращения могут быть осуществлены в соответствии с хорошо известными стандартными подходами, как то описано в литературе, или же как это описано в нижеследующих методиках. Получаемые соединения могут также быть преобразованы в их фармацевтически приемлемые соли с помощью способов, которые известны сами по себе.
Как правило, соединения формулы (I) могут быть получены из сложноэфирного производного 2, в котором R представляет собой (С1-С4)алкил (предпочтительно, метил, этил или трет-бутил, наиболее предпочтительно - этил), следуя различным путям синтеза. Соединения формулы (I), в которых R2 представляет собой водород, могут быть получены посредством омыления сложного эфира 2 с помощью основания, такого как LiOH, NaOH или КОН (в особенности, NaOH) в таком растворителе, как МеОН, EtOH, тетрагидрофуран (ТГФ), ацетон или ацетонитрил (MeCN) (в особенности, MeCN) в присутствии или отсутствии воды (схема 1, способ А). Альтернативно (схема 1, способ В), соединения формулы (I) может быть получено посредством алкилирования сложноэфирных производных 2 алкилирующим агентом R2-X, в котором Х представляет собой уходящую группу, такую как бромид, иодид или трифлат, в присутствии основания, такого как карбонат щелочного металла (например, карбонат калия или карбонат цезия) или гидрид натрия (в особенности, гидрид натрия), в присутствии апротонного растворителя, такого как N,N-диметилформамид (ДМФ), с последующим омылением сложноэфирной функциональной группы основанием, таким как LiOH, NaOH или КОН (в особенности, NaOH) в присутствии или в отсутствии воды. Соединения формулы (I) могут также быть получены посредством восстановительного аминирования сложноэфирного производного 2 альдегидом R2A-СНО, в котором группа R2A-СН2 представляет собой R2, в присутствии восстановителя, такого как цианоборгидрид натрия, в растворителе, таком как уксусная кислота (АсОН), с последующим омылением сложноэфирной функциональной группы основанием, таким как LiOH, NaOH или КОН (в особенности, NaOH) в присутствии или в отсутствии воды (схема 1, способ С).
Сложноэфирные производные 2 могут быть получены, например, посредством взаимодействия в условиях микроволнового облучения аминопроизводного 1 или его кислотно-аддитивной соли (например, соли с HCl) с гетероарилгалогенидом R3-X, в котором Х представляет собой, например, хлорид или бромид, в присутствии основания, такого как N,N-диизопропилэтиламин (ДИЭА), в апротонном растворителе, таком как MeCN.
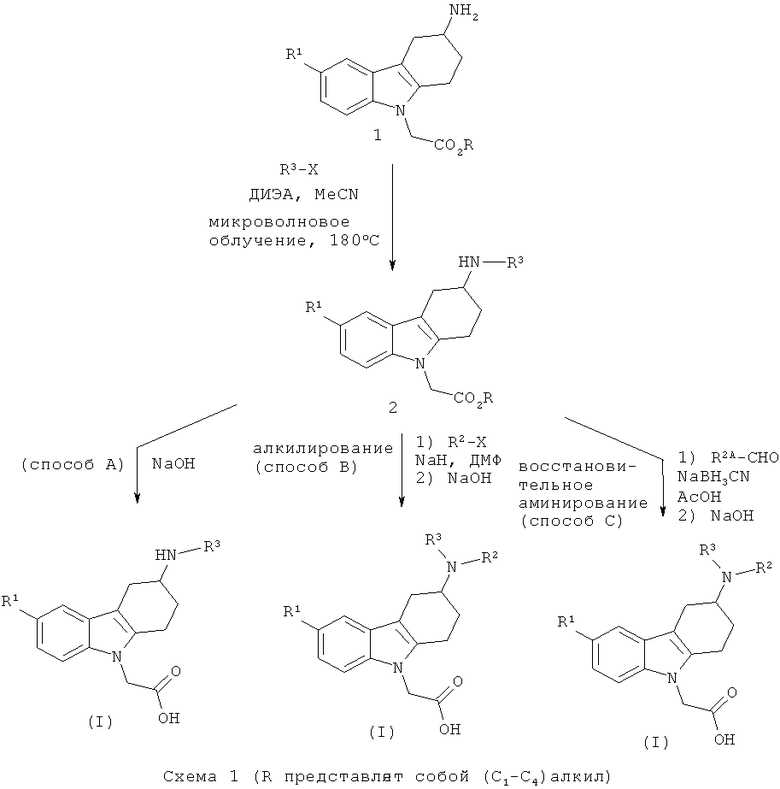
Промежуточные соединения структуры 1 получают в результате снятия защитной группы (PG) с промежуточного соединения структуры 3, используя известные специалисту в соответствующей области условия взаимодействия. Предпочтительно, защитная группа представляет собой такую группу, как трет-бутоксикарбонильная, бензилоксикарбонильная или аллилоксикарбонильная, наиболее предпочтительно, трет-бутоксикарбонильная. Предпочтительно, трет-бутоксикарбонильная группа может быть удалена с помощью кислоты, такой как HCl, в растворителе, таком как диоксан.
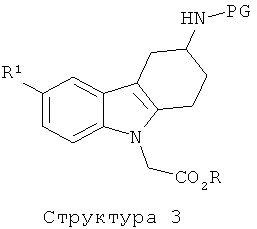
Промежуточное соединение структуры 3 получают посредством взаимодействия промежуточного соединения структуры 4 с соединением формулы L-CH2CO2R, в которой R и L отвечают вышеприведенным определениям, в присутствии основания, такого как карбонат цезия, гидрид натрия трет-бутилат калия и им подобного, в подходящем растворителе, таком как ацетон, MeCN, ТГФ или диоксан. Подходящий L представляет собой уходящую группу, такую как галоид (в частности, бром или хлор), мезилоксигруппа или тозилоксигруппа. Предпочтительно, соединение формулы L-CHzCOzR представляет собой этиловый эфир бромуксусной кислоты.
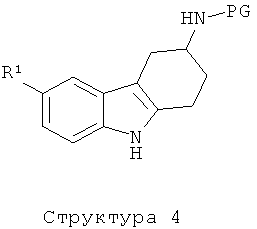
Промежуточное соединение структуры 4, в котором PG отвечает вышеприведенному описанию, получают, например, с помощью синтеза индолов по Фишеру, следуя литературным данным (J.D. На и др.. Bulletin of the Korean Soc. Chem. 2004, 25, 1784-1790): взаимодействие коммерчески доступного или хорошо известного гидразина структуры 5 (или в виде свободного основания, или в виде соли) и циклогексанона структуры 6, который является коммерчески доступным или синтез которого описан в вышеупомянутом литературном источнике, приводит к искомому промежуточному соединению структуры 4 в виде рацемата.
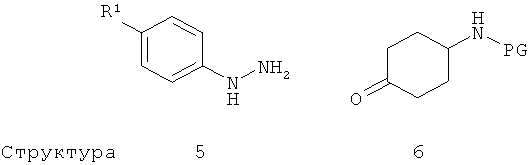
В другом варианте осуществления настоящего изобретения промежуточное соединение структуры 4 получают посредством снабжения защитой аминогруппы в тетрагидрокарбазол-3-иламине структуры 7 с помощью описанных выше способов введения защитной группы, известных специалисту в соответствующей области. Например, аминогруппа промежуточного соединения структуры 7 может быть снабжена трет-бутоксикарбонильной (Вое) защитной группой посредством взаимодействия с Вос2О в присутствии основания, такого как ДИЭА, и каталитического количества 4-диметиламинопиридина (ДМАП) или диметиламиноэтиламина (предпочтительно) в апротонном растворителе, таком как дихлорметан (ДХМ).
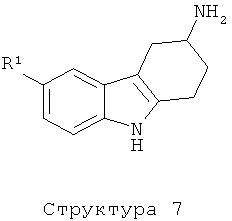
Как (R)-, так и (S)-энантиомер исходного тетрагидрокарбазол-3-иламина структуры 7 получают посредством стереоспецифической реакции, следуя описанной в литературе методике (Rosentreter U. и др., Arzneim. - Forsch. 1989, JP(12), 1519-1521; и Европейский патент ЕР 0242518).
Синтез рацемического гидрохлорида этилового эфира (3RS)-(3-амино-1,2,3,4-тетрагидро-9H-карбазол-9-ил)уксусной кислоты описан в литературе (Ulven, Т.; Kostenis, E. J. Med. Chem. 2005, 48, 897-900).
Стереоселективный синтез метилового эфира (3R)-(3-трет-бутоксикарбониламино-1,2,3,4-тетрагидро-9H-карбазол-9-ил)уксусной кислоты описан в международной заявке на изобретение WO 03/097598.
Во всех тех случаях, когда соединения формулы (I) или промежуточные соединения структуры 1-4 или 7 получают в виде смесей энантиомеров, энантиомеры могут быть разделены с помощью способов, известных специалисту в соответствующей области: например, посредством образования и разделения диастереомерных солей или с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) на хиральной неподвижной фазе, такой как колонка Regis Whelk-O1 (R,R) (10 мкм), колонка Daicel ChiralCel OD-H (5-10 мкм), или колонка Daicel ChiralPak IA (10 мкм) или AD-H (5 мкм). Типичными параметрами для хиральной ВЭЖХ являются изократическая смесь элюента А (EtOH, в присутствии или отсутствии амина, такого как Е1зМ и/или диэтиламин) и элюента Б (гексан) при скорости элюирования от 0,8 до 150 мл/мин.
Экспериментальная часть
Сокращения (как они употребляются в контексте):
Химические методики
Общие замечания
Все растворители и реагенты используют в том виде, в каком их получают из коммерческих источников, если иное не оговорено специально.
Температуры указаны в градусах Цельсия (°С). Если не указано иного, взаимодействия осуществляют при комнатной температуре (КТ).
Для смесей соотношения между долями растворителей, или элюентов, или смесей реагентов в жидкой форме даны в объемных отношениях (об./об.), если иное не оговорено специально.
Параметры аналитической ВЭЖХ, используемые в нижеследующих примерах:
Анализы ВЭЖХ/МС осуществляют с помощью ВЭЖХ-хроматографа Waters 2795 Alliance, оснащенного детектором с диодной матрицей Waters 996 и масс-спектрометром Micromass ZQ Waters (ионизация распылением в электрическом поле), детектирование при длинах волн 200-400 нм (ЖХ-3), или же с помощью установки Agilent 1100, оснащенной бинарным насосом Dionex Р580, детектором с диодной матрицей Dionex PDA-100 и масс-спектрометром Finnigan AQA (ЖХ-1 и ЖХ-2).
Времена удерживания в жидкостной хроматографии (ЖХ) получают при следующих условиях элюирования:
- ЖХ-1: аналитическая ВЭЖХ на колонке Ascentis Express MC C18 (4,6×30 мм, 2,7 мкм, Waters); линейный градиент: вода/0,04% ТФУК (А) и MeCN (Б), от 5% к 95% Б в течение 1,5 мин.; скорость элюирования 4,5 мл/мин, детектирование при 210 нм.
- ЖХ-2: аналитическая ВЭЖХ на колонке Zorbax® SB-AQ (4,6×50 мм, 5 мкм, Agilent); линейный градиент: вода/0,04% ТФУК (А) и MeCN (Б), от 5% к 95% Б в течение 1,5 мин.; скорость элюирования 4,5 мл/мин, детектирование при 210 нм.
- ЖХ-3: аналитическая ВЭЖХ на колонке Agilent SB C-18, (1,8 мкм, 2,1×50 мм), линейный градиент: вода/0,04% ТФУК (А) и MeCN (Б), от 5% к 95% Б в течение 1,5 мин.; скорость элюирования 4,5 мл/мин, детектирование при 210 нм.
Препаративную очистку с помощью ВЭЖХ/МС осуществляют с помощью установки Gilson 333/334 с бинарным градиентным насосом высокого давления, оснащенной автоматическим пробоотборником и сборником фракций Gilson 215, детектором с диодной матрицей Dionex UVD340U, испарительным детектором светорассеяния Polymerlabs PL-ELS 1000 и масс-спектральным детектором Finnigan AQA MC или масс-спектральным детектором Thermo MCQ Plus, с использованием колонки Waters Atlantis ТЗ (10 мкм, 30×75 мм), с линейным градиентом MeCN (А) и воды с 0,5% муравьиной кислоты (Б) в течение 5 мин.; скорость элюирования 75 мл/мин.
Спектры 1Н-ЯМР регистрируют либо с помощью ЯМР спектрометра с Фурье-преобразованием Varian Mercury 300VX, либо с помощью спектрометра Bruker Advance II 400. Химические сдвиги (δ) приводят в миллионных долях (м.д.) по отношению к резонансам протонов, обуславливаемых неполным дейтерированием растворителя для ЯМР. Например, для ДМСО δ (Н) 2,49 м.д. Сокращения s, d, t, q, m и ушир. относятся к синглету, дублету, триплету, квартету мультиплету и уширенному сигналу, соответственно.
Аналитическую ВЭЖХ на хиральной неподвижной фазе осуществляют на колонке Daicel ChiralPak IA (4,6×250 мм, 5 мкм). Типичными параметрами для хиральной ВЭЖХ являются изократическая смесь 80% гептана и 20% EtOH, скорость элюирования 0,8 мл/мин., детектирование при 210 нм (хиральная ВЭЖХ-1).
Препаративную ВЭЖХ на хиральной неподвижной фазе осуществляют на колонке Daicel ChiralPak AD-H (20×250 мм, 5 мкм). Типичными параметрами для хиральной ВЭЖХ являются изократическая смесь 50% EtOH и 50% гексана, скорость элюирования 16 мл/мин., детектирование при 210 нм (хиральная ВЭЖХ-2).
A.1. Синтез энантиомерно обогащенных производных 2,3,4,9-тетрагидро-1H-карбазол-3-амина
A.1.1. Синтез 6-фтор-1,2,4,9-тетрагидроспиро[карбазол-3,2'-[1,3]диоксолана]
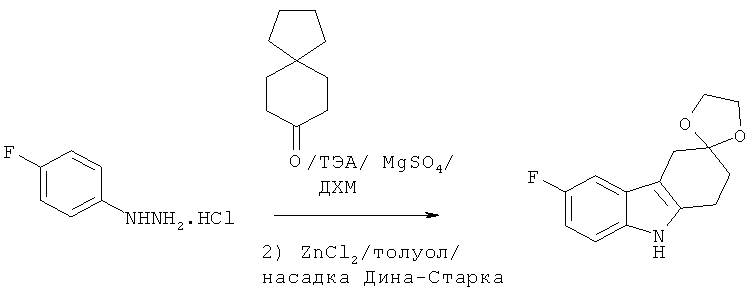
К суспензии MgSO4 (18,4 г, 0,154 моля) в ДХМ (500 мл) добавляют 1,4-диоксаспиро[4,5]декан-8-он (48,0 г, 0,308 моля) и гидрохлорид 4-фторфенилгидразина (50,0 г, 0,308 моля). Затем добавляют по каплям в продолжение 5 минут ТЭА (43,8 мл, 0,308 моля). После добавления ТЭА внутренняя температура повышается от 17°С до 25°С. Получаемую таким образом суспензию оставляют перемешиваться при КТ в течение 4 часов и фильтруют. Твердое вещество белого цвета дважды промывают ДХМ и концентрируют фильтрат при пониженном давлении. Кашицу оранжевого цвета суспендируют в толуоле (500 мл) и добавляют ZnCl2 (38,6 г, 0,283 моля). Получаемый таким образом темно-оранжевый раствор перемешивают при кипячении с использованием насадки Дина-Старка в течение 12 часов. После охлаждения до КТ получаемую таким образом черную смесь фильтруют через целит. Твердое вещество промывают изопропилацетатом и подщелачивают органический фильтрат 1 н. NaOH (до достижения рН~12). Водную фазу экстрагируют изопропилацетатом, пропускают объединенные органические экстракты сквозь целит, сушат над Na2S04, фильтруют и концентрируют под вакуумом, что приводит к указанному в заглавии соединению в виде твердого вещества темно-коричневого цвета.
ЖХ-МС (ЖХ-2): tR: 0,80 мин./[М+Н]+: 248,19.
А.1.2. Синтез 6-фтор-4,9-дигидро-177-карбазол-3-(277)-она
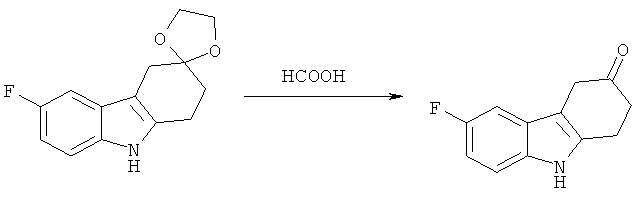
Раствор 6-фтор-1,2,4,9-тетрагидроспиро[карбазол-3,2'-[1,3]диоксолана] (33,7 г, 0,136 моля) в муравьиной кислоте (123 мл) перемешивают при КТ в течение 4 ч 30 мин. Затем при температуре 0°С аккуратно добавляют воду и перемешивают получаемую таким образом суспензию в течение 30 минут при температуре 0-5°С. Суспензию отфильтровывают, дважды промывают твердое вещество желтого цвета водой (2х14 мл) и сушат под высоким вакуумом в течение ночи, что приводит к указанному в заглавии соединению в виде твердого вещества желтого цвета.
1Н-ЯМР (ДМСО-d6): δ 2,75 (m, 2H); 3,15 (m, 2H); 3,5 (s, 2H); 6,85 (m, 1Н); 7,1 (dd, 1Н); 7,25 (m, 1Н); 11,05 (s, 1Н).
А.1.3. Синтез (S)-6-фтор-N-((R)-1-фенилэтил)-2,3,4,9-тетрагидро-1Н-карбазол-3-амина
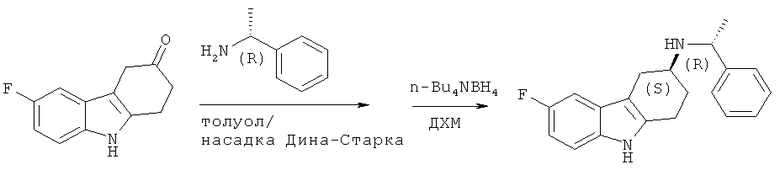
Смесь 6-фтор-4,9-дигидро-1H-карбазол-3-(2H)-она (15 г, 0,074 моля) и (R)-α-метилбензиламина (9,6 мл, 0,074 моля) в безводном толуоле (100 мл) перемешивают при кипячении с использованием насадки Дина-Старка в течение 5 часов. После охлаждения до КТ, реакционную смесь концентрируют под вакуумом, что приводит к неочищенному имину который используют на следующей стадии без дополнительной очистки (крайне неустойчив на воздухе).
К холодному (-50°С) раствору тетагидробората тетра-н-бутиламмония (20,9 г, 0,081 моля) в безводном ДХМ (80 мл) добавляют по каплям в продолжение 2 часов раствор ранее полученного имина (22,6 г, 0,074 моля) в безводном ДХМ (80 мл). По завершении добавления реакционной смеси позволяют нагреться до температуры 15°С в течение ночи. Затем медленно (в продолжение 30 минут) добавляют при температуре 4°С 2н. H2SO4 (40 мл), в результате чего начинается осаждение твердого вещества. Добавляют еще 10 мл 2н. H2SO4 и перемешивают смесь при температуре 4°С в течение 45 минут. Твердое вещество отфильтровывают, промывают водой и сушат под вакуумом, что приводит к неочищенному твердому веществу слегка коричневатого цвета. Данное твердое вещество растворяют в смеси изопропилацетата (135 мл), МеОН (40 мл) и 1н. NaOH (135 мл) и интенсивно перемешивают смесь в течение 45 минут, в результате чего раствор приобретает коричневую/пурпурную окраску. Если твердое вещество растворилось не полностью, добавляют дополнительное количество iPrOAc/МеОН/NaOH (1 об. каждого). Разделяют слои и водную фазу экстрагируют этилацетатом. Объединенные органические фракции сушат над Na2SO4, фильтруют и концентрируют до половинного объема. К данному раствору добавляют МеОН (35 мл), охлаждают до температуры 4°С, добавляют по каплям 4н. HCl в диоксане (0,45 об.) и перемешивают смесь при температуре 4°С в течение 1 часа. Получаемый таким образом осадок отфильтровывают и сушат под вакуумом, что приводит к соли с HCl в виде кристаллов белого цвета. Данное твердое вещество суспендируют в смеси этилацетата (80 мл), МеОН (45 мл), добавляют 1 н. NaOH (80 мл) и перемешивают получаемый таким образом прозрачный желтый раствор в течение 20 минут. Разделяют слои и водную фазу экстрагируют этилацетатом. Объединенные органические фракции сушат над Na2SO4, фильтруют и концентрируют под вакуумом, что приводит к 8,96 г (35%, диастереомерный избыток 95/5) указанного в заглавии соединения в виде твердого вещества белого цвета.
ЖХ-МС (ЖХ-3): tR: 3,63 мин./[М+Н]+: 309,2.
Комментарий: характеристику стереогенного центра в положении 3 в получаемом производном 2,3,4,9-тетрагидро-1H-карбазол-3-амина осуществляют аналогично описанному в Rosentreter U. и др., Arzneim. - Forsch. 1989, JP (12), 1519-1521.
A.1.4. Синтез (R)-6-фтор-N-((S)-1-фенилэтил)-2,3,4,9-тетрагидро-1H-карбазол-3-амина
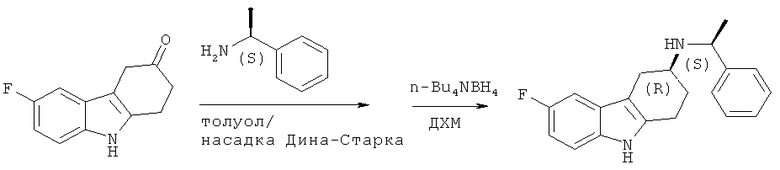
Следуя методике, аналогичной описанной для (8)-6-фтор-N-((R)-1-фенилэтил)-2,3,4,9-тетрагидро-1H-карбазол-3-амина, но используя (S)-α-метилбензиламин для восстановительного аминирования, получают указанное в заглавии соединение в виде твердого вещества белого цвета.
ЖХ-МС (ЖХ-3): tR: 4,01 мин./[М+Н]+ 309,2.
Комментарий: характеристику стереогенного центра в положении 3 в получаемом производном 2,3,4,9-тетрагидро-1H-карбазол-3-амина осуществляют аналогично описанному в Rosentreter U. и др., Arzneim. - Forsch. 1989, 39(12), 1519-1521.
A.1.5. Синтез (S)-6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3-амина
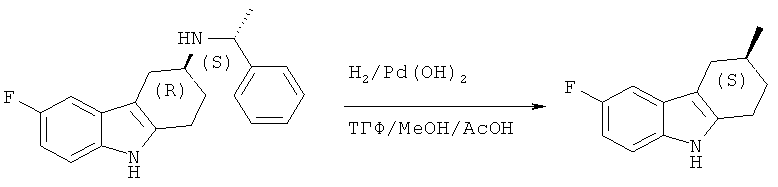
К дегазированному раствору (S)-6-фтор-N-((R)-фенилэтил)-2,3,4,9-тетрагидро-1H-карбазол-3 -амина (8,96 г, 0,029 моля) в смеси ТГФ (60 мл), МеОН (20 мл) и АсОН (10 мл) добавляют 20% Pd(OH)2 (1,34 г). Смесь трижды откачивают и помещают реакционную смесь под давление водорода 1 атм (из баллона). Перемешивают смесь при КТ в течение 10 часов и фильтруют через целит. Промывают фильтрующий слой ТГФ/МеОН и концентрируют фильтрат до объема 50 мл. Остаток растворяют в этилацетате и промывают 1н. NaOH. Водную фазу экстрагируют этилацетатом, сушат объединенные органические фракции над Na2SO4, фильтруют и концентрируют под вакуумом, что приводит к указанному в заглавии соединению в виде твердого вещества белого цвета.
ЖХ-МС (ЖХ-2): tR: 0,64 мин./[M+H+MeCN]+: 246,19
ВЭЖХ (хиральная ВЭЖХ-1): tR: 36,9 мин. (S-изомер); tR: 40,0 мин. (R-изомер); (энантиомерный избыток (э.и.): 93,6%).
А.1.6. Синтез (R)-6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3-амина
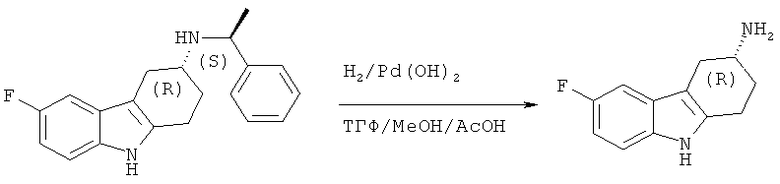
Следуя методике, аналогичной описанной для (S)-6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3 -амина, гидрирование (R)-6-фтор-N-((S)-1-фенилэтил)-2,3,4,9-тетрагидро-1H-карбазол-3-амина (8,7 г, 0,028 моля), приводит к указанному в заглавии соединению в виде твердого вещества белого цвета. ЖХ-МС (ЖХ-2): tR: 0,64 мин./[M+H+MeCN]+: 246,19
ВЭЖХ (хиральная ВЭЖХ-1): tR: 37,1 минут (S-изомер); tR: 39,2 минут (R-изомер); (э.и.: 94,2%).
А.1.7. Синтез (S)-трет-6утклокого эфира (6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3-ил)карбаминовой кислоты
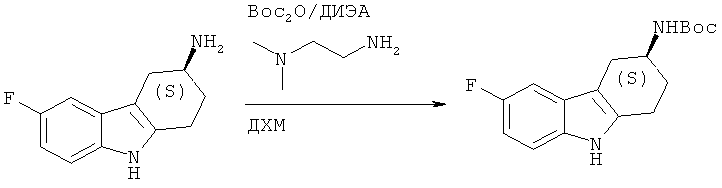
К раствору (S)-6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3-амина (5,2 г, 0,025 моля) и Boc2O (6,66 г, 0,030 моля) в безводном ДХМ (120 мл) добавляют ДИЭА (5,56 мл, 0,032 моля). После перемешивания при КТ в течение 1 ч 45 мин. добавляют диметиламиноэтиламин (0,66 г, 7,7 ммоля). Перемешивание при КТ продолжают в течение 15 минут и разбавляют реакционную смесь в насыщенном водном растворе NH4Cl. Водную фазу дважды экстрагируют ДХМ, объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют под вакуумом, что приводит к неочищенному твердому веществу.
Очистка с помощью флэш-хроматографии (ФХ) (этилацетат/н-гептан: 1/1), приводит к указанному в заглавии соединению в виде пены светло-коричневого цвета.
ЖХ-МС (ЖХ-2): tR: 0,99 мин./[М+Н]+: 305,44.
А.1.8. Синтез (R)-трет-бутилового эфира (6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3-ил)карбаминовой кислоты
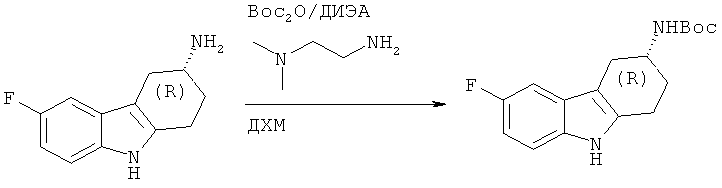
Следуя методике, аналогичной описанной для (S)-трет-6утплоъого эфира (6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3-ил)карбаминовой кислоты, получают указанное в заглавии соединение в виде в виде пены светло-коричневого цвета.
ЖХ-МС (ЖХ-2): tR: 1,00 мин./[М+Н]+: 305,12.
А.1.9. Синтез (S)-этилового эфира 2-(3-((трет-бутоксикарбонил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты
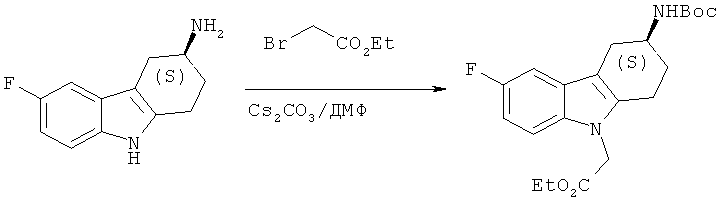
Раствор этилового эфира бромуксусной кислоты (3,08 мл, 0,027 моля) в безводном ДМФ (35 мл) добавляют по каплям к смеси (S)-трет-6утилового эфира (6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3-ил)карбаминовой кислоты (6,5 г, 0,021 моля) и Cs2CO3 (20,5 г, 0,063 моля) в безводном ДМФ (145 мл). Получаемую таким образом реакционную смесь перемешивают при температуре 65°С в течение 2 часов и затем при КТ в течение ночи. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой и солевым раствором, сушат над Na2SO4, фильтруют и концентрируют под вакуумом, что приводит к неочищенному твердому веществу желтого цвета.
Очистка с помощью ФХ (этилацетат/н-гептан:1/1) приводит к указанному в заглавии соединению в виде твердого вещества бледно-желтого цвета.
ЖХ-МС (ЖХ-2): tR: 1,04 мин./[М+Н]+: 391,5.
А.1.10. Синтез (Ю-этилового эфира 2-(3-((трет-бутоксикарбонил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты
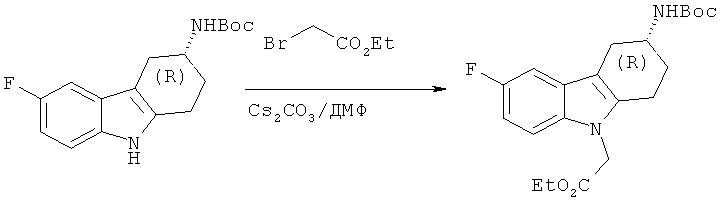
Следуя методике, аналогичной описанной для (S)-этилового эфира 2-(3-((трет-бутоксикарбонил)амино)-6-фтор-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусной кислоты, получают указанное в заглавии соединение в виде пены белого цвета.
ЖХ-МС (ЖХ-2): tR: 1,06 мин./[М+Н]+: 391,16.
A.1.11. Синтез гидрохлорида (8)-этилового эфира 2-(3-амино-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты
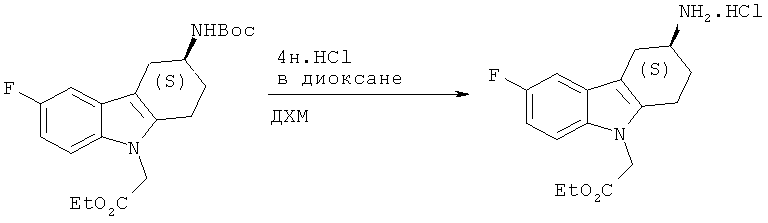
К холодному (0°С) раствору (S)-этилового эфира 2-(3-((трет-бутоксикарбонил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты (8,2 г, 0,021 моля) в безводном ДХМ (50 мл) добавляют по каплям 4н. HCl в диоксане (52,5 мл, 0,21 моля). Получаемую таким образом реакционную смесь перемешивают при температуре 0°С в течение 2 часов и затем при КТ в течение 5 часов. Реакционную смесь концентрируют под вакуумом, растворяют получаемое при этом твердое вещество в EtOH (70 мл) и добавляют при температуре 0°С 3н. HCl в этилацетате (7 мл). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение ночи. После охлаждения до КТ реакционную смесь концентрируют под вакуумом, что приводит к указанному в заглавии соединению в виде порошка бежевого цвета.
ЖХ-МС (ЖХ-2): tR: 0,63 мин./[М+Н]+: 291,08.
А.1.12. Синтез гидрохлорида (R)-этилового эфира 2-(3-амино-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты
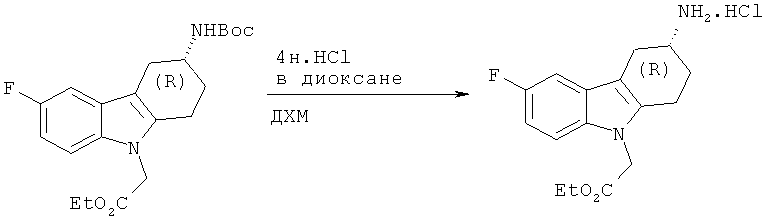
Следуя методике, аналогичной описанной для гидрохлорида (S)-этилового эфира 2-(3-амино-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты, получают указанное в заглавии соединение в виде твердого вещества бежевого цвета.
ЖХ-МС (ЖХ-2): tR: 0,64 мин./[М+Н]+: 291,16
А.1.13. Синтез бензилового эфира (6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3-ил)карбаминовой кислоты
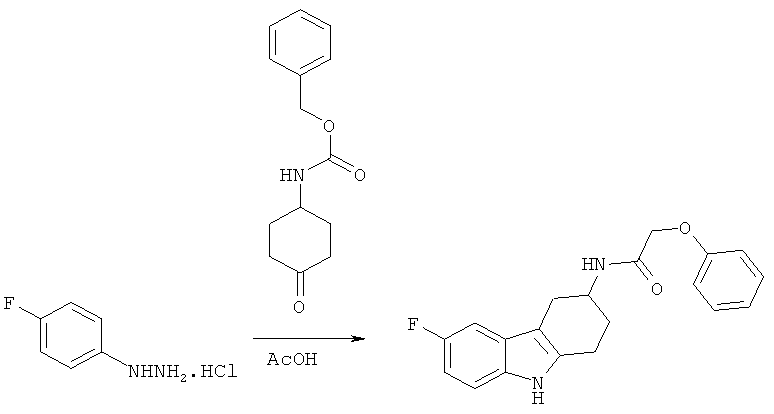
Раствор бензилового эфира (4-оксоциклогексил)карбаминовой кислоты (21,7 г, 87,8 ммоля) и гидрохлорида 4-фторфенилгидразина (14,3 г, 87,8 ммоля) в ледяной АсОН (148 мл) перемешивают при кипячении с обратным холодильником в течение 1 ч 30 мин. После охлаждения до КТ реакционную смесь разбавляют этилацетатом и промывают насыщенным водным раствором NaHCO3. Водную фазу дважды экстрагируют этилацетатом, объединенные органические экстракты промывают насыщенным водным раствором NaHCO3, водой и солевым раствором, сушат над MgSO4, фильтруют и концентрируют под вакуумом, что приводит к указанному в заглавии соединению в виде пены светло-коричневого цвета, которую используют на следующей стадии без дополнительной очистки.
ЖХ-МС (ЖХ-1): tR: 0,83 мин./[М+H]+: 339,25.
А.1.14. Синтез этилового эфира 2-(3-(((бензилокси)карбонил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты
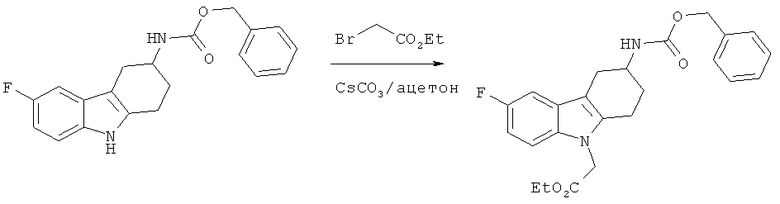
К раствору бензилового эфира (6-фтор-2,3,4,9-тетрагидро-1H-карбазол-3-ил)карбаминовой кислоты (29,8 г, 87,9 ммоля) в ацетоне (252 мл) добавляют Cs2CO3 (71,6 г, 219,8 ммоля). Получаемую таким образом светло-коричневую суспензию перемешивают при КТ в течение 10 минут, а затем добавляют по каплям этиловый эфир бромуксусной кислоты (19,5 мл, 176 ммолей). Реакционную смесь перемешивают при КТ в течение 48 часов, выливают в воду и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой и солевым раствором, сушат над MgSO4, фильтруют и концентрируют под вакуумом, что приводит к неочищенному твердому веществу.
Очистка с помощью ФХ (этилацетат/м-гептан: 1/1), приводит к указанному в заглавии соединению в виде твердого вещества белого цвета. ЖХ-МС (ЖХ-2): tR: 0,88 мин./[M+H]+: 425,26.
Два энантиомера получаемого продукта разделяют с помощью препаративной хиральной ВЭЖХ:
(S)-этиловый эфир 2-(3-(((бензилокси)карбонил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты: ВЭЖХ (хиральная ВЭЖХ-2): tR: 8,42 минут;
(R)-этиловый эфир 2-(3-(((бензилокси)карбонил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты: ВЭЖХ (хиральная ВЭЖХ-2): tR: 10,38 минут.
А.1.15. Синтез гидрохлорида (S)-этилового эфира 2-(3-амино-6-фтор-3,4-дигидро-1H-карбазол-9(2H-ил)уксусной кислоты
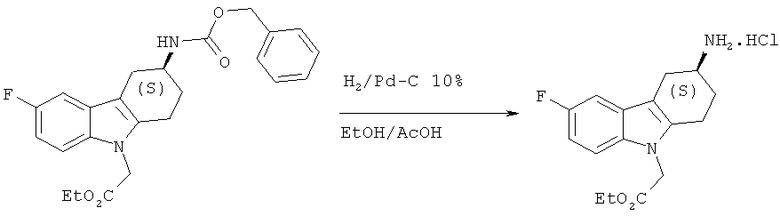
К перемешиваемой дегазированной суспензии (S)-этилового эфира 2-(3-(((бензилокси)карбонил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты (1,67 г, 3,93 ммоля) в смеси EtOH (10,5 мл) и ледяной АсОН (45 мл) добавляют Pd-C (10%, 419 мг). Реакционную смесь помещают под давление водорода 1 атм (из баллона) Н2 и перемешивают при КТ в течение 1 ч 30 мин. Реакционную смесь фильтруют через слой целита и промывают целит ДХМ. Добавляют к фильтрату 4н. HCl в диоксане (9,75 мл), а затем концентрируют его под вакуумом. Получаемое таким образом твердое вещество растирают с диэтиловым эфиром, фильтруют, промывают твердое вещество диэтиловым эфиром и сушат его под вакуумом, что приводит к указанному в заглавии соединению в виде порошка белого цвета.
ЖХ-МС (ЖХ-2): tR: 0,64 мин./[М+Н]+: 291,21.
А.1.16. Синтез гидрохлорида (R)-этилового эфира 2-(3-амино-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты
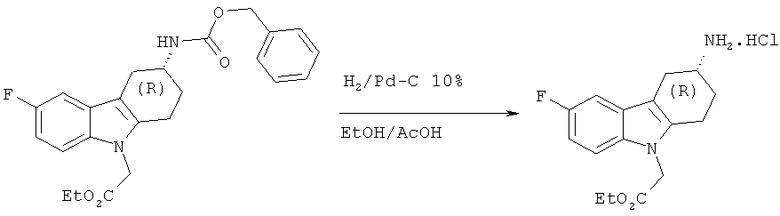
Следуя методике, аналогичной описанной для гидрохлорида (S)-этилового эфира 2-(3-амино-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты, но используя (R)-этиловый эфир 2-(3-(((бензилокси)карбонил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты, получают указанное в заглавии соединение в виде твердого вещества белого цвета.
ЖХ-МС (ЖХ-2): tR: 0,66 мин./[М+Н]+ 291,08.
А.1.17. Синтез производного (3S)- и (3R)-этилового эфира 2-(3-гетероариламино-3,4-дигидро-1H-карбазол-9-(2H-ил)уксусной кислоты (общая методика)
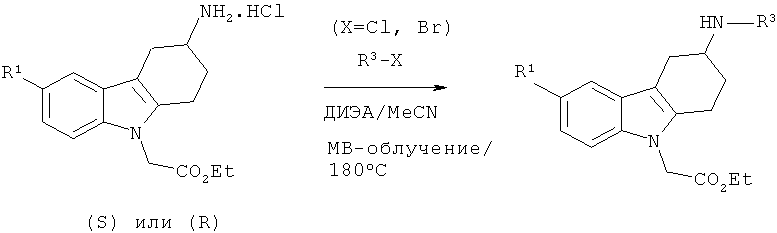
Смесь гидрохлорида (3S)-этилового эфира соответствующего производного 2-(3-амино-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусной кислоты (0,122 ммоля), ДИЭА (0,306 ммоля, 2,5 экв.) и подходящего галогенпроизводного R3-X (0,122 ммоля) в безводном MeCN (1 мл) облучают в микроволновой печи при температуре 180°С в течение 20 минут. После охлаждения до КТ продукты непосредственно подвергают очистке с помощью препаративной ВЭЖХ, что приводит к искомому соединению.
Аналогичным образом получают другие энантиомеры, исходя из гидрохлорида (3R)-этилового эфира соответствующего производного 2-(3-амино-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусной кислоты.
Получение промежуточных соединений
Нижеследующие производные (3S)- и (3R)-этилового эфира 2-(3-гетероариламино-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусной кислоты синтезируют согласно вышеизложенной общей методике (X, присутствующий в описании галогенпроизводного R3-X, обозначает хлор).
А.2. Синтез рацемических производных 2,3,4,9-тетрагидро-1H-карбазол-3-амина
А.2.1. Синтез производных бензилового эфира (2,3,4,9-тетрагидро-1H-карбазол-3-ил)карбаминовой кислоты
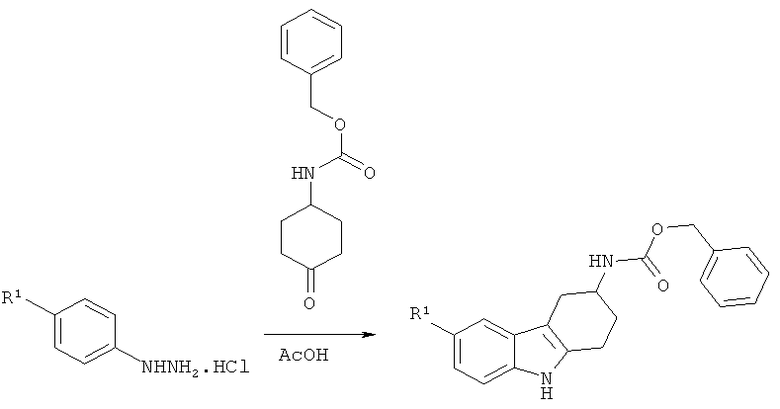
Раствор бензилового эфира (4-оксоциклогексил)карбаминовой кислоты (1 г, 4 ммоля) и гидрохлорида соответствующего арилгидразинового производного, замещенного по положению 4, (1 экв.) в ледяной АсОН (6,8 мл) перемешивают при кипячении с обратным холодильником в течение 1 ч 30 мин. После охлаждения до КТ реакционную смесь разбавляют этилацетатом и промывают насыщенным водным раствором NaHCO3. Водную фазу дважды экстрагируют этилацетатом, объединенные органические экстракты промывают насыщенным водным раствором NaHCO3, водой и солевым раствором, сушат над MgSO4, фильтруют и концентрируют под вакуумом, что приводит к указанному в заглавии соединению в виде пены, которую используют на следующей стадии без дополнительной очистки.
Нижеследующие производные бензилового эфира (2,3,4,9-тетрагидро-1H-карбазол-3-ил)карбаминовой кислоты синтезируют согласно вышеизложенной общей методике.
А.2.2. Синтез производных этилового эфира 2-(3-(((бензилокси)карбонил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты
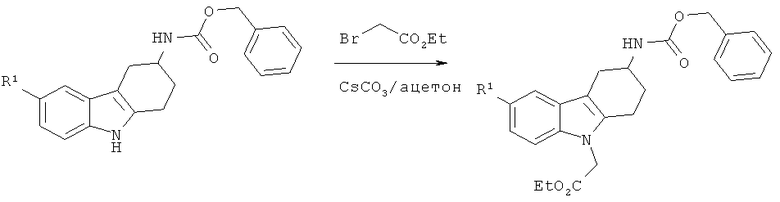
К раствору соответствующего производного бензилового эфира (2,3,4,9-тетрагидро-1H-карбазол-3-ил)карбаминовой кислоты (4 ммоля) в ацетоне (11,5 мл) добавляют Cs2CO3 (10 ммоля, 2,5 экв.). Получаемую таким образом светло-коричневую суспензию перемешивают при КТ в течение 10 минут, а затем добавляют по каплям этиловый эфир бромуксусной кислоты (8 ммолей, 2 экв.). Реакционную смесь перемешивают при КТ в течение 48 часов, выливают в воду и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой и солевым раствором, сушат над MgSO4, фильтруют и концентрируют под вакуумом, что приводит к неочищенному твердому веществу.
Очистка с помощью ФХ (этилацетат/н-гептан:1/1), приводит к указанному в заглавии соединению в виде твердого вещества белого цвета.
Нижеследующие производные этилового эфира 2-(3-(((бензилокси)карбонил)-амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты синтезируют согласно вышеизложенной общей методике.
А.2.3. Синтез гидробромидов производных этилового эфира 2-(3-амино-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты
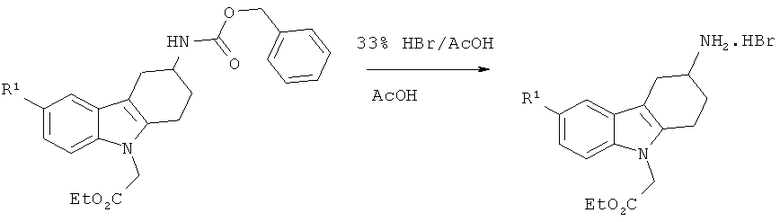
К раствору этилового эфира соответствующего производного 2-(3-(((бензилокси)карбонил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты (500 мг) в ледяной АсОН (12 мл) добавляют 33% HBr в АсОН (3 мл). Реакционную смесь перемешивают при КТ в течение 1 часа и затем концентрируют под вакуумом, что приводит к неочищенному маслянистому веществу. Растирание со смесью диэтилового эфира и ДХМ (9/1) приводит к указанному в заглавии соединению в виде твердого вещества.
Нижеследующие гидробромиды производных этилового эфира 2-(3-амино-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты синтезируют согласно вышеизложенной общей методике.
А.2.4. Синтез производных этилового эфира 2-(3-оксо-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты
А.2.4.1. Получение производных этилового эфира 2-(1,2-дигидроспиро [карбазол-3,2'-[1,3]диоксолан1-9(4H)-ил)уксусной кислоты
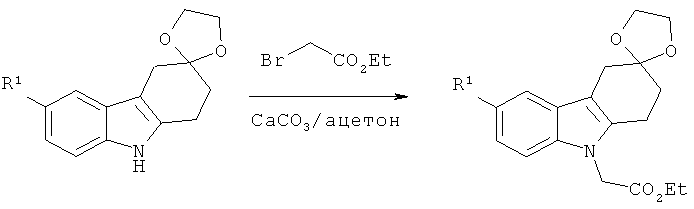
Общая методика:
К раствору соответствующего производного 1,2,4,9-тетрагидроспиро[карбазол-3,2'-[1,3]диоксолана (получаемого аналогично 6-фтор-1,2,4,9-тетрагидроспиро-[карбазол-3,2'-[1,3]диоксолану]) (20 ммолей) в безводном ацетоне (65 мл) добавляют Cs2CO3 (2,5 экв.). Получаемую таким образом суспензию перемешивают при КТ в течение 10 минут в атмосфере аргона, а затем добавляют этиловый эфир бромуксусной кислоты (2 экв.). Перемешивают реакционную смесь в течение 2 суток в атмосфере аргона, фильтруют через целит и промывают осадок на фильтре ацетоном. Фильтрат концентрируют под вакуумом и выливают остаток в воду. Водную фазу экстрагируют этилацетатом, объединенные органические экстракты сушат над MgSO4, фильтруют и концентрируют под вакуумом, что приводит к неочищенному маслянистому веществу.
Очистка с помощью ФХ (этилацетат/н-гептан:1/1), приводит к указанному в заглавии соединению в виде твердого вещества.
Нижеследующее производное этилового эфира 2-(1,2-дигидроспиро[карбазол-3,2'-[1,3]диоксолан]-9(4H)-ил)уксусной кислоты синтезируют согласно вышеизложенной общей методике.
Этиловый эфир 2-(6-фтор-1,2-дигидроспиро[карбазол-3,2'-[1,3]диоксолан]-9-(4Н)-ил)уксусной кислоты
ЖХ-МС (ЖХ-2): tR: 0,89 мин./[М+Н]+: 334,12.
А.2.4.2. Получение производных этилового эфира 2-(3-оксо-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусной кислоты
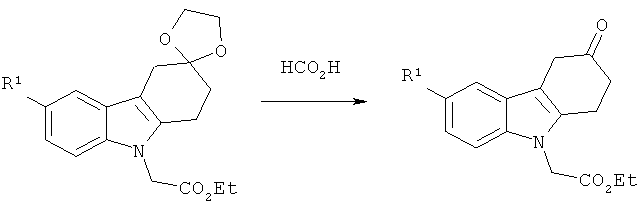
Общая методика:
Раствор этилового эфира соответствующего производного 2-(1,2-дигидроспиро[карбазол-3,2'-[1,3]диоксолан]-9(4H)-ил)уксусной кислоты (20 ммоля) в чистой муравьиной кислоте (17 мл) перемешивают при КТ в течение 4 ч 30 мин. в атмосфере аргона. Реакционную смесь затем охлаждают до температуры 4°С и разлагают остатки реагентов посредством добавления воды (2 мл). Получаемую таким образом суспензию перемешивают в течение 30 минут, а затем фильтруют. После этого сушат твердое вещество под высоким вакуумом.
Нижеследующее производное этилового эфира 2-(3-оксо-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусной кислоты синтезируют согласно вышеизложенной общей методике.
Этиловый эфир 2-(6-фтор-3-оксо-3,4-дигидро-1Н-карбазол-9(2Н)-ил)уксусной кислоты
ЖХ-МС (ЖХ-2): tR: 0,85 мин./[М+Н]+: 290,02.
А.2.5. Синтез производных этилового эфира 2-(3-гетероариламино-3,4-дигидро-1H-карбазол-9-(2H-ил)уксусной кислоты
Общая методика А (посредством восстановительного аминирования):
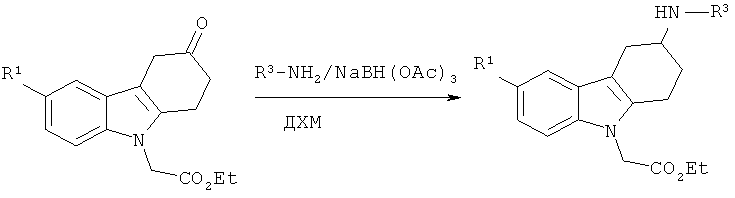
К смеси этилового эфира соответствующего производного 2-(3-оксо-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусной кислоты (50 мг) и R3-NH2 (1,1 экв.) в безводном ДХМ (1 мл) добавляют NaBH(ОАс)3 (2,2 экв.). Реакционную смесь перемешивают при КТ в течение ночи и выливают в насыщенный раствор NaHCO3. Органический слой сушат над безводным MgSO4, фильтруют и концентрируют под вакуумом, что приводит к неочищенному маслянистому веществу. Продукты подвергают очистке с помощью препаративной ВЭЖХ, что приводит к искомому соединению.
Нижеследующие производные этилового эфира 2-(3-гетероариламино-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусной кислоты синтезируют согласно вышеизложенной общей методике А.
Общая методика Б (посредством алкилирования):
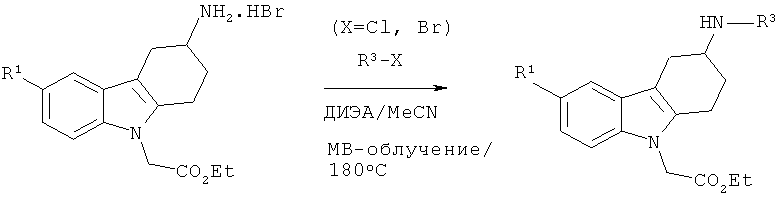
Смесь гидробромида этилового эфира соответствующего производного 2-(3-амино-3,4-дигидро-177-карбазол-9-(2H)-ил)уксусной кислоты (0,122 ммоля), ДИЭА (0,306 ммоля, 2,5 экв.) и подходящего галогенпроизводного R3-X (0,122 ммоля) в безводном MeCN (1 мл) облучают в микроволновой печи при температуре 180°С в течение 20 минут. После охлаждения до КТ продукты непосредственно подвергают очистке с помощью препаративной ВЭЖХ, что приводит к искомому соединению.
Нижеследующие производные этилового эфира 2-(3-гетероариламино-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусной кислоты синтезируют согласно вышеизложенной общей методике Б (X, присутствующий в описании галогенпроизводного R3-X, обозначает хлор).
Б. Синтез конечных соединений формулы (I) (общая методика) 1) Способ А (для соединений формулы (Т), в которых R представляет собой водород) (посредством омыления)
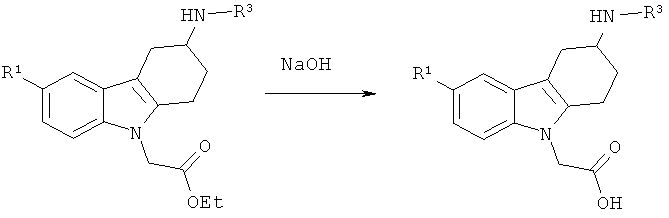
К раствору этилового эфира соответствующего производного 2-(3-гетероариламино-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусной кислоты (0,15 ммоля) в MeCN (1 мл) добавляют 1н. NaOH (0,4 мл, 0,4 ммоля). Реакционную смесь перемешивают при КТ в течение 1 часа, затем добавляют при температуре 0°С 37% HCl (0,1 мл). Продукты непосредственно подвергают очистке с помощью препаративной ВЭЖХ, что приводит к конечному соединению.
2) Способ В (посредством алкилирования)
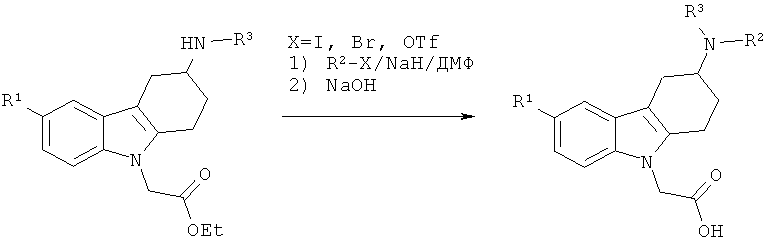
К холодному (0°С) раствору этилового эфира соответствующего производного 2-(3-гетероариламино-3,4-дигидро-1H-карбазол-9-(277)-ил)уксусной кислоты (0,06 ммоля) в безводном ДМФ (0,6 мл), добавляют NaH (0,12 ммоля, 2 экв.). Реакционную смесь перемешивают при температуре 0°С в течение 30 минут, затем добавляют соответствующее галогенпроизводное (R2-X) (0,24 ммоля, 4 экв.). Реакционную смесь перемешивают при КТ в течение 3 часов. Добавляют 1н. NaOH (5,5 экв.), перемешивают смесь при КТ в течение 1 часа, а затем добавляют 37% HCl до достижения рН 1-2. Продукты непосредственно подвергают очистке с помощью препаративной ВЭЖХ, что приводит к конечному соединению.
3) Способ С (посредством восстановительного аминирования)
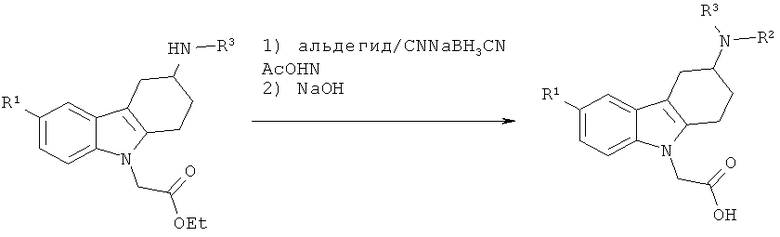
К смеси этилового эфира соответствующего производного 2-(3-гетероариламино-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусной кислоты (0,045 ммоля) и подходящего альдегида (10 экв.) в ледяной АсОН (0,4 мл) добавляют по частям NaBH3CN (10 экв.). Реакционную смесь перемешивают при КТ в течение 45 минут, затем добавляют дополнительное количество NaBH3CN (10 экв.) и продолжают перемешивание при КТ в течение 30 минут. Затем добавляют 30% водный раствор NaOH до достижения рН 9-10 и перемешивают смесь при КТ в течение ночи. После этого добавляют воду и 37% HCl (до достижения рН 1-2) и экстрагируют реакционную смесь ДХМ. Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют под вакуумом, что приводит к неочищенной кислоте. Продукты непосредственно подвергают очистке с помощью препаративной ВЭЖХ, что приводит к конечному соединению.
Получение примеров
Нижеследующие производные 2-(3-гетероариламино-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусной кислоты синтезируют согласно вышеизложенным общим методикам (X, присутствующий в описании галогенпроизводного R2-X в способе В, обозначает иод, за исключением примеров 27 и 34 (X=Br) и примера 41 (X=Off)).
Биологические анализы
Получение рецепторных мембран hCRTH2 и анализ вытеснения радиоактивного лиганда
Вначале рекомбинантные клетки линии HEK293-hCRTH2 отделяют от культуральных планшетов и переводят в 5 мл буфера А для каждого планшета (буфер А: 5 мМ Трис, 1 мМ MgCl2-6H2O, pH=7,4) с помощью резинового скребка. После этого переносят клетки в пробирки для центрифугирования и центрифугируют в течение 5 минут при 400 g. Клеточный гранулят суспендируют заново в том же буфере и замораживают пробирки до температуры -80°С. После этого оттаивают клетки и получают фрагменты мембран посредством гомогенизации с помощью гомогенизатора Polytron (30 секунд). Затем центрифугируют фрагменты мембран при 3000 g в течение 20 минут и заново суспендируют в буфере С (буфер С: 75 мМ Трис, 25 мМ MgCl2, 250 мМ сахарозы, рН 7,4). Аликвоты фрагментов мембран хранят при температуре -20°С.
Анализ связывания осуществляют при конечном анализируемом объеме 250 мкл. Вначале помещают в каждую ячейку 25 мкл исследуемого соединения, предварительно разведенного в буфере для связывания (буфер для связывания: 50 мМ Трис, 100 мМ NaCl, 1 мМ ЭДТК, 0,1% БСА (свободного от протеазы), 0,01% NaN3, 10mM MnCl2 рН 7,0). После добавления 75 мкл буфера для связывания добавляют в каждую ячейку 50 мкл радиоактивного лиганда Н-ПГД2 (при концентрации 2,5 нМ (220,000 расп./мин. на ячейку), от компании ANAWA, ART0662). Анализ связывания инициируют посредством добавления 100 мкл фрагментов мембран CRTH2, достигая конечной концентрации 20 мкг на ячейку. Для неспецифического связывания добавляют к реакционной смеси ПГД2 добавляют до достижения конечной концентрации 10 мМ. Данную смесь для анализа инкубируют в течение 90 минут при комнатной температуре, а затем фильтруют через 96-ячеечный фильтровальный планшет GF/C, предварительно вымоченный в течение 3 часов в 0,5% полиэтиленимина (ПЭИ). Фильтры-ячейки трижды промывают ледяным буфером для связывания. Затем добавляют в каждую ячейку 40 мкл сцинтилляционной жидкости Microscint-40 (Packard) и количественно измеряют остаточную радиоактивность с помощью детектора Topcount (Packard).
Антагонистическая активность соединений, представленных в качестве примеров, приведена в таблице 8.
Анализ вытеснения радиоактивного лиганда - человеческий сывороточный альбумин (ЧСА)
Анализ вытеснения радиоактивного лиганда в присутствии человеческого сывороточного альбумина (ЧСА) осуществляют аналогично описанному выше, но со следующими изменениями. Буфер для связывания с добавкой ЧСА: буфер для связывания+0,5% альбумина из человеческой сыворотки А1887 от компании Sigma (вместо 0,1% БСА). В каждую ячейку помещают 25 мкл исследуемого соединения, предварительно разбавленного в буфере для связывания с добавкой ЧСА. После добавления 75 мкл буфера для связывания с добавкой ЧСА в каждую ячейку добавляют 50 мкл Н-ПГД2 (при концентрации 2,5 нМ (220,000 расп./мин. на ячейку), от компании ANAWA, ART0662). В остальном методика остается идентичной представленной выше.
Антагонистическая активность соединений, представленных в качестве примеров, приведена в таблице 9.
Ссылки:
Shimizu T, Yamashita A. Hayaishi O. Specific binding ofprostaglandin D2 to rat brain synaptic membranes. (Специфическое связывание простагландина D2 с синоптическими мембранами мозга крыс) J. Biol. Chem. 1982. т.257: 13570-13575.
Fortini A. Modesti PA. Abbate R, Gensini GF, Neri Serneri GG. Heparin does not interfere with prostacyclin и prostaglandin D2 binding to platelets. (Гепарин не препятствует связыванию простациклина и простагландина D2 с тромбоцитами) Thromb. Res, 1985. т.40: 319-328.
Sawyer N, Cauchon E, ChateauneufA. Cruz RP, Nicholson DW, Metters KM, O'Neill GP, Gervais FG. Molecular pharmacology of the human PGD2 receptor CRTH2. (Молекулярная фармакология человеческого рецептора ПГД2 CRTH2) Br. J. of Pharmacol. 2002. т.137: 1163-1172
Анализ изменения формы эозинофилов с использованием человеческой плазмы
После получения информированного согласия отбирают образцы крови из вены в соответствии с правилами, одобренными комитетом по этике Базеля, Швейцария. Полиморфноядерные лейкоциты (включающие эозинофилы, базофилы и нейтрофилы) отделяют с помощью методики Polymorphprep (Axis-Shield). Вкратце, слой антикоагулированной цельной крови наносят на среду Polymorphprep с градиентом плотности (плотность 1,113 г/мл) и центрифугируют при 500 g в течение 30 минут.Собирают фракцию полиморфноядерных клеток и удаляют из нее эритроциты посредством лизиса в гипотоническом солевом растворе.
Заново суспендируют полиморфноядерные клетки в буфере для анализа (1×ЗФФ с Ca2+/Mg2+ с добавками 0,1% БСА, 10 мМ ГЭПЭС, и 10 мМ глюкозы, рН 7,4) при концентрации 5×106 клеток/мл и окрашивают с помощью антитела анти-CD49d-АФЦ ((АФЦ=аллофикоцианин) в течение 1 часа при КГ. Исследуемые соединения в различных концентрациях предварительно инкубируют в течение 10 минут в человеческой плазме (антикоагулированной с помощью ингибитора тромбина). После этого добавляют к полиморфноядерным клеткам человеческую плазму до достижения 50% от конечного анализируемого объема для анализа с полиморфноядерными клетками в концентрации 4×106 клеток/мл. После инкубирования в течение 10 минут при температуре 37°С активируют полиморфноядерные клетки в течение 5 минут при температуре 37°С посредством добавления ПГД2 с конечной концентрацией 100 нМ. Активацию останавливают посредством добавления 0,5 мл параформальдегида (1%).
Немедленно после фиксации параформальдегидом образцы анализируют с помощью проточного цитометра FAC S Canto (BD Biosciences) и выявляют целевые клетки по их характеристикам прямого светорассеяния (FSC) и бокового светорассеяния (SSC). Эозинофилы выявляют по сигналу от анти-CD49d-АФЦ (и их характеристическому профилю бокового светорассеяния (SSC). Указывающие на активацию эозинофилов реакции, проявляющиеся в виде изменения формы, количественно описывают как процент клеток с увеличенным прямым светорассеянием.
Антагонистическая активность соединений, представленных в качестве примеров, приведена в таблице 10.
Внутриклеточный анализ мобилизации кальция (спектрофотометрическое детектирование на планшетах, FLIPR)
Клетки (линии клеток почки человеческого эмбриона HEK-293), устойчиво экспрессирующие рецептор hCRTH2 под контролем цитомегаловирусного промотора от однократной вставки экспрессионного вектора pcDNA5 (Invitrogen), выращивают до достижения слияния в модифицированной Дюльбекко среде Игла (МДСИ) (низкое содержание глюкозы, Gibco) с добавкой 10% околоплодной телячьей сыворотки (Bioconcept, Швейцария) в стандартных условиях культивирования клеток млекопитающих (37°С в увлаженной атмосфере с 5% СО2). Клетки отделяют от культуральных чашек с помощью буфера для диссоциации (0,02% ЭДТК в ЗФФ, Gibco) в течение 1 минуты и собирают при КТ посредством центрифугирования при 200 g в течение 5 минут в буфере для анализа (равные части сбалансированного солевого раствора Хэнка (HBSS, Bioconcept) и МДСИ (низкое содержание глюкозы, без фенолового красного, Gibco)). После инкубирования в течение 45 минут (37°С и 5% СО2) в присутствии 1 мкМ флуоресцентного красителя для определения ионов кальция Fluo-4 и 0,04% плюроника F-127 (оба от компании Molecular Probes), а также 20 мМ ГЭПЭС (Gibco) в буфере для анализа клетки промывают и заново суспендируют в буфере для анализа, после чего осуществляют их посев в 384-ячеечные планшеты для флуоресцентного анализа FLIPR (Greiner) при концентрации 50000 клеток в 66 мкл на ячейку и осуществляют седиментацию посредством центрифугирования.
Приготавливают маточные растворы исследуемых соединений в ДМСО с концентрацией 10 мМ, и производят их последовательные разбавления буфером для анализа до концентраций, необходимых для построения кривых ингибирования «доза-отклик». В качестве агониста используют простагландин Da (Biomol, Plymouth Meeting, PA).
Спектрофотометр для FLIPR-анализа Tetra (Molecular Devices) задействуют в соответствии со стандартными инструкциями производителя, добавляя 4 мкл исследуемого соединения, растворенного до концентрации 10 мМ в ДМСО и разбавленного перед экспериментом буфером для анализа до достижения искомой конечной концентрации. После этого добавляют 10 мкл 80 нМ простагландина Dz (Biomol, Plymouth Meeting, PA) в буфере для анализа с добавкой 0,8% бычьего сывороточного альбумина (содержание жирных кислот <0,02%, Sigma) до достижения конечной концентрации 10 нМ и 0,1%, соответственно. Изменения во флуоресценции отслеживают дои после добавления исследуемых соединений при длинах волн возбуждения λех=488 нм и испускания λem=540 нм. Учитывают после вычитания базовой линии величины пика испускания над фоновым уровнем после добавления простагландина D2. Значения нормализуют по отношению к контролю высокого уровня (в отсутствие добавления испытуемых соединений) после вычитания значения базовой линии (в отсутствие добавления простагландина D2). Для аппроксимации данных единой кривой «доза-отклик» по уравнению (А+((В-А)/(1+((С/х)^D)))) и расчета величин IC50 используют программу XLlfit 3.0 (IDBS).
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ДИГИДРОПИРАЗОЛОНЫ ДЛЯ ЛЕЧЕНИЯ КАРДИОВАСКУЛЯРНЫХ И ГЕМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ, ИХ ПРИМЕНЕНИЕ, ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ | 2012 |
|
RU2611012C2 |
| Макрогетероциклические нуклеозидные производные и их аналоги, получение и применение | 2017 |
|
RU2731385C1 |
| АНТАГОНИСТЫ TLR7/8 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2758686C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| ИНГИБИТОРЫ ВИРУСНОЙ РЕПЛИКАЦИИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2014 |
|
RU2678575C2 |
| СОЕДИНЕНИЕ ТРИАЗИНОНА И ИНГИБИТОР КАЛЬЦИЕВЫХ КАНАЛОВ Т-ТИПА | 2013 |
|
RU2645158C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА | 2005 |
|
RU2414468C2 |
| ПРОИЗВОДНЫЕ ИНДАНУКСУСНОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2002 |
|
RU2314298C2 |
| ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ СЕЛЕКТИВНОГО ИНГИБИРОВАНИЯ СВЯЗЫВАНИЯ αβ ИНТЕГРИНА У МЛЕКОПИТАЮЩЕГО | 2000 |
|
RU2263109C2 |
| НОВЫЕ ИНДОЛЬНЫЕ И ПИРРОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2693404C2 |
Настоящего изобретение относится к производным 3-(гетероариламино)-1,2,3,4-тетрагидро-9H-карбазола формулы (I), в которых R1 представляет собой водород, (C1-C4)алкил, (C1-C4)алкоксигруппу, галоид, трифторметоксигруппу или трифторметил, R2 представляет собой водород, (C1-C4)алкил, (C1-C2)алкокси(C2-C3)алкил, (C1-C4)фторалкил или (C3-C6)циклоалкил(C1-C2)алкил, и R3 представляет собой гетероарильную группу, которая является незамещенной или замещенной и к их применению в качестве модуляторов простагландиновых рецепторов, в особенности, модуляторов рецепторов простагландина D2, в лечении различных опосредуемых простагландинами заболеваний и расстройств, к фармацевтическим композициям, содержащим данные соединения и к способам их получения. 4 н. и 19 з.п. ф-лы, 10 табл., 58 пр.
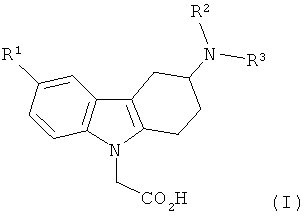
1. Соединение формулы (I):
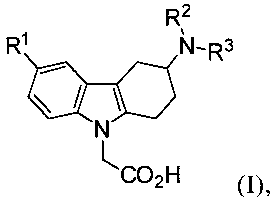
в котором
R1 представляет собой водород, (C1-C4)алкил, (C1-C4)алкоксигруппу, галоид, трифторметоксигруппу или трифторметил,
R2 представляет собой водород, (C1-C4)алкил, (C1-C2)алкокси(C2-C3)алкил, (C1-C4)фторалкил или (C3-C6)циклоалкил(C1-C2)алкил, и
R3 представляет собой гетероарильную группу, которая является незамещенной или моно-, ди- или тризамещенной, где заместители независимо выбраны из группы, включающей галоид, (C1-C4)алкил, (C3-C6)циклоалкил, (C1-C4)алкоксигруппу, (C1-C4)фторалкил и фенил,
где термин «гетероарил» означает 5-10-членный моноциклический или бициклический ароматический цикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из кислорода, азота и серы; или фармацевтически приемлемая соль такого соединения.
2. Соединение по п.1, в котором
R1 представляет собой фтор, хлор или трифторметил,
R2 представляет собой водород, метил, 2-метоксиэтил или циклопропилметил, и
R3 представляет собой гетероарильную группу, которая является монозамещенной фтором или хлором, или
фармацевтически приемлемая соль такого соединения.
3. Соединение по п.1, в котором
R1 представляет собой фтор,
R2 представляет собой водород или метил, и
R3 представляет собой гетероарильную группу, которая является незамещенной или
монозамещенной фтором, хлором или трифторметилом, или
фармацевтически приемлемая соль такого соединения.
4. Соединение по п.1, в котором
R1 представляет собой галоид,
или фармацевтически приемлемая соль такого соединения.
5. Соединение по любому из пп.1 или 4, в котором
R2 представляет собой водород, метил, этил, н-пропил, 2-метоксиэтил, 2,2-дифторэтил или циклопропилметил, или
фармацевтически приемлемая соль такого соединения.
6. Соединение по любому из пп.1- 4, в котором
R2 представляет собой метил,
или фармацевтически приемлемая соль такого соединения.
7. Соединение по любому из пп.1 или 4, в котором
R3 представляет собой гетероарильную группу, которая является
незамещенной или монозамещенной галоидом, метоксигруппой,
трифторметилом или фенилом,
или фармацевтически приемлемая соль такого соединения.
8. Соединение по любому из пп.1, 3 или 4, в котором
R3 представляет собой гетероарильную группу, которая является
незамещенной или монозамещенной фтором, хлором или трифторметилом,
где гетероарил выбран из группы, включающей пиримидил, бензоксазолил и бензотиазолил,
или фармацевтически приемлемая соль такого соединения.
9. Соединение по п.6, в котором
R3 представляет собой гетероарильную группу, которая является
незамещенной или монозамещенной фтором, хлором или трифторметилом, где гетероарил выбран из группы, включающей пиримидил, бензоксазолил и бензотиазолил,
или фармацевтически приемлемая соль такого соединения.
10. Соединение по п.1, выбранное из группы, включающей:
(3S)-2-(6-фтор-3-((5-фторпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((5-фторпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-хлорпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((5-хлорпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((5-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((4-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-фторпиримидин-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-((5-фторпиримидин-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3R)-2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(5-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-(метил(5-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(4-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2Н)-ил)уксусную кислоту,
(3R)-2-(6-фтор-3-(метил(4-(трифторметил)пиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2Н)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(пиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((4,6-диметилпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(4-метилпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорбензо[d]оксазол-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-(бензо[d]оксазол-2-ил(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-(бензо[d]тиазол-2-ил(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(хиназолин-4-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(2-(трифторметил)хиназолин-4-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(2-метилхиназолин-4-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(этил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(пропил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(изопропил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(циклопропилметил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(хиназолин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(5-фенилпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-метоксипиримидин-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((6-хлорбензо[d]тиазол-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорбензо[d]тиазол-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиримидин-2-ил)(2-метоксиэтил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-(метил(5-(трифторметил)пиридин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-фторпиридин-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(3-((5-хлорпиридин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((6-фторбензо[d]тиазол-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((5-фторбензо[d]тиазол-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((6-хлорбензо[d]оксазол-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту и
(3S)-2-(3-((5-хлорпиримидин-2-ил)(2,2-дифторэтил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
или фармацевтически приемлемая соль такого соединения.
11. Соединение по п.1, выбранное из группы, включающей:
(3S)-2-(3-((5-циклопропилпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-3-((6-фторбензо[d]оксазол-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
(3S)-2-(6-фтор-(метил(хиноксалин-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(4-метилтиазол-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(3-((4-(трет-бутил)тиазол-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(4-(трифторметил)тиазол-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(3-((5-(трет-бутил)изоксазол-3-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(1-метил-1H-пиразол-3-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(5-метил-1,3,4-тиадиазол-2-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(6-фтор-3-(изоксазол-3-ил(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(6-фтор-3-(метил(5-метилизоксазол-3-ил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(6-хлор-3-((5-хлорпиримидин-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-метил-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-(трифторметоксигруппу)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-метокси-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту и
2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-(трифторметил)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту,
или фармацевтически приемлемая соль такого соединения.
12. Соединение по п.1, которое представляет собой (3S)-2-(6-фтор-3-((5-хлорпиримидин-2-ил)амино)-3,4-дигидро-1H-карбазол-9-(2H)-ил)уксусную кислоту; или фармацевтически приемлемая соль такого соединения.
13. Соединение по п.1, которое представляет собой (3S)-2-(6-фтор-3-((5-фторпиримидин-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту; или фармацевтически приемлемая соль такого соединения.
14. Соединение по п.1, которое представляет собой (3S)-2-(3-((5-хлорпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту; или фармацевтически приемлемая соль такого соединения.
15. Соединение по п.1, которое представляет собой (3S)-2-(3-((5-хлорбензо[d]оксазол-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту; или фармацевтически приемлемая соль такого соединения.
16. Соединение по п.1, которое представляет собой (3S)-2-(6-фтор-3-((6-фторбензо[d]тиазол-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту; или фармацевтически приемлемая соль такого соединения.
17. Соединение по п.1, которое представляет собой (3S)-2-(3-((5-циклопропилпиримидин-2-ил)(метил)амино)-6-фтор-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту; или фармацевтически приемлемая соль такого соединения.
18. Соединение по п.1, которое представляет собой (3S)-2-(6-фтор-3-((6-фторбензо[d]оксазол-2-ил)(метил)амино)-3,4-дигидро-1H-карбазол-9(2H)-ил)уксусную кислоту; или фармацевтически приемлемая соль такого соединения.
19. Фармацевтическая композиция, включающая соединение по любому из пп.1-18 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, где соединение обладает антагонистической активностью в отношении рецептора CRTH2.
20. Соединение по любому из пп.1-4 или 10-18, или его фармацевтически приемлемая соль для применения в качестве лекарственного средства, где соединение обладает антагонистической активностью в отношении рецептора CRTH2.
21. Применение соединения по любому из пп.1-18 или его фармацевтически приемлемой соли для изготовления лекарственного средства для профилактики и/или лечения заболевания, выбранного из группы, включающей хронические и острые аллергические заболевания/расстройства, включающие астму, аллергическую астму, эозинофильную астму, тяжелую астму, ринит, аллергический ринит, отек Квинке, аллергию на яд насекомых, аллергии на лекарственные средства, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атопический дерматит, бронхиальную астму, аллергию на продукты питания, анафилактический шок, крапивницу, экзему, хронические обструктивное заболевание легких (ХОЗЛ), васкулит малых сосудов, такой как синдром Чарга-Стросса, эозинофильный эзофагит и эозинофильный целлюлит (синдром Уэллса).
22. Соединение по любому из пп.1-4 или 10-18, или его фармацевтически приемлемая соль для профилактики и/или лечения заболевания, выбранного из группы, включающей хронические и острые аллергические заболевания/расстройства, включающие астму, аллергическую астму, эозинофильную астму, тяжелую астму, ринит, аллергический ринит, отек Квинке, аллергию на яд насекомых, аллергии на лекарственные средства, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атопический дерматит, бронхиальную астму, аллергию на продукты питания, анафилактический шок, крапивницу, экзему, хронические обструктивное
заболевание легких (ХОЗЛ), васкулит малых сосудов, такой как синдром Чарга-Стросса, эозинофильный эзофагит и эозинофильный целлюлит (синдром Уэллса).
23. Применение соединения по любому из п.п. 1-18 или его фармацевтически приемлемой соли для изготовления лекарственного средства для профилактики и/или лечения заболевания, выбранного из группы, включающей астму, аллергическую астму, эозинофильную астму, тяжелую астму, аллергический ринит, отек Квинке, аллергию на яд насекомых, аллергии на лекарственные средства, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атопический дерматит, аллергию на продукты питания, анафилактический шок, крапивницу и экзему.
| EA 199901113, 28.08.2000 A1 | |||
| US 7122570 B2, 17.10.2006 | |||
| WO 2008017989 A1, 14.02.2008 | |||
| EP 1505061 A1, 09.02.2005 | |||
| WO 2005056527 A1, 23.06.2005 |
Авторы
Даты
2015-09-10—Публикация
2011-03-21—Подача