Изобретение относится к технологии иммунобиологических лекарственных препаратов, в частности к производству химической холерной вакцины.
В качестве средства для специфической профилактики холеры на территории России используется вакцина холерная бивалентная химическая в форме таблеток, покрытых кишечнорастворимой оболочкой. Вакцина включена в Национальный календарь профилактических прививок по эпидемическим показаниям в соответствии с Приказом Минздрава России №229 от 27.06.2001 г.
Холерная химическая вакцина содержит активный компонент: смесь лиофилизированных холерогена-анатоксина и О-антигенов, полученных из инактивированных формалином бульонных культур холерных вибрионов O1 серогруппы - V. cholerae cholerae 569B классического биовара серовара Инаба и V. cholerae М-41 классического биовара серовара Огава, и вспомогательные вещества - сахар, крахмал, тальк, стеарат кальция (ФСП Р N001465/01-220708 Вакцина холерная бивалентная химическая, таблетки, покрытые кишечнорастворимой оболочкой).
Известен способ получения холерной бивалентной химической вакцины в таблетированной форме, в соответствии с которым в предварительно полученных лиофилизированных фракциях, содержащих холероген-анатоксин и О-антигены, определяют содержание антигенов и конструируют таблетку (патент РФ №2076734). Для этого к определенному количеству антигенов добавляют вспомогательные вещества (сахар, крахмал, тальк, стеарат кальция) в гранулированном виде и таблетируют на таблеточной машине с последующим нанесением ацидорезистентного покрытия из ацетилфталилцеллюлозы, при этом компоненты берут в следующем соотношении мас.%:
О-антигенов серовара Инаба и серовара Огава
из целлацефата (ацетилфталилцеллюлозы)
Недостатком данного способа являются большие потери (10-30%) таблеточной смеси, возникающие из-за различной насыпной плотности основных и вспомогательных веществ.
Кроме того, использование 5% раствора целлацефата в ацетоне для нанесения покрытия требует создания дополнительных условий для обеспечения безопасного производства работ (герметизация технологических процессов или использование мощного вентиляционного оборудования с целью удаления его паров), так как ацетон является легковоспламеняющейся жидкостью, обладающей наркотическим действием (ГОСТ 2768-84 Ацетон технический. Технические условия). Также необходимо отметить, что при применении целлацефата цвет таблеток вакцины часто варьируется от серии к серии.
Известно, что предварительное влажное гранулирование таблеточной смеси позволяет избежать потерь при изготовлении таблетки и получить стандартную по составу лекарственную форму (Георгиевский В.П. Технология и стандартизация лекарств. Т. 1. - Харьков: ООО «РИРЕГ», 1996).
Однако при получении гранул с вышеуказанными вспомогательными веществами не удалось добиться снижения потерь таблеточной смеси при таблетировании, которые сохранялись на уровне 20-30%.
Задачей изобретения является создание способа получения таблетированной формы холерной бивалентной химической вакцины, обеспечивающего сокращение потерь таблеточной смеси.
Технический результат заключается в увеличении выхода таблеток вакцины холерной бивалентной химической при сохранении показателей качества препарата. Дополнительный технический результат заключается в повышении безопасности процесса производства вакцины для операторов, ведущих технологический процесс.
Технический результат решается способом получения таблетированной формы холерной химической вакцины, который включает подготовку и смешивание лиофилизированных антигенов - холерогена-анатоксина, О-антигенов серовара Инаба и серовара Огава с лактозы моногидратом, целлюлозой микрокристаллической, гранулирование таблеточной смеси методом псевдоожиженного слоя с распылением 10% водного раствора поливинилпирролидона сверху с последующим таблетированием и нанесением 20% водного раствора кишечнорастворимого покрытия. При этом компоненты берут в следующем соотношении, мас.%:
О-антигенов серовара Инаба и серовара Огава
на водной основе
Заявляемое соотношение компонентов найдено экспериментально и обеспечивает необходимое качество таблеток вакцины в условиях промышленного производства.
Холероген-анатоксин и О-антигены получены из инактивированных формалином бульонных культур холерных вибрионов O1 серогруппы - V. cholerae 569B классического биовара серовара Инаба и V. cholerae М-41 классического биовара серовара Огава. Подробно способ их получения описан в патентах РФ №2076734 и 2080121. Количество холероген-анатоксина для одной таблетки определяют по содержанию в ней анатоксина в реакции анатоксинсвязывания. Если в 1 мг этого антигена содержится 5000 единиц анатоксинсвязывания, то для получения 1 таблетки, включающей 100000 единиц анатоксинсвязывания, следует взять 20 мг; при иной активности производят соответствующий перерасчет. Добавление О-антигенов Инаба и Огава проводят из расчета их активности в реакции непрямой гемагглютинации; если они активны в дозе 10 мкг (5 мкг) каждый, что соответствует титрам 1:100 (1:200), то для получения одной таблетки берут по 10 мг (5 мг) каждой; при иной активности производят соответствующий перерасчет.
Целлюлоза микрокристаллическая и поливинилпирролидон (Plasdone К-90) описаны в качестве вспомогательных веществ в Государственной Фармакопее XI вып. 2, а лактоза зарегистрирована в РФ в качестве активной фармацевтической субстанции. В качестве кишечнорастворимого покрытия применяют смесь, состоящую из метакриловой кислоты, этилакрилата сополимера 40%, талька, диоксида титана, красителя оксида железа, диоксида кремния коллоидного; натрия двууглекислого, лаурилсульфата натрия (например, Acryl-EZE® или Eudragit® L 100-55). Все вещества описаны в качестве вспомогательных веществ в Европейской Фармакопее. Для нанесения покрытия смесь компонентов кишечнорастворимого покрытия растворяют в воде.
Возможность реализации заявляемого изобретения подтверждается примерами.
Пример 1a. Приготовление таблеток холерной химической вакцины
Подготовленные компоненты в следующем количестве, мас.%: смесь лиофилизированных холерогена-анатоксина и О-антигенов, полученных из инактивированных формалином бульонных культур холерных вибрионов O1 серогруппы - V. cholerae 569B классического биовара серовара Инаба и V. cholerae М-41 классического биовара серовара Огава, - 6, лактозы моногидрата - 44,3, целлюлозы микрокристаллической - 44,3 загружают в смеситель и перемешивают 15 мин, затем подвергают гранулированию методом псевдоожиженного слоя с распылением связующего вещества сверху в аппарате фирмы GLATT GPCG 2. В качестве связующего вещества для образования гранул используют 10% водный раствор поливинилпирролидона. Технологические режимы процесса гранулирования были следующие:
объем поступающего воздуха для псевдоожижения - 80-110 м3/час;
давление сжатого воздуха, подаваемого на форсунку, - 1,0-1,2 бар;
расход связующего вещества (поливинилпирролидона) - 20-30 мл/мин;
температура продукта - 24-26°C.
Поливинилпирролидон был израсходован для гранулирования в количестве 40 мл, что составило 0,4%. Масса таблеточной смеси после гранулирования составила 1,0 кг. Таблеточную смесь далее подвергали таблетированию на таблеточном прессе MiniTabT. Масса готовых для нанесения покрытия таблеток составила 0,99 кг, т.е. потери при таблетировании снизились с 10-30% до 1%.
Нанесение покрытия на таблетку осуществляли 20% водной суспензией Acryl-eze в коутере фирмы GLATT GMPC I Mini до 5% увеличения массы таблеток. Количество использованного 20% раствора Acryl-eze 93A составило 250 мл на 1 кг препарата, что составляет 5 мас.%.
Технологические режимы нанесения пленочного покрытия на таблетки были следующие:
давление сжатого воздуха, подаваемого на форсунку для распыления и атомизации, - 1,0 и 1,4 бар соответственно;
расход подаваемого водного раствора Acryl-eze - 8,2-8,4 мл/мин;
число оборотов барабана - 10-12 об/мин;
расход и температура воздуха, подаваемого на сушку, - 50-55 м3/ч и 40-45°C соответственно.
Пример 1б. Приготовление таблеток холерной химической вакцины
Подготовленные компоненты загружают в смеситель в следующем количестве, мас.%: смесь холерогена-анатоксина и О-антигенов, полученных из инактивированных формалином бульонных культур холерных вибрионов O1 серогруппы - V. cholerae 569B классического биовара серовара Инаба и V. cholerae М-41 классического биовара серовара Огава, - 19, лактозы моногидрата - 36,3; целлюлозы микрокристаллической - 36,3 и перемешивают 15 мин, затем подвергают гранулированию методом псевдоожиженного слоя с распылением связующего вещества сверху в аппарате фирмы GLATT GPCG 2. В качестве связующего вещества для образования гранул использовался 10% водный раствор поливинилпирролидона. Технологические режимы процесса гранулирования были следующие:
объем поступающего воздуха для псевдоожижения - 80-110 м3/час;
давление сжатого воздуха, подаваемого на форсунку, - 1,0-1,2 бар;
расход связующего вещества (поливинилпирролидона) - 20-30 мл/мин;
температура продукта - 24-26°C.
Поливинилпирролидон был израсходован для гранулирования в количестве 80 мл, что составило 0,8%. Масса таблеточной смеси после гранулирования составила 1,0 кг. Таблеточную смесь далее подвергали таблетированию на таблеточном прессе MiniTabT. Масса готовых для нанесения покрытия таблеток составила 0,99 кг, т.е. потери при таблетировании снизились с 10-30% до 1%. Кишечнорастворимое покрытие осуществляли 20% водной суспензией Acryl-eze. Нанесение покрытия на таблетку осуществляли в коутере фирмы GLATT GMPC I Mini до 8% увеличения массы таблеток. Количество использованного 20% раствора Acryl-eze 93A составило 400 мл на 1 кг препарата, что составляет 8 мас.%.
Технологические режимы нанесения пленочного покрытия на таблетки были следующие:
давление сжатого воздуха, подаваемого на форсунку для распыления и атомизации, - 1,0 и 1,4 бар соответственно;
расход подаваемого водного раствора Acryl-eze - 8,2-8,4 мл/мин;
число оборотов барабана - 10-12 об/мин;
расход и температура воздуха, подаваемого на сушку, - 50-55 м3/ч и 40-45°C соответственно.
Пример 2. Проверка свойств холерной химической вакцины
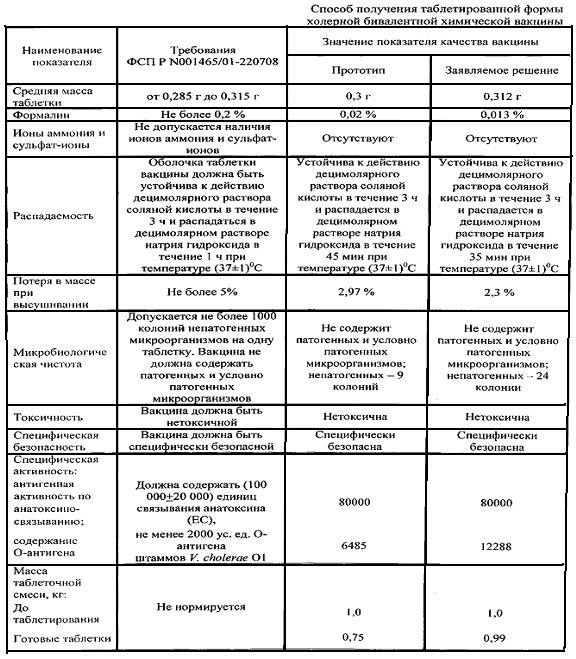
По предложенной технологии была приготовлена серия вакцины холерной бивалентной химической, таблеток, покрытых кишечнорастворимой оболочкой, проверены ее свойства в соответствии с требованиями нормативной документации (ФСП Р N001465/01-220708). Результаты проверки качества препаратов представлены в таблице и свидетельствуют о том, что серия вакцины полностью удовлетворяет требованиям нормативных документов, при этом потери составляют 1%.
Основным тестом in vitro, применяемым для оценки гарантированной доставки лекарственной формы в кишечник человека, является испытание на распадаемость, качественно-количественные показатели которого приведены в таблице. Результаты испытания свидетельствуют о том, что таблетка, покрытая предложенным кишечнорастворимым покрытием на водной основе:
устойчива к действию децимолярного раствора соляной кислоты в течение 3 ч. Это свидетельствует о целостности таблетки при нахождении в желудке человека;
распадается в децимолярном растворе натрия гидроксида в течение 35 мин при температуре (37±1)°C. Это говорит о том, что таблетка растворяется в кишечнике человека.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХОЛЕРОГЕНА-АНАТОКСИНА | 2013 |
|
RU2535122C1 |
| СПОСОБ КОНЦЕНТРИРОВАНИЯ НАТИВНЫХ ХОЛЕРОГЕНА-АНАТОКСИНА И О-АНТИГЕНА VIBRIO CHOLERAE О1 КЛАССИЧЕСКОГО БИОВАРА ШТАММА 569 В СЕРОВАРА ИНАБА | 2011 |
|
RU2451522C1 |
| СПОСОБ КОНЦЕНТРИРОВАНИЯ НАТИВНОГО О-АНТИГЕНА Vidrio cholerae | 2011 |
|
RU2445116C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОРАЛЬНОЙ ХИМИЧЕСКОЙ ВАКЦИНЫ | 1993 |
|
RU2076734C1 |
| СПОСОБ ПРОИЗВОДСТВА ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ХОЛЕРЫ | 1988 |
|
RU2080121C1 |
| ОРАЛЬНАЯ ХИМИЧЕСКАЯ ВАКЦИНА ПРОТИВ ХОЛЕРЫ | 2000 |
|
RU2159128C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХОЛЕРНОГО ТОКСИНА ДЛЯ КОНТРОЛЯ ПРОИЗВОДСТВА ХОЛЕРНОЙ ХИМИЧЕСКОЙ ВАКЦИНЫ | 2022 |
|
RU2799574C1 |
| АВИРУЛЕНТНЫЙ ШТАММ БАКТЕРИЙ Vibrio cholerae КМ 262 БИОВАРА ЭЛЬТОР СЕРОВАРА ОГАВА - ПРОДУЦЕНТ ПРОТЕКТИВНОГО О1 АНТИГЕНА | 2010 |
|
RU2425868C1 |
| ШТАММ БАКТЕРИЙ VIBRIO CHOLERAE KM 200 - ПРОДУЦЕНТ ХОЛЕРНОГО ТОКСИНА И ТОКСИН - КОРЕГУЛИРУЕМЫХ ПИЛЕЙ АДГЕЗИИ | 2001 |
|
RU2193598C1 |
| ШТАММ БАКТЕРИЙ VIBRIO CHOLERAE 2414 КЛАССИЧЕСКОГО БИОВАРА СЕРОВАРА ОГАВА - ПРОДУЦЕНТ ХОЛЕРНОГО ТОКСИНА И ТОКСИНКОРЕГУЛИРУЕМЫХ ПИЛЕЙ АДГЕЗИИ | 2000 |
|
RU2169187C1 |
Изобретение относится к технологии иммунобиологических лекарственных препаратов, в частности к производству химической холерной вакцины. Изобретение раскрывает способ получения таблетированной формы холерной бивалентной химической вакцины, который включает подготовку и смешивание лиофилизированных антигенов - холерогена-анатоксина, О-антигенов серовара Инаба и серовара Огава с лактозы моногидратом, целлюлозой микрокристаллической, гранулирование таблеточной смеси методом псевдоожиженного слоя с распылением 10% водного раствора поливинилпирролидона сверху с последующим таблетированием и нанесением 20% водного раствора кишечнорастворимого покрытия. Способ обеспечивает увеличение выхода таблеток вакцины холерной химической и повышение безопасности процесса производства вакцины для операторов, ведущих технологический процесс. 1 табл., 2 пр.
Способ получения таблетированной формы холерной химической вакцины, включающий смешивание предварительно подготовленных лиофилизированных антигенов - холерогена-анатоксина, О-антигенов серовара Инаба и серовара Огава и вспомогательных веществ, гранулирование таблеточной смеси, таблетирование, нанесение покрытия, отличающийся тем, что антигены смешивают с лактозы моногидратом, целлюлозой микрокристаллической, полученную смесь гранулируют методом псевдоожиженного слоя с распылением 10% водного раствора поливинилпирролидона сверху, таблетируют и наносят 20% водный раствор кишечнорастворимого покрытия на водной основе, при этом компоненты берут в следующем соотношении, мас.%:
| СПОСОБ ПРОИЗВОДСТВА ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ХОЛЕРЫ | 1988 |
|
RU2080121C1 |
| СПОСОБ ОЧИСТКИ УГЛЕВОДОРОДНОГО ГАЗА ОТ СЕРОВОДОРОДА | 2011 |
|
RU2477649C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОРАЛЬНОЙ ХИМИЧЕСКОЙ ВАКЦИНЫ | 1993 |
|
RU2076734C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ ХОЛЕРЫ | 1991 |
|
RU2021817C1 |
| US 5874088 A, 23.02.1999. | |||
Авторы
Даты
2015-09-20—Публикация
2014-08-05—Подача