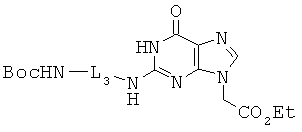
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к производным пептидо-нуклеиновых кислот, химически модифицированных для обеспечения хорошей клеточной пенетрации и сильной аффинности к нуклеиновой кислоте.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 представлены хроматограммы высокоэффективной жидкостной хроматографии ВЭЖХ до и после очистки Олиго 17 с помощью ВЭЖХ с обращенной фазой. Сокращения, используемые в настоящей заявке, определены в таблице на страницах 27-29.
На Фиг.2 представлен масс-спектр MALDI-TOF для очищенной серии Олиго 17.
На Фиг.3 представлены кривые изменения поглощения в зависимости от температуры для Олиго 17 для комплементарной или с нарушенной комплементарностью ДНК.
На Фиг.4(а) и 4(б) представлены изображения конфокальной микроскопии (при 63-кратном увеличении) для 1, 2, 3 и 24 часов после обработки HeLa клеток Олиго 1 и Олиго 2 при 5 мкМ соответственно.
На Фиг.5(а) и 5(б) представлены изображения конфокальной микроскопии (при 63-кратном увеличении) для 0,5 и 1 часа после обработки MCF-7 клеток Олиго 6 и Олиго 7 при 2,5 мкМ соответственно.
На Фиг.6(а) и 6(б) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 6 или 24 часов после обработки HeLa клеток Олиго 1 и Олиго 6 при 1 мкМ соответственно.
На Фиг.7(а) и 7(б) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 24 часов после обработки JAR клеток Олиго 21 и Олиго 28 при 2 мкМ соответственно.
На Фиг.7(в) и 7(г) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 24 часов после обработки А549 клеток Олиго 21 и Олиго 28 при 2 мкМ соответственно.
На Фиг.7(д) и 7(е) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 12 часов после обработки HeLa клеток Олиго 21 и Олиго 28 при 2 мкМ соответственно.
На Фиг.7(ж) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 24 часов после обработки HeLa клеток Одиго 21 при 2 мкМ.
На Фиг.8(а), 8(б) и 8(в) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) для 24 часов после обработки HeLa, A549 и JAR клеток Олиго 22 при 2 мкМ соответственно.
На Фиг.9 представлены результаты вестерн-блоттинга для JAR клеток, обработанных Олиго 9 при 5 мкМ или 10 мкМ, Олиго 10 при 5 мкМ или 10 мкМ, при совместной обработке олигомерами при 5 мкМ или 10 мкМ каждый, и контрольный опыт (без обработки олигомером).
На Фиг.10 представлена типичная структура олигомеров ПНК, описанных в данном изобретении.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Олигонуклеотиды были использованы для различных биологических целей, включая антисмысловое ингибирование экспрессии генов, ПЦР (полимеразную цепную реакцию), диагностический контроль с помощью генных чипов и т.д. Поскольку олигонуклеотиды взаимодействуют в определенной последовательности с нуклеиновыми кислотами, такими как ДНК и РНК, они являются весьма полезными для предсказуемого модулирования биологических процессов с участием ДНК или РНК в клетке. Однако, в отличие от малых молекул лекарственных препаратов, олигонуклеотиды не легко пенетрируют через мембрану клеток млекопитающих и, поэтому, вряд ли влияют на биологические процессы внутри клетки, в случае если они соответствующим образом не модифицированы или не входят в состав, дающий возможность им легко пенетрировать через цитоплазматическую мембрану.
Белки в качестве мишеней лекарственных препаратов. Белки являются посредниками различных клеточных функций. Не удивительно, что большинство в настоящее время продаваемых на рынке лекарственных препаратов показывают терапевтическую активность через модулирующие функции белка(ов). Например, нестероидный противовоспалительный лекарственный препарат - аспирин - ингибирует ферменты, названные циклооксигеназами, в отношении их противовоспалительной активности.
Лосартан связывается и является антагонистом функции трансмембранного рецептора, названного рецептором ангиотензина II, в отношении его противогипертонической активности. Росиглитазон селективно активирует внутриклеточный рецептор, названный рецептором γ, активируемым пролифератором пероксисом (PPARγ), с появлением антидиабетической активности. Этанерцепт является слитым белком, который связывает цитокин, названным фактором некроза опухоли-α (tumor necrosis factor-α, TNF-α), и нейтрализует биологическую активность TNF-α в отношении его противоревматической активности. Герцептин является моноклональным антителом для лечения рака молочной железы путем селективного связывания с erbB2, сверхэкспрессированного в некоторых типах клеток рака молочной железы.
Антисмысловое ингибирование синтеза белка. Белки кодируются ДНК (2-дезоксирибонуклеиновая кислота). В ответ на клеточную стимуляцию ДНК транскрибируется с продуцированием пре-мРНК (незрелая рибонуклеиновая кислота) в ядре. Интроновая(ые) часть(и) пре-мРНК ферментативно сплайсируется, давая мРНК (зрелая рибонуклеиновая кислота), которая затем перемещается к питозольному компоненту. В цитозоле комплекс механизма трансляции, называемый рибосомой, связывает мРНК и осуществляет синтез белка, поскольку он сканирует генетическую информацию, закодированную в мРНК. (Biochemistry vol.41, 4503-4510, 2002; Cancer Res. vol.48, 2659-2668, 1988).
Олигонуклеотид, связанный в определенной последовательности с мРНК или пре-мРНК, называется антисмысловым олигонуклеотидом (antisense oligonucleotide, АО). АО может прочно связывать мРНК и ингибировать синтез белка с помощью рибосомы на мРНК в цитозоле. АО должен находиться внутри клетки, чтобы ингибировать синтез его белка-мишени. АО может прочно связывать пре-мРНК в ядре и влиять на сплайсинг пре-мРНК, продуцируя мРНК с измененной последовательностью и, следовательно, измененным белком.
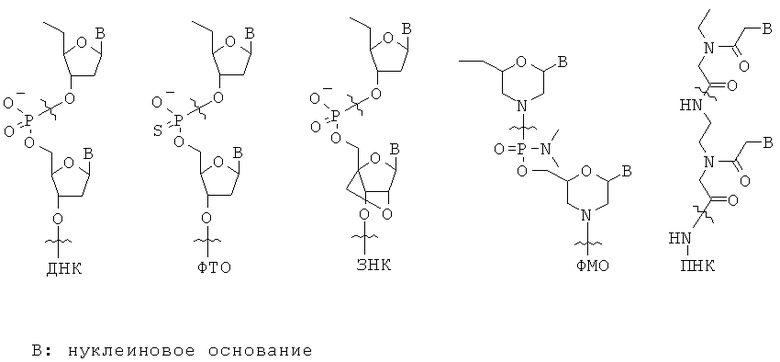
Неприродные олигонуклеотиды. Олигонуклеотиды ДНК или РНК чувствительны к деградации эндогенными нуклеазами, ограничивающими их терапевтическую полезность. На сегодняшний день были разработаны и интенсивно изучены многие типы неприродных олигонуклеотидов. (Clin. Exp. Pharmacol. Physiol. vol.33, 533-540, 2006). Некоторые из них показывают увеличенную метаболическую стабильность по сравнению с ДНК и РНК. Приведенные выше структуры являются химическими структурами некоторых типичных представителей неприродных олигонуклеотидов. Как и ожидалось, такие олигонуклеотиды связывают комплементарную нуклеиновую кислоту, как это делает ДНК или РНК.
Фосфоротиоатный олигонуклеотид - ФТО (phosphorothioate oligonucleotide, РТО) представляет собой аналог ДНК с одним из фосфатных атомов кислорода в остове, замененного на атом серы в расчете на мономер. Такие небольшие структурные изменения делают ФТО сравнительно устойчивым к деградации нуклеазами. (Ann. Rev. Biochem. Vol.54, 367-402, 1985).
Отражая структурное сходство ФТО и ДНК, оба они плохо пенетрируют через клеточную мембрану в большинстве типов клеток млекопитающих. Однако, для некоторых типов клеток, в большом количестве экспрессирующих переносчик(и) ДНК, ДНК и ФТО показывают хорошую клеточную пенетрацию. Известно, что системно введенные ФТО(ы) быстро распределяются в печени и почках. (Nucleic Acids Res. vol.25, 3290-3296, 1997).
В целях облегчения клеточной пенетрации ФТО in vitro на практике обычно осуществляли липофекцию. Однако, липофекция физически изменяет клеточную мембрану, вызывает цитотоксичность, и, следовательно, не будет идеальной при длительном терапевтическом применении.
За последние 20 лет, антисмысловые ФТО(ы) и варианты ФТО(ов) были клинически оценены для лечения злокачественных новообразований, иммунологических нарушений, болезней обмена веществ и так далее. (Biochemistry vol.41, 4503-4510, 2002; Clin. Exp. Pharmacol. Physiol. vol.33, 533-540, 2006). Многие такие антисмысловые кандидаты лекарственных препаратов не были эффективными отчасти из-за плохой клеточной пенетрации ФТО. Для того, чтобы преодолеть плохую клеточную пенетрацию, для проявления терапевтической активности ФТО необходимо вводить в высоких дозах. Однако, известно, что ФТО(ы) связаны с зависимыми от дозы токсичностями, как например увеличенным временем свертывания крови, активацией комплемента, тубулярной нефропатией, активацией клеток Купфера и иммунной стимуляцией, включая спленомегалию, лимфоидную гиперплазию, мононуклеарную клеточную инфильтрацию. (Clin. Exp. Pharmacol. Physiol. vol.33, 533-540, 2006).
Было найдено, что многие антисмысловые ФТО(ы) показывают соответствующую клиническую активность для заболеваний с существенным вкладом печени или почек. ISIS-301012 (мипомерсен) является аналогом ФТО, который ингибирует синтез ароВ-100, белка, вовлеченного в транспорт LDL холестерина (липопротеид низкой плотности, ЛПНП). Мипомерсен проявлял соответствующую клиническую активность у некоторой группы больных атеросклерозом, скорее всего, в силу его преимущественного распределения в печени. (www.medscape.com/viewarticle/556073: имеющий доступ с 19 февраля 2009). ISIS-113715 является аналогом антисмыслового ФТО, ингибирующего синтез протеинтирозинфосфатазы 1В (РТР1В), и было найдено, что он проявляет терапевтическую активность у больных диабетом II типа. (Curr. Opin. Mol. Ther. vol.6, 331-336, 2004).
В фосфорамидитном морфолиновом олигонуклеотиде - ФМО (phosphoroamidite morpholino oligonucleotide, PMO) остов фосфата и 2-дезоксирибозы ДНК заменяются фосфорамидитом и морфолином, соответственно. (Appl. Microbiol. Biotechnol. vol 71, 575-586, 2006). В то время как остов ДНК отрицательно заряжен, остов ФМО является незаряженным. Таким образом, связывание ФМО и мРНК происходит без электростатического отталкивания между остовами и обычно бывает сильнее, чем между ДНК и мРНК. Поскольку ФМО структурно очень отличается от ДНК, ФМО не будет распознаваться гепатическим(ими) переносчиком(ами), распознающим(и) ДНК. Однако, ФМО с трудом пенетрирует через клеточную мембрану.
Пептидо-нуклеиновая кислота - ПНК (peptide nucleic acid, PNA) представляет собой полипептид с N-(2-аминоэтил)глицином в качестве элементарного звена остова, и была описана Nielsen с сотр.. (Science vol.254, 1497-1500, 1991). Подобно ДНК и РНК, ПНК также селективно связывает комплементарную нуклеиновую кислоту [Nature (London) vol.365, 566-568, 1992]. Аналогично ФМО, остов ПНК не заряжен. Таким образом, связывание между ПНК и РНК обычно бывает сильнее, чем между ДНК и РНК. Поскольку ПНК структурно значительно отличается от ДНК, ПНК не будет распознаваться гепатическим(ими) переносчиком(ами), распознающим(и) ДНК, и покажет(ут) профиль распределения в тканях сильно отличающийся от такового для ДНК или ФТО. Однако, ПНК также плохо пенетрирует через мембрану клетки млекопитающего. (Adv. Drug Delivery Rev. vol.55, 267-280, 2003).
В закрытой нуклеиновой кислоте - ЗНК (locked nucleic acid, LNA) рибозное кольцо остова РНК структурно ограничивает увеличение связывающей аффинности к РНК или ДНК. Таким образом, ЗНК(ы) можно рассматривать как производные ДНК или РНК с высокой аффинностью. (Biochemistry vol.45, 7347-7355, 2006).
Антисмысловые механизмы. Антисмысловой механизм отличается в зависимости от типов АО(ов). РНКаза Н распознает дуплекс мРНК с ДНК, РНК или ФТО, и разрушает часть двойной спирали мРНК. Таким образом, антисмысловая активность ФТО существенно амплифицируется РНКазой Н. В то же время, РНКаза Н не распознает дуплекс мРНК с ФМО, ПНК или ЗНК. Иными словами, ФМО, ПНК и ЗНК должны полагаться исключительно на стерическое блокирование мРНК в отношении их антисмысловой активности. (Biochemistry vol.41, 4501-4510, 2002).
Для олигонуклеотидов с такой же связывающей аффинностью к мРНК, ФТО поэтому будет показывать более сильную антисмысловую активность, чем ФМО, ПНК и ЗНК. Для стерического блока АО(ов), как например ФМО, ПНК и ЗНК, для антисмысловой активности желательна сильная аффинность к мРНК.
Антисмысловая активность ПНК. Связывающая аффинность ПНК к мРНК будет возрастать по мере увеличения до определенного момента длины ПНК. Однако, антисмысловая активность ПНК, как представляется, не всегда увеличивается с длиной ПНК. Были случаи, когда антисмысловая активность ПНК достигала максимальной активности при 12-13-мер и после уменьшалась. (Nucleic acids Res. vol.32, 4893-4902, 2004). С другой стороны, оптимальная антисмысловая активность достигалась с 15-18-мер ПНК(ами) по сравнению с конкретной мРНК, отражая то, что структурная доступность направленного связывающего участка (сайта) мРНК будет иметь важное значение. (Biochemistry vol.40, 53-64, 2001).
Во многих случаях сообщалось, что ПНК(ы) ингибируют синтез белка рибосомой при микромолярном уровне при условиях хорошей клеточной пенетрации. (Science vol.258, 1481-85, 1992; Biochemistry vol.40, 7853-7859, 2001; Nucleic acids Res. vol.32, 4893-4902, 2004). Однако, было найдено, что ПНК(ы), нацеленные на весьма доступное положение мРНК, показывают антисмысловую активность при субмикромолярном уровне. (Neuropeptides vol.38, 316-324, 2004; Biochemistry vol.40, 53-64, 2001) или даже при субнаномолярном уровне (Nucleic Acids Res. vol.36, 4424-4432, 2008) при хороших условиях трансфекции.
Кроме того, нацеливание на весьма доступный центр мРНК, сильная связывающая аффинность ПНК к мРНК будет очень необходима для хорошей антисмысловой активности. В отличие от ДНК, ФТО и ЗНК, остов ПНК не заряжен. ПНК проявляет тенденцию к агрегации и становится менее пригодной для связывания с мРНК, поскольку ее размер увеличивается. Желательно улучшить связывающую аффинность ПНК к мРНК без увеличения длины ПНК. Включение мономеров ПНК с точечным зарядом было бы полезным для предотвращения ПНК от агрегации.
Стратегии клеточной пенетрации для ПНК. ПНК(ы) не легко пенетрируют через клеточную мембрану и, как правило, показывают недостаточную антисмысловую активность, если только должным образом не трансфицировались. В начале, антисмысловая активность ПНК оценивалась с помощью микроинъекции (Science vol.258, 1481-85, 1992) или электропорации (Biochemistry vol.40, 7853-7859, 2001). Микроинъекция и электропорация являются инвазивными и неподходящими для применения в терапевтических целях. Чтобы улучшить клеточную пенетрацию, были разработаны различные стратегии. (Adv. Drug Delivery Rev. vol.55, 267-280, 2003; Curr. Top. Med. Chem. vol.7, 727-737, 2007).
ПНК(ы) были эффективно доставлены в клетку с помощью ковалентной инкорпорации пенетрирующих в клетку пептидов (Neuropeptides vol.38, 316-324, 2004), липофекции с последующим образованием дуплекса с комплементарной ДНК (Biochemistry vol.40, 53-64, 2001), липофекции ПНК(т) с ковалентно присоединенным 9-аминоакридином (Nucleic Acids Res. vol.32, 2695-2706, 2004), липофекции ПНК(т) с ковалентно присоединенными фосфонат-анионами (Nucleic Acids Res. vol.36,4424-4432, 2008), и так далее. Клеточная пенетрация также улучшалась при присоединении к ПНК липофильного остатка, как например адамантана (Bioconjugate Chem. vol.10, 965-972, 1999), или амфифильной группы, как например тетрафенилфосфония. (Nucleic Acids Res. vol.29, 1852-1863, 2001). Тем не менее, такая ковалентная модификация вряд ли увеличивает связывающую аффинность к мРНК, несмотря на заметное улучшение в клеточной пенетрации.
ПНК(ы) с ковалетно присоединеным ПКП. Пенетрирующие в клетку пептиды - ПКП(-ы) (cell penetrating peptides, CPPs) представляют собой полипептиды, показывающие хорошую клеточную пенетрацию, и они имеют множество положительных зарядов от остатков аргинина или лизина. На сегодняшний день описаны многие ПКП(-ы), как например транспортан, пенетратин, клеточный сигнал внутриядерной локализации - КСВЛ (nuclear localization signal, NLS) и Tat. Известно, что ПКП(-ы) эффективно несут ковалентно присоединенный груз в клетку. ПНК(-ы) с ковалентно присоединенным ПКП также показали хорошую клеточную пенетрацию.
Хотя некоторые ПНК(-ы) с ковалентно присоединенным ПКП показывали антисмысловую IC50s около 100 нм (Neuropeptides vol.38, 316-324, 2004), для таких ПНК(-т) более распространенной является микромолярная антисмысловая IC50s.
ПНК(-ы) с ковалентно связанным ПКП состоят из двух частей, гидрофобного домена ПНК и положительно заряженного домена ПКП. Такая ПНК имеет тенденцию к агрегации, она захватывается эндосомами внутри клетки и становится недоступной для антисмыслового ингибирования синтеза белка. (Curr. Top. Med. Chem. vol.7, 727-737, 2007; Nucleic Acids Res. vol.33, 6837-6849, 2005). Кроме того, такой ковалентно присоединенный ПКП вряд ли увеличивает связывающую аффинность ПНК к мРНК.
ПНК(-ы) с хиральным остовом. Предпринимались попытки ввести хиральный заместитель на остов 2-аминоэтил-глицина ПНК (2-aminoethyl-glycme, Aeg). Например, растворимость ПНК в воде значительно улучшилась при включении мономера(ов) ПНК с остовом 2-аминоэтил-лизина вместо Aeg. (Angew. Chem. Int. Ed. Engl. vol.35, 1939-1941, 1996).
При включении остова L-(2-амино-2-метил)этил-глицина вместо Aeg, связывающая аффинность ПНК к ДНК и РНК значительно улучшалась. 10-мер ПНК со всем остовом L-(2-амино-2-метил)этил-глицина вместо 2-аминоэтил-глицина показала увеличение температуры плавления (Т. пл.) на 19°С и 10°С по сравнению с комплементарной ДНК и РНК, соответственно. Такое увеличение, по-видимому, не является все же пропорциональным числу замещений L-(2-амино-2-метил)этил-глицином. (J. Am. Chem. Soc. vol.128, 10258-10267, 2006).
GPNA. Сообщалось, что клеточная пенетрация ПНК значительно улучшалась при включении мономеров ПНК с остовом 2-аминоэтил-аргинина вместо Aeg. (J. Am. Chem. Soc. vol.125, 6878-6879, 2003). Такие ПНК(ы) назывались 'GPNA', так как они на остове имеют остаток гуанидиния.
Сообщалось, что GPNAs с остовом 2-аминоэтил-
Сообщалось, что 16-мер антисмысловая GPNA против человеческого EGFR-TK проявляет противоопухолевую активность при перитонеальном введении бестимусным голым мышам, хотя антисмысловая активность для антисмысловой GPNA in vitro в предшествующем уровни техники не документировалась. (WO 2008/061091).
ПНК(-ы) с модифицированным нуклеиновым основанием. Для улучшения аффинности ПНК к нуклеиновым кислотам, как в случае ДНК, были осуществлены модификации нуклеиновых оснований.
ПНК(-ы) с аденином, замещенным 2,6-диаминопурином, оценивались по их аффинности к комплементарной ДНК или РНК. Установлено, что замещение 2,6-диаминопурином вызывает увеличение Т.пл. на 2,5 ~ 6°С на одно замещение. {Nucleic Acids Res. vol.25, 4639-4643, 1997).
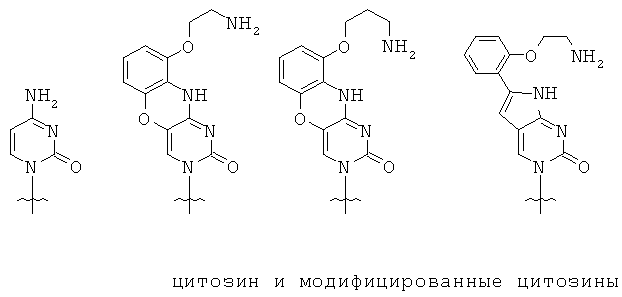
ПНК(-ы) с цитозином, замещенным 9-(2-аминоэтокси)феноксазином, оценивались по их аффинности к комплементарной ДНК или РНК. Единственное замещение 9-(2-аминоэтокси)феноксазином вызывало увеличение Т.пл. на 10,7 ~ 23,7°С, хотя такое увеличение существенно зависело от нуклеотидной последовательности. Нуклеиновое основание 9-(2-аминопророкси)феноксазин также вызывал большое увеличение Т. пл.. В связи с огромным увеличением Т.пл., мономер ПНК с 9-(2-аминоэтокси)феноксазином или 9-(2-аминопропокси)-феноксазином, который заменил цитозин, был назван 'G-clamp' (G-зажим) (Org. Lett. vol.4, 4395-4398, 2002). Однако, о данных по клеточной пенетрации для ПНК(-т) с G-зажимом(ами)) не сообщались.
ПНК(-ы) с цитозином, замещенным 6-{2-(2-аминоэтокси)фенил}-пирролоцитозином или 6-{2,6-ди(2-аминоэтокси)фенил}пирролоцитозином, оценивались по их аффинности к комплементарной ДНК или РНК. Единственное замещение 6-{2-(2-аминоэтокси)фенил}-пирролоцитозином или 6-{2,6-ди(2-аминоэтокси)фенил}пирролоцитозином повышало Т. пл. на 3 ~ 11,5°С. (J. Am. Chem. Soc. vol.130, 12574-12575, 2008). Однако, такие ПНК(-ы) не оценивались в отношении клеточной пенетрации.
Другое применение ПНК(-т). При прочном связывании с микроРНК, ПНК может ингибировать регуляторную функцию микроРНК, приводя к увеличению уровня экспрессии белка(ов), непосредственно регулируемого(ых) микроРНК. (RNA vol.14, 336-346, 2008). При прочном связывании с рибонуклеопротеидом, как например теломеразой, ПНК может модулировать клеточную функцию рибонуклеопротеида. (Bioorg. Med. Chem. Lett. vol.9, 1273-78, 1999). При прочном связывании с определенной частью гена в ядре, ПНК может модулировать уровень транскрипции гена. (Biochemistry vol.46, 7581-89, 2007).
Поскольку ПНК прочно связывает ДНК и РНК и конкурентно распознает одно ошибочное спаривание оснований, ПНК будет пригодна для высокоточного обнаружения однонуклеотидного полиморфизма (single nucleotide polymorphism, SNP). Так как ПНК прочно связывает ДНК и РНК с высокой специфичностью, обеспечиваемой последовательностью, ПНК может найти различные другие терапевтические и диагностические приложения с участием ДНК или РНК. (FASEB vol.14, 1041-1060, 2000).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
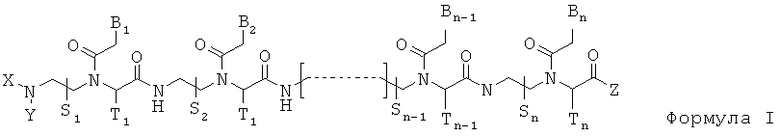
Данное изобретение предлагает новый класс олигомеров ПНК, представленных формулой I, или ее фармацевтически приемлемой соли:
где:
n - целое число, равное или большее 5;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1, и Tn независимо обозначают гидридогруппу, дейтеридогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
Х и Y независимо обозначают гидридогруппу, дейтеридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу, замещенную или незамещенную ацилгруппу, замещенную или незамещенную сульфонилгруппу или замещенную или незамещенную арилгруппу;
Z обозначает гидридогруппу, дейтеридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
B1, B2,…, Bn-1, и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и по меньшей мере одна из B1, B2,…, Bn-1 и Bn независимо обозначает неприродное нуклеиновое основание с замещенной или незамещенной аминогруппой, ковалентно связанной с остатком, ответственным за соответствующие свойства спаривания нуклеиновых оснований.
Олигомер ПНК формулы I показывает улучшенную связывающую аффинность к нуклеиновой кислоте и клеточную пенетрацию по сравнению с соответствующим «немодифицированным» олигомером ПНК. Олигомеры ПНК, описанные в изобретении, пригодны к циклу специфического ингибирования или модулирования клеточных и физиологических функций, обусловленных нуклеиновыми кислотами или физиологически активными молекулами с доменом нуклеиновой кислоты, как например рибонуклеопротеинами. Также олигомеры ПНК, описанные в данном изобретении, пригодны для диагностических целей вследствие их специфической связывающей способности к нуклеиновым кислотам.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение предлагает новый класс олигомеров ПНК, представленных формулой I, или ее фармацевтически приемлемой соли:

где:
n - целое число, равное или большее 5;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1, и Tn независимо обозначают гидридогруппу, дейтеридогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
Х и Y независимо обозначают гидридогруппу, дейтеридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу, замещенную или незамещенную ацилгруппу, замещенную или незамещенную сульфонилгруппу или замещенную или незамещенную арилгруппу;
Z обозначает гидридогруппу, дейтеридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
B1, B2,…, Bn-1, и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и
по меньшей мере одна из B1, B2,…, Bn-1 и Bn независимо обозначает неприродное нуклеиновое основание с замещенной или незамещенной аминогруппой, ковалентно связанной с остатком, ответственным за соответствующие свойства спаривания нуклеиновых оснований.
Олигомер ПНК, описанный в данном изобретении, показывает улучшенную клеточную пенетрацию и связывание с нуклеиновой кислотой по сравнению с «немодифицированным» олигомером ПНК. В данном изобретении «немодифицированный» олигомер ПНК относится к олигомеру ПНК формулы I, где S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1, и Tn представляют собой гидридогруппу; и B1, B2,…, Bn-1, и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин и цитозин.
Олигомер ПНК, описанный в данном изобретении, легко пенетрирует через мембрану клетки млекопитающего и может повлиять или изменить клеточные функции путем последовательного специфического связывания с нуклеиновой кислотой или нуклеопротеином внутри клетки.
Олигомер ПНК формулы I может эффективно ингибировать синтез рибосомных белков прочным связыванием с мРНК. Олигомер ПНК, описанный в данном изобретении, может прочно связывать пре-мРНК и изменять сплайсинг пре-мРНК в мРНК. Кроме того, олигомер ПНК, описанный в данном изобретении, может прочно связывать микроРНК и ингибировать деградацию мРНК, вызванную микроРНК.
Олигомер ПНК формулы I может предсказуемо связывать домен нуклеиновой кислоты рибонуклеопротеина, например, теломеразу, и модулировать ее физиологическую(ие) функцию(и). Олигомер ПНК, описанный в данном изобретении, может связывать ген и модулировать транскрипцию гена. Олигомер ПНК формулы I может связывать вирусный ген или его транскрипт и ингибировать пролиферацию вируса. Олигомер ПНК, описанный в данном изобретении, может повлиять на клеточные функции, отличающиеся от тех, которые описаны выше, путем последовательного специфического связывания нуклеиновой кислоты или нуклеопротеина внутри клетки млекопитающего. Кроме того, олигомер ПНК, описанный в данном изобретении, может прочно связывать бактериальную РНК, нуклеиновую кислоту или ген и ингибировать бактериальную пролиферацию или изменять профили бактериального биосинтеза.
Олигомер ПНК, описанный в данном изобретении, является весьма чувствительным к ошибочному спариванию оснований при связывании с неотъемлемой частью комплементарной ДНК, и будет пригоден для детектирования с высокой точностью однонуклеотидного полиморфизма (SNP). Олигомеры ПНК, описанные в данном изобретении, прочно связывают их комплементарные ДНК(-ы) с высокой специфичностью, обеспечиваемой последовательностью, и могут быть полезны для определения профиля гена. Олигомер ПНК формулы I может быть полезным для зондирования или обнаружения молекулы, содержащей нуклеиновую кислоту, такой как теломер внутри клетки, если метку хромофора, например флуорофора, вводили соответствующим образом. Олигомеры ПНК, описанные в данном изобретении, могут быть полезными для различных диагностических и аналитических целей, отличных от подробно описанных выше.
Олигомер ПНК, описанный в данном изобретении, обладает хорошей растворимостью в воде по сравнению с соответствующим «немодифицированным» олигомером ПНК, и может применяться в виде водного, солевого или буферного раствора. Олигомер ПНК формулы I может входить в состав с катионным липидом, например липофектамином. Олигомер ПНК, описанный в данном изобретении, может образовать дуплекс с комплементарной ДНК и полученный в результате дуплекс может входить в состав с катионным липидом.
Олигомер ПНК, описанный в данном изобретении, может входить в состав различных лекарственных форм, включая инъекционный состав, назальный спрей, таблетку, гранулы, твердую капсулу, мягкую капсулу, липосомный состав, пероральную суспензию, трансдермальный состав и т.д., но выбор ими не ограничивается.
Олигомер ПНК, описанный в данном изобретении, может вводиться субъекту в терапевтически эффективных дозах, которые будут меняться в зависимости от показаний, способа введения, режима дозирования, состояний субъекта и т.д.
Олигомер ПНК, описанный в данном изобретении, может вводиться субъекту различными способами, включая внутривенную инъекцию, подкожную инъекцию, внутрибрюшинную инъекцию, носовую ингаляцию, пероральное введение, трансдермальное применение и т.д., но выбор ими не ограничивается.
Олигомер ПНК формулы I может вводиться субъекту вместе с фармацевтически приемлемым вспомогательным веществом, включая лимонную кислоту, соляную кислоту, винную кислоту, стеариновую кислоту, полиэтиленгликоль, полипропиленгликоль, этанол, бикарбонат натрия, дистиллированную воду, гиалуроновую кислоту, катионный липид, как например липофектамин, крахмал, желатин, тальк, аскорбиновую кислоту, оливковое масло, пальмовое масло, метилцеллюлозу, окись титана, натрий карбоксиметилцеллюлозу, подсластитель, консервант и т.д., но выбор ими не ограничивается.
Олигомер ПНК, описанный в данном изобретении, в зависимости от наличия основной или кислотной функциональной группы (групп), может применяться в виде, нейтрализованном эквивалентным количеством фармацевтически приемлемой кислоты или основания, включая гидроксид натрия, гидроксид калия, соляную кислоту, метансульфоновую кислоту, лимонную кислоту и т.д., но выбор ими не ограничивается.
Предпочтительные олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 5, но меньшее или равное 30;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1 и Tn представляют собой гидридогруппы;
X и Y независимо выбраны из гидридогруппы, замещенной или незамещенной алкилгруппы, замещенной или незамещенной ацилгруппы, замещенной или незамещенной сульфонилгруппы и замещенной или незамещенной арилгруппы;
Z обозначает гидридогруппу, гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
B1, B2,…, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и,
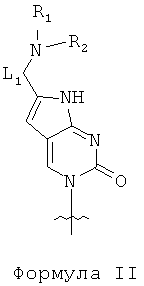
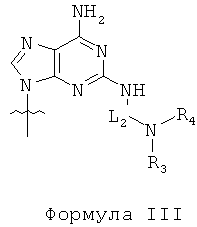
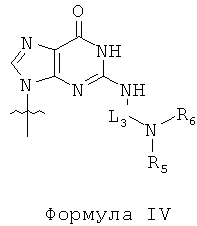
по меньшей мере одна из B1, B2,…, Bn-1 и Bn независимо выбрана из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV:
где:
R1, R2, R3, R4, R5 и R6 независимо выбраны из замещенной или незамещенной алкилгруппы, гидридогруппы, гидроксилгруппы и замещенной или незамещенной алкилоксигруппы; и,
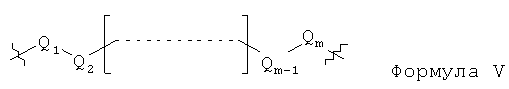
L1, L2 и L3 представляют собой ковалентный линкер, отвечающий формуле V, соединяющий основную аминогруппу в остаток, ответственный за свойства спаривания нуклеиновых оснований:
где:
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу (-СН2-), и Qm непосредственно связана с основной аминогруппой;
Q2, Q3,… и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы, атома кислорода (-O-), атома серы (-S-) и замещенной или незамещенной аминогруппы [-N(Н)-группы или -N(заместители-группы]; и
m - целое число, равное или большее 2, но меньшее или равное 15.
Представляющие особенный интерес олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 8, но меньшее или равное 25;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1 и Tn представляют собой гидридогруппу;
Х и Y независимо выбраны из гидридогруппы, замещенной или незамещенной алкилгруппы и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, B2,…, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере две из B1, В2,…, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из замещенной или незамещенной алкилгруппы и гидридогруппы;
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу, и Qm непосредственно связана с основной аминогруппой;
Q2, Q3,… и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы, атома кислорода и аминогруппы; и
m - целое число, равное или большее 2, но меньшее или равное 12.
Представляющие большой интерес олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 10, но меньшее или равное 25;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1 и Tn представляют собой гидридогруппу;
X и Y независимо выбраны из гидридогруппы и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу, алкилоксигруппу или замещенную или незамещенную аминогруппу; и
B1, B2,…, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тамин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере три из B1, В2,…, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из замещенной или незамещенной алкилгруппы и гидридогруппы;
Q1 и Qm представляют собой метиленгруппу, и Qm непосредственно связана с основной аминогруппой;
Q2, Q3,… и Qm-1 независимо выбраны из метиленгруппы, атома кислорода и аминогруппы; и
m - целое число, равное или большее 2, но меньшее или равное 10.
Представляющие более повышенный интерес олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 10, но меньшее или равное 20;
S1, S2,…, Sn-1, Sn, T1, Т2,…, Tn-1 и Tn представляют гидридогруппу;
X и Y независимо выбраны из гидридогруппы и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, В2,…, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере три из B1, B2,…, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R3, и R5 представляют собой гидридогуппу, и R2, R4 и R6 независимо обозначают гидридогруппу или замещенную или незамещенную амидинилгруппу;
Q1 и Qm представляют собой метиленгруппу, и Qm непосредственно связана с основной аминогруппой;
Q2, Q3,… и Qm-1 независимо выбраны из метиленгруппы, атома кислорода и аминогруппы; и
m - целое число, равное или большее 2, но меньшее или равное 10.
Представляющие наибольший интерес олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 10, но меньшее или равное 20;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1 и Tn представляют собой гидридогруппу;
X и Y независимо выбраны из гидридогруппы и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, В2,…, Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина, и неприродных нуклеиновых оснований;
по меньшей мере три из B1, B2,…, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R3 и R5 представляют собой гидридогруппу, и R2, R4 и R6 независимо обозначают гидридогруппу или амидинилгруппу;
Q1 и Qm представляют собой метиленгруппу, и Qm непосредственно связана с основной аминогруппой;
Q2, Q3,… и Qm-1 независимо выбраны из метиленгруппы и атома кислорода; и
m - целое число, равное или большее 2, но меньшее или равное 8.
Представляющие большой интерес специфические олигомеры ПНК включают олигомеры ПНК формулы I или ее фармацевтически приемлемую соль,
где:
n - целое число, равное или большее 8, но меньшее или равное 20;
S1, S2,…, Sn-1, Sn, T1, T2,…, Tn-1 и Tn представляют собой гидридогруппу;
Х представляет собой гидридогруппу;
Y обозначает гидридогруппу или замещенную или незамещенную ацилгруппу;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, В2,…, Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина и неприродных нуклеиновых оснований;
по меньшей мере три из B1, В2,…, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R3 и R5 представляют собой гидридогруппу, и R2, R4 и R6 независимо обозначают гидридогруппу или амидинилгруппу;
L1 обозначает -(CH2)2-O-(CH2)2-группу, -СН2-O-(СН2)2-группу или -СН2-O-(СН2)3-группу с правой частью непосредственно связанной с основной аминогруппой; и
L2 и L3 независимо выбраны из -(СН2)2-O-(СН2)2-группы, -(СН2)3-O-(СН2)2-группы, -(СН2)2-O-(СН2)3-группы, -(СН2)2-группы, -(СН2)3-группы, -(СН2)4-группы, -(СН2)5-группы, -(СН2)6-группы, -(СН2)7-группы и -(СН2)8-группы с правой частью непосредственно связанной с основной аминогруппой.
Использованные выше термины и сокращения для олигомеров ПНК данного изобретения иллюстрируются ниже в таблице.
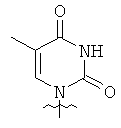
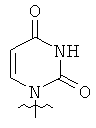
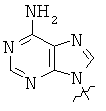
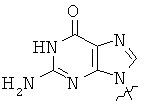
ОБЩИЕ СИНТЕТИЧЕСКИЕ МЕТОДИКИ
Для характеристики молекул, описанных в данном изобретении, снимались спектры ЯМР на ЯМР-спектрометре Varian Mercury 300 МГц, Bruker Avance 400 МГц или Varian Inova 500 МГц. Для определения молекулярного веса применялся Broker Daltonics UltraFlex MALDI-TOF или Agilent LC/MS Ion Trap System (система ионной ловушки). Олигомеры ПНК анализировались и очищались с помощью ВЭЖХ с C18-обращенной фазой или на Hewlett Packard 1050 HPLC или Shimazu LC-6AD HPLC. Если не указано иначе, для хроматографического разделения малых молекул, полученных в данном изобретении, применялся силикагель. Сообщалось, что точка плавления неоткорректирована.
Производные неприродных нуклеиновых оснований, применяемые для синтеза мономеров ПНК, описанной в данном изобретении, получали в соответствии с одним из методов (методы А, Б и В), приведенным ниже, или с незначительной(ыми) модификацией(ями), если только не указано особо в приведенных примерах синтеза.
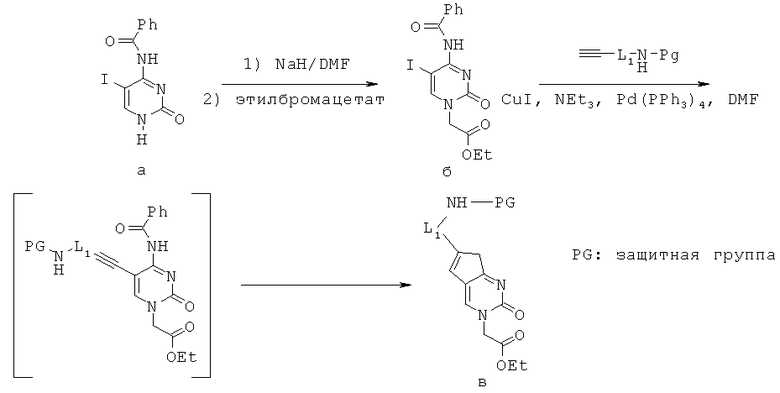
Метод А. Производные 6-алкил-пирролоцитозина синтезировались в виде соответствующим образом защищенных производных в соответствии со схемой 1 или с незначительным(и) изменением(ями) ее. Такие производные 6-алкил-пирролоцитозина применялись для синтеза мономеров ПНК, содержащей нуклеиновое основание, представленное формулой II, в качестве эквивалента цитозина.
Сначала соединение а депротонировали с помощью NaH и затем алкилировали этилбромацетатом с получением соединения б. Соединение б подвергали действию палладия, катализирующего связывание с терминальным ацетиленовым производным, которое циклизовалось in situ в продукт в согласно литературе. (Nucleosides Nucleotides & Nucleic Acids vol.22, 1029-1033, 2003).
Схема 1
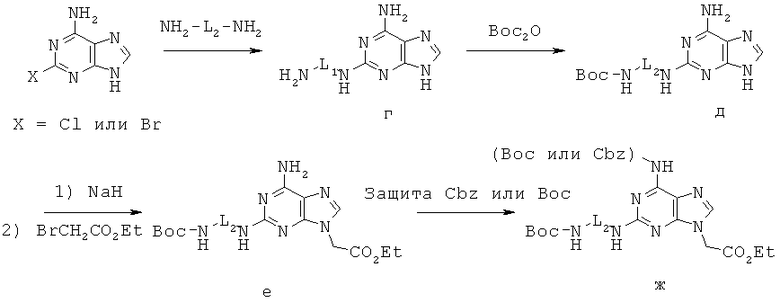
Метод Б. Производные 2,6-диаминопурина синтезировались в виде соответствующим образом защищенных производных в соответствии со схемой 2 или с незначительным(и) изменением(ями) ее. Такие производные 2,6-диаминопурина применялись для синтеза мономеров ПНК, содержащей нуклеиновое основание, представленное Формулой III, в качестве эквивалента аденина.
Сначала 2-галогенаденин реагировал с диамином при высокой температуре с получением соединения г, которое затем реагировало с Вос2О с получением соединения д. Соединение д депротонировали с помощью NaH и алкилировали этилбромацетатом с получением соединения е. Ароматическую аминогруппу соединения е защищали или Cbz- или Boc- группой с получением соединения ж.
Схема 2
Метод В. N-Алкилированные производные гуанина синтезировались в виде соответствующим образом защищенных производных в соответствии со схемой 3 или с незначительными изменениями ее. Такие производные гуанина применялись для синтеза мономеров ПНК, содержащих нуклеиновое основание, представленное Формулой IV, в качестве эквивалента гуанина
Схема 3
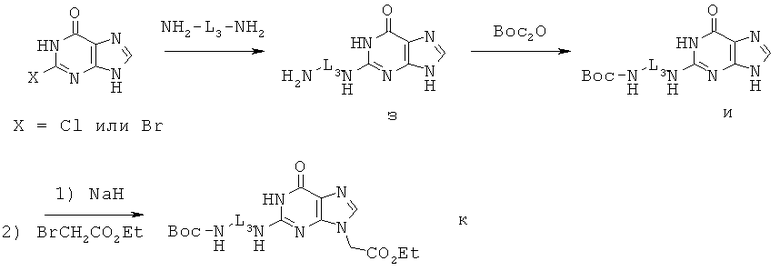
Сначала 2-галогенгипоксантин реагировал с диамином при высокой температуре с получением соединения з, которое затем реагировало с Вос2О с получением соединения и. Соединение и депротонировали с помощью NaH и алкилировали этилбромацетатом с получением соединения к.
Два вида мономеров ПНК синтезировались в соответствии с методом Г или методом Д с получением олигомеров ПНК формулы I. Олигомеры ПНК были получены от компании Panagene, Inc. (www.panagene.com, Daejon, South Korea), используя мономеры ПНК типа п из схемы 4 по запросу CTI Bio. Наоборот, мономеры ПНК типа с из схемы 5 применялись на месте для синтеза олигомеров ПНК в соответствии с методом, описанным ранее или с незначительной(ыми) модификапией(ями) его. (USP 6,133,444).
Метод Г. Мономеры ПНК с модифицированным нуклеиновым основанием получали по схеме 4 или с незначительным(и) изменением(ями) ее в виде соответствующим образом защищенных мономеров для метода синтеза олигомера ПНК, описанного в литературе. (Org. Lett. Том 9, 3291-3293, 2006). В схеме 4, соединение л может соответствовать соединению в схемы 1, соединению ж схемы 2 или соединению к схемы 3, однако, возможно, нет необходимости ограничиваться одним из этих сложноэфирных соединений.
Схема 4
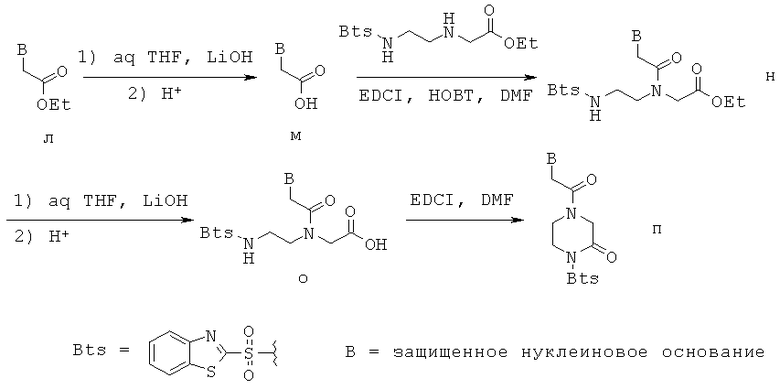
Сначала сложный эфир л подвергали щелочному гидролизу с получением кислоты м, которая затем связывалась с этиловым эфиром N-[2-{N-(2-бензотиазолинил)сульфониламино}этил]-глициновой кислоты с получением соединения н. Соединение н гидролизовалось в мягких условиях с помощью LiOH с получением кислоты о, которая подвергалась циклизации по реакции связывания с EDCI с получением модифицированного мономера ПНК - п. Химическая структура мономера ПНК были принята такой, как на схеме 4 в данном изобретении, учитывая, что согласно литературе таким образом обозначенные мономеры ПНК успешно давали олигомеры ПНК. (Org. Lett. vol.9, 3291-3293, 2006).
Метод Д. Или же, мономеры ПНК с модифицированным нуклеиновым основанием получали в соответствии со схемой 5 или с незначительным(и) изменением(ями) ее в виде соответствующим образом защищенных мономеров для метода синтеза олигомера ПНК, описанного в предшествующем уровне техники. (USP 6,133,444). В схеме 5 соединение л может соответствовать соединению в на схеме 1, соединению ж на схеме 2 или соединению к на схеме 3, однако, возможно нет необходимости ограничиваться одним из этих сложноэфирных соединений.
Схема 5
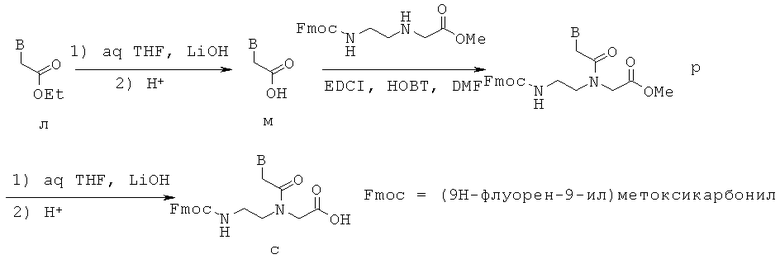
Сначала кислота м связывалась с этиловым эфиром N-[2-{N-(9Н-флуорен-9-ил)амино}этил]-глициновой кислоты с получением соединения р по реакции связывания с EDCI. Затем соединение р гидролизовалось в мягких условиях с помощью LiOH с получением мономера ПНК с модифицированным нуклеиновым основанием.
Следующие примеры содержат подробное описание способов получения соединений, описанных в данном изобретении. Подробные описания этих примеров приведены только для иллюстрации и не должно истолковываться как ограничивающие данное изобретение. Большинство из этих подробных описаний находятся в пределах объема изобретения и служат примером для вышеописанных ОБЩИХ СИНТЕТИЧЕКСИХ МЕТОДИК, которые являются частью изобретения. Сокращения, используемые в следующих примерах, определены в нижеприведенной таблице.
Пример 1. Получение 3-{(трет-бутоксикарбонил)амино}-1-пропанола

К 14 г 3-амино-1-пропанола, растворенного в 150 мл THF и 150 мл воды, по каплям в течение 30 минут прибавляли 40,7 г Вос2О, растворенного в 100 мл THF. После того как реакционную смесь перемешивали в течение 24 часов, THF удаляли при пониженном давлении. Полученный водный слой экстрагировали 200 мл ЕА и органический слой промывали 0,5 М водной лимонной кислотой и дистиллированной водой и затем сушили над безводным сульфатом магния. Сульфат магния отфильтровывали и полученный фильтрат концентрировали в вакууме с получением 25 г соединения 1 в виде бесцветной жидкости. 1Н ЯМР (400 МГц; CDCl3): 
Пример 2. Получение этилового эфира {(N-бензоил)-5-йодцитозин-1-ил}уксусной кислоты (2).
К перемешиваемому раствору 8,3 г N-бензоил-5-йодцитозина, растворенного в 60 мл DMF, при 0°С прибавляли 1,06 г 55% NaH в минеральном масле и раствор перемешивали при комнатной температуре в течение 2 часов. После прибавления к реакционной смеси 2,7 мл этилбромацетата, реакционный раствор перемешивали в течение еще 24 часов при комнатной температуре, за которым следовало удаление растворителя при пониженном давлении. Полученный остаток растворяли и нерастворившееся вещество отфильтровывали. Фильтрат промывали два раза насыщенным водным раствором хлорида аммония, сушили над безводным сульфатом магния и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии (1:1 гексан/ЕА) с получением 6,5 г соединения 2 (соединение 6 в схеме 1) в виде желтого твердого вещества. Т. пл. 154-5°С. 1H ЯМР (400 МГц; CDCl3): 
Пример 3. Получение 3-{3-(трет-бутоксикарбониламино)пропилокси}-1-пропина (3).

К 6,5 г 55% NaH в минеральном масле, диспергированном в 150 мл THF при 0°С, по каплям в течение 15 минут прибавляли 25 г соединения 1 и смесь перемешивали в течение 1 часа. После прибавления по каплям 17,5 мл пропаргилбромида (80% толуольный раствор) в течение 30 минут, реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Реакцию останавливали медленным прибавлением 250 мл воды и THF удаляли при пониженном давлении. Затем полученную водную смесь экстрагировали 250 мл ЕА, которую промывали 3 раза 250 мл воды. Органический слой сушили над безводным сульфатом магния, и сульфат магния отфильтровывали. Полученный фильтрат концентрировали в вакууме и подвергали колоночной хроматографии (5:1 гексан/ЕА) с получением 22,7 г соединения 3 в виде желтой жидкости. 1H ЯМР (400 МГц; DMSOd6): δ 6,78 (т, J=5,2 Гц, 1Н), 4,09 (д, J=2,4 Гц, 2Н), 3,43-3,39 (м, 3Н), 2,95 (кв, J=6,4 Гц, 2Н), 1,60 (м, 2Н), 1,37 (с, 9Н).
Пример 4. Получение 4-{2-(трет-бутоксикарбониламино)этокси}-1-бутина (4)
К 3,8 г 4-(2-азидоэтокси)-1-бутана, растворенного в 17 мл THF, прибавляли 7,2 г трифенилфосфина и 0,7 мл воды и реакционную смесь перемешивали в течение 8 часов, за которым последовало удаление растворителя при пониженном давлении. Затем полученный остаток растворяли в 20 мл ЕА и экстрагировали дважды 10 мл 1 М водной HCl. К водному слою прибавляли водный раствор карбоната натрия с доведением рН до 9~10. К раствору прибавляли 5,96 г Boc2O, растворенного в 15 мл THF, и реакционную смесь перемешивали 12 часов. После удаления в вакууме THF, полученный раствор экстрагировали ЕА. Органический слой промывали 0,5 М водной лимонной кислотой и сушили над безводным сульфатом магния. Органический слой концентрировали и очищали колоночной хроматографией (9:1 гексан/ЕА) с получением 3,4 г соединения 4 в виде желтого масла. 1H ЯМР (400 МГц; CDCl3): 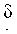
Пример 5. Получение 3-{2-(трет-бутоксикарбониламино)этокси}-1-пропина (5).
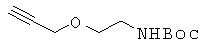
20 г 2-{(трет-бутоксикарбонил)амино}-1-этанола реагировал и его очищали аналогично описанной в примере 3 методики с получением 23,7 г соединения 5 в виде бледно-желтого масла. 1H ЯМР (400 МГц; DMSOd6): δ 6,81 (т, 1Н), 4,11 (д, J=2,4 Гц, 2Н), 3,41 (м, 3Н), 3,07 (кв, J=6,0 Гц, 2Н), 1,38 (с, 9Н).
Пример 6. Получение 3-[N-{3-(трет-бутоксикарбониламино)пропил}-N-(трет-бутокси-карбонил)амино]-1-пропина (6)
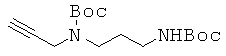
К перемешиваемому раствору N-[3-(трет-бутоксикарбониламино)пропил]-N-(2-пропинил)амина в 83 мл THF и 95 мл воды, прибавляли по каплям 42 г Вос2О при комнатной температуре. Реакционную смесь перемешивали в течение 1,5 часов и концентрировали в вакууме. Полученный водный слой экстрагировали ЕА. ЕА слой промывали последовательно 0,5 М водной лимонной кислотой и рассолом, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и очищали с помощью колоночной хроматографии (1:1 гексан/ЕА) с получением 19 г соединения 6 в виде желтого масла. 1H ЯМР (400 МГц; CDCl3): 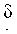
Пример 7. Получение 3-[2-{2,3-бис(бензилоксикарбонил)гуанидино}-этокси]-1-пропина (7)
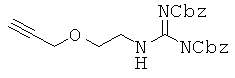
К перемешиваемому раствору 10,9 г соединения 5 в 110 мл МС, прибавляли 110 мл TFA по каплям в течение 2 часов при 0°С и реакционную смесь перемешивали еще 3 часа. Реакционный раствор концентрировали при пониженном давлении и полученный остаток растворяли в 40 мл МС при 0°С, к которому прибавляли 12,3 мл TEA и затем 8,8 г 1,3-бис(бензилоксикарбонил)-2-(метилтио)псевдомочевины при комнатной температуре. Реакционный раствор перемешивали в течение 4 часов и промывали дважды водой. Органический слой сушили над безводным сульфатом магния, концентрировали в вакууме и подвергали колоночной хроматографии (5:1 гексан/ЕА) с получением 9,8 г соединения 7 в виде белого твердого вещества. 1H ЯМР (400 МГц; DMSOd6): 
Пример 8. Получение 2-{(трет-бутоксикарбонил)амино}-1-(2-пропинил-1-окси)}-(R)-пропана (8).
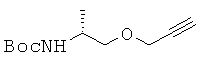
10,8 г трет-бутил-(R)-1-гидрокси-(пропан-2-ил)карбамата реагировал и его очищали по аналогичной методике, описанной в примере 3. с получением 10,1 г соединения 8 в виде желтого масла. 1H ЯМР (500 МГц; DMSOd6): δ 6,63 (д, 1Н), 4,11 (д, 2Н), 3,60 (м, 1Н), 3,37-3,33 (м, 2Н), 3,26-3,23 (м, 1Н), 1,38 (с, 9Н), 1,05 (д, 3Н).
Пример 9. Получение N-[2-{2-(трет-бутоксикарбонил)аминоэтокси}этил]-N-[2-{(3-бутинил)-1-окси}этил]-N-(трет-бутоксикарбонил)амина (9).
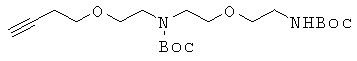
К перемешиваемому раствору 5 г 2-{(3-бутинил)-1-окси}этил метансульфоната и 5,32 г 2-[2-{2-(трет-бутоксикарбонил)амино}этил-1-окси]этиламина в 60 мл ацетонитрила прибавляли по каплям 3,6 г карбоната калия, растворенного в воде при 0°С. Реакционный раствор оставляли медленно нагреваться до комнатной температуры и перемешивали еще 24 часа, а затем концентрировали при пониженном давлении. Полученный остаток растворяли в МС и промывали водой. Органический слой концентрировали и растворяли в 80 мл THF и 80 мл воды, к которым прибавляли 8,4 г Вос2О, растворенного в 50 мл THF. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, за которым следовало удаление THF в вакууме и экстракция ЕА. Органический слой промывали последовательно 0,5 М водной лимонной кислотой, водой и рассолом. Органический слой сушили над безводным сульфатом натрия, концентрировали и очищали с помощью колоночной хроматографии (гексан→1:4 ЕА/гексан) с получением 2,45 г соединения 9 в виде бледно-желтого масла. 1H ЯМР (400 МГц; CDCl3): δ 5,08 (уш.с, 0,5Н), 4,93 (уш.с, 0,5Н), 3,61-3,46 (м, 12Н), 3,31 (м, 2Н), 2,48 (м, 2Н), 1,99 (т, 1Н), 1,48 (с, 9Н), 1,46 (с, 9Н).
Пример 10. Получение этилового эфира 2-[6-{3-(трет-бутоксикарбонил-амино)пропил-1-окси}-метил-2-оксо-2Н-пирроло[2,3-d]пиримидин-3(7Н)-ил]уксусной кислоты (10).
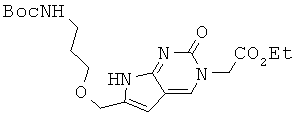
К перемешиваемому раствору 6,5 г соединения 2 в 120 мл DMF, прибавляли последовательно 580 мг CuI, 4,2 мл TEA, 9,74 г соединения 3 и 1,76 г Pd(PPh3)4. Затем реакционную смесь перемешивали в течение 24 часов при 50°С с экранированием от света и концентрировали при пониженном давлении. Полученный остаток растворяли в 250 мл EtOH и перемешивали при кипении в течение 18 часов. Затем раствор концентрировали в вакууме и подвергали хроматографическому разделению (95:5 EA/EtOH) с получением 2,3 г соединения 10 в виде темно-красного губчатого/твердого вещества. 1H ЯМР (400 МГц; DMSOd6): 
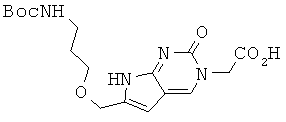
Пример 11. Получение 2-[6-{3-(трет-бутоксикарбониламино)пропил-1-окси}метил-2-оксо-2Н-пирроло-[2,3-d]пиримидин-3(7Н)-ил]уксусной кислоты (11).
К 3,3 г соединения 10 прибавляли 15 мл THF, 30 мл воды и затем 760 мг LiOH и затем смесь перемешивали при комнатной температуре в течение 20 минут. После удаления THF при пониженном давлении, полученный водный раствор промывали диэтиловым эфиром. Водный слой подкисляли до рН 3 с помощью 1 М водной HCl и экстрагировали ЕА. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 2,46 г соединения 11 в виде белого твердого вещества. 1H ЯМР (400 МГц; DMSOd6): 
Пример 12. Получение этилового эфира N-[2-{(бензо[d]тиазол-2-сульфонил)амино}-этил]-N-[2-[6-{3-(трет-бутоксикарбониламино)пропил-1-окси}метил-2-оксо-2Н-пирроло-[2,3-d]пиримидин-3(7Н)-ил]ацетил]глициновой кислоты (12).
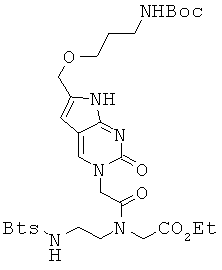
К 4,0 г соединения 11 и 3,6 г этилового эфира N-[2-{(бензо[d]тиазол-2-сульфонил)амино}этил]глициновой кислоты, растворенных в 30 мл DMF, прибавляли при комнатной температуре 2,42 г EDCI и 1,70 г HOBt. Реакционную смесь перемешивали в течение 8 часов. После удаления растворителя в вакууме, полученный остаток растворяли в МС и промывали 1 М водной HCl и затем водой. МС слой концентрировали при пониженном давлении и очищали с помощью колоночной хроматографии (95:5 МС/МеОН) с получением 4,6 г соединения 12 в виде желтого пенистого/твердого вещества. 1H ЯМР (400 МГц; DMSOd6): δ 11,09 (уш.с, 1Н), 8,74 (с, 0,6Н), 8,58 (с, 0,4Н), 8,27 (м, 1Н), 8,20-8,14 (м, 2Н), 7,66 (м, 2Н), 6,56 (уш.с, 1Н), 6,16 (м, 1Н), 4,91 (с, 1,2Н), 4,73 (с, 0,8Н), 4,38 (с, 2,6Н), 4,17 (м, 0,9Н), 4,07 (м, 2,5Н), 3,67 (м, 1,1Н), 3,49-3,44 (м, 4Н), 3,26 (м, 0,9Н), 3,01 (м, 2Н), 1,66 (м, 2Н), 1,38 (с, 9Н), 1,24 (т, J=7,0 Гц, 1,2Н), 1,17 (т, J=7,0 Гц, 1,8Н).
Пример 13. Получение N-[2-{(бензо[d]тиазол-2-сульфонил)амино}-этил]-N-[2-[6-{3-(трет-бутоксикарбониламино)пропил-1-окси}метил-2-оксо-2Н-пирроло-[2,3-d]пиримидин-3(7Н)-ил]ацетил]глицина (13).
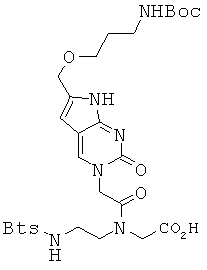
4,5 г соединения 12 и 670 мг LiOH диспергировали в 20 мл THF и 20 мл воды и перемешивали при комнатной температуре в течение 20 минут. THF удаляли в вакууме и полученный водный раствор промывали диэтиловым эфиром. Водный слой подкисляли до рН 3 с помощью 1 М водной HCl и экстрагировали ЕА. Слой ЕА сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 4,4 г соединения 13 в виде темно-желтого твердого вещества. 1Н ЯМР (400 МГц; DMSOd6): δ 11,32 (уш.с, 1Н), 8,36 (м, 1Н), 8,28 (м, 1,6Н), 8,22 (с, 0,4Н), 7,73 (м, 2Н), 6,78 (м, 1Н), 6,20 (с, 1Н), 4,94 (с, 1,2Н), 4,84 (с, 0,8Н), 4,52 (с, 0,8Н), 4,37 (с, 2Н), 4,30 (с, 1,2Н), 4,26 (м, 1,2Н), 4,07 (м, 2Н), 3,87 (м, 0,8Н), 3,43 (м, 2Н), 2,99 (м, 2Н), 1,63 (м, 2Н), 1,37 (с, 9Н).
Пример 14. Получение 1-{(бензо[d]тиазол-2-сульфонил)}-2-оксо-4-[6-{3-(трет-бутоксикарбониламино)пропил-1-окси}метил-2-оксо-2Н-пирроло-[2,3-d]пиримидин-3(7Н)-ил]ацетил]пиперазина (14).
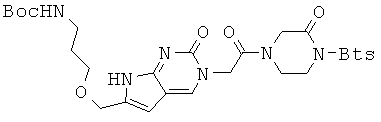
4,4 г соединения 13 и 1,49 г EDCI в 50 мл DMF перемешивали при комнатной температуре в течение 16 часов. После концентрирования реакционной смеси в вакууме, полученный остаток растворяли в 50 мл МС. Раствор МС промывали последовательно 1 М водной HCl и водой, концентрировали в вакууме и затем очищали с помощью колоночной хроматографии (ацетон) с получением 1,5 г соединения 14 в виде коричневого губчатого/твердого вещества. 1H ЯМР (400 МГц; DMSOd6): δ 11,25 (уш.с, 1Н), 8,36 (м, 1Н), 8,29 (м, 1Н), 8,25 (с, 0,6Н), 8,19 (0,4Н), 7,72 (м, 2Н), 6,78 (т, J=5,2 Гц, 1Н), 6,18 (с, 1Н), 4,92 (с, 1,2Н), 4,82 (с, 0,8Н), 4,51 (с, 0,8Н), 4,37 (с, 2Н), 4,29 (с, 1,2Н), 4,23 (м, 1,2Н), 4,06 (м, 2Н), 3,87 (м, 0,8Н), 3,41 (т, J=6,4 Гц, 2Н), 2.98 (кв, J=6,8 Гц, 2Н), 1,62 (м, 2Н), 1,36 (с, 9Н). MS/ESI (m+23/MNa+)=682,2 (экспериментальный), М.в.=659,8 (C28H33N7O8S2).
Исходя из ацетиленовых производных 4~9, производные пирролоцитозина 15~20 получали с помощью аналогичной методики, описанной в примере 10. Спектральные и физические данные для соединений 15~20 приводятся ниже в таблице.
Примеры 15~20. Аналитические данные для производных пирроло-цитозина 15~20.
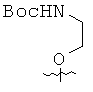
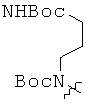
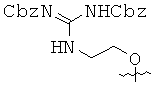
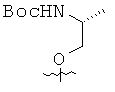
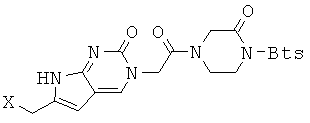
Исходя из производных пирролоцитозина 15, 16, 17 и 20, мономеры ПНК с модифицированным цитозином 21~24 получали аналогично методикам, описанным в примерах 11~14. Спектральные и физические данные для соединений 21~24 приводятся ниже в таблице.
Примеры 21~24. Аналитические данные для цитозиновых мономеров ПНК 21~24.


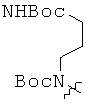

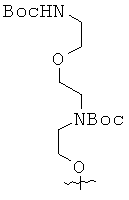
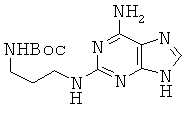
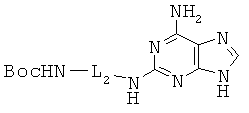
Пример 25. Получение 2-{3-(трет-бутоксикарбониламино)пропил}амино-аденина (25).
6,8 г 2-хлораденина, растворенного в 68 мл 1,3-диаминопропана и 68 мл монометоксиэтанола, перемешивали при кипении в течение 24 часов, и реакционную смесь концентрировали в вакууме. Полученный остаток растворяли в 100 мл THF и 100 мл воды, к которым медленно прибавляли 60 г Boc2O, растворенного в 79 мл THF. Реакционную смесь перемешивали при комнатной температуре в течение 6 часов и затем органический растворитель удаляли при пониженном давлении. Полученный водный слой экстрагировали дважды 100 мл ЕА. Органический слой промывали 0,5 М водной лимонной кислотой и рассолом и сушили над безводным сульфатом магния. Органический слой концентрировали при пониженном давлении и подвергали хроматографическому разделению (1:10 МеОН/МС) с получением 4,07 г соединения, защищенного двумя Вос-группами. Данное соединение растворяли в 100 мл МеОН, к которому медленно прибавляли 45 мл водного насыщенного раствора карбоната натрия. Реакционный раствор перемешивали при 50°С в течение 1 часа и затем концентрировали в вакууме. Полученный остаток растворяли в 50 мл МеОН и нерастворенное вещество отфильтровывали. Затем фильтрат концентрировали с получением 3,16 г соединения 25 в виде белого твердого вещества. 1H ЯМР (400 МГц; DMSOd6): 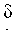
Исходя из 2-хлораденина и соответствующего диамина, производные 2,6-диаминопурина 26~30 получали аналогично методике, описанной в примере 25. Спектральные и физические данные для соединений 26~30 приводятся ниже в таблице.
Пример 26~30. Аналитические данные для производных 2,6-диаминопурина 26~30.
Пример 31. Получение 2-[2-{2-(трет-бутоксикарбониламино)-2-метил}этил]-амино-1Н-пурин-6(9Н)-она (31).
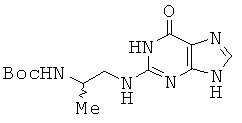
11 г 2-хлоргипоксантина и 4,96 мл 1,2-диаминопропана (рацемата) диспергировали в 33 мл монометоксиэтанола и перемешивали в течение 24 часов при 130°С. Растворитель удаляли в вакууме и полученный остаток растворяли в 97 мл THF и 97 мл воды, к которым медленно прибавляли 22,8 г Вос20, растворенного в 64 мл THE Реакционную смесь перемешивали при комнатной температуре в течение 6 часов и к раствору прибавляли ЕА. Полученный осадок собирали с помощью фильтрации с получением соединения 31 в виде серого твердого вещества. 1H ЯМР (500 МГц; DMSOd6): 
Пример 32. Получение этилового эфира 2-[6-амино-2-{3-(трет-бутоксикарбонил-амино)-пропил}амино-9Н-пурин-9-ил]уксусной кислоты (32).
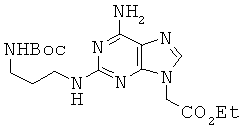
К перемешиваемому раствору 3,16 г соединения 25, растворенного в 100 мл DMF, прибавляли 480 мг 55% NaH в минеральном масле. Реакционный раствор перемешивали в течение 2 часов, после чего медленно прибавляли 1,98 мл этилбромацетата. Двумя часами позже реакционную смесь концентрировали в вакууме и очищали с помощью колоночной хроматографии (1:10 EtOH/EA) с получением 2,92 г аналога диаминопурина 32 в виде бледно-желтого твердого вещества. 1H ЯМР (400 МГц; DMSOd6): δ 7,67 (с, 1Н), 6,80 (т, 1Н), 6,71 (с, 2Н), 6,28 (т, 1Н), 4,85 (с, 2Н), 4,15 (кв, 2Н), 3,20 (кв, 2Н), 2,94 (кв, 2Н), 1,57 (м, 2Н), 1,37 (с, 9Н), 1,21 (т, 3Н).
Пример 33. Получение этилового эфира 2-[6-(бензилоксикарбонил)амино-2-{3-(трет-бутокси-карбониламино)пропил}амино-9Н-пурин-9-ил]уксусной кислоты (33).
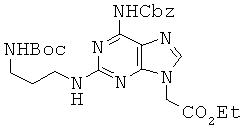
К перемешиваемому раствору 4,68 г соединения 32 в 100 мл DMF, при комнатной температуре прибавляли 13,2 г N-(бензилоксикарбонил)-N'-метил-имидазолий трифлата. Через 12 часов реакционную смесь концентрировали при пониженном давлении и подвергали колоночной хроматографии (5% МеОН в МС) с получением 5,4 г соединения 33 в виде белого твердого вещества. 1H ЯМР (400 МГц; DMSOd6): δ 10,19 (с, 1Н), 7,92 (с, 1Н), 7,45-7,33 (м, 5Н), 6,88 (т, 1Н), 6,77 (т, 1Н), 5,18 (с, 2Н), 4,94 (с, 2Н), 4,16 (кв, 2Н), 3,25 (кв, 2Н), 2,95 (кв, 2Н), 1,60 (м, 2Н), 1,36 (с, 9Н), 1,21 (т, 3Н).
Пример 34. Получение этилового эфира N-[2-{2-(бензо[d]тиазол)сульфонил}-амино-этил]-N-[2-[6-(бензилоксикарбонил)амино-2-{3-(трет-бутоксикарбонил-амино)-пропил}амино-9Н-пурин-9-ил]ацетил]глициновой кислоты (34).
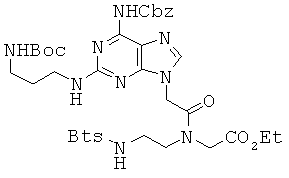
5,4 г соединения 33 и 950 мг LiOH растворяли в 40 мл THF и 40 мл воды и перемешивали при комнатной температуре в течение 1 часа. THF удаляли в вакууме и полученный водный раствор подкисляли до рН 3 с помощью 1 М водной HCl и затем экстрагировали ЕА. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток и 2,92 г этилового эфира 2-N-[2-{(бензо[d]тиазол-2-сульфонил)амино}этил]глициновой кислоты растворяли в 240 мл DMF, к которым при комнатной температуре прибавляли 1,95 г EDCI и 1,38 г HOBt. Реакционную смесь перемешивали в течение 20 часов, концентрировали при пониженном давлении и растворяли в МС. МС раствор промывали 1 М водной HCl, концентрировали в вакууме и затем очищали колоночной хроматографией (5% МеОН/МС) с получением 2,7 г соединения 34 в виде бледно-желтого губчатого вещества. 1H ЯМР (400 МГц; DMSOd6): δ 10,18 (м, 1Н), 8,97 (уш.с, 0,6Н), 8,80 (уш.с, 0,4Н), 8,28 (д, 1Н), 8,18 (м, 1Н), 7,80 (с, 0,6Н), 7,76 (с, 0,4Н), 7,66 (м, 2Н), 7,46-7,32 (м, 5Н), 6,77 (м, 2Н), 5,18 (с, 2Н), 5,10 (с, 1,2Н), 4,89 (с, 0,8Н), 4,45 (с, 0,8Н), 4,17 (кв, 0,8Н), 4,07-4,00 (м, 2,4Н), 3,68 (м, 1,2Н), 3,47 (м, 1,2Н), 3,41 (м, 0,9Н), 3,22 (м, 2,7Н), 2,94 (м, 2Н), 1,59 (м, 2Н), 1,36 (с, 9Н), 1,31-1,12 (м, 3Н).
Пример 35. Получение 1-(бензо[d]тиазол-2-сульфонил)-2-оксо-4-[[6-(бензил-оксикарбонил)амино-2-{3-(трет-бутоксикарбониламино)пропиламино}-9Н-пурин-9-ил]-ацетил]пиперазина (35).
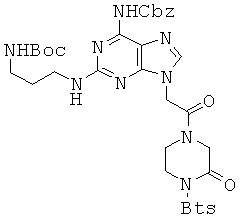
2,7 г соединения 34 и 340 мг LiOH диспергировали в 15 мл THF и 20 мл воды и перемешивали в течение 30 минут при комнатной температуре. THF удаляли при пониженном давлении. Затем полученный водный слой подкисляли до рН 3 с помощью 1 М водной HCl и экстрагировали ЕА. ЕА слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 2,48 г неочищенного продукта. Неочищенный продукт и 716 мг EDCI, растворенного в 70 мл DMF, перемешивали при комнатной температуре в течение 20 часов. Растворитель удаляли при пониженном давлении и полученный в результате остаток растворяли в МС и промывали 1 М водной HCl и затем водой. Органический слой концентрировали в вакууме и очищали колоночной хроматографией (ацетон) с получением 1,4 г соединения 35 в виде белого губчатого вещества. 1H ЯМР (400 МГц; DMSOd6): δ 10,16 (с, 1Н), 8,35 (м, 1Н), 8,26 (м, 1Н), 7,81 (с, 0,6Н), 7,77 (с, 0,4Н), 7,72 (м, 2Н), 7,45-7,31 (м, 5Н), 6,78 (м, 2Н), 5,18 (с, 2Н), 5,12 (с, 1,2Н), 5,01 (с, 0,8Н), 4,55 (с, 0,8Н), 4,29-4,27 (м, 2,4Н), 4,09 (м, 2Н), 3,88 (м, 0,8Н), 3,26 (м, 2Н), 2,95 (м, 2Н), 1,61 (м, 2Н), 1,36 (с, 9Н); MS/ESI (m+1)=779,2 (экспериментальный), М.в.=778,9 (C34H38N10O8S2).
Исходя из производных 2,6-диаминопурина 26~30, модифицированные адениновые мономеры ПНК получали аналогично методикам, описанным в примерах 32~35. Спектральные и физические данные для соединений 36~40 приводятся ниже в таблице.
Примеры 36~40. Аналитические данные для адениновых мономеров ПНК 36~40.
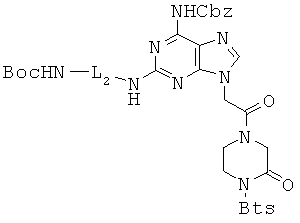

Пример 41. Получение этилового эфира 2-[2-[2-{2-(трет-бутоксикарбониламино)-2-метил}этил]амино-6-оксо-6,9-дигидро-1Н-пурин-2-ил]уксусной кислоты (41).
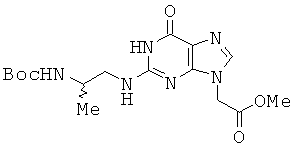
К перемешиваемому раствору 4,69 г соединения 31 в 47 мл DMF прибавляли 790 мг 55% NaH в минеральном масле и реакционный раствор перемешивали в течение 2 часов. После медленного прибавления 1,85 мл этилбромацетата, реакционный раствор перемешивали еще в течение 2 часов. Реакционную смесь концентрировали в вакууме и очищали колоночной хроматографией (5:95 МеОН/МС) с получением 5,04 г соединения 41 в виде бледно-желтого твердого вещества. 1H ЯМР (500 МГц; DMSOd6): δ 10,55 (с, 1Н), 7,67 (с, 1Н), 6,74 (д, 1Н), 6,40 (м, 1Н), 4,87 (с, 2Н), 4,17 (кв, 2Н), 3,65 (м, 1Н), 3,28 (м, 1Н), 3,16 (м, 1Н), 1,36 (с, 9Н), 1,21 (т, 3Н), 1,01 (д, 3Н).
Пример 42. Получение 2-{2-(трет-бутоксикарбониламино)этокси}этиламина (42).
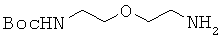
К 146 г [2-{2-(трет-бутоксикарбониламино)этокси}этил]метансульфоната, растворенного в 500 мл DMF, прибавляли 134 г азида натрия. Реакционную смесь перемешивали при 70°С в течение 20 часов и затем концентрировали при пониженном давлении. Полученный остаток растворяли в 1200 мл воды и экстрагировали ЕА. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Полученный в результате остаток растворяли в 2000 мл THF, к которому прибавляли 162 г трифенилфосфина. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, после чего прибавляли 200 мл воды. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и концентрировали до 500 мл при пониженном давлении. Затем полученный в результате осадок отфильтровывали. Фильтрат далее концентрировали при пониженном давлении для удаления THF и промывали МС. Водный слой концентрировали с получением 86,2 г соединения 42 в виде жидкости. 1H ЯМР (400 МГц; CDCl3): δ 4,96 (уш.с, 1Н), 3,54-3,48 (м, 4Н), 3,34 (кв, 2Н), 2,88 (т, 2Н), 1,48-1,46 (м, 11Н).
Пример 43. Получение 2-[2-{2-(трет-бутоксикарбониламино)-этокси}этил]амино-1Н-пурин-6(9Н)-она (43).
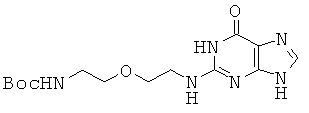
6,3 г соединения 42 и 2,0 г 2-бромгипоксантина диспергировали в 55 мл монометоксиэтанола и 17,5 мл воды. Реакционную смесь перемешивали при кипении в течение 16 часов и растворитель удаляли при пониженном давлении. Затем концентрат перемешивали в 20 мл МС и 10 мл воды в течение 30 минут и полученный в результате осадок собирали фильтрацией с получением 2,1 г соединения 43 в виде бледно-желтого твердого вещества. 1H ЯМР (500 МГц; DMSOd6): δ 12,43 (уш.с, 1Н), 10,45 (уш.с, 1Н), 7,89 (с, 0,2Н), 7,61 (с, 0,8Н), 6,77 (м, 1Н), 6,34 (с, 0,8Н), 6,12 (с, 0,2Н), 3,52 (т, 2Н), 3,41 (м, 4Н), 3,09 (кв, 2Н), 1.36 (с, 9Н).
Пример 44. Получение 2-[2-[3-(трет-бутоксикарбониламино)пропилокси}-этил]]-амино-1Н-пурин-6(9Н)-она (44).
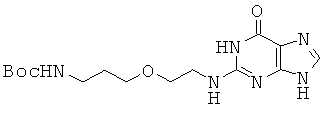
2-{3-(трет-бутоксикарбониламино)пропилокси}этиламин и 2-бромгипо-ксантин реагировали аналогично методике, описанной в примере 43, с получением соединения 44 в виде белого твердого вещества. 1H ЯМР (500 МГц; DMSOd6): δ 12,43 (уш.с, 1Н), 10,45 (уш.с 1Н), 7,61 (м, 1Н), 6,80 (т, 1Н), 6,30 (с, 0,7Н), 6,08 (с, 0,3Н), 3,49 (т, 2Н), 3,41 (т, 4Н), 2,99 (кв, 2Н), 1,61 (м, 2Н), 1,37 (с, 9Н).
Пример 45. Получение 2-{3-(трет-бутоксикарбониламино)пропил}амино-1Н-пурин-6(9Н)-она (45).
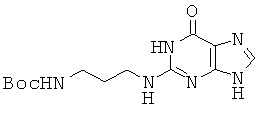
Смесь из 10 г хлоргипоксантина и 19,6 мл 1,3-диаминопропана, диспергированную в 40 мл монометоксиэтанола, перемепгавали при 130°С в течение 10 часов. Затем растворитель удаляли при пониженном давлении и полученный в результате остаток растворяли в 150 мл THF и 150 мл воды, к которым медленно прибавляли 19,2 г Boc2O, растворенного в 100 мл THF. Смесь перемешивали при комнатной температуре в течение 6 часов. После прибавления ЕА полученный в результате осадок собирали фильтрацией с получением 6,31 г соединения 45 в виде темно-зеленого твердого вещества. 1H ЯМР (400 МГц; DMSOd6): δ 11,13 (уш.с, 1Н), 7,64 (с, 1Н), 6,87 (с, 1Н), 6,31 (с, 1Н), 3,23 (кв, 2Н), 2,98 (м, 2Н), 1,62 (м, 2Н), 1,38 (с, 9Н).
Производные гуанина 46~47 получали с помощью соответствующего диамина аналогично методике, описанной в примере 45. Спектральные и физические данные для соединений 46~47 приводятся ниже в таблице.
Примеры 46~47. Аналитические данные для производных гуанина 46~47.
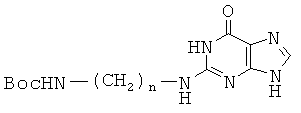
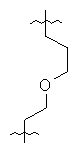
Соединения 43-46 превращались в соединения 48~51 с помощью методики аналогичной описанной в примере 32. Спектральные и физические данные для соединений 48~51 приводятся ниже в таблице.
Примеры 48~51. Аналитические данные для производных гуанина 48~51.

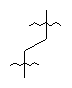
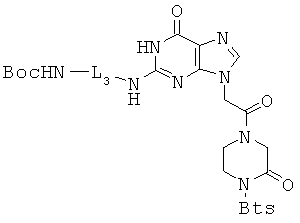
Исходя из производных гуанина 48, 49 и 51, модифицированные гуаниновые мономеры ПНК 52~54 получали аналогично методикам, описанным в примерах 34~35. Спектральные и физические данные для соединений 52~54 приводятся ниже в таблице.
Примеры 52~54. Аналитические данные для гуаниновых мономеров ПНК 52~54.


Пример 55. Получение этилового эфира 2-[6-амино-2-{2-(трет-бутоксикарбонил-амино)этил}-амино-9Н-пурин-9-ил]уксусной кислоты (55).
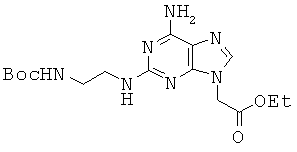
Соединение 55 получали из соединения 26 с помощью методики, аналогичной описанной в примере 32. Бледно-желтое твердое вещество. 1H ЯМР (400 МГц, DMSOd6): δ 7,70 (с, 1Н), 6,84 (т, 1Н), 6,79 (с, 2Н), 6,30 (т, 1Н), 4,87 (с, 2Н), 4,16 (кв, 2Н), 3,25 (кв, 2Н), 3,08 (кв, 2Н), 1,37 (с, 9Н), 1,22 (т, 3Н).
Пример 56. Получение этилового эфира 2-[6-амино-2-[2-{2,3-бис(бензилокси-карбонил)гуанидино}этил]амино-9Н-пурин-9-ил]уксусной кислоты (56).
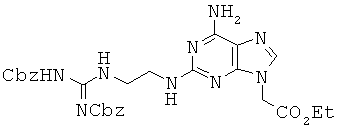
К 4,42 г соединения 55, растворенного в 22 мл МС, медленно прибавляли 22 мл TFA при 0°С и раствор перемешивали в течение 2,5 часов. Реакционный раствор концентрировали при пониженном давлении, к которому прибавляли 100 мл диэтилового эфира. Полученный в результате осадок собирали фильтрацией с получением 5,79 г бледно-коричневого твердого промежуточного продукта. 3,9 г промежуточного продукта растворяли в 39 мл МС, к которому медленно прибавляли 6,9 мл TEA при 0°С. Раствор перемешивали в течение 15 мин при комнатной температуре, к которому прибавляли 2,48 г 1,3-бис(бензилоксикарбонил)-2-(метилтио)псевдомочевины. Затем реакционную смесь перемешивали еще 24 часа и промывали 0,5 М водной HCl. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 4,58 г соединения 56 в виде бледно-желтого твердого вещества. 1Н ЯМР (500 МГц; DMSOd6): δ 11,59 (с, 1Н), 8,56 (т, 1Н), 7,69 (с, 1Н), 7,39-7,29 (м, 10Н), 6,75 (с, 2Н), 6,53 (с, 1Н), 5,15 (с, 2Н), 5,02 (с, 2Н), 4,86 (с, 2Н), 4,13 (кв, 2Н), 3,50 (кв, 2Н), 3,37 (м, 2Н), 1,19 (т, 3Н).
Пример 57. Получение этилового эфира 2-[6-(бензилоксикарбониламино)-2-[2-{2,3-бис-(бензилоксикарбонил)гуанидино}этил]амино-9Н-пурин-9-ил]уксусной кислоты (57).
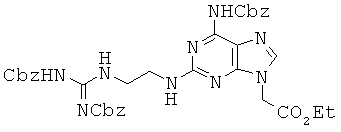
4,54 г соединения 56 и 8,22 г N-(бензилоксикарбонил)-N'-метил-имидазолий трифлата растворяли в 90 мл DMF и перемешивали в течение 29 часов при комнатной температуре. Растворитель удаляли при пониженном давлении и полученный в результате остаток очищали колоночной хроматографией (1:3 гексан/ЕА) с получением 3,06 г соединения 57 в виде белого губчатого/твердого вещества. 1H ЯМР (500 МГц; DMSOd6): δ 11,60 (с, 1Н), 10,25 (с, 1Н), 8,57 (т, 1Н), 7,95 (с, 1Н), 7,45-7,29 (м, 15Н), 7,14 (т, 1Н), 5,18 (с, 2Н), 5,14 (с, 2Н), 5,02 (с, 2Н), 4,95 (с, 2Н), 4,15 (кв, 2Н), 3,54 (кв, 2Н), 3,42 (кв, 2Н), 1,19 (т, 3Н).
Пример 58. Получение этилового эфира 2-[6-амино-2-{4-(трет-бутоксикарбонил-амино)бутил}-амино-9Н-пурин-9-ил]уксусной кислоты (58).
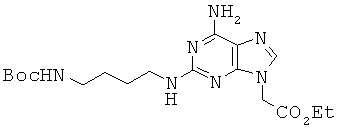
Соединение 58 получали из соединения 27 в виде красновато-желтого губчатого/твердого вещества по методике, аналогичной описанной в примере 32. 1H ЯМР (500 МГц; DMSOd6): δ 7,67 (с, 1Н), 6,79 (т, 1Н), 6,69 (с, 2Н), 6,30 (м, 1Н), 4,85 (с, 2Н), 4,15 (кв, 2Н), 3,22-3,17 (м, 2Н), 2,93-2,89 (м, 2Н), 1,45 (м, 2Н), 1,40-1,36 (м, 11Н), 1,21 (т, 3Н).
Пример 59. Получение этилового эфира 2-[6-(бензилоксикарбониламино)-2-[4-{2,3-бис-(бензилоксикарбонил)гуанидино}бутил]амино-9Н-пурин-9-ил]уксусной кислоты (59).
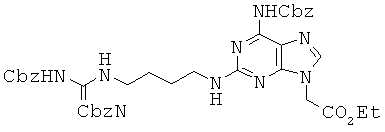
Соединение 59 получали из соединения 58 в виде бледно-желтого губчатого/твердого вещества по методикам, аналогичным описанным в примерах 56~57. 1Н ЯМР (500 МГц; DMSOd6): δ 11,49 (с, 1Н), 10,12 (с, 1Н), 8,28 (т, 1Н), 7,91 (с, 1Н), 7,45-7,31 (м, 5Н), 6,95 (т, 1Н), 5,17 (с, 2Н), 4,93 (с, 2Н), 4,16 (кв, 2Н), 3,28 (м, 4Н), 1,51 (м, 4Н), 1,46 (с, 9Н), 1,38 (с, 9Н), 1,21 (т, 3Н).
Пример 60. Получение этилового эфира 2-[6-амино-2-{5-(трет-бутоксикарбонил-амино)-пентил}амино-9Н-пурин-9-ил] уксусной кислоты (60).
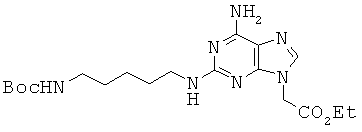
Соединение 60 получали из соединения 28 в виде красновато-желтого губчатого/твердого вещества по методике, аналогичной описанной в примере 32. 1H ЯМР (500 МГц; DMSOd6): δ 7,67 (с, 1Н), 6,78 (т, 1Н), 6,69 (с, 2Н), 6,28 (м, 1Н), 4,85 (с, 2Н), 4,15 (кв, 2Н), 3,18 (кв, 2Н), 2,89 (кв, 2Н), 1,47 (м, 2Н), 1,40-1,34 (м, 11Н), 1,25 (м, 2Н), 1,21 (т, 3Н).
Пример 61. Получение этилового эфира 2-[6-{ди-(трет-бутоксикарбонил)}амино-2-[5-{(трет-бутоксикарбонил)амино}пентил]амино-9Н-пурин-9-ил]уксусной кислоты (61).
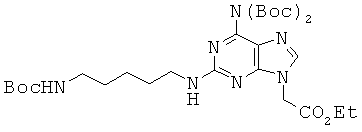
К 6,98 г соединения 60, растворенного в 100 мл THF, прибавляли 7,95 г Вос2О и 186 мг 4-(N,N-диметиламино)пурина, и раствор перемешивали в течение 10 минут. Затем раствор смешивали с 4,62 мл TEA, перемешивали в течение 30 минут, медленно нагревали до 50°С и затем перемешивали при температуре еще 24 часа. Реакционный раствор концентрировали в вакууме и полученный в результате остаток растворяли в 170 мл ЕА и промывали последовательно 0,5 М водной HCl и водой. Органический слой сушили над безводным сульфатом натрия, концентрировали и подвергали хроматографическому разделению (1:1 гексан/МС→МС) с получением соединения 61 в виде желтого губчатого/твердого вещества. 1Н ЯМР (500 МГц; DMSOd6): δ 8,05 (с, 1Н), 7,23 (т, 1Н), 6,77 (т, 1Н), 5,00 (с, 2Н), 4,19 (кв, 2Н), 3,25 (кв, 2Н), 2,91 (кв, 2Н), 1,53 (м, 2Н), 1,40-1,39 (м, 29Н), 1,28 (м, 2Н), 1,22 (т, 3Н).
Пример 62. Получение этилового эфира 2-[2-[2-{2,3-бис-(бензилоксикарбонил)-гуанидино}этил]амино-6-оксо-6,9-дигидро-1Н-пурин-2-ил]уксусной кислоты (62).
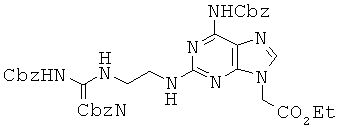
Соединение 50 превращали в соединение 62 в виде белого твердого вещества по методике, аналогичной описанной в примере 57. 1H ЯМР (500 МГц; DMSOd6): δ 11,59 (с, 1Н), 10,68 (с, 1Н), 8,50 (т, 1Н), 7,68 (с, 1Н), 7,42-7,29 (м, 10Н), 6,58 (м, 1Н), 5,13 (с, 2Н), 5,02 (с, 2Н), 4,86 (с, 2Н), 4,12 (кв, 2Н), 3,50 (м, 2Н), 3,46 (м, 2Н), 1,18 (т, 3Н).
Пример 63. Получение 2-[6-(бензилоксикарбониламино)-2-[2-{2,3-бис-(бензил-оксикарбонил)гуанидино)этил]амино-9Н-пурин-9-ил]уксусной кислоты (63).
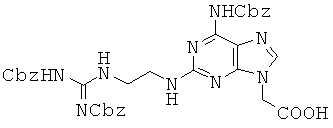
К 2,57 г соединения 57, растворенного в 7,1 мл THF и 7,1 мл воды, прибавляли 340 мг LiOH при 0°С и раствор перемешивали при комнатной температуре в течение 40 минут. Реакционный раствор подкисляли до рН 5~6 1 н водной HCl при 0°С и полученное в результате твердое вещество собирали фильтрацией с получением 2,33 г соединения 63 в виде белого твердого вещества. 1H ЯМР (500 МГц; DMSOd6): δ 11,59 (с, 1Н), 10,21 (с, 1Н), 8,57 (т, 1Н), 7,93 (с, 1Н), 7,45-7,28 (м, 15Н), 7,12 (т, 1Н), 5,17 (с, 2Н), 5,13 (с, 2Н), 5,02 (с, 2Н), 4,83 (с, 2Н), 3,53 (кв, 2Н), 3,42 (кв, 2Н).
Пример 64. Получение трет-бутилового эфира N-[2-{(9Н-флуорен-9-ил)метокси-карбонил-амино}этил)]-N-[2-{6-(бензилоксикарбониламино)-2-[2-{2,3-бис-(бензилокси-карбонил)-гуанидино}этил]амино-9Н-пурин-9-ил}ацетил]глициновой кислоты (64).
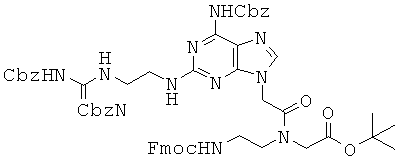
К 1,6 г соединения 63, растворенного в 30 мл DMF, при 0°С прибавляли 660 мг EDCI и 910 мг Fmoc-Aeg-OtBu. Реакционный раствор перемешивали в течение 2 часов при комнатной температуре и затем концентрировали при пониженном давлении. Полученный в результате остаток растворяли в 50 мл МС и промывали 0,5 М водной HCl и органический слой сушили над безводным сульфатом натрия. Затем органический слой концентрировали и подвергали хроматографическому разделению (65:1 МС/МеОН) с получением 500 мг соединения 64 в виде белого твердого вещества. 1H ЯМР (500 МГц; DMSOd6): 
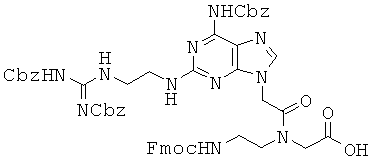
Пример 65. Получение N-[2-{(9Н-флуорен-9-ил)метоксикарбониламино}-этил)]-N-[2-{6-(бензилоксикарбониламино)-2-[2-{2,3-бис(бензилоксикарбонил)-гуанидино}этил]амино-9Н-пурин-9-ил}ацетил]глицина (65).
К 460 мг соединения 64, растворенного в 3,6 мл МС, медленно прибавляли 3,6 мл TFA при 0°С. Реакционный раствор перемешивали при комнатной температуре в течение 3,5 часов и затем прибавляли 50 мл диэтилового эфира. Полученный осадок собирали фильтрацией с получением 430 мг соединения 65 в виде белого твердого вещества. 1H ЯМР (400 МГц; DMSOd6): δ 11,57 (с, 1Н), 10,77 (уш.с, 1Н), 8,66 (с, 1Н), 8,54 (с, 1Н), 7,87 (м, 2Н), 7,63 (м, 2Н), 7,50-7,28 (м, 21Н), 5,26-4,96 (м, 8Н), 4,34-4,18 (м, 4Н), 4,03 (с, 1Н), 3,52-3,36 (м, 7Н), 3,13 (м, 1Н). MS/ESI (m+1)=1019,4 (экспериментальный), М.в.=1018,0 (C53H51N11O11).
Пример 66. Получение N-[2-{(9Н-флуорен-9-ил)метоксикарбониламино}-этил)]-N-[2-{6-(бензилоксикарбониламино)-2-[4-{2,3-бис(бензилоксикарбонил)-гуанидино}-бутил]амино-9Н-пурин-9-ил} ацетил]глицина (66).
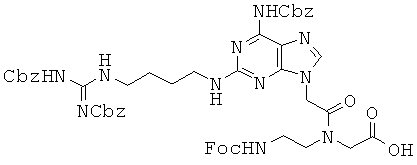
Соединение 59 превращали в соединение 66 в виде белого губчатого/твердого вещества по методикам, аналогичным описанным в примерах 63~65. 1H ЯМР (500 МГц; DMSOd6): δ 12,84 (уш.с, 1Н), 11,50 (с, 1Н), 10,14-10,13 (м, 1Н), 8,28 (м, 1Н), 7,88 (м, 2Н), 7,80-7,77 (м, 1Н), 7,68-7,66 (м, 2Н), 7,49 (т, 1Н), 7,45-7,29 (м, 9Н), 6,90 (м, 1Н), 5,17 (с, 2Н), 5,07 (с, 1,2Н), 4,89 (с, 0,8Н), 4,35-4,18 (м, 3Н), 4,00 (с, 1Н), 3,52 (м, 1Н), 3,35-3,25 (м, 6Н), 3,12 (м, 1Н), 1,49 (м, 4Н), 1,44 (д, 9Н), 1,37 (д, 9Н). MS/ESI (m+1)=978,4 (экспериментальный), М.в.=978,1 (C49H59N11O11).
Пример 67. Получение N-[2-{(9Н-флуорен-9-ил)метоксикарбониламино}-этил)]-N-[2-[6-[2-{2,3-бис(бензилоксикарбонил)гуанидино}этокси]метил-2-оксо-2Н-пирроло[2,3-d]пиримидин-3(7Н)-ил]ацетил]глипина (67).
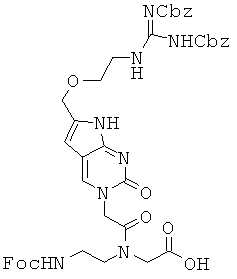
Соединение 18 превращали в соединение 67 в виде бледно-желтого твердого вещества по методикам, аналогичным описанным в примерах 63~65. 1H ЯМР (500 МГц; DMSOd6): δ 11,99 (уш., с, 1Н), 11,57 (уш.с, 1Н), 8,56 (м, 1Н), 8,48-8,45 (м, 1Н), 7,89-7,87 (м, 2Н), 7,70-7,65 (м, 2Н), 7,49-7,26 (м, 15Н), 6,36-6,33 (м, 1Н), 5,20 (с, 2Н), 5,03-5,01 (м, 3,3Н), 4,83 (с, 0,7Н), 4,49-4,17 (м, 5,7Н), 4,01 (м, 1,3Н), 3,57-3,11 (м, 8Н); MS/ESI (m+1)=899,7 (экспериментальный), М.в.=898,9 (C47H46N8O11).
Пример 68. Получение N-[2-{(9Н-флуорен-9-ил)метоксикарбониламино}-этил)]-N-{2-[2-{2,3-бис-(бензилоксикарбонил)гуанидино}этил]амино-6-оксо-6,9-дигидро-1Н-пурин-2-ил]ацетил}глицина (68).
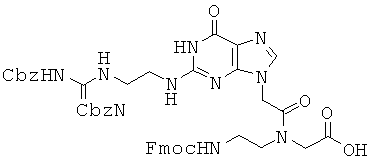
Соединение 62 превращали в соединение 68 в виде белого губчатого/твердого вещества по методикам, аналогичным описанным в примерах 63~65. 1Н ЯМР (500 МГц; DMSOd6): δ 11,58 (с, 1Н), 10,88 (с, 1Н), 8,51 (м, 1Н), 7,93 (м, 1Н), 7,87 (м, 2Н), 7,64 (м, 2Н), 7,47 (т, 1Н), 7,41-7,26 (м, 14Н), 6,66 (уш.с, 1Н), 5,16-4,89 (м, 8Н), 4,34-4,18 (м, 3,8Н), 4,00 (м, 1,2Н), 3,50-3,35 (м, 7Н), 3,13 (м, 1Н); MS/ESI (m+1)=885,3 (экспериментальный), М.в.=884,9 (C45H44N10O10).
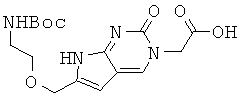
Пример 69. Получение 2-[6-{2-(трет-бутоксикарбониламино)этокси}метил-2-оксо-2Н-пирроло-[2,3-d]пиримидин-3(7Н)-ил]уксусной кислоты (69).
Соединение 16 гидролизовали до соединения 69 в виде бледно-коричневого твердого вещества по методике, аналогичной описанной в примере 11. 1H ЯМР (500 МГц; DMSOd6): δ 13,03 (уш.с, 1Н), 11,31 (с, 1Н), 8,37 (с, 1Н), 6,85 (т, 1Н), 6,19 (с, 1Н), 4,63 (с, 2Н), 4,40 (с, 2Н), 3,42 (т, 2Н), 3,11 (кв, 2Н), 1,37 (с, 9Н).
Пример 70. Получение метилового эфира N-[2-{(9Н-флуорен-9-ил)метокси-карбонил-амино}этил)]-N-{2-[6-{2-(трет-бутоксикарбониламино)-этокси}метил-2-оксо-2Н-пирроло-[2,3-d]пиримидин-3(7Н)-ил]ацетил}глициновой кислоты (70).
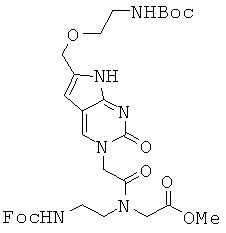
3,6 г соединения 69, 3,6 г Fmoc-Aeg-OMe, 2,5 г EDCI, 1,73 г HOBt и 2,24 мл DIEA растворяли в 70 мл DMF и перемешивали при комнатной температуре в течение 1,5 часа. Реакционный растворитель удаляли при пониженном давлении и полученный в результате остаток растворяли в 100 мл МС и промывали последовательно 1 М водной HCl, дистиллированной водой и рассолом. Органический слой сушили над безводным сульфатом натрия, концентрировали в вакууме и очищали с помощью колоночной хроматографии (100:2 МС/МеОН) с получением 2,5 г соединения 70 в виде желтого губчатого/твердого вещества. 1H ЯМР (500 МГц; DMSOd6): δ 11,30 (с, 1Н), 8,24 (с, 0,65Н), 8,21 (с, 0,35Н), 7,89-7,87 (м, 2Н), 7,71-7,67 (м, 2Н), 7,48-7,25 (м, 5Н), 6,87 (т, 1Н), 6,17 (с, 0,7Н), 6,15 (с, 0,3Н), 4,93 (с, 1,3Н), 4,74 (с, 0,7Н), 4,40-4,39 (м, 2,7Н), 4,35-4,21 (м, 3Н), 4,08 (с, 1,3Н), 3,73 (с, 0,8Н), 3,62 (с, 2,2Н), 3,51 (т, 1,4Н), 3,43-3,30 (м, 3,6Н), 3,13-3,10 (м, 3Н), 1,37 (с, 9Н).
Пример 71. Получение N-[2-{(9Н-флуорен-9-ил)метоксикарбониламино}-этил)]-N-{2-[6-{2-(трет-бутоксикарбониламино)этокси}метил-2-оксо-2Н-пирроло-[2,3-d]пиримидин-3(7Н)-ил]ацетил}глицина (71).
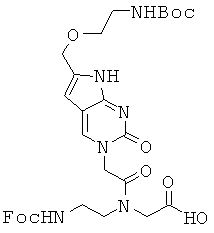
К 5,0 г соединения 70, растворенного в 75 мл 1:1:1 ацетонитрила/ацетона/воды, медленно при 0°С прибавляли 28,5 мл 2,5 н водной LiOH. Реакционный раствор перемешивали в течение 10 минут и нейтрализовали 20%-ной водной лимонной кислотой. После доведения рН раствора до 8 насыщенным водным раствором бикарбоната натрия, к раствору прибавляли 516 мг Fmoc-OSu и раствор перемешивали в течение 2 часов при комнатной температуре. Затем раствор подкисляли до рН 3 с помощью 20%-ной водной лимонной кислоты и перемешивали в течение 90 минут при 0°С. Полученный в результате осадок собирали фильтрацией с получением 4,0 г соединения 71 в виде желтовато-зеленого твердого вещества. 1H ЯМР (500 МГц; DMSOd6): δ 12,02 (уш.с, 1Н), 8,51-8,49 (м, 1Н), 7,89-7,88 (д, 2Н), 7,70-7,50 (м, 2Н), 7,49 (т, 1Н), 7,42-7,28 (м, 4Н), 6,87 (т, 1Н), 6,36 (с, 0,7Н), 6,33 (с, 0,3Н), 5,02 (с, 1,2Н), 4,84 (0,8Н), 4,43-4,42 (м, 2,4Н), 4,34-4,19 (м, 3,2Н), 4,01 (с, 1,4Н), 3,48 (т, 1,2Н), 3,44-3,41 (м, 2,1Н), 3,37-3,29 (м, 2Н), 3,12-3,10 (м, 2,7Н), 1,37 (с, 9Н); MS/ESI (m+1)=689,3 (экспериментальный), М.в.=688,7 (C35H40N6O9).
Пример 72. Получение N-[2-{(9Н-флуорен-9-ил)метоксикарбониламино}-этил)]-N-{2-[5-{(трет-бутоксикарбонил)амино}пентил]амино-6-оксо-6,9-дигидро-1Н-пурин-2-ил]ацетил}глицина (72).
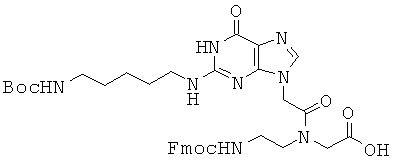
Соединение 51 превращали в соединение 72 в виде белого губчатого/твердого вещества по методикам, аналогичным описанным в примерах 69~71. 1H ЯМР (500 МГц; DMSOd6): δ 13,01 (уш.с, 1Н), 10,52-10,46 (м, 1Н), 7,88 (д, 2Н), 7,65 (д, 2Н), 7,54 (с, 0,5Н), 7,50 (с, 0,5Н), 7,48 (м, 1Н), 7,40 (т, 2Н), 7,31 (м, 2Н), 6,81 (т, 0,5Н), 6,72 (т, 0,5Н), 6,52-6,48 (м, 1Н), 4,98 (с, 1Н), 4,77 (с, 1Н), 4,33 (д, 1Н), 4,23-4,21 (м, 2Н), 4,05 (м, 1Н), 3,96 (с, 1Н), 3,50 (м, 1Н), 3,35 (м, 2Н), 3,21 (м, 2Н), 3,14 (кв, 1Н), 2,88 (м, 2Н), 1,46 (кв, 2Н), 1,39-1,35 (м, 11Н), 1,23 (м, 2Н); MS/ESI (m+1)=717,4 (экспериментальный), М.в.=716,8 (C36H44N8O8)
Пример 73. Получение N-[2-{(9H-флуорен-9-ил)метоксикарбониламино}-этил)]-N-[2-[6-{бис(трет-бутоксикарбонил)амино}-2-{5-(трет-бутоксикарбониламино)-пентил}амино-9Н-пурин-9-ил]ацетил]глицина (73).
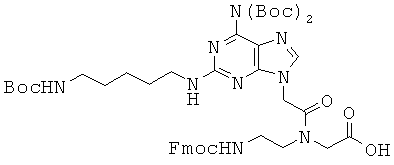
Соединение 61 превращали в соединение 73 в виде белого губчатого/твердого вещества по методикам, аналогичным описанным в примерах 69~71. 1H ЯМР (500 МГц; DMSOd6): δ 12,71 (уш.с, 1Н), 7,90-7,87 (м, 3Н), 7,67 (м, 2Н), 7,44-7,39 (м, 3Н), 7,31 (м, 2Н), 7,07 (м, 1Н), 6,69 (м, 1Н), 5,11 (с, 1,2Н), 4,93 (с, 0,8Н), 4,37-4,21 (м, 3,8Н), 4,01 (с, 1,2Н), 3,52 (м, 1Н), 3,36 (м, 2Н), 3,23 (м, 2Н), 3,13 (м, 1Н), 2,88 (м, 2Н), 1,49 (м, 2Н), 1,38-1,35 (м, 27Н), 1,27-1,25 (м, 4Н); MS/ESI (m+1)=916,5 (экспериментальный), М.в.=916,0 (C46H61N9O11).
Получение олигомеров ПНК: Мономеры ПНК - п, которые синтезировались по схеме 4, отправлялись в компанию Panagene, Inc (www.panagene.com, Daejon, South Korea) для приготовления олигомеров ПНК формулы I по методу, описанному в литературе или с помощью их незначигельного(ных) изменения(й). (Org. Lett. vol 9, 3291-3293, 2006). Олигомеры ПНК получали от Panagene, охарактеризованные методом MALDI-TOF и проанализированные высокоэффективной жидкостной хроматографией - ВЭЖХ с C18-обращенной фазой. Олигомеры ПНК, полученные от Panagene, применялись без дополнительной очистки.
Мономеры ПНК - с - схемы 5 применялись для синтеза олигомеров ПНК формулы I по способу, раскрытому в предшествующем уровне техники или путем его незначительного(ных) изменения(й). (USP 6,133,444). Эти олигомеры ПНК очищались ВЭЖХ с C18-обращенной фазой (водный ацетонитрил с 0,1% TFA) и охарактеризовывались методом MALDI-TOF. На Фиг.1 представлены хроматограммы ВЭЖХ до и после очистки Олиго 17 с помощью ВЭЖХ с обращенной фазой. На Фиг.2 представлен масс-спектр MALDI-TOF для очищенной серии Олиго 17. Фиг.1 и 2 представлены только для иллюстративных целей и не должны истолковываться как ограничивающие данное изобретение.
Олигомеры ПНК, синтезированные для данного изобретения, представлены в таблице 1 наряду с данными их молекулярного веса, полученными с помощью MALDI-TOF. Сокращения, использованные в таблице 1, А, Т, G и С относятся к немодифицированному нуклеиновому основанию аденина, тимина, гуанина и цитозина, соответственно. Модифицированные нуклеиновые основания C(mXn), C(mXng), A(mXn), A(m), A(mg) и G(m) таковы, как определено ниже в таблице 1 наряду с Lys, Fam, L(1) и L(2). Данные олигомеры ПНК представлены только для иллюстративных целей и не должны истолковываться как ограничивающие данное изобретение.
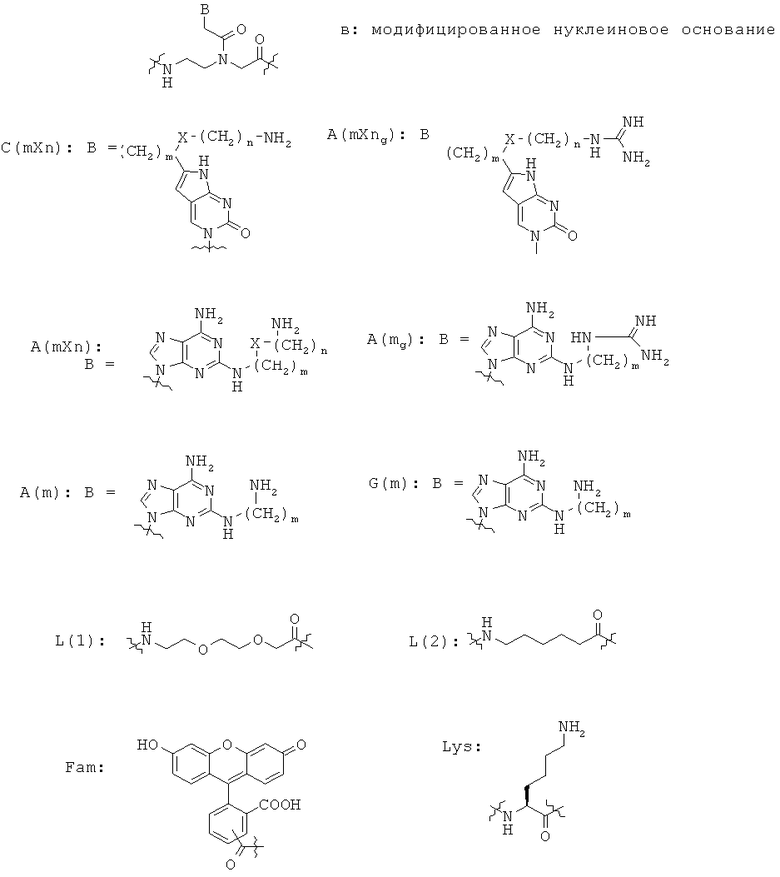
Связывающая аффинность к ДНК. Олигомеры ПНК, описанные в данном изобретении, оценивались в отношении их связывающей аффинности к ДНК путем измерения величины Т. пл. следующим образом.
4 мкМ олигомера ПНК и 4 мкМ ДНК смешивали в водном буферном растворе (рН 7,16, 10 мМ фосфат натрия, 100 мМ NaCl) и выдерживали при 90°С в течение нескольких минут и медленно охлаждали до комнатной температуры. Затем раствор переносили в 4 мл кварцевую кювету и кювету плотно закрывали. Кювету помещали в работающий в ультрафиолетовой/видимой области спектрофотометр Agilent 8453 и регистрировали изменения поглощения при 260 нм при повышении температуры кюветы со скоростью 0,5 или 1,0°С в минуту. Из кривой зависимости «поглощения от времени», температура, показывающая наибольшее увеличение скорости поглощения, считывалась как температура плавления - Т. пл. между ПНК и ДНК. ДНК(ы) для измерения Т.пл. закупались или у фирмы Bioneer, Inc. (www.bioneer.com, Daejon, South Korea) или у Ahram Biosystems (www.ahrambio.com, Seoul, South Korea), и применялись без дополнительной очистки.
На Фиг.3 представлены кривые изменения поглощения с температурой для Олиго 17 по сравнению с комплементарной или с нарушенной комплементарностью ДНК. Для последовательностей ДНК(т) с нарушенной комплементарностью против Олиго 17 см. таблицу 2. На Фиг.3 имеется температура перехода в каждой кривой, которая считывается как величина Т. пл. для кривой.
Величины Т. пл. для олигомеров ПНК, описанных в данном изобретении, представлены в таблице 2. Данные величины Т.пл. представлены только для иллюстративных целей и не должны истолковываться как ограничивающие данное изобретение.
Замена цитозина производным пирролоцитозина в неприродном нуклеиновом основании, описанном в данном изобретении, значительно повышало аффинность олигомера ПНК к комплементарной ДНК. Например, Олиго 10 с тремя «модифицированными» цитозиновыми «С (1O2)» мономерами показал Т. пл., превышающую 85°С, в то время как соответствующий «немодифицированный» Олиго 11 показали Т. пл., равную 58°С. Другие мономеры с модифицированным цитозином, таким как «С (1O3)» или «С (2O2)» также значительно увеличивали аффинность олигомера ПНК к комплементарной ДНК, как представлено на примере Олиго 3 и Олиго 8.
«Модифицированные» адениновые нуклеиновые основания, описанные в данном изобретении, также значительно увеличивали аффинность олигомера ПНК к комплементарной ДНК. Например, Олиго 15 с четырьмя «модифицированными» адениновыми А(7) мономерами показал Т. пл., равную 71°С, которая существенно выше, чем Т. пл., равная 55°С, наблюдаемая для «немодифицированного» Олиго 27. Другие «модифицированные» адениновые мономеры, как например А(4) и А(5) также заметно увеличивали аффинность к комплементарной ДНК.
Найдено, что «модифицированные» мономеры ПНК, описанные в данном изобретении, весьма чувствительны к ошибочному спариванию оснований. Например, уменьшения Т. пл. на 11~14°С наблюдались с ошибочными спариваниями пар оснований для А(5) мономера в Одиго 17. Ошибочные спаривания пар оснований для С(1O2) мономера в Олиго 20 приводило к уменьшениям Т. пл. на 19~22°С.
Клеточная пенетрация. Для того, чтобы оценить способность к клеточной пенетрации олигомеров ПНК, описанной в данном изобретении, раковые клетки человеческого происхождения обрабатывались олигомерами ПНК, ковалентно связанной с флуоресцеином. Примененный метод представлен в краткой форме, как изложено ниже.
На каждое покровное стекло (стерилизованное в автоклаве), помещенное в каждую лунку 24-луночного планшета, засевали 20000~100000 клеток в зависимости от скорости роста примененной линии клеток, и клетки культивировали при 37°С и 5% СО2 в течение 16-24 часов. Затем среду заменяли 500 мкл свежеприготовленной среды Opti-MEM (с или без 1% FBS), к которой прибавляли аликвоту водного исходного раствора олигомера ПНК ковалентно меченого (связанного с) флуоресцеином. После того, как клетки культивировались в течение предварительно обозначенного интервала, их промывали с помощью PBS (phosphate-buffered saline-забуференный фосфатом физиологический раствор) и фиксировали путем инкубирования в 3,7% или 4% параформальдегиде. Клетки тщательно промывали несколько раз PBS или PBS, содержащим 0,1% твина-20. Затем покровное стекло устанавливали на предметное стекло с помощью капли раствора для закрепления и герметизировали лаком для ногтей для конфокальной флуоресцентной микроскопии. Флуоресцентные изображения получали или на конфокальном микроскопе Zeiss LSM 510 (Германия) при 63-кратном увеличении или на конфокальном микроскопе Nikon C1Si при 40-кратном увеличении.
Изображения клеточной пенетрации на фиг.4~8 представлены только для иллюстрации и не должны истолковываться как ограничивающие данное изобретение.
На фиг.4(а) и 4(б) представлены изображения конфокальной микроскопии (при 63-кратном увеличении) для 1, 2, 3 и 24 часов после того, как клетки HeLa обрабатывались Олиго 1 и Олиго 2 при концентрации 5 мкМ, соответственно (без FBS). В то время как интенсивность флуоресценции не вызывает сомнения и становится интенсивной при 24 часах на фиг.4(а), интенсивность флуоресценции на фиг.4(б) является слабой, указывая, что Олиго 1 пенетрирует в клетки HeLa значительно быстрее, чем «немодифицированный» Олиго 2.
На фиг.5(а) и 5(б) представлены изображения конфокальной микроскопии (при 63-кратном увеличении) через 0,5 и 1 час после того, как MCF-7 клетки были обработаны Олиго 6 и Олиго 7 при концентрации 2,5 мкМ, соответственно (без FBS). В то время как интенсивность флуоресценции не вызывает сомнения и становится интенсивной при 1 часе на фиг.5(а), интенсивность флуоресценции на фиг.5(б) является слабой, указывая, что Олиго 6 пенетрирует в MCF-7 клетки значительно быстрее, чем «немодифицированный» Олиго 7.
На фиг.6(а) и 6(б) представлены фотографии конфокальной микроскопии (при 40-кратном увеличении) через 6 или 24 часа после того, как HeLa клетки были обработаны Олиго 1 и Олиго 6 при концентрации 1 мкМ, соответственно (с 1% FBS). В то время как интенсивность флуоресценции является слабой даже при 24 часах на фиг.6(а), интенсивность флуоресценции на фиг.6(б) не вызывает сомнения и становится интенсивной при 24 часах, означая, что Олиго 6 пенетрирует в HeLa клетки значительно быстрее, чем Олиго 1.
На фиг.7(а) и 7(б) представлены фотографии конфокальной микроскопии (при 40-кратном увеличении) через 24 часа после того, как JAR клетки были обработаны Олиго 21 и Олиго 28 при концентрации 2 мкМ, соответственно (без FBS). В то время как интенсивность флуоресценции является сильной на фиг.7(а), на фиг.7(б) интенсивность флуоресценции незначительна, означая, что Олиго 21 пенетрирует в JAR клетки значительно быстрее, чем «немодифицированный» Олиго 28.
На фиг.7(в) и 7(г) представлены фотографии конфокальной микроскопии (при 40-кратном увеличении) через 24 часа после того, как А549 клетки были обработаны Олиго 21 и Олиго 28 при концентрации 2 мкМ, соответственно (без FBS). В то время как интенсивность флуоресценции является сильной на фиг.7(в), на фиг.7(г) интенсивность флуоресценции незначительна, означая, что Олиго 21 пенетрирует в А549 клетки значительно быстрее, чем «немодифицированный» Олиго 28.
На фиг.7(д) и 7(е) представлены фотографии конфокальной микроскопии (при 40-кратном увеличении) через 12 часов после того, как HeLa клетки были обработаны Олиго 21 и Олиго 28 при концентрации 2 мкМ, соответственно (без FBS). В то время как интенсивность флуоресценции на фиг.7(д) является выраженной, на фиг.7(е) интенсивность флуоресценции незначительна, означая, что Олиго 21 пенетрирует в HeLa клетки значительно быстрее, чем «немодифицированный» Олиго 28.
На фиг.7(ж) представлены фотографии конфокальной микроскопии (при 40-кратном увеличении) через 24 часа после того, как HeLa клетки были обработаны Олиго 21 при концентрации 2 мкМ (без FBS). Учитывая, что клеточная флуоресценция на фиг.7 (ж) значительно сильнее, чем на фиг.7(е), Олиго 21 по-видимому пенетрирует через 24 часа вместо 12 часов.
На фиг.8(а), 8(б) и 8(в) представлены изображения конфокальной микроскопии (при 40-кратном увеличении) через 24 часа после того, как HeLa А549 и JAR клетки были обработаны 2 мкМ Олиго 22. соответственно (без FBS). Все изображения связанны с флуоресценцией внутри клетки, указывая, что Олиго 22 обладает хорошей клеточной пенетрацией в тестируемые клетки.
Антисмысловые примеры. Олиго 9 и Олиго 12 обладают теми же последовательностями оснований, как Т1-12 и Т5-12, соответственно, о которых в литературе сообщалось, что они ингибируют рибосомный синтез mdm2. (Nucleic Acids Res. vol.32, 4893-4902, 2004). Олиго 9 и Олиго 12 оценивались в отношении их способности ингибировать рибосомный синтез mdm2 в JAR клетках следующим образом. Такой антисмысловый пример приводится только для иллюстрации и не должен истолковываться как ограничивающий данное изобретение.
JAR клетки (АТСС каталог # НТВ-144) выращивали в RPMI-1640 среде, дополненной 10% FBS и 1% пенициллина-стрептомицина при 37°С и 5% СО2. Клетки затем высевали в каждую лунку 12-луночного планшета, содержащего 1 мл указанной среды, и обрабатывали аликвотой водного исходного раствора Олиго 9 или Олиго 12 при обозначенной выше концентрации. Затем клетки инкубировали при 37°С и 5% СО2 в течение 15 часов.
Клетки в каждой лунке промывали холодным PBS и обрабатывали 80 мкл буфера RIPA, содержащего 1% коктейль ингибиторов протеаз, и планшет инкубировали при 4°С и медленно встряхивали в течение 15 минут. Содержимое каждой лунки отправляли в микропробирку. Микропробирку выдерживали на льду в течение 10 минут и центрифугировали при 10000 g. Полученный в результате супернатант собирали и подвергали количественному определению белка по анализу Брэдфорда (Bradford) и вестерн-блоттингу. Для электрофореза 20 мкг белка помещали на каждой дорожке геля в аппарате MiniGel, отделяли и переносили на мембраны PVDF (0,45 мкн, Millipore). Первое mdm2 антитело, примененное для вестерн-блоттинга, представляло собой SC-965 (Santa Cruz Biotechnology).
На фиг.9 представлены результаты вестерн-блоттинга для клеток JAR, обработанных Олиго 9 при 5 мкМ или 10 мкМ, Олиго 10 при 5 мкМ или 10 мкМ, совместной обработке олигомерами при концентрации 5 мкМ или 10 мкМ каждый, и контрольный опыт (без обработки олигомером). На фиг.9 обработка Олиго 9 или Олиго 10. или совместная обработка с Олиго 9 и Олиго 10 существенно ингибировала рибосомный синтез mdm2 в клетках JAR как при 5 мкМ, так и при 10 мкМ.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ ТИРОЗИНАЗЫ | 2018 |
|
RU2778786C2 |
| НОВЫЕ МОНОМЕРЫ И ОЛИГОМЕРЫ ПЕПТИДНЫХ НУКЛЕИНОВЫХ КИСЛОТ | 2015 |
|
RU2693827C2 |
| СПОСОБ СИНТЕЗА ФТАЛАСЦИДИНА И ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2267492C2 |
| ПЯТИЧЛЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ ОКСОКАРБОНОВОЙ КИСЛОТЫ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2832934C1 |
| ПРОИЗВОДНЫЕ ИЗОКСАЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ АУТОИММУННЫХ ИЛИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1998 |
|
RU2196770C2 |
| СЕЛЕКТИВНЫЕ ЛИГАНДЫ G-КВАДРУПЛЕКСНЫХ СТРУКТУР НУКЛЕИНОВЫХ КИСЛОТ | 2015 |
|
RU2588131C1 |
| СПОСОБЫ СИНТЕЗА АПЛИДИНА И НОВЫХ ПРОТИВООПУХОЛЕВЫХ ПРОИЗВОДНЫХ, СПОСОБЫ ИХ ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2001 |
|
RU2299887C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ НУКЛЕОЗИДЫ И ОЛИГОМЕРЫ, ПОЛУЧЕННЫЕ ИЗ НИХ | 2017 |
|
RU2824141C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ АЦЕТИЛ-СОА-КАРБОКСИЛАЗЫ-2 | 2019 |
|
RU2807629C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ-1 | 2019 |
|
RU2802418C2 |
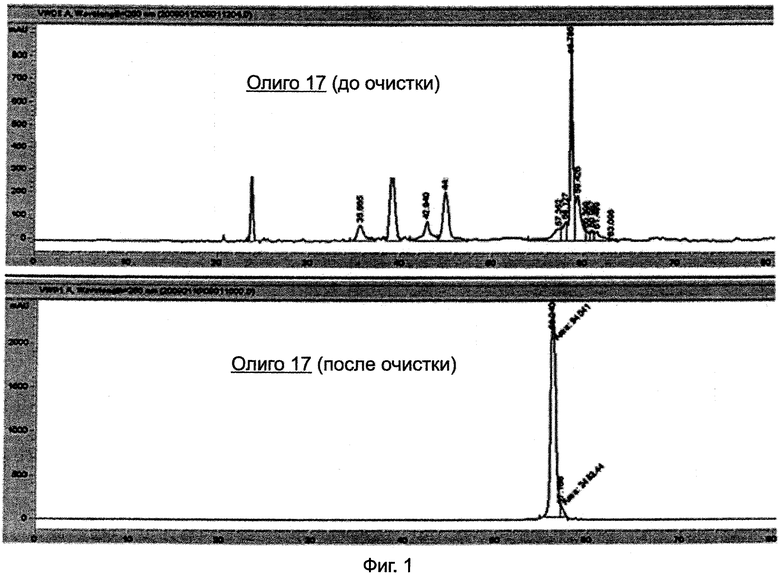
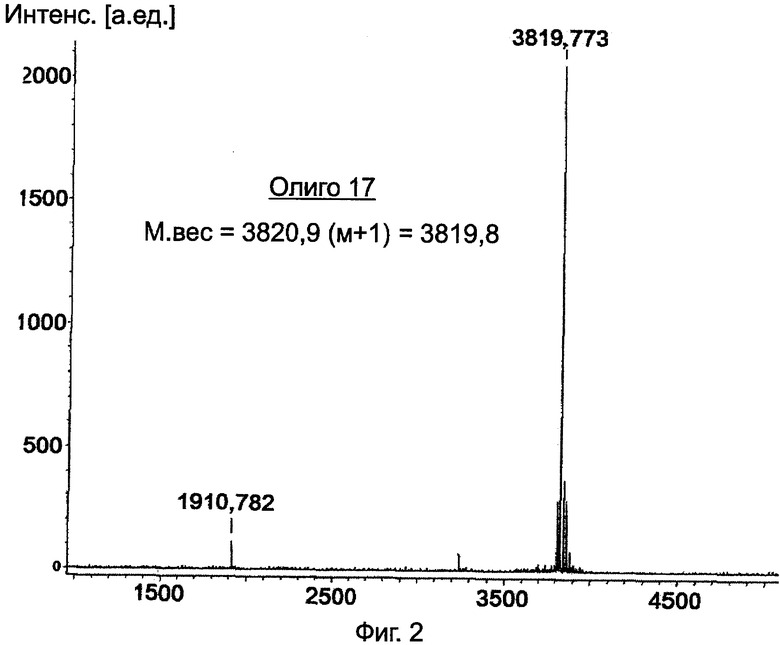
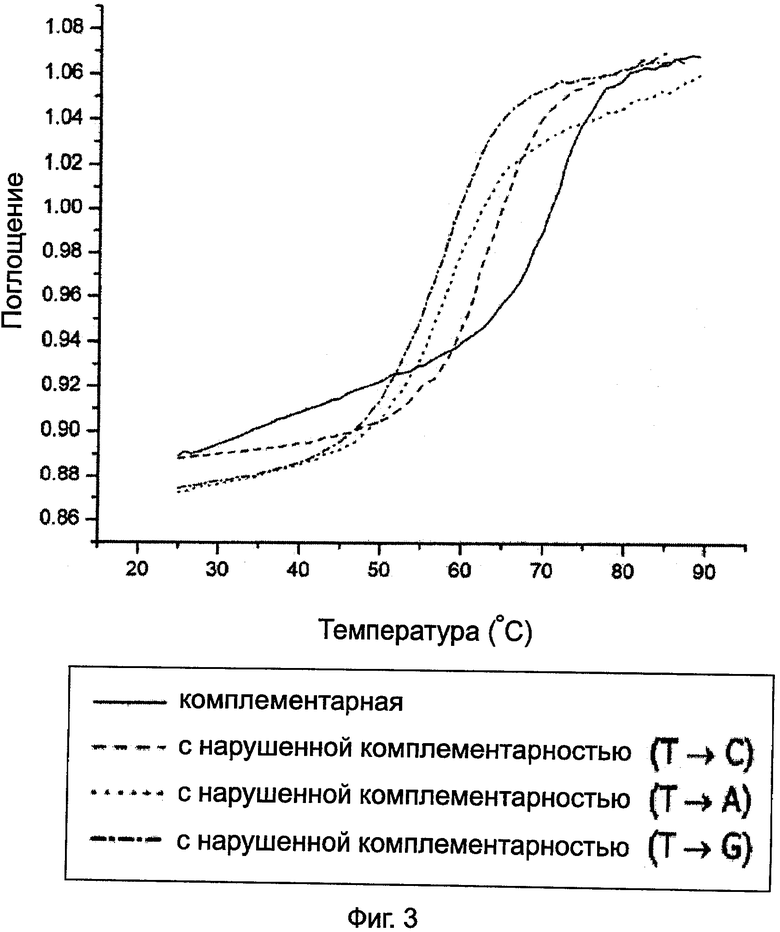

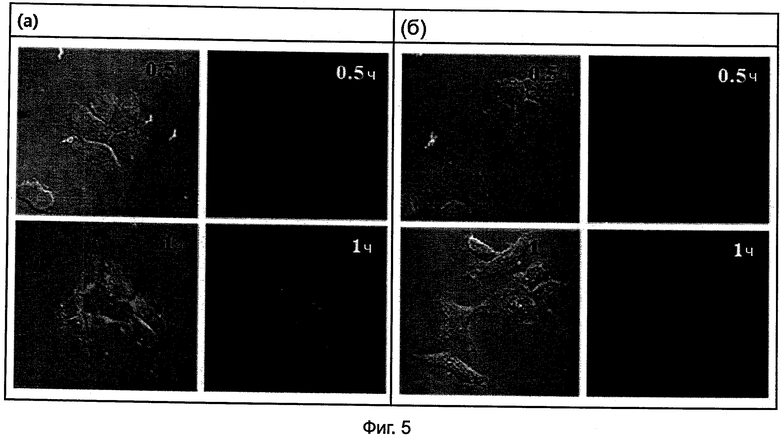
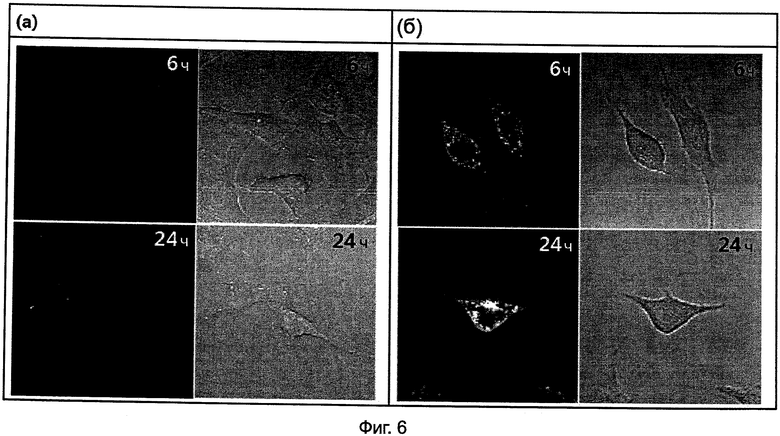
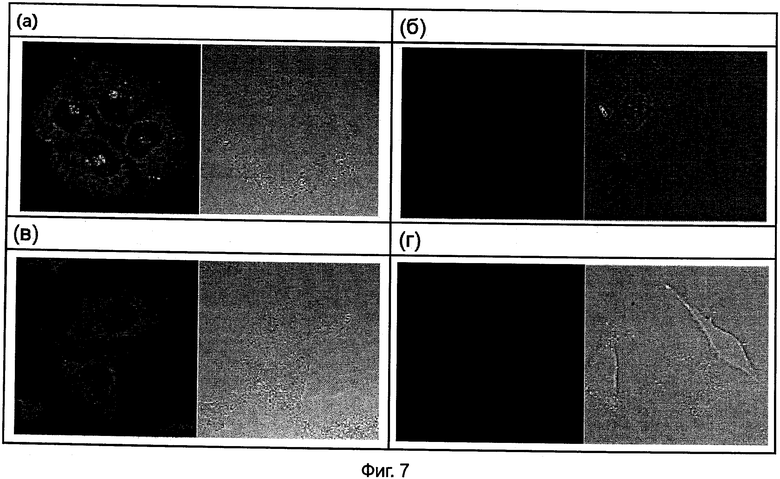
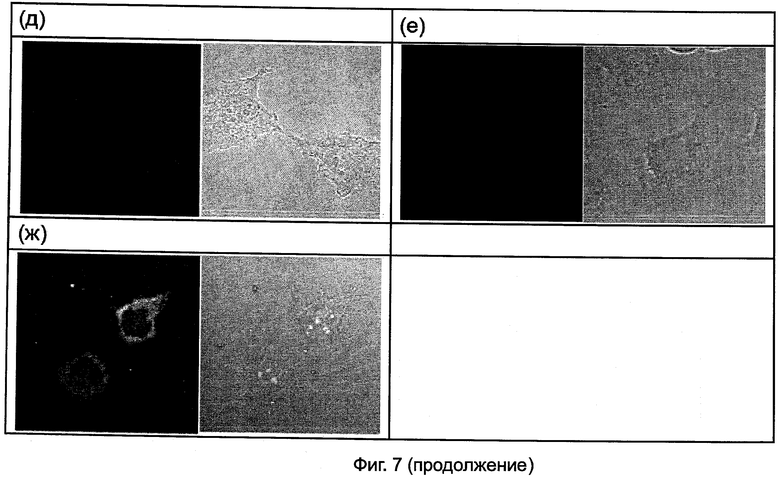
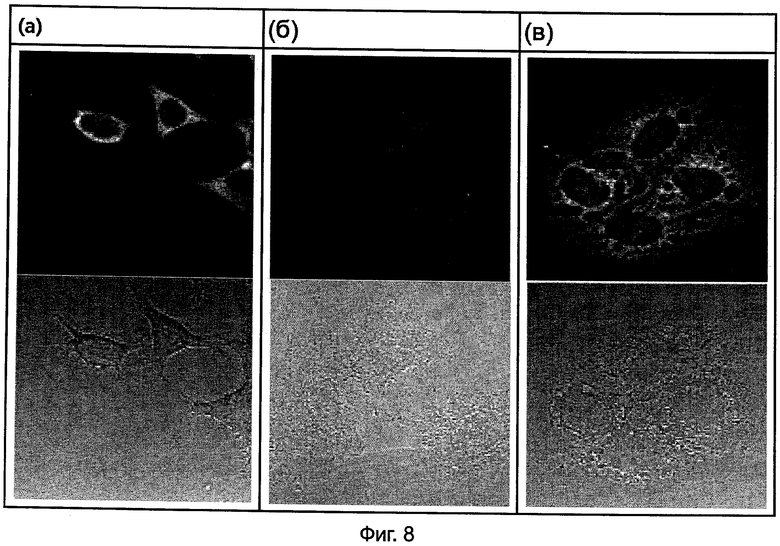
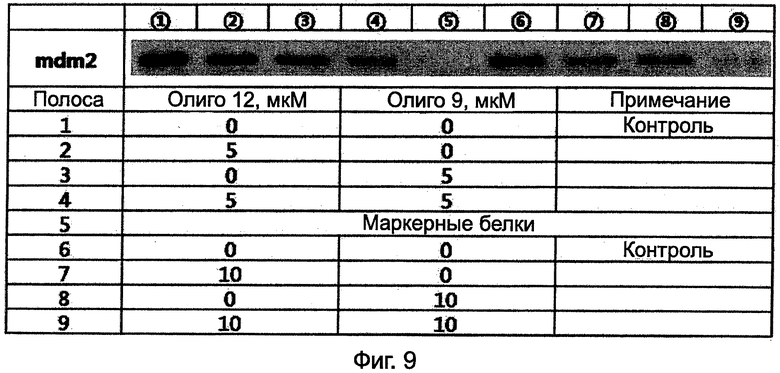
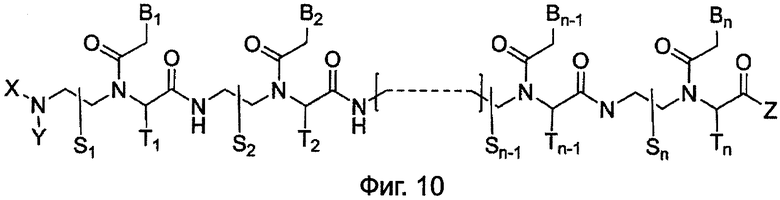
Изобретение относится к новому новый классу производных пептидо-нуклеиновых кислот, которые показывают хорошую клеточную пенетрацию и сильную связывающую аффинность к нуклеиновой кислоте. 10 н. и 6 з.п. ф-лы, 10 ил., 2 табл., 73 пр.
1. Производное пептидо-нуклеиновой кислоты формулы I или ее фармацевтически приемлемой соли:
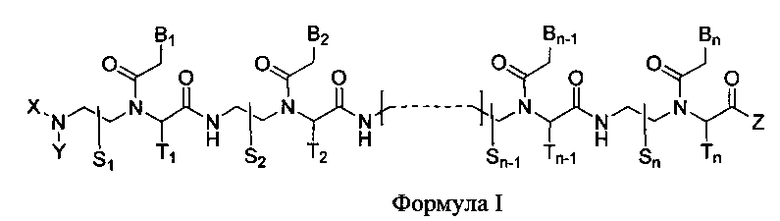
где:
n - целое число, равное или большее 5;
S1, S2, …, Sn-1, Sn, T1, T2,…, Tn-1 и Tn независимо обозначают атом водорода, атом дейтерия, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
X и Y независимо обозначают атом водорода, атом дейтерия, замещенную или незамещенную алкилгруппу, замещенную или незамещенную ацилгруппу, замещенную или незамещенную сульфонилгруппу или замещенную или незамещенную арилгруппу;
Z обозначает гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу;
B1, В2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и
по меньшей мере одна из B1, В2, …, Bn-1 и Bn независимо выбрана из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV:
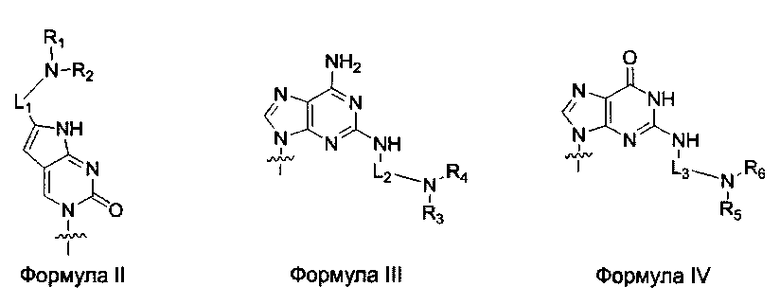
где:
R1, R2, R3, R4, R5 и R6 независимо выбраны из замещенной или незамещенной алкилгруппы и атома водорода; и
L1, L2 и L3 представляют собой ковалентный линкер, отвечающий формуле V, соединяющий основную аминогруппу в остаток, ответственный за свойства спаривания нуклеиновых оснований:
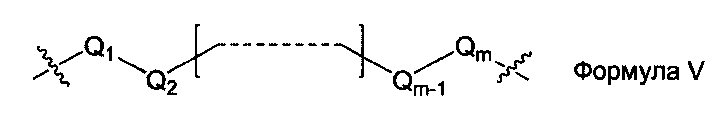
где:
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу (-СН2-) и Qm непосредственно связана с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы, атома кислорода (-O-), атома серы (-S-) и замещенной или незамещенной аминогруппы [-N(H)-группы или -N(заместитель)-группы]; и
m - целое число от 2 до 15.
2. Производное пептидо-нуклеиновой кислоты по п. 1 или ее фармацевтически приемлемой соли,
где:
n - целое число от 5 до 30;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой атом водорода;
X и Y независимо выбраны из атома водорода, замещенной или незамещенной алкилгруппы, замещенной или незамещенной ацилгруппы, замещенной или незамещенной сульфонилгруппы;
Z обозначает гидроксилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу;
B1, В2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и
по меньшей мере одна из B1, В2, …, Bn-1 и Bn независимо выбрана из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV.
3. Производное пептидо-нуклеиновой кислоты по п. 1 или ее фармацевтически приемлемой соли,
где:
n - целое число от 8 до 25;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой атом водорода;
X и Y независимо выбраны из атома водорода, замещенной или незамещенной алкилгруппы и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, В2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере две из B1, В2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из замещенной или незамещенной алкилгруппы и атома водорода;
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу и Qm непосредственно связана с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы, атома кислорода и аминогруппы; и
m - целое число от 2 до 12.
4. Производное пептидо-нуклеиновой кислоты по п. 1 или ее фармацевтически приемлемой соли,
где:
n - целое число от 10 до 25;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой атом водорода;
X и Y независимо выбраны из атома водорода и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу; и
B1, В2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере три из B1, В2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из замещенной или незамещенной алкилгруппы и атома водорода;
Q1 и Qm представляют собой метиленгруппу и Qm непосредственно связана с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метиленгруппы, атома кислорода и аминогруппы; и
m - целое число от 2 до 10.
5. Производное пептидо-нуклеиновой кислоты по п. 1 или ее фармацевтически приемлемой соли,
где:
n - целое число от 10 до 20;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют атом водорода;
X и Y независимо выбраны из атома водорода и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, В2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере три из B1, В2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R3 и R5 представляют собой атом водорода и R2, R4 и R6 независимо обозначают атом водорода или замещенную или незамещенную амидинилгруппу;
Q1 и Qm представляют собой метиленгруппу и Qm непосредственно связана с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метиленгруппы, атома кислорода и аминогруппы; и
m - целое число от 2 до 10.
6. Производное пептидо-нуклеиновой кислоты по п. 1 или ее фармацевтически приемлемой соли,
где:
n - целое число от 10 до 20;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой атом водорода;
X и Y независимо выбраны из атома водорода и замещенной или незамещенной ацилгруппы;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, В2, …, Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина и урацила и ненатуральных нуклеиновых оснований;
по меньшей мере три из B1, В2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R3 и R5 представляют собой атом водорода и R2, R4 и R6 независимо обозначают атом водорода или амидинилгруппу;
Q1 и Qm представляют собой метиленгруппу и Qm непосредственно связана с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метиленгруппы и атома кислорода; и
m - целое число от 2 до 8.
7. Производное пептидо-нуклеиновой кислоты по п. 1 или ее фармацевтически приемлемой соли,
где:
n - целое число от 8 до 20;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой атом водорода;
X представляет собой атом водорода;
Y обозначает атом водорода или замещенную или незамещенную ацилгруппу;
Z обозначает гидроксилгруппу или замещенную или незамещенную аминогруппу;
B1, В2, …, Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина и неприродных нуклеиновых оснований;
по меньшей мере три из B1, В2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R3 и R5 представляют собой атом водорода и R2, R4 и R6 независимо обозначают атом водорода или амидинилгруппу;
L1 обозначает -(СН2)2-O-(СН2)2-группу, -СН2-O-(СН2)2-группу или -СН2-O-(СН2)3-группу с правой частью, непосредственно связанной с основной аминогруппой; и
L2 и L3 независимо выбраны из -(СН2)2-O-(СН2)2-группы, -(СН2)3-O-(СН2)2-группы, -(СН2)2-O-(СН2)3-группы, -(СН2)2-группы, -(СН2)3-группы, -(СН2)4-группы, -(СН2)5-группы, -(СН2)6-группы, -(СН2)7-группы и -(СН2)8-группы с правой частью, непосредственно связанной с основной аминогруппой.
8. Фармацевтическая композиция для обеспечения клеточной пенетрации, содержащая терапевтически эффективное количество производного пептидо-нуклеиновой кислоты по любому из пп. 1-7 или ее фармацевтически приемлемой соли для терапевтической цели.
9. Способ применения производного пептидо-нуклеиновой кислоты по любому из пп. 1-7 или ее фармацевтически приемлемой соли для диагностической цели.
10. Способ применения производного пептидо-нуклеиновой кислоты по любому из пп. 1-7 или ее фармацевтически приемлемой соли для модуляции экспрессии клеточного белка in vitro.
11. Соединение формулы VI:
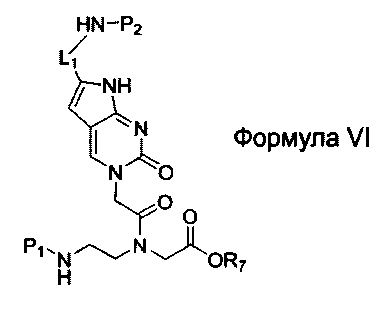
где:
R7 представляет собой атом водорода, N-сукцинилгруппу или замещенную или незамещенную алкилгруппу;
P1 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы и замещенной или незамещенной арилсульфонилгруппы;
Р2 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы, замещенной алкилоксикарбонилгруппы, замещенной или незамещенной алкилгруппы, амидинилгруппы, 1,3-бис(трет-бутокси-карбонил)амидинилгруппы, 1,3-бис-(бензилоксикарбонил)амидинилгруппы; и
L1 представляет собой линкер, отвечающий формуле V:
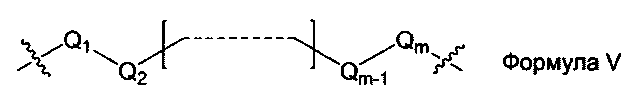
где:
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу и Qm непосредственно связана с аминогруппой;
Q2, Q3, … и Qm-1 независимо выбрана из замещенной или незамещенной метиленгруппы, атома кислорода, атома серы и замещенной или незамещенной аминогруппы; и
m - целое число от 2 до 15.
12. Соединение формулы VII:
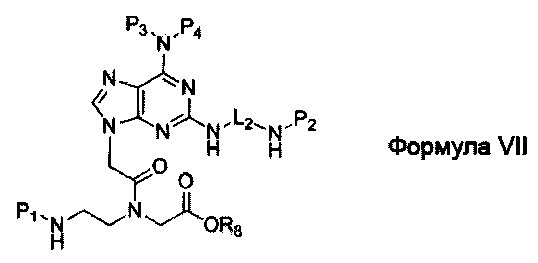
где:
R8 представляет собой атом водорода, N-сукцинилгруппу или замещенную или незамещенную алкилгруппу;
P1 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы и замещенной или незамещенной арилсульфонилгруппы;
Р2 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы, замещенной алкилоксикарбонилгруппы, замещенной или незамещенной алкилгруппы, амидинилгруппы, 1,3-бис(трет-бутокси-карбонил)амидинилгруппы, 1,3-бис-(бензилоксикарбонил)амидинилгруппы;
Р3 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы;
Р4 выбрана из атома водорода и трет-бутоксикарбонилгруппы; и
L2 представляет собой линкер, отвечающий формуле V:
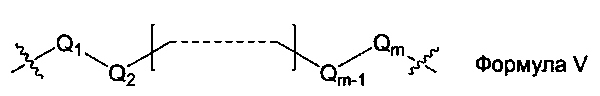
где:
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу и Qm непосредственно связана с аминогруппой;
Q2, Q3, … и Qm-1 независимо выбрана из замещенной или незамещенной метиленгруппы, атома кислорода, атома серы и замещенной или незамещенной аминогруппы; и
m - целое число от 2 до 15.
13. Соединение формулы VIII:
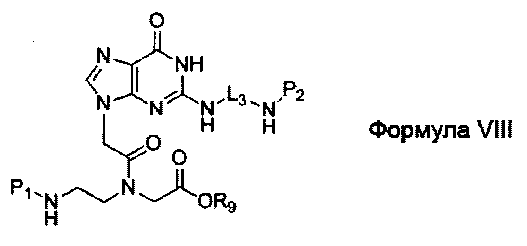
где:
R9 представляет собой атом водорода, N-сукцинилгруппу или замещенную или незамещенную алкилгруппу;
P1 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы и замещенной или незамещенной арилсульфонилгруппы;
Р2 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы, замещенной алкилоксикарбонилгруппы, замещенной или незамещенной алкилгруппы, амидинилгруппы, 1,3-бис(трет-бутокси-карбонил)амидинилгруппы, 1,3-бис-(бензилоксикарбонил)амидинилгруппы; и
L3 представляет собой линкер, отвечающий формуле V:
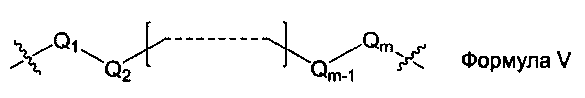
где:
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу и Qm непосредственно связана с аминогруппой;
Q2, Q3, … и Qm-1 независимо выбрана из замещенной или незамещенной метиленгруппы, атома кислорода, атома серы и замещенной или незамещенной аминогруппы; и
m - целое число от 2 до 15.
14. Соединение формулы IX:
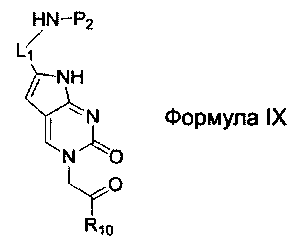
где:
R10 представляет собой гидроксилгруппу, замещенную или незамещенную алкилоксигруппу или замещенную или незамещенную аминогруппу;
Р2 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы, замещенной алкилоксикарбонилгруппы, замещенной или незамещенной алкилгруппы, амидинилгруппы, 1,3-бис(трет-бутокси-карбонил)амидинилгруппы, 1,3-бис-(бензилоксикарбонил)амидинилгруппы; и
L1 представляет собой линкер, отвечающий формуле V:
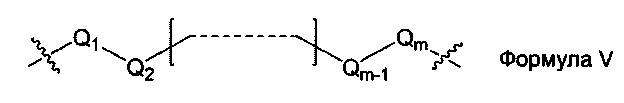
где:
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу и Qm непосредственно связана с аминогруппой;
Q2, Q3, … и Qm-1 независимо выбрана из замещенной или незамещенной метиленгруппы, атома кислорода, атома серы и замещенной или незамещенной аминогруппы; и
m - целое число от 2 до 15.
15. Соединение формулы X:
где:
R11 представляет собой гидроксилгруппу, замещенную или незамещенную алкилоксигруппу или замещенную или незамещенную аминогруппу;
Р2 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы, замещенной алкилоксикарбонилгруппы, замещенной или незамещенной алкилгруппы, амидинилгруппы, 1,3-бис(трет-бутокси-карбонил)амидинилгруппы, 1,3-бис-(бензилоксикарбонил)амидинилгруппы;
Р3 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы;
Р4 выбрана из атома водорода и трет-бутоксикарбонилгруппы; и
L2 представляет собой линкер, отвечающий формуле V:
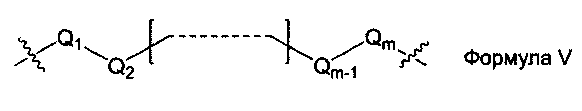
где:
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу и Qm непосредственно связана с аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы, атома кислорода, атома серы и замещенной или незамещенной аминогруппы; и
m - целое число от 2 до 15.
16. Соединение формулы XI:
где:
R12 представляет собой гидроксилгруппу, замещенную или незамещенную алкилоксигруппу или замещенную или незамещенную аминогруппу;
Р2 выбрана из атома водорода, трет-бутоксикарбонилгруппы, (9Н-флуорен-9-ил)метокси-карбонилгруппы, замещенной или незамещенной бензилоксикарбонилгруппы, замещенной алкилоксикарбонилгруппы, замещенной или незамещенной алкилгруппы, амидинилгруппы, 1,3-бис(трет-бутокси-карбонил)амидинилгруппы, 1,3-бис-(бензилоксикарбонил)амидинилгруппы; и
L3 представляет собой линкер, отвечающий формуле V:
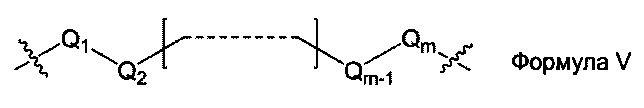
где:
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу и Qm непосредственно связана с аминогруппой;
Q2, Q3, … и Qm-1 независимо выбрана из замещенной или незамещенной метиленгруппы, атома кислорода, атома серы и замещенной или незамещенной аминогруппы; и
m - целое число от 2 до 15.
| EP 816379 A2, 07.01.1998 | |||
| US 6617422 B1, 09.09.2003 | |||
| US 20040265885 A1, 30.12.2004 | |||
| WO1992020702 A1, 26.11.1992 | |||
| WOLFGANG MAISON ET AL.: 'Multicomponent Synthesis of Novel Amino Acid-Nucleobase Chimeras: a Versatile Approach to PNA-Monomers' BIOORGANIC & MEDICINAL CHEMISTRY vol | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| YUN WU ET AL.: 'Synthesis of N-Boc and | |||
Авторы
Даты
2015-09-27—Публикация
2009-03-13—Подача