ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к производным пептидных нуклеиновых кислот, дополнительно целенаправленно воздействующим на пре-мРНК ацетил-КоА-карбоксилазы-2 человека, для исправления старения кожи при посредничестве ацетил-КоА-карбоксилазы-2.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Старению кожи уделяется значительное внимание, так как признаки старения наиболее заметны на коже. Старение кожи начинается в возрасте от примерно двадцати пяти лет до почти тридцати с уменьшением коллагена и эластина в коже, приводя к сухой и менее эластичной коже и даже морщинам. Ожирение является своего рода воспалительной реакцией, вызванной ухудшением кровообращения, произошедшим при чрезмерном отложении внутреннего жира. Внутренний жир на кровеносных сосудах подавляет кровообращение и секрецию различных гормонов для провоцирования старения всего организма, включая кожу. В этом смысле нарушения здоровья и заболевания, связанные с ожирением, должны контролироваться, чтобы получить здоровую и красивую кожу.
Для удовлетворения потребности организма биосинтез и деградация жирных кислот хорошо регулируются, исходя из физиологических состояний. Ацетил-КоА-карбоксилаза (АКК) является биотинзависимым ферментом, который катализирует карбоксилирование ацетил-КоА с получением малонил-КоА, которое является скорость определяющей стадией на первом этапе биосинтеза жирных кислот.
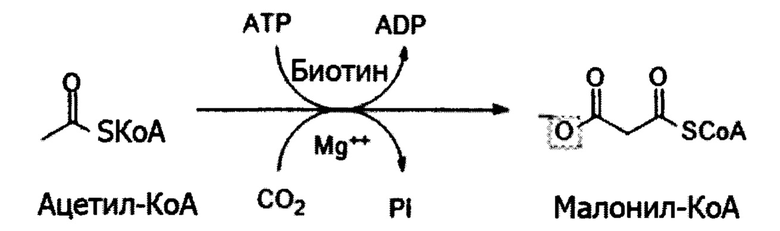
АКК обладает функцией регулирования метаболизма жирных кислот двумя путями. Наиболее важной функцией АКК является обеспечение субстрата малонил-КоА в качестве нового строительного блока в его активном состоянии для биосинтеза жирных кислот. Другая функция заключается в блокировании окисления жирных кислот в митохондриях путем ингибирования переноса ацильной группы жирных кислот.
У человека экспрессируются две основные изоформы АКК: ацетил-КоА-карбоксилаза-1 (АКК-1, АКАКА, ацетил-КоА-карбоксилаза-альфа) и ацетил-КоА-карбоксилаза-2 (АКК-2, АКАКБ, ацетил-КоА-карбоксилаза-бета). Две АКК(ы) имеют отличающиеся друг от друга функции, т.е. АКК-1 поддерживает регулирование синтеза жирных кислот, в то время как АКК-2 в основном регулирует окисление жирных кислот.
АКК(ы), регулирующие биосинтез и окисление жирных кислот, являются потенциальными мишенями при лечении многих заболеваний, как например новые антибиотики, использующие структурные различия бактерий и человеческих АКК(з), метаболический синдром диабета и ожирения, связанные с липогенезом ингибиторы роста раковых клеток и т.д. [Recent Patents Cardiovasc. Drug Discov. Vol 2, 162-80 (2007); PLoS One Vol 12, e0169566 (2017)].
Среди них исследование на АКК-2-/- мутантных мышах привлекло большое внимание, где АКК-2-дефицитные мыши, имевшие более низкий уровень жира с более высокой скоростью окисления жирных кислот, потеряли или сохранили вес тела, несмотря на большее потребление пищи, и снизили риск развития диабета [Science Vol 291, 2613-6 (2001)]. Эти результаты показали возможность ингибиторов АКК-2 оказывать терапевтический эффект на ожирение и диабет. Кроме того, при обработке кожи ингибиторами можно ожидать эффект обезжиривания и впоследствии предупреждение ожирения в коже и изменения к лучшему состояния кожи.
Учитывая значимость ожирения в процессе старения кожи, очень интересно и необходимо разработать ингибиторы АКК-2 или фармацевтические препараты, или косметику на основе механизма экспрессии АКК-2, которые могут улучшить и предотвратить состояние старения кожи.
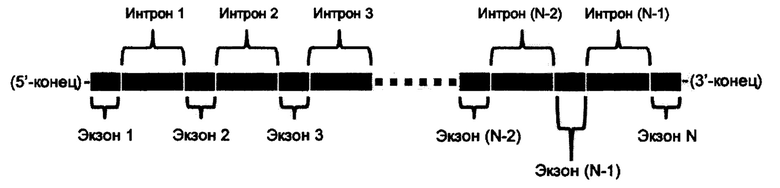
Пре-мРНК: Генетическая информация осуществляется на ДНК (2-дезоксирибонуклеиновая кислота). ДНК транскрибируется для продуцирования пре-мРНК (пре-информационная (матричная) рибонуклеиновая кислота) в ядре. Пре- мРНК млекопитающих обычно состоит из экзонов и интронов, а экзон и интрон взаимосвязаны друг с другом, как схематично приведено ниже. Экзоны и интроны пронумерованы, как проиллюстрировано на рисунке ниже.
[Структура пре-мРНК]
Сплайсинг пре-мРНК: Пре-мРНК подвергается процессингу в мРНК после удаления интронов серией сложных реакций в совокупности называемых "сплайсингом", который схематически обобщен ниже на диаграмме. [Ann. Rev. Biochem. 72(1), 291-336 (2003); Nature Rev. Mol. Cell Biol. 6(5), 386-398 (2005); Nature Rev. Mol. Cell Biol. 15(2), 108-121 (2014)].
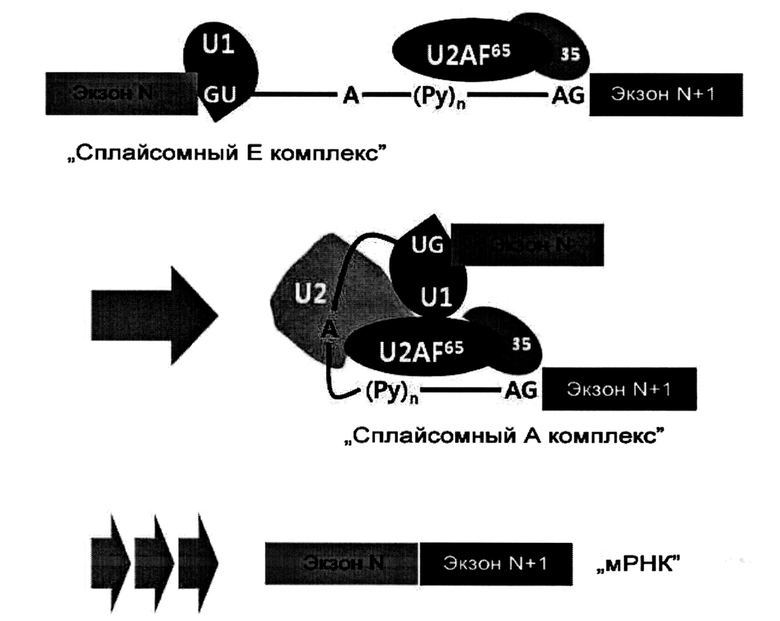
Сплайсинг инициируется образованием "сплайсомного Е комплекса" (т.е. ранний сплайсомный комплекс) между пре-мРНК и адапторными факторами сплайсинга. В "сплайсомном Е комплексе", U1 связывается с областью соединения экзона N и интрона N, и U2AF35 связывает область соединения интрона N и экзона (N+1). Таким образом, области соединения экзон/интрон или интрон/экзон являются критическими для образования раннего сплайсомного комплекса. "Сплайсомный Е комплекс" превращается в "сплайсомный А комплекс" при дополнительном комплексообразовании с U2. "Сплайсомный А комплекс" претерпевает серию сложных реакций для удаления или сплайсирования интрона, чтобы присоединить соседние экзоны.
Синтез рибосомного белка. Белки кодируются ДНК (2-дезоксирибонуклеиновая кислота). В ответ на клеточную стимуляцию или спонтанно ДНК транскрибируется для продуцирования пре-мРНК (пре-матричная рибонуклеиновая кислота) в ядре. Интроны пре-мРНК ферментативным путем сплайсируются для получения мРНК (матричная рибонуклеиновая кислота), которая затем транслоцируется в цитоплазму. В цитоплазме комплекс трансляционной структуры, называемый рибосомой, связывается с мРНК и осуществляется синтез белка, поскольку он сканирует генетическую информацию, кодируемую по мРНК. [Biochemistry vol 41, 4503-4510 (2002); Cancer Res. vol 48, 2659-2668 (1988)].
Антисмысловой олигонуклеотид (ACQ) (Antisense Oligonucleotide, ASO): Связывание олигонуклеотида с нуклеиновой кислотой, включая ДНК, мРНК и пре-мРНК, в сиквенс-специфичном методе (т.е. комплементарно) называется антисмысловым олигонуклеотидом (АСО).
Если АСО прочно связывается с мРНК в цитоплазме, например, АСО может ингибировать синтез рибосомного белка по мРНК. Необходимо, чтобы АСО присутствовал внутри цитоплазмы для того, чтобы ингибировать синтез рибосомного белка его белка-мишени.
Антисмысловое ингибирование сплайсинга. Если АСО прочно связывается с пре-мРНК в ядре, АСО может ингибировать или модулировать сплайсинг пре-мРНК в мРНК. Необходимо, чтобы АСО присутствовал внутри ядра для того, чтобы ингибировать или модулировать сплайсинг пре-мРНК в мРНК. Такое антисмысловое ингибирование сплайсинга продуцирует мРНК или мРНК(ы), не содержащие экзона, таргетированного с помощью АСО. Такая(ие) мРНК(ы) называется(ются) "сплайс-вариантом(ами)", и кодирует(ют) белок(и) меныний(ие), чем белок, кодируемый полноразмерной мРНК.
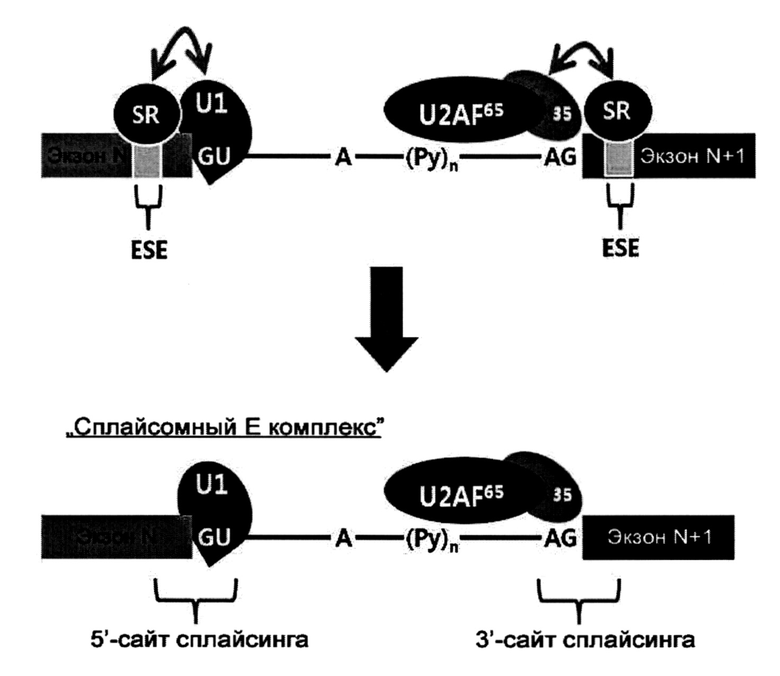
В принципе, сплайсинг может быть нарушен при ингибировании образования «сплайсомного Е комплекса». Если АСО прочно связывается с областью соединения (5' → 3') экзон-интрон, т.е. "5' сайт сплайсинга», то АСО блокирует образование комплекса между пре-мРНК и фактором U1, и, следовательно, образование «сплайсомного Е комплекса». Аналогичным образом, «сплайсомный Е комплекс» не может образоваться, если АСО прочно связывается с областью соединения (5' → 3') интрон-экзон, т.е. «3' сайт сплайсинга».
3' сайт сплайсинга и 5' сайт сплайсинга схематически проиллюстрированы на рисунке, приведенном ниже.
Олигонуклеотиды не природного происхождения.
ДНК- или РНК- олигонуклеотиды подвержены деградации эндогенными нуклеазами, ограничивая их терапевтическую ценность. В настоящее время были разработаны и интенсивно исследованы многие виды олигонуклеотидов не природного происхождения (не встречающиеся в природе). [Clin. Exp.Pharmacol. Physiol. vol 33, 533-540 (2006)]. Некоторые из них показывают длительную метаболическую стабильность по сравнению с ДНК и РНК. Ниже приведены химические структуры для нескольких типичных олигонуклеотидов не природного происхождения. Такие олигонуклеотиды предсказуемо связываются с комплементарной нуклеиновой кислотой, как это делает ДНК или РНК.
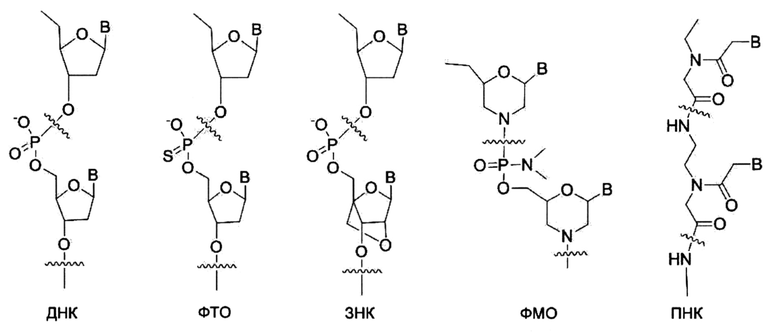
В: Нуклеиновое основание
Фосфоротиоатный олигонуклеотид: Фосфоротиоатный олигонуклеотид (ФТО) (Phosphorothioate oligonucleotide, РТО) является аналогом ДНК с одним остовом атомов фосфатного кислорода, замещенных атомом серы в мономере. Такое небольшое структурное изменение сделало ФТО сравнительно устойчивым к деградации нуклеазами. [Ann. Rev. Biochem. vol 54, 367-402 (1985)].
Отражая структурное сходство в остове ФТО и ДНК, они оба плохо проникают в клеточную мембрану в большинстве типов клеток млекопитающих. При этом, для некоторых типов клеток, чрезмерно экспрессирующих транспортер(ы) ДНК, ДНК и ФТО показывают хорошее проникновение в клетки. Известно, что системно вводимые ФТО(ы) легко распределяются в печени и почках. [Nucleic Acids Res. vol 25, 3290-3296 (1997)].
Для того, чтобы облегчить проникновение в клетки ФТО in vitro, обычно на практике применяют липофекцию. Однако, липофекция физически изменяет клеточную мембрану, вызывает цитотоксичность, и поэтому не будет идеальным для долгосрочного терапевтического применения in vivo.
За прошедшие 30 лет антисмысловые ФТО(ы) и варианты ФТО(ов) были клинически оценены для лечения рака, иммунологических расстройств, метаболических заболеваний и так далее. [Biochemistry vol 41, 4503-4510 (2002); Clin. Exp.Pharmacol. Physiol. vol 33, 533-540 (2006)]. Многие из таких кандидатов антисенс-препаратов не были успешно разработаны отчасти из-за плохого проникновения в клетки ФТО. Для того, чтобы преодолеть плохое проникновение в клетки, ФТО необходимо вводить в высокой дозе для терапевтической активности. Однако, известно, что ФТО(ы) связаны с дозолимитирующей токсичностью, включающей увеличенное время свертывания, активацию комплемента, тубулярную нефропатию, активацию купферовых клеток и иммунную стимуляцию, включая спленомегалию, лимфоидную гиперплазию, мононуклеарную клеточную инфильтрацию. [Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)].
Было найдено, что многие антисмысловые ФТО(ы) показывают надлежащую клиническую активность при заболеваниях со значительной ролью печени или почек. Мипомерсен является аналогом ФТО, который ингибирует синтез ароВ-100, белка, вовлеченного в транспорт холестерина липопротеинов низкой плотности (LDL). Мипомерсен проявлял надлежащую клиническую активность у больных атеросклерозом, скорее всего, из-за его избирательного распределения в печени. [Circulation vol 118(7), 743-753 (2008)]. ISIS-113715 является антисмысловым аналогом ФТО, ингибирующим синтез протеинтирозинфосфатазы 1B (РТР1 В), и было установлено, что показывает терапевтическую активность у больных сахарным диабетом II типа. [Curr. Opin. Mol. Ther. vol 6, 331-336(2004)].
Запертая нуклеиновая кислота.
В запертой нуклеиновой кислоте (ЗНК) (locked nucleic acid, LNA) рибозное кольцо остова РНК структурно затрудняет увеличить связывающую способность для РНК или ДНК. Таким образом, ЗНК можно рассматривать как аналог ДНК или РНК высокой аффинности. [Biochemistry vol 45, 7347-7355 (2006)].
Фосфородиамидат морфолиновый олигонуклеотид.
В фосфородиамидат морфолиновом олигонуклеотиде (ФМО) (phosphorodiamidate morpholino oligonucleotide, РМО) фосфатный остов и 2-дезоксирибоза ДНК заменяются фосфорамидатом и морфолином, соответственно. [Appl. Microbiol. Biotechnol. vol 71, 575-586 (2006)]. При этом остов ДНК отрицательно заряжен, остов ФМО не заряжен. Таким образом, связывание между ФМО и мРНК не имеет электростатического отталкивания между остовами и оказывается, как правило, сильнее, чем таковое между ДНК и мРНК. Так как ФМО структурно очень сильно отличается от ДНК, ФМО не будет распознаваться печеночным(и) транспортером(ами), распознающим(ими) ДНК. ФМО может проявлять другое распределение в тканях по сравнению с ФТО, но ФМО, как и ФТО, не легко проникает в клеточную мембрану.
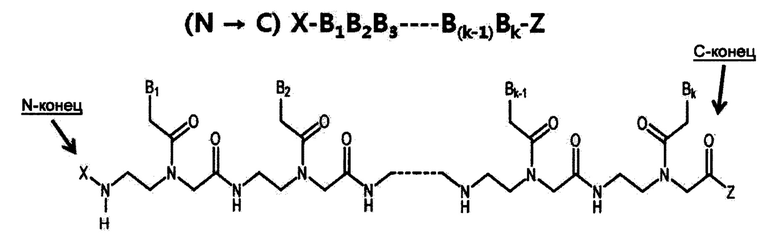
Пептидная нуклеиновая кислота.
Пептидная нуклеиновая кислота (ПНК) (peptide nucleic acid, PNA) является полипептидом с N-(2-аминоэтил)глицином в качестве остовного звена и была открыта Dr. Nielsen и коллегами. [Science vol 254, 1497-1500 (1991)]. Химическая структура и сокращенная номенклатура ПНК иллюстрируются на представленном ниже рисунке. Подобно ДНК и РНК, ПНК также селективно связывается с комплементарной нуклеиновой кислотой. [Nature (London) vol 365, 566-568 (1992)]. При связывании с комплементарной нуклеиновой кислотой N-конец ПНК рассматривается как эквивалент «5'-конца» ДНК или РНК и С-конец ПНК как эквивалент «3'-конца» ДНК или РНК.
Подобно ФМО, остов ПНК не заряжен. Таким образом, связывание между ПНК и РНК оказывается, как правило, сильнее, чем связывание между ДНК и РНК. Так как ПНК заметно отличается от ДНК по химической структуре, ПНК не будет распознаваться печеночным(ми) транспортером(ами), распознающим(ими) ДНК, и будет показывать профиль распределения в тканях, отличный от такого для ДНК или ФТО. Однако, ПНК также плохо проникает через мембрану клеток млекопитающих. [Adv. Drug Delivery Rev. vol 55, 267-280 (2003)].
Модифицированные нуклеиновые основания для улучшения мембранной проницаемости ПНК.
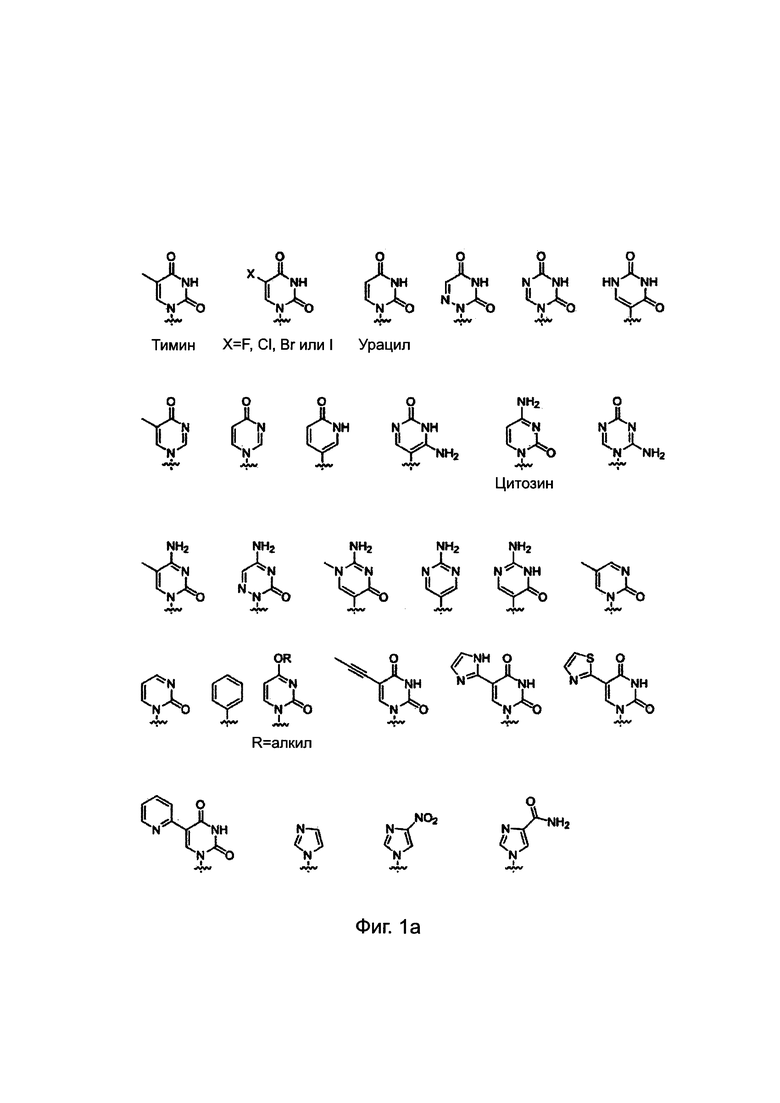
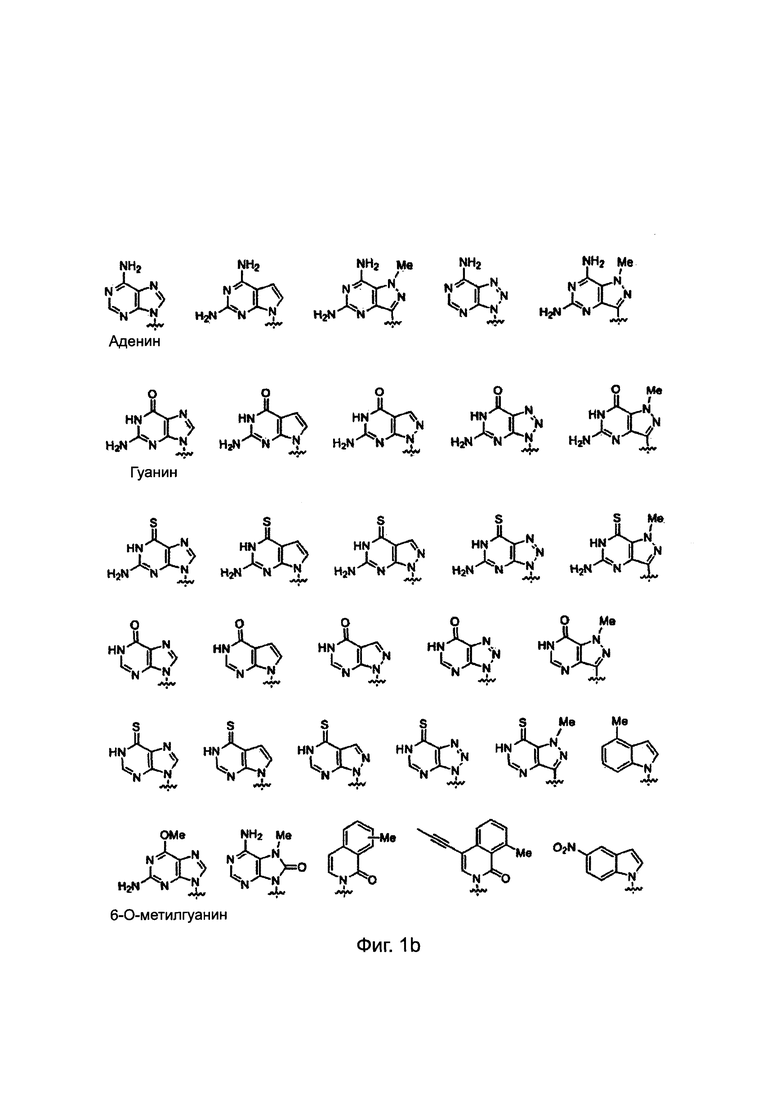
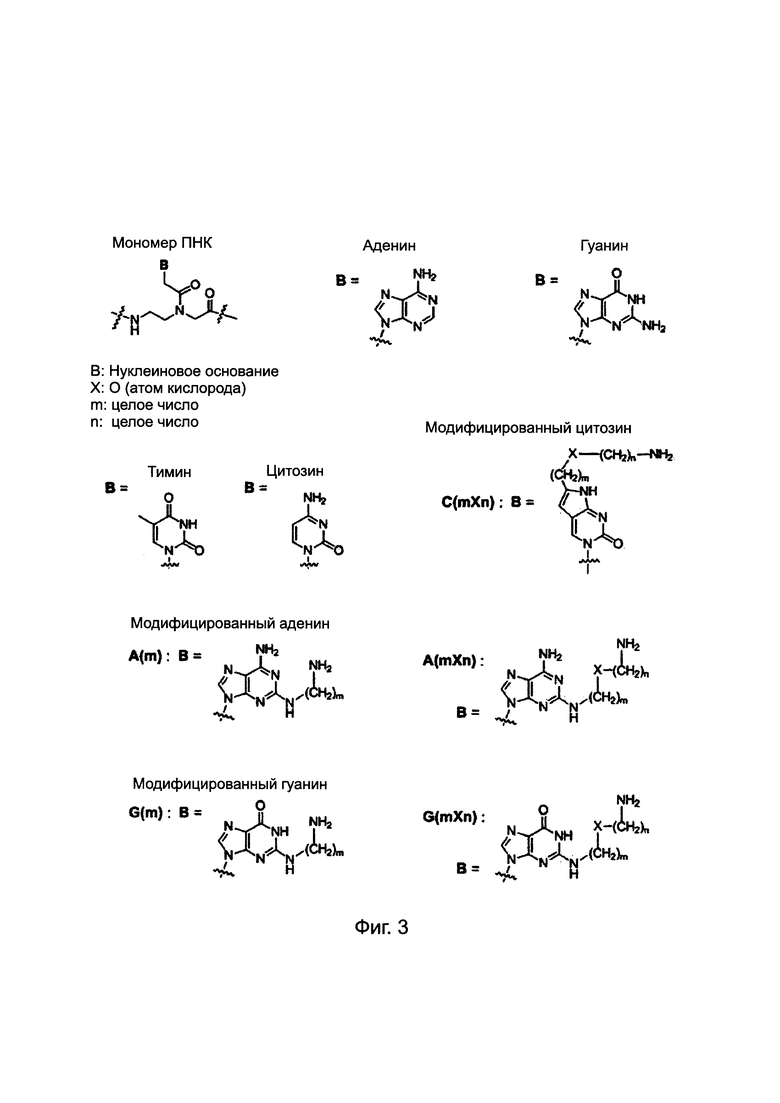
ПНК была получена высоко проницаемой в мембраны клеток млекопитающих путем введения модифицированных нуклеиновых оснований с катионным липидом или его эквивалентном ковалентно к нему присоединенным. Химические структуры таких модифицированных нуклеиновых оснований приведены ниже. Было найдено, что такие модифицированные нуклеиновые основания цитозина, аденина и гуанина предсказуемо и комплементарно гибридизируются с гуанином, тимином и цитозином, соответственно. [РСТ Appl. No. PCT/KR2009/001256; ЕР2268607; US8680253].
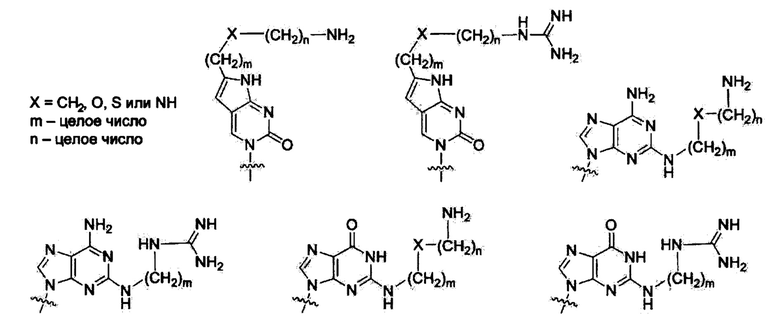
Включение таких модифицированных нуклеиновых оснований в ПНК имеет сходство с ситуациями липофекции. При липофекции молекулы олигонуклеотида с фосфатным остовом скрыты катионными липидными молекулами, такими как липофектамин, и такие липофектамин/олигонуклеотидные комплексы склонны проникать через мембрану довольно легко по сравнению с оголенными молекулами олигонуклеотидов.
Было найдено, что в дополнение к хорошей мембранной проницаемости, эти производные ПНК обладают ультра-сильным сродством к комплементарной нуклеиновой кислоте. Например, введение от 4 до 5 модифицированных нуклеиновых оснований в 11-13-мерные производные ПНК легко давало прирост Tm в 20°С или выше при дуплексном образовании с комплементарной ДНК. Такие производные ПНК очень чувствительны к ошибочному спариванию пары оснований. Ошибочное спаривание пары
оснований приводило к потере Tm от 11 до 22°С в зависимости от типа модифицированного основания, а также последовательности ПНК.
Малая интерферирующая РНК (siPHK) (small Interfering RNA, siRNA).
Малая интерферирующая РНК (siPHK) относится к двухцепочечной РНК из 20-25 пар оснований. [Microbiol. Mol. Biol. Rev. vol 67(4), 657-685 (2003)]. Антисмысловая цепь siPHK каким-то образом взаимодействует с белками, образуя «индуцированный РНК комплекс сайленсинга» (RNA-induced Silencing Complex, RISC). Затем RISC связывается с определенной частью мРНК, комплементарной к антисмысловой цепи siPHK. мРНК, образовавшая комплекс с RISC, подвергается расщеплению. Таким образом, siPHK каталитически индуцирует расщепление целевой мРНК, и, следовательно, подавляет экспрессию белка с помощью мРНК. RISC не всегда связывается с полной комплементарной последовательностью в пределах целевой мРНК, что вызывает опасения, связанные с ненаправленными действиями лекарственного действия siPHK. Как и другие классы олигонуклеотида с остовом ДНК или РНК, siPHK обладает плохой клеточной проницаемостью и, следовательно, имеет тенденцию показывать плохую терапевтическую активность in vitro или in vivo, если должным образом не подготовлена или химически не модифицирована для получения хорошей мембранной проницаемости.
siРНК АКК.
Сообщалось, что смесь siPHK АКК-1 и siPHK АКК-2 ингибирует экспрессию мРНК(т) АКК-1 и АКК-2 и белков в линии раковых клеток глиобластомы после липофекции при 20 нМ каждого [PLoS One Vol 12, е0169566 (2017)]. Эти результаты могут быть полезны при изучении метастаза липогенной опухоли, связанного с АКК.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Проблема, подлежащая решению
Поскольку ожирение оказывает сильный эффект на старение кожи, должны контролироваться состояния здоровья и заболевания, связанные с ожирением, чтобы получить здоровую и красивую кожу.
Исследование на АКК-2-/- мутантных мышах в отношении ожирения привлекло большое внимание. Кроме того, хотя сообщалось, что siPHK АКК(з) ингибируют экспрессию siPHK АКК(з) и белков в линии раковых клеток, siPHK(ы) обходятся слишком дорого для производства и разработки в качестве средства от старения кожи, не говоря уже о трудности доставки в кожу. Поэтому необходимо разработать лекарственные препараты или косметические средства на основе механизма экспрессии АКК-2, которые могут исправить и предотвратить состояние старения кожи.
Решение проблемы
Данное изобретение предлагает производное пептидной нуклеиновой кислоты (ПНК), представленное формулой I, или его фармацевтически приемлемую соль:
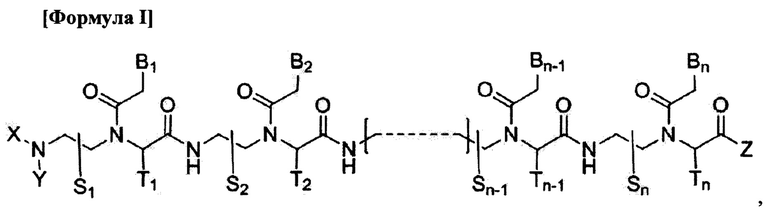
где
n - целое число от 10 до 21;
соединение формулы I обладает по меньшей мере 10-мерным комплементарным перекрыванием с 18-мерной последовательностью пре-мРНК [(5' → 3')
GGCCAUUUCGUCAGUAUC] в пре-мРНК АКК-2 человека;
соединение формулы I полностью комплементарно пре-мРНК АКК-2 человека или частично комплементарно пре-мРНК АКК-2 человека с одним или двумя ошибочными спариваниями;
S1, S2,  Sn-1, Sn, T1, T2,
Sn-1, Sn, T1, T2,  Tn-1 и Tn независимо обозначают атом водорода, атом дейтерия, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
Tn-1 и Tn независимо обозначают атом водорода, атом дейтерия, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
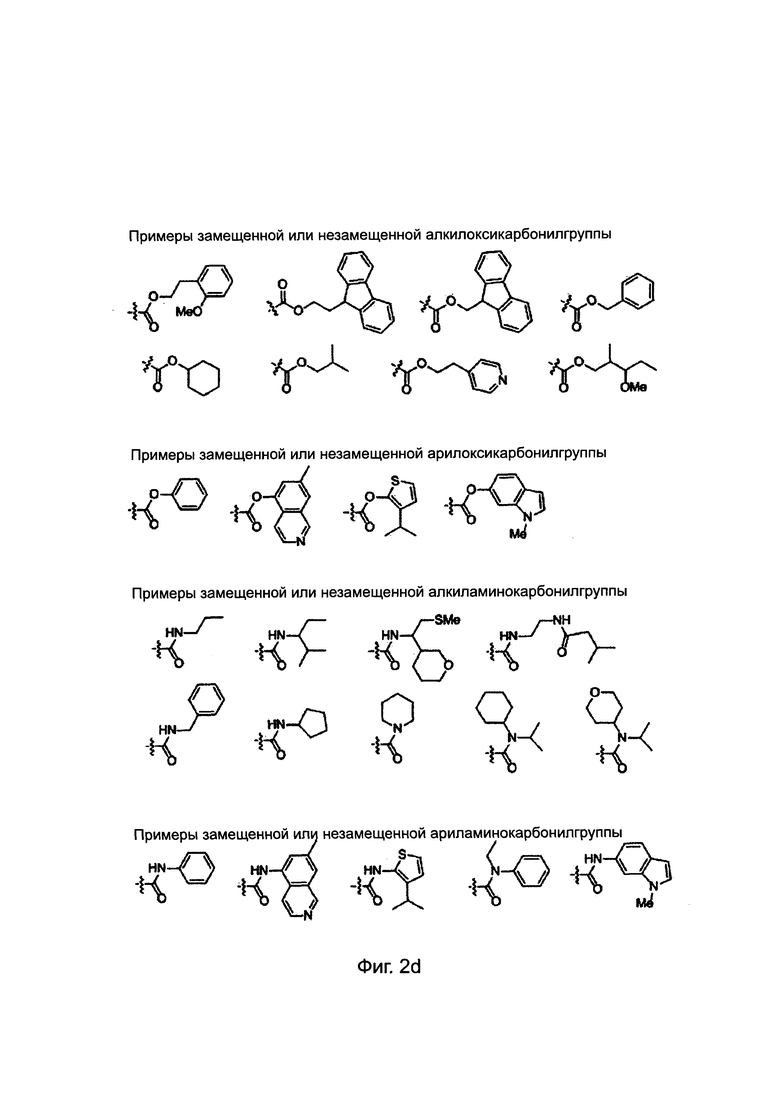
X и Y независимо обозначают атом водорода, атом дейтерия, формилгруппу [Н-С(=O)-], аминокарбонилгруппу [NH2-C(=O)-], аминотиокарбонилгруппу [NH2-C(=S)-], замещенную или незамещенную алкилгруппу, замещенную или незамещенную арилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную алкилацилгруппу, замещенную или незамещенную арилацилгруппу, замещенную или незамещенную алкилоксикарбонилгруппу, замещенную или незамещенную арилоксикарбонилгруппу, замещенную или незамещенную алкиламинокарбонилгруппу, замещенную или незамещенную ариламинокарбонилгруппу, замещенную или незамещенную алкиламинотиокарбонилгруппу, замещенную или незамещенную ариламинотиокарбонилгруппу, замещенную или незамещенную алкилокситиокарбонилгруппу, замещенную или незамещенную арилокситиокарбонилгруппу, замещенную или незамещенную алкилсульфонилгруппу, замещенную или незамещенную арилсульфонилгруппу, замещенную или незамещенную алкилфосфонилгруппу или замещенную или незамещенную арилфосфонилгруппу;
Z обозначает атом водорода, атом дейтерия, гидроксигруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную аминогруппу, замещенную или незамещенную алкилгруппу или замещенную или незамещенную арилгруппу;
В1, В2,  Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения; и
Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения; и
по меньшей мере четыре из В1, В2,  Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения с замещенной или незамещенной аминогруппой, ковалентно связанной с остатком нуклеинового основания.
Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения с замещенной или незамещенной аминогруппой, ковалентно связанной с остатком нуклеинового основания.
Соединение формулы I индуцирует пропуск «экзона 12» в пре-мРНК АКК-2 человека, дает сплайс-вариант(ы) мРНК АКК-2 человека, не содержащий(ие) «экзона 12», и, следовательно, пригодно для ингибирования функциональной активности гена, считывающего пре-мРНК АКК-2 человека.
Условие, что «п представляет собой целое число от 10 до 21» буквально означает, что n является целым числом, выбираемым из группы целых чисел 11, 12, 13, 14, 15, 16, 17, 18, 19 и 20.
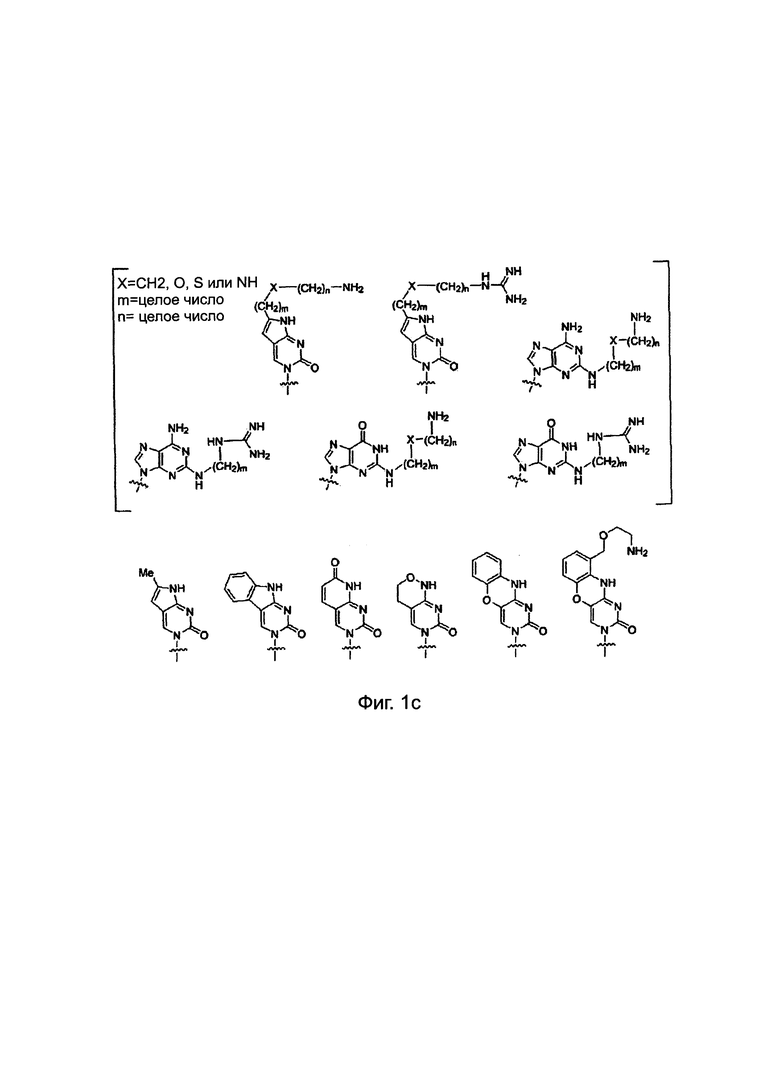
Химические структуры природных нуклеиновых оснований или нуклеиновых оснований не природного происхождения в производном ПНК формулы I подтверждаются примерами на Фиг. 1а-1с. Природные (т.е. встречающиеся в природе) нуклеиновые основания или нуклеиновые основания не природного происхождения (т.е. не встречающиеся в природе), описанные в настоящем изобретении, включают, но не ограничиваются нуклеиновыми основаниями, представленными на Фиг. 1а-1с. Обеспечение таких нуклеиновых оснований не природного происхождения является иллюстрацией разнообразия приемлемых нуклеиновых оснований, и поэтому не должно быть истолковано для ограничения объема настоящего изобретения.
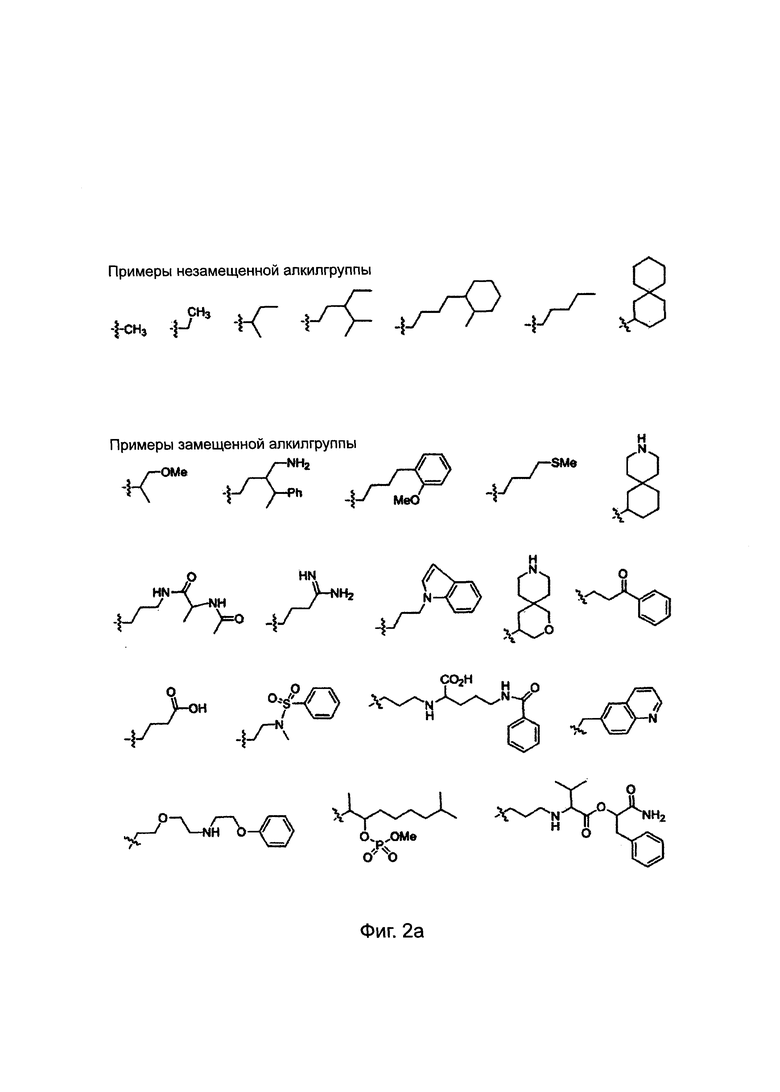
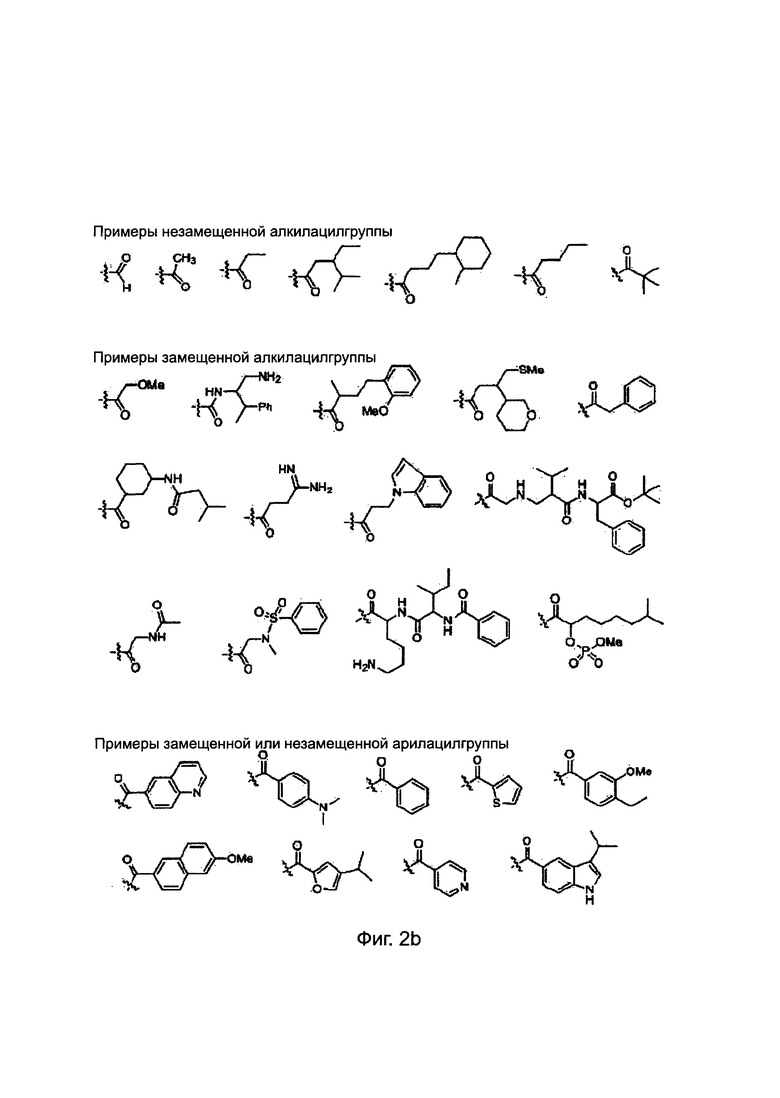
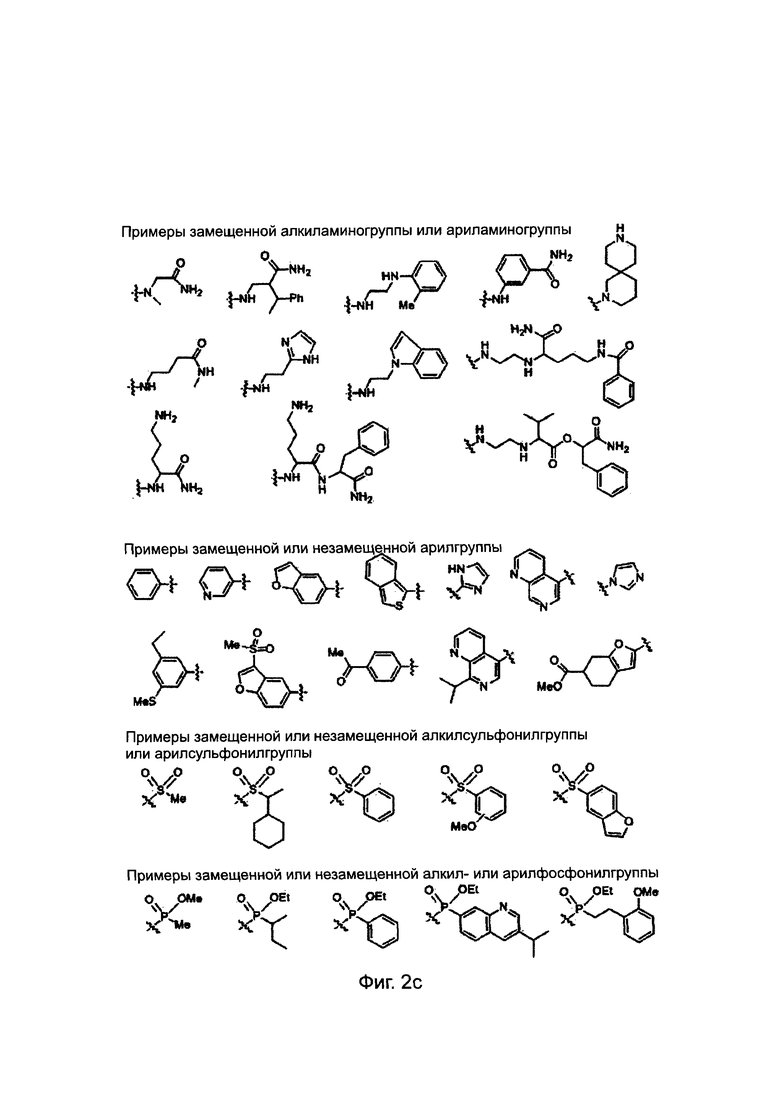
Заместители, выбранные для описания производного ПНК формулы I, приведены на Фиг. 2а-2е. Фиг. 2а приводит примеры для замещенных или незамещенных алкилгрупп. Замещенные или незамещенные алкилацилгруппы и замещенные или незамещенные арилацилгруппы приведены на Фиг. 2b. Фиг. 2 с иллюстрирует примеры для замещенной или незамещенной алкиламиногруппы, замещенной или незамещенной ариламиногруппы, замещенной или незамещенной арилгруппы, замещенной или незамещенной алкилсульфонилгруппы или арилсульфонилгруппы и замещенной или незамещенной алкилфосфонилгруппы или арилфосфонилгруппы. Фиг. 2d приводит примеры для замещенной или незамещенной алкилоксикарбонилгруппы или арилоксикарбонилгруппы, замещенной или незамещенной алкиламинокарбонилгруппы или ариламинокарбонилгруппы. На Фиг. 2е приведены примеры для замещенной или незамещенной алкиламинотиокарбонилгруппы, замещенной или незамещенной ариламинотиокарбонилгруппы, замещенной или незамещенной алкилокситиокарбонилгруппы и замещенной или незамещенной арилокситиокарбонилгруппы. Обеспечение таких типичных заместителей является иллюстрацией разнообразия приемлемых заместителей, и поэтому не должно быть истолковано для ограничения объема настоящего изобретения. Специалист в данной области может легко додумать, что олигонуклеотидная последовательность является ключевым фактором для сиквенс-специфичного связывания олигонуклеотида с целевой последовательностью пре-мРНК по сравнению с заместителями в N-конце или С-конце.
Соединение формулы 1 прочно связывается с комплементарной ДНК, пример которой приведен в предшествующем уровне техники [PCT/KR2009/001256]. Дуплекс между производным ПНК формулы I и его полноразмерной комплементарной ДНК или РНК обладает значением Tm слишком высоким для достоверного определения в водном буфере. Соединение ПНК формулы I дает высокие значения Tm с комплементарными ДНК(ами) более короткой длины.
Соединение формулы I комплементарно связывается с 5' сайтом сплайсинга "экзона 12" пре-мРНК АКК-2 человека. [NCBI Reference Sequence: NG_046907]. 16-мерная последовательность [(5' → 3') GCCAUUUCGUCAGUAU] охватывает область соединения «экзона 12» и "интрона 12" в пре-мРНК АКК-2 человека, и состоит из 8-мерной от "экзона 12" и 8-мерной от "интрона 12". Таким образом, 16-мерная последовательность пре-мРНК может обычно обозначаться как [(5' → 3')  где последовательность экзона и интрона определяется соответственно "заглавными" и "строчными" буквами и область соединения экзона-интрона выражается
где последовательность экзона и интрона определяется соответственно "заглавными" и "строчными" буквами и область соединения экзона-интрона выражается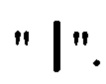 Традиционное обозначение для пре-мРНК дополнительно иллюстрируется 30-мерной последовательностью [(5' → 3')
Традиционное обозначение для пре-мРНК дополнительно иллюстрируется 30-мерной последовательностью [(5' → 3') 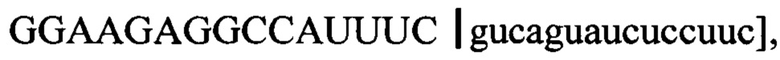 охватывающей область соединения "экзона 12" и "интрона 12" в пре-мРНК АКК-2 человека.
охватывающей область соединения "экзона 12" и "интрона 12" в пре-мРНК АКК-2 человека.
Соединение формулы I прочно связывается с целевым 5' сайтом сплайсинга пре-мРНК АКК-2 человека, считанного с гена АКК-2 человека, и препятствует образованию «раннего сплайсомного комплекса» для получения сплайс-варианта(ов) мРНК АКК-2, не содержащего(их) "экзона 12" (пропуск экзона 12).
Сильное сродство РНК позволяет соединению формулы I вызвать пропуск "экзона 12" АКК-2, даже если производное ПНК имеет одно или два ошибочных спаривания с целевым 5' сайтом сплайсинга в пре-мРНК АКК-2. Подобным образом производное ПНК формулы I все еще может индуцировать пропуск "экзона 12" АКК-2 в мутантной пре-мРНК АКК-2, обладающей одним или двумя однонуклеотидными полиморфизмами (single nucleotide polymorphism, SNPs) в целевом сайте сплайсинга.
Соединение формулы I обладает хорошей клеточной проницаемостью и может быть легко доставлено в клетку как «оголенный» олигонуклеотид, примером чего является предшествующий уровень техники [PCT/KR2009/001256]. Таким образом, соединение, описанное в настоящем изобретении, индуцирует пропуск "экзона 12" в пре-мРНК АКК-2 и дает сплайс-вариант(ы) мРНК АКК-2, не содержащий(ие) "экзона 12" АКК-2 в клетках, обработанных соединением формулы I как «оголенным» олигонуклеотидом. Соединение формулы I не требует каких-либо средств или составов для доставки в клетку, чтобы мощно индуцировать пропуск целевого экзона в клетках. Соединение формулы I легко индуцирует пропуск "экзона 12" АКК-2 в клетках, обработанных соединением, описанным в настоящем изобретении, как «оголенным» олигонуклеотидом при субфемтомолярной концентрации.
Вследствие хорошей клеточной или мембранной проницаемости, производное ПНК формулы I может местно вводиться в виде «оголенного» олигонуклеотида для индуцирования пропуска "экзона 12" АКК-2 в коже. Соединению формулы I не требуется лекарственная форма для увеличения трансдермальной доставки в ткань-мишень с точки зрения надлежащей терапевтической или биологической активности. Обычно соединение формулы I растворяют в воде и сорастворителе и наружно или трансдермально вводят при субпикомолярной концентрации, чтобы вызвать желаемую терапевтическую или биологическую активность в коже-мишени. Соединение, описанное в настоящем изобретении, не обязательно должно быть интенсивно или агрессивно вводиться, чтобы вызвать топическую терапевтическую активность. Тем не менее, производное ПНК формулы I может входить в состав с косметическими ингредиентами или адъювантами в качестве наружного крема или лосьона. Такой наружный косметический крем или лосьон может быть пригоден для лечения старения кожи.
Соединение, описанное в настоящем изобретении, может вводиться местно пациенту при терапевтически или биологически эффективной концентрации в диапазоне от 1 аМ до более чем 1 нМ, которая будет варьироваться в зависимости от схемы приема препарата, состояний или ситуаций пациента и так далее.
Производное ПНК формулы I может различным образом входить в состав, включая, но не ограничиваясь инъекциями, назальным спреем, трансдермальным пластырем и так далее. Кроме того, производное ПНК формулы I может вводиться пациенту в терапевтически эффективной дозе и доза введения может варьироваться в зависимости от показания, способа введения, схемы введения доз, состояний или ситуаций пациента и так далее.
Соединение формулы I может использоваться в сочетании с фармацевтически приемлемой кислотой или основанием, включая, но не ограничиваясь, гидроксид натрия, гидроксид калия, соляную кислоту, метансульфоновую кислоту, лимонную кислоту, трифторуксусную кислоту и другие
Производное ПНК формулы I или его фармацевтически приемлемая соль может вводиться пациенту вместе с фармацевтически приемлемым адьювантом, включая, но не ограничиваясь, лимонную кислоту, соляную кислоту, винную кислоту, стеариновую кислоту, полиэтиленгликоль, полипропиленгликоль, этанол, изопропанол, бикарбонат натрия, дистиллированную воду, консервант(ы) и другие.
Предпочтительным является производное ПНК формулы I или его фармацевтически приемлемая соль:
где
n - целое число от 10 до 21;
соединение формулы I обладает по меньшей мере 10-мерным комплементарным перекрыванием с 18-мерной последовательностью пре-мРНК [(5' → 3')
GGCCAUUUCGUCAGUAUC] в пре-мРНК АКК-2 человека;
соединение формулы I полностью комплементарно пре-мРНК АКК-2 человека или частично комплементарно пре-мРНК АКК-2 человека с одним или двумя ошибочными спариваниями;
S1, S2,  Sn-1, Sn, T1, T2,
Sn-1, Sn, T1, T2,  Tn-1 и Tn независимо обозначают атом водорода, атом дейтерия;
Tn-1 и Tn независимо обозначают атом водорода, атом дейтерия;
X и Y независимо обозначают атом водорода, атом дейтерия, формилгруппу [Н-С(=O)-], аминокарбонилгруппу [NH2-C(=O)-], аминотиокарбонилгруппу [NH2-C(=S)-], замещенную или незамещенную алкилгруппу, замещенную или незамещенную арилгруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную алкилацилгруппу, замещенную или незамещенную арилацилгруппу, замещенную или незамещенную алкилоксикарбонилгруппу, замещенную или незамещенную арилоксикарбонилгруппу, замещенную или незамещенную алкиламинокарбонилгруппу, замещенную или незамещенную ариламинокарбонилгруппу, замещенную или незамещенную алкиламинотиокарбонилгруппу, замещенную или незамещенную ариламинотиокарбонилгруппу, замещенную или незамещенную алкилокситиокарбонилгруппу, замещенную или незамещенную арилокситиокарбонилгруппу, замещенную или незамещенную алкилсульфонилгруппу, замещенную или незамещенную арилсульфонилгруппу, замещенную или незамещенную алкилфосфонилгруппу или замещенную или незамещенную арилфосфонилгруппу;
Z обозначает атом водорода, гидроксигруппу, замещенную или незамещенную алкилоксигруппу, замещенную или незамещенную арилоксигруппу или замещенную или незамещенную аминогруппу;
В1, В2,  Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения
Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения
по меньшей мере четыре из В1, В2,  Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения, представленных формулой II, формулой III или формулой IV:
Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения, представленных формулой II, формулой III или формулой IV:
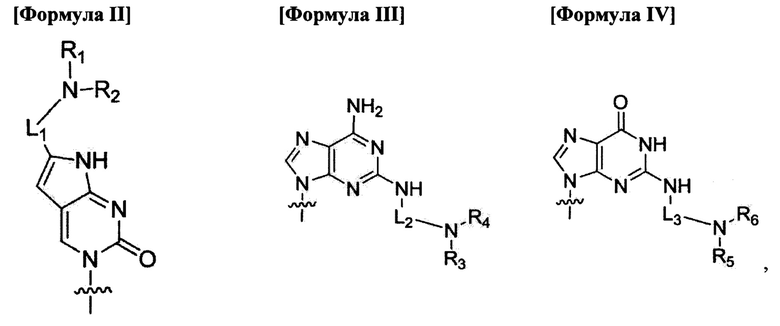
где
R1, R2, R3, R4, R5 и R6 независимо выбраны из атома водорода и замещенной или незамещенной алкилгруппы;
L1, L2 и L3 являются ковалентным линкером, представленным формулой V, ковалентно соединяющим основную аминогруппу с остатком нуклеинового основания:
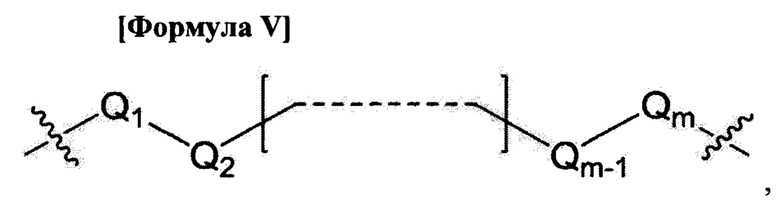
где
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу (-СН2-) и Qm непосредственно связывается с основной аминогруппой;
Q2, Q3,  и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы, атома кислорода (-O-), атома серы (-S-) и замещенной или незамещенной аминогруппы [-N(H)- или -N(заместитель)-]; и
и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы, атома кислорода (-O-), атома серы (-S-) и замещенной или незамещенной аминогруппы [-N(H)- или -N(заместитель)-]; и
m - целое число от 1 до 15.
Представляет интерес олигомер ПНК формулы I или его фармацевтически приемлемая соль:
где
n - целое число от 11 до 16;
соединение формулы I обладает по меньшей мере 10-мерным комплементарным перекрыванием с 18-мерной последовательностью пре-мРНК [(5' → 3')
GGCCAUUUCGUCAGUAUC] в пре-мРНК АКК-2 человека;
соединение формулы I полностью комплементарно пре-мРНК АКК-2 человека;
S1, S2,  Sn-1, Sn, T1, T2,
Sn-1, Sn, T1, T2,  Tn-1 и Tn представляют собой атом водорода;
Tn-1 и Tn представляют собой атом водорода;
X и Y независимо обозначают атом водорода, замещенную или незамещенную алкилацилгруппу или замещенную или незамещенную алкилоксикарбонилгруппу;
Z обозначает замещенную или незамещенную аминогруппу;
В1, В2,  Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения;
Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения;
по меньшей мере пять из В1, В2,  Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения, представленных формулой II, формулой III или формулой IV;
Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 являются атомом водорода;
Q1 и Qm представляют собой метиленгруппу и Qm непосредственно связывается с основной аминогруппой;
Q2, Q3,  и Qm-1 независимо выбраны из метиленгруппы и атома кислорода; и
и Qm-1 независимо выбраны из метиленгруппы и атома кислорода; и
m - целое число от 1 до 9.
Представляет интерес производное ПНК формулы I или его фармацевтически приемлемая соль:
где
n - целое число от 11 до 16;
соединение формулы I обладает по меньшей мере 10-мерным комплементарным перекрыванием с 18-мерной последовательностью пре-мРНК [(5' → 3')
GGCCAUUUCGUCAGUAUC] в пре-мРНК АКК-2 человека;
соединение формулы I полностью комплементарно пре-мРНК АКК-2 человека;
S1, S2,  Sn-1, Sn, T1, T2,
Sn-1, Sn, T1, T2,  Tn-1 и Tn представляют собой атом водорода;
Tn-1 и Tn представляют собой атом водорода;
X представляет собой атом водорода;
Y обозначает замещенную или незамещенную алкилоксикарбонилгруппу;
Z обозначает замещенную или незамещенную аминогруппу;
В1, В2,  Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения;
Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения;
по меньшей мере пять из В1, В2,  Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения, представленных формулой II, формулой III или формулой IV;
Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 являются атомами водорода;
L1 обозначает -(СН2)2-O-(СН2)2-группу, -СН2-O-(СН2)2-группу, -СН2-O-(СН2)3-группу, -СН2-O-(СН2)4-группу или -СН2-O-(СН2)5-группу; и
L2 и L3 независимо выбраны из -(СН2)2-O-(СН2)2-группы, -(СН2)3-O-(СН2)2-группы, -(СН2)2-O-(СН2)3-группы, -(СН2)2-группы, -(СН2)3-группы, -(СН2)4-группы, -(СН2)5-группы, -(СН2)6-группы, -(СН2)7-группы и -(CH2)8-группы.
Представляет интерес производное ПНК формулы I, которое выбрано из группы соединений, приведенных ниже (называемые в дальнейшем АСО(ы) (антисмысловые олигонуклеотиды) 1, 2, 3, 4, 5 и 6, соответственно), или его фармацевтически приемлемая соль:
(N → C) Fethoc-CTG(6)-ACG(6)-AA(5)A-TG(6)G-C(1O2)C-NH2;
(N → C) Fethoc-TA(5)C(1O2)-TGA(5)-CGA(5)-AA(5)T-G(6)GC(1O2)-C-NH2;
(N → C) Fethoc-TA(5)C-TG(5)A-C(1O2)GA(5)-AA(5)T-G(5)G-NH2;
(N → C) Fethoc-AC(1O2)T-GA(5)C-GA(5)A-A(5)TG(5)-GC(1O2)-NH2;
(N → C) Fethoc-CTG(6)-AC(1O2)G-A(5)AA(5)-TG(6)G-NH2;
(N → C) Fethoc-CTG(6)-AC(1O2)G-A(5)AA(5)-TG(6)G-C(1O2)C-NH2,
где
A, G, T и С представляют собой мономеры ПНК с природным нуклеиновым основанием аденином, тимином, гуанином и цитозином, соответственно;
C(pOq), А(р) и G(p) представляют собой мономеры ПНК с нуклеиновым основанием не природного происхождения, представленным формулой VI, формулой VII и формулой VIII, соответственно;
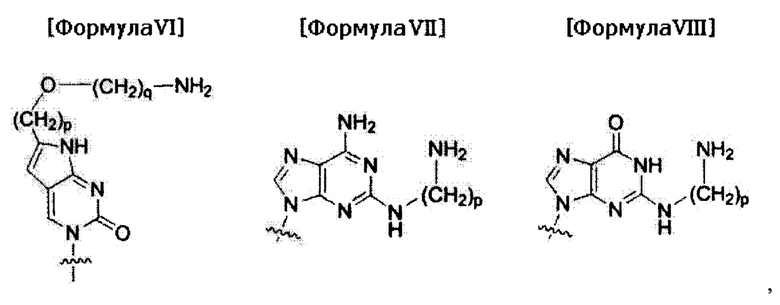
где
р и q - целые числа, например, р равно 1 или 5 и q равно 2 в случае АСО 4; и
"Fethoc-" представляет собой сокращение для
"[2-(9-фторенил)этил-1-окси]карбонилгруппы" и "-NH2" - для незамещенной "аминогруппы".
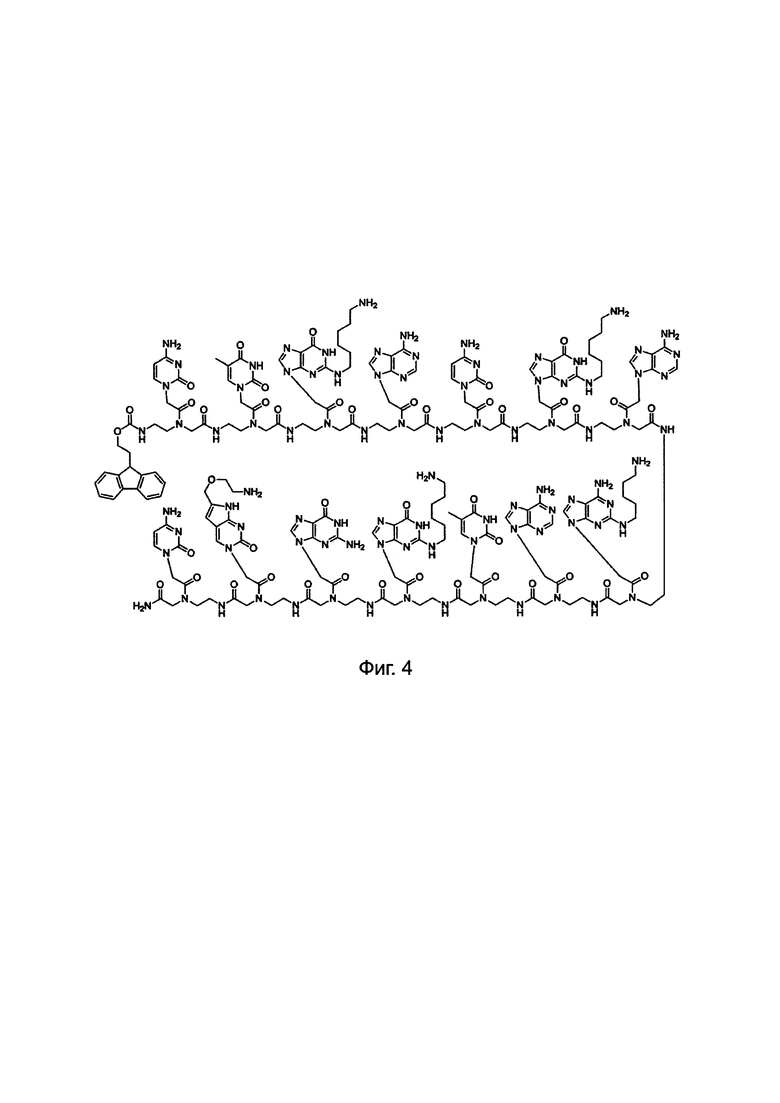
Фиг. 3 в совокупности и недвусмысленно представляет химические структуры для мономеров ПНК, сокращенных как A, G, Т, С, C(pOq), А(р) и G(p). Как обсуждалось в предшествующем уровне техники [PCT/KR2009/001256], C(pOq) рассматривается как мономер ПНК с "модифицированным цитозином" вследствие его гибридизации в "гуанин". А(р) принимается за мономеры ПНК с "модифицированным аденином" вследствие их гибридизации в "тимин" и G(p) принимается за мономеры ПНК с "модифицированным гуанином" вследствие их гибридизации в "цитозин". Кроме того, для того, чтобы проиллюстрировать сокращения, применяемые для таких производных ПНК, химическая структура АСО 1 "(N → С) CTG(6)-ACG(6)-AA(5)A-TG(6)G-C(1O2)C-NH2" приведена на Фиг. 4.
АСО 1 эквивалентен последовательности ДНК "(5' → 3')
CTG-ACG-AAA-TGG-CC" для комплементарного связывания с пре-мРНК. 14-мерная ПНК имеет 14-мерное комплементарное перекрывание с 14-мерной последовательностью, обозначенной "жирным шрифтом" и "подчеркнутой" в 30-мерной последовательности РНК [(5' → 3') 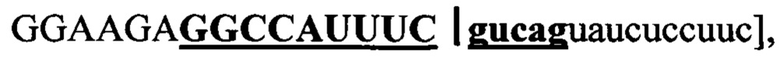 охватывающей область соединения "экзона 12" и "интрона 12" в пре-мРНК АКК-2 человека.
охватывающей область соединения "экзона 12" и "интрона 12" в пре-мРНК АКК-2 человека.
Одним из аспектов настоящего изобретения является способ лечения состояний или заболеваний, связанных с транскрипцией гена АКК-2 человека, включающий введение пациенту производного пептидной нуклеиновой кислоты в соответствии с настоящим изобретением или его фармацевтически приемлемой соли.
Одним из аспектов настоящего изобретения является способ лечения старения кожи, включающий введение пациенту производного пептидной нуклеиновой кислоты в соответствии с настоящим изобретением или его фармацевтически приемлемой соли.
Одним из аспектов настоящего изобретения является фармацевтическая композиция для лечения состояний или заболеваний, связанных с транскрипцией гена АКК-2 человека, включающая производное пептидной нуклеиновой кислоты в соответствии с настоящим изобретением или его фармацевтически приемлемую соль.
Одним из аспектов настоящего изобретения является косметическая композиция для лечения состояний или заболеваний, связанных с транскрипцией гена АКК-2 человека, включающая производное пептидной нуклеиновой кислоты в соответствии с настоящим изобретением или его фармацевтически приемлемую соль.
Одним из аспектов настоящего изобретения является фармацевтическая композиция для лечения старения кожи, включающая производное пептидной нуклеиновой кислоты в соответствии с настоящим изобретением или его фармацевтически приемлемую соль.
Одним из аспектов настоящего изобретения является косметическая композиция для лечения старения кожи, включающая производное пептидной нуклеиновой кислоты в соответствии с настоящим изобретением или его фармацевтически приемлемую соль.
Эффект изобретения
Состояния или заболевания, связанные с транскрипцией гена АКК-2 человека, можно лечить введением производного ПНК формулы I или его фармацевтически приемлемой соли.
Старение кожи можно лечить введением производного ПНК формулы I или его фармацевтически приемлемой соли.
Краткое пояснение фигур
Фиг. 1а-1с. Примеры природных нуклеиновых оснований или нуклеиновых оснований не природного происхождения (модифицированных), выбираемых для производного пептидной нуклеиновой кислоты формулы I.
Фиг. 2а-2е. Примеры заместителей, выбираемых для производного пептидной нуклеиновой кислоты формулы I.
Фиг. 3. Химические структуры мономеров ПНК с природным или модифицированным нуклеиновым основанием.
Фиг. 4. Химическая структура "АСО 1".
Фиг. 5. Химические структуры мономеров Fmoc-ПНК, используемых для синтеза производных ПНК данного изобретения.
Фиг. 6a-6b. C18-обращено-фазовые ВЭЖХ хроматограммы "АСО 1" до и после очистки ВЭЖХ, соответственно.
Фиг. 7. ESI-TOF масс-спектр "АСО 1", очищенного C18-RP препаративной ВЭЖХ.
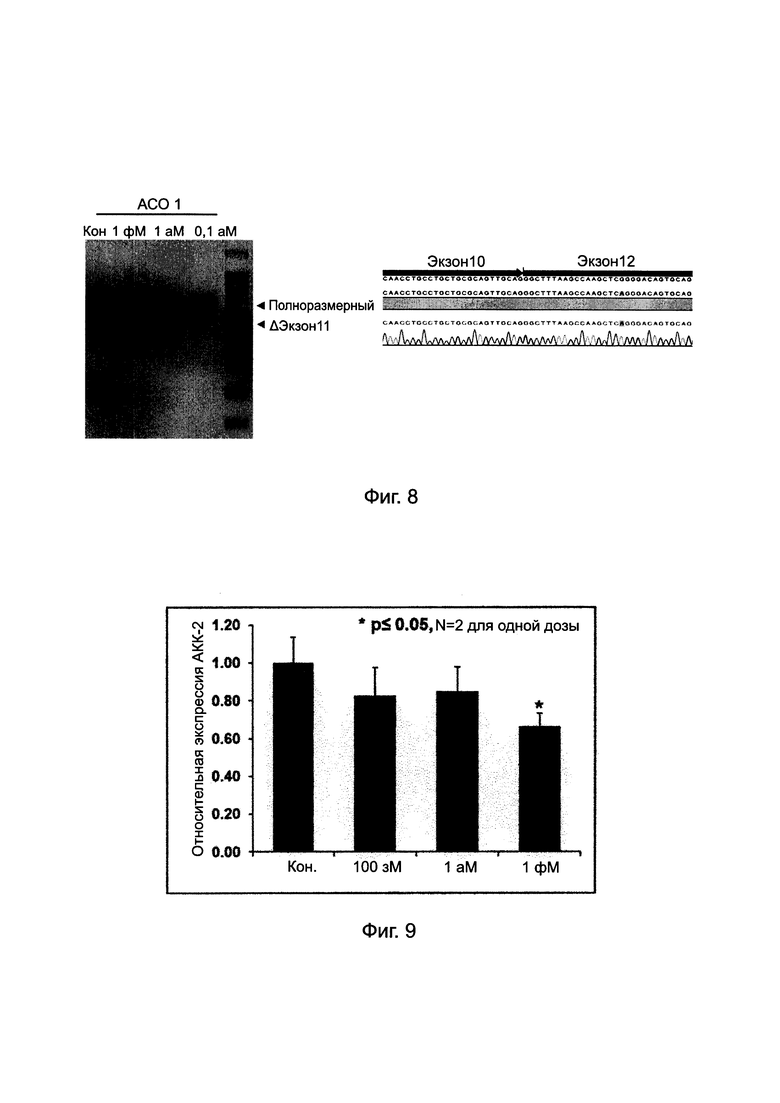
Фиг. 8. Пропуск экзона мРНК АКК-2 с помощью "АСО 1" в С2С12.
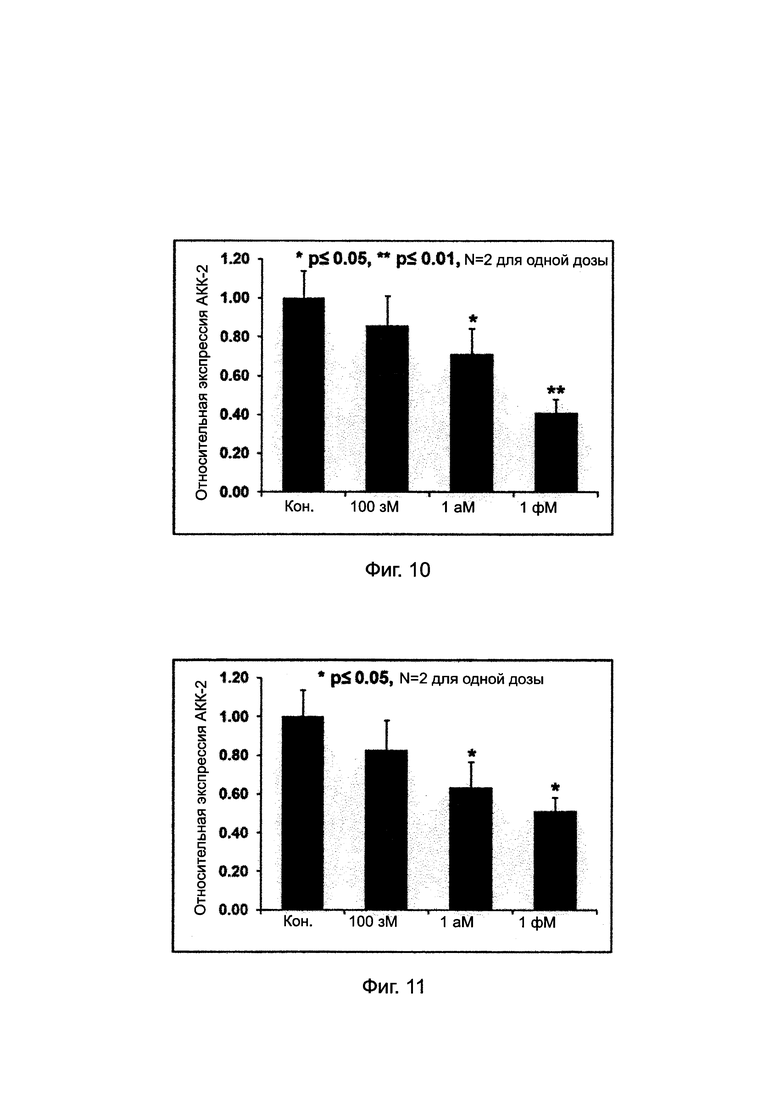
Фиг. 9. Ингибирование уровней мРНК АКК-2 с помощью "АСО 1" в С2С12.
Фиг. 10. Ингибирование уровней мРНК АКК-2 с помощью "АСО 6" в С2С12.
Фиг. 11. Ингибирование уровней мРНК АКК-2 с помощью "АСО 5" в С2С12.
Лучший вариант осуществления изобретения
Общие методики приготовления олигомеров ПНК
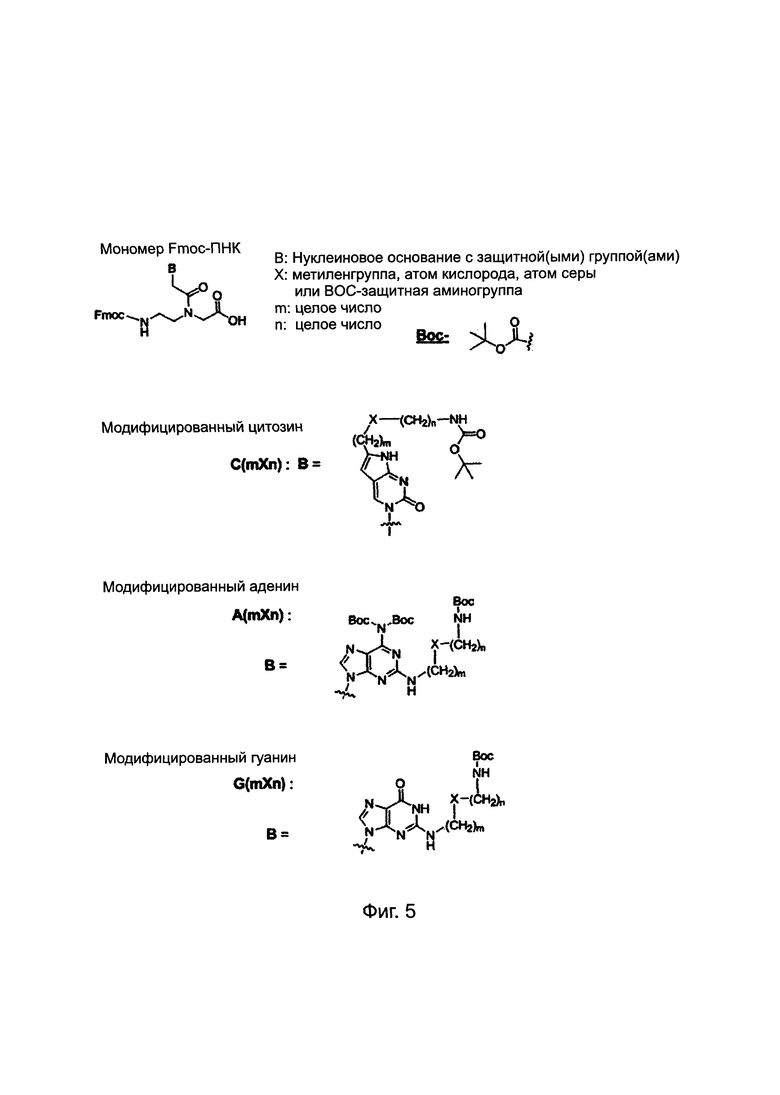
Олигомеры ПНК синтезировали с помощью твердофазного пептидного синтеза (solid phase peptide synthesis, SPPS), основанного на Fmoc-химии в соответствии со способом, раскрытым в предшествующем уровне техники [US6,133,444; WO96/40685] с незначительными, но требуемыми изменениями. Fmoc представляет собой {(9-фторенил)метилокси}карбонилгруппу. Твердая подложка, применяемая в данном исследовании, представляла собой амидную смолу H-Rink Amide-ChemMatrix, закупленную в PCAS BioMatrix Inc. (Квебек, Канада). Мономеры Fmoc-ПНК с модифицированным нуклеиновым основанием синтезировали, как описано в предшествующем уровне техники [PCT/KR 2009/001256] или с незначительными изменениями. Для синтеза производных ПНК настоящего изобретения использовались конкретные мономеры Fmoc-ПНК с модифицированным нуклеиновым основанием и мономеры Fmoc-ПНК с нуклеиновым основанием природного происхождения. Олигомеры ПНК очищали с помощью C18-обращено-фазовой ВЭЖХ (вода/ацетонитрил или вода/метанол с 0,1% TFA) и характеризовали масс-спектрометрией, включая ESI/TOF/MS.
Схема 1 иллюстрирует типичный цикл удлинения мономеров, принятый в SPPS данного исследования, и синтетические детали (тонкости) приведены ниже. Однако, для специалиста в данной области имеется много незначительных изменений, очевидно, возможных при эффективном проведении таких реакций SPPS на автоматическом пептидном синтезаторе или неавтоматическом пептидном синтезаторе. Каждая стадия реакции в схеме 1 кратко представлена, как изложено ниже.
[Схема 1]
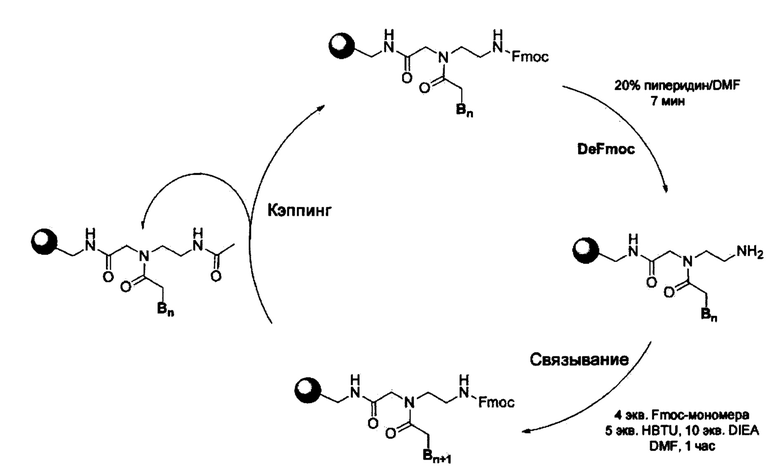
[Активация смолы H-Rink-ChemMatrix] Если аминогруппа на смоле не защищена с помощью Fmoc, встряхивали 0,01 ммоль (около 20 мг смолы) смолы ChemMatrix в 1,5 мл 20% пиперин/DMF в трубке «libra» в течение 20 минут, и раствор DeFmoc отфильтровывали. Смолу промывали в течение 30 сек каждый раз последовательно 1,5 мл метиленхлорида (МС), 1,5 мл диметилформамида (DMF), 1,5 мл МС, 1,5 мл DMF и 1,5 мл МС. Полученные свободные аминогруппы на твердой подложке подвергали связыванию с мономером Fmoc-ПНК.
[DeFmoc] Когда аминогруппа на смоле была защищена Fmoc, суспензию 0,01 ммоль (около 20 мг) смолы встряхивали в 1,5 мл 20% пиперидина/DMF в течение 7 мин, и DeFmoc раствор отфильтровывали. Смолу промывали в течение 30 сек последовательно каждый раз 1,5 мл МС, 1,5 мл DMF, 1,5 мл МС, 1,5 мл DMF и 1,5 мл МС. Полученные свободные аминогруппы на твердой подложке тотчас подвергали связыванию с мономером Fmoc-ПНК.
[Связывание с мономером Fmoc-ПНК] Свободные аминогруппы на твердой подложке связывались с мономером Fmoc-ПНК следующим образом. 0,04 ммолей мономера ПНК, 0,05 ммолей HBTU и 0,1 ммоль DIEA инкубировали в течение 2 мин в 1 мл безводного DMF и прибавляли к смоле со свободными аминогруппами. Раствор смолы встряхивали в течение 1 часа и реакционную смесь фильтровали. Затем смолу промывали в течение 30 сек последовательно каждый раз 1,5 мл МС, 1,5 мл DMF и 1,5 мл МС.
Химические структуры мономеров Fmoc-ПНК с модифицированным нуклеиновым основанием, используемым в данном изобретении, представлены на Фиг. 5. Мономеры Fmoc-ПНК с модифицированным нуклеиновым основанием, представленные на Фиг. 5, должны быть приняты в качестве примеров и, следовательно, не должны рассматриваться для ограничения объема данного изобретения. Специалист в данной области может легко догадаться о целом ряде изменений в мономерах Fmoc-ПНК для синтеза производного ПНК формулы I.
[Кэпирование] После реакции связывания непрореагированные свободные аминогруппы кэпировали при встряхивании в течение 5 минут в 1,5 мл раствора кэпирования (5% уксусный ангидрид и 6% 2,6-лейтидин в DMF). Затем раствор кэпирования отфильтровывали и промывали в течение 30 сек последовательно каждый раз 1,5 мл МС, 1,5 мл DMF и 1,5 мл МС.
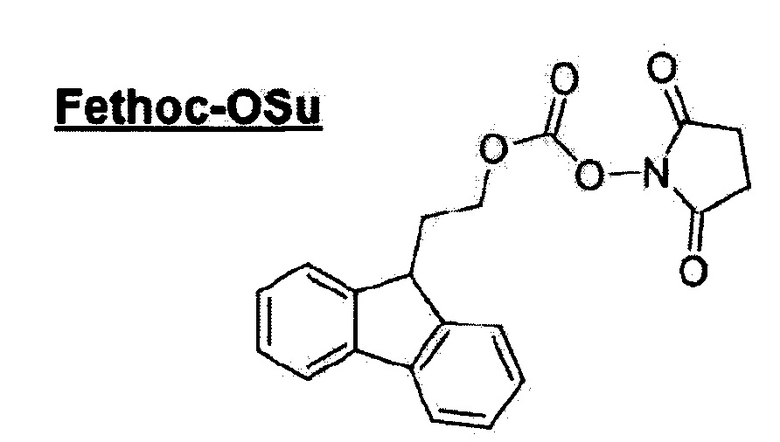
[Введение группы "Fethoc-" в N-конец] Группу "Fethoc-" вводили в N-конец при взаимодействии свободной аминогруппы на смоле с "Fethoc-OSu" с помощью следующего способа. Суспензию смолы в растворе 0,1 ммоля Fethoc-OSu и 0,1 ммоль DIEA в 1 мл безводного MDF встряхивали в течение 1 часа и раствор отфильтровывали. Смолу промывали в течение 30 сек последовательно каждый раз 1,5 мл МС, 1,5 мл DMF и 1,5 мл МС. Химическая структура "Fethoc-OSu" [CAS No. 179337-69-0, C20H17NO5, M.B.351,36], используемая в данном изобретении, приведена, как указано ниже.
[Отщепление смолы] Олигомеры ПНК, связанные со смолой, отщепляли от смолы встряхиванием в течение 3 часов в 1,5 мл отщепляющего раствора (2,5% триизопропилсилана и 2,5% воды в трифторуксусной кислоте). Смолу отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток растирали в порошок с помощью диэтилового эфира и полученный осадок собирали с помощью фильтрации для очистки обращено-фазовой ВЭЖХ.
[Анализ ВЭЖХ и очистка] После отщепления смолы технический продукт производного ПНК очищали с помощью C18-обращено-фазовой ВЭЖХ, элюируя водой/ацетонитрилом или водой/метанолом (градиентный метод), содержащих 0,1% TFA. Фиг. 6а и 6b представляют типичные хроматограммы ВЭЖХ для "АСО 1" до и после очистки ВЭЖХ, соответственно.
Синтетические примеры для производного ПНК формулы I
Для того, чтобы комплементарно целенаправленно воздействовать на 5' сайт сплайсинга "экзона 12" в пре-мРНК АКК-2 человека, производные ПНК данного изобретения получали согласно методикам синтеза, приведенным выше, или с незначительными изменениями. Предоставление таких производных ПНК, целенаправленно воздействующих на пре-мРНК АКК-2 человека, является примером производных ПНК формулы I, и не должно быть истолковано для ограничения объема данного изобретения.

Таблица 1 приводит производные ПНК, комплементарно целенаправленно воздействующие на 5' сайт сплайсинга "экзона 12" в пре-мРНК АКК-2 человека, считанной с гена АКК-2 человека [Стандартная/эталонная последовательность NCBI (Национального центра биотехнологической информации): NG_046907], а также данные по структурному исследованию с помощью масс-спектрометрии. Предоставление производных пептидной нуклеиновой кислоты в таблице 1 данного изобретения является примером производных ПНК формулы I, и не должно быть истолковано для ограничения объема настоящего изобретения.
"АСО 1" имеет 14-мерное комплементарное перекрывание с 14-мерной последовательностью, обозначенной "жирным шрифтом" и "подчеркнутой" в пределах 30-мерной последовательности РНК [(5' → 3') 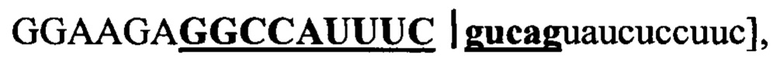 охватывающей область соединения "экзона 12" и "интрона 12" в пре-мРНК АКК-2 человека. Таким образом, "АСО 1" имеет 9-мерное перекрывание с "экзоном 12" и 5-мерное перекрывание с "интроном 12" в пределах пре-мРНК АКК-2 человека.
охватывающей область соединения "экзона 12" и "интрона 12" в пре-мРНК АКК-2 человека. Таким образом, "АСО 1" имеет 9-мерное перекрывание с "экзоном 12" и 5-мерное перекрывание с "интроном 12" в пределах пре-мРНК АКК-2 человека.
Связывающая аффинность "ACQ" для комплементарной ДНК
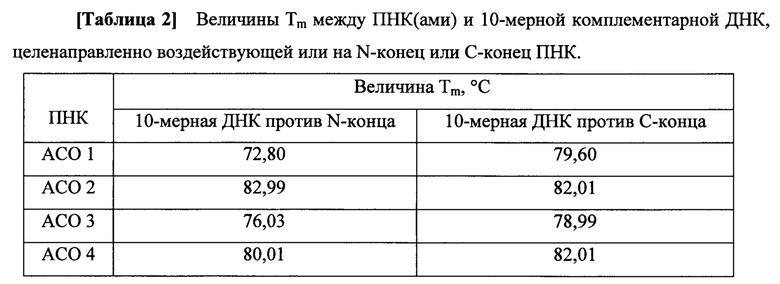
Производные ПНК формулы I оценивали по их связывающей аффинности к 10-мерным ДНК(ам) комплементарно целенаправленно воздействующим или на N-конец или С-конец. Связывающую аффинность оценивали величиной Tm для дуплекса между ПНК и 10-мерной комплементарной ДНК. Дуплекс между производными ПНК и полностью комплементарными ДНК(ами) показывают, что величины Tm слишком высоки, чтобы можно было надежно определить в водном буферном растворе, так как буферный раствор склонен кипеть во время измерения Tm. Величины Tm для полноразмерных ПНК(т) можно предсказать и сравнить на основе величины Tm для дуплекса между ПНК и 10-мерной комплементарной ДНК.
Величины Tm определяли на спектрометре с УФ и видимой областями спектра следующим образом. Смешанный раствор 4 мкМ олигомера ПНК и 4 мкМ комплементарной 10-мерной ДНК в 4 мл водного буфера (рН 7,16, 10 мМ фосфата натрия, 100 мМ NaCl) в 15 мл полипропиленовой пробирке фирмы Falcon инкубировали при 90°С в течение нескольких минут и медленно охлаждали до обычной температуры. Затем раствор переносили в 3 мл кварцевую УФ кювету, снабженную герметичной крышкой, и кювету устанавливали в спектрофотометр Agilent 8453 с УФ и видимой областями спектра. Изменение поглощения при 260 нм регистрировали с повышением температуры кюветы либо на 0,5, либо 1,0°С в минуту. Из кривой поглощения от температуры, температуру, показывающую самую высокую интенсивность поглощения, считывали как температуру Tm между ПНК и 10-мерной ДНК. ДНК(ы) для измерения Tm приобретали от Bioneer (www.bioneer.com, Dajeon, Республика Корея) и использовали без дополнительной очистки.
Наблюдаемые величины Tm производных ПНК формулы I показали высокие значения для комплементарного связывания с 10-мерной ДНК, как представлено в таблице 1.
Например, "АСО 1" показал величину Tm, равную 72,80°С, для дуплекса с 10-мерной комплементарной ДНК целенаправленно воздействующей на 10-мерный N-конец в ПНК как обозначено "жирным шрифтом" и "подчеркнуто" в [(N → С) 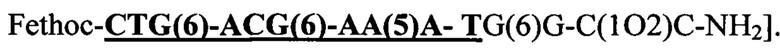 При этом "АСО 1" показал Tm, равную 79,60°С, для дуплекса с 10-мерной комплементарной ДНК целенаправленно воздействующей на 10-мерный С-конец в ПНК как обозначено "жирным шрифтом" и "подчеркнуто" в [(N → С)
При этом "АСО 1" показал Tm, равную 79,60°С, для дуплекса с 10-мерной комплементарной ДНК целенаправленно воздействующей на 10-мерный С-конец в ПНК как обозначено "жирным шрифтом" и "подчеркнуто" в [(N → С) 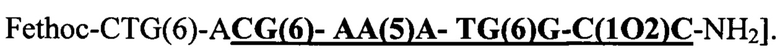
Примеры биологических активностей производных ПНК формулы I
Производные ПНК в данном изобретении оценивали in vitro на антисмысловые активности АКК-2 в скелетных мышечных клетках С2С12 с помощью количественной полимеразной цепной реакции с детекцией в реальном времени (real-time quantitative polymerase chain reaction, RT-qPCR) и т.д. Биологические примеры предусмотрены в качестве примеров для иллюстрации биологических профилей производных ПНК формулы I, и поэтому не должны быть истолкованы для ограничения объема нынешнего изобретения.
Пример 1. Пропуск экзона, индуцированный "АСО 1" в С2С12.
"АСО 1" оценивали по его способности индуцировать пропуск "экзона 12" АКК-2 в клетках С2С12, как описано ниже.
[Культура клеток и обработка АСО] Клетки С2С12 (2×105) (Cat. No. CRL-1772, АТСС) выращивали в 60 мм чашке для культивирования, содержащей модифицированную по способу Дульбекко среду Игла (Dulbecco Modified Eagle Medium: DMEM) (Cat. No. 12-604F, Lonza), подкрепленной 10% FBS (Fetal Bovine Serum - фетальная бычья сыворотка) (Cat. No. 10099-41, GIBCO) и 1% стрептомицина/пенициллина (Cat. No. 15140-122, GIBCO) в атмосфере 5% CO2 при 37°С. Клетки либо ничем не обрабатывали (отрицательный контроль), либо обрабатывали аликвотой водного исходного "ASO 1" в течение 5 часов при 100 зМ до 1 фМ.
[Экстракция РНК и ПЦР в два раунда] Суммарную РНК экстрагировали с помощью RNeasy mini kit (Qiagen, Cat. No. 714106) согласно инструкциям производителя из обработанных АСО 1 клеток и кДНК получали из 200 нг РНК с помощью системы одностадийной ПЦР с обратной транскрипцией (One-Step RT-PCR System Superscript™ III) (Cat. No. 12574-018, Invitrogen). К смеси 200 нг РНК, 25 мкл 2Х рабочего буферного раствор, 2 мкл Superscript III™ RT/Platinum Taq Mix, 1 мкл 10 мкМ (микромольная концентрация) прямого праймера экзона 9 (5'-TTTTCCGACAAGTGCAGAG-3') и 1 мкл 10 мкМ обратного праймера экзона 15 (5'-AACGTCCACAATGTTCAG-3') в ПЦР пробирке прибавляли обработанной в автоклаве дистиллированную воду до общего объема 50 мкл. После реакции при 60°С в течение 30 минут и при 94°С в течение 2 минут, 30 циклов процесса ПЦР при 94°С в течение 15 секунд, при 50°С в течение 30 секунд и при 68°С в течение 1 минуты получали первый неочищенный продукт. Смесь 1 мкл неочищенного продукта, 1 мкл 10 мкМ прямого праймера экзона 10 (5'-GAG ТАС ТТА ТАС AGC CAG G-3') и 1 мкл 10 мкМ обратного праймера экзона 14 (5'-ТТС TGA АСА TCG CGT CTG-3') реагировали, используя набор Taq полимеразы PyroHostStart (Cat. No. K-2611-FCG) согласно инструкциям производителя при 95°С в течение 2 минут и затем имел место процесс ПЦР при 95°С в течение 30 секунд, при 47°С в течение 1 минуты и при 72°С в течение 20 секунд.
[Идентификация продуктов пропуска экзона электрофорезом] Продукты ПЦР (10 мкл) подвергались электрофоретическому разделению на 2% агарозном геле. Ожидаемые полосы от обработки "АСО 1" собирали и анализировали с помощью секвенирования по Сенгеру для оценки последовательности пропуска экзона.
[Пропуск экзона, индуцированный "АСО 1"] Как можно видеть на Фиг. 8, клетки, обработанные "АСО 1" при 0,1 аМ до 1 фМ зависимым от концентрации образом, давали вариант сплайсинга мРНК АКК-2 без экзона 11.
Пример 2. Ингибирование образования мРНК АКК-2 с помощью "АСО 1" в С2С12.
"АСО 1" оценивали с помощью количественной полимеразной цепной реакции с детекцией в реальном времени (RT-qPCR) по его способности подавлять образование мРНК АКК-2 в С2С12, как описано ниже.
[Культура клеток и обработка АСО] Клетки С2С12 (Cat. No. CRL-1772, АТСС) поддерживали в модифицированной по способу Дульбекко среде Игла (DMEM, Cat. No. 12-604F, Lonza), подкрепленной 10% фетальной бычьей сывороткой (Cat. No. 10099-41, GIBCO) и 1% стрептомицина/пенициллина (Cat. No. 15140-122, GIBCO), которые выращивали при 37°С в условиях 5% CO2. Клетки С2С12 (2×105), стабилизированные в течение 24 часов в 60 мм чашке для культивирования, инкубировали в течение 24 часов с "АСО 1" при 0 (отрицательный контроль) и 100 зМ до 1 фМ.
[Экстракция РНК и синтез кДНК] Суммарную РНК экстрагировали с помощью RNeasy Mini kit (Qiagen, Cat. No. 714106) согласно инструкциям производителя из обработанных "ASO 1" клеток и кДНК получали из 400 нг РНК с помощью набора для синтеза первой цепи кДНК PrimeScript™ (Takara, Cat. No. 6110A). К смеси 400 нг РНК, 1 мкл случайного гексамера и 1 мкл dNTP (дезоксинуклеозидтрифосфат) (10 мМ) в ПЦР-пробирке прибавляли воду, обработанную DEPC, до общего объема 10 мкл, которая реагировала при 65°С в течение 5 минут. кДНК синтезировали прибавлением 10 мкл PrimeScript RTase к реакционной смеси и проведением реакции последовательно при 30°С в течение 10 минут и при 42°С в течение 60 минут.
[Количественная ПЦР в реальном времени] Для оценки уровня экспрессии мРНК АКК-2 человека количественную ПЦР в реальном времени выполняли с синтезированной кДНК с помощью линейного разрушаемого зонда (Taqman). Смесь кДНК, линейного разрушаемого зонда (Thermo, Mm01204651), IQ супермикса (BioRad, Cat. No 170-8862) и воды без нуклеазной активности в ПЦР-пробирке реагировала с помощью системы CFX96 Touch в реальном времени (BioRad) в соответствии с условиями цикла, указанными следующим образом: при 95°С течение 3 минут (первичная денатурация), за которым следует 50 циклов по 10 сек при 95°С (денатурация) и 30 сек при 60°С (отжиг и полимеризация). Интенсивность флуоресценции измеряли в конце каждого цикла и результат ПЦР оценивали с помощью кривой плавления. После того, как пороговый цикл (Ct) каждого гена стандартизировали GAPDH, изменение Ct сравнивали и анализировали.
[Снижение мРНК АКК-2 с помощью «АСО 1»] Как можно видеть на Фиг. 9, по сравнению с контрольным экспериментом, количество мРНК АКК-2 уменьшилось при обработке "АСО 1" зависимым от концентрации образом от 100 зМ до 1 фМ, и статистически значимое 30% понижение наблюдалось при обработке "АСО 1" при концентрации 1фМ. (t-критерий Стьюдента был сделан для проверки статистического уровня значимости полученных результатов).
Пример 3. Ингибирование образования мРНК АКК-2 с помощью "АСО 6" в С2С12.
"АСО 6" оценивали с помощью количественной ПЦР в реальном времени по его способности подавлять образование мРНК АКК-2 в С2С12, как описано ниже.
[Культура клеток и обработка АСО] Клетки С2С12 (Cat. No. CRL-1772, АТСС) поддерживали в модифицированной по способу Дульбекко среде Игла (DMEM, Cat. No. 12-604F, Lonza), подкрепленной 10% фетальной бычьей сывороткой (Cat. No. 10099-41, GIBCO) и 1% стрептомицина/пенициллина (Cat. No. 15140-122, GIBCO), которые выращивали при 37°С и в условиях 5% СО2. Клетки С2С12 (2×105), стабилизированные в течение 24 часов в 60 мм чашке для культивирования, инкубировали в течение 24 часов с "АСО 6" при 0 (отрицательный контроль) и 100 зМ до 1 фМ.
[Экстракция РНК и синтез кДНК] Суммарную РНК экстрагировали с помощью RNeasy Mini kit (Qiagen, Cat. No. 714106) согласно инструкциям производителя из обработанных «АСО 6» клеток и кДНК получали из 400 нг РНК с помощью набора для синтеза первой цепи кДНК PrimeScript™ (Takara, Cat. No. 6110A). К смеси 400 нг РНК, 1 мкл случайного гексамера и 1 мкл dNTP (дезоксинуклеозидтрифосфат) (10 мМ) в ПЦР-пробирке прибавляли воду, обработанную DEPC, до общего объема 10 мкл, которая реагировала при 65°С в течение 5 минут. кДНК синтезировали прибавлением 10 мкл PrimeScript RTase к реакционной смеси и проведением реакции последовательно при 30°С в течение 10 минут и при 42°С в течение 60 минут.
[Количественная ПЦР в реальном времени] Для оценки уровня экспрессии мРНК АКК-2 человека количественную ПЦР в реальном времени выполняли с синтезированной кДНК с помощью линейного разрушаемого зонда (Taqman). Смесь кДНК, линейного разрушаемого зонда (Thermo, Mm01204651), IQ супермикса (BioRad, Cat. No 170-8862) и воды без нуклеазной активности в ПЦР-пробирке реагировала с помощью системы CFX96 Touch в реальном времени (BioRad) в соответствии с условиями цикла, указанными следующим образом: при 95°С течение 3 минут (первичная денатурация), за которым следует 50 циклов по 10 сек при 95°С (денатурация) и 30 сек при 60°С (отжиг и полимеризация). Интенсивность флуоресценции измеряли в конце каждого цикла и результат ПЦР оценивали с помощью кривой плавления. После того, как пороговый цикл (Ct) каждого гена стандартизировали GAPDH, изменение Ct сравнивали и анализировали.
[Снижение мРНК АКК-2 с помощью «АСО 6»] Как можно видеть на Фиг. 10, количество мРНК АКК-2 уменьшилось при обработке "АСО 6" зависимым от концентрации образом от 100 зМ до 1 фМ. По сравнению с контрольным опытом статистически значимое 30% и 50% понижение наблюдалось при обработке "АСО 6" при концентрации 1 аМ и 1 фМ, соответственно. (Т-критерий Стьюдента был сделан для проверки статистического уровня значимости полученных результатов).
Пример 4. Ингибирование образования мРНК АКК-2 с помощью "АСО 5" в С2С12.
"АСО 5" оценивали аналогичным методом, как описано ниже.
[Культура клеток и обработка АСО] Клетки С2С12 (Cat. No. CRL-1772, АТСС) поддерживали в модифицированной по способу Дульбекко среде Игла (DMEM, Cat. No. 12-604F, Lonza), подкрепленной 10% фетальной бычьей сывороткой (Cat. No. 10099-41, GIBCO) и 1% стрептомицина/пенициллина (Cat. No. 15140-122, GIBCO), которые выращивали при 37°С и в условиях 5% СО2. Клетки С2С12 (2×105), стабилизированные в течение 24 часов в 60 мм чашке для культивирования, инкубировали в течение 24 часов с "АСО 5" при 0 (отрицательный контроль) и 100 зМ до 1 фМ.
[Экстракция РНК и синтез кДНК] Суммарную РНК экстрагировали с помощью RNeasy Mini kit (Qiagen, Cat. No. 714106) согласно инструкциям производителя из обработанных «АСО 5» клеток и кДНК получали из 400 нг РНК с помощью набора для синтеза первой цепи кДНК PrimeScript™ (Takara, Cat. No. 6110A). К смеси 400 нг РНК, 1 мкл случайного гексамера и 1 мкл dNTP (дезоксинуклеозидтрифосфат) (10 мМ) в ПЦР-пробирке прибавляли воду, обработанную DEPC, до общего объема 10 мкл, которая реагировала при 65°С в течение 5 минут. кДНК синтезировали прибавлением 10 мкл PrimeScript RTase к реакционной смеси и проведением реакции последовательно при 30°С в течение 10 минут и при 42°С в течение 60 минут.
[Количественная ПЦР в реальном времени] Для оценки уровня экспрессии мРНК АКК-2 человека количественную ПЦР в реальном времени выполняли с синтезированной кДНК с помощью линейного разрушаемого зонда (Taqman). Смесь кДНК, линейного разрушаемого зонда (Thermo, Mm01204651), IQ супермикса (BioRad, Cat. No. 170-8862) и воды без нуклеазной активности в ПЦР-пробирке реагировали с помощью системы CFX96 Touch в реальном времени (BioRad) в соответствии с условиями цикла, указанными следующим образом: при 95°С течение 3 минут (первичная денатурация), за которым следует 50 циклов по 10 сек при 95°С (денатурация) и 30 сек при 60°С (отжиг и полимеризация). Интенсивность флуоресценции измеряли в конце каждого цикла и результат ПЦР оценивали с помощью кривой плавления. После того, как пороговый цикл (Ct) каждого гена стандартизировали GAPDH, изменение Ct сравнивали и анализировали.
[Снижение мРНК АКК-2 с помощью «АСО 5»] Как можно видеть на Фиг. 11, количество мРНК АКК-2 уменьшилось при обработке "АСО 5" зависимым от концентрации образом от 100 зМ до 1 фМ. По сравнению с контрольным опытом статистически значимое 30% и 42% понижение наблюдалось при обработке "АСО 5" при концентрации 1 аМ и 1 фМ, соответственно. (Т-критерий Стьюдента был сделан для проверки статистического уровня значимости полученных результатов).
Пример 5. Получение лосьона для ухода за телом, содержащего соединение формулы I (вес./вес. %).
Соединение формулы I, например "АСО 1", входило в состав лосьона для ухода за телом для наружного применения для пациентов. Лосьон для ухода за телом получали, как описано ниже. Учитывая, что существует множество возможных разновидностей лосьона для ухода за телом, данный состав следует рассматривать в качестве примера и не должен быть истолкован для ограничения объема настоящего изобретения.
В отдельном стакане смешанные вещества части А и части В растворяли при 80°С, соответственно. Часть А и часть В смешивали и превращали в эмульсию с помощью гомогенизатора с 3600 об/мин при 80°С в течение 5 минут. Превращенную в эмульсию часть С фильтровали через фильтр 50 меш и фильтрат прибавляли к смеси части А и В. Полученную смесь превращали в эмульсию с помощью гомогенизатора с 3600 об/мин при 80°С в течение 5 минут. После прибавления части D к смеси части А, В и С при 35°С полученную смесь превращали в эмульсию с помощью гомогенизатора с 2500 об/мин при 25°С в течение 3 минут. Наконец, следили за тем, чтобы обеспечить однородную дисперсию и полное уничтожение пены.
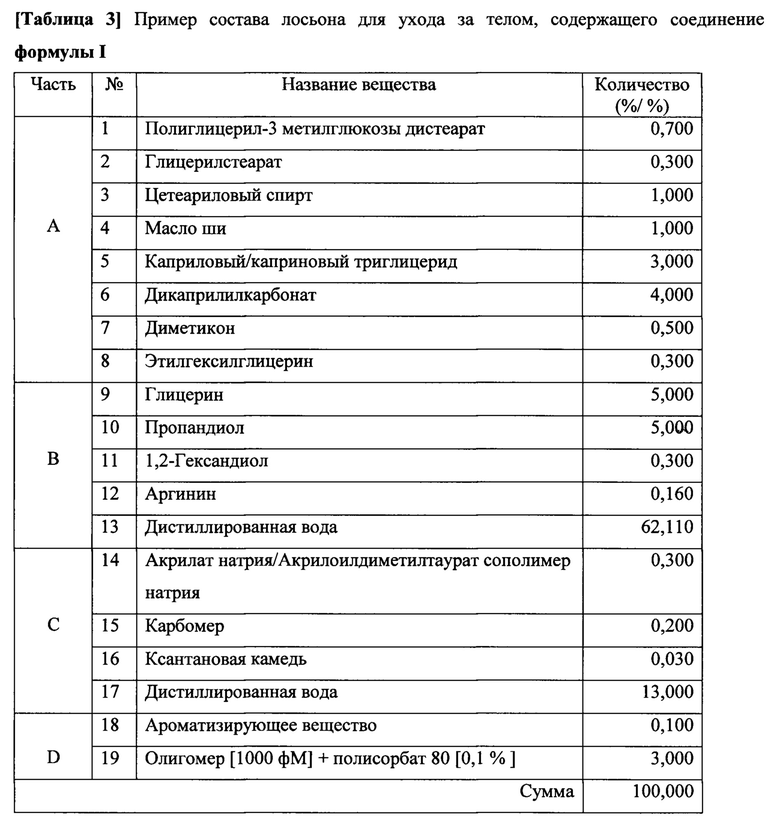
Пример 6. Получение крема для лица, содержащего соединение формулы I (вес/вес, %)
Соединение формулы I, например "АСО 1", входило в состав крема для лица для наружного применения для пациентов. Крем для лица получали, как описано ниже. Учитывая, что существует множество возможных разновидностей крема наружного применения, данный состав следует рассматривать в качестве примера и не должен быть истолкован для ограничения объема настоящего изобретения
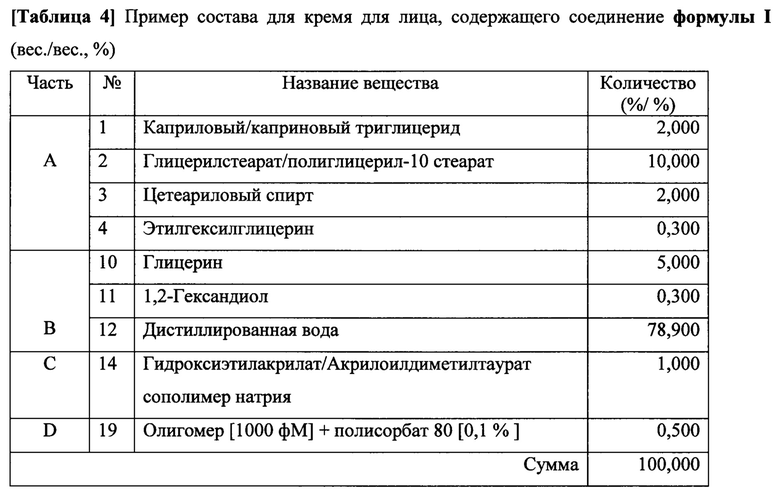
В отдельном стакане смешанные вещества части А и части В растворяли при 80°С, соответственно. Часть А и часть В смешивали и превращали в эмульсию с помощью гомогенизатора с 3600 об/мин при 80°С в течение 5 минут. После прибавления части С к смеси части А и В, полученную смесь превращали в эмульсию с помощью гомогенизатора с 3600 об/мин при 80°С в течение 5 минут. После прибавления части D к смеси части А, В и С при 35°С, полученную смесь превращали в эмульсию с помощью гомогенизатора с 3600 об/мин при 35°С в течение 5 минут. Наконец, следили за тем, чтобы обеспечить однородную дисперсию и полное уничтожение пены при 25°С.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ ТИРОЗИНАЗЫ | 2018 |
|
RU2778786C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ-1 | 2019 |
|
RU2802418C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ К HIF-1-АЛЬФА | 2017 |
|
RU2753517C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ АНДРОГЕНОВОГО РЕЦЕПТОРА | 2017 |
|
RU2753966C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ ДЛЯ SNAP25 | 2017 |
|
RU2766701C2 |
| АНТИСМЫСЛОВОЕ ДЛЯ SCN9A ОБЕЗБОЛИВАЮЩЕЕ СРЕДСТВО | 2018 |
|
RU2762293C2 |
| ПРОПУСК ЭКЗОНОВ С ПОМОЩЬЮ ПРОИЗВОДНЫХ ПЕПТИДО-НУКЛЕИНОВЫХ КИСЛОТ | 2017 |
|
RU2786637C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ ПРОТИВ SCN9A | 2017 |
|
RU2748834C2 |
| ПРОИЗВОДНЫЕ ПЕПТИДО-НУКЛЕИНОВЫХ КИСЛОТ С ХОРОШЕЙ КЛЕТОЧНОЙ ПЕНЕТРАЦИЕЙ И СИЛЬНОЙ АФФИННОСТЬЮ К НУКЛЕИНОВОЙ КИСЛОТЕ | 2009 |
|
RU2564032C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФРАТАКСИНОМ (FXN), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА FXN | 2012 |
|
RU2620980C2 |







Изобретение относится к области биотехнологии. Описана группа изобретения, включающая производное пептидной нуклеиновой кислоты для индукции пропуска экзона в пре-мРНК АКК-2 человека и способ индукции пропуска экзона 12 в пре-мРНК АКК-2 человека с получением варианта сплайсинга мРНК АКК-2 без экзона 12 АКК-2 в клетках in vitro. Производное пептидной нуклеиновой кислоты обладает по меньшей мере 10-мерным комплементарным перекрыванием с 18-мерной последовательностью пре-мРНК [(5'→3') GGCCAUUUCGUCAGUAUC] в пре-мРНК АКК-2 человека. Изобретение расширяет арсенал средств для индукции пропуска экзона в пре-мРНК АКК-2 человека. 2 н. и 3 з.п. ф-лы, 11 ил., 4 табл., 6 пр.
1. Производное пептидной нуклеиновой кислоты, представленное формулой I, или его фармацевтически приемлемая соль для индукции пропуска экзона в пре-мРНК АКК-2 человека:
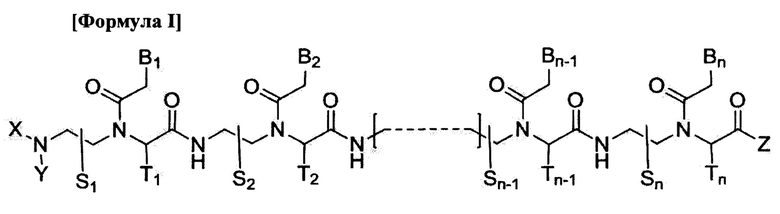
где
n - целое число от 11 до 15;
соединение формулы I обладает по меньшей мере 10-мерным комплементарным перекрыванием с 18-мерной последовательностью пре-мРНК [(5'→3') GGCCAUUUCGUCAGUAUC] в пре-мРНК АКК-2 человека;
соединение формулы I полностью комплементарно пре-мРНК АКК-2 человека или частично комплементарно пре-мРНК АКК-2 человека с одним или двумя ошибочными спариваниями;
S1,S2, …, Sn-1, Sn, T1,T2, …, Tn-1 и Tn обозначают атом водорода;
X и Y независимо обозначают атом водорода или замещенную или незамещенную алкилоксикарбонилгруппу;
Z обозначает замещенную или незамещенную аминогруппу;
B1, В2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения; и
по меньшей мере четыре из B1, В2, …, Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения с замещенной или незамещенной аминогруппой, ковалентно связанной с остатком нуклеинового основания.
2. Производное пептидной нуклеиновой кислоты по п. 1 или его фармацевтическая соль,
где
n - целое число от 11 до 15;
соединение формулы I обладает по меньшей мере 10-мерным комплементарным перекрыванием с 18-мерной последовательностью пре-мРНК [(5'→3') GGCCAUUUCGUCAGUAUC] в пре-мРНК АКК-2 человека;
соединение формулы I полностью комплементарно пре-мРНК АКК-2 человека или частично комплементарно пре-мРНК АКК-2 человека с одним или двумя ошибочными спариваниями;
S1,S2, …, Sn-l, Sn, T1, Т2, …, Tn-1 и Tn обозначают атом водорода;
X и Y независимо обозначают атом водорода или замещенную или незамещенную алкилоксикарбонилгруппу;
Z обозначает замещенную или незамещенную аминогруппу;
B1, В2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения;
по меньшей мере четыре из B1, В2, …, Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения, представленных формулой II, формулой III или формулой IV:
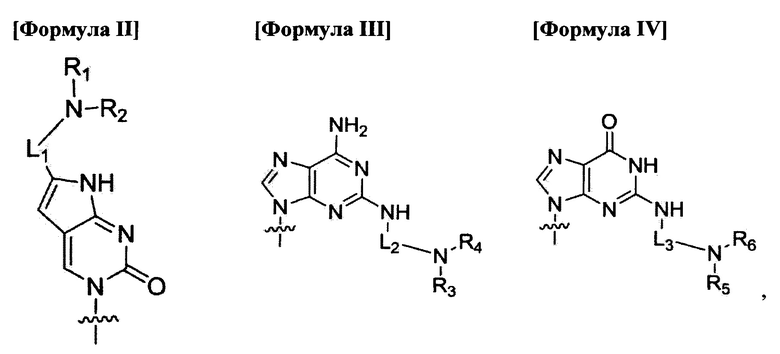
где
R1, R2, R3, R4, R5 и R6 являются атомом водорода;
L1, L2 и L3 являются ковалентным линкером, представленным формулой V, ковалентно соединяющим основную аминогруппу с остатком нуклеинового основания:
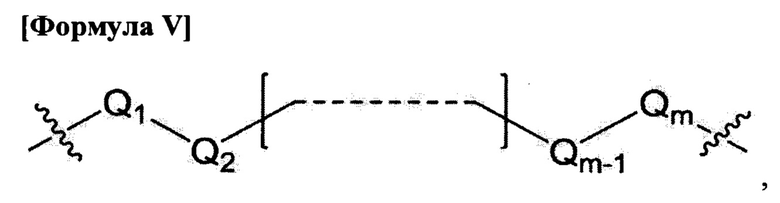
где
Q1 и Qm представляют собой замещенную или незамещенную метиленгруппу (-СН2-) и Qm непосредственно связывает основную аминогруппу;
Q2, Q3, … и Qm-1 независимо выбраны из замещенной или незамещенной метиленгруппы и атома кислорода (-O-); и
m - целое число от 1 до 15.
3. Производное пептидной нуклеиновой кислоты по п. 2 или его фармацевтическая соль, где
n - целое число от 11 до 15;
соединение формулы I обладает по меньшей мере 10-мерным комплементарным перекрыванием с 18-мерной последовательностью пре-мРНК [(5'→3') GGCCAUUUCGUCAGUAUC] в пре-мРНК АКК-2 человека;
соединение формулы I полностью комплементарно пре-мРНК АКК-2 человека;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой атом водорода;
X является атомом водорода;
Y обозначает замещенную или незамещенную алкилоксикарбонилгруппу;
Z обозначает замещенную или незамещенную аминогруппу;
B1, В2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включая аденин, тимин, гуанин, цитозин и урацил, и нуклеиновых оснований не природного происхождения;
по меньшей мере пять из B1, В2, …, Bn-1 и Bn независимо выбраны из нуклеиновых оснований не природного происхождения, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 являются атомом водорода;
L1 обозначает -(СН2)2-O-(СН2)2-группу, -СН2-O-(СН2)2-группу, -СН2-O-(СН2)3- группу, -СН2-O-(СН2)4- группу или -CH2-O-(CH2)5-группу; и
L2 и L3 независимо выбраны из -(СН2)2-O-(СН2)2-группы, -(СН2)3-O-(СН2)2-группы, -(СН2)2-O-(СН2)3-группы, -(СН2)2-группы, -(СН2)3-группы, -(СН2)4-группы, -(СН2)5-группы, -(СН2)6-группы, -(СН2)7-группы и -(СН2)8-группы.
4. Производное пептидной нуклеиновой кислоты по п. 3, которое выбрано из группы производных пептидной нуклеиновой кислоты, приведенной ниже, или его фармацевтически приемлемая соль:
(N→C) Fethoc-CTG(6)-ACG(6)-AA(5)A-TG(6)G-C(1O2)C-NH2;
(N→C) Fethoc-CTG(6)-AC(1O2)G-A(5)AA(5)-TG(6)G-NH2; и
(N→C) Fethoc-CTG(6)-AC(lO2)G-A(5)AA(5)-TG(6)G-C(1O2)C-NH2,
где
A, G, T и С представляют собой мономеры пептидной нуклеиновой кислоты с природным нуклеиновым основанием аденином, тимином, гуанином и цитозином, соответственно;
С(1O2), А(5) и G(6) представляют собой мономеры пептидной нуклеиновой кислоты с нуклеиновым основанием не природного происхождения, как указано ниже:
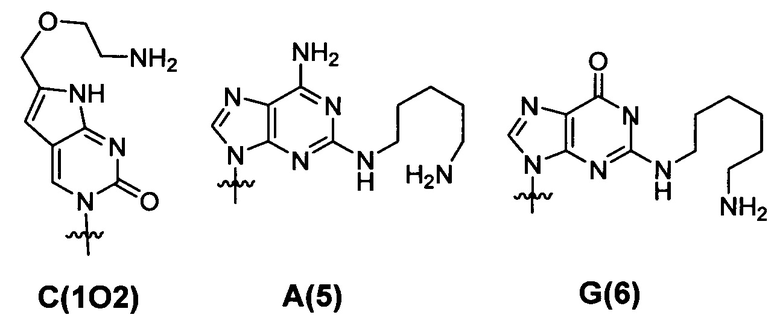
и
"Fethoc-" представляет собой сокращение для "[2-(9-фторенил)этил-1-окси]карбонилгруппы".
5. Способ индукции пропуска экзона 12 в пре-мРНК АКК-2 человека с получением варианта сплайсинга мРНК АКК-2 без экзона 12 АКК-2 в клетках in vitro, включающий введение в контакт клеток с 1 пМ или менее водным раствором производного пептидной нуклеиновой кислоты по п. 1 или его фармацевтически приемлемой соли.
| WO 2018122610 A1 05.07.2018 | |||
| WO 2018127733 A1 12.07.2018 | |||
| WO 2018138585 A1 02.08.2018 | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
Авторы
Даты
2023-11-17—Публикация
2019-08-05—Подача