Область техники, к которой относится изобретение
Изобретение относится к области электрохимического материаловедения и электрохимической технологии, более конкретно к аноду низкотемпературного топливного элемента с полимерной мембраной, использующего в качестве топлива метанол или водород. Изобретение также предоставляет способ изготовления такого анода.
Уровень техники
В международной заявке WO 2008/110651 (опубл. 18.09.2008) раскрыт трехкомпонентный катализатор состава Pt-Ru-MeOx (Me представляет собой Мо, W или V), нанесенный на углеродную подложку, в котором Pt и Ru присутствуют в форме металлических наночастиц, a Me присутствует в форме оксидов в различных спепенях окисления, отличающийся тем, что соотношение атомов Pt/Ru находится в пределах 0,1-2, соотношение атомов Pt/Me находится в пределах 0,1-10. Катализатор способен окислять СО до СО2 при потенциалах, начиная с 0,1 В, по отношению к обратимому водородному электроду в растворе серной кислоты с концентрацией 0,5 моль/л. Примерами предпочтительного осуществления изобретения подтверждено эффективное окисление СО до CO2 начиная с потенциала 0,3 В. Рассматриваемый катализатор не предназначен для непосредственного применения метанола в качестве топлива.
В заявке US 20060141334 (опубл. 29.06.2006) описан твердый анодный катализатор для низкотемпературых топливных элементов, активный слой которого является солью гетерополикислоты, включающей благородный металл и/или переходный металл; эта соль имеет молекулярную массу от 800 до 10000. Благородный металл выбран из платиновой группы, а переходный металл может быть молибденом. В примерах показана применимость промышленно выпускаемой гетерополикислоты состава Na5H3[PtMo6O24]·xH2O (структура андерсеновского типа) в качестве катализатора окисления метанола в топливном элементе (1 М СН3ОН+0,5 М H2SO4). Электроокисление метанола в значимой степени начинается лишь при потенциале выше 0,5 В, а максимальный анодный ток достигается при потенциале не ниже 0,75 В по отношению к обратимому водородному электроду (ОВЭ) в том же растворе, что является недостатком при практическом применении разработанного анода.
В патенте СА 2219213 (опубл. 25.04.1998) раскрыт состав анодного катализатора, включающий платину, компонент М и компонент Y, где платина и компонент М образуют сплав и сплав Pt-M находится в тесном контакте с компонентом Y. Компонент М выбран из элементов групп IIIA и IVA, а Y представляет молибден, вольфрам или их оксиды. Предложенные катализаторы эффективны для окисления водорода, содержащего порядка 12 частей на миллион СО. Их применение для электроокисления метанола не описано.
В заявке US 20050147867 (опубл. 07.06.2005) раскрыт состав активного слоя электрода, включающего два компонента. Первый каталитический компонент соответствует формуле Pt-Y (Y - молибден, вольфрам или их оксиды), второй каталитический компонент может быть описан формулой Pt-M (М представляет собой, в частности, рутений); первый и второй каталитические компоненты формируют один смешанный слой и находятся в электрическом контакте друг с другом. Показано, что катализатор эффективно работает лишь до содержания СО в газовой смеси в 100 ppm, что является существенным недостатком таких катализаторов и делает их применение малоперспективным.
В патенте СА 2268694 (опубл. 15.10.1999) раскрыт анод топливного элемента для окисления метанола, который в качестве первичного каталитически активного компонента содержит, по меньшей мере, один металл платиновой группы или его сплав, отличающийся тем, что в состав каталитического слоя также входят комплексы переходного металла с незамещенными и замещенными фталоцианинами, за счет чего усиливается каталитический эффект металла платиновой группы при анодном окислении метанола. В качестве переходного металла применяют никель или палладий. Согласно представленным в патенте данным каталитический эффект в отношении реакции электроокисления СН3ОН по сравнению с Pt/Pd-электродом небольшой. В патенте отсутствуют сведения об устойчивости электродного материала в процессе его длительной работы.
В заявке ЕР 1819004 (опубл. 15.08.2007) раскрыт катализатор для прямого окисления спирта, содержащий платину и вещество, приготовленное из молибдена и, по меньшей мере, одного молибденового соединения в качестве активной составляющей. В диапазоне потенциалов 0,4-0,6 В относительно хлорид-серебряного электрода сравнения, т.е. более 0,6 В относительно ОВЭ, бинарные платино-молибденовые катализаторы, содержащие 69-82% Pt, при окислении метанола способны давать ток плотностью 5-25 мА/см2 геометрической поверхности электрода при загрузке Pt ~0,37 мг/см2. Однако для практического использования таких анодов желательно проводить окисление метанола при менее положительных электродных потенциалах.
В публикации Weishan Li, Jin Lu, Jinghua Du, Dongsheng Lu, Hongyu Chen, Hong Li, Yingmin W. «Electrocatalytic oxidation ofmethanol on polyaniline-stabilized Pt-НхМоО3 in sulfuric acid solution». Electrochemistry Communications. №7 (2005). P. 406-410 описан электрод с каталитическим слоем состава полианилин-платина-молибденовая бронза (Pan-Pt-HxMoO3, где x принимает значения от 0 до 2), на котором окисление метанола (0,1 М СН3ОН+0,5 М H2SO4) возможно при потенциале 0,6 В относительно хлорид-серебряного электрода (более 0,8 В относительно ОВЭ). В первоначальный момент электролиза токи на Pan-Pt-HxMoO3-электроде существенно превышают токи на Pt-электроде. Однако спустя 1800 секунд после начала электролиза (потенциал составляет 0,6 В относительно хлорид-серебряного электрода) токи на Pan-Pt-НхМоО3-электроде уменьшаются практически до нуля. Это является существенным недостатком предложенной системы.
В публикации Р. Justin, G. Ranga Rao «Methanol oxidation on МоО3 promoted Pt/C electrocatalyst». International Journal of Hydrogen Energy. Vol.36 (2011). P.5875-5884 описаны катализаторы C/Pt-МоО3, в которых массовое соотношение Pt:МоО3 составляет 2:1, 2:2 и 2:3, а каталитический слой нанесен на углеродный носитель Vulcan carbon XC-72R (производство Cabot Corp.). Для катализатора C/Pt-МоО3 (2:2) исследование окисления метанола (1,0 М СН3ОН+0,5 М H2SO4) при потенциале 0,6 В относительно хлорид-серебряного электрода (~0,80 В относительно ОВЭ) показало уменьшение тока от 300 до 200 мА/мг Pt в течение первых 1800 секунд электролиза, что соответствует снижению каталитической активности на треть.
В качестве аналога предлагаемого технического решения авторы рассматривают анод метанольного топливного элемента, описанный в статье X.D. Xiang, Q.M. Huang, Z. Fu, Y.L. Lin, W. Wu, S.J. Hu, W.S. Li «НхМоО3-assisted deposition of platinum nanoparticles on MWNTs for electrocatalytic oxidation ofmethanol». International Journal of Hydrogen Energy. Vol.37 (2012) P.4710-4716. В этой публикации описаны катализаторы для электроокисления метанола, нанесенные на одностенные углеродные нанотрубки (MWNTs). Наночастицы платины нанесены на указанный носитель полиольным методом с использованием этиленгликоля в качестве восстановителя. В состав активного слоя электрода введены молибденовые бронзы HxMoO3, где х принимает значение от 0 до 2. При потенциале 0,6 В относительно хлорид-серебряного электрода (~0.80 В относительно ОВЭ) в системе 0,5 М H2SO4+0.5 M СН3ОН указанный электрод способен давать ток плотностью не ниже 0,4 А/см2 геометрической поверхности электрода. За время эксперимента (1000 с) плотность тока уменьшается примерно на треть.
Главным недостатком анодов, описанных в указанных научных публикациях, является то, что электроокисление метанола проводится при сильно положительных потенциалах относительно обратимого водородного электрода в том же растворе (не ниже 0,8 В). Это делает неперспективным их применение в реальных топливных элементах вследствие крайне небольшой электродвижущей силы, которая может быть получена в метанол-кислородных топливных элементах, использующих такие аноды. Кроме того, предложенные электроды отравляются продуктами прочной хемосорбции, что приводит к уменьшению токов окисления в течение времени.
Таким образом, существует потребность в разработке новых анодов для низкотемпературных метанольных и водородных топливных элементов для преодоления и устранения указанных недостатков известных технических решений.
Раскрытие изобретения
В результате обширных исследований авторы настоящего изобретения установили, что недостатки известного уровня техники в большой мере могут быть преодолены созданием анода низкотемпературного метанольного или водородного топливного элемента с полимерной мембраной, включающего электропроводный углеродный носитель, каталитический слой и токоотвод, который в качестве каталитического слоя содержит композитный материал, приготовленный из соединений платины и водородсодержащих молибденовых бронз состава HxMoO3, где х принимает значение от 0,2 до 0,4, и для получения указанного каталитического композитного материала:
а) химически синтезируют молибденовую бронзу состава HxMoO3, где х принимает значение от 0,2 до 0,4, восстановлением оксида молибдена (VI) цинковым порошком в среде 2-3 М хлористоводородной кислоты при 0-10°С;
б) синтезированную бронзу намазывают на поверхность электропроводного углеродного носителя с получением электрода-предшественника С/HxMoO3;
в) электрод-предшественник высушивают в токе аргона при температуре от 150 до 200°С и помещают в электрохимическую ячейку с деаэрированным раствором, содержащим растворимую соль Pt(II) в 0,5-1,0 М серной кислоте;
г) в растворе, насыщенном аргоном, проводят бестоковое осаждение платины на электрод-предшественник за счет перезарядки молибденовой бронзы с получением электрода, имеющего каталитический слой из nPt0 (Hx-2n-МоО3), и полученный электрод отмывают 0,5-1,0 М серной кислотой от соединений платины с получением анода низкотемпературного метанольного или водородного топливного элемента.
Первым техническим результатом является повышение стабильности тока электроокисления метанола во времени. Другим техническим результатом является существенное снижение рабочего потенциала анода при электроокислении метанола до 0,4-0,6 В относительно обратимого водородного электрода в том же растворе, что более приемлемо для реальных электрокаталитических приложений. Третьим техническим результатом изобретения является распространение области применения анода низкотемпературного топливного элемента с полимерной мембраной не только на процесс электроокисления метанола, но и на процесс окисления водорода, существенно загрязненного монооксидом углерода. Еще одним результатом является замена в составе каталитического слоя анода дефицитного и дорогостоящего рутения на более доступный и дешевый молибден без ухудшения каталитической активности и других важных электрохимических характеристик получаемого электрода.
Технические результаты достигаются за счет осуществления предлагаемого способа изготовления анода низкотемпературного метанольного или водородного топливного элемента с полимерной мембраной, характеризующийся следующей последовательностью операций:
а) химически синтезируют молибденовую бронзу состава HxMoO3, где х принимает значение от 0,2 до 0,4, восстановлением оксида молибдена (VI) цинковым порошком в среде 2-3 М хлористоводородной кислоты при 0-10°С;
б) синтезированную бронзу намазывают на поверхность электропроводного углеродного носителя с получением электрода-предшественника С/HxMoO3;
в) электрод-предшественник высушивают в токе аргона при температуре от 150 до 200°С и помещают в электрохимическую ячейку с деаэрированным раствором, содержащим растворимую соль Pt(II) в 0,5-1,0 М серной кислоте;
г) в растворе, насыщенном аргоном, проводят бестоковое осаждение платины на электрод-предшественник за счет перезарядки молибденовой бронзы с получением электрода, имеющего каталитический слой из nPt (Hx-2nMoO3), и полученный электрод отмывают 0,5-1,0 М серной кислотой от соединений платины с получением анода низкотемпературного метанольного или водородного топливного элемента.
Не ограничиваясь конкретной теорией, авторы изобретения утверждают, что предлагаемый способ изготовления электрода обеспечивает образование на его поверхности каталитического слоя, эффективно окисляющего метанол и моноксид углерода при потенциалах 0,4-0,6 В относительно ОВЭ в том же растворе. Эффективность электроокисления объясняется бифункциональным механизмом электрокатализа: на частицах платины происходит адсорбция СО-подобных частиц, а окисленная молибденовая бронза обеспечивает присутствие кислородсодержащих соединений на границе Pt/Hx-2nMoO3. В результате химической реакции между ними происходит десорбция хемосорбированного вещества, являющегося ядом для электроокисления малых органических молекул, с поверхности платины. Это приводит к ускорению электроокисления метанола (монооксида углерода) через слабосвязанные с поверхностью электрода частицы.
Краткое описание чертежей
На фиг.1 представлена хроноамперометрограмма окисления метанола (система 0,5 М H2SO4/1,0 М СН3ОН) на аноде при потенциале 0,60 В относительно ОВЭ в соответствии с одним из вариантов осуществления изобретения (кривая а) по сравнению с анодом со слоем платины, нанесенной электроосаждением из раствора H2PtCl6 при Е 0,25 В (кривая b).
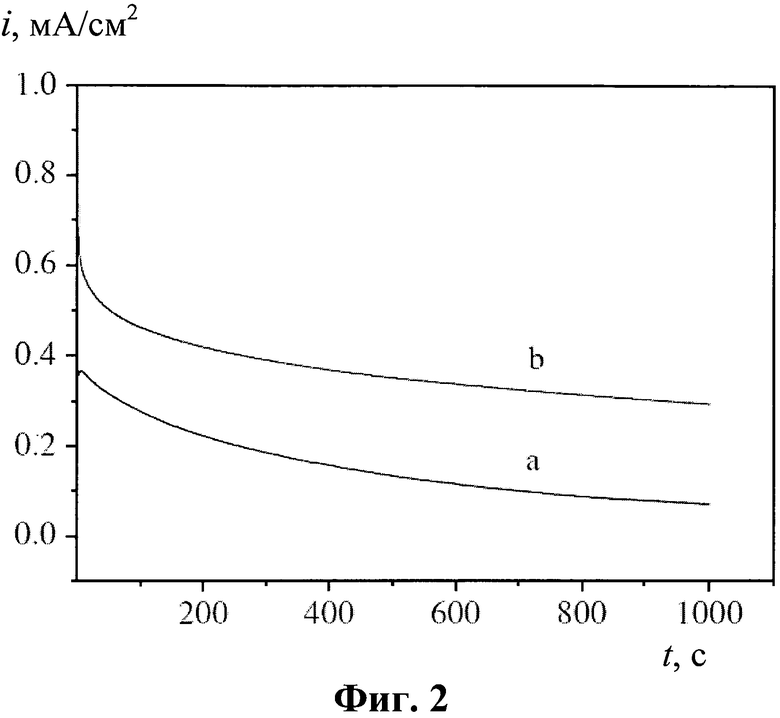
На фиг.2 представлена хроноамперометрограмма окисления метанола (система 0,5 М H2SO4/0,5 М СН3ОН) на аноде-аналоге изобретения (кривая b) при потенциале 0,6 В относительно хлорид-серебряного электрода (0,8 В относительно ОВЭ) по сравнению с анодом со слоем платины, осажденной на носителе (одностенные углеродные нанотрубки MWNTs, кривая а).
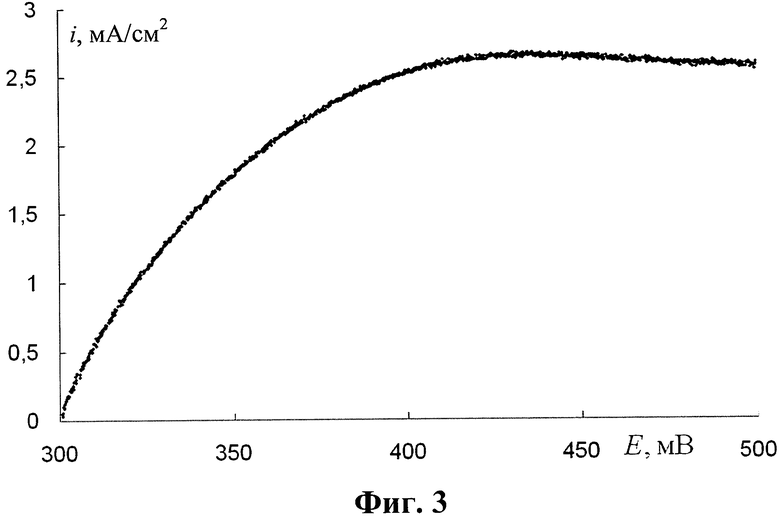
На фиг.3 показана анодная поляризационная кривая, полученная на предлагаемом аноде в 0,5 М растворе H2SO4, насыщенном СО на вращающемся дисковом электроде (ВДЭ).
Осуществление изобретения
Возможность осуществления изобретения с достижением его технических результатов будет показана на следующих примерах.
Пример 1. Изготовление анода
Водородсодержащую молибденовую бронзу получают химическим восстановлением 3,0 г МоО3 цинковым порошком (первая порция составляет 0,5 г, последующие порции 0,1 г) в среде 2-3 М хлористоводородной кислоты при 0-10°С.
В результате синтеза получают красную моноклинную бронзу НхМоО3 с содержанием водорода в ней х=0,2-0,4.
Полученную бронзу без связующего наносят на плоскую поверхность стеклоуглерода (GC) или иного углеродного носителя в расчете 3,75±0,3 мг на 1 см2 геометрической поверхности электрода. Толщина нанесенного слоя молибденовых бронз составляет приблизительно 9 мкм. Приготовленный таким образом электрод высушивают в токе аргона особой чистоты, получая электрод-предшественник.
Перед осаждением платины электрод-предшественник С/HxMoO3 поляризуют в 0,5 М серной кислоте в течение 30 мин, поддерживая потенциал приблизительно равным -0,1 В отн. о.в.э., учитывая, что более низкий потенциал приводит к разрушению слоя молибденовой бронзы. Затем прекращают наложение внешнего поляризующего тока и раствор серной кислоты заменяют деаэрированным раствором, содержащим 0,002 моль/л K2PtCl4 в 0,5 М серной кислоте, что обеспечивает осаждение платины без протекания внешнего тока. Продолжительность осаждения составляет от 9 до 12 ч, при этом достигается практически постоянное значение потенциала электрода, составляющее приблизительно 0,55 В. Дальнейшая выдержка электрода в растворе не имеет смысла, поскольку скорость осаждения платины становится очень низкой, а слой оксидных соединений молибдена может разрушаться.
Полученный материал охарактеризован методом рентгенофазового анализа (РФА). На дифрактограмме наблюдаются рефлексы при 2θ=33,82°, 39,74° и 67,63°, характерные для платины и при 2θ=12,83°, 23,40°, 25,77°, 27,39°, характерные для окисленной молибденовой бронзы (CuKα-излучение).
Примеры 2-9. Электрохимическое окисление метанола
Анод с геометрической поверхностью 2 см помещают в ячейку, наполненную раствором (20-100 мл), содержащим от 0,1 до 1,0 моль/л метанола и 0,5 моль/л серной кислоты. При помощи потенциостата потенциал анода задают в интервале от 0,4 до 0,6 В и в течение времени от 10 минут до 5 часов регистрируют зависимость тока, протекающего через анод, от времени. Данные приведены в таблицах 1 и 2.
Результаты показывают, что при потенциале 0,45 В относительное снижение тока во времени сопоставимо с аналогичной величиной для анода-аналога, работающего при намного более высоком потенциале 0,8 В относительно ОВЭ, что соответствует значению 0,6 В относительно хлорид-серебряного электрода, приведенному в статье, описывающей аналог. Из-за того, что данные, полученные в соответствии с изобретением, и данные, приведенные в статье X.D. Xiang, Q.M. Huang, Z. Fu, Y.L. Lin, W. Wu, S.J. Hu, W.S. Li «НхМоО3-assisted deposition of platinum nanoparticles on MWNTs for electrocatalytic oxidation of methanol». International Journal of Hydrogen Energy. Vol.37 (2012). P. 4710-4716, относятся к разным значениям потенциала электрода (0,6 и 0,8 В соответственно), их сравнение невозможно.
Известно, что Pt-Ru-электроды, такие как электрод, описанный в статье Chi С.-F., Yang M.-C., Weng H.-Sh. A proper amount of carbon nanotubes for improving the performance of Pt-Ru/C catalysts for methanol electrooxidation // Journal of Power Sources. Vol.193 (2009). P.462-469, обладают наилучшей каталитической активностью в реакции электроокисления метанола. Сравнение каталитической активности анода, изготовленного в соответствии с изобретением, с данными, приведенными в указанной статье, показало, что активность изготовленных образцов не уступает активности дорогостоящего и дефицитного Pt-Ru-катализатора. Кроме того, при сравнении данных надо иметь в виду, что приведенные в статье данные относятся к 30°С, тогда как характеристики анодов в соответствии с изобретением были получены при более низкой температуре (25°С).
Относительное снижение тока во времени (за 800 с) для предлагаемого электрода меньше (23%), чем для аналога MWNTs/Pt-HxMoO3 (30%). Таким образом, анод, изготовленный в соответствии с изобретением, превосходит известные аналоги по устойчивости каталитического эффекта во времени.
Пример 10
Водный раствор H2SO4 (0,5 М) в течение 30 минут насыщают барботированием СО со скоростью приблизительно 1 пузырек в минуту. На поверхность вращающегося дискового электрода (ВДЭ) наносят каталитический слой, приготовленный в соответствии с изобретением, ВДЭ помещают в раствор, задают и поддерживают частоту вращения 500 мин-1 и проводят электроокисление оксида углерода (II) (СО) в потенциодинамическом режиме при развертке потенциала от Енач 0,3 В в анодную сторону со скоростью 5 мВ/с, осуществляя поляризационные измерения.
Эффективное окисление растворенного в электролите СО начинается при потенциалах положительнее 0,3 В, а предельный диффузионный ток окисления достигается при потенциале 0,4 В, что существенно лучше по сравнению с результатами для аналогов (0,50-0,60 В), в частности - для раскрытого в заявке WO 2008/110651.
Высокая электрокаталитическая активность предложенного катализатора в реакции электроокисления растворенного в электролите СО позволяет считать, что электрод должен иметь высокую устойчивость к примеси СО в водороде, используемом в водородно-кислородном топливном элементе, и, следовательно, включающий его элемент способен работать на водороде с большим содержанием СО.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРИГОТОВЛЕНИЯ БИМЕТАЛЛИЧЕСКОГО КАТАЛИЗАТОРА (ВАРИАНТЫ) И ЕГО ПРИМЕНЕНИЕ ДЛЯ ТОПЛИВНЫХ ЭЛЕМЕНТОВ | 2010 |
|
RU2428769C1 |
| Способ приготовления электрода-катализатора для электрохимического получения водорода | 2022 |
|
RU2813184C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ КАТАЛИТИЧЕСКОГО ЭЛЕКТРОДА НА ОСНОВЕ ГЕТЕРОПОЛИСОЕДИНЕНИЙ ДЛЯ ВОДОРОДНЫХ И МЕТАНОЛЬНЫХ ТОПЛИВНЫХ ЭЛЕМЕНТОВ | 2012 |
|
RU2561711C2 |
| КАТАЛИЗАТОР ДЛЯ ТВЁРДОПОЛИМЕРНЫХ ТОПЛИВНЫХ ЭЛЕМЕНТОВ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2022 |
|
RU2802919C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ МЕМБРАННО-ЭЛЕКТРОДНОГО БЛОКА С ТВЕРДЫМ ПОЛИМЕРНЫМ ЭЛЕКТРОЛИТОМ | 2023 |
|
RU2805994C1 |
| КАТАЛИТИЧЕСКИЙ ЭЛЕКТРОД ДЛЯ СПИРТОВЫХ ТОПЛИВНЫХ ЭЛЕМЕНТОВ | 2012 |
|
RU2507640C1 |
| ЭЛЕКТРОКАТАЛИЗАТОР ДЛЯ ТВЁРДОПОЛИМЕРНЫХ ТОПЛИВНЫХ ЭЛЕМЕНТОВ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2022 |
|
RU2798434C1 |
| Способ изготовления самоувлажняющегося электрокатализатора для водородно-воздушных топливных элементов | 2020 |
|
RU2744103C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ПЛАТИНО-РУТЕНИЕВЫХ ЭЛЕКТРОКАТАЛИЗАТОРОВ | 2010 |
|
RU2446009C1 |
| АНОД ДЛЯ ПРЯМОГО ЭЛЕКТРООКИСЛЕНИЯ БОРГИДРИДОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ | 2009 |
|
RU2396637C1 |
Изобретение относится к области электротехники, а именно к аноду низкотемпературного метанольного топливного элемента с полимерной мембраной и способу его изготовления. Предложенный анод содержит в качестве каталитического слоя композитный материал, приготовленный из соединений платины и водородсодержащих молибденовых бронз состава НxМоО3; где х принимает значение от 0,2 до 0,4. Повышение стабильности тока электроокисления метанола во времени, существенное снижение рабочего потенциала анода при электроокислении метанола до 0,4-0,6 В, а также устойчивость к примеси СО в водороде является техническим результатом изобретения. 2 н.п. ф-лы, 3 ил., 2 табл., 10 пр. 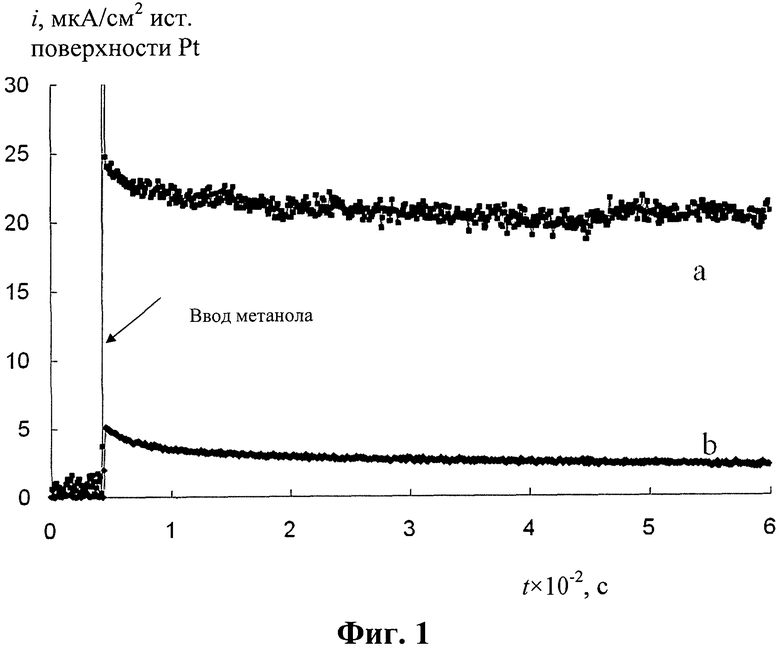
1. Анод низкотемпературного метанольного топливного элемента с полимерной мембраной, включающий электропроводный углеродный носитель, каталитический слой и токоотвод, отличающийся тем, что в качестве каталитического слоя содержит композитный материал, приготовленный из соединений платины и водородсодержащих молибденовых бронз состава HxMoO3, где х принимает значение от 0,2 до 0,4, и указанный каталитический композитный материал получен способом, при осуществлении которого:
а) химически синтезируют молибденовую бронзу состава HxMoO3, где х принимает значение от 0,2 до 0,4, восстановлением оксида молибдена (VI) цинковым порошком в среде 2-3 М хлористоводородной кислоты при 0-10°С;
б) синтезированную бронзу намазывают на поверхность электропроводного углеродного носителя с получением электрода-предшественника С/HxMoO3;
в) электрод-предшественник высушивают в токе аргона при температуре от 150 до 200°С и помещают в электрохимическую ячейку с деаэрированным раствором, содержащим растворимую соль Pt(II) в 0,5-1,0 М серной кислоте;
г) в растворе, насыщенном аргоном, проводят бестоковое осаждение платины на электрод-предшественник за счет перезарядки молибденовой бронзы с получением электрода, имеющего каталитический слой из nPt (Hx-2nMoO3) и полученный электрод отмывают 0,5-1,0 М серной кислотой от соединений платины с получением анода низкотемпературного метанольного или водородного топливного элемента.
2. Способ изготовления анода низкотемпературного метанольного или водородного топливного элемента с полимерной мембраной, характеризующийся тем, что при осуществлении указанного способа:
а) химически синтезируют молибденовую бронзу состава HxMoO3, где х принимает значение от 0,2 до 0,4, восстановлением оксида молибдена (VI) цинковым порошком в среде 2-3 М хлористоводородной кислоты при 0-10°С;
б) синтезированную бронзу намазывают на поверхность электропроводного углеродного носителя с получением электрода-предшественника С/HxMoO3;
в) электрод-предшественник высушивают в токе аргона при температуре от 150 до 200°С и помещают в электрохимическую ячейку с деаэрированным раствором, содержащим растворимую соль Pt(II) в 0,5-1,0 М серной кислоте;
г) в растворе, насыщенном аргоном, проводят бестоковое осаждение платины на электрод-предшественник за счет перезарядки молибденовой бронзы с получением электрода, имеющего каталитический слой из nPt0 (Hx-2nMoO3), и полученный электрод отмывают 0,5-1,0 М серной кислотой от соединений платины с получением анода низкотемпературного метанольного или водородного топливного элемента.
| CN 103606687 A, 26.02.2014 | |||
| ЭЛЕКТРОКАТАЛИЗАТОР ВОССТАНОВЛЕНИЯ КИСЛОРОДА, СОДЕРЖАЩИЙ ЕГО ТОПЛИВНЫЙ ЭЛЕМЕНТ И СПОСОБ ПОЛУЧЕНИЯ ЭЛЕКТРОЭНЕРГИИ | 2006 |
|
RU2422947C2 |
| US 6855452 B1, 15.02.2005 | |||
| JP 2007005284 A, 11.01.2007 | |||
| JP 2009117355 A,28.05.2009 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОЗИТИВНЫХ ИЗОБРАЖЕНИЙ | 1990 |
|
RU1819004C |
| US 5922488 A,13.07.1999 | |||
Авторы
Даты
2015-09-27—Публикация
2014-04-21—Подача