1. ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ И ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Эта заявка испрашивает приоритет согласно §119(е) 35 U.S.С. (Свод федеральных законов США) предварительной заявки на патент США №61/218005, поданной 17 июня 2009 года, содержание которой включено сюда посредством ссылки во всей ее полноте.
Рассматриваемая в данный момент заявка содержит перечень последовательностей, который был представлен на рассмотрение через EFS-Web и тем самым является включенным во всей его полноте посредством ссылки. Указанная копия ASCII (американский стандартный код для обмена информацией) создана 15 июня 2010 года и названа 381493PC.txt и имеет размер 141482 байта.
2. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против VEGF, фармацевтическим композициям, содержащим антитела против VEGF, и терапевтическим применениям таких антител.
3. ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ангиогенез оказался привлекательной терапевтической мишенью из-за его вовлеченности в целый ряд патологических состояний, включая рост опухолей, пролиферативные ретинопатии, возрастную дегенерацию желтого пятна, ревматоидный артрит (RA) и псориаз (Folkman et al., 1992, J. Biol. Chem. 267:10931-10934). Первое указание на специфичные молекулярные ангиогенные факторы было основано на наблюдении сильного неоваскулярного ответа, индуцированного пересаженными опухолями. Теперь известно, что ангиогенез является существенным для роста большинства первичных опухолей и их последующих метастазов. Многие молекулы с того момента связывали с позитивной регуляцией ангиогенеза, включая трансформирующий фактор роста (TGF)-α, TGF-β, фактор роста гепатоцитов (HGF), фактор некроза опухолей-а, ангиогенин, интерлейкин (IL)-8 и фактор роста эндотелия сосудов (VEGF, также именуемый VEGFA или фактор проницаемости сосудов (VPF)) (Ferrara et al., 2003, Nature Medicine 9:669-676).
Белки VEGF являются важными сигнальными белками, участвующими как в нормальном эмбриональном образовании и развитии сосудов (образование cte novo эмбриональной системы кровообращения), так и в аномальном ангиогенезе (рост кровеносных сосудов из предсуществующей сосудистой системы) (Ferrara et al., 1996, Nature 380:439-442; Dvorak etal., 1995, Am. J. Pathol. 146:1029-1039). VEGF ассоциирован с солидными опухолями и гематологическими злокачественными образованиями, внутриглазными неоваскулярными синдромами, воспалением, отеком мозга и патологией женских половых путей (Ferrara et al., 2003, Nature Medicine 9:669-676). мРНК VEGF сверхэкспрессируется во многих человеческих опухолях, включая опухоли легкого, молочной железы, желудочно-кишечного тракта, почки, поджелудочной железы и яичника (Berkman et al., 1993, J. Clin. Invest. 91:153-159). Увеличения уровня VEGF во внутриглазной жидкости и стекловидном теле глаз связывали с разными ретинопатиями (Aiello et al., 1994, N. Engl. J. Med. 331:1480-1487). Возрастная дегенерация желтого пятна (AMD), главная причина потери зрения у пожилых людей, обусловлена неоваскуляризацией и выпотом из сосудов. Была показана локализация VEGF в хориоидальных неоваскулярных оболочках у пациентов, пораженных AMD (Lopez et al., 1996, Invest. Ophtalmo. Vis. Sci. 37:855-868).
Семейство генов VEGF включает прототипный элемент VEGFA, а также VEGFB, VEGFC, VEGFD и плацентарый фактор роста (PLGF). Человеческий ген VEGFA организован как восемь экзонов, разделенных семью интронами. Существуют по меньшей мере шесть разных изоформ VEGF: VEGF121, VEGF145, VEGF162, VEGF165, VEGF165b, VEGF183, VEGF189 и VEGF206, где подстрочные символы относятся к числу аминокислот, остающихся после отщепления сигнального пептида. Нативный VEGF представляет собой 45 кДа гомодимерный гепаринсвязывающий гликопротеин (Ferrara et al., 2003, Nature Medicine 9:669-676). VEGF (конкретно VEGFA) связывается с двумя родственными рецепторными тирозинкиназами, VEGFR-1 (также именуемый Flt-1) и VEGFR-2 (также именуемый Flk-1 или область киназного домена (KDR) или CD309). Каждый рецептор имеет семь внеклеточных и одну трансмембранную область. VEGF также связывается с нейрофилинами NRP1 (также именуемыми рецептор фактора роста клеток эндотелия сосудов 165 (VEGF165R) или CD304) и NRP2, также именуемым рецептор 2 фактора роста клеток эндотелия сосудов 165 (VEGF165R2)).
Принимая во внимание его центральную роль в регуляции ангиогенеза, VEGF является привлекательной мишенью для терапевтического вмешательства. Действительно, множество терапевтических стратегий, нацеленных на блокирование VEGF или системы сигнализации его рецептора, разрабатывается в настоящее время для лечения неопластических заболеваний. Антитело против VEGF бевацизумаб, также именуемое rhuMAb VEGF или Avastin®, представляет собой рекомбинантное гуманизированное моноклональное антитело против VEGF, созданное и продаваемое на рынке Genentech (Presta et al., 1997, Cancer Res. 57:4593-4599). Для того чтобы сконструировать бевацизумаб, гипервариабельные участки (CDR) мышиного моноклонального антитела против VEGF А.4.6.1 пересадили на человеческие каркасы и константную область IgG. Для улучшения связывания затем в молекулы были введены дополнительные мутации вне CDR с получением антитела, в котором примерно 93% аминокислотной последовательности происходит из человеческого IgG1, и примерно 7% последовательности происходит из мышиного антитела А.4.6.1. Бевацизумаб имеет молекулярную массу примерно 149000 Дальтон и является гликозилированным.
Ранибизумаб представляет собой фрагмент Fab с созревшей аффинностью, происходящий из бевацизумаба. Ранибизумаб имеет более высокую аффинность в отношении VEGF и также меньше по размеру, обеспечивая его лучшее проникновение в сетчатку и, таким образом, лечение глазных неоваскуляризаций, ассоциированных с AMD (Lien and Lowman, In: Chernajovsky, 2008, Therapeutic Antibodies. Handbook of Experimental Pharmacology 181, Springer-Verlag, Berlin Heidelberg 131-150). Ранибизумаб был разработан и продается на рынке Genentech под торговым названием Lucentis®.
Лечение раковых пациентов с применением схемы, которая включает Avastin®, может приводить к побочным эффектам, включая гипертензию, протеинурию, тромбоэмболические события, кровотечение и токсичность для сердца (Blowers & Hall, 2009, Br. J. Nurs. 18(6):351-6, 358). Бевацизумаб также может вызывать иммунный ответ при введении людям, несмотря на то, что он является гуманизированным антителом. Такой иммунный ответ может приводить к опосредованному иммунным комплексом клиренсу антител или фрагментов из кровообращения, и делает повторное введение неподходящим для терапии, снижая, посредством этого, терапевтическую пользу для пациента и ограничивая повторное введение антитела.
Соответственно, существует потребность в предложении улучшенных антител против VEGF или фрагментов, которые преодолевают одну или более чем одну из этих проблем, например, путем генерации вариантов с более высокой аффинностью, чем бевацизумаб, которые можно вводить в пониженных дозировках, или вариантов с пониженной иммуногенностью и другими побочными эффектами по сравнению с бевацизумабом.
Цитирование или указание на любую ссылку в этом разделе или в любом другом разделе данной заявки не следует истолковывать как признание того, что такая ссылка доступна в качестве предшествующего уровня техники по отношению к настоящему изобретению.
4. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к вариантам бевацизумаба, антитела против VEGF, с пониженной иммуногенностью и/или улучшенной аффинностью к VEGF по сравнению с бевацизумабом или ранибизумабом. Бевацизумаб имеет три CDR (гипервариабельный участок) тяжелой цепи, именуемых здесь (в порядке от амино- до карбоксиконца) как CDR-H1, CDR-H2 и CDR-H3, и три CDR легкой цепи, именуемых здесь (в порядке от амино- до карбоксиконца) как CDR-L1, CDR-L2 и CDR-L3. Последовательности CDR бевацизумаба показаны на Фиг.1А и 1Б, и их нумерация изложена в Таблице 1 (для CDR тяжелой цепи) и Таблице 2 (для CDR легкой цепи). Родственное антитело, ранибизумаб, было получено созреванием аффинности бевацизумаба. Ранибизумаб имеет последовательности CDR-L1, CDR-L2, CDR-L3 и CDR-H2, идентичные бевацизумабу, но отличается по своим последовательностям CDR-H1 и CDR-H3 от последовательностей бевацизумаба. Последовательности тяжелой и легкой цепи ранибизумаба показаны на Фиг.1В, и CDR изложены на Фиг.1Г.
Антитела по изобретению обычно имеют по меньшей мере одну аминокислотную замену в по меньшей мере одном CDR тяжелой цепи по сравнению с бевацизумабом и ранибизумабом.
В определенных аспектах антитела против VEGF включают по меньшей мере одну замену по сравнению с бевацизумабом или ранибизумабом, выбранную из N31F в CDR-H1; K64S в CDR-H2; K64Q в CDR-H2; Y53F в CDR-Н2; Н97Е в CDR-H3; H97D в CDR-H3; Н97Р в CDR-H3; Y98F в CDR-H3; Y99E в CDR-H3; Y99D в CDR-H3; S100aG в CDR-H3 и Т51А в CDR-L2. В других аспектах антитела против VEGF включают по меньшей мере одну замену, выбранную из Таблиц 8 и 9. Дополнительные мутации, которые могут быть включены в варианты антител с улучшенной аффинностью, могут быть деиммунизирующими заменами-кандидатами, такими как замены, описанные в Таблице 6, а также другими мутациями, например, заменами, которые не нарушают способность антител связываться с VEGF, включая, но не ограничиваясь, мутации, описанные в Таблицах 10 и 11, или известные мутации, такие как мутации, описанные в Таблицах от 12-1 до 12-9 и 13. Кроме того, дополнительные мутации, которые могут быть включены, включают, но не ограничены, мутации, описанные в Таблицах 14-16.
В конкретных воплощениях антитела против VEGF по изобретению включают комбинацию замен, выбранных из Таблицы 7, и возможно одну или более чем одну дополнительную мутацию, например, деиммунизирующие замены-кандидаты, такие как замены, описанные в Таблице 6, а также другие мутации, например, замены, которые не нарушают способность антител связываться с VEGF, включая, но не ограничиваясь, мутации, описанные в Таблицах 10 и 11, или известные мутации, такие как мутации, описанные в Таблицах от 12-1 до 12-9 и 13. Кроме того, дополнительные мутации, которые могут быть включены в антитела против VEGF по изобретению, включают, но не ограничиваются, мутации, описанные в Таблицах 14-16.
В других воплощениях антитела против VEGF по изобретению включают одну или более чем одну из следующих замен в CDR: K64S (CDR-H2), K64Q (CDR-H2), Y53F и K64Q (CDR-H2), Н97Е и Y98F (CDR-H3) или Т51А (CDR-L2). Антитела против VEGF также возможно могут включать одну или более чем одну дополнительную мутацию или комбинацию мутаций, выбранных из одной или более чем одной из Таблиц 6, 7, 8, 9, 10, 11, от 12-1 до 12-9 или 13-16.
Дополнительные замены в CDR могут включать N31 F (CDR-H1), Н97Е (CDR-H3), H97D (CDR-H3), Н97Р (CDR-H3), Y99E (CDR-H3), Y99D (CDR-H3), SIOOaG (CDR-H3), где положение 3 в CDR-H3 возможно не представляет собой тирозин, Т28Р, N31F, N31G и N31M (CDR-H1), Н97А, H97Q, H97S, Н97Т, S100aD, S100aE, и SIOOAv (CDR-H3), T30W, T30R или T30Q (CDR-H1), Y53F, T58F, A61G, А61К, A61R, А61Н, A61Y, K64G, К64Е, R65L, R65T, R65A, R65E и R65D (CDR-H2), и Y98F, и YIOOeF (CDR-H3). Данные CDR возможно содержат одну или более чем одну дополнительную мутацию или комбинации мутаций, выбранных из одной или более чем одной из Таблиц 6, 7, 8, 9, 10, 11, от 12-1 до 12-9 и 13.
Кроме того, дополнительные замены могут включать замены в CDR тяжелой цепи, включающие комбинацию замен, выбранных из: (а) N31F в CDR-H1, H97D в CDR-H3, Y99D в CDR-H3 и SIOOaG в CDR-H3; (б) N31F в CDR-H1, Н97Р в CDR-H3, Y99D в CDR-H3 и SIOOaG в CDR-H3; (в) N31F в CDR-H1, Н97Р в CDR-H3 и Y99E в CDR-H3; (г) N31F в CDR-H1, Н97Е в CDR-H3 и Y99E в CDR-H3; (д) N31F в CDR-H1, H97D в CDR-H3 и Y99E в CDR-H3; (е) N31F в CDR-H1, Н97Е в CDR-H3, Y99D в CDR-H3 и S100aG в CDR-H3; (ж) N31F в CDR-H1, Y99D в CDR-H3 и SIOOaG в CDR-H3; (з) N31F в CDR-H1, Н97Р в CDR-H3 и Y99D в CDR-H3; (и) N31F в CDR-H1, H97D в CDR-H3 и S100aG в CDR-H3; (к) N31F в CDR-H1 и SIOOaG в CDR-H3 или (л) N31F в CDR-H1, Н97Р в CDR-H3 и S100aG в CDR-H3. Дополнительные возможные замены могут включать одну или более чем одну дополнительную мутацию или комбинацию мутаций, выбранных из одной или более чем одной из Таблиц 6, 7, 8, 9, 10, 11, от 12-1 до 12-9 и 13.
Кроме того, дополнительные замены тяжелой цепи могут включать по меньшей мере одну замену, выбранную из A61F в CDR-H2, А61Е в CDR-H2, A61D в CDR-H2, D62L в CDR-H2, D62G в CDR-H2, D62Q в CDR-H2, D62T в CDR-H2, D62K в CDR-H2, D62R в CDR-H2, D62E в CDR-H2, D62H в CDR-H2, K64S в CDR-H2, K64V в CDR-H2, K64Q в CDR-H2, R65V в CDR-H2, R65F в CDR-H2, R65H в CDR-H2, R65N в CDR-H2, R65S в CDR-H2, R65Q в CDR-H2, R65K в CDR-H2, R65I в CDR-H2 и Y98H в CDR-H3. Возможно, может быть включена одна или более чем одна дополнительная мутация или комбинация мутаций, выбранных из одной или более чем одной из Таблиц 7, 8, 9, 10, 11, от 12-1 до 12-9 и 13.
В определенных аспектах антитела по изобретению имеют последовательности VH и VL, имеющие по меньшей мере 80%-ную идентичность последовательности (и в определенных воплощениях по меньшей мере 85%-ную, по меньшей мере 90%-ную, по меньшей мере 95%-ную, по меньшей мере 98%-ную или по меньшей мере 99%-ную идентичность последовательности) с последовательностями VH и VL бевацизумаба или ранибизумаба и включают по меньшей мере одну аминокислотную замену в по меньшей мере одном CDR по сравнению с бевацизумабом или ранибизумабом. В других аспектах антитела по изобретению имеют последовательности VH и VL, имеющие по меньшей мере 80%-ную идентичность последовательности (и в определенных воплощениях по меньшей мере 85%-ную, по меньшей мере 90%-ную, по меньшей мере 95%-ную, по меньшей мере 98%-ную или по меньшей мере 99%-ную идентичность последовательности) с последовательностями VH и VL бевацизумаба или ранибизумаба, и включают по меньшей мере одну аминокислотную замену в по меньшей мере одной каркасной области по сравнению с бевацизумабом или ранибизумабом. В конкретных воплощениях процентная доля идентичности последовательности для тяжелой цепи и легкой цепи по сравнению с последовательностями VH и VL бевацизумаба или ранибизумаба независимо выбрана из по меньшей мере 80%-ной, по меньшей мере 85%-ной, по меньшей мере 90%-ной, по меньшей мере 95%-ной идентичности последовательности или по меньшей мере 99%-ной идентичности последовательности. В определенных аспектах антитела по изобретению имеют последовательности VH и/или VL, имеющие по меньшей мере 95%-ную, по меньшей мере 98%-ную или по меньшей мере 99%-ную идентичность последовательности с последовательностями VH и/или VL бевацизумаба или ранибизумаба.
В определенных аспектах антитела по изобретению имеют вплоть до 17 аминокислотных замен в их CDR по сравнению с бевацизумабом или ранибизумабом. Варианты антител с 17 аминокислотными заменами, которые сохраняют их способность к связыванию с мишенью, были получены Bostrom et al., 2009, Science 323:1610-14.
В конкретных воплощениях антитело против VEGF по изобретению имеет, независимо:
- вплоть до одной, вплоть до двух, вплоть до трех, вплоть до четырех, вплоть до пяти, вплоть до шести, вплоть до семи, вплоть до восьми, вплоть до девяти или вплоть до десяти замен в CDR-H1 по сравнению с соответствующим CDR бевацизумаба или ранибизумаба;
- вплоть до одной, вплоть до двух, вплоть до трех, вплоть до четырех, вплоть до пяти, вплоть до шести, вплоть до семи, вплоть до восьми, вплоть до девяти, вплоть до десяти, вплоть до одиннадцати, вплоть до двенадцати, вплоть до тринадцати, вплоть до четырнадцати, вплоть до пятнадцати, вплоть до шестнадцати или вплоть до семнадцати замен в CDR-H2 по сравнению с соответствующим CDR бевацизумаба или ранибизумаба;
- вплоть до одной, вплоть до двух, вплоть до трех, вплоть до четырех, вплоть до пяти, вплоть до шести, вплоть до семи, вплоть до восьми, вплоть до девяти, вплоть до десяти, вплоть до одиннадцати, вплоть до двенадцати, вплоть до тринадцати или вплоть до четырнадцати замен в CDR-H3 по сравнению с соответствующим CDR бевацизумаба или ранибизумаба;
- вплоть до одной, вплоть до двух, вплоть до трех, вплоть до четырех, вплоть до пяти, вплоть до шести, вплоть до семи, вплоть до восьми, вплоть до девяти, вплоть до десяти или вплоть до одиннадцати замен в CDR-L1 по сравнению с соответствующим CDR бевацизумаба или ранибизумаба;
- вплоть до одной, вплоть до двух, вплоть до трех, вплоть до четырех, вплоть до пяти, вплоть до шести или вплоть до семи замен в CDR-L2 по сравнению с соответствующим CDR бевацизумаба или ранибизумаба; и
- вплоть до одной, вплоть до двух, вплоть до трех, вплоть до четырех, вплоть до пяти, вплоть до шести, вплоть до семи, вплоть до восьми или вплоть до девяти замен в CDR-L3 по сравнению с соответствующим CDR бевацизумаба или ранибизумаба.
Согласно настоящему изобретению дополнительно предложены фармацевтические композиции, содержащие модифицированные антитела против VEGF. В некоторых аспектах фармацевтические композиции имеют повышенную аффинность к VEGF и/или пониженную иммуногенность по сравнению с бевацизумабом или ранибизумабом.
В изобретении предложены нуклеиновые кислоты, содержащие нуклеотидные последовательности, кодирующие антитела против VEGF по изобретению, а также векторы, содержащие нуклеиновые кислоты. Дополнительно в изобретении предложены прокариотические и эукариотические клетки-хозяева, трансформированные вектором, содержащим нуклеотидную последовательность, кодирующую антитело против VEGF, а также эукариотические (такие как клетки млекопитающих) клетки-хозяева, модифицированные методами генной инженерии для экспрессии нуклеотидных последовательностей. Также предложены способы получения антител против VEGF путем культивирования клеток-хозяев.
Антитела против VEGF по изобретению являются полезными при лечении раковых заболеваний (например, карциномы толстой кишки, карциномы прямой кишки, немелкоклеточного рака легкого и рака молочной железы), заболеваний сетчатки (например, возрастной дегенерации желтого пятна ("AMD")) и иммунных расстройств (например, ревматоидного артрита).
В определенных аспектах антитела против VEGF по изобретению можно использовать в пониженных дозировках по сравнению с бевацизумабом или ранибизумабом, например, в дозировках, меньших по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%.
Следует отметить, что формы единственного и множественного числа, используются в настоящей заявке, как обычно в патентных заявках, для обозначения одного или более чем одного, если контекст ясно не диктует иное. Дополнительно, термин «или» используется в настоящей заявке, как обычно в патентных заявках, для обозначения разделительного «или» или связывающего «и».
Все публикации, упомянутые в этом описании изобретения, включены сюда посредством ссылки. Любое обсуждение документов, актов, веществ, устройств, предметов или тому подобного, которые были включены в данное описание изобретения, имеет единственную цель предоставления контекста для настоящего изобретения. Не следует делать допущения того, что любой или все эти предметы образуют часть основы предшествующего уровня техники или представляли уровень обычных общих знаний в данной области, релевантных в отношении настоящего изобретения, в том виде, в котором они существовали когда-либо до даты приоритета данной заявки.
Отличительные признаки и преимущества изобретения станут более очевидными из следующего подробного описания его воплощений.
5. КРАТКОЕ ОПИСАНИЕ ТАБЛИЦ И ГРАФИЧЕСКИХ МАТЕРИАЛОВ
В Таблице 1 показана нумерация аминокислот в CDR тяжелой цепи бевацизумаба. CDR 1-3 раскрыты в SEQ ID NO:3-5, соответственно.
В Таблице 2 показана нумерация аминокислот в CDR легкой цепи бевацизумаба. CDR 1-3 раскрыты в SEQ ID NO:6-8, соответственно.
В Таблице 3 показаны пептиды VL бевацизумаба, которые протестировали на иммуногенность.
В Таблице 4 показаны пептиды VH. бевацизумаба, которые протестировали на иммуногенность.
В Таблице 5 показаны идентифицированные области эпитопов Т-клеток CD4+ в бевацизумабе. Области CDR подчеркнуты.
В Таблице 6 показаны мутации-кандидаты в CDR-H2 и CDR-H3 для снижения иммуногенности бевацизумаба. Нумерация аминокислот в Таблице 6 соответствует нумерации по Kabat в тяжелой цепи бевацизумаба.
В Таблице 7 показаны аминокислотные замены в CDR тяжелой цепи в бевацизумабе, приводящие к улучшенной KD, как проанализировано поверхностным плазменным резонансом. Δkon относится к кратности улучшения kon (мутант/дикий тип). Δkoff относится к кратности улучшения koff (мутант/дикий тип). ΔKD относится к улучшению KD у мутанта относительно дикого типа. Нумерация аминокислот в Таблице 7 соответствует нумерации по Kabat в тяжелой цепи бевацизумаба.
В Таблице 8 показаны мутации в CDR тяжелой цепи бевацизумаба, которые, как показывают предварительные исследования по связыванию, увеличивают аффинность к VEGF (данные не показаны). Нумерация аминокислот в Таблице 8 соответствует нумерации по Kabat в тяжелой цепи бевацизумаба.
В Таблице 9 показаны мутации в CDR тяжелой цепи бевацизумаба, которые, как показывают предварительные исследования, увеличивают аффинность в отношении VEGF (данные не показаны). Нумерация аминокислот в Таблице 9 соответствует нумерации по Kabat в тяжелой цепи бевацизумаба.
В Таблице 10 показаны мутации в CDR тяжелой цепи бевацизумаба, которые не влияют на связывание и могут быть включены в антитела по изобретению. Нумерация аминокислот в Таблице 10 соответствует нумерации по Kabat в тяжелой цепи бевацизумаба.
В Таблице 11 показаны мутации в CDR легкой цепи бевацизумаба, которые не влияют на связывание и могут быть включены в антитела по изобретению. Нумерация аминокислот в Таблице 11 соответствует нумерации по Kabat в легкой цепи бевацизумаба.
В Таблицах от 12-1 до 12-9 показаны известные мутации в CDR тяжелой цепи бевацизумаба, которые можно включать в антитела по изобретению. Каждая строка в Таблицах от 12-1 до 12-9 включает отличный известный вариант. Для каждого варианта известные последовательности CDR выделены более темным фоном. Идентификаторы последовательности для каждого варианта, идентифицированного в Таблицах от 12-1 до 12-9, изложены в Таблицах от 20-1 до 20-9, соответственно. В колонке CDR-H1 дана частичная последовательность CDR-H1. Последний аспарагин в CDR-H1 не показан. Эта частичная последовательность соответствует SEQ ID NO:411. Несмотря на то, что известные мутации в CDR-H1 показаны в контексте этой частичной последовательности, отмечается, что существуют мутации в контексте полноразмерной CDR.
В Таблице 13 показаны известные мутации в CDR легкой цепи бевацизумаба, которые можно включать в антитела по изобретению. Каждая строка в Таблице 13 включает отличный известный вариант. Для каждого варианта известные последовательности CDR выделены более темным фоном. Идентификаторы последовательности для каждого варианта, идентифицированного в Таблице 13, изложены в Таблице 20-10.
В Таблице 14 показаны пептиды CDR2 VH, которые протестировали на иммуногенность, где неизменные остатки из SEQ ID NO:62 указаны пустой ячейкой. Также приведены результаты анализа Т-клеток CD4+.
В Таблице 15 показаны пептиды CDR3 VH бевацизумаба, которые протестировали на иммуногенность, где неизменные остатки из SEQ ID NO:74 указаны пустой ячейкой. Также приведены результаты анализа Т-клеток CD4+.
В Таблице 16 показаны пептиды CDR2 VL, которые протестировали на иммуногенность, где неизменные остатки из SEQ ID NO:25 указаны пустой ячейкой. Также приведены результаты анализа Т-клеток CD4+.
В Таблице 17 показаны избранные модификации эпитопов для трех эпитопов Т-клеток CD4+в бевацизумабе.
В Таблице 18 показаны мутанты единичной вариабельной области и ассоциированный с ними средний показатель интенсивности флуоресценции (MFI).
В Таблице 19 показаны мутанты объединенной вариабельной области и ассоциированные с ними EC50.
В Таблицах от 20-1 до 20-10 показаны SEQ ID NO, когда они известны, соответствующие CDR вариантов бевацизумаба, перечисленных в Таблицах от 12-1 до 12-9 и в Таблице 13, соответственно. N/A указывает неизвестную последовательность CDR.
Фиг.1А-1Г. На Фиг.1А показаны аминокислотные последовательности вариабельных областей тяжелой и легкой цепи бевацизумаба, SEQ ID NO:1 и SEQ ID NO:2, соответственно, причем области CDR выделены жирным подчеркнутым текстом. На Фиг.1Б показаны последовательности CDR и соответствующие идентификаторы последовательности бевацизумаба. На Фиг.1 В показаны аминокислотные последовательности тяжелой и легкой цепей ранибизумаба, SEQ ID NO:9 и SEQ ID NO:10, соответственно, причем области CDR выделены жирным подчеркнутым текстом. На Фиг.1Г показаны последовательности CDR и соответствующие идентификаторы последовательности ранибизумаба.
На Фиг.2А-2Б показаны ответы на пептиды VL бевацизумаба. На Фиг.2А показаны проценты ответов доноров на каждый пептид VL с индексом стимуляции 2,95 или выше. N=99 доноров. На Фиг.2Б показан средний индекс стимуляции для всех 99 доноров для каждого пептида плюс или минус стандартная ошибка.
На Фиг.3А-3Б показаны ответы на пептиды VH бевацизумаба. На Фиг.3А показаны проценты ответов доноров на каждый пептид VH с индексом стимуляции 2,95 или выше. N=99 доноров. На Фиг.3Б показан средний индекс стимуляции для всех 99 доноров для каждого пептида плюс или минус стандартная ошибка.
На Фиг.4А-4В показаны ответы Т-клеток CD4+ на пептиды эпитопов мутантного бевацизумаба. Средние ответы на немодифицированные последовательности родительского эпитопа указаны незакрашенными значками. Большие кружки указывают избранные изменения, приведенные в Таблице 17. Фиг.4А относится к пептидам CDR2 VH; Фиг.4Б относится к пептидам CDR3 VH; и Фиг.4В относится к пептидам CDR2 VL.
6. ПОДРОБНОЕ ОПИСАНИЕ
6.1 АНТИТЕЛА ПРОТИВ VEGF
Согласно настоящему изобретению предложены антитела против VEGF. Если не указано иное, термин «антитело» (Ab) относится к молекуле иммуноглобулина, которая специфично связывается или является иммунологически реактивной с конкретным антигеном и включает поликлональные, моноклональные, модифицированные методами генной инженерии и модифицированные иными способами формы антител, включая, но не ограничиваясь, химерные антитела, гуманизированные антитела, гетероконъюгатные антитела (например, биспецифичные антитела, диатела, триатела и тетратела) и антигенсвязывающие фрагменты антител, включающие, например, фрагменты Fab', F(ab')2, Fab, Fv, rIgG и scFv. Кроме того, если не указано иное, подразумевается, что термин «моноклональное антитело» (mAb) включает как интактные молекулы, так и фрагменты антитела (такие как, например, фрагменты Fab и F(ab')2), которые способны специфично связываться с белком. Фрагменты Fab и F(ab')2 не имеют фрагмента Fc интактного антитела, быстрее подвергаются клиренсу из кровообращения животного и могут иметь меньшее неспецифичное связывание в ткани, чем интактное антитело (Wahl et al., 1983, J. Nucl. Med. 24:316).
Термин "scFv" относится к одноцепочечному Fv антителу, в котором вариабельные домены тяжелой цепи и легкой цепи из традиционного антитела были связаны с образованием одной цепи.
Ссылки на "VH" относятся к вариабельной области иммуноглобулиновой тяжелой цепи антитела, включая тяжелую цепь Fv, scFv или Fab. Ссылки на "VL" относятся к вариабельной области легкой цепи иммуноглобулина, включая легкую цепь Fv, scFv, dsFv или Fab. Антитела (Ab) и иммуноглобулины (Ig) представляют собой гликопротеины, имеющие такие же структурные характеристики. В то время как антитела демонстрируют специфичность связывания в отношении конкретной мишени, иммуноглобулины включают как антитела, так и другие молекулы, подобные антителам, которые не имеют специфичности в отношении мишени. Нативные антитела и иммуноглобулины обычно представляют собой гетеротетрамерные гликопротеины (с молекулярной массой) приблизительно 150000 Дальтон, составленные из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая тяжелая цепь имеет на амино конце вариабельный домен (VH) с последующим рядом константных доменов. Каждая легкая цепь имеет вариабельный домен на амино конце (VL) и константный домен на карбокси конце.
Антитела против VEGF по изобретению связываются с человеческим VEGF и ингибируют активность рецептора VEGF в клетке.
Антитела против VEGF по изобретению содержат области, определяющие комплементарность (CDR), которые являются родственными по последовательности CDR антитела бевацизумаб (также известного как Avastin®) и/или ранибизумаб (также известного как Lucentis®).
CDR также известны как гипервариабельные участки в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов называются каркас (FR). Как известно в данной области, положение аминокислоты/граница, очерчивающая гипервариабельный участок антитела, может варьировать, в зависимости от контекста и разных определений, известных в данной области. Некоторые положения в пределах вариабельного домена могут рассматриваться как гибридные гипервариабельные положения в том, что эти положения могут считаться находящимися в пределах гипервариабельного участка при одном наборе критериев, в то время как могут считаться находящимися вне гипервариабельного участка при другом наборе критериев. Одно или более чем одно из этих положений также может находиться в расширенных гипервариабельных участках. Согласно изобретению предложены антитела, содержащие модификации в этих гибридных гипервариабельных положениях. Каждый из вариабельных доменов нативной тяжелой и легкой цепи содержит четыре FR области, главным образом, принимающие конфигурацию β-складчатого слоя, соединенные тремя CDR, которые образуют петли, соединяющие и в некоторых случаях образующие часть β-складчатой структуры. CDR в каждой цепи удерживаются в тесной близости друг с другом областями FR в порядке FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4 и с CDR из другой цепи, содействуя образованию сайта связывания мишени антител (смотри Kabat et al., Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, Md. 1987). Нумерация аминокислотных остатков иммуноглобулинов в том виде, как она здесь используется, осуществляется согласно системе нумерации аминокислотных остатков иммуноглобулинов Kabat et al., если не указано иное.
Последовательности вариабельных участков тяжелой и легкой цепи бевацизумаба представлены SEQ ID NO:1 и SEQ ID NO:2, соответственно. Последовательности вариабельных участков тяжелой и легкой цепи также описаны на Фиг.1А. Последовательности CDR бевацизумаба и их соответствующие идентификаторы представлены на Фиг.1Б. Любые нуклеотидные последовательности, кодирующие SEQ ID NO:1 или SEQ ID NO:2, можно использовать в композициях и способах по настоящему изобретению.
Последовательности тяжелой и легкой цепей ранибизумаба представлены SEQ ID NO:9 и SEQ ID NO:10, соответственно. Последовательности тяжелой и легкой цепей также описаны на Фиг.1В. Последовательности CDR ранибизумаба и их соответствующие идентификаторы представлены на Фиг.1Г. Любые нуклеотидные последовательности, кодирующие SEQ ID NO:9 или SEQ ID NO:10, можно использовать в композициях и способах по настоящему изобретению.
Согласно настоящему изобретению дополнительно предложены фрагменты антитела против VEGF, содержащие последовательности CDR, которые являются родственными последовательностям CDR бевацизумаба и ранибизумаба. Термин «фрагмент антитела» относится к части полноразмерного антитела, обычно к области, связывающей мишень, или к вариабельному участку. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2 и Fv. Фрагмент "Fv" представляет собой минимальный фрагмент антитела, который содержит полный сайт распознавания и связывания мишени. Эта область состоит из димера вариабельного домена одной тяжелой и одной легкой цепи в тесной нековалентной ассоциации (димер VH-VL). Именно в этой конфигурации три CDR каждого вариабельного домена взаимодействуют с определением сайта связывания мишени на поверхности димера VH-VL. Часто шесть CDR придают антителу специфичность связывания мишени. Однако в некоторых случаях даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичные в отношении мишени) может иметь способность распознавать и связывать мишень. Фрагменты антитела «одноцепочечная Fv» или "scFv" содержат домены VH и VL антитела в одной полипептидной цепи. Обычно полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает образование scFv желательной структуры для связывания мишени. «Однодоменные антитела» состоят из одного домена VH или VL, которые демонстрируют достаточную аффинность в отношении мишени. В конкретном воплощении однодоменное антитело представляет собой антитело Camelid (смотри, например, Riechman, 1999, Journal of Immunological Methods 231:25-38).
Fab фрагмент содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab' фрагменты отличаются от Fab фрагментов добавлением нескольких остатков на карбоксильном конце домена CH1 тяжелой цепи, включая один или более чем один цистеин из шарнирной области антитела. F(ab') фрагменты продуцируются расщеплением дисульфидной связи на шарнирных цистеинах продукта расщепления F(ab')2 пепсином. Дополнительные химические связывания фрагментов антитела известны обычным специалистам в данной области.
В определенных воплощениях антитела против VEGF по изобретению представляют собой моноклональные антитела. Термин «моноклональное антитело» в том виде, как он здесь используется, не ограничивается антителами, полученными посредством технологии гибридомы. Термин «моноклональное антитело» относится к антителу, которое происходит из одного клона, включая любой эукариотический, прокариотический или фаговый клон, а не к способу, посредством которого оно получено. Моноклональные антитела, полезные в связи с настоящим изобретением, могут быть получены с использованием широкого спектра методик, известных в данной области, включая применение гибридомы, рекомбинантных методик и методик фагового дисплея или их комбинацию. Антитела против VEGF по изобретению включают химерные, приматизированные, гуманизированные или человеческие антитела.
Антитела против VEGF по изобретению могут быть химерными антителами. Термин «химерное» антитело в том виде, как он здесь используется, относится к антителу, имеющему вариабельные последовательности, происходящие из иммуноглобулина, не являющегося человеческим, такого как крысиное или мышиное антитело, и константные области человеческого иммуноглобулина, типично выбранные из матрицы человеческого иммуноглобулина. Способы получения химерных антител известны в данной области. Смотри, например, Morrison, 1985, Science 229(4719):1202-7; Oi et al., 1986, BioTechniques 4:214-221; Gillies et al., 1985, J. Immunol. Methods 125:191-202; патенты США №5807715; 4816567 и 4816397, которые включены сюда посредством ссылки во всей их полноте.
Антитела против VEGF по изобретению могут быть гуманизированными. «Гуманизированные» формы антител, не являющихся человеческими (например, мышиных), представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие субдомены антител, связывающие мишень), которые содержат минимальные последовательности, происходящие из иммуноглобулина, не являющегося человеческим. В общем, гуманизированное антитело будет содержать по существу все из по меньшей мере одного и типично двух вариабельных доменов, в которых все или по существу все участки CDR соответствуют участкам иммуноглобулина, не являющегося человеческим, и все или по существу все области FR представляют собой области последовательности человеческого иммуноглобулина. Гуманизированное антитело также может содержать по меньшей мере часть константной области иммуноглобулина (Fc), типично константную область консенсусной последовательности человеческого иммуноглобулина. Способы гуманизации антител известны в данной области. Смотри, например, Riechmann et al., 1988, Nature 332:323-7; патенты США №:5530101; 5585089; 5693761; 5693762 и 6180370, выданные Queen et al.; EP 239400; публикацию PCT WO 91/09967; патент США №5225539; ЕР 592106; ЕР 519596; Padlan, 1991, Mol. Immunol., 28:489-498; Studnicka et al., 1994, Prot. Eng. 7:805-814; Roguska et al., 1994, Proc. Natl. Acad. Sci. 91:969-973 и патент США №5565332, которые все включены сюда посредством ссылки во всей их полноте.
Антитела против VEGF по изобретению могут быть человеческими антителами. Полностью «человеческие» антитела против VEGF могут быть желательными для терапевтического лечения человеческих пациентов. Термин «человеческие антитела» в том виде, как он здесь используется, включает антитела, имеющие аминокислотную последовательность человеческого иммуноглобулина, и включает антитела, выделенные из библиотек человеческих иммуноглобулинов, или из животных, трансгенных в отношении одного или более чем одного человеческого иммуноглобулина, и которые не экспрессируют эндогенные иммуноглобулины. Человеческие антитела могут быть получены множеством способов, известных в данной области, включая способы фагового дисплея с использованием библиотек антител, происходящих из последовательностей человеческих иммуноглобулинов. Смотри патенты США №4444887 и 4716111 и публикации РСТ WO 98/46645; WO 98/50433; WO 98/24893; WO 98/16654; WO 96/34096; WO 96/33735; и WO 91/10741, каждая из которых включена сюда посредством ссылки во всей ее полноте. Человеческие антитела также можно получать с использованием трансгенных мышей, которые не способны экспрессировать функциональные эндогенные иммуноглобулины, но которые могут экспрессировать гены человеческих иммуноглобулинов. Смотри, например, публикации РСТ WO 98/24893; WO 92/01047; WO 96/34096; WO 96/33735; патенты США №5413923; 5625126; 5633425; 5569825; 5661016; 5545806; 5814318; 5885793; 5916771 и 5939598, которые включены сюда посредством ссылки во всей их полноте. Кроме того, у таких компаний, как Medarex (Princeton, NJ), Astellas Pharma (Deerfield, IL), Amgen (Thousand Oaks, CA) и Regeneron (Tarrytown, NY), можно заказать поставку человеческих антител, направленных против выбранного антигена, с использованием технологии, аналогичной технологии, описанной выше. Полностью человеческие антитела, которые распознают выбранный эпитоп, можно генерировать с использованием методики, названной "управляемая селекция". В этом подходе выбранное моноклональное антитело, не являющееся человеческим, например, мышиное антитело, используют для управления селекцией полностью человеческого антитела, распознающего такой же эпитоп (Jespers etal., 1988, Biotechnology 12:899-903).
Антитела против VEGF по изобретению могут быть приматизированными. Термин «приматизированное антитело» относится к антителу, содержащему вариабельные области обезьяны и человеческие константные области. Способы продукции приматизированных антител известны в данной области. Смотри, например, патенты США №5658570; 5681722 и 5693780, которые включены сюда посредством ссылки во всей их полноте.
Антитела против VEGF по изобретению могут быть биспецифичными антителами. Биспецифичные антитела являются моноклональными, часто человеческими или гуманизированными антителами, которые имеют специфичности связывания в отношении по меньшей мере двух разных антигенов. В настоящем изобретении одна из специфичностей связывания может быть направлена к VEGF, другая может быть в отношении любого другого антигена, например, в отношении белка поверхности клетки, рецептора, субъединицы рецептора, тканеспецифичного антигена, белка, происходящего из вирусов, белка оболочки, кодируемого вирусом, белка бактериального происхождения или белка бактериальной поверхности и т.д. В конкретном воплощении антитело по изобретению представляет собой биспецифичное антитело со специфичностями связывания в отношении и VEGF, и CD3.
Антитела против VEGF по изобретению включают производные антител. Например, но не в качестве ограничения, производные антител типично модифицированы гликозилированием, ацетилированием, ПЭГилированием, фосфорилированием, амидированием, получением производных посредством известных защитных/блокирующих групп, протеолитическим расщеплением, связыванием с клеточным лигандом или другим белком (смотри Раздел 6.6 для обсуждения конъюгатов антител) и т.д. Любую из многочисленных химических модификаций можно проводить известными методиками, включая, но не ограничиваясь, специфичное химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина и т.д. Дополнительно производное может содержать одну или более чем одну неприродную аминокислоту, например, с использованием технологии ambrx (смотри, например, Wolfson, 2006, Chem. Biol. 13(10):1011-2).
В еще одном другом воплощении изобретения антитела против VEGF или их фрагменты могут представлять собой антитела или фрагменты антител, последовательность которых была модифицирована для изменения по меньшей мере одной биологической эффекторной функции, опосредованной константной областью, относительно соответствующей последовательности дикого типа.
Например, в некоторых воплощениях антитело против VEGF по изобретению может быть модифицировано для ослабления по меньшей мере одной биологической эффекторной функции, опосредованной константной областью, по отношению к немодифицированному антителу, например, ослабленного связывания с рецептором Fc (FcγR). Связывание с FcγR может быть ослаблено мутированием сегмента иммуноглобулиновой константной области антитела в конкретных областях, необходимых для взаимодействий с FcγR (смотри, например, Canfi'eld and Morrison, 1991, J. Exp.Med. 173:1483-1491; и Lund et al., 1991, J. Immunol. 147:2657-2662). Уменьшение способности антитела к связыванию с FcγR также может снижать другие эффекторные функции, которые полагаются на взаимодействия с FcγR, такие как опсонизация, фагоцитоз и антиген-зависимая клеточная цитотоксичность ("ADCC").
В других воплощениях антитело против VEGF по изобретению может быть модифицировано для приобретения или улучшения по меньшей мере одной биологической эффекторной функции, опосредованной константной областью, относительно немодифицированного антитела, например, для усиления взаимодействий с FcγR (смотри, например, патент США 2006/0134709). Например, антитело против VEGF по изобретению может иметь константную область, которая связывается с FcγRIIA, FcγRIIB и/или FcγRIIIA с большей аффинностью, чем соответствующая константная область дикого типа.
Таким образом, антитела по изобретению могут иметь изменения биологической активности, которые приводят к повышенной или пониженной опсонизации, фагоцитозу или ADCC. Такие изменения известны в данной области. Например, модификации в антителах, которые снижают активность ADCC, описаны в патенте США №5834597. Типичный вариант для снижения ADCC соответствует «мутанту 3», показанному на Фиг.4 патента США №5834597, в котором остаток 236 удален, и остатки 234, 235 и 237 (используя нумерацию EU) заменены аланинами.
В некоторых воплощениях антитела против VEGF по изобретению имеют низкие уровни или не содержат фукозу. Антитела, не содержащие фукозу, связывали с повышенной ADCC (активность, особенно при низких дозах антитела. Смотри Shields et al., 2002, J. Biol. Chem. 277:26733-26740; Shinkawa et al., 2003, J. Biol. Chem. 278:3466-73. Способы получения бесфукозных антител включают рост в клетках крысиной миеломы YB2/0 (АТСС CRL 1662). Клетки YB2/0 экспрессируют низкие уровни мРНК FUT8, которая кодирует α-1,6-фукозилтрансферазу, фермент, необходимый для фукозилирования полипептидов.
В еще одном другом аспекте антитела против VEGF или их фрагменты могут быть антителами или фрагментами антител, которые были модифицированы для увеличения или снижения их аффинностей связывания с фетальным рецептором Fc, FcRn, например, мутированием отрезка константной области иммуноглобулина в конкретных областях, участвующих во взаимодействиях с FcRn (смотри, например, WO 2005/123780). В конкретных воплощениях антитело против VEGF класса IgG подвергают мутации так, что по меньшей мере один из аминокислотных остатков 250, 314 и 428 константной области тяжелой цепи заменен один или в любой их комбинации, как, например, в положениях 250 и 428, или в положениях 250 и 314, или в положениях 314 и 428, или в положениях 250, 314 и 428, причем положения 250 и 428 являются специфической комбинацией. Для положения 250 заменяющий аминокислотный остаток может представлять собой любой аминокислотный остаток, отличный от треонина, включая, без ограничения, аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серин, валин, триптофан или тирозин. Для положения 314 заменяющий аминокислотный остаток может представлять собой любой аминокислотный остаток, отличный от лейцина, включая, без ограничения, аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, метионин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан или тирозин. Для положения 428 заменяющий аминокислотный остаток может представлять собой любой аминокислотный остаток, отличный от метионина, включая, без ограничения, аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан или тирозин. Конкретные комбинации подходящих аминокислотных замен указаны в Таблице 1 патента США №7217797, который включен сюда посредством ссылки во всей полноте. Такие мутации увеличивают связывание антитела с FcRn, что защищает антитело от деградации и увеличивает его период полувыведения.
В других аспектах антитело против VEGF имеет одну или более чем одну аминокислоту, вставленную в одну или более чем одну из его гипервариабельных областей, например, как описано у Jung and Pluckthun, 1997, Protein Engineering 10(9):959-966; Yazaki et al., 2004. Protein Eng Des. Sel. 17(5):481-9. Epub 2004 Aug 17; и US 2007/0280931.
В разных воплощениях антитела против VEGF или их фрагменты могут представлять собой антитела или фрагменты антител, которые были модифицированы для повышенной экспрессии в гетерологичных хозяевах. В определенных воплощениях антитела против VEGF или их фрагменты могут представлять собой антитела или фрагменты антител, которые были модифицированы для повышенной экспрессии в и/или секреции из гетерологичных клеток-хозяев. В некоторых воплощениях антитела против VEGF или их фрагменты модифицированы для повышенной экспрессии в бактериях, таких как Е. coli. В других воплощениях антитела против VEGF или их фрагменты модифицированы для повышенной экспрессии в дрожжах (Kieke et al., 1999, Proc. Nat'l Acad. Sci. USA 96:5651-5656). В других воплощениях антитела против VEGF или их фрагменты модифицированы для повышенной экспрессии в клетках насекомых. В дополнительных воплощениях антитела против VEGF или их фрагменты модифицированы для повышенной экспрессии в клетках млекопитающих, таких как клетки СНО (яичник китайского хомячка).
В определенных воплощениях антитела против VEGF или их фрагменты могут представлять собой антитела или фрагменты антител, которые были модифицированы для увеличения стабильности антител во время получения. В некоторых воплощениях антитела или их фрагменты могут быть модифицированы для замены одной или более чем одной аминокислоты, такой как аспарагин или глутамин, которые являются чувствительными к неферментативному дезамидированию, аминокислотами, которые не подвергаются дезамидированию (Huang et al., 2005, Anal. Chem. 77:1432-1439). В других воплощениях антитела или их фрагменты могут быть модифицированы для замены одной или более чем одной аминокислоты, которая является чувствительной к окислению, такой как метионин, цистеин или триптофан, аминокислотой, которая не подвергается легкому окислению. В других воплощениях антитела или их фрагменты могут быть модифицированы для замены одной или более чем одной аминокислоты, которые являются чувствительными к циклизации, такой как аспарагиновая или глутаминовая кислота, аминокислотой, которая не подвергается легкой циклизации.
6.2 НУКЛЕИНОВЫЕ КИСЛОТЫ И СИСТЕМЫ ЭКСПРЕССИИ
Настоящее изобретение охватывает молекулы нуклеиновых кислот и клетки-хозяева, кодирующие антитела против VEGF по изобретению.
Антитело против VEGF по изобретению может быть получено рекомбинантной экспрессией генов легкой и тяжелой цепи иммуноглобулина в клетке-хозяине. Для рекомбинантной экспрессии антитела клетку-хозяина трансфицируют одним или более чем одним вектором рекомбинантной экспрессии, несущим фрагменты ДНК, кодирующие легкую и тяжелую иммуноглобулиновые цепи антитела так, что легкая и тяжелая цепи экспрессируются в клетке-хозяине и, возможно, секретируются в среду, в которой культивируются клетки-хозяева, из которой можно выделить антитела. Для получения генов тяжелой и легкой цепи антитела, включения данных генов в векторы рекомбинантной экспрессии и введения векторов в клетки-хозяева используют стандартные методологии генной инженерии, такие как методологии, описанные в Molecular Cloning; A Laboratory Manual, Second Edition (Sambrook, Fritsch and Maniatis (eds), Cold Spring Harbor, N.Y., 1989), Current Protocols in Molecular Biology (Ausubel, F.M. et al., eds., Greene Publishing Associates, 1989) и в патенте США №4816397.
В одном воплощении антитела против VEGF являются аналогичными бевацизумабу или ранибизумабу, кроме изменений в одном или более чем одном CDR. В другом воплощении антитела против VEGF являются аналогичными бевацизумабу или ранибизумабу, кроме изменений в одной или более чем одной каркасной области. В еще одном другом воплощении антитела против VEGF являются аналогичными бевацизумабу или ранибизумабу, кроме изменений в одном или более чем одном CDR и в одной или более чем одной каркасной области. Такие антитела названы здесь собирательно как имеющие последовательности «родственные бевацизумабу» или «родственные ранибизумабу», и иногда на них делают ссылку просто как на антитела против VEGF по изобретению. Для получения нуклеиновых кислот, кодирующих антитела против VEGF, сперва получают фрагменты ДНК, кодирующие вариабельные области легкой и тяжелой цепи. Эти ДНК могут быть получены амплификацией и модификацией ДНК зародышевой линии или кДНК, кодирующих вариабельные последовательности легкой и тяжелой цепи, например, с использованием полимеразной цепной реакции (ПЦР). Последовательности ДНК зародышевой линии для человеческих генов вариабельной области тяжелой и легкой цепи известны в данной области (смотри, например, "VBASE", базу данных последовательностей человеческой зародышевой линии; смотри также Kabat, E.A. et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No.91-3242; Tomlinson et al., 1992, J. Mol. Biol. 22T:116-198; и Сох et al., 1994, Eur. J. Immunol. 24:827-836; содержания каждой из которых включены сюда посредством ссылки). Фрагмент ДНК, кодирующий вариабельную область тяжелой или легкой цепи бевацизумаба или ранибизумаба, можно синтезировать и использовать как матрицу для мутагенеза с генерацией варианта, как здесь описано, с использованием методик традиционного мутагенеза; в качестве альтернативы, фрагмент ДНК, кодирующий вариант, можно синтезировать непосредственно.
Как только получены фрагменты ДНК, кодирующие сегменты VH и VL против VEGF, с этими фрагментами ДНК можно дополнительно манипулировать стандартными методиками генной инженерии, например, для превращения генов вариабельной области в гены полноразмерной цепи антитела, в гены Fab фрагмента или в ген scFv. В данных манипуляциях фрагмент ДНК, кодирующий VL или VH, связывают функциональным образом с другим фрагментом ДНК, кодирующим другой белок, такой как константная область антитела или гибкий линкер. Подразумевается, что термин «связанный функциональным образом» в том виде, как он используется в данном контексте, означает то, что два фрагмента ДНК связаны так, что аминокислотные последовательности, кодируемые двумя фрагментами ДНК, остаются в рамке считывания.
Выделенную ДНК, кодирующую область VH, можно превратить в ген полноразмерной тяжелой цепи путем связывания функциональным образом ДНК, кодирующей VH, с другой молекулой ДНК, кодирующей константные области тяжелой цепи (CH1, CH2, СН3 и, возможно СН4). Последовательности человеческих генов константой области тяжелой цепи известны в данной области (смотри, например, Kabat, E.A. et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No.91-3242), и фрагменты ДНК, охватывающие эти области, могут быть получены стандартной ПЦР-амплификацией. Константной областью тяжелой цепи может быть константная область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но в определенных воплощениях представляет собой константную область IgG1 или IgG4. Для гена тяжелой цепи Fab фрагмента ДНК, кодирующая VH, может быть связана функциональным образом с другой молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи.
Выделенную ДНК, кодирующую область VL, можно превратить в ген полноразмерной легкой цепи (а также в ген легкой цепи Fab) путем связывания функциональным образом ДНК, кодирующей VL, с другой - молекулой ДНК, кодирующей константную область легкой цепи, CL. Последовательности человеческих генов константной области легкой цепи известны в данной области (смотри, например, Kabat, E.A. et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition (U.S. Department of Health and Human Services, NIH Publication No.91-3242)), и фрагменты ДНК, охватывающие эти области, могут быть получены стандартной ПЦР-амплификацией. Константная область легкой цепи может быть константной областью каппа или лямбда, но в определенных воплощениях представляет собой константную область каппа. Для создания гена scFv фрагменты ДНК, кодирующие VH и VL, связывают функциональным образом с другим фрагментом, кодирующим гибкий линкер, например, кодирующим аминокислотную последовательность (Gly4~Ser)3 так, что последовательности VH и VL можно экспрессировать в виде смежного одноцепочечного белка с областями VL и VH, связанными гибким линкером (смотри, например, Bird et al., 1988, Science 242:423-426; Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., 1990, Nature 348:552-554).
Для экспрессии антител против VEGF по изобретению ДНК, кодирующие неполные или полноразмерные легкие и тяжелые цепи, полученные как описано выше, вставляют в экспрессионные векторы так, что гены связываются функциональным образом с последовательностями контроля транскрипции и трансляции. В данном контексте подразумевается, что термин «связанный функциональным образом» означает, что ген антитела лигирован в вектор так, что последовательности контроля транскрипции и трансляции в пределах вектора служат их намеченной функции регуляции транскрипции и трансляции гена антитела. Экспрессионный вектор и последовательности контроля экспрессии выбирают так, чтобы они были совместимыми с используемой клеткой-хозяином экспрессии. Ген легкой цепи антитела и ген тяжелой цепи антитела может быть вставлен в отдельные векторы или, более типично, оба гена вставляют в тот же самый экспрессионный вектор.
Гены антитела вставляют в экспрессионный вектор стандартными способами (например, лигирование комплементарных сайтов рестрикции на фрагменте гена антитела и векторе или лигирование тупых концов при отсутствии сайтов рестрикции). До вставки последовательностей легких или тяжелых цепей антител против VEGF по изобретению экспрессионный вектор уже может нести последовательности константной области антитела. Например, одним подходом для превращения последовательностей VH и VL против VEGF в гены полноразмерных антител является их вставка в экспрессионные векторы, уже кодирующие константные области тяжелой цепи и легкой цепи, соответственно так, что сегмент VH связывается функциональным образом с сегментом(ами) СН в пределах вектора, и сегмент VL связывается функциональным образом с сегментом CL в пределах вектора. Дополнительно или альтернативно, рекомбинантный вектор экспрессии может кодировать сигнальный пептид, который облегчает секрецию цепи антитела из клетки-хозяина. Ген цепи антитела может быть клонирован в вектор так, что сигнальный петид связывается в рамке считывания с аминоконцом цепи антитела. Сигнальный пептид может быть сигнальным пептидом иммуноглобулина или гетерологичным сигнальным пептидом (т.е. сигнальным пептидом из неиммуноглобулинового белка).
Кроме генов цепи антитела, векторы рекомбинантной экспрессии по изобретению несут регуляторные последовательности, которые контролируют экспрессию генов цепи антитела в клетке-хозяине. Подразумевается, что термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования), которые контролируют транскрипцию или трансляцию генов цепи антитела. Такие регуляторные последовательности описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology 185 (Academic Press, San Diego, CA, 1990). Специалисту в данной области будет понятно, что конструкция экспрессионного вектора, включающая набор регуляторных последовательностей, может зависеть от таких факторов, как выбор клетки-хозяина, подлежащей трансформированию, уровень экспрессии желательного белка и т.д. Подходящие регуляторные последовательности для экспрессии в клетке-хозяине млекопитающего включают вирусные элементы, которые управляют высокими уровнями экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, происходящие из цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса обезьян 40 (SV40) (такие как промотор/энхансер SV40), аденовируса (например, главный поздний промотор аденовируса (AdMLP)) и вируса полиомы. Для дальнейшего описания вирусных регуляторных элементов и их последовательностей, смотри, например, патент США №5168062, выданный Stinski, патент США №4510245, выданный Bell et al., и патент США №4968615, выданный Schaffner et al.
Кроме генов цепей антитела и регуляторных последовательностей, векторы рекомбинантной экспрессии по изобретению могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, репликаторы), и селектируемые маркерные гены. Селектируемый маркерный ген облегчает селекцию клеток-хозяев, в которые был введен вектор (смотри, например, патенты США №4399216, 4634665 и 5179017, которые все выданы Axel et al.). Например, типично селектируемый маркерный ген придает устойчивость к лекарственным средствам, таким как G418, пуромицин, бластидицин, гигромицин или метотрексат, клетке-хозяину, в которую был введен вектор. Подходящие селектируемые маркерные гены включают ген дигидрофолатредуктазы (DHFR) (для применения в клетках-хозяевах DHFR" с метотрексатной селекцией/амплификацией) и ген пео (для селекции G418). Для экспрессии легкой и тяжелой цепей экспрессионный вектор(ы), кодирующий тяжелую и легкую цепи, переносят в клетку-хозяина стандартными методиками. Подразумевается, что разные формы термина «трансфекция» охватывают широкий спектр методик, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, липофекцию, осаждение фосфатом кальция, трансфекцию с ОЕАЕ(диэтиламиноэтил)-декстраном и тому подобное.
Можно экспрессировать антитела по изобретению либо в прокариотических, либо в эукариотических клетках-хозяевах. В определенных воплощениях экспрессия антител проводится в эукариотических клетках, например, клетках-хозяевах млекопитающих, для оптимальной секреции правильно свернутого и иммунологически активного антитела. Типичные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по изобретению включают клетки яичника китайского хомячка (клетки СНО) (включая клетки СНО DHFR-, описанные Uriaub and Chasin, 1980, Proc. Natl. Acad. Sci. USA 77:4216-4220, используемые с DHFR селектируемым маркером, например, как описано в Kaufman and Sharp, 1982, Mol. Biol. 159:601-621), миеломные клетки NSO, клетки COS, клетки 293 и клетки SP2/0. При введении векторов рекомбинантной экспрессии, кодирующих гены антитела, в клетки-хозяева млекопитающих, антитела продуцируются культивированием клеток-хозяев в течение достаточного периода времени для обеспечения экспрессии антитела в клетках-хозяевах или секреции антитела в культуральную среду, в которой выращивают клетки-хозяева. Антитела можно выделять из культуральной среды с использованием стандартных способов очистки белка. Клетки-хозяева также можно использовать для получения частей интактных антител, таких как Fab фрагменты или молекулы scFv. Понятно, что вариации приведенной выше методики находятся в пределах объема настоящего изобретения. Например, может быть желательной трансфекция клетки-хозяина ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (но не обе) антитела против VEGF по данному изобретению.
Методику генной инженерии также можно использовать для удаления некоторых или всех ДНК, кодирующих одну из двух или обе легкую и тяжелую цепи, которые не являются необходимыми для связывания с VEGF. Молекулы, экспрессируемые из таких усеченных молекул ДНК, также охватываются антителами по изобретению.
Кроме того, могут быть получены бифункциональные антитела, в которых одна тяжелая и одна легкая цепь представляют собой антитело по изобретению, а другие тяжелая и легкая цепь являются специфичными в отношении антигена, отличного от VEGF, путем поперечного связывания антитела по изобретению со вторым антителом стандартными способами химического поперечного связывания. Бифункциональные антитела также можно создать экспрессией нуклеиновой кислоты, сконструированной так, чтобы она кодировала бифункциональное антитело.
В определенных воплощениях антитела с двойной специфичностью, т.е. антитела, которые связывают VEGF и неродственный ему антиген, с использованием того же самого сайта связывания, можно получить мутированием аминокислотных остатков в CDR легкой цепи и/или тяжелой цепи. В разных воплощениях антитела с двойной специфичностью, которые связывают два антигена, такие как HER2 и VEGF, можно получить мутированием аминокислотных остатков на периферии антигенсвязывающего сайта (Bostrom et al., 2009, Science 323:1610-1614). Бифункциональные антитела можно сделать. путем экспрессии нуклеиновой кислоты, сконструированной так, чтобы она кодировала антитело с двойной специфичностью.
Для рекомбинантной экспрессии антитела против VEGF по изобретению клетку-хозяина можно сотрансфицировать двумя экспрессионными векторами по изобретению, первым вектором, кодирующим полипептид, происходящий из тяжелой цепи, и вторым вектором, кодирующим полипептид, происходящий из легкой цепи. Типично каждый из двух векторов содержит отдельный селектируемый маркер. В качестве альтернативы, можно использовать один вектор, который кодирует полипептиды как тяжелой, так и легкой цепи.
Как только получена нуклеиновая кислота, кодирующая одну или более чем одну часть антитела против VEGF, в кодирующую последовательность могут быть введены дополнительные изменения или мутации, например, с получением нуклеиновых кислот, кодирующих антитела с разными последовательностями CDR, антитела с пониженной аффинностью к рецептору Fc или антитела разных подклассов.
Антитела против VEGF по изобретению также можно получить химическим синтезом (например, способами, описанными в Solid Phase Peptide Synthesis, 2nd ed., 1984 The Pierce Chemical Co., Rockford, III.). Варианты антител также можно генерировать с использованием бесклеточной платформы (смотри, например, Chu et al., 2001, Biochemia No.2 (Roche Molecular Biologicals)).
Как только получено антитело против VEGF по изобретению посредством рекомбинантной экспрессии, его можно очистить любым способом очистки молекулы иммуноглобулина, известным в данной области, например, хроматографией (например, ионообменная, аффинная, конкретно посредством аффинности в отношении VEGF после селекции с белком А или белком G, и гель-фильтрация), центрифугированием, дифференциальной растворимостью или любой другой стандартной методикой очистки белков. Кроме того, антитела против VEGF по настоящему изобретению или их фрагменты можно сливать с описанными здесь гетерологичными полипептидными последовательностями или известными в данной области иным способом для облегчения очистки.
Сразу после выделения антитело против VEGF можно, если это желательно, дополнительно очистить, например, высокоэффективной жидкостной хроматографией (смотри, например, Fisher, Laboratory Techniques In Biochemistry And Molecular Biology (Work and Burdon, eds., Elsevier, 1980) или гель-фильтрацией на колонке Superdex™ 75 (Pharmacia Biotech AB, Uppsala, Швеция).
6.3 БИОЛОГИЧЕСКИЕ АКТИВНОСТИ АНТИТЕЛ ПРОТИВ VEGF
В определенных воплощениях антитела против VEGF по изобретению имеют определенные биологические активности, такие как конкуренция с бевацизумабом или ранибизумабом за связывание с VEGF или нейтрализация активности VEGF.
Соответственно, в определенных воплощениях антитела против VEGF по изобретению конкурируют с бевацизумабом или ранибизумабом за связывание с VEGF. Способность конкурировать за связывание с VEGF можно протестировать с использованием конкурентного анализа. В одном примере конкурентного анализа VEGF прикрепляют к твердой поверхности, например, микролуночного планшета, путем приведения в контакт планшета с раствором VEGF (например, в концентрации 1 мкг/мл в PBS (фосфатно-солевой буферный раствор) в течение ночи при 4°С). Планшет промывают (например, 0,1% Tween 20 в PBS) и блокируют (например, в Superblock, Thermo Scientific, Rockford, IL). В лунки добавляют смесь субнасыщающего количества биотинилированного бевацизумаба (80 нг/мл) или эквивалентного количества биотинилированного ранибизумаба и немеченого бевацизумаба (или ранибизумаба, в зависимости от обстоятельств) («контрольное» антитело) или конкурирующего антитела против VEGF («тестируемое» антитело) в последовательном разведении (например, в концентрации 2,8 мкг/мл, 8,3 мкг/мл или 25 мкг/мл) в буфере для ELISA (например, 1% BSA (бычий сывороточный альбумин) и 0,1% Tween 20 в PBS), и планшеты инкубируют в течение 1 часа с мягким встряхиванием. Планшет промывают, в каждую лунку добавляют 1 мкг/мл стрептавидина, конъюгированного с HRP (пероксидаза хрена), разведенного в буфере для ELISA, и планшеты инкубируют в течение 1 часа. Планшеты промывают, и связанные антитела детектируют добавлением субстрата (например, ТМВ (тетраметилбензидин), Biofx Laboratories Inc., Owings Mills, MD). Реакцию завершают добавлением останавливающего буфера (например, Bio FX Stop Reagents, Biofx Laboratories Inc., Owings Mills, MD), и оптическую плотность измеряют при 650 нм с использованием микропланшет-ридера (например, VERSAmax, Molecular Devices, Sunnyvale, CA). Вариации данного конкуретного анализа также можно использовать для тестирования конкуренции между антителом против VEGF по изобретению и бевацизумабом или ранибизумабом. Например, в определенных аспектах антитело против VEGF используют в качестве контрольного антитела, и бевацизумаб или ранибизумаб используют в качестве тестируемого антитела. Дополнительно, вместо растворимого VEGF можно использовать мембраносвязанный VEGF, экспрессируемый на поверхностях клеток (например, клеток млекопитающих) в культуре. В данной области известны и могут применяться другие форматы конкурентных анализов.
В разных воплощениях антитело против VEGF по изобретению снижает связывание меченого бевацизумаба или ранибизумаба по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 99% или на процентную долю в диапазоне между любыми из вышеуказанных значений (например, антитело против VEGF по изобретению снижает связывание меченого бевацизумаба или ранибизумаба на 50%-70%) при использовании антитела против VEGF в концентрации 0,08 мкг/мл, 0,4 мкг/мл, 2 мкг/мл, 10 мкг/мл, 50 мкг/мл, 100 мкг/мл или в концентрации, варьирующей между любым из вышеуказанных значений (например, в концентрации, варьирующей от 2 мкг/мл до 10 мкг/мл).
В других воплощениях бевацизумаб или ранибизумаб уменьшает связывание меченого антитела против VEGF по изобретению по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или на процентную долю в диапазоне между любым из вышеупомянутых значений (например, бевацизумаб или ранибизумаб уменьшает связывание меченого антитела против VEGF по изобретению на 50%-70%), при использовании бевацизумаба или ранибизумаба в концентрации 0,4 мкг/мл, 2 мкг/мл, 10 мкг/мл, 50 мкг/мл, 250 мкг/мл или в концентрации, варьирующей между любыми из вышеупомянутых значений (например, в концентрации, варьирующей от 2 мкг/мл до 10 мкг/мл).
В других аспектах антитело против VEGF по изобретению ингибирует (или нейтрализует) активность VEGF в целом ряде анализов in vitro, таких как пролиферация клеток или миграция клеток. Например, в одном воплощении анализируемая активность VEGF представляет собой индукцию пролиферации эндотелиальных клеток («ЕС») (смотри, например, протокол Qin et al., 2006, J. Biol. Chem. 281:32550-32558). В другом воплощении анализируемая активность VEGF представляет собой индукцию миграции ЕС (смотри, например, протокол анализа соскабливания in vitro, описанный Liang et al., 2007, Nat. Protoc. 2:329-333). В конкретном воплощении антитело против VEGF тестируют на способность реверсировать пролиферацию и миграцию клеток, стимулируемую VEGF, и делокализацию белков плотных контактов, индуцируемую VEGFie5, в иммортализованных коровьих эндотелиальных клетках сетчатки (Deissler et al., 2008, British Journal of Ophthalmology 92:839-843). В еще одном воплощении нейтрализацию активности VEGF анализируют с использованием анализа с репортером (смотри, например, Yohno et al., 2003, Biological & Pharmaceutical Bulletin 26(4):417-20 и патент США №6787323).
В данной области известны и могут использоваться другие форматы анализов нейтрализации VEGF.
В разных воплощениях антитело против VEGF по изобретению нейтрализует VEGF по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или на процентную долю в диапазоне между любым из вышеупомянутых значений (например, антитело против VEGF по изобретению нейтрализует активность VEGF на 50%-70%) при использовании антитела против VEGF в концентрации 2 нг/мл, 5 нг/мл, 10 нг/мл, 20 нг/мл, 0,1 мкг/мл, 0,2 мкг/мл, 1 мкг/мл, 2 мкг/мл, 5 мкг/мл, 10 мкг/мл, 20 мкг/мл, или в концентрации в диапазоне между любыми из вышеуказанных значений (например, в концентрации, варьирующей от 1 мкг/мл до 5 мкг/мл).
В некоторых воплощениях антитело против VEGF по изобретению имеет эффективность, составляющую по меньшей мере 0,7 от эффективности, 0,8 от эффективности, по меньшей мере 0,9 от эффективности, по меньшей мере 1 от эффективности, по меньшей мере в 1,1 раза большую эффективность, по меньшей мере в 1,25 раза большую эффективность, по меньшей мере в 1,5 раза большую эффективность, по меньшей мере в 2 раза большую эффективность, по меньшей мере в 5 раз большую эффективность, по.меньшей мере в 10 раз большую эффективность, по меньшей мере в 20 раз большую эффективность, по меньшей мере в 50 раз большую эффективность, по меньшей мере в 100 раз большую эффективность, по меньшей мере в 200 раз большую эффективность, по меньшей мере в 500 раз большую эффективность, по меньшей мере в 1000 раз большую эффективность, чем бевацизумаб или ранибизумаб, по нейтрализации VEGF, или имеющие эффективность по нейтрализации VEGF относительно бевацизумаба или ранибизумаба в диапазоне между любой парой из вышеупомянутых значений (например, от 0,9-кратной до 5-кратной относительно эффективности бевацизумаба или ранибизумаба, или от 2-кратной до 50-кратной относительно эффективности бевацизумаба или ранибизумаба по нейтрализации VEGF).
6.4 КИНЕТИЧЕСКИЕ СВОЙСТВА АНТИТЕЛ ПРОТИВ VEGF
В определенных воплощениях антитела против VEGF по изобретению имеют высокую аффинность связывания в отношении VEGF. В конкретных воплощениях антитела против VEGF по настоящему изобретению имеют специфичные константы скорости ассоциации (значения kon или ka), константы скорости диссоциации (значения koff или kd), константы аффинности (значения KD), константы диссоциации (значения Ко) и/или значения IC50 (ингибирующая концентрация). В разных воплощениях константы связывания для взаимодействия антител против VEGF с рецептором VEGF можно определять с использованием поверхностного плазменного резонанса, например, согласно способу, раскрытому в Karlsson et al., 1991, J. Immunol. Methods 145:229-240. В определенных аспектах такие значения выбраны из следующих воплощений.
В конкретном воплощении антитело против VEGF по изобретению связывается с VEGF с kon по меньшей мере 104 М-1с-1, по меньшей мере 5×104 М-1с-1, по меньшей мере 105 М-1с-1, по меньшей мере 5×105 М-1с-1, по меньшей мере 106 M-1c-1, по меньшей мере 5×106 М-1с-1, по меньшей мере 107 М-1с-1, по меньшей мере 5×107 М-1с-1, по меньшей мере 108 М-1с-1, по меньшей мере 5×108 М-1с-1, по меньшей мере 109 М-1с-1 или с kon в любом интервале между любой парой из вышеупомянутых значений (например, от 5×105 до 5×106 M-1c-1 или от 107 до 108 М-1с-1).
В другом воплощении антитело против VEGF по изобретению связывается с VEGF с koff скорости 10-3 с-1 или меньше, 5×10-4 с-1 или меньше, 10-4 с-1 или меньше, 5×10-5 с-1 или меньше, 10-5 с-1 или меньше, 5×10-6 с-1 или меньше, 10-6 с-1 или меньше, 5×10-7 с-1 или меньше, 10-7 с-1 или меньше, 5×10-8 с-1 или меньше, 10-8 с-1 или меньше, или с koff скорости в любом интервале между любой парой вышеупомянутых значений (например, от 5×10-4 до 10-6 с-1, или от 10-3 до 5×10-5 с-1).
В другом воплощении антитело против VEGF по изобретению связывается с VEGF с KA (kon/koff) по меньшей мере 108 М-1, по меньшей мере 5×109 М-1, по меньшей мере 1010 М-1, по меньшей мере 5×1010 М-1, 1011 М-1, по меньшей мере 5×1011 М-1, по меньшей мере 1012 М-1, по меньшей мере 5×1012 М-1, по меньшей мере 1013 М-1, по меньшей мере 5×1013 М-1, по меньшей мере 1014 М-1, по меньшей мере 5×1014 М-1, по меньшей мере 1015 М-1 или с KD в любом интервале между любой парой из вышеупомянутых значений (например, от 5×109 M-1 до 1011 М-1, или от 1011 М-1 до 5×1014 М-1).
В других воплощениях антитело против VEGF по изобретению связывается с VEGF с KD (koff/kon) 10-8 М или меньше, 5×10-9 М или меньше, 10-9 М или меньше, 5×10-10 М или меньше, 10-10 М или меньше, 5×10-11 М или меньше, 10-11 М или меньше, 5×10-12 М или меньше, 10-12 М или меньше, 5×10-13 М или меньше, 10-13 М или меньше, 5×10-14 М или меньше, 10-14 М или меньше, 5×10-15 М или меньше, 10-15 М или меньше, или с KD в любом интервале между любой парой из вышеупомянутых значений (например, от 5×10-9 до 5×10-12 М, или от 5×10-11 М до 5×10-13 М).
В конкретных воплощениях значение KD (koff/kon) определяется анализами, хорошо известными в данной области или описанными здесь, например, ELISA, изотермической титрационной калориметрией (ITC), флуоресцентным поляризационным анализом или любыми другими биосенсорами, такими как BIAcore.
В некоторых воплощениях антитело против VEGF по изобретению связывается с VEGF и ингибирует связывание VEGF с рецептором VEGF (Flt-1 или Flk-1) со значением IC50 меньше чем 5×107 нМ, меньше чем 107 нМ, меньше чем 5×106 нМ, меньше чем 106 нМ, меньше чем 5×105 нМ, меньше чем 105 нМ, меньше чем 5×104 нМ, меньше чем 104 нМ, меньше чем 5×103 нМ, меньше чем 103 нМ, меньше чем 5×102 нМ, меньше чем 100 нМ, меньше чем 90 нМ, меньше чем 80 нМ, меньше чем 70 нМ, меньше чем 65 нМ, меньше чем 60 нМ, меньше чем 50 нМ, меньше чем 40 нМ, меньше чем 30 нМ, меньше чем 25 нМ, меньше чем 20 нМ, меньше чем 15 нМ, меньше чем 12 нМ, меньше чем 10 нМ, меньше чем 5 нМ, меньше чем 1 нМ, меньше чем 5×10-1 нМ, меньше чем 10-1 нМ, меньше чем 5×10-2 нМ, меньше чем 10-2 нМ, меньше чем 5×10-3 нМ, меньше чем 10-3 нМ, меньше чем 5×10-4 нМ, или меньше чем 10-4 нМ, или с IC50 в любом интервале между любой парой вышеупомянутых значений (например, от 5×107 до 50 нМ, или от 15 нМ до 5×10-3 нМ). IC50 можно измерять согласно способам, хорошо известным в данной области или описанным здесь, например, ELISA.
В других воплощениях антитело против VEGF по изобретению связывается с VEGF и нейтрализует активность VEGF в биопробе (например, пролиферацию или миграцию ЕС) со значением IC50 меньше чем 5×107 нМ, меньше чем 107 нМ, меньше чем 5×106 нМ, меньше чем 106 нМ, меньше чем 5×105 нМ, меньше чем 105 нМ, меньше чем 5×104 нМ, меньше чем 104 нМ, меньше чем 5×103 нМ, меньше чем 103 нМ, меньше чем 5×102 нМ, меньше чем 100 нМ, меньше чем 90 нМ, меньше чем 80 нМ, меньше чем 70 нМ, меньше чем 65 нМ, меньше чем 60 нМ, меньше чем 50 нМ, меньше чем 40 нМ, меньше чем 30 нМ, меньше чем 25 нМ, меньше чем 20 нМ, меньше чем 15 нМ, меньше чем 12 нМ, меньше чем 10 нМ, меньше чем 5 нМ, меньше чем 1 нМ, меньше чем 5×10-1 нМ, меньше чем 10-1 нМ, меньше чем 5×10-2 нМ, меньше чем 10-2 нМ, меньше чем 5×10'3 нМ, меньше чем 10-3 нМ, меньше чем 5×10-4 нМ, или меньше чем 10-4 нМ, или с IC50 в любом интервале между любой парой из вышеупомянутых значений (например, от 5×107 до 50 нМ, или от 15 нМ до 5×10-3 нМ). Типичный анализ нейтрализации, который можно использовать для измерения BK50 антитела против VEGF, описан в разделе 6.3 ниже.
В определенных воплощениях антитело против VEGF связывается с VEGF и ингибирует связывание VEGF с Flt-1, Flk-1 или с ими обоими, или ингибирует активность VEGF в анализе нейтрализации VEGF со значением IC50 от приблизительно 1 пМ до приблизительно 1 мкМ. В конкретных воплощениях антитело против VEGF связывается с VEGF и ингибирует связывание VEGF с Flt-1, Flk-1 или с ими обоими, или ингибирует активность VEGF в анализе нейтрализации VEGF со значением IC50 от 10 пМ до 100 нМ, от 100 пМ до 10 нМ, от 200 пМ до 5 нМ, от 300 пМ до 4 нМ, от 500 пМ до 3 нМ, от 750 пМ до 2 нМ, от 1 нМ до 20 нМ, от 500 пМ до 40 нМ, от 50 пМ до 50 нМ, от 250 пМ до 100 нМ и от 100 нМ до 1 мкМ, или с IC50 в любом интервале между любой парой из вышеупомянутых значений (например, от 10 пМ до 50 нМ или от 750 пМ до 2 нМ).
В определенных аспектах вышеупомянутых воплощений IC50 измеряют в присутствии VEGF в концентрации, 0,001 мкМ, 0,005 мкМ, 0,01 мкМ, 0,05 мкМ, 0,1 мкМ, 0,5 мкМ, 1 мкМ, 10 мкМ, 20 мкМ, 30 мкМ, 40 мкМ, 50 мкМ, 60 мкМ, 70 мкМ, 80 мкМ, 90 мкМ, 100 мкМ, 200 мкМ, 300 мкМ, 400 мкМ, 500 мкМ, 600 мкМ, 700 мкМ, 800 мкМ, 900 мкМ, 1000 мкМ или в концентрации в любом интервале между любой парой из вышеупомянутых значений (например, от 0,01 до 50 мкМ или от 10 мкМ до 100 мкМ).
В определенных воплощениях кинетические свойства антитела по изобретению являются сравнимыми или улучшенными относительно свойств бевацизумаба или ранибизумаба в анализе сравнения. Например, в определенных воплощениях антитело против VEGF по изобретению связывается с VEGF с kon скорости, варьирующей от приблизительно 0,5× до 1000× относительно kon бевацизумаба или ранибизумаба, например, kon 0,5× относительно kon бевацизумаба или ранибизумаба, kon 0,75× относительно kon бевацизумаба или ранибизумаба, kon 0,9× относительно kon бевацизумаба или ранибизумаба, kon 1× относительно kon бевацизумаба или ранибизумаба, kon 1,1× относительно kon бевацизумаба или ранибизумаба, kon 1,2× относительно kon бевацизумаба или ранибизумаба, kon 1,3× относительно kon бевацизумаба или ранибизумаба, kon 1,4× относительно kon бевацизумаба или ранибизумаба, kon 1,5× относительно kon бевацизумаба или ранибизумаба, kon 1,75× относительно kon бевацизумаба или ранибизумаба, kon 2х относительно kon бевацизумаба или ранибизумаба, kon 2,25× относительно kon бевацизумаба или ранибизумаба, kon 2,5× относительно kon бевацизумаба или ранибизумаба, kon 3× относительно kon бевацизумаба или ранибизумаба, kon 4х относительно kon бевацизумаба или ранибизумаба, kon 5× относительно kon бевацизумаба или ранибизумаба, kon 7,5× относительно kon бевацизумаба или ранибизумаба, kon 10× относительно kon бевацизумаба или ранибизумаба, kon 15× относительно kon бевацизумаба или ранибизумаба, kon 20× относительно kon бевацизумаба или ранибизумаба, kon 50× относительно kon бевацизумаба или ранибизумаба, kon 75× относительно kon бевацизумаба или ранибизумаба, kon 100× относительно kon бевацизумаба или ранибизумаба, kon 150× относительно kon бевацизумаба или ранибизумаба, kon 200× относительно kon бевацизумаба или ранибизумаба, kon 200× относительно kon бевацизумаба или ранибизумаба, или kon, варьирующей между любой парой из вышеупомянутых значений, например, kon 2×-75× относительно kon бевацизумаба или ранибизумаба, kon 5×-100× относительно kon бевацизумаба или ранибизумаба, kon 0,5×-1000× относительно kon бевацизумаба или ранибизумаба, kon 0,75×-200× относительно kon бевацизумаба или ранибизумаба и т.д.
В определенных воплощениях антитело против VEGF по изобретению связывается с VEGF с koff скорости, варьирующей от 0,001× до 3× относительно koff бевацизумаба или ранибизумаба, например, koff 0,002× относительно koff бевацизумаба или ранибизумаба, koff 0,005× относительно koff бевацизумаба или ранибизумаба, koff 0,0075× относительно koff бевацизумаба или ранибизумаба, koff 0,01× относительно koff бевацизумаба или ранибизумаба, koff 0,025× относительно koff бевацизумаба или ранибизумаба, koff 0,05× относительно koff бевацизумаба или ранибизумаба, koff 0,075× относительно koff бевацизумаба или ранибизумаба, koff 0,1× относительно koff бевацизумаба или ранибизумаба, koff 0,25× относительно koff бевацизумаба или ранибизумаба, koff 0,5× относительно koff бевацизумаба или ранибизумаба, koff 0,75× относительно koff бевацизумаба или ранибизумаба, koff 0,9× относительно koff бевацизумаба или ранибизумаба, koff 1,1× относительно koff бевацизумаба или ранибизумаба, koff 1,25× относительно koff бевацизумаба или ранибизумаба, koff 1,5× относительно koff бевацизумаба или ранибизумаба, koff относительно 1,75× koff бевацизумаба или ранибизумаба, koff 4× относительно koff бевацизумаба или ранибизумаба, koff 3× относительно koff бевацизумаба или ранибизумаба, koff 2× относительно koff бевацизумаба или ранибизумаба, koff 3× относительно koff бевацизумаба или ранибизумаба или koff, варьирующей между любой парой из вышеупомянутых значений, например, koff от 0,01× до 1,1× относительно koff бевацизумаба или ранибизумаба, koff от 0,05× до 1,25× относительно koff бевацизумаба или ранибизумаба, koff от 0,1× до 0,9× относительно koff бевацизумаба или ранибизумаба и т.д.
В других воплощениях антитело против VEGF по изобретению связывается с VEGF с KA (kon/koff), варьирующей от 0,25× до 1000× относительно KA бевацизумаба или ранибизумаба, например, KA 0,5× относительно KA бевацизумаба или ранибизумаба, KA 0,75× относительно KA бевацизумаба или ранибизумаба, KA 1× относительно KA бевацизумаба или ранибизумаба, KA 2× относительно KA бевацизумаба или ранибизумаба, KA 4× относительно KA бевацизумаба или ранибизумаба, KA 10× относительно KA бевацизумаба или ранибизумаба, KA 15× относительно KA бевацизумаба или ранибизумаба, KA 20× относительно KA бевацизумаба или ранибизумаба, KA 30× относительно KA бевацизумаба или ранибизумаба, KA 40× относительно KA бевацизумаба или ранибизумаба, KA 50× относительно KA бевацизумаба или ранибизумаба, KA 100× относительно KA бевацизумаба или ранибизумаба, KA 250× относительно KA бевацизумаба или ранибизумаба, KA 500× относительно KA бевацизумаба или ранибизумаба, KA 750× относительно KA бевацизумаба или ранибизумаба, KA 1000× относительно KA бевацизумаба или ранибизумаба или KA, варьирующей между любой парой из вышеупомянутых значений, например, KA 0,75×-10,5× относительно KA бевацизумаба или ранибизумаба, KA 1×-100× относительно KA бевацизумаба или ранибизумаба, KA 10×-20× KA бевацизумаба или ранибизумаба, KA 4×-50× относительно KA бевацизумаба или ранибизумаба, KA 2×-20× относительно KA бевацизумаба или ранибизумаба, или любого значения, или интервала, который можно рассчитать из раскрытых здесь kon и koff скоростей.
В других воплощениях антитело против VEGF по изобретению связывается с VEGF с KD (koff/kon), варьирующей от 0,001× до 10× относительно KD бевацизумаба или ранибизумаба, например, KD 0,001× относительно KD бевацизумаба или ранибизумаба, KD 0,005× относительно KD бевацизумаба или ранибизумаба, KD 0,01× относительно KD бевацизумаба или ранибизумаба, KD 0,05× относительно KD бевацизумаба или ранибизумаба, KD 0,075× относительно KD бевацизумаба или ранибизумаба, KD 0,1× относительно KD бевацизумаба или ранибизумаба, KD 0,2× относительно KD бевацизумаба или ранибизумаба, KD 0,3× относительно KD бевацизумаба или ранибизумаба, KD 0,4× относительно KD бевацизумаба или ранибизумаба, KD 0,5× относительно KD бевацизумаба или ранибизумаба, KD 0,6× относительно KD бевацизумаба или ранибизумаба, KD 0,7× относительно KD бевацизумаба или ранибизумаба, KD 0,8× относительно KD бевацизумаба или ранибизумаба, KD 0,9× относительно KD бевацизумаба или ранибизумаба, KD 1× относительно KD бевацизумаба или ранибизумаба, KD 1,5× относительно KD бевацизумаба или ранибизумаба, KD 2× относительно KD бевацизумаба или ранибизумаба, KD 4× относительно KD бевацизумаба или ранибизумаба, KD 7,5× относительно KD бевацизумаба или ранибизумаба, KD 10× относительно KD бевацизумаба или ранибизумаба, или KD, варьирующей между любой парой из вышеупомянутых значений, например, KD 0,01×-2× относительно KD бевацизумаба или ранибизумаба, KD 0,1×-1,5× относительно KD бевацизумаба или ранибизумаба, KD 0,7×-4× относительно KD бевацизумаба или ранибизумаба, KD 0,2×-2× относительно KD бевацизумаба или ранибизумаба, или любого значения, или интервала, который можно рассчитать из раскрытых здесь kon и koff скорости.
В некоторых воплощениях антитело против VEGF по изобретению связывается с VEGF и ингибирует связывание VEGF с Flt-1, Flk-1 или с ими обоими, или нейтрализует активность VEGF со значением IC50, варьирующим от 0,001× до 10× относительно IC50 бевацизумаба или ранибизумаба, например, IC50 0,001× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,005× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,01× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,05× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,075× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,1× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,2× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,3× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,4× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,5× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,6× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,7× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,8× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,9× относительно IC50 бевацизумаба или ранибизумаба, IC50 1× относительно IC50 бевацизумаба или ранибизумаба, IC50 1,5× относительно IC50 бевацизумаба или ранибизумаба, IC50 2× относительно IC50 бевацизумаба или ранибизумаба, IC50 4× относительно IC50 бевацизумаба или ранибизумаба, IC50 7,5× относительно IC50 бевацизумаба или ранибизумаба, IC50 10× относительно IC50 бевацизумаба или ранибизумаба, или IC50, варьирующей между любой парой из вышеупомянутых значений, например, IC50 0,01×-2× относительно IC50 бевацизумаба или ранибизумаба, IC50 0,1×-1,5× относительно IC50 бевацизумаба или ранибизумаба, или IC50 0,7×-4× относительно IC50 бевацизумаба или ранибизумаба, или IC50 0,2×-2× относительно IC50 бевацизумаба или ранибизумаба. В определенных воплощениях одна замена в CDR может приводить к вышеупомянутым различиям в IC50 по сравнению с бевацизумабом или ранибизумабом, тогда как антитело против VEGF по изобретению может содержать такую замену и вплоть до 16 дополнительных замен в CDR по сравнению с бевацизумабом или ранибизумабом.
6.5 ПОНИЖЕННАЯ ИММУНОГЕННОСТЬ АНТИТЕЛ ПРОТИВ VEGF
В определенных аспектах согласно настоящему изобретению предложены антитела против VEGF, имеющие пониженную иммуногенность по сравнению с бевацизумабом или ранибизумабом. Согласно настоящему изобретению предложены антитела против VEGF, имеющие одну или множественные аминокислотные замены в их CDR и/или каркасных областях по сравнению с CDR бевацизумаба, где по меньшей мере одна замена снижает иммуногенность антитела по сравнению с бевацизумабом или ранибизумабом. В определенных воплощениях пониженная иммуногенность возникает из-за одной или более чем одной аминокислотной замены, которая приводит к устранению или ослаблению одного или более чем одного эпитопа Т-клеток.
В определенных аспектах антитела против VEGF по изобретению, имеющие пониженную иммуногенность, имеют сравнимую или улучшенную биологическую активность по сравнению с бевацизумабом или ранибизумабом, например, аффинность в отношении VEGF или нейтрализацию активности VEGF. Такие свойства можно протестировать, например, способами, описанными в разделе 6.3 выше.
В определенных воплощениях иммуногенность антитела против VEGF по изобретению снижена относительно антитела бевацизумаб или ранибизумаб. Такие антитела обычно имеют варианты последовательностей относительно вариабельной области тяжелой и/или легкой цепи в областях, соответствующих SEQ ID NO:25, SEQ ID NO:62 и/или SEQ ID NO:74. Антитела обычно будут иметь одну, две или три аминокислотных замены в одной, двух или всех трех последовательностях, соответствующих SEQ ID NO:25, SEQ ID NO:62 и SEQ ID NO:74, хотя здесь рассматриваются и вплоть до четырех или пяти замен в одной, двух или всех трех областях.
Фраза вариант с «пониженной иммуногенностью» в том виде, как она используется в настоящем изобретении, относится к антителу против VEGF с вариантом последовательности в области, соответствующей SEQ ID NO:25, SEQ ID NO:62 и/или SEQ ID NO:74, которое вызывает ослабленный пролиферативный ответ в одноядерных клетках периферической крови по сравнению с пептидом SEQ ID NO:25, SEQ ID NO:62 или SEQ ID NO:74, соответственно. Типичный анализ пролиферации, который можно использовать для оценки пролиферативного ответа, изложен в разделе 7 ниже. Ослабленный пролиферативный ответ может быть отражен в показателях процентной доли отвечающих организмов, индекса стимуляции или их обоих.
В других воплощениях по сравнению с пептидом, имеющим последовательность SEQ ID NO:25, SEQ ID NO:62 или SEQ ID NO:74, вариант последовательности приводит к по меньшей мере на 25% меньшему числу отвечающих организмов, к по меньшей мере на 30% меньшему числу отвечающих организмов, к по меньшей мере на 35% меньшему числу отвечающих организмов, к по меньшей мере на 40% меньшему числу отвечающих организмов, к по меньшей мере на 45% меньшему числу отвечающих организмов, к по меньшей мере на 50% меньшему числу отвечающих организмов, к по меньшей мере на 60% меньшему числу отвечающих организмов, к по меньшей мере на 65% меньшему числу отвечающих организмов, к по меньшей мере на 70% меньшему числу отвечающих организмов, к по меньшей мере на 75% меньшему числу отвечающих организмов, к по меньшей мере на 80% меньшему числу отвечающих организмов, к по меньшей мере на 85% меньшему числу отвечающих организмов, к по меньшей мере на 90% меньшему числу отвечающих организмов, к по меньшей мере на 95% меньшему числу отвечающих организмов, на 100% меньшему числу отвечающих организмов или к снижению числа отвечающих организмов в интервале между любыми из вышеупомянутых значений, например, на 25%-75% меньшему числу отвечающих организмов, на 50%-90% меньшему числу отвечающих организмов, на 60%-100% меньшему числу отвечающих организмов, на 70%-90% меньшему числу отвечающих организмов или тому подобное.
В других воплощениях вариант последовательности приводит к индексу стимуляции, который по меньшей мере на 5% меньше, по меньшей мере на 10% меньше, по меньшей мере на 15% меньше, по меньшей мере на 20% меньше, по меньшей мере на 25% меньше, по меньшей мере на 30% меньше, по меньшей мере на 35% меньше или по меньшей мере на 40% меньше, чем индекс стимуляции, вызванный пептидом SEQ ID NO:25, SEQ ID NO:62 или SEQ ID NO:74, соответственно, или приводит к. индексу стимуляции, сниженному на значение в интервале между любыми из вышеупомянутых значений по сравнению с пептидом SEQ ID NO:25, SEQ ID NO:62 или SEQ ID NO:74, например, на 5%-20% меньше, 10%-30% меньше, 25%-35% меньше, 30%-40% меньше или тому подобное.
Типичные воплощения антител-кандидатов против VEGF с пониженной иммуногенностью по сравнению с бевацизумабом или ранибизумабом содержат одну или более чем одну замену в CDR или комбинации замен, изложенные в Таблице 6. Возможно, антитела против VEGF с пониженной иммуногенностью по сравнению с бевацизумабом или ранибизумабом содержат одну или более чем одну дополнительную замену, такую как мутации в CDR в любой из Таблиц 7-13, одиночно или в комбинации.
Кроме того, дополнительные типичные воплощения антител-кандидатов против VEGF с пониженной иммуногенностью по сравнению с бевацизумабом или ранибизумабом содержат одну или более чем одну замену в CDR или комбинации замен, изложенные в Таблицах 14-16. Некоторые предпочтительные воплощения антител против VEGF с пониженной иммуногенностью по сравнению с бевацизумабом или ранибизумабом приведены в Таблице 19.
6.6 КОНЪЮГАТЫ АНТИТЕЛ
Антитела против VEGF по изобретению включают конъюгаты антител, которые модифицированы, например, ковалентным присоединением любого типа молекулы к антителу, так что ковалентное присоединение не мешает связыванию с VEGF.
В определенных аспектах антитело против VEGF по изобретению может быть конъюгировано с эффекторной группировкой или меткой. Термин «эффекторная группировка» в том виде, как он здесь используется, включает, например, антинеопластические агенты, лекарственные средства, токсины, биологически активные белки, например, ферменты, другие антитела или фрагменты антител, синтетические или встречающиеся в природе полимеры, нуклеиновые кислоты (например, ДНК и РНК), радионуклиды, конкретно радиоактивный йод, радиоизотопы, хелатированные металлы, наночастицы и репортерные группы, такие как флуоресцентные соединения или соединения, которые можно детектировать спектроскопией ЯМР (ядерный магнитный резонанс) или ЭПР (электронный парамагнитный резонанс).
В одном примере антитела против VEGF могут быть конъюгированы с эффекторной группировкой, такой как цитотоксический агент, радионуклид или лекарственная группировка для модификации данного биологического ответа. Эффекторная группировка может быть белком или полипептидом таким как, например, и без ограничения, токсин (например, абрин, рицин А, эндотоксин Pseudomonas или токсин Diphtheria), сигнальная молекула (такая как α-интерферон, β-интерферон, фактор роста нервов, фактор роста тромбоцитов или тканевой активатор плазминогена), тромботический агент или антиангиогенный агент (например, ангиостатин или эндостатин), или модификатор биологического ответа, такой как цитокин или фактор роста (например, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), интерлейкин-6 (IL-6), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF) или фактор роста нервов (NGF)).
В другом примере эффекторными группировками могут быть цитотоксины или цитотоксические агенты. Примеры цитотоксинов или цитотоксических агентов включают таксол, цитохалазин В, грамицидин D, бромистый этидий, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорабицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин и их аналоги или гомологи.
Эффекторные группировки также включают, но не ограничены, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацила декарбазин), алкилирующие агенты (например, мехлорэтамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклотосфамид, бусульфан, дибромманнит, стрептозоцин, митомицин С5 и цис-дихлордиаминплатина(11) (DDP) цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин), блеомицин, митрамицин, антрамицин (АМС), калихеамицины или дуокармицины) и антимитотические агенты (например, винкристин и винбластин).
Другие эффекторные группировки могут включать радионуклиды, такие как, но не ограничиваясь, 111In и 90Y, Lu177, висмут213, калифорний252, иридий192 и вольфрам188/рений188, и лекарственные средства, такие как, но не ограничиваясь, алкилфосфохолины, ингибиторы топоизомеразы I, таксоиды и сурамин.
Методики конъюгирования таких эффекторных группировок с антителами хорошо известны в данной области (смотри, например, Hellstrom et al., Controlled Drug Delivery, 2nd Ed., at pp.623-53 (Robinson et al., eds., 1987)); Thorpe et al., 1982, Immunol. Rev. 62:119-58 и Dubowchik et al., 1999, Pharmacology and Therapeutics 83:67-123).
В одном примере антитело против VEGF или его фрагмент слито посредством ковалентной связи (например, пептидной связи) через N-конец или С-конец антитела, или изнутри с аминокислотной последовательностью другого белка (или его частью, например, частью белка из по меньшей мере 10, 20 или 50 аминокислот). Антитело или его фрагмент могут быть связаны с другим белком на N-конце константного домена антитела. Для создания таких слияний можно использовать методики генной инженерии, например, как описано в WO 86/01533 и ЕР 0392745. В другом примере эффекторная молекула может увеличивать период полувыведения in vivo, и/или усиливать доставку антитела через эпителиальный барьер в иммунную систему. Примеры подходящих эффекторных молекул данного типа включают полимеры, альбумин, альбуминсвязывающие белки или альбуминсвязывающие соединения, такие как соединения, описанные в WO 2005/117984.
В определенных аспектах антитело против VEGF конъюгировано с низкомолекулярным токсином. В определенных типичных воплощениях антитело против VEGF по изобретению конъюгировано с доластатином или пептидными аналогами или производными доластатина, например, с ауристатином (патенты США №5635483 и 5780588). Лекарственные группировки доластатина или ауристатина могут быть присоединены к антителу через его N (амино) конец, С (карбоксильный) конец или изнутри (WO 02/088172). Типичные воплощения ауристатина включают монометилауристатиновые лекарственные группировки DE и DF, связанные N-концом, как раскрыто в патенте США №7498298, который включен сюда посредством ссылки во всей его полноте (раскрывающий, например, линкеры и способы получения монометилвалиновых соединений, таких как ММАЕ и MMAF, конъюгированные с линкерами).
В других типичных воплощениях низкомолекулярные токсины включают, но не ограничиваются, калихеамицин, майтанзин (патент США №5208020), трихотен и СС1065. В одном воплощении изобретения антитело конъюгировано с одной или более чем одной молекулой майтанзина (например, от примерно 1 до примерно 10 молекул майтанзина на молекулу антитела). Майтанзин, например, может быть превращен в May-SS-Me, который может быть восстановлен до Мау-ЗНЗ и может прореагировать с антителом (Chari et at., 1992, Cancer Research 52: 127-131) с генерацией слитого конъюгата майтанзиноид-антитело или майтанзиноид-Fc. Структурные аналоги калихеамицина, которые также можно использовать, включают, но не ограничиваются γ1 1, γ3 1, N-ацетил-γ1 1, PSAG и θ1 1, (Hinman et al., 1993, Cancer Research 53:3336-3342; Lode et al., 1998, Cancer Research 58:2925-2928; патент США №5714586; патент США №5712374; патент США №5264586; патент США №5773001).
Антитела по изобретению также могут быть конъюгированы с липосомами для направленной доставки (смотри, например, Park et al., 1997, Adv. Pharmacol. 40:399-435; Many & Schwendener, 2004, Methods in Molecular Medicine 109:389-401).
В одном примере антитела по настоящему изобретению могут быть присоединены к группировкам поли(этиленгликоля) (ПЭГ). В одном конкретном примере антитело представляет собой фрагмент антитела, и ПЭГ группировки могут быть присоединены через любую доступную аминокислотную боковую цепь или концевую аминокислотную функциональную группу, находящуюся во фрагменте антитела, например, любую свободную амино, имино, тиольную, гидроксильную или карбоксильную группу. Такие аминокислоты могут встречаться в природе во фрагменте антитела или могут быть сконструированы во фрагменте с использованием способов генной инженерии. Смотри, например, патент США №5219996. Для присоединения двух или более чем двух молекул ПЭГ можно использовать многие сайты. Группировки ПЭГ можно ковалентно связывать через тиольную группу по меньшей мере одного цистеинового остатка, локализованного во фрагменте антитела. Когда в качестве точки присоединения используется тиольная группа, можно использовать подходящим образом активированные эффекторные группировки, например, селективные в отношении тиола производные, такие как малеимиды и производные цистеина.
В конкретном примере конъюгат антитела против VEGF представляет собой модифицированный фрагмент Fab', который является ПЭГилированным, т.е. имеет ковалентно присоединенный к нему ПЭГ (поли(этиленгликоль)), например, согласно способу, раскрытому в ЕР0948544. Смотри также Poly(ethyleneglycol) Chemistry, Biotechnical and Biomedical Applications, (J. Milton Harris (ed.), Plenum Press, New York, 1992); Poly(ethyleneglycol) Chemistry and Biological Applications, (J. Milton Harris and S. Zaiipsky, eds., American Chemical Society, Washington D.C., 1997); и Bioconjugation Protein Coupling Techniques for the Biomedical Sciences, (M.Aslam and A.Dent, eds., Grove Publishers, New York, 1998); и Chapman, 2002, Advanced Drug Delivery Reviews 54:531-545. ПЭГ может быть присоединен к цистеину в шарнирной области. В одном примере Fab' фрагмент, модифицированный ПЭГ, имеет малеимидную группу, ковалентно связанную с одной тиольной группой в модифицированной шарнирной области. Остаток лизина может быть ковалентно связан с малеимидной группой, и к каждой из аминогрупп на остатке лизина может быть присоединен метоксиполи(этиленгликолевый)полимер, имеющий молекулярную массу приблизительно 20000 Да. Общая молекулярная масса ПЭГ, присоединенного к Fab' фрагменту, следовательно, может составлять приблизительно 40000 Да.
Слово «метка» при использовании здесь относится к детектируемому соединению или композиции, которые можно конъюгировать прямо или опосредованно с антителом против VEGF по изобретению. Метка сама по себе может быть детектируемой (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химическое изменение соединения-субстрата или композиции, которое является детектируемым. Полезные флуоресцентные группировки включают, но не ограничиваются, флуоресцеин, флуоресцеина изотиоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и тому подобное. Полезные ферментативные метки включают, но не ограничиваются, щелочную фосфатазу, пероксидазу хрена, глюкозооксидазу и тому подобное.
Дополнительные конъюгаты антитела против VEGF, которые, среди прочих, являются полезными в диагностических целях, описаны в разделе 6.7 ниже.
6.7 ДИАГНОСТИЧЕСКИЕ ПРИМЕНЕНИЯ АНТИТЕЛ ПРОТИВ VEGF
Антитела против VEGF по изобретению, включая те антитела, которые были модифицированы, например, биотинилированием, пероксидазой хрена или любой другой детектируемой группировкой (включая группировки, описанные в разделе 6.6), можно преимущественно использовать в диагностических целях.
Конкретно антитела против VEGF, например, можно использовать для очистки или детекции VEGF, включая диагностические способы как in vitro, так и in vivo, но не ограничиваясь этим. Например, антитела имеют применение в иммуноанализах для качественного и количественного измерения уровней VEGF в биологических образцах. Смотри, например, Harlow et al., Antibodies: A Laboratory Manual, Second Edition (Cold Spring Harbor Laboratory Press, 1988), которая включена сюда посредством ссылки во всей полноте.
Настоящее изобретение дополнительно охватывает антитела или их фрагменты, конъюгированные с диагностическим агентом. Антитела можно использовать диагностически, например, для детекции экспрессии интересующей мишени в конкретных клетках, тканях или сыворотке; или для мониторинга развития или прогрессирования иммунологического ответа как части клинической методики тестирования, например, для определения эффективности данной схемы лечения. Детекцию можно облегчать связыванием антитела с детектируемым веществом. Примеры детектируемых веществ включают разные ферменты, простетические группы, флуоресцентные вещества, люминисцентные вещества, биолюминисцентные вещества, радиоактивные вещества, металлы, излучающие позитроны, детектируемые с использованием разных позитронно-эмиссионных томографии, и ионы нерадиоактивных парамагнитных металлов. Детектируемое вещество может быть связано или конъюгировано с антителом (или его фрагментом) либо прямо, либо опосредованно, через промежуточное соединение (такое как, например, линкер, известный в данной области) с использованием методик, известных в данной области. Примеры ферментативных меток включают люциферазы (например, люциферазу светляков и бактериальную люциферазу; патент США №4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (HRPO), щелочную фосфатазу, β-галактозидазу, ацетилхолинэстеразу, глюкоамилазу, лизоцим, сахаридоксидазы (например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфатдегидрогеназа), гетероциклические оксидазы (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и тому подобное. Примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных веществ включают умбеллиферон, флуоресцеин, флуоресцеина изотиоцианат, родамин, дихлортриазиниламин, флуоресцеин, дансилхлорид или фикоэритрин; пример люминисцентного вещества включает люминол; примеры биолюминисцентных веществ включают люциферазу, люциферин и экворин; и примеры подходящего радиоактивного вещества включают 125I, 131I, 111In или 99Tc.
Согласно изобретению предложена детекция экспрессии VEGF, включающая приведение в контакт биологического образца (клетки, ткань или жидкость организма индивидуума) с использованием одного или более чем одного антитела против VEGF по изобретению (возможно конъюгированного с детектируемой группировкой), и детектирование того, является ли образец или нет позитивным в отношении экспрессии VEGF, или имеет ли образец измененную (например, пониженную или повышенную) экспрессию по сравнению с контрольным образцом.
Заболевания, которые можно диагностировать с использованием настоящих способов, включают, но не ограничиваются, описанные здесь заболевания. В определенных воплощениях ткань или жидкость организма представляет собой периферическую кровь, лейкоциты периферической крови, биопсии тканей, таких как легкое, или биопсии кожи и ткань.
6.8 ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ ПРОТИВ VEGF
6.8.1 Клиническая польза
Антитела против VEGF по изобретению можно использовать для лечения разных новообразований или отличных от неопластических состояний, характеризующихся патологическим ангиогенезом.
Антитела по изобретению являются полезными в лечении опухолей, при которых ангиогенез играет важную роль в росте опухоли, включая раковые заболевания и доброкачественные опухоли. Примеры раковых заболеваний, подлежащих здесь лечению, включают, но не ограничиваются, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких раковых заболеваний включают плоскоклеточный рак, рак легкого (включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого), рак брюшной полости, гепатоцеллюлярный рак, желудочный рак или рак желудка (включая раковое заболевание желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки или почечное раковое заболевание, рак печени, рак простаты, рак вульвы, рак щитовидной железы, печеночную карциному и разные типы рака головы и шеи, такие как В-клеточная лимфома (включая низкой степени/фолликулярную неходжкинскую лимфому (NHL); мелкоклеточную лимфоцитарную (SL) NHL, промежуточной степени/фолликулярную NHL; промежуточной степени диффузную NHL; высокой степени иммунобластную NHL; высокой степени лимфобластную NHL; высокой степени мелкоклеточную NHL с нерасщепленными клетками; генерализованную NHL; лимфому из клеток мантии; лимфому, связанную со СПИД; и макроглобулинемию Вальденстрема); хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); волосатоклеточный лейкоз; хронический миелобластный лейкоз и посттрансплантационный лимфопролиферативный синдром (PTLD), а также ненормальную пролиферацию сосудов, ассоциированную с факоматозом, отек (такой как отек, ассоциированный с опухолями мозга) и синдром Мейгса. Более конкретно, раковые заболевания, которые поддаются лечению антителами по изобретению, включают рак молочной железы, колоректальный рак, рак прямой кишки, немелкоклеточный рак легкого, неходжкинскую лимфому (NHL), рак клеток почки, рак простаты, рак печени, рак поджелудочной железы, саркому мягких тканей, саркому Капоши, карциноидную карциному, рак головы и шеи, меланому, рак яичника, мезотелиому и множественную миелому. В некоторых воплощениях антитела против VEGF по изобретению используются для лечения колоректального рака у пациента-человека.
Настоящее изобретение охватывает антиангиогенную терапию, стратегию лечения ракового заболевания, направленную на ингибирование развития кровеносных сосудов опухоли, требующихся для предоставления питательных веществ для поддержки роста опухоли. Поскольку ангиогенез участвует как в первичном росте опухоли, так и в образовании метастазов, антиангиогенное лечение, предложенное в настоящем изобретении, способно ингибировать неопластический рост опухоли в первичном сайте, а также предупреждать метастазы опухолей во вторичных сайтах.
Отличные от неопластических состояния, которые поддаются лечению антителами по изобретению, включают заболевания сетчатки (например, возрастная дегенерация желтого пятна), иммунные и воспалительные заболевания (например, ревматоидный артрит, псориаз, атеросклероз, диабетические и другие пролиферативные ретинопатии, включая синдром Терри, ретролентальную фиброплазию, неоваскулярную глаукому, возрастную дегенерацию макулы, тиреоидные гиперплазии (включая диффузный токсический зоб), трансплантацию роговицы и других тканей, хроническое воспаление, воспаление легких, нефротический синдром, преэклампсию, асцит, выпот в область перикарда (такой как выпот, ассоциированный с перикардитом) и плевральный выпот).
Соответственно, согласно настоящему изобретению предложены способы лечения любого из вышеупомянутых заболеваний у пациента, нуждающегося в этом, включающие введение пациенту антитела против VEGF по изобретению. Возможно, указанное введение повторяют, например, через одни сутки, двое суток, трое суток, пять суток, одну неделю, две недели, три недели, один месяц, пять недель, шесть недель, семь недель, восемь недель, два месяца или три месяца. Повторное введение может осуществляться в той же самой дозе или в другой дозе. Введение может повторяться один раз, два раза, три раза, четыре раза, пять раз, шесть раз, семь раз, восемь раз, девять раз, десять раз или более. Например, согласно определенным схемам дозировки пациент получает терапию против VEGF в течение длительного периода времени, например, 6 месяцев, 1 год или более. Количество антитела против VEGF, введенное пациенту, в определенных воплощениях представляет собой терапевтически эффективное количество. «Терапевтически эффективное» количество антитела против VEGF, в том виде, как оно здесь используется, можно вводить в виде одной дозы или на протяжении курса согласно терапевтической схеме, например, на протяжении недельного, двухнедельного, трехнедельного, одномесячного, трехмесячного, шестимесячного, однолетнего или более длительного курса. Типичные терапевтические схемы описаны в разделе 6.11 ниже.
Согласно настоящему изобретению лечение заболевания охватывает лечение пациентов, уже продиагностированных как имеющих любую форму заболевания на любой клинической стадии проявления; задержку начала или развития, или обострения, или ухудшения симптомов или признаков заболевания; и/или предупреждение, и/или уменьшение тяжести заболевания.
«Субъект» или «пациент», которому вводят антитело против VEGF по изобретению, предпочтительно представляет собой млекопитающее, такое как отличное от примата млекопитающее (например, корова, свинья, лошадь, кошка, собака, крыса и т.д.) или примат (например, обезьяна или человек). В определенных воплощениях субъект или пациент представляет собой человека. В определенных аспектах человек представляет собой пациента-ребенка. В других аспектах человек представляет собой взрослого пациента.
6.9 ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПУТИ ВВЕДЕНИЯ
Здесь предложены композиции, содержащие антитело против VEGF по изобретению и, возможно, один или более чем один дополнительный терапевтический агент, такой как комбинация терапевтических агентов, описанная в разделе 6.10 ниже. Композиции обычно будут поставлять в виде части стерильной фармацевтической композиции, которая обычно будет включать фармацевтически приемлемый носитель. Эта композиция может находиться в любой подходящей форме (в зависимости от желательного способа ее введения пациенту).
Антитела против VEGF по изобретению можно вводить пациенту множеством путей, как, например, перорально, чрескожно, подкожно, интраназально, внутривенно, внутримышечно, в глаз, местно, подоболочечно и в желудочки головного мозга. Самый подходящий путь введения в любом данном случае будет зависеть от конкретного антитела, субъекта, природы и тяжести заболевания и физического состояния субъекта.
Для лечения показаний, отличных от заболеваний сетчатки, эффективная доза антитела против VEGF по изобретению может варьировать от примерно 0,1 до примерно 75 мг/кг на однократное (например, болюсное) введение, многократные введения или непрерывное введение, или до достижения сывороточной концентрации 0,01-5000 мкг/мл сыворотки на однократное (например, болюсное) введение, многократные введения или непрерывное введение, или любой эффективный интервал или значение в нем, в зависимости от состояния, которое лечат, пути введения и возраста, массы и состояния субъекта. В определенных воплощениях, например, для лечения ракового заболевания, каждая доза может варьировать от примерно 0,1 мг до примерно 50 мг на килограмм массы тела, например, от примерно 3 мг до примерно 25 мг на килограмм массы тела. Антитело можно приготовить в виде препарата в водном раствора и вводить подкожной инъекцией.
Для лечения заболеваний сетчатки (например, возрастной дегенерации желтого пятна (AMD)), дозировка подходящим образом приводит к концентрации антитела против VEGF в водянистой влаге глаза, в который произведена инъекция, 1-50 мкг/мл. Для лечения AMD каждая доза может составлять от 0,1 мг до примерно 1 мг, например, от примерно 0,25 до примерно 0,5 мг. Антитело можно приготовить в виде препарата в водном растворе и вводить интравитреальной инъекцией.
Фармацевтические композиции могут быть удобным образом представлены в стандартных лекарственных формах, содержащих заданное количество антитела против VEGF по изобретению на дозу. Такая единица может содержать, например, но без ограничения, от 0,1 мгдо 5 г, например, от 1 мг до 1 г или от 10 до 50 мг. Фармацевтически приемлемые носители для применения в изобретении могут принимать широкий спектр форм, в зависимости, например, от состояния, подлежащего лечению, или пути введения.
Терапевтические препараты антител против VEGF по изобретению можно готовить для хранения в виде лиофилизированных препаратов или водных растворов смешиванием антитела, имеющего желательную степень чистоты, с возможными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами, типично используемыми в данной области (которые все именуются здесь «носители»), т.е. буферами, стабилизаторами, консервантами, агентами, обеспечивающими изотоничность, неионными детергентами, антиоксидантами и другими разнообразными добавками. Смотри Remington's Pharmaceutical Sciences, 16th edition (Osol, ed. 1980). Такие добавки должны быть нетоксичными для реципиентов при используемых дозировках и концентрациях.
Буферы помогают поддерживать рН в интервале, который приближается к физиологическим условиям. Они могут присутствовать в концентрации, варьирующей от примерно 2 мМ до примерно 50 мМ. Подходящие буферы для применения в настоящем изобретении включают как органические, так и неорганические кислоты и их соли, как, например, цитратные буферы (например, смесь мононатрия цитрат-динатрия цитрат, смесь лимонная кислота-тринатрия цитрат, смесь лимонная кислота-мононатрия цитрат и т.д.), сукцинатные буферы (например, смесь янтарная кислота-мононатрия сукцинат, смесь янтарная кислота-гидроксид натрия, смесь янтарная кислота-динатрия сукцинат и т.д.), тартратные буферы (например, смесь винная кислота-натрия тартрат, смесь винная кислота-калия тартрат, смесь винная кислота-гидроксид натрия и т.д.), фумаратные буферы (например, смесь фумаровая кислота-мононатрия фумарат), смесь фумаровая кислота-динатрия фумарат, смесь мононатрия фумарат-динатрия фумарат и т.д.), глюконатные буферы (например, смесь глюконовая кислота-натрия глюконат, смесь глюконовая кислота-гидроксид натрия, смесь глюконовая кислота-калия глюконат и т.д.), оксалатный буфер (например, смесь щавелевая кислота-натрия оксалат, смесь щавелевая кислота-гидроксид натрия, смесь щавелевая кислота-калия оксалат и т.д.), лактатные буферы (например, смесь молочная кислота-натрия лактат, смесь молочная кислота-гидроксид натрия, смесь молочная кислота-калия лактат и т.д.) и ацетатные буферы (например, смесь уксусная кислота-натрия ацетат, смесь уксусная кислота-гидроксид натрия и т.д.). Кроме того, можно использовать фосфатные буферы, гистидиновые буферы и соли триметиламина, такие как Tris.
Для задержки роста микробов можно добавлять консерванты и можно добавлять в количествах, варьирующих от 0,2% до 1% (масс./об.). Подходящие консерванты для применения в настоящем изобретении включают фенол, бензиновый спирт, мета-крезол, метилпарабен, пропилпарабен, октадецилдиметилбензиламмония хлорид, бензалкония галогениды (например, хлорид, бромид и йодид), гексаметония хлорид и алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцинол, циклогексанол и 3-пентанол. Агенты для обеспечения изотоничности, иногда известные как «стабилизаторы», можно добавлять для обеспечения изотоничности жидких композиций по настоящему изобретению, и они включают многоатомные спирты, например, многоатомные спирты с тремя или большим числом гидроксильных групп, такие как глицерин, эритрит, арабит, ксилит, сорбит и манит.Термин «стабилизаторы» относится к широкой категории эксципиентов, которые могут выполнять различные функции, от наполнителя до добавки, которая солюбилизирует терапевтический агент или помогает предотвращать денатурацию или прилипание к стенке контейнера. Типичными стабилизаторами могут быть многоатомные спирты (перечисленные выше); аминокислоты, такие как аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.д., органические сахара или многоатомные спирты, такие как лактоза, трегалоза, стахиоза, маннит, сорбит, ксилит, рибит, миоинозит, галактит, глицерин и тому подобное, включая циклитолы, такие как инозит; полиэтиленгликоль; аминокислотные полимеры; серосодержащие восстанавливающие агенты, такие как мочевина, глутатион, тиоктовая кислота, натрия тиогликолят, тиоглицерин, α-монотиоглицерин и натрия тиосульфат; низкомолекулярные полипептиды (например, пептиды из 10 остатков или менее); белки, такие как человеческий сывороточный альбумин, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; моносахариды, такие как ксилоза, манноза, фруктоза, глюкоза; дисахариды, такие как лактоза, мальтоза, сахароза; и трисахариды, такие как раффиноза; и полисахариды, такие как декстран. Стабилизаторы могут присутствовать в интервале от 0,1 до 10000 частей на часть активного белка по массе.
Неионные поверхностно-активные вещества или детергенты (также известные как «увлажнители») можно добавлять для того, чтобы способствовать солюбилизации терапевтического агента, а также для защиты терапевтического белка против агрегации, индуцированной встряхиванием, что также позволяет действовать на композицию поверхностному напряжению сдвига без вызова денатурации белка. Подходящие неионные поверхностно-активные вещества включают полисорбаты (20, 80 и т.д.), полоксамеры (184, 188 и т.д.), поверхностно-активные полиолы, моноэфиры полиоксиэтиленсорбитана (TWEEN®-20, TWEEN®-80 и т.д.). Неионные поверхностно-активные вещества могут присутствовать в интервале от примерно 0,05 мг/мл до примерно 1,0 мг/мл, например, от примерно 0,07 мг/мл до примерно 0,2 мг/мл.
Дополнительные разнообразные эксципиенты включают наполнители (например, крахмал), хелаторы (например, EDTA (этилендиаминтетрауксусная кислота)), антиоксиданты (например, аскорбиновая кислота, метионин, витамин Е) и сорастворители.
Приведенная здесь композиция также может содержать комбинацию терапевтического агента, помимо антитела против VEGF по изобретению. Примеры подходящей комбинации терапевтических агентов приведены в разделе 6.10 ниже.
Схема дозировки для подкожного введения может варьировать от одного раза каждые шесть месяцев до ежесуточного, в зависимости от целого ряда клинических факторов, включая тип заболевания, тяжесть заболевания и чувствительность пациента к антителу против VEGF.
Дозировка антитела против VEGF по изобретению, подлежащего введению, будет варьировать согласно конкретному антителу, типу заболевания (например, раковое, воспалительное и т.д.), субъекту и тяжести заболевания, физическому состоянию субъекта, терапевтической схеме (например, используется ли комбинированный терапевтический агент) и выбранному пути введения; подходящая дозировка легко может быть определена специалистом в данной области.
Специалисту в данной области будет понятно, что оптимальное количество и интервал во времени индивидульных дозировок антитела против VEGF по изобретению будут определяться природой и степенью проявления состояния, которое лечат, формой, путем и местом введения, возрастом и состоянием конкретного субъекта, которого лечат, и которые лечащий врач в конечном счете определит как подходящие дозировки, подлежащие применению. Эту дозировку можно повторять настолько часто, насколько это является уместным. При развитии побочных эффектов количество и/или частоту дозировки можно изменять или снижать согласно нормальной клинической практике.
6.10 КОМБИНИРОВАННАЯ ТЕРАПИЯ
Ниже описаны комбинационные способы, в которых можно использовать антитело против VEGF по изобретению. Комбинационные способы по изобретению включают введение пациенту по меньшей мере двух агентов, первый из которых представляет собой антитело против VEGF по изобретению, и второй из которых представляет собой комбинированный терапевтический агент. Антитело против VEGF и комбинированный терапевтический агент можно вводить одновременно, последовательно или раздельно.
Способы комбинационной терапии по настоящему изобретению могут приводить к эффекту, большему, чем аддитивный, давая терапевтическую пользу, когда ни антитело против VEGF, ни комбинированный терапевтический агент, не вводят в количестве, в котором они являются терапевтически эффективными по отдельности.
В настоящих способах антитело против VEGF по изобретению и комбинированный терапевтический агент могут вводиться одновременно, либо совместно, либо последовательно. При использовании здесь, когда говорят, что антитело против VEGF по изобретению и комбинированный терапевтический агент вводят последовательно, это значит, что их вводят пациенту в те же самые сутки, например, во время того же самого визита пациента. Последовательное введение может осуществляться с интервалом во времени 1, 2, 3, 4, 5, 6, 7 или 8 часов. В отличие от этого, говорят, что антитело против VEGF по изобретению и комбинированный терапевтический агент вводят раздельно, если их вводят пациенту в разные сутки, например, антитело против VEGF по изобретению и комбинированный терапевтический агент могут вводить с интервалом в 1 сутки, 2 суток или 3 суток, одну неделю, 2 недели или месяц. В способах по настоящему изобретению введение антитела против VEGF по изобретению может предшествовать введению комбинированного терапевтического агента или следовать за ним.
В качестве неограничивающего примера, антитело против VEGF по изобретению и комбинированный терапевтический агент могут вводить одновременно в течение периода времени с последующим вторым периодом времени, в течение которого введение антитела против VEGF по изобретению и комбинированного терапевтического агента чередуется.
Из-за потенциальных синергетических эффектов введения антитела против VEGF по изобретению и комбинированного терапевтического агента, такие агенты можно вводить в количествах, которые, при введение одного или обоих агентов по отдельности, не являются терапевтически эффективными.
В определенных аспектах комбинированный терапевтический агент представляет собой антиангиогенный агент, противоревматическое лекарственное средство, противовоспалительный агент, химиотерапевтический агент, радиотерапевтическое средство, иммунодепрессант или цитотоксическое лекарственное средство.
Предполагают, что, при использовании для лечения разных заболеваний, антитела против VEGF по изобретению можно комбинировать с другими терапевтическими агентами, подходящими для того же самого или аналогичных заболеваний. При использовании для лечения ракового заболевания, антитела по настоящему изобретению можно использовать в комбинации с традиционными противораковыми терапиями, такими как хирургия, радиотерапия, химиотерапия или их комбинации.
В некоторых других аспектах другие терапевтические агенты, полезные для комбинированной противоопухолевой терапии антителом по изобретению, включают антагонисты, например, антитела (или) другие факторы, которые участвуют в росте опухоли, такие как EGFR (рецептор эпидермального фактора роста), ErbB2 (также известный как Her2), ErbB3, ErbB4 или TNF-α (фактор некроза опухоли-альфа).
Иногда для лечения раковых заболеваний и иммунных заболеваний также может быть полезным введение пациенту одного или более чем одного цитокина. В предпочтительном воплощении антитело против VEGF вводят совместно с агентом, ингибирующим рост.
Подходящими дозировками для агента, ингибирующего рост, являются дозировки, используемые в настоящее время, и они могут быть снижены благодаря комбинированному действию (синергизму) агента, ингибирующего рост, и антитела против VEGF.
Для лечения раковых заболеваний, иммунных заболеваний и заболеваний сетчатки противовоспалительные агенты можно подходящим образом использовать в комбинации с антителами против VEGF по изобретению. Противовоспалительные агенты включают, но не ограничиваются следующими: ацетаминофен, дифенилгидрамин, меперидин, дексаметазон, пентаза, месалазин, азакол, кодеина фосфат, бенорилат, фенбуфен, напрозин, диклофенак, этодолак и индометацин, аспирин и ибупрофен.
Химиотерапевтические агенты для лечения раковых заболеваний можно подходящим способом использовать в комбинации с антителами против VEGF по изобретению. Химиотерапевтические агенты включают, но не ограничены, радиоактивные молекулы, токсины, также называемые цитотоксинами или цитотоксическими агентами, которые включают любой агент, который является вредным для жизнеспособности клеток, агенты и липосомы или другие везикулы, содержащие Химиотерапевтические соединения. Примеры подходящих химиотерапевтических агентов включают, но не ограничиваются, 1-дегидротестостерон, 5-фторурацила декарбазин, 6-меркаптопурин, 6-тиогуанин, актиномицин D, адриамицин, алдеслейкин, антитело против α5β1 интегрина, алкилирующие агенты, аллопуринол натрия, алтретамин, амифостин, анастрозол, антрамицин (АМС), антимитотические агенты, цис-дихлордиамина платина(II) (DDP) цисплатин, диаминодихлорплатина, антрациклины, антибиотики, антиметаболиты, аспарагиназа, живая BCG (бацилла Кальметта-Герена) (внутривезикулярная), бетаметазона натрия фосфат и бетаметазона ацетат, бикалутамид, блеомицина сульфат, бусульфан, кальция лейковорин, калихеамицин, капецитабин, карбоплатин, ломустин (CCNU), кармустин (BSNU), хлорамбуцил, цисплатин, кладрибин, колхицин, конъюгированные эстрогены, циклофосфамид, циклотосфамид, цитарабин, цитохалазин В, цитоксан, дакарбазин, Дактиномицин, дактиномицин (ранее актиномицин), даунирубицин HCl, даунорубицина цитрат, денилейкин, дифтитокс, дексразоксан, дибромманнит, дигидроксиантрациндион, доцетаксел, долазетрона мезилат, доксорубицин HCl, дронабинол, L-аспарагиназа Е. coli, эолоциксимаб, эметин, эпоетин-α, L-аспарагиназа Erwinia, этерифицированные эстрогены, эстрадиол, эстрамустина натрия фосфат, бромистый этидий, этинилэстрадиол, этидронат, этопозид, фактор citrororum, этопозида фосфат, филграстим, флоксуридин, флуконазол, флударабина фосфат, фторурацил, флутамид, фолиновая кислота, гемцитабин HCl, глюкокортикоиды, гозерелина ацетат, грамицидин D, гранизетрон HCl, гидроксимочевина, идарубицин HCl, ифосфамид, интерферон α-2b, иринотекан HCl, летрозол, лейковорин кальция, лейпролида ацетат, левамизол HCl, лидокаин, ломустин, майтанзиноид, мехлорэтамин HCl, медроксипрогестерона ацетат, мегестрола ацетат, мелфалан HCl, меркаптипурин, месна, метотрексат, метилтестостерон, митрамицин, митомицин С, митотан, митоксантрон, нилутамид, октреотида ацетат, онданзетрон HCl, паклитаксел, динатрий памидронат, пентостатин, пилокарпин HCl, плимицин, полифепросан 20 с кармустиновым имплантом, натрий порфимер, прокаин, прокарбазин HCl, пропранолол, ритуксимаб, сарграмостим, стрептозотоцин, тамоксифен, таксол, тенипозид, тенопозид, тестолактон, тетракаин, тиотепа, хлорамбуцил, тиогуанин, тиотепа, топотекан HCl, торемифена цитрат, трастузумаб, третиноин, вальрубицин, винбластина сульфат, винкристина сульфат и винорелбина тартрат.
Любой антиангиогенный агент можно использовать в сочетании с антителами против VEGF по изобретению, включая агенты, перечисленные Carmeliet and Jain, 2000, Nature 407:249-257. В определенных воплощениях антиангиогенный агент представляет собой другой антагонист VEGF или антагонист рецептора VEGF, такой как варианты VEGF, растворимые фрагменты рецептора VEGF, аптамеры, способные блокировать VEGF или VEGFR, нейтрализующие антитела против VEGFR, низкомолекулярные ингибиторы тирозинкиназ-VEGFR и любые их комбинации. Альтернативно или дополнительно, пациенту можно вводить совместно два или более чем два антитела против VEGF.
В определенных воплощениях в сочетании с антителами против VEGF по изобретению можно использовать гормональную терапию. В некоторых воплощениях гормональная терапия включает один или более чем один агент, который ингибирует стимуляцию роста раковых клеток эстрогеном и/или прогестероном, например, селективный модулятор рецептора эстрогена, такой как тамоксифен, ингибитор ароматазы, такой как анастрозол (Arimidex®) или летрозол (Femara), инактиватор ароматазы, такой как экземестан (Aromastin®), или агент, который ингибирует продукцию эстрогена, такой как гозерелин (Zoladex). В других воплощениях гормональная терапия осуществляется одним или более чем одним агентом, который ингибирует продукцию гормонов из яичников.
В некоторых аспектах антитело против VEGF можно использовать в сочетании с низкомолекулярным ингибитором протеин-тирозинкиназы (РТК). В некоторых воплощениях ингибитор РТК является специфичным в отношении VEGF-рецепторной тирозинкиназы. В других воплощениях ингибитор РТК связывается с более чем одним семейством VEGF-рецепторных тирозинкиназ (например, VEGFR-1, VEGFR-2). В других воплощениях ингибиторы протеин-тирозинкиназ, полезные в композициях и способах по изобретению, включают ингибиторы РТК, которые не связываются селективно с VEGF-семейством рецепторных тирозинкиназ, но также связываются с тирозинкиназными доменами других семейств белков, таких как HER2, HER3, HER4, PDGFR (рецептор фактора роста тромбоцитов) и/или Raf.
В некоторых воплощениях тирозинкиназа представляет собой рецепторную тирозинкиназу, т.е. внутриклеточный домен большего белка, который имеет внеклеточный лиганд-связывающий домен и активируется связыванием одного или более чем одного лиганда. В определенных воплощениях протеин-тирозинкиназа представляет собой нерецепторную тирозинкиназу. Ингибиторы РТК для применения в способах по настоящему изобретению включают, но не ограничиваются, гефитиниб (ZD-1839, Iressa®), эрлотиниб (OSI-1774, Tarceva™), канертиниб (С1-1033), вандетаниб (ZD6474, Zactima®), тирфостин AG-825 (CAS 149092-50-2), лапатиниб (GW-572016), сорафениб (BAY43-9006), AG-494 (CAS 133550-35-3), RG-13022 (CAS 149286-90-8), RG-14620 (CAS 136831-49-7), BIBW 2992 (Tovok), тирфостин 9 (CAS 136831-49-7), тирфостин 23 (CAS 118409-57-7), тирфостин 25 (CAS 118409-58-8), тирфостин 46 (CAS 122520-85-8), тирфостин 47 (CAS 122520-86-9), тирфостин 53 (CAS 122520-90-5), бутеин (1-(2,4-дигидроксифенил)-3-(3,4-дигидроксифенил)-2-пропен-1-он 2',3,4,4'-тетрагидроксихалкон; CAS 487-52-5), куркумин ((Е,Е)-1,7-бис(4-гидрокси-3-метоксифенил)-1,6-гептадиен-3,5-дион; CAS 458-37-7), N4-(1-бензил-1Н-индазол-5-ил)-N6,N6-диметил-пиридо-[3,4-d]-пиримидин-4,6-диамин (202272-68-2), AG-1478, AG-879, циклопропанкарбоновой кислоты (3-(6-(3-трифторметил-фениламино)-пиримидин-4-иламино)-фенил)-амид (CAS 879127-07-8), N8-(3-хлор-4-фторфенил)-N2-(1-метилпиперидин-4-ил)-пиримидо[5,4-d]пиримидин-2,8-диамин, 2HCl (CAS 196612-93-8), 4-(4-бензилоксианилино)-6,7-диметоксихиназолин (CAS 179248-61-4), N-(4-((3-хлор-4-фторфенил)амино)пиридо[3,4-d]пиримидин-6-ил)2-бутинамид (CAS 881001-19-0), EKB-569, HKI-272 и HKI-357.
В конкретном воплощении антитело против VEGF по изобретению используют в комбинации с внутривенной химиотерапией на основе 5-фторурацила. Данная комбинация является подходящей, среди прочего, для лечения первой или второй линии пациентов с метастатической карциномой толстой кишки или прямой кишки.
В другом конкретном воплощении антитело против VEGF по изобретению используют в комбинации с карбоплатином и паклитакселем. Данная комбинация является подходящей, среди прочего, для лечения первой линии пациентов с неоперабельным, местно распространенным, рецидивирующим или метастатическим неплоскоклеточным, немелкоклеточным раком легкого.
В еще одном другом конкретном воплощении антитело против VEGF по изобретению используют в комбинации с паклитакселем. Данная комбинация является подходящей, среди прочего, для лечения пациентов, которые не подвергались химиотерапии по поводу НЕР2-негативного рака молочной железы.
Для лечения заболеваний сетчатки антитела против VEGF по изобретению можно использовать в комбинации с Е10030, ПЭГилированным аптамером против тромбоцитарного фактора роста (PDGF); с ARC1905, ПЭГилированным аптамером, имеющим в качестве мишени компонент С5 каскада комплемента; и с волоциксимабом, моноклональным антителом, имеющим в качестве мишени трансмембранный рецептор α5β1 интегрина; с фотодинамической терапией с Visudyne® (PDT); или с аптамером Macugen® (натрия пегаптаниб).
6.11 СХЕМЫ ЛЕЧЕНИЯ
Согласно настоящему изобретению предложены схемы лечения, включающие введение антител против VEGF по изобретению. Схема лечения будет меняться в зависимости от возраста пациента, массы и болезненного состояния. Схема лечения может продолжаться от 2 недель до неопределенного времени. В конкретных воплощениях схема лечения продолжается от 2 недель до 6 месяцев, от 3 месяцев до 5 лет, от 6 месяцев до 1 или 2 лет, от 8 месяцев до 18 месяцев или тому подобное. Схема лечения может быть схемой с неизменяющейся дозой или схемой с многократно меняющейся дозой.
Для типичных схем дозировки, описанных ниже, антитело против VEGF можно вводить в виде стерильного, не содержащего консервантов раствора для подкожного введения.
Для лечения метастатического колоректального рака антитело против VEGF по изобретению вводят внутривенно в дозе 0,5-15 мг/кг каждые 2 недели с болюсом-IFL (схема с иринотеканом, 5-фторурацилом и лейковорином). В конкретных воплощениях доза составляет 1-4 мг/кг, 2-6 мг/кг, 0,5-3 мг/кг, 1-10 мг/кг, 3-4,8 мг/кг или 1-4,5 мг/кг каждые две недели с болюсом-IFL.
В другом воплощении для лечения метастатического колоректального рака антитело против VEGF по изобретению вводят внутривенно в дозе 1-30 мг/кг каждые 2 недели с FOLFOX4 (схема с оксалиплатином, лейковорином и фторурацилом). В конкретных воплощениях доза составляет 2-9 мг/кг, 3-12 мг/кг, 1-7,5 мг/кг, 2-20 мг/кг, 6-9,75 мг/кг или 4-9,5 мг/кг каждые две недели с FOLFOX4.
Для лечения неплоскоклеточного немелкоклеточного рака легкого антитело против VEGF по изобретению вводят внутривенно в дозе 2-40 мг/кг каждые три недели с карбоплатином/паклитакселем. В конкретных воплощениях доза составляет 5-14 мг/кг, 4-20 мг/кг, 10-17,5 мг/кг, 7-14 мг/кг, 10-30 мг/кг или 3-30 мг/кг каждые три недели с карбоплатином/паклитакселем.
Для лечения метастатического рака молочной железы антитело против VEGF по изобретению вводят внутривенно в дозе 0,5-20 мг/кг каждые две недели с паклитакселем. В конкретных воплощениях доза составляет 1-4 мг/кг, 2-6 мг/кг, 0,5-3 мг/кг, 1-10 мг/кг, 3-4,8 мг/кг или 1-4,5 мг/кг каждые две недели с паклитакселем.
Для лечения метастатического рака молочной железы антитело против VEGF по изобретению вводят внутривенно в дозе 0,5-20 мг/кг каждые две недели в виде монотерапии. В конкретных воплощениях доза составляет 1-4 мг/кг, 2-6 мг/кг, 0,5-3 мг/кг, 1-10 мг/кг, 3-4,8 мг/кг или 1-4,5 мг/кг каждые две недели в виде монотерапии.
Для лечения возрастной дегенерации желтого пятна (AMD) антитело против VEGF по изобретению вводят в дозе 0,1-1 мг посредством интравитреальной инъекции один раз в месяц (приблизительно в 28 суток). В конкретных воплощениях доза составляет 0,1-0,4 мг, 0,2-0,6 мг, 0,1-0,25 мг, 0,25-0,5 мг, 0,25-0,75 мг или 0,3-0,45 мг посредством интравитреальной инъекции один раз в месяц (приблизительно в 28 суток). В конкретном воплощении пациент, которого лечат антителом против VEGF по изобретению, имеет влажную AMD. В другом конкретном воплощении пациент имеет сухую AMD.
6.12 ДИАГНОСТИЧЕСКИЕ И ФАРМАЦЕВТИЧЕСКИЕ НАБОРЫ
В настоящем изобретении предложены фармацевтические наборы, содержащие антитела против VEGF (включая конъюгаты антител) по изобретению. Фармацевтический набор представляет собой упаковку, содержащую антитело против VEGF по изобретению (например, либо в лиофилизированной форме, либо в виде водного раствора) и одно или более чем одно из следующего:
- комбинированный терапевтический агент, например, как описано в разделе 6.10 выше;
- устройство для введения антитела против VEGF, например, шприц-ручка, игла и/или шприц; и
- вода фармацевтического качества или буфер для ресуспендирования антитела, если антитело находится в лиофилизированной форме.
В определенных аспектах каждая единичная доза антитела против VEGF упакована раздельно, и набор может содержать одну или более чем одну единичную дозу (например, две единичные дозы, три единичные дозы, четыре единичные дозы, пять единичных доз, восемь единичных доз, десять единичных доз или более). В конкретном воплощении каждая одна или более чем одна единичная доза размещена в шприце или шприце-ручке.
Также включены диагностические наборы, содержащие антитела против VEGF (включая конъюгаты антител) по изобретению. Диагностический набор представляет собой упаковку, содержащую антитело против VEGF по изобретению (например, в лиофилизированной форме или в виде водного раствора) и один или более чем один реагент, полезный для проведения диагностического анализа. Когда антитело против VEGF мечено ферментом, набор может включать субстраты и кофакторы, необходимые для фермента (например, предшественник субстрата, который дает детектируемый хромофор или флуорофор). Кроме того, могут быть включены другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или лизисный буфер) и тому подобное. В определенных воплощениях антитело против VEGF, включенное в диагностический набор, иммобилизовано на твердой поверхности, или твердая поверхность (например, предметное стекло), на которой может быть иммобилизовано антитело, включена в набор. Относительные количества разных реактивов могут широко варьировать для обеспечения концентраций реактивов в растворе, которые существенно оптимизируют чувствительность анализа. В конкретном воплощении антитело и один или более чем один реактив могут быть предоставлены (индивидуально или объединенно) в виде сухих порошков, обычно лиофилизированных, включающих эксципиенты, которые при растворении будут давать раствор реактива, имеющий подходящую концентрацию.
7. ПРИМЕР 1: ИДЕНТИФИКАЦИЯ Т-КЛЕТОЧНЫХ ЭПИТОПОВ БЕВАЦИЗУМАБА
7.1 МАТЕРИАЛЫ И МЕТОДЫ
7.1.1 Пептиды
Пептиды синтезировали с использованием много игольного формата (multi-pin format) Mimotopes (Adelaide, Австралия). Последовательности V областей легкой и тяжелой цепи бевацизумаба были синтезированы в виде 15-мерных пептидов, перекрывающихся на 12 аминокислот (Таблицы 3 и 4), всего в виде 69 пептидов. Пептиды получали в лиофилизированном виде и были ресуспендированы в DMSO (диметилсульфоксид) (Sigma-Aldrich) в концентрации приблизительно 1-2 мг/мл. Исходные препараты пептидов хранили в замороженном состоянии при -20°С.
7.1.2 Человеческие одноядерные клетки периферической крови
Продукты на основе лейкоцитарной пленки от общественных доноров приобретали у Stanford Blood Center, Palo Alto, CA. Вещество лейкоцитарной пленки разводили 1:1 DPBS (фосфатно-солевой буферный раствор, модифицированный по Дульбекко), не содержащим кальций или магний. Разведенное вещество лейкоцитарной пленки (25-35 мл) вводили на дно 50 мл конических центрифужных пробирок (Sarsted или Costar) с 12,5 мл FicollPaque-PLUS (GE Healthcare). Образцы центрифугировали при 900 g в течение 30 минут при комнатной температуре. Одноядерные клетки периферической крови (РВМС) собирали с поверхности раздела фаз. Добавляли DPBS до доведения конечного объема до 50 мл, и клетки центрифугировали при 350 д в течение 5 минут.Осажденные клетки ресуспендировали в DPBS и подсчитывали.
7.1.3 Дендритные клетки
Для выделения дендритных клеток в культуральные колбы Т75 (Costar) высевали 108 свежевыделенных РВМС в 30 мл общем объеме среды AIM V (Invitrogen). Избыток РВМС замораживали при -80°С в 90%-ной фетальной телячей сыворотке (FCS), 10% DMSO в концентрации 5×107 клеток/мл. Колбы Т75 инкубировали при 37°С в 5% CO2 в течение 2 часов. Неприкрепившиеся клетки удаляли, и прикрепившийся монослой промывали DBPS. Для различения дендритных клеток и моноцитов добавляли 30 мл среды AIM V, содержащей 800 единиц/мл GM-CSF (R and D Systems) и 500 единиц/мл IL-4 (R and D Systems). Колбы инкубировали в течение 5 суток. На сутки 5 добавляли IL-1α (Endogen) и TNFα (фактор некроза опухоли-альфа) (Endogen) до концентрации 50 пг/мл и 0,2 нг/мл. Колбы инкубировали в течение еще двух суток. На сутки 7 дендритные клетки собирали добавлением 3 мл EDTA, содержащей от 0,5 до 1,0 мг митомицина С (Sigma-Aldrich), для достижения конечной концентрации 10 мМ EDTA и от 16,5 до 33 мкг/мл митомицина С. Колбы инкубировали еще один час при 37°С и 5% СО2. Дендритные клетки собирали и промывали в среде AIM V 2-3 раза.
7.1.4 Культура клеток
На сутки 7 ранее замороженные аутологические РВМС быстро размораживали на водяной бане при 37°С. Клетки немедленно разводили в средах DPBS или AIM V и центрифугировали при 350 g в течение 5 минут. Клетки CD4+ обогащали негативной селекцией с использованием магнитных шариков (набор Easy-Sep CD4+, Stem Cell Technologies). Аутологические Т-клетки CD4+ и дендритные клетки сокультивировали в концентрации 2×105 Т-клеток CD44 на 2×104 дендритных клеток на лунку в 96-луночных круглодонных планшетах (Costar 9077). Пептиды добавляли в концентрации приблизительно 5 мкг/мл. Контрольные лунки содержали один носитель на основе DMSO (Sigma) в концентрации 0,25% об./об. Лунки позитивного контроля содержали DMSO в концентрации 0,25% и столбнячный анатоксин (List Biologicals или CalBioChem) в концентрации 1 мкг/мл. Культуры инкубировали в течение 5 суток. В сутки 5 добавляли 0,25 мкКи тритированного тимидина (Amersham или GE Healthcare) на лунку. В сутки 6 культуры собирали на фильтровальные подложки с использованием сборщика Packard Filtermate Cell. Сцинтилляционные измерения проводили с использованием сцинтилляционного счетчика Wallac MicroBeta 1450 (Perkin Elmer).
7.1.5 Анализ данных
Средние фоновые значения СРМ (число импульсов в минуту) рассчитывали усреднением индивидуальных результатов в повторности 6-12. Усредняли значения СРМ четырех лунок позитивного контроля. Усредняли лунки в двойной или тройной повторности для каждого пептида. Значения индекса стимуляции для лунок позитивного контроля и лунок с пептидами рассчитывали делением средних экспериментальных значений СРМ на средние контрольные значения. Для включения в набор данных требуется индекс стимуляции, больший чем 3,0 относительно лунок позитивного контроля со столбнячным анатоксином. Отмечали ответ для любого пептида, приводящий к индексу стимуляции 2,95 или больше. Пептиды тестировали с использованием образцов периферической крови от группы из 99 доноров. Собирали ответы на все пептиды. Для каждого протестированного пептида рассчитывали процентную долю из набора доноров, которые отвечали с индексом стимуляции 2,95 или больше. Кроме того, также рассчитывали средний индекс стимуляции для всех доноров.
7.2 РЕЗУЛЬТАТЫ
7.2.1 Идентификация эпитопов Т-клеток CD4+ в областях VH и VL бевацизумаба
Пептиды-эпитопы Т-клеток CD4+ идентифицировали анализом процента ответов на пептиды в пределах набора из 99 доноров. Средний процент ответа и стандартное отклонение рассчитывали для всех протестированных пептидов, описывающих V области тяжелой цепи и легкой цепи бевацизумаба. Показатель ответа, больший чем или равный среднему фоновому ответу плюс три стандартных отклонения, считался потенциальным эпитопом Т-клеток CD4+. Для V области легкой цепи бевацизумаба протестировали 32 пептида (Таблица 3), что привело к среднему фоновому проценту ответа 2,1±2,7%. Определили, что значение в три стандартных отклонения над фоном составляет 10,2%. Один пептид в положении 13 (Q40-T54) продемонстрировал этот уровень ответа в наборе данных пептидов легкой цепи бевацизумаба с показателем ответа 15,2% (Фиг.2А). Для V области тяжелой цепи бевацизумаба протестировали 37 пептидов (Таблица 4). Средний фоновый процент ответа составлял 2,8±3,1%. Значение в три стандартных отклонения над фоном составляло 12,1%. Один пептид в пределах набора данных для тяжелой цепи бевацизумаба, #18 (N52-R56), достигал процента ответа 16,2% (Фиг.3А). Второй пептид в положении #30 в наборе данных для тяжелой цепи достигал показателя ответа 9,1% и считался эпитопом благодаря повышенному индексу стимуляции (смотри ниже).
Средний индекс стимуляции рассчитывали для всех пептидов в наборе данных. Пептид 13 легкой цепи имел высокий средний индекс стимуляции 1,82±0,24 s.e.m. (стандартная ошибка среднего) (Фиг.2Б). Пептид #18 тяжелой цепи имел значение среднего индекса стимуляции 2,16±0,35 s.e.m. (Фиг.3Б). Пептид в положении #30 давал средний индекс стимуляции 1,45±0,18 s.e.m. (Фиг.3Б) из-за повышенного среднего индекса стимуляции и показателя ответа выше среднего. Пептид в положении #30 был включен при определении содержания эпитопов Т-клеток CD4+ V области данного антитела. Все эти значения индекса стимуляции значительно выше, чем средний индекс стимуляции для всех пептидов в двух наборах данных (1,14±0,07 для всех 69 пептидов тяжелой цепи и легкой цепи).
Эти данные указывают на то, что в V областях бевацизумаба есть три области эпитопов Т-клеток CD4+ (Таблица 5). В области VL эпитоп находится в положении пептида 13, который охватывает каркас 2 и две аминокислоты из CDR2. Данная последовательность содержит мышиную обратную мутацию (V46), вставленную в последовательность во время гуманизации. В Таблице 5 подчеркнуты аминокислоты, происходящие из CDR. В тяжелой цепи идентифицировали две области пептидных эпитопов. Более сильный эпитоп в положении #18 охватывает всю CDR2. Вторая область пептидного эпитопа содержит аминокислоты как каркаса 3, так и CDR3.
7.2.2 Варианты с пониженной иммуногенностью антител-вариантов бевацизумаба
Бевацизумаб подвергали мутационному анализу (смотри Пример 2 ниже). Основываясь на исследованиях по связыванию антигена, проведенных в сочетании с мутационным анализом, идентифицировали набор аминокислотных замен-кандидатов в области CDR-H2 и CDR-H3, которые не приводят к значительному снижению аффинности антитела к VEGF (Таблица 6). Данные аминокислотные замены тестировали одиночно или в комбинации для идентификации вариантов бевацизумаба с пониженной иммуногенностью по сравнению с антителом дикого типа.
8. ПРИМЕР 2: ИДЕНТИФИКАЦИЯ ВАРИАНТОВ БЕВАЦИЗУМАБА С ПОВЫШЕННОЙ АФФИННОСТЬЮ К VEGF
Антитело бевацизумаб подвергали всестороннему мутационному анализу для идентификации мутантов, которые имели повышенную аффинность к VEGF по сравнению с бевацизумабом. Повышенную аффинность к VEGF мутантов-кандидатов с высокой аффинностью по сравнению с бевацизумабом анализировали BIAcore для подтверждения их характеристик связывания.
8.1 МАТЕРИАЛЫ И МЕТОДЫ
8.1.1 BIAcore
Клонировали пятнадцать конструкций вариантов VH области бевацизумаба наряду с немодифицированной областью VL в человеческую плазмиду, содержащую IgG1, экспрессируемую в клеточных линиях 293Т/17, путем временной трансфекции, и антитела очищали посредством аффинности белка А или белка G. Аффинность антител в отношении VEGF (R&D Systems, Minneapolis, MN) определяли с использованием системы поверхностного плазменного резонанса BIAcore 2000 и 3000 (BIAcore, GE Healthcare, Piscataway, NJ). Поликлональное антитело козы против человеческого Fc (Jackson Immunoresearch) сначала иммобилизировали на поверхности биосенсора с использованием стандартных реактивов BIAcore для аминного сочетания (N-этил-N'-диметиламино-пропилкарбодиимид, EDC; N-гидроксисукцинимид, NHS; и этаноламин HCl, рН 8,5), с последующим захватом антител против VEGF (бевацизумаб и варианты бевацизумаба) на параллельных поверхностях при низкой скорости тока 5 мкл/мин. RL поддерживали на низком уровне для минимизации авидности из-за димерной природы VEGF. На контрольной поверхности не осуществляли захват антитела, чтобы она служила в качестве негативного контроля. Затем во все проточные ячейки инъецировали VEGF со скоростью тока 50 мкл/мин в течение двух минут для отслеживания ассоциации, с последующим 25-минутным током подвижного буфера HBS-P (10 мМ HEPES, 150 мМ хлорид натрия, 0,005% Р-20, рН 7,4) для отслеживания фазы диссоциации. В каждом цикле над поверхностью инъецировали VEGF в 6 разных концентрациях, варьирующих от 0 нМ до 512 нМ и с четырехкратными инкрементами. Поверхность регенерировали 1,5% H3PO4 со скоростью тока 100 мкл/мин в двух коротких импульсах в конце каждого цикла. Данные по связыванию аппроксимировали к модели 1:1 Лангмюра для извлечения констант связывания при помощи программы BIAevaluate. В каждом анализе применяли двойной контроль для устранения фоновых ответов от контрольной поверхности и контроля в виде одного буфера. Все данные по кинетике связывания анализировали по меньшей мере в трех отдельных определениях.
8.2 РЕЗУЛЬТАТЫ
Результаты показаны в виде абсолютных чисел и как кратность улучшения по сравнению с диким типом. Почти все перечисленные варианты имели улучшенные скорости ассоциации (kon) и диссоциации (koff) по сравнению с бевацизумабом или диким типом (Таблица 7). Конечные значения аффинности для вариантов находились в интервале 0,1 нМ и достигали такого низкого значения, как 0,08 нМ, для варианта, соответствующего SEQ ID NO:82. Эти значения контрастируют с бевацизумабом, который имеет измеренную в данных экспериментах аффинность 1,9 нМ.
В Таблицах 8 и 9 показаны дополнительные варианты тяжелой цепи, которые, как показывают предварительные исследования по связыванию, имеют большую аффинность к VEGF, чем бевацизумаб (данные не показаны). В Таблице 10 показаны варианты тяжелой цепи, которые, как показывают предварительные исследования, имеют аффинность к VEGF, аналогичную аффинности бевацизумаба (данные не показаны). В Таблице 11 показаны варианты легкой цепи, которые, как показывают предварительные исследования, имеют аффинность к VEGF, аналогичную аффинности бевацизумаба (данные не показаны).
9. ПРИМЕР 3: СЕЛЕКЦИЯ ДЕИММУНИЗИРОВАННЫХ ВАРИАНТОВ ПЕПТИДОВ
Получали варианты пептидов (Таблицы 14-16), соответствующих иммуногенным областям бевацизумаба (смотри Пример 1). Варианты пептидов отбирали на основе всестороннего мутационного анализа, описанного в Примере 2, в котором были идентифицированы модификации CDR, которые по существу не снижают аффинность связывания бевацизумаба с VEGF.
Всего синтезировали и протестировали 77 пептидов на основе исследований по связыванию антигенов, включая два синтеза каждого из родительских 15-мерных пептидов. Всего протестировали 93 доноров с родительским пептидом и вариантами пептидов, используя способ, описанный в разделе 7.1, и результаты показаны на Фиг.4А-4В. Конкретно на Фиг.4А-4В показаны ответы Т-клеток CD4+ на мутантные пептидные эпитопы бевацизумаба. Средние ответы нанемодифицированные последовательности родительского эпитопа показаны незакрашенными значками. Большие кружки показывают отобранные пептиды, на которые дана ссылка в Таблице 17 (смотри ниже). На Фиг.4А показаны пептиды CDR2 VH; на Фиг.4Б показаны пептиды CDR3 VH; и на Фиг.4В показаны пептиды CDR2 VL. Данные по иммуногенности для отобранных пептидов показаны в Таблице 17.
Для пептидов CDR2 вариабельной области тяжелой цепи средний процент ответа на родительские пептиды в данном исследовании составлял 5,38% и 6,45%. Три мутантных пептида демонстрировали пониженные общий показатель ответа и средний индекс стимуляции по сравнению с родительскими пептидами.
Показатели ответа на родительский пептид для пептидных эпитопов CDR3 вариабельной области тяжелой цепи в данном исследовании составляли 7,53% и 6,45%. Обнаружили одну последовательность мутантного пептида, которая демонстрировала пониженные общие ответы по сравнению с родительским пептидом.
Наконец, показатели ответа на родительский пептид CDR2 вариабельной области легкой цепи в данном исследовании составляли 25,8% и 15%. Был идентифицирован один мутантный пептид, который демонстрировал пониженную общую иммуногенность по сравнению с родительским пептидом.
Для демонстрации того, что деиммунизирующие мутации сохраняли аффинность к VEGF по сравнению с бевацизумабом, использовали проточную цитометрию для сравнения свойств связывания вариантов антител, включающих мутации в модифицированных пептидах эпитопов (либо в виде одиночных, либо двойных модификаций аминокислот и бевацизумаб). Несколько деиммунизирующих мутаций имели сравнимую или повышенную аффинность к VEGF по сравнению с бевацизумабом.
В одном исследовании временно трансфицированные клетки 293с18, экспрессирующие поверхностно связанные формы вариантов бевацизумаба, окрашивали rHu VEGF, конъюгированным cAlexa647 (Invitrogen Cat#PHG0143), в концентрации 3 нМ и антителом козы против человеческого каппа-RPE (Southern Biotech Cat#2063-09) в разведении 1:400. Данные собирали посредством проточной цитометрии с использованием проточного цитометра DakoCytomation CyAn ADP и анализировали с использованием программы анализа Treestar's FloJo. Средние интенсивности флуоресценции (MFI), измеренные в данной работе, изложены в Таблице 18.
В другом исследовании измеряли ЕС5о бевацизумаба и связывание вариантов антитела с VEGF. Генерировали графики титрования антитела с использованием бевацизумаба и его вариантов с rHu VEGF, конъюгированным с Alexa647, как описано выше, с VEGF, последовательно разведенным в два раза от 5 мкМ до 0,01 мкМ. Значения EC50 показаны в Таблице 19.
10. КОНКРЕТНЫЕ ВОПЛОЩЕНИЯ. ЦИТИРОВАНИЕ ССЫЛОК
Все публикации, патенты, патентные заявки и другие документы, процитированные в данной заявке, являются тем самым включенными посредством ссылки во всей их полноте для всех целей в такой же степени, как если бы каждая отдельная публикация, патент, патентная заявка или другой документ были индивидуально указаны как включенные посредством ссылки для всех целей. В то время как разные конкретные воплощения были проиллюстрированы и описаны, будет понятно, что можно делать разные изменения без отступления от сущности и объема изобретения(й).
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ TNF-α И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2595379C2 |
| ЛЕЧЕНИЕ ИНТЕРСТИЦИАЛЬНОГО ЦИСТИТА | 2008 |
|
RU2570559C2 |
| УЛУЧШЕННЫЕ АМИНОКИСЛОТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ ПРОТИВ IL-6R И СОДЕРЖАЩИЕ ИХ ПОЛИПЕПТИДЫ ДЛЯ ЛЕЧЕНИЯ СВЯЗАННЫХ С IL-6R ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ | 2010 |
|
RU2539798C2 |
| СПОСОБЫ ЛЕЧЕНИЯ БОЛИ, ВЫЗВАННОЙ ОСТЕОАРТРИТОМ, ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА ФАКТОРА РОСТА НЕРВОВ И СОДЕРЖАЩИХ ЕГО КОМПОЗИЦИЙ | 2006 |
|
RU2429013C2 |
| АНТИТЕЛА С РН-ЗАВИСИМЫМ СВЯЗЫВАНИЕМ АНТИГЕНА | 2011 |
|
RU2570729C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ВИСЦЕРАЛЬНОЙ БОЛИ ПУТЕМ ВВЕДЕНИЯ АНТИТЕЛ-АНТАГОНИСТОВ, НАПРАВЛЕННЫХ ПРОТИВ ПЕПТИДА, СВЯЗАННОГО С ГЕНОМ КАЛЬЦИТОНИНА | 2010 |
|
RU2535074C2 |
| ПОЛИПЕПТИДЫ ДЛЯ СВЯЗЫВАНИЯ С "РЕЦЕПТОРОМ КОНЕЧНЫХ ПРОДУКТОВ ГЛИКИРОВАНИЯ", А ТАКЖЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ, В КОТОРЫХ ОНИ ПРИНИМАЮТ УЧАСТИЕ | 2010 |
|
RU2558301C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ БОЛИ | 2009 |
|
RU2522493C2 |
| БИСПЕЦИФИЧЕСКИЕ ДВУХВАЛЕНТНЫЕ АНТИТЕЛА АНТИ-VEGF/АНТИ-ANG-2 | 2011 |
|
RU2597973C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИ-VEGF/АНТИ-ANG-2 АНТИТЕЛА | 2009 |
|
RU2542382C2 |


















































































































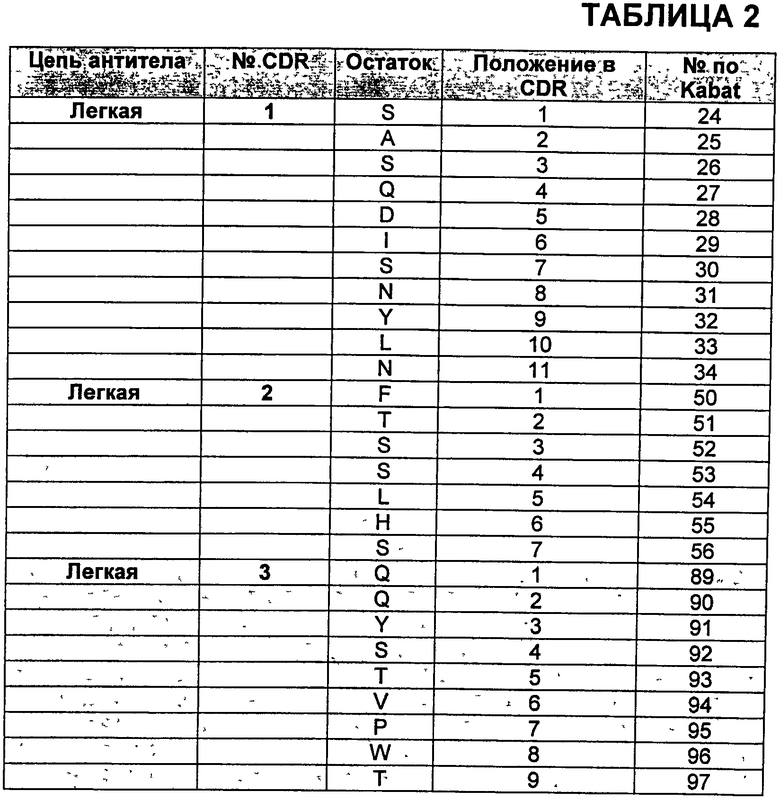
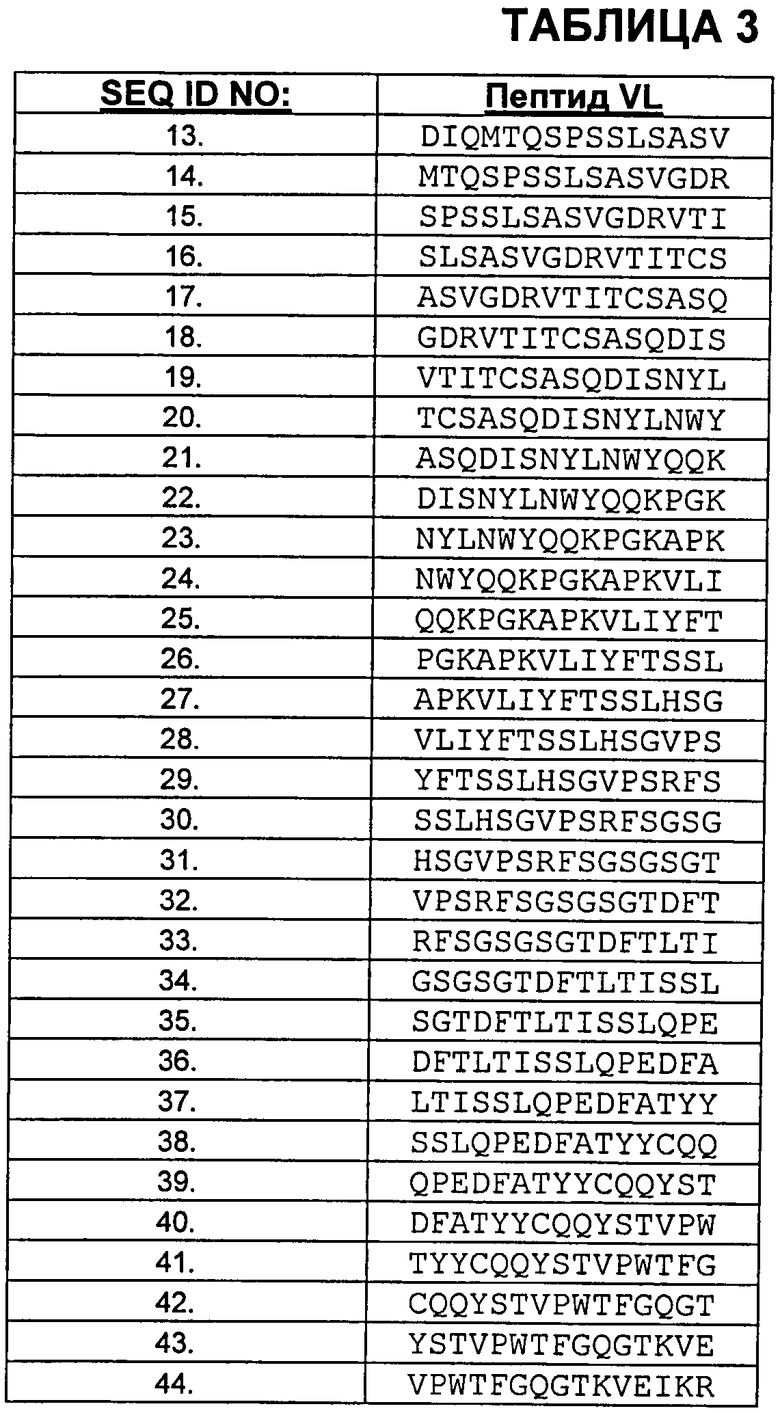
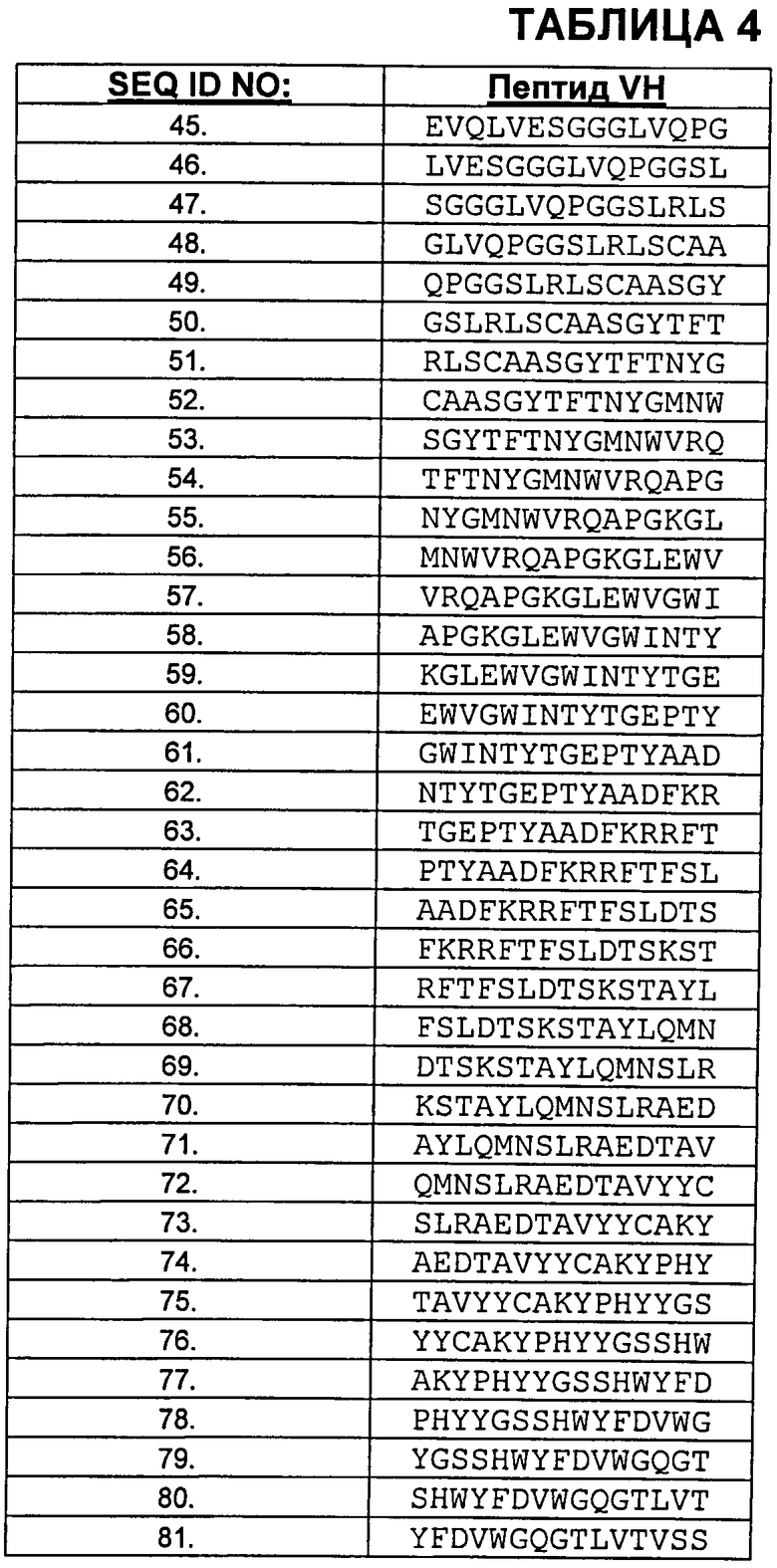


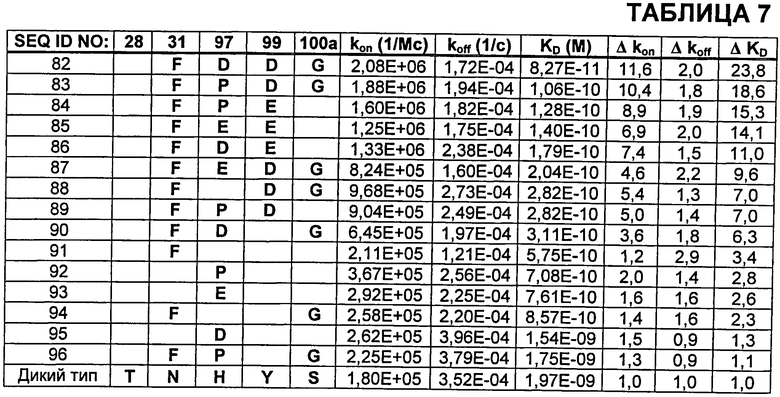

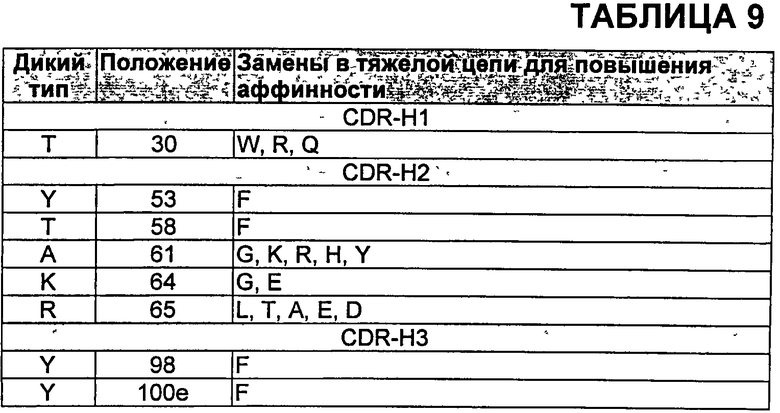
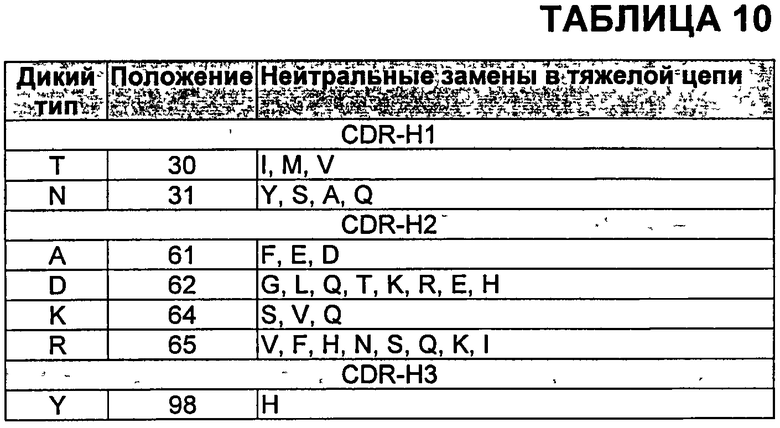
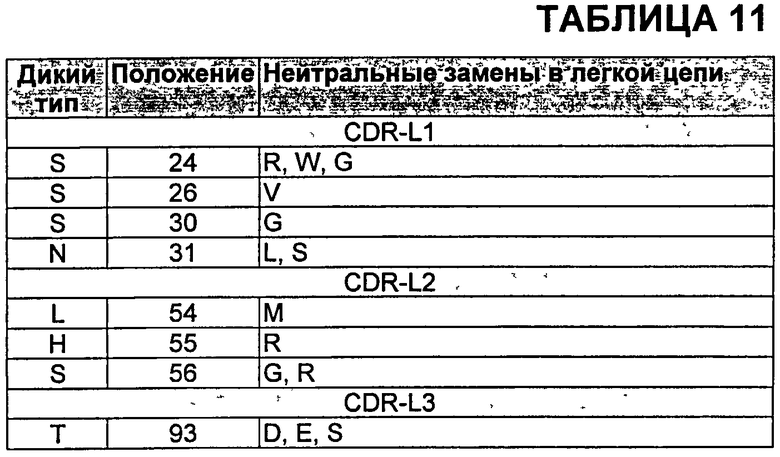

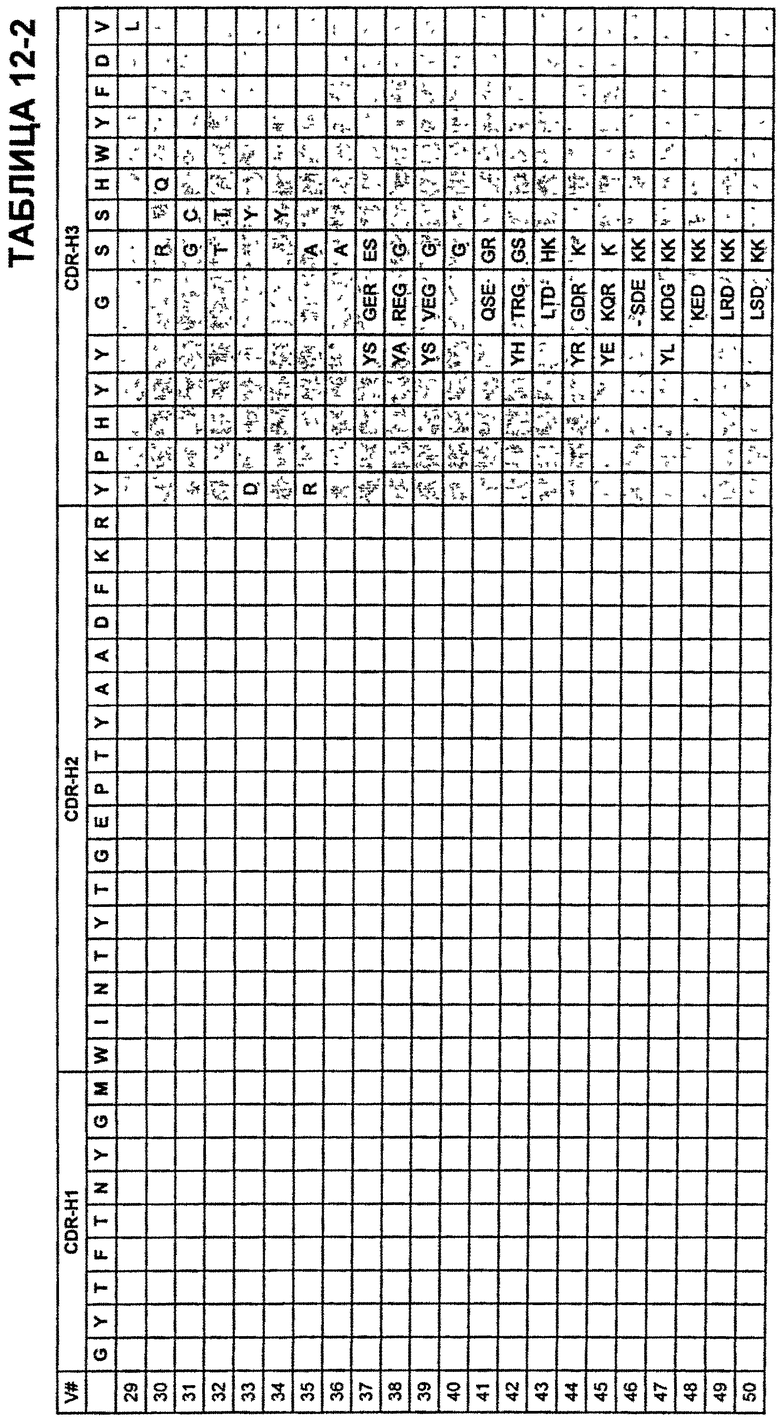
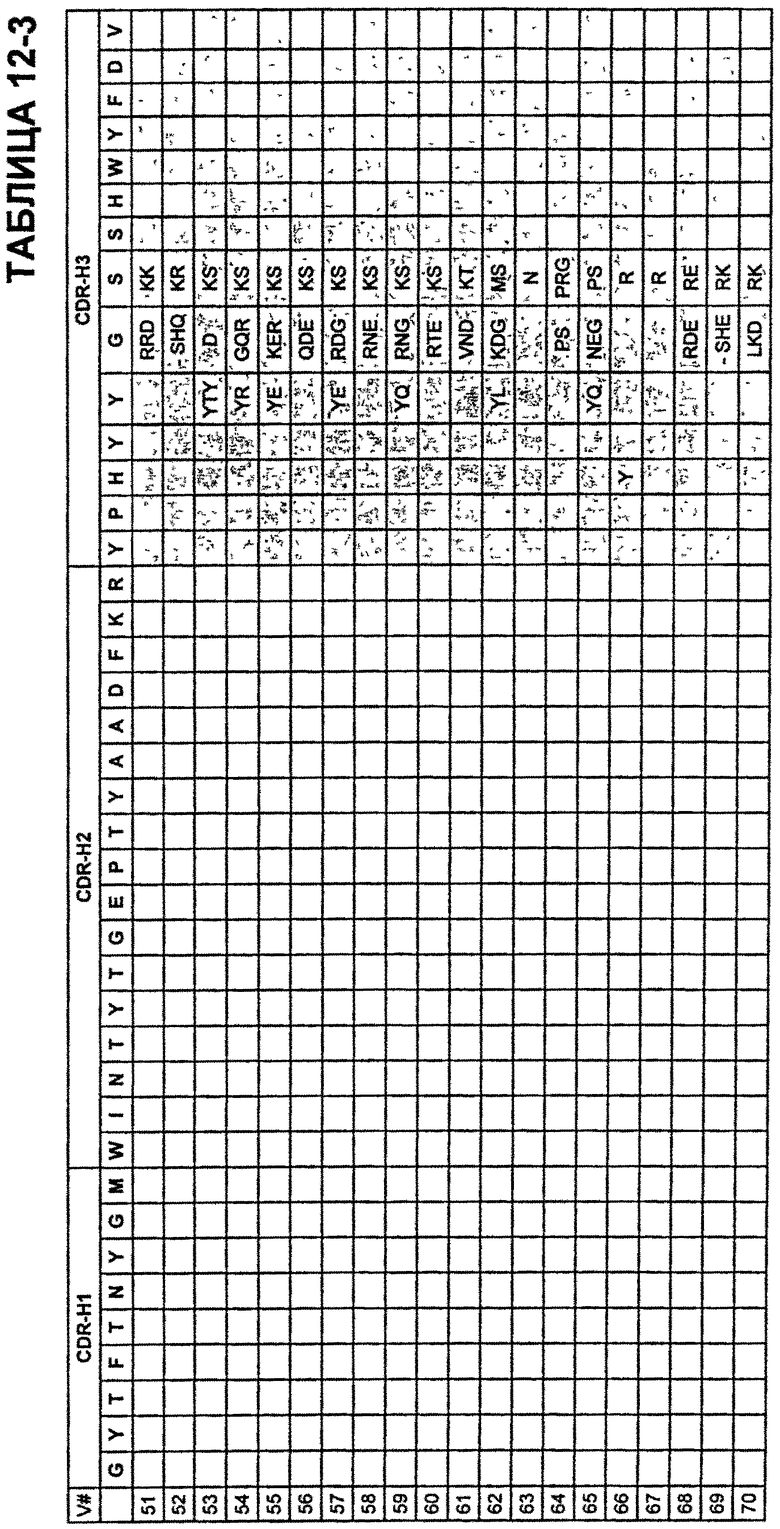
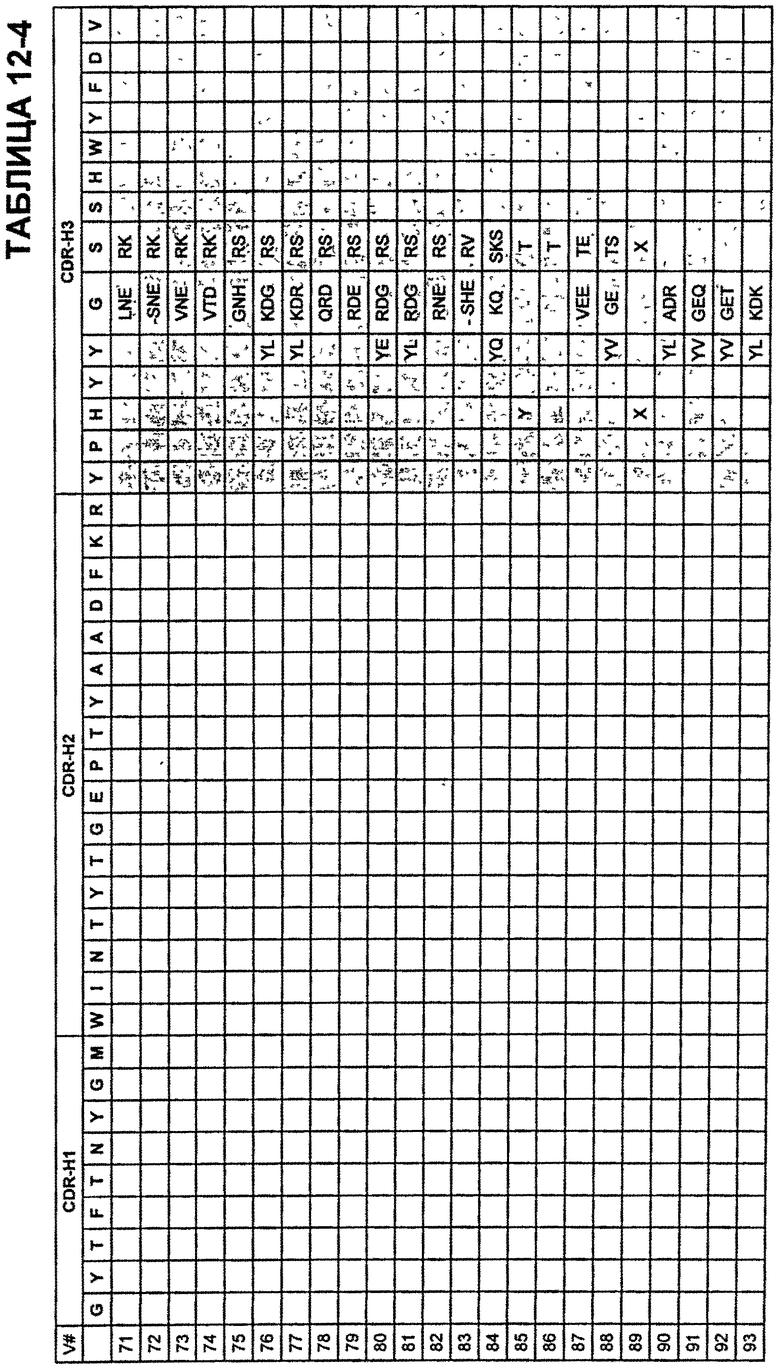

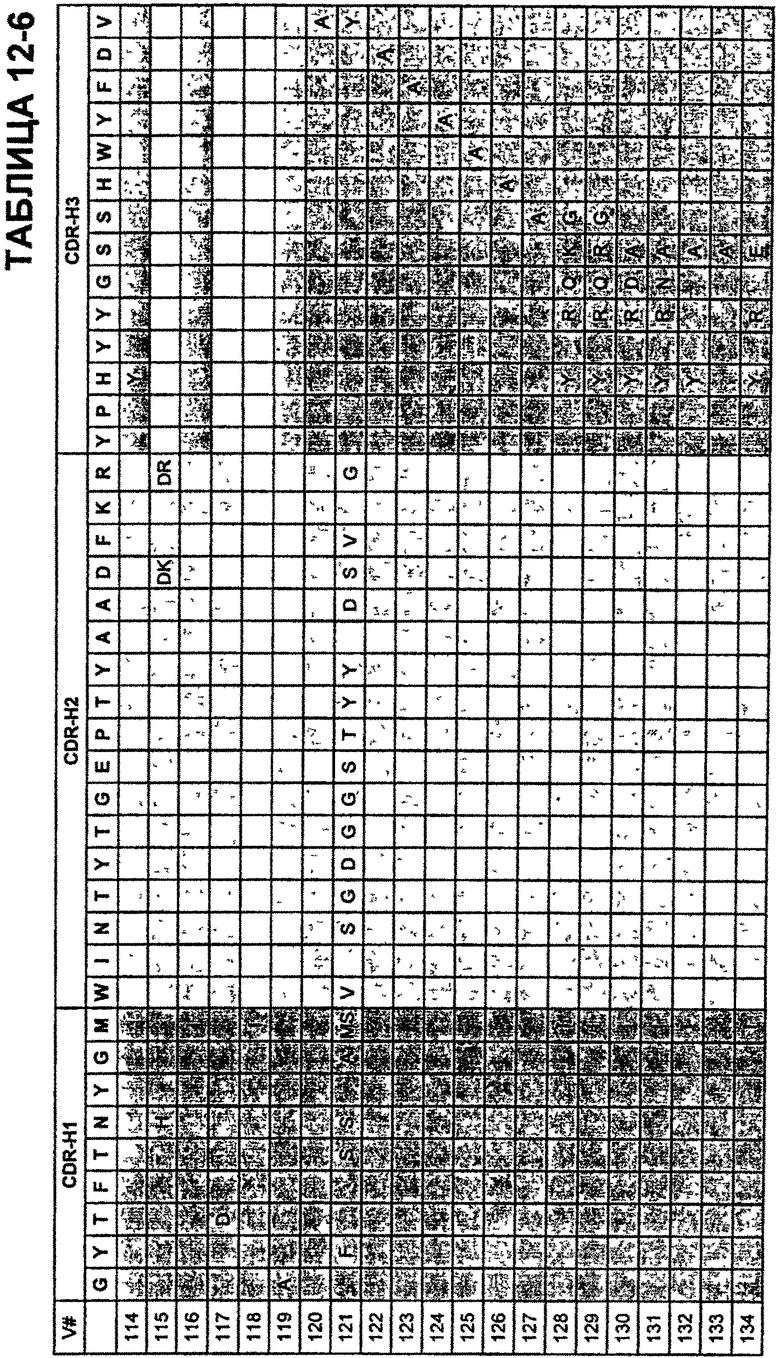
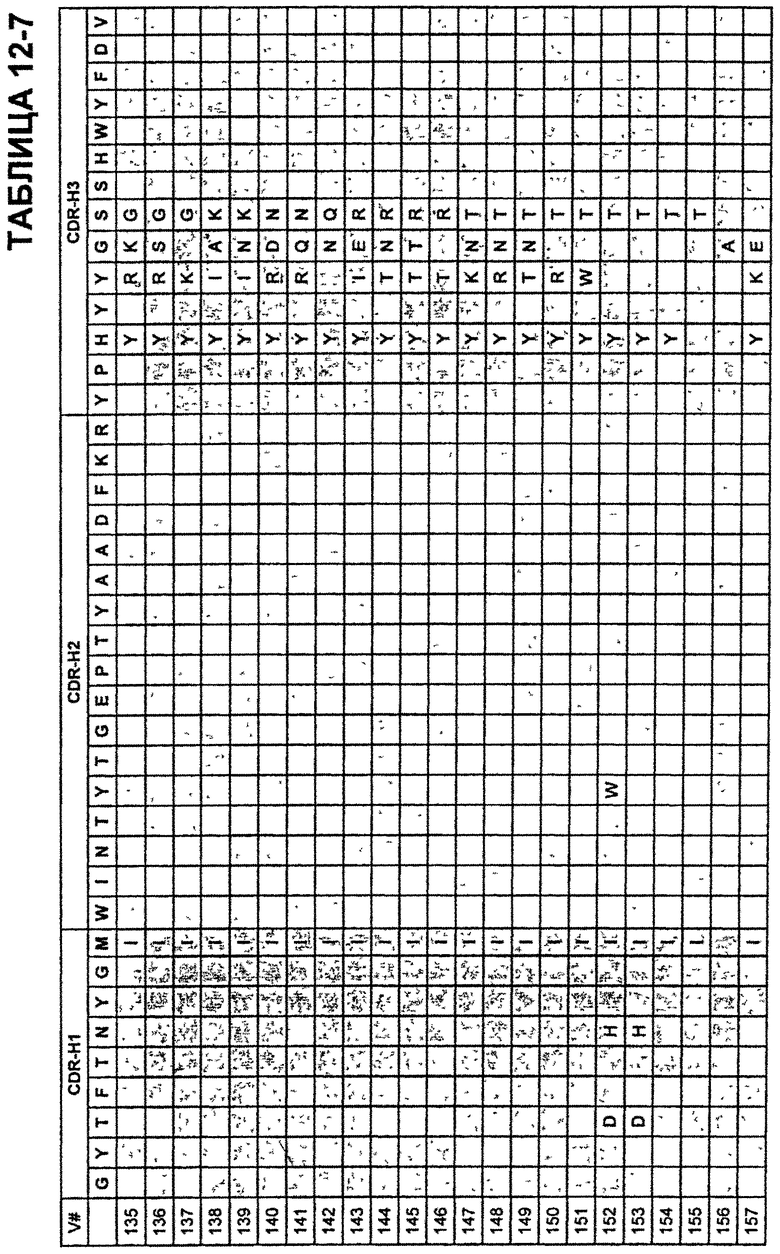

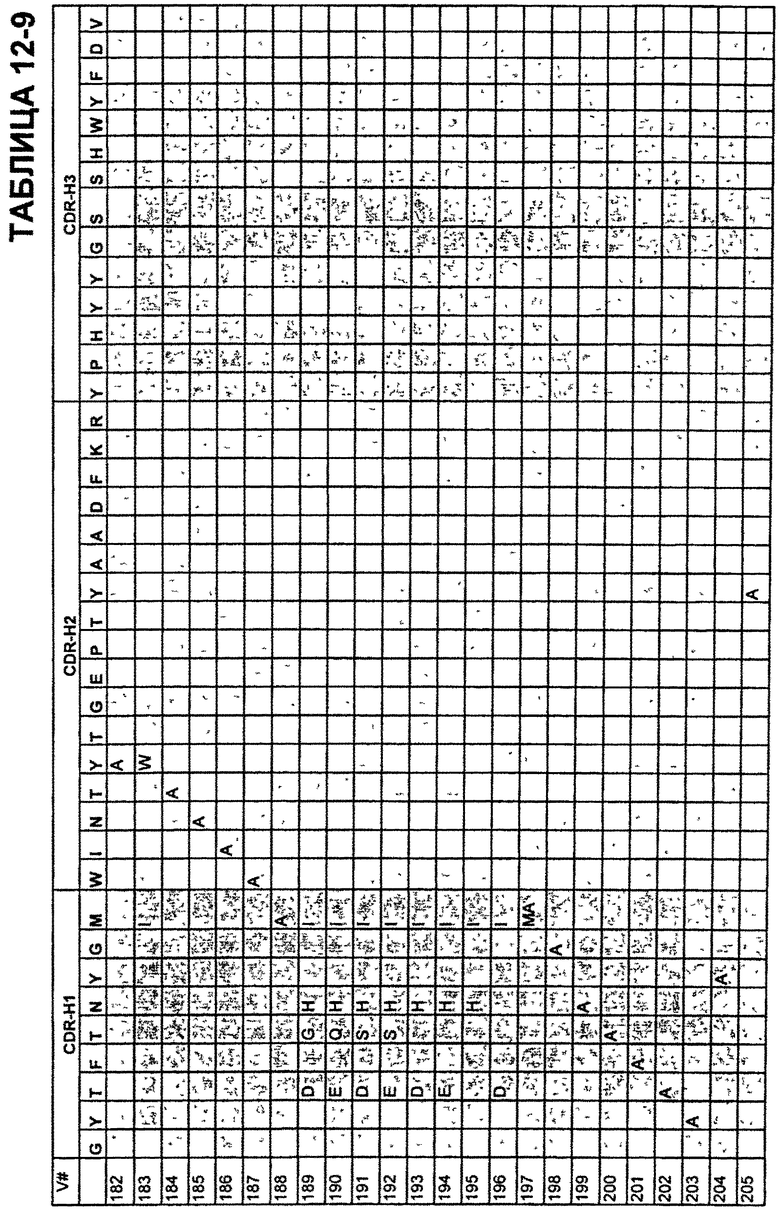
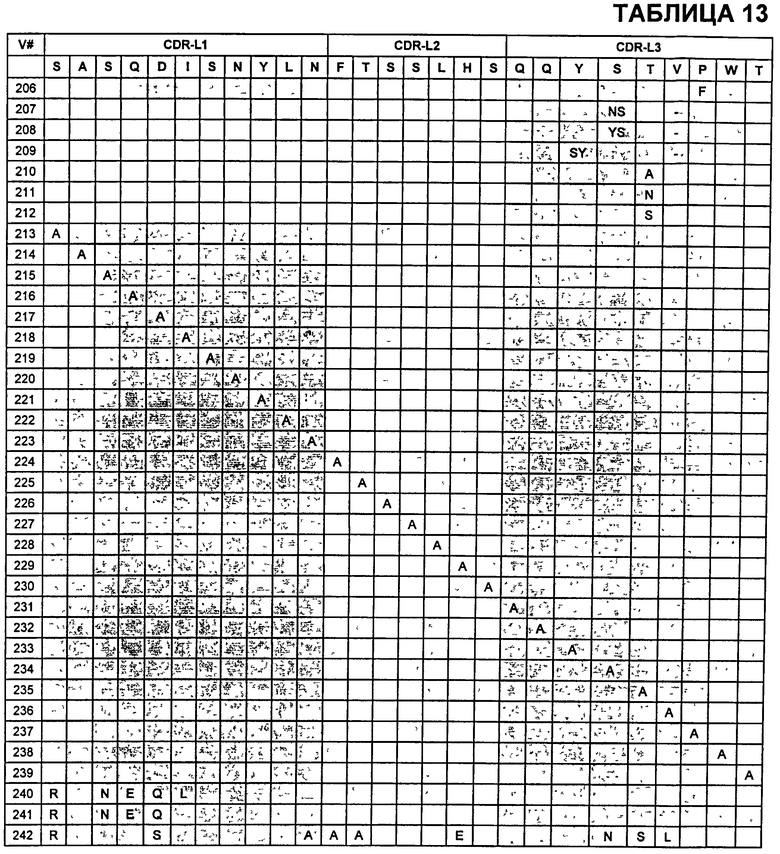
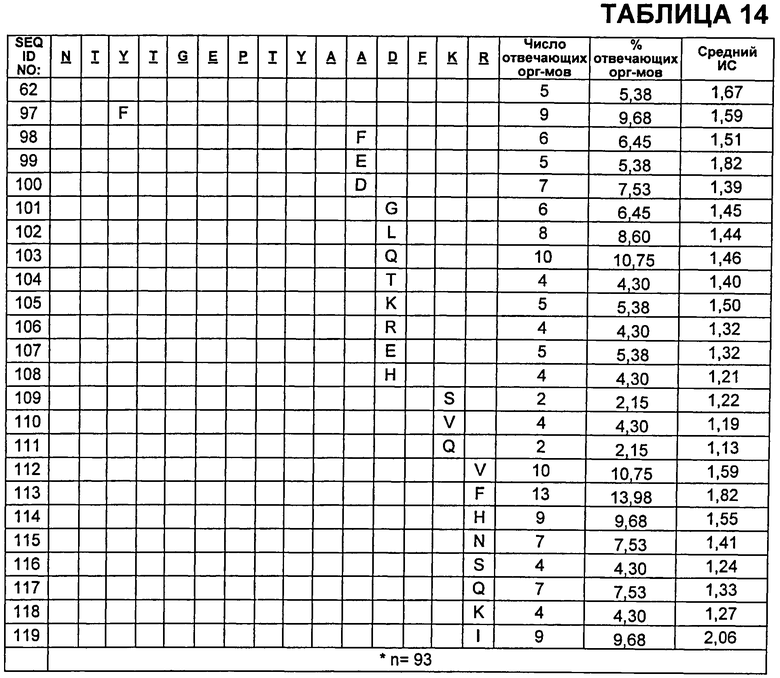
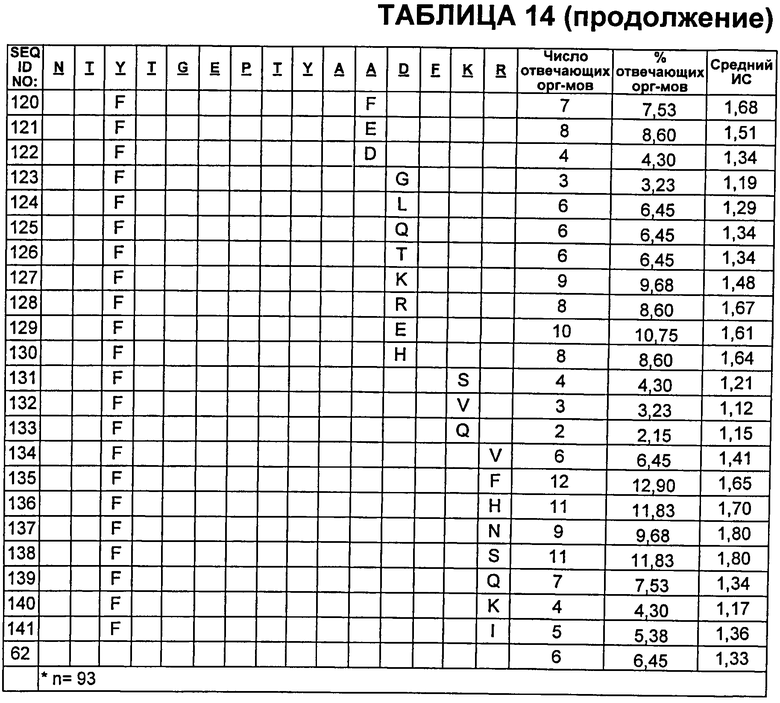
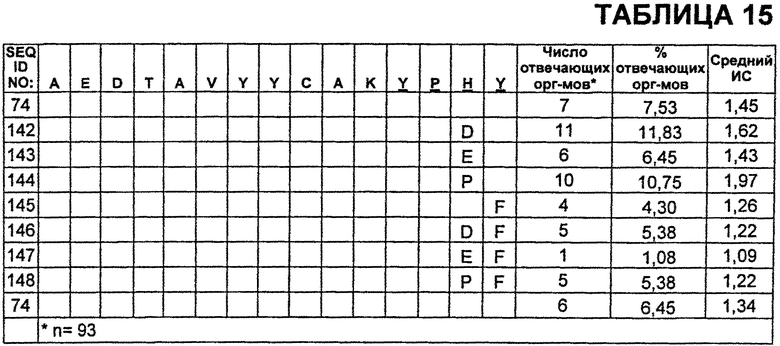
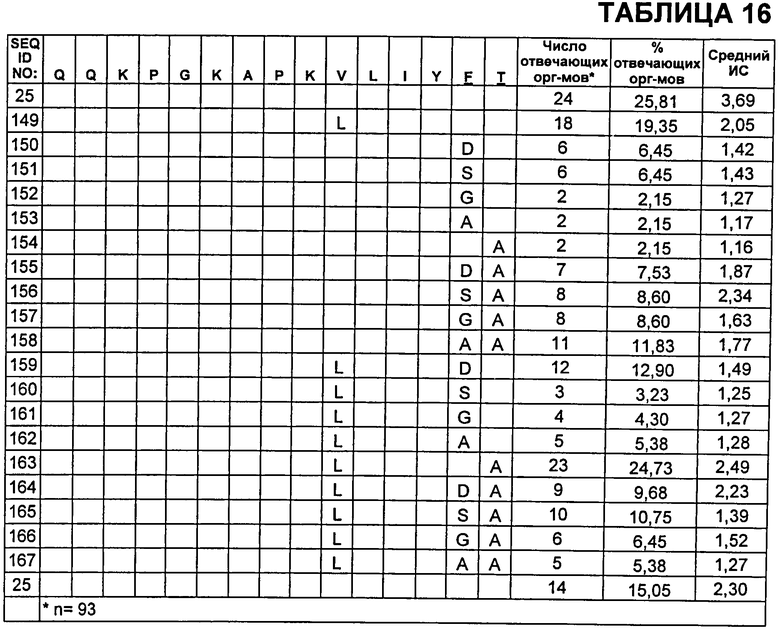
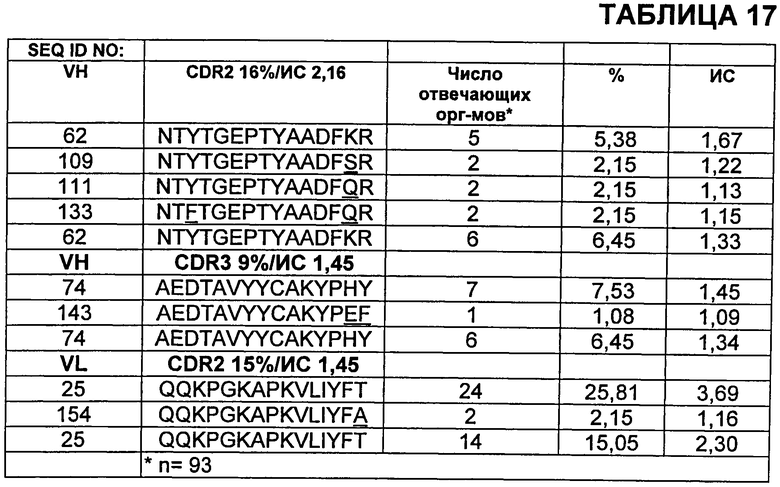
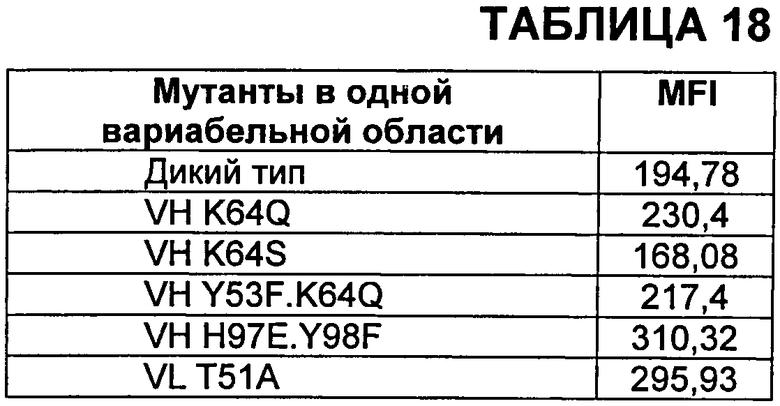

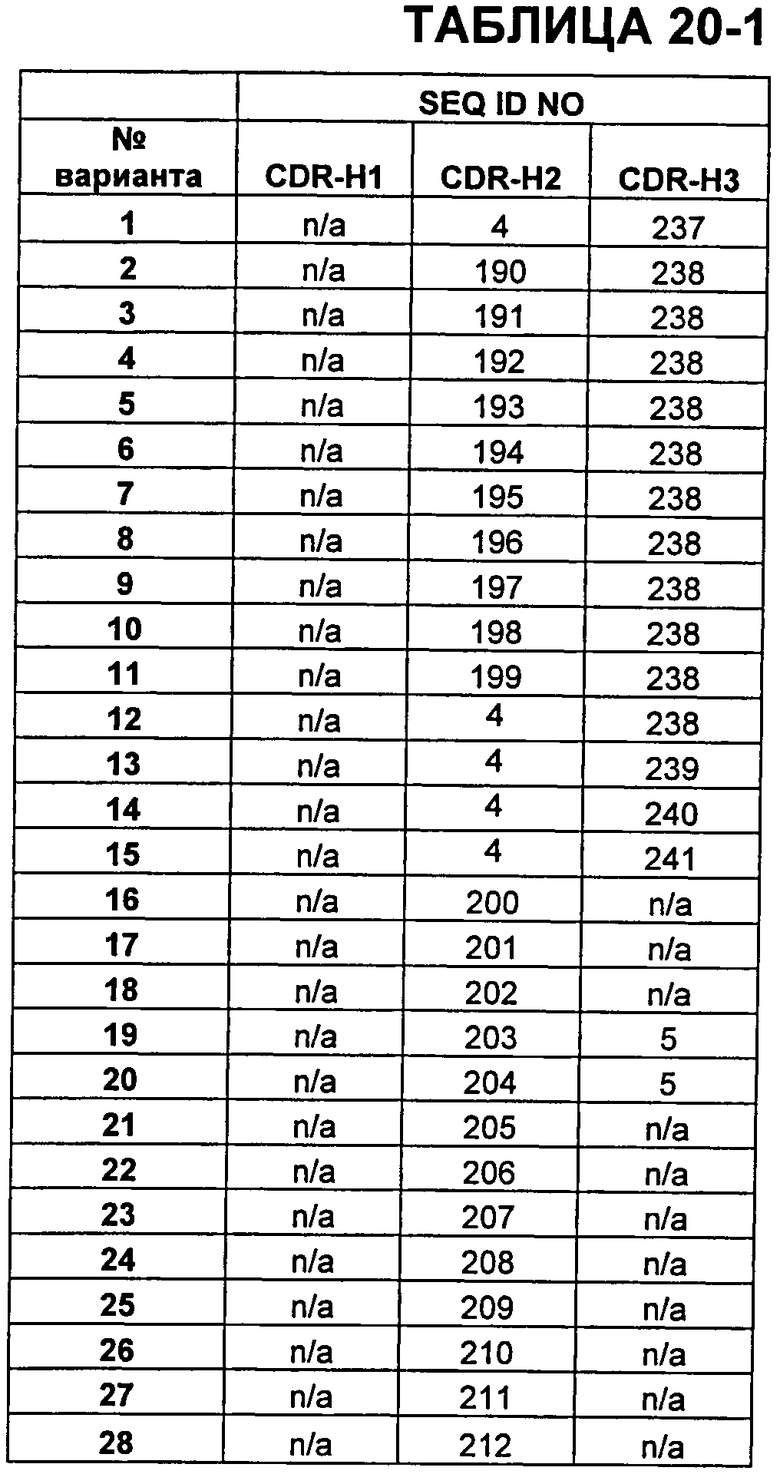
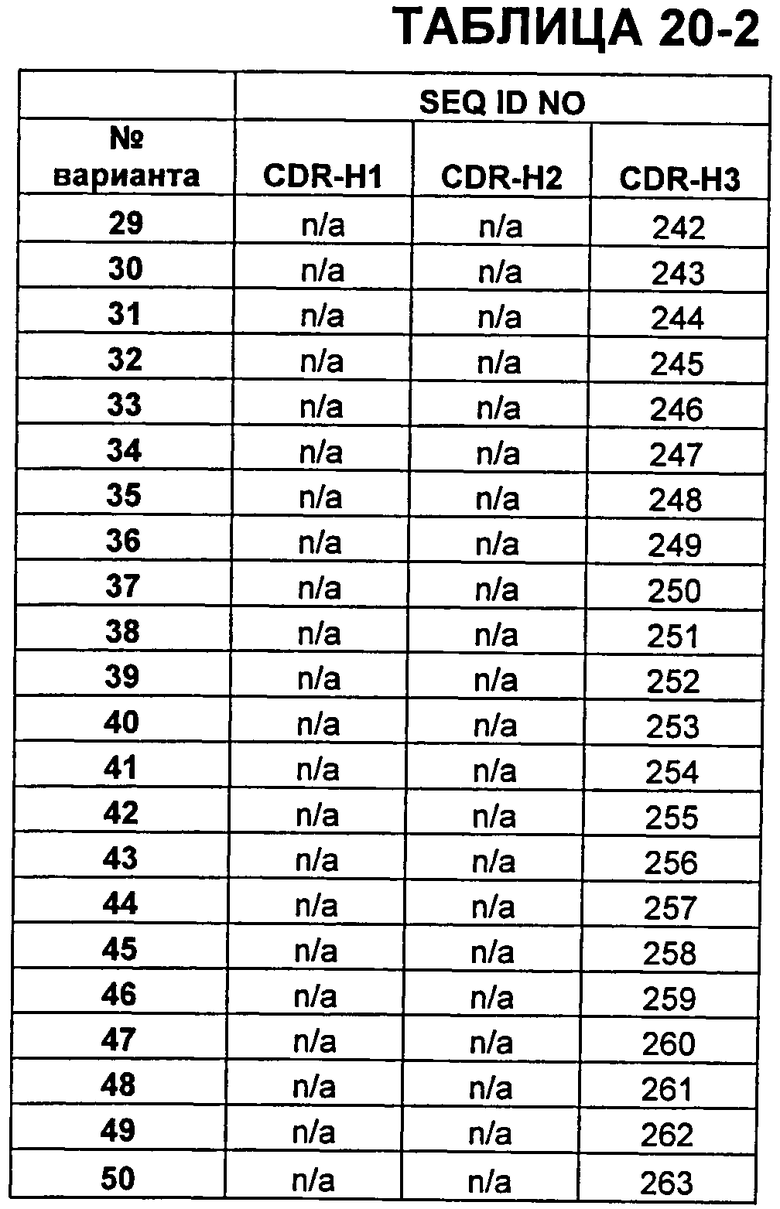

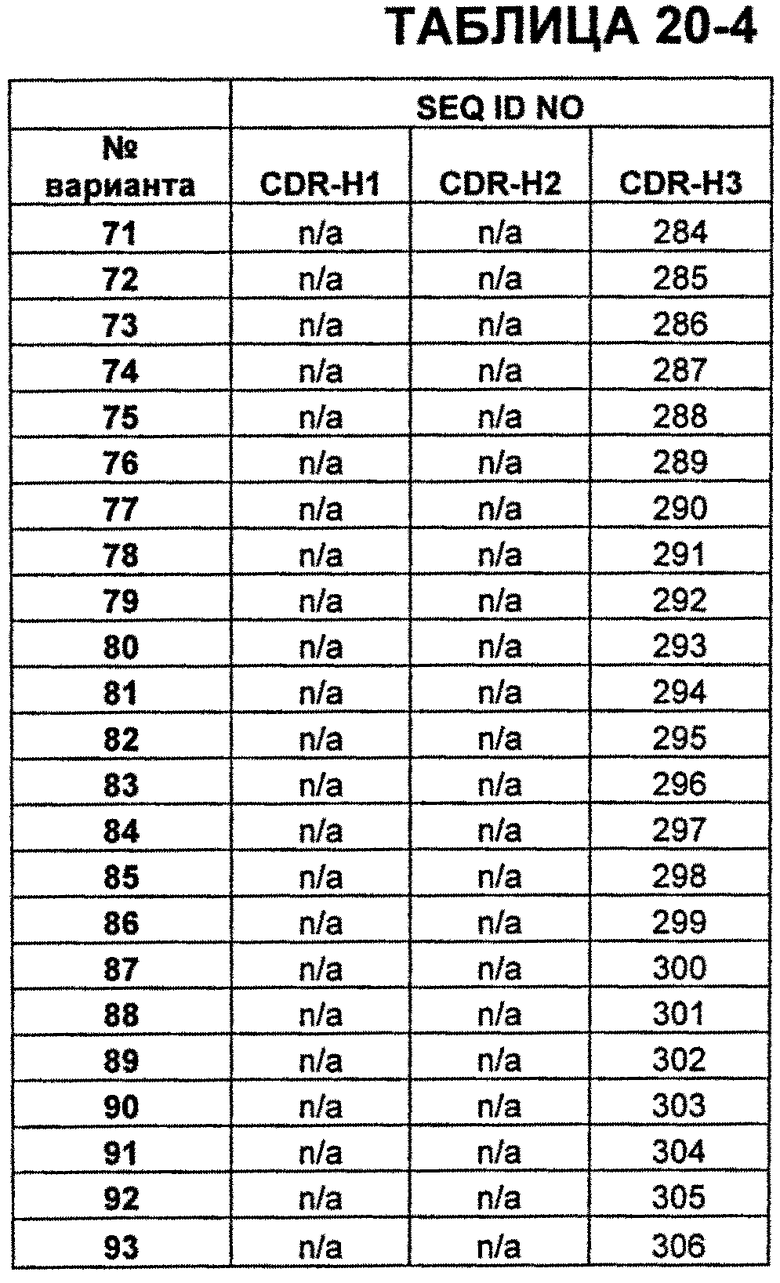

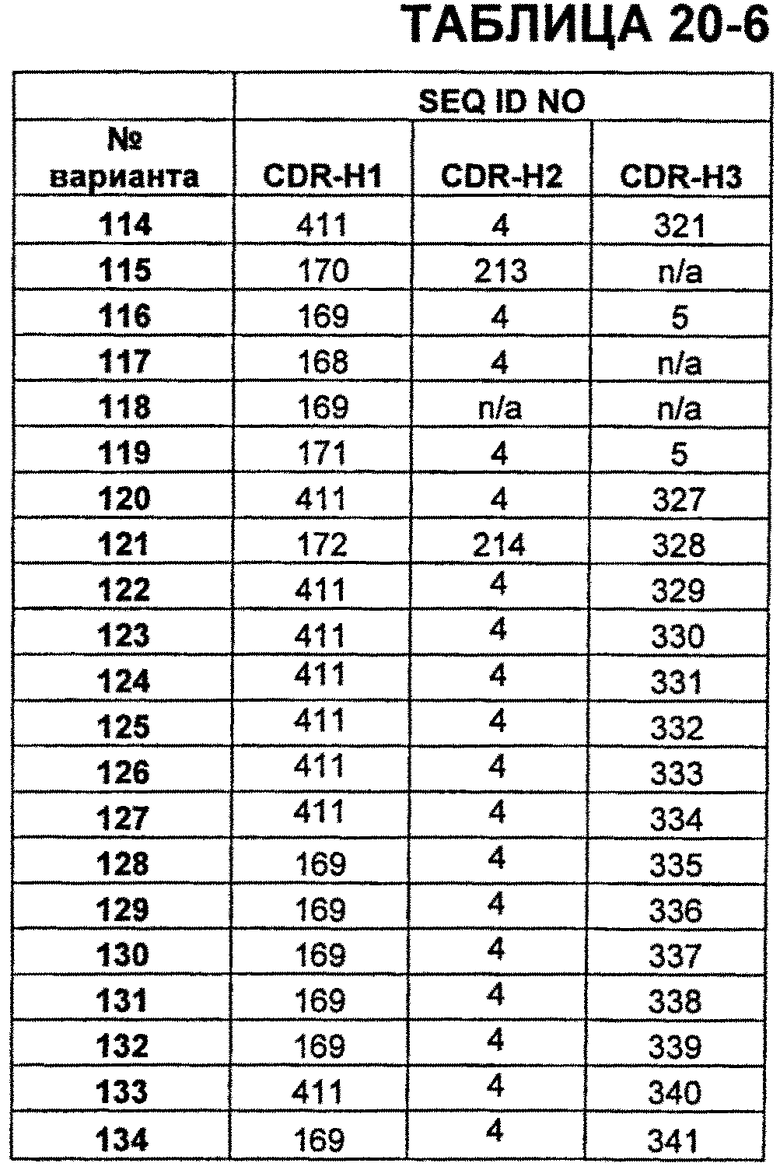
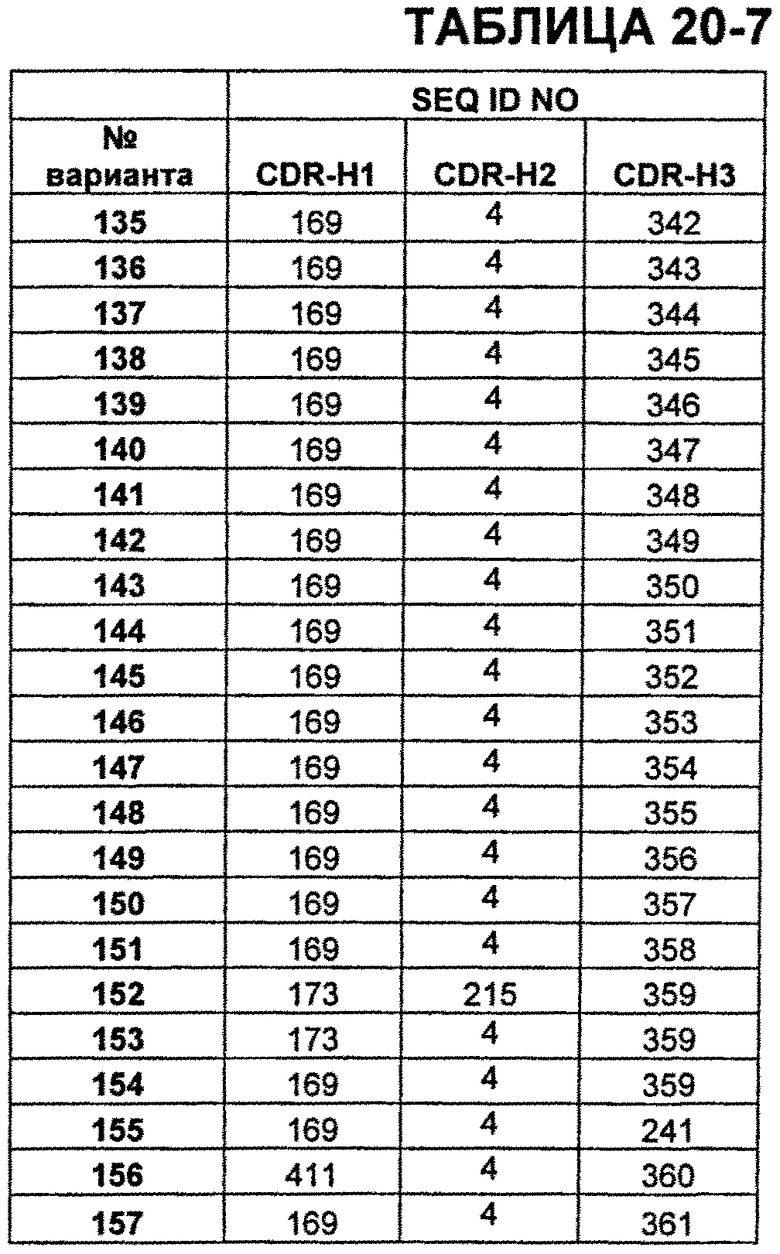
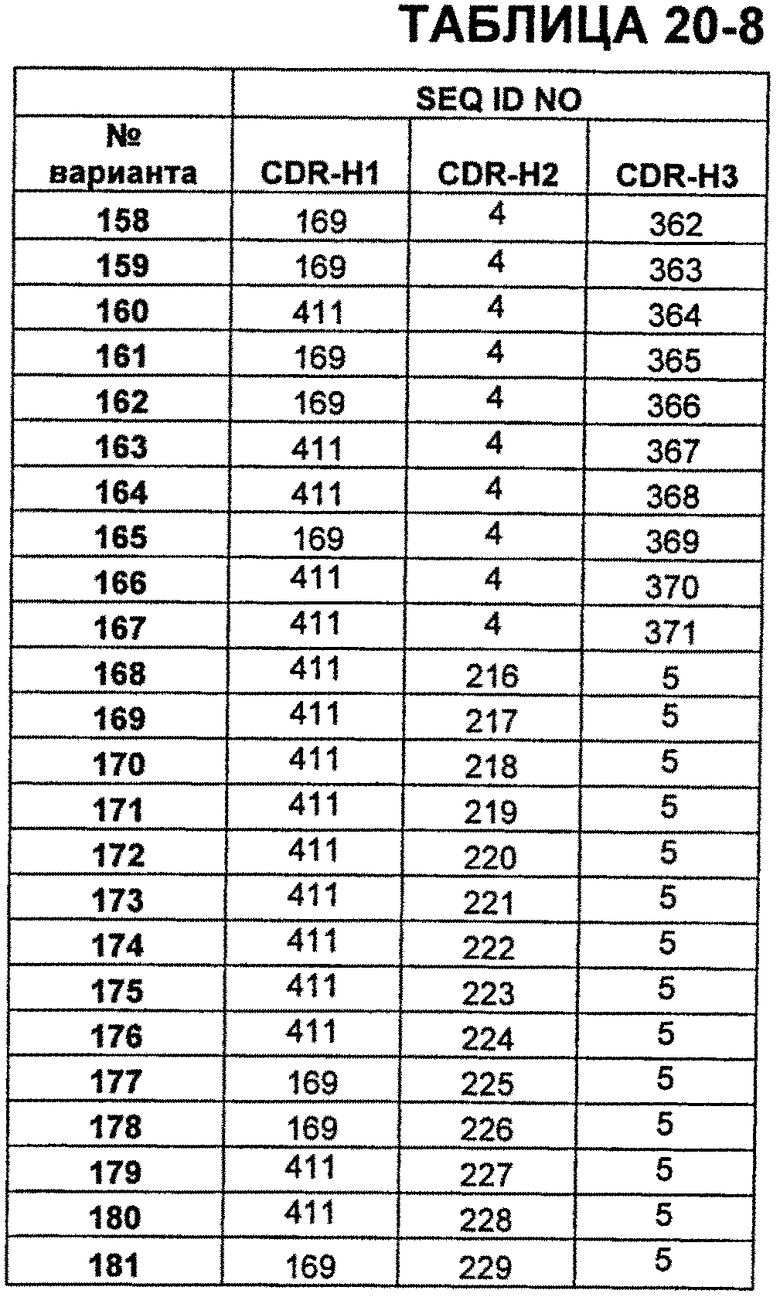

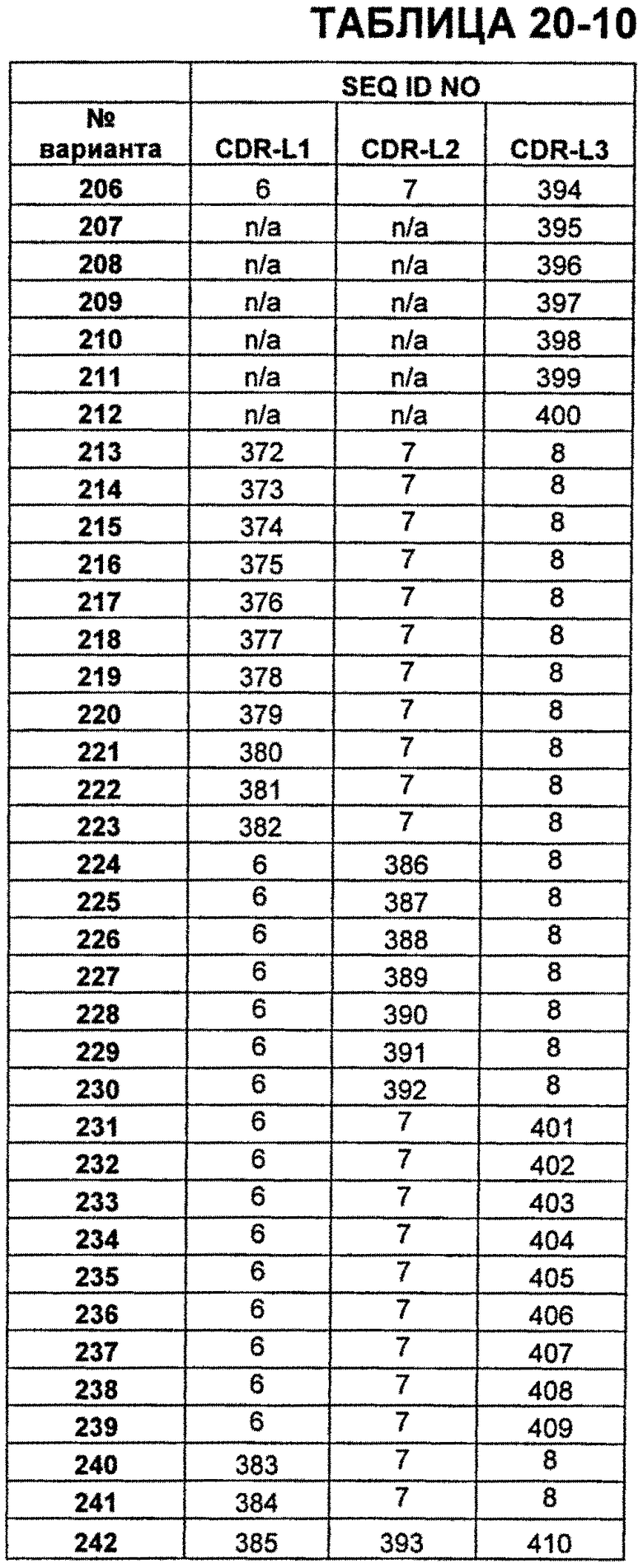




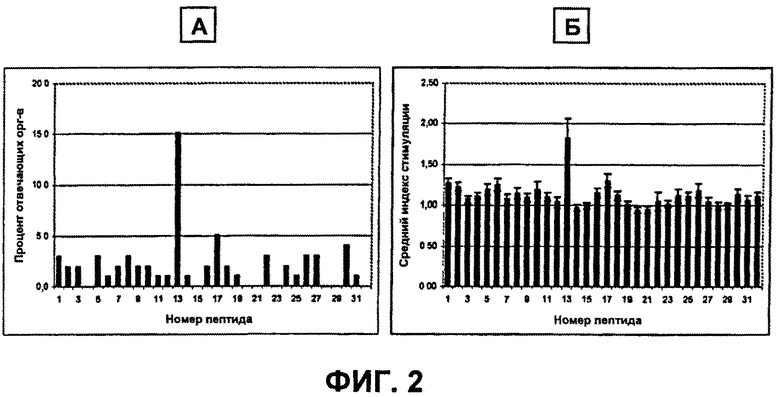
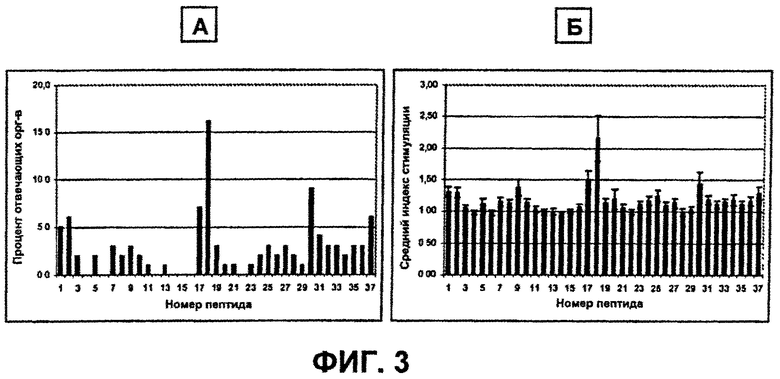
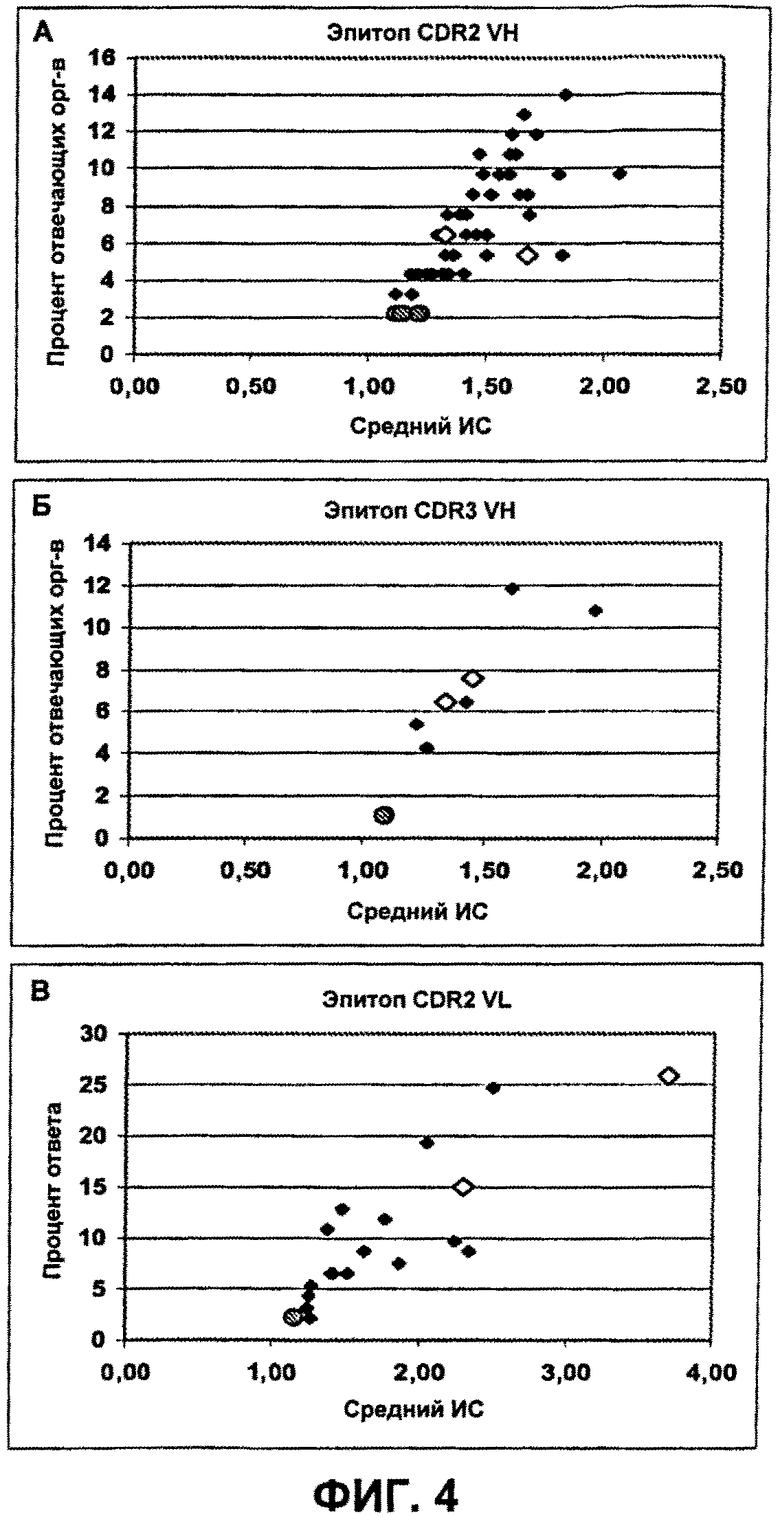
Изобретения относятся к области биотехнологии. Предложены: варианты моноклонального антитела против VEGF или его антигенсвязывающего фрагмента, которые характеризуются тем, что содержат 6 CDR и при этом возможно замену Т51А в CDR-L2, а также имеют одну или комбинацию замен по сравнению с антителом бевацизумабом, а именно: 1. K64S в CDR-H2; 2. K64Q в CDR-H2; 3. Y53F и K64Q в CDR-H2; 4. Y53F и K64S в CDR-H2; 5. Н97Е в CDR-H3; 6. Y98F в CDR-H3; 7. Н97Е и Y98F в CDR-H3; 8. Н97Р и Y98F в CDR-H3. Описаны: конъюгат антитело - лекарственное средство, нейтрализующий активность VEGF, на основе антитела или его антигенсвязывающего фрагмента; фармацевтическая композиция также на основе антитела или его антигенсвязывающего фрагмента, или конъюгата, которая нейтрализует активность VEGF. Раскрыт способ лечения ракового заболевания, а также способ лечения возрастной дегенерации желтого пятна или иммунного расстройства на основе указанного антитела, его антигенсвязывающего фрагмента или конъюгата. Использование изобретения обеспечивает новые варианты антитела против VEGF или его антигенсвязывающего фрагмента, обладающие пониженной иммуногенностью, по сравнению с бевацизумабом. 5 н. и 21 з.п. ф-лы, 4 ил., 20 табл., 3 пр.
1. Моноклональное антитело против VEGF (фактор роста эндотелия сосудов) или связывающий фрагмент моноклонального антитела против VEGF, которые содержат шесть CDR, которые имеют одну или более аминокислотных замен или комбинаций аминокислотных замен по сравнению с референсным антителом против VEGF или референсным антигенсвязывающим фрагментом против VEGF, которые имеют CDR, имеющие аминокислотные последовательности, соответствующие SEQ ID NO: 3 (CDR-H1), SEQ ID NO: 4 (CDR-H2), SEQ ID NO: 5 (CDR-H3), SEQ ID NO: 6 (CDR-L1), SEQ ID NO: 7 (CDR-L2) и SEQ ID NO: 8 (CDR-L3), где указанные одна или более аминокислотных замен или комбинаций аминокислотных замен выбраны из:
1. K64S в CDR-H2;
2. K64Q в CDR-H2;
3. Y53F и K64Q в CDR-H2;
4. Y53F и K64S в CDR-H2;
5. Н97Е в CDR-H3;
6. Y98F в CDR-H3;
7. Н97Е и Y98F в CDR-H3;
8. Н97Р и Y98F в CDR-H3;
и возможно замену Т51А в CDR-L2.
2. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые включают CDR-H2 замену K64S.
3. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые включают CDR-H2 замену K64Q.
4. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые включают CDR-H2 замены Y53F и K64Q.
5. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые включают CDR-H3 замену Н97Е.
6. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые включают CDR-H3 замены Н97Р и Y98F.
7. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые включают CDR-H3 замены Н97Е и Y98F.
8. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые включают CDR-H3 замены Н97Е и Y98F и CDR-L2 замену Т51А.
9. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTYTGEPTYAADFSR;
CDR-H3 аминокислотную последовательность YPHYYGSSHWYFDV (SEQ ID NO: 5);
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FTSSLHS (SEQ ID NO: 7); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
10. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTYTGEPTYAADFQR;
CDR-H3 аминокислотную последовательность YPHYYGSSHWYFDV (SEQ ID NO: 5);
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FTSSLHS (SEQ ID NO: 7); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
11. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTFTGEPTYAADFQR;
CDR-H3 аминокислотную последовательность YPHYYGSSHWYFDV (SEQ ID NO: 5);
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FTSSLHS (SEQ ID NO: 7); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
12. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTYTGEPTYAADFKR (SEQ ID NO: 4);
CDR-H3 аминокислотную последовательность YPEYYGSSHWYFDV;
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FTSSLHS (SEQ ID NO: 7); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
13. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTYTGEPTYAADFKR (SEQ ID NO: 4);
CDR-H3 аминокислотную последовательность YPPFYGSSHWYFDV;
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FTSSLHS (SEQ ID NO: 7); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
14. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTYTGEPTYAADFKR (SEQ ID NO: 4);
CDR-H3 аминокислотную последовательность YPEFYGSSHWYFDV;
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FTSSLHS (SEQ ID NO: 7); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
15. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTYTGEPTYAADFSR;
CDR-H3 аминокислотную последовательность YPHYYGSSHWYFDV (SEQ ID NO: 5);
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FASSLHS (SEQ ID NO: 387); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
16. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTYTGEPTYAADFQR;
CDR-H3 аминокислотную последовательность YPHYYGSSHWYFDV (SEQ ID NO: 5);
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FASSLHS (SEQ ID NO: 387); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
17. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTFTGEPTYAADFQR;
CDR-H3 аминокислотную последовательность YPHYYGSSHWYFDV (SEQ ID NO: 5);
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FASSLHS (SEQ ID NO: 387); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
18. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п. 1, которые содержат следующие последовательности:
CDR-H1 аминокислотную последовательность GYTFTNYGMN (SEQ ID NO: 3);
CDR-H2 аминокислотную последовательность WINTYTGEPTYAADFKR (SEQ ID NO: 4);
CDR-H3 аминокислотную последовательность YPEFYGSSHWYFDV;
CDR-L1 аминокислотную последовательность SASQDISNYLN (SEQ ID NO: 6);
CDR-L2 аминокислотную последовательность FASSLHS (SEQ ID NO: 387); и
CDR-L3 аминокислотную последовательность QQYSTVPWT (SEQ ID NO: 8).
19. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, представляющие собой человеческое или гуманизированное антитело или связывающий фрагмент против VEGF человеческого или гуманизированного антитела, соответственно.
20. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, представляющие собой IgG, например IgG1 или IgG2.
21. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1, которые:
(1) включают одну или более чем одну мутацию в Fc области, которые увеличивают активность ADCC (антиген-зависимая клеточная цитотоксичность);
(2) являются нефукозилированными; и/или
(3) включают одну или более чем одну мутацию в Fc области, которые либо увеличивают связывание с FcγR, либо увеличивают связывание с FcRn.
22. Моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1 которые имеют, кроме указанной одной или более чем одной замены, последовательность VH, соответствующую SEQ ID NO: 1, и последовательность VL, соответствующую SEQ ID NO: 2.
23. Конъюгат антитело - лекарственное средство, нейтрализующий активность VEGF, содержащий моноклональное антитело против VEGF или связывающий фрагмент против VEGF по п.1.
24. Фармацевтическая композиция, нейтрализующая активность VEGF, содержащая терапевтически эффективное количество моноклонального антитела против VEGF или связывающего фрагмента против VEGF по любому из пп.1-22 или конъюгата антитело - лекарственное средство по п. 23 и фармацевтически приемлемый носитель.
25. Способ лечения ракового заболевания у пациента-человека, включающий введение этому пациенту терапевтически эффективного количества моноклонального антитела против VEGF или связывающего фрагмента против VEGF по любому из пп.1-22, конъюгата антитело - лекарственное средство по п. 23 или фармацевтической композиции по п.24, возможно, где раковое заболевание представляет собой метастатическую карциному толстой кишки, метастатическую карциному прямой кишки, неплоскоклеточный немелкоклеточный рак легкого или метастатический HER2-негативный рак молочной железы, также возможно, где неплоскоклеточный немелкоклеточный рак легкого является неоперабельным, местнораспространенным, рецидивирующим или метастатическим.
26. Способ лечения возрастной дегенерации желтого пятна или иммунного расстройства у пациента-человека, включающий введение этому пациенту терапевтически эффективного количества моноклонального антитела против VEGF или связывающего фрагмента против VEGF по любому из пп.1-22, конъюгата антитело - лекарственное средство по п.23 или фармацевтической композиции по п.24, возможно, где иммунное расстройство представляет собой ревматоидный артрит или диффузный токсический зоб.
| US2002032315 A1, 14.03.2002MIDELFORT et al., "Context-dependent mutations predominate in an engineered high-affinity single chain antibody fragment", Protein Science, 2006, 15, pp.324-334RU2365382 C2, 27.08.2009 |
Авторы
Даты
2015-11-10—Публикация
2010-06-17—Подача