ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антисмысловому олигомеру, который является причиной пропуска экзона 53 в гене дистрофина человека, и к фармацевтической композиции, включающей этот олигомер.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Мышечная дистрофия Дюшенна (DMD) является самой часто встречающейся формой наследственной прогрессирующей мышечной дистрофии, которая поражает одного на приблизительно 3500 новорожденных мальчиков. Хотя двигательные функции редко отличаются от таковых здоровых людей в раннем детском возрасте и в подростковом периоде, у детей в возрасте приблизительно 4-5 лет отмечается мышечная слабость. Затем мышечная слабость прогрессирует до утраты способности передвигаться к приблизительно 12-летнему возрасту и смерти вследствие сердечной или дыхательной недостаточности в возрасте от двадцати до двадцати девяти лет. DMD является таким серьезным нарушением. В настоящее время нет эффективной терапии для DMD, и разработка нового терапевтического средства была сильно желательной.
Известно, что причиной DMD является мутация в гене дистрофина. Ген дистрофина расположен на хромосоме Х и представляет собой огромный ген, состоящий из 2,2 миллионов пар нуклеотидов ДНК. ДНК транскрибируется в предшественники мРНК, и интроны удаляются в результате сплайсинга с синтезом мРНК, в которой 79 экзонов соединены вместе. Эта мРНК транслируется в 3685 аминокислот с образованием белка дистрофина. Белок дистрофин связывают с сохранением стабильности мембраны мышечных клеток и необходим для усиления мышечных клеток. Ген дистрофина у пациентов с DMD содержит мутацию, и поэтому белок дистрофин, являющийся функциональным в мышечных клетках, редко экспрессируется. Поэтому в теле пациентов с DMD структура мышечных клеток не сохраняется, что приводит к большому поступлению ионов кальция в мышечные клетки. В результате возникает ответная реакция, подобная воспалению, с активацией фиброза, так что мышечные клетки лишь с трудом могут регенерироваться.
Причиной мышечной дистрофии Беккера (BMD) также является мутация в гене дистрофина. Симптомы включают мышечную слабость, которая сопровождается атрофией мышц, но типично представляют собой слабовыраженную и медленную в развитии мышечную слабость по сравнению с DMD. Во многих случаях ее начало имеет место во взрослом состоянии. Различия в клинических симптомах между DMD и BMD, как полагают, основаны на том, нарушает или нет мутация рамку считывания для аминокислот при трансляции мРНК для дистрофина в белок дистрофин (непатентный документ 1). Конкретнее, в случае DMD присутствие мутации сдвигает рамку считывания для аминокислот, так что экспрессия функционального белка дистрофина аннулируется, тогда как в случае BMD белок дистрофин, который функционирует, хотя недостаточно, продуцируется, поскольку рамка считывания для аминокислот сохраняется, хотя часть экзонов делетирована в результате мутации.
Считают, что пропуск экзона будет служить в качестве способа лечения DMD. Этот способ включает модифицирование сплайсинга для восстановления рамки считывания для аминокислот в мРНК дистрофина и индукции экспрессии белка дистрофина, обладающего частично восстановленной функцией (непатентный документ 2). Часть аминокислотной последовательности, которая является мишенью в случае пропуска экзонов, будет утрачена. По этой причине белок дистрофин, экспрессируемый в результате этого лечения, становится короче нормального белка, но поскольку рамка считывания для аминокислот сохраняется, частично сохраняется функция стабилизации мышечных клеток. Поэтому считают, что пропуск экзона будет вести DMD к симптомам, схожим с таковыми BMD, которая является более слабовыраженной. Подход с использованием пропуска экзона прошел испытания на животных, используя мышей и собак, и в настоящее время оценивается в клинических испытаниях на являющихся людьми пациентах с DMD.
Пропуск экзона можно индуцировать посредством связывания антисмысловых нуклеиновых кислот, мишенью которых является или 5', или 3' сайт сплайсинга, или оба сайта, или сайты внутри экзона. Экзон будет включаться в мРНК, только когда оба сайта сплайсинга будут распознаваться комплексом сплайсомой. Таким образом, пропуск экзона можно индуцировать посредством таргетинга сайтов сплайсинга с использованием антисмысловых нуклеиновых кислот. Кроме того, связывание белка SR с экзонным энхансером сплайсинга (ESE), как полагают, необходимо для распознавания экзона механизмом сплайсинга. Соответственно, пропуск экзона можно также индуцировать с помощью таргетинга ESE.
Поскольку мутация гена дистрофина может отличаться в зависимости от пациентов с DMD, необходима разработка антисмысловых нуклеиновых кислот на основе сайта или типа соответствующей генетической мутации. Ранее антисмысловые нуклеиновые кислоты, которые индуцируют пропуск экзона, для всех 79 экзонов были созданы Steve Wilton и др., University of Western Australia (непатентный документ 3), а антисмысловые нуклеиновые кислоты, которые индуцируют пропуск экзона, для 39 экзонов были созданы Annemieke Aartsma-Rus. и др., Нидерланды (непатентный документ 4).
Считается, что лечение приблизительно 8% всех пациентов с DMD может осуществляться с помощью пропуска 53-го экзона (в дальнейшем называемого «экзоном 53»). На протяжении последних лет множество исследовательских организаций сообщили об исследованиях, в которых экзон 53 в гене дистрофина был таргетирован для пропуска экзона (патентные документы 1-4; непатентный документ 5). Однако метод пропуска экзона 53 с высокой эффективностью все еще не создан.
Патентный документ 1: публикация международной заявки WO 2006/000057
Патентный документ 2: публикация международной заявки WO 2004/048570
Патентный документ 3: US 2010/0168212
Патентный документ 4: публикация международной заявки WO 2010/048586
Непатентный документ 1: Monaco A.P. et al., Genomics 1988; 2: p. 90-95
Непатентный документ 2: Matsuo M., Brain Dev. 1996; 18: p. 167-172
Непатентный документ 3: Wilton S.D. et al., Molecular Therapy 2007: 15: p. 1288-1296
Непатентный документ 4: Annemieke Aartsma-Rus et al., (2002) Neuromuscular Disorders 12: S71-S77
Непатентный документ 5: Linda J. Popplewell et al., (2010) Neuromuscular Disorder, vol. 20, no 2, p. 102-110
ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
При вышеизложенных обстоятельствах были желательны антисмысловые олигонуклеотиды с сильной индукцией пропуска экзона 53 в гене дистрофина и терапевтические средства против мышечной дистрофии, включающие олигомеры.
В результате тщательных исследований структуры гена дистрофина авторы настоящего изобретения установили, что пропуск экзона 53 можно индуцировать с высокой эффективностью посредством таргетинга последовательности, состоящей из нуклеотидов с 32-го по 56-й с 5'-конца экзона 53 в предшественнике мРНК (в дальнейшем называемом «пре-МРНК»), в гене дистрофина, с помощью антисмысловых олигомеров. На основе этого открытия авторы настоящего изобретения осуществили настоящее изобретение.
Т.е. настоящим изобретением является следующее.
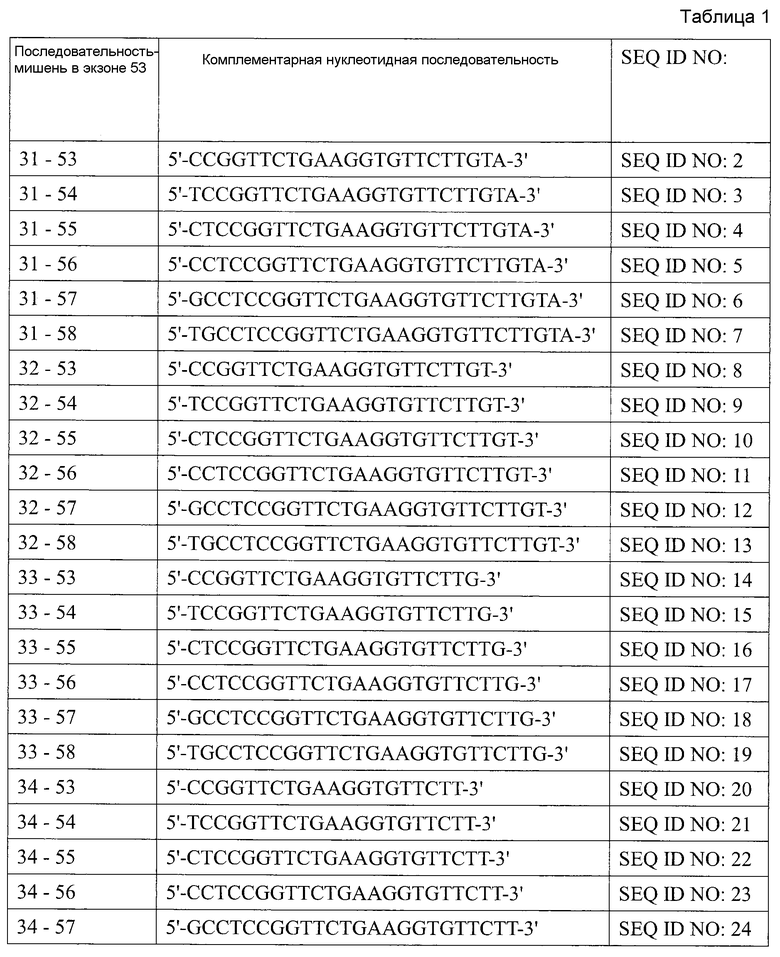
[1] Антисмысловой олигомер, который является причиной пропуска 53-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, комплементарной любой из последовательностей, состоящей из нуклеотидов с 31-го по 53-й; с 31-го по 54-й, с 31-го по 55-й; с 31-го по 56-й; с 31-го по 57-й; с 31-го по 58-й; с 32-го по 53-й; с 32-го по 54-й; с 32-го по 55-й; с 32-го по 56-й; с 32-го по 57-й; с 32-го по 58-й; с 33-го по 53-й; с 33-го по 54-й; с 33-го по 55-й; с 33-го по 56-й; с 33-го по 57-й; с 33-го по 58-й; с 34-го по 53-й; с 34-го по 54-й; с 34-го по 55-й; с 34-го по 56-й; с 34-го по 57-й; с 34-го по 58-й; с 35-го по 53-й; с 35-го по 54-й; с 35-го по 55-й; с 35-го по 56-й; с 35-го по 57-й; с 35-го по 58-й; с 36-го по 53-й; с 36-го по 54-й; с 36-го по 55-й; с 36-го по 56-й; с 36-го по 57-й или с 36-го по 58-й с 5'-конца 53-го экзона в гене дистрофина человека.
[2] Антисмысловой олигомер в соответствии с [1] выше, который представляет собой олигонуклеотид.
[3] Антисмысловой олигомер в соответствии с [2] выше, в случае которого сахарная составляющая и/или область соединения через фосфатную группу по крайней мере одного нуклеотида, составляющего олигонуклеотид, является модифицированной.
[4] Антисмысловой олигомер в соответствии с [3] выше, в случае которого сахарной составляющей по крайней мере одного нуклеотида, составляющего олигонуклеотид, является рибоза, в которой группа 2'-ОН заменена любой группой, выбираемой из группы, состоящей из OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br и I (где R представляет собой алкил или арил, а R' представляет собой алкилен).
[5] Антисмысловой олигомер в соответствии с [3] или [4] выше, в случае которого областью соединения через фосфатную группу по крайней мере одного нуклеотида, составляющего олигонуклеотид, является любая область, выбираемая из группы, состоящей из фосфоротиоатной связи, фосфородитиоатной связи, алкилфосфонатной связи, фосфорамидатной связи и боранофосфатной связи.
[6] Антисмысловой олигомер в соответствии с [1] выше, который представляет собой морфолино олигомер.
[7] Антисмысловой олигомер в соответствии с [6] выше, который представляет собой морфолино-фосфородиамидатный олигомер.
[8] Антисмысловой олигомер в соответствии с любым из [1]-[7] выше, в случае которого 5'-концом является любая из групп с химическими формулами [1]-[3] ниже:
[9] Антисмысловой олигомер в соответствии с любым из [1]-[8] выше, состоящий из нуклеотидной последовательности, комплементарной последовательности, состоящей из нуклеотидов с 32-го по 56-й или с 36-го по 56-й с 5'-конца 53-го экзона в гене дистрофина человека.
[10] Антисмысловой олигомер в соответствии с любым из [1]-[8] выше, состоящий из нуклеотидной последовательности, представленной любой последовательностью, выбираемой из группы, состоящей из SEQ ID NO: 2-37.
[11] Антисмысловой олигомер в соответствии с любым из [1]-[8] выше, состоящий из нуклеотидной последовательности, представленной любой последовательностью, выбираемой из группы, состоящей из SEQ ID NO: 11, 17, 23, 29 и 35.
[12] Антисмысловой олигомер в соответствии с любым из [1]-[8] выше, состоящий из нуклеотидной последовательности, представленной SEQ ID NO: 11 или 35.
[13] Фармацевтическая композиция для лечения мышечной дистрофии, включающая в качестве активного ингредиента антисмысловой олигомер в соответствии с любым из [1]-[12] выше, или его фармацевтически приемлемую соль или гидрат.
Антисмысловой олигомер настоящего изобретения может индуцировать пропуск 53 в гене дистрофина человека с высокой эффективностью. Кроме того, симптомы мышечной дистрофии Дюшенна можно эффективно облегчить посредством введения фармацевтической композиции настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в линии клеток рабдомиосаркомы (клеток RD) человека.
На фиг. 2 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в происходящие из нормальных тканей человека фибробласты (клетки TIG-119) для индукции дифференциации в мышечные клетки.
На фиг. 3 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в происходящие от являющегося человеком пациента с DMD фибробласты (клетки 5017) для индукции дифференциации в мышечные клетки.
На фиг. 4 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 45-52) для индукции дифференциации в мышечные клетки.
На фиг. 5 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 48-52) для индукции дифференциации в мышечные клетки.
На фиг. 6 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 48-52) для индукции дифференциации в мышечные клетки.
На фиг. 7 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 45-52 или делецией экзонов 48-52) для индукции дифференциации в мышечные клетки.
На фиг. 8 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках в случае, когда ген myoD человека вводят в фибробласты от являющегося человеком пациента с DMD (с делецией экзонов 45-52) для индукции дифференциации в мышечные клетки.
На фиг. 9 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 10 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 11 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 12 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 13 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 14 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 15 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 16 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 17 демонстрируется эффективность пропуска экзона 53 (2'-OMe-S-РНК) в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека.
На фиг. 18 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека при соответствующих концентрациях олигомеров.
На фиг. 19 демонстрируется эффективность пропуска экзона 53 в гене дистрофина человека в клетках рабдомиосаркомы (клетках RD) человека при соответствующих концентрациях олигомеров.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже настоящее изобретение описывается подробно. Описываемые ниже варианты осуществления, как предполагается, представлены только в качестве примера для описания настоящего изобретения, а не ограничения лишь следующими вариантами осуществления. Настоящее изобретение может быть осуществлено различными способами без отступа от сущности настоящего изобретения.
Все публикации, опубликованные заявки на патенты, патенты и другие патентные документы, приведенные в описании настоящего изобретения, включены сюда посредством ссылки в их полном объеме. Описание настоящего изобретения, таким образом, включает посредством ссылки содержание описания изобретения и чертежей в заявке на патент Японии (№ 2010-196032), поданной 1 сентября 2011, на основании которой испрашивается приоритет.
1. Антисмысловой олигомер
Настоящим изобретением обеспечивается антисмысловой олигомер (в дальнейшем называемый «олигомером» настоящего изобретения»), который является причиной пропуска 53-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, комплементарной любой из последовательностей (в дальнейшем также называемых «последовательностями-мишенями»), состоящей из нуклеотидов с 31-го по 53-й; с 31-го по 54-й, с 31-го по 55-й; с 31-го по 56-й; с 31-го по 57-й; с 31-го по 58-й; с 32-го по 53-й; с 32-го по 54-й; с 32-го по 55-й; с 32-го по 56-й; с 32-го по 57-й; с 32-го по 58-й; с 33-го по 53-й; с 33-го по 54-й; с 33-го по 55-й; с 33-го по 56-й; с 33-го по 57-й; с 33-го по 58-й; с 34-го по 53-й; с 34-го по 54-й; с 34-го по 55-й; с 34-го по 56-й; с 34-го по 57-й; с 34-го по 58-й; с 35-го по 53-й; с 35-го по 54-й; с 35-го по 55-й; с 35-го по 56-й; с 35-го по 57-й; с 35-го по 58-й; с 36-го по 53-й; с 36-го по 54-й; с 36-го по 55-й; с 36-го по 56-й; с 36-го по 57-й или с 36-го по 58-й с 5'-конца 53-го экзона в гене дистрофина человека.
Экзон 53 в гене дистрофина человека
В настоящем изобретении термин «ген», как предполагается, означает ген в геноме, а также включает кДНК, предшественник мРНК и мРНК. Предпочтительно геном является предшественником мРНК, т.е. пре-мРНК.
В геноме человека ген дистрофина человека располагается в локусе Xp21.2. Ген дистрофина человека имеет размер, равный 3,0×106 п.о. и является самым большим геном среди известных генов человека. Однако кодирующие области гена дистрофина человека, рассредоточенные в виде 79 экзонов на всем протяжении гена дистрофина человека, составляют лишь 14 т.п.о. (Roberts, RG. et al., Genomics, 16: 536-538 (1993)). Пре-мРНК, которая является транскриптом гена дистрофина человека, подвергается сплайсингу с образованием зрелой мРНК размером 14 т.о. Нуклеотидная последовательность гена дистрофина человека дикого типа известна (№ доступа в GenBank - NM_004006).
Нуклеотидная последовательность экзона 53 в гене дистрофина человека дикого типа представлена SEQ ID NO: 1.
Олигомер настоящего изобретения предназначен для вызова пропуска экзона 53 в гене дистрофина человека, с модифицированием тем самым белка, кодируемого геном дистрофина типа DMD, в белок дистрофина типа BMD. Соответственно, экзон 53 в гене дистрофина, который является мишенью пропуска экзона с помощью олигомера настоящего изобретения, включает как дикий тип, так и мутантные типы.
В частности, мутанты экзона 53 гена дистрофина человека включают полинуклеотиды, определенные в (а) или (b) ниже.
(а) Полинуклеотид, который гибридизуется в жестких условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO: 1; и
(b) Полинуклеотид, состоящий из нуклеотидной последовательности, идентичной на по крайней мере 90% нуклеотидной последовательности SEQ ID NO: 1.
Используемый здесь термин «полинуклеотид», как предполагается, означает ДНК или РНК.
Как здесь используется, «полинуклеотид, который гибридизуется в жестких условиях», относится, например, к полинуклеотиду, получаемому при гибридизации колоний, гибридизации бляшек, гибридизации по Саузерну или т.п., используя в качестве зонда весь полинуклеотид, состоящий из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, например, SEQ ID NO: 1, или его часть. Метод гибридизации, который может использоваться, включает методы, описанные, например, в “Sambrook & Russell, Molecular Cloning: A Laboratory Manual Vol. 3, Cold Spring Harbor, Laboratory Press 2001”, “Ausubel, Current Protocols in Molecular Biology, John Wiley & Sons 1987-1997” и т.д.
Используемый здесь термин «комплементарная нуклеотидная последовательность» не ограничивается только нуклеотидными последовательностями, которые образуют пары Уотсона-Крика с нуклеотидными последовательностями-мишенями, но, как предполагается, также включает нуклеотидные последовательности, которые образуют пары оснований неоднозначного соответствия. Используемый здесь термин «пара Уотсона-Крика» относится к паре нуклеиновых оснований, в которой водородные связи образуются между аденином и тимином, аденином и урацилом или гуанином и цитозином, а термин «пара оснований неоднозначного соответствия» относится к паре нуклеиновых оснований, в которой водородные связи образуются между гуанином и урацилом, инозином и урацилом, инозином и аденином или инозином и цитозином. Используемый здесь термин «комплементарная нуклеотидная последовательность» не только относится к нуклеотидной последовательности, комплементарной на 100% нуклеотидной последовательности-мишени, но также относится к комплементарной нуклеотидной последовательности, которая может содержать, например, 1-3, 1 или 2 или один нуклеотид, не комплементарный нуклеотидной последовательности-мишени.
Как здесь используются, «жесткие условия» могут быть любыми из условий «низкой жесткости», условий «средней жесткости» и чрезмерно жестких условий. Условиями «низкой жесткости» являются, например, 5х SSC, 5x раствор Денхардта, 0,5% SDS, 50% формамида при 32°С. Условиями «средней жесткости» являются, например, 5х SSC, 5x раствор Денхардта, 0,5% SDS, 50% формамида при 42οС или 5х SSC, 1% SDS, 50 мМ Трис-HCl (pH 7,5), 50% формамида при 42°С. Чрезмерно жесткими условиями являются, например, 5х SSC, 5x раствор Денхардта, 0,5% SDS, 50% формамида при 50°С или 0,2х SSC, 1% SDS при 65°С. В этих условиях ожидается, что полинуклеотиды с большей гомологией будут с успехом получены при более высоких температурах, хотя в жесткость гибридизации вовлечены разнообразные факторы, включающие температуру, концентрацию зонда, длину зонда, ионную силу, время, концентрацию соли и другие, и квалифицированные в данной области техники специалисты могут соответственно выбрать эти факторы для достижения соответствующей жесткости.
В случае использования для гибридизации имеющихся в продаже наборов может использоваться, например, Alkphos Direct Labeling and Detection System (GE Healthcare). В этом случае в соответствии с приложенным протоколом после культивирования с меченым зондом в течение ночи мембрану отмывают основным буфером для отмывки, содержащим 0,1% (в отношении веса к объему) SDS при 55°С с выявлением тем самым гибридизованных полинуклеотидов. Альтернативно, в случае создания зонда на основе всей нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO: 1, или ее части гибридизацию можно выявить с помощью набора DIG Nucleic Acid Detection Kit (Roche Diagnostics), когда зонд метят дигоксигенином (DIG), используя имеющийся в продаже реагент (например, PCR Labeling Mix (Roche Diagnostics), и т.д.).
Помимо полинуклеотидов, описанных выше, другие полинуклеотиды, которые могут гибридизоваться, включают полинуклеотиды, идентичные на 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более, 99,1% или более, 99,2% или более, 99,3% или более, 99,4% или более, 99,5% или более, 99,6% или более, 99,7% или более, 99,8% или более, или 99,9% или более полинуклеотиду SEQ ID NO: 1, в соответствии с расчетом с использованием программ для поиска гомологии BLAST, используя параметры по умолчанию.
Идентичность между нуклеотидными последовательностями можно определить, используя алгоритм BLAST (средство поиска основного локального совмещения) Karlin и Altschul (Proc. Natl. Acad. Sci. USA 872264-2268, 1990; Proc. Natl. Acad. Sci. USA 90: 5873, 1993). Были разработаны программы, названные BLASTN и BLASTX, на основе алгоритма BLAST (Altschul SF et al., J. Mol. Biol. 215: 403, 1990). В случае установления нуклеотидной последовательности, используя BLASTX, параметрами являются, например, оценка = 100 и длина слова = 12. В случае использования программ BLAST и BLAST с использованием пропусков используются параметры по умолчанию для каждой программы.
Примеры нуклеотидных последовательностей, комплементарных последовательностям, состоящим из нуклеотидов с 31-го по 53-й; с 31-го по 54-й, с 31-го по 55-й; с 31-го по 56-й; с 31-го по 57-й; с 31-го по 58-й; с 32-го по 53-й; с 32-го по 54-й; с 32-го по 55-й; с 32-го по 56-й; с 32-го по 57-й; с 32-го по 58-й; с 33-го по 53-й; с 33-го по 54-й; с 33-го по 55-й; с 33-го по 56-й; с 33-го по 57-й; с 33-го по 58-й; с 34-го по 53-й; с 34-го по 54-й; с 34-го по 55-й; с 34-го по 56-й; с 34-го по 57-й; с 34-го по 58-й; с 35-го по 53-й; с 35-го по 54-й; с 35-го по 55-й; с 35-го по 56-й; с 35-го по 57-й; с 35-го по 58-й; с 36-го по 53-й; с 36-го по 54-й; с 36-го по 55-й; с 36-го по 56-й; с 36-го по 57-й или с 36-го по 58-й с 5'-конца экзона 53.

Предпочтительно, когда олигомер настоящего изобретения состоит из нуклеотидной последовательности, комплементарной любой из последовательностей, состоящей из нуклеотидов с 32-го по 56-й, с 33-го по 56-й, с 34-го по 56-й, с 35-го по 56-й или с 36-го по 56-й (например, SEQ ID NO: 11, SEQ ID NO: 17, SEQ ID NO: 23, SEQ ID NO: 29 или SEQ ID NO: 35) с 5'-конца 53-го экзона в гене дистрофина человека.
Предпочтительно олигомер настоящего изобретения состоит из нуклеотидной последовательности, комплементарной любой из последовательностей, состоящей из нуклеотидов с 32-го по 56-й или с 36-го по 56-й (например, SEQ ID NO: 11 или SEQ ID NO: 35) с 5'-конца 53-го экзона в гене дистрофина человека.
Термин «является причиной пропуска 53-го экзона в гене дистрофина человека», как предполагается, означает, что в результате связывания олигомера настоящего изобретения с сайтом, соответствующим экзону 53 транскрипта (например, пре-мРНК) с гена дистрофина человека, например, нуклеотидная последовательность, соответствующая 5'-концу экзона 54, соединяется с 3'-края нуклеотидной последовательности, соответствующей 3'-концу экзона 51, у пациентов с DMD с делецией экзона 52, когда транскрипт подвергается сплайсингу, что приводит тем самым к образованию зрелой мРНК, в которой нет сдвига рамки считывания.
Соответственно, не требуется, чтобы олигомер настоящего изобретения имел нуклеотидную последовательность, комплементарную на 100% последовательности-мишени, когда речь идет об олигомере, который вызывает пропуск экзона 53 в гене дистрофина человека. Олигомер настоящего изобретения может включать, например, 1-3, 1 или 2 или один нуклеотид, не комплементарный последовательности-мишени.
Здесь «связывание», описанное выше, как предполагается, означает, что когда олигомер настоящего изобретения смешивают с транкриптом с гена дистрофина человека, оба гибридизуются в физиологических условиях с образованием двухцепочечной нуклеиновой кислоты. Термин «в физиологических условиях» относится к условиям, заданным для воспроизводства in vivo окружения по показателю рН, состава солей и температуры. Условиями являются, например, 25-40°С, предпочтительно 37°С, рН 5-8, предпочтительно рН 7,4 и 150 мМ концентрация хлорида натрия.
Вызывается или нет пропуск экзона 53 в гене дистрофина человека, можно подтвердить посредством введения олигомера настоящего изобретения в клетку, экспрессирующую дистрофин, (например, клетки рабдомиосаркомы), амплифицирования района, окружающего экзон 53 мРНК с гена дистрофина человека, на основе тотальной РНК из клетки, экспрессирующей дистрофин, с помощью ОТ-ПЦР и выполнения «вложенной» ПЦР или анализа последовательности на амплифицированном с помощью ПЦР продукте.
Эффективность пропуска можно определить следующим образом. мРНК гена дистрофина человека выделяют из исследуемых клеток; в мРНК измеряют уровень «А» полинуклеотидной полосы в случае, когда экзон 53 пропущен, и уровень «В» полинуклеотидной полосы в случае, когда экзон 53 не пропущен. Используя эти величины измерений «А» и «В», эффективность рассчитывают согласно следующему уравнению:
Эффективность пропуска (%) = A/(A+B)×100
Олигомер настоящего изобретения включает, например, олигонуклеотид, морфолино олигомер или пептидо-нуклеиновую кислоту (ПНК), имеющий длину от 18 до 28 нуклеотидов. Предпочтительно длина составляет от 21 до 25 нуклеотидов, и предпочтительными являются морфолино олигомеры.
Описанный выше олигонуклеотид (в дальнейшем называемый «олигонуклеотидом настоящего изобретения») представляет собой олигомер настоящего изобретения, состоящий из нуклеотидов в качестве составных единиц. Такие нуклеотиды могут быть любыми из рибонуклеотидов, дезоксирибонуклеотидов и модифицированных нуклеотидов.
Модифицированный нуклеотид относится к нуклеотиду, имеющему полностью и частично модифицированные нуклеиновые основания, сахарные составляющие и/или области соединения через фосфатную группу, который является рибонуклеотидом или дезоксирибонуклеотидом.
Нуклеиновые основания включают, например, аденин, гуанин, гипоксантин, цитозин, тимин, урацил и их модифицированные основания. Примеры таких модифицированных нуклеиновых оснований включают, но без ограничения, псевдоурацил, 3-метилурацил, дигидроурацил, 5-алкилцитозины (например, 5-метилцитозин), 5-алкилурацилы (например, 5-этилурацил), 5-галогенурацилы (5-бромурацил), 6-азапиримидин, 6-алкилпиримидины (6-метилурацил), 2-тиоурацил, 4-тиоурацил, 4-ацетилцитозин, 5-(карбоксигидроксиметил)урацил, 5'-карбоксиметиламинометил-2-тиоурацил, 5'-карбоксиметиламинометилурацил, 1-метиладенин, 1-метилгипоксантин, 2,2-диметилгуанин, 3-метилцитозин, 2-метиладенин, 2-метилгуанин, N6-метиладенин, 7-метилгуанин, 5-метоксиаминометил-2-тиоурацил, 5-метиламинометилурацил, 5-метилкарбонилметилурацил, 5-метилоксиурацил, 5-метил-2-тиоурацил, 2-метилтио-N6-изопентениладенин, урацил-5-оксиуксусную кислоту, 2-тиоцитозин, пурин, 2,6-диаминопурин, 2-аминопурин, изогуанин, индол, имидазол, ксантин и т.д.
Модификация сахарной составляющей может включать, например, модификации в 2'-положении рибозы и модификации других положений сахара. Модификация в 2'-положении рибозы включает замену 2'-ОН рибозы на OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br и I, где R представляет собой алкил или арил, а R' представляет собой алкилен.
Модификация в других положениях сахара включает, например, замену О в 4'-положении рибозы или дезоксирибозы на S, образование мостика между 2' и 4'-положениями сахара, например, LNA (закрытой нуклеиновой кислоты) или ENA (нуклеиновых кислот с 2'-О,4'-С-этиленовым мостиком), но без ограничения ими.
Модификация области соединения через фосфатную группу включает, например, модификацию с заменой фосфодиэфирной связи на фосфоротиоатную связь, фосфородитиоатную связь, алкилфосфонатную связь, фосфорамидатную связь или боранофосфатную связь (Enya et al., Bioorganic & Medicinal Chemistry, 2008, 18, 9154-9160) (см., например, отечественные повторные публикации в Японии РСТ-заявок с № 2006/129594 и 2006/038608).
Предпочтительно алкилом является неразветвленный или разветвленный алкил, содержащий от 1 до 6 атомов углерода. Конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, трет-пентил, н-гексил и изогексил. Алкил может необязательно быть замещенным. Примерами таких заместителей являются галоген, алкокси, циано и нитро. Алкил может быть замещен 1-3 заместителями.
Предпочтительно циклоалкилом является циклоалкил, содержащий 5-12 атомов углерода. Конкретные примеры включают циклопентил, циклогексил, циклогептил, циклооктил, циклодецил и циклододецил.
Галоген включает фтор, хлор, бром и йод.
Алкокси представляет собой неразветвленный или разветвленный алкокси, содержащий 1-6 атомов углерода, такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси, н-гексилокси, изогексилокси и т.д. Среди прочего, алкокси, содержащий 1-3 атомов углерода, является предпочтительным.
Предпочтительно арилом является арил, содержащий 6-10 атомов углерода. Конкретные примеры включают фенил, α-нафтил и β-нафтил. Среди прочего, фенил является предпочтительным. Арил может быть необязательно замещенным. Примерами таких заместителей являются алкил, галоген, алкокси, циано и нитро. Арил может быть замещен одним-тремя такими заместителями.
Предпочтительно алкиленом является неразветвленный или разветвленный алкилен, содержащий от 1 до 6 атомов углерода. Конкретные примеры включают метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, 2-(этил)триметилен и 1-(метил)тетраметилен.
Ацил включает неразветвленный или разветвленный алканоил или ароил. Примеры алканоила включают формил, ацетил, 2-метилацетил, 2,2-диметилацетил, пропионил, бутирил, изобутирил, пентаноил, 2,2-диметилпропионил, гексаноил и т.д. Примеры ароила включают бензоил, толуоил и нафтоил. Ароил может быть необязательно замещенным в замещаемых положениях и может быть замещен алкилом(ами).
Предпочтительно олигонуклеотидом настоящего изобретения является олигомер настоящего изобретения, содержащий составную единицу, представляемую общей формулой ниже, причем группа -ОН в положении 2' рибозы замещена метокси, а областью соединения через фосфатную группу является фосфоротиоатная связь.
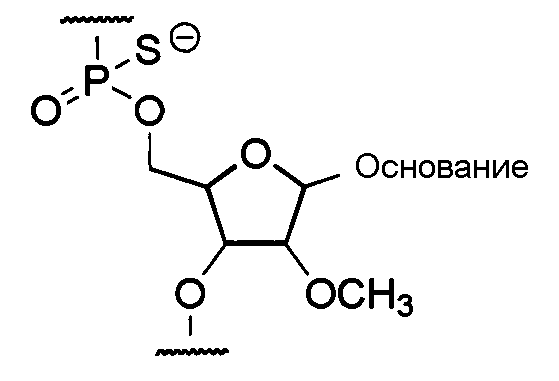
где основание представляет собой нуклеиновое основание.
Олигонуклеотид настоящего изобретения можно без труда синтезировать, используя различные автоматизированные синтезаторы (например, AKTA oligopilot plus 10/100 (GE Healthcare). В альтернативном случае синтез можно также поручить сторонней организации (например, Promega Inc. или Takara Co.) и т.д.
Морфолино олигомером настоящего изобретения является олигомер настоящего изобретения, содержащий составную единицу, представляемую общей формулой ниже:
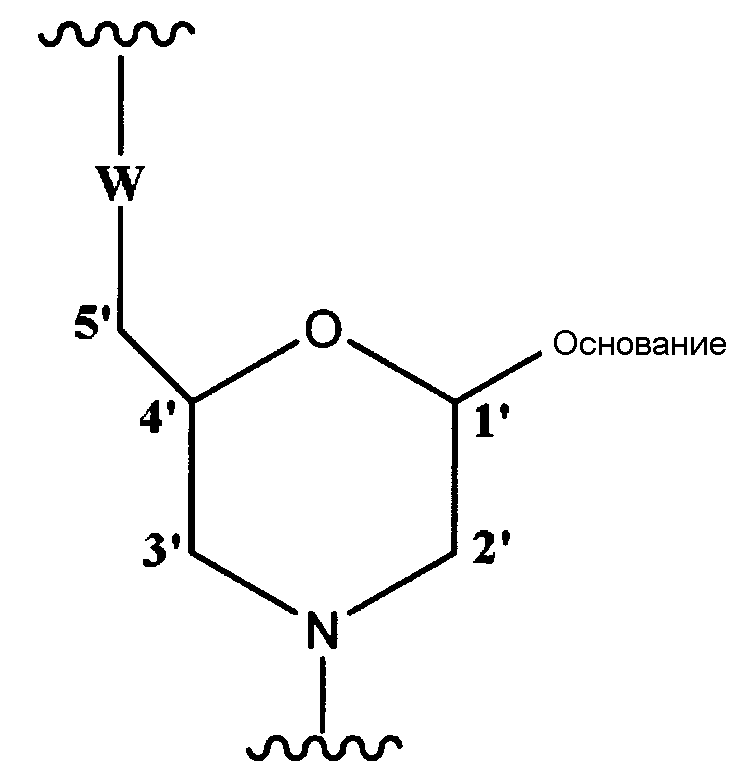
где основание имеет то же определенное выше значение, и
W представляет собой группу, представленную любой из следующих групп:
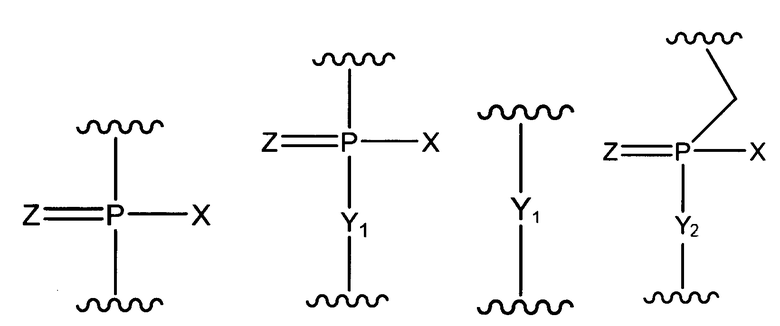
где X представляет собой -CH2R1, -O-CH2R1, -S-CH2R1, -NR2R3 или F;
R1 представляет собой Н или алкил;
R2 и R3, которые могут быть одинаковыми или различными, представляют собой каждый Н, алкил, циклоалкил или арил;
Y1 представляет собой O, S, СН2 или NR1;
Y2 представляет собой O, S или NR1;
Z представляет собой O или S.
Предпочтительно морфолино олигомером является олигомер, содержащий составную единицу, представляемую общей формулой ниже, (морфолино-фосфородиамидатный олигомер (в дальнейшем называемый «РМО»)).
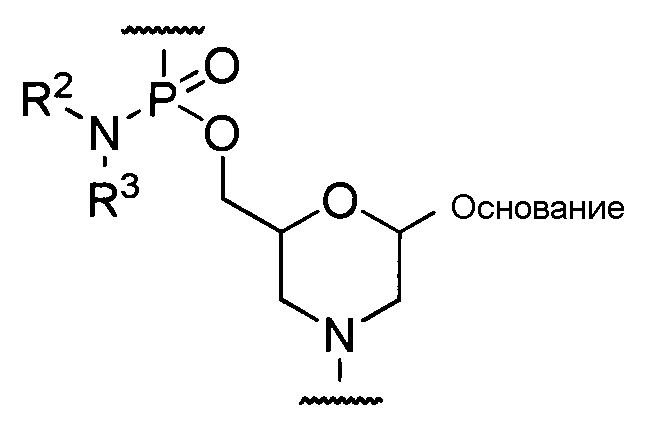
где основание, R2 и R3 имеют то же определенное выше значение.
Морфолино олигомер можно получить в соответствии, например, с WO 1991/009033 или WO 2009/064471. В частности, РМО можно получить с помощью процедуры, описанной в WO 2009/064471, или получить с помощью представленного ниже процесса.
Способ получения РМО
Вариантом РМО является, например, соединение, представляемое общей формулой (I) ниже, (в дальнейшем РМО (I)).
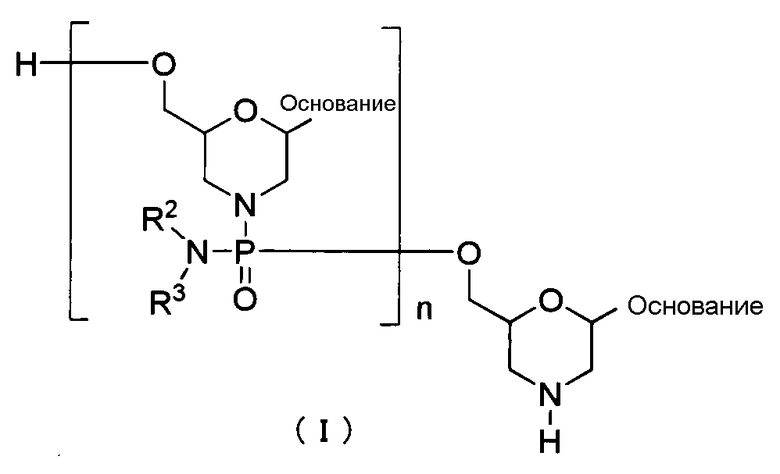
где основание, R2 и R3 имеют то же определенное выше значение, а
n является заданным целым числом от 1 до 99, предпочтительно заданным целым числом от 18 до 28.
РМО (I) можно получить в соответствии с известным способом, например можно получить посредством выполнения следующих стадий процедур.
Соединения и реагенты, используемые в стадиях ниже, особо не ограничиваются при условии, что они обычно используются для получения РМО.
Также все следующие стадии можно выполнить с использованием жидкофазного способа или твердофазного способа (используя руководства и имеющиеся в продаже автоматизированные устройства для твердофазного синтеза. При получении РМО твердофазным способом желательно использовать автоматизированный синтезатор ввиду простых технических требований и точного синтеза.
(1) Стадия А:
Осуществляют реакцию соединения, представляемого общей формулой (II) ниже (в дальнейшем называемого соединением (II)) с кислотой для приготовления соединения, представляемого общей формулой (III) ниже (в дальнейшем называемого соединением (III)):
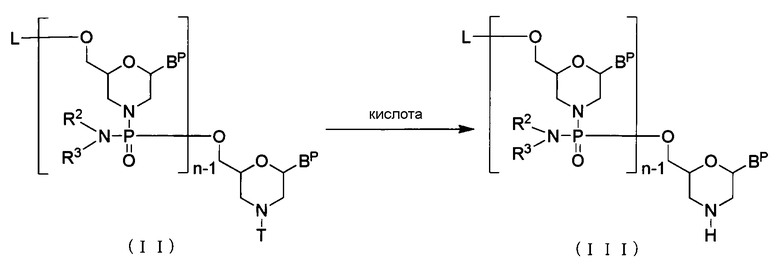
где n, R2 и R3 имеют то же определенное выше значение, а
каждый BP независимо представляет собой нуклеиновое основание, которое может быть необязательно защищено;
Т представляет собой тритил, монометокситритил или диметокситритил; и
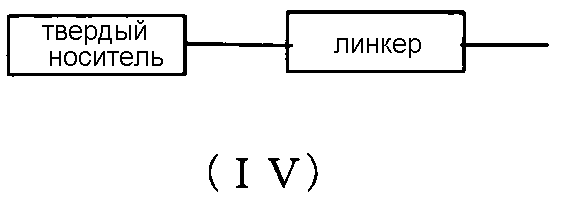
L представляет собой водород, ацил или группу, представляемую общей формулой (IV) ниже, (в дальнейшем называемую группой (IV).
В случае BP «нуклеиновое основание» включает то же нуклеиновое основание, что в случае «основания» при условии, что аминогруппу или гидроксильную группу в нуклеиновом основании, представленном BP, можно защитить.
Такая защитная группа для аминогруппы особо не ограничивается при условии, что она используется в качестве защитной группы для нуклеиновых кислот. Конкретные примеры включают бензоил, 4-метоксибензоил, ацетил, пропионил, бутирил, изобутирил, фенилацетил, феноксиацетил, 4-трет-бутилфеноксиацетил, 4-изопропилфеноксиацетил и (диметиламино)метилен. Конкретные примеры защитной группы для гидроксильной группы включают 2-цианоэтил, 4-нитрофенетил, фенилсульфонилэтил, метилсульфонилэтил и триметилсилилэтил, и фенил, который может быть замещен (1-5)электроноакцепторной группой в оптимальных замещаемых положениях, дифенилкарбамоил, диметилкарбамоил, диэтилкарбамоил, метилфенилкарбамоил, 1-пиролидинилкарбамоил, морфолинокарбамоил, 4-(трет-бутилкарбокси)бензил, 4-[(диметиламино)карбокси]бензил и 4-(фенилкарбокси)бензил (см., например, WO 2009/064472).
«Твердый носитель» особо не ограничивается при условии, что это носитель, используемый для твердофазной реакции синтеза нуклеиновых кислот. Желательно наличие у носителя следующих свойств: например, (i) он труднорастворим в реагентах, которые могут использоваться для синтеза морфолино производных нуклеиновых кислот, (например, дихлорметане, ацетонитриле, тетразоле, N-метилимидазоле, пиридине, уксусном ангидриде, лутидине, трифторуксусной кислоте); (ii) он является химически устойчивым к реагентам, используемым для синтеза морфолино производных нуклеиновых кислот; (iii) его можно химически модифицировать; (iv) его можно нагрузить желаемыми морфолино производными нуклеиновых кислот; (v) он обладает прочностью, достаточной для выдерживания высокого давления на протяжении всех обработок; и (vi) он характеризуется постоянным диапазоном диаметра частиц и их распределением. В частности, он включает поддающийся разбуханию полистирол (например, аминометилполистирольную смолу, сшитую 1% дибензилбензолом (200-400 меш) (2,4-3,0 ммоль/г) (производства Tokyo Chemical Industry), аминометилированную полистирольную смолу ·HCl [1% дибензилбензола, 100-200 меш] (производства Peptide Institute, Inc.)), не поддающийся разбуханию полистирол (например, основной носитель (производства GE Healthcare), полистирол с присоединение ПЭГ-цепи(ей) (например, NH2-ПЭГ-смолу (производства Watanabe Chemical Co), смолу TentaGel), стекло с контролируемым размером пор (стекло с контролируемым размером пор; CPG) (производства, например, CPG), оксалильное стекло с контролируемым размером пор (см., например, Alul et al., Nucleic Acid Research, Vol. 19, 1527 (1991)), носитель TentaGel-аминополиэтиленгликоль-дериватизированный носитель (например, Wright et al., см., Tetrahedron Letters, Vol. 34, 3373 (1993) и сополимер Poros-полистирол/дивинилбензол.
«Линкер», который может использоваться, является известным линкером, обычно используемым для соединения нуклеиновых кислот или морфолино производных нуклеиновых кислот. Примеры включают 3-аминопропил, сукцинил, 2,2'-диэтанолсульфонил и (длинноцепочечный алкил)амино (LCAA).
Эту стадию можно выполнить посредством осуществления реакции соединения (II) с кислотой.
«Кислота», которую можно использовать на этой стадии, включает, например, трифторуксусную кислоту, дихлоруксусную кислоту и трихлоруксусную кислоту. Используемая кислота находится соответственно в диапазоне, например, от 0,1 моль-эквивалентов до 1000 моль-эквивалентов, если исходить из 1 моль соединения (II), предпочтительно в диапазоне от 1 моль-эквивалента до 100 моль-эквивалентов, если исходить из 1 моль соединения (II).
В сочетании с описанной выше кислотой может использоваться органический амин. Органический амин особо не ограничивается и включает, например, триэтиламин. Количество используемого органического амина находится соответственно в диапазоне, например, от 0,01 моль-эквивалентов до 10 моль-эквивалентов и предпочтительно в диапазоне от 0,1 моль-эквивалентов до 2 моль-эквивалентов, если исходить из 1 моль кислоты.
В случае использования на этой стадии соли или смеси кислоты и органического амина соль или смесь включает, например, соль или смесь трифторуксусной кислоты и триэтиламина, а конкретнее, смесь 1 эквивалента триэтиламина и 2 эквивалентов трифторуксусной кислоты.
Кислота, которая может использоваться на этой стадии, может также использоваться в форме разведения соответствующим растворителем в концентрации, составляющей от 0,1% до 30%. Растворитель особо не ограничивается, когда речь идет об инертном по отношении к реакции растворителе, и включает, например, дихлорметан, ацетонитрил, спирт (этанол, изопропанол, трифторэтанол и т.д.), воду или их смесь.
Предпочтительно в описанной выше реакции ее температура находится в диапазоне, например, от 10°С до 50°С, более предпочтительно в диапазоне от 20°С до 40°С и наиболее предпочтительно в диапазоне от 25°С до 35°С.
Время реакции может варьировать в зависимости от вида используемой кислоты и температуры реакции и находится соответственно в диапазоне от 0,1 минуты до 24 часов вообще, а предпочтительно в диапазоне от 1 минуты до 5 часов.
После завершения этой стадии можно добавить основание, в случае необходимости, для нейтрализации кислоты, оставшейся в системе. «Основание» особо не ограничивается и включает, например, диизопропиламин. Основание может также использоваться в форме разведения соответствующим растворителем в концентрации, составляющей от 0,1% (в объемном отношении) до 30% (в объемном отношении).
Растворитель, используемый на этой стадии, особо не ограничивается, когда речь идет об инертном по отношении к реакции растворителе, и включает дихлорметан, ацетонитрил, спирт (этанол, изопропанол, трифторэтанол и т.д.), воду или их смесь. Предпочтительно температура реакции находится в диапазоне, например, от 10°С до 50°С, более предпочтительно в диапазоне от 20οС до 40οС и наиболее предпочтительно в диапазоне от 25°С до 35°С.
Время реакции может варьировать в зависимости от вида используемого основания и температуры реакции и находится соответственно в диапазоне от 0,1 минуты до 24 часов вообще, а предпочтительно в диапазоне от 1 минуты до 5 часов.
В случае соединения (II) соединение общей формулы (IIa) ниже (в дальнейшем соединение (IIa)), где n равно 1, а L представляет собой группу (IV), можно получить с помощью следующей процедуры.
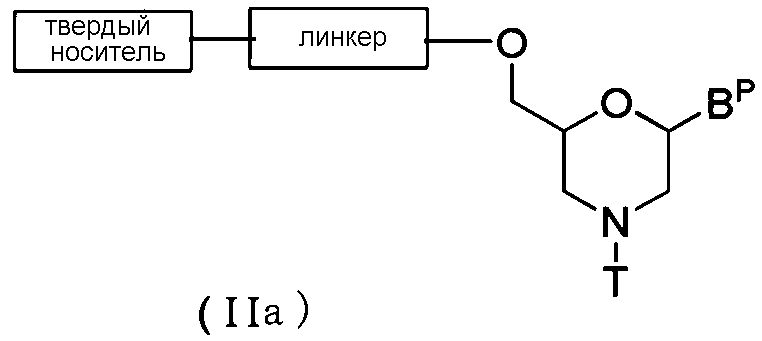
где BP, T, линкер и твердый носитель имеют то же определенное выше значение.
Стадия 1
Осуществляют реакцию соединения, представляемого общей формулой (V) ниже, с ацилирующим агентом для получения соединения, представляемого общей формулой (VI) ниже, (в дальнейшем называемого соединением (VI)).
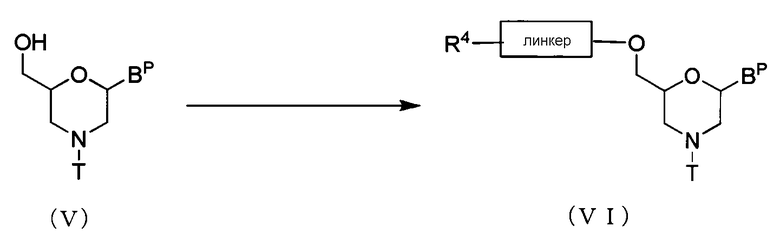
где BP, T и линкер имеют то же определенное выше значение, а
R4 представляет собой гидрокси, галоген или амино.
Эту стадию можно выполнить с помощью известных процедур для введения линкеров, используя соединение (V) в качестве исходного вещества.
В частности, соединение, представляемое общей формулой (VIa) ниже, можно получить посредством выполнения способа, известного как эстерификация, используя соединение (V) и янтарный ангидрид.
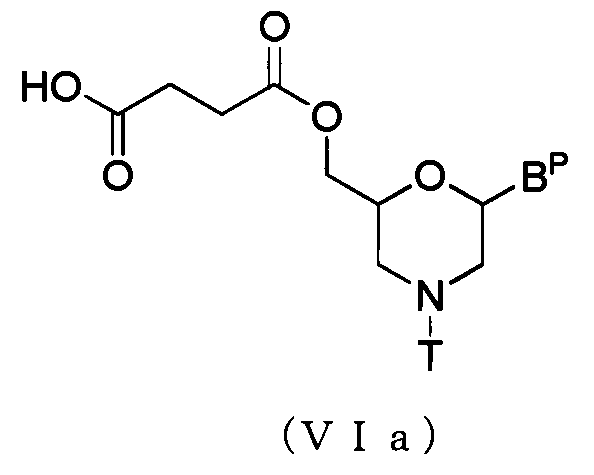
где BP и T то же определенное выше значение.
Стадия 2
Осуществляют реакцию соединения (VI) c твердым носителем с помощью конденсирующего средства для получения соединения (IIa).
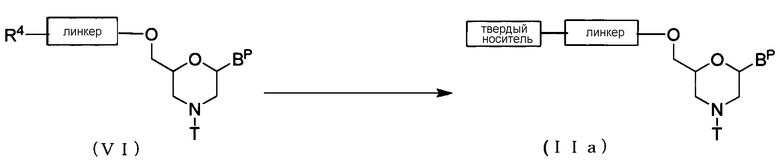
где BP, R4, T, линкер и твердый носитель имеют то же определенное выше значение.
Эту стадию можно выполнить, используя соединение (VI) и твердый носитель, в соответствии с процессом, известным как реакция конденсации.
В случае соединения (II) соединение, представляемое общей формулой (IIa2) ниже, где n равно 2-99, а L представляет собой группу, представляемую общей формулой (IV), можно получить, используя соединение (IIa) в качестве исходного материала и повторения стадии А и стадии В способа получения РМО, описанного здесь, желаемое число раз.
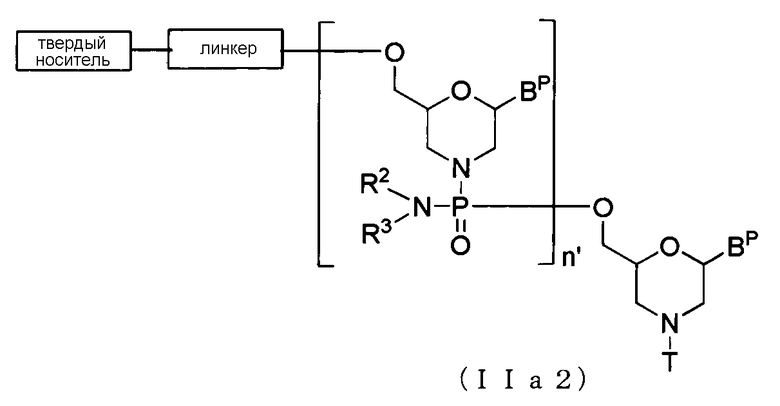
где BP, R2, R3, T, линкер и твердый носитель имеют то же определенное выше значение, а
n' равно 1-98.
В случае соединения (II) соединение общей формулы (IIb) ниже, где n равно 1, а L представляет собой водород, можно получить с помощью процедуры, описанной, например, в WO 1991/009033.
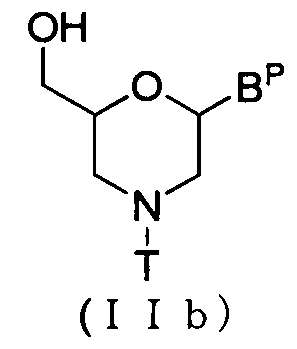
где BP и T имеют то же определенное выше значение.
В случае соединения (II) соединение, представляемое общей формулой (IIb2) ниже, где n равно 2-99, а L представляет собой водород, можно получить, используя соединение (IIb) в качестве исходного вещества и повторения стадии А и стадии В способа получения РМО, описанного здесь, желаемое число раз.
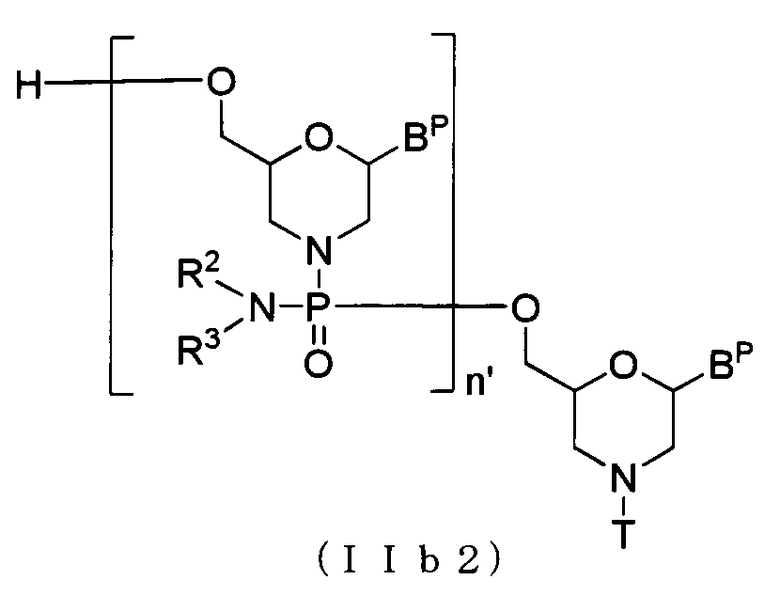
где BP, n', R2, R3 и T имеют то же определенное выше значение.
В случае соединения (II) соединение, представляемое общей формулой (IIc) ниже, где n равно 1, а L представляет собой ацил, можно получить посредством выполнения процедуры, известной как реакция ацилирования, используя соединение (IIb).
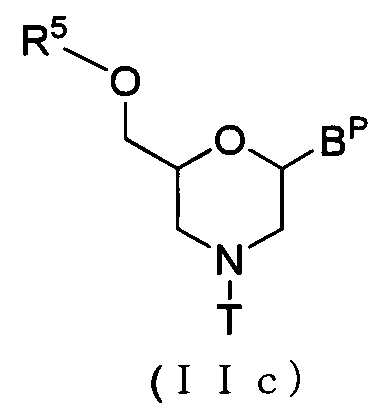
где BP и T имеют то же определенное выше значение, а
R5 представляет собой ацил.
В случае соединения (II) соединение, представляемое общей формулой (IIc2) ниже, где n равно 2-99, а L представляет собой ацил, можно получить, используя соединение (IIc) в качестве исходного вещества и повторения стадии А и стадии В способа получения РМО, описанного здесь, желаемое число раз.
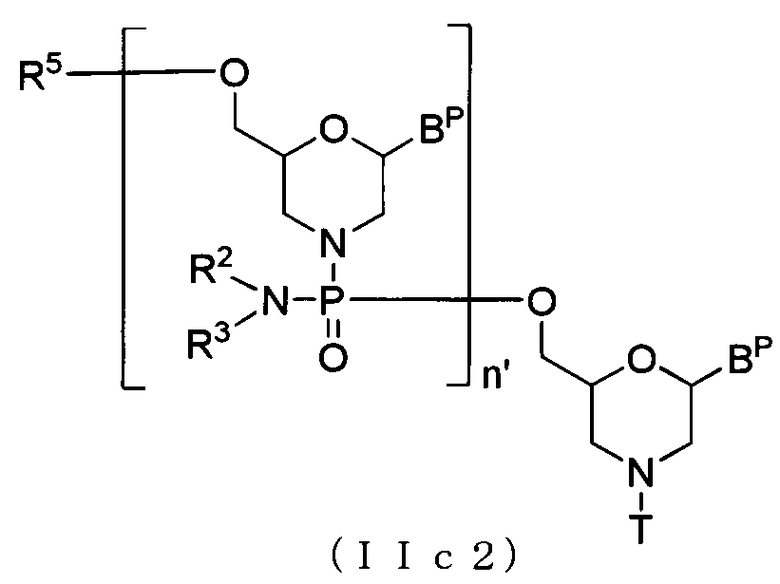
где BP, n', R2, R3, R5 и T имеют то же определенное выше значение.
(2) Стадия В
Осуществляют реакцию соединения (III) с соединением морфолино мономером в присутствии основания для приготовления соединения, представляемого общей формулой (VII) ниже, (в дальнейшем называемого соединением (VII)):
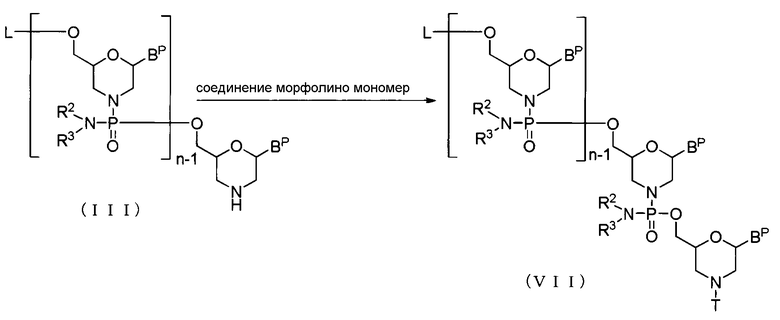
где BP, L, n, R2, R3 и T имеют то же определенное выше значение.
Эту стадию можно выполнить посредством осуществления реакции соединения (III) с соединением морфолино мономером в присутствии основания.
Соединение морфолино мономер включает, например, соединения, представляемые общей формулой (VIII) ниже:
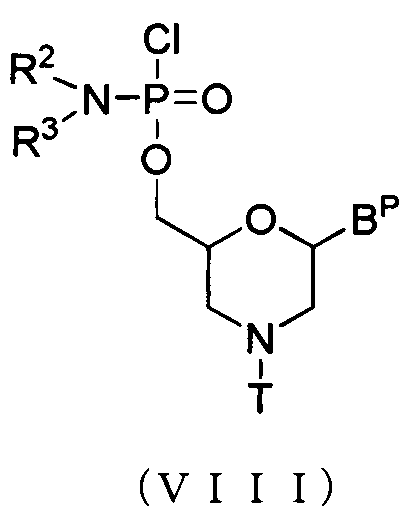
где BP, R2, R3 и T имеют то же определенное выше значение.
«Основание», которое может использоваться на этой стадии, включает, например, диизопропиламин, триэтиламин и N-этилморфолин. Используемое количество основания находится соответственно в диапазоне от 1 моль-эквивалента до 1000 моль-эквивалентов, если исходить из 1 моль соединения (III), предпочтительно от 10 моль-эквивалентов до 100 моль-эквивалентов, если исходить из 1 моль соединения (III).
Соединение морфолино мономер и основание, которые могут использоваться на этой стадии, могут также использоваться в виде разведения соответствующим растворителем в концентрации, составляющей от 0,1% до 30%. Растворитель особо не ограничивается, когда речь идет об инертном по отношении к реакции растворителе, и включает, например, N,N-диметилимидазолидон, N-метилпиперидон, DMF, дихлорметан, ацетонитрил, тетрагидрофуран или их смесь.
Предпочтительно температура реакции находится в диапазоне, например, от 0°С до 100°С, а более предпочтительно в диапазоне от 10°С до 50°С.
Время реакции может варьировать в зависимости от вида используемого основания и температуры реакции и находится соответственно в диапазоне от 1 минуты до 28 часов вообще, а предпочтительно в диапазоне от 30 минут до 24 часов.
Кроме того, после завершения этой стадии можно добавить ацилирующий агент, в случае необходимости. «Ацилирующий агент» включает, например, уксусный ангидрид, ацетилхлорид и феноксиуксусный ангидрид. Ацилирующий агент может также использоваться в виде разведения соответствующим растворителем в концентрации, составляющей от 0,1% до 30%. Растворитель особо не ограничивается, когда речь идет об инертном по отношении к реакции растворителе, и включает, например, дихлорметан, ацетонитрил, спирт(ы) (этанол, изопропанол, трифторэтанол и т.д.), воду или их смесь.
В случае необходимости, основание, такое как пиридин, лутидин, коллидин, триэтиламин, диизопропилэтиламин, N-этилморфолин и т.д., может также использоваться в сочетании с ацилирующим агентом. Количество ацилирующего агента находится соответственно в диапазоне от 0,1 моль-эквивалентов до 10000 моль-эквивалентов и предпочтительно в диапазоне от 1 моль-эквивалента до 1000 моль-эквивалентов. Количество основания находится соответственно в диапазоне, например, от 0,1 моль-эквивалентов до 100 моль-эквивалентов и предпочтительно в диапазоне от 1 моль-эквивалента до 10 моль-эквивалентов, если исходить из 1 моль ацилирующего агента.
Предпочтительно температура в этой реакции находится в диапазоне от 10°С до 50°С, более предпочтительно в диапазоне от 10°С до 50°С, намного более предпочтительно в диапазоне от 20°С до 40°С и наиболее предпочтительно в диапазоне от 25°С до 35°С. Время реакции может варьировать в зависимости от вида используемого ацилирующего агента и температуры реакции и находится соответственно в диапазоне от 0,1 минуты до 24 часов вообще, а предпочтительно в диапазоне от 1 минуты до 5 часов.
(3) Стадия С
В соединении (VII), полученном на стадии В, защитную группу удаляют, используя агент для снятия защиты, для получения соединения, представляемого общей формулой (IX).
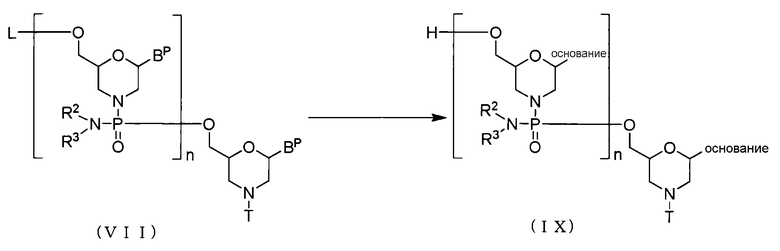
где основание, BP, L, n, R2, R3 и T имеют то же определенное выше значение.
Эту стадию можно выполнить посредством осуществления реакции соединения (VII) с агентом для снятия защиты.
«Агент для снятия защиты» включает, например, концентрированный водный раствор аммиака и метиламин. «Агент для снятия защиты», используемый на этой стадии, может также использоваться в виде разведения, например, водой, метанолом, этанолом, изопропиловым спиртом, ацетонитрилом, тетрагидрофураном, DMF, N,N-диметилимидазолидоном, N-метилпиперидоном или смесью этих растворителей. Среди прочего, этанол является предпочтительным. Используемое количество агента для снятия защиты находится соответственно в диапазоне, например, от 1 моль-эквивалента до 100000 моль-эквивалентов и предпочтительно в диапазоне от 10 моль-эквивалентов до 1000 моль-эквивалентов, если исходить из 1 моль соединения (VII).
Температура реакции находится соответственно в диапазоне от 15°С до 75°С, предпочтительно в диапазоне от 40°С до 70°С и более предпочтительно в диапазоне от 50°С до 60°С. Время реакции для снятия защиты может варьировать в зависимости от вида соединения (VII), температуры реакции и т.д. и находится соответственно в диапазоне от 10 минут до 30 часов, предпочтительно от 30 минут до 24 часов и более предпочтительно в диапазоне от 5 часов до 20 часов.
(4) Стадия D
РМО (I) получают посредством осуществления реакции соединения (IX), полученного на стадии С, с кислотой:
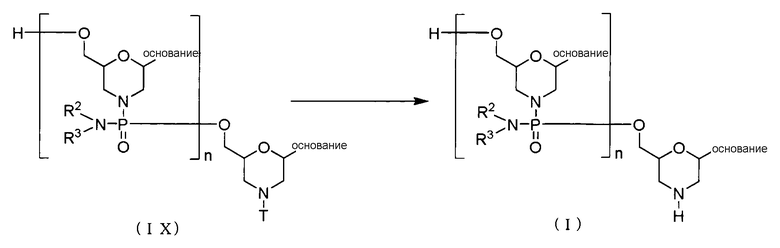
где основание, n, R2, R3 и T имеют то же определенное выше значение.
Эту стадию можно выполнить посредством добавления кислоты к соединению (IX).
«Кислота», которая может использоваться на этой стадии, включает, например, трихлоруксусную кислоту, дихлоруксусную кислоту, уксусную кислоту, фосфорную кислоту, соляную кислоту и т.д. Используемая кислота используется соответственно для того, чтобы раствор мог иметь рН в диапазоне от 0,1 до 4,0 и более предпочтительно в диапазоне от 1,0 до 3,0. Растворитель особо не ограничивается, когда речь идет об инертном по отношении к реакции растворителе, и включает, например, ацетонитрил, воду или их смесь.
Температура реакции находится соответственно в диапазоне от 10°С до 50°С, предпочтительно в диапазоне от 20°С до 40°С и более предпочтительно в диапазоне от 25οС до 35οС. Время реакции для снятия защиты может варьировать в зависимости от вида соединения (IX), температуры реакции и т.д. и находится соответственно в диапазоне от 0,1 минуты до 5 часов, предпочтительно от 1 минуту до 1 часа и более предпочтительно в диапазоне от 1 минуты до 30 минут.
РМО (I) можно получить посредством подвергания реакционной смеси, полученной на этой стадии, обычным способам разделения и очистки, таким как экстракция, концентрирование, нейтрализация, фильтрация, разделение центрифугированием, рекристаллизация, хроматография на колонке С8-С18 с обращенной фазой, катионообменная хроматография на колонке, анионообменная хроматография на колонке, гель-фильтрация на колонке, жидкостная хроматография высокого разрешения, диализ, ультрафильтрация и т.д., отдельно или в их сочетании. Таким образом, желаемый РМО (I) можно выделить и очистить (см., например, WO 1991/09033).
В случае очистки РМО (I) с использованием хроматографии с обращенной фазой в качестве растворителя для элюирования может использоваться, например, смесь растворов 20 мМ триэтиламина/ацетатного буфера и ацетонитрила.
В случае очистки РМО (I) с использованием ионообменной хроматографии в качестве растворителя для элюирования может использоваться, например, смесь растворов 1 М солевого раствора и 10 мМ водного раствора 10 мМ гидроксида натрия.
Пептидо-нуклеиновой кислотой является олигомер настоящего изобретения, имеющий группу, представляемую следующей общей формулой, в качестве составной единицы:
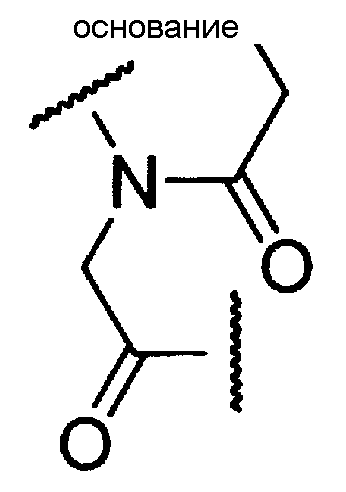
где основание имеет то же определенное выше значение.
Пептидо-нуклеиновые кислоты можно приготовить, обратившись к следующей литературе.

В олигомере настоящего изобретения 5'-конец может быть любой из химических структур (1)-(3) ниже и предпочтительно является (3)-ОН.
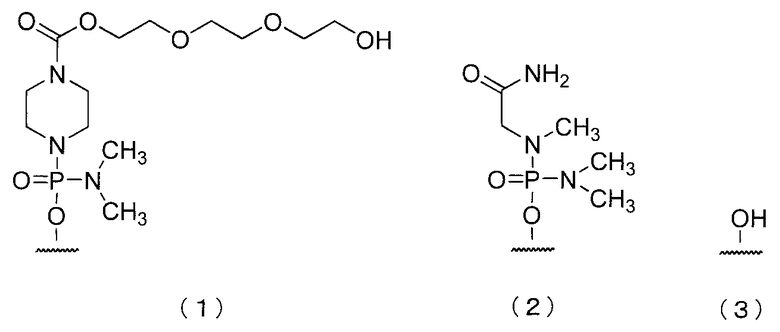
В дальнейшем группы, представленные (1), (2) и (3) выше называют «группой (1)», «группой (2)» и «группой (3)» соответственно.
2. Фармацевтическая композиция
Олигомер настоящего изобретения вызывает пропуск экзона 53 с более высокой эффективностью, чем антисмысловые олигомеры известного уровня техники. Поэтому ожидается, что степень мышечной дистрофии можно уменьшить с высокой эффективностью посредством введения фармацевтической композиции, включающей олигомер настоящего изобретения, пациентам с DMD. Например, в случае использования фармацевтической композиции, включающей олигомер, даже в дозе, меньшей таковой олигомеров известного уровня техники, можно достичь те же терапевтические эффекты. Соответственно, можно уменьшить побочные эффекты, и это является экономным.
В другом варианте осуществления настоящим изобретением обеспечивается фармацевтическая композиция для лечения мышечной дистрофии, включающая в качестве активного ингредиента олигомер настоящего изобретения, его фармацевтически приемлемую соль или гидрат, (в дальнейшем называемая «композицией настоящего изобретения»).
Примерами фармацевтически приемлемой соли олигомера настоящего изобретения, содержащейся в композиции настоящего изобретения, являются соли щелочных металлов, такие как соли натрия, калия и лития; соли щелочноземельных металлов, такие как соли кальция и магния; соли металлов, такие как соли алюминия, железа, цинка, меди, никеля, кобальта и т.д., аммонийные соли, соли органических аминов, такие как соли трет-октиламина, дибензиламина, морфолина, глюкозамина, алкилового эфира фенилглицина, этилендиамина, N-метилглюкамина, гуанидина, диэтиламина, триэтиламина, дициклогексиламина, N,N'-дибензилэтилендиамина, хлорпрокаина, прокаина, диэтаноламина, N-бензилфенэтиламина, пиперазина, тетраметиламмония, трис(гидроксиметил)аминометана, соли гидрогалогенидов, такие как соли гидрофторатов, гидрохлоридов, гидробромидов и гидроиодидов, соли неорганических кислот, такие как нитраты, перхлораты, сульфаты, фосфаты и т.д., (низший алкан)сульфонаты, такие как метансульфонаты, трифторметансульфонаты и этансульфонаты, арилсульфонаты, такие как бензолсульфонаты и пара-толуолсульфонаты, соли органических кислот, такие как ацетаты, малаты, фумараты, сукцинаты, цитраты, тартраты, оксалаты, малеаты и т.д., и соли аминокислот, такие как соли глицина, лизина, аргинина, орнитина, глютаминовой кислоты и аспарагиновой кислоты. Эти соли можно получить известными способами. В альтернативном случае олигомер настоящего изобретения, содержащийся в композиции настоящего изобретения, может быть в форме его гидрата.
Путь введения композиции настоящего изобретения особо не ограничивается при условии, что он является фармацевтически приемлемым путем для введения, и может быть выбран в зависимости от способа лечения. Ввиду легкости доставки в мышечные ткани предпочтительными являются внутривенное введение, внутриартериальное введение, внутримышечное введение, подкожное введение, оральное введение, введение в ткани, чрескожное введение и т.д. Также лекарственные формы, подходящие в случае композиции настоящего изобретения, особо не ограничиваются и включают, например, различные инъецируемые препараты, пероральные средства, капли, лекарственные формы для ингаляции, мази, лосьоны и т.д.
В случае введения олигомера настоящего изобретения пациентам с мышечной дистрофией композиция настоящего изобретения предпочтительно содержит носитель для способствования доставке олигомера в мышечные ткани. Такой носитель особо не ограничивается, когда речь идет о фармацевтически приемлемом носителе, и примеры включают катионные носители, такие как катионные липосомы, катионные полимеры и т.д., или носители с использованием оболочки вируса. Катионными носителями являются, например, липосомы, состоящие из 2-О-(2-диэтиламиноэтил)карабамоил-1,3-О-диолеоилглицерина и фосфолипидов в качестве основных составных частей, (в дальнейшем называемые «липосомами А»), Oligofectamine (зарегистрированный товарный знак) (производства Invitrogen Corp.), Lipofectin (зарегистрированный товарный знак) (производства Invitrogen Corp.), Lipofectamine (зарегистрированный товарный знак) (производства Invitrogen Corp.), Lipofectamine 2000 (зарегистрированный товарный знак) (производства Invitrogen Corp.), DMRIE-C (зарегистрированный товарный знак) (производства Invitrogen Corp.), GeneSilencer (зарегистрированный товарный знак) (производства Gene Therapy Systems), TransMessenger (зарегистрированный товарный знак) (производства QIAGEN, Inc.), TransIT TKO (зарегистрированный товарный знак) (производства Mirus) и Nucleofector II (Lonza). Среди прочено, липосома А является предпочтительной. Примерами катионных полимеров являются JetSI (зарегистрированный товарный знак) (производства Qbiogene, Inc.) и Jet-PEI (зарегистрированный товарный знак) (полиэтиленимин, производства Qbiogene, Inc.). Примером носителей с использованием оболочки вируса является GenomeOne (зарегистрированный товарный знак) (липосома HVJ-E, производства Ishihara Sangyo). В альтернативном случае могут также использоваться медицинские изделия, описанные в патенте Японии с № 2924179, и катионные носители, описанные в отечественных повторных публикациях в Японии РСТ-заявок с № 2006/129594 и 2008/096690.
Концентрация олигомера настоящего изобретения, содержащегося в композиции настоящего изобретения, может варьировать в зависимости от вида носителя и т.д. и находится соответственно в диапазоне от 0,1 нМ до 100 мкМ, предпочтительно в диапазоне от 1 нМ до 10 мкМ и более предпочтительно в диапазоне от 10 нМ до 1 мкМ. Весовое соотношение олигомера настоящего изобретения, содержащегося в композиции настоящего изобретения, и носителя (носитель/олигомер настоящего изобретения) может варьировать в зависимости от характеристики олигомера, типа носителя и т.д. и находится соответственно в диапазоне от 0,1 до 100, предпочтительно в диапазоне от 1 до 50 и более предпочтительно в диапазоне от 10 до 20.
Помимо олигомера настоящего изобретения и носителя, описанного выше, фармацевтически приемлемые добавки могут также быть необязательно в рецептуре композиции настоящего изобретения. Примерами таких добавок являются вспомогательные средства для эмульгирования (например, жирные кислоты, содержащие 6-22 атомов углерода, и их фармацевтически приемлемые соли, альбумин и декстран), стабилизаторы (например, холестерин и фосфатидная кислота), агенты для придания изотоничности (например, хлорид натрия, глюкоза, мальтоза, лактоза, сахароза, трегалоза) и агенты для контролирования рН (например, соляная кислота, серная кислота, фосфорная кислота, уксусная кислота, гидроксид натрия, гидроксид калия и триэтаноламин). Может использоваться одна или более этих добавок. Содержание добавки в композиции настоящего изобретения составляет 90% по весу или менее, предпочтительно 70% по весу или менее и более предпочтительно 50% по весу или менее.
Композицию настоящего изобретения можно приготовить посредством добавления олигомера настоящего изобретения к дисперсии носителя и перемешивания в достаточной мере смеси. Добавки можно добавлять на соответствующей стадии или до, или после добавления олигомера настоящего изобретения. Содержащий воду растворитель, который может использоваться при добавлении олигомера настоящего изобретения, особо не ограничивается, когда речь идет о фармацевтически приемлемом растворителе, и примерами являются вода для инъекции или дистиллированная вода для инъекции, раствор электролитов, такой как физиологический солевой раствор и т.д., и раствор сахара, такой как раствор глюкозы, раствор мальтозы и т.д. Квалифицированный в данной области техники специалист может соответствующе выбрать условия для рН и температуры по такому поводу.
Композицию настоящего изобретения можно приготовить в виде жидкой формы и ее лиофилизированного препарата. Лиофилизированный препарат можно приготовить с помощью лиофилизации композиции настоящего изобретения в жидкой форме обычным способом. Лиофилизацию можно выполнить, например, посредством стерилизации подходящим образом композиции настоящего изобретения в жидкой форме, распределения аликвот по контейнерам-флаконам, выполнения предварительного замораживания в течение 2 часов в условиях приблизительно от -40°С до -20°С, выполнения первичного высушивания при 0-10°С при пониженном давлении, а затем выполнения вторичного высушивания при приблизительно 15-25°С при пониженном давлении. Вообще, лиофилизированный препарат композиции настоящего изобретения можно получить с помощью замещения содержимого флакона азотом и закупоривания.
Вообще лиофилизированный препарат композиции настоящего изобретения может использоваться после восстановления посредством добавления произвольного подходящего раствора (жидкости для восстановления) и растворения вновь препарата. Такая жидкость для восстановления включает воду для инъекции, физиологический солевой раствор и другие жидкости для инфузии. Объем жидкости для восстановления может варьировать в зависимости от намеченного применения и т.д. и особо не ограничивается, и подходяще, когда он превышает в 0,5-2 раза объем до лиофилизации или составляет не более чем 500 мл.
Желательным является контролирование вводимой дозы композиции настоящего изобретения, приняв во внимание следующие факторы: тип и лекарственную форму олигомера настоящего изобретения, содержащего в композиции, состояния пациентов, в том числе возраст, вес тела и т.д., путь введения и характеристики и степень заболевания. Суточная доза, рассчитываемая как количество олигомера настоящего изобретения, находится обычно в области от 0,1 мг до 10 г/человека и предпочтительно от 1 мг до 1 г/человека. Эта область числовых значений может иногда меняться в зависимости от типа целевого заболевания, пути введения и молекулы-мишени. Следовательно, в каком-то случае может быть достаточной доза ниже этой области, и наоборот, доза выше этой области может иногда потребоваться. Композицию можно вводить от одного до нескольких раз в день или с интервалами от одного дня до нескольких дней.
Тем не менее, в другом варианте осуществления композиции настоящего изобретения обеспечивается фармацевтическая композиция, включающая вектор, способный к экспрессии олигонуклеотида настоящего изобретения, и описанный выше носитель. Таким экспрессионным вектором может быть вектор, способный к экспрессии множества олигонуклеотидов настоящего изобретения. В рецептуре такой композиции могут быть фармацевтически приемлемые добавки, как и в случае композиции настоящего изобретения, содержащей олигомер настоящего изобретения. Концентрация экспрессионного вектора, содержащегося в композиции, может варьировать в зависимости от типа носителя и т.д. и находится соответственно в диапазоне от 0,1 нМ до 100 мкМ, предпочтительно в диапазоне от 1 нМ до 10 мкМ и более предпочтительно в диапазоне от 10 нМ до 1 мкМ. Весовое соотношение экспрессионного вектора, содержащегося в композиции, и носителя (носитель/экспрессионный вектор) может варьировать в зависимости от характеристики экспрессионного вектора, типа носителя и т.д. и находится соответственно в диапазоне от 0,1 до 100, предпочтительно в диапазоне от 1 до 50 и более предпочтительно в диапазоне от 10 до 20. Содержание носителя, содержащегося в композиции, является таким же, как и в случае композиции настоящего изобретения, содержащей олигомер настоящего изобретения, и способ приготовления фармацевтической композиции, включающей вектор, является таким же, как и в случае композиции настоящего изобретения.
В дальнейшем настоящее изобретение будет подробнее описано со ссылкой на ПРИМЕРЫ и ТЕСТОВЫЕ ПРИМЕРЫ ниже, но, как считается, не ограничивается ими.
ПРИМЕРЫ
СПРАВОЧНЫЙ ПРИМЕР 1
4-{[2S,6R)-6-(4-Бензамидо-2-оксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксомасляная кислота, нагруженная на аминометилполистирольную смолу
Стадия 1: Получение 4-{[(2S,6R)-6-(4-бензамидо-2-оксопиримидин-1(2Н)-ил)-4-тритилморфолин-2-ил]метокси}-4-оксомасляной кислоты
В атмосфере аргона 22,0 г N-{1-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-2-оксо-1,2-дигидропиримидин-4-ил}бензамида и 7,04 г 4-диметиламинопиридина (4-DMAP) суспендировали в 269 мл дихлорметана, и к суспензии добавляли 5,76 г янтарного ангидрида с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционному раствору добавляли 40 мл метанола и смесь концентрировали при пониженном давлении. Остаток экстрагировали, используя этилацетат и 0,5 М водный раствор дигидрогенфосфата калия. Результирующий органический слой промывали последовательно с использованием 0,5 М водного раствора дигидрогенфосфата калия, воды и соляного раствора в указанном порядке. Результирующий органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении с образованием 25,9 г продукта.
Стадия 2: Получение 4-{[(2S,6R)-6-(4-бензамидо-2-оксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксомасляной кислоты, нагруженной на аминометилполистирольную смолу
После растворения 23,5 г 4-{[(2S,6R)-6-(4-бензамидо-2-оксопиримидин-1(2Н)-ил)-4-тритилморфолин-2-ил]метокси}-4-оксомасляной кислоты в 336 мл пиридина (обезвоженного) к раствору добавляли 4,28 г 4-DMAP и 40,3 г 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида. Затем к смеси добавляли 25,0 г аминометилполистирольной смолы, сшитой 1% DVB, (производства Tokyo Chemical Industry Co., Ltd, A1543) и 24 мл триэтиламина с последующим встряхиванием при комнатной температуре в течение 4 дней. После завершения реакции смолу отделяли с помощью фильтрации. Полученную в результате смолу последовательно промывали пиридином, метанолом и дихлорметаном в указанном порядке и сушили при пониженном давлении. К результирующей смоле добавляли 150 мл тетрагидрофурана (обезвоженного), 15 мл уксусного ангидрида и 15 мл 2,6-лутидина и смесь встряхивали при комнатной температуре в течение 2 часов. Смолу отделяли с помощью фильтрации, последовательно промывали пиридином, метанолом и дихлорметаном в указанном порядке и сушили при пониженном давлении с образованием 33,7 г продукта.
Величину привеса продукта определяли посредством измерения поглощения ультрафиолетовых лучей при 409 нм молярного количества тритила на г смолы, используя известный способ. Величина привеса смолы равнялась 397,4 мкмоль/г.
Условия измерения поглощения ультрафиолетовых лучей
Устройство: U-2910 (Hitachi, Ltd.)
Растворитель: метансульфокислота
Длина волны: 265 нм
Значение ε: 45000
СПРАВОЧНЫЙ ПРИМЕР 2
4-Оксо-4-{[(2S,6R)-6-(6-оксо-2-[2-феноксиацетамидо]-1Н-пурин-9-ил)-4-тритилморфолин-2-ил]метокси}масляная кислота, нагруженная на аминометилполистирольную смолу
Стадия 1: Получение N2-(феноксиацетил)гуанозина
Гуанозин, 100 г, сушили при 80°С при пониженном давлении в течение 24 часов. Потом к нему добавляли 500 мл пиридина (безводного) и 500 мл дихлорметана (безводного), к смеси по каплям добавляли 401 мл хлортриметилсилана в атмосфере аргона при 0°С с последующим перемешиванием при комнатной температуре в течение 3 часов. Смесь снова охлаждали на льду и к ней порциями добавляли 66,3 г феноксиацетилхлорида. После охлаждения на льду смесь перемешивали в течение еще 3 часов. К реакционному раствору добавляли 500 мл метанола и смесь перемешивали при комнатной температуре в течение ночи. Затем растворитель удаляли с помощью перегонки при пониженном давлении. К остатку добавляли 500 мл метанола и трижды осуществляли концентрирование при пониженном давлении. К остатку добавляли 4 л воды и смесь перемешивали в течение часа при охлаждении на льду. Образовавшиеся преципитаты отделяли с помощью фильтрации, последовательно промывали водой и холодным метанолом, а затем сушили с образованием 150,2 г целевого соединения (выход: 102%) (см. Org. Lett. (2004), Vol. 6, No. 15, 2555-2557).
Стадия 2
N-{9-[(2R,6S)-6-(гидроксиметил)-4-морфолин-2-ил]-6-оксо-6,9-дигидро-1Н-пурин-2-ил}-2-феноксиацетамид пара-толуолсульфонат
В 480 мл метанола суспендировали 30 г соединения, полученного на стадии 1, и к суспензии при охлаждении на льду добавляли 130 мл 2 н соляной кислоты. Впоследствии к смеси добавляли 56,8 г тетрабората аммония и 16,2 г периодата натрия в указанном порядке и осуществляли перемешивание при комнатной температуре в течение 3 часов. Реакционный раствор охлаждали на льду и нерастворимые вещества удаляли с помощью фильтрации с последующей промывкой 100 мл метанола. Фильтрат и жидкость, использованную для промывки, объединяли и смесь охлаждали на льду. К смеси добавляли 11,52 г 2-пиколинборана. После перемешивания в течение 20 минут к смеси медленно добавляли 54,6 г пара-толуолсульфокислоты моногидрата с последующим перемешиванием при 4°С в течение ночи. Преципитаты отделяли с помощью фильтрации и промывали 500 мл холодного метанола и сушили с образованием 17,7 г целевого соединения (выход: 43,3%).
1H ЯМР (δ, ДМСО-d6): 9,9-9,2 (2H, ушир.), 8,35 (1H, с), 7,55 (2H, м), 7,35 (2H, м), 7,10 (2H, д, J=7,82 Гц), 7,00 (3H, м), 5,95 (1H, дд, J=10,64, 2,42 Гц), 4,85 (2H, с), 4,00 (1H, м), 3,90-3,60 (2H, м), 3,50-3,20 (5H, м), 2,90 (1H, м), 2,25 (3H, с).
Стадия 3: Получение N-{9-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-6-оксо-6,9-дигидро-1Н-пурин-2-ил}-2-феноксиацетамида
В 30 мл дихлорметана суспендировали 2,0 г соединения, полученного на стадии 2, и к суспензии при охлаждении на льду добавляли 13,9 г триэтиламина и 18,3 г тритилхлорида. Смесь перемешивали при комнатной температуре в течение часа. Реакционный раствор промывали насыщенным водным раствором бикарбоната натрия, а затем водой и сушили. Органический слой концентрировали при пониженном давлении. К остатку добавляли 40 мл 0,2 М натрий-цитратного буфера (рН 3)/метанола (1:4) (в объемном отношении)) и смесь перемешивали. Впоследствии добавляли 40 мл воды и смесь перемешивали в течение часа при охлаждении на льду. Смесь отделяли с помощью фильтрации, промывали холодным метанолом и сушили с образованием 1,84 г целевого соединения (выход: 82%).
Стадия 4: Получение 4-оксо-4-{[(2S,6R)-6-(6-оксо-2-[2-феноксиацетамидо]-1Н-пурин-9-ил)-4-тритилморфолин-2-ил]метокси}масляной кислоты, нагруженной на аминометилполистирольную смолу
Соединение заголовка получали способом, схожим с таковым СПРАВОЧНОГО ПРИМЕРА 1, за исключением того, что N-{9-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-6-оксо-6,9-дигидро-1Н-пурин-2-ил}-2-феноксиацетамид использовали на этой стадии вместо N-{1-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-2-оксо-1,2-дигидропиримидин-4-ил}бензамида, используемого на стадии 1 СПРАВОЧНОГО ПРИМЕРА 1.
СПРАВОЧНЫЙ ПРИМЕР 3
4-{[(2S,6R)-6-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксомасляная кислота, нагруженная на аминометилполистирольную смолу
Соединение заголовка получали способом, схожим с таковым СПРАВОЧНОГО ПРИМЕРА 1, за исключением того, что 1-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-5-метилпиримидин-2,4(1Н,3Н)-дион использовали на этой стадии вместо N-{1-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-2-оксо-1,2-дигидропиримидин-4-ил}бензамида, используемого на стадии 1 СПРАВОЧНОГО ПРИМЕРА 1.
СПРАВОЧНЫЙ ПРИМЕР 4
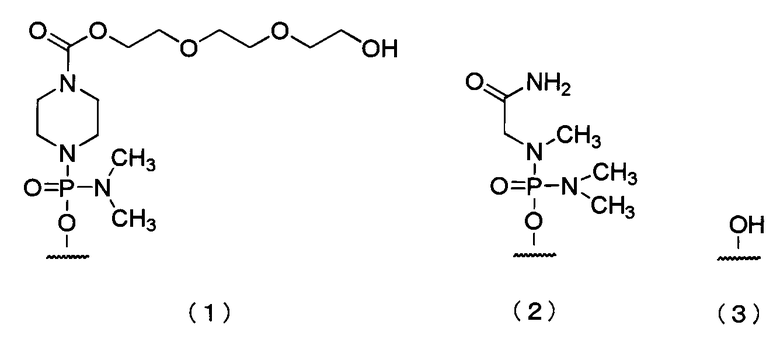
1,12-Диоксо-1-(4-тритилпиперазин-1-ил)-2,5,8,11-тетраокса-15-пентакаприновая кислота, нагруженная на аминометилполистирольную смолу
Соединение заголовка получали способом, схожим с таковым СПРАВОЧНОГО ПРИМЕРА 1, за исключением того, что 2-[2-(2-гидроксиэтокси)этокси]этил-4-тритилпиперазин-1-карбоновую кислоту (соединение, описанное в WO 2009/064471) использовали на этой стадии вместо N-{1-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-2-оксо-1,2-дигидропиримидин-4-ил}бензамида.
В соответствии с описаниями в ПРИМЕРАХ 1-12 ниже и СПРАВОЧНЫХ ПРИМЕРАХ ниже были синтезированы различные типы РМО, представленные РМО с № 1-11 и 13-16 в ТАБЛИЦЕ 2. Синтезированный РМО растворяли в воде для инъекции (производства Otsuka Pharmaceutical Factory, Inc.). РМО с № 12 покупали у Gene Tools, LLC.
ПРИМЕР 1
РМО с № 8
В реакционный сосуд переносили 2 г (800 мкмоль) 4-{[(2S,6R)-6-(4-бензамидо-2-оксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксомасляной кислоты, нагруженной на аминометилполистирольную смолу (см. СПРАВОЧНЫЙ ПРИМЕР 1), и к ней добавляли 30 мл дихлорметана. Обеспечивали выдерживание смеси в течение 30 минут. После дальнейшей промывки два раза смеси с использованием 30 мл дихлорметаном начинали следующий цикл синтеза. В каждый цикл добавляли желаемое соединение морфолино мономер для образования нуклеотидной последовательности соединения заголовка.
Используемым раствором для снятия защиты был раствор, полученный в результате растворения смеси трифторуксусной кислоты (2 эквивалентов) и триэтиламина (1 эквивалента) в растворе дихлорметана, содержащем 1% (в объемном отношении) этанола и 10% (в объемном отношении) 2,2,2-трифторэтанола, с получением 3% (в отношении веса к объему) раствора. Используемым нейтрализующим раствором был раствор, полученный в результате растворения N,N-диизопропилэтиламина в растворе дихлорметана, содержащем 25% (в объемном отношении) 2-пропанола, с получением 5% (в объемном отношении) раствора. Используемым раствором А для соединения был раствор, полученный в результате растворения соединения морфолино мономера в 1,3-диметил-2-имидазолидиноне, содержащем 10% (в объемном отношении) N,N-диизопропилэтиламина, с получением 0,15 М раствора. Используемым раствором В для соединения был раствор, полученный в результате растворения N,N-диизопропилэтиламина в 1,3-диметил-2-имидазолидиноне, с получением 10% (в объемном отношении) раствора. Используемым раствором для кэпирования был раствор, полученный в результате растворения 20% (в объемном отношении) уксусного ангидрида и 30% (в объемном отношении) 2,6-лутидина в дихлорметане.
Аминометилполистирольную смолу, нагруженную синтезированным выше РМО, извлекали из реакционного сосуда и сушили при комнатной температуре в течение по крайней мере 2 часов при пониженном давлении. Высушенный РМО, нагруженный на аминометилполистирольную смолу, загружали в реакционный сосуд и к нему добавляли 200 мл смеси 20% водный раствор аммиака -этанол (1/4). Смесь перемешивали при 55°С в течение 15 часов. Аминометилполистирольную смолу отделяли с помощью фильтрации и промывали 50 мл смеси вода-этанол (1/4). Результирующий фильтрат концентрировали при пониженном давлении. Результирующий остаток растворяли в 100 мл смеси растворителей, состоящей из 20 мМ буфера уксусная кислота - триэтиламин (буфера ТЕАА) и ацетонитрила, (1/4) и фильтровали через мембранный фильтр. Полученный фильтрат очищали с помощью HPLC с обращенной фазой. Используемыми условиями были следующие условия.
Исследовали каждую фракцию и продукт получали в 100 мл смеси ацетонитрил-вода (1/1), к которым добавляли 200 мл этанола. Смесь концентрировали при пониженном давлении. Дальнейшее высушивание при пониженном давлении давало белое сухое вещество. К полученному в результате сухому веществу добавляли 300 мл 10 мМ водного раствора фосфорной кислоты для суспендирования сухого вещества. К суспензии добавляли 10 мл 2М водного раствора фосфорной кислоты и смесь перемешивали в течение 15 минут. Кроме того, для нейтрализации добавляли 15 мл 2М водного раствора едкого натра. Затем добавляли 15 мл 2М водного раствора гидроксида натрия, чтобы сделать раствор щелочным, с последующей фильтрацией через мембранный фильтр (0,45 мкм). Смесь тщательно промывали 100 мл 10 мМ водного раствора гидроксида натрия с получением продукта в виде водного раствора.
Полученный в результате водный раствор, содержащий продукт, очищали на колонке с анионообменной смолой. Используемыми условиями были следующие условия.
Каждую фракцию исследовали (с помощью HPLC) и продукт получали в виде водного раствора. К результирующему водному раствору добавляли 225 мл 0,1 М фосфатного буфера (рН 6,0) для нейтрализации. Смесь фильтровали через мембранный фильтр (0,45 мкм). Затем выполняли ультрафильтрацию в описываемых ниже условиях.
Фильтрат концентрировали с получением приблизительно 250 мл водного раствора. Результирующий водный раствор фильтровали через мембранный фильтр (0,45 мкм). Полученный водный раствор лиофилизировали с получением 1,5 г целевого соединения в виде белого, вроде хлопка, сухого вещества.
ESI-TOF-MS (электроспрей-ионизационная времяпролетная масс-спектрометрия)
Рассчитанное значение: 6924,83
Установленное значение: 6923,54
ПРИМЕР 2
РМО с № 1
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1.
MALDI-TOF-MS (лазерная десорбционная/ионизационная с использованием матрицы времяпролетная масс-спектрометрия)
Рассчитанное значение: 8291,96
Установленное значение: 8296,24
ПРИМЕР 3
РМО с № 2
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1.
ESI-TOF-MS
Рассчитанное значение: 7310,13
Установленное значение: 7909,23
ПРИМЕР 4
РМО с № 3
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1.
ESI-TOF-MS
Рассчитанное значение: 8270,94
Установленное значение: 8270,55
ПРИМЕР 5
РМО с № 4
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1 за исключением того, что в качестве исходного материала была использована 4-(((2S,6R)-6-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-4-тритилморфолин-2-ил)метокси)-4-оксомасляная кислота, нагруженная на аминометилполистирольную смолу, (СПРАВОЧНЫЙ ПРИМЕР 3).
ESI-TOF-MS
Рассчитанное значение: 7310,13
Установленное значение: 7310,17
ПРИМЕР 6
РМО с № 5
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1 за исключением того, что в качестве исходного материала была использована 4-(((2S,6R)-6-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-4-тритилморфолин-2-ил)метокси)-4-оксомасляная кислота, нагруженная на аминометилполистирольную смолу, (СПРАВОЧНЫЙ ПРИМЕР 3).
ESI-TOF-MS
Рассчитанное значение: 8270,94
Установленное значение: 8270,20
ПРИМЕР 7
РМО с № 6
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1.
ESI-TOF-MS
Рассчитанное значение: 5964,01
Установленное значение: 5963,68
ПРИМЕР 8
РМО с № 7
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1.
ESI-TOF-MS
Рассчитанное значение: 6609,55
Установленное значение: 6608,85
ПРИМЕР 9
РМО с № 9
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1 за исключением того, что в качестве исходного материала была использована 4-оксо-4-(((2S,6R)-6-(6-оксо-2-(2-феноксиацетамидо)-1Н-пурин-9(6Н)-ил)-4-тритилморфолин-2-ил)метокси)масляная кислота, нагруженная на аминометилполистирольную смолу, (СПРАВОЧНЫЙ ПРИМЕР 2).
ESI-TOF-MS
Рассчитанное значение: 7280,11
Установленное значение: 7279,42
ПРИМЕР 10
РМО с № 10
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1 за исключением того, что в качестве исходного материала была использована 4-оксо-4-(((2S,6R)-6-(6-оксо-2-(2-феноксиацетамидо)-1Н-пурин-9(6Н)-ил)-4-тритилморфолин-2-ил)метокси)масляная кислота, нагруженная на аминометилполистирольную смолу, (СПРАВОЧНЫЙ ПРИМЕР 2).
ESI-TOF-MS
Рассчитанное значение: 8295,95
Установленное значение: 8295,91
ПРИМЕР 11
РМО с № 13
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1 за исключением того, что в качестве исходного материала была использована 1,12-диоксо-1-(4-тритилпиперазин-1-ил)-2,5,8,11-тетраокса-15-пентакаприновая кислота, нагруженная на аминометилполистирольную смолу, (СПРАВОЧНЫЙ ПРИМЕР 4).
ESI-TOF-MS
Рассчитанное значение: 7276,15
Установленное значение: 7276,69
ПРИМЕР 12
РМО с № 14
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1 за исключением того, что в качестве исходного материала была использована 1,12-диоксо-1-(4-тритилпиперазин-1-ил)-2,5,8,11-тетраокса-15-пентакаприновая кислота, нагруженная на аминометилполистирольную смолу, (СПРАВОЧНЫЙ ПРИМЕР 4).
ESI-TOF-MS
Рассчитанное значение: 8622,27
Установленное значение: 8622,29
СРАВНИТЕЛЬНЫЙ ПРИМЕР 1
РМО с № 11
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1.
ESI-TOF-MS
Рассчитанное значение: 10274,63
Установленное значение: 10273,71
СРАВНИТЕЛЬНЫЙ ПРИМЕР 2
РМО с № 15
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1.
ESI-TOF-MS
Рассчитанное значение: 9941,33
Установленное значение: 9940,77
СРАВНИТЕЛЬНЫЙ ПРИМЕР 3
РМО с № 16
Соединение заголовка было получено в соответствии с процедурой ПРИМЕРА 1.
ESI-TOF-MS
Рассчитанное значение: 8238,94
Установленное значение: 8238,69
ТЕСТОВЫЙ ПРИМЕР 1
In vitro анализ
Используя набор Amaxa Cell Line Nucleofector Kit L в Nucleofector II (Lonza), 10 мкМ олигомеров РМО с № 1-8 настоящего изобретения и антисмыслового олигомера РМО с № 11 трансфецировали в 4×105 клеток RD (линии клеток рабдомиосаркомы человека). Использовали программу Т-030.
После трансфекции клетки культивировали в течение ночи в 2 мл минимальной питательной среды Игла (ЕМЕМ) (производства Sigma, в дальнейшем того же производства), содержащей 10% фетальной телячьей сыворотки (FCS) (производства Invitrogen), в условиях 37°С и 5% СО2. Клетки дважды промывали PBS (производства Nissui, в дальнейшем того же производства) и к клеткам добавляли 500 мкл ISOGEN (производства Nippon Gene). После обеспечения выдерживания клеток при комнатной температуре в течение нескольких минут для лизиса клеток лизат получали в пробирке Eppendorf. Тотальную РНК экстрагировали в соответствии с протоколом, приложенным к ISOGEN. Концентрацию тотальной экстрагированной РНК определяли, используя NonoDrop ND-1000 (производства LMS).
Одностадийную ОТ-ПЦР выполняли с использованием 400 нг экстрагированной тотальной РНК, используя набор Titan One Tube RT-PCR Kit (производства Roche). Реакционный раствор готовили в соответствии с протоколом, приложенным к набору. РТС-100 (производства MJ Research) использовали в качестве термоциклера. Используемой программой для ОТ-ПЦР является следующая программа.
50°С, 30 мин: обратная транскрипция
94°С, 2 мин: тепловая денатурация
[94°С, 10 секунд, 58οС, 30 секунд, 68°С, 45 секунд] × 30 циклов: амплификация с помощью ПЦР
68°С, 7 мин: конечная элонгация
Ниже приведены нуклеотидные последовательности прямого и обратного праймеров, используемых для ОТ-ПЦР.
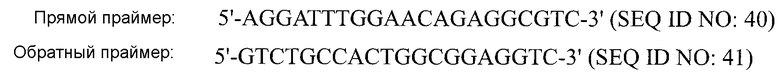
Затем выполняли «вложенную» ПЦР с использованием продукта, амплифицированного с помощью ОТ-ПЦР выше, используя Taq ДНК-полимеразу (производства Roche). Используемой программой для ПЦР является следующая программа.
94°С, 2 мин: тепловая денатурация
[94°С, 15 секунд, 58οС, 30 секунд, 68οС, 45 секунд] × 30 циклов: амплификация с помощью ПЦР
68°С, 7 мин: конечная элонгация
Ниже приведены нуклеотидные последовательности прямого и обратного праймеров, используемых для «вложенной» ПЦР выше.
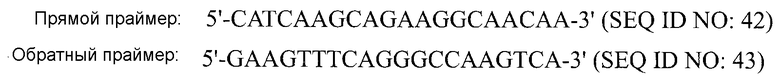
1 мкл продукта реакции «вложенной» ПЦР выше анализировали, используя Bioanalyzer (производства Agilent Technologies, Inc.).
Определяли уровень «А» полинуклеотидной полосы в случае, когда экзон 53 пропущен, и уровень «В» полинуклеотидной полосы в случае, когда экзон 53 не пропущен. На основе этих величин измерений «А» и «В» эффективность пропуска рассчитывали согласно следующему уравнению:
Эффективность пропуска (%) = A/(A+B)×100
Экспериментальные результаты
Результаты представлены на фиг. 1. В результате этого эксперимента обнаружено, что олигомеры РМО с № 1-8 настоящего изобретения являлись причиной пропуска экзона 53 со значительно более высокой эффективностью, чем антисмысловой олигомер РМО с № 11. В частности, олигомеры с № 3 и 8 настоящего изобретения продемонстрировали эффективность пропуска экзона, превышающую в более чем четыре раза таковую антисмыслового олигомера РМО с № 11.
ТЕСТОВЫЙ ПРИМЕР 2
In vitro анализ с использованием фибробластов человека
Ген myoD человека (SEQ ID NO: 44) вводили в клетки TIG-119 (происходящие из нормальных тканей человека фибробласты, National Institute of Biomedical Innovation) или клетки 5017 (происходящие от пациента с DMD фибробласты, Coriell Institute for Medical Research), используя коэкспрессионный ретровирусный вектор ZsGreeen1.
После инкубации в течение 4-5 дней ZsGreen-положительные, myoD-трансформированные фибробласты выделяли с помощью FACS и засевали в количестве 5×104/см2 в 12-луночный планшет. В качестве среды для роста использовали 1 мл модифицированной Дульбекко среды Игла: питательной среды F-12 (DMEM/F-12) (Invitrogen Corp.), содержащей 10% FCS и 1% пенициллина/стрептомицина (P/S) (Sigma-Aldrich, Inc.),
Через 24 часа среду заменяли средой для дифференциации (DMEM/F-12, содержащей 2% лошадиной сыворотки (Invitrogen Corp.), 1% P/S и добавку к жидким средам ITS (Sigma, Inc.). Среду меняли каждые 2-3 дня и инкубацию продолжали в течение 12-14 дней для дифференциации в мышечные трубочки.
Впоследствии эту среду для дифференциации заменяли средой для дифференциации, содержащей 6 мкМ Endo-Porter (Gene Tools), и к ней добавляли морфолино олигомер в конечной концентрации, составляющей 10 мкМ. После инкубации в течение 48 часов тотальную РНК экстрагировали из клеток, используя Тризол (производства Invitrogen Corp.). ОТ-ПЦР выполняли с использованием 50 нг экстрагированной тотальной РНК, используя набор QIAGEN OneStep RT-PCR Kit. Реакционный раствор готовили в соответствии с протоколом, приложенным к набору. iCycler (производства Bio-Rad) использовали в качестве термоциклера. Используемой программой для ОТ-ПЦР является следующая программа.
50°С, 30 мин: обратная транскрипция
95°С, 15 мин: тепловая денатурация
[94°С, 1 мин, 60°С, 1 мин, 72οС, 1 мин] × 35 циклов: амплификация с помощью ПЦР
72°С, 7 мин: конечная элонгация
Используемыми праймерами были hEX51F и hEX55R.
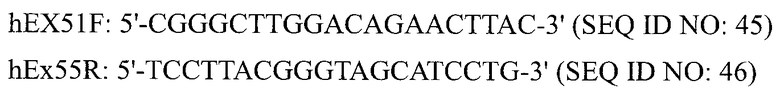
Продукты реакции ОТ-ПЦР выше разделяли с помощью электрофореза в 2% агарозном геле и изображения гелей фиксировали с помощью GeneFlash (Syngene). Используя Image J (производства National Institutes of Health), определяли уровень «А» полинуклеотидной полосы в случае, когда экзон 53 пропущен, и уровень «В» полинуклеотидной полосы в случае, когда экзон 53 не пропущен. На основе этих величин измерений «А» и «В» эффективность пропуска рассчитывали согласно следующему уравнению:
Эффективность пропуска (%) = A/(A+B)×100
Экспериментальные результаты
Результаты представлены на фиг. 2 и 3. В результате этого эксперимента обнаружено, что в клетках TIG-119 все олигомеры РМО с № 3, 8 и 9 настоящего изобретения (фиг. 2) являлись причиной пропуска экзона 53 с большей эффективностью, чем антисмысловой олигомер РМО с № 12 (фиг. 2). В частности, олигомеры с № 3 и 8 настоящего изобретения продемонстрировали эффективность пропуска экзона, превышающую в более чем два раза таковую антисмыслового олигомера РМО с № 12 (фиг. 2).
Кроме того, в результате этого эксперимента обнаружено, что оба олигомеры РМО с № 3 и 8 настоящего изобретения (фиг. 3) являлись причиной пропуска экзона 53 с большей эффективностью, чем антисмысловой олигомер РМО с № 12 (фиг. 3). В частности, олигомеры с № 3 и 8 настоящего изобретения продемонстрировали эффективность пропуска экзона, превышающую в более чем семь раз таковую антисмыслового олигомера РМО с № 12 (фиг. 3).
ТЕСТОВЫЙ ПРИМЕР 3
In vitro анализ с использованием фибробластов человека
Линию клеток фибробластов кожи (фибробластов от являющегося человеком пациента с DMD (с делецией экзонов 45-52 или экзонов 48-52)) устанавливали с помощью биопсии из срединной части левого плеча пациента с DMD с делецией экзонов 45-52 или пациента с DMD с делецией экзонов 48-52. Ген myoD человека (SEQ ID NO: 44) вводили в фибробласты, используя коэкспрессионный ретровирусный вектор ZsGreeen1.
После инкубации в течение 4-5 дней ZsGreen-положительные, myoD-трансформированные фибробласты выделяли с помощью FACS и засевали в количестве 5×104/см2 в 12-луночный планшет. В качестве среды для роста использовали 1 мл модифицированной Дульбекко среды Игла: питательной среды F-12 (DMEM/F-12) (Invitrogen Corp.), содержащей 10% FCS и 1% пенициллина/стрептомицина (P/S) (Sigma-Aldrich, Inc.),
Через 24 часа среду заменяли средой для дифференциации (DMEM/F-12, содержащей 2% лошадиной сыворотки (Invitrogen Corp.), 1% P/S и добавку к жидким средам ITS (Sigma, Inc.). Среду меняли каждые 2-3 дня и инкубацию продолжали в течение 12, 14 или 20 дней для дифференциации в мышечные трубочки.
Впоследствии эту среду для дифференциации заменяли средой для дифференциации, содержащей 6 мкМ Endo-Porter (Gene Tools), и к ней добавляли морфолино олигомер в конечной концентрации, составляющей 10 мкМ. После инкубации в течение 48 часов тотальную РНК экстрагировали из клеток, используя Тризол (производства Invitrogen Corp.). ОТ-ПЦР выполняли с использованием 50 нг экстрагированной тотальной РНК, используя набор QIAGEN OneStep RT-PCR Kit. Реакционный раствор готовили в соответствии с протоколом, приложенным к набору. iCycler (производства Bio-Rad) использовали в качестве термоциклера. Используемой программой для ОТ-ПЦР является следующая программа.
50°С, 30 мин: обратная транскрипция
95°С, 15 мин: тепловая денатурация
[94°С, 1 мин, 60°С, 1 мин, 72οС, 1 мин] × 35 циклов: амплификация с помощью ПЦР
72°С, 7 мин: конечная элонгация
Используемыми праймерами были hEx44F и hEx55R.
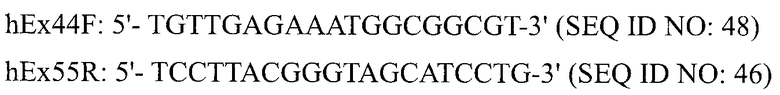
Продукты реакции ОТ-ПЦР выше разделяли с помощью электрофореза в 2% агарозном геле и изображения гелей фиксировали с помощью GeneFlash (Syngene). Используя Image J (производства National Institutes of Health), определяли уровень «А» полинуклеотидной полосы в случае, когда экзон 53 пропущен, и уровень «В» полинуклеотидной полосы в случае, когда экзон 53 не пропущен. На основе этих величин измерений «А» и «В» эффективность пропуска рассчитывали согласно следующему уравнению:
Эффективность пропуска (%) = A/(A+B)×100
Экспериментальные результаты
Результаты представлены на фиг. 4 и 5. В результате этого эксперимента обнаружено, что олигомеры РМО с № 3 и 8 настоящего изобретения являлись причиной пропуска экзона 53 с эффективностью вплоть до 80% в клетках от пациента с DMD с делецией экзонов 45-52 (фиг. 4) или с делецией экзонов 48-52 (фиг. 5). Также установлено, что олигомеры РМО с № 3 и 8 настоящего изобретения являются причиной пропуска экзона 53 с большей эффективностью, чем антисмысловой олигомер РМО с № 15 в клетках от пациента с DMD с делецией экзонов 45-52 (фиг. 4).
ТЕСТОВЫЙ ПРИМЕР 4
Вестерн-блоттинг
Олигомер РМО с № 8 настоящего изобретения добавляли к клеткам в концентрации, составляющей 10 мкМ, и белки экстрагировали из клеток спустя 72 часа, используя буфер RIRA (производства Thermo Fisher Scientific), содержащий Complete Mini (производства Roche Applied Science), и измеряли, используя набор для исследования белков BCA (производства Thermo Fisher Scientific). Белки разделяли с помощью электрофореза в 3-8% геле в Трис-ацетатном буфере NuPAGE (производства Invitrogen) при 150 В в течение 75 минут и переносили на мембрану PVDF (производства Millipore), используя устройство для «полусухого» блоттинга. Мембрану PVDF блокировали с использованием 5% агента для блокирования ECL (производства GE Heathcare), в затем мембрану инкубировали в растворе антитела против дистрофина (производства NCL-Dys1, Novocastra). После дальнейшей инкубации в растворе конъюгированного с пероксидазой козьего антитела против IgG мыши (модель № 170-6516, Bio-Rad) мембрану окрашивали с использованием системы для Вестерн-блоттинга ECL Plus (производства GE Healthcare).
Иммуноокрашивание
К клеткам добавляли олигомер РМО с № 3 или 8. Через 72 часа клетки фиксировали в 3% параформальдегиде в течение 10 минут с последующей инкубацией в 10% Triton-Х в течение 10 минут. После блокирования в PBS, содержащем 10% козьей сыворотки, мембрану инкубировали в растворе антитела против дистрофина (производства NCL-Dys1, Novocastra). Далее мембрану инкубировали в растворе антитела против IgG мыши (производства Invitrogen). Мембрану заключали в реагент Pro Long Gold Antifade (производства Invitrogen) и рассматривали с помощью флуоресцентного микроскопа.
Экспериментальные результаты
Результаты представлены на фиг. 6 и 7. В результате этого эксперимента было подтверждено с помощью Вестерн-блоттинга (фиг. 6) и иммуноокрашивания (фиг. 7), что олигомеры РМО с № 3 и 8 настоящего изобретения индуцируют экспрессию гена дистрофина.
ТЕСТОВЫЙ ПРИМЕР 5
In vitro анализ с использованием фибробластов человека
Этот эксперимент был выполнен, как описано в ТЕСТОВОМ ПРИМЕРЕ 3.
Экспериментальные результаты
Результаты представлены на фиг. 8. В результате этого эксперимента обнаружено, что в клетках от пациентов с DMD с делецией экзонов 45-52 олигомеры РМО с № 3 и 8 настоящего изобретения являлись причиной пропуска экзона 53 с более высокой эффективностью, чем олигомеры РМО с № 13 и 14 настоящего изобретения (фиг. 8).
ТЕСТОВЫЙ ПРИМЕР 6
In vitro анализ
Эксперименты были выполнены, используя антисмысловые олигомеры 2'-О-метокси-фосфоротиоатов (2'-OMe-S-РНК), представленные SEQ ID NO: 49-123. Различные антисмысловые олигомеры, использованные для этого анализа, были приобретены у Japan Bio Services. Ниже представлены последовательности различных антисмысловых олигомеров.
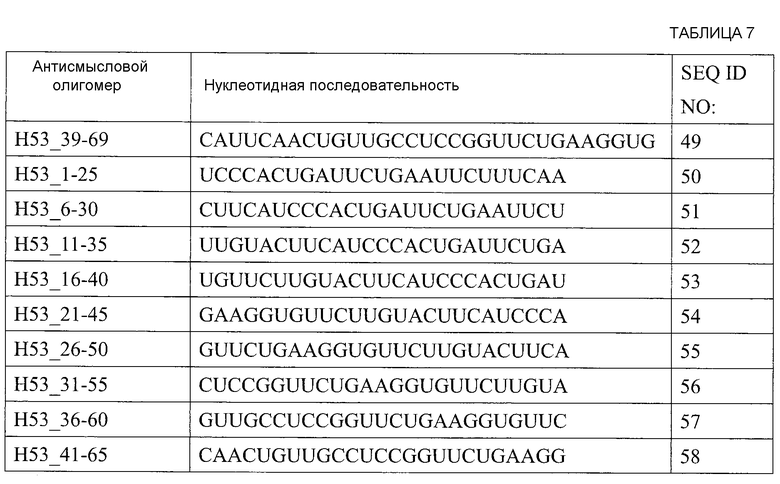

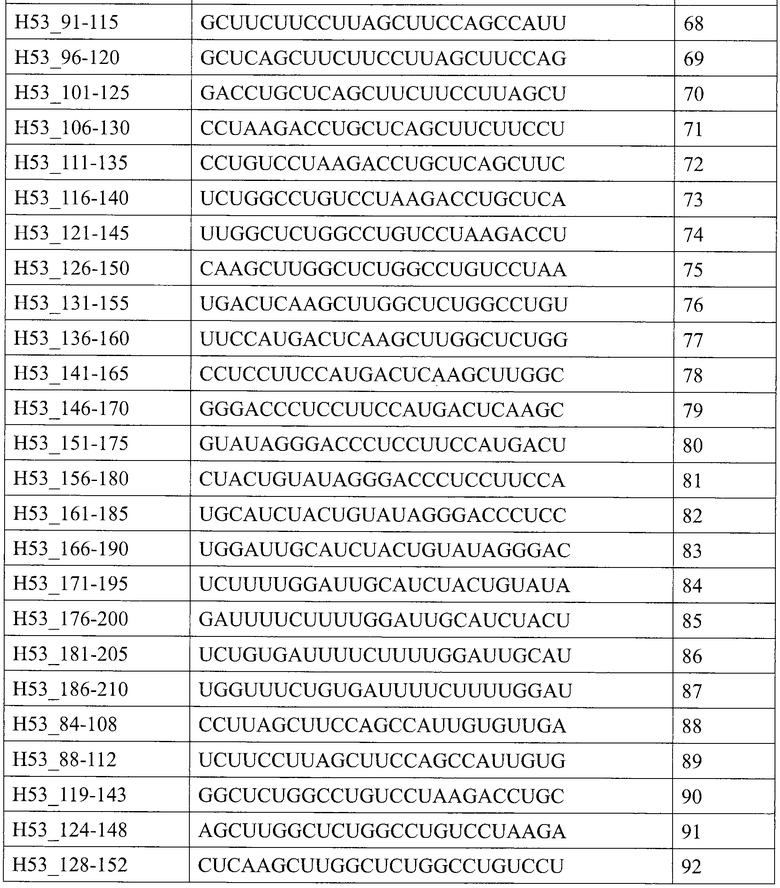
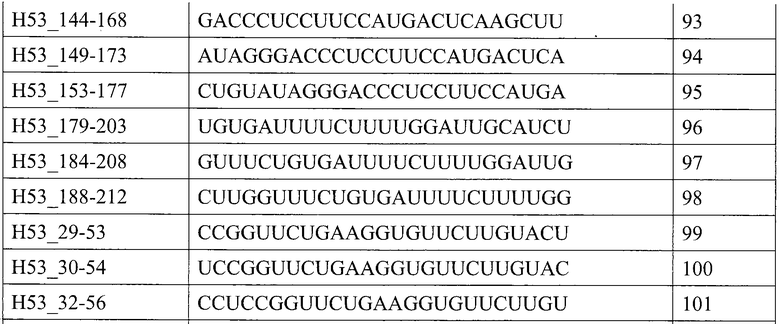
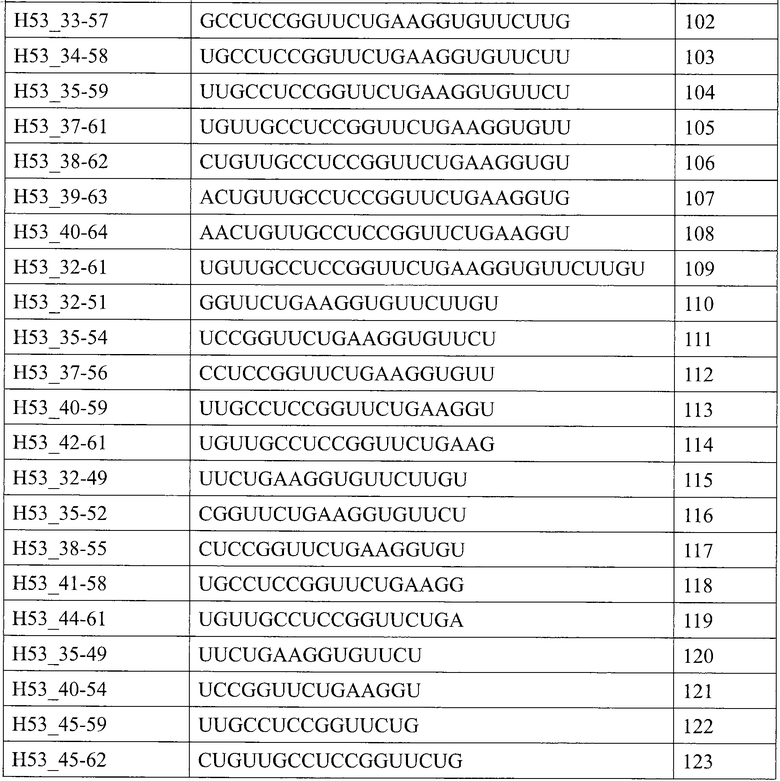
Клетки RD (линии клеток рабдомиосаркомы человека) засевали в количестве 3×105 в 6-луночный планшет и культивировали в 2 мл минимальной питательной среды Игла (ЕМЕМ) (производства Sigma, Inc., в дальнейшем того же производства), содержащей 10% фетальной телячьей сыворотки (FCS) (производства Invitrogen Corp.), в условиях 37°С и 5% СО2 в течение ночи. Готовили комплексы различных антисмысловых олигомеров (Japan Bio Services) (1 мкМ) для пропуска экзона 53 и Липофектамина 2000 (производства Invitrogen Corp.) и 200 мкл добавляли к клеткам RD в случае замены 1,8 мл среды для достижения конечной концентрации, составляющей 100 нМ.
После окончания добавления клетки культивировали в течение ночи. Клетки дважды промывали PBS (производства Nissui в дальнейшем того же производства) и к клеткам добавляли 500 мкл ISOGEN (производства Nippon Gene). После обеспечения выдерживания клеток при комнатной температуре в течение нескольких минут для лизиса клеток лизат получали в пробирке Eppendorf. Тотальную РНК экстрагировали в соответствии с протоколом, приложенным к ISOGEN. Концентрацию тотальной экстрагированной РНК определяли, используя NonoDrop ND-1000 (производства LMS).
Одностадийную ОТ-ПЦР выполняли с использованием 400 нг экстрагированной тотальной РНК, используя набор Titan One Tube RT-PCR Kit (производства Roche). Реакционный раствор готовили в соответствии с протоколом, приложенным к набору. РТС-100 (производства MJ Research) использовали в качестве термоциклера. Используемой программой для ОТ-ПЦР является следующая программа.
50°С, 30 мин: обратная транскрипция
94°С, 2 мин: тепловая денатурация
[94°С, 10 секунд, 58°С, 30 секунд, 68°С, 45 секунд] × 30 циклов: амплификация с помощью ПЦР
68°С, 7 мин: конечная элонгация
Ниже приведены нуклеотидные последовательности прямого и обратного праймеров, используемых для ОТ-ПЦР.
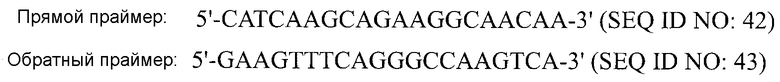
Впоследствии выполняли «вложенную» ПЦР с использованием продукта, амплифицированного с помощью ОТ-ПЦР выше, используя Taq ДНК-полимеразу (производства Roche). Используемой программой для ПЦР является следующая программа.
94°С, 2 мин: тепловая денатурация
[94°С, 15 секунд, 58°С, 30 секунд, 68°С, 45 секунд] × 30 циклов: амплификация с помощью ПЦР
68°С, 7 мин: конечная элонгация
Ниже приведены нуклеотидные последовательности прямого и обратного праймеров, используемых для «вложенной» ПЦР выше.
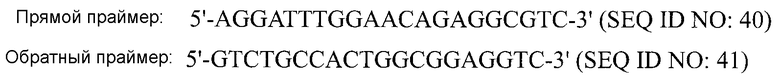
1 мкл продукта реакции «вложенной» ПЦР выше анализировали, используя Bioanalyzer (производства Agilent Technologies, Inc.).
Определяли уровень «А» полинуклеотидной полосы в случае, когда экзон 53 пропущен, и уровень «В» полинуклеотидной полосы в случае, когда экзон 53 не пропущен. На основе этих величин измерений «А» и «В» эффективность пропуска определяли согласно следующему уравнению:
Эффективность пропуска (%) = A/(A+B)×100
Экспериментальные результаты
Результаты представлены на фиг. 9-17. В результате этого эксперимента обнаружено, что, когда антисмысловые олигомеры были рассчитаны на нуклеотиды 31-61 с 5'-конца экзона 53 в гене дистрофина человека, пропуск экзона 53 мог вызываться с высокой эффективностью.
ТЕСТОВЫЙ ПРИМЕР 7
Используя набор Amaxa Cell Line Nucleofector Kit L в Nucleofector II (Lonza), 0,3-30 мкМ антисмысловых олигомеров трансфецировали в 3,5×105 клеток RD (линии клеток рабдомиосаркомы человека). Использовали программу Т-030.
После трансфекции клетки культивировали в течение ночи в 2 мл минимальной питательной среды Игла (ЕМЕМ) (производства Sigma, в дальнейшем того же производства), содержащей 10% фетальной телячьей сыворотки (FCS) (производства Invitrogen Corp.), в условиях 37°С и 5% СО2. Клетки дважды промывали PBS (производства Nissui, в дальнейшем того же производства) и к клеткам добавляли 500 мкл ISOGEN (производства Nippon Gene). После обеспечения выдерживания клеток при комнатной температуре в течение нескольких минут для лизиса клеток лизат получали в пробирке Eppendorf. Тотальную РНК экстрагировали в соответствии с протоколом, приложенным к ISOGEN. Концентрацию тотальной экстрагированной РНК определяли, используя NonoDrop ND-1000 (производства LMS).
Одностадийную ОТ-ПЦР выполняли с использованием 400 нг экстрагированной тотальной РНК, используя набор QIAGEN OneStep RT-PCR Kit (производства Qiagen, Inc.). Реакционный раствор готовили в соответствии с протоколом, приложенным к набору. РТС-100 (производства MJ Research) использовали в качестве термоциклера. Используемой программой для ОТ-ПЦР является следующая программа.
50°С, 30 мин: обратная транскрипция
95°С, 15 мин: тепловая денатурация
[94°С, 30 секунд, 60°С, 30 секунд, 72°С, 1 мин] × 35 циклов: амплификация с помощью ПЦР
72°С, 10 мин: конечная элонгация
Ниже приведены нуклеотидные последовательности прямого и обратного праймеров, используемых для ОТ-ПЦР.
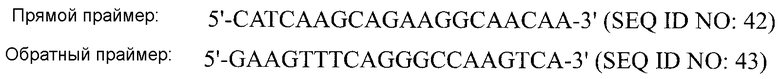
1 мкл продукта реакции ПЦР выше анализировали, используя Bioanalyzer (производства Agilent Technologies, Inc.).
Определяли уровень «А» полинуклеотидной полосы в случае, когда экзон 53 пропущен, и уровень «В» полинуклеотидной полосы в случае, когда экзон 53 не пропущен. На основе этих величин измерений «А» и «В» эффективность пропуска определяли согласно следующему уравнению:
Эффективность пропуска (%) = A/(A+B)×100
Экспериментальные результаты
Результаты представлены на фиг. 18 и 19. В результате этого эксперимента обнаружено, что олигомер РМО с № 8 настоящего изобретения являлся причиной пропуска экзона 53 со значительно более высокой эффективностью, чем антисмысловые олигомеры РМО с № 15 и 16 (фиг. 18). Также обнаружено, что олигомеры с № 3 и 8 настоящего изобретения являлись причиной пропуска экзона 53 со значительно более высокой эффективностью, чем олигомеры РМО с № 13 и 14 настоящего изобретения (фиг. 19), Эти результаты указывали на то, что последовательности с группой -ОН на 5'-конце обеспечивают большую эффективность пропуска даже в случае одинаковых последовательностей.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Экспериментальные результаты в ТЕСТОВЫХ ПРИМЕРАХ служат доказательством того, что во всех клеточных окружениях все олигомеры настоящего изобретения (РМО с № 1-10) являлись причиной пропуска экзона 53 со значительной большей эффективностью, чем олигомеры (РМО с № 11, 12, 15 и 16) в соответствии с известным уровнем техники. Используемыми в ТЕСТОВОМ ПРИМЕРЕ 2 клетками 5017 являются клетки, изолированные от пациентов с DMD, а используемыми в ТЕСТОВЫХ ПРИМЕРАХ 3 и 5 фибробластами являются клетки от пациентов с DMD, являющиеся мишенью для пропуска экзона 53. В частности, в ТЕСТОВЫХ ПРИМЕРАХ 3 и 5 олигомеры настоящего изобретения демонстрируют эффективность пропуска экзона 53, составляющую 90% или более в клетках от пациентов с DMD, которые являются мишенью для пропуска экзона 53. Следовательно, олигомеры настоящего изобретения могут индуцировать пропуск экзона 53 с высокой эффективностью при введении пациентам с DMD.
Следовательно, олигомеры настоящего изобретения очень полезны для лечения DMD.
Список последовательностей в виде текста нестандартного формата
SEQ ID NO: 2: синтетическая нуклеиновая кислота
SEQ ID NO: 3: синтетическая нуклеиновая кислота
SEQ ID NO: 4: синтетическая нуклеиновая кислота
SEQ ID NO: 5: синтетическая нуклеиновая кислота
SEQ ID NO: 6: синтетическая нуклеиновая кислота
SEQ ID NO: 7: синтетическая нуклеиновая кислота
SEQ ID NO: 8: синтетическая нуклеиновая кислота
SEQ ID NO: 9: синтетическая нуклеиновая кислота
SEQ ID NO: 10: синтетическая нуклеиновая кислота
SEQ ID NO: 11: синтетическая нуклеиновая кислота
SEQ ID NO: 12: синтетическая нуклеиновая кислота
SEQ ID NO: 13: синтетическая нуклеиновая кислота
SEQ ID NO: 14: синтетическая нуклеиновая кислота
SEQ ID NO: 15: синтетическая нуклеиновая кислота
SEQ ID NO: 16: синтетическая нуклеиновая кислота
SEQ ID NO: 17: синтетическая нуклеиновая кислота
SEQ ID NO: 18: синтетическая нуклеиновая кислота
SEQ ID NO: 19: синтетическая нуклеиновая кислота
SEQ ID NO: 20: синтетическая нуклеиновая кислота
SEQ ID NO: 21: синтетическая нуклеиновая кислота
SEQ ID NO: 22: синтетическая нуклеиновая кислота
SEQ ID NO: 23: синтетическая нуклеиновая кислота
SEQ ID NO: 24: синтетическая нуклеиновая кислота
SEQ ID NO: 25: синтетическая нуклеиновая кислота
SEQ ID NO: 26: синтетическая нуклеиновая кислота
SEQ ID NO: 27: синтетическая нуклеиновая кислота
SEQ ID NO: 28: синтетическая нуклеиновая кислота
SEQ ID NO: 29: синтетическая нуклеиновая кислота
SEQ ID NO: 30: синтетическая нуклеиновая кислота
SEQ ID NO: 31: синтетическая нуклеиновая кислота
SEQ ID NO: 32: синтетическая нуклеиновая кислота
SEQ ID NO: 33: синтетическая нуклеиновая кислота
SEQ ID NO: 34: синтетическая нуклеиновая кислота
SEQ ID NO: 35: синтетическая нуклеиновая кислота
SEQ ID NO: 36: синтетическая нуклеиновая кислота
SEQ ID NO: 37: синтетическая нуклеиновая кислота
SEQ ID NO: 38: синтетическая нуклеиновая кислота
SEQ ID NO: 39: синтетическая нуклеиновая кислота
SEQ ID NO: 40: синтетическая нуклеиновая кислота
SEQ ID NO: 41: синтетическая нуклеиновая кислота
SEQ ID NO: 42: синтетическая нуклеиновая кислота
SEQ ID NO: 43: синтетическая нуклеиновая кислота
SEQ ID NO: 44: синтетическая нуклеиновая кислота
SEQ ID NO: 45: синтетическая нуклеиновая кислота
SEQ ID NO: 46: синтетическая нуклеиновая кислота
SEQ ID NO: 47: синтетическая нуклеиновая кислота
SEQ ID NO: 48: синтетическая нуклеиновая кислота
SEQ ID NO: 49: синтетическая нуклеиновая кислота
SEQ ID NO: 50: синтетическая нуклеиновая кислота
SEQ ID NO: 51: синтетическая нуклеиновая кислота
SEQ ID NO: 52: синтетическая нуклеиновая кислота
SEQ ID NO: 53: синтетическая нуклеиновая кислота
SEQ ID NO: 54: синтетическая нуклеиновая кислота
SEQ ID NO: 55: синтетическая нуклеиновая кислота
SEQ ID NO: 56: синтетическая нуклеиновая кислота
SEQ ID NO: 57: синтетическая нуклеиновая кислота
SEQ ID NO: 58: синтетическая нуклеиновая кислота
SEQ ID NO: 59: синтетическая нуклеиновая кислота
SEQ ID NO: 60: синтетическая нуклеиновая кислота
SEQ ID NO: 61: синтетическая нуклеиновая кислота
SEQ ID NO: 62: синтетическая нуклеиновая кислота
SEQ ID NO: 63: синтетическая нуклеиновая кислота
SEQ ID NO: 64: синтетическая нуклеиновая кислота
SEQ ID NO: 65: синтетическая нуклеиновая кислота
SEQ ID NO: 66: синтетическая нуклеиновая кислота
SEQ ID NO: 67: синтетическая нуклеиновая кислота
SEQ ID NO: 68: синтетическая нуклеиновая кислота
SEQ ID NO: 69: синтетическая нуклеиновая кислота
SEQ ID NO: 70: синтетическая нуклеиновая кислота
SEQ ID NO: 71: синтетическая нуклеиновая кислота
SEQ ID NO: 72: синтетическая нуклеиновая кислота
SEQ ID NO: 73: синтетическая нуклеиновая кислота
SEQ ID NO: 74: синтетическая нуклеиновая кислота
SEQ ID NO: 75: синтетическая нуклеиновая кислота
SEQ ID NO: 76: синтетическая нуклеиновая кислота
SEQ ID NO: 77: синтетическая нуклеиновая кислота
SEQ ID NO: 78: синтетическая нуклеиновая кислота
SEQ ID NO: 79: синтетическая нуклеиновая кислота
SEQ ID NO: 80: синтетическая нуклеиновая кислота
SEQ ID NO: 81: синтетическая нуклеиновая кислота
SEQ ID NO: 82: синтетическая нуклеиновая кислота
SEQ ID NO: 83: синтетическая нуклеиновая кислота
SEQ ID NO: 84: синтетическая нуклеиновая кислота
SEQ ID NO: 85: синтетическая нуклеиновая кислота
SEQ ID NO: 86: синтетическая нуклеиновая кислота
SEQ ID NO: 87: синтетическая нуклеиновая кислота
SEQ ID NO: 88: синтетическая нуклеиновая кислота
SEQ ID NO: 89: синтетическая нуклеиновая кислота
SEQ ID NO: 90: синтетическая нуклеиновая кислота
SEQ ID NO: 91: синтетическая нуклеиновая кислота
SEQ ID NO: 92: синтетическая нуклеиновая кислота
SEQ ID NO: 93: синтетическая нуклеиновая кислота
SEQ ID NO: 94: синтетическая нуклеиновая кислота
SEQ ID NO: 95: синтетическая нуклеиновая кислота
SEQ ID NO: 96: синтетическая нуклеиновая кислота
SEQ ID NO: 97: синтетическая нуклеиновая кислота
SEQ ID NO: 98: синтетическая нуклеиновая кислота
SEQ ID NO: 99: синтетическая нуклеиновая кислота
SEQ ID NO: 100: синтетическая нуклеиновая кислота
SEQ ID NO: 101: синтетическая нуклеиновая кислота
SEQ ID NO: 102: синтетическая нуклеиновая кислота
SEQ ID NO: 103: синтетическая нуклеиновая кислота
SEQ ID NO: 104: синтетическая нуклеиновая кислота
SEQ ID NO: 105: синтетическая нуклеиновая кислота
SEQ ID NO: 106: синтетическая нуклеиновая кислота
SEQ ID NO: 107: синтетическая нуклеиновая кислота
SEQ ID NO: 108: синтетическая нуклеиновая кислота
SEQ ID NO: 109: синтетическая нуклеиновая кислота
SEQ ID NO: 110: синтетическая нуклеиновая кислота
SEQ ID NO: 111: синтетическая нуклеиновая кислота
SEQ ID NO: 112: синтетическая нуклеиновая кислота
SEQ ID NO: 113: синтетическая нуклеиновая кислота
SEQ ID NO: 114: синтетическая нуклеиновая кислота
SEQ ID NO: 115: синтетическая нуклеиновая кислота
SEQ ID NO: 116: синтетическая нуклеиновая кислота
SEQ ID NO: 117: синтетическая нуклеиновая кислота
SEQ ID NO: 118: синтетическая нуклеиновая кислота
SEQ ID NO: 119: синтетическая нуклеиновая кислота
SEQ ID NO: 120: синтетическая нуклеиновая кислота
SEQ ID NO: 121: синтетическая нуклеиновая кислота
SEQ ID NO: 122: синтетическая нуклеиновая кислота
SEQ ID NO: 123: синтетическая нуклеиновая кислота
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИСМЫСЛОВЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2012 |
|
RU2619184C2 |
| АНТИСМЫСЛОВЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2018 |
|
RU2681470C1 |
| АНТИСМЫСЛОВЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2012 |
|
RU2651468C1 |
| АНТИСМЫСЛОВЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2015 |
|
RU2730681C2 |
| АНТИСМЫСЛОВЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2015 |
|
RU2695430C2 |
| АНТИСМЫСЛОВЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2015 |
|
RU2825834C2 |
| АНТИСМЫСЛОВЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2015 |
|
RU2702424C2 |
| АНТИСМЫСЛОВАЯ НУКЛЕИНОВАЯ КИСЛОТА | 2016 |
|
RU2724554C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИСМЫСЛОВОЙ ОЛИГОНУКЛЕОТИД, И ЕЕ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ МЫШЕЧНОЙ ДИСТРОФИИ ДЮШЕННА | 2019 |
|
RU2799442C2 |
| ОЛИГОНУКЛЕОТИД ДЛЯ ЛЕЧЕНИЯ ПАЦИЕНТОВ С МЫШЕЧНОЙ ДИСТРОФИЕЙ | 2013 |
|
RU2674600C2 |



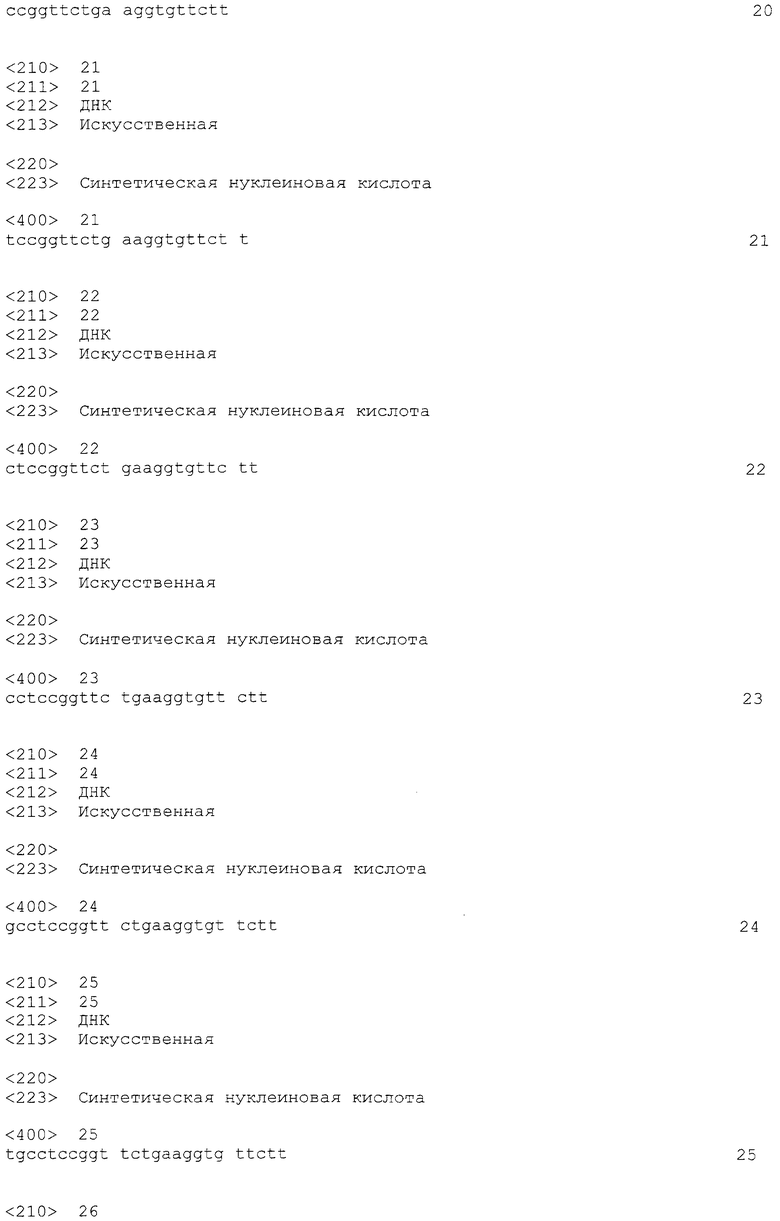


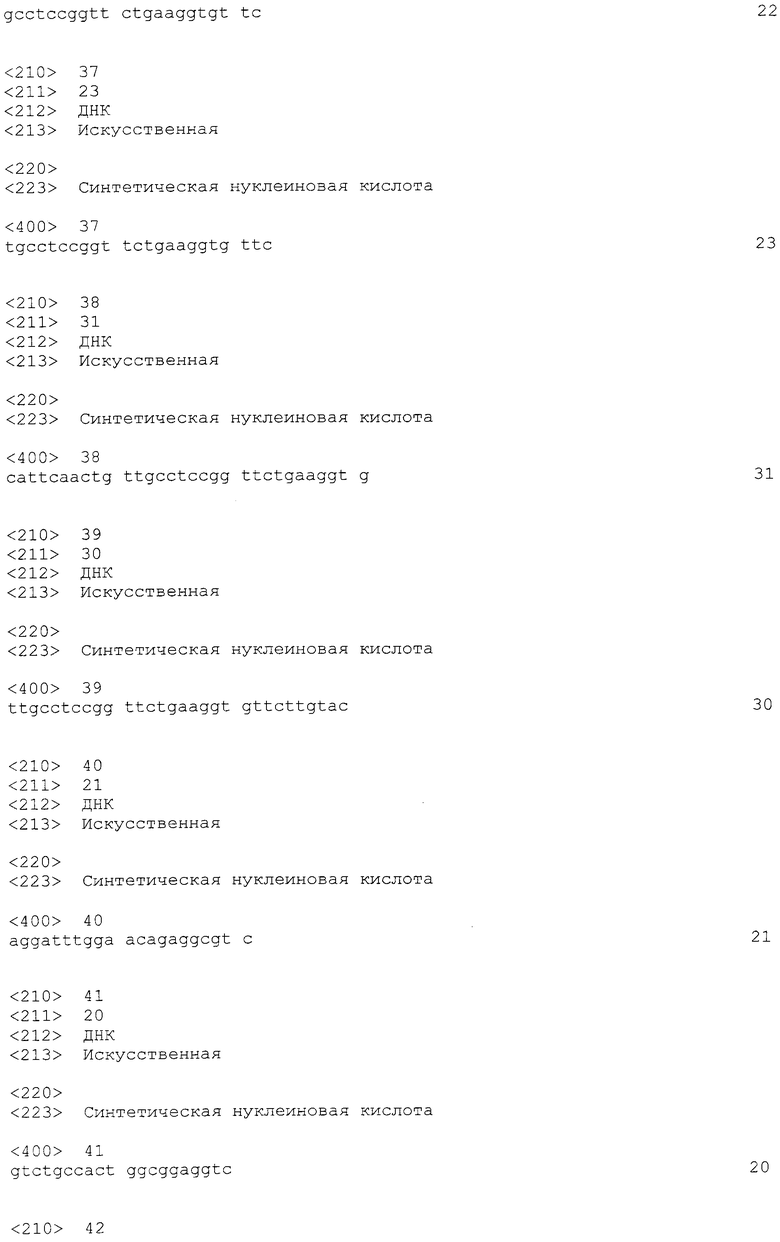
















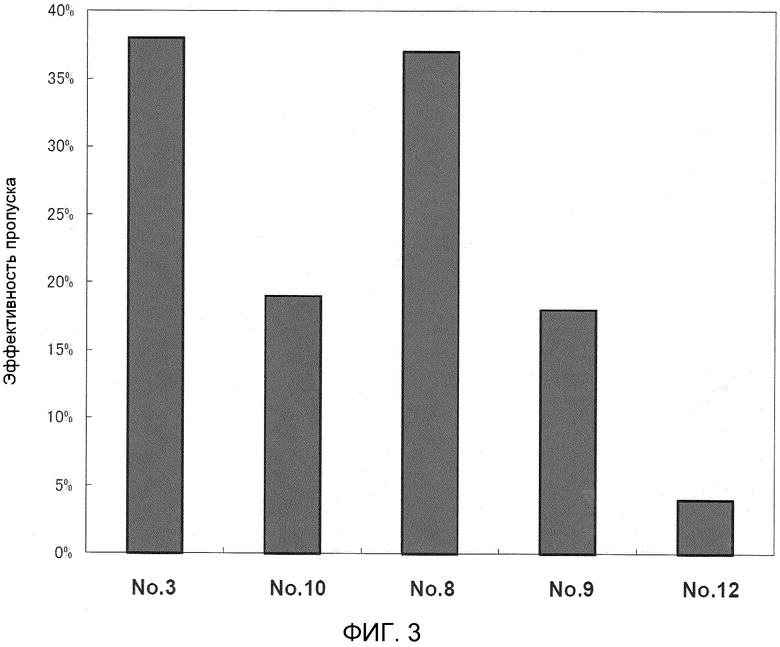
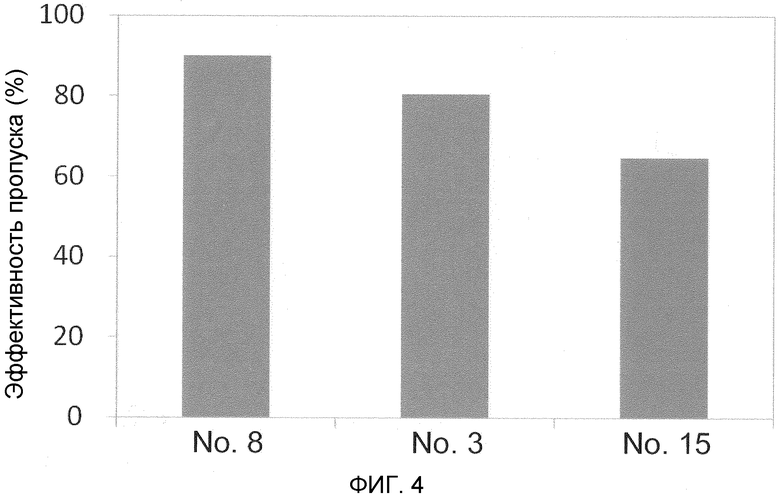
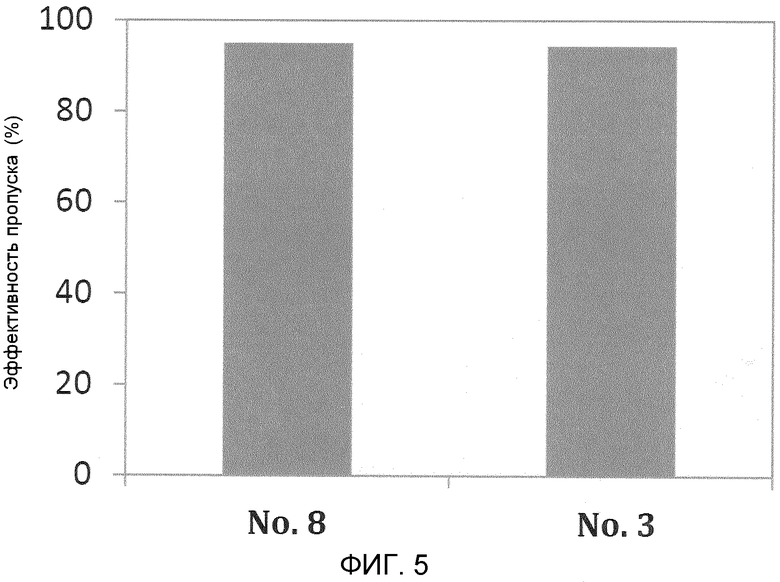
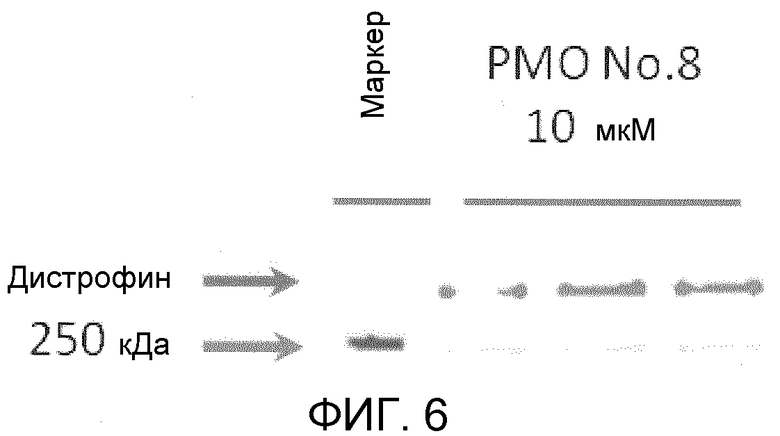
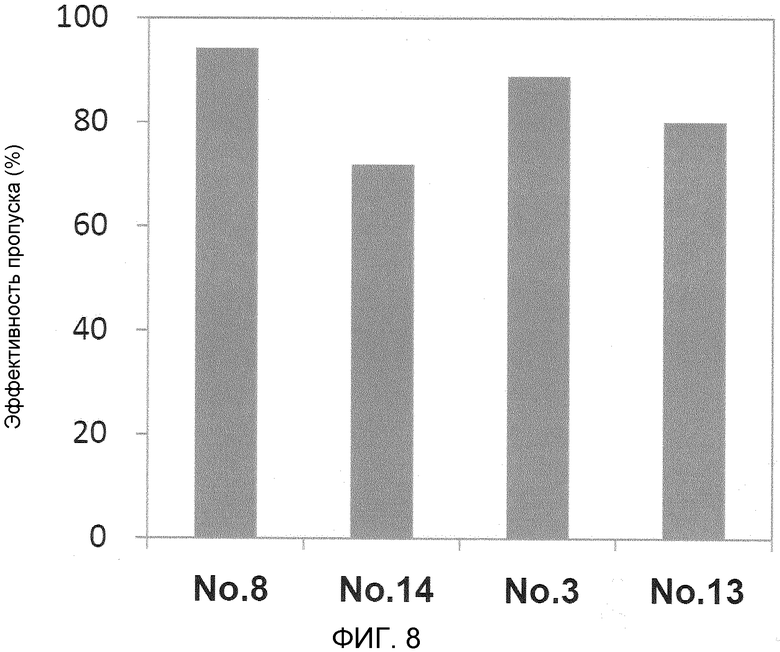
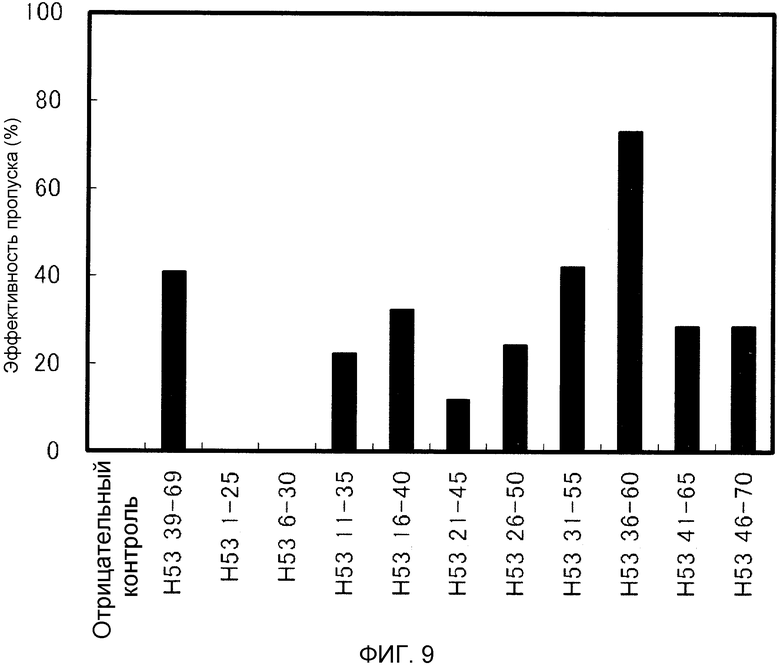
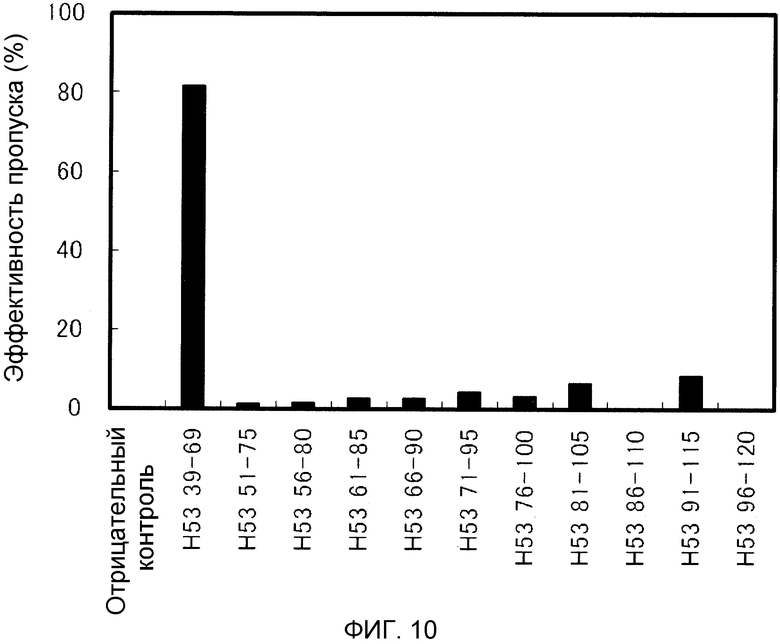
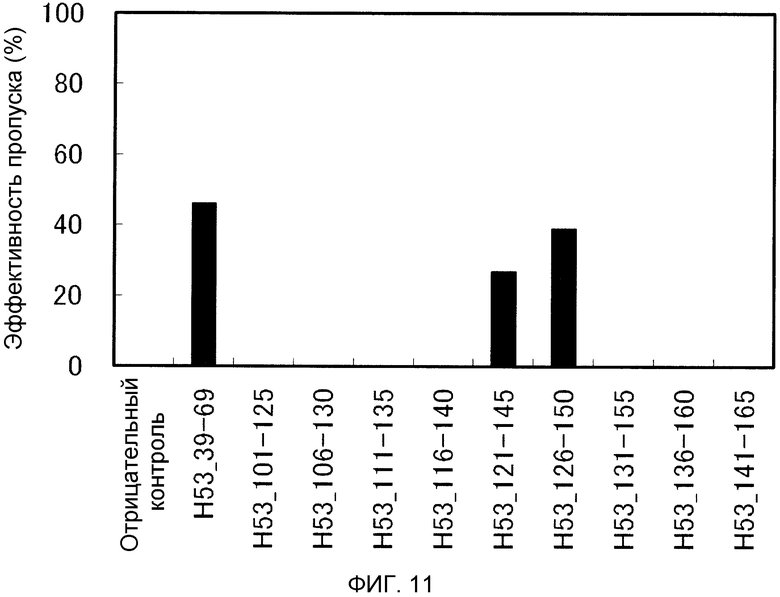
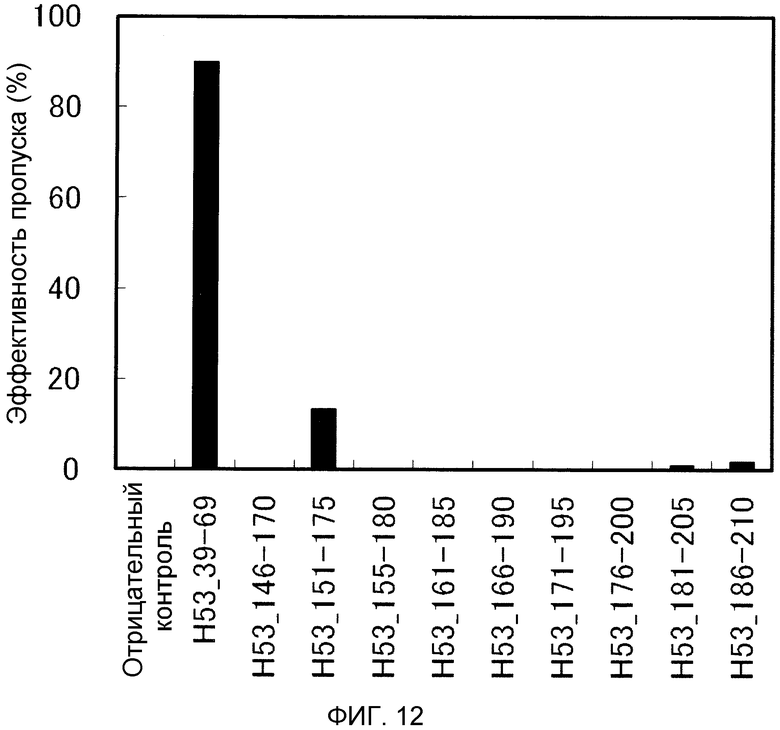
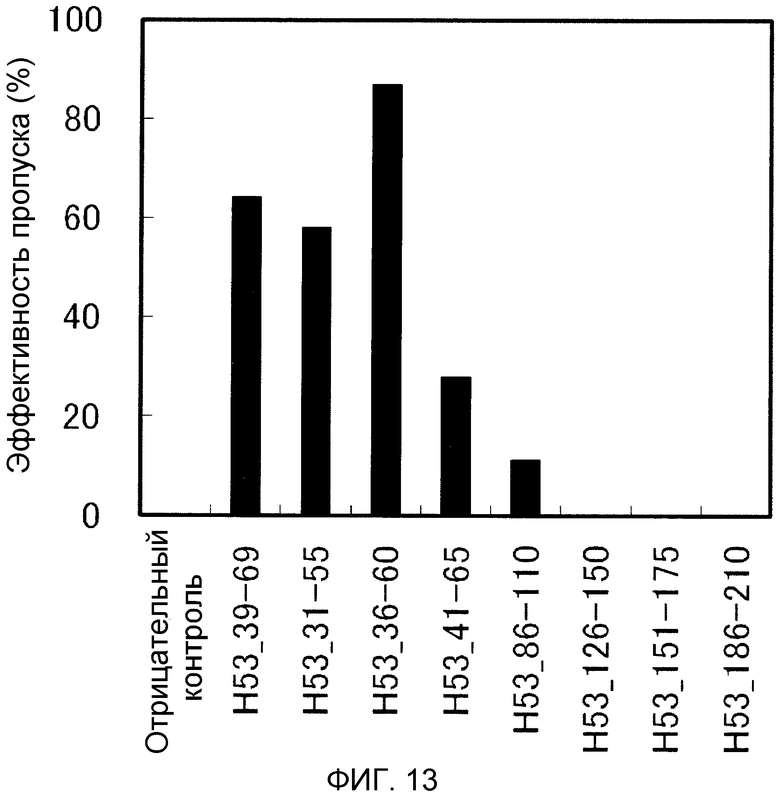
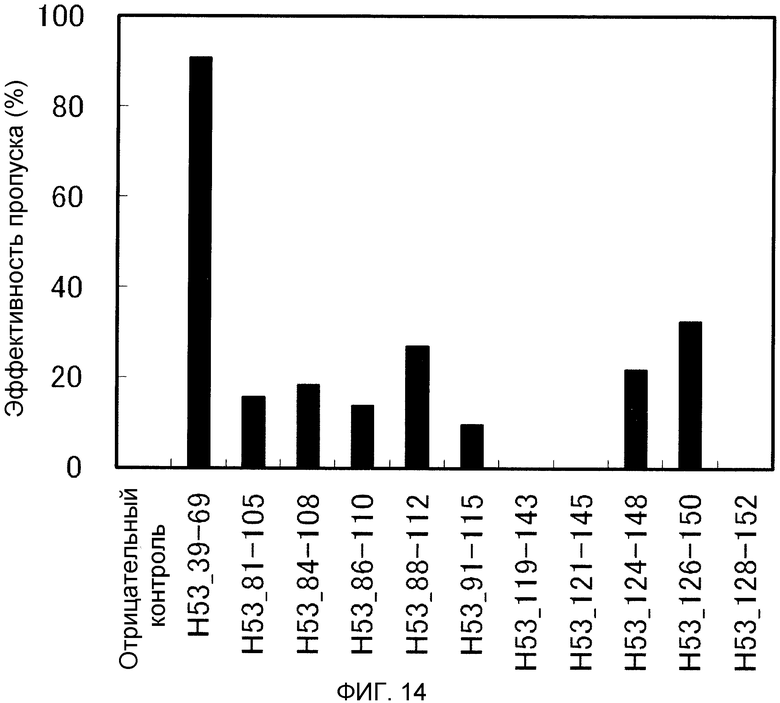
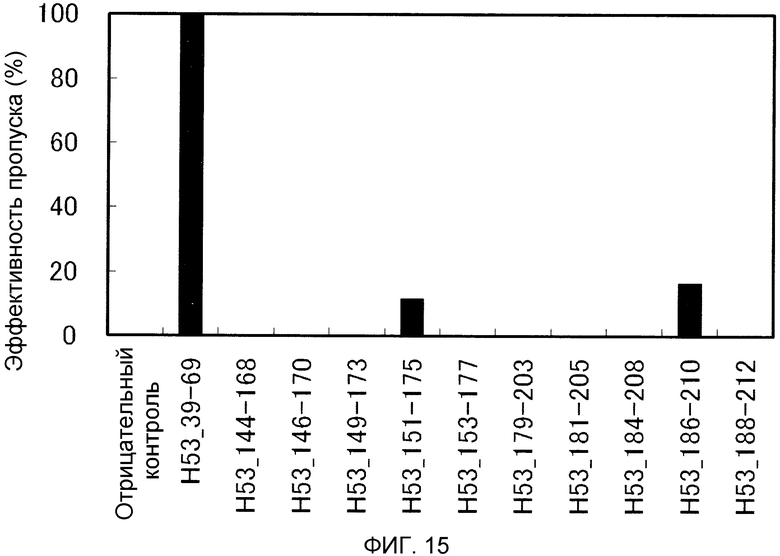
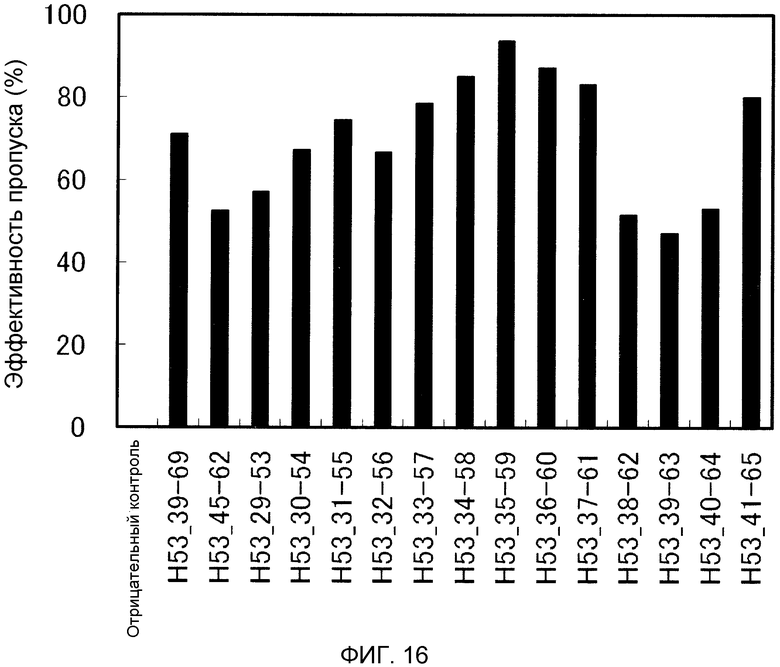
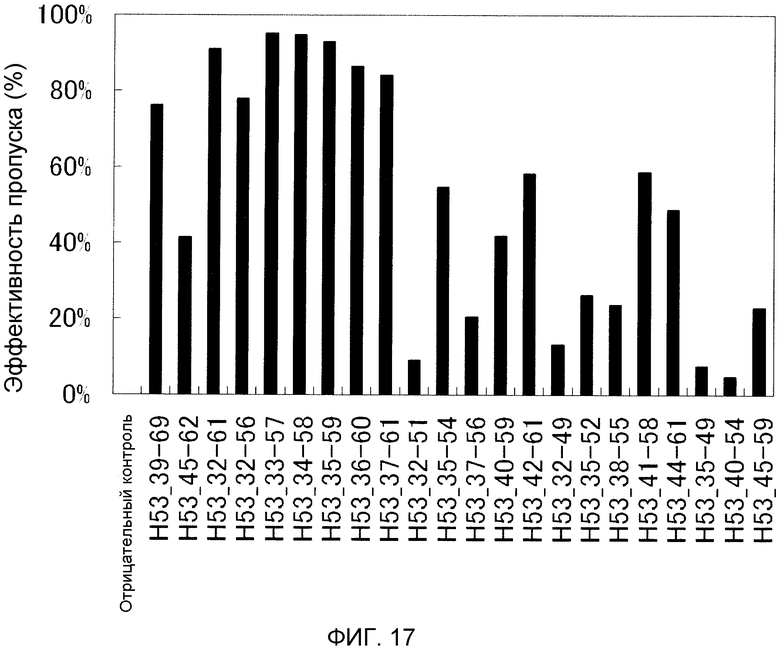
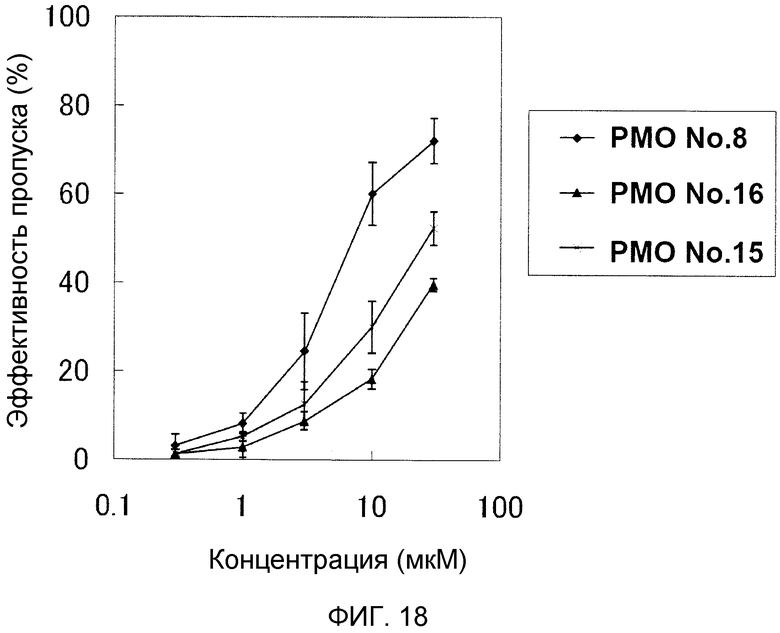
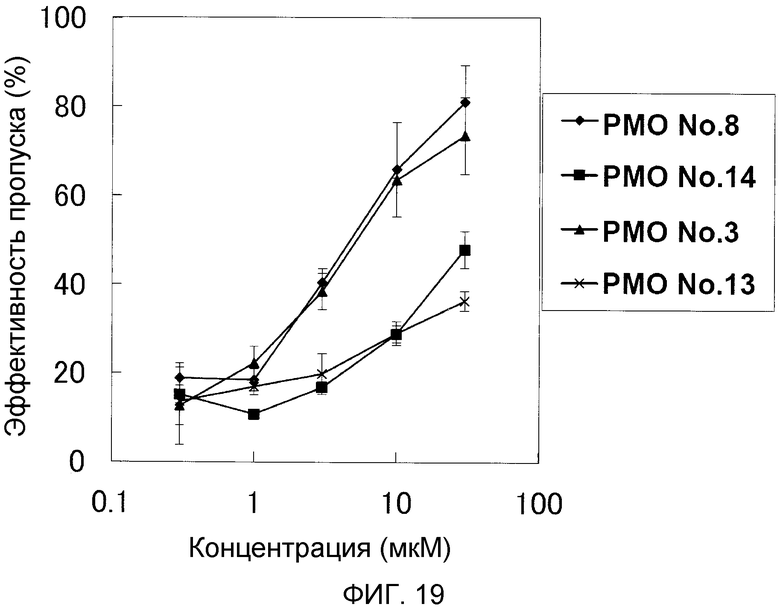
Группа изобретений относится к области биотехнологии, в частности к антисмысловым олигомерам, используемым в качестве активного ингредиента в фармацевтических композициях для лечения мышечной дистрофии. Антисмысловой олигомер состоит из нуклеотидной последовательности, 100% комплементарной нуклеотидной последовательности-мишени или нуклеотидной последовательности, в которой 1 или 2 нуклеотида, не комплементарные нуклеотидной последовательности-мишени, содержатся в нуклеотидной последовательности, 100% комплементарной нуклеотидной последовательности-мишени. Нуклеотидная последовательность-мишень представляет собой любую из последовательностей, состоящую из нуклеотидов с 32-го по 56-й или с 36-го по 56-й с 5′-конца 53-го экзона в гене дистрофина человека. При этом 53-й экзон в гене дистрофина человека обладает нуклеотидной последовательностью, выбранной из (a) и (b): (a) нуклеотидная последовательность SEQ ID NO: 1 и (b) нуклеотидная последовательность, обладающая по меньшей мере 90% идентичностью с нуклеотидной последовательностью SEQ ID NO: 1. Данный олигомер эффективно обеспечивает вызов пропуска 53-го экзона в гене дистрофина человека. 2 н. и 11 з.п. ф-лы, 19 ил., 7 табл., 6 пр.
1. Антисмысловой олигомер, который является причиной пропуска 53-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, 100% комплементарной нуклеотидной последовательности-мишени, или нуклеотидной последовательности, в которой 1 или 2 нуклеотида, не комплементарные нуклеотидной последовательности-мишени, содержатся в нуклеотидной последовательности, 100% комплементарной нуклеотидной последовательности-мишени, где нуклеотидная последовательность-мишень представляет собой любую из последовательностей, состоящую из нуклеотидов с 32-го по 56-й или с 36-го по 56-й с 5′-конца 53-го экзона в гене дистрофина человека, где 53-й экзон в гене дистрофина человека обладает нуклеотидной последовательностью, выбранной из (a) и (b):
(a) нуклеотидная последовательность SEQ ID NO: 1, и
(b) нуклеотидная последовательность, обладающая по меньшей мере 90% идентичностью с нуклеотидной последовательностью SEQ ID NO: 1.
2. Антисмысловой олигомер по п. 1, который представляет собой олигонуклеотид.
3. Антисмысловой олигомер по п. 2, в случае которого сахарная составляющая и/или область соединения через фосфатную группу по крайней мере одного нуклеотида, составляющего олигонуклеотид, является модифицированной.
4. Антисмысловой олигомер по п. 3, в случае которого сахарной составляющей по крайней мере одного нуклеотида, составляющего олигонуклеотид, является рибоза, в которой группа 2'-ОН заменена любой группой, выбираемой из группы, состоящей из OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br и I (где R представляет собой алкил или арил, а R' представляет собой алкилен).
5. Антисмысловой олигомер по п. 3, в случае которого областью соединения через фосфатную группу по крайней мере одного нуклеотида, составляющего олигонуклеотид, является любая область, выбираемая из группы, состоящей из фосфоротиоатной связи, фосфородитиоатной связи, алкилфосфонатной связи, фосфорамидатной связи и боранофосфатной связи.
6. Антисмысловой олигомер по п. 4, в случае которого областью соединения через фосфатную группу по крайней мере одного нуклеотида, составляющего олигонуклеотид, является любая область, выбираемая из группы, состоящей из фосфоротиоатной связи, фосфородитиоатной связи, алкилфосфонатной связи, фосфорамидатной связи и боранофосфатной связи.
7. Антисмысловой олигомер по п. 1, который представляет собой морфолино олигомер.
8. Антисмысловой олигомер по п. 7, который представляет собой морфолино-фосфородиамидатный олигомер.
9. Антисмысловой олигомер по п. 7, в случае которого 5'-концом является любая из групп с химическими формулами (1)-(3) ниже:
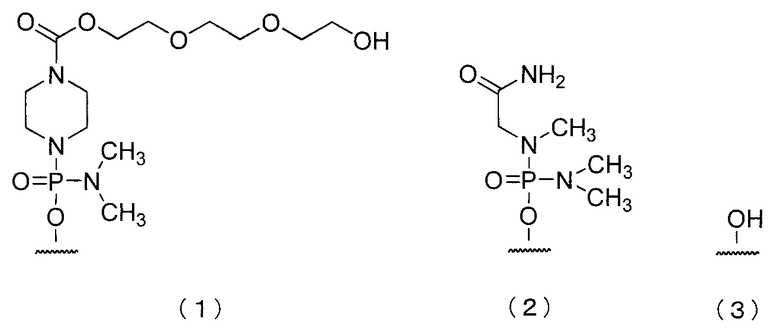
10. Антисмысловой олигомер по п. 8, в случае которого 5'-концом является любая из групп с химическими формулами (1)-(3) ниже:
 .
.
11. Антисмысловой олигомер по любому из пп. 1-10, состоящий из нуклеотидной последовательности, представленной SEQ ID NO: 11 или 35.
12. Фармацевтическая композиция для лечения мышечной дистрофии, включающая в качестве активного ингредиента антисмысловой олигомер по любому из пп. 1-11.
13. Фармацевтическая композиция для лечения мышечной дистрофии по п. 12, которую вводят для лечения мышечной дистрофии Дюшенна.
| US 2010168212 A1 01.07.2010.EP 2135948 A2 23.12.2009.MITRAPANT C et al., By-passing the nonsense mutation in the 4 CV mouse model of muscular dystrophy by induced exon skipping | |||
| J Gene Med | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2015-11-10—Публикация
2011-08-31—Подача