Изобретение относится к области медицины и генной инженерии и может быть использовано для лечения методом суицидной генотерапии вирусного гепатита С (ВГС-инфекции) всех известных субтипов.
В настоящее время проблема борьбы с ВГС-инфекцией (вирусом гепатита типа «С») приобрела глобальный характер из-за распространения вируса практически во всех странах, в том числе и в Российской Федерации, где количество ВГС-инфицированных по официальной оценке приближается к 5 миллионам человек (Богомолов П.О., Оказание медицинской помощи пациентам с хроническим гепатитом «С», Доклад Главного гепатолога МЗ Московской области, 2014). Острый гепатит С в большинстве случаев (в 70-85%) переходит в хроническую инфекцию, которая часто течет бессимптомно первые 10-15 лет, что затрудняет выявление и лечение ВГС. Как установлено, в США продолжительность жизни больных хроническим гепатитом С сокращена на 8-12 лет, если у них не было эффективного курса противовирусной терапии (Center for Disease Control and Prevention. HCV. http://www.cdc.gov/hepatitis/HCV. Accessed 8 Oct 2010). В Российской Федерации почти у 40% пациентов с хроническим гепатитом С через 20-25 лет после инфицирования выявляется цирроз печени (Самохвалов Е.И., Николаева Л.И., Альховский С.В. и др. Частота встречаемости отдельных субтипов вируса гепатита С в Московском регионе. // Вопросы вирусологии. 2013, №1, с. 36-40). Основной целью лечения является уничтожение вируса и предотвращение развития отдаленных осложнений. Успешное лечение определяют как достижение устойчивого вирусологического ответа (УВО), который подтверждается нерегистрируемыми уровнями РНК ВГС (HCV), по меньшей мере, спустя 6 месяцев после прекращения терапии (Pearlman В.L. Hepatitis С treatment update. Am. J. Med. 2004; 117(5): 344-352). Вероятность завершить терапию эффективно, т.е. достичь УВО, который включает в себя и нормализацию биохимических показателей печени, значительно выше, если терапия начата в острой фазе инфекции, но и в первые 10 лет течения хронического гепатита она больше, чем в более поздние сроки. Для ВГС характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Из этого следует, что практически у каждой вирусной частицы в последовательности геномной РНК есть хотя бы один и более нуклеотидов, по которым она отличается от предшественника. К настоящему времени, выделяют 7 генотипов и 67 субтипов ВГС (Donald В. Smith, Jens Bukh, Carla Kuiken, A. Scott Muerhoff, Charles M. Rice, Jack T. Stapleton, Peter Simmonds // Expanded Classification of Hepatitis С Virus Into 7 Genotypes and 67 Subtypes: Updated criteria and Genotype Assignment Web Resource. HEPATOLOGY 2014; 59[1]: 318-327).
В настоящее время разработано достаточно много препаратов, применяемых для лечения и профилактики ВГС-инфекции, различающихся механизмами воздействия, способами введения и лекарственными формами.
Известно, что для лечения острой ВГС-инфекции хорошо зарекомендовали себя химические препараты - ингибиторы ВГС-специфических ферментов. Так, например, известна композиция, обладающая иммуногенной активностью против ВИЧ, содержащая стериоизомеры алкил [2-(2-{5-[4-(4-{2-[1-(2-метоксикарбониламино-ацетил)-пирролидин-2-ил]-3Н-имидазол-4-ил}-фенил)-бута-1,3-диинил]-1H-имидазол-2-ил}-пирролидин-1-ил)-2-оксо-этил]-карбаматов общей формулы 1, проявляющие высокую активность по отношению к вирусу гепатита С (патент РФ 2518369, приоритет от 07.02.2013). Однако, для лечения хронической формы ВГС-инфекции применение химических препаратов -ингибиторов ВГС-специфических ферментов оказалось не эффективным из-за низкой точности копирования матрицы и, как следствие, высокой частоты образования устойчивых форм.
Известно использование интерферонов для осуществления этиотропного лечения ВГС с доказанной эффективностью (Болезни печени и желчевыводящих путей / Под ред. В.Т. Ивашкина. - М.: Изд. Дом М-Вести, 2002. - 432 с.). Интерфероны обладают комплексной активностью, включая антипролиферативное, иммуномодулирующее, противовирусное действия, а также участвуют в индукции дифференцировки клеток, из которых наиболее часто используемым, является интерферон-α [National Institute of Health Consen-sus development conference statement: Management of hepatitis С 2002 // Hepatology. - 2002. - Vol. 36, N5 (suppl. 1). - P. 3-19.]. Однако, при проведении противовирусной терапии необходимо контролировать не только эффективность лечения, но и проявления побочных эффектов, наиболее частым из которых является гриппоподобный синдром (повышение температуры, слабость, головная боль, тошнота), тромбоцитопения, нейтропения, снижение аппетита, похудание, депрессия, раздражительность, нарушение сна (Лобзин Ю.В., Жданов К.В., Волжанин В.М. и др. Вирусные гепатиты: клиника, диагностика, лечение. - СПб.: ООО «Издательство ФОЛИАНТ», 2003. - 192 с.), что достаточно часто имеет место при использовании интерферонов. Указанные препараты также не обеспечивают достаточной эффективности при лечении хронической формы ВГС.
Известно, что для лечения острой ВГС-инфекции хорошо зарекомендовали клинические протоколы, пользующие различные препараты интерферонов-α в сочетании с рибовирином (US Patents 6277830, 6824768), нуклеозильные производные и другие ВГС-специфические ингибиторы ферментов (US Patents 6660721, 8614207), моноклональные антитела (US Patents 5308750, 6428792, 6692908, 6951646, 7105303, 7314919, 8603468, WO 2007111965, WO 2002008292, WO 2007143701, US Patent Application 2005035735), пептидные или siPHK ингибиторы ВГС-специфических ферментов (US Patent 7326536, US Patent Application 0070004635, WO 2006035061). Для повышения эффективности лечения и снижения нежелательных побочных эффектов применяют различные комбинации с использованием интерферона, как например, в патенте РФ 2394589, приоритет от 14.07.2004, где предлагается для приготовления лекарственного средства, предназначенного для лечения вызываемой ВГС инфекции, использовать конъюгат интерферона-α с водорастворимым полимером в комбинации с рибавирином и циклоспорином А. Предполагается, что изобретение обеспечивает эффективное воздействие у пациентов с HCV инфекцией, которые изначально не отвечали на монотерапию пэгилированным интерфероном, а также комбинацией интерферона альфа с рибавирином или интерферона с циклоспорином А. Однако, результаты клинического лечения с использованием указанных препаратов показывают уровень излечения не выше 50%. При этом, ВГС-инфицированные, которые после лечения интерфероном или препаратами на его основе относятся к группе так называемых «не отвечающих», являются источником резистентных форм вируса. Клинические протоколы лечения ВГС-инфекции с помощью интерферонов-α в сочетании с рибовирином или другими ингибиторами ВГС-специфических ферментов увеличивают продолжительность периода появления резистентных форм вируса у хронически ВГС-инфицированных, достоверно не снижая процент «не отвечающих». Есть обоснованные предположения, что появлению резистентных форм вируса у хронически ВГС-инфицированных служат укороченные геномы ВГС (РНК-репликоны), способные к самостоятельной репликации в цитоплазме зараженной клетки в виде двунитевых РНК (US Patent Application 20130115592). Репликация двунитевых РНК не приводит к формированию вирусных частиц, но служит субстратом для образования рекомбинантных структур и восстановлению способности к формированию инфекционных вирусных частиц (US Patent Application 20130115592). Все это заставляет искать новые комбинационные подходы к лечению ВГС-инфекции, особенно при хроническом течении (US Patent Application 20140127158).
Последние достижения, касающиеся лечения хронического течения ВГС-инфекции, основаны на использовании высокоспецифичных ингибиторов вирусных
ферментов (DAA - direct acting antiviral - прямое антивирусное действие) (Pamela S. Belperio, PharmD, BCTPS, AAHIVE National Public Health Clinical Pharmacist VA Office of Public Health / Population Health. Chronic Hepatitis С Virus (HCV) Infection: Treatment Considerations from the Department of Veterans Affairs National Hepatitis С Resource Center Program and the Office of Public Health; last revised on May 13, 2014). Эти препараты найдены в экспериментах на клеточных культурах, содержащих РНК-репликоны ВГС (эксперименты in vitro), что косвенно свидетельствует о признании роли РНК-репликонов в развитии патологии у инфицированных вирусом людей (in vivo). Результаты клинических испытаний DAA терапии людей с хронической формой ВГС-инфекции показывают эффективность около 85%. Однако, стоимость такого лечения составляет не менее $30 тыс. Кроме того, применяемые протоколы DAA терапии лечения хронической ВГС-инфекции, приводят, зачастую, к возникновению устойчивых вариантов (с частотой 0,5%; S. Margeridon-Thermet, R.W. Shafer. Comparison of the Mechanisms of Drug Resistance among HIV, Hepatitis B, and Hepatitis C // Viruses 2010, v. 2 (12), pp. 2696-2739). Механизмом, лежащим в основе появления устойчивых форм, зачастую, являются РНК рекомбинационные события (Е. Simon-Loriere, Е.С. Holmes. Why do RNA viruses recombine? // Nat Rev Microbiol. 2011, v. 9(8): 617-626; Domingo E., J. Sheldon, C. Perales. Viral Quasispecies Evolution // Microbiology and Molecular Biology Reviews June 2012 v. 76(2) p. 159-216).
Таким образом, применяемые в настоящее время препараты и композиции, позволяют повысить эффективность лечения и профилактики ВГС, однако нигде не говорится о полной стерилизации организма от вируса. Отсутствие такой стерилизации, согласно имеющимся данным в отношении клинического течения ВГС, приводит, спустя длительный период, к «новому» появлению вируса или его рекомбинантных форм.
Известны примеры использования для стериалицации организма от вирусов так называемой «суицидной генотерапии». В качестве суицидной генотерапии (около 12% клинических протоколов FDA) различных вирусных инфекций (http://www.eurolab.ua/encyclopedia/287/5966/), применяются гены тимидин киназы вируса простого герпеса (HSV-ТК; Goebel, Е.A., Davidson, В.L., Graham, S.М., Kern, J.A. Tumor reduction in vivo after adenoviral mediated gene transfer of the herpes simplex virus thymidine kinase gene and ganciclovir treatment in human head and neck squamous cell carcinoma // Otolaryngology and Head and Neck Surgery 1998, v. 119, pp. 331-336), бактериального гена дезаминазы 2-окси-6-аминопиримидина (CD; Mulen С.А., М. Kilstrup, R.M. Blaese.: Transfer of the bacterial gene for cytosine deaminase to mammalian cells confers lethal sensitivity to 5 fluorocytosine: a negative selection system // Proc. Natl. Acad. Sci. USA 1992, v. 89, №1, pp. 33-37) илифрагмент гена токсина дифтерии (DT-A), кодирующий моно АДФ-рибозил трансферазу дифтамина фактора элонгации EF2 (Qiao J., Caruso М.: PG13 Packaging Cells Produce Recombinant Retroviruses Carrying a Diphtheria Toxin Mutant Which Kills Cancer Cells // J. Virology July 2002, Vol. 76, №14, p. 7343-7348). Последовательность гена токсина дифтерии исключительно устойчива к аминокислотным заменам и ошибкам трансляции. Кроме того, его активность не требует введения в организм дополнительных низкомолекулярных субстратов (Corda D., Di Girolamo М. Functional aspects of protein mono-ADPribosylation // The EMBO Journal 2003, v. 22, №9, pp. 1953-1958). Белок обладает высокой токсичностью, благодаря которой, единственная целая молекула или ее DT-A фрагмент, способна убить клетку (Yamaizumi М., E. Mekada, T. Uchida, Y. Okada.: One molecule of diphtheria toxin fragment A introduced into a cell can kill the cell // Cell 1978, v. 15, pp. 245-250). Одним из видов «суицидной генотерапии» является технология АГП (антивирусной генетичиской программы), обеспечивающая селективное уничтожение клеток, зараженных вирусом гепатита типа «С» (HCV) или его инфекционной РНК и предусматривающая введение в клетки плазмиды pcDT, кодирующей псевдо HCV <<->> РНК и способной направлять синтез А-субъединицы дифтерийного токсина в зараженных HCV клетках (Патент РФ 2158139, приоритет от 04.11.1999; Патент РФ 2159285, приоритет от 06.032000). Сравнение между всеми последовательностями секвенированных изолятов (http://s2as02.genes.nig.ac.jp/) и изменчивости структуры РНК-зависимой РНК-полимеразы ВГС субтипа 1b, обозначаемой как белок NS5b (http://hcv.lanl.gov/content/sequence/HCV/variability/HCV_variability.html), позволяют положительно оценить известную стратегию АГП уничтожения клеток, зараженных ВГС или его РНК-репликонами (US Patents 7790448 и 8022197, US Patent Applications 20030215917, 20080182895, 20090035747, 20100028922, 20110053160, 20110129868, 20110245328). Однако АГП приводит к высвобождению из клеток токсических молекул А-субъединицы токсина дифтерии, которые вызывают у млекопитающих синдром увеличения сосудистой проницаемости (WO 2005052129), что негативно отразится на последствиях клинического применения технологии АГП.
Известны средства адресной доставки с выраженной тропностью к гепатоцитам, которые способны переносить в клетки различные вещества, имеющие анти-ВГС активность (US Patents Application, 20090054246, 20080044437, 20070264285), из которых наиболее простыми методами выглядят основанные на применении бактериофагов (US Patents Application 20130017210). Последние удобны в контролируемом производстве и применении (Carlee Е. Ashley, Eric С. Carnes, Genevieve К. Phillips, Paul N. Durfee, Mekensey D. Buley, Christopher A. Lino, David P. Padilla, BrandyPhillips, Mark В. Carter, Cheryl. L. Willman, C. Jeffrey Brinkera, Jerri do Carmo Caldeira, Bryce Chackerian, Walker Wharton, David S. Peabody. Cell-Specific Delivery of Diverse Cargos by Bacteriophage MS2 Virus-Like Particles // ACS Nano 26 July 2011; 5[7]: 5729-5745). Известны способы упаковки молекул РНК в вирион фага MS2 применяемые в рамках так называемой технологии защиты РНК от действия внешней среды - метод «армирования» РНК (US Patents 5677124, 5919625 и 5939262). Первые протоколы «армирования» РНК позволяли упаковать линейную молекулу размером не более 500 нуклеотидных звеньев, тогда как к настоящему времени опубликованы протоколы «армирования» РНК с размерами 2248 нуклеотидов (Y. Wei, С. Yang, В. Wei, Jie Huang, L. Wang, S. Meng, R. Zhang, J. Li. RNase-Resistant Virus-Like Particles Containing Long Chimeric RNA Sequences Produced by Two-Plasmid Coexpression System // JOURNAL OF CLINICAL MICROBIOLOGY, May 2008, Vol. 46 [5], p. 1734-1740) и 3034 оснований (S. Zhan, J. Li, R. Xu, L. Wang, K. Zhang, R. Zhang. Armored Long RNA Controls or Standards for Branched DNA Assay for Detection of Human Immunodeficiency Virus Type // JOURNAL OF CLINICAL MICROBIOLOGY, Aug. 2009, Vol. 47[8], p. 2571-2576). Однако, длинные РНК должны иметь способность к упаковке в псевдовирионы фага MS2 и удовлетворять определенным правилам РНК-дизайна (J. Lee, W. Kladwang, М. Leea, D. Cantub, M. Azizyana, H. Kimc, A. Limpaechera, S. Yoonc, A. Treuillea, R. Das. RNA design rules from a massive open laboratory // PNAS February 11, 2014, vol. 111 [6], pp. 2122-2127). Расчеты соответствующих структур проводят на сайте http://getsatisfaction.com/EteRNAgame. Известная система продукции псевдовирионов фага MS2 с инкупсулированной в них РНК еще не является фармацевтически приемлемой. Объясняется это тем, что она ограничивается бактерией E. coli, способной выделять в среду культивирования лиополисахарид (LPS), известный как экзотоксин, и который способствует развитию сильного иммунологического ответа на препарат, в котором содержится LPS (WO 2006121232).
Таким образам из уровня техники известны способы получения псевдовирионов фага MS2, содержащие невирусную РНК, однако их применение ограничивается диагностикой ВГС-инфекции и не найдены подходы для получения фармацевтически приемлемой субстанции. Кроме того, все применяемые в настоящее время препараты и композиции, предназначенные для воздействия на различные типы и субтипы ВГС, не учитывают индивидуальные особенности структуры его генома, связанные с высокой частотой генетических изменений, приводящие к наличию у одного пациента отличающихся структур геномов. Соответственно, и применяемые DAA протоколы терапии (direct acting antiviral - прямое антивирусное действие),предназначенные для лечения хронической ВГС-инфекции, приводят, зачастую, к возникновению устойчивых вариантов.
Задачей настоящего изобретения является создание лекарственного средства для лечения хронической формы вирусного гепатита С, способного обеспечить полную стерилизации организма от клеток, зараженных РНК вирусом гепатита С, при минимизации нежелательных побочных воздействий.
Решение указанной задачи обеспечивается тем, что, в отличие от известных лекарственных средств для лечения вирусного гепатита С, новым то, что лекарственное средство содержит модифицированные псевдовирионы фага MS2, оболочка которых создана белками «А» и «В» фага MS2, а часть геномной РНК, кодирующая «репликазу», заменена РНК, способной селективно уничтожать клетки, зараженные вирусом гепатита С или его РНК репликоном, при этом геном модифицированного псевдовириона фага MS2 характеризуется нуклеотидной последовательностью, соответствующей SEQ ID NO1.
Предлагаемая генетическая конструкция псевдовириона фага MS2 позволяет получить эффективное лекарственное средство для лечения вирусного гепатита С на основе наноструктур псевдовирионов фага MS2 с инкапсулированной в них РНК, являющейся субстратом для ВГС-специфического фермента NS5b, взаимодействие которых приводит к гибели клеток, зараженных ВГС или его репликонами, а также обеспечить технологичность микробиологического производства указанного средства, созданного с использованием генной инженерии.
Результаты исследований иллюстрируются графическими изображениями:
Фиг. 1 - нуклеотидная последовательность, кодирующая модифицированный псевдовирион фага MS2;
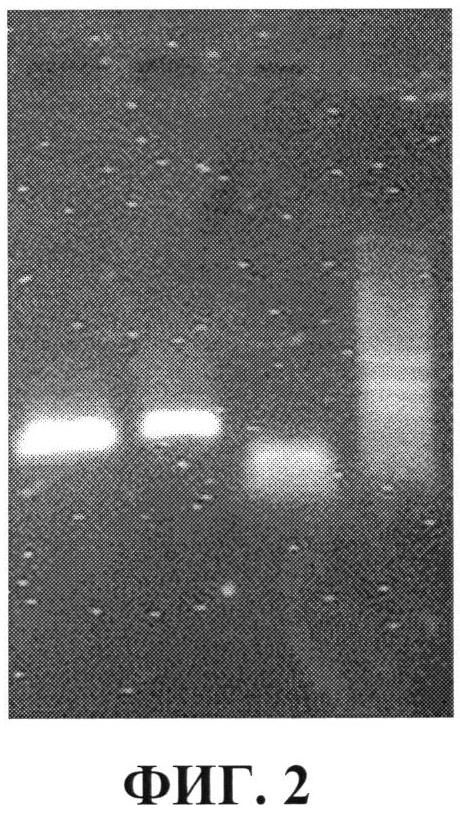
Фиг. 2 - результат ПЦР (полимеразной цепной реакции) гена токсина дифтерии;
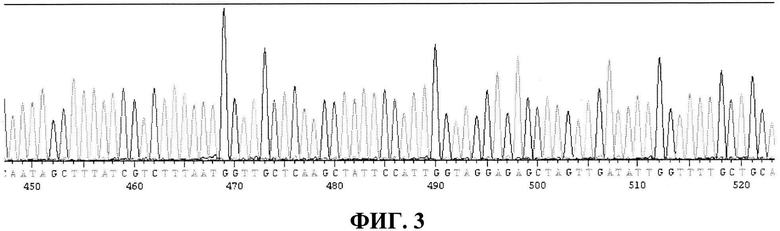
Фиг. 3 - фрагмент результата секвенирования для определения структуры токсина;
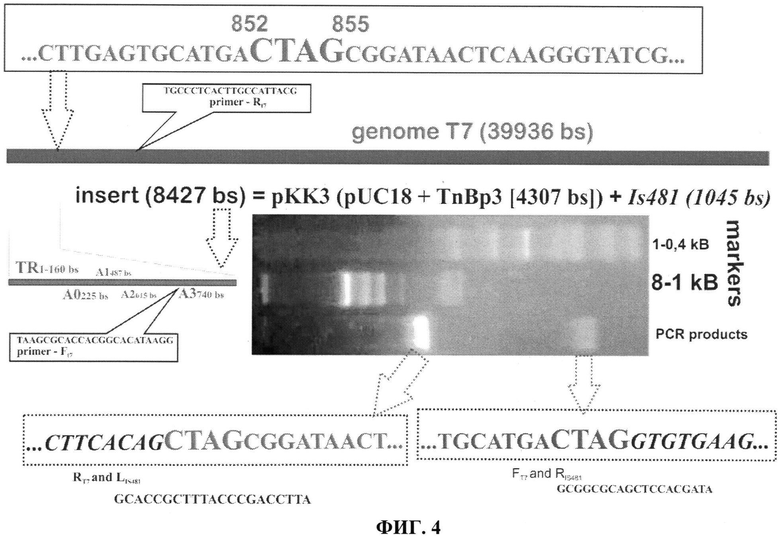
Фиг. 4 - схема образования коинтегратов T7::pAGP с результатами определения сайта интеграции.;
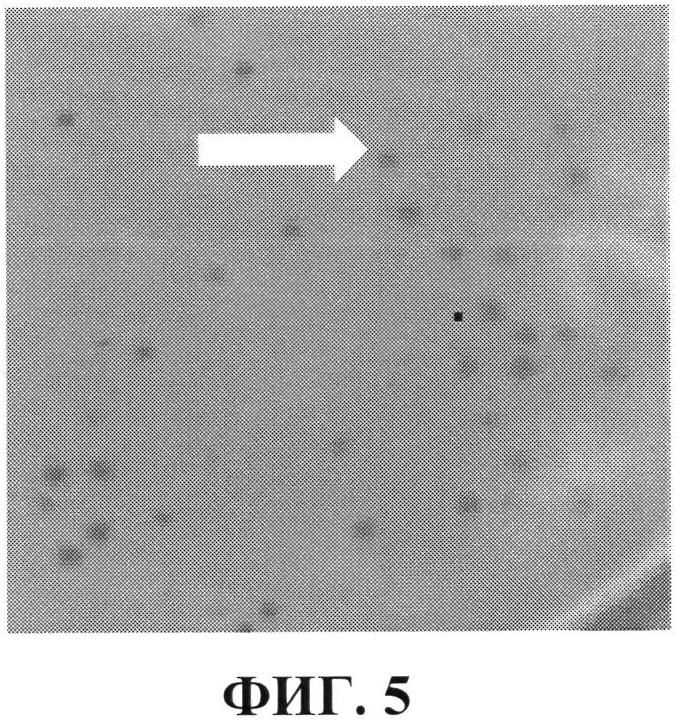
Фиг. 5 - титрование псевдовирионов фага MS2 на газоне штамма HBCS140;
Предлагаемое лекарственное средство может быть реализовано на базе существующего уровня техники следующей последовательностью действий.
Первоначально производят подготовительные генно-инженерные манипуляции, в том числе, по схеме (WO 2005052129), в ПЦР - получали ДНК фрагментагена (асс. №AB 602359), соответствующую ORF (открытая рамка трансляции) А-субъединице токсина дифтерии (76-654 п.о.), но, во-первых, содержащую на N-конце тетрапептид MLMM - метионил-лейцил-диметионил) и, во-вторых, имеющий замены в ORF известные специалистам. Затем на 5′-конец пристыковывают ДНК последовательность A/GCCACC. В антисмысловой ориентации на 3′-конец полученного ДНК-фрагмента вводят 3′-UTR ВГС субтипа 1b (асс. №AF 176573, фрагмент 9375-9600 о.). Полученную АГП проверяют на способность образовывать дуплексы на сайте rna.tbi.univie.ac.at/RNAz.
Одновременно с созданием АГП, из кДНК полноразмерного генома фага MS2 (pMS3.6) делетируют ORF РНК-репликазы (асс. №V 00642, 1761-3380 п.о., Княжев В.А., Сивов И.Г., Сергиенко В.И. РНК-трансдукция неинфекционными вирионами фага MS2 // Молекулярная генетика, микробиология и вирусология 2002, №3, стр. 56-63). Вновь полученный вариант плазмиды обозначен pMS3,6ΔRep.
Бактериофаг Т7 способен к трансдукции плазмид colE1-типа, за счет образования IS481-зависимого коинтеграта между ДНК плазмиды и фага (WO 199804731). Выявить трасндуцирующие частицы можно при последующих пассажах бактериофага на RecA или RecBCsbcB мутантных реципиентных бактериях E. coli. При этом посевы следует выдерживать при комнатной температуре, при которой потомство псевдолизогенных клонов по фенотипу будет вести себя похожим образом, что описано для бактериофага Т3 (Krueger D.Н., W. Presber S. Hansen, Н.A. Rosenthal. Biological functions of the bacteriophage T3 SAMase gene // J. Virol. 1975, 16 (2), pp. 453-455). Фаговое T7 потомство, полученное от псевдолизогенов, позволяет получать Hft-лизаты (лизаты с высокой частотой трансдукции, J.N. Coetzee. Intra-species Transduction with Proteus mirabilis High Frequency Transducing Phages // Journal of General Microbiology 1976, v. 93, pp. 153-165, R.I. Chatc, D. Botstein, T. Watanabe, Y. Ogata. Specialized Transduction of Tetracycline Resis-tance by Phage P22 in Salmonella typhimurium. II. Properties of a High-Frequency-Transducing Lysate // Virology 1972, v. 60, pp. 883-898). Основываясь на информации о природе рецепторного комплекса для фага Т7 (U. Qimron, В. Marintcheva, S. Tabor, С.С. Richardson. Genome wide screens for Escherichia coli genes affecting growth of T7 bacteriophage // PNAS December 12, 2006, vol. 103[50], pp. 19039-19044), установили возможность Т7-зависимой трансдукции плзмид colE1-типа к ряду грам-отрицательных бактерий, в числе которых Escherichia coli, Salmonella enterica Typhimurium, Shigella flexnery, Bordetella parapertussis, Pseudomonas aeruginosa, Pseudomonas putida, Erwinia carotovorum, Yersinia enterocolitica, Francisella spp, Brucella abortus. В эти бактерии с помощью различных методов генетического переноса можно ввести плазмиду pMS1,9 с клонированным геном РНК-репликазыфага MS2, что позволяет определять титр псевдовиронов (например, штамм HBCS140).
Потомство клонов псевдолизогенов с pMS1,9 можно вырастить на плотных питательных средах строго при комнатной температуре и, после получения бактериальной массы, перенести клетки в условия 37°C. Прогретые псевдолизогенные бактерии начинают выделять псевдовирионы фага MS2 с упакованной в них АГП. Полученные псевдовирионы фага MS2, могут иметь тропность к гепатоцитам (Княжев В.А., Сивов И.Г., Сергиенко В.И. Бактериофаг доставляет РНК в гепатоциты // VI-ая международная конференция Канны (Франция), апрель 2002 г.), если провести их модификацию.
Модификации псевдовирионов фага MS2, содержащих АГП, следует разделить по методам их создания на генетические и химические. Генетические модификации касались введения на С-конец ORF «В»-белка различных пептидов. С этой целью, 5′-концевую последовательность ORF «В»-белка, не изменяя фазу трансляции, удлинили фрагментом, кодирующим адресный для мембраны гепатоцитов пептид CS-белка циркумспорозоитной фазы Plasmodium falciparum (19 а.о.). Еще одной генетической модификацией 5′-концевой последовательности ORF «В»-белка по указанной выше схеме было удлинение PTD-пептидом (Protein Transduction Domain). Другой генетической модификацией являются замены в позиции 55-69; 270-278; 304-321 ORF «В»-белка так, чтобы модифицированный ген кодировал белковый продукт, имеющий сайты узнаваемые протеазой NS3. РНК псевдовирионов фага MS2, содержащих АГП, с модифицированным геном «В»-белка («В*15») была устойчива к действию РНК-аз сыворотке крови здоровых людей. В сыворотке больных хронической формой гепатита «С» наблюдали разрушение РНК псевдовирионов фага MS2, содержащих АГП.
Химические модификации касались обработки РНК псевдовирионов фага MS2, содержащих АГП, 6-пептидил замещенными производными аминопенициллановой кислоты. Пептидами, используемыми для модификации, были пептид CS-белка или PTD-пептиды.
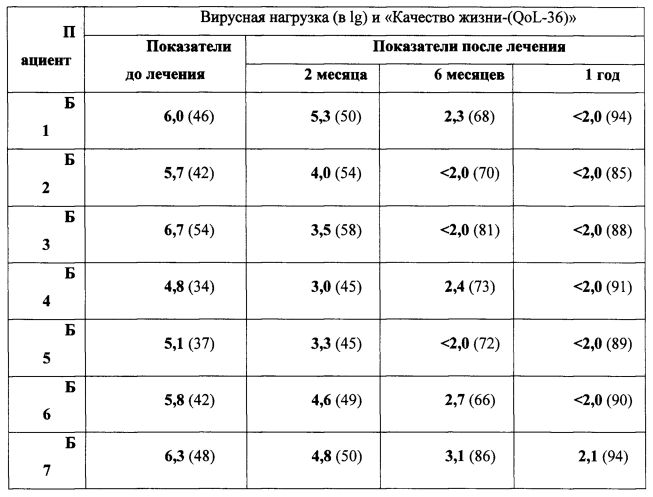
Токсичность и лечебный эффект модифицированных псевдовирионов фага MS2, содержащих АГП, контролируют по известным специалистам технологическим регламентам (анализ титра специфических иммуноглобулинов (RU 2239453) и цитотоксических лимфоцитов (RU 2514019), а так же вирусную нагрузку (RU 2468743) и показатель качества жизни (QoL-36, RU 2482844), относящейся к здоровью - Health Related Quality of Life [HRQOL]).
Привлечение добровольцев к участию в исследованиях осуществлялось с учетом положений Хельсинской Декларацией Всемирной медицинской ассоциации (ВМА) «Этические Принципы для медицинских исследований с человеком», параграф 22 части «В».
Все манипуляции с материалами подозрительными на зараженность ВГС проводятся с учетом правил СП 3.1.3112-13, утвержденными Постановлением Главного санитарного врача РФ от 22.10.2013 №58.
Краткое описание графических изображений:
Фиг. 1 - нуклеотидная последовательность, кодирующая модифицированный псевдовирион фага MS2 (SEQ ID NO1). Геном получен в результате рекомбинации in vitro между кДНК геномной РНК фага MS2 и антивирусной генетической программы (Патент РФ 2159285) по схеме описанной ранее (Княжев В.А., Сивов И.Г., Сергиенко В.И. Бактериофаг доставляет РНК в гепатоциты // VI-ая международная конференция Канны (Франция), апрель 2002 г.). Геном содержит четыре открытые рамки трансляции: по смысловой цепи 130-1311 п.о., 1335-1727 п.о., 1678-2109 п.о., по антисмысловой цепи 2534-1767 п.о.;
Фиг. 2 - приведен результат ПЦР гена токсина дифтерии. Продукт ПЦР, получен на матрице хромосомной ДНК токсинообразующего штамма Corynebateria diphtheriae. Дорожки нумерованы справа налево. По 4-ой (крайняя справа) результат разделения маркеров молекулярного веса фрагментов ДНК (10-1,0 т.п.н., сверху вниз). Наиболее светлыми полосами выглядят 4-2 т.п.н. На второй дорожке показан позитивный результат, когда размер продукта ПЦР имеет подвижность сравнимую с фрагментом около 1,7 т.п.н.
Фиг. 3 - приведен фрагмент результата определения структуры токсина. Указанный секвенс (последовательность нуклеотидов) соответствует части гена DT 1192-1267 а.о. с точковой заменой С1261→Т, что в результате дает мотив «ТТТТ», тогда как в GenBank «ТТТС».
Фиг. 4 - приведена схема образования коинтегратов T7::pAGP с результатами определения сайта интеграции. Структура коинтеграта хромосомы Т7 (серый) и плазмиды рКК3 (черный). Сайт интеграции находиться после промотора A3 (позиция 740 п.о. Т7 генома). Плазмидная часть коинтеграта ограничена полноразмерными прямыми повторами IS481 (черные указатели показаны точечным контуром) и копиями CTAG (852-855 п.о. Т7 генома). Последовательности «стыков», показаны в штриховых прямоугольниках (серым и черным цветом, соответственно). В реакциях PCR амплификации (результат - на фото) использовали праймерные олигонуклеотиды(последовательности праймеров показаны на фигуре). На фото (сверху - вниз): дорожка 1 - маркеры размеров 1-0,4 т.п.о., дорожка 2 - маркеры размеров 8-1 т.п.о., дорожка 3 (нижняя) - продукты амплификации с соответствующими парами праймеров. Секвенирование продуктов амплификации выполнили согласно «Руководству» для 373А Автоматического секвенатора (Applied Biosysthems, USA), использовали наборы окрашенных ABI терминирующих нуклеотдов в реакции с Taq-полимеразной FS (Perkin Elmer, USA). Файлы экспериментальных данных (формат EMBL) сравнивали с последовательностями (асс. №J 02518) основы GENBANK.
Фиг. 5 - приведено титрование псевдовирионов фага MS2 на газоне штамма HBCS140. Негативные колонии («бляшки», указаны стрелкой) псевдовирионов фага MS2 на газоне штамма HBCS140 (разведение фаголизата 10-7, число негативных колоний - 84).
Изобретение поясняется следующими примерами:
Пример 1. Получение модифицированного ДНК фрагмента, соответствующего ORF А-субъединице токсина дифтерии.
Хомосомную ДНК токсинообразующего штамма Corynebateria diphtheriae использовали для ПЦР в качестве матрицы. Размер полученного продукта составил около 1,7 т.п.н. (Фиг. 2). Указанные на Фиг. 3 секвенс (последовательность нуклеотидов) соответствует части гена DT 1192-1267 а.о. с точковой заменой С1261→Т, что в результате дает мотив «ТТТТ», тогда как в GenBank указана последовательность «ТТТС».
Замена лидерного пептида на последовательность MLMM была проведена с помощью 99-ти членного полинуклеотида структуры 5′PO4-AATTATTTTATGAGTCCTGGTAAGG
GGATACGTTCATATGGCTAGCATGGGCGCTGATGATGTTGATGGGCGCTGATGATGTTGTTGATTCTTCTAAAT-3′OH (подчеркиванием указан NdeI сайт для реклонирования). Для удобства реклонирования и выделения токсина использовали второй 57-ми членный полинуклеотид 5′PO4-TTTTTGAAATCAAAAGCGATCCGAATTCTGAAAGGTAGTGGGGT CGTGTGCTGGTAA-3′OH (подчеркиванием указан EcoRI сайт для реклонирования). Оба полинуклеотида в структуру плазмиды по месту комплиментарных последовательностей вводили RecA-зависимой реакцией замещения цепи. Гереродуплекс получали в реакции удлинения праймера с Taq-полимеразой и последующего лигирования однитевых разрывов с 5′-фосфатными концами длинных полигонуклеотидов. Вновь полученную цепь амплифицировали в ПЦР с праймерами, комплиментарными последовательностям с NdeI и EcoRI сайтами. Из продукта амплификации вырезали NdeI - EcoRI фрагмент,который клонировали в плазмиду pGEM-T, «вскрытую» указанными эндонуклеазами (схема реклонирования показана на Фиг. 4).
Пример 2. Получение плазмиды pMS3,6ΔRep.
Геномную РНК бактериофага амплифицировали в ОТ-ПЦР с праймерами указанными в публикации (Княжев В.А., Сивов И.Г., Сергиенко В.И. РНК-трансдукция неинфекционными вирионами фага MS2 // Молекулярная генетика, микробиология и вирусология 2002, №3, стр. 56-63) и после объединения двух фрагментов кДНК получили плазмиду pMS3,6, которая вызывает образование инфекционного фага в условиях индукции. В ORF гена «репликазы» методом точкового мутагенеза последовательность СААСАА заменили CCGCCG (сайт для Eco52I). Делецию гена «репликазы» (1615 п.о.) проводили эндонуклеазами рестрикции Eco52I и Sacl, обработкой ДНК плазмиды pMS3,6 с последующей восстановлением последовательности сайта для EcoRI. Полученная плазмида получила обозначение pMS3,6ΔRep.
Пример 3. Получение плазмиды pAGP (pMS3,6ΔRep, AGP).
Фрагмент кДНК, кодирующий АГП, собран по схеме (Сивов И.Г., Соболев А.Ю., Самохвалов Е.И., Сергиенко В.И. Антивирусная генетическая программа - новый тип ДНК-вакцины / /Доклады Академии наук 2001, №6, стр. 834-837) ограничен сайтами NotI-EcoRI, что позволяет заменить Eco52I-Sacl фрагмент на NotI-EcoRI фрагмент.
Пример 4. Получение псевдолизогенов по фагу Т7.
Спонтанные транспозиции IS481 выявляли при заражении штаммов E. coli pAGP. При трансдукции маркера AmpR бактериофагом Т7 реципиентами служили RecA или RecBC SbcB-штаммы E. coli, а селекцию AmpR клонов проводили при 25°C. Из материала трансдуктантов при температурах более 25°C выделялся бактериофаг Т7 (псевдолизогения). Частота образования псевдолизогенных клонов 1-5×10-9. IS481-зависимые интеграции плазмиды pAGP в геном бактериофага находятся в последовательности TGAGTGCATGA CTAGCGGATA между промотором A3 и первой ORF. Указанная последовательность находится в начале хромосомы бактериофага Т7 (841-861 п.н.).
Пример 5. Получение Hft-лизатов и трансдукция фагом Т7.
Коинтеграты T7::pAGP в потомстве выделенных псевдолизогенных клонов могли быть размножены так же как это описано для бактериофагов (RU 2209088). Для этогопотомство псевдолизогенных клонов заражали фагом Т7 при t=30°C. Полученными лизатами (соотношение титров фаг:коинтеграт=1:1) проводили трансдукцию фенотипов лекарственной устойчивости (AmpR) некоторых грамотрицательных бактерий, в числе которых Escherichia coli, Salmonella enterica Typhimurium, Shigella flexnery, Bordetella parapertussis, Pseudomonas aeruginosa, Pseudomonas putida, Erwinia carotovorum, Yersinia enterocolitica, Francisella spp, Brucella abortus.
Пример 6. Получение высокого титра псевдовирионов фага MS2, содержащих АГП.
Псевдолизогенные Т7:: pAGP клетки могли быть выращены в жидкой минимальной среде, которая «аэрировалась» на магнитной мешалке, при комнатной температуре в течение 48 часов не менее. По достижению оптической плотности, соответствующей стандарту 109 клеток на 1 мл, в среду добавляли глюкозу, тритон и дрожжевой экстракт до концентраций, характерных для L-бульона (Maniatis Т., Fritsch E.F., Sambrook J.E. Molecular Cloning: a Laboratory Manual // Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 1982.1st.2nd,3th v′s.), а также рифампицин (до 150 мкг/мл), и, подогревая среду до 38°C, продолжали «аэрацию» еще 24 часа.
Выделение псевдовирионов, проводили после осветления клеточного лизата центрифугированием (15000 об/мин) с последующим осаждением ПЭГ-6000 в присутствии NaCl, как известно специалистам. В результате всех проведенных выше процедур был получен модифицированный псевдовирион фага MS2, геном которого характеризуется нуклеотидной последовательностью, соответствующей SEQ ID NO1.
\Пример 7. Генетические модификации псевдовирионов.
Генетические модификации псевдовирионов проводили фрагментами ДНК, кодирующими:
пептид CS-белка циркумспорозоитной фазы Pl. falciparum (DKHIEQILKKLKQPNEGEP),
или PTD пептиды: GRKKRRQRRR; NRRMKWKKPKKKRK; RQIKIWFQNRRMKWKK; VRLPPPVRLPPPVRLPPP; TRQARRNRRRRWRERQR; RRRRNRTRRNRRRVR; TRRQRTRRARRNR; KRPAAIKKAGQAKKKK; GWTLNSAGYLLGKINLKALAALAKKIL; LLIILRRRIRKQAHAHSK, известные специалистам, что проводило к удлинению ORF «В»-белка в плазмиде pAGP.
Другой генетической модификацией являются замены в позиции 55-69; 270-278; 304-321 ORF «В»-белка так, чтобы модифицированный ген кодировал белковый продукт, имеющий сайты узнаваемые протеазой NS3.
Пример 8. Синтез 6-АПА модифицированных пептидов.
Полученные на пептидном синтезаторе ABI 488А (Perkin Elmer, Norwalk, Conn.) методом F-moc (метод твердофазного синтеза пептидов с флуренилметоксикарбонил/трет-бутил производными аминокислот) пептиды, требовали стадии «снятия защиты» с 15 мМ трифлуороуксусной кислотой (TFA) и проводили выделение целевого продукта методом жидкостной хроматографией высокого давления (HPLC) согласно прилагаемым инструкциям.
Лиофильно высушенные 8-ми или 12-ти членные пептиды, со структурой указанной выше, использовали для создания конъюгатов с натриевой солью бромоацетилированной 6-АПА в 100 мМ бортном буфере (pH=8.3). Конъюгаты пептидов с 6-АПА вновь выделяли с помощью HPLC и лиофилизировали. Часть препарата комбинированного «гаптена» использовали для определения его способности ковалентно присоединяться к сывороточному альбумину человека (технология в общем виде описана в US Patent 4596768).
Пример 9. Химические модификации псевдовирионов.
Для определения и количественной оценки β-лактамазной активности псевдовирионов использовали методику, основанную на изменении окраски антибиотика нитроцефина при распаде его β-лактамной связи описанную ранее (И.В. Жильцов, И.С. Веремей, В.М. Семенов, И.И. Генералов, С.К. Егоров. Механизм гидролиза β-лактамной связи под воздействием альбумина // Иммунопатология, аллергология, инфектология 2011, №3: стр. 24-31). Для проведения экспериментов мы использовали химически чистый нитроцефин производства Calbiochem. При этом максимум поглощения продукта реакции меняется с 390 нм на 486 нм. Пептиды смешивали с псевдовирионами в «молярном» соотношении 10:1 в 10 мМ фосфатном буфере (pH=8,0). Реакцию проводили при комнатной температуре в течении 24 часов. Определение титра псевдовирионов до и после модификации, позволяет оценивать конечную концентрацию частиц в растворах (коэффициент 0,2).
Пример 10. Протокол введения псевдовирионов.
Препараты для введения проверяли на токсичность с помощью теста с Limulus амебным лизатом <0,1 ед/мкг. Введение проводили двух- или трехкратно с интервалом в две недели (титры псевдовирионов определенные с помощью чувствительного штамма HBCS140). При первичном введении титр псевдовирионов был ≤108. Методы введениявнутримышечный, пероральный или ректальный. Количество введений определяли по результатам оценки кожной пробы.
Пример 11. ИФА.
Уровень антител классов IgG и IgM определяли с помощью коммерческих наборов «РекомбиБест анти-ВГС» или, для определения ВГС-антигенов, с помощью "ВГС АГ/АТ-ИФА-БЕСТ" согласно прилагаемым инструкциям.
Пример 12. Определение CTL активности.
CTL (цитотоксический лимфоцит) активность определяли методом внутрикожной пробы с синтетическими коммерческими ВГС-специфическими антигенами фирмы «РекомбиБест» или НПО «Вектор».
Пример 13. Определение эффективности лечения псевдовирионами.
Техника подсчета: Набор для количественного RT-PCR (Becton Dickinson, USA), опрос по протоколу «QoL-36».
Предлагаемое лекарственное средство позволяет обеспечить эффективное лечение хронической ВГС-инфекции посредством полной стерилизации организма от клеток,зараженных РНК вирусом гепатита С, при минимизации нежелательных побочных воздействий, упростить процесс вакцинации и может быть реализовано в амбулаторных условиях на базе имеющегося оборудования.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОДИРУЮЩАЯ ДНК (кДНК) ДЛЯ ПОЛУЧЕНИЯ ВИРУСОПОДОБНЫХ ЧАСТИЦ ВИРУСА ГЕПАТИТА С, СПОСОБ ПОЛУЧЕНИЯ ВИРУСОПОДОБНЫХ ЧАСТИЦ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2007 |
|
RU2375449C2 |
| СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВИЧ-ИНФЕКЦИИ ТИПА 1 СУБТИПА А | 2015 |
|
RU2600162C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЧАСТИЦ БАКТЕРИОФАГОВ СЕМЕЙСТВА LEVIVIRUS | 2020 |
|
RU2811106C2 |
| СПОСОБ СЕЛЕКТИВНОГО УНИЧТОЖЕНИЯ КЛЕТОК (ВАРИАНТЫ) | 1999 |
|
RU2158139C1 |
| ПЕГИЛИРОВАННЫЙ ИНТЕРФЕРОН ЛЯМБДА, ОБЛАДАЮЩИЙ ВЫСОКОЙ БИОДОСТУПНОСТЬЮ ПРИ ПЕРОРАЛЬНОМ ПРИМЕНЕНИИ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2017 |
|
RU2678332C1 |
| Способ получения ВПЧ бактериофага и способ получения модифицированного ВПЧ бактериофага | 2022 |
|
RU2790451C1 |
| СПОСОБ РЕПРОДУКЦИИ IN VITRO ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТИ NS3 ПРОТЕАЗЫ ВИРУСА ГЕПАТИТА C (НСУ) | 1995 |
|
RU2149185C1 |
| СПОСОБ ПОЛИСИГНАЛЬНОЙ АКТИВАЦИИ АПОПТОЗА КЛЕТОК ЗЛОКАЧЕСТВЕННЫХ СОЛИДНЫХ ОПУХОЛЕЙ | 2015 |
|
RU2599462C1 |
| Онколитический способ терапии рака молочной железы. | 2018 |
|
RU2695136C1 |
| Иммунобиологическое средство для повышения клеточного ответа против вируса гепатита С | 2023 |
|
RU2811136C1 |

Изобретение относится к области медицины и генной инженерии и предназначено для лечения вирусного гепатита С (ВГС). Предложено лекарственное средство, содержащее модифицированные псевдовирионы фага MS2, оболочка которых создана белками «А» и «В» фага MS2, а часть геномной РНК, кодирующая «репликазу», заменена РНК, способной селективно уничтожать клетки, зараженные вирусом гепатита С или его РНК репликоном, при этом геном модифицированного псевдовириона фага MS2 характеризуется нуклеотидной последовательностью, соответствующей SEQ ID NO 1. Изобретение обеспечивает эффективное средство для лечения хронической ВГС-инфекции. 5 ил., 1 табл., 13 прим.
Лекарственное средство для лечения вирусного гепатита С, отличающееся тем, что оно содержит модифицированные псевдовирионы фага MS2, оболочка которых создана белками «А» и «В» фага MS2, а часть геномной РНК, кодирующая «репликазу», заменена РНК, способной селективно уничтожать клетки, зараженные вирусом гепатита С или его РНК репликоном, при этом геном модифицированного псевдовириона фага MS2 характеризуется нуклеотидной последовательностью, соответствующей SEQ ID NO 1.
| Электрический конденсатор | 1986 |
|
SU1394255A1 |
| DATABASE, GenBank, V00642.1, 21.10.1996 [найдено 11.06.2015] | |||
| Найдено из Интернет: URL: http://www.ncbi.nlm.nih.gov/Genbank/ | |||
| ВИРУСОПОДОБНЫЕ ЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ ГИБРИДНЫЙ БЕЛОК БЕЛКА ОБОЛОЧКИ БАКТЕРИОФАГА АР205 И АНТИГЕННОГО ПОЛИПЕПТИДА | 2005 |
|
RU2409667C2 |
| СПОСОБ СЕЛЕКТИВНОГО УНИЧТОЖЕНИЯ КЛЕТОК (ВАРИАНТЫ) | 1999 |
|
RU2158139C1 |
| WO 9213081 A1, 06.08.1992 | |||
| DE WACHTER R | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Eur J Biochem | |||
| Устройство станционной централизации и блокировочной сигнализации | 1915 |
|
SU1971A1 |
Авторы
Даты
2015-11-20—Публикация
2014-10-15—Подача