Изобретение относится к медицине и может быть использовано для селективного уничтожения клеток, зараженных РНК вируса гепатита С (HCV). Гепатит, вызванный этим вирусом или его РНК, носит характер хронической инфекции (Lemon SM, Brown ЕА. Hepatitis С virus and chronic liver disease. Curr. Clin. Top. Infect. Dis. 1994, v. 14, pp. 120-41). Вирус или его РНК способны заражать не только клетки печени, но, возможно, клетки костномозгового и эпителиального происхождения (Taglione Е., Vatteroni ML, Martini P., Galluzzo Е., Lombardini F., Delle Sedie A., Bendinelli W., Pasero G., Bencivelli W. , Riente L. Hepatitis С virus infection: prevalence in psoriasis and psorriatic arthritis. J. Rheumatol. 1999, v.26, N 2, p.p. 370-372; Jean-Pierre Bronowicki, Marie-Anne Loriot, Valeri Tiers, Yves Grignon, Anna Linda Zignero and Cristian Brechot. Hepatitis С Virus Persistence in Human Hematopoietic Cells Injected Into SCID Mice. Hepatology, 1998, v. 28, p.p. 211-218).
Известно, что геномная РНК вируса гепатита С размножается при помощи комплементарной HCV-специфической <<->> РНК (A. A. Khromykh, М.Т. Kenney, E.G. Westaway. Trans-Complementation of Flavivirus RNA Polymerase Gene NS5 by Using Kunjin Virus Replicon-Expressing BHK Cells. J. Virology, 1998, v. 72, N 9, p. p. 7270-7279). Оба типа реакции репликации ведет HCV-специфическая РНК-полимераза, которая узнает консервативные 5'- и 3'- последовательности в геномной и комплементарной РНК (Kolykhalov А.А., Feinstone S.M., Rice С.М. Identification of a hingly conserved sequence element at the 3 terminus of hepatitis С virus genome RNA. J. Virol. 1996, v. 70, p.p. 3363-3371).
Все усилия по созданию ДНК-вакцин направлены на решение двух задач: экспрессирующих либо HCV-специфические антигены, либо образование анти-HCV рибозимов. Однако изменчивость геномной РНК в процессе ее репликации ограничивает возможности этих двух решений.
Задачей настоящего изобретения является создание плазмиды, с помощью которой можно селективно уничтожить клетки, зараженные геномной РНК вируса гепатита С (HCV).
Поставленная задача решается путем создания плазмиды, названной нами p-cDT, которая при транскрипции образует не транслируемую РНК. Однако в случае зараженной HCV клетки транскрипт из-за 5'- и 3'-концевых HCV-специфических последовательностей способен служить матрицей для синтеза комплементарной РНК. Эта РНК транслируется как геномная РНК HCV, но в результате трансляции образуется токсичный для клетки фермент АДФ-рибозил трансфераза дифтаминильного остатка фактора элонгации, являющийся ингибитором синтеза белка.
Способ конструирования плазмиды заключается в том, что в плазмиду pSV3-neo между сайтами рестрикции HindIII и EcoRI была встроена ДНК, предварительно составленная из фрагментов ДНК: 5'- и 3'-концевые HCV-специфические HindIII - Ncol и Xmal - EcoRI, а также Ncol - Xmal фрагмент, кодирующий фермент. Последовательности фрагментов, ограниченные необходимыми сайтами рестрикции, получали в полимеразной цепной реакции с соответствующими праймерами и матрицами. ДНК конструкцию синтезировали соединением трех частей: 300 нуклеотидов, кодирующих 5'-концевую часть РНК HCV, 103 нуклеотида, кодирующих 3'-концевую часть РНК HCV и 585 нуклеотидов, кодирующих последовательность А-субъединицы токсина дифтерии. Полная нуклеотидная последовательность HindIII - EcoRI фрагмента показана на фиг.1.
Для получения РНК in vitro ДНК конструкцию амплифицировали в ПЦР с помощью безошибочной термополимеразы Pwo II, а затем транскрибировали полученный ампликон РНК-полимеразой бактериофага Т7. Полученную РНК смешивали с инфекционной РНК HCV и вводили методом электропорации в клетки линий Нер-2 или переживающие гепатоциты человека. Эффективность анти-HCV действия ДНК конструкции определяли после ее введения в состав ретровирусного вектора и последующей трансформации полученным вектором клеток линии Нер-2. После селекции клонов, стабильно наследующих ретровирусный вектор pSV3-neo с ДНК-конструкцией, в клетки методом электропорации вводили инфекционную РНК HCV.
Во всех случаях в течение 7 дней контролировали образование РНК HCV специфического антигена и амплификацию РНК в клетках и в среде.
Перечисленные выше генетические конструкции приводят к гибели клетки, зараженной HCV.
Ни в клетках, ни в среде инкубации не обнаружили инфекционных РНК HCV.
Таким образом, предлагаемое изобретение имеет следующие преимущества: во-первых, обеспечивается селективное уничтожение клеток, зараженных геномной РНК вируса гепатита С (HCV). Во-вторых, псевдо HCV <<->> РНК находится в составе ретровирусного вектора, что обеспечивает интеграцию конструкции в геном клеток и ее экспрессию. В третьих, псевдо HCV <<->> РНК не способна к трансляции.
Сущность изобретения поясняется на следующих примерах.
Пример 1 использования плазмиды p-cDT, кодирующей псевдо HCV <<->> РНК.
1. ДНК плазмиды p-cDT методом электропорации вводили в клетки линии Нер-2.
2. Трансформированные клетки отбирали на среде RPMI 1640 с генетицином (1 мг/мл).
3. Клоны устойчивых к генетицину (G 418) использовали для определения HCV-специфических антигенов и РНК.
4. После определения антигенов и РНК в G418 клетки методом электропорации вводили инфекционную РНК HCV.
5. Через 24 часа после электропорации в G418 клетках начинали определять HCV-специфические антигены и РНК, а также дифтерийный токсин.
6. Контроли показали, что за 10 часов до первых морфологических признаков гибели клеток от действия дифтерийного токсина методом твердофазного ИФА определяется сам токсин.
7. Четкие морфологические признаки гибели G 418 клеток наблюдали через 48 часов после электропорации.
Пример 2 использования плазмиды p-cDT, кодирующей псевдо HCV <<->> РНК.
1. В ПЦР с термополимеразой Pwo II, двумя олигонуклеотидными праймерами (5'- TAATACGACTCACTATAGGGAATTCGACAGCTGGGCGG-А-3' и 5'- TTCACGCAGAAAGCGTCTA-3') и матрицей ДНК плазмиды р-cDT.
2. Выделенный ампликон использовали для его транскрипции РНК-полимеразой бактериофага Т7.
3. Полученную РНК методом электропорации вводили в клетки линии Нер-2.
4. Через 24 часа после электропорации в клетках начинали определять дифтерийный токсин. Токсин определяли в течение 120 часов после электропорации.
5. Полученную РНК смешивали с инфекционной РНК HCV и методом электропорации вводили в клетки линии Нер-2.
6. Через 6 часов после электропорации в клетках начинали определять HCV-специфические антигены и РНК, а также дифтерийный токсин.
7. Контроли показали, что за 10 часов до первых морфологических признаков гибели клеток от действия дифтерийного токсина методом твердофазного ИФА определяется сам токсин.
8. Четкие морфологические признаки гибели клеток наблюдали через 18 часов после электропорации.
Предлагаемая генно-инженерная конструкция позволяет селективно уничтожить клетки, зараженные вирусом гепатита С.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЛАЗМИДА PCDT, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2000 |
|
RU2159285C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ВИРУСНОГО ГЕПАТИТА С | 2014 |
|
RU2568872C1 |
| КОДИРУЮЩАЯ ДНК (кДНК) ДЛЯ ПОЛУЧЕНИЯ ВИРУСОПОДОБНЫХ ЧАСТИЦ ВИРУСА ГЕПАТИТА С, СПОСОБ ПОЛУЧЕНИЯ ВИРУСОПОДОБНЫХ ЧАСТИЦ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2007 |
|
RU2375449C2 |
| ВАКЦИНЫ ПРОТИВ ВИРУСОВ ГЕПАТИТА | 1995 |
|
RU2189254C2 |
| Набор рекомбинантных плазмидных ДНК для получения рекомбинантных вирусов Сендай штамм Москва (варианты) | 2021 |
|
RU2787724C1 |
| УСОВЕРШЕНСТВОВАНИЕ ГЕНЕТИЧЕСКИХ КОНСТРУКЦИЙ ДЛЯ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ АНТИВИЧ ТЕРАПИИ | 2013 |
|
RU2533817C1 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ПРОТИВ ВИРУСА ГЕПАТИТА С | 2005 |
|
RU2351363C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ОДНОВРЕМЕННОГО ОБНАРУЖЕНИЯ HCV АНТИГЕНА/АНТИТЕЛА | 2014 |
|
RU2667429C2 |
| Система для активации цитидиндезаминаз APOBEC/AID человека и/или урацил-ДНК-гликозилазы UNG человека и ее применение для элиминации ккз ДНК вируса гепатита B из клеток человека, в частности из гепатоцитов | 2018 |
|
RU2703532C1 |
| к-ДНК ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА (TBEV) | 1995 |
|
RU2202612C2 |
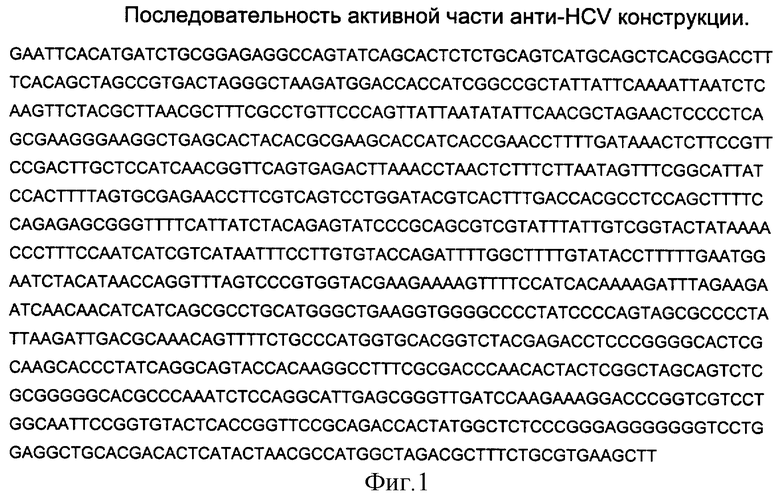
Изобретение относится к медицине и может быть использовано для селективного уничтожения клеток, зараженных РНК вируса гепатита C(HCV). Способ включает 1-й вариант: введение в клетки плазмиды р-cDT, содержащий ДНК с последовательностью нуклеотидов, пприведенной на фиг.1, кодирующую псевдо HCV <<->> РНК и способную направлять синтез А-субъединицы дифтерийного токсина в зараженных клетках, при этом псевдо HCV <<->> РНК не убивает здоровые клетки, незараженные HCV. 2-й вариант: введение в клетки псевдо HCV <<->> РНК, кодируемую ДНК с нуклеотидной последовательностью, приведенной на фиг. 1, и способную направлять синтез А-субъединицы дифтерийного токсина в зараженных клетках. Псевдо HCV <<->> РНК не убивает здоровые клетки, незараженные HCV. Псевдо HCV <<->> РНК получают путем ПЦР с использованием в качестве матрицы ДНК с последовательностью нуклеотидов, приведенной на фиг.1, с последующей транскрипцией РНК-полимеразой. Преимущество изобретения состоит в избирательности действия указанной конструкции, а именно на клетки, зараженные вирусом гепатита С (НСV). 2 с. и 2 з.п.ф-лы, 1 ил.
| Сепарирующее решето корнеклубнеуборочных машин | 1973 |
|
SU464287A1 |
| Способ получения цемента | 1976 |
|
SU718400A1 |
| DE 19532651 A1, 06.03.1997 | |||
| US 5610054 A, 11.03.1997 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
Авторы
Даты
2000-10-27—Публикация
1999-11-04—Подача