Изобретение относится к области нанотехнологии, в частности к растениеводству.
В пат. 2095055, МПК А61К 9/52, А61К 9/16, А61К 9/10, Российская Федерация, опубликован 10.11.1997, предложен способ получения твердых непористых микросфер включающий расплавление фармацевтически неактивного вещества-носителя, диспергирование фармацевтически активного вещества в расплаве в инертной атмосфере, распыление полученной дисперсии в виде тумана в замораживающей камере под давлением, в инертной атмосфере, при температуре от -15 до -50°С и разделение полученных микросфер на фракции по размерам. Суспензия, предназначенная для введения путем парентеральной инъекции, содержит эффективное количество указанных микросфер, распределенных в фармацевтически приемлемом жидком векторе, причем фармацевтически активное вещество микросферы нерастворимо в указанной жидкой среде.
Недостатки предложенного способа: сложность и длительность процесса, применение специального оборудования.
В пат. 2101010, МПК А61К 9/52, А61К 9/50, А61К 9/22, А61К 9/20, А61К 31/19, Российская Федерация, опубликован 10.01.1998, предложена жевательная форма лекарственного препарата со вкусовой маскировкой, обладающая свойствами контролируемого высвобождения лекарственного препарата, содержит микрокапсулы размером 100-800 мкм в диаметре и состоит из фармацевтического ядра с кристаллическим ибупрофеном и полимерного покрытия, включающего пластификатор, достаточно эластичного, чтобы противостоять жеванию. Полимерное покрытие представляет собой сополимер на основе метакриловой кислоты.
Недостатки изобретения: использование сополимера на основе метакриловой кислоты, так как данные полимерные покрытия способны вызывать раковые опухоли; сложность исполнения; длительность процесса.
В пат. 2159037, МПК A01N 25/28, A01N 25/30, Российская Федерация, опубликован 20.11.2000, предложен способ получения микрокапсул реакцией полимеризации на границе раздела фаз, содержащие твердый агрохимический материал 0,1-55 мас. %, суспендированный в перемешивающейся с водой органической жидкости, 0,01-10 мас. % неионного диспергатора, активного на границе раздела фаз и не действующего как эмульгатор.
Недостатки предложенного метода: сложность, длительность, использование высокосдвигового смесителя.
В статье «Разраработка микрокапсулированных и гелеобразных продуктов и материалов для различных отраслей промышленности», Российский химический журнал, 2001, т. XLV, №5-6, с. 125-135, описан способ получения микрокапсул лекарственных препаратов методом газофазной полимеризации, так как авторы статьи считают непригодным метод химической коацервации из водных сред для микрокапсулирования лекарственных препаратов вследствие того, что большинство из них являются водорастворимыми. Процесс микрокапсулирования по методу газофазной полимеризации с использованием n-ксилилена включает следующие основные стадии: испарение димера n-ксилилена (170°С), термическое разложение его в пиролизной печи (650°С при остаточном давлении 0,5 мм рт. ст.), перенос продуктов реакции в «холодную» камеру полимеризации (20°С, остаточное давление 0,1 мм рт. ст.), осаждение и полимеризация на поверхности защищаемого объекта. Камера полимеризации выполнена в виде вращающегося барабана, оптимальная скорость для покрытия порошка 30 об/мин. Толщина оболочки регулируется временем нанесения покрытия. Этот метод пригоден для капсулирования любых твердых веществ (за исключением склонных к интенсивной сублимации). Получаемый поли-n-ксилилент - высококристаллический полимер, отличающийся высокой ориентацией и плотной упаковкой, обеспечивает конформное покрытие.
Недостатками предложенного способа являются сложность и длительность процесса, использование метода газофазной полимеризации, что делает способ неприменимым для получения микрокапсул лекарственных препаратов в полимерах белковой природы вследствие денатурации белков при высоких температурах.
В статье «Разработка микро- и наносистем доставки лекарственных средств», Российский химический журнал, 2008, t. LII, №1, с. 48-57, представлен метод получения микрокапсул с включенными белками, который существенно не снижает их биологической активности, осуществляемый процессом межфазного сшивания растворимого крахмала или гидроксиэтилкрахмала и бычьего сывороточного альбумина (БСА) с помощью терефталоил хлорида. Ингибитор протеиназ - апротинин, либо нативный, либо с защищенным активным центром был микрокапсулирован при его введении в состав водной фазы. Сплющенная форма лиофилизованных частиц свидетельствует о получении микрокапсул или частиц резервуарного типа. Приготовленные таким образом микрокапсулы не повреждались после лиофилизации и легко восстанавливали свою сферическую форму после регидратации в буферной среде. Величина рН водной фазы являлась определяющим при получении прочных микрокапсул с высоким выходом.
Недостатком предложенного способа получения микрокапсул является сложность процесса, что, в свою очередь, приводит к уменьшению выхода конечных капсул.
В пат. 2173140, МПК А61К 009/50, А61К 009/127, Российская Федерация, опубликован 10.09.2001, предложен способ получения кремнийорганолипидных микрокапсул с использованием роторно-кавитационной установки, обладающей высокими сдвиговыми усилиями и мощными гидроакустическими явлениями звукового и ультразвукового диапазона для диспергирования.
Недостатком данного способа является применение специального оборудования - роторно-квитационной установки, которая обладает ультразвуковым действием, что оказывает влияние на образование микрокапсул и при этом может вызывать побочные реакции в связи с тем, что ультразвук разрушающе действует на полимеры белковой природы, поэтому предложенный способ применим при работе с полимерами синтетического происхождения.
В пат. 2359662, МПК А61К 009/56, A61J 003/07, B01J 013/02, A23L 001/00, опубликован 27.06.2009, Российская Федерация, предложен способ получения микрокапсул с использованием распылительного охлаждения в распылительной градирне Niro при следующих условиях: температура воздуха на входе 10°С, температура воздуха на выходе 28°С, скорость вращения распыляющего барабана 10000 оборотов/мин. Микрокапсулы по изобретению обладают улучшенной стабильностью и обеспечивают регулируемое и/или пролонгированное высвобождение активного ингредиента.
Недостатками предложенного способа являются длительность процесса и применение специального оборудования, комплекс определенных условий (температура воздуха на входе 10°С, температура воздуха на выходе 28°С, скорость вращения распыляющего барабана 10000 оборотов/мин).
В пат. WO 2009/148058 JP, МПК B01J 13/04, A23L 1/00, А61К 35/20, А61К 45/00, А61К 47/08), А61К 47/26, А61К 47/32, А61К 47/34, А61К 47/36, А61К 9/50, B01J 2/04, B01J 2/06, опубликован 10.12.2009, описан процесс получения микрокапсул, применимый для промышленного производства, в которых высокое содержание гидрофильного биологически активного вещества, заключенного в оболочку. Предлагаемые микрокапсулы могут быть использованы в пищевой, фармацевтической и в других областях промышленности. В процесс производства применяются диспергирующие композиции, состоящие из гидрофильных биологически активных веществ и ПАВ в твердом жире. Температура не ниже, чем температура плавления твердого жира.
Недостатками данного способа являются сложность и длительность процесса получения микрокапсул.
В пат. WO 2010/076360 ES, МПК B01J 13/00; А61К 9/14; А61К 9/10; А61К 9/12, опубликован 08.07.2010, предложен новый способ получения твердых микро- и наночастиц с однородной структурой с размером частиц менее 10 мкм, где обработанные твердые соединения имеют естественное кристаллическое, аморфное, полиморфное и другие состояния, связанные с исходным соединением. Метод позволяет получить твердые микро- и наночастиц с существенно сфероидальной морфологией.
Недостатком предложенного способа является сложность процесса, а отсюда низкий выход конечного продукта.
В пат. WO 2010/014011 NL, МПК А61К 9/50; B01J 13/02; А61К 9/50; B01J 13/02, опубликован 4.02.2010, описан способ получения микрокапсул диаметром от 0,1 мкм до 25 мкм, включающих: ядро частицы диаметром 90 нм до 23 мкм, содержащее не менее 3% активного компонента по весу частицы; покрытие, которое полностью охватывает основные частицы, содержащие не менее 20% от веса гидрофобного полимера, выбранного из целлюлозных эфиров, сложных эфиров целлюлозы, шеллака, клейковины, полилактида, гидрофобных производных крахмала, поливинилацетата, полимеров или сополимеров на основе эфира акриловой кислоты и/или метакриловой кислоты эфир и их комбинации. Активный компонент не высвобождается при введении в водосодержащие продукты питания, напитки, пищевые или фармацевтические композиции. После приема внутрь, однако, активный компонент выделяется быстро.
Недостатками данного способа являются сложность, длительность процесса, а также применение ультразвука и специального оборудования, использование в качестве оболочек микрокапсул сополимеров акриловой или метакриловой кислоты, которые способны вызывать раковые опухоли.
В пат. WO 2011/003805 ЕР, МПК B01J 13/18; B65D 83/14; C08G 18/00, опубликован 13.01.2011, описан способ получения микрокапсул, которые подходят для использования в композициях, образующих герметики, пены, покрытия или клеи.
Недостатками предложенного способа являются применение центрифугирования для отделения от технологической жидкости, длительность процесса, а также применение данного способа не в фармацевтической промышленности.
В пат. 20110223314, МПК B05D 7/00 20060101 B05D 007/00, В05С 3/02 20060101 В05С 003/02; В05С 11/00 20060101 В05С 011/00; B05D 1/18 20060101 B05D 001/18; B05D 3/02 20060101 B05D 003/02; B05D 3/06 20060101 B05D 003/06 от 10.03. 2011 US, описан способ получения микрокапсул методом суспензионной полимеризации, относящийся к группе химических методов с применением нового устройства и ультрафиолетового облучения.
Недостатком данного способа являются сложность и длительность процесса, применение специального оборудования, использование ультрафиолетового облучения.
В пат. WO 2011/127030 US, МПК А61К 8/11; B01J 2/00; B01J 13/06; C11D 3/37; C11D 3/39; C11D 17/00, опубликован 13.10.2011, предложено несколько способов получения микрокапсул: межфазной полимеризацией, термоиндуцированным разделением фаз, распылительной сушкой, выпариванием растворителя и др.
Недостатками предложенных способов являются сложность, длительность процессов, а также применение специального оборудования (фильтр (Albet, Dassel, Германия), распылительная сушилка для сбора частиц (Spray-4М8 Сушилка от ProCepT, Бельгия)).
В пат. WO 2011/160733 ЕР, МПК B01J 13/16, опубликован 29.12.2011, описан способ получения микрокапсул, которые содержат оболочки и ядра нерастворимых в воде материалов. Водный раствор защитного коллоида и раствор смеси по меньшей мере двух структурно различных бифункциональных диизоцианатов (А) и (В), нерастворимых в воде, собираются вместе до образования эмульсии, затем добавляется к смеси бифункциональных аминов и нагревается до температуры не менее 60°C до формирования микрокапсул.
Недостатками предложенного способа являются сложность, длительность процесса, использование в качестве оболочек микрокапсул полимеров синтетического происхождения и их смесей.
В пат.WO 2012/007438, ЕР МПК А61К 8/11; A61Q 13/00; B01J 13/16; B01J 13/18, опубликован 19.01.2012, описан способ получения частиц со средним диаметром менее 50 микрон, состоящих по крайней мере из одной оболочки, методом ступенчатой полимеризации с участием мономера изоцианата. По крайней мере одна оболочка образована цепной реакцией полимеризации роста (желательно свободно-радикальной полимеризации), которая не связана с изоцианатом. Изобретение также относится к способу получения таких частиц, в которых оболочка формируется до цепного роста полимеризации при температуре, при которой цепная реакция роста подавляется. Изобретение также обеспечивает полностью сформулированные продукты, предпочтительно жидкости и гели, которые содержат указанные частицы.
Недостатками предложенного способа являются сложность и длительность процесса, получение микрокапсул химическим методом ступенчатой полимеризации. Получаемые данным способом частицы имеют достаточно большой размер - 50 мкм.
Наиболее близким методом является способ, предложенный в пат. 2134967, МПК A01N 53/00, A01N 25/28, опубликован 27.08.1999, Российская Федерация (1999). В воде диспергируют раствор смеси природных липидов и пиретроидного инсектицида в весовом отношении 2-4:1 в органическом растворителе, что приводит к упрощению способа микрокапсулирования.
Недостатком метода является диспергирование в водной среде, что делает предложенный способ неприменимым для получения микрокапсул водорастворимых препаратов в водорастворимых полимерах.
Техническая задача - упрощение и ускорение процесса получения нанокапсул водораствормых сельскохозяйственных препаратов группы цитокининов в альгинате натрия, уменьшение потерь при получении нанокапсул (увеличение выхода по массе).
Решение технической задачи достигается способом получения нанокапсул аденина, характеризующийся тем, что в качестве оболочки нанокапсул используется альгинат натрия, а также получение нанокапсул физико-химическим способом осаждения нерастворителем с использованием осадителя - гексана.
Результатом предлагаемого метода является получение нанокапсул аденина в альгинате натрия в течение 15 минут. Выход нанокапсул составляет более 90%.
ПРИМЕР 1. Получение нанокапсул аденина в соотношении ядро:облолочка 1:3
К 1,5 г альгината натрия в изопропаноле добавляют 0,01 г препарата Е472с (сложный эфир глицерина с одной-двумя молекулами пищевых жирных кислот и одной-двумя молекулами лимонной кислоты, причем лимонная кислота как трехосновная может быть этерифицирована другими глицеридами и как оксокислота - другими жирными кислотами. Свободные кислотные группы могут быть нейтрализованы натрием) в качестве поверхностно-активного вещества. Полученную смесь ставят на магнитную мешалку и включают перемешивание. 0,5 г порошка аденина по порциям добавляют в суспензию альгината натрия в изопропаноле. После образования самостоятельной твердой фазы очень медленно по каплям добавляют 5 мл гексана. Полученную суспензию нанокапсул отфильтровывают на фильтре, промывают гексаном и сушат.
Получено 2 г белого порошка. Выход составил 100%.
ПРИМЕР 2. Получение нанокапсул аденина в соотношении ядро:облолочка 1:1
К 0,5 г альгината натрия в изопропаноле добавляют 0,01 г препарата Е472с в качестве поверхностно-активного вещества. Полученную смесь ставят на магнитную мешалку и включают перемешивание. 0,5 г порошка аденина по порциям добавляют в суспензию альгината натрия в изопропаноле. После образования самостоятельной твердой фазы очень медленно по каплям добавляют 3 мл гексана. Полученную суспензию нанокапсул отфильтровывают на фильтре, промывают гексаном и сушат.
Получено 0,92 г белого порошка. Выход составил 92%.
ПРИМЕР 3. Получение нанокапсул аденина в соотношении ядро:облолочка 5:1
К 0,1 г альгината натрия в изопропаноле добавляют 0,01 г препарата Е472с в качестве поверхностно-активного вещества. Полученную смесь ставят на магнитную мешалку и включают перемешивание. 0,5 г порошка аденина по порциям добавляют в суспензию альгината натрия в изопропаноле. После образования самостоятельной твердой фазы очень медленно по каплям добавляют 3 мл гексана. Полученную суспензию нанокапсул отфильтровывают на фильтре, промывают гексаном и сушат.
Получено 0,6 г белого порошка. Выход составил 100%.
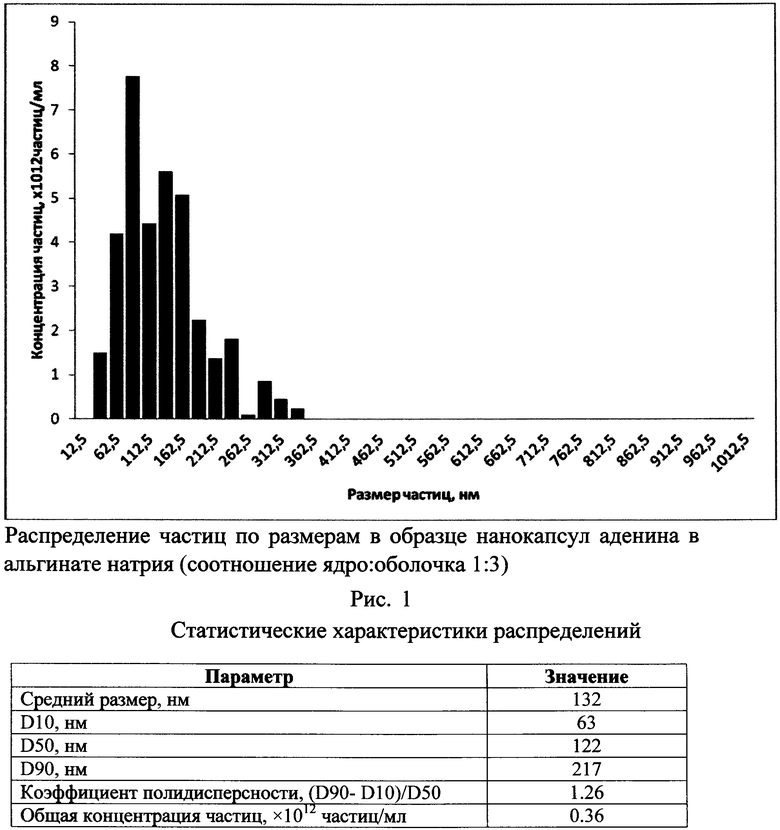
ПРИМЕР 4. Определение размеров нанокапсул методом NTA.
Измерения проводили на мультипараметрическом анализаторе наночастиц Nanosight LM0 производства Nanosight Ltd (Великобритания) в конфигурации HS-BF (высокочувствительная видеокамера Andor Luca, полупроводниковый лазер с длиной волны 405 нм и мощностью 45 мВт). Прибор основан на методе анализа траекторий наночастиц (Nanoparticle Tracking Analysis, NTA), описанном в ASTM E2834.
Оптимальным разведением для разведения было выбрано 1:100. Для измерения были выбраны параметры прибора: Camera Level=16, Detection Threshold=10 (multi), Min Track Length:Auto, Min Expected Size: Auto.длительность единичного измерения 215s, использование шприцевого насоса.
Таким образом, как показано на рис. 1, средний размер нанокапсул аденина составляет 132 нм.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НАНОКАПСУЛ АДЕНИНА В АЛЬГИНАТЕ НАТРИЯ | 2014 |
|
RU2560520C1 |
| Способ получения нанокапсул доксициклина | 2020 |
|
RU2730452C1 |
| Способ получения нанокапсул сухого экстракта топинамбура в ксантановой камеди | 2016 |
|
RU2632428C1 |
| Способ получения нанокапсул сухого экстракта топинамбура | 2016 |
|
RU2634256C2 |
| Способ получения нанокапсул сухого экстракта топинамбура | 2016 |
|
RU2640127C2 |
| Способ получения нанокапсул сухого экстракта топинамбура | 2016 |
|
RU2626821C1 |
| Способ получения нанокапсул стрептоцида в каппа-каррагинане | 2017 |
|
RU2657767C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОКАПСУЛ АМИНОГЛИКОЗИДНЫХ АНТИБИОТИКОВ В АЛЬГИНАТЕ НАТРИЯ | 2015 |
|
RU2599841C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОКАПСУЛ ЦИПРОФЛОКСАЦИНА ГИДРОХЛОРИДА В АЛЬГИНАТЕ НАТРИЯ | 2015 |
|
RU2599007C1 |
| Способ получения нанокапсул хлоральгидрата в альгинате натрия | 2015 |
|
RU2626507C1 |
Изобретение относится к области нанотехнологии и фармацевтической химии. В способе получения нанокапсул аденина в альгинате натрия в качестве оболочки нанокапсул используется альгинат натрия, в качестве ядра - аденин. При осуществлении способа порошок аденина добавляют в суспензию альгината натрия в изопропаноле, содержащую препарат Е472с в качестве поверхностно-активного вещества. После образования самостоятельной твердой фазы приливают гексан. Полученную суспензию нанокапсул отфильтровывают и сушат. Процесс осуществляют в течение 15 минут. Способ обеспечивает упрощение и ускорение процесса получения нанокапсул и увеличение выхода по массе. 1 ил., 4 пр.
Способ получения нанокапсул аденина в альгинате натрия, характеризующийся тем, что в качестве оболочки нанокапсул используется альгинат натрия, при этом порошок аденина добавляют в суспензию альгината натрия в изопропаноле, содержащую препарат Е472с в качестве поверхностно-активного вещества, после образования самостоятельной твердой фазы приливают гексан, полученную суспензию нанокапсул отфильтровывают и сушат, процесс осуществляют в течение 15 минут.
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛИРОВАННЫХ ПРЕПАРАТОВ, СОДЕРЖАЩИХ ПИРЕТРОИДНЫЕ ИНСЕКТИЦИДЫ | 1997 |
|
RU2134967C1 |
| СОЛОДОВНИК В.Д | |||
| "Микрокапсулирование", Москва, "Химия",1980, стр.136-139 | |||
| Способ получения микрокапсул | 1978 |
|
SU676316A1 |
| Способ получения микрокапсул | 1976 |
|
SU707510A3 |
| МИКРОКАПСУЛА ДЛЯ ДЛИТЕЛЬНОГО ВЫСВОБОЖДЕНИЯ ФИЗИОЛОГИЧЕСКИ АКТИВНОГО ПЕПТИДА | 1993 |
|
RU2098121C1 |
Авторы
Даты
2015-11-27—Публикация
2014-07-28—Подача