Изобретение относится к области органической химии - синтезу производных 2-(бензил)фурана, представляющих интерес в синтезе веществ фармацевтического назначения.
Изобретение относится к разработке способа получения производных 2-(бензил)фурана общей формулы Ia-к, которые могут быть использованы в качестве исходных соединений для синтеза замещенных арилуксусных кислот - высокоэффективных нестероидных противовоспалительных препаратов [М. Noji, Н. Sunahara, K.-I. Tsuchiya, Т. Mukai, A. Komasaka, K. Ishii, Synthesis, 2008, 3835-3845, J. - P. Rieu, A. Boucherle, H. Cousse, G. Mouzin, Tetrahedron, 1986, 42, 4095-4131].


Одним из распространенных методов модификации ароматических соединений является реакция Фриделя-Крафтса. Однако использование данного подхода в случае фурановых субстратов накладывает особенности на протекание данной реакции, что связано с ацидофобностью фуранов. Например, использование концентрированных минеральных кислот и легкогидролизуемых кислот Льюиса часто приводит к осмолению реакционной смеси и, как следствие, снижению выходов продуктов реакции. Поэтому поиск новых каталитических систем, позволяющих с высокими выходами вводить в фурановое ядро требуемый набор заместителей, является актуальной задачей.
Для алкилирования фурана в условиях реакции Фриделя-Крафтса обычно используют такие кислоты Льюиса, как производные трехфтористого бора [С.-Н. Lee, W.-S. Cho, Tetrahedron Lett., 1999, 40, 8879-8882; F. Mühlthau, O. Schuster, T. Bach, J. Am. Chem. Soc., 2005, 127, 9348-9349], хлорид золота (III) [P. Rubenbauer, T. Bach, Adv. Synth. Catal., 2008, 350, 1125-1130] или трифлаты редкоземельных металлов [М. Noji, Т. Ohno, K. Fuji, N. Futaba, Н. Tajima, K. Ishii, J. Org. Chem., 2003, 68, 9340-9347; M. Noji, H. Sunahara, K.-I. Tsuchiya, T. Mukai, A. Komasaka, K. Ishii, Synthesis, 2008, 3835-3845]. К недостаткам использования перечисленных каталитических систем можно отнести высокую стоимостью, а также токсичность катализаторов.
Задача изобретения - поиск новой каталитической системы на основе доступных солей меди, позволяющей с высокими выходами получать производные 2-бензилфурана I, которые представляют интерес в качестве исходных соединений для синтеза нестероидных противовоспалительных препаратов.
Техническим результатом является разработка новой эффективной каталитической системы алкилирования фуранового ядра, позволяющей с высокими выходами вводить широкий набор заместителей в целевые продукты.
В основе заявляемого метода лежит описанный ранее однореакторный метод синтеза 2-(2-ацилвинил)индолов, где на первой стадии процесса происходит алкилирование фурановых субстратов разнообразными 2-(N-тозил)аминобензиловыми спиртами в присутствии медного купороса [Uchuskin М.G., Molodtsova N.V., Lysenko S.A., Strel′nikov V.N., Trushkov I.V., Butin A.V., Eur. J. Org. Chem. 2014, 2508-2515; Учускин М.Г., Лысенко С.А., Молодцова Н.В., Трушков И.В., Бутин А.В., патент РФ №2488581]. К недостаткам данного метода следует отнести использование двукратного избытка катализатора и, кроме этого, применение уксусной кислоты в качестве растворителя, что усложняет процедуру выделения целевых продуктов.
Технический результат достигается в результате использования в качестве катализатора бромида меди (II) в реакции коммерчески доступных бензиновых спиртов и 2-алкил(арил)фуранов в 1,2-дихлорэтане.


Температуры плавления и спектральные характеристики 2-(бензил)фуранов Iб-к приведены в таблице 1.
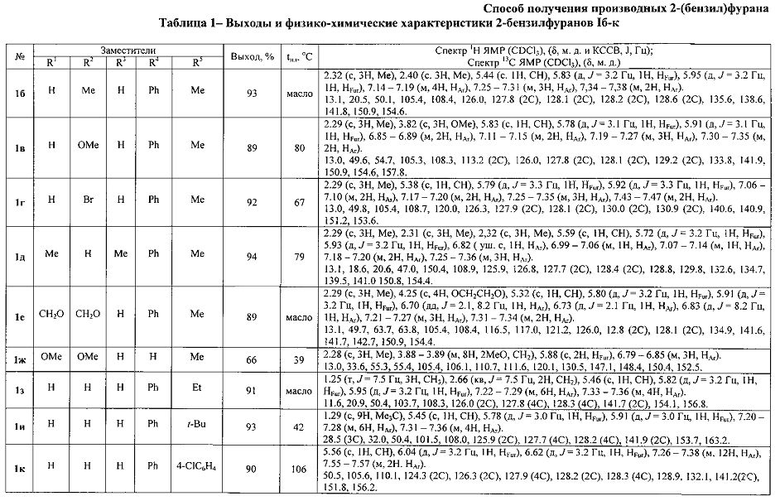
Полученный технический результат открывает путь к широкому ряду производных 2-(бензил)фурана I и позволяет вводить в ароматическое ядро требуемый набор заместителей.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения 2-бензгидрил-5-метилфурана Iа.
Пример 1
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 102 мг CuSO4·5H2O (0.41 ммоль) и 10 мл 1,2-дихлорэтана кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 86% (0.583 г).
Тпл=49-51°C.
Спектр 1H ЯМР (CDCl3), (δ, м. д. и КССВ, J, Гц): 2.30 (с, 3Н, Me), 5.44 (с, 1Н, СН), 5.80 (д, J=3.2 Гц, 1Н, HFur), 5,93 (д, J=3.2 Гц, 1Н, HFur), 7.22-7.29 (м, 6Н, HAr), 7.31-7.36 (м, 4H, HAr).
Спектр 13C ЯМР (CDCl3), (δ, м. д.): 13.0, 50.4, 105.4, 108.5, 126.0 (2С), 127.8 (4С), 128.2 (4С), 141.6 (2С), 150.9, 154.2.
Пример 2
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 71 мг CuCl2·2Н2О (0.41 ммоль) и 10 мл 1,2-дихлорэтана кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 58% (0.389 г).
Пример 3
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 102 мг Cu(NO2)2·3H2O (0.41 ммоль) и 10 мл 1,2-дихлорэтана кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 12% (0.08 г).
Пример 4
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 115 мг CoSO4·7H2O (0.41 ммоль) и 10 мл 1,2-дихлорэтана кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 53% (0.355 г).
Пример 5
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 115 мг NiSO4·7H2O (0.41 ммоль) и 10 мл 1,2-дихлорэтана кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 61% (0.415 г).
Пример 6
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 112 мг FeSO4·7H2O (0.41 ммоль) и 10 мл 1,2-дихлорэтана кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 32% (0.214 г).
Пример 7
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 90 мг NiBr2 (0.41 ммоль) и 10 мл 1,2-дихлорэтана кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 13% (0.087 г).
Пример 8
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 61 мг CuBr2 (0.27 ммоль) и 10 мл толуола кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 15% (0.101 г).
Пример 9
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 61 мг CuBr2 (0.27 ммоль) и 10 мл ацетонитрила кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 68% (0.456 г).
Пример 10
Смесь 0.5 г (2.72 ммоль) бензгидрола, 0.6 мл (6.66 ммоль) сильвана, 61 мг CuBr2 (0.27 ммоль) и 10 мл 1,2-дихлорэтана кипятят в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр, удаляют растворитель при пониженном давлении. Продукт реакции - дифенил((5-метил)фур-2-ил)метан Ia - очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер), фракция 5-40 мкм, элюент - петролейный эфир. Выход 93% (0.63 г).
В таблице 2 приведены данные о влиянии условий проведения реакции на выход 2-бензилгидрил-5-метилфурана Iа (примеры 1-10).

Как видно из таблицы 2, результат, а именно получение 2-бензгидрил-5-метилфурана Iа, с высоким выходом может быть достигнут при кипячении смеси исходных соединений в присутствии бромида меди (II) в 1,2-дихлорэтане.
Методом 10 получен ряд производных 2-бензилфурана Ia-к с выходами 66-94%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-{1-[(4-МЕТИЛФЕНИЛ)СУЛЬФОНИЛ]-1Н-ИНДОЛ-2-ИЛ}БУТ-3-ЕН-2-ОНА | 2012 |
|
RU2488581C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-(3,5-ДИФЕНИЛФУРАН-2-ИЛ)БУТАН-2-ОНА | 2016 |
|
RU2634000C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БИС(5-АЛКИЛ-2-ФУРИЛ)(2-АЗИДОФЕНИЛ)МЕТАНОВ | 2012 |
|
RU2502735C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АРИЛ(ГЕТАРИЛ)-1Н-ИНДОЛОВ | 2010 |
|
RU2439056C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-(2-АЦИЛВИНИЛ)ИНДОЛОВ | 2014 |
|
RU2570421C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ (Е)-4-(ИНДОЛ-2-ИЛ)ПРОП-2-ЕН-1-ОНА | 2016 |
|
RU2633999C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-АЦИЛВИНИЛ)ИНДОЛОВ | 2012 |
|
RU2495027C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ (Е)-2-(2-АЦИЛВИНИЛ)БЕНЗОФУРАНА | 2016 |
|
RU2633998C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-(БЕНЗОФУРАН-2-ИЛ)БУТАН-2-ОНА | 2017 |
|
RU2656208C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ (E)-4-(6,7-ДИМЕТОКСИ-2-МЕТИЛ-3-ХИНОЛИЛ)-3-БУТЕН-2-ОНА | 2010 |
|
RU2425034C1 |
Изобретение относится к области органической химии - синтезу производных 2-(бензил)фурана формулы I a-k, представляющих интерес в синтезе препаратов фармацевтического назначения,
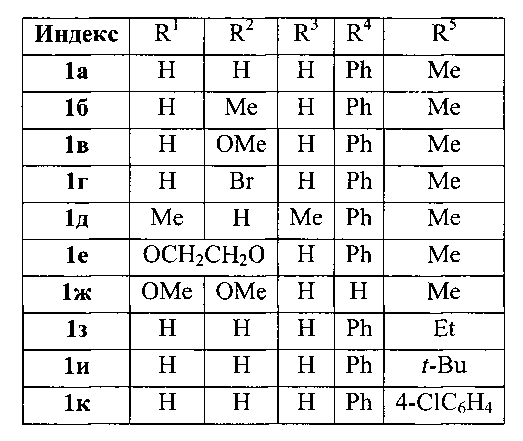
который заключается в реакции алкилирования 2-алкил(арил)фуранов доступными бензиловыми спиртами в присутствии бромида меди (II) в 1,2-дихлорэтане. 2 табл., 10 пр.

Способ получения производных 2-(бензил)фурана общей формулы

где
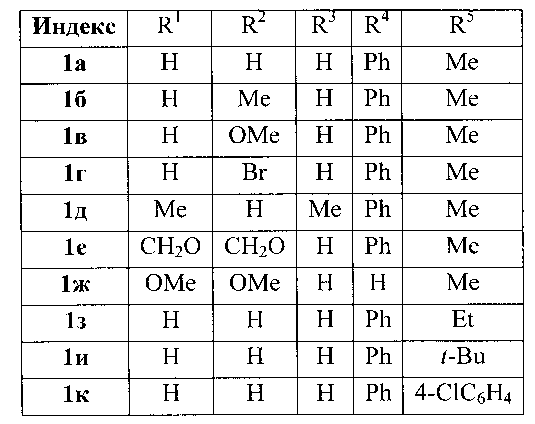
отличающийся тем, что смесь доступных 2-алкил(арил)фуранов и бензиловых спиртов обрабатывают бромидом меди (II) в 1,2-дихлорэтане.
| База данных СА (онлайн) | |||
| "Polyfuril(aril) and their derivatives",Kulnevich V.G | |||
| et al, Khimiya Geterotsiklicheskikh Soedinenii,1984,no.3,p.707-8 Найдено в STN, AN 101:6957 | |||
| M.Noji et al, "A Novel Shynthetic Route to 2-Frylalkamoic Acid by a Rhuthenium-Catalyyzed Chemoselective Oxidation of Furan Rings", Synthesis,2008,no.3,p.3835-3845 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-{1-[(4-МЕТИЛФЕНИЛ)СУЛЬФОНИЛ]-1Н-ИНДОЛ-2-ИЛ}БУТ-3-ЕН-2-ОНА | 2012 |
|
RU2488581C1 |
Авторы
Даты
2015-12-10—Публикация
2014-12-16—Подача