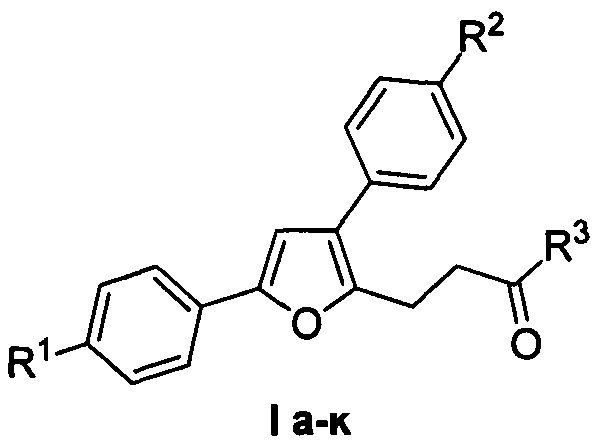
Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных 4-(3,5-дифенилфуран-2-ил)бутан-2-она, представляющих интерес в качестве исходных соединений для синтеза веществ фармацевтического назначения.
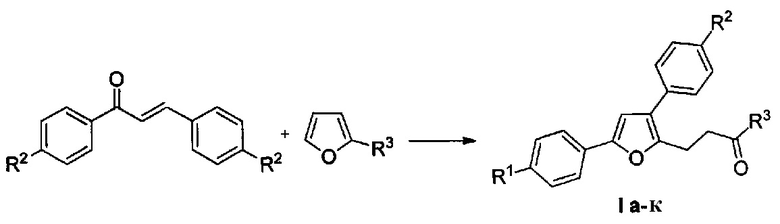
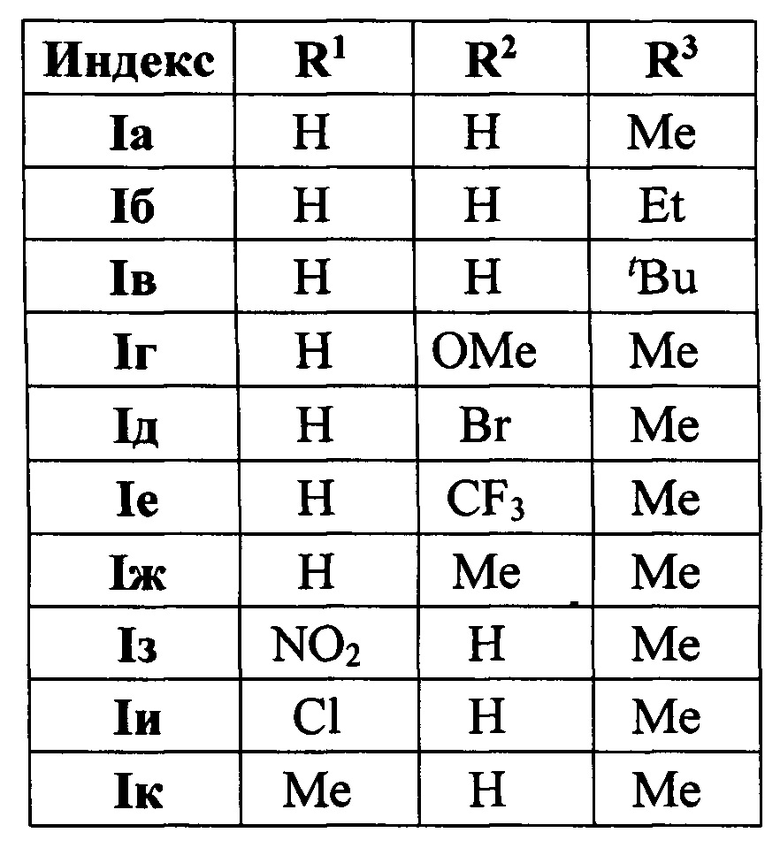
Изобретение относится к разработке способа получения производных 4-(3,5-дифенилфуран-2-ил)бутан-2-она общей формулы I a-к, которые являются привлекательными объектами для медицинской химии. Данные соединения могут быть использованы в синтезе аналогов лифагала, природного соединения, являющегося селективным ингибитором фосфоинозитид-3-киназы (PIKα) - потенциального противоопухолевого средства [F. Marion, D.Е. Williams, В.О. Patrick, I. Hollander, R. Mallon, S.С. Kim, D.M. Roll, L. Feldberg, R.V. Soest, R.J. Andersen Org. Lett. 2006, 8, 321-324].
На сегодняшний день способы синтеза производных 4-(3,5-дифенил-фуран-2-ил)бутан-2-она не описаны. Ближайшими структурными аналогами производных 4-(3,5-дифенилфуран-2-ил)бутан-2-она являются 2,4-диарил-5-алкилфураны, которые получают кислотно-катализируемой реакцией Пааля-Кнорра [В.В. Thompson, J. Montgomery Org. Lett. 2011, 13, 3289-3291], основно- или кислотно-катализируемой изомеризацией β-алкинилкетонов [D.I. MaGee, J.D. Leach, S. Setiadji Tetrahedron 1999, 55, 2847-2856; T. Wang, X.L. Chen, L. Chem, Z.P. Zhan Org. Lett. 2011, 13, 3324-3327], внутримолекулярной реакцией Виттига [K.W. Chen, S. Syu, Y.J. Jang, W. Lin Org. Biomol. Chem. 2011, 9, 2098-2106]. Множество методов синтеза 2,4-диарил-5-алкилфуранов основано на использовании реакций, катализируемых соединениями переходных металлов. Так, например, 2,4-ди-арил-5-алкилфураны получены изомеризацией алкинилэпоксидов в присутствии хлорида индия [J.Y. Kang, В.Т. Connell J. Org. Chem. 2011, 76, 2379-2383], изомеризацией аллиловых спиртов под действием соединений золота [X. Du, F. Song, Y. Lu, H. Chen, Y. Liu Tetrahedron 2009, 65, 1839-1845], рутения [Y. Lian, T. Huber, K.D. Heps, R.G. Bergman, J.A. Ellman Angew. Chem. Int. Ed. 2013, 52, 629-633] и кобальта [J.R. Hummel, J.A. Ellman J. Am. Chem. Soc. 2015, 137, 490-498]. Кроме того, известна реакция внутримолекулярной циклизации кетоалленов под действием соединений индия [A.S. Dudnik, V. Gevorgyan Angew. Chem. Int. Ed. 2007, 46, 5195-5197], палладия [Y. Xia, Y. Xia, R. Ge, Z. Liu, Q. Xiao, Y. Zhang, J. Wang Angew. Chem. Int. Ed. 2014, 53, 3917-3921] или золота [S. Hosseyni, Y. Su, X. Shi Org. Lett., 2015 17, 6010-6013].
К ограничениям перечисленных методов необходимо отнести труднодоступность исходных соединений, использование нестабильных, агрессивных или токсичных реагентов, требующих специальных условий хранения, применение дорогостоящих катализаторов на основе драгоценных металлов, а также ограничения, связанные с возможностью введения требуемого набора заместителей в целевое фурановое ядро.
В основе заявляемого метода лежит описанная перегруппировка β-(фур-2-ил)алкилкетонов, катализируемая бромидом меди(II) в присутствии уксусной кислоты в ацетонитриле и приводящая к производным 4-(3,5-ди-фенилфур-2-ил)бутан-2-она [В. Yin, Н. Yu, Z. Li, W. Zhong, W. Gu Synthesis 2012, 44, 3735-3742].
Задача изобретения - разработка нового эффективного метода получения производных 4-(3,5-дифенилфуран-2-ил)бутан-2-она I а-к, представляющих интерес в качестве легкодоступных исходных соединений для синтеза биологически активных веществ.
Техническим результатом является создание простого и эффективного метода синтеза производных 4-(3,5-дифенилфуран-2-ил)бутан-2-она с использованием доступных исходных соединений и реагентов, позволяющего получать целевые продукты с высоким выходом, а также варьировать заместители в фурановом ядре, что, в конечном счете, позволяет преодолеть ряд ограничений и недостатков существующих методов.
Технический результат достигается в результате взаимодействия доступных халконов с 2-замещенными фуранами при нагревании в 1,4-диоксане в присутствии трифторметансульфокислоты.
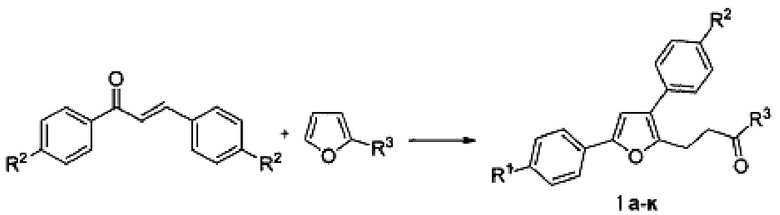
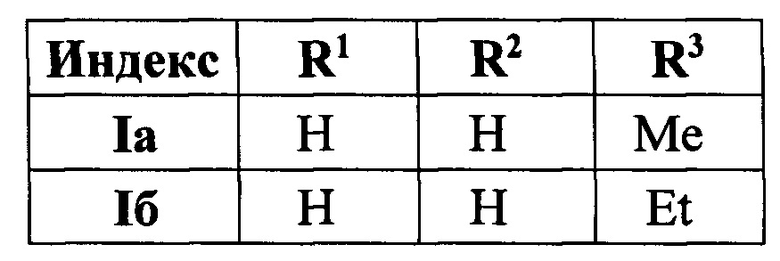
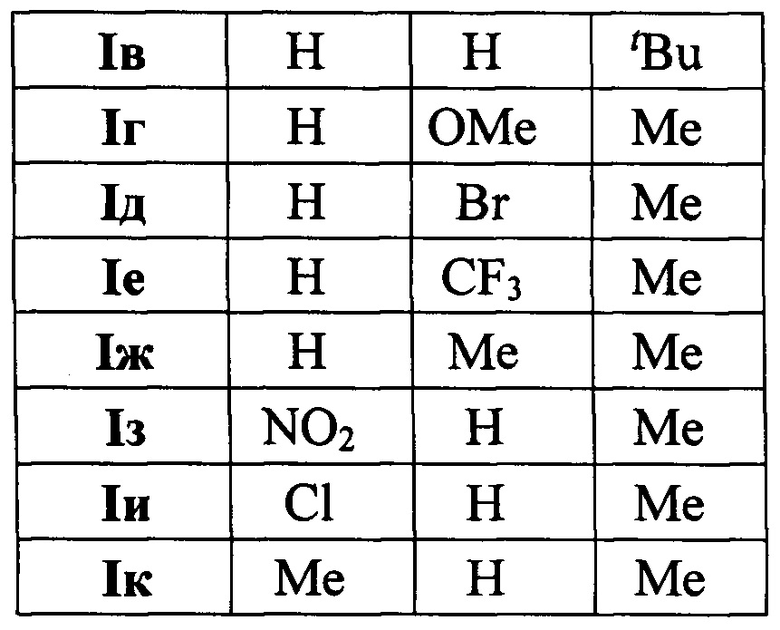
Полученный технический результат позволяет получать желаемые продукты I a-к с хорошими выходами. Помимо этого, метод имеет широкую область применения, что выражается в многочисленном наборе субстратов, которые могут быть использованы для синтеза замещенных 4-(3,5-дифенил-фуран-2-ил)бутан-2-онов, являющихся перспективными для фармации соединениями.
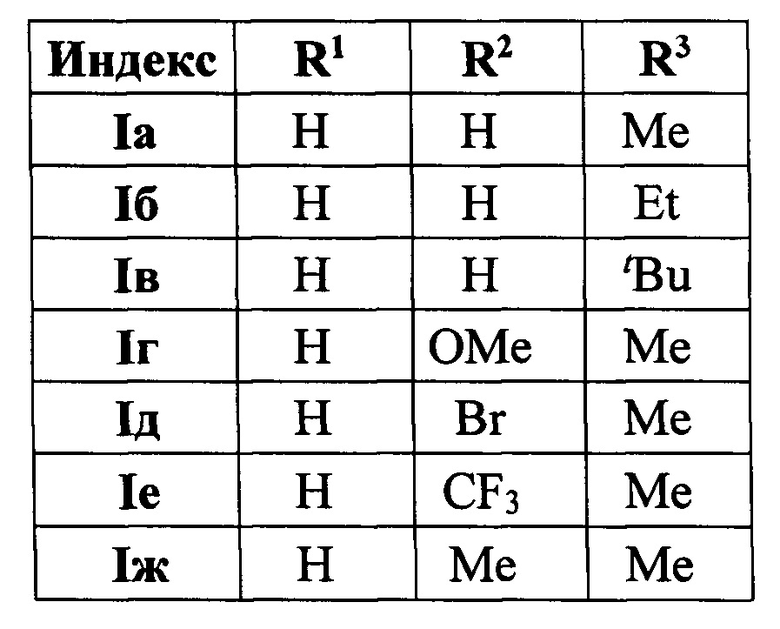
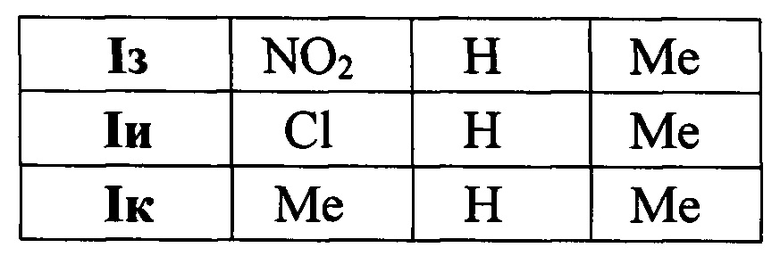
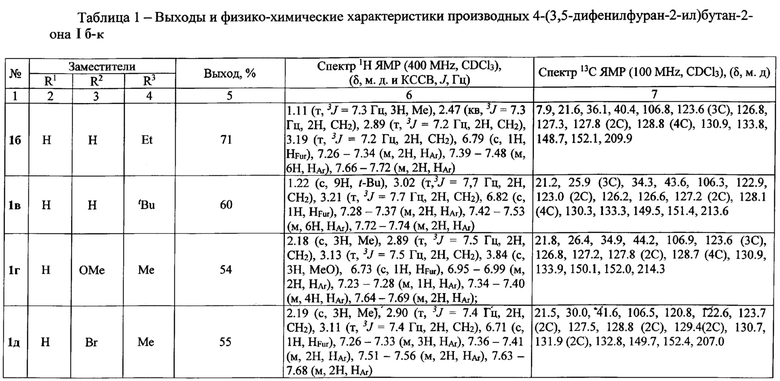
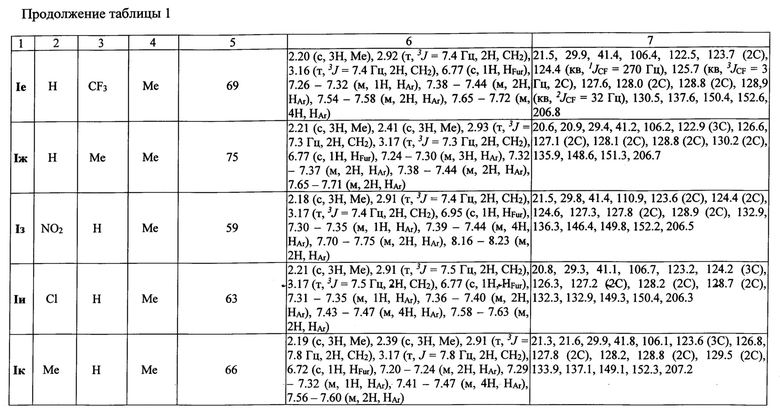
Выходы продуктов и спектральные характеристики производных 4-(3,5-дифенилфуран-2-ил)бутан-2-она I б-к приведены в таблице 1.
Совокупность существенных признаков; изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения 4-(3,5-дифенилфуран-2-ил)бутан-2-она Iа-к.
Пример 1.
Смесь (Е)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и трифторметансульфокислоты (2.25 мкл, 25 мкмоль) в 2 мл 1,4-диоксана перемешивают при 90°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 72% (104 мг).
Спектр 1Н ЯМР (400 MHz, CDCl3), (δ, м. д. и КССВ, J, Гц): 2.22 (с, 3Н, Me), 2.94 (т, 3J=7.2 Гц, 2Н, СН2), 3.18 (т, 3J=7.2 Гц, 2Н, СН2), 6.79 (с, 1Н, HFur), 7.27-7.35 (м, 2Н, НAr), 7.40-7.46 (м, 6Н, НAr), 7.68-7.70 (м, 2Н, НAr).
Спектр 13С ЯМР (100 MHz, CDCl3), (δ,'м. д.): 20.8, 29.4, 41.2, 106.2, 122.9 (3С), 126.2, 126.7, 127.2 (2С), 128.1 (4С), 130.2, 133.1, 148.9, 151.4, 206.7
Пример 2.
Смесь (E)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и трифторметансульфокислоты (4.5 мкл, 50 мкмоль) в 2 мл 1,4-диоксана перемешивают при 90°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 72% (104 мг).
Пример 3.
Смесь (E)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и трифторметансульфокислоты (1.35 мкл, 15 мкмоль) в 2 мл 1,4-диоксана перемешивают при 90°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 58% (84 мг).
Пример 4.
Смесь (Е)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и трифторметансульфокислоты (2.25 мкл, 25 мкмоль) в 2 мл толуола перемешивают при 90°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 68% (99 мг).
Пример 5.
Смесь (Е)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и трифторметансульфокислоты (2.25 мкл, 25 мкмоль) в 2 мл 1,2-дихлорэтана перемешивают при 90°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 66% (96 мг).
Пример 6.
Смесь (E)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и трифторметансульфокислоты (2.25 мкл, 25 мкмоль) в 2 мл 1,4-диоксана перемешивают при 100°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 71% (103 мг).
Пример 7.
Смесь (Е)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и (2.25 мкл, 25 мкмоль) трифторметансульфокислоты в 2 мл 1,4-диоксана перемешивают при 80°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 67% (97 мг).
Пример 8.
Смесь (E)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и моногидрата толуолсульфокислоты (4.8 мг, 25 мкмоль) в 2 мл 1,4-диоксана перемешивают при 90°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 65% (94 мг).
Пример 9.
Смесь (E)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и трифторуксусной кислоты (1,9 мкл, 25 мкмоль) в 2 мл 1,4-диоксана перемешивают при 90°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 15% (22 мг).
Пример 10.
Смесь (E)-халкона (104 мг, 0.5 ммоль), 2-метилфурана (54 мкл, 0.6 ммоль) и метансульфокислоты (1,6 мкл, 25 мкмоль) 2 мл 1,4-диоксана перемешивают при 90°С в течение 24 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 70% (102 мг).
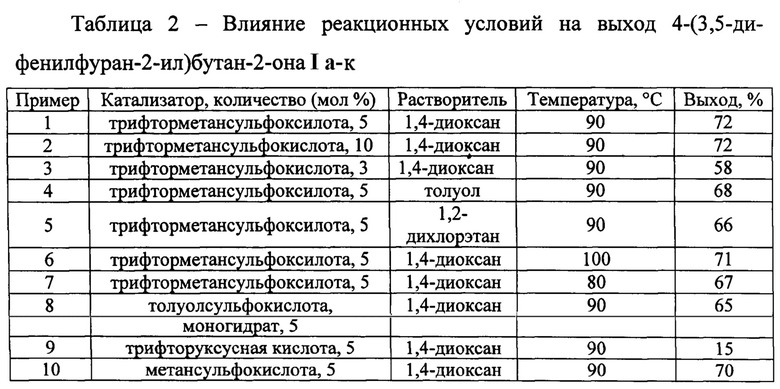
В таблице 2 приведены данные о влиянии условий проведения реакции на выход 4-(3,5-дифенилфуран-2-ил)бутан-2-она (примеры 1-10).
Как видно из таблицы 2, результат, а именно получение 4-(3,5-ди-фенилфуран-2-ил)бутан-2-она, может быть достигнут при использовании трифторметансульфокислоты в качестве катализатора. Оптимальным количеством используемого катализатора является 5 мол %. Снижение количества катализатора приводит к существенному снижению выхода соответствующего продукта, тогда как увеличение количества катализатора не приводит к увеличению выхода продукта. Другие кислоты Бренстеда не позволяют получить продукт с более высоким выходом. Оптимальными условиями для осуществления обсуждаемого химического превращения является нагревание реакционной смеси в 1,4-диоксане при 90°С.
Методом 1 получен ряд производных 4-(3,5-дифенилфуран-2-ил)бутан-2-она I а-k с выходами 54-75%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-(БЕНЗОФУРАН-2-ИЛ)БУТАН-2-ОНА | 2017 |
|
RU2656208C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-(2-АЦИЛВИНИЛ)ИНДОЛОВ | 2014 |
|
RU2570421C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-(БЕНЗИЛ)ФУРАНА | 2014 |
|
RU2570420C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ (Е)-4-(ИНДОЛ-2-ИЛ)ПРОП-2-ЕН-1-ОНА | 2016 |
|
RU2633999C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ (Е)-2-(2-АЦИЛВИНИЛ)БЕНЗОФУРАНА | 2016 |
|
RU2633998C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-АЦИЛВИНИЛ)ИНДОЛОВ | 2012 |
|
RU2495027C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АРИЛ(ГЕТАРИЛ)-1Н-ИНДОЛОВ | 2010 |
|
RU2439056C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БИС(5-АЛКИЛ-2-ФУРИЛ)(2-АЗИДОФЕНИЛ)МЕТАНОВ | 2012 |
|
RU2502735C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-{1-[(4-МЕТИЛФЕНИЛ)СУЛЬФОНИЛ]-1Н-ИНДОЛ-2-ИЛ}БУТ-3-ЕН-2-ОНА | 2012 |
|
RU2488581C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ (E)-4-(6,7-ДИМЕТОКСИ-2-МЕТИЛ-3-ХИНОЛИЛ)-3-БУТЕН-2-ОНА | 2010 |
|
RU2425034C1 |
Изобретение относится к области органической химии – способу получения новых гетероциклических соединений - производных 4-(3,5-дифенилфуран-2-ил)бутан-2-он формулы I а-к, представляющих интерес в качестве исходных соединений для синтеза веществ фармацевтического назначения, который заключается во взаимодействии доступных халконов и 2-замещенных фуранов при нагревании 1,4-диоксане в присутствии трифторметансульфокислоты. 2 табл., 10 пр.
Способ получения производных (4-(3,5-дифенилфуран-2-ил)бутан-2-она общей формулы I а-к
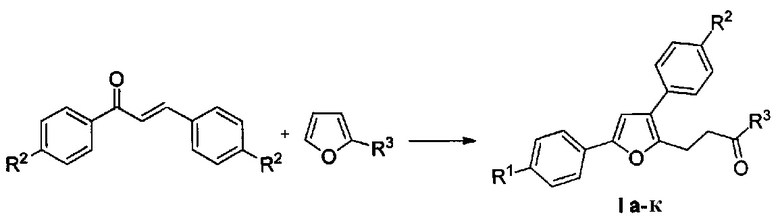
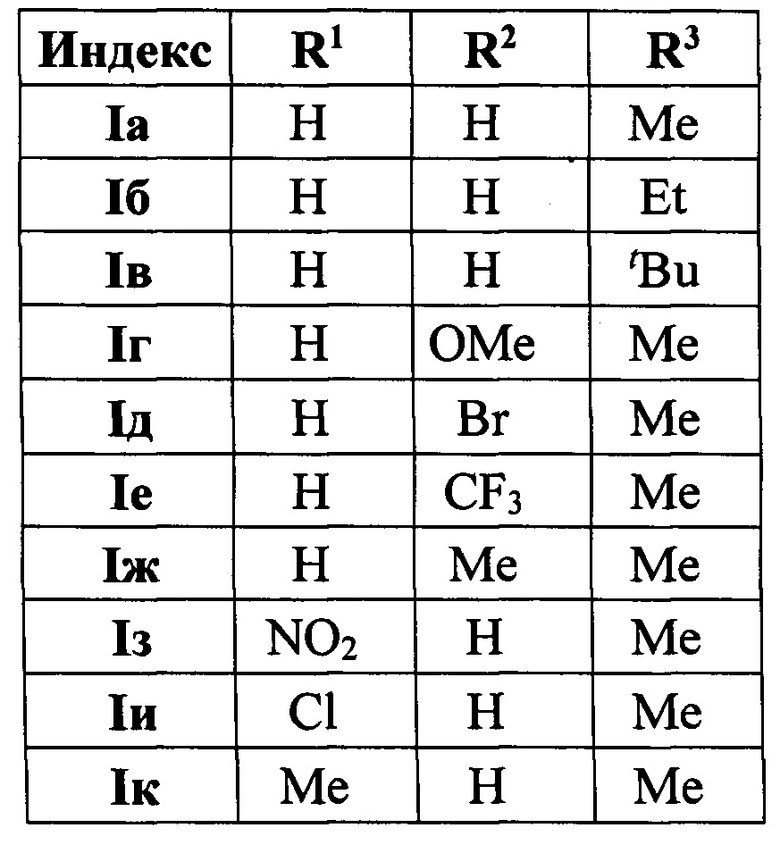
характеризующийся тем, что смесь доступных халконов и 2-замещенных фуранов нагревают в 1,4-диоксане в присутствии трифторметансульфокислоты.
| B.B.Thompson et al | |||
| "Enone- Alkyne Reductive Coupling: A Versatile Entry to Substituted Pyrroles", Organic Letters, 2011, v.13, no.13, 3289-3291 | |||
| Biaolin Yin et al | |||
| "Copper-Catalyzed Ring Opening of Furans as a Concise Route to Polysubtituted Furan under Mild Conditions", Synthesis, 2012, v.44, p.3735-3742 | |||
| Способ получения ацеталей или кеталей фуранового ряда | 1986 |
|
SU1384588A1 |
Авторы
Даты
2017-10-23—Публикация
2016-12-14—Подача