Объектом изобретения являются фармацевтические композиции, содержащие рифаксимин в форме микрогранул, которые делают гастрорезистентными полимер, нерастворимый при значениях рН между 1,5 и 4,0 и растворимый при значениях рН между 5,0 и 7,5, их получение и их применение при изготовлении лекарственных препаратов, полезных в лечении воспалительных заболеваний кишечника (IBD) и главным образом болезни Крона.
Предшествующий уровень техники
Кишечный аппарат поражается множеством воспалительных заболеваний под общим названием воспалительные заболевания кишечника. В частности, болезнь Крона представляет собой тяжелое хроническое воспалительное заболевание, поражающее различные части пищеварительного тракта, от рта до ануса, главным образом его можно наблюдать в последней части тонкой кишки, либо в подвздошной, либо в ободочной кишке, либо в обеих из них, и иногда в слизистой оболочке ободочной кишки, а также в анальной области. В рассматриваемой части кишечника воспаление, отек и изъязвление имеют место во всей кишечной стенке, вызывая стеноз, кровоточащие язвы и боль, в то время как непораженные участки ткани выглядят нормально. При болезни Крона наблюдаются чередующиеся периоды воспалительных симптомов различной тяжести с такими симптомами, как диарея, абдоминальная боль, потеря массы, часто сопровождающиеся трещинами или периректальными фистулами. От двух третей до трех четвертей пациентов с болезнью Крона в определенный момент жизни нуждаются в операции. Операцию используют либо для ослабления симптомов, которые не поддаются терапевтическому лечению, либо для коррекции осложнений, таких как блокада, перфорация, абсцесс или кровотечение в кишечнике.
Роль кишечной бактериальной флоры в этиопатогенезе воспалительных заболеваний кишечника и, в частности, болезни Крона, подтверждает, например, частота локализации в областях с высокими концентрациями бактерий, см. Jannowitz Н.D., в Inflamm. Bowel Dis., 1998, 44, 29-39; отклонение в продвижении фекалий определяет ремиссию эндоскопических повреждений, которые вновь появляются при восстановлении канализирования, см. Rutgeerts, Р., в Lancet, 1991, 338, 771-774; экспериментальные модели, например "нокаут"- мышь по гену IL-10 или другим, указывают на то, что спонтанный колит не развивается, если поддерживаются "аксенические" условия, см. Blumberg R.S., в Curr. Opin. Immunol., 1999, 11(6), 648-56; воспаление слизистой оболочки кишечника развивается после контакта с веществом фекалий, см. Harper Р.Н., в Gut, 1985, 26(3), 279-84; после хирургического "куративного" лечения, состоящего в подвздошно-ободочном анастомозе, лечение антибиотиками замедляет развитие как эндоскопических, так и клинических рецидивов, см. Cameron J.L., в Ann. Surg., 1992, 215, 546-52; и наличие фистул или гнойных мешочков дополнительно подтверждает вклад бактерий в развитие заболевания.
Ранее болезнь Крона лечили лекарственными средствами, которые способны уменьшать или сдерживать воспаление, например кортизонами, салазопирином, месалазином, иммуносупрессантами, специальными химиотерапевтическими средствами, антибиотиками и белковыми ингибиторами действий фактора некроза опухоли (TNF). В процессе лечения острой фазы воспалительного заболевания кишечника часто необходимы более сильные терапевтические воздействия, чтобы обеспечить парентеральное питание, для восстановления потери белков, жидкостей и солей, для предоставления кишечнику покоя для облегчения рубцевания язв. Целью такой терапии является уменьшение частоты повторного появления симптомов и уменьшение тяжести обострений, когда они появляются. Однако при современных терапиях обострения поддаются лечению примерно в 50-70% случаев, а рецидивы встречаются у 80% пациентов.
Антибиотики обычно применяют для уменьшения роста люминальных бактерий; для уменьшения воспалительного состояния, поддерживаемого в результате бактериального роста; для снижения симптомов острой фазы заболевания, например диареи, кишечной боли и метеоризма; и для предупреждения и излечения септических осложнений, например абсцессов, фистул и интоксикации.
Наиболее часто применяемые антибиотики всасываются системно, например метронидазол (активный в отношении некоторых паразитов параллельно с многими анаэробными бактериями) и ципрофлоксацин (активный против таких бактерий, как Е. coli и аэробные энтеробактерии). Метронидазол применяли в дозе 10-20 мг/кг/сутки в течение 4 месяцев (Sunterland, L. Gut, 1991, 32, 1071-5), в то время как ципрофлоксацин применяли в дозе 1000 мг/сутки в течение 6 недель (Colombel J.F. в Am. J.Gastroenterol., 1999, 94, 674-8), тогда как Prantera в Am. J.Gastroenterol., 1996, 91, 328-32 выбрал комбинацию двух антибиотиков, используя метронидазол в дозе 1000 мг/сутки и ципрофлоксацин в дозе 1000 мг/сутки в течение 12 недель. Высокая системная биодоступность этих антибиотиков является основой высокой частоты их побочных эффектов, зарегистрированных при долгосрочных терапиях, что отрицательно влияет на их применение. Частота побочных эффектов при применении метронидазола находится в интервале от 10% до 20% в зависимости от дозы и продолжительности лечения. Наиболее частые побочные эффекты включают в себя металлический вкус, желудочную непереносимость, тошноту, глоссит, сильную головную боль, вертиго, атаксию, судороги и нейротоксичность. У 10-85% пациентов с долгосрочным лечением зарегистрирована периферическая невропатия, которая может уменьшиться только после нескольких месяцев перерыва в лечении. Процент побочных эффектов, описанных в исследованиях ципрофлоксацина, варьируется и зависит отчасти от дозировки и длительности лечения. Наиболее частые из побочных эффектов имеют желудочно-кишечное происхождение, но также было часто описано повышение трансаминазы и кожные реакции. Таким образом, в данной области техники существует необходимость в альтернативной долгосрочной терапии воспалительных заболеваний пищеварительного тракта, например желудочно-кишечных патологий.
Полезно, чтобы фармацевтический препарат на основе антибиотиков, применяемый для лечения воспалительных заболеваний кишечника (например, желудочно-кишечных патологий), обладал одной или более чем одной из следующих характеристик: активностью на кишечном уровне, низким всасыванием, сдерживанием уровня бактерий в полости кишечника, широким спектром действия против микроорганизмов (например, кишечных грамположительных, грамотрицательных, аэробных и анаэробных компонентов), возможностью долгосрочного лечения без побочных эффектов, легкостью введения для облегчения соблюдения пациентом режима и схемы лечения даже при возможной необходимости высокой дозировки, например долгосрочного дозирования и/или многократного дозирования в сутки.
Антибиотиком, обладающим несколькими из этих характеристик, является рифаксимин (INN (международное непатентованное название); см. The Merck Index, XIII Ed., 8304), который характеризуется широким спектром действия против многих грамположительных и грамотрицательных бактерий, включая аэробные и анаэробные бактерии. Исследования биодоступности у здоровых добровольцев показали, что при пероральном приеме всасывается менее 1% рифаксимина и он концентрируется в кишечной полости и в фекалиях, как описано здесь (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int. J. Clin. Pharmacol. Res, 14 (2), 51-56, (1994)). Отсутствие всасывания рифаксимина подтверждено у пациентов, страдающих хроническим заболеванием кишечника (см. Rizzello, Eur. J.Clin. Pharmacol. (1998) 54, 91-93). Кроме того, низкий профиль всасывания рифаксимина снижает частоту побочных эффектов и нежелательный риск фармакологических взаимодействий. Таким образом, рифаксимин можно считать полезным в терапии воспалительного хронического заболевания кишечника и, в частности, болезни Крона. Потенциальная эффективность рифаксимина при хронических воспалительных заболеваниях кишечника подтверждена, см. Gionchetti, P., Dig. Dis. Sci., 1999, 44, 1220-1, который предложил применение рифаксимина у пациентов со среднетяжелым или тяжелым неспецифическим язвенным колитом, не поддающимся стероидной терапии.
Рифаксимин описан в итальянском патенте IT 1154655 (1980) и в ЕР 0161534 (1985), оба из которых включены в данное описание изобретения посредством ссылки в полном объеме для всех целей. В ЕР 0161534 раскрыт способ получения рифаксимина, используя рифамицин О в качестве исходного вещества (The Merck Index, XIII Ed., 8301).
Руководство по кристаллизации и сушке рифаксимина описано в итальянской патентной заявке № MI2003A002144 (2003), в европейской патентной заявке №ЕР1557421 (2003), в патентной заявке США №10/728,090 (2003), в патентной заявке РСТ № WO 2005/044823, все из которых включены в данное описание изобретения посредством ссылки в полном объеме для всех целей. Экспериментальные условия, описанные в этих патентах, позволяют получить полиморфные формы рифаксимина, называемые Форма α, Форма β, Форма γ, Форма δ и Форма ε соответственно.
Рифаксимин одобрен в нескольких странах для лечения патологий, этиология которых отчасти или полностью является следствием острых и хронических кишечных инфекций, вызванных грамположительными и грамотрицательными бактериями, с синдромами диареи, измененной микрофлорой кишечника, летними диареяподобными эпизодами, диареи путешественников и энтероколита; до- и послеоперационной профилактики инфекционных осложнений желудочно-кишечной хирургии; а также терапии гипераммониемии в качестве сопутствующего агента. Рифаксимин в настоящее время имеется в продаже в виде таблеток или капсул с дозировкой 100 мг и 200 мг, в готовом к употреблению препарате для детей или в виде мази для лечения местных инфекций.
Исследования имеющихся в продаже образцов, в частности таблеток 200 мг, показали потенциальную пользу рифаксимина при предупреждении рецидива болезни Крона после эндоскопической резекции. Однако отсутствие группы плацебо в клиническом испытании не позволяет сделать определенные выводы, см. Rizzello, Gut, 2000, 47, Supp.3, А12. Однако предложенную позологию применения 200 мг таблеток рифаксимина следует считать субоптимальной из-за необходимости применения вплоть до шести таблеток в сутки в течение трех месяцев, что приводит к плохому соблюдению пациентами режима и схемы лечения. Таблетки рифаксимина 200 мг также применялись для лечения болезни Крона с дозировками 600 мг/сутки в течение 16 недель, как описано в Shafran, I., Am. J.Gastroenterol., 2003, 98 (Suppl.) S-250.
Таким образом, в данной области существует необходимость в фармацевтической композиции рифаксимина для лечения инфекций, особенно локализованных в кишечном тракте. Предыдущие композиции после введения высвобождаются и распределяются между желудком и кишечником. Следовательно, когда рифаксимин, наконец, достигает кишечного тракта, концентрация является слишком низкой, что приводит к необходимости повышенных дозировок. Чтобы максимизировать терапевтическую эффективность рифаксимина в лечении кишечных заболеваний, в данной заявке предложены новые фармацевтические композиции, и они включают, например, микрогранулы рифаксимина с гастрорезистентным пленочным покрытием, которые растворяются с высвобождением антибиотика только в кишечном тракте. Эта новая композиция максимизирует контакт между активным ингредиентом и слизистой оболочкой кишечника вследствие, отчасти, большой площади поверхности микрогранул. Новые композиции также позволяют облегчить введение высокой и низкой дозы, например, при применении в педиатрии.
Новые гастрорезистентные препараты рифаксимина имеют преимущества из-за различия рН в желудочной среде (например, значения от примерно 1,5 до примерно 4,0 в зависимости от состояния натощак или в присутствии пищи) и полости кишечника (например, значения от примерно 5,0 до примерно 7,5 в зависимости от рассматриваемых трактов).
В новых формах также использованы полиморфные формы рифаксимина.
Покрытие фармацевтических микрогранул гастрорезистентной пленкой является методикой, известной в фармацевтической области в течение многих лет. Его, как правило, проводят в две стадии: гранулирование и нанесение покрытия. Тем не менее, многие активные вещества, включая рифаксимин, характеризуются очень мелким размером частиц, например в случае рифаксимина примерно 50% частиц имеет диаметр частиц между 10 мкм и 40 мкм. В таких условиях это очень затруднительно с использованием традиционных систем, таких как покрытие в псевдоожиженном слое или котловая технология. Очень часто происходит агломерация, либо часто получается случайная смесь покрытых и непокрытых частиц.
Авторы изобретения обнаружили, и это является объектом изобретения, что можно получить микрогранулы рифаксимина с энтеросолюбильным покрытием путем применения технологии псевдоожиженного слоя, которая неожиданно позволяет за одну стадию и одновременно осуществить влажную грануляцию порошка и покрыть полученные микрогранулы полимером, резистентным к желудочной среде, обычно называемым энтеросолюбильным покрытием. При данном подходе минимизированы главные недостатки влажной грануляции и покрытия микрогранул, которые заключаются в отдельных требующихся стадиях, а также затратах времени и труда, необходимых для осуществления всей процедуры, особенно в крупном масштабе. Этот результат получают в результате комбинирования свойств рифаксимина и правильного баланса количества рифаксимина, энтеросолюбильного полимера, пластификатора и параметров процесса.
Эффективность данной технологии в обеспечении полного слоя покрытия вокруг рифаксимина продемонстрирована с помощью SEM (сканирующей электронной микроскопии), как показано на Фиг.1А (Сканирующая электронная микроскопия гастрорезистентных микрогранул рифаксимина) и 1Б (Сканирующая электронная микроскопия одной гранулы из гастрорезистентных микрогранул рифаксимина), где ясно показано, что рифаксимин полностью покрыт энтеросолюбильным полимером. Размеры частиц являются достаточно однородными, без больших комков или очень мелко измельченного порошка. Если бы таковые присутствовали, один или оба этих аспекта оказывали бы отрицательное воздействие в любом дальнейшем лекарственном препарате.
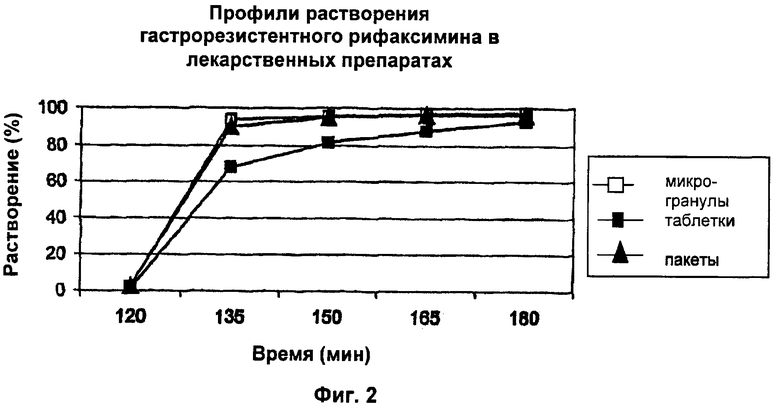
Как подтверждение полноты покрытия, профиль растворения гастрорезистентных микрогранул рифаксимина показывает, что рифаксимин полностью удерживается при низком рН и высвобождается при рН выше 5,0, как показано на Фиг.2 (Профили растворения).
Для максимизации высвобождения активного ингредиента вблизи слизистой оболочки кишечника использовали значительное различие рН между желудочной средой, значения от 1,5 до 4,0 в зависимости от состояния натощак или в присутствии пищи, и полостью кишечника, значения от 5,0 до 7,5 в зависимости от рассматриваемых трактов. Для этой цели использовали энтеросолюбильные полимерные вещества, обладающие свойством растворяться при значениях рН между 5,0 и 7,5, включающие: сополимеры метакриловой кислоты с акриловым или метакриловым эфиром, такие как сополимер метакриловой кислоты и этилакрилата (1:1) и сополимер метакриловой кислоты и метилметакрилата (1:2), поливинилацетата фталат, ацетатфталат гидроксипропилцеллюлозы и ацетатфталат целлюлозы, продукты, доступные на рынке, например, с товарными знаками KOLLICOAT®, EUDRAGIT®, AQUATERIC®, AQOAT®.
Нанесение таких гастрорезистентных пленок на порошок или гранулы рифаксимина осуществляют с помощью стандартного аппарата для технологии покрытия в псевдоожиженном слое. Пленочное покрытие, растворенное в органических растворителях или суспендированное в воде, наносят путем распыления на порошки или гранулы, поддерживаемые в суспензии воздухом в системах с псевдоожиженным слоем. Наиболее применимыми органическими растворителями являются: метиленхлорид, метиловый спирт, изопропиловый спирт, ацетон, триэтилацетат и этиловый спирт. Альтернативно полимерное гастрорезистентное вещество можно наносить суспендированным в воде. Такая методика является предпочтительной, поскольку она не требует использования растворителей и, следовательно, позволяет избежать токсикологических проблем и проблем, связанных с безопасностью.
Вместе с полимерным веществом можно добавлять другие эксципиенты с антиагломерационными свойствами, такие как тальк; пластифицирующими свойствами, такие как ацетилированные глицериды, диэтилфталат, пропиленгликоль и полиэтиленгликоль; поверхностно-активные вещества, такие как полисорбат и полиоксиэтиленатные сложные эфиры, пеногасители, а также антиадгезивные агенты.
Успешное применение вышеуказанной технологии к покрытию порошка рифаксимина является необычным, поскольку в уровень техники технологии псевдоожиженного слоя не входит распыление энтеросолюбильного полимера непосредственно на активный ингредиент без какой-либо предварительной обработки, такой как грануляция или нанесение слоя активного ингредиента на инертные частицы. Действительно, без какой-либо предварительной обработки порошка могут иметь место некоторые недостатки, такие как образование больших комков, большой диапазон диаметра частиц, неоднородный состав микрогранул, неоднородный слой покрытия. Появление некоторых из этих недостатков является обычным для рифаксимина, порошок которого состоит из мелкоизмельченных частиц и является исключительно гидрофобным, электростатическим, гигроскопичным и трудным для смешивания с обычными эксципиентами в порошке. Кроме того, он имеет предрасположенность к сегрегации, не позволяющей получить однородную смесь. При наличии таких нежелательных характеристик для получения рифаксимина с покрытием требовалось бы использование более чем одной стадии и большого количества эксципиентов, которые ограничивали бы фармацевтическую активность дозировки для человека.
Как дополнительное преимущество настоящего изобретения гастрорезистентные микрогранулы рифаксимина, полученные на основе описанной технологии по настоящему изобретению, можно непосредственно использовать для заполнения в капсулы, или их можно смешивать с эксципиентами и усилителями сладости, что обеспечивает возможность введения водной суспензии.
Кроме того и более значимо, гастрорезистентные микрогранулы рифаксимина можно также непосредственно использовать для изготовления таблеток посредством технологии прямого прессования посредством добавления стандартных наполнителей или носителей. Как дополнительное преимущество на таблетках можно сделать бороздку для изменения активности дозы, или их можно ломать, чтобы облегчить глотание, без потери гастрорезистентных свойств микрогранул.
Все эти возможности придают большую значимость технологии изготовления гастрорезистентных микрогранул рифаксимина, описанной в настоящем изобретении, делая ее пригодной для широкого модулирования дозировок и фармацевтических форм.
В заключение, настоящее изобретение демонстрирует, по сравнению с другими имеющимися в продаже препаратами рифаксимина, значительные улучшения, которые можно резюмировать как возможность изготовления только в одну стадию гастрорезистентных микрогранул рифаксимина, которые остаются нерастворимыми в желудке (например, при интервале рН между примерно 1,5 и примерно 4,0) и растворимыми в кишечнике (например, при более высоком рН, например, между примерно 5,5 и примерно 7,5), вводить более высокую дозу, направляя максимальное высвобождение активного ингредиента в кишечник и в то же время делая максимальным его контакт со слизистой оболочкой кишечника благодаря высокой площади поверхности микрогранул.
Описание изобретения
Объект изобретения составляют фармацевтические препараты, содержащие микрогранулы рифаксимина, покрытые гастрорезистентным полимером, который нерастворим при значениях рН в интервале между 1,5 и 4,0 и растворим при значениях рН в интервале между 5,0 и 7,5, их получение и их применение при воспалительных заболеваниях кишечника и, в частности, при болезни Крона.
Микрогранулы могут иметь диаметр от примерно 1 микрона до примерно 900 микронов или более предпочтительно диаметр от примерно 10 микронов до примерно 500 микронов.
Гастрорезистентность может быть получена с использованием какого-либо вещества, нерастворимого при значениях рН в интервале между примерно 1 и примерно 4,9, от примерно 1,4 до примерно 4,2 или от примерно 1,5 до примерно 4,0. Подходящие полимеры могут быть также растворимыми при значениях рН в интервале от примерно 5,0 до примерно 7,0, от 5,0 до примерно 7,5 или от 5,0 до примерно 7,7 и выше.
Полимерные вещества, используемые в гастрорезистентных композициях рифаксимина, солюбилизируются, как обсуждается выше, при значениях рН, составляющих в полости кишечника, например, от примерно 4,9 до примерно 7,7, и могут использоваться в качестве гастрорезистентных, энтеросолюбильных покрытий для высвобождения лекарственного средства в кишечнике, когда это желательно. Примеры пригодных полимерных веществ включают, например, акриловые полимеры, сополимеры метакриловой кислоты с акриловым или метакриловым эфиром (например, сополимер метакриловой кислоты и этилакрилата (1:1) и сополимер метакриловой кислоты и метилметакрилата (1:2), поливинилацетат фталат, ацетатфталат гидроксипропилцеллюлозы и ацетат фталат целлюлозы), а также ацетат фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, поливинилацетат фталат. Имеющиеся в продаже продукты включают, например, KOLLICOAT®, EUDRAGIT® (например EUDRAGIT 40), AQUATERIC®, AQOAT®.
Энтеросолюбильные вещества, которые растворимы при высоких значениях рН, часто используют для систем доставки, специфичных для ободочной кишки, и они применимы в гастрорезистентных препаратах рифаксимина, описанных здесь. Используемые энтеросолюбильные полимеры можно также модифицировать путем смешивания с другими покрывающими продуктами, которые не чувствительны к рН. Примеры таких покрывающих продуктов включают, например, нейтральные сложные эфиры метакриловой кислоты с небольшой частью триметиламмониоэтилметакрилата хлорида, продаваемого в настоящее время под товарными знаками EUDRAGIT® и EUDRAGIT® RL; дисперсию нейтральных эфиров без каких-либо функциональных групп, продаваемую под товарными знаками EUDRAGIT® NE30D и EUDRAGIT® NE30, EUDRAGIT® 40; полисахариды, такие как амилоза, хитозан, хондроитина сульфат, декстран, гуаровая камедь, инулин и пектин; и другие рН-независимые покрывающие продукты.
Полимер составляет от примерно 5% до примерно 75% массы микрогранулы. В других воплощениях полимер составляет от примерно 10% и примерно 60%, от 20% до примерно 55%, от примерно 30% до примерно 80% или от 25% до примерно 50% массы микрогранулы. Массовый процент полимера от массы микрогранулы может, в частности, зависеть от используемого полимера, температуры полимера, препарата (например, пакет, пилюля, капсула и т.д.) и от рН, при котором полимер растворим.
Гастрорезистентные микрогранулы рифаксимина могут дополнительно содержать один или более чем один разбавитель, пластификатор, антиагломерационный агент, антиадгезивный агент, скользящие вещества, поверхностно-активные пеногасители или красящие вещества. Эти вещества вместе с другими полимерами и покрытиями (например, защитными покрытиями, поверхностными покрытиями и пленками) описаны ниже.
В состав покрытия можно включать подходящие ингредиенты, такие как пластификаторы, которые включают, например, адипаты, азелаты, бензоаты, цитраты, изоэбукаты, фталаты, себакаты, стеараты и гликоли. Обычные пластификаторы включают ацетилированные моноглицериды, бутилфталилбутилгликолят, дибутилтартрат, диэтилфталат, диметилфталат, этилфталилэтилгликолят, глицерин, этиленгликоль, пропиленгликоль, триацетинцитрат, триацетин, трипропиноин, диацетин, дибутилфталат, ацетилмоноглицерид, полиэтиленгликоли, касторовое масло, триэтилцитрат, многоатомные спирты, ацетатные эфиры, триацетат глицерина, ацетилтриэтилцитрат, дибензилфталат, дигексилфталат, бутилоктилфталат, диизононилфталат, бутилоктилфталат, диоктилазелат, эпоксидированный таллат, триизооктилтримеллитат, диэтилгексилфталат, ди-н-октилфталат, ди-1-октилфталат, ди-1-децилфталат, ди-н-ундецилфталат, ди-н-тридецилфталат, три-2-этилгексилтримеллитат, ди-2-этилгексиладипат, ди-2-этилгексилсебакат, ди-2-этилгексилазелат, дибутилсебакат, глицерилмонокаприлат и глицерилмонокапрат. Как понятно специалисту в данной области техники, также можно предусмотреть различные другие слои. Количество пластификатора, используемое в полимерном материале, обычно находится в интервале от примерно 10% до примерно 50%, например примерно 10, 20, 30, 40 или 50% из расчета на массу сухого полимера.
Возможные модифицирующие компоненты защитного слоя, который можно использовать поверх энтеросолюбильного или других покрытий, включают водопроницаемый барьерный слой (полупроницаемый полимер), который может быть последовательно нанесен после энтеросолюбильного или другого покрытия для уменьшения скорости проникновения воды через энтеросолюбильный слой покрытия и, таким образом, увеличения лаг-периода высвобождения лекарственного средства. Покрытия, общеизвестные специалистам в данной области техники, можно использовать для этой цели посредством применения методик нанесения покрытия, таких как нанесение покрытия в псевдоожиженном слое, используя растворы полимеров в воде или подходящих органических растворителях, либо путем использования водных полимерных дисперсий. Например, пригодные вещества включают ацетат целлюлозы, ацетатбутират целлюлозы, ацетатпропионат целлюлозы, этилцеллюлозу, жирные кислоты и их эфиры, воски, зеин и водные полимерные дисперсии, такие как EUDRAGIT® RS и RL 30D, EUDRAGIT® NE 30D, EUDRAGIT® 40, AQUACOAT®, SURELEASE®, целлюлозо-ацетатный латекс. Также можно использовать комбинации полимеров и гидрофильных полимеров, таких как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза (KLUCEL®, Hercules Corp.), гидроксипропилметилцеллюлоза (НРМС) (METHOCEL®, Dow Chemical Corp.), поливинилпирролидон.
Также в гастрорезистентные препараты рифаксимина можно включать пеногасители. В одном воплощении пеногаситель представляет собой симетикон. Количество используемого пеногасителя обычно составляет от 0% до 0,5% от конечной композиции. Можно добавлять другие агенты для улучшения обрабатываемости герметизирующего или барьерного слоя. Такие агенты включают, например, тальк, коллоидный кремнезем, поливиниловый спирт, диоксид титана, микронизированный кремнезем, белую сажу, глицеринмоностеарат, трисиликат магния и стеарат магния или их смесь.
Количество полимера, которое следует использовать в гастрорезистентных композициях, обычно регулируют для достижения желаемых свойств в отношении доставки лекарственного средства, включая количество лекарственного средства, которое следует доставить, скорость и место доставки лекарственного средства, время задержки высвобождения лекарственного средства и размер отдельных частиц в композиции. Комбинация всех твердых компонентов полимерного материала, включая сополимеры, наполнители, пластификаторы, а также возможные эксципиенты и вспомогательные вещества для обработки, обычно составляет от примерно 1% до примерно 50% от массы ядра.
Гастрорезистентные микрогранулы рифаксимина содержат рифаксимин в полиморфной форме и/или в сырьевой форме. Формы в любой микрогрануле могут представлять собой смесь или могут представлять собой чистую форму. Форма рифаксимина может зависеть, в частности, от формы рифаксимина, на которую нанесено покрытие, от композиции эксципиентов и от способа, используемого для получения микрогранул. Полиморфные формы рифаксимина выбраны из Формы α, Формы β, Формы γ, Формы δ или Формы ε рифаксимина, упомянутых выше.
Смесь, содержащую гастрорезистентное вещество, готовят путем суспендирования компонентов в деминерализованной воде и гомогенизации суспензии посредством смесительной системы высокой скорости, предпочтительно гомогенизатора Ultra Turax, с целью получения гомогенной суспензии, содержащей от 15% до 30% твердых частиц. Гомогенную суспензию, содержащую гастрорезистентное вещество, можно наносить с помощью системы для покрытия или аппарата с псевдоожиженным слоем.
В настоящем изобретении использована технология псевдоожиженного слоя. Смесь, содержащую активный ингредиент, поддерживают в суспензии потоком теплого воздуха, в то же время гастрорезистентную суспензию распыляют с помощью форсунки, приделанной к верхней части (верхнее распыление) или нижней части (нижнее распыление - система Вюрстера) аппарата. Например, аппарат с псевдоожиженным слоем типа Glatt GPG 30 использовали с системой Вюрстера 18 дюймов с распыляющей форсункой 1,8 мм.
Параметры процесса, включая температуру входящего воздуха, температуру продукта и скорость нанесения пленки, специально контролируют. Скорость нанесения пленки и температура воздуха сбалансированы во избежание перегрева продукта в результате неоднородного образования гастрорезистентных микрогранул (слишком быстрое высыхание продукта) или агломерации смеси, подлежащей покрытию, для замедления высыхания продукта.
При изготовлении, например, партии 25 кг гастрорезистентного рифаксимина можно использовать форсуночное распыление от 150 до 300 г/мин. Можно также использовать форсуночное распыление от 150 и 250 г/мин и давление от 1,0 до 1,5 бар (1,0-1,5×105 Па). Скорость и давление можно регулировать независимо. Температуру продукта в процессе распыления поддерживают постоянной между примерно 20°С и примерно 40°С. Температуру воздуха на входе можно также регулировать от примерно 40°С до примерно 75°С, предпочтительно от примерно 60°С и примерно 70°С.
Полученные гастрорезистентные микрогранулы готовят в виде композиции для лекарственных препаратов с целью получения, после добавления воды, суспензии с приятным для пациентов вкусом. С этой целью к гастрорезистентным микрогранулам можно добавлять подсластители, такие как: сахароза, сорбит, маннит, сахарин, ацесульфам, неогесперидин; суспендирующие агенты, такие как поливинилпирролидон (ПВП), натрий-карбоксиметилцеллюлоза, пектин, ксантановая камедь, агар; и скользящие вещества, такие как силикагель.
Гастрорезистентные микрогранулы смешивают с вышеупомянутыми эксципиентами в подходящем аппарате, таком как двухконусный смеситель или V-образный смеситель, в течение времени, необходимого для получения гомогенности гастрорезистентных микрогранул в смеси. Отношение между гастрорезистентными микрогранулами и эксципиентами составляет от 1:0,1 до 1:10, предпочтительно от 1:0,5 до 1:5. Полученную смесь можно распределить в пакеты, содержащие рифаксимин в количестве от 1 мг до 3000 мг, предпочтительно от 50 мг до 800 мг.
Полученные гастрорезистентные микрогранулы рифаксимина можно непосредственно прессовать в таблетки после смешивания подходящих эксципиентов, таких как разбавители, например дикальция фосфат, кальция сульфат, целлюлоза, микрокристаллическая целлюлоза (AVICEL®), гидроксипропилметилцеллюлоза, кукурузный крахмал, лактоза, каолин, маннит, хлорид натрия, сухой крахмал; связующие агенты, такие как крахмал, желатин, сахара, такие как сахароза, глюкоза, декстроза, лактоза, синтетическая смола, альгинат натрия, карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон, полиэтиленгликоль, этилцеллюлоза, вода, воски, спирт; смазывающие агенты, такие как тальк, стеарат магния, стеарат кальция, стеариновая кислота, гидрированные растительные масла, полиэтиленгликоль; скользящие вещества, такие как коллоидный кремнезем, тальк; разрыхлители, такие как кукурузный и картофельный крахмал, кроскармелоза, кросповидон, натрия крахмала гликолят, красящие агенты, подсластители, такие как сахароза, сорбит, маннит, сахарин, ацесульфам, неогесперидин.
Можно использовать общепринятую технологию и аппарат, известные специалистам в области изготовления таблеток. Гастрорезистентные микрогранулы смешивают с вышеупомянутыми эксципиентами в подходящем аппарате, таком как двухконусный смеситель или V-образный смеситель, в течение времени, необходимого для получения гомогенности гастрорезистентных микрогранул в смеси.
Гастрорезистентные микрогранулы рифаксимина обладают хорошими свойствами в отношении способности свободно течь, когезивности и смазывания, таким образом, соотношение между гастрорезистентными микрогранулами и эксципиентами составляет от 1:0,2 до 1:0,05, предпочтительно от 1:0,15 до 1:0,1. Полученную смесь можно прессовать, используя подходящий пуансон, с целью получения таблеток, содержащих рифаксимин в количестве от 50 мг до 600 мг, предпочтительно от 100 мг до 500 мг. Как описано выше, полезные свойства гастрорезистентных микрогранул рифаксимина позволяют получить смесь, пригодную для прямого прессования с добавлением минимального количества эксципиентов. Возможность получения таблеток, используя смесь, содержащую вплоть до 93% гастрорезистентных микрогранул, является дополнительным преимуществом: это позволяет сохранять дозу 400 мг с подходящим размером для поддержания хорошего соблюдения пациентом режима и схемы лечения.
Таблетки могут быть успешно покрыты стандартной гидрофильной пленкой для достижения вкусомаскирующих свойств и улучшения внешнего вида. Подходящими веществами могут быть: гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза (KLUCEL®, Hercules Corp.), гидроксипропилметилцеллюлоза (METHOCEL®, Dow Chemical Corp.), поливинилпирролидон.
Таблетки, содержащие гастрорезистентные микрогранулы рифаксимина, могут быть покрыты пленкой согласно общепринятой методике, известной специалистам в данной области техники, выбирая в качестве полимера одно или более чем одно вещество из целлюлозы и ее замещенных вариантов, таких как гидропропилцеллюлоза, гидрометилцеллюлоза, гидропропилметилцеллюлоза. Альтернативой эфирам целлюлозы являются некоторые акрилаты, такие как сополимеры метакрилата и метилметакрилата. Полимеры можно использовать в виде растворов, либо водной системы, либо системы на основе органических растворителей. Включение пластификатора улучшает гибкость покрывающей пленки; за счет добавления пластификаторов уменьшается риск растрескивания пленки и улучшается адгезия пленки к субстрату. Примеры обычных пластификаторов включают глицерин, пропиленгликоль, полиэтиленгликоли, триацетин, ацетилированные моноглицериды, цитратные эфиры и фталатные эфиры. Для улучшения внешнего вида продукта обычно используют красители. Можно использовать водорастворимые и/или растворимые в органических растворителях красители, такие как альбуминовый лак, диоксид титана, оксид железа. Наконец, к покрытию можно добавлять стабилизаторы, такие как ЭДТА.
Картина, показанная на Фиг.3 (Сканирующая электронная микроскопия гастрорезистентных микрогранул рифаксимина, прессованных в таблетки), и данные на Фиг.2 показывают, что прессование не изменяет целостность гастрорезистентного слоя микрогранул, прессованных в таблетки.
Кроме того, полученные гастрорезистентные микрогранулы рифаксимина обладают такими благоприятными свойствами в отношении размера частиц и способности к свободной текучести, которые позволяют использовать их непосредственно с добавлением инертных разбавителей и скользящих веществ для заполнения в твердые желатиновые капсулы. Примеры обычных разбавителей включают дикальция фосфат, кальция сульфат, целлюлозу, микрокристаллическую целлюлозу, гидроксипропилметилцеллюлозу, кукурузный крахмал, лактозу, каолин, маннит, хлорид натрия, сухой крахмал, от примерно 1 до примерно 225 мг. В этом случае плотность гастрорезистентных микрогранул от 0,25 до 0,45 мг/мл позволяет наполнять 140-250 мг рифаксимина в стандартные твердые желатиновые капсулы 000 в соответствии с содержанием рифаксимина в гастрорезистентных микрогранулах.
Все лекарственные препараты, а именно термически запаиваемые пакеты, таблетки и капсулы, можно с пользой применять в терапии воспалительного заболевания кишечника, включая болезнь Крона.
Следующие ниже примеры следует рассматривать как дополнительную иллюстрацию объекта изобретения, а не как ограничение.
Пример 1
Препарат рифаксимина в гастрорезистентных микрогранулах
В аппарат с псевдоожиженным слоем, Glatt GPC30, с системой Вюрстера 18 дюймов с 1,8 мм распылительным соплом загружают 25000 г порошка рифаксимина и 125 г Aerosil в качестве флюидизатора. Одновременно в смесителе при перемешивании готовят суспензию, используя 48107 г деминерализованной воды, 9281 г сополимера метакриловой кислоты и этилакрилата, имеющегося в продаже под торговым названием KOLLIСОАТ® МАЕ 100Р, 1392 г пропилгликоля, 2475 г талька, 557 г диоксида титана FU и 62 г оксида железа Е172. Твердые компоненты суспензии гомогенно смешивают в деминерализованной воде на высокоскоростном гомогенизаторе (Ultra Turrax). Приготовленную суспензию подают в распылительную систему аппарата с псевдоожиженным слоем и распыляют при давлении от 1,0 до 1,5 бар (1,0-1,5×105 Па) через 1,8 мм сопло на смесь порошка рифаксимина и Aerosil 200, поддерживаемую в суспензии в псевдоожиженном слое потоком теплого воздуха.
Используемые условия описаны в таблице 1:
Полученные микрогранулы подвергают гранулометрическому анализу с помощью технологии светорассеяния, используя аппарат Malvern Mastersizer 2000 с получением следующих результатов:
100%<200 микрон
99,17%<150 микрон
90,03%<100 микрон
48,37%<50 микрон
6,20%<10 микрон
Рифаксимин в препарате гастрорезистентных микрогранул соответствует 61,4% от суммарной массы частиц.
Пример 2
SEM микроскопия гастрорезистентных микрогранул рифаксимина
Для наблюдений используют инструмент SEM Philips 515.
На гастрорезистентные микрогранулы рифаксимина напыляют золотом при постоянном токе 30 мА с получением слоя Аu примерно 100 нм. Применяли ускоряющее напряжение 15 кВ.
Изображения записывали в цифровом виде с помощью CCD-камеры (камера с зарядовой связью). Изображение микрогранул рифаксимина показано на Фиг.1А, в то время как на Фиг.1Б показан элемент отдельной микрогранулы.
Пример 3
Гастрорезистентные микрогранулы рифаксимина, приготовленные в виде термозапаиваемых пакетов
9,12 кг гастрорезистентных микрогранул рифаксимина, полученных согласно примеру 1, 19,58 кг сорбита, 0,49 кг аспартама, 0,21 кг безводной лимонной кислоты, 2,10 кг пектина, 2,10 кг маннита, 0,21 кг неогесперидина DC, 1,12 кг вишневого корригента и 0,07 кг силикагеля просеивают на сите с отверстиями 0,5 мм, а затем смешивают в течение 20 минут в V-образном смесителе. Полученную в результате смесь распределяют в термозапаиваемые пакеты, содержащие 5 граммов продукта, соответствующих 800 мг рифаксимина. В приведенной ниже таблице 2 приведена композиция лекарственного продукта, термозапаиваемого пакета:
Пример 4
Гастрорезистентные микрогранулы рифаксимина, приготовленные в виде прессованных таблеток
9,3 кг гастрорезистентных микрогранул рифаксимина, полученных согласно примеру 1, 593 г натрия крахмала гликолята, 100 г стеарата магния просеивают на сите с отверстиями 0,5 мм, а затем смешивают в течение 20 минут в V-образном смесителе. Полученную в результате смесь прессуют, используя роторную таблетирующую машину (Fette 1200), оборудованную продолговатыми пуансонами с отметкой 19×9 мм, при конечной массе 718 мг (соответствующей содержанию рифаксимина 400 мг).
Состав таблетки приведен в таблице 3.
Затем таблетки покрывают пленкой гидроксипропилметилцеллюлозы, используя традиционное чановое оборудование, чтобы улучшить внешний вид и достичь вкусомаскирующих свойств. Состав одинарной пленки приведен в таблице 4:
Пример 5
Гастрорезистентные микрогранулы рифаксимина, приготовленные в твердой капсуле
9,0 кг гастрорезистентных микрогранул рифаксимина, полученных согласно примеру 1, смешивают и просеивают через сито 0,5 мм с 110 г талька и 1,1 кг лактозы. Полученную в результате смесь помещают в твердые желатиновые капсулы типа 000, используя стандартное оборудование, подобное Zanasi LZ64, с конечной массой 461,00, соответствующей содержанию рифаксимина 270 мг. Композиция для капсулы приведена в таблице 5.
Пример 6
Данные по растворению гастрорезистентной микрогранулы лекарственных препаратов рифаксимина
Гастрорезистентность фармацевтического препарата оценивают согласно описанию на стр.247 Фармакопеи США (USP), издание 28а.
Тест на растворение лекарственных препаратов, содержащих гастрорезистентные микрогранулы рифаксимина, описанных в примерах 1, 3 и 4 и состоящих из гастрорезистентных микрогранул рифаксимина, термозапаянных пакетов, содержащих гастрорезистентные микрогранулы рифаксимина, и таблеток, содержащих гастрорезистентные микрогранулы рифаксимина, соответственно, оценивают, используя приведенные ниже условия.
Оборудование: SOTAX АТ7 Smart.
Среда: HCl 0,1 н., рН 1; через 2 часа добавляют фосфатный буфер с 2% лаурилсульфата натрия для доведения рН до 6,8.
Скорость перемешивания: 100 об/мин.
Температура: 37°С.
Время отбора образцов: 120, 135, 150 и 180 мин.
Содержание растворенного рифаксимина измеряют методом ВЭЖХ.
Результаты, представленные в таблице 6, представляют собой среднее из шести измерений и выражены в виде процента растворения от суммарного количества рифаксимина.
После 12 месяцев хранения при 25°С микрогранулы, изготовленные, как в примере 1, демонстрируют аналогичный профиль растворения, а именно растворение 2,2% через 120 мин при рН 1 в 0,1 н. соляной кислоте и 91,1% через 60 мин в фосфатном буфере при рН 6,8.
Пример 7
Лечение болезни Крона
Лекарственный препарат рифаксимина, содержащий гастрорезистентные микрогранулы, описанные в примере 3, использовали в клиническом многоцентровом рандомизированном испытании в сравнении с плацебо у пациентов, пораженных болезнью Крона. Набирали 55 пациентов с болезнью Крона в острой фазе и в фазе от легкой до средней тяжести, имеющих значение CDAI (индекс активности болезни Крона) от 200 до 300. Первичный конечный результат представлял собой процент пациентов в клинической ремиссии, определенной как CDAI ниже 150 пунктов к концу исследования. Пациентов, рандомизированных на две группы: группу А из 27 пациентов и группу Б из 28 пациентов, лечили в течение 12 недель в соответствии со следующими терапевтическими схемами:
Группа А: рифаксимин 800 мг, вводимый 2 раза в сутки в суммарной дозировке, равной 1600 мг/сутки;
Группа Б: плацебо, вводимое 2 раза в сутки в таком количестве, чтобы соответствовать содержанию дозы активного вещества.
Первичный конечный результат, клиническая ремиссия после 12 недель терапии, достигается у 51,9% пациентов с гастрорезистентным препаратом и у 32,1% пациентов, которых лечили плацебо. Кроме того, только одному пациенту из группы, которую лечили рифаксимином, пришлось рано оставить клиническое испытание в связи с несостоятельностью лечения, в то время как девять пациентов, которых лечили плацебо, прервали лечение.
Результаты суммированы в таблице 7.
Пример 8
Лечение пациентов с болезнью Крона, характеризующихся уровнем С-реактивного белка выше нормального
В начале лечения 31 пациент имел уровень С-реактивного белка, индекс воспаления в процессе, выше нормального. Пациенты были разделены на две группы: одна из 16 пациентов, которых лечили рифаксимином, и другая, которую лечили плацебо, как описано в примере 3.
Первичный конечный результат, клиническая ремиссия, был получен у 62,5% пациентов, которых лечили новой композицией рифаксимина, и только у 20,5% пациентов, которых лечили плацебо. Кроме того, ни один из пациентов подгруппы, которую лечили рифаксимином, не вышел из исследования в связи с несостоятельностью лечения, в отличие от 6 пациентов подгруппы, которую лечили плацебо.
В таблице 8 показаны полученные результаты.
Процент побочных эффектов аналогичен в двух группах, что подтверждает отличную переносимость композиции рифаксимина при непрерывном и длительном применении.



Изобретение относится к фармацевтической композиции, содержащей рифаксимин в форме микрогранул, которые делают гастрорезистентными полимер, нерастворимый при значениях рН между 1,5 и 4,0 и растворимый при значениях рН между 5,0 и 7,5. Также изобретение обеспечивает способ получения и применение указанной фармацевтической композиции при изготовлении лекарственных препаратов, подходящих для лечения воспалительных заболеваний кишечника и, главным образом, болезни Крона. Использование фармацевтической композиции позволяет повысить терапевтическую эффективность рифаксимина при лечении кишечных заболеваний, облегчить введение высокой и низкой дозы, например, при применении в педиатрии. 3 н. и 13 з.п. ф-лы, 3 ил., 8 табл.
1. Фармацевтическая композиция для лечения воспалительных заболеваний кишечника, содержащая гастрорезистентные микрогранулы рифаксимина, отличающаяся тем, что
диаметр микрогранул составляет от примерно 1 до примерно 900 мкм и микрогранулы содержат полимеры, нерастворимые при значениях рН от 1,5 до 4,0 и растворимые при значениях рН от 5,0 до 7,7.
2. Фармацевтическая композиция по п.1, где диаметр гастрорезистентных микрогранул рифаксимина составляет от примерно 10 до примерно 500 мкм.
3. Фармацевтическая композиция по п.1, отличающаяся тем, что полимеры выбраны из группы, состоящей из акрилового полимера, сополимеров метакриловой кислоты с акриловым или метакриловым эфиром, целлюлозы, ацетатфталата целлюлозы, поливинилацетатфталата и флюидизированного сополимера метакриловой кислоты и этилакрилата.
4. Фармацевтическая композиция по п.1, отличающаяся тем, что количество гастрорезистентных полимеров составляет от 5 до 75% по массе от общей массы микрогранулы.
5. Фармацевтическая композиция по п.1, отличающаяся тем, что микрогранулы дополнительно содержат один или более чем один из разбавителей, пластификатора, антиагломерационнных, антиадгезивных, смазывающих агентов, пеногасителей и красящих веществ.
6. Фармацевтическая композиция по п.1, отличающаяся тем, что гастрорезистентные микрогранулы рифаксимина содержат одну или более полиморфных форм или сырьевую форму рифаксимина.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что полиморфные формы рифаксимина выбраны из Формы α, Формы β, Формы γ, Формы δ или Формы ε.
8. Фармацевтическая композиция по п.1, содержащая
от примерно 1 до примерно 3000 мг гастрорезистентных микрогранул рифаксимина;
от 0 до примерно 450 мг подсластителя, выбранного из одного или более чем одного из аспартама, сахара, ксилита, лактита, цикламата натрия, декстрозы, фруктозы, глюкозы, лактозы и сахарозы или неогесперидина DC;
от 0 до примерно 50 мг органической кислоты, выбранной из одной или более чем одной из лимонной кислоты, уксусной кислоты, адипиновой кислоты, фумаровой кислоты, глутаровой кислоты, яблочной кислоты, янтарной кислоты или винной кислоты;
от примерно 1 до примерно 500 мг суспендирующего агента, выбранного из одного или более чем одного из поливинилпирролидона (ПВП), натрий-карбоксиметилцеллюлозы, пектина, ксантановой камеди или агар-агара;
от 0 до примерно 500 мг маннита;
от 0 до примерно 4000 мг сахарного спирта, выбранного из одного или более сахарных спиртов, таких как лактит, мальтит, маннит, сорбит и ксилит, ксантановой камеди, декстринов или мальтодекстринов;
от 0 до примерно 300 мг корригента, выбранного из одного или более чем одного из фруктового или овощного корригента;
и от 0 до примерно 100 мг смазывающего вещества, выбранного из одного или более чем одного из силикагеля, стеарата магния или талька,
в термически запаянном пакете.
9. Фармацевтическая композиция по п.1, отличающаяся тем, что она представлена в форме, выбранной из группы, состоящей из прессованных таблеток, твердых желатиновых капсул и термически запаянных пакетов.
10. Фармацевтическая композиция по п.9, где таблетка содержит
от примерно 0 до примерно 50 мг полимеров, выбранных из одного или более чем одного из целлюлозы и ее замещенных вариантов, таких как гидроксипропилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилметилцеллюлоза, некоторых акрилатов, таких как сополимеры метакрилата и метилметакрилата;
от примерно 0 до примерно 5 мг пластификатора, выбранного из одного или более чем одного из глицерина, пропиленгликоля, полиэтиленгликолей, триацетина, ацетилированных моноглицеридов, цитратных эфиров и фталатных эфиров;
от примерно 0 до примерно 1 мг стабилизатора, такого как ЭДТА;
от примерно 0 до примерно 10 мг красителя, выбранного из одного или более чем одного из альбуминового лака, диоксида титана, оксида железа.
11. Фармацевтическая композиция по п.10, где таблетка содержит
от примерно 50 до примерно 1000 мг гастрорезистентных микрогранул рифаксимина;
от примерно 1 до примерно 500 мг разбавителей, выбранных из одного или более чем одного из дикальция фосфата, кальция сульфата, целлюлозы, микрокристаллической целлюлозы, гидроксипропилметилцеллюлозы, кукурузного крахмала, лактозы, каолина, маннита, хлорида натрия, сухого крахмала,
от примерно 1 до примерно 500 мг связующих агентов, выбранных из одного или более чем одного из крахмала, желатина, сахара, такого как сахароза, глюкоза, декстроза, лактоза, синтетической смолы, альгината натрия, карбоксиметилцеллюлозы, метилцеллюлозы,
поливинилпирролидона, полиэтиленгликоля, этилцеллюлозы, воды, восков и спирта;
от примерно 0 до примерно 20 мг смазывающих агентов, выбранных из одного или более чем одного из талька, стеарата магния, стеарата кальция, стеариновой кислоты, гидрогенизированных растительных масел и полиэтиленгликоля;
от примерно 0 до примерно 20 мг смазывающих агентов, выбранных из одного или более чем одного из коллоидного диоксида кремния и талька;
от примерно 0 до примерно 200 мг разрыхлителей, выбранных из одного или более чем одного из натрий-карбоксиметилцеллюлозы, кукурузного и картофельного крахмала, кроскармелозы, кросповидона и натрия крахмала гликолята;
от примерно 0 до примерно 10 мг красителей, выбранных из одного или более чем одного из диоксида титана и оксида железа;
от примерно 0 до примерно 500 мг подсластителей, выбранных из одного или более чем одного из сахарозы, сорбита, маннита, сахарина, ацесульфама и неогесперидина.
12. Фармацевтическая композиция по п.10, где капсула содержит
от примерно 50 до примерно 450 мг гастрорезистентных микрогранул рифаксимина;
от примерно 0 до примерно 25 мг смазывающих агентов, выбранных из одного или более чем одного из талька, стеарата магния, стеарата кальция, стеариновой кислоты, гидрогенизированных растительных масел и полиэтиленгликоля;
от примерно 1 до примерно 225 мг разбавителей, выбранных из одного или более чем одного из: дикальция фосфата, кальция сульфата, целлюлозы, микрокристаллической целлюлозы, гидроксипропилметилцеллюлозы, кукурузного крахмала, лактозы, каолина, маннита, хлорида натрия и сухого крахмала.
13. Применение фармацевтической композиции по п.1 для изготовления лекарственных препаратов для лечения воспалительных заболеваний кишечника.
14. Применение по п.13, отличающееся тем, что воспалительное заболевание кишечника представляет собой болезнь Крона.
15. Применение по п.14, отличающееся тем, что уровень С-реактивного белка у пациентов, страдающих болезнью Крона, выше стандартного.
16. Способ изготовления фармацевтической композиции для лечения воспалительных заболеваний кишечника, содержащей рифаксимин в форме гастрорезистентных микрогранул, имеющих размер от примерно 1 до примерно 900 мкм, отличающийся тем, что он включает
распыление через форсунку водной суспензии, содержащей рифаксимин, по меньшей мере один гастрорезистентный полимер и по меньшей мере один фармацевтический эксципиент, в аппарат с псевдоожиженным слоем, где распыление осуществляют под давлением от 1,0 до 1,5 бар (1-1,5·105 Па) и при скорости потока от 150 до 300 г/мин, и где рифаксимин поддерживают суспендированным в водной суспензии при помощи потока теплого воздуха.
| ЕР 0616808, 28.09.1994 | |||
| US 2004170617, 02.09.2004 | |||
| US 2005008652, 13.01.2005 | |||
| US 6861053, 01.03.2005. |
Авторы
Даты
2010-11-10—Публикация
2006-03-06—Подача