[Область техники]
[0001]
Настоящее изобретение относится к циклопропановому соединению, обладающему антагонизмом к орексиновому рецептору, или его фармацевтически приемлемой соли и его медицинскому применению. Настоящее изобретение также относится к фармацевтической композиции, содержащей вышеупомянутое соединение в качестве действующего ингредиента.
Предпосылки изобретения
[0002]
Орексин-A (OX-A, состоящий из 33 аминокислотных пептидов) и орексин-B (OX-B, состоящий из 28 аминокислотных пептидов), два типа интрацеребральных нейропептидов, которые экспрессируются нейронами, локализованными в гипоталамусе в головном мозге, были открыты (патентный документ 5 и непатентный документ 1) в качестве эндогенных лигандов связанных с G-белком рецепторов, преимущественно находящихся в мозге, а именно орексиновых рецепторов (патентные документы 1-4). Было известно, что такие орексиновые рецепторы включают два подтипа, а именно OX1 рецептор (OX1) в качестве подтипа 1 типа и OX2 рецептор (OX2) в качестве подтипа 2 типа. OX1 связывается с OX-A более селективно, чем с OX-B, и OX2 способен связываться с OX-A, а также с OX-B. Орексин, как было обнаружено, стимулирует потребление пищи у крыс, и, следовательно, предположили, что орексин будет играть физиологическую роль в качестве медиатора в центральном механизме обратной связи для контроля пищевого поведения (непатентный документ 1). С другой стороны, было замечено, что орексины контролируют состояния сон-бодрствование. Таким образом, считают, что орексины, возможно, приведут к новым терапевтическим средствам от нарколепсии, а также бессонницы и других нарушений сна (непатентный документ 2). К тому же предполагают, что орексиновые сигналы в вентральной тегментальной области, имеющие отношение нейронной пластичности, связанной с опийной зависимостью и никотиновой зависимостью, играют важную роль in vivo (непатентный документ 3 и непатентный документ 4). Также сообщили, что OX2 рецептор селективно ингибировали для облегчения зависимости от этанола в эксперименте с использованием крыс (непатентный документ 5). Кроме того, известно, что кортикотропин-рилизинг-фактор (CRF), вовлеченный в депрессию и тревожное расстройство, вовлечен в индуцированное орексином поведение крыс и это может играть важную роль в некоторых воздействиях стресса (непатентный документ 6).
Орексиновые рецепторы обнаруживаются в головном мозге млекопитающих и могут участвовать в развитии множества патологий, таких как депрессия; дисфория; тревога; привыкания; обсессивно-компульсивное расстройство; аффективный невроз; депрессивный невроз; невроз тревоги; дистимическое расстройство; расстройство настроения; сексуальная дисфункция; психосексуальная дисфункция; расстройство половой функции; шизофрения; биполярная депрессия; делириозный синдром; деменция; тяжелая умственная отсталость и дискинезии, такие как болезнь Хантингтона и синдром Туретта; расстройства пищевого поведения; нарушения сна; сердечно-сосудистые заболевания, диабет; нарушения аппетита/вкусовых ощущений; рвота/тошнота; астма; болезнь Паркинсона; синдром/болезнь Кушинга; базофильная аденома; пролактинома; гиперпролактинемия; гипопитуитаризм; опухоль/аденома гипофиза; заболевания гипоталамуса; воспалительное заболевание кишечника; дискинезия желудка; язвы желудка; синдром Фрэлиха; заболевания гипофиза, гипоталамический гипогонадизм; синдром Кальмана (аносмия, гипосмия); функциональная или психогенная аменорея; гипопитуитаризм; гипоталамический гипотиреоз; дисфункция системы гипоталамус-надпочечники; идиопатическая гиперпролактинемия; связанная с гипоталамическими нарушениями недостаточность гормона роста; идиопатическая недостаточность гормона роста; карликовость; гигантизм; акромегалия; нарушенные биологические и циркадные ритмы; нарушения сна, связанные с такими заболеваниями, как неврологические нарушения, невропатическая боль и синдром усталых ног; заболевания сердца и легких, острая и застойная сердечная недостаточность; гипотензия; гипертензия; задержка мочи; остеопороз; стенокардия; инфаркт миокарда; ишемический или геморрагический инсульт; субарахноидальное кровоизлияние; язвы; аллергии; доброкачественная гипертрофия предстательной железы; хроническая почечная недостаточность; заболевание почек; нарушение толерантности к глюкозе; мигрень; гипералгезия; боль; повышенная или преувеличенная чувствительность к боли, такая как гипералгезия, каузалгия и аллодиния; острая боль; жгучая боль; атипичная лицевая боль; невропатическая боль; боль в пояснице; комплексный регионарный болевой синдром I и II; боль при артрите; боль при спортивных травмах; боль, связанная с инфекцией, например ВИЧ, боль после химиотерапии; постинсультная боль; послеоперационная боль; невралгия; состояния, связанные с внутренней болью, такие как синдром раздраженного кишечника, мигрень и ангина; недержание мочевого пузыря, например императивное недержание мочи; толерантность к наркотикам или отказ от наркотиков; приступы апноэ во сне; нарколепсия; бессонница; парасомния; и нейродегенеративные расстройства, включающие нозологические единицы, такие как комплекс растормаживания-деменции-паркинсонизма-амиотрофии; паллидопонтонигральная дегенерация эпилепсия; судорожные приступы и другие заболевания, связанные с общей дисфункцией орексиновой системы.
(2R)-2-{(1S)-6,7-диметокси-1-[2-(4-трифторметил-фенил)этил]-3,4-дигидро-1H-изохинолин-2-ил}-N-метил-2-фенилацетамид (ACT-078573; алморексант), соединение, которое функционирует в качестве антагониста орексинового рецептора, было разработано для клинического применения в качестве терапевтического средства от бессонницы (патентный документ 6). Это соединение вызывает снижение бессонницы у крыс, которые характеризуются пониженными функциями пробуждения и спонтанной локомоторной активностью, и дозозависимо увеличивает как время сна с быстрым движением глаз (REM), так и время сна без REM, и данное соединение при введении нормальным людям дозозависимо проявляет снижение латентного периода сна, эффективность сна и увеличение общего времени сна (непатентный документ 7). Существует также статья, сообщающая, что соединение при введении пациентам с бессонницей проявляет улучшение эффективности сна, короткий латентный период сна, увеличение длительности сна с REM и улучшение соотношения сна с REM (непатентный документ 8). Кроме того, также было описано, что это соединение улучшает функцию памяти модельных крыс (патентный документ 7), и что соединение является эффективным при посттравматическом стрессовом расстройстве (патентный документ 8). С другой стороны, 5-хлор-2-{(5R)-5-метил-4-[5-метил-2-(2H-1,2,3-триазол-2-ил)бензоил]-1,4-диазепан-1-ил}-1,3-бензоксазол (MK-4305; суворексант, патентный документ 9) и MK-6096, которые обладают двумя орексиновыми антагонизмами к OX1 и OX2, были разработаны для клинического применения в качестве медикамента от бессонницы.
Документы известного уровня техники
Патентные документы
[0003]
Патентный документ 1: публикация международной заявки № WO 1996/34877
Патентный документ 2: JP 10-327888 A
Патентный документ 3: JP 10-327889 A
Патентный документ 4: JP 11-178588 A
Патентный документ 5: JP 10-229887 A
Патентный документ 6: публикация международной заявки № WO 2005/118548
Патентный документ 7: публикация международной заявки № WO 2007/105177
Патентный документ 8: публикация международной заявки № WO 2009/047723
Патентный документ 9: публикация международной заявки № WO 2008/069997
Непатентные документы
[0004]
Непатентный документ 1: Sakurai T. et al., Cell, 1998, 92, 573-585
Непатентный документ 2: Chemelli R. M. et al., Cell, 1999, 98, 437-451.
Непатентный документ 3: S. L. Borgland et al., Neuron, 2006, 49, 589-601
Непатентный документ 4: C. J. Winrow et al., Neuropharmacology, 2010, 58, 185-194
Непатентный документ 5: J. R. Shoblock et al., Psychopharmacology, 2011, 215, 191-203
Непатентный документ 6: T. Ida et al., Biochemical and Biophysical Research Communications, 2000, 270, 318-323
Непатентный документ 7: F. Jenck et al., Nature Nature Medicine 2007, 13, 150-155
Непатентный документ 8: G. Dorffner et al., European Neuropsychopharmacology, Vol. 20, Supplement, 3, 2007, S252-S253
Краткое описание настоящего изобретения
[0005]
Целью настоящего изобретения является обеспечение циклопропанового соединения или его фармацевтически приемлемой соли, обладающего антагонизмом к орексиновому рецептору, и фармацевтической композиции, содержащей вышеупомянутое.
[0006]
Настоящее изобретение относится к следующему с [1] по [25]:
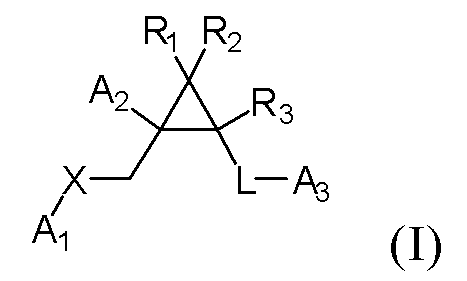
[1] Соединение, представленное следующей формулой (I), или его фармацевтически приемлемая соль:
[Формула 1]
 ,
,
где
A1 представляет пиримидинильную группу или N-оксид-пиримидинильную группу, каждая из которых может необязательно содержать заместители, выбранные из замещающей группы α,
каждый из A2 и A3 независимо представляет арильную группу, выбранную из группы 1, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы α, или гетероциклическую группу, выбранную из группы 3, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β,
каждый из R1, R2 и R3 независимо представляет атом водорода, атом галогена, C1-6 алкильную группу, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, или C3-8 циклоалкильную группу, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β,
X представляет атом кислорода, C1-6 алкиленовую группу, формулу -NR4-, где R4 представляет атом водорода или C1-6 алкильную группу,
L представляет связь или формулу -CONH-, где
замещающая группа α: циано-группа, атом галогена, гидроксильная группа, оксогруппа, формула -NR5R6, где каждый из R5 и R6 независимо представляет собой атом водорода или C1-6 алкильную группу, C1-6 алкильная группа, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, C1-6 алкоксигруппа, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, C1-6 алкилкарбонильная группа, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, C1-6 алкилсульфонильная группа, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, арильная группа, выбранная из группы 1, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, и гетероарильная группа, выбранная из группы 2, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β;
замещающая группа β: циано-группа, атом галогена, гидроксильная группа, C3-8 циклоалкильная группа и C1-6 алкоксигруппа;
группа 1: фенильная группа, нафтильная группа, азуленильная группа, антрильная группа и фенантрильная группа;
группа 2: фурильная группа, тиенильная группа, пирролильная группа, имидазолильная группа, триазолильная группа, тетразолильная группа, тиазолильная группа, пиразолильная группа, оксазолильная группа, изоксазолильная группа, изотиазолильная группа, фуразанильная группа, тиадиазолильная группа, оксадиазолильная группа, пиридильная группа, пиразинильная группа, пиридазинильная группа, триазинильная группа, индолильная группа, изоиндолильная группа, индазолильная группа, бензоксазолильная группа, бензизоксадиазолильная группа, бензотиазолильная группа, бензизотиазолильная группа, хинолильная группа и изохинолильная группа; и
группа 3: фурильная группа, тиенильная группа, пирролильная группа, имидазолильная группа, триазолильная группа, тетразолильная группа, тиазолильная группа, пиразолильная группа, оксазолильная группа, изоксазолильная группа, изотиазолильная группа, фуразанильная группа, тиадиазолильная группа, оксадиазолильная группа, пиридильная группа, пиразинильная группа, пиридазинильная группа, пиримидинильная группа, триазинильная группа, 2-пиридонильная группа, 4-пиридонильная группа, пиридазидонильная группа, пиримидидонильная группа, пуринильная группа, птеридинильная группа, хинолильная группа, изохинолильная группа, нафтилидильная группа, хиноксалильная группа, циннолильная группа, хиназолильная группа, фталазильная группа, имидазопиридильная группа, имидазотиазолильная группа, имидазооксазолильная группа, бензимидазолильная группа, индолильная группа, изоиндолильная группа, индазолильная группа, пирролопиридильная группа, тиенопиридильная группа, фторпиридильная группа, бензоксазолильная группа, бензизооксадиазолильная группа, бензотиазолильная группа, бензизотиазолильная группа, пиридопиримидинильная группа, оксодигидропиридопиримидинильная группа, бензофурильная группа, бензотиенильная группа, бензотиадиазолильная группа, бензо[1,3]диоксолильная группа, тиенофурильная группа, дигидроизобензофуранильная группа, хроманильная группа, изохроманильная группа, 1,3-диоксаинданильная группа, 1,4-диоксатетралинильная группа и дигидробензо[1,4]оксазинильная группа.
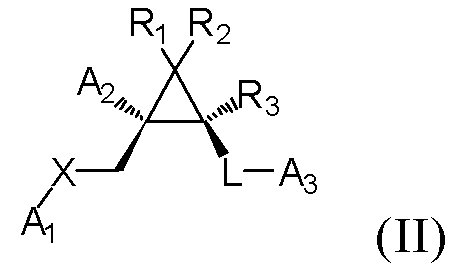
[2] Соединение в соответствии с [1] выше, которое представлено следующей формулой (II), или его фармацевтически приемлемая соль:
[Формула 2]
 ,
,
где A1, A2, A3, R1, R2, R3, X и L имеют такие же определения, как таковые в соответствии с [1] выше.
[3] Соединение в соответствии с [1] или [2] выше, которое представлено следующей формулой (III), или его фармацевтически приемлемая соль:
[Формула 3]
 ,
,
где
A1 представляет пиримидинильную группу или N-оксид-пиримидинильную группу, каждая из которых замещена R1a, R1b и R1c,
A2 представляет арильную группу, выбранную из группы 1, или гетероарильную группу, выбранную из группы 2, каждая из которых замещена R2a, R2b, R2c и R2d,
A3 представляет арильную группу, выбранную из группы 1, или гетероциклическую группу, выбранную из группы 3, каждая из которых замещена R3a, R3b, R3c и R3d, где
каждый из R1a, R1b и R1c независимо представляет атом водорода, гидроксильную группу, C1-6 алкильную группу, галоген-C1-6 алкильную группу, гидрокси-C1-6 алкильную группу или C1-6 алкокси-C1-6 алкильную группу, где
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-C1-6 алкильную группу,
каждый из R3a, R3b, R3c и R3d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу, галоген-C1-6 алкильную группу, C1-6 алкокси-C1-6 алкильную группу, циано-группу или циано-C1-6 алкильную группу, и
X, L, группа 1, группа 2 и группа 3 имеют такие же определения, как таковые в соответствии с [1] выше.
[4] Соединение в соответствии с [3] выше или его фармацевтически приемлемая соль, где L представляет формулу -CONH-.
[5] Соединение в соответствии с [4] выше или его фармацевтически приемлемая соль, где X представляет атом кислорода.
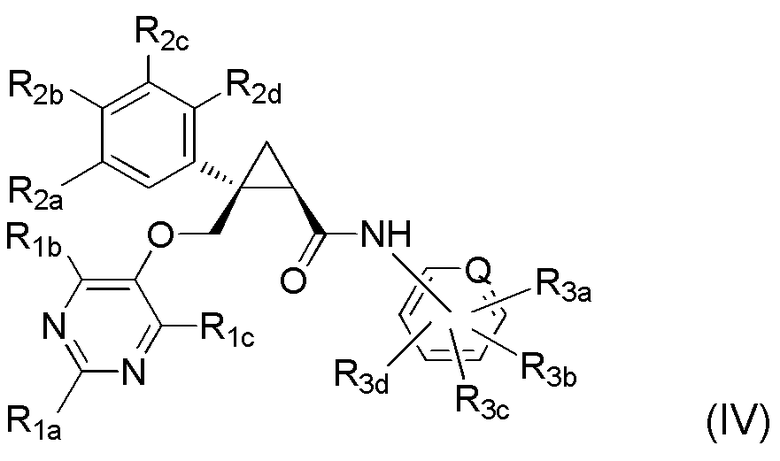
[6] Соединение, представленное следующей формулой (IV), или его фармацевтически приемлемая соль:
[Формула 4]
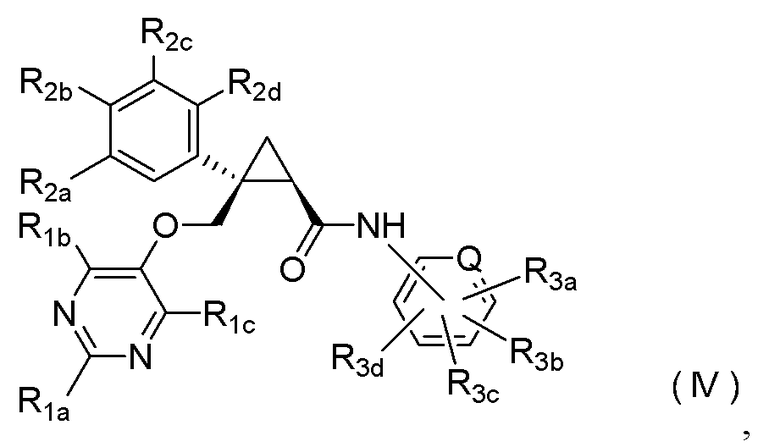
где
Q представляет -CH- или атом азота,
каждый из R1a и R1b независимо представляет C1-6 алкильную группу, галоген-C1-6 алкильную группу, гидрокси-C1-6 алкильную группу или C1-6 алкокси-C1-6 алкильную группу,
R1c представляет атом водорода или гидроксильную группу,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу, галоген-C1-6 алкильную группу или циано-группу, и
каждый из R3a, R3b, R3c и R3d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу, галоген-C1-6 алкильную группу, C1-6 алкокси-C1-6 алкильную группу, циано-группу или циано-C1-6 алкильную группу.
[7] Соединение, представленное следующей формулой (A), или его фармацевтически приемлемая соль:
[Формула 5]
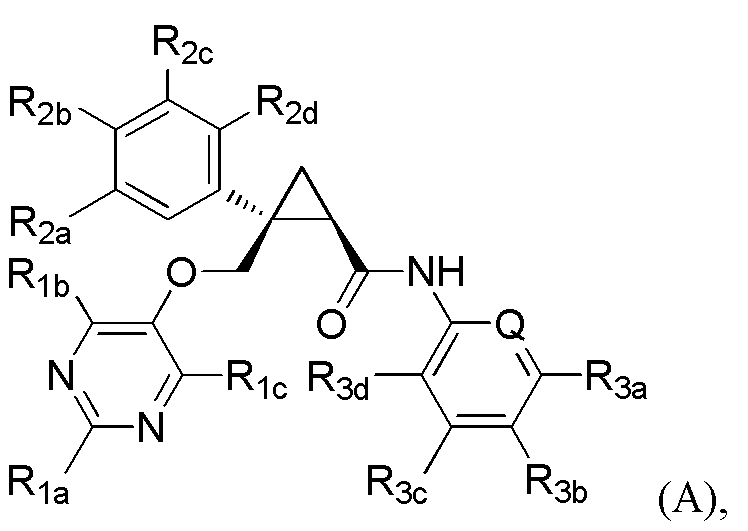
где
Q представляет -CH- или атом азота,
если Q представляет -CH-,
R1a и R1b каждый независимо представляет C1-6 алкильную группу, галоген-C1-6 алкильную группу или C1-6 алкокси-C1-6 алкильную группу,
R1c представляет атом водорода,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-C1-6 алкильную группу,
каждый из R3a и R3c независимо представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкокси-C1-6 алкильную группу, циано-группу или циано-C1-6 алкильную группу,
R3b представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу или C1-6 алкокси-C1-6 алкильную группу, и
R3d представляет атом водорода или атом фтора,
или
если Q представляет атом азота,
каждый из R1a и R1b независимо представляет C1-6 алкильную группу, галоген-C1-6 алкильную группу, гидрокси-C1-6 алкильную группу или C1-6 алкокси-C1-6 алкильную группу,
R1c представляет атом водорода или гидроксильную группу,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-C1-6 алкильную группу,
R3a представляет атом водорода, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу или C1-6 алкокси-C1-6 алкильную группу,
R3b представляет атом водорода, атом галогена, C1-6 алкильную группу или галоген-C1-6 алкильную группу,
R3c представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу или C1-6 алкокси-C1-6 алкильную группу, и
R3d представляет атом водорода.
[8] Соединение в соответствии с [7] выше, которое представлено следующей формулой (B), или его фармацевтически приемлемая соль:
[Формула 6]
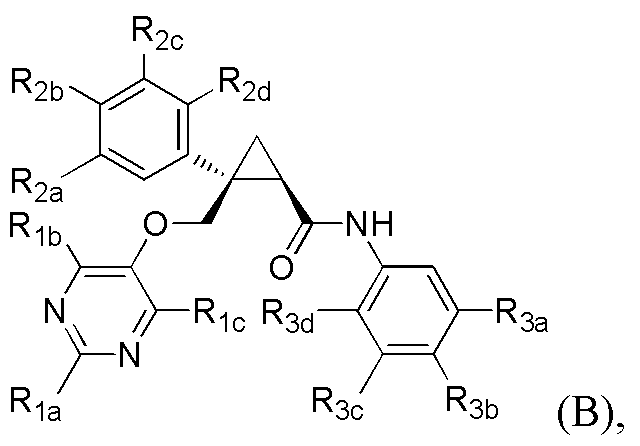
где
каждый из R1a и R1b независимо представляет C1-6 алкильную группу, галоген-C1-6 алкильную группу или C1-6 алкокси-C1-6 алкильную группу,
R1c представляет атом водорода,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-C1-6 алкильную группу,
каждый из R3a и R3c независимо представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкокси-C1-6 алкильную группу, циано-группу или циано-C1-6 алкильную группу,
R3b представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу или C1-6 алкокси-C1-6 алкильную группу, и
R3d представляет атом водорода или атом фтора.
[9] Соединение в соответствии с [7] выше, которое представлено следующей формулой (C), или его фармацевтически приемлемая соль:
[Формула 7]
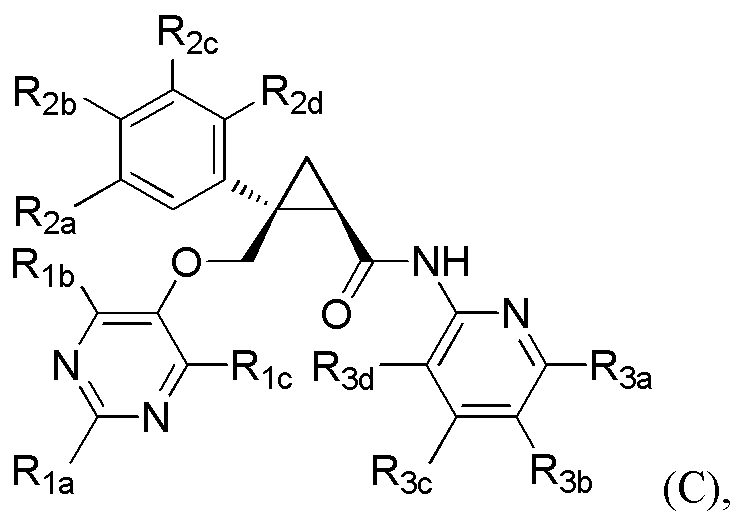
где
R1a представляет C1-6 алкильную группу или гидрокси-C1-6 алкильную группу,
R1b представляет C1-6 алкильную группу, галоген-C1-6 алкильную группу, гидрокси-C1-6 алкильную группу или C1-6 алкокси-C1-6 алкильную группу,
R1c представляет атом водорода или гидроксильную группу,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-C1-6 алкильную группу,
R3a представляет заместитель, выбранный из атома водорода, атома галогена, C1-6 алкильной группы, C1-6 алкоксигруппы и C1-6 алкокси-C1-6 алкильной группы,
R3b представляет атом водорода, атом галогена, C1-6 алкильную группу или галоген-C1-6 алкильную группу,
R3c представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу или C1-6 алкокси-C1-6 алкильную группу, и
R3d представляет атом водорода.
[10] Соединение в соответствии с [9] выше или его фармацевтически приемлемая соль, где R1a представляет метильную группу, R1b представляет метильную группу, этильную группу, гидроксиметильную группу, метоксиметильную группу или метоксиэтильную группу, и R1c представляет атом водорода.
[11] Соединение, которое выбрано из следующих соединений, или его фармацевтически приемлемая соль:
1) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 1),
2) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 16),
3) (1R,2S)-N-[3-(диметиламино)фенил]-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 19),
4) (1R,2S)-N-(3-хлорфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 24),
5) (1R,2S)-N-(3-циано-4-фторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 26),
6) (1R,2S)-N-(3-хлор-4-фторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 32),
7) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(3-метоксифенил)-2-фенилциклопропанкарбоксамид (пример 36),
8) (1R,2S)-N-[3-(цианометил)фенил]-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 39),
9) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенил-N-[3-(трифторметил)фенил]циклопропанкарбоксамид (пример 43),
10) (1R,2S)-N-(5-хлор-4-метилпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 45),
11) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 51),
12) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-[5-фтор-4-(метоксиметил)пиридин-2-ил]-2-фенилциклопропанкарбоксамид (пример 71),
13) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 73),
14) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 82),
15) (1R,2S)-N-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 84),
16) (1R,2S)-N-(4-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 85),
17) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксиметилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 86),
18) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(4-фторфенил)циклопропанкарбоксамид (пример 92),
19) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-фенилциклопропанкарбоксамид (пример 93),
20) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 94),
21) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 95),
22) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 96),
23) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 100),
24) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид (пример 104),
25) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксиметилпиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид (пример 109),
26) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид (пример 111),
27) (1R,2S)-2-(3-цианофенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 117),
28) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 119),
29) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 120),
30) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 121),
31) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 129),
32) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)циклопропанкарбоксамид (пример 130),
33) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 131),
34) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 132),
35) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 133),
36) (1R,2S)-N-(3,4-дифторфенил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 134),
37) (1R,2S)-N-(2,4-дифторфенил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 135),
38) (1R,2S)-N-(5-цианопиридин-2-ил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 137),
39) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)циклопропанкарбоксамид (пример 138),
40) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(4-(метоксиметил)-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 139),
41) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(4-(метоксиметил)-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 140),
42) (1R,2S)-N-(5-фторпиридин-2-ил)-2-{[(4-(метоксиметил)-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 141),
43) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 145),
44) (1R,2S)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 149),
45) (1R,2S)-N-(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 150),
46) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 164),
47) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)циклопропанкарбоксамид (пример 165),
48) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 166),
49) (1R,2S)-N-(5-цианопиридин-2-ил)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 167),
50) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 168),
51) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 169),
52) (1R,2S)-N,2-бис(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 170),
53) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)циклопропанкарбоксамид (пример 173),
54) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-(3-метоксифенил)циклопропанкарбоксамид (пример 186),
55) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-метоксифенил)циклопропанкарбоксамид (пример 189),
56) (1R,2S)-N-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-метоксифенил)циклопропанкарбоксамид (пример 190),
57) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-[(4-метоксиметил-2-метилпиримидин-5-ил)оксиметил]циклопропанкарбоксамид (пример 191),
58) (1R,2S)-2-(3-фторфенил)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 192),
59) (1R,2S)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 193),
60) (1R,2S)-N-(3,4-дифторфенил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 194),
61) (1R,2S)-N,2-бис(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 195),
62) (1R,2S)-N-(2,4-дифторфенил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 196),
63) (1R,2S)-N-(2,5-дифторфенил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 197),
64) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 198),
65) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 199),
66) (1R,2S)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-[5-(трифторметил)пиридин-2-ил]циклопропанкарбоксамид (пример 201),
67) (1R,2S)-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 202),
68) (1R,2S)-N,2-бис(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 203),
69) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 204),
70) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 205),
71) (1R,2S)-N-(3,4-дифторфенил)-2-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 207),
72) (1R,2S)-2-(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 211),
73) (1R,2S)-2-(3,4-дифторфенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 212),
74) (1R,2S)-N,2-бис(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 214),
75) (1R,2S)-N-(2,4-дифторфенил)-2-(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 216),
76) (1R,2S)-2-(3,5-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 218),
77) (1R,2S)-2-(3,5-дифторфенил)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 219),
78) (1R,2S)-N-(3,4-дифторфенил)-2-(3,5-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 221),
79) (1R,2S)-2-(3-хлорфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 225),
80) (1R,2S)-2-(3-хлорфенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 226),
81) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиэтил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 229),
82) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 231),
83) (1R,2S)-N-(3,4-дифторфенил)-2-(3-фтор-5-метоксифенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 232),
84) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(5-фторпиридин-2-ил)-2-[(4-метоксиметил-2-метилпиримидин-5-ил)оксиметил]циклопропанкарбоксамид (пример 233),
85) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 234),
86) (1R,2S)-2-(3-фтор-5-метоксифенил)-2-[(4-метоксиметил-2-метилпиримидин-5-ил)оксиметил]-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 235),
87) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 236),
88) (1R,2S)-2-(4-фтор-3-метоксифенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 239),
89) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 240),
90) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 241),
91) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 242),
92) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 243),
93) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 244),
94) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 245),
95) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 246),
96) (1R,2S)-N-(4-хлорпиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)циклопропанкарбоксамид (пример 247),
97) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид (пример 248),
98) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-5-метоксифенил)-N-(5-фтор-4-метилпиримидин-2-ил)циклопропанкарбоксамид (пример 256),
99) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-(3-трифторметилфенил)циклопропанкарбоксамид (пример 266),
100) (1R,2S)-2-(4-бромфенил)-N-(5-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 273),
101) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторметилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 282),
102) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-(3-йодфенил)циклопропанкарбоксамид (пример 283),
103) (1R,2S)-N-(5-фторпиридин-2-ил)-2-{[(4-гидроксиметил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 286),
104) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(4-фторфенил)циклопропанкарбоксамид (пример 316),
105) (1R,2S)-2-{[(4-фторметил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 320),
106) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-4-гидроксифенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 321),
107) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-4-метоксифенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 322),
108) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-{[(2-гидроксиметил-4-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 323),
109) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-[5-фтор-2-гидроксифенил]-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 324),
110) (1R,2S)-2-{[(2,4-диметил-6-оксо-1,6-дигидропиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 326),
111) (1R,2S)-N-(2-цианопиридин-4-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 41),
112) (1R,2S)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-N-(5-фторпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 293),
113) (1R,2S)-N-(5-хлор-4-метилпиридин-2-ил)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-2-(3-фторфенил)циклопропанкарбоксамид (пример 295),
114) (1R,2S)-N-(3,4-фторпиридин-2-ил)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-2-(3-фторфенил)циклопропанкарбоксамид (пример 296),
115) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-[N-(2-метил-4-трифторметилпиримидин-5-ил)метиламинометил]циклопропанкарбоксамид (пример 302),
116) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фтор-5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 327),
117) (1R,2S)-N-(2-хлорпиридин-4-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 33),
118) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фторпиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 53),
119) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 61),
120) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фторпиридин-3-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 88),
121) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-метоксипиридин-3-ил)циклопропанкарбоксамид (пример 89),
122) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фтор-5-метилпиридин-3-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 91),
123) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-метоксипиридин-3-ил)циклопропанкарбоксамид (пример 112),
124) (1R,2S)-N-(5-цианопиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 200),
125) (1R,2R)-2-[(2,4-диметилпиримидин-5-ил)этил]-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 292),
126) (1R,2S)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-N-(4-фторфенил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 294),
127) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 317),
128) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)-2-фенилциклопропанкарбоксамид (пример 318)
и
129) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 321).
[12] Соединение, которое выбрано из следующих соединений, или его фармацевтически приемлемая соль:
1) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 1),
11) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 51),
14) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 82),
21) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 95),
31) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 129) и
89) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 240).
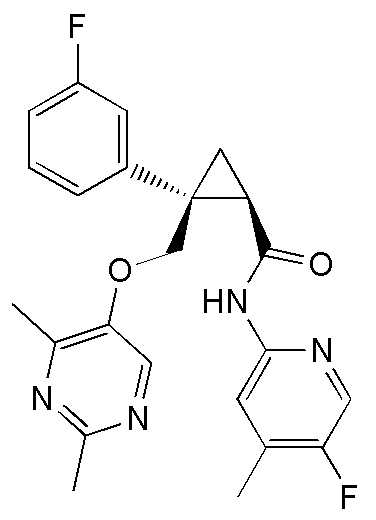
[13] (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 82), представленный следующей формулой, или его фармацевтически приемлемая соль:
[Формула 8]
[14] (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 95), представленный следующей формулой, или его фармацевтически приемлемая соль:
[Формула 9]
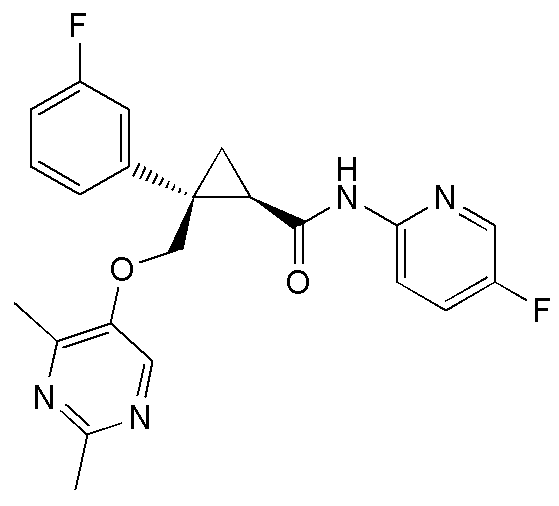
[15] (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 129), представленный следующей формулой, или его фармацевтически приемлемая соль:
[Формула 10]

[16] Фармацевтическая композиция, содержащая в качестве действующего ингредиента соединение в соответствии с любым одним из [1]-[15] выше или его фармацевтически приемлемую соль.
[17] Фармацевтическая композиция в соответствии с [16] выше, которая предназначена для лечения нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору.
[18] Фармацевтическая композиция в соответствии с [17] выше, где указанное нарушение сна является бессонницей.
[19] Способ лечения нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору, который включает введение соединения в соответствии с любым одним из [1]-[15] выше или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[20] Способ в соответствии с [19] выше, где указанное нарушение сна является бессонницей.
[21] Соединение в соответствии с любым одним из [1]-[15] выше или его фармацевтически приемлемая соль для применения в качестве действующего ингредиента фармацевтической композиции.
[22] Соединение или его фармацевтически приемлемая соль в соответствии с [21] выше, где указанная фармацевтическая композиция предназначена для лечения нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору.
[23] Соединение или его фармацевтически приемлемая соль в соответствии с [22] выше, где указанное нарушение сна является бессонницей.
[24] Применение соединения в соответствии с любым одним из [1]-[15] выше или его фармацевтически приемлемой соли в производстве фармацевтической композиции для лечения нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору.
[25] Применение в соответствии с [24] выше, где указанное нарушение сна является бессонницей.
[0007]
Циклопропановое соединение согласно настоящему изобретению или его фармацевтически приемлемая соль обладает антагонизмом к орексиновому рецептору. Следовательно, циклопропановое соединение или его фармацевтически приемлемая соль имеет потенциал применимости для лечения нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору, например, бессонницы.
Краткое описание графических материалов
[0008]
На фиг.1 показаны результаты, полученные путем измерения увеличения времени сна для каждого из соединений из примеров 1, 51, 82, 95, 129 и 240 при пероральном введении мышам.
Подробное описание изобретения
[0009]
В дальнейшем в данном документе значения символов, выражений и т.п., применяемых в описании настоящей заявки, будут разъяснены и, таким образом, настоящее изобретение будет подробно описано.
[0010]
В описании настоящей заявки структурная формула соединения для удобства может указывать на определенный изомер. Настоящее изобретение включает все изомеры, образованные в связи со структурой соединения, такие как геометрические изомеры, оптические изомеры на основе асимметричных атомов углерода, пространственные изомеры или таутомеры и их изомерные смеси. Таким образом, соединение согласно настоящему изобретению не ограничено описаниями формулы, приведенными для удобства, и может быть любым из изомера или смеси. Соответственно, возможен случай, при котором соединение содержит асимметричные атомы углерода в своей молекуле, и существуют оптически активная форма и рацемическая форма. Однако настоящее изобретение не ограничивается ими, а включает все случаи. Более того, также возможен случай, при котором существуют полиморфизмы кристаллов. Настоящее изобретение не ограничивается ими, и оно включает монокристаллы или их смеси. Могут быть включены гидраты, за исключением ангидридов. Все эти вещества включены в объем формулы изобретения в описании настоящей заявки.
Настоящее изобретение включает соединение, образованное посредством введения изотопной метки в соединение формулы (I). Это соединение идентично соединению формулы (I) за исключением того, что один или несколько его атомов замещены атомом(ами) с атомной массой или массовым числом, отличных от таковых, которые, как правило, встречаются в природе. Примеры изотопа, который может быть включен в соединение согласно настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фтора, фосфора, серы, йода и хлора. Конкретные примеры включают 2H, 3H, 11C, 14C, 13N, 15O, 18F, 35S, 123I и 125I.
Соединение согласно настоящему изобретению и его фармацевтически приемлемое производное (например, соль), которые включают вышеописанные изотопы и/или другие изотопы, включены в объем формулы изобретения в описании настоящей заявки. Меченное изотопом соединение согласно настоящему изобретению, например, соединение, в которое введен радиоактивный изотоп(ы), такие как 3H и/или 14C, применимо для анализа распределения в тканях фармацевтического средства и/или субстрата. Изотопы 3H и 14C считаются применимыми вследствие простоты получения и обнаружения. Изотопы 11C и 18F считаются применимыми для PET (позитронно-эмиссионная томография), и изотоп 125I считается применимым для SPECT (однофотонная эмиссионная компьютерная томография). Все эти изотопы применимы для получения изображения головного мозга. Замещение тяжелым изотопом, таким как 2H, является преимущественным для некоторых типов терапии, таких как увеличение периода полувыведения in vivo или уменьшение необходимой дозы вследствие более высокой метаболической стабильности. Таким образом, такой тяжелый изотоп считается применимым при определенных обстоятельствах. Меченное изотопом соединение формулы (I) согласно настоящему изобретению может быть единообразно получено путем осуществления методик, раскрытых в схемах и/или примерах, как описано ниже, с применением широко применяемых меченных изотопом реактивов вместо не меченных изотопом реактивов.
[0011]
В настоящем описании выражение "атом галогена" применяют для обозначения атома фтора, атома хлора, атома брома, атома йода и т.д. Предпочтительно это атом фтора или атом хлора.
[0012]
Выражение "C1-6 алкильная группа" применяют для обозначения алкильной группы, содержащей 1-6 атомов углерода. Примеры предпочтительной C1-6 алкильной группы включают линейные или разветвленные алкильные группы, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, трет-бутильная группа, н-пентильная группа, изопентильная группа, неопентильная группа, н-гексильная группа, 1-метилпропильная группа, 1,2-диметилпропильная группа, 1-этилпропильная группа, 1-метил-2-этилпропильная группа, 1-этил-2-метилпропильная группа, 1,1,2-триметилпропильная группа, 1-метилбутильная группа, 2-метилбутильная группа, 1,1-диметилбутильная группа, 2,2-диметилбутильная группа, 2-этилбутильная группа, 1,3-диметилбутильная группа, 2-метилпентильная группа и 3-метилпентильная группа. Из них более предпочтительными являются метильная группа, этильная группа и н-пропильная группа.
[0013]
Выражение "C1-6 алкиленовая группа" применяют для обозначения алкиленовой группы, содержащей 1-6 атомов углерода. Примеры предпочтительной C1-6 алкиленовой группы включают линейные или разветвленные алкиленовые группы, такие как метиленовая группа, этиленовая группа, н-пропиленовая группа, изопропиленовая группа, н-бутиленовая группа, изобутиленовая группа, н-пентиленовая группа, изопентиленовая группа и неопентиленовая группа. Из них более предпочтительными являются метиленовая группа, этиленовая группа и н-пропиленовая группа.
[0014]
Выражение "C1-6 алкоксигруппа" применяют для обозначения оксигруппы, связанной с вышеупомянутой "C1-6 алкильной группой". Конкретные примеры такой C1-6 алкоксигруппы включают метоксигруппу, этоксигруппу, 1-пропилокси-группу, 2-пропилокси-группу, 2-метил-1-пропилокси-группу, 2-метил-2-пропилокси-группу, 1-бутилокси-группу, 2-бутилокси-группу, 1-пентилокси-группу, 2-пентилокси-группу, 3-пентилокси-группу, 2-метил-1-бутилокси-группу, 3-метил-1-бутилокси-группу, 2-метил-2-бутилокси-группу, 3-метил-2-бутилокси-группу, 2,2-диметил-1-пропилокси-группу, 1-гексилокси-группу, 2-гексилокси-группу, 3-гексилокси-группу, 2-метил-1-пентилокси-группу, 3-метил-1-пентилокси-группу, 4-метил-1-пентилокси-группу, 2-метил-2-пентилокси-группу, 3-метил-2-пентилокси-группу, 4-метил-2-пентилокси-группу, 2-метил-3-пентилокси-группу, 3-метил-3-пентилокси-группу, 2,3-диметил-1-бутилокси-группу, 3,3-диметил-1-бутилокси-группу, 2,2-диметил-1-бутилокси-группу, 2-этил-1-бутилокси-группу, 3,3-диметил-2-бутилокси-группу и 2,3-диметил-2-бутилокси-группу, предпочтительно метоксигруппу, этоксигруппу и 1-пропилокси-группу.
[0015]
Выражение "галоген-C1-6 алкильная группа" применяют для обозначения вышеупомянутой "C1-6 алкильной группы", в которой атом(ы) водорода замещены 1-5 вышеупомянутыми "атомами галогенов". Конкретные примеры такой галоген-C1-6 алкильной группы включают фторметильную группу, дифторметильную группу, трифторметильную группу, трихлорметильную группу, 1-фторэтильную группу, 2-фторэтильную группу, 2-хлорэтильную группу, 1,2-дифторэтильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, 1-фторпропильную группу, 2-фторпропильную группу, 3-фторпропильную группу, 3-хлорпропильную группу, 2-фтор-2-пропильную группу, 4-фторбутильную группу, 5-фторпентильную группу и 6-фторгексильную группу, предпочтительно фторметильную группу, дифторметильную группу и трифторметильную группу.
[0016]
Выражение "гидрокси-C1-6 алкильная группа" применяют для обозначения вышеупомянутой "C1-6 алкильной группы", в которой атом(ы) водорода замещены 1-2 гидроксильными группами. Конкретные примеры таких гидрокси-C1-6 алкильных групп включают гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 1,2-дигидроксиэтильную группу, 1-гидроксипропильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 2-гидрокси-2-пропильную группу, 1,2-дигидроксипропильную группу, 1,3-дигидроксипропильную группу, 2,3-дигидроксипропильную группу, 4-гидроксибутильную группу, 5-гидроксипентильную группу и 6-гидроксигексильную группу, предпочтительно гидроксиметильную группу, 1-гидроксиэтильную группу и 2-гидроксиэтильную группу.
[0017]
Выражение "C1-6 алкокси-C1-6 алкильная группа" применяют для обозначения вышеупомянутой "C1-6 алкоксигруппы", связанной с вышеупомянутой "C1-6 алкильной группой". Конкретные примеры такой C1-6 алкокси-C1-6 алкильной группы включают метоксиметильную группу, 1-метоксиэтильную группу, 2-метоксиэтильную группу, 1-метоксипропильную группу, 2-метоксипропильную группу, 3-метоксипропильную группу, 2-метокси-2-пропильную группу, (1-пропилокси)метильную группу, (2-пропилокси)метильную группу, 1-(1-пропилокси)этильную группу, 2-(1-пропилокси)этильную группу, 1-(2-пропилокси)этильную группу, 2-(2-пропилокси)этильную группу, 1-(1-пропилокси)пропильную группу, 2-(1-пропилокси)пропильную группу, 3-(1-пропилокси)пропильную группу, 2-(1-пропилокси)-2-пропильную группу, 1-(2-пропилокси)пропильную группу, 2-(2-пропилокси)пропильную группу, 3-(2-пропилокси)пропильную группу и 2-(2-пропилокси)-2-пропильную группу, предпочтительно метоксиэтильную группу, 1-метоксиэтильную группу и 2-метоксиэтильную группу.
[0018]
Выражение "C1-6 алкилкарбонильная группа" применяют для обозначения алкильной группы, содержащей 1-6 атомов углерода, в которой один атом водорода замещен карбонильной группой. Примеры предпочтительной C1-6 алкилкарбонильной группы включают ацетильную группу, пропионильную группу и бутирильную группу.
[0019]
Выражение "C1-6 алкилсульфонильная группа" применяют для обозначения алкильной группы, содержащей 1-6 атомов углерода, в которой один атом водорода замещен сульфонильной группой. Примеры такой C1-6 алкилсульфонильной группы включают метилсульфонильную группу, этилсульфонильную группу, н-пропилсульфонильную группу, изопропилсульфонильную группу, н-бутилсульфонильную группу, изобутилсульфонильную группу, трет-бутилсульфонильную группу, н-пентилсульфонильную группу, изопентилсульфонильную группу, неопентилсульфонильную группу, н-гексилсульфонильную группу и 1-метилпропилсульфонильную группу.
[0020]
Выражение "C3-8 циклоалкильная группа" применяют для обозначения циклической алкильной группы, содержащей 3-8 атомов углерода. Примеры предпочтительной C3-8 циклоалкильной группы включают циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу и циклооктильную группу.
[0021]
Выражение "арильная группа" применяют для обозначения арильной группы, выбранной из группы 1. Группа 1 подразумевает фенильную группу, нафтильную группу, азуленильную группу, антрильную группу и фенантрильную группу, предпочтительно фенильную группу и нафтильную группу.
[0022]
Выражение "гетероарильная группа" применяют для обозначения гетероарильной группы, выбранной из группы 2. Группа 2 подразумевает фурильную группу, тиенильную группу, пирролильную группу, имидазолильную группу, триазолильную группу, тетразолильную группу, тиазолильную группу, пиразолильную группу, оксазолильную группу, изоксазолильную группу, изотиазолильную группу, фуразанильную группу, тиадиазолильную группу, оксадиазолильную группу, пиридильную группу, пиразинильную группу, пиридазинильную группу, триазинильную группу, индолильную группу, изоиндолильную группу, индазолильную группу, бензоксазолильную группу, бензизооксадиазолильную группу, бензотиазолильную группу, бензизотиазолильную группу, хинолильную группу и изохинолильную группу, предпочтительно тиенильную группу и пиридильную группу.
[0023]
Выражение "гетероциклическая группа" применяют для обозначения арильной группы, выбранной из группы 3. Группа 3 подразумевает фурильную группу, тиенильную группу, пирролильную группу, имидазолильную группу, триазолильную группу, тетразолильную группу, тиазолильную группу, пиразолильную группу, оксазолильную группу, изоксазолильную группу, изотиазолильную группу, фуразанильную группу, тиадиазолильную группу, оксадиазолильную группу, пиридильную группу, пиразинильную группу, пиридазинильную группу, пиримидинильную группу, триазинильную группу, 2-пиридонильную группу, 4-пиридонильную группу, пиридазидонильную группу, пиримидидонильную группу, пуринильную группу, птеридинильную группу, хинолильную группу, изохинолильную группу, нафтилидильную группу, хиноксалильную группу, циннолильную группу, хиназолильную группу, фталазильную группу, имидазопиридильную группу, имидазотиазолильную группу, имидазооксазолильную группу, бензимидазолильную группу, индолильную группу, изоиндолильную группу, индазолильную группу, пирролопиридильную группу, тиенопиридильную группу, фторпиридильную группу, бензоксазолильную группу, бензизооксадиазолильную группу, бензотиазолильную группу, бензизотиазолильную группу, пиридопиримидинильную группу, оксодигидропиридопиримидинильную группу, бензофурильную группу, бензотиенильную группу, бензотиадиазолильную группу, бензо[1,3]диоксолильную группу, тиенофурильную группу, дигидроизобензофуранильную группу, хроманильную группу, изохроманильную группу, 1,3-диоксаинданильную группу, 1,4-диоксатетралинильную группу и дигидробензо[1,4]оксазинильную группу, предпочтительно тиазолильную группу, оксазолильную группу, пиридильную группу, пиразинильную группу, пиридазинильную группу, пиримидинильную группу, хинолильную группу и изохинолильную группу.
[0024]
Выражение "замещающая группа α" применяют для обозначения циано-группы, атома галогена, гидроксильной группы, оксогруппы, формулы -NR6R7, где каждый из R6 и R7 независимо представляет атом водорода или C1-6 алкильную группу, C1-6 алкильной группы, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, C1-6 алкоксигруппы, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, C1-6 алкилкарбонильной группы, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, C1-6 алкилсульфонильной группы, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, арильной группы, выбранной из группы 1, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β, и гетероарильной группы, выбранной из группы 2, которая может необязательно содержать от 1 до 3 заместителей, выбранных из замещающей группы β. Предпочтительно "замещающая группа α" является циано-группой, атомом фтора, атомом хлора, атомом брома, гидроксильной группой, диметиламино-группой, гидроксилметильной группой, фторметильной группой, трифторметильной группой, метоксигруппой, этоксигруппой, метоксиметильной группой или цианометильной группой.
[0025]
Выражение "замещающая группа β" применяют для обозначения циано-группы, атома галогена, гидроксильной группы, C3-8 циклоалкильной группы и C1-6 алкоксигруппы.
[0026]
Циклопропановое соединение формулы (I) согласно настоящему изобретению может также быть фармацевтически приемлемой солью. Конкретные примеры таких фармацевтически приемлемых солей включают: соли неорганических кислот (например, сульфат, нитрат, перхлорат, фосфат, карбонат, бикарбонат, гидрофторид, гидрохлорид, гидробромид, гидройодид); органические карбоксилаты (например, ацетат, оксалат, малеат, тартрат, фумарат, цитрат); органические сульфонаты (например, метансульфонат, трифторметансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, камфорсульфонат); соли аминокислот (например, аспартат, глутамат); соли четвертичного амина; соли щелочных металлов (например, натриевая соль, калиевая соль); и соли щелочноземельных металлов (например, магниевая соль, кальциевая соль).
[0027]
Варианты осуществления настоящего изобретения включают соединение, представленное следующей формулой (IV), или его фармацевтически приемлемую соль:
[Формула 11]
 ,
,
где Q, R1a, R1b, R1c, R2a, R2b, R2c, R2d, R3a, R3b, R3c и R3d имеют такие же определения, как таковые в соответствии с [6] выше.
[0028]
Варианты осуществления настоящего изобретения включают соединение, представленное следующей формулой (A), или его фармацевтически приемлемую соль:
[Формула 12]
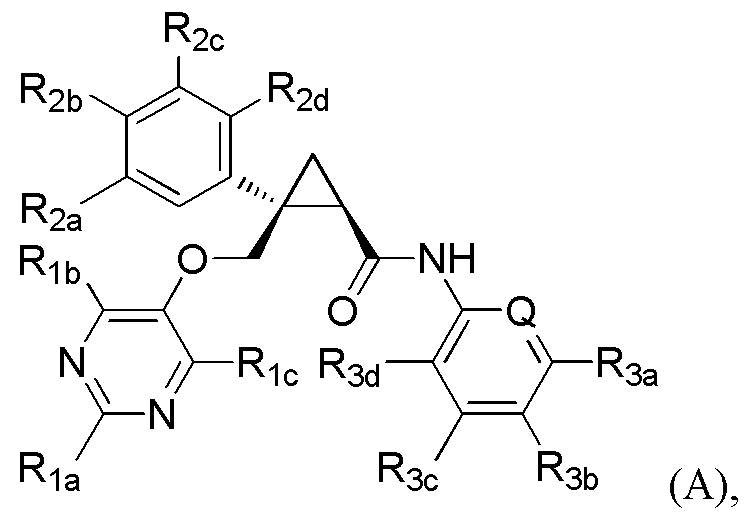
где Q, R1a, R1b, R1c, R2a, R2b, R2c и R2d имеют такие же определения, как таковые в соответствии с [7] выше, и если Q представляет -CH- или атом азота, R3a, R3b, R3c и R3b имеют такие же определения, как таковые в соответствии с [7] выше.
[0029]
Варианты осуществления настоящего изобретения включают соединение, представленное следующей формулой (B), или его фармацевтически приемлемую соль:
[Формула 13]
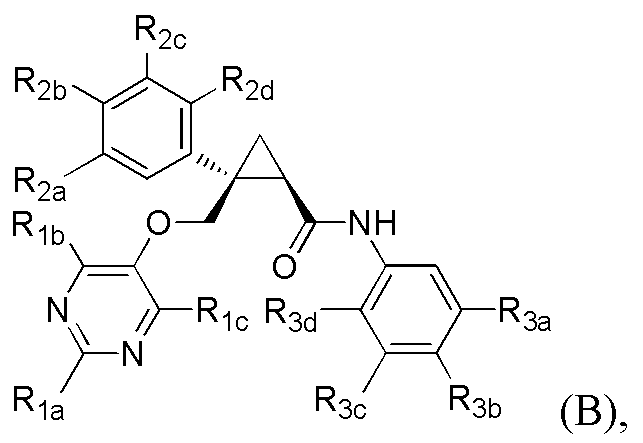
где R1a, R1b, R1c, R2a, R2b, R2c, R2d, R3a, R3b, R3c и R3b имеют такие же определения, как таковые в соответствии с [8] выше.
[0030]
Варианты осуществления настоящего изобретения включают соединение, представленное следующей формулой (C), или его фармацевтически приемлемую соль:
[Формула 14]
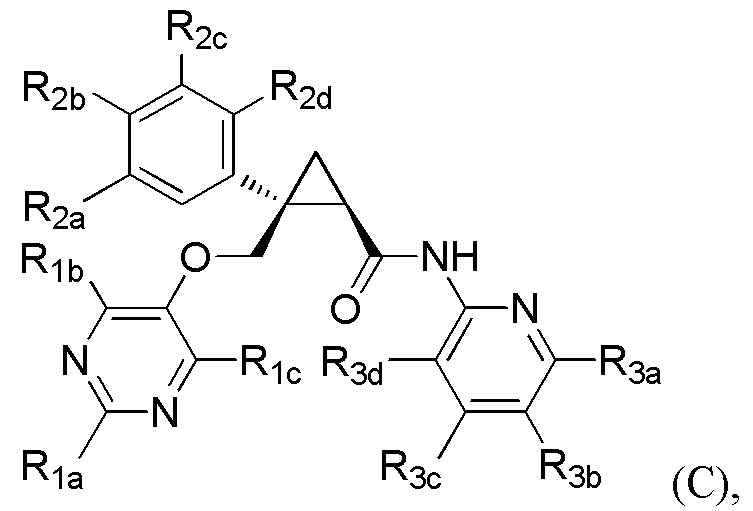
где R1a, R1b, R1c, R2a, R2b, R2c, R2d, R3a, R3b, R3c и R3d имеют такие же определения, как таковые в соответствии с [9] выше.
[0031]
В варианте осуществления настоящего изобретения предпочтительным является соединение формулы (IV) или его фармацевтически приемлемая соль, где Q представляет собой -CH- или атом азота, и если Q представляет собой атом азота, -NH- из -CONH- может быть связан во 2-, 3- или 4-положении по отношению к Q фенильного кольца.
[0032]
В варианте осуществления настоящего изобретения предпочтительным является соединение формулы (B) или его фармацевтически приемлемая соль, где R1a представляет собой C1-6 алкильную группу; R1b представляет собой C1-6 алкильную группу, галоген-C1-6 алкильную группу или C1-6 алкокси-C1-6 алкильную группу; R1c представляет собой атом водорода; каждый из R2a, R2b, R2c и R2d независимо представляет собой атом водорода, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-C1-6 алкильную группу; каждый из R3a и R3c независимо представляет собой атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкокси-C1-6 алкильную группу, циано-группу или циано-C1-6 алкильную группу; R3b представляет собой атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу или C1-6 алкокси-C1-6 алкильную группу; и R3d представляет атом водорода или атом фтора.
[0033]
В варианте осуществления настоящего изобретения предпочтительным является соединение формулы (C) или его фармацевтически приемлемая соль, где R1a представляет собой C1-6 алкильную группу или гидрокси-C1-6 алкильную группу; R1b представляет собой C1-6 алкильную группу, гидрокси-C1-6 алкильную группу или C1-6 алкокси-C1-6 алкильную группу; R1c представляет собой атом водорода или гидроксильную группу; каждый из R2a, R2b, R2c и R2d независимо представляет собой атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-C1-6 алкильную группу; R3a представляет собой заместитель, выбранный из атома водорода, атома галогена, C1-6 алкильной группы, C1-6 алкоксигруппы и C1-6 алкокси-C1-6 алкильной группы; R3b представляет собой атом водорода, атом галогена, C1-6 алкильную группу или галоген-C1-6 алкильную группу; R3c представляет собой атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу или C1-6 алкокси-C1-6 алкильную группу; и R3d представляет собой атом водорода.
[0034]
В варианте осуществления настоящего изобретения особенно предпочтительным является соединение формулы (C) или его фармацевтически приемлемая соль, где R1a представляет собой метильную группу; R1b представляет собой метильную группу, этильную группу, гидроксиметильную группу, метоксиметильную группу или метоксиэтильную группу; и R1c представляет собой атом водорода.
[0035]
В частности, циклопропановое соединение или его фармацевтически приемлемая соль согласно настоящему изобретению предпочтительно выбрана из следующих соединений:
1) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 1),
2) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 16),
3) (1R,2S)-N-[3-(диметиламино)фенил]-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 19),
4) (1R,2S)-N-(3-хлорфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 24),
5) (1R,2S)-N-(3-циано-4-фторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 26),
6) (1R,2S)-N-(3-хлор-4-фторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 32),
7) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(3-метоксифенил)-2-фенилциклопропанкарбоксамид (пример 36),
8) (1R,2S)-N-[3-(цианометил)фенил]-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 39),
9) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенил-N-[3-(трифторметил)фенил]циклопропанкарбоксамид (пример 43),
10) (1R,2S)-N-(5-хлор-4-метилпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 45),
11) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 51),
12) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-[5-фтор-4-(метоксиметил)пиридин-2-ил]-2-фенилциклопропанкарбоксамид (пример 71),
13) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 73),
14) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 82),
15) (1R,2S)-N-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 84),
16) (1R,2S)-N-(4-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 85),
17) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксиметилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 86),
18) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(4-фторфенил)циклопропанкарбоксамид (пример 92),
19) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-фенилциклопропанкарбоксамид (пример 93),
20) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 94),
21) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 95),
22) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 96),
23) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 100),
24) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид (пример 104),
25) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксиметилпиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид (пример 109),
26) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид (пример 111),
27) (1R,2S)-2-(3-цианофенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 117),
28) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 119),
29) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 120),
30) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 121),
31) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 129),
32) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)циклопропанкарбоксамид (пример 130),
33) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 131),
34) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 132),
35) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 133),
36) (1R,2S)-N-(3,4-дифторфенил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 134),
37) (1R,2S)-N-(2,4-дифторфенил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 135),
38) (1R,2S)-N-(5-цианопиридин-2-ил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 137),
39) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)циклопропанкарбоксамид (пример 138),
40) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(4-(метоксиметил)-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 139),
41) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(4-(метоксиметил)-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 140),
42) (1R,2S)-N-(5-фторпиридин-2-ил)-2-{[(4-(метоксиметил)-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 141),
43) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 145),
44) (1R,2S)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 149),
45) (1R,2S)-N-(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 150),
46) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 164),
47) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)циклопропанкарбоксамид (пример 165),
48) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 166),
49) (1R,2S)-N-(5-цианопиридин-2-ил)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 167),
50) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 168),
51) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 169),
52) (1R,2S)-N,2-бис(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 170),
53) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)циклопропанкарбоксамид (пример 173),
54) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-(3-метоксифенил)циклопропанкарбоксамид (пример 186),
55) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-метоксифенил)циклопропанкарбоксамид (пример 189),
56) (1R,2S)-N-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-метоксифенил)циклопропанкарбоксамид (пример 190),
57) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-[(4-метоксиметил-2-метилпиримидин-5-ил)оксиметил]циклопропанкарбоксамид (пример 191),
58) (1R,2S)-2-(3-фторфенил)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 192),
59) (1R,2S)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 193),
60) (1R,2S)-N-(3,4-дифторфенил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 194),
61) (1R,2S)-N,2-бис(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 195),
62) (1R,2S)-N-(2,4-дифторфенил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 196),
63) (1R,2S)-N-(2,5-дифторфенил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 197),
64) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 198),
65) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 199),
66) (1R,2S)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-[5-(трифторметил)пиридин-2-ил]циклопропанкарбоксамид (пример 201),
67) (1R,2S)-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 202),
68) (1R,2S)-N,2-бис(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 203),
69) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 204),
70) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 205),
71) (1R,2S)-N-(3,4-дифторфенил)-2-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 207),
72) (1R,2S)-2-(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 211),
73) (1R,2S)-2-(3,4-дифторфенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 212),
74) (1R,2S)-N,2-бис(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 214),
75) (1R,2S)-N-(2,4-дифторфенил)-2-(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 216),
76) (1R,2S)-2-(3,5-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 218),
77) (1R,2S)-2-(3,5-дифторфенил)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 219),
78) (1R,2S)-N-(3,4-дифторфенил)-2-(3,5-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 221),
79) (1R,2S)-2-(3-хлорфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 225),
80) (1R,2S)-2-(3-хлорфенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 226),
81) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиэтил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 229),
82) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 231),
83) (1R,2S)-N-(3,4-дифторфенил)-2-(3-фтор-5-метоксифенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 232),
84) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(5-фторпиридин-2-ил)-2-[(4-метоксиметил-2-метилпиримидин-5-ил)оксиметил]циклопропанкарбоксамид (пример 233),
85) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 234),
86) (1R,2S)-2-(3-фтор-5-метоксифенил)-2-[(4-метоксиметил-2-метилпиримидин-5-ил)оксиметил]-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 235),
87) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 236),
88) (1R,2S)-2-(4-фтор-3-метоксифенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 239),
89) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 240),
90) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 241),
91) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 242),
92) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 243),
93) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 244),
94) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 245),
95) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 246),
96) (1R,2S)-N-(4-хлорпиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)циклопропанкарбоксамид (пример 247),
97) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид (пример 248),
98) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-5-метоксифенил)-N-(5-фтор-4-метилпиримидин-2-ил)циклопропанкарбоксамид (пример 256),
99) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-(3-трифторметилфенил)циклопропанкарбоксамид (пример 266),
100) (1R,2S)-2-(4-бромфенил)-N-(5-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 273),
101) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторметилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 282),
102) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-(3-йодфенил)циклопропанкарбоксамид (пример 283),
103) (1R,2S)-N-(5-фторпиридин-2-ил)-2-{[(4-гидроксиметил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид (пример 286),
104) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(4-фторфенил)циклопропанкарбоксамид (пример 316),
105) (1R,2S)-2-{[(4-фторметил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 320),
106) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-4-гидроксифенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 321),
107) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-4-метоксифенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 322),
108) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-{[(2-гидроксиметил-4-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 323),
109) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-[5-фтор-2-гидроксифенил]-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 324),
110) (1R,2S)-2-{[(2,4-диметил-6-оксо-1,6-дигидропиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 326),
111) (1R,2S)-N-(2-цианопиридин-4-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 41),
112) (1R,2S)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-N-(5-фторпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 293),
113) (1R,2S)-N-(5-хлор-4-метилпиридин-2-ил)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-2-(3-фторфенил)циклопропанкарбоксамид (пример 295),
114) (1R,2S)-N-(3,4-фторпиридин-2-ил)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-2-(3-фторфенил) циклопропанкарбоксамид (пример 296),
115) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-[N-(2-метил-4-трифторметилпиримидин-5-ил)метиламинометил]циклопропанкарбоксамид (пример 302),
116) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фтор-5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 327),
117) (1R,2S)-N-(2-хлорпиридин-4-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид (пример 33),
118) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фторпиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 53),
119) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 61),
120) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фторпиридин-3-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 88),
121) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-метоксипиридин-3-ил)циклопропанкарбоксамид (пример 89),
122) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фтор-5-метилпиридин-3-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 91),
123) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-метоксипиридин-3-ил)циклопропанкарбоксамид (пример 112),
124) (1R,2S)-N-(5-цианопиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (пример 200),
125) (1R,2R)-2-[(2,4-диметилпиримидин-5-ил)этил]-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 292),
126) (1R,2S)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-N-(4-фторфенил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 294),
127) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 317),
128) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)-2-фенилциклопропанкарбоксамид (пример 318)
и
129) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5- ил)окси]метил}-N-(5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид (пример 321).
Более предпочтительно циклопропановое соединение или его фармацевтически приемлемая соль выбрано из следующих соединений:
(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 1),
(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамид (пример 51),
(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 82),
(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 95),
(1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 129) и
(1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(пиридин-2-ил)циклопропанкарбоксамид (пример 240).
Особенно предпочтительно циклопропановое соединение или его фармацевтически приемлемая соль выбрано из следующих соединений:
(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (пример 82), представленный следующей формулой, или его фармацевтически приемлемая соль:
[Формула 15]
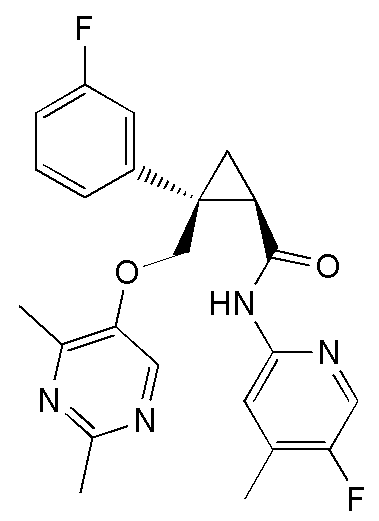
(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (пример 95), представленный следующей формулой, или его фармацевтически приемлемая соль:
[Формула 16]
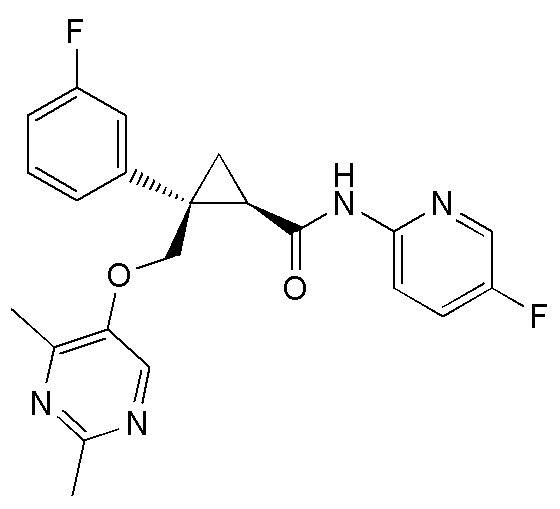
и
(1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид (пример 129), представленный следующей формулой, или его фармацевтически приемлемая соль:
[Формула 17]
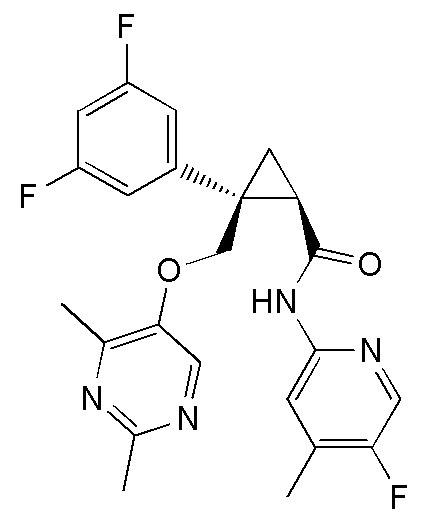
[0036]
Далее будет описан способ получения соединения формулы (I) согласно настоящему изобретению [называемое в дальнейшем в данном документе соединением (I); соединения, представленные другими формулами, будут называться аналогичным образом] или его фармацевтически приемлемой соли.
В формуле (I) в случае, когда L представляет формулу -CONH-, соединение (I) или его фармацевтически приемлемую соль можно получить следующим способом.
Соединение (I), представленное следующей формулой (I-1), и его промежуточное химическое соединение синтезируют, например, с помощью следующих основных способов получения и способов, описанных в примерах получения и примерах, которые будут описаны далее.
Формула (I-1):
[Формула 18]
 ,
,
где A1, A2, A3, R1, R2, R3 и X имеют такие же определения, как таковые описанные выше.
[0037]
"Уходящая группа" в исходном материале, применяемом при получении соединения (I) согласно настоящему изобретению, особым образом не ограничена при условии, что она может использоваться в реакции нуклеофильного замещения. Предпочтительные примеры такой уходящей группы включают атом галогена, C1-6 алкилсульфонилокси-группу, которая может быть замещена вышеописанной замещающей группой α, и арилсульфонилокси-группу, которая может быть замещена вышеописанной замещающей группой α. Конкретные примеры включают атом хлора, атом брома, атом йода, метансульфонилокси-группу, трифторметансульфонилокси-группу и пара-толуолсульфонилокси-группу.
[0038]
1. Основной способ получения 1:
[Формула 19]
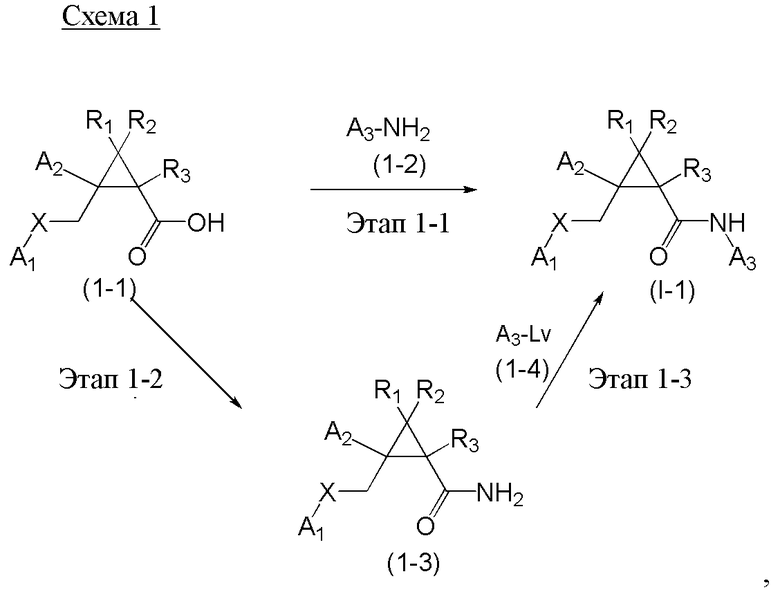
где каждый из R1, R2 и R3 представляет собой водород; Lv представляет уходящую группу, включая, например, атом галогена (атом хлора, атом брома, атом йода и т.д.) и сульфонилокси-группу, такую как метансульфонилокси-группа, пара-толуолсульфонилокси-группа или трифторметансульфонилокси-группа (которая представлена TfO в формуле); и A1, A2, A3 и X имеют те же значения, как таковые, описанные выше.
[0039]
Этап 1-1:
Данный этап представляет собой этап непосредственной конденсации соединения (1-1) с соединением (1-2) (способ 1) или индуцирования соединения (1-1) в галогенангидрид (способ 2), смешанный ангидрид кислоты (способ 3), активный сложный эфир (способ 4) или подобное и затем конденсации полученного продукта с соединением (1-2) с тем, чтобы получить соединение (I-1).
[0040]
Способ 1:
Если соединение (1-1) непосредственно конденсируют с соединением (1-2), применяют конденсирующее средство. Такую реакцию конденсации можно проводить при таких же условиях, как обычно применяемые условия, описанные в публикациях, как описано ниже. Известные способы описаны, например, в Rosowsky, A.; Forsch, R. A.; Moran, R. G.; Freisheim, J. H.; J. Med. Chem., 34(1), 227-234 (1991), Brzostwska, M.; Brossi, A.; Flippen-Anderson, J. L.; Heterocycles, 32(10), 1968-1972 (1991), Romero, D. L.; Morge, R. A.; Biles, C.; Berrios-Pena, N.; May, P. D.; Palmer, J. R.; Johnson, P. D.; Smith, H. W.; Busso, M.; Tan, C.-K.; Voorman, R. L.; Reusser, F.; Althaus, I. W.; Downey, K. M.; So, A. G.; Resnick, L.; Tarpley, W. G., Aristoff, P. A.; J. Med. Chem., 37(7), 998-1014 (1994).
Соединение (1-1) может быть либо в свободной форме, либо солью.
[0041]
Растворитель, применяемый в настоящем изобретении, особым образом не ограничен при условии, что он не ингибирует реакцию. Примеры такого растворителя включают тетрагидрофуран, 1,4-диоксан, этилацетат, метилацетат, дихлорметан, хлороформ, N,N-диметилформамид, толуол и ксилол. Примеры конденсирующего средства включают CDI (N,N'-карбонилдиимидазол), Bop (1H-1,2,3-бензотриазол-1-илокси(три(диметиламино))фосфония гексафторфосфат), WSC (1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид), DCC (N,N-дициклогексилкарбодиимид), диэтилфосфорилцианид и PyBOP (бензотриазол-1-илокситрис(пирролидино)фосфония гексафторфосфат). Соединение (1-2) применяют в количестве от 1 эквивалента до в значительной степени избыточного количества по отношению к соединению (1-1). К тому же органическое основание, такое как триэтиламин, можно добавлять в количестве от 1 эквивалента до в значительной степени избыточного количества соединения (1-1), когда необходимо.
Время реакции особым образом не ограничено. Как правило, оно составляет от 0,5 до 48 часов и предпочтительно от 0,5 до 24 часов. Температура реакционной смеси зависит от применяемого исходного материала, применяемого растворителя и т.п. и, следовательно, особым образом не ограничена. Она составляет предпочтительно от температуры охлаждения льдом до температуры возврата флегмы растворителя.
[0042]
Способ 2: (способ синтеза с применением галогенангидрида)
В данной реакции соединение (1-1) превращают в соответствующий галогенангидрид согласно способу, известному специалисту в данной области техники, и затем галогенангидриду дают возможность реагировать с соединением (1-2) с получением соединения (I-1).
Примеры основания, применяемого в реакции, включают триэтиламин, пиридин, карбонат калия и диизопропилэтиламин. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от -78°C до температуры возврата флегмы растворителя и предпочтительно от -20°C до комнатной температуры. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и способен растворять исходное вещество до определенной степени. Предпочтительные примеры такого растворителя включают тетрагидрофуран, эфир, толуол и дихлорметан.
[0043]
Способ 3: (способ синтеза с применением ангидрида кислоты)
После того как соединение (1-1) превратили в смешанный ангидрид кислоты, смешанному ангидриду кислоты давали возможность реагировать с соединением (1-2) с тем, чтобы получить соединение (I-1). Смешанный ангидрид кислоты можно синтезировать способом, известным специалисту в данной области техники. Например, его можно синтезировать с помощью реакции соединения (1-1) со сложным эфиром хлормуравьиной кислоты, таким как этилхлороформиат, в присутствии основания, такого как триэтиламин. Такой эфир хлормуравьиной кислоты и основание применяют в количестве от 1 до 2 эквивалентов по отношению к соединению (1-1). Температура реакционной смеси составляет от -30°C до комнатной температуры и предпочтительно от -20°C до комнатной температуры.
Этап конденсации смешанного ангидрида кислоты и соединения (1-2) проводят, например, с помощью реакции смешанного ангидрида кислоты с соединением (1-2) в растворителе, таком как дихлорметан, тетрагидрофуран или N,N-диметилформамид. Соединение (1-2) применяют в количестве от 1 эквивалента до в значительной степени избыточного количества по отношению к смешанному кислотному ангидриду.
Время реакции особым образом не ограничено. Как правило, оно составляет от 0,5 до 48 часов и предпочтительно от 0,5 до 12 часов. Температура реакционной смеси составляет от -20°C до 50°C и предпочтительно от -20°C до комнатной температуры.
[0044]
Способ 4: (способ синтеза с применением активного сложного эфира)
После того как соединение (1-1) превратили в активный сложный эфир, активному сложному эфиру позволяют реагировать с соединением (1-2) с тем, чтобы получить соединение (I-1). Этап получения активного сложного эфира проводят, например, с помощью реакции соединения (1-1) с синтезирующим активный сложный эфир реактивом в растворителе, таком как 1,4-диоксан, тетрагидрофуран или N,N-диметилформамид, в присутствии конденсирующего средства, такого как DCC. Примером синтезирующего активный сложный эфир реактива является N-гидроксисукцинимид. Такой синтезирующий активный сложный эфир реактив и конденсирующее средство применяют в количестве от 1 до 1,5 эквивалента по отношению к соединению (1-1). Время реакции особым образом не ограничено. Как правило, оно составляет от 0,5 до 48 часов и предпочтительно от 0,5 до 24 часов.
Температура реакционной смеси составляет от -20°C до -50°C и предпочтительно от -20°C до комнатной температуры.
Этап конденсации активного сложного эфира и соединения (1-2) проводят, например, с помощью реакции активного сложного эфира с соединением (1-2) в растворителе, таком как дихлорметан, тетрагидрофуран или N,N-диметилформамид. Соединение (1-2) применяют в количестве от 1 эквивалента до в значительной степени избыточного количества по отношению к активному сложному эфиру. Время реакции особым образом не ограничено. Как правило, оно составляет от 0,5 до 48 часов и предпочтительно от 0,5 до 24 часов. Температура реакционной смеси составляет от -20°C до -50°C и предпочтительно от -20°C до комнатной температуры.
[0045]
Этап 1-2:
Данный этап представляет собой этап получения соединения (1-3) из соединения (1-2).
Данный этап представляет собой этап превращения соединения (1-1) в соответствующий галогенангидрид или ангидрид кислоты с помощью способов, описанных в способе 2 и способе 3 выше, и затем реакции галогенангидрида или ангидрида кислоты с аммиаком с тем, чтобы получить соединение (1-3). Аммиак, применяемый в реакции, может быть либо газом, либо водным раствором. Он также может быть солью аммония. Соединение (1-3) можно также получить с помощью реакции гексаметилдисилазана с галогенангидридом и затем добавления метанола в продукт реакции с последующей обработкой кислотой (R. Pellegata et al., Synthesis, 1985, 517).
Более того, соединение (1-3) можно также получить путем нагревания соединения (1-1) и мочевины.
[0046]
Этап 1-3:
Данный этап представляет собой этап получения соединения (I-1) из соединения (1-3).
Он представляет собой этап воздействия на соединение (1-3) и соединение (1-4) реакции конденсации с помощью переходного металла с тем, чтобы получить соединение (I-1).
На данном этапе реакцию можно проводить при условиях, которые обычно применяют для реакции конденсации между арилгалогенидом или арилбороновой кислотой и амидом кислоты, при которых применяют переходный металл.
Реакция конденсации с применением меди описана, например, в публикациях, таких как Hanhui Xu, Christian Wolf, Chem. Commun, 2009, 1715; и Suribabu Jammi et al., Synlett. 2009 (20), 3323. Тип медьсодержащего реактива, применяемого в данной реакции, особым образом не ограничен. Предпочтительные примеры такого медьсодержащего реактива включают йодид меди, окись меди и трифторметансульфонат меди(II).
Реакция конденсации с применением комплекса палладия описана, например, в публикации, такой как Van den Hoogenband, A et al., Tetrahedron Lett. 2004, 45, 8535; и Ghosh, A et al., Org. Lett. 2003, 5, 2207. Тип палладийсодержащего реактива, применяемого в данной реакции, особым образом не ограничен. Предпочтительные примеры такого палладийсодержащего реактива включают трис(дибензилиденацетон)дипалладий, хлорид палладия и ацетат палладия(II). Примеры лиганда, применяемого в данной реакции, включают XantPhos (4,5-бис(дифенилфосфино)-9,9-диметилксантен), X-Phos (2-дициклогексилфосфино-2',4',6'-триизопропилбифенил), BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил), DPPF (1,1'-бис(дифенилфосфино)ферроцен) и трис(трет-бутилокси)фосфин. Реактив на основе переходного металла применяют в количестве примерно от 0,001 до 0,1 эквивалента по отношению к количеству исходного материала. Тип растворителя, применяемого в данной реакции, особым образом не ограничен при условии, что он не ингибирует реакцию. Предпочтительные примеры такого растворителя включают бензол, толуол, ксилол, N,N-диметилформамид, 1-метил-2-пирролидон, тетрагидрофуран, 1,4-диоксан, ацетонитрил и пропионитрил. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от температуры охлаждения льдом до температуры возврата флегмы растворителя и предпочтительно от комнатной температуры до температуры возврата флегмы растворителя, например. Время реакции особым образом не ограничено. Как правило, оно составляет от 0,5 до 48 часов и предпочтительно от 0,5 до 24 часов.
[0047]
Основной способ получения 2:
[Формула 20]
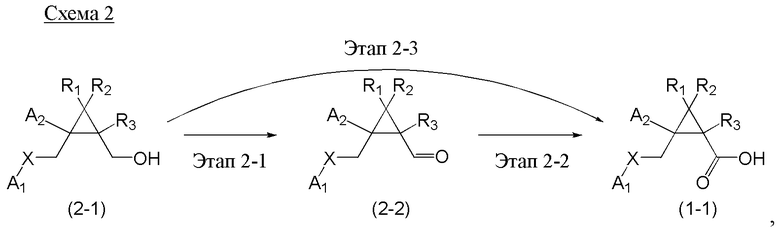
где A1, A2, R1, R2, R3 и X имеют такие же значения, как таковые, описанные выше.
[0048]
Основной способ получения 2 представляет собой способ получения соединения (1-1), т.е. промежуточного соединения для синтеза соединения (I-1) согласно настоящему изобретению, в котором применяют соединение (2-1) в качестве исходного материала, и который включает [этап 2-1] и [этап 2-2] или [этап 2-3].
Соединение (2-1) можно получить из коммерчески доступного продукта способом, известным специалисту в данной области техники. Кроме того, его можно также получить путем применения способов, описанных в примерах получения в примерах.
[0049]
Этап 2-1:
Данный этап представляет собой этап воздействия на соединение (2-1) реакции окисления с получением соединения (2-2). Альдегидное соединение можно получить из спиртового соединения в соответствии со способом, известным специалисту в данной области техники.
Примеры известного способа окисления, применяемого в реакции, включают окисление по Сверну, окисление по Кори-Киму, окисление по Моффату, окисление PCC, окисление PDC, окисление по Дессу-Мартину, окисление SO3-пиридином и окисление TEMPO.
Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Примеры такого растворителя включают диметилсульфоксид, тетрагидрофуран, толуол, дихлорметан и хлороформ.
Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от -78°C до температуры возврата флегмы растворителя и предпочтительно от -78°C до комнатной температуры. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов.
[0050]
Этап 2-2:
Данный этап представляет собой этап воздействия на соединение (2-3) реакции окисления с получением соединения (1-1). Соединение карбоновой кислоты можно получить из альдегидного соединения в соответствии со способом, известным специалисту в данной области техники.
В качестве способа окисления можно использовать обычно применяемый способ окисления. Например, можно использовать способы, описанные в примерах получения в примерах.
[0051]
Этап 2-3:
Данный этап представляет собой этап воздействия на соединение (2-1) реакции окисления с получением соединения (1-1). В качестве условий окисления можно использовать обычно применяемые условия. Например, окисление можно проводить с применением TEMPO-бисацетилйодбензола. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Например, дихлорметан, хлороформ, ацетонитрил, толуол или подобные смешивают с водой, и можно применять смешанный растворитель.
Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от 0°C до температуры возврата флегмы растворителя. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов.
Более того, можно использовать способы, описанные в примерах получения в примерах.
[0052]
Основной способ получения 3:
[Формула 23]
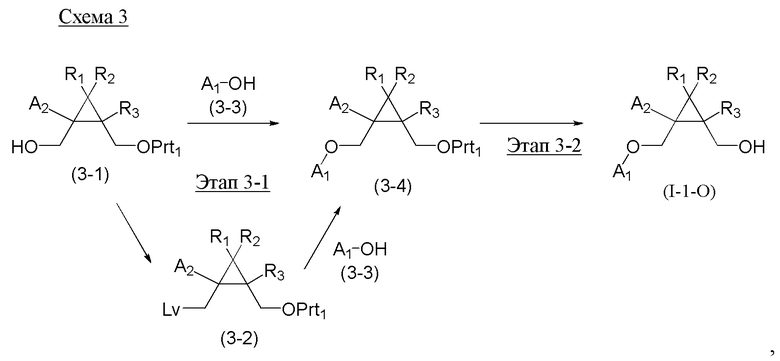
где Lv представляет уходящую группу, такую как атом галогена (атом хлора, атом брома, атом йода или подобное), сульфонилокси-группу, такую как метансульфонилокси-группу, пара-толуолсульфонилокси-группу или трифторметансульфонилокси-группу или подобное; Prt1 представляет защитную группу для гидроксильной группы; и A1, A2, R1, R2 и R3 имеют такие же значения, как таковые, описанные выше.
[0053]
Основной способ получения 3 представляет собой способ получения соединения (I-1-O), т.е. промежуточного соединения для синтеза соединения (I) согласно настоящему изобретению, в котором применяют соединение (3-1) в качестве исходного материала, и который включает [этап 3-1] и [этап 3-2].
Соединение (I-1-O) также можно получить из коммерчески доступного продукта согласно способу, известному специалисту в данной области техники. Кроме того, его можно получить с помощью использования способов, описанных в примерах получения в примерах.
[0054]
Этап 3-1:
Данный этап представляет собой этап обеспечения возможности непосредственной реакции соединения (3-1) с соединением (3-3) или превращения соединения (3-1) в соединение (3-2) и затем реакции соединения (3-2) с соединением (3-3) с тем, чтобы получить соединение (3-4).
Если соединение (3-1) непосредственно реагирует с соединением (3-3), данную реакцию можно проводить при условиях, обычно применяемых в реакции Мицунобу (например, условия, описанные в O. Mitsunobu, Synthesis, 1(1981), D. L. Hughes, Organic Reactions, 42, 335(1992), и т.д.).
Реакцию проводят с применением производного фосфина, такого как трифенилфосфин, и сложного диэфира азодикарбоновой кислоты, например, диэтилазодикарбоксилата или диизопропилазодикарбоксилата. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Например, можно применять тетрагидрофуран, бензол, толуол или N,N-диметилформамид. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от температуры охлаждения льдом до комнатной температуры.
Альтернативно, соединение (3-4) можно получить путем превращения соединения (3-1) в соединение (3-2) с уходящей группой и затем проведения реакции нуклеофильного замещения между соединением (3-2) и соединением (3-3). В частности, основанию дают возможность действовать на соединение (3-3) с образованием аниона и аниону затем дают возможность реагировать с соединением (3-2) с тем, чтобы получить соединение (3-4), например.
Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию. Данную реакцию можно проводить, давая возможность подходящему основанию действовать на соединение (3-3) в количестве от 1 эквивалента до в значительной степени избыточного количества по отношению к соединению в органическом растворителе, таком как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид или диметилсульфоксид. Примеры применяемого основания включают гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия, метоксид натрия, этилат натрия и трет-бутоксид калия.
Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от -78°C до температуры возврата флегмы растворителя и предпочтительно от температуры охлаждения льдом до 100°C.
Соединение (3-2) можно получить путем превращения гидроксильной группы соединения (3-1) в уходящую группу.
Примеры такой уходящей группы включают атом галогена (атом хлора, атом брома или атом йода) и сульфонилокси-группу, такую как метансульфонилокси-группа, пара-толуолсульфонилокси-группа или трифторметансульфонилокси-группа.
Реакцию можно проводить при тех же условиях, как таковые, обычно применяемые в реакции превращения гидроксильной группы в такую уходящую группу (например, условия, описанные в R. K. Crossland and K. L. Servis, Journal of Organic Chemistry, 35, 3195 (1970), Y. Yoshida, Y. Sakakura, N. Aso, S. Okada, и Y. Tanabe, Tetrahedron, 55, 2183 (1999).
Если уходящая группа представляет собой, например, атом галогена, соединение (3-2) можно получить, давая возможность соединению (3-1) реагировать с тионилхлоридом, тионилбромидом, трибромидом фосфора или тетрагалогенметан-трифенилфосфином. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Предпочтительные примеры такого растворителя включают бензол, толуол, ксилол, дихлорметан и хлороформ. Кроме того, возможен случай, при котором положительных результатов, таких как повышение выхода, можно достичь при добавлении основания. Основание, применяемое в реакции, особым образом не ограничено при условии, что оно не ингибирует реакцию. Предпочтительные примеры такого основания включают карбонат натрия, карбонат калия, триэтиламин, пиридин и N,N-диизопропилэтиламин. Температура реакционной смеси, как правило, составляет от -78°C до температуры возврата флегмы растворителя и предпочтительно от температуры охлаждения льдом до температуры возврата флегмы растворителя.
Если уходящая группа представляет собой сульфонилокси-группу, соединение (3-2) можно получить, давая возможность соединению (3-1) реагировать с метансульфонилхлоридом, пара-толуолсульфонилхлоридом, безводной трифторметансульфоновой кислотой и т.д. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Предпочтительные примеры такого растворителя включают тетрагидрофуран, толуол, ксилол, дихлорметан, хлороформ и N,N-диметилформамид. Температура реакционной смеси составляет, как правило, от -78°C до температуры возврата флегмы растворителя и предпочтительно от температуры охлаждения льдом до комнатной температуры. Кроме того, возможен случай, при котором положительных результатов, таких как повышение выхода, можно достичь при добавлении основания. Основание, применяемое в реакции, особым образом не ограничено при условии, что оно не ингибирует реакцию. Предпочтительные примеры такого основания включают карбонат натрия, карбонат калия, триэтиламин, пиридин и N,N-диизопропилэтиламин.
[0055]
Этап 3-2:
Данный этап представляет собой этап снятия защитной группы с соединения (3-4) с получением соединения (I-1-O).
Если Prt1 представляет трет-бутилдиметилсилильную группу или трет-бутилдифенилсилильную группу, реакцию можно проводить при тех же условиях, как таковые, обычно применяемые в реакции снятия защитной силильной группы (например, условия, описанные в публикации, такой как T. W. Green and P. G. M. Wuts, "Protective Groups in Organic Chemistry, Third Edition," John Wiley & Sons (1999), pp. 113-148). В частности, дают возможность фториду тетра-н-бутиламмония действовать на соединение (3-4) в органическом растворителе, таком как тетрагидрофуран, или дают возможность соляной кислоте действовать на соединение (3-4) в этаноле с тем, чтобы получить соединение (I-1-O). Растворитель, применяемый в данной реакции, особым образом не ограничен при условии, что он не ингибирует реакцию. Предпочтительные примеры такого растворителя включают дихлорметан, метанол, этанол, пропанол, этилацетат, тетрагидрофуран и 1,4-диоксан. Кроме того, возможен случай, при котором положительных результатов, таких как повышение выхода, могут быть достигнуты при добавлении уксусной кислоты.
Если Prt1 представляет собой бензильную группу, реакцию можно проводить при тех же условиях, как таковые, обычно применяемые в реакции снятия бензильной защитной группы (например, условия, описанные в публикации, такой как T. W. Green and P. G. M. Wuts, "Protective Groups in Organic Chemistry, Third Edition," John Wiley & Sons (1999), pp. 76-86). В частности, реакцию можно проводить, например, с помощью способа каталитического восстановления, в котором применяют палладий на углероде, гидроксид палладия на углероде или подобное в качестве катализатора в органическом растворителе, таком как этанол в атмосфере водорода.
Растворитель, применяемый в данной реакции, особым образом не ограничен при условии, что он не ингибирует реакцию. Примеры такого растворителя включают метанол, этанол, пропанол, этилацетат, тетрагидрофуран и 1,4-диоксан. Условия реакции особым образом не ограничены. Реакцию можно проводить при температуре от комнатной температуры до температуры возврата флегмы растворителя при давлении от нормального атмосферного давления до 150 атмосферных давлений и предпочтительно при температуре от комнатной температуры до 60°C при давлении от нормального атмосферного давления до 5 атмосферных давлений.
[0056]
Основной способ получения 4:
[Формула 22]
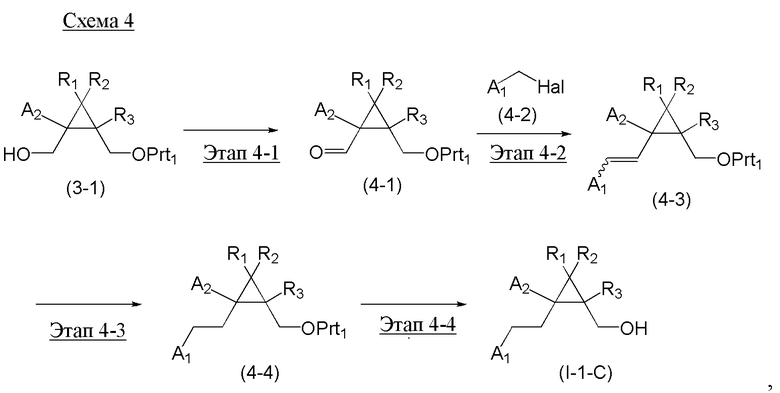
где Prt1, A1, A2, R1, R2 и R3 имеют такие же значения, как таковые, описанные выше.
Основной способ получения 4 представляет собой способ получения соединения (I-1-C), т.е. промежуточного соединения для синтеза соединения (I) согласно настоящему изобретению, при котором применяют соединение (3-1) в качестве исходного материала, и который включает 4 этапа от [этап 4-1] до [этап 4-4].
Соединение (I-1-C) можно также получить из коммерчески доступного продукта способом, известным специалисту в данной области техники. Кроме того, его можно получить с использованием способов, описанных в примерах получения в примерах.
[0057]
Этап 4-1
Данный этап представляет собой этап окисления спиртового соединения (3-1) с получением альдегида (4-1). Данную реакцию можно проводить при тех же условиях, как таковые для этапа 2-1.
[0058]
Этап 4-2
Данный этап представляет собой этап получения олефина (4-3) из альдегида (4-1). Данную реакцию можно проводить при обычно применяемых условиях. В частности, например, применяют соединение (4-2) и реактив Виттига, синтезированный из трифенилфосфина, и им дают возможность реагировать с соединением (4-1) в присутствии основания с тем, чтобы получить соединение (4-3).
[0059]
Этап 4-3
Данный этап представляет собой этап восстановления олефина в соответствии с каталитическим восстановлением водородом. Данную реакцию можно проводить при обычно применяемых условиях.
[0060]
Этап 4-4
Данный этап представляет собой этап снятия защитной группы с соединения (4-3) с получением соединения (I-1-C). Данную реакцию можно проводить тем же способом, что и для этапа 3-2.
[0061]
5. Основной способ получения 5:
[Формула 23]
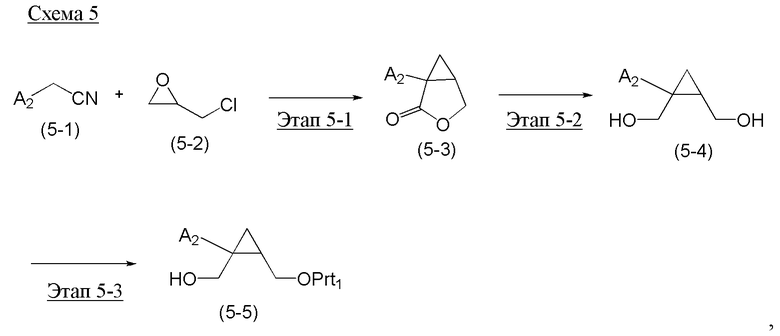 ,
,
где Prt1 и A1 имеют такие же значения, как таковые, описанные выше.
Основной способ получения 5 представляет собой способ получения соединения (5-5), т.е. промежуточного соединения для синтеза соединения (I) согласно настоящему изобретению, в котором применяют соединение (5-1) в качестве исходного материала, и который включает с [этапа 5-1] по [этап 5-3].
Соединение (5-5) можно также получить из коммерчески доступного продукта способом, известным специалисту в данной области техники. Кроме того, его можно получить с применением способов, описанных в примерах получения в примерах.
[0062]
Этап 5-1
Данный этап представляет собой этап реакции производного ацетонитрила (5-1) с эпихлоргидрином (5-2) с получением соединения (5-3). Соединение (5-3) можно получить при обычно применяемых условиях реакции (например, условия, описанные в S, Shuto, Bioorganic & Medicinal Chemistry, 10 (2002), 3829) или с использованием способов, описанных в примерах получения в примерах. Более того, оптически активное вещество соединения (5-3) можно получить с применением оптически активного эпихлоргидрина.
[0063]
Этап 5-2
Данный этап представляет собой этап восстановления лактона (5-3) с получением соединения (5-4). Примеры восстанавливающего средства, применяемого в реакции, включают боргидрид натрия, боргидрид лития и алюмогидрид лития.
Растворитель, применяемый в данной реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Примеры такого растворителя включают тетрагидрофуран и диэтиловый эфир. В некоторых случаях спиртовой растворитель, такой как метанол, смешивают с таким растворителем. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от -78°C до температуры возврата флегмы растворителя и предпочтительно от -78°C до комнатной температуры. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов.
[0064]
Этап 5-3
Данный этап представляет собой этап защиты гидроксильной группы соединения (5-4). Примеры защитной группы, применяемой в данном документе, включают ацетильную группу, метоксиметильную группу, тритильную группу, бензильную группу, трет-бутилдифенилсилильную группу и триизопропилсилильную группу. Данную реакцию можно проводить при таких же условиях, как таковые, обычно применяемые при введении защитной группы на гидроксильную группу (например, условия, описанные в публикации, такой как T. W. Green and P. G. M. Wuts, "Protective Groups in Organic Chemistry, Third Edition," John Wiley & Sons (1999), pp. 17-245). К тому же, как в случае примера 49, данную реакцию можно проводить путем ацетилирования с применением фермента.
[0065]
6. Основной способ получения 6:
[Формула 24]
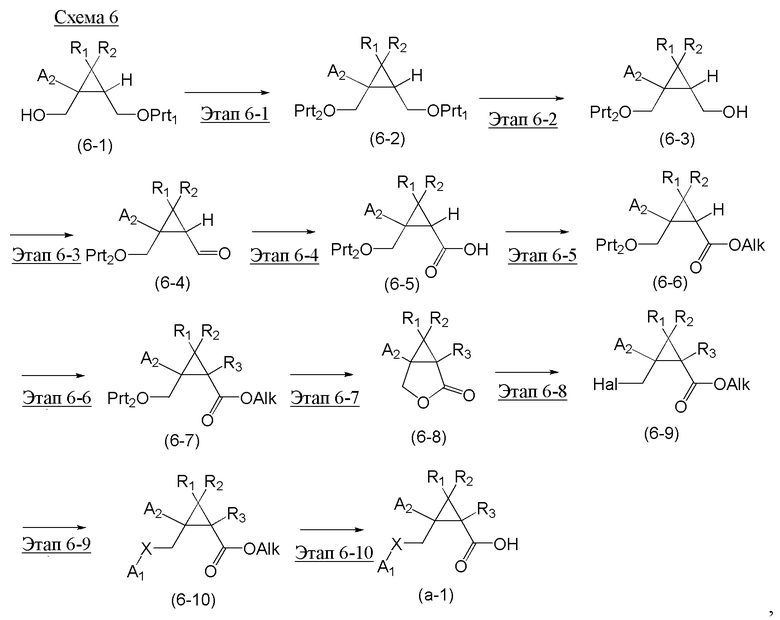
где Alk представляет C1-6 алкильную группу; Hal представляет атом галогена; Prt1 представляет силильную группу, такую как трет-бутилдиметилсилильная группа, трет-бутилдифенилсилильная группа или триизопропилсилильная группа; Prt2 представляет защитную группу для гидроксильной группы, отличную от силильной группы; и X, R1, R2, R3, A1 и A2 имеют такие же значения, как таковые, описанные выше.
Основной способ получения 6 представляет собой способ получения соединения (a-1), т.е. промежуточного соединения для синтеза соединения (I) согласно настоящему изобретению, в котором применяют соединение (6-1) в качестве исходного материала, и который включает 10 этапов с [этапа 6-1] по [этап 6-10].
[0066]
Этап 6-1
Данный этап представляет собой этап защиты гидроксильной группы соединения (6-1). Примеры защитной группы, применяемой в данном документе, включают метоксиметильную группу, тритильную группу и бензильную группу. Такую защитную группу можно вводить при обычно применяемых условиях, описанных для этапа 5-3.
[0067]
Этап 6-2
Данный этап представляет собой этап избирательного снятия защитной группы соединения (6-2). Снятие защитной группы можно проводить при обычно применяемых условиях.
[0068]
Этапы 6-3, 6-4
Данные этапы представляют собой этапы получения карбоновой кислоты (6-5) из соединения (6-3) такими же способами, как таковые для этапа 2-1 и этапе 2-2 основного способа получения 2.
[0069]
Этап 6-5
Данный этап представляет собой этап этерификации карбоновой кислоты (6-5) с получением соединения (6-6). Этерификацию можно проводить при обычно применяемых условиях.
[0070]
Этап 6-6
Данный этап представляет собой этап введения заместителя (R3) в α-углерод от карбонильной группы сложного эфира (6-6). Предпочтительным примером основания, применяемого в данном документе, является диизопропиламид лития. В качестве алкилирующего средства применяют алкилгалогенид, альдегид, кетон или подобное. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Примеры такого растворителя включают тетрагидрофуран и диэтиловый эфир. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от -78°C до температуры возврата флегмы растворителя и предпочтительно от -78°C до комнатной температуры. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов.
[0071]
Этап 6-7
Данный этап представляет собой этап избирательного снятия защитной группы соединения (6-7). Как правило, одновременно со снятием защитной группы в молекуле протекает циклизация в лактон. Снятие защитной группы можно проводить при обычно применяемых условиях.
[0072]
Этап 6-8
Данный этап представляет собой этап реакции соединения (6-8) с тионилгалогенидом в спиртовом растворителе с тем, чтобы получить галогенированный сложный эфир (6-9). Тионилгалогенид, применяемый в реакции, предпочтительно является тионилбромидом. В качестве растворителя предпочтительным является метанол или этанол. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от -78°C до температуры возврата флегмы растворителя и предпочтительно от -78°C до комнатной температуры. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 48 часов.
[0073]
Этап 6-9
Данный этап представляет собой этап получения соединения (6-10) в результате реакции нуклеофильного замещения между соединением (6-9) и соединением (3-3). Условия реакции могут быть такими же, как таковые для способа получения соединения (3-4) из соединения (3-2) в основном способе получения 3.
[0074]
Этап 6-10
Данный этап представляет собой этап получения соединения (a-1) в результате гидролиза сложного эфира соединения (6-10). В качестве условий реакции можно применять водный раствор гидроксида натрия или водный раствор гидроксида калия, например. Также, органический растворитель, такой как метанол или этанол, применяют, когда необходимо. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от -78°C до температуры возврата флегмы растворителя и предпочтительно от комнатной температуры до температуры возврата флегмы растворителя. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов.
[0075]
Основной способ получения 7:
Основной способ получения 7 представляет собой способ получения соединения (7-2), т.е. промежуточного соединения для синтеза соединения (I) согласно настоящему изобретению, в котором применяют соединение (7-1) в качестве исходного материала, и который включает [этап 7-1]. Соединение (7-1) можно также получить из коммерчески доступного продукта способом, известным специалисту в данной области техники. Кроме того, его можно получить с использованием способов, описанных в примерах получения в примерах.
[Формула 25]
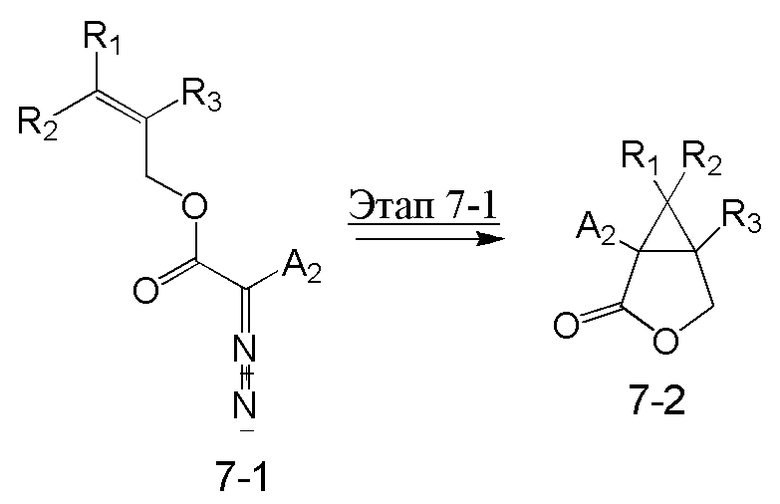
[0076]
Этап 7-1
Данный этап представляет собой этап получения соединения (7-2), который включает внутримолекулярную циклизацию диазосоединения (7-1). Реакцию можно проводить при обычно применяемых условиях для получения карбена из диазосоединения. Реакцию можно проводить, например, способами, описанными в Doyle, M. P., Organic Letters, 2008, 2(8), 1145-1147; и Chen, C., Bioorganic & Medicinal Chemistry Letters, 2008, 18, 3328-3332.
[0077]
Основной способ синтеза 8:
[Формула 26]
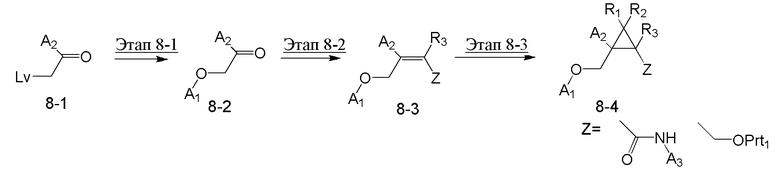
Основной способ получения 8 представляет собой способ получения соединения (8-4) из соединения (8-1) через [этап 8-1], [этап 8-2] и [этап 8-3]. Соединение (8-1) можно получить из коммерчески доступного продукта способом, известным специалисту в данной области техники.
[0078]
Этап 8-1
Данный этап представляет собой этап получения соединения (8-2) из соединения (8-1) путем применения способа получения соединения (3-4) из соединения (3-2) в основном способе получения 3.
[0079]
Этап 8-2
Данный этап представляет собой этап получения олефина (8-3) из кетона (8-2) с помощью реакции Виттига или реакции Хорнера-Вадсворта-Эммонса. Данную реакцию можно проводить при обычно применяемых условиях.
[0080]
Этап 8-3
Данный этап представляет собой этап получения соединения (8-4) путем циклопропанирования олефина (8-3). Такое циклопропанирование можно проводить, например, с помощью реакции Симмонса-Смита, или при условиях, при которых диазосоединение объединяют с металлическим катализатором, таким как ацетат родия.
[0081]
Основной способ получения 9:
[Формула 27]
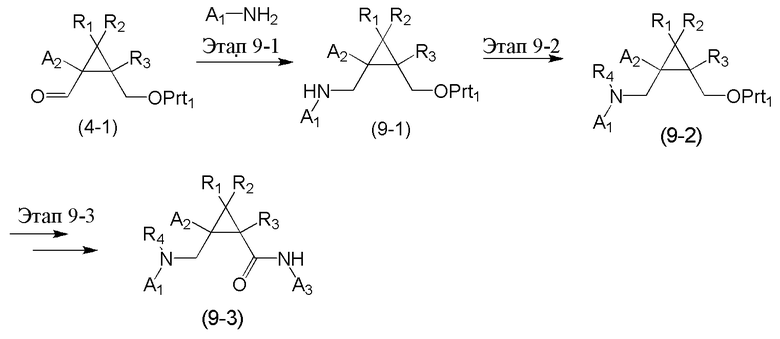
[0082]
Этап 9-1
Данный этап представляет собой этап получения соединения (9-1) путем восстановительного аминирования соединения (4-1). В качестве условий реакции можно использовать обычные условия для восстановительного аминирования. Примеры восстанавливающего средства включают боргидрид натрия и триацетоксиборгидрид натрия.
Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Примеры такого растворителя включают тетрагидрофуран и DMF. В некоторых случаях кислоту, такую как уксусная кислота, можно смешать с таким растворителем. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от -78°C до температуры возврата флегмы растворителя и предпочтительно от 0°C до комнатной температуры. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов.
[0083]
Этап 9-2
Данный этап представляет собой этап получения соединения (9-2) путем восстановительного аминирования соединения (9-1). Условия реакции являются такими же, как таковые, используемые для этапа 9-1.
[0084]
Этап 9-3
Данный этап представляет собой этап получения соединения (9-3) из соединения (9-2) в соответствии со способами, описанными для этапа 3-2, этапа 2-1, этапа 2-2, и основным способом получения 1.
[0085]
Основной способ получения 10:
[Формула 28]
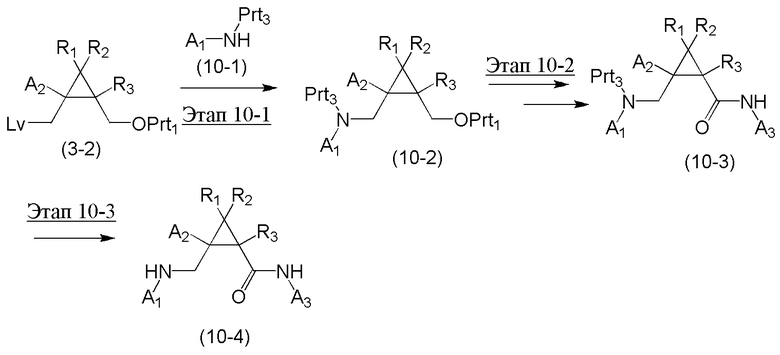
[0086]
Этап 10-1
Данный этап представляет собой этап реакции соединения (3-2) с амином (10-1), защищенным амидом или карбаматом, в присутствии основания с тем, чтобы получить соединение (10-2). Предпочтительные примеры основания, применяемого в данном документе, включают гидрид натрия, карбонат цезия и гидроксид натрия. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Примеры такого растворителя включают тетрагидрофуран, ацетонитрил и DMF. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от 0°C до температуры возврата флегмы растворителя. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов. К тому же предпочтительные примеры защитной группы Prt3 включают: защитные группы для амида, такие как трифторацетильная группа; и защитные группы для карбамата, такие как трет-бутилкарбамат.
[0087]
Этап 10-2
Данный этап представляет собой этап получения соединения (10-3) из соединения (10-2) согласно способу, описанному для этапа 9-3.
[0088]
Этап 10-3
Данный этап представляет собой этап получения соединения (10-4) путем снятия защиты соединения (10-3). Снятие защиты можно проводить при обычно применяемых условиях.
[0089]
Основной способ получения 11
[Формула 29]
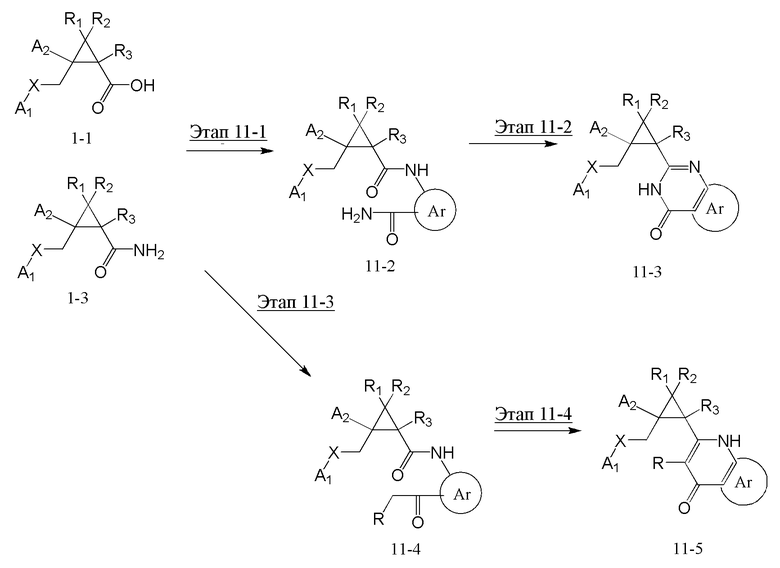
[0090]
Этап 11-1
Данный этап представляет собой этап синтеза ариламида (11-2) из соединения (1-1) или соединения (1-3) при условиях, описанных в основном способе получения 1.
[0091]
Этап 11-2
Данный этап представляет собой этап синтеза конденсированного производного пиримидона (11-3) из соединения (11-2) путем внутримолекулярной циклизации с применением основания. Предпочтительные примеры основания, применяемого в данном документе, включают трет-бутоксид калия, гидрид натрия, карбонат цезия, карбонат калия и этилат натрия. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Примеры такого растворителя включают тетрагидрофуран, 1,4-диоксан, DMF, MMP, ацетонитрил, этанол и 2-пропанол. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от 0°C до температуры возврата флегмы растворителя и предпочтительно от комнатной температуры до температуры возврата флегмы растворителя. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов.
[0092]
Этап 11-3
Данный этап представляет собой этап синтеза ариламида (11-4) из соединения (1-1) или соединения (1-3) при условиях, описанных в основном способе получения 1.
[0093]
Этап 11-4
Данный этап представляет собой этап синтеза конденсированного производного пиридона (11-5) из соединения (11-4) путем внутримолекулярной циклизации с применением основания. Предпочтительные примеры оснований, применяемых в данном документе, включают трет-бутоксид калия, гидрид натрия, карбонат цезия, карбонат калия и этилат натрия. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Примеры такого растворителя включают тетрагидрофуран, 1,4-диоксан, DMF, NMP, ацетонитрил, этанол и 2-пропанол. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от 0°C до температуры возврата флегмы растворителя и предпочтительно от комнатной температуры до температуры возврата флегмы растворителя. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов.
[0094]
Основной способ получения 12:
[Формула 30]
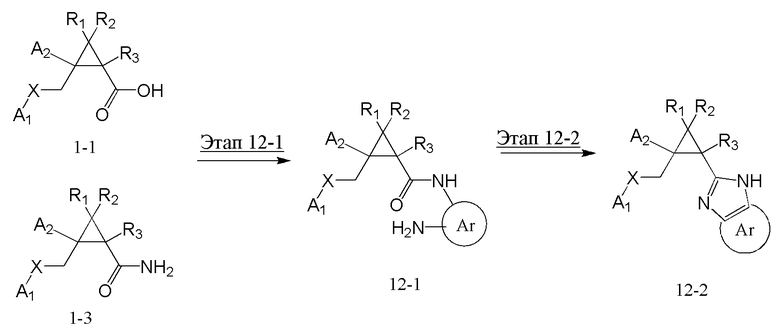
[0095]
Этап 12-1
Данный этап представляет собой этап синтеза ариламида (12-1) из соединения (1-1) или соединения (1-3) при условиях, описанных в основном способе получения 1.
[0096]
Этап 12-2
Данный этап представляет собой этап синтеза конденсированного производного имидазола (12-2) из соединения (12-1) путем внутримолекулярной циклизации с применением кислоты. Предпочтительные примеры кислоты, применяемой в данном документе, включают уксусную кислоту, трифторуксусную кислоту, соляную кислоту и пара-толуолсульфоновую кислоту. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Например, уксусную кислоту применяют в качестве растворителя. Другие примеры растворителя включают тетрагидрофуран, 1,4-диоксан, DMF, NMP, ацетонитрил, этанол и 2-пропанол. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от 0°C до температуры возврата флегмы растворителя и предпочтительно от комнатной температуры до температуры возврата флегмы растворителя. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов.
[0097]
Основной способ получения 13:
[Формула 31]
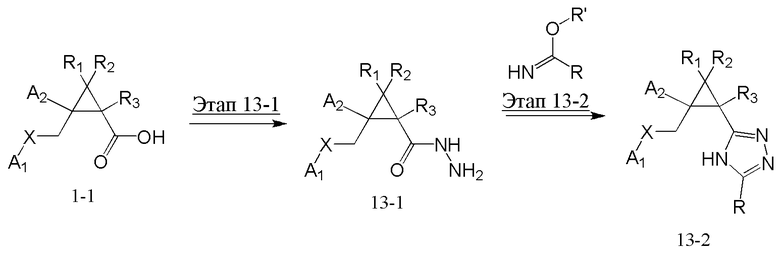
[0098]
Этап 13-1
Данный этап представляет собой этап синтеза гидразида (13-1) из соединения (1-1). В качестве условий синтеза, применяемых в данном документе, можно использовать общеизвестный способ. Например, монозащищенный гидразин и соединение (1-1) подвергают амидной конденсации, и затем проводят снятие защитной группы с тем, чтобы синтезировать вышеупомянутое соединение. Амидирование можно проводить способом, описанным для этапа (1-1). Защитная группа гидразина особым образом не ограничена. Примеры такой защитной группы включают трет-бутоксикарбонил, бензилоксикарбонил и трифторацетил.
[0099]
Этап 13-2
Данный этап представляет собой этап реакции соединения (13-1) с производным имидата для синтеза производного триазола (13-2). Реакцию можно проводить при нейтральных условиях или при добавлении кислоты или основания. В качестве кислоты, применяемой в данном документе, подходит уксусная кислота, соляная кислота или подобное. В качестве основания, применяемого в данном документе, подходит имидазол, триэтиламин, карбонат калия или подобное. Растворитель, применяемый в реакции, особым образом не ограничен при условии, что он не ингибирует реакцию и растворяет исходное вещество до определенной степени. Например, уксусную кислоту применяют в качестве растворителя. Другие примеры растворителя включают тетрагидрофуран, 1,4-диоксан, DMF, NMP, ацетонитрил, этанол и 2-пропанол. Температура реакционной смеси особым образом не ограничена. Как правило, она составляет от 0°C до температуры возврата флегмы растворителя и предпочтительно от комнатной температуры до температуры возврата флегмы растворителя. Время реакции особым образом не ограничено. Как правило, оно составляет от 5 минут до 48 часов и предпочтительно от 5 минут до 24 часов.
[00100]
Полученное таким образом соединение формулы (I) согласно настоящему изобретению можно переработать в фармацевтически приемлемую соль в соответствии с обычным способом, когда необходимо. Такую фармацевтически приемлемую соль можно получить путем комбинирования соответствующим образом способов, которые обычно применяют в области органической синтетической химии. В частности, раствор соединения свободного типа согласно настоящему изобретению подвергают титрованию для нейтрализации раствором кислоты, например. К тому же соединение формулы (I) согласно настоящему изобретению подвергают хорошо известной реакции образования сольвата, когда необходимо, с тем, чтобы его можно было превратить в сольват.
[0101]
Эти способы являются типичными примерами способа получения соединения (I). Соединения исходного материала или различные реактивы в способе получения соединения (I) могут образовывать соль или гидрат, и все они отличаются в зависимости от исходного материала, применяемого растворителя и т.п. и особым образом не ограничены при условии, что они не ингибируют реакцию. Применяемый растворитель также отличается в зависимости от исходного материала, реактива и т.п., и, разумеется, особым образом не ограничен при условии, что он не ингибирует реакцию и способен растворять исходное вещество до определенной степени. Если соединение (I) получают в свободной форме, его можно превратить согласно общепринятому способу в состояние вышеупомянутой соли, которую может образовать соединение (I). Подобным образом, если соединение (I) получают в виде соли соединения (I), его можно превратить в свободную форму соединения (I) согласно общепринятому способу. Также различные изомеры (например, геометрические изомеры, оптические изомеры на основе асимметричных атомов углерода, поворотные изомеры и стерические изомеры), полученные для соединения (I), можно очистить и выделить с помощью применения обычных средств разделения, например, перекристаллизации, способа с диастереоизомерной солью, способа ферментативного разделения и различных хроматографических методик (например, тонкослойной хроматографии, колоночной хроматографии и газовой хроматографии).
[0102]
Выражение "композиция", применяемое в данном документе, включает продукт, содержащий конкретный ингредиент в конкретном количестве, и любой продукт, к которому прямо или косвенно приводит комбинация конкретных ингредиентов в конкретных количествах. Такое выражение относится к фармацевтической композиции, как предполагается, включающей продукт, содержащий действующий ингредиент и инертный ингредиент, составляющий носитель, и включающей любой продукт, к которому прямо или косвенно приводит комбинация, комплексообразование или агрегация любых двух или более ингредиентов или диссоциация, другие типы реакций или взаимодействия одного или нескольких ингредиентов. Таким образом, фармацевтическая композиция согласно настоящему изобретению включает любую композицию, полученную путем смешивания соединения согласно настоящему изобретению с фармацевтически приемлемым носителем. Выражение "фармацевтически приемлемый" применяют для обозначения того, что носитель, разбавитель или среда должны быть совместимы с другими ингредиентами препарата, и должны быть нетоксичны для потребителя.
[0103]
Что касается способности соединения согласно настоящему изобретению связываться с орексиновым рецептором OX1R и/или OX2R, антагонизм по отношению к орексиновому рецептору 1 и/или орексиновому рецептору 2 по большей части проявляет величину IC50 200 нМ или менее, и соединение, которое проявляет величину IC50 100 нМ или менее, является предпочтительным. Считается более предпочтительным циклопропановое соединение, у которого способность связываться с орексиновым рецептором 2 (величина IC50) составляет 10 нМ или менее.
[0104]
Циклопропановое соединение согласно настоящему изобретению, или его фармацевтически приемлемая соль, или его сольват обладает антагонизмом к орексиновому рецептору. Таким образом, циклопропановое соединение согласно настоящему изобретению или его фармацевтически приемлемая соль, или его сольват обладает применимостью в качестве терапевтического средства при нарушении сна, в отношении которого эффективен антагонизм к орексиновому рецептору. Примеры нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору, включают бессонницу.
[0105]
Циклопропановое соединение согласно настоящему изобретению, его фармацевтически приемлемая соль или его сольват можно применять для составления препарата согласно обычному способу. Примеры предпочтительной лекарственной формы включают пероральные препараты (таблетки, гранулы, порошки, капсулы, сиропы и т.д.), инъекционные растворы (для внутривенного введения, для внутримышечного введения, для подкожного введения, для внутрибрюшинного введения и т.д.) или продукт для местного применения [всасываемые через кожу средства (мази, клейкий накожный пластырь и т.д.), глазные растворы, назальные препараты, суппозитории и т.д.].
[0106]
В случае производства пероральных твердых препаратов, например, циклопропановое соединение согласно настоящему изобретению, его фармацевтически приемлемую соль или его сольват смешивают с наполнителями, связующими, средствами, улучшающими распадаемость, смазывающими средствами, красителями и т.д., если необходимо, и полученную смесь подвергают обработке в порошки, мелкие гранулы, гранулы, таблетки, таблетки, покрытые оболочкой, капсулы и т.д. в соответствии с общепринятым способом. В случае получения таблеток или гранул, их можно покрывать пленкой, если необходимо.
Примеры наполнителей, применяемых в данном документе, включают лактозу, кукурузный крахмал и кристаллическую целлюлозу и т.д. Примеры связующих, применяемых в данном документе, включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и т.д. Примеры средств, улучшающих распадаемость, применяемых в данном документе, включают карбоксиметилцеллюлозу кальция, кроскармелозу натрия и т.д. Примеры смазывающих средств, применяемых в данном документе, включают стеарат магния, стеарат кальция и т.д. Примеры красителей, применяемых в данном документе, включают оксид титана и т.д. Примеры покровных средств, применяемых в данном документе, включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу и т.д. Однако, разумеется, примеры вышеупомянутых средств не ограничиваются этим.
Вышеупомянутые твердые препараты, такие как таблетки, капсулы, гранулы или порошки могут содержать в качестве действующего ингредиента циклопропановое соединение согласно настоящему изобретению, его фармацевтически приемлемую соль или его сольват, как правило, в количестве от 0,001% до 99,5% по весу и предпочтительно от 0,001% до 90% по весу.
[0107]
В случае производства инъекционных растворов (для внутривенного введения, для внутримышечного введения, для подкожного введения, для внутрибрюшинного введения и т.д.) к циклопропановому соединению согласно настоящему изобретению, его фармацевтически приемлемой соли и или его сольвату добавляют, например, регуляторы pH, буферные средства, суспендирующие средства, солюбилизаторы, антиоксиданты, предохраняющие средства (консерванты), вещества, регулирующие тоничность и т.д., если необходимо, и полученную смесь затем подвергают обработке с получением такого инъекционного раствора в соответствии с общепринятым способом. К тому же такой инъекционный раствор можно получить в виде лиофилизированного препарата для растворения при применении.
Примеры регуляторов pH и буферных средств, применяемых в данном документе, включают органическую кислоту или неорганическую кислоту и/или их соль. Примеры суспендирующих средств, применяемых в данном документе, включают метилцеллюлозу, полисорбат 80, карбоксиметилцеллюлозу натрия и т.д. Примеры солюбилизаторов, применяемых в данном документе, включают полисорбат 80, полиэтиленсорбитан-монолаурат и т.д. Примеры антиоксидантов, применяемых в данном документе, включают α-токоферол и т.д. Примеры предохраняющих средств, применяемых в данном документе, включают метил пара-оксибензоат, этил-пара-оксибензоат и т.д. Примеры веществ, регулирующих тоничность, применяемых в данном документе, включают глюкозу, хлорид натрия, маннит и т.д. Однако, разумеется, примеры вышеуказанных средств не ограничиваются этим.
Такие инъекционные растворы могут содержать действующий ингредиент, как правило, в количестве от 0,000001% до 99,5% по весу и предпочтительно от 0,000001% до 90% по весу.
[0108]
В случае производства продуктов для местного применения, например, циклопропановое соединение согласно настоящему изобретению, его фармацевтически приемлемую соль или его сольват смешивают с материалами основы и вышеупомянутые вспомогательные средства, такие как предохраняющие средства, стабилизаторы, регуляторы pH, антиоксиданты, красители и т.д. добавляют к ним, если необходимо, и полученную смесь затем подвергают обработке с получением всасываемых через кожу средств (мази, клейкие накожные пластыри и т.д.), глазные растворы, назальные препараты, суппозитории и т.д. в соответствии с общепринятым способом.
В качестве материалов основы, применяемых в данном документе, можно применять разнообразные типы исходных материалов, которые, как правило, применяют в фармацевтических продуктах, лечебно-профилактической косметике, косметических продуктах и других продуктах. Примеры таких исходных материалов включают животные или растительные масла, минеральные масла, масла на основе сложных эфиров, воски, эмульгаторы, высшие спирты, жирные кислоты, силиконовые масла, поверхностно-активные вещества, фосфолипиды, спирты, многоатомные спирты, водорастворимые полимеры, глинистые минералы, очищенную воду и т.д.
Такие препараты для наружного применения могут содержать действующий ингредиент, как правило, в количестве от 0,000001% до 99,5% по весу и предпочтительно от 0,000001% до 90% по весу.
[0109]
Доза циклопропанового соединения согласно настоящему изобретению, его фармацевтически приемлемой соли или его сольвата различается в зависимости от степени выраженности симптомов, возраста, пола, массы тела, пути введения/типа соли, конкретного типа заболевания и т.п. Как правило, в случае перорального введения циклопропановое соединение согласно настоящему изобретению, его фармацевтически приемлемую соль или его сольват вводят в дозе примерно от 30 мкг до 10 г, предпочтительно от 100 мкг до 5 г и более предпочтительно от 100 мкг до 1 г взрослому в сутки. В случае введения посредством инъекции вводится доза от приблизительно 30 мкг до 1 г, предпочтительно от 100 мкг до 500 мг и более предпочтительно от 100 мкг до 300 мг взрослому в сутки. В обоих случаях ее вводят однократно или разделяют на несколько введений.
[0110]
Соединение согласно настоящему изобретению можно применять в качестве химического зонда для связывания целевого белка физиологически активного низкомолекулярного соединения. Другими словами, соединение согласно настоящему изобретению можно превратить в зонд для аффинной хроматографии, фотоаффинный зонд или подобное путем введения группы для мечения, линкера или подобного в часть, отличную от структурной части, необходимой для проявления активности соединения, в соответствии со способами, описанными в J. Mass Spectrum. Soc. Jpn. Vol. 51, №5, 2003, pp. 492-498; WO 2007/139149; и т.д.
Примеры такой группы для мечения, линкера или подобного, применяемые для такого химического зонда, включают группы, описанные в следующих группах с (1) по (5).
(1) Группы для мечения белка, такие как фотоаффинные группы для мечения (например, бензоильная группа, бензофеноновая группа, азидная группа, карбонилазидная группа, диазиридиновая группа, еноновая группа, диазогруппа и нитрогруппа), и группы с химическим сродством (например, кетонная группа, в которой альфа атом углерода является замещенным атомом галогена, карбамоильная группа, сложноэфирная группа, алкилтио-группа, акцептор Михаэля, такой как α,β-ненасыщенный кетон или сложный эфир, и оксирановая группа),
(2) расщепляемые линкеры, такие как -S-S-, -O-Si-O-, моносахарид (глюкозная группа, галактозная группа и т.д.) или дисахарид (лактоза и т.д.), и олигопептидные линкеры, которые могут быть расщеплены с помощью ферментативной реакции,
(3) группы для FISH-мечения, такие как биотин и 3-(4,4-дифтор-5,7-диметил-4H-3a,4a-диаза-4-бора-s-индацен-3-ил)пропионильная группа,
(4) группы для радиоактивного мечения, такие как 125I, 32P, 3H и 14C; группы для флуоресцентного мечения, такие как флуоресцеин, родамин, дансил, умбеллиферон, 7-нитрофуразанил и 3-(4,4-дифтор-5,7-диметил-4H-3a,4a-диаза-4-бора-s-индацен-3-ил)пропионильная группа; хемилюминесцентные группы, такие как люмиферин и люминол; и обнаруживаемые маркеры, включающие ионы тяжелых металлов, такие как ион металла-лантаноида и ион радия, или
(5) группы, которые позволяют связываться с твердофазными носителями, такими как стеклянные шарики, стеклянная пластина, микротитровальный планшет, агарозные шарики, агарозная пластина, полистироловые шарики, полистироловая пластина, нейлоновые шарики и нейлоновая пластина.
Зонд, который приготовлен путем введения группы для мечения или подобной, выбранной из вышеописанных групп с (1) по (5), в соединение согласно настоящему изобретению в соответствии со способами, описанными в вышеупомянутой публикации и т.п., может применяться в качестве химического зонда для идентификации меченого белка, применяемого для поиска новых мишеней при разработке новых лекарств.
[0111]
В дальнейшем настоящее изобретение будет описано более подробно в следующих примерах, примерах получения и тестовых примерах. Однако данные примеры не предназначены для ограничения объема настоящего изобретения. Более того, сокращения, применяемые в примерах, являются общеупотребительными сокращениями, которые хорошо известны специалисту в данной области техники. Несколько сокращений представляют собой следующие.
THF: тетрагидрофуран
DMF: N,N-диметилформамид
TFA: трифторуксусная кислота
HATU: гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония
LC-MS: жидкостная хроматография-масс-спектрометрия
Pd2DBA3: трис(дибензилиденацетон)дипалладий
LDA: диизопропиламид лития
NaHMDS: гексаметилдисилазид натрия
TEMPO: (2,2,6,6-тетраметилпиперидин-1-ил)оксил
DBU: 1,8-диазабицикло[5.4.0]ундец-7-ен
HOBt: 1-гидроксибензтриазол
WSC: гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида
Xantphos: 4,5-бис(дифенилфосфино)-9,9-диметилксантен
NMP: 1-метил-2-пирролидинон
Химические сдвиги в спектре протонного ядерного магнитного резонанса записывают в единицах δ (частей на миллион) по отношению к тетраметилсилану. Коэффициенты взаимодействия записывают в герцах (Гц). В отношении структуры, с: синглет, д: дублет, т: триплет, кв.: квартет, и шир.: широкий.
[0112]
Выражение "комнатная температура", как правило, означает примерно от 10°C до приблизительно 35°C в следующих примерах и примерах получения. Символ "%" означает процент по весу, если не указано иное.
[0113]
Пример получения 1
Синтез 2-метокси-4-метилпиримидин-5-ола (Продукт 1-5)
[Формула 32]
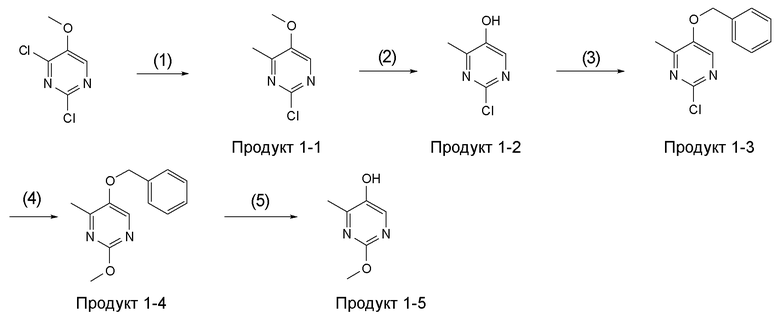
[0114]
(1) 2-Хлор-5-метокси-4-метилпиримидин (Продукт 1-1)
2,4-Дихлор-5-метоксипиримидин (10 г) растворяли в THF (100 мл) и затем добавляли ацетилацетон железа(III) (1,97 г), метилхлорид магния (3,0M: 22,4 мл) в раствор при охлаждении. Полученную смесь перемешивали при комнатной температуре в течение ночи. После этого ацетилацетон железа(III) (1,97 г) и метилхлорид магния (3,0 M: 22,4 мл) дополнительно дважды добавляли в реакционный раствор. После этого добавляли 1N водный раствор соляной кислоты в реакционную смесь и затем добавляли диэтиловый эфир в реакционный раствор для осуществления разделения жидкости и экстракции. Органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (6,6 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,46 (с, 3H), 3,92 (с, 3H), 8,06 (с, 1H).
[0115]
(2) 2-Хлор-4-метилпиримидин-5-ол (Продукт 1-2)
Дихлорметановый раствор (50 мл) соединения Продукта 1-1 (6,6 г) добавляли по каплям в дихлорметановый раствор (1,0 М: 100 мл) трибромида бора и полученную смесь затем перемешивали при комнатной температуре в течение 4 суток. После этого добавляли метанол в реакционную смесь и затем добавляли 5N водный раствор гидроксида натрия в реакционный раствор для нейтрализации. Разделение жидкости и экстракцию проводили последовательно с применением хлороформа и этилацетата при значении pH примерно pH 2-3. Органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Диэтиловый эфир добавляли к полученному остатку для его затвердевания, и затвердевший продукт собирали с помощью фильтрации, и затем сушили с тем, чтобы получить титульное соединение.
1H-ЯМР (400 МГц, DMSO-d6) δ (частей на миллион): 2,32 (с, 3H), 8,09 (с, 1H), 10,61 (с, 1H).
[0116]
(3) 5-Бензилокси-2-хлор-4-метилпиримидин (Продукт 1-3)
Гидрид натрия (60% масляная дисперсия; 66,2 мг) добавляли в THF-раствор (4,0 мл) соединения Продукта 1-2 (200 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 10 минут. После этого бензилбромид (197 мкл) добавляли в реакционный раствор. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После этого DMF (2,0 мл) добавляли в реакционный раствор и полученную смесь затем перемешивали в течение 4 часов. После этого насыщенный водный раствор хлорида аммония добавляли в реакционную смесь и осуществляли разделение жидкости и экстракцию диэтиловым эфиром. Полученный органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (317 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,51 (с, 3H), 5,15 (с, 2H), 7,37-7,40 (м, 5H), 8,10 (с, 1H).
[0117]
(4) 5-Бензилокси-2-метокси-4-метилпиримидин (Продукт 1-4)
Метоксид натрия (143 мг) добавляли в DMF-раствор (4,0 мл) Продукта 1-3 (310 мг) и полученную смесь затем перемешивали при 70°C в течение 2 часов. После этого реакционную смесь охлаждали, затем к ней добавляли 1N водный раствор соляной кислоты и осуществляли разделение жидкости и экстракцию диэтиловым эфиром. Полученный органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (220 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,44 (с, 3H), 3,93 (с, 1H), 5,07 (с, 2H), 7,35-7,41 (м, 5H), 7,99 (с, 1H).
[0118]
(5) 2-Метокси-4-метилпиримидин-5-ол (Продукт 1-5)
Гидроксид палладия добавляли в метанольный раствор (8,0 мл) соединения Продукта 1-4 (220 мг) и полученную смесь затем перемешивали в атмосфере водорода в течение 2,5 часов. После этого реакционную смесь фильтровали через целит и затем полученный фильтрат концентрировали при пониженном давлении с тем, чтобы получить неочищенное титульное соединение (130 мг).
1H-ЯМР (400 МГц, DMSO-d6) δ (частей на миллион): 2,26 (с, 3H), 3,77 (с, 1H), 7,95 (с, 1H).
[0119]
Пример получения 2
Синтез 2-этил-4-метилпиримидин-5-ола (Продукт 2-2)
[Формула 33]
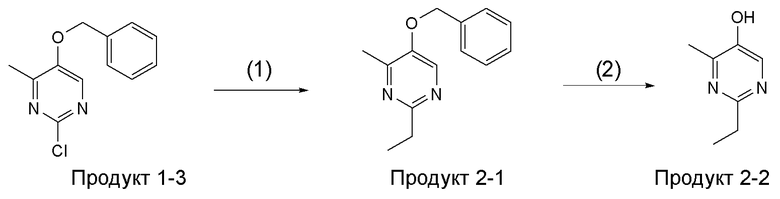
[0120]
(1) 5-Бензилокси-2-этил-4-метилпиримидин (Продукт 2-1)
Карбонат калия (1,4 г), 1,1-бис(дифенилфосфино)ферроцендихлорпалладий(II) (дихлорметановый комплекс) (276 мг) добавляли в THF-раствор (10 мл) соединения Продукта 1-3 (793 мг) и затем добавляли к нему диэтилцинк (1 М: 3,72 мл). Полученную смесь перемешивали при 65°C в течение ночи. После этого добавляли в реакционную смесь воду и осуществляли разделение жидкости и экстракцию этилацетатом. Полученный органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (400 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,32 (т, J=8,0 Гц, 1H), 2,49 (с, 3H), 2,86 (д, J=8,0 Гц, 1H), 2,90 (д, J=7,6 Гц, 1H), 5,13 (с, 2H), 7,33-7,43 (м, 5H), 8,16 (с, 1H).
[0121]
(2) 2-Этил-4-метилпиримидин-5-ол (Продукт 2-2)
Гидроксид палладия добавляли в метанольный раствор (8,0 мл) соединения Продукта 2-1 (220 мг) и полученную смесь затем перемешивали в атмосфере водорода в течение 2,5 часов. После этого реакционную смесь фильтровали через целит и полученный фильтрат затем концентрировали при пониженном давлении с тем, чтобы получить неочищенное титульное соединение (130 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,30 (т, J=8,0 Гц, 1H), 2,48 (с, 3H), 2,83 (д, J=8,0 Гц, 1H), 2,88 (д, J=8,0 Гц, 1H), 8,04 (с, 1H).
[0122]
Пример получения 3
Синтез 4-этил-2-метилпиримидин-5-ола (Продукт 3-3)
[Формула 34]
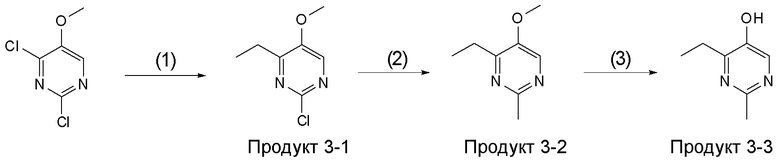
[0123]
(1) 2-Хлор-4-этил-5-метоксипиримидин (Продукт 3-1)
2,4-Дихлор-5-метоксипиримидин (5 г) растворяли в THF (50 мл) и затем ацетилацетон железа(III) (985 мг) и этилхлорид магния (0,91 М: 36,9 мл) добавляли в раствор при охлаждении. Полученную смесь перемешивали при комнатной температуре в течение ночи. После этого ацетилацетон железа(III) (985 мг) и метилхлорид магния (0,91 М: 36,9 мл) дополнительно дважды добавляли в реакционный раствор. 1N водный раствор соляной кислоты добавляли в реакционную смесь и осуществляли разделение жидкости и экстракцию диэтиловым эфиром. Органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (1 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,25 (т, J=8,0 Гц, 1H), 2,78 (д, J=7,6 Гц, 1H), 2,82 (д, J=8,0 Гц, 1H), 3,92 (с, 3H), 8,06 (с, 1H).
[0124]
(2) 4-Этил-5-метокси-2-метилпиримидин (Продукт 3-2)
Триметилалюминий (2,0 М: 6,95 мл) и тетракистрифенилфосфинпалладий(0) (335 мг) добавляли в THF-раствор (15, мл) соединения Продукта 3-1 (1,0 г) и затем перемешивали полученную смесь при 70°C в течение 2 суток. После этого реакционный раствор добавляли по каплям к ледяной воде и затем превращали путем добавления 1N соляной кислоты из нейтрального в слабокислый. Затем осуществляли разделение жидкости и экстракцию этилацетатом. Органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (736 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,24 (т, J=7,6 Гц, 1H), 2,64 (с, 3H), 2,76 (д, J=7,6 Гц, 1H), 2,80 (д, J=7,6 Гц, 1H), 3,89 (с, 1H), 8,10 (с, 1H).
[0125]
(3) 4-Этил-2-метилпиримидин-5-ол (Продукт 3-3)
Трибромид бора (1,0 М, 118 мл) добавляли по каплям в дихлорметановый раствор (69,6 мл) соединения Продукта 3-2 (5,12 г). Полученную смесь перемешивали при комнатной температуре в течение 4 суток. После этого аммиак/метанол добавляли в реакционный раствор с последующим быстрым охлаждением. Реакционный раствор, который превратили из нейтрального в слабокислый, фильтровали и затем концентрировали фильтрат при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (от этилацетата к смеси этилацетат:метанол) с тем, чтобы получить титульное соединение (4,0 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,13 (т, J=8,0 Гц, 1H), 2,43 (с, 3H), 2,61 (д, J=8,0 Гц, 1H), 2,65 (д, J=7,6 Гц, 1H), 8,04 (с, 1H), 9,85 (с, 1H).
[0126]
Пример получения 4
Синтез 2,4-диметилпиримидин-5-ола (Продукт 4-2)
[Формула 35]
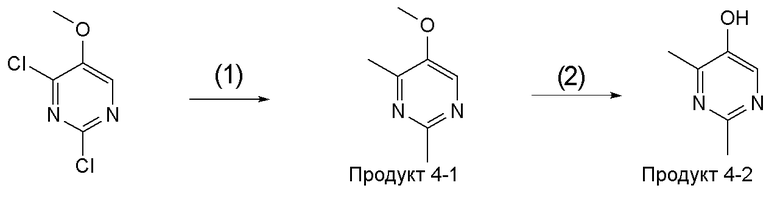
[0127]
(1) 5-Метокси-2,4-диметилпиримидин (Продукт 4-1)
2,4-Дихлор-5-метоксипиримидин (5,3 г) растворяли в THF (51,3 мл) и затем добавляли в раствор тетракис(трифенилфосфин)палладий (1,71 г) и триметилалюминий (2,0М: 51,8 мл). Температуру полученной смеси повышали до 75°C и полученную смесь затем перемешивали в течение ночи. После этого 1 эквивалент триметилалюминия добавляли в реакционный раствор и затем полученную смесь перемешивали в течение 6 часов. После этого насыщенный водный раствор хлорида аммония добавляли по каплям в реакционный раствор при охлаждении на льду и осуществляли разделение жидкости и экстракцию хлороформом. Органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат к этилацетату) с тем, чтобы получить титульное соединение (4,2 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,42 (с, 3H), 2,63 (с, 3H), 3,88 (с, 3H), 8,08 (с, 1H).
[0128]
(2) 2,4-Диметилпиримидин-5-ол (Продукт 4-2)
Дихлорметановый раствор (100,0 мл) соединения Продукта 4-1 (15,5 г) добавляли по каплям в трибромид бора (1,0 М в дихлорметане, 400,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 суток и реакционный раствор резко охлаждали метанолом. Реакционный раствор, который превратили из нейтрального в слабокислый, фильтровали, и фильтрат затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (от этилацетата к этанолу) с тем, чтобы получить титульное соединение (10,1 г).
1H-ЯМР (400 МГц, DMSO-d6) δ (частей на миллион): 2,26 (с, 3H), 2,41 (с, 3H), 8,02 (с, 1H).
[0129]
Пример получения 5
Синтез 6-фтор-5-метоксиметилпиридин-3-амина (Продукт 5-3)
[Формула 36]
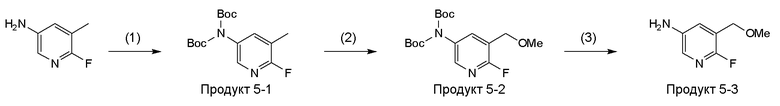
[0130]
(1) Ди-трет-бутил(6-фтор-5-метилпиридин-3-ил)-имиддикарбонат (Продукт 5-1)
Ди-трет-бутилкарбонат (2,59 г) и каталитическое количество 4-диметиламинопиридина (0,01 г) добавляли в THF-раствор (10 мл) 5-амино-2-фтор-3-пиколина (0,5 г), и полученную смесь затем перемешивали при комнатной температуре в течение 67 часов. После этого добавляли воду в реакционный раствор и смесь экстрагировали этилацетатом. Полученный в результате экстракт промывали водой и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (хлороформ) с тем, чтобы получить титульное соединение (1,14 г).
[0131]
(2) Ди-трет-бутил[6-фтор-5-метоксиметилпиридин-3-ил]-имиддикарбонат (Продукт 5-2)
Соединение Продукта 5-1 (500 мг) и N-бромсукцинимид (272 мг) растворяли в тетрахлорметане (5 мл) и затем добавляли 2,2'-азобис(изобутилнитрат) (25,1 мг) в раствор. Полученную смесь перемешивали при 80°C в течение 5 часов. После этого добавляли воду в реакционный раствор и смесь экстрагировали этилацетатом. Полученный в результате экстракт промывали водой и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и затем остаток растворяли в метаноле (5 мл). Затем метоксид натрия (413 мг) добавляли в раствор и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. После этого добавляли воду в реакционный раствор и смесь экстрагировали этилацетатом. После этого полученный в результате экстракт промывали водой и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=20:1-2:1) с тем, чтобы получить титульное соединение.
[0132]
(3) 6-Фтор-5-метоксиметилпиридин-3-амин (Продукт 5-3)
Трифторуксусную кислоту (1 мл) добавляли в дихлорметановый раствор (5 мл) соединения Продукта 5-2 и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. После этого насыщенный водный раствор бикарбоната натрия добавляли в реакционный раствор и смесь экстрагировали дихлорметаном. Полученный в результате экстракт промывали водой и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с тем, чтобы получить целевое соединение (60 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,43 (с, 3H), 4,43 (с, 3H), 7,20 (ддт, J=8,0, 2,4, 0,8 Гц, 1H), 7,53 (т, J=2,4, Гц, 1H).
[0133]
Пример получения 6
Синтез 4-метоксиметилпиридин-2-амина (Продукт 6-3)
[Формула 37]
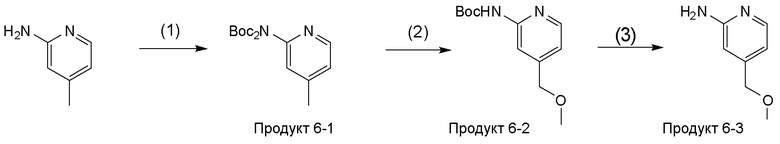
[0134]
(1) Ди-трет-бутил(4-метилпиридин-2-ил)имиддикарбонат (Продукт 6-1)
Ди-трет-бутилкарбонат (4,04 г), 4-диметиламинопиридин (226 мг) и триэтиламин (5,17 мл) добавляли в дихлорметановый раствор (50 мл) 2-амино-4-метилпиридина (1,0 г) и полученную смесь затем перемешивали при комнатной температуре в течение 72 часов. После этого добавляли воду в реакционный раствор и смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующей фильтрацией. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (1,7 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,45 (с, 18H), 2,37 (с, 3H), 7,03 (дд, J=5,2, 0,8 Гц, 1H), 7,05 (д, J=0,8 Гц, 1H), 8,34 (д, J=5,2 Гц, 1H).
MS [M+H]+=309
[0135]
(2) Трет-бутил(4-метоксиметилпиридин-2-ил)карбамат (Продукт 6-2)
Бензоилпероксид (23,6 мг) добавляли в тетрахлорметановый раствор (10 мл) соединения Продукта 6-1 (300 мг) и N-бромсукцинимида (173 мг) и полученную смесь затем нагревали с обратным холодильником в течение 1 часа. После этого 2,2'-азобис(изобутилнитрат) (16,0 мг) добавляли в реакционный раствор и полученную смесь дополнительно нагревали с обратным холодильником в течение 5 часов. После этого реакционный раствор охлаждали комнатной температуры и затем фильтровали его через целит. Фильтрат концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы с получить соответствующий бензилбромид.
Метоксид натрия (25% раствор в метаноле: 1 мл) добавляли в раствор полученного бромида в метаноле (3 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 19 часов. После этого реакционный растворитель отгоняли при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=от 4:1 к 3:2) с тем, чтобы получить титульное соединение (62 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,53 (с, 9H), 3,42 (с, 3H), 4,46 (с, 2H), 6,96-6,97 (м, 1H), 7,91 (шир.с, 1H), 8,24-8,25 (м, 1H).
MS [M+H]+=239
[0136]
(3) 4-Метоксиметилпиридин-2-амин (Продукт 6-3)
Трифторуксусную кислоту (1 мл) добавляли в дихлорметановый раствор (3 мл) соединения Продукта 6-2 (62 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 3 часов. После этого 5N водный раствор гидроксида натрия добавляли в реакционный раствор и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующей фильтрацией. Фильтрат концентрировали при пониженном давлении с тем, чтобы с получить целевое соединение (35 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,41 (с, 3H), 4,37 (с, 2H), 4,66 (шир.с, 2H), 6,51 (с, 1H), 6,59 (д, J=5,6 Гц, 1H), 7,99 (д, J=5,6 Гц, 1H).
[0137]
Пример получения 7
Синтез 4-(дифторметил)пиридин-2-амина (Продукт 7-4)
[Формула 38]
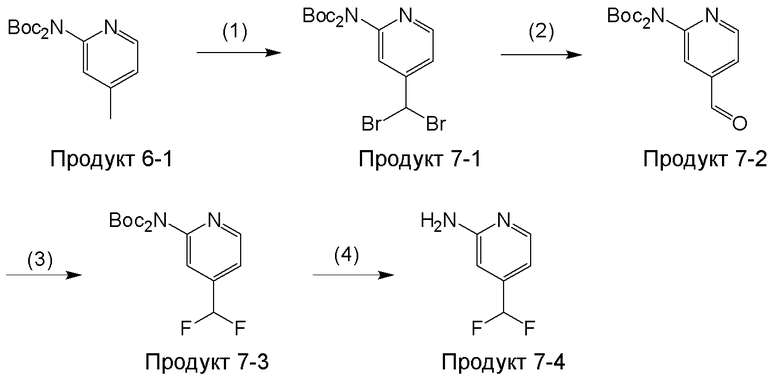
[0138]
(1) Ди-трет-бутил[4-(дибромметил)пиридин-2-ил]имиддикарбонат (Продукт 7-1)
2,2'-Азобис(изобутилнитрат) (74,7 мг) добавляли в тетрахлорметановый раствор (47 мл) соединения Продукта 6-1 (1,4 г) и N-бромсукцинимида (807 мг) и полученную смесь затем нагревали с обратным холодильником в течение 4 часов. После этого реакционный раствор охлаждали до комнатной температуры и затем его фильтровали через целит. Фильтрат концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (210 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,46 (с, 18H), 6,54 (с, 1H), 7,36 (дд, J=5,2, 1,6 Гц, 1H), 7,45 (д, J=1,6 Гц, 1H), 8,48 (д, J=5,2 Гц, 1H).
MS [M+H]+=467
[0139]
(2) Ди-трет-бутил(4-формилпиридин-2-ил)имиддикарбонат (Продукт 7-2)
Диметилсульфоксид (500 мкл) и нитрит серебра (692 мг) добавляли в толуольный раствор (5 мл) соединения Продукта 7-1 (210 мг) и полученную смесь затем перемешивали при 60°C в течение 2 часов. Температуру реакционного раствора повышали до 80°C и реакционный раствор дополнительно перемешивали в течение 19 часов. После этого реакционный раствор охлаждали до комнатной температуры и затем фильтровали через силикагель. Фильтрат концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (100 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,47 (с, 18H), 7,61 (дд, J=5,2, 1,2 Гц, 1H), 7,74 (д, J=1,2 Гц, 1H), 8,70 (д, J=5,2 Гц, 1H), 10,08 (с, 1H).
[0140]
(3) Ди-трет-бутил(4-дифторметилпиридин-2-ил)имиддикарбонат (Продукт 7-3)
Диэтиламиносульфат-трифторид (122 мкл) добавляли в дихлорметановый раствор (3 мл) соединения Продукта 7-2 (100 мг) при 0°C. Температуру реакционного раствора повышали до комнатной температуры и реакционный раствор затем перемешивали в течение 3,5 часов. После этого насыщенный водный раствор бикарбоната натрия добавляли в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующей фильтрацией. Фильтрат концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (78 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,46 (с, 18H), 6,65 (т, J=55,6 Гц, 1H), 7,32 (д, J=5,2 Гц, 1H), 7,43 (с, 1H), 8,58 (д, J=5,2 Гц, 1H).
MS [2M+Na]+=711
[0141]
(4) 4-Дифторметилпиридин-2-амин (Продукт 7-4)
Трифторуксусную кислоту (0,5 мл) добавляли в дихлорметановый раствор (2 мл) соединения Продукта 7-3 (78 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 3 часов. После этого 5N водный раствор гидроксида натрия добавляли в реакционный раствор и полученную смесь затем экстрагировали хлороформом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующей фильтрацией. Фильтрат концентрировали при пониженном давлении с тем, чтобы с получить целевое соединение (30 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 4,61 (шир.с, 2H), 6,51 (т, J=56,0 Гц, 1H), 6,60 (шир.с, 1H), 6,74-6,76 (м, 1H), 8,17 (д, J=5,2 Гц, 1H).
[0142]
Пример получения 8
Синтез 5-фтор-4-метоксиметилпиридин-2-амина (Продукт 8-3)
[Формула 39]
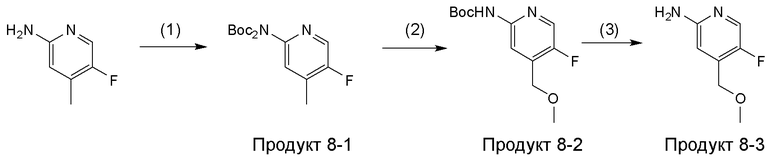
[0143]
(1) Ди-трет-бутил(5-фтор-4-метилпиридин-2-ил)имиддикарбонат (Продукт 8-1)
Ди-трет-бутилкарбонат (1,73 г), 4-диметиламинопиридин (242 мг) и триэтиламин (1,66 мл) добавляли в дихлорметановый раствор (50 мл) 2-амино-5-фтор-4-метилпиридина (500 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 6 суток. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующей фильтрацией. Фильтрат концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (737 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,45 (с, 18H), 2,32-2,33 (м, 3H), 7,08 (шир.д, J=5,6 Гц, 1H), 8,23 (д, J=1,2 Гц, 1H).
MS [2M+Na]+=675
[0144]
(2) Трет-бутил(5-фтор-4-метоксиметилпиридин-2-ил)карбамат (Продукт 8-2)
2,2'-Азобис(изобутилнитрат) (158 мг) добавляли в тетрахлорметановый раствор (20 мл) соединения Продукта 8-1 (630 мг) и N-бромсукцинимида (377 мг) и полученную смесь затем нагревали с обратным холодильником в течение 11 часов. После этого реакционный раствор охлаждали до комнатной температуры и затем его фильтровали через целит. Фильтрат концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы с получить соответствующий бромид.
Метоксид натрия (104 мг) добавляли в раствор полученного бромида в метаноле (10 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 3 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (180 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,53 (с, 9H), 3,46 (с, 3H), 4,52 (шир.с, 2H), 7,21 (шир.с, 1H), 8,02-8,03 (м, 2H).
MS [M-tBu+H]+=201
[0145]
(3) 5-Фтор-4-метоксиметилпиридин-2-амин (Продукт 8-3)
Трифторуксусную кислоту (2 мл) добавляли в дихлорметановый раствор (6 мл) соединения Продукта 8-2 (180 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 17 часов. После этого 5N водный раствор гидроксида натрия добавляли в реакционный раствор и полученную смесь затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с тем, чтобы получить целевое соединение (90 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,45 (с, 3H), 4,32 (шир.с, 2H), 4,47 (с, 2H), 6,58 (д, J=4,8 Гц, 1H), 7,86 (д, J=1,6 Гц, 1H).
MS [M+H]+=157
[0146]
Пример получения 9
Синтез 5-фтор-4-метоксипиридин-2-амина (Продукт 9-3)
[Формула 40]
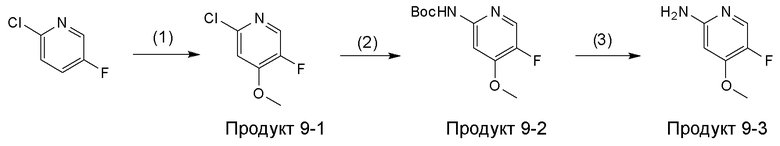
[0147]
(1) 2-Хлор-5-фтор-4-метоксипиридин (Продукт 9-1)
THF-раствор (20 мл) н-бутиллития (2,64М раствор в н-гексане: 10,4 мл) охлаждали до -78°C и THF-раствор (20 мл) 2-хлор-5-фторпиридина (3,0 г) и N,N-диизопропиламина (4,49 мл) затем добавляли по каплям в раствор. Полученную смесь перемешивали при такой же температуре, как описано выше, в течение 2 часов. После этого THF-раствор (10 мл) триметилбората (4,74 г) добавляли в реакционный раствор и затем температуру повышали до комнатной температуры с последующим перемешиванием в течение 1,5 часов. После этого реакционный раствор охлаждали до 0°C и добавляли к нему уксусную кислоту (3,92 мл) с последующим перемешиванием в течение 20 минут. После этого добавляли пероксид водорода (30% водный раствор; 7,05 мл) в реакционный раствор и температуру снова повышали до комнатной температуры с последующим перемешиванием в течение 15 часов. После этого реакционный раствор охлаждали до 0°C и затем добавляли к нему насыщенный водный раствор тиосульфата натрия с последующим перемешиванием в течение 2 часов. После этого добавляли 5N соляную кислоту в реакционный раствор и полученную смесь затем экстрагировали этилацетатом и хлороформом. Объединенный органический слой сушили над сульфатом магния и затем фильтровали. Растворитель концентрировали при пониженном давлении с тем, чтобы с получить соответствующий спирт.
Йодметан (4,18 мл) добавляли в раствор полученного спирта в хлороформе (100 мл) и карбоната серебра (16,4 г). Температуру полученной смеси повышали до 40°C и смесь затем перемешивали в течение 4 часов. После этого реакционный раствор охлаждали до комнатной температуры и затем фильтровали через целит-силикагель. Фильтрат концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (1,9 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,95 (с, 3H), 6,91 (д, J=6,0 Гц, 1H), 8,11 (д, J=2,4 Гц, 1H).
MS [M+H]+=162
[0148]
(2) Трет-бутил(5-фтор-4-метоксипиридин-2-ил) карбамат (Продукт 9-2)
Температуру раствора в 1,4-диоксане (50 мл) соединения Продукта 9-1 (1,0 г), трет-бутилкарбамата (870 мг), xantphos (1,07 г), трифосфата калия (1,97 г) и Pd2DBA3 (567 мг) повышали до 100°C. После этого раствор затем перемешивали в течение 3,5 часов. Далее реакционный раствор охлаждали до комнатной температуры и затем фильтровали через целит. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (470 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,53 (с, 9H), 3,97 (с, 3H), 7,51 (шир.с, 1H), 7,69 (д, J=6,4 Гц, 1H), 7,96 (д, J=3,2 Гц, 1H).
MS [M+H]+=243
[0149]
(3) 5-Фтор-4-метоксипиридин-2-амин (Продукт 9-3)
Трифторуксусную кислоту (1 мл) добавляли в дихлорметановый раствор (2 мл) соединения Продукта 9-2 (200 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 1,5 часов. После этого добавляли 5N водный раствор гидроксида натрия в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с тем, чтобы получить целевое соединение (110 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,87 (с, 3H), 4,27 (шир.с, 2H), 6,06 (д, J=5,6 Гц, 1H), 7,80 (д, J=3,2 Гц, 1H).
[0150]
Пример получения 10
Синтез 3-бром-5-(дифторметокси)пиридина (Продукт 10)
[Формула 41]
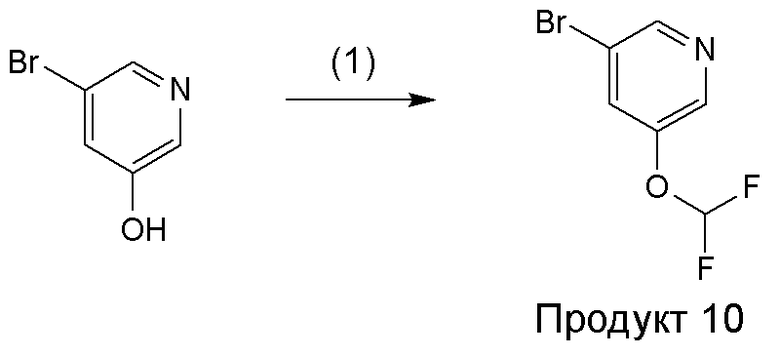
[0151]
(1) 3-Бром-5-(дифторметокси)пиридин (Продукт 10)
Карбонат калия (7,13 г) и хлордифторуксусную кислоту (1,75 мл) добавляли в DMF-раствор (40 мл) 3-бром-5-гидроксипиридина (3,0 г). Температуру полученной смеси повышали до 100°C и затем смесь перемешивали в течение 24 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали диэтиловым эфиром. Органический слой последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния с последующей фильтрацией. Растворитель концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гексан:диэтиловый эфир) с тем, чтобы получить титульное соединение (670 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 6,56 (т, J=72,0 Гц, 1H), 7,67-7,68 (м, 1H), 8,43 (д, J=2,4 Гц, 1H), 8,56 (д, J=2,0 Гц, 1H).
MS [M+H]+=224
[0152]
Пример получения 11
Синтез 4-метоксиметил-2-метилпиримидин-5-ола (Продукт 11-3)
[Формула 42]
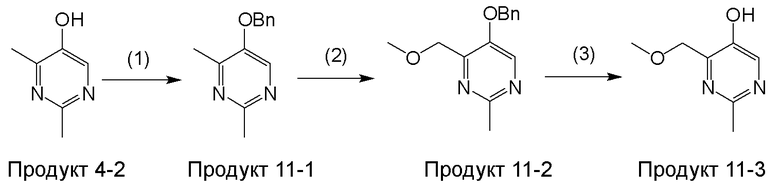
[0153]
(1) 5-Бензилокси-2,4-диметилпиримидин (Продукт 11-1)
THF-раствор (80 мл) Продукта 4-2 (5,0 г) охлаждали до 0°C и затем добавляли трет-бутоксид калия (5,43 г) в раствор. Полученную смесь перемешивали при 0°C в течение 30 минут. После этого добавляли бензилбромид (5,73 мл) в реакционный раствор при такой же температуре, как описано выше, и температуру смеси повышали до комнатной температуры с последующим перемешиванием в течение 20 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат к этилацетату) с тем, чтобы получить титульное соединение (6,0 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,48 (с, 3H), 2,62 (с, 3H), 5,13 (с, 2H), 7,33-7,42 (м, 5H), 8,13 (с, 1H).
MS [M+H]+=215
[0154]
(2) 5-Бензилокси-4-метоксиметил-2-метилпиримидин (Продукт 11-2)
Хлороформный раствор (200 мл) соединения Продукта 11-1 (13 г) охлаждали до 0°C и после этого медленно по каплям добавляли к нему бром (3,11 мл). Температуру реакционного раствора повышали до комнатной температуры и раствор затем перемешивали в течение 18 часов. После этого насыщенный водный раствор бикарбоната натрия добавляли в реакционный раствор и полученную смесь затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении, остаток затем очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат к этилацетату) с тем, чтобы с получить соответствующий бромид.
Метоксид натрия (2,56 г) добавляли в раствор полученного бромида в метаноле (180 мл) и полученную смесь затем нагревали с обратным холодильником в течение 21 часа. После этого реакционный раствор концентрировали при пониженном давлении и затем добавляли этилацетат и воду в концентрат. Полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (9,0 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,70 (с, 3H), 3,52 (с, 3H), 4,63 (с, 2H), 5,16 (с, 2H), 7,34-7,41 (м, 5H), 8,24 (с, 1H).
MS [M+H]+=245
[0155]
(3) 4-Метоксиметил-2-метилпиримидин-5-ол (Продукт 11-3)
10% палладий на углероде (900 мг) добавляли в этилацетатный раствор (300 мл) соединения Продукта 11-2 (8,8 г) и полученную смесь затем перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. После этого реакционный раствор фильтровали через целит и фильтрат затем концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (5,3 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,61 (с, 3H), 3,56 (с, 3H), 4,79 (с, 2H), 7,90 (шир.с, 1H), 8,25 (с, 1H).
[0156]
Пример получения 12
Синтез 4-(2-метоксиэтил)-2-метилпиримидин-5-ола (Продукт 12-2)
[Формула 43]
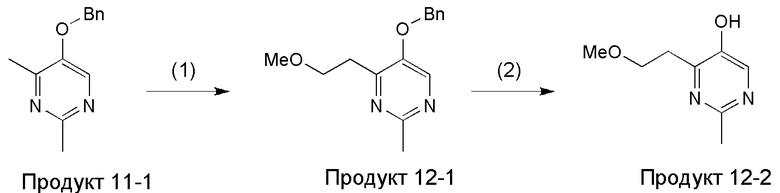
[0157]
(1) 5-Бензилокси-4-(2-метоксиэтил)-2-метилпиримидин (Продукт 12-1)
Соединение Продукта 11-1 (1,66 г) растворяли в THF (130 мл) и полученный раствор охлаждали до 0°C. THF-раствор (8,5 мл) 1N LDA добавляли по каплям в раствор и полученную смесь затем перемешивали в течение 30 минут. После этого хлорметил-метиловый эфир (0,88 мл) добавляли в реакционный раствор. Полученную смесь дополнительно перемешивали при комнатной температуре в течение 12 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Полученный в результате экстракт промывали водой и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (0,65 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,63 (с, 3H), 3,11 (т, J=7,2 Гц, 2H), 3,35 (с, 3H), 3,79 (т, J=7,2 Гц, 2H), 5,13 (с, 2H), 7,33-7,42 (м, 5H), 8,16 (с, 1H).
[0158]
(2) 4-(2-Метоксиэтил)-2-метилпиримидин-5-ол (Продукт 12-2)
Соединение Продукта 12-1 (0,65 г) растворяли в этилацетате (9 мл), и полученный раствор охлаждали до 0°C. После этого добавляли 5% палладий на углероде (0,31 г) в раствор с последующим замещением водородом. Затем полученный в результате продукт перемешивали при комнатной температуре в течение 2 часов. После этого реакционный раствор фильтровали и растворитель затем отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат к смеси этилацетат:метанол) с тем, чтобы получить титульное соединение (0,36 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,61 (с, 3H), 3,09 (т, J=5,6 Гц, 2H), 3,64 (с, 3H), 3,80 (т, J=5,6 Гц, 2H), 8,24 (с, 1H), 8,39 (шир.с, 1H).
[0159]
Пример получения 13
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоновой кислоты (Продукт 13-7)
[Формула 44]
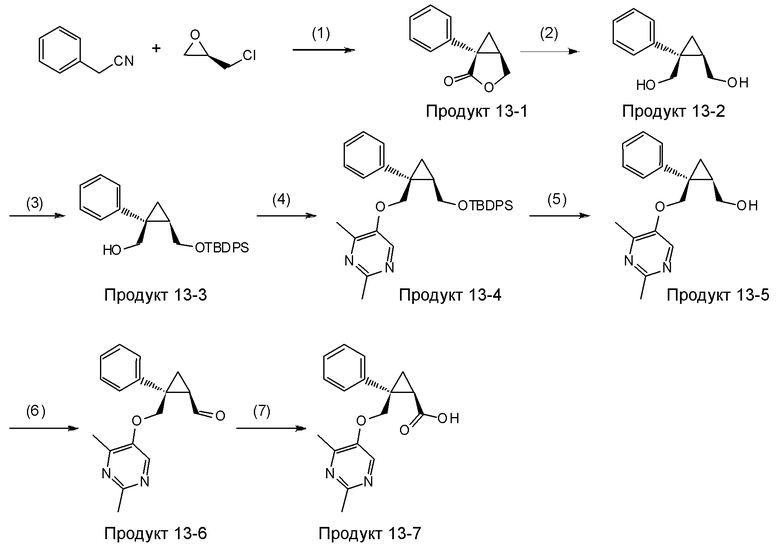
[0160]
(1) (1S,5R)-1-фенил-3-оксабицикло[3.1.0]гексан-2-он (Продукт 13-1)
Фенилацетонитрил (20 г) растворяли в THF (500 мл) и затем добавляли по каплям NaHMDS (323 мл, 1,06 М) в раствор при охлаждении на льдосоляной бане. Полученную смесь перемешивали в течение 2 часов и R-(-)-эпихлоргидрин (15,8 г) затем добавляли по каплям в реакционный раствор (3 часа, 0°C). Полученную смесь перемешивали в течение 2 часов (где внутреннюю температуру поддерживали около 0°C) и затем ее перемешивали при комнатной температуре в течение ночи. После этого реакционный раствор охлаждали на льду и добавляли к нему по каплям небольшое количество воды. Реакционный раствор концентрировали при пониженном давлении и после этого добавляли этанол (200 мл) и 1N водный раствор гидроксида калия (200 мл) к остатку. Полученную смесь нагревали с обратным холодильником в течение 8 часов. После этого температуру реакционного раствора возвращали до комнатной температуры и затем добавляли концентрированную соляную кислоту в раствор с тем, чтобы довести значение pH до pH <2. После этого смесь перемешивали при 0°C в течение 2 часов. После этого реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Далее реакционный раствор концентрировали при пониженном давлении и добавляли этилацетат и воду в концентрат для осуществления разделения жидкости. Органический слой последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Полученный в результате органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (24,7 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,37 (т, J=4,8 Гц, 1H), 1,65 (дд, J=7,8, 4,4 Гц, 1H), 2,54-2,58 (м, 1H), 4,30 (д, J=9,2 Гц, 1H), 4,47 (дд, J=9,4, 4,4 Гц, 1H), 7,25-7,45 (м, 5H).
[0161]
(2) (1S,2R)-1-фенилциклопропан-1,2-диметанол (Продукт 13-2)
Боргидрид натрия (10,7 г) добавляли к раствору соединения Продукта 13-1 (24,7 г) в THF-метаноле (200 мл-100 мл) при 0°C и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. При охлаждении на льду добавляли воду в реакционный раствор, и полученную смесь концентрировали при пониженном давлении, и затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (20,5 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,78 (т, J=5,2 Гц, 1H), 1,87 (дд, J=8,6, 5,2, 1H), 1,60-1,76 (м, 1H), 3,42 (т, J=11,6, 1H), 3,57 (дд, J=9,4, 4,4 Гц, 1H), 4,14-4,28 (м, 2H) 7,22-7,44 (м, 5H).
[0162]
(3) (1S,2R)-2-(трет-бутилдифенилсилилоксиметил)-1-фенилциклопропилметанол (Продукт 13-3)
Соединение Продукта 13-2 (10 г) и имидазол (4,01 г) растворяли в DMF (90 мл) и полученную смесь охлаждали до -15°C. После этого DMF-раствор (20 мл) трет-бутилдифенилсилилхлорида добавляли по каплям в реакционный раствор (в течение приблизительно 30 минут; нерастворимые вещества осаждали почти одновременно с завершением добавления по каплям). После того как смесь перемешивали в течение 1 часа, добавляли метанол в реакционный раствор и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. После этого добавляли воду в органический слой и полученную смесь затем экстрагировали этилацетатом. Полученный в результате экстракт последовательно промывали насыщенным водным раствором хлорида аммония, водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (10,5 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,71 (т, J=5,6 Гц, 1H), 1,04 (дд, J=9,6, 5,2 Гц, 1H), 1,50-1,58 (м, 1H), 3,50 (дд, J=12,4, 1,6 Гц, 1H), 3,53 (дд, J=11,6, 1,6 Гц, 1H), 3,71 (дд, J=12,4, 1,6 Гц, 1H), 4,10 (т, J=12,0 Гц, 1H), 4,20 (дд, J=12,0, 5,6 Гц, 1H), 7,21-7,46 (м, 10H), 7,7-7,76 (м, 5H).
[0163]
(4) 5-[(1S,2R)-2-(трет-бутилдифенилсилилоксиметил)-1-фенилциклопропилметокси]-2,4-диметилпиримидин (Продукт 13-4)
Диизопропилазодикарбоксилат (1,13 мл) добавляли по каплям в THF-раствор (15 мл) соединения Продукта 13-3 (1,50 г), трифенилфосфина (1,42 г) и 2,4-диметил-пиримидин-5-ола (0,58 г), полученного в примере получения 4, при 0°C и полученную смесь затем перемешивали при комнатной температуре в течение 1 суток. После этого реакционный раствор концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (1,76 г).
MS [M+Na]+=545.
[0164]
(5) [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропил]метанол (Продукт 13-5)
Фторид тетрабутиламмония (1М раствор в THF: 4,24 мл) добавляли по каплям в THF-раствор (21 мл) соединения Продукта 13-4 (1,76 г) при комнатной температуре и полученную смесь затем перемешивали при комнатной температуре в течение 17 часов. После этого реакционный раствор концентрировали при пониженном давлении и остаток затем очищали с помощью хроматографии на колонке с NH-силикагелем (от смеси н-гептан:этилацетат к этилацетату) с тем, чтобы получить титульное соединение (0,98 г).
MS [M+H]+=285.
[0165]
(6) [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенил]циклопропанкарбальдегид (Продукт 13-6)
Дихлорметановый раствор (10 мл) оксалилхлорида (593 мкл) охлаждали до -78°C и дихлорметановый раствор (2 мл) диметилсульфоксида (981 мкл) добавляли по каплям в полученный в результате раствор. Через пятнадцать минут дихлорметановый раствор (3 мл) соединения Продукта 13-5 (981 мг) добавляли по каплям в реакционный раствор при -78°C и полученную смесь затем перемешивали при такой же температуре, как описано выше, в течение 75 минут. После этого триэтиламин (3,83 мл) добавляли в реакционный раствор и температуру полученной смеси повышали до 0°C. Добавляли воду и насыщенный водный раствор хлорида аммония в реакционный раствор и полученную смесь затем экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат к этилацетату) с тем, чтобы получить титульное соединение (753,4 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,69 (дд, J=8,0, 4,8 Гц, 1H), 1,97 (дд, J=6,0, 5,2 Гц, 1H), 2,35 (с, 3H), 2,50-2,53 (м, 1H), 2,59 (с, 3H), 4,19 (д, J=10,0 Гц, 1H), 4,45 (д, J=9,6 Гц, 1H), 7,25-7,52 (м, 5H), 7,94 (с, 1H), 9,86 (д, J=3,6 Гц, 1H).
[0166]
(7) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоновая кислота (Продукт 13-7)
2-Метил-2-бутен (2,25 мл), безводный дигидрофосфат натрия (318 мг) и хлорит натрия (482 мг) добавляли в водно-ацетоновый раствор (12 мл) соединения 13-6 при комнатной температуре и полученную смесь затем перемешивали в течение 100 минут. Реакционный раствор концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат=1:1 к смеси хлороформ:метанол=10:1) с тем, чтобы получить титульное соединение (639 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,57 (дд, J=8,0, 4,8 Гц, 1H), 1,75 (т, J=4,8 Гц, 1H), 2,27 (дд, J=8,0, 5,6 Гц, 1H), 2,33 (с, 3H), 2,56 (с, 3H), 4,45 (д, J=9,6 Гц, 1H), 4,50 (д, J=9,2 Гц, 1H), 7,26-7,52 (м, 5H), 8,16 (с, 1H).
[0167]
Пример получения 14
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты (Продукт 14-6)
[Формула 45]
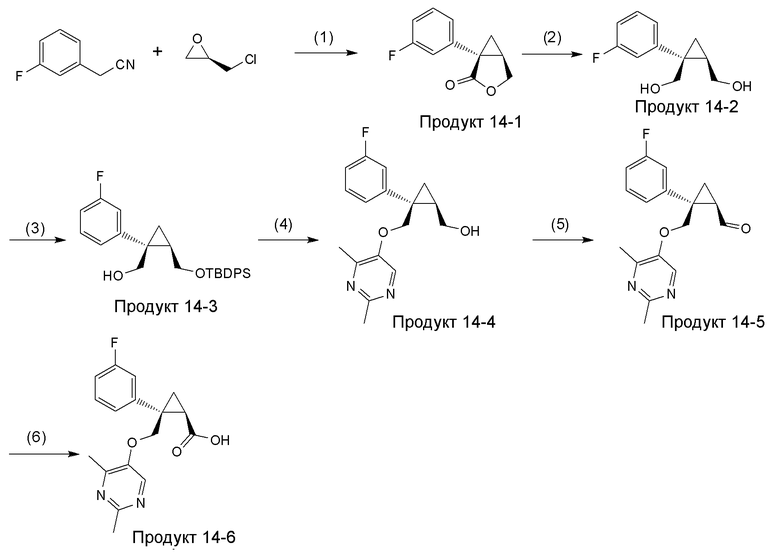
[0168]
(1) (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-он (Продукт 14-1)
3-Фторфенилацетонитрил (70 г) растворяли в THF (500 мл) и затем добавляли по каплям NaHMDS (1000 мл, 1,06М) в раствор при охлаждении на льдосоляной бане. Полученную смесь перемешивали в течение 1 часа и R-(-)-эпихлоргидрин (40,6 мл) затем добавляли по каплям в реакционный раствор (приблизительно 10 минут, внутренняя температура <10°C). Полученную смесь перемешивали в течение 2 часов (причем внутреннюю температуру поддерживали около 0°C) и затем ее перемешивали при комнатной температуре в течение 14 часов. После этого реакционный раствор охлаждали на льду и добавляли к нему по каплям небольшое количество воды. Реакционный раствор концентрировали при пониженном давлении и после этого добавляли этанол (700 мл) и 1N водный раствор гидроксида калия (1000 мл) к остатку. Полученную смесь нагревали с обратным холодильником в течение 5 часов. После этого температуру реакционного раствора возвращали до комнатной температуры и затем добавляли 5N соляную кислоту (400 мл) в раствор. Полученную смесь перемешивали при 60°C в течение 1 часа. После этого реакционный раствор концентрировали при пониженном давлении и добавляли этилацетат и воду в концентрат для осуществления разделения жидкостей. Органический слой последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Полученный в результате органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (84,9 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,41 (т, J=5,2 Гц, 1H), 1,64 (дд, J=8,0, 5,2 Гц, 1H), 2,56-2,63 (м, 1H), 4,30 (д, J=9,2 Гц, 1H), 4,47 (дд, J=9,2, 4,8 Гц, 1H), 6,96-7,02 (м, 1H), 7,16-7,21 (м, 2H), 7,28-7,35 (м, 1H).
[0169]
(2) (1S,2R)-1-(3-фторфенил)циклопропан-1,2-диметанол (Продукт 14-2)
Боргидрид натрия (25 г) добавляли в раствор соединения Продукта 14-1 (72,7 г) в THF-метаноле (440 мл-220 мл) при 0°C и полученную смесь затем перемешивали при комнатной температуре в течение 65 часов. При охлаждении на льду добавляли воду и 5N соляную кислоту в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (72,7 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,80 (т, J=5,0 Гц, 1H), 1,10 (дд, J=8,6, 5,0 Гц, 1H), 1,62-1,71 (м, 1H), 3,41 (т, J=11,4 Гц, 1H), 3,58 (д, J=12,0 Гц, 1H), 4,12-4,25 (м, 2H), 6,90-6,96 (м, 1H), 7,08-7,14 (м, 1H), 7,16-7,21 (м, 1H) 7,24-7,32 (м, 1H).
[0170]
(3) {(1S,2R)-[2-(трет-бутилдифенилсилилоксиметил)-1-(3-фторфенил)циклопропил]}метанол (Продукт 14-3)
Соединение Продукта 14-2 (42,4 г) и триэтиламин (33,0 мл) растворяли в дихлорметане (216 мл) и полученную смесь охлаждали до -20°C. После этого добавляли по каплям трет-бутилдифенилсилилхлорид (56,3 мл) в реакционный раствор (примерно 30 минут; нерастворимые вещества осаждали почти одновременно с завершением добавления по каплям). После того как смесь перемешивали в течение 1 часа, реакционный раствор дополнительно перемешивали при комнатной температуре в течение 20 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали дихлорметаном. Полученный в результате экстракт промывали водой и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (67,8 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,73 (т, J=5,2 Гц, 1H), 1,04 (дд, J=8,4, 5,2 Гц, 1H), 1,09 (с, 9H), 1,48-1,53 (м, 1H), 3,52 (т, J=12,0 Гц, 1H), 3,56 (дд, J=9,6, 1,6 Гц, 1H), 3,70 (дд, J=9,6, 1,6 Гц, 1H), 4,18 (т, J=12,0 Гц, 1H), 4,20 (дд, J=12,0, 5,2 Гц, 1H), 6,93 (тдд, J=8,0, 2,4, 1,2 Гц, 1H), 7,11 (дт, J=9,6, 2,4 Гц, 1H), 7,20 (дт, J=8,0, 1,2 Гц, 1H), 7,28 (тд, J=8,0, 6,0 Гц, 1H), 7,37-7,49 (м, 6H), 7,69-7,74 (м, 4H).
[0171]
(4) {(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил}метанол (Продукт 14-4)
Диизопропилазодикарбоксилат (0,316 мл) добавляли по каплям в THF-раствор (10 мл) соединения Продукта 14-3 (581 мг), трифенилфосфина (1,3 г) и 2,4-диметил-пиримидин-5-ола (183 мг), полученного в примере получения 4, при 0°C и полученную смесь затем перемешивали при комнатной температуре в течение 2 суток. После этого реакционный раствор концентрировали при пониженном давлении и затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-7:3). Полученный (1S,2R)-2-(трет-бутилдифенилсилилоксиметил)-1-{[(2,4-диметилпиримидин-5-ил)окси]метил}-1-(3-фторфенил)циклопропан растворяли в THF (15 мл) и фторид тетрабутиламмония (1М раствор в THF: 1,61 мл) затем добавляли по каплям в раствор при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. После этого реакционный раствор концентрировали при пониженном давлении и затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=10:1-0:1) с тем, чтобы получить титульное соединение (238 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,00 (т, J=5,6 Гц, 1H), 1,25-1,33 (м, 1H), 1,78-1,88 (м, 1H), 2,39 (с, 3H), 2,61 (с, 3H), 3,58 (дд, J=12,0, 9,6 Гц, 1H), 4,02-4,11 (м, 1H), 4,12 (д, J=10,4 Гц, 1H), 4,43 (д, J=9,6 Гц, 1H), 6,92-6,98 (м, 1H), 7,10-7,16 (м, 1H), 7,18-7,23 (м, 1H), 7,29 (тд, J=8,0, 6,0 Гц, 1H), 8,00 (с, 1H).
[0172]
(4 - Альтернативный способ)
{(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил}метанол (Продукт 14-4) (альтернативный способ)
Триэтиламин (14,5 мл) добавляли в дихлорметановый раствор (200 мл) соединения Продукта 14-3 (41,3 г) и полученную смесь охлаждали до 0°C. Метансульфонилхлорид (7,34 мл) добавляли по каплям в реакционный раствор и полученную смесь затем перемешивали в течение 1 часа. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали дихлорметаном. Полученный в результате экстракт сушили над безводным сульфатом натрия и растворитель затем отгоняли при пониженном давлении. 2,4-Диметил-пиримидин-5-ол (14,1 г), полученный в примере получения 4-(2), и карбонат цезия (61,8 г) добавляли в раствор полученного остатка в ацетонитриле (200 мл) и полученную смесь затем нагревали до 70°C. Реакционный раствор перемешивали при 70°C в течение 4 часов и охлаждали его до 0°C. Фторид тетрабутиламмония (1М раствор в THF: 190 мл) добавляли по каплям в реакционный раствор и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Полученный в результате экстракт сушили над безводным сульфатом натрия и растворитель затем отгоняли при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с NH-силикагелем (н-гептан:этилацетат=9:1-1:1) с тем, чтобы получить титульное соединение (20,7 г).
[0173]
(5) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбальдегид (Продукт 14-5)
Дихлорметановый раствор (7 мл) оксалилхлорида (137 мкл) охлаждали до -78°C и к нему добавляли по каплям диметилсульфоксид (226 мкл) (внутренняя температура: -60°C или ниже). Полученную смесь перемешивали при такой же температуре, как описано выше, в течение 10 минут. После этого дихлорметановый раствор (3 мл) соединения Продукта 14-4 (238 мг) добавляли по каплям в реакционный раствор при -78°C и полученную смесь затем перемешивали при такой же температуре, как описано выше, в течение 30 минут. После этого триэтиламин (671 мкл) добавляли в реакционный раствор и полученную смесь затем перемешивали в течение 15 минут. После этого температуру реакционного раствора повышали до комнатной температуры. Насыщенный водный раствор хлорида натрия добавляли в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении с тем, чтобы с получить неочищенное титульное соединение (236 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,67 (дд, J=8,0, 4,8 Гц, 1H), 1,96-2,00 (м, 1H), 2,36 (с, 3H), 2,49-2,55 (м, 1H), 2,59 (с, 3H), 4,19 (д, J=9,6 Гц, 1H), 4,44 (д, J=10,0 Гц, 1H), 6,97-7,04 (м, 1H), 7,14-7,20 (м, 1H), 7,21-7,25 (м, 1H), 7,30-7,37 (м, 1H), 7,95 (с, 1H), 9,87 (д, J=3,2 Гц, 1H).
[0174]
(6) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновая кислота (Продукт 14-6)
Соединение Продукта 14-5 (18,9 г), 2-метил-2-бутен (26,1 мл) и дигидрофосфат натрия (9,07 г) растворяли в смешанном растворителе из ацетона и воды (200 мл/40 мл) и добавляли хлорит натрия (6,26 г) частями в раствор. Полученную смесь перемешивали при комнатной температуре в течение 2 часов и затем реакционный раствор концентрировали при пониженном давлении. Осажденное твердое вещество собирали с помощью фильтрации и затем промывали дихлорметаном. После этого растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:1-0:1 и затем этилацетат:метанол=10:1) с тем, чтобы получить титульное соединение (16,2 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,55 (дд, J=8,4, 5,6 Гц, 1H), 1,76 (т, J=5,6 Гц, 1H), 2,25 (дд, J=8,4, 6,4 Гц, 1H), 2,33 (с, 3H), 2,55 (с, 3H), 4,47 (т, J=9,6 Гц, 1H), 4,50 (д, J=9,6 Гц, 1H), 6,99 (тдд, J=8,0, 2,4, 1,2 Гц, 1H), 7,21 (дт, J=9,6, 2,4 Гц, 1H), 7,26 (тд, J=8,0, 1,2 Гц, 1H), 7,32 (тд, J=8,0, 6,0 Гц, 1H), 8,21 (с, 1H).
Соединение Продукта 14-6 можно получить непосредственно из соединения Продукта 14-4 следующим способом.
Соединение Продукта 14-4 (300 мг) и TEMPO (5 мол.%, 7,74 мг) растворяли в ацетонитриле-фосфатном (pH 6,4) буфере (5 мл, 5 мл) и затем добавляли 2N HCl (150 мкл) и хлорит натрия (180 мг) в раствор. Полученный раствор нагревали до 40°C и 5 вес.% водный раствор гипохлорной кислоты (2 мол.%, 26,5 мкл) затем добавляли в реакционный раствор с последующим перемешиванием в течение 2 часов. После этого реакционный раствор охлаждали до комнатной температуры и затем добавляли избыточное количество 2-метил-2-бутена в реакционный раствор с последующим перемешиванием в течение 5 минут. После этого реакционный раствор подвергали разделению жидкости и экстракции дихлорметаном и отгоняли растворитель при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:1-0:1 и затем этилацетат:метанол=9:1) с тем, чтобы получить титульное соединение (215 мг).
[0175]
Пример получения 15
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)циклопропанкарбоновой кислоты (Продукт 15-5)
Титульное соединение синтезировали из 4-фторфенилацетонитрила тем же способом, что и в примере получения 13.
[Формула 46]
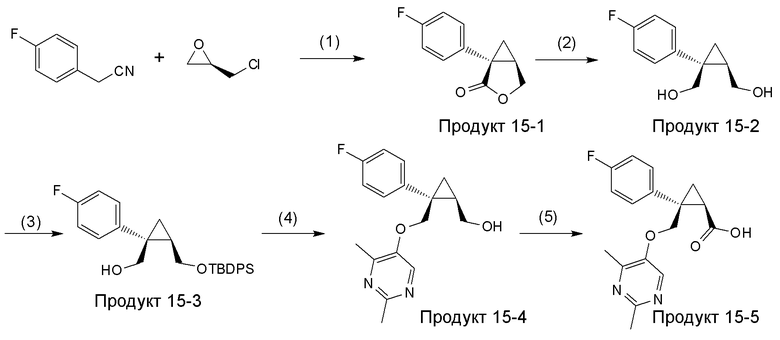
[0176]
15-1
15-2
15-3
15-4
15-5
MS [M+H]+=317.
[0177]
Пример получения 16
Синтез (1R,2S)-2-{[(3,5-дифторфенил)-2-[(2,4-диметилпиримидин-5-ил)окси]метил]циклопропанкарбоновой кислоты (Продукт 16-7)
[Формула 47]
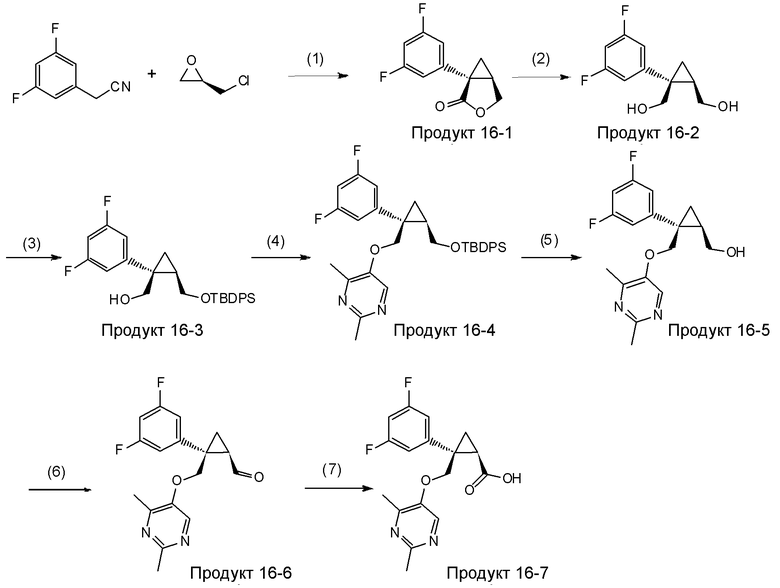
[0178]
Титульное соединение синтезировали из 3,5-дифторфенилацетонитрила тем же способом, что и в примере получения 13.
[0179]
16-1
16-2
16-3
16-4
16-5
16-6
16-7
MS [M+H]+=335
[0180]
Пример получения 17
Синтез 2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(2-метоксифенил)циклопропанкарбоновой кислоты (Продукт 17-4)
[Формула 48]
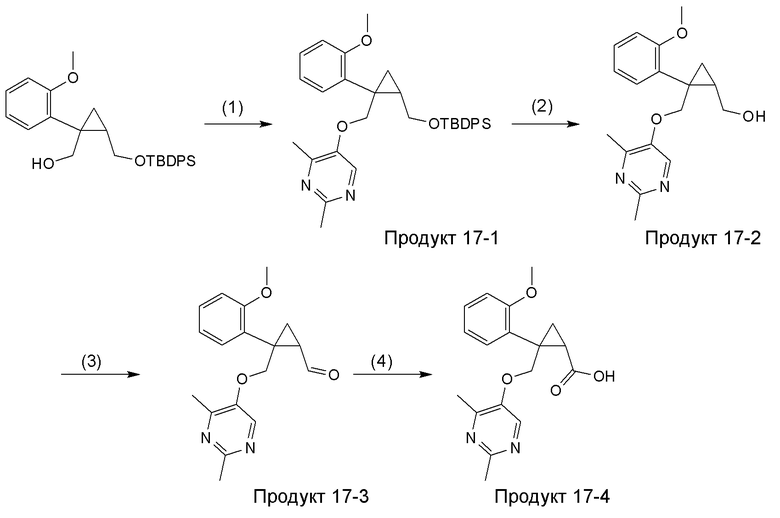
[0181]
(1) 5-{(1S,2R)-2-[трет-бутил(дифенил)силилоксиметил]-1-(2-метоксифенил)циклопропил}метокси-2,4-диметилпиримидин (Продукт 17-1)
Трифенилфосфин (610 мг) добавляли в толуольный раствор (15 мл) [2-({[трет-бутил(дифенил)силил]окси}метил)-1-(2-метоксифенил)циклопропил]метанола (800 мг), синтезированного из (2-метоксифенил)ацетонитрила и эпихлоргидрина в соответствии со способом из примера получения 13, и тетрабромметана (772 мг) при комнатной температуре. Температуру полученной смеси повышали до 40°C и смесь затем перемешивали в течение 2 часов. После этого добавляли насыщенный водный раствор бикарбоната натрия в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующей фильтрацией. Фильтрат концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-9:1) с тем, чтобы с получить соответствующий бромид.
Карбонат калия (210 мг) добавляли в DMF-раствор (10 мл) полученного бромида и соединения Продукта 4-2 (113 мг) при комнатной температуре и температуру полученной смеси повышали до 50°C с последующим перемешиванием в течение 2 часов. После этого температуру реакционного раствора повышали до 70°C и реакционный раствор дополнительно перемешивали в течение 11 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующей фильтрацией. Фильтрат концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-1:4) с тем, чтобы получить титульное соединение (148 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,94 (дд, J=6,2, 5,2 Гц, 1H), 1,07 (с, 9H), 1,10 (дд, J=8,8, 5,2 Гц, 1H), 1,54-1,61 (м, 1H), 2,21 (с, 3H), 2,58 (с, 3H), 3,80 (с, 3H), 3,95 (д, J=6,8 Гц, 2H), 4,11 (д, J=9,8 Гц, 1H), 4,25 (д, J=9,8 Гц, 1H), 6,82-6,91 (м, 2H), 7,19-7,42 (м, 8H), 7,65-7,69 (м, 4H), 7,87 (с, 1H).
MS [M+Na]+=575
[0182]
(2) {2-{[(2,4-Диметилпиримидин-5-ил)окси]метил}-2-(2-метоксифенил)циклопропил}метанол (Продукт 17-2)
Фторид тетрабутиламмония (1М раствор в THF: 322 мкл) добавляли по каплям в THF-раствор (1,3 мл) соединения Продукта 17-1 (148 мг) при комнатной температуре и полученную смесь затем перемешивали при комнатной температуре в течение 23 часов. Реакционный раствор концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат=1:1, к этилацетату, к смеси этилацетат:метанол=9:1) с тем, чтобы получить титульное соединение (75 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,99 (дд, J=6,2, 5,2 Гц, 1H), 1,21 (дд, J=8,8, 5,2 Гц, 1H), 1,68-1,76 (м, 1H), 2,32 (с, 3H), 2,45 (дд, J=8,8, 2,4 Гц, 1H), 2,58 (с, 3H), 3,48-3,54 (м, 1H), 3,88 (с, 3H), 4,13 (дт, J=8,8, 6,4 Гц, 1H), 4,18 (д, J=10,0 Гц, 1H), 4,33 (д, J=10,0 Гц, 1H), 6,87 (дд, J=8,0, 1,2 Гц, 1H), 6,94 (дт, J=8,0, 1,2 Гц, 1H), 7,24-7,29 (м, 1H), 7,34 (дд, J=8,0, 1,6 Гц, 1H), 7,94 (с, 1H).
[0183]
(3) 2-{[(2,4-Диметилпиримидин-5-ил)окси]метил}-2-(2-метоксифенил)циклопропанкарбальдегид (Продукт 17-3)
Дихлорметановый раствор (0,5 мл) оксалилхлорида (82 мкл) охлаждали до -78°C и после этого добавляли по каплям к нему дихлорметановый раствор (0,5 мл) диметилсульфоксида (136 мкл). Через десять минут дихлорметановый раствор соединения Продукта 17-2 (75 мг) добавляли по каплям в реакционный раствор при -78°C и полученную смесь затем перемешивали при такой же температуре, как описано выше, в течение 40 минут. После этого триэтиламин (534 мкл) добавляли в реакционный раствор и температуру полученной смеси затем повышали до 0°C с последующим перемешиванием в течение 15 минут. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующей фильтрацией. Фильтрат концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат=9:1 к этилацетату) с тем, чтобы получить титульное соединение (41 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,55 (дд, J=8,4, 5,2 Гц, 1H), 1,97 (дд, J=6,2, 5,2 Гц, 1H), 2,28 (с, 3H), 2,42 (ддд, J=8,4, 6,2, 4,0 Гц, 1H), 2,56 (с, 3H), 3,87 (с, 3H), 4,17 (д, J=9,6 Гц, 1H), 4,41 (д, J=9,6 Гц, 1H), 6,88 (дд, J=8,0, 0,8 Гц, 1H), 6,94 (дт, J=8,0, 0,8 Гц, 1H), 7,26-7,30 (м, 1H), 7,37 (дд, J=8,0, 1,8 Гц, 1H), 7,90 (с, 1H), 9,82 (д, J=4,0 Гц, 1H).
[0184]
(4) 2-{[(2,4-Диметилпиримидин-5-ил)окси]метил}-2-(2-метоксифенил)циклопропанкарбоновая кислота (Продукт 17-4)
2-Метил-2-бутен (139 мкл), безводный дигидрофосфат натрия (23,6 мг) и хлорит натрия (44,4 мг) добавляли в водно-ацетоновый раствор (1,3 мл) соединения Продукта 17-3 (41 мг) при комнатной температуре. Полученную смесь перемешивали в течение 2,5 часов. После этого реакционный раствор концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат=1:1 к смеси хлороформ:метанол=9:1) с тем, чтобы получить титульное соединение (35 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,50 (дд, J=8,0, 5,2 Гц, 1H), 1,70 (дд, J=6,4, 5,2 Гц, 1H), 2,13 (дд, J=8,0, 6,4 Гц, 1H), 2,31 (с, 3H), 2,56 (с, 3H), 3,89 (с, 3H), 4,40 (д, J=9,2 Гц, 1H), 4,57 (д, J=9,2 Гц, 1H), 6,89 (дд, J=8,0, 1,2 Гц, 1H), 6,95 (дт, J=8,0, 1,2 Гц, 1H), 7,27-7,30 (м, 1H), 7,42 (дд, J=8,0, 1,2 Гц, 1H), 8,19 (с, 1H).
[0185]
Пример получения 18
Синтез 2-(3-цианофенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоновой кислоты (Продукт 18-4)
[Формула 49]
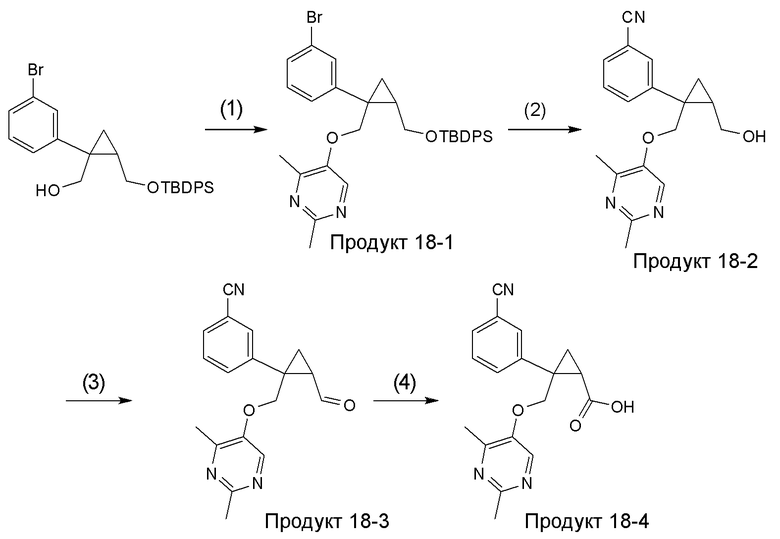
[0186]
(1) 5-[1-(3-Бромфенил)-2-(трет-бутилдифенилсилилоксиметил)циклопропилметокси-2,4-диметилпиримидин (Продукт 18-1)
Диизопропилазодикарбоксилат (0,706 мл) добавляли по каплям в THF-раствор (13 мл) [1-(3-бромфенил)-2-(трет-бутилдифенилсилилоксиметил)]циклопропилметанола (1,3 г), синтезированного из (3-бромфенил)ацетонитрила и эпихлоргидрина тем же способом, что и в примере получения 13, трифенилфосфина (893 мг) и 2,4-диметил-пиримидин-5-ола (390 мг), синтезированного в примере получения 4-(2), при 0°C. Полученную смесь затем перемешивали при комнатной температуре в течение 14 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-3:2) с тем, чтобы получить титульное соединение (880 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,95 (т, J=5,8 Гц, 1H), 1,08 (с, 9H), 1,17-1,35 (м, 1H), 1,55-1,65 (м, 1H), 2,30 (с, 3H), 2,61 (с, 3H), 3,75 (дд, J=11,2, 8,0 Гц, 1H), 4,04 (дд, 1H, J=11,2, 5,4 Гц, 1H), 4,11 (д, J=9,6 Гц, 1H), 4,19 (д, J=9,6 Гц, 1H), 7,17 (т, J=7,8 Гц, 1H), 7,31-7,39 (м, 6H), 7,40-7,46 (м, 2H), 7,59 (т, J=2,0 Гц, 1H), 7,62-7,68 (м, 4H), 7,88 (с, 1H).
[0187]
(2) 3-(1-{[(2,4-Диметилпиримидин-5-ил)окси]метил}-2-гидроксиметилциклопропан-1-ил}бензонитрил (Продукт 18-2)
Цианид цинка (172 мг) и тетракистрифенилфосфинпалладий (169 мг) добавляли в DMF-раствор (20 мл) соединения Продукта 18-1 (880 мг) и полученную смесь затем перемешивали в атмосфере азота при 90°C в течение 7 часов. После этого температуру реакционного раствора возвращали до комнатной температуры и добавляли к нему насыщенный водный раствор бикарбоната натрия. Полученную смесь затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток растворяли в THF (10 мл) и фторид тетрабутиламмония (1М раствор в THF: 2,19 мл) затем добавляли по каплям в раствор при комнатной температуре. Полученную смесь затем перемешивали при комнатной температуре в течение 5 часов. После этого реакционный раствор концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат (1:0-0:1) к смеси этилацетат:метанол (9:1)) с тем, чтобы получить титульное соединение (415 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,07 (т, J=6,0 Гц, 1H), 1,31 (дд, J=8,6, 5,4 Гц, 1H), 1,74-1,84 (м, 1H), 2,38 (с, 3H), 2,60 (с, 3H), 3,63 (дд, J=12,0, 9,2 Гц, 1H), 4,09 (дд, J=12,0, 5,4 Гц, 1H), 4,16 (д, J=10,0 Гц, 1H), 4,38 (д, J=10,0 Гц, 1H), 7,45 (т, J=7,6 Гц, 1H), 7,54-7,58 (м, 1H), 7,68-7,72 (м, 1H), 7,73-7,75 (м, 1H), 8,01 (с, 1H).
[0188]
(3) 3-(1-{[(2,4-Диметилпиримидин-5-ил)окси]метил}-2-формилциклопропан-1-ил}бензонитрил (Продукт 18-3)
Дихлорметановый раствор (7 мл) оксалилхлорида (239 мкл) охлаждали до -78°C и добавляли к нему диметилсульфоксид (394 мкл) по каплям (внутренняя температура: -60°C или ниже). Полученную смесь перемешивали при такой же температуре, как описано выше, в течение 10 минут. После этого дихлорметановый раствор (7 мл) соединения Продукта 18-2 (415 мг) добавляли по каплям в реакционный раствор при -78°C и полученную смесь затем перемешивали при такой же температуре, как описано выше, в течение 30 минут. После этого добавляли триэтиламин (1,17 мл) в реакционный раствор и затем смесь перемешивали в течение 15 минут. После этого температуру реакционного раствора повышали до комнатной температуры. Насыщенный водный раствор хлорида натрия добавляли в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении с тем, чтобы получить неочищенное титульное соединение (236 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,41 (т, J=7,2 Гц, 1H), 1,69 (дд, J=8,4, 5,2 Гц, 1H), 2,03 (т, J=5,8 Гц, 1H), 2,35 (с, 3H), 2,59 (с, 3H), 4,22 (д, J=10,0 Гц, 1H), 4,42 (д, J=10,0 Гц, 1H), 7,50 (т, J=8,2 Гц, 1H), 7,59-7,65 (м, 1H), 7,70-7,75 (м, 1H), 7,76-7,79 (м, 1H), 7,96 (с, 1H), 9,92 (д, J=2,8 Гц, 1H).
[0189]
(4) 2-(3-Цианофенил)-2-{1-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоновая кислота (Продукт 18-4)
Соединение Продукта 18-3 (415 мг), 2-метил-2-бутен (0,717 мл) и дигидрофосфат натрия (243 мг) растворяли в смешанном растворителе из ацетона и воды (10 мл/2 мл). Хлорит натрия (244 мг) добавляли порциями в раствор. Полученную смесь затем перемешивали при комнатной температуре в течение 14 часов и реакционный раствор затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат:метанол 1:0-17:3) с тем, чтобы получить титульное соединение (265 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,61 (дд, J=8,4, 5,6 Гц, 1H), 1,79 (т, J=5,6 Гц, 1H), 2,20-2,27 (м, 1H), 2,37 (с, 3H), 2,60 (с, 3H), 4,46 (д, J=9,6 Гц, 1H), 4,59 (д, J=9,6 Гц, 1H), 7,49 (т, J=7,8 Гц, 1H), 7,59-7,63 (м, 1H), 7,72-7,77 (м, 1H), 7,80 (т, J=1,8 Гц, 1H), 8,28 (с, 1H).
[0190]
Пример получения 19
Синтез (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоновой кислоты (Продукт 19-3)
[Формула 50]
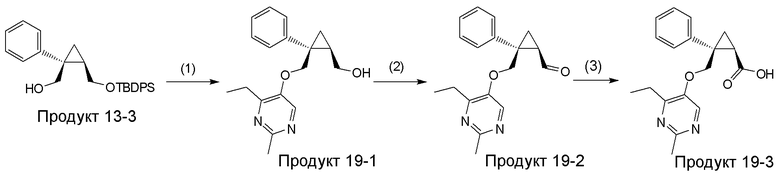
[0191]
Титульное соединение синтезировали из соединения Продукта 13-3 и соединение Продукта 3-3 тем же способом, что и в примере получения 13.
[0192]
19-1
19-2
19-3
[0193]
Пример получения 20
Синтез (1R,2R)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоновой кислоты (Продукт 20-6)
[Формула 51]
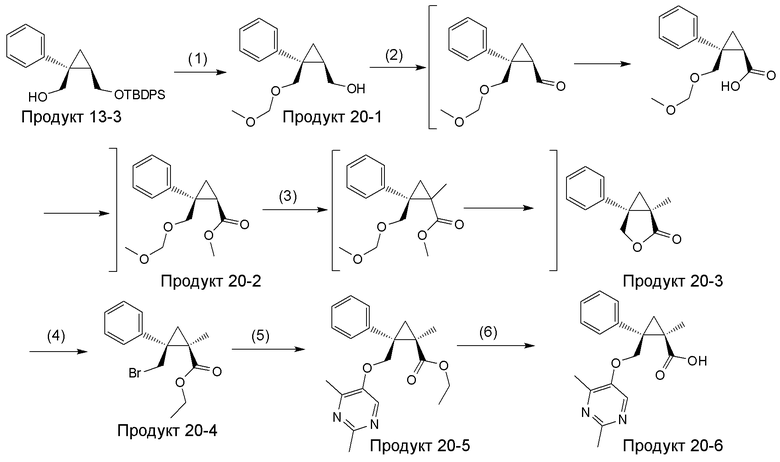
[0194]
(1) [(1R,2S)-2-(метоксиметоксиметил)-2-фенилциклопропил]метанол (Продукт 20-1)
N,N-диизопропилэтиламин (4,35 мл) и хлорметил-метиловый эфир (1,52 мл) добавляли в дихлорметановый раствор (40 мл) соединения Продукта 13-3 (4 г) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. После этого добавляли воду в реакционный раствор и смесь экстрагировали дихлорметаном. Органический слой сушили над сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в THF (40 мл) и фторид тетрабутиламмония (1М раствор в THF: 1,61 мл) затем добавляли в раствор при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После этого реакционный раствор концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-1:1) с тем, чтобы получить титульное соединение (1,93 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,79 (т, J=5,6 Гц, 1H), 1,11 (дд, J=8,8, 5,2 Гц, 1H), 1,70-1,80 (м, 1H), 3,19 (с, 3H), 3,35-3,45 (м, 1H), 3,57 (д, J=10,4 Гц, 1H), 4,04-4,16 (м, 2H), 4,52 (д, J=6,4 Гц, 1H), 4,59 (д, J=6,8 Гц, 1H), 7,18-7,24 (м, 1H), 7,25-7,34 (м, 2H), 7,35-7,42 (м, 2H).
[0195]
(2) Метил-(1R,2S)-2-метоксиметоксиметил-2-фенилциклопропанкарбоксилат (Продукт 20-2)
Дихлорметановый раствор (15 мл) оксалилхлорида (1,5 мл) охлаждали до -78°C и затем добавляли к нему дихлорметановый раствор (5 мл) диметилсульфоксида (2,49 мл) по каплям (внутренняя температура: -65°C или ниже). Полученную смесь перемешивали при такой же температуре, как описано выше, в течение 5 минут. После этого дихлорметановый раствор (20 мл) соединения Продукта 20-1 (1,93 г) добавляли по каплям в реакционный раствор при -78°C и полученную смесь затем перемешивали при такой же температуре, как описано выше, в течение 30 минут. После этого триэтиламин (7,33 мл) добавляли в реакционный раствор и полученную смесь затем перемешивали в течение 15 минут. После этого температуру реакционного раствора повышали до комнатной температуры. Насыщенный водный раствор хлорида натрия добавляли в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении с тем, чтобы получить альдегид (1,93 г). Полученный альдегид (1,93 г), 2-метил-2-бутен (4,65 мл) и дигидрофосфат натрия растворяли в смешанном растворителе из ацетона и воды (60 мл/15 мл) и затем добавляли хлорит натрия (1,58 г) частями в раствор в то время, как раствор перемешивали при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 5 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния и затем концентрировали растворитель при пониженном давлении. Остаток растворяли в смешанном растворителе из метанола и THF (20 мл/20 мл) и в при перемешивании при комнатной температуре добавляли триметилсилилдиазометан (2М раствор в гексане: 8,76 мл) в раствор. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. После этого небольшое количество уксусной кислоты добавляли в реакционный раствор и таким образом разлагали избыточный триметилсилилдиазометан. Полученный в результате продукт концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-4:1) с тем, чтобы получить титульное соединение (1,65 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,43 (дд, J=8,0, 4,8 Гц, 1H), 1,60 (дд, J=6,2, 4,8 Гц, 1H), 2,12 (дд, J=8,0, 6,2 Гц, 1H), 3,14 (с, 3H), 3,75 (с, 3H), 3,85 (д, J=10,0 Гц, 1H), 3,98 (д, J=9,6 Гц, 1H), 4,48 (с, 2H), 7,21-7,28 (м, 1H), 7,29-7,34 (м, 2H), 7,37-7,42 (м, 2H).
[0196]
(3) (1S,5R)-1-метил-5-фенил-3-оксабицикло[3.1.0]гексан-2-он (Продукт 20-3)
При перемешивании при -78°C добавляли н-бутиллитий (2,69М раствор в гексане: 3,3 мл) в THF-раствор (22 мл) диизопропиламина (1,25 мл). Полученную смесь перемешивали при -78°C в течение 30 минут. После этого THF-раствор (11 мл) соединения Продукта 20-2 (1,11 г) добавляли в реакционный раствор и полученную смесь затем перемешивали при -78°C в течение 1 часа. После этого добавляли йодметан (703 мкл) в реакционный раствор и полученную смесь перемешивали в течение 3 часов при повышении температуры до комнатной температуры. После этого насыщенный водный раствор хлорида аммония добавляли в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Полученный слой промывали насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток растворяли в THF (10 мл) и при перемешивании при комнатной температуре добавляли 7,5N соляную кислоту (10 мл) в раствор. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Полученный органический слой последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. После завершения концентрирования под вакуумом остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-4:1) с тем, чтобы получить титульное соединение (314 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,15 (с, 3H), 1,36 (д, J=5,2 Гц, 1H), 1,51 (д, J=4,8 Гц, 1H), 4,38 (дд, J=12,4, 9,2 Гц, 2H), 7,20-7,44 (м, 5H).
[0197]
(4) Этил-(1R,2R)-2-бромметил-1-метил-2-фенилциклопропанкарбоксилат (Продукт 20-4)
При перемешивании при -15°C добавляли по каплям тионилбромид (247 мкл) в этанол (2 мл). После этого соединение Продукта 20-3 (150 мг) добавляли в раствор и полученную смесь затем перемешивали при -15°C в течение ночи. После этого реакционный раствор концентрировали при пониженном давлении и затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-3:17) с тем, чтобы получить титульное соединение (131 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,02 (с, 3H), 1,31-1,37 (м, 1H), 1,34 (т, J=7,0 Гц, 3H), 1,91 (д, J=5,2 Гц, 1H), 3,79 (д, J=10,0 Гц, 1H), 3,87 (дд, J=10,0, 1,0 Гц, 1H), 4,24 (кв. J=7,0 Гц, 2H), 7,26-7,43 (м, 5H).
[0198]
(5) Этил-(1R,2R)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-1-метил-2-фенилциклопропанкарбоксилат (Продукт 20-5)
Карбонат калия (91,4 мг), 2,4-диметил-пиримидин-5-ол (71,2 мг), синтезированный в примере получения 4-(2), и йодид тетрабутиламмония (81,4 мг) добавляли в DMF-раствор (3 мл) соединения Продукта 20-4 (131 мг). Реакционный раствор перемешивали при 70°C в течение 5 часов и температуру реакционного раствора затем возвращали до комнатной температуры. Добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-2:3) с тем, чтобы получить титульное соединение (133 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,08 (с, 3H), 1,22 (т, J=7,0 Гц, 3H), 1,30 (д, J=4,8 Гц, 1H), 1,96 (д, J=4,8 Гц, 1H), 2,40 (с, 3H), 2,58 (с, 3H), 4,04-4,17 (м, 2H), 4,30 (дд, J=12,2, 5,4 Гц, 2H), 7,26-7,48 (м, 5H), 7,90 (с, 1H).
[0199]
(6) (1R,2R)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-1-метил-2-фенилциклопропанкарбоновая кислота (Продукт 20-6)
5N водный раствор гидроксида натрия (235 мкл) добавляли в этанольный раствор (2 мл) соединения Продукта 20-5 (133 мг) и полученную смесь затем перемешивали при 80°C в течение 5 часов. Далее температуру реакционного раствора возвращали до комнатной температуры, реакционный раствор нейтрализовали 5N соляной кислотой с последующим концентрированием под вакуумом. Остаток полностью промывали THF и затем фильтровали. Фильтрат сушили над сульфатом магния и затем концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (144 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,10 (с, 3H), 1,24-1,34 (м, 1H), 1,95 (шир.д, J=4,4 Гц, 1H), 2,34 (с, 3H), 2,51 (с, 3H), 4,36 (шир.д, J=9,2 Гц, 1H), 4,44 (шир.д, J=9,6 Гц, 1H), 7,26-7,47 (м, 5H), 8,04 (с, 1H).
[0200]
Карбоновые кислоты из примеров получения 21-47 синтезировали таким же способом, как таковые из примера получения 13, за исключением того, что (±)-эпихлоргидрин применяли в виде рацемической формы, вместо применения R-(-)-эпихлоргидрина.
[0201]
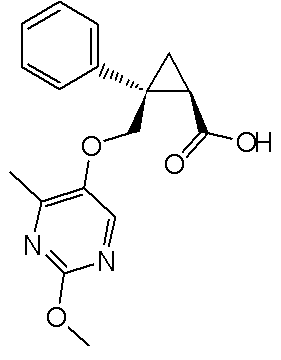
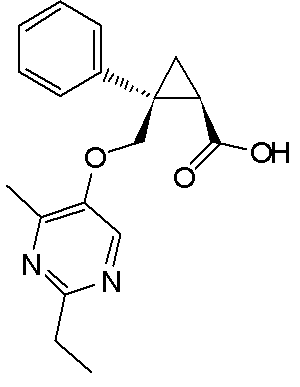
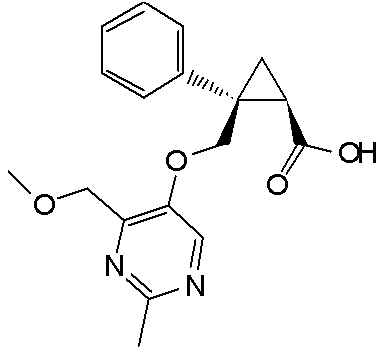
[0202]
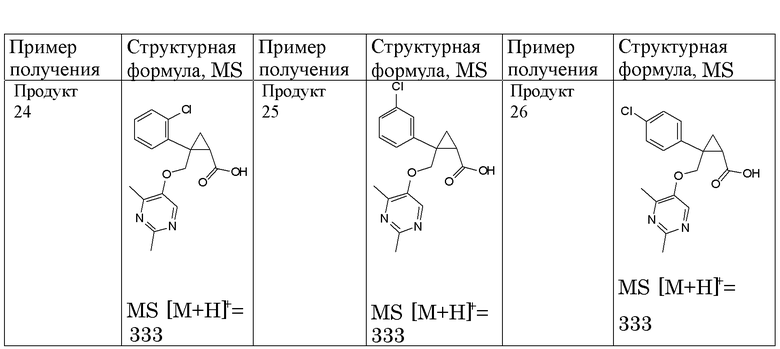
[0203]
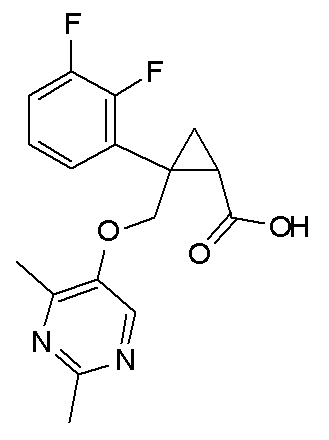
MS [M+H]+=335
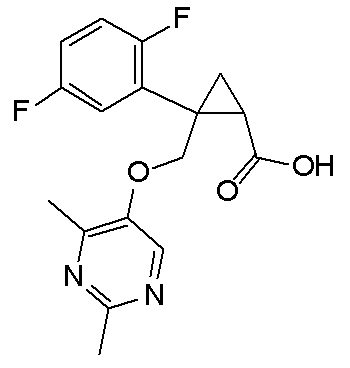
MS [M+H]+=335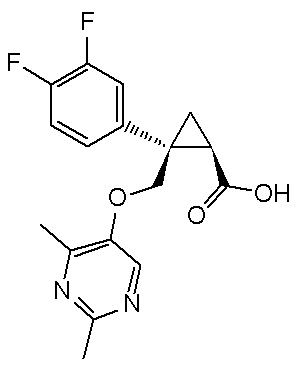
MS [M+H]+=335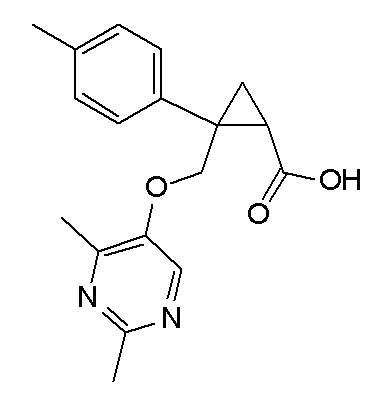
MS [M+H]+=313
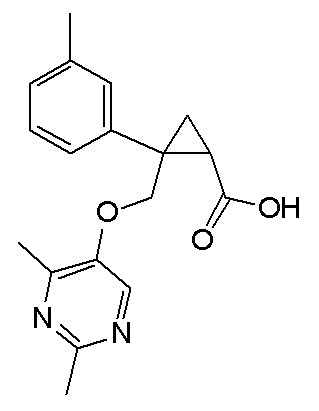
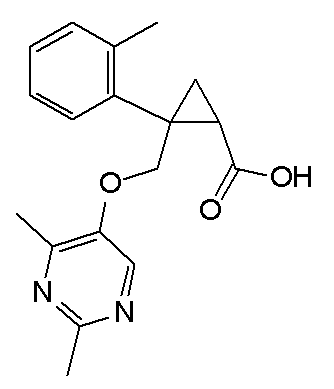
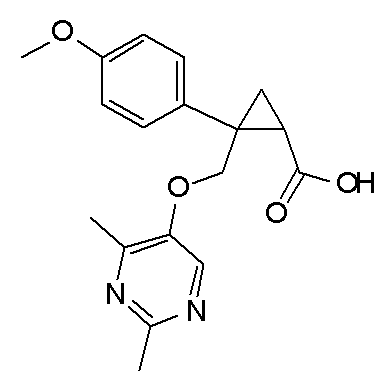
MS [M+H]+=329
[0204]
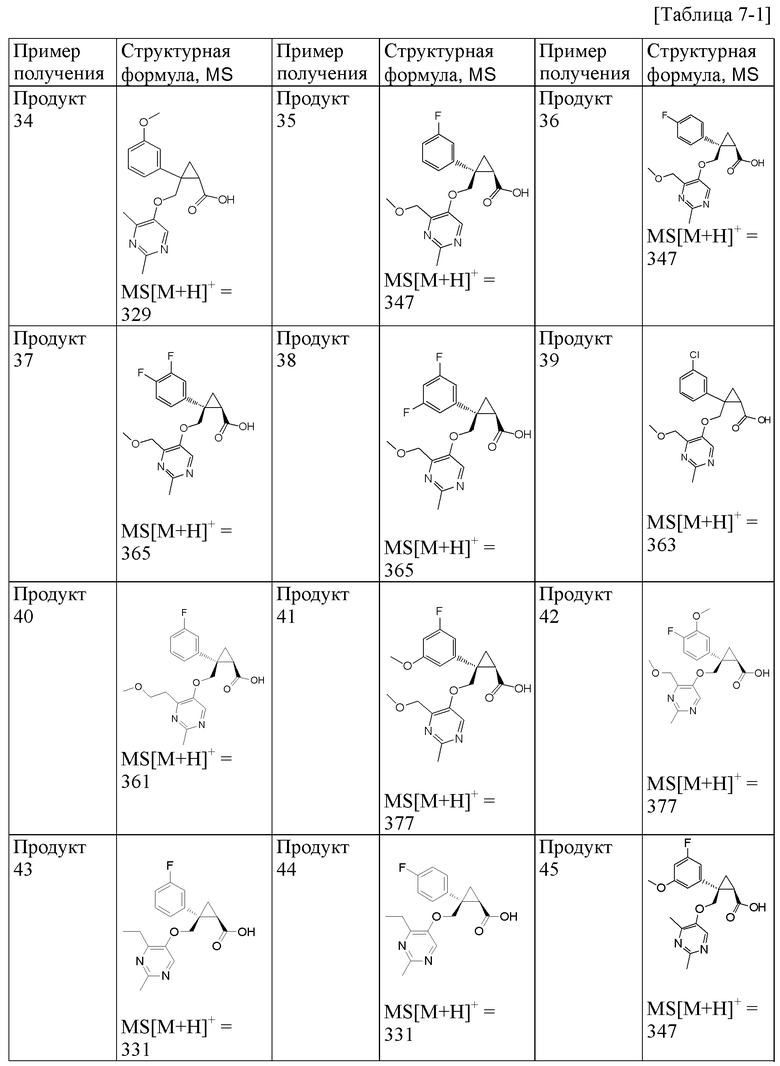
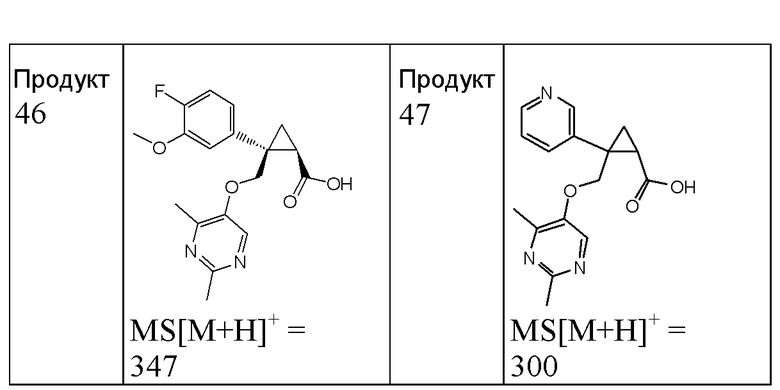
[0205]
Пример получения 48
Синтез 2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-3,3-диметил-2-фенилциклопропанкарбоновой кислоты (Продукт 48-5)
[Формула 52]
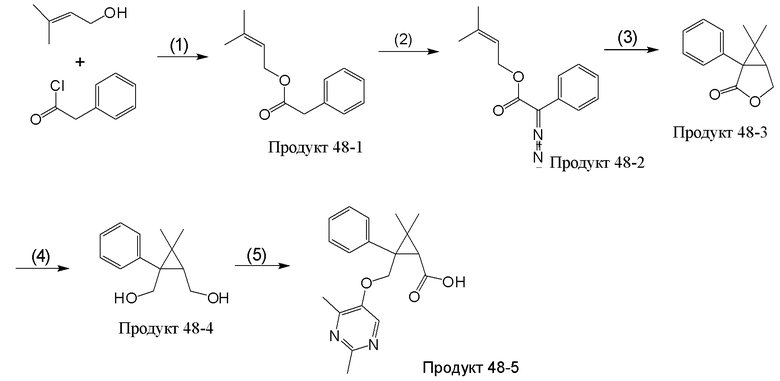
[0206]
(1) 3-Метил-2-бутен-1-ил-фенилацетат (Продукт 48-1)
Триэтиламин (9,7 мл) и фенилацетилхлорид (7,67 мл) добавляли в дихлорметановый раствор (50 мл) 3-метил-2-бутен-1-ола (5 г) в то время, как раствор перемешивали при охлаждении на льду. Полученную смесь перемешивали при охлаждении на льду в течение 3 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали дихлорметаном. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-19:1) с тем, чтобы получить титульное соединение (11,5 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,69 (с, 3H), 1,75 (с, 3H), 3,63 (с, 2H), 4,59 (д, J=7,2 Гц, 2H), 5,30-5,37 (м, 1H), 7,23-7,36 (м, 5H).
[0207]
(2) 3-Метил-2-бутен-1-ил-диазофенилацетат (Продукт 48-2)
Продукт 48-1
DBU (9,26 мл) и 4-ацетамидбензолсульфонил азид (13,5 г) добавляли в ацетонитрильный раствор (100 мл) соединения Продукта 48-1 (11,5 г) в то время, как раствор перемешивали при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 15 часов. Реакционный раствор концентрировали при пониженном давлении и затем в него добавляли воду. Полученную смесь затем экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, высушивали над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-19:1) с тем, чтобы получить титульное соединение (8,45 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,75 (с, 3H), 1,78 (с, 3H), 4,77 (д, J=7,6 Гц, 2H), 5,36-5,44 (м, 1H), 7,15-7,20 (м, 1H), 7,35-7,41 (м, 2H), 7,45-7,51 (м, 2H).
[0208]
(3) 6,6-Диметил-1-фенил-3-оксабицикло[3.1.0]гексан-2-он (Продукт 48-3)
При перемешивании при 50°C дихлорметановый раствор (180 мл) Продукта 48-2 (8,45 г) добавляли по каплям в дихлорметановый раствор (360 мл) димера ацетата родия(II) (324 мг) в течение 2 часов. После этого реакционный раствор перемешивали при 50°C в течение 1 часа. После этого реакционный раствор охлаждали до комнатной температуры и затем концентрировали растворитель при пониженном давлении с тем, чтобы получить необработанное титульное соединение (8 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,88 (с, 3H), 1,32 (с, 3H), 2,39 (д, J=5,2 Гц, 1H), 4,25 (д, J=9,6 Гц, 1H), 4,53 (дд, J=9,6, 5,2 Гц, 1H), 7,27-7,39 (м, 5H).
[0209]
(4) (3,3-Диметил-1-фенилциклопропан-1,2-диил)диметанол (Продукт 48-4)
Алюмогидрид лития (1,5 г) добавляли в THF-раствор (100 мл) Продукта 48-3 (8 г) в то время, как раствор перемешивали при охлаждении на льду. Полученную смесь перемешивали в течение 1 часа. После этого лед и небольшое количество 27% водного раствора аммиака добавляли в реакционный раствор и полученную смесь затем перемешивали при комнатной температуре в течение 10 минут. После этого добавляли целит и сульфат магния в реакционный раствор и полученную смесь затем перемешивали в течение 10 минут. После этого реакционный раствор фильтровали и фильтрат затем концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (6,52 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,78 (с, 3H), 1,25 (с, 3H), 1,49 (дд, J=7,0, 5,8 Гц, 1H), 3,72 (дд, J=12,2, 11,0 Гц, 1H), 3,89 (д, J=12,0 Гц, 1H), 4,03 (д, J=12,2 Гц, 1H), 4,10 (дд, J=11,8, 5,8 Гц, 1H), 7,21-7,37 (м, 5H).
[02010]
(5) 2-{[(2,4-Диметилпиримидин-5-ил)окси]метил}-3,3-диметил-2-фенилциклопропанкарбоновая кислота (Продукт 48-5)
Титульное соединение синтезировали из Продукта 48-4 в соответствии со способом из примеров получения 13-(6) и 13-(7).
MS [M+H]+=327
[0211]
Пример получения 49
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенилциклопропил)метанола (Продукт 14-4)
[Формула 53]
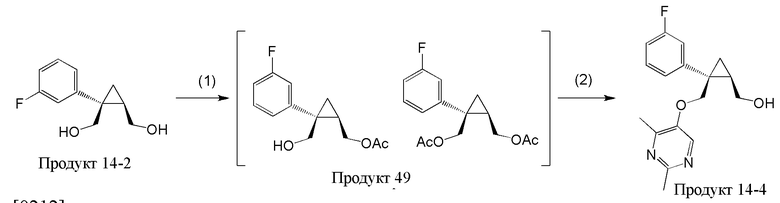
[0212]
(1) Смесь [(1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил]метилацетата, [(1S,2R)-1-(3-фторфенил)-1,2-диил]бис(метилен)диацетата (Продукт 49)
Липазу из candida antarctica, иммобилизированную на акриловой смоле (SIGMA, 1,78 г), добавляли в раствор в THF (110 мл)-винилацетате (25 мл) соединения Продукта 14-2 (35,5 г) при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 17 часов. После этого реакционный раствор фильтровали и полученный фильтрат концентрировали с тем, чтобы получить титульное соединение (43,7 г).
MS [M+H]+=239,281
[0213]
(2) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенилциклопропил)метанол (Продукт 14-4)
Диизопропилазодикарбоксилат (45,8 мл) добавляли по каплям в THF-раствор (400 мл) соединения Продукта 49 (43,7 г), трифенилфосфина (57 г) и 2,4-диметил-пиримидин-5-ола (Продукт 4-2, 24,7 г) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 15 часов. После этого насыщенный водный раствор бикарбоната натрия добавляли в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния и затем концентрировали. Полученный продукт реакции растворяли в EtOH-1N водном растворе гидроксида натрия (200 мл-200 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. После этого 5N водный раствор гидроксида натрия (100 мл) добавляли в реакционный раствор и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Далее реакционный раствор концентрировали при пониженном давлении при комнатной температуре и полученный остаток затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении и затем остаток очищали с помощью колоночной хроматографии на силикагеле (от смеси гептан:этилацетат=1:4 к смеси этилацетат:метанол=1:1). Полученный неочищенный продукт фильтровали через подушку из NH-силикагеля (этилацетатом) с последующим концентрированием растворителя при пониженном давлении с тем, чтобы получить титульное соединение (39,3 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,00 (т, J=5,2 Гц, 1H), 1,24-1,30 (м, 1H), 1,79-1,85 (м, 1H), 2,39 (с, 3H), 2,60 (с, 3H), 3,55-3,61 (м, 1H), 4,03-4,13 (м, 1H), 4,12 (д, J=9,6 Гц, 1H), 4,43 (д, J=9,6 Гц, 1H), 6,92-6,98 (м, 1H), 7,11-7,15 (м, 1H), 7,19-7,22 (м, 1H), 7,25-7,31 (м, 1H), 8,00 (с, 1H).
[0214]
Пример получения 50
Синтез (1R,2S)-2-(3,5-дифторфенил)-2-[2-(4-метоксибензилокси)-4-(трифторметилпиримидин-5-ил)оксиметил]циклопропанкарбоновой кислоты (Продукт 50-7)
[Формула 54]
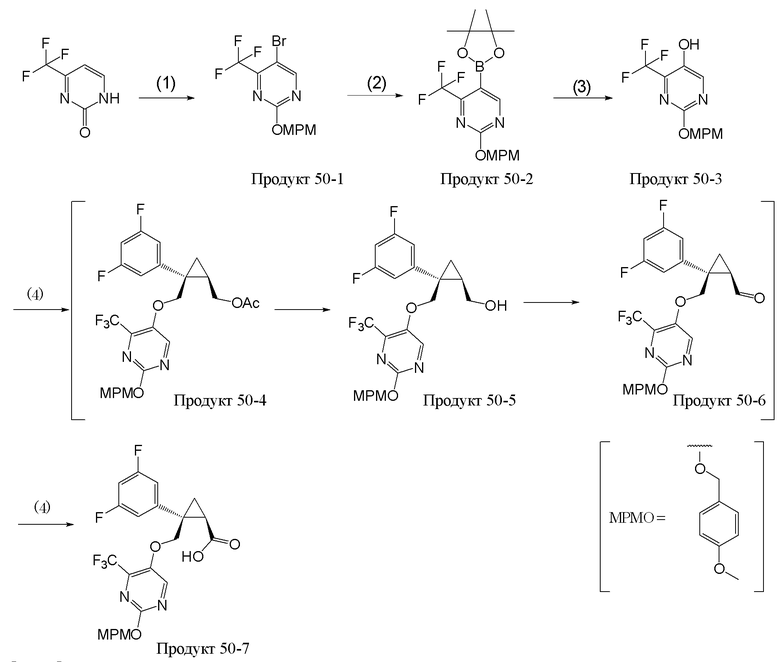
[0215]
1) 5-Бром-2-(4-метоксибензилокси)-4-трифторметилпиримидин (Продукт 50-1)
Ацетат калия (15,3 г) добавляли в раствор (50 мл) в уксусной кислоте 4-(трифторметил)пиримидин-2(1H)-она (CAS № 104048-92-2; 8,4 г) и после этого добавляли по каплям бром (2,6 мл) в раствор при 40°C. Полученную смесь перемешивали при 70°C в течение 1,5 часов. После этого реакционную смесь концентрировали при пониженном давлении и затем добавляли воду и этилацетат в остаток для осуществления разделения жидкости и экстракции. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Оксихлорид фосфора (40 мл) добавляли в полученный остаток и полученную таким образом смесь затем перемешивали в течение 1,5 часов при нагревании с обратным холодильником. Реакционную смесь концентрировали при пониженном давлении и оксихлорид фосфора затем отгоняли. После этого добавляли к остатку лед и осуществляли разделение жидкости и экстракцию гексаном. Полученный органический слой сушили над сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении с тем, чтобы получить неочищенный продукт.
Гидрид натрия (60% масляная дисперсия: 2,05 г) добавляли в THF-раствор (150 мл) 4-метоксибензилового спирта (7,07 г) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. THF-раствор полученного ранее неочищенного продукта добавляли по каплям в реакционную смесь и полученную смесь затем перемешивали в течение ночи. После этого насыщенный водный раствор хлорида аммония добавляли в реакционную смесь с последующим быстрым охлаждением. THF отгоняли при пониженном давлении и осуществляли разделение жидкости и экстракцию этилацетатом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-3:1) с тем, чтобы получить титульное соединение (12,5 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,81 (с, 3H), 5,40 (с, 2H), 6,87-6,90 (м, 2H), 7,43 (шир.шир.д, J=7,6 Гц, 2H), 8,76 (с, 1H).
[0216]
(2) 2-(4-Метоксибензилокси)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4-трифторметилпиримидин (Продукт 50-2)
Ацетат калия (9,3 г) и бис(пинаколато)дибор (9,63 г) добавляли в 1,4-диоксановый раствор (130 мл) соединения Продукта 50-1 (11,5 г) и затем проводили деаэрацию и замещение азотом в полученном растворе. После этого 1,1-бис(дифенилфосфино)ферроцендихлорпалладий(II) добавляли в реакционный раствор и полученную смесь нагревали с обратным холодильником при 110°C в течение 6 часов. После этого реакционную смесь немного концентрировали при пониженном давлении и отгоняли 1,4-диоксан. Затем этилацетат добавляли в полученный продукт и затем реакционный раствор фильтровали. Фильтрат концентрировали при пониженном давлении и затем очищали полученный остаток с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-1:2) с тем, чтобы получить титульное соединение (8,0 г).
MS [M+H]+=433.
[0217]
(3) 2-(4-Метоксибензилокси)-4-трифторметилпиримидин-5-ол (Продукт 50-3)
30% водный пероксид водорода (502 мкл) и 2N водный раствор гидроксида натрия (2,44 мл) добавляли в THF-раствор (20 мл) соединения Продукта 50-2 (2 г) при охлаждении на льду и полученную смесь затем перемешивали в течение 15 минут. После этого реакционный раствор дополнительно перемешивали при комнатной температуре в течение 30 минут. После этого 1N водный раствор соляной кислоты добавляли в реакционную смесь и доводили pH смешанного раствора до приблизительно pH 5. Проводили разделение жидкости и экстракцию диэтиловым эфиром в реакционном растворе. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-1:1) с тем, чтобы получить титульное соединение (980 мг).
MS [M+Na]+=323.
[0218]
(4) (1R,2S)-2-(3,5-дифторфенил)-2-[2-(4-метоксибензилокси)]-4-(трифторметилпиримидин-5-ил)оксиметил)циклопропанкарбоновая кислота (Продукт 50-7)
Титульное соединение получали из соединения Продукта 49 и соединения Продукта 50-3 в соответствии со способами из примера получения 13-(4)-13-(7).
MS [M+Na]+=533.
[0219]
Пример получения 51
Синтез (1R,2S)-2-[2-(2,4-диметилпиримидин-5-ил)этил]-2-фенилциклопропанкарбоновой кислоты (Продукт 51-9)
[Формула 55]
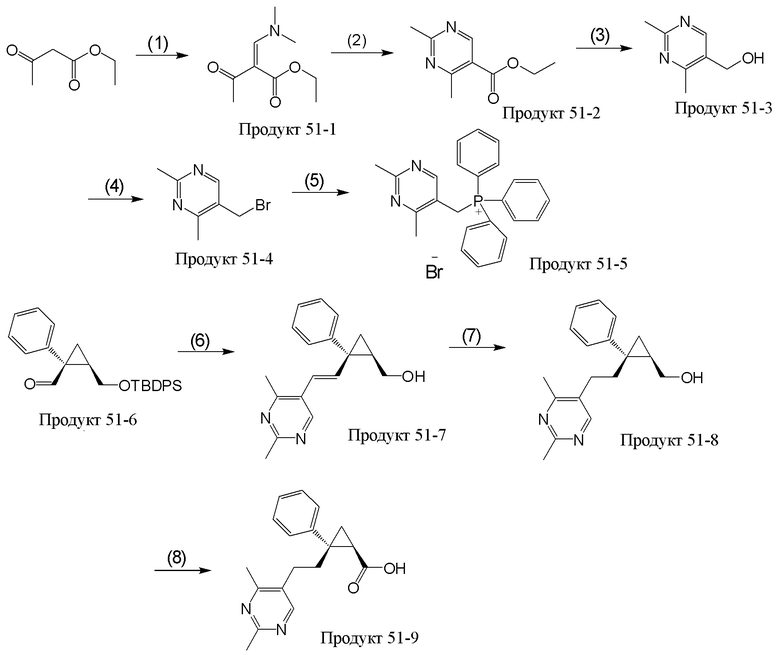
[0220]
(1) Этил-2-[(диметиламино)метилен]-3-оксобутаноат (Продукт 51-1)
N,N-диметилформамиддиметилацеталь (80,4 мл) добавляли по каплям в этилацетоацетат (63 г) и полученную смесь затем перемешивали при комнатной температуре в течение 14 часов. После этого реакционный раствор концентрировали при пониженном давлении и затем проводили азеотропную перегонку с толуолом три раза с тем, чтобы получить неочищенное титульное соединение (89 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,33 (т, J=7,2 Гц, 3H), 2,33 (с, 3H), 3,07 (шир.с, 6H), 4,23 (кв. J=7,2 Гц, 2H), 7,68 (с, 1H).
[0221]
(2) Этил-2,4-диметилпиримидин-5-карбоксилат (Продукт 51-2)
Соединение Продукта 51-1 (10 г), гидрохлорид ацетамидина (5,11 г) и этилат натрия (3,67 г) растворяли в этаноле (100 мл) и полученную смесь затем перемешивали при 100°C в течение 5 часов. После этого температуру реакционного раствора возвращали до комнатной температуры и затем концентрировали реакционный раствор при пониженном давлении. Воду добавляли к остатку и затем экстрагировали полученную смесь этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния с последующим концентрированием под вакуумом с тем, чтобы получить неочищенное титульное соединение (8,76 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,41 (т, J=7,0 Гц, 3H), 2,75 (с, 3H), 2,80 (с, 3H), 4,40 (кв. J=7,0 Гц, 2H), 9,05 (с, 1H).
[0222]
(3) (2,4-Диметилпиримидин-5-ил)метанол (Продукт 51-3)
THF-раствор (30 мл) соединения Продукта 51-2 (8,76 г) добавляли по каплям в суспензию (50 мл) в THF алюмогидрида лития (1,84 г) в то время, как раствор перемешивали при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После этого, пока реакционный раствор перемешивали при охлаждении на льду, 27% водный раствор аммиака и целит последовательно добавляли к нему и полученную смесь затем перемешивали в течение 30 минут. После этого сульфат магния добавляли в реакционный раствор с последующей фильтрацией. Фильтрат затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат (9:1-3:2) к смеси этилацетат:метанол (9:1)) с тем, чтобы получить титульное соединение (670 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,52 (с, 3H), 2,68 (с, 3H), 4,71 (с, 2H), 8,50 (с, 1H).
[0223]
(4) 5-Бромметил-2,4-диметилпиримидин (Продукт 51-4)
Трибромид фосфора (0,912 мл) добавляли в раствор в толуоле и дихлорметане (10 мл-5 мл) соединения Продукта 51-3 (670 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 3 часов. После этого добавляли лед в реакционный раствор в то время, как раствор перемешивали при охлаждении на льду, и затем добавляли насыщенный водный раствор бикарбоната натрия в реакционный раствор. Полученную смесь экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния с последующим концентрированием под вакуумом с тем, чтобы получить неочищенное титульное соединение (354 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,58 (с, 3H), 2,70 (с, 3H), 4,44 (с, 2H), 8,48 (с, 1H).
[0224]
(5) Бромид [(2,4-диметилпиримидин-5-ил)метил]трифенилфосфония (Продукт 51-5)
Трифенилфосфин (462 мг) добавляли в толуольный раствор (15 мл) соединения Продукта 51-4 (354 мг) и полученную смесь затем перемешивали при 140°C в течение 5 часов. Температуру реакционного раствора доводили до комнатной температуры и осажденное твердое вещество затем собирали фильтрацией с последующей промывкой трет-бутилметиловым эфиром с тем, чтобы получить титульное соединение (610 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,87 (д, J=1,2 Гц, 3H), 2,62 (д, J=1,6 Гц, 3H), 5,68 (д, J=14,4 Гц, 2H), 7,64-7,75 (м, 6H), 7,77-7,88 (м, 9H), 8,36 (д, J=2,4 Гц, 1H).
[0225]
(6) (1R,2S)-2-[(E,Z)-2-(2,4-диметилпиримидин-5-ил)винил]-2-фенилциклопропилметанол (Продукт 51-7)
К THF-раствору (7 мл) соединения Продукта 51-5 (610 мг) добавляли н-бутиллитий (2,64M раствор в н-гексане: 0,5 мл) при перемешивании при -78°C. Полученную смесь перемешивали при такой же температуре, как описано выше, в течение 30 минут. После этого THF-раствор (4 мл) (1S,2R)-2-(трет-бутилдифенилсилилоксиметил)-1-фенилциклопропанкарбальдегида (Продукт 51-6, 602 мг), который получили из соединения Продукта 13-3 в соответствии со способом из примера получения 53-(1), добавляли в реакционный раствор и полученную смесь затем перемешивали при 0°C в течение 4 часов. После этого добавляли воду и небольшое количество уксусной кислоты в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния с последующим концентрированием под вакуумом. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-4:1). Полученное соединение растворяли в THF (10 мл) и затем добавляли фторид тетрабутиламмония (1M раствор THF: 2,64 мл) в полученный раствор. Полученную смесь перемешивали при комнатной температуре в течение 12 часов. После этого реакционный раствор концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат (9:1-0:1) к смеси этилацетат:метанол (19:1)) с тем, чтобы получить титульное соединение (113 мг).
MS [M+H]+=281
[0226]
(7) (1R,2S)-2-[2-(2,4-диметилпиримидин-5-ил)этил]-2-фенилциклопропилметанол (Продукт 51-8)
10% палладий на углероде (содержание воды: 50%, 100 мг) добавляли в этилацетатный раствор (20 мл) соединения Продукта 51-7 (113 мг) и затем проводили каталитическое восстановление водородом полученного раствора при комнатной температуре при нормальном давлении в течение 30 минут. После этого реакционный раствор фильтровали через целит и затем концентрировали фильтрат при пониженном давлении с тем, чтобы получить неочищенное титульное соединение (80 мг).
MS [M+H]+=283
[0227]
(8) (1R,2S)-2-[2-(2,4-диметилпиримидин-5-ил)этил]-2-фенилциклопропанкарбоновая кислота (Продукт 51-9)
Титульное соединение синтезировали из соединения Продукта 51-8 в соответствии со способом из примеров получения 13-(6) и 13-(7).
MS [M+H]+=297
[0228]
Пример получения 52
Синтез 2,4-диметилпиримидин-5-амина (Продукт 52-2)
Исходное вещество синтезировали согласно способу, описанному в Heterocycles, 57(11), 2045-2064, 2002.
[Формула 56]
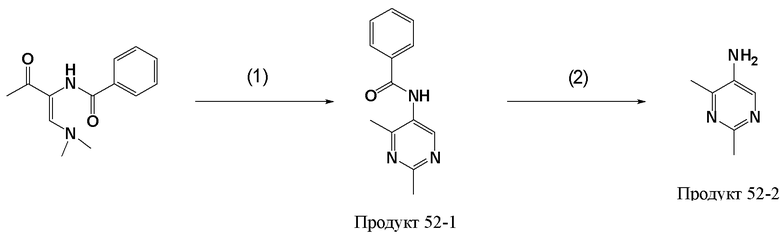
[0229]
(1) N-(2,4-диметилпиримидин-5-ил)бензамид (Продукт 52-1)
Гидрохлорид ацетамидина (8,31 г) и карбонат калия (6,06 г) добавляли в этанольный раствор (55,6 мл) N-{(1Z)-1-[(диметиламино)метилен]-2-оксопропил}бензамида (6,8 г) и температуру полученной смеси затем повышали до 70°C с последующим перемешиванием в течение 15 часов. После этого реакционный раствор концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=4:1-0:10) с тем, чтобы получить титульное соединение (4,1 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,53 (с, 3H), 2,72 (с, 3H), 7,44-7,64 (м, 3H), 7,89-7,92 (м, 2H), 8,01 (с, 1H).
[0230]
(2) 2,4-Диметилпиримидин-5-амин (Продукт 52-2)
Соединение Продукта 52-1 (4,0 г) растворяли в этаноле (20 мл)-2N водном растворе гидроксида натрия (20 мл) и полученный раствор затем перемешивали при 70°C в течение 1 суток. После этого реакционный раствор экстрагировали этилацетатом и хлороформом, и затем сушили органический слой над сульфатом магния с последующей фильтрацией. Органический слой концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (1,63 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,38 (с, 3H), 2,59 (с, 3H), 3,52 (шир.с, 2H), 8,01 (с, 1H).
[0231]
Пример получения 53
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)(метил)амино]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты (Продукт 53-6)
[Формула 57]
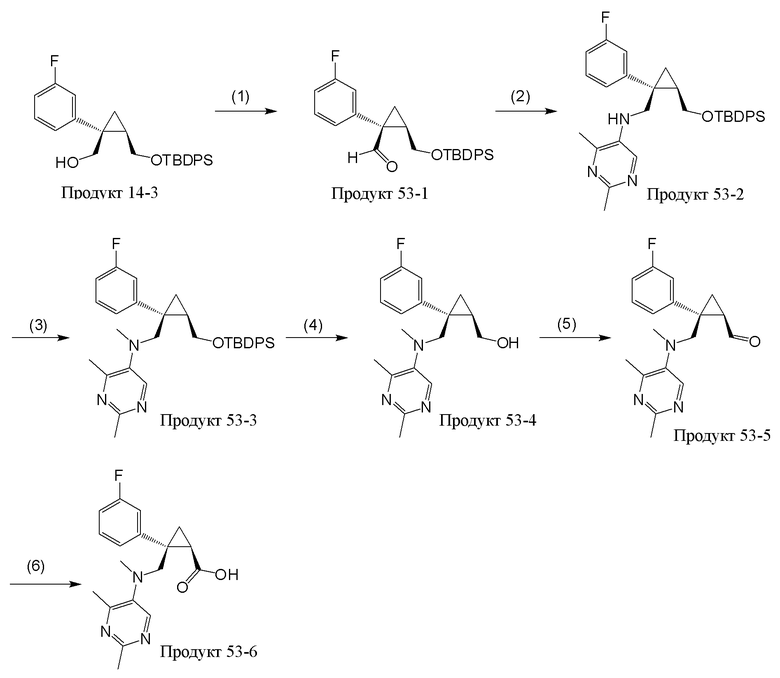
[0232]
(1) (1R,2S)-2-(трет-бутилдифенилсилилоксиметил)-1-(3-фторфенил)циклопропанкарбальдегид (Продукт 53-1)
Дихлорметановый раствор (50 мл) оксалилхлорида (1,26 мл) охлаждали до -78°C и затем добавляли по каплям дихлорметановый раствор (10 мл) диметилсульфоксида (2,04 мл) в реакционный раствор. Через пятнадцать минут добавляли по каплям дихлорметановый раствор (12 мл) соединения Продукта 14-3 (3,0 г) в реакционный раствор при -78°C и полученную смесь затем перемешивали при такой же температуре, как описано выше, в течение 60 минут. После этого триэтиламин (8,03 мл) добавляли в реакционный раствор и температуру полученной смеси затем поднимали до 0°C с последующим перемешиванием в течение 2 часов. После этого добавляли насыщенный водный раствор хлорида аммония в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=10:0-4:1) с тем, чтобы получить титульное соединение (3,7 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,07 (с, 9H), 1,53 (дд, J=8,2, 4,8 Гц, 1H), 1,76 (дд, J=7,2, 5,2 Гц, 1H), 1,90-2,10 (м, 1H), 3,68 (дд, J=12,4, 9,6 Гц, 1H), 4,08 (дд, J=11,6, 9,6 Гц, 1H), 6,98-7,16 (м, 3H), 7,46-7,63 (м, 7H), 7,64-7,73 (м, 4H), 9,59 (с, 1H).
[0233]
(2) N-[(1S,2R)-2-(трет-бутилдифенилсилилоксиметил)-1-(3-фторфенил)циклопропилметил}-2,4-диметилпиримидин-5-амин (Продукт 53-2)
Уксусную кислоту (1,5 мл) добавляли в хлороформный раствор (60 мл) соединения Продукта 53-1 (3,7 г) и соединения Продукта 52-2 (1,37 г) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. После этого триацетоксиборгидрид натрия (5,44 г) добавляли в реакционный раствор, и полученную смесь затем перемешивали в течение 15 часов. После этого добавляли насыщенный водный раствор бикарбоната натрия в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Полученный экстракт сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-0:10) с тем, чтобы получить титульное соединение (4,26 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,75 (т, J=5,2 Гц, 1H), 1,09-1,13 (м, 1H), 1,11 (с, 9H), 1,54-1,62 (м, 1H), 2,08 (с, 3H), 2,56 (с, 3H), 3,32 (д, J=12,8 Гц, 1H), 3,50 (д, J=12,8 Гц, 1H), 3,59 (дд, J=11,6, 10,0 Гц, 1H), 4,16 (дд, J=11,6, 6,0 Гц, 1H), 6,90-6,96 (м, 1H), 7,04-7,08 (м, 1H), 7,13-7,16 (м, 1H), 7,25-7,47 (м, 7H), 7,63-7,69 (м, 4H), 7,79 (с, 1H).
[0234]
(3) N-{[(1S,2R)-2-(трет-бутилдифенилсилилоксиметил)-1-(3-фторфенил)циклопропилметил}-N,2,4-триметилпиримидин-5-амин (Продукт 53-3)
Формальдегид (1,59 мл) и триацетоксиборгидрид натрия (3,71 г) добавляли в ацетонитрильный раствор (30 мл) соединения Продукта 53-2 (4,62 г) и полученную смесь затем перемешивали в течение 1 часа. После этого формальдегид (1,59 мл) и триацетоксиборгидрид натрия (3,71 г) дополнительно добавляли в реакционный раствор и полученную смесь затем перемешивали в течение 30 минут. После этого добавляли насыщенный водный раствор бикарбоната натрия в реакционный раствор и полученную смесь экстрагировали этилацетатом. Полученный в результате экстракт сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-0:10) с тем, чтобы получить титульное соединение (4,26 г).
MS [M+H]+=555
[0235]
(4) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)(метил)амино]метил}-2-(3-фторфенил)циклопропил]метанол (Продукт 53-4)
Фторид тетрабутиламмония (1M раствор THF: 17,5 мл) добавляли по каплям в THF-раствор (30 мл) соединения Продукта 53-3 (3,23 г) при комнатной температуре и полученную смесь затем перемешивали при комнатной температуре в течение 17 часов. После этого концентрировали реакционный раствор при пониженном давлении остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:1-0:10) с тем, чтобы получить титульное соединение (1,84 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,80 (т, J=5,2 Гц, 1H), 1,18 (дд, J=9,2, 5,2 Гц, 1H), 1,54-1,64 (м, 1H), 2,20 (с, 3H), 2,57 (с, 3H), 2,69 (с, 3H), 3,35 (д, J=13,6 Гц, 1H), 3,47 (д, J=13,6 Гц, 1H), 3,60 (дд, J=11,6, 9,2 Гц, 1H), 4,03 (дд, J=11,6, 9,2 Гц, 1H), 6,82-6,87 (м, 1H), 6,92-6,96 (м, 1H), 7,01-7,04 (м, 1H), 7,13-7,19 (м, 1H), 8,10 (с, 1H).
[0236]
(5) [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)(метил)амино]метил}-2-(3-фторфенил)циклопропанкарбальдегид (Продукт 53-5)
Дихлорметановый раствор (40 мл) оксалилхлорида (343 мкл) охлаждали до -78°C, и дихлорметановый раствор (10 мл) диметилсульфоксида (560 мкл) затем добавляли по каплям к нему. Через тридцать минут добавляли по каплям дихлорметановый раствор (9,6 мл) соединения Продукта 53-4 (620 мг) в реакционный раствор при -78°C и полученную смесь затем перемешивали при такой же температуре, как описано выше, в течение 30 минут. После этого триэтиламин (8,03 мл) добавляли в реакционный раствор и полученную смесь затем перемешивали в течение 30 минут. После этого температуру реакционного раствора повышали до 0°C и реакционный раствор затем перемешивали в течение 2 часов. После этого добавляли насыщенный водный раствор бикарбоната натрия в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=2:3-0:10) с тем, чтобы получить титульное соединение (617 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,60-1,67 (м, 1H), 1,78 (т, J=5,6 Гц, 1H), 2,08 (с, 3H), 2,26-2,32 (м, 1H), 2,58 (с, 3H), 2,66 (с, 3H), 3,42 (д, J=14,0 Гц, 1H), 3,53 (д, J=14,0 Гц, 1H) 6,91-7,06 (м, 3H), 7,21-7,27 (м, 1H), 8,07 (с, 1H), 9,74 (д, J=4,0 Гц, 1H).
[0237]
(6) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)(метил)амино]метил}-2-(3-фторфенил)циклопропанкарбоновая кислота (Продукт 53-6)
2-Метил-2-бутен (1,08 мл), безводный дигидрофосфат натрия (731 мг) и хлорит натрия (367 мг) добавляли в водно-ацетоновый раствор (10 мл) соединения Продукта 53-5 (617 мг) при комнатной температуре и полученную смесь затем перемешивали в течение 2 часов. После этого реакционный раствор экстрагировали этилацетатом и органический слой затем промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и затем очищали остаток с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат=1:4 к смеси этилацетат:метанол=4:1) с тем, чтобы получить титульное соединение (632 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,60-1,63 (м, 2H), 2,03-2,08 (м, 1H), 2,08 (с, 3H), 2,60 (с, 3H), 2,66 (с, 3H), 3,56 (д, J=12,8 Гц, 1H), 3,64 (д, J=12,8 Гц, 1H), 6,91-6,97 (м, 1H), 7,04-7,08 (м, 1H), 7,11-7,14 (м, 1H), 7,23-7,29 (м, 1H), 8,39 (с, 1H).
[0238]
Пример получения 54
Синтез (1R,2S)-2-[(2,4-диметоксипиримидин-5-ил)(метил)амино]метил-2-фенилциклопропанкарбоновой кислоты (Продукт 54)
Титульное соединение синтезировали тем же образом, как таковое в примере получения 53.
[Формула 58]
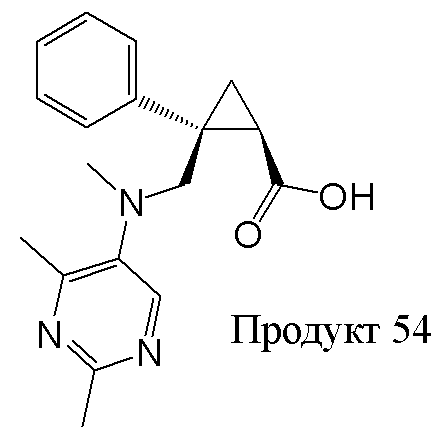
[0239]
MS [M+H]+=312
[0240]
Пример получения 55
Синтез (1S,2R)-2-[(трет-бутоксикарбонил)(2-метил-4-трифторметилпиримидин-5-ил)амино]метил-2-(3-фторфенил)циклопентанкарбоновой кислоты (Продукт 55-6)
[Формула 59]
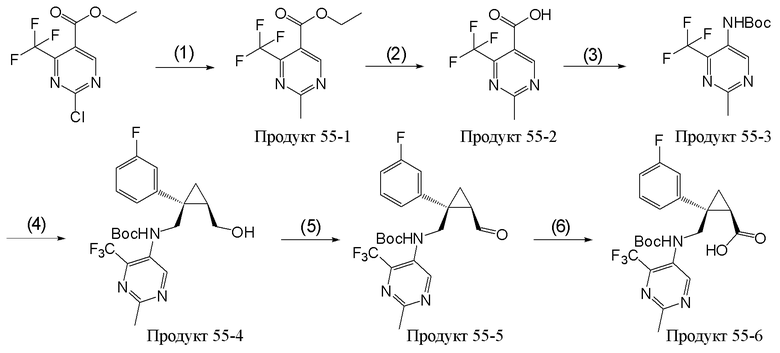
[0241]
(1) Этил-2-метил-4-трифторметилпиримидинкарбоксилат (Продукт 55-1)
Этил-2-хлор-4-(трифторметил)пиримидин-5-карбоксилат (9,7 г) растворяли в THF (100 мл) и после этого триметилалюминий (38,1 мл, 2M) и тетракис(трифенилфосфин)палладий(0) добавляли в полученный раствор. Полученную смесь перемешивали при 70°C в течение ночи. После этого реакционную смесь охлаждали до комнатной температуры и добавляли по каплям насыщенный водный раствор хлорида аммония и 5N водный раствор соляной кислоты в реакционный раствор при охлаждении на льду. После этого добавляли воду в реакционный раствор в момент времени, в который закончилось пенообразование, и разделение жидкости и экстракцию осуществляли этилацетатом. Органический слой сушили над сульфатом магния и растворитель затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-2:1) с тем, чтобы получить титульное соединение (8,1 г).
MS [M+H]+=235.
[0242]
(2) 2-Метил-4-трифторметилпиримидин-5-карбоксилат (Продукт 55-2)
2N водный раствор гидроксида натрия (26 мл) добавляли в раствор в THF-этаноле (80 мл-20 мл) соединения Продукта 55-1 (8,1 г) и полученную смесь затем перемешивали при комнатной температуре в течение 2 часов. После этого завершение реакции подтверждали с помощью LC-MS и затем добавляли 1N водный раствор соляной кислоты в реакционный раствор для его нейтрализации. Затем реакционный раствор концентрировали при пониженном давлении и затем отгоняли THF и этанол. 2N водный раствор соляной кислоты добавляли в остаток для доведения значения его pH до pH 2-3 и осуществляли разделение жидкости и экстракцию этилацетатом. Органический слой сушили над сульфатом магния. Растворитель концентрировали при пониженном давлении с тем, чтобы получить неочищенное титульное соединение (6,2 г).
MS [M+H]+=207.
[0243]
(3) Трет-бутил(2-метил-4-трифторметилпиримидин-5-ил)карбамат (Продукт 55-3)
Триэтиламин (10,3 мл) и дифенилфосфорилазид (9,55 мл) добавляли в раствор в толуоле-трет-бутаноле (50 мл-50 мл) соединения Продукта 55-2 (6,2 г). Полученную смесь перемешивали при 100°C в течение ночи. После этого реакционную смесь охлаждали и воду затем добавляли к ней с последующим концентрированием под вакуумом. Насыщенный водный раствор бикарбоната натрия добавляли к остатку и осуществляли разделение жидкости и экстракцию этилацетатом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-3:1) с тем, чтобы получить титульное соединение (8,0 г).
MS [M+H]+=278.
[0244]
(4) Трет-бутил{[(1S,2R)-1-(3-фторфенил)-2-гидроксиметилциклопропил]метил}(2-метил-4-трифторметилпиримидин-5-ил)карбамат (Продукт 55-4)
Триэтиламин (322 мкл) и метансульфонилхлорид (171 мкл) добавляли в дихлорметановый раствор (6,0 мл) соединения Продукта 49 (500 мг) при охлаждении на льду и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. После этого воду добавляли в реакционную смесь и осуществляли разделение жидкости и экстракцию дихлорметаном. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении с тем, чтобы получить неочищенный продукт. После этого добавляли карбонат цезия и соединение Продукта 55-3 (699 мг) в ацетонитрильный раствор (10 мл) неочищенного продукта и полученную смесь затем перемешивали при 80°C в течение ночи. После этого реакционную смесь охлаждали и затем к ней добавляли воду. Затем осуществляли разделение жидкости и экстракцию этилацетатом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток растворяли в метаноле (5 мл) и затем добавляли 1N водный раствор гидроксида натрия (1,26 мл) в раствор с последующим перемешиванием при комнатной температуре в течение 30 минут. После этого воду добавляли в реакционную смесь и осуществляли разделение жидкости и экстракцию этилацетатом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-1:1) с тем, чтобы получить титульное соединение (200 мг).
MS [M+Na]+=478.
[0245]
(5) Трет-бутил{[(1S,2R)-1-(3-фторфенил)-2-формилциклопропил]метил}(2-метил-4-трифторметилпиримидин-5-ил)карбамат (Продукт 55-5)
Реактив Десса-Мартина добавляли в дихлорметановый раствор (5 мл) соединения Продукта 55-4 (200 мг) при охлаждении на льду. Полученную смесь перемешивали в течение 1 часа и затем добавляли смешанный раствор водного раствора бикарбоната натрия и водный раствор сульфита натрия в реакционную смесь. Полученную смесь перемешивали до тех пор, пока она не становилась прозрачной. Реакционную смесь подвергали разделению жидкостей и экстракции дихлорметаном. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=4:1-1:1) с тем, чтобы получить титульное соединение (180 мг).
MS [M+Na]+=476.
[0246]
(6) (1S,2R)-2-[(трет-бутоксикарбонил)(2-метил-4-трифторметилпиримидин-5-ил)амино]метил-2-(3-фторфенил)циклопропанкарбоновая кислота (Продукт 55-6)
2-Метил-2-бутен (210 мкл), дигидрофосфат натрия (57,2 мг) и хлорит натрия (53,9 мг) добавляли в водно-ацетоновый смешанный растворитель (4 мл-2 мл) соединения Продукта 55-5 (180 мг). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. После этого добавляли воду в реакционный раствор и осуществляли разделение жидкости и экстракцию дихлорметаном. Полученный органический слой сушили над сульфатом магния. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении с тем, чтобы получить неочищенный продукт титульного соединения (186 мг).
MS [M+Na]+=492.
[0247]
Соединение из примера получения 56 (Продукт 56) получали в соответствии со способом из примера получения 13. Однако спирт, соответствующий Продукту 13-5, синтезировали из диола, соответствующего Продукту 13-2, в соответствии со способом из примера получения 49.
[0248]
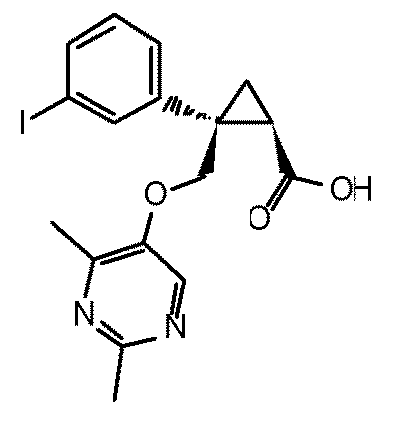
MS [M+H]+=425
[0249]
Пример 1
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамида (1)
[Формула 60]
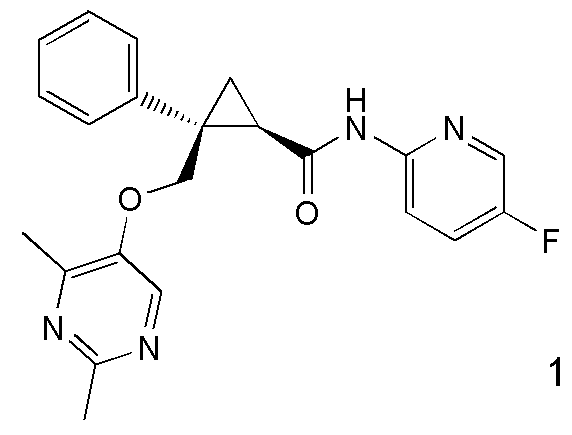
[0250]
Карбоновую кислоту Продукта 13-7 (639 мг) растворяли в дихлорметане (10 мл) и после этого добавляли в раствор оксалилхлорид (367 мкл) и DMF (каталитическое количество). Реакционный раствор перемешивали при комнатной температуре в течение 1 часа. После этого реакционный раствор концентрировали при пониженном давлении с получением неочищенного хлорангидрида. Затем диизопропилэтиламин (848 мкл) добавляли в THF-раствор (10,0 мл) 2-амино-5-фторпиридина (360 мг) и температуру полученной смеси затем повышали до 60°C. THF-раствор (5,0 мл) неочищенного хлорангидрида добавляли по каплям в реакционный раствор и полученную смесь затем перемешивали при такой же температуре, как описано выше, в течение 1 часа. После этого реакционную смесь охлаждали до комнатной температуры и затем перемешивали ее в течение 1 часа. После этого реакционный раствор концентрировали при пониженном давлении и затем распределяли его в этилацетате и воде, чтобы отделить органический слой. Органический слой сушили над безводным сульфатом магния и затем концентрировали фильтрат при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на NH-силикагеле (н-гептан:этилацетат=19:1-3:2). Затем диэтиловый эфир добавляли к полученному продукту интереса. Осажденное твердое вещество собирали с помощью фильтрации и затем сушили с тем, чтобы получить титульное соединение (418 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,60-1,64 (м, 1H), 1,90 (т, J=5,2 Гц, 1H), 2,12 (шир.т, 1H), 2,20 (с, 3H), 2,54 (с, 3H), 4,40 (д, J=9,2 Гц, 1H), 4,51 (д, J=9,2 Гц, 1H), 7,26-7,47 (м, 6H), 7,96 (с, 1H), 8,06-8,12 (м, 2H), 8,33 (шир.с, 1H).
MS [M+H]+=393
[0251]
* Соединения из примеров 2-45 синтезировали реакцией карбоновой кислоты Продукта 13-7 с любым амином тем же способом, что и в примере 1.
[0252]
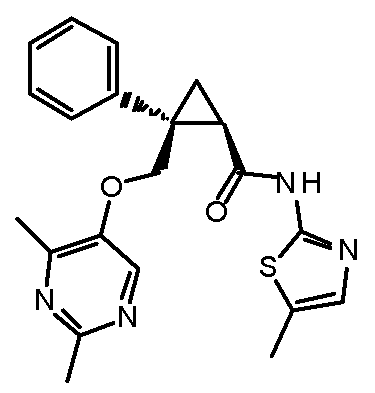
MS [M+H]+=395
MS [M+H]+=395
MS [M+H]+=409
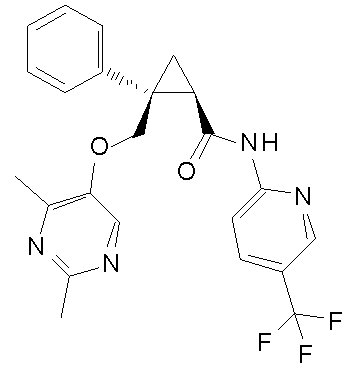
MS [M+H]+=443
[0253]
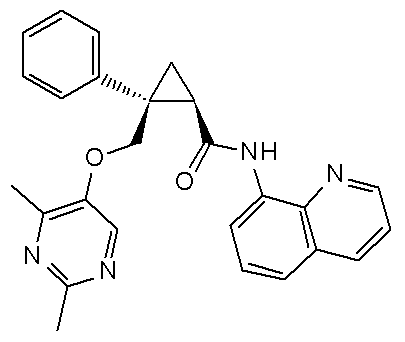
MS [M+H]+=447
MS [M+H]+=447
[0254]
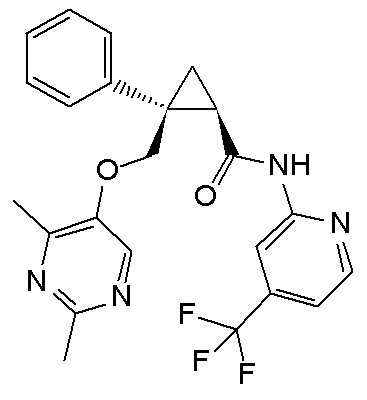
MS [M+H]+=405
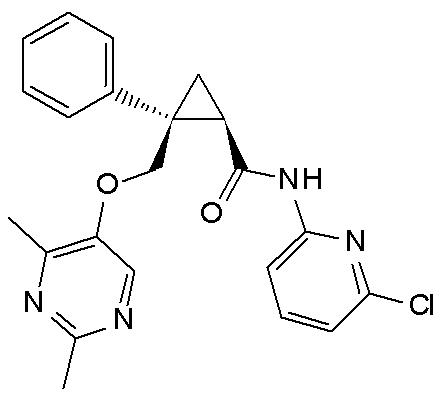
MS [M+H]+=409
MS [M+H]+=425
[0255]
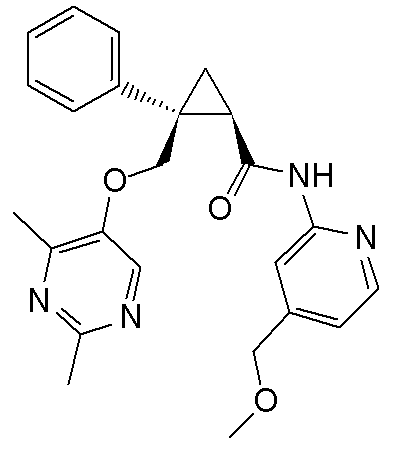
MS [M+H]+=419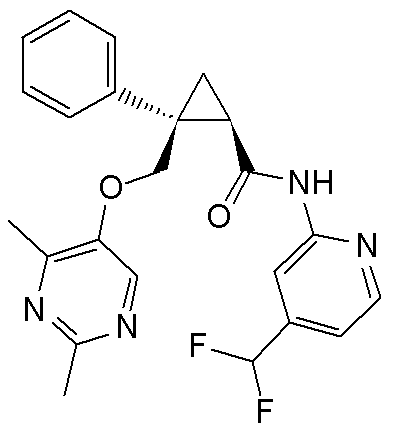
MS [M+H]+=425
[0256]
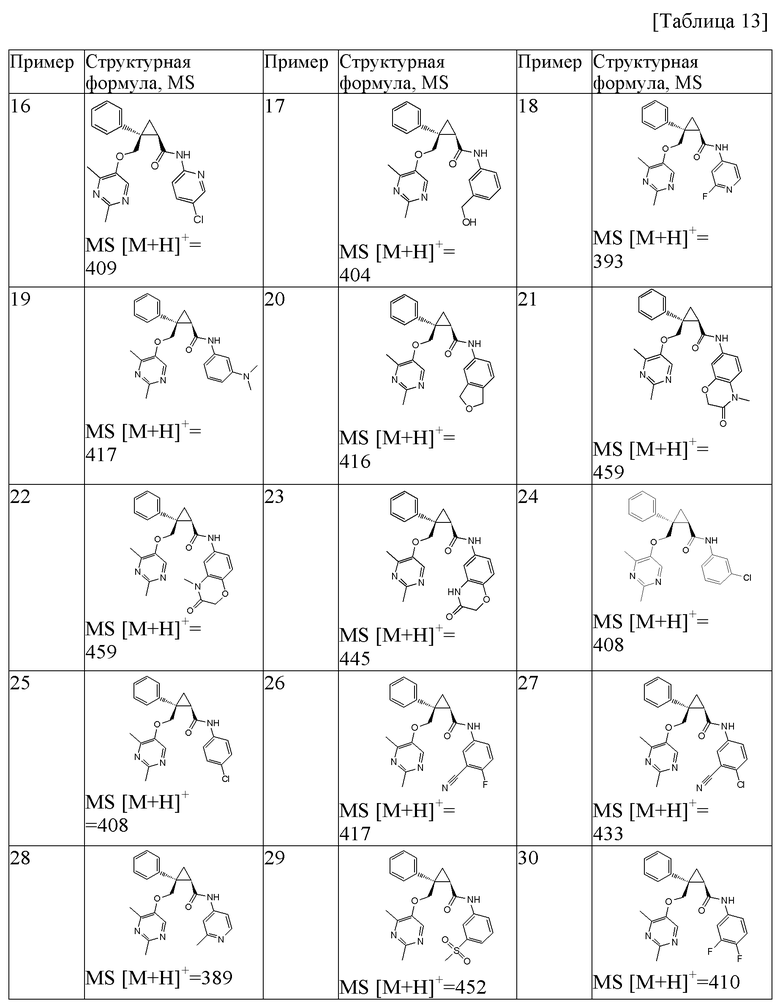
[0257]
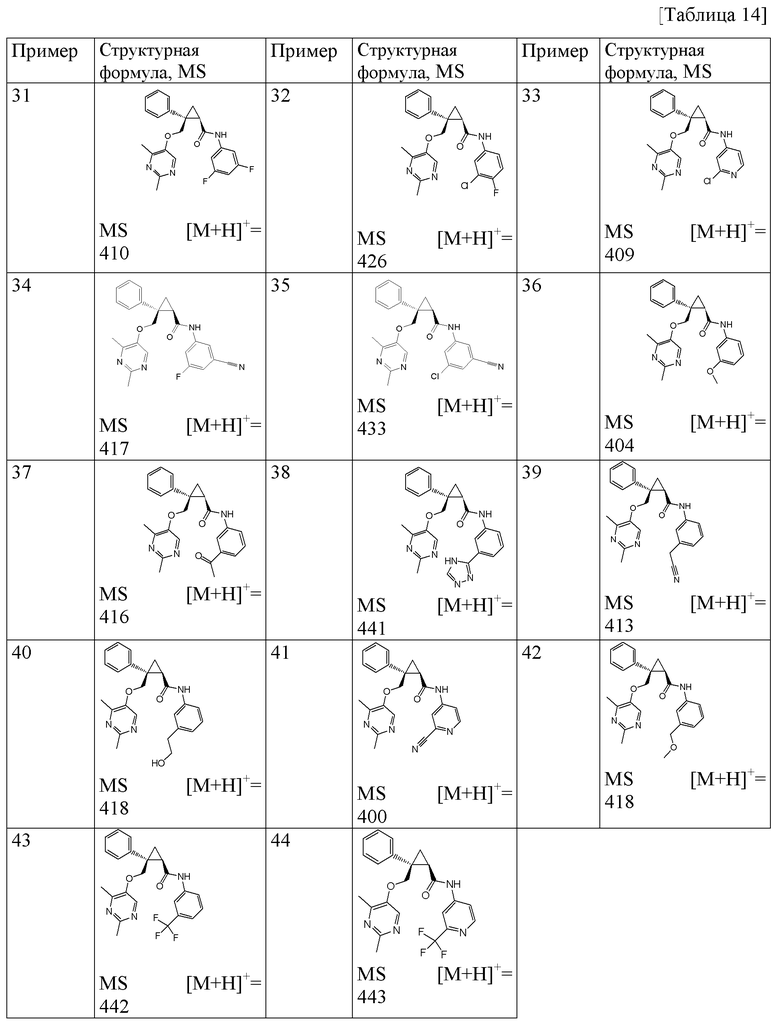
[0258]
Пример 45
Синтез (1R,2S)-N-(5-хлор-4-метилпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамида (45)
[Формула 61]
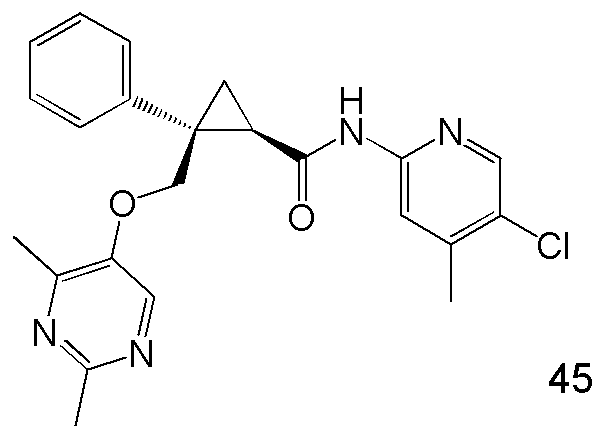
[0259]
Карбоновую кислоту Продукта 13-7 (500 мг) растворяли в дихлорметане (5 мл) и затем добавляли оксалилхлорид (288 мкл) и DMF (несколько капель) в полученный раствор. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После этого реакционный раствор концентрировали при пониженном давлении с тем, чтобы получить неочищенный хлорангидрид. После этого N,N-диизопропилэтиламин (664 мкл) добавляли в 1,4-диоксановый раствор (4,5 мл) 2-амино-5-хлор-4-метилпиридина (359 мг) и температуру полученной смеси повышали до 125°C. 1,4-диоксановый раствор (3 мл) неочищенного хлорангидрида добавляли по каплям в реакционный раствор и при поддерживании температуры полученную смесь перемешивали в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и реакционный раствор затем перемешивали в течение 12 часов. После этого добавляли несколько капель воды в реакционный раствор с последующим концентрированием при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на NH-силикагеле (н-гептан:этилацетат). Полученный продукт промывали эфиром и затем сушили с тем, чтобы получить титульное соединение (95,5 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,54-1,68 (м, 1H), 1,90 (т, J=5,6 Гц, 1H), 2,07-2,16 (м, 1H), 2,21 (с, 3H), 2,35 (с, 3H), 2,55 (с, 3H), 4,40 (д, J=9,6 Гц, 1H), 4,51 (д, J=9,6 Гц, 1H), 7,20-7,50 (м, 5H), 7,97 (с, 1H), 7,98 (с, 1H), 8,16 (с, 1H), 8,27 (с, 1H).
MS [M+H]+=423
[0260]
* Соединения из примеров 46-50 синтезировали реакцией карбоновой кислоты Продукта 13-7 с любым амином тем же способом, что и в примере 45. Очистку проводили с помощью LC-MS.
[0261]
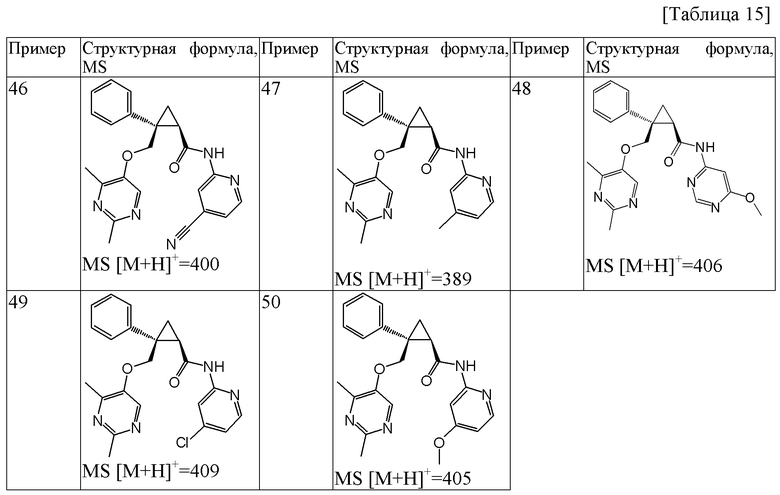
[0262]
Пример 51
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамида (51)
[Формула 62]
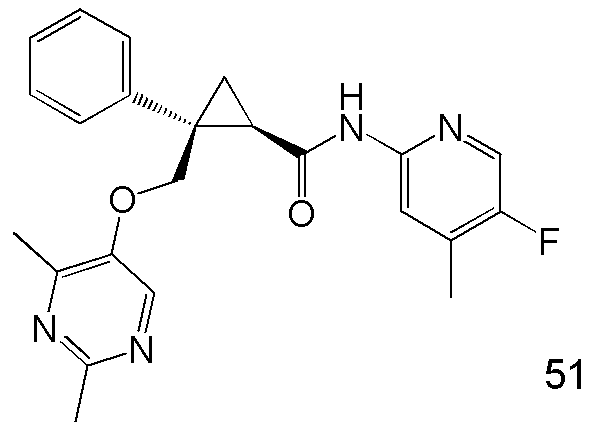
[0263]
Карбоновую кислоту Продукта 13-7 (2,86 г) растворяли в DMF (57 мл) и затем добавляли 2-амино-5-фтор-4-пиколин (1,45 г) и N,N-диизопропилэтиламин (2 мл) к этому раствору. После этого HATU (4,38 г) добавляли к смешанному раствору при охлаждении на льду. Смешанный раствор перемешивали в атмосфере азота при комнатной температуре в течение 3 часов. После этого добавляли 2-амино-5-фтор-4-пиколин (242 мг) в реакционный раствор и полученную смесь дополнительно перемешивали в течение 15 часов. После этого 2-амино-5-фтор-4-пиколин (300 мг) добавляли в реакционный раствор и полученную смесь дополнительно перемешивали в течение 24,5 часов. Далее добавляли воду в реакционный раствор и затем смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат). Полученный целевой продукт растворяли в этилацетате (2 мл) и гексане (24 мл) при 60°C и оставляли ее в течение ночи при постепенном охлаждении полученной смеси до комнатной температуры. После этого осажденное твердое вещество собирали с помощью фильтрации и затем сушили с тем, чтобы получить титульное соединение (2,4 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,56-1,66 (м, 1H), 1,90 (т, J=4,8 Гц, 1H), 2,10 (дд, J=8,0, 6,0 Гц, 1H), 2,21 (с, 3H), 2,24-2,30 (м, 3H), 2,55 (с, 3H), 4,41 (д, J=9,6 Гц, 1H), 4,51 (д, J=9,6 Гц, 1H), 7,20-7,54 (м, 5H), 7,90-8,04 (м, 3H), 8,25 (с, 1H).
MS [M+H]+=407
[0264]
* Соединения из примеров 52-72 синтезировали реакцией карбоновой кислоты Продукта 13-7 с любым амином тем же способом, что и в примере 51.
[0265]
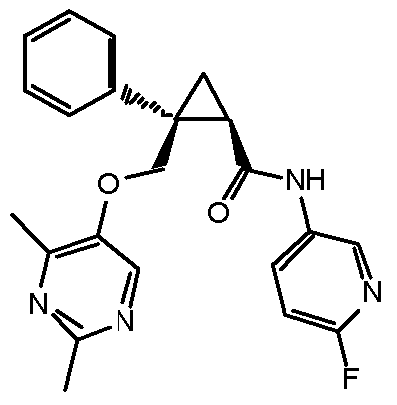
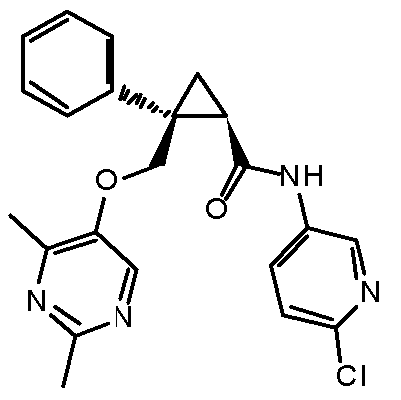
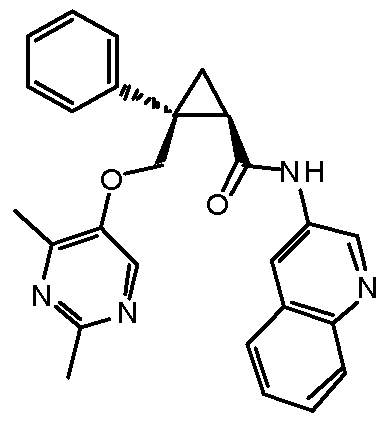
[0266]
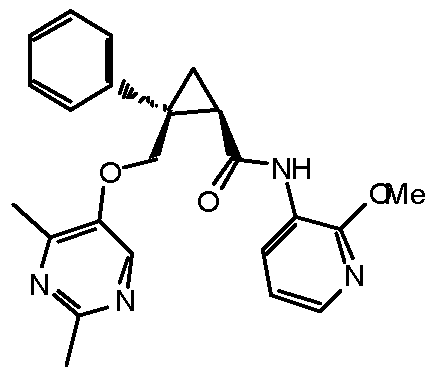
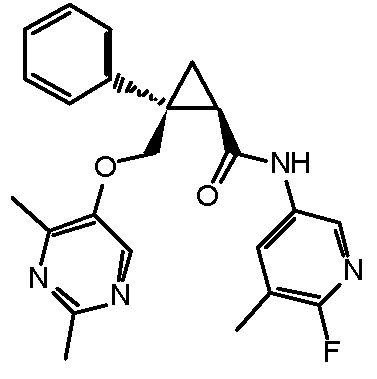
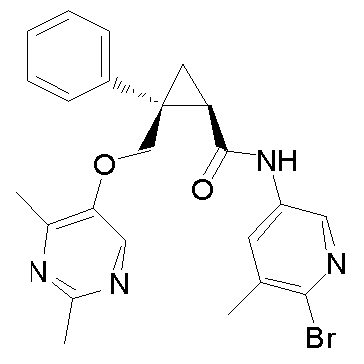
[0267]
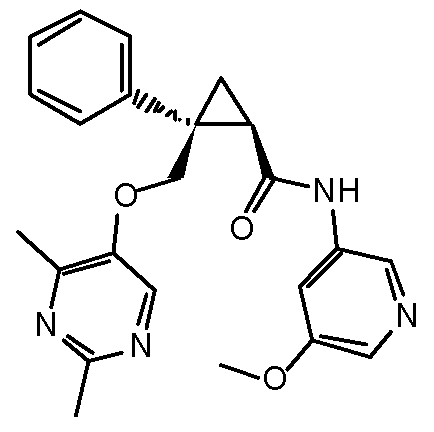
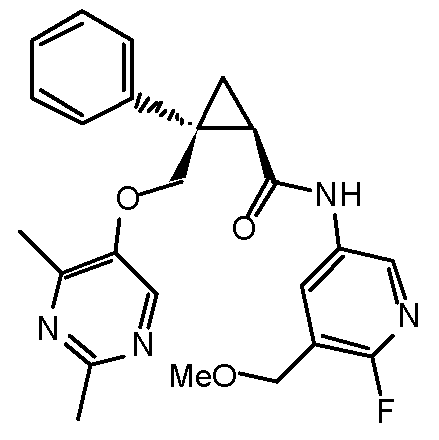
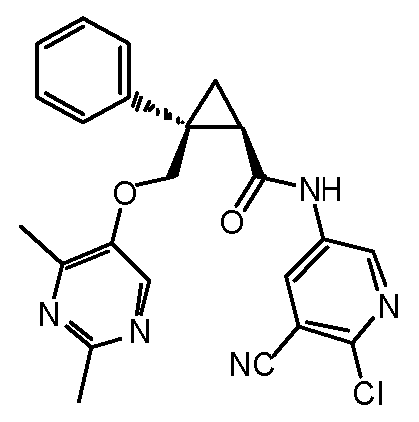
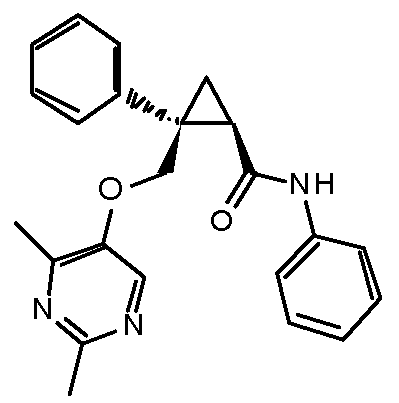
MS [M+H]+=374
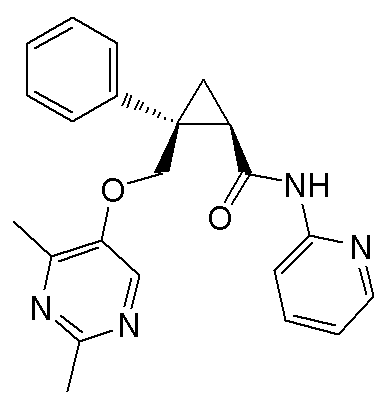
MS [M+H]+=375
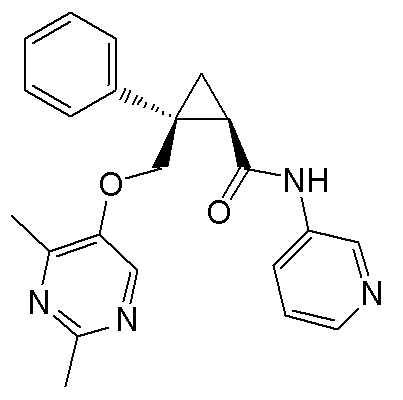
MS [M+H]+=375
[0268]
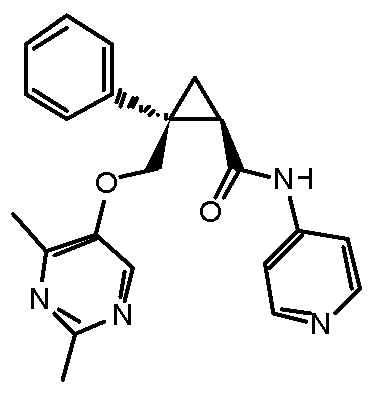
MS [M+H]+=375
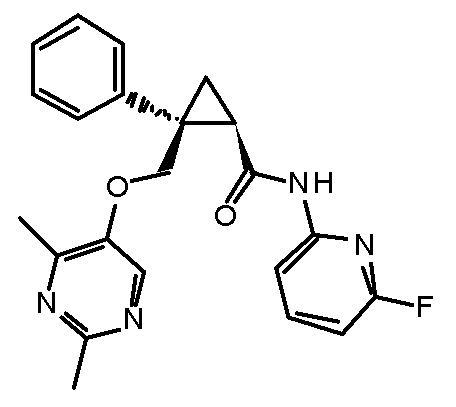
MS [M+H]+=393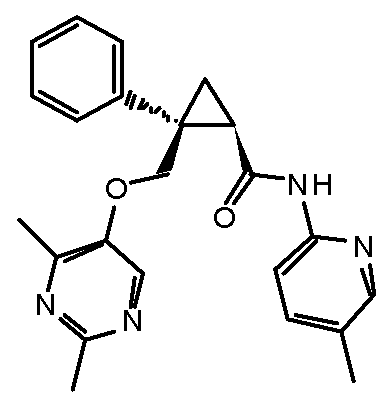
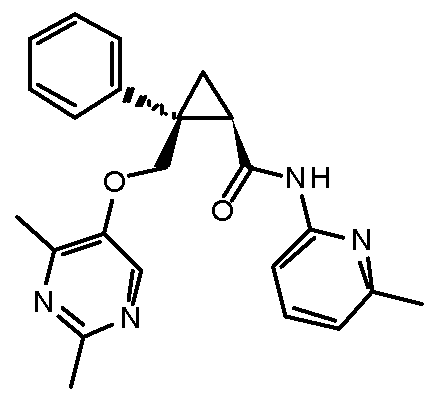
[0269]
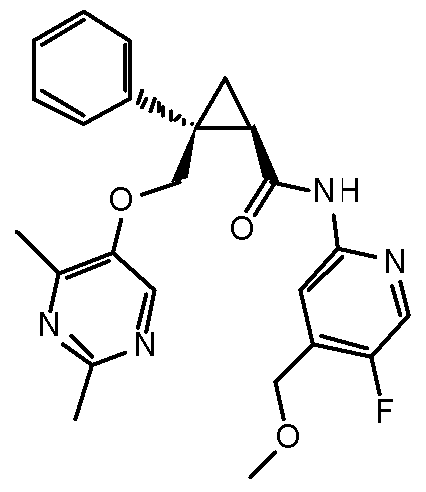
MS [M+H]+=437
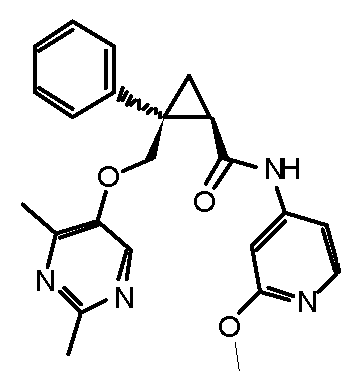
[0270]
Пример 73
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-фенилциклопропанкарбоксамида (73)
[Формула 63]
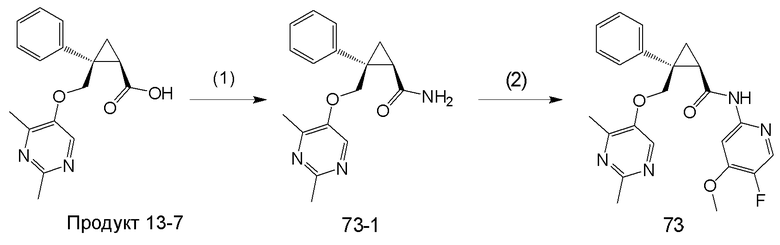
[0271]
(1) (1R,2S)-2-({[(2,4-диметилпиримидин-5-ил)окси]метил}})-2-фенилциклопропанкарбоксамид (73-1)
N,N-диизопропилэтиламин добавляли в (15 мл) карбоновой кислоты Продукта 13-7 (1,0 г), HOBt (679 мг), WSC (963 мг) и хлорида аммония (358 мг) при комнатной температуре и полученную смесь затем перемешивали в течение 7 дней. После этого добавляли насыщенный водный раствор бикарбоната натрия в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-1:4). Полученный неочищенный продукт растворяли в этилацетате и н-гексан затем добавляли в раствор. Осажденное твердое вещество собирали с помощью фильтрации и затем сушили с тем, чтобы получить соединение 74-1 (606 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,53 (дд, J=8,4, 4,8 Гц, 1H), 1,79 (дд, J=6,0, 4,8 Гц, 1H), 1,99 (дд, J=8,4, 6,0 Гц, 1H), 2,35 (с, 3H), 2,58 (с, 3H), 4,45 (с, 2H), 5,40 (шир.с, 1H), 5,77 (шир.с, 1H), 7,27-7,36 (м, 3H), 7,42-7,45 (м, 2H), 7,98 (с, 1H).
MS [M+H]+=298
[0272]
(2) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-фенилциклопропанкарбоксамид (73)
Температуру 1,4-диоксанового раствора (20 мл) соединения 73-1 (300 мг), 2-хлор-5-фтор-4-метоксипиридина (245 мг), полученного в примере получения 9-(1), xantphos (351 мг), трифосфата калия (429 мг) и Pd2DBA3 (185 мг) повышали до 95°C и затем раствор перемешивали в течение 26 часов. После этого добавляли воду в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующим фильтрованием. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат=7:3 к этилацетату) и затем с помощью колоночной хроматографии на NH-силикагеле (н-гептан:этилацетат=4:1-2:3). Полученный неочищенный продукт растворяли в хлороформе и н-гексан затем добавляли в раствор. Осажденное твердое вещество собирали с помощью фильтрации и затем сушили с тем, чтобы получить титульное соединение (304 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,63 (дд, J=8,0, 5,6 Гц, 1H), 1,89 (т, J=5,6 Гц, 1H), 2,11 (дд, J=8,0, 5,6 Гц, 1H), 2,23 (с, 3H), 2,55 (с, 3H), 3,88 (с, 3H), 4,41 (д, J=9,6 Гц, 1H), 4,51 (д, J=9,6 Гц, 1H), 7,28-7,39 (м, 3H), 7,45-7,48 (м, 2H), 7,82 (д, J=6,4 Гц, 1H), 7,97 (д, J=2,8 Гц, 1H), 7,98 (с, 1H), 8,30 (шир.с, 1H).
MS [M+Na]+=445
[0273]
* Соединения из примеров 74 и 75 синтезировали из амида карбоновой кислоты, полученного в примере 73-(1), тем же способом, что и в примере 73-(2).
[0274]
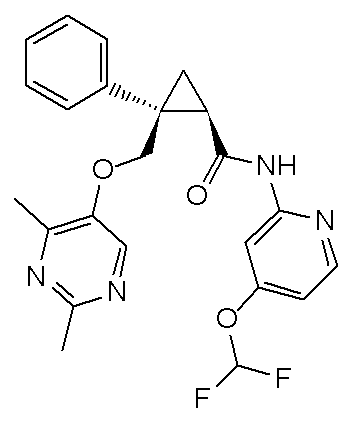
MS [M+H]+=441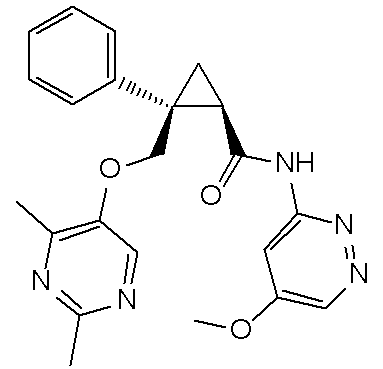
[0275]
Пример 76
Синтез (1R,2S)-N-(4,6-дифторпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамида (76-1) и (1R,2S)-N-(2,6-дифторпиридин-4-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамида (76-2)
[Формула 64]
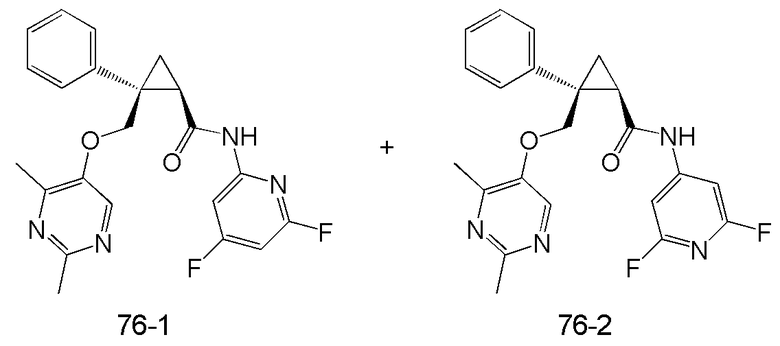
[0276]
Гидрид натрия (60%, 26,9 мг) добавляли в NMP-раствор (5 мл) соединения 73-1 (100 мг) и полученную смесь перемешивали при комнатной температуре в течение 10 минут. После этого 2,4,6-трифторпиридин (89,4 мг) добавляли в реакционный раствор. Температуру реакционного раствора повышали до 100°C и затем его перемешивали в течение 4 дней. После этого воду добавляли в реакционный раствор и полученную смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния с последующим фильтрованием. Фильтрат концентрировали при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=4:1-1:9) с тем, чтобы получить титульное соединение 76-1 (11,1 мг) и титульное соединение 76-2 (23,4 мг).
[0277]
76-1
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,64 (дд, J=8,0, 5,6 Гц, 1H), 1,91 (т, J=5,6 Гц, 1H), 2,09 (дд, J=8,0, 5,6 Гц, 1H), 2,22 (с, 3H), 2,55 (с, 3H), 4,37 (д, J=9,8 Гц, 1H), 4,48 (д, J=9,8 Гц, 1H), 6,39 (дт, J=7,6, 1,6 Гц, 1H), 7,28-7,39 (м, 3H), 7,43-7,46 (м, 2H), 7,74 (дд, J=10,0, 1,6 Гц, 1H), 7,95 (с, 1H), 8,21 (шир.с, 1H).
MS [M+H]+=411
[0278]
76-2
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,70 (дд, J=8,0, 5,6 Гц, 1H), 1,94 (т, J=5,6 Гц, 1H), 2,07 (дд, J=8,0, 5,6 Гц, 1H), 2,22 (с, 3H), 2,57 (с, 3H), 4,42 (д, J=9,6 Гц, 1H), 4,51 (д, J=9,6 Гц, 1H), 7,00 (с, 2H), 7,31-7,39 (м, 3H), 7,42-7,45 (м, 2H), 7,86 (шир.с, 1H), 7,98 (с, 1H).
MS [M+H]+=411
[0279]
Пример 77
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)-2-фенилциклопропанкарбоксамида (77)
[Формула 65]
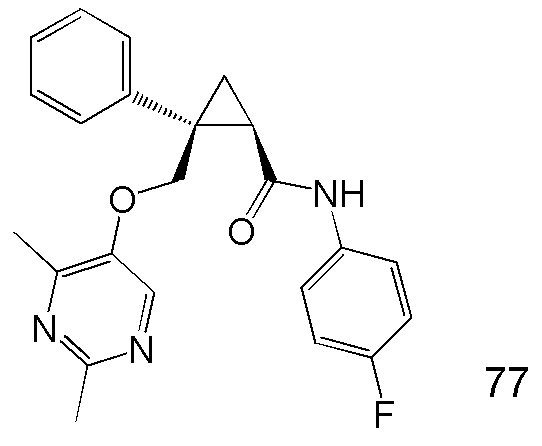
[0280]
Карбоновую кислоту Продукта 13-7 (30 мг) растворяли в N,N-диметилформамиде (1 мл) и затем добавляли 4-фторанилин (33,7 мг), N,N-диизопропилэтиламин (176 мкл) и HOBt (40,9 мг) в полученный раствор. Затем добавляли в него WSC (58,1 мг) при комнатной температуре и полученную смесь перемешивали в течение 21 часа. После этого реакционный раствор разделяли очисткой с применением LC-MS (Waters, колонка: CAPCELL PAK, C18, ACR, S-5, внутренний диаметр 20 мм×50 мм, AGEE01114, подвижная фаза: метанол-вода-TFA) с тем, чтобы получить титульное соединение (10,34 мг).
MS [M+H]+=392
[0281]
* Соединения из примеров 78-80 синтезировали реакцией карбоновой кислоты Продукта 13-7 с любым амином тем же способом, что и в примере 77. Очистку проводили с помощью LC-MS.
[0282]

[0283]
Пример 81
Синтез (1R,2S)-2-[(2,4-диметил-1-оксопиримидин-5-ил)оксиметил]-N-(6-фторпиридин-3-ил)-2-фенилциклопропанкарбоксамида (81)
[Формула 66]
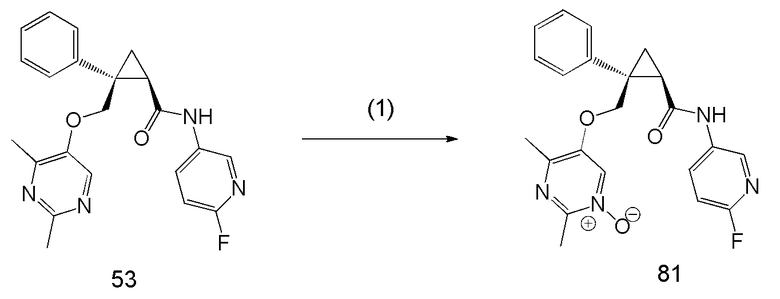
[0284]
Соединение 53 (40 мг) растворяли в дихлорметане (5 мл) и 3-хлорпероксибензойную кислоту (26,4 мг) затем добавляли в раствор. Полученную смесь перемешивали в течение 18 часов. После этого добавляли карбонат калия (50 мг) в реакционный раствор и полученную смесь дополнительно перемешивали в течение 1 часа. После завершения фильтрования растворитель отгоняли при пониженном давлении и остаток затем очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=3:1-0:1 и затем этилацетат:метанол=8:1) с тем, чтобы получить титульное соединение (25,0 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,62 (дд, J=8,0, 5,2 Гц, 1H), 1,86 (т, J=5,2 Гц, 1H), 2,23 (дд, J=8,0, 6,0 Гц, 1H), 2,24 (с, 3H), 2,54 (с, 3H), 4,38 (д, J=9,6 Гц, 1H), 4,41 (д, J=9,6 Гц, 1H), 6,89 (дд, J=9,2, 2,8 Гц, 1H), 7,27 (т, J=7,2 Гц, 1H), 7,32 (т, J=7,2 Гц, 2H), 7,42 (д, J=7,2 Гц, 2H), 7,91 (с, 1H), 8,18-8,22 (м, 2H), 8,62 (шир.с, 1H).
[0285]
Пример 82
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамида (82)
[Формула 67]
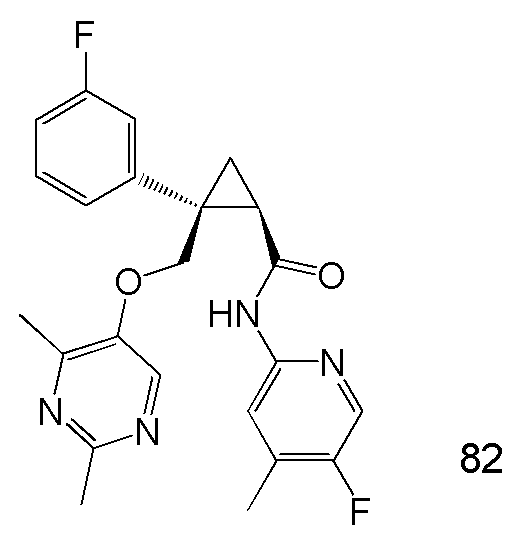
[0286]
N,N-диизопропилэтиламин (278 мкл) и HATU (604 мг) добавляли в DMF-раствор (9,7 мл) карбоновой кислоты Продукта 14-6 (388 мг) и 2-амино-5-фтор-4-пиколина (154 мг) при перемешивании при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 6 часов. После этого воду добавляли в реакционный раствор и полученную смесь затем экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-2:3). Твердое вещество осаждали THF-гептаном и затем собирали фильтрованием с тем, чтобы получить титульное соединение (289 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,55-1,65 (м, 1H), 1,91 (т, J=5,6 Гц, 1H), 2,05-2,13 (м, 1H), 2,22 (с, 3H), 2,27 (с, 3H), 2,56 (с, 3H), 4,41 (д, J=10,0 Гц, 1H), 4,50 (д, J=9,2 Гц, 1H), 6,97-7,04 (м, 1H), 7,14-7,20 (м, 1H), 7,22-7,28 (м, 1H), 7,33 (тд, J=8,0, 5,8 Гц, 1H), 7,93 (д, J=5,2 Гц, 1H), 7,99 (с, 1H), 8,00 (с, 1H), 8,24 (шир.с, 1H).
MS [M+Na]+=447
[0287]
* Соединения из примеров 83-93 синтезировали реакцией карбоновой кислоты Продукта 14-6 с любым амином тем же способом, что и в примере 82.
[0288]
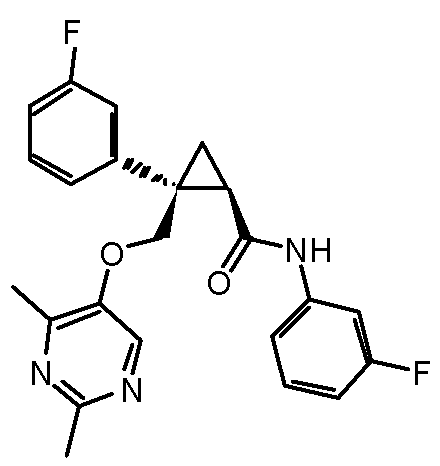
MS [M+H]+=410
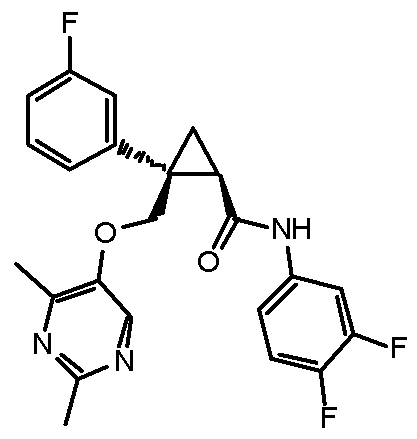
MS [M+H]+=428
MS [M+H]+=427
MS [M+H]+=455
[0289]
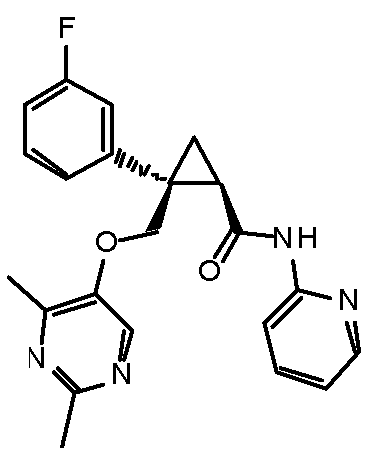
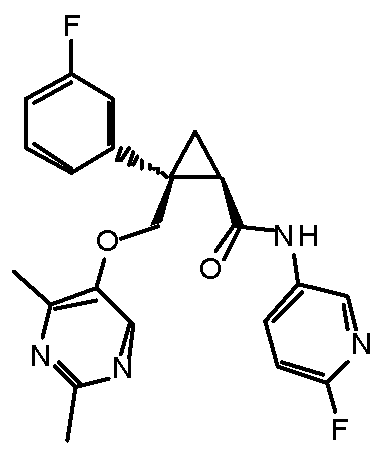
MS [M+H]+=411
MS [M+H]+=423
MS [M+H]+=393
[0290]
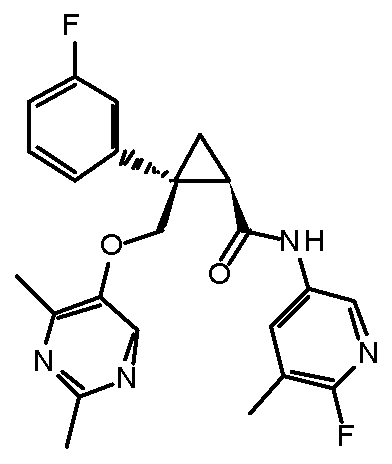
MS [M+H]+=425
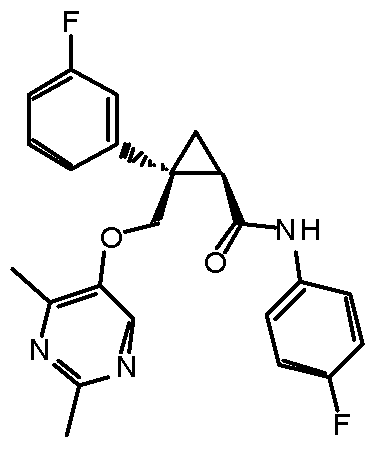
MS [M+H]+=410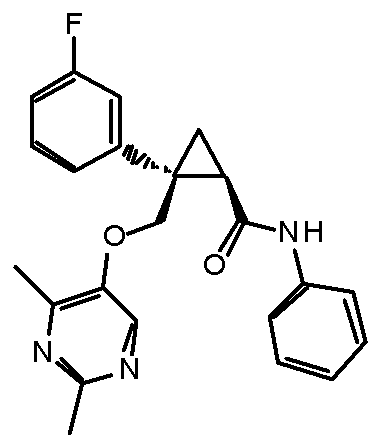
MS [M+H]+=392
[0291]
Пример 94
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамида (94)
[Формула 68]
[0292]
Раствор карбоксамида 94-1 (150 мг), полученного из карбоновой кислоты Продукта 14-6 в соответствии со способом из примера 73-(1), 2-хлор-5-фтор-4-метоксипиридина (Продукт 9-1; 115 мг), xantphos (165 мг), трифосфата калия (202 мг) и Pd2DBA3 (87,2 мг) в 1,4-диоксане (5 мл) нагревали до 95°C и перемешивали в течение 18 часов. Реакционный раствор охлаждали до комнатной температуры и фильтровали через целит. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали хроматографией на силикагеле (от смеси н-гептан:этилацетат=7:3 к этилацетату) и хроматографией на NH-силикагеле (н-гептан:этилацетат=4:1-2:3). Полученный неочищенный продукт растворяли в хлороформе с последующим добавлением н-гексана. Осажденное твердое вещество получали фильтрованием и сушили с получением продукта титульного соединения (82,9 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,63 (дд, J=8,0, 5,6 Гц, 1H), 1,91 (т, J=5,6Гц, 1H), 2,10 (дд, J=8,0, 5,6 Гц, 1H), 2,23 (с, 3H), 2,56 (с, 3H), 3,87 (с, 3H), 4,41 (д, J=9,6 Гц, 1H), 4,51 (д, J=9,6 Гц, 1H), 6,99-7,03 (м, 1H), 7,16-7,26 (м, 2H), 7,31-7,36 (м, 1H), 7,80 (д, J=6,4 Гц, 1H), 7,98 (д, J=2,8 Гц, 1H), 7,99 (с, 1H), 8,28 (шир.с, 1H).
MS[M+Na]+=463
[0293]
Пример 95
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (95)
[Формула 69]
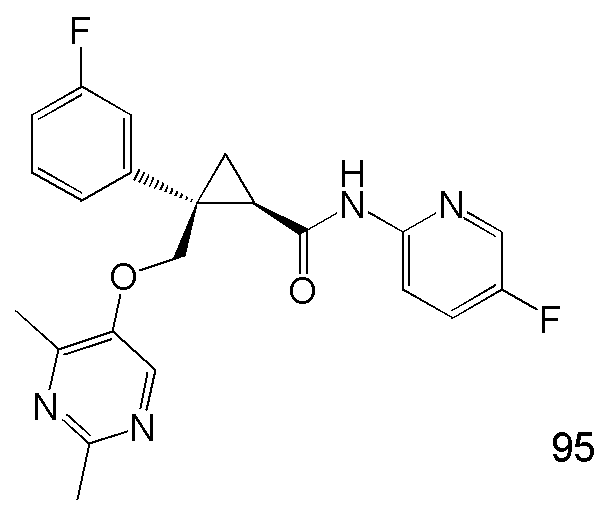
[0294]
Карбоновую кислоту Продукта 14-6 (226 мг) растворяли в дихлорметане (10 мл) и затем добавляли оксалилхлорид (122 мкл) и DMF (несколько капель) в полученный раствор. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. После этого реакционный раствор концентрировали при пониженном давлении с тем, чтобы получить неочищенный хлорангидрид. N,N-диизопропилэтиламин (283 мкл) добавляли в THF-раствор (10 мл) 2-амино-5-фторпиридина (96,1 мг) и затем повышали температуру раствора до 60°C. THF-раствор неочищенного хлорангидрида добавляли по каплям в реакционный раствор и полученную смесь перемешивали в течение 1 часа при поддержании температуры. После этого реакционную смесь охлаждали до комнатной температуры и реакционный раствор затем перемешивали в течение 1 часа. После этого реакционный раствор концентрировали при пониженном давлении и затем разделяли между этилацетатом и водой с тем, чтобы отделить органический слой. Органический слой сушили над безводным сульфатом магния и фильтрат затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на NH-силикагеле (н-гептан:этилацетат=2:1) и затем добавляли диэтиловый эфир в полученный целевой продукт. Осажденное твердое вещество собирали с помощью фильтрации и затем сушили с тем, чтобы получить титульное соединение (130 мг).
1H-ЯМР (400 МГц, d-DMSO) δ (частей на миллион): 1,46-1,50 (м, 1H), 1,68 (т, J=6,0 Гц, 1H), 2,01 (с, 3H), 2,36 (с, 3H), 2,59-2,63 (м, 1H), 4,27 (д, J=10,4 Гц, 1H), 4,66 (д, J=10,4 Гц, 1H), 7,06-7,11 (м, 1H), 7,37-7,44 (м, 3H), 7,60-7,65 (м, 1H), 7,85-7,89 (м, 1H), 8,11 (с, 1H), 8,30 (д, J=3,2 Гц, 1H), 11,20 (шир.с, 1H)
MS [M+H]+=411
[0295]
* Соединения из примеров 96-99 синтезировали реакцией карбоновой кислоты Продукта 14-6 или ее рацемической формы с любым амином тем же способом, что и в примере 95.
[0296]
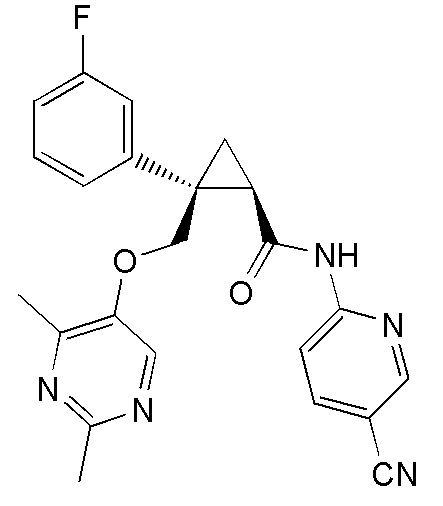
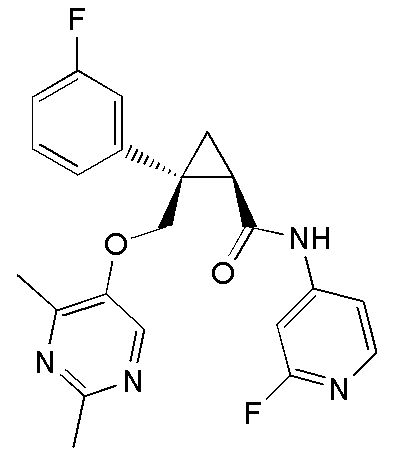
MS [M+H]+=411
[0297]
Пример 100
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (100)
[Формула 70]
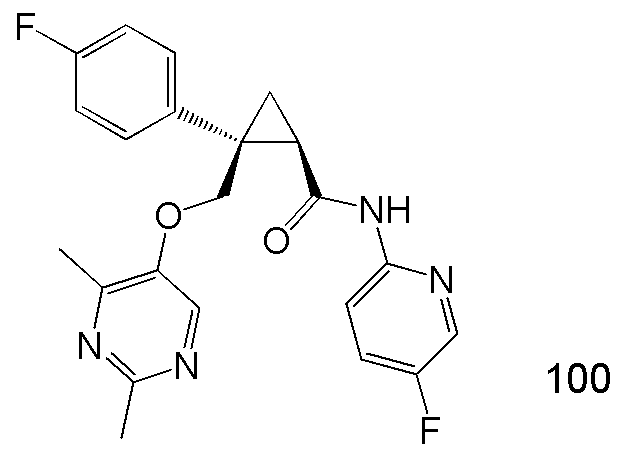
[0298]
Карбоновую кислоту Продукта 15-5 (200 мг) растворяли в дихлорметане (10 мл) и затем добавляли оксалилхлорид (108 мкл) и DMF (несколько капель) в полученный раствор. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. После этого реакционный раствор концентрировали при пониженном давлении с тем, чтобы получить неочищенный хлорангидрид. N,N-диизопропилэтиламин (250 мкл) добавляли в THF-раствор (10 мл) 2-амино-5-фторпиридина (85 мг), и затем поднимали температуру раствора до 60°C. THF-раствор неочищенного хлорангидрида добавляли по каплям в реакционный раствор и затем перемешивали полученную смесь в течение 1 часа при постоянной температуре. После этого реакционную смесь охлаждали до комнатной температуры и затем перемешивали реакционный раствор в течение 1 часа. После этого реакционный раствор концентрировали при пониженном давлении и затем разделяли между этилацетатом и водой с тем, чтобы отделить органический слой. Органический слой сушили над безводным сульфатом магния и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на NH-силикагеле (н-гептан:этилацетат=2:1) и затем добавляли диэтиловый эфир в полученный целевой продукт интереса. Осажденное твердое вещество собирали с помощью фильтрации и затем сушили с тем, чтобы получить титульное соединение (102 мг).
1H-ЯМР (400 МГц, d-DMSO) δ (частей на миллион): 1,43-1,45 (м, 1H), 1,66 (т, J=4,4 Гц, 1H), 2,02 (с, 3H), 2,36 (с, 3H), 2,55-2,58 (м, 1H), 4,26 (д, J=10,4 Гц, 1H), 4,59 (д, J=10,4 Гц, 1H), 7,15-7,20 (м, 2H), 7,57-7,65 (м, 3H), 7,86-7,89 (м, 1H), 8,09 (с, 1H), 8,30 (д, J=3,2 Гц, 1H), 11,18 (шир.с, 1H)
MS [M+H]+=411
[0299]
* Соединения из примеров 101-103 синтезировали тем же способом, что и в примере 100, с применением 2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)циклопропанкарбоновой кислоты, которую можно синтезировать с применением рацемической формы эпихлоргидрина в примере получения 15. Очистку проводили с помощью LC-MS.
[0300]
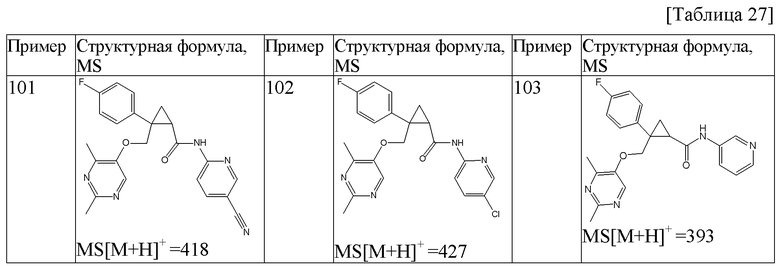
[0301]
Пример 104
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамида (104)
[Формула 71]

[0302]
Раствор (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)циклопропанкарбоксамида (150 мг), который был синтезирован тем же способом, что и Продукт73-1, 2-хлор-5-фтор-4-метоксипиридина (Продукт 9-1; 115 мг), xantphos (165 мг), трифосфата калия (202 мг) и Pd2DBA3 (87,2 мг) в 1,4-диоксане (5 мл) нагревали до 95°C и перемешивали в течение 16 часов. Реакционный раствор охлаждали до комнатной температуры и фильтровали через целит. Фильтрат концентрировали при пониженном давлении и очищали полученный остаток хроматографией на силикагеле (н-гептан:этилацетат=7:3 к этилацетату). Полученный неочищенный продукт растворяли в хлороформе с последующим добавлением н-гексана. Осажденное твердое вещество получили фильтрацией и высушили с получением продукта титульного соединения (35,6 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,60 (дд, J=8,0, 5,2 Гц, 1H), 1,89 (т, J=5,2 Гц, 1H), 2,06 (дд, J=8,0, 5,2 Гц, 1H), 2,23 (с, 3H), 2,55 (с, 3H), 3,88 (с, 3H), 4,40 (д, J=9,4 Гц, 1H), 4,46 (д, J=9,4 Гц, 1H), 7,03-7,08 (м, 2H), 7,42-7,46 (м, 2H), 7,81 (д, J=6,8 Гц, 1H), 7,97-7,98 (м, 2H), 8,24 (шир.с, 1H).
MS[M+H]+=441
[0303]
Пример 105
Синтез (1R,2S)-N,2-бис(4-фторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N,2-бис(4-фторфенил)циклопропанкарбоксамида (105)
[Формула 72]
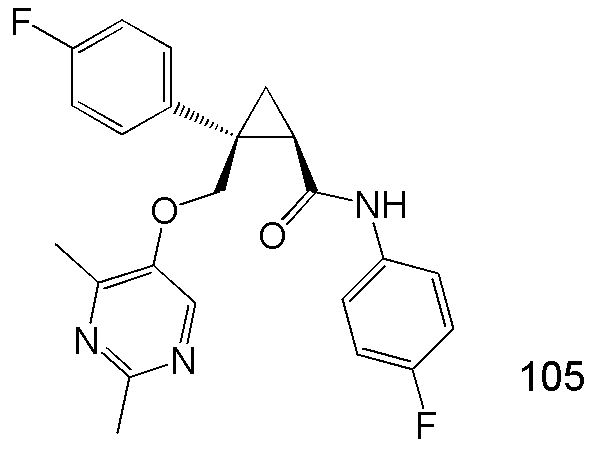
[0304]
Карбоновую кислоту Продукта 15-5 (33 мг) растворяли в DMF (2 мл) и затем добавляли 4-фторанилин (15 мг), N,N-диизопропилэтиламин (23,5 мкл) и HATU (51,3 мг) в раствор. Полученную смесь перемешивали при комнатной температуре в течение 20 часов. После этого воду добавляли в реакционный раствор и полученную смесь экстрагировали этилацетатом. Органический слой концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-2:3) с тем, чтобы получить титульное соединение (22,1 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,53-1,62 (м, 1H), 1,89 (т, J=5,4 Гц, 1H), 2,01 (дд, J=8,2, 5,8 Гц, 1H), 2,25 (с, 3H), 2,57 (с, 3H), 4,47 (дд, J=12,4, 9,6 Гц, 2H), 6,97-7,08 (м, 4H), 7,37-7,46 (м, 4H), 7,50 (шир.с, 1H), 7,99 (с, 1H).
[0305]
* Соединения из примеров 106-112 синтезировали реакцией карбоновой кислоты Продукта 15-5 с любым амином тем же способом, что и в примере 105.
[0306]
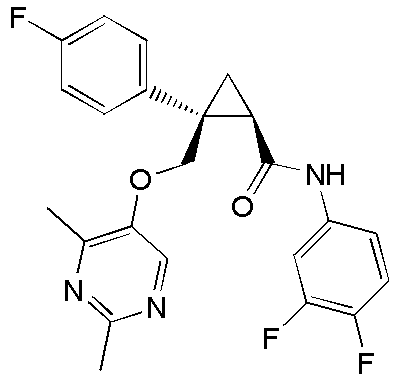
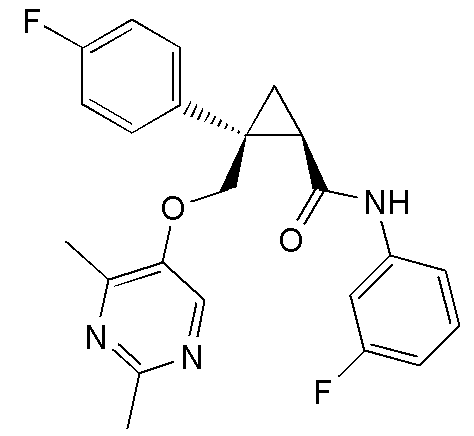
MS [M+H]+=455
[0307]
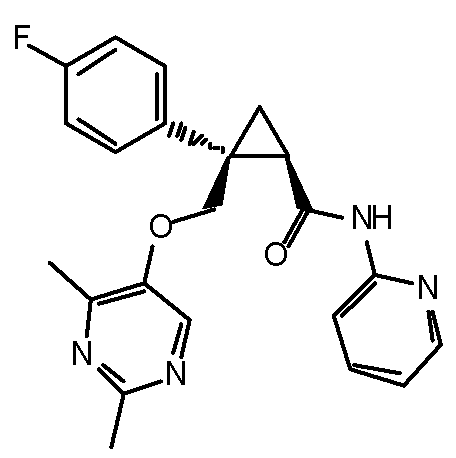
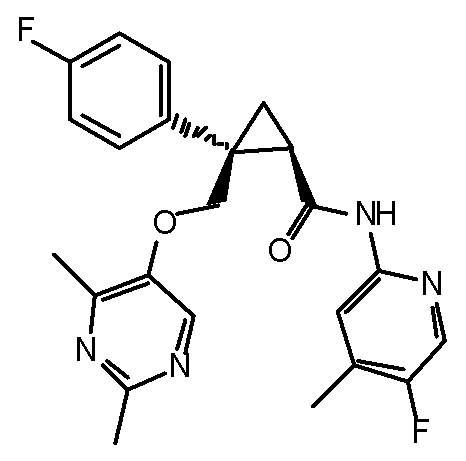

[0308]
Пример 113
Синтез (1R, 2R)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-1-метил-2-фенилциклопропанкарбоксамида (113)
[Формула 73]
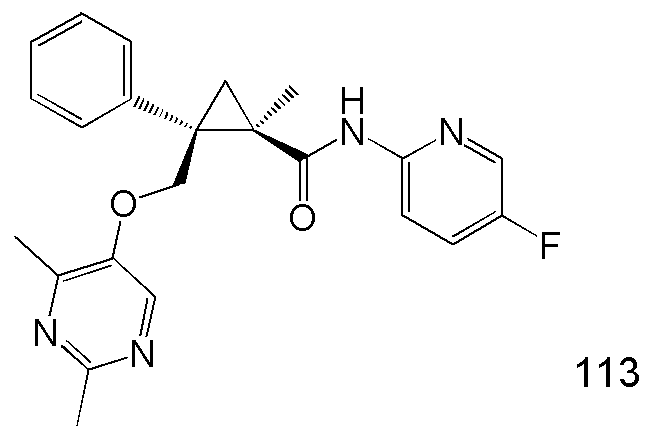
[0309]
Оксалилхлорид (22,8 мкл) добавляли в дихлорметановый раствор (1,5 мл) карбоновой кислоты Продукта 20-6 (41,5 мг) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 2 часов и затем концентрировали реакционный раствор при пониженном давлении. Остаток растворяли в дихлорметане (1 мл). Затем дихлорметановый раствор (1 мл) 2-амино-5-фторпиридина (22,3 мг) и N,N-диизопропилэтиламина (69,4 мкл) добавляли в полученный раствор при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 4 часов. После этого воду добавляли в реакционный раствор и затем экстрагировали полученную смесь этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат) с тем, чтобы получить титульное соединение (8,0 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,25 (с, 3H), 1,34 (д, J=5,6 Гц, 1H), 2,08 (д, J=5,2 Гц, 1H), 2,25 (с, 3H), 2,53 (с, 3H), 4,29 (дд, J=15,6, 9,6 Гц, 2H), 7,28-7,42 (м, 4H), 7,42-7,48 (м, 2H), 7,87 (с, 1H), 8,07-8,13 (м, 2H), 8,32 (шир.с, 1H).
[0310]
Пример 114
Синтез (1R,2R)-N-(5-цианопиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-1-метил-2-фенилциклопропанкарбоксамида (114)
[Формула 74]
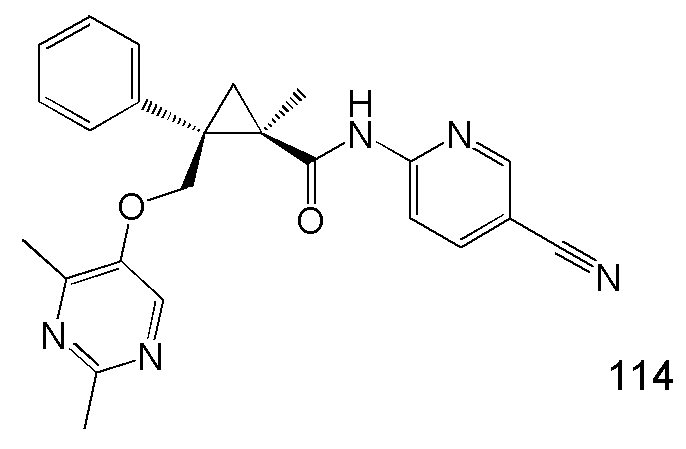
[0311]
Оксалилхлорид (24,7 мкл) добавляли в дихлорметановый раствор (1,5 мл) карбоновой кислоты Продукта 20-6 (45 мг) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 2 часов и затем концентрировали реакционный раствор при пониженном давлении. Остаток растворяли в дихлорметане (1,5 мл) и после этого добавляли THF-раствор (1 мл) 2-амино-5-цианопиридина (22,3 мг) и N,N-диизопропилэтиламина (75,3 мкл) в раствор при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После этого воду добавляли в реакционный раствор и затем экстрагировали полученную смесь этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-0:1) с тем, чтобы получить титульное соединение (28,2 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,26 (с, 3H), 1,38 (д, J=5,2 Гц, 1H), 2,12 (д, J=5,2 Гц, 1H), 2,25 (с, 3H), 2,53 (с, 3H), 4,25 (д, J=9,6 Гц, 1H), 4,32 (д, J=9,6 Гц, 1H), 7,30-7,42 (м, 3H), 7,43-7,48 (м, 2H), 7,85-7,91 (м, 2H), 8,23 (дд, J=8,6, 1,0 Гц, 1H), 8,50 (шир.с, 1H), 8,53-8,56 (м, 1H).
[0312]
Пример 115
Синтез (1R,2S)-2-(3-цианофенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)циклопропанкарбоксамида (115)
[Формула 75]
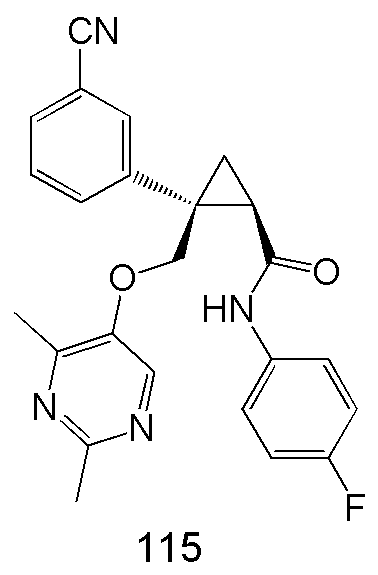
[0313]
N,N-диизопропилэтиламин (28,5 мкл) и HATU (62,2 мг) добавляли в DMF-раствор (1 мл) карбоновой кислоты Продукта 18-4 (40 мг) и 4-фторанилина (18,2 мг) при перемешивании раствора при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 8 часов. После этого добавляли воду в реакционный раствор и затем экстрагировали смесь этилацетатом. Органический слой концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-2:3). Затем полученный продукт подвергали хиральному разделению с применением ВЭЖХ (колонка Daicel Chiral pak IA, н-гексан:этанол 30%) с тем, чтобы получить титульное соединение (13,1 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,59 (дд, J=8,0, 5,2 Гц, 1H), 1,96 (т, J=5,4 Гц, 1H), 2,08 (дд, J=8,0, 6,0 Гц, 1H), 2,25 (с, 3H), 2,57 (с, 3H), 4,49 (с, 2H), 6,96-7,04 (м, 2H), 7,40-7,46 (м, 2H), 7,49 (т, J=7,8 Гц, 1H), 7,61 (шир.д, J=7,6 Гц, 1H), 7,72 (шир.д, J=7,6 Гц, 1H), 7,84 (шир.д, J=8,0 Гц, 2H), 8,00 (с, 1H).
[0314]
* Соединения из примеров 116 и 117 синтезировали реакцией карбоновой кислоты Продукта 18-4 и любого амина тем же способом, что и в примере 115.
[0315]
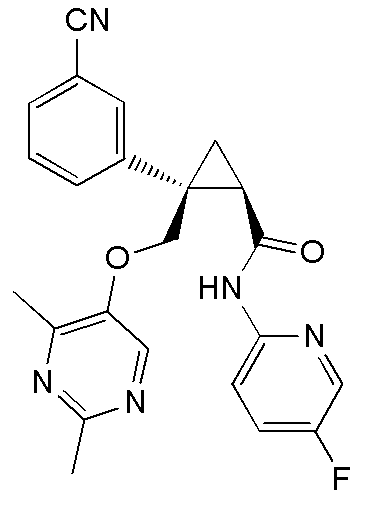
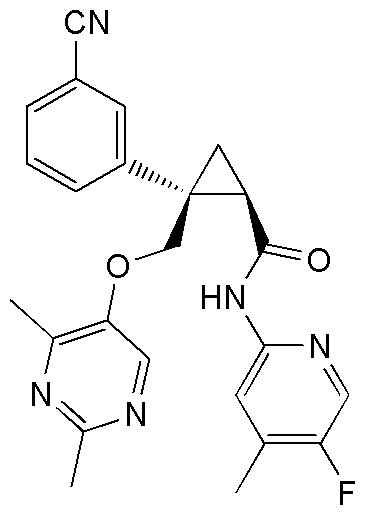
[0316]
Пример 118
Синтез (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-фенил-N-(пиридин-2-ил)циклопропанкарбоксамида (118)
[Формула 76]
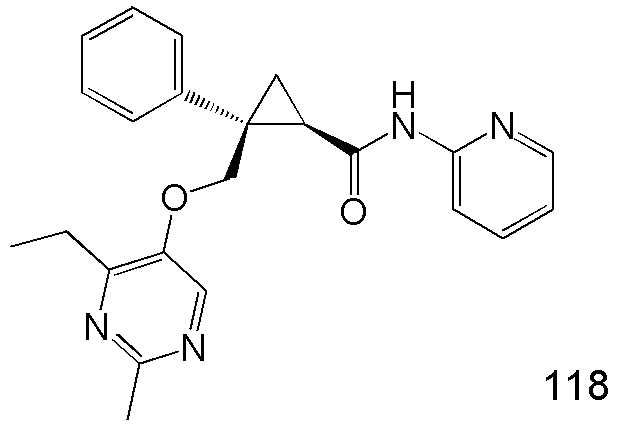
[0317]
N,N-диизопропилэтиламин (21,4 мкл) и HATU (46,8 мг) добавляли в DMF-раствор (0,75 мл) карбоновой кислоты Продукта 19-3 (30 мг) и 2-аминопиридина (8,9 мг) при перемешивании раствора при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После этого добавляли воду в реакционный раствор и затем экстрагировали смесь этилацетатом. Органический слой концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-2:3) с тем, чтобы получить титульное соединение (32,1 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,97 (т, J=7,6 Гц, 3H), 1,62 (дд, J=8,2, 5,0 Гц, 1H), 1,91 (т, J=5,4 Гц, 1H), 2,10-2,18 (м, 1H), 2,50-2,65 (м, 2H), 2,56 (с, 3H), 4,44 (д, J=9,2 Гц, 1H), 4,51 (д, J=9,2 Гц, 1H), 6,96-7,02 (м, 1H), 7,25-7,39 (м, 3H), 7,43-7,48 (м, 2H), 7,62-7,68 (м, 1H), 7,99 (с, 1H), 8,07 (шир.д, J=8,8 Гц, 1H), 8,23 (дкв., J=4,8, 0,8 Гц, 1H), 8,65 (шир.с, 1H).
[0318]
* Соединения из примеров 119-121 синтезировали реакцией карбоновой кислоты Продукта 19-3 и любого амина тем же способом, что и в примере 1.
[0319]
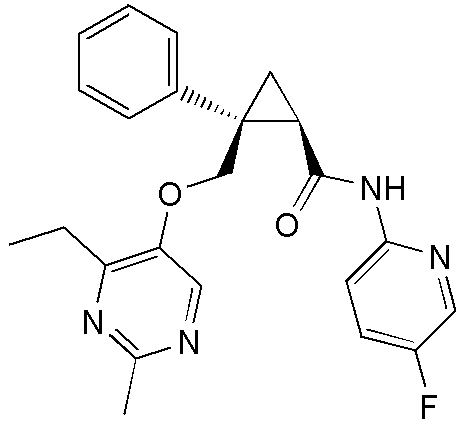
MS [M+H]+=407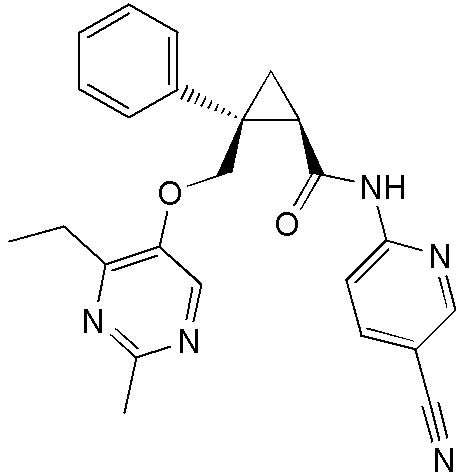
MS [M+H]+=414
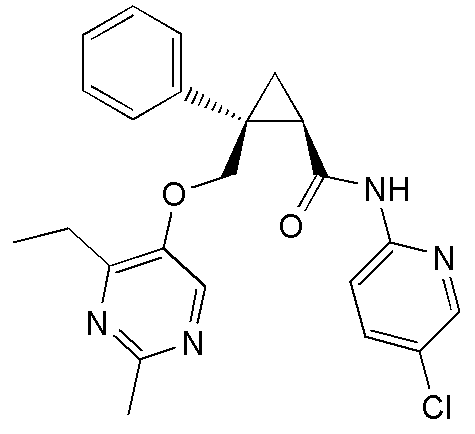
MS [M+H]+=423
[0320]
* Соединения из примеров 122-124 синтезировали реакцией карбоновой кислоты Продукта 19-3 с любым амином тем же способом, что и в примере 51.
[0321]
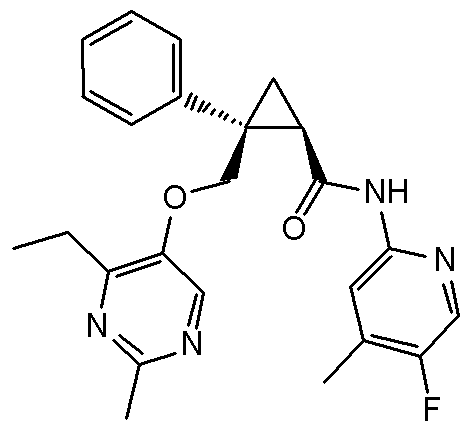
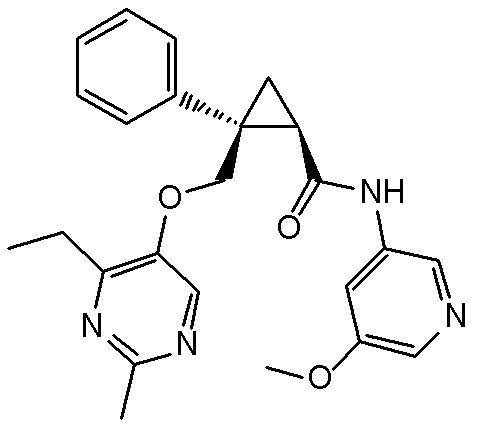
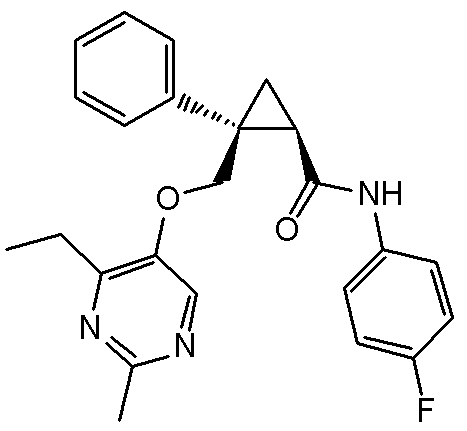
[0322]
* Соединения из примеров 125 и 126 синтезировали реакцией карбоновой кислоты Продукта 17-4 с любым амином тем же способом, что и в примере 1.
[0323]
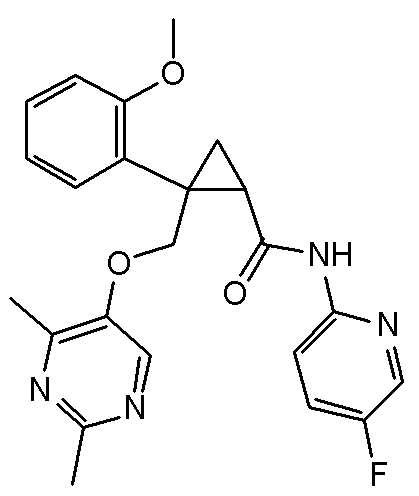
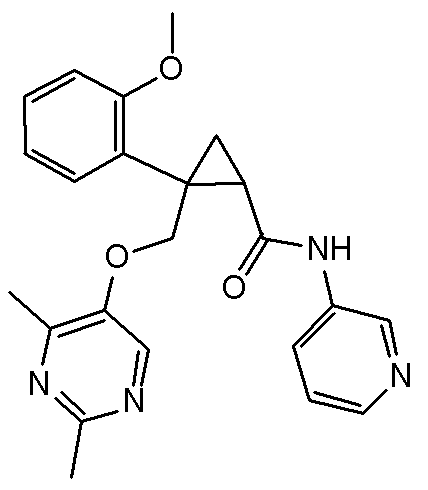
MS [M+H]+=405
[0324]
Пример 127
Синтез (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(2-метокси-4-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамида (127)
[Формула 77]
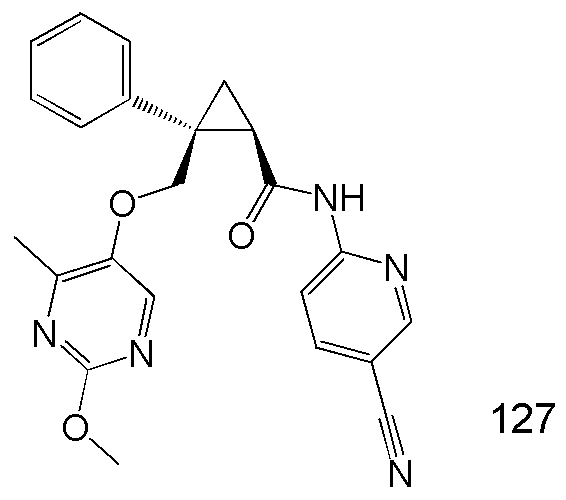
[0325]
Титульное соединение синтезировали амидированием карбоновой кислоты Продукта 21 тем же способом, что и в примере 1.
MS [M+H]+=416
[0326]
Пример 128
Синтез (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(2-этил-4-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамида (128)
[Формула 78]
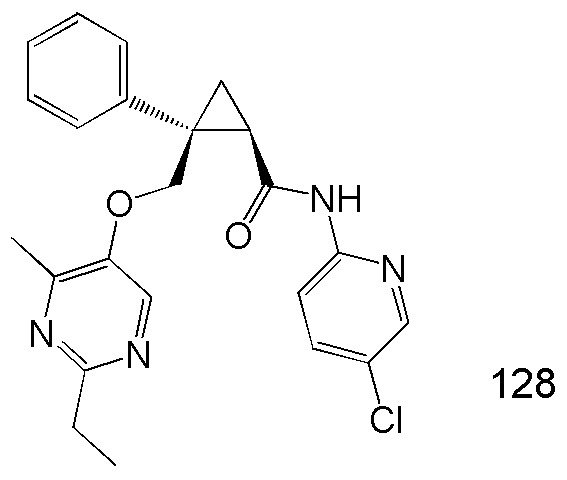
[0327]
Титульное соединение синтезировали амидированием карбоновой кислоты Продукта 22 примера получения 22 тем же способом, что и в примере 1.
MS [M+H]+=423
[0328]
Пример 129
Синтез (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамида (129)
[Формула 79]
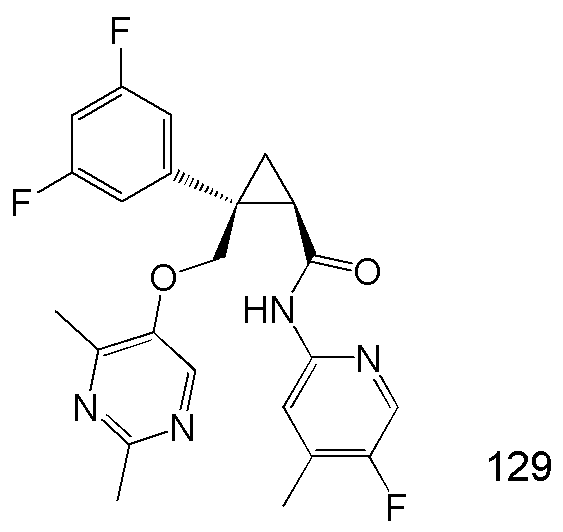
[0329]
2-Амино-5-фтор-4-пиколин (415 мг), HATU (1,71 г) и N,N-диизопропилэтиламин (1,56 мл) добавляли в DMF-раствор (20 мл) карбоновой кислоты Продукта 16-7 (1,0 г). Полученную смесь перемешивали при комнатной температуре в течение 2 дней. После этого добавляли воду в реакционный раствор и затем экстрагировали полученную смесь диэтиловым эфиром. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и затем очищали остаток с помощью колоночной хроматографии на NH-силикагеле (н-гептан:этилацетат=4:1-1:2) с тем, чтобы получить титульное соединение (880 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,60-1,63 (м, 1H), 1,92 (т, J=5,6 Гц, 1H), 2,07 (шир.т, J=8,0 Гц, 1H), 2,22 (с, 3H), 2,27 (с, 3H), 2,56 (с, 3H), 4,41 (д, J=9,2 Гц, 1H), 4,49 (д, J=9,6 Гц, 1H), 6,76 (т, J=8,8 Гц, 1H), 6,97-6,99 (шир.д, 2H), 7,90 (д, J=6,4 Гц, 1H), 7,99 (с, 2H), 8,27 (шир.с, 1H).
[0330]
* Соединения из примеров 130-138 синтезировали реакцией карбоновой кислоты Продукта 16-7 с любым амином тем же способом, что и в примере 51.
[0331]
MS [M+H]+=428
MS [M+H]+=411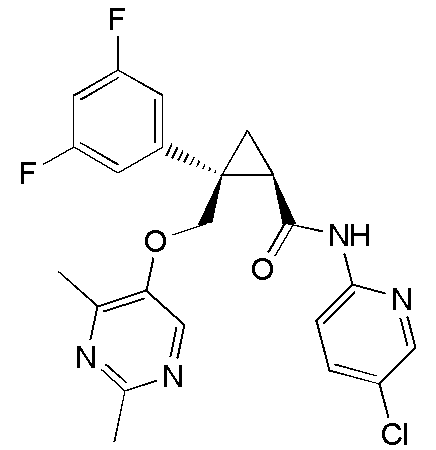
MS [M+H]+=445
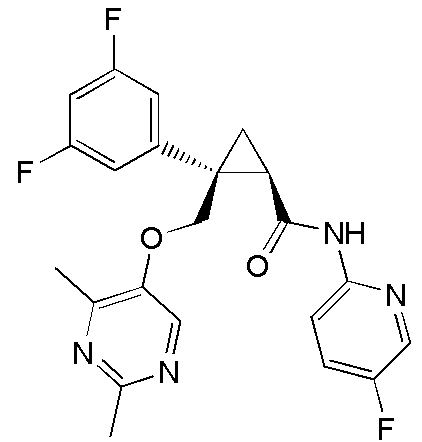
MS [M+H]+=429
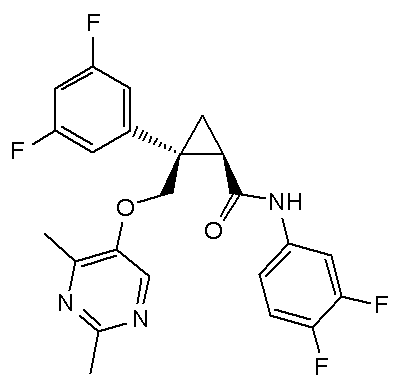
MS [M+H]+=446
[0332]
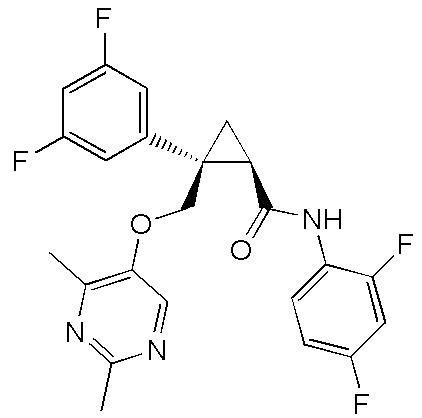
MS [M+H]+=446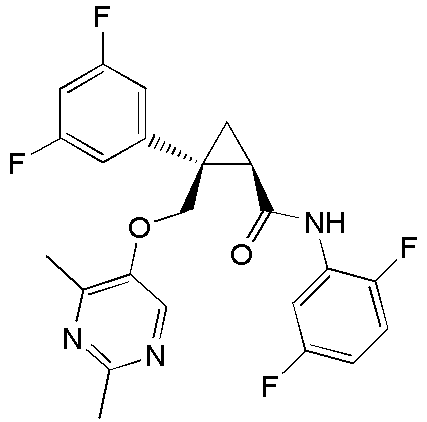
MS [M+H]+=446
MS [M+H]+=436
MS [M+H]+=459
[0333]
* Соединения из примеров 139-142 синтезировали реакцией карбоновой кислоты Продукта 23 с любым амином тем же способом, что и в примере 1.
[0334]
MS [M+Na]+=461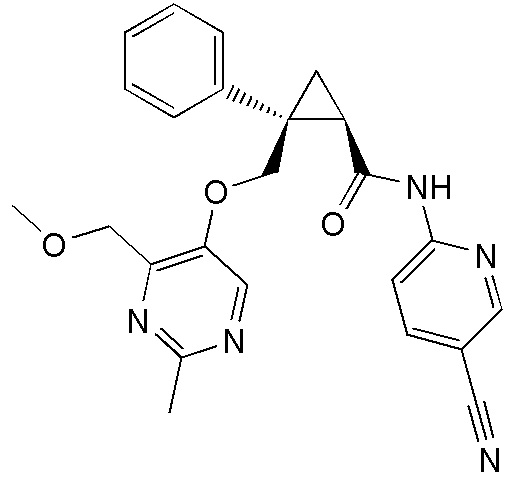
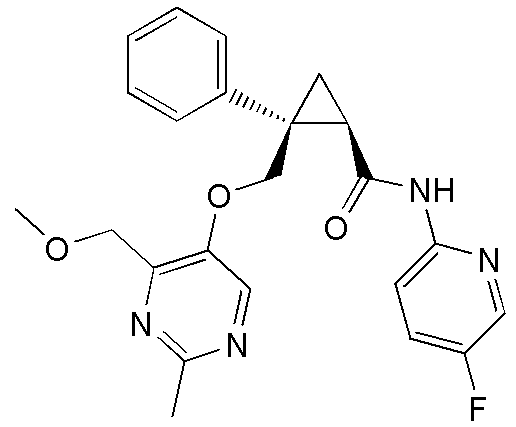
MS [M+]+=423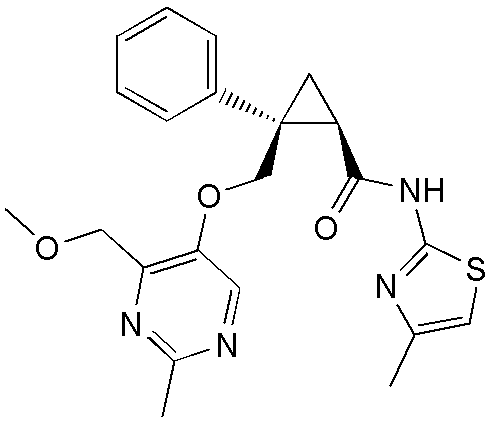
[0335]
* Соединения из примеров 143-150 синтезировали реакцией карбоновой кислоты Продукта 23 с любым амином тем же способом, что и в примере 51.
[0336]
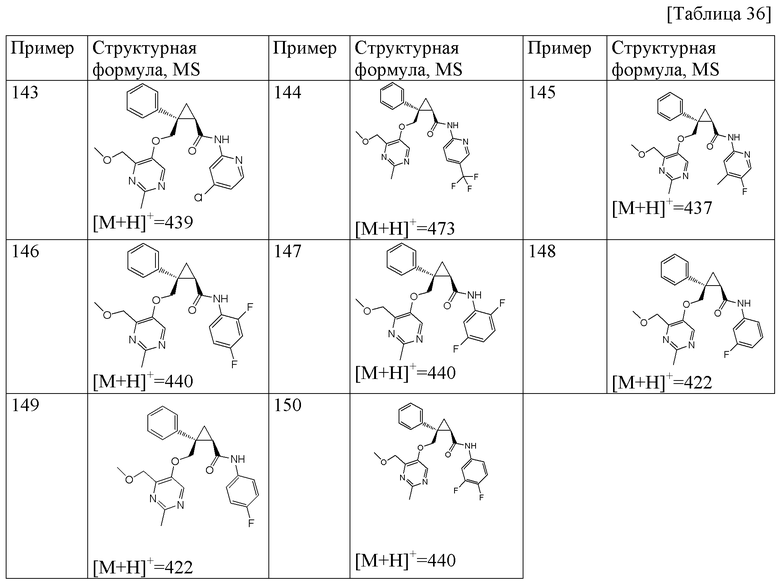
[0337]
* Соединения из примеров 151-153 синтезировали реакцией карбоновой кислоты Продукта 24 с любым амином тем же способом, что и в примере 1.
[0338]
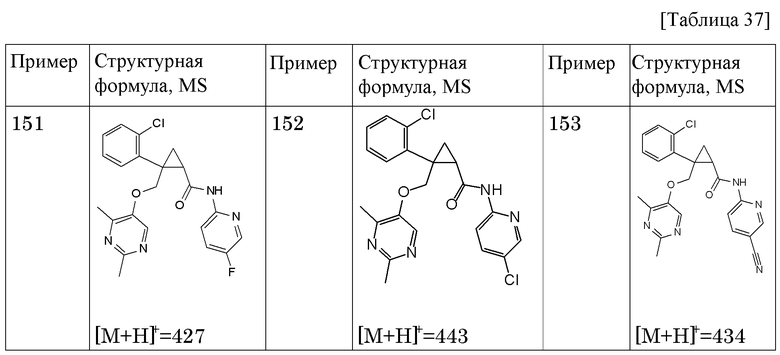
[0339]
* Соединения из примеров 154-157 синтезировали реакцией карбоновой кислоты Продукта 25 с любым амином тем же способом, что и в примере 1.
[0340]
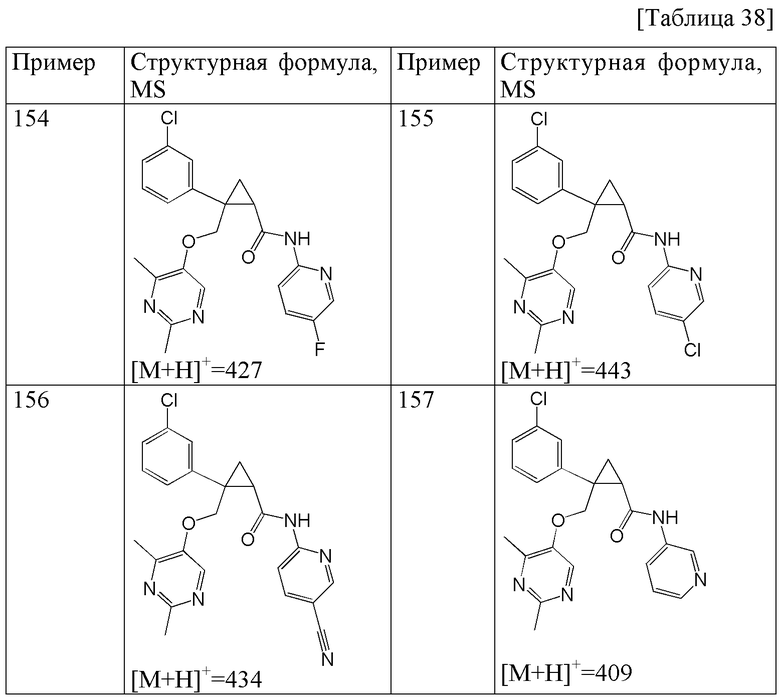
[0341]
* Соединения из примеров 158-161 синтезировали реакцией карбоновой кислоты Продукта 26 и любым амином тем же способом, что и в примере 1. Соединение из примера 161 получали путем осуществления хирального разделения рацемических продуктов (Chiral pak-IA (гексан:этанол=70:30, 15 мл/мин, 254 нм, rt) 10,5 мин. ((+)- форма), 13,0 мин. ((-)- форма, целевое соединение).
[0342]
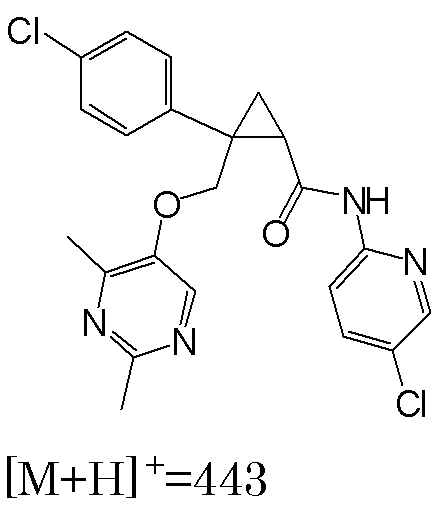
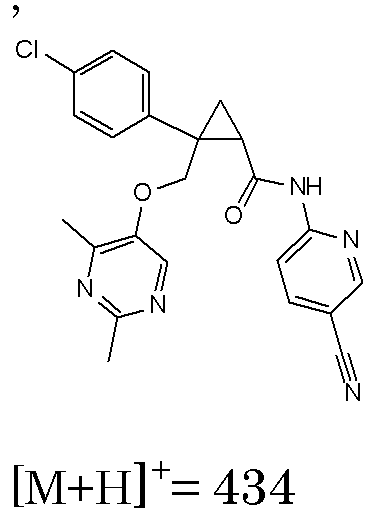
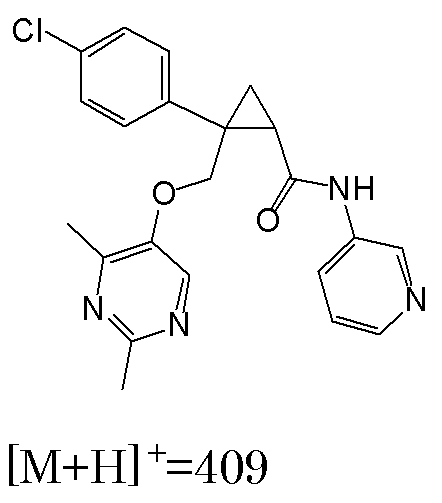
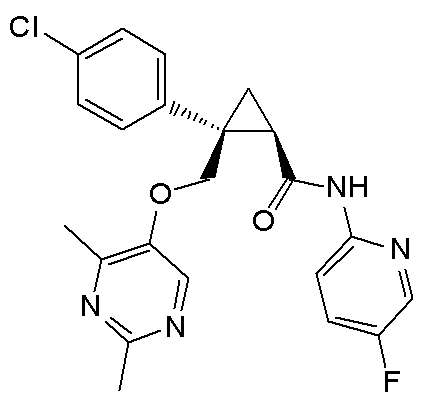
[0343]
Пример 162
Синтез 2-(2,3-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (162)
[Формула 80]
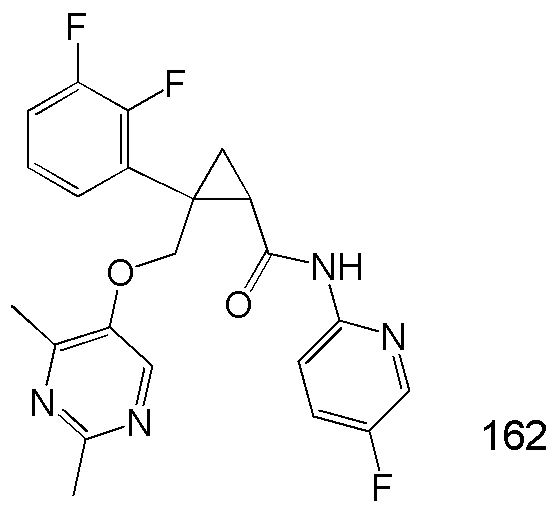
[0344]
Титульное соединение синтезировали амидированием карбоновой кислоты Продукта 27 тем же способом, что и в примере 51.
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,53 (дд, J=8,0, 5,2 Гц, 1H), 1,94 (т, J=5,2 Гц, 1H), 2,16-2,22 (м, 4H), 2,54 (с, 3H), 4,34 (д, J=9,6 Гц, 1H), 4,42 (д, J=9,6 Гц, 1H), 7,06-7,42 (м, 4H), 7,93 (с, 1H), 8,09-8,14 (м, 2H), 8,34 (шир.с, 1H).
MS [M+H]+=429.
[0345]
Пример 163
Синтез 2-(2,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (163)
[Формула 81]
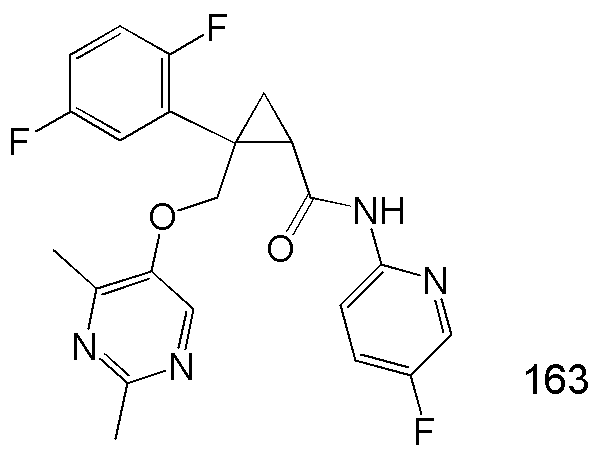
[0346]
Титульное соединение синтезировали амидированием карбоновой кислоты Продукта 28 тем же способом, что и в примере 51.
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,53 (дд, J=8,0, 5,2 Гц, 1H), 1,94 (т, J=5,2 Гц, 1H), 2,17 (шир.т, J=7,6 Гц, 1H), 2,22 (с, 3H), 2,54 (с, 3H), 4,32 (д, J=9,6 Гц, 1H), 4,40 (д, J=9,6 Гц, 1H), 6,97-7,43 (м, 4H), 7,93 (с, 1H), 8,10-8,14 (м, 2H), 8,34 (шир.с, 1H).
MS [M+H]+=429.
[0347]
* Соединения из примеров 164-172 синтезировали реакцией карбоновой кислоты (Продукт 29) и любого амина тем же способом, что и в примере 52.
[0348]
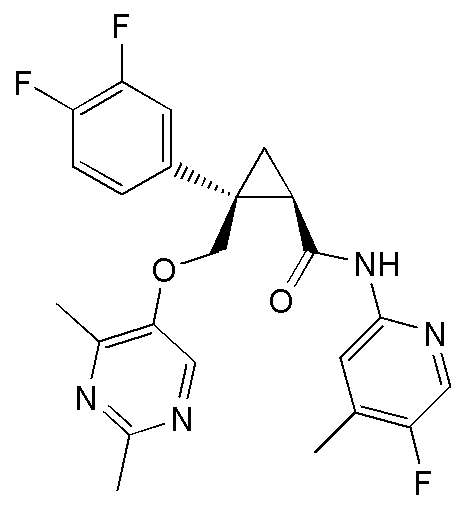
MS [M+H]+=443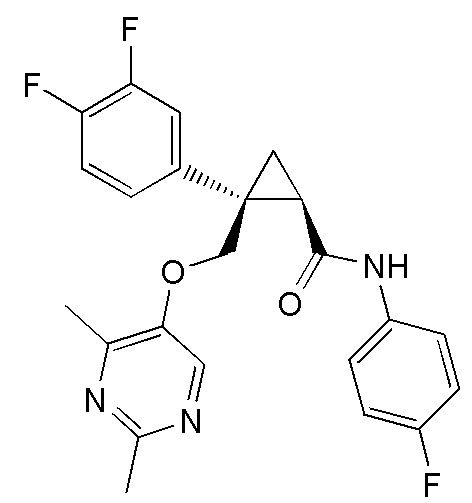
MS [M+H]+=428
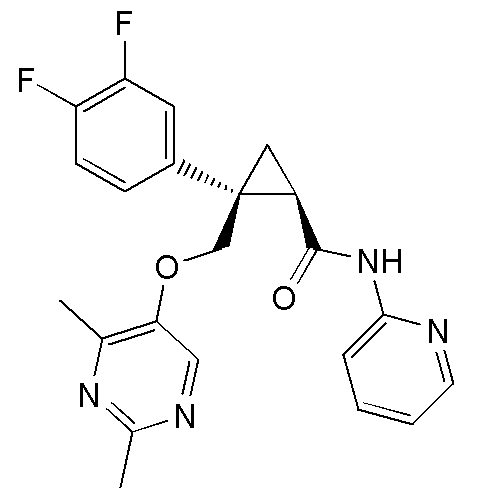
MS [M+H]+=411
[0349]
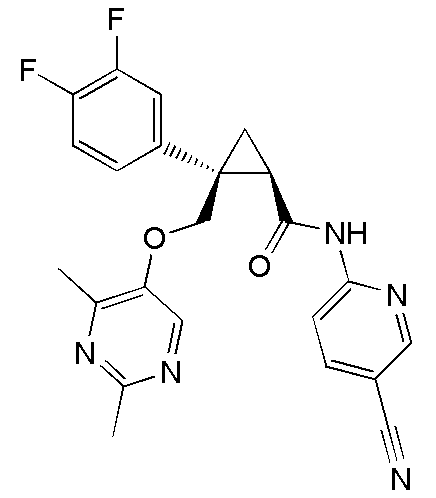
MS [M+H]+=436
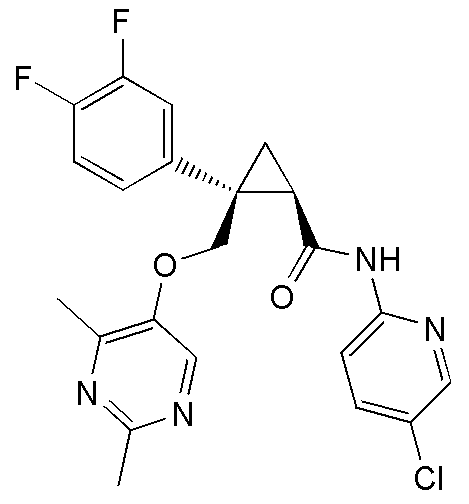
MS [M+H]+=445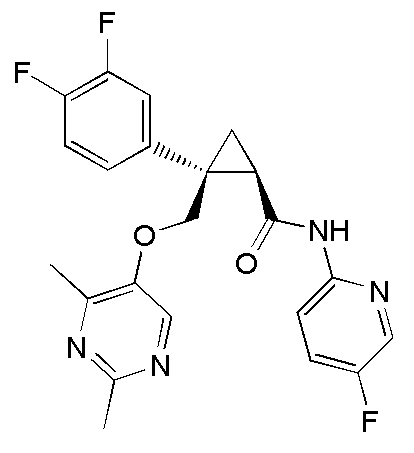
MS [M+H]+=429
MS [M+H]+=446
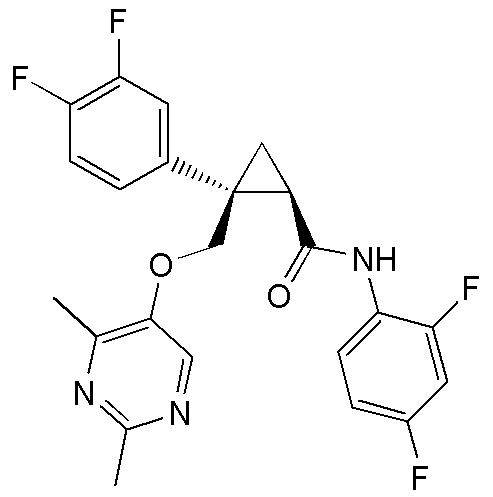
MS [M+H]+=446
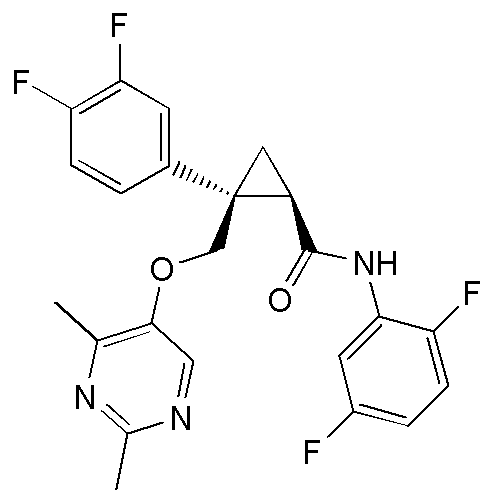
MS [M+H]+=446
[0350]
Пример 173
Синтез (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)циклопропанкарбоксамида (173)
[Формула 82]
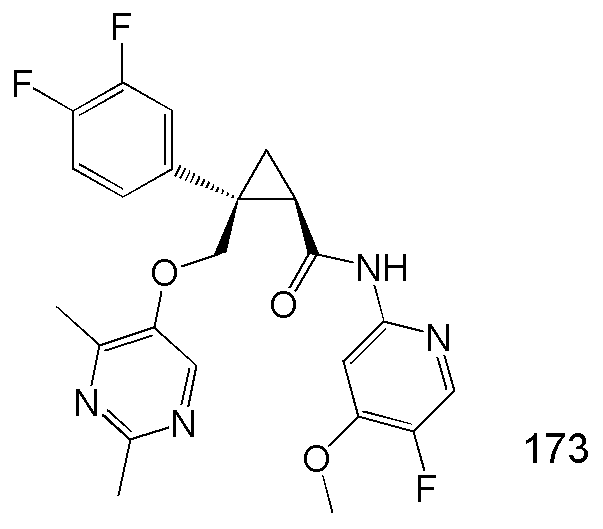
[0351]
Титульное соединение синтезировали из Продукта 29 согласно примеру 73.
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,60 (дд, J=8,0, 5,6 Гц, 1H), 1,90 (т, J=5,6 Гц, 1H), 2,06 (дд, J=8,0, 5,6 Гц, 1H), 2,24 (с, 3H), 2,56 (с, 3H), 3,88 (с, 3H), 4,40 (д, J=9,6 Гц, 1H), 4,46 (д, J=9,6 Гц, 1H), 7,12-7,32 (м, 3H), 7,79 (д, J=6,8 Гц, 1H), 7,98-7,99 (м, 2H), 8,25 (шир.с, 1H).
MS [M+H]+=459
[0352]
* Соединения из примеров 174 и 175 синтезировали реакцией карбоновой кислоты Продукта 30 и любого амина тем же способом, что и в примере 45.
[0353]
[0354]
* Соединения из примеров 176 и 177 синтезировали реакцией карбоновой кислоты Продукта 31 из примера получения 31 и любого амина тем же способом, что и в примере 1.
[0355]
[0356]
* Соединения из примеров 178-180 синтезировали реакцией карбоновой кислоты Продукта 32 из примера получения 32 и любого амина тем же способом, что и в примере 1.
[0357]
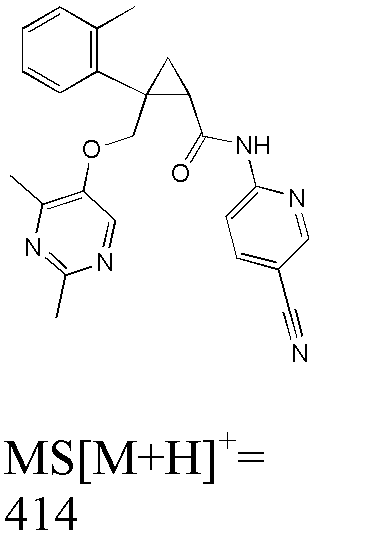
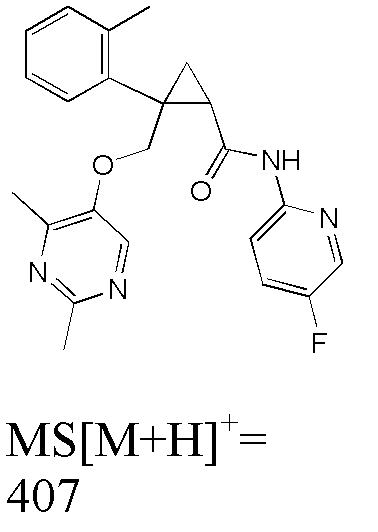
[0358]
* Соединения из примеров 181 и 182 синтезировали реакцией карбоновой кислоты Продукта 33 из примера получения 33 и любого амина тем же способом, что и в примере 45.
[0359]
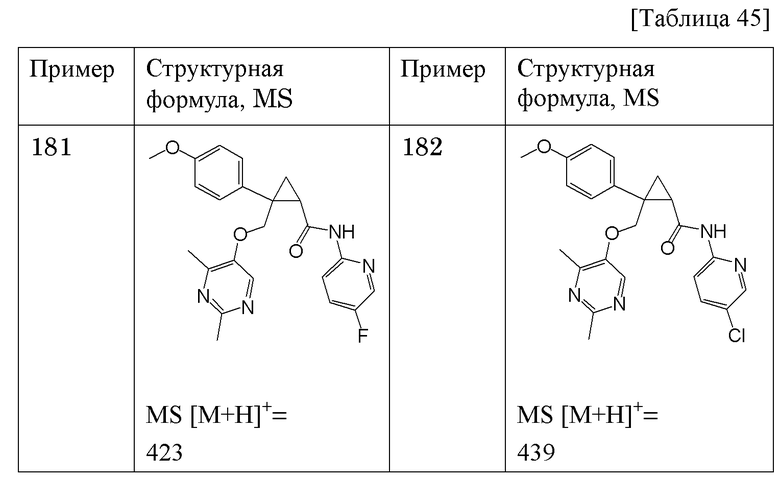
[0360]
* Соединения из примеров 183-190 синтезировали реакцией карбоновой кислоты Продукта 34 из примера получения 34 и любого амина тем же способом, что и в примере 1. Соединения из примеров 186-190 получили путем осуществления хирального разделения.
[0361]
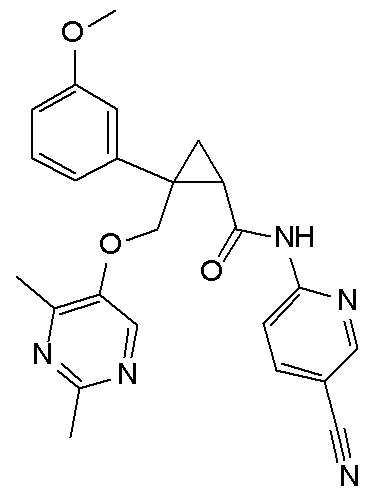
MS [M+H]+=430
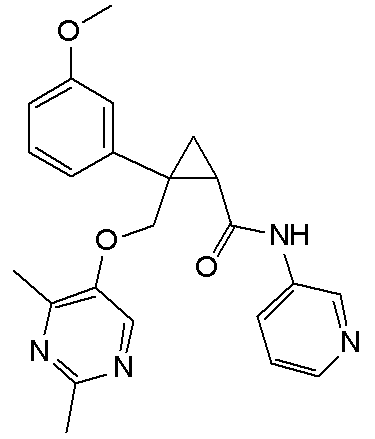
MS [M+H]+=405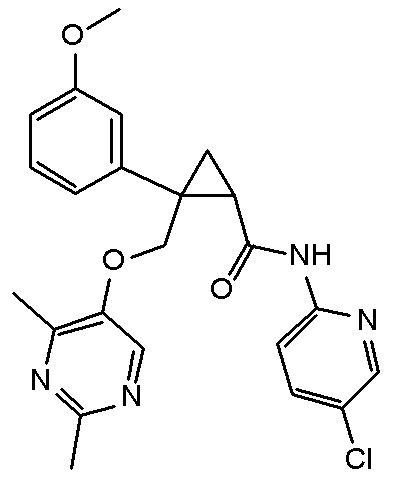
MS [M+H]+=439
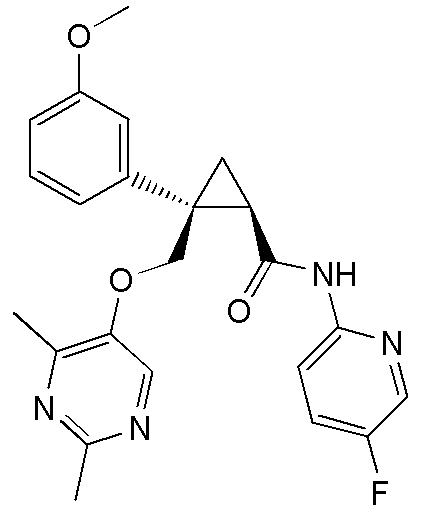
MS [M+H]+=423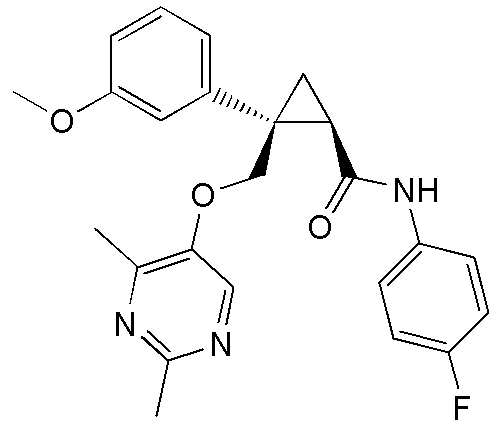
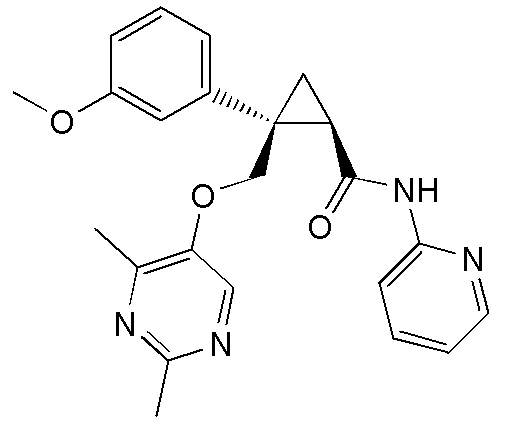
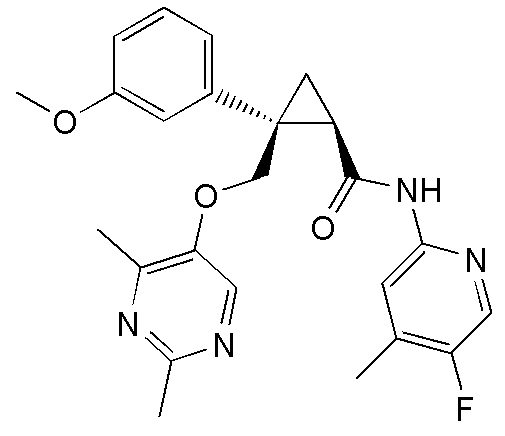
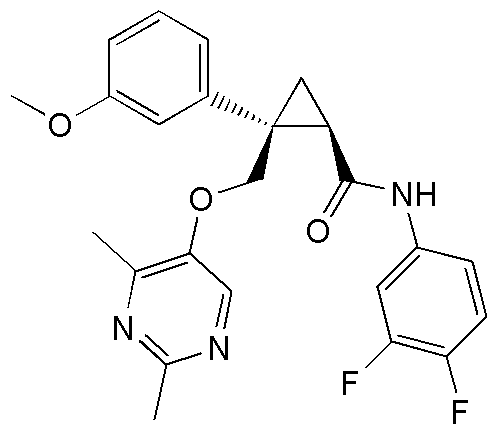
[0362]
* Соединения из примеров 191-201 синтезировали реакцией карбоновой кислоты Продукта 35 и какого-либо амина. Следует отметить, что в отношении способов конденсации, соединения из примеров 193-197 конденсировали согласно способу из примера 51 и соединения из примеров 198 и 201 конденсировали посредством способа из примера 1.
[0363]
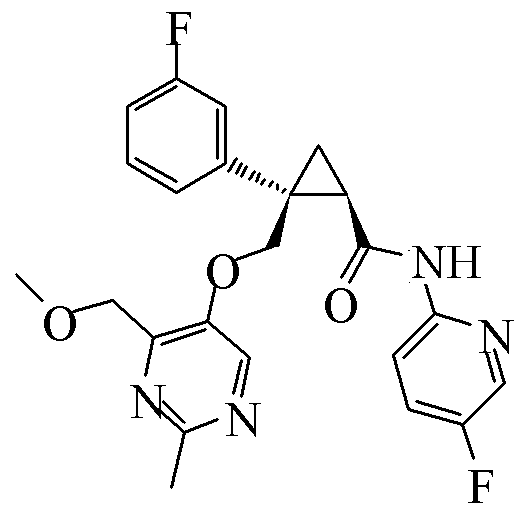
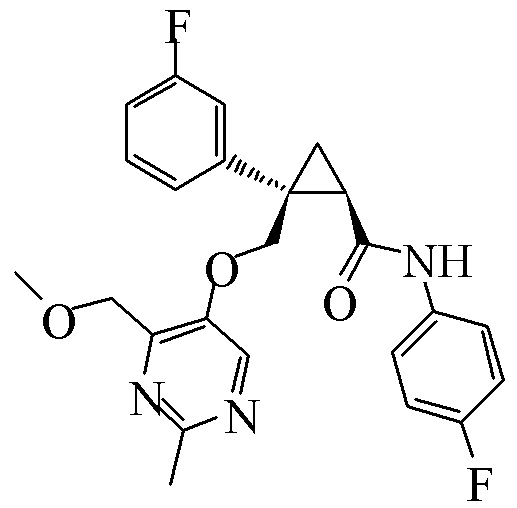
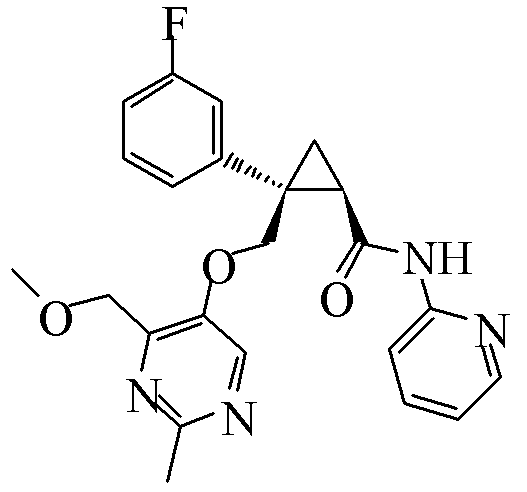
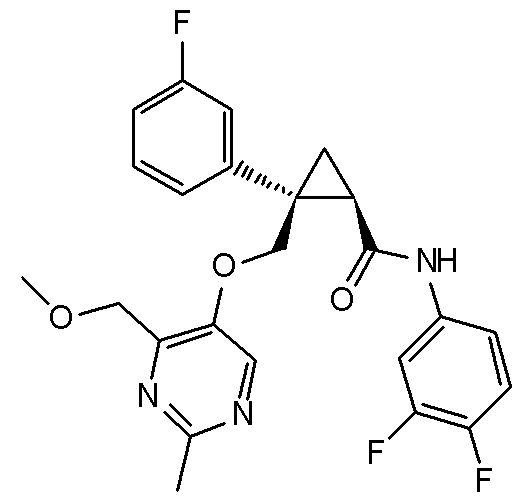
[0364]
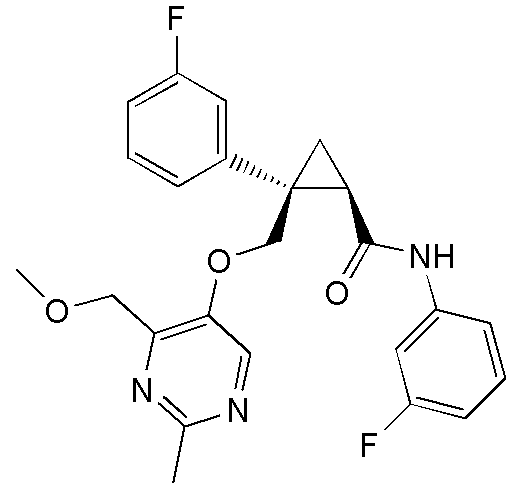

MS [M+H]+=458
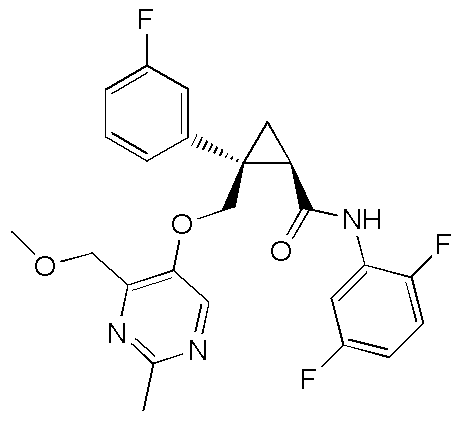
MS [M+H]+=458

[0365]
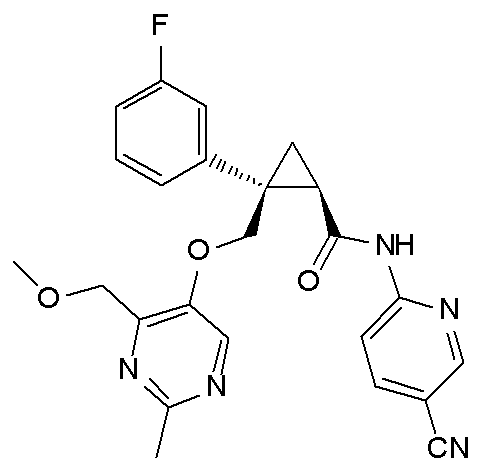
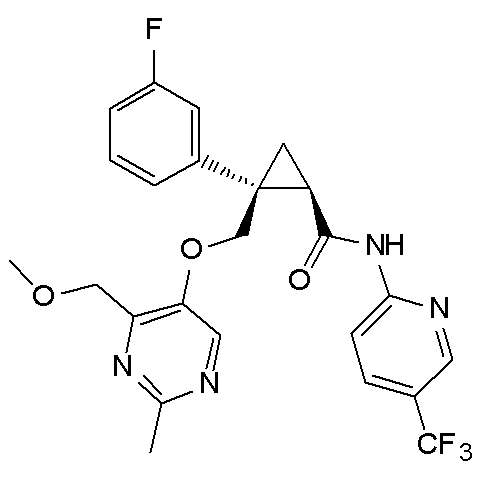
[0366]
* Соединения из примеров 202-210 синтезировали реакцией карбоновой кислоты Продукта 36 и любого амина тем же способом, что и в примере 51.
[0367]
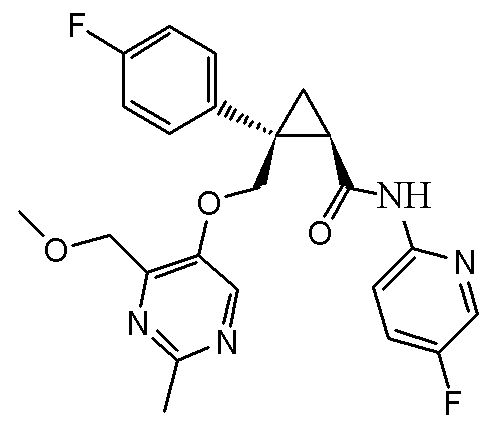
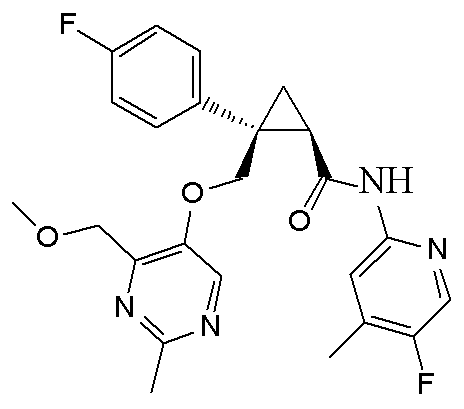
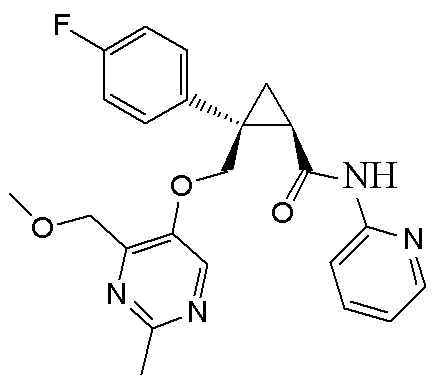
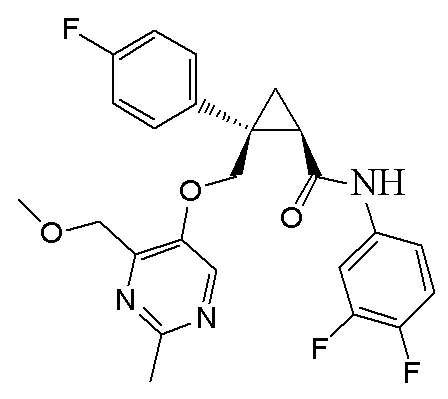
[0368]
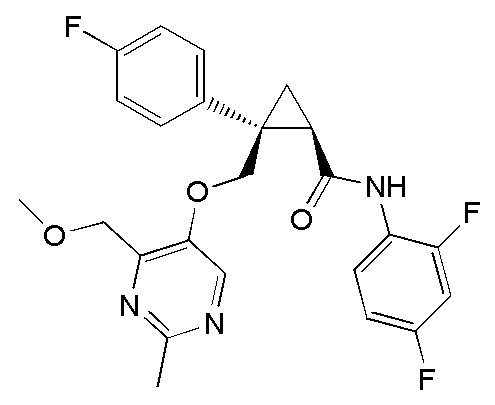
MS [M+H]+=458
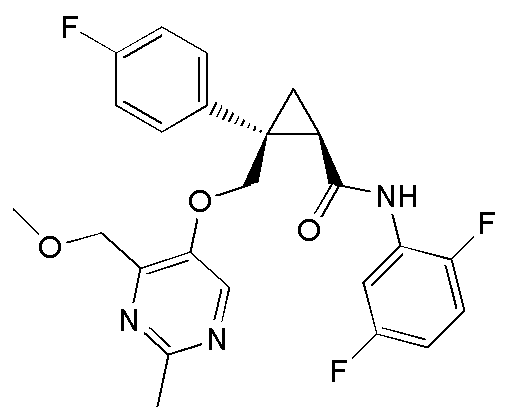
MS [M+H]+=458.
[0369]
* Соединения из примеров 211-217 синтезировали реакцией карбоновой кислоты Продукта 37 и любого амина тем же способом, что и в примере 51.
[0370]
MS [M+H]+=441
MS [M+H]+=473
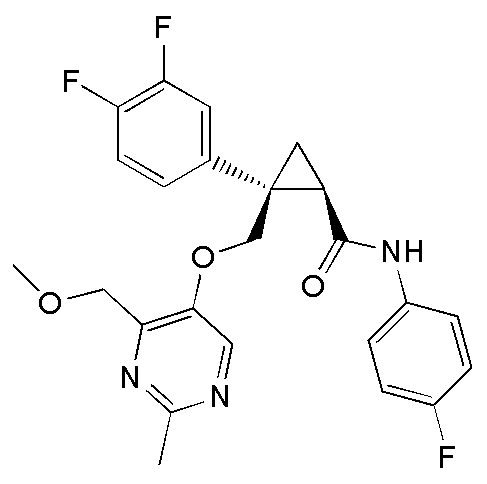
MS [M+H]+=458
[0371]
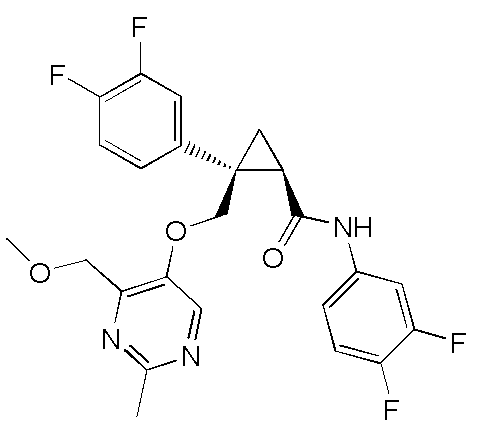
MS [M+H]+=476
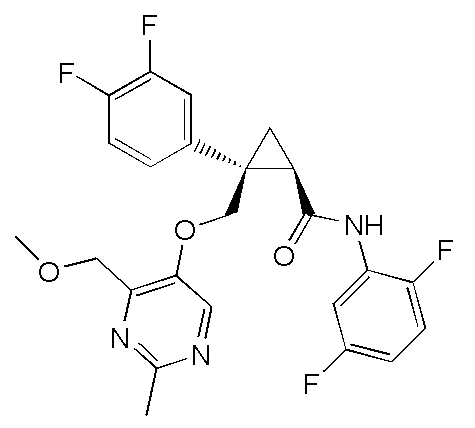
MS [M+H]+=476
MS [M+H]+=476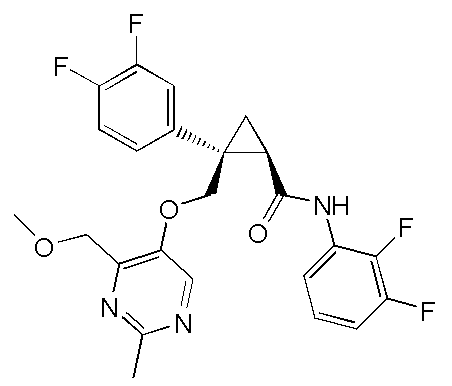
MS [M+H]+=476
[0372]
* Соединения из примеров 218-221 синтезировали реакцией карбоновой кислоты Продукта 38 и любого амина тем же способом, что и в примере 51.
[0373]
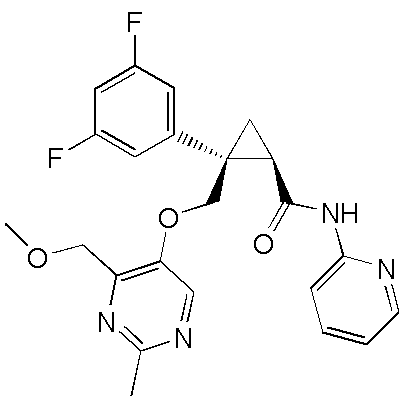
MS [M+Na]+=464
MS [M+H]+=459
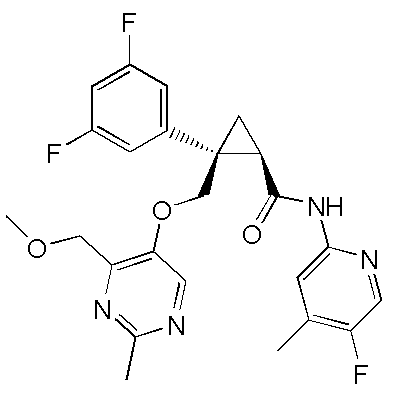
MS [M+Na]+=496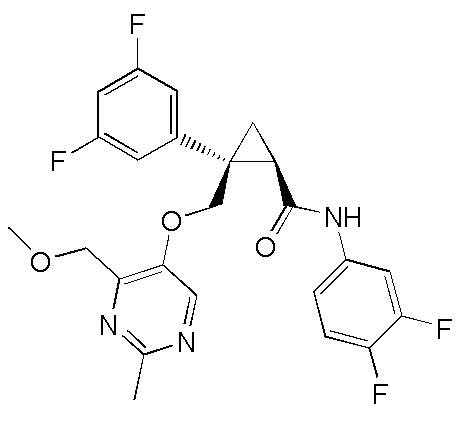
MS [M+Na]+=498
[0374]
* Соединения из примеров 222-227 синтезировали реакцией карбоновой кислоты Продукта 39 и какого-либо амина. Следует отметить, что в отношении способов конденсации, соединения из примеров 222-226 конденсировали согласно способу из примера 51 и соединение из примера 227 конденсировали посредством способа из примера 1. К тому же, соединения из примеров 225 и 226 получили путем осуществления хирального разделения рацемических продуктов.
[0375]
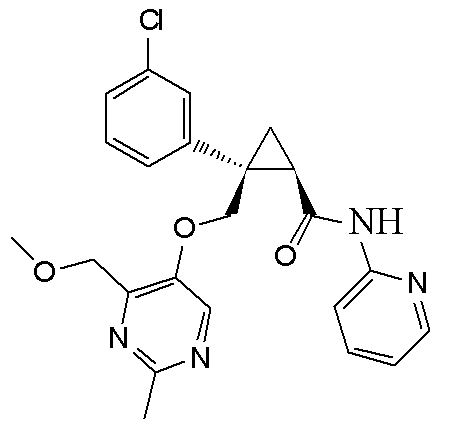
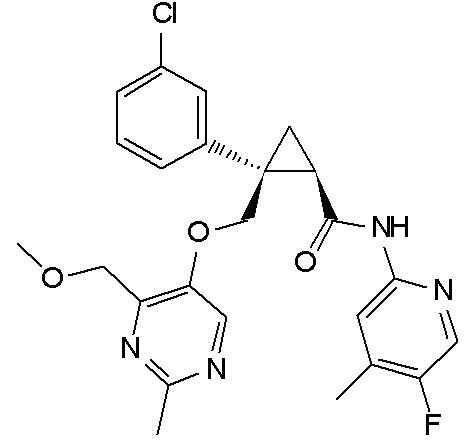
[0376]
* Соединения из примеров 228-230 синтезировали реакцией карбоновой кислоты Продукта 40 и любого амина тем же способом, что и в примере 51.
[0377]
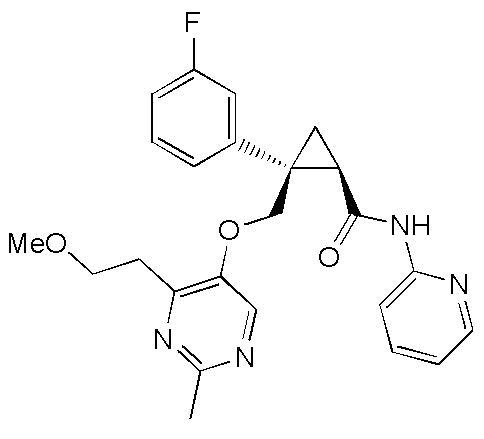
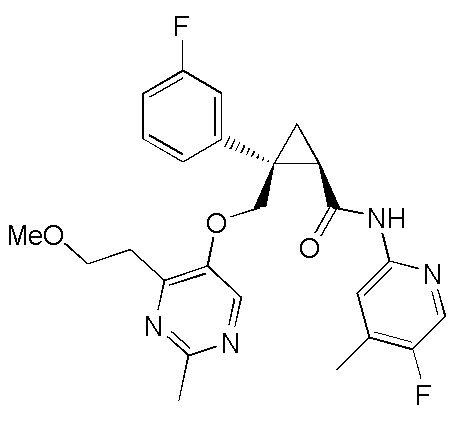
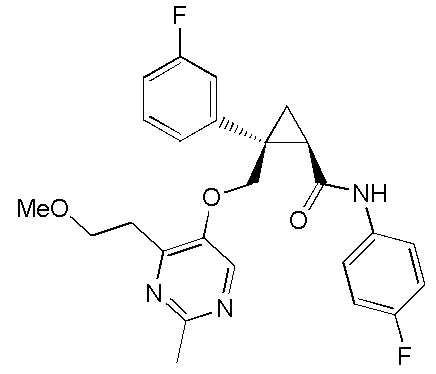
[0378]
* Соединения из примеров 231-236 синтезировали реакцией карбоновой кислоты Продукта 41 и любого амина тем же способом, что и в примере 51.
[0379]
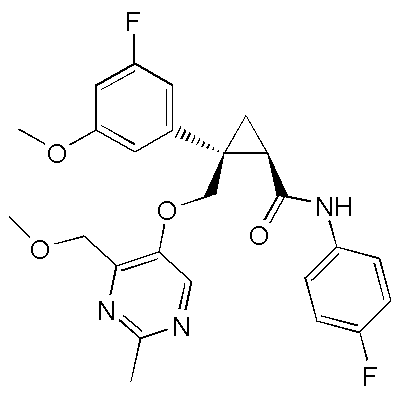
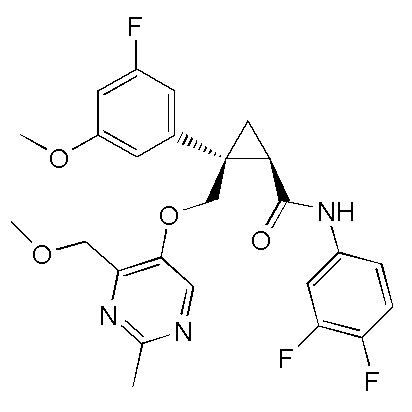
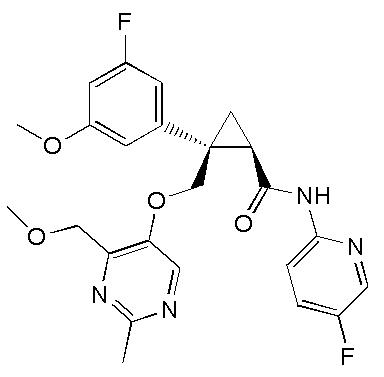
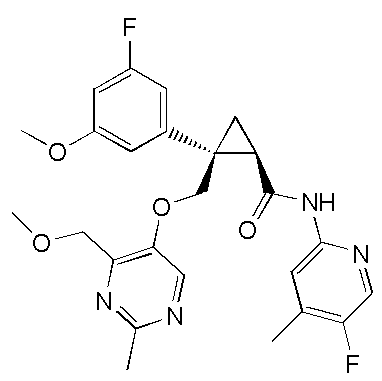
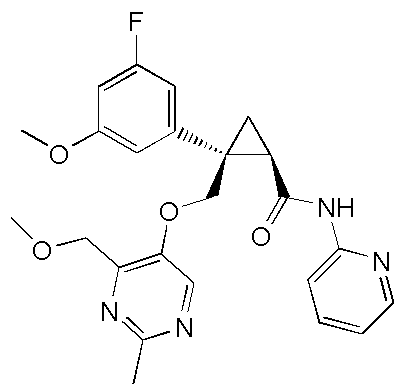
[0380]
* Соединения из примеров 237-239 синтезировали реакцией карбоновой кислоты Продукта 42 и любого амина тем же способом, что и в примере 51.
[0381]
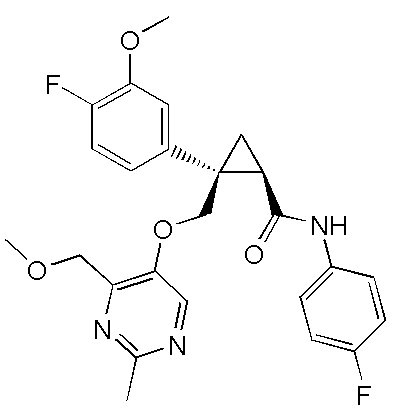
MS [M+Na]+=492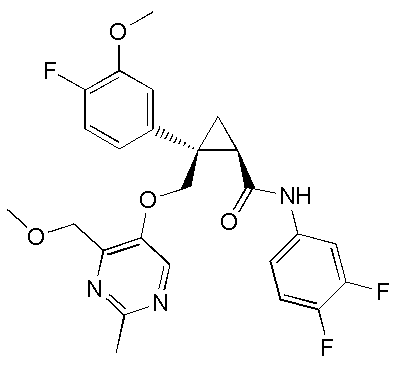
MS [M+H]+=488
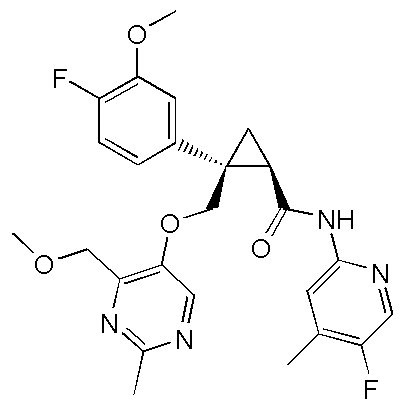
MS [M+Na]+=507.
[0382]
* Соединения из примеров 240-244 синтезировали реакцией карбоновой кислоты Продукта 43 и любого амина тем же способом, что и в примере 1.
[0383]
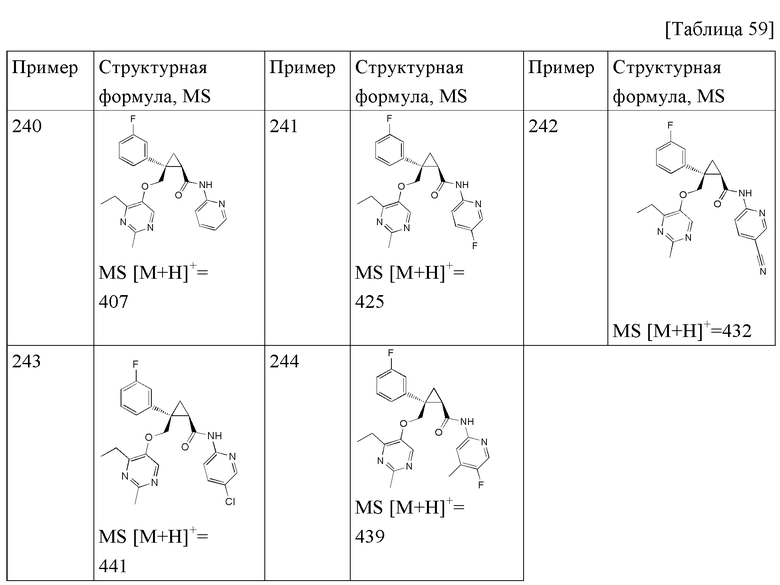
[0384]
* Соединения из примеров 245-250 синтезировали реакцией карбоновой кислоты Продукта 44 и любого амина тем же способом, что и в примере 1.
[0385]
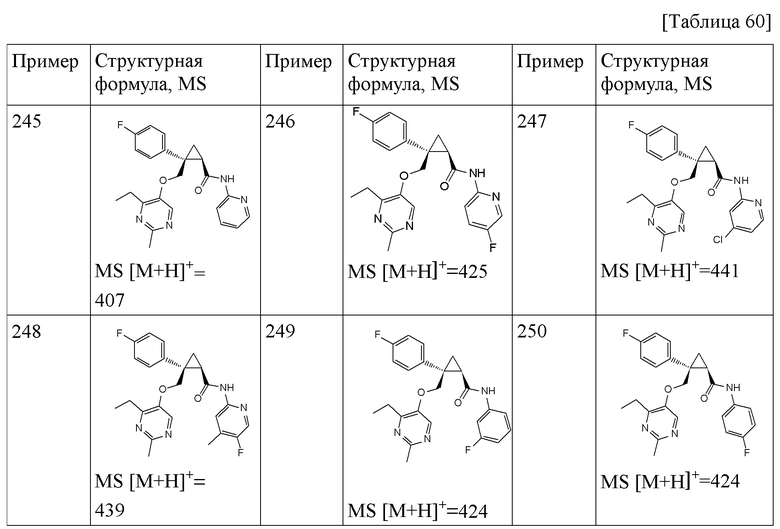
[0386]
* Соединения из примеров 251-256 синтезировали реакцией карбоновой кислоты Продукта 45 или соответствующей рацемической формы и какого-либо амина. Следует отметить, что соединения из примеров 251-253 конденсировали согласно способу из примера 51 и, что соединения из примеров 254-256 конденсировали посредством способа из примера 1 с последующим хиральным разделением.
[0387]
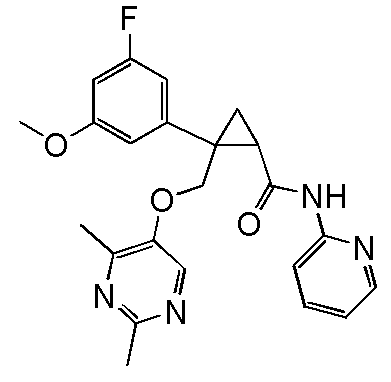
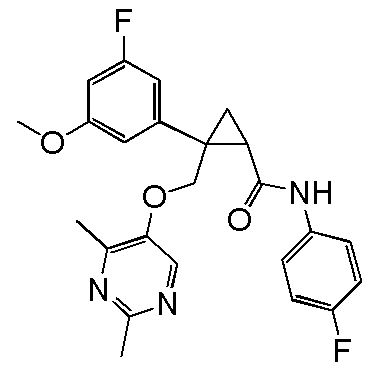
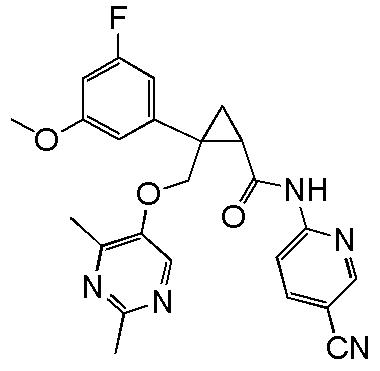
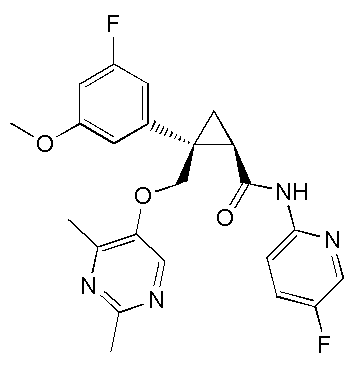
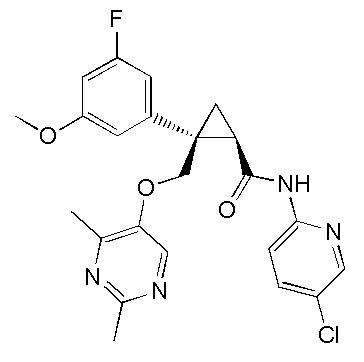
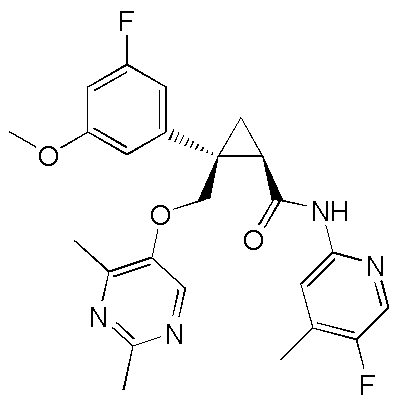
[0388]
* Соединения из примеров 257-259 синтезировали реакцией карбоновой кислоты Продукта 46 и любого амина тем же способом, что и в примере 51.
[0389]
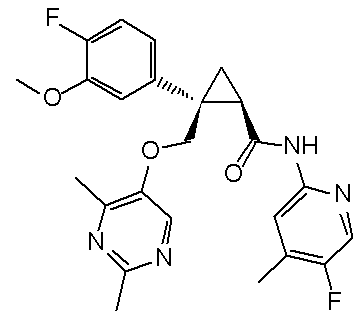

[0390]
Пример 260
Синтез N-(5-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-пиридин-3-илциклопропанкарбоксамида (260)
[Формула 83]
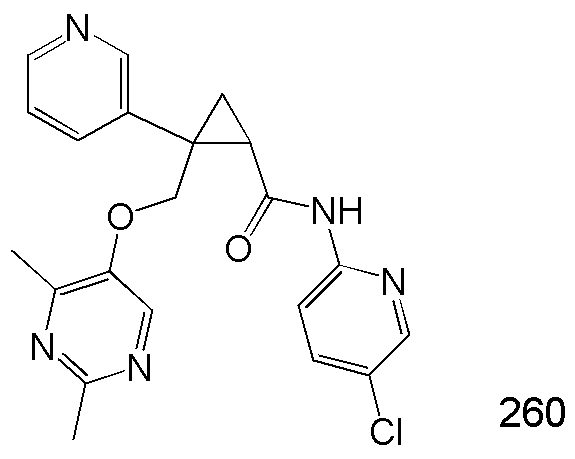
[0391]
Титульное соединение синтезировали путем амидирования карбоновой кислоты Продукта 47 согласно способу из примера 51.
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,63 (дд, J=8,0, 5,2 Гц, 1H), 1,96 (т, J=4,8 Гц, 1H), 2,14-2,22 (м, 1H), 2,22 (с, 3H), 2,56 (с, 3H), 4,44 (д, J=9,6 Гц, 1H), 4,49 (д, J=9,6 Гц, 1H), 7,29-7,33 (м, 1H), 7,61-7,64 (м, 1H), 7,79 (дт, J=7,6, 1,9 Гц, 1H), 7,99 (с, 1H), 8,04-8,07 (м, 1H), 8,20-8,22 (м, 1H), 8,56-8,59 (м, 1H), 8,77-8,78 (м, 1H), 8,89-8,95 (шир.с, 1H).
[0392]
* Соединения из примеров 261-281 синтезировали согласно способам, описанным в примерах получения и примерах.
[0393]
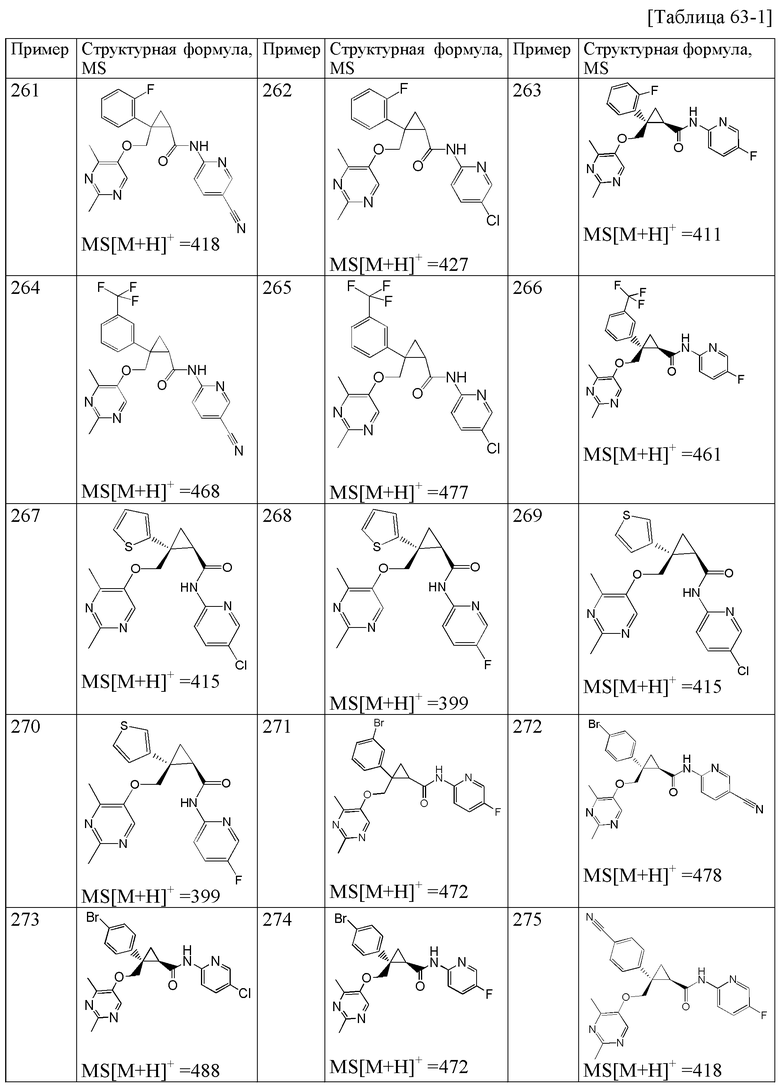
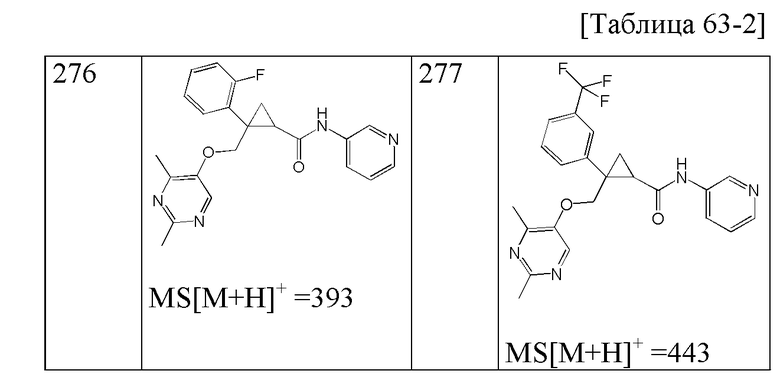
[0394]
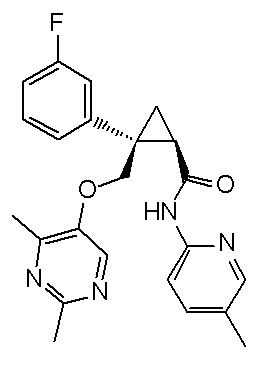
MS [M+H]+=407, MS [M+Na]+=429
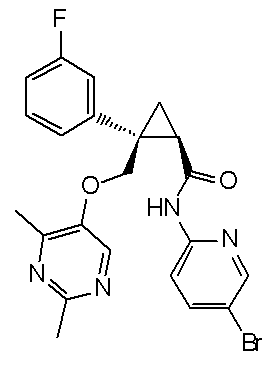
MS [M+Na]+=493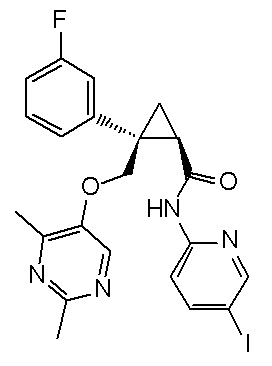
MS [M+Na]+=541
MS [M+H]+=451, MS [M+Na]+=473
[0395]
Пример 282
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторметилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамида (282)
[Формула 84]
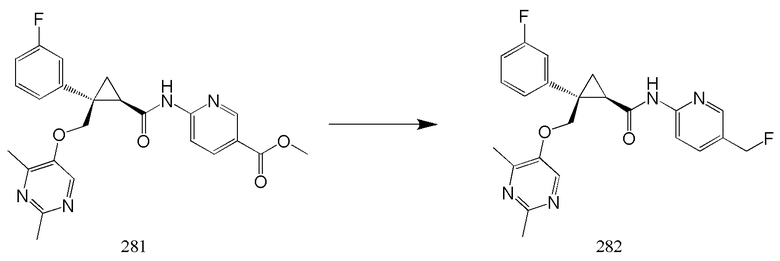
[0396]
Соединение 281 (51,6 мг) растворили в THF (5 мл) и затем добавляли к полученному раствору алюмогидрид лития (8,73 мг) при охлаждении в водяной бане со льдом. Полученную смесь перемешивали в течение 30 минут и затем переместили реакционный раствор в охлажденную льдом воду. После этого к нему добавляли этилацетат для осуществления разделения жидкости. Органический слой промывали насыщенным водным раствором хлорида натрия. Полученный в результате органический слой высушили над сульфатом магния и затем концентрировали растворитель при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на силикагеле (этилацетат:метанол=1:0-9:1) с тем, чтобы получить спиртовое промежуточное соединение (20 мг). Полученное спиртовое промежуточное соединение (20 мг) растворяли в дихлорметане (3 мл) и затем добавляли [бис(2-метоксиэтил)амино]сульфотрифторид (34,9 мкл) к полученному раствору при охлаждении в водяной бане со льдом. Полученную смесь перемешивали в течение 0,5 часа и затем ее перемешивали при комнатной температуре в течение 3 часов. После этого насыщенный водный раствор бикарбоната натрия добавляли к реакционному раствору и затем осуществляли разделение жидкости при помощи этилацетата. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия. Полученный в результате органический слой высушили над сульфатом магния и затем концентрировали растворитель при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на силикагеле (н-гептан:этилацетат=7:3-1:1) с тем, чтобы получить титульное соединение (5,0 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,55-1,65 (м, 1H), 1,93 (т, J=5,6 Гц, 1H), 2,10-2,18 (м, 1H), 2,21 (с, 3H), 2,55 (с, 3H), 4,40 (д, J=9,6 Гц, 1H), 4,50 (д, J=9,6 Гц, 1H), 5,34 (д, J=48,0 Гц, 2H), 6,97-7,04 (м, 1H), 7,14-7,21 (м, 1H), 7,22-7,28 (м, 1H), 7,33 (тд, J=8,0 Гц, 6,0 Гц, 1H), 7,70 (тд, J=8,8 Гц, 2,0 Гц, 1H), 8,09 (д, J=8,0 Гц, 1H), 8,30 (д, J=2,0 Гц, 1H), 8,32 (т, J=2,0 Гц, 1H), 8,40 (шир.с, 1H).
MS [M+Na]+=447
[0397]
Соединение из примера 283 синтезировали из карбоновой кислоты Продукта 56, полученной в примере получения 56, тем же способом, что и в примере 82. Соединения из примеров 284 и 285 синтезировали тем же способом, что и в примере 81.
[0398]
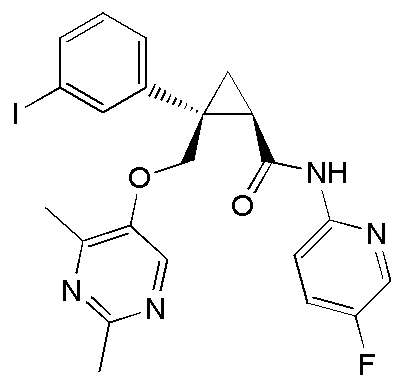
MS [M+H]+=519
MS [M+H]+=427
MS [M+H]+=427
[0399]
Пример 286
Синтез (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-{[(4-гидроксиметил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамида (286)
[Формула 85]
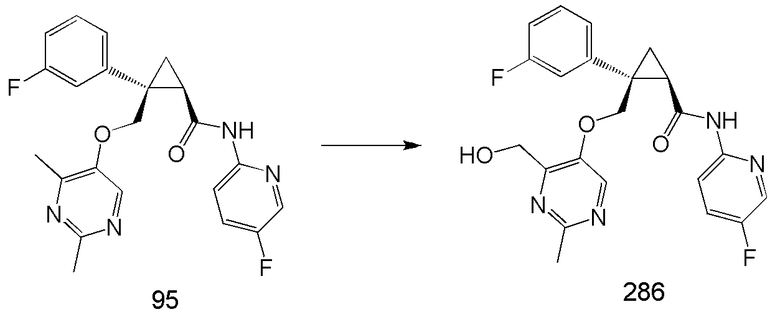
[0400]
К THF-раствору (10 мл) соединения 95 (200 мг) добавляли при перемешивании при -78°C n-BuLi (2,76M раствор в н-гексане: 0,371 мл) и полученный раствор затем перемешивали в течение 1 часа. После этого добавляли THF-раствор (3 мл) (2-бензолсульфонил-3-фенилоксазиридина) (Davis, F. A., J. Org. Chem. 1982, 47, 1774) (135 мг) к реакционному раствору при -78°C. В то время как температуру реакционного раствора повышали до комнатной температуры, его перемешивали в течение 14 часов. После этого насыщенный водный раствор хлорида аммония добавляли к реакционному раствору с последующей экстракцией при помощи этилацетата. Органический слой промывали насыщенным водным раствором хлорида натрия, высушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-0:1). Полученный в результате продукт снова очищали при помощи ВЭЖХ с тем, чтобы получить титульное соединение (1,19 мг).
1H-ЯМР (600 МГц, CD3OD) δ (частей на миллион): 1,56 (т, J=6,0 Гц, 1H), 1,85 (т, J=6,0 Гц, 1H), 2,49 (т, J=6,0 Гц, 1H), 2,53 (с, 3H), 4,41 (д, J=12,0 Гц, 1H), 4,49 (д, J=12,0 Гц, 1H), 4,57 (д, J=12,0 Гц, 1H), 4,66 (д, J=12,0 Гц, 1H), 6,98-7,04 (м, 1H), 7,32-7,36 (м, 1H), 7,36-7,39 (м, 2H), 7,44-7,50 (м, 1H), 7,90-7,95 (м, 1H), 8,13 (с, 1H), 8,17 (шир.с, 1H).
MS [M+Na]+=449
[0401]
Соединения из примеров 287-290 синтезировали из карбоновой кислоты Продукта 48-5 согласно примерам.
[0402]
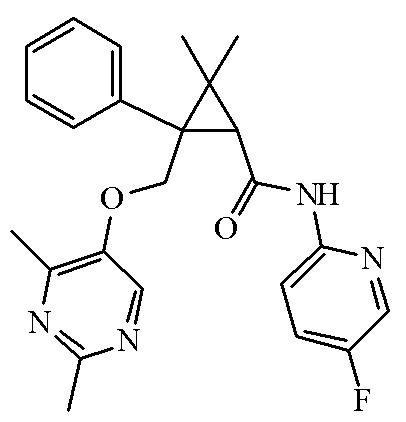
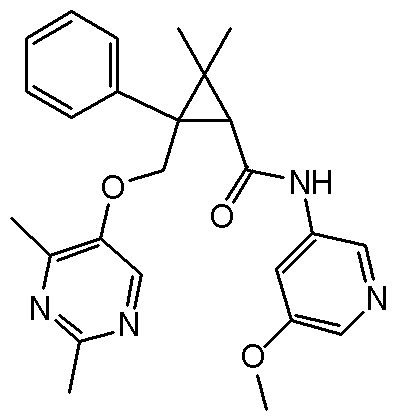
[0403]
Пример 291
Синтез (1R,2S)-2-(3,5-дифторфенил)-N-(5-фторпиридин-2-ил)-2-{[(2-оксо-4-трифторметил-1,2-дигидропиримидин-5-ил)окси]метил}циклопропанкарбоксамида (291)
[Формула 86]
[0404]
2-Амино-5-фторпиридин (26,4 мг), HATU (89,4 мг) и N,N-диизопропилэтиламин (40,7 мкл) добавляли к DMF-раствору (2 мл) соединения Продукта 50-7 (100 мг). Полученную смесь перемешивали при комнатной температуре в течение ночи. После этого добавляли воду к реакционному раствору и полученную смесь затем экстрагировали при помощи диэтилового эфира. Органический слой промывали насыщенным водным раствором хлорида натрия, затем высушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении. К остатку добавляли 4N соляную кислоту/этилацетат (2 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. После этого реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия и этилацетат, и полученную смесь затем подвергали разделению жидкостей и экстракции. Полученный органический слой сушили над сульфатом магния. Полученный в результате органический слой концентрировали при пониженном давлении и полученный остаток затем очищали при помощи колоночной хроматографии на силикагеле (н-гептан:этилацетат=2:1-0:1) с тем, чтобы получить титульное соединение (30 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,59-1,63 (м, 1H), 1,86 (т, J=6,0 Гц, 1H), 2,17 (шир.т, J=6,0 Гц, 1H), 4,41 (т, J=10,8 Гц, 2H), 6,70-6,76 (м, 1H), 6,97 (д, J=6,0 Гц, 2H) 7,38-7,43 (м, 1H), 7,91 (с, 1H), 8,06-8,09 (м, 2H), 9,13 (с, 1H).
MS [M+Na]+=485.
[0405]
Пример 292
Синтез (1R,2R)-2-[2-(2,4-диметилпиримидин-5-ил)этил]-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамида (292)
[Формула 87]
[0406]
Соединение Продукта 51-9 обработали тем же образом, что и в примере 291 с тем, чтобы получить титульное соединение.
MS [M+H]+=405
[0407]
Пример 293
Синтез (1R,2S)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-N-(5-фторпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамида (293)
[Формула 88]
[0408]
Соединение Продукта 53-6 (50 мг) растворяли в DMF (15,6 мл) и после этого HATU (116 мг), N,N-диизопропилэтиламин (79,4 мкл) и 2-амино-5-фтор-4-пиколин (57,5 мг) добавляли к раствору. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. После этого воду добавляли к реакционному раствору и затем концентрировали реакционный раствор при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на силикагеле (н-гептан:этилацетат=7:3-3:7) с тем, чтобы получить титульное соединение (26,8 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,54 (дд, J=9,6, 4,8 Гц, 1H), 1,69 (т, J=5,2 Гц, 1H), 1,86-1,90 (м, 1H), 2,04 (с, 3H), 2,32 (с, 1H), 2,52 (с, 3H), 2,63 (с, 3H), 3,54 (д, J=13,6 Гц, 1H), 3,59 (д, J=13,6 Гц, 1H), 6,89-7,05 (м, 3H), 7,20-7,26 (м, 2H), 7,97 (с, 1H), 8,05-8,10 (м, 2H), 8,10 (с, 1H), 8,55 (шир.с, 1H).
[0409]
Соединения из примеров 294-296 синтезировали реакцией карбоновой кислоты Продукта 53-6 с любым амином согласно способу из примера 293.
[0410]
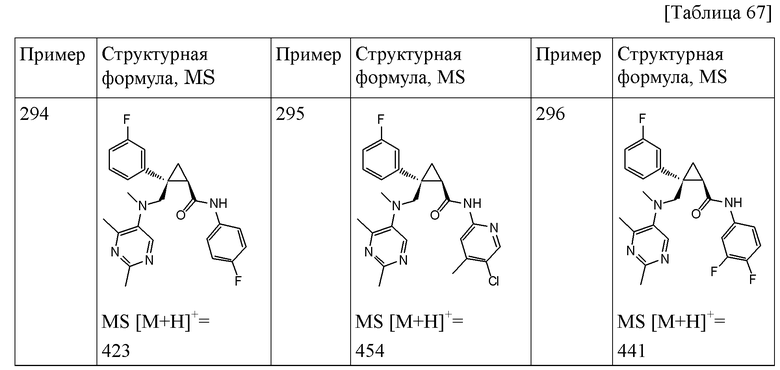
[0411]
Соединения из примеров 297-301 синтезировали из карбоновой кислоты Продукта 54 согласно способу из примера 293.
[0412]
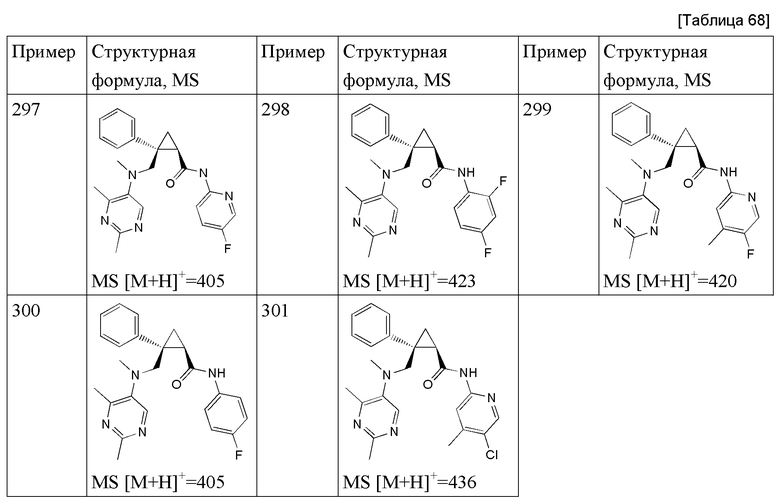
[0413]
Пример 302
Синтез (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-[N-(2-метил-4-трифторметилпиримидин-5-ил)аминометил]циклопропанкарбоксамида (302)
[Формула 89]
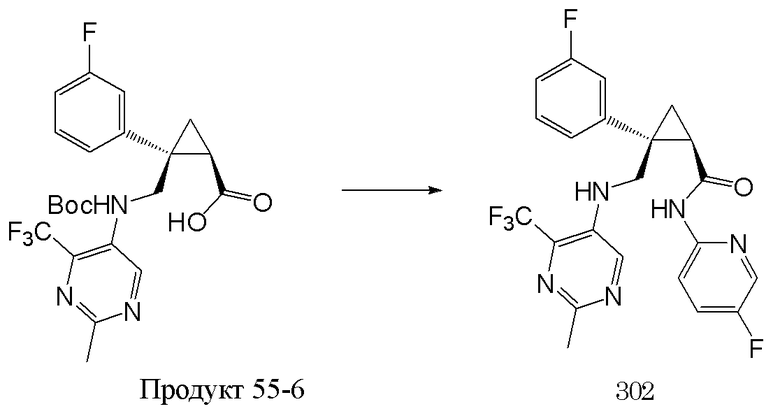
[0414]
2-Амино-5-фторпиридин (8,6 мг), HATU (29,2 мг) и N,N-диизопропилэтиламин (13,3 мкл) добавляли к DMF-раствору (1 мл) соединения Продукта 55-6 (30 мг). Полученную смесь перемешивали при комнатной температуре в течение ночи. После этого добавляли воду к реакционному раствору и затем экстрагировали полученную смесь при помощи диэтилового эфира. Органический слой промывали водным раствором хлорида натрия, затем высушили над безводным сульфатом магния и затем отфильтровали. Фильтрат концентрировали при пониженном давлении. К остатку добавляли 4N соляную кислоту/этилацетат (3 мл) и затем перемешивали полученную смесь при комнатной температуре в течение 1 часа. После этого реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия и этилацетат и полученную смесь затем подвергали разделению жидкостей и экстракции. Полученный органический слой высушили над сульфатом магния. Полученный в результате органический слой концентрировали при пониженном давлении и полученный остаток затем очищали при помощи колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-1:1) с тем, чтобы получить титульное соединение (8,6 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,53-1,56 (м, 1H), 1,81 (т, J=5,2 Гц, 1H), 2,02 (шир.т, J=7,6 Гц, 1H), 2,57 (с, 3H), 3,77 (дд, J=14,0, 5,6 Гц, 1H), 3,89 (дд, J=13,6, 5,6 Гц, 1H), 4,45 (шир.с, 1H), 6,98-7,15 (м, 3H), 7,30-7,47 (м, 2H), 8,13-8,17 (м, 3H), 8,32 (с, 1H).
MS [M+Na]+=486.
[0415]
Пример 303
Синтез 2-{(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропил}-5-фтор-1H-бензимидазола (303)
[Формула 90]
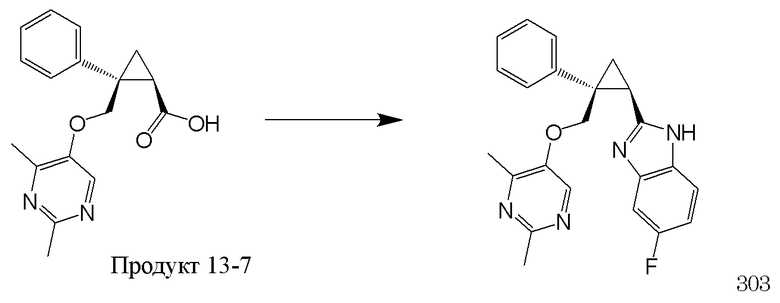
[0416]
HATU (153 мг), N,N-диизопропилэтиламин (104 мкл) и 3,4-диамино-5-фторбензол (45,3 мг) добавляли к DMF-раствору (3 мл) соединения Продукта 13-7 (100 мг) и полученную смесь затем перемешивали при комнатной температуре в течение ночи. После этого воду добавляли к реакционной смеси и затем осуществляли разделение жидкости и экстракцию при помощи этилацетата. Полученный органический слой высушили над сульфатом магния и полученный в результате органический слой затем концентрировали при пониженном давлении. Полученный остаток растворили в уксусной кислоте (3 мл) и полученный раствор затем перемешивали при 90°C в течение 5 часов. После этого реакционную смесь концентрировали при пониженном давлении и полученный в результате продукт отфильтровали при помощи NH-силикагелевой подушки. Фильтрат концентрировали при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на силикагеле (н-гептан:этилацетат=5:1 к этилацетату) с тем, чтобы получить титульное соединение (15 мг).
MS [M+H]+=389.
[0417]
Соединения из примеров 304 и 305 синтезировали тем же способом, что и в примере 303.
[0418]
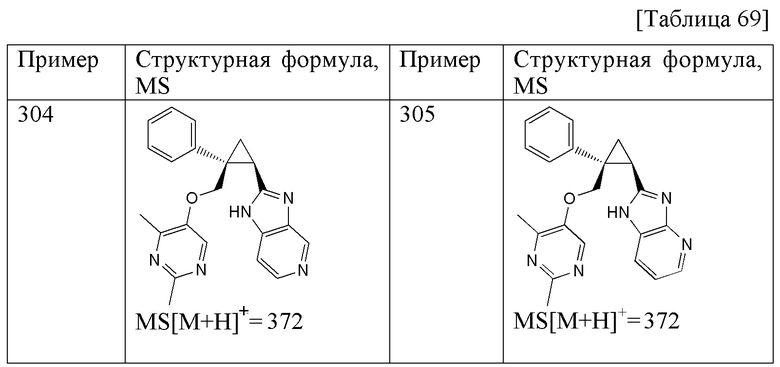
[0419]
Пример 306
Синтез 2-{(1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропил}-6-фтор-1H-имидазо[4,5-b]пиридина (306)
[Формула 91]
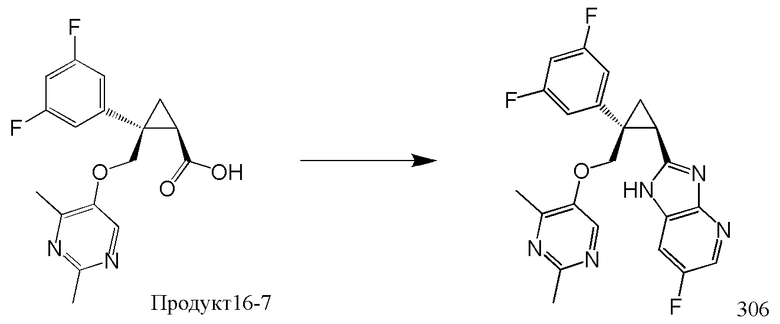
[0420]
HATU (45,9 мг), N,N-диизопропилэтиламин (31,2 мкл) и 2,3-диамино-5-фторбензол (15,5 мг) добавляли к DMF-раствору (900 мкл) соединения Продукта 16-7 (30 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 2 часов. После этого насыщенный водный раствор бикарбоната натрия добавляли к реакционной смеси и затем осуществляли разделение жидкости и экстракцию при помощи этилацетата. Полученный органический слой высушили над сульфатом магния и полученный в результате органический слой затем концентрировали при пониженном давлении. Полученный остаток растворили в уксусной кислоте (900 мкл) и полученный раствор затем перемешивали при помощи INITIATOR MICROWAVE SYNTHESIZER (Biotage) при 150°C в течение 11 часов. После этого реакционную смесь концентрировали при пониженном давлении и добавляли этилацетат и водный раствор бикарбоната натрия к остатку для осуществления разделения жидкости и экстракции. Полученный органический слой высушили над сульфатом магния и полученный в результате органический слой затем концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (н-гептан:этилацетат=5:1-0:1) с тем, чтобы получить титульное соединение (9,3 мг).
MS [M+H]+=426.
[0421]
Пример 307
Синтез 6-хлор-2-{(1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропил}-1H-имидазо[4,5-b]пиридина (307)
[Формула 92]
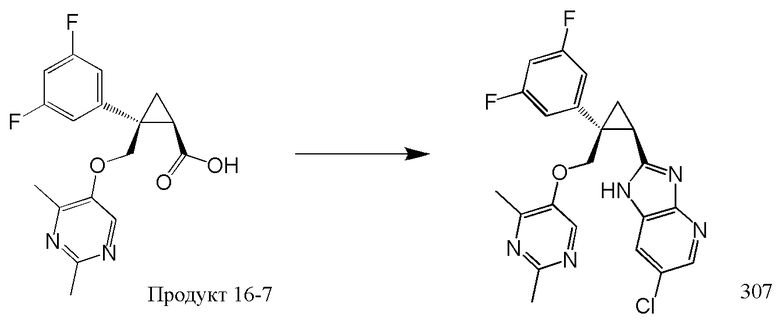
[0422]
Титульное соединение синтезировали тем же способом, что и в примере 306.
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,87 (дд, J=8,8, 5,6 Гц, 1H), 2,11 (с, 3H), 2,50 (с, 3H), 2,21 (т, J=6,0 Гц, 1H), 2,68 (дд, J=8,8, 6,4 Гц, 1H), 4,41 (д, J=10,0 Гц, 1H), 4,45 (д, J=9,6 Гц, 1H), 6,77-6,82 (м, 1H), 6,99-7,09 (м, 2H), 7,82 (с, 1H), 7,88 (д, J=2,4 Гц, 1H), 8,22 (д, J=2,0 Гц, 1H), 11,5 (с, 1H).
[0423]
Следующие соединения синтезировали тем же способом, что и в примере 306.
[0424]
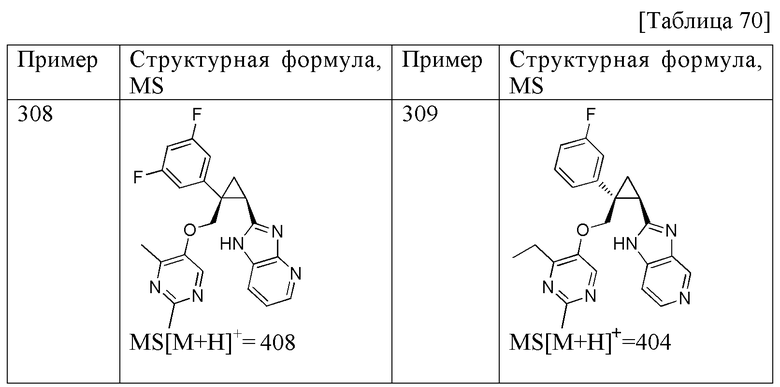
[0425]
Пример 310
Синтез 2-[(1R,2S)-2-{{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]хиназолин-4(1H)-она (310)
[Формула 93]
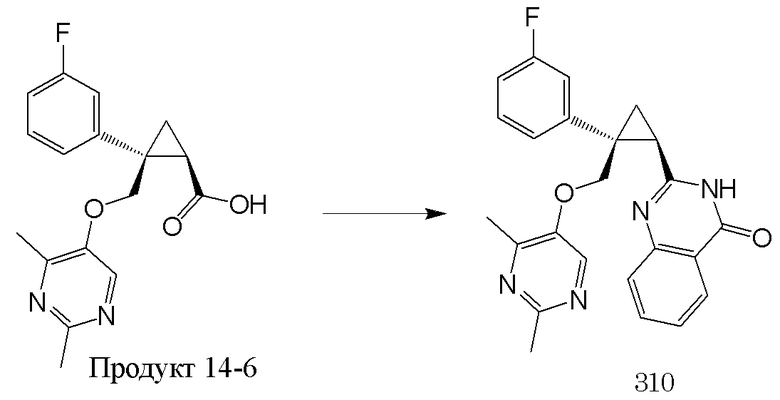
[0426]
Соединение Продукта 14-6 (50 мг), 2-аминобензамид (23,7 мг) и HATU (66,1 мг) растворили в DMF (0,24 мл) и после этого добавляли к раствору N,N-диизопропилэтиламин (22,9 мкл). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. После этого воду добавляли к реакционному раствору и полученную смесь затем экстрагировали при помощи этилацетата. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и затем высушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток растворяли в изопропиловом спирте (3 мл). Калий трет-бутоксид (35,5 мг) добавляли к раствору и полученную смесь затем перемешивали при нагревании при 100°C в течение 2 часов. После этого реакционный раствор охлаждали до комнатной температуры. Капельку воды добавляли к реакционному раствору и полученную смесь затем концентрировали при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на NH-силикагеле (н-гептан:этилацетат=9:1-0:1) с тем, чтобы получить титульное соединение (20,6 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,65 (дд, J=8,0, 5,2 Гц, 1H), 2,14 (с, 3H), 2,33 (т, J=5,2 Гц, 1H), 2,44 (с, 3H), 2,75-2,79 (м, 1H), 4,43 (д, J=9,6, 1H), 4,45 (д, J=9,6 Гц, 1H), 7,07 (тдд, J=8,0, 2,0, 1,2 Гц, 1H), 7,39 (тд, J=8,0, 6,0 Гц, 1H), 7,46-7,52 (м, 2H), 7,62-7,65 (м, 2H), 7,75 (т, J=6,8 Гц, 1H), 7,79 (с, 1H), 8,33 (д, J=8,0 Гц, 1H), 13,1 (шир.с, 1H).
MS[M+H]+: 417
[0427]
MS[M+H]+=451
[0428]
Следующие соединения синтезировали реакцией карбоновой кислоты, описанной в примерах получения, с любым амином тем же способом, что и в примере 51.
[0429]
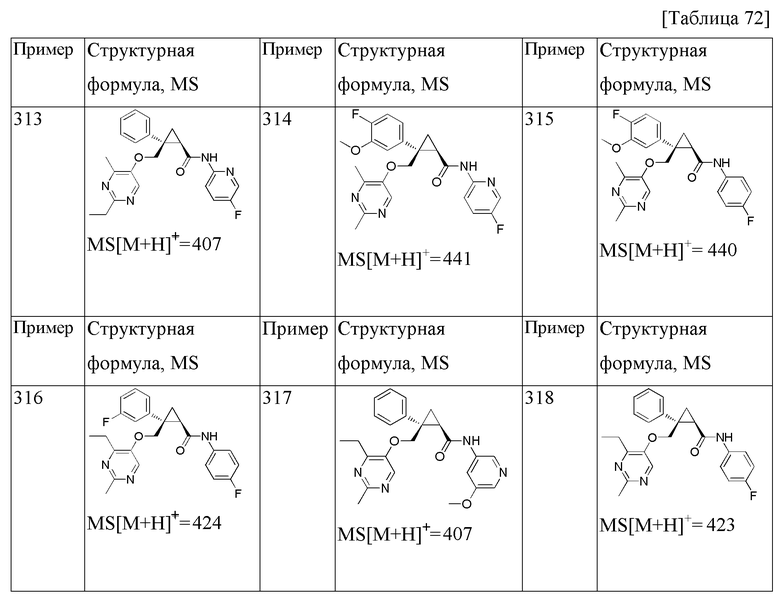
[0430]
Пример 319
Синтез (1R,2S)-2-{{[(2,4-диметилпиримидин-5-ил)окси]метил}}-N-(5-фтор-3-гидроксипиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамида (319)
[Формула 94]
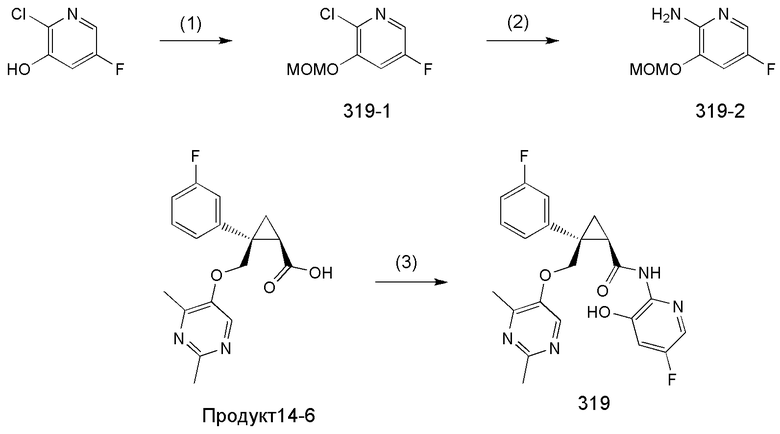
[0431]
(1) 2-Хлор-5-фтор-3-(метоксиметокси)пиридин (319-1)
DMF-раствор (10 мл) 2-хлор-5-фтор-3-гидроксипиридина (500 мг) охлаждали до 0°C. Гидроксид натрия (60% масляная дисперсия: 149 мг) добавляли к реакционному раствору и полученную смесь перемешивали при 0°C в течение 15 минут. Хлорметил-метиловый эфир (293 мкл) добавляли к реакционному раствору при той же температуре, как описано выше, и полученную смесь нагрели до комнатной температуры и перемешивали в течение 1 часа. Диэтиловый эфир и воду добавляли к реакционному раствору и органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия. Органический слой высушили над безводным сульфатом магния и затем отфильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали при помощи колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-7:3) с тем, чтобы получить титульное соединение (598 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,52 (с, 3H), 5,28 (с, 2H), 7,32 (дд, J=9,2, 2,8 Гц, 1H), 7,95 (дд, J=2,8, 0,8 Гц, 1H).
[0432]
(2) 5-Фтор-3-(метоксиметокси)пиридин-2-амин (319-2)
Бензофенонимин (55,3 мкл), 2,2-бис(дифенилфосфино)-1,1-бинафтил (29,3 мг), натрий трет-бутоксид (22,6 мг) и Pd2DBA3 (15,3 мг) добавляли к толуольному раствору (0,5 мл) соединения 319-1 (30 мг). Реакционный раствор нагрели до 100°C и перемешивали в течение 3 часов. Диэтиловый эфир добавляли к реакционному раствору и полученную смесь отфильтровали при помощи целита. Фильтрат концентрировали при пониженном давлении. Добавляли 2M соляную кислоту (78,5 мкл) к THF-раствору (1 мл) остатка и полученную смесь перемешивали при комнатной температуре в течение 12 часов. Насыщенный водный раствор бикарбоната натрия добавляли к реакционному раствору и смесь экстрагировали при помощи дихлорметана. Органический слой высушили над безводным сульфатом магния и затем отфильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали при помощи колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1 к этилацетату) с тем, чтобы получить титульное соединение (17 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,49 (с, 3H), 4,52 (шир.с, 2H), 5,20 (с, 2H), 7,09 (дд, J=9,6, 2,6 Гц, 1H), 7,63 (д, J=2,6 Гц, 1H).
MS [M+H]+=173
[0433]
(3) Синтез (1R,2S)-2-{{[(2,4-диметилпиримидин-5-ил)окси]метил}}-N-(5-фтор-3-гидроксипиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамида (319)
Продукт 14-6 (30 мг) растворяли в DMF (0,6 мл). 5-фтор-3-(метоксиметокси)пиридин-2-амин (соединение 319-2: 17 мг), добавляли HATU (39,7 мг) и N,N-диизопропилэтиламин (15 мкл) в раствор и полученную смесь перемешивали при комнатной температуре в течение 5 часов. После этого ее нагрели до 40°C и дополнительно перемешивали в течение 22 часов. Добавляли воду в реакционный раствор и экстрагировали смесь этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, высушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток отфильтровали через NH-силикагелевую подушку. Фильтрат концентрировали при пониженном давлении. После этого остаток растворяли в смешанном растворителе THF (0,5 мл)-метанол (0,5 мл) и добавляли 5 M соляную кислоту (0,5 мл) в раствор. Реакционный раствор нагревали до 90°C и перемешивали в течение 30 минут. Насыщенный водный раствор бикарбоната натрия добавляли в реакционный раствор и экстрагировали смесь хлороформом. Органический слой сушили над безводным сульфатом магния и затем фильтровали. Фильтрат концентрировали при пониженном давлении и очищали остаток с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-1:9) с тем, чтобы получить титульное соединение (8,2 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,74 (дд, J=8,0, 5,6 Гц, 1H), 1,97 (т, J=5,6 Гц, 1H), 2,22 (дд, J=8,0, 5,6 Гц, 1H), 2,27 (с, 3H), 2,58 (с, 3H), 4,42 (д, J=9,6 Гц, 1H), 4,51 (д, J=9,6 Гц, 1H), 7,00-7,05 (м, 2H), 7,18 (дт, J=9,6, 2,4 Гц, 1H), 7,24 (дт, J=8,0, 1,2 Гц, 1H), 7,34 (дт, J=6,6, 5,6 Гц, 1H), 7,73 (д, J=2,4 Гц, 1H), 7,97 (с, 1H), 8,56 (шир.с, 1H), 10,43 (с, 1H).
MS[M+H]+=427
[0434]
Пример 320
Синтез (1R,2S)-2-{[(4-фторметил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (320)
[Формула 95]
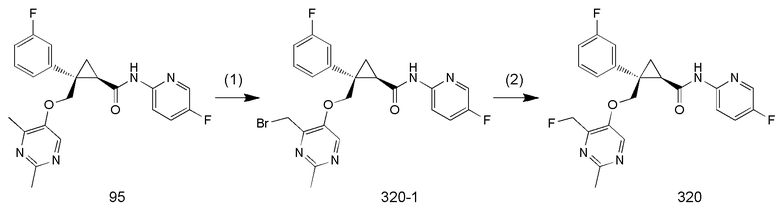
[0435]
(1) Синтез (1R,2S)-2-{[(4-бромметил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (320-1)
Бром (65,5 мкл) добавляли в хлороформный раствор (15 мл) соединения 95 (500 мг) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Насыщенный водный раствор тиосульфата натрия добавляли в реакционный раствор и смесь экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-7:3), чтобы получить соединение 317-1 (153 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,61-1,68 (м, 1H), 1,90-1,97 (м, 1H), 2,11-2,18 (м, 1H), 2,59 (с, 3H), 4,24 (т, J=11,8 Гц, 2H), 4,56 (с, 2H), 6,97-7,05 (м, 1H), 7,19-7,41 (м, 4H), 8,03-8,10 (м, 1H), 8,12 (с, 1H), 8,15 (с, 1H), 8,35 (шир.с, 1H).
[0436]
(2) (1R,2S)-2-{[(4-(фторметил-2-метилпиримидин-5-ил)окси)метил]-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (320)
Калия фторид (17,8 мг) и 18-краун-6 (80,9 мг) добавляли в ацетонитрильный раствор (10 мл) соединения 320-1 (50 мг) и полученную смесь перемешивали при 60°C в течение 8 часов. Температуру реакционного раствора снижали до комнатной температуры. Добавляли воду в реакционный раствор и экстрагировали смесь этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, затем высушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-1:1) с тем, чтобы получить титульное соединение (3,03 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,60-1,65 (м, 1H), 1,92 (т, J=5,4 Гц, 1H), 2,09-2,16 (м, 1H), 2,63 (с, 3H), 4,50 (д, J=9,4 Гц, 1H), 4,56 (д, J=9,4 Гц, 1H), 5,20 (дд, J=22,8, 12,0 Гц, 1H), 5,31 (дд, J=22,8, 12,0 Гц, 1H), 6,98-7,05 (м, 1H), 7,13-7,19 (м, 1H), 7,22-7,28 (м, 1H), 7,30-7,43 (м, 2H), 8,02-8,10 (м, 1H), 8,14 (д, J=2,8 Гц, 1H), 8,18 (с, 1H), 8,36 (шир.с, 1H).
[0437]
Пример 321
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-4-гидроксифенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (321)
[Формула 96]
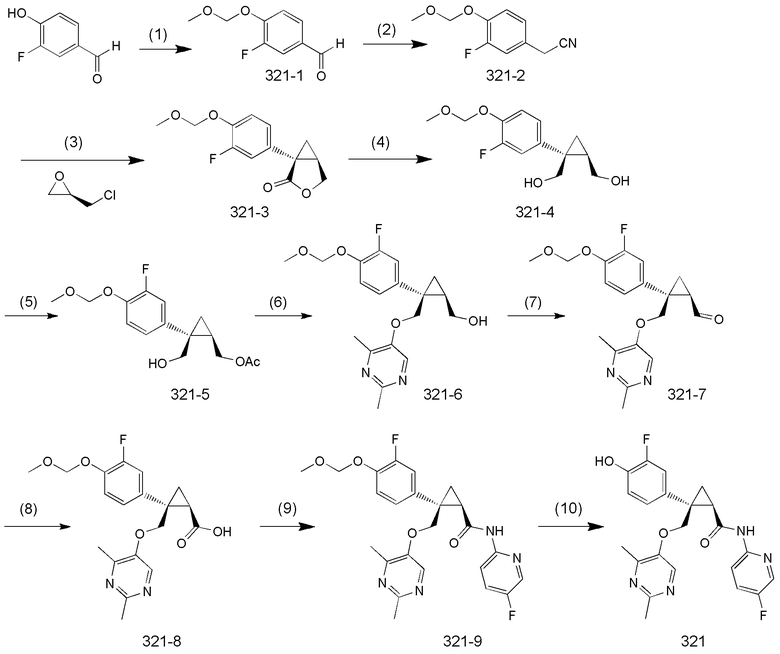
[0438]
(1) 3-Фтор-4-(метоксиметокси)бензальдегид (321-1)
N,N-диизопропилэтиламин (23,7 мл) и хлорметилметиловый эфир (7,76 мл) добавляли в дихлорметановый (130 мл) раствор 3-фтор-4-гидроксибензальдегида (13 г) при охлаждении на льду и полученную смесь перемешивали при комнатной температуре в течение 11 часов. Добавляли воду в реакционный раствор и смесь экстрагировали дихлорметаном. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-7:3) с тем, чтобы получить титульное соединение (17,4 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,54 (с, 3H), 5,32 (с, 2H), 7,31-7,36 (м, 1H), 7,60-7,65 (м, 2H), 9,88 (д, J=2,4 Гц, 1H)
[0439]
(2) 2-[3-Фтор-4-(метоксиметокси)фенил]ацетонитрил (321-2)
Боргидрид натрия (2,15 г) добавляли в раствор в метаноле-THF (20 мл-100 мл) соединения 321-1 (17,4 г) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Насыщенный водный раствор хлорида аммония добавляли в реакционный раствор и смесь экстрагировали этилацетатом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане (100 мл). Триэтиламин (19,8 мл) и метансульфонилхлорид (8,05 мл) добавляли в раствор при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Добавляли воду в реакционный раствор и экстрагировали смесь этилацетатом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток растворяли в ацетонитриле (100 мл). Йодид натрия (2,83 г) и цианид натрия (6,95 г) добавляли в раствор и полученную смесь перемешивали при 80°C в течение 3 часов. После этого цианид натрия (9,27 г) и диметилсульфоксид (30 мл) добавляли в реакционный раствор и полученную смесь перемешивали при 100°C в течение 5 часов. Реакционный раствор концентрировали при пониженном давлении. Воду добавляли в остаток и смесь затем экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, затем высушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-1:1) с тем, чтобы получить титульное соединение (11,5 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,52 (с, 3H), 3,70 (с, 2H), 5,22 (с, 2H), 7,01-7,06 (м, 1H), 7,09 (дд, J=11,4, 2,2 Гц, 1H), 7,20 (т, J=8,8 Гц, 1H)
[0440]
(3) (1S,5R)-1-[3-фтор-4-(метоксиметокси)фенил]-3-оксабицикло[3.1.0]гексан-2-он (321-3)
NaHMDS (63,6 мл, 1,9 M) добавляли в THF-раствор (60 мл) соединения 321-2 (11,5 г) при перемешивании раствора при -15°C. Полученную смесь перемешивали при -15°C в течение 30 минут и затем добавляли (R)-(-)-эпихлоргидрин (4,61 мл) в реакционную смесь. Полученную смесь перемешивали при -15°C в течение 1 часа и затем перемешивали при комнатной температуре в течение ночи. Небольшое количество воды добавляли в реакционный раствор и полученную смесь концентрировали при пониженном давлении. Этанол (90 мл) и 1N водный раствор гидроксида калия (118 мл) добавляли в полученный остаток и смесь перемешивали при 110°C в течение 5 часов. Температуру реакционного раствора снизили до комнатной температуры. После этого 5N добавляли соляную кислоту (82,5 мл) в реакционный раствор и полученную смесь перемешивали при 50°C в течение 3 часов. Температуру реакционного раствора снизили до комнатной температуры. Воду добавляли в реакционный раствор и смесь экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, затем высушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток промывали трет-бутилметиловым эфиром и затем собрали фильтрованием. Полученное твердое вещество (5,58 г) растворяли в дихлорметане (60 мл). N,N-диизопропилэтиламин (7 мл) и хлорметилметиловый эфир (2,24 мл) добавляли в раствор при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Добавляли воду в реакционный раствор и экстрагировали смесь этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, затем высушили над сульфатом магния и концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (7,09 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,37 (т, J=5,0 Гц, 1H), 1,57-1,63 (м, 1H), 2,50-2,57 (м, 1H), 3,51 (с, 3H), 4,29 (д, J=9,2 Гц, 1H), 4,46 (дд, J=9,2, 4,4 Гц, 1H), 5,21 (с, 2H), 7,08-7,12 (м, 1H), 7,13-7,24 (м, 2H)
[0441]
(4) (1S,2R)-1-[3-фтор-4-(метоксиметокси)фенил]циклопропан-1,2-диметанол (321-4)
Лития боргидрид (918 мг) добавляли в раствор в THF-MeOH (100 мл-20 мл) соединения 321-3 (7,09 г) при перемешивании раствора при -30°C. Полученную смесь перемешивали при комнатной температуре в течение 15 часов. Добавляли воду в реакционный раствор. После этого добавляли насыщенный водный раствор хлорида аммония в смесь и полученную смесь экстрагировали этилацетатом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан/этилацетат=9:1-3:7) с тем, чтобы получить титульное соединение (6,94 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,77 (т, J=5,2 Гц, 1H), 1,06 (дд, J=8,6, 5,0 Гц, 1H), 1,60-1,68 (м, 1H), 2,60-2,65 (м, 1H), 2,88-2,96 (м, 1H), 3,35-3,45 (м, 1H), 3,52 (с, 3H), 3,52-3,59 (м, 1H), 4,10-4,24 (м, 2H), 5,19 (с, 2H), 7,06-7,18 (м, 3H)
[0442]
(5) {(1R,2S)-2-[3-фтор-4-(метоксиметокси)фенил]-2-(гидроксиметил)циклопропил]}метилацетат (321-5)
Винилацетат (3,75 мл) и липазу из candida antarctica, иммобилизированную на акриловой смоле, (SIGMA, 0,35 г) добавляли в THF-раствор (20 мл) соединения 321-4 (6,94 г) и полученную смесь перемешивали при комнатной температуре в течение 15 часов. Реакционный раствор фильтровали и фильтрат концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (7,57 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,79 (т, J=5,4 Гц, 1H), 1,12 (дд, J=9,0, 5,0 Гц, 1H), 1,52-1,67 (м, 1H), 2,14 (с, 3H), 3,51 (с, 3H), 3,65 (д, J=12,2 Гц, 1H), 3,95 (д, J=12,2 Гц, 1H), 4,02 (дд, J=12,0, 10,0 Гц, 1H), 4,56 (дд, J=12,0, 5,6 Гц, 1H), 5,19 (с, 2H), 7,00-7,16 (м, 3H)
[0443]
(6) {(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-[3-фтор-4-(метоксиметокси)фенил]циклопропил}метанол (321-6)
Диизопропил дикарбоксилат (6,04 мл) добавляли по каплям в THF-раствор (100 мл) соединения 321-5 (7,57 г), трифенилфосфина (7,99 г) и 2,4-диметил-пиримидин-5-ола (3,15 г) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14,5 часов. Реакционный раствор концентрировали при пониженном давлении. После этого н-гептан/этилацетат (5/1) добавляли в остаток и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Образованное твердое вещество отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на NH-силикагеле (н-гептан:этилацетат=1:0-1:1). Полученное соединение растворяли в этаноле (50 мл). 1N водный раствор NaOH (50 мл) добавляли в раствор и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель отгоняли при пониженном давлении. После этого воду добавляли в остаток и экстрагировали смесь этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, затем высушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на NH-силикагеле (н-гептан:этилацетат=9:1-0:1) с тем, чтобы получить титульное соединение (7,4 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,95 (т, J=5,8 Гц, 1H), 1,15-1,30 (м, 1H), 1,72-1,83 (м, 1H), 2,16 (дд, J=5,2, 3,2 Гц, 1H), 2,40 (с, 3H), 2,61 (с, 3H), 3,50-3,59 (м, 1H), 3,51 (с, 3H), 4,02-4,10 (м, 2H), 4,39 (д, J=9,6 Гц, 1H), 5,19 (с, 2H), 7,08-7,22 (м, 3H), 8,00 (с, 1H)
[0444]
(7) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-[3-фтор-4-(метоксиметокси)фенил]циклопропанкарбальдегид (321-7)
Дихлорметановый (20 мл) раствор диметилсульфоксида (5,8 мл) добавляли по каплям в дихлорметановый (100 мл) раствор оксалилхлорида (3,45 мл) при перемешивании раствора при -78°C. Полученную смесь перемешивали при -78°C в течение 10 минут и затем добавляли по каплям дихлорметановый (30 мл) раствор соединения 321-6 (7,4 г) в реакционную смесь. Полученную смесь перемешивали при -78°C в течение 30 минут. После этого добавляли триэтиламин (17,1 мл) в реакционную смесь и полученную смесь перемешивали в течение 2 часов, пока она не нагревалась до 0°C. Добавляли воду в реакционный раствор и экстрагировали смесь дихлорметаном. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (7,8 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,50-1,70 (м, 1H), 1,95 (т, J=5,6 Гц, 1H), 2,38 (с, 3H), 2,42-2,50 (м, 1H), 2,60 (с, 3H), 3,51 (с, 3H), 4,16 (д, J=9,8 Гц, 1H), 4,40 (д, J=9,8 Гц, 1H), 5,21 (с, 2H), 7,10-7,24 (м, 3H), 7,94 (с, 1H), 9,85 (д, J=3,2 Гц, 1H)
[0445]
(8) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-[3-фтор-4-(метоксиметокси)фенил]циклопропанкарбоновая кислота (321-8)
2-метил-2-бутен (11,5 мл) и дигидрофосфат натрия (3,89 г) добавляли в ацетоно-водный (100 мл-25 мл) раствор соединения 321-7 (7,8 г). Реакционный раствор охлаждали на льду. Хлорит натрия (3,91 г) добавляли в реакционный раствор и полученную смесь перемешивали при комнатной температуре в течение 15 часов. Добавляли воду в реакционный раствор и смесь экстрагировали этилацетатом. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-0:1) с тем, чтобы получить титульное соединение (4,57 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,49-1,55 (м, 1H), 1,70-1,76 (м, 1H), 2,18-2,25 (м, 1H), 2,36 (с, 3H), 2,56 (с, 3H), 3,52 (с, 3H), 4,40-4,50 (м, 2H), 5,21 (с, 2H), 7,13-7,29 (м, 3H), 8,18 (с, 1H)
[0446]
(9) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-[3-фтор-4-(метоксиметокси)фенил]-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (321-9)
Титульное соединение 321-9 (1,01 г) получили реакцией соединения 321-8 (1,00 г) и 2-амино-5-фторпиридина (328 мг) тем же способом, что и в примере 51 (с HATU в качестве реагирующего вещества).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,57-1,64 (м, 1H), 1,86-1,92 (м, 1H), 2,05-2,10 (м, 1H), 2,23 (с, 3H), 2,56 (с, 3H), 3,52 (с, 3H), 4,38 (д, J=9,2 Гц, 1H), 4,46 (д, J=9,2 Гц, 1H), 5,21 (с, 2H), 7,12-7,28 (м, 3H), 7,35-7,43 (м, 1H), 7,97 (с, 1H), 8,03-8,09 (м, 1H), 8,12 (с, 1H), 8,35 (с, 1H)
MS[M+H]+=471
[0447]
(10) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-4-гидроксифенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (321)
5N соляную кислоту (15 мл) добавляли в THF-раствор (15 мл) соединения 321-9 (1,01 г) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. 5N водный раствор гидроксида натрия добавляли в реакционный раствор при охлаждении на льду для нейтрализации и смесь затем экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, затем высушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток промывали этилацетатом и собрали фильтрованием с тем, чтобы получить титульное соединение 321 (721 мг).
1H-ЯМР (400 МГц, CD3OD) δ (частей на миллион): 1,47-1,55 (м, 1H), 1,78-1,85 (м, 1H), 2,20 (с, 3H), 2,40-2,47 (м, 1H), 2,46 (с, 3H), 4,40 (д, J=9,8 Гц, 1H), 4,59 (д, J=9,8 Гц, 1H), 6,85-6,93 (м, 1H), 7,15-7,22 (м, 1H), 7,27-7,34 (м, 1H), 7,43-7,52 (м, 1H), 7,89-7,97 (м, 1H), 8,06 (с, 1H), 8,17 (д, J=3,2 Гц, 1H)
MS[M+H]+=427
[0448]
Пример 322
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-4-метоксифенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (322)
[Формула 97]
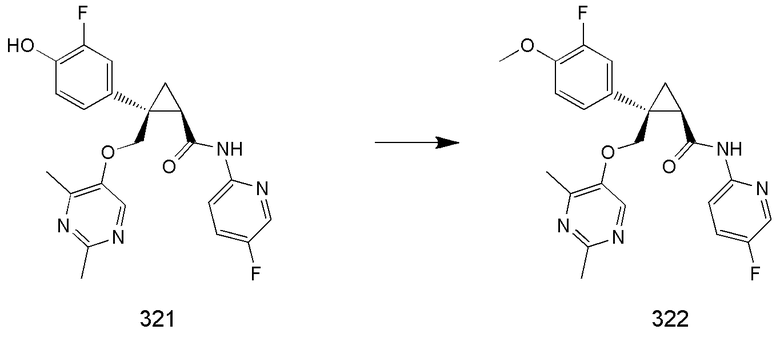
[0449]
Карбонат цезия (172 мг) и метилйодид (26,8 мкл) добавляли в DMF-раствор (5 мл) соединения 321 (150 мг) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли воду в реакционный раствор и экстрагировали смесь этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-2:3) с тем, чтобы получить титульное соединение (70 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,58 (дд, J=7,8, 5,4 Гц, 1H), 1,88 (т, J=5,4 Гц, 1H), 2,03-2,10 (м, 1H), 2,23 (с, 3H), 2,56 (с, 3H), 4,89 (с, 3H), 4,38 (д, J=9,2 Гц, 1H), 4,46 (д, J=9,2 Гц, 1H), 6,93 (т, J=8,4 Гц, 1H), 7,13-7,23 (м, 2H), 7,35-7,42 (м, 1H), 7,98 (с, 1H), 8,06 (дд, J=9,6, 3,8 Гц, 1H), 8,10 (д, J=2,8 Гц, 1H), 8,49 (шир.с, 1H)
[0450]
Пример 323
Синтез (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-{[(2-гидроксиметил-4-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамида (323)
[Формула 98]
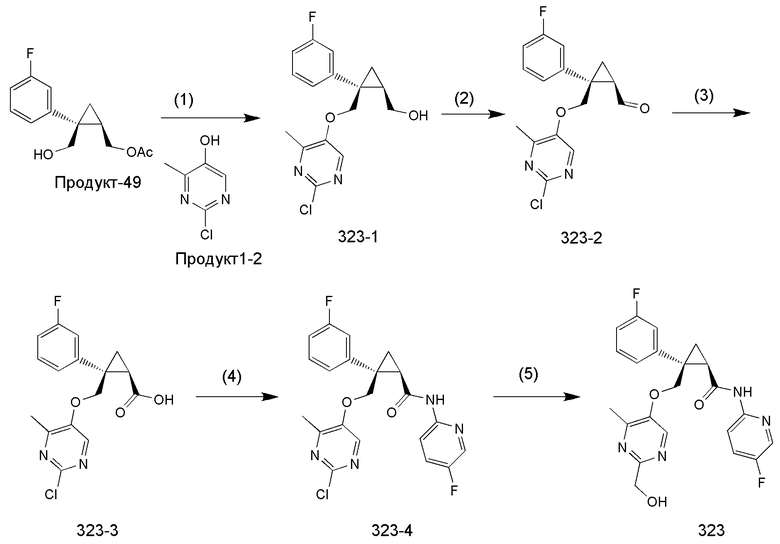
[0451]
(1) {(1R,2S)-2-{[(2-хлор-4-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил}метанол (323-1)
Диизопропилазодикарбоксилат (5,39 мл) добавляли в THF-раствор (45 мл) Продукта 49 (5,58 г), Продукта 1-2 (2,81 г) и трифенилфосфина (6,14 г) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Добавляли небольшое количество воды в реакционный раствор и полученную смесь концентрировали при пониженном давлении. Добавляли н-гептан/этилацетат (5/1) в полученный остаток и смесь перемешивали при комнатной температуре в течение 1 часа. Образованное твердое вещество отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в этаноле-THF (45 мл-45 мл). 1N водный раствор гидроксида натрия добавляли в раствор и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель отгоняли при пониженном давлении. После этого воду добавляли в остаток и смесь экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, затем высушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-2:3) с тем, чтобы получить титульное соединение (5,67 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 0,99-1,05 (м, 1H), 1,25-1,33 (м, 1H), 1,76-1,87 (м, 1H), 1,88-1,94 (м, 1H), 2,42 (с, 3H), 3,55-3,65 (м, 1H), 4,02-4,12 (м, 1H), 4,12-4,20 (м, 1H), 4,42 (дд, J=9,6, 3,6 Гц, 1H), 6,92-6,99 (м, 1H), 7,09-7,15 (м, 1H), 7,16-7,22 (м, 1H), 7,24-7,33 (м, 1H), 7,93 (с, 0,5H), 7,97 (с, 0,5H)
[0452]
(2) (1R,2S)-2-{[(2-хлор-4-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбальдегид (323-2)
Дихлорметановый раствор (25 мл) диметилсульфоксида (5 мл) добавляли по каплям в дихлорметановый раствор (100 мл) оксалилхлорида (2,98 мл) при перемешивании раствора при -78°C. Полученную смесь перемешивали при -78°C в течение 10 минут и затем добавляли по каплям дихлорметановый раствор (25 мл) соединения 323-1 (5,67 г) в реакционную смесь. Полученную смесь перемешивали при -78°C в течение 30 минут. После этого добавляли триэтиламин (14,7 мл) в реакционную смесь и полученную смесь перемешивали в течение 2 часов, в то время как она нагревалась до 0°C. Воду добавляли в реакционный раствор и смесь экстрагировали дихлорметаном. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (7,12 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,69 (дд, J=8,4, 5,2 Гц, 1H), 1,95-2,01 (м, 1H), 2,39 (с, 1H), 2,53-2,60 (м, 1H), 4,24 (дд, J=10,0, 3,2 Гц, 1H), 4,44 (дд, J=9,8, 3,4 Гц, 1H), 6,99-7,06 (м, 1H), 7,12-7,18 (м, 1H), 7,19-7,25 (м, 1H), 7,30-7,38 (м, 1H), 7,89 (с, 0,5H), 7,93 (с, 0,5H), 9,94 (с, 1H)
[0453]
(3) (1R,2S)-2-{[(2-хлор-4-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновая кислота (323-3)
2-метил-2-бутен (11,7 мл) и дигидрофосфат натрия (3,98 г) добавляли в ацетоно-водный (80 мл-20 мл) раствор соединения 323-2 (7,1 г). Реакционный раствор охлаждали на льду. Хлорит натрия (4 г) добавляли в реакционный раствор и полученную смесь перемешивали при комнатной температуре в течение 18 часов. Воду добавляли в реакционный раствор и смесь экстрагировали этилацетатом. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-3:7) с тем, чтобы получить титульное соединение (5,77 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,62-1,69 (м, 1H), 1,72-1,80 (м, 1H), 2,21-2,29 (м, 1H), 2,40 (с, 1H), 4,37-4,47 (м, 1H), 4,47-4,54 (м, 1H), 6,97-7,05 (м, 1H), 7,13-7,20 (м, 1H), 7,21-7,26 (м, 1H), 7,33 (тд, J=8,0, 6,0 Гц, 1H), 7,98 (с, 0,5H), 8,02 (с, 0,5H)
MS[M+H]+=337
[0454]
(4) (1R,2S)-2-{[(2-хлор-4-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (323-4)
Титульное соединение синтезировали реакцией карбоновой кислоты 323-3 и 2-амино-5-фторпиридина тем же способом, что и в примере 51.
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,61-1,69 (м, 1H), 1,88-1,95 (м, 1H), 2,08-2,17 (м, 1H), 2,25 (с, 3H), 4,40-4,50 (м, 1H), 4,50-4,57 (м, 1H), 6,98-7,06 (м, 1H), 7,11-7,18 (м, 1H), 7,21-7,25 (м, 1H), 7,30-7,38 (м, 1H), 7,38-7,45 (м, 1H), 7,92 (с, 0,5H), 7,96 (с, 0,5H), 8,02-8,09 (м, 1H), 8,13 (д, J=3,2 Гц, 1H), 8,33 (шир.с, 1H)
[0455]
(5) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-{[(2-гидроксиметил-4-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид (323)
(Трет-бутилдиметилсилилоксиметил)три-н-бутилолово (Tetrahedron Vol. 45, №4, 993-1006: 121 мг) и тетракистрифенилфосфинпалладий (13,4 мг) добавляли в раствор в N-метилпирролидоне (2,5 мл) соединения 323-4 (100 мг) и полученную смесь перемешивали при 140°C в течение 6 часов. Температуру реакционного раствора снизили до комнатной температуры. После этого THF (2 мл) и тетрабутиламмония фторид (1M раствор THF: 232 мкл) добавляли в реакционный раствор и полученную смесь перемешивали при комнатной температуре в течение 14 часов. Воду добавляли в реакционный раствор и смесь экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-1:1) с тем, чтобы получить титульное соединение (26,6 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,65 (дд, J=8,4, 5,6 Гц, 1H), 1,93 (т, J=5,6 Гц, 1H), 2,08-2,18 (м, 1H), 2,27 (с, 3H), 4,46 (д, J=9,2 Гц, 1H), 4,54 (д, J=9,2 Гц, 1H), 4,66 (2H, с), 6,98-7,05 (м, 1H), 7,14-7,30 (м, 2H), 7,32-7,43 (м, 2H), 8,03-8,09 (м, 1H), 8,07 (с, 1H), 8,14 (д, J=2,8 Гц, 1H), 8,30 (шир.с, 1H)
[0456]
Пример 324
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-6-гидроксифенил]-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (324)
[Формула 99]
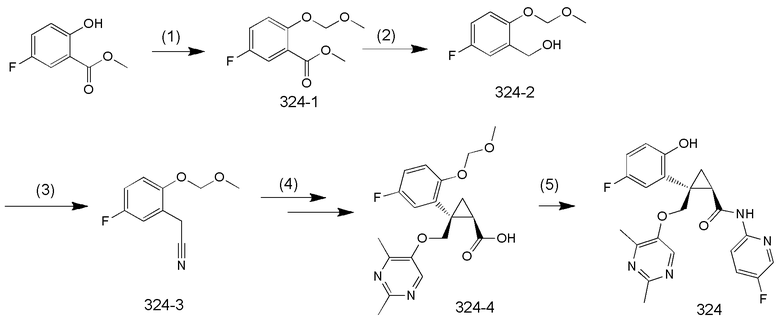
[0457]
(1) Метил 5-фтор-2-(метоксиметокси)бензоат (324-1)
N,N-диизопропилэтиламин (15,4 мл) и хлорметилметиловый эфир (4,91 мл) добавляли в дихлорметановый (100 мл) раствор метил 5-фтор-2-гидроксибензоата (10 г) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Добавляли воду в реакционный раствор и смесь экстрагировали дихлорметаном. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (12,4 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,52 (с, 3H), 3,90 (с, 3H), 5,20 (с, 2H), 7,11-7,22 (м, 2H), 7,47-7,52 (м, 1H)
[0458]
(2) [5-Фтор-2-(метоксиметокси)фенил]метанол (324-2)
Алюмогидрид лития (2,2 г) добавляли в THF-раствор (200 мл) соединения 324-1 (12,4 г) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли ледяную воду частями в реакционный раствор и при этом разлагали избыток алюмогидрида лития. После этого добавляли небольшое количество 27% водного раствора аммония и целит в остаток и полученную смесь перемешивали при комнатной температуре в течение 20 минут. Сульфат магния добавляли в реакционный раствор и смесь фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан/этилацетат=1:0-3:1) с тем, чтобы получить титульное соединение (5,23 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,48 (с, 3H), 4,68 (д, J=6,4 Гц, 2H), 5,18 (с, 2H), 6,92 (тд, J=8,8, 2,8 Гц, 1H), 7,03-7,10 (м, 2H)
[0459]
(3) 2-[5-Фтор-2-(метоксиметокси)фенил]ацетонитрил (324-3)
Триэтиламин (5,95 мл) и метансульфонилхлорид (2,42 мл) добавляли в дихлорметановый (60 мл) раствор соединения 324-2 (5,23 г) при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Насыщенный водный раствор хлорида натрия добавляли в реакционный раствор и экстрагировали смесь этилацетатом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток растворяли в диметилсульфоксиде (30 мл). Цианид натрия (2,09 г) и йодид натрия (851 мг) добавляли в раствор, и полученную смесь перемешивали при 90°C в течение 3 часов. Температуру реакционного раствора понижали до комнатной температуры. После этого добавляли воду в реакционный раствор и смесь экстрагировали диэтиловым эфиром. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-4:1) с тем, чтобы получить титульное соединение (4,33 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,49 (с, 3H), 3,70 (с, 2H), 5,21 (с, 2H), 6,95-7,02 (м, 1H), 7,08-7,13 (м, 2H)
[0460]
(4) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-[3-фтор-6-(метоксиметокси)фенил]циклопропанкарбоновая кислота (324-4)
Титульное соединение синтезировали из соединения 324-3 согласно способу из примера получения 321 (3)-(8).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,47 (дд, J=8,2, 5,0 Гц, 1H), 1,77 (дд, J=6,2, 5,4 Гц, 1H), 2,18 (дд, J=8,4, 6,4 Гц, 1H), 2,30 (с, 3H), 2,57 (с, 3H), 3,50 (с, 3H), 4,41 (д, J=9,6 Гц, 1H), 4,53 (д, J=9,6 Гц, 1H), 5,23 (кв. J=6,8 Гц, 2H), 6,95 (ддд, J=8,8, 7,6, 3,2 Гц, 1H), 7,06 (дд, J=8,8, 4,8 Гц, 1H), 7,18 (дд, J=8,8, 3,0 Гц, 1H), 8,16 (с, 1H)
[0461]
(5) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-[5-фтор-2-гидроксифенил]-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (324)
Титульное соединение синтезировали из карбоновой кислоты 328-4 согласно способу из примера 3 (1)-(2).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,55-1,66 (м, 1H), 1,92-1,97 (м, 1H), 2,07-2,16 (м, 1H), 2,25 (с, 3H), 2,58 (с, 3H), 4,46 (дд, J=11,6, 9,2 Гц, 2H), 6,86-7,06 (м, 4H), 7,36-7,45 (м, 1H), 8,02 (с, 1H), 8,06-8,15 (м, 1H), 8,14 (д, J=2,8 Гц, 1H), 8,62 (шир.с, 1H)
MS[M+Na]+=448
[0462]
Пример 325
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-6-гидроксипиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамида (325)
[Формула 100]
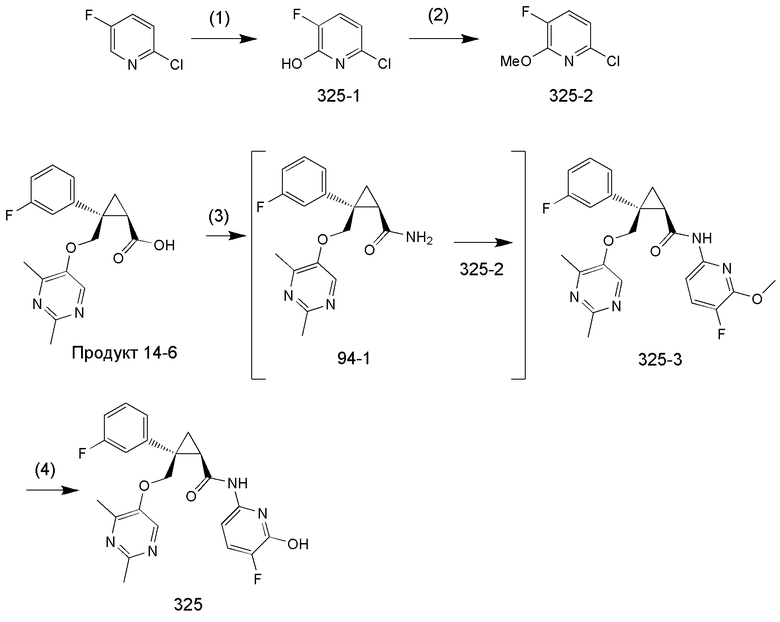
[0463]
(1) 6-Хлор-3-фторпиридин-2-ол (325-1)
3-Хлорпероксибензойную кислоту (21 г) добавляли в дихлорметановый (200 мл) раствор 2-хлор-3-фторпиридина (10 г) и полученную смесь перемешивали при 65°C в течение 8 часов. Реакционный раствор охлаждали на льду. Добавляли насыщенный водный раствор тиосульфата натрия в реакционный раствор и полученную смесь перемешивали в течение 20 минут. Насыщенный водный раствор бикарбоната натрия добавляли в реакционный раствор и смесь экстрагировали хлороформом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток промывали трет-бутилметиловым эфиром/н-гептаном (1/1) и твердое вещество собирали с помощью фильтрации. Полученное твердое вещество растворяли в THF (150 мл). Триэтиламин (13,2 мл) и ангидрид трифторуксусной кислоты (33,2 мл) добавляли в раствор при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Добавляли небольшое количество воды в реакционный раствор. После этого 5N водный раствор гидроксида натрия добавляли в смесь при перемешивании раствора при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор превратили в слабокислый добавлением уксусной кислоты и затем его экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, затем высушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-1:1). Полученное твердое вещество промывали трет-бутилметиловым эфиром/н-гептаном (1/1) и затем собирали фильтрованием с тем, чтобы получить титульное соединение (2,6 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 6,50 (д, J=8,0 Гц, 1H), 7,24-7,33 (м, 1H)
[0464]
(2) 6-Хлор-3-фтор-2-метоксипиридин (325-2)
Метилйодид (262 мкл) и карбонат серебра (1,12 г) добавляли в хлороформный раствор (3 мл) соединения 325-1 (300 мг) и полученную смесь перемешивали при 40°C в течение 5 часов. Температуру реакционного раствора снизили до комнатной температуры. Реакционный раствор фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=1:0-1:1) с тем, чтобы получить титульное соединение (86 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 4,03 (с, 3H), 6,86 (дд, J=8,0, 2,4 Гц, 1H), 7,30 (дд, J=9,6, 8,0 Гц, 1H)
[0465]
(3) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-6-метоксипиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (325-3)
Титульное соединение синтезировали из соединения 94-1 и соединения 325-2 таким же способом, что и в примере 73.
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,61-1,67 (м, 1H), 1,92 (т, J=5,4 Гц, 1H), 2,05-2,16 (м, 1H), 2,24 (с, 3H), 2,56 (с, 3H), 3,96 (с, 3H), 4,42 (д, J=9,4 Гц, 1H), 4,53 (д, J=9,4 Гц, 1H), 6,97-7,05 (м, 1H), 7,16-7,22 (м, 1H), 7,23-7,40 (м, 3H), 7,55 (дд, J=8,6, 2,2 Гц, 1H), 7,94-8,03 (м, 1H)
MS[M+Na]+=441
[0466]
(4) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-6-гидроксипиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид (325)
Смесь соединения 325-3 (70 мг) и пиридина гидрохлорида (367 мг) перемешивали при 115°C в течение 2,5 часов. Температуру реакционного раствора снизили до комнатной температуры. После этого добавляли воду в реакционный раствор и полученную смесь экстрагировали этилацетатом. Отгоняли растворитель. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (от смеси н-гептан:этилацетат (19:1-0:1) к смеси этилацетат:метанол (9:1)). Полученный очищенный продукт дополнительно повторно очищали препаративной TLC на силикагеле (этилацетат:метанол=19:1) с тем, чтобы получить титульное соединение (30 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,60-1,67 (м, 1H), 1,89 (т, J=5,6 Гц, 1H), 2,28 (с, 3H), 2,35 (дд, J=8,4, 6,0 Гц, 1H), 2,57 (с, 3H), 4,46 (дд, J=21,6, 9,6 Гц, 2H), 6,89-7,01 (м, 2H), 7,12-7,32 (м, 4H), 8,00 (с, 1H), 10,6 (шир.с, 1H)
MS[M+Na]+=427
[0467]
Пример 326
Синтез (1R,2S)-2-{[(2,4-диметил-6-оксо-1,6-дигидропиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (326)
[Формула 101]
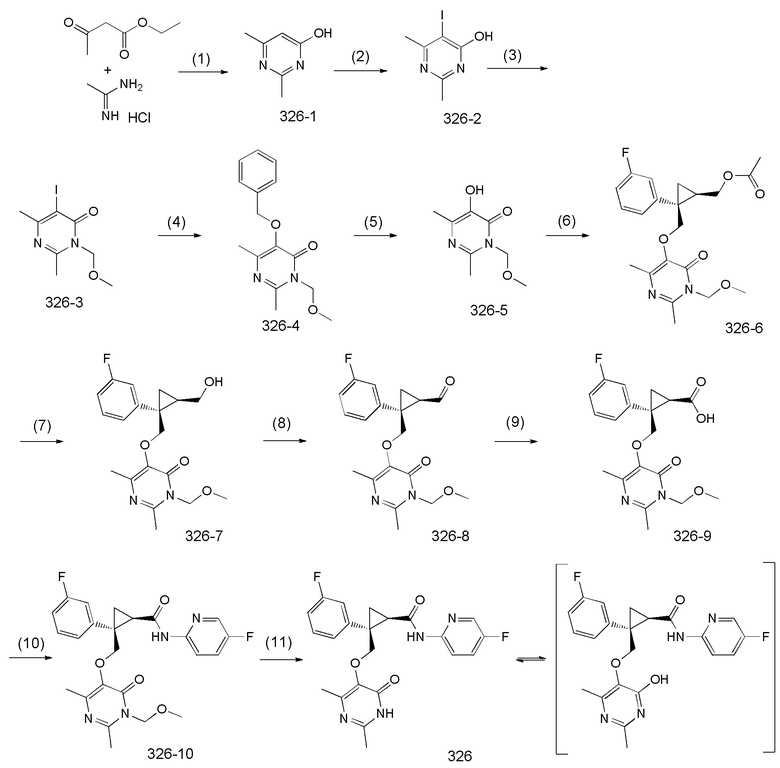
[0468]
(1) 2,6-Диметилпиримидин-4-ол (326-1)
Добавляли натрий (3,6 г) частями в этанол (92 мл) за 2 часа при перемешивании раствора при комнатной температуре. После этого добавляли этилацетоацетат (10 мл) и гидрохлорид ацетамидина (7,42 г) в реакционный раствор, и полученную смесь перемешивали при 70°C в течение 16 часов. После этого реакционную смесь перемешивали при 100°C в течение 9 часов и температуру реакционного раствора снижали до комнатной температуры. Добавляли концентрированную соляную кислоту в реакционный раствор, чтобы довести значение pH до приблизительно 5. Полученную смесь концентрировали при пониженном давлении, чтобы получить неочищенное титульное соединение (25,6 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,30 (с, 3H), 2,46 (с, 3H), 6,17 (с, 1H)
[0469]
(2) 5-Йод-2,6-диметилпиримидин-4-ол (326-2)
Необработанное соединение 326-1 (25,6 г) растворяли в 1,25N водном растворе гидроксида натрия (140 мл). Йод (19,9 г) добавляли в раствор и полученную смесь затем перемешивали при 120°C в течение 2 часов. Температуру реакционного раствора снижали до комнатной температуры и реакционный раствор затем экстрагировали хлороформом. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении с тем, чтобы получить титульное соединение (14,5 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,49 (с, 3H), 2,60 (с, 3H), 12,8 (шир.с, 1H)
[0470]
(3) 5-Йод-3-(метоксиметил)-2,6-диметилпиримидин-4(3H)-он (326-3)
N,N-диизопропилэтиламин (13,1 мл) добавляли в дихлорметановый (100 мл) раствор соединения 326-2 (14,5 г). Хлорметилметиловый эфир (4,85 мл) добавляли в реакционный раствор при перемешивании раствора при -40°C. Полученную смесь перемешивали при комнатной температуре в течение 15 часов. Добавляли воду в реакционный раствор и смесь экстрагировали дихлорметаном. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-0:1) с тем, чтобы получить титульное соединение (10,6 г) и 5-йод-4-(метоксиметокси)-2,6-диметилпиримидин (2,55 г).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,54 (с, 3H), 2,57 (с, 3H), 3,44 (с, 3H), 5,52 (с, 2H)
[0471]
(4) 5-(Бензилокси)-3-(метоксиметил)-2,6-диметилпиримидин-4(3H)-он (326-4)
Соединение 326-3 (4,78 г) растворяли в толуоле (130 мл). Карбонат цезия (10,6 г), 1,10-фенантролин (4,41 г) и йодид меди (3,1 г) добавляли в раствор и полученную смесь перемешивали в течение 5 минут. После этого бензиловый спирт (5,28 мл) добавляли в реакционную смесь. Полученную смесь перемешивали при 110°C в течение 5 дней. Реакционную смесь разбавили этилацетатом и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=19:1-1:2) с тем, чтобы получить титульное соединение (1,42 г).
MS[M+H]+=275.
[0472]
(5) 5-Гидрокси-3-(метоксиметил)-2,6-диметилпиримидин-4(3H)-он (326-5)
Соединение 326-4 (1,42 г) растворяли в этилацетате (30 мл). Добавляли в раствор палладий-углерод (700 мг) и полученную смесь перемешивали в атмосфере водорода в течение 1 часа. Фильтровали реакционную смесь через целит и фильтрат концентрировали при пониженном давлении, чтобы получить неочищенное титульное соединение (954 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 2,27 (с, 3H), 2,53 (с, 3H), 3,41 (с, 3H), 5,47 (с, 2H), 6,07 (шир.с, 1H).
[0473]
(6) [(1R,2S)-2-(3-фторфенил)-2-({[1-(метоксиметил)-2,4-диметил-6-оксо-1,6-дигидропиримидин-5-ил]окси}метил)циклопропил]метилацетат (326-6)
THF-раствор (5 мл) Продукта 49 (1,36 г) добавляли в THF-раствор (15 мл) соединения 326-5 (954 мг). После этого добавляли трифенилфосфин (1,63 г) в смесь и добавляли по каплям диизопропилазодикарбоксилат (1,9 M, 3,27 мл) в смесь при охлаждении на льду. Полученную смесь перемешивали при такой же температуре, как описано выше, в течение 2 часов, затем нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-0:1) с тем, чтобы получить титульное соединение (1,0 г).
MS[M+Na]+=427.
[0474]
(7) 5-{[(1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил]метокси}-3-(метоксиметил)-2,6-диметилпиримидин-4(3H)-он (326-7)
2N водный раствор гидроксида натрия (1,36 мл) добавляли в этанольный раствор (10 мл) соединения 326-6 (1,0 г). Полученную смесь перемешивали при комнатной температуре в течение 30 минут. После этого добавляли воду в реакционный раствор и добавляли хлороформ в полученную смесь для осуществления разделения жидкости и экстракции. Полученный органический слой сушили над сульфатом магния. Его концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=2:1-0:1) с тем, чтобы получить титульное соединение (895 мг).
MS[M+Na]+=385.
[0475]
(8) (1R,2S)-2-(3-фторфенил)-2-({[1-(метоксиметил)-2,4-диметил-6-оксо-1,6-дигидропиримидин-5-ил]окси}метил)циклопропанкарбальдегид (326-8)
Реактив Десса-Мартина добавляли в дихлорметановый (15 мл) раствор соединения 326-7 (895 мг) при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 1 часа и смешанный раствор водного раствора бикарбоната натрия-водного раствора сульфита натрия затем добавляли в реакционную смесь при охлаждении на льду. Полученную смесь перемешивали в этом состоянии в течение 30 минут и затем добавляли дихлорметан в реакционную смесь для осуществления разделения жидкости и экстракции. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=3:1-0:1) с тем, чтобы получить титульное соединение (779,5 мг).
MS[M+H]+=361.
[0476]
(9) (1R,2S)-2-(3-фторфенил)-2-({[1-(метоксиметил)-2,4-диметил-6-оксо-1,6-дигидропиримидин-5-ил]окси}метил)циклопропанкарбоновая кислота (326-9)
2-Метил 2-бутен (1,14 мл), дигидрофосфат натрия (389 мг) и хлорит натрия (305 мг) добавляли в водно-ацетоновый смешанный растворитель (8 мл-2 мл) соединения 326-8 (779 мг). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. После этого добавляли воду в реакционный раствор и добавляли хлороформ в реакционный раствор для осуществления разделения жидкости и экстракции. Небольшое количество 1N соляной кислоты добавляли в полученный экстракт и дополнительно добавляли хлороформ в реакционный раствор для осуществления разделения жидкости и экстракции. Полученный органический слой сушили над сульфатом магния. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с тем, чтобы получить неочищенный продукт титульной карбоновой кислоты (814 мг).
MS[M+H]+=377.
[0477]
(10) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-({[1-(метоксиметил)-2,4-диметил-6-оксо-1,6-дигидропиримидин-5-ил]окси}метил)циклопропанкарбоксамид (326-10)
2-Амино-5-фторпиридин (17,9 мг), HATU (60,7 мг) и N,N-диизопропилэтиламин (27,7 мкл) добавляли в смешанный раствор дихлорметана (13 мл)-DMF (2,6 мл) соединения 326-9 (50 мг). Полученную смесь перемешивали при комнатной температуре в течение ночи и затем проводили реакцию с помощью LC-MS. 2-амино-5-фторпиридин дополнительно добавляли в количестве 2 эквивалентов (30 мг) и полученную смесь перемешивали при 90°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры. Добавляли воду в реакционный раствор и добавляли диэтиловый эфир в полученную смесь для осуществления разделения жидкости и экстракции. Полученный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=9:1-1:2) с тем, чтобы получить титульное соединение (41 мг).
MS[M+Na]+=493.
[0478]
(11) (1R,2S)-2-{[(2,4-диметил-6-оксо-1,6-дигидропиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (326)
Смешанный раствор этанола (3 мл)-концентрированной соляной кислоты (1 мл) соединения 330-10 (150 мг) перемешивали при 90°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и добавляли по каплям 1N водный раствор гидроксида натрия в реакционный раствор. Осажденные кристаллы фильтровали, промывали водой и затем промывали раствором трет-бутилметилового эфира-гептана (1:1). Кристалл, который собрали фильтрованием, высушили при пониженном давлении с тем, чтобы получить титульное соединение (62 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,33 (дд, J=8,0, 4,8 Гц, 1H), 1,52 (т, J=4,4 Гц, 1H), 1,74 (с, 3H), 2,02 (с, 3H), 2,62 (т, J=7,6 Гц, 1H), 4,22 (д, J=10,8 Гц, 1H), 4,80 (д, J=11,2 Гц, 1H), 7,03-7,08 (м, 1H), 7,33-7,40 (м, 2H), 7,49-7,50 (м, 1H), 7,52-7,72 (м, 1H), 8,03-8,06 (м, 1H), 8,31 (д, J=3,2 Гц, 1H), 11,1 (с, 1H), 12,2 (шир.с, 1H).
MS[M+Na]+=449.
[0479]
Пример 327
Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фтор-5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамида (327)
[Формула 102]
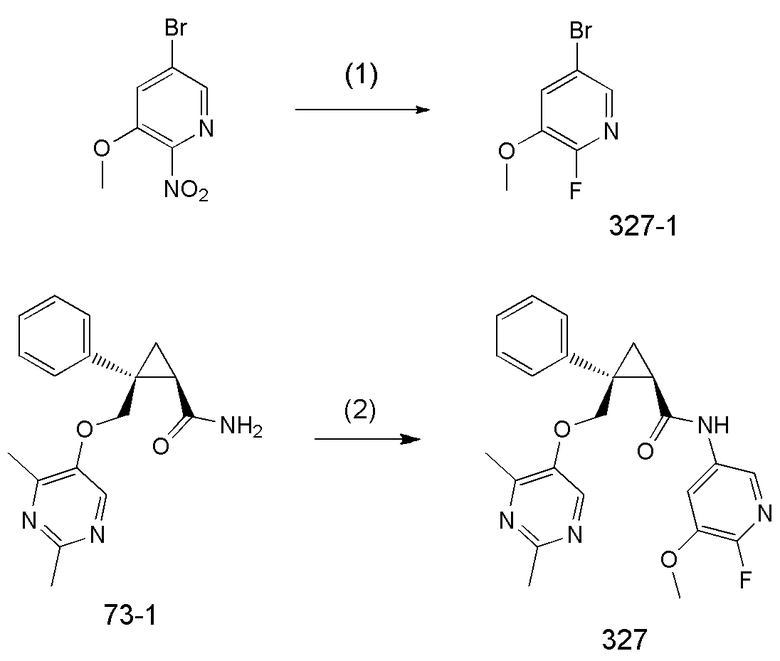
[0480]
(1) Синтез 3-бром-6-фтор-5-метоксипиридина (327-1)
Тетрабутил аммония фторид (1,0M раствор THF: 3,9 мл) добавляли в DMF-раствор (5 мл) 5-бром-3-метокси-2-нитропиридина (CAS №152684-26-9) (450 мг) и полученную смесь перемешивали при 70°C в течение 72 часов. Реакционный раствор охлаждали до комнатной температуры. Воду добавляли в реакционный раствор и смесь экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан:этилацетат=10:1-2:1) с тем, чтобы получить титульное соединение (258 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 3,91 (с, 3H), 7,39 (дд, J=8,8, 2,4 Гц, 1H), 7,80 (т, J=2,4 Гц, 1H).
[0481]
(2) Синтез (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фтор-5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамида (327)
1,4-Диоксановый раствор (3 мл) карбоксамида 73-1 (50 мг), соединения 327-1 (48 мг), xantphos (29 мг), трифосфата калия (71 мг) и Pd2DBA3 (15 мг) нагревали до 100°C и перемешивали в течение 15 часов. Добавляли воду в реакционный раствор и полученную смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (н-гептан к смеси н-гептан:этилацетат=1:2) с тем, чтобы получить титульное соединение (5,9 мг).
1H-ЯМР (400 МГц, CDCl3) δ (частей на миллион): 1,65 (дд, J=8,0, 5,6 Гц, 1H), 1,91 (т, J=5,6 Гц, 1H), 2,10 (дд, J=8,0, 5,6 Гц, 1H), 2,25 (с, 3H), 2,56 (с, 3H), 3,81 (с, 3H), 4,47 (д, J=9,6 Гц, 1H), 4,54 (д, J=9,6 Гц, 1H), 7,30 (т, J=7,2 Гц, 1H), 7,37 (т, J=7,2 Гц, 2H), 7,46 (д, J=7,2 Гц, 2H), 7,54 (т, J=2,4 Гц, 1H), 7,71 (шир.с, 1H), 7,93 (дд, J=9,2, 2,4 Гц, 1H), 8,01 (с, 1H).
MS[M+Na]+=423
[0482]
Тестовый пример
1. Измерение способности связываться с орексиновым рецептором
Анализ проводили с применением покрытого агглютинином из проростков пшеницы 96-луночного планшета Flash Plate (PerkinElmer). Объем одной анализируемой лунки составлял 100 мкл, и композиция реакционного раствора была следующей:
25 мМ HEPES (pH 7,5), 1 мМ CaCl2, 4,5 мМ MgCl2, 0,5% BSA (бычий сывороточный альбумин), 0,1% азид натрия, 0,05% Tween-20 и 0,2% DMSO.
Клеточные мембраны получали из рекомбинантных CHO клеток, которые экспрессируют OX2 или OX1. Клеточные мембраны использовали в количестве 5 мкг белка/анализ. Тестируемое соединение в различных концентрациях и 0,2 нМ [125I]-OX-A в качестве меченого вещества добавляли к клеточным мембранам и затем позволяли реагировать при комнатной температуре в течение 30 минут. После завершения реакции реакционный раствор полностью сливали и лунки затем промывали один раз 200 мкл отмывочного буфера (25 мМ HEPES (pH 7,5), 1 мМ CaCl2, 5 мМ MgCl2, 0,5% BSA, 0,1% азид натрия, 0,05% Tween-20 и 525 мМ хлорид натрия). Наконец, радиоактивность каждой лунки измеряли с применением сцинцилляционного счетчика (TopCount, PerkinElmer). Полученные результаты показаны в виде значений IC50 (нМ) в следующей таблице.
[0483]
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
[0484]
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
[0485]
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
(IC50),
нМ
[0486]
2. Измерение антагонизма (PLAP-анализ)
Антагонистическое действие соединения согласно настоящему изобретению для предотвращения активации OX2 и OX1 орексином-A (OX-A), который является естественным пептидным агонистом, измеряли с применением клеточного репортерного анализа. Использовали экспрессирующую генетически рекомбинантный человеческий OX2 клеточную линию HEK-293 (№ доступа NM_001526.3) или экспрессирующую генетически рекомбинантный человеческий OX1 клеточную линию HEK-293 (№ доступа NM_001525.2), которые содержали pBabeCLIH в качестве вектора экспрессии. Клетки высевали при плотности 10000 клеток/лунка на 96-луночный планшет без покрытия на среду Игла в модификации Дульбекко (№ в каталоге Sigma D6046: которая содержала 10% об./об. инактивированной нагреванием фетальной бычьей сыворотки). Клетки культивировали при 37°C в течение ночи для того, чтобы они могли прикрепиться к планшету. На следующий день клетки инкубировали с соединением согласно настоящему изобретению, растворенным в среде Игла в модификации Дульбекко (№ в каталоге Sigma A8806: которая содержала 0,1% вес./об. бычьего сывороточного альбумина,), и добавляли в планшет с клетками до достижения конечной концентрации 0,1% диметилсульфоксида.
Полученную таким образом смесь инкубировали при комнатной температуре в течение 1 часа. После этого человеческий OX-A и форсколин растворяли в такой же среде, как описано выше, которая содержала альбумин фетальной бычьей сыворотки, и среду затем добавляли к клеткам с получением в результате конечной концентрации 300 нМ форсколина. Затем клетки культивировали при 37°C в течение примерно 18-24 часов. Во время культивирования в результате активации орексинового рецептора и последующего дозозависимого возрастания концентрации внутриклеточного кальция, репортерный фермент, плацентарная щелочная фосфатаза (PLAP), экспрессировался под контролем промотора CRE x4 + VIP в векторе pBabeCLcre4vPdNN и секретировался в супернатант культуральной среды. На следующий день активность репортерного фермента определяли посредством смешивания 5 мкл супернатанта культуральной среды с 20 мкл буфера для определения (содержащего 1,34 г/л бикарбоната натрия, 1,27 г/л карбоната натрия и 0,2 г/л гептагидрата сульфата магния в воде) и 25 мкл реактива Lumi-Phos530 (Wako Pure Chemical Industries Ltd.) с последующим инкубированием полученной смеси, защищенной от света, при комнатной температуре в течение 2 часов перед осуществлением измерения люминесценции (ARVO Reader, PerkinElmer). Величину Kd человеческого OX-A по отношению к каждому рецептору измеряли при помощи титрования от 0 до 300 нМ. Затем величину IC50 для соединения согласно настоящему изобретению по отношению к активности 1 нМ человеческого OX-A преобразовывали в величину Ki (нМ) с помощью уравнения Ченга-Прусова. Полученные величины Ki (нМ) показаны в следующей таблице.
[0487]
(Ki),
нМ
(Ki),
нМ
(Ki),
нМ
(Ki),
нМ
(Ki),
нМ
(Ki),
нМ
[0488]
3. Эксперимент по влиянию на сон
В качестве способа измерения влияния соединения согласно настоящему изобретению на время сна осуществляли исследования электроэнцефалограммы (EEG) и электромиограммы (EMG) на мышах (C57BL/6NCrlCrLj).
Для измерения мозговых волн и мышечных импульсов осуществляли вживление электродов EEG и EMG отдельным мышам, и мышей затем содержали в условиях, в которых они могли свободно передвигаться и привыкнуть к отдельным клеткам для регистрации в течение 1 недели или дольше. После этого усиленные сигналы EEG и EMG регистрировали в цифровой форме.
Мыши получали путем перорального введения либо наполнитель, либо тестируемое соединение в среде, после чего режим сон/бодрствование мышей регистрировали в течение 3 часов.
В отношении анализа сна использовали программное обеспечение для автоматического анализа от Kissei Comtec Co., Ltd. для подробного анализа частоты EEG и активности сигналов EMG и для определения состояний сна и бодрствования. После этого рассчитывали суммарное время сна за 3 часа.
Воздействие данного соединения на возрастание времени сна оценивали как различие между временем сна в день введения среды и временем сна в последующий день введения лекарственного средства. Полученные результаты показаны в следующей таблице.
[0489]
№
время сна,
10 мг/кг
(мин./3 часа)
№
время сна,
10 мг/кг
(мин./3 часа)
№
время сна,
10 мг/кг
(мин./3 часа)
[0490]
Кроме того, из вышеприведенных соединений соединения из примеров 1, 51, 82, 95, 129 и 240 перорально вводили мышам в дозе 0,3, 1, 3, 10, 30 или 100 мг/кг и измеряли продление времени сна каждым соединением (см. следующий график). Минимальную эффективную дозу (MED; мг/кг) получали исходя из суммарного времени сна мышей за три часа после введения. Полученные результаты составляли 30, 3, 1-3, ≤1, 1-3 и 10 мг/кг для соединений из примеров 1, 51, 82, 95, 129 и 240, соответственно.
[0491]
Как более подробно описано выше, циклопропановые соединения согласно настоящему изобретению, их фармацевтически приемлемая соль или сольват обладают антагонизмом к орексиновому рецептору, способствуют увеличению времени сна и, следовательно, имеют потенциал применимости для лечения нарушения сна, например бессонницы, посредством антагонизма к орексиновому рецептору.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И СОЕДИНЕНИЯ, КОТОРЫЕ МОЖНО ИСПОЛЬЗОВАТЬ ДЛЯ СИНТЕЗА АНТАГОНИСТОВ РЕЦЕПТОРОВ ОРЕКСИНА-2 | 2013 |
|
RU2617696C2 |
| ПРОИЗВОДНЫЕ АРИЛАМИДОВ В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2011 |
|
RU2535671C1 |
| ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV | 2010 |
|
RU2574410C2 |
| НОВОЕ СОЕДИНЕНИЕ БИФЕНИЛА ИЛИ ЕГО СОЛЬ | 2016 |
|
RU2726622C2 |
| ПРОИЗВОДНЫЕ АМИДА В КАЧЕСТВЕ БЛОКАТОРОВ Nav1.7 И Nav1.8 | 2018 |
|
RU2768149C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА ИНГИБИТОРА LSD1 НА ОСНОВЕ ЭКСПРЕССИИ INSM1 | 2018 |
|
RU2789449C2 |
| НОВОЕ СОЕДИНЕНИЕ БИФЕНИЛА ИЛИ ЕГО СОЛЬ | 2018 |
|
RU2765152C2 |
| ИМИДАЗО[1, 2-B]ПИРИДАЗИНОВЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ КИНАЗ | 2013 |
|
RU2635917C2 |
| АРИЛ-ЗАМЕЩЕННЫЕ КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ БЛОКАТОРОВ КАЛЬЦИЕВЫХ ИЛИ НАТРИЕВЫХ КАНАЛОВ | 2010 |
|
RU2575168C2 |
| УСИЛИТЕЛЬ ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА С ПРИМЕНЕНИЕМ НОВОГО СОЕДИНЕНИЯ БИФЕНИЛА | 2018 |
|
RU2765153C2 |
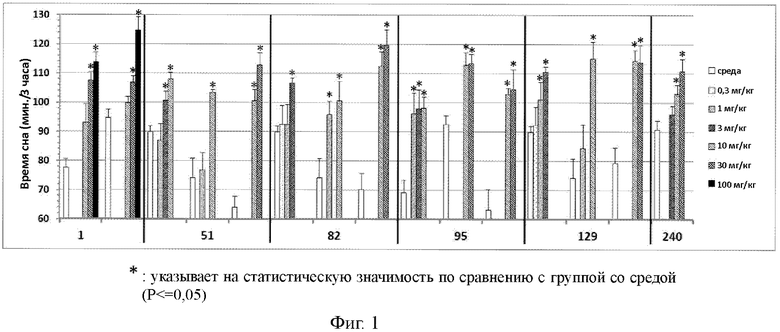
Изобретение относится к соединению структурной формулы (IV), обладающему антагонистической активностью в отношении орексинового рецептора. В формуле (IV) Q представляет -СН- или атом азота, каждый из R1a и R1b независимо представляет С1-6алкильную группу, галоген-С1-6алкильную группу, гидрокси-С1-6алкильную группу или С1-6алкокси-С1-6алкильную группу, R1c представляет атом водорода или гидроксильную группу, каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6алкильную группу, C1-6алкоксигруппу или галоген-С1-6алкильную группу или циано-группу, и каждый из R3a, R3b, R3c и R3d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6алкильную группу, C1-6алкоксигруппу, галоген-С1-6алкильную группу, C1-6алкокси-С1-6алкильную группу, циано-группу или циано-С1-6алкильную группу. Изобретение также относится к фармацевтической композиции, содержащей указанное соединение, и к способу лечения нарушения сна. 10 н. и 10 з.п. ф-лы, 1 ил., 75 табл., 327 пр.
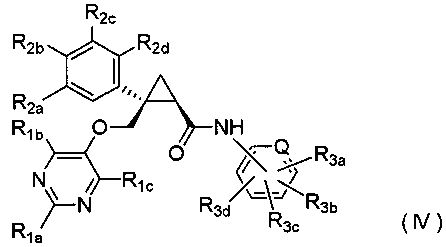
1. Соединение, представленное следующей формулой (IV), или его фармацевтически приемлемая соль:

где
Q представляет -СН- или атом азота,
каждый из R1a и R1b независимо представляет С1-6 алкильную группу, галоген-С1-6 алкильную группу, гидрокси-С1-6 алкильную группу или С1-6 алкокси-С1-6 алкильную группу,
R1c представляет атом водорода или гидроксильную группу,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-С1-6 алкильную группу или циано-группу, и
каждый из R3a, R3b, R3c и R3d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу, галоген-С1-6 алкильную группу, C1-6 алкокси-С1-6 алкильную группу, циано-группу или циано-С1-6 алкильную группу.
2. Соединение, представленное следующей формулой (А), или его фармацевтически приемлемая соль:
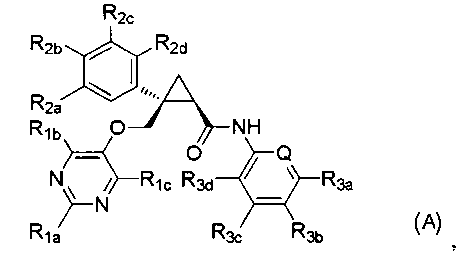
где
Q представляет -СН- или атом азота,
если Q представляет -СН-,
каждый из R1a и R1b независимо представляет С1-6 алкильную группу, галоген-С1-6 алкильную группу или С1-6 алкокси-C1-6 алкильную группу,
R1c представляет атом водорода,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, C1-6 алкильную группу, С1-6 алкоксигруппу или галоген-С1-6 алкильную группу,
каждый из R3a и R3c независимо представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-С1-6 алкильную группу, С1-6 алкоксигруппу, C1-6 алкокси-С1-6 алкильную группу, циано-группу или циано-С1-6 алкильную группу,
R3b представляет атом водорода, атом галогена, С1-6 алкильную группу, галоген-С1-6 алкильную группу, С1-6 алкоксигруппу или C1-6 алкокси-С1-6 алкильную группу, и
R3d представляет атом водорода или атом фтора,
или
если Q представляет атом азота,
каждый из R1a и R1b независимо представляет С1-6 алкильную группу, галоген-С1-6 алкильную группу, гидрокси-С1-6 алкильную группу или C1-6 алкокси-С1-6 алкильную группу,
R1c представляет атом водорода или гидроксильную группу,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-С1-6 алкильную группу,
R3a представляет атом водорода, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу или C1-6 алкокси-С1-6 алкильную группу,
R3b представляет атом водорода, атом галогена, С1-6 алкильную группу или галоген-C1-6 алкильную группу,
R3c представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-С1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкокси-С1-6 алкильную группу или циано-группу, и
R3d представляет атом водорода.
3. Соединение по п. 1 или 2, которое представлено следующей формулой (В), или его фармацевтически приемлемая соль:
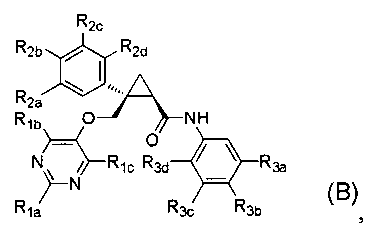
где
каждый из R1a и R1b независимо представляет C1-6 алкильную группу, галоген-С1-6 алкильную группу или C1-6 алкокси-С1-6 алкильную группу,
R1c представляет атом водорода,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-С1-6 алкильную группу,
каждый из R3a и R3c независимо представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-С1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкокси-С1-6 алкильную группу, циано-группу или циано-С1-6 алкильную группу,
R3b представляет атом водорода, атом галогена, C1-6 алкильную группу, галоген-C1-6 алкильную группу, C1-6 алкоксигруппу или C1-6 алкокси-С1-6 алкильную группу, и
R3d представляет атом водорода или атом фтора.
4. Соединение по п. 1 или 2, которое представлено следующей формулой (С), или его фармацевтически приемлемая соль:
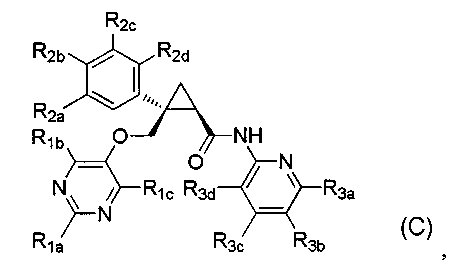
где
R1a представляет C1-6 алкильную группу или гидрокси-С1-6 алкильную группу,
R1b представляет C1-6 алкильную группу, галоген-С1-6 алкильную группу, гидрокси-С1-6 алкильную группу или C1-6 алкокси-С1-6 алкильную группу,
R1c представляет атом водорода или гидроксильную группу,
каждый из R2a, R2b, R2c и R2d независимо представляет атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкоксигруппу или галоген-С1-6 алкильную группу,
R3a представляет атом водорода, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу или C1-6 алкокси-С1-6 алкильную группу,
R3b представляет атом водорода, атом галогена, C1-6 алкильную группу или галоген-С1-6 алкильную группу,
R3c представляет атом водорода, атом галогена, С1-6 алкильную группу, галоген-C1-6 алкильную группу, С1-6 алкоксигруппу или С1-6 алкокси-С1-6 алкильную группу, и
R3d представляет атом водорода.
5. Соединение по п. 4 или его фармацевтически приемлемая соль, где R1a представляет метильную группу, R1b представляет метильную группу, этильную группу, гидроксиметильную группу, метоксиметильную группу или метоксиэтильную группу, и R1c представляет атом водорода.
6. Соединение, которое выбрано из следующих соединений, или его фармацевтически приемлемая соль:
1) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамид,
2) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
3) (1R,2S)-N-[3-(диметиламино)фенил]-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
4) (1R,2S)-N-(3-хлорфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
5) (1R,2S)-N-(3-циано-4-фторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
6) (1R,2S)-N-(3-хлор-4-фторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
7) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(3-метоксифенил)-2-фенилциклопропанкарбоксамид,
8) (1R,2S)-N-[3-(цианометил)фенил]-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
9) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенил-N-[3-(трифторметил)фенил]циклопропанкарбоксамид,
10) (1R,2S)-N-(5-хлор-4-метилпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
11) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамид,
12) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-[5-фтор-4-(метоксиметил)пиридин-2-ил]-2-фенилциклопропанкарбоксамид,
13) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-фенилциклопропанкарбоксамид,
14) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид,
15) (1R,2S)-N-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид,
16) (1R,2S)-N-(4-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид,
17) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксиметилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид,
18) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(4-фторфенил)циклопропанкарбоксамид,
19) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-фенилциклопропанкарбоксамид,
20) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид,
21) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
22) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид,
23) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
24) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид,
25) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксиметилпиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид,
26) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид,
27) (1R,2S)-2-(3-цианофенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид,
28) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамид,
29) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
30) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
31) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид,
32) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)циклопропанкарбоксамид,
33) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид,
34) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
35) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
36) (1R,2S)-N-(3,4-дифторфенил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
37) (1R,2S)-N-(2,4-дифторфенил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
38) (1R,2S)-N-(5-цианопиридин-2-ил)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
39) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)циклопропанкарбоксамид,
40) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(4-(метоксиметил)-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
41) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(4-(метоксиметил)-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
42) (1R,2S)-N-(5-фторпиридин-2-ил)-2-{[(4-(метоксиметил)-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
43) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
44) (1R,2S)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
45) (1R,2S)-N-(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
46) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид,
47) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)циклопропанкарбоксамид,
48) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид,
49) (1R,2S)-N-(5-цианопиридин-2-ил)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
50) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
51) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
52) (1R,2S)-N,2-бис(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
53) (1R,2S)-2-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метоксипиридин-2-ил)циклопропанкарбоксамид,
54) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-(3-метоксифенил)циклопропанкарбоксамид,
55) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-метоксифенил)циклопропанкарбоксамид,
56) (1R,2S)-N-(3,4-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-метоксифенил)циклопропанкарбоксамид,
57) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-[(4-метоксиметил-2-метилпиримидин-5-ил)оксиметил]циклопропанкарбоксамид,
58) (1R,2S)-2-(3-фторфенил)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
59) (1R,2S)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид,
60) (1R,2S)-N-(3,4-дифторфенил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
61) (1R,2S)-N,2-бис(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
62) (1R,2S)-N-(2,4-дифторфенил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
63) (1R,2S)-N-(2,5-дифторфенил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
64) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
65) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
66) (1R,2S)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-[5-(трифторметил)пиридин-2-ил]циклопропанкарбоксамид,
67) (1R,2S)-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
68) (1R,2S)-N,2-бис(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
69) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
70) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
71) (1R,2S)-N-(3,4-дифторфенил)-2-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
72) (1R,2S)-2-(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид,
73) (1R,2S)-2-(3,4-дифторфенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
74) (1R,2S)-N,2-бис(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
75) (1R,2S)-N-(2,4-дифторфенил)-2-(3,4-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
76) (1R,2S)-2-(3,5-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид,
77) (1R,2S)-2-(3,5-дифторфенил)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
78) (1R,2S)-N-(3,4-дифторфенил)-2-(3,5-дифторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
79) (1R,2S)-2-(3-хлорфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}-N-(пиридин-2-ил)циклопропанкарбоксамид,
80) (1R,2S)-2-(3-хлорфенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
81) (1R,2S)-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиэтил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
82) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(4-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
83) (1R,2S)-N-(3,4-дифторфенил)-2-(3-фтор-5-метоксифенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
84) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(5-фторпиридин-2-ил)-2-[(4-метоксиметил-2-метилпиримидин-5-ил)оксиметил]циклопропанкарбоксамид,
85) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
86) (1R,2S)-2-(3-фтор-5-метоксифенил)-2-[(4-метоксиметил-2-метилпиримидин-5-ил)оксиметил]-N-(пиридин-2-ил)циклопропанкарбоксамид,
87) (1R,2S)-2-(3-фтор-5-метоксифенил)-N-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
88) (1R,2S)-2-(4-фтор-3-метоксифенил)-N-(5-фтор-4-метилпиридин-2-ил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
89) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(пиридин-2-ил)циклопропанкарбоксамид,
90) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
91) (1R,2S)-N-(5-цианопиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид,
92) (1R,2S)-N-(5-хлорпиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид,
93) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид,
94) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(пиридин-2-ил)циклопропанкарбоксамид,
95) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
96) (1R,2S)-N-(4-хлорпиридин-2-ил)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)циклопропанкарбоксамид,
97) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(4-фторфенил)циклопропанкарбоксамид,
98) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-5-метоксифенил)-N-(5-фтор-4-метилпиримидин-2-ил)циклопропанкарбоксамид,
99) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-(3-трифторметилфенил)циклопропанкарбоксамид,
100) (1R,2S)-2-(4-бромфенил)-N-(5-хлорпиридин-2-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
101) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторметилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид,
102) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-(3-йодфенил)циклопропанкарбоксамид,
103) (1R,2S)-N-(5-фторпиридин-2-ил)-2-{[(4-гидроксиметил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоксамид,
104) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(4-фторфенил)циклопропанкарбоксамид,
105) (1R,2S)-2-{[(4-фторметил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
106) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-4-гидроксифенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
107) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фтор-4-метоксифенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
108) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-{[(2-гидроксиметил-4-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
109) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-[5-фтор-2-гидроксифенил]-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
110) (1R,2S)-2-{[(2,4-диметил-6-оксо-1,6-дигидропиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
111) (1R,2S)-N-(2-цианопиридин-4-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
112) (1R,2S)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-N-(5-фторпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид,
113) (1R,2S)-N-(5-хлор-4-метилпиридин-2-ил)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-2-(3-фторфенил)циклопропанкарбоксамид,
114) (1R,2S)-N-(3,4-фторпиридин-2-ил)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-2-(3-фторфенил)циклопропанкарбоксамид,
115) (1R,2S)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)-2-[N-(2-метил-4-трифторметилпиримидин-5-ил)метиламинометил]циклопропанкарбоксамид,
116) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фтор-5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид,
117) (1R,2S)-N-(2-хлорпиридин-4-ил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-фенилциклопропанкарбоксамид,
118) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фторпиридин-3-ил)-2-фенилциклопропанкарбоксамид,
119) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид,
120) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фторпиридин-3-ил)-2-(3-фторфенил)циклопропанкарбоксамид,
121) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-метоксипиридин-3-ил)циклопропанкарбоксамид,
122) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(6-фтор-5-метилпиридин-3-ил)-2-(3-фторфенил)циклопропанкарбоксамид,
123) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(4-фторфенил)-N-(5-метоксипиридин-3-ил)циклопропанкарбоксамид,
124) (1R,2S)-N-(5-цианопиридин-2-ил)-2-(3-фторфенил)-2-{[(4-метоксиметил-2-метилпиримидин-5-ил)окси]метил}циклопропанкарбоксамид,
125) (1R,2R)-2-[(2,4-диметилпиримидин-5-ил)этил]-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамид,
126) (1R,2S)-2-[N-(2,4-диметилпиримидин-5-ил)метиламинометил]-N-(4-фторфенил)-2-(3-фторфенил)циклопропанкарбоксамид,
127) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид,
128) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(4-фторфенил)-2-фенилциклопропанкарбоксамид
и
129) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-N-(5-метоксипиридин-3-ил)-2-фенилциклопропанкарбоксамид.
7. Соединение, которое выбрано из следующих соединений, или его фармацевтически приемлемая соль:
1) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фторпиридин-2-ил)-2-фенилциклопропанкарбоксамид,
11) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-фенилциклопропанкарбоксамид,
14) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид,
21) (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид,
31) (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид и
89) (1R,2S)-2-{[(4-этил-2-метилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(пиридин-2-ил)циклопропанкарбоксамид.
8. (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)-2-(3-фторфенил)циклопропанкарбоксамид, представленный следующей формулой, или его фармацевтически приемлемая соль:
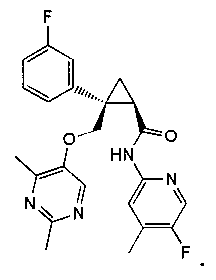
9. (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид, представленный следующей формулой, или его фармацевтически приемлемая соль:
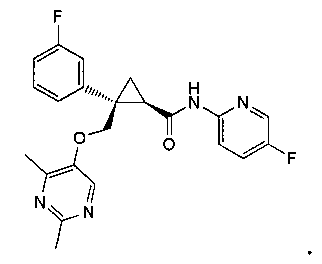
10. (1R,2S)-2-(3,5-дифторфенил)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-N-(5-фтор-4-метилпиридин-2-ил)циклопропанкарбоксамид, представленный следующей формулой, или его фармацевтически приемлемая соль:
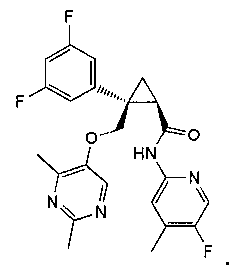
11. Фармацевтическая композиция, обладающая антагонистической активностью в отношении орексинового рецептора, содержащая в качестве действующего ингредиента соединение по любому одному из пп. 1-10 или его фармацевтически приемлемую соль.
12. Фармацевтическая композиция по п. 11, которая предназначена для лечения нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору.
13. Фармацевтическая композиция по п. 12, где указанное нарушение сна представляет собой бессонницу.
14. Способ лечения нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору, который включает введение соединения по любому одному из пп. 1-10 или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
15. Способ по п. 14, где указанное нарушение сна представляет собой бессонницу.
16. Соединение по любому одному из пп. 1-10 или его фармацевтически приемлемая соль для применения в качестве действующего ингредиента фармацевтической композиции, обладающей антагонистической активностью в отношении орексинового рецептора.
17. Соединение или его фармацевтически приемлемая соль по п. 16, где указанная фармацевтическая композиция предназначена для лечения нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору.
18. Соединение или его фармацевтически приемлемая соль по п. 17, где указанное нарушение сна представляет собой бессонницу.
19. Применение соединения по любому одному из пп. 1-10 или его фармацевтически приемлемой соли в производстве фармацевтической композиции для лечения нарушения сна, в отношении которого эффективен антагонизм к орексиновому рецептору.
20. Применение по п. 19, где указанное нарушение сна представляет собой бессонницу.
| WO2009039942 A1, 02.04.2009 | |||
| WO2008038251 A2, 03.04.2008 | |||
| WO2008081399 A2, 10.07.2008 | |||
| ПРОИЗВОДНЫЕ БЕНЗОДИОКСОЛА, БЕНЗОФУРАНА, ДИГИДРОБЕНЗОФУРАНА И БЕНЗОДИОКСАНА И СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ | 1997 |
|
RU2190609C2 |
| US20100144760 A1, 10.06.2010. | |||
Авторы
Даты
2015-12-20—Публикация
2011-09-20—Подача