Перекрестная ссылка
По настоящей заявке испрашивается приоритет предварительной заявки США № 61/600109, поданной 17 февраля 2012, содержание которой включено в настоящее описание посредством ссылки во всей своей полноте.
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям и способам, которые можно использовать для получения соединений, полезных в качестве антагонистов рецепторов орексина-2.
Уровень техники
Рецепторы орексина представляет собой рецепторы, связанные с G-белком и находящиеся преимущественно в мозге. Их эндогенные лиганды, орексин-A и орексин-B, экспрессируются нейронами, локализованными в гипоталамусе. Орексин-A представляет собой пептид, состоящий из 33 аминокислот; орексин-B состоит из 28 аминокислот. (Sakurai T. et al., Cell, 1998, 92, 573-585). Они представляют собой два подтипа рецепторов орексина, OX1 и OX2; OX1 связывает предпочтительно орексин-A, тогда как OX2 связывает как орексин-A, так и орексин-B. Орексины стимулируют потребление пищи у крыс, и было высказано предположение, что сигнальная система орексина может играть роль в центральном механизме регулирования пищевого поведение (Sakurai et al., supra). Наблюдалось также, что орексины регулируют состояния бодрствования-сна (Chemelli R.M. et al., Cell, 1999, 98, 437-451). Орексины могут также играть роль в изменениях мозга, связанных с опоидной и никотиновой зависимостью (S.L. Borgland et al., Neuron, 2006, 49, 598-601; C.J. Winrow et al., Neuropharmacology, 2010, 58, 185-194) и этанольной зависимостью (J.R. Shoblock et al., Psychopharmacology, 2011, 215, 191-203). Кроме того, было высказано предположение, что орексины принимают участие в некоторых стрессовых реакциях (T. Ida et al, Biochem. Biophys. Res. Commun., 2000, 270, 318-323).
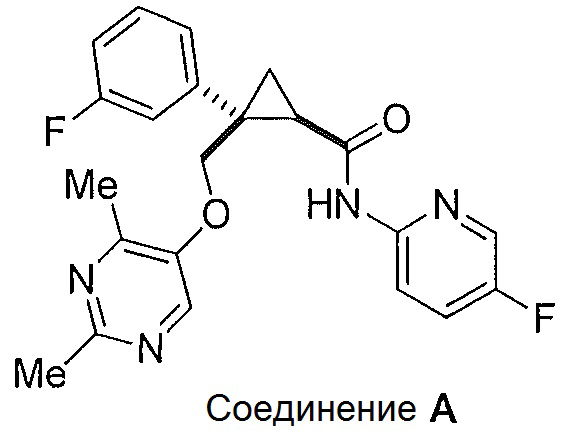
Было обнаружено, что соединения, такие как (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (далее соединение A) являются эффективными антагонистами рецепторов орексина и могут оказаться полезными при лечении нарушений сна, таких как бессонница, а также в других случаях терапевтического использования.
 .
.
Таким образом, существует необходимость в способах синтеза и в промежуточных соединениях, которые можно использовать для получения соединения A и родственных соединений. Поэтому задачей настоящего изобретения является создание таких способов и промежуточных соединений.
Сущность изобретения
В настоящем изобретении предоставлены способы, которые можно использовать для получения соединений, полезных в качестве антагонистов рецепторов орексина-2.
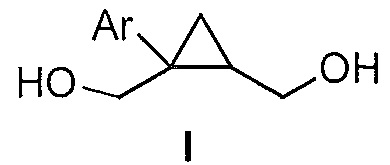
Предоставлен способ получения соединения формулы I:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила,
включающий одну или более стадий:
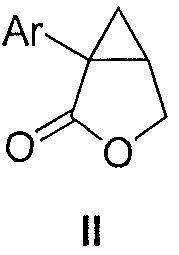
i) обеспечения композиции, содержащей соединение формулы II:
 ,
,
где Ar является таким, как указано выше, и органический растворитель, где указанная композиция находится при температуре от -30 до 40°C, или от -30 до 30°C, или от -30 до 10°C, или от -10 до 0°C, или от -10 до -5°C; и
ii) добавления к указанной композиции гидридного восстанавливающего агента, где указанный агент восстанавливает указанное соединение формулы II до указанного соединения формулы I,
с получением, таким образом, указанного соединения формулы I.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления указанный органический растворитель представляет собой ароматический углеводородный растворитель, алифатический углеводородный растворитель, галогенированный углеводородный растворитель или эфирный растворитель.
В некоторых вариантах осуществления способ может дополнительно включать стадию смешивания (например, путем перемешивания) указанной композиции после указанной стадии добавления в течение промежутка времени от 12 до 24 часов.
В некоторых вариантах осуществления способ может дополнительно включать стадию гашения реакции путем добавления к указанной композиции слабой водной кислоты (например, лимонной кислота, EDTA или винной кислоты).
В некоторых вариантах осуществления соединение формулы II имеет абсолютную стереохимию формулы IIa:
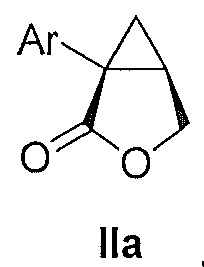
В некоторых вариантах осуществления соединение формулы II имеет энантиомерный избыток (эи) стереоизомера формулы IIa по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
В некоторых вариантах осуществления соединение формулы II или формулы IIa представляет собой соединение:
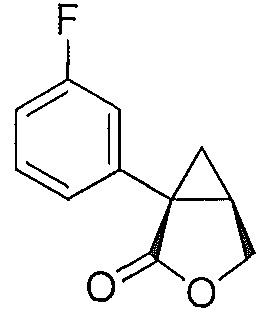 .
.
В некоторых вариантах осуществления соединение формулы I имеет абсолютную стереохимию формулы Ia:
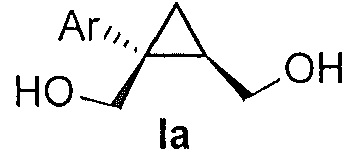 .
.
В некоторых вариантах осуществления соединение формулы I имеет энантиомерный избыток (эи) стереоизомера формулы Ia по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
В некоторых вариантах осуществления соединение формулы I или формулы Ia представляет собой
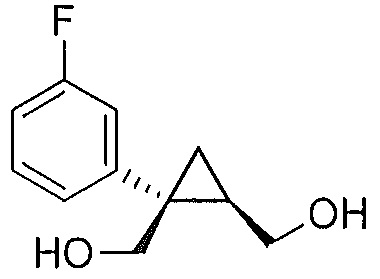 .
.
Также предоставлено соединение формулы III:
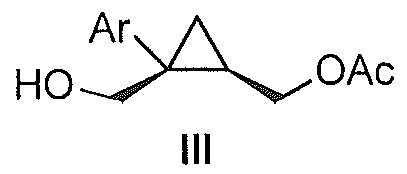 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления соединение представляет собой
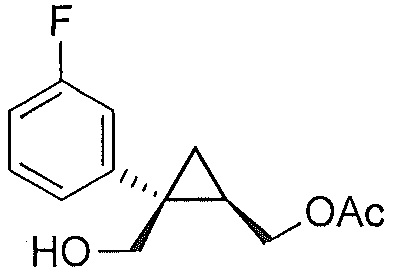 .
.
Также предоставлен способ получения соединения формулы III:
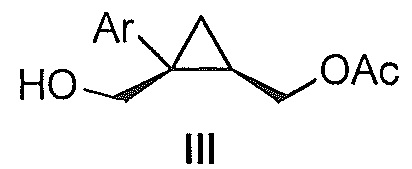 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила,
включающий взаимодействие смеси:
i) соединения формулы Ia:
 ,
,
где Ar является таким, как указано выше,
ii) винилацетата,
iii) липазы и
iv) органического растворителя,
в течение промежутка времени от 5 до 36 часов или от 7 до 18 часов,
с получением, таким образом, соединения формулы III.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления органический растворитель представляет собой тетрагидрофуран, 2-метилтетрагидрофуран, эфирный растворитель, ацетон или ацетонитрил.
В некоторых вариантах осуществления указанная липаза представляет собой липазу Candida Antarctica, например, липазу Candida Antarctica B, которая может быть присоединена к твердому носителю, такому как акриловая смола.
В некоторых вариантах осуществления способ может дополнительно включать стадию фильтрования смеси после осуществления указанного взаимодействия до получения фильтрата, и может дополнительно включать концентрирование фильтрата до получения концентрированного фильтрата. В некоторых вариантах осуществления способ может дополнительно включать стадию промывки концентрированного фильтрата водой или водой, содержащей соль (например, 15-20% раствором NaCl в воде).
Также предоставлено соединение формулы IV:
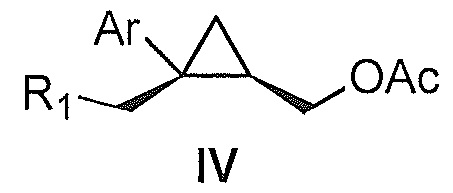 ,
,
где
Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R1 представляет собой уходящую группу.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления уходящая группа представляет собой сложный сульфонатный эфир, выбранный из группы, состоящей из: мезилата, тозилата, нозилата, бензолсульфоната и брозилата.
В некоторых вариантах осуществления соединение представляет собой
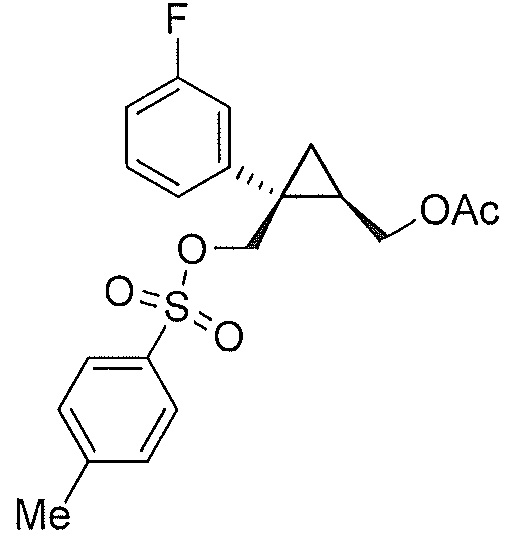 .
.
В некоторых вариантах осуществления соединение формулы IV имеет абсолютную стереохимию формулы IVa:
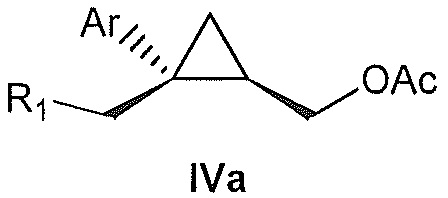 .
.
В некоторых вариантах осуществления соединение формулы IV имеет энантиомерный избыток (эи) стереоизомера формулы IVa по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
Далее предоставлен способ получения соединения формулы IV:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R1 представляет собой уходящую группу сложного сульфонатного эфира,
включающий взаимодействие соединения формулы III:
 ,
,
где Ar является таким, как указано выше,
с соединением, выбранным из группы, состоящей из: тозилхлорида, мезилхлорида, нозилхлорида, толуолсульфонилхлорида, толуолсульфонового ангидрида и метансульфонового ангидрида,
где указанное взаимодействие осуществляют в органическом растворителе в присутствии основания,
с получением, таким образом, указанного соединения формулы IV.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления реакцию осуществляют в течение промежутка времени от 10 минут до 2 часов.
В некоторых вариантах осуществления указанное основание представляет собой органический амин или карбонат натрия.
В некоторых вариантах осуществления соединение формулы III представляет собой:
 .
.
В некоторых вариантах осуществления соединение формулы IV имеет абсолютную стереохимию формулы IVa:
 .
.
В некоторых вариантах осуществления соединение формулы IV имеет энантиомерный избыток (эи) стереоизомера формулы IVa по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
Также предоставлен способ получения соединения формулы V:
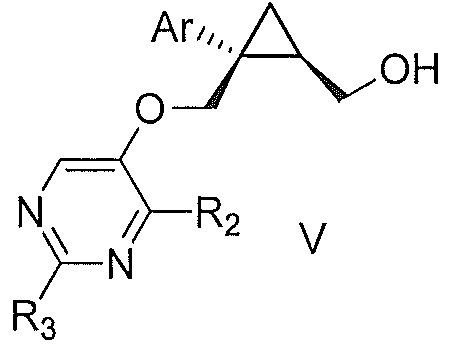 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, C1-6алкила, галогенC1-6алкила, C1-6алкокси и гидроксиC1-6алкила,
включающий стадии:
a) перемешивания смеси, состоящей из:
i) соединения формулы IV:
 ,
,
где Ar является таким, как указано выше; и
R1 представляет собой уходящую группу,
ii) замещенного пиримидина формулы VI:
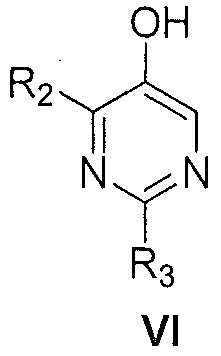 ,
,
где R2 и R3 являются такими, как указано выше;
iii) основания и
iv) органического растворителя,
при температуре от 65 до 70°C, в течение от 1 до 12 часов; и затем
b) взаимодействия указанной смеси с водным основанием в течение промежутка времени от 2 до 20 часов,
с получением, таким образом, указанного соединения формулы V.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила.
В некоторых вариантах осуществления соединение формулы IV имеет абсолютную стереохимию формулы IVa:
 .
.
В некоторых вариантах осуществления соединение формулы IV имеет энантиомерный избыток (эи) стереоизомера формулы IVa по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
Далее предоставлен способ получения соединения формулы VI:

где R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила,
включающий стадии нагревания смеси, состоящей из:
i) соединения формулы B:
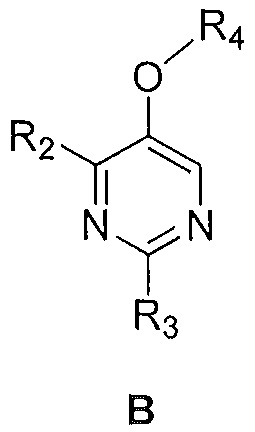 ,
,
где
R2 и R3 являются такими, как указано выше; и
R4 представляет собой C1-6алкил,
ii) алкоксидной или гидроксидной соли,
iii) тиола и
iv) органического растворителя,
с получением, таким образом, указанного соединения формулы VI.
В некоторых вариантах осуществления нагревание осуществляют при температуре от 50°C до 140°C. В некоторых вариантах осуществления нагревание включает кипячение или кипячение с обратным холодильником смеси.
В некоторых вариантах осуществления нагревание осуществляют в течение от 5 до 50 часов.
Также предоставлен способ получения соединения формулы B:
 ,
,
где
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила; и
R4 представляет собой C1-6алкил,
включающий смешивание:
i) соединения формулы A
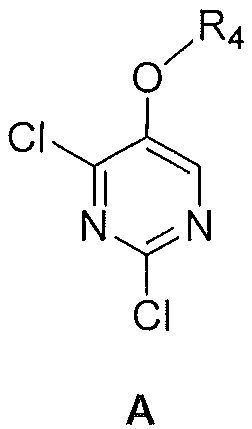
где R4 является таким, как указано выше,
ii) триметилалюминия,
iii) палладиевого катализатора и
iv) органического растворителя,
с получением, таким образом, указанного соединения формулы B.
В некоторых вариантах осуществления стадию смешивания осуществляют в течение промежутка времени от 12 до 48 часов.
В некоторых вариантах осуществления стадию смешивания осуществляют при температуре от 20°C до 110°C.
В некоторых вариантах осуществления способ дополнительно включает стадию гашения реакции, например, водой, содержащей основание (например, гидроксид, такой как гидроксид натрия).
В некоторых вариантах осуществления способ дополнительно включает стадию обработки указанного соединения формулы B раствором, содержащим хлористый водород и растворитель, такой как спирт (например, изопропиловый спирт), до получения указанного соединения формулы B в виде хлористоводородной соли. В некоторых вариантах осуществления это осуществляют после стадии гашения.
Далее предоставлен способ получения соединения формулы B:
 ,
,
где
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила; и
R4 представляет собой C1-6алкил,
включающий смешивание:
i) соединения формулы A:

где R4 является таким, как указано выше,
ii) никелевого катализатора (например, Ni(acac)2, Ni(PPh3)2Cl2 или Ni(dppp)Cl2),
iii) алкилмагнийгалогенида и
iv) органического растворителя,
с получением, таким образом, указанного соединения формулы B.
В некоторых вариантах осуществления смешивание осуществляют в течение промежутка времени от 6 до 36 часов.
В некоторых вариантах осуществления смешивание осуществляют при температуре от 10°C до 30°C.
В некоторых вариантах осуществления способ дополнительно включает стадию гашения реакции, например, водой, содержащей кислоту (например, лимонную кислоту). В некоторых вариантах осуществления способ дополнительно включает стадию добавления гидроксида аммония после стадии гашения.
В некоторых вариантах осуществления способ дополнительно включает взаимодействие соединения формулы B с раствором, содержащим хлористый водород и растворитель, такой как спирт (например, изопропиловый спирт), до получения соединения формулы B в виде хлористоводородной соли.
Также предоставлен способ получения соединения формулы VII:
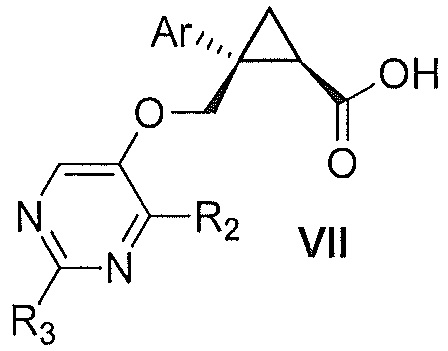 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, C1-6алкила, галогенC1-6алкила, C1-6алкокси и гидроксиC1-6алкила,
включающий стадии:
a) окисления соединения формулы V:
 ,
,
где Ar, R2 и R3 являются такими, как указано выше,
первым окисляющим агентом, до получения альдегида формулы VIII:
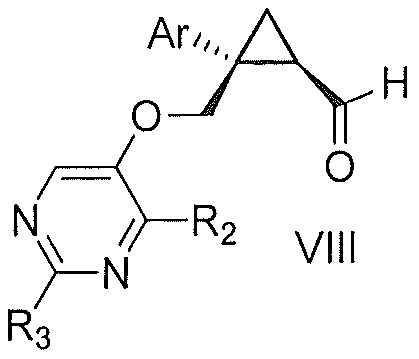 ,
,
где Ar, R2 и R3 являются такими, как указано выше; и затем
b) окисления альдегида формулы VIII вторым окисляющим агентом,
с получением, таким образом, указанного соединения формулы VII.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила.
В некоторых вариантах осуществления первый окисляющий агент представляет собой гипохлорит натрия.
В некоторых вариантах осуществления стадию окисления a) катализируют эффективным количеством 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO).
В некоторых вариантах осуществления вторым окисляющим агентом является хлорит натрия.
В некоторых вариантах осуществления первый окисляющий агент и второй окисляющий агент являются одинаковыми. В некоторых вариантах осуществления первый окисляющий агент и второй окисляющий агент отличаются друг от друга.
В некоторых вариантах осуществления стадию окисления a) и/или стадию b) осуществляют в органическом растворителе (например, дихлорметане, тетрагидрофуране, 2-метилтетрагидрофуране, толуоле, ацетонитриле или этилацетате).
Далее предоставлен способ получения соединения формулы VII:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, C1-6алкила, галогенC1-6алкила, C1-6алкокси и гидроксиC1-6алкила,
включающий: окисление соединения формулы V:
 ,
,
где Ar, R2 и R3 являются такими, как указано выше,
гипохлоритом натрия и хлоритом натрия,
с получением, таким образом, указанного соединения формулы VII.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила.
В некоторых вариантах осуществления окисление гипохлоритом натрия и хлоритом натрия осуществляют одновременно.
В некоторых вариантах осуществления окисление катализируют эффективным количеством 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO).
Также предоставлен способ получения соединения формулы IX:
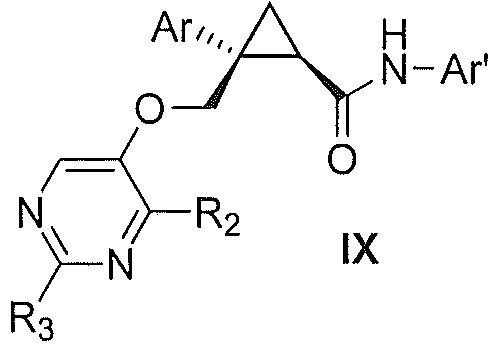 ,
,
где
Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила;
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, C1-6алкила, галогенC1-6алкила, C1-6алкокси и гидроксиC1-6алкила; и
Ar' представляет собой группу пиридина:
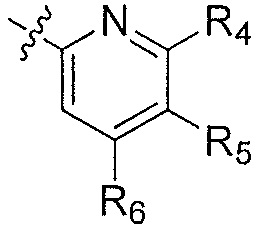 ,
,
где
R4 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила, C1-6алкокси и (C1-6алкокси)C1-6алкила;
R5 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила и галогенC1-6алкила; и
R6 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила, галогенC1-6алкила, C1-6алкокси, (C1-6алкокси)C1-6алкила и циано;
включающий стадии взаимодействия соединения формулы VII:
 ,
,
где Ar, R2 и R3 являются такими, как указано выше,
с соединением формулы X:
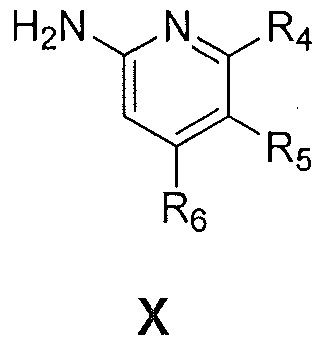 ,
,
где R4, R5 и R6 являются такими, как указано выше,
причем указанное взаимодействие осуществляют в органическом растворителе в присутствии органического амина и амида агента сочетания,
с получением, таким образом, указанного соединения формулы IX.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила.
Подробное описание изобретения
Все ссылки на патенты США включены в описание в той степени, в которой они соответствуют настоящему описанию.
A. Определения
Соединения настоящего изобретения включают такие, которые в общем описаны выше и дополнительно проиллюстрированы вариантами осуществления, подвариантами осуществления и примерами, раскрытыми в описании. Как используется в данном описании, применяются следующие определения, если не указано иное.
Как раскрыто в описании, соединения настоящего изобретения могут быть необязательно замещены одним или более заместителями, такими, как в общем проиллюстрировано выше или как предоставлено конкретными классами, подклассами и примерами изобретения. Обычно термин "замещенный" относится к замене водорода в данной структуре специфическим заместителем. Если не указано иное, замещенная группа может иметь заместитель в каждом разрешенном для замещения положении группы, и если более одного положения в любой данной структуре может быть замещено более чем одним заместителем, выбранным из указанной группы, указанные заместители могут быть одинаковыми или различными в каждом положении. Комбинации заместителей, предусмотренные в настоящем изобретении, предпочтительно являются такими, которые приводят к образованию стабильных или химически реализуемых соединений.
Термин "изомеры" относится к соединениям с одинаковым числом и типом атомов, и, следовательно, с той же молекулярной массой, но отличающимся в отношении расположения или конфигурации атомов.
Термин "стереоизомеры" относится к изомерам, которые отличаются только расположением атомов в пространстве.
Термин "абсолютная стереохимия" относится к специфическому пространственному расположению атомов или групп в химическом соединении вокруг асимметрического атома. Например, атом углерода является асимметрическим, если он присоединен к четырем различным типам атомов или групп атомов.
Термин "диастереоизомеры" относится к стереоизомерам, которые не являются зеркальными изображениями друг друга.
Термин "энантиомеры" относится к стереоизомерам, которые представляет собой неналагающиеся зеркальные изображения друг друга.
Энантиомеры включают "энантиомерно чистые" изомеры, которые включают по существу единственный энантиомер в количестве, например, больше чем или равном 90%, 92%, 95%, 98% или 99%, или равном 100% одного энантиомера.
Термин "энантиомерно чистые", как используется в данном описании, означает соединение или композицию соединений, которая включает по существу единственный энантиомер в количестве, например, больше чем или равном 90%, 92%, 95%, 98% или 99%, или равном 100% единственного энантиомера.
Термин "стереохимически чистый", как используется в данном описании, означает соединение или его композицию, которая включает один стереоизомер соединения и по существу не содержит других стереоизомеров указанного соединения. Например, стереохимически чистая композиция соединения, имеющего один хиральный центр, по существу не будет содержать противоположного энантиомера указанного соединения. Стереохимически чистая композиция соединения, имеющего два хиральных центра, по существу не будет содержать диастереоизомеров и по существу не будет содержать энантиомеров указанного соединения. Конкретное стереохимически чистое соединение включает более чем около 80% по массе одного стереоизомера соединения и менее чем около 20% по массе других стереоизомеров указанного соединения, более предпочтительно, более чем около 90% по массе одного стереоизомера соединения и менее чем около 10% по массе других стереоизомеров указанного соединения, еще более предпочтительно, более чем около 95% по массе одного стереоизомера соединения и менее чем около 5% по массе других стереоизомеров указанного соединения, и наиболее предпочтительно, более чем около 97% по массе одного стереоизомера соединения и менее чем около 3% по массе других стереоизомеров указанного соединения. См., например, патент США 7189715.
Термины "R" и "S", описывающие изомеры, представляет собой определители стереохимической конфигурации у асимметрически замещенного атома углерода. Обозначение асимметрически замещенного атома углерода как "R" или "S" осуществляют, применяя правила приоритета Кана-Ингольда-Прелога, хорошо известные специалистам в данной области, и раскрытые в Правилах Международного Союза Теоретической и Прикладной Химии (IUPAC) номенклатуры в органической химии. Раздел E, Стереохимия.
"Энантиомерный избыток" (эи) энантиомера, когда он выражен в процентах, представляет собой [(молярная доля основного энантиомера) минус (молярная доля меньшего энантиомера)]×100.
Термин "стабильный", как используется в данном описании, относится к соединениям, которые по существу не изменяются, будучи помещены в условия, используемые для их получения, детектирования и предпочтительно их выделения, очистки и использования для одной или более раскрытых в описании целей. В некоторых вариантах осуществления стабильное соединение или химически реализуемое соединение представляет собой такое соединение, которое по существу не изменяется при хранении при температуре 40°C или меньше, в отсутствии влаги или других химически реакционных условий, в течение по меньшей мере недели.
Термин "кипячение с обратным холодильником", как используется в данном описании, относится к способу, при котором пары кипящей жидкости конденсируются и возвращаются в смесь, из которой они образовались, обычно при кипячении жидкости в сосуде, присоединенном к холодильнику.
Термин "концентрирование", как используется в данном описании, относится к уменьшению объема растворителя в композиции или в смеси.
Термин "фильтрат" относится к жидкости, полученной после ее фильтрования; причем фильтрование, обычно включает удаление твердых веществ суспензии из жидкости.
Термин "органическое" соединение, как используется в данном описании, относится к соединению, которое содержит углерод. Аналогично, термин "органический растворитель" относится к соединению, содержащему углерод, которое используют в качестве растворителя. Примеры органических растворителей включают, но, не ограничиваясь ими, амиды кислот, такие как Ν,Ν-диметилформамид и Ν,Ν-диметилацетамид; спирты, такие как этанол, метанол, изопропанол, амиловый спирт, этиленгликоль, пропиленгликоль, 1-бутанол, бутилкарбитолацетат и глицерин; алифатические углеводороды, такие как гексан и октан; ароматические углеводороды, такие как толуол, ксилолы и бензол; кетоны, такие как ацетон, метилэтилкетон и циклогексанон; галогенированные углеводороды, такие как метиленхлорид, хлорбензол и хлороформ; сложные эфиры, такие как этилацетат, амилацетат и бутилацетат; простые эфиры, такие как тетрагидрофуран, 2-метилтетрагидрофуран, 1,4-диоксан, трет-бутилметиловый эфир, диэтиловый эфир и диметиловый эфир этиленгликоля; нитрилы, такие как ацетонитрил; и сульфоксиды, такие как диметилсульфоксид.
Термин "неорганическое" соединение относится к соединению, которое не содержит углерода.
Термин "углеводород" относится к органическому соединению, состоящему из атомов углерода и водорода. Примеры углеводородов, полезных в качестве "углеводородных растворителей", включают, но, не ограничиваясь ими, "ароматические углеводородные растворители", такие как бензол, толуол, ксилолы и т.д., и "алифатические углеводородные растворители", такие как пентан, гексан, гептан и т.д.
Термины "амин", "органический амин", "аминное основание" или "органическое аминное основание", как используется в данном описании, относятся к органическим соединениям, содержащим основной атом азота (R-NRʹRʹʹ), и могут быть первичными (R-NH2), вторичными (R-NHRʹ) или третичными (R-NRʹRʹʹ) аминами. R, Rʹ и Rʹʹ независимо выбирают из группы, состоящей из алкила (например, циклоалкила), арила и гетероарила, причем указанные группы могут быть необязательно замещенными, или R и Rʹ, R и Rʹʹ и/или Rʹ и Rʹʹ, если присутствуют, могут также объединяться с образованием циклических или гетероалициклических колец. Термин гетероалициклический, как используется в данном описании, относится к моно-, би- или трициклическим кольцам или кольцевым системам, содержащим один или более гетероатомов (например, кислорода, азота или серы) по меньшей мере в одном из указанных колец. Кольцевая система может быть "насыщенным кольцом", что означает, что указанное кольцо не содержит каких-либо алкеновых или алкиновых фрагментов, или оно может быть также "ненасыщенным кольцом", что означает, что оно содержит по меньшей мере один алкеновый или алкиновый фрагмент, при условии, что указанная кольцевая система не является ароматической. Циклическая или гетероалициклическая группа может быть незамещенной или замещенной, как определено в описании.
В некоторых вариантах осуществления амин является ароматическим. Примеры ароматических аминов включают, но, не ограничиваясь ими, пиридин, пиримидин, хинолин, изохинолины, пурин, пиррол, имидазол и индол. Ароматические амины могут быть замещенными или незамещенными.
Термин "необязательно замещенный" используют взаимозаменяемо с выражением "замещенный или незамещенный" и он означает, что группа может быть замещена одним или более подходящими заместителями, которые могут быть одинаковыми или различными. В некоторых вариантах осуществления подходящие заместители могут быть выбраны из алкила, циклоалкила, биарила, карбоциклического арила, гетероалициклического арила, гетероарила, ацила, амидино, амидо, амино, алкоксиамино, карбамоила, карбокси, циано, простого эфира, гуанидина, гидроксамоила, гидроксила, имино, изоцианато, изотиоцианато, галогена, нитро, силила, сульфонила, сульфинила, сульфенила, сульфонато, сульфамоила, сульфонамидо, тиокарбонила, тиола, тиоцианато, тиокарбамоила, тиоамидо и мочевины.
Примеры включают, но, не ограничиваясь ими, триэтиламин, пиридин, диметиламинопиридин, N-метилморфолин, основание Хунига (Ν,Ν-диизопропилэтиламин) и 1,8-диазобицикло[5.4.0]ундец-7-ен (DBU).
Термин "амид", как используется в данном описании, относится к органической функциональной группе, содержащей карбонильную группу (C=O), связанную с атомом азота (N).
Термин "агент сочетания амидов" относится к агенту, который можно использовать для присоединения азота и карбоксильной группы с образованием амида, обычно путем активирования карбоксильной группы. Примеры агентов сочетания амидов включают, но, не ограничиваясь ими, карбодиимиды, такие как Ν,Νʹ-дициклогексилкарбодиимид (DCC), N-(3-диметиламинопропил)-Nʹ-этилкарбодиимид (EDC) или гидрохлорид N-(3-диметиламинопропил)-Nʹ-этилкарбодиимида (EDAC), Ν,Νʹ-диизопропилкарбодиимид (DIC); имидазолий, такой как 1,1ʹ-карбонилдиимидазол (CDI), 1,1ʹ-карбонилди(1,2,4-триазол) (CDT); соли урония или гуанидиния, такие как гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурония (HATU), гексафторфосфат O-(бензотриазол-1-ил)-Ν,Ν,Νʹ,Nʹ-тетраметилурония (HBTU) и гексафторфосфат O-(бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурония (TBTU); фосфониевые соли, такие как гексафторфосфат бензотриазол-1-илокси)трис(диметиламино)фосфония (BOP или реагент Кастро), гексафторфосфат (бензотриазол-1-илокси)трипирролидинфосфония (PyBOP®, Merck KGaA, Germany), гексафторфосфат 7-азабензотриазол-1-илокси)трипирролидинфосфония (PyAOP); ангидриды алкилфосфониевой кислоты, такие как ®T3P (Archimica, Germany), и т.д.
"Водным" называют раствор, в котором вода представляет собой растворяющую среду или растворитель. "Водное основание" представляет собой основание в воде. "Водная кислота" представляет собой кислоту в воде.
"Кислота" представляет собой соединение, которое может действовать в качестве донора протонов или в качестве акцептора электронной пары, и поэтому может взаимодействовать с основанием. Сила кислоты соответствует ее способности или тенденции терять протон. "Сильной кислотой" является такая кислота, которая полностью растворяется в воде. Примеры сильных кислот включают, но, не ограничиваясь ими, хлористоводородную кислоту (HCl), йодистоводородную кислоту (HI), бромистоводородную кислоту (HBr), перхлоркислоту (HClO4), азотную кислоту (HNO3), серную кислоту (H2SO4) и т.д. "Слабая" или "мягкая" кислота, напротив, только частично растворяется, образуя равновесный раствор кислоты и конъюгата кислоты и основания. Примеры слабых кислот включают, но, не ограничиваясь ими, карбоновые кислоты, такие как уксусная кислота, лимонная кислота, муравьиная кислота, глюконовая кислота, молочная кислота, щавелевая кислота, винная кислота, этилендиаминтетрауксусная кислота (EDTA) и т.д.
"Основание" представляет собой соединение, которое может акцептировать протон (ион водорода) или служит донором электронной пары. Основания могут быть органическими (например, DBU, карбонат цезия и т.д.) или неорганическими. Термин "сильное основание", как используется в данном описании, представляет собой соединение, которое способно депротонировать очень слабые кислоты. Примеры сильных оснований включают, но, не ограничиваясь ими, гидроксиды, алкоксиды и аммиак.
"Гидроксид" представляет собой общеизвестный двухатомный анион OH- или его соль (обычно соль щелочного металла или щелочноземельного металла). Примеры гидроксидов включают, но, не ограничиваясь ими, гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид лития (LiOH) и гидроксид кальция (Ca(OH)2).
"Алкоксид" представляет собой RO-, основание, сопряженное со спиртом. Примеры включают, но, не ограничиваясь ими, метоксид, этоксид и пропоксид.
"Окисляющий агент" представляет собой агент, который можно использовать для окисления соединения, в результате чего соединение теряет электроны или повышает свою степень окисления. Примеры включают, но, не ограничиваясь ими, кислород, озон, органические пероксиды, такие как пероксид водорода, галогены, такие как фтор или хлор, или галогеновые соединения, такие как хлорит, хлорат или перхлорат, нитратные соединения, такие как азотная кислота, серную кислоту или надсерную кислоту, гипогалогенитные соединения, такие как гипохлорит и гипохлорит натрия (NaClO), соединения шестивалентного хрома, такие как хромовая и дихромовая кислоты и триоксид хрома, пиридинийхлорхромат и хромат/дихромат, перманганатные соединения, перборат натрия, оксид азота, оксид серебра, тетроксид осмия, реагент Толленса и 2,2'-дипиридилдисульфид.
"Восстанавливающий агент" представляет собой агент, который можно использовать для восстановления соединения, в результате чего соединение приобретает электроны или происходит снижение его степени окисления. "Гидридный восстанавливающий агент" представляет собой восстанавливающий агент, включающий гидрид. Примеры включают, но, не ограничиваясь ими, боргидрид натрия, боргидрид лития, литийалюминийгидрид, трибутоксиалюминийгидрид лития, диизобутилалюминийгидрид (DIB AH), боргидрид цинка (См., например, Nakata et al., Tett. Lett., 24, 2653-56, 1983) и триэтилборгидрид лития (Super-Hydride®, Sigma- Aldrich, Saint Louis, Missouri). См. Seyden-Penne, J. (1997). Reductions by the Alumino- and Boronhydrides in Organic Synthesis, 2nd edition. Wiley-VCH.
"Уходящая группа" представляет собой группу или заместитель соединения, которые можно заменить другой группой или заместителем в реакции замещения, такой как реакция нуклеофильного замещения. Например, общеизвестные уходящие группы включают группы галогенов; уходящие группы сложных сульфонатных эфиров, такие как мезилат (метансульфонат или -OMs), тозилат (п-толуолсульфонат или -OTs), брозилат, нозилат, безилат (бензолсульфонат) и т.п.; трифлаты, такие как трифторметансульфонат; и ацилоксигруппы, такие как ацетокси, трифторацетокси и т.п. См., например, патент США 8101643.
Термин "липаза", как используется в данном описании, представляет собой фермент, способный ацилировать стерилгликозид. Примеры включают, но, не ограничиваясь ими, липазу Aspergillus; липазу Aspergillus niger; липазу Thermomyces lanuginosa; липазу Candida Antarctica A; липазу Candida Antarctica B; липазу Candida cylindracae; липазу Candida deformans; липазу Candida lipolytica; липазу Candida parapsilosis; липазу Candida rugosa; липазу Corynebacterium acnes; липазу Cryptococcus spp. S-2; липазу Fusarium culmorum; липазу Fusarium heterosporum; липазу Fusarium oxysporm; липазу Mucor javanicus; липазу Rhizomucor miehei; липазу Rhizomucor delemar; липазу Burkholderia (Pseudomonas) cepacia; липазу Pseudomonas camembertii; липазу Pseudomonas fluorescens; липазу Rhizopus; липазу Rhizopus arrhizus; липазу Staphylococcus aureus; липазу Geotrichium candidum; липазу Hyphozyma sp.; липазу Klebsiella oxytoca; и их гомологи (например, их варианты, аминокислотные последовательности которых по меньшей мере на 80%, по меньшей мере на 85%; по меньшей мере на 90%, по меньшей мере на 92%; по меньшей мере на 94%; по меньшей мере на 95%, по меньшей мере на 96%; по меньшей мере на 97%; по меньшей мере на 98% или по меньшей мере на 99% идентичны последовательности любого из указанных дикого типа ферментов). См. патентную публикацию США № 2012/0009659.
"Липаза Candida Antarctica" представляет собой липазу исходно выделенную из Candida Antarctica (но в настоящее время обычно экспрессируемую рекомбинантно, например, в видах Aspergillus), и может быть в форме A, форме B и т.д. В некоторых вариантах осуществления указанная липаза присоединена к смоле (например, акриловой смоле). Например, липаза Candida Antarctica B доступна в иммобилизованном на акриловой смоле виде (Novozym® 435, Sigma-Aldrich, Saint Louis, Missouri). В некоторых вариантах осуществления указанный фермент выбирают из группы, состоящей из: липазы Candida Antarctica A, липазы Candida Antarctica B и их гомологов (например, их вариантов, аминокислотные последовательности которых по меньшей мере на 80%, по меньшей мере на 85%; по меньшей мере на 90%, по меньшей мере на 92%; по меньшей мере на 94%; по меньшей мере на 95%, по меньшей мере на 96%; по меньшей мере на 97%; по меньшей мере на 98% или по меньшей мере на 99% идентичны последовательностям любого из указанных ферментов). См. патентную публикацию США № 2012/0009659.
Термин "гашение", как известно специалистам в данной области, относится к остановке или по существу к остановке химической реакции.
Термин "катализировать" означает ускорение реакции под действием катализатора. Катализатор представляет собой соединение или вещество, которое принимает участие в химической реакции, но само не расходуется в реакции.
Добавление одного или более соединений или агентов "одновременно" или "параллельно" означает, что оба они используются одновременно или в перекрывающиеся промежутки времени. Например, окисление первым и вторым окисляющими агентами в некоторых вариантах осуществления осуществляться добавлением в сосуд через несколько отверстий одновременно или в перекрывающиеся промежутки времени.
Термины "Ar" или "арил" относятся к ароматическому карбоциклическому фрагменту, содержащему одно или более замкнутых колец. Примеры включают, но без ограничений, фенил, нафтил, антраценил, фенантраценил, бифенил и пиренил.
Термин "гетероарил" относится к циклическому фрагменту, содержащему одно или более замкнутых колец, с одним или более гетероатомами (например, кислородом, азотом или серой) по меньшей мере в одном из колец, где по меньшей мере одно из колец является ароматическим, и где кольцо или кольца могут быть независимо конденсированы и/или соединены мостиком. Примеры включают, но без ограничений, хинолинил, изохинолинил, индолил, фурил, тиенил, пиразолил, хиноксалинил, пирролил, индазолил, тиено[2,3-c]пиразолил, бензофурил, пиразоло[1,5-a]пиридил, тиофенилпиразолил, бензотиенил, бензотиазолил, тиазолил, 2-фенилтиазолил и изоксазолил.
Термины "алкил" или "алкильная группа", как используется в данном описании, означают линейную (т.е. неразветвленную), разветвленную или циклическую углеводородную цепь, которая является полностью насыщенной. В некоторых вариантах осуществления алкильные группы содержат 1, 2 или 3, до 4, 5 или 6 атомов углерода (например, C1-4, C2-4, C3-4, C1-5, C2-5, C3-5, C1-6, C2-6, C3-6). В некоторых вариантах осуществления алкильные группы содержат 3-4 атома углерода. В некоторых вариантах осуществления алкильные группы содержат 1-3 атома углерода. В еще других вариантах осуществления алкильные группы содержат 2-3 атома углерода, и в еще других вариантах осуществления алкильные группы содержат 1-2 атома углерода. В некоторых вариантах осуществления термин "алкил" или "алкильная группа" относится к циклоалкильной группе, известной также как карбоцикл. Неограничивающие примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, циклопропил и циклогексил.
Термины "алкенил" или "алкенильная группа", как используются в данном описании, относятся к линейной (т.е. неразветвленной), разветвленной или циклической углеводородной цепи, которая содержит одну или более двойных связей. В некоторых вариантах осуществления алкенильные группы содержат 2-6 атомов углерода. В некоторых вариантах осуществления алкенильные группы содержат 2-4 атома углерода. Еще в других вариантах осуществления алкенильные группы содержат 3-4 атома углерода, и еще в других вариантах осуществления алкенильные группы содержат 2-3 атома углерода. В соответствии с другим аспектом термин алкенил относится к неразветвленной углеводородной цепи, содержащей две двойные связи и называется также "диеном". В других вариантах осуществления термин "алкенил" или "алкенильная группа" относится к циклоалкенильной группе. Неограничивающие примеры алкенильных групп включают -CH=CH2, -CH2CH=CH2 (называемый также как аллил), -CH=CHCH3, -CH2CH2CH=CH2, -CH2CH=CHCH3, -CH=CH2CH2CH3, -CH=CH2CH=CH2 и циклобутенил.
Термин "алкокси" или "алкилтио", как используется в данном описании, относится к алкильной группе, как определено выше, присоединенной к основной углеродной цепи через атом кислорода ("алкокси") или серы ("алкилтио").
Термины "метилен", "этилен" и "пропилен", как используется в данном описании, относятся к двухвалентным фрагментам -CH2-, -CH2CH2- и -CH2CH2CH2-, соответственно.
Термины "этенилен", "пропенилен" и "бутенилен", как используется в данном описании, относятся к двухвалентным фрагментам -CH=CH-, -CH=CHCH2-, -CH2CH=CH-, -CH=CHCH2CH2-, -CH2CH=CH2CH2- и -CH2CH2CH=CH-, где каждая этениленовая, пропениленовая и бутениленовая группа может находиться в цис- или транс-конфигурации. В некоторых вариантах осуществления этениленовая, пропениленовая и бутениленовая группы могут находиться в транс-конфигурации.
Термин "алкилиден" относится к двухвалентной углеводородной группе, образованной в результате моно- или диалкилзамещения метилена. В некоторых вариантах осуществления алкилиденовая группа содержит 1-6 атомов углерода. В других вариантах осуществления алкилиденовая группа содержит 2-6, 1-5, 2-4 или 1-3 атома углерода. Такие группы включают пропилиден (CH3CH2CH=), этилиден (CH3CH=) и изопропилиден (CH3(CH3)CH=), и т.п.
Термин "алкенилиден" относится к двухвалентной углеводородной группе, содержащей одну или более двойных связей, образованных в результате моно- или диалкенильного замещения метилена. В некоторых вариантах осуществления алкенилиденовая группа содержит 2-6 атома углерода. В других вариантах осуществления алкенилиденовая группа содержит 2-6, 2-5, 2-4 или 2-3 атома углерода. В соответствии с одним из аспектов, алкенилиден содержит две двойные связи. Примеры алкенилиденовых групп включают CH3CH=C=, CH2=CHCH=, CH2=CHCH2CH= и CH2=CHCH2CH=CHCH=. Термин "сложный C1-6алкиловый эфир или амид" относится к сложным C1-6алкиловым эфирам или к C1-6алкиламидам, где каждая C1-6алкильная группа является такой, как указано выше. Такие группы сложных C1-6алкиловых эфиров имеют формулу (C1-6алкил)OC(=O)- или (C1-6алкил)C(=O)O-. Такие C1-6алкиламидные группы имеют формулы (C1-6алкил)NHC(=O)- или (C1-6алкил)C(=O)NH-.
Термин "сложный C2-6алкениловый эфир или амид" относится к сложным C2-6алкениловым эфирам или C2-6алкениламидам, где каждая C2-6алкенильная группа является такой, как указано выше. Такие C2-6алкенильные сложноэфирные группы имеют формулы (C2-6алкенил)OC(=O)- или (C2-6алкенил)C(=O)O-. Такие C2-6алкениламидные группы имеют формулы (C2-6алкенил)NHC(=O)- или (C2-6алкенил)C(=O)NH-.
Термин "галоген" относится к фтору, хлору, брому или йоду.
Термин "галогеналкил" относится к алкильной группе, замещенной одним или более атомами галогена. Например, "фторметил" относится к метильной группе, замещенной одним или более атомами фтора (например, монофторметил, дифторметил, трифторметил).
Термин "гидроксиалкил" относится к алкильной группе, замещенной гидроксильной группой (-OH).
Термин "фторметокси", как используется в данном описании, относится к фторметильной группе, как определено выше, присоединенной к основной углеродной цепи через атом кислорода.
Термин "тиол" относится к сероорганическому соединению R-SH, где R представляет собой алифатическую группу.
Термин "циано" относится к группе -C≡N или -CN.
Термин "алифатический" относится к ациклическому или циклическому неароматическому углеродному соединению.
Термин "защитная группа", как используется в данном описании, означает, что конкретный функциональный фрагмент, например, O, S или N, временно блокирован, так что реакцию можно вести селективно по другому реакционному сайту в многофункциональном соединении. Например, в некоторых вариантах осуществления, как подробно раскрыто в описании, используют некоторые защитные группы кислорода. Защитные группы кислорода включают, но, не ограничиваясь ими, группы, связанные с кислородом с образованием простых эфиров, такие как метил, замещенный метил (например, Trt (трифенилметил), MOM (метоксиметил), MTM (метилтиометил), BOM (бензилоксиметил), PMBM или MPM (пара-метоксибензилоксиметил)), замещенный этил (например, 2-(триметилсилил)этил), бензил, замещенный бензил (например, пара-метоксибензил), силил (например, TMS (триметилсилил), TES (триэтилсилил), TIPS (триизопропилсилил), TBDMS (трет-бутилдиметилсилил), трибензилсилил, TBDPS (трет-бутилдифенилсилил), 2-триметилсилилпроп-2-енил, трет-бутил, тетрагидропиранил, аллил и т.д.
В некоторых вариантах осуществления раскрытые в описании соединения могут быть получены в виде солей, таких как фармацевтически приемлемые соли. "Фармацевтически приемлемые соли" представляет собой соли, которые сохраняют необходимую биологическую активность исходного соединения и не вызывают нежелательных токсикологических эффектов. Конкретные примеры фармацевтически приемлемых солей включают соли неорганических кислот (такие как сульфаты, нитраты, перхлораты, фосфаты, карбонаты, бикарбонаты, фторгидраты, гидрохлориды, гидробромиды и гидроиодиды), органические карбоксилаты (такие как ацетаты, оксалаты, малеаты, тартраты, фумараты и цитраты), органические сульфонаты (такие как метансульфонаты, трифторметансульфонаты, этансульфонаты, бензолсульфонаты, толуолсульфонаты и камфорсульфонаты), соли аминокислот (такие как аспартаты и глютаматы), соли четвертичных аминов, соли щелочных металлов (такие как соли натрия и соли калия) и соли щелочноземельных металлов (такие как соли магния и соли кальция).
Если не указано иное, использованная в описании для описания химических групп или фрагментов номенклатура соответствует общепринятой, где название читается слева направо, точка присоединения к остальной молекуле находится с правой стороны названия. Например, группа "(C1-3алкокси)C1-3алкил" присоединена к молекуле по алкильному концу. Другие примеры включают метоксиэтил, где присоединения происходит по этильному концу, и метиламино, где присоединение происходит по аминному концу.
Если не указано иное, когда одно- или двухвалентная группа описывается с помощью химической формулы, включающей один или два фрагмента концевых связей, следует понимать, что присоединение читается слева направо.
Если не указано иное, подразумевается, что изображенные в описании структуры включают все энантиомерные, диастереоизомерные и геометрические (или конформационные) формы структур; например, R и S конфигурации для каждого асимметрического центра, (Z) и (E) изомеры двойных связей, и (Z) и (E) конформационные изомеры. Поэтому, отдельные стереохимические изомеры, а также энантиомерные, диастереоизомерные и геометрические (или конформационные) смеси соединений настоящего изобретения включены в объем настоящего изобретения. Если не указано иное, все таутомерные формы соединений настоящего изобретения включены в объем настоящего изобретения.
Кроме того, если не указано иное, подразумевается, что изображенные в описании структуры включают соединения, которые отличаются присутствием одного или более изотопно обогащенных атомов. Например, соединения предоставленных структур, за исключением замены водорода дейтерием или тритием, или замены углерода 13C- или 14C-обогащенным углеродом, включены в объем настоящего изобретения. Такие соединения можно использовать, например, в качестве аналитических средств или зондов в биологических анализах.
B. Соединения и химический синтез
Было обнаружено, что предоставленные в описании соединения {например, промежуточные соединения) и способы, пригодные для получения соединений, которые можно использовать в качестве антагонистов рецепторов орексина-2, таких как (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (соединение A далее), являются эффективными антагонистами рецепторов орексина, могут быть полезными при лечении нарушений сна, таких как бессонница, а также для других терапевтических применений.

Однако следует понимать, что раскрытые в описании соединения и способы могут быть также полезны для получения аналогичных соединений и/или для проведения аналогичных химических синтезов.
Предоставлен способ получения соединения формулы I:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила и C1-6алкокси, галогенC1-6алкила,
включающий одну или более стадий:
i) получения композиции, содержащей соединение формулы II:
 ,
,
где Ar является таким, как указано выше, и органический растворитель, где указанная композиция находится при температуре от -30 до 40°C или от -30 до 30°C, или от -30 до 10°C, или от -10 до 0°C, или от -10 до -5°C; и
ii) добавления к указанной композиции гидридного восстанавливающего агента, где указанный агент восстанавливает указанное соединение формулы II до указанного соединения формулы I,
с получением, таким образом, указанного соединения формулы I.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления указанный органический растворитель представляет собой ароматический углеводородный растворитель, алифатический углеводородный растворитель, галогенированный углеводородный растворитель или эфирный растворитель.
В некоторых вариантах осуществления способ может дополнительно включать стадию смешивания (например, путем перемешивания) композиции после указанной стадии добавления в течение промежутка времени от 12 до 24 часов.
В некоторых вариантах осуществления способ может дополнительно включать стадию гашения реакции путем добавления к указанной композиции слабой водной кислоты (например, лимонной кислоты, EDTA или винной кислоты).
В некоторых вариантах осуществления соединение формулы II имеет абсолютную стереохимию формулы IIa:

В некоторых вариантах осуществления соединение формулы II имеет энантиомерный избыток (эи) стереоизомера формулы IIa по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
В некоторых вариантах осуществления соединение формулы II или формулы IIa представляет собой соединение:
 .
.
В некоторых вариантах осуществления соединение формулы I имеет абсолютную стереохимию формулы Ia:
 .
.
В некоторых вариантах осуществления соединение формулы I имеет энантиомерный избыток (эи) стереоизомера формулы Ia по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
В некоторых вариантах осуществления соединение формулы I или формулы Ia представляет собой:
 .
.
Также предоставлено соединение формулы III:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или может быть замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления соединение представляет собой
 .
.
Также предоставлен способ получения соединения формулы III:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила,
включающий взаимодействие смеси состоящей из:
i) соединения формулы Ia:
 ,
,
где Ar является таким, как указано выше,
ii) винилацетата,
iii) липазы и
iv) органического растворителя,
в течение промежутка времени от 5 до 36 часов, или от 7 до 18 часов,
с получением, тем самым, соединения формулы III.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления органический растворитель представляет собой тетрагидрофуран, 2-метилтетрагидрофуран, эфирный растворитель, ацетон или ацетонитрил.
В некоторых вариантах осуществления указанная липаза представляет собой липазу Candida Antarctica, например, липазу Candida Antarctica B, которая может быть присоединена к твердому носителю, такому как акриловая смола.
В некоторых вариантах осуществления способ может дополнительно включать стадию фильтрования смеси после указанного взаимодействия для получения фильтрата, и может также включать концентрирование фильтрата до получения концентрированного фильтрата. В некоторых вариантах осуществления способ может дополнительно включать стадию промывки концентрированного фильтрата водой или водой, содержащей соль (например, 15-20% раствор NaCl в воде).
Также предоставлено соединение формулы IV:
 ,
,
где
Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R1 представляет собой уходящую группу.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления уходящая группа представляет собой сложный сульфонатный эфир. Уходящую группу выбирают из группы, состоящей из: мезилата, тозилата, нозилата, бензолсульфоната и брозилата.
В некоторых вариантах осуществления соединение представляет собой:
 .
.
В некоторых вариантах осуществления соединение формулы IV имеет абсолютную стереохимию формулы IVa:
 .
.
В некоторых вариантах осуществления соединение формулы IV имеет энантиомерный избыток (эи) стереоизомера формулы IVa по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
Далее предоставлен способ получения соединения формулы IV:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R1 представляет собой уходящую группу сложного сульфонатного эфира,
включающий взаимодействие соединения формулы III:
 ,
,
где Ar является таким, как указано выше,
с соединением, выбранным из группы, состоящей из: тозилхлорида, мезилхлорида, нозилхлорида, толуолсульфонилхлорида, толуолсульфонового ангидрида и метансульфонового ангидрида,
где указанное взаимодействие осуществляют в органическом растворителе в присутствии основания,
с получением, таким образом, указанного соединения формулы IV.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления реакцию осуществляют в течение промежутка времени от 10 минут до 2 часов.
В некоторых вариантах осуществления указанное основание представляет собой органический амин или карбонат натрия.
В некоторых вариантах осуществления соединение формулы III представляет собой:
 .
.
В некоторых вариантах осуществления соединение формулы IV имеет абсолютную стереохимию формулы IVa:
 .
.
В некоторых вариантах осуществления соединение формулы IV имеет энантиомерный избыток (эи) стереоизомера формулы IVa по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
Также предоставлен способ получения соединения формулы V:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, C1-6алкила, галогенC1-6алкила, C1-6алкокси и гидроксиC1-6алкила,
включающий стадии:
a) перемешивания смеси, состоящей из:
i) соединения формулы IV:
 ,
,
где Ar является таким, как указано выше; и
R1 представляет собой уходящую группу,
ii) замещенного пиримидина формулы VI:
 ,
,
где R2 и R3 являются такими, как указано выше;
iii) основания и
iv) органического растворителя,
при температуре от 65-70°C, в течение от 1 до 12 часов; и затем
b) взаимодействия указанной смеси с водным основанием в течение промежутка времени от 2 до 20 часов,
с получением, таким образом, указанного соединения формулы V.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила.
В некоторых вариантах осуществления соединение формулы IV имеет абсолютную стереохимию формулы IVa:
 .
.
В некоторых вариантах осуществления соединение формулы IV имеет энантиомерный избыток (эи) стереоизомера формулы IVa по меньшей мере 75, 80, 85, 90, 95, 98, 99% или больше.
Далее предоставлен способ получения соединения формулы VI:
 ,
,
где R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила,
включающий стадии нагревания смеси, состоящей из:
i) соединения формулы B:

где
R2 и R3 являются такими, как указано выше; и
R4 представляет собой C1-6алкил,
ii) алкоксидной или гидроксидной соли,
iii) тиола и
iv) органического растворителя,
с получением, таким образом, указанного соединения формулы VI.
В некоторых вариантах осуществления нагревание осуществляют при температуре от 50°C до 140°C. В некоторых вариантах осуществления нагревание включает кипячение или кипячение с обратным холодильником смеси.
В некоторых вариантах осуществления осуществляют в течение промежутка времени от 5 до 50 часов.
Также предоставлен способ полученияа соединения формулы B:
 ,
,
где
R2 и R3, каждый независимо, выбирают из группы, состоящей из водорода и C1-6алкила; и
R4 представляет собой C1-6алкил,
включающий смешивание:
i) соединения формулы A:
 ,
,
где R4 является таким, как указано выше,
ii) триметилалюминия,
iii) палладиевого катализатора и
iv) органического растворителя,
с получением, таким образом, указанного соединения формулы B.
В некоторых вариантах осуществления стадию смешивания осуществляют в течение промежутка времени от 12 до 48 часов.
В некоторых вариантах осуществления стадию смешивания осуществляют при температуре от 20 до 110°C.
Далее предоставлен способ получения соединения формулы B:
 ,
,
где
R2 и R3, каждый независимо, выбирают из группы, состоящей из водорода и C1-6алкила; и
R4 представляет собой C1-6алкил,
включающий смешивание:
i) соединения формулы A:
 ,
,
где R4 является таким, как указано выше,
ii) никелевого катализатора (например, Ni(acac)2, Ni(PPh3)2Cl2 или Ni(dppp)Cl2),
iii) алкилмагнийгалогенида и
iv) органического растворителя,
с получением, таким образом, указанного соединения формулы B.
В некоторых вариантах осуществления смешивание осуществляют в течение промежутка времени от 6 до 36 часов.
В некоторых вариантах осуществления смешивание осуществляют при температуре от 10 до 30°C.
Также предоставлен способ получения соединения формулы VII:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, C1-6алкила, галогенC1-6алкила, C1-6алкокси и гидроксиC1-6алкила,
включающий стадии:
a) окисления соединения формулы V:
 ,
,
где Ar, R2 и R3 являются такими, как указано выше,
первым окисляющим агентом, до образования альдегида формулы VIII:
 ,
,
где Ar, R2 и R3 являются такими, как указано выше; и затем
b) окисления указанного альдегида формулы VIII вторым окисляющим агентом,
с получением, таким образом, указанного соединения формулы VII.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из: хлора, фтора, брома и йода.
В некоторых вариантах осуществления R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила.
В некоторых вариантах осуществления первый окисляющий агент представляет собой гипохлорит натрия.
В некоторых вариантах осуществления окисление на стадии a) катализируют эффективным количеством 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO).
В некоторых вариантах осуществления второй окисляющий агент представляет собой хлорит натрия.
В некоторых вариантах осуществления первый окисляющий агент и второй окисляющий агент являются одинаковыми. В некоторых вариантах осуществления первый окисляющий агент и второй окисляющий агент отличаются друг от друга.
Далее предоставлен способ получения соединения формулы VII:
 ,
,
где Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила; и
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, C1-6алкила, галогенC1-6алкила, C1-6алкокси и гидроксиC1-6алкила,
включающий: окисление соединения формулы V:
 ,
,
где Ar, R2 и R3 являются такими, как указано выше,
гипохлоритом натрия и хлоритом натрия,
с получением, таким образом, указанного соединения формулы VII.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила.
В некоторых вариантах осуществления окисление гипохлоритом натрия и хлоритом натрия осуществляют одновременно.
В некоторых вариантах осуществления окисление катализируют эффективным количеством TEMPO.
Также предоставлен способ получения соединения формулы IX:
 ,
,
где
Ar представляет собой арил, такой как фенил, причем указанный арил может быть незамещенным или замещен 1-3 раза, например, заместителями, независимо выбранными из группы, состоящей из: галогена, C1-6алкила, C1-6алкокси и галогенC1-6алкила;
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, C1-6алкила, галогенC1-6алкила, C1-6алкокси и гидроксиC1-6алкила; и
Arʹ представляет собой группу пиридина:
 ,
,
где
R4 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила, C1-6алкокси и (C1-6алкокси)C1-6алкила;
R5 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила и галогенC1-6алкила; и
R6 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила, галогенC1-6алкила, C1-6алкокси, (C1-6алкокси)C1-6алкила и циано;
включающий стадии взаимодействия соединения формулы VII:
 ,
,
где Ar, R2 и R3 являются такими, как указано выше,
с соединением формулы X:
 ,
,
где R4, R5 и R6 являются такими, как указано выше,
причем указанное взаимодействие осуществляют в органическом растворителе в присутствии органического амина и агента сочетания амидов,
до получения указанного соединения формулы IX.
В некоторых вариантах осуществления Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода.
В некоторых вариантах осуществления R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и C1-6алкила.
Следует понимать, что любое из перечисленных выше соединений и использованное в раскрытых в описании способах может быть получено в стереохимически чистой форме, и они включены в настоящее изобретение. В некоторых вариантах осуществления стереохимически чистое соединение имеет более чем около 75% по массе одного стереоизомера соединения и менее чем около 25% по массе других стереоизомеров указанного соединения, более чем около 80% по массе одного стереоизомера соединения и менее чем около 20% по массе других стереоизомеров указанного соединения, или более чем около 85% по массе одного стереоизомера соединения и менее чем около 15% по массе других стереоизомеров указанного соединения, или более чем около 90% по массе одного стереоизомера соединения и менее чем около 10% по массе других стереоизомеров указанного соединения, или более чем около 95% по массе одного стереоизомера соединения и менее чем около 5% по массе других стереоизомеров указанного соединения, или более чем около 97% по массе одного стереоизомера соединения и менее чем около 3% по массе других стереоизомеров указанного соединения, или более чем около 98% по массе одного стереоизомера соединения и менее чем около 2% по массе других стереоизомеров указанного соединения. В некоторых вариантах осуществления стереохимически чистое соединение имеет более чем 99% по массе одного стереоизомера соединения и менее чем 1 % по массе других стереоизомеров указанного соединения.
Как указано выше, в некоторых вариантах осуществления раскрытые в описании соединения могут быть получены в виде солей, таких как фармацевтически приемлемые соли.
ПРИМЕРЫ
Общая часть
Колоночную хроматографию осуществляют, используя Biotage SP4. Удаление растворителя осуществляют, используя или роторный испаритель Buchii, или центробежный испаритель Genevac. Препаративную ЖХ/МС осуществляют, используя автоочиститель Waters и 19×100 мм XTerra 5 микрон MS C18 колонку в условиях кислотной подвижной фазы. ЯМР спектры записывают, используя спектрометр Varian 400 или 500 МГц.
Термин "в инертной атмосфере" используют для описания реактора (например, реакционного сосуда, колбы, стеклянного реактора и т.п.), в котором воздух заменен по существу не содержащим влаги или сухим инертным газом (таким как азот, аргон и т.п.). Термин "эквивалент" (сокращение: эквив.), как используется в данном описании, описывает стехиометрию (молярное отношение) реагента или реагирующего соединения путем сравнения с ранее установленным исходным материалом. Термин "масса" (сокращение: масс.), как используется в данном описании, соответствует отношению массы вещества или группы веществ путем сравнения с массой конкретного химического компонента реакции или очистки, конкретно указанной ниже в примерах. Указанное отношение рассчитывают как: г/г или кг/кг. Термин "объем" (сокращение: об.), как используется в данном описании, соответствует отношению объема конкретного вещества или группы веществ к массе или объему предварительно установленного химического компонента реакции или очистки. Использованные в уравнении единицы включают соответствие порядков величин. Например, отношение рассчитывают как: мл/мл, мл/г, л/л или л/кг.
Общие способы и детали экспериментов для получения соединений настоящего изобретения приведены ниже. В некоторых случаях, конкретное соединение раскрывают, используя пример. Однако следует учитывать, что в каждом случае целый ряд соединений настоящего изобретения получают согласно предоставленным ниже схемам и экспериментальной части.
В описании использованы следующие сокращения:
A. Получение циклопропановых соединений формулы II
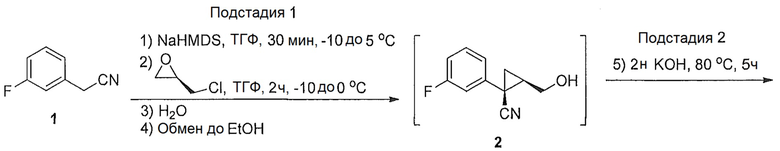

(1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-он (4)
3-фторфенилацетонитрил (1,200 г, 1,48 моль, 1,0 эквив.) растворяют в ТГФ (1500 мл) и охлаждают до -3°C. К полученному раствору по каплям добавляют бис(триметилсилил)амин натрия (2,0M раствор в ТГФ, 1520 мл, 3,04 моль, 2,05 эквив.), поддерживая внутреннюю температуру ниже 7°C. Полученной смеси дают перемешиваться в течение 29 час при 0°C, после чего ее нагревают до комнатной температуры и гасят добавлением воды (85 мл). Полученную смесь концентрируют почти досуха на роторном испарителе и добавляют этанол (1500 мл), затем водный раствор гидроксида калия (2,0М, 1477 мл). Полученную смесь нагревают до 80°C и выдерживают при указанной температуре в течение 5 часов, после чего ее охлаждают до комнатной температуры. Добавляют водный раствор хлористоводородной кислоты (6М, 944 мл) и воду (189 мл). Полученную смесь нагревают до 60°C и выдерживают при указанной температуре в течение 2 часов. Полученную смесь охлаждают до комнатной температуры и добавляют затравочные кристаллы соединения 4 ((1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-он) (1,5 г, 0,005 эквив.). Полученную суспензию выдерживают при перемешивании в течение ночи и затем фильтруют. Осадок на фильтре промывают раствором 2:1 вода/этанол (2×200 мл), затем водой (3×400 мл) до тех пор, пока pH фильтрата не достигает pH=7. Осадок на фильтре сушат в вакууме, продувая азотом, с получением (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она (4, 205,31 г, 70% выход, 91% эи) в виде не совсем белого твердого кристаллического вещества.
(1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-он:
1H ЯМР (500 МГц, ДМСО-d6) δ 7,43-7,36 (м, 1H), 7,35-7,31 (м, 1H), 7,31-7,28 (м, 1H), 7,14-7,08 (м, 1H), 4,46 (дд, J=9,1, 4,6 Гц, 1H), 4,25 (д, J=9,1 Гц, 1H), 2,80 (дт, J=8,0, 4,6 Гц, 1H), 1,72 (дд, J=7,9, 4,8 Гц, 1H), 1,37 (т, J=4,8 Гц, 1H); 13C ЯМР (126 МГц, ДМСО-d6) δ 175,35, 161,98 (д, JCF=243,1 Гц), 137,67 (д, JCF=8,2 Гц), 130,15 (д, JCF=8,6 Гц), 124,19 (д, JCF=2,8 Гц), 115,01 (д, JCF=22,4 Гц), 113,95 (д, JCF=20,9 Гц), 67,93, 30,70 (д, JCF=2,4 Гц), 25,57, 19,99.
HRMS Вычислено для C11H10FO2 [M+H]+ 193,0665; найдено 193,0659.
ВЭЖХ TM-1172 способ мониторинга указанных выше стадий процесса:
ВЭЖХ параметры:
TM-1213: Хиральный ВЭЖХ анализ для соединения 4
Оборудование, реагенты и подвижная фаза:
Параметры ВЭЖХ:
Хроматографические параметры:
Расчеты:
Тесты пригодности системы должны пройти все критерии приемлемости, прежде чем будет разрешен анализ результатов из раздела анализа образцов.
Расчет % энантиомерного избытка:
Расчет % энантиомерного избытка (%-эи) для каждого из препаратов образца 4 с использованием соответствующих площадей пиков, полученных из анализа после введения каждого образца, и следующего уравнения:
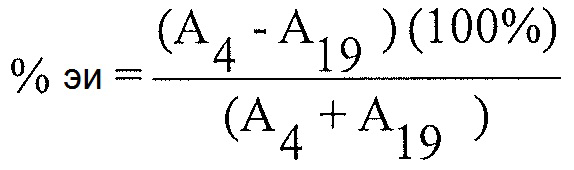
А4 = Площадь пика для соединения 4 для каждой инъекции раствора образца
A19 = Площадь пика для соединения 19 для каждой инъекции раствора образца
Примечание: Соединение 19 представляет собой энантиомер соединения 4.
Энантиомерный избыток рассчитан как 91% для соединения 4.
B. Получение соединений формулы I
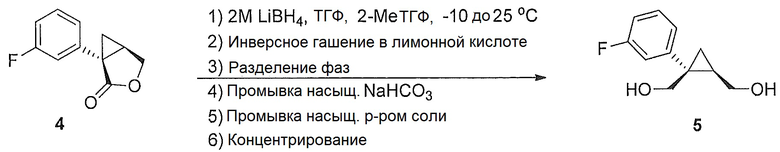
((1S,2R)-1-(3-фторфенил)циклопропан-1,2-диил)диметанол (5)
(1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-он (4, 10,08 г, 0,052 моль, 1,0 эквив.) растворяют в 2-метил-ТГФ (75,60 мл) в атмосфере азота. Полученный раствор охлаждают до (-5)-(-10°C), и к реакционной смеси добавляют 2,0M тетрагидроборат лития в ТГФ (39,34 мл, 0,079 моль, 1,5 эквив.), при этом поддерживая внутреннюю температуру ниже 0°C. Реакционную смесь перемешивают при 20-25°C в течение 14-16 часов и за ходом реакции следят, используя ВЭЖХ и ТСХ (EtOAc/гептан=1/1). После завершения реакции, реакционную смесь охлаждают до 0-5°C и подвергают обратному гашению в предварительно охлажденный (0-5°C) 20% водный раствор лимонной кислоты (50,40 мл, 1,67 эквив.) с такой скоростью, чтобы поддерживать внутреннюю температуру ниже 5°C. После завершения гашения, реакционную смесь нагревают до 20-25°C и перемешивают в течение по меньшей мере 20 мин. Водный слой подвергают один раз обратной экстракции 2-метил-ТГФ (50,40 мл). Органические слои объединяют и промывают один раз насыщенным водным раствором бикарбоната натрия (20,16 мл) и один раз 20% водным NaCl (20,16 мл). Растворитель удаляют при пониженном давлении, затем азеотропно перегоняют с 2-метил-ТГФ до тех пор, пока KF не становится меньше, чем 1500 м.д., с получением указанного в заголовке соединения 5, ((1S,2R)-1-(3-фторфенил)циклопропан-1,2-диил)диметанола; (10,29 г).
((1S,2R)-1-(3-фторфенил)циклопропан-1,2-диил)диметанол:
1H ЯМР (500 МГц, CD3OD) δ 7,28 (тд, J=8,0, 6,2 Гц, 1H), 7,22-7,17 (м, 1H), 7,16-7,09 (м, 1H), 6,96-6,85 (м, 1H), 3,99-3,93 (м, 2H), 3,71 (д, J=12,0 Гц, 1H), 3,56 (дд, J=11,9, 9,5 Гц, 1H), 1,52 (тт, J=9,1, 6,1 Гц, 1H), 1,10 (дд, J=8,7, 5,1 Гц, 1H), 0,85 (т, J=5,5 Гц, 1H); 13C ЯМР (126 МГц, CD3OD) δ 164,10 (д, JCF=243,6 Гц), 148,96 (д, JCF=7,5 Гц), 130,74 (д, JCF=8,4 Гц), 125,61 (д, JCF=2,7 Гц), 116,77 (д, JCF=21,6 Гц), 113,93 (д, JCF=21,3 Гц), 67,16, 63,31, 33,04, 28,09, 17,44.
ВЭЖХ способ мониторинга за стадией B процесса:
Параметры ВЭЖХ
Хроматографические параметры
C. Получение ацетатов формулы III
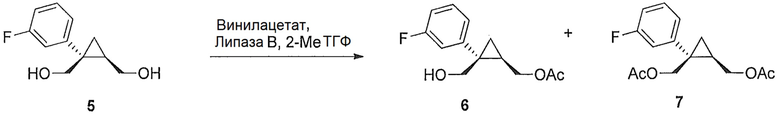
((1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил)метилацетат (6)
((1S,2R)-1-(3-фторфенил)циклопропан-1,2-диил)диметанол (5, 7,89 г, 0,040 моль, 1,0 эквив.) растворяют в 2-метил-ТГФ (23,68 мл) в атмосфере азота. Добавляют липазу на акриловой смоле (Candida Antarctica Lipase B, Sigma-Aldrich, Saint Louis, Missouri) (417,5 мг, 5,0% масс.). Добавляют винилацетат (5,56 мл, 0,060 моль, 1,5 эквив.), и реакционную смесь перемешивают при 20-25°C, контролируя отношение моноацетата и диацетата (8-9 час) по данным ВЭЖХ и ТСХ (EtOAc/гептан-1/1). После завершения реакции, липазу удаляют фильтрованием и промывают 2-метил-ТГФ (71,04 мл). Полученный фильтрат и промывные растворы объединяют и промывают 15% водным раствором NaCl (27,63 мл), затем насыщенным водным раствором NaCl (23,68 мл). Растворитель удаляют при пониженном давлении, затем азеотропно перегоняют с 2-метил-ТГФ до тех пор, пока KF не становится меньше, чем 1500 м.д., с получением указанного в заголовке соединения 6, ((1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил)метилацетата, (9,59 г).
((1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил)метилацетат:
1H ЯМР (500 МГц, CD3OD) δ 7,28 (тт, J=19,4, 9,7 Гц, 1H), 7,18-7,14 (м, 1H), 7,12-7,04 (м, 1H), 6,96-6,87 (м, 1H), 4,36 (дд, J=11,9, 7,2 Гц, 1H), 4,25 (дд, J=11,9, 8,3 Гц, 1H), 3,85 (д, J=11,9 Гц, 1H), 3,77 (д, J=11,9 Гц, 1H), 2,09 (с, 3H), 1,58-1,49 (м, 1H), 1,15 (дд, J=8,8, 5,1 Гц, 1H), 0,95-0,90 (м, 1H); 13C ЯМР (126 МГц, CD3OD) δ 173,03, 164,10 (д, JCF=243,8 Гц), 148,31 (д, JCF=7,4 Гц), 130,86 (д, JCF=8,4 Гц), 125,78 (д, JCF=2,8 Гц), 116,90 (д, JCF=21,4 Гц), 114,16 (д, JCF=21,3 Гц), 66,46, 65,77, 33,39, 24,73, 20,92, 16,79.
ВЭЖХ способ мониторинга стадии В процесса:
Оборудование, реагенты и подвижная фаза:
Параметры ВЭЖХ
D. Получение соединений формулы IV

((1R,2S)-2-(3-фторфенил)-2-((тозилокси)метил)циклопропил)метилацетат (8)
((1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил)метилацетат (6, 9,59 г, 0,040 моль, 1,0 эквив.) растворяют в 2-метил-ТГФ (95,9 мл) в атмосфере азота. Полученный раствор охлаждают до 10-15°C, и к реакционной смеси добавляют пиридин (11,4 мл, 0,141 моль, 3,5 эквив.), поддерживая при этом внутреннюю температуру ниже 15°C. К реакционной смеси порциями добавляют твердый ангидрид пара-толуолсульфоновой кислоты (15,76 г, 0,048 моль, 1,2 эквив.), поддерживая при этом внутреннюю температуру ниже 15°C. Реакционную смесь перемешивают при 10-15°C в течение по меньшей мере 1 часа, осуществляя при этом контроль по данным ВЭЖХ и ТСХ (EtOAc/гептан=1/1). После завершения реакции, реакционную смесь гасят водой (38,4 мл), поддерживая при этом внутреннюю температуру ниже 25°C. Органический слой дважды промывают 1н. HCl (38,0 мл каждая промывка) до pH 1-2 (вторая водная промывка), и затем промывают насыщенным водным раствором NaHCO3 (33,6 мл) до pH ≥7, затем насыщенным водным раствором NaCl (23,98 мл). Органический слой выделяют и концентрируют при пониженном давлении приблизительно до 24,0 мл. Медленно добавляют н-гептан (86,3 мл) при перемешивании. Полученную суспензию перемешивают в течение по меньшей мере 30 мин при 20-22°C и затем перемешивают в течение по меньшей мере 1 часа при 0-5°C. Полученную суспензию фильтруют, и осадок на фильтре промывают по меньшей мере два раза н-гептаном (14,4 мл используют для каждой промывки). Осадок на фильтре сушат в атмосфере азота и/или в вакууме, с получением указанного в заголовке соединения ((1R,2S)-2-(3-фторфенил)-2-((тозилокси)метил)циклопропил)метилацетата (8, 11,05 г, 89,3% эи) в виде не совсем белого до желто-коричневого твердого вещества.
((1R,2S)-2-(3-фторфенил)-2-((тозилокси)метил)циклопропил)метилацетат:
1H ЯМР (500 МГц, CD3OD) δ 7,55 (д, J=8,3 Гц, 2H), 7,32-7,27 (м, 2H), 7,23 (тд, J=8,0, 6,1 Гц, 1H), 7,02 (дд, J=7,7, 0,9 Гц, 1H), 6,95-6,90 (м, 1H), 6,90-6,84 (м, 1H), 4,36 (д, J=10,9 Гц, 1H), 4,32 (дд, J=12,1, 6,3 Гц, 1H), 4,17 (д, J=10,9 Гц, 1H), 4,08 (дд, J=12,1, 9,1 Гц, 1H), 2,42 (с, 3H), 2,09 (с, 3H), 1,68 (тт, J=9,0, 6,3 Гц, 1H), 1,19 (дд, J=8,9, 5,5 Гц, 1H), 1,00 (т, J=5,8 Гц, 1H); 13C ЯМР (126 МГц, CD3OD) δ 171,38, 162,58 (д, JCF=244,6 Гц), 144,92, 144,51 (д, JCF=7,4 Гц), 132,52, 129,73 (д, JCF=8,5 Гц), 129,51, 127,36, 124,50 (д, JCF=2,9 Гц), 115,47 (д, JCF=21,8 Гц), 113,45 (д, JCF=21,3 Гц), 74,17, 63,50, 28,94, 23,49, 20,11, 19,49, 15,67.
HRMS Вычислено для C20H21FO5SNa [M+Na]+ 415,0991; найдено 415,0973.
ВЭЖХ способ мониторинга стадии D процесса:
ВЭЖХ параметры:
Анализ соединения 8 с помощью хиральной ВЭЖХ
TM-1257: Хиральная ВЭЖХ, анализ соединения 8
Оборудование, реагенты и подвижная фаза:
Параметры ВЭЖХ:
Хроматографические параметры:
Расчеты:
Расчет энантиомерного избытка в %:
Рассчитывают % энантиомерного избытка (%-эи) для соединения 8, используя площади соответствующих пиков, полученные из анализов каждого из образцов, и следующее уравнение:
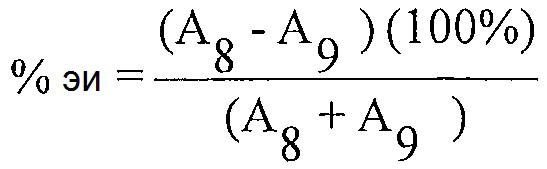
A8 = Средняя площадь пика соединения 8 для каждого раствора образца
A9 = Средняя площадь пика соединения 8 для каждого раствора образца
Примечание: Соединение 9 представляет собой энантиомер соединения 8.
Энантиомерный избыток рассчитан как 89,3% для соединения 8.
E. Получение соединения формулы V
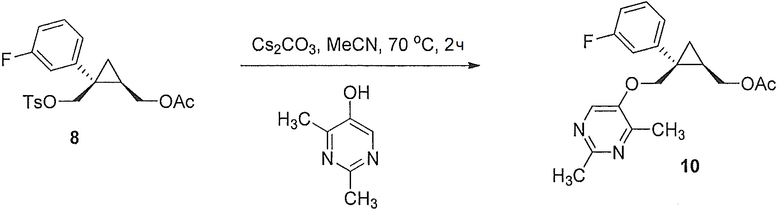
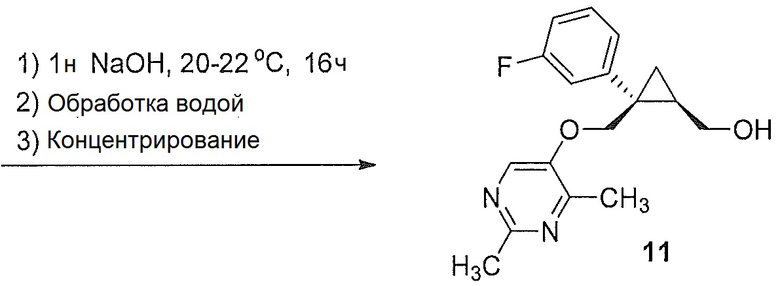
((1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропил)метанол (11)
((1R,2S)-2-(3-фторфенил)-2-((тозилокси)метил)циклопропил)метилацетат (8, 11,05 г, 0,028 моль, 1,0 эквив.), 2,4-диметилпиримидин-5-ол (3,74 г, 0,030 моль, 1,07 эквив.) и карбонат цезия (22,94 г, 1,8 эквив.) растворяют в ACN (110,5 мл) в атмосфере азота. Полученный раствор интенсивно перемешивают и нагревают до 65-70°C в течение 2-3 часов. Реакцию отслеживают по данным ВЭЖХ и ТСХ (EtOAc/гептан=1/1). После завершения к реакционному раствору добавляют водный 1н. раствор NaOH (71,82 мл). Реакционную смесь перемешивают при температуре 20-25°C в течение 10-16 часов, и реакцию отслеживают по данным ВЭЖХ и ТСХ (EtOAc/гептан=1/1). После завершения реакции гидролиза реакционную смесь разбавляют MTBE (110,50 мл) и перемешивают в течение по меньшей мере 15 мин. Водный слой подвергают обратной экстракции MTBE (55,25 мл). Органические слои объединяют и промывают один раз водным раствором NaCl (33,15 мл). Растворитель удаляют при пониженном давлении, с получением указанного в заголовке соединения; ((1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропил)метанол: (11, 8,51 г).
((1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропил)метанол:
1H ЯМР (500 МГц, ДМСО-d6) δ 8,21 (с, 1H), 7,33 (тд, J=8,0, 6,5 Гц, 1H), 7,20 (д, J=7,9 Гц, 1H), 7,19-7,14 (м, 1H), 7,01 (ддд, J=8,3, 2,6, 1,2 Гц, 1H), 4,63 (т, J=5,4 Гц, 1H), 4,36 (дд, J=22,5, 10,5 Гц, 2H), 3,72-3,61 (м, 2H), 2,45 (с, 3H), 2,22 (с, 3H), 1,51-1,43 (м, 1H), 1,23 (дд, J=8,9, 5,0 Гц, 1H), 1,01 (дд, J=6,0, 5,3 Гц, 1H). 13C ЯМР (126 МГц, ДМСО-d6) δ 162,48 (д, JCF=243,0 Гц), 158,91, 156,26, 149,51, 147,47 (д, JCF=7,5 Гц), 139,85, 130,35 (д, JCF=8,5 Гц), 124,72 (д, JCF=2,5 Гц), 115,54 (д, JCF=21,3 Гц), 113,43 (д, JCF=20,9 Гц), 72,73, 60,70, 29,23, 28,64, 24,94, 18,77, 17,06.
HRMS Вычислено для C17H20FN2O2 [M+H]+ 303,1590; найдено 303,1517.
ВЭЖХ способ мониторинга стадии Е процесса:
Получение образца:
Объединяют реакционную смесь (5 мкл) с 1 мл ацетонитрила, перемешивают и инъецируют.
Суммирование хроматографических условий:
F. Получение соединений формулы VII
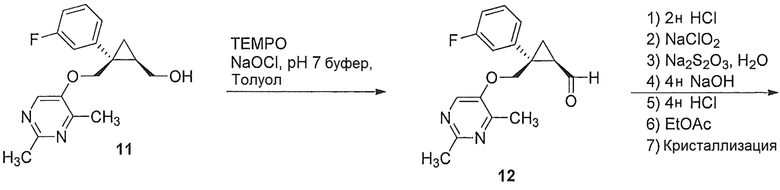
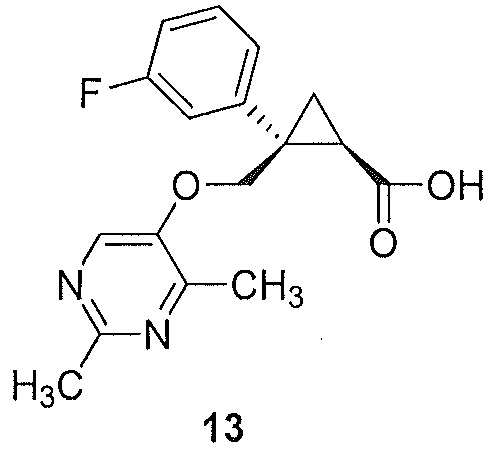
(1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропанкарбоновая кислота (13)
((1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропил)метанол (11, 87,5 г, 290 ммоль, 1,0 эквив.) растворяют в толуоле (390 мл). К полученной смеси добавляют pH 7 буфер (107 г, полученный из 4,46 г двухосновного фосфата натрия и 7,79 г одноосновного фосфата натрия в 94,4 мл воды) и 2,2,6,6-тетраметилпиперидин-1-оксил (TEMPO) (0,93 г, 5,9 ммоль, 0,02 эквив.). Полученную смесь охлаждают до 0°C и по каплям добавляют раствор гипохлорита натрия (5% активного хлора, 383 мл, 304 ммоль, 1,05 эквив.), поддерживая внутреннюю температуру ниже 9°C. Полученную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 2 часов. К полученной смеси добавляют водный раствор хлористоводородной кислоты (2,0М, 8,73 мл, 0,05 эквив.), затем раствор хлорита натрия (36,0 г, 318 ммоль, 1,1 эквив.) в воде (87 мл), поддерживая внутреннюю температуру ниже 26°C. Полученную смесь перемешивают при комнатной температуре в течение 4 часов и затем охлаждают до 10°C. Добавляют раствор тиосульфата натрия (92 г, 579 ммоль, 2,0 эквив.) в воде (177 мл), поддерживая внутреннюю температуру ниже 20°C. Полученную смесь перемешивают в течение 20 мин, и затем добавляют водный раствор гидроксида натрия (4н., 87 мл, 348 ммоль, 1,2 эквив.) для доведения pH примерно до 13. Полученную смесь нагревают до 80°C в течение 4 часов, затем охлаждают до комнатной температуры. Перемешивание прекращают и фазам дают возможность разделиться. Нижнюю водную фазу собирают, и верхнюю органическую фазу промывают один раз 4н. раствором гидроксида натрия (17 мл). Объединенные водные фазы подкисляют водным раствором хлористоводородной кислоты (4н., 17 мл) до pH=4 и экстрагируют этилацетатом (2×470 мл). Объединенные органические фазы промывают примерно 20% водным раствором NaCl (175 мл). Органические фазы концентрируют на роторном испарителе с получением 96,84 г неочищенного масла. Порцию (74 г) указанного неочищенного масла растворяют в ацетонитриле (400 мл) и концентрируют досуха на роторном испарителе. Добавляют другую порцию ацетонитрила (400 мл), и полученную смесь снова концентрируют досуха. К остатку добавляют ацетонитрил (370 мл). Полученную смесь нагревают до 65°C, с получением прозрачного раствора. Полученную смесь охлаждают до комнатной температуры, затем до 0°C и выдерживают при указанной температуре в течение 6 часов. Полученную смесь фильтруют, и влажный осадок на фильтре промывают ацетонитрилом (2×74 мл). Осадок на фильтре сушат в вакууме, продувая азотом, затем в вакуумном термостате при 20 мм рт ст и 40°C, с получением (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропанкарбоновой кислоты (13, 56,9 г, 80% выход) в виде не совсем белого твердого кристаллического вещества.
(1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропанкарбоновая кислота:
1H ЯМР (500 МГц, ДМСО-d6) δ 12,47 (с, 1H), 8,17 (с, 1H), 7,39 (тд, J=8,0, 6,4 Гц, 1H), 7,29 (д, J=7,9 Гц, 1H), 7,27-7,22 (м, 1H), 7,10 (тд, J=8,3, 2,1 Гц, 1H), 4,63 (д, J=10,2 Гц, 1H), 4,30 (д, J=10,2 Гц, 1H), 2,46 (с, 3H), 2,26 (с, 3H), 2,13 (дд, J=7,7, 6,6 Гц, 1H), 1,63-1,54 (м, 2H); 13C ЯМР (126 МГц, ДМСО-d6) δ 172,65, 162,48 (д, JCF=243,6 Гц), 159,08, 156,24, 149,45, 145,15 (д, JCF=7,5 Гц), 139,60, 130,71 (д, JCF=8,5 Гц), 124,79 (д, JCF=2,6 Гц), 115,60 (д, JCF=21,8 Гц), 114,32 (д, JCF=20,8 Гц), 71,15, 33,92 (д, JCF=2,0 Гц), 26,46, 24,96, 19,72, 18,70.
HRMS Вычислено для C17H18FN2O3 [M+H]+ 317,1301; найдено 317,1298.
Получение образца:
Переносят 10 мкл реакционной смеси в ВЭЖХ ампулу, содержащую 1 мл разбавляющего раствора, и перемешивают вращением. Переносят 100 мкл указанного раствора в ВЭЖХ ампулу, содержащую 1 мл разбавляющего раствора, и перемешивают вращением. Получают раствор образца.
Суммирование хроматографических условий:
G. Получение соединений формулы IX
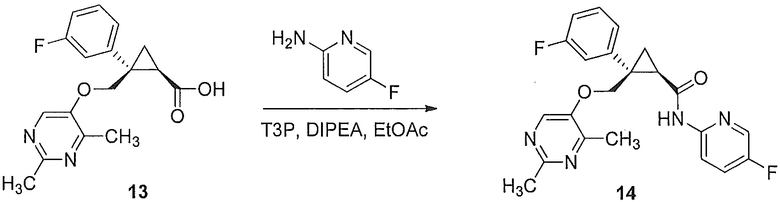
(1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(S-фторпиридин-2-ил)циклопропанкарбоксамид (14)
(1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропанкарбоновую кислоту (13, 12,80 г, 0,040 моль, 1,0 эквив.) и 2-амино-5-фторпиридин (4,76 г, 0,0425 моль, 1,05 эквив.) растворяют в этилацетате (102,4 мл) в атмосфере азота. Полученный раствор охлаждают до 0-5°C, и к реакционной смеси добавляют N,N-диизопропилэтиламин (14,10 мл, 0,081 моль, 2,0 эквив.), при этом поддерживая внутреннюю температуру при 0-15°C. Реакционную смесь перемешивают при 0-10°C в течение 20-30 минут. К реакционной смеси добавляют н-пропилфосфоновый ангидрид (T3P; 50% масс/масс раствор в этилацетате, 36,1 г, 1,4 эквив.), при этом поддерживая внутреннюю температуру при 0-15°C. Реакционную смесь перемешивают при 20-25°C в течение по меньшей мере 20-24 часов, и ход реакции отслеживают по данным ВЭЖХ и ТСХ (EtOAc/гептан=1/1). После завершения реакции, реакционную смесь охлаждают до 0-5°C и затем гасят водой (64,0 мл), при этом поддерживая внутреннюю температуру ниже 10-15°C. Водный слой подвергают обратной экстракции MTBE (76,8 мл). Органические слои объединяют и промывают один раз насыщенным водным раствором NaHCO3 (38,4 мл) и один раз водой (38,4 мл). Органический слой осветляют фильтрованием, и фильтр промывают MTBE (12,8 мл). Затем органический слой концентрируют при пониженном давлении до минимального перемешиваемого объема. К реакционной смеси добавляют этилацетат (60,8 мл), и полученную смесь нагревают не более чем до 50°C, с получением прозрачного раствора. Медленно добавляют н-гептан (86,3 мл) при перемешивании. Реакционную смесь охлаждают до 20-25°C, и полученную суспензию перемешивают в течение по меньшей мере 1 часа при 20-25°C, и затем перемешивают по меньшей мере в течение 1 часа при 0-5°C. Суспензию фильтруют и осадок на фильтре дважды промывают смесью 5:1 гептан/этилацетат (2×12,8 мл). Осадок на фильтре сушат в атмосфере азота и/или в вакууме, с получением указанного в заголовке соединения, (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида, (14, 12,54 г, >99% эи) в виде не совсем белого твердого вещества.
(1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид:
1H ЯМР (500 МГц, ДМСО-d6) δ 11,19 (с, 1H), 8,31 (д, J=3,0 Гц, 1H), 8,12 (с, 1H), 7,94-7,85 (м, 1H), 7,62 (тт, J=8,7, 3,1 Гц, 1H), 7,44 (дд, J=10,6, 1,5 Гц, 1H), 7,41-7,40 (м, 1H), 7,39 (с, 1H), 7,14-7,06 (м, 1H), 4,67 (д, J=10,2 Гц, 1H), 4,29 (т, J=9,9 Гц, 1H), 2,63 (т, J=7,0 Гц, 1H), 2,38 (с, 3H), 2,03 (с, 3H), 1,76-1,64 (м, 1H), 1,49 (дд, J=8,0, 4,8 Гц, 1H); 13C ЯМР (125 МГц, ДМСО-d6) δ 168,68, 161,98 (д, JCF=242,3 Гц), 158,46, 155,15, 155,38 (д, JCF=247,9 Гц), 148,90, 148,51, 145,00 (д, JCF=7,7 Гц), 139,37, 135,15 (д, JCF=24,9 Гц), 130,06 (д, JCF=8,4 Гц), 125,05 (д, JCF=19,5 Гц), 124,70 (д, JCF=2,6 Гц), 115,71 (д, JCF=21,7 Гц), 114,20 (д, JCF=4,1 Гц), 113,70 (д, JCF=20,9 Гц), 70,80, 34,09 (д, JCF=1,9 Гц), 26,90, 24,38, 18,37, 17,78.
HRMS Вычислено для C22H21F2N4O2 [M+H]+ 411,1627; найдено 411,1632.
Получение образца:
Переносят 500 мкл реакционной смеси в ВЭЖХ ампулу, содержащую 500 мкл ацетонитрила, и перемешивают вращением.
Суммирование хроматографических условий:
Хиральный ВЭЖХ анализ для (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (14)
TM-1186: Хиральный ВЭЖХ анализ для соединения 14
Оборудование, реагенты и подвижная фаза:
Параметры ВЭЖХ:
Хроматографические параметры:
Расчеты:
Расчет энантиомерного избытка %:
Рассчитывают % энантиомерного избытка (%-эи) для соединения 14, используя площади соответствующих пиков, полученные из анализов каждого образца, и следующее уравнение:
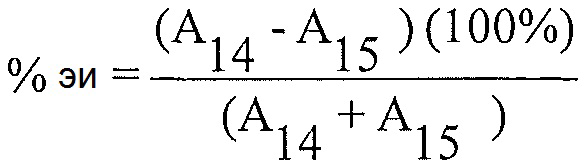
A14 = Средняя площадь пика соединения 14 для каждого раствора образца
A15 = Средняя площадь пика соединения 15 для каждого раствора образца
Примечание: Энантиомер соединения 14 представляет собой соединение 15.
Энантиомерный избыток рассчитан как >99% для соединения 14.
Альтернативный способ получения соединений формулы IX
(1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (14)
(1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропанкарбоновую кислоту (13, 12,80 г, 0,040 моль, 1,0 эквив.), 2-амино-5-фторпиридин (4,76 г, 0,0425 моль, 1,05 эквив.) и гексафторфосфат Ν,Ν,Νʹ,Νʹ-тетраметил-O-(7-азабензотриазол-1-ил)урония (HATU; 16,16 г, 0,0425 моль, 1,05 эквив.) растворяют в ДМФ (64,0 мл), в атмосфере азота. Полученный раствор охлаждают до 0-5°C, и к реакционной смеси добавляют N,N-диизопропилэтиламин (14,10 мл, 0,081 моль, 2,0 эквив.), при этом поддерживая внутреннюю температуру ниже 10°C. Реакционную смесь перемешивают при 20-25°C в течение по меньшей мере 20-24 часов и отслеживают, используя данные ВЭЖХ и ТСХ (EtOAc/гептан=1/1). Если (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропанкарбоновая кислота составляет >2%, добавляют дополнительно гексафторфосфат Ν,Ν,Νʹ,Νʹ-тетраметил-O-(7-азабензотриазол-1-ил)урония (в расчете на конверсию) при 20-25°C, и затем к реакционной смеси добавляют N,N-диизопропилэтиламин (в расчете на конверсию), при этом поддерживая внутреннюю температуру ниже 10°C. Если (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропанкарбоновая кислота составляет <2%, но конверсия в указанное в заголовке соединение составляет <97%, к реакционной смеси добавляют дополнительно 2-амино-5-фторпиридин (в расчете на конверсию) при температуре 20-25°C. После завершения реакции, реакционную смесь разбавляют MTBE (51,2 мл) и охлаждают до 0-5°C. Реакцию гасят водой (64,0 мл), при этом поддерживая внутреннюю температуру ниже 10-15°C. Реакционную смесь нагревают вплоть до 20-25°C, и добавляют MTBE (76,8 мл). Водный слой подвергают обратной экстракции один раз MTBE (128,0 мл) и один раз толуолом (102,4 мл). Органические слои объединяют и промывают один раз насыщенным водным раствором NaHCO3 (38,4 мл) и 18% водным раствором NaCl (2×32,0 мл). Анализируют HATU побочный продукт в органическом слое: если он составляет >0,2%, необходимы дополнительные промывки 18% водным раствором NaCl. Органический слой тщательно фильтруют, и фильтр промывают MTBE (12,8 мл). Затем его концентрируют при пониженном давлении до минимального перемешиваемого объема. Остаточный толуол в остатке составляет <10%. К реакционной смеси добавляют этилацетат (60,8 мл), и полученную смесь нагревают не более чем до 50°C, с получением прозрачного раствора. Полученный раствор охлаждают до 20-25°C, и медленно при перемешивании добавляют н-гептан (86,3 мл). Полученную суспензию перемешивают в течение по меньшей мере 30 мин при 20-25°C и затем перемешивают по меньшей мере в течение 1 часа при 0-5°C. Суспензию фильтруют, и осадок на фильтре промывают смесью 5:1 гептан/этилацетат (2×12,8 мл). Осадок на фильтре сушат в атмосфере азота и/или в вакууме, с получением указанного в заголовке соединения, (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида, (14, 11,65 г) в виде белого или не совсем белого твердого вещества.
(1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид:
1H ЯМР (500 МГц, ДМСО-d6) δ 11,19 (с, 1H), 8,31 (д, J=3,0 Гц, 1H), 8,12 (с, 1H), 7,94-7,85 (м, 1H), 7,62 (тт, J=8,7, 3,1 Гц, 1H), 7,44 (дд, J=10,6, 1,5 Гц, 1H), 7,41-7,40 (м, 1H), 7,39 (с, 1H), 7,14-7,06 (м, 1H), 4,67 (д, J=10,2 Гц, 1H), 4,29 (т, J=9,9 Гц, 1H), 2,63 (т, J=7,0 Гц, 1H), 2,38 (с, 3H), 2,03 (с, 3H), 1,76-1,64 (м, 1H), 1,49 (дд, J=8,0, 4,8 Гц, 1H); 13C ЯМР (125 МГц, ДМСО-d6) δ 168,68, 161,98 (д, JCF=242,3 Гц), 158,46, 155,15, 155,38 (д, JCF=247,9 Гц), 148,90, 148,51, 145,00 (д, JCF=7,7 Гц), 139,37, 135,15 (д, JCF=24,9 Гц), 130,06 (д, JCF=8,4 Гц), 125,05 (д, JCF=19,5 Гц), 124,70 (д, JCF=2,6 Гц), 115,71 (д, JCF=21,7 Гц), 114,20 (д, JCF=4,1 Гц), 113,70 (д, JCF=20,9 Гц), 70,80, 34,09 (д, JCF=1,9 Гц), 26,90, 24,38, 18,37, 17,78.
HRMS Вычислено для C22H21F2N4O2 [M+H]+ 411,1627; найдено 411,1632.
H. Получение соединений формулы VI
5-метокси-2,6-диметилпиримиди-1-нийхлорид (17)
2,4-дихлор-5-метоксипиримидин (16, 400 г, 2,23 моль, 1,0 эквив) растворяют в 2-метилтетрагидрофуране (4,0 л). К полученной смеси добавляют триметилалюминий (2,0M в гептане, 2200 мл, 2,0 эквив.), поддерживая при этом внутреннюю температуру ниже 35°C. Добавляют тетракис(трифенилфосфин)палладий(0) (25,8 г, 0,022 моль, 0,01 эквив.), и полученную смесь нагревают до 80°C. Полученную смесь перемешивают в течение 24 час при 80°C, охлаждают до комнатной температуры и медленно добавляют к холодному (5-10°C) водному раствору гидроксида натрия (6н., 4,0 л), поддерживая при этом внутреннюю температуру погашенного раствора ниже 15°C (Осторожно: происходит выделение газа метана). Полученную смесь нагревают до комнатной температуры и выдерживают при перемешивании в течение 30 мин, после чего перемешивание прекращают и фазам дают разделиться. Фазы разделяют. Верхнюю органическую фазу фильтруют через предварительно набитую древесным углем колонку (200 г), используя дополнительно 2-метилтетрагидрофуран (1,0 л). Полученный раствор концентрируют до 2/3 объема. Полученную смесь разбавляют свежим 2-метилтетрагидрофураном (4,0 л) и затем концентрируют в вакууме до тех пор, пока не собирают 4,0 л дистиллята. К оставшемуся раствору медленно добавляют раствор хлористого водорода в изопропиловом спирте (5М, 670 мл, 3,35 моль, 1,5 эквив.), в результате чего образуется кристаллический осадок. Полученную суспензию перемешивают в течение 1 часа и фильтруют. Влажный осадок на фильтре промывают 2-метилтетрагидрофураном (800 мл) и затем сушат в вакууме при продувании азотом, с получением 5-метокси-2,6-диметилпиримиди-1-нийхлорида (17, 279 г, 70% выход) в виде бледно-желтого твердого вещества.
5-Метокси-2,6-диметилпиримиди-1-нийхлорид:
1H ЯМР (500 МГц, ДМСО-d6) δ 8,60 (с, 1H), 3,97 (с, 3H), 2,68 (с, 3H), 2,49 (с, 3H); I3C ЯМР (126 МГц, ДМСО-d6) δ 160,14, 155,22, 150,35, 134,89, 57,02, 21,80, 18,46.
HRMS Вычислено для C7H11N2O [M+H] 139,0871; найдено 139,0874.

5-метокси-2,6-диметилпиримиди-1-нийхлорид (17)
В трехгорлую круглодонную колбу, снабженную механической мешалкой, дополнительной воронкой, температурным датчиком и отверстием для впуска N2, последовательно загружают 2-MeTHF (330 мл, 10,5 об., содержание воды: <300 ч./млн.), 2,4-дихлор-5-метоксипиримидин (16, 30,0 г, 0,164 моль) (FWD Chem, Shanghai, China или Amfinecom, Inc., St. Petersburg, VA) и NiCl2(dppp) (1,4 г, 2,6 ммоль, 1,6% моль). Полученную смесь дегазируют, откачивая при пониженном давлении, и затем продувают азотом (3 раза при комнатной температуре). Полученную смесь охлаждают до 15°C, и добавляют раствор 3M метилмагнийхлорида в ТГФ (125 мл, 2,25 эквив.) через капельную воронку, поддерживая внутреннюю температуру 15-25°C в течение 1,5 часа (Примечание: вначале 6 мл MeMgCl медленно добавляют при 15-20°C, и выдерживают в течение 15 мин для активации катализатора). Капельную воронку промывают 2-MeTHF (15 мл). После добавления MeMgCl, реакционную смесь нагревают до комнатной температуры в течение 1 часа, используя водяную баню. Реакционную смесь перемешивают в течение 13 час при комнатной температуре с охлаждением на водяной бане (В это время, по данным ВЭЖХ реакция завершается. Магниевая соль осаждается в виде золотисто-желтой взвеси). Полученную суспензию переносят в предварительно охлажденный (10°C) 15% водный раствор лимонной кислоты (300 мл) через канюлю, с такой скоростью, чтобы поддерживать температуру ниже 30°C, и двухфазную смесь интенсивно перемешивают в течение 15 мин. Реакционную колбу промывают 2-MeTHF (60 мл). После перемешивания в течение 15 мин, добавляют гидроксид аммония (28%, 150 мл), поддерживая температуру ниже 30°C (pH водного слоя: ~10). Двухфазную смесь перемешивают в течение дополнительно 15 мин. В это время добавляют хлорид натрия (83 г) и дают раствориться (~20 мин). После разделения фаз, водный слой подвергают обратной экстракции 2-MeTHF (300 мл). После отсечения фазы, органические слои объединяют, концентрируют и азеотропно сушат (ниже 40°C), используя быструю промывку 2-MeTHF (300 мл). Выпавшую в осадок неорганическую соль отфильтровывают, фильтруют через ин-лайн CUNO-фильтр, и промывают 120 мл 2-MeTHF. Промывной раствор объединяют с начальным фильтратом.
Образование соли и выделение: Неочищенный пиримидин в 2-MeTHF (полный объем 270 мл) обрабатывают 5н. HCl в 2-изопропаноле (33 мл, 0,165 моль) при 10°C. Суспензию охлаждают приблизительно до (-10)-(-15°C) в течение 30 мин и дополнительно выдерживают в течение 30 мин при указанной температуре. Полученную суспензию фильтруют и промывают предварительно охлажденным 2-MeTHF (45 мл, -15°C). Влажный осадок на фильтре сушат в вакууме, продувая азотом, в течение ночи, с получением 22,2 г (77,4%) соли HCl 2,4-диметил-5-метоксипиримидина, 17, в виде желто-оранжевого твердого кристаллического вещества.
5-метокси-2,6-диметилпиримиди-1-нийхлорид:
1H ЯМР (500 МГц, ДМСО-d6) δ 8,60 (с, 1H), 3,97 (с, 3H), 2,68 (с, 3H), 2,49 (с, 3H); 13C ЯМР (126 МГц, ДМСО-d6) δ 160,14, 155,22, 150,35, 134,89, 57,02, 21,80, 18,46.
HRMS Вычислено для C7H11N2O [M+H]+ 139,0871; найдено 139,0874.

2,4-диметилпиримидин-5-ол (18)
1-бутанол (158 мл) добавляют в реакционную колбу, которая снабжена механической мешалкой, температурным датчиком, отверстием для впуска азота и оборудованием для дистилляции. Растворитель охлаждают до 10-15°C и 3 порциями загружают трет-бутоксид калия (33,7 г, 0,3 моль), поддерживая внутреннюю температуру ниже 40°C. К полученной суспензии добавляют 1-додекантиол (43,2 мл, 0,18 моль) и перемешивают при 20-25°C в течение 30 мин. К суспензии добавляют 1-додекантиол (43,2 мл, 0,18 моль), и полученную смесь дополнительно перемешивают при комнатной температуре в течение 30 мин. Затем 3 порциями добавляют 5-метокси-2,6-диметилпиримиди-1-нийхлорид, 17, (21 г, 0,12 моль) при интенсивном перемешивании, и впуск промывают 1-бутанолом (10 мл). Реакционную колбу дегазируют, используя вакуум и продувая азотом (3×) и затем поддерживают в атмосфере азота. Реакционную смесь нагревают до 117-120°C, и собирают летучий трет-бутанол (~30 мл). Затем реакционную смесь выдерживают при температуре кипения с обратным холодильником (120-125°C) в течение 20 часов (преобразование составляет 99,5%). Реакционную смесь охлаждают до 10-15°C, и добавляют 6н. HCl (90 мл) при 10-15°C. Добавляют деионизированную воду (63 мл), и реакционную смесь выдерживают 20 мин при комнатной температуре. Добавляют гептан (126 мл), перемешивают в течение 15 мин и оставляют расслаиваться в течение 15 мин. Продукт, содержащий нижний водный слой, сливают в подходящую емкость. Верхний органический слой экстрагируют объединенным раствором воды (84 мл), 6н. HCl (21 мл) и MeOH (42 мл). Органический слой подвергают обратной экстракции водой (42 мл). Водные слои объединяют и охлаждают до 10-15°C. pH водного слоя доводят до 6,8-7,2 50% гидроксидом натрия (26 мл). Добавляют хлорид натрия (37,8 г), и реакционную смесь перемешивают в течение 30 мин. Загружают 2-MeTHF (140 мл), перемешивают в течение 15 мин и оставляют расслаиваться. Водный слой дважды подвергают обратной экстракции 2-MeTHF (140 мл), с регулированием pH водного слоя после каждой экстракции (0,5 мл 6н. HC1, желательный pH водного слоя составляет 6,8~7,2). Примечание: pH водного слоя слегка повышается после каждой экстракции, и требуется соответствующая поправка (0,25 мл 6н. HC1). Органические слои объединяют и концентрируют при пониженном давлении до минимального перемешиваемого объема, поддерживая внутреннюю температуру ниже 40°C. Концентрированный раствор сушат азеотропно, используя 2-MeTHF (3×65 мл), и затем загружают 2-MeTHF для доведения конечного объема растворителя до 100 мл (все продукты на стенках реактора должны раствориться). Нерастворимый неорганический материал отфильтровывают, используя воронку из спекшегося стекла. Реактор и приемник фильтра промывают 2-MeTHF (40 мл). Полученный фильтрат концентрируют при пониженном давлении, поддерживая внутреннюю температуру ниже 40°C, до примерно 60 мл от полного объема загрузки. Затем реакционную смесь промывают гептаном (4×80 мл), и конечный объем загрузки доводят до полного объема 65 мл. Затем суспензионную смесь охлаждают до 0-5°C в течение 30 мин и выдерживают в течение 1 часа при указанной температуре. Полученную суспензию фильтруют, и влажный осадок на фильтре промывают предварительно охлажденным (0-5°C) гептаном (63 мл). Влажный осадок на фильтре сушат в вакууме, продувая азотом при комнатной температуре в течение 24 час, с получением 11,6 г 2,4-диметилпиримидин-5-ола, (18, 78-85% выход).
2,4-диметилпиримидин-5-ол:
1H ЯМР (500 МГц, ДМСО-d6) δ 9,88 (с, 1H), 8,05 (с, 1H), 2,43 (с, 1H), 2,28 (с, 1H); 13C ЯМР (126 МГц, ДМСО-d6) δ 157,24, 153,71, 147,60, 141,80, 24,39, 18,33.
HRMS Вычислено для C6H9N2O [M+H]+ 125,0715; найдено 125,0720.

Альтернативный способ получения 2,4-диметилпиримидин-5-ола (18)
В 22-литровую круглодонную колбу загружают трет-бутоксид калия (1200 г, 11 моль, 3,5 эквив.) и 1-бутанол (2700 мл). Полученную смесь перемешивают в течение 40 мин, и затем добавляют 1-декантиол (1300 мл, 6,1 моль, 2,0 эквив.). К полученной суспензии порциями добавляют 5-метокси-2,6-диметилпиримиди-1-нийхлорид (17, 532 г, 3,05 моль, 1,0 эквив.), используя минимальное количество 1-бутанола для смывки при необходимости. Полученную смесь нагревают до 105-110°C и перемешивают в течение 24 часов при указанной температуре. Полученную смесь охлаждают до комнатной температуры и медленно добавляют водный раствор хлористоводородной кислоты (6н., 2000 мл), поддерживая внутреннюю температуру ниже 35°C. Добавляют гептан (2700 мл), и полученную смесь перемешивают в течение 10 мин. Перемешивание прекращают, и фазы разделяются. Верхнюю органическую фазу подвергают обратной промывке дополнительным количеством 6н. раствора HCl (1000 мл). Водные фазы объединяют и нейтрализуют добавлением водного раствора гидроксида натрия (50% масс/масс, 789 мл) до pH=7-8, затем экстрагируют 2-метилтетрагидрофураном (2×3000 мл). 2-метилтетрагидрофуран удаляют вакуумной перегонкой и заменяют гептаном (3000 мл). Полученную смесь концентрируют почти досуха и добавляют гептан (1300 мл). Полученную суспензию фильтруют, и влажный осадок на фильтре промывают гептаном (3×400 мл). Осадок на фильтре сушат в вакууме, продувая азотом, с получением 2,4-диметилпиримидин-5-ола (18, 281 г, 74% выход) в виде не совсем белого твердого вещества.
2,4-диметилпиримидин-5-ол:
1H ЯМР (500 МГц, ДМСО-d6) δ 9,88 (с, 1H), 8,05 (с, 1H), 2,43 (с, 3H), 2,28 (с, 3H); 13C ЯМР (126 МГц, ДМСО-d6) δ 157,24, 153,71, 147,60, 141,80, 24,39, 18,33.
HRMS Вычислено для C6H9N2O [M+H]+ 125,0715; найдено 125,0720.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ХИНОЛИНОВЫЕ СОЕДИНЕНИЯ | 2018 |
|
RU2810113C2 |
| СОЕДИНЕНИЯ ТИЕНОПИРИДИНОНА | 2019 |
|
RU2827549C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2654857C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИДИНОНА | 2018 |
|
RU2806751C2 |
| ПРОЛЕКАРСТВА ЛЕВОДОПА, КОМПОЗИЦИИ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЯ | 2005 |
|
RU2365580C2 |
| 11,13-МОДИФИЦИРОВАННЫЕ САКСИТОКСИНЫ ДЛЯ ЛЕЧЕНИЯ БОЛИ | 2018 |
|
RU2778455C2 |
| ПРОИЗВОДНЫЕ 1,5- И 1,7-НАФТИРИДИНА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ FGFR | 2012 |
|
RU2629194C2 |
| НОВЫЕ СОЕДИНЕНИЯ ДЛЯ МОДУЛИРОВАНИЯ КЛЕТОЧНОЙ ПРОЛИФЕРАЦИИ | 2001 |
|
RU2277531C9 |
| ПРОТИВОРАКОВЫЕ БЕНЗОПИРАЗИНЫ, ДЕЙСТВУЮЩИЕ ПОСРЕДСТВОМ ИНГИБИРОВАНИЯ FGFR-КИНАЗ | 2012 |
|
RU2639863C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИДИНОНА | 2018 |
|
RU2806625C2 |
Настоящее изобретение относится к способу получения соединения формулы IX, которое является эффективным антагонистом рецепторов орексина и может оказаться полезным при лечении нарушений сна, таких как бессонница. Предлагаемый способ включает стадию взаимодействия соединения формулы VII с соединением формулы X в органическом растворителе в присутствии органического амина и агента сочетания амидов. В формулах IX, VII и X Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза заместителями, независимо выбранными из группы, состоящей из: галогена, С1-6алкила, С1-6алкокси и галогенС1-6алкила; R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, С1-6алкила, галогенС1-6алкила, С1-6алкокси и гидроксиС1-6алкила; и Ar' представляет собой группу пиридина:
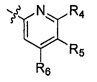 ,
,
где
R4 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила, С1-6алкокси и (С1-6алкокси)С1-6алкила; R5 выбирают из группы, состоящей из: водорода, галогена, С1-6алкила и галогенС1-6алкила; R6 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила, галогенС1-6алкила, С1-6алкокси, (С1-6алкокси)С1-6алкила и циано. 29 з.п. ф-лы, 8 пр.
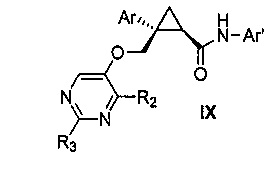 ,
,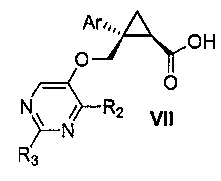
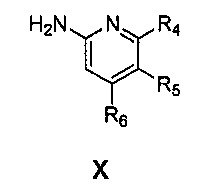
1. Способ получения соединения формулы IX:
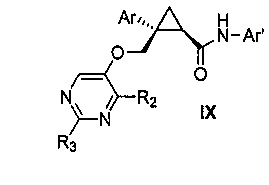 ,
,
где
Ar представляет собой фенил, причем указанный фенил может быть незамещенным или замещен 1-3 раза заместителями, независимо выбранными из группы, состоящей из: галогена, С1-6алкила, С1-6алкокси и галогенС1-6алкила;
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода, С1-6алкила, галогенС1-6алкила, С1-6алкокси и гидроксиС1-6алкила; и
Ar' представляет собой группу пиридина:
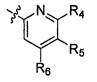 ,
,
где
R4 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила, С1-6алкокси и (С1-6алкокси)С1-6алкила;
R5 выбирают из группы, состоящей из: водорода, галогена, С1-6алкила и галогенС1-6алкила; и
R6 выбирают из группы, состоящей из: водорода, галогена, C1-6алкила, галогенС1-6алкила, С1-6алкокси, (С1-6алкокси)С1-6алкила и циано,
включающий стадии взаимодействия соединения формулы VII:
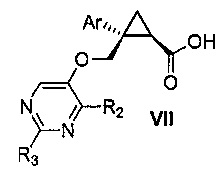 ,
,
где Ar, R2 и R3 являются такими, как указано выше,
с соединением формулы X:
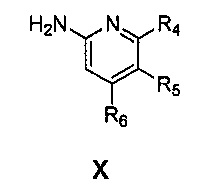
где R4, R5 и R6 являются такими, как указано выше,
причем указанное взаимодействие осуществляют в органическом растворителе в присутствии органического амина и агента сочетания амидов,
с получением указанного соединения формулы IX.
2. Способ по п. 1, где Ar является незамещенным или замещен 1-3 раза галогеном, независимо выбранным из группы, состоящей из хлора, фтора, брома и йода, и
R2 и R3, каждый независимо, выбирают из группы, состоящей из: водорода и С1-6алкила.
3. Способ по п. 1, где указанный органический растворитель выбирают из группы, состоящей из: этилацетата, N,N-диметилформамида (ДМФ), N,N-диметилацетамида (DMA), N-метил-2-пирролидона (NMP), ацетона, толуола, ацетонитрила и дихлорметана.
4. Способ по п. 1, где указанный агент сочетания амидов представляет собой пропилфосфоновый ангидрид или три-н-пропилфосфоновый ангидрид.
5. Способ по п. 1, где указанное соединение формулы IX представляет собой
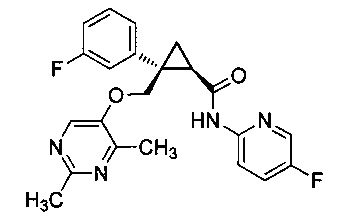 .
.
6. Способ по п. 1, где указанное соединение формулы VII
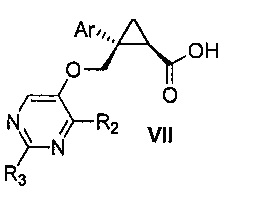 ,
,
где Ar, R2 и R3 такие, как указано в п. 1,
получают способом, включающим: окисление соединения формулы V:
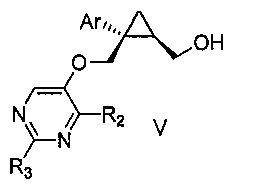 ,
,
где Ar, R2 и R3 являются такими, как указано выше,
гипохлоритом натрия и хлоритом натрия,
с получением, таким образом, указанного соединения формулы VII.
7. Способ по п. 6, где указанное окисление гипохлоритом натрия и хлоритом натрия осуществляют одновременно.
8. Способ по п. 6, где указанное окисление катализируют эффективным количеством 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO).
9. Способ по п. 1, где указанное соединение формулы VII:
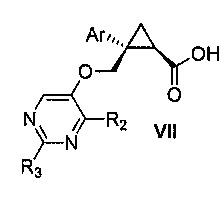 ,
,
где Ar, R2 и R3 такие, как указано в пп. 1-8,
получают способом, включающим стадии:
а) окисления соединения формулы V:
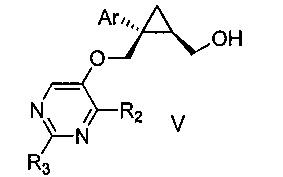
где Ar, R2 и R3 являются такими, как указано выше,
первым окисляющим агентом, с получением альдегида формулы VIII:
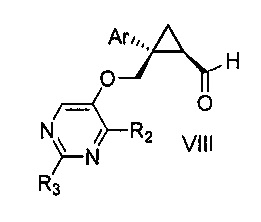 ,
,
где Ar, R2 и R3 являются такими, как указано выше; и затем
b) окисления указанного альдегида формулы VIII вторым окисляющим агентом,
с получением, таким образом, указанного соединения формулы VII.
10. Способ по п. 9, где первый окисляющий агент представляет собой гипохлорит натрия.
11. Способ по п. 9, где указанную стадию окисления а) катализируют эффективным количеством 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO).
12. Способ по п. 9, где второй окисляющий агент представляет собой хлорит натрия.
13. Способ по любому из пп. 6-12, где указанное соединение формулы V,
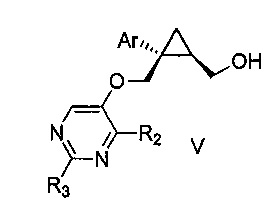 ,
,
где Ar, R2 и R3 являются такими, как указано в пп. 6-12,
получают при помощи способа, включающего стадии:
а) перемешивания смеси, состоящей из:
i) соединения формулы IV:
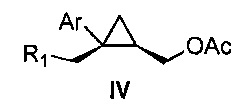 ,
,
где Ar является таким, как указано выше, R1 представляет собой уходящую группу,
ii) замещенного пиримидина формулы VI:
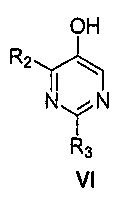 ,
,
где R2 и R3 являются такими, как указано выше;
iii) основания; и
iv) органического растворителя,
при температуре от 65-70°C, в течение промежутка времени от 1 до 12 часов; и затем
b) взаимодействия указанной смеси с водным основанием в течение промежутка времени от 2 до 20 часов,
с получением, таким образом, указанного соединения формулы V.
14. Способ по п. 13, где указанное соединение формулы IV:
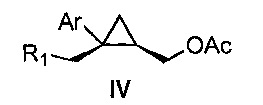
где Ar является такими, как указано в п. 13, и R1 представляет собой уходящую группу сложного сульфонатного эфира,
получают при помощи способа, включающего взаимодействие соединения формулы III:
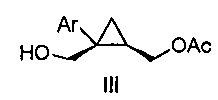 ,
,
где Ar является таким, как указано выше,
с соединением, выбранным из группы, состоящей из: тозилхлорида, мезилхлорида, нозилхлорида, толуолсульфонилхлорида, толуолсульфонового ангидрида и метансульфонового ангидрида, где указанное взаимодействие осуществляют в органическом растворителе в присутствии основания,
с получением, таким образом, указанного соединения формулы IV.
15. Способ по п. 14, где основание представляет собой органический амин или карбонат калия.
16. Способ по п. 14, где указанный органический растворитель выбирают из группы, состоящей из: дихлорметана, тетрагидрофурана, 2-метилтетрагидрофурана, толуола, ацетонитрила и этилацетата.
17. Способ по п. 14, где указанное соединение формулы IV имеет абсолютную стереохимию формулы IVa:
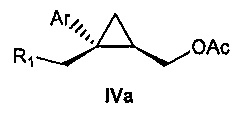 ,
,
где соединение имеет энантиомерный избыток (эи) стереоизомера формулы IVa по меньшей мере 80%.
18. Способ по п. 14, где указанное соединение формулы IV представляет собой:
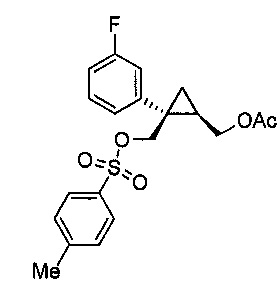 .
.
19. Способ по п. 14, где указанное соединение формулы III:
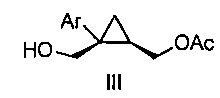 ,
,
где Ar является таким, как указано в п. 14,
получают способом, включающим взаимодействие смеси из:
i) соединения формулы Ia:
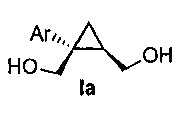 ,
,
где Ar является таким, как указано выше;
ii) винилацетата;
iii) липазы; и
iv) органического растворителя,
в течение промежутка времени от 5 до 36 часов,
с получением, таким образом, соединения формулы III.
20. Способ по п. 19, где указанная липаза представляет собой липазу Candida Antarctica.
21. Способ по п. 19, где указанное соединение формулы III представляет собой:
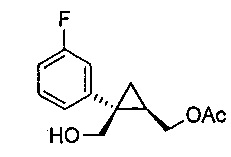 .
.
22. Способ по п. 19, где соединение формулы I:
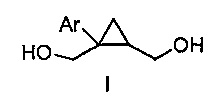
где Ar является таким, как указано в п. 19,
получают при помощи способа, включающего стадии:
i) обеспечения композиции, содержащей органический растворитель и соединение формулы II:
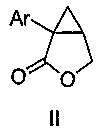 ,
,
где Ar является таким, как указано выше, и где температура указанной композиции составляет от -30 до 40°C; и
ii) добавления к указанной композиции гидридного восстанавливающего агента, который восстанавливает указанное соединение формулы II до указанного соединения формулы I,
с получением, таким образом, указанного соединения формулы I, которое имеет абсолютную стереохимию формулы Ia:
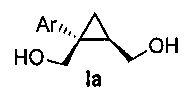 ,
,
где Ar является таким, как указано выше.
23. Способ по п. 22, где Ar замещен 1-3 раз галогеном, выбранным из группы, состоящей из хлора, фтора, брома и йода.
24. Способ по п. 22, где органический растворитель представляет собой ароматический углеводородный растворитель, алифатический углеводородный растворитель, галогенированный углеводородный растворитель или эфирный растворитель.
25. Способ по п. 22, где указанный гидридный восстанавливающий агент представляет собой боргидрид лития или триэтилборгидрид лития.
26. Способ по п. 22, дополнительно включающий стадию гашения реакции восстановления путем добавления к указанной композиции слабой водной кислоты.
27. Способ по п. 22, где соединение формулы II имеет абсолютную стереохимию формулы IIa:
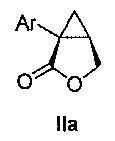 ,
,
где Ar является таким, как указано в п. 22, соединение имеет энантиомерный избыток (эи) стереоизомера формулы IIa по меньшей мере 80%.
28. Способ по п. 22, где соединение формулы II представляет собой соединение:
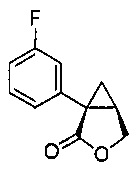 .
.
29. Способ по п. 22, где соединение формулы I имеет энантиомерный избыток (эи) стереоизомера формулы Ia по меньшей мере 80%.
30. Способ по п. 22, где соединение формулы I представляет собой:
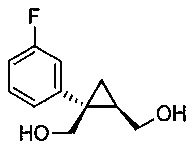 .
.
| WO 2008150364A1, 11.12.2008 | |||
| K.Yamaguchi et al, Construction of a cis-Cyclopropane via Reductive Radical Decarboxylation | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J.Org.Chem., 2003, 68, 9255-9262 | |||
| WO 2008057575A2, 15.05.2008 | |||
| RU 2009147733A, 27.06.2011. | |||
Авторы
Даты
2017-04-26—Публикация
2013-02-14—Подача