ВВЕДЕНИЕ
Раковый метастаз представляет собой процесс, включающий ряд последовательных этапов и требующий каскада взаимодействий между клетками хозяина и опухолевыми клетками (Steeg PS et al. (2007) Nature 449:671-3). Эти этапы включают отделение от первичной опухоли, инвазию и задержку в кровеносной системе, выход в паренхиму органов; и пролиферацию в сочетании с ангиогенезом (Sawyer TK et al. (2004) Expert Opin Investig Drugs 13:1-19). Существует растущий интерес к исследованию механизмов миграции и инвазии, которые считают критическими этапами процесса метастазирования. Вмешательство в любой из этих этапов для остановки метастатического каскада представляет собой хороший способ предотвращения метастатического роста опухолей.
Наши предшествующие данные показывают, что рекомбинантный капсидный белок VP1 (rVP1) вируса ящура (FMDV) индуцировал апоптоз у нескольких видов раковых клеток через интегриновый сигнальный путь (Peng JM et al. (2004) J. Biol. Chem. 279:52168-74). Показано, что с применением процесса, подобного рефолдингу rVP1 в водорастворимую форму, глобулярный бычий сывороточный альбумин (G-BSA) можно преобразовать в фибриллярный BSA (F-BSA), который, подобно rVP1, индуцирует апоптоз опухолевой клетки через интегриновый/FAK/Akt сигнальный путь (Huang et al. (2009) BMC Biotechnol. 9:2).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предоставляются способы подавления раковых метастазов. Раковые метастазы представляют собой самую распространенную причину неэффективности лечения и смерти у пациентов с раком. Инвазия и/или миграция опухолевых клеток значительно подавляется после взаимодействия опухолевых клеток с фибриллярными белками, где фибриллярные белки в качестве неограничивающих примеров включают rVP1, F-HSA, и F-BSA. Опухолевые клетки, представляющие интерес, включают карциномы, например, карциному молочной железы, эпителиальную аденокарциному яичника, аденокарциному предстательной железы и т.д.
В одном из аспектов изобретение относится к композиции, включающей терапевтически эффективное количество фибриллярного сывороточного альбумина человека и фармацевтически приемлемый носитель для применения в лечении млекопитающего с раком, например, для подавления раковых клеток, подавления метастазов и т.д.
В некоторых вариантах осуществления изобретения опухолевые клетки приводят в контакт in vivo с фибриллярными белками, где контактирование может быть местным, например, представлять собой внутриопухолевое введение или инъекцию, или системным. Например, в настоящем документе показано, что rVP1 значительно подавляет метастазирование рака молочной железы у мыши и человека и метастазирование рака предстательной железы и рака яичников у человека in vivo. Показано, что F-HSA значительно подавляет метастазирование рака молочной железы. В одном из вариантов осуществления изобретение относится к композициям, указанным выше, для применения в лечении рака у млекопитающего, где рак представляет собой, по меньшей мере, один из рака молочной железы, рака яичников, рака шейки матки, рака предстательной железы и рака легких.
В некоторых вариантах осуществления изобретения предоставлены композиции фибриллярных белков, выступающих в качестве лекарственных средств для борьбы с раковыми метастазами, где композицию для фармацевтического средства предоставляют в дозе, эффективно ингибирующей метастазирование. В другом аспекте изобретение относится к способу, включающему получение композиции для применения в лечении пациента, больного раком. Способ включает получение фибриллярного сывороточного альбумина человека и смешивание фибриллярного сывороточного альбумина человека с фармацевтически приемлемым носителем. В другом аспекте изобретение относится к способу, включающему растворение HSA в растворе SDS; помещение растворенного HSA в колонку для гель-фильтрации с диаметром пор, позволяющим разделять белки с молекулярной массой, составляющей 70 кДа и более; элюирование HSA из колонки; и диализ раствора против фосфатно-солевого буфера с удалением SDS.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг. 1. Воздействие rVP1 на инвазию/миграцию клеток и цитотоксичность для клеток MDA-MB-231, клеток PC-3 и клеток 22Rv1. (A и B) Клеточную инвазию/миграцию клеток MDA-MB-231, клеток PC-3 и клеток 22Rv1 при обработке rVP1 в течение 24 часов измеряли с применением камеры Бойдена. rVP1 значительно подавлял инвазию/миграцию опухолевых клеток. (C) Цитотоксичность клеток MDA-MB-231, клеток PC-3 и клеток 22Rv1 при обработке rVP1 в течение 24 часов измеряли с применением MTT-теста. 0,1 μΜ и 0,2 μΜ rVP1 не влияли на жизнеспособность опухолевых клеток. Данные представлены в виде средних значений ± S.D. (n=3). *: P<0,05, **: P<0,01 и ***: P<0,001 относительно контроля (обработка 0 μΜ rVP).
Фиг. 2. Воздействие rVP1 на клеточную инвазию и цитотоксичность для клеток SK-OV-3 и клеток CaSki. (A) Клеточную инвазию клеток SK-OV-3 и клеток CaSki при обработке rVP1 в течение 24 часов измеряли с применением камеры Бойдена. rVP1 значительно подавляли инвазию опухолевых клеток. (B) Клеточную цитотоксичность клеток SK-OV-3 и клеток CaSki при обработке rVP1 в течение 24 часов измеряли с применением MTT-теста. От 0,2 μΜ до 0,4 μΜ rVP1 в клетках SKOV-3 и от 0,2 μΜ до 0,6 μΜ rVP1 в клетках CaSki не влияли на жизнеспособность клеток. Белые столбики, клетки SKOV-3; черные столбики, клетки CaSki. Данные представлены в виде средних значений ± S.D. (n=3). *: P<0,05; **: P<0,01; ***: P<0,001.
Фиг. 3. Воздействие rVP1 на клеточную инвазию и цитотоксичность для клеток SK-OV-3ip.1. (A) Клетки SK-OV-3ip.1 высевали на верхнюю камеру на 1 час с последующей обработкой rVP1 в течение 24 часов. После инкубации клетки с нижней поверхности мембраны разделяли и подсчитывали. (B) Клетки SK-OV-3ip.1 обрабатывали rVP1 в течение 24 часов, после чего проводили анализ WST-1. Коэффициенты выживаемости клеток определяли посредством измерения оптической плотности при 450 нм (опорная длина волны 690 нм). Процент выживаемости клеток рассчитывали как (O.Dобработка/O.Dконтроль)×100%. Данные представлены в виде средних значений ± S.D. (n=3). *, P<0,05 и **, P<0,01 относительно контроля.
Фиг. 4. Метастатическая способность клеток MDA-MB-231 исчезала после обработки rVP1 in vivo. Клетки MDA-MB-231, обработанные 0,1 μΜ и 0,2 μΜ rVP1 in vitro в течение 24 часов, далее собирали и внутривенно вводили мышам в хвостовую вену. Через 14 суток мышей умерщвляли. Изучали макроскопическую картину (A) и проводили гистопатологическое исследование (B и C) легкого в трех разных группах мышей. rVP1 значительно подавлял метастатическую способность клеток MDA-MB-231. ***: P<0,001.
Фиг. 5. rVP1 подавлял клетки PC-3, дававшие метастазы в лимфоузлы, и ингибировал остеолиз в тазовых костях. (A) Лимфоузлы здоровой мыши и мыши с опухолью при наличии или отсутствии обработки rVP1. (B) Тазовые кости здоровых мышей и мышей с опухолью при наличии и отсутствии обработки rVP1 (стрелка).
Фиг. 6. Гистологическая картина in vivo метастазов рака печени у безтимусных мышей с имплантированными клетками SK-OV-3, предотвращенных с применением rVP1. Типичные участки печени с окраской H&E (гемотоксилин-эозин) от обработанных и не обработанных rVP1 мышей. Самкам безтимусных мышей BALB/cAnN-Foxn1 имплантировали 5×106 раковых клеток SK-OV-3 на мышь посредством интраперитонеальной инъекции, (a-b) через 60 суток печень обработанных PBS несущих SK-OV-3 мышей была окружена опухолевыми клетками, (c-d) через 340 суток после имплантации SK-OV-3 печень обработанных rVP1 мышей не демонстрировала признаков инвазии, (e-f) печень здоровой мыши (т.е., без имплантации SK-OV-3).
Фиг. 7. Воздействие F-HSA на клеточную миграцию, инвазию и цитотоксичность для клеток MDA-MB-231, клеток PC-3, клеток 22Rv1 и клеток CaSki. Анализ миграции и инвазии in vitro, F-HSA значительно ингибировал клеточную инвазию (черный столбик) и миграцию (белый столбик) для клеток MDA-MB-231 (A), клеток PC-3 (C), клеток 22Rv1 (E) и клеток CaSki (G) с применением камеры Бойдена. Воздействие F-HSA на цитотоксичность для клеток MDA-MB-231, клеток PC-3, клеток 22Rv1 и клеток CaSki с применением MTT-теста. (B, D, F, и H). Миграция и инвазия представлены как соотношение числа обработанных клеток к числу необработанных клеток. Показаны средние значения ± S.D. для трех независимых экспериментов с тремя повторами для каждого. **: P<0,01 и ***: P<0,001 относительно необработанных клеток.
Фиг. 8. F-HSA подавлял метастазирование опухолевых клеток TS/A in vivo. (A) Макроскопическая картина и гистопатологическое исследование легкого мышей при наличии и отсутствии обработки F-HSA. (B и C) Относительная масса легкого и число очагов опухоли в легком мыши без обработки или с обработкой F-HSA. ***: P<0,001.
Фиг. 9. F-HSA подавлял метастазирование опухолевых клеток MDA-MB-231 in vivo. (A) Макроскопическая картина и гистопатологическое исследование легкого мышей при наличии и отсутствии обработки F-HSA. (B и C) Относительная масса легкого и число очагов опухоли в легком мыши без обработки или с обработкой F-HSA. ***: P<0,001.
Фиг. 10. Воздействие F-BSA на клеточную инвазию и цитотоксичность для клеток CaSki. (A) Клеточную инвазию клеток CaSki, обработанных F-BSA в течение 24 часов, измеряли с применением камеры Бойдена. F-HSA значительно подавлял инвазию опухолевых клеток. (B) Цитотоксичность клеток CaSki, обработанных F-BSA в течение 24 часов, измеряли посредством MTT-теста. F-HSA при концентрации 0,1 μΜ или 0,2 μΜ не оказывал эффекта на жизнеспособность клеток CaSki. Данные представлены в виде средних значений ± S.D. (n=3). *: P<0,05; **: P<0,01.
Фиг. 11. Схема имплантации опухоли при обработке rVP1.
Фиг. 12 представляет собой реализацию экспериментальных данных, где показано сравнение уровня флуоресценции при увеличивающихся концентрациях F-HSA, HSA и A β (1-42) после инкубации в присутствии 20 μΜ амилоид-специфичной краски ThT в течение 1 часа.
Фиг. 13 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака молочной железы.
Фиг. 14 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака молочной железы.
Фиг. 15 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака яичника.
Фиг. 16 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака шейки матки.
Фиг. 17 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака предстательной железы.
Фиг. 18 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака предстательной железы.
Фиг. 19 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака легкого.
Фиг. 20A-20H представляют собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на подавление клеточной миграции и инвазии опухолевых клеток без влияния на жизнеспособность здоровых клеток.
Фиг. 21A-21C представляют собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на подавление метастазирования клеток рака молочной железы мыши TS/A в легкое.
Фиг. 22A-22C представляют собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на подавление метастазирования клеток рака молочной железы MDA-MB-231 мыши в легкое.
ОПРЕДЕЛЕНИЯ
В приведенном ниже описании ряд терминов, традиционно применяющихся в области клеточной культуры, используют в широком смысле. Для предоставления ясного и точного понимания заявки и формулы изобретения и объема, в котором следует понимать такие термины, приведены следующие определения.
Термины "субъект", "индивидуум" и "пациент" в настоящем документе используют взаимозаменяемо и относят к млекопитающему, которого определяют к лечению и/или лечат. В варианте осуществления млекопитающее представляет собой человека. Термины "субъект", "индивидуум" и "пациент", таким образом, охватывают индивидуумов, больных раком (например, колоректальный рак, аденокарциному яичника или предстательной железы, карциному молочной железы и т.д.), включая подвергшихся или являющихся кандидатами на резекцию (хирургическое вмешательство) для удаления раковой ткани (например, колоректальной раковой ткани). Субъекты могут представлять собой человека, но также включают других млекопитающих, особенно млекопитающих, применяемых в качестве лабораторных моделей заболеваний человека, например, мышей, крыс и т.д.
Как применяют в настоящем документе, термины "лечение" и т.п. относят к введению средства или проведению процедуры (например, облучения, хирургического вмешательства и т.д.) с целью получения эффекта. Эффект может быть профилактическим в отношении полного или частичного предотвращения заболевания или его симптомов и/или может быть терапевтическим в отношении предоставления частичного или полного излечения заболевания и/или симптомов заболевания. "Лечение", как применяют в настоящем документе, охватывает любое лечение любой метастатической опухоли у млекопитающего, особенно у человека, и включает: (a) предотвращение заболевания или симптомов заболевания, возникающего у индивидуума, который может быть предрасположен к заболеванию, но которому еще не ставили диагноз заболевания (например, включая заболевания, которые могут быть ассоциированы с или вызваны первичным заболеванием; (b) ингибирование заболевания, т.е., остановка его развития; и (c) облегчение заболевания, т.е., обеспечение ремиссии заболевания. При лечении опухолей (например, рака) терапевтическое средство может непосредственно сокращать раковые метастазы.
Термин "клеточная культура" или "культура" относится к поддержанию клеток в искусственной среде in vitro. Однако следует понимать, что термин "клеточная культура" представляет собой обобщенный термин, и его можно использовать для обозначения культивирования не только индивидуальных клеток, но также тканей или органов.
Как применяют в настоящем документе, термин "опухоль" относится к любому виду неопластического роста и пролиферации клеток, злокачественному или доброкачественному, и к любому виду предраковых и раковых клеток и тканей.
Термины "рак", "неоплазия" и "опухоль" в настоящем документе используют взаимозаменяемо и относят к клеткам, которые характеризуются автономным нерегулируемым ростом, при котором они проявляют патологический паттерн роста, которому свойственна значительная утрата контроля клеточной пролиферации. В основном, клетки, представляющие интерес для обнаружения, анализа, классификации или лечения, в настоящей заявке включают предраковые (например, доброкачественные), злокачественные, преметастатические, метастатические и неметастатические клетки. Примеры рака в качестве неограничивающих примеров включают рак молочной железы, рак толстого кишечника, рак легких, рак предстательной железы, гепатоцеллюлярную карциному, рак желудка, рак поджелудочной железы, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, рак мочевыводящих путей, рак щитовидной железы, рак почек, карциному, меланому, рак головы и шеи и рак головного мозга.
В зависимости от природы рака у пациента получают соответствующий образец. Как применяют в настоящем документе, фраза "образец раковой ткани" относится к любым клеткам, полученным из раковой опухоли. В случае солидных опухолей, не дающих метастазы, как правило, получают образец ткани из хирургически удаленной опухоли и готовят его к анализу общепринятыми способами. Альтернативно в качестве анализируемого образца можно брать и применять образец биологической жидкости, такой как лимфа, кровь или сыворотка, или образец экссудата, такого как экссудат органа, пораженного раком (например, экссудат молочной железы). В случае лейкозов получают и соответствующим образом подготавливают лимфоциты или лейкемические клетки. Так же, в случае любого дающего метастазы рака, клетки можно получать из биологической жидкости, такой как лимфа, кровь, сыворотка, или периферического пораженного органа или его экссудата.
Как применяют в настоящем документе, термин "метастазирование" относится к росту раковой опухоли в органе или части тела, не соединенном непосредственно с органом, пораженным первичной раковой опухолью. Следует понимать, что метастазирование включает микрометастазирование, которое представляет собой наличие необнаруживаемого количества раковых клеток в органе или части тела, не соединенном непосредственно с органом, пораженным первичной раковой опухолью. Метастазирование также можно определять как ряд этапов процесса, таких как выход раковых клеток из места первичной опухоли и миграция и/или инвазия раковых клеток в другие части организма. Таким образом, настоящее изобретение предоставляет способ определения риска дальнейшего роста одного или нескольких раков в органе или части тела, не соединенном непосредственно с органом, пораженным первичной раковой опухолью, и/или любых этапов процесса, приводящего к такому росту.
"Патология" рака включает все симптомы, нарушающие здоровье пациента. В качестве неограничивающих примеров они включают патологический или неконтролируемый рост клеток, метастазирование, воздействие на нормальное функционирование соседних клеток, высвобождение цитокинов или других секреторных веществ на патологическом уровне, подавление или ослабление воспалительного или иммунного ответа, неоплазию, предопухолевое состояние, рак, инвазию в соседние или отдаленные ткани или органы, такие как лимфоузлы, и т.д.
Как применяют в настоящем документе, термины "рецидив рака" и "рецидив опухоли" и их грамматических варианты относятся к дальнейшему росту неопластических или раковых клеток после постановки диагноза рака. В частности, рецидив может возникать при дальнейшем росте раковых клеток в пораженной раком ткани. Так же, "распространение опухоли" наблюдается, когда клетки опухоли расселяются в соседние или отдаленные ткани и органы; таким образом, распространение опухоли включает метастазирование опухоли.
Термин "диагноз" применяют в настоящем документе для обозначения идентификации молекулярного или патологического состояния, заболевания или состояния, такого как идентификация молекулярного подтипа рака молочной железы, рака предстательной железы или других типов рака.
Термин "прогноз" применяют в настоящем документе для обозначения предсказания вероятности обусловленной раком смерти или прогрессирования неопластического заболевания, такого как рак легкого, прямой кишки, кожи или пищевода, включая рецидив, метастазирование и устойчивость к лекарственному средству. Термин "предсказание" применяют в настоящем документе для обозначения предсказания или оценки, основанных на наблюдениях, опыте или научных выводов. В одном примере врач может предсказывать вероятность того, что пациент останется в живых после хирургического удаления первичной опухоли и/или химиотерапии в течение определенного периода времени без рецидива рака.
Как применяют в настоящем документе, фраза "безрецидивная выживаемость" относится к отсутствию рецидива и/или распространения опухоли и состоянию пациента после постановки диагноза в отношении влияния рака на продолжительность жизни пациента. Фраза "общая выживаемость" относится к состоянию пациента после постановки диагноза, несмотря на возможность того, что причина смерти пациента необязательно связана непосредственно с влиянием рака. Фразы "вероятность безрецидивной выживаемости", "риск рецидива" и их варианты относятся к вероятности рецидива или распространения опухоли у пациента после постановки диагноза рака, где вероятность определяют согласно способу по изобретению.
Как применяют в настоящем документе, термин "коррелирует" или "коррелирует с" и подобные термины относятся к статистической связи между двумя событиями, где события включают числа, наборы данных и т.п. Например, в случае, когда событие выражают числами, положительная корреляция (которую в настоящем документе также обозначают как "прямую корреляцию") означает, что при увеличении одной величины также увеличивается и другая. Отрицательная корреляция (которую в настоящем документе также обозначают как "обратную корреляцию") означает, что при увеличении одной величины другая уменьшается.
Термин "выделенный" предназначен для обозначения того, что соединение отделяют от всех или некоторых компонентов, сопутствующих ему в природе. "Выделенный" также относится к состоянию соединения (например, белка), отделенного от всех или некоторых компонентов, сопутствующих ему во время обработки (например, химический синтез, рекомбинантная экспрессия, среда для культивирования и т.п.).
"Биологический образец" охватывает ряд типов образцов, полученных от индивидуума. Определение охватывает кровь и другие жидкие образцы биологического происхождения, образцы твердых тканей, такие как биоптат или тканевые культуры или клетки, полученные от них и их потомков. Определение также включает образцы, с которыми проводили любые манипуляции после их получения, такие как обработка реагентами; промывка; или обогащение определенными популяциями клеток, таких как раковые клетки. Определение также включает образец, который обогащали определенными типами молекул, например, нуклеиновыми кислотами, полипептидами и т.д. Термин "биологический образец" охватывает клинический препарат и также включает ткань, полученную посредством хирургического удаления, ткань, полученную посредством биопсии, клетки в культуре, клеточные супернатанты, клеточные лизаты, образцы ткани, органы, костный мозг, кровь, плазму, сыворотку и т.п. "Биологический образец" включает образец, полученный из раковой клетки пациента, например, образец, содержащий полинуклеотиды и/или полипептиды, полученные из раковой клетки пациента (например, клеточный лизат или другой клеточный экстракт, содержащий полинуклеотиды и/или полипептиды); и образец, содержащий раковые клетки пациента. Биологический образец, содержащий раковую клетку пациента, также может включать не раковые клетки.
ОПИСАНИЕ КОНКРЕТНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к способу получения фибриллярных белков и способам лечения с применением фибриллярных белков. Способ лечения включает подавление раковых метастазов.
Способ лечения
В настоящем документе описан способ ингибирования раковых метастазов. Способ включает введение терапевтически эффективного количества белка с фибриллярной структурой нуждающемуся в этом пациенту. Способ далее может включать этапы получения белка и изменения белка с приданием ему фибриллярной структуры перед введением фибриллярного белка. Введение фибриллярного белка ингибирует инвазию и/или миграцию опухолевых клеток (например, в окружающие ткани).
Настоящий способ находит применение в ряде раковых терапий опухолей (включая предотвращение рака и лечение рака после постановки диагноза) у млекопитающего, особенно у человека. Субъекты, имеющие опухоль, подозреваемые на наличие опухоли или характеризующиеся риском развития опухоли, подлежат лечению, описываемому в настоящем документе.
Способы лечения рака согласно рассматриваемому способу могут быть конкретно направлены на раковые клетки, которые представляют собой метастатические клетки или характеризуются высоким риском метастазирования. В связи с этим, фибриллярный белок можно использовать терапевтически для влияния на/предотвращения выхода и инвазии раковых клеток в другие ткани.
Например, раковые метастазы, которые можно ингибировать способом по настоящему изобретению, в качестве неограничивающих примеров включают карциномы, включая аденокарциномы, и особенно карциномы молочной железы, аденокарциному предстательной железы и аденокарциному яичника. Другие метастазы, которые можно лечить, включают метастазы, происходящие от раков в почке, легком, печени, коже (например, меланома), прямой кишке, поджелудочной железе или шейке матки.
Белок с фибриллярной структурой, применяемый для лечения рака, может представлять собой альбумин, фибронектин, rVP1, rVP2, rVP3, P1 или химерный белок, содержащий части VP1, VP2, VP3 и/или VP4. Альбуминовые белки можно получать от любого животного, представляющего интерес, например, сывороточный альбумин человека, бычий сывороточный альбумин и т.д. В определенных вариантах осуществления фибриллярный белок дополнительно индуцирует апоптоз раковой клетки посредством модулирования Akt-сигнального пути. В некоторых случаях фибриллярный белок модулирует интегрин α5β1 или αvβ3, что приводит к дезактивации Akt. В других случаях фибриллярный альбумин связывается с интегрином и вызывает клеточный апоптоз в основном через интегрин/FAK/Akt/GSK-3β/каспаза-3-сигнальный путь.
Как указано выше, настоящий способ включает введение фибриллярных белков индивидууму (например, пациенту, представляющему собой человека) с тем, чтобы, например, подавлять инвазию и миграцию раковых клеток. Это можно сопровождать введением фибриллярного белка индивидууму, как описано в настоящем документе, с предоставлением сокращения метастазирования рака по сравнению с субъектами, которым не вводили фибриллярный белок. Способы лечения согласно рассматриваемым способам можно также применять для предотвращения рецидивов, сокращения миграции раковых клеток, уменьшения размера опухоли, уменьшения массы опухоли и/или улучшения клинического исхода у пациентов.
Типы рака
Способы, относящиеся к раку и предоставленные в настоящем документе, включают, например, применение лечения фибриллярным белком в качестве борьбы с метастазированием рака. Способы пригодны в отношении лечения или предотвращения широкого спектра раков, таких как раки, которые могут давать метастазы (например, карциномы и саркомы).
Карциномы, подлежащие лечению способом, описываемым в настоящем документе, в качестве неограничивающих примеров включают карциному пищевода, печеночно-клеточную карциному, базально-клеточную карциному (форма рака кожи), плоскоклеточную карциному (различные ткани), карциному мочевого пузыря, включая переходноклеточную карциному (злокачественная неоплазия мочевого пузыря), бронхогенную карциному, карциному прямой кишки, колоректальную карциному, карциному желудка, карциному легкого, включая мелкоклеточную карциному и немелкоклеточную карциному легкого, адренокортикальную карциному, карциному щитовидной железы, карциному поджелудочной железы, карциному молочной железы, карциному яичника, карциному предстательной железы, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному, почечноклеточную карциному, протоковую карциному in situ или карциному желчных протоков, хориокарциному, семиному, эмбриональную карциному, опухоль Вильма, цервикальную карциному, карциному матки, карциному яичка, остеогенную карциному, эпителиальную карциному и носоглоточную карциному.
Саркомы, подлежащие лечению способом, описываемым в настоящем документе, в качестве неограничивающих примеров включают фибросаркому, миксосаркому, липосаркому, хондросаркому, хордому, остеогенную саркому, остеосаркому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, саркому Юинга, лейомиосаркому, рабдомиосаркому и саркомы других мягких тканей.
Другие солидные опухоли, подлежащие лечению способом, описываемым в настоящем документе, в качестве неограничивающих примеров включают глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, неврому слухового нерва, олигодендроглиому, менангиому, меланому, нейробластому и ретинобластому.
Другие раки, подлежащие лечению способом, описываемым в настоящем документе, включают атипичную менингиому (головной мозг), карциному островковых клеток (поджелудочная железа), медуллярную карциному (щитовидная железа), мезенхиому (кишечник), печеночноклеточную карциному (печень), гепатобластому (печень), светлоклеточную карциному (почка) и нейрофиброму средостения.
Дополнительные примеры раков, подлежащих лечению способами, описываемыми в настоящем документе, в качестве неограничивающих примеров включают раки нейроэктодермального и эпителиального происхождения. Примеры раков нейроэктодермального происхождения в качестве неограничивающих примеров включают саркому Юинга, опухоли спинного мозга, опухоли головного мозга, супратенториальные примитивные нейроэктодермальные опухоли у детей, тубулокистозную карциному, слизеобразующую тубулярную и веретеноклеточную карциному, опухоли почки, опухоли средостения, нейроглиомы, нейробластомы и саркомы у подростков и молодых людей. Примеры раков эпителиального происхождения в качестве неограничивающих примеров включают мелкоклеточный рак легких, раки молочной железы, хрусталика, прямой кишки, поджелудочной железы, почки, печени, яичника и бронхиального эпителия.
Сочетание с другими способами лечения раков
Терапевтическое введение фибриллярного белка может включать введение как часть схемы лечения, которое можно сочетать или не сочетать с дополнительными стандартными способами лечения раков, включая в качестве неограничивающих примеров иммунотерапию, химиотерапевтические средства и хирургические вмешательства (например, описанные далее ниже).
Кроме того, терапевтическое введение фибриллярного белка также может представлять собой пост-терапевтическое лечение субъекта, получавшего лечение рака, где лечение рака может представлять собой, например, хирургическое вмешательство, лучевую терапию, введение химиотерапевтических средств и т.п. Терапию рака с применением фибриллярных белков по настоящему изобретению также можно использовать в комбинации с иммунотерапией. В других примерах фибриллярные белки можно вводить в комбинации с одним или несколькими химиотерапевтическими средствами (например, циклофосфамид, доксорубицин, винкристин и преднизон (CHOP)) и/или в комбинации с лучевой терапией и/или в комбинации с хирургическим вмешательством (например, пре- или пост-хирургическое вмешательство для удаления опухоли). Если фибриллярные белки применяют в сочетании с хирургическим вмешательством, фибриллярный белок можно вводить до, во время или после хирургического вмешательства для удаления раковых клеток, и можно вводить системно или местно в область хирургического вмешательства. Фибриллярный белок отдельно или в комбинациях, описанных выше, можно вводить системно (например, посредством парентерального введения, например, внутривенным путем) или местно (например, в область опухоли, например, посредством внутриопухолевого введения (например, в солидную опухоль, в лимфоузел, поврежденный лимфомой или лейкозом), введением в кровеносный сосуд, питающий солидную опухоль, и т.д.).
Любой из широкого спектра способов лечения рака можно использовать в комбинации со способом лечения фибриллярным белком, описываемым в настоящем документе. Такие способы лечения рака включают хирургическое вмешательство (например, хирургическое удаление рака), лучевую терапию, пересадку костного мозга, химиотерапевтическое лечение, лечение модификаторами биологического ответа и определенные комбинации указанных выше способов.
Лучевая терапия в качестве неограничивающих примеров включает рентгеновское или гамма-излучение, которое предоставляют с применением внешнего источника излучения, такого как луч, или посредством имплантации небольшого источника радиоактивного излучения.
Химиотерапевтические средства представляют собой непептидные (т.е., небелковые) соединения, которые подавляют пролиферацию раковых клеток, и включают цитотоксические средства и цитостатические вещества. Неограничивающие примеры химиотерапевтических средств включают алкилирующие средства, нитрозомочевины, антиметаболиты, противоопухолевые антибиотики, растительные (барвинок) алкалоиды и стероидные гормоны.
Вещества, подавляющие клеточную пролиферацию, известны в данной области и широко применяются. Такие вещества включают алкилирующие средства, такие как азотистые иприты, нитрозомочевины, производные этиленимина, алкилсульфонаты и триазены, включая в качестве неограничивающих примеров мехлоретамин, циклофосфамид (CYTOXAN™), мелфалан (L-сарколизин), кармустин (BCNU), ломустин (CCNU), семустин (метил-CCNU), стрептозоцин, хлорзотоцин, урамустин, хролметин, ифосфамид, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бусульфан, дакарбазин и темозоломид.
Антиметаболиты включают аналоги фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозин деаминазы, включая в качестве неограничивающих примеров цитарабин (ЦИТОЗАР-U), цитозинарабинозид, фторурацил (5-FU), флоксуридин (FudR), 6-тиогуанин, 6-меркаптопурин (6-MP), пентостатин, 5-фторурацил (5-FU), метотрексат, 10-пропаргил-5,8-дидеазафолат (PDDF, CB3717), 5,8-дидеазатетрагидрофолиевую кислоту (DDATHF), лейковорин, фосфат флударабина, пентостатин и гемцитабин.
Подходящие натуральные вещества и их производные (например, алкалоиды барвинка, противоопухолевые антибиотики, ферменты, лимфокины, и эпиподофиллотоксины) в качестве неограничивающих примеров включают Ara-C, паклитаксел (ТАКСОЛ®), доцетаксел (ТАКСОТЕР®), дезоксисоформицин, митомицин-C, L-аспарагиназу, азатиоприн; бреквинар; алакалоиды, например, винкристин, винбластин, винорелбин, виндезин и т.д.; подофиллотоксины, например, этопозид, тенипозид и т.д.; антибиотики, например, антрациклин, даунорубицин гидрохлорид (дауномицин, рубидомицин, церубидин), идарубицин, доксорубицин, эпирубицин и морфолиновые производные и т.д.; феноксизон бисциклопептиды, например, дактиномицин; основные гликопептиды, например, блеомицин; антрахиноновые гликозиды, например, пликамицин (митрамицин); антрацендионы, например, митоксантрон; азиринопирроловые индолдионы, например, митомицин; макроциклические иммуносупрессоры, например, циклоспорин, FK-506 (такролимус, програф), рапамицин и т.д.; и т.п.
Другие антипролиферативные цитотоксические средства представляют собой навелбен, CPT-11, анастразол, летразол, капецитабин, релоксафин, циклофосфамид, ифозамид и дролоксафин.
Воздействующие на микротрубочки средства с антипролиферативной активностью также пригодны для использования и в качестве неограничивающих примеров включают аллоколхицин (NSC 406042), галихондрин B (NSC 609395), колхицин (NSC 757), производные колхицина (например, NSC 33410), долстатин 10 (NSC 376128), майтанзин (NSC 153858), ризоксин (NSC 332598), паклитаксел (ТАКСОЛ®), производные ТАКСОЛ®, доцетаксел (ТАКСОТЕР®), тиоколхицин (NSC 361792), тритил цистерин, винбластина сульфат, винкристина сульфат, натуральные и синтетические эпотилоны, включая в качестве неограничивающих примеров эпотилон A, эпотилон B, дискодермолид; эстрамустин, нокодазол и т.п.
Модуляторы гормонов и стероиды (включая синтетические аналоги), пригодные для использования, в качестве неограничивающих примеров включают адренокортикостероиды, например, преднизон, дексаметазон и т.д.; эстрогены и прогестины, например, гидроксипрогестерона капроат, медроксипрогестерона ацетат, мегестрола ацетат, эстрадиол, кломифен, тамоксифен и т.д.; и суппрессанты адренокотропных гормонов, например, аминоглютетимид; 17α-этинилэстрадиол; диэтилстилбестрол, тестостерон, флюоксиместерон, дромостанолона пропионат, тестолактон, метилпреднизолон, метил-тестостерон, преднизолон, триамцинолон, хлортрианизен, гидроксипрогестерон, аминоглютетимид, эстрамустин, медроксипрогестерона ацетат, леупролид, Флутамид (Дрогенил), Торемифен (Фарестон) и ZOLADEX®. Эстрогены стимулируют пролиферацию и дифференцировку, таким образом, соединения, связывающиеся с рецепторами к эстрогену, применяют для блокировки их активности. Кортикостероиды могут ингибировать пролиферацию Т-клеток.
Другие химиотерапевтические средства включают комплексные соединения с металлами, например, цисплатин (цис-DDP), карбоплатин, и т.д.; мочевины, например, гидроксимочевину; и гидразины, например, N-метилгидразин; эпидофиллотоксин; ингибитор топоизомеразы; прокарбазин; митоксантрон; лейковорин; тегафур; и т.д. Другие антипролиферативные средства, представляющие интерес, включают иммуносупрессоры, например, микофеноловую кислоту, талидомид, дезоксиспергуалин, азаспорин, лефлуномид, мизорибин, азаспиран (SKF 105685); IRESSA® (ZD 1839, 4-(3-хлор-4-фторфениламино)-7-метокси-6-(3-(4-морфолинил)пропокси)хиназолин); и т.д.
"Таксаны" включают паклитаксел, а также любые активные производные таксанов или пролекарственные средства. "Паклитаксел" (к которому в настоящем документе следует относить аналоги, составы, и производные, такие как, например, доцетаксел, ТАКСОЛ, ТАКСОТЕР (составы доцетаксела), 10-дезацетиловые аналоги паклитаксела и 3'N-дезбензоил-3'N-t-бутоксикарбониловые аналоги паклитаксела) можно легко получать с применением способов, известных специалистам в данной области.
Паклитаксел следует понимать не только как традиционную химически доступную форму паклитаксела, но и его аналоги и производные (например, ТАКСОТЕРТМ доцетаксел, как указано выше) и конъюгаты паклитаксела (например, паклитаксел-PEG, паклитаксел-декстран, или паклитаксел-ксилоза).
При лечении некоторых индивидуумов согласно способу по настоящему изобретению может быть желательным применение схемы лечения с высокими дозами в сочетании со средствами защиты не раковых клеток. При таком лечении можно применять любое средство, способное защитить не раковые клетки, такое как фолиновая кислота, производные фолата или лейковорин. Такие защитные средства хорошо известны специалистам в данной области. Защитные средства включают те, которые не препятствуют способности соединений по настоящему изобретению модулировать клеточные функции.
Введение фибриллярного белка
Введение фибриллярного белка можно проводить различными способами в различные части организма, включая внутриопухолевое, внутривенное, интрадермальное, подкожное, пероральное (например, ингаляция), трансдермальное (т.е., местное), трансмукозальное, интраперитонеальное, внутриартериальное и ректальное введение. Другие подходящие способы включают введение композиции перорально, буккально, назально, назофарингеально, парентерально, энтерально, гастрально, местно, трансдермально, подкожно, внутримышечно, в таблетках, твердой, порошковой, жидкой, аэрозольной формах, инъекцией в опухоль, инъекцией в соседние с опухолью ткани, внутривенным вливанием и внутриартериальным вливанием. Введение можно проводить местно или системно, с применением или без применения дополнительных эксципиентов. Введение также можно проводить посредством применения препарата пролонгированного действия в месте опухоли или вокруг места опухоли субъекта.
Специалист в данной области должен понимать, что доступен ряд подходящих способов введения состава по настоящему изобретению индивидууму или хозяину, например, пациенту, нуждающемуся в этом, и, хотя для доставки определенного состава можно использовать более одного способа, один способ может предоставлять более быстрый и более сильный эффект, чем другой.
Фраза "терапевтически эффективное количество" относится к количеству, которое обеспечивает желаемое действие при приемлемом соотношении польза/риск, что применяют к любому виду терапевтического лечения. Эффективное количество может варьировать в зависимости от таких факторов, как заболевание или состояние, которое подлежит лечению, определенные представляющие интерес компоненты, подлежащие введению, размер субъекта или тяжесть заболевания или состояния. Специалист в данной области может эмпирически определять эффективное количество конкретного соединения без необходимости проведения лишних экспериментов.
Согласно примерам реализации, белок можно вводить как часть композиции, что более подробно описано ниже. Композиция может быть представлена в различных формах, включая порошки, кремы, гели, бальзамы, мази, растворы, таблетки, капсулы, спреи и пластыри. Для доставки композиции пациенту можно использовать носители и переносчики. Такие носители включают солюбилизаторы, разбавители и диспергирующие среды. Эти носители являются биологически совместимыми и фармацевтически приемлемыми и не изменяют лечебные свойства фибриллярного белка. Эксципиенты, вспомогательные лекарственные средства и другие ингредиенты также можно включать в композицию.
Дозы
В способах вводят эффективное количество фибриллярного белка нуждающемуся в этом индивидууму. В частности, особый интерес представляют фибриллярные белки, которые ингибируют метастазирование рака у хозяина при введении фибриллярных белков в эффективном количестве. Вводимое количество варьирует в зависимости от цели введения, здоровья и физического состояния индивидуума, подлежащего лечению, возраста, таксономической группы индивидуума, подлежащего лечению (например, человек, не являющийся человеком примат, примат и т.д.), силы желаемого эффекта, состава композиции фибриллярного белка, оценки клинической ситуации лечащим врачом и других значимых факторов. Ожидают, что количество попадает в относительно широкий диапазон, который можно определять посредством рутинных испытаний. Например, количество фибриллярного белка, применяемого для подавления раковых метастазов, составляет не больше приблизительно того количества, которое в обратном случае может оказать необратимое токсическое воздействие на индивидуума (т.е., максимальная допустимая доза). В других случаях количество приблизительно равно или даже значительно ниже порога токсического действия, но, тем не менее, находится в диапазоне иммуноэффективных концентраций, или даже равно минимально эффективной дозе.
Индивидуальные дозы, как правило, составляют не менее, чем количество, необходимое для получения измеримого воздействия на субъекта, и их можно определять на основе фармакокинетики и фармакологии для абсорбции, распространения, метаболизма и выведения ("ADME") фибриллярного белка и его побочных продуктов и, таким образом, они основаны на фармакокинетике композиции в организме субъекта. Это включает рассмотрение пути введения, а также размера дозы, который можно устанавливать для местного (нанесение непосредственно на место желаемого воздействия для получения в основном местного эффекта), энтерального (введение через желудочно-кишечный тракт для получения системного или местного эффекта, поддерживаемого для участка желудочно-кишечного тракта) или парентерального (введение другими путями, отличными от желудочно-кишечного тракта, для получения системного или местного эффекта) применения. Например, введение фибриллярного белка проводят, как правило, посредством инъекции и часто внутривенного, внутримышечного, внутриопухолевого введения или их сочетания.
Фибриллярный белок можно вводить посредством вливания или посредством местной инъекции, например, посредством вливания со скоростью, составляющей приблизительно от 50 мг/ч до приблизительно 400 мг/ч, включая приблизительно от 75 мг/ч до приблизительно 375 мг/ч, приблизительно от 100 мг/ч до приблизительно 350 мг/ч, приблизительно от 150 мг/ч до приблизительно 350 мг/ч, приблизительно от 200 мг/ч до приблизительно 300 мг/ч, приблизительно от 225 мг/ч до приблизительно 275 мг/ч. Приведенные в качестве примера скорости вливания могут обеспечивать желаемые терапевтические дозы, составляющие, например, приблизительно от 0,5 мг/м2/сутки до приблизительно 10 мг/м2/сутки, включая приблизительно от 1 мг/м2/сутки до приблизительно 9 мг/м2/сутки, приблизительно от 2 мг/ м2/сутки до приблизительно 8 мг/м2/сутки, приблизительно от 3 мг/м2/сутки до приблизительно 7 мг/м2/сутки, приблизительно от 4 мг/м2/сутки до приблизительно 6 мг/м2/сутки, приблизительно от 4,5 мг/м2/сутки до приблизительно 5,5 мг/м2/сутки. Введение (например, посредством вливания) можно повторять через желаемые промежутки времени, например, через период, составляющий приблизительно от 1 суток до приблизительно 5 суток, или каждые несколько суток, например, приблизительно каждые пять суток, через приблизительно каждый месяц, приблизительно каждые 2 месяца и т.д. Введение также можно проводить до, во время или после других терапевтических вмешательств, таких как хирургическое вмешательство для удаления раковых клеток. Фибриллярный белок также можно вводить как часть комбинированного лечения, при котором к субъекту применяют, по меньшей мере, один из способов, включающих иммунотерапию, химиотерапию рака или лучевую терапию (как более детально описано ниже).
Фармакокинетику фибриллярного белка и его соответствующую биологическую активность у индивидуума, как правило, оценивают по фракции фибриллярного белка, присутствующей в месте назначения. Например, введенный фибриллярный белок может накапливаться с гликоконъюгатами или другими биологическими мишенями, которые концентрируют вещества в раковых клетках и тканях рака. Таким образом, режимы дозирования, при которых фибриллярный белок вводят с тем, чтобы он постепенно накапливался в заданном участке, могут быть частью стратегии, позволяющей понижать индивидуальные дозы. Это также может означать, что, например, дозу фибриллярного белка, который более медленно расходуется in vivo, можно понижать по сравнению с эффективной концентрацией, рассчитанной на основе анализов in vitro (например, эффективное количество in vitro приближается к концентрации мМ, по сравнению с менее чем мМ концентрацией in vivo).
В качестве примера эффективное количество для дозы или режима дозирования можно рассчитывать на основе IC50 данного фибриллярного белка для ингибирования клеточной миграции. Под "IC50" понимают концентрацию лекарственного средства, необходимую для 50% ингибирования in vitro. Альтернативно, эффективное количество можно рассчитывать на основе концентрации EC50 данного фибриллярного белка. Под "EC50" понимают концентрацию в плазме, необходимую для обеспечения 50% максимального эффекта in vivo. В связанных вариантах осуществления дозирование также можно определять на основе ED50 (эффективная доза).
Как правило, в отношении фибриллярного белка по настоящему изобретению эффективное количество составляет обычно не более 200X рассчитанной IC50. Как правило, количество вводимого фибриллярного белка составляет менее чем приблизительно 200X, менее чем приблизительно 150X, менее чем приблизительно 100X и во многих вариантах осуществления менее чем приблизительно 75X, менее чем приблизительно 60X, 50X, 45X, 40X, 35X, 30X, 25X, 20X, 15X, 10X и даже менее чем приблизительно 8X или 2X рассчитанной IC50. В одном из вариантов осуществления эффективное количество составляет приблизительно от 1X до 50X рассчитанной IC50 и иногда составляет приблизительно от 2X до 40X, приблизительно от 3X до 30X или приблизительно от 4X до 20X рассчитанной IC50. В других вариантах осуществления эффективное количество равно рассчитанной IC50, и в определенных вариантах осуществления эффективное количество представляет собой количество, превышающее рассчитанную IC50.
Эффективное количество не может превышать 100X рассчитанной EC50. Например, количество вводимого фибриллярного белка составляет менее чем приблизительно 100X, менее чем приблизительно 50X, менее чем приблизительно 40X, 35X, 30X или 25X, и во многих вариантах осуществления менее чем приблизительно 20X, менее чем приблизительно 15X и даже менее чем приблизительно 10X, 9X, 9X, 7X, 6X, 5X, 4X, 3X, 2X или 1X рассчитанной EC50. Эффективное количество может составлять приблизительно от 1X до 30X рассчитанной EC50 и иногда приблизительно от 1X до 20X или приблизительно от 1X до 10X рассчитанной EC50. Эффективное количество также может быть равно рассчитанной EC50 или превышать рассчитанную EC50. IC50 можно рассчитывать на основе ингибирования клеточной миграции/инвазии in vitro. Расчет можно проводить известными в данной области способами или способами, описанными в примерах ниже.
Эффективные количества для дозы и/или режима дозирования можно легко определять эмпирически на основе анализов, на основе исследований безопасности, исследований с увеличением дозы и исследований для определения диапазона доз, на основе личных отношений врача и пациента, а также на основе анализов in vitro и in vivo, таких как анализы, описываемые в настоящем документе и проиллюстрированные в разделе экспериментов ниже. Например, концентрация, используемая для применения рассматриваемого способа у мышей, варьирует от приблизительно 1 мг/кг до приблизительно 25 мг/кг в зависимости массы тела мыши. На основе этих данных, концентрация фибриллярного белка, который можно применять для человека, может варьировать, например, от приблизительно 0,083 мг/кг до приблизительно 2,08 мг/кг. Другие дозы можно определять на основе экспериментов, использующих модели на животных, с применением известных в данной области способов (Reagan-Shaw et al. (2007) The FASEB Journal 22:659-661).
Фармацевтические составы
Также предоставлены фармацевтические композиции, содержащие фибриллярный белок, применяемый в способах лечения, описанных выше. Термин "композиция фибриллярного белка" применяют в настоящем документе для удобства и относят в целом к композициям, содержащим фибриллярный белок по настоящему изобретению, включая конъюгированный фибриллярный белок, или оба белка. Композиции, применяемые для подавления роста и/или метастазирования раковых клеток, описаны ниже.
Композиции фибриллярного белка, например, в форме фармацевтически приемлемой соли, можно формулировать для перорального, местного или парентерального введения, как описано выше. В определенных вариантах осуществления, например, в случае, когда фибриллярный белок вводят в инъецируемой жидкой форме (такой, как в вариантах осуществления, в которых его вводят внутривенно или непосредственно в ткань), композицию фибриллярного белка предоставляют в виде готовой к применению лекарственной формы или в виде восстанавливаемого способного к долгому хранению порошка или жидкости, составленной из фармацевтически приемлемых носителей и эксципиентов.
Способы получения фибриллярного белка, подходящего для введения индивидууму (например, человеку), описаны ниже и в US Pat Pub No. 2008/0300186, который включен в настоящий документ посредством ссылки. Пример способа получения фибриллярного белка может включать фармацевтическую композицию, содержащую эффективное количество фибриллярного белка и фармацевтические эксципиенты (например, физиологический раствор). Фармацевтическая композиция может необязательно включать другие добавки (например, буферы, стабилизаторы, консерванты и т.п.). Эффективное количество фибриллярного белка может представлять собой количество, эффективное для обеспечения подавления раковых метастазов (например, миграции и/или инвазии рака). Терапевтическую цель (например, уменьшение массы опухоли и/или сдерживание роста рака) можно достигать с применением разовой или многократной дозы при различных схемах дозирования.
Концентрация фибриллярного белка в фармацевтических составах может варьировать от менее чем приблизительно 0,1%, как правило, от или, по меньшей мере, приблизительно от 2% до 20% до 50% или более по массе, и ее выбирают преимущественно на основе объема жидкости, вязкости и т.д. согласно конкретному выбранному способу введения и нуждам пациента. Полученные композиции могут быть представлены в форме раствора, суспензии, таблетки, пилюли, капсулы, порошка, геля, крема, лосьона, мази, аэрозоля или т.п. Существующие способы получения парентерально вводимых композиций известны или ясны специалистам в данной области и более подробно описаны в таких публикациях, как Remington's Pharmaceutical Science, 18th ed., Mack Publishing Company, NY (1995).
По другому аспекту настоящего изобретения фибриллярный HSA можно включать в фармацевтическую или нутрицевтическую композицию вместе с дополнительными активными средствами, носителями, переносчиками, эксципиентами или вспомогательными средствами, которые будут ясны специалистам в данной области по прочтении настоящей заявки.
Фармацевтические или нутрицевтические композиции предпочтительно содержат, по меньшей мере, один фармацевтически приемлемый носитель. В таких фармацевтических композициях фибриллярный HSA или эквиваленты фибриллярного HSA образуют "активное соединение", также обозначаемое как "активное средство". Как применяют в настоящем документе, понятие "фармацевтически приемлемый носитель" включает растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание средства и т.п., приемлемые для фармацевтического введения. Дополнительные активные соединения также можно включать в композиции. Фармацевтическую композицию формулируют с тем, чтобы она была приемлема для предполагаемого пути введения. Примеры путей введения включают парентеральное, например, внутривенное, интрадермальное, подкожное, пероральное (например, ингаляция), трансдермальное (местое), трансмукозальное и ректальное введение. Растворы или суспензии, применяемые для парентерального, интрадермального или подкожного введения могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, жирные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и средства для регулирования тоничности, такие как хлорид натрия или декстроза. pH можно регулировать с применением кислот или оснований, таких как соляная кислота или гидроксид натрия. Парентеральный препарат можно заключать в ампулы, одноразовые шприцы или сосуды для многократных доз, выполненные из стекла или пластика.
Фармацевтические композиции, подходящие для проведения инъекции, включают стерильные водные растворы (водорастворимые) или суспензии и стерильные порошки немедленного получения стерильных инъецируемых растворов или суспензий. Подходящие носители для внутривенного введения включают физиологический раствор, бактериостатическую воду, Cremophor® EL (BASF, Parsippany, N.J.) или фосфатно-солевой буфер (PBS). Во всех случаях композиция должна быть стерильной и текучей в той степени, которая обеспечивает возможность введения через шприц. Она должна быть стабильной в условиях получения и хранения и должна быть защищена от инфицирующего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленовый гликоль и т.п.) и их подходящие смеси. Необходимую текучесть можно поддерживать, например, посредством применения покрытия, такого как лецитин, посредством поддержания необходимого размера частиц в случае суспензии и посредством применения поверхностно-активных веществ. Предотвращение воздействия микроорганизмов можно обеспечивать посредством применения различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Согласно вариантам осуществления в композицию добавляют средства придания изотоничности, например, сахара, полиспирты, такие как маннит, сорбит или хлорид натрия. Замедленное всасывание инъекционных композиций можно обеспечивать посредством включения в композицию средства, которое замедляет всасывание, например, алюминия моностеарата и желатина.
Стерильные инъецируемые растворы можно получать посредством включения активного соединения в необходимом количестве в подходящий растворитель с одним ингредиентом или смесью ингредиентов, указанных выше, по мере необходимости, с последующей фильтрующей стерилизацией. Как правило, суспензии получают посредством включения активного соединения в стерильный носитель, который содержит основную диспергирующую среду и другие необходимые ингредиенты, указанные выше. В случае стерильных порошков для получения стерильных инъецируемых растворов препарат получают посредством вакуумной сушки или лиофилизации, в результате чего получают порошок активного ингредиента в смеси с любым дополнительным необходимым ингредиентом в растворе, который предварительно подвергают фильтрующей стерилизации.
Известно, что при пероральном введении фибриллярный белок необходимо защищать от переваривания. Как правило, это обеспечивают посредством соединения фибриллярного белка с композицией, которая обеспечивает его устойчивость к кислотному и ферментативному гидролизу, или посредством заключения его в носитель, характеризующийся соответствующей устойчивостью, такой как липосома. Способы защиты представляющего интерес соединения от переваривания хорошо известны в данной области.
Пероральные композиции, как правило, включают инертный разбавитель или съедобный носитель. Для проведения перорального терапевтического введения активное соединение можно объединять с эксципиентами и применять в форме таблетки, пастилки или капсулы, например, желатиновой капсулы. Пероральные композиции также можно получать с применением жидкого носителя для применения в качестве ополаскивателя для рта. В композицию можно включать фармацевтически совместимые связывающие средства, или вспомогательные средства. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любой из следующих ингредиентов или соединения со сходными свойствами: связывающее средство, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующее средство, такое как альгиновая кислота, Примогель или кукурузный крахмал; смазочное средство, такое как стеарат магния или Стеротес; способствующее скольжению средство, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метил салицилат, или клубничный, вишневый, виноградный, лимонный или апельсиновый ароматизатор.
Для введения посредством ингаляции соединения доставляют в форме спрей-аэрозоля из контейнера под давлением или распылителя, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или небулайзера.
Для увеличения времени полувыведения из сыворотки инъецируемые препараты фибриллярного белка также можно заключать в капсулы, заключать в полость липосомы, получать в форме коллоидного раствора, пегилировать (Greenwald et al. (2003) Advanced Drug Delivery Rev. 55:217-250; Pasut et al. (2004) Expert Opin. Ther. Patents 14:859-894) или применять другие общепринятые способы, которые обеспечивают более продолжительное время полувыведения из сыворотки. Для получения липосомы доступен ряд способов, как описано, например, в Szoka et al. (1980) Ann. Rev. Biophys. Bioeng. 9:467, патентах США №№ 4235871, 4501728 и 4837028. Также препараты можно получать в формах, обеспечивающих контролируемое высвобождение или замедленное высвобождение для высвобождения и введения композиций фибриллярного белка в виде смесей или последовательно применяемых компонентов.
Согласно вариантам осуществления интравитреальную инъекцию проводят с применением основанных на PLGA микрочастиц или наночастиц (липосом). Также можно использовать основанные на PEG составы. Таким образом, другие способы для инъецируемых фармацевтических композиций применяют специально для интравитреальной инъекции.
Системное введение также может быть трансмукозальным или трансдермальным. Для трансмукозального или трансдермального введения в составе применяют пенетранты, подходящие для барьера, который необходимо преодолеть. Такие пенетранты широко известны в данной области и включают, например, в случае трансмукозального введения, детергенты, соли желчных кислот и производные фусидовой кислоты. Трансмукозальное введение можно проводить с применением назальных спреев или суппозиториев. В случае трансдермального введения активные соединения включают в мази, бальзамы, гели или кремы, широко известные в данной области. Соединения также можно получать в форме суппозиториев (например, с общепринятыми основами для суппозиториев, такими как масло какао и другие глицериды) или удерживающих клизм для ректального введения.
В дополнение к другим способам доставки, соединения доставляют в глазных каплях или посредством интраокулярной инъекции. В отношении глазных капель композиции по настоящему изобретению необязательно содержат один или несколько эксципиентов, предназначенных для местного применения в глаз или нос. Эксципиенты, широко используемые в фармацевтических композициях, предназначенных для местного применения в глаза, такие как растворы или спреи, в качестве неограничивающих примеров включают средства придания тоничности, консерванты, хелатирующие средства, буферные средства, поверхностно-активные вещества и антиоксиданты. Подходящие средства для регуляции тоничности включают маннит, хлорид натрия, глицерин, сорбит и т.п. Подходящие консерванты включают сложный эфир п-гидроксибензойной кислоты, хлорид бензалкония, бензододециния бромид, поликватерниум-1 и т.п. Подходящие хелатирующие средства включают эдетат натрия и т.п. Подходящие буферные средства включают фосфаты, бораты, цитраты, ацетаты и т.п. Подходящие поверхностно-активные вещества включают ионные и неионные поверхностно-активные вещества, хотя предпочтительны неионные поверхностно-активные вещества, такие как полисорбаты, производные полиэтоксилированного касторового масла и полимер оксиэтилированного третичного октилфенола формальдегида (тилоксапол). Подходящие антиоксиданты включают сульфиты, аскорбаты, BHA и BHT. Композиции по настоящему изобретению необязательно содержат дополнительное активное средство. За исключением необязательного консервирующего ингредиента (например, поликватерниум-1), композиции по настоящему изобретению предпочтительно не содержат полимерных ингредиентов, отличных от поливинилпирролидона или полистиролсульфоновой кислоты.
Если композиции по настоящему изобретению содержат поливинилпирролидон, поливинилпирролидоновый ингредиент предпочтительно выбирают или применяют с тем, чтобы минимизировать содержание пероксида. Партии свежеполученного поливинилпирролидона более предпочтительны, чем старые партии. Дополнительно, особенно в тех случаях, когда композиция содержит более 0,5% поливинилпирролидона, поливинилпирролидоновый ингредиент необходимо термально обрабатывать (т.е., нагревать до температуры, превышающей комнатную температуру) перед смешиванием с олопатадином для снижения количества пероксидов в поливинилпирролидоновом ингредиенте и уменьшения влияния пероксидов на химическую стабильность олопатадина. Несмотря на то, что длительная термальная обработка водного раствора поливинилпирролидона значительно сокращает количество пероксидов, это может приводить к изменению окраски (от желтого к желто-коричневому) раствора поливинилпирролидона. Чтобы значительно уменьшать количество или устранять пероксиды без изменения окраски раствора поливинилпирролидона, pH водного раствора поливинилпирролидона необходимо приводить к pH, составляющему 11-13, перед температурной обработкой. При более высоком pH раствора поливинилпирролидона для обеспечения значительного сокращения количества пероксида требуются значительно более короткие периоды нагревания.
Один подходящий способ термальной обработки поливинилпирролидонового ингредиента представляет собой следующий. Сначала растворяют поливинилпирролидоновый ингредиент в очищенной воде с получением 4-6% раствора, затем поднимают pH раствора до pH 11-13 (эффективный диапазон pH составляет 11-11,5), затем нагревают до температуры, находящейся в диапазоне 60-121°C, предпочтительно 65-80°C и наиболее предпочтительно 70-75°C. Повышенную температуру следует поддерживать в течение приблизительно 30-120 минут (предпочтительно 30 минут). После охлаждения нагретого раствора охлаждают до комнатной температуры к нему добавляют HCl для приведения pH к значению 3,5-8, в зависимости от необходимого pH для композиции олопатадина.
В частности, в случае композиций, предназначенных к доставке в виде глазных капель, композиции предпочтительно содержат средство, регулирующее тоничность, в количестве, достаточном для обеспечения офтальмически приемлемой осмоляльности композиции (как правило, 150-450 мОсм, предпочтительно 250-350 мОсм). pH глазных композиций по настоящему изобретению предпочтительно составляет 4-8, предпочтительно составляет 6,5-7,5 и наиболее предпочтительно составляет 6,8-7,2.
Композиции глазных капель по настоящему изобретению предпочтительно упаковывают в контейнеры из непрозрачного пластика. Предпочтительный контейнер для глазной композиции представляет собой контейнер из полиэтилена с низкой плотностью, стерилизованный с применением оксида этилена вместо гамма-облучения.
В отношении глазных инъецируемых средств фармацевтические композиции по настоящему изобретению вводят в область, нуждающуюся в лечении, посредством субконъюктивального введения. Один предпочтительный способ субконъюктивального введения в глаз включает инъецируемые составы, содержащие фармацевтические композиции, описываемые в настоящем документе. Другой предпочтительный способ субконъюктивального введения включает имплантанты, содержащие композиции пролонгированного высвобождения.
Композиции, доставляемые субконъюктивально, содержат, по вариантам осуществления, глазной состав пролонгированного действия, содержащий активное средство для субконъюктивального введения. По вариантам осуществления глазной состав пролонгированного действия содержит микрочастицы в основном очищенного активного средства. Применяемые микрочастицы можно включать в вещество для получения капсул, которое представляет собой биосовместимый фармацевтически приемлемый полимер или липид. Составы пролонгированного действия можно получать с тем, чтобы высвобождать все или большинство активных средств в течение длительного периода времени. Полимерную или липидную матрицу, при ее наличии, можно получать с тем, чтобы она разрушалась со степенью, достаточной для удаления с места введения после высвобождения всех или большинства активных средств. Состав пролонгированного действия может представлять собой жидкий состав, содержащий фармацевтически приемлемый полимер и растворенное или дисперсное активное средство. При инъекции полимер образует средство пролонгированного действия в месте инъекции, например, посредством гелификации или осаждения.
Твердые устройства, подходящие для имплантации в глаз, можно также выполнять с тем, чтобы они содержали полимеры и были биоразрушаемыми или не биоразрушаемыми. Биоразрушаемые полимеры, которые можно использовать при получении глазных имплантатов, несущих композиции по настоящему изобретению, включают в качестве неограничивающих примеров алифатические сложные полиэфиры, так как полимеры и сополимеры поли(гликолид), поли(лактид), поли(e-капролактон), поли(гидроксибутират) и поли(гидроксивалерат), полиаминокислоты, полиортоэфиры, полиангидриды, алифатические поликарбонаты и простые полиэфиры лактоны. Примеры подходящих не биоразрушаемых полимеров включают силиконовые эластомеры.
По вариантам осуществления активные соединения соединяют с носителями, которые защищают соединение от быстрого удаления из организма, такими как состав с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Можно использовать биоразрушаемые биосовместимые полимеры, такие как винилацетат этилена, полиангидриды, полигликолевую кислоту, коллаген, полиортоэфиры и полимолочную кислоту. Способы получения таких составов известны специалистам в данной области. Материалы также можно коммерчески получать в Alza Corporation и Nova Pharmaceutics, Inc. Также в качестве фармацевтически приемлемых носителей можно использовать липосомные суспензии (включая липосомы, направленные на инфицированные клетки, с моноклональными антителами к клеточно-специфичным антигенам).
Композицию фибриллярного белка можно вводить в виде одного фармацевтического состава. Ее также можно вводить с эффективным количеством другого средства, которое включает другие подходящие соединения и носители, и также можно использовать в комбинации с другими активными средствами. Настоящее изобретение, таким образом, также включает фармацевтические композиции, содержащие фармацевтически приемлемые эксципиенты.
Фармацевтически приемлемые эксципиенты включают, например, любые подходящие носители, вспомогательные средства, носители или разбавители, и легко доступны неограниченному кругу лиц. Фармацевтические композиции по настоящему изобретению могут далее содержать другие активные средства, хорошо известные в данной области. Фармацевтически приемлемые эксципиенты также хорошо известны специалистам в данной области и являются легкодоступными.
Например, композиции фибриллярного белка можно смешивать с общепринятыми фармацевтически приемлемыми носителями и эксципиентами (т.е., переносчиками) и применять в форме водных растворов, таблеток, капсул, эликсиров, суспензий, сиропов, пастилок, пластырей и т.п., однако, как правило, фибриллярный белок предоставляют в виде инъецируемого средства. Фармацевтические композиции могут содержать обычные носители и эксципиенты, такие как кукурузный крахмал или желатин, лактозу, декстрозу, сахарозу, микрокристаллическую целлюлозу, каолин, маннит, дифосфат кальция, хлорид натрия и альгиновую кислоту. Дезинтегрирующие средства, широко используемые в составах, включают кроскармеллозу, микрокристаллическую целлюлозу, кукурузный крахмал, крахмалгликолят натрия и альгиновую кислоту. Можно также включать консерванты и т.п. Все эти компоненты хорошо известны в данной области. Такие фармацевтические композиции содержат в определенных вариантах осуществления приблизительно от 0,1% до приблизительно 90% по массе активного соединения, и в более общем смысле приблизительно от 1% до приблизительно 30% по массе активного соединения. См., например, патент США № 5985310, заявка которого включена в настоящий документ в качестве ссылки.
Композиции фибриллярного белка можно предоставлять в фармацевтически приемлемом эксципиенте, который может представлять собой раствор, такой как водный раствор, часто физиологический раствор, или их можно предоставлять в форме порошка. Композиции фибриллярного белка могут содержать другие компоненты, такие как фармацевтические категории маннита, лактозы, крахмала, стеарата магния, натрия сахарина, талька, целлюлозы, глюкозы, сахарозы, магния, карбоната и т.п. Композиции могут содержать фармацевтически приемлемые вспомогательные средства, необходимые для обеспечения соответствия физиологическим условиям, такие как средства для регуляции pH и буферные средства, средства для регуляции токсичности и т.п., например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.п.
Выбор эксципиента частично определяется конкретным соединением, а также конкретным способом, применяемым для введения композиции. Таким образом, существует широкий спектр подходящих составов фармацевтической композиции по настоящему изобретению. Следующие способы и эксципиенты предоставлены в качестве примера и не предназначены для ограничения.
Жидкая композиция, как правило, представляет собой суспензию или раствор соединения или фармацевтически приемлемую соль в подходящем жидком носителе(носителях), например, в этаноле, глицерине, сорбите, неводном растворителе, таком как полиэтиленгликоль, масло или вода, с суспендирующим средством, консервантом, поверхностно-активным веществом, средством для смачивания, ароматизатором или красителем. Альтернативно, жидкий состав можно получать из восстанавливаемого порошка.
Составы, подходящие для парентерального введения, включают водные и неводные, изотонические стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферы, бактериостатические вещества, и растворы, которые обеспечивают изотоничность состава с кровью предполагаемого пациента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства, растворители, загустители, стабилизаторы и консерванты. Составы можно получать в запечатанных контейнерах для однократной дозы или многократных доз, таких как ампулы и флаконы, и их можно хранить в сублимированном (лиофилизированном) состоянии, при котором для инъекции требуется только добавление стерильного жидкого эксципиента, например, воды, непосредственно перед применением. Приготовленные для немедленного применения растворы для инъекции и суспензии можно получать из стерильных порошков, гранул и таблеток видов, описанных выше.
Фибриллярные белки по настоящему изобретению и их фармацевтически приемлемые соли, активные при парентеральном введении, можно формулировать для внутримышечного, интратекального или внутривенного введения. Типичная композиция для внутримышечного или интратекального введения представляет собой суспензию или раствор активного ингредиента в масле, например, арахисовом масле или кунжутном масле. Типичная композиция для внутривенного или интратекального введения представляет собой стерильный изотонический водный раствор, содержащий, например, активный ингредиент и декстрозу или хлорид натрия или смесь декстрозы и хлорида натрия. Другие примеры включают раствор Рингера с лактатом для инъекции, раствор Рингера с лактатом и декстрозой для инъекции, Normosol-M и декстрозу, Isolyte E, ацилированный раствор Рингера для инъекции и т.п. В состав необязательно можно включать сорастворитель, например, полиэтиленгликоль, хелатирующее средство, например, этилендиамин тетрауксусную кислоту, и антиоксидант, например, пиросульфит натрия. Альтернативно, раствор можно лиофилизировать, а затем восстанавливать с применением подходящего растворителя непосредственно перед введением.
Фибриллярные белки по настоящему изобретению и их фармацевтически приемлемые соли, активные при ректальном введении, можно формулировать в форме суппозиториев. Типичный суппозиторий, как правило, состоит из активного ингредиента со связующим веществом и/или смазкой, такой как желатин или масло какао или другие низкоплавкие растительные или синтетические воски или жиры.
Фибриллярные белки по настоящему изобретению и их фармацевтически приемлемые соли, активные при местном введении, можно формулировать в форме трансдермальных композиций или трансдермальных средств доставки ("пластыри"). Такие композиции включают, например, основу, источник активного соединения, контрольную мембрану, покровный материал и контактный клей. Такие трансдермальные пластыри можно использовать для предоставления непрерывного или прерываемого введения соединений по настоящему изобретению в регулируемых количествах. Способы получения и применения трансдермальных пластырей для доставки фармацевтических средств хорошо известны в данной области. См., например, патент США № 5023252, включенный в настоящий документ в качестве ссылки в полном объеме. Такие пластыри можно получать для непрерывной доставки, прерываемой доставки или доставки по необходимости фармацевтических средств.
Составы по настоящему изобретению также можно получать в виде аэрозолей, которые вводят посредством ингаляции. Эти аэрозоли можно заключать в приемлемые пропелленты под давлением, такие как дихлордифторметан, пропан, азот и т.п. Также их можно получать в виде фармацевтических средств для составов, не находящихся под давлением, таких как для применения в небулайзере или аэрозольном ингаляторе.
Составы, подходящие для местного введения, можно получать в виде кремов, гелей, паст или пен, содержащих, в дополнение к активному ингредиенту, носители, известные в данной области как подходящие.
Составы суппозиториев также получают посредством смешивания с рядом основ, таких как эмульгирующие основы или водорастворимые основы. Составы, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен.
Можно предоставлять стандартные лекарственные формы для перорального или ректального введения, такие как сиропы, эликсиры и суспензии, где каждая единица дозирования, например, чайная ложка, столовая ложка, таблетка или суппозиторий, содержит определенное количество композиции, содержащей один или несколько фибриллярных белков. Так же, стандартные лекарственные формы для инъекции или внутривенного введения могут содержать фибриллярный белок (белки) в композиции в виде раствора в стерильной воде, обычном физиологическом растворе или другом фармацевтически приемлемом носителе.
Как применяют в настоящем документе, термин "стандартная лекарственная форма" относится к физически дискретным единицам, подходящим в качестве стандартных доз для человека и животного, где каждая единица содержит определенное количество соединений по настоящему изобретению, рассчитанное как количество, достаточное для получения желаемого действия, в смеси с фармацевтически приемлемым разбавителем, носителем или переносчиком. Характеристики новых стандартных лекарственных форм по настоящему изобретению зависят от конкретного применяемого соединения и эффекта, который необходимо получить, а также фармакодинамики в организме хозяина, характерной для каждого соединения.
Специалисты в данной области должны понимать, что размер дозы может варьировать в зависимости от функций конкретного фибриллярного белка, свойств носителя и т.п. Подходящие дозы для данного соединения будут легко установлены специалистами в данной области посредством ряда способов.
Токсичность и терапевтическую эффективность таких соединений можно определять стандартными фармацевтическими способами с применением клеточных культур или экспериментальных животных, например, для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Соотношение между токсическими и терапевтическими эффектами дозы представляет собой терапевтический индекс, и его можно выражать как соотношение LD50/ED50. Соединения, характеризующиеся высокими терапевтическими индексами, являются предпочтительными. Хотя можно использовать соединения, которые характеризуются токсическими побочными эффектами, необходимо внимательно разрабатывать систему доставки, которая направляет такие соединения к месту пораженной ткани, с тем, чтобы минимизировать возможные повреждения непораженных клеток и, таким образом, сокращать побочные эффекты.
Данные, полученные при анализе клеточных культур и исследований на животных, можно использовать при расчете диапазона доз для применения для человека. Дозы таких соединений находятся предпочтительно в диапазоне циркулирующих концентраций, которые включают ED50 с низкой токсичностью или отсутствием токсичности. Дозы могут варьировать в пределах этого диапазона в зависимости от применяемой лекарственной формы и применяемого пути введения. Для любого соединения, применяемого в способе по изобретению, терапевтически эффективную дозу можно устанавливать заранее на основе анализов клеточных культур. Дозу можно определять в моделях на животных для получения диапазона циркулирующих концентраций в плазме, который включает IC50 (т.е., концентрацию тестируемого соединения, которая обеспечивает половину от максимального ингибирования симптомов), как определено на основе анализа клеточной культуры. Такие данные можно использовать для более точного применения подходящих для человека доз. Уровни в плазме можно измерять, например, посредством высокоэффективной жидкостной хроматографии.
Термин "эффективное количество" относится к количеству биологически активных молекул или конъюгата или их производного, достаточному для получения заметного терапевтического эффекта без чрезмерных нежелательных побочных эффектов (таких как токсичность, раздражение и аллергический ответ) в соответствии с приемлемым соотношением польза/риск при применении способом по изобретению. Терапевтический эффект может включать, например, не ограничиваясь этим, значительную цитотоксичность в отношении раковых клеток, но меньшую цитотоксичность в отношении здоровых клеток. Эффективное количество для субъекта зависит от типа субъекта, размера и здоровья субъекта, свойств и тяжести подлежащего лечению состояния, способа введения, продолжительности лечения, характеристик сопутствующего лечения (при его наличии), конкретных применяемых составов и т.п. Таким образом, заранее определить точное эффективное количество невозможно. Однако эффективное количество для данной ситуации могут определять специалисты в данной области с применением общепринятого экспериментирования, основанного на данных, предоставленных в настоящем документе.
Способы получения фибриллярного белка
Согласно настоящему изобретению, описан способ лечения метастазов рака посредством введения фибриллярного белка. Фибриллярный белок может представлять собой природный белок и, в таком случае, его можно выделять с применением известных в данной области способов для применения в способе лечения, описанном выше. Фибриллярный белок также можно получать искусственно посредством любого известного в данной области способа, например, посредством изменения структуры глобулярного белка на структуру фибриллярного белка. В одном примере фибриллизацию белков можно индуцировать способом без применения фибриллы-затравки, как описано в US Pat Pub No.2008/0800186, описание которой включено в настоящий документ в качестве ссылки. Этот способ имеет преимущества, которые включают легкость контроля, однородность получаемого белка и возможность увеличения количества получаемого белка. Кроме того, фибриллизацию белков можно индуцировать этим способом без применения фибриллы-затравки. В этом способе можно применять даже очень небольшое количество белка. Как применяют в настоящем документе, "белок" включает один или несколько белков, белковых фрагментов, полипептидов или пептидов. Белки включают как синтетические, так и природные белки.
Согласно способу, раскрытому ранее в US Pat Pub No.2008/0800186, в этом способе можно применять даже очень небольшое количество белка. Как применяют в настоящем документе, "белок" включает один или несколько белков, белковых фрагментов, полипептидов или пептидов. Белки включают как синтетические, так и природные белки. Способ можно использовать для перевода природных белов, независимо от их последовательности, в фибриллярную форму простым и быстрым способом. Способ включает этапы растворения глобулярного белка в растворе, который содержит детергенты, и внесение раствора в колонку для разделения молекул по размеру, которая позволяет разделять белки с молекулярной массой, составляющей 70 кДа или более, и элюирование белка из раствора, содержащего детергент. В примере реализации способ включает этапы получения глобулярного белка, получения раствора, содержащего глобулярный белок, добавление детергента к раствору, содержащему глобулярный белок, и внесение раствора в колонку для разделения молекул по размеру с размером пор, позволяющим разделять белки с молекулярной массой, составляющей 70 кДа или более, необязательно при низкой концентрация детергента.
Глобулярные белки представляют собой один из двух основных классов белков по третичной структуре. Глобулярные белки, как правило, растворимы и в воде образуют сферические молекулы. Они характеризуются сложной вторичной структурой, содержащей комбинации мотивов вторичной структуры, таких как α-спирали, β-спирали и петли. Другой основной класс белков по третичной структуре образуют фибриллярные белки, или фиброзные белки. Фибриллярные белки, как правило, нерастворимы и характеризуются вытянутой формой. Они обладают более простой вторичной структурой, часто основанной всего на одном типе мотива вторичной структуры. В примерах реализации глобулярный белок представляет собой альбумин, например, сывороточный альбумин человека, фибронектин и т.д. Также можно использовать рекомбинантные неструктурированные белки, которые выделяют из телец включения E. coli с применением 8M мочевины, например, рекомбинантный капсидный белок VP1 вируса ящура (rVP1), рекомбинантный капсидный белок VP2 вируса ящура (rVP2), рекомбинантный капсидный белок VP3 вируса ящура (rVP3) или белок-предшественник P1 белков VP1, VP2, VP3 и VP4. Белок может также представлять собой химерный белок, содержащий части VP1, VP2, VP3 и/или VP4, например, VP42, который содержит части как VP2, так и VP4. Также можно использовать другие глобулярные белки (например, бычий сывороточный альбумин), включая как природные белки, так и синтетические олигопептиды.
Поверхностно-активные вещества, которые в настоящем документе также называют детергентами, представляют собой вещества, которые понижают поверхностное натяжение воды и увеличивают растворимость органических соединений. Детергенты могут быть ионными, включая катионные, анионные и цвиттер-ионные детергенты, а также неионными. Детергенты выполняют функцию разрушения нековалентных связей в белках, тем самым денатурируя белки, в результате чего они теряют свою природную форму или конформацию. В примерах реализации применяемый детергент представляет собой додецилсульфат натрия (SDS), полученный в Sigma. В других примерах реализации применяемый детергент представляет собой Цвиттергент 3-14, полученный в Calbiochem.
Амилоиды представляют собой фибриллярные белковые агрегаты с β-связями. Многие белки способны к формированию амилоид-подобных волокон с характеристиками, которые включают фибриллярную морфологию, субструктуру из протофиламентов, дифракционную картину с бета-тяжами, усиленную бета-структуру, окрашивание красителем Конго красным и связывание с ThT. В примерах реализации глобулярный белок изменяют с формированием амилоид-подобных фибрилл, что позволяет идентифицировать измененный белок по его амилоид-подобным свойствам.
Белок для лечения рака можно выбирать на основании тяжести заболевания и желаемой цитотоксичности в отношении раковых клеток. В примерах реализации выбирают наибольшую цитотоксичность в отношении раковых клеток. Фибриллярные белки могут включать фибриллярные белки, полученные из одного типа белка или более чем одного, более чем двух, более чем трех или более типов. Например, в способах лечения, описанных выше, можно вводить фибриллярные белки rVP1 и фибриллярный BSA вместе в одной дозе или раздельно.
Согласно реализации, при изменении структуры глобулярного белка с получением структуры фибриллярного белка и их разделении можно использовать хроматографию. Как правило, хроматографию проводят с применением колонок, однако возможно применение других способов, таких как применяемые для проведения тонкослойной хроматографии. Способ хроматографии включает разделение по размеру, аффинность и ионный обмен. Хотя возможно получение фибриллярных белков партиями, применение колонки позволяет преобразовывать глобулярные белки в фибриллярную форму быстрым, надежным, эффективным и непрерывным способом. При применении колонок также возможно повышение производительности.
Согласно примерам реализации применяют эксклюзионную хроматографию с размером пор сорбента, позволяющим разделять белки с молекулярной массой, составляющей, по меньшей мере, приблизительно 70 кДа. Размер применяемых пор сорбента может варьировать в зависимости от различных характеристик глобулярного белка, например, его размера. Размер пор влияет на проникновение белков в матрикс сорбента, таким образом, вызывая механические силы, которые способствуют разворачиванию/сворачиванию белка и усиливают фибриллогенные комплексы. В примерах реализации применяемая колонка для разделения молекул по размеру представляет собой Superdex 200. В других примерах реализации колонка для разделения молекул по размеру представляет собой HW55S.
Для колоночной хроматографии можно использовать буферный раствор с низкой концентрация(концентрациями) детергента для элюирования колонки. В примерах реализации колонку для разделения молекул по размеру элюируют буферным раствором, содержащим 25 мМ Tris-HCl (pH 8,0), 1 мМ ЭДТА, 0,1 M NaCl и 0,05% SDS. В других примерах реализации колонку для разделения молекул по размеру элюируют буферным раствором, содержащим 25 мМ Tris-HCl, pH 8,0, 1 мМ ЭДТА, 0,1 M NaCl и 0,05% Цвиттергента 3-14. Элюант можно собирать в виде фракций, и фракции, содержащие фибриллярный белок, затем объединять. Объединенную фракцию затем можно фильтровать для очистки и изоляции фибриллярного белка, например, проводить диализ против PBS для удаления SDS или Цвиттергента 3-14.
Согласно реализации, сывороточный альбумин человека (HSA) можно превращать в фибриллярный сывороточный альбумин человека способами, описываемыми в настоящем документе для получения фибриллярных белков. Согласно реализации, показано, что сывороточный альбумин человека можно переводить в фибриллярную форму способами, описываемыми в настоящем документе. В отношении получения фибриллярных белков патент США № 7488800 включен в настоящий документ в качестве ссылки.
Показано, что фибриллярный HSA (F-HSA) проявляет, по меньшей, такую же эффективность, как рекомбинантный капсидный белок вируса ящура (rVP1), в индукции апоптоза у ряда раковых клеток. К преимуществам применения F-HSA вместо rVP1 в качестве лекарственного средства для лечения рака относят то, что HSA представляет собой эндогенный белок человека. Таким образом, HSA или его производные со сходной последовательностью и структурой с меньшей вероятностью, чем чужеродные белки, такие как rVP1, приводят к иммуногенности и нейтрализации антител при клиническом применении.
Согласно реализации, F-HSA получали посредством растворения HSA в 1% растворе SDS, пропуская через колонку для гель-фильтрации Superdex-200 и элюируя буферным раствором, содержащим 25 мМ Tris-HCl (pH 8,0), 1 мМ ЭДТА, 0,1 M NaCl и 0,05% SDS (фиг. 1). После проведения диализа против PBS для удаления SDS выявлено, что, в отличие от HSA, элюированный из колонки Superdex-200 F-HSA демонстрировал повышенные уровни флуоресценции при амилоид-специфичной окраске ThT в зависимости от количества.
Также показано, что F-HSA индуцировал цитотоксичность раковых клеток. Поскольку фибриллярный сывороточный альбумин связывается с рецепторами на клеточной поверхности, такими как интегрины, в то время как для глобулярного сывороточного альбумина это не характерно, полагают, что изменение структуры сывороточного альбумина с глобулярной на фибриллярную форму избирательно направляет белки на раковые клетки, экспрессирующие большее количество интегрина α5β1 по сравнению с нормальными клетками. F-HSA дозозависимо ингибировал рост клеток рака молочной железы, включая клетки TS/A (аденокарцинома молочной железы мыши) и MDA-MB-231 (аденокарцинома молочной железы человека), с IC50, составляющим 0,15 (фиг. 13) и 0,48 μΜ (фиг. 14), соответственно. F-HSA ингибировал рост клеток SKOV3 рака яичников с IC50, составляющим 0,6 μΜ (фиг. 15), и рост клеток CaSki рака шейки матки с IC50, составляющим 1,1 μΜ (фиг. 16). F-HSA также индуцировал цитотоксичность клеток PC-3 и 22Rv1 рака предстательной железы с IC50, составляющим 0,35 (фиг. 17) и 0,2 μΜ (фиг. 18), соответственно. Кроме того, F-HSA индуцировал цитотоксичность в ряде линий клеток рака легкого (фиг. 19).
Согласно реализации, таким образом, описан способ лечения рака. Способ включает этапы получения HSA, изменения структуры HSA на фибриллярную и введения терапевтически эффективного количества F-HSA нуждающемуся в этом пациенту. Превращение HSA в фибриллярную форму усиливает его цитотоксическое воздействие на клетки-мишени.
В примерах реализации рак представляет собой рак почки, молочной железы, легкого, предстательной железы, печени, шейки матки или яичников. В примерах реализации фибриллярный HSA участвует в индукции апоптоза раковой клетки посредством модулирования Akt-сигнального пути. В некоторых случаях фибриллярный HSA модулирует интегрин α5β1 или ανβ3, что приводит к дезактивации Akt. В других случаях фибриллярный HSA связывается с интегрином и вызывает клеточный апоптоз в основном через интегрин/FAK/Akt/GSK-3β/каспаза-3-сигнальный путь.
Фибриллярный белок HSA, его производные, ортологи или другие белки, характеризующиеся значительным сходством с HSA в отношении лечения рака, можно выбирать на основании тяжести заболевания и желаемой цитотоксичности в отношении раковых клеток. В примерах реализации для большей цитотоксичности в отношении раковых клеток выбирают белок с мотивом RGD или большей молекулярной массой. Мотив RGD представляет собой лиганд к интегринам. Показано, что фибриллярные белки индуцируют гибель клеток посредством модулирования интегрин/Akt-сигнального пути. Показано, что фибриллярные белки с мотивами RGD, такие, как rVP1-S200 и FN-S200, являются более цитотоксическими, чем белки без мотивов RGD, такие как BSA-S200 и rVP3-S200.
"Вариант" относится к полинуклеотиду или полипептиду, который отличается от исходного полинуклеотида или полипептида, но сохраняет его основные свойства. Типичный вариант полинуклеотида отличается нуклеотидной последовательностью от другого, исходного полинуклеотида. Изменения нуклеотидной последовательности варианта могут менять или не менять аминокислотную последовательность полипептида, который кодируется исходным полинуклеотидом. Изменения нуклеотида могут приводить к заменам аминокислот, вставкам и делециям в полипептиде, который кодируется исходной последовательностью, как описано в настоящем документе.
Типичный вариант полипептида отличается аминокислотной последовательностью от другого, исходного полипептида. Как правило, изменения ограничены тем, что последовательности исходного полипептида и варианта в целом очень сходны и, во многих участках, идентичны. Вариант и исходный полипептид могут отличаться по аминокислотной последовательности на одну или несколько замен, вставок и делеций в любых комбинациях. Замененный или вставленный аминокислотный остаток может кодироваться или не кодироваться генетическим кодом. Вариант полинуклеотида или полипептида может быть природным, таким как аллельный вариант, или может представлять собой вариант, не известный в природе. Неприродные варианты полинуклеотидов и полипептидов можно получать посредством мутагенеза или прямого синтеза.
"Ортолог" обозначает полипептид или полинуклеотид, полученный от другого вида и представляющий собой функциональный аналог полипептида или полинуклеотида другого вида. Отличия последовательностей ортологов представляют собой результат видообразования.
Как применяют в настоящем документе, двадцать стандартных аминокислот и их обозначения применяют общепринятым способом. См. Immunology-A Synthesis (2nd Edition, E. S. Golub и D. R. Gren, Eds., Sinauer Associates, Sunderland, Mass. (1991)), включенный в настоящий документ в качестве ссылки. Стереоизомеры (например, D-аминокислоты) двадцати стандартных аминокислот, искусственные аминокислоты, такие как α-,α-двузамещенные аминокислоты, N-алкил-аминокислоты, молочная кислота и другие нестандартные аминокислоты также могут представлять собой подходящие компоненты для полипептидов по настоящему изобретению. Примеры нестандартных аминокислот включают: 4-гидроксипролин, γ-карбоксиглутаминат, ε-Ν,Ν,Ν-триметиллизин, ε-Ν-ацетиллизин, O-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, σ-N-метиларгинин и другие сходные аминокислоты и иминокислоты (например, 4-гидроксипролин). В обозначениях полипептидов, применяемых в настоящем документе, область слева представляет собой аминоконцевую область, а область справа представляет собой карбоксиконцевую область, согласно стандартному применению и способу обозначения.
В применении к полипептидам термин "существенная идентичность" означает, что две последовательности пептидов при оптимальном выравнивании, таком как выравнивание посредством программ GAP или BESTFIT с применением стандартного веса пропусков, идентичны, по меньшей мере, на 80 процентов, предпочтительно, по меньшей мере, на 90 процентов, более предпочтительно, по меньшей мере, на 95 процентов, и наиболее предпочтительно, по меньшей мере, на 99 процентов. Предпочтительно, неидентичные положения отличаются консервативными аминокислотными заменами. Консервативные аминокислотные замены относятся к взаимозаменяемости остатков со сходными боковыми цепями. Например, группа аминокислот, содержащих алифатические боковые цепи, включает глицин, аланин, валин, лейцин и изолейцин; группа аминокислот, содержащих алифатические гидроксильные боковые цепи, включает серин и треонин; группа аминокислот, содержащих амид-содержащие боковые цепи, включает аспарагин и глутамин; группа аминокислот, содержащих ароматические боковые цепи, включает фенилаланин, тирозин и триптофан; группа аминокислот, содержащих основные боковые цепи, включает лизин, аргинин и гистидин; и группа аминокислот, содержащих сера-содержащие боковые цепи, включает цистеин и метионин. Предпочтительные консервативные аминокислотные замены представляют собой: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамин-аспарагин и аспарагин-глутамин.
Как указано в настоящем документе, небольшие изменения аминокислотных последовательностей композиций, проявляющих цитотоксическую активность, рассматривают как включенные в настоящее изобретение, при условии, что изменения аминокислот последовательности HSA обеспечивают, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95%, или, по меньшей мере, 99% идентичность. В частности, рассматривают консервативные замены аминокислот. Консервативные замены представляют собой замены, происходящие в пределах семейства аминокислот со сходными боковыми цепями. Генетически кодируемые аминокислоты, как правило, разделяют на семейства: (1) кислые = аспартат, глутаминат; (2) основные = лизин, аргинин, гистидин; (3) неполярные = аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) полярные незаряженные = глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Другие предпочтительные семейства следующие: серин и треонин, которые относят к семейству алифатических гидроксильных аминокислот; аспарагин и глутамин, которые относят к семейству амид-содержащих аминокислот; аланин, валин, лейцин и изолейцин, которые относят к семейству алифатических аминокислот; и фенилаланин, триптофан, и тирозин, которые относят к семейству ароматических аминокислот. Например, следует понимать, что отдельные замены лейцина на изолейцин или валин, аспартата на глутаминат, треонина на серин или сходные замены аминокислоты на структурно родственные аминокислоты не оказывают заметного эффекта на сворачивание или свойства полученной молекулы, особенно если замена не затрагивает аминокислоту в каркасном участке. Посредством анализа специфической активности производного полипептида можно легко определять, приводит ли замена аминокислоты к получению функционального пептида. Специалисты в данной области могут легко получать фрагменты или аналоги белков или пептидов по настоящему изобретению. Предпочтительные амино- и карбокси-концевые области фрагментов или аналогов находятся возле границ функциональных доменов. Структурные и функциональные домены можно идентифицировать посредством сравнения нуклеотидных или аминокислотных последовательностей с данными общественно доступных или запатентованных банков последовательностей. Предпочтительно применяют компьютеризированные способы сравнения для идентификации мотивов последовательности или ожидаемой конформации белковых доменов, которые содержатся в белках с известной структурой или функцией. Известны способы идентификации последовательностей белка, которые укладываются в известные трехмерные структуры. Bowie et al. Science 253:164 (1991). Таким образом, указанные выше примеры показывают, что специалисты в данной области могут распознавать мотивы последовательности и структурные конформации, которые можно использовать для определения структурных и функциональных доменов согласно изобретению.
Эффективные замены аминокислот представляют собой замены, которые: (1) уменьшают чувствительность к протеолизу, (2) уменьшают чувствительность к окислению, (3) изменяют аффинность связывания при формировании белковых комплексов, (4) изменяют связывающую способность и (5) предоставляют или модифицируют другие физико-химические или функциональные свойства таких аналогов. Аналоги могут включать различные мутации в последовательности, отличной от последовательности природного пептида. Например, в природную последовательность (предпочтительно в область полипептида, находящуюся вне домена(доменов), формирующего(их) межмолекулярные контакты) можно вносить одиночные или множественные замены аминокислот (предпочтительно консервативные аминокислотные замены). Консервативная аминокислотная замена не должна существенно изменять структурные характеристики исходной последовательности (например, замененная аминокислота не должна нарушать спираль, характерную для исходной последовательности, или нарушать другие типы вторичной структуры, характерные для исходной последовательности). Примеры известных в данной области вторичных и третичных структур полипептидов описаны в Proteins, Structures and Molecular Principles (Creighton, Ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, N.Y. (1991)); и Thornton et at. Nature 354:105 (1991), которые включены в настоящий документ в качестве ссылок.
Как применяют в настоящем документе, термин "полипептидный фрагмент" относится к полипептиду, содержащему делецию в аминоконцевой или карбоксиконцевой области, но у которого остальная аминокислотная последовательность идентична соответствующим областям природной последовательности, полученной, например, от полноразмерной последовательности кДНК. Длина фрагментов, как правило, составляет, по меньшей мере, 5, 6, 8 или 10 аминокислот, предпочтительно, по меньшей мере, 14 аминокислот, более предпочтительно, по меньшей мере, 20 аминокислот, как правило, по меньшей мере, 50 аминокислот, и даже более предпочтительно, по меньшей мере, 70 аминокислот.
Как правило, способ получения фибриллярных белков включает растворение белков в SDS или другом подходящем растворе детергента; пропускание растворенных белков через колонку для гель-фильтрации с размером пор, позволяющим разделять белки с молекулярной массой, составляющей 70 кДа и более; элюирование белка из колонки; и диализ элюата против забуференного физиологического раствора с удалением SDS или детергента.
На первом этапе глобулярный белок, как правило, растворяют в растворителе. Например, глобулярный белок растворяют в PBS с поверхностно-активными веществами. Поверхностно-активные вещества, которые в настоящем документе также обозначают как детергенты, представляют собой вещества, уменьшающие поверхностное натяжение воды и увеличивающие растворимость органических соединений. Детергенты могут быть ионными, включая катионные, анионные, и цвиттер-ионные детергенты, а также неионными. Детергенты вносят вклад в разрушение нековалентных связи в белках, тем самым денатурируя белки, в результате чего они теряют исходную форму или конформацию. В примерах реализации применяемый детергент представляет собой додецилсульфат натрия (SDS), полученный в Sigma. В других примерах реализации применяемый детергент представляет собой Цвиттергент 3-14, полученный в Calbiochem.
В некоторых аспектах способа применяют эксклюзионную хроматографию с размером пор сорбента, позволяющим разделять белки с молекулярной массой, составляющей, по меньшей мере, приблизительно 70 кДа. Размер применяемых пор сорбента может варьировать в зависимости от различных характеристик глобулярного белка, например, его размера. Размер пор влияет на проникновение белков в матрикс сорбента, таким образом, вызывая механические силы, которые способствуют разворачивание/сворачивание белка и усиливают фибриллогенные комплексы. В примерах реализации применяемая колонка для разделения молекул по размеру представляет собой Superdex 200. В других примерах реализации колонка для разделения молекул по размеру представляет собой HW55S. Другие детали способа получения фибриллярных белков можно найти в US Pat Pub No.2008/0800186, описание которой включено в настоящий документ в качестве ссылки.
Следующие примеры приведены для предоставления специалистам в данной области полного описания способа получения и применения настоящего изобретения и не предназначены для ограничения объема изобретения.
Эксперименты
Пример 1
Способы
Клеточные линии и культуры. Клетки SK-OV-3 (линия клеток карциномы яичника человека; ATCC HTB-77) и клетки SK-OV-3ip.1, и CaSki клетки (линия клеток карциномы шейки матки человека; ATCC CRL-1550) хранили при 37°C в средах McCoy's 5A и RPMI-1640, соответственно. Клетки MDA-MB-231 (линия клеток аденокарциномы молочной железы человека; ATCC HTB-26) и клетки TS/A (линия клеток аденокарциномы молочной железы мыши) хранили при 37°C в модифицированной Дульбекко среде Игла (DMEM)/F12 и среде DMEM, соответственно. Клетки PC-3 (линия клеток аденокарциномы предстательной железы человека; ATCC CRL-1435) и клетки 22Rv1 (линия клеток карциномы предстательной железы человека; ATCC CRL-2505) хранили при 37°C в среде RPMI-1640. Все среды были обогащены 10% эмбриональной телячьей сывороткой (FBS), 2 мМ L-глутамином, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина.
Анализ цитотоксичности. Выживаемость клеток определяли посредством MTT-теста или анализа WST-1. Вкратце, 1×105 клеток/лунку опухолевых клеток высевали в 96-луночные планшеты в лишенную сыворотки среду и инкубировали в течение 1 часа. Обработку клеток последовательными концентрациями rVP1, F-BSA или F-HSA проводили в лишенной сыворотки среде в течение 24 часов при 37°C. После обработки в каждую лунку добавляли раствор MTT (0,5 мг/мл) с последующей инкубацией в течение 4 часов. Количество жизнеспособных клеток прямо пропорционально выделению формазана, которое, после растворения в изопропаноле, можно измерять спектрофотометрически при 570 нм с применением спектрофотометра ELISA для чтения планшетов. Данные выражали в виде процентов состояния без обработки и представляли в виде средних значений ± S.D.
Анализ WST-1 проводили по инструкциям производителя (Roche, Mannheim, Germany). Вкратце, 2×104 клеток добавляли к 100 мкл среды на лунку в 96-луночный планшет и инкубировали при 37°C в 5% CO2 в течение ночи во влажной камере. Клетки, прикрепленные к лункам, инкубировали в среде, лишенной сыворотки, и обрабатывали серийными разведениями rVP1. После инкубации при 37°C в 5% CO2 в течение 16 часов с тем, чтобы позволить лекарственному средству оказать эффект, в каждую лунку добавляли 10 мкл реагента WST-1, и затем содержимое планшета перемешивали на шейкере при 150 об./мин. в течение 1 мин. После инкубации при 37°C в 5% CO2 в течение следующих 2 часов с тем, чтобы позволить реагенту WST-1 метаболизироваться, определяли пропорцию выживших клеток на основе оптической плотности (рабочая длина волны 450 нм, опорная длина волны 690 нм). Процент выживших клеток рассчитывали как (O.D.обработка/O.D.контроль)×100%, в то время как процент ингибирования роста рассчитывали как [1-(O.D.обработка/O.D.контроль)]×100%. IC50 представляет собой концентрацию, при которой реагент предоставляет 50% ингибирование клеточной выживаемости.
Анализ клеточной миграции и инвазии. Анализы клеточной миграции и инвазии проводили посредством анализа миграции и инвазии с применением камеры Бойдена (Corning). Мембраны верхних камер с 8-μΜ порами покрывали 20 мкг/мл фибронектином для анализа клеточной миграции или 40 мкг/мл матригелем для анализа клеточной инвазии и помещали в лунку с 1 мл PBS и инкубировали в течение 2 часов при 37°C. Раковые клетки (1×105) ресуспендировали в лишенной сыворотки среде и высевали на верхнюю камеру на 1 час. Различные концентрации фибриллярных белков, таких как rVP1, добавляли в верхнюю камеру, после чего в нижнюю камеру добавляли среду для культивирования (10% среда FBS). Клетки инкубировали в течение 24 часов при 37°C. По завершении инкубации клетки с верхней стороны мембраны удаляли с применением ватной палочки, а клетки, мигрировавшие на нижнюю поверхность мембраны, отделяли с применением раствора для диссоциации клеток (Sigma) и подсчитывали с применением проточного цитометра (компания BD).
Проведение имплантации метастазов на мышиной модели аденокарциномы молочной железы TS/A у мышей BALB/c. Клетки аденокарциномы молочной железы мыши TS/A культивировали в DMEM, обогащенной 10% FBS, 2 мМ L-глутамином, 100 Ед/мл пенициллином и 100 мкг/мл стрептомицином во влажной атмосфере с 95% воздуха и 5% CO2 при 37°C. После сбора клеток клетки TS/A (3×105/100 мкл PBS/мышь) внутривенно вводили в латеральную хвостовую вену девяти мышам на группу. Контрольную среду или фибриллярные белки, такие как F-HSA, внутривенно вводили каждые двое суток в течение десяти раз. В конце трех мышей на группу умерщвляли, а других применяли для анализа выживаемости.
В другом эксперименте клетки аденокарциномы молочной железы мыши TS/A сначала культивировали в DMEM, обогащенной 10% FBS, 2 мМ L-глутамином, 100 Ед/мл пенициллином и 100 мкг/мл стрептомицином с обработкой фибриллярными белками или без нее, такими как rVP1 (0,1-0,2 μΜ), во влажной атмосфере с 95% воздуха и 5% CO2 при 37°C. После сбора клеток клетки TS/A, предварительно обработанные или не обработанные rVP1, внутривенно вводили (3×105/100 мкл PBS/мышь) в латеральную хвостовую вену девяти мышам на группу, соответственно. Через 14 суток всех мышей умерщвляли и извлекали легкие.
Проведение имплантации метастатических ксенотрансплантатов на мышиной модели рака молочной железы человека. Клетки аденокарциномы молочной железы человека MDA-MB-231 культивировали в DMEM/F12, обогащенной 10% FBS, 2 мМ L-глутамином, 100 Ед/мл пенициллином и 100 мкг/мл стрептомицином, во влажной атмосфере с 95% воздуха и 5% CO2 при 37°C. После сбора клеток, клетки MDA-MB-231 (3×105/100 мкл PBS/мышь) внутривенно вводили в латеральную хвостовую вену девяти мышам на группу, соответственно. Через сутки после введения опухоли внутривенно вводили фибриллярные белки, такие как F-HSA (1 мг/кг BW), каждые двое суток в течение десяти раз, в то время как мышам из контрольной группы инъецировали только среду. Трех мышей на группу умерщвляли в этот момент времени, а оставшихся мышей применяли для определения коэффициента выживаемости.
Проведение имплантации ортотропного ксенотрансплантата на мышиной модели рака предстательной железы человека. Клетки рака предстательной железы человека PC-3 культивировали в среде RPMI-1640, обогащенной 10% FBS, 2 мМ L-глутамином, 100 Ед/мл пенициллином и 100 мкг/мл стрептомицином во влажной атмосфере с 95% воздуха и 5% CO2 при 37°C. После сбора клеток, клетки PC-3 отмывали и ортотопически вводили в предстательную железу (× 105/20 мкл PBS/мышь). В одной группе через четыре недели после имплантации PC-3 внутривенно вводили фибриллярные белки, такие как rVP1 (25 мг/кг), в то время как в другой группе rVP1 вводили через 10 недель после имплантации рака. Такое же количество rVP1 вводили три раза в неделю в течение 6 недель, и по завершении обработки rVP1 3 мышей из каждой группы умерщвляли для выявления метастазов рака. Оставшихся мышей применяли для определения коэффициента выживаемости.
Проведение имплантации метастатических ксенотрансплантатов на мышиной модели рака яичников человека SK-OV-3. Исследования на животных проводили согласно руководствам по содержанию и применению лабораторных животных Медицинского центра национальной обороны, Тайвань. Самкам безтимусных мышей BALB/cAnN-Foxn1 8-недельного возраста, которых получали в Национальном центре лабораторных животных, Тайвань, вводили 5×106 раковых клеток SK-OV-3 на мышь посредством интраперитонеальной инъекции. Через 6 суток после имплантации SK-OV-3 мышей обрабатывали фибриллярными белками (например, rVP1, 15 мг/кг BW) или PBS (контроль), и обработку повторяли через сутки в течение 60 суток. Процент выживаемости и массу тела регистрировали до смерти мышей или через 340 суток после имплантация опухоли.
Выделение клеток SK-OV-3ip.1. Мышей умерщвляли резким смещением шейных позвонков через 60 суток после имплантация клеток SK-OV-3. Затем в живот инъецировали 3 мл PBS и выделяли интраперитонеальные клетки (приблизительно 2 мл) с применением 5-мл шприца и иглой калибра 25×1". Клетки центрифугировали при 200×g в течение 5 мин при 4°C и собирали сгусток клеток. Для удаления эритроцитов добавляли NH4Cl в объеме, в 5 раз превышающем объем сгустка клеток (0,144 M), и NH4HCO3 в объеме, составляющем 1/2 объема сгустка клеток (0,01 M), и инкубировали при 4°C в течение 5 мин. Клетки центрифугировали при 200×g в течение 5 мин при 4°C и собирали сгусток клеток. Клетки культивировали в среде McCoy's 5A с 20% FBS в атмосфере с 5% CO2 при 37°C в течение 3 суток перед проведением анализа посредством вестерн-блоттинга уровней рецептора HER-2 с применением стандартного способа вестерн-блоттинга с последующим разделением SDS-PAGE на 8-16% градиентном геле (Invitrogen).
Гистопатология. Органы фиксировали в 10% нейтральном буферном формалине. Затем ткани заливали парафином и получали срезы 4 μΜ, которые окрашивали гематоксилином и эозином (H&E) для световой микроскопии.
Статистический анализ. Все данные представляли в виде средних значений ± стандартная ошибка и оценивали с применением Microsoft Excel. К данным по выживаемости применяли логарифмический ранговый критерий для определения различий между группами, обработанными или не обработанными лекарственными средствами. Для определения суммарных различий между разными способами обработки проводили t-тест Стьюдента и анализ ANOVA. Значения P<0,05, P<0,01 и P<0,001 считали статистически значимыми. rVP1 подавлял инвазию и/или миграцию клеток для клеток MDA-MB-231, клеток PC-3, клеток 22Rv1, клеток SK-OV-3, клеток CaSki и клеток SK-OV-3ip.1 in vitro.
Для определения того, подавляет ли rVP1 инвазию и/или миграцию опухолевых клеток, инвазию и/или миграцию клеток измеряли с применением камеры Бойдена. После обработки различными концентрациями rVP1 (от 0,1 до 0,2 μΜ rVP1 для клеток аденокарциномы молочной железы человека MDA-MB-231, клеток аденокарциномы предстательной железы человека PC-3, клеток карциномы предстательной железы человека 22Rv1; от 0,2 μΜ до 0,4 μΜ rVP1 для клеток карциномы яичников человека SK-OV-3 и SK-OV-3ip.1; от 0,2 μΜ до 0,6 μΜ rVP1 для клеток карциномы шейки матки человека CaSki) инвазия и/или миграция значительно сокращались. Следует отметить, что эти концентрации rVP1 не влияли на выживаемость клеток, что устанавливали с применением MTT-теста или анализа WST-1 (фиг. 1-3). Таким образом, rVP1 может значительно подавлять метастазирование клеток рака молочной железы человека, рака предстательной железы, рака шейки матки и рака яичников in vitro.
ПРИМЕР 2
rVP1 подавляет метастазирование опухолевых клеток in vivo.
A. Обработанные rVP1 in vitro клетки MDA-MB-231, введенные внутривенно мышам BALB/c. Определяли, могут ли предварительно обработанные rVP1 в течение 24 часов для ингибирования метастатической активности in vitro клетки аденокарциномы молочной железы человека MDA-MB-231, затем введенные внутривенно мышам, демонстрировать уменьшение метастазирования в легкое мыши по сравнению с клетками MDA-MB-231, предварительно не обработанными rVP1. Данные показывают, что клетки MDA-MB-231, обработанные 0,1 и 0,2 μΜ rVP1, значительно сокращали раковые метастазы в ткань легкого мыши (фиг. 4A). Относительная масса легкого и количество очагов опухоли в легком также значительно уменьшались по сравнению с группой, не обработанной rVP1 (фиг. 4B-C).
B. Модель ортотопической ксенотрансплантации PC-3. Также определяли, может ли rVP1 подавлять метастазирование рака предстательной железы in vivo. Клетки аденокарциномы предстательной железы человека PC-3 сначала ортотопически имплантировали в предстательную железу безтимусных мышей и через 4 недели или 10 недель после имплантации внутривенно вводили rVP1 (25 мг/кг) три раза в неделю в течение 6 недель. По завершении обработки rVP1 мышей умерщвляли для проведения вскрытия. Наши данные показывают, что rVP1 значительно подавлял метастазирование клеток PC-3 в лимфоузлы (таблица 1, фиг. 5A) и тазовые кости, а также ингибировал остеолиз в тазовых костях (фиг. 5B).
C. Модель метастатической ксенотрансплантации SK-OV-3. Данные in vitro показывают, что rVP1 подавляет инвазию клеток яичников человека SK-OV-3. Для определения того, может ли rVP1 также подавлять метастазирование рака яичников SK-OV-3 in vivo, создавали модель имплантации метастатического ксенотрансплантата мышам рака яичников человека SK-OV-3. Обнаружили, что через 60 суток печень обработанных PBS несущих SK-OV-3 мышей была окружена опухолевыми клетками. С другой стороны, у несущих SK-OV-3 мышей, которым интраперитонеально вводили rVP1 (15 мг/кг) через сутки в течение 60 суток не обнаруживали видимой инвазии опухолевых клеток в печень (фиг. 6).
ПРИМЕР 3
F-HSA подавляет инвазию и/или миграцию опухолевых клеток для клеток MDA-MB-231, клеток PC-3, клеток 22Rv1 и клеток CaSki in vitro.
Для определения того, подавляют ли другие фибриллярные белки, такие как F-HSA, инвазию и/или миграцию раковых клеток, оценивали влияние F-HSA на инвазию и/или миграцию раковых клеток с применением камеры Бойдена. После обработки различными концентрациями F-HSA (от 0,1 μΜ до 0,2 μΜ F-HSA для клеток MDA-MB-231; от 0,025 до 0,1 μΜ F-HSA для клеток PC-3; от 0,025 до 0,05 μΜ F-HSA для клеток 22Rv1; от 0,2 до 0,4 μΜ F-HSA для клеток CaSki) способность к инвазии и/или миграции ряда раковых клеток значительно сократилась. Следует отметить, что в таких концентрациях F-HSA не влиял на жизнеспособность клеток, что определяли посредством MTT-теста (фиг. 7).
ПРИМЕР 4
F-HSA подавляет метастазирование опухолевых клеток in vivo.
Для дальнейшего определения того, может ли F-HSA подавлять метастазирование опухолевых клеток in vivo, клетки аденокарциномы молочной железы мыши TS/A внутривенно вводили в латеральную хвостовую вену мышей BALB/c или клетки аденокарциномы молочной железы человека MDA-MB-231 инъецировали безтимусным мышам, соответственно. Затем на следующие сутки внутривенно вводили F-HSA (1 мг/кг), а затем один раз в каждые двое суток в течение десяти раз. По завершении обработки F-HSA мышей умерщвляли для выявления метастазов в легких. Наши результаты показывают, что F-HSA значительно подавляет метастазирование клеток TS/A и клеток MDA-MB-231 в легкие (фиг. 8A и 9A) по сравнению с мышами, несущими TS/A или MDA-MB-231 и обработанными только контрольной средой. Относительная масса легкого и количество очагов опухоли в легком у обработанных F-HSA несущих TS/A или MDA-MB-231 мышей были значительно меньше по сравнению с несущими TS/A или MDA-MB-231 мышами, не обработанными лекарственным средством (фиг. 8B-C и 9B-C).
ПРИМЕР 5
F-BSA подавляет инвазию клеток CaSki in vitro.
Также определяли, подавляют ли другие фибриллярные белки, такие как F-BSA, инвазию клеток карциномы шейки матки человека CaSki. Инвазию клеток измеряли с применением камеры Бойдена. Обнаружили, что F-BSA в концентрации 0,1 μΜ - 0,2 μΜ, не влияя на жизнеспособность клеток, на что указывает MTT-тест, значительно подавляет миграцию/инвазию клеток CaSki (фиг.10).
ПРИМЕР 6
F-HSA демонстрирует повышенные уровни флуоресценции при амилоид-специфичной окраске ThT в зависимости от дозы.
На фиг. 12 представлена реализация экспериментальных данных, показывающих, что F-HSA, подобно фибриллам амилоида Αβ (1-42), демонстрирует повышенные уровни флуоресценции при амилоид-специфичной окраске ThT в зависимости от дозы по сравнению с BSA, который не пропускали через колонку Superdex-200. Этот результат показывает, что F-HSA имеет фибриллярную структуру, подобную Αβ (1-42), в то время как HSA имеет глобулярную структуру. (Связывание ThT представляет собой одну из характеристик амилоидо-подобных белков).
ПРИМЕР 7
F-HSA оказывает цитотоксический эффект на клетки рака молочной железы.
На фиг. 13 представлен цитотоксический эффект F-HSA на клетки TS/A, а на фиг. 14 представлен цитотоксический эффект F-HSA на клетки MDA-MB-231. Каждый тип клеток в течение 16 часов обрабатывали различными концентрациями F-HSA в лишенной сыворотки среде для культивирования. Жизнеспособность клеток определяли посредством MTT-теста. Глобулярный HSA не оказывал цитотоксического эффекта на нормальные или раковые клетки.
ПРИМЕР 8
F-HSA оказывает цитотоксический эффект на клетки рака яичника и шейки матки.
На фиг. 15 представлен цитотоксический эффект F-HSA на клетки SKOV-3, а на фиг. 16 представлен цитотоксический эффект F-HSA на клетки CaSki. Каждый тип клеток в течение 16 часов обрабатывали различными концентрациями F-HSA в лишенной сыворотки среде для культивирования. Жизнеспособность клеток определяли посредством MTT-теста.
ПРИМЕР 9
F-HSA оказывает цитотоксический эффект на клетки рака предстательной железы.
На фиг. 17 представлен цитотоксический эффект F-HSA на клетки PC-3, а на фиг. 7 представлен цитотоксический эффект F-HSA на клетки 22 Rvl. Каждый тип клеток в течение 16 часов обрабатывали различными концентрациями F-HSA в лишенной сыворотки среде для культивирования. Жизнеспособность клеток определяли посредством MTT-теста.
ПРИМЕР 10
F-HSA оказывает цитотоксический эффект на клеточные линии рака легкого.
Согласно реализации, представленной на фиг. 19, показано, что F-HSA индуцирует цитотоксичность в клеточных линиях аденокарциномы A549, CL1-0, CM-5, H1299, PC13 и PC14; клеточной линии плоскоклеточной карциномы легкого H520; и клеточной линии крупноклеточной карциномы легких H661. На фиг. 19 представлены IC50 для соответствующих клеточных линий.
ПРИМЕР 11
F-HSA подавляет инвазию и миграцию опухолевых клеток in vitro.
Также обнаружено, что F-HSA эффективно подавляет инвазию и миграцию опухолевых клеток in vitro, как показано согласно реализации экспериментальных данных на фиг. 20. Как показано на фиг. 9A, 9C, 9E и 9G, F-HSA значительно сокращает способность опухолевых клеток к инвазии/миграции в концентрациях, не влияющих на жизнеспособность ни клеток рака, ни нормальных клеток.
ПРИМЕР 12
F-HSA подавляет метастазирование опухолевых клеток in vivo.
F-HSA подавлял клеточные линии опухолевых клеток рака молочной железы TS/A и MDA-MB-231 in vivo. На фиг. 21A и 22A показано, что F-HSA значительно подавляет метастазирование клеток рака молочной железы TS/A и MDA-MB-231 в легкое по сравнению с несущими TS/A или MDA-MB-231 мышами, не обработанными F-HSA. На фиг. 21B, 21C, 22B и 22C показаны масса и количество очагов опухолевых клеток в ткани легкого, что также подтверждает эффективность F-HSA in vivo.
Согласно реализации, клетки рака молочной железы инъецировали субъектам в хвостовую вену. Очаги опухолевых клеток, обнаруженные в ткани легкого, показывали, что клетки рака молочной железы метастазировали в легкое.
Материалы и Способы
Получение F-HSA. Двадцать миллиграмм HSA растворяли в 10 мл PBS с 1% SDS (масс./об.). Раствор HSA обрабатывали ультразвуком в течение 5 мин и затем вносили в Superdex-200, которую предварительно уравновешивали элюирующим раствором (25 мМ Tris- HCl (pH 8,0), 1 мМ ЭДТА, 0,1 M NaCl и 0,05% SDS). Колонку элюировали со скоростью 1 мл/мин и объединяли фракции от C3 до C7, содержащие HSA. Объединенные фракции концентрировали до 2-3 мг/мл и затем проводили диализ против PBS с применением диализной мембраны Cellu-Sep T4/Nominal (MWCO:12000-14000 Да). Буфер PBS меняли каждые два часа при комнатной температуре в течение трех раз. Выход HSA-S200 составлял приблизительно 75%.
Анализ флуоресценции тиофлавина T (ThT). Связывание ThT представляет собой одну из характеристик амилоидо-подобных белков. Для измерения флуоресценции увеличивающиеся концентрации белков инкубировали с 20 μΜ ThT в течение 1 часа при комнатной температуре, после чего троекратно измеряли флуоресценцию с применением Wallac Victor2 1420 Multilabel Counter (Perkin Elmer Life Science, Уолтем, Массачусетс, США). Длина волны возбуждения и длина волны испускания составляли 430 нм и 486 нм, соответственно. Фоновый сигнал ThT от буферного раствора вычитали из соответствующих значений.
Выживаемость клеток определяли посредством колориметрического анализа MTT. Экспоненциально растущие клетки (2 × 104 клеток/лунку для TS/A) высевали в 96-луночный планшет в среду с 10% FBS и инкубировали в течение 24 часов. Обработку клеток последовательными концентрациями белков проводили в лишенной сыворотки среде в течение 16 часов при 37°C. После обработки в каждую лунку добавляли раствор MTT (0,5 мг/мл), после чего следовал инкубационный период продолжительностью 4 часа. Количество жизнеспособных клеток прямо пропорционально выделению формазана, который, после растворения изопропанолом, можно измерять спектрофотометрически при 570 нм с применением спектрофотометра ELISA для чтения планшетов.
Анализ жизнеспособности клеток. Жизнеспособность клеток измеряли посредством анализа WST-1 по инструкциям производителя (Roche, Мангейм, Германия). Вкратце, в 96-луночный планшет к 100 мкл среды на лунку добавляли 2×104 клеток и инкубировали при 37°C в 5% CO2 в течение ночи во влажной камере. Клетки, прикрепленные к лункам, инкубировали в лишенной сыворотки среде и обрабатывали различными концентрациями F-HSA. После инкубации при 37°C в 5% CO2 в течение 16 часов с тем, чтоб позволить лекарственному средству оказать эффект, в каждую лунку вносили 10 мкл реагента WST-1. Планшет затем помещали на шейкер и встряхивали при 150 об./мин. в течение 1 мин. После инкубации при 37°C в 5% CO2 в течение следующих 2 часов с тем, чтобы позволить реагенту WST-1 метаболизироваться, определяли процент выживших клеток на основе оптической плотности (рабочая длина волны 450 нм, опорная длина волны 690 нм). Процент выживших клеток рассчитывали как (O.D.обработка/O.D.контроль)×100%, в то время как процент ингибирования роста рассчитывали как [1-(O.D.обработка/O.D.контроль)]×100%. Согласно данному эксперименту, IC50 представляет собой концентрацию, при которой реагент предоставляет 50% ингибирование клеточной выживаемости.
Анализ клеточной миграции и инвазии. Клеточную миграцию и инвазию оценивали с применением камеры Бойдена для анализа миграции и инвазии (Corning). Мембраны верхних камер с 8-μΜ порами покрывали 20 мкг/мл фибронектином для анализа клеточной миграции или 40 мкг/мл матригелем для анализа клеточной инвазии и помещали в лунку с 1 мл PBS и инкубировали в течение 2 часов при 37°C. Раковые клетки (1×105) ресуспендировали в лишенной сыворотки среде и высевали на верхнюю камеру на 1 час. Различные концентрации фибриллярных белков, таких как rVP1, добавляли в верхнюю камеру, после чего в нижнюю камеру добавляли среду для культивирования, содержащую 10% FBS. Клетки инкубировали в течение 24 часов при 37°C. По завершении инкубации клетки с верхней стороны мембраны удаляли с применением ватной палочки, а клетки, мигрировавшие на нижнюю поверхность мембраны, отделяли с применением раствора для диссоциации клеток (Sigma) и подсчитывали с применением проточного цитометра (компания BD). Однако в данных концентрациях F-HSA не влиял на жизнеспособность клеток при измерении посредством MTT-теста, как показано на фиг. 9B, 9D, 9F и 9H. Жизнеспособность и цитотоксичность измеряли посредством MTT-теста или анализа WST-1. Эти наборы выполнены для спектрофотометрического измерения роста клеток как функции митохондриальной активности в живых клетках (Roche).
Метастазирование рака молочной железы in vivo. Клетки аденокарциномы молочной железы мыши TS/A внутривенно вводили в латеральную хвостовую вену мышам BALB/c или клетки аденокарциномы молочной железы человека MDA-MB-231 инъецировали безтимусным мышам. Затем на следующие сутки внутривенно вводили F-HSA (1 мг/кг), а затем один раз каждые двое суток в течение десяти раз. По завершении обработки F-HSA мышей умерщвляли для выявления метастазов в легких.

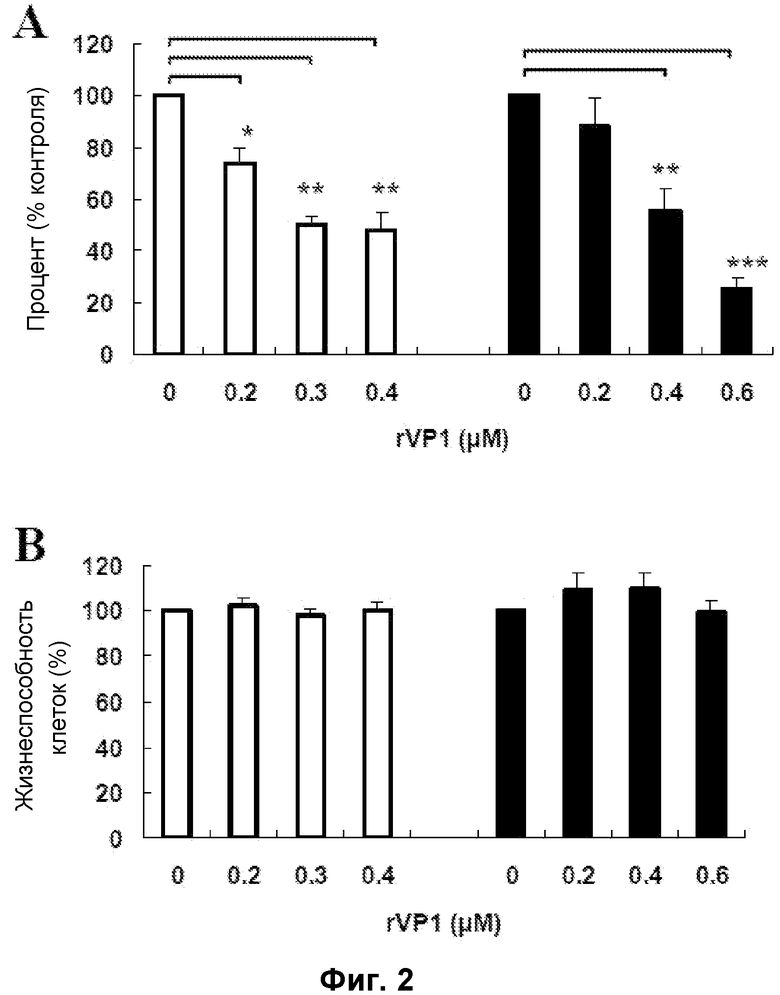
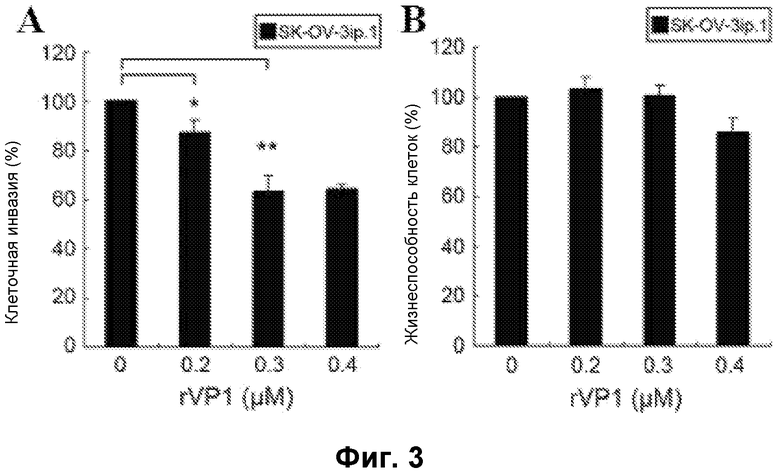
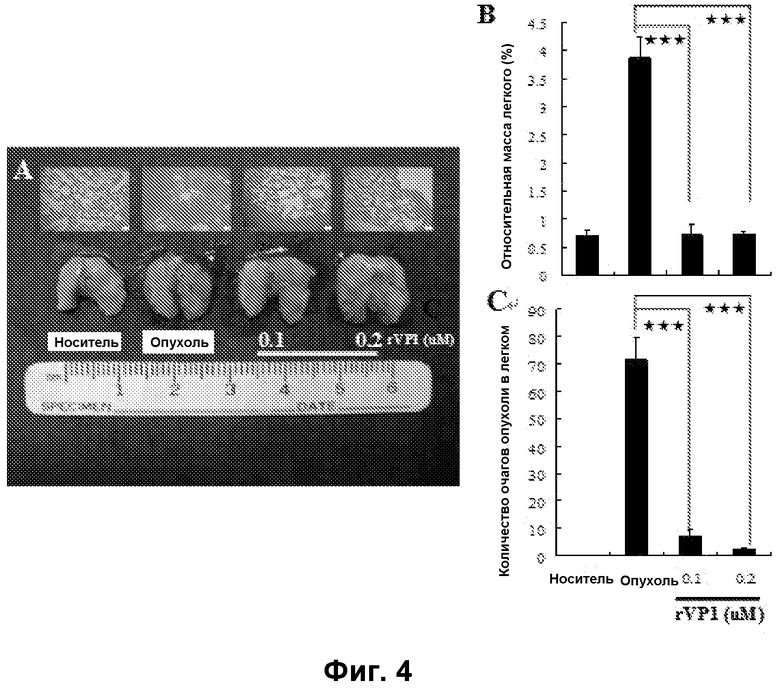
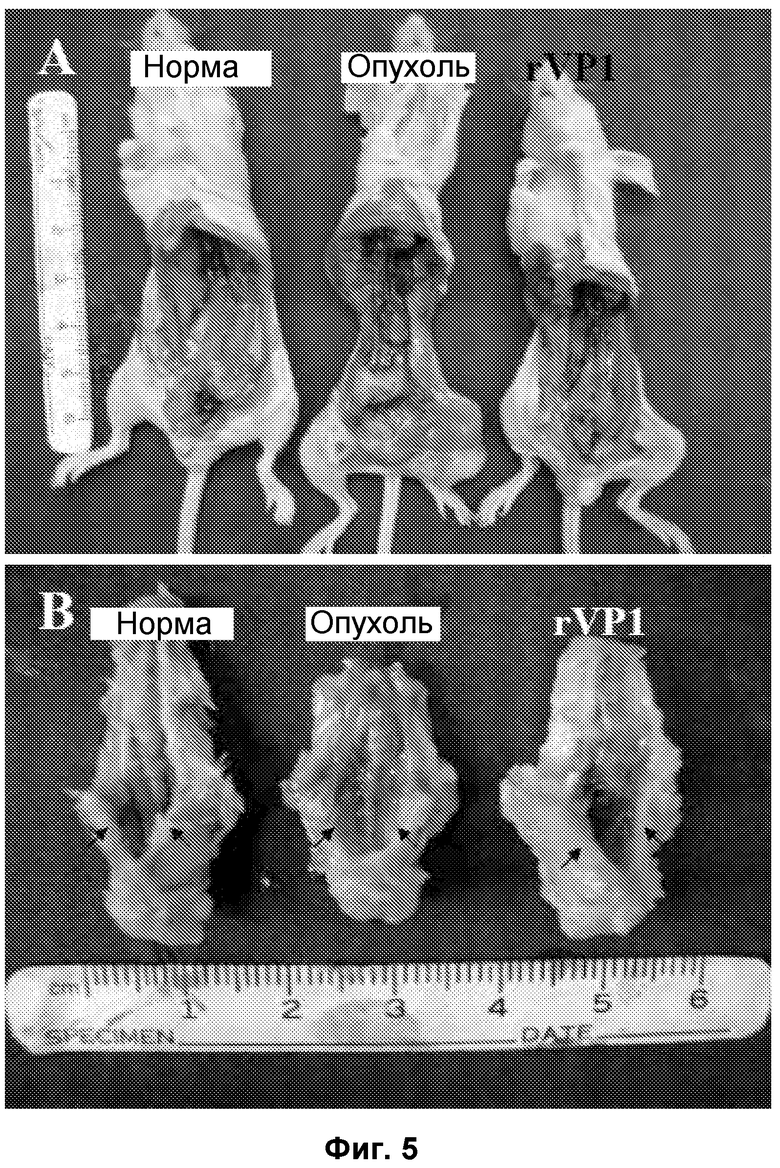
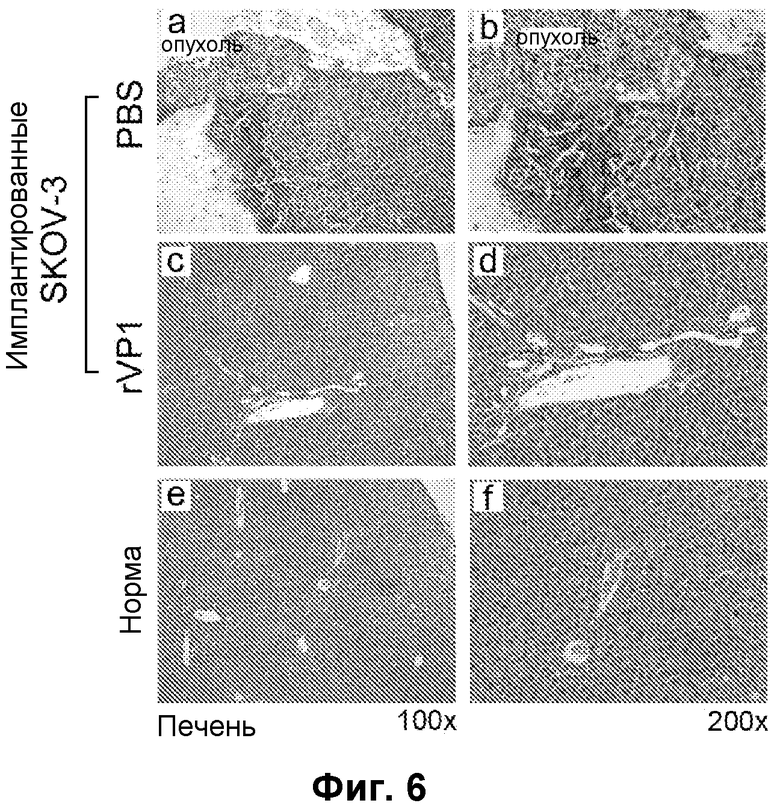

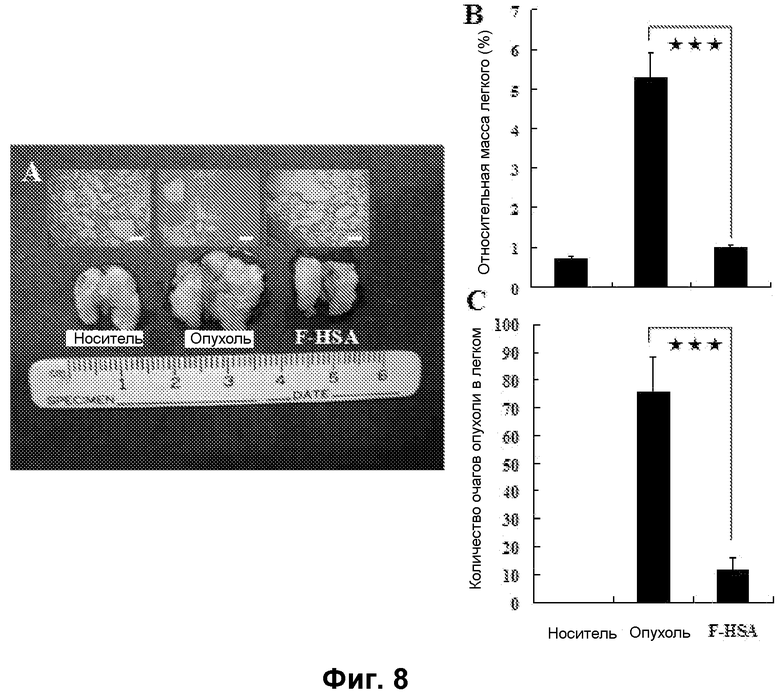
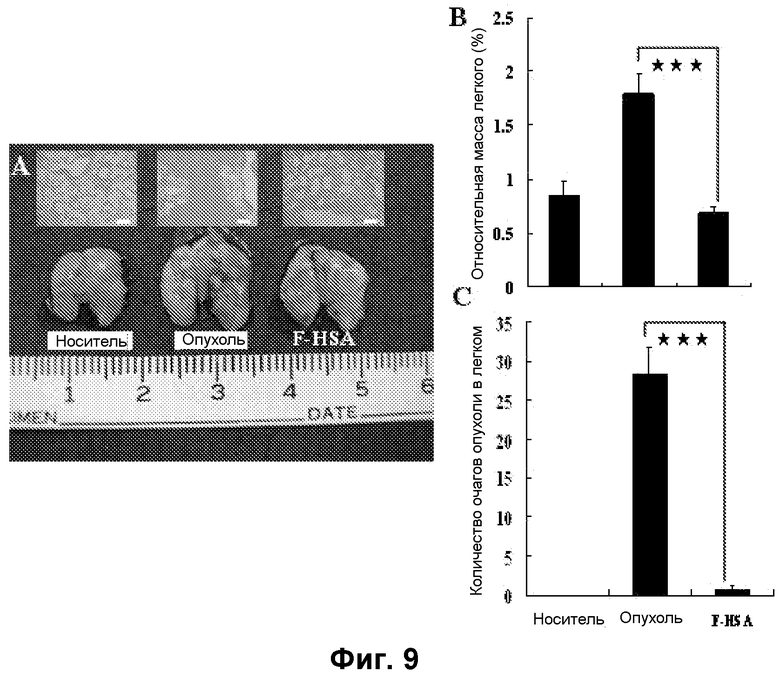

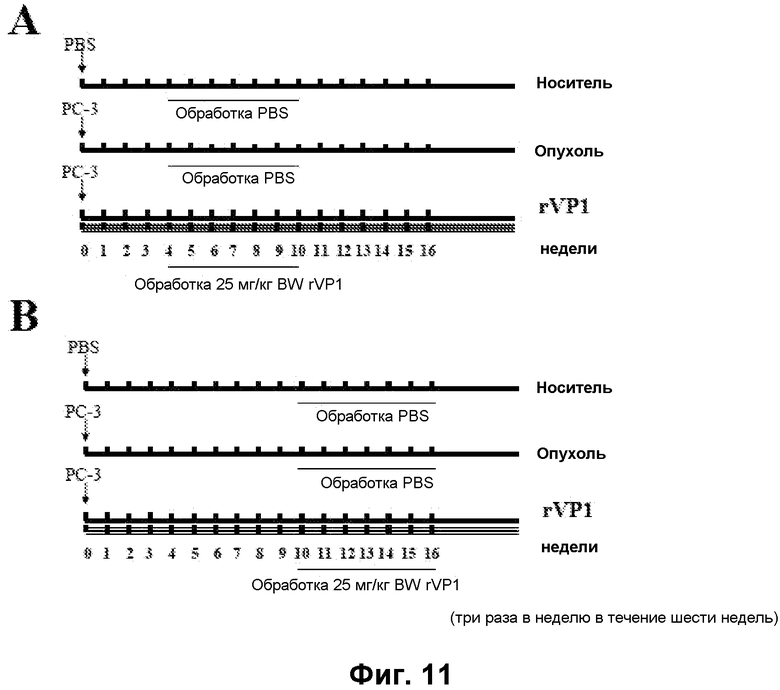

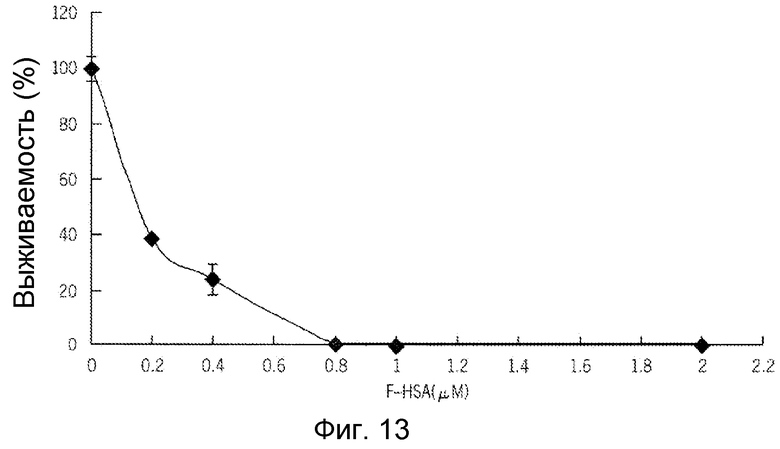
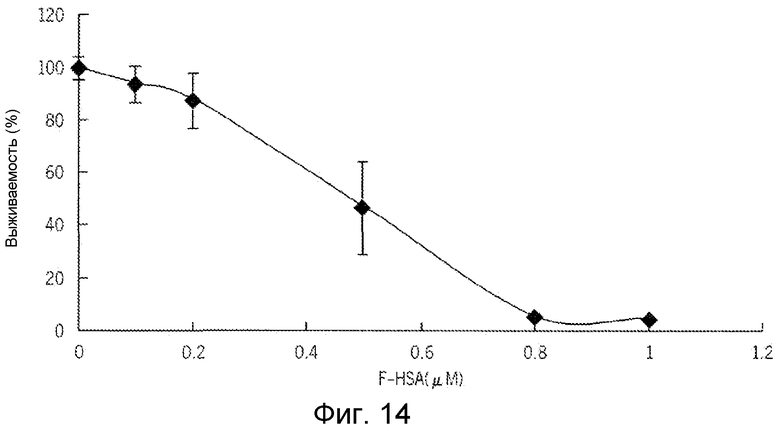
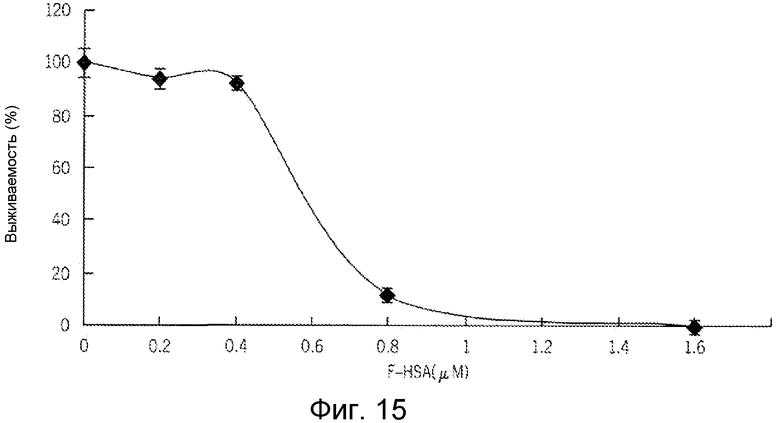
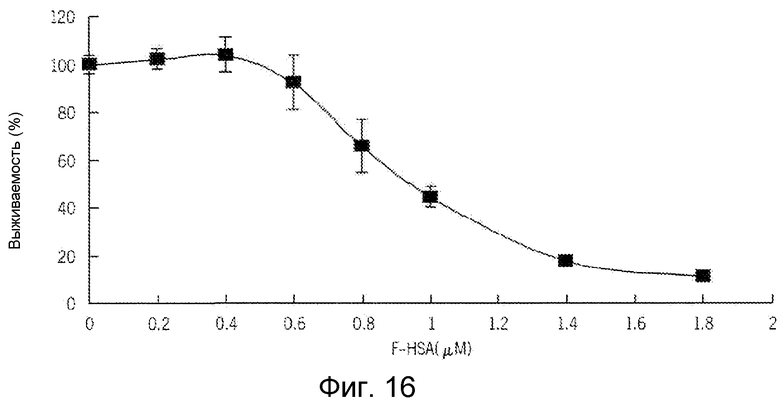
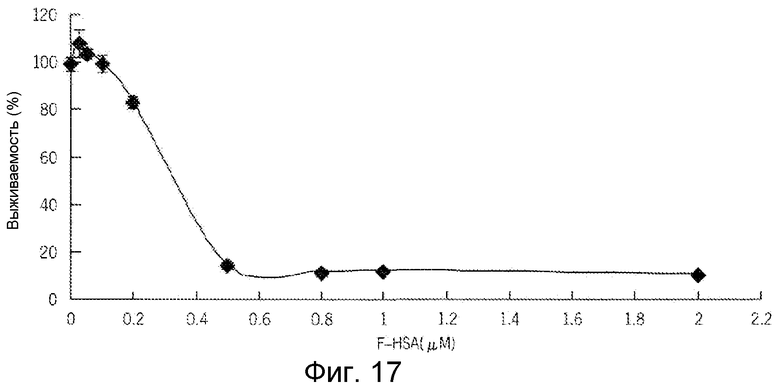
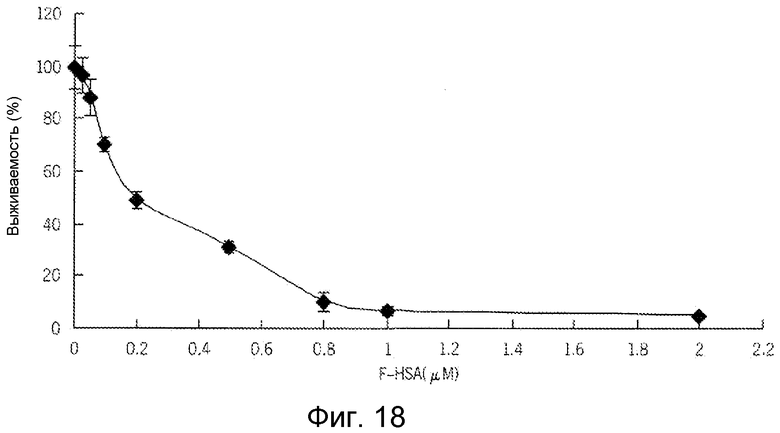
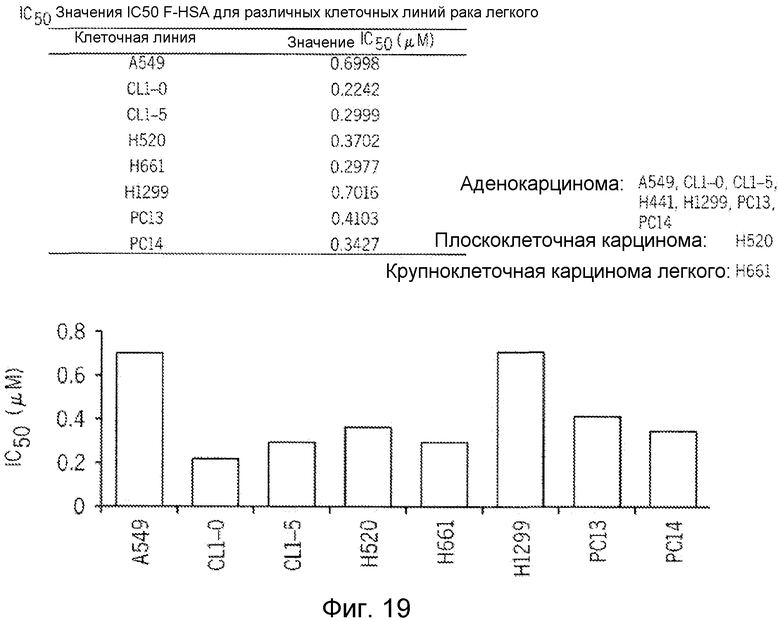
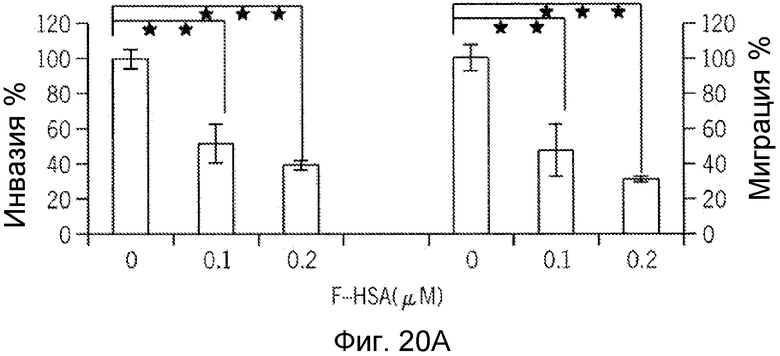
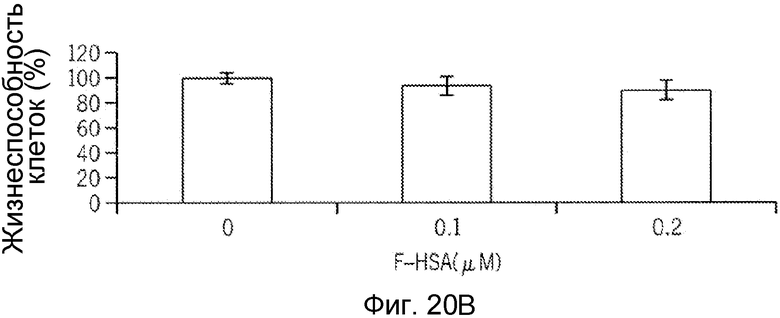
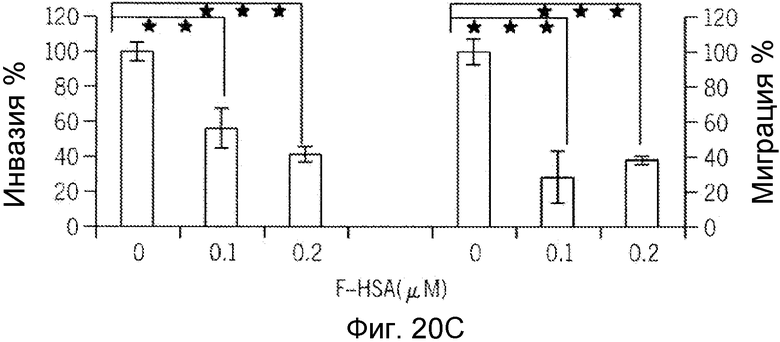

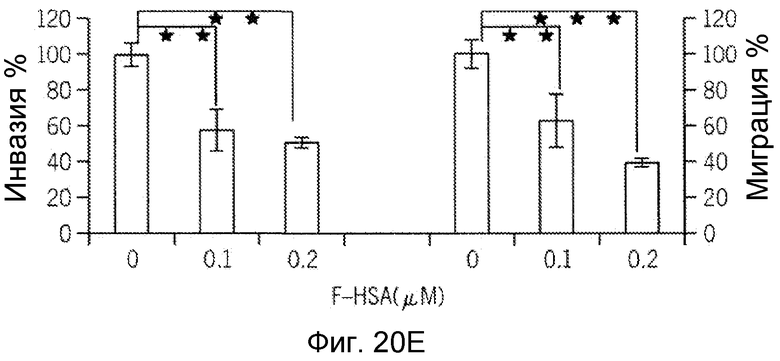
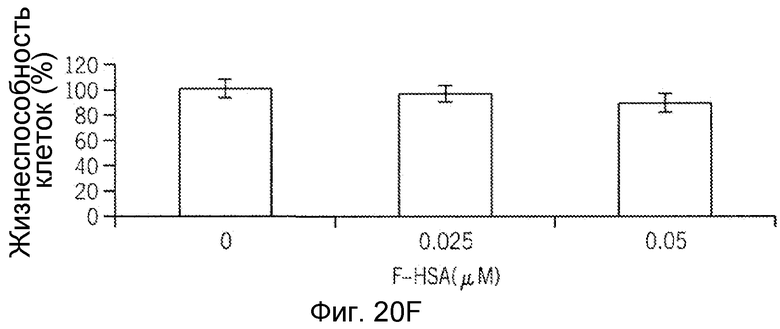
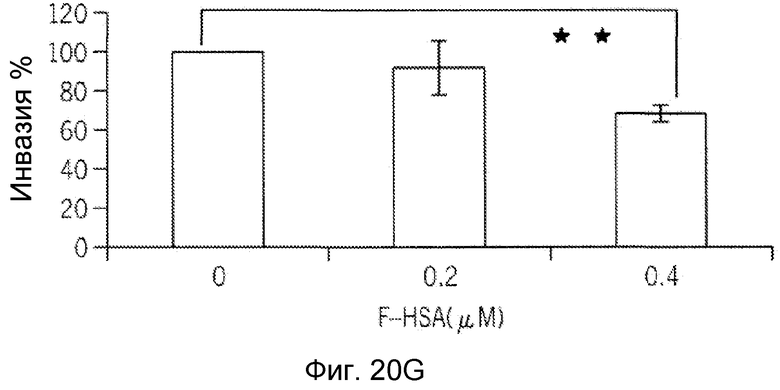
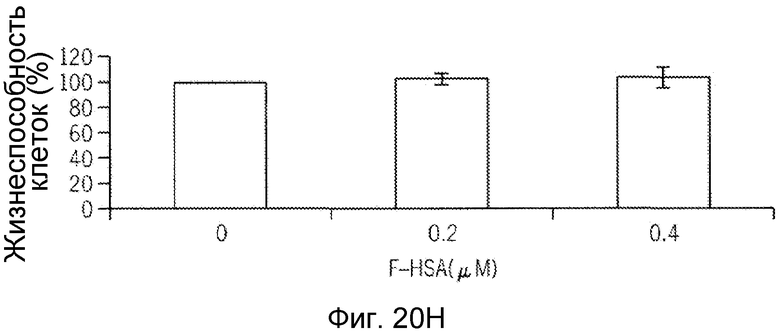
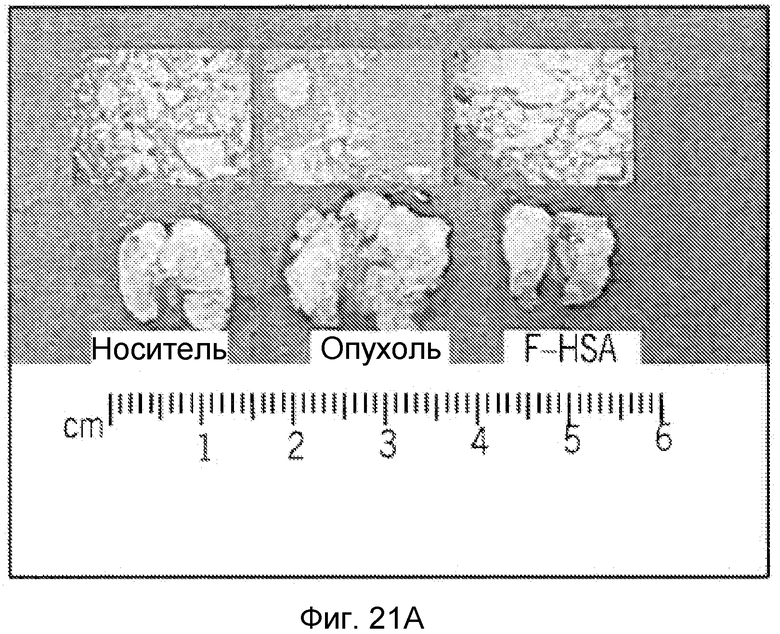
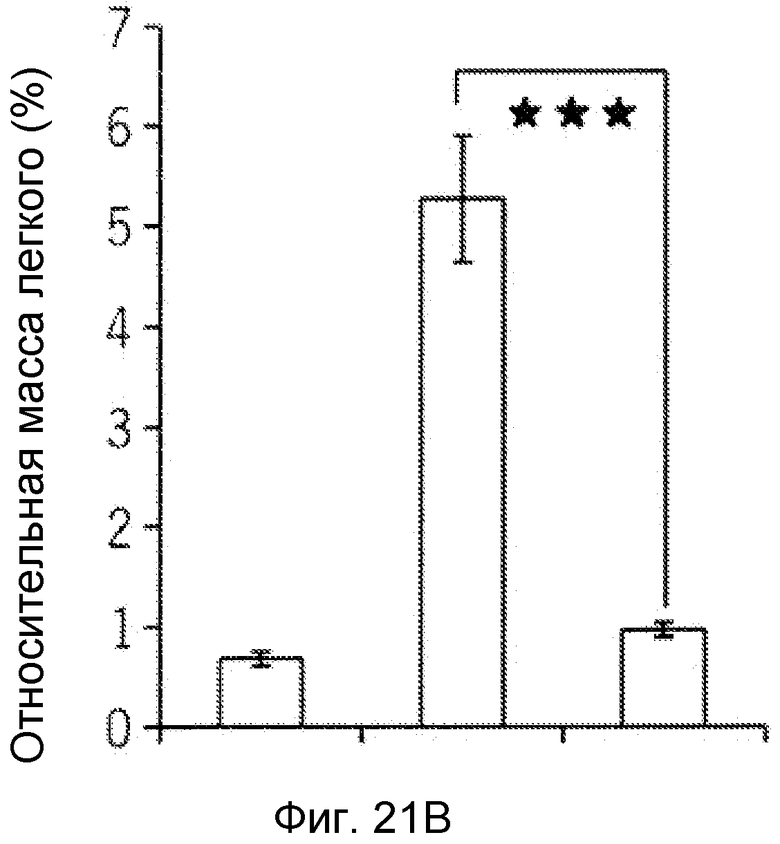

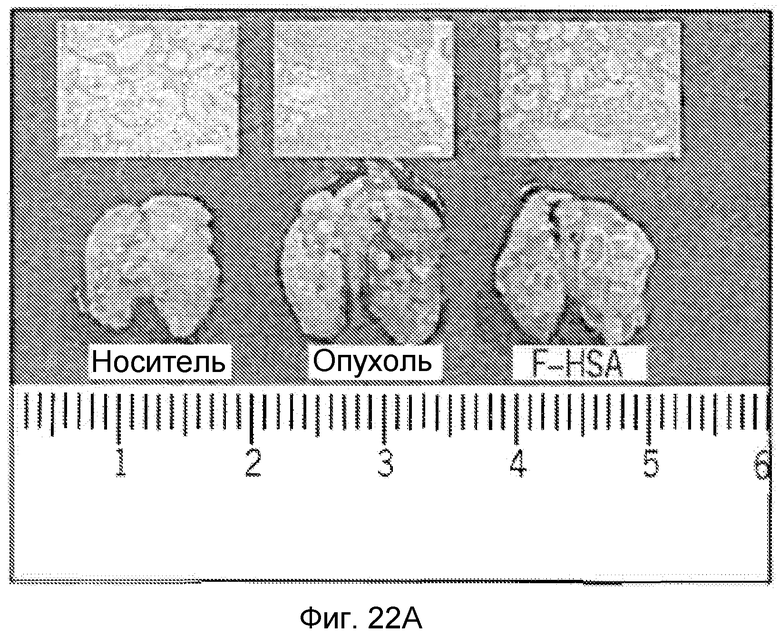
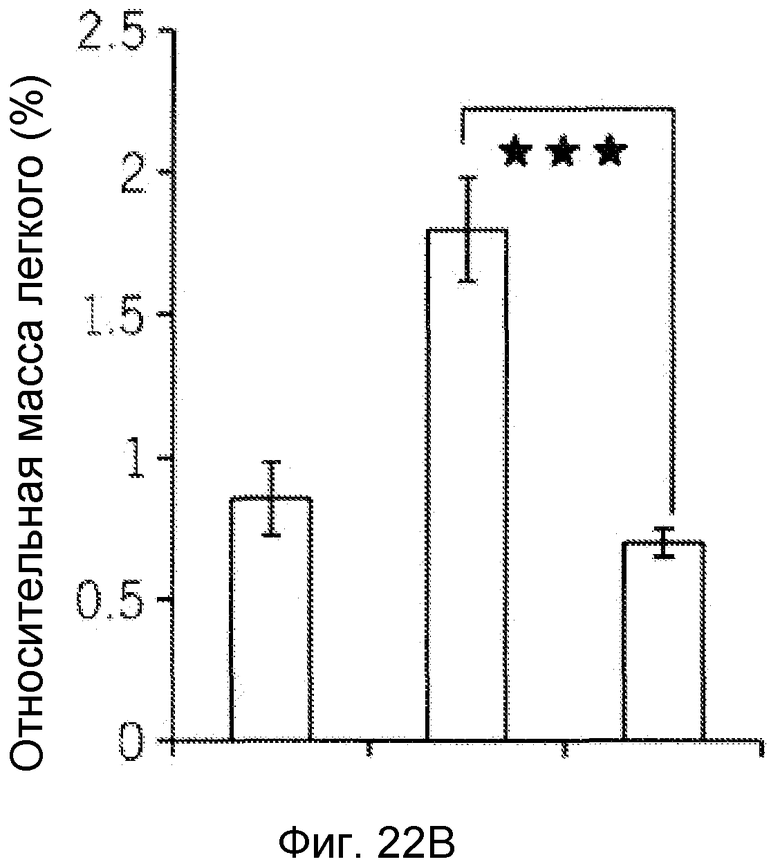
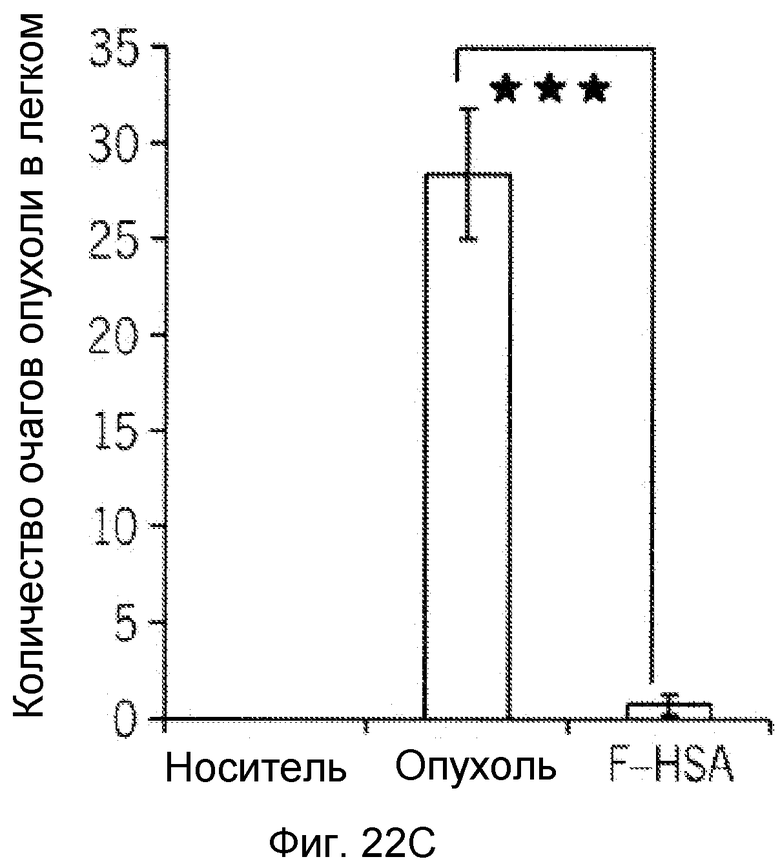
Группа изобретений относится к области медицины, а именно к онкологии, и предназначена для подавления раковых метастазов. Фармацевтическая композиция для подавления раковых метастазов у индивидуума содержит фибриллярный белок и фармацевтически приемлемый эксципиент. Указанный фибриллярный белок выбирают из группы, состоящей из фибриллярного альбумина, фибриллярного сывороточного альбумина человека и фибриллярных капсидных белков вируса ящура. Для приготовления указанной композиции получают фибриллярный сывороточный альбумин человека и смешивают его в терапевтически эффективном количестве с фармацевтически приемлемым носителем. Использование группы изобретений позволяет повысить эффективность подавления раковых метастазов. 3 н. и 8 з.п. ф-лы, 1 табл., 33 ил., 12 пр.
1. Фармацевтическая композиция для подавления раковых метастазов у индивидуума, содержащая фибриллярный белок и фармацевтически приемлемый эксципиент, где указанный фибриллярный белок выбирают из группы, состоящей из фибриллярного альбумина, фибриллярного сывороточного альбумина человека и фибриллярных капсидных белков вируса ящура.
2. Фармацевтическая композиция по п.1, где указанный рак характеризуется повышенной экспрессией интегрина α5β1 и/или αvβ3.
3. Способ получения композиции по п.1, включающий следующие стадии:
получение фибриллярного сывороточного альбумина человека; и
смешивание фибриллярного сывороточного альбумина человека в терапевтически эффективном количестве с фармацевтически приемлемым носителем.
4. Способ по п.3, где стадия получения фибриллярного сывороточного альбумина человека дополнительно включает:
растворение сывороточного альбумина человека в растворе детергента;
пропускание растворенного сывороточного альбумина человека через колонку для гель-фильтрации с размером пор, позволяющим разделять белки с молекулярной массой, составляющей 70 кДа и более;
элюирование сывороточного альбумина человека из колонки.
5. Способ лечения рака у пациента, представляющего собой человека, включающий введение указанному пациенту композиции по п.1.
6. Способ по п.5, где указанный фибриллярный белок содержит фибриллярный альбумин.
7. Способ по п.6, где указанный фибриллярный белок содержит фибриллярный сывороточный альбумин человека.
8. Способ по п.5, где указанный фибриллярный белок содержит фибриллярные капсидные белки вируса ящура.
9. Способ по п.5, где указанное введение выбрано из группы, состоящей из внутривенной инъекции, подкожной инъекции, интраперитонеальной инъекции, внутриартериальной инъекции, внутримышечной инъекции, внутриопухолевой инъекции, инъекции в прилежащие к опухоли ткани, внутривенного вливания и внутриартериального вливания.
10. Способ по п.5, где указанный способ далее включает введение второго терапевтического средства и/или применение лучевой терапии к указанному индивидууму.
11. Способ по п.10, где указанное второе терапевтическое средство представляет собой химиотерапевтическое средство.
| US 5922676 A, 13.07.1999 | |||
| US 20080300186 А1, 04.12.2008 | |||
| US 2009214669 A1, 27.08.2009 | |||
| MORRIS PG et al | |||
| Microtubule active agents: beyond the taxane frontier | |||
| Clin Cancer Res., 2008, 14(22), p.7167-72 | |||
| US 6299856 B1, 09.10.2001. |
Авторы
Даты
2015-12-20—Публикация
2010-11-19—Подача