ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В настоящей заявке описаны способы синтеза модифицированных по атому фосфора нуклеиновых кислот, содержащих хиральные Х-фосфонатные составляющие. Описанные в данном документе способы дают нуклеиновые кислоты с модифицированным остовом высокой диастереомерной чистоты посредством асимметричной реакции ахиральной молекулы, содержащей химически устойчивую H-фосфонатную составляющую, с нуклеозидом/нуклеотидом.
УРОВЕНЬ ТЕХНИКИ
Олигонуклеотиды могут использоваться терапевтических, диагностических и новых и наноматериальных приложениях. Использование природных последовательностей ДНК или РНК ограничено их стабильностью относительно нуклеаз. Кроме того, in vitro исследования показали, что на свойства антисмысловых нуклеотидов, такие как сродство к связыванию, последовательность специфического связывания с комплементарной РНК, стабильность относительно нуклеаз, влияют конфигурации фосфорных атомов. Поэтому в данной области имеется потребность в способах получения олигонуклеотидов, которые стереоконтролируются по фосфору и проявляют желательную стабильность к деградации, сохраняя в то же самое время сродство к экзогенным или эндогенным комплементарным ДНК/РНК последовательностям. Имеется потребность в легком синтезе этих соединений на твердом носителе или в растворе, что позволит получить широкое разнообразие синтетических модификаций на сахарах или нуклеооснованиях данного олигонуклеотида.
В данной заявке описываются стереоконтролируемые синтезы модифицированных по атому фосфора полимерных и олигомерных нуклеиновых кислот, которые в некоторых вариантах осуществляются на твердых носителях.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения представлен способ синтеза нуклеиновой кислоты, содержащей хиральную Х-фосфонатную составляющую, который включает реакцию молекулы, содержащей ахиральную Н-фосфонатную составляющую, и нуклеозида, содержащего 5'-ОН составляющую, с образованием конденсированного промежуточного соединения; и превращение данного конденсированного промежуточного соединения в нуклеиновую кислоту, содержащую хиральную Х-фосфонатную составляющую.
В некоторых вариантах, способ, где стадия реакции молекулы, содержащей ахиральную Н-фосфонатную составляющую, и нуклеозида, содержащего 5'-ОН составляющую, с образованием конденсированного промежуточного соединения, представляет собой реакцию в "одном котле". В некоторых вариантах, данный способ дает нуклеиновую кислоту, содержащую хиральную X-фосфонатную составляющую Формулы 1

В некоторых вариантах соединения Формулы 1, R1 представляет собой -ОН, -SH, -NRdRd, -N3, галоген, водород, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa или -SRc. Y1 является О, NRd, S, или Se. Ra является блокирующей составляющей. Rc является блокирующей группой. В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2, или -HP(O)(Re). В каждом случае Re представляет собой, независимо, водород, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-, или катион, который представляет собой Na+1, Li+1, или К+1. Y2 является О, NRd, или S. В каждом случае R2 представляет собой, независимо, водород, -ОН, -SH, NRdRd, -N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb, или -SRc, где Rb является блокирующей составляющей. В каждом случае Ва представляет собой, независимо, блокированный или деблокированный аденин, цитозин, гуанин, тимин, урацил или модифицированное нуклеооснование. В каждом случае X представляет собой, независимо, алкил, алкокси, арил, алкилтио, ацил, -NRfRf, алкенилокси, алкинилокси, алкенилтио, алкинилтио, -S-Z+, -Se-Z+, или -ВН3 -Z+. В каждом случае Rf представляет собой, независимо, водород, алкил, алкенил, алкинил, или арил. Z+ представляет собой аммоний ион, алкиламмоний ион, гетероароматический иминиевый ион, или гетероциклический иминиевый ион, любой из которых является первичным, вторичным, третичным или четвертичным, или Z представляет собой моновалентный металлический ион. R3 представляет собой водород, блокирующую группу, связывающую составляющую, соединенную с твердым носителем или связывающую составляющую, соединенную с нуклеиновой кислотой; и n представляет собой целое число от 1 до приблизительно 200. В некоторых вариантах данного способа, каждая Х-фосфонатная составляющая соединения Формулы 1 имеет диастереомерную чистоту более 98%, как определено методом 31Р ЯМР спектроскопии или методом высокоэффективной жидкостной хроматографии с обращенной фазой. В некоторых вариантах данного способа, каждая Х-фосфонатная составляющая имеет Rp конфигурацию. В других вариантах данного способа, каждая Х-фосфонатная составляющая имеет Sp конфигурацию. В других вариантах данного способа, каждый Х-фосфонат имеет, независимо, Rp конфигурацию или Sp конфигурацию.
В еще одних вариантах данного способа, молекула, содержащая ахиральную H-фосфонатную составляющую, представляет собой соединение Формулы 2
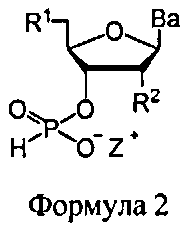
В Формуле 2, R1 представляет собой -NRdRd, -N3, галоген, водород, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -Р(O)(Re)2, -HP(O)(Re), -ORa, или -SRc. Y1 представляет собой О, NRd, S или Se. Ra является блокирующей составляющей. Rc является блокирующей группой. В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2, или -HP(O)(Re). В каждом случае Re представляет собой, независимо, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-. Y2 представляет собой О, NRd, или S. R2 представляет собой водород, -NRdNd, N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb, или -SRc, где Rb является блокирующей составляющей. Ва представляет собой блокированный или деблокированный аденин, цитозин, гуанин, тимин, урацил или модифицированное нуклеооснование. Z+ представляет собой аммоний ион, алкиламмоний ион, гетероароматический иминиевый ион, или гетероциклический иминиевый ион, любой из которых является первичным, вторичным, третичным или четвертичным, или моновалентным металлическим ионом.
В некоторых вариантах данного способа, он включает дополнительно хиральный реагент. В еще других вариантах данного способа хиральный реагент представляет собой соединение Формулы 3
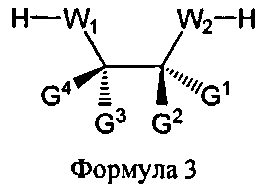
W1 и W2 представляют собой, независимо, -NG5-, -O- или -S-. G1, G2, G3, G4, и G5 представляют собой, независимо, водород, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетарил, или арил, или две из G1, G2, G3, G4, и G5 представляют G6, и, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее приблизительно до 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или неслитым, и где не более четырех из G1, G2, G3, G4, и G5 являются G6. В некоторых вариантах данного способа, нуклеозидом, содержащим 5'-ОН составляющую, является соединение Формулы 4
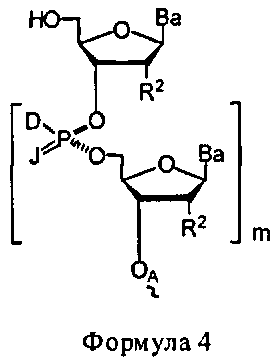
В каждом случае R2 представляет собой, независимо, водород, -HRdRd, N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb, или -SRc, где Rb является блокирующей составляющей. Y1 является О, NRd, S, или Se. Rc является блокирующей группой. В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2 или -HP(O)(Re). В каждом случае Re представляет собой, независимо, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2- или гетероарил-Y2-. Y2 является О, NRd, или S. В каждом случае Ва представляет собой, независимо, блокированный или деблокированный аденин, цитозин, гуанин, тимин, урацил или модифицированное нуклеооснование. m представляет собой целое число от 0 до n-1. n является целым числом от 1 до приблизительно 200. ОA соединена с тритильной составляющей, силильной составляющей, ацетильной составляющей, ацильной составляющей, арильной составляющей, связывающая составляющая соединена с твердым носителем или связывающая составляющая соединена с нуклеиновой кислотой. J является О и D, является Н или J, является S, Se или ВН3 и D является хиральным лигандом C1 или составляющей Формулы А
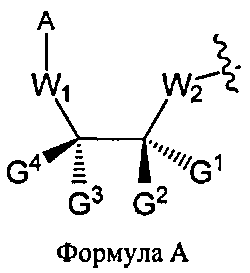
В Формуле A, W1 и W2 являются, независимо, NHG5, ОН или SH. А представляет собой водород, ацил, арил, алкил, аралкил или силильную составляющую. G1, G2, G3, G4, и G5 представляют собой, независимо, водород, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероарил, или арил, или две из G1, G2, G3, G4 и G5 являются G6, и, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоцикловое или содержащее гетероатом кольцо, включающее приблизительно до 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или неслитым, и где не более четырех из G1, G2, G3, G4, и G5 являются G6. В еще других вариантах данного способа, он дополнительно включает введение конденсирующего реагента CR, с помощью которого молекула, содержащая ахиральную H-фосфонатную составляющую, активируется, реагируя с данным хиральным реагентом с образованием хирального промежуточного соединения.
В дополнительных вариантах данного способа, конденсирующий реагент CR представляет собой Ar3PL2, (ArO)3PL2
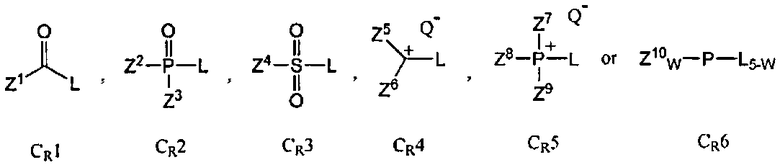
Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8, Z9 и Z10 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, или гетероарилокси, или где любая из Z2 и Z3, Z5 и Z6, Z7 и Z8, Z8 и Z9, Z9 и Z7, или Z7 и Z8 и Z9, взятые вместе, образуют 3-20-членное алициклическое или гетероциклическое кольцо. Q- является противоанионом, L является отщепляемой группой, и w является целым числом от 0 до 3. Ar представляет собой арил, гетероарил, и/или одна из Ar групп присоединена к полимерному носителю. В некоторых вариантах данного способа, противоионом конденсирующего реагента cr является Cl-, Br-, BF4 -, PF6 -, TfO-, Tf2N-, AsF6 -, ClO4 -, или SbF6 -, где Tf является CF3SO2. В других вариантах данного способа отщепляемой группой конденсирующего реагента CR является F, Cl, Br, I, 3-нитро-1,2,4-триазол, имидазол, алкилтриазол, тетразол, пентафторобензол, или 1-гидроксибензотриазол.
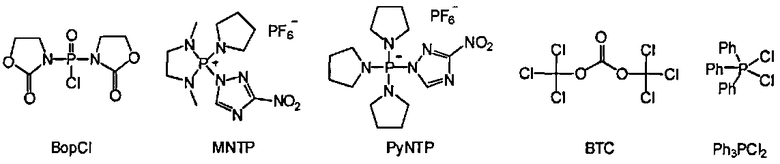
В некоторых вариантах данного способа конденсирующим реагентом является фосген, трихлорометил хлороформиат, бис(трихлорометил)карбонат (БТК), оксалил хлорид, Ph3PCl2, (PhO)3PCl2, N,N'-бис(2-оксо-3-оксазолидинил)фосфиновый хлорид (BopCl), 1,3-диметил-2-(3-нитро-1,2,4-триазол-1-ил)-2-пирролидин-1-ил-1,3,2-диазофосфолидиний гексафторофосфат (MNTP), или 3-нитро-1,2,4-триазол-1-ил-трис(пирролидин-1-ил)фосфоний гексафторофосфат (PyNTP)
В еще одном варианте данного способа, он дополнительно включает введение активирующего реагента AR. В одном варианте, активирующим реагентом AR является
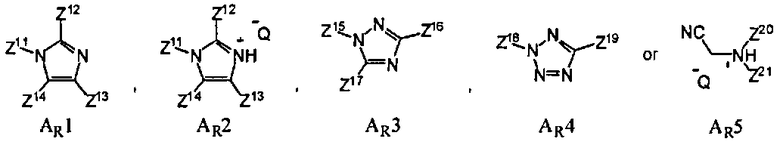
где Z11, Z12, Z13, Z14, Z15, Z16, Z17, Z18, Z19, Z20 и Z21 представляют собой, независимо, водород, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси или гетероарилокси, или где любая из Z11 и Z12, Z11 и Z13, Z11 и Z14, Z12 и Z13, Z12 и Z14, Z13 и Z14, Z15 и Z16, Z15 и Z17, Z16 и Z17, Z18 и Z19, или Z20 и Z21, взятые вместе, образуют 3-20-членное алициклическое или гетероциклическое кольцо, или образуют 5 или 20-членное ароматическое кольцо; и Q- является противоионом. В одном варианте, противоионом активирующего реагента AR является Cl-, Br-, BF4 -, PF6 - TfO-, Tf2N-, AsF6 -, ClO4 - или SbFe6 -, где Tf является CF3SO2. В одном варианте, активирующим реагентом AR является имидазол, 4,5-дицианоимидазол (DCI), 4,5-дихлороимидазол, 1-фенилимидазолий трифлат (PhIMT), бензимидазолий трифлат (BIT), бензтриазол, 3-нитро-1,2,4-триазол (NT), тетразол, 5-этилтиотетразол, 5-(4-нитрофенил)тетразол, N-цианометилпирролидиний трифлат (ЦМПТ), N-цианометилпиперидиний трифлат, N-цианометилдиметиламмоний трифлат. В другом варианте, активирующим реагентом AR является 4,5-дицианоимидазол (DCI), 1-фенилимидазолий трифлат (PhIMT), бензимидазолий трифлат (BIT), 3-нитро-1,2,4-триазол (NT), тетразол, или N-цианометилпирролидиний трифлат (ЦМПТ)
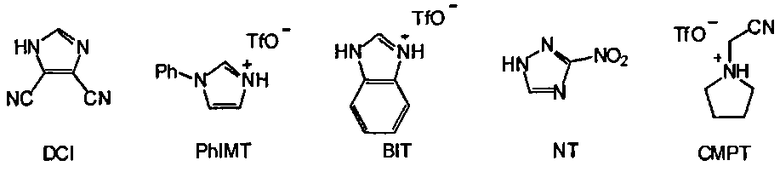
В одном варианте активирующим реагентом AR является N-цианометилпирролидиний трифлат (ЦМПТ).
В некоторых вариантах данного способа реакция осуществляется в апротонном органическом растворителе. В других вариантах данного способа растворителем является ацетонитрил, пиридин, тетрагидрофуран или дихлорометан. В других вариантах данного способа, когда апротонный органический растворитель не является основным, на реакционной стадии присутствует основание. В некоторых вариантах данного способа указанным основанием является пиридин, хинолин или N,N-диметиланилин. В некоторых вариантах данного способа основанием является
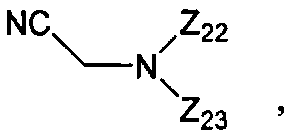
где Z22 и Z23 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси или гетероарилокси, или где любые из Z22 и Z23, взятые вместе, образуют 3-10-членное алициклическое или гетероциклическое кольцо. В некоторых вариантах данного способа основанием является N-цианометилпирролидин. В некоторых вариантах данного способа апротонный органический растворитель является безводным. В других вариантах данного способа безводный апротонный органический растворитель является свежеперегнанным. В еще других вариантах данного способа, свежеперегнанным безводным апротонным органическим растворителем является пиридин. В другом варианте данного способа, свежеперегнанным безводным апротонным органическим растворителем является ацетонитрил.
В некоторых вариантах настоящего способа стадия превращения конденсированного промежуточного соединения в соединение Формулы 1 включает: модифицирование конденсированного промежуточного соединения с получением соединения Формулы 5
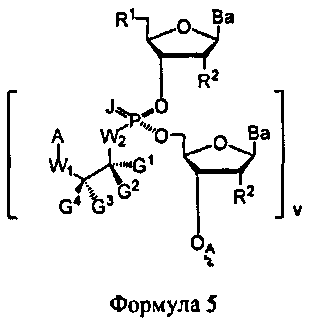
В Формуле 5, R1 представляет собой -NRdRd, -N3, галоген, водород, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa, или -SRc. Y1 является О, NRd, S или Se. Ra является блокирующей составляющей. Rc является блокирующей группой. В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2 или -HP(O)(Re). В каждом случае Re представляет собой, независимо, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2- или гетероарил-Y2-. Y2 является О, NRd или S. В каждом случае R2 представляет собой, независимо, водород, -NRdRd, N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb или -SRc, где Rb является блокирующей составляющей. В каждом случае Ва представляет собой, независимо, блокированный или деблокированный аденин, цитозин, гуанин, тимин, урацил, или модифицированное нуклеооснование. В каждом случае J является S, Se, или ВН3. v является целым числом, равным 1. OA присоединена к связывающей составляющей, соединенной с твердым носителем, или связывающей составляющей, соединенной с нуклеиновой кислотой. А представляет собой ацил, арил, алкил, аралкил или силильную составляющую. G1, G2, G3, G4, и G5 представляют собой, независимо, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероарил или арил, или две из G1, G2, G3, G4, и G5 являются G6, и, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее до приблизительно 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или неслитым, и где не более четырех из G1, G2, G3, G4, и G5 являются G6.
В некоторых вариантах данного способа он включает стадии: (а) разблокирования R1 соединения Формулы 5 с получением соединения Формулы 4, где m является, по меньшей мере, 1, J является S, Se или ВН3 и D является составляющей Формулы А; (b) реакции соединения Формулы 4 с использованием метода согласно п. 10, где стадия превращения конденсированного промежуточного соединения включает кэппирование данного промежуточного соединения и модифицирование кэппированного конденсированного промежуточного соединения с получением соединения Формулы 5, где v больше 2 и меньше приблизительно 200; и (с) при необходимости, повторения стадий (а) и (b) с получением соединения Формулы 5, где v больше 3 и меньше приблизительно 200. В других вариантах данного способа он дополнительно включает стадию превращения соединения Формулы 5 в соединение Формулы 1, где каждая Ва составляющая деблокирована. R1 представляет собой -ОН, -SH, -NRdRd, -N3, галоген, водород, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa или -SRc. Y1 является О, NRd, S или Se. Ra является блокирующей составляющей. Rc является блокирующей группой. В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2, или -HP(O)(Re). В каждом случае Re представляет собой, независимо, водород, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-, или катион, который является Na+1, Li+1 или К+1. Y2 является О, NRd или S. В каждом случае R2 представляет собой, независимо, водород, -ОН, -SH, -NRdRd, -N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb, или -SRc, где Rb является блокирующей составляющей. R3 является Н. В каждом случае X является, независимо, -S-Z+, -Se-Z+ или -ВН3 -Z+. Z+ представляет собой аммоний ион, алкиламмоний ион, гетероароматический иминиевый ион или гетероциклический иминиевый ион, любой из которых является первичным, вторичным, третичным или четвертичным, или Z представляет собой моновалентный металлический ион.
В некоторых вариантах данного способа, стадия превращения конденсированного промежуточного соединения в соединение Формулы 1 включает подкисление данного конденсированного промежуточного соединения с получением соединения Формулы 4, где m равняется, по меньшей мере, единице, J является О, и D является Н. В некоторых вариантах способа, конденсированное промежуточное соединение содержит составляющую Формулы А'
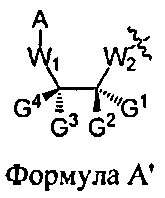
А является водородом, и G1 и G2 представляют собой, независимо, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероарил или арил, и G3, G4, и G5 представляют собой, независимо, водород, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероарил или арил, или две из G1, G2, G3, G4 и G5 являются G6, и взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее до приблизительно 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или неслитым, и где не более четырех из G1, G2, G3, G4 и G5 являются G6. В некоторых вариантах данного способа он дополнительно включает: (а) реакцию соединения Формулы 4, где m равняется, по меньшей мере, единице, J является О и D является Н, с использованием метода согласно п. 10, где стадия превращения конденсированного промежуточного соединения в соединение Формулы 1 включает подкисление данного конденсированного промежуточного соединения с получением соединения Формулы 4, где m равняется, по меньшей мере, 2 и меньше приблизительно 200; J является О, и D является Н, и (b) при необходимости, повторение стадии (а) с получением соединения Формулы 4, где m больше 2 и меньше приблизительно 200.
В некоторых вариантах данного способа, подкисление включает добавление такого количества кислоты Бренстеда (Brønsted) или Льюиса (Lewis), которое эффективно для превращения конденсированного промежуточного соединения в соединение Формулы 4 без удаления пуриновой или пиримидиновой составляющих из конденсированного промежуточного соединения. В других вариантах настоящего способа, подкисление включает добавление 1% трифтороуксусной кислоты в органическом растворителе, 3% дихлороуксусной кислоты в органическом растворителе или 3% трихлороуксусной кислоты в органическом растворителе. В еще других вариантах данного способа, подкисление дополнительно включает добавление катионного поглотителя. В некоторых вариантах данного способа катионным поглотителем является триэтилсилан или триизопропилсилан.
В некоторых вариантах данного способа, стадия превращения конденсированного промежуточного соединения в соединение Формулы 1 дополнительно включает разблокирование R1 перед стадией подкисления конденсированного промежуточного соединения.
В других вариантах данного способа он дополнительно включает стадию модифицирования соединения Формулы 4 для введения X составляющей с получением, таким способом, соединения Формулы 1, где R3 является блокирующей группой или связывающей составляющей, соединенной с твердым носителем.
В еще других вариантах данного способа, он дополнительно включает обработку X-модифицированного соединения с получением соединения Формулы 1, где R1 представляет собой -ОН, -SH, -NRdRd, -N3, галоген, водород, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa или -SRc. Y1 является O, NRd, S, или Se. Ra является блокирующей составляющей. Rc является блокирующей группой. В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2 или -HP(O)(Re). В каждом случае Re представляет собой, независимо, водород, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2- или катион, который представляет собой Na+1, Li+1, или К+1. Y2 является О, NRd, или S. В каждом случае R2 представляет собой, независимо, водород, -ОН, -SH, -NRdRd, -N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb, или -SRc, где Rb является блокирующей составляющей. В каждом случае Ва составляющая деблокирована. R3 является Н. В каждом случае X представляет собой, независимо, алкил, алкокси, арил, алкилтио, ацил, -NRfRf, алкенилокси, алкинилокси, алкенилтио, алкинилтио, -S-Z+, -Se-Z+, или -ВН3 -Z+. В каждом случае Rf представляет собой, независимо, водород, алкил, алкенил, алкинил или арил. Z+ является аммоний ионом, алкиламмоний ионом, гетероароматическим иминий ионом или гетероциклическим иминий ионом, любой из которых является первичным, вторичным, третичным или четвертичным, или Z представляет собой моновалентный металлический ион. n больше 1 и меньше приблизительно 200.
В некоторых вариантах данного способа, стадия модифицирования осуществляется с использованием борирующего агента, серного электрофила или селенового электрофила.
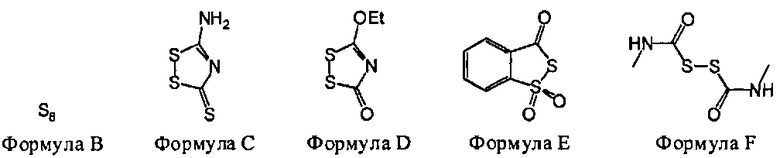
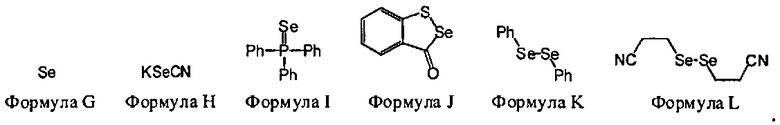
В некоторых вариантах данного способа, серным электрофилом является соединение, имеющее одну из следующих формул:
S8(Формула В), Z24-S-S-Z25 или Z24-S-X-Z25.
Z24 и Z25 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкокси, арилокси, гетероарилокси, ацил, амид, имид или тиокарбонил или Z24 и Z25, взятые вместе, образуют 3-8 членное алициклическое или гетероциклическое кольцо, которое может быть замещенным или незамещенным; X является SO2, О или NRf; и Rf представляет собой водород, алкил, алкенил, алкил, или арил.
В некоторых вариантах данного способа, серным электрофилом является соединение Формулы В, С, D, Е или F
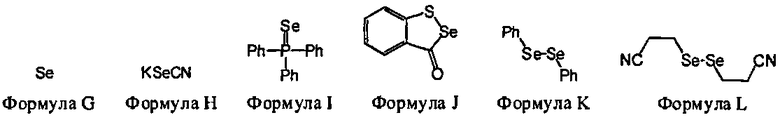
В некоторых вариантах данного способа, селеновым электрофилом является соединение, имеющее одну из следующих формул:
Se(Формула G), Z26-Se-Se-Z27, или Z26-Se-X-Z27
Z26 и Z27 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, гетероарилокси, ацил, амид, имид или тиокарбонил, или Z26 и Z27, взятые вместе, образуют 3-8 членное алициклическое или гетероциклическое кольцо, которое может быть замещенным или незамещенным; X является SO2, S, О, или NRf; и Rf является водородом, алкилом, алкенилом, алкинилом или арилом.
В некоторых вариантах данного способа, селеновым электрофилом является соединение Формулы G, H, I, J, К или L
В некоторых вариантах данного способа борирующим агентом является боран-N,N-диизопропилэтиламин (ВН3·DIPEA), боран-пиридин (ВН3·Py), боран-2-хлоропиридин (ВН3·CPy), боран-анилин (ВН3·An), боран-тетрагидрофуран (ВН3·THF), или боран-диметилсульфид (ВН3·Me2S).
В некоторых вариантах данного способа, стадия модифицирования осуществляется с использованием силилирующего реагента, затем серного электрофила, селенового электрофила, борирующего агента, алкилирующего агента, альдегида, или ацилирующего агента.
В некоторых вариантах данного способа, силилирующим реагентом является хлоротриметилсилан (TMS-Cl), триизопропилсилилхлорид (TIPS-Cl), t-бутилдиметилсилилхлорид (TBDMS-Cl), t-бутилдифенилсилилхлорид (ТБДФС-Cl), 1,1,1,3,3,3-гексаметилдисилизан (HMDS), N- триметилсилилдиметиламин (TMSDMA), N-триметилсилилдиэтиламин (TMSDEA), N-триметилсилилацетамид (TMSA), N,О-бис(триметилсилил)ацетамид (БСА), или N,O-бис(триметилсилил)трифтороацетамид(BSTFA).
В некоторых вариантах данного способа, серным электрофилом является соединение, имеющее одну из следующих формул: S8 (Формула В), Z24-S-S-Z25, или Z24-S-X-Z25, где Z24 и Z25 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, гетероарилокси, ацил, амид, имид или тиокарбонил, или Z24 и Z25, взятые вместе, образуют 3-8 членное алициклическое или гетероциклическое кольцо, которое может быть замещенным или незамещенным; X является SO2, О, или NRf; и Rf представляет собой водород, алкил, алкенил, алкинил или арил.
В некоторых вариантах данного способа, серным электрофилом является соединение Формулы В, С, D, Е, или F
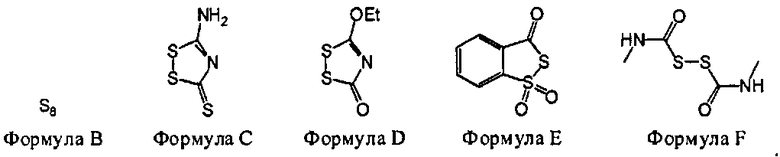
В некоторых вариантах данного способа, селеновым электрофилом является соединение, имеющее одну из следующих формул: Se (Формула G), Z26-Se-Se-Z27, или Z26-Se-X-Z27, где Z26 и Z27 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, гетероарилокси, ацил, амид, имид, или тиокарбонил, или Z26 и Z27, взятые вместе, образуют 3-8 членное алициклическое или гетероциклическое кольцо, которое может быть замещенным или незамещененым; X является SO2, S, О, или NRf; и Rf представляет собой водород, алкил, алкенил, алкинил или арил.
В некоторых вариантах данного способа, селеновым электрофилом является соединение Формулы G, H, I, J, К или L
В некоторых вариантах данного способа, борирующим агентом является боран-N,N-диизопропилэтиламин (ВН3·DIPEA), боран-пиридин (ВН3·Py), боран-2-хлоропиридин (ВН3·CPy), боран-анилин (ВН3·An), боран-тетрагидрофуран (ВН3·THF), или боран-диметилсульфид (ВН3·Me2S).
В некоторых вариантах данного способа, алкилирующим агентом является алкил галогенид, алкенил галогенид, алкинил галогенид, алкил сульфонат, алкенил сульфонат, или алкинил сульфонат. В других вариантах данного способа, альдегидом является (пара)-формальдегид, алкил альдегид, алкенил альдегид, алкинил альдегид, или арил альдегид.
В некоторых вариантах данного способа, ацилирующим агентом является соединение Формулы M или N
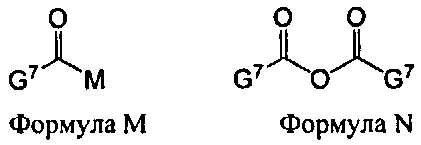
G7 представляет собой алкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил или арил, гетероарил, алкилокси, арилокси или гетероарилокси; и М представляет собой F, Cl, Br, I, 3-нитро-1,2,4-триазол, имидазол, алкилтриазол, тетразол, пентафторобензол или 1-гидроксибензотриазол.
В некоторых вариантах данного способа, стадия модифицирования осуществляется путем реакции с галогенирующим реагентом, затем путем реакции с нуклеофилом. В некоторых вариантах данного способа, галогенирующим реагентом является CCl4, CBr4, Cl2, Br2, I2, сульфурил хлорид (SO2Cl2), фосген, бис(трихлорометил)карбонат (БТК), монохлорид серы, дихлорид серы, хлорамин, CuCl2, N-хлоросукцинимид (NCS), CI4, N-бромосукцинимид (NBS), или N-йодосукцинимид (NIS). В других вариантах данного способа, нуклеофилом является NRfRfH, RfOH, или RfSH, где Rf представляет собой водород, алкил, алкенил, алкинил, или арил, и, по меньшей мере, одна из Rf NRfRfH не является водородом.
В некоторых вариантах данного способа, хиральным реагентом является соединение Формулы 3, где W1 является NHG5 и W2 является ОН. В некоторых вариантах данного способа, хиральный реагент отвечает Формуле O или Формуле P
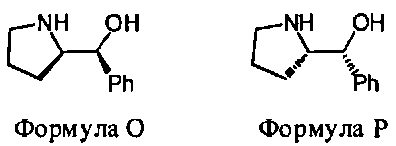
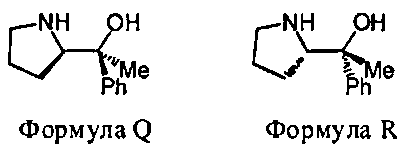
В некоторых вариантах данного способа, хиральный реагент отвечает Формуле Q или Формуле R
В некоторых вариантах данного способа, Ra представляет собой замещенный или незамещенный тритил или замещенный силил. В других вариантах данного способа Ra представляет собой замещенный или незамещенный тритил или замещенный силил. Rb представляет собой замещенный или незамещенный тритил, замещенный силил, ацетил, ацил или замещенный метиловый эфир.
В некоторых вариантах данного способа, R3 является блокирующей группой, которая представляет собой замещенный тритил, ацил, замещенный силил, или замещенный бензил. В других вариантах данного способа, R3 представляет собой связывающую составляющую, соединеннную с твердым носителем.
В некоторых вариантах данного способа, блокирующей группой Ва составляющей является бензиловая, ацильная, формильная, диалкилформамидиниловая, изобутириловая, феноксиацетильная, или тритиловая составляющая, любая из которых может быть незамещенной или замещенной. В некоторых вариантах данного способа, R1 представляет собой -N3, -NRdRd, алкинилокси, или -ОН. В некоторых вариантах данного способа, R1 представляет собой -N3, -NRdRd, алкинилокси, или -ОН. В других вариантах данного способа, R2 представляет собой -NRdRd, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, или гетероарил-Y1-, и замещена флуоресцентной или биомолекулярной связывающими составляющими. В еще других вариантах данного способа, R2 представляет собой -NRdRd, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, или гетероарил-Y1-, и замещена флуоресцентной или биомолекулярной связывающими составляющими.
В некоторых вариантах данного способа, заместитель на R2 представляет собой флуоресцентную составляющую. В других вариантах данного способа, заместителем на R2 является биотин или авидин. В еще других вариантах данного способа, заместитель на R2 представляет собой флуоресцентную составляющую. В некоторых вариантах данного способа, заместителем на R2 является биотин или авидин. В других вариантах данного способа, R2 представляет собой -ОН, -N3, водород, галоген, алкокси, или алкинилокси. В еще других вариантах данного способа, R2 представляет собой -ОН, -N3, водород, галоген, алкокси или алкинилокси. В некоторых вариантах данного способа, Ва представляет собой 5-бромоурацил, 5-йодоурацил, или 2,6-диаминопурин. В других вариантах данного способа, Ва модифицируется путем замещения флуоресцентной или биомолекулярной связывающей составляющей. В еще других вариантах данного способа, Ва модифицируется путем замещения флуоресцентной или биомолекулярной связывающей составляющей. В некоторых вариантах данного способа, заместителем на Ва является флуоресцентная составляющая. В других вариантах данного способа, заместителем на Ва является биотин или авидин. В еще других вариантах данного способа, заместителем на Ва является флуоресцентная составляющая. В некоторых вариантах данного способа, заместителем на Ва является биотин или авидин.
В некоторых вариантах данного способа, Z представляет собой пиридиний ион, триэтиламмоний ион, N,N-диизопропилэтиламмоний ион, 1,8-диазабицикло[5.4.0]ундец-7-ений ион, ион натрия или ион калия. В других вариантах данного способа, Z представляет собой пиридиний ион, триэтиламмоний ион, N,N-диизопропилэтиламмоний ион, 1,8-диазабицикло[5.4.0]ундец-7-ений ион, ион натрия или ион калия. В некоторых вариантах данного способа, X представляет собой алкил, алкокси, -NRfRf, -S-Z+ или -ВН3 -Z+. В других вариантах данного способа, X представляет собой алкил, алкокси, -NRfRf, -S-Z+ или -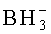
В одном варианте данного способа, серный электрофил отвечает Формуле F, Формуле Е или Формуле В. В некоторых вариантах данного способа, серный электрофил отвечает Формуле F, Формуле Е или Формуле В. В других вариантах данного способа, селеновый электрофил отвечает Формуле G или Формуле L. В еще других вариантах данного способа, селеновый электрофил отвечает Формуле G или Формуле L. В некоторых вариантах данного способа, борирующим агентом является боран-N,N-диизопропилэтиламин (ВН3·DIPEA), боран-2-хлоропиридин (ВН3·CPy), боран-тетрагидрофуран (ВН3·THF) или боран-диметилсульфид (ВН3·Me2S). В других вариантах данного способа, галогенирующим агентом является CCl4, CBr4, Cl2, сульфурил хлорид (SO2Cl2), или N-хлоросукцинимид (NCS). В еще других вариантах данного способа, конденсирующий реагент представляет собой бис(трихлорометил)карбонат (БТК), Ph3PCl2 или - N,N'-бис(2-оксо-3-оксазоллидинил)фосфиновый хлорид (BopCl).
В другом аспекте настоящего изобретения, представлен способ идентификации или обнаружения молекулы-мишени в образце, способ, включающий: контактирование образца, который предположительно содержит молекулу-мишень, с нуклеиновокислотной сенсорной молекулой Формулы 1, синтезированной согласно способов данного изобретения, где изменение в сигнале, генерируемом блоком генерации сигнала, указывает на присутствие указанной мишени в указанном образце. Нуклеиновокислотная сенсорная молекула специфическим образом связывается с молекулой-мишенью. В некоторых вариантах имеется множество нуклеиновокислотных сенсорных молекул. В некоторых вариантах, множество нуклеиновокислотных сенсорных молекул включает нуклеиновокислотные сенсорные молекулы, которые связываются специфическим образом с отличающимися молекулами-мишенями. В некоторых случаях данный способ дополнительно включает количественное определение величины изменения сигнала, генерируемого блоком генерации сигнала, для количественного определения молекул-мишеней в данном образце. Блок генерации сигнала выявляет любой вид сигнала, включая, но не ограничиваясь этим, флуоресценцию, поверхностно-плазмонный резонанс, тушение флуоресценции, хемилюминесценцию, интерферометрию или измерение показателя преломления.
Образец, который анализируется, является образцом окружающей среды, биологически опасным материалом, органическим образцом, лекарством, токсином, ароматизатором, отдушкой или биологическим образцом. Биологический образец представляет собой клетку, клеточный экстракт, клеточный лизат, ткань, тканевой экстракт, биологическую жидкость, сыворотку, кровь или кровяной продукт. В некоторых вариантах данного способа присутствие молекулы-мишени указывает на наличие патологического состояния. В некоторых вариантах данного способа присутствие молекулы-мишени указывает на присутствие желательной молекулы.
В другом аспекте данного изобретения, представлен способ амплификации необходимых участков нуклеиновой кислоты из нуклеиновокислотной матрицы, который включает: (а) введение множества первых ПЦР праймеров, имеющих участок фиксированной нуклеотидной последовательности, комплементарный требуемой консенсусной последовательности; (b) введение множества вторых ПЦР праймеров, (с) амплификацию нуклеиновокислотной матрицы посредством ПЦР (полимеразной цепной реакции) с использованием множества первых ПЦР праймеров и множества вторых ПЦР праймеров при условиях, где подмножество множества первых праймеров связывается с требуемой консенсусной последовательностью при условиях, где подмножество данного множества первых праймеров связывается с требуемой консенсусной последовательностью в значительной степени там, где это имеет место в матрице, и подмножество данного множества вторых праймеров связывается с матрицей в местоположениях, удаленных от первых праймеров, так что происходит конкретная амплификация нуклеиновокислотных участков, фланкированные первым праймером и вторым праймером, и где множество первых ПЦР праймеров и/или множество вторых ПЦР являются молекулами нуклеиновой кислоты Формулы 1, которые получают согласно способов настоящего изобретения.
В некоторых вариантах, данная матрица является геномной ДНК. В некоторых вариантах, данная матрица является эукариотной геномной ДНК. В некоторых вариантах, данная матрица является геномной ДНК человека. В некоторых вариантах, данная матрица является прокариотной ДНК. В некоторых вариантах, данная матрица представляет собой ДНК, которая является клонированной геномной ДНК, субгеномным участком ДНК, хромосомным или субхромосомным участком. В некоторых вариантах, матрица представляет собой РНК.
ИНКОРПОРАЦИЯ ПУТЕМ ОТСЫЛКИ
Все публикации и патентные заявки, раскрытые в этой спецификации, инкорпорированы в данном документе путем отсылки в своей целостности в той же самой степени, как если бы конкретно и индивидуально было указано на инкорпорацию путем отсылки каждой индивидуальной публикации или патентной заявки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Преимущества данного изобретения конкретно сформулированы в формуле изобретения. Лучшее понимание особенностей и преимуществ настоящего изобретения будет достигнуто путем отсылки к последующему подробному описанию, которое излагает иллюстративные варианты, в которых представлены принципы данного изобретения, и к сопровождающим чертежам, где:
Фигура 1. 1Н ЯМР спектр (Sp)-4tt(CDCl3)
Фигура 2. 31P ЯМР спектр (Sp)-4tt(CDCl3)
Фигура 3. 1Н ЯМР спектр (Rp)-4tt(CDCl3)
Фигура 4. 31Р ЯМР спектр (Rp)-4tt(CDCl3)
Фигура 5А. UPLC® (ультражидкостная хроматография) профиль неочищенного (Sp)-5tt
Фигура 5В. UPLC® профиль неочищенного (Sp)-5tt с использованием БТК вместо Ph3PC12
Фигура 6А. UPLC® профиль неочищенного (Sp)-5tt
Фигура 6В. UPLC® профиль неочищенного (Sp)-5tt с использованием БТК вместо PH3PCL2
Фигура 7А. UPLC® профиль неочищенного (Rp)-5tt
Фигура 7В. UPLC® профиль неочищенного (Rp)-5tt
Фигура 8. UPLC® профиль неочищенного (Rp)-5tt
Фигура 9А. UPLC® профиль неочищенного (Sp)-5ct
Фигура 9В. UPLC® профиль неочищенного (Sp)-5ct
Фигура 10А. UPLC® профиль неочищенного (Rp)-5ct
Фигура 10В. UPLC® профиль неочищенного (Rp)-5ct
Фигура 11. UPLC® профиль неочищенного (Sp)-5at
Фигура 12. UPLC® профиль неочищенного (Rp)-5at
Фигура 13. UPLC® профиль неочищенного (Sp)-5gt
Фигура 14. UPLC® профиль неочищенного (Rp)-5gt
Фигура 15А. UPLC® профиль неочищенного (Sp)-5tt
Фигура 15В. UPLC® профиль неочищенного (Sp)-5tt
Фигура 16А. UPLC® профиль неочищенного (Sp)-5tt
Фигура 16В. UPLC® профиль неочищенного (Sp)-5tt
Фигура 17А. UPLC® профиль неочищенного (Rp)-5tt
Фигура 17В. UPLC® профиль неочищенного (Rp)-5tt
Фигура 18. UPLC® профиль неочищенного (Sp)-5ct
Фигура 19. UPLC® профиль неочищенного (Rp)-5ct
Фигура 20А. UPLC® профиль неочищенного (Sp)-5at
Фигура 20В. UPLC® профиль неочищенного (Sp)-5at
Фигура 21. UPLC® профиль неочищенного (Sp)-5at
Фигура 22А. UPLC® профиль неочищенного (Rp)-5at
Фигура 22В. UPLC® профиль неочищенного (Rp)-5at
Фигура 23. UPLC® профиль неочищенного (Sp)-5gt
Фигура 24. UPLC® профиль неочищенного (Rp)-5gt
Фигура 25. UPLC® профиль неочищенного (Sp)-7tt
Фигура 26. UPLC® профиль неочищенного (Rp)-7tt
Фигура 27. UPLC® профиль неочищенного (Sp)-8tt
Фигура 28. UPLC® профиль неочищенного (Rp)-8tt
Фигура 29А. UPLC® профиль Bcex-(Sp)-[Tps]3T
Фигура 29В. MALDI TOF-MC спектр Всех-(Sp)-[TPS]3Т
Фигура 30А. UPLC® профиль неочищенного (Sp, Rp, Sp)-[TPS]3Т
Фигура 30В. MALDI TOF-MC спектр (Sp, Rp, Sp)-[TPS]3Т
Фигура 31А. UPLC® профиль неочищенного (RP, SP, RP)-[TPS]3Т
Фигура 31В. MALDI TOF-MC спектр (Rp, Sp, Rp)-[Tps]3T
Фигура 32А. UPLC® профиль Bcex-(Rp)-[TPS]3T
Фигура 32В. MALDI TOF-MC спектр Всех-(Rp)-[TPS]3Т
Фигура 33А. UPLC® профиль неочищенного (Sp)-9uMu
Фигура 33В. MALDI TOF-MC спектр (Sp)-9uMu
Фигура 34А. UPLC® профиль неочищенного (Rp)-9uMu
Фигура 34В. MALDI TOF-MC спектр (Rp)-9uMu
Фигура 35А. UPLC® профиль неочищенного (Sp)-10uFu
Фигура 35В. MALDI TOF-MC спектр (Sp)-10uFu
Фигура 36А. UPLC® профиль неочищенного (Rp)-10uFu
Фигура 36В. MALDI TOF-MC спектр (Rp)-10uFu
Фигура 37А. UPLC® профиль неочищенного (Sp)-11nt
Фигура 37В. MALDI TOF-MC спектр (Sp)-11nt
Фигура 38А. UPLC® профиль неочищенного (Rp)-11nt
Фигура 38В. MALDI TOF-MC спектр (Rp)-11nt
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения.
Если не оговорено иное, следующие термины, использованные в этой заявке, включая спецификацию и формулу изобретения, имеют определения, данные ниже. Следует отметить, что, как используется в данном описании и формуле изобретения, сингулярные формы "a" "an" и "the" включают множественные формы ссылок, если в контексте четко не указано иное. Если не указано иное, применяются обычные методы масс-спектрометрии, ЯМР, высокоэффективной жидкостной хроматографии, химии белков, биохимии, рекомбинантной ДНК и фармакологии. В данной заявке использование "или" или "и" означает "и/или", если не утверждается иное. Кроме того, использование термина "включающий", также как и других форм, таких как "включает" и "включенный", не является ограничивающим.
Термин "нуклеиновая кислота" включает поли- или олиго-рибонуклеотиды (РНК) и поли- или олиго-дезоксирибонуклеотиды (ДНК; РНК или ДНК, полученные из N-гликозидов или С-гликозидов нуклеооснований и/или модифицированных нуклеооснований; нуклеиновые кислоты, полученные из сахаров и/или модифицированных сахаров; и нуклеиновые кислоты, полученые из фосфатных мостиков и/или модифицированных фосфорно-атомных мостиков. Данный термин охватывает нуклеиновые кислоты, содержащие любые комбинации нуклеооснований, модифицированных нуклеооснований, сахаров, модифицированных сахаров, фосфатных мостиков или модифицированных фосфорных атомных мостиков. Примеры включают, но не ограничиваясь этим, нуклеиновые кислоты, содержащие рибозные составляющие, нуклеиновые кислоты, содержащие дезоксирибозные составляющие, нуклеиновые кислоты, содержащие как рибозные так и дезоксирибозные составляющие, нуклеиновые кислоты, содержащие рибозные и модифицированные рибозные составляющие. Префикс поли- касается нуклеиновой кислоты, содержащей от приблизительно 1 до приблизительно 10000 нуклеотидных мономерных единиц и где префикс олиго- касается нуклеиновой кислоты, содержащей от приблизительно 1 до приблизительно 200 нуклеотидных мономерных единиц.
Термин "нуклеооснование" касается тех частей нуклеиновых кислот, которые задействованы в образовании водородных связей, связывающих одну нить нуклеиновой кислоты с другой комплементарной нитью последовательно специфическим способом. Наиболее общими природными нуклеооснованиями являются аденин (А), гуанин (G), урацил (U), цитозин (С) и тимин (Т).
Термин "модифицированное нуклеооснование" касается составляющей, которая может заменить нуклеооснование. Модифицированное нуклеооснование имитирует пространственное расположение, электронные свойства или некоторое другое физико-химическое свойство данного нуклеооснования и сохраняет свойство связывать водородной связью одну нить нуклеиновой кислоты с другой последовательно специфическим способом. Модифицированное нуклеооснование может спариваться с каждым из пяти природных оснований (урацил, тимин, аденин, цитозин или гуанин) без существенного влияния на свойства плавления, распознавания внутриклеточными ферментами или активность олигонуклеотидного дуплекса.
Термин "нуклеозид" касается составляющей, в которой нуклеооснование или модифицированное нуклеооснование ковалентно связано с сахаром или модифицированным сахаром.
Термин "сахар" касается моносахарида в закрытой или открытой форме. Сахара включают, но не ограничиваясь этим, рибозную, дезоксирибозную, пентофуранозную, пентопиранозную и гексопиранозную составляющие.
Термин "модифицированный сахар" касается составляющей, которая может заменить сахар.
Модифицированный сахар имитирует пространственное расположение, электронные свойства или некоторое другое физико-химическое свойство сахара.
Термин "нуклеотид" касается составляющей, где нуклеооснование или модифицированное нуклеооснование ковалентно связано с сахаром или модифицированным сахаром, и данный сахар или модифицированный сахар ковалентно связан с фосфатной группой или модифицированной фосфорно-атомной составляющей.
Термин "хиральный реагент" касается соединения, которое является хиральным или энантиочистым и может быть использовано для асимметричной индукции в нуклеиновокислотном синтезе.
Термин "хиральный лиганд" или "хиральное вспомогательное средство" касается составляющей, которая является хиральной или энантиочистой и контролирует стереохимический выход реакции.
В реакции конденсации термин "конденсирующий реагент" касается реагента, который активирует менее реакционный сайт и делает его более чувствительным к атаке нуклеофила.
Термин "блокирующая составляющая" касается группы, которая временно маскирует реакционную способность функциональной группы. Данная функциональная группа может быть впоследствии демаскирована путем удаления данной блокирующей составляющей.
Термины "борирующие агенты", "серные электрофилы", "селеновые электрофилы" касаются соединений, которые полезны на стадии модифицирования, используемой для введения ВН3, S, и Se групп, соответственно, для модификации на фосфорном атоме.
Термин "составляющая" касается специфического сегмента или функциональной группы молекулы.
Химическими составляющими являются часто распознаваемые химические частицы, встроенные или присоединенные к молекуле.
Термин "твердый носитель" касается любого носителя, который обеспечивает синтетическое массовое производство нуклеиновых кислот и может быть, при необходимости, повторно утилизирован. Как в данном документе используется, данный термин касается полимера, который нерастворим в применяемых средах на реакционных стадиях, осуществляемых для синтеза нуклеиновых кислот, и дериватизирован для включения реакционных групп.
Термин "связывающая составляющая" касается любой составляющей, помещенной, при необходимости, между концевым нуклеозидом и твердым носителем или между концевым нуклеозидом и другим нуклеозидом, нуклеотидом или нуклеиновой кислотой.
Как используется в данном документе, термины "терапия" или "лечение", или "временное облегчение" или "улучшение" используются взаимозаменяемо. Эти термины касаются подхода для получения выгодных или желательных результатов, включая, но не ограничиваясь этим, терапевтическую пользу и/или профилактическую пользу. Под терапевтической пользой понимается подавление или улучшение первопричинного расстройства, которое подвергается лечению. Кроме того, терапевтическая польза достигается посредством подавления или улучшения одного или нескольких физиологических симптомов, ассоциированных с первичным расстройством, так что у пациента наблюдается улучшение, несмотря на то, что данный пациент может еще страдать от указанного расстройства. Для профилактической пользы, данные композиции могут назначаться пациенту, который имеет риск развития конкретной болезни, или пациенту, сообщающему о наличии одного или нескольких симптомов болезни, даже несмотря на то, что эта болезнь не была диагностирована.
Термин "терапевтический эффект", который в данном документе используется, охватывает терапевтическую пользу и/или профилактическую пользу, как описано выше. Профилактический эффект включает задержку или исключение возникновения болезни или состояния, задержку или исключение появления симптомов болезни или состояния, замедление, остановку прогрессирования болезни или состояния, или их любых комбинаций.
Термин "алкильная" группа касается алифатической углеводородной группы. Алкильная составляющая может быть насыщенной алкильной группой (что означает, что она не содержит никаких элементов ненасыщенности, например, двойных связей углерод-углерод или тройных связей углерод-углерод), или данная алкильная составляющая может быть ненасыщенной алкильной группой (что означает, что она содержит, по меньшей мере, один элемент ненасыщенности). Данная алкильная составляющая, насыщенная или ненасыщенная, может быть разветвленной, прямой цепью или включать циклическую часть. Точкой присоединения алкила является углеродный атом, который не является частью кольца.
"Алкильная" составляющая может иметь от 1 до 10 углеродных атомов (всякий раз, когда она в данном документе появляется, числовая область, такая как "1-10", касается каждого целого числа в данной области; например, "от 1 до 10 углеродных атомов" означает, что данная алкильная группа может состоять из 1 углеродного атома, 2 углеродных атомов, 3 углеродных атомов, и т.д., до и включая 10 углеродных атомов, хотя данное определение также покрывает появление термина "алкил", где числовая область не обозначена). Алкил включает алкильные группы как с прямыми так и разветвленными цепями. Алкильная группа соединений, описанных в данном документе, может обозначаться как "С1-С6 алкил" или иметь подобные обозначения. Лишь в качестве примера, "C1-С6 алкил" указывает на то, что в данной алкильной цепи имеется один, два, три, четыре, пять или шесть углеродных атомов, т.е. данная алкильная цепь выбирается из группы, состоящей из метила, этила, пропила, изо-пропила, н-бутила, изо-бутила, втор-бутила и t-бутила. Типичные алкильные группы включают, но не ограничиваясь этим, метил, этил, пропил, изопропил, бутил, изобутил, третичный бутил, пентил, гексил, аллил, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил и подобное. В одном аспекте, алкилом является C1-С6 алкил. Как используется в данном документе, термин "арил" касается ароматического кольца, где каждый из атомов, образующих кольцо, является атомом углерода. Арильные кольца формируются пятью, шестью, семью, восемью, девятью или больше чем девятью углеродными атомами. Арильные группы являются замещенными или незамещенными. В одном аспекте, арил является фенилом или нафталинилом. В зависимости от структуры, арильная группа может быть монорадикальной или дирадикальной (например, ариленовой группой). В одном аспекте, арилом является С6-С10 арил. Термин "гетероарил" или, как альтернатива, "гетероароматическое соединение" относится к 5-18-членному ароматическому радикалу (например, С5-С13 гетероарил), который включает один или несколько кольцевых гетероатомов, которые выбираются из азота, кислорода и серы, и который может быть моноциклической, бициклической, трициклической или тетрациклической кольцевой системой. Когда бы этот термин не появлялся в данном тексте, числовая область, такая как "5-18" относится к каждому целому числу в данной области; например, "5-18 кольцевых атомов" означает, что данная гетероарильная группа может состоять из 5 кольцевых атомов, 6 кольцевых атомов, и т.д., до и включая 18 кольцевых атомов. N-содержащая "гетероароматическая" или "гетероарильная" составляющая касается ароматической группы, в которой, по меньшей мере, один из остовных атомов данного кольцао представляет собой атом азота. Полициклическая гетероарильная группа может быть слитой или неслитой. Гетероатом(ы) в данном гетероарильном радикале, при необходимости, окислены. Один или несколько атомов азота, если они присутствуют, при необходимости, кватернизованны. Гетероарил присоединен к остальной части молекулы посредством любого атома кольца(ец). Примеры гетероарилов включают, но не ограничиваясь этим, азепинил, акридинил, бензимидазолил, бензиндолил, 1,3-бензодиоксолил, бензофуранил, бензооксазолил, бензо[d]тиазолил, бензотиадиазолил, бензо[b][1,4]диоксепинил, бензо[b][1,4]оксазинил, 1,4-бензодиоксанил, бензонафтофуранил, бензоксазолил, бензодиоксолил, бензодиоксинил, бензоксазолил, бензопиранил, бензопирнонил, бензофуранил, бензоуранонил, бензофуразанил, бензотиазолил, бензотиенил (бензотиофенил), бензотиено[3,2-d]пиримидинил, бензотриазолил, бензо[4,6]имидазо[1,2-а]пиридинил, карбазолил, циннолинил, циклопента[d]пиримидинил, 6,7-дигидро-5H-циклопента[4,5]тиено[2,3-d]пиримидинил, 5,6-дигидробензо[h]хиназолинил, 5,6-дигидробензо[h]циннолинил, 6,7-дигидро-5H-бензо[6,7]циклогепта[1,2-с]пиридазинил, дибензофуранил1, дибензотиофенил, фуранил, фуразанил, фуранонил, фуро[3,2-с]пиридинил, 5,6,7,8,9,10-гексагидроц[d]пиримидинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиридазинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиридинил, изотиазолил, имидазолил, индазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, изохинолил, индолизинил, изоксазолил, 5,8-метано-5,6,7,8-тетрагидрохиназолинил, нафтиридинил, 1,6-нафтиридинонил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, 5,6,6а,7,8,9,10,10а-октагидробензо[h]хиназолинил, 1-фенил-1H-пирролил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пиранил, пирролил, пиразолили, пиразоло[3,4-d|пиримидинил, пиридинил, пиридо[3,2-d]пиримидинил, пиридо[3,4-d]пиримидинил, пиразинил, пиримидинил, пиридазинил, пирролил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетрагидрохинолинил, 5,6,7,8-тетрагидрохиназолинил, 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d] пиримидинил, 6,7,8,9-тетрагидро-5H-циклогепта[4,5]тиено[2,3-d] пиримидинил, 5,6,7,8-тетрагидропиридо[4,5-с]пиридазинил, тиазолил, тиадиазолил, тиапиранил, триазолил, тетразолил, триазинил, тиено[2,3-d]пиримидинил, тиено[3,2-d]пиримидинил, тиено[2,3-с]придинил, и тиофенил (т.е. тиенил). Если в данной спецификации не сделана специальная оговорка, гетерарильная составляющая замещена, при необходимости, одним или несколькими заместителями, которые представляют собой, независимо: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, гало, циано, нитро, оксо, тиоксо, триметилсиланил, -ORa, -SRa, -OC(O)Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)S(O)tRa (где t равняется 1 или 2), -S(O)tORa (где t равняется 1 или 2), или -S(O)tN(Ra)2 (где t равняется 1 или 2), где каждая R' представляет собой, независимо, водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил.
Термин "алициклический" касается целиком углеродной составляющей, которая является как алифатической, так и циклической. Алициклические группы содержат одно или несколько целиком углеродных колец, которые могут быть насыщенными или ненасыщенными, но не имеют ароматических свойств. Алициклические группы являются замещенными или незамещенными и могут содержать от одного до десяти углеродных атомов. В одном аспекте, алициклическое соединение представляет собой моноциклический циклоалкан. В другом аспекте алициклическое соединение представляет собой бициклический циклоалкан.
Термин "аралкил" относится к алкильной группе, замещенной арильной группой. Подходящие аралкильные группы включают бензил, пиколил, и такое подобное, каждая из которых может быть, при необходимости, замещенной.
"Ацильная составляющая" относится к алкил(С=O), арил(С=O), или аралкил(С=O) группам.
Ацильная составляющая может иметь промежуточную составляющую (Y), которая представляет собой окси, амино, тио, или селено между карбонильной и углеводородной группами. Например, ацильной группой может быть алкил-Y-(С=O), арил-Y-(С=O) или аралкил-Y-(С=O).
"Алкенильные" группы представляют собой группы с прямыми, разветвленными цепями и циклические углеводородные группы, содержащие, по меньшей мере, одну двойную связь углерод-углерод. Алкенильные группы могут быть замещенными.
"Алкинильные" группы представляют собой группы с прямыми, разветвленными цепями и циклические углеводородные группы, содержащие, по меньшей мере, одну тройную связь углерод-углерод. Алкинильные группы могут быть замещенными.
"Алкокси" группа касается алкильной группы, связанной с кислородом, т.е. (алкил)-O- группа, где алкил является таким, как определено выше. Примеры включают метокси (-ОСН3) или этокси (-ОСН2СН3) группы.
"Алкенилокси" группа касается алкенильной группы, связанной с кислородом, т.е. (алкенил)-O-группа, где алкенил является таким, как определено выше.
"Алкинилокси" группа касается алкинильной группы, связанной с кислородом, т.е. (алкинил)-O-группа, где алкинил является таким, как определено выше.
"Арилокси" группа касается арильной группы, связанной с кислородом, т.е. (арил)-O-группа, где арил является таким, как определено выше. Пример включает фенокси (-OC6H5).
Термин "алкилселено" касается алкильной группы, которая имеет присоединенную к ней замещенную селено группу, т.е. (алкил)-Se- группа, где алкил является таким, как определено выше.
Термин "алкенилселено" касается алкенильной группы, которая имеет присоединенную к ней замещенную селено группу, т.е. (алкенил)-Se- группа, где алкенил является таким, как определено выше.
Термин "алкинилселено" касается алкинильной группы, которая имеет присоединенную к ней замещенную селено группу, т.е. (алкинил)-Se- группа, где алкинил является таким, как определено выше.
Термин "алкилтио" касается алкильной группы, присоединенной к мостиковому атому серы, т.е. (алкил)-S-группа, где алкил является таким, как определено выше. Например, алкилтио представляет собой метилтио и такое подобное.
Термин "алкенилтио" относится к алкенильной группе, присоединенной к мостиковому атому серы, т.е. (алкенил)-S- группа, где алкенил является таким, как определено выше.
Термин "алкинилтио" касается алкинильной группы, присоединенной к мостиковому атому серы, т.е. (алкинил)-S- группа, где алкинил является таким, как определено выше.
Термин "алкиламино" касается аминогруппы, замещенной, по меньшей мере, одной алкильной группой, т.е.. -NH(алкил) или -N-(алкил)2, где алкил является таким, как определено выше.
Термин "алкениламино" касается аминогруппы, замещенной, по меньшей мере, одной алкенильной группой, т.е. -NH(алкенил) или -N-(алкенил)2, где алкенил является таким, как определено выше.
Термин "алкиниламино" касается аминогруппы, замещенной, по меньшей мере, одной алкинильной группой, т.е. -NH(алкинил) или -N-(алкинил)2, где алкинил является таким, как определено выше.
Термин "галоген", как предполагается, включает фтор, хлор, бром и иод. "Флуоресцентная группа" относится к молекуле, которая, при возбуждении светом с определенной длиной волны излучает свет с другой длиной волны. Флуоресцентные группы включают, но не ограничиваясь этим, индольные группы, флуоресцеин, тетраметилродамин, тексас красный (Texas Red), BODIPY, 5-[(2-аминоэтил)амино]нафталин-1-сульфоновую кислоту (EDANS), кумарин и люцифер желтый (Lucifer yellow).
"Аммоний ион" представляет собой положительно заряженный полиатомный катион химической формулы NH4 +.
"Алкиламмоний ион" представляет собой ион аммония, в котором, по меньшей мере, один из его водородных атомов заменен алкильной группой, где алкил является таким, как определено выше. Примеры включают триэтиламмоний ион, N,N-диизопропилэтиламмоний ион.
"Иминиевый ион" имеет общую структуру R2C=NR2 +. R группы относятся к алкильной, алкенильной, алкинильной, арильной группам, как определено выше. "Гетероароматический иминиевый ион" касается иминиевого иона, где азот и его присоединенные R группы образуют гетероароматическое кольцо. "Гетероциклический иминиевый ион" касается иминиевого иона, где азот и его присоединенные R группы образуют гетероциклическое кольцо.
Термины "амино" или "амин" касаются -N(Rh)2 радикальной группы, где каждая Rh представляет собой, независимо, водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил, если в спецификации не сделана специальная оговорка. Когда -N(Rf)2 группа имеет две Rf, отличные от водорода, они могут быть скомбинированы с атомом азота с образованием 4-, 5-, 6-, или 7-членного кольца. Например, -N(Rf)2, как подразумевается, включает, но не ограничиваясь этим, 1-пирролидинил и 4-морфолинил. Любое или несколько из перечисленных ниже соединений, включая водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклили, гетероциклилалкил, гетероарил или гетероарилалкил являются, при необходимости, замещенными одним или несколькими заместителями, которые представляют собой, независимо, алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, гало, циано, трифторометил, трифторометокси, нитро, триметилсиланил, -OR1, -SR1, -OC(O)R1, -N(R1)2, -C(O)Ri, -C(O)OR1, -ОС(O)N(Ri)2, -C(O)N(R1)2, -N(R1)C(O)ORi, -N(R1)С(O)Ri, -N(R1)C(O)N(Ri)2, N(R1)C(NRi)N(Ri)2, -N(R1)S(O)tR1 (где t равняется 1 или 2), -S(O)tORf (где t равняется 1 или 2) или -S(O)tN(Rf)2 (где t равняется 1 или 2), где каждая R1 представляет собой, независимо, водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил.
"Карбамат", как в данном документе используется, касается составляющей, присоединенной к аминогруппе, которая имеет формулу -C(O)OR, где R представляет собой алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил. Примеры включают, но не ограничиваясь этим, Boc(трет-бутил-ОС(О)-), CBz (бензил-OC(О)-), Теос(Me3SiCH2CH2OC(O)-), аллок (аллил-ОС(О)-) или Fmoc (9-флуоренилметил-ОС(O)-).
"Замещенный силил", как в данном документе используется, касается составляющей, которая имеет формулу R3Si-. Примеры включают, но не ограничиваясь этим, TBDMS (трет-бутилдиметилсилили), ТБДФС (трет-бутилдифенилсилил) или TMS (триметилсилил).
Термин "тиол" касается -SH групп и включает замещенные тиоловые группы, т.е. -SRj группы, где каждая Rj представляет собой, независимо, замещенный или незамещенный алкил, циклоалкил, алкенил, алкинил, арил аралкил, гетероциклил или гетероциклилалкильную группу, как определено выше.
СПОСОБЫ СИНТЕЗА
Общее обсуждение способов синтеза нуклеиновой кислоты, содержащей хиральную X-фосфонатную составляющую
Настоящий способ предусматривает эффективный синтез модифицированных по атому фосфора нуклеиновых кислот с контролируемой стереохимической конфигурацией у атома фосфора, с получением, таким образом, стереоопределенного олигонуклеотида. Данный способ исключает потребность в сложных разделениях диастереомерных смесей и предусматривает использование легкодоступных дешевых ахиральных исходных материалов. Раскрытый в данном документе способ синтеза включает асимметричную реакцию ахиральной H-фосфонатной составляющей (Формула 2) с нуклеозидом, содержащим нуклеофильную составляющую, такую как гидрокси группа (Формула 4-1, где Q1 является блокирующей групой или связывающей с носителем или с нуклеотидной цепью составляющей), с получением модифицированной по атому фосфора нуклеиновой кислоты, содержащей хиральную Х-фосфонатную составляющую, которая представляет собой соединение Формулы 1, как показано на Схеме 1. Таким способом получается нуклеотидный полимер или олигомер, имеющий высокую диастереомерную чистоту. В некоторых вариантах, нуклеиновая кислота содержит модификации нуклеооснований, сахарной составляющей и/или защитных групп
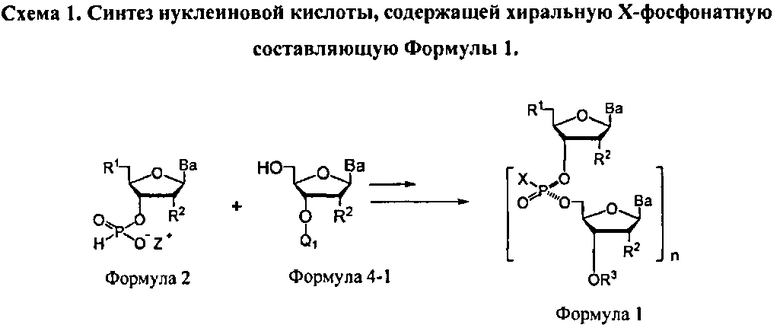
Реакция молекулы, содержащей ахиральную H-фосфонатную составляющую Формулы 2, с нуклеозидом, содержащим нуклеофильную составляющую Формулы 4-1, приводит к образованию конденсированного промежуточного соединения, которое превращается в нуклеиновую кислоту, содержащую хиральную Х-фосфонатную составляющую. Синтез конденсированного промежуточного соединения включает стадии (а) активации соединения Формулы 2 конденсирующим агентом, (b) реакции с хиральным реагентом, с последующей (с) реакцией с соединением Формулы 4-1. Общая схема представлена на Схеме 2. Хиральный реагент оказывается присоединенным к конденсированному промежуточному соединению как хиральная вспомогательная группа. В представленном в данном документе процессе, стадии (а)-(с), ведущие к конденсированному промежуточному соединению, могут быть осуществлены без выделения каких-либо промежуточных соединений, т.е. в том же самом котле или в "одном котле". Таким образом, данный процесс исключает необходимость выделения дискретных промежуточных соединений. Раскрытый в данном документе способ может осуществляться в растворе или на твердом носителе. В зависимости от условий реакции, для стадии конденсации может быть полезным добавление активирующего реагента. Например, данный активирующий реагент может быть введен в реакцию после завершения стадий (а)-(с) или добавлен к реакционной смеси одновременно с протеканием стадий (а)-(с)
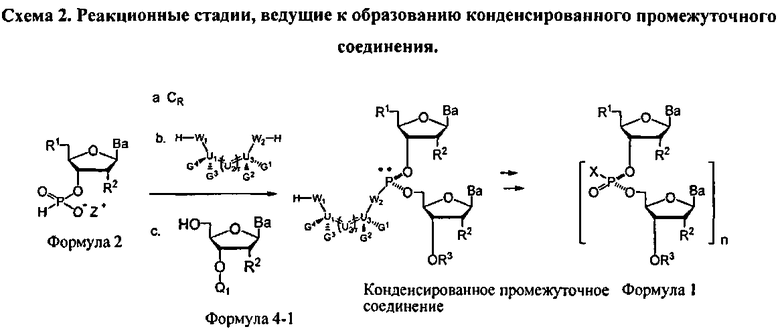
В одном варианте конденсированное промежуточное соединение превращается в нуклеиновую кислоту, содержащую хиральную X фосфонатную составляющую Формулы 1, путем кэппирования хирального вспомогательного соединения на конденсированном промежуточном соединении составляющей А, которая представляет собой ацильную, арильную, алкильную, аралкильную или силильную составляющую, и модифицирования фосфора с введением J, представляющей собой S, Se или ВН3, с получением соединения Формулы 5-1. В одном варианте (Опция А, Схема 3), соединение Формулы 5-1 превращается в соединение Формулы 1, где X является S, Se, или ВН3, и n равняется 1 (димер), путем расщепления хирального вспомогательного соединения и разблокирования блокирующих групп, и, при необходимости, отщепления от твердого носителя. При образовании димера стадия кэппирования на Схеме 3 необязательна. Как альтернатива (Опция В, Схема 3), соединение Формулы 5-1 подвергается элонгации цепи путем повторения стадий с получением конденсированного промежуточного соединения, где к данному олигонуклеотиду добавляется дополнительный мономер Формулы 2. Стадии кэппирования, модификации, разблокирования и элонгации цепи повторяются до достижения необходимого n. В этот момент, хиральные вспомогательные соединения у каждого фосфоната расщепляются, оставшиеся блокирующие группы расщепляются, включая, при необходимости, отщепление от твердого носителя с получением соединения Формулы 1, где X является S, Se, или ВН3, и n больше или равно 2 и меньше приблизительно 200
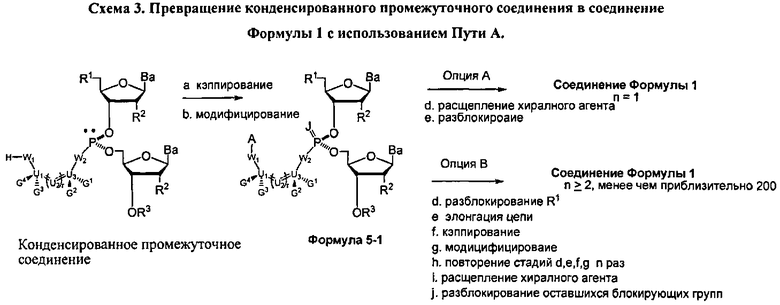
В другом представленном в данном документе способе, конденсированное промежуточное соединение превращается в нуклеиновую кислоту, содержащую хиральную X фосфонатную составляющую Формулы 1, путем подкисления конденсированного промежуточного соединения для удаления блокирующей группы у R1, что также удаляет хиральное вспомогательное соединение. В одном варианте (Опция А, Схема 4), соединение Формулы 4 модифицируется для введения X составляющей к фосфору, с получением соединения Формулы 1, которое разблокировано для удаления оставшихся блокирующих групп и удаления их от носителя, при необходимости, с получением соединения Формулы 1, где R3 является водородом, и n равняется 1.
Как альтернатива, соединение Формулы 4 на Схеме 4 (Опция В) подвергается реакции элонгации цепи и затем подкисляется для разблокирования R1 блокирующей группы вновь добавленного нуклеозида. Стадия элонгации цепи и стадия R1 разблокировки проводятся с m повторениями. В этот момент, соединение Формулы 4, где m равняется n-1, модифицируется с введением X составляющей к каждому фосфору с получением соединения Формулы 1, которое разблокировано для удаления оставшихся блокирующих групп и удаления, при необходимости, от носителя, с получением соединения Формулы 1, где R3 является водородом и n больше или равно 2, и меньше приблизительно 200
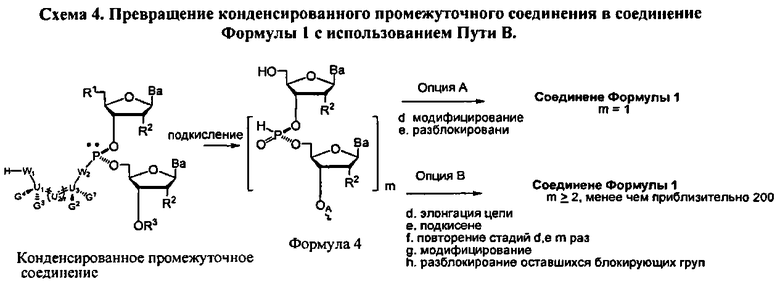
В обеих опциях (А и В) Схемы 4, X представляет собой алкил, алкокси, арил, алкилтио, ацил, -NRfRf, алкенилокси, алкинилокси, алкенилтио, алкинилтио, -S-Z+, -Se-Z+, или -ВН3 -Z+, где каждая Rf представляет собой, независимо, водород, алкил, алкенил, алкинил или арил; Z+ является аммоний ионом, алкиламмоний ионом, гетероароматическим иминий ионом или гетероциклическим иминий ионом, любой из которых является первичным, вторичным, третичным или четвертичным, или Z является моновалентным металлическим ионом. В других вариантах, Z является пиридиний ионом, триэтиламмоний ионом, N,N-диизопропилэтиламмоний ионом, 1,8-диазабицикло[5.4.0]ундец-7-ений ионом, ионом натрия или ионом калия.
Модифицированная по атому фосфора нуклеиновая кислота, содержащая хиральную X-фосфонатную составляющую Формулы 1.
Способ данного изобретения дает нуклеиновую кислоту, содержащую хиральную Х-фосфонатную составляющую следующей общей Формулы 1-1 или Фомулы 1-2
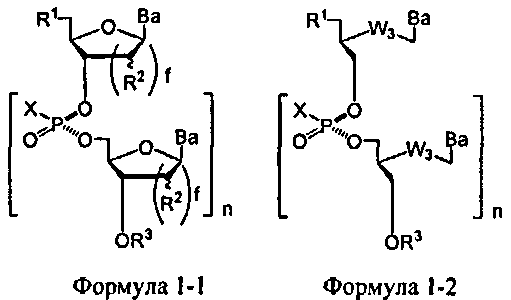
Где Х-фосфонатная составляющая соединяет природные нуклеозидные составляющие или неприродные нуклеозидные составляющие, где природное рибозное кольцо заменено большим или меньшим кислородсодержащим кольцом, или где данное кольцо заменено нециклической структурой, где W3 является -S-, -O-, замещенным или незамещенным амино, алкиленом, алкениленом или алкиниленом. В других вариантах данной нуклеиновой кислоты, Х-фосфонатная составляющая соединяет природные нуклеозидные составляющие с неприродными нуклеозидными составляющими. В еще других вариантах данной нуклеиновой кислоты, Х-фосфонатная составляющая соединяет друг с другом нуклеозидные составляющие с различными сахарными составляющими.
В одном варианте данного изобретения, нуклеиновой кислотой, содержащей хиральную X-фосфонатную составляющую, является соединение Формулы 1
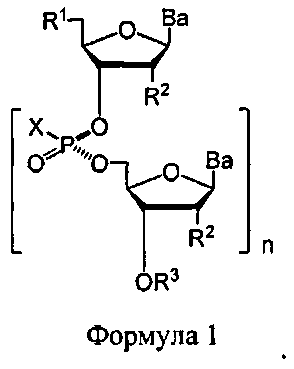
В Формуле 1, R1 представляет собой -ОН, -SH, NRdRd, -N3, галоген, водород, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa или -SRc.
Y1 является О, NRd, S, или Se.
Ra является блокирующей составляющей.
Rc является блокирующей группой.
В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2, или -HP(O)(Re).
В каждом случае Re представляет собой, независимо, водород, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-, или катион, который представляет собой Na+1, Li+1, или К+1.
Y2 является О, NRd, или S.
В каждом случае R2 представляет собой, независимо, водород, -ОН, -SH, -NRdRd, -N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb, или -SRc, где Rb является блокирующей составляющей.
В каждом случае Ва представляет собой блокированный или деблокированный аденин, цитозин, гуанин, тимин, урацил или модифицированное нуклеооснование.
В каждом случае X представляет собой, независимо, алкил, алкокси, арил, алкилтио, ацил, -NRfRf, алкенилокси, алкинилокси, алкенилтио, алкинилтио, -S-Z+, -Se-Z+, или -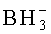
В каждом случае Rf представляет собой, независимо, водород, алкил, алкенил, алкинил или арил.
Z+ является аммоний ионом, алкиламмоний ионом, гетероароматическим иминий ионом или гетероциклическим иминий ионом, любой из которых является первичным, вторичным, третичным или четвертичным, или Z является моновалентным металлическим ионом.
R3 является водородом, блокирующей группой, связывающей оставляющей, которая соединена с твердым носителем, или связывающей составляющей, соединенной с нуклеиновой кислотой; и n является целым числом от 1 до приблизительно 200.
В одном варианте, любая из R2 групп замещена, например, флуоресцентной составляющей, биотиновой составляющей или авидиновой составляющей.
В одном варианте, описанная в данном документе нуклеиновая кислота получается из целиком рибонуклеотидных мономеров. В другом варианте, она получается из целиком дезоксирибонуклеотидных мономеров. В еще другом варианте, данная нуклеиновая кислота получается из смеси рибонуклеотидных и или дезоксирибонуклеотидных мономеров. В одном варианте данная нуклеиновая кислота является смесью РНК и ДНК составляющих. В другом варианте, данная нуклеиновая кислота включает заместителя у R2, который отсутствует в РНК или ДНК нуклеиновых кислотах.
Ва представляет нуклеооснование, которое является природным или модифицированным нуклеооснованием. В каждом случае нуклеооснование является, независимо, блокированным или деблокированным.
В каждом случае X представляет собой, независимо, алкил, алкокси, арил, алкилтио, ацил, -NRfRf, алкенилокси, алкинилокси, алкенилтио, алкинилтио, -S-Z+, -Se-Z+, или -ВН3 -Z+ где в каждом случае Rf представляет собой, независимо, водород, алкил, алкенил, алкинил или арил; Z+ является аммоний ионом, алкиламмоний ионом, гетероароматическим иминий ионом или гетероциклическим иминий ионом, любой из которых является первичным, вторичным, третичным или четвертичным, или Z является моновалентным металлическим ионом. В некоторых вариантах, X является алкилом, алкокси, -NRfRf, -S-Z+, или -ВН3 -Z+. В других вариантах, Z является пиридиний ионом, триэтиламмоний ионом, N,N-диизопропилэтиламмоний ионом, 1,8-диазабицикло[5.4.0]ундец-7-ений ионом, ионом натрия или ионом калия.
R3 является водородом, блокирующей группы, связывающей составляющей, соединенной с твердым носителем, или связывающей составляющей, соединенной с нуклеиновой кислотой, которые получают с использованием предложенных в данном документе способов или известных в данной области. Нуклеиновая кислота, присоединенная к R3, полученная с использованием известных методов, содержит атомы фосфора, которые являются модифицированными, немодифицированными, или смесями модифицированных и немодифицированных атомов фосфора и включает любую конфигурацию у фосфорного атома. В одном варианте, R3 является связывающей составляющей, присоединенной к другому нуклеозиду или нуклеотиду.
Х-фосфонатная составляющая
Как используется в данном документе, Х-фосфонатная составляющая касается атома фосфора межнуклеозидной остовной связи, который модифицирован для образования ковалентной связи с составляющей X, где X может представлять собой, но не ограничиваясь этим, серу, селен, алкил, бор, ацил, амино, тиол или алкокси. X составляющая модифицирует атом фосфора путем замены одного из кислородных атомов в межнуклеозидном остове. Межнуклеозидные остовные связи показаны ниже (внутри обозначенных пунктиром прямоугольников) для двух фрагментов нуклеиновой кислоты в качестве неограничивающих примеров. Левая структура ниже показывает фосфатную группу, найденную в природных межнуклеозидных остовных связях. Правая структура ниже показывает Х-фосфонатную составляющую как межнуклеозидную остовную связь
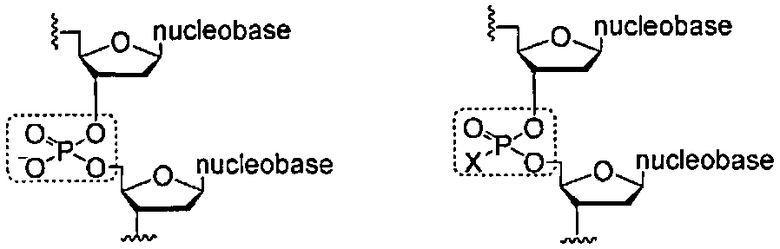
Фосфоротиоатная составляющая включает серную составляющую как X составляющую.
Фосфороселеноатная составляющая включает селеновую составляющую как X составляющую. Алкилфосфонатная составляющая (например, метилфосфонат) включает алкильную группу (например, метильную группу) как X составляющую. Борофосфонатная составляющая включает борановую группу как X составляющую.
В одном варианте, данная нуклеиновая кислота содержит фосфоротиоатные группы в остовных связях. В некоторых вариантах, нуклеиновая кислота содержит фосфороселеноатные группы в остовных связях. В других вариантах, нуклеиновая кислота содержит алкилфосфонатные группы (например, метилфосфонат) в остовных связях. В еще других вариантах, данная нуклеиновая кислота содержит борофосфонатные группы в остовных связях.
Каждая X составляющая может быть выбрана, независимо, из описанных в данном документе различных X составляющих. Это дает возможность иметь в пределах одной нуклеиновой кислоты множество X составляющих. В одном варианте, одна и та же X составляющая используется по всей нуклеиновой кислоте. В других вариантах, в данной нуклеиновой кислоте используются различные X составляющие. Например, в одной нуклеиновой кислоте несколько Х-фосфонатов являются фосфоротиоатными составляющими, тогда как другими Х-фосфонатами в той же самой нуклеиновой кислоте являются алкилфосфонатные составляющие. Для специалистов в данной области понятно, что возможны другие вариации и альтерации фосфорных модификаций, и это зависит от использования и приложений этих нуклеиновых кислот. В некоторых вариантах, выбор X составляющей зависит от биохимических свойств данной нуклеиновой кислоты и ее взаимодействий с биологическими образцами.
Конфигурация Х-фосфонатной составляющей
Описанные в данном документе способы полезны для контроля конфигурации каждого фосфорного атома в межгликозидной остовной связи. Хиральный реагент позволяет осуществлять специфический контроль хиральности Х-фосфоната. Так, в каждом синтетическом цикле может быть выбрана либо Rp либо Sp конфигурация, что позволяет контролировать всю трехмерную структуру нуклеиновокислотного продукта. В некоторых вариантах, выбор Rp и Sp конфигураций делается с целью придать специфическую трехмерную суперструктуру нуклеиновокислотной цепи.
В некоторых вариантах, каждая Х-фосфонатная составляющая может иметь Rp конфигурацию. В других вариантах, каждая Х-фосфонатная составляющая может иметь Sp конфигурацию. В другом варианте, каждая Х-фосфонатная составляющая может иметь, независимо, Rp конфигурацию или SP конфигурацию. В специфических вариантах, Х-фосфонатные составляющие чередуются по нуклеиновой кислоте между Rp и Sp, таким образом как Rp, Sp, Rp или Sp, Rp, Sp. В других специфических вариантах, Х-фосфонатные составляющие содержат повторяющиеся конфигурации RP, RP, SP, Sp no данной нуклеиновой кислоте. В еще других вариантах, нуклеиновая кислота включает все Rp конфигурации. В дополнительных вариантах, нуклеиновая кислота включает все Sp составляющие. В некоторых вариантах, 5' и 3' концевые межнуклеозидные остовные связи имеют SP конфигурацию, а внутренние межнуклеозидные остовные связи все имеют Rp конфигурацию. Описанные в данном документе варианты служат примерами того, каким образом может контролироваться конфигурация с использованием этих способов. Описанная в данном документе нуклеиновая кислота не ограничивается этими образцами конфигураций. Специалистам в данной области понятно, что возможны другие вариации и альтерации Rp и Sp конфигураций, и это зависит от применения и приложений данной нуклеиновой кислоты.
Определение чистоты Х-фосфонатных конфигураций
Чистота конфигурации каждой Х-фосфонатной составляющей в нуклеиновой кислоте определяется с использованием обычных аналитических методов, таких как, но не ограничиваясь этим, 31Р ЯМР спектроскопия или высокоэффективная жидкофазная хроматография с обращенной фазой. С использованием описанных в данном документе способов, в одном варианте, каждая Х-фосфонатная составляющая данного соединения может быть более чем на 80% диастереомерно чистой. В другом варианте, каждая Х-фосфонатная составляющая данного соединения может быть более чем на 60% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая данного соединения может быть более чем на 70% диастереомерно чистой. В одном варианте, каждая X-фосфонатная составляющая данного соединения может быть более чем на 85% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая данного соединения может быть более чем на 90% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая данного соединения может быть более чем на 95% диастереомерно чистой. В другом варианте, каждая Х-фосфонатная составляющая данного соединения может быть более чем на 98% диастереомерно чистой. В другом ваританте, каждая Х-фосфонатная составляющая данного соединения может быть более чем на 99% диастереомерно чистой. В одном варианте, каждая X-фосфонатная составляющая данного соединения может быть более чем на приблизительно 60%, более чем на приблизительно 70%, более чем на приблизительно 80%, более чем на приблизительно 83%, более чем приблизительно на 84%, более чем приблизительно на 85%, более чем приблизительно на 86%, более чем приблизительно на 87%, более чем приблизительно на 88%, более чем приблизительно на 89%, более чем приблизительно на 90%, более чем приблизительно на 91%, более чем приблизительно на 92%, более чем приблизительно на 93%, более чем приблизительно на 94%, более чем приблизительно на 95%, более чем приблизительно на 96%, более чем приблизительно на 97%, более чем приблизительно на 98%, или более чем приблизительно на 99% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 60% до приблизительно 99,9% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 60% до приблизительно 99% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 60% до приблизительно 70% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 70% до приблизительно 80% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 80% до приблизительно 90% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 80% до приблизительно 99% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 85% до приблизительно 95% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 90% до приблизительно 95% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 95% до приблизительно 99% диастереомерно чистой. В одном варианте, каждая Х-фосфонатная составляющая может быть от приблизительно 90% до приблизительно 99,9% диастереомерно чистой.
Количество конкретной конфигурации относительно другой конфигурации влияет на трехмерную структуру нуклеиновых кислот, так же как и на их стабильность. Соответственно, разные конфигурации влияют на биологические, химические и физические свойства нуклеиновых кислот. В одном варианте, данная нуклеиновая кислота содержит больший процент Sp конфигурации, чем Rp конфигурации. В другом варианте, данная нуклеиновая кислота содержит больший процент Rp конфигурации, чем Sp конфигурации. В другом варианте, данная нуклеиновая кислота содержит одинаковый процент Rp конфигурации и Sp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 0-20% Rp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 20-40% Rp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 40-60% Rp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 60-80% Rp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 80-100% Rp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 0-20% Sp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 20-40% Sp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 40-60% Sp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 60-80% Sp конфигурации. В одном варианте, данная нуклеиновая кислота может содержать 80-100% Sp конфигурации.
Длина модифицированной по фосфорному атому нуклеиновой кислоты
Нуклеиновая кислота, включающая хиральную Х-фосфонатную составляющую Формулы 1, содержит от приблизительно 1 нуклеозида до примерно 200 нуклеозидов. В некоторых вариантах, нуклеиновая кислота, содержащая хиральную Х-фосфонатную составляющую Формулы 1, комбинируется в дальнейшем в олигомеры или полимеры. В некоторых вариантах, нуклеиновая кислота Формулы 1 является димером. В других вариантах, нуклеиновая кислота Формулы 1 содержит до приблизительно 100 нуклеозидов. В других вариантах, нуклеиновая кислота Формулы 1 содержит до приблизительно 150 нуклеозидов. В других вариантах, нуклеиновая кислота Формулы 1 содержит до приблизительно 200 нуклеозидов. В других вариантах, нуклеиновая кислота Формулы 1 содержит до приблизительно 300 нуклеозидов. В некоторых вариантах, нуклеиновая кислота Формулы 1 содержит от приблизительно 1 до приблизительно 200 нуклеозидов. В других вариантах, нуклеиновая кислота Формулы 1 содержит от 1 до приблизительно 150 нуклеозидов. В дополнительных вариантах, нуклеиновая кислота содержит от 1 до приблизительно 10 нуклеозидов. В других вариантах, нуклеиновая кислота Формулы 1 содержит от приблизительно 10 до приблизительно 50 нуклеозидов. В дополнительных вариантах, нуклеиновая кислота содержит от приблизительно 10 до приблизительно 100 нуклеозидов. В некоторых вариантах, нуклеиновая кислота содержит от 1 до приблизительно 5 нуклеозидов, или от приблизительно 5 до приблизительно 10 нуклеозидов, или от приблизительно 5 до приблизительно 15 нуклеозидов, или от приблизительно 10 до приблизительно 20 нуклеозидов, или от приблизительно 15 до приблизительно 25 нуклеозидов, или от приблизительно 20 до приблизительно 30 нуклеозидов, или от приблизительно 25 до приблизительно 35 нуклеозидов, или от приблизительно 30 до приблизительно 40 нуклеозидов. В некоторых вариантах Формулы 1, n равняется целому числу от 1 до приблизительно 200. В некоторых вариантах Формулы 1, n равняется целому числу от 1 до приблизительно 150. В некоторых вариантах Формулы 1, n равняется целому числу от 1 до приблизительно 10. В некоторых вариантах Формулы 1, n равняется целому числу от 1 до приблизительно 50. В некоторых вариантах Формулы 1, n равняется целому числу от 10 до приблизительно 100. В некоторых вариантах Формулы 1, n равняется целому числу от 1 до приблизительно 5, или от приблизительно 5 до приблизительно 10, или от приблизительно 5 до приблизительно 15, или от приблизительно 10 до приблизительно 20, или от приблизительно 15 до приблизительно 25, или от приблизительно 20 до приблизительно 30, или от приблизительно 25 до приблизительно 35, или от приблизительно 30 до приблизительно 40.
Дополнительные вариации нуклеиновой кислоты, модифицированной по атому фосфора
Нуклеиновая кислота Формулы 1 может быть одноцепочечной. В некоторых вариантах, нуклеиновая кислота Формулы 1 гибридизирована с комплементарной цепочкой с образованием двухцепочечной нуклеиновой кислоты.
В некоторых вариантах, нуклеиновая кислота Формулы 1 может включать открытую линейную структуру. В других вариантах, соответствующие концы нуклеиновой кислоты Формулы 1 соединяются с образованием кольцевой структуры.
Внутри нуклеиновой кислоты сахарный компонент каждой единицы содержит одинаковые или разные сахара. В некоторых вариантах, данные сахара являются модифицированными сахарами или сахарами, которые замещены. В некоторых вариантах, данные сахара все являются рибозными сахарными составляющими. В некоторых вариантах, данные сахара все являются дезоксирибозными сахарными составляющими. В других вариантах, данные сахара все являются пентофуранозными, пентопиранозными или гексопиранозными составляющими. В дополнительных вариантах, сахарный компонент включает замкнутые кольцевые структуры или открытые структуры.
В структуре нуклеиновой кислоты на фосфорные атомные мостики обычно ссылаются как на образующие межнуклеозидный остов нуклеиновых кислот. Межнуклеозидные остовные связи в нуклеиновых кислотах включают, но не ограничиваясь этим, 2'-5' фосфорные атомные мостики, 3'-5' фосфорные атомные мостики, 5'-3' фосфорные атомные мостики, и 3'-2' фосфорные атомные мостики, и 4'-2' мостики, описанные в патенте США No. 6608186 и работе Joyce, G.F. Nature, 2002, 418,214-220. Неограничивающие примеры этих вариаций в межнуклеозидных остовных связях приведены ниже
В зависимости от сахарного компонента или компонента с модифицированным сахаром, также предусмотрены другие типы фосфорных атомных мостиков, включая, но не ограничиваясь этим, метилен бисфосфонатные мостики, показанные ниже и описанные в работе Xu, L. et al, J. Med. Chem., 2005, 48,4177-4181

Нуклеиновая кислота Формулы 1 может содержать одинаковые или разные нуклеооснования. В некоторых вариантах, нуклеиновая кислота Формулы 1 содержит все одинаковые нуклеооснования, В других вариантах, нуклеиновая кислота Формулы 1 содержит все разные нуклеооснования. В других вариантах, нуклеиновая кислота Формулы 1 содержит природные нуклеооснования. В некоторых вариантах, нуклеиновая кислота Формулы 1 содержит модифицированные нуклеооснования. В еще других вариантах, нуклеиновая кислота содержит нуклеооснования, которые имитируют нуклеоосновную последовательность природной нуклеиновой кислоты. В некоторых вариантах, нуклеиновая кислота Формулы 1 содержит смесь природных нуклеооснований и модифицированных нуклеооснований.
Молекулы, содержащие ахиральную H-фосфонатную составляющую
Молекула, содержащая ахиральную H-фосфонатную составляющую, является соединением Формулы 2
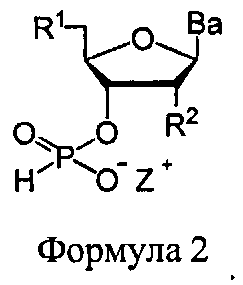
В Формуле 2, R1 представляет собой -NRdRd, -N3, галоген, водород, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa, или -SRc.
Y1 является О, NRd, S, или Se,
Ra является блокирующей составляющей.
Rc является блокирующей группой.
В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2, или -HP(O)(Re).
В каждом случае Re представляет собой, независимо, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-.
Y2 является О, NRd или S.
R2 представляет собой водород, -NRdRd, N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb или -SRc, где Rb является блокирующей составляющей.
Ва является блокированным или деблокированным аденином, цитозином, гуанином, тимином, урацилом или модифицированным нуклеооснованием.
Z+ является аммоний ионом, алкиламмоний ионом, гетероароматическим иминий ионом или гетероциклическим иминий ионом, любой из которых является первичным, вторичным, третичным или четвертичным, или моновалентным металлическим ионом.
В некоторых вариантах, Z является пиридиний ионом, триэтиламмоний ионом, N,N-диизопропилэтиламмоний ионом, 1,8-диазабицикло[5.4.0]ундец-7-ений ионом, ионом натрия или ионом калия.
В некоторых вариантах, данный сахар является рибозным кольцом. В других вариантах, сахар является дезоксирибозной, пентофуранозной, пентопиранозной, или гексапиранозной составляющими. В других вариантах, данный сахар является модифицированным сахаром. В некоторых вариантах, данный сахар является аналогом глицерина или сахаром с субституциями. H-фосфонатные нуклеозидные мономеры легко получаются, и они являются стабильными. Методы их получения описаны (см., например, Froehler, B.C. Methods in Molecular Biology. In Protocols for Oligonucleotides and Analogs; Agrawal, S., Ed.; Humana: Totowa, 1993; vol 20, p 63-80).
В некоторых вариантах, нуклеозидный мономер содержит ахиральную H-фосфонатную составляющую, присоединенную к данному нуклеозиду в 3' положении. В еще других вариантах, нуклеозидный мономер содержит ахиральную H-фосфонатную составляющую, присоединенную к нуклеозидной составляющей в 3' положении через промежуточную связывающую составляющую. В специфических вариантах, промежуточная связывающая составляющая представляет собой метиленовую группу (см., например, WO/2001/02415). В некоторых вариантах H-фосфонатная ссотавляющая присоединена к 2' положению данного нуклеозидного мономера. В других вариантах, нуклеозидный мономер содержит ахиральную H-фосфонатную составляющую, присоединенную к нуклеозиду в 5' положении.
Соединения со свободной нуклеофильной составляющей
Соединение, содержащее свободную нуклеофильную составляющую, является соединением
Формулы 4-1 и реагирует через фосфорный центр хирального промежуточного соединения.
Направление атаки на фосфор нуклеофильной группы или составляющей зависит от заместителей хирального вспомогательного соединения на хиральном промежуточном соединении (конденсированное промежуточное соединение). В одном варианте, добавление активирующего реагента может быть полезным в плане помощи данному соединению, содержащему свободную нуклеофильную составляющую, прореагировать в фосфорном центре хирального промежуточного соединения
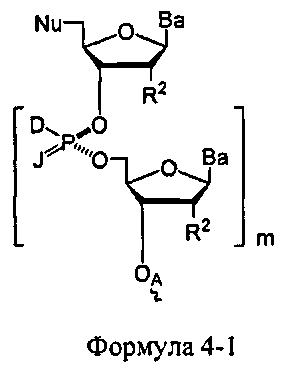
В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, является нуклеиновой кислотой, предварительно полученной с использованием описанных в данном документе способов или полученной с использованием других известных методов нуклеиновокислотного синтеза. В одном варианте, соединение, содержащее свободную нуклеофильную составляющую, содержит единственный нуклеозидный мономер. В другом варианте, соединение, содержащее свободную нуклеофильную составляющую, содержит более одной нуклеозидной единицы. В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, является продктом стадии элонгации цепи. В еще других вариантах, соединение, содержащее свободную нуклеофильную составляющую, является олигомером. В дополнительных вариантах, соединение, содержащее свободную нуклеофильную составляющую, является полимером. В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, содержит гидроксильную группу как свободную нуклеофильную составляющую. В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, содержит аминогруппу как свободную нуклеофильную составляющую. В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, содержит тиоловую группу как свободную нуклеофильную составляющую.
В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, содержит нуклеофильную составляющую в любом положении данного нуклеозидного сахара. В некоторых вариантах, нуклеофильная составляющая локализована в 5' положении сахара. В некоторых вариантах, нуклеофильная составляющая локализована в 4' положении данного сахара.
В других вариантах, нуклеофильная составляющая локализована в 3' положении сахара. В других вариантах, нуклеофильная составляющая локализована в 2' положении данного сахара. В некоторых вариантах, соединение Формулы 4-1 представляет собой нуклеозид, содержащий 5'-OH составляющую, и является соединением Формулы 4
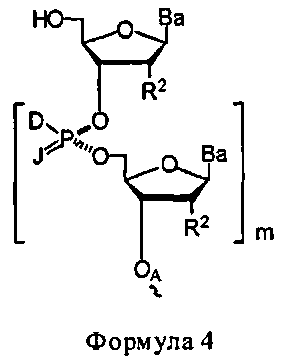
В Формуле 4, в каждом случае R2 представляет собой, независимо, водород, NRdRd, N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb или -SRc, где Rb является блокирующей составляющей.
Y1 является О, NRd, S или Se.
Rc является блокирующей группой.
В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2 или -HP(O)(Re).
В каждом случае Re представляет собой, независимо, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-.
Y2 является О, NRd или S.
В каждом случае Ва является, независимо, блокированным или деблокированным аденином, цитозином, гуанином, тимином, урацилом или модифицированным нуклеооснованием.
m является целым числом от 0 до n-1.
n является целым числом от 1 до приблизительно 200.
OA соединена с тритиловой составляющей, силильной составляющей, ацетильной составляющей, ацильной составляющей, арилацильной составляющей, связывающей ссотавляющей, соединенной с твердым носителем, или связывающей составляющей, соединенной с нуклеиновой кислотой.
J является О, и D является Н, или J является S, Se, или ВН3 и D являются хиральным лигандом C1 или составляющей Формулы А
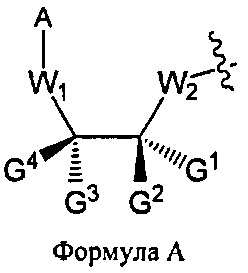
где W1 и W2 являются, независимо, NHG5, ОН или SH.
А представляет собой водород, ацил, арил, алкил, аралкил или силильную составляющую. G1, G2, G3, G4, и G5 представляют собой, независимо, водород, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероарил, или арил, или две из G1, G2, G3, G4, и G5 являются G6, и, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее до приблизительно 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или неслитым и где не более четырех из G1, G2, G3, G4, и G5 являются G6.
В других вариантах, где J является S, Se, или ВН3 и D является составляющей Формулы A-I
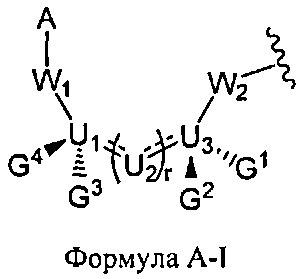
где U1, U3, U2, r, G1, G2, G3, G4, W1, W2, А являются такими, как в данном документе определено для Формулы 3-1. В варианте Формулы A-I, А является водородом.
В некоторых вариантах, нуклеозид, содержащий 5'-ОН составляющую Формулы 4, является промежуточным соединением из предыдущего цикла элонгации цепи, как в данном документе описано. В еще других вариантах, соединение Формулы 4 является промежуточным соединением из другого известного метода синтеза нуклеиновых кислот. В некоторых вариантах, соединение Формулы 4 присоединено к твердому носителю. В других вариантах, соединение Формулы 4 не присоединено к твердому носителю и является свободным в растворителе или растворе. В одном варианте, m равно 0, и соединение формулы 4 является единственной нуклеозидной единицей и рассматривается как первый нуклеозид данной нуклеиновой кислоты. В некоторых вариантах, m равно 0, и соединение формулы 4 является нуклеозидной единицей, присоединенной к другой нуклеиновой кислоте через 3'-кислород. В других вариантах, m больше 0, и соединение формулы 4 является полимерной или олигомерной кислотой, содержащей 5'-ОН составляющую. В других вариантах, m больше 0, и соединение формулы 4 является конечным продуктом предыдущего цикла элонгации цепи. В некоторых вариантах, где m больше 0, соединение формулы 4 является нуклеозидом, который дополнительно присоединен к нуклеотиду через связь или в 3' положении или в другом положении на данном нуклеозиде. Когда соединение формулы 4 присоединено к другому нуклеотиду или нуклеиновой кислоте, фосфатная межнуклеозидная остовная связь включает, но не ограничиваясь этим, 2'-5' фосфорные атомные мостики, 3'-5' фосфорные атомные мостики, 5'-3' фосфорные атомные мостики, и 3'-2' фосфорные атомные мостики и 4'-2' мостики. Фосфатная межнуклеозидная остовная связь включает другие типы фосфорных атомных мостиков, включая, но не ограничиваясь этим, метилен бисфосфонатные мостики.
Нуклеиновая кислота Формулы 1 содержит одинаковые или разные нуклеооснования. В некоторых вариантах, нуклеиновая кислота Формулы 1 содержит все одинаковые нуклеооснования. В других вариантах, нуклеиновая кислота Формулы 1 содержит все разные нуклеооснования. В других вариантах, нуклеиновая кислота Формулы 1 содержит природные нуклеооснования. В некоторых вариантах, нуклеиновая кислота Формулы 1 содержит модифицированные нуклеооснования. В еще других вариантах, нуклеиновая кислота содержит нуклеооснования, которые имитируют нуклеоосновную последовательность природной нуклеиновой кислоты. В некоторых вариантах, нуклеиновая кислота Формулы 1 содержит смесь природных нуклеооснований и модифицированных нуклеооснований.
Соединение, содержащее свободную нуклеофильную составляющую, является свободным в растворе. В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, не присоединено к твердому носителю. Это позволяет синтезировать нуклеиновые кислоты в растворе (жидкофазный синтез или синтез в растворе). Как альтернатива, соединение, содержащее свободную нуклеофильную составляющую, предварительно присоединяется к другой составляющей, такой как твердый носитель. В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, является нуклеозидом, присоединенным к твердому носителю в положении 3' гидроксила нуклеозида. Присоединение нуклеиновой кислоты к твердому носителю позволяет проводить синтез с ипользованием твердофазного синтеза. В процессе синтеза нуклеиновой кислоты соединение, присоединенное к твердому носителю, обрабатывается различными реагентами в одном или повторных циклах элонгации цепи для достижения пошагового удлинения растущей нуклеиновокислотной цепи с помощью индивидуальных нуклеиновокислотных единиц. Стадии очистки обычно не проводятся до синтеза полностью собранной нуклеиновокислотной последовательности. Известны различные типы материалов твердого носителя, которые используются в синтезе нуклеиновых кислот, белков и олигосахаридов. В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, присоединено к твердому носителю через связывающую составляющую. В других вариантах, соединение, содержащее свободную нуклеофильную составляющую, присоединено к твердому носителю без связывающей составляющей.
Соединение, содержащее свободную нуклеофильную составляющую, включает сахар, замещенный сахар или модифицированный сахар. В некоторых вариантах, данный сахар является рибозным сахаром. В некоторых вариантах, данный сахар является дезоксирибозным сахаром. В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, включает смесь рибозного сахара и дезоксирибозного сахара. В других вариантах, данный сахар является пентофуранозной, пентопиранозной, гексопиранозной составляющими или их смесями. В дополнительных вариантах, сахар содержит замкнутую кольцевую структуру, открытую структуру или их смеси.
Нуклеозидный реагент, содержащий незащищенную-ОН составляющую, может содержать незащищенную-ОН группу в любом положении на сахарном остове. В одном варианте, ахиральная H-фосфонатная составляющая конденсируется с нуклеозидом, содержащим 5'-ОН составляющую, с образованием конденсированного промежуточного соединения. В другом варианте, ахиральная Н-фосфонатная составляющая конденсируется с нуклеозидом, содержащим 4'-ОН составляющую, с образованием конденсированного промежуточного состояния. В другом варианте, ахиральная Н- фосфонатная составляющая конденсируется с нуклеозидом, содержащим 3'-ОН составляющую, с образованием конденсированного промежуточного соединения. В еще другом варианте, ахиральная H-фосфонатная составляющая конденсируется с нуклеозидом, содержащим 2'-ОН составляющую, с образованием конденсированного промежуточного соединения.
В некоторых вариантах, подкисление конденсированного промежуточного соединения дает соединение Формулы 4, где m равняется, по меньшей мере, 1. В других вариантах, конденсированное промежуточное соединение содержит составляющую Формулы А', которая эквивалентна составляющей Формулы А, где А является водородом и где G' и G2 представляют собой, независимо, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероарил или арил, и G3, G4, и G5 представляют собой, независимо, водород, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероарил или арил, или две из G1, G2, G3, G4, и G5 являются G6, и, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее до приблизительно 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или неслитым, и где не более четырех из G1, G2, G3, G4, и G5 являются G6.
Подробное обсуждение способов синтеза
Расширение нуклеиновокислотной цепи может осуществляться в 3'-5' направлении. В одном варианте, нуклеиновая кислота синтезируется от свободного гидроксила в 5'-конце повторяющимися циклами химических реакций. Как альтернатива, расширение нуклеиновокислотной цепи может осуществляться в 5'-3' направлении. В одном варианте, нуклеиновая кислота синтезируется от свободного гидроксила в 3'-конце повторяющимися циклами химических реакций.
Один вариант способа синтеза нуклеиновой кислоты показан на Схеме 5 (Путь А). Понятно, что рассмотренные в данном документе способы не ограничиваются данной схемой, последовательностью событий или ее промежуточными соединениями. В одном варианте, описанном на Схеме 5, ахиральный H-фосфонат Формулы 2 обрабатывается конденсирующим реагентом с образованием промежуточного соединения со структурой II. В одном варианте, к реакционной смеси на стадии конденсации добавляется активирующий реагент. Использование активирующего реагента зависит от условий реакции, таких как растворители, которые применяются для данной реакции. Промежуточное соединение со структурой II не выделяется и обрабатывается в том же самом котле с хиральным реагентом с образованием хирального промежуточного соединения структуры III. Промежуточное соединение со структурой III не выделяется и подвергается реакции в том же самом котле с нуклеозидом или модифицированным нуклеозидом структуры IV с получением хирального фосфитного соединения структуры V. В некоторых вариантах, структуру V экстрагируют в растворитель для отделения ее от побочных продуктов, примесей и/или реагентов. В других вариантах, когда данный способ осуществляется посредством твердофазного синтеза, твердый носитель, включающий соединение структуры V, отфильтровывается от побочных продуктов, примесей и/или реагентов. Если конечная нуклеиновая кислота больше, чем димер, хиральное вспомогательное соединение в соединении структуры V кэппируется блокирующей группой с получением соединения со структурой VI. Если конечная нуклеиновая кислота является димером, стадия кэппирования не является необходимой. Соединение структуры VI модифицируется путем реакции с электрофилом с получением соединения со структурой VII. Модифицированное и конденсированное промежуточное соединение структуры VII разблокируется для удаления блокирующей группы в 5'-конце растущей нуклеиновокислотной цепи с получением соединения структуры IV. Соединение структуры IV, при необходимости, повторно вводится в цикл элонгации цепи для образования конденсированного промежуточного соединения, кэппированного конденсированного промежуточного соедиенния, модифицированного кэппированного конденсированного промежуточного соединения, и 5'-депротектированного модифицированного кэппированного промежуточного соединения. После, по меньшей мере, одного раунда цикла элонгации цепи, 5'-депротектированное модифицированное кэппированное промежуточное соединение разблокируется путем удаления хирального вспомогательного лиганда и других защитных групп, например, защитных групп нуклеооснования, модифицированного нуклеооснования, сахара и модифицированного сахара, с получением нуклеиновой кислоты Формулы 1. В других вариантах, нуклеозид, содержащий 5'-ОН составляющую, является промежуточным соединением из предыдущего цикла элонгации цепи, как в данном документе описано. В еще других вариантах, нуклеозид, содержащий 5'-ОН составляющую, является промежуточным соединением, полученным с использованием другого известного метода синтеза нуклеиновых кислот. После цикла синтеза с первым нуклеозидом, нуклеозиды, нуклеотиды или нуклеиновые кислоты, которые содержат незащищенную -ОН составляющую, могут быть использованы для последующих циклов элонгации. В вариантах, где используется твердый носитель, модифицированная по фосфорному атому нуклеиновая кислота затем отщепляется от данного твердого носителя. В некоторых вариантах, нуклеиновая кислота остается присоединенной к твердому носителю для целей очистки и затем отщепляется от твердого носителя после очистки. В одном варианте, синтез, описанный на Схеме 5 (Путь А), полезен, когда G' и G2 положения хирального вспомогательного лиганда Формулы А являются водородом. В еще других вариантах, соединения структур III-VII содержат составляющую Формулы A-I вместо составляющей Формулы А
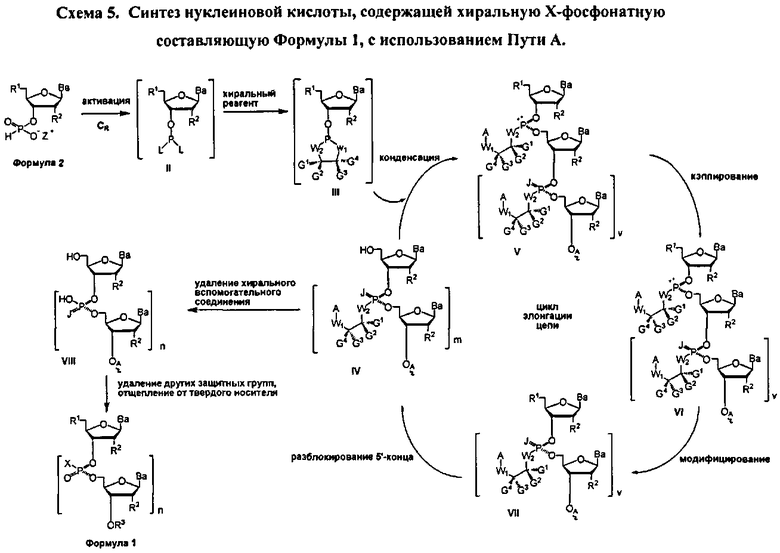
В другом варианте, описанном на Схеме 6 (Путь В), ахиральный H-фосфонат Формулы 2 обрабатывается конденсирующим реагентом с образованием промежуточного соединения со структурой II. В одном варианте, на стадии конденсации к реакционной смеси добавляется активирующий реагент. Использование активирующего реагента зависит от условий реакции, таких как растворители, которые применяются для данной реакции. Промежуточное соединение структуры II не выделяется и обрабатывается в том же самом котле с хиральным реагентом с образованием хирального промежуточного соединения структуры III. Промежуточное соединение структуры III не выделяется и подвергается реакции в том же самом котле с нуклеозидом или модифицированным нуклеозидом со структурой IX с получением хирального фосфитного соединения структуры X. В некоторых вариантах, структура X экстрагируется в растворитель для ее отделения от побочных продуктов, примесей и/или реагентов. В других вариантах, когда данный способ осуществляется через твердофазный синтез, твердый носитель, включающий соединение структуры X, отфильтровывается от побочных продуктов, примесей и/или реагентов. Соединение структуры X обрабатывается кислотой для удаления блокирующей группы в 5'-конце растущей нуклеиновокислотной цепи (структура XI). На стадии подкисления также удаляется хиральный вспомогательный лиганд с получением соединения структуры IX. 5'-деблокированное промежуточное соединение, при необходимости, повторно вводят в цикл элонгации цепи для образования конденсированного промежуточного соединения, содержащего блокированный 5'-конец, которое затем подкисляют для удаления 5'-концевой блокирующей группы и хирального вспомогательного лиганда. После, по меньшей мере, одного раунда цикла элонгации цепи, 5'-депротектированное промежуточное соединение подвергается стадии модификации с введением составляющей X, связанной с каждым из фосфорных атомов, с получением соединения структуры XII, Модифицированное промежуточное соединение разблокируется путем удаления оставшихся защитных групп, например, нуклеоосновной, модифицированной нуклеоосновной, сахарной или модифицированной сахарной защитных групп, с получением нуклеиновой кислоты Формулы 1. В других вариантах, нуклеозид, содержащий 5'-ОН составляющую, является промежуточным соединением из предыдущего цикла элонгации цепи, как в данном документе описано. В еще других вариантах, нуклеозид, содержащий 5'-ОН составляющую, является промежуточным соединением, полученным с использованием другого известного метода синтеза нуклеиновой кислоты. После цикла синтеза с первым нуклеозидом, нуклеозид, нуклеотид или нуклеиновая кислота, которые содержат незащищенную -ОН составляющую, могут использоваться для последующих циклов элонгации. В вариантах с использованием твердого носителя, нуклеиновая кислота, модифицированная по атому фосфора, затем отщепляется от твердого носителя. В некоторых вариантах, нуклеиновая кислота остается присоединенной к твердому носителю для целей очистки и затем отщепляется от твердого носителя после очистки. В одном варианте, синтез, описанный на Схеме 6 (Путь В), полезен, когда G1 и G2 положения хирального вспомогательного лиганда Формулы А не являются водородом. В некоторых вариантах, соединения структур III, X и XI содержат составляющую Формулы A-I вместо составляющей Формулы А
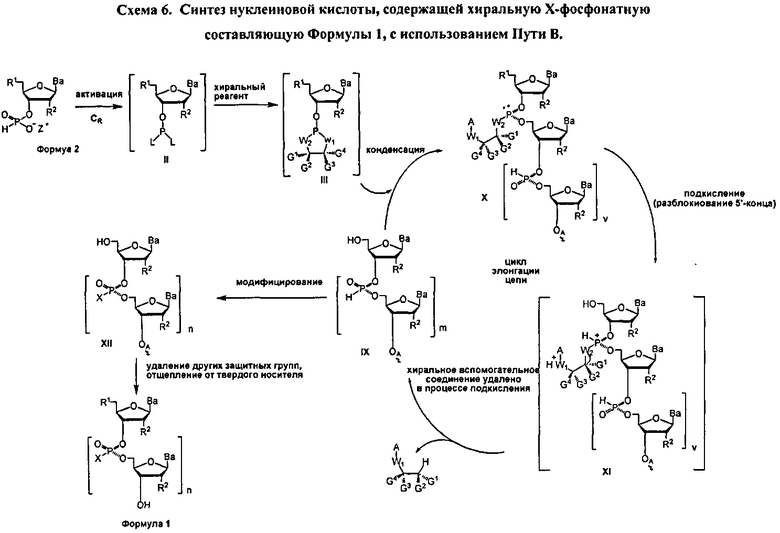
Обратный 5'-3' синтез нуклеиновой кислоты.
Нуклеиновая кислота, содержащая хиральную Х-фосфонатную составляющую Формулы 1, как альтернатива, синтезируется в направлении 5'-3'. В вариантах с использованием твердого носителя, нуклеиновая кислота присоединена к твердому носителю через ее 5' конец растущей нуклеиновой кислоты, предоставляя тем самым свою 3' группу для реакции, включая ферментативную реакцию (например, лигирование и полимеризация). В некоторых вариантах, эта ориентация создается путем приготовления нуклеозидных мономеров, содержащих ахиральную Н-фосфонатную составляющую в 5' положении и защищенную гидроксильную группу в 3' положении. В одном варианте, нуклеиновую кислоту синтезируют в соответствии со Схемой 7. На Схеме 7, -R4 является -ORb, как определено выше, или, на последнем цикле синтеза, является R4, которая эквивалентна R1, как в данном документе определено
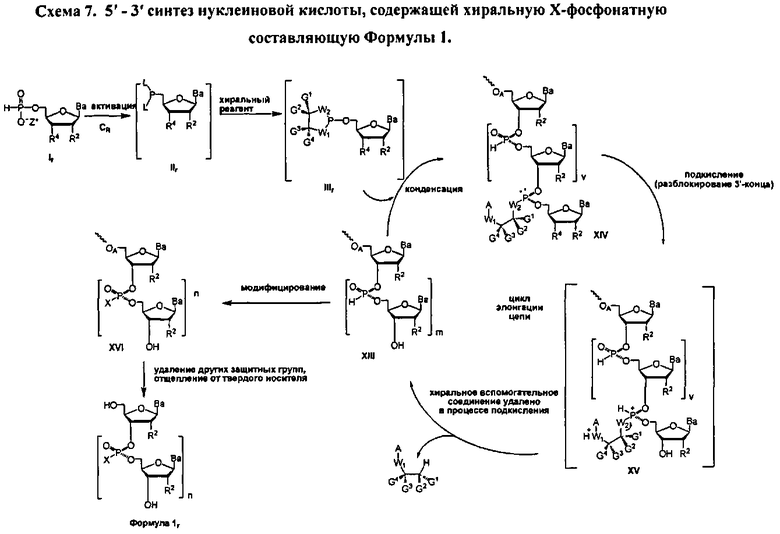
В некоторых вариантах, описанных на Схеме 7, ахиральный H-фосфонат структуры Ir обрабатывается конденсирующим реагентом с получением промежуточного соединения структуры II,. Промежуточное соединение структуры IIr не выделяется и обрабатывается в том же самом котле с хиральным реагентом с образованием промежуточного соединения структуры IIIr. В одном варианте, на стадии конденсации используется активирующий реагент. Использование активирующего реагента зависит от условий реакции, таких как растворители, которые применяются для данной реакции. Промежуточное соединение структуры IIIr не выделяется и подвергается реакции в том же самом котле с нуклеозидом или модифицированным нуклеозидом структуры XIII с получением хирального фосфитного соединения структуры XIV. В некоторых вариантах, структуру XIV экстрагируют в растворитель для отделения от побочных продуктов, примесей и/или реагентов. В других вариантах, когда данный способ реализуется путем твердофазного синтеза, твердый носитель, включающий соединение структуры XIV, отфильтровывается от побочных продуктов, примесей и/или реагентов. Соединение структуры XIV обрабатывается кислотой с удалением блокирующей группы в 3'-конце растущей нуклеиновокислотной цепи (структура XV). Стадия подкисления также удаляет хиральный вспомогательный лиганд с получением соединения структуры XIII. 3'-разблокированное промежуточное соединение, при необходимости, повторно вводится в цикл элонгации цепи с образованием конденсированного промежуточного соединения, содержащего блокированный 3'-конец, которое затем подкисляется для удаления 3'-концевой блокирующей группы и хирального вспомогательного лиганда. После, по меньшей мере, одного раунда цикла элонгации цепи, 3'-депротектированное промежуточное соединение подвергается стадии модификации с введением составляющей X, связанной с каждым из фосфорных атомов, с получением соединения структуры XVI. Модифицированное промежуточное соединение разблокируется путем удаления оставшихся защитных групп, например, нуклеоосновной, модифицированной нуклеоосновной, сахарной или модифицированной сахарной защитных групп, с получением нуклеиновой кислоты Формулы 1. В других вариантах, нуклеозид, содержащий 3'-ОН составляющую, является промежуточным соединением из предыдущего цикла элонгации цепи, как в данном документе описано. В еще других вариантах, нуклеозид, содержащий 3'-ОН составляющую, является промежуточным соединением, полученным с использованием другого известного метода синтеза нуклеиновой кислоты. После цикла синтеза с первым нуклеозидом, нуклеозиды, нуклеотиды или нуклеиновые кислоты, которые содержат незащищенную -ОН составляющую, могут использоваться для последующих циклов элонгации. В вариантах с использованием твердого носителя, нуклеиновая кислота, модифицированная по атому фосфора, затем может быть отщеплена от твердого носителя, расположенного в 5' конце. В некоторых вариантах, нуклеиновая кислота, при необходимости, может оставаться присоединенной к твердому носителю для целей очистки и затем отщепляется от твердого носителя после очистки. В одном аспекте, синтез, описанный на Схеме 7, полезен, когда оба из G1 и G2 положений хирального вспомогательного лиганда Формулы А не являются водородом. Обратный 5'-3' синтез может быть осуществлен с использованием тех же самых исходных материалов на Схеме 7 по механизму, аналогичному стадиям на Пути А. В некоторых вариантах, соединения структур III, XIV и XV содержат составляющую Формулы A-I вместо составляющей Формулы А.
Цикл элонгации цепи
Стереоселективный синтез модифицированной по фосфорному атому нуклеиновой кислоты включает цикл элонгации цепи. Цикл элонгации цепи начинается с реакции конденсации между соединением, которое является следующей единицей (например, молекулярной, содержащей ахиральную H-фосфонатную составляющую), которая добавляется к нуклеиновой кислоте, и другим соединением, содержащим свободную нуклеофильную составляющую (например, гидроксильную составляющую), В некоторых вариантах, соединение, содержащее свободную нуклеофильную составляющую, является мономерным нуклеозидом. В других вариантах, соединение, содержащее свободную нуклеофильную составляющую, является нуклеиновокислотным олигомером или полимером из предыдущего цикла элонгации цепи, как в данном документе описано. В других вариантах, соединение, содержащее свободную нуклеофильную составляющую, является нуклеиновокислотным олигомером или полимером из цикла элонгации цепи, проведенным с использованием других методов, известных в данной области.
Число раундов циклов элонгации цепи определяется длиной синтезируемой нуклеиновой кислоты. В некоторых вариантах, имеет место один цикл элонгации цепи. В других вариантах, цикл элонгации цепи повторяется более одного раза для достижения ступенчатого удлинения растущей олигонуклеотидной цепи отдельными нуклеотидными единицами.
В одном варианте, если нуклеиновая кислота является димером, необходим один раунд цикла элонгации цепи. В другом варианте, если нуклеиновая кислота содержит десять нуклеозидных единиц, требуется 9 раундов цикла элонгации цепи. В еще одном варианте, если к предварительно синтезированной нуклеиновокислотной цепи необходимо добавить 20 дополнительных нуклеозидных единиц, требуется 20 раундов цикла элонгации цепи. Специалистам в данной области очевидно, что число циклов элонгации цепи может регулироваться для получения необходимой длины данной нуклеиновой кислоты. Нуклеиновые кислоты, синтезированные с помощью описанных в данном документе способов, не ограничиваются числом циклов элонгации цепи, как в данном документе описано.
Модификация конденсированного промежуточного соединения, полученного с использованием Пути А, для введения Х-фосфонатной составляющей
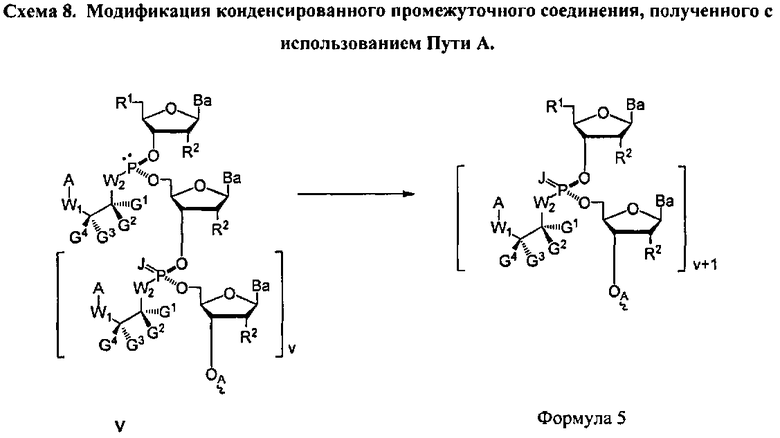
В соединении Формулы 5, R1 представляет собой -NRdRd, -N3, галоген, водород, алкил, алкенил, алкинил, алкил-Y1-,алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -P(O)(Re)2, или -НР(O)(Re), -ORa, или -SRc.
Y1 является О, NRd, S, или Se; Ra является блокирующей составляющей.
Rc является блокирующей группой.
В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2, или -HP(O)(Re).
В каждом случае Re представляет собой, независимо, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-.
Y2 является О, NRd, или S.
В каждом случае R2 предствавляет собой, независимо, водород, -NRdRd, N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb, или -SRc, где Rb является блокирующей составляющей.
В каждом случае Ba является, независимо, блокированным или деблокированным аденином, цитозином, гуанином, тимином, урацилом или модифицированным нуклеооснованием. В каждом случае J является S, Se, или ВН3; v является целым числом от 1 до n-1.
OA соединена со связывающей составляющей, которая соединена с твердым носителем или связывающей составляющей, которая соединена с нуклеиновой кислотой. А представляет собой ацил, арил, алкил, аралкил или силильную составляющую; и G1, G2, G3, G4, и G5 представляют собой, независимо, водород, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероарил, или арил, или две из G1, G2, G3, G4, и G5 являются G6, и, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее до приблизительно 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или не слитым и где не более четырех из G1, G2, G3, G4 и G5 являются G6.
В некоторых вариантах, соединение Формулы 5 содержит составляющую Формулы A-I, присоединенную к атому фосфора. В других вариантах, соединение Формулы 5 содержит составляющую Формулы А, присоединенную к фосфорному атому. В способе, проиллюстрированном посредством Пути А, конденсированное промежуточное соединение, являющееся результатом добавления нового нуклеозида, кэппировано для получения соединения структуры V и затем модифицировано по фосфору для введения J, которая представляет собой S, Se или ВН3, с получением соединения Формулы 5, где v является целым числом от 1 до n-1. Соединение Формулы 5 или обрабатывается для расщепления кэппированного хирального вспомогательного соединения и разблокирования оставшихся блокирующих групп или подвергается дополнительным циклам элонгации цепи и модификации фосфора. В случае, когда конечная нуклеиновая кислота является димером, кэппинг не является необходимым. В одном варианте структуры V, А представляет собой водород, ацил, арил, алкил, аралкил или силильную составляющую. В одном варианте Схемы 9, конденсированное промежуточное соединение, образовавшееся в результате добавления нового нуклеозида, не кэппировано для получения соединения структуры V, где v равно 0. Эта структура V, где v равняется 0, затем модифицируется по фосфору с введением J, которая представляет собой S, Se, или ВН3, с получением Формулы 5, где v является целым числом, равным 0.
В некоторых вариантах, модифицирующим агентом является серный электрофил, селеновый электрофил или борирующий агент.
В некоторых вариантах, серный электрофил является соединением, которое имеет одну из следующих формул:
S8(Формула В), Z24-S-S-Z25, или Z24-S-X-Z25,
где Z24 и Z25 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, гетероарилокси, ацил, амид, имид, или тиокарбонил, или Z24 и Z25 взяты вместе с образованием 3-8 членногое алициклического или гетероциклического кольца, которое может быть замещенным или незамещенным; X является SO2, О, или NRf; и Rf представляет собой водород, алкил, алкенил, алкинил или арил. В других вариантах, серным электрофилом является соединение Формулы В, С, D, Е, или F
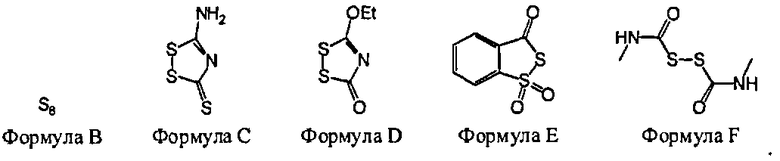
В других вариантах, серный электрофил имеет Формулу F, Формулу Е или Формулу В. В некоторых вариантах, селеновым электрофилом является соединение, имеющее одну из следующих формул:
Se(Формула G), Z26-Se-Se-Z27, или Z26-Se-X-Z27,
где Z26 и Z27 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, гетероарилокси, ацил, амид, имид или тиокарбонил, или Z26 и Z27 взяты вместе с образованием 3-8 членного алициклического или гетероциклического кольца, которое может быть замещенным или незамещенным; X является SO2, S, О, или NRf; и Rf представляет собой водород, алкил, алкенил, алкинил или арил.
В других вариантах, селеновым электрофилом является соединение Формулы G, H, I, J, К или L
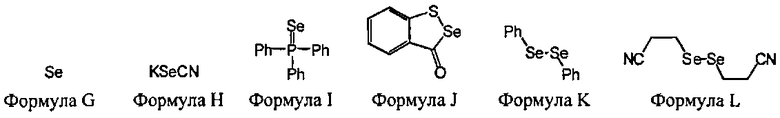
В некоторых вариантах, селеновый электрофил имеет Формулу G или Формулу L.
В некоторых вариантах, борирующим агентом является боран-N,N-диизопропилэтиламин (ВН3·DIPEA), боран-пиридин (ВН3·Py), боран-2-хлоропиридин (BH3·CPy), боран-анилин (ВН3·An), боран-тетрагидрофуран (ВН3·THF), или боран-диметилсульфид (ВН3·Me2S), анилин-цианоборан, трифенилфосфин-карбоалкоксибораны.
В других вариантах, борирующим агентом является боран-N,N-диизопропиламин (ВН3·DIPEA), боран-2-хлоропиридин (ВН3·CPy), боран-тетрагидрофуран (ВН3·THF), или боран-диметилсульфид (ВН3·Me2S).
В дополнительных вариантах, после модификации конденсированного промежуточного соединения, полученного посредством Пути А, соединение Формулы 5 разблокируется в положении R1 с получением соединения Формулы 4, где m равняется, по меньшей мере, 1, J является S, Se, или ВН3, и D является составляющей Формулы А. В некоторых вариантах, после разблокирования R1, получается соединение Формулы 4, где D является составляющей Формулы A-I. Соединение Формулы 4 реагирует с нуклеозидом структуры III, давая конденсированное промежуточное соединение. Стадия превращения данного конденсированного промежуточного соединения включает кэппирование конденсированного промежуточного соединения и модифицирование кэппированного конденсированного промежуточного соединения с получением соединения Формулы 5. В некоторых вариантах соединения Формулы 5, v равняется больше 2 и меньше приблизительно 200. Разблокирование в R1 положении, реакция с нуклеозидом структуры III, кэппирование и модификация, при необходимости, повторяются с получением соединения Формулы 5, где v увеличивается на 1. В некоторых вариантах соединения Формулы 5, v больше 3 и меньше приблизительно 200.
В дополнительных вариантах, соединение Формулы 5 превращается в соединение Формулы 1, где в некоторых вариантах каждая Ва составляющая деблокирована. В других вариантах, соединение Формулы 5 превращается в соединение Формулы 1, где не все Ва составляющие деблокированы. R1 представляет собой -ОН, -SH, -NRdRd, -N3, галоген, водород, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa, или -SRc; где Y1 является О, NRd, S, или Se, Ra является блокирующей составляющей, и Rc является блокирующей группой. В некоторых вариантах, R1 разблокирована. В еще других вариантах, R1 остается блокированной.
В каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, замещенный силил, карбамат, -P(O)(Re)2, или -HP(O)(Re), и в каждом случае Re представляет собой, независимо, водород, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-, или катион, который является Na+1, Li+1, или К+1, где Y2 является О, NRd, или S. В каждом случае R2 представляет собой, независимо, водород, -ОН, -SH, -NRdRd, N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-.
В некоторых вариантах, R3 является Н. В других вариантах, R3 является блокирующей группой или связывающей составляющей, соединенной с твердым носителем, нуклеозидом, нуклеотидом или нуклеиновой кислотой. В некоторых вариантах, в каждом случае X является, независимо, -S-Z+, -Se-Z+, или -ВН3 -Z+; и Z+ является аммоний ионом, алкиламмоний ионом, гетероароматическим иминий ионом или гетероциклическим иминий ионом, любой из которых является первичным, вторичным, третичным или четвертичным, или Z+ является моновалентным металлическим ионом.
Модификация соединения Формулы 4, полученного с использованием Пути В, для введения Х-фосфонатной составляющей.
Способы, использованные для модификации соединения Формулы 4, полученного с использованием Пути В, иллюстрируются Реакционными Схемами 9а и 9b. Известно, что фосфонат и фосфит таутомеризуются и существуют в равновесии. Фосфитный таутомер менее устойчив, чем фосфонатный таутомер. Равновесие смещается в сторону фосфонатного таутомера при нейтральных условиях вследствие очень сильной связи Р=O. При кислотных условиях фосфорильная группа данного фосфоната становится обратимо протонированной. Расщепление Р-Н связи в промежуточном соединении происходит медленно с образованием фосфитного промежуточного соединения. Затем структура IX модифицируется с образованием структуры XII, с использованием реагентов, показанных на Реакционных Схемах 9а и 9b
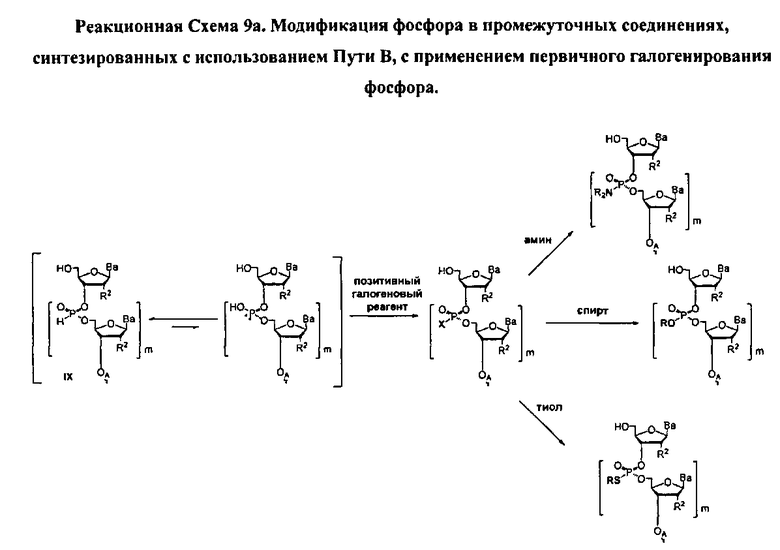
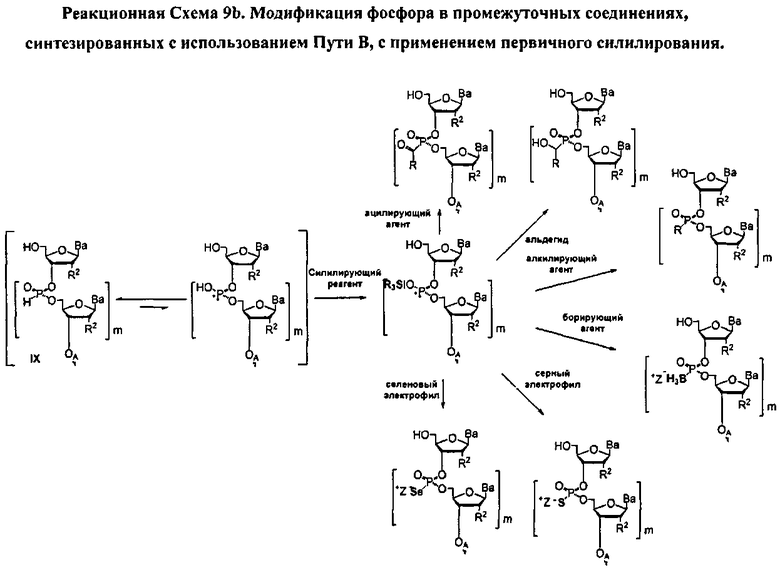
В некоторых вариантах, стадия модифицирования осуществляется путем реакции структуры IX с галогенирующим реагентом с последующей реакцией с нуклеофилом (Схема 9а). В специфических вариантах, галогенирующий реагент представляет собой CCl4, CBr4, CI4, Cl2, Br2, I2, сульфурил хлорид (SO2Cl2), фосген, бис(трихлорометил)карбонат(ВТК), монохлорид серы, дихлорид серы, хлорамин, CuCl2, N-хлоросукцинимид (NCS), N-бромосукцинимид (NBS), или N-йодосукцинимид (NIS). В других специфических вариантах, галогенирующим реагентом является CCl4, CBr4, Cl2, сульфурил хлорид (SO2Cl2), или N-хлоросукцинимид (NCS). В некоторых вариантах, данным нуклеофилом является первичный или вторичный амин, спирты или тиолы. В других вариантах, данным нуклеофилом является NRfRfH, RfOH, или RfSH, где Rf представляет собой водород, алкил, алкенил, алкинил или арил, и, по меньшей мере, одна из Rf NRfRfH не является водородом. Стадия модифицирования может также проводиться путем реакции структуры IX с силилирующим реагентом, с последующей реакцией с серным электрофилом, селеновым электрофилом, борирующим агентом, алкилирующим агентом, альдегидом или ацилирующим агентом (Схема 9b). В специфических вариантах, силилирующий реагент представляет собой хлоротриметилсилан (TMS-Cl), триизопропилсилилхлорид (TIPS-Cl), t-бутилдиметилсилилхлорид (TBDMS-Cl), t-бутилдифенилсилилхлорид (ТБДФС-Cl), 1,1,1,3,3,3-гексаметилдисилизан (HMDS), N-триметилсилилдиметиламин (TMSDMA), N-триметилсилилдиэтиламин (TMSDEA), N-тритметилсилилацетамид (TMSA), N-бис(триметилсилил)ацетамид (БСА), или N,O-бис(триметилсилил)трифтороацетамид (BSTFA).
В других специфических вариантах, серным электрофилом является соединение, которое имеет одну из следующих формул:
S8(Формула В), Z24-S-S-Z25 или Z24-S-X-Z25,
где Z24 и Z25 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, гетероарилокси, ацил, амид, имид или тиокарбонил, или Z24 и Z25 взяты вместе с образованием 3-8 членного алициклического или гетероциклического кольца, которое может быть замещенным или незамещенным; X является SO2, О или NRf и Rf представляет собой водород, алкил, алкенил, алкинил или арил. В других вариантах, серный электрофил представляет собой соединение Формулы В, С, D, Е, или F
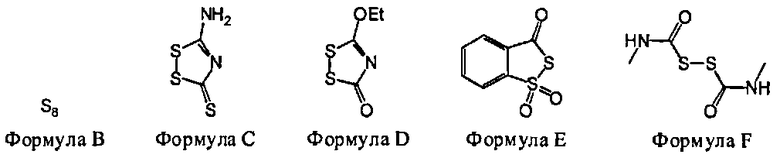
В других вариантах, серный электрофил имеет Формулу F, Формулу Е или Формулу В.
В некоторых вариантах, селеновым электрофилом является соединеение, которое имеет одну из следующих формул:
Se (Формула G), Z26-Se-Se-Z27 или Z26-Se-X-Z27,
где Z26 и Z27 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, гетероарилокси, ацил, амид, имид, или тиокарбонил, или Z26 и Z27 взяты вместе с образованием 3-8 членного алициклического иил гетероциклического кольца, которое может быть замещенным или незамещенным; X является SO2, S, О, или NRf и Rf представляет собой водород, алкил, алкенил, алкинил или арил.
В других вариантах, селеновым электрофилом является соединение Формулы G, H, I, J, К, или L
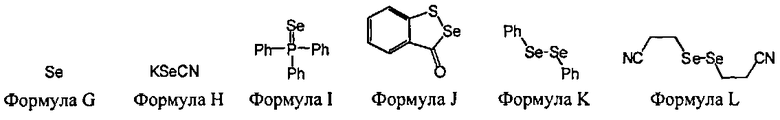
В некоторых вариантах, селеновый электрофил имеет Формулу G или Формулу L.
В некоторых вариантах, борирующий агент представляет собой боран-N,N-диизопропилэтиламин (ВН3·DIPEA), боран-пиридин (ВН3·Py), боран-2-хлоропиридин (ВН3·CPy), боран-анилин (ВН3·An), боран-тетрагидрофуран (ВН3-THF), или боран-диметилсульфид (ВН3·Me2S), анилин-цианоборан, трифенилфосфин-карбоалкоксибоарны.
В других вариантах, борирующий агент представляет собой боран-N,N-диизопропилэтиламин (ВН3·DIPEA), боран-2-хлоропиридин (ВН3·CPy), боран-тетрагидрофуран (ВН3·THF), или боран-диметилсульфид (BH3·Me2S).
В других вариантах, алкилирующий агент представляет собой алкил галогенид, алкенил галогенид, алкинил галогенид, алкил сульфонат, алкенил сульфонат или алкинил сульфонат.
В других вариантах, данным альдегидом является (пара)-формальдегид, алкил альдегид, алкенил альдегид, алкинил альдегид или арил альдегид.
В еще других вариантах, ацилирующим агентом является соединение Формулы М или N
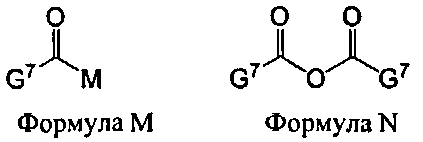
где G7 представляет собой алкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси или гетероарилокси; и М представляет собой F, Cl, Br, I, 3-нитро-1,2,4-триазол, имидазол, алкилтриазол, тетразол, пентафторобензол или 1-гидроксибензотриазол.
В дополнительных вариантах, после подкисления, соединение Формулы 4, где m равняется, по меньшей мере, единице, J является О и D является H, подвергается реакции с нуклеозидом структуры III с образованием конденсированного промежуточного соединения, которое преобразуется путем подкисления с получением соединения Формулы 4, где m равняется, по меньшей мере, 2 и меньше приблизительно 200; J является О, и D является H. В других вариантах, соединение Формулы 4, при необходимости, дополнительно реагирует с нуклеозидлм структуры III с образованием конденсированного промежуточного соединения с последующим подкислением. Реакция с нуклеозидом структуры III и подкисление повторяются до достижения желательного числа единиц в растущей цепи. В некоторых вариантах получают соединение Формулы, где m увеличено на 1. В некоторых вариантах получают соединение Формулы 4, в котором m больше 2 и меньше приблизительно 200. В некоторых вариантах конденсированное промежуточное соединение содержит составляющую Формулы A-I вместо момтавляющей Формулы А.
В дополнительных вариантах, соединение Формулы 4 модифицируется с введением X составляющей, с получением, таким образом, соединения Формулы 1. В одном варианте соединения Формулы 1, R3 является блокирующей группой или связывающей составляющей, соединенной с твердым носителем. В других вариантах, R1 разблокирована. В еще других вариантах, соединение Формулы 1 обрабатывается таким образом, что R1 остается блокированной, В еще других вариантах, соединение Формулы 1 обрабатывается таким образом, что R1 является -ОН, -SH, -HRdRd, -N3, галогеном, водородом, алкилом, алкенилом, алкинилом, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa или -SRc; где Y1 является О, NRd, S, или Se, Ra является блокирующей составляющей, и Rc является блокирующей группой, в каждом случае Rd представляет собой, независимо, водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2, или -HP(O)(Re), и в каждом случае Re представляет собой, независимо, водород, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-, или катион, который является Na+1, Li+1, или К+1, где Y2 является О, NRd, или S. В каждом случае R2 представляет собой, независимо, водород, -ОН, -SH, -NRdRd, N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-. В некоторых вариантах, R2 разблокирована. В еще других вариантах, R2 остается блокированной. В некоторых вариантах, каждая Ва составляющая деблокирована. В других вариантах, не все Ва составляющие деблокированы. В других вариантах, R3 является Н. В некоторых вариантах, R3 является блокирующей группой или связывающей составляющей, соединенной с твердым носителем, нуклеозидом, нуклеотидом или нуклеиновой кислотой. В некоторых вариантах, в каждом случае X представляет собой, независимо, алкил, алкокси, арил, алкилтио, ацил, -NRfRf, алкенилокси, алкинилокси, алкенилтио, алкинилтио, -S-Z+, -Se-Z+, или -ВН3 -Z+; в каждом случае Rf представляет собой, независимо, водород, алкил, алкенил, алкинил или арил; Z+ является аммоний ионом, алкиламмоний ионом, гетероароматическим иминий ионом или гетероциклическим иминий ионом, любой из которых является первичным, вторичным, третичным или четвертичным, или Z+ является моновалентным металлическим ионом.
УСЛОВИЯ РЕАКЦИЙ И РЕАГЕНТЫ, ИСПОЛЬЗОВАННЫЕ В СПОСОБАХ ДАННОГО ИЗОБРЕТЕНИЯ
Условия
Стадии реагирования молекулы, содержащей ахиральную H-фосфонатную составляющую, и нуклеозида, содержащего 5'-ОН составляющую, с образованием конденсированного промежуточного соединения могут осуществляться без выделения любых промежуточных соединений. В некоторых вариантах, стадии реагирования молекулы, содержащей ахиральную Н-фосфонатную составляющую, и нуклеозида, содержащего 5'-ОН составляющую, с образованием конденсированного промежуточного соединения осуществляются в реакции в одном котле. В одном варианте, молекула, содержащая ахиральную H-фосфонатную составляющую, конденсирующий реагент, хиральный реагент, и соединение, содержащее свободную нуклеофильную составляющую, добавляются к реакционной смеси в разные моменты времени. В другом варианте, молекула, содержащая ахиральную H-фосфонатную составляющую, конденсирующий реагент и хиральный реагент присутствуют в одном и том же реакционном сосуде или одном котле. В другом варианте, молекула, содержащая ахиральную H-фосфонатную составляющую, конденсирующий реагент, хиральный реагент и соединение, содержащее свободную нуклеофильную составляющую, присутствуют в одном и том же реакционном сосуде или котле. Это позволяет проводить реакцию без выделения промежуточных соединений и исключает продолжительные по времени стадии, что обеспечивает экономичный и эффективный синтез. В специфических вариантах, ахиральный H-фосфонат, конденсирующий реагент, хиральный аминоспирт, 5'-ОН нуклеозид присутствуют в одно и то же время в реакционной смеси. В дополнительном варианте, образование хирального промежуточного соединения для конденсации осуществляется in situ, и оно не выделяется до реакции конденсации. В другом варианте, молекула, содержащая ахиральную H-фосфонатную составляющую, активируется реакцией с конденсирующим реагентом, хиральным реагентом в другом реакционном сосуде, отличном от того, который использовался при реакции хирального промежуточного соединения с соединением, содержащим свободную 5'-ОН составляющую. В одном варианте, активирующий реагент добавляется на стадии конденсации. В одном варианте, активирующий реагент добавляется после того как ахиральная H-фосфонатная составляющая, конденсирующий реагент и хиральный реагент уже были смешаны вместе. В другом варианте, активирующий реагент добавляется вместе с ахиральной H-фосфонатной составляющей, конденсирующим реагентом и хиральным реагентом. В зависимости от условий реакции, активирующий реагент может быть полезен в процессе синтеза, например, на стадии конденсации. Например, если в качестве основания на стадии предварительной активации или конденсации используется пиридин, активирующий реагент, такой как ЦМПТ, не требуется, поскольку пиридин действует как нуклеофильный катализатор (т.е. активатор). Если на стадии конденсации используется другое основание, такое как N-цианометил пирролидин (ЦМП), который не является таким нуклеофильным как пиридин, тогда активирующий реагент, такой как ЦМПТ, может быть добавлен в качестве активирующего реагента.
Синтез на твердом носителе
В некоторых вариантах, синтез нуклеиновой кислоты проводится в растворе. В других вариантах, синтез нуклеиновой кислоты проводится на твердой фазе. Реакционные группы твердого носителя могут быть незащищенными или защищенными. В процессе синтеза олигонуклеотида твердый носитель обрабатывается различными реагентами в нескольких циклах синтеза для достижения ступенчатого удлинения растущей олигонуклеотидной цепи за счет индивидуальных нуклеотидных единиц. Как используется в данном документе, нуклеозидная единица в конце данной цепи, которая прямо связана с твердым носителем, называется "первым нуклеозидом". Первый нуклеозид связан с твердым носителем через линкерную составляющую, т.е. дирадикал с ковалентными связями, как с полимером твердого носителя так и нуклеозидом. Данный линкер остается интактным в процессе проведения циклов синтеза, осуществляемых для сборки олигонуклеотидной цепи, и отщепляется после сборки цепи, освобождая олигонуклеотид от носителя. Твердые носители для твердофазного синтеза нуклеиновый кислот включают носители, описанные в, например, в патентах США под номерами 4659774, 5141813,4458066; патентах США Карутера (Caruthers) Nos. 4415732,4458066,4500707,4668777,4973679 и 5132418; патентах США Андруса и др. (Andrus et al.) Nos. 5047524, 5262530; и патентах США Костера (Koster) 4725677 (переизданного как Re34069). В некоторых вариантах, твердой фазой является органический полимерный носитель. В других вариантах, твердой фазой является неорганический полимерный носитель. В некоторых вариантах, органическим полимерным носителем является полистирол, аминометил полистирол, привитой сополимер полиэтиленгликоль-полистирола, полиакриламид, полиметакрилат, поливиниловый спирт, высокоструктурированный полимер (ВКП), или другие синтетические полимеры, углеводы, такие как целлюлоза и крахмал, или другие полимерные углеводы, или другие органические полимеры и любые сополимеры, композиционные материалы или комбинации вышеупомянутых неорганических или органических материалов. В других вариантах, неорганическим полимерным носителем является кремнезем, диоксид алюминия, контролируемое полистекло (СКП), которое является силикагелевым носителем, или аминопропиловое СКП. Другие полезные твердые носители включают флуоресцирующие твердые носители (см., например, WO/2005/070859), твердые носители на основе длинноцепочечного алкиламинового (LCAA) стекла с контролируемой пористостью (СКП) (см., например, S. P. Adams, К. S. Kavka, E. J. Wykes, S. В. Holder and G. R. Galluppi, J. Am. Chem. Soc., 1983, 105, 661-663; G. R. Gough, M. J. Bruden and P. T. Gilham, Tetrahedron Lett; 1981, 22,4177-4180). Мембранные носители и полимерные мембраны (см., например, Innovation and Perspectives in Solid Phase Synthesis, Peptides, Proteins and Nucleic Acids, ch 21 pp 157-162,1994, Ed. Roger Epton и патент США No. 4923901) также полезны для синтеза нуклеиновых кислот. После формирования мембрана может быть химически функционалазирована для использования в синтезе нуклеиновых кислот. Кроме присоединения функциональной группы к мембране, могут быть использованы линкерная или спейсерная группы, присоединенные к данной мембране, для минимизации стерического несоответствия между данной мембраной и синтезируемой цепью.
Другие подходящие твердые носители включают широко известные в данной области носители, которые подходят для использования в тведофазных методологиях, включая, например, стеклянный носитель PrimerTM 200, стекло с контролируемой пористостью (СКП), оксалиловое стекло с контролируемой пористостью (см., например, Alul, et al.. Nucleic Acids Research, 1991, 19, 1527), TentaGel Support-аминополиэтиленгликоль-дериватизированный носитель (см., например, Wright, et al.. Tetrahedron Lett., 1993, 34,3373) и сополимер полистирол/дивинилбензол Poros. Полимеры с активированной поверхностью были продемонстрированы для использования в синтезе природных и модифицированных нуклеиновых кислот и белков на нескольких средах из твердых носителей. Материал твердого носителя может представлять собой любой полимер, имеющий приемлемо однородную пористость, достаточное содержание амина, и достаточную эластичность, чтобы выдерживать любые манипуляции оператора без утраты целостности. Примеры подходящих селективных материалов включают нейлон, полипропилен, полиэфир, политетрафтороэтилен, полистирол, поликарбонат и нитроцеллюлозу. Твердым носителем могут служить другие материалы, в зависимости от конструкции, примененной исследователем. Рассматривая некоторые конструкции, например, металл с покрытием, можно выбрать, в частности, золото или платину (см., например, публикацию США No. 20010055761). В одном варианте олигонуклеотидного синтеза, например, нуклеозид закрепляется на твердом носителе, который функционализирован гидроксильным или амино остатками. Как альтернатива, данный твердый носитель дериватизируется, давая лабильную к кислоте триалкокситритильную группу, такую как триметокситритильную группу (ТМТ). Не вдаваясь в теорию, можно предположить, что присутствие триалкокситритильной защитной группы позволит проводить первичное детритилирование при условиях, обычно используемых на ДНК синтезаторах. Для более быстрого выделения олигонуклеотидного материала в растворе с водным аммиаком, при необходимости, в данный носитель вводится дигликоатный линкер.
Связывающая составляющая
Связывающая составляющая или линкер используется, при необходимости, для соединения твердого носителя с соединением, содержащим свободную нуклеофильную составляющую. Известны подходящие линкеры, такие как короткие молеклы, которые служат для связи твердого носителя с функциональными группами (например, гидроксильными группами) первичных молекул нуклеозида в методах твердофазного синтеза. В некоторых вариантах, связывающей составляющей является сукцинаминовый кислотный линкер, или сукцинатный линкер (-СО-СН2-СН2-СО-), или оксалиловый линкер (-СО-СО-). В других вариантах, связывающая составляющая и данный нуклеозид связаны вместе через эфирную связь. В других вариантах, связывающая составляющая и данный нуклеозид связаны вместе через амидную связь. В дополнительных вариантах, связывающая составляющая соединяет данный нуклеозид с другим нуклеотидом или нуклеиновой кислотой. Подходящие линкеры раскрыты, например, в работе Oligonucleotides And Analogues A Practical Approach, Ekstein, F. Ed., IRL Press, N.Y., 1991, Chapter 1. Линкерная составляющая используется для связи данного соединения, содержащего свободную нуклеофильную составляющую, с другим нуклеозидом, нуклеотидом или нуклеиновой кислотой. В некоторых вариантах, связывающей составляющей является фосфодиэфирная связь. В других вариантах, связывающей составляющей является H-фосфонатная составляющая. В еще других вариантах, связывающей составляющей является Х-фосфонатная составляющая.
Растворители для синтеза
Синтез нуклеиновых кислот осуществляется в апротонном органическом растворителе. В некоторых вариантах, растворителем является ацетонитрил, пиридин, тетрагидрофуран или дихлорометан. В некоторых вариантах, когда данный апротонный растворитель не является основным, на реакционной стадии присутствует основание. В некоторых вариантах, где присутствует основание, основанием является пиридин, хинолин или N,N-диметиланилин, или N-цианометилпирролидин. Другие примеры оснований включают пирролидин, пиперидин, N-метил пирролидин, пиридин, хинолин, N,N-диметиламинопиридин (DMAP), N,N-диметиланилин или N-цианометилпирролидин. В некоторых вариантах данного способа, основанием является
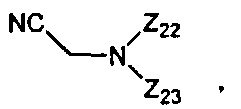
где Z22 и Z23 представляют собой, независимо, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси или гетероарилокси, или где любая из Z22 и Z23 взяты вместе с образованием 3-10 членного алициклического или гетероциклического кольца. В некоторых вариантах данного способа, основанием является N-цианометилпирролидин. В некоторых вариантах, данный апротонный органический растворитель является безводным. В других вариантах, безводный апротонный органический растворитель является свежеперегнанным. В некоторых вариантах, свежеперегнанным безводным апротонным органическим растворителем является пиридин. В других вариантах, свежеперегнанным безводным апротонным органическим растворителем является тетрагидрофуран. В других вариантах, свежеперегнанным безводным апротонным органическим растворителем является ацетонитрил.
Данный растворитель может представлять собой комбинацию из 2 или нескольких растворителей. В зависимости от того, какой растворитель выбран для данного синтеза, полезным может быть добавление активирующего реагента.
Условия подкисления для удаления блокирующих групп
Подкисление для удаления блокирующих групп проводится кислотой Бренстеда или кислотой Льюиса. В некоторых вариантах, подкисление использутся для удаления R1 блокирующих групп. Полезными кислотами Бренстеда являются карбоновые кислоты, алкилсульфоновые кислоты, арилсульфоновые кислоты, фосфорная кислота и ее производные, фосфоновая кислота и ее производные, алкилсульфоновые кислоты и их производные, арилфосфоновые кислоты и их производные, фосфиновая кислота, диалкилфосфиновые кислоты, и диарилфосфиновые кислоты, которые имеют значение рКа (25°С в воде) от -0.6 (трифтороуксусная кислота) до 4,76 (уксусная кислота) в органическом растворителе или воде (в случае 80% уксусной кислоты). Концентрация данной кислоты (1-80%), используемой на стадии подкисления, зависит от кислотности данной кислоты. Следует учитывать крепость данной кислоты, поскольку сильно кислотные условия приведут к депуринированию/депиримидинированию, где пуриниловое или пиримидиниловое основания отщепляются от рибозного кольца
В некоторых вариантах, подкисление проводится кислотой Льюиса в органическом растворителе.
Полезными кислотами Льюиса являются ZnX2, где X является Cl, Br, I, или CF3SO3.
В некоторых вариантах, подкисление включает добавление такого количества кислоты Бренстеда или Льюиса, которое эффективно для превращения конденсированного промежуточного соединения в соединение Формулы 4 без удаления пуриновых составляющих из конденсированного промежуточного соединения.
Кислоты, которые полезны на стадии подкисления, также включают, но не ограничиваясь этим, 10% фосфорную кислоту в органическом растворителе, 10% хлористоводородную кислоту в органическом растворителе, 1% трифтороуксусную кислоту в органическом растворителе, 3% дихлороуксусную кислоту в органическом растворителе или 80% уксусную кислоту в воде. Концентрация любой из используемых в данном процессе кислот Бренстеда или Льюиса выбирается такой, чтобы она не превышала концентрацию, которая обусловливает отщепление данного нуклеооснования от сахарной составляющей.
В некоторых вариантах, подкисление включает добавление 1% трифтороуксусной кислоты в органическом растворителе. В некоторых вариантах, подкисление включает добавление от приблизительно 0,1% до приблизительно 8% трифтороуксусной кислоты в органическом растворителе. В других вариантах, подкисление включает добавление 3% дихлороуксусной кислоты в органическом растворителе. В других вариантах, подкисление включает добвление от приблизительно 0,1% до приблизительно 10% дихлороуксусной кислоты в органическом растворителе. В еще других вариантах, подкисление включает добавление 3% трихлороуксусной кислоты в органическом растворителе. В еще других вариантах, подкисление включает добавление от приблизительно 0,1% до приблизительно 10% трихлороуксусноц кислоты в органическом растворителе. В некоторых вариантах, подкисление включает добавление 80% уксусной кислоты в. воде. В некоторых вариантах, подкисление включает добавление от приблизительно 50% до приблизительно 90%, или от приблизительно 50% до приблизительно 80%, от приблизительно 50% до приблизительно 70%, от приблизительн 50% до приблизительно 60%, от приблизительно 70% до приблизительно 90% уксусной кислоты в воде. В некоторых вариантах, подкисление включает дополнительное добавление катионных поглотителей к кислотному раствору. В специфических вариантах, катионными поглотителями могут быть триэтилсилан или триизопропилсилан. В некоторых вариантах, R1 деблокирована перед стадией подкисления конденсированного промежуточного соединения. В некоторых вариантах, R1 деблокируется посредством подкисления, которое включает добавление 1% трифтороуксусной кислоты в органическом растворителе. В некоторых вариантах, R1 деблокируется посредством подкисления, которое включает добавление 3% дихлороуксусной кислоты в органическом растворителе. В некоторых вариантах, R1 деблокируется посредством подкисления, которое включает добавление 3% трихлороуксусной кислоты в органическом растворителе.
Удаление блокирующих составляющих или групп
Функциональные группы, такие как гидроксильная или амино составляющие, которые локализованы на нуклеооснованиях или сахарных составляющих, обычно блокируются с помощью блокирующих (защитных) групп (составляющих) в процессе синтеза и впоследствии разблокируются. В общем, блокирующая группа делает химическую функциональность молекулы инертной к специфическим условиям реакции и может быть позже удалена от такой функциональности в молекуле без значительного повреждения остатка данной молекулы (см., например, Green and Wuts, Protective Groups in Organic Synthesis, 2nd Ed., John Wiley & Sons, New York, 1991). Например, аминогруппы могут быть блокированы азотными блокирующими группами, такими как фталимидо, 9-флудренилметоксикарбонил (FMOC), трифенилметилсульфенил, t-ВОС, 4,4'-диметокситритил (ДМТр), 4-метокситритил (MMTr), 9-фенилксантин-9-ил (Pixyl), тритил (Tr), или 9-(п-метоксифенил)ксантин-9-ил (МОХ). Карбоксильные группы могут быть защищены как ацетильные группы. Гидрокси группы могут быть защищены такими группами как тетрагидропиранил (ТНР), t-бутилдиметилсилил (TBDMS), 1-[(2-хлоро-4-метил)фенил]-4-метоксипиперидин-4-ил (Ctmp), 1-(2-фторофенил)-4-метоксипиперидин-4-ил (Fpmp), 1-(2-хлороэтокси)этил, 3-метокси-1,5-дикарбометоксипентан-3-ил (MDP), бис(2-ацетоксиэтокси)метил (АСЕ), триизопропилсилилоксиметил (ТОМ), 1-(2-цианоэтокси)этил (СЕЕ), 2-цианоэтоксиметил (СЕМ), [4-(N-дихлороацетил-N-метиламино)бензилокси]метил, 2-цианоэтил (CN), пивалоилоксиметил (PivOM), левунилоксиметил (ALE). Другие репрезентативные гидроксил блокирующие группы описаны (см., например, Beaucage et al.. Tetrahedron, 1992, 46,2223). В некоторых вариантах, гидроксил блокирующие группы являются кислотно-лабильными группами, такими как, тритил, монометокситритил, диметокситритил, триметокситритил, 9-фенилксантин-9-ил (Pixyl) и 9-(п-метоксифенил)ксантин-9-ил (МОХ). Химические функциональные группы могут также блокироваться путем их включения в форму предшественника. Так, азидогруппа может рассматриваться как блокированная форма амина, поскольку азидогруппа легко превращается в амин. Дополнительные репрезентативные защитные группы, использованные в нуклеиновокислотном синтезе, известны из литературы (см., например, Agrawal et al., Protocols for Oligonucleotide Conjugates, Eds., Humana Press, New Jersey, 1994, Vol.26, pp.1-72). Известны и применяются различные методы для удаления блокирующих групп из нуклеиновых кислот. В некоторых вариантах, все блокирующие группы удалены. В других вариантах, блокирующие группы удалены частично. В еще других вариантах, могут быть подобраны условия реакции для удаления блокирующих групп на некоторых составляющих. В некоторых вариантах, где R2 является блокирующей группой, удаление блокирующей группы с R2 ортогонально удалению блокирующей группы с R1. Блокирующие группы на R1 и R2 остаются интактными на стадиях синтеза и коллективно удаляются после сборки цепи. В некоторых вариантах, R2 блокирующие группы удаляются одновременно с отщеплением данных нуклеиновых кислот от твердого носителя и с удалением нуклеоосновных блокирующих групп. В специфических вариантах, блокирующая группа на R1 удаляется, тогда как блокирующие группы на R2 и нуклеооснованиях остаются интактными. Блокирующие группы на R1 расщепляются на твердых носителях органическим основанием, таким как первичный амин, вторичный амин или их смесь. Разблокирование R1 положения обычно называется депротектированием переднего конца. В одном варианте, нуклеоосновные блокирующие группы, если таковые присутствуют, расщепляются после сборки соответствующей нуклеиновой кислоты кислотным реагентом. В другом варианте, одна или несколько нуклеоосновных блокирующих групп не расщепляется ни при кислотных ни при основных условиях, расщепляясь, например, фторидными солями или фтористоводородными кислотными комплексами. В еще другом варианте, одна или несколько нуклеоосновных блокирующих групп расщепляется после сборки соответствующей нуклеиновой кислоты в присутствии основания или основного растворителя, и где нуклеоосновная блокирующая группа устойчива к условиям стадии депротектирования переднего конца аминами.
В некоторых вариантах, блокирующие группы для нуклеооснований не требуются. В других вариантах, для нуклеооснований требуются блокирующие группы. В еще других вариантах, некоторые нуклеооснования требуют блокирующей группы, тогда как другие нуклеооснования не требуют блокирующих групп. В вариантах, где данные нуклеооснования заблокированы, блокирующие группы либо полностью, либо частично удаляются при условиях, отвечающих удалению блокирующей группы на переднем конце. Например, R1 может означать ORa, где Ra является ацилом, и Ва означает гуанин, блокированный ацильной группой, включая, но не ограничиваясь этим, изобутирил, ацетил или 4-(трет-бутлфенокси)ацетил. Ацильные группы на R1 и Ва будут удалены или частично удалены на той же самой стадии разблокирования.
РЕАГЕНТЫ
Конденсирующий реагент
Конденсирующий реагент (CR), полезный в способах данного изобретения, имеет одну из следующих общих формул: Ar3PL3 и (Ar3O)3PL2
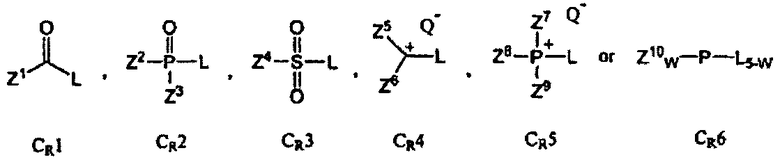
где Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8, Z9 и Z10 выбираются, независимо, из алкила, амноалкила, циклоалкила, гетероцикла, циклоалкилалкила, гетероциклоалкила, арила, гетероарила, алкилокси, арилокси или гетероарилокси, или где любая из Z2 и Z3, Z5 и Z6, Z7 и Z8, Z8 и Z9, Z9 и Z7, или Z7 и Z8 и Z9 взяты вместе с образованием от 3 до 20 членного алициклического или гетероциклического кольца; Q- является противоанионом; w является целым числом от 0 до 3; L является отщепляемой группой; и Ar представляет собой арил, гетероарил, и/или одна из Ar групп присоединена к полимерному носителю.
В некоторых вариантах, противоионом конденсирующего реагента CR является Cl-, Br-, BF4 -, PF6 -, TfO-, Tf2N-, AsF6 -, ClO4 -, или SbF6 -, где Tf является CF3SO2. В некоторых вариантах, отщепляемой группой конденсирующего реагента СR является F, Cl, Br, I, 3-нитро-1,2,4-триазол, имидазол, алкилтриазол, тетразол, пентафторобензол или 1-гидроксибензотриазол. Примеры конденсирующих агентов, которые могут быть использованы в данном способе, включают, но не ограничиваясь этим, пентафторобензоил хлорид, карбонилдиимидазол (CDI), 1-мезитиленсульфонил-3-нитротриазол (MSNT), 1-этил-3-(3'-диметиламинопропил)карбодиимид гидрохлорид (EDCI-HCl), бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторофосфат (РуВОР), N,N'-бис(2-оксо-3-оксазолидинил)фосфиновый хлорид (BopCl), 2-(1//-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторофосфат (HATU), и О-бензотриазол-N,N,N',N'-тетраметилуроний гексафторофосфат (HBTU), DIPCDI; N,N'-бис(2-оксо-3-оксазолидинил)фосфиновый бромид (ВорВг), 1,3-диметил-2-(3-нитро-1,2,4-триазол-1-ил)-2-пирролидин-1-ил-1,3,2-диазафосфолидиний гексафторофосфат (MNTP), 3-нитро-1,2,4-триазол-1-ил-трис(пирролидин-1-ил)фосфоний гексафторофосфат (PyNTP), бромотрипирролидинофосфоний гексафторофосфате (PyBrOP); О-(бензотриазол-1-ил)-N,N,N'N'-тетраметилуроний тетрафтороборат (TBTU); тетраметилфтороформамидиний гексафторофосфат (TFFH); (PhO)3PCl2, и бис(трихлорометил)карбонат (БТК). В некоторых вариантах, противоион конденсирующего реагента cr представляет собой Cl-, Br-, BF4 -, PF6 -, TfO-, Tf2N-, AsF6 -, ClO4 -, или SbFe6 -, где Tf является CF3SO2.
В других вариантах данного изобретения, конденсирующий реагент представляет собой 1-(2,4,6-триизопропилбензолсульфонил)-5-(пиридин-2-ил) тетразолид, пивалоил хлорид, бромотриспирролидинофосфоний гексафторофосфат, N,N'-бис(2-оксо-3-оксазолидинил) фосфиновый хлорид (BopCl), (PhO)3PCl2, или 2-хлоро-5,5-диметил-2-оксо-1,3,2-диоксафосфинан, бис(трихлорометил)карбонат (БТК), или Ph3PCl2. В одном варианте, конденсирующий реагент представляет собой N,N'-бис(2-оксо-3-оксазолидинил)фосфиновый хлорид (BopCl). В одном варианте, конденсирующим реагентом является бис(трихлорометил)карбонат (БТК). В одном варианте, конденсирующим реагентом является Ph3PCl2. Другие известные конденсирующие реагенты описаны в литературе (см., например, WO/2006/066260). В других вариантах, конденсирующим реагентом является 1,3-диметил-2-(3-нитро-1,2,4-триазол-1-ил)-2-пирролидин-1-ил-1,3,2-диазафосфолидиний гексафторофосфат (MNTP), 3-нитро-1,2,4-триазол-1-ил-трис(пирролидин-1-ил)фосфоний гексафторофосфате (PyNTP), бис(трихлорометил)карбонат (БТК), (PhO)3PCl2, или Ph3PCl2
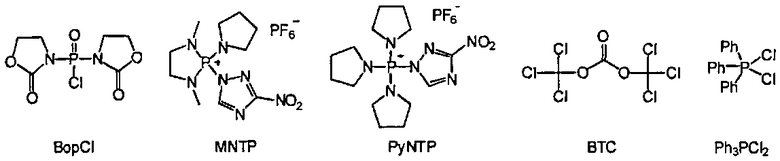
Активирующий реагент
Активирующий реагент, полезный в данном случае, должен обладать сильной способностью к передаче протонов, чтобы активировать хиральное промежуточное соединение для реакции с соединением, содержащим свободную нуклеофильную составляющую, В одном варианте, хиральное промежуточное соединение отвечает структуре III, показанной на Схеме 5 или 6, или структуре IIIr показанной на Схеме 7. Активирующий реагент действует путем протонирования атома азота структуры III или IIIr, где W1 является азотом. Использование активирующего реагента зависит от использованных для данного синтеза растворителей. Активирующий реагент (AR), полезный в способе данного изобретения, имеет одну из следующих общих формул:
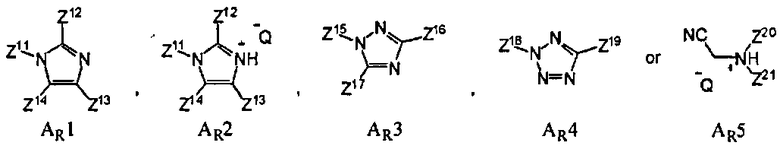
Z11, Z12, Z13, Z14, Z15, Z16, Z17, Z18, Z19, Z20, и Z21 представляют собой, независимо, водород, алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси или гетероарилокси, или где любая из Z11 и Z12, Z11 и Z13, Z11 и Z14, Z12 и Z13, Z12 и Z14, Z13 и Z14, Z15 и Z16, Z15 и Z17, Z16 и Z17, Z18 и Z19, или Z20 и Z21 взяты вместе с образованием 3-20-членного алициклического или гетероциклического кольца, или с образованием 5- или 20-членного ароматического кольца. Q- является противоионом. В некоторых вариантах данного способа, противоином активирующего реагента AR является Cl-, Br-, BF4 -, PF6 -, TfO-, Tf2N-, AsF6 -, ClO4 или SbF6 -, где Tf является CF3SO2.
В некоторых вариантах данного способа, активирующим реагентом является имидазол, 4,5-дицианоимидазол (DCI), 4,5-дихлороимидазол, 1-фенилимидазолий трифлат (PhIMT), бензимидазолий трифлат (BIT), бензтриазол, 3-нитро-1,2,4-триазол (NT), тетразол, 5-этилтиотетразол, 5-(4-нитрофенил)тетразол, N-цианометилпирролидиний трифлат (ЦМПТ), N-цианометилпиперидиний трифлат, N-цианометилдиметиламмоний трифлат. В некоторых вариантах данного способа, активирующим реагентом является 4,5-дицианоимидазол (DCI), 1-фенилимидазолий трифлат (PhIMT), бензимидазолий трифлат (BIT), 3-нитро-1,2,4-триазол (NT), тетразол или N-цианометилпирролидиний трифлат (ЦМПТ)
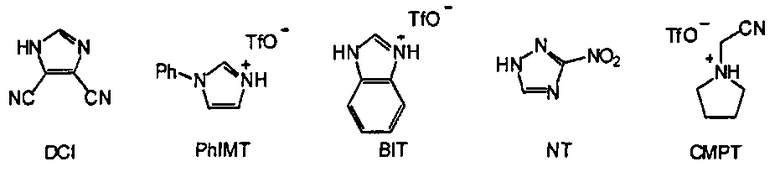
В некоторых вариантах данного способа, активирующим реагентом является N-цианометилпирролидиний трифлат (ЦМПТ).
Хиральный реагент
В способах настоящего изобретения, хиральные реагенты используются для предоставления стереоселективности в формировании Х-фосфонатных связей. В этом способе могут быть использованы многие хиральные вспомогательные соединения, которые являются соединениями Формулы 3-1, где W1 и W2 являются любыми из -O-, -S-, или -NG5-, которые способны реагировать с H-фосфонатным исходным материалом, соединением Формулы 2, с образованием хирального вспомогательного соединения, как показано на структуре III Схем 5 и 6

U1 и U3 являются атомами углерода, которые связаны с U2, если она присутствует, или друг с другом, если г равняется 0, посредством одинарной, двойной или тройной связи. U2 является -C-, -CG8-, -CG8G8-, -NG8-, -N-, -O-, или -S-, где r является целым числом от 0 до 5, и соседними являются не более двух гетероатомов. Когда любая из U2 является С, тройная связь должна образоваться между второй U2, которая является С, или с одной из U1 или U3. Подобно этому, когда любая из U2 является CG8, двойная связь образуется между второй U2, которая является -CG8- или -N-, или с одной из U1 или U3.
Например, в некоторых вариантах, -U1-(U2)r-U3- является -CG3G4-CG1G2-. В некоторых вариантах, -U1-(U2)r-U3- является -CG3=CG1-. В некоторых вариантах, -U1-(U2)r-U3- является -С≡C-. В некоторых вариантах, -U1-(U2)r-U3- является -CG3=C G8-CG1G2-. В некоторых вариантах, -U1-(U2)r-U3- является -CG3G4-O-CG1-G2-. В некоторых вариантах, -U1-(U2)r-U3- является -CG3G4-NG8-CG1G2-. В некоторых вариантах, -U1-(U2)r-U3- является -CG3G4-N-CG2-. В некоторых вариантах, -U1-(U2)r-U3- является -CG3G4-N=C G8-CG1G2-.
G1, G2, G3, G4, G5, и G8 представляют собой, независимо, водород, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетарил или арил, или две из G1, G2, G3, G4, и G5 являются G6, и, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее приблизительно до 20 кольцевых атомов, которое является моноциклическим или полициклическим, и является слитым или неслитым. В некоторых вариантах, образованное таким образом кольцо является замещенным оксо, тиоксо, алкильной, алкенильной, алкинильной, гетероарильной или арильной составляющими.
В некоторых вариантах, когда данное кольцо, образованное двумя взятыми вместе G6, является замещенным, оно замещено составляющей, которая является достаточно объемистой для придания стереоселективности в процессе реакции.
Например, в некоторых вариантах, кольцо, образованное двумя взятыми вместе G6, представляет собой циклопентил, пирролили, циклопропил, циклогексинил, циклопентенил, тетрагидропиранил или пиперазинил.
В некоторых вариантах данного изобретения, хиальным реагентом является соединение Формулы 3
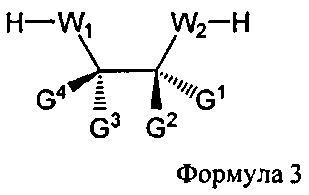
В некоторых вариантах Формулы 3, W1 и W2 являются, независимо, -NG5-, -O-, или -S-; G1, G2, G3, G4, и G5 представляют собой, независимо, водород, алкил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетарил или арил, или две из G1, G2, G3, G4, и G5 являются G6, и, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее приблизительно до 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или неслитым, и не более четырех из G1, G2, G3, G4, и G5 являются G6. Подобно соединениям Формулы 3', любая из G1, G2, G3, G4, или G5 является замещенной оксо, тиоксо, алкильной, алкенильной, алкинильной, гетероарильной или арильной составляющими. В некоторых вариантах, такое замещение индуцирует стереоселективность в образовании Х-фосфоната.
В некоторых варианатх данного изобретения, хиральный реагент имеет одну из следующих Формул:
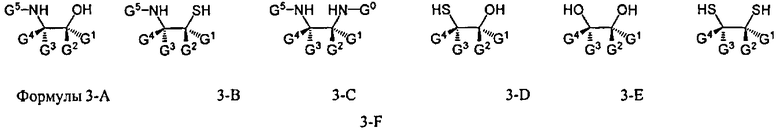
В некоторых вариантах, хиральным реагентом является аминоспирт.В некоторых других вариантах, хиральным реагентом является аминотиол. В еще других вариантах, хиральным реагентом является аминофенол. В некоторых вариантах, хиральным реагентом является (S)- и (R)-2-метиламино-1-фенилэтанол, (1R, 2S)-эфедрин, или (1R, 2S)-2-метиламино-1,2-дифенилэтанол. В других вариантах данного изобретения, хиральным реагентом является соединение одной из следующих формул:
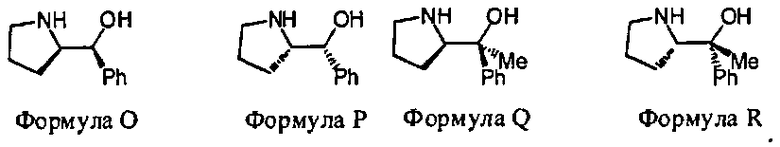
Выбор хирального реагента, например, изомера, представленного Формулой О, или его стереоизомера. Формула Р, позволяет осуществлять специфический контроль хиральности на атоме фосфора. Так, в каждом цикле синтеза может быть выбрана или Rp, или 5р конфигурация, позволяя осуществлять контроль всей трехмерной структуры нуклеиновокислотного продукта. В некоторых вариантах данного изобретения, нуклеиновокислотный продукт имеет все Rp стереоцентры. В некоторых вариантах данного изобретения, нуклеиновокислотный продукт имеет все Sp стереоцентры. В некоторых вариантах, выбор Rp и Sp центров делается для придания цепи нуклеиновой кислоты специфической трехмерной суперструктуры.
Нуклеооснования и модифицированные нуклеооснования
Нуклеооснование Ва в Формуле 1 является природным нуклеооснованием или модифицированным нуклеооснованием, полученным из природных нуклеооснований. Примеры включают, но не ограничиваясь этим, урацил, тимин, аденин, цитозин и гуанин, имеющие свои соответствующие аминогруппы, защищенные ацильными защитными группами, 2-фтороурацил, 2-фторцитозин, 5-бромоурацил, 5-йодоурацил, 2,6-диаминопурин, азацитозин, пиримидиновые аналоги, такие как псевдоизоцитозин и псевдоурацил, и другие модифицированные нуклеооснования, такие как 8-замещенные пурины, ксантин или гипоксантин (последние два являются природными продуктами деградации). Модифицированные нуклеооснования, раскрытые в работах Chiu and Rana, RNA, 2003, 9, 1034-1048, Limbach et al. Nucleic Acids Research, 1994,22,2183-2196 и Revankar and Rao, Comprehensive Natural Products Chemistry, vol. 7, 313, также предусмотрены как Ва составляющие Формулы 1.
Соединения, представленные следующими общими формулами, также предусмотрены как модифицированные нуклеооснования:
В вышеприведенных формулах, R8 представляет собой линейную или разветвленную алкильную, арильную, аралкильную или арилоксиалкильную группу, имеющую от 1 до 15 атомов углерода, включая, лишь в качестве примера, метильную, изопропильную, фенильную, бензильную или феноксиметильную группу; и каждая из R9 и R10 представляет линейную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода.
Модифицированные нуклеооснования также включают увеличенные в размерах нуклеооснования, к которым добавлены одно или несколько бензольных колец. Описанные в каталоге Glen Research catalog (www.glenresearch.com) нуклеоосновные замещения, Krueger AT et al. Асе. Chem. Res., 2007, 40, 141-150; Kool, ET, Асе. Chem. Res., 2002, 35,936-943; Benner S.A., et al., Nat. Rev. Genet., 2005, 6, 553-543; Romesberg, F.E., et al., Curr. Opin. Chem. Biol., 2003, 7, 723-733; Hirao, I., Curr. Opin. Chem. Biol., 2006, 10,622-627, предусмотрены как полезные для синтеза описанных в данном документе нуклеиновых кислот. Некоторые примеры этих увеличенных в размерах нуклеооснований приведены ниже
В данном документе модифицированные нуклеооснования также охватывают структуры, которые не считаются нуклеооснованиями, но являются другими составляющими, такими как, но не ограничиваясь этим, полученные из коррина или порфирина кольца. Замены полученных из порфирина оснований описаны в работе Morales-Rojas, H and Kool, ET, Org. Lett., 2002, 4,4377-4380.
Ниже приведен пример полученного из порфирина кольца, которое может быть использовано как замена основания
Другие модифицированные нуклеооснования также включают замены оснований, такие как показанные ниже
Предусмотрены также модифицированные нуклеооснования, которые являются флуоресцентными. Неограничивающие примеры этих основных замен включают фенантрен, пирен, стильбен, изоксантин, изозантоптерин, терфенил, тертиофен, бензотертиофен, кумарин, люмазин фиксированный стильбен, бензо-урацил и нафто-урацил, как показано ниже
Модифицированные основания могут быть незамещенными или содержать дополнительные замены, такие как гетероатомы, алкильные группы или связывающие составляющие, соединенные с флуоресцентными составляющими, биотиновую или авидиновую составляющие, или другой белок иди пептиды. Модифицированные нуклеооснования включают также некоторые универсальные основания, которые не являются нуклеооснованиями в наиболее классическом смысле, но действуют подобно нуклеооснованиям. Одним репрезентативным примером такого универсального основания служит 3-нитропиррол.
В дополнение к нуклеозидам структуры IV или IX, в раскрытом в данном документе способе могут также использоваться другие нуклеозиды, которые включают модифицированные нуклеооснования, или нуклеооснования, ковалентно связанные с модифицированными сахарами. Некоторые примеры нуклеозидов, которые содержат модифицированные нуклеооснования, включают 4-ацетилцитидин; 5-(карбоксигидроксиметил)уридин; 2'-O-метилцитидин; 5-карбоксиметиламинометил; 5-карбоксиметиламинометилуридин; дигидроуридин; 2'-O-метилпсевдоуридин; бета, D-галактосилкуозин; 2'-O-methylguanosine; N6-изопентениладенозин; 1-метиладенозин; 1-метилпсевдоуридин; 1-метилгуанозин; 1-метил инозин; 2,2-диметилгуанозин; 2-метиладенозин; 2-метилгуанозин; N7-метилгуанозин; 3-метил-цитидин; 5-метилцитидин; N6-метиладенозин; 7-метилгуанозин; 5-метиламиноэтилуридин; 5-метоксиаминометил-2-тиоуридин; бета,D-манносилкуозин; 5-метоксикарбонилметилуридин; 5-метоксиуридин; 2-метилтио-N6-изопентиладенозин; N-(9-бета,D-рибофуранозил-2-метилтиопурин-6-ил)карбамоил)треонин; N-((9-бета,D-рибофуранозилпурин-6-ил)-N-метилкарбамоил)треонин; уридин-5-оксиуксусная кислота метиловый эфир; уридин-5-оксиуксусная кислота (v); псевдоуридин; куозин; 2-тиоцитидин; 5-метил-2-тиоуридин; 2-тиоуридин; 4-тиоуридин; 5-метилуридин; 2'-O-метил-5-метилуридин; и 2'-O-метилуридин.
В некоторых вариантах, нуклеозиды включают 6'-модифицированные бициклические нуклеозидные аналоги, которые имеют либо (R) либо (5)-хиральность в 6'-положении и включают аналоги, описанные в патенте США No. 7399845, В других вариантах, нуклеозиды включают 5'-модифицированные бициклические нуклеозидные аналоги, которые имеют либо (R) либо (S)-хиральность в 5'-положении и включают аналоги, описанные в публикации американской патентной заявки No. 20070287831.
В некоторых вариантах, нуклеооснования или модифицированные нуклеооснования включают биомолекулярные связывающие составляющие, такие как антитела, фрагменты антител, биотин, авидин, стрептавидин, рецепторные лиганды, или хелатообразующие составляющие. В других вариантах, Ва является 5-бромоурацилом, 5-йодоурацилом или 2,6-диаминопурином. В еще других вариантах, Ва модифицируется путем замещения флуоресцентной или биомолекулярной связывающей составляющей. В некоторых вариантах, заместителем на Ва является флуоресцентная составляющая, В других вариантах, заместителем на Ва является биотин или авидин.
Модифицированные сахара нуклеотида/нуклеозида
Самыми распространенными природными нуклеотидами являются рибозные сахара, связанные с нуклеооснованиями аденозином (А), цитозином (С), гуанином (G) и тимином (Т) или урацилом (U). Также предусмотрены модифицированные нуклеотиды, где фосфатная группа или составляющие с модифицированным атомом фосфора в данных нуклеотидах могут быть связаны с различными положениями сахара или модифицированного сахара. Как неограничивающие примеры, фосфатная группа или составляющая с модифицированным атомом фосфора могут быть сцеплены с 2', 3', 4' или 5' гидроксильной составляющей сахара или модифицированного сахара. Нуклеотиды, которые включают модифицированные нуклеооснования, описанные выше, могут также быть использованы в раскрытом в этом документе способе. В некоторых вариантах, нуклеотиды или модифицированные нуклеотиды, содержащие незащищенную -ОН составляющую, используются в раскрытом в данном документе способе.
В дополнение к рибозной составляющей, описанной на Схемах 1-4b, в раскрытые в данном документе нуклеиновые кислоты могут быть введены другие модифицированные сахара. В некоторых вариантах, модифицированные сахара содержат один или несколько заместителей во 2' положении, включая один из следующих: F; CF3, CN, N3, NO, NO2, O-, S-, или N-алкил; О-, S-, или N-алкенил; O-, S- или N-алкинил; или О-алкил-O-алкил, О-алкил-N-алкил или N-алкил-O-алкил, где данные алкил, алкенил и алкинил могут быть замещенными или незамещенными C1-С10 алкилом или C2-C10 алкенилом и алкинилом. Примеры заместителей включают, но не ограничиваясь этим,, O(СН2)nOCH3, и O(CH2)nNH2, где n равняется от 1 до приблизительно 10, МОЕ, DMAOE, DMAEOE. В этом документе предусмотрены также модифицированные сахара, описанные в WO 2001/088198; и работе Martin et al., Helv. Chim. Acta, 1995, 78, 486-504. В некоторых вариантах, модифицированные сахара включают замещенные силильные группы, РНК отщепляемую группу, репортерную группу, флуоресцентную метку, интеркалятор, группу для улучшения фармакокинетических свойств нуклеиновой кислоты, или группу для улучшения фармакодинамических свойств нуклеиновой кислоты, и другие заместители, имеющие схожие свойства. Данные модификации могут быть сделаны в 2', 3', 4', 5', или 6' положениях данного сахара или модифицированного сахара, включая 3' положение данного сахара на 3'-концевом нуклеотиде или в 5' положении 5'-концевого нуклеотида.
Модифицированные сахара также включают сахарные миметики, такие как циклобутильная или циклопентильная составляющие, вместо пентофуранозильного сахара. Репрезентативные патенты США, в которых рассмотрено получение таких модифицированных сахарных структур, включают, но не ограничиваясь этим, патенты США: 4981957; 5118800; 5319080 и 5359044. Некоторые предусмотренные модифицированные сахара включают
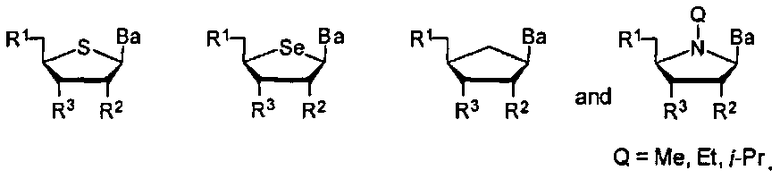
Другие неограничивающие примеры модифицированных сахаров включают глицерин, который образует глицерин-нуклеиновокислотные (GNA) аналоги. Один пример GNA аналога показан ниже и описан в работах Zhang, R et al„ J. Am. Chem. Soc., 2008, 130, 5846-5847; Zhang L, et at., J. Am. Chem. Soc., 2005,127,4174-4175 и Tsai CH et al., PNAS, 2007, 14598-14603
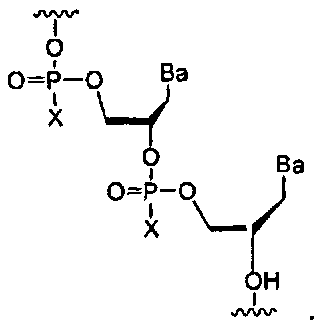
где X является таким, как описано выше. Другой пример полученного из GNA аналога, пластичной нуклеиновой кислоты (FNA) на основе смешанных ацеталь аминалей формил глицерина, описан в работах Joyce GF et al., PNAS, 1987, 84,4398-4402 и Heuberger BD and Switzer C, J. Am. Chem. Soc., 2008,130,412-413, и представлен ниже
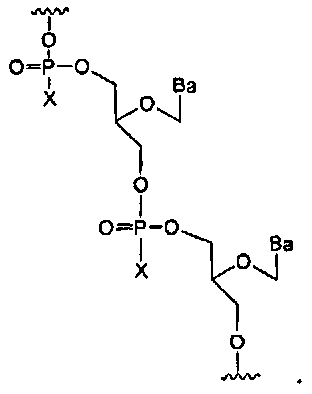
Блокирующие группы
В описанных реакциях, в некоторых вариантах необходимо защитить реакционные функциональные группы, например, гидрокси, амино, тиол или карбокси группы, где они требуются в конечном продукте, чтобы исключить их нежелательное участие в данных реакциях. Защитные группы используются для блокирования некоторых или всех реакционных составляющих и предотвращения их участия в химических реакциях до удаления данной защитной группы. В одном варианте, каждая защитная группа может удаляться с использованием разных средств. Защитные группы, которые расщепляются при полностью несопоставимых условиях реакции, удовлетворяют требованиям дифференциального удаления. В некоторых вариантах, защитные группы удаляются с помощью кислоты, основания и/или посредством гидрогенолиза. Группы, такие как тритил, диметокситритил, ацеталь и t-бутилдиметилсилил являются кислотно-лабильными и используются в некоторых вариантах для защиты карбокси и гидрокси реакционных составляющих в присутствии аминогрупп, защищенных Cbz группами, которые удаляются путем гидрогенолиза, и/или Fmoc группами, которые являются основно-лабильными. В других вариантах, карбоновокислотные и гидрокси реакционные составляющие блокируются основно-лабильными группами, такими как, метил, этил и ацетил, в присутствии аминов, блокированных кислотно-лабильными группами но не ограничиваясь этим, такими как t-бутилкарбамат, или карбаматы, которые являются как кислотно-, так и основно-устойчивыми, но могут удаляться гидролитически.
В другом варианте, гидрокси реакционные составляющие блокируются гидролитически удаляемыми защитными группами, такими как бензильная группа, тогда как аминогруппы, способные образовывать водородные связи с кислотами, блокируются основно-лабильными группами, такими как Fmoc. В другом варианте, карбоновокислотные реакционные составляющие защищены путем превращения в простые эфирные соединения, или они блокированы, в еще одном варианте, окислительно-удаляемыми защитными группами, такими как 2,4-диметоксибензил, тогда как сосуществующие аминогруппы блокированы фторид-лабильными силильной или карбаматной блокирующими группами.
Аллил-блокирующие группы полезны в присутствии кислотно- или основно-защитных групп, поскольку они устойчивы и могут быть впоследствии удалены с помощью металлических или пи-кислотных катализаторов. Например, аллил-блокированные гидроксигруппы могут быть депротектированы Pd(0)-катализируемой реакцией в присутствии кислотно-лабильной t-бутилкарбаматной или основно-лабильной аминоацетатной защитных групп. Еще одной формой защитной группы является смола, к которой присоединено соединение или промежуточное соединение. Пока данный остаток присоединен к смоле, эта функциональная группа заблокирована и не может реагировать. Когда он освобожден от смолы, данная функциональная группа готова к реакции.
Типичными блокирующими/защитными группами являются, лишь в качестве примера
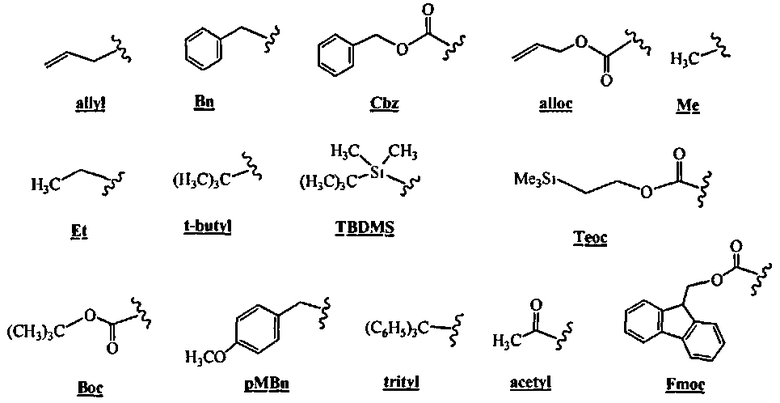
Репрезентативные защитные группы, полезные для защиты нуклеотидов в процессе синтеза, включают основно-лабильные группы и кислотно-лабильные защитные группы. Основно-лабильные защитные группы используются для защиты экзоциклических аминогрупп гетероциклических нуклеооснований. Этот тип защиты достигается, в общем, путем ацилирования. Тремя обычно используемыми ацилирующими группами для этой цели являются бензоил хлорид, феноксиуксусный ангидрид и изобутирил хлорид. Эти защитные группы устойчивы к условиям реакции, используемым при синтезе нуклеиновой кислоты, и они расщепляются с приблизительно одинаковыми скоростями при обработке основанием в конце синтеза. В некоторых вариантах, 5'-защитной группой является тритил, монометокси тритил, диметокситритил, триметокситритил, 2-хлоротритил, DATE, TBTr, 9-фенилксантин-9-ил (Pixyl), или 9-(п-метоксифенил)ксантин-9-ил (МОХ).
В некоторых вариантах, в соединения Формул 1, 2, 4, или 5 вводятся тиоловые составляющие и они осуществляют защиту. В некоторых вариантах, защитные группы включают, но не ограничиваясь этим, пиксил (Pixyl), тритил, бензил, п-метоксибензил (РМВ), или трет-бутил (t-Bu). Другие защитные группы плюс подробное описание способов, применимых к созданию защитных групп и их удалению, описаны в работах Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999 и Kocienski, Protective Groups, Thieme Verlag, New York, NY, 1994, которые инкорпорированы в данном документе путем отсылки к этим источникам. В некоторых вариантах, R1 является -ORa, где Ra является замещенным или незамещенным тритилом, или замещенным силилом. В других вариантах, R1 является -N3, -NRdRd, алкинилокси, или -ОН. В некоторых вариантах, R2 является -ORb, где Rb представляет собой замещенный или незамещенный тритил, замещенный силил, ацетил, ацил, или замещенный метиловый эфир. В других вариантах, R2 представляет собой NRdRd, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, где Y1 является О, NRd, S или Se, и замещена флуоресцентной или биомолекулярной связывающими составляющими. В еще других вариантах, заместителем на R2 является флуоресцентная составляющая. В некоторых вариантах, заместителем на R2 является биотин или авидин. В некоторых вариантах, R2 является -ОН, -N3, водородом, галогеном, алкокси или алкинилокси.
В других вариантах, R3 является блокирующей группой, которая представляет собой замещенный тритил, ацил, замещенный силил или замещенный бензил. В еще других вариантах, R3 является связывающей составляющей, соединенной с твердым носителем. В дополнительных вариантах, блокирующей группой Ва составляющей является бензил, ацил, формил, диалкилформамидинил, изобутирил, феноксиацетил или тритильная составляющая, каждая из которых может быть незамещенной или замещенной.
СПОСОБЫ ИСПОЛЬЗОВАНИЯ НУКЛЕИНОВЫХ КИСЛОТ, СОДЕРЖАЩИХ ХИРАЛЬНУЮ Х-ФОСФОНАТНУЮ СОСТАВЛЯЮЩУЮ
Стереоопределенные олигонуклеотиды, содержащие хиральную Х-фосфонатную составляющую, которые получены с использованием способов данного изобретения, полезны в ряде областей для применений, обусловленных сочетанием стабильности, определенной хиральности и легкости синтеза. В широком смысле, соединения, синтезированные с помощью этого способа, полезны как терапевтические агенты, диагностические зонды и реагенты, синтетические инструменты для получения других олигонуклеотидных продуктов и наноструктурных материалов, подходящих для создания разнообразных новых материалов и компьютерных приложений.
Стереоопределенные олигонуклеотиды данного изобретения имеют улучшенную сывороточную устойчивость, по сравнению с таковой у природных ДНК/РНК эквивалентов, и в частности, Стереоопределенные олиголнуклеотиды класса фосфоротиоатов.
Кроме того, Sp изомер более устойчив, чем Rp изомер. В некоторых вариантах, уровень сывороточной устойчивости модулируется введением либо всех Sp центров, либо Sp центров в выбранных положениях для придания резистентности к деградации. В других вариантах, введение выборочных Rp и/или Sp стереоцентров может предусматривать парную ассоциацию специфических оснований с эндогенной или экзогенной мишенью, защищая, таким образом, данную мишень от метаболизма или усиливая конкретную биологическую реакцию.
Активация рибонуклеазы Н также модулируется присутствием стереоконтролированных фосфоротиоатных нуклеиновокислотных аналогов, причем природная ДНК/РНК более чувствительна, чем Rp стереоизомер, который, в свою очередь, более чувствителен, чем соответствующий Sp изомер.
Улучшенная дуплексная стабильность в отношении РНК отмечается для Rp фосфоротиоатных олигонуклеотидов, которые имеют большую дуплексную стабильность, чем соответствующие Sp олигонуклеотиды, которые, в свою очередь, демонстрируют более высокую устойчивость, чем таковая у природных ДНК/РНК. Улучшенная дуплексная стабильность в отношении ДНК отмечается для Sp, которые имеют большую дуплексную стабильность, чем Rp, имеющие большую стабильность, чем таковая у природных ДНК/РНК. (Р. Guga, Curr. Top Med. Chem., 2007, 7, 695-713). Эти молекулы могут быть полезными как терапевтические агенты в ряде конкретных приложений. Они могут быть введены в олигонуклеотиды, которые также содержат стандартные ДНК/РНК нуклеозиды, или могут быть синтезированы как полные последовательности стереоконтролированных олигонуклеотидов данного изобретения. Некоторые категории терапевтических агентов включают, но не ограничиваясь этим, антисмысловые олигонуклеотиды, антигенные олигонуклеотиды, которые образуют тройную спираль с последовательностями-мишенями, подавляя транскрипцию нежелательных генов и модулируя экспрессию белков и/или активность, ложные олигонуклеотиды, ДНК вакцины, аптамеры, рибозимы, дезоксирибозимы (ДНКзимы или ДНК энзимы), си(si)РНК, микроРНК, нкРНК (некодирующие РНК), и Р-модифицированные промедикаменты. Модуляция включает, косвенно или прямо, увеличение или снижение активности белка, или ингибирование или промотирование экспрессии белка. Эти нуклеиновокислотные соединения могут использоваться для контроля пролиферации клеток, репликации вирусов или любых других клеточных сигнальных процессов. В одном примере, область сиРНК терапевтических агентов нуждается в олигонуклеотидных видах, которые могут дать повышенную устойчивость против рибонуклеазной активности, с целью увеличения продолжительности действия, по сравнению с таковой, наблюдаемой для сиРНК, состоящей из природных нуклеозидов. Кроме того, образование спирали А-формы представляется более показательным в плане успешного вхождения PHKi, чем присутствие специфических природных элементов на данном олигонуклеотиде. Оба эти требования могут быть удовлетворены путем использования стероконтролируемых олигонуклеотидов данного изобретения, и это может обеспечить повышенную устойчивость (Y-L Chiu, T.M, Rana RNA, 2003, 9,1034-1048).
Описанные в данной заявке нуклеиновые кислоты полезны как терапевтические агенты против различных болезненных состояний, включая их использование как антивирусных агентов. Нуклеиновые кислоты могут быть использованы как агенты для лечения заболеваний путем модуляции ДНК и/или РНК активности. В некоторых вариантах, данные нуклеиновые кислоты могут использоваться для ингибирования экспрессии специфических генов. Например, нуклеиновые кислоты могут быть комплементарными по отношению к специфической матричной РНК (мРНК) последовательности-мишени. Они могут быть использованы для ингибирования репликации вирусов, таких как ортопоксвирус, вирус коровьей оспы, герпес, папиллома, инфлюэнца, цитомегаловирус и другие вирусы. Другие примеры включают использование как антисмысловых соединений против ВИЧ РНК или другой ретровирусной РНК, или для гибридизации с ВИЧ мРНК, кодирующего белок-мишень, или с TAR участком ВИЧ мРНК. В некоторых вариантах, данные нуклеиновые кислоты имитируют вторичную структуру TAR участка ВИЧ мРНК, и таким образом связывают белок-мишень. В одном варианте, данные нуклеиновые кислоты используются для ингибирования экспрессии белка-мишени путем контактирования клетки с соединением Формулы 1, где экспрессия других белков в данной клетке не ингибируется или ингибируется минимально. В некоторых вариантах, ингибирование белка-мишени происходит in vivo в млекопитающем. В других вариантах, терапевтически эффективное количество соединения Формулы 1 используется для ингибирования экспрессии белка-мишени.
Другие примеры белков, где экспрессия может быть модулирована, включают Jun N-концевые киназные (JNK) белки, диацилглицерин ацилтрансферазу I, аполипоппротеид В, глюкагоновый рецептор, Аврора (Aurora) В, ацил СоА холестерин ацилтрансферазу-2, с-реактивный белок, STAT (трансдукторы сигнала и активаторы транскрипции) семейство белков, и MDR Р-гликопротеид. Данные нуклеиновые кислоты могут использоваться для ингибирования экспрессии протеин фосфатазы 1В (РТР1В), РНК-зависимой РНК вирусной полимеразы. Данные нуклеиновые кислоты могут использоваться для индуцирования событий, таких как апоптоз в раковых клетках, или для того, чтобы сделать клетку более чувствительной к апоптозу. Нуклеиновые кислоты могут быть использованы для модуляции активностей белков. Например, они могут способствовать модуляции активности рибонуклеазы Н по полирезистентности (MDR) РНК молекул.
Описанные в данном документе нуклеиновые кислоты полезны для лечения признаков, включая, но не ограничиваясь этим, гиперхолистеринемии, тяжелого острого респираторного синдрома (ТОРС), ретровирусных заболеваний, таких как СПИД или ВИЧ, других вирусных инфекций, внутриматочных инфекций и рака.
При использовании в качестве терапевтического агента описанная в данном документе нуклеиновая кислота используется как фармацевтическая композиция. В некоторых вариантах, фармацевтическая композиция включает терапевтически эффективное количество нуклеиновой кислоты, содержащей хиральную Х-фосфонатную составляющую Формулы 1, или ее фармацевтически приемлемой соли, и, по меньшей мере, один фармацевтически приемлемый инактивный ингредиент, который выбирается из фармацевтически приемлемых разбавителей, фармацевтически приемлемых наполнителей и фармацевтически приемлемых носителей. В другом варианте, данная фармацевтическая композиция составляется для внутривенной инъекции, перорального использования, буккального использования, ингаляции, назального использования, местного применения, глазного или ушного использования. В дополнительных вариантах, данная фармацевтическая композиция является таблеткой, пилюлей, капсулой, жидкостью, средством для ингаляции, назальным спреем, суппозиторием, суспензией, гелем, коллоидным веществом, дисперсией, раствором, эмульсией, мазью, лосьоном, глазными или ушными каплями. Второй категорией, где соединения, синтезированные с помощью способов данного изобретения, полезны, является их применение в качестве праймеров или зондов. Поскольку данный способ предполагает полный контроль последовательности, природной или неприродной, и стереохимии в фосфорном центре, специфическим образом может быть получена любая конкретная молекула.
Кроме того, дополнительная рибонуклеазная резистентность дает молекулы, которые устойчивы при ex-vivo или in-vivo условиях. Стереоопределенные олигонуклеотиды настоящего изобретения могут быть использованы как зонды для исследования механизмов ферментативных реакций, включающих атомы фосфора, таких как ферментация, сшивание и полимеризация нуклеиновых кислот. Этот класс молекул может быть использован как зонды для исследования рибозимных и дезоксирибозимных реакционных механизмов. Они могут также действовать как зонды для исследования PHKi и других некодирующих РНК опосредованных подавляющих гены механизмов или как зонды для анализа взаимодействий белок-нуклеиновая кислота. Способность определять трехмерную структуру путем введения выбранных Rp или Sp фосфорных стереоцентров открывает возможность конструирования новых классов, так называемых молекулярных маяков.
Поскольку данный способ синтеза не ограничен узким набором природных нуклеооснований, модифицированные нуклеооснования или другие модификации данного основания или сахара, или концов позволяют использовать этот класс олигонуклеотидов в качестве зондов или сенсоров для нуклеиновых кислот, белков и любых биологических или химических веществ в растворе. Они могут также использоваться подобным образом, без модифицированных нуклеооснований, с использованием стандартных методов обнаружения, вместо природных ДНК/РНК. Любой из них может быть введен как часть диагностической пробы.
Такие диагностические тесты могут быть проведены с использованием биологических жидкостей, тканей, интактных клеток или выделенных клеточных компонентов. Как и в случае с ингибированием экспрессии генов, в диагностических приложениях используется способность нуклеиновых кислот гибридизироваться с комплементарной цепочкой нуклеиновой кислоты.
Гибридизация представляет собой специфическое относительно данной последовательности образование водородных связей между олигомерными соединениями посредством пар оснований Уотсона-Крика и/или Хугштина с РНК или ДНК. Основания таких пар оснований считаются комплементарными одно к другому. Нуклеиновые кислоты могут быть использованы для анализа телесных состояний, например, болезненных состояний у жиыотных. Они могут быть использованы для идентификации аденовирусов или вирусов инфлюэнцы в пробе или как интеркаляционные агенты или зонды. Например, они могут использоваться для обнаружения ДНК метилирования или зондирования ДНК взаимодействий с другими клеточными компонентами, такими как белки.
В другом аспекте данного изобретения, представлен способ идентификации или обнаружения молекулы-мишени в образце, способ, включающий: контактирование образца, который, как предполагается, содержит молекулу-мишень, с нуклеиновокислотной сенсорной молекулой Формулы 1, синтезированной согласно способов настоящего изобретения, где изменение сигнала, генерируемого блоком генерации сигнала, указывает на присутствие указанной мишени в указанном образце. Нуклеиновокислотная сенсорная молекула связывается специфическим образом с молекулой-мишенью. В некоторых вариантах имеется множество нуклеиновокислотных сенсорных молекул. В некоторых вариантах, множество нуклеиновокислотных сенсорных молекул включает нуклеиновокислотные сенсорные молекулы, которые специфическим образом связываются с отличающимися молекулами-мишенями. В других примерах, данный способ дополнительно включает количественное определение величины изменения сигнала, генерированного генерирующим сигнал блоком, для количественного определения содержания молекул-мишеней в данном образце. Генерирующий сигнал блок обнаруживает любой вид сигнала, включая, но не ограничиваясь этим, флуоресценцию, поверхностно-плазмонный резонанс, тушение флуоресценции, хемилюминесценцию, интерферометрию или определение показателя преломления.
Анализируемый образец представляет собой образец из окружающей среды, биологически опасный материал, органический образец, лекарство, токсин, ароматизатор, отдушку или биологический образец. Биологическим образцом является клетка, клеточный экстракт, клеточный лизат, ткань, тканевой экстракт, телесная жидкость, сыворотка, кровь или кровяной продукт. В некоторых вариантах данного способа, присутствие молекулы-мишени указывает на присутствие патологического состояния. В некоторых вариантах данного способа, присутствие молекулы-мишени указывает на присутствие желательной молекулы.
В схожем использовании, стереоопределенные олигонуклеотиды, полученные с использованием способов данного изобретения, полезны как праймеры для ПЦР или как матрицы или праймеры для ДНК/РНК синтеза с использованием полимераз. Температуры плавления могут быть оптимизированы для конкретного приложения, в зависимости от селективного введения Rp или Sp хиральности фосфора в олигонуклеотидный продукт.
В другом аспекте данного изобретения, представлен способ амплификации необходимых участков нуклеиновой кислоты из нуклеиновокислотной матрицы, который включает: (а) введение множества первых ПЦР праймеров, имеющих участок фиксированной нуклеотидной последовательности, комплементарный требуемой консенсусной последовательности; (b) введение множества вторых ПЦР праймеров, (с) амплификацию нуклеиновокислотной матрицы посредством ПЦР (полимеразной цепной реакции) с использованием множества первых ПЦР праймеров и множества вторых ПЦР праймеров при условиях, где подмножество множества первых праймеров связывается с требуемой консенсусной последовательностью при условиях, где подмножество данного множества первых праймеров связывается с требуемой консенсусной последовательностью в значительной степени там, где это имеет место в матрице, и подмножество данного множества вторых праймеров связывается с матрицей в местоположениях, удаленных от первых праймеров, так что нуклеиновокислотные участки, фланкированные первым праймером и вторым праймером, конкретно амплифицируются, и где множество первых ПЦР праймеров и/или множество вторых ПЦР являются молекулами нуклеиновой кислоты Формулы 1, которые получают согласно способов настоящего изобретения.
В некоторых вариантах, данная матрица является геномной ДНК. В некоторых вариантах, данная матрица является эукариотной геномной ДНК. В некоторых вариантах, данная матрица является геномной ДНК человека. В некоторых вариантах, данная матрица является прокариотной ДНК. В некоторых вариантах, данная матрица представляет собой ДНК, которая является клонированной геномной ДНК, субгеномным участком ДНК, хромосомным или субхромосомным участком. В некоторых вариантах, матрица представляет собой РНК.
Стереоопределенные олигонуклеотиды также полезны, благодаря их повышенной устойчивости и способности сохранять распознавание и связывание со своими биологическими мишенями, как вещества для ДНК чипов и олигонуклеотидных микроматриц. Они могут также использоваться как стабилизированные олигонуклеотиды, как альтернатива природным нуклеиновым кислотам, таким как тРНК и мРНК в бесклеточном синтезе белков.
Дополнительная область, где способность контролировать устойчивость, молекулярный состав, включая неприродные составляющие, и структуру, все в пределах одного и того же синтеза, является полезной для приложений в области конструирования ДНК наноматериалов.
Стереоопределенные олигонуклеотиды данного изобретения могут быть использованы как вещества для конструирования нуклеиновокислотных наноструктур, состоящих из дуплексных, триплексных, квадруплексных и других структур более высокого порядка. Способность внедрять другие органические составляющие в молекулы, полученные этими способами, ведет к приложениям в области наноматериалов путем конструирования специфических, неприродных структур более высокого порядка. Устойчивость in viva и эластичность такой конструкции позволят использовать эти молекулы в ДНК компьютерах, например. Кроме того, металлические хелатообразующие или проводящие органические молекулы могут быть введены в Стереоопределенные олигонуклеотиды данного изобретения, что даст возможность использовать их как ДНК нанопроводники в электронных приборах или ДНК/РНК нано-машины (F.A. Aldate, A.L. Palmer, Science, 2008, 321, 1795-1799).
ПРИМЕРЫ
Общая информация
Все ЯМР-спектры были записаны на приборе Varian Mercury 300. 1Н ЯМР-спектры были получены при 300 МГц с использованием тетраметилсилана (TMS) (δ 0.0) как внутреннего эталона в CDCl3. 31Р ЯМР-спектры были получены при 121,5 МГц с использованием 85% H3PO4 (δ 0.0) как внешнего эталона. MALDI TOF-MC записывались на приборе Applied Biosystems Voyager System 4327. Силикагелевая колоночная хроматографмия проводилась с использованием Kanto силикагеля 60N (сферический, нейтральный, 63-210 мкм). Аналитическая тонкослойная хроматография проводилась на пластинках Merck Kieselgel 60-F254. Безводные органические растворители готовили с применением соответствующих процедур перед использованием. Другие органические растворители имели степень чистоты выше технической и использовались в полученном виде. ACQUITY UPLC® (ультражидкостная хроматография) проводилась с использованием ВЕН C18 (1,7 мкм, 2,1×150 мм). Выход dTT, dCT, dAT, dGT, rUrU, и гири фосфоротиоатных димеров определялся путем измерений УФ поглощательной способности на волне 260 нм с использованием приблизительных значений коэффициентов молярной экстинкции для природных dTT (16800), dCT (15200), dAT (22800), dGT (20000), rUU (19600), rUU (19600) димеров, соответственно.
Сокращения:
bz:бензоил
Реактив Бокажа (Beaucage): 3H-1,2-бензодитиол-3-он 1,1-диоксид
БСА: N,O-бис(триметилсилил)ацетамид
ВТК: бис(трихлорометил)карбонат
се: цианоэтил
CF3COIm: N-трифтороацетилимидазол
ЦМП: N-цианометил пирролидин
ЦМПТ: N-цианометил пирролидиний трифторометансульфонат
СКП: стекло с контролируемой пористостью
ДБУ; 1,8-диазабицикло[5.4,0]ундец-7-ен
ДХК: дихлороуксусная кислота
ДХМ: дихлорометан, CH2Cl2
ДМАц: N,N-диметилацетамид
ДМАН: 1,8-бис(диметиламино)нафталин
ДМТр: 4,4′-диметокситритил
ДТД: N,N′-диметилтиурам дисульфид
ВКП: высокоструктурированный полистирол
рас: феноксиацетил
ТБС: t-бутилдиметилсилил
ТБДФС: t-бутилдифенилсилил
ТФК: трифтороуксусная кислота
L-2: то же, что и Формула Р в данной заявке
D-2: то же, что и Формула О в данной заявке
L-6: то же, что и Формула R в данной заявке
D-6: то же, что и Формула Q в данной заявке
Пример 1: Синтез в растворе фосфоротиоатного димера, (Sp)-1,8-диазабицикло[5.4.0]ундец-7-ений
N3-бензоил-5′-O-(трет-бутилдифенилсилил)тимидин-3′-ил N3-бензоил-3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил фосфоротиоата [(Sp)-4tt] с использованием Пути А 8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(трет-бутилдифенилсилил)тимидин-3′-ил фосфонат (1t) (96,0 мг, 120 мкмоль) обезвоживали путем повторных совместных выпариваний с безводным пиридином и потом растворяли в безводном пиридине (2 мл). Добавляли БТК (29,7 мг 100 мкмоль), и данную смесь перемешивали в течение 10 минут. К данной реакционной смеси по каплям добавляли с помощью шприца аминоспиртовый L-2 (21,3 мг, 120 мкмоль) раствор, который был приготовлен путем повторных совместных выпариваний с безводным пиридином и растворения в безводном пиридине (1 мл), и данную смесь перемешивали в течение 5 минут под атмосферой аргона. К раствору N3-бензоил-3′-O-(трет-бутилдиметилсилил)тимидина (3t), который был приготовлен путем повторных совместных выпариваний с безводным пиридином и растворения в пиридине (500 мкмоль), с помощью шприца добавляли данную реакционную смесь. Через 30 минут к реакционной смеси добавляли ДТД (42,5 мг, 120 мкмоль). Еще через 5 минут данный растворитель выпаривали под сниженным давлением. К остатку добавляли концентрированный NH3-EtOH (40 мл; 3:1, объем/объем), и данную смесь перемешивали в течение 12 ч при комнатной температуре. Данную смесь концентрировали до сухого состояния под сниженным давлением. Неочищенную смесь разбавляли CHCl3 (15 мл) и промывали 0,2 М кислым углекислым триэтиламмонием (20 мл).
Водный слой подвергали обратному экстрагированию CHCl3 (4×15 мл). Объединенные органические слои осушивали над Na2SO4, фильтровали и концентрировали до сухого состояния под сниженным давлением. Остаток очищали методом препаративной тонкослойной хроматографии. Данный продукт растворяли в CHCl3 (5 мл), промывали 0,2 М 1,8-диазабицикло[5.4.0]ундец-7-ений кислым углекислым буфером (10 мл) и подвергали обратному экстрагированию CHCl3 (3×5 мл). Объединенные органические слои осушивали над Na2SO4, фильтровали и концентрировали до сухого состояния с получением (Sp)-4tt (41,8 мг, 98% выход, Rp:Sp=9:91) в виде белой пены. 1Н и 31Р ЯМР спектры (Фигура 1 и 2, соответственно) были идентичны спектрам контрольного образца, синтезированного с помощью обычного H-фосфонатного метода. 31Р ЯМР (121,5 МГц, CDCl3) δ 57.4 (Rp изомер: 57.9). Синтетическая схема показана на Схеме 10
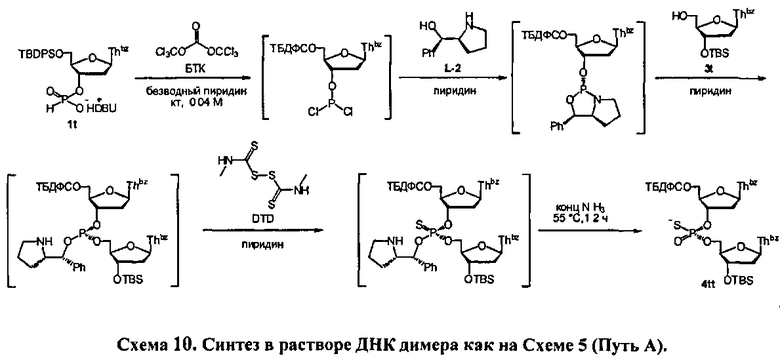
Пример 2: Синтез в растворе фосфоротиоатного димера, (Sp)-1,8-диазабицикло[5.4.0]ундец-7-ений 6-N-бензоил-5′-O-(трет-бутилдифенилсилил)-дезоксиаденозин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил фосфоротиоата [(Sp)-4at] с использованием Пути А. (Sp)-4at получен из 1,8-диазабицикло[5.4.0]ундец-7-ений 6-N-бензоил-5′-O-(трет-бутилдифенилсилил)-дезоксиаденозин-3′-ил фосфоната (1а) вместо 1t, с использованием реакционных стадий, описанных выше для (Sp)-4tt.
Пример 3: Синтез в растворе фосфоротиоатного димера, (Sp)-1,8-диазабицикло[5.4.0]ундец-7-ений 4-N-бензоил-5′-O-(трет-бутилдифенилсилил)-дезксицитидин-3′-ил-3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил фосфоротиоата [(Sp)-4ct] с использованием Пути А. (Sp)-4ct получен из 1,8-диазабицикло[5.4.0]ундец-7-ений 4-N-бензоил-5′-O-(трет-бутилдифенилсилил)-дезоксицитидин-3′-ил фосфоната (1с) вместо 1t, с использованием реакционных стадий, описанных выше для (Sp)-4tt.
Пример 4: Синтез в растворе фосфоротиоатного димера, (Sp)-1,8-диазабицикло[5.4.0]ундец-7-ений 2-N-феноксиацетил-5′-O-(трет-бутилдиметил)-дезоксигуазин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил фосфоротиоата [(Sp)-4gt] с использованием Пути А. (Sp)-4gt получен из 1,8-диазабицикло[5.4.0]ундец-7-ений 2-N-феноксиацетил-5′-O-(трет-бутилдифенилсилил)-дезоксигуанозин-3′-ил фосфоната (1g) вместо 1t, с использованием реакционных стадий, описанных выше для (Sp)-4tt.
Пример 5: Синтез в растворе фосфоротиоатного димера, (Rp)-1,8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(трет-бутилдифенилсилил)тимидин-3′-ил N3-бензоил-3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил фосфоротиоата [(Rp)-4tt] с использованием Пути А. (Rp)-4tt был получен в виде белой пены (93% выход, Rp:Sp=95:5) с использованием аминоспирта D-2 вместо L-2 методом, сходным с использованным для (Sp)-4tt в Примере 1. 1Н и 31P ЯМР-спектры показаны на Фигурах 3 и 4, соответственно. 31Р ЯМР (121,5 МГц, CDCl3) δ 57.6 (Sp изомер: 57.3.
Пример 6: Синтез в растворе фосфоротиоатного димера, (Rp)-1,8-диазабицикло[5.4.0]ундец-7-ений 6-N-бензоил-5′-O-(трет-бутилдифенилсилил)дезоксиаденозин-3-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил фосфоротиоата [(Rp)-4at] с использованием Пути А. (Rp)-4at получен путем превращений, описанных выше в Примере 2, с использованием соединения 1а и аминоспирта D-2 как хирального реагента, вместо L-2.
Пример 7: Синтез в растворе фосфоротиоатного димера, (Rp)-1,8-диазабицикло[5.4.0]ундец-7-ений 4-N-бензоил-5′-O-(трет-бутилдифенилсилил)дезоксицитидин-3′-ил-3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил фосфоротиоата [(Rp)-4ct] с использованием Пути А. (Rp)-4ct получен путем превращений, описанных выше в Примере 3, с использованием соединения 1c и аминоспирта D-2 как хирального реагента, вместо L-2.
Пример 8: Синтез в растворе фосфоротиоатного димера, (Rp)-1,8-диазабицикло[5.4.0]ундец-7-ений 2-N-феноксиацетил-5′-O-(трет-бутилдифенилсилил)дезоксигуанозин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил фосфоротиоата [(Rp)-4gt] с использованием Пути А. (Rp)-4gt получен путем превращений, описанных выше в Примере 4, с использованием соединения lg и аминоспирта D-2 как хирального реагента, вместо L-2.
Пример 9: Депротектирование с получением (Sp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5tt].
(Sp)-4tt (50 мкмоль) обезвоживали путем повторных совместных выпариваний с безводным пиридином и безводным толуолом и затем растворяли в триэтиламин тригидрофториде (500 мкл). Данную смесь перемешивали в течение 15 ч при комнатной температуре. Затем к смеси добавляли 0,1 М аммоний ацетатный буфер (2,5 мл), и смесь промывали Et2O (3×3 мл). Объединенные органические слои подвергали обратной экстракции 0,1 М аммоний ацетатным буфером (3 мл). Затем объединенные водные слои концентрировали досуха под сниженным давлением, и остаток очищали методом колоночной хроматографии с обращенной фазой [линейный градиент ацетонитрила 0-10% в 0,1 М аммоний ацетатном буфере (рН 7,0)] с получением (Sp)-5tt. Схема депротектирования представлена на Схеме 11.
Схема 11. Депротектирование
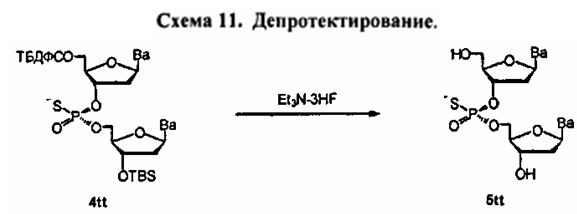
Пример 10: Депротектирование с получением (Sp)-аммоний дезоксиаденозин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5at].
(Sp)-5at получен, как описано выше в Примере 9, с использованием (Sp)-4at вместо (Sp)-4tt.
Пример 11: Депротектирование с получением (Sp)-аммоний дезоксицитидин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5ct].
(Sp)-5ct получен, как описано выше в Примере 9, с использованием (Sp)-4ct вместо (Sp)-4tt.
Пример 12: Депротектирование с получением (Sp)-аммоний дезоксигуанозин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5gt].
(Sp)-5gt получен, как описано выше в Примере 9, с использованием (Sp)-4gt вместо (Sp)-4tt.
Пример 13: Депротектирование с получением (Rp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5tt].
(Rp)-5tt получен, как описано выше в Примере 9, с использованием (Rp)-4tt вместо (Sp)-4tt, подобным образом, что и (Sp)-5tt.
Пример 14: Депротектирование с получением (Rp)-аммоний дезоксиаденозин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5at].
(Rp)-5at получен, как описано выше в Примере 9, с использованием (Rp)-4at вместо (Sp)-4п.
Пример 15: Депротектирование с получением (Rp)-аммоний дезоксицитидин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5ct].
(Rp)-5ct получен, как описано выше в Примере 9, с использованием (Rp)-4ct вместо (Sp)-4tt.
Пример 16; Депротектирование с получением (Rp)-аммоний дезоксигуанозин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5gt].
(Rp)-5gt получен, как описано выше в Примере 9, с использованием (Rp)-4gt вместо (Sp)-4tt, подобным образом, что и (Sp)-5tt.
Пример 17: Синтез (Rp)-5′-O-(трет-бутилдифенилсилил)тимидин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил H-фосфоната [(Rp)-7tt] с использованием Пути В.
Соединение It (100 мкмоль) обезвоживается путем повторных совместных выпариваний с безводным пиридином и затем растворяется в безводном пиридине (1 мл). К данной смеси добавляют N,N′-бис(2-оксо-3-оксазолидинил)фосфиновый хлорид (BopCl; 500 мкмоль), и смесь перемешивается в течение 5 минут. К данной смеси, по каплям, с помощью шприца добавляют раствор аминоспирта ((αR, 2S)-6) (100 мкмоль), который был обезвожен путем совместных выпариваний с безводным пиридином и растворен в безводном пиридине (1 мл), и данную смесь перемешивают в течение 5 минут под атмосферой аргона. 3′-O-(трет-бутилдиметилсилил)тимидин обезвоживается путем повторных совместных выпариваний с безводным пиридином и растворяется в 100 мкмоль пиридина. Вышеуказанную смесь добавляют через канюлю к раствору 3′-O-(трет-бутилдиметилсилил)тимидина 3t в безводном (100 мкмоль) пиридине. Через 15 минут данную смесь концентрируют под сниженным давлением. Остаток разбавляют CH2Cl2 (5 мл) и промывают насыщенным NaHCO3 (3×5 мл). Объединенные водные слои подвергают обратной экстракции CH2Cl2 (2×5 мл). Объединенные органические слои осушают над Na2SO4, фильтруют и концентрируют до приблизительно 1 мл под сниженным давлением. Данный остаток добавляется по каплям через шприц к перемешиваемому 1% раствору трифтороуксусной кислоты (ТФК) в безводном CH2Cl2 (20 мл) при 0°С. Еще через 5 минут данную смесь разбавляют безводным CH2Cl2 (100 мл) и промывают насыщенными NaHCO3 водными растворами (2×100 мл). Объединенные водные слои подвергают обратной экстракции CH2Cl2 (2×100 мл). Объединенные органические слои осушают над Na2SO4, фильтруют и концентрируют до сухого состояния под сниженным давлением с получением неочищенного (Rp)-7tt. Схема синтеза представлена на Схеме 12
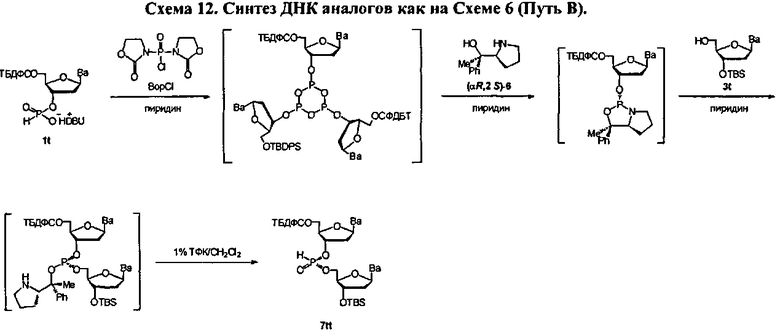
Пример 18: Синтез (Rp)-6-N-бензоил-5′-(5-(трет-бутилдифенилсилил)дезоксиаденозин-3′-ил N-O-(трет-бутилдиметилсилил)тимидин-5′-ил H-фосфоната [(Rp)-7at] с использованием Пути В. Неочищенный (Rp)-7at получен, как описано в Примере 17, с использованием 1а вместо It.
Пример 19: Синтез (Rp)-4-N-бензоил-5′-O-(трет-бутилдифенилсилил)дезоксицитидин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил H-фосфоната [(Rp)-7ct] с использованием Пути В. Неочищенный (Rp)-7ct получен, как описано в Примере 17, с использованием 1c вместо 1t.
Пример 20: Синтез (Rp)-2-N-феноксиацетил-5′-O-(трет-бутилдифенилсилил)дезоксигуанозин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил H-фосфоната [(Rp)-7gt] с использованием Пути В. Неочищенный (Rp)-7gt получен, как описано в Примере 17, с использованием 1g вместо 1t.
Пример 21: Синтез (Sp)-5′-O-(трет-бутилдифенилсилил)тимидин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил H-фосфоната [(Sp)-7tt] с использованием Пути В. Неочищенный (Sp)-7tt получен, как описано в Примере 17, с использованием (αS, 2R)-6 вместо (αR, 2S)-6 как хирального реагента.
Пример 22: Синтез (Sp)-6-N-ензоил-5′-O-(трет-бутилдифенилсилил)дезоксиаденозин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил H-фосфоната [(Sp)-7at] с использованием Пути В. Неочищенный (Sp)-7at получен, как описано в Примере 17, с использованием соединения 1а и (αS, 2R)-6 вместо (αS, 2R)-6 как хирального реагента.
Пример 23: Синтез (Sp)-4-N-бензоил-5′-O-(трет-бутилдифенилсилил)дезоксицитидин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил H-фосфоната [(Sp)-7ct] с использованием Пути В. Неочищенный (Sp)-7ct получен, как описано в Примере 17, с использованием соединения 1с и (αS, 2R)-6 вместо (αR, 2S)-6 как хирального реагента.
Пример 24: Синтез (Sp)-2-N-феноксиацетил-5′[-O-(трет-бутилдифенилсилил)дезоксигуанозин-3′-ил 3′-O-(трет-бутилдиметилсилил)тимидин-5′-ил H-фосфоната [(Sp)-7gt] с использованием Пути В. Неочищенный (Sp)-7gt получен, как описано в Примере 17, с использованием соединения 1g вместо 1t и соединения (αS,2R)-6 вместо соединения (αR, 2S)-6, как хирального реагента.
Пример 25: Модификация с получением (Rp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5tt], как показано на общей Схеме 13.
(Sp)-7tt обезвоживается путем повторных совместных выпариваний с безводным пиридином и безводным толуолом, и затем растворяется в CH3CN (1 мл). Добавляют N,O-бис(триметилсилил)ацетамид (БСА; 100 мкл). Через 1 минуту добавляют N,N′-диметилтиурам дисульфид (ДТД; 120 мкмоль). Еще через 3 минуты данную смесь концентрируют досуха под сниженным давлением с получением неочищенного (Rp)-4tt. Затем неочищенный (Rp)-4tt растворяют в триэтиламин тригидрофториде (1 мл). Данную смесь перемешивают в течение 15 ч при комнатной температуре. Потом к данной смеси добавляют 0,1 М аммоний ацетатный буфер (5 мл, и смесь промывается Et2O (3×5 мл). Объединенные орагнические слои подвергают обратной экстракции 0,1 М аммоний ацетатным буфером (5 мл). Объединенные водные слои затем концентрируют досуха под сниженным давлением, и остаток очищают методом колоночной хроматографии с обращенной фазой [линейный градиент ацетонитрила 0-10% в 0,1 М аммоний ацетатном буфере (рН 7,0)] с получением (Rp)-5tt. Стадии модификации показаны на Схеме 13
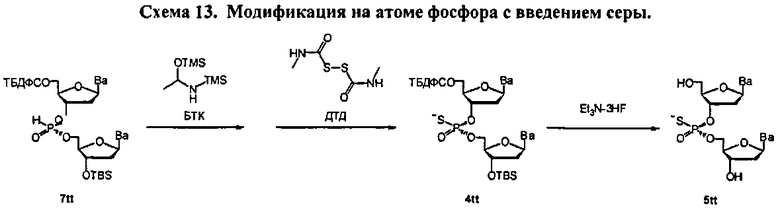
Пример 26: Модификация с получением (Rp)-аммоний дезоксиаденозин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5at].
(Rp)-5at получен, как описано в Примере 25, с использованием (Sp)-7at вместо (Sp)-7tt.
Пример 27: Модификация с получением (Rp)-аммоний дезоксицитидин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5ct].
(Rp)-5ct получен, как описано в Примере 25, с использованием (Sp)-7ct вместо (Sp)-7tt.
Пример 28: Модификация с получением (Rp)-аммоний дезоксигуанозин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5gt].
(Rp)-5gt получен, как описано в Примере 25, с использованием (Sp)-7gt вместо (Sp)-7tt.
Пример 29: Модификация с получением (Sp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5tt].
(Sp)-5tt получен, как описано в Примере 25, с использованием (Rp)-7tt вместо (Sp)-7tt.
Пример 30: Модификация с получением (Sp)-аммоний дезоксиаденозин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5at].
(Sp)-5at получен, как описано в Примере 25, с использованием (Sp)-7at вместо (Sp)-7tt.
Пример 31: Модификация с получением (Sp)-аммоний дезоксицитидин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5ct].
(Sp)-5ct получен, как описано в Примере 25, с использованием (Rp)-7ct вместо (Sp)-7tt.
Пример 32: Модификация с получением (Sp)-аммоний дезоксигуанозин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5gt].
(Sp)-5gt получен, как описано в Примере 25, с использованием (Rp)-7gt вместо (Sp)-7tt.
Пример 33: Синтез РНК аналогового димера, (Sp)-1,8-диазабицикло[5.4.0]ундец-7-ений 5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)уридин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил фосфоротиоата [(Sp)-10uu] с использованием Пути А. 1,8-диазабицикло[5.4.0]ундец-7-ений 5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)уридин-3′-ил фосфонат (8u) (100 мкмоль) обезвоживается путем повторных совместных выпариваний с безводным пиридином и затем растворяется в безводном пиридине (1 мл). Добавляют N,N′-бис(2-оксо-3-оксазолидинил)фосфиновый хлорид (BopCl; 500 мкмоль), и данную смесь перемешивают в течение 5 минут. К данной смеси, по каплям, с помощью шприца добавляют раствор аминоспирта (L-2) (100 мкмоль), который был обезвожен путем повторных совместных выпариваний с безводным пиридином и растворен в безводном пиридине (1 мл), и данную смесь перемешивают в течение 5 минут под атмосферой аргона. 2′,3′-O-бис(трет-бутилдиметилсилил)уридин 9u обезвоживают путем повторных совместных выпариваний с безводным пиридином и растворяют в 100 мкмоль пиридина. Затем вышеуказанную смесь добавляют через канюлю в раствор 2′,3′-O-бис(трет-бутилдиметилсилил)уридина 9u (100 мкмоль).
Через 10 минут добавляют N-трифтороацетил имидазол (CP3COIm; 200 мкмоль). Еще через 30 с добавляют N,N′-диметилтиурам дисульфид (ДТД; 120 мкмоль). Еще через 3 минуты данную смесь высушивают в вакууме. К этому остатку добавляют конц. NH3-EtOH (3:1, объем/объем, 10 мл), и смесь перемешивают в течение 12 ч, и затем концентрируют досуха под сниженным давлением. Затем данную смесь разбавляют СНС13 (5 мл) и промывают 0,2 М фосфатным буфером (рН 7,0, 5 мл). Водные слои подвергают обратной экстракции CHCl3 (2×5 мл). Объединенные органические слои осушают над Na2SO4, фильтруют и концентрируют досуха под сниженным давлением. Остаток очищают методом перпаративной тонкослойной хроматографии. Данный продукт растворяют в CHCl3 (5 мл), промывают 0,2 М 1,8-диазабицикло[5.4.0]ундец-7-ений бикарбонатным буфером (5 мл) и подвергают обратной экстракции CHCl3 (2×5 мл). Объединенные органические слои осушают над Na2SO4, фильтруют и концентрируют до сухого состояния с получением (Sp)-10uu. Схема синтеза представлена на Схеме 14
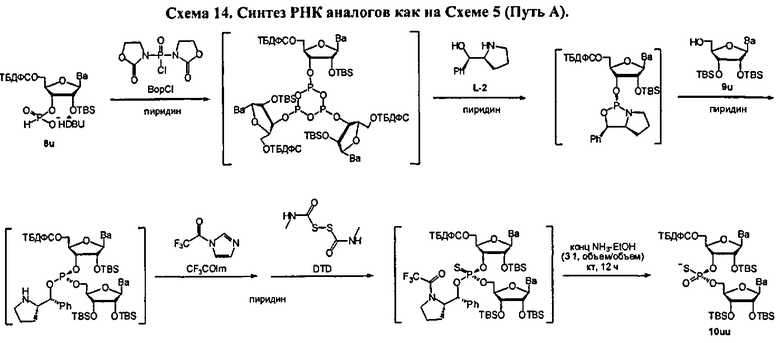
Пример 34: Синтез РНК аналогового димера, (Sp)-1,8-диазабицикло[5.4.0]ундец-7-ений 6-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)аденозин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил фосфоротиоата [(Sp)-10au] с использованием Пути А. (Sp)-10au получен, как описано в Примере 33, с использованием 1,8-диазабицикло[5.4.0]ундец-7-ений 6-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)аденозин-3′-ил фосфоната (8а) вместо 8u.
Пример 35: Синтез РНК аналогового димера, (Sp)-1,8-диазабицикло[5.4.0]ундец-7-ений 4-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)цитидин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил фосфоротиоата [(Sp)-10cu] с использованием Пути А. (Sp)-10cu получен, как описано в Примере 33, с использованием 1,8-диазабицикло[5.4.0]ундец-7-ений 4-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)цитидин-3′-ил фосфоната (8c) вместо 8u.
Пример 36: Синтез РНК аналогового димера, (Sp)-1,8-диазабицикло[5.4.0]ундец-7-ений 2-N-феноксиацетил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)гуанозин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил фосфоротиоата [(Sp)-10gu] с использованием Пути А. (Sp)-10gu получен, как описано в Примере 33, с использованием 1,8-диазабицикло[5.4.0]ундец-7-ений 2-N-феноксиацетил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)гуанозин-3′-ил фосфоната (8g) вместо 8u.
Пример 37: Синтез РНК аналогового димера, (Rp)-1,8-диазабицикло[5.4.0]ундец-7-ений 5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)уридин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил фосфоротиоата [(Rp)-10uu] с использованием Пути А. (Rp)-10uu получен, как описано в Примере 33, с использованием хирального реагента D-2 вместо хирального реагента L-2.
Пример 38: Синтез РНК аналогового димера, (Rp)-1,8-диазабицикло[5.4.0]ундец-7-ений 6-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)аденозин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил фосфоротиоата [(Rp)-10au] с использованием Пути А.
(Rp)-10au получен, как описано в Примере 33, с использованием 8а, вместо 8u и хирального реагента D-2, вместо хирального реагента L-2.
Пример 39: Синтез РНК аналогового димера, (Rp)-1,8-диазабицикло[5.4.0]ундец-7-ений 4-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)цитидин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил фосфоротиоата [(Rp)-10cu] с использованием Пути А. (Rp)-10cu получен, как описано в Примере 33, с использованием 8c вместо 8u и хирального реагента D-2 вместо хирального рагента L-2.
Пример 40: Синтез РНК аналогового димера, (Rp)-1,8-диазабицикло[5.4.0]ундец-7-ений 2-N-феноксиацетил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)гуанозин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил фосфоротиоата [(Rp)-10gu] с использованием Пути А. (Rp)-10gu получен, как описано в Примере 33, с использованием 8g вместо 8u и хирального реагента D-2 вместо хирального реагента L-2.
Пример 41: Депротектирование с получением (Sp)-триэтиламмоний уридин-3′-ил уридин-5′-ил фосфоротиоата [(Sp)-11uu].
(Sp)-10uu (50 мкмоль) обезвоживали путем повторных совместных выпариваний с безводным пиридином и безводным толуолом и затем растворяли в 1М растворе тетрабутиламмоний фторида (TBAF) в безводном ТГФ (500 мкл). Данную смесь перемешивали в течение 12 ч при комнатной температуре. К данной смеси добавляли 0.05М триэтиламмоний ацетатный буферный раствор (рН 6,9, 2,5 мл), данную смесь промывали Et2O (3×3 мл). Объединенные органические слои подвергали обратной экстракции 0,05М триэтиламмоний ацетатным буфером (3 мл). Объединенные водные слои затем концентрировали досуха под сниженным давлением, и остаток очищали методом колоночной хроматографии с обращенной фазой [линейный градиент ацетонитрила 0-10% в 0,1М триэтиламмоний ацетатном буфере (рН 6,9)] с получением (Sp)-11uu. Схема депротектирования представлена на Схеме 15

Пример 42: Депротектирование с получением (Sp)-триэтиламмоний аденозин-3′-ил уридин-5′-ил фосфоротиоата [(Sp)-11au].
(Sp)-11au получен, как описано в Примере 41, с использованием (Sp)-10au вместо (Sp)-10uu.
Пример 43: Депротектирование с получением (Sp)-триэтиламмоний цитидин-3′-ил уридин-5′-ил фосфоротиоата [(Sp)-11cu].
(Sp)-11cu получен, как описано в Примере 41, с использованием (Sp)-10cu вместо (Sp)-10uu.
Пример 44: Депротектирование с получением (Sp)-триэтиламмоний гуанозин-3′-ил уридин-5′-ил фосфоротиоата [(Sp)-11gu].
(Sp)-11gu получен, как описано в Примере 41, с использованием (Sp)-10gu вместо (Sp)-10uu.
Пример 45: Депротектирование с получением (Rp)-триэтиламмоний уридин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-11uu].
(Rp)-11uu получен, как описано в Примере 41, с использованием (Rp)-10uu вместо (Sp)-10uu.
Пример 46: Депротектирование с получением (Rp)-триэтиламмоний аденозин 3′-ил уридин-5′-ил фосфоротиоата [(Rp)-11au].
(Rp)-11au получен, как опичано в Примере 41, с использованием (Rp)-10au вместо (Sp)-10uu.
Пример 47: Депротектирование с получением (Rp)-триэтиламмоний цитидин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-11cu].
(Rp)-11cu получен, как описано в Примере 41, с использованием (Rp)-10cu вместо (Sp)-10uu.
Пример 48: Депротектирование с получением (Rp)-триэтиламмоний гуанозин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-11gu].
(Rp)-11gu получен, как описано в Примере 41, с использованием (Rp)-10gu вместо (Sp)-10uu.
Пример 49: Синтез РНК аналогового димера, (Rp)-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)уридин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил H-фосфоната [(Rp)-12uu] с использованием Пути В.
8u (100 мкмоль) обезвоживают путем повторных совместных выпариваний с безводным пиридином и затем растворяют в безводном пиридине (1 мл). Добавляют N,N′-бис(2-оксо-3-оксазолидинил)фосфиновый хлорид (BopCl; 500 мкмоль), и данную смесь перемешивают в течение 5 минут. К данной смеси, по каплям, с помощью шприца добавляют раствор аминоспирта ((αR, 2S)-6) (100 мкмоль), который обезвоживается путем совместных выпариваний с безводным пиридином и растворяется в безводном пиридине (1 мл), и данную смесь перемешивают в течение 5 минут под атмосферой аргона. Затем данную смесь добавляют через канюлю в раствор 9u (100 мкмоль), который готовят путем повторных совместных выпариваний с безводным пиридином и растворяют в пиридине. Через 15 минут данную смесь концентрируют под сниженным давлением. Осадок растворяют в CH2Cl2 (5 мл) и промывают насыщенным NaHCO3 (3×5 мл). Объединенные водные слои подвергают обратной экстракции CH2Cl2 (2×5 мл). Объединенные органические слои осущивают над Na2SO4, фильтруют и концентрируют до приблизительно 1 мл под сниженным давлением. Данный остаток добавляют по каплям через шприц к перемешиваемому 1% раствору трифтороуксусной кислоты (ТФК) в безводном CH2Cl2 (20 мл) при 0°С. Еще через 5 минут данную смесь разбавляют безводным CH2Cl2 (100 мкл) и промывают насыщенными водными растворами NaHCO3 (2×100 мл). Объединенные водные слои подвергают обратной экстракции CH2Cl2 (2×100 мл). Объединенные органические слои осушают над Na2SO4, фильтруют и концентрируют досуха под сниженным давлением с получением неочищенного (Rp)-12uu, который анализируют методом 31Р ЯМР. Схема синтеза представлена на Схеме 16
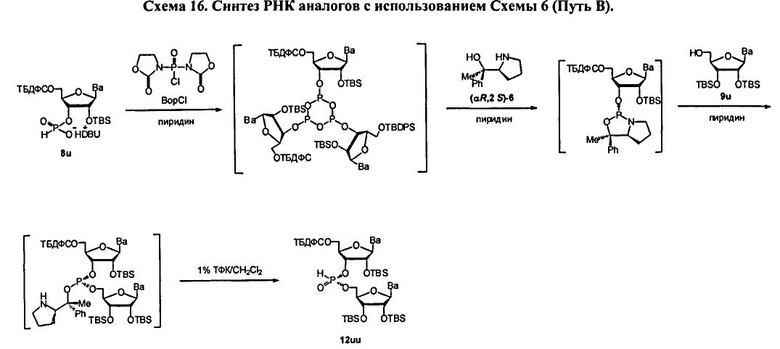
Пример 50: Синтез РНК аналогового димера, (Rp)-6-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)аденозин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил H-фосфоната [(Rp)-12au] с использованием Пути В.
Неочищенный (Rp)-12au получен, как описано в Примере 49, с использованием 8a вместо 8u.
Пример 51: Синтез РНК аналогового димера, (Rp)-4-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)цитидин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил H-фосфоната [(Rp)-12cu] с использованием Пути В.
Неочищенный (Rp)-12cu получен, как описано в Примере 49, с использованием 8c вместо 8u.
Пример 52: Синтез РНК аналогового димера, (Rp)-2-N-феноксиацетил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)гуанозин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил H-фосфоната [(Rp)-12gu] с использованием Пути В.
Неочищенный (Rp)-12gu получен, как описано в Примере 49, с использованием 8g вместо 8u.
Пример 53: Синтез РНК аналогового димера, (Sp)-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)уридин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил H-фосфоната [(Sp)-12uu] с использованием Пути В.
Неочищенный (Sp)-12uu получен, как описано в Примере 49, с использованием хирального реагента (αS, 2R)-6 вместо хирального реагента (αR, 2S)-6.
Пример 54: Синтез РНК аналогового димера, (Sp)-6-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)аденозин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил H-фосфоната [(Sp)-12au] с использованием Пути В.
Неочищенный (Sp)-12au получен, как описано в Примере 49, с использованием 8а вместо 8u и хирального реагента (αS, 2R)-6 вместо хирального реагента (αR, 2S)-6.
Пример 55: Синтез РНК аналогового димера, (Sp)-4-N-бензоил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)цитидин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил Н-фосфоната [(Sp)-12cu] с использованием Пути В.
Неочищенный (Sp)-12cu получен, как описано в Примере 49, с использованием 8c вместо 8u и хирального реагента (αS, 2R)-6 вместо хирального реагента (αR, 2S)-6.
Пример 56: Синтез РНК аналогового димера, (Sp)-2-N-феноксиацетил-5′-O-(трет-бутилдифенилсилил)-2′-O-(трет-бутилдиметилсилил)гуанозин-3′-ил 2′,3′-O-бис(трет-бутилдиметилсилил)уридин-5′-ил H-фосфоната [(Sp)-12gu] с использованием Пути В.
Неочищенный (Sp)-12gu получен, как описано в Примере 49, с использованием 8g вместо 8u и хирального реагента (αS, 2R)-6 вместо хирального реагента (αR, 2S)-6.
Пример 57: Модификация с получением (Rp)-триэтиламмоний уридин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-11uu].
(Sp)-12uu обезвоживается путем повторных совместных выпариваний с безводным пиридином и безводным толуолом и затем растворяется в СН3СН (1 мл). Добавляют N,O-бис(триметилсилил)ацетамид (БСА; 100 мкл). Через 1 минуту добавляется N,N′-диметилтиурам дисульфид (ДТД; 120 мкмоль). Еще через 3 минуты данную смесь концентрируют досуха под сниженным давлением с получением неочищенного (Rp)-10uu. Затем неочищенный (Rp)-10uu растворяют в 1М растворе тетрабутиламмоний фторида (TBAF) в безводном ТГФ (1 мл). Данную смесь перемешивают в течение 12 ч при комнатной температуре. К смеси добавляют 0,05 М триэтиламмониевый ацетатный буферный раствор (рН 6,9, 5 мл), и смесь промывают Et2O (3×5 мл). Объединенные органические слои подвергают обратной экстракции 0,05 М триэтиламмониевым ацетатным буфером (5 мл). Объединенные водные слои затем концентрируют до сухого состояния под сниженным давлением, и остаток очищают методом колоночной хроматографии с обращенной фазой [линейный градиент ацетонитрила 0-10% в 0,1М триэтиламмониевом ацетатном буфере (рН 6,9)] с получением (Rp)-11uu. Схема модификации представлена на Схеме 17
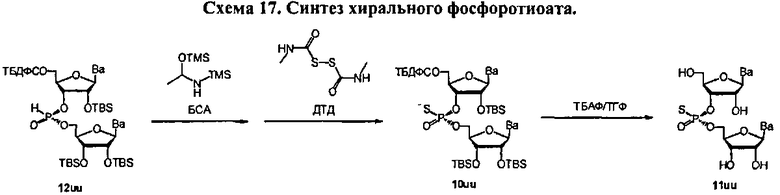
Пример 58: Модификация с получением (Rp)-триэтиламмоний аденозин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-11au].
(Rp)-11au получен, как описано в Примере 57, с использованием (Sp)-12au вместо (Sp)-12uu.
Пример 59: Модификация с получением (Rp)-триэтиламмоний цитидин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-11cu],
(Rp)-11cu получен, как описано в Примере 57, с использованием (Rp)-12cu вместо (Rp)-12uu.
Пример 60: Модификация с получением (Rp)-триэтиламмоний гуанозин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-11gu].
(Rp)-11gu получен, как описано в Примере 57, с использованием (Sp)-12gu вместо (Sp)-12uu.
Пример 61: Модификация с получением (Rp)-триэтиламмоний уридин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-11uu].
(Sp)-11uu получен, как описано в Примере 57, с использованием (Rp)-12uu вместо (Sp)-12uu.
Пример 62: Модификация с получением (Sp)-триэтиламмоний аденозин-3′-ил уридин-5′-ил фосфоротиоата [(Sp)-11au].
(Sp)-11au получен, как описано в Примере 57, с использованием (Rp)-12au вместо (Sp)-12uu.
Пример 63: Модификация с получением (Sp)-триэтиламмоний цитидин-3′-ил уридин-5′-ил фосфоротиоата [(Sp)-11cu].
(Sp)-11cu получен, как описано в Примере 57, с использованием (Rp)-12cu вместо (Sp)-12uu.
Пример 64: Модификация с получением (Sp)-триэтиламмоний гуанозин-3′-ил уридин-5′-ил фосфоротиоата [(Sp)-11gu].
(Sp)-11gu получен, как описано в Примере 57, с использованием (Rp)-12gu вместо (Sp)-12uu, способом, сходным с таковым для (Rp)-11uu.
Пример 65: Твердофазный синтез ДНК аналогов, имеющих Х-фосфонатные составляющие, с использованием Схемы 5 (Путь А).
Насыщенная 5′-O-(ДМТр)тимидином ВКП (высокоструктурированный полистирол) или СКП смола (0,5 мкмоль) с использованием сукцинилового линкера применена для данного синтеза. Элонгация цепи осуществлялась путем повторения стадий, представленных в Таблице 1. После удлинения цепи группу 5′-O-ДМТр удаляли посредством обработки 3% ДХК в CH2Cl2 (3×5 с) и проводили промывку CH2Cl2. Затем олигомер на ВКП или СКП смоле обрабатывали 25% NH3 -пиридин (9:1, объем/объем) в течение 15 ч при 55°С для удаления хиральных вспомогательных соединений и защитных групп нуклеооснований, и также для освобождения данного олигомера от ВКП или СКП смолы. ВКП или СКП смолу удаляли путем фильтрации и промывали Н2О. Фильтрат концентрировали досуха. Остаток растворяли в Н2О, промывали Et2O, и объединенные промывки подвергали обратной экстракции H2O. Объединенные водные слои концентрировали досуха. Результирующий неочищенный продукт анализировали и/или очищали методом высокоэффективной жидкостной хроматографии с обращенной фазой с линейным градиентом 0-20% ацетонитрила в 0,1М аммоний ацетатном буфере (рН 7,0) в течение 60 минут при 50°С при скорости 0,5 мл/мин с получением стереорегулярных Х-фосфонатных ДНК.

* получение предварительно-активированного мономера на Стадии 3 Таблицы 1: 1,8-диазабицикло[5.4.0]ундец-7-ений 5′-O-(ДМТр)-2′-дезоксирибонуклеозид-3′-ил фосфонат обезвоживается путем повторных совместных выпариваний с безводным пиридином и затем растворяется в безводном пиридине. К данному раствору добавляют BopCl, и данную смесь перемешивают в течение 5 минут. К данной смеси, по каплям, с помощью шприца добавляют раствор аминоспирта (L-2 или D-2), который обезвоживается путем повторных совместных выпариваний с безводным пиридином и растворения в безводном пиридине, и данную смесь перемешивают в течение 5 минут под атмосферой аргона.
Bce-(Rp)-[Tps]9T (фосфоротиоат)
Согласно описанной выше процедуры, 5′-O-(ДМТр)тимидин 3′-O-сукцинат, связанный с НСР (0,5 мкмоль), дает все-(Rp)-[Tps]9Т[1,52 A260 единиц, 17,7 нмоль (35%), исходя из предположения 7% гипохромности: УФ (H2O) αmax 267 нм, αmin 236 нм] после очистки одной десятой неочищенного продукта методом высокоэффективной жидкостной хроматографии с обращенной фазой. <4% очищенного олигомера сбраживается путем инкубации с нуклеазой Р1 в течение 1 ч при 37°С.
Пример 66: Твердофазный синтез ДНК аналогов, имеющих Х-фосфонатные составляющие, с использованием Схемы 6 (Путь В).
Насыщенная 5′-O-(ДМТр)тимидином СКП смола с использованием сукцинилового или оксалилового линкера обрабатывается 1% ТФК в CH2Cl3 (3×5 с) для удаления 5′-O-ДМТр группы, промывается CH2Cl2 и безводным пиридином, и высушивается в вакууме. Элонгация цепи осуществляется путем повторения следующих стадий (а) и (b). (а) Реакция сопряжения с использованием раствора, содержащего соответствующий предварительно активированный мономер* (0,2М) в безводном пиридине (10 минут) под аргоном. После конденсации твердый носитель промывают безводным пиридином и CH2Cl2. (b) Удаление 5′-O-ДМТр группы и хирального вспомогательного соединения одновременно, путем обработки 1% ТФК в CH2Cl2-Et3SiH (1:1, объем/объем) (3×5 с), и последующих промывок CH2Cl2 и безводным пиридином. Результирующие олигонуклеозидные H-фосфонаты на смоле превращают в Х-фосфонатные ДНК, как описано ниже.
* получение предварительно активированного мономера: 1.8-диазабицикло[5.4.0]ундец-7-ений 5′-O-(ДМТр)-2′-дезоксирибонуклеозид-3′-ил фосфонат обезвоживается путем повторных совместных выпариваний с безводным пиридином и затем растворяется в безводном пиридине. К данному раствору добавляют BopCl, и смесь перемешивают в течение 5 минут. К данной смеси, по каплям, с помощью шприца, добавляют раствор аминоспирта (L-6 или D-6), который обезвоживается путем повторных совместных выпариваний с безводным пиридином и растворения в безводном пиридине, и смесь перемешивают в течение 5 минут под атмосферой аргона.
Фосфоротиоат (X=S-)
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через сукциниловый линкер, полученный как выше, обрабатывается 10 вес.% S8 в CS2-пиридин-триэтиламине (35:35:1, объем/объем/объем) при комнатной температуре в течение 3 ч и последовательно промывается CS2, пиридином и CH3CN. Данную смолу обрабатывают 25% водным раствором NH3 при комнатной температуре в течение 12 ч и промывают Н2О. Водные растворы объединяют и концентрируют досуха под сниженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулированных фосфоротиоатных ДНК.
Боранофосфат(Х=
Безводный ДМФ, N,О-бис(триметилсилил)ацетамид (БСА) и ВН3·SMe2 добавляют к олигонуклеозидному H-фосфонату, загруженному на СКП смолу через оксалиловый линкер, полученный как выше, при комнатной температуре. Через 15 минут данную смолу последовательно промывают ДМФ, CH3CN и СН3ОН. Затем смолу обрабатывают насыщенным раствором NH3 в СН3ОН при комнатной температуре в течение 12 ч и промывают СН3ОН. СН3ОН растворы объединяют и концентрируют досуха под сниженным давлением, и смолу очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулированных боранофосфатных ДНК.
Гидроксиметилфосфонат (Х=СН2ОН)
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через оксалиловый линкер, полученный как выше, обрабатывается 0,1 М триметилсилилхлоридом (TMSCl) в пиридин-1-метил-2-пирролидоне (NMP) (1:9, объем/объем) при комнатной температуре в течение 10 минут и газообразным формальдегидом при комнатной температуре в течение 30 минут, и затем промывается NMP и CH3CN. Затем смолу обрабатывают 25% водным раствором NH3 при комнатной температуре в течение 12 ч и промывают H2O. Объединенные водные слои концентрируют до сухого состояния под сниженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулированных гидроксиметилфосфонатных ДНК.
Фосфорамидат (X=NH2)
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через оксалиловый линкер, полученный как выше, обрабатывается насыщенным раствором NH3 CCl4-1,4-диоксана (4:1, объем/объем) при 0°С в течение 30 минут и промывается 1,4-диоксаном. Объединенные органические растворы концентрируют досуха под сниженным давлением, обрабатывают 25% водным раствором NH3 при комнатной температуре в течение 12 ч и промывают H2O. Объединенные водные растворы концентрируют досуха при сниженном давлении, и остаток очищается методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулированных фосфорамидатных ДНК.
N-пропилфосфорамидат (X=NHPr)
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через оксалиловый линкер, полученный как выше, обрабатывают смесью CCl4-пропиламин (9:1, объем/объем) при комнатной температуре в течение 1 ч и промывают СН3ОН. Объединенные органические растворы концентрируют до сухого состояния под сниженным давлением, обрабатывают 25% водным раствором NH3 при комнатной температуре в течение 12 ч и промывают Н2О. Объединенные водные растворы концентрируют до сухого состояния под сниженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулированных N-пропилфосфорамидатных ДНК.
N-[(2-диметиламино)этил]фосфорамидат [X=NH(CH2)2NMe2]
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через оксалиловый линкер, полученный как выше, обрабатывают смесью CCl4-2-диметиламиноэтиламин (9:1, объем/объем) при комнатной температуре в течение 1 ч и промывают CH3CN. Объединенные органические растворы концентрируют досуха под сниженным давлением, обрабатывают 25% водным раствором NH3 при комнатной температуре в течение 12 ч и промывают H2O. Объединенные водные растворы концентрируют досуха под сниженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулированных N-[(2-диметиламино)этил]фосфорамидатныхДНК.
Пример 67: Синтез всех-(Sp)-d[CSASGST] (фосфоротиоат)
Соответствующий олигонуклеозидный H-фосфонат синтезировался на СКП смоле через сукциниловый линкер, как описано выше, и обрабатывался 0,2 М раствором реагента Бокажа (Beaucage) в смеси БСА-CH3CN (1:8, объем/объем) при комнатной температуре в течение 30 минут, и данную смолу промывали CH3CN. Затем смолу обрабатывали 25% водным раствором NH3 при комнатной температуре в течение 12 ч и промывали H2O. Объединенные водные слои концентрировали досуха под сниженным давлением, и остаток анализировался и характеризовался методами высокоэффективной жидкостной хроматографии с обращенной фазой и MALDI-TOF-MC. Высокоэффективная жидкостная хроматография с обращенной фазой выполнялась с линейным градиентом 0-20% ацетонитрила в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 60 минут при 50°С и скорости потока 0,5 мл/мин с использованием колонки типа µBondasphere 5 мкм С18 (100 Å, 3.9 мм × 150 мм) (фирмы Уотерс (Waters)).
Пример 68: Синтез всех-(Rp)-d[CSASGST] (фосфоротиоат)
Соответствующий олигонуклеозидный H-фосфонат синтезировался на СКП смоле через сукциниловый линкер, как описано выше, и обрабатывался 0,2 М раствором реагента Бокажа (Beaucage) в смеси БСА-CH3CN (1:8, объем/объем) (0,2 мл) при комнатной температуре в течение 30 минут, и данную смолу промывали CH3CN. Смолу обрабатывали 25% водным раствором NH3 (5 мл) при комнатной температуре в течение 12 ч и промывали H2O. Объединенные водные слои концентрировали досуха под сниженным давлением, и остаток анализировался и характеризовался методами высокоэффективной жидкостной хроматографии с обращенной фазой и MALDI-TOF-MC. Высокоэффективная жидкостная хроматография с обращенной фазой выполнялась с линейным градиентом 0-20% ацетонитрила в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 60 минут при 50°С и скорости потока 0,5 мл/мин с использованием колонки типа µBondasphere 5 мкм С18 (100 Å, 3,9 мм × 150 мм) (фирмы Уотерс (Waters)).
Пример 69: Синтез всех-(Sp)-[Ts]9T (фосфоротиоат)
Соответствующий олигонуклеозидный H-фосфонат синтезировался на СКП смоле через сукциниловый линкер, как описано выше, и обрабатывался 0,2 М раствором реагента Бокажа (Beaucage) в смеси БСА-CH3CN (1:8, объем/объем) (0,2 мл) при комнатной температуре в течение 30 минут, и данную смолу промывали CH3CN. СКП смолу обрабатывали 25% водным раствором NH3 (5 мл) при комнатной температуре в течение 24 ч и промывали H2O. Объединенные водные слои концентрировали досуха под сниженным давлением, и остаток анализировался и характеризовался методами высокоэффективной жидкостной хроматографии с обращенной фазой и MALDI-TOF-MC. Высокоэффективная жидкостная хроматография с обращенной фазой выполнялась с линейным градиентом 0-20% ацетонитрила в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 80 минут при 30°С и скорости потока 0,5 мл/мин с использованием колонки типа µBondasphere 5 мкм С18 (100 Å, 3.9 мм × 150 мм) (фирмы Уотерс (Waters)).
Пример 70: Синтез всех (Rp)-[TS]9Т (фосфоротиоат)
Соответствующий олигонуклеозидный H-фосфонат синтезировался на СКП смоле через сукциниловый линкер, как описано выше, и обрабатывался 0,2 М раствором реагента Бокажа (Beaucage) в смеси БСА-CH3CN (1:8, объем/объем) (0,2 мл) при комнатной температуре в течение 30 минут, и данную смолу промывали CH3CN. Смолу обрабатывали 25% водным раствором NH3 (5 мл) при комнатной температуре в течение 24 ч и промывали H2O. Объединенные водные слои концентрировали досуха под сниженным давлением, и остаток анализировался и характеризовался методами высокоэффективной жидкостной хроматографии с обращенной фазой и MALDI-TOF-MC. Высокоэффективная жидкостная хроматография с обращенной фазой выполнялась с линейным градиентом 0-20% ацетонитрила в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 80 минут при 30°С и скорости потока 0,5 мл/мин с использованием колонки типа µBondasphere 5 мкм С18 (100 Å, 3.9 мм × 150 мм) (фирмы Уотерс (Waters)).
Пример 71: Синтез всех (Rp)-[TB]3Т (боранофосфат)
Соответствующий олигонуклеозидный H-фосфонат синтезировался на СКП смоле через сукциниловый линкер, как описано выше, и обрабатывался смесью ДМФ (0,8 мл), БСА (0,1 мл) и ВН3·S(СН3)2 (0,1 мл) при комнатной температуре в течение 15 минут, и данную смолу последовательно промывали ДМФ, CH3CN и СН3ОН. Затем смолу обрабатывали насыщенным раствором NH3 в СН3ОН (5 мл) при комнатной температуре в течение 2 ч и промывали СН3ОН. Объединенные органические растворы концентрировали досуха под сниженным давлением, и остаток анализировался и характеризовался методами высокоэффективной жидкостной хроматографии с обращенной фазой и MALDI-TOF-MC. Высокоэффективная жидкостная хроматография с обращенной фазой выполнялась с линейным градиентом 0-20% ацетонитрила в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 60 минут при 30°С и скорости потока 0,5 мл/мин с использованием колонки типа PEGASIL ODS 5 мкм (120 Å, 4.0 мм × 150 мм) (фирмы Сеншу Пак (Senshu Pak)).
Пример 72: Синтез всех-(Sp)-[TB]3Т (боранофосфат)
Соответствующий олигонуклеозидный H-фосфонат синтезировался на СКП смоле через сукциниловый линкер, как описано выше, и обрабатывался смесью ДМФ (0,8 мл), БСА (0,1 мл) и ВН3·S(СН3)2 (0,1 мл) при комнатной температуре в течение 15 минут, и данную смолу последовательно промывали ДМФ, CH3CN и СН3ОН. Затем смолу обрабатывали насыщенным раствором NH3 в СН3ОН (5 мл) при комнатной температуре в течение 2 ч и промывали СН3ОН. Объединенные органические растворы концентрировали досуха под сниженным давлением, и остаток анализировался и характеризовался методами высокоэффективной жидкостной хроматографии с обращенной фазой и MALDI-TOF-MC. Высокоэффективная жидкостная хроматография с обращенной фазой выполнялась с линейным градиентом 0-20% ацетонитрила в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 60 минут при 30°С и скорости потока 0,5 мл/мин с использованием колонки типа PEGASIL ODS 5 мкм (120 Å, 4.0 мм × 150 мм) (фирмы Сеншу Пак (Senshu Pak)).
Пример 73: Синтез всех-(Sp)-[TN]3Т (N-(2-диметиламино)этил]фосфорамидат)
Соответствующий олигонуклеозидный H-фосфонат синтезировался на СКП смоле через оксалиловый линкер, как описано выше, и обрабатывался CCl4-2-диметиламиноэтиламином (9:1, объем/объем) при комнатной температуре в течение 1 ч и промывался CH3CN. Объединенные органические растворы концентрировали досуха под сниженным давлением, и остаток анализировался и характеризовался методами высокоэффективной жидкостной хроматографии с обращенной фазой и MALDI-TOF-MC. Высокоэффективная жидкостная хроматография с обращенной фазой выполнялась с линейным градиентом 0-20% ацетонитрила в 0,1 М триэтиламмоний ацетатном буфере (рН 7,0) в течение 60 минут при 30°С и скорости потока 0,5 мл/мин с использованием колонки типа PEGASIL ODS 5 мкм (120 Å, 4.0 мм × 150 мм) (фирмы Сеншу Пак (Senshu Pak)).
Пример 74: Синтез всех-(Rp)-[TN]3Т (N-(2-диметиламино)этил]фосфорамидат)
Соответствующий олигонуклеозидный H-фосфонат синтезировался на СКП смоле через оксалиловый линкер, как описано выше, и обрабатывался CCl4-2-диметиламиноэтиламином (9:1, объем/объем) при комнатной температуре в течение 1 ч и промывался CH3CN. Объединенные органические растворы концентрировали досуха под сниженным давлением, и остаток анализировался и характеризовался методами высокоэффективной жидкостной хроматографии с обращенной фазой и MALDI-TOF-MC. Высокоэффективная жидкостная хроматография с обращенной фазой выполнялась с линейным градиентом 0-20% ацетонитрила в 0,1 М триэтиламмоний ацетатном буфере (рН 7,0) в течение 60 минут при 30°С и скорости потока 0,5 мл/мин с использованием колонки типа PEGASIL ODS 5 мкм (120 Å, 4.0 мм × 150 мм) (фирмы Сеншу Пак (Senshu Pak)).
Пример 75: Общая процедура для твердофазного синтеза Х-фосфонатной РНК с использованием Схемы 5 (Путь А).
Насыщенная 5′-O-(ДМТр)уридином ВКП или СКП смола с использованием сукцинилового линкера применена для данного синтеза. Элонгация цепи осуществлялась путем повторения стадий, представленных в Таблице 2. После удлинения цепи группу 5′-O-ДМТр удаляли посредством обработки 3% ДХК в CH2Cl2, и смолу последовательно промывали CH2Cl2 и EtOH. Затем смолу обрабатывали 25% водным раствором NH3 -EtOH (3:1, объем/объем) в течение 2 ч при комнатной температуре и удаляли путем фильтрации. Фильтрат разбавляли 25% водным раствором NH3-EtOH (3:1, объем/объем) и помещали в герметично закрытую колбу на 48 ч при комнатной температуре. Данный раствор концентрировали под сниженным давлением, и остаток очищали методом высокоэффективной жидкостной хроматографии с обращенной фазой. Фракции, содержащие необходимые 2′-O-ТБС-защищенные Х-фосфонатные РНК, собирали и лиофилизировали. Остаток обрабатывали 1 М TBAF раствором в безводном ТГФ в течение 24 ч при комнатной температуре. Добавляли 0.05 М ТЕАА буферный раствор (рН 6,9), и ТГФ удаляли путем выпаривания. Остаток обессоливали с помощью картриджа Sep-pak C18 и очищали методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулярных Х-фосфонатных РНК.

* приготовление предварительно активированного мономера на Стадии 3 Таблицы 2: 1.8-диазабицикло[5.4.0]ундец-7-ений 5′-O-(ДМТр)-2′-O-(ТБС)-рибонуклеозид-3′-ил фосфонат обезвоживается путем повторных совместных выпариваний с безводным пиридином и затем растворяется в безводном пиридине. К данному раствору добавляют BopCl, и смесь перемешивают в течение 5 минут. К данной смеси, по каплям, с помощью шприца добавляют раствор аминоспирта (L-2 или D-2), который обезвоживается путем повторных совместных выпариваний с безводным пиридином, и растворяется в безводном пиридине, и смесь перемешивают в течение 5 минут под атмосферой аргона.
Пример 76: Общая процедура для твердофазного синтеза Х-фосфонатной РНК с использованием Схемы 6 (Путь В).
Процедура синтеза H-фосфонатной РНК. Насыщенная 5′-O-(ДМТр)уридином смола СКП с использованием сукцинилового или оксалилового линкера обрабатывается 1% ТФК в CH2Cl2 (3×5 с) для удаления 5′-O-ДМТр группы, промывается CH2Cl2 и безводным пиридином, и высушивается в вакууме. Элонгация цепи проводится путем повторения следующих стадий (а) и (b). (а) Реакция соединения с использованием раствора, содержащего соответствующий предварительно активированный мономер* (0,2 М) в безводном пиридине, (10 минут) под атмосферой аргона. После конденсации твердый носитель промывают безводным пиридином и CH2Cl2. (b) Удаление 5′-O-ДМТр группы и хирального вспомогательного соединения одновременно путем обработки 1% ТФК в CH2Cl2-Et3SiH (1:1, объем/объем) (3×5 с) и последующими промывками CH2Cl2 и безводным пиридином. Результирующие олигонуклеозидные H-фосфонаты на смоле превращаются в модифицированные по остову РНК аналоги, как описано ниже.
* получение предварительно активированного мономера
1,8-диазабицикло[5.4.0]ундец-7-ений 5′-O-(ДМТр)-2′-O-(ТБС)-рибонуклеозид-3′-ил фосфонат обезвоживается путем повторных совместных с безводным пиридином выпариваний и затем растворяется в безводном пиридине. К данному раствору добавляют BopCl, и смесь перемешивают в течение 5 минут. К данной смеси, по каплям, с помощью шприца добавляют аминоспирт (L-6 или D-6), который обезвоживается путем повторных совместных выпариваний с безводным пиридином и растворяется в безводном пиридине, и смесь перемешивают в течение 5 минут под атмосферой аргона.
Фосфоротиоат (X=S-)
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через сукциниловый линкер, полученный как выше, обрабатывают 10 вес.% S8 в CS2-пиридин-триэтиламин (35:35:1, объем/объем/объем) при комнатной температуре в течение 3 ч и последовательно промывают CS2, пиридином и EtOH. Затем смолу обрабатывают смесью 25% NH3 водный раствор-EtOH (3:1, объем/объем) в течение 2 ч при комнатной температуре и удаляют путем фильтрации. Фильтрат разбавляют 25% NH3 водный раствор-EtOH (3:1, объем/объем) и помещают в герметично закрытую колбу на 12 ч при комнатной температуре. Раствор концентрируют под сниженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой. Фракции, содержащие необходимые 2′-O-ТБС-защищенные фосфоротиоатные РНК собирают и лиофилизируют. Остаток обрабатывают 1 М TBAF раствором в безводном ТГФ в течение 24 ч при комнатной температуре. Добавляют 0,05 М ТЕАА буферный раствор (рН 6,9), и ТГФ удаляют путем выпаривания. Остаток обессоливают с помощью картриджа Sep-pak C18, и очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулярных фосфоротиоатных РНК.
Боранофосфат (X=
Безводный ДМФ, N,O-бис(триметилсилил)ацетамид (БСА), и ВН3·SMe2 добавляют к олигонуклеозидному H-фосфонату, загруженному на СКП смолу через оксалиловый линкер, полученный как выше, при комнатной температуре. Через 15 минут данную смолу последовательно промывают ДМФ, CH3CN и EtOH. Затем смолу обрабатывают 25% NH3 водный раствор-EtOH (3:1, объем/объем) в течение 2 ч при комнатной температуре и удаляют путем фильтрации. Фильтрат разбавляют 25% NH3 водный раствор-EtOH (3:1, объем/объем) и помещают в герметично закрытую колбу на 12 ч при комнатной температуре. Данный раствор концентрируют под пониженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой. Фракции, содержащие необходимые 2′-O-ТБС-защищенные боранофосфатные РНК, собирают и лиофилизируют. Остаток обрабатывают 1 М TBAF раствором в безводном ТГФ в течение 24 ч при комнатной температуре. Добавляют 0,05 М ТЕАА буферный раствор (рН 6,9), и ТГФ удаляют путем выпаривания. Остаток обессоливают с помощью картриджа Sep-pak C18 и очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулярных боранофосфатных РНК.
Гидроксиметилфосфонат (Х=CH2OH)
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через оксалиловый линкер, полученный как выше, обрабатывают 0,1 М триметилсилилхлоридом (TMSCl) в пиридин-1-метил-2-пирролидоне (NMP) (1:9, объем/объем) при комнатной температуре в течение 10 минут и газообразным формальдегидом при комнатной температуре в течение 30 минут, и затем промывают NMP и EtOH. Затем смолу обрабатывают смесью 25% NH3 водный раствор-EtOH (3:1, объем/объем) в течение 2 ч при комнатной температуре и удаляют путем фильтрации. Фильтрат разбавляют 25% NH3 водный раствор-EtOH (3:1, объем/объем) и помещают в герметично закрытую колбу на 12 ч при комнатной температуре. Данный раствор концентрируют под сниженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой. Фракции, содержащие необходимые 2′-O-ТБС-защищенные гидроксиметилфосфонатные РНК, собирают и лиофилизируют. Остаток обрабатывают 1М TBAF раствором в безводном ТГФ в течение 24 ч при комнатной температуре. Добавляют 0,05 М ТЕАА буферный раствор (рН 6,9), и ТГФ удаляют путем выпаривания. Остаток обессоливают с помощью Sep-pak C18 картриджа и очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулярных гидроксиметилфосфонатных РНК.
Фосфороамидат (X=NH2)
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через оксалиловый линкер, полученный как выше, обрабатывают насыщенным NH3 раствором в CCl4-l,4-диоксане (4:1, объем/объем) при 0°С в течение 30 минут и промывают 1,4-диоксаном. Объединенные органические растворы концентрируют досуха под сниженным давлением. Фильтрат разбавляют смесью 25% NH3 водный раствор-EtOH (3:1, объем/объем) и помещают в герметически закрытую колбу на 12 ч при комнатной температуре. Раствор концентрируют под сниженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой. Фракции, содержащие необходимые 2′-O-ТБС-защищенные фосфорамидатные РНК, собирают и лиофилизируют. Остаток обрабатывают 1М TBAF раствором в безводном ТГФ в течение 24 ч при комнатной температуре. Добавляют 0,05 М ТЕАА буферный раствор (рН 6,9), и ТГФ удаляют путем выпаривания. Остаток обессоливают с помощью картриджа Sep-pak C18 и очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулярных фосфорамидатных РНК.
N-пропилфосфорамидат (X=NHPr)
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через оксалиловый линкер, полученный как выше, обрабатывают CCl4-пропиламином (9:1, объем/объем) при комнатной температуре в течение 1 ч и промывают СН3ОН. Объединенные органические растворы концентрируют досуха под сниженным давлением. Фильтрат разбавляют 25% NH3 водный раствор-EtOH (3:1, объем/объем) и помещают в герметически закрытую колбу на 12 ч при комнатной температуре. Данный раствор концентрируют под сниженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой. Фракции, содержащие необходимые 2′-O-ТБС-защищенные N-пропилфосфорамидатные РНК, собирают и лиофилизируют. Остаток обрабатывают 1 М TBAF раствором в безводном ТГФ в течение 24 ч при комнатной температуре. Добавляют 0,05М ТЕАА буферный раствор (рН 6,9), и ТГФ удаляют путем выпаривания. Остаток обессоливают с помощью картриджа и очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулярных N-пропилфосфорамидатных РНК.
N[(2-диметиламино)этил]фосфорамидат [X=NH(CH2)2NMe2]
Олигонуклеозидный H-фосфонат, загруженный на СКП смолу через оксалиловый линкер, полученный как выше, обрабатывают CCl4-2-диметиламиноэтиламином (9:1, объем/объем) при комнатной температуре в течение 1 ч и промывают CH3CN. Объединенные органические растворы концентрируют досуха под сниженным давлением. Фильтрат разбавляют 25% NH3 водный раствор-EtOH (3:1, объем/объем) и помещают в герметически закрытую колбу на 12 ч при комнатной температуре. Данный раствор концентрируют под сниженным давлением, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой. Фракции, содержащие необходимые 2′-O-ТБС-защищенные N-[(2-диметиламино)этил]фосфорамидатные РНК, собирают и лиофилизируют. Остаток обрабатывают 1 М TBAF раствором в безводном ТГФ в течениег 24 ч при комнатной температуре. Добавляют 0,05 М ТЕАА буферный раствор (рН 6,9), и ТГФ удаляют путем выпаривания. Остаток обессоливают с помощью картриджа Sep-pak C18 cartridge и очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой с получением стереорегулярных N-[(2-диметиламино)этил]фосфорамидатных РНК.
Пример 77: Твердофазный синтез: общая процедура для получения предварительно активированного мономерного раствора.
Соответствующий Н-фосфонатный моноэфир обезвоживали путем повторных совместных выпариваний с безводным пиридином и безводным толуолом, и затем растворяли в безводном растворителе. К этому раствору, по каплям добавляли конденсирующий реагент и перемешивали в течение 10 минут. Затем добавляли аминоспирт и перемешивали еще в течение 10 минут с получением предварительно активированного мономерного раствора.
Пример 78: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5tt] с использованием Пути А
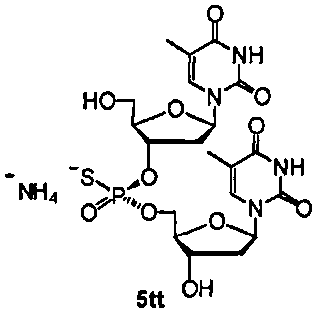
Насыщенную N3-бензоил-5′-O-(4,4′-диметокситритил)тимидином ВКП смолу (16,4 мг; 30,5 мкмоль/г, 0,5 мкмоль) с использованием сукцинилового линкера обрабатывали 3% ДХК/ДХМ (3×1 мл), затем промывали ДХМ (3×1 мл) и безводным MeCN (3×1 мл). После высушивания данной смолы под сниженным давлением (>5 минут) добавляли раствор предварительно активированного мономера (250 мкл, 25 мкмоль; который состоял из 8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (25 мкмоль, в качестве Н-фосфонатного моноэфира), MeCN-пиридина (9:1, объем/объем, в качестве растворителя), Ph3PCl2 (62,5 мкмоль, в качестве конденсирующего реагента), и L-2 (30 мкмоль, в качестве аминоспирта). После перемешивания в течение 2 минут реакционный раствор удаляли, смолу промывали MeCN (3×1 мл) и высушивали под сниженным давлением (>5 минут). В качестве стадии модификации, результирующее промежуточное соединение на данной смоле сульфурировали путем обработки 0,3 М ДТД/MeCN (500 мкл, 150 мкмоль) в течение 5 минут, затем смолу промывали MeCN (3×1 мл) и ДХМ (3×1 мл). 5′-O-ДМТр группу удаляли посредством обработки 3% ДХК / ДХМ (3×1 мл), и смолу промывали ДХМ (3×1 мл). Затем фосфоротиоатный димер на смоле обрабатывали 25% NH3 (1 мл) в течение 12 ч при 55°С для удаления хирального вспомогательного соединения и защитных групп нуклеооснований а также для освобождения данного димера от смолы. Смолу удаляли путем фильтрации и промывали H2O. Фильтрат концентрировали досуха. Остаток растворяли в H2O (2 мл), промывали Et2O (3×2 мл), и объединенные промывки подвергали обратной экстракции H2O (2 мл). Объединенные водные слои концентрировали до сухого состояния. Результирующий неочищенный продукт анализировали методом UPLC® с обращенной фазой с линейным градиентом 0-20% МеОН в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 15 минут при 55°С и скорости 0.4 мл/мин. Данный продукт был идентичен контрольному образцу, синтезированному обычным Н-фосфонатным методом. Выход (Sp)-5tt составлял 97% (Rp:Sp=2:98). Время удерживания: 13,4 минут ((Rp)-5tt: 12,3 минут). Общая схема представлена на Схеме 18. UPLC профиль показан на Фигуре 5А. В другом синтезе (Sp)-5tt, ВТК (20 мкмоль) был использован вместо Ph3PCl2 (62,5 мкмоль).
Данный продукт был идентичен контрольному образцу, синтезированному обычным Н-фосфонатным методом. Выход (Sp)-5tt составлял 95% (Rp:Sp=3:97). Время удерживания: 13,5 минут ((Rp)-5tt: 12,4 минут). UPLC профиль показан на Фигуре 5В
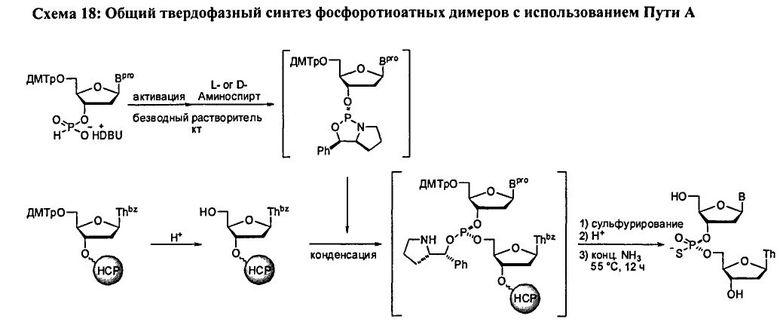
Пример 79: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5tt].
Насыщенная N3-бензоил-5′-O-(4,4′-диметокситритил)тимидином НСР смола (16,4 мг; 30,5 мкмоль/г, 0,5 мкмоль) с использованием сукцинилового линкера обрабатывалась 3% ДХК/ДХМ (3×1 мл), затем промывалась ДХМ (3×1 мл) и безводным MeCN (3×1 мл). После высушивания смолы под сниженным давлением (>5 минут) добавляли раствор предварительно активированного мономера (200 мкл, 25 мкмоль; который состоял из 8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (25 мкмоль, в качестве Н-фосфонатного моноэфира), MeCN-ЦМП (9:1, объем/объем, в качеств растворителя), Ph3PCl2 (62,5 мкмоль, в качестве конденсирующего реагента), и L-2 (30 мкмоль, в качестве аминоспирта)) с последующим добавлением 5 М ЦМПТ / MeCN (50 мкл, 250 мкмоль, в качестве активирующего реагента). После перемешивания в течение 10 минут данный реакционный раствор удаляли, смолу промывали MeCN (3×1 мл), высушивали под сниженным давлением (>5 минут). Результирующее промежуточное соединение на смоле сульфурировали посредством обработки 0,3 М ДТД/MeCN (500 мкл, 150 мкмоль) в течение 5 минут, затем смолу промывали MeCN (3×1 мл) и ДХМ (3×1 мл). 5′-O-ДМТр группу удаляли путем обработки 3% ДХК/ДХМ (3×1 мл) и промывали ДХМ (3×1 мл). Затем фосфоротиоатный димер на смоле обрабатывали 25% NH3 (1 мл) в течение 12 ч при 55°С для удаления хирального вспомогательного соединения и защитных групп данных нуклеооснований и также для освобождения данного димера от смолы. Смолу удаляли фильтрацией и промывали H2O. Фильтрат концентрировали досуха. Остаток растворяли в H2O (2 мл), промывали Et2O (3×2 мл), и объединенные промывки подвергали обратной экстракции H2O (2 мл).
Объединенные водные слои концентрировали до сухого состояния. Результирующий неочищенный продукт анализировали методом UPLC® с обращенной фазой с линейным градиентом 0-20% МеОН в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 15 минут при 55°С и скорости 0,4 мл/мин. Данный продукт был идентичен контрольному образцу, синтезированному с помощью обычного H-фосфонатного метода. Выход (Sp)-5tt составлял 98% (Rp:Sp=1:99). Время удерживания: 13,5 минут ((Rp)-5tt: 12,4 минут). UPLC профиль показан на Фигуре 6А. Это соединение было также получено с использованием "БТК (16 мкмоль) и L-2 (26 мкмоль)" вместо "Ph3PCl2 (62,5 мкмоль) и L-2 (30 мкмоль)" схожим с описанным выше способом. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5tt составлял 95% (Rp:Sp=1:99). Время удерживания: 13,5 минут ((Rp)-5tt; 12,4 минут). UPLC профиль (метод ультражидкостной хроматографии) показан на Фигуре 6В.
Пример 80: Твердофазный синтез фосфоротиоатного димера, (Rp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5tt] с использованием Пути А.
Это соединение было получено с использованием "D-2 (30 мкмоль)" вместо "L-2 (30 мкмоль)" по способу, подобному "Примеру 78". Данный продукт был идентичен контрольному обоазцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5tt составлял 98% (Rp:Sp=97:3). Время удерживания: 12,2 минут ((Sp)-5tt: 13,5 минут). UPLC профиль показан на Фигуре 7А. В другом синтезе (Rp)-5tt, БТК (20 мкмоль) использовался вместо Ph3PCl2 (62,5 мкмоль). Продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5tt составлял 97% (Rp:Sp=95:5). Время удерживания: 12,3 минут ((Sp)-5tt: 13,6 минут). UPLC профиль показан на Фигуре 7 В.
Пример 81: Твердофазный синтез фосфоротиоатного димера, (Rp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5tt] с использованием Пути А.
Это соединение было получено с использованием "D-2 (30 мкмоль)" вместо "L-2 (30 мкмоль)" по способу, подобному "Примеру 79". Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5tt составлял 98% (Rp:Sp=98:2). Время удерживания: 12,3 минут ((Sp)-5tt: 13,6 минут). UPLC профиль показан на Фигуре 8.
Пример 82: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний 2′-дезоксицитидин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5ct] с использованием Пути А
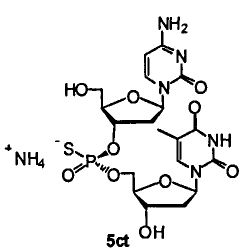
Это соединение было получено с использованием "8-диазабицикло[5.4.0]ундец-7-ений 4-N-бензоил-5′-O-(4,4′-диметокситритил)-2′-дезоксицитидин-3′-ил фосфоната (25 мкмоль)" вместо "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (25 мкмоль)" по способу, подобному Примеру 78. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5ct составлял 98% (Rp:Sp=3:97). Время удерживания 9,7 минут ((Rp)-5ct: 8,7 минут). UPLC профиль показан на Фигуре 9А. Это соединение было также получено с использованием "БТК (16 мкмоль) и L-2 (26 мкмоль)" вместо "Ph3PCl2 (62,5 мкмоль) и L-2 (30 мкмоль)", как описано. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного Н-фосфонатного метода. Выход (Sp)-5 с1 составлял 94% (Rp:Sp=3:97). Время удерживания: 9,7 минут (Rp)-5ct: 8,7 минут). UPLC профиль показан на Фигуре 9В.
Пример 83: Твердофазный синтез фосфоротиоатного димера, (Rp)-аммоний 2′-дезоксицитидин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5ct] с использованием Пути А.
Это соединение было получено с использованием "D-2 (30 мкмоль)" вместо "L-2 (30 мкмоль)" по способу, подобному эксперименту в Примере 82, Фигура 9А. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5ct составлял 98% (Rp:Sp=97:3). Время удерживания: 8,6 минут ((Sp)-5ct: 9,7 минут). UPLC профиль показан на Фигуре 10А. Это соединение было также получено с использованием "D-2 (30 мкмоль)" вместо "L-2 (30 мкмоль)" по способу, подобному Примеру 82, Фигура 9В. Выход (Rp)-5ct составлял 87% (Rp:Sp=98:2). Время удерживания: 8,6 минут ((Sp)-5ct: 9,8 минут). UPLC профиль показан на Фигуре 10В.
Пример 84: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний 2′-дезоксиаденин-3′-ил тимидин-5′-ил фосфоротиоате [(Sp)-5at] с использованием Пути А
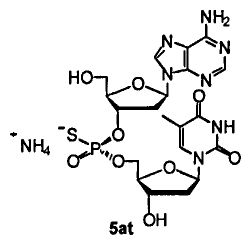
Это соединение было получено с использованием "8-диазабицикло[5.4.0]ундец-7-ений 6-N,N-дибензоил-5′-O-(4,4′-диметокситритил)-2′-дезоксиаденин-3′-ил фосфоната (25 мкмоль)" вместо "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (25 µmol)" по способу, подобному Примеру 78. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5at составлял 96% (Rp:Sp=1:99). Время удерживания: 14,0 минут ((Rp)-5at: 12,6 минут). UPLC профиль показан на Фигуре 11.
Пример 85: Твердофазный синтез фосфоротиоатного димера, (Rp)-аммоний 2′-днзоксиаденин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5at] с использованием Пути А.
Это соединение было получено с использованием "D-2 (30 мкмоль)" вместо "L-2 (30 мкмоль)" по способу, подобному Примеру 83. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5at составлял 96% (Rp:Sp=96:4). Время удерживания: 12,5 минут ((Sp)-5at: 14,1 минут). UPLC профиль показан на Фигуре 12.
Пример 86: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний 2′-дезоксигуанин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5gt] с использованием Пути А
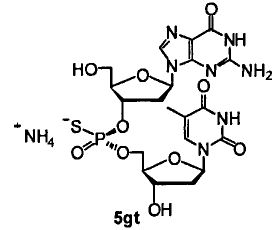
Это соединение было получено с использованием "8-диазабицикло[5.4.0]ундец-7-ений О6-цианоэтил-2-N-феноксиацетил-5′-O-(4,4′-диметокситритил)-2′-дезоксигуанин-3′-ил фосфоната (25 мкмоль)" вместо "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ид фосфоната (25 мкмоль)" по способу, подобному Примеру 78. Даный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5gt составлял 96% (Rp:Sp=2:98). Время удерживания: 11,5 минут ((Rp)-5gt: 10,3 минут). UPLC профиль показан на Фигуре 13.
Пример 87: Твердофазный синтез фосфоротиоатного димера, (Rp)-аммоний 2′-дезоксигуанин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5gt] с использованием Пути А.
Это соединение было получено с использованием "D-2 (30 мкмоль)" вместо "L-2 (30 мкмоль)" по способу, подобному Примеру 86. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5gt составлял 96% (Rp:Sp=97:3). Время удерживания: 10,3 минут ((Sp)-5gt: 11,6 минут). UPLC профиль показан на Фигуре 14.
Пример 88: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5tt] с использованием Пути В
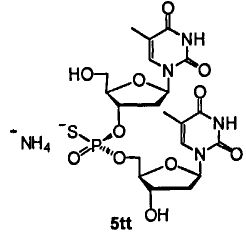
Насыщенная N3-бензоил-5′-O-(4,4′-диметокситритил)тимидином НСР смола (16,4 мг; 30,5 мкмоль/г, 0,5 мкмоль) с использованием сукцинилового линкера обрабатывалась 1% ТФК / ДХМ (3×1 мл) для удаления 5′-O-ДМТр группы, промывалась ДХМ (3×1 мл) и безводным MeCN (3×1 мл) и высушивалась в вакууме. Добавляли раствор предварительно активированного мономера (200 мкл, 50 мкмоль; который состоял из 8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (50 мкмоль, в качестве Н-фосфонатного моноэфира), MeCN-ЦМП (9:1, объем/объем, в качестве растворителя), Ph3PCl2 (125 мкмоль, в качестве конденсирующего реагента), и L-6 (52 мкмоль, в качестве аминоспирта)) с последующим добавлением 5 М ЦМПТ / MeCN (50 мкл, 250 мкмоль). После перемешивания в течение 2 минут данный реакционный раствор удаляли, и смолу промывали MeCN (3×1 мл), ДХМ (3×1 мл) и высушивали под сниженным давлением (>5 минут). 5′-O-ДМТр группу и хиральное вспомогательное соединение одновременно удаляли путем обработки 1% ТФК в ДХМ (3×1 мл), промывали ДХМ (3×1 мл) и безводным MeCN (3×1 мл), и высушивали в вакууме.
Результирующее промежуточное соединение на смоле сульфурировали посредством обработки растворной смесью 0,2 М реагент Бокажа/ MeCN (200 мкл, 40 мкмоль) и БСА (25 мкл, 100 мкмоль) в течение 20 минут, затем смолу промывали MeCN (3×1 мл). Затем фосфоротиоатный димер на смоле обрабатывали 25% NH3-EtOH (2 мл, 4:1, объем/объем) в течение 12 ч при комнатной температуре для удаления защитных групп данных нуклеооснований и также для освобождения данного димера от смолы. Смолу удаляли фильтрацией и промывали H2O. Фильтрат концентрировали досуха. Остаток растворяли в H2O (2 мл), промывали Et2O (3×2 мл), и объединенные промывки подвергали обратной экстракции H2O (2 мл). Объединенные водные слои концентрировали до сухого состояния. Результирующий неочищенный продукт анализировали методом UPLC® (ультражидкостная хроматография) с обращенной фазой с линейным градиентом 0-20% МеОН в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 15 минут при 55°С и скорости 0,4 мл/мин. Данный продукт был идентичен контрольному образцу, синтезированному с помощью обычного H-фосфонатного метода. Выход (Sp)-5tt составлял 96% (Rp:Sp=4:96). Время удерживания: 13,5 минут ((Rp)-5tt: 12,4 минут). UPLC профиль показан на Фигуре 15А.
В альтернативном синтезе это соединение было также получено с использованием "БТК (32 мкмоль)" вместо "Ph3PCl2 (125 мкмоль)" по способу, подобному описанному ранее. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного Н-фосфонатного метода. Выход (Sp)-5tt составлял 96% (Rp:Sp=5:95). Время удерживания; 13,4 минут ((Rp)-5tt; 12,3 минут). UPLC профиль показан на Фигуре 15В.
Пример 89: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоате [(Sp)-5tt] с использованием Пути В.
В альтернативном синтезе, [(Sp)-5tt] был получен с использованием "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (25 мкмоль), БТК (16 мкмоль), и L-6 (26 мкмоль))" вместо "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (50 мкмоль), Ph3PCl2 (125 мкмоль) и L-6 (52 мкмоль)" по способу, подобному в Примере 88, Фигура 15А. Общая схема представлена на Схеме 19. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5tt составлял 93% (Rp:Sp=6:94). Время удерживания: 13,5 минут ((Rp)-5tt; 12,4 минут). UPLC профиль показан на Фигуре 16А. Это соединение было получено с использованием "0,2 М ДТД / MeCN (200 мкл, 80 мкмоль)" вместо "0,2 М реагент Бокажа / MeCN (200 мкл, 40 мкмоль)" по способу, подобному описанному выше. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5tt составлял 95% (Rp:Sp=6:94). Время удерживания: 13,5 минут ((Rp)-5tt: 12.4 минут). UPLC профиль показан на Фигуре 16В
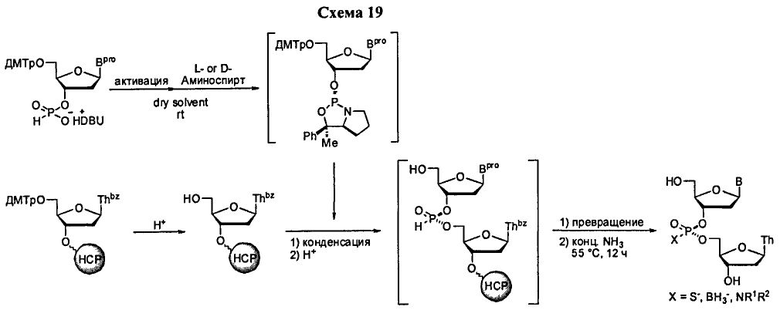
Пример 90: Твердофазный синтез фосфоротиоатного димера, (Rp)-аммоний тимидин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5tt] с использованием Пути В.
Это соединение было получено с использованием "D-6 (52 мкмоль)" вместо "L-6 (52 мкмоль)" по способу, подобному таковым в Примере 88, Фигура 15А. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5tt составлял 95% (Rp,Sp=97:3). Время удерживания: 12,3 минут ((Sp)-5tt: 13,6 минут), UPLC профиль показан на Фигуре 17А.
Это соединение было получено с использованием "D-6 (52 мкмоль)" вместо "L-6 (52 мкмоль)" по способу, подобному таковым в Примере 88, Фигура 15В. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5tt составлял 94% (Rp:Sp=97:3). Время удерживания: 12,3 минут ((Sp)-5tt: 13,6 минут). UPLC профиль показан на Фигуре 17В.
Пример 91: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний 2′-дезоксицитидин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5ct] с использованием Пути В
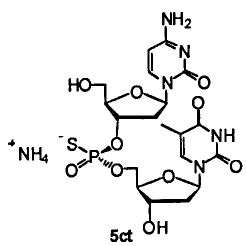
Это соединение было получено с использованием "8-диазабицикло[5.4.0]ундец-7-ений 4-N-бензоил-5′-O-(4,4′-диметокситритил)-2′-дезоксицитидин-3′-ил фосфоната (50 мкмоль)" вместо "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (50 мкмоль)" по способу, подобному Примеру 88. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (.Sp)-5ct составлял 95% (Rp:Sp=4:96). Время удерживания; 9,7 минут ((Rp)-5ct: 8,7 минут). UPLC профиль показан на Фигуре 18.
Пример 92: Твердофазный синтез фосфоротиоатного димера, (Rp)-аммоний 2′-дезоксицитидин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5ct] с использованием Пути В.
Это соединение было получено с использованием "D-6 (52 мкмоль)" вместо "L-6 (52 мкмоль)" по способу, подобному Примеру 91. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5ct составлял 96% (Rp:Sp=97:3). Время удерживания: 8,6 минут ((Sp)-5ct: 9,8 минут). UPLC профиль показан на Фигуре 19.
Пример 93: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний 2′-дезоксиаденин-3′-ил тимидин-5′-ил фосфоротиоате [(Sp)-5at] с использованием Пути В
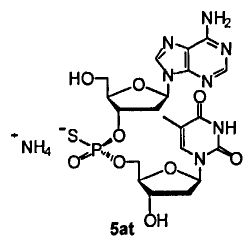
Это соединение было получено с использованием "8-диазабицикло[5.4.0]ундец-7-ений 6-N,N-дибензоил-5′-O-(4,4′-диметокситритил)-2′-дезоксиаденин-3′-ил фосфоната (50 мкмоль)" вместо "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (50 мкмоль)" по способу, подобному Примеру 88. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5at составлял 95%, Rp:Sp=5:95. Время удерживания: 14,0 минут ((Rp)-5at: 12,5 минут). UPLC профиль показан на Фигуре 20А.
Это соединение было также получено с использованием "БТК (32 мкмоль)" вместо "Ph3PCl2 (125 мкмоль)" по способу, подобному описанному в этом примере для Фигуры 20А. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5at составлял 94% (Rp:Sp=5:95). Время удерживания: 13,9 минут ((Rp)-5at: 12,5 минут). UPLC профиль показан на Фигуре 20В.
Пример 94: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний 2′-дезоксиаденин-3′-ил тимидин-5′-ил фосфоротиоата [(Sp)-5at] с использованием Пути В.
Это соединение было получено с использованием "8-диазабицикло[5.4.0]ундец-7-ений 6-N-((диметиламино)метилен)-5 ′-O-(4,4′-диметокситритил)-2′-дезоксиаденин-3 ′-ил фосфоната (50 мкмоль)" вместо ""8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (50 мкмоль)" по способу, подобному Примеру 88.
Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5at составлял 91%, Rp:Sp=5:95. Время удерживания: 13,9 минут ((Rp)-5at: 12,5 минут). UPLC профиль показан на Фигуре 21.
Пример 95: Твердофазный синтез фосфоротиоатного димера, (Rp)-аммоний 2′-дезоксиаденин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5at] с использованием Пути В.
Это соединение было получено с использованием "D-6 (52 мкмоль)" вместо "L-6 (52 мкмоль)" по способу, подобному Примеру 93, Фигура 20А. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5at составлял 96% (Rp:Sp=97:3). Время удерживания: 12,5 минут ((Sp)-5at: 14,0 минут). UPLC профиль показан на Фигуре 22А.
Это соединение было получено с использованием "D-6 (52 мкмоль)" вместо "L-6 (52 мкмоль)" по способу, подобному Примеру 93, Фигура 20В. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5at составлял 94% (Rp:5р=95:5). Время удерживания: 12,4 минут ((Rp)-5at: 14,0 минут). UPLC профиль показан на Фигуре 22В.
Пример 96: Твердофазный синтез фосфоротиоатного димера, (Sp)-аммоний 2′-дезоксигуанин-3′-ил тимидин-5′-ил фосфоротоата [(Sp)-5gt] с использованием Пути В.
Это соединение было получено с использованием "8-диазабицикло[5.4.0]ундец-7-ений О6-цианоэтил-2-N-феноксиацетил-5′-O-(4,4′-диметокситритил)-2′-дезоксигуанин-3′-ил фосфоната (50 мкмоль)" вместо "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (50 мкмоль)" 6-N-(диметиламино)метилен)-5′-O-(4,4′-диметокситритил)-2′-дезоксиаденин-3′-ил фосфоната (50 мкмоль)" по способу, подобному Примеру 88. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-5gt составлял 95%, (Rp:Sp=6:94). Время удерживания: 11,5 минут ((Rp)-5gt: 10,3 минут). UPLC профиль показан на Фигуре 23.
Пример 97: Твердофазный синтез фосфоротиоатного димера, (Rp)-аммоний 2′-дезоксигуанин-3′-ил тимидин-5′-ил фосфоротиоата [(Rp)-5gt] с использованием Пути В.
Это соединение было получено с использованием "D-2 (52 мкмоль)" вместо "L-2 (52 мкмоль)" по способу, подобному Примеру 96. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-5gt составлял 95% (Rp:Sp=94:6). Время удерживания: 10,3 минут ((Rp)-5gt: 11,6 минут). UPLC профиль показан на Фигуре 24.
Пример 98: Твердофазный синтез боранофосфатного димера, (Sp)-аммоний тимидин-3′-ил тимидин-5′-ил боранофосфата [(Sp)-7tt] с использованием Пути В
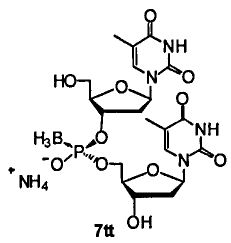
Насыщенная N3-бензоил-5′-O-(4,4′-диметокситритил)тимидином ВКП смола (16,4 мг; 30,5 мкмоль/г, 0,5 мкмоль) с использованием сукцинилового линкера обрабатывалась 1% ТФК / ДХМ (3×1 мл) для удаления 5′-O-ДМТр группы, промывалась ДХМ (3×1 мл) и безводным MeCN (3×1 мл) и высушивалась в вакууме. Добавляли раствор предварительно активированного мономера (200 мкл, 50 мкмоль; который состоял из 8-диазабицикло[5.4.0]ундец-7-ений N3-бетот-5′-O-(4,А′-диметокситритил)тимидин-3′-ил фосфоната(50 мкмоль, в качестве Н-фосфонатного моноэфира), MeCN-ЦМП (9:1, объем/объем, в качестве растворителя), БТК (32 мкмоль в качестве конденсирующего реагента), и D-6 (52 мкмоль, в качестве аминоспирта)) с последующим добавлением 5 М ЦМПТ / MeCN (50 мкл, 250 мкмоль). После перемешивания в течение 2 минут реакционный раствор удаляли, смолу промывали MeCN (3×1 мл), ДХМ (3×1 мл) и высушивали под сниженным давлением (>5 минут). 5′-O-ДМТр группу и хиральное вспомогательное соединение одновременно удаляли путем обработки 1% ТФК в ДХМ (3×1 мл), и смолу промывали ДХМ (3×1 мл) и безводным MeCN (3×1 мл), и высушивали в вакууме. Результирующее промежуточное соединение на смоле борировали посредством обработки смесью ВН3-SMe2-БСА-ДМАц (1 мл, 1:1:8, объем/объем/объем) в течение 15 минут, затем данную смолу промывали ДМАц (3×1 мл), MeCN (3×1 мл) и МеОН (3×1 мл). Затем боранофосфатный димер на смоле обрабатывали 2 М NHs / EtOH (2 мл) в течение 12 ч при комнатной температуре для удаления защитных групп нуклеооснований и также для освобождения данного димера от смолы. Смолу удаляли фильтрацией и промывали МеОН. Фильтрат концентрировали досуха. Остаток растворяли в H2O (2 мл), промывали Et2O (3×2 мл), и объединенные промывки подвергали обратной экстракции Н;0 (2 мл). Объединенные водные слои концентрировали до сухого состояния. Результирующий неочищенный продукт анализировали методом UPLC® с обращенной фазой с линейным градиентом 0-15% MeCN в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 15 минут при 60°С и скорости 0,5 мл/мин. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Sp)-7tt определяли путем измерения УФ поглощательной способности на волне 260 нм с использованием приблизительного коэффициента молярной экстинкции для природного ТТ димера (16800). Выход (Sp)-7tt составлял 89% (Rp:Sp=4:96). Время удерживания: 9,6 минут ((Rp)-7tt: 9,8 минут). UPLC профиль показан на Фигуре 25.
Пример 99: Твердофазный синтез боранофосфатного димера, (Rp)-аммоний тимидин-3′-ил тимидин-5′-ил боранофосфата [(Rp)-7tt] с использованием Пути В.
Это соединение было получено с использованием "L-2 (52 мкмоль)" вместо "D-2 (52 мкмоль)" по способу, подобному Примеру 98. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-7М определяли путем измерения УФ поглощательной способности при 260 нм с использованием приблизительной величины коэффициента молярной экстинкции для природного ТТ димера (16800). Выход (Rp)-7tt составлял 90%, Rp:Sp=95:5. Время удерживания: 9,8 минут ((Sp)-7tt: 9,7 минут). UPLC профиль показан на Фигуре 26.
Пример 100: Твердофазный синтез N-[(2-диметиламино)этил]фосфороамидатного димера, (Sp)-тимидин-3′-ил тимидин-5′-ил N-[(2-диметиламино)этил]фосфороамидата [(Sp)-8tt] с использованием Пути В
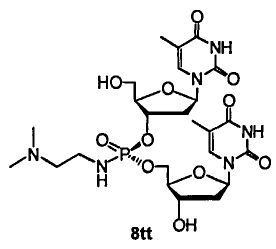
Насыщенная N3-бензоил-5-О(4,4′-диметокситритил)тимидином ВКП смола (16,4 мг; 30,5 мкмоль/г, 0,5 мкмоль) с использованием сукцинилового линкера обрабатывалась 1% ТФК / ДХМ (3×1 мл) для удаления 5′-O-ДМТр группы, промывалась ДХМ (3×1 мл) и безводным MeCN (3×1 мл) и высушивалась в вакууме. Добавляли раствор предварительно активированного мономера (200 мкл, 50 мкмоль; который состоял из 8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (50 мкмоль, в качестве Н-фосфонатного моноэфира), MeCN-ЦМП (9:1, объем/объем, в качестве растворителя), БТК (32 мкмоль в качестве конденсирующего реагента) и L-6 (52 мкмоль, в качестве аминоспирта)) с последующим добавлением 5 М ЦМПТ / MeCN (50 мкл, 250 мкмоль). После перемешивания в течение 2 минут реакционный раствор удаляли, и смолу промывали MeCN (3×1 мл), ДХМ (3×1 мл), и высушивали под сниженным давлением (>5 минут). 5′-O-ДМТр группу и хиральное вспомогательное соединение одновременно удаляли путем обработки 1% ТФК в ДХМ (3×1 мл), смолу промывали ДХМ (3×1 мл) и безводным MeCN (3×1 мл) и высушивали в вакууме. Результирующее промежуточное соединение на смоле амидировали посредством обработки смесью CCl4-Me2N(CH2)2NH2 (1 мл, 1:9, объем/объем) в течение 30 минут, затем данную смолу промывали DCM (3×1 мл). Затем фосфороамидатный димер на смоле обрабатывали 2 М NH3 / EtOH (2 мл) в течение 12 ч при комнатной температуре для удаления защитных групп нуклеооснований и также для освобождения данного димера от смолы. Смолу удаляли фильтрацией и промывали МеОН. Фильтрат концентрировали досуха. Остаток растворяли в H2O (2 мл), промывали Et2O (3×2 мл), и объединенные промывки подвергали обратной экстракции H2O (2 мл). Объединенные водные слои концентрировали до сухого состояния. Результирующий неочищенный продукт анализировали методом UPLC® с обращенной фазой с линейным градиентом 0-20% МеОН в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 15 минут при 55°С и скорости 0,4 мл/мин. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного Н-фосфонатного метода. Выход (Sp)-8tt определяли путем измерения УФ поглощательной способности на волне 260 нм с использованием приблизительного коэффициента молярной экстинкции для природного ТТ димера (16800). Выход (Sp)-8tt составлял 90% (Rp:Sp=6:94). Время удерживания: 10,3 минут ((Rp)-8tt: 9,6 минут). UPLC профиль показан на Фигуре 27.
Пример 101: Твердофазный синтез N-[(2-диметиламино)этил]фосфорамидатного димера, (Rp)-тимидин-3′-илтимидин-5′-ил N-[(2-диметиламино)этил]фосфорамидата [(Rp)-8tt] с использованием пути В.
Это соединение было получено с использованием "D-2 (52 мкмоль)" вместо "L-2 (52 мкмоль)" по способу, подобному Примеру 100. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного H-фосфонатного метода. Выход (Rp)-8tt определяли путем измерения УФ поглощательной способности при 260 нм с использованием приблизительной величины коэффициента молярной экстинкции для природного ТТ димера (16800). Выход (Rp)-8М составлял 86%, Rp:Sp=96:4. Время удерживания: 9,6 минут ((Sp)-8tt: 10,3 минут). UPLC профиль показан на Фигуре 28.
Пример 102: Твердофазный синтез фосфоротиоатного тетрамера, все-(Sp)-[Tps]3Т (фосфоротиоат) с использованием Пути А
Насыщенная 5′-O-(4,4′-диметокситритил)тимидином ВКП смола (0,5 мкмоль) с использованием сукцинилового линкера была применена для данного синтеза. Элонгация цепи проводилась путем повторения стадий, приведенных в Таблице 3. После элонгации цепи группу 5′-O-ДМТр удаляли путем обработки 3% ДХК/ДХМ (3×1 мл), и проводили промывку ДХМ (3×1 мл). Затем фосфоротиоатный тетрамер на смоле обрабатывали 25% NH3 в течение 12 ч при 55°С для удаления хиральных вспомогательных соединений и защитных групп данных нуклеооснований, а также для освобождения тетрамера от смолы. Смолу удаляли путем фильтрации и промывали H2O. Фильтрат концентрировали досуха. Остаток расворяли в (2 мл), промывали Et2O (3×2 мл), и объединенные промывки подвергали обратной экстракции H2O (2 мл). Объединенные водные слои концентрировали до сухого состояния. Результирующий неочищенный продукт анализировали методом UPLC® с обращенной фазой с линейным градиентом 0-30% МеОН в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 30 минут при 55°С и скорости 0,4 мл/мин. Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного фосфорамидитного метода. Выход данного продукта определяли путем измерения УФ поглощательной способности при 260 нм с использованием приблизительного значения коэффициента молярной экстинкции для природного Т4 тетрамера (33000). Средний выход реакции соединения составлял 96%, оптическая чистота 96% (средняя: 99%). Время удерживания: 23,0 минут; МС (MALDI TOF-MC) m/z. Рассчит. для C40H52N8O23P3S2 [М-Н]- 1201,15, найдено 1200,97. UPLC профиль показан на Фигуре 29.

* Получение "предварительно активированного (Rp)- или (Sp)-мономерного раствора" 8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфонат (25 мкмоль) обезвоживали путем повторных совместных выпариваний с безводным пиридином и безводным толуолом, затем растворяли в безводном MeCN-ЦМП (9:1, объем/объем). К данному раствору добавляли Ph3PCl2 (62,5 мкмоль) и перемешивали в течение 10 минут.Затем добавляли L-2 (30 мкмоль; D-2 в качестве "Sp" раствора) и перемешивали еще в течение 10 минут с получением предварительно активированного мономерного раствора.
Пример 103: Твердофазный синтез фосфоротиоатного тетрамера, (Sp, Rp, Sp)-[Tps]3T (фосфоротиоат) с использованием Пути А
Это соединение было получено по способу, подобному использованному для получения всех-(Sp)-[Tps]3T в Примере 102. Выход данного продукта определяли путем измерения УФ поглощательной способности при 260 нм с использованием приблизительного значения коэффициента молярной экстинкции для природного Т4 тетрамера (33000). Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного фосфорамидитного метода. Средний выход реакции соединения составлял 98%, оптическая чистота 94% (средняя: 98%). Время удерживания: 22,3 минут; МС (MALDI TOF-MC) m/z. Рассчит.для C40H52N8O23P3S3 [М-Н]- 1201.15, найдено 1200,97. UPLC профиль показан на Фигуре 30.
Пример 104: Твердофазный синтез фосфоротиоатного тетрамера, (Rp, Sp, Rp)-[Tps]3T (фосфоротиоат) с использованием Пути А
Это соединение было получено по способу, подобному использованному для получения всех-(Sp)-[Tps]T в Примере 102, Выход данного продукта определяли путем измерения УФ поглощательной способности при 260 им с использованием приблизительного значения коэффициента молярной экстинкции для природного Т4 тетрамера (33000). Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного фосфорамидитного метода. Средний выход реакции соединения составлял 97%, оптическая чистота 96% (средняя: 99%). Время удерживания: 21,7 минут; МС (MALDI TOF-MC) m/z. Рассчит. для C40H52N8O23P3S3 [М-Н]- 1201,15, найдено 1200,96. UPLC профиль показан на Фигуре 31.
Пример 105: Твердофазный синтез фосфоротиоатного тетрамера, все-(Rp)-[Tps]3Т (фосфоротиоат) с использованием Пути А
Это соединение было получено по способу, подобному использованному для получения всех-(Sp)-[Tps]3Т. Выход данного продукта определяли путем измерения УФ поглощательной способности при 260 нм с использованием приблизительного значения коэффициента молярной экстинкции для природного Т4 тетрамера (33000). Данный продукт был идентичен контрольному образцу, синтезированному с использованием обычного фосфорамидитного метода. Средний выход реакции соединения составлял 95%, оптическая чистота 92% (средняя: 97%). Время удерживания: 19,1 минут; МС (MALDI TOF-MC) m/z. Рассчит. для C40H52N8O23P3S3 [М-Н]+ 1201,15, найдено 1200,92. UPLC профиль показан на Фигуре 32.
Пример 106: Твердофазный синтез РНК фосфоротиоатного тетрамера, (Sp)-аммоний 2′-O-метилуридин-3′-ил уридин-5′-ил фосфоротиоата [(Sp)-9uMu] с использованием Пути А
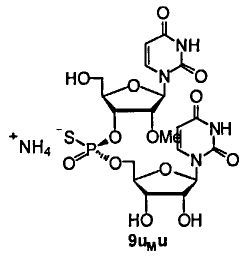
Насыщенная 2′-O-ацетил-N3-бензоил-5′-O-(4,4′-диметокситритил)уридином СКП смола (21,4 мг; 23,4 мкмоль/г, 0,5 мкмоль) с использованием сукцинилового линкера обрабатывалась 3% ДХК/ДХМ (3×1 мл), затем промывалась ДХМ (3×1 мл) и безводным MeCN (3×1 мл). После высушивания смолы под сниженным давлением (>5 минут) добавляли раствор предварительно активированного мономера (250 мкл, 25 мкмоль; который состоял из 8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)-2′-O-метилуридин-3′-ил фосфоната(25 мкмоль, в качестве Н-фосфонатного моноэфира), MeCN-пиридина (9:1, объем/объем, в качестве растворителя), Ph3PCl2 (62,5 мкмоль, в качестве конденсирующего реагента), и L-2 (30 мкмоль, в качестве аминоспирта)). После перемешивания в течение 5 минут реакционный раствор удаляли, и смолу промывали MeCN (3×1 мл), высушивали под сниженным давлением (>5 минут). Результирующее промежуточное соединение сульфурировали путем обработки 0,3 М ДТД / MeCN (500 мкл, 150 мкмоль) в течение 5 минут, затем промывали MeCN (3×1 мл) и ДХМ (3×1 мл). 5′-O-ДМТр группу удаляли путем обработки 3% ДХК/ДХМ (3×1 мл) и промывали ДХМ (3×1 мл), Фосфоротиоатный димер на смоле затем обрабатывали 25% NH3 (1 мл) в течение 12 ч при 55°С для удаления хирального вспомогательного соединения и защитных групп на данных нуклеооснованиях, а также для освобождения димера от смолы. Смолу удаляли путем фильтрации и промывали H2O. Фильтрат концентрировали досуха. Остаток растворяли в H2O (2 мл), промывали Et2O (3×2 мл) и объединенные промывки подвергали обратному экстрагированию H2O (2 мл). Объединенные водные слои концентрировали досуха. Результирующий неочищенный продукт анализировали методом UPLC® с обращенной фазой с линейным градиентом 0-20% МеОН в 0,1 М аммоний ацетатном буфере (рН 7,0) в течение 15 минут при 55°С и скорости 0,4 мл/мин. Выход (Sp)-9uMu составлял 95% (Rp:Sp=2:98). Время удерживания: 10,2 минут ((Rp)-9uMu: 9,3 минут); МС (MALDI TOF-MC) m/z. Рассчит. для C19H24N4O13PS [M-H]- 579,08, найдено 578,92. UPLC профиль показан на Фигуре 33.
Пример 107: Твердофазный синтез РНК фосфоротиоатного тетрамера, (Rp)-аммоний 2′-O-метилуридин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-9uMu] с использованием Пути А.
Это соединение было получено с использованием "D-2 (30 мкмоль)" вместо "L-2 (30 мкмоль)" по способу, подобному Примеру 106. Выход (Rp)-9uMu составлял 94% (Rp:Sp=95:5). Время удерживания: 9,3 минут ((Sp)-9uMu: 10,3 минут); МС (MALDI TOF-MC) m/z. Рассчит. для C19H24N4O13PS[M-H]- 579,08, найдено 578,97. UPLC профиль показан на Фигуре 34.
Пример 108: Твердофазный синтез РНК фосфоротиоатного тетрамера, (Sp)-аммоний 2′-дезокси-2′-фтороуридин-3′-ил уридин-5′-ил фосфоротиоата [(Sp)-10uFu] с использованием Пути А
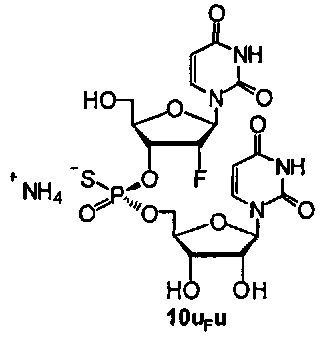
Это соединение было получено с использованием "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)-2′-дезокси-2′-фтороуридин-3′-ил фосфоната (25 мкмоль)" вместо "8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)-2′-O-метилуридин-3′-ил фосфоната (25 мкмоль)" по способу, подобному Примеру 106. Выход (Sp)-10uFu составлял 93% (Rp:5р=1:99). Время удерживания: 10,6 минут ((Rp)-10uFu: 8,5 минут); МС (MALDI TOF-MC) m/z. Рассчит. для C18H21FN4O12PS [M-H]- 567,06, найдено 566,96. UPLC профиль показан на Фигуре 35. Пример 109: Твердофазный синтез РНК фосфоротиоатного тетрамера, (Rp)-аммоний 2′-дезокси-2′-фтороуридин-3′-ил уридин-5′-ил фосфоротиоата [(Rp)-10uFu] с использованием Пути А
Данное соединение было получено с использованием "D-2 (30 мкмоль)" вместо "L-2 (30 мкмоль)" по способу, подобному Примеру 108. Выход (Rp)-10uFu] составлял 92%, Rp:Sp=96:4. Время удерживания: 8,4 минут ((Sp)-10uFu: 10,7 минут); МС (MALDI TOF-MC) m/z. Рассчит. для C18H21FN4O12PS [M-H]- 567,06, найдено 566,97. UPLC профиль показан на Фигуре 36.
Пример 110: Синтез из раствора неприродного основания (Sp)-аммоний 1-(3-нитропиррол-1-ил)-2-дезоксирибофураноз-3-ил тимидин-5′-ил фосфоротиоата [(Sp)-11nt] с использованием Пути А
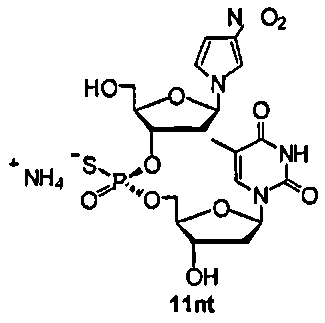
Это соединение было получено с использованием "8-диазабицикло[5.4.0]ундец-7-ений 5-O-(4,4′диметокситритил)-1-(3-нитропиррол-1-ил)-2-дезоксирибофураноз-3-ил фосфоната (25 мкмоль)" вместо ”8-диазабицикло[5.4.0]ундец-7-ений N3-бензоил-5′-O-(4,4′-диметокситритил)тимидин-3′-ил фосфоната (25 мкмоль)" по способу, подобному Примеру 78. Выход данного продукта определяли путем измерения УФ поглощательной способности при 260 нм с использованием приблизительного значения коэффициента молярной экстинкции для природного СТ димера (15200). Выход (Sp)-11nt составлял 98%. Время удерживания: 16,3 минут. (Rp)-11nt не удалось разрешить; МС (MALDI TOF-МС) m/z. Рассчит.для C19H24N4O11PS [М-Н]-547,09, найдено 547,02. UPLC профиль показан на Фигуре 37.
Пример 111: Синтез из раствора неприродного нуклеооснования (Rp)-аммоний 1-(3-нитропиррол-1-ил)-2-дезоксирибофураноз-3-ил тимидин-5′-ил фосфоротиоата [(Rp)-11nt] с использованием Пути А Это соединение было получено с использованием "D-2 (30 мкмоль)" вместо "L-2 (30 мкмоль)" по способу, подобному Примеру 110. Выход данного продукта оперделяли путем измерения УФ поглощательной способности при 260 нм с использованием приблизительного значения коэффициента молярной экстинкции для природного СТ димера (15200). Выход (Rp)-11nt составлял 97%. Время удерживания: 16,1 минут, (Rp)-11nt не удалось разделить; МС (MALDI TOF-MC) m/z. Рассчит. для C19H24N4O11PS [M-H]- 547,09, найдено 547,01. UPLC профиль показан на Фигуре 38.
Хотя в данной заявке были представлены и описаны предпочтительные варианты настоящего изобретения, специалистам в данной области очевидно, что такие варианты представлены лишь в качестве примера. Для специалистов в данной области возможны многочисленные вариации, изменения и замены без отклонения от сути изобретения. Следует понимать, что в практическом приложении данного изобретения могут применяться различные альтернативы описанным вариантам изобретения. Предполагается, что прилагаемая формула изобретения определяет объем данного изобретения и что ею охватываются способы, структуры и их эквиваленты в рамках данной формулы.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОЛЕКАРСТВА НУКЛЕИНОВЫХ КИСЛОТ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2612521C2 |
| АСИММЕТРИЧНАЯ ВСПОМОГАТЕЛЬНАЯ ГРУППА | 2013 |
|
RU2693381C2 |
| КОМПОЗИЦИИ ОЛИГОНУКЛЕОТИДОВ И СПОСОБЫ С НИМИ | 2016 |
|
RU2830607C2 |
| КОМПОЗИЦИИ ОЛИГОНУКЛЕОТИДОВ И СПОСОБЫ С НИМИ | 2016 |
|
RU2797833C1 |
| СОПРЯЖЕННЫЕ АНТИСМЫСЛОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2697152C2 |
| ПРОЛЕКАРСТВА PTH | 2017 |
|
RU2747316C2 |
| МОДИФИЦИРОВАННЫЕ ОЛИГОНУКЛЕОТИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2708237C2 |
| МОДИФИЦИРОВАННЫЕ ОЛИГОНУКЛЕОТИДЫ, АКТИВИРУЮЩИЕ РНКазу Н | 2017 |
|
RU2740501C2 |
| VEGF-НЕЙТРАЛИЗУЮЩИЕ ПРОЛЕКАРСТВА ДЛЯ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2673881C2 |
| ИЗОКСАЗОЛИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ АМИДГИДРОЛАЗЫ ЖИРНЫХ КИСЛОТ | 2010 |
|
RU2539595C2 |
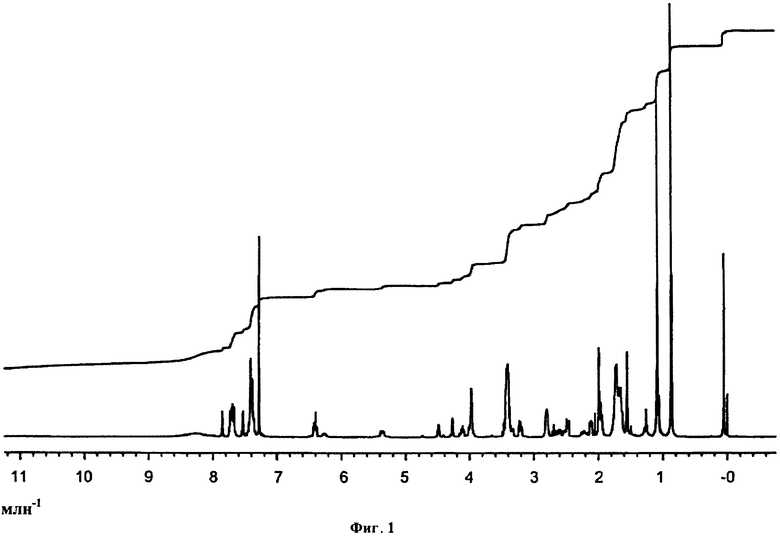
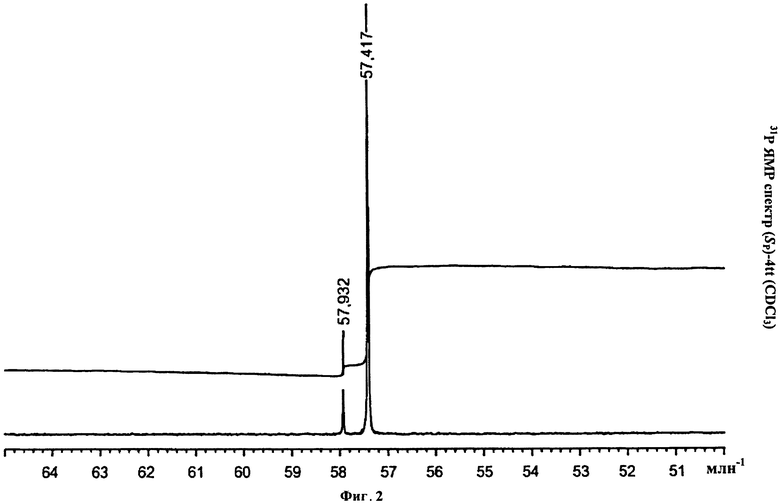
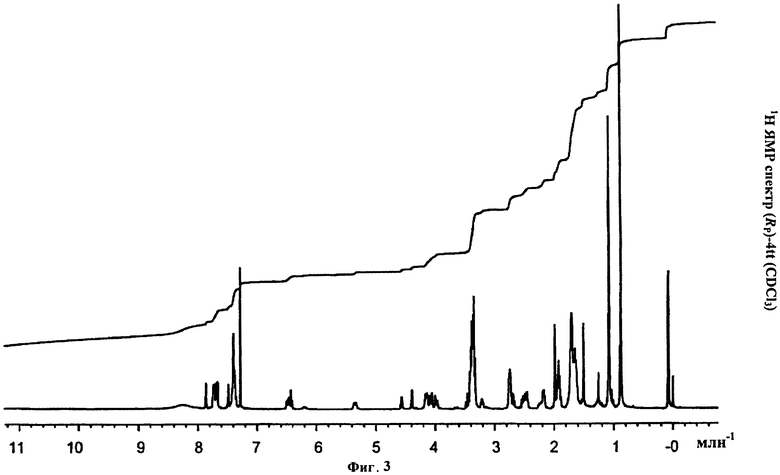
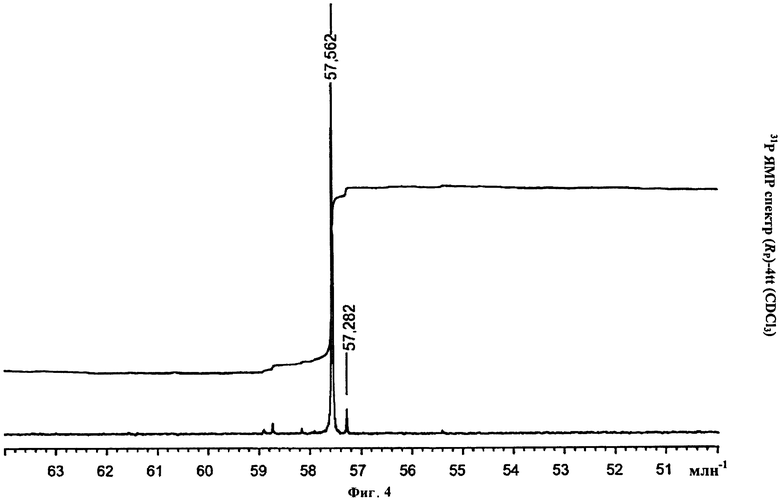
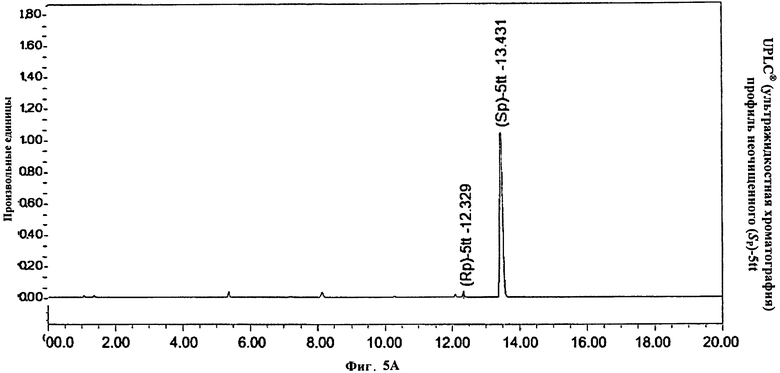
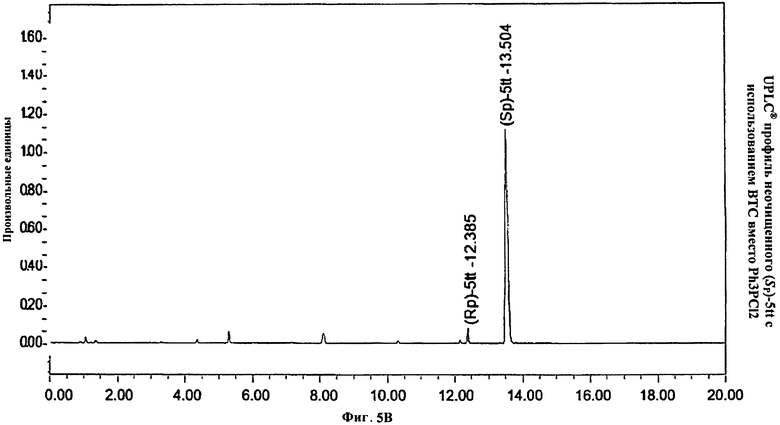
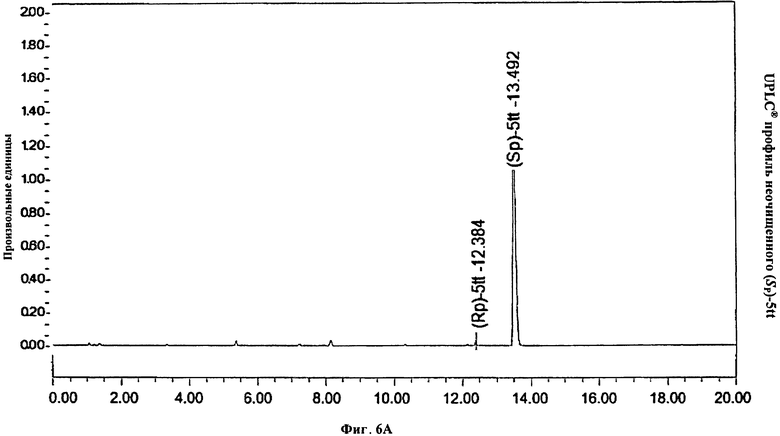
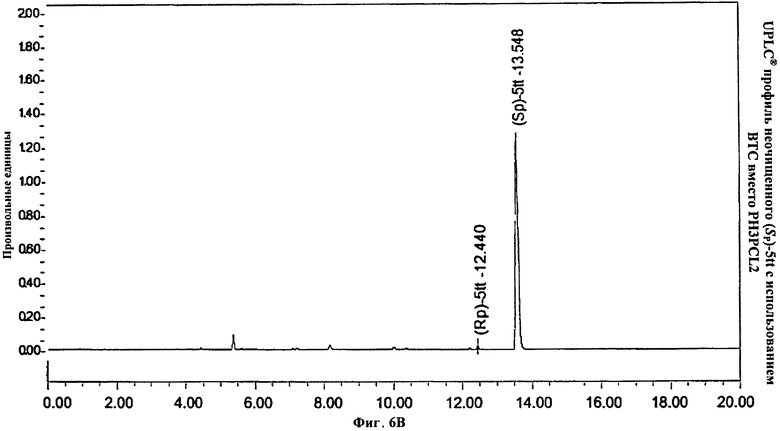

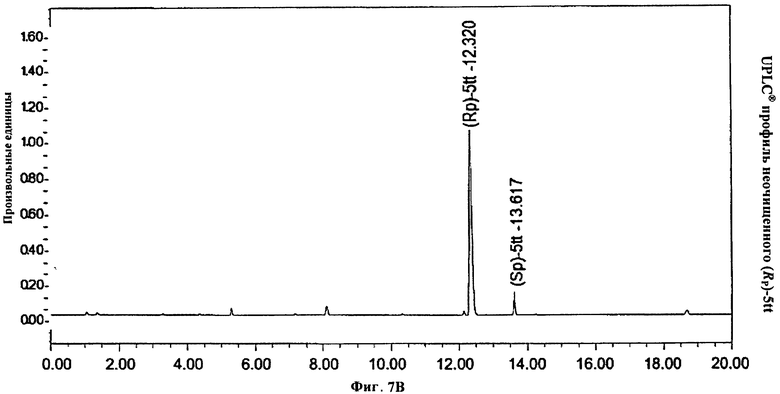
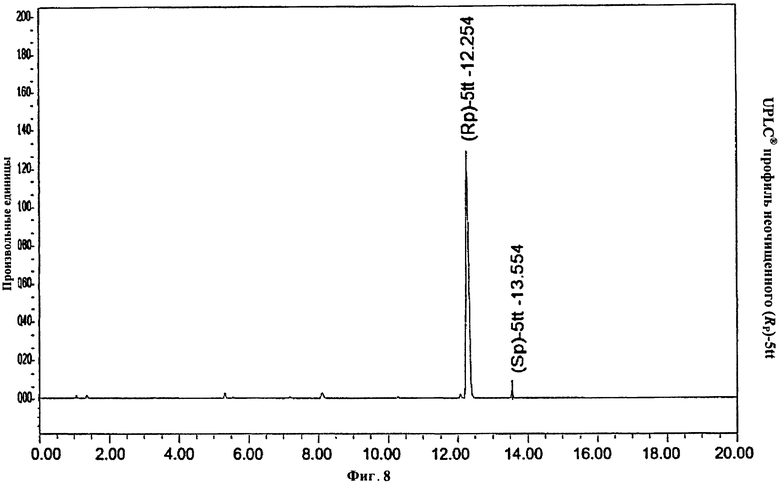
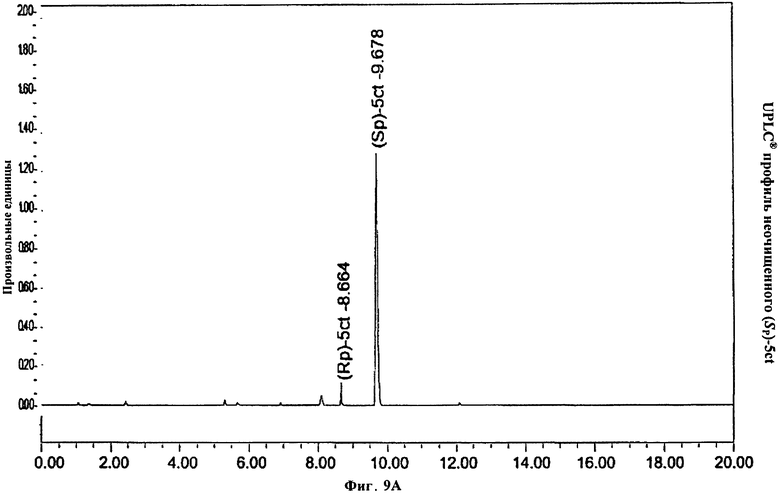
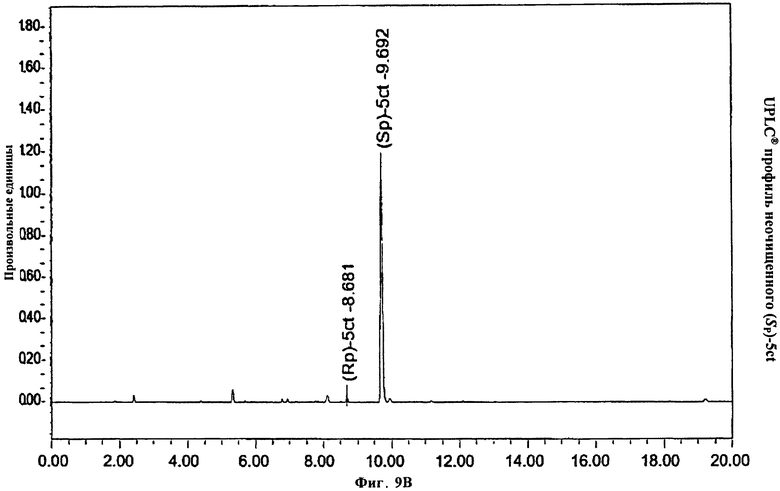
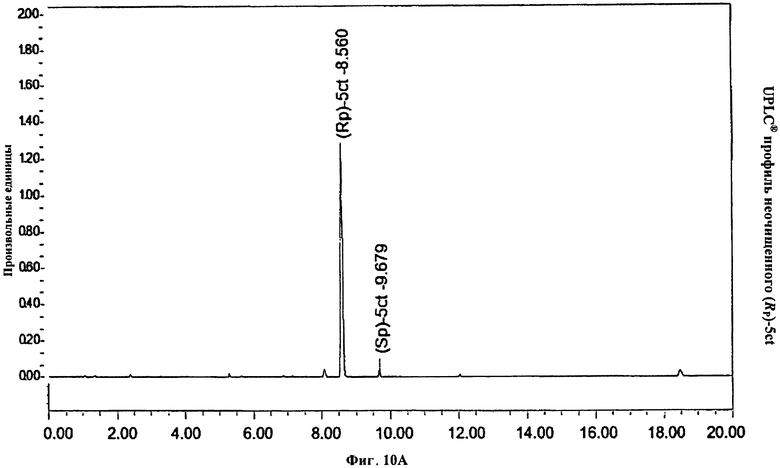
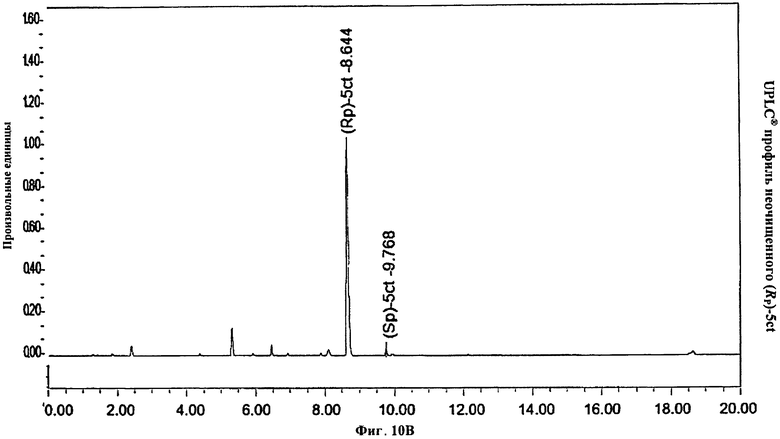
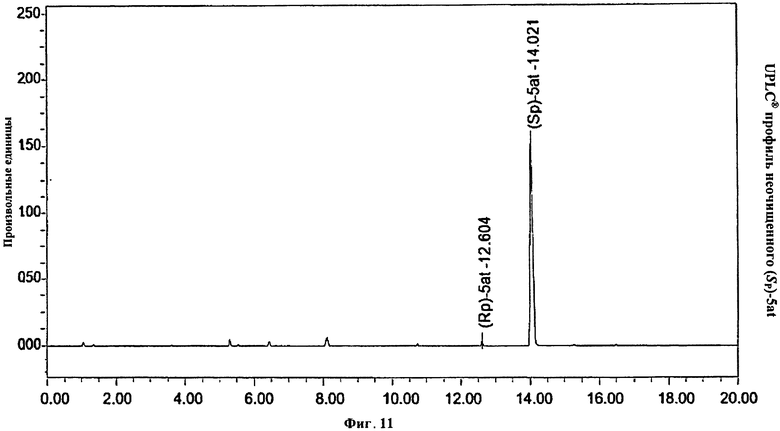
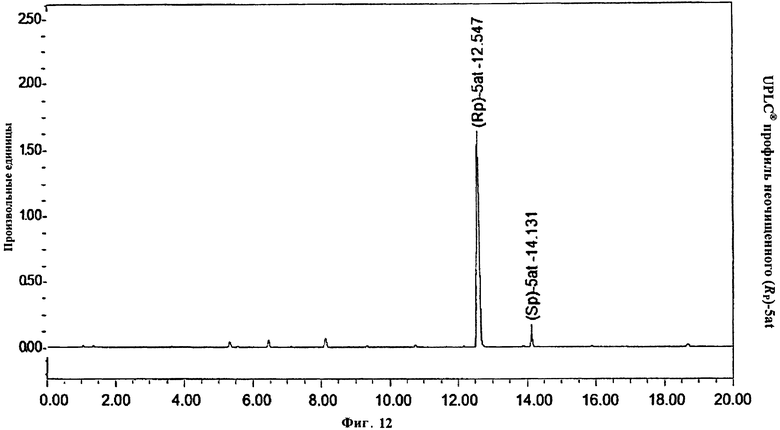
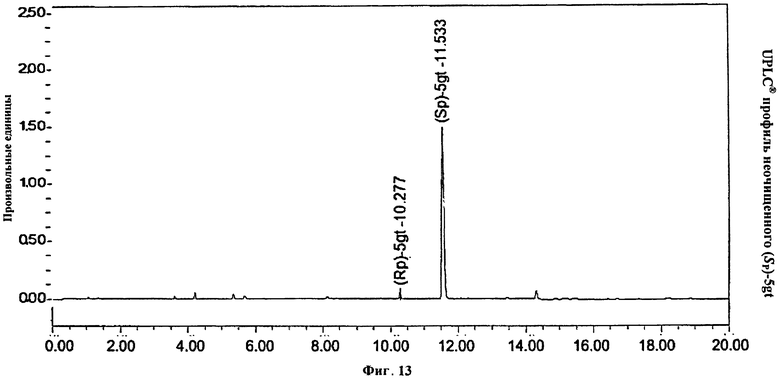
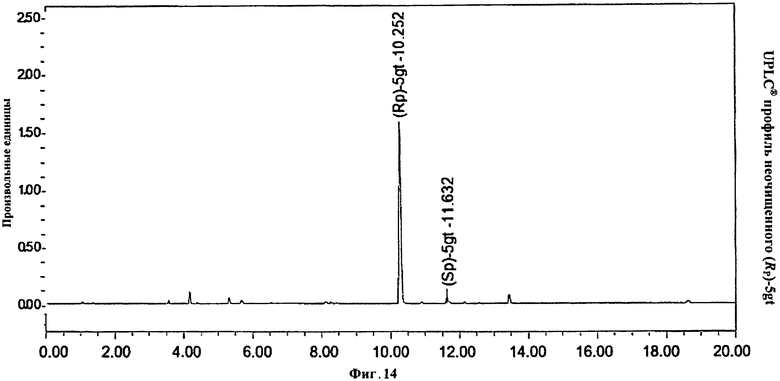
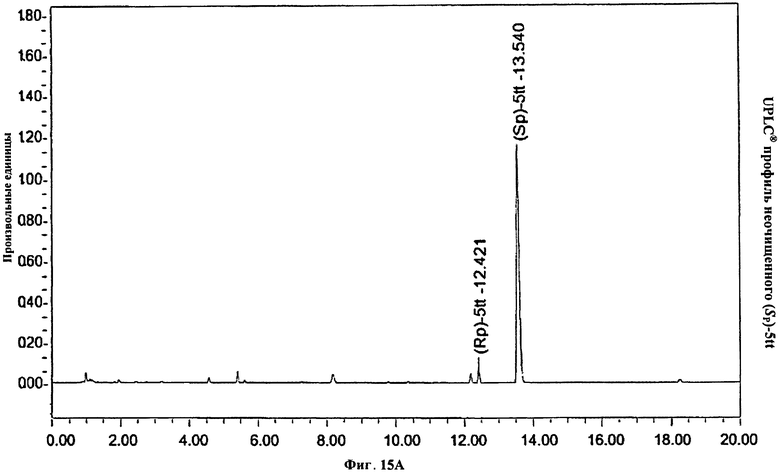
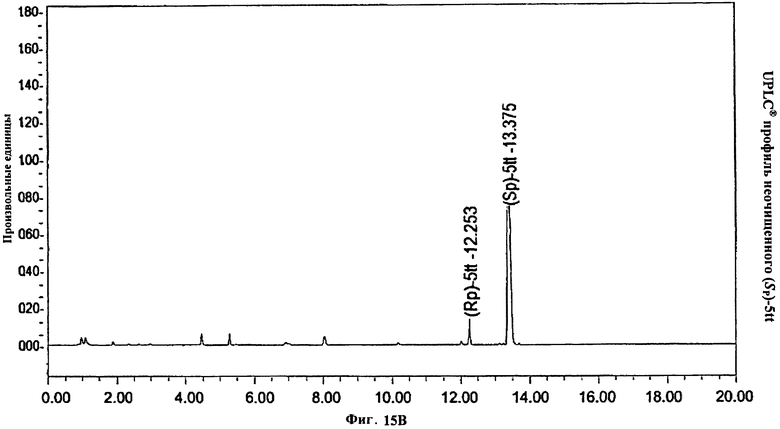
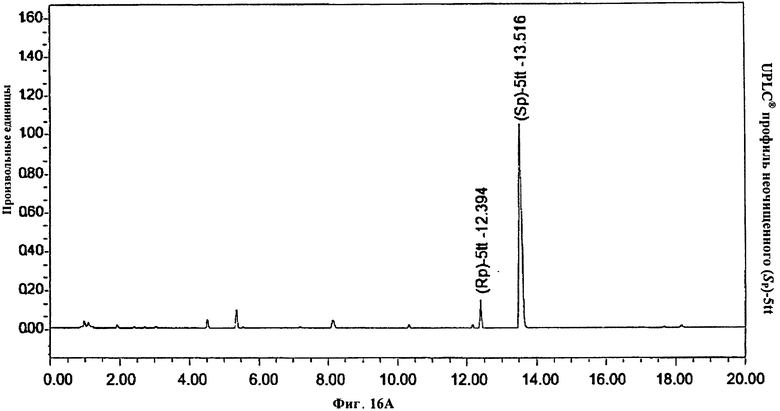
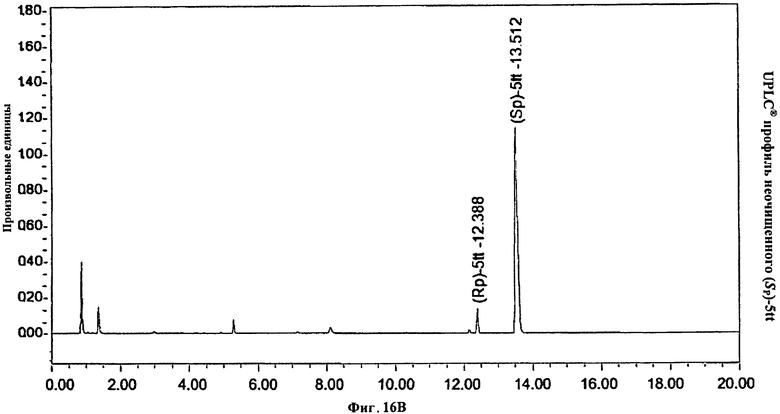
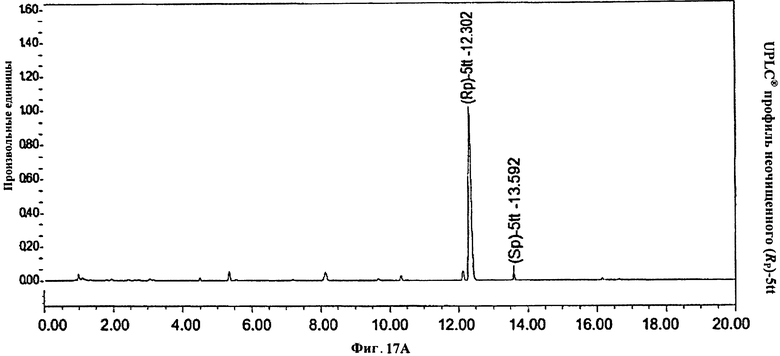
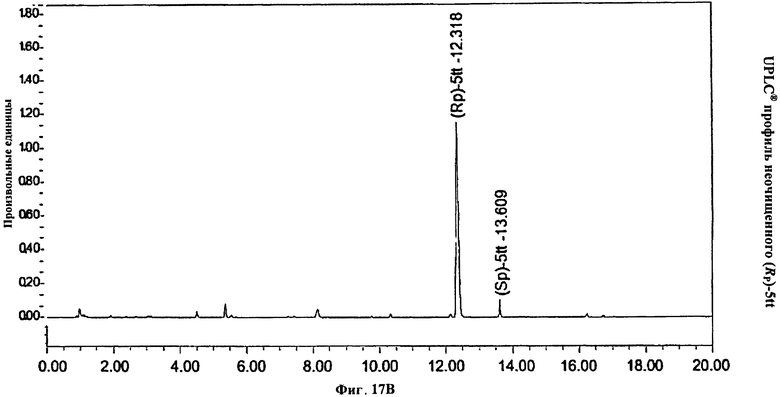
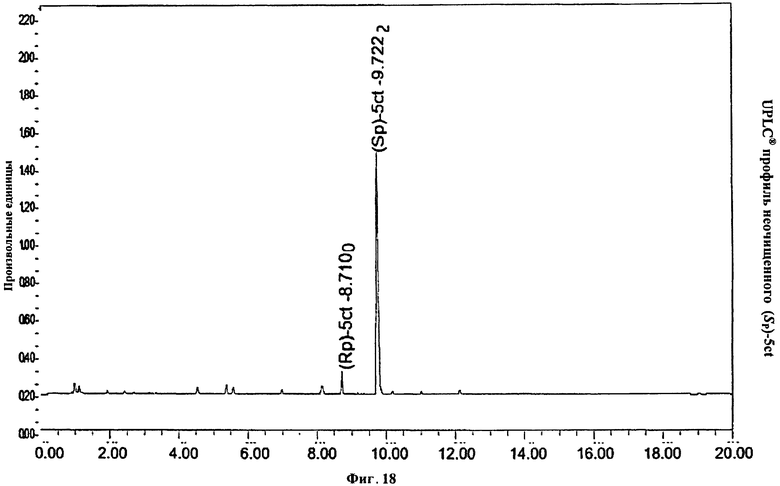
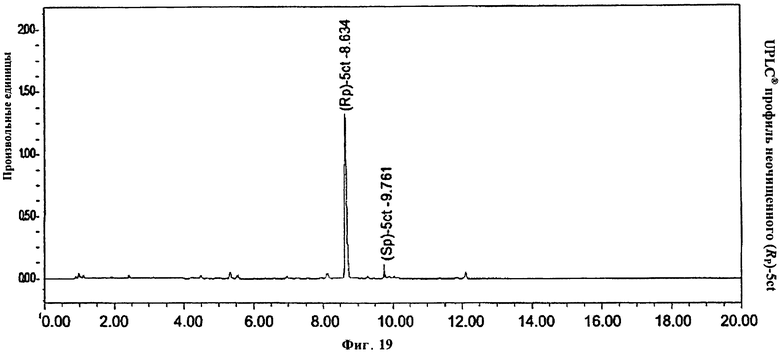
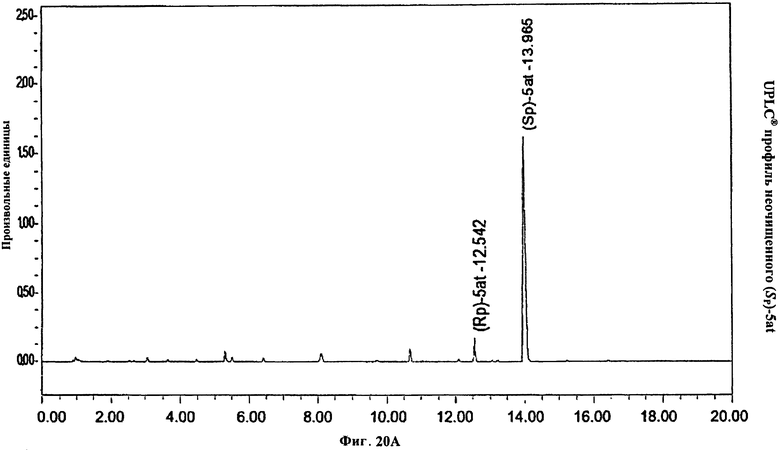
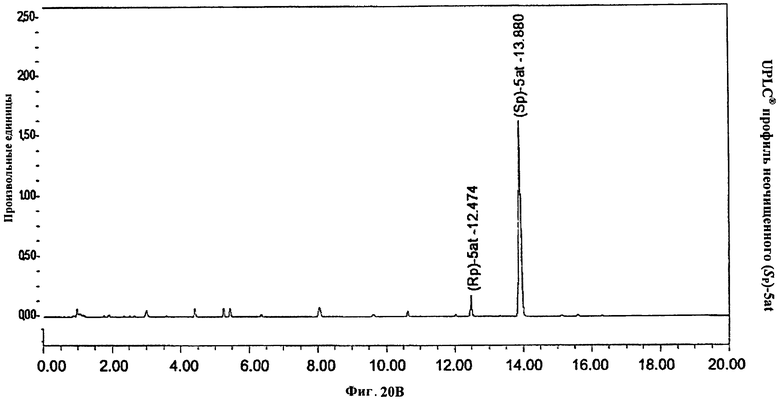
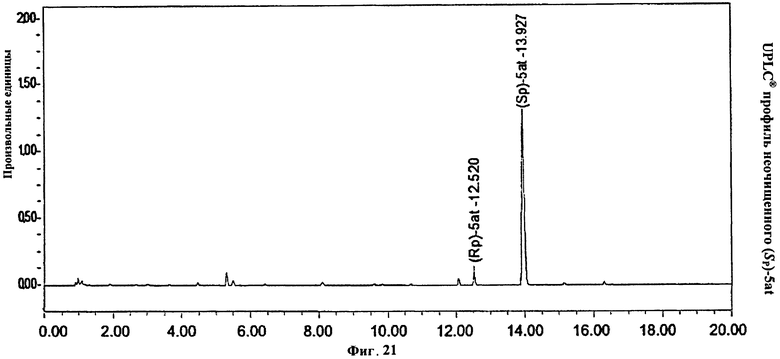
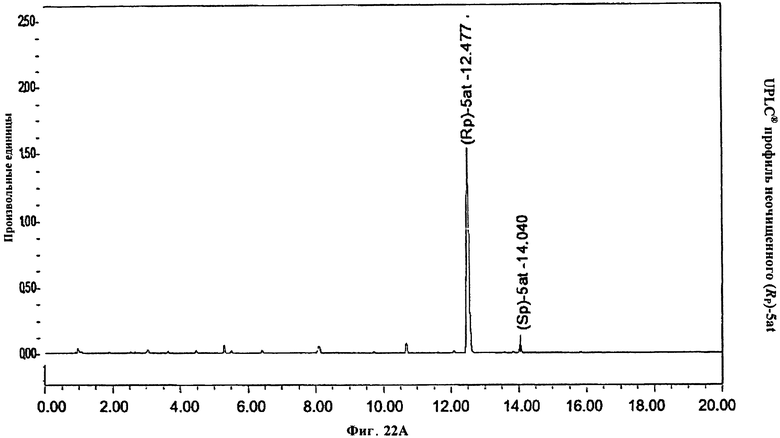
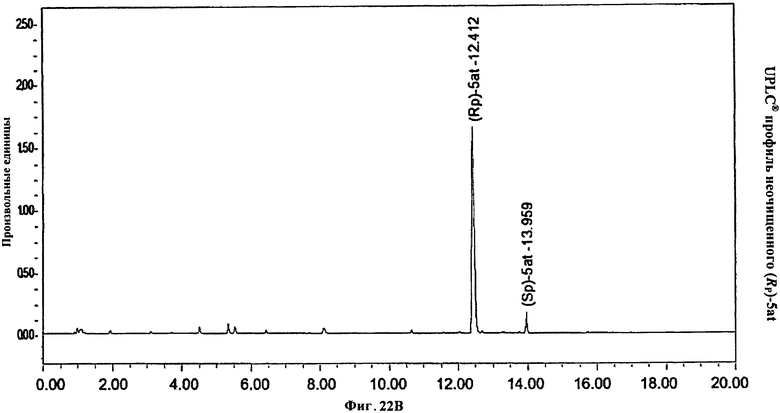
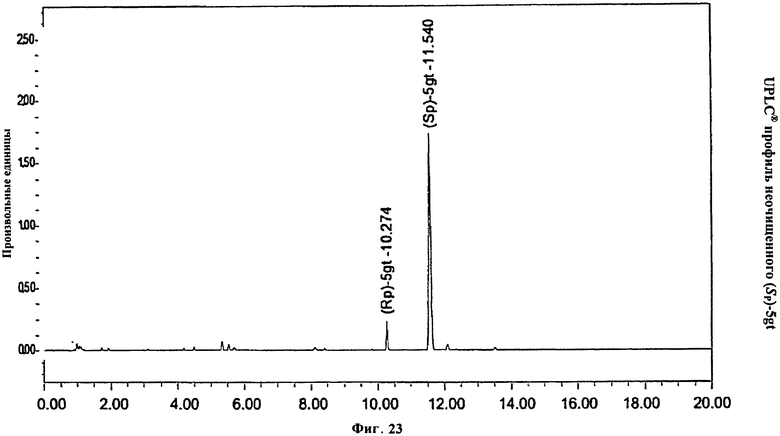
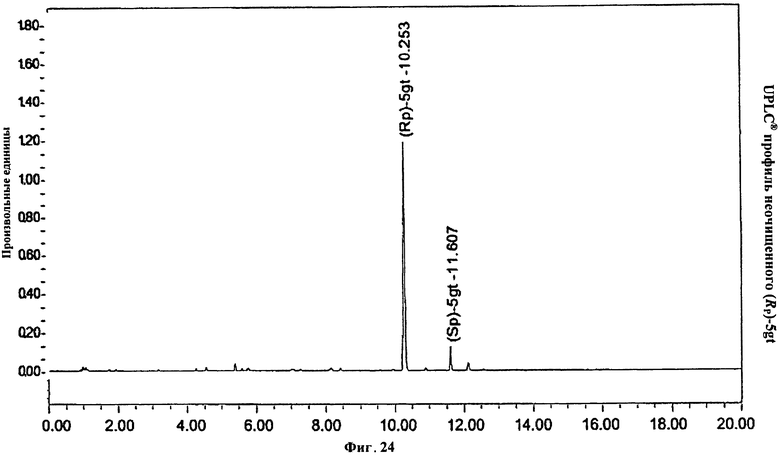
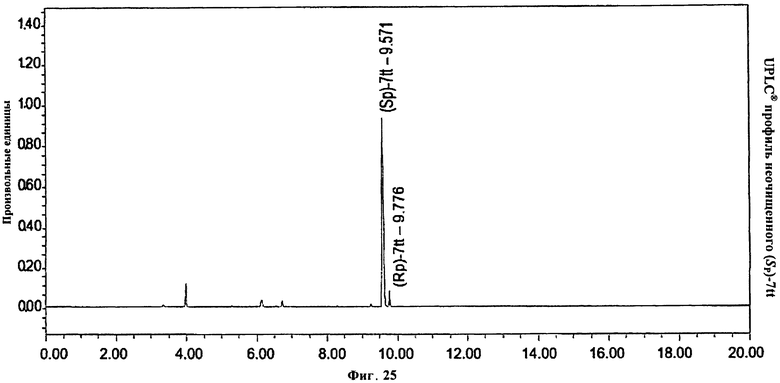
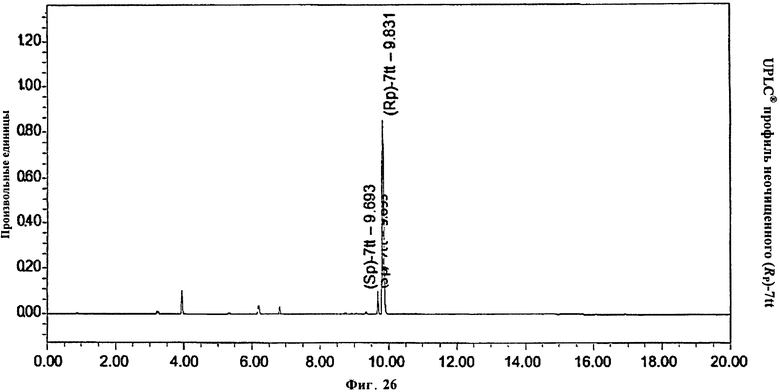

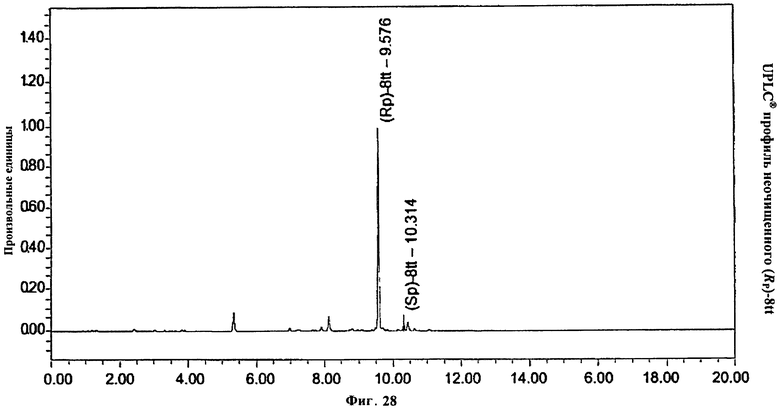
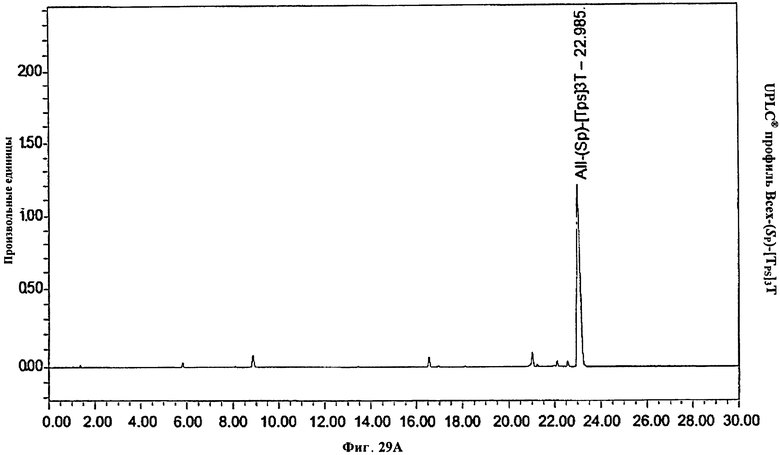
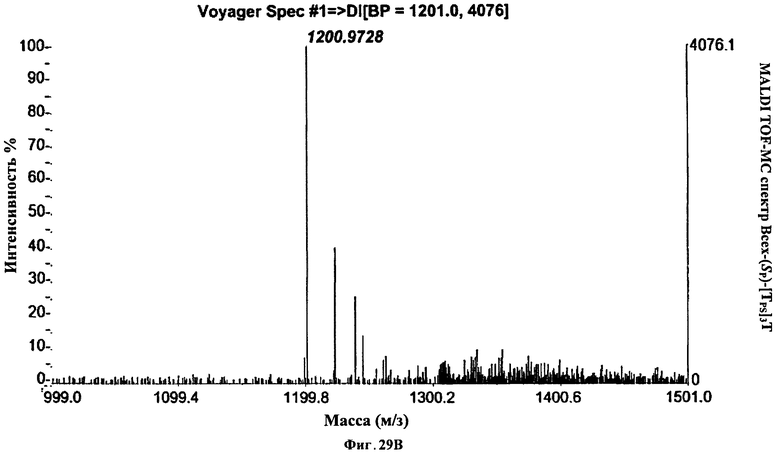
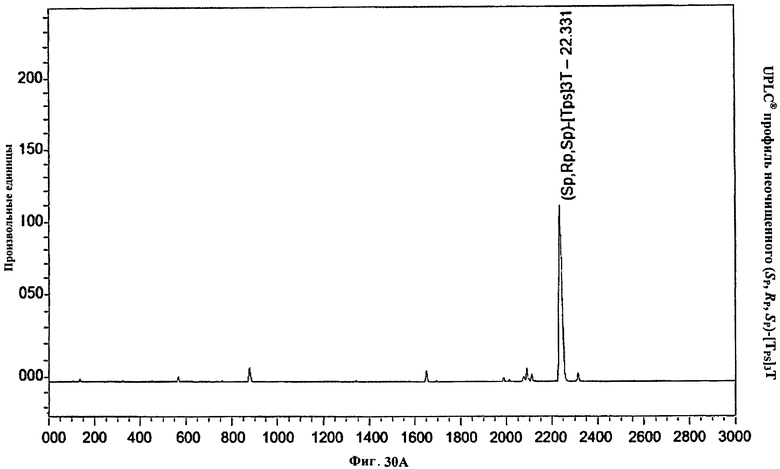
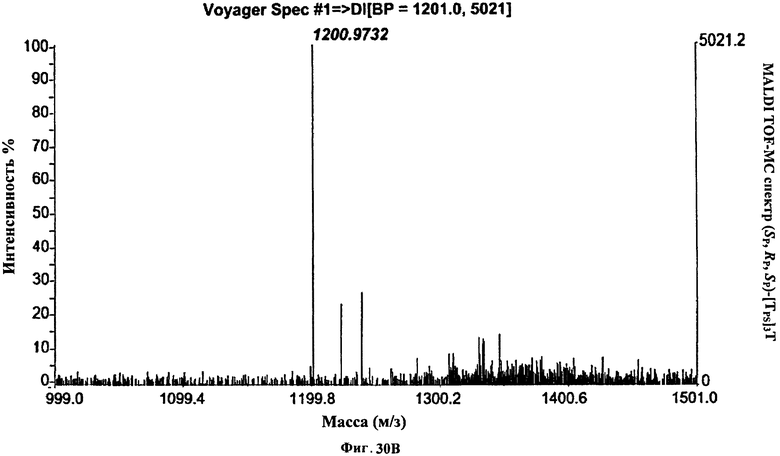
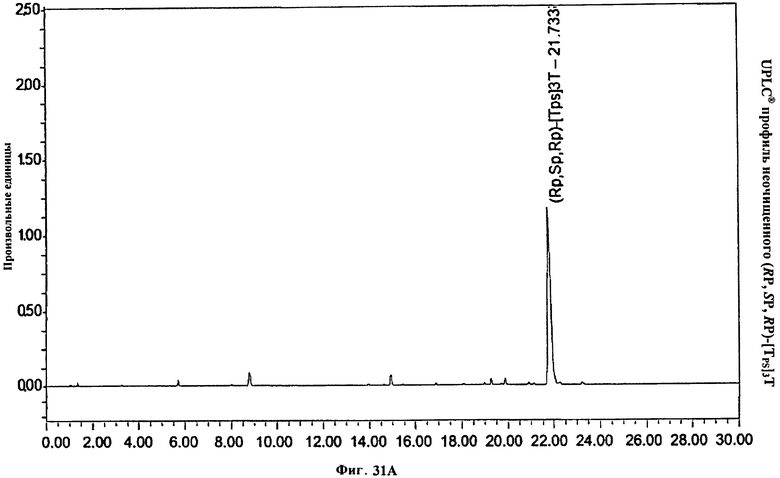
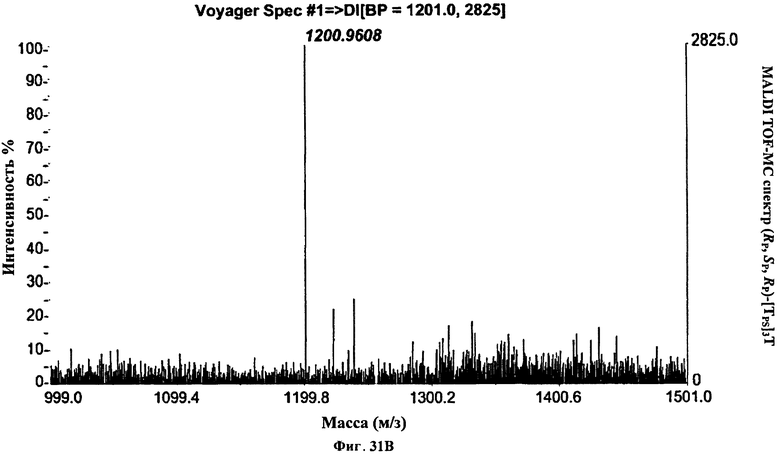
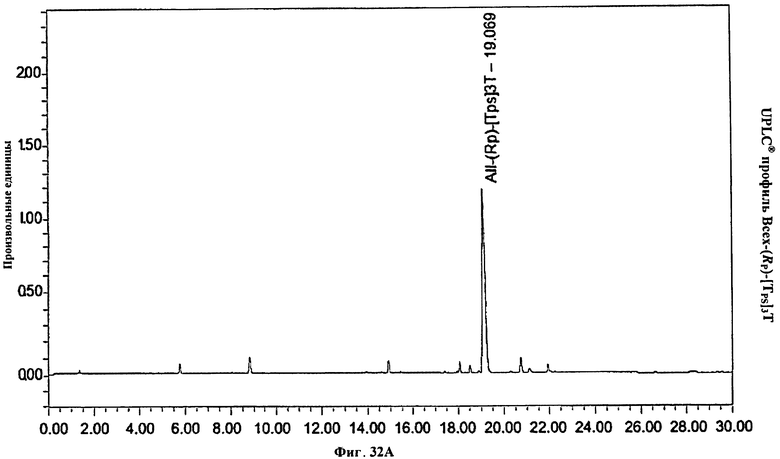
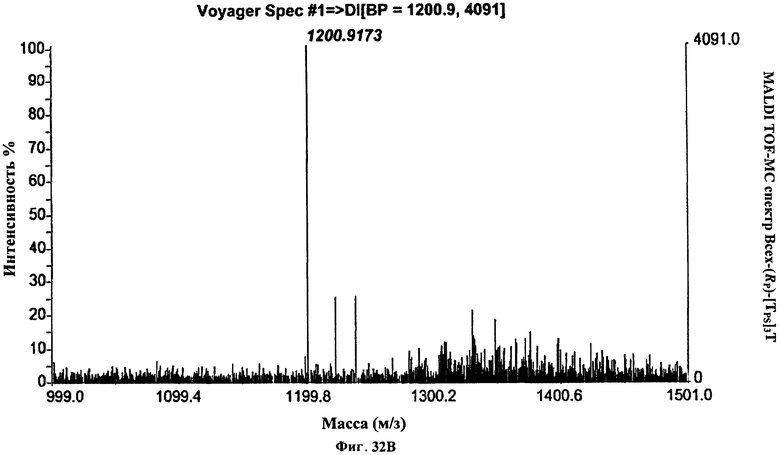

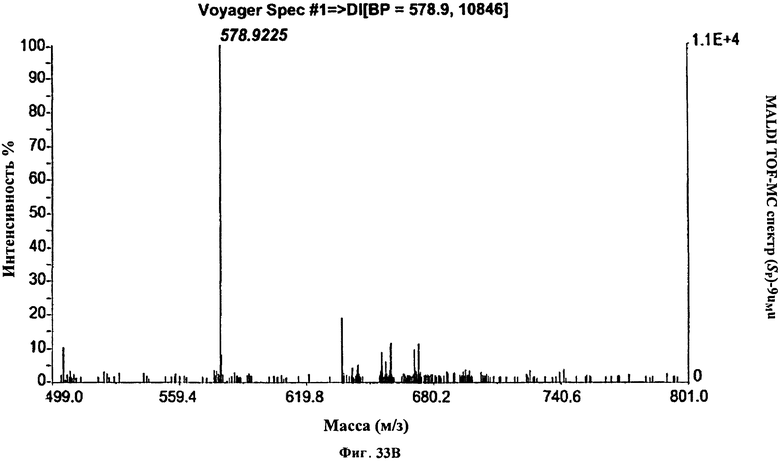
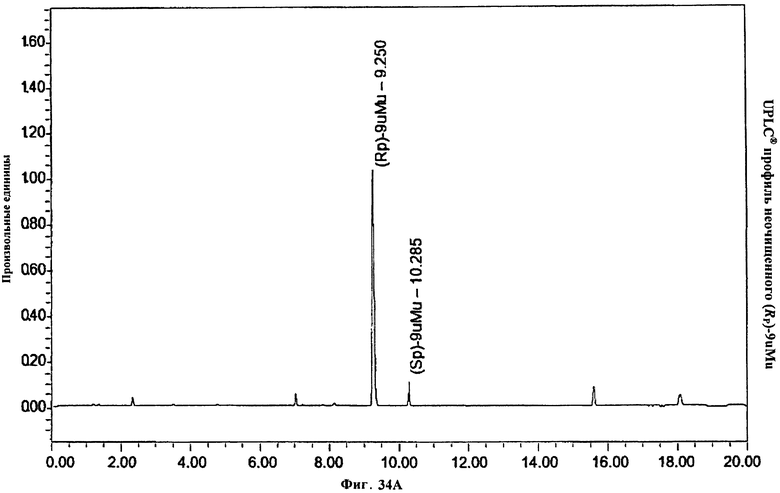
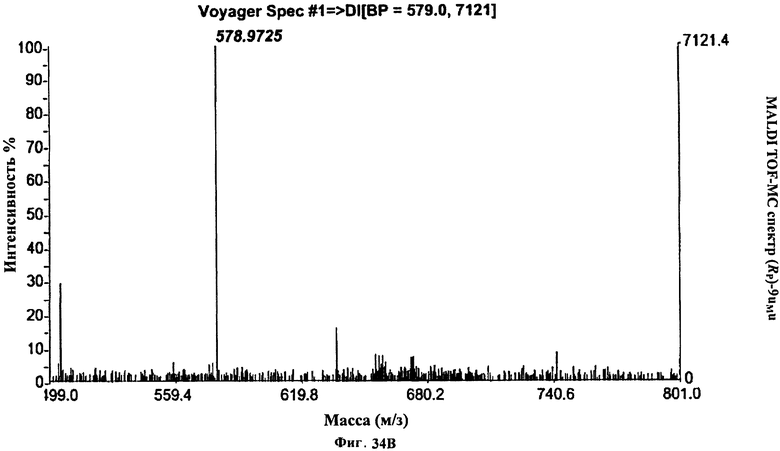
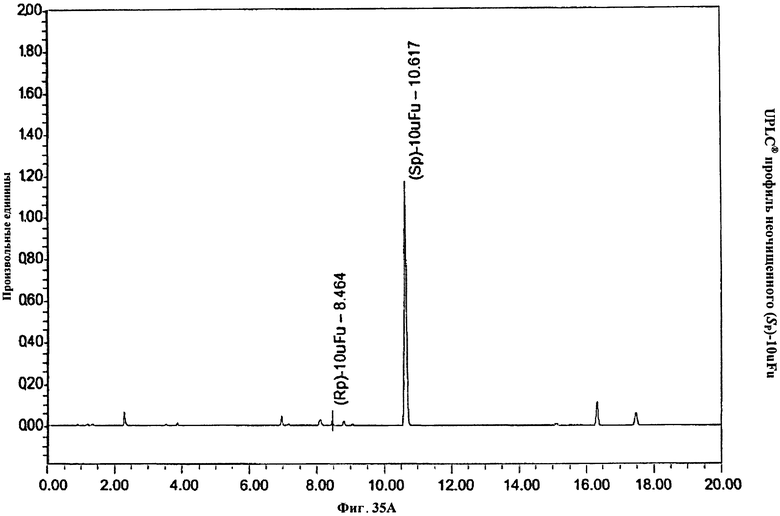
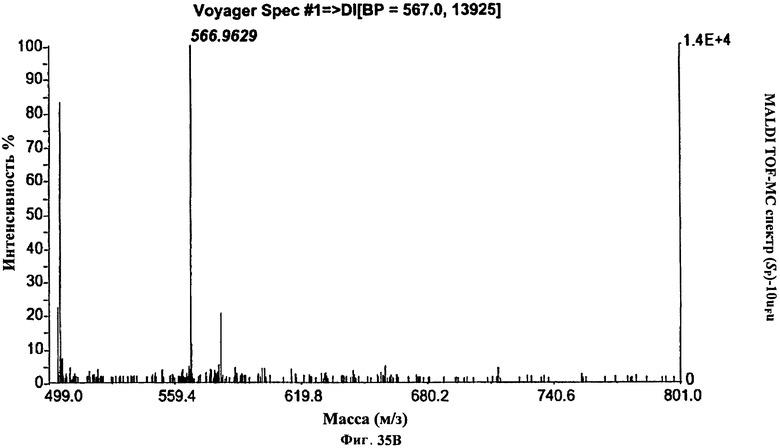
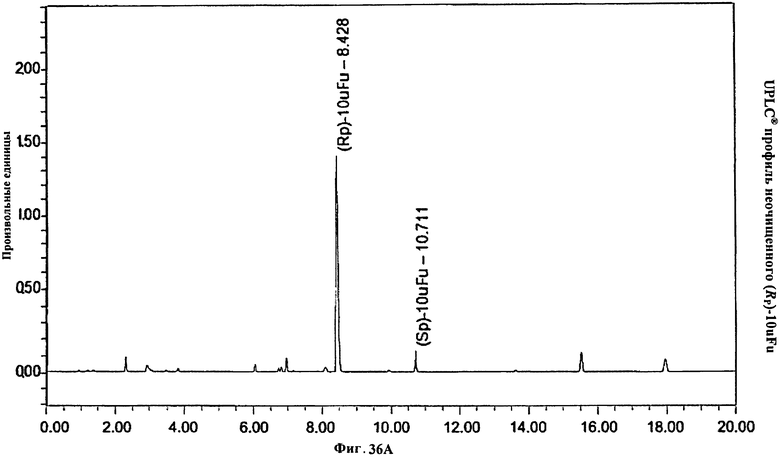
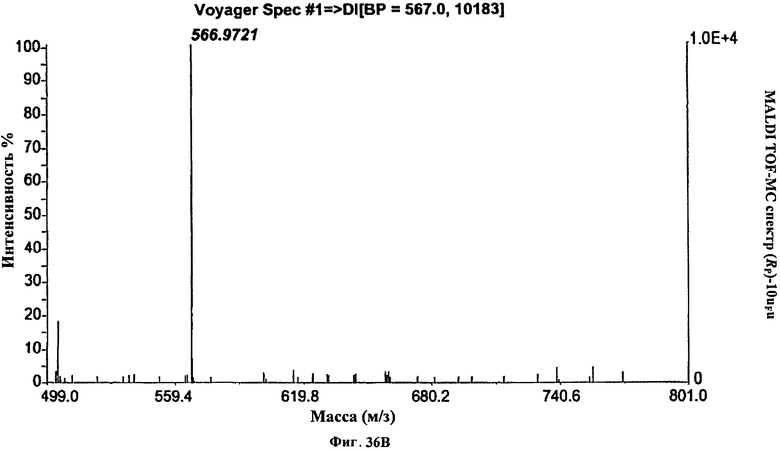
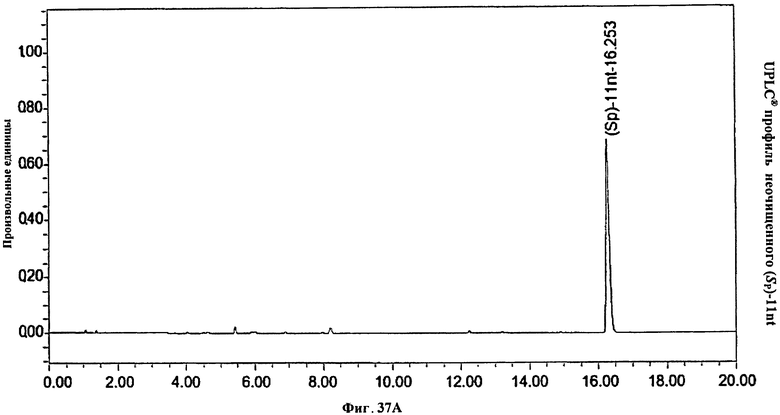

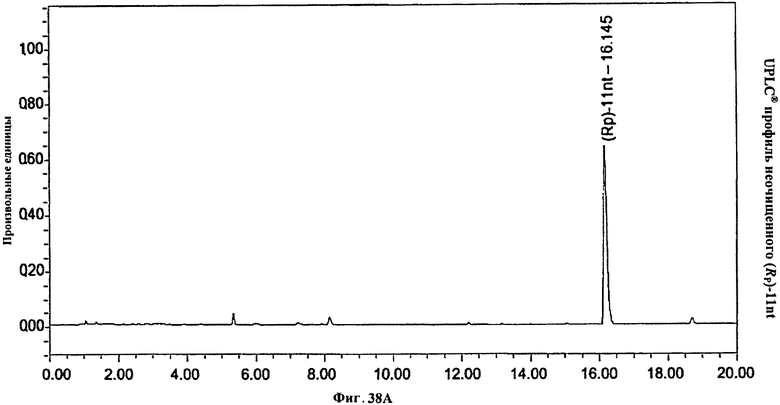
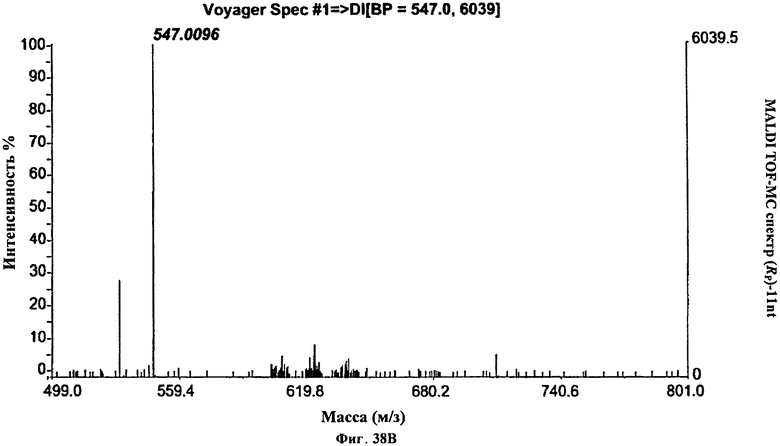
Изобретение относится к способу синтеза нуклеиновой кислоты, содержащей хиральную X-фосфонатную составляющую, который может быть использован в фармацевтической промышленности. Предложенный способ включает реакцию молекулы, содержащей ахиральную H-фосфонатную составляющую, хирального реагента, конденсирующего реагента, активирующего молекулу, содержащую ахиральную H-фосфонатную составляющую для реакции с указанным хиральным реагентом, и нуклеозида, содержащего 5′-OH составляющую, с получением конденсированного промежуточного соединения; и превращение данного конденсированного промежуточного соединения в нуклеиновую кислоту, содержащую хиральную X-фосфонатную составляющую. Предложен новый эффективный способ получения модифицированных нуклеиновых кислот. 63 з.п. ф-лы, 58 ил., 3 табл., 111 пр.
1. Способ синтеза нуклеиновой кислоты, содержащей хиральную X-фосфонатную составляющую, который включает реакцию молекулы, содержащей ахиральную H-фосфонатную составляющую, хирального реагента, конденсирующего реагента, активирующего молекулу, содержащую ахиральную H-фосфонатную составляющую для реакции с указанным хиральным реагентом, и нуклеозида, содержащего 5′-OH составляющую, с получением конденсированного промежуточного соединения; и превращение данного конденсированного промежуточного соединения в нуклеиновую кислоту, содержащую хиральную X-фосфонатную составляющую, где нуклеиновая кислота, содержащая хиральную X-фосфонатную составляющую, представляет собой соединение Формулы 1
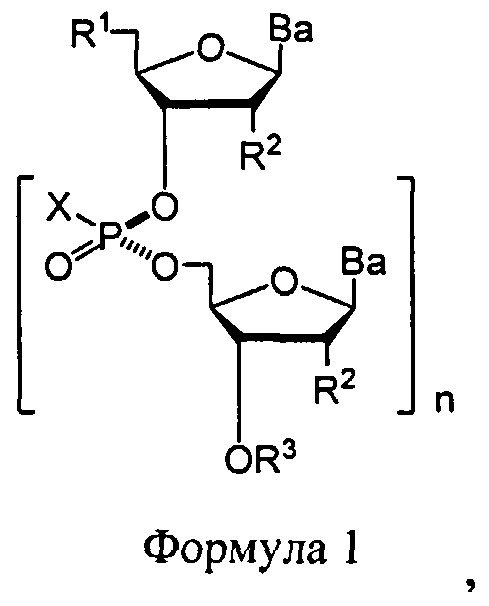
где молекула, содержащая ахиральную H-фосфонатную составляющую, представляет собой соединение Формулы 2
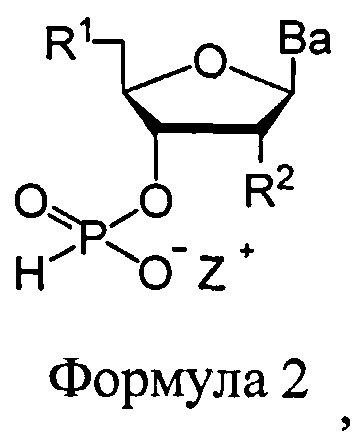
где нуклеозид, содержащий 5′-OH составляющую, представляет собой соединение Формулы 4
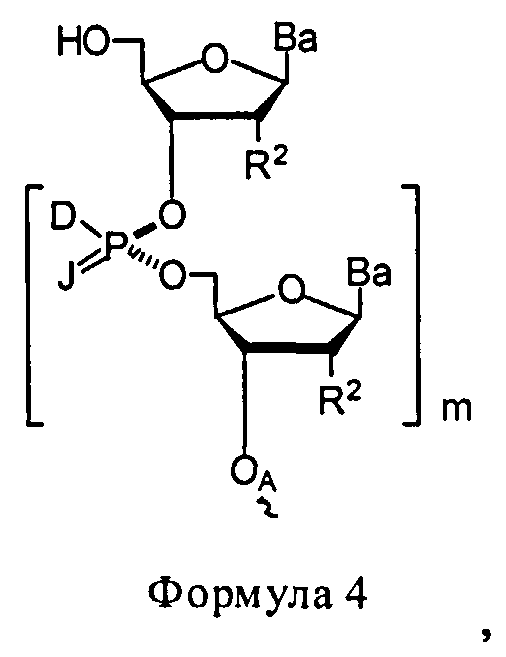
где хиральный реагент представляет собой соединение Формулы 3
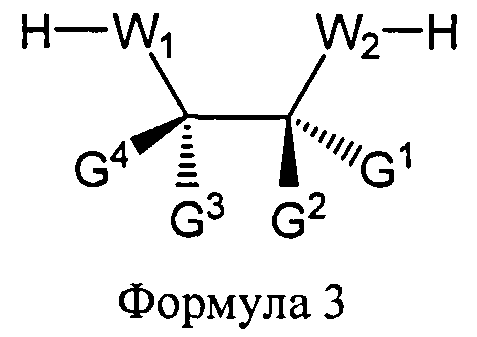
где конденсированное промежуточное соединение представляет собой соединение Формулы 5
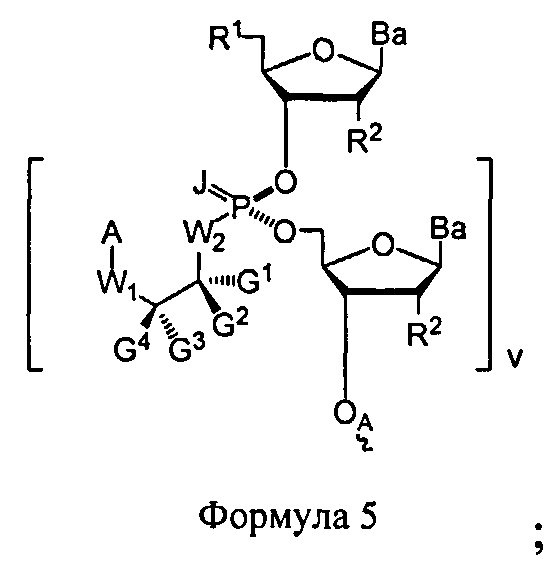
и подкисление конденсированного промежуточного продукта с получением нуклеиновой кислоты, содержащей хиральную X-фосфонатную составляющую, где
каждый R1 представляет собой -OH, -SH, -NRdRd, -N3, галоген, водород, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил, (C1-C10)алкил-Y1-, (C2-C10)алкенил-Y1-, (C2-C10)алкинил-Y1-, (C6-C10)арил-Y1-, (5-18-членный)гетероарил-Y1- с кольцевым атомом, которым является N, O или S, -P(O)(Re)2, -HP(O)(Re), -ORa, или -SRc;
Y1 является O, NRd, S или Se;
Ra является блокирующей составляющей;
Rc является блокирующей группой;
в каждом случае Rd представляет собой, независимо, водород, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил, (C6-C10)арил, (C2-C10)ацил, замещенный силил, карбамат, -P(O)(Re)2 или -HP(O)(Re);
в каждом случае Re представляет собой, независимо, водород, (C1-C10)алкил, (C6-C10)арил, (C2-C10)алкенил, (C2-C10)алкинил, (C1-C10)алкил-Y2-, (C2-C10)алкенил-Y2-, (C2-C10)алкинил-Y2-, (C6-C10)арил-Y2- или (5-18-членный)гетероарил-Y2- с кольцевым атомом, которым является N, O, или S, или катион, который представляет собой Na+1, Li+1 или К+1;
Y2 является O, NRd или S;
в каждом случае R2 представляет собой, независимо, водород, OH, -SH, -NRdRd, -N3, галоген, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил, (C1-C10)алкил-Y1-, (C2-C10)алкенил-Y1-, (C2-C10)алкинил-Y1-, (C6-C10)арил-Y1-, (5-18-членный)гетероарил-Y1- с кольцевым атомом, которым является N, O, или S, -ORb, или -SRc, любой из которых является незамещенным или замещенным авидином или биотином, любой из которых является незамещенным или замещенным флуоресцентной или биомолекулярной связывающей составляющими;
где Rb является блокирующей составляющей;
в каждом случае Ba является независимо аденином, цитозином, гуанином, тимином или урацилом, которые являются замещенными или незамещенными блокирующей группой, или являются незамещенными или замещенными флуоресцентной или биомолекулярной связывающей составляющими;
в каждом случае X представляет собой, независимо, (C1-C10)алкил, (C1-C10)алкокси, (C6-C10)арил, (C1-C10)алкилтио, (C2-C10)ацил, -NRfRf, (C2-C10)алкенилокси, (C2-C10)алкинилокси, (C2-C10)алкенилтио, (C2-C10)алкинилтио, -S-Z+, -Se-Z+ или -BH3 -Z+, где связь между B и P является одинарной;
в каждом случае Rf представляет собой, независимо, водород, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил, или (C6-C10)арил;
Z+ является аммоний ионом, (C1-C10)алкиламмоний ионом, (5-18-членным)гетероароматическим иминий ионом с кольцевым атомом, которым является N, O или S, или (5-18-членным)гетероциклическим иминий ионом с кольцевым атомом, которым является N, O или S, каждый из которых является первичным, вторичным, третичным или четвертичным, или Z+ является моновалентным металлическим ионом;
R3 является водородом, блокирующей группой, связывающей составляющей, соединенной с нерастворимым полимером, или связывающей составляющей, соединенной с нуклеиновой кислотой;
m является целым числом от 0 до n-1;
v является целым числом от 1 до n-1;
n является целым числом от 1 до 200,
OA соединена с тритилом, силилом, ацетилом, (C2-C10)ацилом, (C6-C10)арилом, связывающей составляющей, соединенной с нерастворимым полимером или связывающей составляющей, соединенной с нуклеиновой кислотой;
J является O и D является H или J является S, Se, или BH3, где связь между B и P является одинарной, и когда J является BH3, W2 является -O-, и D является составляющей Формулы A
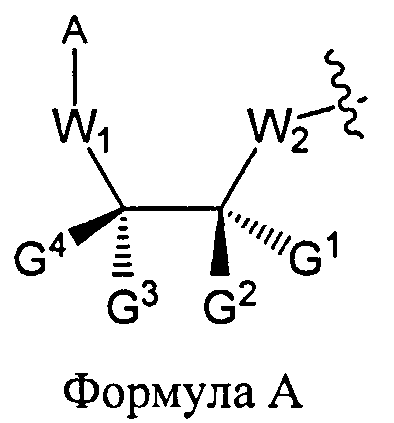
где A представляет собой водород, (C2-C10)ацил, (C6-C10)арил, (C1-C10)алкил, (C6-C10)аралкил или силильную составляющую;
где W1 и W2 являются, независимо, -NG5-, -O- или -S-;
G1, G2, G3, G4 и G5 представляют собой, независимо, водород, (C1-C10)алкил, (C6-C10)аралкил, (C3-C10)циклоалкил, (C4-C10)циклоалкилалкил, (5-18-членный) гетероциклил с кольцевым атомом, которым является N, O или S, (5-18-членный) гетероарил с кольцевым атомом, которым является N, O или S, или (C6-C10)арил, или два из G1, G2, G3, G4 и G5 являются G6, которые, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее до 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или неслитым с кольцевым атомом, которым является N, O или S, и где не более четырех из G1, G2, G3, G4 и G5 являются G6, и где G1 и G2 и/или G3 и G4 являются различными,
где каждый замещенный силил или силильная составляющая являются независимо TBDMS (трет-бутилдиметилсилил), ТБДФС (трет-бутилдифенилсилил) или TMS (триметилсилил),
где каждая связывающая составляющая является независимо сукцинаминовым кислотным линкером, или сукцинатным линкером (-CO-CH2-CH2-CO-), или оксалиловым линкером (-CO-CO-);
где в каждом случае флуоресцентная или биомолекулярная связывающая составляющие являются независимо индольной группой, флуоресцеином, тетраметилродамином, техасским красным (Texas Red), BODIPY, 5-[(2-аминоэтил)амино]нафталин-1-сульфоновой кислотой (EDANS), кумарином и люцифером желтым (Lucifer yellow), антителом, фрагментом антитела, биотином, авидином, стрептавидином, рецепторным лигандом или хелатообразующей составляющей; и
где каждая блокирующая группа и каждая блокирующая составляющая являются независимо фталимидо, 9-флудренилметоксикарбонилом (FMOC), трифенилметилсульфенилом, t-BOC, 4,4′-диметокситритилом (ДМТр), 4-метокситритилом (ММТr), 9-фенилксантин-9-илом (Pixyl), тритилом (Tr), 9-(п-метоксифенил)ксантин-9-илом (MOX), ацетилом, тетрагидропиранилом (ТНР), t-бутилдиметилсилилом (TBDMS), 1-[(2-хлоро-4-метил)фенил]-4-метоксипиперидин-4-илом (Ctmp), 1-(2-фторофенил)-4-метоксипиперидин-4-илом (Fpmp), 1-(2-хлороэтокси)этил, 3-метокси-1,5-дикарбометоксипентан-3-илом (MDP), бис(2-ацетоксиэтокси)метилом (ACE), триизопропилсилилоксиметилом (TOM), 1-(2-цианоэтокси)этилом (CEE), 2-цианоэтоксиметилом (CEM), [4-(N-дихлороацетил-N-метиламино)бензилокси]метилом, 2-цианоэтилом (CN), пивалоилоксиметилом (PivOM), левунилоксиметилом (ALE), тритилом, монометокситритилом, диметокситритилом, триметокситритилом, 9-фенилксантин-9-илом (Pixyl) и 9-(п-метоксифенил)ксантин-9-илом (MOX).
2. Способ по п.1, отличающийся тем, что стадия сочетания нуклеозида, содержащего ахиральную H-фосфонатную составляющую хирального реагента и нуклеозида, содержащего 5′-OH составляющую, с получением конденсированного промежуточного соединения представляет собой реакцию ″в одном котле″.
3. Способ по п.1, отличающийся тем, что каждая X-фосфонатная составляющая соединения Формулы 1 является более чем на 98% диастереомерно чистой, как установлено с использованием метода 31P ЯМР-спектроскопии или высокоэффективной жидкостной хроматографии с обращенной фазой.
4. Способ по п.1, отличающийся тем, что каждая X-фосфонатная составляющая имеет RP конфигурацию.
5. Способ по п.1, отличающийся тем, что каждая X-фосфонатная составляющая имеет SP конфигурацию.
6. Способ по п.1, отличающийся тем, что каждая X-фосфонатная составляющая имеет, независимо, RP или SP конфигурацию.
7. Способ по п.1, где конденсирующий реагент CR является Ar3PL2, (ArO)3PL2
или где конденсирующий реагент представляет собой бис(трихлорометил)карбонат (БТК), (PhO)3PCl2, Ph3PCl2, N,N′-бис(2-оксо-3-оксазолидинил)фосфиновый хлорид (BopCl), 1,3-диметил-2-(3-нитро-1,2,4-триазол-1-ил)-2-пирролидин-1-ил-1,3,2-диазафосфолидиний гексафторофосфат (MNTP), или 3-нитро-1,2,4-триазол-1-ил-трис(пирролидин-1-ил)фосфоний гексафторофосфат (PyNTP)
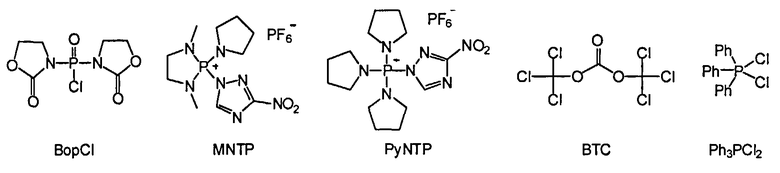
Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8, Z9 и Z10 представляют собой, независимо, (C1-C10)алкил, (C1-C10)аминоалкил, (C3-C10)циклоалкил, (5-18-членный)гетероцикл с кольцевым атомом, которым является N, O или S, (C4-C10)циклоалкилалкил, (5-18-членный)гетероциклоалкил с кольцевым атомом, которым является N, O или S, (C6-C10)арил, (5-18-членный)гетероарил с кольцевым атомом, которым является N, O или S, (C1-C10)алкилокси, (C6-C10)арилокси или (5-18-членный)гетероарилокси с кольцевым атомом, которым является N, O или S, или где любая из Z2 и Z3, Z5 и Z6, Z7 и Z8, Z8 и Z9, Z9 и Z7, или Z7 и Z8, и Z9 взяты вместе с образованием 3-20 членного алициклического или гетероциклического кольца с кольцевым атомом, которым является N, O или S;
Q- является противоионом;
L является отщепляемой группой;
w является целым числом от 0 до 3; и
Ar является (C6-C10)арилом, (5-18-членный)гетероарилом с кольцевым атомом, которым является N, O или S, и/или одна из Ar групп присоединена к нерастворимому полимеру.
8. Способ по п.7, отличающийся тем, что противоином конденсирующего реагента CR является Cl-, Br-, BF4 -, PF6 -, TfO-, Tf2N-, AsF6 -, ClO4 - или SbF6 -, где Tf является CF3SO2.
9. Способ по п.7, отличающийся тем, что отщепляемой группой конденсирующего реагента CR является F, Cl, Br, I, 3-нитро-1,2,4-триазол, имидазол, (C3-C10)алкилтриазол, тетразол, пентафторобензол или 1-гидроксибензотриазол.
10. Способ по п.7, отличающийся тем, что дополнительно включает введение активирующего реагента AR, где активирующий реагент AR представляет собой имидазол, 4,5-дицианоимидазол (DCI), 4,5-дихлороимидазол, 1-фенилимидазолий трифлат (PhIMT), бензимидазолий трифлат (BIT), бензтриазол, 3-нитро-1,2,4-триазол (NT), тетразол, 5-этилтиотетразол, 5-(4-нитрофенил)тетразол, N-цианометилпирролидиний трифлат (ЦМПТ), N-цианометилпиперидиний трифлат, N-цианометилдиметиламмоний трифлат; или один из
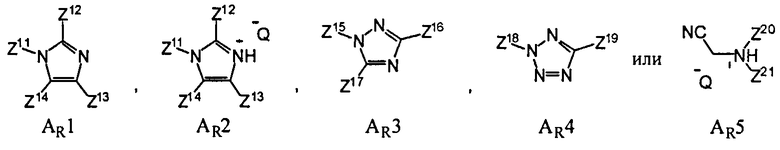
где Z11, Z12, Z13, Z14, Z15, Z16, Z17, Z18, Z19, Z20 и Z21 представляют собой, независимо, водород, (C1-C10)алкил, (C1-C10)аминоалкил, (C3-C10)циклоалкил, (5-18-членный) гетероцикл с кольцевым атомом, которым является N, O или S, (C4-C10)циклоалкилалкил, (5-18-членный)гетероциклоалкил с кольцевым атомом, которым является N, O или S, (C6-C10)арил, (5-18-членный) гетероарил с кольцевым атомом, которым является N, O или S, (C1-C10)алкилокси, (C6-C10)арилокси, или (5-18-членный)гетероарилокси с кольцевым атомом, которым является N, O или S, или где любые из Z11 и Z12, Z11 и Z13, Z11 и Z14, Z12 и Z13, Z12 и Z14, Z13 и Z14, Z15 и Z16, Z15 и Z17, Z16 и Z17, Z18 и Z19, или Z20 и Z21 взяты вместе с образованием 3-20-членного алициклического или гетероциклического кольца с кольцевым атомом, которым является N, O или S, или с образованием 5 или 20-членного ароматического кольца, и Q- является противоионом.
11. Способ по п.10, отличающийся тем, что противоионом активирующего реагента AR является Cl-, Br-, BF4 -, PF6 -, TfO-, Tf2N-, AsF6 -, ClO4 - или SbF6 -, где Tf является CF3SO2.
12. Способ по п.10, отличающийся тем, что активирующий реагент AR является N-цианометилпирролидиний трифлатом (ЦМПТ).
13. Способ по п.1, отличающийся тем, что данная реакция осуществляется в апротонном органическом растворителе.
14. Способ по п.13, отличающийся тем, что данным растворителем является ацетонитрил, пиридин, тетрагидрофуран или дихлорометан.
15. Способ по п.14, отличающийся тем, что данный апротонный растворитель не является основным, при этом основание присутствует на стадии реакции.
16. Способ по п.15, отличающийся тем, что данным основанием является пиридин, хинолин, N,N-диметиланилин или N-цианометилпирролидин.
17. Способ по п.15, отличающийся тем, что основанием является
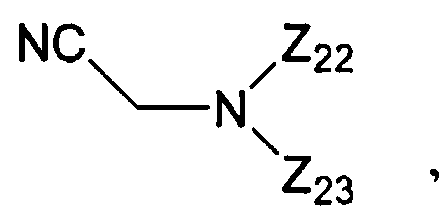
где Z22 и Z23 представляют собой, независимо, (C1-C10)алкил, (C1-C10)аминоалкил, (C3-C10)циклоалкил, (5-18-членный)гетероцикл с кольцевым атомом, которым является N, O или S, (C4-C10)циклоалкилалкил, (5-18-членный)гетероциклоалкил с кольцевым атомом, которым является N, O или S, (C6-C10)арил, (5-18-членный)гетероарил с кольцевым атомом, которым является N, O или S, (C1-C10)алкилокси, (C6-C10)арилокси, или (5-18-членный)гетероарилокси с кольцевым атомом, которым является N, O или S,
или где любые из Z22 и Z23 взяты вместе с образованием 3-10-членного алициклического или гетероциклического кольца с кольцевым атомом, которым является N, O или S.
18. Способ по п.15, отличающийся тем, что данным основанием является N-цианометилпирролидин.
19. Способ по п.13, отличающийся тем, что данный апротонный растворитель является безводным.
20. Способ по п.19, отличающийся тем, что данный безводный апротонный растворитель является свежеперегнанным.
21. Способ по п.20, отличающийся тем, что данный свежеперегнанный безводный апротонный органический растворитель является пиридином или ацетонитрилом.
22. Способ по п.1, где каждая Ba составляющая является незамещенной; R1 представляет собой -OH, -SH, -NRdRd, -N3, галоген, водород, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил, (C1-C10)алкил-Y1-, (C2-C10)алкенил-Y1-, (C2-C10)алкинил-Y1-, (C6-C10)арил-Y1-, (5-18-членный)гетероарил-Y1- с кольцевым атомом, которым является N, O или S, -P(O)(Re)2, -HP(O)(Re), -ORa или -SRc;
Y1 является O, NRd, S или Se;
Ra является блокирующей составляющей;
Rc является блокирующей группой;
в каждом случае Rd представляет собой, независимо, водород, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил, (C6-C10)арил, (C2-C10)ацил, замещенный силил, карбамат, -P(O)(Re)2 или -HP(O)(Re);
в каждом случае Re представляет собой, независимо, водород, (C1-C10)алкил, (C6-C10)арил, (C2-C10)алкенил, (C2-C10)алкинил, (C1-C10)алкил-Y2-, (C2-C10)алкенил-Y2-, (C2-C10)алкинил-Y2-, (C6-C10)арил-Y2- или (5-18-членный)гетероарил-Y2- с кольцевым атомом, которым является N, O или S, или катион, который является Na+1, Li+1 или K+1;
Y2 является O, NRd или S;
в каждом случае R2 представляет собой, водород, -OH, -SH, -NRdRd, -N3, галоген, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил, (C1-C10)алкил-Y1-, (C2-C10)алкенил-Y1-, (C2-C10)алкинил-Y1-, (C6-C10)арил-Y1-, (5-18-членный)гетероарил-Y1- с кольцевым атомом, которым является N, O или S;
R3 является H;
в каждом случае X является, независимо, -S-Z+, -Se-Z+ или -BH3 -Z+ , где связь между B и P является одинарной, и когда J является BH3, W2 является -O-; и
Z+ является аммоний ионом, (C1-C10)алкиламмоний ионом, (5-18-членным)гетероароматическим иминий ионом с кольцевым атомом, которым является N, O или S, или (5-18-членным)гетероциклическим иминий ионом с кольцевым атомом, которым является N, O или S, любой из которых является первичным, вторичным, третичным или четвертичным, или Z+ является моновалентным металлическим ионом.
23. Способ по п.1, где m равно, по меньшей мере, единице, J является O и D является H.
24. Способ по п.23, где А является водородом; и
где G1 и G2 представляют собой, независимо, (C1-C10)алкил, (C6-C10)аралкил, (C3-C10)циклоалкил, (C4-C10)циклоалкилалкил, (5-18-членный)гетероарил с кольцевым атомом, которым является N, O или S, или (C6-C10)арил, и G3, G4 и G5 представляют собой, независимо, водород, (C1-C10)алкил, (C6-C10)аралкил, (C3-C10)циклоалкил, (C4-C10)циклоалкилалкил, (5-18-членный)гетероциклил с кольцевым атомом, которым является N, O или S, (5-18-членный)гетероарил с кольцевым атомом, которым является N, O или S, или (C6-C10)арил, или две из G1, G2, G3, G4 и G5 являются G6, и, взятые вместе, образуют насыщенное, частично ненасыщенное или ненасыщенное карбоциклическое или содержащее гетероатом кольцо, содержащее приблизительно до 20 кольцевых атомов, которое является моноциклическим или полициклическим, слитым или неслитым с кольцевым атомом, которымявляется N, O или S, и где не более четырех из G1, G2, G3, G4 и G5 являются G6.
25. Способ по п.1, отличающийся тем, что подкисление включает добавление такого количества кислоты Бренстеда или Льюиса, которое эффективно для превращения конденсированного промежуточного соединения в соединение Формулы 4 без удаления пуриновой или пиримидиновой составляющих из конденсированного промежуточного соединения.
26. Способ по п.1, отличающийся тем, что подкисление включает добавление 1% трифтороуксусной кислоты в органическом растворителе, 3% дихлоруксусной кислоты в органическом растворителе или 3% трихлоруксусной кислоты в органическом растворителе.
27. Способ по п.1, отличающийся тем, что подкисление дополнительно включает добавление поглотителя катионов, где поглотителем катионов является триэтилсилан или триизопропилсилан.
28. Способ по п.1, где конденсированное промежуточное соединение является модифицированным с использованием борирующего агента, серного электрофила или селенового электрофила.
29. Способ по п.28, отличающийся тем, что серным электрофилом является соединение, имеющее одну из следующих формул:
S8 (Формула B), Z24-S-S-Z25 или Z24-S-X-Z25,
где Z24 и Z25 представляют собой, независимо, (C1-C10)алкил, (C1-C10)аминоалкил, (C3-C10)циклоалкил, (5-18-членный)гетероцикл с кольцевым атомом, которым является N, O или S, (C4-C10)циклоалкилалкил, (5-18-членный)гетероциклоалкил с кольцевым атомом, которым является N, O или S, (C6-C10)арил, (5-18-членный)гетероарил с кольцевым атомом, которым является N, O или S, (C1-C10)алкилокси, (C6-C10)арилокси, (5-18-членный)гетероарилокси с кольцевым атомом, которым является N, O или S, (C2-C10)ацил, амид, имид или тиокарбонил, или Z24 и Z25 взяты вместе с образованием 3-8-членного алициклического или гетероциклического кольца с кольцевым атомом, которым является N, O или S, которое может быть замещенным
или незамещенным, где заместители гетероциклического кольца независимо представляют собой алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -OR1, -SR1, -OC(O)R1, -N(R1)2, -C(O)R1, -C(O)OR1, -OC(O)N(R1)2, -C(O)N(R1)2, -N(R1)C(O)OR1, -N(R1)C(O)R1, -N(R1)C(O)N(R1)2, -N(R1)C(NR1)N(R1)2, -N(R1)S(O)tR1 (где t равняется 1 или 2), -S(O)tORf (где t равняется 1 или 2) или -S(O)tN(Rf)2 (где t равняется 1 или 2), где каждая R1 представляет собой, независимо, водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил; и
X является SO2, O, или NRf; и Rf представляет собой водород, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил или (C6-C10)арил.
30. Способ по п.29, отличающийся тем, что серным электрофилом является соединение Формулы B, C, D, E или F:
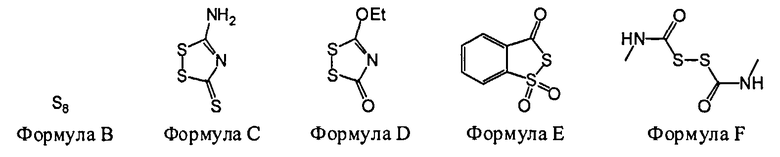
31. Способ по п.28, отличающийся тем, что селеновым электрофилом является соединение, имеющее одну из следующих формул:
Se (Формула G), Z26-Se-Se-Z27 или Z26-Se-X-Z27, где Z26 и Z27 представляют собой, независимо, (С1-С10)алкил, (С1-С10)аминоалкил, (С3-С10)циклоалкил, (5-18-членный)гетероцикл с кольцевым атомом, которым является N, O или S, (C4-C10)циклоалкилалкил, (5-18-членный)гетероциклоалкил с кольцевым атомом, которым является N, O или S, (C6-C10)арил, (5-18-членный)гетероарил с кольцевым атомом, которым является N, O или S, (C1-C10)алкилокси, (C6-C10)арилокси, (5-18-членный)гетероарилокси с кольцевым атомом, которым является N, O или S, (C2-C10)ацил, амид, имид или тиокарбонил, или Z26 и Z27 взяты вместе с образованием 3-8-членного алициклического или гетероциклического кольца с кольцевым атомом, которым является N, O или S, которое может быть замещенным или незамещенным, где заместители алициклического или гетероциклического кольца независимо представляют собой алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -OR1, -SR1, -OC(O)R1, -N(R1)2, -C(O)R1, -C(O)OR1, -OC(O)N(R1)2, -C(O)N(R1)2, -N(R1)C(O)OR1, -N(R1)C(O)R1, -N(R1)C(O)N(R1)2, -N(R1)C(NR1)N(R1)2, -N(R1)S(O)tR1 (где t равняется 1 или 2), -S(O)tORf (где t равняется 1 или 2) или -S(O)tN(Rf)2 (где t равняется 1 или 2), где каждая R1 представляет собой, независимо, водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил; и
X является O2, O, S или NRf; и Rf является водородом, (C1-C10)алкилом, (C2-C10)алкенилом, (C2-C10)алкинилом или (C6-C10)арилом.
32. Способ по п.31, отличающийся тем, что селеновым электрофилом является соединение Формулы G, H, I, J, К или L
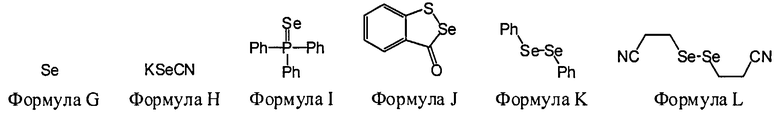
33. Способ по п.28, отличающийся тем, что борирующий агент представляет собой боран-N,N-диизопропилэтиламин (BH3·DIPEA), боран-пиридин (BH3·Ру), боран-2-хлоропиридин (BH3·СРу), боран-анилин (BH3·An), боран-тетрагидрофуран (BH3·THF) или боран-диметилсульфид (BH3·Me2S).
34. Способ по п.28, отличающийся тем, что модифицирование осуществляется с использованием силилирующего реагента, затем серного электрофила, селенового электрофила, борирующего агента, алкилирующего агента, альдегида или ацилирующего агента, где силилирующим реагентом является хлоротриметилсилан (TMS-Cl), триизопропилсилилхлорид (TIPS-Cl), t-бутилдиметилсилилхлорид (TBDMS-Cl), t-бутилдифенилсилилхлорид (ТБДФС-Cl), 1,1,1,3,3,3-гексаметилдисилизан (HMDS), N-триметилсилилдиметиламин (TMSDMA), N-триметилсилилдиэтиламин (TMSDEA), N-триметилсилилацетамид (TMSA), N,O-бис(триметилсилил)ацетамид (БСА) или N,O-бис(триметилсилил)трифтороацетамид (BSTFA).
35. Способ по п.34, отличающийся тем, что серным электрофилом является соединение, имеющее одну из следующих формул:
S8 (Формула B), Z24-S-S-Z25 или Z24-S-X-Z25,
где Z24 и Z25 представляют собой, независимо, (C1-C10)алкил, (C1-C10)аминоалкил, (C3-C10)циклоалкил, (5-18-членный)гетероцикл с кольцевым атомом, которым является N, O или S, (C4-C10)циклоалкилалкил, (5-18-членный)гетероциклоалкил с кольцевым атомом, которым является N, O или S, (C6-C10)арил, (5-18-членный)гетероарил с кольцевым атомом, которым является N, O или S, (C1-C10)алкилокси, (C6-C10)арилокси, (5-18-членный)гетероарилокси с кольцевым атомом, которым является N, O или S, (C2-C10)ацил, амид, имид или тиокарбонил, или Z24 и Z25, взятые вместе, с образованием 3-8-членного алициклического или гетероциклического кольца с кольцевым атомом, которым является N, O или S, которое может быть замещенным или незамещенным любым из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, арилалкила, гетероарила, гетероарилалкила, гидрокси, галогена, циано, трифторметила, трифторметокси, нитро, триметилсиланила, -OR1, -SR1, -OC(O)R1, -N(R1)2, -C(O)R1, -C(O)OR1, -OC(O)N(R1)2, -C(O)N(R1)2, -N(R1)C(O)OR1, -N(R1)C(O)R1, -N(R1)C(O)N(R1)2, -N(R1)C(NR1)N(R1)2, -N(R1)S(O)tRl (где t равняется 1 или 2), -S(O)tORf (где t равняется 1 или 2) или -S(O)tN(Rf)2 (где t равняется 1 или 2), где каждая R1 представляет собой, независимо, водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил;
X является SO2, O, или NRf; и Rf представляет собой водород, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил или (C6-C10)арил.
36. Способ по п.35, отличающийся тем, что серным электрофилом является соединение Формулы B, C, D, E или F:
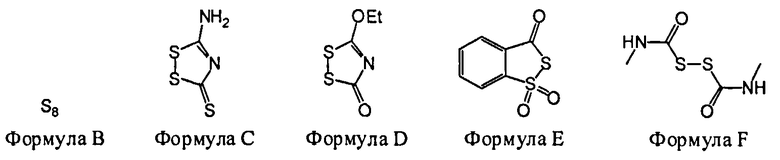
37. Способ по п.34, отличающийся тем, что селеновым электрофилом является соединение, имеющее одну из следующих формул:
Se (Формула G), Z26-Se-Se-Z27 или Z26-Se-X-Z27,
где Z26 и Z27 представляют собой, независимо, (C1-C10)алкил, (C1-C10)аминоалкил, (C3-C10)циклоалкил, (5-18-членный)гетероцикл с кольцевым атомом, которым является N, O или S, (C4-C10)циклоалкилалкил, (5-18-членный)гетероциклоалкил с кольцевым атомом, которым является N, O или S, (C6-C10)арил, (5-18-членный)гетероарил с кольцевым атомом, которым является N, O или S, (C1-C10)алкилокси, (C6-C10)арилокси, (5-18-членный)гетероарилокси с кольцевым атомом, которым является N, O или S, (C2-C10)ацил, амид, имид или тиокарбонил, или Z26 и Z27 взяты вместе с образованием 3-8-членного алициклического или гетероциклического кольца с кольцевым атомом, которым является N, O или S, которое может быть замещенным или незамещенным любым из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, арилалкила, гетероарила, гетероарилалкила, гидрокси, галогена, циано, трифторметила, трифторметокси, нитро, триметилсиланила, -OR1, -SR1, -OC(O)R1, -N(R1)2, -C(O)R1, -C(O)OR1, -OC(O)N(R1)2, -C(O)N(R1)2, -N(R1)C(O)OR1, -N(R1)C(O)R1, -N(R1)C(O)N(R1)2, -N(R1)C(NR1)N(R1)2, -N(R1)S(O)tR1 (где t равняется 1 или 2), -S(O)tORf (где t равняется 1 или 2) или -S(O)tN(Rf)2 (где t равняется 1 или 2), где каждая R1 представляет собой, независимо, водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил;
X является SO2, S, O или NRf; и Rf представляет собой водород, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил или (C6-C10)арил.
38. Способ по п.34, отличающийся тем, что селеновым электрофилом является соединение Формулы G, H, I, J, K или L

39. Способ по п.34, отличающийся тем, что борирующим агентом является боран-N,N-диизопропилэтиламин (BH3·DIPEA), боран-пиридин (BH3·Ру), боран-2-хлоропиридин (BH3·СРу), боран-анилин (BH3·An), боран-тетрагидрофуран (BH3·THF) или боран-диметилсульфид (BH3·Me2S).
40. Способ по п.34, отличающийся тем, что алкилирующий агент представляет собой (C1-C10)алкил галогенид, (C2-C10)алкенил галогенид, (C2-C10)алкинил галогенид, (C1-C10)алкил сульфонат, (C2-C10)алкенил сульфонат или (C2-C10)алкинил сульфонат.
41. Способ по п.34, отличающийся тем, что альдегидом является (пара)-формальдегид, (C2-C10)алкил альдегид, (C3-C10)алкенил альдегид, (C3-C10)алкинил альдегид или (C6-C10)арил альдегид.
42. Способ по п.34, отличающийся тем, что ацилирующим агентом является соединение Формулы M или N:
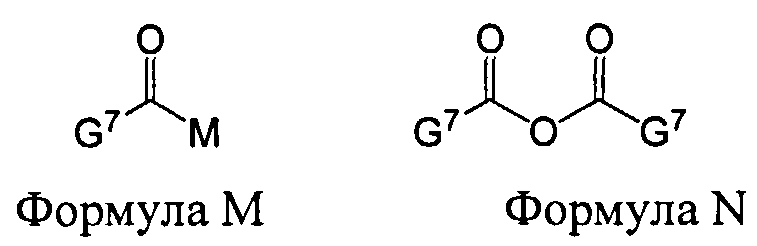
где G7 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (5-18-членный)гетероцикл с кольцевым атомом, которым является N, O или S, (C4-C10)диклоалкилалкил, (5-18-членный)гетероциклоалкил с кольцевым атомом, которым является N, O или S, (C6-C10)арил, (5-18-членный)гетероарил с кольцевым атомом, которым является N, O или S, (C1-C10)алкилокси, (C6-C10)арилокси или (5-18-членный)гетероарилокси с кольцевым атомом, которым является N, O или S; и M является F, Cl, Br, I, 3-нитро-1,2,4-триазолом, имидазолом, (C3-C10)алкилтриазолом, тетразолом, пентафторобензолом или 1-гидроксибензотриазолом.
43. Способ по п.28, отличающийся тем, что модифицирование осуществляется путем реакции с галогенирующим реагентом, затем реакции с нуклеофилом.
44. Способ по п.43, отличающийся тем, что галогенирующим реагентом является CCl4, CBr4, Cl2, Br2, I2, сульфурилхлорид (SO2Cl2), фосген, бис(трихлорометил)карбонат (БТК), монохлорид серы, дихлорид серы, хлорамин, CuCl2, N-хлоросукцинимид (NCS), CI4, N-бромосукцинимид (NBS) или N-йодосукцинимид (NIS).
45. Способ по п.43, отличающийся тем, что данным нуклеофилом является NRfRfH, RfOH или RfSH, где Rf представляет собой водород, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил или (C6-C10)арил, и по меньшей мере одна из Rf NRfRfH не является водородом.
46. Способ по п.1, где W1 является NHG5 и W2 является O в формулах 3 и А.
47. Способ по п.1, отличающийся тем, что хиральный реагент имеет Формулу O или Формулу P:
48. Способ по п.1, отличающийся тем, что хиральный реагент имеет Формулу Q или Формулу R:
49. Способ по п.1, отличающийся тем, что блокирующей группой Ba составляющей является бензил, (C2-C10)ацил, формил, ди(C1-C10)алкилформамидинил, изобутирил, феноксиацетил или тритильная составляющая.
50. Способ по п.1, отличающийся тем, что R1 является -N3, -NRdRd, (C2-C10)алкинилокси или -OH.
51. Способ по п.1, отличающийся тем, что R2 представляет собой -NRdRd, (C1-C10)алкил, (C2-C10)алкенил, (C2-C10)алкинил, (C1-C10)алкил-Y1-, (C2-C10)алкенил-Y1-, (C2-C10)алкинил-Y1-, (C6-C10)арил-Y1-, (5-18-членный)гетероарил-Y1 с кольцевым атомом, которым является N, O или S, и является замещенным флуоресцентной или биомолекулярной связывающей составляющими.
52. Способ по п.1, отличающийся тем, что R2 представляет собой -OH, -N3, водород, галоген, (C1-C10)алкокси или (C2-C10)алкинилокси.
53. Способ по п.2, отличающийся тем, что R2 представляет собой -OH, -N3, водород, галоген, (C1-C10)алкокси или (C2-C10)алкинилокси.
54. Способ по п.1, отличающийся тем, что Ba представляет собой 5-бромоурацил, 5-йодоурацил или 2,6-диаминопурин.
55. Способ по п.1, отличающийся тем, что Ba модифицирована путем замещения флуоресцентной или биомолекулярной связывающей составляющей, где флуоресцентная или биомолекулярная связывающая составляющие являются индольной группой, флуоресцеином, тетраметилродамином, техасским красным (Texas Red), BODIPY, 5-[(2-аминоэтил)амино]нафталин-1-сульфоновой кислотой (EDANS), кумарином, люцифером желтым (Lucifer yellow), антителом, фрагментом антитела, биотином, авидином, стрептавидином, рецепторным лигандом или хелатообразующей составляющей.
56. Способ по п.1, отличающийся тем, что Z является пиридиний ионом, триэтиламмоний ионом, N,N-диизопропилэтиламмониевым ионом, 1,8-диазабицикло[5.4.0]ундец-7-ений ионом, ионом натрия или ионом калия.
57. Способ по п.1, отличающийся тем, что X является (C1-C10)алкилом, (C1-C10)алкокси, -NRfRf, -S-Z+ или -BH3-Z+, где связь между B и P является одинарной, и когда J является BH3, W2 является -O-.
58. Способ по п.30, отличающийся тем, что серный электрофил имеет Формулу F, Формулу E или Формулу B.
59. Способ по п.36, отличающийся тем, что серный электрофил имеет Формулу F, Формулу E или Формулу B.
60. Способ по п.32, отличающийся тем, что селеновый электрофил имеет Формулу G или Формулу J.
61. Способ по п.38, отличающийся тем, что селеновый электрофил имеет Формулу G или Формулу J.
62. Способ по пп.33 или 39, отличающийся тем, что борирующим агентом является боран-N,N-диизопропилэтиламин (BH3·DIPEA), боран-2-хлоропиридин (BH3·СРу), боран-тетрагидрофуран (BH3·THF) или боран-диметилсульфид (BH3·Ме2S).
63. Способ по п.44, отличающийся тем, что галогенирующим агентом является CCl4, CBr4, Cl2, сульфурилхлорид (SO2Cl2) или N-хлоросукцинимид (NCS).
64. Способ по п.9, отличающийся тем, что конденсирующий реагент представляет собой бис(трихлорометил)карбонат (БТК), (PhO)3PCl2, Ph3PCl2 или N,N-бис(2-оксо-3-оксазолидинил)фосфиниевый хлорид (BopCl).
| N.Oka et al., J.Am.Chem.Soc., 2008, N.130, pp.16031-16037 | |||
| N.Oka et al., Nucleic Acids Symposium Series, 2005, N.49, p.131-132 | |||
| WO 00/04034 A2, 27.01.2000 | |||
| N.Iwamoto et al, Nucleic Acids Symposium Series, 2006, n.50, pp.159-160 | |||
| F.Seela et al., J.Org.Chem., 1991, N.56, pp.3861-3869 | |||
| H.Almer et al, J.Org.Chem., 1992, n.57, pp.6163-6169 | |||
| J | |||
| Nilsson et al, Chem | |||
| Commun., 2004, pp.2566-2567. |
Авторы
Даты
2016-01-20—Публикация
2009-12-02—Подача