Изобретение относится к области химической технологии, а именно к высокотемпературным каталитическим окислительным способам превращения метана с получением синтез-газа: смеси Н2 и СО, являющегося исходным сырьем для получения моторных топлив, метанола, диметилового эфира, альдегидов, спиртов и других ценных веществ, к катализаторам, использующимся при получении синтез-газа, и способам их получения.
Известен способ получения синтез-газа путем каталитического превращения углеводородов в присутствии кислородсодержащих газов и/или паров воды (RU 2204434, 2003). Катализатором процесса превращения является сложный композит, содержащий смешанные оксиды со структурой перовскита или флюорита и переходные и/или благородные металлы, который дополнительно содержит компоненты с низким коэффициентом термического расширения. Катализаторы готовят сложным многостадийным синтезом носителя, состоящего из оксида алюминия или смешанного каркасного фосфата циркония, кальция и стронция, которые затем пропитывают растворами солей переходных металлов, которые после высушивания и прокаливания образуют смешанный оксид со структурой перовскита M1B1-yMyOz и/или оксид со структурой флюорита 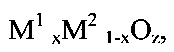 где М - элемент 8 группы (Pt, Rh, Ir), М1 - редкоземельный или щелочно-земельный элемент, М2 - элемент IV b группы Периодической системы (Zr, Hf), В - переходный элемент - 3d элементы 4-го периода, 0,01<x<1,0, у<1, z определяется степенью окисления катионов и их стехиометрическим соотношением. Описано превращение на использованных катализаторах газовой смеси, содержащей 25% метана, 12,5% кислорода, остальное азот. При температурах 720-790°C конверсия метана составляет 70-99%, селективность по СО 88-99%, по водороду 73-99%.
где М - элемент 8 группы (Pt, Rh, Ir), М1 - редкоземельный или щелочно-земельный элемент, М2 - элемент IV b группы Периодической системы (Zr, Hf), В - переходный элемент - 3d элементы 4-го периода, 0,01<x<1,0, у<1, z определяется степенью окисления катионов и их стехиометрическим соотношением. Описано превращение на использованных катализаторах газовой смеси, содержащей 25% метана, 12,5% кислорода, остальное азот. При температурах 720-790°C конверсия метана составляет 70-99%, селективность по СО 88-99%, по водороду 73-99%.
Недостатком способа является проведение процесса при сильном разбавлении метан-кислородной смеси азотом, ведущее к необходимости последующего проведения разделения получаемого синтез-газа и инертного разбавителя, что является очень трудоемким и дорогостоящим процессом. Указанная необходимость диктуется тем, что разбавленный синтез-газ не пригоден для практического использования. Кроме того, используемому в способе катализатору свойственна сложная многостадийная процедура приготовления катализатора, а также дороговизна, обусловленная использованием металлов платиновой группы.
Известен способ парциального окисления метана кислородом в реакционной смеси с избытком метана в присутствии катализатора - оксида со структурой перовскита, содержащего редкоземельные и переходные элементы, дополнительно содержащего Al2O3 (RU 2144844, 2003). Массовое отношение компонентов катализатора составляет: перовскит ABOx 5-40, носитель - Al2O3 60-95, где А - редкоземельный элемент, В - переходный элемент, который включает 3d элементы IV периода Периодической таблицы, x определяется степенью окисления А, В и их стехиометрическим соотношением.
Процесс селективного окисления метана кислородом проводят в проточном реакторе при температуре 700-850°C, объемной скорости 25000-200000 час-1 и составе реакционной смеси СН4:O2:N2=1:2:12 или 1:2:25.
Катализатор готовят в 2 этапа - приготовление носителя и нанесение активного компонента. Для приготовления Al2O3 в лопастном смесителе смешивают корунд и переосажденный гидроксид алюминия, взятые в соотношении 1:1, в присутствии азотной кислоты в качестве пептизатора. В качестве поверхностно-активного вещества вводят 1% глицерина. Полученную пасту формуют в виде черенков или микроблоков сотовой структуры через специальную насадку с помощью шприца. Далее носитель сушат и прокаливают при 1300°C. Полученный носитель дробят, отсеивают фракцию 0,5-0,25 мм и пропитывают растворами нитратов редкоземельных элементов (например, нитратов La, Се, Nd) и нитратов переходных элементов (например, нитратов Со, Ni, Mn) или/и растворами - H2PtCl6, H2IrCl6, RhCl3. После пропитки катализатор сушат и прокаливают на воздухе при 900°C 2 часа. Стадии пропитки и прокаливания могут повторяться.
Наибольшую каталитическую активность достигают на катализаторе состава 40% LaCo0,96Ir0,04/α-Al2O3. При подаче на приготовленный катализатор газовой смеси, состоящей из метана, кислорода и гелия в соотношении СН4:O2:Не=2:1:12, с объемной скоростью 120000 л/час, при 800° достигают конверсию метана 98%, селективность по Н2 и СО, равную 100%, что соответствует выходу целевого продукта 98%. На катализаторе 20% NdCoO3/Al2O3 при подаче газовой смеси, состоящей из метана, кислорода и гелия в соотношении СН4:O2:Не=2:1:25, с объемной скоростью 120000 л/час, при 850°C достигают конверсию 85%, селективность по Н2 85%, по СО 87%, что соответствует выходам Н2 и СО 72% и 74% соответственно.
Недостатком способа является проведение процесса при сильном разбавлении метан-кислородной смеси инертным газом - азотом или гелием. Процедура разделения получаемого синтез-газа и инертного разбавителя является очень трудоемким и дорогостоящим процессом. Необходимость разделения диктуется тем, что разбавленный синтез-газ не пригоден для практического использования.
Наиболее близким к заявляемому изобретению по технической сущности и достигаемому эффекту является способ получения синтез-газа (RU 2433950, 2011) путем высокотемпературного каталитического окислительного превращения метана, заключающийся в подаче в реактор, в который помещен катализатор, а свободный объем которого заполнен инертной насадкой, исходной газовой смеси, содержащей смесь метана и молекулярного кислорода без инертного газа со скоростью 4315-24100 мл/г катализатора в час. Используемый в процессе катализатор представляет из себя сложный оксид с слоистой перовскитной структурой, содержащий редкоземельные элементы - La или Nd, щелочно-земельные элементы - Sr или Са, и переходный элемент - Со, отвечающий формулам LaSrCoO4 или NdCaCoO4. При этом катализатор получают путем механического перемешивания и последующего прокаливания при температуре 1100°C твердой порошкообразной смеси, содержащей, в зависимости от состава катализатора, оксид кобальта, оксид лантана или оксид неодима, карбонат стронция или карбонат кальция, взятые в стехиометрических соотношениях, отвечающих вышеуказанным формулам. Исходные компоненты в стехиометрических количествах, соответствующих формулам LaSrCoO4 и NdCaCoO4, перетирают в фарфоровой ступке или планетарной мельнице и образовавшуюся порошкообразную смесь прокаливают при 1100°C, затем снова перетирают и прокаливают при 1200°C. Способ при температуре 850-910°C обеспечивает конверсию метана до 92%, селективность по Н2 до 97,7%, по СО до 99,7%, выход Н2 до 83%, СО до 85%. и производительность катализатора по СО - до 10900 мл/г/ч. Недостатками способа являются недостаточно высокие выходы водорода и СО, а также недостаточно высокая конверсия метана, содержание которого в получаемом синтез-газе затрудняет его последующее использование. При этом используемому катализатору свойственна сложная процедура его приготовления. Таким образом, известный способ получения синтез-газа недостаточно эффективен.
Задачей изобретения является повышение эффективности способа получения синтез-газа.
Поставленная задача достигается созданием способа получения синтез-газа высокотемпературным каталитическим окислительным превращением метана, заключающегося в подаче в реактор, в который помещен катализатор, а свободный объем которого заполнен инертной насадкой, исходной газовой смеси, содержащей смесь метана и молекулярного кислорода, причем катализатор представляет из себя сложный оксид общей формулы NdaCabCucNidCoeOf, где а=0, 1, 2; b=0, 1, 2; c=0, 1; d=0, 1, 2; е=0, 1, 2; f=3, 4, 5, полученный путем растворения исходных веществ в воде, выпаривания образованного раствора до загустевания, высушивания полученного продукта в муфельной печи при 250-350°C и последующего прокаливания в течение 4-6 ч при 900-1000°C с использованием в качестве исходных веществ водорастворимых соединений Nd, Са, Со, Ni, Cu, образующих при прокаливании оксиды указанных металлов.
Предпочтительно в качестве исходных веществ используют
- нитрат ниодима Nd(NO3)3·6H2O, оксид кальция СаО, нитрат кобальта Со(NO3)2·6H2O, нитрат никеля Ni(NO3)2·6H2O, нитрат меди Cu(NO3)2·6H2O, взятые в стехиометрических соотношениях, отвечающих общей формуле NdaCabCucNidCoeOf, где а=0, 1, 2; b=0, 1, 2; с=0, 1; d=0, 1, 2; е=0, 1, 2; f=3, 4, 5;
- Nd(NO3)3·6H2O, Со(No3)2·6H2O в стехиометрических количествах, соответствующих формуле NdCoO3;
- Nd(NO3)3·6H2O, СаО, Co(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле NdCaCoO4;
- Nd(NO3)3·6H2O, Co(NO3)2·6H2O, Ni(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле NdNiCoO4;
- Nd(NO3)3·6H2O, Co(NO3)2·6H2O, Cu(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле NdCuCoO4;
- СаО, Со(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле Ca2Co2O5;
- Nd(NO3)3·6H2O, Ni(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле Nd2Ni2O5.
Окислительное превращение метана преимущественно осуществляют при температуре на катализаторе 860-958°C.
В качестве исходной газовой смеси преимущественно используют смесь метана и молекулярного кислорода с объемным отношением метан:молекулярный кислород 2:1.
Получаемый технический результат заключается в повышении конверсии метана, выходов оксида углерода и водорода, в упрощении технологии проведения способа и сокращении затрат за счет проведения процесса в отсутствие инертных газов, а также использования катализатора, получаемого более простым способом за счет отсутствия сложной стадии помола твердых исходных реагентов и снижения температуры прокаливания катализатора.
Сущность изобретения заключается в следующем.
Процесс высокотемпературного каталитического окислительного превращения метана в смесь СО и Н2 осуществляют в обогреваемом кварцевом реакторе проточного типа, изготовленном в виде трубки U-образной формы с карманом для термопары, расположенным между входящей и выходящей трубками реактора. В нижней части реактора помещают катализатор, а свободный объем реактора до и после катализатора заполняют кварцевой крошкой. Исходное сырье представляет собой смесь метана и молекулярного кислорода. Причем возможно использование в качестве исходного сырья смеси магистрального природного газа и технического кислорода. Возможно, также, в качестве кислорода использовать воздух и смесь воздуха с инертными газами.
Исходную сырьевую газовую смесь подают в реактор, в котором она достигает катализатора, и осуществляют нагрев катализатора до температуры 755-965°C, предпочтительно до 860-958°C, которую поддерживают в течение протекания всего процесса окислительного превращения метана. Подачу сырья в реактор осуществляют со скоростью 8,8-9,6 л/г катализатора в час (далее - л/г/ч). Объемное отношение метан:кислород в исходной газовой смеси может составлять 1,5:1-4:1, предпочтительно 2:1.
Катализатор, на котором ведут процесс окислительного превращения метана, согласно изобретению, представляет собой сложный оксид темно-серого или черного цвета, включающий в свой состав ионы кобальта (Со), никеля (Ni), меди (Cu), неодима (Nd), кальция (Са), причем мольные соотношения компонентов катализатора - исходных веществ, в качестве которых используют водорастворимые соединения неодима (Nd), кальция (Са), кобальта (Со), никеля (Ni), меди (Cu), образующие при прокаливании оксиды указанных металлов, соответствуют общей формуле NdaCabCucNidCoeOf, где а=0, 1, 2; b=0, 1, 2; с=0, 1; d=0, 1, 2; е=0, 1, 2; f=3, 4, 5.
Способ получения катализатора по изобретению характеризуется простой технологией и доступностью исходных компонентов. В качестве исходных веществ при получении катализатора возможно использовать различные водорастворимые соединения вышеуказанных металлов, такие как, например, нитраты, хлориды, сульфаты, ацетаты, растворимые оксиды и гидроксиды в различных сочетаниях, образующих при прокаливании оксиды металлов, в частности используют Nd в виде нитрата Nd(NO3)3·6H2O, Са в виде оксида СаО, Со в виде нитрата Co(NO3)2·6H2O, Ni в виде нитрата Ni(NO3)2·6H2O, Cu в виде нитрата Cu(NO3)2·6H2O. Исходные компоненты в стехиметрических количествах, соответствующих общей формуле NdaCabCucNidCoeOf, где а=0, 1, 2; b=0, 1, 2; с=0, 1; d=0, 1, 2; е=0, 1, 2; f=3, 4, 5, растворяют в воде, и образовавшийся раствор выпаривают до загустевания, высушивают в муфельной печи при 250-350°C и прокаливают в течение 4-6 ч при 900-1000°C. Полученную массу измельчают и отсеивают фракцию 0,5-1 мм, которую в количестве 0,2±0,01 г загружают в реактор для использования в качестве катализатора высокотемпературного окислительного превращения метана в способе получения синтез-газа. Допустимо использование катализатора в виде порошка, частиц произвольного размера, либо в виде таблеток при проведении процесса в реакторе большего объема.
Приведенные ниже примеры иллюстрируют изобретение, но не ограничивают его.
Пример 1
Для приготовления катализатора (в таблице приведен под номером 1) в качестве исходных веществ берут следующие соединения: Nd в виде нитрата Nd(NO3)3·6H2O, Со в виде нитрата Со(NO3)2·6H2O, в стехиометрических количествах, соответствующих формуле NdCoO3.
Смесь исходных веществ растворяют в воде. Образовавшийся раствор выпаривают до загустевания, высушивают в муфельной печи при 300C и прокаливают 5 ч при 900C. Образовавшийся сложный оксид используют в качестве катализатора окислительного превращения метана.
Пример 2. Условия и процедура приготовления катализатора (в таблице приведен под номером 2) аналогичны примеру 1, за исключением использования в качестве исходных веществ соединений Nd(NO3)3·6H2O, СаО, Co(NO3)2·6H2O, взятых в стехиометрических количествах, соответствующих формуле NdCaCoO4.
Пример 3. Условия и процедура приготовления катализатора (в таблице приведен под номером 3) аналогичны примеру 1, за исключением использования в качестве исходных веществ соединении Nd(NO3)3·6H2O, Со(NO3)2·6H2O, Ni(NO3)2·6H2O, взятых в стехиометрических количествах, соответствующих формуле NdNiCoO4.
Пример 4. Условия и процедура приготовления катализатора (в таблице приведен под номером 4) аналогичны примеру 1, за исключением использования в качестве исходных веществ соединений Nd(NO3)3·6H2O, Со(NO3)2·6H2O, Cu(NO3)2·6H2O, взятых в стехиометрических количествах, соответствующих формуле NdCuCoO4.
Пример 5. Условия и процедура приготовления катализатора (в таблице приведен под номером 5) аналогичны примеру 1, за исключением использования в качестве исходных веществ соединений СаО, Со(NO3)2·6H2O, взятых в стехиометрических количествах, соответствующих формуле Са2Со2О5.
Пример 6
Условия и процедура приготовления катализатора (в таблице приведен под номером 6) аналогичны примеру 1, за исключением использования в качестве исходных веществ соединений Nd(NO3)3·6H2O, Ni(NO3)2·6H2O, взятых в стехиометрических количествах, соответствующих формуле Nd2Ni2O5.
Примеры 7-48. Окислительное превращение метана в синтез-газ
В обогреваемый кварцевый реактор проточного типа, изготовленный в виде трубки U-образной формы с карманом для термопары, расположенным между входящей и выходящей трубками реактора, помещают 0,2 г катализатора в виде частиц размером 0,5-1 мм, а свободный объем реактора до и после катализатора заполняют кварцевой крошкой. Исходное сырье представляет собой смесь метана и молекулярного кислорода в соотношении 2:1, причем возможно использование в качестве исходного сырья смеси магистрального природного газа и технического кислорода или воздуха.
Метан и кислород через расходомеры подают в реактор, где они, контактируя с кварцевой крошкой, образуют гомогенную смесь. Поток гомогенной метан-кислородной смеси в реакторе достигает слоя катализатора, и катализатор в токе этой смеси нагревают до необходимой температуры, значение которой оговорено в таблице.
Газовую смесь, образовавшуюся в результате реакции на катализаторе, охлаждают в конденсаторе для отделения паров воды, и часть смеси направляют в газовый хроматограф для определения состава продуктов реакции.
Анализ реакционной газовой смеси, выходящей из реактора, показывает, что помимо целевых продуктов - смеси Н2 и СО, она может включать в свой состав непрореагировавшие метан и кислород, а также воду, диоксид углерода, С2-С3 углеводороды (этилен, этан, пропилен, пропан).
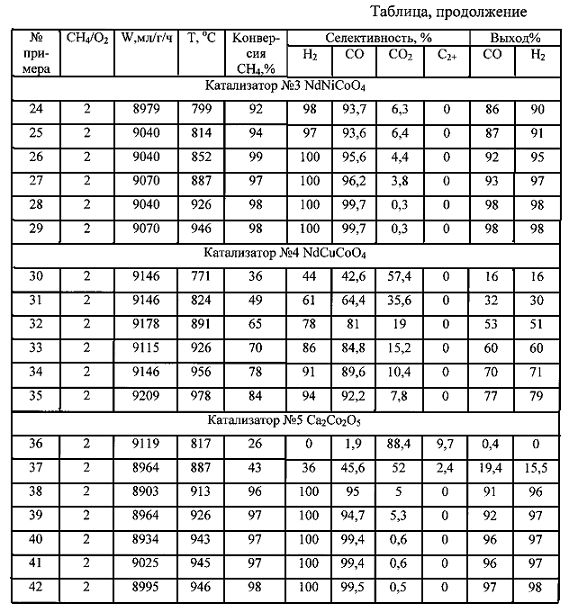
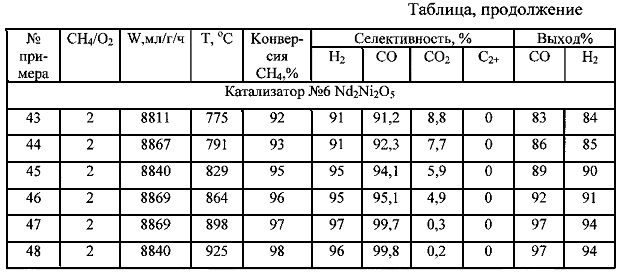
Результаты проведения получения синтез-газа, полученные с использованием разных катализаторов при варьировании значений температуры в слое катализатора (Т), мольного отношения метан:кислород (СН4/O2), скорости подачи метан-кислородной смеси (W), приведены в таблице. В таблице в качестве показателей эффективности способа приведены данные по конверсии метана, селективности образования продуктов реакции (в расчете на превращенный метан), выходу целевых продуктов.
Согласно экспериментальным данным, приведенным в таблицах, описываемый способ обеспечивает конверсию метана до 99%, селективность по Н2 до 100%, по СО до 100%, выход Н2 и СО до 99%.
Выход монооксида углерода рассчитывают путем умножения численного значения конверсии метана на численное значение селективности образования СО, выход водорода рассчитывают по формуле wH2вых·100/wCH4·2, где wH2 - количество водорода на выходе из реактора моль, wCH4 - скорость подачи метана на входе в реактор, моль.
Повышение значения температуры в слое катализатора способствует росту селективности по водороду и монооксиду углерода, повышению выхода целевых продуктов. Проведение процесса предпочтительно осуществлять при температуре в слое катализатора не ниже 860°C.
Таким образом, способ согласно изобретению обеспечивает высокие выходы целевого продукта без использования инертных газов, наличие которых значительно усложняет технологию проведения способа. При этом указанный способ проводят с использованием катализатора, полученного по простой технологии.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА | 2014 |
|
RU2572530C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРА И СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА В ЕГО ПРИСУТСТВИИ | 2023 |
|
RU2814309C1 |
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА | 2024 |
|
RU2834479C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОВСКИТОВ | 2009 |
|
RU2440292C2 |
| КОМПОЗИТНЫЙ ОКСИД КАТАЛИЗАТОРА РИФОРМИНГА УГЛЕВОДОРОДОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2009 |
|
RU2476267C2 |
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА | 2010 |
|
RU2433950C1 |
| КАТАЛИЗАТОР РИФОРМИНГА УГЛЕВОДОРОДОВ И СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА С ИСПОЛЬЗОВАНИЕМ ТАКОВОГО | 2008 |
|
RU2475302C2 |
| КАТАЛИЗАТОР (ВАРИАНТЫ), СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА | 2003 |
|
RU2248932C1 |
| СПОСОБ ПОЛУЧЕНИЯ НЕНАСЫЩЕННЫХ НИТРИЛОВ И КАТАЛИЗАТОР ДЛЯ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2077528C1 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА | 2013 |
|
RU2547845C1 |
Изобретение относится к высокотемпературным каталитическим окислительным способам превращения метана с получением синтез-газа и может быть использовано в химической технологии. В реактор подают исходную газовую смесь, содержащую смесь метана и молекулярного кислорода. В реактор помещен катализатор, а свободный объем заполнен инертной насадкой. Катализатор представляет из себя сложный оксид общей формулы NdaCabCucNidCOeOf, где а=0, 1, 2; b=0, 1, 2; с=0, 1; d=0, 1, 2; е=0, 1, 2; f=3, 4, 5. Катализатор получен путем растворения исходных веществ в воде, выпаривания образованного раствора до загустевания, высушивания полученного продукта в муфельной печи при 250-350°C и последующего прокаливания в течение 4-6 ч при 900-1000°C. В качестве исходных веществ используют водорастворимые соединения Nd, Са, Со, Ni, Cu, образующие при прокаливании оксиды указанных металлов. Технический результат: повышение конверсии метана, выходов оксида углерода и водорода, упрощение технологии проведения способа и сокращение затрат на процесс. 9 з.п. ф-лы, 1 табл., 48 пр.
1. Способ получения синтез-газа высокотемпературным каталитическим окислительным превращением метана, заключающийся в подаче в реактор, в который помещен катализатор, а свободный объем которого заполнен инертной насадкой, исходной газовой смеси, содержащей смесь метана и молекулярного кислорода, причем катализатор представляет из себя сложный оксид общей формулы NdaCabCucNidCoeOf, где a=0, 1, 2; b=0, 1, 2; c=0, 1; d=0, 1, 2; e=0, 1, 2; f=3, 4, 5, полученный путем растворения исходных веществ в воде, выпаривания образованного раствора до загустевания, высушивания полученного продукта в муфельной печи при 250-350°C и последующего прокаливания в течение 4-6 ч при 900-1000°C с использованием в качестве исходных веществ водорастворимых соединений Nd, Ca, Со, Ni, Cu, образующих при прокаливании оксиды указанных металлов.
2. Способ по п. 1, отличающийся тем, что в качестве исходных веществ используют нитрат ниодима Nd(NO3)3·6H2O, оксид кальция СаО, нитрат кобальта Со(NO3)2·6H2O, нитрат никеля Ni(NO3)2·6H2O, нитрат меди Cu(NO3)2·6H2O, взятые в стехиометрических соотношениях, отвечающих общей формуле NdaCabCucNidCoeOf, где a=0, 1, 2; b=0, 1, 2; c=0, 1; d=0, 1, 2; e=0, 1, 2; f=3, 4, 5.
3. Способ по п. 1, отличающийся тем, что в качестве исходных веществ используют Nd(NO3)3·6H2O, Со(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле NdCoO3.
4. Способ по п. 1, отличающийся тем, что в качестве исходных веществ используют Nd(NO3)3·6H2O, СаО, Со(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле NdCaCoO4.
5. Способ по п. 1, отличающийся тем, что в качестве исходных веществ используют Nd(NO3)3·6H2O, Со(NO3)2·6H2O, Ni(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле NdNiCoO4.
6. Способ по п. 1, отличающийся тем, что в качестве исходных веществ используют Nd(NO3)3·6H2O, Со(NO)3)2·6H2O, Cu(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле NdCuCoO4.
7. Способ по п. 1, отличающийся тем, что в качестве исходных веществ используют СаО, Со(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле Ca2Co2O5.
8. Способ по п. 1, отличающийся тем, что в качестве исходных веществ используют Nd(NO3)3·6H2O, Ni(NO3)2·6H2O в стехиометрических количествах, соответствующих формуле Nd2Ni2O5.
9. Способ по п. 1, отличающийся тем, что окислительное превращение метана преимущественно осуществляют при температуре на катализаторе 860-958°C.
10. Способ по п. 1, отличающийся тем, что в качестве исходной газовой смеси преимущественно используют смесь метана и молекулярного кислорода с объемным отношением метан:молекулярный кислород, равным 2:1.
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА | 2010 |
|
RU2433950C1 |
| КАТАЛИЗАТОР РИФОРМИНГА УГЛЕВОДОРОДОВ И СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА С ИСПОЛЬЗОВАНИЕМ ТАКОВОГО | 2008 |
|
RU2475302C2 |
| КОМПОЗИТНЫЙ ОКСИД КАТАЛИЗАТОРА РИФОРМИНГА УГЛЕВОДОРОДОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2009 |
|
RU2476267C2 |
| Прибор для очистки живности от перьев, щетины и т.п. | 1929 |
|
SU17647A1 |
| JP 2000000469 A, 07.01.2000 | |||
| WO03039740 A1, 15.05.2003. | |||
Авторы
Даты
2016-01-20—Публикация
2014-11-25—Подача