Область техники
Настоящее изобретение относится к новым рекомбинантным белкам, мультиспецифическим белковым комплексам, содержащим мультиспецифические антитела, к способам их конструирования и их получения. Настоящее изобретение также относится к новому применению технологий, применимых в получении мультиспецифических белковых комплексов.
Уровень техники
Поиск технологий для построения мультиспецифических антител, применимых и масштабируемых для коммерческих и терапевтических целей, был трудно выполнимым. Подвергались анализам многие способы, но почти все характеризовались существенными недостатками, такими как, помимо прочего, плохая растворимость, неэкспрессируемость в клетках млекопитающих, низкий выход образования гетеродимеров, техническая сложность производства, иммуногенность, короткое время полужизни in vivo, нестабильность (например, Hollinger et al., (1993) PNAS 90:6444-6448; патент США №5932448; патент США №6833441; патент США №5591828; патент США №7129330; патент США №7507796; Fischer et al., (2007) Pathobiology 74:3-14; Booy (2006) Arch. Immunol. Ther. Exp. 54:85-101; Cao et al. (2003) 55:171-197; и Marvin et al., (2006) Current Opinion in Drug Discovery & Development 9(2): 184-193). Таким образом, существует потребность в улучшенных технологиях и способах создания мультиспецифических антител.
Сущность изобретения
Настоящее изобретение относится к новым белковым комплексам и к способам создания и производства белковых комплексов. В одном аспекте настоящее изобретение относится к суперспиральному домену, который связывается с СН-компонентом Fc, причем по необходимости суперспиральный домен может быть или может не быть отщепляемым от Fc-содержащего белка. В другом аспекте настоящее изобретение относится к белку, содержащему комплекс привязки и СН-компонента Fc, причем привязка может быть или может не быть отщепляемой от белка. В другом аспекте настоящее изобретение относится к белку, содержащему суперспираль, привязку и СН-компонент Fc, оптимально способный к образованию белкового комплекса, причем привязка и/или суперспираль могут быть или могут не быть отщепляемыми от белка в зависимости от желаемого эффекта. В другом аспекте настоящее изобретение относится к способу получения белка, содержащего привязку, где привязка отщепляется клеткой-хозяином или отщепляется в результате химической или ферментативной реакции in vitro. В другом аспекте настоящее изобретение относится к белку, содержащему суперспираль, привязку и СН-компонент Fc, оптимально способный к образованию белкового комплекса, причем привязка и/или суперспираль являются отщепляемыми от белка клеткой-хозяином, которая экспрессирует белок и усиленно экспрессирует ферменты, способные отщеплять привязку и/или суперспираль от белка.
В другом аспекте настоящее изобретение относится к способу получения белка или белкового комплекса, содержащего суперспираль и привязку, где привязка и/или суперспираль отщепляется клеткой-хозяином или отщепляется в результате химической или ферментативной реакции in vitro. В одном конкретном варианте осуществления белковый комплекс дополнительно содержит СН-компонент Fc. В другом аспекте настоящее изобретение относится к способу производства гетеромерного белкового комплекса, предусматривающему стадию культивирования клетки-хозяина при условиях, обеспечивающих экспрессию двух различных белков одинаковыми или различными рекомбинантными последовательностями нуклеиновой кислоты, причем каждый белок содержит суперспиральный домен и привязку. В следующем варианте осуществления клетка-хозяин содержит рекомбинантную последовательность нуклеиновой кислоты, кодирующую фермент, способный расщеплять привязку и/или суперспираль. В одном варианте осуществления способ производства дополнительно предусматривает стадию выделения белков, продуцированных клеткой-хозяином. В другом варианте осуществления способ производства дополнительно предусматривает стадию отщепления привязки и/или суперспирали от белка, продуцированного клеткой-хозяином.
В другом аспекте настоящее изобретение относится к белковым комплексам, описанным в настоящем документе, с привязкой и/или суперспиралью или без таковых. В дополнение ко многим усовершенствованиям и преимуществам, обеспеченным согласно настоящему документу, настоящее изобретение представляет простой, эффективный, высокопроизводительный способ производства по существу гомогенных гетеромультимерных комплексов.
В одном предпочтительном варианте осуществления настоящее изобретение относится к белковому комплексу, содержащему два или более полипептидов, где
первый полипептид содержит первый суперспиральный домен (СС) и первый СН-компонент Fc (FcCH); a
второй полипептид содержит (1) второй суперспиральный домен (СС) и второй FcCH,
где первый СС и второй СС образуют комплекс друг с другом; и первый FcCH и второй FcCH образуют комплекс друг с другом.
В одном варианте осуществления первый СС содержит последовательность формулы I по данному документу, а второй СС содержит последовательность формулы II по данному документу.
Во втором аспекте настоящее изобретение относится к белковому комплексу, содержащему (а) первый полипептид, содержащий первый суперспиральный домен (СС), где первый СС содержит гептадный повтор формулы I; и (b) второй полипептид, содержащий Fc СН-компонент и вторую суперспираль (СС), где второй СС содержит гептадный повтор формулы II, где n в формулах I и II больше или равно 2, и где в каждом гептадном повторе первый СС содержит остаток X6, который противоположен по заряду остатку Х'7 во втором СС, а первый СС содержит остаток Х7, который противоположен по заряду остатку Х'5 во втором СС.
В одном варианте осуществления первый полипептид дополнительно содержит VH-домен и VL-домен, а второй полипептид дополнительно содержит VH- и VL-домены, где VH- и VL-домены каждого полипептида связываются друг с другом в направлении от N-конца к С-концу: VL-CL-привязка-VH.
В следующем варианте осуществления VH-домен каждого полипептида отличается других. В другом варианте осуществления VL-домен каждого полипептида отличается от других.
В одном варианте осуществления белковый комплекс по настоящему изобретению содержит шарнирный участок, где шарнирный участок содержит мутацию K222A в своем шарнирном участке, мутацию С220А в своем шарнирном участке или мутации K222A и С220А в своем шарнирном участке.
В одном варианте осуществления белковый комплекс выбран из группы, состоящей из антитела, иммуноадгезина, пептидного антитела или аффитела. Таким образом, в соответствии со следующим вариантом осуществления первый и/или второй полипептиды могут дополнительно содержать связывающую мишень последовательность антитела (например, VH- или VL-домен), пептидное антитело (например, пептид), иммуноадгезин (например, внеклеточный домен) или каркасный белок, содержащий последовательность, которая связывает мишень.
В соответствии с одним вариантом осуществления белковый комплекс представляет собой антитело с одним плечом.
В одном аспекте настоящее изобретение относится к белковому комплексу, содержащему суперспираль, содержащему (а) первый полипептид, содержащий первый суперспиральный домен (СС), где первый СС содержит гептадный повтор формулы I:

где
X1 представляет собой гидрофобный аминокислотный остаток или аспарагин, каждый из Х2, Х3 и Х6 представляет собой любой аминокислотный остаток, Х4 представляет собой гидрофобный аминокислотный остаток, и каждый из Х5 и Х7 представляет собой заряженный аминокислотный остаток; и
(b) второй полипептид, содержащий второй суперспиральный домен (СС), где второй СС содержит гептадный повтор формулы II:

где
X'1 представляет собой гидрофобный аминокислотный остаток или аспарагин, каждый из Х'2, Х'3 и Х'6 представляет собой любой аминокислотный остаток,
Х'4 представляет собой гидрофобный аминокислотный остаток, и каждый из Х'5 и X'7 представляет собой заряженный аминокислотный остаток;
где n в формулах I и II больше или равно 2; и где в каждом гептадном повторе первый СС содержит остаток X5, который противоположен по заряду остатку Х'7 во втором СС, и первый СС содержит остаток Х7, который противоположен по заряду остатку Х'5 во втором СС.
В варианте осуществления каждый из первого и второго полипептидов содержит VH- и СН1-домены, и каждый может дополнительно содержать шарнирный домен. В другом варианте осуществления каждый из первого и второго полипептидов дополнительно содержит СН2- и СН3-домены. В еще одном варианте осуществления каждый из первого и второго полипептидов содержит VH-, СН1-, шарнирный, СН2- и СН3-домены, расположенные друг относительно друга в направлении от N-конца к С-концу: VH-СН1-шарнир-СН2-СН3.
В одном аспекте настоящее изобретение относится к антителу, содержащему (а) первый полипептид, содержащий VH-домен и первый суперспиральный домен (СС), где первый СС содержит гептадный повтор формулы I:
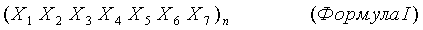
где
X1 представляет собой гидрофобный аминокислотный остаток или аспарагин, каждый из Х2, Х3 и Х6 представляет собой любой аминокислотный остаток,
Х4 представляет собой гидрофобный аминокислотный остаток, и каждый из Х5 и X7 представляет собой заряженный аминокислотный остаток; и
(b) второй полипептид, содержащий VH-домен и второй суперспиральный домен (СС), где второй СС содержит гептадный повтор формулы II:
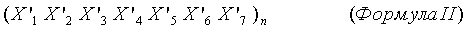
где
X'1 представляет собой гидрофобный аминокислотный остаток или аспарагин, каждый из Х'2, Х'3 и Х'6 представляет собой любой аминокислотный остаток,
Х'4 представляет собой гидрофобный аминокислотный остаток, и каждый из Х'5 и Х'7 представляет собой заряженный аминокислотный остаток;
где n в формулах I и II больше или равно 2; и где в каждом гептадном повторе первый СС содержит остаток Х5, который противоположен по заряду остатку Х'7 во втором СС, и первый СС содержит остаток Х7, который противоположен по заряду остатку Х'5 во втором СС.
В варианте осуществления каждый из первого и второго полипептидов содержит VH- и СН1-домены, и каждый может дополнительно содержать шарнирный домен. В другом варианте осуществления каждый из первого и второго полипептидов дополнительно содержит СН2- и СН3-домены. В еще одном варианте осуществления каждый из первого и второго полипептидов содержит VH-, СН1-, шарнирный, СН2- и СН3-домены, расположенные друг относительно друга в направлении от N-конца к С-концу: VH-СН1-шарнир-СН2-СН3.
В конкретном варианте осуществления антитело дополнительно содержит третий и четвертый полипептиды, где третий полипептид содержит первый VL-домен, а четвертый полипептид содержит второй VL-домен. В варианте осуществления VH-домен первого полипептида связывается с VL-доменом третьего полипептида с помощью привязки, и VH-домен второго полипептида связывается с VL-доменом четвертого полипептида с помощью привязки. В другом варианте осуществления третий полипептид дополнительно содержит первый CL-домен, где первые VL- и CL-домены расположены друг относительно друга в третьем полипептиде в направлении от N-конца к С-концу: VL-CL, и четвертый полипептид дополнительно содержит второй CL-домен, и где вторые VL- и CL-домены расположены друг относительно друга в четвертом полипептиде в направлении от N-конца к С-концу: VL-CL.
В дополнительном варианте осуществления последовательности первого VL-домена и второго VL-домена являются одинаковыми. В следующем варианте осуществления N-конец VH по меньшей мере одного из первого или второго полипептидов соединен с С-концом CL привязкой.
Во втором аспекте настоящее изобретение относится к антителу, содержащему (а) первый полипептид, содержащий VH-домен и первый суперспиральный домен (СС), где первый СС содержит гептадный повтор формулы I; и (b) второй полипептид, содержащий СН2- и СН3-домены и второй суперспиральный домен (СС), где второй СС содержит гептадный повтор формулы II, где n в формулах I и II больше или равно 2, и где в каждом гептадном повторе первый СС содержит остаток Х5, который противоположен по заряду остатку Х'7 во втором СС, и первый СС содержит остаток X7, который противоположен по заряду остатку Х'5 во втором СС.
В одном варианте осуществления второго аспекта настоящего изобретения первый полипептид содержит VH- и СН1-домены и может дополнительно содержать шарнирный домен. В другом варианте осуществления первый полипептид дополнительно содержит СН2- и СН3-домены. В следующем варианте осуществления второго аспекта настоящего изобретения первый полипептид содержит VH-, СН1-, шарнирный, СН2- и СН3-домены, расположенные друг относительно друга в направлении от Н-конца к С-концу: VH-СН1-шарнир-СН2-СН3. В еще одном варианте осуществления второго аспекта настоящего изобретения антитело дополнительно содержит третий полипептид, где третий полипептид содержит VL-домен. В одном примере третий полипептид дополнительно содержит CL-домен, и VL- и CL-домены расположены друг относительно друга в направлении от N-конца к С-концу: VL-CL. В еще одном варианте осуществления второго аспекта настоящего изобретения N-конец VH первого полипептида соединен с С-концом CL привязкой.
В одном варианте осуществления антитело с двумя плечами по настоящему изобретению содержит одну, а не две привязки так, что антитело содержит (1) полипептид, содержащий суперспиральный домен и тяжелую цепь, привязанную к легкой цепи в соответствии с настоящим изобретением, (2) полипептид, содержащий суперспиральный домен и тяжелую цепь, и (3) полипептид, содержащий легкую цепь. В другом варианте осуществления предусматривается клетка-хозяин, которая экспрессирует такое антитело с двумя плечами.
В других вариантах осуществления гидрофобный аминокислотный остаток в любом из X1, X'1, X4 и Х'4 выбран из группы аланина, валина, лейцина, изолейцина, триптофана, фенилаланина и метионина. В другом варианте осуществления заряженный аминокислотный остаток в любом из Х5, Х'5, Х7 и Х'7 выбран из группы лизина, аргинина, гистидина, аспарагиновой кислоты и глутаминовой кислоты. В следующем варианте осуществления по меньшей мере в одном гептадном повторе первого СС X1 представляет собой аспарагин, и соответствующий X'1 представляет собой аспарагин по меньшей мере в одном гептадном повторе второго СС.
В еще одном варианте осуществления первый СС содержит гептадный повтор, где X1 представляет собой лейцин или аспарагин, Х2 представляет собой аланин или глутамин, Х3 представляет собой аланин или глутамин, Х4 представляет собой лейцин, X5 представляет собой глутаминовую кислоту, Х6 представляет собой лизин или триптофан, а Х7 представляет собой глутаминовую кислоту; и второй СС содержит гептадный повтор, где X'1 представляет собой лейцин или аспарагин, Х'2 представляет собой аланин или глутамин, Х'3 представляет собой аланин или глутамин, Х'4 представляет собой лейцин, X'5 представляет собой лизин, Х'6 представляет собой лизин или триптофан, а Х'7 представляет собой лизин.
В следующих вариантах осуществления п в формулах I и II больше или равно 3, например, больше или равно 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100.
В дополнительных вариантах осуществления по меньшей мере один из первого или второго СС связан С-концом с константным доменом белка. Например, константным доменом является СН3-домен, и первый СС связан С-концом с СН3-доменом первого полипептида, а второй СС связан С-концом с СН3-доменом второго полипептида. Связывание, например, осуществляется расщепляемой линкерной последовательностью. В других вариантах осуществления сайт расщепления эндопептидазой Lys-C расположен ближе к N-концу по меньшей мере одного из первого или второго СС.
В другом аспекте настоящее изобретение относится к антителу, содержащему первый полипептид, содержащий VL-, CL-, привязки, VH-, СН1-, СН2- и СН3-домены, расположенные друг относительно друга в направлении от N-конца к С-концу: VL-CL-привязка-VH-СН1-СН2-СН3 (формула III). В одном варианте осуществления антитело дополнительно содержит второй полипептид формулы III.
В конкретном варианте осуществления антитело по настоящему изобретению является мультиспецифическим. Например, антитело является способным к связыванию по меньшей мере 2 антигенов, или антитело является способным к связыванию по меньшей мере 2 эпитопов на одном и том же антигене. В другом варианте осуществления антитело является биспецифическим.
В дополнительном варианте осуществления белки по настоящему изобретению содержат привязку, содержащую глициновый (G) и сериновый (S) остатки. В одном варианте осуществления привязка, например, характеризуется длиной от 15 до 50 аминокислот. В конкретном варианте осуществления привязка характеризуется длиной от 20 до 32 аминокислот, например, характеризуется длиной 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 или 32 аминокислот. Привязка в одном варианте осуществления содержит GGS повторы. В другом варианте осуществления привязка является отщепляемой. В одном предпочтительном варианте осуществления привязка является отщепляемой в двух сайтах на или близко к N- и С-концам привязки одним и тем же ферментом. В одном варианте осуществления привязка содержит сайт расщепления для фурина. В следующем варианте осуществления фуриновым сайтом расщепления является RXRXRR (SEQ ID NO:25), где X является любой аминокислотой.
В следующем варианте осуществления антитело по настоящему изобретению содержит мутацию, которая удаляет сайт расщепления эндопептидазой Lys-C. В одном примере мутация, которая удаляет сайт расщепления эндопептидазой Lys-C, находится в шарнирном домене. Например, антитело содержит замену K222A (европейская система нумерации).
В другом варианте осуществления привязка или линкер являются расщепляемыми одной или несколькими из следующих эндопептидаз: фурином, тромбином, гененазой, Lys-C, Arg-C, Asp-N, Glu-C, фактором Ха, протеазой вируса гравировки табака (TEV), энтерокиназой, протеазой риновируса С3 человека (HRV С3) или кининогеназой. В конкретном варианте осуществления привязка или линкер содержат пептидную связь аспарагин-глицин, например, пептидную связь аспарагин-глицин, которая является расщепляемой гидроксиламином.
В одном варианте осуществления антитело по настоящему изобретению дополнительно содержит мутации в CL/CH1 и/или в VH/VL области контакта с использованием методики «KnH». В одном варианте осуществления мультиспецифическое антитело по настоящему изобретению было сконструировано с использованием суперспирали по настоящему изобретению и «кнопки и застежки» в области контакта CL/CH1.
В дополнительном варианте осуществления антитело по настоящему изобретению содержит константный участок, конъюгированный с цитотоксическим средством.
В еще одном варианте осуществления антитело по настоящему изобретению экспрессируется эукариотической клеткой, например, клеткой млекопитающего, такой как клетка СНО. В альтернативном варианте осуществления антитело экспрессируется прокариотической клеткой, например, клеткой Е. coli.
В следующем аспекте настоящее изобретение относится к способу получения белкового комплекса, такого как антитело. В соответствии с этим настоящее изобретение представляет некоторые новые аспекты. В одном варианте осуществления этот способ предусматривает стадию культивирования клетки, содержащей вектор, кодирующий белок по настоящему изобретению, в культуральной среде. В одном варианте осуществления способ дополнительно предусматривает извлечение белка из клетки или культуральной среды. В другом варианте осуществления способ дополнительно предусматривает стадии (а) захватывания антитела в колонке, содержащей Белок А, (b) элюирование антитела из колонки и (с) разбавление элюированного антитела раствором, содержащим хаотропное средство или мягкое поверхностно-активное вещество.
В еще одном аспекте настоящее изобретение относится к способу поддержания содержащего суперспираль антитела в растворе. Этот способ предусматривает поддержание антитела в присутствии хаотропного средства или мягкого поверхностно-активного вещества. Примеры хаотропных средств или мягких поверхностно-активных веществ, которые могут быть использованы в этом способе, включают аргинин, гуанидин-HCl, мочевину, перхлорат лития, гистидин, додецилсульфат натрия (SDS), Твин, Тритон и NP-40.
В одном варианте осуществления гетеромультимерный комплекс по настоящему изобретению связывается с двумя или более молекулами-мишенями. В другом варианте осуществления каждый полипептид в гетеромультимерном комплексе связывается с другой молекулой-мишенью. В еще одном варианте осуществления гетеромультимерный комплекс ингибирует биологическую активность молекулы-мишени (молекул), с которой он связывается. В одном варианте осуществления, когда желаемый биологический эффект заключается в приведении клетки в истощенное или инактивированное состояние в непосредственной близости от эффекторной клетки (например, Т-лимфоцит, натуральная киллерная клетка (NK), макрофаг или другие одноядерные клетки), одной из молекул-мишеней может быть CD3, CD16 или CD64.
В соответствии с одним вариантом осуществления гетеромультимерный комплекс по настоящему изобретению связывается по меньшей мере с двумя молекулами-мишенями, выбранными из группы, состоящей из: IL-1 альфа и IL-1 бета, IL-12 и IL-18; IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-5 и IL-4; IL-13 и 1b-1 бета; IL-13 и IL-25; IL-13 и ТАКС; IL-13 и MDC; IL-13 и МЕР; IL-13 и TGF-P; агониста IL-13 и LHR; IL-12 и TWEAK, IL-13 и CL25; IL-13 и SPRR2a; IL-13 и SPRR2b; IL-13 и ADAM8, IL-13 и PED2, IL17A и IL17F, CD3 и CD19, CD138 и CD20; CD138 и CD40; CD19 и CD20; CD20 и CD3; CD3 8 и CD138; CD3 8 и CD20; CD3 8 и CD40; CD40 и CD20; CD-8 и IL-6; CD20 и BR3, ТNFальфа и TGF-бета, ТNFальфа и IL-1 бета; ТNFальфа и IL-2, TNFальфа и IL-3, ТNFальфа и IL-4, ТNFальфа и IL-5, ТNFальфа и IL6, ТNFальфа и IL8, TNFальфа и IL-9, ТNFальфа и IL-10, TNFальфa и IL-11, ТNFальфа и IL-12, ТNFальфа и IL-13, ТNFальфа и IL-14, ТNFальфа и IL-15, ТNFальфа и IL-16, ТNFальфа и IL-17, ТNFальфа и IL-18, ТNFальфа и IL-19, ТNFальфа и IL-20, ТNFальфа и IL-23, TNFальфа и TNFальфа, ТNFальфа и CD4, ТNFальфа и VEGF, ТNFальфа и MIF, ТМFальфа и ICAM-1, ТNFальфа и PGE4, ТNFальфа и PEG2, ТМFальфа и RANK лиганда, ТМFальфа и Те38; ТNFальфа и BAFF; ТNFальфа и CD22; ТNFальфа и CTLA-4; ТNFальфа и GP130; TNFα и IL-12p40; VEGF и HER2, VEGF-A и HER2, VEGF-A и PDGF, HER1 и HER2, VEGF-A и VEGF-C, VEGF-C и VEGF-D, HER2 и DR5, VEGF и IL-8, VEGF и MET, VEGFR и MET рецептора, VEGFR и EGFR, HER2 и CD64, HER2 и CD3, HER2 и CD16, HER2 и HER3; EGFR и HER2, EGFR и HER3, EGFR и HER4, IL-13 и CD40L, IL4 и CD40L, TNFR1 и IL-1R, TNFR1 и IL-6R и TNFR1 и IL-18R, ЕрСАМ и CD3, MAPG и CD28, EGFR и CD64, CSPG и RGM А; CTLA-4 и BTN02; IGF1 и IGF2; IGF1/2 и Erb2B; MAG и RGM A; NgR и RGM A; NogoA и RGM A; OMGp и RGM A; PDL-I и CTLA-4; и RGM А и RGM В.
В следующем варианте осуществления настоящее изобретение относится к выделенному антителу, содержащему первую тяжелую цепь, содержащую последовательность SEQ ID NO:1, вторую тяжелую цепь, содержащую последовательность SEQ ID NO:2, и легкую цепь, содержащую последовательность SEQ ID NO:3, где антитело специфически связывает FcεRI и FcγR2b.
В другом варианте осуществления настоящее изобретение относится к выделенному антителу, содержащему первую тяжелую цепь, содержащую последовательность SEQ ID NO:4, вторую тяжелую цепь, содержащую последовательность SEQ ID NO:5, и легкую цепь, содержащую последовательность SEQ ID NO:6, где антитело специфически связывает HER2.
В еще одном варианте осуществления настоящее изобретение относится к выделенному антителу, содержащему первую тяжелую цепь, содержащую последовательность SEQ ID NO:7, вторую тяжелую цепь, содержащую последовательность SEQ ID NO:5, и легкую цепь, содержащую последовательность SEQ ID NO:8, где антитело специфически связывает EGFR.
В дополнительном варианте осуществления настоящее изобретение относится к выделенному антителу, содержащему первую последовательность легкой цепи и первую последовательность тяжелой цепи, содержащую последовательность SEQ ID NO:9, и вторую последовательность легкой цепи и вторую последовательность тяжелой цепи, содержащую последовательность SEQ ID NO:10, где антитело специфически связывает HER2 и EGFR.
В следующем варианте осуществления настоящее изобретение относится к выделенному антителу, содержащему первую последовательность легкой цепи и первую последовательность тяжелой цепи, содержащую последовательность SEQ ID NO:11, и вторую последовательность легкой цепи и вторую последовательность тяжелой цепи, содержащую последовательность SEQ ID NO:10, где антитело специфически связывает HER2 и EGFR.
Настоящее изобретение также относится к применению антител, полученных в соответствии со способами, описанными в настоящем документе, в способах лечения. В одном варианте осуществления настоящее изобретение относится к применению антитела, которое специфически связывает FcεR1 и FcγR2b, в способе лечения аллергической или воспалительной реакции (например, аутоиммунного заболевания) у субъекта. Этот способ предусматривает введение антитела или фрагмента антитела субъекту в течение времени и в количестве, достаточных для лечения аллергической или воспалительной реакции у субъекта. В другом варианте осуществления настоящее изобретение относится к применению антитела, которое специфически связывает HER2 или EGFR (или и HER2, и EGFR), в способе лечения опухоли у субъекта. Этот способ предусматривает введение антитела или фрагмента антитела субъекту в течение времени и в количестве, достаточных для лечения опухоли у субъекта.
В конкретных вариантах осуществления способы лечения, описанные в настоящем документе, предусматривают применение фрагмента антитела, который не содержит суперспирали и/или привязки. В этом варианте осуществления последовательности суперспирали и/или привязки отщепляются от антитела после получения, и полученное в результате рекомбинантное антитело применяется для терапевтического введения. В следующих вариантах осуществления способы лечения предусматривают введение субъекту эффективного количества второго лекарства. Второе лекарство может представлять собой другое антитело или фрагмент антитела, химиотерапевтическое средство, цитотоксическое средство, антиангиогенное средство, иммуносупрессивное средство, пролекарство, цитокин, цитокиновый антагонист, цитотоксическую лучевую терапию, кортикостероид, противорвотное средство, противораковую вакцину, анальгетик или ингибирующее рост средство. Второе лекарство может быть введено до или после введения первого лекарства (например, антитела или фрагмента антитела). В другом варианте осуществления второе лекарство вводится одновременно с первым лекарством.
В дополнительных вариантах осуществления настоящее изобретение относится к выделенному полинуклеотиду, кодирующему последовательность любой из SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 17-18, 26, 31-32 или 35-36 или их комбинации, вектору, содержащему полинуклеотид, содержащий последовательность любой из SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 17-18, 26, 31-32 или 35-36 или их комбинации, и клетке-хозяину, содержащей такой вектор. Клеткой-хозяином может быть эукариотическая клетка, такая как клетка дрожжей, насекомых или млекопитающих. В одном варианте осуществления клеткой млекопитающего является клетка яичника китайского хомячка (клетка СНО). Клеткой-хозяином также может быть прокариотическая клетка, такая как клетка Е. coli. В других вариантах осуществления настоящее изобретение характеризует выделенный полипептид, содержащий любую последовательность из SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 17-18, 26, 31-32 или 35-36 или их комбинации.
Другие признаки и преимущества настоящего изобретения будут очевидны из следующего подробного описания, графических материалов и формулы изобретения.
Краткое описание чертежей
На фиг.1 схематично представлены ионные и гидрофобные взаимодействия между аминокислотами в типичной структуре суперспирали (СС). Остатки в первой СС обозначены X1-Х7, а остатки во второй СС обозначены X'1-X'7. Обозначены ионные взаимодействия между остатком X5 первой СС и остатком Х'7 второй СС, а также остатком X7 первой СС и остатком Х'5 второй СС. Кроме того, показаны гидрофобные взаимодействия между остатками Х4, и Х'4, и X1, и X'1.
На фиг.2А показаны аминокислотные последовательности типичных ACID.p1 (SEQ ID NO:12) и BASE.p1 (SEQ ID NO:13) суперспиральных доменов гетеродимеризации и кодирующие их последовательности ДНК (SEQ ID NO:21 и SEQ ID NO:22, соответственно).
На фиг.2В схематично представлены взаимодействия между типичными суперспиральными доменами гетеродимеризации ACID.p1 и BASE.p1 и последовательностями ДНК SEQ ID NO:21 и SEQ ID NO:22, соответственно.
На фиг.3 схематично представлена структура типичного биспецифического антитела, содержащего общую легкую цепь (общую LC), гетеродимерную суперспираль и мутацию в шарнирном участке (K222A; система нумерации по Kabat) первой и второй тяжелых цепей (НС1 и НС2), которая удаляет сайт расщепления эндопептидазой Lys-C.
На фиг.4А схематично представлена структура типичного антитела с одним плечом, содержащего полноразмерную тяжелую цепь (НС1), неполную тяжелую цепь (НС2), не содержащую VH- и СН1-доменов, легкую цепь (общую LC), гетеродимерную суперспираль и мутацию в шарнирном участке (K222A) НС1, которая удаляет сайт расщепления эндопептидазой Lys-C.
На фиг.4В схематично представлена структура типичного конъюгированного антитела, содержащего две полноразмерные тяжелые цепи, общую легкую цепь, суперспираль и цитотоксическое средство, конъюгированный с одним из константных участков тяжелой цепи. Цитотоксическое средство отмечено звездочкой.
На фиг.5 схематично представлена структура типичного привязанного биспецифического антитела. Антитело содержит две тяжелых цепи (НС1 и НС2) и две легких цепи (LC1 и LC2). Привязка связывает N-конец вариабельной тяжелой цепи НС1 с С-концом константной легкой цепи LC1, а вторая привязка связывает N-конец вариабельной тяжелой цепи НС2 с С-концом константной легкой цепи LC2. В этом примере привязки включают повторы глицин-глицин-серин (GGS). На этой фигуре легкие цепи (LC1 и LC2) являются различными, но привязанное антитело также может содержать общую легкую цепь. Типичное привязанное антитело дополнительно содержит гетеродимерную суперспираль и мутацию в шарнирном участке (K222A) НС1 и НС2, которая удаляет сайт расщепления эндопептидазой Lys-C.
На фиг.6 схематично представлена структура типичных тяжелой цепи (НС) и легкой цепи (LC), а также типичной привязки, связывающей N-конец вариабельной тяжелой цепи с С-концом константной легкой цепи. В этом примере расстояние, перекрытое привязкой, составляет приблизительно 92А или приблизительно 22 аминокислот в длину. Были тестированы привязки длиной 20, 23 и 26 аминокислот.
На фиг.7А схематично представлена структура типичного антитела, содержащего отщепляемые привязки и гетеродимерную суперспираль. Как показано на фигуре, типичная привязка связывает С-конец легкой цепи (LC) с N-концом тяжелой цепи (НС). Привязка может быть отщеплена от антитела по сайтам расщепления (X) с использованием, например, эндопептидазы Lys-C, фурина (РС1) или МН3ОН (гидроксиламина). Типичные сайты расщепления расположены на N- и С-концах привязки. Типичное антитело, показанное на фиг.7А, также содержит гетеродимерную суперспираль, которая может быть отщеплена от антитела по сайтам расщепления (X) ближе к N-концу к суперспиральным доменам с использованием, например, эндопептидазы Lys-C, фурина (РС1) или NH2OH.
На фиг.7В схематично представлены типичные расщепляемые привязки. В верхней части схемы показана типичная 26 аминокислотная последовательность привязки (SEQ ID NO:17) в SEQ ID NO:31, которая может быть отщеплена фурином и связывает N-конец легкой цепи (LC) и С-конец тяжелой цепи (НС). Фурин может отщеплять последовательность привязки по двухосновным сайтам (аргинин-аргинин) на N- и С-концах привязки. В нижней части схемы показана типичная 26 аминокислотная последовательность привязки (SEQ ID NO:18) в SEQ ID NO:32, которая может быть отщеплена эндопептидазой Lys-C по лизиновым остаткам на N- и С-концах последовательности привязки.
На фиг.8 показаны последовательности тяжелой цепи (НС; последовательность к FcγR2b-BASE.p1 и последовательность к FcεR1-ACID.p1) и общей легкой цепи (4d5 LC) биспецифического антитела, которое связывается и с FcεR1, и с FcγR2b. Последовательность к FcγR2b-BASE.p1 (SEQ ID NO:1) содержит последовательность тяжелой цепи к FcγR2b человека с последовательностью BASE.p1 суперспирального домена гетеродимеризации и мутацию K222A в шарнирном участке. Последовательность к FcεR1-ACID.p1 (SEQ ID NO:2) содержит последовательность тяжелой цепи к FcεR1 человека с последовательностью ACID.p1 суперспирального домена гетеродимеризации и мутацию K222A в шарнирном участке. Легкая цепь 4d5 антитела (SEQ ID NO:3) является общей для НС и FcγR2b, и FcεR1 этого биспецифического антитела.
На фиг.9-1 и 9-2 представлены последовательности, использованные для образования типичных антител с одним плечом. Одно типичное антитело с одним плечом специфически связывает HER2 и содержит последовательность антитела к HER2 1.ACID.p1 (НС анти-HER2 антитела-1 с последовательностью ACID.p1 суперспирального домена гетеродимеризации и мутацией K222A; SEQ ID NO:4), последовательность truncFC.BASE.p1 (тяжелую цепь, не содержащую VH- и СН1-домены с последовательностью BASE.p1 суперспирального домена гетеродимеризации; SEQ ID NO:5) и последовательность LC анти-HER2 антитела-1 (SEQ ID NO:6). Другое типичное антитело с одним плечом специфически связывает EGFR и содержит НС последовательности к EGFR (D1.5).ACID.p1 (к EGFR (D1.5) с последовательностью ACID.p1 суперспирального домена гетеродимеризации и мутацией K222A в шарнирном участке; SEQ ID NO:7), последовательность truncFC.BASE.p1 (тяжелую цепь, не содержащую VH- и CH1-доменов с последовательностью BASE.p1 суперспирального домена гетеродимеризации; SEQ ID NO:5) и последовательность LC антитела к EGFR (D1.5) (SEQ ID NO:8).
На фиг.10 показаны последовательности привязанных НС и LC (анти-НЕР2 (антитела-1) 26.ACID.p1 и D1.5-26.BASE.p1) биспецифического антитела, которое связывает и HER2, и EGFR/HER1. Последовательность анти-НЕР2 (антитела-1) 26.ACID.p1 содержит последовательность LC анти-НЕР2 антитела-1, привязанную к последовательности НС анти-НЕР2 антитела-1 с помощью 26-аминокислотной глицин-глицин-серин (GGS) привязки с суперспиральным доменом гетеродимеризации ACID.p1 и мутацией K222A (SEQ ID NO:9). Последовательность D1.5-26.BASE.p1 содержит последовательность LC антитела к EGFR D1.5, привязанную к последовательности НС антитела к EGFR D1.5 с помощью 26-аминокислотной привязки GGS с суперспиральным доменом гетеродимеризации BASE.p1 и мутацией K222A (SEQ ID NO:10).
На фиг.11 показаны последовательности привязанных НС и LC (анти-НЕР2 (антитела-2) 26.ACID.p1 и DL5.26.BASE.p1) другого типичного антитела, которое связывает и HER2, и EGFR/HER1. Последовательность (анти-HER2 (антитела-2) 26.ACID.p1 содержит последовательность LC анти-HER2 антитела-2, привязанную к последовательности НС анти-HER2 антитела-2 с помощью 26-аминокислотной привязки GGS, с суперспиральным доменом гетеродимеризации ACID.p1 и мутацией K222A (SEQ ID NO:11). Последовательность DL5.26.BASE.p1 содержит последовательность LC D1.5 антитела к EGFR, привязанную к последовательности НС антитела к EGFR D1.5 с помощью 26-аминокислотной привязки GGS, с суперспиральным доменом гетеродимеризации BASE.p1 и мутацией K222A (SEQ ID NO:10).
На фиг.12А-1, 12А-2, 12В-1, 12В-2 и 12В-3 представлены неполные аминокислотные последовательности НС (SEQ ID NO:15) и LC (SEQ ID NO:16) и последовательности ДНК SEQ ID NO:23 и SEQ ID NO:24, соответственно, анти-HER2 антитела-1, использованного для конструирования содержащих суперспиральные домены гетеродимеризации антител. Начало последовательности НС анти-HER2 антитела-1 показано на фигуре 12А, как расположение мутации K222A в последовательности. На фигуре 12В обозначено начало вариабельной легкой цепи (VL) анти-HER2 антитела-1, конец LC анти-HER2 антитела-1, начало вариабельной тяжелой цепи (VH) анти-HER2 антитела-1, конец VH анти-HER2 антитела-1 и расположение мутации K-А. Расположения сайтов рестрикции ClaI/Bsp106, BamH1 и ApaI, применимых в конструировании векторов, содержащих эти последовательности, также обозначены на фигурах 12А и 12В.
На фиг.13А и 13В представлены серии графиков результатов масс-спектрометрии и схематические представления, свидетельствующие о том, что гетеродимерная суперспираль может быть отщеплена от типичного биспецифического антитела α-FcεR1/α-FcγR2b с использованием эндопептидазы Lys-C. Показаны теоретические массы антитела с суперспиралью (левая схема) и антитела без суперспирали (правая схема), находящиеся в пределах погрешности экспериментально наблюдаемых масс, показанных на графиках результатов масс -спектрометрии выше соответствующей схемы, показывающей, что суперспираль была отщеплена от антитела.
На фиг.14А и 14В представлены серии графиков результатов масс-спектрометрии и схематические представления, свидетельствующие о том, что эндопептидаза Lys-C (правые панели) не расщепляет LC или НС типичного биспецифического антитела α-FcεR1/α-FcγR2b, но отщепляет суперспираль от НС (сравнение двух левых нижних панелей и двух правых нижних панелей). Теоретические массы легкой цепи (М.м.=26263), тяжелой цепи со суперспиральным доменом (М.м.=54917 или 55164) и тяжелой цепи без суперспирального домена (М.м.=50528 и 50767) находятся в пределах погрешности экспериментально наблюдаемых масс, показанных на графиках результатов масс-спектрометрии для соответствующего конструкта.
На фиг.15 представлены серии графиков, показывающих, что типичное биспецифическое антитело α-FcτR1/α-FcγR2b специфически и одновременно связывает оба эти антигена.
На фиг.16 представлен график, показывающий результаты анализа высвобождения гистамина с типичным биспецифическим антителом α-FcτR1/α-FcγR2b с общей LC. Концентрация антитела, использованная в анализе (в мкг/мл), обозначена по оси х, а количество высвобожденного гистамина (в нг/мл) обозначено по оси y.
На фиг.17А и 17В представлены серии графиков результатов масс-спектрометрии и схематические представления, свидетельствующие о том, что суперспираль может быть отщеплена от типичного антитела к α-EGFR с одним плечом с использованием эндопептидазы Lys-C. Теоретические массы антитела с одним плечом с суперспиралью (М.м.=109112) и антитела с одним плечом без суперспирали (М.м.=100419) находятся в пределах погрешности экспериментально наблюдаемых масс, показанных на графике результатов масс-спектрометрии для соответствующего конструкта.
На фиг.18А, 18В и 18С представлены серии графиков результатов масс-спектрометрии и схематические представления, свидетельствующие о том, что эндопептидаза Lys-C не расщепляет LC (легкую цепь с одним плечом; левые панели), полноразмерную НС (тяжелую цепь с одним плечом; средние панели) или НС, не содержащую VH- и СН1-доменов, (Fc с одним плечом; правые панели) типичного антитела к α-EGFR, но отщепляет суперспиральный домен от НС и НС, не содержащей VH- и СН1-доменов. Теоретическая молекулярная масса для соответствующих конструктов обозначена ниже графика, показывающего результаты масс-спектрометрии, и в каждом случае находится в пределах погрешности экспериментально наблюдаемой молекулярной массы.
На фиг.19А и 19В представлены серии графиков результатов масс-спектрометрии и схематические представления, свидетельствующие о том, что суперспираль может быть отщеплена от типичного привязанного биспецифического антитела к α-EGFR/α-HER2 с использованием эндопептидазы Lys-C. Теоретическая молекулярная масса расщепленного и нерасщепленного антител также обозначена на фигуре и находится в пределах погрешности, соответствующей экспериментально наблюдаемой молекулярной массе, обозначенной в результатах масс-спектрометрии.
На фиг.20А и 20В представлены серии графиков результатов масс-спектрометрии и схематические представления, свидетельствующие о том, что суперспираль может быть отщеплена от типичного привязанного биспецифического антитела к α-EGFR/α-HER2 с использованием эндопептидазы Lys-C, где антитело сначала обрабатывали эндопептидазой Lys-C, а затем образец подвергали масс-спектрометрическому анализу. Теоретические молекулярные массы расщепленных и нерасщепленных HC/LC комплексов также обозначены на фигуре, и теоретическая молекулярная масса каждого конструкта находится в пределах погрешности экспериментально наблюдаемой молекулярной массы, показанной в результатах масс-спектрометрии.
На фиг.21 представлен график, на котором показаны результаты октетного анализа, указывающего на то, что антитело к HER2 1 дикого типа и антитело к α-EGFR дикого типа не дают перекрестную реакцию с антигеном друг друга, но связывают соответствующий им антиген.
На фиг.22 представлен график, на котором показаны результаты октетного анализа, указывающего на то, что антитело к HER2 1 с одним плечом и антитело к α-EGFR с одним плечом не дают перекрестную реакцию с антигеном друг друга, но связывают соответствующий им антиген.
На фиг.23А представлен график, на котором показаны результаты октетного анализа, указывающего на то, что типичное привязанное биспецифическое антитело-1 к HER2/антитело к α-EGFR (8323) одновременно связывает и HER2, и EGFR. На верхней кривой антитело сначала инкубировали с внеклеточным доменом (ECD) EGFR, а затем с рецепторным ECD HER2, а на нижней кривой антитело сначала инкубировали с рецепторным ECD HER2, а затем с ECD EGFR.
На фиг.23В представлены серии графиков, показывающих аффинности связывания типичного биспецифического анти-HER2 антитела-1/антитела к α-EGFR с HER2 (верхняя часть) и EGFR1 (нижняя часть).
На фиг.24 представлено изображение иммуноблотов, показывающих, что типичное биспецифическое антитело к HER2 1/антитело к α-EGFR (D1.5) ингибирует в зависимости от дозы опосредованное трансформирующим фактором роста альфа (TGFa) фосфорилирование EGFR (рецептора эпидермального фактора роста) в экспрессирующих EGFR клетках NR6 (левая сторона). Антитело к EGFR D1.5 использовали в качестве контроля (правая сторона). Уровни фосфорилирования определяли с использованием антитела к фосфотирозину (α-pTyr), a антитело к тубулину (α-тубулин) использовали в качестве загрузочного контроля.
На фиг.25 представлены серии графиков, свидетельствующих о том, что биспецифическое антитело к HER2 1/антитело к α-EGFR (D1.5) ингибирует TGFα-индуцированный рост в течение трех суток в клетках NR6, которые являются стабильно трансфицированными для экспрессии EGFR.
На фиг.26 представлен график, свидетельствующий о том, что типичное биспецифическое антитело к HER2 1/антитело к α-EGFR (D1.5) ингибирует рост амплифицированных HER2 клеток ВТ474 в течение пяти суток аналогично контролю с антителом к HER2 1.
На фиг.27 представлены серии графиков, на которых показаны результаты анализа Fc-Fc и ELISA Fc-Fc в десятисуточном анализе фармакокинетических показателей (PK) человеческого контрольного IgG1-антитела (к EGFR) D1.5 с использованием мышей SCID Beige.
На фиг.28А и 28В представлены серии графиков, на которых показаны результаты ELISA EGFR-HER2 и ELISA Fc-Fc в десятисуточном анализе PK типичного биспецифического анти-HER2 антитела-1/антитела к α-EGFR (D1.5) с использованием мышей SCID Beige.
На фиг.29 представлен график, на котором показано сравнение воздействия типичного биспецифического анти-HER2 антитела-1/антитела к α-EGFR (D1.5) с контрольным D1.5 (к EGFR) и контрольным (антитело к HER2 2) антителами у мышей. Типичное биспецифическое антитело к HER2 1/антитело к α-EGFR (D1.5) оказывает воздействие у мышей за период времени теста, которое подобно воздействию контрольных антител.
На фиг.30А-1 и 30А-2, 30В-1 и 30В-2, 30С-1, 30С-2, 30С-3, 30С-4 и 30С-5, 30D-1, 30D-2 и 30D-3 представлены графики масс-спектроскопии, на которых показаны продукты расщепления тяжелой цепи и легкой цепи антитела после расщепления фурином в клетке, коэкспрессирующей фурин.
На фиг.31 представлен полный график масс-спектроскопии, на котором показано биспецифическое антитело, полученное с помощью экспрессии расщепляемого фурином привязанного антитела с суперспиралью в клетке СНО, которая коэкспрессировала фурин, и воздействия на антитело карбоксипептидазным расщеплением.
На фиг.32 (А) и (В) представлен уменьшенный график масс-спектроскопии, на котором показано биспецифическое антитело, полученное с помощью экспрессии расщепляемого фурином привязанного антитела с суперспиралью в клетке СНО, которая коэкспрессировала фурин, и воздействия на антитело карбоксипептидазным расщеплением.
Подробное описание изобретения
Не ограничиваясь какой-либо теорией, заявители полагают, что суперспиральные домены димеризации, описанные в настоящем документе, представляют начальный триггер, который запускает связывание двух или более молекул вместе с высокой степенью точности и эффективности, что удивительно, даже в присутствии участков Fc иммуноглобулина, где участки Fc также естественно прикреплены друг к другу в условиях клеточной культуры.
При уменьшении гомодимеризации тяжелых цепей применение суперспиральных доменов гетеродимеризации, описанных в настоящем документе, представляет прорыв в возможности производить однородную популяцию белковых комплексов, содержащих СН-компонент Fc (например, мультиспецифических или антител с одним плечом и т.д.). Мультиспецифические комплексы выгодны для использования в терапевтических применениях, поскольку, например, они могут контролировать взаимное расположение мишени (например, клетки опухоли) и средства, направленного на мишень (например, Т-клетки), или они могут устранить необходимость в комбинированной терапии и риск, связанный с получением субъектом двух или более видов терапевтического лечения. Кроме того, для облегчения конструирования антител, включающих Мультиспецифические антитела, привязки в соответствии с настоящим изобретением могут быть использованы для связывания легкой и тяжелой цепей антитела и тем самым обеспечивать надлежащую ассоциацию каждой легкой цепи с соответствующей ей тяжелой цепью.
I. Определения
Термин «антитело» в настоящем документе используется в самом широком смысле и относится к любой иммуноглобулиновой (Ig) молекуле, содержащей две тяжелые цепи и две легкие цепи, и любому их фрагменту, мутанту, варианту или производной при условии, что они проявляют желаемую биологическую активность (например, активность по связыванию эпитопа). Примеры антител включают моноклональные антитела, поликлональные антитела, мультиспецифические антитела и фрагменты антител.
Система нумерации по Kabat обычно используется при ссылке на остаток в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). «Европейская система нумерации» или «индекс Европейского Союза» обычно используется при ссылке на остаток константного участка тяжелой цепи иммуноглобулина (например, индекс Европейского Союза приведен в Kabat et al., supra). «Индекс Европейского Союза по Kabat» относится к нумерации ЕС остатков человеческого антитела IgG1. Если в настоящем документе не указано иное, ссылки на числа остатков в вариабельном домене антител означает нумерацию остатков в соответствии с системой нумерации по Kabat. Если в настоящем документе не указано иное, ссылки на числа остатков в константном домене тяжелой цепи антител означает нумерацию остатков в соответствии с европейской системой нумерации.
Термин «мультиспецифическое антитело» используется в самом широком смысле и в особенности охватывает антитело, которое характеризуется полиэпитопной специфичностью. Такие мультиспецифические антитела включают без ограничения антитело, содержащее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), где единица VHVL характеризуется полиэпитопной специфичностью, антитела, содержащие два или более VL- и VH-доменов, причем каждая единица VHVL связывается с разными эпитопами, антитела, содержащие два или более единичных вариабельных доменов, причем каждый единичный вариабельный домен связывается с разными эпитопами, полноразмерные антитела, фрагменты антител, такие как Fab, Fv, dsFv, scFv, диатела, биспецифические диатела и триатела, фрагменты антител, связанные ковалентно или нековалентно. «Полиэпитопная специфичность» относится к способности специфически связываться с двумя или более разными эпитопами на одной и той же или других мишени(ях). «Моноспецифический» относится к способность связываться только с одним эпитопом. В соответствии с одним вариантом осуществления мультиспецифическое антитело представляет собой IgG-антитело, которое связывается с каждым эпитопом с аффинностью от 5 мкМ до 0,001 пМ, от 3 мкМ до 0,001 пМ, от 1 мкМ до 0,001 пМ, от 0,5 мкМ до 0,001 пМ или от 0,1 мкМ до 0,001 пМ.
Встречающаяся в природе основная 4-цепочечная единица антитела является гетеротетрамерным гликопротеином, состоящим из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей (IgM-антитело состоит из 5 основных гетеротетрамерных единиц наряду с дополнительным полипептидом, названным цепью J, и поэтому содержит 10 связывающих антиген сайтов, в то время как секретируемые IgA-антитела могут полимеризоваться с формированием поливалентных комплексов, содержащих 2-5 основных 4-цепочечных единиц вместе с цепью J). В случае IgG 4-цепочечная единица, как правило, характеризуется массой около 150000 Дальтон. Каждая цепь L связывается с цепью одной ковалентной дисульфидной связью, в то время как две цепи Н связываются друг с другом одной или несколькими дисульфидными связями в зависимости от изотипа цепи Н. Каждая цепь Н и L также характеризуется регулярно расположенными межцепочечными дисульфидными мостиками. Каждая цепь Н содержит на N-конце вариабельной домен (VH) с последующими тремя константными доменами (CH) для каждой из цепей α и γ и четырьмя доменами CH для изотипов µ и ε. Каждая цепь L содержит на N-конце вариабельный домен (VL) с последующим константным доменом (CL) на другом его конце. VL выравнивается с VH, a CL выравнивается с первым константным доменом тяжелой цепи (CH1). Считается, что определенные аминокислотные остатки формируют область контакта между вариабельными доменами легких цепей и тяжелых цепей. Спаривание VH и VL вместе формирует единый связывающий антиген сайт. По структуре и свойствам различных классов антител, см., например, Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, стр.71 и Chapter 6.
Цепь L любых видов позвоночных может быть причислена к одному из двух четко различающихся типов, названных каппа и лямбда, на основании аминокислотных последовательностей их константных доменов. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей (CH) иммуноглобулины могут быть причислены к различным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, содержащие тяжелые цепи, обозначенные α, δ, γ, ε и µ, соответственно. Классы γ и α дополнительно подразделяются на подклассы на основании относительно незначительных различий в последовательности Сн и функции, например, у людей экспрессируются следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Термин «вариабельный» описывает тот факт, что определенные сегменты вариабельных доменов у антител широко различаются по последовательности. Домен V опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако вариабельность неравномерно распределена в 110-аминокислотном интервале вариабельных доменов. Наоборот, участки V состоят из относительно инвариантных отрезков, названных каркасными участками (FR) из 15-30 аминокислот, отделенных более короткими участками крайней вариабельности, названными «гипервариабельными участками», каждый из которых характеризуется длиной 9-12 аминокислот. Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит четыре FR, преимущественно принимающие конфигурацию бета-листа, соединенные тремя гипервариабельными участками, которые формируют соединяющие петли, а в некоторых случаях формирующие части структуры бета-листа. Гипервариабельные участки каждой цепи удерживаются вместе в непосредственной близости посредством FR и с гипервариабельными участками от другой цепи способствуют образованию связывающего антиген сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Константные домены не вовлечены напрямую в связывание антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в клеточной зависимой от антитела цитотоксичности (ADCC).
Термин «гипервариабельный участок», «HVR» или «HV» при использовании в настоящем документе относится к участкам вариабельного домена антитела, которые являются гипервариабельными в последовательности и/или формируют структурно определенные петли. Обычно антитела содержат шесть HVR, три в VH (H1, H2, Н3) и три в VL (L1, L2, L3). В нативных антителах Н3 и L3 демонстрируют наибольшее разнообразие из шести HVR, а Н3, в частности, как полагают, играют уникальную роль в придании тонкой специфичности антителам. См., например, Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Действительно, встречающиеся в природе верблюжьи антитела, состоящие только из тяжелой цепи, являются функциональными и стабильными в отсутствии легкой цепи. См., например, Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
Ряд описаний HVR используется и охватывается настоящим документом. Принцип определяющих комплементарность участков (CDR) по Kabat основан на вариабельности последовательности и является наиболее часто используемым (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Напротив, принцип Chothia основывается на расположении структурных петель (Chothia and Lesk.7. Mol. Biol. 196:901-917 (1987)). Принцип HVR АЬМ представляет собой компромисс между принципом HVR по Kabat и принципом структурных петель Chothia и реализуется программным обеспечением Oxford Molecular, моделирующим антитела АЬМ. «Контактные» HVR основываются на анализе доступных комплексных кристаллических структур. Остатки каждого из этих HVR приведены ниже.
HVR могут содержать следующие «расширенные HVR»: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3) в VH. Остатки вариабельного домена нумеруются по Kabat et al. выше для каждого из этих определений.
«Каркасные участки» (FR) являются такими остатками вариабельного домена, которые отличны от остатков CDR. Каждый вариабельный домен обычно характеризуется четырьмя FR, идентифицированными как FR1, FR2, FR3 и FR4. Если CDR определяются по Kabat, остатки FR легкой цепи расположены около остатков 1-23 (LCFR1), 35-49 (LCFR2), 57-88 (LCFR3) и 98-107 (LCFR4), а остатки FR тяжелой цепи расположены около остатков 1-30 (HCFR1), 36-49 (HCFR2), 66-94 (HCFR3) и 103-113 (HCFR4) в остатках тяжелой цепи. Если CDR содержат аминокислотные остатки из гипервариабельных петель, остатки FR легкой цепи расположены около остатков 1-25 (LCFR1), 33-49 (LCFR2), 53-90 (LCFR3) и 97-107 (LCFR4) в легкой цепи, а остатки FR тяжелой цепи расположены около остатков 1-25 (HCFRI), 33-52 (HCFR2), 56-95 (HCFR3) и 102-113 (HCFR4) в остатках тяжелой цепи. В некоторых случаях, когда CDR содержит аминокислоты и из CDR, определенных по Kabat, и аминокислоты из гипервариабельной петли, остатки FR будут соответствующим образом уточнены. Например, если CDRH1 содержит аминокислоты Н26-Н35, остатки FR1 тяжелой цепи располагаются в положениях 1-25, а остатки FR2 располагаются в положениях 36-49.
«Консенсусный каркас человека» является каркасом, который представляет наиболее часто встречающиеся аминокислотные остатки в отборе последовательностей каркасных последовательностей VL или VH иммуноглобулина человека. Как правило, отбор последовательностей VL или VH иммуноглобулина человека осуществляется из подгруппы последовательностей вариабельного домена. Обычно подгруппа последовательностей представляет собой подгруппу в соответствии с Kabat. В одном варианте осуществления для VL подгруппой является подгруппа каппа I по Kabat. В одном варианте осуществления для VH подгруппой является подгруппа III по Kabat.
Одним примером «интактного» антитела является антитело, которое содержит связывающий антиген сайт, а также CL и по меньшей мере константные домены тяжелой цепи CH1, CH2 и CH3. Константные домены могут быть константными доменами нативной последовательности (например, человеческими константными доменами нативной последовательности) или их вариантом аминокислотной последовательности.
«Фрагменты антител» содержат часть интактного антитела, предпочтительно связывающую антиген, или вариабельный участок интактного антитела. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела (Db); тандемные диатела (taDb), линейные антитела (например, патент США №5641870, пример 2; Zapata et al., Protein Eng. 8(10):1057-1062 (1995)); антитела, с одним плечом, антитела с единичным вариабельным доменом, минитела, молекулы антител с одной цепью и мультиспецифические антитела, сформированные из фрагментов антител (например, включающие без ограничения Db-Fc, taDb-Fc, taDb-СН3 и (scFV)4-Fc).
Экспрессия «однодоменных антител» (sdAb) или «антител с единичным вариабельным доменом (SVD)», как правило, относится к антителам, в которых единичный вариабельный домен (VH или VL) может обеспечивать антигенное связывание. Другими словами, единичный вариабельный домен не требует взаимодействия с другим вариабельным доменом для распознавания антигена-мишени. Примеры антител с единичным доменом включают антитела, полученные от верблюжьих (ламы и верблюды) и хрящевых рыб (например, акулы-няньки), а также полученные рекомбинантными способами из человеческих и мышиных антител (Nature (1989) 341:544-546; Dev Comp Immunol (2006) 30:43-56; Trend Biochem Sci (2001) 26:230-235; Trends Biotechnol (2003):21:484-490; WO 2005/035572; WO 03/035694; Febs Lett (1994) 339:285-290; WO 00/29004; WO 02/051870).
Экспрессия «линейных антител», как правило, относится к антителам, описанным в Zapata et al., Protein Eng. 8(10):1057-1062 (1995). Вкратце, эти антитела содержат пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые вместе с полипептидами комплементарной легкой цепи формируют пару связывающих антиген участков. Линейные антитела могут быть биспецифическими или моноспецифическими.
Термин «выступ во впадину» или метод «КnН», упоминаемый в настоящем документе, относится к методу, направляющему спаривание двух полипептидов вместе in vitro или in vivo путем введения выпячивания (выступа) одного полипептида в углубление (впадину) другого полипептида в области контакта, в которой они взаимодействуют. Например, KnH были введены в связывающие Fc:Fc области контакта, области контакта CL:CH1 или области контакта VH/VL антител (например, заявка на патент США №2007/0178552, WO 96/027011, WO 98/050431 и Zhu et al. (1997) Protein Science 6:781-788). Это особенно применимо в управлении спариванием двух различных тяжелых цепей вместе в ходе производства мультиспецифических антител. Например, мультиспецифические антитела, содержащие KnH в своих участках Fc, могут дополнительно содержать единичные вариабельные домены, связанные с каждым участком Fc, или дополнительно содержать различные вариабельные домены тяжелых цепей, которые спарены с подобными или отличающимися вариабельными доменами легких цепей. Метод КnН также может быть использован для спаривания двух различных рецепторных внеклеточных доменов вместе или любых других полипептидных последовательностей, которые содержат различные распознающие мишень последовательности (например, включающие аффитела, пептидные антитела и другие слитые молекулы Fc). Расщепление антител папаином дает два идентичных связывающих антиген фрагмента, названных фрагментами «Fab» и остаточным фрагментом «Fc», обозначениями, отражающими его способность легко кристаллизоваться. Фрагмент Fab состоит из полной цепи L вместе с вариабельным участком домена цепи Н (VH) и первого константного домена одной тяжелой цепи
(CH1). Обработка антитела трипсином дает единичный большой фрагмент F(ab')2, который почти соответствует двум связанным дисульфидной связью фрагментам Fab, характеризующимся связывающей двухвалентный антиген активностью, и все еще способный к перекрестному связыванию антигена. Фрагменты Fab' отличаются от фрагментов Fab наличием нескольких дополнительных остатков на карбоксиконце домена CH1, содержащего один или несколько цистеинов из шарнирного участка антитела. Fab'-SH в настоящем документе представляет собой обозначение для Fab', в котором цистеиновый остаток(остатки) константных доменов несет свободную тиольную группу. Фрагменты антител F(ab')2 исходно были получены как пары фрагментов Fab', между которыми содержатся шарнирные цистеины. Также известны другие химически слитые фрагментов антител.
Фрагмент Fc содержит карбоксиконцевые части обеих цепей Н, удерживаемых вместе дисульфидами. Эффекторные функции антител определяются последовательностями на участке Fc; этот участок также является частью, распознаваемой рецепторами Fc (FcR), находящимися на определенных типах клеток.
«Fv» состоит из димера домена вариабельного участка с одной тяжелой и одной легкой цепями в прочной нековалентной ассоциации. При фолдинге этих двух доменов возникает шесть гипервариабельных петель (по 3 петли в каждой из цепей Н и L), которые представляют аминокислотные остатки для связывания антигена и придают связывающую антиген специфичность антителу. Однако даже единичный вариабельный домен (или половина Fv, содержащий только три CDR, специфических для антигена) обладает способностью распознавать и связывать антиген, хотя часто с более низкой аффинностью, чем полный сайт связывания.
«Одноцепочечные Fv», также обозначаемые как «sFv» или «scFv», являются фрагментами антител, которые содержат домены VH и VL антител, соединенные в единую полипептидную цепь. Предпочтительно полипептид sFv дополнительно содержит полипептидный линкер между доменами VH и VL, который дает возможность sFv формировать желаемую структуру для связывания антигена. Для обзора sFv см. Pluckthun, The Pharmacology of Monoclonal Аntibоdiеs, vol.113, Rosenbwg and Moore eds.. Springer-Verlag, New York, pp.269-315 (1994); Malmborg et al., J. Immunol. Methods 183:7-13, 1995.
Термин «диатела» относится к малым фрагментам антител, полученным путем конструирования фрагментов sFv (см. предыдущий абзац) с короткими линкерами (около 5-10 остатков) между доменами VH и VL так, что достигается межцепочечное а не внутрицепочечное слияние доменов V, что дает двухвалентный фрагмент, т.е. фрагмент, содержащий два связывающих антиген сайта. Биспецифические диатела являются гетеродимерами двух «кроссоверных» фрагментов sFv, в которых домены VH и VL двух антител представлены на различных полипептидных цепях. Диатела описаны более полно, например, в европейском патенте №404097; WO 93/11161 и в Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993).
Термин «антитело с одним плечом» или «антитела с одним плечом» относится к антителу, которое содержит (1) вариабельный домен, соединенный пептидной связью с полипептидом, содержащим домен СН2, домен СН3 или домен СН2-СН3, и (2) второй домен СН2, СН3 или СН2-СН3, где вариабельный домен не соединен пептидной связью с полипептидом, содержащим второй домен СН2, СН3 или СН2-СН3. В одном варианте осуществления антитело с одним плечом содержит 3 полипептида: (1) первый полипептид, содержащий вариабельный домен (например, VH), CH1, СН2 и СН3, (2) второй полипептид, содержащий вариабельный домен (например, VL) и домен CL, и (3) третий полипептид, содержащий домены СН2 и СН3. В варианте осуществления третий полипептид не содержит вариабельный домен. В другом варианте осуществления антитело с одним плечом содержит неполный шарнирный участок, содержащий два цистеиновых остатка, которые формируют дисульфидные связи, соединяющие константные тяжелые цепи. В одном варианте осуществления вариабельные домены антитела с одним плечом формируют связывающий антиген участок. В другом варианте осуществления вариабельный домен антитела с одним плечом является единичным вариабельным доменом, причем каждый единичный вариабельной домен представляет собой связывающий антиген участок.
Антитела по настоящему изобретению могут быть «химерными» антителами, в которых часть тяжелой и/или легкой цепи являются идентичными или гомологичными соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих к конкретному классу или подклассу антител, тогда как оставшаяся(иеся) цепь(и) идентична(ы) или гомологична(ы) соответствующим последовательностям в антителах, полученных от других видов или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител, при условии, что они проявляют желаемую биологическую активность (патент США №4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Интересующие согласно настоящему документу химерные антитела включают приматизированные антитела, содержащие связывающие антиген последовательности вариабельных доменов, полученные от приматов, отличных от человека (например, от обезьяны Старого Света, человекообразной обезьяны и т.д.), и последовательности константных участков человека.
«Гуманизированные» формы отличных от человеческих (например, грызунов) антител являются химерными антителами, которые содержат минимальную последовательность, полученную от отличного от человеческого антитела. В большинстве своем гуманизированные антитела являются человеческими иммуноглобулинами (антитело-реципиент), в котором остатки из гипервариабельного участка реципиента замещены остатками из гипервариабельного участка видов, отличных от человеческого (антитело-донор), таких как мышь, крыса, кролик или примат, отличный от человека, обладающие желаемой специфичностью, аффинностью и емкостью антитела. В некоторых случаях остатки каркасного участка (FR) человеческого иммуноглобулина замещены соответствующими отличными от человеческих остатками. Более того, гуманизированные антитела могут содержать остатки, которые отсутствуют в антителе-реципиенте или антителе-доноре. Данные модификации выполнены для дальнейшего улучшения характеристики антитела. В целом гуманизированное антитело будет содержать в основном все по меньшей мере из одного, а обычно двух вариабельных доменов, в которых все или в основном все из гипервариабельных петель соответствуют таковым в отличном от человеческого иммуноглобулине, и все или в основном все из FR являются таковыми из последовательности иммуноглобулина человека. Необязательно гуманизированное антитело также будет содержать по меньшей мере часть константного участка (Fc) иммуноглобулина из иммуноглобулина человека. Дополнительные подробности см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Термин «комплекс» или «комплексный», используемый в настоящем документе, относится к ассоциации из двух или более молекул, взаимодействующих друг с другом через связи и/или силы (например, вандерваальсовы, гидрофобные, гидрофильные силы), которые не являются пептидными связями. В одном варианте осуществления комплекс является гетеромультимерным. Следует понимать, что термин «белковый комплекс» или «полипептидный комплекс», используемый в настоящем документе, включает комплексы, которые содержат небелковую молекулу, конъюгированную с белком в белковом комплексе (например, содержащий без ограничения химические молекулы, такие как токсин или маркирующее средство).
Термин «гетеромультимер» или «гетеромультимерный», используемый в настоящем документе, описывает два или более полипептидов, которые взаимодействуют друг с другом посредством непептидной ковалентной связи (например, дисульфидной связи) и/или посредством нековалентного взаимодействия (например, водородных связей, ионных связей, вандерваальсовых сил и гидрофобных взаимодействий), в которых по меньшей мере две молекулы характеризуются последовательностями, отличными одна от другой.
Используемый в настоящем документе термин «иммуноадгезин» обозначает молекулы, которые сочетают специфичность связывания гетерологического белка («адгезина») с эффекторными функциями константных доменов иммуноглобулина. Структурно иммуноадгезины характеризуются слиянием аминокислотной последовательности с желаемой специфичностью связывания, причем аминокислотная последовательность является отличной от сайта распознавания и связывания антигена в антителе (т.е., является «гетерологической» по сравнению с константным участком антитела), и последовательностью константного домена иммуноглобулина (например, последовательность СН2 и/или СН3 IgG). Типичные последовательности адгезина содержат смежные аминокислотные последовательности, содержащие часть рецептора или лиганда, который связывается с интересующим белком. Последовательности адгезина также могут быть последовательностями, которые связывают интересующий белок, но не являются рецепторной или лигандной последовательностями (например, адгезиновыми последовательностями в пептидных антителах). Такие полипептидные последовательности могут быть выбраны или идентифицированы различными способами, в том числе методами фагового дисплея, а также методами высокопроизводительной сортировки. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, например, подтипов IgG-1, IgG-2, IgG-3 или IgG-4, IgA (включающего IgA-1 и IgA-2), IgE, IgD или IgM.
Антитело по настоящему изобретению, «которое связывает» интересующий антиген, является антителом, связывающим антиген с достаточной аффинностью так, что антитело является применимым в качестве диагностического и/или терапевтического средства для нацеливания на белок или клетку или ткань, экспрессирующие антиген, и не дает существенную перекрестную реакцию с другими белками. В таких вариантах осуществления степень связывания антитела с «немишеневым» белком будет составлять менее около 10% от связывания антитела с его конкретным белком-мишенью, как определено анализом клеточной сортировки с активацией флуоресценции (FACS) или радиоиммунопреципитации (RIA) или ELISA. В отношении связывания антитела с молекулой-мишенью термин «специфическое связывание» или «специфически связывается с» или является «специфическим для» конкретного полипептида или эпитопа на конкретной полипептидной мишени означает связывание, которое измеримо отличается от неспецифического взаимодействия (например, неспецифическим взаимодействием может быть связывание с бычьим сывороточным альбумином или казеином). Специфическое связывание может быть измерено, например, путем определения связывания молекулы по сравнению со связыванием контрольной молекулы. Например, специфическое связывание может быть определено через конкурирование с контрольной молекулой, которая подобна мишени, например, избыток немеченой мишени. В этом случае специфическое связывание выявляется, если связывание меченой мишени с зондом конкурентно ингибируются избыточной немеченой мишенью. Термин «специфическое связывание» или «специфически связывается с» или является «специфическим для» конкретного полипептида или эпитопа на конкретной полипептидной мишени, используемый в настоящем документе, может быть продемонстрирован, например, молекулой, характеризующейся Kd для мишени по меньшей мере около 200 нМ, альтернативно по меньшей мере около 150 нМ, альтернативно по меньшей мере около 100 нМ, альтернативно по меньшей мере около 60 нМ, альтернативно по меньшей мере около 50 нМ, альтернативно по меньшей мере около 40 нМ, альтернативно по меньшей мере около 30 нМ, альтернативно по меньшей мере около 20 нМ, альтернативно по меньшей мере около 10 нМ, альтернативно по меньшей мере около 8 нМ, альтернативно по меньшей мере около 6 нМ, альтернативно по меньшей мере около 4 нМ, альтернативно по меньшей мере около 2 нМ, альтернативно по меньшей мере около 1 нМ или больше. В одном варианте осуществления термин «специфическое связывание» относят к связыванию, при котором молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде без существенного связывания с любым другим полипептидом или полипептидным эпитопом.
«Аффинность связывания» в общем относится к силе общей суммы нековалентных взаимодействий между единичным сайтом связывания молекулы (например, антитела) и ее партнером связывания (например, антигеном). Если не указано иное, используемый в настоящем документе термин «аффинность связывания» относится к истинной аффинности связывания, которая отражает взаимодействие 1:1 между членами пары связывания (например, антитела и антигена). Аффинность молекулы Х к ее партнеру Y в общем может быть представлена константой диссоциации (Kd). Например, Kd может составлять около 200 нМ, 150 нМ, 100 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 8 нМ, 6 нМ, 4 нМ, 2 нМ, 1 нМ или быть сильнее. Аффинность может быть измерена общими способам, известными в данной области, включая те, что описаны в настоящем документе. Антитела с низкой аффинностью обычно связывают антиген медленно и характеризуются тенденцией быстро диссоциировать, тогда как антитела с высокой аффинностью обычно связывают антиген быстрее и характеризуются тенденцией оставаться связанными дольше. В данной области известны разнообразные способы измерения аффинности связывания, любой из которых может быть использован для целей настоящего изобретения.
В одном варианте осуществления «Kd» или «значение Kd» в соответствии с настоящим изобретением измеряют с использованием испытаний поверхностного плазменного резонанса с использованием BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Пискатавэй, Нью-Джерси) при 25°С с чипами с иммобилизированными антигенами СМ5 при -10 единицах отклика (RU). Вкратце, карбоксиметилированные декстрановые биосенсорные чипы (СМ5, BIAcore Inc.) активируют N-этил-N'-(3-диметиламинопропил)-карбодиимидом гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разводят 10 мМ ацетата натрия при рН 4,8 до 5 мкг/мл (~0,2 мкМ) перед инъекцией при скорости потока 5 мкл/минута для достижения приблизительно 10 единиц отклика (RU) спаренного белка. После инъекции антигена вводят 1 М этаноламина, чтобы блокировать непрореагировавшие группы. Для кинетических измерений двукратные серийные разведения Fab (например, от 0,78 нМ до 500 нМ) вводят в PBS с 0,05% Твин-20 (PBST) при 25°С при скорости потока приблизительно 25 мкл/минута. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают с использованием простой модели связывания Langmuir один-к-одному (программное обеспечение для оценки BIAcore, версия 3.2) путем одновременного построения сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Kd) вычисляют как отношение koff/kon. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации в ходе упомянутого выше анализа поверхностного плазменного резонанса превышает 106 М-1 с-1, то скорость ассоциации может быть определена с помощью метода гашения флуоресценции, согласно которому измеряют увеличение или снижение интенсивности испускания флуоресценции (возбуждение = 295 нМ; испускание = 340 М, полоса пропускания 16 нМ) при 25°С 20 нМ антитела против антигена (в форме Fab) в PBS при рН 7,2 в присутствии увеличивающихся концентраций антигена, как измерено на спектрометре, таком как спектрофотометр, оснащенный ограничителем потока (Aviv Instruments), или спектрофотометр SLM-Aminco серии 8000 (ThermoSpectronic), оснащенный кюветой для перемешивания, содержащей красный краситель.
«Скорость ассоциации» или «kon» в соответствии с настоящим изобретением также может быть определена тем же методом поверностного плазменного резонанса, описанным выше, с использованием BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Пискатавэй, Нью-Джерси) при 25°С с чипами с иммобилизированными антигенами СМ5 при ~10 единицах отклика (RU). Вкратце, карбоксиметилированные декстрановые биосенсорные чипы (СМ5, BIAcore Inc.) активируют N-этил-N'-(3-диметиламинопропил)-карбодиимидом гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разводят в 10 мМ ацетата натрия при рН 4,8 до 5 мкг/мл (~0,2 мкМ) перед инъекцией при скорости потока 5 мкл/минута для достижения приблизительно 10 единиц отклика (RU) спаренного белка. После инъекции антигена вводят 1 М этаноламина для блокирования непрореагировавших групп. Для измерений кинетических показателей двукратные серийные разведения Fab (например, от 0,78 нМ до 500 нМ) вводят в PBS с 0,05% Твин-20 (PBST) при 25°С при скорости потока приблизительно 25 мкл/минута. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляют с использованием простой лангмуровской модели связывания один-к-одному (программное обеспечение для оценки BIAcore, версия 3.2) путем одновременного построения сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Kd) вычисляют как отношение koff/kon. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Тем не менее, если скорость ассоциации в ходе упомянутого выше анализа поверхностного плазмонного резонанса превышает 106 М-1 с-1, то скорость ассоциации предпочтительно определяют путем использования метода гашения флуоресценции, согласно которому измеряют увеличение или снижение интенсивности испускания флуоресценции (возбуждение = 295 нМ; испускание = 340 нМ, полоса пропускания 16 нМ) при 25°С 20 нМ антитела против антигена (в форме Fab) в PBS при рН 7,2 в присутствии увеличивающихся концентраций антигена, как измерено на спектрометре, таком как спектрофотометр, оснащенный ограничителем потока (Aviv Instruments), или спектрофотометр SLM-Aminco серии 8000 (ThermoSpectronic), оснащенный кюветой для перемешивания.
«Биологически активный», «биологическая активность» и «биологические характеристики» в отношении к полипептиду по настоящему изобретению, такому как антитело, фрагмент или их производное, означает характеризующийся способностью связываться с биологической молекулой, за исключением случая, когда указано иное.
Термины «пептидное антитело» или «пептидные антитела» относятся к слитым молекулам произвольно образованных пептидов и домена Fc. См. патент США №6660843, Feige et al., выданный 9 декабря 2003 г. (включенный посредством ссылки в полном объеме). Они содержат один или несколько пептидов, связанных с N-концом, С-концом, боковыми цепями аминокислот или более чем с одним из этих сайтов. Технология пептидного антитела дает возможность разработки терапевтических средств, которые включают пептиды, нацеленные на один или несколько лигандов или рецепторов, наводящие на опухоль пептиды, переносящие через мембрану пептиды и т.п.Методика пептидного антитела оказалась применима в разработке ряда таких молекул, в том числе линейных и дисульфид-связанных пептидов, «тандемных пептидных мультимеров» (т.е., более чем один пептид на единичной цепи домена Fc). См., например, патент США №6660843; заявку на патент США №2003/0195156, опубликованную 16 октября 2003 г.(соответствующую WO 02/092620, опубликованной 21 ноября 2002 г.); заявку на патент США №2003/0176352, опубликованную 18 сентября 2003 г.(соответствующую WO 03/031589, опубликованной 17 апреля 2003 г.); патентный документ США №09/422838, поданный 22 октября 1999 г.(соответствующий WO 00/24770, опубликованной 4 мая 2000 г.); заявку на патент США №2003/0229023, опубликованную 11 декабря 2003 г.; WO 03/057134, опубликованную 17 июля 2003 г.; заявку на патент США №2003/0236193, опубликованную 25 декабря 2003 г.(соответствующую PCT/US04/010989, поданной 8 апреля 2004 г.); патентный документ США №10/666480, поданный 18 сентября 2003 г.(соответствующий WO 04/026329, опубликованной 1 апреля 2004 г.), каждый из которых тем самым включен посредством ссылки в полном объеме.
«Аффитела» или «аффитело» относятся к применению белков, связанных пептидной связью с участком Fc, где белок используется в качестве каркаса для обеспечения связывающей поверхности для молекулы-мишени. Часто белок является природным белком, таким как стафилококковый белок А или связывающий IgG домен В или белок Z, полученный из них (см. Nilsson et al. (1987), Prot Eng 1, 107-133, и патент США №5143844), или их фрагмент или производное. Например, аффитела могут быть созданы из вариантов белков Z, характеризующихся измененной аффинностью связывания с молекулой(ами)-мишенью(ями), где сегмент белка Z был мутирован путем случайного мутагенеза для создания библиотеки вариантов, способных связывать молекулу-мишень. Примеры аффитела можно найти в патенте США №6534628, Nord K et al., Prot Eng 8:601-608 (1995), и в Nord K et al., Nat Biotech 15:772-777 (1997). Biotechnol Appi Biochem. 2008 Jim; 50 (Pt 2):97-112.
«Выделенный» гетеромультимер или комплекс означает гетеромультимер или комплекс, который был отделен и/или извлечен из компонентов его естественного окружения в клеточной культуре. Загрязняющие компоненты естественного окружения являются материалами, которые могут мешать диагностическому или терапевтическому применениям гетеромультимеров и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления гетеромультимер будет очищен (1) до более чем 95% по массе белка, определенной методом Лоури, и наиболее предпочтительно до более чем 99% по массе, (2) до степени, достаточной для получения по меньшей мере 15 остатков в N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с центрифужными чашками, или (3) до гомогенности с помощью SDS-PAGE при восстанавливающих или невосстанавливающих условиях с использованием Куммаси синего или предпочтительно окрашивания серебром.
Гетеромультимеры по настоящему изобретению обычно являются очищенными до существенной гомогенности. Фразы «существенно гомогенный», «существенно гомогенная форма» и «существенная гомогенность» используются для обозначения того, что продукт по существу не содержит побочных продуктов, возникающих в результате нежелательных полипептидных комбинаций (например, гомомультимеров).
Выраженная в отношении чистоты существенная гомогенность означает, что количество побочных продуктов не превышает 10%, 9%, 8%, 7%, 6%, 4%, 3%, 2% или 1% по массе или менее чем 1% по массе. В одном варианте осуществления побочный продукт составляет менее 5%.
Термин «биологическая молекула» относится к нуклеиновой кислоте, белку, углеводу, липиду и их комбинациям. В одном варианте осуществления биологическая молекула существует в природе.
Термин «выделенное» при использовании для описания различных антител, раскрытых в настоящем документе, означает антитело, которое было идентифицировано и выделено и/или извлечено из клетки или клеточной культуры, в которой оно было экспрессировано. Примесными компонентами его естественного окружения являются материалы, которые обычно могут мешать диагностическому или терапевтическому применениям полипептида и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления антитело будет очищено (1) до степени, достаточной для получения по меньшей мере 15 остатков в N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с центрифужными чашками, или (2) до гомогенности с помощью SDS-PAGE при невосстанавливающих или восстанавливающих условиях с использованием Куммаси синего или предпочтительно окрашивания серебром. Выделенное антитело содержит антитела in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент естественного окружения полипептида не будет представлен. Однако обычно выделенный полипептид будет получен путем по меньшей мере одной стадии очистки.
Под термином «связанный» или «связывает», используемым в настоящем документе, подразумевается либо прямое связывание пептидной связью между первой и второй аминокислотной последовательностью, либо связывание, которое включает третью аминокислотную последовательность, являющуюся связанной пептидной связью с первой и второй аминокислотными последовательностями и находящуюся между ними. Например, линкерный пептид, связанный с С-концом одной аминокислотной последовательности и с N-концом другой аминокислотной последовательности.
Под термином «линкер», используемым в настоящем документе, подразумевается аминокислотная последовательность, характеризующаяся длиной из двух или более аминокислот. Линкер может состоять из нейтральных полярных или неполярных аминокислот. Линкер может характеризоваться длиной, например, от 2 до 100 аминокислот, например, длиной от 2 до 50 аминокислот, например, длиной из 3, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот. Линкер может быть «расщепляемым», например, путем ауторасщепления или ферментативного или химического расщепления. Сайты расщепления в аминокислотных последовательностях, а также ферменты и химические средства, которые расщепляют по таких сайтам, хорошо известны в данной области и также описаны в настоящем документе.
Под термином «привязка», используемым в настоящем документе, подразумевается аминокислотный линкер, который соединяет две разные аминокислотные последовательности. Привязка, как описано в настоящем документе, может связывать N-конец вариабельного домена тяжелой цепи иммуноглобулина с С-концом константного домена легкой цепи иммуноглобулина. В конкретных вариантах осуществления привязка характеризуется длиной от около 15 до 50 аминокислот, например, длиной от 20 до 26 аминокислот (например, длиной из 20, 21, 22, 23, 24, 25 или 26 аминокислот). Привязка может быть «расщепляемой», например, путем ауторасщепления или ферментативного или химического расщепления с использованием стандартных для данной области способов и реагентов.
Ферментативное расщепление «линкера» или «привязки» может характеризоваться применением эндопептидазы, такой как, например, Lys-C, Asp-N, Arg-C, V8, Glu-C, химотрипсин, трипсин, пепсин, папаин, тромбин, гененаза, фактор Ха, TEV (протеаза вируса гравировки табака), энтерокиназа, HRV С3 (протеаза риновируса СЗ человека), кининогеназа, а также подобные субтилизину пробелковые конвертазы (например, фурин (РС1), РС2 или РС3) или N-аргинин двухосновная конвертаза. Химическое расщепление может характеризоваться применением, например, гидроксиламина, N-хлорсукцинимида, N-бромсукцинимида или цианогенбромида.
Термин «сайт расщепления эндопептидазой Lys-C», используемый в настоящем документе, представляет собой остаток лизина в аминокислотной последовательности, которая может быть отщеплена с С-концевой стороны эндопептидазой Lys-C. Эндопептидаза Lys-C отщепляет с С-концевой стороны остаток лизина.
Под термином «гептадный повтор», используемым в настоящем документе, подразумевается последовательность 7 следующих друг за другом аминокислот, которые повторяются по меньшей мере один раз в аминокислотной последовательности. Гептадные повторы могут быть расположены последовательно в аминокислотной последовательности с С-концом первого повтора, непосредственно примыкающим к N-концу второго повтора. В одном варианте осуществления гептадный повтор характеризуется последовательностью формулы I или формулы II, как определено в настоящем документе.
Под «суперспиральным доменом», «суперспиральным доменом гетеродимеризации», «спиралью» или «спиральным доменом гетеродимеризации», как использует в настоящем документе, подразумевается аминокислотная последовательность, формирующая альфа-спиральную структуру, которая может взаимодействовать со второй альфа-спиральной структурой (вторым «суперспиральным доменом») для формирования «суперспирали» или «гетеродимерной суперспирали». Альфа-спиральные структуры могут быть вращающимися вправо альфа-спиралями. В одном варианте осуществления альфа-спиральные структуры сформированы гептадными повторами. В одном конкретном примере суперспиральный домен характеризуется структурой, показанной на фигуре 1, в которой остатки в «Х1» и «X1'» положениях первой и второй альфа-спиральной структуры осуществляют гидрофобные взаимодействия друг с другом, остатки в «Х4» и «Х4'» положениях первой и второй альфа-спиральной структуры осуществляют гидрофобные взаимодействия друг с другом, остатки в «Х5» положениях первой альфа-спиральной структуры осуществляют ионные взаимодействия с остатками в «Х7'» положениях второй альфа-спиральной структуры, а остатки в «X7» положениях первой альфа-спиральной структуры осуществляют ионные взаимодействия с остатками в «Х5'» положениях второй альфа-спиральной структуры. Суперспиральный домен может быть образован из 2 или более гептадных повторов формулы I или формулы II, как определено в настоящем документе.
Под «гидрофобным остатком» подразумевается аланин, валин, лейцин, изолейцин, триптофан, фенилаланин, пролин или метионин. В конкретном варианте осуществления гидрофобный остаток не является пролином.
Под «заряженным остатком» подразумевается кислая или основная аминокислота. Лизин, аргинин и гистидин являются основными аминокислотами, а аспарагиновая кислота и глутаминовая кислота являются кислотными аминокислотами.
Под «хаотропным средством» подразумевается растворимое в воде вещество, которое разрушает трехмерную структуру белка (например, антитела), нарушая стабилизирующие внутримолекулярные взаимодействия (например, водородные связи, вандерваальсовы силы или гидрофобные эффекты). Типичными хаотропными средствами являются без ограничения мочевина, гуанидин-HCl, перхлорат лития, гистидин и аргинин.
Под «мягким поверхностно-активным веществом» подразумевается растворимое в воде вещество, которое разрушает трехмерную структуру белка (например, антитела), нарушая стабилизирующие внутримолекулярные взаимодействия, например, водородные связи, вандерваальсовы силы или гидрофобные эффекты), но которое не разрушает необратимо белковую структуру с потерей биологической активности (т.е. не денатурирует белок). Типичными мягкими поверхностно-активными веществами являются без ограничения твин (например, Твин-20), тритон (например, Тритон Х-100), NP-40 (нонилфеноксиполиэтоксиэтанол), Nonidet P-40 (октилфеноксиполиэтоксиэтанол) и додецилсульфат натрия (SDS).
«Шарнирный участок» обычно определяется как простирающийся от Glu216 до Pro230 IgG1 человека (Burton, Molec. Immunol. 22:161-206 (1985)). Шарнирные участки других изотипов IgG могут быть выравнены с последовательностью IgG1 путем помещения первого и последнего остатков цистеина, формирующих S-S связи между тяжелыми цепями в одинаковых положениях.
«Более низкий шарнирный участок» на участке Fc обычно определяется как отрезок остатков, расположенных непосредственно на С-конце до шарнирного участка, т.е. остатки от 233 по 239 участка Fc. До настоящего изобретения связывание Fc-гаммаR. обычно приписывалось аминокислотным остаткам в более низком шарнирном участке на участке Fc IgG.
«Домен СН2» участка Fc IgG человека обычно простирается от остатков около 231 до около 340 IgG. Домен СН2 является уникальным в том, что он не спарен тесно с другим доменом. Вместо этого, две N-связаннные разветвленные углеводные цепи включаются между двумя доменами СН2 в интактной нативной молекуле IgG. Предполагается, что углевод может обеспечить замену для спаривания домена с доменом и помочь стабилизировать домен СН2 (Burton, Molec. Immunol. 22:161-206 (1985)).
«Домен СН3» содержит отрезок из остатков от С-конца до домена СН2 на участке Fc (например, от около аминокислотного остатка 341 до около аминокислотного остатка 447 в IgG).
Термин «участок Fc» в настоящем документе используют для определения С-концевого участка тяжелой цепи иммуноглобулина, включая участки Fc нативной последовательности и варианты участков Fc. Хотя границы участка Fc тяжелой цепи иммуноглобулина могут варьировать, участок Fc тяжелой цепи IgG человека обычно определяется отрезком от аминокислотного остатка в положении Cys226 или от Pro230 до его карбоксильного конца. С-концевой лизин (остаток 447 в соответствии с европейской системой нумерации) участка Fc может быть удален, например, в ходе получения или очистки антитела, или путем рекомбинантного построения нуклеиновой кислоты, кодирующей тяжелую цепь антитела. В соответствии с этим композиция интактных антител может содержать популяцию антител с удалением всех остатков K447, популяцию антител без удаления всех остатков K447 и популяцию антител с и без остатка K447.
«Функциональный участок Fc» обладает «эффекторной функцией» участка Fc нативной последовательности. Типичные «эффекторные функции» включают связывание C1q; CDC; связывание рецептора Fc; ADCC; фагоцитоз; понижающую регуляцию рецепторов клеточной поверхностности (например, рецепторов В-клеток; BCR) и т.д. Такие эффекторные функции обычно требуют, чтобы участок Fc был объединен со связывающим доменом (например, вариабельным доменом антитела), и могут быть оценены с использованием различных испытаний, как раскрыто, например, в определениях в настоящем документе.
«Участок Fc нативной последовательности» содержит аминокислотную последовательность, идентичную аминокислотной последовательности участка Fc, найденного в природе. Участки Fc нативной последовательности человека содержат участок Fc нативной последовательности IgG1 человека (аллотипы не-А и А); участок Fc нативной последовательности IgG2 человека; участок Fc нативной последовательности IgG3 человека и участок Fc нативной последовательности IgG4 человека, а также их варианты природного происхождения.
«Вариантный участок Fc» содержит аминокислотную последовательность, которая отличается от таковой участка Fc нативной последовательности посредством по меньшей мере одной аминокислотной модификации, предпочтительно одной или нескольких аминокислотных замен. Предпочтительно вариантный участок Fc характеризуется по меньшей мере одной аминокислотной заменой по сравнению с участком Fc нативной последовательности или участком Fc родительского полипептида, например, от около одной до около десяти аминокислотных замен и предпочтительно от около одной до около пяти аминокислотных замен на участке Fc нативной последовательности или на участке Fc исходного полипептида. Вариантный участок Fc в настоящем документе предпочтительно будет характеризоваться по меньшей мере около 80% гомологией с участком Fc с нативной последовательностью и/или с участком Fc родительского полипептида и, кроме того, наиболее предпочтительно по меньшей мере около 90% гомологией, кроме того, более предпочтительно по меньшей мере около 95% гомологией.
Термин «комплекс Fc», используемый в настоящем документе, относится к двум доменам СН2 на участке Fc, взаимодействующим друг с другом, и/или к двум доменам СН3 на участке Fc, взаимодействующим друг с другом, где домены СН2 и/или домены СН3 взаимодействуют посредством связей и/или сил (например, вандерваальсовых, гидрофобных, гидрофильных сил), которые не являются пептидными связями.
Термин «компонент Fc», используемый в настоящем документе, относится к шарнирному участку, домену СН2 или домену СН3 на участке Fc.
Термин «СН-компонент Fc» или «FcCH», используемый в настоящем документе, относится к полипептиду, содержащему домен СН2, домен СН3 или домены СН2 и СН3 на участке Fc.
«Эффекторные функции» антитела относятся к биологическим активностям, свойственным участку Fc (участку Fc с нативной последовательностью или участку Fc с вариантной аминокислотной последовательностью) антитела и варьируют в зависимости от изотипа антитела. Примерами эффекторных функций антитела являются: связывание C1q и зависимая от комплемента цитотоксичность; Fc-рецепторное связывание; зависимая от антитела клеточно-опосредованная цитотоксичность (ADCC); фагоцитоз; понижающая регуляция клеточных поверхностных рецепторов (например, рецептора В-клеток) и активация В-клеток.
«Зависимая от антитела клеточно-опосредованная цитотоксичность» или «ADCC» относится к форме цитотоксичности, при которой секретированный Ig, связанный с рецепторами Fc (FcR), присутствующими на определенных цитотоксических клетках (например, натуральных киллерных (NK) клетках, нейтрофилах и макрофагах), дает возможность этим цитотоксическими эффекторным клеткам специфически связываться с несущей антиген клеткой-мишенью и впоследствии убивать клетку-мишень цитотоксическими средствами. Антитела «вооружают» цитотоксические клетки и безусловно необходимы для такого киллинга. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют исключительно FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR в стволовых кроветворных клетках кратко охарактеризована в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Для оценки активности ADCC интересующей молекулы может быть выполнено испытание in vitro ADCC, такое как описаное в патентах США №№5500362, 5821337 или 5821337. Применяемые эффекторные клетки для таких испытаний включают одноядерные клетки периферической крови (РВМС) и натуральные киллерные (NK) клетки. В качестве альтернативы или дополнительно активность ADCC интересующей молекулы может быть оценена in vivo, например, с использованием животной модели, такой как раскрытая в Clynes et al., Proc. Natl. Acad. Sci. USA 95:652-656 (1998).
«Рецептор Fc» или «FcR» описывает рецептор, который связывается с участком Fc антитела. Предпочтительным FcR является человеческий FcR нативной последовательности. Более того, предпочтительным FcR является FcR, который связывает антитело IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), характеризующиеся подобными аминокислотными последовательностями, которые отличаются в первую очередь их цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит иммунорецепторный тирозиновый активационный мотив (ITAM) в своем цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в своем цитоплазматическом домене (см. обзор М. в Daeron, Annu. Rev. Immumol. 15:203-234 (1997)). FcR представлены в обзоре Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991); Capel et al., Immunomethods 4:25-34 (1994); и в de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Другие FcR, включая те, что будут идентифицированы в дальнейшем, в настоящем документе охватываются термином «FcR». Термин также предусматривает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)).
«Человеческие эффекторные клетки» представляют собой лейкоциты, которые экспрессируют один или несколько FcR и выполняют эффекторные функции. Предпочтительно клетки экспрессируют по меньшей мере FcγRIII и выполняют ADCC-эффекторные функции. Примерами человеческих лейкоцитов, которые опосредуют ADCC, являются одноядерные клетки периферической крови (РВМС), натуральные киллерные (NK) клетки, моноциты, цитотоксические Т-клетки и нейтрофилы; причем предпочтительными являются РВМС и NK-клетки. Эффекторные клетки могут быть выделены из нативного источника, например, из крови.
«Комплемент-зависимая цитотоксичность» или «CDC» относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны с их собственным антигеном. Для оценки активации комплемента может быть выполнен анализ CDC например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
Термин «терапевтически эффективное количество» относится к количеству антитела, фрагмента антитела или производного для лечения заболевания или нарушения у субъекта. В случае опухоли (например, злокачественной опухоли) терапевтически эффективное количество антитела или фрагмента антитела (например, мультиспецифического антитела или фрагмента антитела) может снижать количество злокачественных клеток; уменьшать размер первичной опухоли; ингибировать (например, до некоторой степень замедлять и предпочтительно останавливать) инфильтрацию периферических органов злокачественными клетками; ингибировать (например, до некоторой степени замедлять и предпочтительно останавливать) метастаз опухоли; до некоторой степени ингибировать рост опухоли и/или до некоторой степени облегчать один или несколько симптомов, связанных с нарушением. В том случае, когда антитело или фрагмент антитела могут предотвращать рост и/или убивать существующие злокачественные клетки, они могут быть цитостатическими и/или цитотоксическими. Для терапии злокачественных опухолей эффективность in vivo может быть измерена, например, путем оценки длительности выживания, времени развития заболевания (ТТР), степеней ответа (RR), длительности ответа и/или качества жизни.
Под «снижением или ингибированием» подразумевается способность вызывать общее снижение предпочтительно на 20% или больше, более предпочтительно на 50% или больше и наиболее предпочтительно на 75%, 85%, 90%, 95% или больше. Снижение или ингибирование может относиться к симптомам заболевания, подлежащего лечению, наличию или размеру метастазов, размеру первичной опухоли, а также размеру или количеству кровеносных сосудов при ангиогенных заболеваниях.
Термины «злокачественная опухоль» и «злокачественный» относятся к физиологическим состояниям или описывают физиологические состояния у млекопитающих, которые обычно характеризуются нерегулируемым ростом/пролиферацией клеток. Включенными в данное определение являются доброкачественные и злокачественные опухоли. Примерами злокачественной опухоли являются без ограничения карцинома, лимфома, бластома, саркома и лейкоз. Более конкретными примерами таких злокачественных опухолей являются чешуйчато-клеточная злокачественная опухоль, мелкоклеточная злокачественная опухоль легкого, немелкоклеточная злокачественная опухоль легкого, аденокарцинома легкого, чешуйчатая карцинома легкого, злокачественная опухоль брюшины, гепатоклеточная злокачественная опухоль, гастральная или желудочная злокачественная опухоль, включающая злокачественную опухоль желудочно-кишечного тракта, злокачественная опухоль поджелудочной железы, глиобластома, глиома, злокачественная опухоль шейки матки, злокачественная опухоль яичника, злокачественная опухоль печени, злокачественная опухоль мочевого пузыря, гепатома, злокачественная опухоль молочной железы, злокачественная опухоль толстой кишки, колоректальная злокачественная опухоль, эндометриальная карцинома, или карцинома матки, карцинома слюнной железы, злокачественная опухоль почки (например, почечно-клеточная карцинома), злокачественная опухоль печени, злокачественная опухоль предстательной железы, злокачественная опухоль наружных половых органов, злокачественная опухоль щитовидной железы, печеночная карцинома, анальная карцинома, карцинома полового члена, меланома и различные типы злокачественной опухоли головы и шеи. Под «ранней стадией злокачественной опухоли» подразумевается злокачественная опухоль, которая не является инвазивной или метастатической или классифицируется как злокачественная опухоль стадии 0, I или II. Термин «предопухолевый» относится к состоянию или росту, которые обычно предшествуют или развиваются в злокачественную опухоль. Под «неметастатическим» подразумевается злокачественная опухоль, которая является доброкачественной, или которая остается на первичном участке и не проникает в лимфатическую или кровеносную системы или в ткани, отличные от первичного участка. Обычно неметастатической злокачественной опухолью является любая злокачественная опухоль, которая представляет собой злокачественную опухоль стадии 0, I или II, а иногда злокачественную опухоль стадии III.
«Незлокачественное заболевание или нарушение, предусматривающее аномальную активацию HER2» является состоянием, которое не включает злокачественную опухоль, при котором в клетках или ткани субъекта, страдающего или предрасположенного к заболеванию или нарушению, происходит аномальная активация HER2. Примерами таких заболеваний или нарушений являются аутоиммунное заболевание (например, псориаз), см. определение ниже; эндометриоз; склеродерма; рестеноз; полипы, такие как полипы толстой кишки, носовые полипы или желудочно-кишечные полипы; фиброаденома; респираторное заболевание (например, хронический бронхит, бронхиальная астма, включающая острую астму и аллергическую астму, фиброз мочевого пузыря, бронхоэктаз, аллергический или другой ринит или синусит, недостаточность α1-анти-трипсина, кашли, легочная эмфизема, легочный фиброз или гиперреактивные дыхательные пути, хроническая обструктивная болезнь легких и хроническое обструктивное легочное нарушение); холецистит; нейрофиброматоз; поликистоз почек; воспалительные заболевания; кожные нарушения, включающие псориаз и дерматит; сосудистое заболевание; состояния, включающие аномальную пролиферацию сосудистых эпителиальных клеток; язвы желудочно-кишечного тракта; болезнь Менетрие, секретирующая аденома или синдром потери белка; почечные нарушения; ангиогенные нарушения; глазное заболевание, такое как старческая дегенерация желтого пятна, предполагаемый глазной гистоплазматозный синдром, неоваскуляризация сетчатки в результате пролиферативной диабетической ретинопатии, васкуляризация сетчатки, диабетическая ретинопатия или старческая дегенерация желтого пятна; костные патологии, такие как остеоартрит, остеомаляция и остеопороз; повреждение в результате церебрального ишемического события; фиброзные или отечные болезни, такие как цирроз печени, фиброз легкого, саркоидоз, тиреоидит, системный синдром повышенной вязкости, болезнь Ослера-Вебера-Ренду, хроническое окклюзивное легочное заболевание или отек, вызванная ожогами, травмой, облучением, инсультом, гипоксией или ишемией; реакция гиперчувствительности кожи; диабетическая ретинопатия и диабетическая нефропатия; синдром Гийена-Барре; болезнь «трансплантат против хозяина» или отторжение трансплантата; болезнь Педжета; костное или суставное воспаление; фотостарение (например, вызванное УФ облучением кожи человека); доброкачественная гипертрофия предстательной железы; определенные микробные инфекции, включающие микробные патогены, выбранных из аденовируса, хантавирусов, Borrelia burgdorferi, Yersinia spp. и Bordetella pertussis; тромбоз, вызванный агрегацией тромбоцитов; репродуктивные состояния, такие как эндометриоз, синдром гиперстимуляции яичников, преэклампсия, дисфункциональное маточное кровотечение или менометроррагия; синовит; атерома; острая и хроническая нефропатии (включающие пролиферативный гломерулонефрит и вызванное диабетом почечное заболевание); экзема; гипертрофическое рубцовое образование; эндотоксический шок и грибковая инфекция; семейный аденоматоз толстой кишки; нейродегенеративные заболевания (например, болезнь Альцгеймера, СПИД-ассоциированная деменция, болезнь Паркинсона, амиотрофический боковой склероз, пигментный ретинит, спинальная мышечная атрофия и церебральная дегенерация); миелодиспластические синдромы; апластическая анемия; ишемические повреждения; фиброз легкого, почек или печени; заболевание гиперчувствительности, опосредуемое Т-клетками; детский гипертрофический пилорический стеноз; обструктивный синдром мочевыделительной системы; псориатический артрит и тиреоидит Хашимото.
«Аллергическое или воспалительное нарушение» согласно настоящему документу представляет собой заболевание или нарушение, которое вызвано гиперактивацией иммунной системы индивидуума. Типичные аллергические или воспалительные нарушения включают без ограничения бронхиальную астму, псориаз, ревматоидный артрит, атонический дерматит, рассеянный склероз, системную красную волчанку, экзему, трансплантацию органов, старческую дегенерацию желтого пятна, болезнь Крона, язвенный колит, эозинофильный эзофагит и аутоиммунные заболевания, связанные с воспалением.
«Аутоиммунное заболевание» в настоящем документе представляет заболевание или нарушение, возникающее и направленное против собственных тканей индивидуума, или результат косегрегации или его проявления, или возникающее в результате этого состояние. Примерами аутоиммунных заболеваний или нарушений являются без ограничения артрит (ревматоидный артрит, такой как острый артрит, хронический ревматоидный артрит, подагрический артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит, артрит позвоночника и ювенильный ревматоидный артрит, остеоартрит, прогрессирующий хронический артрит, деформирующий артрит, первичный хронический полиартрит, реактивный артрит и анкилозирующий спондилит), воспалительные гиперпролиферативные кожные заболевания, псориаз, такой как бляшечный псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей, дерматит, включающий контактный дерматит, хронический контактный дерматит, аллергической дерматит, аллергической контактный дерматит, герпетиформный дерматит и атопический дерматит, Х-связанный гипер-IgM синдром, крапивница, такая как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, включающая хроническую аутоиммунную крапивницу, полимиозит/дерматомиозит, ювенильный дерматомиозит, токсический эпидермальный некролиз, склеродерма (включающая системную склеродерму), склероз, такой как системный склероз, рассеянный склероз (MS, такой как оптикоспинальный MS, первичный прогрессирующий MS (PPMS) и рецидивино-ремиттирующий MS (RRMS), прогрессивный системный склероз, атеросклероз, артериосклероз, диссеминированный склероз и атаксический склероз, воспалительное заболевание кишечника (IBD) (например, болезнь Крона, аутоиммуно опосредуемые желудочно-кишечные заболевания, колит, такой как язвенный колит, colitis ulcerosa, микроскопический колит, коллагенозный колит, полипозный колит, некротизирующий энтероколит, трансмуральный колит и аутоиммунное воспалительное заболевание кишечника), гангренозная пиодермия, узловая эритема, первичный склерозирующий холангит, эписклерит), дыхательный дистресс-синдром, включающий дыхательный дистресс-синдром взрослых или острый дыхательный дистресс-синдром (ARDS), менингит, воспаление всей или части сосудистой оболочки глазного яблока, воспаление радужной оболочки глаза, хориоидит, аутоиммунное гематологические нарушение, ревматоидный спондилит, внезапная потеря слуха, IgE-опосредуемые заболевания, такие как анафилаксия, аллергический и атопический ринит, энцефалит, такой как энцефалит Расмуссена, лимбический и/или энцефалит мозгового ствола, увеит, такой как, передний увеит, острый передний увеит, грануломатозный увеит, негрануломатозный увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (GN) с нефротического синдрома и без такового, такой как хронический или острый гломерулонефрит, например, первичный GN, иммуно-опосредованный GN, мембранный GN (мембранная нефропатия), идиопатический мембранный GN или идиопатическая мембранная нефропатия, мембрано- или мембранный пролиферативный GN (MPGN), включающий тип I и тип II, и быстро прогрессирующий GN, аллергические состояния, аллергическая реакция, экзема, включающая аллергическую или атопическую экзему, астма, такая как asthma bronchiale, бронхиальная астма и аутоиммунная астма, состояния, включающие инфильтрацию Т-клеток и хронические воспалительные ответы, хроническое легочное воспалительное заболевание, аутоиммунный миокардит, нарушение адгезии лейкоцитов, системная эритематозная волчанка (SLE), или системная красная волчанка, такая как кожная SLE, подострая кожная эритематозная волчанка, синдром неонатальной волчанки (NLE), диссеминированная красная волчанка, волчанка (включающая нефрит, энцефалит, педиатрическую, непочечную, надпочечную, дискоидную, аллопецию), ювенильный (тип I) сахарный диабет, включающий детский инсулин-зависимый сахарный диабет (IDDM), сахарный диабет взрослых (диабет типа II), аутоиммунный диабет, идиопатический несахарный диабет, иммунные ответы, связанные с острой и замедленной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, туберкулез, саркоидоз, гранулематоз, включающий лимфоматозный гранулематоз, гранулематоз Вегенера, агранулоцитоз, васкулит, включающий воспаление сосудов (включающее воспаление крупных сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит (Такаясу), воспаление средних сосудов (включая болезнь Кавасаки и узелковый полиартериит), микроскопический полиартериит, воспаление сосудов центральной нервной системы, некротический, кожный или гиперчувствительный васкулит, системный некротический васкулит и ассоциированный с ANCA васкулит, такой как васкулит или синдром Черджа-Стросса (CSS)), темпоральный артериит, апластическая анемия, аутоиммунная апластическая анемия, анемия с положительной реакцией Кумбса, анемия Даймонда-Блэкфена, гемолитическая анемия или иммунная гемолитическая анемия, включающая аутоиммунную гемолитическую анемию (AIHA), злокачественная анемия (пернициозная анемия), болезнь Аддисона, истинная эритроцитарная анемия или аплазия (PRCA), дефицит фактора VIII, гемофилия А, аутоиммунная нейтропения, панцитопения, лейкопения, заболевания, включающие лейкоцитарный диапедез, воспалительные нарушения центральной нервной системы, синдром повреждения нескольких органов, такой как вторичный в результате септицемии, травмы или кровоизлияния, заболевания, опосредованные комплексом антиген-антитело, заболевание антигломерулярной базальной мембраны, синдром антифосфолипидного антитела, аллергический неврит, болезнь Бехчета, синдром Кастельмана, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, пемфигоид, такой как буллезный пемфигоид и кожный пемфигоид, пузырчатка (включающая обыкновенную пузырчатку, эксфолиативную пузырчатку, пузырчаткоподобный пемфигоид слизистой мембраны и эритематозную пузырчатку), аутоиммунные полиэндокринопатии, болезнь или синдром Рейтера, нефрит иммунных комплексов, опосредуемый антителом нефрит, оптиконейромиелит, полинейропатии, хроническая нейропатия, такая как полинейропатия IgM или IgM-опосредуемая нейропатия, тромбоцитопения (развивающаяся у больных инфарктом миокарда, например), включающая тромботическую тромбоцитопеническую пурпуру (ТТР) и аутоиммунную или иммуноопосредованную тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ITP), включающая хроническую или острую ITP, аутоиммунное заболевание яичка и яичника, включающее аутоиммунный орхит и оофорит, первичный гипотиреоз, гипопаратиреоз, аутоиммунные эндокринные заболевания, включающие тиреоидит, такой как аутоиммунный тиреоидит, болезнь Хашимото, хронический тиреоидит (тиреоидит Хашимото) или подострый тиреоидит, аутоиммунное заболевание щитовидной железы, идиопатический гипотиреоз, болезнь Грейвса, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или синдромы полигландулярной эндокринопатии), паранеопластические синдромы, включающие неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром «скованного человека» или синдром «скованного индивидуума», энцефаломиелит, такой как аллергический энцефаломиелит, или encephalomyelitis allergica, и экспериментальный аллергический энцефаломиелит (ЕАЕ), миастения гравис, такая как связанная с тимомой миастения гравис, церебеллярная дегенерация, нейромиотония, опсоклонус или синдром опсоклонуса-миоклонуса (OMS) и сенсорная нейропатия, мультифокальная двигательная нейропатия, синдром Шихана, аутоиммунный гепатит, хронический гепатит, люпоидный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидная интерстициальная пневмония, облитерирующий бронхиолит (не связанный с трансплантацией) против NSIP, синдром Гийена-Барре, болезнь Берже (IgA-нефропатия), идиопатическая IgA-нефропатия, линейный IgA-дерматоз, первичный билиарный цирроз, пневмоцирроз, синдром аутоиммунной энтеропатии, глютеиновая болезнь, целиакия, глютенчувствительная целиакия (глютеновая энтеропатия), рефракторная спру, идиопатическая спру, криоглобулинемия, амилотрофический латеральный склероз (ALS; болезнь Лу Герига), заболевание коронарной артерии, аутоиммунное заболевание уха, такое как аутоиммунное заболевание внутреннего уха (AIED), аутоиммунная потеря слуха, опсоклонус-миоклонус-синдром (OMS), полихондрия, такая как рефрактерная или рецидивирующая полихондрия, легочный альвеолярный протеиноз, амилоидоз, склерит, незлокачественный лимфоцитоз, первичный лимфоцитоз, который включает моноклональный В-клеточный лимфоцитоз (например, доброкачественная моноклональная гаммапатия и моноклональная гаммапатия неустановленного происхождения, MGUS), периферическая нейропатия, паранеопластический синдром, каналопатии, такие как эпилепсия, мигрень, аритмия, мышечные нарушения, глухота, слепота, периодический паралич и каналопатии центральной нервной системы, аутизм, воспалительная миопатия, фокальный сегментарный гломерулосклероз (FSGS), эндокринная офтальмопатия, увеоретинит, хориоретинит, аутоиммунное гепатологическое нарушение, фибромиалгия, множественное эндокринное расстройство, синдром Шмидта, воспаление надпочечника, желудочная атрофия, пресенильная деменция, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания, диабетическая нефропатия, синдром Дресслера, очаговая алопеция, CREST-синдром (кальциноз, феномен Рейно, пищеводная дискинезия, склеродактилия и телеангиэктазия), мужское и женское аутоиммунное бесплодие, смешанное заболевание соединительной ткани, болезнь Чагаса, ревматическиая лихорадка, рецидивный выкидыш, аллергический альвеолит у сельскохозяйственных рабочих, мультиформная эритема, пост-кардиотомический синдром, синдром Кушинга, легочная аллергия птицеводов, аллергический грануломатозный ангиит, доброкачественный лимфоцитарный ангиит, синдром Альпорта, альвеолит, такой как аллергический альвеолит и фиброзный альвеолит, интерстициальное заболевание легкого, трансфузионная реакция, проказа, малярия, лейшманиоз, трипаносомоз, шистосомоз, аскаридоз, аспергиллез, синдром Самптера, синдром Каплана, лихорадка денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный легочный фиброз, интерстициальный легочный фиброз, идиопатический легочный фиброз, фиброз мочевого пузыря, эндофтальмит, стойкая возвышающаяся эритема, эритробластоз плода, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филяриоз, циклит, такой как хронический циклит, гетерохронный циклит, иридоциклит или циклит Фукса, пурпура Шенлейна-Геноха, инфекция вируса иммунодефицита человека (HIV), инфекция вируса ECHO, кардиомиопатия, болезнь Альцгеймера, инфекция парвовируса, инфекция вируса краснухи, синдромы поствакцинации, врожденная инфекция краснухи, инфекции вируса Эпштейна-Барр, свинка, синдром Эванса, аутоиммунное гонадное нарушение, хорея Сиденгама, пост-стрептококковый нефрит, облитерирующий тромбангиит, тиреотоксикоз, сухотка спинного мозга, хориоидит, гигантоклеточная полимиалгия, эндокринная офтальмопатия, хроническая гиперчувствительная пневмония, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, идиопатический нефритный синдром, минимально измененная нефропатия, доброкачественное семейное и ишемически-реперфузионное нарушение, ретинальная аутоиммунность, воспаление суставов, бронхит, хроническое обструктивное заболевание дыхательных путей, силикоз, афты, афтозный стоматит, артериосклеротические нарушения, аспермиогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемия, контрактура Дюпюитрена, факоанафилактический эндофтальмит, аллергический энтерит, лепрозная узловатая эритема, идиопатический лицевой паралич, синдром хронической усталости, ревматическая лихорадка, болезнь Хаммена-Рича, сенеоневральная потеря слуха, пароксизмальная гемоглобинурия, гипогонадизм, региональный илеит, лейкопения, инфекционный мононуклеоз, поперечный миелит, первичная идиопатическая микседема, нефроз, симпатическая офтальмия, гранулематозный орхит, панкреатит, острый полирадикулоневрит, гангренозная пиодермия, тиреоидит де Карвена, приобретенная атрофия селезенки, бесплодие из-за антисперматозоидных антител, незлокачественная тимома, витилиго, SCID и болезнь, ассоциированная с вирусом Эпштейна-Барр, синдром приобретенного иммунодефицита (СПИД), паразитарные заболевания, такие так лейшманиоз, синдром токсического шока, пищевое отравление, состояния, включающие инфильтрацию Т-клетками, недостаточность лейкоцитарной адгезии, иммунные ответы, связанные с острой и отсроченной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, заболевания, включающие лейкоцитарный диапедез, синдром поражения нескольких органов, заболевания, опосредуемые комплексом антиген-антитело, антигломерулярное заболевание базальной мембраны, аллергический неврит, аутоиммунные полиэндокринопатии, оофорит, первичная микседема, аутоиммунный атрофический гастрит, симпатическая офтальмия, ревматические заболевания, смешанные заболевания соединительной ткани, нефротический синдром, инсулит, полиэндокринное поражение, периферическая нейропатия, аутоиммунный полигландулярный синдром типа I, идиопатический гипопаратиреоз взрослых (AOIH), полная аллопеция, отсроченная кардиомиопатия, приобретенный буллезный эпидермолиз (ЕВА), гематохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит, решетчатый, фронтальный, верхнечелюстной или клиновидный синусит, связанное с эозинофилами нарушение, такое как эозинофилия, легочная инфильтрационная эозинофилия, синдром эозинофилии-миалгии, синдром Лоффлера, хроническая эозинофильная пневмония, тропическая легочная эозинофилия, бронхопневмонический аспергиллез, аспергиллема или гранулема, содержащая эозинофилы, анафилаксия, серонегативные спондилоартриты, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, склера, эписклера, хронический кожно-слизистый кандидоз, синдром Брутона, транзиторная гипогаммаглобулинемия детей, синдром Вискотта-Олдрича, атаксическая телеангиэктазия, аутоиммунные нарушения, связанные с коллагеновой болезнью, ревматизм, неврологическое заболевание, ишемическое реперфузионное нарушение, снижение реакции кровяного давления, сосудистая дисфункция, ангиэктазия, тканевое повреждение, кардиососудистая ишемия, гипералгезия, церебральная ишемия и заболевание, сопровождающее васкуляризацию, аллергические нарушения гиперчувствительности, гломерулонефрит, реперфузионное повреждение, реперфузионное повреждение миокарда и других тканей, дерматоз с острыми воспалительными компонентами, острый гнойный менингит или другие воспалительные нарушения центральной нервной системы, глазные и глазничные воспалительные нарушения, синдромы, связанные с трансфузией гранулоцитов, индуцированная цитокинами токсичность, острое тяжелое воспаление, хроническое трудноизлечимое воспаление, пиелит, пневмоцирроз, диабетическая ретинопатия, диабетическое нарушение крупных артерий, эндометриальная гиперплазия, пептическая язва, вальвулит и эндометриоз.
Термин «цитотоксический средство», используемый в настоящем документе, относится к веществу, которое ингибирует или препятствует функции клетки и/или вызывает разрушение клетки. Подразумевается, что термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, Ra223, P32 и радиоактивные изотопы Lu), химиотерапевтические средства, например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие средства, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты, а также различные противоопухолевые, противораковые и химиотерапевтические средства, раскрытые в настоящем документе. В настоящем документе описаны и другие цитотоксические средства. Противоопухолевое средство вызывает разрушение опухолевых клеток.
«Химиотерапевтическое средство» представляет собой химическое соединение, применимое для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид CYTOXAN®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азуридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включающие альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (в частности буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапакон; лапахол; колхицины; бетулиновую кислоту; камптотецин (в том числе синтетический аналог топотекана (HYCAMTIN®), СРТ-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (в том числе его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (в том числе синтетические аналоги KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид мехлоретаминоксида, мелфалан; новембихин, фенестерин, преднимустин, трофосфамид, урацилиприта; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности калихеамицин гамма-1 (см., например, Agnew, Chem Intl. Ed. Engl. 33: 183-186 (1994)); динемицин, в том числе динемицин А; эсперамицин; а также неокарциностатиновый хромофор и родственные хромофоры хромопротеиновых энедииновых антибиотиков), алкациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофиллин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMYCIN® (в том числе морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марселломицин, митомицины, такие как митомицин С, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметотрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренергические средства, такие как аминоглютетимид, митотан, трилостан; заменитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидгликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиния ацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Юджин, Орегон); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридан А и ангуидин); уретан; виндесин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); тиотепа; таксоиды, например, паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Принстон, Нью Джерси), ABRAXANE™, не содержащая кремофора, альбумин-сконструированная композиция наночастиц паклитаксела (American Pharmaceutical Partners, Шаумбуг, Иллинойс) и доксетаксел TAXOTERE® (Rhone-Poulenc Rorer, Энтони, Франция); хлоранбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейкововин; винорелбин NAVELBINE®; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из приведенных выше; а также комбинации двух или более из приведенных выше, например, CHOP, аббревиатура для комбинированной терапии циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, аббревиатура для лечебной схемы с оксалиплатином (ELOXATIN™) в комбинации с 5-FU и лейкововином.
В это определение включены также антигормональные средства, которые действуют регулирующим, понижающим, блокирующим или ингибирующим образом на гормоны, которые могут способствовать росту злокачественной опухоли, и часто являются формой системного лечения, или лечения всего организма. Они сами могут быть гормонами. Примеры включают антиэстрогены и селективные модуляторы рецепторов эстрогенов (SERM), в том числе, например, тамоксифен (включая тамоксифен NOLVADEX®), EVISTA® ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON; антипрогестероны; отрицательные регуляторы эстрогеновых рецепторов (ERD); средства с функцией подавления или отключения яичников, например, агонисты гормона, высвобождающего лютеинизирующий гормон (LHRH), такие как LUPRON® и лейпролида ацетат ELIGARD®, гозерелина ацетат, бузерелина ацетат и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующую продупирование эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегастрола ацетат MEGASE®, форместан, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARMIDEX®. Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), DIDROCAL® этидронат, NE-58095, золедроновую кислоту/золедронат ZOMETA®, алендронат FOSAMAX®, памидронат AREDIA®, тилодронат SKELID® или ризедронат ACTONEL®, а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигналов, участвующих в аберрантной пролиферации клеток, таких как, например РКС-альфа, Ralfn H-Ras, и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины генотерапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®, ингибитор топоизомеразы 1 LURTOTECAN®; rmRH ABARELIX®; лапатиниб дитозилат (двойной тирозинкиназный низкомолекулярный ингибитор ЕгЬВ-2 и EGFR, также известный как GW572016); а также фармацевтически приемлемые соли, кислоты или производные любого из вышеупомянутых средств.
«Ингибирующее рост средство» при использовании в настоящем документе относится к соединению или композиции, которые ингибируют рост клетки как in vitro, так и in vivo. Таким образом, ингибирующее рост средство может быть средством, которое существенно снижает процентное соотношение клеток в S-фазе. Примеры ингибирующего рост средства включают средства, которые блокируют протекание клеточного цикла (в фазе, отличной от S-фазы), такие как средства, которые индуцируют остановку G1- и остановку М-фазы. Классические блокаторы М-фазы включают алкалоиды барвинка (например, винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средства, которые останавливают G1, также содействуют остановке S-фазы, например, алкилирующие ДНК агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ага-С.Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, озаглавленной «Cell cycle regulation, oncogenes, and antineoplastic drugs», Murakami et al. (WB Saunders: Philadelphia, 1995), в частности, стр.13. Таксаны (паклитаксел и доцетаксел) являются противораковыми лекарственными средствами, полученными из тиса. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из европейского тиса, является полусинтетическим аналогом паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел способствуют сборке микротрубочек из тубулиновых димеров и стабилизируют микротрубочки путем предотвращения деполимеризации, которая приводит к ингибированию митоза в клетках.
Термин «противораковая терапия», используемый в настоящем документе, относится к лечению, которое уменьшает или ингибирует злокачественную опухоль у субъекта. Примеры противораковой терапии включают цитотоксическую лучевую терапию, а также введение субъекту терапевтически эффективного количества цитотоксического средства, химиотерапевтического средства, ингибирующего рост средства, противораковой вакцины, ингибитора ангиогенеза, пролекарства, цитокина, цитокинового антагониста, кортикостероида, иммуносупрессивного средства, противорвотного средства, антитела или фрагмента антитела или анальгетика.
Термин «пролекарство», используемый в настоящем документе, относится к предшествующей форме или к форме, представляющей собой производное фармацевтически активного вещества, которая является менее цитотоксической по отношению к опухолевым клеткам по сравнению с исходным лекарственным средством и способна ферментативно активироваться или превращаться в более активную исходную форму. См., например, Wilman, Prodrugs in Cancer Chemotherapy Biochemical Society Transactions, 14, pp.375-382, 615th Meeing Belfast (1986) и Stella et al., Prodrugs: A Chemical Approach to targeted Drug Delivery Directed Drug Delivery, Borchardt et al., (ed.), pp.247-267, Humana press (1985). Пролекарства включают без ограничения фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, модифицированные D-аминокислотами пролекарства, гликозилированные пролекарства, бета-лактамсодержащие пролекарства, необязательно замещенные феноксиацетамидсодержащие пролекарства или необязательно замещенные фенилацетамидсодержащие пролекарства, 5-фторцитозин и другие 5-фторуридиновые пролекарства, которые могут быть преобразованы в более активные цитотоксические свободные лекарственные средства. Примеры цитотоксических лекарственных средств, на основе которых могут быть получены пролекарственные формы для применения в настоящем изобретении, включают без ограничения описанные выше химиотерапевтические средства.
Термин «цитокин» представляет собой обобщенный термин для белков, высвобождаемых одной популяцией клеток, которые действуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. К цитокинам относятся гормоны роста, такие как гормон роста человека (HGH), N-метионильный гормон роста человека и бычий гормон роста; паратироидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тироидный стимулирующий гормон (TSH) и лютеинизирующий гормон (LH); эпидермальный фактор роста (EGF); печеночный фактор роста; фактор роста фибробластов (FGF); пролактин; плацентарный лактоген; фактор-альфа и -бета некроза опухоли; маллериан-ингибирующее вещество; мышиный гонадотропин-связанный пептид; ингибин; активин; сосудистый эндотелиальный фактор роста; интегрин; тромбопоэтин (ТРО); факторы роста нервов, такие как NGF-альфа; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста I и II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарный-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1альфа, IL-1бета, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; IL-18; фактор некроза опухоли, такие как TNF-альфа и TNF-бета; и другие полипептидные факторы, включая LIF и комплектный лиганд (KL). Используемый в настоящем документе термин «цитокин» включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов нативных последовательностей.
Под «цитокиновым антагонистом» подразумевается молекула, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность по меньшей мере одного цитокина. Например, цитокиновые антагонисты могут ингибировать цитокиновую активность путем ингибирования экспрессии и/или секреции цитокина или путем связывания с цитокином или с цитокиновым рецептором. Цитокиновые антагонисты включают антитела, пептиды с синтетическими или нативными последовательностями, иммуноадгезины и низкомолекулярные антагонисты, которые связываются с цитокином или цитокиновым рецептором. Цитокиновый антагонист необязательно является конъюгированным с цитотоксическим средством или слитым с ним. Типичными антагонистами TNF являются этанерцепт (ENBREL®), инфликсимаб (REMICADE®) и адалимумаб (HUMIRA™).
Термин «иммуносупрессивное средство», используемый в настоящем документе, относится к веществам, которые действуют, подавляя или маскируя иммунную систему получающего лечение субъекта. Они включают вещества, которые супрессируют продуцирование цитокина, отрицательно регулируют или супрессируют экспрессию собственного антигена или маскируют антигены МНС. Примеры иммуносупрессивных средств включают 2-амино-6-арил-5-замещенные пиримидины (см. патент США №4665077); микофенолата мофетил, такой как CELLCEPT®; азатиоприн (IMURAN®, АгА8АК®/6-меркаптопурин; бромокриптин; даназол; дапсон; глутаральдегид (который маскирует антигены МНС, как описано в патенте США №4120649); антиидиотипические антитела для антигенов МНС и фрагментов МНС; циклоспорин А; стероиды, такие как кортикостероиды и глюкокортикостероиды, например, преднизон, преднизолон, такой как PEDIAPRED® (преднизолона фосфат натрия) или ORAPRED® (пероральный раствор преднизолона фосфата натрия), метилпреднизолон и дексаметазон; метотрексат (перорально или подкожно) (RHEUMATREX®, TREXALL™); гидроксихлороквин/хлороквин; сульфасалазин; лефлуномид; цитокин или антагонисты цитокиновых рецепторов, в том числе антитела к интерферону-γ, -β или -α, антитела к фактору некроза опухоли-α(инфликсимаб или адалимумаб), анти-TNFα иммуноадгезин (ENBREL®, этанерцепт), антитела к фактору некроза опухоли-α, антитела к интрелейкину-2 и антитела к рецептору IL-2; антитела к LFA-1, в том числе антитела к CD11a и к CD18; антитела к L3T4; гетерологичный антилимфоцитный глобулин; поликлональные или пан-Т антитела, или моноклональные антитела к CD3 или к CD4/CD4a; растворимый пептид, содержащий LFA-3-связывающий домен (WO 90/08187); стрептокиназа; TGF-β; стрептодорназа; РНК или ДНК хозяина; FK506; RS-61443; деоксиспергуалин; рапамицин; Т-клеточный рецептор (Cohen et al., патент США №5114721); фрагменты Т-клеточного рецептора (Offher et al. Science 251: 430-432 (1991); WO 90/11294; laneway. Nature 341:482 (1989); и WO 91/01133); антитела Т-клеточного рецептора (европейский патент №340109), такие как Т10 В9; циклофосфамид (CYTOXAN®); дапсон; пеницилламин (CUPRIMINE®); плазмообмен или внутривенный иммуноглобулин (IVIG). Они могут быть использованы по одному или в комбинации друг с другом, в частности, комбинации стероидов и другого иммуносупрессивного средства или такие комбинации с последующей поддерживающей дозой с нестероидным средством для снижения потребности в стероидах.
Термин «анальгетик» относится к лекарственному средству, которое действует, ингибируя или подавляя боль у субъекта. Типичные анальгетики включают нестероидные противовоспалительные лекарственные средства (NSAID), включающие ибупрофен (MOTRIN®), напроксен (NAPROSYN®), ацетилсалициловую кислоту, индометацин, сулиндак и толметин, в том числе их соли и производные, а также различные другие виды медицинских препаратов, используемых для снижения колющих болей, которые могут иметь место, включая противосудорожные средства (габапентин, фенилоин, карбамазепин) или трициклические антидепресанты. Конкретные примеры включают ацетаминофен, аспирин; амитриптилин (ELAVIL®), карбамазепин (TEGRETOL®), фенилтоин (DILANTIN®), габапентин (NEURONTIN®), (Е)-N-ваниллил-8-метил-6-нонеамид (CAPSAICIN®) или нервный блокатор.
Термин «кортикостероид» относится к любому из нескольких синтетических или природных веществ с общей химической структурой стероидов, которые имитируют или увеличивают действия встречающихся в природе кортикостероидов. Примеры синтетических кортикостероидов включают преднизон, преднизолон (в том числе метилпреднизолон), дексаметазон, глюкокортикоид и бетаметазон.
Термин «противораковая вакцина», используемый в настоящем документе, относится к композиции, которая стимулирует иммунный ответ у субъекта по отношению к злокачественной опухоли. Противораковые вакцины обычно состоят из источника ассоциированного со злокачественной опухолью материала или клеток (антигена), которые могут быть аутологическими (от себя) или аллогенными (от других) для субъекта, наряду с другими компонентами (например, вспомогательными средствами) для дальнейшего стимулирования и повышения иммунного ответа на антиген. Противораковые вакцины в результате могут стимулировать иммунную систему субъекта к продуцированию антител к одному или нескольким специфическим антигенам, и/или для продуцирования киллерных Т-клеток, чтобы атаковать клетки злокачественной опухоли, которые несут такие антигены.
Термин «цитотоксическая лучевая терапия», используемый в настоящем документе, относится к лучевой терапии, которая ингибирует или препятствует функции клеток и/или вызывает разрушение клеток. Лучевая терапия может предусматривать, например, внешнее облучение или терапию радиоактивно меченым средством, таким как антитело. Термин предназначен для включения применения радиоактивных изотопов (например, At11, I131, Y125, Re186, Re188, Sm153, Bi212, Ra223, Р32 и радиоактивных изотопов Lu).
Термин «молекула-мишень» относится к молекуле, которая может связываться с белковым комплексом по настоящему изобретению (предпочтительно с аффинностью Kd, выше чем 1 мкМ в соответствии с анализом Скэтчарда). Примеры молекул-мишеней включают без ограничения растворимые белки сыворотки и их рецепторы, такие как цитокины и цитокиновые рецепторы, адгезины, факторы роста и их рецепторы, гормоны, вирусные частицы (например, RSV F белок, CMV, StaphA, вирус гриппа, гепатита С), микроорганизмы (например, бактериальные клеточные белки, клетки грибов), адгезины, белки CD и их рецепторы.
«Противорвотное средство» представляет собой соединение, которое ослабляет или предотвращает рвоту у субъекта. Противорвотные соединения включают, например, антагонисты рецептора нейрокинина-1, антагонисты рецептора 5НТ3 (такие как ондансетрон, гранисетрон, трописетрон и затизетрон), агонисты рецепторов GABAB, такие как баклофен, кортикостероиды, такие как дексаметазон, KENALOG®, ARISTOCORT® или NASALIDE®, антидопаминергическое средство, фенотиазины (например, прохлорперазин, флуфеназин, тиоридазин и мезоридазин), дронабинол, метроклопрамид, домперидон, галоперидол, циклизин, лоразепам, прохлорперазин и левомепромазин.
«Субъектом» является позвоночное, такое как млекопитающее, например, человек. Млекопитающие включают без ограничения сельскохозяйственных животных (например, коров), животных для спорта, домашних животных (например, кошек, собак и лошадей), приматов, мышей и крыс.
Коммерчески доступные реагенты, упомянутые в примерах, были использованы в соответствии с инструкциями изготовителя, если не указано иное. Источником этих клеток, определенных в следующих примерах и во всем описании с помощью инвентарных номеров АТСС, является Американская коллекция типовых культур, Манассас, Вирджиния. Если не указано иное, в настоящем изобретении используются стандартные процедуры метода рекомбинантной ДНК, такие как описанные выше и в следующих справочниках: Sambrook et al., выше; Ausubel et al., Current Protocols in Molecular Biology (Green Publishing Associates and Wiley Interscience, NY, 1989); Innis et al., PCR Protocols: A Guide to Methods and Applications (Academic Press, Inc., NY, 1990); Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Press, Cold Spring Harbor, 1988); Gait, Oligonucleotide Synthesis (IRL Press, Oxford, 1984); Freshney, Animal Cell Culture, 1987; Cohgan et al., Current Protocols in Immunology, 1991.
Во всем описании и формуле изобретения слово «содержать» или его вариации, такие как «содержит» или «содержащий», понимают как подразумевающее включение установленного целого числа или группы целых чисел, но не исключает любые другие целое число или группу целых чисел.
II. Конструирование содержащих суперспираль и привязанных антител
Белковые комплексы, описанные в настоящем документе, могут быть сконструированы с использованием гетеродимеризующего домена (например, суперспирального домена) и/или привязки.
Применение гетеродимеризующего домена дает возможности конструирования относительно чистой популяции антител, которые характеризуются разными тяжелыми цепями в одном антителе. В частности, как описано выше, антитела, как правило, содержат две идентичные тяжелые цепи, каждая из которых спарена с идентичной легкой цепью. Применение технологии суперспирального домена гетеродимеризации в соответствии с настоящим изобретением позволяет разным тяжелым цепям антител димеризоваться преимущественно друг с другом с образованием единого антитела. Полученное в результате антитело, таким образом, содержит две разные тяжелые цепи, каждая из которых, как правило, (но не обязательно) спарена с идентичной легкой цепью. Каждая пара тяжелых и легких цепей в таком антителе характеризуется различной специфичностью связывания из-за наличия разных тяжелых цепей, и, таким образом, антитело можно рассматривать как мультиспецифическое антитело. Привязки могут быть использованы для конструирования антител в соответствии с настоящим изобретением либо отдельно, либо в комбинации с методом суперспирали. Привязки могут соединять С-конец константной легкой цепи с N-концом вариабельной тяжелой цепи, таким образом обеспечивая надлежащую ассоциацию легкой цепи и тяжелой цепи, а также продуцирование рекомбинантных антител с помощью кодирующей одно антитело плазмиды. Ниже описаны антитела, включающие суперспирали и/или привязки.
А. Суперспиральные домены
Гетеродимеризующий домен, использованный для создания белковых комплексов, описанных в настоящем документе, может быть альфа-спиралью (например, вращающейся вправо альфа-спиралью), которая может формировать суперспираль при ассоциации со второй альфа-спиралью, содержащей противоположно заряженные остатки. Для создания гомогенных или почти гомогенных популяций гетеродимерных молекул домен гетеродимеризации должен характеризоваться сильным предпочтением для формирования гетеродимеров над гомодимерами. В этом отношении домены гетеродимеризации, описанные в настоящем документе, обеспечивают существенное преимущество над лейциновыми зипперными доменами Fos/Jun, потому что Jun с готовностью формирует гомодимеры. Типичные альфа-спиральные домены гетеродимеризации проиллюстрированы на фиг.1, 2А и 2 В. В конкретных вариантах осуществления первый суперспиральный домен содержит гептадный повтор формулы I:
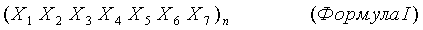
X1 представляет собой гидрофобный аминокислотный остаток или аспарагин, каждый из Х2, Х3 и Х6 представляет собой любой аминокислотный остаток,
X4 представляет собой гидрофобный аминокислотный остаток, и каждый из Х5 и Х7 представляет собой заряженный аминокислотный остаток; и второй суперспиральный домен содержит гептадный повтор формулы II:
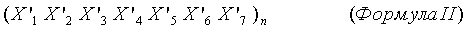
X'1 представляет собой гидрофобный аминокислотный остаток или аспарагин,
каждый из Х'2, Х'3 и Х'6 представляет собой любой аминокислотный остаток,
Х'4 представляет собой гидрофобный аминокислотный остаток, и каждый из Х'5 и Х'7 представляет собой заряженный аминокислотный остаток.
В формуле I и формуле II n больше или равняется 2 (например, больше или равняется 3 или 4) и меньше или равняется 100. В одном варианте осуществления n равняется 2-20.
Остатки Х5 и Х7 первого суперспирального домена и остатки Х'5 и Х'7 второго суперспирального домена могут характеризоваться, но не обязательно, одинаковыми зарядами. Таким образом, в одном примере остатки Х5 и Х7 первого суперспирального домена являются основными остатками, а остатки Х'5 и Х'7 второго суперспирального домена являются кислыми остатками. В другом примере Х5 в первом суперспиральном домене является основным остатком, а Х7 первого суперспирального домена является кислым остатком. В этом примере второй суперспиральный домен содержит основный остаток в положении Х'5 и кислый остаток в положении Х'7. Как показано на фигуре 1, ионное взаимодействие происходят между остатком Х5 первого суперспирального домена и остатком Х'7 второго суперспирального домена, а также между остатком Х7 первого суперспирального домена и остатком Х'5 второго суперспирального домена. В родственном примере X5 в первом суперспиральном домене является кислым остатком, Х7 в первом суперспиральном домене является основным остатком, Х'5 во втором суперспиральном домене является кислым остатком, а X'7 во втором суперспиральном домене является основным остатком. Кроме того, включение по меньшей мере одного гептадного повтора с аспарагином в положении X1/X'1 как первого, так и второго суперспирального доменов может быть использовано для обеспечения параллельной ориентации первого и второго суперспиральных доменов.
Гидрофобные остатки в гептадных повторах предпочтительно выбираются из аланина, валина, лейцина, изолейцина, триптофана, фенилаланина и метионина. Пролин, хотя и гидрофобный, в одном варианте осуществления не включен в суперспиральный домен формулы I или формулы II, поскольку присутствие пролина в аминокислотной последовательности может ограничить ее способность формировать альфа-спиральную структуру. Кроме того, в других вариантах осуществления суперспиральный домен формулы I или формулы II не содержит глициновый остаток по причине его конформационной гибкости, глицин трудно принимает ограниченную альфа-спиральную структуру. Заряженные остатки, которые могут быть включены в суперспиральный домен формулы I или формулы II, включают лизин, аргинин, гистидин, аспарагиновую кислоту и глутаминовую кислоту, где лизин, аргинин и гистидин являются основными остатками, а аспарагиновая кислота и глутаминовая кислота являются кислыми остатками.
В конструировании антитела, описанного в настоящем документе, может использоваться суперспиральный домен формулы I и суперспиральный домен формулы II (первый и второй суперспиральные домены), где первый суперспиральный домен связывается с первым константным доменом антитела (например, СН3 первой тяжелой цепи), а второй суперспиральный домен связывается со вторым константным доменом антитела (например, СН3 второй тяжелой цепи). Связывание может быть прямым связыванием через пептидную связь или может осуществляться через линкерную последовательность. Линкер может быть пептидом, связанным с С-концом одной аминокислотной последовательности (например, константным участком) и с N-концом другой аминокислотной последовательности (например, суперспиральным доменом). Линкер может быть достаточно длинным, чтобы допустить отщепление суперспирального домена от константного участка антитела, как описано далее в другом месте настоящего документа, но достаточно коротким, чтобы обеспечить гетеродимерную ассоциацию двух константных участков антител (например, двух константных участков тяжелых цепей). В связи с этим, линкером может быть аминокислотная последовательность длиной от 2 до 100 аминокислот. В конкретном варианте осуществления линкер характеризуется длиной от 2 до 50 аминокислот, например, длиной 3, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот. Линкер может состоять, например, из нейтральных, полярных или неполярных аминокислот.
В. Мультиспецифические антитела
Следует понимать, что вариабельные домены таких антител могут быть получены несколькими способами. Например, вариабельные домены антител по настоящему изобретению могут быть такими же, что и существующие антитела, известные в данной области.
Суперспиральный домен может быть использован для создания мультиспецифического антитела (антитела, которое связывает по меньшей мере два антигена или по меньшей мере два эпитопа на одном и том же антигене). В одном примере мультиспецифическое антитело является биспецифическим антителом. Обычно во встречающихся в природе IgG-антителах вариабельные участки каждой пары тяжелой и легкой цепей в антителе являются идентичными. Применение суперспиральных доменов в соответствии с настоящим изобретением дает возможность двум тяжелым цепям в антителе быть разными, что дает в результате антитела, содержащие связывающие антиген домены с разными специфичностями связывания. В частности, суперспиральные домены гетеродимеризации на каждой тяжелой цепи (например, ближе к С-концу от СН3) способствуют связыванию между разными тяжелыми цепями. Необязательно суперспиральные домены связываются с константными участками тяжелой цепи с помощью линкера, который может быть отщеплен так, что суперспираль может быть удалена из антитела после сборки.
Схематическое представление типичного биспецифического антитела, которое содержит две разные тяжелые цепи (НС1 и НС2) и две идентичные или общие легкие цепи, показано на фиг.3. Типичное биспецифическое антитело на фиг.3 также содержит гетеродимерную суперспираль. Антитело также может содержать сайт расщепления эндопептидазой Lys-C ближе к N-концу от каждого суперспирального домена гетеродимеризации, что позволяет удалять суперспираль из антитела, как только антитело собрано. Обе тяжелые цепи в таком типичном биспецифическом антителе также содержат мутацию K222A в шарнирном участке для удаления сайта расщепления эндопептидазой Lys-С так, что обработка эндопептидазой Lys-C приводит к удалению только суперспирали, а не расщеплению константных участков тяжелой цепи.
Наряду с тем, что типичное антитело содержит мутацию, которая удаляет сайт расщепления эндопептидазой Lys-C в шарнирном участке, расположение сайтов расщепления эндопептидазой Lys-C может варьировать в зависимости от используемой последовательности антитела. Специалист в данной области может легко рассмотреть последовательность антитела, чтобы определить наличие каких-либо сайтов расщепления (например, сайта расщепления эндопептидазой Lys-C) в последовательностях тяжелой или легкой цепей, которые нужно будет удалить, чтобы предотвратить расщепление самого антитела при удалении последовательностей суперспирали или привязки.
Кроме того, мультиспецифические антитела могут быть сконструированы с использованием способов, описанных в настоящем документе, при которых тяжелая цепь утрачивает СН1-домен (VH напрямую соединена с шарнирным-СН2-доменом), а соответствующая легкая цепь утрачивает CL-домен. Такие антитела могут быть использованы для сближения различных антигенов вместе или для связывания В- и Т-клеток.
С. Антитела с «одним плечом»
Гетеродимеризующие суперспиральные домены также могут быть использованы для создания антител с «одним плечом». Схематическая диаграмма, иллюстрирующая пример антитела с «одним плечом», приведена на фиг.4А. Типичное антитело, показанное на фиг.4А, содержит легкую цепь (LC), одну полноразмерную тяжелую цепь (НС1) и вторую тяжелую цепь (НС2) без VH- и СН1-доменов, а также часть шарнирного участка. Обе НС1 и НС2 содержат суперспиральные домены гетеродимеризации на С-конце. Последовательность НС1 в этом примере содержит мутацию K222A в шарнирном участке для удаления сайта расщепления эндопептидазой Lys-C так, что расщепление Lys-C удаляет только суперспираль и не приводит к расщеплению в тяжелой цепи.
D. Конъюгированные белковые комплексы
Суперспиральные домены гетеродимеризации также могут быть использованы для создания белковых комплексов, таких как антитела (например, моноспецифические, биспецифические, мультиспецифические, с «одним плечом» или привязанные антитела), в которых константный участок модифицируется с помощью конъюгации с цитотоксическим средством. Например, суперспиральный домен гетеродимеризации дает возможность конструирования антител, где один из константных участков тяжелой цепи (НС1 или НС2) содержит модификацию, которая позволят конъюгацию с цитотоксическим средством, тогда как другой константный участок тяжелой цепи - нет. В одном примере НС1 конъюгирован с цитотоксическим средством, тогда как НС2 - нет. Схематическая диаграмма, иллюстрирующая пример конъюгированного антитела, показана на фиг.4В. Типичное антитело включает две полноразмерные тяжелые цепи и две идентичные легкие цепи (общая легкая цепь), а также суперспираль. Отмеченная звездочкой одна из тяжелых цепей была конъюгирована с цитотоксическим средством (например, токсином). Аналогичным образом, в альтернативном конструкте антитела один из константных участков легкой цепи может быть конъюгирован с цитотоксическим средством, при этом другой константный участок легкой цепи - нет (например, LC1 конъюгирован с цитотоксическим средством, и LC2 - нет).
В одном конкретном примере константный участок антитела может быть модифицирован для введения электрофильных компонентов, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте, используемом для конъюгации цитотоксического средства с антителом, или на самом цитотоксическом средстве. Сахара гликозилированных антител могут быть окислены, например, перйодатными окислителями, с образованием альдегидных или кетонных групп, которые могут реагировать с аминогруппой линкерных реагентов или с цитотоксическим средством. Образующиеся иминовые группы основания Шиффа могут формировать стабильную связь или могут быть восстановлены, например, с помощью боргидридных реагентов, с образованием стабильных аминных связей. Нуклеофильные группы на цитотоксическом средстве включают без ограничения аминную, тиольную, гидроксильную, гидразидную, оксимную, гидразиновую, тиосемикарбазоновую, гидразинкарбоксилатную и арилгидразидную группы, способные реагировать с образованием ковалентных связей с электрофильными группами на участках антитела и линкерных реагентах, включающих (i) активные эфиры, такие как NHS-эфиры, HOBt-эфиры, галогенформиаты и галогенангидриды, (ii) алкил- и бензилгалогениды, такие как галогенацетамиды, и (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Е. Привязанные белковые комплексы
В настоящем изобретении также представлены белковые комплексы, сконструированные с использованием привязок, например, антитело может содержать привязку, которая связывает С-конец константной легкой цепи с N-концом вариабельной тяжелой цепи. Привязка помогает надлежащей ассоциации легкой цепи и тяжелой цепи (например, ассоциации легкой цепи с тяжелой цепью, к которой она привязана). Такое привязанное антитело может быть сконструировано с гетеродимеризующим доменом или без такового, как описано выше. Схематическое представление типичного привязанного антитела, содержащего суперспираль, показано на фиг.5. Типичное антитело, показанное на фиг.5, содержит две разные тяжелые цепи (НС1 и НС2), а также две разные легкие цепи (LC1 и LC2). Привязанные антитела также могут быть сконструированы с содержанием общих легких цепей и/или общих тяжелых цепей. В типичном антителе НС1 и НС2 содержат мутацию K222A в шарнирном участке для удаления сайта расщепления эндопептидазой Lys-C, как описано выше, а также суперспиральные домены гетеродимеризации на их С-концах.
Добавление гетеродимеризующего домена к привязанному антителу помогает в сближении комплексов тяжелой цепи/легкой цепи и, таким образом, снижает или устраняет гомодимеризацию таких комплексов. В конкретном варианте осуществления привязки достаточно длинные, чтобы покрыть расстояние между N-концом вариабельной тяжелой цепи и С-концом константной легкой цепи в собранном антителе (фиг.6), чтобы обеспечить надлежащую ассоциацию легкой цепи/тяжелой цепи, но достаточно короткие, чтобы предотвратить межцепочечную ассоциацию (например, ассоциацию легкой цепи с тяжелой цепью, к которой она не привязана). В примере, показанном на фиг.6, расстояние между N-концом вариабельной тяжелой цепи и С-концом константной легкой цепи составляет приблизительно 92 А. Пептидная связь покрывает около 4,3 А. В этом примере привязка должна составлять около 22 аминокислот в длину, чтобы покрыть расстояние между N-концом вариабельной тяжелой цепи и С-концом константной легкой цепи. Расстояние между С-концом константной легкой цепи и N-концом вариабельной тяжелой цепи может различаться у разных антител, и длина привязки, таким образом, также может варьировать у разных антител. Были проанализированы привязки из 20, 23 и 26 аминокислот в длину, и, как правило, эффективными являются привязки из 15-50 аминокислот. Привязка может оставаться гибкой и не формировать вторичные структуры, и для данной цели может быть использована привязка, содержащая глициновые (G) и сериновые (S) остатки. Привязка может состоять исключительно из остатков G и S, но также может содержать другие остатки, настолько длинные, чтоб привязка оставалась гибкой, позволяя сборку легкой цепи и тяжелой цепи антитела. В конкретном варианте осуществления привязка содержит повторы GGS (фиг.5). Что касается привязки длиной 15-30 аминокислот в одном варианте осуществления, она содержит по меньшей мере 5 повторов GGS. Типичная привязка, описанная в настоящем документе и характеризующаяся последовательностью SEQ ID NO:14, содержит 8 повторов GGS и содержит дополнительный глициновый остаток на обоих N- и С-концах. Другие типичные последовательности привязок показаны на фиг.7В и содержат либо фурин, либо сайт расщепления эндопептидазой Lys-Cs на их N- и С-концах.
F. Отщепление привязки и линкерных последовательностей
Как только белковый комплекс собран, привязка может больше не потребоваться и при желании может быть отщеплена от антитела. Сайты расщепления, находящиеся в привязке, но не в последовательности антитела, могут быть использованы для удаления привязки. Аналогичным образом, суперспираль также может быть больше не нужна, после того как антитело собрано, и также при желании может отщепляться от антитела.
На фиг.7А проиллюстрировано расположение типичных сайтов расщепления в привязке, а также в линкерной последовательности, которая соединяет суперспираль с антителом. Как правило, сайты расщепления в привязке расположены на С- и N-концах последовательности привязки или вблизи от них или в последовательности антитела в или близко к сайту, где антитело и привязка соединены. Сайт расщепления для линкера обычно расположен при N-конце линкерной последовательности (или суперспирали) или в последовательности антитела в сайте, где антитело и линкер (или суперспираль) соединены, или вблизи от него. Если линкер отщепляется с использованием эндопептидазы Lys-C (например, на лизиновом остатке на С-конце константной тяжелой цепи), может потребоваться, чтобы последовательность антитела была модифицирована с удалением сайта расщепления эндопептидазы Lys-Cs. Примером такой модификации является мутация лизина в шарнирном участке на аланин (например, K222A, система нумерации по Kabat; K222A, европейская система нумерации, в типичных антителах, описанных в настоящем документе). Если для применения согласно настоящему изобретению выбраны другие средства расщепления, могут потребоваться модификации других сайтов расщепления, которые производят аналогичным образом.
Отщепление аминокислотных последовательностей с определенных сайтов является стандартным в данной области техники и может включать ферментативное отщепление, химическое отщепление или аутопроцессинг. Например, привязка или линкер могут быть отщеплены от белка с использованием эндопептидазы. Типичные эндопептидазы включают без ограничения Lys-C, Asp-N, Arg-C, V8, Glu-C, тромбин, гененазу (вариант субтилизин-BPN'-протеазы), фактор Ха, TEV (пистеин-протеазу вируса гравировки табака), энтерокиназу, HRV С3 (протеазу риновируса С3 человека), кининогеназу, химотрипсин, трипсин, пепсин и папаин, каждый из которых коммерчески доступен (например, от Boehringer Mannheim, Thermo Scientific, или New England Biolabs). Lys-C отщепляет с карбоксильного конца лизиновых остатков, V8 и Glu-C отщепляют с карбоксильного конца глутаминовых остатков, Arg-C отщепляет с карбоксильного конца аргининовых остатков, Asp-N отщепляет с аминоконца аспартатных остатков, химотрипсин отщепляет с карбоксильного конца тирозиновых, фенилаланиновых, триптофановых и лейциновых остатков, а трипсин отщепляет с карбоксильного конца аргининовых и лизиновых остатков. TEV расщепляет аминокислотную последовательность GluAsnLeuTyrPheGlnGly (SEQ ID NO:19) между «Gln» и «Gly» остатками. Применение таких ферментов является стандартным в данной области техники, и протоколы предоставляются производителями.
В качестве альтернативного варианта привязка или линкер могут быть отщеплены от белка с использованием химиката, такого как гидроксиламин. Гидроксиламин расщепляет пептидные связи аспарагин-глицин. Если гидроксиламин используется для отщепления привязки и линкера от белка, может потребоваться, чтобы несколько глициновых или аспарагиновых остатков в белке были мутированы для предотвращения фрагментирования белка.
В данной области известны многие другие химикаты, которые расщепляют пептидные связи. Например, N-хлорсукцинимид расщепляет с С-концевой стороны триптофановых остатков (Shechter et al., Biochemistry 15:5071-5075 (1976)). N-бромсукцинимид и цианогенбромид также расщепляют с С-концевой стороны триптофановых остатков. Кроме того, 2-нитротиоцианобензойная кислота или органофосфины могут быть использованы для расщепления белка с N-концевой стороны цистеинового остатка (см., например, европейский патент №0339217).
Линкер или привязка также могут быть отщеплены по двухосновным сайтам (например, по сайтам аргинин-аргинин, лизин-аргинин или лизин-лизин). Ферменты, которые расщепляют по двухосновным сайтам, известны в данной области техники и включают, например, конвертазу, расщепляющую двухосновный аргинин по N-концу (Chow et al., JBC 275:19545-19551 (2000)), и субтилизин-подобные пробелковые конвертазы, такие как фурин (РС1), РС2 и РС3 (Steiner (1991) в Peptide Biosynthesis and Processing (Fricker ed.) pp.1-16, CRC Press, Boca Raton, FL; Muller et al., JBC 275:39213-39222, (2000)).
Белки, как известно, аутопроцессируются. Например, белок Hedgehog процессируется по сайту расщепления Gly.AspTrpAsnAlaArgTrp.CysPhe (SEQ ID NO:20) за счет протеолитической активности белка. Аутопротеолитический сайт расщепления также может быть включен в последовательность линкера или привязки.
G. Другие характеристики белков
В соответствии с данным изобретением белки могут включать последовательности из любого источника, в том числе от человека и мышей, или их комбинации. Последовательности определенных участков белков (например, гипервариабельных участков) также могут являться искусственными последовательностями, такими как последовательности, идентифицированные при скрининге библиотеки (например, библиотеки фагового дисплея), включая случайные последовательности.
В случае антител, содержащих последовательности из разных источников, антитела могут быть «химерными» антителами, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих к конкретному классу или подклассу антител, тогда как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям антител, полученных из других видов или принадлежащих другому классу или подклассу антител; это же касается и фрагментов таких антител, при условии, что они обладают желаемой биологической активностью (патент США №4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Такие химерные антитела могут, например, содержать мышиные вариабельные участки (или их части) и человеческие константные участки.
Химерные антитела также необязательно могут же быть «гуманизированными» антителами, которые содержат минимальную последовательность, полученную из антитела отличного от человеческого происхождения. Обычно гуманизированные антитела являются антителами человека (антитело-реципиент), в которых остатки из гипервариабельного участка антитела-реципиента замещены остатками из гипервариабельного участка видов, отличных от человека (антитело-донор), таких как мышь, крыса, кролик или примат, отличный от человека, характеризующихся желаемой специфичностью, аффинностью и емкостью антитела. В некоторых случаях остатки каркасного участка (FR) иммуноглобулина человека замещены соответствующими остатками из антитела отличного от человеческого происхождения. Более того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются ни в антителе-реципиенте, ни в антителе-доноре. Эти модификации осуществляются с целью дальнейшего улучшения характеристик антитела. Как правило, гуманизированное антитело будет содержать главным образом все или по меньшей мере один, а в типичных случаях два вариабельных домена, в которых все или главным образом все гипервариабельные петли соответствуют таковым иммуноглобулина отличного от человеческого происхождения, а все или главным образом все из FR являются таковыми из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, из иммуноглобулина человека. Для более подробной информации см. Jones et al., Nature 321:522-525 (1986); Riechmarm et al. Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Более подробно, гуманизированное антитело может содержать один или несколько аминокислотных остатков, включенных в него из источника отличного от человеческого происхождения. Такие аминокислотные остатки из источника отличного от человеческого происхождения часто называют «импортными» остатками, поскольку они обычно заимствуются из «импортного» вариабельного домена. Гуманизирование может быть выполнено, главным образом, следующим методом Winter и сотрудников (Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); Verhoeyen et al. Science 239:1534-1536 (1988)), путем замещения CDR или последовательностей CDR грызунов на соответствующие последовательности антитела человека. Следовательно, такие «гуманизированные» антитела являются химерными антителами (патент США №816567), в которых небольшая часть интактного вариабельного домена человека была замещена соответствующей последовательностью из видов, отличных от человека. На практике гуманизированные антитела обычно являются антителами человека, в которых некоторые остатки CDR и возможно некоторые остатки FR замещены остатками из аналогичных сайтов антител грызунов.
Выбор вариабельных доменов человека, и легких, и тяжелых цепей, подлежащих использованию в создании гуманизированных антител, очень важен для снижения антигенности. В соответствии с так называемым методом «максимального соответствия» проводят скрининг последовательности вариабельного домена антитела грызуна по полной библиотеке известных последовательностей вариабельных доменов человека. Затем последовательность антитела человека, которая наиболее близка к таковой грызуна, принимают в качестве каркасного участка (FR) человека для гуманизированного антитела (Sims et al., J. Immunol. 151:2296 (1993); Chothia et al., J. Mol. Biol. 196:901 (1987)). В соответствии с другим методом используют особый каркасный участок, полученный из консенсусной последовательности всех антител человека определенной подгруппы легких или тяжелых цепей. Один и тот же каркасный участок может быть использован для нескольких различных гуманизированных антител (Carter et al., Proc. Nail. Acad. Sci. USA 89:4285 (1992); Presta et al., J. Immnol. 151:2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и других подходящих биологических свойств. Для достижения этой цели в соответствии с типичным методом гуманизированные антитела получают в процессе анализа исходных последовательностей и различных теоретических гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Имеются компьютерные программы, которые иллюстрируют и изображают возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулина. Просмотр этих изображений позволяет анализировать вероятную роль остатков в функционировании кандидатного иммуноглобулина, т.е. анализировать остатки, которые влияют на способность кандидатного иммуноглобулина связывать свой антиген. Таким образом, могут быть отобраны и скомбинированы остатки FR из реципиентных и импортных последовательностей так, чтобы добиться желаемых характеристик антитела, таких как повышенная аффинность к антигену(ам)-мишени(ям). Как правило, на связывание с антигеном непосредственно и наиболее значимо влияют CDR.
III. Векторы, клетки-хозяева и способы рекомбинации
Для рекомбинантного продуцирования антитела в соответствии с настоящим изобретением кодирующую его нуклеиновую кислоту выделяют и вставляют в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую антитело, легко выделяют и секвенируют с использованием традиционных методик (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела). Существует множество векторов. Выбор вектора зависит частично от того, какие клетки-хозяева будут использованы. Обычно предпочтительными клетками-хозяевами являются клетки либо прокариотического, либо эукариотического (как правило, клетки млекопитающих, а также грибов (например, дрожжей), насекомых, растений и ядросодержащие клетки из других многоклеточных организмов) происхождения. Следует учитывать, что для этих целей могут быть использованы константные участки любого изотипа, включая константные участки IgG, IgM, IgA, IgD и IgE, и, что такие константные участки могут быть получены из каких-либо видов человека или животных.
а. Получение антител с использованием прокариотических клеток-хозяев
i. Конструирование вектора
Полинуклеотидные последовательности, кодирующие полипептидные компоненты антитела в соответствии с настоящим изобретением, могут быть получены с использованием стандартных методик рекомбинации. Желаемые полинуклеотидные последовательности могут быть выделены и секвенированы из продуцирующих антитела клеток, таких как клетки гибридомы. Альтернативно, полинуклеотиды могут быть синтезированы с использованием нуклеотидного синтезатора или методик ПЦР. После получения последовательности, кодирующие полипептиды, вставляются в рекомбинантный вектор, способный к репликации и экспрессии гетерологических полинуклеотидов в прокариотических хозяевах. Специалистам известны и доступны многие векторы, которые могут быть использованы для целей настоящего изобретения. Выбор подходящего вектора будет в основном зависеть от размера нуклеиновых кислот, подлежащих вставке в вектор, и конкретной клетки-хозяина, подлежащей трансформации вектором. Каждый вектор содержит различные компоненты в зависимости от его функции (амплификации или экспрессии гетерологического полинуклеотида или и того, и другого) и его совместимости с конкретной клеткой-хозяином, в которой он находится. Компоненты вектора обычно содержат без ограничения точку начала репликации, маркерный ген для отбора, промотор, сайт связывания рибосом (RBS), сигнальную последовательность, вставку гетерологической нуклеиновой кислоты и последовательность терминации транскрипции.
Как правило, плазмидные векторы, содержащие репликон и контрольные последовательности, которые получены из видов, совместимых с клеткой-хозяином, используют для этих хозяев. Вектор обычно несет сайт репликации, а также маркирующие последовательности, которые способны обеспечить фенотипический отбор трансформированных клеток. Например, Е. coli обычно трансформируют с использованием pBR322, плазмиды, полученной из вида Е. coli. pBR322 содержит гены, кодирующие устойчивость к ампицилину (Amp) и тетрациклину (Tet), и, таким образом, дает возможность легко идентифицировать трансформированные клетки. pBR322, ее производные или другие микробные плазмиды, или бактериофаги также могут содержать промоторы или могут быть модифицированы для содержания промоторов, которые могут быть использованы микробными организмами для экспрессии эндогенных белков. Примеры производных pBR322, используемых для экспрессии конкретных антител, подробно описаны Carter et al. в патенте США №5648237.
Кроме того, фаговые векторы, содержащие репликон, и контрольные последовательности, совместимые с микроорганизмом-хозяином, могут быть использованы в качестве трансформирующих векторов для этих хозяев. Например, бактериофаг, такой как λGEM.TM.-11, может быть использован в создании рекомбинантного вектора, которым можно трансформировать восприимчивые клетки-хозяева, такие как LE392 Е. coli.
Экспрессирующий вектор в соответствии с настоящим изобретением может содержать две или более пары промотор-цистрон, кодирующие каждый из полипептидных компонентов. Промотор представляет собой нетранслируемую регуляторную последовательность, локализованную в 3'-5' направлении (5') относительно цистрона, которая модулирует его экспрессию. Прокариотические промоторы обычно делятся на два класса: индуцибельные и конститутивные. Индуцибельный промотор представляет собой промотор, который инициирует повышенные уровни транскрипции цистрона, находящегося под его контролем, в ответ на изменения условий культивирования, например, присутствие или отсутствие какого-либо питательного компонента или изменение температуры.
Хорошо известно большое количество промоторов, узнаваемых различными потенциальными клетками-хозяевами. Выбранный промотор может быть функционально связан с ДНК цистрона, кодирующей легкую или тяжелую цепь, путем удаления промотора из ДНК, являющейся источником материала, посредством расщепления ферментами рестрикции и вставки выделенной промоторной последовательности в вектор в соответствии с настоящим изобретением. Могут быть использованы и нативная промоторная последовательность, и множество гетерологических промоторов для управления амплификацией и/или экспрессией генов-мишеней. В некоторых вариантах исполнения используются гетерологические промоторы, поскольку они обычно обеспечивают более интенсивную транскрипцию и более высокие выходы экспрессированного гена-мишени по сравнению с нативным промотором полипептида-мишени.
Промоторы, приемлемые для применения в прокариотических хозяевах, включают промотор PhoA, β-галактамазные и лактозные промоторные системы, триптофановую (trp) промоторную систему и гибридные промоторы, такие как tac- или trc-промоторы. Однако приемлемыми также являются и другие промоторы, которые функционируют в бактериях (такие как другие известные бактериальные или фаговые промоторы). Их нуклеотидные последовательности были опубликованы, что дает возможность специалисту лигировать их к цистронам, кодирующим легкие и тяжелые цепи-мишени (Siebenlist et al., (1980) Cell 20:269), с использованием линкеров или адаптеров, чтобы обеспечить любые необходимые сайты рестрикции.
В одном из аспектов настоящего изобретения каждый цистрон в рекомбинантном векторе содержит компонент сигнальной последовательности секреции, который управляет транслокацией экспрессированных полипептидов через мембрану. Как правило, сигнальной последовательностью может быть компонент вектора, а может быть часть ДНК полипептида-мишени, которая вставляется в вектор. Сигнальная последовательность, выбранная для целей настоящего изобретения, должна быть последовательностью, которая распознается и процессируется (т.е. расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и не процессируют сигнальные последовательности, нативные для гетерологических полипептидов, сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы, состоящей из щелочной фосфатазы, пенициллиназы, Ipp или термостабильного энтеротоксина II (STII) лидерных последовательностей, LamB, PhoE, PelB, OmpA и MBP. В одном варианте настоящего изобретения сигнальными последовательностями, используемыми в обоих цистронах экспрессирующей системы, являются сигнальные последовательности STII или их варианты.
В другом аспекте продуцирование иммуноглобулинов в соответствии с настоящим изобретением может происходить в цитоплазме клетки-хозяина, а поэтому не требуется присутствия сигнальных последовательностей секреции в каждом цистроне. В соответствии с этим легкие и тяжелые цепи иммуноглобулина экспрессируются, сворачиваются и собираются с образованием функциональных иммуноглобулинов в цитоплазме. Некоторые штаммы хозяев (например, trxB-штаммы Е. coil) обеспечивают такие условия в цитоплазме, которые благоприятствуют образованию дисульфидных связей, и тем самым способствуют надлежащему сворачиванию и сборке экспрессированных белковых субъединиц (Proba & Pluckthun Gene, 159:203 (1995)).
Прокариотические клетки-хозяева, подходящие для экспрессии антител в соответствии с настоящим изобретением, включают архебактерии и эубактерии, такие как грамотрицательные или грамположительные микроорганизмы. Примерами применимых бактерий являются Escherichia (например, Е. coli), Bacilli (например, В. subtilis), энтеробактерии, бактерии видов Pseudomonas (например, Р. aeruginosa), Salmonella typhimurium, Serratia marcescans, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном варианте осуществления используются грамотрицательные клетки. В одном варианте осуществления в качестве хозяев в соответствии с настоящим изобретением используются клетки Е. coli. Примеры штаммов Е. coli включают штамм W3110 (Bachmann, Cellular & Molecular Biology, vol.2 (Washington, D.C.: American Society for Microbiology, 1987), pp.1190-1219; депозитный ATCC №27325) и его производные, в том числе штамм 33D3, характеризующийся генотипом W3110 ΔfhuA (ΔtonA) ptr3 lac Iq lacL8 ΔompTΔ (nmpc-fepE) degP41 kanR (патент США №5639635). Подходящими также являются и другие штаммы и их производные, такие как 294 Е. coli (ATCC №31446), В Е. coli, λ 1776 Е. coli (ATCC №31537) и RV308 Е. coli (ATCC №31608). Эти примеры являются иллюстративными, а не ограничивающими. Методы конструирования производных любой из вышеупомянутых бактерий, характеризующихся определенными генотипами, известны в данной области и описаны, например, в Bass et al., Proteins 8:309-314 (1990). Обычно соответствующие бактерии необходимо отбирать с учетом реплицируемости репликона в клетках бактерии. Например, виды Е. coli, Serratia или Salmonella могут быть приемлемыми для использования в качестве хозяина, если для обеспечения репликона используются хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410. Обычно клетка-хозяин должна секретировать минимальные количества протеолитических ферментов, а поэтому в клеточную культуру желательно включать дополнительные ингибиторы протеазы.
ii. Продуцирование антител
Клетки-хозяева трансформируют описанными выше экспрессирующими векторами и культивируют в стандартной питательной среде, модифицированной так, чтобы она была подходящей для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
Трансформация означает введение ДНК прокариотическому хозяину так, что ДНК является реплицируемой либо в виде внехромосомного элемента, либо как хромосомный интегрант. В зависимости от используемой клетки-хозяина трансформацию выполняют стандартными методами, подходящими для таких клеток. Бактериальные клетки, обладающие прочными барьерами клеточных стенок, обычно обрабатывают кальцием, а именно хлоридом кальция. В другом методе для трансформации используется полиэтиленгликоль/DMSO. Еще одной методикой трансформации является электропорация.
Прокариотические клетки, используемые для продуцирования полипептидов в соответствии с настоящим изобретением, выращиваются в среде, известной из уровня техники и приемлемой для культивирования выбранных клеток-хозяев. Примеры приемлемой среды включают бульон Луриа (LB) с необходимыми питательными добавками. В некоторых вариантах осуществления среда также содержит средство для отбора, выбранное исходя из конструкции экспрессирующего вектора, для селективного обеспечения роста прокариотических клеток, содержащих данный экспрессирующий вектор. Например, в среду для роста клеток, экспрессирующих ген устойчивости к ампициллину, добавляется ампициллин.
Помимо источников углерода, азота и неорганического фосфата также могут быть включены любые необходимые добавки в соответствующих концентрациях, введенные отдельно или как смесь с другой добавкой или средой, такой комплексный источник азота. Культуральная среда необязательно может содержать один или несколько восстанавливающих средств, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолята, дитиоэритритола и дитиотреитола.
Прокариотические клетки-хозяева культивируются при соответствующих температурах. Для выращивания Е. coli предпочтительная температура варьирует от приблизительно 20°С до приблизительно 39°С, более предпочтительно от приблизительно 25°С до приблизительно 37°С, еще более предпочтительно приблизительно 30°С. рН среды может быть любым рН, варьирующим от приблизительно 5 до 9, в зависимости, главным образом, от организма-хозяина. Для Е. coli рН предпочтительно составляет от 6,8 до 7,4 и более предпочтительно, приблизительно 7,0.
Если в экспрессирующем векторе в соответствии с настоящим изобретением используется индуцибельный промотор, то экспрессия белка индуцируется в условиях, приемлемых для активации данного промотора. В одном аспекте настоящего изобретения для регулирования транскрипции полипептидов используются промоторы PhoA. В соответствии с этим трансформированные клетки-хозяева для индуцирования культивируются в среде с ограниченным содержанием фосфата. Предпочтительно средой с ограниченным содержанием фосфата является среда C.R.A.P. (см., например, Simmons et al., J. Immunol. Methods (2002) 263:133-147). В соответствии с используемым векторным конструктом может быть использован ряд других индукторов, известных в данной области.
В одном варианте осуществления экспрессированные полипептиды в соответствии с настоящим изобретением секретируются в периплазму клеток-хозяев и извлекаются из нее. Извлечение белка обычно включает разрушение микроорганизма, обычно такими средствами как осмотический шок, обработка ультразвуком или лизис. После разрушения клеток клеточные остатки или целые клетки могут быть удалены путем центрифугирования или фильтрации. Далее белки могут быть очищены, например, с помощью хроматографии на аффинной смоле. Альтернативно могут быть перенесены в культуральную среду и выделены из нее. Клетки могут быть извлечены из культуры, а культуральный супернатант фильтруют и концентрируют для дальнейшей очистки полученных белков. Затем экспрессированные полипептиды могут быть выделены и идентифицированы с использованием хорошо известных методов, таких как электрофорез в полиакриламидном геле (PAGE) и Вестерн-блот-анализ.
В одном аспекте настоящего изобретения антитела продуцируют в большом количестве посредством процесса ферментации. Для продуцирования рекомбинантных белков доступны различные крупномасштабные процедуры периодической ферментации с добавлением субстрата. Крупномасштабную ферментацию проводят в ферментерах емкостью по меньшей мере 1000 литров, предпочтительно емкостью от приблизительно 1000 до 100000 литров. Такие ферментеры снабжены лопастной мешалкой для распределения кислорода и питательных компонентов, особенно глюкозы (предпочтительного источника углерода/энергии). Ферментация небольшого масштаба, как правило, относится к ферментации в ферментере рабочей емкостью не более чем приблизительно 100 литров, и может варьировать от приблизительно 1 литра до приблизительно 100 литров.
В процессе ферментации индукция экспрессию белков обычно инициируют после того, как клетки были наращены в приемлемых условиях до желаемой плотности, например, OD 550 приблизительно 180-220, при этом клетки находятся в ранней стационарной фазе. В соответствии с используемым векторным конструктом может быть использован ряд индукторов, известных в данной области и описанных выше. Перед индукцией клетки можно выращивать в течение меньшего периода времени. Клетки обычно индуцируют в течение приблизительно 12-50 часов, хотя время индуцирования может быть увеличено или уменьшено.
Для увеличения выхода продукта и для улучшения качества полипептидов в соответствии с настоящим изобретением различные условия ферментации могут быть модифицированы. Например, для обеспечения надлежащей сборки и сворачивания секретированных полипептидов антител могут быть использованы дополнительные векторы, усиленно экспрессирующие белки-шапероны, такие как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил-цис,транс-изомераза с шаперонной активностью), для совместной трансформации прокариотических клеток-хозяев. Было продемонстрировано, что белки-шапероны облегчают надлежащее сворачивание и растворимость гетерологических белков, продуцируемых в бактериальных клетках-хозяевах (Chen et al. (1999) J. Bio. Chem. 274:19601-19605; Georgiou et al., патент США №6083715; Georgiou et al., патент США №6027888; Bothmann & Pluckthun (2000) J. Biol. Chem. 275:17100-17105; Ramm & Pluckthim (2000) J. Biol. Chem. 275:17106-17113; Arie et al. (2001) Mol. Microbiol. 39:199-210).
Для минимизации протеолиза экспрессируемых гетерологических белков (особенно тех, которые является протеолитически восприимчивыми) в соответствии с настоящим изобретением могут быть использованы некоторые штаммы-хозяева, дефицитные по протеолитическим ферментам. Например, штаммы клеток-хозяев могут быть модифицированы введением генной(ых) мутации(ий) в гены, кодирующие известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их комбинации. Некоторые дефицитные по протеазе штаммы Е. coli являются доступными и описаны, например, в Joly et al. (1998) Proc. Natl. Acad. Sci. USA 95:2773-2777; Georgiou et al., в патенте США №5264365; Georgiou et al., патент США №5508192; Hara et al., Microbial Drug Resistance, 2:63-72 (1996).
В одном варианте осуществления штаммы Е. coli, дефицитные по протеолитическим ферментам и трансформированные плазмидами, усиленно экспрессирующими один или несколько белков-шаперонов, используют в качестве клеток-хозяев в экспрессирующей системе в соответствии с настоящим изобретением.
iii. Очистка антител
Могут быть использованы стандартные методы очистки, известные из уровня техники. Примерами подходящих процедур очистки являются следующие процедуры: фракционирование на иммуноаффинных или ионообменных колонках, осаждение этанолом, обращенно-фазовая HPLC, хроматография на силикагеле или на катионообменной смоле, такой как DEAE, хроматофокусирование, SDS-PAGE, осаждение сульфатом аммония и гель-фильтрация с использованием, например, сефадекса G-75.
В одном аспекте для иммуноаффинной очистки продуктов полноразмерных антител в соответствии с настоящим изобретением используется белок А, иммобилизированный на твердой фазе. Белок А представляет собой 41 кДа белок клеточной стенки Staphylococcus aureus, который с высокой аффинностью связывается с Fc-участком антител (Lindmark et al. (1983), J. Immunol. Meth. 62:1-13). Твердой фазой, на которой иммобилизирован белок А, предпочтительно является колонка со стеклянной или кварцевой поверхностью, более предпочтительно стеклянная колонка с регулируемым размером пор или колонка, содержащая кремниевую кислоту. В некоторых применениях колонка была покрыта реагентам, таким как глицерин, для предотвращения неспецифического присоединения примесей.
На первой стадии очистки препарат, полученный из клеточной культуры, как описано выше, наносят на твердую фазу с иммобилизированным на ней белком А для обеспечения специфического связывания интересующего антитела с белком А. Затем твердую фазу промывают для удаления примесей, неспецифически связавшихся с твердой фазой. Интересующее антитело может быть снято с твердой фазы путем элюирования раствором, содержащим хаотропное средство или мягкое поверхностно-активное вещество. Типичные хаотропные средства и мягкие поверхностно-активные вещества включают без ограничения гуанидин-HCl, мочевину, перхлорат лития, аргинин, гистидин, SDS (додецилсульфат натрия), твин, тритон и NP-40, каждый из которых коммерчески доступен. Разведение антитела в растворе, содержащем хаотропное средство или мягкое поверхностно-активное вещество, после элюирования из колонки (например, из колонки с mAbSure) поддерживает стабильность антитела после элюирования и позволяет добиться эффективного удаления суперспирали эндопептидазой Lys-C.
b. Образование антител с использованием эукариотических клеток-хозяев
Векторные компоненты обычно включают без ограничения одно или несколько из следующих: сигнальная последовательность, точка начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
i. Компонент в виде сигнальной последовательности
Вектор для применения в эукариотической клетке-хозяине может содержать сигнальную последовательность или другой полипептид, содержащий специфический сайт расщепления на N-конце интересующего зрелого белка или полипептида. Выбранной гетерологической сигнальной последовательностью может быть последовательность, которая распознается и процессируется (т.е., отщепляется сигнальной пептидазой) клеткой-хозяином. Для экспрессии в клетках млекопитающих доступны сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, сигнальная последовательность gD вируса простого герпеса. ДНК для такого участка-предшественника лигируют в рамку считывания с ДНК, кодирующей антитело.
ii. Точка начала репликации
Обычно такой компонент, как точка начала репликации не является необходимым для экспрессирующих векторов млекопитающих. Например, обычно может быть использована точка начала репликации SV40, но только потому, что она содержит ранний промотор.
iii. Компонент в виде гена отбора
Экспрессирующий и клонирующий векторы могут содержать ген отбора, также называемый селектируемым маркером. Типичные гены отбора кодируют белки, которые: (а) придают устойчивость к антибиотикам или к другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) служат дополнением при ауксотрофных дефицитах в соответствующих случаях или (с) обеспечивают критически важные питательные компоненты, недоступные из комплексной среды.
В одном из примеров в схеме отбора используется лекарственное средство, прекращающее рост клетки-хозяина. Те клетки, которые успешно трансформируются гетерологическим геном, продуцируют белок, придающий устойчивость к лекарственному средству, и, поэтому, выживают в ходе выполнения протокола отбора. Примерами лекарственных средств, применяемых для такого доминантного отбора, являются неомицин, микофеноловая кислота и гигромицин.
Другим примером приемлемых селектируемых маркеров для клеток млекопитающих являются маркеры, которые позволяют идентифицировать клетки, способные принимать кодирующую антитело нуклеиновую кислоту, такие маркеры, как гены DHFR, тимидинкиназы, металлотионеина-I и -II, предпочтительно гены металлотионеина приматов, аденозиндезаминазы, орнитиндекарбоксилазы и т.д.
Например, клетки, трансформированные селектируемым геном DHFR, сначала идентифицируют путем культивирования всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. Если используют DHFR дикого типа, то подходящей клеткой-хозяином является линия клеток яичника китайского хомяка (СНО), дефицитная по активности DHFR (например, CRL-9069 АТСС).
Альтернативно, клетки-хозяева (в частности, хозяева дикого типа, содержащие эндогенный DHFR), трансформированные или совместно трансформированные последовательностями ДНК, кодирующими антитело, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3'-фосфотрансфераза (АРН), могут быть отобраны путем выращивания клеток в среде, содержащей средство отбора по селектируемому маркеру, такое как аминогликозидный антибиотик, например, канамицин, неомицин или G418. См., например, патент США №4965199.
iv. Компонент промотора
Экспрессирующие и клонирующие векторы обычно содержат промотор, который распознается организмом-хозяином и функционально соединенный к нуклеиновой кислоте, кодирующей полипептид антитела. Известны промоторные последовательности эукариот. Фактически все гены эукариот содержат обогащенный AT участок, локализованный на расстоянии приблизительно 25-30 оснований в 3'-5' направлении от сайта инициации транскрипции. Другой последовательностью, обнаруженной на расстоянии 70-80 оснований в 3'-5' направлении от точки начала транскрипции многих генов, является участок CNCAAT, где N может означать любой нуклеотид. На 3'-конце большинства эукариотических генов имеется последовательность ААТААА, которая может быть сигналом для добавления хвоста poly А к 3'-концу кодирующей последовательности. Все эти последовательности могут быть соответствующим образом вставлены в эукариотические экспрессирующие векторы.
Транскрипция полипептидов антител из векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов вирусов, таких как, например, полиомавирус, вирус оспы кур, аденовирус (такой как аденовирус 2), вирус коровьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В и обезьяний вирус 40 (SV40); гетерологическими промоторами млекопитающих, например, промотором актина или промотором иммуноглобулина, или промоторами теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев.
Ранние и поздние промоторы вируса SV40 удобно получать в виде рестрикционного фрагмента SV40, который также содержит точку начала репликации вируса SV40. Предранний промотор цитомегаловируса человека обычно получается в виде рестрикционного фрагмента HindIII E. Система для экспрессии ДНК в клетках-хозяевах млекопитающих с использованием папилломавируса коров в качестве вектора, раскрыта в патенте США №4419446. Модификация этой системы описана в патенте США №4601978. Альтернативно, в качестве промотора может быть использован длинный концевой повтор вируса саркомы Рауса.
v. Компонент в виде энхансерного элемента
Транскрипция ДНК, кодирующей полипептид антитела у высших эукариот, может быть усилена вставкой энхансерной последовательности в вектор. В настоящее время известно много энхансерных последовательностей из генов млекопитающих (например, генов глобина, эластазы, альбумина, α-фетопротеина и инсулина). Можно также использовать энхансер из вируса эукариотических клеток. Примерами являются энхансер SV40, расположенный на поздней стороне от точки начала репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомы на поздней стороне от точки начала репликации и энхансеры аденовируса. См. также Yaniv, Nature 297: 17-18 (1982), в которой описаны энхансерные элементы для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положении 5' или 3' по отношению к кодирующей пептид последовательности антитела, при условии достижения эффекта, но обычно он расположен в сайте 5' от промотора.
vi. Компонент для терминации транскрипции
Типичные экспрессирующие векторы, используемые в эукариотических клетках-хозяевах, также будут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5'- и иногда 3'-нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним применимым компонентом для терминации транскрипции является участок полиаденилирования бычьего гормона роста. См. WO 94/11026 и описанные в ней экспрессирующие векторы.
vii. Отбор и трансформация клеток-хозяев
Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах в настоящем документе включают клетки высших эукариот, описанные в настоящем документе, включая клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (культуре ткани) стало рутинной процедурой. Примерами применимых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны С VI, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen. Virol. 36:59 (1977)); клетки почки детеныша хомяка (ВНК, ATCC CCL 10); клетки яичника китайского хомяка/.DHFR (СНО, Uriaub et al., Proc. Nail. Acad. Sci. USA 77: 4216 (1980)); мышиные клетки Сертоли (ТМ4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы Buffalo (BRL ЗА, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (HepG2, HB 8065); опухолевые клетки молочной железы мыши (ММТ 060562, ATCC CCL51); клетки TRI (Mather et al., Annal N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4 и клеточная линия человеческой гепатомы (Нер G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для продуцирования антитела и культивируют в обычной питательной среде, соответствующим образом модифицированной для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
viii. Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения антитела по настоящему изобретению, могут быть культивированы в различных средах. Приемлемыми для культивирования клеток-хозяев являются коммерчески доступные среды, такие как среда Хама F10 (Sigma), минимальная поддерживающая среда (MEM) (Sigma), RPMI-1640 (Sigma) и модифицированная Дульбекко среда Игла (DMEM) (Sigma). Кроме того, любая из сред, описанных в Ham et al., Meth. Enz. 58: 44 (1979), Bames et al., Anal. Biochem. 102: 255 (1980), в патентах США №№4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430, WO 87/00195 или в патенте США Re. №30985, может быть использована в качестве культуральной среды для клеток-хозяев. Любая из этих сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия и фосфат кальция и магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCIN™), микроэлементами (определенными как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, которые будут известны специалистам в данной области. Условия культивирования, такие как температура, рН и т.п., представляют собой условия, используемые ранее в случае клеток-хозяев, отобранных для экспрессии, и будут очевидны для специалиста в данной области техники.
ix. Очистка антитела
При использовании рекомбинантных методик антитело может быть продуцировано внутриклеточно или непосредственно секретировано в среду. Если антитело продуцируется внутриклеточно, на первом этапе остатки в виде частиц, либо клетки-хозяева, либо лизированные фрагменты удаляют, например, центрифугированием или ультрафильтрацией. Если антитело секретируется в среду, супернатанты из таких систем экспрессии обычно сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белков, например, ультрафильтрационного устройства Amicon или Millipore Pellicon. На любом из вышеизложенных этапов с целью ингибирования протеолиза может быть добавлен ингибитор протеаз, такой как PMSF, а для предотвращения роста случайных примесных микроорганизмов могут быть добавлены антибиотики.
Композиция антител, полученных из клеток, может быть очищена с использованием, например, хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии, причем аффинная хроматография является предпочтительной методикой очистки. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого домена Fc иммуноглобулина, который присутствует в антителе. Белок А может быть использован для очистки антител, которые основаны на тяжелых цепях γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для у3 человека (Guss et al., EMBO J. 5: 1567-1575 (1986)). Матрицей, с которой связывается аффинный лиганд, наиболее часто является агароза, но имеются и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают возможность более высоких скоростей потока и более коротких периодов обработки, чем могут быть достигнуты в случае агарозы. Если антитело содержит домен СН3, для очистки применима смола Bakerbond АВХ (J.T. Baker, Филлипсбург, Нью-Джерси). В зависимости от извлекаемого антитела для очистки белка также могут быть применены другие методики, такие как фракционирование на ионообменной колонке, преципитация этанолом, обращенно-фазовая HPLC, хроматография на силикагеле, хроматография на гепарин-Sepharose™, хроматография на анионо- или катионообменных смолах (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и преципитация сульфатом аммония.
В одном варианте осуществления интересующее антитело снимают с твердой фазы колонки элюированием раствором, содержащим хаотропное средство или мягкое поверхностно-активное вещество. Типичными примерами хаотропных средств или мягких поверхностно-активных веществ являются без ограничения гуанидин-HCl, мочевина, перхлорат лития, аргинин, гистидин, SDS (додецил сульфат натрия), Твин, Тритон и NP-40, которые являются коммерчески доступными.
После любого(ых) предварительного(ых) этапа(ов) очистки смесь, содержащая интересующее антитело и примеси, может быть подвергнута хроматографии гидрофобных взаимодействий при низких рН с использованием элюирующего буфера с рН приблизительно 2,5-4,5, предпочтительно выполняемой при низких концентрациях солей (например, около 0-0,25 М соли).
х. Продуцирование антител с использованием бакуловирусов
Рекомбинантный бакуловирус может быть создан совместной трансфекцией плазмидой, кодирующей антитело или фрагмент антитела и ДНК вируса BaculoGold™ (Pharmingen), клетки насекомого, такой как клетка Spodoptera frugiperda (например, клетки Sf9; CRL 1711 АТСС) или клетка Drosophila melanogaster S2, с использованием, например, липофектина (коммерчески доступного от GIBCO-BRL). В конкретном примере последовательность антитела является слитой в 3'-5' направлении от эпитопной метки, находящейся в экспрессирующем векторе бакуловируса. Такие эпитопные метки включают poly-His метки. Может быть использован ряд плазмид, в том числе плазмиды, полученные из коммерчески доступных плазмид, таких как pVL1393 (Novagen) или pAcGP67B (Pharmingen). Вкратце, последовательность, кодирующая антитело или его фрагмент может быть амплифицирована с помощью ПЦР с праймерами, комплементарными 5' и 3' участкам. 5'-Праймер может содержать фланкирующие сайты (выбранных) ферментов рестрикции. Затем продукт может быть расщеплен выбранными ферментами рестрикции и субклонирован в экспрессирующий вектор.
После трансфекции экспрессирующим вектором клетки-хозяева (например, клетки Sf9) инкубируют в течение 4-5 суток при 28°С, а высвобожденный вирус собирают и используют для дальнейших амплификации. Инфицирование вирусом и экспрессия белка могут быть выполнены, как описано, например, O'Reilley et al. (Baculovirus expression vectors: A Laboratory Manual. Oxford: Oxford University Press (1994)).
Затем экспрессированное антитело, меченное poly-His, может быть очищено, например, Ni2+-хелатной аффинной хроматографией, как изложено ниже. Экстракты могут быть приготовлены из рекомбинантных клеток Sf9, инфицированных вирусом, как описано Rupert et al. (Nature 362:175-179 (1993)). Вкратце, клетки Sf9 промывают, ресуспендируют в буфере для ультразвуковой обработки (25 мл HEPES, рН 7,9; 12,5 мМ MgCl2; 0,1 мМ EDTA; 10% глицерина; 0,1% NP-40; 0,4 M KC1) и дважды подвергают ультразвуковой обработке в течение 20 секунд на льду. Гомогенаты, полученные из клеток при воздействии ультразвука, осветляют центрифугированием, и супернатанты разводят в 50 раз загрузочным буфером (50 мМ фосфата; 300 мМ NaCl; 10% глицерина, рН 7,8) и фильтруют через фильтр с порами размером 0,45 мкм. Колонку, наполненную Ni2+-NTA агарозой (коммерчески доступной от Qiagen) с объемом слоя 5 мл готовят, промывают 25 мл воды и уравновешивают 25 мл загрузочного буфера. Отфильтрованный клеточный экстракт наносят на колонку со скоростью 0,5 мл в минуту. Колонку промывают загрузочным буфером до начального порога А280; при котором начинают сбор фракций. Далее колонка промывают вторичным буфером для промывания (50 мМ фосфата; 300 мМ NaCl; 10% глицерина, рН 6,0), который неспецифически элюирует связанный белок. После достижения начального порога А280 колонку снова проявляют в градиенте имидазола от 0 до 500 мМ во вторичном буфере для промывания. Один миллилитр фракции собирают и анализируют с помощью SDS-PAGE и окрашивания серебром или Вестерн-блоттинга с Ni2+-NTA, конъюгированным со щелочной фосфатазой (Qiagen). Фракции, содержащие элюированное антитело, меченное His10, объединяют и диализуют против загрузочного буфера.
Альтернативно, очистка антитела может быть выполнена с использованием известных хроматографических методик, включая, например, колоночную хроматографию с белком А или белком G. Интересующее антитело может быть снято с твердой фазы колонки элюированием раствором, содержащим хаотропное средство или мягкое поверхностно-активное вещество. Типичные хаотропные средства и мягкие поверхностно-активные вещества включают без ограничения гуанидин-HCl, мочевину, перхлорат лития, аргинин, гистидин, SDS (додецил сульфат натрия), твин, тритон и NP-40.
с. Оптимизированная методика очистки
Ниже показан один конкретный подход к очистке, который может быть использован для антител, содержащих суперспираль.

Кроме аргинина, в вышеописанном протоколе после начального этапа на колонке с белком А могут быть использованы другие хаотропные средства или мягкие поверхностно-активные вещества, которые включают без ограничения гуанидин-HCl, мочевину, перхлорат лития, гистидин, SDS (додецил сульфат натрия), твин, тритон и NP-40, каждое из которых является коммерчески доступными. Разведение антитела в растворе, содержащем хаотропное средство или мягкое поверхностно-активное вещество, после элюирования из колонки, содержащей белок А (например, колонки с mAbSure), на начальном этапе поддерживает стабильность антитела после элюирования и позволяет добиться эффективного удаления суперспирали с помощью эндопептидазы Lys-C.
IV. Конъюгированные белки
Настоящее изобретение также относится к конъюгированным белкам, таким как конъюгированные антитела или иммуноконъюгаты (например, «конъюгаты антитело-лекарственное средство» или «ADC»), содержащим любое из описанных в настоящем документе антител (например, антитело, содержащее суперспираль, привязанное антитело или антитело, полученное в соответствии с описанными в настоящем документе способами), в которых один из константных участков легкой цепи или тяжелой цепи конъюгирован с молекулой химического соединения, такого как краситель или цитотоксическое средство, например, химиотерапевтическое средство, лекарственное средство, средство ингибирования роста, токсин (например, ферментативно активный токсин бактериального, грибного, растительного или животного происхождения или их фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат). В частности, как описано в настоящем документе, применение доменов с суперспиралью дает возможность конструирования антител, содержащих две различные тяжелые цепи (НС1 и НС2), а также две различные легкие цепи (LC1 и LC2). Иммуноконъюгат, сконструированный с использованием способов, описанных в настоящем документе, может содержать цитотоксическое средство, конъюгированное с константным участком только одной из тяжелых цепей (НС1 или НС2) или только одной из легких цепей (LC1 или LC2). Также вследствие того, что иммуноконъюгат может содержать цитотоксическое средство, прикрепленное только к одной тяжелой или легкой цепи, количество цитотоксического средства, вводимое субъекту, снижается по сравнению с введением антитела, содержащего цитотоксическое средство, прикрепленное к обеим тяжелым или легким цепям. Снижение количества цитотоксического средства, вводимого субъекту, ограничивает нежелательные побочные явления, связанные с цитотоксическим средством.
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических средств, т.е., лекарственных средств, для уничтожения или ингибирования опухолевых клеток, при лечении злокачественных опухолей (Syrigos and Epenetos, Anticancer Research 19:605-614 (1999); Niculescu-Duvaz and Springer, Adv. Drg. Del. Rev. 26:151-172 (1997); патент США №4975278) делает возможной целевую доставку части лекарственного средства к опухолям и его внутриклеточное накопление, где систематическое введение таких неконъюгированных лекарственных средств может привести к неприемлемым уровням токсичности для нормальных клеток, как и для опухолевых клеток, которые необходимо элиминировать (Baldwin et al. Lancet (Mar. 15, 1986):603-605 (1986); Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," in Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (ed.s), pp.475-506). Таким образом, необходима максимальная эффективность при минимальной токсичности. Имеются сообщения о том, что и поликлональные антитела, и моноклональные антитела применимы для таких стратегий (Rowland et al., Cancer Immunol. Immunother. 21:183-187 (1986)). Лекарственные средства, используемые в этих способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986) supra). Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, токсины растений, такие как рицин, низкомолекулярные токсины, такие как гельданамицин (Mandler et al., Jour. of the Nat. Cancer Inst. 92(19):1573-1581 (2000); Mandler et al., Bioorganic & Med. Chem. Letters 10:1025-1028 (2000); Mandler et al., Bioconjugate Chem. 13:786-791 (2002)), майтанзиноиды (европейский патент №1391213; Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996)) и калихеамицин (Lode et al.. Cancer Res. 58:2928 (1998); Hinman et al., Cancer Res. 53:3336-3342 (1993)). Механизмы цитотоксического и цитостатического действия токсинов могут включать связывание с тубулинами, связывание с ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства обычно бывают неактивными или менее активными при конъюгировании с большими антителами или лигандами белковых рецепторов.
В настоящем документе (например, выше) описаны химиотерапевтические средства, используемые в создании иммуноконъюгатов. Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают цепь А дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosd), цепь А рицина, цепь А абрина, цепь А модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, WO 93/21232, опубликованную 28 октября 1993 г. Для получения радиоконъюгированных антител доступен ряд радионуклеидов. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антитела и цитотоксического средства получаются с использованием ряда средств, связывающих бифункциональные белки, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидо соединения (такие как бис-(п-азидобензоил)гександиамин), бис-диазониевые производные (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен, как описано Vitetta et al. Science 238: 1098 (1987). Примером хелатирующего средства для конъюгирования радионуклеотида с антителом, является меченная углеродом-14 1-изотиоцианатобензил-3 -метилдиэтилентриаминпентауксусная кислота (MX-DTPA). См., например, WO 94/11026.
Также в настоящем документе рассмотрены конъюгаты антитела с одним или несколькими низкомолекулярными токсинами, такими как калихеамицин, майтанзиноиды, доластатины, ауростатины, трикотецен и СС1065 и их производными, характеризующимися токсической активностью.
i. Майтанзин и майтанзиноиды
В некоторых вариантах осуществления иммуноконъюгат содержит антитело (полноразмерное или фрагменты) в соответствии с настоящим изобретением, конъюгированное с одной или несколькими майтанзиноидными молекулами.
Майтанзиноиды представляют собой ингибиторы митоза, действие которых заключается в ингибировании полимеризации тубулина. Майтанзин впервые был выделен из восточноафриканского кустарника Maytenus serrata (патент США №3896111). Впоследствии было обнаружено, что некоторые микробы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры майтанзинола С-3 (патент США №4151042). Синтетический майтанзинол и его производные и аналоги раскрыты, например, в патентах США №№4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Части майтанзиноидных лекарственных средств являются привлекательными частями лекарственных средств в составе конъюгатов антитела с лекарственным средством, поскольку они i) относительно легко получаются путем ферментации или химической модификации, дериватизации продуктов ферментации; ii) легко поддаются дериватизации функциональными группами, приемлемыми для конъюгирования с помощью недисульфидных линкеров с антителами; ш) стабильны в плазме и iv) эффективны по отношению к ряду линий опухолевых клеток.
Иммуноконъюгаты, содержащие майтанзиноиды, способы их производства и их терапевтическое применение описаны, например, в патентах США №№5208020, 5416064 и в европейском патенте №0425235 В1, раскрытие которых тем самым явно включено посредством ссылки. В Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996), описаны иммуноконъюгаты, содержащие майтанзиноид, обозначенный DM1, связанный с моноклональным антителом С242, направленным непосредственно на колоректальную злокачественную опухоль человека. Было обнаружено, что этот конъюгат высоко цитотоксичен по отношению к клеткам злокачественной опухоли ободочной кишки в культуре и проявляет противоопухолевую активность в анализе роста опухоли in vivo. В Chari et al., Cancer Research 52:127-131 (1992) описаны иммуноконъюгаты, в которых майтанзиноид был конъюгирован через дисульфидный линкер с антителом А7 мыши, связывающимся с антигеном в линиях клеток злокачественной опухоли ободочной кишки человека, или с другим моноклональным антителом ТА.1 мыши, которое связывает онкоген HER-2/neu. Цитотоксичность конъюгата ТА.1-майтанзиноид была проанализирована in vitro на линии клеток злокачественной опухоли молочной железы человека SK-BR-3, которая экспрессирует 3×105 поверхностных антигенов HER-2 на клетку. Конъюгат лекарственного средства достигал степени цитотоксичности, близкой к цитотоксичности свободного майтанзиноидного лекарственного средства, которая может быть повышена путем увеличения числа молекул майтанзиноида на молекулу антитела. Конъюгат А7-майтанзиноид показал низкую системную цитотоксичность у мышей.
Конъюгаты антитело-майтанзиноид получаются путем химического связывания антитела с молекулой майтанзиноида без значительной потери биологической активности и антитела, и матанзиноида. См., например, патент США №5208020 (раскрытие которого тем самым включено посредством ссылки). В среднем 3-4 молекулы майтанзиноида, конъюгированные с молекулой антитела, показали эффективность в повышении цитотоксичности по отношению к клеткам-мишеням без негативного влияния на функцию или растворимость антитела, хотя предполагается, что даже одна молекула токсина на антитело увеличит цитотоксичность по сравнению с применением свободного антитела. Майтанзиноиды хорошо известны в данной области и могут быть синтезированы по известным методикам или выделены из природных источников. Подходящие майтанзиноиды описаны, например, в патенте США №5208020 и в других патентах и непатентных публикациях, процитированных выше. Предпочтительными майтанзиноидами являются майтанзинол и аналоги майтанзинола, модифицированные по ароматическому кольцу или в других положениях молекулы майтанзинола, такие как различные сложные эфиры майтанзинола.
Из уровня техники известно много линкерных групп для создания конъюгатов антитело-майтанзиноид, включая, например, те, которые описаны в патенте США №5208020 или в европейском патенте №0425235 Bl, Chari et al., Cancer Research 52:127-131 (1992), и в публикации патентной заявки США №2005/0169933, раскрытия которых тем самым включены посредством ссылки. Конъюгаты антитело-майтанзиноид, содержащие линкерный компонент SMCC могут быть получены, как раскрыто в публикации патентной заявки США №2005/0169933. Линкерные группы включают дисульфидные группы, тиоэфирные группы, чувствительные к кислоте группы, фоточувствительные группы, чувствительные к пептидазам группы или чувствительные к эстеразам группы, такие как раскрытые в вышеуказанных патентах, предпочтительными являются дисульфидные и тиоэфирные группы. Дополнительные линкерные группы раскрыты и проиллюстрированы в настоящем документе.
Конъюгаты антитела и майтанзиноида могут быть получены с помощью ряда средств, связывающих бифункциональные белки, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (таких как диметиладипимидат НСl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительные связывающие средства для обеспечения дисульфидной связи включают М-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP) (Carisson et al., Biochem. J. 173:723-737 (1978)) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP).
Линкер может быть прикреплен к молекуле майтанзиноида в разных положениях в зависимости от типа связи. Например, сложноэфирная связь может быть образована путем взаимодействия с гидроксильной группой с использованием традиционных методик связывания. Реакция может осуществляться в положении С-3, характеризующемся гидроксильной группой, в положении С-14, модифицированном гидроксиметилом, в положении С-15, модифицированном гидроксильной группой, и в положении С-20, характеризующемся гидроксильной группой. В предпочтительном варианте осуществления связь образуется в положении С-3 майтанзинола или аналога майтанзинола.
ii. Ауристатины и доластатины
В некоторых вариантах осуществления иммуноконъюгат содержит антитело в соответствии с настоящим изобретением, конъюгированное с доластатинами или пептидными аналогами доластатина и его производными, ауристатинами. (патенты США №№5635483 и 5780588). Было показано, что доластатины и ауристатины влияют на динамику микротрубочек, гидролиз ГТФ и деление ядер и клеток (Woyke et al., Antimicrob. Agents and Chemother. 45(12):3580-3584 (2001)) и обладают противораковой (патент США №5663149) и противогрибковой активностью (Pettit et al., Antimicrob. Agents Chemother. 42:2961-2965 (1998)). Часть доластатинового или ауристатинового лекарственного средства может быть прикреплена к антителу на N-(амино)конце или С-(карбокси)конце части пептидного лекарственного средства (WO 02/088172).
Типичные варианты осуществления с ауристатином представляют связанные N-концом части монометилауристатинового лекарственного средства DE и DF, раскрытые в публикации патентной заявки США №2005/0238649 «Монометилвалиновые соединения, способные к конъюгированию с лигандами», раскрытие которой тем самым включено посредством ссылки.
Как правило, части лекарственного средства, основанные на пептидах, могут быть получены формированием пептидной связи между двумя и более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии с методом жидкофазного синтеза (см. Е.Schröder and K.Lübke, «The Peptides,» volume 1, pp.76-136, 1965, Academic Press), который хорошо известен в области химии пептидов. Части ауристатинового/доластатинового лекарственного средства могут быть получены в соответствии со следующим методами: патенты США №№5635483 и 5780588; Pettit et al., J. Nat. Prod. 44:482-485 (1981); Pettit et al., Anti-Cancer Drug Design 13:47-66 (1998); Poncet, Curr. Pharm. Des. 5:139-162 (1999); и Pettit, Fortschr. Chem. Org. Naturst. 70:1-79 (1997). См. также Doronina, Nat. Biotechnol. 21(7):778-784 (2003); и публикацию патентной заявки США №2005/0238649 «Монометилвалиновые соединения, способные к конъюгированию с лигандами», тем самым включенные посредством ссылки во всей своей полноте (описывающие, например, линкеры и способы получения монометилвалиновых соединений, таких как ММАЕ и MMAF, конъюгированных с линкерами).
iii. Калихеамицин
В других вариантах осуществления иммуноконъюгат содержит антитело в соответствии с настоящим изобретением, конъюгированное с одной или несколькими молекулами калихеамицина. Калихеамициновое семейство антибиотиков в субпикомолярных концентрациях способно приводить к образованию разрывов двухцепочечной ДНК. Описание получения конъюгатов калихеамицинового семейства см. в патентах США №№5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296 (все принадлежат American Cyanamid Company). Структурные аналоги калихеамицина, которые могут быть использованы, включают без ограничения γ1 I, α2 I, α3 I, N-ацетил-γ1 I, PSAG и θI 1 (Hinman et al.. Cancer Research 53: 3336-3342 (1993), Lode et al., Cancer Research 58: 2925-2928 (1998) и вышеупомянутые патенты США, принадлежащие American Cyanamid). Другим противоопухолевым лекарственным средством, с которым может быть конъюгировано антитело, является QFA, который является антифолатом. Как калихеамицин, так и QFA содержат внутриклеточные сайты действия и с трудом проходят через плазматическую мембрану. Поэтому поглощение клетками указанных средств посредством опосредованной антителами интернализации значительно усиливает их цитотоксические действия.
iv. Другие цитотоксические средства
Другие противоопухолевые средства, которые могут быть конъюгированными с антителами по настоящему изобретению или созданными в соответствии со способами, описанными в настоящем документе, включают BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство средств, известных под общим названием комплекс LL-Е33288, описанный в патентах США №№5053394 и 5770710, а также эсперамицины (патент США №5877296).
Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают дифтерийную А-цепь, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модекцина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytoiacca americana (PAPI, PAPII и PAP-S), ингибитора индийского огурца (Momordica charantia), курцина, кротина, ингибитор Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецины (см., например, WO 93/21232, опубликованную 28 октября 1993 г.).
Настоящее изобретение также относится к иммуноконъюгату, образованному между антителом и соединением с нуклеолитической активностью (например, рибонуклеаза или ДНК-эндонуклеаза, такая как дезоксирибонуклеаза, ДНКаза).
Для селективной деструкции опухоли антитело может содержать высокорадиоактивный атом. Для продуцирования радиоконъюгированных антител доступны разнообразные радиоактивные изотопы. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Если конъюгат используется для выявления, он может содержать радиоактивный атом для сцинтиграфических исследований, например, tc99m или I123, или спиновую метку для ядерного магнитно-резонансного (ЯМР) изображения (также известного как магнитно-резонансная томография, МРТ), такую как, опять же, йод-123, йод-131, иридий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоизотопные или другие метки могут быть введены в конъюгаты известными путями. Например, пептид может быть биосинтезирован или может быть синтезирован с помощью химического аминокислотного синтеза с использованием приемлемых аминокислотных предшественников, например, фтор-19 вместо водорода. Такие метки как Tc99m или I123, Re186, Re188 и In111 могут быть прикреплены к пептиду через цистеиновый остаток. Иттрий-90 может быть прикреплен через лизиновый остаток. Способ IODOGEN (Fraker et al., Biochem. Biophys. Res. Commun. 80:49-57 (1978)) может быть использован для включения йода-123. В «Monoclonal Antibodies in Immunoscintigraphy» (Chatal, CRC Press 1989) подробно описаны и другие способы.
Конъюгаты антитела и цитотоксического средства могут быть получены с использованием ряда бифункциональных связывающих белок средств, таких как, N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(Н-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипиминат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис (п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен, как описано в Vitetta et al., Science 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является типичным хелатирующим средством для конъюгации радионуклеотида с антителом. См., например, WO 94/11026. Линкер может быть «расщепляемым линкером», способствующим высвобождению цитотоксического лекарственного средства в клетке. Например, могут быть использованы кислотно-нестабильный линкер, чувствительный к пептидазе линкер, фотонестабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari et al., Cancer Research 52:127-131 (1992); патент США №5208020).
Соединения в соответствии с настоящим изобретением специально предполагают без ограничения ADC, полученный с кросс-линкерными реагентами: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, от Pierce Biotechnology, Inc., Рокфорд, Иллинойс, США). См. стр.467-498,2003-2004 Applications Handbook and Catalog.
v. Получение коньюгированных антител
В конъюгированных антителах в соответствии с настоящим изобретением антитело конъюгируют с одним или несколькими частями (например, частями лекарственного средства), например, от около 1 до около 20 частей на антитело, необязательно через линкер. Конъюгированные антитела могут быть получены несколькими путями с использованием реакций органической химии, условий и реагентов, известных специалистам в данной области техники, в том числе (1) реакция нуклеофильной группы антитела с двухвалентным линкерным реагентом через ковалентную связь с последующей реакцией с интересующей частью и (2) реакция нуклеофильной группы части с двухвалентным линкерным реагентом через ковалентную связь с последующей реакцией с нуклеофильной группой антитела. В настоящем документе описаны дополнительные способы получения конъюгированных антител.
Линкерный реагент может быть составлен из одного или нескольких линкерных компонентов. Типичные линкерные компоненты включают 6-малеимидокапроил («МС»), малеимидопропаноил («МР»), валин-цитруллин («val-cit»), аланин-фенилаланин («ala-phe»), п-аминобензилоксикарбонил («РАВ»), N-сукцинимидил-4-(2-пуридилтио)пентаноат («SPP»), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат («SMCC') и N-сукцинимидил-(4-йодацетил)аминобензоат («SIAB»). В данной области известны и другие линкерные компоненты, а некоторые из них описаны в настоящем документе. См. также публикацию заявки на патент США №2005/0238649 «Монометилвалиновые соединения, способные конъюгировать с лигандами», содержание которой тем самым включено в настоящий документ в полном ее объеме.
В некоторых вариантах осуществления линкер может содержать аминокислотные остатки. Типичные аминокислотные линкерные компоненты включают дипептид, трипептид, тетрапептид или пентапептид. Типичные дипептиды включают валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Типичные трипептиды включают глицин-валин-цитрулин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, которые содержит аминокислотный линкерный компонент, включают как встречающиеся в природе, так и минорные аминокислоты и аналоги аминокислот неприродного происхождения, такие как цитруллин. Аминокислотные линкерные компоненты могут быть разработаны и оптимизированы в своей селективности для ферментативного расщепления конкретными ферментами, например, ассоциированная с опухолью протеаза, катепсин В, С и D или протеаза плазмин.
Нуклеофильные группы антител включают без ограничения: (i) N-концевые аминные группы, (ii) аминные группы боковых цепей, например, лизин, (iii) тиольные группы боковых цепей, например, цистеин, и (iv) гидроксильные или аминогруппы Сахаров, где антитело является гликозилированным. Аминные, тиольные и гидроксильные группы являются нуклеофильными и способны взаимодействовать с образованием ковалентных связей с электрофильными группами на линкерных частях и линкерных реагентах, включающих: (i) активные сложные эфиры, такие как NHS сложные эфиры, HOBt сложные эфиры, галогенформиаты и галогенангидриды; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы. Определенные антитела содержат восстанавливаемые межцепочечные дисульфиды, т.е. цистеиновые мостики. Антитела могут быть активированы для конъюгации с линкерными реагентами путем обработки восстановителем, таким как DTT (дитиотреитол). Каждый цистеиновый мостик, таким образом, будет образовать теоретически два химически активных тиольных нуклеофила. Дополнительные нуклеофильные группы могут быть введены в антитела посредством реакции лизинов с 2-иминотиоланом (реактив Траута), приводящей к превращению амина в тиол. Реактивные тиольные группы могут быть введены в антитело (или его фрагмент) путем введения одного, двух, трех, четырех или более цистеиновых остатков (например, получение мутантных антител, содержащих один или несколько ненативных цистеиновых аминокислотных остатков).
Конъюгированные антитела в соответствии с настоящим изобретением также могут быть получены путем модификации антитела с введением электрофильных частей, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или части лекарственного средства или другой части. Сахара гликозилированных антител могут быть окислены, например, перйодатными окислительными реагентами, с образованием альдегидных или кетоновых групп, которые могут реагировать с аминогруппой линкерных реагентов или частями лекарственного средства или другими частями. Полученные иминогруппы основания Шиффа могут образовывать стабильные связи, или могут быть восстановлены, например, боргидридными реагентами с образованием стабильных аминных связей. В одном варианте осуществления реакция углеводной части гликозилированного антитела либо с галактоза-оксидазой, либо с мета-перйодатом натрия может приводить к образованию карбонильных (альдегидных и кетоновых) групп в белке, который может реагировать с соответствующими группами на части лекарственного средства или другой части (Hermanson, Bioconjugate Techniques). В другом варианте осуществления белки, содержащие N-концевые сериновые или треониновые остатки, могут реагировать с мета-перйодатом натрия, приводя к образованию альдегида вместо первой аминокислоты (Geoghegan and Stroh, Bioconjugate Chem, Bioconjugate Chem. 3:138-146 (1992), патент США №5362852). Такой альдегид может быть подвергнут реакции с частью лекарственного средства или нуклеофилом линкера.
Подобным образом, нуклеофильные группы на части (такой как часть лекарственного средства) включают без ограничения аминные, тиольные, гидроксильные, гидразидные, оксимные, гидразиновые, тиосемикарбазонные, гидразинкарбоксилатные и арилгидразидные группы, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных частях и линкерных реагентах, включающих: (i) активные сложные эфиры, такие как NHS сложные эфиры, HOBt сложные эфиры, галогенформиаты и галогенангидриды, (ii) алкил- и бензилгалогениды, такие как галогенацетамиды, и (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
В качестве альтернативы, слитый белок, включающий антитело и цитотоксическое средство, может быть создан, например, с помощью рекомбинантных методик или путем пептидного синтеза. По своей длине ДНК может включать соответствующие участки, кодирующие две части конъюгата, либо смежные друг с другом, либо разделенные участком, кодирующим линкерный пептид, который не нарушает желаемые свойства конъюгата. В еще одном варианте осуществления антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) для применения в предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводится индивидууму с последующим удалением несвязанного конъюгата из кровотока с использованием удаляющего средства, а затем вводится «лиганд» (например, авидин), который конъюгируется с цитотоксическим средством (например, радионуклеотидом).
V. Терапевтические применения
Белковые комплексы, такие как антитела и фрагменты антител, описанные в настоящем документе (например, антитела, содержащие суперспираль, привязанные антитела или антитела, полученные в соответствии со способами, описанными в настоящем документе), могут быть использованы для терапевтических применений. Например, такие антитела и фрагменты антител могут быть использованы для лечения опухолей, в том числе предраковых, неметастатических, метастатических и злокачественных опухолей (например, злокачественной опухоли ранней стадии), для лечения аллергических и воспалительных заболеваний, для лечения аутоиммунных заболеваний или для лечения субъектов с риском развития злокачественной опухоли (например, злокачественной опухоли молочной железы, колоректальной злокачественной опухоли, злокачественной опухоли легкого, почечно-клеточной карциномы, глиомы или злокачественной опухоли яичника), аллергических и воспалительных нарушений или аутоиммунных заболеваний.
Термин «злокачественная опухоль» включает группу пролиферативных нарушений, в том числе без ограничения предраковые новообразования, доброкачественные опухоли и злокачественные образования. Доброкачественные опухоли остаются локализованными на месте происхождения и не обладают способностью к инфильтрации, проникновению или метастазированию в отдаленные участки. Злокачественные образования будут проникать и повреждать другие ткани вокруг себя. Они также обладают способностью отрываться от места, где они появились, и распространяться на другие части организма (метастазировать), как правило, через кровяное русло или через лимфатическую систему, где расположены лимфатические узлы. Первичные опухоли классифицируются по типу ткани, в которой они возникают, метастатические опухоли классифицируются по типу ткани, из которой раковые клетки произошли. Со временем клетки злокачественного образования становятся более аномальными и все меньше напоминают нормальные клетки. Такое изменение внешнего вида раковых клеток называется дифференцировкой опухоли, и раковые клетки описываются как хорошо дифференцированные, умеренно дифференцированные, плохо дифференцированы или недифференцированные. Хорошо дифференцированные клетки являются вполне нормальными по виду и напоминают нормальные клетки, из которых они возникли. Недифференцированные клетки являются клетками, которые стали настолько аномальными, что уже не представляется возможным определить происхождение клеток.
Опухоль может быть солидной опухолью или опухолью нетвердых или мягких тканей. Примеры опухолей мягких тканей включают лейкоз (например, хронический миелогенный лейкоз, острый миелогенный лейкоз, острый лимфобластный лейкоз у взрослых, острый миелогенный лейкоз, острый лимфобластный лейкоз из зрелых В-клеток, хронический лимфоцитарный лейкоз, пролимфоцитарный лейкоз или волосатоклеточный лейкоз) или лимфому (например, неходжкинскую лимфому, кожную Т-клеточную лимфому или болезнь Ходжкина). Солидная опухоль включает любую злокачественную опухоль тканей организма, кроме крови, костного мозга или лимфатической системы. Солидные опухоли могут быть далее разделены на происходящие из эпителиальных клеток и происходящие из неэпителиальных клеток. Примеры эпителиально-клеточных солидных опухолей включают опухоли желудочно-кишечного тракта, толстой кишки, молочной железы, предстательной железы, легкого, почки, печени, поджелудочной железы, яичника, головы и шеи, ротовой полости, желудка, двенадцатиперстной кишки, тонкого кишечника, толстого кишечника, анального отверстия, желчного пузыря, губы, носоглотки, кожи, матки, мужских половых органов, мочевыделительных органов, мочевого пузыря и кожи. Солидные опухоли неэпителиального происхождения включают саркомы, опухоли головного мозга и костные опухоли.
Эпителиальные злокачественные опухоли обычно развиваются из доброкачественных опухолей до преинвазивной стадии (например, карциномы in situ), в злокачественную опухоль, которая проникла через базальную мембрану и распространилась в субэпителиальную строму.
Мультиспецифические белковые комплексы также могут быть использованы в этих терапевтических применениях, и антитела, которые связывают HER2, могут быть использованы, в частности, для лечения злокачественной опухоли молочной железы, колоректальной злокачественной опухоли, злокачественной опухоли легкого, почечноклеточной карциномы, глиомы или злокачественной опухоли яичника.
Другие субъекты, которые являются кандидатами на получение композиций по настоящему изобретению, имеют или находятся под угрозой развития патологической пролиферации фиброваскулярной ткани, розовых угрей, синдрома приобретенного иммунодефицита, закупорки артерий, атопического кератита, бактериальных язв, болезни Бехчета, опухолей крови, обструктивного заболевания сонной артерии, хороидальной неоваскуляризации, хронического воспаления, хронического отслоения сетчатки, хронического увеита, хронического витреита, нарушения при длительном ношении контактных линз, отторжения трансплантата роговицы, неоваскуляризации роговицы, неоваскуляризации трансплантата роговицы, болезни Крона, болезни Илса, эпидемического кератоконъюктивита, грибковых язв, инфекций простого герпеса, инфекций опоясывающего лишая, синдромов повышенной вязкости, саркомы Калоши, лейкоза, липидной дегенерации, болезни Лайма, маргинального кератолизиса, язвы Мурена, микобактериальных инфекции, отличных от проказы, миопии, неоваскулярного заболевания глаз, врожденных ямок в диске зрительного нерва, синдрома Ослера-Вебера (Ослера-Вебера-Ренду), остеоартрита, болезни Педжета, pars planitis, пемфигоида, фликтенулезного кератита, полиартериита, осложнений после применения лазера, протозойных инфекций, эластической псевдоксантомы, птеригия и сухого кератита, радиальной кератотомии, ретинальной неоваскуляризации, ретинопатии недоношенных, ретролентальной фиброплации, саркоида, склерита, серповидноклеточной анемии, синдрома Шегрена, солидных опухолей, болезни Старгарта, болезни Стивенса-Джонсона, верхнего лимбального кератоконъюнктивита, сифилиса, системной волчанки, краевой дегенерации Террьена, токсоплазмоза, саркомы Юинга, нейробластомы, остеосаркомы, ретинобластомы, рабдомиосаркомы, язвенного колита, окклюзии вен, дефицита витамина А, саркоидоза Вегенера, связанного с диабетом нежелательного ангиогенеза, паразитарных заболеваний, нарушения заживления ран, послеоперационной гипертрофии, повреждения или травмы (например, острого повреждения легкого/ARDS), задержки роста волос, торможения овуляции и формирования желтого тела, задержки имплантации и задержки развития эмбриона в матке.
Примеры аллергических или воспалительных нарушений или аутоиммунных заболеваний или нарушений, которые могут подлежать лечению с использованием содержащего суперспираль антитела, привязанного антитела или антитела, полученного в соответствии со способами, описанными в настоящем документе, включают без ограничения артрит (ревматоидный артрит, такой как острый артрит, хронический ревматоидный артрит, подагрический артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит, артрит позвоночника и ювенильный ревматоидный артрит, остеоартрит, прогрессирующий хронический артрит, деформирующий артрит, первичный хронический полиартрит, реактивный артрит и анкилозирующий спондилит), воспалительные гиперпролиферативные кожные заболевания, псориаз, такой как бляшечный псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей, дерматит, включающий контактный дерматит, хронический контактный дерматит, аллергической дерматит, аллергической контактный дерматит, герпетиформный дерматит и атопический дерматит, Х-связанный гипер-IgM синдром, крапивница, такая как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, включающая хроническую аутоиммунную крапивницу, полимиозит/дерматомиозит, ювенильный дерматомиозит, токсический эпидермальный некролиз, склеродерма (включающая системную склеродерму), склероз, такой как системный склероз, рассеянный склероз (MS, такой как оптикоспинальный MS, первичный прогрессирующий MS (PPMS) и рецидивино-ремиттирующий MS (RRMS), прогрессивный системный склероз, атеросклероз, артериосклероз, диссеминированный склероз и атаксический склероз, воспалительное заболевание кишечника (IBD) (например, болезнь Крона, аутоиммуно опосредуемые желудочно-кишечные заболевания, колит, такой как язвенный колит, colitis ulcerosa, микроскопический колит, коллагенозный колит, полипозный колит, некротизирующий энтероколит, трансмуральный колит и аутоиммунное воспалительное заболевание кишечника), гангренозная пиодермия, узловая эритема, первичный склерозирующий холангит, эписклерит), дыхательный дистресс-синдром, включающий дыхательный дистресс-синдром взрослых или острый дыхательный дистресс-синдром (ARDS), менингит, воспаление всей или части сосудистой оболочки глазного яблока, воспаление радужной оболочки глаза, хориоидит, аутоиммунное гематологические нарушение, ревматоидный спондилит, внезапная потеря слуха, IgE-опосредуемые заболевания, такие как анафилаксия, аллергический и атопический ринит, энцефалит, такой как энцефалит Расмуссена, лимбический и/или энцефалит мозгового ствола, увеит, такой как, передний увеит, острый передний увеит, грануломатозный увеит, негрануломатозный увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (GN) с нефротического синдрома и без такового, такой как хронический или острый гломерулонефрит, например, первичный GN, иммуно-опосредованный GN, мембранный GN (мембранная нефропатия), идиопатический мембранный GN или идиопатическая мембранная нефропатия, мембрано- или мембранный пролиферативный GN (MPGN), включающий тип I и тип II, и быстро прогрессирующий GN, аллергические состояния, аллергическая реакция, экзема, включающая аллергическую или атопическую экзему, астма, такая как asthma bronchiale, бронхиальная астма и аутоиммунная астма, состояния, включающие инфильтрацию Т-клеток и хронические воспалительные ответы, хроническое легочное воспалительное заболевание, аутоиммунный миокардит, нарушение адгезии лейкоцитов, системная эритематозная волчанка (SLE), или системная красная волчанка, такая как кожная SLE, подострая кожная эритематозная волчанка, синдром неонатальной волчанки (NLE), диссеминированная красная волчанка, волчанка (включающая нефрит, энцефалит, педиатрическую, непочечную, надпочечную, дискоидную, аллопецию), ювенильный (тип I) сахарный диабет, включающий детский инсулин-зависимый сахарный диабет (IDDM), сахарный диабет взрослых (диабет типа II), аутоиммунный диабет, идиопатический несахарный диабет, иммунные ответы, связанные с острой и замедленной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, туберкулез, саркоидоз, гранулематоз, включающий лимфоматозный гранулематоз, гранулематоз Вегенера, агранулоцитоз, васкулит, включающий воспаление сосудов (включающее воспаление крупных сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит (Такаясу), воспаление средних сосудов (включая болезнь Кавасаки и узелковый полиартериит), микроскопический полиартериит, воспаление сосудов центральной нервной системы, некротический, кожный или гиперчувствительный васкулит, системный некротический васкулит и ассоциированный с ANCA васкулит, такой как васкулит или синдром Черджа-Стросса (CSS)), темпоральный артериит, апластическая анемия, аутоиммунная апластическая анемия, анемия с положительной реакцией Кумбса, анемия Даймонда-Блэкфена, гемолитическая анемия или иммунная гемолитическая анемия, включающая аутоиммунную гемолитическую анемию (AIHA), злокачественная анемия (пернициозная анемия), болезнь Аддисона, истинная эритроцитарная анемия или аплазия (PRCA), дефицит фактора VIII, гемофилия А, аутоиммунная нейтропения, панцитопения, лейкопения, заболевания, включающие лейкоцитарный диапедез, воспалительные нарушения центральной нервной системы, синдром повреждения нескольких органов, такой как вторичный в результате септицемии, травмы или кровоизлияния, заболевания, опосредованные комплексом антиген-антитело, заболевание антигломерулярной базальной мембраны, синдром антифосфолипидного антитела, аллергический неврит, болезнь Бехчета, синдром Кастельмана, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, пемфигоид, такой как буллезный пемфигоид и кожный пемфигоид, пузырчатка (включающая обыкновенную пузырчатку, эксфолиативную пузырчатку, пузырчаткоподобный пемфигоид слизистой мембраны и эритематозную пузырчатку), аутоиммунные полиэндокринопатии, болезнь или синдром Рейтера, нефрит иммунных комплексов, опосредуемый антителом нефрит, оптиконейромиелит, полинейропатии, хроническая нейропатия, такая как полинейропатия IgM или IgM-опосредуемая нейропатия, тромбоцитопения (развивающаяся у больных инфарктом миокарда, например), включающая тромботическую тромбоцитопеническую пурпуру (ТТР) и аутоиммунную или иммуноопосредованную тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ITP), включающая хроническую или острую ITP, аутоиммунное заболевание яичка и яичника, включающее аутоиммунный орхит и оофорит, первичный гипотиреоз, гипопаратиреоз, аутоиммунные эндокринные заболевания, включающие тиреоидит, такой как аутоиммунный тиреоидит, болезнь Хашимото, хронический тиреоидит (тиреоидит Хашимото) или подострый тиреоидит, аутоиммунное заболевание щитовидной железы, идиопатический гипотиреоз, болезнь Грейвса, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или синдромы полигландулярной эндокринопатии), паранеопластические синдромы, включающие неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром «скованного человека» или синдром «скованного индивидуума», энцефаломиелит, такой как аллергический энцефаломиелит, или encephalomyelitis allergica, и экспериментальный аллергический энцефаломиелит (ЕАЕ), миастения гравис, такая как связанная с тимомой миастения гравис, церебеллярная дегенерация, нейромиотония, опсоклонус или синдром опсоклонуса-миоклонуса (OMS) и сенсорная нейропатия, мультифокальная двигательная нейропатия, синдром Шихана, аутоиммунный гепатит, хронический гепатит, люпоидный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидная интерстициальная пневмония, облитерирующий бронхиолит (не связанный с трансплантацией) против NSIP, синдром Гийена-Барре, болезнь Берже (IgA-нефропатия), идиопатическая IgA-нефропатия, линейный IgA-дерматоз, первичный билиарный цирроз, пневмоцирроз, синдром аутоиммунной энтеропатии, глютеиновая болезнь, целиакия, глютенчувствительная целиакия (глютеновая энтеропатия), рефрактерная спру, идиопатическая спру, криоглобулинемия, амилотрофический латеральный склероз (ALS; болезнь Лу Герига), заболевание коронарной артерии, аутоиммунное заболевание уха, такое как аутоиммунное заболевание внутреннего уха (AIED), аутоиммунная потеря слуха, опсоклонус-миоклонус-синдром (OMS), полихондрия, такая как рефракторная или рецидивирующая полихондрия, легочный альвеолярный протеиноз, амилоидоз, склерит, незлокачественный лимфоцитоз, первичный лимфоцитоз, который включает моноклональный В-клеточный лимфоцитоз (например, доброкачественная моноклональная гаммапатия и моноклональная гаммапатия неустановленного происхождения, MGUS), периферическая нейропатия, паранеопластический синдром, каналопатии, такие как эпилепсия, мигрень, аритмия, мышечные нарушения, глухота, слепота, периодический паралич и каналопатии центральной нервной системы, аутизм, воспалительная миопатия, фокальный сегментарный гломерулосклероз (FSGS), эндокринная офтальмопатия, увеоретинит, хориоретинит, аутоиммунное гепатологическое нарушение, фибромиалгия, множественное эндокринное расстройство, синдром Шмидта, воспаление надпочечника, желудочная атрофия, пресенильная деменция, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания, диабетическая нефропатия, синдром Дресслера, очаговая алопеция, CREST-синдром (кальциноз, феномен Рейно, пищеводная дискинезия, склеродактилия и телеангиэктазия), мужское и женское аутоиммунное бесплодие, смешанное заболевание соединительной ткани, болезнь Чагаса, ревматическиая лихорадка, рецидивный выкидыш, аллергический альвеолит у сельскохозяйственных рабочих, мультиформная эритема, пост-кардиотомический синдром, синдром Кушинга, легочная аллергия птицеводов, аллергический грануломатозный ангиит, доброкачественный лимфоцитарный ангиит, синдром Альпорта, альвеолит, такой как аллергический альвеолит и фиброзный альвеолит, интерстициальное заболевание легкого, трансфузионная реакция, проказа, малярия, лейшманиоз, трипаносомоз, шистосомоз, аскаридоз, аспергиллез, синдром Самптера, синдром Каплана, лихорадка денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный легочный фиброз, интерстициальный легочный фиброз, идиопатический легочный фиброз, фиброз мочевого пузыря, эндофтальмит, стойкая возвышающаяся эритема, эритробластоз плода, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филяриоз, циклит, такой как хронический циклит, гетерохронный циклит, иридоциклит или циклит Фукса, пурпура Шенлейна-Геноха, инфекция вируса иммунодефицита человека (HIV), инфекция вируса ECHO, кардиомиопатия, болезнь Альцгеймера, инфекция парвовируса, инфекция вируса краснухи, синдромы поствакцинации, врожденная инфекция краснухи, инфекции вируса Эпштейна-Барр, свинка, синдром Эванса, аутоиммунное гонадное нарушение, хорея Сиденгама, пост-стрептококковый нефрит, облитерирующий тромбангиит, тиреотоксикоз, сухотка спинного мозга, хориоидит, гигантоклеточная полимиалгия, эндокринная офтальмопатия, хроническая гиперчувствительная пневмония, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, идиопатический нефритный синдром, минимально измененная нефропатия, доброкачественное семейное и ишемически-реперфузионное нарушение, ретинальная аутоиммунность, воспаление суставов, бронхит, хроническое обструктивное заболевание дыхательных путей, силикоз, афты, афтозный стоматит, артериосклеротические нарушения, аспермиогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемия, контрактура Дюпюитрена, факоанафилактический эндофтальмит, аллергический энтерит, лепрозная узловатая эритема, идиопатический лицевой паралич, синдром хронической усталости, ревматическая лихорадка, болезнь Хаммена-Рича, сенсоневральная потеря слуха, пароксизмальная гемоглобинурия, гипогонадизм, региональный илеит, лейкопения, инфекционный мононуклеоз, поперечный миелит, первичная идиопатическая микседема, нефроз, симпатическая офтальмия, гранулематозный орхит, панкреатит, острый полирадикулоневрит, гангренозная пиодермия, тиреоидит де Карвена, приобретенная атрофия селезенки, бесплодие из-за антисперматозоидных антител, незлокачественная тимома, витилиго, SCID и болезнь, ассоциированная с вирусом Эпштейна-Барр, синдром приобретенного иммунодефицита (СПИД), паразитарные заболевания, такие так лейшманиоз, синдром токсического шока, пищевое отравление, состояния, включающие инфильтрацию Т-клетками, недостаточность лейкоцитарной адгезии, иммунные ответы, связанные с острой и отсроченной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, заболевания, включающие лейкоцитарный диапедез, синдром поражения нескольких органов, заболевания, опосредуемые комплексом антиген-антитело, антигломерулярное заболевание базальной мембраны, аллергический неврит, аутоиммунные полиэндокринопатии, оофорит, первичная микседема, аутоиммунный атрофический гастрит, симпатическая офтальмия, ревматические заболевания, смешанные заболевания соединительной ткани, нефротический синдром, инсулит, полиэндокринное поражение, периферическая нейропатия, аутоиммунный полигландулярный синдром типа I, идиопатический гипопаратиреоз взрослых (AOIH), полная аллопеция, отсроченная кардиомиопатия, приобретенный буллезный эпидермолиз (ЕВА), гематохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит, решетчатый, фронтальный, верхнечелюстной или клиновидный синусит, связанное с эозинофилами нарушение, такое как эозинофилия, легочная инфильтрационная эозинофилия, синдром эозинофилии-миалгии, синдром Лоффлера, хроническая эозинофильная пневмония, тропическая легочная эозинофилия, бронхопневмонический аспергиллез, аспергиллема или гранулема, содержащая эозинофилы, анафилаксия, серонегативные спондилоартриты, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, склера, эписклера, хронический кожно-слизистый кандидоз, синдром Брутона, транзиторная гипогаммаглобулинемия детей, синдром Вискотта-Олдрича, атаксическая телеангиэктазия, аутоиммунные нарушения, связанные с коллагеновой болезнью, ревматизм, неврологическое заболевание, ишемическое реперфузионное нарушение, снижение реакции кровяного давления, сосудистая дисфункция, ангиэктазия, тканевое повреждение, кардиососудистая ишемия, гипералгезия, церебральная ишемия и заболевание, сопровождающее васкуляризацию, аллергические нарушения гиперчувствительности, гломерулонефрит, реперфузионное повреждение, реперфузионное повреждение миокарда и других тканей, дерматоз с острыми воспалительными компонентами, острый гнойный менингит или другие воспалительные нарушения центральной нервной системы, глазные и глазничные воспалительные нарушения, синдромы, связанные с трансфузией гранулоцитов, индуцированная цитокинами токсичность, острое тяжелое воспаление, хроническое трудноизлечимое воспаление, пиелит, пневмоцирроз, диабетическая ретинопатия, диабетическое нарушение крупных артерий, эндометриальная гиперплазия, пептическая язва, вальвулит и эндометриоз.
В дополнение к терапевтическим применениям, антитела по настоящему изобретению могут быть использованы и для других целей, включающих способы диагностики, такие как способы диагностики заболеваний и состояний, описанных в настоящем документе.
VI. Дозировки, составы и продолжительность
Белки по настоящему изобретению будут сформулированы, дозированы и введены способом в соответствии с надлежащей медицинской практикой. Факторы, рассматриваемые в этом контексте, включают конкретное нарушение, подлежащее лечению, конкретного млекопитающего, получающего лечение, клиническое состояние отдельного субъекта, причину нарушения, сайт доставки средства, способ введения, схему введения и другие факторы, известные медицинским специалистам. «Терапевтически эффективное количество» белка, подлежащего введению, будет регулироваться, исходя из таких соображений, и является минимальным количеством, необходимым для профилактики, ослабления или лечения конкретного нарушения (например, злокачественной опухоли, аллергического или воспалительного нарушения или аутоиммунного нарушения). Белки должны быть, но не обязательно, сформулированы с одним или несколькими средствами, используемыми в настоящее время для профилактики или лечения нарушения. Эффективное количество таких других средств зависит от количества белков, присутствующих в составе, типа нарушения или лечения и других факторов, обсуждаемых выше. Как правило, они используются в тех же дозировках и с путями введения, использованными согласно настоящему документу выше, или от около 1 до 99% ранее использованных дозировок. Обычно облегчение или лечение злокачественной опухоли предусматривает ослабление одного или нескольких симптомов или медицинских проблем, связанных со злокачественной опухолью. Терапевтически эффективное количество лекарственного средства может осуществить что-либо одно или комбинацию из следующего: уменьшение (по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или более) числа клеток злокачественной опухоли; уменьшение или ингибирование размера опухоли или опухолевой нагрузки; ингибирование (т.е. уменьшение до некоторой степени и/или остановка) инфильтрации клеток злокачественной опухоли в периферические органы; уменьшение гормональной секреции в случае аденомы; уменьшение густоты сосудов; ингибирование опухолевого метастазирования; ослабление или ингибирование роста опухоли и/или облегчение до некоторой степени одного или нескольких из симптомов, связанных со злокачественной опухолью. В некоторых вариантах осуществления белки используются для профилактики возникновения или повторного возникновения злокачественной опухоли или аутоиммунного нарушения у субъекта.
В одном варианте осуществления настоящее изобретение может быть использовано для увеличения продолжительности выживания человека, подверженного или имеющего диагноз злокачественной опухоли или аутоиммунного нарушения. Продолжительность выживания определяется как время от начала введения лекарственного средства до смерти. Продолжительность выживания также может быть измерена стратифицированным соотношением рисков (HR) группы лечения по сравнению с контрольной группой, которое представляет риск смерти для субъекта в ходе лечения.
В еще одном варианте осуществления лечение в соответствии с настоящим изобретением существенно повышает показатель ответной реакции в группе людей, подверженных риску развития или имеющих диагноз злокачественной опухоли, которые принимают лечение различными видами противораковой терапии. Показатель ответной реакции определяется как процентное отношение среди субъектов, получающих лечение, тех, которые отвечают на лечение. В одном аспекте комбинированное лечение в соответствии с настоящим изобретением с использованием белков в соответствии с настоящим изобретением и хирургического вмешательства, лучевой терапии или одного или нескольких химиотерапевтических средств существенно увеличивает показатель ответной реакции в группе лечения субъектов по сравнению с группой лечения хирургическим вмешательством, лучевой терапией или химиотерапией отдельно, причем увеличение характеризуется р-значением критерия хи-квадрата менее чем 0,005. Дополнительные измерения терапевтической эффективности в лечении злокачественных опухолей описаны в публикации заявки на патент США №20050186208.
Терапевтические составы готовятся с использованием стандартных способов, известных в данной области, путем смешивания активного ингредиента, характеризующегося желаемой степенью чистоты с необязательными физиологически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences (20th edition), ed. A.Gennaro, 2000, Lippincott, Williams & Wilkins, Филадельфия, Пенсильвания). Приемлемые носители включают солевой раствор или буферы, такие как фосфатный, нитратный и из солей других органических кислот; антиоксиданты, в том числе аскорбиновая кислота; полипептиды с низким молекулярной массой (менее чем около 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкоза, манноза или десктрины; хелатирующие средства, такие как EDTA; сахарные спирты, такие как маннит или сорбит; образующие соль противоионы, такие как ион натрия; и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или PEG.
Необязательно, но предпочтительно, состав содержит фармацевтически приемлемую соль, предпочтительно хлорид натрия, и предпочтительно при концентрациях, близких к физиологическим. Необязательно составы в соответствии с настоящим изобретением могут содержать фармацевтически приемлемый консервант. В некоторых вариантах осуществления диапазоны концентрации консерванта составляют от 0,1 до 2,0%, обычно в объемном отношении. Приемлемые консерванты включают консерванты, известные в фармацевтических отраслях. Предпочтительными консервантами являются бензиловый спирт, фенол, м-крезол, метилпарабен и пропилпарабен. Необязательно составы в соответствии с настоящим изобретением могут включать фармацевтически приемлемое поверхностно-активное вещество при концентрации от 0,005 до 0,02%.
Состав в соответствии с настоящим документом также может содержать более чем одно активное соединение, как необходимо для конкретного показания, подлежащего лечению, предпочтительно с взаимодополняющими активными ингредиентами, которые отрицательно не влияют друг на друга. Такие молекулы соответственно присутствуют в комбинациия в количествах, которые эффективны для предназначенной цели.
Активные ингредиенты также могут быть предусмотрены захваченными в микрокапсулы, полученные, например, методиками коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозная или желатиновая микрокапсула и поли(метилметакрилатная) микрокапсула, соответственно, в коллоидальных системах доставки лекарственных средств (например, в липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методики раскрыты в Remington's Pharmaceutical Sciences, supra.
Могут быть получены препараты замедленного высвобождения. Приемлемые примеры препаратов замедленного высвобождения включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, причем матрицы находятся в форме сформованных изделий, например, пленки или микрокапсула. Примеры матриц замедленного высвобождения включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поли(виниловый спирт)), полилактиды (патент США №3773919), сополимеры L-глутаминовой кислоты и γ-этил-Д-глутамата, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и лейпролида ацетата), и поли-D-(-)-3-гидроксимасляную кислоту. Тогда как полимеры, такие как этиленвинилацетат и сополимер молочной кислоты и гликолевой кислоты облегчают высвобождение молекул в течение более 100 суток, определенные гидрогели высвобождают белки в течение более коротких периодов времени. Если инкапсулированные антитела остаются в организме в течение длительного времени, они могут изменить естественные свойства или агрегировать в результате воздействия влажности при 37°С, что приводит к потере биологической активности и возможным изменениям иммуногенности. Для стабилизации могут быть разработаны рациональные стратегии в зависимости от участвующего механизма. Например, если механизм агрегации, как обнаружено, осуществляет образование межмолекулярной S-S связи через тиодисульфидный обмен, стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизацией из кислотных растворов, регулированием содержания влаги, использованием соответствующих добавок и разработкой специальных композиций полимерных матриц.
Белки, описанные в настоящем документе (например, содержащее суперспираль антитело, привязанное антитело или антитело, полученное в соответствии со способами, описанными в настоящем документе), вводятся человеку в соответствии с известными способами, такими как внутривенное введение в виде болюса или непрерывной инфузией в течение определенного периода времени, внутримышечный, внутрибрюшинный, внутрицереброспинальный, подкожный, внутрисуставной, интрасиновиальный, интратекальный, местный или ингаляционный пути. Локальное введение может быть особенно желательным, если обширные побочные эффекты или токсичность связаны с антагонизмом к молекуле-мишени, распознаваемой белками. Стратегия ex vivo также может быть использована для терапевтических применений. Стратегии ех vivo предусматривают трансфекцию или трансдукцию клеток, полученных от субъекта, полинуклеотидом, кодирующим белок в соответствии с настоящим изобретением. Затем трансфицированные или трансдуцированные клетки обратно вводятся субъекту. Клетками могут быть любые из широкого диапазона типов, включая без ограничения стволовые кроветворные клетки (например, клетки костного мозга, макрофаги, моноциты, дендритные клетки, Т-клетки или В-клетки), фибробласты, эпителиальные клетки, эндотелиальные клетки, кератиноциты или мышечные клетки.
В одном примере белковые комплексы (например, содержащее суперспираль антитело, привязанное антитело или антитело, полученное в соответствии со способами, описанными в настоящем документе) вводятся местно, например, путем прямых инъекций, если позволяет нарушение или расположение опухоли, и инъекции могут повторяться периодически. Белковый комплекс также может быть доставлен субъекту системно или непосредственно в клетки опухоли, например, в опухоль или ложе опухоли с последующим удалением опухоли хирургическим путем для предотвращения или уменьшения локального рецидива или метастазирования.
VII. Готовые изделия
Другой вариант осуществления в соответствии с настоящим изобретением представляет готовое изделие, содержащее один или несколько белковых комплексов, описанных в настоящем документе, и материалы, применимые для лечения или диагностирования нарушения (например, аутоиммунного заболевания или злокачественной опухоли). Готовое изделие содержит контейнер и этикетку или листовку-вкладыш в упаковку или связанную с контейнером. Приемлемые контейнеры предусматривают, например, флаконы, ампулы, шприцы и т.д. Контейнеры могут быть сформованы из разнообразных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая эффективна для лечения состояния, и в нем может быть предусмотрено отверстие для стерильного доступа (например, контейнер может быть пакетом внутривенного раствора или ампулой с пробкой, прокалываемой иглой для подкожной инъекции). По меньшей мере одно активное средство в композиции является антителом или фрагментом антитела в соответствии с настоящим изобретением. Этикетка или листовка-вкладыш в упаковку указывает, что композиция используется для лечения конкретного состояния. Этикетка или листовка-вкладыш в упаковку будет дополнительно содержать инструкции по введению композиции антитела субъекту. Также предусматривается готовые изделия и наборы, содержащие комбинационные виды терапии, описанные в настоящем документе.
Листовка-вкладыш в упаковку относится к инструкциям, обычно включенным в коммерческие упаковки терапевтических продуктов, которые содержат информацию по назначениям, применению, дозировке, введению, противопоказаниям и/или предостережениям, касающимся применения таких терапевтических продуктов. В определенных вариантах осуществления листовка-вкладыш в упаковку указывает, что композиция используется для лечения злокачественной опухоли молочной железы, колоректальной злокачественной опухоли, злокачественной опухоли легкого, почечноклеточной карциномы, глиомы или злокачественной опухоли яичника.
Кроме того, готовое изделие дополнительно может предусматривать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекции (BWFI), фосфатно-буферный солевой раствор, раствор Рингера и раствор декстрозы. Он дополнительно может включать другие материалы, рассматриваемые с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
Также предусматриваются наборы, которые применимы для различных целей, например, для очистки или иммунопреципитации антигена (например, HER2 или EGFR) из клеток. Для выделения и очистки антигена (например, HER2 или EGFR) набор может содержать антитело (например, антитело EGFR/HER2), соединенное с гранулами (например, сефарозными гранулами). Могут быть предусмотрены наборы, которые содержат антитела для выявления и количественного определения антигена in vitro, например, с помощью ELISA или Вестерн-блоттинга. Как и готовое изделие, набор содержит контейнер и этикетку или листовку-вкладыш в упаковку на контейнере связанную с контейнером. В контейнере находится композиция, содержащая по меньшей мере одно мультиспецифическое антитело или фрагмент антитела в соответствии с настоящим изобретением. Могут быть предусмотрены дополнительные контейнеры, которые содержат, например, разбавители и буферы или контрольные антитела. Этикетка или листовка-вкладыш в упаковку может предусматривать описание композиции, а также инструкции для предназначенного in vitro или диагностического применения.
Вышеизложенное письменное описание считается достаточным, чтобы позволить специалисту в данной области осуществить на практике настоящее изобретение. Следующие примеры предлагаются исключительно с иллюстративными целями и не предназначены ограничивать объем настоящего изобретения каким-либо путем. Действительно, различные модификации настоящего изобретения в дополнение к показанным и описанным в настоящем документе станут очевидны специалистам в данной области техники из предшествующего описания и подпадают под объем приложенной формулы изобретения.
VII. Молекулы-мишени
Примеры молекул, которые могут быть мишенями для комплекса в соответствии с настоящим изобретением, включают без ограничения растворимые сывороточные белки и их рецепторы и другие связанные с мембраной белки (например, адгезины).
В другом варианте осуществления связывающий белок в соответствии с настоящим изобретением способен к связыванию одного, двух или более цитокинов, родственных цитокину белков и цитокиновых рецепторов, выбранных из группы, состоящей из ВМР1, ВМР2, ВМР3В (GDF10), ВМР4, ВМР6, ВМР8, CSF1 (M-CSF), CSF2 (GM-CSF), CSF3 (G-CSF), ЕРО, FGF1 (aFGF), FGF2 (bFGF), FGF3 (int-2), FGF4 (HST), FGF5, FGF6 (HST-2), FGF7 (KGF), FGF9, FGF10, FGF11, FGF12, FGF12B, FGF14, FGF16, FGF17, FGF19, FGF20, FGF21, FGF23, IGF1, IGF2, IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNB1, IFNG, IFNW1, FEL1, FEL1 (EPSELON), FEL1 (ZETA), ILIA, IL1B, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, ILI1, IL12A, IL12B, IL13, IL14, IL15, IL16, IL17, IL17B, IL18, IL19, IL20, IL22, IL23, IL24, IL25, IL26, IL27, IL28A, IL28B, IL29, IL30, PDGFA, PDGFB, TGFA, TGFB1, TGFB2, TGFB3, LTA (TNF-b), LTB, TNF (TNF-a), TNFSF4 (OX40 лиганд), TNFSF5 (CD40 лиганд), TNFSF6 (FasL), TNFSF7 (CD27 лиганд), TNFSF8 (CD30 лиганд), TNFSF9 (4-1 ВВ лиганд), TNFSF10 (TRAIL), TNFSF11 (TRANCE), TNFSF12 (AP03L), TNFSF13 (April), TNFSF13B, TNFSF14 (HVEM-L), TNFSF15 (VEGI), TNFSF18, HGF (VEGFD), VEGF, VEGFB, VEGFC, IL1R1, IL1R2, IL1RL1, LL1RL2, IL2RA, IL2RB, IL2RG, IL3RA, IL4R, IL5RA, IL6R, IL7R, IL8RA, IL8RB, IL9R, IL10RA, IL10RB, IL11RA, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL15RA, IL17R, IL18R1, IL20RA, IL21R, IL22R, IL1HY1, IL1RAP, IL1RAPL1, IL1RAPL2, IL1RN, IL6ST, IL18BP, IL18RAP, IL22RA2, AIF1, HGF. LEP (лептин), PTN и THPO.
В другом варианте осуществления молекулой-мишенью является хемокин, хемокиновый рецептор или родственный хемокину белок, выбранный из группы, состоящей из CCL1 (1-309), CCL2 (MCP-1/MCAF), CCL3 (MIP-Ia), CCL4 (MIP-Ib), CCL5 (RANTES), CCL7 (MCP-3), CCL8 (mcp-2), CCLH (эотаксин), CCL13 (MCP-4), CCL15 (MIP-Id), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19 (MDP-3b), CCL20 (MIP-3а), CCL21 (SLC/exodus-2), CCL22 (MDC/STC-I), CCL23 (MPIF-I), CCL24 (МР1Р-2/эотаксин-2), CCL25 (TECK), CCL26 (эотаксин-3), CCL27 (CTACK/ILC), CCL28, CXCL1 (GR01), CXCL2 (GRO2), CXCL3 (GR03), CXCL5 (ENA-78), CXCL6 (GCP-2), CXCL9 (MIG), CXCL10 (IP 10), CXCLI1 (I-TAC), CXCL12 (SDF1), CXCL13, CXCL14, CXCL16, PF4 (CXCL4), PPBP (CXCL7), CX3CL1 (SCYD1), SCYE1, XCL1 (лимфотактин), XCL2 (SCM-Ib), BLR1 (MDR15), CCBP2 (D6/JAB61), CCR1 (CKR1/HM145), CCR2 (mcp-1RB/RA), CCR3 (CKR3/CMKBR3), CCR4, CCR5 (CMKBR5/ChemR13), CCR6 (CMKBR6/CKR-L3/STRL22/DRY6), CCR7 (CKR7/EBI1), CCR8 (CMKBR8/TER1/CKR- LI), CCR9 (GPR-9-6), CCRL1 (VSHK1), CCRL2 (L-CCR), XCR1 (GPR5/CCXCR1), CMKLR1, CMKOR1 (RDC1), CX3CR1 (V28), CXCR4, GPR2 (CCR10), GPR31, GPR81 (FKSG80), CXCR3 (GPR9/CKR-L2), CXCR6 (TYMSTR/STRL33/Bonzo), HM74, IL8RA (IL8Ra), IL8RB (IL8Rb), LTB4R (GPR16), TCP10, CKLFSF2, CKLFSF3, CKLFSF4, CKLFSF5, CKLFSF6, CKLFSF7, CKLFSF8, BDNF, C5R1, CSF3, GRCC10 (C10), EPO, FY (DARC), GDF5, HDF1A, DL8, PRL, RGS3, RGS13, SDF2, SLIT2, TLR2, TLR4, TREM1, TREM2 и VHL.
В другом варианте осуществления связывающие белки в соответствии с настоящим изобретением способны к связыванию одной или нескольких мишеней, выбранных из группы, состоящей из ABCF1; ACVR1; ACVR1B; ACVR2; ACVR2B; ACVRL1; ADORA2A; Аггрекан; AGR2; AICDA; AIF1; AIG1; АКАР1; АКАР2; АМН; AMHR2; ANGPT1; ANGPT2; ANGPTL3; ANGPTL4; ANPEP; АРС; АРОС1; AR; AZGP1 (цинк-альфа-гликопротеин); В7.1; В7.2; BAD; BAFF (BLys); BAG1; ВАН; BCL2; BCL6; BDNF; BLNK; BLR1 (MDR15); ВМР1; ВМР2; ВМР3В (GDF10); ВМР4; ВМР6; ВМР8; BMPR1A; BMPR1B; BMPR2; BPAG1 (плектин); BRCA1; C19orflO (IL27w); С3; С4А; С5; C5R1; CANT1; CASP1; CASP4; CAV1; CCBP2 (D6/JAB61); CCL1 (1-309); CCLI1 (эотаксин); CCL13 (MCP-4); CCL15 (MIP-Id); CCL16 (HCC-4); CCL17 (TARC); CCL18 (PARC); CCL19 (MIP-3m); CCL2 (МСР-1); MCAF; CCL20 (MIP-3а); CCL21 (МТР-2); SLC; exodus-2; CCL22 (MDC/STC-I); CCL23 (MPIF-I); CCL24 (МР1Р-2/эотаксин-2); CCL25 (TECK); CCL26 (эотаксин-3); CCL27 (CTACK/ILC); CCL28; CCL3 (MTP-Ia); CCL4 (MDP-Ib); CCL5 (RANTES); CCL7 (MCP-3); CCL8 (mcp-2); CCNA1; CCNA2; CCND1; CCNE1; CCNE2; CCR1 (CKR1/HM145); CCR2 (mcp-1RB/RA);CCR3 (CKR3/CMKBR3); CCR4; CCR5 (CMKBR5/ChemR13); CCR6 (CMKBR6/CKR-L3/STRL22/DRY6); CCR7 (CKR7/EBI1); CCR8 (CMKBR8/TER1/CKR-L1); CCR9 (GPR-9-6); CCRL1 (VSHK1); CCRL2 (L-CCR); CD164; CD19; CD1C; CD20; CD200; CD22; CD24; CD28; CD3; CD37; CD38; CD3E; CD3G; CD3Z; CD4; CD40; CD40L; CD44; CD45RB; CD52; CD69; CD72; CD74; CD79A; CD79B; CD8; CD80; CD81; CD83; CD86; CDH1 (Е-кадгерин); CDH10; CDH12; CDH13; CDH18; CDH19; CDH20; CDH5; CDH7; CDH8; CDH9; CDK2; CDK3; CDK4; CDK5; CDK6; CDK7; CDK9; CDKN1A (p21Wapl/Cipl); CDKN1B (p27Kipl); CDKN1C; CDKN2A (P16INK4a); CDKN2B; CDKN2C; CDKN3; CEBPB; CER1; CHGA; CHGB; хитиназа; CHST10; CKLFSF2; CKLFSF3; CKLFSF4; CKLFSF5; CKLFSF6; CKLFSF7; CKLFSF8; CLDN3;CLDN7 (клаудин-7); CLN3; CLU (кластерин); CMKLR1; CMKOR1 (RDC1); CNR1; COL18A1; COL1A1; COL4A3; COL6A1; CR2; CRP; CSF1 (M-CSF); CSF2 (GM-CSF); CSF3 (GCSF);CTLA4; CTNNB1 (b-катенин); CTSB (катепсин В); CX3CL1 (SCYD1); CX3CR1 (V28); CXCL1 (GR01); CXCL10 (IP-10); CXCLI1 (I-TAC/IP-9); CXCL12 (SDF1); CXCL13; CXCL14;CXCL16; CXCL2 (GR02); CXCL3 (GR03); CXCL5 (ENA-78/LIX); CXCL6 (GCP-2); CXCL9 (MIG); CXCR3 (GPR9/CKR-L2); CXCR4; CXCR6 (TYMSTR/STRL33/Bonzo); CYB5; CYC1; CYSLTR1; DAB2IP; DES; DKFZp451J0118; DNCL1; DPP4; E2F1; ECGF1; EDG1; EFNA1; EFNA3; EFNB2; EOF; EGFR; ELAC2; ENG; EN01; EN02; EN03; EPHB4; EPO; ERBB2 (Her-2); EREG; ERK8; ESR1; ESR2; F3 (TF); FADD; FasL; FASN; FCER1A; FCER2; FCGR3A; FGF; FGF1 (aFGF); FGF10; FGF11; FGF12; FGF12B; FGF13; FGF14; FGF16; FGF17; FGF18; FGF19; FGF2 (bFGF); FGF20; FGF21; FGF22; FGF23; FGF3 (int-2); FGF4 (HST); FGF5; FGF6 (HST-2); FGF7 (KGF); FGF8; FGF9; FGFR3; FIGF (VEGFD); FEL1 (EPSILON); FIL1 (ZETA); FLJ12584; FLJ25530; FLRT1 (фибронектин); FLT1; FOS; FOSL1 (FRA-I); FY (DARC); GABRP (GABAa); GAGEB1; GAGEC1; GALNAC4S-6ST; GATA3; GDF5; GFI1; GGT1; GM-CSF; GNAS1; GNRH1; GPR2 (CCR10); GPR31; GPR44; GPR81 (FKSG80); GRCC10 (C10); GRP; GSN (Гелсолин); GSTP1; HAVCR2; HDAC4; HDAC5; HDAC7A; HDAC9; HGF; HIF1A; HDP1; гистамин и гистаминовые рецепторы; HLA-A; HLA-DRA; HM74; HMOX1; HUMCYT2A; ICEBERG; ICOSL; ID2; IFN-α; IFNA1; IFNA2; IFNA4; IFNA5; IFNA6; IFNA7; IFNB1; IFN-гамма; DFNW1; IGBP1; IGF1; IGF1R; IGF2; IGFBP2; IGFBP3; IGFBP6; IL-I; IL10; IL10RA; IL10RB; IL11; IL11RA; IL-12; IL12A; IL12B; IL12RB1; IL12RB2; IL13; IL13RA1; IL13RA2; IL14; IL15; IL15RA; IL16; IL17; IL17B; IL17C; IL17R; IL18; IL18BP; IL18R1; IL18RAP; IL19; ILIA; IL1B; IL1F10; IL1F5; IL1F6; IL1F7-IL1F8; IL1F9; IL1HY1; IL1R1; IL1R2; IL1RAP; IL1RAPL1; IL1RAPL2; IL1RL1; IL1RL2, IL1RN; IL2; IL20; IL20RA; IL21R; IL22; IL22R; IL22RA2; IL23; IL24; IL25; IL26; IL27; IL28A; IL28B; IL29; IL2RA; IL2RB; IL2RG; IL3; IL30; IL3RA; IL4; IL4R; IL5; IL5RA; IL6; IL6R; IL6ST (гликопротеин 130); EL7; EL7R; EL8; IL8RA; DL8RB; IL8RB; DL9; DL9R; DLK; INHA; INHBA; INSL3; INSL4; IRAKI; ERAK2; ITGA1; ITGA2; ITGA3; ITGA6 (а6 интегрин); ITGAV; ITGB3; ITGB4 (b 4 интегрин); JAG1; JAK1; JAK3; JUN; K6HF; KAI1; KDR; KITLG; KLF5 (GC Box BP); KLF6; KLK10; KLK12; KLK13; KLK14; KLK15; KLK3; KLK4; KLK5; KLK6; KLK9; KRT1; KRT19 (Кератин 19); KRT2A; KHTHB6 (специфический для волоса кератин типа Н); LAMAS; LEP (лептин); Lingo-p75; Lingo-Troy; LPS; LTA (TNF-b); LTB; LTB4R (GPR16); LTB4R2; LTBR; MACMARCKS; MAG или Omgp; MAP2K7 (c-Jun); MDK; MIB1; мидкин; MEF; MIP-2; MKI67; (Ki-67); MMP2; MMP9; MS4A1; MSMB; MT3 (металлотионектин-III); MTSS1; MUC1 (муцин); MYC; MYD88; NCK2; нейрокан; NFKB1; NFKB2; NGFB (NGF); NGFR; NgR-Lingo; NgR-Nogo66 (Nogo); NgR-p75; NgR-Troy; нМЕ1 (NM23A); N0X5; NPPB; NROB1; NROB2; NR1D1; NR1D2; NR1H2; NR1H3; NR1H4; NR1I2; NR1I3; NR2C1; NR2C2; NR2E1; NR2E3; NR2F1; NR2F2; NR2F6; NR3C1; NR3C2; NR4A1; NR4A2; NR4A3; NR5A1; NR5A2; NR6A1; NRP1; NRP2; NT5E; NTN4; ODZ1; OPRD1; P2RX7; PAP; PARTI; PATE; PAWR; PCA3; PCNA; PDGFA; PDGFB; PECAM1; PF4 (CXCL4); PGF; PGR; фосфакан; PIAS2; PIK3CG; PLAU (uPA); PLG; PLXDC1; PPBP (CXCL7); PPID; PR1; PRKCQ; PRKD1; PRL; PROC; PROK2; PSAP; PSCA; PTAFR; PTEN; PTGS2 (COX-2); PTN; RAC2 (p21Rac2); RARB; RGS1; RGS13; RGS3; RNFI10 (ZNF144); ROB02; S100A2; SCGB1D2 (липофилин В); SCGB2A1 (маммаглобин2); SCGB2A2 (маммаглобин 1); SCYE1 (эндотелиальный ативирующий моноциты цитокин); SDF2; SERPINA1; SERPINA3; SERP1NB5 (maspin); SERPINE1 (PAI-I); SERPDMF1; SHBG; SLA2; SLC2A2; SLC33A1; SLC43A1; SLIT2; SPP1; SPRR1B (Spri); ST6GAL1; STAB1; STAT6; STEAP; STEAP2; TB4R2; ТВХ21; TCP 10; TDGF1; ТЕК; TGFA; TGFB1; TGFB1I1; TGFB2; TGFB3; TGFBI; TGFBR1; TGFBR2; TGFBR3; TH1L; THBS1 (тромбоспондин-1); THBS2; THBS4; THPO; TIE (Tie-1); TMP3; tissue фактор; TLR10; TLR2; TLR3; TLR4; TLR5; TLR6; TLR7; TLR8; TLR9; TNF; TNF-a; TNFAEP2 (B94); TNFAIP3; TNFRSFI1A; TNFRSF1A; TNFRSF1B; TNFRSF21; TNFRSF5; TNFRSF6 (Fas); TNFRSF7; TNFRSF8; TNFRSF9; TNFSF10 (TRAIL); TNFSF1 1 (TRANCE); TNFSF12 (AP03L); TNFSF13 (April); TNFSF13B; TNFSF14 (HVEM-L); TNFSF15 (VEGI); TNFSF18; TNFSF4 (0Х40 лиганд); TNFSF5 (CD40 лиганд); TNFSF6 (FasL); TNFSF7 (CD27 лиганд); TNFSF8 (CD30 лиганд); TNFSF9 (4-1 ВВ лиганд); TOLLIP; Toll-подобные рецепторы ТОР2А (топоизомераза Еа); ТР53; ТРМ1; ТРМ2; TRADD; TRAF1; TRAF2; TRAF3; TRAF4; TRAF5; TRAF6; TREM1; TREM2; TRPC6; TSLP; TWEAK; VEGF; VEGFB; VEGFC; версикан; VHL C5; VLA-4; XCL1 (лимфотактин); XCL2 (SCM-Ib); XCR1(GPR5/CCXCR1); YY1 и ZFPM2.
Предпочтительные молекулы-мишени для антител, охваченных настоящим изобретением, включают CD белки, такие как CD3, CD4, CD8, CD16, CD19, CD20, CD34; CD64, CD200, члены семейства рецепторов ЕгЬВ, такие как рецептор EGF, HER2, HER3 или рецептор HER4; молекулы клеточной адгезии, такие как LFA-1, Мас1, р150.95, VLA-4, ICAM-1, VCAM, альфа4/бета7-интегрин и альфау/бета3-интегрин, включающие либо альфа-, либо бета-субъединицы его (например, антитела к CD 11 а, к CD 18 или к CD11b); факторы роста, такие как VEGF-A, VEGF-C; тканевой фактор (TF); альфа-интерферон (альфа1IFN); ТNFальфа, интрелейкин, такой как IL-1бета, IL-3, IL-4, IL-5, IL-8, IL-9, IL-13, IL17A/F, IL-18, IL-13Rальфа1, IL13Rальфа2, IL-4R, IL-5R, IL-9R, IgE; антигены группы крови; flk2/flt3-рецептор; рецептор ожирения (OB); mpl-рецептор; CTLA-4; RANKL, RANK, RSV белок F, белок С и т.д.
В одном варианте осуществления гетеромультимерные комплексы в соответствии с настоящим изобретением связываются по меньшей мере с двумя молекулами-мишенями, выбранными из группы, состоящей из IL-1 альфа и IL-1 бета, IL-12 и IL-18; IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-5 и IL-4; IL-13 и IL-бета; IL-13 и IL- 25; IL-13 и TARC; IL-13 и MDC; IL-13 и MEF; IL-13 и TGF-β; агонист IL-13 и LHR; IL-12 и TWEAK, IL-13 и CL25; IL-13 и SPRR2a; IL-13 и SPRR2b; IL-13 и ADAM8, IL-13 и PED2, IL17A и IL17F, CD3 и CD19, CD138 и CD20; CD138 и CD40; CD19 и CD20; CD20 и CD3; CD38 и CD138; CD38 и CD20; CD38 и CD40; CD40 и CD20; CD-8 и IL-6; CD20 и BR3, ТNFальфа и TGF-бета, ТNFальфа и IL-1 бета; ТNFальфа и IL-2, TNF альфа и IL-3, ТNFальфа и IL-4, ТNFальфа и IL-5, ТNFальфа и IL6, ТNFальфа и IL8, ТNFальфа и IL-9, ТNFальфа и IL-10, ТNFальфа и IL-11, ТNFальфа и IL-12, ТNFальфа и IL-13, ТNFальфа и IL-14, ТNFальфа и IL-15, ТNFальфа и IL-16, ТNFальфа и IL-17, ТNFальфа и IL-18, ТNFальфа и IL-19, ТNFальфа и IL-20, ТNFальфа и IL-23, ТNFальфа и ТNFальфа, ТNFальфа и CD4, ТNFальфа и VEGF, ТNFальфа и MIF, ТNFальфа и ICAM-1, ТNFальфа и PGE4, ТNFальфа и PEG2, ТNFальфа и RANK лиганд, ТNFальфа и Те38; ТNFальфа и BAFF; ТNFальфа и CD22; ТNFальфа и CTLA-4; ТNFальфа и GP130; TNFα и IL-12p40; VEGF и HER2, VEGF-A и HER2, VEGF-A и PDGF, HER1 и HER2, VEGF-A и VEGF-C, VEGF-C и VEGF-D, HER2 и DR5, VEGF и IL-8, VEGF и MET, рецептор VEGFR и MET, VEGFR и EGFR, HER2 и CD64, HER2 и CD3, HER2 и CD16, HER2 и HER3; EGFR(HER1) и HER2, EGFR и HER3, EGFR и HER4, IL-13 и CD40L, IL4 и CD40L, TNFR1 и IL-1R, TNFR1 и IL-6R и TNFR1 и IL-18R, ЕрСАМ и CD3, MAPG и CD28, EGFR и CD64, CSPGs и RGM A; CTLA-4 и BTN02; IGF1 и IGF2; IGF1/2 и Erb2B; MAG и RGM A; NgR и RGM A; NogoA и RGM A; OMGp и RGM A; PDL-I и CTLA-4; и RGM А и RGM В.
Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, могут быть использованы в качестве иммуногенов для образования антител. Для трансмембранных молекул, таких как рецепторы, их фрагменты (например, внеклеточный домен рецептора), могут быть использованы в качестве иммуногена. Альтернативно, в качестве иммуногена могут быть использованы клетки, экспрессирующие трансмембранную молекулу. Такие клетки могут быть получены из природных источников (например, линий злокачественных клеток) или могут быть клетками, которые трансформированы рекомбинантными методами для экспрессии трансмембранной молекулы. Другие антигены и их формы, применимые для получения антител, будут очевидны специалистам в данной области техники.
Все патенты, патентные заявки, публикации патентных заявок и другие публикации, цитированные или упомянутые в настоящем описании, включены в настоящий документ посредством ссылки в той же степени, как если бы каждый независимый патент, патентная заявка, публикация патентной заявки и публикация были специально и отдельно указаны для включения посредством ссылки. Такие патентные заявки, в частности, включают предварительные заявки на патенты США №№61/243,105 и 61/266,992, поданные 16 сентября 2009 г. и 4 декабря 2009 г., соответственно, по которым настоящая заявка заявляет приоритет.
Примеры
Пример 1. Конструирование векторов для экспрессии содержащих суперспираль антител
Суперспиральные домены гетеродимеризации, описанные в настоящем документе, могут быть связаны с константной цепью (например, С-концом НС) любого антитела. Из уровня техники известны многочисленные последовательности антител, которые могут быть использованы для конструирования содержащих суперспираль антител, также из уровня техники хорошо известны методы, необходимые для манипулирования последовательностями ДНК. Ниже описан типичный способ конструирования содержащих суперспираль антител.
Остов НС для образования антител, содержащих суперспираль, конструировали следующим образом. Смысловые и антисмысловые олигонуклеотиды разрабатывали и синтезировали для кодирования последовательности либо ACID.p1 (GGSAQLEKELQALEKENAQLEWELQALEKELAQGAT; SEQ ID NO:33), либо BASE.p1 (GGSAQLKKKLQALKKKNAQLKWKLQALKKKLAQGAT; SEQ ID NO:34) суперспирального домена с 5' AscI и 3' XbaI «липкими» концами. Олигонуклеотиды отжигали, фосфорилировали и лигировали в расщепленную и дефосфорилированную плазмиду pRK (Genentech Inc.; Eaton et al., Biochemistry 25:8343-8347 (1986)). Сн1-Сн3-домен hIgG1 получали с использованием ПЦР (полимеразной цепной реакции) с включением 5'-сайта множественного клонирования (MCS) (ClaI-BamHI-KpnI-ApaI) и 3'-сайта AscI и клонировали в предварительно полученный вектор pRK-ACID.p1 или pRK-BASE.p1 с использованием ClaI и AscI. В заключение осуществляли мутацию лизинового остатка в положении Н222 (система нумерации по Kabat) в аланиновый остаток с использованием набора для направленного мутагенеза Quikchange II XL от Stratagene для предотвращения высвобождения Fab во время расщепления Lys-C.
Антитела, содержащие суперспиральный домен, конструировали следующим образом. Для общей LC и антител с одним плечом VH-домен желаемого антитела получали с использованием ПЦР с включением 5' Clal и 3' ApaI сайтов рестрикции. Фрагменты ПЦР расщепляли и клонировали в полученный подобным образом остовный вектор. В конструкты LC, уже имеющиеся для этих антител, не нужно было вносить никаких изменений.
Для привязанных антител VH-домен (без сигнальной последовательности) желаемого антитела сначала получали с использованием ПЦР, где 5'-праймер, содержал 3' половину привязки GGS и был терминирован по 5' BamHI сайту, а 3'-праймер был терминирован по 3' ApaI сайту. Фрагменты расщепляли и клонировали в полученный подобным образом остовный вектор. Затем получали соответствующую LC желаемого антитела с использованием ПЦР, где 5'-праймер был терминирован по 5' Clal сайту, а 3'-праймер содержал 5' часть привязки GGS и был терминирован по 3' BamHI. Фрагмент LC присоединяли к соответствующей ей НС (теперь в остовном векторе) путем клонирования фрагмента в переднюю часть VH с использованием ClaI и BamHI. Полная последовательность привязки, связывающей LC с VH, представляла собой GGGSGGSGGSGGSGGSGGSGGSGGSG (SEQ ID NO:14). Векторами трансфицировали клетки млекопитающего (СНО или клетки 293) с использованием стандартных методов трансфекции.
Биспецифическое антитело, которое специфически связывает и FceRI, и FcγR2b и имеет общую LC, получали с использованием способов, описанных в настоящем документе. Такое антитело характеризуется последовательностью «BASE.p1», содержащей последовательность НС, специфическую к FcγR2b человека, с последовательностью BASE.p1 суперспирального домена и мутацией K222A (SEQ ID NO:1), последовательностью «ACID.p1», содержащей последовательность НС, специфическую к FceRI человека, с последовательностью ACID.p1 суперспирального домена и мутацией K222A (SEQ ID NO:2) и последовательностью общей LC (SEQ ID NO:3) (фигура 8).
Также получали антитела с одним плечом, которые специфически связывают либо HER2, либо EGFR. Антитело, которое специфически связывает HER2, содержит последовательность НС анти-HER2 антитела-1 с последовательностью ACID.p1 суперспирального домена и мутацией K222A (SEQ ID NO:4), участок НС, не содержащий VH- и СН1-доменов, с последовательностью BASE.p1 суперспирального домена (SEQ ID NO:5) и последовательность LC анти-HER2 антитела-1 (SEQ ID NO:6). Антитело, которое специфически связывает EGFR, содержит последовательность НС к EGFR с последовательностью ACID.p1 суперспирального домена и мутацией K222A (SEQ ID NO:7), участок НС, не содержащий VH- и CH1-доменов, с BASE.p1 последовательностью суперспирального домена (SEQ ID NO:5) и последовательностью LC к EGFR (D1.5) (SEQ ID NO:8) (фигуры 9-1 и 9-2).
Также получали привязанные антитела, которые специфически связывают HER2 и EGFR/HER1 (фигуры 10 и 11). Одно антитело, которое специфически связывает HER2 и EGFR, содержит (1) последовательность LC анти-HER2 антитела-1, привязанную к последовательности НС анти-НЕР2 антитела-1 с помощью 26-аминокислотной привязки GGS, последовательность ACID.p1 суперспирального домена и мутацию K222A (SEQ ID NO:9) и (2) последовательность LC антитела к EGFR, привязанную к последовательности НС антитела к EGFR с помощью 26-аминокислотной привязки GGS, последовательность BASE.p1 суперспирального домена и мутацию K222A (SEQ ID NO:10) (фигура 10). Второе антитело, которое специфически связывает HER2 и EGFR, содержит (1) последовательность LC анти-НЕР2 антитела-2, привязанную к последовательности НС анти-НЕР2 антитела-2 с помощью 26 аминокислотной привязки GGS, последовательность ACID.p1 суперспирального домена и мутацию K222A (SEQ ID NO:11) и (2) последовательность LC антитела к EGFR, привязанную к последовательности НС антитела к EGFR с помощью 26 аминокислотной привязки GGS, последовательность BASE.p1 суперспирального домена и мутацию K222A (SEQ ID NO:10) (фигура 11). Последовательности LC и НС анти-HER2 антитела-1, использованные для конструирования содержащих суперспираль антител, показаны на фиг.12А и 12В (SEQ ID NO:15 и 16). Расположение различных сайтов рестрикции, использованных в конструировании векторов, кодирующих эти антитела, также показаны на фиг.12В 1-3.
Пример 2. Очистка содержащих суперспираль антител
Ниже показана типичная схема, которая может быть использована для очистки содержащих суперспираль антител.

Более конкретно, антитела выделяли из кондиционированной среды с использованием смолы mAbSure Select от GE Healthcare (Швеция) в течение ночи при 4°С. Колонку промывали двумя объемами колонки (CV) PBS (фосфатно-буферного солевого раствора), затем 10 CV PBS+0,1% поверхностно-активного вещества Тритон X114, а затем 10 CV калий-фосфатного буфера. Колонки элюировали 10 мМ уксусной кислоты (рН 2,9) и сразу же разбавляли аргинином (конечная концентрация 100 мМ) и Tris (конечная концентрация 200 мМ), рН 8,0. Суперспирали удаляли из антител при обработке эндопептидазой Lys-C (Wako Pure Chemical Laboratories) в соотношении 1:500 (мас:мас) при 37°С в течение 1-5 часов. Расщепленные образцы наносили обратно на колонку со смолой mAbSure для отделения отщепленных суперспиралей от антител и элюировали, как указано выше. Концентрации антител доводили до 10 мг/мл перед разделением путем эксклюзионной хроматографии прогоном через колонку Sephacryl S200 в PBS, 150 мМ NaCl, 100 мМ аргинина и 1 мМ NaN3. Пиковые фракции объединяли и диализовали против PBS в течение ночи перед масс-спектрометрическим анализом для обеспечения идентичности и чистоты.
В дополнение к аргинину другие хаотропные средства или мягкие поверхностно-активные вещества, которые могут быть использованы в вышеописанном протоколе очистки после начальной стадии в колонке со смолой mAbSure, включают без ограничения гуанидин-HCl, мочевину, перхлорат лития, гистидин, SDS (додецилсульфат натрия), Твин, Тритон и NP-40, каждый из которых коммерчески доступен. Разбавление антитела раствором, содержащим хаотропное средство или мягкое поверхностно-активное вещество, после элюирования из колонки, изначально содержащей Белок А, (например, колонка mAbSure), поддерживает стабильность антитела после элюирования и обеспечивает эффективное удаление суперспирали эндопептидазой Lys-C.
Таблица 1 показывает обобщение результатов очистки для анти-HER2 антитела-1/α-EGFR (D 1.5) антител.
Суперспираль удаляли из антитела эндопептидазой Lys-C в ходе процесса очистки.
Антитело, сконструированное с использованием суперспиральных доменов гетеродимеризации, но которое уже не содержит суперспираль, в следующих примерах называется «рекомбинантным антителом».
Пример 3. Расщепление содержащих суперспираль антител
Различные содержащие суперспираль антитела подвергали экспериментам расщепления, чтобы показать, что суперспираль (и привязка, если присутствует) может быть отщеплена от последовательности антитела, при этом последовательность антитела останется интактной. В частности, на фиг.13А и В показано, что суперспираль была отщеплена от типичного α-FcεR1/α-FcγR2b антитела с использованием эндопептидазы Lys-C, и что антитело осталось интактным. Теоретическая масса антитела с суперспиралью находится в пределах погрешности массы, наблюдаемой экспериментально с помощью масс-спектрометрии. Подобным образом, теоретическая масса рекомбинантного антитела без суперспирали находится в пределах погрешности массы, наблюдаемой экспериментально с помощью масс-спектрометрии, что говорит о том, что Lys-C отщепила суперспираль от антитела.
Результаты масс-спектрометрии также показали, что эндопептидаза Lys-C не расщепляет LC или НС типичного α-FcεR1/α-FcγR2b антитела (фигуры 14А и В). В частности, молекулярную массу определяли перед обработкой эндопептидазой Lys-C (левые панели), а также после обработки эндопептидазой Lys-C (правые панели) для LC (две верхние панели) и НС α-FcεR1 и α-FcγR2b (четыре нижние панели) с использованием масс-спектрометрии. Экспериментально наблюдаемые молекулярные массы находятся в пределах погрешности теоретических масс для различных конструктов, что говорит о том, что эндопептидаза Lys-C отщепляет суперспиральный домен от НС, но не расщепляет сами LC или НС.
Подобным образом, результаты масс-спектрометрии показали, что суперспираль была отщеплена от типичного a-EGFR антитела с одним плечом с использованием эндопептидазы Lys-C (фигуры 17А и В). В частности, экспериментально наблюдаемая молекулярная масса находилась в пределах погрешности теоретической массы и антитела с одним плечом с суперспиралью, и антитела с одним плечом без суперспирали. Как показано на фиг.18А-С, теоретическая молекулярная масса находилась в пределах погрешности экспериментально наблюдаемой молекулярной массы каждого конструкта, что указывает на то, что эндопептидаза Lys-C не расщепляет LC, НС или НС, не содержащую VH- и СН1-доменов, (Fc с одним плечом) типичного a-EGFR антитела, но отщепляет суперспиральные домены от НС и НС, не содержащей VH- и СН1-доменов.
Кроме того, результаты масс-спектрометрии показали, что суперспираль была отщеплена от типичного привязанного α-HER2/α-EGFR антитела с использованием эндопептидазы Lys-C (фигуры 19А и В). Как показано на фиг.19В, теоретическая и экспериментально наблюдаемая молекулярные массы находятся в пределах погрешности для каждого конструкта. Суперспираль также отщепляли от типичного привязанного α-HER2/α-EGFR антитела с использованием эндопептидазы Lys-C, для этого антитело сначала обрабатывали эндопептидазой Lys-C, а затем образец подвергали масс-спектрометрическому анализу (фигуры 20А-В). Теоретическая молекулярная масса каждого конструкта находится в пределах погрешности экспериментально наблюдаемой молекулярной массы, что указывает на то, что суперспираль действительно отщепляется от последовательности антитела, и что сама последовательность антитела не расщепляется. Результаты масс-спектрометрии, содержащие молекулярную массу (MS), типичных содержащих суперспираль антител обобщены в таблице 2.
плечом
FC 26568
HC 50665
НС 55016
Пример 4. Характеристика рекомбинантных антител
Для определения сохранения у типичных рекомбинантных антител, сконструированных с использованием суперспиральных доменов гетеродимеризации, способностей связывания антител, от которых получали их последовательности, выполняли анализы связывания. Эти анализы связывания проводили с использованием программы Wizard для кинетических параметров на системе ForteBio Octet. Концентрация для всех анализированных образцов составляла 25 мкг/мл, концентрация, показывающая насыщенность проб к IgG человека в повторяющихся экспериментах и с различными образцами. Пробы нагружали первым образцом в течение 15 минут и промывали 30 секунд в PBS. Все объединения для второго и третьего образцов выполняли в течение 10 минут с 30-секундными промываниями в PBS между объединениями.
В частности, пробу к IgG человека (октет) нагружали биспецифическим рекомбинантным антителом к FcεR1/к FcγR2b с общей LC путем инкубации пробы с 25 мкг/мл антитела в течение 15 минут с последующим этапом промывания в PBS. Для оценивания связывания нагруженную пробу инкубировали с 25 мкг/мл FceR1, а затем с 25 мкг/мл FcγR2b. Между двумя инкубациями для связывания выполняли стадию промывания в PBS. Данные, представленные на фиг.15 показывают, что биспецифическое рекомбинантное антитело одновременно связывало оба эти антигена.
Для анализа функциональности рекомбинантных антител клеточную линию базофильного лейкоза крыс (RBL), созданную для экспрессии FcεRIa человека и FcγR2b1 человека, культивировали в течение 72 часов при 37°С с 1 мкг/мл NP-специфического IgE человека (JW8.5.13) в полной ростовой среде (MEM с солями Игла от Gibco, № по каталогу 11090, 1 мМ глутамина (Genentech Inc.), 1 мМ пирувата натрия (Gibco № по каталогу 11360-070), 0,1 мМ заменимых аминокислот (Gibco №по каталогу 11140-050), 1,5 г/л бикарбоната натрия (Gibco №по каталогу 25080-094), 15% эмбриональной телячьей сыворотки (Hyclone № по каталогу SH3 0071.03). Клетки трипсинизировали и высевали в 96-луночный плоскодонный планшет для тканевых культур с 3,5×105 клеток/мл в 200 мкл полной ростовой среды, содержащей 1 мкг/мл NP-специфического IgE человека, и позволяли адгезии протекать в течение 2 часов. Затем клетки три раза промывали свежей средой для удаления несвязанного NP-специфического IgE человека. Клетки обрабатывали 0-10 мкг/мл биспецифического антитела и инкубировали в течение 1 часа при 37°С перед активацией антигеном. Клетки активировали инкубацией с 0,1 мкг/мл NP-конъюгированного овальбумина (Biosearch Technologies, Inc., № по каталогу N-5051-10) в течение 45 минут при 37°С.После инкубации измеряли уровни гистамина в клеточных супернатантах (клеточной культуральной среде) с помощью ELISA (иммуносорбентного анализа со связыванием фермента) с использованием набора Histamine ELISA (KMI Diagnostics, Миннеаполис, Миннесота). Фоновые уровни гистамина получали из клеток, обработанных только NP-специфическим IgE человека без активации (фигура 16).
Также выполняли октетные исследования связывания для типичных антител с одним плечом и привязанных рекомбинантных антител. В качестве контроля использовали октетный анализ, чтобы показать, что антитело к HER2 1 дикого типа и α-EGFR антитело дикого типа не дают перекрестной реакции с антигеном друг друга, но связывают их соответствующий антиген (фигура 21). Для анализа типичных содержащих суперспираль антител антителом к HER2 1 с одним плечом нагружали пробу антител к IgG человека при 25 мкг/мл в течение 15 минут, а затем пробу промывали в PBS в течение 30 секунд. Затем нагруженную пробу инкубировали с EGFR ECD (внеклеточным доменом) при 25 мкг/мл, что показало отсутствие сигнала связывания. Затем пробу промывали в течение 30 секунд в PBS и инкубировали с ECD HER2 рецептора при 25 мкг/мл, что позволило зарегистрировать сильный сигнал связывания (фигура 22; верхняя кривая).
Пробу антитела к IgG человека нагружали EGFR рекомбинантным антителом с одним плечом при 25 мкг/мл в течение 15 минут, а затем промывали в PBS в течение 30 секунд. Затем пробу инкубировали с HER2 ECD при 25 мкг/мл, что показало отсутствие сигнала связывания. Пробу промывали в течение 30 секунд в PBS и инкубировали с EGFR BCD при 25 мкг/мл, что позволило зарегистрировать сильный сигнал связывания (фигура 22; нижняя кривая).
Привязанное биспецифическое рекомбинантное антитело к EGFR(D1.5)/K HER2 инкубировали с пробой антитела к IgG человека при 25 мкг/мл в течение 15 минут, а затем промывали в PBS в течение 30 секунд. При этой инкубации нагружали пробу биспецифическим антителом. Затем пробу инкубировали с EGFR ECD при 25 мкг/мл в течение 3 минут с последующим 30-секундным промыванием в PBS, а затем инкубировали с ECD HER2 рецептора при 25 мкг/мл в течение 3 минут (фигура 23А; нижняя кривая). Для получения результатов, показанных на нижней кривой фигуры 23А, нагруженную биспецифическими антителами пробу сначала инкубировали с ECD HER2 рецептора, а затем с ECD EGFR. Данные показали, что биспецифическое рекомбинантное антитело одновременно связывает и EGF, и HER2 рецепторы. Как показано на фиг.23 В, биспецифическое антитело к EGFR(D1.5)/K HER2 связывает HER2 с Kd приблизительно 0,06 нМ и связывает EGF рецептор с Kd приблизительно 0,660 нМ.
Для последующего анализа характеристик связывания рекомбинантных антител выполняли основанные на клетках анализы на двух клеточных линиях, либо NR6, экспрессирующих EGFR или HER2, либо клетках НСА7, которые коэкспрессируют и EGFR, и HER2. Перед выполнением испытаний связывания клетки собирали и оставляли охлаждаться в течение 30 минут на льду в буфере для связывания (среда RPMI с 1% эмбриональной телячьей сыворотки (FBS), 10 мМ HEPES и 0,2% NaN3). Немеченое антитело получали с желаемой исходной концентрацией и разбавляли 1:1 буфером для связывания для получения нескольких точек данных. Меченое антитело получали с одной концентрацией, подлежащей применению во всем анализе. Исследования равновесного связывания выполняли с использованием меченного радиоактивным изотопом антитела конкурентным методом при различных концентрациях немеченого антитела. В 96-луночный планшет помещали немеченое антитело, потом меченый материал, а затем в смесь добавляли клетки. Планшет инкубировали в течение 2 часов при комнатной температуре. После инкубации клетки в планшете собирали с использованием мембраны Millipore для планшетов Multi-Screen для отделения раствора от клеток. Связанное с клеткой меченное радиоактивным изотопом антитело затем подсчитывали на счетчике Perkin Elmer Gamma, данные анализировали с использованием программного обеспечения New Ligand. Результаты исследований сродства к связыванию для конструктов антитела с одним плечом и привязанного рекомбинантного антитела обобщены в таблице 3.
Функциональные свойства типичных рекомбинантных антител также характеризовали биохимически. Экспрессирующие EGFR клетки NR6 высевали в 12-луночные планшеты. После сывороточного голодания клетки предварительно инкубировали с различными концентрациями антител в течение 2 часов при 37°С. Затем клетки стимулировали TGFα в течение 12 минут. Цельные клеточные лизаты подвергали анализу SDS-PAGE, а иммуноблоты исследовали с анти-фосфотирозином, анти-фосфоАkt или анти-тубулином в качестве загрузочного контроля (фигура 24). Эти результаты показывают, что типичное α-EGFR(D1.5)/к HER2 (антитело 1) рекомбинантное антитело, подобно D1.5 IgG1 контрольному антителу, ингибировало индуцированное TGFα фосфорилирование в экспрессирующих EGFR клетках NR6 в зависимости от дозы.
Для испытаний клеточной пролиферации клетки высевали в 96-луночные планшеты (EGFR-NR6: 2000 клеток/лунка) (ВТ474: 10000 клеток/лунка) и инкубировали в течение ночи при 37°С. На следующий день среду удаляли, а клетки обрабатывали содержащей 1% сыворотки средой. Для сравнения эффекта на клеточный рост α-EGFR(D1.5)/к HER2 (антитело 1) рекомбинантного антитела с D1.5 антителом на клетках EGFR-NR6 в среду добавляли 3 нМ TGFα и клетки обрабатывали антителами с различными концентрациями. Через 3 дня в каждую лунку добавили AlamarBlue и флуоресценцию считывали с использованием 96-луночного флуорометра с возбуждением при 530 нм и испусканием 590 нм. Результаты выражены в относительных единицах флуоресценции (RFU) (фигура 25). Для сравнения эффекта на клеточный рост α-EGFR(D1.5)/K HER2 (антитело 1) рекомбинантного антитела с антителом к HER2 1 клетки ВТ474 обрабатывали содержащей 1% сыворотки средой с различными концентрациями антитела (фигура 26). Через 5 суток выполняли анализ AlamarBlue, как описано выше. Эти результаты показывают, что типичное α-EGFR(D1.5)/к HER2 (антитело 1) рекомбинантное антитело подобно D1.5 IgG1 контрольному антителу ингибировало индуцированное TGFa фосфорилирование в экспрессирующих EGFR клетках NR6 в зависимости от дозы и подобно антителу к HER2 1 ингибировало рост клеток ВТ474.
Пример 5. Анализ фармакокинетических показателей рекомбинантных антител
Исследования фармакокинетических показателей проводили для сравнения фармакокинетических показателей (РК) биспецифического рекомбинантного антитела с таковыми типичных антител к IgG человека (hIgG) и для определения дозировки для эффективности экспериментов. Подобно D1.5 hIgG1 контрольному антителу HER1/HER2 (D1.5/антитело к HER2 1) рекомбинантное антитело также показало перекрестную отвечаемость у мышей. Антитело к HER2 2 hIgG1 контрольное антитело не показало перекрестной отвечаемости у мышей.
PK D1.5 hIgG1 антитела положительного контроля определяли за 10-суточный период с использованием мышей SCID Beige. В частности, концентрацию антитела в сыворотке с течением времени определяли с использованием анализа Fc-Fc после введения антитела при различных дозах (0,5 мг/кг, 5 мг/кг и 50 мг/кг). Кроме того, концентрацию в сыворотке по отношению к дозе контролировали в течение десяти суток с использованием анализа ELISA Fc-Fc (фигура 27). Также определяли площадь под кривой (AUC), нормализованную относительно дозы, и обобщали в таблице 4. D1.5 hIgG1 антитело показало нелинейные PK у мышей в диапазоне анализированных доз.
Кроме того, PK анти-HER2 антитела-2 hIgG1 антител положительного контроля также определяли за 10-суточный период с использованием мышей SCID Beige. Концентрацию антитела в сыворотке с течением времени определяли с использованием ELISA Fc-Fc или ELISA HER2-ECD (внеклеточного домена) после введения антитела при 10 мг/кг. AUC, нормализованную относительно дозы, также определяли и обобщали в таблице 5.
Подобным образом, РК HER1(EGFR)/HER2 (D1.5/антитело-1 к HER2) рекомбинантного антитела определяли за десятисуточный период у мышей SCID Beige. Концентрацию антитела в сыворотке с течением времени определяли с использованием ELISA Fc-Fc или ELISA EGFR-HER2 после введения антитела при различных дозах (0,5 мг/кг, 5 мг/кг и 20 мг/кг). Кроме того, концентрацию в сыворотке в зависимости от дозы контролировали в течение десяти суток с использованием ELISA Fc-Fc или ELISA EGFR-HER2 (фигура 28). AUC, нормализованную относительно дозы, также определяли и обобщали в таблице 6. HER1(EGFR)/HER2 (D1.5/антитело к HER2 1) рекомбинантное антитело показало нелинейные РК у мышей в диапазоне анализированных доз.
На основе результатов испытаний РК определили, что HER1(EGFR)/HER2 (D1.5/антитело-1 к HER2) рекомбинантное антитело оказывает подобное или лучшее воздействие на мышей за период времени анализа (до 10 суток) по сравнению с D1.5 hIgG1 контрольным антителом (фигура 29).
Пример 6. Получение привязанных антител в рекомбинантных линиях клеток млекопитающих с экспрессией ферментов для отщепления привязок
Для конструкции 26АА расщепляемых фурином привязанных антител с суперспиралью (фигура 30А) сначала получали VH-домен (без сигнальной последовательности) желаемого антитела с использованием ПЦР, где 5'-праймер содержал 3' половину привязки GGS-фурин и был терминирован по 5' BamHI сайту, а 3'-праймер был терминирован по 3' ApaI сайту. Фрагменты расщепляли и клонировали в полученный подобным образом антитело-суперспиральный остовный вектор. Затем получали соответствующую LC желаемого антитела с использованием ПЦР, где 5'-праймер был терминирован по 5' ClaI сайту, и 3'-праймер содержал 5' часть привязки фурин-GGS и был терминирован по 3' BamHI. Фрагмент LC присоединяли к соответствующей ей НС (теперь в суперспиральный остов антитела) путем клонирования фрагмента в переднюю часть VH посредством ClaI и BamHI. Завершенная последовательность привязки, связывающая CL с VH, представляла собой RCRRGSGGSGGSGGSGGSGGSGRSRKRR (SEQ ID NO:35). Для конструкции 26АА отщепляемой фурином привязки (-С) (фигура 30В) две мутации вводили в вышеупомянутый конструкт. Выполняли мутацию С-концевого остатка Cys LC в остаток Ala с использованием набора Quikchange II XL для направленного на сайт мутагенеза от Stratagene. В соответствии с системой нумерации по Kabat концевой остаток Cys в CL находится в положении 214. Также выполняли мутацию С220 НС в А для устранения возможного ошибочного сворачивания из-за этого нового не связанного дисульфидом Cys.
Способы, примененные в конструировании 32АА расщепляемой фурином привязки (фигура 30С) были идентичны таковым для конструкции 26АА расщепляемой фурином привязки, за исключением того, что окончательная последовательность привязки представляла собой RKRKRRGSGGSGGSGGSGGSGGSGRSRKRR (SEQ ID NO:36). Для усиленной экспрессии фурина человеческий или мышиный фурин клонировали в векторную систему pRK и совместно трансфицировали плазмидами цепи антитела.
Расщепление карбоксипептидазой В (фигура 30D) выполняли в 50 мМ бората натрия при рН 8,0 в течение 1 часа при 37°С с 1:20 мас.:масс. СрВ.
На фиг.30А1-2 представлена схема и краткие результаты масс-спектрометрии (MS) для 26 аминокислотной отщепляемой фурином привязки. Кривая или график MS тяжелой цепи показывает тяжелую цепь (1), которая содержит полные нативные N- и С-концы, а также меньшее количество «полноразмерного антитела» (т.е. в этих исследованиях не было расщеплено по какому-либо фуриновому сайту (FL)). Кривая MS легкой цепи показывает пик, соответствующий LC с полноразмерной привязкой (1), и три другие пика (2-4), соответствующих разрушению 3'-конца привязки, предположительно из-за активности карбоксипептидазы В в среде СНО. Отсутствие пиков MS на участке нижней кривой, обозначенном лиловым овалом, свидетельствует об отсутствии расщепления по N-концевому фуриновому сайту. На рисунке полученного антитела демонстрируются ненативные остатки (подчеркнутая «R»), а также 23-26 аминокислотная привязка, все еще прикрепленная к С-концу LC.
На фиг.30В 1-2 представлена схема и краткие результаты масс-спектрометрии (MS) для 26 аминокислотной отщепляемой фурином привязки («-С»), В этом конструкте остаток С удаляли и замещали. Кривая MS тяжелой цепи показывает тяжелую цепь (1), которая имеет полные нативные N- и С-концы и отсутствие остального «полноразмерного антитела» (FL). Кривая MS легкой цепи показывает пик, соответствующий LC с 2 дополнительными остатками R (пик 2) с одним дополнительным остатком R (пик 3) и с ее нативным С-концом (пик 4), предположительно из-за активности карбоксипептидазы В в среде СНО. На рисунке полученного антитела демонстрируются ненативные остатки (желтый цвет), а также 0, 1 или 2 остатка R, все еще прикрепленные к С-концу LC.
На фиг.30С 1-5 представлена схему и краткие результаты масс-спектрометрии (MS) для 32 аминокислотной отщепляемой фурином привязки. На фиг.30С3 показана тяжелая цепь (пик 1), которая содержит полные нативные N- и С-концы, а также меньшее количество «полноразмерного антитела» (FL), которое не было расщеплено по какому-либо фуриновому сайту. На фиг.30С2 и 30С3 показан материал, полученный из клеток СНО, экспрессирующих нативные уровни фурина, тогда как на фиг.30С4 и 30С5 показан материал, полученный из клеток СНО, усиленно экспрессирующих фурин. На фиг.30С2 показан пик, соответствующий LC с полноразмерной привязкой (пик 1), и пять других пиков (пики 2-6), соответствующих разрушению 3'-конца привязки, а также дополнительный пик, показывающий, что LC только с распознающей фурин последовательностью все еще прикреплена (пик 7), и пять дополнительных пиков (пики 8-12), соответствующих разрушению С-концевых основных остатков, предположительно из-за активности карбоксипептидазы В в среде СНО. На фиг.30С5 показана тяжелая цепь (1), которая содержит полные нативные N- и С-концы и отсутствие остального полноразмерного антитела (FL), а на фиг.30С4 показана LC, теперь полностью расщепленная по N-концевому фуриновому сайту (7), и четыре дополнительных пика (8-11), соответствующих разрушению С-концевых основных остатков.
Фигура 30D2 является аналогичной Фигуре 30С4. Через 1 час инкубации при 37°С с 1:20 мас.:мас. СрВ остальные остатки (соответствующие пикам 7-11) полностью удаляли, получая в результате LC с нативным с-концом (фигура 30D3). На фигуре показаны только ненативные остатки, подлежащие мутации K222A в каждой НС, а в другом случае полностью нативное (по сравнению с исходным) биспецифическое антитело.
Пример 7. Экспрессия расщепляемого ферментом привязанного мультиспецифического антитела с суперспиралью в эукариотических клетках и получение мультиспецифического антитела без привязок или суперспиралей
Привязанные биспецифические антитела с суперспиралями, содержащие два различных VH и VL, в которых каждое плечо распознает разную мишень, получали в клетках СНО, усиленно экспрессирующих фурин человека, как описано выше. Антитело, которое также содержало мутацию K222A, обрабатывали эндопептидазой Lys-C для удаления суперспирали и карбоксипептидазой В. Для достижения конечного продукта не нужно было, чтобы антитело мутировало далее в шарнире и константных участках. На фиг.31 показана полная кривая масс-спектрометрии конечного продукта. Хотя небольшое количество гомодимера наблюдается в полной MS, это связано с дисбалансом в уровне экспрессии двух цепей Ab и легко исправляется путем модуляции их относительных уровней экспрессии. На фиг.32 показана сокращенная кривая масс-спектрометрии конечного продукта. Наблюдаемые массы LC и НС подтверждают, что все цепи Ab содержат нативные N- и С-концы.
Эти результаты показывают, что эта платформа может быть использована для получения нескольких типов с одним плечом и биспецифическим антител в клетках млекопитающих. Авторам настоящего изобретения удалось создать зрелые биспецифические антитела, отличающиеся от их исходных Ab дикого типа только одной мутацией Lys-Ala в шарнирном участке каждой НС. Эти антитела сохраняют свою специфичность, и биспецифические варианты способны связывать оба антигена одновременно. Эти антитела связывают их антигены с высоким сродством.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ ГЕТЕРОМУЛЬТИМЕРНЫХ БЕЛКОВ | 2011 |
|
RU2624027C2 |
| ПОЛУЧЕНИЕ ГЕТЕРОМУЛЬТИМЕРНЫХ БЕЛКОВ С ИСПОЛЬЗОВАНИЕМ КЛЕТОК МЛЕКОПИТАЮЩИХ | 2015 |
|
RU2727012C2 |
| ВВЕДЕНИЕ ФИКСИРОВАННЫХ ДОЗ HER-АНТИТЕЛ | 2005 |
|
RU2438705C2 |
| КОМПОЗИЦИИ АНТИТЕЛ | 2005 |
|
RU2426554C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО, КОТОРОЕ СВЯЗЫВАЕТСЯ С ДОМЕНОМ II HER2, И ЕГО КИСЛЫЕ ВАРИАНТЫ | 2009 |
|
RU2543664C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, АНАЛОГИ АНТИТЕЛ, КОМПОЗИЦИИ И СПОСОБЫ | 2010 |
|
RU2580038C2 |
| АНТИТЕЛО-ПОДОБНЫЕ СВЯЗЫВАЮЩИЕ БЕЛКИ С ДВОЙНЫМИ ВАРИАБЕЛЬНЫМИ ОБЛАСТЯМИ, ИМЕЮЩИЕ ОРИЕНТАЦИЮ СВЯЗЫВАЮЩИХ ОБЛАСТЕЙ КРЕСТ-НАКРЕСТ | 2012 |
|
RU2695880C2 |
| КОМПОЗИЦИЯ АНТИТЕЛ К HER2 | 2005 |
|
RU2361880C2 |
| ПОЛИПЕПТИДНЫЕ ВАРИАНТЫ С ИЗМЕНЕННОЙ ЭФФЕКТОРНОЙ ФУНКЦИЕЙ | 2005 |
|
RU2367667C2 |
| НОВЫЕ АНТИТЕЛА | 2008 |
|
RU2490277C2 |









































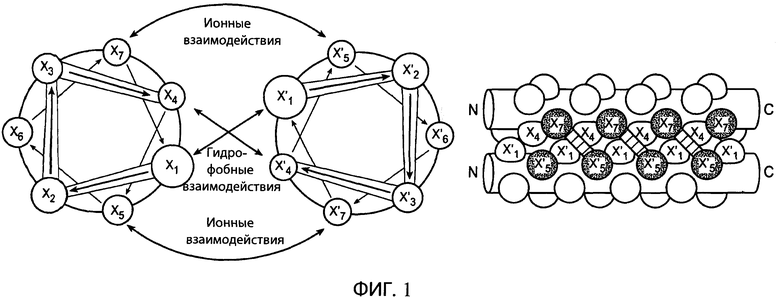

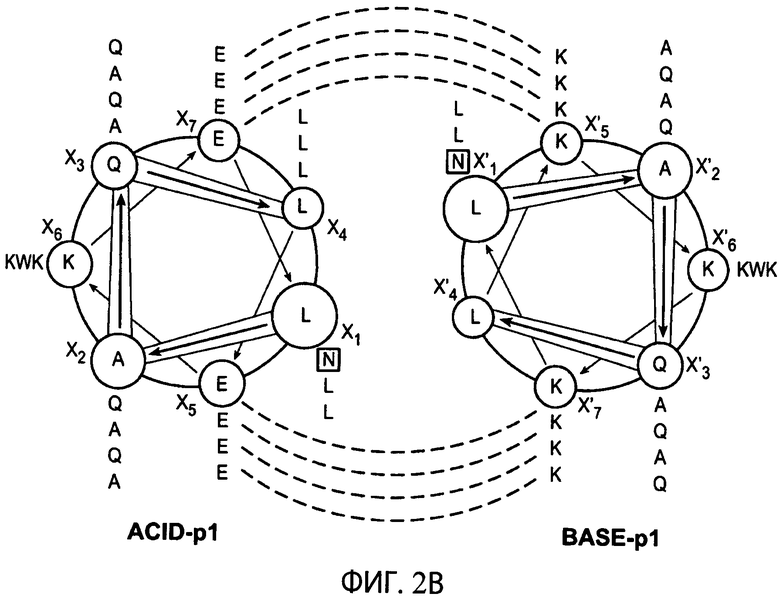
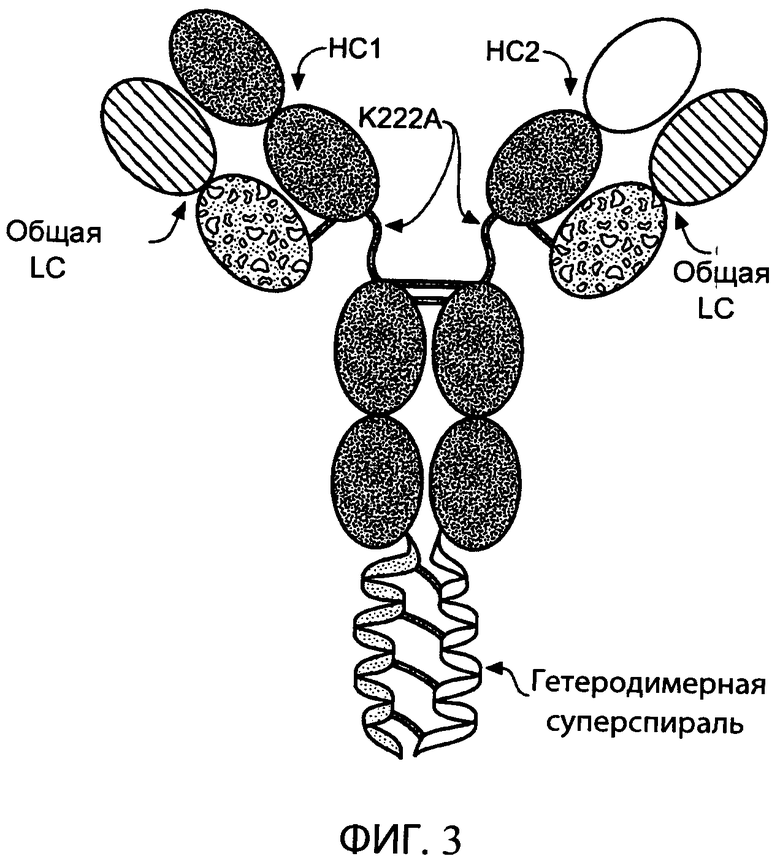
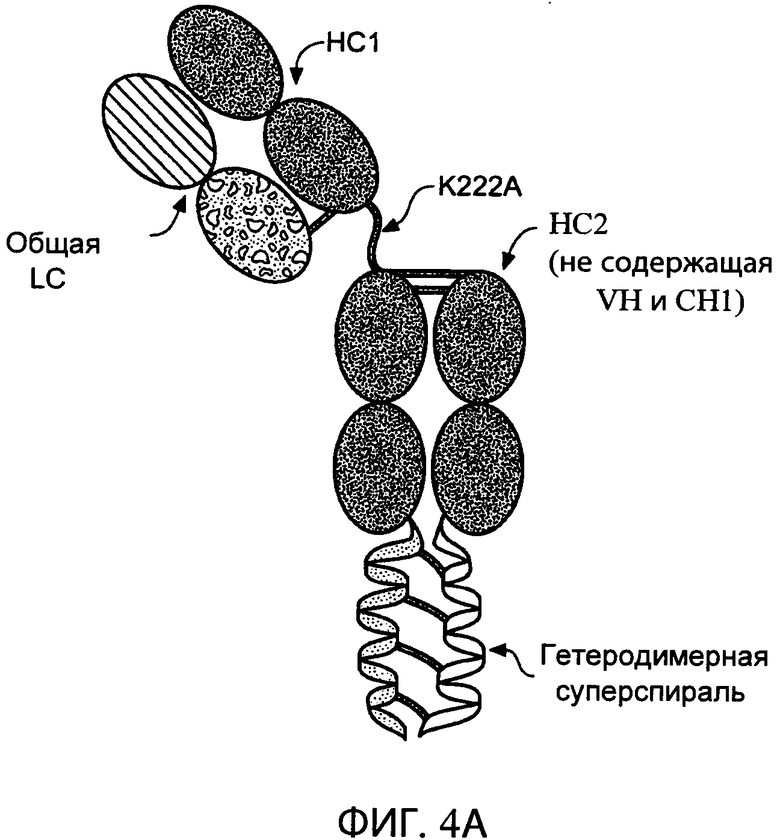
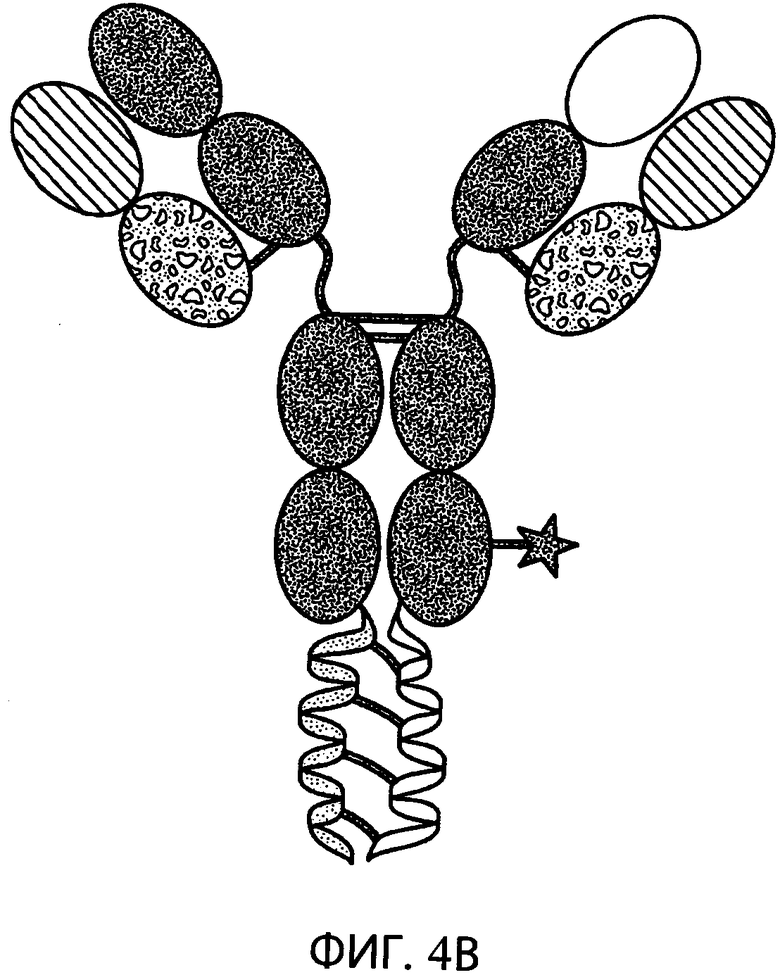
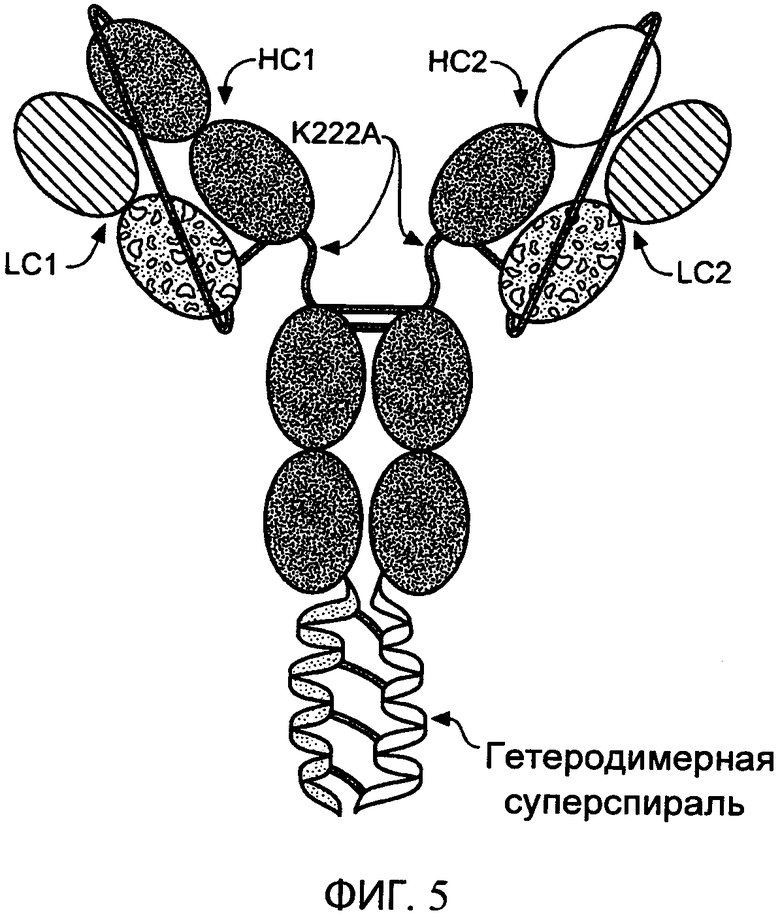
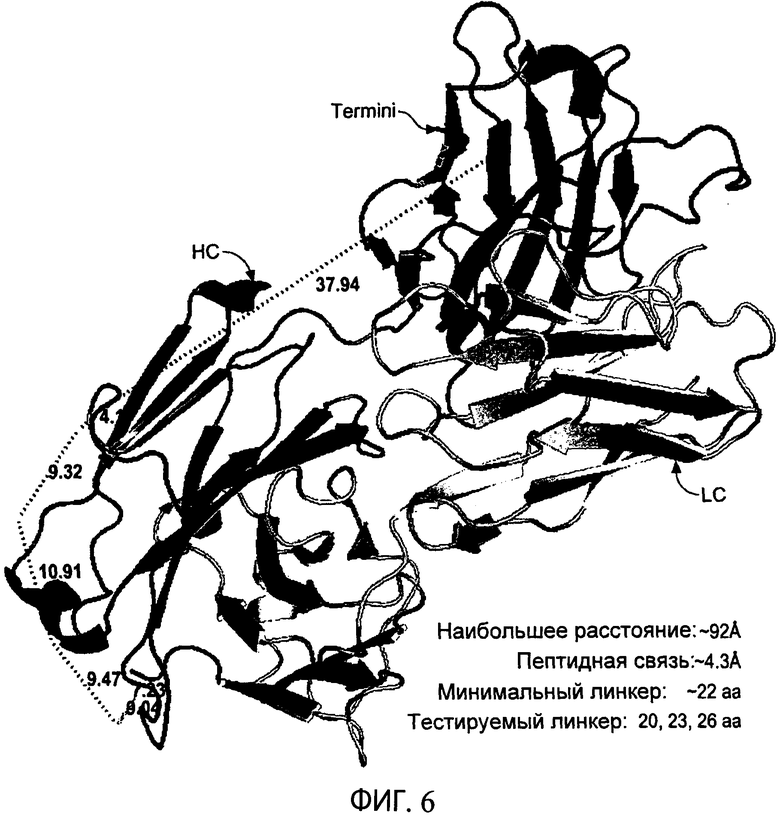
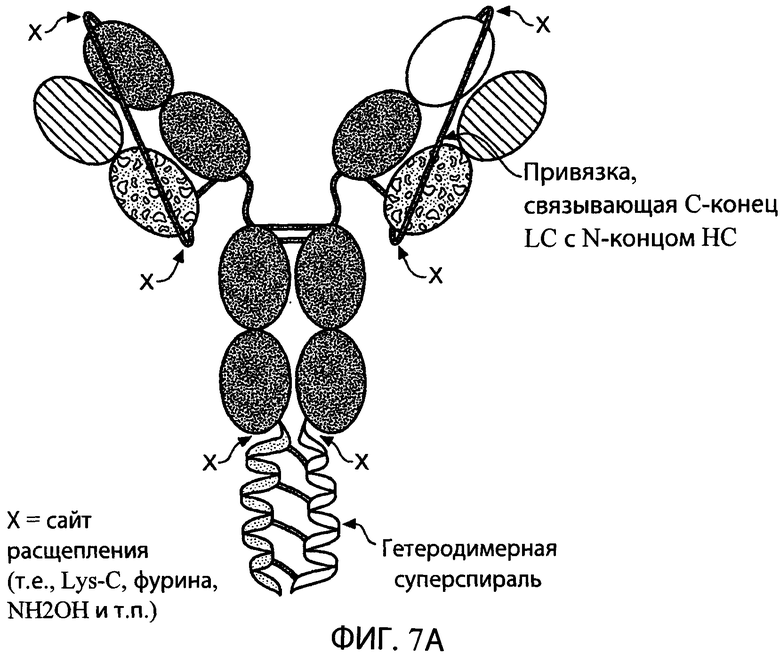
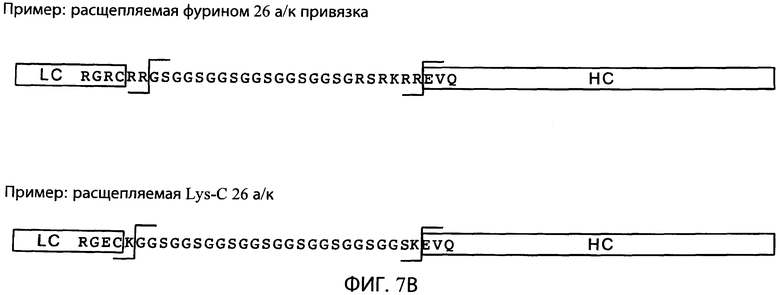









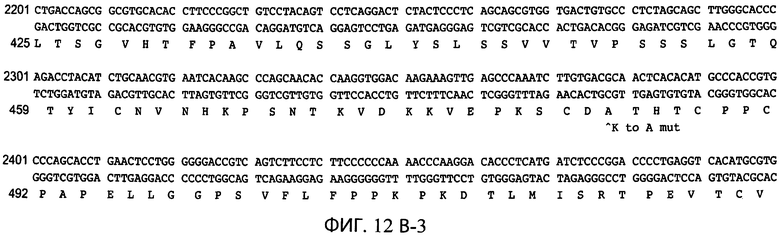
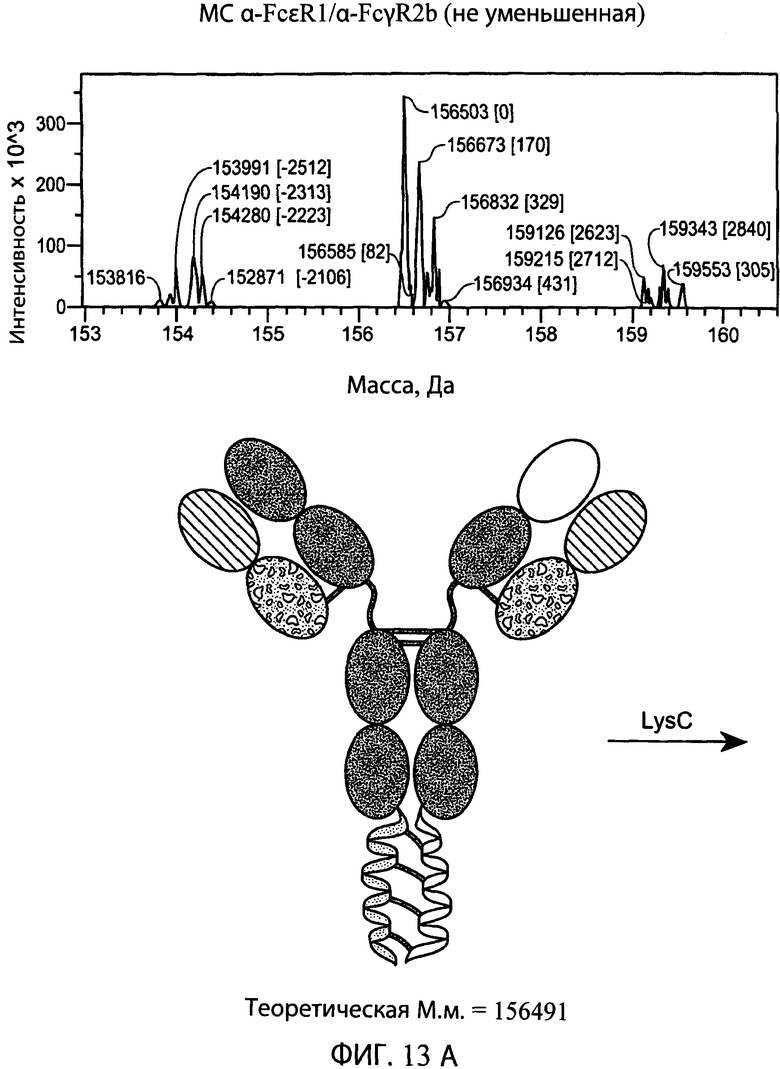
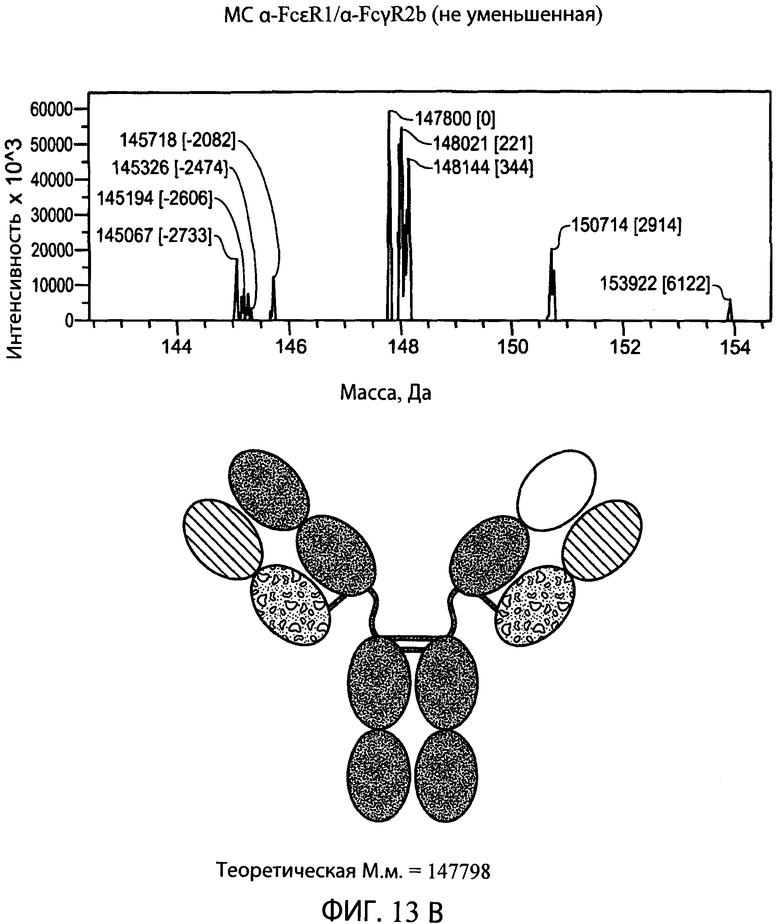
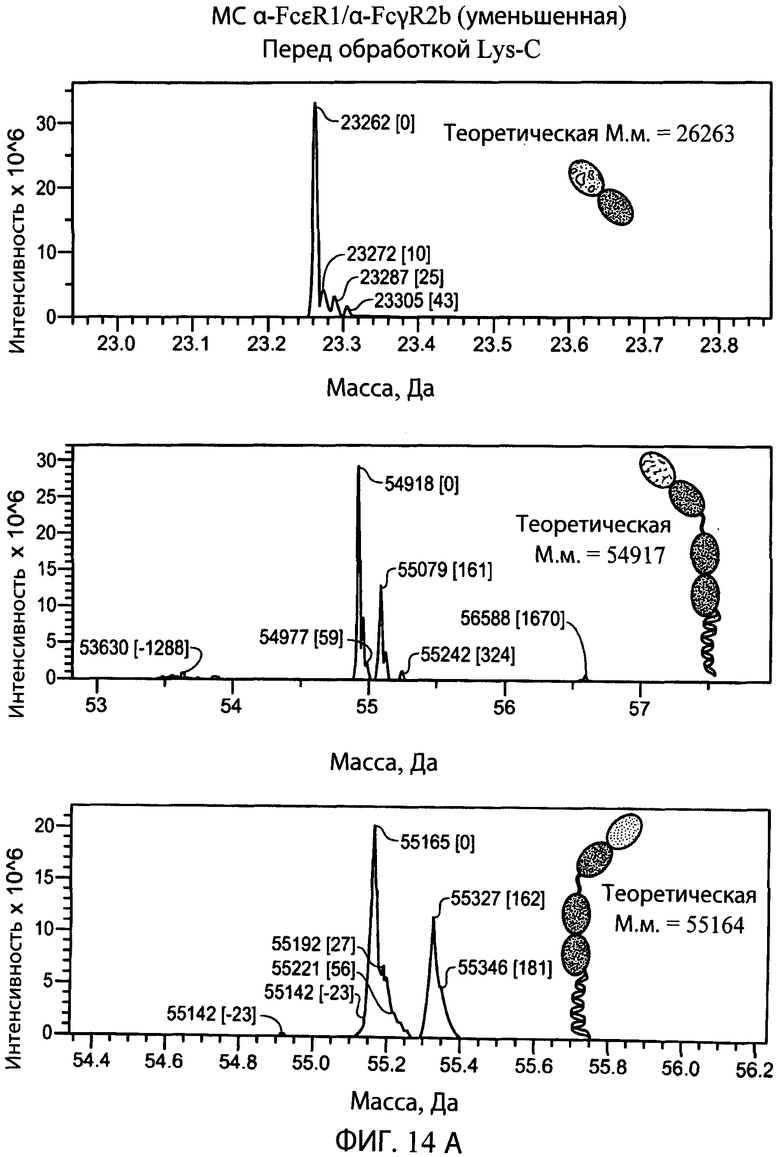
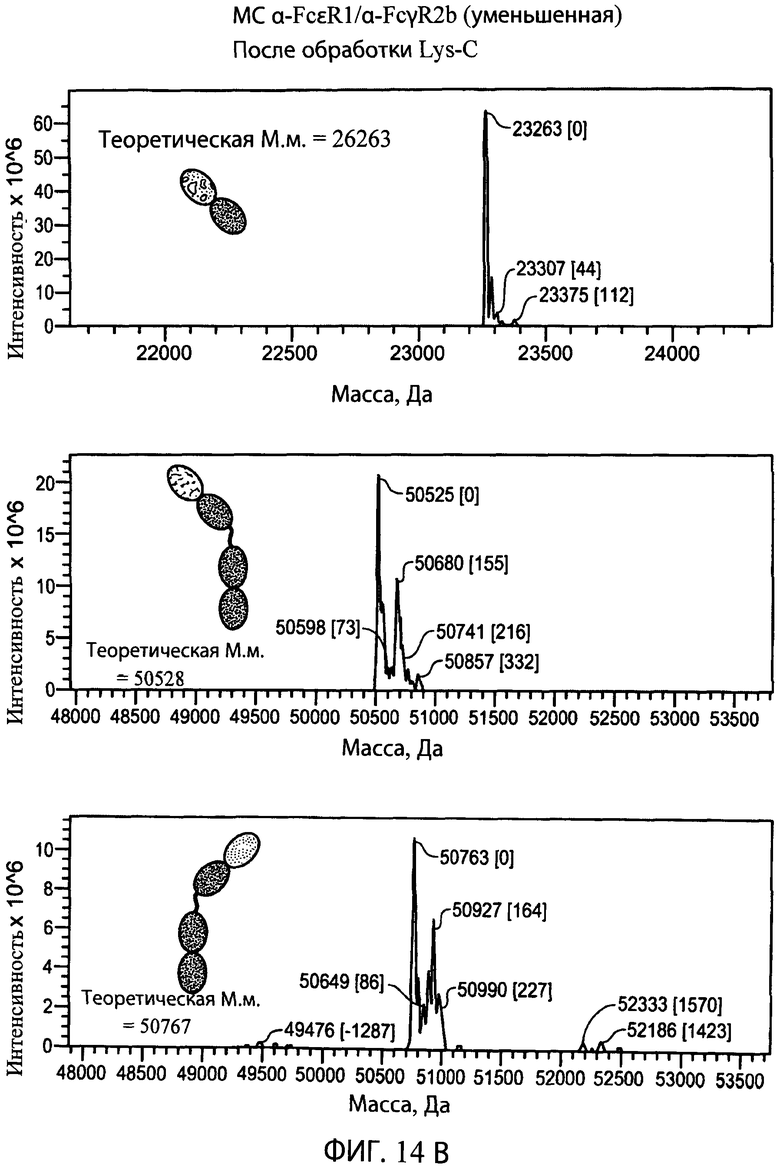
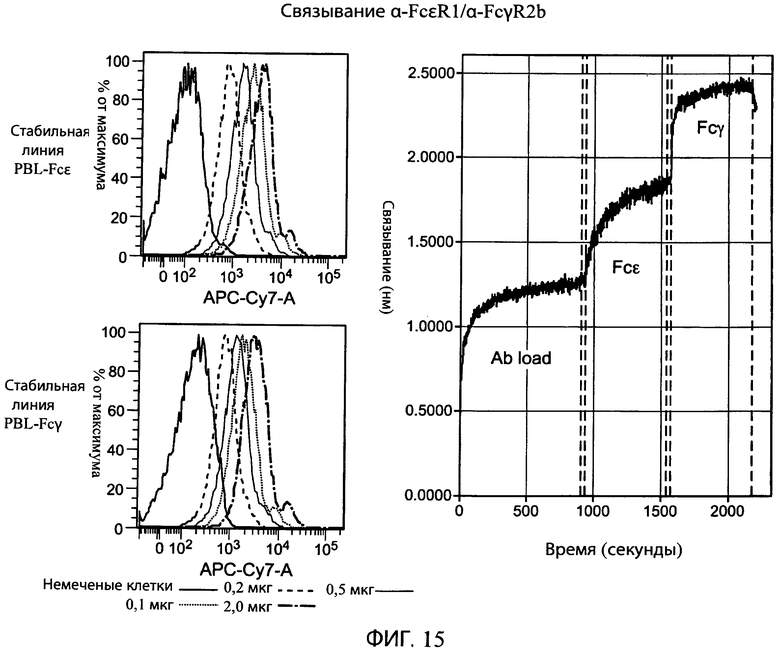
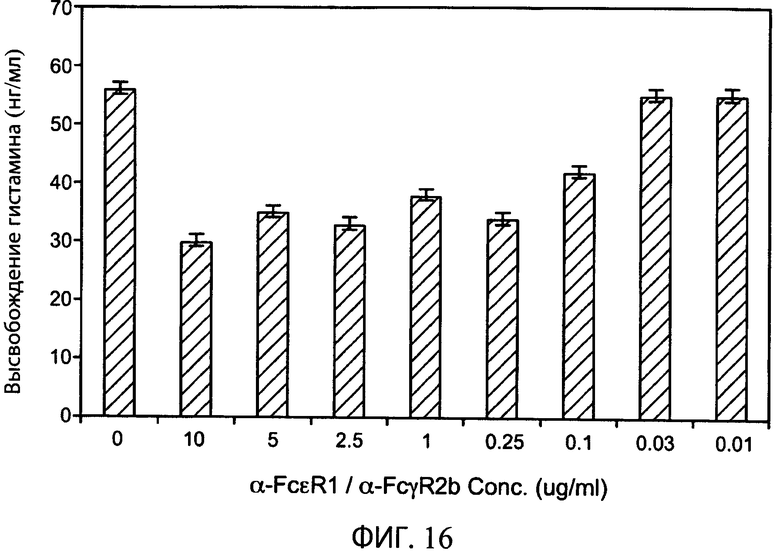
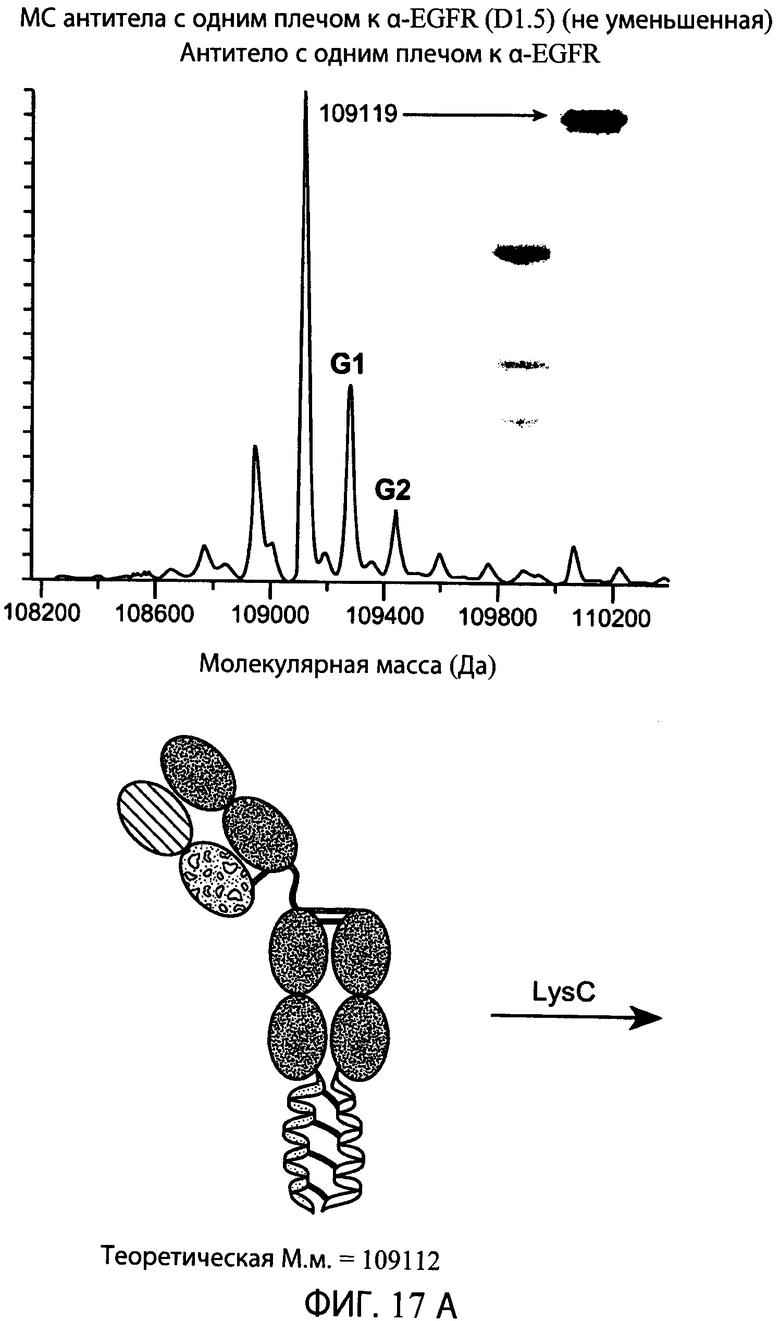
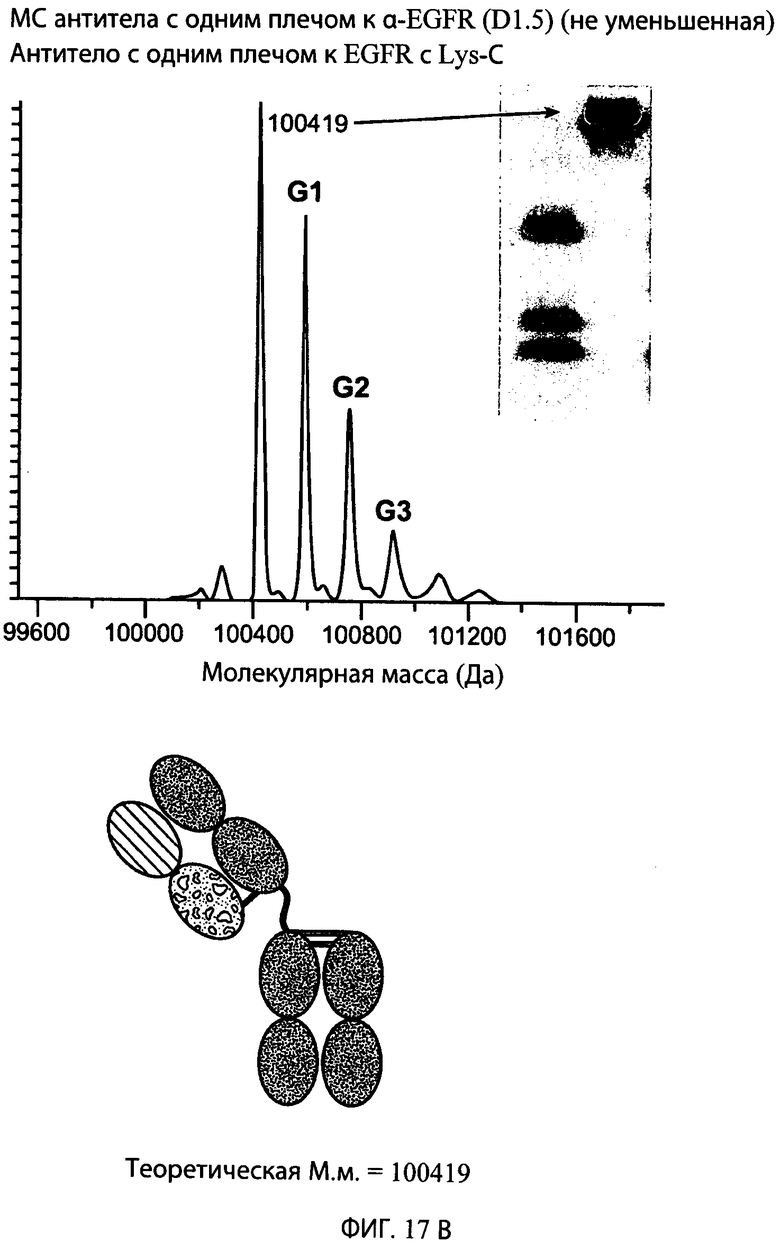

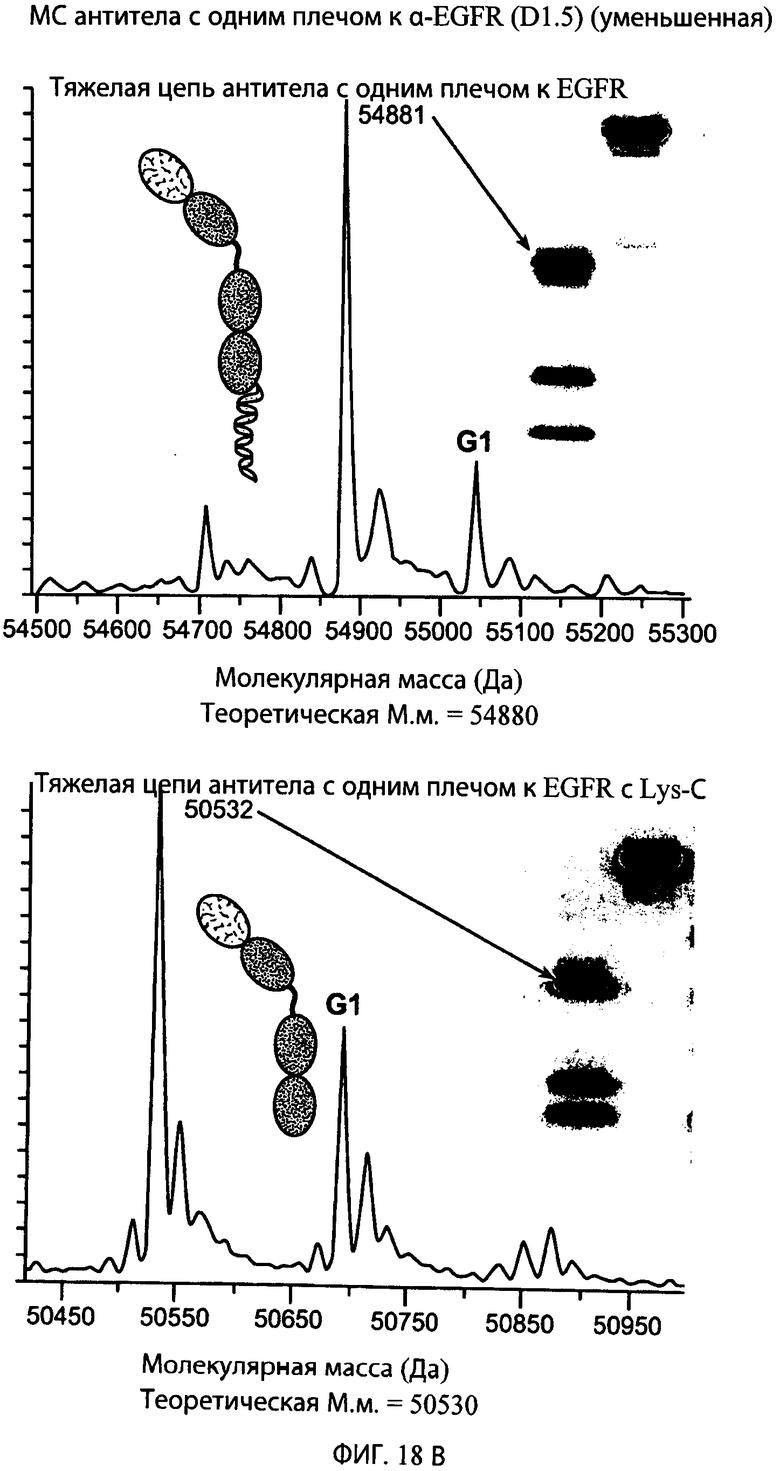
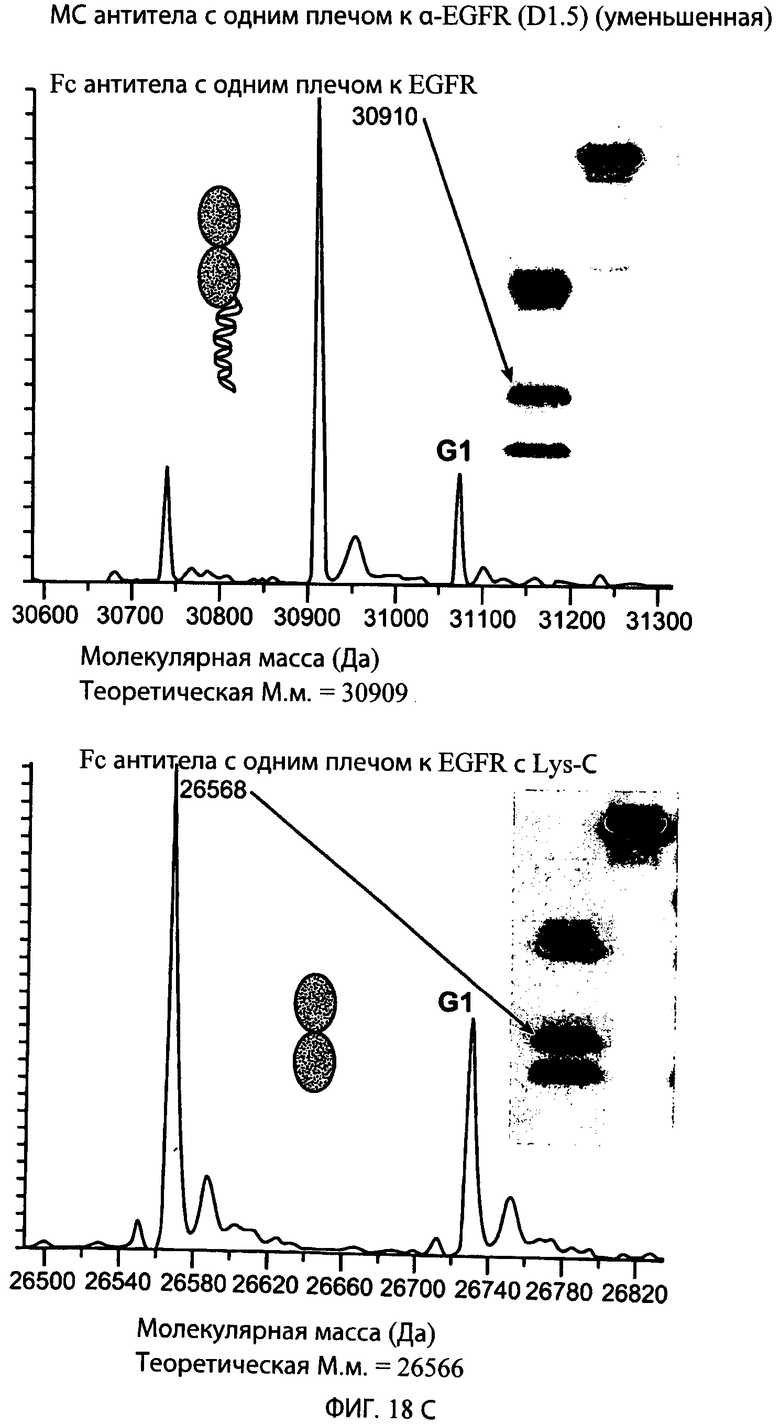
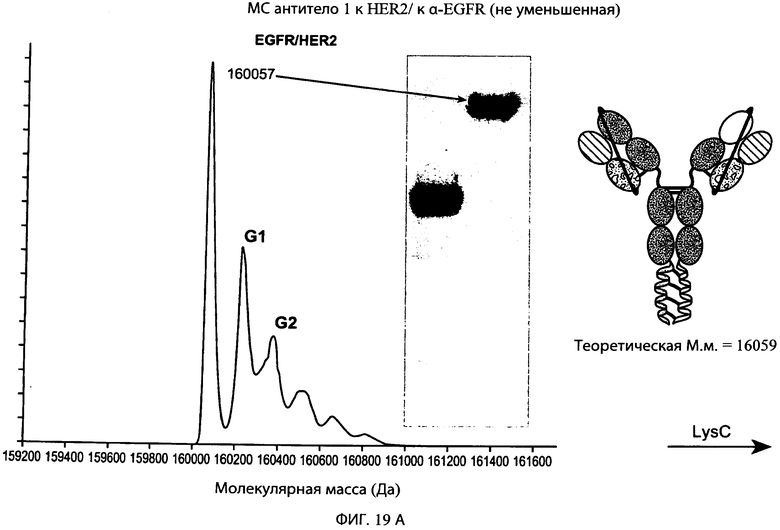
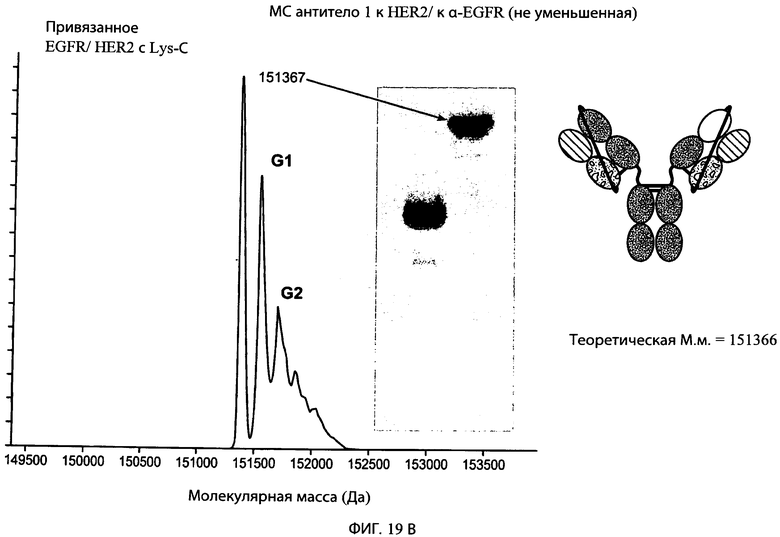
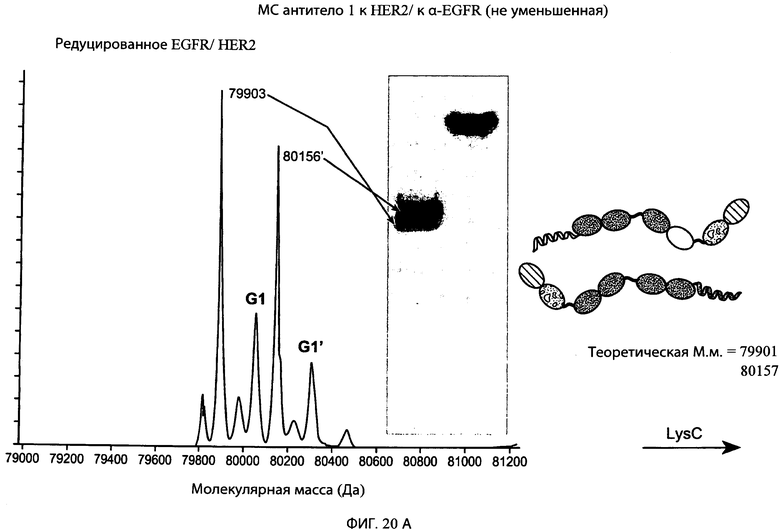
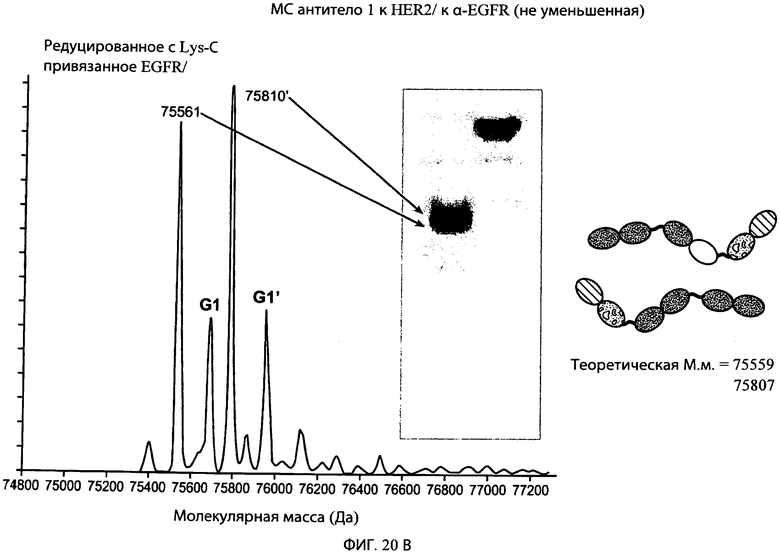
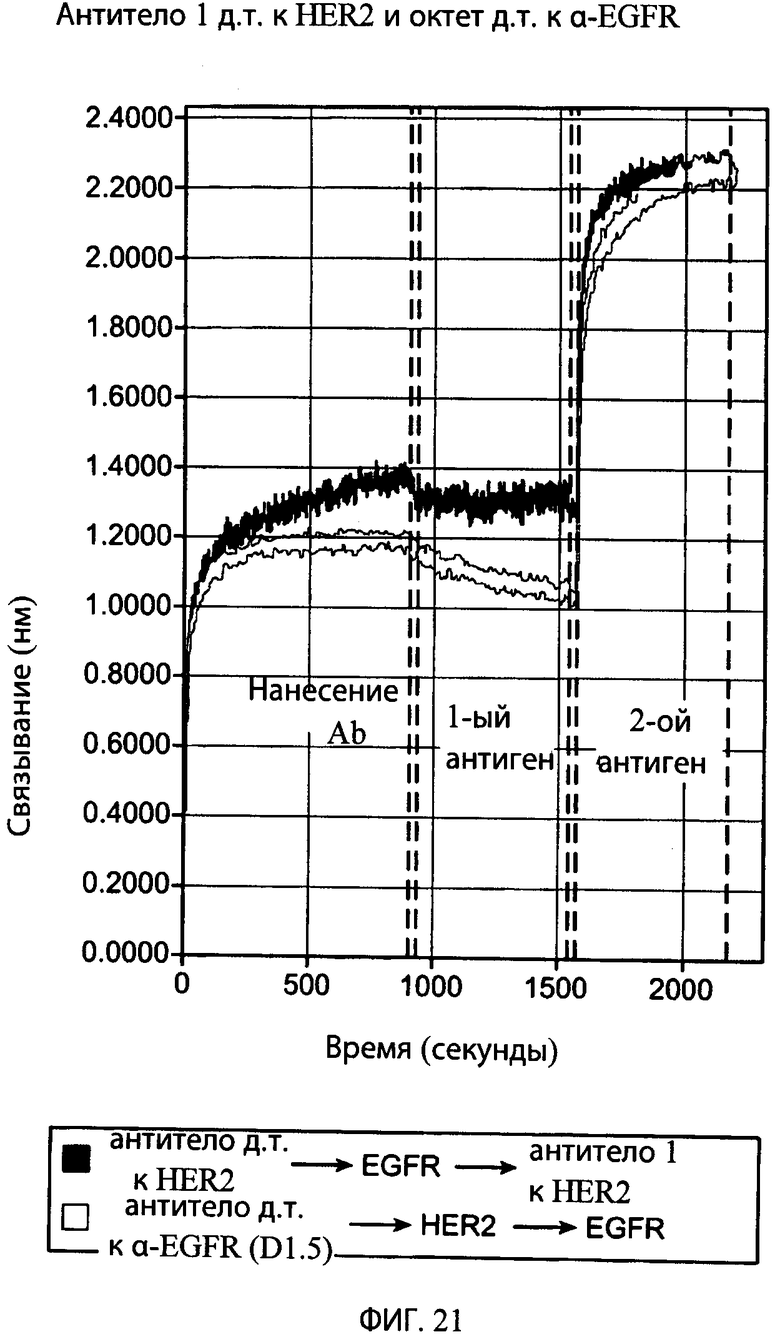

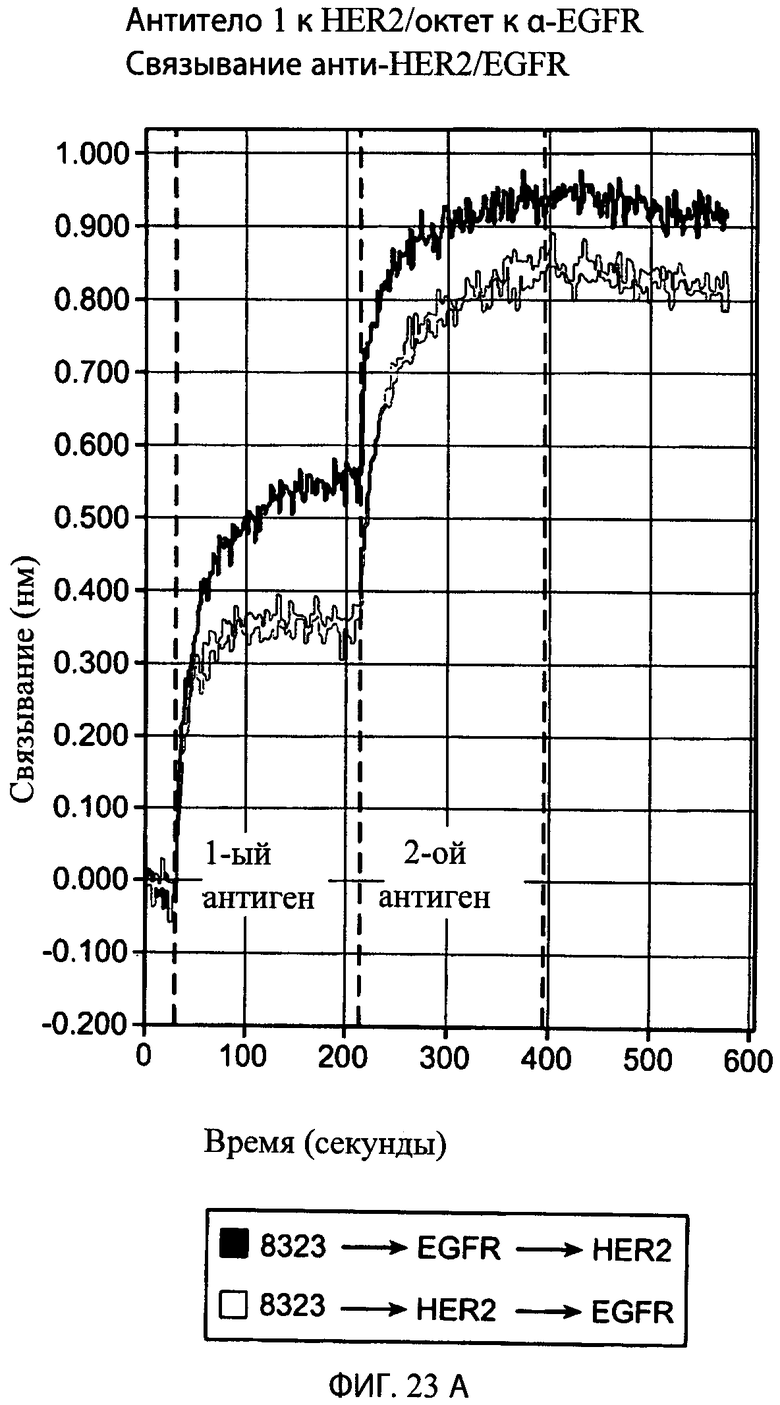
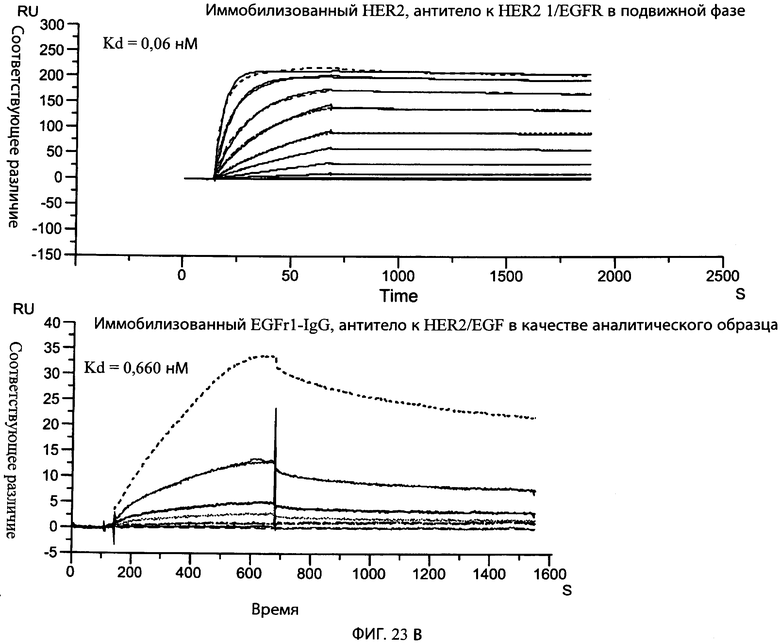
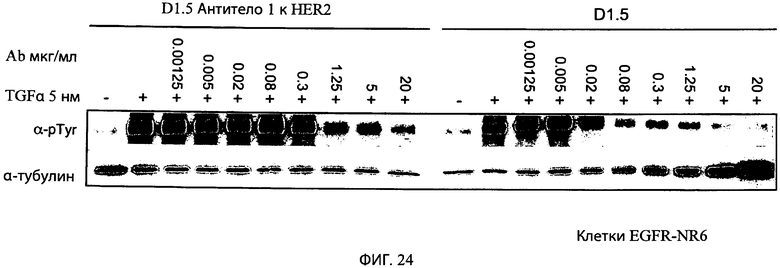
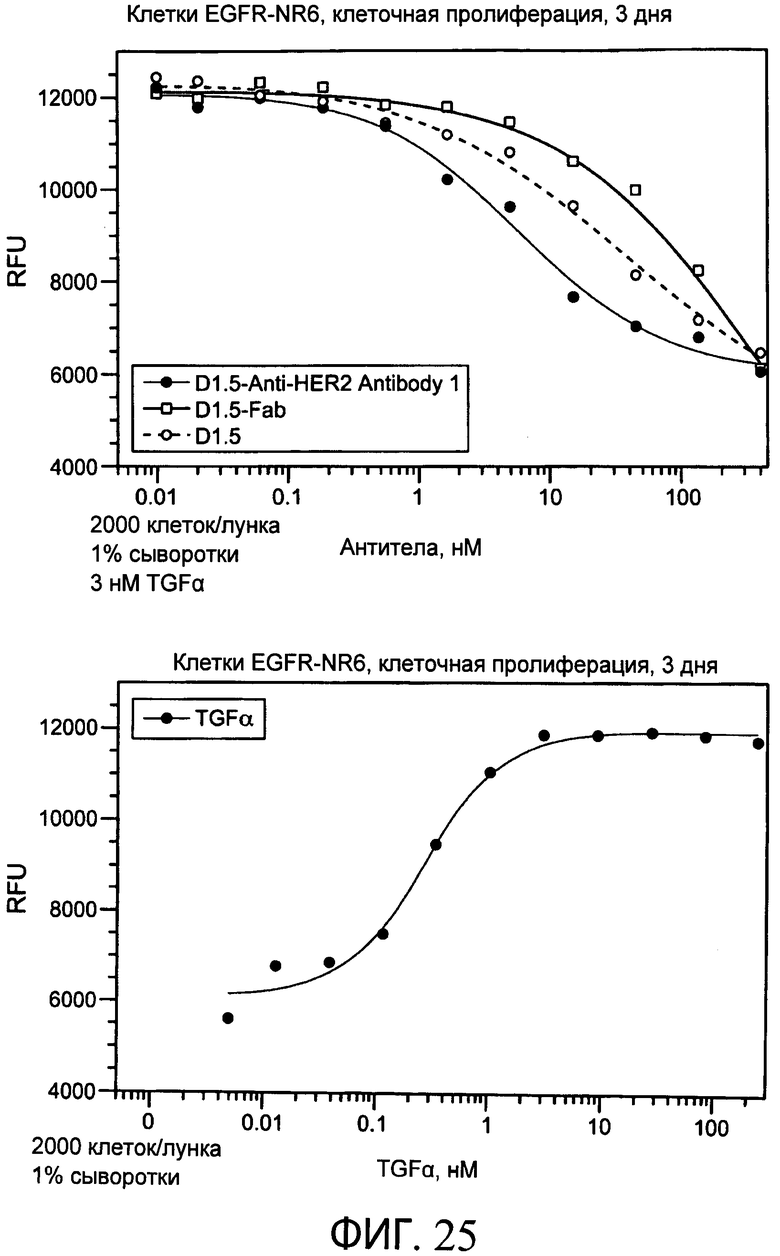
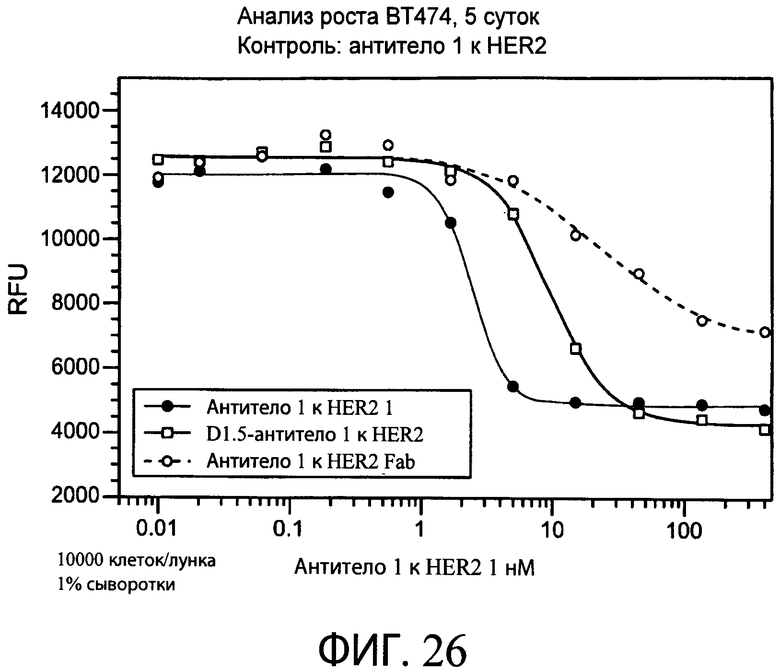
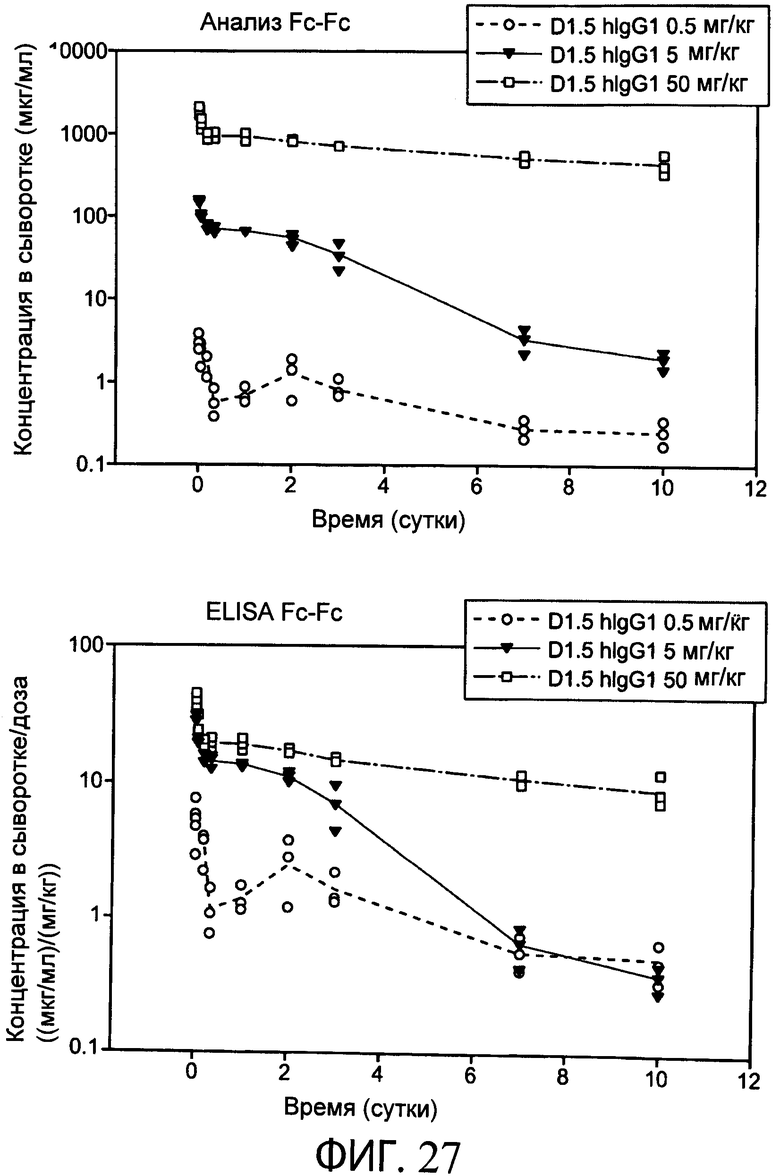
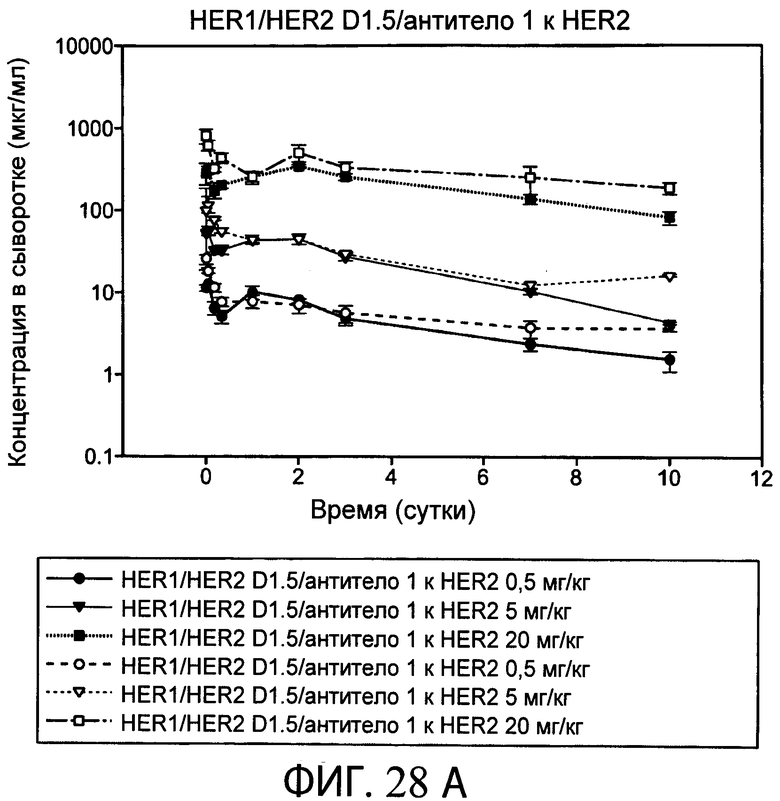
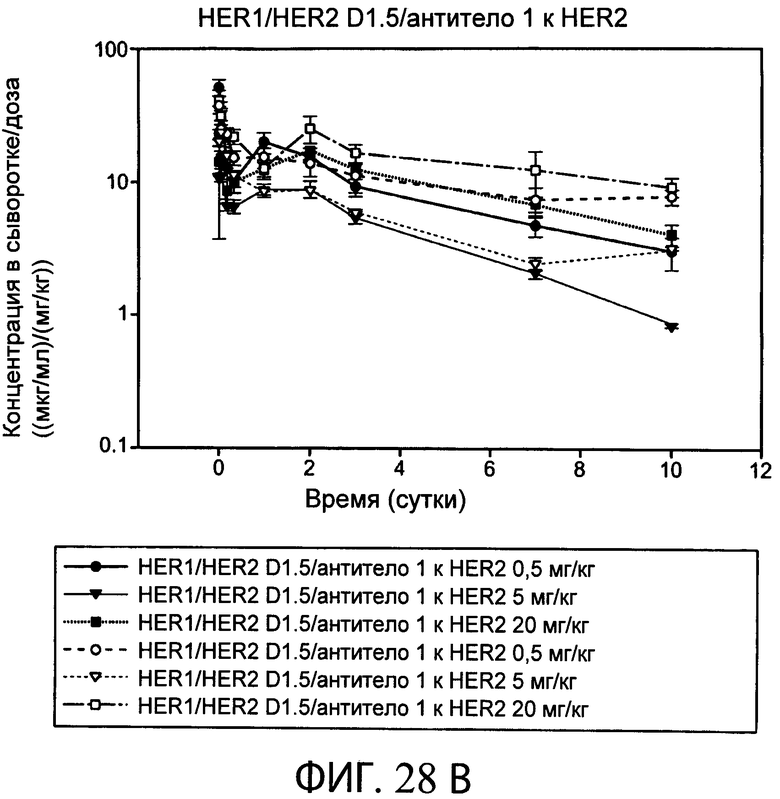
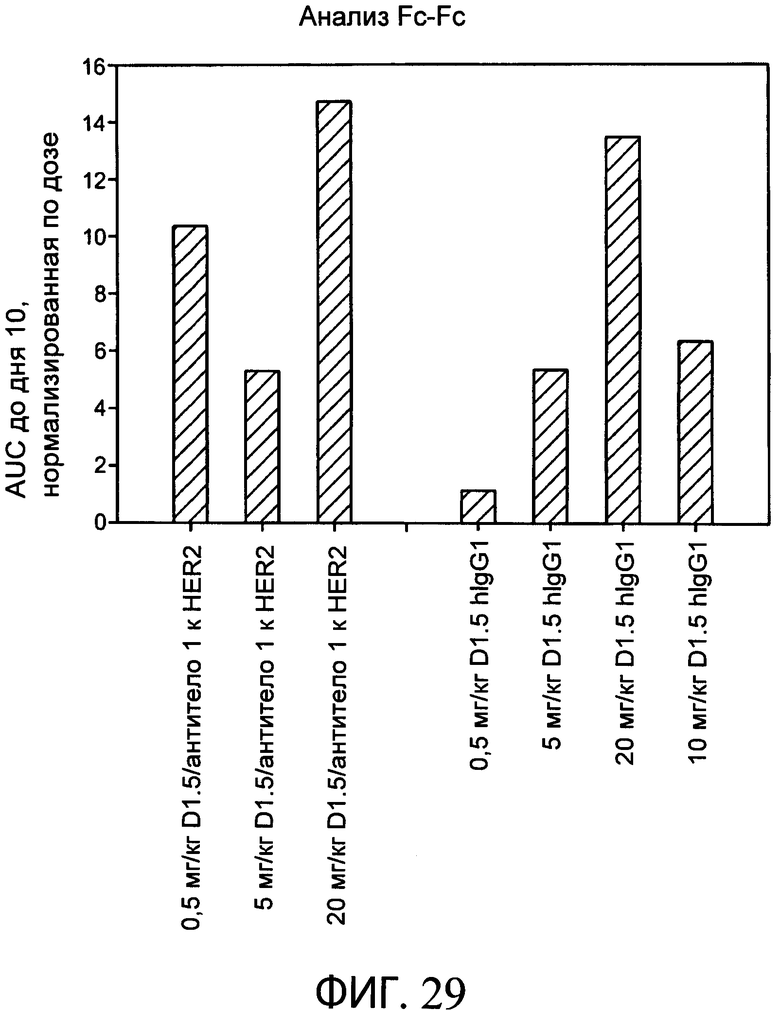
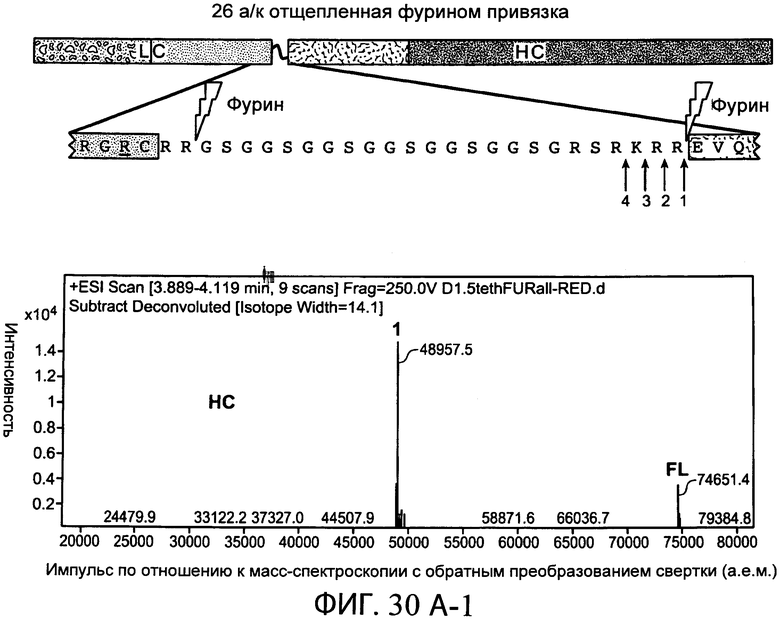
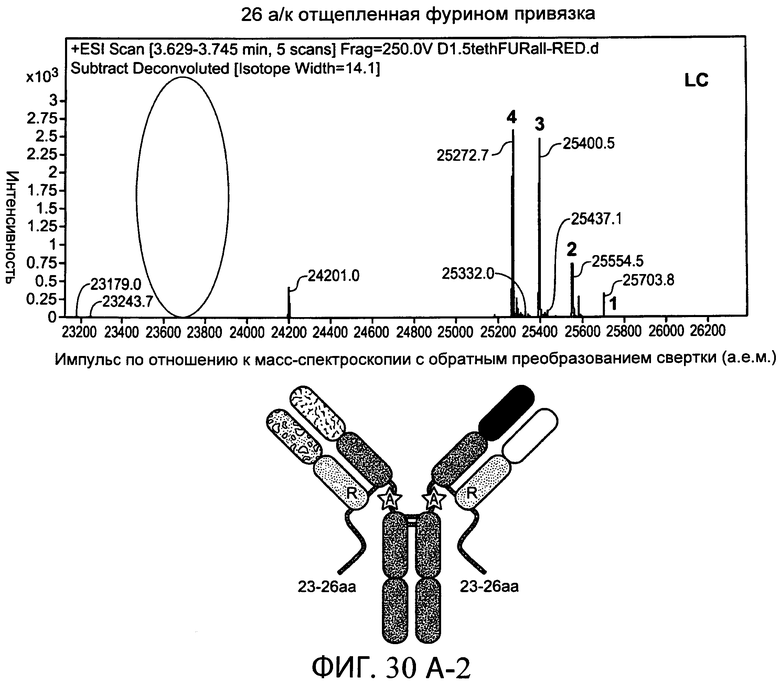
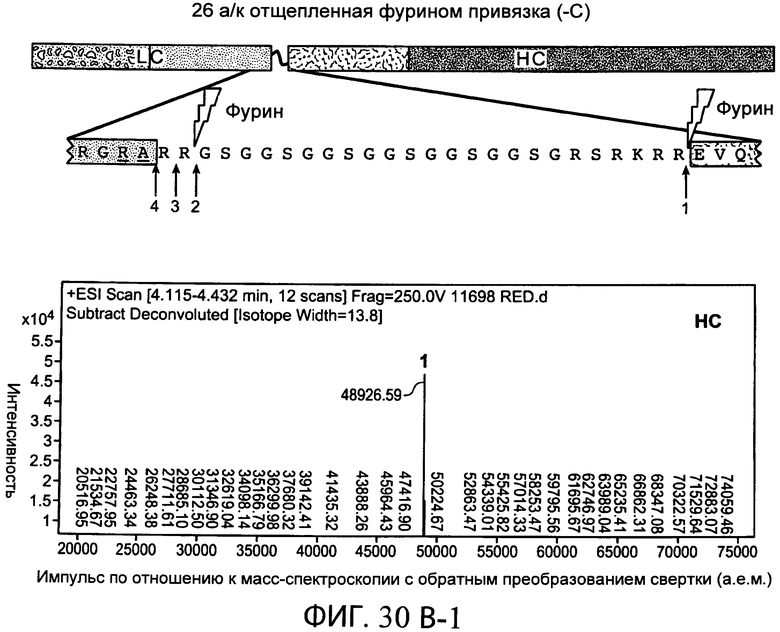
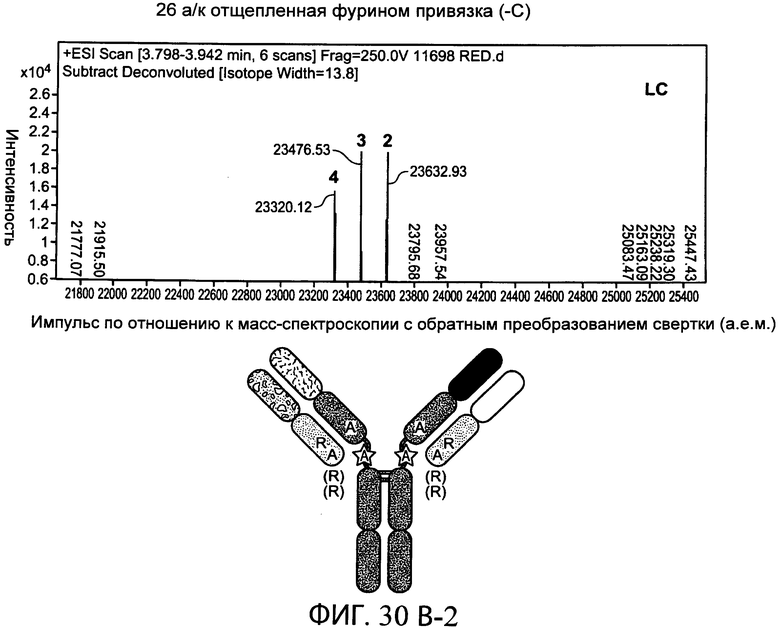
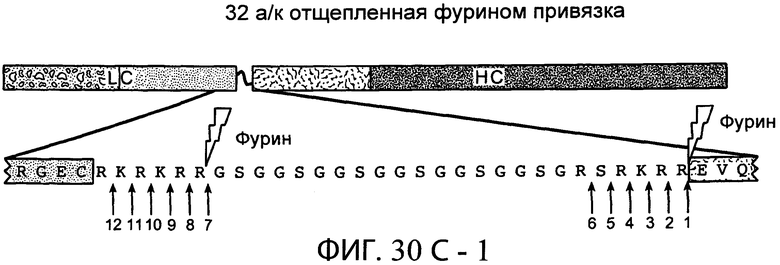
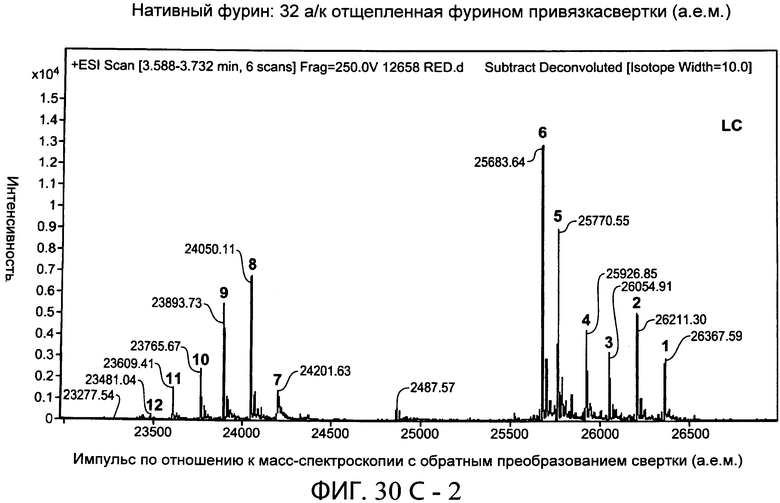
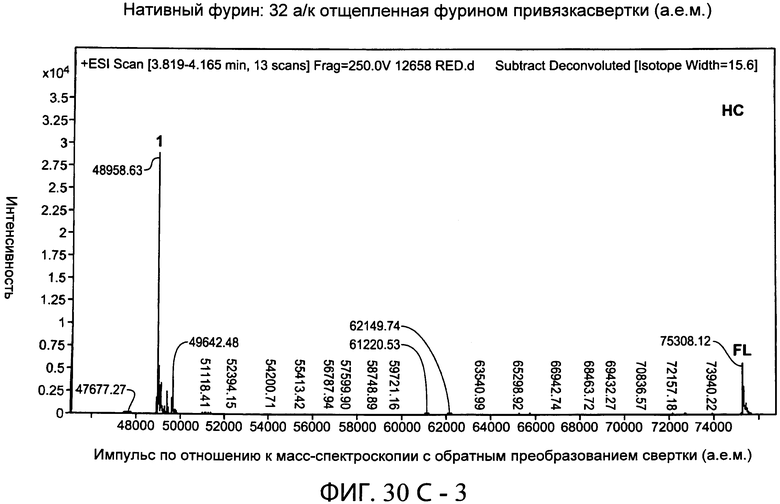
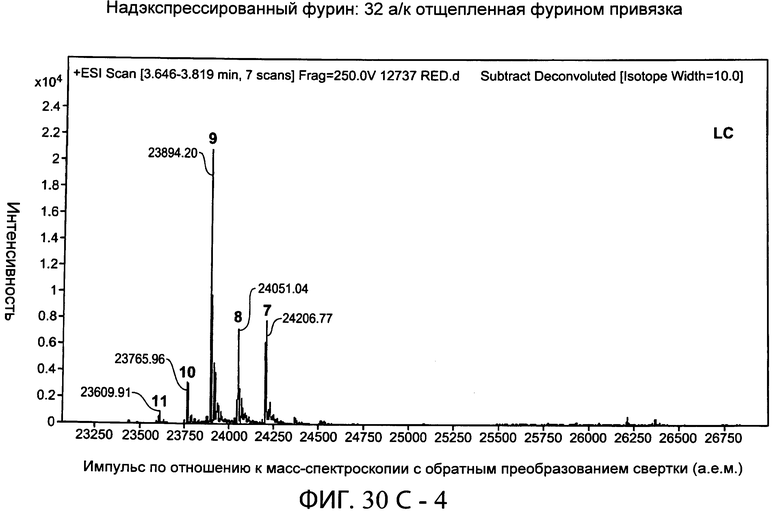
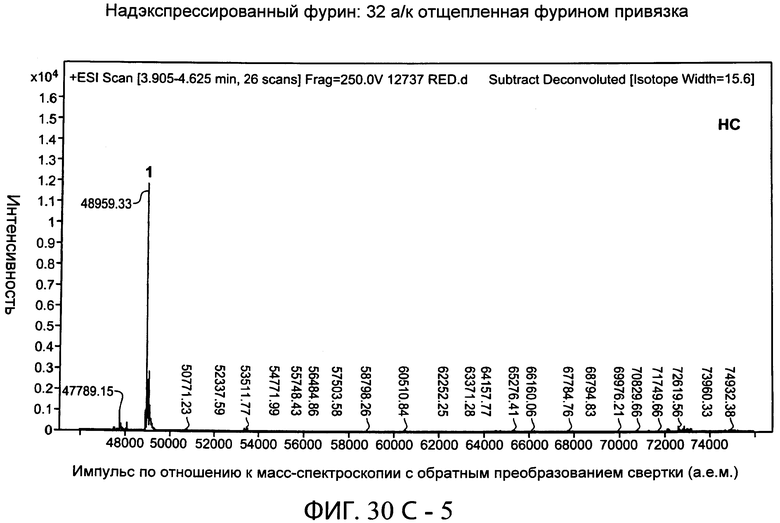
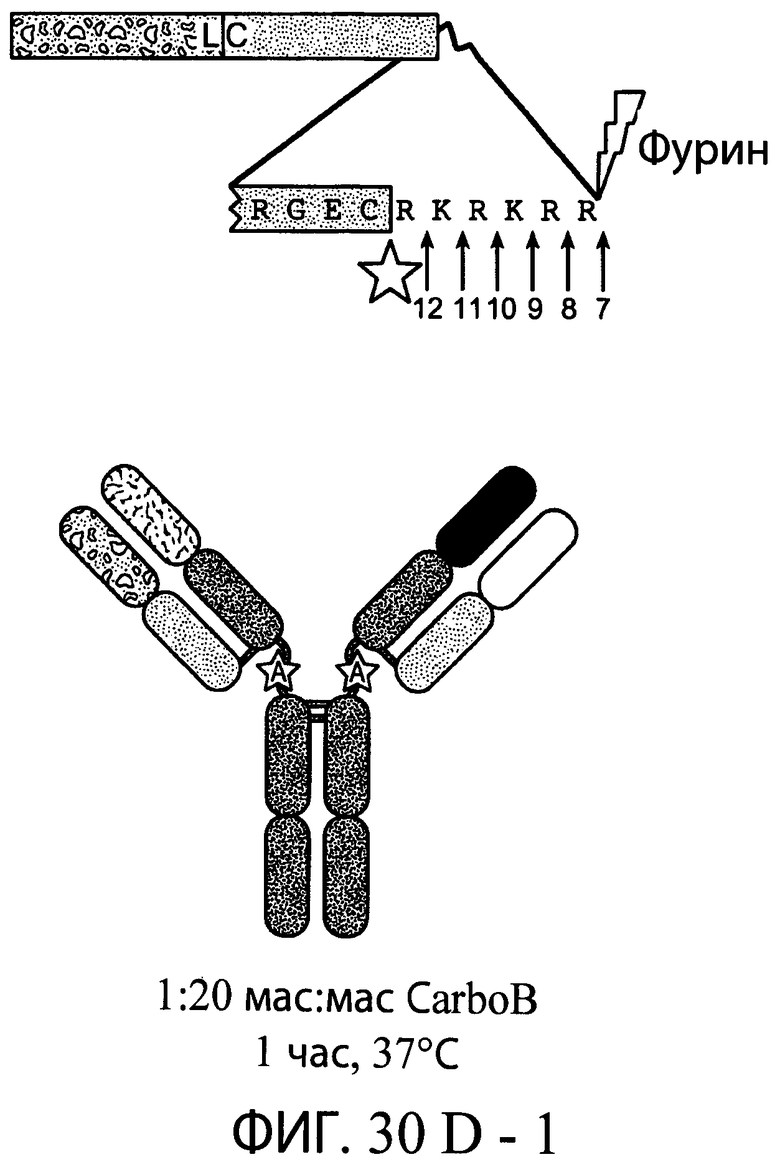
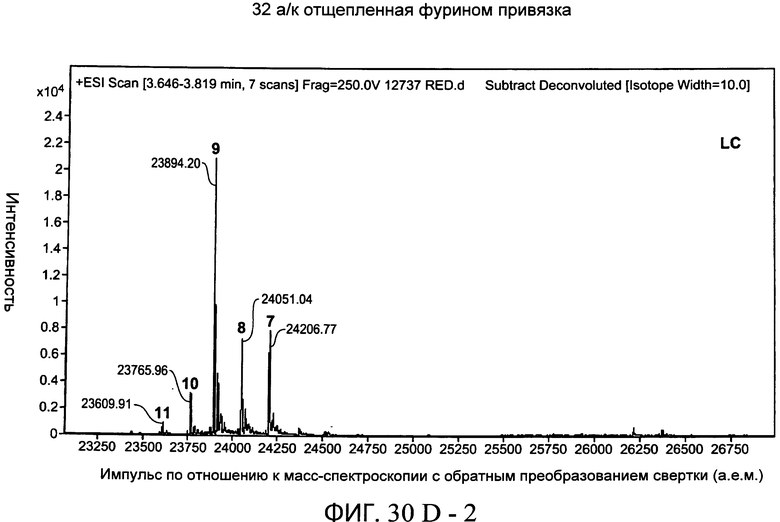
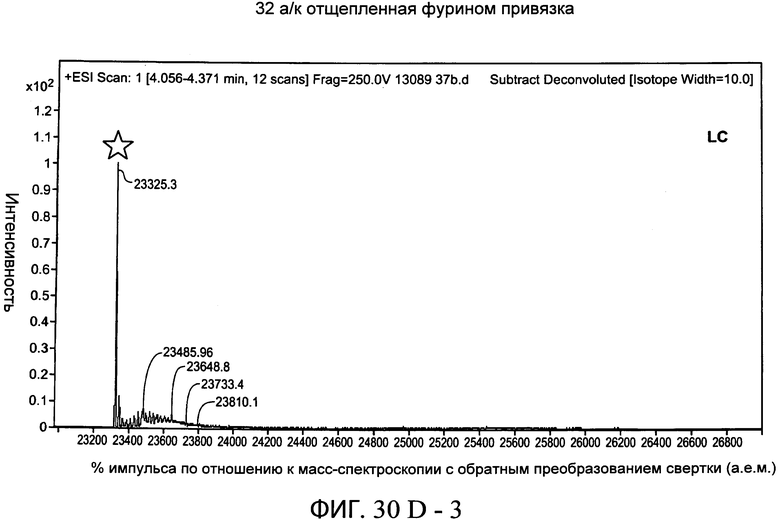
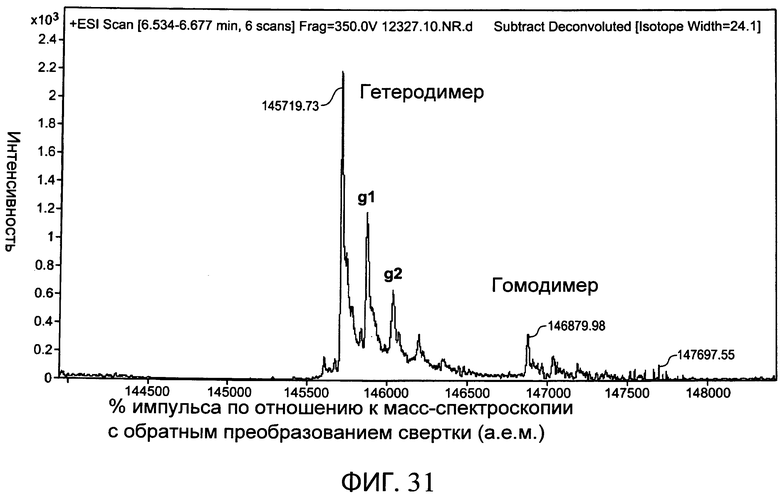
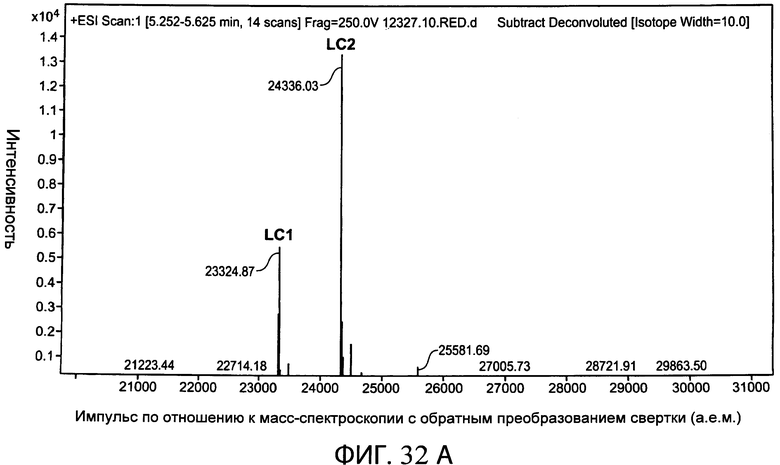
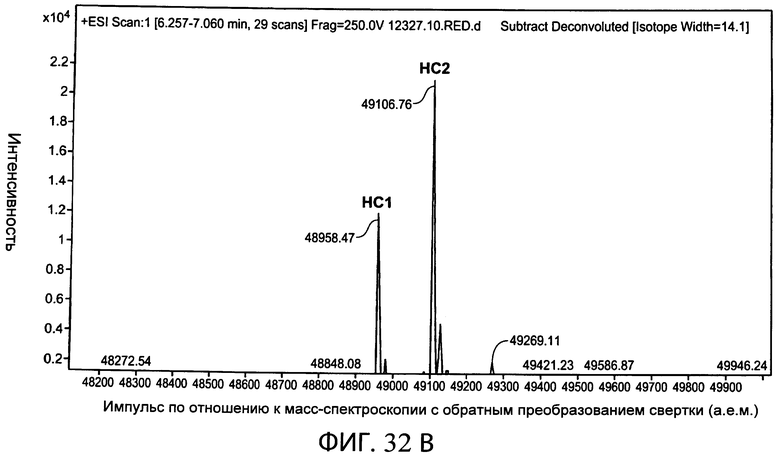
Изобретение относится к области иммунологии. Предложено антитело для использования в качестве биспецифического антитела, которое характеризуется тем, что содержит 4 полипептида. Первый и второй полипептид содержат: VH-домен, который связан с константным доменом, и суперспиральный домен (СС). При этом СС связан с константным доменом расщепляемым линкером и содержит в случае первого полипептида гептадный повтор: (X1X2X3X4X5X6X7)n, а в случае второго полипептида СС содержит гептадный повтор: (X′1Х′2Х′3Х′4Х′5Х′6Х′7)n, где n больше или равно 2. X1, X′1 - гидрофобный аминокислотный остаток или аспарагин, каждый из Х2, Х3, Х6, Х′2, Х′3 и Х′6 представляет собой любой аминокислотный остаток, Х4, Х′4 - гидрофобный аминокислотный остаток, а каждый из Х5, Х7, Х′5 и Х′7 представляет собой заряженный аминокислотный остаток. Причем в каждом гептадном повторе первый СС содержит остаток Х5, который противоположен по заряду остатку Х′7 во втором СС, и первый СС содержит остаток Х7, который противоположен по заряду остатку Х′5 во втором СС. Третий и четвертый полипептид содержат первый и второй VL-домены, соответственно. Также предложено антитело для использования в качестве гетеродимерного, содержащее три полипептида. При этом первый полипептид содержит: VH-домен, который связан с константным доменом, и суперспиральный домен (СС). Второй полипептид содержит константный домен, содержащий СН2- и СH3-домены и СС-домен. При этом СС связан с константным доменом расщепляемым линкером и содержит гептадный повтор такой же, как в биспецифическом антителе. Третий полипептид содержит VL-домен. Описан также способ получения антитела, предусматривающий стадию культивирования клетки, содержащей вектор, кодирующий антитело по изобретению в культуральной среде. Использование изобретения обеспечивает новый способ димеризации антител в присутствии константных областей при наличии СС домена, что может найти применение в получении биспецифических и гетеродимерных антител. 3 н. и 14 з.п. ф-лы, 32 ил., 6 табл., 7 пр.
1. Антитело, содержащее:
(a) первый полипептид, содержащий VH-домен, связанный с константным доменом, и первый суперспиральный домен (СС), где первый СС содержит гептадный повтор формулы I:
(X1X2X3X4X5X6X7)n (Формула I),
где
X1 представляет собой гидрофобный аминокислотный остаток или аспарагин,
каждый из Х2, Х3 и Х6 представляет собой любой аминокислотный остаток,
Х4 представляет собой гидрофобный аминокислотный остаток, а
каждый из Х5 и Х7 представляет собой заряженный аминокислотный остаток; и
(b) второй полипептид, содержащий VH-домен, связанный с константным доменом, и второй суперспиральный домен (СС), где второй СС содержит гептадный повтор формулы II:
(X′1Х′2Х′3Х′4Х′5Х′6Х′7)n (Формула II),
где
X′1 представляет собой гидрофобный аминокислотный остаток или аспарагин,
каждый из Х′2, Х′3 и Х′6 представляет собой любой аминокислотный остаток,
Х′4 представляет собой гидрофобный аминокислотный остаток, а
каждый из Х′5 и Х′7 представляет собой заряженный аминокислотный остаток;
где n в формулах I и II больше или равно 2;
где в каждом гептадном повторе первый СС содержит остаток Х5, который противоположен по заряду остатку Х′7 во втором СС, и первый СС содержит остаток Х7, который противоположен по заряду остатку Х′5 во втором СС, и
где СС связан с константным доменом с помощью линкера, и где линкер является расщепляемым,
(c) третий полипептид, где указанный третий полипептид содержит первый VL-домен,
и
(d) четвертый полипептид, где указанный четвертый полипептид содержит второй VL-домен,
причем антитело предназначено для использования в качестве биспецифического антитела.
2. Антитело по п.1, в котором каждый из первого и второго полипептидов содержит VH- и СН1-домены, шарнирный домен или СН2- и СН3-домены.
3. Антитело по п.1, в котором
(a) VH-домен первого полипептида связан с VL-доменом третьего полипептида с помощью привязки, а VH-домен второго полипептида связан с VL-доменом четвертого полипептида с помощью привязки;
(b) третий полипептид дополнительно содержит первый CL-домен, где указанные первые VL- и CL-домены расположены друг относительно друга в третьем полипептиде в направлении от N-конца к С-концу: VL-CL, а четвертый полипептид дополнительно содержит второй CL-домен, и где указанные вторые VL- и CL-домены расположены друг относительно друга в четвертом полипептиде в направлении от N-конца к С-концу: VL-CL; или
(c) последовательности указанного первого VL-домена и указанного второго VL-домена являются одинаковыми.
4. Антитело по любому из пп.1-3, в котором N-конец VH по меньшей мере одного из указанного первого или указанного второго полипептидов соединен с С-концом CL привязкой.
5. Антитело, содержащее:
(a) первый полипептид, содержащий VH-домен, связанный с константным доменом, и первый суперспиральный домен (СС), где первый СС содержит гептадный повтор формулы I:
(X1X2X3X4X5X6X7)n (Формула I),
где
X1 представляет собой гидрофобный аминокислотный остаток или аспарагин,
каждый из Х2, Х3 и Х6 представляет собой любой аминокислотный остаток,
X4 представляет собой гидрофобный аминокислотный остаток, и
каждый из Х5 и Х7 представляет собой заряженный аминокислотный остаток; и
(b) второй полипептид, содержащий константный домен, содержащий СН2- и СН3-домены и второй суперспиральный домен (СС), где второй СС содержит гептадный повтор формулы II:
(X′1Х′2Х′3Х′4Х′5Х′6Х′7)n (Формула II),
где
X′1 представляет собой гидрофобный аминокислотный остаток или аспарагин,
каждый из X′2, X′3 и X′6 представляет собой любой аминокислотный остаток,
X′4 представляет собой гидрофобный аминокислотный остаток, и
каждый из X′5 и X′7 представляет собой заряженный аминокислотный остаток;
где n в формулах I и II больше или равно 2;
где в каждом гептадном повторе первый СС содержит остаток Х5, который противоположен по заряду остатку X′7 во втором СС, и первый СС содержит остаток Х7, который противоположен по заряду остатку X′5 во втором СС, и
где СС связан с константным доменом с помощью линкера, и где линкер является расщепляемым, и
(с) третий полипептид, где указанный третий полипептид содержит первый VL-домен,
причем антитело предназначено для использования в качестве гетеродимерного антитела.
6. Антитело по п.5, в котором первый полипептид содержит VH- и СН1-домены, шарнирный домен или СН2- и СН3-домены.
7. Антитело по п.5, которое дополнительно содержит третий полипептид, причем третий полипептид содержит VL-домен.
8. Антитело по п.7, в котором указанный третий полипептид дополнительно содержит CL-домен, a VL- и CL-домены расположены друг относительно друга в направлении от N-конца к С-концу: VL-CL.
9. Антитело по п.8, в котором N-конец VH указанного первого полипептида соединен с С-концом CL привязкой.
10. Антитело по п.1, которое является мультиспецифическим.
11. Антитело по п.3, в котором указанная привязка:
(a) содержит глициновый (G) и сериновый (S) остатки;
(b) характеризуется длиной от 15 до 50 аминокислот;
(c) является расщепляемой одной или несколькими из следующих эндопептидаз: фурином, тромбином, гененазой, Lys-C, Arg-C, Asp-N, Glu-C, фактором Xa, протеазой вируса гравировки табака (TEV), энтерокиназой, протеазой риновируса С3 человека (HRV С3) и кининогеназой, и причем антитело модифицировано с удалением любого сайта расщепления эндопептидазой; или
(d) содержит пептидную связь аспарагин-глицин.
12. Антитело по п.9, в котором указанная привязка:
(a) содержит глициновый (G) и сериновый (S) остатки;
(b) характеризуется длиной от 15 до 50 аминокислот;
(c) является расщепляемой одной или несколькими из следующих эндопептидаз: фурином, тромбином, гененазой, Lys-C, Arg-C, Asp-N, Glu-C, фактором Xa, протеазой вируса гравировки табака (TEV), энтерокиназой, протеазой риновируса С3 человека (HRV С3) и кининогеназой, и причем антитело модифицировано с удалением любого сайта расщепления эндопептидазой; или
(d) содержит пептидную связь аспарагин-глицин.
13. Антитело по п.1, в котором указанный линкер:
(a) является расщепляемым одной или несколькими из следующих эндопептидаз: фурином, тромбином, гененазой, Lys-C, Arg-C, Asp-N, Glu-C, фактором Xa, протеазой вируса гравировки табака (TEV), энтерокиназой, протеазой риновируса С3 человека (HRV С3) и кининогеназой; или
(b) содержит пептидную связь аспарагин-глицин.
14. Антитело по п.5, в котором указанный линкер:
(a) является расщепляемым одной или несколькими из следующих эндопептидаз: фурином, тромбином, гененазой, Lys-C, Arg-C, Asp-N, Glu-C, фактором Xa, протеазой вируса гравировки табака (TEV), энтерокиназой, протеазой риновируса С3 человека (HRV С3) и кининогеназой; или
(b) содержит пептидную связь аспарагин-глицин.
15. Антитело по п.1, которое:
(a) содержит мутацию, которая удаляет сайт расщепления эндопептидазой Lys-C в шарнирном домене;
(b) содержит константный участок, конъюгированный с цитотоксическим средством; или
(c) экспрессируется клеткой млекопитающего или прокариотической клеткой.
16. Антитело по п.5, которое:
(a) содержит мутацию, которая удаляет сайт расщепления эндопептидазой Lys-C в шарнирном домене;
(b) содержит константный участок, конъюгированный с цитотоксическим средством; или
(c) экспрессируется клеткой млекопитающего или прокариотической клеткой.
17. Способ получения антитела, предусматривающий стадию культивирования клетки, содержащей вектор, кодирующий антитело по любому из пп.1-16 в культуральной среде.
| US2003170230 A1, 11.09.2003 | |||
| US20070014794 A1, 18.01.2007 | |||
| ARNDT et al., "Helix-stabilized Fv (hsFv) antibody fragments: substituting the constant domains of a fab fragment for a heterodimeric coiled coil domain", J.Mol.biol., 2001, 312, стр.221-228 | |||
| MASON et al., "Coiled coil domains: stability, specificity, and biological implications", |
Авторы
Даты
2016-01-27—Публикация
2010-09-16—Подача