Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет предварительной заявки на патент США рег. № 61/327302 под названием «Получение гетеромультимерных белков», которая была подана 23 апреля 2010, и полное содержание которой вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к способам получения гетеромультимерных белков.
Предшествующий уровень техники
Моноклональные антитела типа IgG содержат две идентичных антигенсвязывающих "руки" и константный домен (Fc). Антитела с различной специфичностью своих связывающих "рук" обычно не встречаются в природе, а поэтому они могут быть сконструированы с применением химической технологии (например, химическим методом перекрестного сшивания и т.п.), методов рекомбинантной ДНК и/или технологии слияния клеток.
Биспецифические антитела могут одновременно связываться с двумя различными антигенами. Это их свойство позволяет разработать терапевтические стратегии, которые было бы невозможно осуществить с использованием стандартных моноклональных антител. Широкая панель репрезентативных антител, которые были разработаны в формате биспецифических антител, указывает на огромный интерес специалистов к этим молекулам. См., Berg J., Lotscher E., Steimer K.S., et al., «Bispecific antibodies that mediate killing of cells infected with human immunodeficiency virus of any strain», Proc. Natl. Acad. Sci. USA (1991) 88(11):4723-4727, и Fischer N. and Leger O., "Biospecific Antibodies: Molecules That Enable Novel Therapeutic Strategies", Pathobiology (2007) 74:3-14.
Другим классом мультиспецифических молекул являются рекомбинантные слитые белки. Рекомбинантные слитые белки, состоящие из внеклеточного домена иммунорегуляторных белков и константного домена (Fc) иммуноглобулина (Ig), представляют все увеличивающийся класс терапевтических препаратов, применяемых в медицине. Иммуноадгезины объединяют в себе связывающуюся область последовательности белка с нужной специфичностью и эффекторный домен антитела. Иммуноадгезины обладают двумя ценными свойствами, которые играют важную роль в их активности как терапевтических средств, а именно, они обладают специфичностью к мишени и фармакокинетической стабильностью (время их полужизни in vivo сравнимо с временем полужизни антител). Иммуноадгезины могут быть использованы в качестве антагониста для ингибирования или блокирования нежелательных взаимодействий, или в качестве агониста для имитации или усиления физиологических ответов. См., Chamow S.M., Zhang D.Z., Tan X.Y., et al., «A humanized, bispecific immunoadhesin-antibody that retargets CD3+ effectors to kill HIV-1-infected cells» J. Hematother 1995; 4(5):439-446.
В литературе также обсуждались и другие мультиспецифические молекулы. Так, например, они обсуждаются в публикациях: Fisher et al., Pathobiology (2007) 74:3-14 (обзор различных биспецифических молекул); в патенте США № 6660843, выданном 9 декабря 2003, Feige et al. (пептидные антитела); в публикации патента США № 2002-004587, опубликованного 10 января 2002 (мультиспецифические антитела); в патенте США № 7612181, выданном 3 ноября 2009, Wu et al. (антитела с двумя вариабельными доменами); в патенте США № 6534628, Nord K. et al., Prot Eng (1995) 8:601-608, Nord K. et al., Nat Biotech (1997) 15:772-777, и Grönwall et al., Biotechnol Appl Biochem. (2008) Jun; 50(Pt 2):97-112 (аффинные антитела); Martens et al., Clin Cancer Res (2006), 12:6144-6152 и Jin et al., Cancer Res (2008) 68(11):4360-4368 (антитела с одной «рукой»); Bostrom et al., Science (2009) 323:1610-1614 (Fab с двойным действием, антитела со смешанной валентностью). Специалистам известны антитела и другого типа.
Изготовление клинически чистого материала для получения мультиспецифических молекул, описанных выше, связано с определенными проблемами. Как указывалось выше, существует множество методов получения молекул со смешанными связывающими "руками", то есть со связывающими "руками", которые не являются идентичными друг другу. Каждый из этих методов имеет свои недостатки.
Метод химического перекрестного сшивания является трудоемким, поскольку может возникнуть необходимость очистки релевантных молекул от гомодимеров и других нежелательных побочных продуктов. Кроме того, стадии химической модификации могут приводить к нарушению целостности белков и, тем самым, к снижению их стабильности. Таким образом, этот метод часто является неэффективным и может приводить к потере активности антитела.
Технология слияния клеток (например, гибридомная технология) заключается в экспрессии двух тяжелых и двух легких цепей, случайная сборка которых приводит к образованию 10 комбинаций антител. Нужные гетеромультимерные антитела представляют собой лишь небольшую фракцию продуцируемых таким образом антител. Очистка нужных гетеромультимерных белков приводит к резкому снижению выхода продукта и к повышению затрат на их производство.
Методы рекомбинантных ДНК были применены для получения различных гетеромультимерных белков, например, одноцепочечного Fv, диантител и т.п., которые не содержат Fc-домена. Главным недостатком молекулы антитела этого типа является отсутствие Fc-домена, а следовательно, и способности антитела к индуцированию эффекторной функции (например, активации комплемента, связывания с Fc-рецептором и т.п.). Таким образом, желательно получить такое биспецифическое антитело, которое содержало бы функциональный Fc-домен.
Методы рекомбинантных ДНК были также применены для получения биспецифических антител со структурой «узлы в дырках». См. заявку на патент США 20030078385 (Arathoon et al. - Genentech). Одним из недостатков такой стратегии является то, что легкие цепи двух родительских антител должны быть идентичными для предотвращения ошибочного спаривания и образования нежелательных и/или неактивных молекул в результате их экспрессии в одной и той же клетке.
Таким образом, необходимость в разработке альтернативных способов получения гетеромультимерных белков остается актуальной. И описанное здесь изобретение относится к таким способам. Эти и другие аспекты и преимущества настоящего изобретения будут очевидны из нижеследующего описания.
Краткое описание сущности изобретения
Получение гетеромультимерных белков, например, мультиспецифических антител, с применением современных технологий связано с определенными проблемами, включая получение смеси продуктов, низкий выход и снижение/элиминацию эффекторных функций и т.п. Таким образом, желательно получить эффективные гетеромультимерные белки с высоким выходом.
Различные методы продуцирования молекул антител, по существу, хорошо известны специалистам. В патенте США № 6331415 (Cabilly et al.), например, описан метод рекомбинантного продуцирования иммуноглобулина, в котором тяжелая и легкая цепи экспрессируются одновременно из одного вектора или из двух отдельных векторов, находящихся в одной клетке. В публикации Wibbenmeyer et al. (1999, Biochim Biophys Acta 1430(2):191-202) и Lee & Kwak (2003, J. Biotechnology 101:189-198) описано продуцирование моноклональных антител из отдельно полученных тяжелых и легких цепей с использованием плазмид, экспрессируемых в отдельных культурах E. coli. Различные другие подходящие методы получения антител описаны, например, Harlow, et al., ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., (1988), и в заявке WO2006028936. Кроме того, в каждой из этих работ указаны недостатки, такие как низкий выход, применение химических соединений.
Настоящее изобретение относится к способам экспрессии каждого компонента, например, одной "руки" антитела, гетеромультимерного белка, содержащего шарнирную область, в отдельной клетке-хозяине, и сборки гетеромультимерного белка, содержащего шарнирную область, например, мультиспецифического антитела, без добавления восстановителя.
Настоящее изобретение относится к простому и эффективному способу/экономически выгодному способу получения гетеромультимерных белков, например, мультиспецифических антител.
Настоящее изобретение относится к эффективным и новым способам получения мультиспецифических иммуноглобулиновых комплексов (например, мультиспецифических антител) и других мультимерных белков (в целом называемых здесь «гетеромультимерными белками»), где указанные способы не имеют ограничений, присущих традиционным методам. Гетеромультимерные белки, такие как биспецифические антитела, могут быть получены в виде высокогомогенного гетеромультимерного полипептида способами согласно изобретению. Кроме того, описанные здесь способы не требуют добавления восстановителя для образования по меньшей мере одной, по меньшей мере двух, по меньшей мере трех и по меньшей мере четырех межцепьевых дисульфидных связей в гетеромультимерном белке.
В первом аспекте изобретения описанный здесь способ позволяет получить гетеромультимерный белок, включающий первый полипептид, содержащий шарнирную область и имеющий первый домен гетеродимеризации, и второй полипептид, содержащий шарнирную область и имеющий второй домен гетеродимеризации, где указанный второй домен гетеродимеризации взаимодействует с указанным первым доменом гетеродимеризации, и где первый и второй полипептиды, содержащие шарнирную область, связаны друг с другом по меньшей мере одной межцепьевой дисульфидной связью; причем указанный способ включает стадии:
(a) культивирования первой клетки-хозяина, содержащей первую нуклеиновую кислоту, кодирующую первый полипептид, содержащий шаринирную область, в условиях, при которых экспрессируется полипептид, содержащий шарнирную область;
(b) культивирования второй клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую второй полипептид, содержащий шаринирную область, в условиях, при которых экспрессируется полипептид, содержащий шарнирную область;
(c) разрушения клеточных мембран в целях высвобождения первого и второго полипептидов, содержащих шарнирную область, во внеклеточную среду, где первая и вторая клетки-хозяева были объединены в одну суспензию; и
(d) выделения гетеромультимерного белка,
где указанный способ не требует добавления восстановителя.
Во втором аспекте настоящее изобретение относится к способу получения гетеромультимерного белка, включающего первый полипептид, содержащий шарнирную область и имеющий первый домен гетеродимеризации, и второй полипептид, содержащий шарнирную область и имеющий второй домен гетеродимеризации, где указанный второй домен гетеродимеризации взаимодействует с указанным первым доменом гетеродимеризации, и где первый и второй полипептиды, содержащие шарнирную область, связаны друг с другом по меньшей мере одной межцепьевой дисульфидной связью; причем указанный способ включает стадии:
(a) получения очищенного первого полипептида, содержащего шарнирную область и имеющего первый домен гетеродимеризации;
(b) получения очищенного второго полипептида, содержащего шарнирную область и имеющего второй домен гетеродимеризации;
(c) объединения первого и второго полипептидов, содержащих шарнирную область;
(d) рефолдинга первого полипептида, содержащего шарнирную область, со вторым полипептидом, содержащим шарнирную область; и
(e) выделения комплекса гетеромультимерного белка.
В третьем аспекте настоящее изобретение относится к способу получения гетеромультимерного белка, где указанный способ включает инкубирование первой пары полипептидов тяжелой и легкой цепи иммуноглобулина и второй пары полипептидов тяжелой и легкой цепи иммуноглобулина в условиях, позволяющих осуществлять мультимеризацию первой и второй пары полипептидов с образованием по существу гомогенной популяции антител, где указанные условия не требуют добавления восстановителя; где первая пара полипептидов обладает способностью связываться с первой мишенью; вторая пара полипептидов обладает способностью связываться со второй молекулой-мишенью; и где Fc-полипептид первого полипептида тяжелой цепи и Fc-полипептид второго полипептида тяжелой цепи встречаются на интерфейсе, и интерфейс второго Fc-полипептида содержит выступ, который может входить в полость интерфейса первого Fc-полипептида.
В четвертом аспекте настоящее изобретение относится к способу создания комбинаторной библиотеки гетеромультимерных белков, включающей первый полипептид, содержащий шарнирную область и имеющий первый домен гетеродимеризации, и второй полипептид, содержащий шарнирную область и имеющий второй домен гетеродимеризации, где указанный второй домен гетеродимеризации взаимодействует с указанным первым доменом гетеродимеризации, и где первый и второй полипептиды, содержащие шарнирную область, связаны друг с другом по меньшей мере одной межцепьевой дисульфидной связью; причем указанный способ включает стадии:
(a) культивирования первой клетки-хозяина и по меньшей мере двух дополнительных клеток-хозяев, где:
a. указанная первая клетка-хозяин включает первую нуклеиновую кислоту, кодирующую полипептид, содержащий первый домен гетеродимеризации, и
b. указанные дополнительные клетки-хозяева включают нуклеиновую кислоту, кодирующую полипептид, содержащий второй домен гетеродимеризации,
(b) объединения первой и по меньшей мере двух дополнительных клеток-хозяев;
(c) обработки указанных клеток так, чтобы первый и второй полипептиды, содержащие домен гетеродимеризации, высвобождались во внеклеточную среду; и
(d) выделения гетеромультимерных белков,
где указанный способ не требует добавления восстановителя.
В пятом аспекте настоящее изобретение относится к гетеромультимерным белкам, полученным описанными здесь способами.
Следует отметить, что способы согласно изобретению могут включать и другие стадии, которые представляют собой рутинные стадии, обычно осуществляемые для инициации и/или завершения процессов, проводимых описанными здесь способами согласно изобретению. Так, например, в одном из вариантов изобретения, стадию (a) в способе согласно изобретению проводят после стадии, в которой нуклеиновую кислоту, кодирующую первый полипептид, содержащий шарнирную область, вводят в первую клетку-хозяина, а нуклеиновую кислоту, кодирующую второй полипептид, содержащий шарнирную область, вводят во вторую клетку-хозяина. В одном из вариантов изобретения способы согласно изобретению также включают стадию очистки гетеромультимерных белков, обладающих специфичностью связывания по меньшей мере с двумя различными мишенями. В одном из вариантов изобретения до проведения стадии очистки гетеромультимерных белков, не более чем примерно 10%, 15% или 20% выделенных полипептидов присутствует в виде мономеров или димеров «тяжелая цепь-легкая цепь».
В одном из вариантов изобретения первый и/или второй полипептид, содержащий шарнирную область, представляет собой тяжелую цепь антитела. В другом варианте изобретения тяжелую цепь антитела спаривают с легкой цепью антитела, в результате чего получают пару «тяжелая цепь-легкая цепь». В некоторых вариантах изобретения пара «тяжелая цепь-легкая цепь» связана ковалентной связью. В другом варианте изобретения пара «тяжелая цепь-легкая цепь» определяет мишень-связывающую «руку». В некоторых вариантах изобретения мишень-связывающие "руки" являются идентичными. В некоторых вариантах изобретения каждая мишень-связывающая «рука» распознает две различные мишени.
В некоторых вариантах изобретения первый и/или второй полипептид, содержащий шарнирную область, включает Fc-область. В другом варианте изобретения первый и/или второй полипептид, содержащий шарнирную область, включает по меньшей мере один константный домен тяжелой цепи. В другом варианте изобретения первый и/или второй полипептид, содержащий шарнирную область, включает вариабельный домен тяжелой цепи. В другом варианте изобретения первый и/или второй полипептид, содержащий шаринирную область, включает рецептор-связывающий домен. В некоторых вариантах изобретения первый и/или второй полипептид, содержащий шарнирную область, являются по существу идентичными (то есть, домен гетеродимеризации не может быть идентичен областям, находящимся за пределами домена гетеродимеризации). В некоторых вариантах изобретения первый и/или второй полипептид, содержащие шарнирную область, не являются идентичными.
В некоторых вариантах изобретения гетеромультимерный белок выбран из группы, состоящей из антитела, биспецифического антитела, мультиспецифического антитела, антитела с одной «рукой», моноспецифического одновалентного антитела, мультиспецифического одновалентного антитела, биспецифического максиантитела, моноантитела, иммуноадгезина, пептидного антитела, биспецифического пептидного антитела, одновалентного пептидного антитела, аффинного антитела и гибрида «рецептор-белок».
В некоторых вариантах изобретения указанные гетеромультимерные белки содержат шарнирную область, которая имеет по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или любое целое число цистеиновых остатков, которые обычно образуют дисульфидную связь между тяжелыми цепями. В некоторых вариантах изобретения дополнительные цистеины были введены в шарнирную область.
Гетеромультимерный белок согласно изобретению может также представлять собой фрагмент антитела, такой как, например, Fc или Fc-слитый полипептид, при условии, что он будет содержать шарнирную область иммуноглобулина. Fc-слитый полипептид обычно содержит Fc-полипептид (или его фрагмент), слитый с гетерологичной полипептидной последовательностью (такой как антигенсвязывающий домен), такой как внеклеточный домен рецептора (ECD), слитый с Fc-полипептидом иммуноглобулина (например, ECD Flt-рецептора, слитый с Fc IgG2). Так, например, в одном из вариантов изобретения, Fc-слитый полипептид содержит VEGF-связывающий домен, который может представлять собой рецептор VEGF, включающий flt, flk и т.п. Гетеромультимерный белок согласно изобретению обычно содержит константный домен тяжелой цепи и константный домен легкой цепи. В одном из вариантов изобретения гетеромультимерный белок согласно изобретению включает модификацию (например, такую как, но не ограничивающуюся ими, инсерция одной или нескольких аминокислот, например, с образованием последовательности димеризации, такой как «лейциновая застежка»), введенную для обеспечения димеризации или мультимеризации тяжелых цепей. В некоторых вариантах изобретения часть Fc-полипептида (но не весь полипептид) может отсутствовать в гетеромультимере согласно изобретению, при условии, что он будет сохранять шарнирную область иммуноглобулина. В некоторых из этих вариантов отсутствующей последовательностью Fc-полипептида является часть CH2- и/или CH3-доменов или полноразмерные CH2- и/или CH3-домены. В некоторых из этих вариантов, гетеромультимерный белок содержит домен димеризации (такой как последовательность «лейциновая застежка»), например, присоединенный к C-концу фрагмента тяжелой цепи. В некоторых из этих вариантов гетеромультимерный белок содержит домен димеризации, в который были введены мутации с образованием домена димеризации «узлы в дырках» (более подробное определение см. ниже).
В некоторых вариантах способов и гетеромультимерных белков согласно изобретению, полипептиды, содержащие шарнирную область, обладают по меньшей мере одним свойством, которое способствует гетеромеризации и при этом минимизирует гомодимеризацию первого и второго полипептидов, содержащих шарнирную область (например, между Fc-полипептидами тяжелых цепей). Такое(ие) свойство(а) способствует(ют) повышению выхода и/или чистоты и/или гомогенности группы гетеромультимерных белков, полученных описанными здесь способами согласно изобретению. В одном из вариантов изобретения Fc-полипептиды первого и второго полипептидов, содержащих шарнирную область, встречаются/взаимодействуют на интерфейсе. В некоторых вариантах изобретения, где Fc-полипептиды первого и второго полипептидов, содержащих шарнирную область, встречаются на интерфейсе, указанный интерфейс второго Fc-полипептида включает выступ, который может быть помещен в полость в интерфейсе первого Fc-полипептида. В одном из вариантов изобретения первый Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал полость, либо второй Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал выступ, либо то и другое. В одном из вариантов изобретения первый Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал полость, а второй Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал выступ, или то и другое. В одном из вариантов изобретения интерфейс второго Fc-полипептида содержит выступ, который может быть помещен в полость в интерфейсе первого Fc-полипептида, где указанные полость или выступ или то, и другое были введены в интерфейс первого и второго Fc-полипептидов, соответственно. В некоторых вариантах изобретения, где первый и второй Fc-полипептиды встречаются на интерфейсе, указанный интерфейс первого Fc-полипептида содержит выступ, который может быть помещен в полость в интерфейсе второго Fc-полипептида. В одном из вариантов изобретения второй Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал полость, либо первый Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал выступ или то, и другое. В одном из вариантов изобретения второй Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал полость, а первый Fc-полипептид был модифицирован путем изменения матричного/исходного полипептида так, чтобы он содержал выступ, или то и другое. В одном из вариантов изобретения интерфейс первого Fc-полипептида содержит выступ, который может быть помещен в полость в интерфейсе второго Fc-полипептида, где указанные выступ или полость или то, и другое были введены в интерфейс первого и второго Fc-полипептидов, соответственно.
В одном из вариантов изобретения каждый выступ и каждая полость содержит природный аминокислотный остаток. В одном из вариантов изобретения Fc-полипептид, содержащий выступ, получают путем замены исходного остатка из интерфейса матричного/исходного полипептида «импортным» остатком, имеющим более крупную боковую цепь, чем исходный остаток. В одном из вариантов изобретения Fc-полипептид, содержащий выступ, получают способом, включающим стадию, в которой нуклеиновую кислоту, кодирующую исходный остаток из интерфейса указанного полипептида, заменяют нуклеиновой кислотой, кодирующей «импортный» остаток, имеющий более крупную боковую цепь, чем исходный остаток. В одном из вариантов изобретения исходным остатком является треонин. В одном из вариантов изобретения «импортным» остатком является аргинин (R). В одном из вариантов изобретения «импортным» остатком является фенилаланин (F). В одном из вариантов изобретения «импортным» остатком является тирозин (Y). В одном из вариантов изобретения «импортным» остатком является триптофан (W). В одном из вариантов изобретения «импортным» остатком являются R, F, Y или W. В одном из вариантов изобретения выступ получают путем замены двух или более остатков в матричном/исходном полипептиде. В одном из вариантов изобретения в Fc-полипептиде, содержащем выступ, треонин в положении 366 был заменен триптофаном, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al. (pp. 688-696 in Sequences of proteins of immunological interest, 5th ed., Vol. 1 (1991; NIH, Bethesda, MD)).
В некоторых вариантах изобретения Fc-полипептид, содержащий полость, получают путем замены исходного остатка в интерфейсе матричного/исходного полипептида «импортным» остатком, имеющим менее крупную боковую цепь, чем исходный остаток. Так, например, Fc-полипептид, содержащий полость, может быть получен способом, включающим стадию, в которой нуклеиновую кислоту, кодирующую исходный остаток из интерфейса указанного полипептида, заменяют нуклеиновой кислотой, кодирующей «импортный» остаток, имеющий менее крупную боковую цепь, чем исходный остаток. В одном из вариантов изобретения исходным остатком является треонин. В одном из вариантов изобретения исходным остатком является лейцин. В одном из вариантов изобретения исходным остатком является тирозин. В одном из вариантов изобретения «импортный» остаток не является цистеином (C). В одном из вариантов изобретения «импортным» остатком является аланин (A). В одном из вариантов изобретения «импортным» остатком является серин (S). В одном из вариантов изобретения,«импортным» остатком является треонин (T). В одном из вариантов изобретения «импортным» остатком является валин (V). Полость может быть получена путем замены одного или нескольких исходных остатков матричного/исходного полипептида. Так, например, в одном из вариантов изобретения, Fc-полипептид, содержащий полость, имеет замену двух или более исходных аминокислот, выбранных из группы, состоящей из треонина, лейцина и тирозина. В одном из вариантов изобретения Fc-полипептид, включающий полость, содержит два или более «импортных остатков», выбранных из группы, состоящей из аланина, серина, треонина и валина. В некоторых вариантах изобретения Fc-полипептид, содержащий полость, имеет замену двух или более исходных аминокислот, выбранных из группы, состоящей из треонина, лейцина и тирозина, и где указанные исходные аминокислоты были заменены «импортными» остатками, выбранными из группы, состоящей из аланина, серина, треонина и валина. В одном из вариантов изобретения в Fc-полипептиде, содержащем полость, треонин в положении 366 был заменен серином, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше. В одном из вариантов изобретения, в Fc-полипептиде, содержащем полость, лейцин в положении 368 был заменен аланином, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше. В одном из вариантов изобретения в Fc-полипептиде, содержащем полость, тирозин в положении 407 был заменен валином, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше. В одном из вариантов изобретения Fc-полипептид, содержащий полость, имеет две или более аминокислотных замен, выбранных из группы, состоящей из T366S, L368A и Y407V, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше. В некоторых вариантах этих фрагментов антител, в Fc-полипептиде, содержащем выступ, треонин в положении 366 был заменен триптофаном, где аминокислоты пронумерованы в соответствии с Европейской системой нумерации (EU), Kabat et al., см. выше.
В различных вариантах изобретения Fc-полипептид первого и второго полипептидов тяжелой цепи могут быть, а могут и не быть идентичными, при условии, что они будут обладать способностью к димеризации с образованием Fc-области (определенной в настоящем описании). Первый Fc-полипептид обычно тесно связан с одним или несколькими доменами тяжелой цепи иммуноглобулина в одном полипептиде, например, с последовательностями шарнирной области, константного и/или вариабельного доменов. В одном из вариантов изобретения первый Fc-полипептид содержит по меньшей мере часть последовательности шарнирной области (включая всю эту последовательность), по меньшей мере часть CH2-домена (включая весь этот домен) и/или по меньшей мере часть CH3-домена (включая весь этот домен). В одном из вариантов изобретения первый Fc-полипептид содержит последовательность шарнирной области и CH2- и CH3-домены иммуноглобулина. В одном из вариантов изобретения второй Fc-полипептид содержит по меньшей мере часть последовательности шарнирной области (включая всю эту последовательность), по меньшей мере часть CH2-домена (включая весь этот домен) и/или по меньшей мере часть CH3-домена (включая весь этот домен). В одном из вариантов изобретения второй Fc-полипептид содержит последовательность шарнирной области и CH2- и CH3-домены иммуноглобулина. В одном из вариантов изобретения антитело согласно изобретению содержит первый и второй Fc-полипептиды, каждый из которых включает по меньшей мере часть по меньшей мере одного константного домена антитела. В одном из вариантов изобретения константный домен антитела представляет собой CH2- и/или CH3-домен. В любом из вариантов антитела согласно изобретению, которое содержит константный домен, указанный константный домен антитела может происходить от иммуноглобулина любого класса, например, IgG. Источником иммуноглобулина может быть иммуноглобулин любого подходящего вида (например, IgG может быть человеческим IgG1) или синтетический иммуноглобулин.
В одном из вариантов изобретения первый полипептид легкой цепи и второй полипептид легкой цепи в первой и второй связывающейся с молекулой-мишенью "руки" антитела согласно изобретению, соответственно, включают детерминанты, связывающиеся с другим/отличающимся антигеном (например, другие/отличающиеся последовательности вариабельного домена). В одном из вариантов изобретения первый полипептид легкой цепи и второй полипептид легкой цепи в первой и второй связывающейся с молекулой-мишенью "руке" антитела согласно изобретению, соответственно, включают одну и ту же (то есть, общую) антигенсвязывающую детерминанту, например, одну и ту же последовательность вариабельного домена.
Способы согласно изобретению позволяют получить гетеромультимерные молекулы с высокой гомогенностью. Настоящее изобретение относится к способам, в которых по меньшей мере примерно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% полипептидов присутствует в комплексе, содержащем первую пару полипептидов тяжелой и легкой цепей и вторую пару полипептидов тяжелой и легкой цепей. В одном из вариантов настоящее изобретение относится к способам, в которых примерно 60-99%, 70-98%, 75-97%, 80-96%, 85-96% или 90-95% полипептидов присутствует в комплексе, содержащем первую пару полипептидов тяжелой и легкой цепей и вторую пару полипептидов тяжелой и легкой цепей.
В одном из вариантов изобретения антитело согласно изобретению выбрано из группы, состоящей из IgG, IgE, IgA, IgM и IgD. В некоторых вариантах изобретения шарнирная область антитела согласно изобретению предпочтительно представляет собой шарнирную область иммуноглобулина, выбранного из группы, состоящей из IgG, IgA и IgD. Так, например, в некоторых вариантах изобретения, антитело или шарнирная область антитела представляют собой антитело или шарнирную область IgG, которым, в некоторых вариантах изобретения, является IgG1 или IgG2 (например, IgG2a или IgG2b). В некоторых вариантах изобретения антитело согласно изобретению выбрано из группы, состоящей из IgG, IgA и IgD. В одном из вариантов изобретения указанное антитело является человеческим, гуманизованным, химерным или нечеловеческим (например, мышиным).
Гетеромультимерные белки согласно изобретению по существу обладают способностью связываться, предпочтительно, специфически, с антигенами. Такими антигенами являются, например, опухолевые антигены, факторы регуляции выживания клеток, факторы регуляции пролиферации клеток, молекулы, ассоциированные с развитием или дифференцировкой ткани (например, молекулы, которые, как известно или как предполагается, играют определенную роль в таких функциях), молекулы клеточной поверхности, лимфокины, цитокины, молекулы, участвующие в регуляции клеточного цикла, молекулы, участвующие в васкулогенезе, и молекулы, ассоциированные с ангиогенезом (например, молекулы, которые, как известно или как предполагается, играют определенную роль в ангиогенезе). Антигеном, с которым может связываться гетеромультимерный белок согласно изобретению, может быть член субсерии антигенов одной из вышеупомянутых категорий, где другая(ие) субсерия(и) указанной категории содержит(ат) другие молекулы/антигены, обладающие отличающимися свойствами (по отношению к представляющему интерес антигену). Предполагается, что представляющий интерес антиген может также принадлежать к двум или более категориям. В одном из вариантов настоящее изобретение относится к гетеромультимерному белку, который связывается, предпочтительно специфически, с опухолевым антигеном, который не является молекулой клеточной поверхности. В одном из вариантов изобретения опухолевым антигеном является молекула клеточной поверхности, такая как полипептид рецептора. Другим примером, в некоторых вариантах изобретения, может служить гетеромультимерный белок согласно изобретению, который связывается, предпочтительно специфически, с опухолевым антигеном, который не является фактором дифференцировки кластеров. Другим примером может служить гетеромультимерный белок согласно изобретению, который обладает способностью связываться, предпочтительно специфически, с фактором дифференцировки кластеров, который, в некоторых вариантах изобретения, не является, например, CD3 или CD4. В некоторых вариантах изобретения, гетеромультимерным белком согласно изобретению является анти-VEGF антитело. В некоторых вариантах изобретения гетеромультимерным белком согласно изобретению является биспецифическое антитело, выбранное из группы, состоящей из IL-1альфа/IL-1бета, IL-12/IL-18; IL-13/IL-9; IL- 13/IL-4; IL-13/IL-5; IL-5/IL-4; IL-13/IL-lбета; IL-13/IL-25; IL-13/TARC; IL-13/MDC; IL-13/MEF; IL-13/TGF-β; агониста IL-13/LHR; IL-12/TWEAK, IL-13/CL25; IL-13/SPRR2a; IL-13/SPRR2b; IL-13/ADAM8, IL-13/PED2, IL17A/IL17F, CD3/CD19, CD138/CD20; CD138/CD40; CD19/CD20; CD20/CD3; CD38/CD138; CD38/CD20; CD38/CD40; CD40/CD20; CD-8/IL-6; CD20/BR3, TNFальфа/TGFбета, TNFальфа/IL-1бета; TNFальфа/IL-2, TNFальфа/IL-3, TNFальфа/IL-4, TNFальфа/IL-5, TNFальфа/IL6, TNFальфа/IL8, TNFальфа/IL-9, TNFальфа/IL-10, TNFальфа/IL-11, TNFальфа/IL-12, TNFальфа/IL-13, TNFальфа/IL-14, TNFальфа/IL-15, TNFальфа/IL-16, TNFальфа/IL-17, TNFальфа/IL-18, TNFальфа/IL-19, TNFальфа/IL-20, TNFальфа/IL-23, TNFальфа/IFNальфа, TNFальфа/CD4, TNFальфа/VEGF, TNFальфа/MIF, TNFальфа/ICAM-1, TNFальфа/PGE4, TNFальфа/PEG2, лиганда TNFальфа/RANK, TNFальфа/Te38; TNFальфа/BAFF; TNFальфа/CD22; TNFальфа/CTLA-4; TNFальфа/GP130; TNFα/IL-12p40; VEGF/HER2, VEGF-A/HER2, VEGF-A/PDGF, HER1/HER2, VEGF-A/VEGF-C, VEGF-C/VEGF-D, HER2/DR5, VEGF/IL-8, VEGF/MET, рецептора VEGFR/MET, VEGFR/EGFR, HER2/CD64, HER2/CD3, HER2/CD16, HER2/HER3; EGFR/HER2, EGFR/HER3, EGFR/HER4, IL-13/CD40L, IL4/CD40L, TNFR1/IL-1R, TNFR1/IL-6R, TNFR1/IL-18R, EpCAM/CD3, MAPG/CD28, EGFR/CD64, CSPGs/RGM A; CTLA-4/BTNO2; IGF1/IGF2; IGF1/2/Erb2B; MAG/RGM A; NgR/RGM A; NogoA/RGM A; OMGp/RGM A; PDL-I/CTLA-4; и RGM A/RGM B, IL1β/IL18, NRP1A/VEGFA, VEGFA/NRP2, cMET/EGFR, ALK1/BMP9, VEGFA/α5β1, HER1/HER3-BU и CMV. В некоторых вариантах изобретения гетеромультимерный белок согласно изобретению связывается по меньшей мере с двумя молекулами-мишенями, выбранными из группы, состоящей из α5β1, ALK1, BMP9, IL-1альфа, IL-1бета, TARC, MDC, MEF, TGF-β, агониста LHR, TWEAK, CL25, SPRR2a, SPRR2b, ADAM8, PED2, CD3, CD4, CD16, CD19, CD20, CD22, CD28, CD40, CD38, CD64, CD138, CD-8, BR3, TNFальфа, TGF-бета, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-17A, IL-17F, IL-18, IL-19, IL-20, IL-23, IL-25, IFNальфа, MIF, ICAM-1, PGE4, PEG2, лиганда RANK, Te38, BAFF, CTLA-4, GP130, IL-12p40, VEGF, VEGF-A, PDGF, HER1, HER2, HER3, HER3-BU, HER4, VEGF-C, VEGF-D, DR5, cMET, MET, рецептора MET, VEGFR, EGFR, CD40L, TNFR1, IL-1R, IL-6R, IL-18R, EpCAM, MAPG, CSPGs, BTNO2, IGF1, IGF2, IGF1/2, Erb2B, MAG, NgR, NogoA, NRP1, NRP2, OMGp, PDL-I, RGM A и RGM B. В некоторых вариантах изобретения гетеромультимерный белок согласно изобретению связывается с CD3 и по меньшей мере с одной дополнительной молекулой-мишенью, выбранной из BLR1, BR3, CD19, CD20, CD22, CD72, CD79A, CD79B, CD180 (RP105), CR2, FcRH1, FcRH2, FcRH5, FCER2, FCRL4, HLA-DOB и NAG14.
В способах согласно изобретению первая и вторая клетки-хозяева могут быть культивированы в любых условиях, позволяющих экспрессировать и выделять представляющие интерес полипептиды. Так, например, в одном из вариантов изобретения, первую клетку-хозяина и вторую клетку-хозяина в способе согласно изобретению культивируют в виде отдельных клеточных культур. В другом варианте изобретения первую клетку-хозяина и вторую клетку-хозяина в способе согласно изобретению культивируют в виде смешанной культуры, содержащей обе клетки-хозяина.
В некоторых вариантах изобретения, клетки-хозяева, экспрессирующие по меньшей мере один, по меньшей мере два, по меньшей мере три или более дополнительных полипептидов, содержащих шарнирную область, могут быть культивированы в одной и той же культуре или в отдельных культурах в виде первой и/или второй клетки-хозяина, содержащей шарнирную область. В некоторых вариантах изобретения дополнительный(ые) полипептид(ы), содержащий(е) шарнирную область, включает(ют) один и тот же домен гетеродимеризации в виде первого полипептида, содержащего шарнирную область. В некоторых вариантах изобретения дополнительный(ые) полипептид(ы), содержащий(е) шарнирную область, включает(ют) один и тот же домен гетеродимеризации в виде второго полипептида, содержащего шарнирную область.
Гетеромультимерные белки могут быть модифицированы так, чтобы они обладали улучшенными и/или дополнительными нужными свойствами. Такими свойствами являются биологические функции, такие как иммунные эффекторные функции, желательное время полужизни/клиренс in vivo, биологическая доступность, биологическое распределение или другие фармакокинетические свойства. Такие модификации хорошо известны специалистам и могут быть также определены эмпирически, и могут включать модификации группами, которые могут происходить или могут не происходить от пептидов. Так, например, антитела могут быть гликозилированными или негликозилированными, в основном, в зависимости, по меньшей мере частично, от природы клетки-хозяина. Предпочтительными антителами согласно изобретению являются негликозилированные антитела. Негликозилированное антитело, полученное способом согласно изобретению, может быть затем гликозилировано, например, с применением методов гликозилирования in vitro, хорошо известных специалистам. Как описано в настоящей заявке, гетеромультимерные белки согласно изобретению могут быть продуцированы в прокариотических клетках, например, в E. coli. Продуцированные в E. coli гетеромультимерные белки обычно являются негликозилированными и не обладают биологическими функциями, обычно ассоциированными с профилями гликозилирования, наблюдаемыми для гетеромультимерных белков, продуцируемых в клетках-хозяевах млекопитающих (например, СНО).
Настоящее изобретение также относится к иммуноконъюгатам, включающим гетеромультимерный белок согласно изобретению, конъюгированный с гетерологичной молекулой. При этом может быть использована любая гетерологичная молекула, при условии, что ее конъюгирование с антителом не будет приводить к значительному снижению нужной функции и/или нужного свойства антитела. Так, например, в некоторых вариантах изобретения иммуноконъюгат содержит гетерологичную группу, которой является цитотоксический агент. В некоторых вариантах изобретения указанный цитотоксический агент выбран из группы, состоящей из радиоактивного изотопа, химиотерапевтического агента и токсина. В некоторых вариантах изобретения указанный токсин выбран из группы, состоящей из калихеамицина, майтанзина и трихотена. В некоторых вариантах изобретения иммуноконъюгат содержит гетерологичную молекулу, которая представляет собой детектируемый маркер. В некоторых вариантах изобретения указанный детектируемый маркер выбран из группы, состоящей из радиоактивного изотопа, члена пары «лиганд-рецептор», члена пары «фермент-субстрат» и члена пары молекул, участвующих в переносе флуоресцентной резонансной энергии.
В одном из аспектов настоящее изобретение относится к композициям, содержащим гетеромультимерный белок согласно изобретению и носитель, который в некоторых вариантах изобретения является фармацевтически приемлемым.
В одном из аспектов настоящее изобретение относится к композициям, содержащим описанный здесь иммуноконъюгат и носитель, который в некоторых вариантах изобретения является фармацевтически приемлемым.
В одном из аспектов настоящее изобретение относится к композиции, содержащей популяцию мультиспецифических гетеромультимерных белков согласно изобретению. Как очевидно для специалиста в данной области, такая композиция по существу не может быть полностью (то есть, на 100%) гомогенной. Однако, как описано в настоящей заявке, способы согласно изобретению позволяют получить по существу, гомогенную популяцию мультиспецифических гетеромультимерных белков. Так, например, настоящее изобретение относится к композиции, содержащей гетеромультимерные белки, где по меньшей мере 40%, 45%, 50%, 55%, 60%, 65%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% указанных гетеромультимерных белков представляют собой описанное здесь мультиспецифическое антитело (например, биспецифическое антитело и т.п.) согласно изобретению.
В одном из аспектов настоящее изобретение относится к клеточной культуре, включающей смесь первой клетки-хозяина и второй клетки-хозяина, где указанная первая клетка-хозяин содержит нуклеиновую кислоту, кодирующую первый полипептид, содержащий шарнирную область, а вторая клетка-хозяин содержит нуклеиновую кислоту, кодирующую второй полипептид, содержащий шарнирную область, и где указанные две пары обладают различными специфичностями связывания с мишенью. В одном из аспектов настоящее изобретение относится к клеточной культуре, содержащей смесь первой клетки-хозяина и второй клетки-хозяина, где указанная первая клетка-хозяин экспрессирует первую пару полипептидов тяжелой и легкой цепей, а вторая клетка-хозяин экспрессирует вторую пару полипептидов тяжелой и легкой цепей, и где указанные две пары обладают различными специфичностями связывания с мишенью.
В другом аспекте настоящее изобретение относится к промышленному изделию, включающему контейнер и содержащуюся в нем композицию согласно изобретению, где указанная композиция включает гетеромультимерный белок (например, антитело) согласно изобретению. В другом аспекте настоящее изобретение относится к промышленному изделию, включающему контейнер и содержащуюся в нем композицию согласно изобретению, где указанная композиция содержит описанный здесь иммуноконъюгат. В некоторых вариантах изобретения эти промышленные изделия также включают инструкции по применению указанной композиции.
В другом аспекте настоящее изобретение относится к полинуклеотидам, кодирующим гетеромультимерный белок согласно изобретению. В другом аспекте настоящее изобретение относится к полинуклеотидам, кодирующим описанный здесь иммуноконъюгат.
В одном из аспектов настоящее изобретение относится к рекомбинантным векторам для экспрессии молекулы (например, антитела) согласно изобретению. В другом аспекте настоящее изобретение относится к рекомбинантным векторам для экспрессии иммуноконъюгата согласно изобретению.
В способах согласно изобретению может быть использовано любое количество клеток-хозяев. Такие клетки известны специалистам (некоторые из них описаны в настоящей заявке), либо они могут быть определены эмпирически с точки зрения возможности их применения в способах согласно изобретению, проводимых рутинными методами, известными специалистам. В одном из вариантов изобретения клетка-хозяин является прокариотической. В некоторых вариантах изобретения клеткой-хозяином является грамотрицательная бактериальная клетка. В одном из вариантов изобретения клеткой-хозяином является E. coli. В некоторых вариантах изобретения E. coli представляет собой штамм, дефицитный по липопротеину (Δlpp). В некоторых вариантах изобретения генотип клетки-хозяина E. coli не содержит генов degP и prc и имеет мутантный ген spr. В одном из вариантов изобретения клеткой-хозяином является клетка млекопитающего, например, клетка яичника китайского хомячка (CHO).
В одном из аспектов настоящее изобретение относится к клеткам-хозяевам, содержащим полинуклеотид или рекомбинантный вектор согласно изобретению. В одном из вариантов изобретения клеткой-хозяином является клетка млекопитающего, например, клетка яичника китайского хомячка (CHO). В одном из вариантов изобретения клеткой-хозяином является прокариотическая клетка. В некоторых вариантах изобретения клеткой-хозяином является грамотрицательная бактериальная клетка, которая в некоторых вариантах изобретения представляет собой E. coli. Клетки-хозяева согласно изобретению могут также содержать полинуклеотид или рекомбинантный вектор, кодирующий молекулу, экспрессия которой в клетке-хозяине приводит к повышению выхода гетеромультимерного белка в способе согласно изобретению. Так, например, указанной молекулой может быть белок шаперон. В одном из вариантов изобретения указанной молекулой является прокариотический полипептид, выбранный из группы, состоящей из DsbA, DsbC, DsbG и FkpA. В некоторых вариантах изобретения указанный полинуклеотид или рекомбинантный вектор кодируют DsbA и DsbC. В некоторых вариантах изобретения клеткой-хозяином E. coli является штамм, дефицитный по эндогенной протеазной активности. В некоторых вариантах изобретения генотип клетки-хозяина E. coli является генотипом штамма E. coli, в котором отсутствуют гены degP и prc и присутствует мутантный ген spr. В некоторых вариантах изобретения генотипом клетки-хозяина E. coli является lpp.
Гетеромультимерные белки согласно изобретению находят широкое применение в различных целях. Одним из примеров гетеромультимерного белка согласно изобретению может служить терапевтическое антитело. Другим примером гетеромультимерного белка согласно изобретению может служить антитело-агонист. Другим примером гетеромультимерного белка согласно изобретению может служить антитело-антагонист. Гетеромультимерный белок согласно изобретению может также представлять собой диагностическое антитело. Еще одним примером гетеромультимерного белка согласно изобретению является блокирующее антитело. Другим примером гетеромультимерного белка согласно изобретению является нейтрализующее антитело.
В одном из аспектов настоящее изобретение относится к способам лечения или замедления развития заболевания у индивидуума, где указанные способы включают введение указанному индивидууму гетеромультимерного белка согласно изобретению. В одном из вариантов изобретения таким заболеванием является рак. В другом варианте изобретения указанное заболевание ассоциируется с нарушением регуляции ангиогенеза. В другом варианте изобретения, таким заболеванием является иммунное расстройство, такое как ревматоидный артрит, иммунная тромбоцитопеническая пурпура, системная красная волчанка и т.п.
В одном из аспектов настоящее изобретение относится к применению гетеромультимерного белка (например, антитела) согласно изобретению в целях приготовления лекарственного препарата для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное (такое как аутоиммунное) расстройство и/или расстройство, ассоциированное с ангиогенезом.
В одном из аспектов настоящее изобретение относится к применению нуклеиновой кислоты согласно изобретению в целях приготовления лекарственного препарата для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное (например, аутоиммунное) расстройство и/или расстройство, ассоциированное с ангиогенезом.
В одном из аспектов настоящее изобретение относится к применению экспрессионного вектора согласно изобретению в целях приготовления лекарственного препарата для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное (такое как аутоиммунное) расстройство и/или расстройство, ассоциированное с ангиогенезом.
В одном из аспектов настоящее изобретение относится к применению клетки-хозяина согласно изобретению в целях приготовления лекарственного препарата для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное (такое как аутоиммунное) расстройство и/или расстройство, ассоциированное с ангиогенезом.
В одном из аспектов настоящее изобретение относится к применению промышленного изделия согласно изобретению в целях приготовления лекарственного препарата для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное (такое как аутоиммунное) расстройство и/или расстройство, ассоциированное с ангиогенезом.
В одном из аспектов настоящее изобретение относится к применению набора согласно изобретению в целях приготовления лекарственного препарата для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное (такое как аутоиммунное) расстройство и/или расстройство, ассоциированное с ангиогенезом.
Другие объекты, отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения. Однако следует отметить, что подробное описание изобретения и конкретные примеры его осуществления, приведенные с указанием предпочтительных вариантов изобретения, даны лишь в иллюстративных целях, поскольку в него могут быть внесены различные изменения и модификации, не выходящие за рамки существа и объема изобретения и очевидные для специалиста в области, к которой относится настоящее изобретение.
Краткое описание графического материала
На фигуре 1A проиллюстрировано полностью окисленное полуантитело. На этой фигуре не показаны «узлы» или «дырки» или другие домены гетеродимеризации. Полуантитело, представленное на этой фигуре, имеет изотип IgG1. Для специалиста в данной области очевидно, что в виде полуантител с соответствующими межцепьевыми и внутрицепьевыми связями могут быть представлены иммуноглобулины других изотипов. В интактном Ab цистеины шарнирной области образуют межцепьевые дисульфидные связи.
На фигуре 1B проиллюстрировано полноразмерное биспецифическое антитело. На этой фигуре не показаны дисульфидные связи между тяжелыми цепями в шарнирной области.
На фигурах 2A и B проиллюстрированы плазмиды, кодирующие полуантитела с «узлами» и «дырками», соответственно.
На фигуре 3A проиллюстрировано получение гетеромультимерных белков, например, биспецифических антител, с применением метода общих легких цепей. Полученное BsAb имеет две различных тяжелых цепи, каждая из которых спарена с общей легкой цепью.
На фигуре 3B проиллюстрировано получение гетеромультимерных белков, например, биспецифических антител, с использованием отдельно сконструированных и экспрессированных полуантител. Полученное BsAb обычно имеет две различных тяжелых цепи, каждая из которых спарена с его когнатной легкой цепью. В этом методе каждая легкая цепь необязательно должна быть одинаковой для каждого полуантитела.
На фигуре 4A представлена блок-схема, на которой проиллюстрировано получение биспецифических антител с использованием отдельно сконструированных и экспрессированных полуантител. Этот метод был проведен с помощью окислительно-восстановительной химической реакции.
На фигуре 4B показан кумасси-окрашенный гель. Два полуантитела были проанализированы с помощью электрофореза в ДСН-ПААГ в восстанавливающих и невосстанавливающих условиях. Доминирующей фракцией является пара легкая цепь-тяжелая цепь размером 75 кД для каждого полуантитела в восстанавливающих условиях. В восстанавливающих условиях (например, при обработке ДТТ) каждая цепь визуально наблюдалась как отдельная полоса.
На фигуре 4C представлены результаты масс-спектрометрии ESI-TOF полуантитела, полученные при обработке 1 мМ N-этилмалеимида (NEM) и без такой обработки. После обработки NEM, какого-либо изменения массы полуантитела не наблюдалось, что указывает на то, что все цистеиновые остатки были полностью окислены. Окисленные цистеины шарнирной области представлены как циклический дисульфид в проиллюстрированной аминокислотной последовательности. Предполагаемая масса полуантитела составляла 72,548 дальтон, и именно такая масса наблюдалась после масс-спектрометрии, что указывает на отсутствие ковалентных аддуктов.
На фигуре 4D представлены хроматограмма карбоксиметила (CM), фотография ДСН-ПААГ-геля и приведенная масса продукта биспецифического анти-EGFR/анти-c-met антитела. CM-хроматография давала один пик, который затем анализировали с помощью электрофореза в ДСН-ПААГ. Большая полоса на геле представляла полноразмерное (то есть, интактное) биспецифическое антитело. В области 75 кД также могла наблюдаться небольшая полоса. Большая полоса была затем проанализирована с помощью масс-спектрометрии, и этот анализ указывал на то, что только детектируемый продукт интактного антитела соответствовал теоретической молекулярной массе (MW) биспецифического анти-EGFR/анти-c-met антитела.
На фигуре 5A представлена блок-схема крупномасштабного получения биспецифических антител с использованием отдельно сконструированных и экспрессированных полуантител.
На фигуре 5B представлена фотография геля, которая указывает на то, что очищенные полуантитела имеют размер молекулы в основном ~75 кД в невосстанавливающих условиях. В восстанавливающих условиях (например, при обработке ДТТ) каждая цепь визуально наблюдалась как отдельная полоса.
На фигуре 5C представлены результаты ДСН-ПААГ-анализа очищенного биспецифического антитела после удаления агрегатов, указывающие на то, что крупной молекулой является интактное биспецифическое антитело размером 150 кД. Кроме того, проиллюстрированы те же самые образцы, которые были проанализированы в восстанавливающих условиях, и которые указывают на то, что весь выделенный продукт представляет собой легкую цепь или тяжелую цепь антитела.
На фигуре 6A представлен график, иллюстрирующий биологическую активность антител в отношении нейтрализации цитокинов IL-4 и IL-13 в анализе на пролиферацию клеток TF-2. На графике показано, что это биспецифическое антитело обладает такой же активностью, как и два продуцируемых у млекопитающего полноразмерных антитела, добавляемых вместе или отдельно.
На фигуре 6B представлена панель из трех графиков, иллюстрирующая фармакокинетические (ФК) свойства анти-IL-4/анти-IL-13 биспецифического антитела собакоподобных обезьян для Fc дикого типа и мутированного Fc, как было определено с помощью ELISA. На первом графике показаны фармакокинетические (ФК) свойства для Fc дикого типа в дозе 2 мг/кг. На среднем графике также показаны фармакокинетические (ФК) свойства для Fc в дозе 20 мг/кг. На последнем графике показаны фармакокинетические (ФК) свойства для мутантного Fc в дозе 20 мг/кг. Биспецифическое антитело обнаруживало двухкамерную модель клиренса у тестируемых животных. Самки обозначены заштрихованными кружочками, а самцы обозначены незаштрихованными кружочками. У трех животных наблюдался терапевтический ответ с вырабатыванием антител, что указывало на резкое снижение уровня измеряемого антитела в сыворотке на 21-й день.
На фигуре 7 представлена фотография полиакриламидного геля. Перед лизисом, весь сбраживаемый бульон смешивали в различных отношениях. Затем белок, образовавшийся после лизиса, экстрагировали и загружали на гель для электрофореза в невосстанавливающих условиях. Очищенные биспецифические антитела, образовавшиеся при проведении этой процедуры, визуально наблюдались как верхняя полоса на геле.
На фигуре 8A представлена фотография двух полиакриламидных гелей для сравнения продуцирования биспецифического антитела при культивировании клеток отдельно и при совместном культивировании клеток, экспрессирующих полуантитела. В условиях совместного культивирования, интактное биспецифическое антитело продуцируется на гораздо более высоком уровне. При независимой экспрессии и очистке полуантител с последующим их смешиванием, полуантитела составляют менее чем 5% от интактного биспецифического антитела. В условиях совместного культивирования, более чем 40% составляют интактные биспецифические антитела, как было определено по 150 кД/(150 кД + 75 кД) с применением методов детерминации белка Li-Core.
На фигуре 8B схематически проиллюстрирован эксперимент по совместному культивированию с использованием варьирующегося количества клеточной популяции для начальной инокуляции. Используемые отношения и относительное количество полноразмерного биспецифического антитела представлены в нижней части фигуры.
На фигуре 8C представлена фотография геля для трех отдельных 10-литровых ферментеров, в которых содержатся клетки и анти- EGFR и анти-c-Met антитела в соотношении 1:1. При проведении каждой процедуры продуцировалось полноразмерное биспецифическое антитело в виде главного продукта, что указывало на воспроизводимость этого процесса.
На фигуре 8D представлена блок-схема способа совместного культивирования для продуцирования гетеромультимерных белков, например, биспецифических антител.
На фигуре 8E представлена хроматограмма УФ-поглощения на 280 нм, на которой были идентифицированы два высоких пика при времени удерживания 91,79 и 102,35. Последующий масс-спектрометрический анализ показал, что интактное биспецифическое антитело было эффективно отделено от избыточного полуантитела.
На фигуре 8F проиллюстрирован анализ пика 91,79, представленного на фигуре 8E, с помощью электрофореза в ДСН-ПААГ и масс-спектрометрии. Приведение масс-спектрометрических данных выявило одиночный пик при 146051,89 дальтон, что соответствует ожидаемой массе биспецифического антитела. Примесные гомодимерные молекулы не детектировались.
На фигуре 8G проиллюстрировано сравнение рабочих блок-схем для независимого продуцирования гетеромультимерных белков и для их продуцирования путем совместного культивирования.
На фигуре 9A представлены три хроматограммы. На верхней хроматограмме пик поглощения при элюировании образца без EDTA отсутствует. На средней хроматограмме наблюдается отчетливый пик элюирования для образца EDTA, из которого авторами настоящего изобретения было выделено приблизительно 1,5 мг белка. На нижней хроматограмме также наблюдался аналогичный пик элюирования для образца, который был обработан EDTA и Mg, и из которого авторами настоящего изобретения было выделено 1,1 мг белка. Белки, выделенные из EDTA-образца, EDTA + Mg-образца и пула фракций, имеющих такое же время удерживания, как и необработанный EDTA-образец, анализировали с помощью электрофореза в ДСН-ПААГ в восстанавливающих и в невосстанавливающих условиях.
На фигуре 9B представлена фотография ДСН-ПААГ-геля, описанного на фигуре 9A. Образцы, обработанные EDTA, продуцировали интактное биспецифическое антитело, которое высвобождалось в культуральную среду.
На фигуре 9C-1, на фигуре 9C-2 и на фигуре 9C-3 представлены хроматограммы масс-спектрометрии для выделенных образцов, описанных на фигуре 9A. Эти образцы с EDTA давали ожидаемую массу для биспецифического антитела и массу для избыточного полуантитела.
На фигуре 9D представлены фотография ДСН-ПААГ-геля и масс-хроматограммы указанных полос. Дорожка 1 - маркеры молекулярной массы (MW), дорожка 2 - независимо экспрессируемое анти-IL-13 антитело, дорожка 3 - независимо экспрессируемое анти-IL-4 антитело и дорожка 4 – со-культура двух клеток. Масс-спектральный анализ всех трех образцов показал, что со-культура продуцирует интактное биспецифическое антитело и избыточное количество одного полуантитела, анти-IL-4 антитела. Также показано, что анти-IL-13 полуантитело имеет стехиометрическое ограничение. При независимой экспрессии и очистке полуантител с их последующим смешиванием, эти полуантитела составляют приблизительно 2% (анти-IL-13 антитела) и 3% (анти-IL-4 антитела) от всего количества интактного биспецифического антитела. В условиях совместного культивирования приблизительно 60% составляют интактные биспецифические антитела, как было определено по 150 кД/(150 кД+75 кД) с применением методов детерминации белка Li-Core.
На фигуре 9E-1 и на фигуре 9E-2 представлены две ГХ-хроматограммы для двух со-культур, которые имеют различные соотношения клеток в исходном инокуляте для ферментации, как указано на фигуре. При этом наблюдалось явное различие в продуктах, что соответствовало соотношению клеток в исходном инокуляте. При применении такого подхода становится очевидным, что соотношение клеток в исходном инокуляте может быть изменено для достижения оптимального продуцирования гетеромультимерного белка.
На фигуре 9F показана панель из четырех фотографий, на которых проиллюстрирован ДСН-ПААГ-анализ в восстанавливающих и в невосстанавливающих условиях для восьми различных биспецифических антител, полученных описанным здесь способом совместного культивирования. Не восстанавливающие гели для анти-CD3/анти-CD19 гетеромультимерных белков не показаны. Стрелками указаны интактные биспецифические антитела.
На фигуре 10 схематически проиллюстрирован матричный метод скрининга гетеромультимерных белков.
На фигуре 11 представлены два графика, которые иллюстрируют in vitro активность биспецифических антител, полученных описанными здесь методами.
На фигуре 12 представлен график, на котором показано, что анти-EGFR/анти-c-met биспецифическое антитело обладает противоопухолевой активностью в модели ксенотрансплантата поджелудочной железы KP4 in vivo.
На фигуре 13 представлен график, на котором показано, что анти-EGFR/анти-c-met биспецифическое антитело обладает противоопухолевой активностью в модели ксенотрансплантата эпидермоидной карциномы A431 in vivo.
На фигуре 14 представлены ГХ-хроматограммы: A) «узла» до сборки, B) «дырок» до сборки, C) биспецифического антитела после сборки. На фигуре 14D представлен гель для каждой "руки" до сборки.
На фигуре 15 представлена электрофоретическая хроматограмма вещества после сборки, указывающая на то, что 86% вещества являются полностью окисленными.
На фигуре 16: Характеризация собранного биспецифического антитела после сборки: A) ГХ-хроматограмма гибридизованного биспецифического антитела, указывающая на то, что данное вещество составляет >90,5% биспецифического антитела, B) гель очищенного вещества, C) приведенные данные масс-спектрономии конечного образца и D) таблица теоретических масс.
На фигуре 17 схематически проиллюстрированы окислительно-восстановительные реакции (с нагреванием): a) образец нагревают в течение одного часа для циклизации дисульфидных связей, b) затем охлаждают, и цистеины восстанавливают с использованием 2 мМ DTT в течение двух часов, и c) затем концентрируют, и цистеины окисляют воздухом путем диализа при комнатной температуре.
На фигуре 18 схематически проиллюстрированы окислительно-восстановительные реакции (без нагревания): a) образец смешивают в течение двух часов, b) цистеины восстанавливают с использованием 2 мМ DTT в течение двух часов, и c) затем концентрируют, и цистеины окисляют воздухом, а EDTA удаляют путем диализа при комнатной температуре.
На фигуре 19 представлены данные анализа биспецифического антитела после сборки: A) ГХ-хроматограмма, полученная при осуществлении окислительно-восстановительной реакции с проведением стадии нагревания, B) ГХ-хроматограмма, полученная при осуществлении окислительно-восстановительной реакции без проведения стадии нагревания.
Сокращения
ADCC = Антитело-зависимая клеточно-опосредуемая цитотоксичность
API = Антипатогенные иммуноадгезины
BPI = Белок, усиливающий бактерицидное действие/проницаемость
C1q = Фактор комплемента 1q
CD = Кластер дифференцировки
CDC = Комплемент-зависимая цитотоксичность
CH1 или CH1 = Первый константный домен тяжелой цепи
CH2 или CH2 = Второй константный домен тяжелой цепи
CH3 или CH3 = Третий константный домен тяжелой цепи
CH4 или CH4 = Четвертый константный домен тяжелой цепи
CL или CL = Константный домен легкой цепи
CTLA = Молекула, ассоциированная с цитотоксическими Т-лимфоцитами
Fc = Кристаллизующийся фрагмент
FcγR = Рецептор гамма Fc-части IgG
HIV (ВИЧ) = Вирус иммунодефицита человека
ICAM = Молекула межклеточной адгезии
BsAb = Биспецифическое антитело
BsDb = Биспецифическое диантитело
dsFv = Fv, стабилизированный дисульфидом
Fc = Константный фрагмент антитела
Fd = VH +CH1 антитела
FcR = Fc-рецептор
Fv = Вариабельный фрагмент антитела
IgG = Иммуноглобулин G
mAb = Моноклональное антитело
PBL = Лимфоцит периферической крови
scDb = Одноцепочечное диантитело
scFv = Одноцепочечный Fv
(scFv)2 = Тандем scFv-scFv
Tandab = Тандемное диантитело
VH или VH = Вариабельный домен тяжелой цепи антитела
VL или VL = Вариабельный домен легкой цепи антитела
Подробное описание изобретения
Настоящее изобретение подробно описано далее со ссылками на нижеследующие определения и примеры. Все патенты и публикации, включая все последовательности, приведенные в указанных патентах и публикациях, точно вводятся в настоящее описание посредством ссылки.
Если это конкретно не определено в описании настоящей заявки, то все используемые здесь технические и научные термины имеют значения, в основном понятные среднему специалисту в области, к которой относится изобретение. В публикациях Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994), и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991), приводится общий словарь многих терминов, обычно употребляемых специалистами и используемых в настоящем изобретении. Хотя для практического осуществления изобретения и анализов могут быть применены методы и материалы, аналогичные или эквивалентные описанным здесь методам и материалы, однако предпочтительными являются методы и материала, описанные в настоящей заявке. Численные интервалы включают числовые значения, указанные в данном интервале. Если это не оговорено особо, то нуклеиновые кислоты записываются слева направо в направлении 5'→3', а аминокислотные последовательности записываются слева направо в направлении от амино-конца до карбокси-конца, соответственно. Определение конкретных понятий и специальных терминов специалисты могут, в частности, найти в руководстве Sambrook et al., 1989, и Ausubel F.M. et al., 1993. Следует отметить, что настоящее изобретение не ограничивается конкретно описанными здесь методами, протоколами и реагентами, которые могут варьировать.
Численные интервалы включают числовые значения, указанные в данном интервале.
Если это не оговорено особо, то нуклеиновые кислоты записываются слева направо в направлении 5'→3', а аминокислотные последовательности записываются слева направо в направлении от амино-конца до карбокси-конца, соответственно.
Представленные в настоящей заявке заголовки разделов не ограничивают различных аспектов или вариантов настоящего изобретения, которые упоминаются в настоящей заявке посредством ссылки на описание в целом. В соответствии с этим, термины, определенные непосредственно ниже, будут более подробно объяснены со ссылками на описание настоящего изобретения в целом.
I. Определения
Термины «гетеромультимер», «гетеромультимерный комплекс» или «гетеромультимерный белок» означают молекулу, включающую по меньшей мере первый полипептид, содержащий шарнирную область, и второй полипептид, содержащий шарнирную область, где аминокислотная последовательность второго полипептида, содержащего шарнирную область, отличается от аминокислотной последовательности первого полипептида, содержащего шарнирную область, по меньшей мере одним аминокислотным остатком. Гетеромультимер может включать «гетеродимер», образованный первым и вторым полипептидами, содержащими шарнирную область, либо он может образовывать более высокоупорядоченные третичные структуры, в которых, помимо первого и второго полипептидов, содержащих шарнирную область, присутствуют и другие полипептиды. Полипептиды гетеромультимера могут взаимодействовать друг с другом посредством непептидного связывания, ковалентного связывания (например, посредством дисульфидной связи) и/или нековалентного связывания (например, посредством водородных связей, ионных связей, ван-дер-ваальсовых сил и/или гидрофобных взаимодействий).
Используемый здесь термин «домен гетеромультимеризации» означает модификации или добавления, введенные в биологическую молекулу для стимуляции образования гетеромультимера и стерически затрудненного гомомультимера. Любой домен гетеродимеризации, который является в высокой степени предпочтительным для образования гетеродимеров, а не гомодимеров, входит в объем настоящего изобретения. Репрезентативные примеры приводятся в публикациях, которыми являются, но не ограничиваются ими, заявка на патент США 20030078385 (Arathoon et al. – Genentech, где описаны «узлы в дырках»); WO2007147901 (Kjaergaard et al. - Novo Nordisk, где описаны ионные взаимодействия); WO 2009089004 (Kannan et al. – Amgen, где описаны эффекты электростатического сдвига); предварительная заявка на патент США 61/243105 (Christensen et al. – Genentech, где описаны суперспирализованные спирали). См. также, например, публикацию Pack, P. & Plūckthun, A., Biochemistry 31, 1579-1584 (1992), где описана «лейциновая застежка», или публикацию Pack et al., Bio/Technology 11, 1271-1277 (1993), где описан мотив «спираль-петля-спираль». Используемые здесь термины «домен гетеромультимеризации» и «домен гетеродимеризации» являются синонимами.
Используемый здесь термин «полипептид, содержащий шарнирную область» означает полипептид, который включает область, соответствующую шарнирной области иммуноглобулина, известной специалистам, например, область, расположенную между CH1 и CH2 доменами тяжелой цепи. Используемые здесь термины «шарнирная область», «шарнирная последовательность» и их варианты имеют общепринятое значение и описаны, например, в публикациях Janeway's Immunobiology (Garland Science, Taylor & Francis Group, LLC, NY) (7th ed., 2008); Bloom et al., Protein Science (1997), 6:407-415; Humphreys et al., J. Immunol. Methods (1997), 209:193-202. См. также, например, публикации Burton, Molec. Immunol. 22:161-206 (1985), и Papadea, C. and I. J. Check (1989) "Human immunoglobulin G and immunoglobulin G subclasses: biochemical, genetic, and clinical aspects". Crit Rev Clin Lab Sci 27(1):27-58. Следует отметить, что число аминокислот, а также число цистеиновых остатков, доступных для образования межцепьевой дисульфидной связи в иммуноглобулинах различных классов и изотипов, варьирует. Все указанные шарнирные области могут присутствовать в полипептидах, содержащих шарнирную область, и входят в объем настоящего изобретения.
Термин «антитело» используется здесь в самом широком смысле и означает любую молекулу иммуноглобулина (Ig), содержащую две тяжелых цепи и две легких цепи, и любой ее фрагмент, мутант, вариант или производное, при условии, что они обладают нужной биологической активностью (например, активностью связывания с эпитопом). Примерами антител являются моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, описанные в настоящей заявке. Антитело может быть человеческим, гуманизованным и/или аффинно зрелым.
Другими словами, используемый здесь термин «антитело» означает структуру иммуноглобулина G (IgG). Однако специалисту в данной области понятно/известно, что в описанном здесь способе согласно изобретению может быть использовано антитело, принадлежащее к иммуноглобулинам любого класса. Для ясности, молекула IgG содержит пару идентичных тяжелых цепей (HC) и пару идентичных легких цепей (LC). Каждая LC имеет один вариабельный домен (VL) и один константный домен (CL), а каждая HC имеет один вариабельный домен (VH) и три константных домена (CH1, CH2 и CH3). CH1 и CH2 домены соединены друг с другом шарнирной областью. Такая структура хорошо известна специалистам. Описание этой структуры приводится на фигуре 1В.
Используемый здесь термин «полуантитело» означает одну тяжелую цепь иммуноглобулина, связанную с одной легкой цепью иммуноглобулина. Репрезентативное полуантитело описано на фигуре 1A. Для специалиста в данной области очевидно, что полуантитело может также иметь антигенсвязывающий домен, состоящий из одного вариабельного домена.
Термин «максиантитело» означает слитый белок, содержащий scFv, слитый с Fc-полипептидом. Такое антитело описано на фигуре 8a заявки WO 2009089004. Биспецифическое максиантитело описано на фигуре 2 заявки WO 2009089004.
Термин «CH2-домен» Fc-области человеческого IgG обычно относится к остаткам, расположенным от примерно положения 231 до примерно положения 340 IgG в соответствии с Европейской системой нумерации. Уникальность CH2-домена состоит в том, что он тесно не спаривается с другим доменом. Вместо этого, две N-связанных разветвленных углеводных цепи встроены между двумя CH2-доменами интактной нативной молекулы IgG. Было высказано предположение, что углевод может служить заменителем пары «домен-домен» и облегчать стабилизацию CH2-домена. Burton, Molec. Immunol. 22:161-206 (1985).
Термин «CH3-домен» включает фрагмент, простирающийся от С-концевых остатков до CH2-домена в Fc-области (то есть, от примерно аминокислотного остатка 341 до примерно аминокислотного остатка 447 IgG в соответствии с Европейской системой нумерации).
Используемый здесь термин «Fc-область» обычно означает димерный комплекс, включающий С-концевые полипептидные последовательности тяжелой цепи иммуноглобулина, где С-концевая полипептидная последовательность образуется в результате гидролиза интактного антитела папаином. Fc-область может включать природные или модифицированные последовательности Fc. Хотя границы Fc-последовательности тяжелой цепи иммуноглобулина могут варьировать, однако, Fc-последовательность тяжелой цепи человеческого IgG обычно определяют как фрагмент, начинающийся от аминокислотного остатка в положении приблизительно Cys226 или от остатка в положении приблизительно Pro230, и простирающийся до ее карбокси-конца. Если это не оговорено особо, то аминокислотные остатки в Fc-области или в константной области пронумерованы в соответствии с Европейской системой нумерации, также обозначаемой EU-индексом, как описано у Кэбата (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991). Fc-последовательность иммуноглобулина обычно включает два константных домена, CH2-домен и CH3-домен, и необязательно CH4-домен. Используемый здесь термин «Fc-полипептид» означает один из полипептидов, который составляет Fc-область, например, мономерный Fc. Fc-полипептид может быть получен из любого подходящего иммуноглобулина, такого как иммуноглобулин подтипов IgG1, IgG2, IgG3 или IgG4, или иммуноглобулин IgA, IgE, IgD или IgM. Fc-область включает карбокси-концевые части обеих Н-цепей, связанных друг с другом дисульфидными связями. Эффекторные функции антител определяют по последовательностям в Fc-области, где указанная область также является частью, распознаваемой Fc-рецепторами (FcR), расположенными на клетках некоторых типов. В некоторых вариантах изобретения Fc-полипептид содержит часть последовательности шарнирной области дикого типа или всю эту последовательность (в основном, у N-конца). В некоторых вариантах изобретения Fc-полипептид не содержит функциональной последовательности шарнирной области или последовательности шарнирной области дикого типа.
«Функциональная Fc-область» обладает «эффекторной функцией» Fc-области с нативной последовательностью. Примеры «эффекторных функций» включают связывание с C1q; CDC; связывание с Fc-рецептором; ADCC; фагоцитоз; негативную регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора; BCR) и т.п. Для осуществления таких эффекторных функций обычно требуется, чтобы Fc-область была объединена со связывающим доменом (например, с вариабельным доменом антитела), и такие эффекторные функции могут быть проанализированы, например, с помощью различных анализов, описанных в разделе «Определения».
«Fc-область с нативной последовательностью» содержит аминокислотную последовательность, идентичную природной аминокислотной последовательности Fc-области. Человеческими Fc-областями с нативной последовательностью являются Fc-область человеческого IgG1 с нативной последовательностью (не-А и А-аллотипы); Fc-область человеческого IgG2 с нативной последовательностью; Fc-область человеческого IgG3 с нативной последовательностью и Fc-область человеческого IgG4 с нативной последовательностью, а также все природные варианты вышеуказанных областей.
«Вариант Fc-области» содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности нативной Fc-области благодаря введению в эту область по меньшей мере одной аминокислотной модификации, а предпочтительно одной или нескольких аминокислотных замен. Предпочтительно, чтобы такой вариант Fc-области, в отличие от Fc-области с нативной последовательностью или Fc-области родительского полипептида, имел по меньшей мере одну аминокислотную замену, например, примерно от одной до десяти аминокислотных замен, а предпочтительно примерно от одной до пяти аминокислотных замен Fc-области с нативной последовательностью или в Fc-области родительского полипептида. Описанный здесь вариант Fc-области предпочтительно должен быть по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% гомологичен Fc-области с нативной последовательностью и/или Fc-области родительского полипептида.
Используемый здесь термин «Fc-компонент» означает шарнирную область, CH2-домен или CH3-домен Fc-области.
В некоторых вариантах изобретения полипептид, содержащий шарнирную область, включает Fc-область IgG, предпочтительно происходящую от Fc-области человеческого IgG дикого типа. Термин «Fc человеческого IgG дикого типа» означает природные аминокислотные последовательности, обычно встречающиеся у человека. Очевидно, что такая Fc-последовательность может слегка варьироваться у разных индивидуумов, и в эту последовательность дикого типа могут быть внесены одна или несколько модификаций, которые также входят в объем настоящего изобретения. Так, например, Fc-область может содержать дополнительные модификации, не относящиеся к настоящему изобретению, такие как мутация в сайте гликозилирования или включение неприродной аминокислоты.
Термин «вариабельная область» или «вариабельный домен» означает домен тяжелой или легкой цепи антитела, участвующий в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют аналогичные структуры, где каждый домен содержит четыре консервативных каркасных области (FR) и три гипервариабельных области (HVR). (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).) Для сообщения специфичности связывания с антигеном может оказаться достаточным присутствия одного домена VH или VL. Кроме того, для скрининга библиотеки комплементарных VH или VL доменов, антитела, которые связываются с конкретным антигеном, могут быть выделены с использованием антигенсвязывающих VH или VL доменов антитела, соответственно. См., например, Portolano et al., J. Immunol. 150:880-887 (1993); Clackson et al., Nature 352:624-628 (1991).
Используемый здесь термин «Fab» означает антигенсвязывающий фрагмент антитела. Как указывалось выше, для гидролиза интактного антитела может быть использован папаин. Гидролиз антител папаином приводит к продуцированию двух идентичных антигенсвязывающих фрагментов, то есть «Fab»-фрагментов и остаточного «Fc»-фрагмента (то есть, Fc-области, см. выше). Fab-фрагмент состоит из полноразмерной L-цепи, связанной с доменом вариабельной области H-цепи (VH), и первым константным доменом одной тяжелой цепи (CH1).
Используемые здесь термины «антигенсвязывающая «рука», «рука», связывающаяся с молекулой-мишенью», «мишень-связывающая «рука» и их варианты означают часть компонента гетеромультимерного белка согласно изобретению, обладающую способностью специфически связываться с представляющей интерес мишенью. Вообще говоря и предпочтительно, антигенсвязывающая «рука» представляет собой комплекс полипептидных последовательностей иммуноглобулина, например, CDR и/или последовательностей вариабельных доменов легкой и тяжелой цепи иммуноглобулина.
Термин «мишень» или «молекула-мишень» означает молекулу, распознаваемую связывающей «рукой» гетеромультимерного белка. Так, например, если гетеромультимерным белком является антитело, то мишенью могут быть эпитопы на одной молекуле или на различных молекулах, либо патоген или опухолевая клетка, в зависимости от конкретной ситуации. Аналогичным образом, если гетеромультимерным белком является слитый белок «рецептор-Fc», то мишенью может быть когнатный партнер по связыванию с рецептором. Для специалиста в данной области очевидно, что мишень определяют по специфичности связывания с мишень-связывающей «рукой», и что различные мишень-связывающие "руки" могут распознавать различные мишени. Мишень предпочтительно, связывается с гетеромультимерным белком согласно изобретению с аффинностью, превышающей 1 мкМ/кД (в соответствии с анализом Скэтчарда). Примерами молекул-мишеней являются, но не ограничиваются ими, растворимые сывороточные белки и/или их рецепторы, такие как цитокины и/или рецепторы цитокинов, адгезины, факторы роста и/или их рецепторы, гормоны, вирусные частицы (например, белок F вируса RSV, CMV, StaphA, вирус гриппа, вирус гепатита С), микроорганизмы (например, белки бактериальных клеток, клетки грибов), адгезины, белки CD и их рецепторы.
Одним из примеров «интактного» или «полноразмерного» антитела является антитело, содержащее антигенсвязывающую «руку», а также CL и по меньшей мере константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут представлять собой константные домены с нативной последовательностью (например, константные домены человеческой нативной последовательности) или варианты их аминокислотных последовательностей.
Используемый здесь термин «связывание» означает стадии, необходимые для связывания первого и второго полипептидов, содержащих шарнирную область, друг с другом, например, с образованием ковалентной связи. Такие стадии включают восстановление, гибридизацию и/или окисление цистеиновых остатков в первом и втором полипептидах, содержащих шарнирную область, с образованием межцепьевой дисульфидной связи. Связывание может быть достигнуто посредством химического перекрестного сшивания или с использованием системы окислительно-восстановительных реакций. См., например, Humphreys et al., J. Immunol. Methods (1998) 217:1-10, и Zhu et al., Cancer Lett., (1994) 86:127-134.
Термин «мультиспецифическое антитело» используется в самом широком смысле, и в частности, охватывает антитело, обладающее специфичностью ко многим эпитопам. Такими мультиспецифическими антителами являются, но не ограничиваются ими, антитело, содержащее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), где компонент VHVL обладает специфичностью ко многим эпитопам; антитела, имеющие два или более VL и VH доменов, где каждый компонент VHVL связывается с различными эпитопами; антитела, имеющие два или более отдельных вариабельных доменов, связывающихся с различными эпитопами; полноразмерные антитела, фрагменты антител, такие как Fab, Fv, dsFv, scFv, диантитела, биспецифические антитела и триантитела; фрагменты антител, которые связаны ковалентной или нековалентной связью. Термин «специфичность ко многим эпитопам» означает способность специфически связываться с двумя или более различными эпитопами на одной и той же или на различных мишенях. Термин «моноспецифичный» относится к способности связываться только с одним эпитопом. В соответствии с одним из вариантов изобретения, мультиспецифическим антителом является антитело IgG, которое связывается с каждым эпитопом с аффинностью 5 мкМ-0,001 пМ, 3 мкМ-0,001 пМ, 1 мкМ-0,001 пМ, 0,5 мкМ-0,001 пМ или 0,1 мкМ-0,001 пМ. Биспецифическое антитело схематически проиллюстрировано на фигуре 1B.
Термин «фрагменты антитела» включает часть интактного антитела, предпочтительно антиген-связывающую часть или вариабельную область интактного антитела. Примерами фрагментов антител являются Fab-, Fab'-, F(ab')2- и Fv-фрагменты; диантитела (Db); тандемные диантитела (taDb), антитела с прямой цепью (например, патент США № 5641870; Zapata et al., Protein Eng. 8(10):1057-1062 (1995)); антитела с одной «рукой», антитела с одним вариабельным доменом, миниантитела, молекулы одноцепочечного антитела и мультиспецифические антитела, происходящие от фрагментов антител (например, включая, но не ограничиваясь ими, Db-Fc, taDb-Fc, taDb-CH3 и (scFV)4-Fc).
Термины «антитела с одним доменом (sdAb)» или «антитела с одним вариабельным доменом (SVD)» обычно означают антитела, в которых один вариабельный домен (VH или VL) может сообщать связывание с антигеном. Другими словами, один вариабельный домен необязательно должен взаимодействовать с другим вариабельным доменом для распознавания антигена-мишени. Антитела с одним доменом состоят из одного мономерного вариабельного домена антитела (VH или VL) на каждой антигенсвязывающей «руке». Примерами антител с одним доменом являются антитела, происходящие от животных семейства верблюжьих (лам и верблюдов) и хрящевых рыб (например, акул-нянек), и антитела, полученные из человеческих и мышиных антител рекомбинантными методами (Ward et al., Nature (1989) 341:544-546; Dooley and Flajnik, Dev. Comp. Immunol. (2006) 30:43-56; Muyldermans et al., Trend Biochem Sci (2001) 26:230-235; Holt et al., Trends Biotechnol (2003): 21:484-490; WO 2005/035572; WO 03/035694; Davies and Riechmann, Febs Lett (1994) 339:285-290; WO00/29004; WO 02/051870). Антитело с одним вариабельным доменом может присутствовать в антигенсвязывающей «руке» (например, в виде гомо- или гетеромультимера) вместе с другими вариабельными областями или вариабельными доменами, причем, в данном случае, такое антитело не является антителом с одним доменом.
Термин «линейные антитела» обычно означает антитела, описанные Zapata et al., Protein Eng. 8(10):1057-1062 (1995). Вкратце, эти антитела содержат пару тандемных Fd-сегментов (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Термины «узлы в дырках» или упомянутая здесь технология «KnH» означают технологию спаривания двух полипептидов друг с другом in vitro или in vivo путем введения выступа (узла) в один полипептид и полости (дырки) в другой полипептид в интерфейсе, в котором происходит их взаимодействие. Так, например, KnH вводят в интерфейсы связывания Fc:Fc, интерфейсы CL:CH1 или интерфейсы VH /VL антител (например, US2007/0178552, WO 96/027011, WO 98/050431 и Zhu et al. (1997) Protein Science 6:781-788). Такая технология является особенно подходящей для инициации спаривания двух различных тяжелых цепей в процессе получения мультиспецифических антител. Так, например, мультиспецифические антитела, имеющие KnH в своих Fc-областях, могут также включать отдельные вариабельные домены, связанные с каждой Fc-областью, или различные вариабельные домены тяжелой цепи, образующие пару с аналогичными или различными вариабельными доменами легкой цепи. Технология KnH может быть также применена для спаривания двух различных внеклеточных доменов рецептора или любых других полипептидных последовательностей, содержащих различные мишень-распознающие последовательности (например, включая аффинные антитела, пептидные антитела и другие Fc-гибриды).
«Fv» состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, жестко связанных друг с другом нековалентной связью. После укладки этих двух доменов образуется шесть гипервариабельных петель (по 3 петли, каждая из которых происходит от Н- и L-цепи), которые обеспечивают аминокислотные остатки для связывания с антигеном и сообщают антителу специфичность связывания с антигеном. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью распознавать антиген и связываться с ним, хотя часто и с меньшей аффинностью, чем весь сайт связывания.
«Одноцепочечные Fv-фрагменты», также обозначаемые «sFv» или «scFv», представляют собой фрагменты антитела, которые включают домены VH и VL антитела, соединенные в одной полипептидной цепи. Предпочтительно, полипептид scFv, между своими доменами VH и VL, также содержит полипептидный линкер, который обеспечивает образование scFv со структурой, необходимой для связывания с антигеном. Описание scFv можно найти в работе Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Malmborg et al., J. Immunol. Methods 183:7-13, 1995.
Термин «диантитела» означает небольшие фрагменты антител, полученные путем конструирования sFv-фрагментов (см. предыдущий параграф) с короткими линкерами (примерно 5-10 остатков) между доменами VH и VL, так, чтобы достигалось межцепьевое, но не внутрицепьевое спаривание доменов V, с образованием двухвалентного фрагмента, то есть фрагмента, имеющего два антигенсвязывающих сайта. Биспецифическими диантителами являются гетеродимеры двух «перекрестно связанных» sFv-фрагментов, в которых домены VH и VL двух антител присутствуют на различных полипептидных цепях. Диантитела более подробно описаны, например, в EP 404097; WO 93/11161; и Holliger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993).
Термины «антитело с одной «рукой»» или «антитела с одной «рукой»» означают антитело, которое содержит (1) вариабельный домен, присоединенный посредством пептидной связи к полипептиду, содержащему CH2-домен, CH3-домен или CH2-CH3-домен, и (2) второй CH2-, CH3- или CH2-CH3-домен, где вариабельный домен не связан пептидной связью с полипептидом, содержащим второй CH2-, CH3- или CH2-CH3-домен. В одном из вариантов изобретения антитело с одной «рукой» содержит 3 полипептида: (1) первый полипептид, включающий вариабельный домен (например, VH), CH1, CH2 и CH3, (2) второй полипептид, включающий вариабельный домен (например, VL) и CL-домен, и (3) третий полипептид, включающий CH2- и CH3-домен. В другом варианте изобретения антитело с одной «рукой» имеет неполную шарнирную область, содержащую два цистеиновых остатка, образующих дисульфидные связи с константными тяжелыми цепями. В одном из вариантов изобретения вариабельные домены антитела с одной «рукой» образуют антигенсвязывающую область. В другом варианте изобретения вариабельные домены антитела с одной «рукой» представляют собой отдельные вариабельные домены, каждый из которых представляет собой антигенсвязывающую область. В одном из вариантов изобретения антителом с одной «рукой» является антитело с одним вариабельным доменом.
Антитела согласно изобретению могут представлять собой «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, происходящих от конкретного вида или принадлежащих к конкретному классу или подклассу антител, а остальная(ые) цепь(и) идентична(ы) или гомологична(ы) соответствующим последовательностям антител, происходящих от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они обладают нужной биологической активностью (см. патент США № 4816567 и публикацию Morrison et al. Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Представляющими интерес химерными антителами согласно изобретению являются «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельных доменов, происходящие от последовательностей константной области приматов, не являющихся человеком (например, мартышек, человекообразных обезьян и т.п.), и человека.
«Гуманизованные» формы нечеловеческих антител (например, антител грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую от нечеловеческого антитела. По большей части, гуманизованные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки, происходящие от гипервариабельной области данного антитела-реципиента, заменены остатками, происходящими от гипервариабельной области нечеловеческого антитела (донорного антитела), такого как мышиное антитело, крысиное антитело, кроличье антитело или антитело приматов, не являющихся человеком, где указанные антитела обладают нужной специфичностью, аффинностью и связывающей способностью. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина заменены соответствующими остатками нечеловеческого антитела. Кроме того, гуманизованные антитела могут содержать остатки, которые не обнаруживаются в антителе-реципиенте или в антителе-доноре. Эти модификации вводят для улучшения свойств антитела. В общих чертах, гуманизованное антитело может содержать, в основном, все или по меньшей мере один, а обычно два вариабельных домена, в которых все или почти все гипервариабельные петли соответствуют гипервариабельным петлям нечеловеческого иммуноглобулина, и все или почти все FR представляют собой FR с последовательностью человеческого иммуноглобулина. Гуманизованное антитело также содержит, но необязательно, по меньшей мере часть константной области иммуноглобулина (Fc), обычно, области человеческого иммуноглобулина. Более подробное описание см. у Jones et al. Nature, 321:522-525 (1986); Riechmann et al. Nature 332:323-327 (1998), и Presta Curr. Op. Struct. Biol., 2:593-596 (1992).
Термин «пептидное антитело» или «пептидные антитела» оозначает гибрид спонтанно продуцируемых пептидов с Fc-доменом. См. патент США № 6660843, выданный 9 декабря 2003, Feige et al. (который во всей своей полноте вводится в настоящее описание посредством ссылки). Такие антитела включают один или несколько пептидов, связанных с N-концом, с C-концом, с аминокислотными боковыми цепями или с более чем одним из этих сайтов. Технология получения пептидных антител позволяет создавать терапевтические средства, включающие пептиды, нацеленные на один или несколько лигантов или рецепторов; пептиды, обеспечивающие «хоминг» опухолей; трансмембранные пептиды и т.п. Было подтвержено, что технология получения пептидных антител может быть применена для конструирования ряда указанных молекул, включая линейные пептиды и пептиды с затрудненной дисульфидной конформацией, «тандемные пептидные мультимеры» (то есть, имеющие более чем один пептид на одной цепи Fc-домена). См., например, патент США № 6660843; заявку на патент США № 2003/0195156, опубликованную 16 октября, 2003 (соответствующую заявке WO 02/092620, опубликованной 21 ноября, 2002); заявку на патент США № 2003/0176352, опубликованную 18 сентября, 2003 (соответствующую заявке WO 03/031589, опубликованной 17 апреля, 2003); заявку США рег. № 09/422838, поданную 22 октября, 1999 (соответствующую заявке WO 00/24770, опубликованной 4 мая, 2000); заявку на патент США № 2003/0229023, опубликованную 11 декабря, 2003; заявку WO 03/057134, опубликованную 17 июля, 2003; заявку на патент США № 2003/0236193, опубликованную 25 декабря, 2003 (соответствующую заявке PCT/US04/010989, поданной 8 апреля, 2004); заявку США, рег. № 10/666480, поданную 18 сентября, 2003 (соответствующую заявке WO 04/026329, опубликованной 1 апреля, 2004), которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Термин «аффинные антитела» или «аффинное антитело» относится к применению белка, связанного пептидной связью с Fc-областью, где указанный белок используется в качестве каркаса для создания поверхности, связывающейся с молекулой-мишенью. Чаще всего, указанный белок представляет собой природный белок, такой как стафилококковый белок A или IgG-связывающий домен B, или происходящий от него белок Z (см. Nilsson et al. (1987), Prot. Eng. 1, 107-113, и патент США № 5143844) или его фрагмент или производное. Так, например, аффинные антитела могут быть получены из вариантов белка Z, обладающих измененной аффинностью связывания с молекулой(ами)-мишенью(ями), где сегмент белка Z был мутирован методом неспецифического мутагенеза с получением библиотеки вариантов, обладающих способностью связываться с молекулой-мишенью. Примерами аффинных антител являются антитела, описанные в патенте США № 6534628, Nord K. et al., Prot Eng 8:601-608 (1995) и Nord K. et al., Nat Biotech 15:772-777 (1997). Biotechnol Appl Biochem. 2008 Jun; 50(Pt 2):97-112.
Используемый здесь термин «иммуноадгезин» означает молекулы, которые обладают специфичностью связывания гетерологичного белка («адгезина») в комбинации с эффекторными функциями константных доменов иммуноглобулина. По своей структуре иммуноадгезины содержат слияние аминокислотной последовательности, обладающей нужной специфичностью связывания, но не являющейся антиген-распознающей последовательностью и антигенсвязывающим сайтом антитела (то есть, по сравнению с константной областью антитела, является «гетерологичным»), и последовательности константного домена иммуноглобулина (например, CH2 и/или CH3-последовательности IgG). Репрезентативными последовательностями адгезина являются непрерывные аминокислотные последовательности, содержащие по меньшей мере часть рецептора или лиганда, которые связываются с представляющим интерес белком. Адгезиновыми последовательностями могут быть также последовательности, которые связываются с представляющим интерес белком, но не с последовательностями рецептора или лиганда (например, адгезиновые последовательности в пептидных антителах). Такие полипептидные последовательности могут быть выбраны или идентифицированы различными методами, включая методы фагового представления и методы крупномасштабного сортинга. Последовательность константного домена иммуноглобулина в иммуноадгезине может происходить от любого иммуноглобулина, такого как иммуноглобулин подтипов IgG1, IgG2, IgG3 или IgG4, IgA (включая IgA1 и IgA2), IgE, IgD или IgM.
Используемые здесь термины «комплекс» или «комплексный» относятся к ассоциации двух или более молекул, которые взаимодействуют друг с другом посредством связей и/или сил (например, ван-дер-ваальсовых сил, гидрофобных сил, гидрофильных сил), которые не являются пептидными связями. В одном из вариантов изобретения указанный комплекс является гетеромультимерным. Следует отметить, что используемый здесь термин «белковый комплекс» или «полипептидный комплекс» включает комплекс, имеющий небелковую молекулу, конъюгированную с белком в белковом комплексе (например, включая, но не ограничиваясь ими, химические молекулы, такие как токсин или детектирующий агент).
Гетеромультимерным белком согласно изобретению, «который связывается с представляющим интерес антигеном», является белок, который связывается с мишенью с аффинностью, достаточной для использования указанного гетеромультимерного белка в качестве диагностического и/или терапевтического средства для нацеливания на белок, клетку или ткань, экспрессирующие такую мишень, и не обладает значительной перекрестной реактивностью с другими белками. В таких вариантах изобретения уровень связывания гетеромультимерного белка с белком, «не являющимся мишенью», составляет менее чем примерно 10% от уровня связывания антитела с его конкретным белком-мишенью, как было определено с помощью анализа методом клеточного сортинга с активацией флуоресценции (FACS) или радиоиммунопреципитации (РИА) или ELISA. Термин «специфическое связывание» с конкретным полипептидом или эпитопом на конкретном полипептиде-мишени или «специфически связывается» с конкретным полипептидом или эпитопом на конкретном полипептиде-мишени или «специфичный» к конкретному полипептиду или эпитопу на конкретном полипептиде-мишени, если данный термин относится к связыванию гетеромультимерного белка с молекулой-мишенью, означает, что такое связывание в значительной степени отличается от неспецифического взаимодействия (например, неспецифическим взаимодействием может быть связывание с альбумином бычьей сыворотки или с казеином). Специфическое связывание может быть измерено, например, путем определения уровня связывания молекулы по сравнению с уровнем связывания контрольной молекулы. Так, например, специфическое связывание может быть определено по конкуренции с контрольной молекулой, которая аналогична мишени, например, по избытку немеченной мишени. В этом случае на специфическое связывание указывает связывание меченой мишени с зондом, которое конкурентно ингибируется избытком немеченой мишени. Используемые здесь термины «специфическое связывание» или «специфически связывается» с конкретным полипептидом или эпитопом или «специфичный к» этому полипептиду или эпитопу на конкретном полипептиде-мишени могут относиться, например, к молекуле, имеющей Kd для мишени, равный по меньшей мере примерно 200 нМ, альтернативно, по меньшей мере примерно 150 нМ, альтернативно, по меньшей мере примерно 100 нМ, альтернативно, по меньшей мере примерно 60 нМ, альтернативно, по меньшей мере примерно 50 нМ, альтернативно, по меньшей мере примерно 40 нМ, альтернативно, по меньшей мере примерно 30 нМ, альтернативно, по меньшей мере примерно 20 нМ, альтернативно, по меньшей мере примерно 10 нМ, альтернативно, по меньшей мере примерно 8 нМ, альтернативно, по меньшей мере примерно 6 нМ, альтернативно, по меньшей мере примерно 4 нМ, альтернативно, по меньшей мере примерно 2 нМ, альтернативно, по меньшей мере примерно 1 нМ или более. В одном из вариантов изобретения термин «специфическое связывание» означает связывание, при котором гетеромультимерный белок связывается с конкретным полипептидом или эпитопом на конкретном полипептиде, но при этом почти не связывается с любым другим полипептидом или полипептидным эпитопом.
Термин «аффинность связывания» по существу означает силу суммарных нековалентных взаимодействий одного сайта связывания молекулы (например, антитела) с его партнером по связыванию (например, с антигеном). Если это не оговорено особо, то используемый здесь термин «аффинность связывания» означает природную аффинность связывания, при которой происходит взаимодействие 1:1 между членами пар связывания (например, антитела с антигеном). Аффинность связывания молекулы Х с ее партнером Y, в общих чертах, может называться константой диссоциации (Kd). Так, например, Kd может составлять примерно 200 нМ, 150 нМ, 100 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 8 нМ, 6 нМ, 4 нМ, 2 нМ, 1 нМ или более. Аффинность может быть определена стандартными методами, известными специалистам, включая описанные здесь методы. Низкоаффинные антитела обычно связываются с антигеном с меньшей скоростью и имеют тенденцию легко диссоциироваться, тогда как высокоаффинные антитела обычно связываются с антигеном с большей скоростью и имеют тенденцию оставаться связанными в течение более длительного периода времени. Специалистам в данной области известны различные методы измерения аффинности связывания, и для осуществления настоящего изобретения может быть применен любой из этих методов.
В одном из вариантов изобретения «Kd» или «величину Kd» согласно изобретению измеряют в анализах методом поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С с использованием чипов СМ5 с иммобилизованной на них мишенью (например, антигеном) при величине единиц отклика (RU), составляющей ~10. Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N’-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ), а затем инъецируют при скорости потока 5 мкл/минуту до достижения величины единиц отклика (RU) связанного белка, составляющей ~10. После инъекции антигена, для блокирования непрореагировавших групп вводят 1М этаноламин. Для измерения кинетики реакции вводят инъекции двукратных серийных разведений Fab (например, 0,78 нМ-500 нМ) в PBS, содержащем 0,05% Tween® 20 (PBST) при 25°С и при скорости потока приблизительно 25 мкл/мин. Скорость ассоциации (kon) и скорость диссоциации (koff) вычисляют с использованием простой лангмюровской модели связывания 1:1 (BIAcore Evaluation Software version 3.2) при одновременном построении сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Kd) вычисляют как отношение koff/kon. См., например, Chen, Y., et al. J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации превышает 106 М-1⋅с-1, как было определено выше методом поверхностного плазмонного резонанса, то такая скорость ассоциации может быть определена методом гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение=295 нм; излучение=340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ антитела против антигена (в Fab-форме) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, как было измерено на спектрометре, таком как спектрофотометр, снабженный ограничителем потока (Aviv Instrumtnts), или на спектрофотометре SLM-Aminco серии 8000 (ThermoSpectronic), снабженном кюветой для перемешивания.
Термины «биологически активный», «биологическая активность» и «биологические свойства», если они относятся к гетеромультимерному белку согласно изобретению, такому как антитело, его фрагмент или производное, означают, что такой белок обладает способностью связываться с биологической молекулой, если это не оговорено особо.
Термин «выделенный», если он относится к различным описанным здесь гетеромультимерным полипептидам, означает, что гетеромультимер был выделен и/или очищен от клетки или клеточной культуры, в которой он экспрессируется. Контаминирующими компонентами его природного окружения являются материалы, негативно влияющие на диагностическую или терапевтическую эффективность данного гетеромультимера, и такими компонентами могут быть ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах изобретения указанный гетеромультимер может быть очищен (1) на более чем 95% по массе белка, как было определено методом Лаури, а наиболее предпочтительно на более чем 95% по массе белка, (2) до степени, достаточной для введения по меньшей мере 15 остатков у N-концевой или внутренней аминокислотной последовательности, с использованием секвенатора, снабженного центрифужным сосудом, или (3) до гомогенности, что может быть подтверждено с помощью электрофореза в ДСН-ПААГ в восстанавливающих или в невосстанавливающих условиях с окрашиванием кумасси синим или, предпочтительно, серебром. Однако, обычно, выделенный полипептид может быть получен по меньшей мере в одной стадии очистки.
Гетеромультимеры согласно изобретению обычно очищают до высокой степени гомогенности. Используемые здесь термины «в высокой степени гомогенный», «по существу гомогенная форма» и «высокая степень гомогенности» означают, что данный продукт в основном не содержит побочных продуктов, образованных комбинациями нежелательных полипептидов (например, гомомультимеров).
«Высокая степень гомогенности» продукта, с точки зрения его чистоты, означает, что количество побочного продукта не превышает 10%, 9%, 8%, 7%, 6%, 4%, 3%, 2% или 1% по массе или составляет менее чем 1% по массе. В одном из вариантов изобретения количество побочного продукта составляет ниже 5%.
Термин «биологическая молекула» означает нуклеиновую кислоту, белок, углевод, липид и их комбинации. В одном из вариантов изобретения биологическая молекула является природной.
Используемые здесь термины «связанный» или «связывается» означают, что между первой и второй аминокислотной последовательностями существует прямая пептидная связь, или связь, которая присоединяет третью аминокислотную последовательность, которая представляет собой пептид, связанный с первой и второй аминокислотными последовательностями и находится между этими последовательностями. Так, например, линкерный пептид связан с С-концом одной аминокислотной последовательности и с N-концом другой аминокислотной последовательности.
Используемый здесь термин «линкер» означает аминокислотную последовательность, имеющую длину в две или более аминокислоты. Линкер может состоять из нейтральных полярных или неполярных аминокислот. Линкер может иметь длину в 2-100 аминокислот, например, 2-50 аминокислот, например, в 3, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот. Линкер может быть «расщепляемым», например, саморасщепляемым или расщепляемым ферментами или химическими веществами. Сайты расщепления в аминокислотных последовательностях, а также ферменты и химические вещества, расщепляющие такие сайты, хорошо известны специалистам и описаны в настоящей заявке.
Используемый здесь термин «связующий компонент» означает аминокислотный линкер, который связывает две другие аминокислотные последовательности. Описанный здесь связующий компонент может связывать N-конец вариабельного домена тяжелой цепи иммуноглобулина с C-концом константного домена легкой цепи иммуноглобулина. В конкретных вариантах изобретения связующий компонент имеет длину примерно 15-50 аминокислот, например, 20-26 аминокислот (например, 20, 21, 22, 23, 24, 25 или 26 аминокислот). Связующий компонент может быть «расщеплен», например, посредством саморасщепления или ферментативного расщепления или химического расщепления с применением стандартных методов и реагентов.
Ферментативное расщепление «линкера» или «связующего компонента» может быть осуществлено с использованием эндопептидазы, такой как, например, Lys-C, Asp-N, Arg-C, V8, Glu-C, химотрипсин, трипсин, пепсин, папаин, тромбин, гененаза, фактор Xa, TEV (цистеиновая протеаза вируса гравировки табака), энтерокиназа, HRV C3 (протеаза человеческого риновируса C3), кининогеназа, а также субтилизин-подобные пропротеин-конвертазы (например, фурин (PC1), PC2 или PC3) или двухосновная N-аргинин-конвертаза. Химическое расщепление может быть осуществлено с использованием, например, гидроксиламина, N-хлорсукцинимида, N-бромсукцинимида или бромциана.
Используемый здесь термин «сайт расщепления Lys-C-эндопептидазой» означает лизиновый остаток в аминокислотной последовательности, который может быть расщеплен у С-конца Lys-C-эндопептидазой. Lys-C-эндопептидаза расщепляет лизиновый остаток у C-конца.
Термин «хаотропный агент» означает водорастворимое вещество, которое разрушает трехмерную структуру белка (например, антитела) в результате нарушения стабилизации внутримолекулярных взаимодействий (например, водородных связей, ван-дер-ваальсовых сил или гидрофобных эффектов). Репрезентативными хаотропными агентами являются, но не ограничиваются ими, мочевина, гуанидин-HCl, перхлорат лития, гистидин и аргинин.
Термин «слабый детергент» означает водорастворимое вещество, которое разрушает трехмерную структуру белка (например, антитела) в результате нарушения стабилизации внутримолекулярных взаимодействий (например, водородных связей, ван-дер-ваальсовых сил или гидрофобных эффектов), но которое не подвергает перманентному разрушению структуры белка и не приводит к потери биологической активности (то есть, к денатурации белка). Репрезентативными слабыми детергентами являются, но не ограничиваются ими, Tween (например, Tween-20), Triton (например, Triton X-100), NP-40 (нонилфеноксиполиэтоксилэтанол), Nonidet P-40 (октилфеноксиполиэтоксилэтанол) и додецилсульфат натрия (ДСН).
Термин «эффекторные функции» антитела означает биологические активности, приписываемые Fc-области (Fc-области с нативной аминокислотной последовательностью или Fc-области с измененной аминокислотной последовательностью) антитела, и варьирующиеся в зависимости от изотипа антитела. Примерами эффекторных функций антител являются: связывание с C1q и комплемент-зависимая цитотоксичность; связывание с Fc-рецептором; антитело-зависимая клеточно-опосредуемая цитотоксичность (ADCC); фагоцитоз; ингибирование функции рецепторов клеточной поверхности (например, В-клеточного рецептора); и активация В-клеток.
«Антитело-зависимая клеточно-опосредуемая цитотоксичность» или «ADCC» означает форму цитотоксичности, при которой секретируется Ig, связанный с Fc-рецепторами (FcR), присутствующими на некоторых цитотоксических клетках (например, на природных клетках-киллерах (NK), нейтрофилах и макрофагах), что позволяет этим цитотоксическим эффекторным клеткам специфически связываться с антиген-несущими клетками-мишенями и тем самым уничтожать эти клетки-мишени под действием цитотоксинов. Эти антитела «вооружают» цитотоксические клетки и являются абсолютно необходимыми для такого цитолиза. Первичные клетки, опосредующие ADCC, то есть NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные, полученные для экспрессии FcR на гемопоэтических клетках, систематизированы в таблице 3 на странице 464 публикации Ravetch & Kinet Annu. Rev. Immunol. (1991) 9:457-92. Для оценки ADCC-активности представляющей интерес молекулы может быть проведен анализ на ADCC in vitro, такой как анализ, описанный в патентах США №№ 5500362 или 5821337. Эффекторными клетками, подходящими для таких анализов, являются мононуклеарные клетки периферической крови (МКПК) и природные клетки-киллеры (NK). Альтернативно или дополнительно, ADCC-активность представляющей интерес молекулы может быть оценена in vivo, например, на животном-модели, такой как модель, описанная Clynes et al., Proc. Natl. Acad. Sci., USA, 95:652-656 (1998).
Используемые здесь термины «Fc-рецептор» или “FcR” означают рецептор, который связывается с Fc-областью антитела. Предпочтительным FcR является человеческий FcR. Кроме того, предпочтительным FcR является FcR, который связывается с антителом IgG (гамма-рецептор), и такими рецепторами являются рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторами FcγRII являются FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют аналогичные аминокислотные последовательности, отличающиеся, главным образом, своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене иммунорецепторный активирующий мотив на основе тирозина (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене иммунорецепторный ингибирующий мотив на основе тирозина (ITIM)(см. Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcR описаны в публикациях Ravetch & Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994), и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Используемый здесь термин «FcR» также охватывает и другие FcR, включая FcR, которые будут идентифицированы в будущем. Этот термин также включает неонатальный рецептор FcRn, ответственный за передачу материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976), и Kim et al., European J. Immunol. 24:2429-2434 (1994)).
«Человеческими эффекторными клетками» являются лейкоциты, которые экспрессируют один или несколько FcR и обладают эффекторными функциями. Предпочтительно, указанные клетки экспрессируют по меньшей мере FcγRIII и обладают эффекторной ADCC-функцией. Примерами человеческих лейкоцитов, опосредующих ADCC, являются мононуклеарные клетки периферической крови (МКПК), природные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы, при этом предпочтительными являются МКПК и NK-клетки. Эффекторные клетки могут быть выделены из природного источника, например, из крови.
«Комплемент-зависимая цитотоксичность» или «CDC» означает лизис клеток-мишеней в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами соответствующего подкласса, которые образуют комплекс с когнатным антигеном. Для оценки активации комплемента может быть проведен анализ на CDC, описанный, например, в публикации Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
Термин «терапевтически эффективное количество» означает количество антитела, фрагмента антитела или его производного, эффективное для лечения заболевания или расстройства у индивидуума. В случае опухоли (например, раковой опухоли) такое терапевтически эффективное количество антитела или его фрагмента (например, мультиспецифического антитела или его фрагмента) может снижать число раковых клеток; уменьшать размер первичной опухоли; ингибировать (то есть, замедлять до некоторой степени, а предпочтительно, прекращать) инфильтрацию раковых клеток в периферические органы; ингибировать (то есть, замедлять до некоторой степени, а предпочтительно, прекращать) развитие метастазов опухоли; ингибировать, до некоторой степени, рост опухоли; и/или ослаблять, до некоторой степени, один или несколько симптомов, ассоциированных с расстройством. Антитело или его фрагмент, до некоторой степени, может предотвращать рост раковых клеток и/или уничтожать раковые клетки, и такое антитело или его фрагмент могут иметь цитостатическое и/или цитотоксическое действие. Эффективность противораковой терапии может быть оценена in vivo, например, путем определения продолжительности жизни; времени, прошедшего до начала прогрессирования заболевания (ТТР); скорости ответа (RR), продолжительности ответа и/или качества жизни.
Термины «ослаблять или ингибировать» в основном относятся к снижению, предпочтительно на 20% или более, более предпочтительно на 50% или более, а наиболее предпочтительно на 75%, 85%, 90%, 95% или более. «Ослабление или ингибирование» может относиться к симптомам расстройства, подвергаемого лечению, к присутствию или размеру метастазов, к размеру первичной опухоли или к размеру или числу кровеносных сосудов при ангиогенезе.
Термины «рак» и «раковый» означают или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом/пролиферацией клеток. Этот термин также включает доброкачественные и злокачественные раковые опухоли. Примерами рака являются, но не ограничиваются ими, карцинома, лимфома, бластома, саркома и лейкоз. Более конкретными примерами таких раковых опухолей являются плоскоклеточный рак, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарцинома легких, плоскоклеточная карцинома легких, рак брюшной полости, гепатоцеллюлярный рак, рак желудка или кишечника, включая рак желудочно-кишечного тракта; рак поджелудочной железы; глиобластома; глиома; рак шейки матки; рак яичника; рак печени; рак мочевого пузыря; гепатома; рак молочной железы; рак толстой кишки; рак прямой и ободочной кишки; карцинома эндометрия или матки; карцинома слюнных желез; рак почек (например, почечно-клеточная карцинома); рак печени; рак предстательной железы; рак вульвы; рак щитовидной железы; гепатокарцинома; карцинома заднего прохода; карцинома пениса; меланома, а также рак головы и шеи различных типов. Термин «рак на ранней стадии» означает рак, который не является инвазивным или метастазирующим, или классифицируется как рак на стадии 0, I или II. Термин «предраковый» относится к состоянию или к опухоли, которые обычно предшествуют раковому заболеванию или развиваются в раковое заболевание. Термин «неметастазирующий» относится к раковому заболеванию, которое является доброкачественным или которое остается в первичном участке локализации и не распространяется в лимфатическую систему или систему кровеносных сосудов или в ткани, не являющиеся первичным участком возникновения опухоли. Обычно неметастазирующим раком является любой рак на стадии 0, I или II, а иногда рак на стадии III.
Используемый здесь термин «аллергическое или воспалительное расстройство» означает заболевание или расстройство, вызываемое гиперактивацией иммунной системы индивидуума. Репрезентативными аллергическими или воспалительными расстройствами являются, но не ограничиваются ими, астма, псориаз, ревматоидный артрит, атопический дерматит, рассеянный склероз, системная красная волчанка, экзема, заболевание, ассоциированное с трансплантацией органов, возрастная дегенерация желтого пятна, болезнь Крона, язвенный колит, эозинофильный эзофагит и аутоиммунные заболевания, ассоциированные с воспалением.
Используемый здесь термин «аутоиммунное заболевание» означает заболевание или расстройство, вызываемое реакцией, продуцируемой организмом против своих собственных тканей или органов, либо косегрегацию или манифестацию этих расстройств или ассоциированное с ними состояние. Примерами аутоиммунных заболеваний или расстройств являются, но не ограничиваются ими, артрит (ревматоидный артрит, такой как острый артрит, хронический ревматоидный артрит, подагрический артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит, артрит позвонков и юношеский ревматоидный артрит, остеоартрит, прогредиентный хронический артрит, деформирующий артрит, хронический первичный полиартрит, реактивный артрит и анкилозирующий спондилит), воспалительные гиперпролиферативные заболевания кожи, псориаз, такой как бляшковый псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей; дерматит, включая контактный дерматит, хронический контактный дерматит, аллергический дерматит, аллергический контактный дерматит, герпетиформный дерматит и атопический дерматит; сцепленный с Х-хромосомой гипер-IgM-синдром, крапивница, такая как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, включая хроническую аутоиммунную крапивницу, полимиозит/дерматомиозит, ювенильный дерматомиозит, токсический эпидермальный некролиз, склеродермия (включая системную склеродермию), склероз, такой как системный склероз, рассеянный склероз (РС), такой как РС, сопровождающийся нарушением функции спинного мозга и органов зрения, первичный прогрессирующий РС (ППРС) и рецидивирующий-ремитирующий РС (РРРС), прогрессирующий системный склероз, атеросклероз, артериосклероз, рассеянный склероз и атаксический склероз; воспалительное заболевание кишечника (ВЗК) (например, болезнь Крона, аутоиммунные желудочно-кишечные расстройства, колиты, такие как язвенный колит, неспецифический язвенный колит, микроскопический колит, коллагенозный колит, полипозный колит, некрозирующий энтероколит и трансмуральный колит и аутоиммунное воспалительное заболевание кишечника); гангренозная пиодермия, узелковая эритема, первичный склерозирующий холангит, эписклерит), респираторный дистресс-синдром, включая респираторный дистресс-синдром взрослых (РДСВ) или острый респираторный дистресс-синдром, менингит, воспаление всего или части увеального тракта, ирит, хороидит, аутоиммунное гематологическое расстройство, ревматоидный спондилит, внезапная потеря слуха, IgE-опосредуемые заболевания, такие как анафилаксия и аллергический и атопический ринит, энцефалит, такой как энцефалит Расмуссена и энцефалит с поражением конечностей и/или ствола головного мозга, увеит, такой как передний увеит, острый передний увеит, грануломатозный увеит, негрануломатозный увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (ГН) с нефротическим синдромом или без нефротического синдрома, такой как хронический или острый гломерулонефрит, такой как первичный ГН, иммуноопосредованный ГН, мембранозный ГН (мембранозная нефропатия), идиопатический мембранозный ГН или идиопатическая мембранозная нефропатия, мембранозный или мембранозно-пролиферативный ГН (МПГН), включая глумерулонефрит типа I и типа II, и быстро прогрессирующий ГН, аллергические состояния, аллергическая реакция, экзема, включая аллергическую или атопическую экзему; астма, такая как бронхиальная астма и аутоиммунная астма; состояния, вызываемые инфильтрацией Т-клеток и хронические воспалительные реакции; хроническое воспалительное заболевание легких, аутоиммунный миокардит, недостаточная адгезия лейкоцитов; системная красная волчанка (systemic lupus erythematodes) (СКВ), такая как кожная СКВ или подострая кожная СКВ, волчаночный синдром новорожденных (ВСР), диссеминированная красная волчанка, волчанка (включая нефрит, церебрит, детскую волчанку, непочечную волчанку, внепочечную волчанку, дискоидную волчанку, алопецию); юношеский сахарный диабет (типа I), включая детский инсулинзависимый сахарный диабет (ИЗСД), сахарный диабет взрослых (диабет типа II), аутоиммунный диабет, идиопатический несахарный диабет, иммунные реакции, ассоциированные с острой гиперчувствительностью и гиперчувствительностью замедленного типа, опосредуемой цитокинами и Т-лимфоцитами; туберкулез, саркоидоз, гранулематоз, включая лимфоматоидный гранулематоз, гранулематоз Вегенера, агранулоцитоз; васкулитиды, включая васкулит (включая васкулит крупных кровеносных сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит (Такаясу)), васкулит средних кровеносных сосудов (включая болезнь Кавазаки и узелковый полиартериит), полиартериит капилляров, васкулит ЦНС, некрозирующий васкулит, кожный васкулит или васкулит, ассоциированный с гиперчувствительностью, системный некрозирующий васкулит и ANCA-ассоциированный васкулит, такой как васкулит или синдром Черга-Штраусса (СЧШ), височный артериит, апластическая анемия, аутоиммунная апластическая анемия, положительная анемия Кумбса, анемия Даймонда-Блекфана, гемолитическая анемия или иммунная гемолитическая анемия, включая аутоиммунную гемолитическую анемию (АИГА), злокачественная анемия (пернициозная анемия), болезнь Аддисона, истинная эритроцитарная анемия или аплазия (ИЭА), дефицит фактора VIII, гемофилия А, аутоиммунная нейтропения, панцитопения, лейкопения, заболевания, приводящие к диапедезу лейкоцитов, воспалительные расстройства ЦНС, синдром поражения многих органов, такой как вторичный синдром, ассоциированный с сепсисом, травмой или геморрагией; заболевания, опосредуемые образованием комплекса “антиген-антитело”, болезнь гломерулярных базальных мембран, катализируемая реакцией антитело-антиген, антифосфолипидный синдром, аллергический нейрит, болезнь/синдром Бехчета, синдром Кастлемана, синдром Гудпасчера, синдром Рейно, синдром Сьегрена, синдром Стивенса-Джонсона, пемфигоид, такой как буллезный пемфигоид и кожный пемфигоид, пузырчатка (включая пузырчатку вульгарную, пузырчатку листовидную, пемфигоид слизистых оболочек-мембранозный пемфигоид и пузырчатку эритематозную), аутоиммунная полиэндокринопатия, болезнь или синдром Райтера, нефрит, ассоциированный с иммунными комплексами, антитело-опосредуемый нефрит, нейромиелит зрительного нерва, полиневропатии, хроническая невропатия, такая как IgM-полиневропатия или IgM-опосредованная невропатия, тромбоцитопения (например, развивающаяся у пациента с инфарктом миокарда), включая тромботическую тромбоцитопеническую пурпуру (ТТП), и аутоиммунную или иммуно-опосредованную тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ИТП), включая хроническую или острую ИТП; аутоиммунное заболевание яичек и яичника, включая аутоиммунный орхит и оофорит, первичный гипотиреоидит, гипопаратиреоидит, аутоиммунные эндокринные заболевания, включая тиреодит, такой как аутоиммунный тиреоидит, болезнь Хашимото, хронический тиреоидит (тиреоидит Хашимото), или подострый тиреоидит, аутоиммунное заболевание щитовидной железы, идиопатический гипотиреоидит, болезнь Грейвса, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или синдромы полигландулярной эндокринопатии), паранеопластические синдромы, включая неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром «негнущегося человека», энцефаломиелит, такой как аллергический энцефаломиелит (или encephalomyelitis allergica) и экспериментальный аллергический энцефаломиелит (ЭАЭ), тяжелая миастения, такая как тяжелая миастения, ассоциированная с тимомой, дегенерация мозжечка, невромиотония, опсоклонус или синдром “пляшущих глаз” (СПГ) и невропатия органов чувств, мультифокальная невропатия двигательной системы, синдром Шихана, аутоиммунный гепатит, хронический гепатит, волчаночный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидный интерстициальный пневмонит, облитерирующий бронхиолит (не передающийся, в отличие от NSIP); синдром Гийена-Барре, болезнь Бергера (IgA-нефропатия), идиопатическая IgA-нефропатия, линейный IgA-дерматоз, первичный билиарный цирроз, пневмоноцирроз, синдром аутоиммунной энтеропатии, заболевание кишечника или целиакия, кишечная спру (глютеновая энтеропатия), не поддающаяся лечению спру, идиопатическая спру, криоглобулинемия, амилотрофический боковой склероз (АБС; болезнь Луи Герига), ишемическая болезнь сердца; аутоиммунное заболевание уха, такое как аутоиммунное заболевание внутреннего уха (АЗВУ); аутоиммунная потеря слуха; синдром «пляшущих глаз» (СПГ), полихондрит, такой как не поддающийся лечению или рецидивирующий полихондрит; легочный альвеолярный протеиноз, амилоидоз, склерит, нераковый лимфоцитоз, первичный лимфоцитоз, включая моноклональный В-клеточный лимфоцитоз (например, доброкачественную моноклональную гаммапатию и моноклональную гаммапатию неясной этиологии, MGUS); периферическая невропатия, паранеопластический синдром; «каналопатии», такие как эпилепсия, мигрень, аритмия, мышечные расстройства, глухота, слепота, периодический паралич и «каналопатии» ЦНС, аутизм, воспалительная миопатия, очаговый и сегментарный гломерулосклероз (ОСГС), эндокринная офтальмопатия, увеоретинит, хориоретинит, аутоиммунное заболевание печени, фибромиалгия, множественная эндокринная недостаточность, синдром Шмидта, адреналит, атрофия желудка, пресенильная деменция, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания, диабетическая нефропатия, синдром Дресслера, гнездная алопеция, синдром CREST (кальциноз, феномен Рейно, нарушение моторики пищевода, склеродактилия и телеангиэктазия), аутоиммунное бесплодие у мужчин и женщин, смешанное заболевание соединительных тканей, болезнь Чагаса, ревматическая лихорадка, привычный выкидыш, болезнь легких у фермеров, мультиформная эритема, посткардиотомный синдром, синдром Кушинга, болезнь легких любителей птиц, аллергический гранулематозный ангиит, доброкачественный лимфоцитарный ангиит, синдром Альпорта, альвеолит, такой как аллергический альвеолит и фиброзный альвеолит, интерстициальная болезнь легких, трансфузионная болезнь, лепра, малярия, лейшманиоз, кипаносомоз, шистосомоз, аскариоз, аспергиллез, синдром Сэмптера, синдром Каплана, лихорадка денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный легочный фиброз, интерстициальный легочный фиброз, идиопатический легочный фиброз, кистозный фиброз, эндофтальмит, эритема возвышенная стойкая, эритробластоз плода, эозинофильный фасцит, синдром Шульмана, синдром Фелти, фляриоз, циклит, такой как хронический циклит, гетерохронический циклит, иридоциклит или циклит Фукса, пурпура Геноха-Шенлейна, инфекция, вызываемая вирусом иммунодефицита человека (ВИЧ), инфекции, вызываемые эховирусом; кардиомиопатия, болезнь Альцгеймера, инфекции, вызываемые парвовирусом; инфекции, вызываемые вирусом коревой краснухи; синдром, развивающийся после вакцинации; наследственная инфекция, вызываемая вирусом коревой краснухи; инфекции, вызываемые вирусом Эпштейна-Барра; паротит, синдром Эванса, аутоиммунная гонадная недостаточность, хорея Сиденгама, пост-стрептококковый нефрит, облитерирующий тромбоангиит, тиротоксикоз, сухотка спинного мозга, хориоидит, гигантоклеточная полимиалгия, эндокринная офтальмопатия, пневмонит, ассоциированный с хронической гиперчувствительностью, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, синдром идиопатического нефрита, нефропатия, характеризующаяся минимальными изменениями почечной ткани, доброкачественные наследственные и вызываемые ишемией реперфузионные поражения, аутоиммунное заболевание сетчатки, воспаление суставов, бронхит, хроническое обструктивное заболевание дыхательных путей, силикоз, афты, афтозный стоматит, артериосклеротические расстройства, аспермиогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемия, контрактура Дюпюитрена, факоанафилактическая эндофтальмия, аллергический энтерит, нодозная лепроматозная эритема, идиопатический лицевой паралич, синдром хронической усталости, ревматическая лихорадка, синдром Хаммена-Рича; нейросенсорная потеря слуха, пароксизмальная гемоглобинурия, гипогонадизм, регионарный илеит, лейкопения, инфекционный мононуклеоз, поперечный миелит, первичная идиопатическая миксидема, нефроз, симпатическая офтальмия, гранулематозный орхит, панкреатит, острый полирадикулит, гангренозная пиодермия, тиреоидит Кервена, приобретенная атрофия спинного мозга, бесплодие, вызываемое антителами против сперматозоидов, незлокачественная тимома, витилиго, тяжелый комбинированный иммунодефицит (ТКИД) и заболевания, вызываемые вирусом Эпштейна-Барра; синдром приобретенного иммунодефицита (СПИД), паразитарные болезни, такие как лейшманиоз, синдром токсического шока, отравление пищевыми продуктами, состояния, вызываемые инфильтрацией Т-клеток, недостаточная адгезия лейкоцитов, иммунные ответы, ассоциированные с острой гиперчувствительностью и с гиперчувствительностью замедленного типа, опосредуемой цитокинами и Т-лимфоцитами, заболевания, ассоциированные с диапедезом лейкоцитов, синдром поражения многих органов, заболевания, опосредуемые образованием комплекса «антиген-антитело», болезнь гломерулярных базальных мембран, аллергический неврит, аутоиммунная полиэндокринопатия, оофорит, первичная микседема, аутоиммунный атрофический гастрит, симпатическая офтальмия, ревматические заболевания, смешанное заболевание соединительных тканей, нефротический синдром, инсулит, полиэндокринная недостаточность, невропатия периферических органов, аутоиммунный полигландулярный синдром типа I, идиопатический гипопаратиреоидит взрослых (ИГВ), общая алопеция, застойная кардиомиопатия, приобретенный буллезный эпидермолиз (ПБЭ), гемохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит; решетчатый синусит, фронтит, верхнечелюстной синусит или сфеноидит; эозонофильные расстройства, такие как эозинофилия, легочная инфильтрирующая эозинофилия, синдром эозинофилии-миалгии, синдром Лефлера, хроническая эозинофильная пневмония, тропическая легочная эозинофилия, бронхопневмонический аспергиллез, аспергиллема или гранулемы, содержащие эозинофилы; анафилаксия, серонегативные спондилоартриты, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, склерит, эписклерит, хронический слизисто-кожный кандидоз, синдром Брутона, преходящая гипогаммаглобулинемия у детей, синдром Вискотта-Алдрича, синдром атаксии-телеангиэктазии, аутоиммунные расстройства, ассоциированные с коллагеновой болезнью, ревматизм, неврологическое заболевание, ишемическое реперфузионное поражение, реакция на снижение кровяного давления, сосудистая дисфункция, ангиоэктазия, повреждение ткани, сердечно-сосудистая ишемия, гипералгезия, ишемия головного мозга и заболевание, сопровождающееся васкуляризацией, аллергические расстройства, ассоциированные с гиперчувствительностью, гломерулонефриты, реперфузионное повреждение, реперфузионное повреждение миокарда или других тканей, дерматозы с компонентами острого воспаления, острый гнойный менингит или другие воспалительные расстройства центральной нервной системы, воспалительные заболевания глаз и глазницы; синдромы, ассоциированные с трансфузией гранулоцитов; токсичность, индуцированная цитокинами, острое серозное воспаление, хроническое трудноизлечимое воспаление, пиелит, пневмоноцирроз, диабетическая ретинопатия, диабетическое поражение крупных артерий, гиперплазия периферических артерий, пептическая язва, вальвувит и эндометриоз.
Используемый здесь термин «цитотоксический агент» означает вещество, которое ингибирует или предотвращает функционирование клеток и/или вызывает деструкцию клеток. Этот термин включает радиоактивные изотопы (например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 223Ra, 32Р и радиоактивные изотопы Lu), химиотерапевтические агенты, например, метотрексат, адриамицин, винкаалкалоиды (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркалирующие агенты, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины, происходящие от бактерий, грибов, растений или животных, включая их фрагменты и/или варианты, и различные противоопухолевые, противораковые и химиотерапевтические средства, описанные ниже. Другие цитотоксические агенты описаны в настоящей заявке. Опухолецидное средство вызывает деструкцию опухолевых клеток.
«Химиотерапевтическое средство» представляет собой химическое соединение, которое может быть использовано для лечения рака. Примерами химиотерапевтических средств являются алкилирующие агенты, такие как тиотепа и циклофосфамид CYTOXAN®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги, адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновая кислота; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая его синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотные аналоги горчичного газа, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый аналог горчичного газа; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности, калихеамицин гамма 1 (см., например, Agnew, Chem. Intl. Ed. Engl., 33:183-186 (1994)); динемицин, включая динемицин А; эсперамицин, а также неокарзиностатиновый хромофор и родственные хромопротеиновые энедииновые антибиотики-хромофоры); аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMYCIN® (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, келамицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадренергические средства, такие как аминоглютетимид, митотан, трилостан; средство, восполняющее недостаток фолиевой кислоты, такое как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2’,2”-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®), дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); тиотепа; таксоиды, например, паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princeton, N.J.); препарат паклитаксела из наночастиц, полученный на основе альбумина и не содержащий кремофора ABRAXANETM (American Pharmaceutical Partners, Schaumberg, IL) и доцетаксел TAXOTERE®, (Rhone-Poulenc Rorer, Antony, France), хлоранбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®), платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейкововин, винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноиды, такие как ретиноевая кислота; капецитабин (XELODA®); фармацевтически приемлемые соли, кислоты и производные всех вышеуказанных соединений, а также комбинации двух или более вышеупомянутых соединений, таких как CHOP, где указанная аббревиатура означает циклофосфамид, доксорубицин, винкристин и преднизолон, используемые в комбинированной терапии, и FOLFOX, где указанная аббревиатура означает оксалиплатин (ELOXATINTM) в комбинации с 5-FU и лейкововином, применяемые в терапии.
В определение этого термина также входят антигормональные средства, регулирующие, снижающие, блокирующие или ингибирующие действие гормонов, которые могут стимулировать рост раковой опухоли, и которые часто используются для системного или комплексного лечения. Такими средствами могут быть сами гормоны. В качестве примеров могут служить антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен EVISTA®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; антипрогестероны; ингибиторы эстрогенового рецептора (ERD); агенты, которые подавляют или ингибируют функцию яичника, например, агонисты лютеинизирующего рилизинг-фактора (LHRH), такие как ацетат лейпролида LUPRON® и ELIGARD®, ацетат гозерелина, ацетат бузерелина и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу и регулируют продуцирование эстрогенов в коре надпочечника, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола MEGASE®, эксеместан AROMASIN®, форместанин, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®. Кроме того, в указанное определение химиотерапевтических средств входят бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат DIDROCAL®, NE-58095, золедроновая кислота/золедронат ZOMETA®, алендронат FOSAMAX®, памидронат AREDIA®, тилудронат SKELID® или ризедронат ACTONEL®, а также троксацитабин (1,3-диоксолановый аналог нуклеозид-цитозина); антисмысловые олигонуклеотиды, а в частности, олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигнала, участвующих в пролиферации аберрантных клеток, такие как, например, PKC-альфа, Raf, H-Ras, и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генотерапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 LURTOTECAN®; rmRH ABARELIX®; дитозилат лапатиниба (низкомолекулярный ингибитор тирозинкиназы, направленный на ErbB-2 и EGFR, также известный как GW572016) и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных соединений.
Используемый здесь термин «рост-ингибирующий агент» означает соединение или композицию, ингибирующие рост клеток in vitro или in vivo. Таким образом, рост-ингибирующим агентом может быть агент, значительно снижающий процент клеток в фазе S. Примерами рост-ингибирующих агентов являются агенты, блокирующие прохождение клеточного цикла (во всех фазах, кроме фазы S), такие как агенты, индуцирующие блокирование фазы G1 и фазы М. Классическими средствами, блокирующими фазу М, являются винкаалкалоиды (например, винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средствами, блокирующими фазу G1, а также блокирующими переход в фазу S, являются, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в публикации The Molecular Basis of Cancer, Mendelsohn & Israel, eds., Chapter 1, entitled «Cell cycle regulation, oncogenes and antineoplastic drugs», Murakami et al. (WB Saunders: Philadelphia, 1995), в частности, на стр.13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, получаемые из дерева тис. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), получаемый из Европейского тиса, представляет собой полусинтетический аналог паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел индуцируют сборку микротрубочек из тубулиновых димеров и стабилизируют микротрубочки путем предупреждения деполимеризации, что приводит к ингибированию митоза клеток.
Используемый здесь термин «противораковая терапия» означает лечение, которое приводит к ослаблению или подавлению рака у индивидуума. Примерами противораковой терапии являются цитотоксическая лучевая терапия, а также введение индивидууму терапевтически эффективного количества цитотоксического агента, химиотерапевтического средства, рост-ингибирующего агента, противораковой вакцины, ингибитора ангиогенеза, пролекарства, цитокина, антагониста цитокина, кортикостероида, иммунодепрессанта, противорвотного средства, антитела или его фрагмента или аналгетика.
Используемый в настоящей заявке термин «пролекарство» означает предшественник или производное фармацевтически активного вещества, которые, по сравнению с родительским лекарственным средством, являются менее цитотоксичными по отношению к опухолевым клеткам и способны ферментативно активироваться или превращаться в более активную зрелую форму. См., например, Wilman, «Prodrugs in Cancer Chemotherapy» Biochemical Society Transactions, 14, pp.375-382, 615th Meeting Belfast (1986) и Stella et al. «Prodrugs: A Chemical Approach to Targeted Drug Delivery», Directed Drug Delivery, Borchardt et al., (ed.), pp.247-267, Humana Press (1985). Пролекарствами являются, но не ограничиваются ими, фосфат-содержащие пролекарства, тиофосфат-содержащие пролекарства, сульфат-содержащие пролекарства, пептид-содержащие пролекарства, лекарственные средства, модифицированные D-аминокислотой, гликозилированные пролекарства, бета-лактам-содержащие пролекарства; пролекарства, содержащие необязательно замещенный феноксиацетамид, или пролекарства, содержащие необязательно замещенный фенилацетамид; 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примерами цитотоксических лекарственных средств, которые могут быть дериватизированы с получением пролекарственной формы для ее использования в настоящем изобретении, являются, но не ограничиваются ими, химиотерапевтические средства, описанные выше.
Термин «цитокин» является общим термином, относящимся к белкам, которые высвобождаются одной клеточной популяцией и которые действуют на другие клетки как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины и стандартные полипептидные гормоны. Помимо вышеуказанных определений, понятие «цитокины» также включает гормоны роста, такие как человеческий гормон роста (HGH), N-метионильный человеческий гормон роста и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреоид-стимулирующий гормон (TSH) и лютеинизирующий гормон (LH); эпидермальный фактор роста (EGF); фактор роста гепатоцитов, фактор роста фибробластов (FGF); пролактин; плацентарный лактоген; фактор некроза опухоли-альфа и -бета; мюллеровский ингибирующий фактор; пептид, ассоциированный с мышиным гонадотропином; ингибин; активин; васкулярный эндотелиальный фактор роста; интегрин; тромбопоэтин (ТРО); факторы роста нервных тканей, такие как NGF-альфа; тромбоцитарный фактор роста; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста-I или -II; эритропоэтин (EPO); факторы, индуцирующие остеогенез; интерфероны, такие как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарный-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1альфа, IL-1бета, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-18; фактор некроза опухоли, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, включая LIF и лиганд kit (KL). Используемый здесь термин «цитокин» включает белки, происходящие от природных источников или от рекомбинантной клеточной культуры, и биологически активные эквиваленты цитокинов с нативной последовательностью.
«Антагонист цитокинов» означает молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность по меньшей мере одного цитокина. Так, например, антагонисты цитокинов могут ингибировать активность цитокина посредством ингибирования экспрессии и/или секреции цитокинов, или посредством связывания с цитокином или с рецептором цитокина. Антагонистами цитокинов являются антитела, синтетические пептиды или пептиды с нативной последовательностью, иммуноадгезины и низкомолекулярные антагонисты, которые связываются с цитокином или с рецептором цитокина. Антагонист цитокинов необязательно конъюгирован или связан с цитотоксическим агентом. Репрезентативными антагонистами TNF являются этанерцепт (ENBREL®), инфликсимаб (REMICADE®) и адалимумаб (HUMIRA™).
Используемый здесь термин «иммуносупрессорное средство» означает вещества, которые подавляют иммунную систему или маскируют иммунную систему индивидуума, подвергаемого лечению. Такими средствами являются вещества, которые подавляют продуцирование цитокинов, ингибируют или подавляют экспрессию аутоантигена или маскируют антигены МНС. Примерами таких иммуносупрессорных средств являются 2-амино-6-арил-5-замещенные пиримидины (см. патент США № 4665077); микофенолят-мофетил, такой как CELLCEPT®; азатиоприн (IMURAN®, AZASAN®/6-меркаптопурин; бромкриптин; даназол; дапсон; глутаральдегид (который маскирует антигены MHC, как описано в патенте США № 4120649); антиидиотипические антитела против антигенов МНС и фрагментов МНС; циклоспорин А; стероиды, такие как кортикостероиды или глюкокортикостероиды, например, преднизон, преднизолон, такой как PEDIAPRED® (преднизолон-фосфат натрия) или ORAPRED® (раствор преднизолона-фосфата натрия для перорального введения), метилпреднизолон и дексаметазон; метотрексат (для перорального или подкожного введения) (RHEUMATREX®, TREXALL™); гидроксихлорохин/хлорохин; сульфасалазин; лефлуномид; антагонисты цитокинов или рецепторов цитокинов, включая антитела против интерферона-γ, -β или -α; антитела против фактора некроза опухоли-α (инфликсимаб или адалимумаб), иммуноадгезин против TNF-α (этанерцепт ENBREL®), антитела против фактора некроза опухоли-β, антитела против интерлейкина-2 и антитела против рецептора IL-2; анти-LFA-1 антитела, включая анти-CD11a антитела и анти-CD18 антитела; анти-L3T4 антитела; гетерологичный антилимфоцитарный глобулин; поликлональные или пан-T-антитела или моноклональные анти-CD3 антитела или анти-CD4/CD4a антитела; растворимый пептид, содержащий LFA-3-связывающий домен (заявка WO 90/08187); стрептокиназа; TGF-β; стрептодорназа; РНК или ДНК хозяина; FK506; RS-61443; дезоксиспергуалин; рапамицин; T-клеточный рецептор (Cohen et al., патент США № 5114721); фрагменты T-клеточного рецептора (Offner et al., Science, 251:430-432 (1991); WO 90/11294; Ianeway, Nature, 341:482 (1989); и WO 91/01133); антитела против T-клеточных рецепторов (EP 340109), такие как T10B9; циклофосфамид (CYTOXAN®); дапсон; пеницилламин (CUPRIMINE®); заменитель плазмы; или иммуноглобулин для внутривенного введения (IVIG). Эти иммуносупрессорные средства могут быть введены отдельно или в комбинации друг с другом, а в частности, в виде комбинаций стероидов и другого иммуносупрессорного агента или комбинаций с нестероидным агентом, вводимых в поддерживающей дозе для снижения потребности в стероидах.
«Аналгетик» означает лекарственное средство, которое ослабляет или подавляет боль у индивидуума. Репрезентативными аналгетиками являются нестероидные противовоспалительные лекарственные средства (НСПВС), включая ибупрофен (MOTRIN®), напроксен (NAPROSYN®), ацетилсалициловую кислоту, индометацин, сулиндак и толметин, включая их соли и производные, а также различные другие лекарственные препараты, используемые для ослабления кинжальной боли, включая противосудорожные средства (габапентин, фенилоин, карбамазепин) или трициклические антидепрессанты. Конкретными примерами таких средств являются ацетаминофен, аспирин, амитриптилин (ELAVIL®), карбамазепин (TEGRETOL®), фенилтоин (DILANTIN®), габапентин (NEURONTIN®), (E)-N-ваниллил-8-метил-6-нонеамид (CAPSAICIN®) или блокатор нервных импульсов.
Термин «кортикостероид» означает любое одно из нескольких синтетических или природных веществ, имеющих общую химическую структуру стероидов, которые имитируют или усиливают действие природных кортикостероидов. Примерами синтетических кортикостероидов являются преднизон, преднизолон (включая метилпреднизолон), дексаметазон-триамцинолон и бетаметазон.
Используемый здесь термин «противораковая вакцина» означает композицию, которая стимулирует иммунный ответ против рака у индивидуума. Противораковые вакцины обычно состоят из источника ассоциированного с раком материала или клеток (антигена), которые могут быть аутологичными (происходящими от одного и того же индивидуума) или аллогенными (происходящими от разных индивидуумов) по отношению к данному индивидууму, а также из других компонентов (например, адъювантов), используемых для дополнительной стимуляции и усиления иммунного ответа против антигена. Противораковые вакцины могут стимулировать иммунную систему индивидуума с продуцированием антител против одного или нескольких специфических антигенов и/или с продуцированием Т-клеток-киллеров, атакующих раковые клетки, имеющие эти антигены.
Используемый здесь термин «цитотоксическая лучевая терапия» означает лучевую терапию, которая ингибирует или подавляет функцию клеток и/или вызывает деструкцию клеток. Лучевая терапия может включать, например, облучение внешним пучком или терапию радиоактивно меченным агентом, таким как антитело. Этот термин включает применение радиоактивных изотопов (например, At211, I131, I125, Y90, Re186, Re188, Sml53, Bi212, Ra223, Ρ32 и радиоактивных изотопов Lu).
«Индивидуум» представляет собой позвоночное, такое как млекопитающее, например, человек. Млекопитающими являются, но не ограничиваются ими, сельскохозяйственные животные (такие как коровы), животные, участвующие в спортивных состязаниях, животные-компаньоны (такие как кошки, собаки и лошади), приматы, мыши и крысы.
Если это не оговорено особо в контексте описания изобретения, то термины «первый» полипептид и «второй» полипептид и их варианты являются просто общими идентификаторами, и не должны рассматриваться как специфический или конкретный полипептид или компонент антител согласно изобретению.
Коммерчески доступные реагенты. описанные в примерах, были использованы в соответствии с инструкциями производителей, если это не оговорено особо. Источником клеток, указанных в нижеследующих примерах и во всем описании изобретения под регистрационными номерами АТСС, являются Американская коллекция типовых культур, Manassas, VA. Если это не оговорено особо, то в настоящем изобретении применяются стандартные методы рекомбинантных ДНК, описанные выше и в нижеследующей справочной литературе: Sambrook et al., см. выше; Ausubel et al., Current Protocols in Molecular Biology (Green Publishing Associates and Wiley Interscience, NY, 1989); Innis et al., PCR Protocols: A Guide to Methods and Applications (Academic Press, Inc., NY, 1990); Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Press, Cold Spring Harbor, 1988); Gait, Oligonucleotide Synthesis (IRL Press, Oxford, 1984); Freshney, Animal Cell Culture, 1987; Coligan et al., Current Protocols in Immunology, 1991.
В настоящем документе и в формуле изобретения, при употреблении слова «содержать» или его вариантов, таких как «содержит» или «содержащий», подразумевается, что данный объект включает указанный элемент или группу элементов, но не исключает присутствия любого другого элемента или целой группы элементов.
II. Конструирование гетеромультимерных белков
Обычно, описанные здесь гетеромультимерные белки содержат значительную часть Fc-области антитела. Однако, в других аспектах изобретения, тяжелая цепь содержит только часть CH1-, CH2 и/или CH3 доменов.
Домены гетеромультимеризации
Гетеромультимерные белки содержат домен гетеромультимеризации. В целях получения в основном гомогенной популяции гетеродимерных молекул, для образования гетеродимеров, но не гомодимеров, домен гетеродимеризации должен быть в высокой степени предпочтительным. Хотя описанные здесь гетеромультимерные белки используются в технологии «узлы в дырках» для облегчения гетеромультимеризации, однако, для специалиста в этой области очевидно, что в настоящем изобретении могут быть использованы и другие домены гетеромультимеризации.
«Узлы в дырках»
Применение «узлов в дырках» как метода продуцирования мультиспецифических антител хорошо известно специалистам. См. патент США № 5731168, выданный 24 марта 1998 и переуступленный Genentech, публикацию заявки PCT № WO2009089004, опубликованной 16 июля 2009 и переуступленной Amgen, и патент США № 20090182127, опубликованный 16 июля 2009 и переуступленный Novo Nordisk A/S. См. также Marvin and Zhu, Acta Pharmacologica Sincia (2005) 26(6):649-658, и Kontermann (2005) Acta Pharmacol. Sin., 26:1-9. Краткое обсуждение приводится в настоящем описании.
Термин «выступ» означает по меньшей мере одну аминокислотную боковую цепь, которая выступает за пределы интерфейса первого полипептида, а поэтому может находиться в компенсирующей полости в смежном интерфейсе (то есть, в пограничной области второго полипептида), и таким образом, будет стабилизировать гетеромультимер, а поэтому будет благоприятствовать, например, образованию гетеромультимера, а не гомомультимера. Такой выступ может присутствовать в исходном интерфейсе, либо он может быть введен путем синтеза (например, путем модификации нуклеиновой кислоты, кодирующей интерфейс). Обычно нуклеиновую кислоту, кодирующую интерфейс первого полипептида, модифицируют так, чтобы она кодировала выступ. Для достижения этой цели, нуклеиновую кислоту, кодирующую по меньшей мере один «исходный» аминокислотный остаток в интерфейсе первого полипептида, заменяют нуклеиновой кислотой, кодирующей по меньшей мере один «импортный» аминокислотный остаток, который имеет более крупную боковую цепь, чем исходный аминокислотный остаток. Следует отметить, что может присутствовать более чем один исходный и соответствующий «импортный» остаток. Верхний предел числа заменяемых исходных остатков представляет собой общее число остатков в интерфейсе первого полипептида. Объемы боковых цепей различных аминокислотных остатков указаны в нижеследующей таблице.
Свойства аминокислотных остатков
(дальтон)
(ангстрем3)
(ангстрем2)
b Приводятся величины, взятые в публикации A.A. Zamyatnin, Prog. Biophys. Mol. Biol. 24:107-123, 1972.
c Приводятся величины, взятые в публикации C. Chothia, J. Mol. Biol. 105:1-14, 1975. Доступная площадь поверхности определена на фигурах 6-20 этой публикации.
Предпочтительными «импортными» остатками для образования выступа обычно являются природные аминокислотные остатки, предпочтительно выбранные из аргинина (R), фенилаланина (F), тирозина (Y) и триптофана (W). Наиболее предпочтительными являются триптофан и тирозин. В одном из вариантов изобретения исходный остаток, используемый для образования выступа, имеет небольшой объем боковой цепи, и такими остатками являются аланин, аспарагин, аспарагиновая кислота, глицин, серин, треонин или валин.
Термин «полость» означает по меньшей мере одну аминокислотную боковую цепь, которая представляет собой углубление в интерфейсе второго полипептида, и поэтому может вмещать соответствующий выступ, находящийся в смежном интерфейсе первого полипептида. Такая полость может присутствовать в исходном интерфейсе, либо она может быть введена путем синтеза (например, путем модификации нуклеиновой кислоты, кодирующей интерфейс). Обычно нуклеиновую кислоту, кодирующую интерфейс второго полипептида, модифицируют так, чтобы она кодировала полость. Для достижения этой цели, нуклеиновую кислоту, кодирующую по меньшей мере один «исходный» аминокислотный остаток в интерфейсе второго полипептида, заменяют ДНК, кодирующей по меньшей мере один «импортный» аминокислотный остаток, который имеет менее крупную боковую цепь, чем исходный аминокислотный остаток. Следует отметить, что может присутствовать более чем один исходный и соответствующий «импортный» остаток. Верхний предел числа заменяемых исходных остатков представляет собой общее число остатков в интерфейсе второго полипептида. Объемы боковых цепей различных аминокислотных остатков указаны выше в таблице 1. Предпочтительными «импортными» остатками для образования полости обычно являются природные аминокислотные остатки, предпочтительно выбранные из аланина (A), серина (S), треонина (T) и валина (V). Наиболее предпочтительными являются серин, аланин или треонин. В одном из вариантов изобретения исходный остаток, используемый для образования полости, имеет большой объем боковой цепи, и такими остатками являются тирозин, аргинин, фенилаланин или триптофан.
«Исходным» аминокислотным остатком является остаток, заменяемый «импортным» остатком, который может иметь меньший или больший объем боковой цепи, чем исходный остаток. «Импортным» аминокислотным остатком может быть природный или неприродный аминокислотный остаток, но предпочтительным является природный остаток. «Природными» аминокислотными остатками являются остатки, кодируемые генетическим кодом и перечисленные выше в таблице 1. «Неприродный аминокислотный остаток» представляет собой остаток, который не кодируется генетическим кодом, но обладает способностью ковалентно связываться со смежным(и) аминокислотным(и) остатком(ами) полипептидной цепи. Примерами неприродных аминокислотных остатков являются норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, описанные, например, в публикации Ellman et al., Meth. Enzym. 202:301-336 (1991). Для получения таких неприродных аминокислотных остатков могут быть применены методы, описанные в публикации Noren et al. Science 244:182 (1989) и Ellman et al., см. выше. Вкратце, этот метод включает химическую активацию супрессорной тРНК неприродным аминокислотным остатком и последующую транскрипцию и трансляцию РНК in vitro. Способ согласно изобретению включает замену по меньшей мере одного исходного аминокислотного остатка, однако, может быть заменен более, чем один аминокислотный остаток. Обычно интерфейсы первого и второго полипептида могут включать столько аминокислотных остатков, заменяющих исходные аминокислотные остатки, сколько это нужно, но не более того. Обычно исходные остатки, которые должны быть заменены, называют «скрытыми» остатками. Под словом «скрытый» подразумевается, что данный остаток, подвергаемый замене, по существу не доступен для растворителя. Вообще говоря, в целях предотвращения возможного окисления или ошибочного спаривания дисульфидных связей, «импортный» остаток не должен быть цистеином.
Выступ обладает «способностью располагаться» в полости, что означает, что пространственная локализация выступа и полости в интерфейсе первого полипептида и второго полипептида, соответственно, и размеры выступа и полости позволяют выступу локализоваться в полости без какого-либо значительного нарушения нормального связывания первого и второго полипептидов в интерфейсе. Поскольку выступы, такие как Tyr, Phe и Trp, обычно располагаются не перпендикулярно оси интерфейса и имеют предпочтительную конформацию, то расположение выступа и соответствующей полости по одной линии зависит от моделирования пары выступ/полость исходя из трехмерной структуры, полученной с помощью рентгеновской кристаллографии или ядерного магнитного резонанса (ЯМР). Это может быть достигнуто с применением широко известных методов.
Термин «исходная или матричная нуклеиновая кислота» означает нуклеиновую кислоту, кодирующую представляющий интерес полипептид, который может быть «модифицирован» (то есть, генетически сконструирован или мутирован) так, чтобы он содержал выступ или полость. Первоначально взятая или исходная нуклеиновая кислота может быть природной нуклеиновой кислотой, либо она может содержать нуклеиновую кислоту, которая была подвергнута предварительной модификации (например, нуклеиновую кислоту, кодирующую фрагмент гуманизованного антитела). Термин «модификация» нуклеиновой кислоты означает, что исходная нуклеиновая кислота была мутирована путем встраивания, делеции или замены по меньшей мере одного кодона, кодирующего представляющей интерес аминокислотный остаток. Обычно кодон, кодирующий исходный остаток, заменяют кодоном, кодирующим «импортный» остаток. Методы генетической модификации ДНК, проводимой таким способом, описаны в публикации Mutagenesis: a Practical Approach, M.J. McPherson, Ed., (IRL Press, Oxford, UK. (1991), и включают, например, сайт-направленный мутагенез, кассетный мутагенез и мутагенез с помощью полимеразной цепной реакции (ПЦР). Мутация исходной/матричной нуклеиновой кислоты, соответственно, приводит к изменению исходного/матричного полипептида, кодируемого исходной/матричной нуклеиновой кислотой.
Выступ или полость могут быть «включены» в интерфейс первого или второго полипептида методами синтеза, например, рекомбинантными методами, методом пептидного синтеза in vitro, то есть методами введения неприродных аминокислотных остатков, описанных ранее; методами ферментативного или химического присоединения пептидов или некоторыми комбинациями этих методов. В соответствии с этим, выступ или полость, которые были «включены», являются «неприродными» или «ненативными», и это означает, что они не существуют в природе или отсутствуют в исходном полипептиде (например, в гуманизованном моноклональном антителе).
Обычно «импортный» аминокислотный остаток, используемый для образования выступа, имеет относительно небольшое число «ротамеров» (например, примерно 3-6). «Ротамер» представляет собой энергетически благоприятную конформацию аминокислотной боковой цепи. Ряд ротамеров различных аминокислотных остатков приводится в публикации Ponders and Richards, J. Mol. Biol. 193:775-791 (1987).
III. Векторы, клетки-хозяева и рекомбинантные методы
Для рекомбинантного продуцирования гетеромультимерного белка (например, антитела) согласно изобретению, нуклеиновую кислоту, кодирующую такой белок, выделяют и встраивают в реплицирующийся вектор для последующего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующая антитело, может быть легко выделена и секвенирована стандартными методами (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела). Многие векторы являются доступными. Выбор вектора частично зависит от используемой клетки-хозяина. Вообще говоря, предпочтительными клетками-хозяевами являются прокариотические или эукариотические клетки (обычно клетки млекопитающих, но также могут быть использованы клетки грибов (например, дрожжей), клетки насекомых, клетки растений и ядро-содержащие клетки других многоклеточных организмов). Следует отметить, что для этой цели могут быть использованы константные области антитела любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и что такие константные области могут быть получены от любого человека или животного.
a. Конструирование гетеромультимерных белков с использованием прокариотических клеток-хозяев
i. Конструирование вектора
Полинуклеотидные последовательности, кодирующие полипептидные компоненты гетеромультимерных белков (например, антитела) согласно изобретению, могут быть получены стандартными рекомбинантными методами. Нужные полинуклеотидные последовательности могут быть выделены и секвенированы, например, из антитело-продуцирующих клеток, таких как гибридомные клетки. Альтернативно, полинуклеотиды могут быть синтезированы с помощью синтезатора нуклеотидов или ПЦР-методами. После получения последовательностей, кодирующих полипептиды, эти последовательности встраивают в рекомбинантный вектор, способный реплицироваться и экспрессировать гетерологичные полинуклеотиды в прокариотических хозяевах. В целях настоящего изобретения могут быть использованы многие доступные и известные векторы. Выбор соответствующего вектора зависит, главным образом, от размера нуклеиновых кислот, встраиваемых в указанный вектор, и от конкретной клетки-хозяина, трансформируемой этим вектором. Каждый вектор содержит различные компоненты, в зависимости от его функции (амплификации или экспрессии гетерологичного полинуклеотида или того и другого) и от его совместимости с конкретной клеткой-хозяином, в которой он находится. Компонентами вектора обычно являются, но не ограничиваются ими, ориджин репликации, селективный маркерный ген, промотор, сайт связывания с рибосомой (RBS), сигнальная последовательность, встроенная гетерологичная нуклеиновая кислота и последовательность терминации транскрипции.
В основном, плазмидные векторы, содержащие репликон и регуляторные последовательности, происходящие от видов, совместимых с клеткой-хозяином, используются вместе с этими же хозяевами. Такой вектор обычно имеет сайт репликации, а также маркирующие последовательности, способные осуществлять фенотипический отбор в трансформированных клетках. Так, например, E. coli обычно трансформируют с использованием pBR322, плазмиды, происходящей от E. coli различных видов. pBR322 содержит гены, кодирующие резистентность к ампициллину (Amp) и к тетрациклину (Tet), и является простым средством для идентификации трансформированных клеток. pBR322, ее производные или другие микробные плазмиды или бактериофаг могут также содержать, либо они могут быть модифицированы так, чтобы они содержали промоторы, которые могут быть использованы этим микробным организмом для экспрессии эндогенных белков. Примеры производных pBR322, используемых для экспрессии конкретных антител, подробно описаны в патенте США № 5648237, Carter et al.
Кроме того, фаговые векторы, содержащие репликон и регуляторные последовательности, совместимые с микроорганизмом-хозяином, могут быть использованы в качестве трансформирующих векторов в комбинации с этими хозяевами. Так, например, бактериофаг, такой как λGEMTM-11, может быть использован для получения рекомбинантного вектора, который может быть применен для трансформации восприимчивых клеток-хозяев, таких как E.coli LE392.
Экспрессионный вектор согласно изобретению может содержать две или более пар промотор-цистрон, кодирующих каждый из полипептидных компонентов. Промотором является нетранслируемая регуляторная последовательность, локализованная выше (со стороны 5’-конца) от цистрона, модулирующего ее экспрессию. Прокариотические промоторы обычно подразделяются на два класса, индуцибельные и конститутивные. Индуцибельным промотором является промотор, который инициирует повышение уровней транскрипции цистрона, находящегося под его контролем, в ответ на изменения условий культивирования, например, в присутствии или в отсутствие питательных элементов или при изменении температуры.
Большинство промоторов, распознаваемых различными потенциальными клетками-хозяевами, хорошо известны специалистам. Выбранный промотор может быть функционально присоединен к цистронной ДНК, кодирующей, например, легкую или тяжелую цепь, путем выделения промотора из ДНК-источника посредством ее гидролиза рестриктирующими ферментами и встраивания выделенной промоторной последовательности в вектор согласно изобретению. Нативная промоторная последовательность и многие гетерологичные промоторы могут быть использованы для прямой амплификации и/или экспрессии генов-мишеней. В некоторых вариантах изобретения используются гетерологичные промоторы, поскольку они, по сравнению с нативным промотором для нужных полипептидов, позволяют значительно повышать уровень транскрипции и увеличивать выходы экспрессируемого гена-мишени.
Промоторами, подходящими для использования в прокариотических хозяевах, являются промотор PhoA, промоторные системы β-галактамазы и лактозы, промоторная система триптофана (trp) и слитые промоторы, такие как промотор tac или промотор trc. Однако могут быть также использованы и другие промоторы, которые являются функциональными в бактериях (например, другие известные бактериальные или фаговые промоторы). Нуклеотидные последовательности этих промоторов были опубликованы, что облегчает специалистам в данной области проводить их функциональное лигирование с цистрон-кодирующими генами гетеромультимерного белка, например, нужных легких и тяжелых цепей (Siebenlist et al. (1980) Cell 20:269), с использованием линкеров или адаптеров для доставки всех требуемых рестрикционных сайтов.
В одном из аспектов изобретения каждый цистрон в рекомбинантном векторе содержит такой компонент, как секреторная сигнальная последовательность, регулирующая транслокацию экспрессируемых полипептидов через мембрану. В общих чертах, указанной сигнальной последовательностью может быть компонент вектора, либо такой последовательностью может быть часть ДНК-полипептида-мишени, встраиваемого в этот вектор. Сигнальной последовательностью, выбранной в целях осуществления изобретения, должна быть последовательность, распознаваемая и процессируемая (то есть, отщепляемая сигнальной пептидазой) клеткой-хозяином. В случае использования прокариотических клеток-хозяев, не распознающих и не процессирующих сигнальные последовательности, которые являются нативными для гетерологичных полипептидов, эту сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы, состоящей из лидерной последовательности щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II (STII), LamB, PhoE, PelB, OmpA и МВР. В одном из вариантов изобретения сигнальными последовательностями, используемыми в обоих цистронах экспрессионной системы, являются сигнальные последовательности STII или их варианты.
В другом аспекте изобретения продуцирование иммуноглобулинов согласно изобретению может происходить в цитоплазме клетки-хозяина, и поэтому в данном случае не требуется присутствия секреторных сигнальных последовательностей в каждом цистроне. В соответствии с этим, легкие и тяжелые цепи иммуноглобулина экспрессируются и подвергаются укладке и сборке с образованием функциональных иммуноглобулинов в цитоплазме. Некоторые штаммы хозяев (например, trxB--штаммы E.coli) имеют соответствующие условия в цитоплазме, которые благоприятствуют образованию дисульфидных связей и тем самым способствуют правильной укладке и сборке субъединиц экспрессируемого белка. См. Proba & Plūckthun, Gene, 159:203 (1995).
Прокариотическими клетками-хозяевами, подходящими для экспрессии гетеромультимерных белков (например, антител) согласно изобретению, являются архебактерии и эубактерии, такие как грамотрицательные или грамположительные микроорганизмы. Примерами подходящих бактерий являются Escherichia (например, E. coli), Bacilli (например, B. subtilis), Enterobacteria, Pseudomonas species (например, P. aeruginosa), Salmonella typhimurium, Serratia marcescans, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном из вариантов изобретения используются грамотрицательные клетки. В одном из вариантов изобретения клетки E. coli используются в качестве хозяев согласно изобретению. Примерами штаммов E. coli являются штамм W3110 (Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, D.C.: American Society for Microbiology, 1987), pp. 1190-1219; ATCC Deposit No. 27325) и их производные, включая штамм 33D3, имеющий генотип W3110 ΔfhuA (ΔtonA) ptr3 lac lq lacL8 ΔompTΔ(nmpc-fepE)degP41 kanR (патент США № 5639635). Подходящими также являются и другие штаммы и их производные, такие как E. coli 294 (ATCC 31446), E. coli B, E. coliλ 1776 (ATCC 31537) и E. coli RV308 (ATCC 31608). В одном из вариантов изобретения, в частности, используется E. coli Δlpp. Эти примеры приводятся лишь в иллюстративных, но не ограничивающих целях. Методы конструирования производных любых вышеупомянутых бактерий, имеющих определенные генотипы, известны специалистам и описаны, например, в публикации Bass et al., Proteins, 8:309-314 (1990). Вообще говоря, соответствующие бактерии должны быть выбраны с учетом реплицируемости репликона в клетках бактерий. Так, например, клетки вида E. coli, Serratia или Salmonella могут быть использованы в качестве хозяев, если для доставки репликона используются хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410. Обычно клетки-хозяева должны секретировать минимальное количество протеолитических ферментов, а при желании, в клеточную культуру могут быть введены дополнительные ингибиторы протеазы.
ii. Продуцирование полипептидов
Клетки-хозяева трансформируют вышеописанными экспрессионными векторами и культивируют в стандартной питательной среде, модифицированной, если это необходимо, для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
Трансформация означает введение ДНК в прокариотического хозяина так, чтобы ДНК реплицировалась в виде внехромосомного элемента или хромосомного компонента. В зависимости от используемой клетки-хозяина, трансформацию осуществляют стандартными методами, применимыми для трансформации таких клеток. Обработка кальцием, а именно хлоридом кальция, обычно применяется для бактериальных клеток, имеющих плотные клеточные стенки. В других методах трансформации используются полиэтиленгликоль/ДМСО. В еще одном методе используется электропорация.
Прокариотические клетки, используемые для продуцирования полипептидов согласно изобретению, культивируют в среде, известной специалистам и подходящей для культивирования выбранных клеток-хозяев. Примерами подходящей среды являются бульон Луриа (LB) с необходимыми питательными добавками. В некоторых вариантах изобретения среда также содержит средство для отбора, выбранное исходя из конструирования экспрессионного вектора, которое способствуют селективному росту прокариотических клеток, содержащих экспрессионный вектор. Так, например, в среду для культивирования клеток, экспрессирующих ген резистентности к ампициллину, добавляют ампициллин.
Помимо источников углерода, азота и неорганического фосфата, в среду могут быть также включены любые необходимые добавки в соответствующих концентрациях, вводимые как отдельно, так и в смеси с другими добавками или средой, такими как комплексный источник азота. Культуральная среда может содержать, но необязательно, один или несколько восстановителей, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолята, дитиоэритритола и дитиотреитола.
Прокариотические клетки-хозяева культивируют при соответствующих температурах. Для культивирования E.coli предпочтительной температурой является, например, температура примерно от 20°С до 39°С, более предпочтительно примерно от 25°С до 37°С, а еще более предпочтительно примерно 30°С. рН среды может варьироваться в пределах примерно от 5 до 9, в зависимости, главным образом, от организма хозяина. Для E.coli рН составляет предпочтительно примерно от 6,8 до 7,4, а более предпочтительно примерно 7,0.
Если в экспрессионном векторе согласно изобретению используется индуцибельный промотор, то экспрессия белка индуцируется в условиях, подходящих для активации данного промотора. В одном из аспектов изобретения, для регуляции транскрипции полипептидов используются промоторы PhoA. В соответствии с этим, трансформированные клетки-хозяева культивируют в среде для индуцирования с ограниченным содержанием фосфата. Предпочтительной средой с ограниченным содержанием фосфата является среда С.R.А.Р. (см., например, Simmons et al., J. Immunol. Methods (2002) 263:133-147). В комбинации с используемой векторной конструкцией могут быть использованы и различные другие индукторы, известные специалистам.
В одном из вариантов изобретения первую и вторую клетки-хозяева, содержащие шарнирную область, культивируют отдельно, и экспрессируемые полипептиды согласно изобретению секретируются в периплазму клеток-хозяев и могут быть выделены из этой периплазмы. Во втором варианте изобретения первую и вторую клетки-хозяева, содержащие шарнирную область, культивируют отдельно, и перед выделением полипептида, содержащего шарнирную область, две культуры клеток-хозяев смешивают, и клетки осаждают. В третьем варианте изобретения первую и вторую клетки-хозяева, содержащие шарнирную область, культивируют отдельно, центрифугируют и ресуспендируют отдельно, а перед выделением полипептидов, содержащих шарнирную область, смешивают. В четвертом варианте изобретения первую и вторую клетки-хозяева, содержащие шарнирную область, культивируют вместе в одном и том же сосуде для культивирования. Выделение белка в основном осуществляют путем разрушения клеточной мембраны микроорганизма, обычно такими методами, как осмотический шок, обработка ультразвуком или лизис. После разрушения клеток, клеточный дебрис или целые клетки могут быть удалены путем центрифугирования или фильтрации. Белки могут быть дополнительно очищены, например, с помощью хроматографии на аффинной смоле. Альтернативно, белки могут быть перенесены в клеточную среду и выделены из нее. Клетки могут быть удалены из культуры, а супернатант культуры может быть подвергнут фильтрации и концентрированию для дополнительной очистки полученных белков. Экспрессированные полипептиды могут быть затем выделены и идентифицированы общеизвестными методами, такими как электрофорез в полиакриламидном геле (ПААГ) и Вестерн-блот-анализ. Выделенные полипептиды могут быть использованы для продуцирования гетеромультимерных белков.
В одном из аспектов изобретения гетеромультимерный белок (например, антитело) продуцируют в большом количестве посредством ферментации. Для получения рекомбинантных белков могут быть проведены различные крупномасштабные процедуры ферментации в культуре с подпиткой. Крупномасштабную ферментацию проводят в ферментере емкостью по меньшей мере 1000 литров, а предпочтительно примерно от 1000 до 100000 литров. Такие ферментеры снабжены лопастной мешалкой для равномерного распределения кислорода и микроэлементов, в частности, глюкозы (предпочтительного источника углерода/энергии). Термин «лабораторная ферментация», в общих чертах, означает ферментацию в ферментере объемом не более чем примерно 100 литров, и такой объем может варьировать примерно от 1 литра до 100 литров.
В процессе ферментации, индуцирование экспрессии белков обычно инициируют после того, как клетки, культивируемые в подходящих условиях, достигнут нужной плотности, например, OD550, составляющей примерно 180-220, то есть ранней стационарной фазы. В комбинации с используемой векторной конструкцией могут быть использованы и различные другие индукторы, известные специалистам и описанные выше. Перед индуцированием клетки могут быть культивированы в течение меньшего периода времени. Клетки обычно индуцируют в течение примерно 12-50 часов, хотя время индуцирования может быть увеличено или уменьшено.
Для увеличения выхода продукта и для улучшения качества полипептидов согласно изобретению могут быть изменены различные условия ферментации. Так, например, для обеспечения «правильной» сборки и укладки секретированных гетеромультимерных белков (например, антител) могут быть использованы дополнительные векторы, в которых происходит сверхэкспрессия белков-шаперонов, таких как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил-цис,транс-изомераза с шаперонной активностью), и которые предназначены для котрансформации прокариотических клеток-хозяев. Было продемонстрировано, что белки-шапероны облегчают правильную укладку и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen et al. (1999) J. Bio. Chem. 274:19601-19605; Georgiou et al., патент США № 6083715; Georgiou et al., патент США № 6027888; Bothmann & Plūckthun (2000) J. Biol. Chem. 275:17100-17105; Ramm & Plūckthun (2000) J. Biol. Chem. 275:17106-17113; Arie et al. (2001) Mol. Microbiol. 39:199-210.
Для минимизации протеолиза экспрессируемых гетерологичных белков (в частности, белков, которые являются протеолитически чувствительными), в настоящем изобретении могут быть использованы некоторые штаммы-хозяева, дефицитные по протеолитическим ферментам. Так, например, штаммы клеток-хозяев могут быть модифицированы для введения генетической(их) мутации(й) в гены, кодирующие известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их комбинации. Некоторые дефицитные по протеазе штаммы E.coli являются доступными и описаны, например, в публикации Joly et al. (1998), см. выше; Georgiou et al., патент США № 5264365; Georgiou et al., патент США № 5508192; Hara et al., Microbial Drug Resistance, 2:63-72 (1996).
В одном из вариантов изобретения штаммы E.coli, дефицитные по протеолитическим ферментам и трансформированные плазмидами, сверхэкспрессирующими один или несколько белков-шаперонов, используются в качестве клеток-хозяев в экспрессионной системе согласно изобретению. Во втором варианте изобретения штамм E. coli является дефицитным по липопротеину внешней мембраны (Δlpp).
iii. Очистка гетеромультимерных белков
В одном из вариантов изобретения гетеромультимерный белок, полученный, как описано в настоящей заявке, дополнительно очищают и получают препараты, которые являются по существу гомогенными, и поэтому они могут быть использованы в последующих анализах и для различных целей. При этом могут быть применены стандартные методы очистки белков, известные специалистам. Подходящими примерами методов очистки являются следующие методы: фракционирование на иммуноаффинных или ионообменных колонках, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на двуокиси кремния или на катионообменной смоле, такой как DEAE, хроматофокусирование, электрофорез в ДСН-ПААГ, преципитация сульфатом аммония и гель-фильтрация, проводимая с использованием, например, сефадекса G-75.
В одном из аспектов изобретения белок A, иммобилизованный на твердой фазе, используют для иммуноаффинной очистки, например, продуктов полноразмерных антител согласно изобретению. Белок A представляет собой 41 кД-белок клеточной стенки, который происходит от Staphylococcus aureus и который связывается с высокой аффинностью с Fc-областью антител. Lindmark et al. (1983) J. Immunol. Meth. 62:1-13. Твердой фазой, на которой иммобилизован белок A, предпочтительно является колонка, имеющая поверхность, на которую нанесены стекло или двуокись кремния, более предпочтительно колонка, на которую нанесено стекло с регулируемым размером пор, или колонка с кремниевой кислотой. В некоторых случаях, в целях предотвращения неспецифической адгезии примесей, колонку покрывают реагентом, таким как глицерин.
В первой стадии очистки препарат, полученный из клеточной культуры, как описано выше, наносят на твердую фазу, иммобилизованную белком А, для обеспечения специфического связывания представляющего интерес антитела с белком А. Затем твердую фазу промывают для удаления примесей, неспецифически связанных с твердой фазой. Гетеромультимерный белок (например, антитело) выделяют из твердой фазы путем элюирования.
b. Получение гетеромультимерных белков с использованием эукариотических клеток-хозяев
Компонентами векторов обычно являются, но не ограничиваются ими, один или несколько из следующих компонентов: сигнальная последовательность, ориджин репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
i. Компонент сигнальная последовательность
Вектор, используемый в эукариотических клетках-хозяевах, может также содержать сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления у N-конца зрелого белка, или представляющий интерес полипептид. Выбранной гетерологичной сигнальной последовательностью предпочтительно является последовательность, которая распознается и процессируется (то есть, отщепляется сигнальной пептидазой) клеткой-хозяином. Для экспрессии в клетках млекопитающих используются сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, сигнальная последовательность gD вируса простого герпеса. ДНК для такой области-предшественника лигируют с ДНК, кодирующей нужный(е) гетеромультимерный(е) белок(ки) (например, антитела) с сохранением рамки считывания.
ii. Ориджин репликации
Обычно такой компонент как ориджин репликации не является необходимым для экспрессионных векторов млекопитающих. Так, например, ориджин репликации SV40 обычно используется только потому, что он содержит ранний промотор.
iii. Компонент селективный ген
Экспрессионный и клонирующий векторы могут содержать селективный ген, также называемый селективным маркером. Обычно селективные гены кодируют белки, которые (а) сообщают резистентность к антибиотиками или к другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) компенсируют дефицит, обусловленный ауксотрофией, если это необходимо, или (с) обеспечивают доставку важных питательных веществ, которые не поступают из комплексных сред.
Одним из примеров схемы отбора является использование лекарственного средства, прекращающего рост клетки-хозяина. Клетки, которые были успешно трансформированы гетерологичным геном, продуцируют белок, сообщающий резистентность к лекарственному средству и тем самым способствующий выживанию этих клеток в селективной среде. Для такого доминантного отбора могут быть использованы, например, лекарственные средства, такие как неомицин, микофеноловая кислота и гигромицин.
Другими примерами подходящих селективных маркеров для клеток млекопитающих являются маркеры, которые позволяют идентифицировать клетки, способные встраивать антитело-кодирующую нуклеиновую кислоту, такую как гены DHFR, тимидинкиназы, металлотионеина-I и I-I, предпочтительно гены, кодирующие металлотионеин приматов, аденозин-дезаминазу, орнитин-декарбоксилазу и т.п.
Так, например, клетки, трансформированные селективным геном DHFR, сначала идентифицируют путем культивирования всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. В случае использования DHFR дикого типа, подходящей клеткой-хозяином является клеточная линия яичника китайского хомячка (СНО), дефицитная по DHFR-активности (например, ATCC CRL-9096).
Альтернативно, клетки-хозяева (в частности, хозяева дикого типа, содержащие эндогенный DHFR), трансформированные или котрансформированные ДНК-последовательностями, кодирующими антитело, белок DHFR дикого типа и другой селективный маркер, такой как аминогликозид-3’-фосфотрансфераза (АРН), могут быть отобраны путем культивирования клеток в среде, содержащей агент для отбора, проводимого с использованием селективного маркера, такого как аминогликозидный антибиотик, например, канамицин, неомицин или G418. См., например, патент США № 4965199.
iv. Компонент промотор
Экспрессионные и клонирующие векторы обычно содержат промотор, распознаваемый организмом-хозяином и функционально присоединенный к нужной нуклеиновой кислоте, кодирующей полипептид(ы) (например, антитело), содержащий(е) шарнирную область. Промоторные последовательности для эукариотов известны специалистам. Фактически, все гены эукариотов имеют АТ-богатую область, локализованную приблизительно в области, расположенной на 25-30 нуклеотидов выше от сайта инициации транскрипции. Другой такой последовательностью, локализованной приблизительно в области, расположенной на 70-80 нуклеотидов выше от сайта инициации транскрипции многих генов, является область CNCAAT, где N может означать любой нуклеотид. У 3’-конца большинства эукариотических генов расположена последовательность ААТААА, которая может служить сигналом для присоединения poly A-хвоста к 3’-концу кодирующей последовательности. Все указанные последовательности могут быть соответствующим образом встроены в эукариотические экспрессионные векторы.
Транскрипция нужного(ых) полипептида(ов) (например, антитела), содержащего(их) шарнирную область, из векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов таких вирусов, как, например, вирус полиомы, вирус оспы домашней птицы, аденовирус (такой как аденовирус 2), вирус коровьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В и обезьяний вирус 40 (SV40); гетерологичными промоторами млекопитающих, например, промотором актина или промотором иммуноглобулина; и промоторами белков теплового шока, при условии, что такие промоторы являются совместимыми с системами клеток-хозяев.
Ранние и поздние промоторы вируса SV40 обычно получают в виде рестрикционного фрагмента SV40, который также содержит ориджин репликации вируса SV40. Предранний промотор человеческого цитомегаловируса обычно получают в виде рестрикционного HindIII-фрагмента Е. Система экспрессии ДНК в клетках-хозяевах млекопитающих, полученная на основе коровьего папилломавируса, используемого в качестве вектора, описана в патенте США № 4419446. Модификация такой системы описана в патенте США № 4601978. Экспрессия кДНК человеческого β-интерферона в мышиных клетках под контролем промотора тимидинкиназы вируса простого герпеса также описана в публикации Reyers et al., Nature 297:598-601 (1982). Альтернативно, в качестве промотора может быть использован вирус саркомы Рауса, имеющий длинный концевой повтор.
v. Компонент энхансерный элемент
Транскрипция ДНК, кодирующей нужный(ые) полипептид(ы) (например, антитело), содержащий(ие) шарнирную область, в высших эукариотах, может быть усилена при встраивании в вектор энхансерной последовательности. В настоящее время известно много энхансерных последовательностей, происходящих от генов млекопитающих (генов глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако обычно используется энхансер от вируса эукариотической клетки. Примерами является энхансер вируса SV40, локализованный в поздней области ориджина репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомавируса, локализованный в поздней области ориджина репликации, и энхансеры аденовируса. См. также публикацию Yaniv, Nature 297:17-18 (1982), в которой описаны энхансерные элементы для усиления активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в 5’- или 3’-положении по отношению к последовательности, кодирующей полипептид антитела, при условии, что будет достигаться такое усиление, но предпочтительно, чтобы он находился в 5’-положении от промотора.
vi. Компонент сайт терминации транскрипции
Экспрессионные векторы, используемые в эукариотических клетках-хозяевах, также обычно содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно расположены со стороны 5’-конца, а иногда 3’-конца от нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибированные в виде полиаденилированных фрагментов в нетранслированной части мРНК, кодирующей антитело. Одним из подходящих компонентов терминации транскрипции является область полиаденилирования коровьего гормона роста. См. описание экспрессионных векторов в WO 94/11026 и в настоящей заявке.
vii. Отбор и трансформация клеток-хозяев
Клетками-хозяевами, подходящими для клонирования и экспрессии ДНК в описанных здесь векторах, являются описанные высшие эукариотические клетки, включая клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (тканевой культуре) представляет собой рутинную процедуру. Примерами подходящих клеточных линий-хозяев млекопитающих являются клетки почек обезьяны CV1, трансформированные вирусом SV40 (COS-7, ATCC CRL 1651); клеточная линия почек человеческого эмбриона (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почек детеныша хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); мышиные клетки Сертоли (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почек обезьяны (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почек собак (MDCK, ATCC CCL 34); клетки печени лабораторной крысы Buffalo (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухолевые клетки мышиной молочной железы (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и клеточная линия человеческой гепатомы (Hep G2).
Клетки-хозяева трансформируют вышеописанными экспрессирующими или клонирующими векторами для продуцирования нужного(ых) полипептида(ов) (например, антитела), содержащего(их) шарнирную область, и культивируют в стандартной питательной среде, модифицированной, если это необходимо, для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
viii. Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования нужного(ых) полипептида(ов) (например, антитела), содержащего(их) шарнирную область, согласно изобретению, могут быть культивированы в различных средах. Коммерчески доступными средами, подходящими для культивирования клеток-хозяев, являются среды, такие как среда Хэмса F10 (Sigma), минимальная поддерживающая среда ((МЕМ)Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma). Кроме того, в качестве культуральной среды для культивирования клеток-хозяев может быть использована любая среда, описанная в публикации Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), в патентах США №№ 4767704, 4657866, 4927762, 4560655 или 5122469; в WO 90/03430; в WO 87/00195 или в патенте США Re.№ 30985. В любую из этих сред могут быть добавлены, если это необходимо, гормоны и/или другие факторы роста (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия и фосфат кальция и магния), буферы (такие как HEPES), нуклеотиды (такие как аденозин и тимидин), антибиотики (такие как лекарственное средство гентамицинТМ), микроэлементы (определенные как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярных дозах) и глюкоза или эквивалентный источник энергии. Могут быть также включены любые другие необходимые добавки в соответствующих концентрациях, известных специалистам в данной области. Условия культивирования, такие как температура, рН и т.п., аналогичны условиям, ранее используемым для экспрессии выбранных клеток-хозяев, и известны среднему специалисту в данной области.
ix. Очистка гетеромультимерных белков
С применением техники рекомбинантных ДНК, полипептиды, содержащие шарнирную область, могут быть продуцированы внутри клеток, либо они могут быть непосредственно секретированы в среду. Если в первой стадии полипептид, содержащий шарнирную область, продуцируется внутри клеток, то клеточный дебрис или клетки-хозяева или их лизированные фрагменты удаляют, например, путем центрифугирования или ультрафильтрации. Если полипептид, содержащий шарнирную область, секретируется в среду, то обычно, сначала концентрируют супернатанты, полученные из таких экспрессионных систем, с использованием коммерчески доступного фильтра для концентрирования белков, например, устройства для ультрафильтрации Amicon или Millipore Pellicon. Для ингибирования протеолиза, в любой из предшествующих стадий может быть использован ингибитор протеазы, такой как PMSF, а для предупреждения размножения случайно вносимых примесных микроорганизмов могут быть использованы антибиотики.
Композиция гетеромультимеров, полученная из клеток, может быть очищена, например, с помощью хроматографии на гидроксиапатитах, гель-электрофореза, диализа и аффинной хроматографии, при этом предпочтительным методом очистки является аффинная хроматография. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, присутствующего в данном антителе. Белок А может быть использован для очистки антител, содержащих тяжелые цепи γ1, γ2 или γ4 человеческого иммуноглобулина (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Для всех мышиных изотипов и для человеческой цепи γ3 рекомендуется G-белок (Guss et al., EMBO J. 5:1567-1575 (1986)). В качестве матрицы, с которой связывается аффинный лиганд, наиболее часто используется агароза, но могут быть использованы и другие матрицы. Механически стабильные матрицы, такие как стекло с регулируемым размером пор или поли(стиролдивинил)бензол, обеспечивают более высокую скорость потока и позволяют сократить время обработки, что не может быть достигнуто с использованием агарозы. Если антитело содержит домен СН3, то для его очистки может быть использована смола Bakerbond ABXTM (J.T. Baker, Phillipsburg, N.J.). В зависимости от выделяемого антитела могут быть также применены и другие методы очистки белка, такие как фракционирование на ионообменной колонке, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на двуокиси кремния, хроматография на гепарин-сефарозеТМ, хроматография на анионо- или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, электрофорез в ДСН-ПААГ и преципитация сульфатом аммония.
После проведения любой(ых) предварительной(ых) стадии(й) очистки, смесь, содержащая представляющее интерес антитело и примеси, может быть подвергнута гидрофобной хроматографии при низком рН с использованием элюирующего буфера при рН примерно 2,5-4,5, предпочтительно при низкой концентрации соли (например, примерно 0-0,25М соли). Способ продуцирования гетеромультимерных белков (помимо любого из вышеописанных конкретных методов) может, альтернативно или дополнительно, включать диализ раствора, содержащего смесь указанных полипептидов.
x. Продуцирование антитела с использованием бакуловируса
Рекомбинантный бакуловирус может быть продуцирован путем котрансфекции плазмиды, кодирующей антитело или его фрагмент, и вирусной ДНК BaculoGoldTM (Pharmingen) в клетку насекомого, такую как клетка Spodoptera frugiperda (например, клетки Sf9; ATCC CRL 1711) или клетка Drosophila melanogaster S2, с использованием, например, липофектина (поставляемого от GIBCO-BRL). В конкретном примере, последовательность антитела присоединяют в область, расположенную выше эпитопной метки, содержащейся в бакуловирусном экспрессионном векторе. Такими эпитопными метками являются поли-His-метки. При этом могут быть использованы различные плазмиды, включая плазмиды, происходящие от коммерчески доступных плазмид, таких как pVL1393 (Novagen) или pAcGP67B (Pharmingen). Кратко, последовательность, кодирующая антитело или его фрагмент, может быть амплифицирована с помощью ПЦР с использованием праймеров, комплементарных 5'- и 3'-областям. 5'-праймер может включать фланкирующие (выбранные) рестрикционные сайты. Затем продукт может быть гидролизован выбранными рестриктирующими ферментами и субклонирован в экспрессионный вектор.
После трансфекции экспрессионным вектором, клетки-хозяева (например, клетки Sf9) инкубируют в течение 4-5 дней при 28°C, и высвобождаемый вирус собирают и используют для последующих амплификаций. Инфицирование вирусом и экспрессия белка могут быть осуществлены, как описано, например, O'Reilley et al. (Baculovirus expression vectors: A Laboratory Manual. Oxford: Oxford University Press (1994)).
Экспрессированное поли-His-меченное антитело может быть затем очищено, например, с помощью аффинной хроматографии на Ni2+-хелатном комплексе. Экстракты могут быть получены из клеток Sf9, инфицированных рекомбинантным вирусом как описано Rupert et al. (Nature 362:175-179 (1993)). Кратко, клетки Sf9 промывают, ресуспендируют в буфере для обработки ультразвуком (25 мл HEPES pH 7,9; 12,5 мМ MgCl2; 0,1 мМ EDTA; 10% глицерин; 0,1% NP-40; 0,4 M KCl), и два раза обрабатывают ультразвуком в течение 20 секунд на льду. Обработанные ультразвуком клетки осветляют путем центрифугирования, после чего супернатант 50-кратно разводят в загрузочном буфере (50 мМ фосфат; 300 мМ NaCl; 10% глицерин, pH 7,8) и фильтруют через 0,45-мкм фильтр. Колонку с Ni2+-NTA-агарозой (поставляемую Qiagen) приготавливают с объемом слоя 5 мл, промывают 25 мл воды и уравновешивают 25 мл загрузочного буфера. Отфильтрованный клеточный экстракт загружают на колонку со скоростью 0,5 мл в минуту. Колонку промывают загрузочным буфером до базового значения A280, при котором начинают сбор фракций. Затем колонку промывают вторым промывочным буфером (50 мМ фосфат; 300 мМ NaCl; 10% глицерин, pH 6,0), который элюирует неспецифически связанный белок. После того, как величина A280 снова достигнет базового уровня, колонку проявляют градиентом 0-500 мМ имидазола во втором промывочном буфере. Было собрано 1 мл фракций, которые затем анализировали с помощью электрофореза в ДСН-ПААГ и окрашивания серебром или вестерн-блот-анализа, проводимого с использованием Ni2+-NTA, конъюгированного со щелочной фосфатазой (Qiagen). Фракции, содержащие элюированное His10-меченное антитело, собирали в пул и диализовали против загрузочного буфера.
Альтернативно, очистка антитела может быть осуществлена известными хроматографическими методами, включая, например, хроматографию на колонке с белком A или с G-белком. В одном из вариантов изобретения представляющее интерес антитело может быть выделено из твердой фазы колонки путем элюирования в растворе, содержащем хаотропный агент или слабый детергент. Репрезентативными хаотропными агентами и слабыми детергентами являются, но не ограничиваются ими, гуанидин-HCl, мочевина, перхлорат лития, аргинин, гистидин, ДСН (додецилсульфат натрия), Tween, Triton и NP-40, которые являются коммерчески доступными.
IV. Образование/сборка гетеромультимерных белков
Образование полноразмерного гетеромультимерного белка включает повторную сборку первого и второго полипептидов, содержащих шарнирную область, посредством образования дисульфидных связей, где указанная повторная сборка в описании настоящего изобретения называется рефолдингом. Рефолдинг включает связывание первого полипептида, содержащего шарнирную область, со вторым полипептидом, содержащим шарнирную область, и образование межцепьевых дисульфидных связей. Рефолдинг, также называемый в настоящем изобретении ренатурацией, проводят in vitro без добавления восстановителя.
Клетки-хозяева могут быть культивированы с применением вышеописанных методов либо в виде отдельных культур, либо в виде одной культуры. В одном из этих методов первые клетки-хозяева и вторые клетки-хозяева культивируют в одном и том же сосуде для культивирования (иногда такая культура называется здесь сокультурой или смешанной культурой). В другом методе первые и вторые клетки-хозяева культивируют в отдельных сосудах для культивирования. В одном из таких методов отдельные культуры обрабатывают отдельно и, перед разрушением клеточной мембраны, смешивают/объединяют. В другом методе отдельные культуры, перед разрушением клеточной мембраны, смешивают, а затем обрабатывают. В одном из таких методов отдельные культуры, перед разрушением клеточной мембраны, смешивают, но не обрабатывают. В одном из таких методов одну культуру, содержащую первые и вторые клетки-хозяева, обрабатывают до разрушения клеточной мембраны. В другом методе совместно культивированные клетки не обрабатывают до разрушения клеточной мембраны. Обработка клеток включает центрифугирование и ресуспендирование в соответствующем буфере (например, буфере для экстракции).
Буферы для экстракции известны и могут быть выбраны самим специалистом в этой области без излишнего экспериментирования.
Мембраны клеток-хозяев разрушают методами, известными специалистам. Такими методами являются сообщение проницаемости клеточной мембране и дезинтеграция клеточной мембраны. Сообщение проницаемости клеточной мембране означает сообщение мембране «пропускной способности», например, путем введения «дыр» без нарушения целостности всей мембраны так, чтобы клетка оставалась жизнеспособной. Другими словами, такая проницаемость обеспечивает прохождение макромолекул через клеточную мембрану и сохранение клеточной структуры на уровне, достаточном для обеспечения жизнеспособности клетки. В противоположность этому, дезинтеграция клеточной мембраны приводит к высвобождению содержимого клетки во внеклеточную среду и к гибели клетки.
Методами разрушения клеточных мембран являются, но не ограничиваются ими, ферментативный лизис, обработка ультразвуком, осмотический шок, пропускание через микрофлюидизатор, добавление EDTA, применение различных детергентов, растворителей (таких как толуол, диметилсульфоксид и т.п.), поверхностно-активных веществ (таких как Triton-X 100, Tween 20 и т.п.) и гипотонических буферов, применение методов замораживания/оттаивания, электропорация и пропускание через шаровой гомогенизатор из нержавеющей стали.
После высвобождения полипептидов, содержащих шарнирную область, из клетки (либо путем сообщения ей проницаемости, либо ее дезинтеграции), домены гетеромультимеризации инициируют связывание гетеромультимерных белков. Образование межцепьевых дисульфидных связей между связанными полипептидами, содержащими шарнирную область, достигается без добавления восстановителей. Затем полученный гетеромультимерный белок, связанный дисульфидными связями, очищают. Такой белок может быть, но необязательно, получен для исследований, а также в диагностических, терапевтических или в других целях.
V. Молекулы-мишени
Примерами молекул, на которые может быть нацелен гетеромультимерный белок согласно изобретению, являются, но не ограничиваются ими, растворимые сывороточные белки и их рецепторы, и другие мембраносвязанные белки (например, адгезины).
В другом варианте изобретения гетеромультимерный белок согласно изобретению обладает способностью связываться с одним, двумя или более цитокинами; белками, родственными цитокинам, и рецепторами цитокинов, выбранными из группы, состоящей из: BMPI, BMP2, BMP3B (GDFIO), BMP4, BMP6, BMP8, CSFI (M-CSF), CSF2 (GM-CSF), CSF3 (G-CSF), EPO, FGFI (aFGF), FGF2 (bFGF), FGF3 (int-2), FGF4 (HST), FGF5, FGF6 (HST-2), FGF7 (KGF), FGF9, FGF10, FGF11, FGF12, FGF12B, FGF14, FGF16, FGF17, FGF19, FGF20, FGF21, FGF23, IGF1, IGF2, IFNAI, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNBI, IFNG, IFNWI, FELI, FELI (EPSELON), FELI (ZETA), IL1A, IL1 B, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, IL11, IL12A, IL12B, IL13, IL14, IL15, IL16, IL17, IL17B, IL18, IL19, IL20, IL22, IL23, IL24, IL25, IL26, IL27, IL28A, IL28B, IL29, IL30, PDGFA, PDGFB, TGFA, TGFB1, TGFB2, TGFB3, LTA (TNF-β), LTB, TNF (TNF-α), TNFSF4 (лиганда OX40), TNFSF5 (лиганда CD40), TNFSF6 (FasL), TNFSF7 (лиганда CD27), TNFSF8 (лиганда CD30), TNFSF9 (лиганда 4-1BB), TNFSF10 (TRAIL), TNFSF11 (TRANCE), TNFSF12 (APO3L), TNFSF13 (April), TNFSF13B, TNFSF14 (HVEM-L), TNFSF15 (VEGI), TNFSF18, HGF (VEGFD), VEGF, VEGFB, VEGFC, ILIR1, IL1R2, IL1RL1, LL1RL2, IL2RA, IL2RB, IL2RG, IL3RA, IL4R, IL5RA, IL6R, IL7R, IL8RA, IL8RB, IL9R, IL10RA, IL10RB, IL11RA, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL15RA, IL17R, IL18R1, IL20RA, IL21R, IL22R, IL1HY1, IL1RAP, IL1RAPL1, IL1RAPL2, IL1RN, IL6ST, IL18BP, IL18RAP, IL22RA2, AIFI, HGF, LEP (лептина), PTN и THPO.
В другом варианте изобретения молекулой-мишенью является хемокин, рецептор хемокина или родственный хемокину белок, выбранные из группы, состоящей из CCLI (I-309), CCL2 (MCP-1/MCAF), CCL3 (MIP-la), CCL4 (MIP-lb), CCL5 (RANTES), CCL7 (MCP- 3), CCL8 (mcp-2), CCLH (эотаксина), CCL13 (MCP-4), CCL15 (MIP-ld), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19 (MDP-3b), CCL20 (MIP-3a), CCL21 (SLC/exodus-2), CCL22 (MDC/STC-I), CCL23 (MPIF-I), CCL24 (MPIF-2/эотаксина-2), CCL25 (TECK), CCL26 (эотаксина-3), CCL27 (CTACK/ILC), CCL28, CXCLI (GROI), CXCL2 (GRO2), CXCL3 (GR03), CXCL5 (ENA-78), CXCL6 (GCP-2), CXCL9 (MIG), CXCL10 (IP10), CXCL11 (I-TAC), CXCL12 (SDFI), CXCL13, CXCL14, CXCL16, PF4 (CXCL4), PPBP (CXCL7), CX3CL1 (SCYDI), SCYEI, XCLI (лимфотактина), XCL2 (SCM-lb), BLRI (MDR15), CCBP2 (D6/JAB61), CCRI (CKRI/HM145), CCR2 (mcp-IRB/RA), CCR3 (CKR3/CMKBR3), CCR4, CCR5 (CMKBR5/ChemR13), CCR6 (CMKBR6/CKR-L3/STRL22/DRY6), CCR7 (CKR7/EBII), CCR8 (CMKBR8/TERI/CKR-LI), CCR9 (GPR-9-6), CCRLI (VSHKI), CCRL2 (L-CCR), XCRI (GPR5/CCXCRI), CMKLRI, CMKORI (RDCI), CX3CR1 (V28), CXCR4, GPR2 (CCRIO), GPR31, GPR81 (FKSG80), CXCR3 (GPR9/CKR-L2), CXCR6 (TYMSTR/STRL33/Bonzo), HM74, IL8RA (IL8Ra), IL8RB (IL8Rb), LTB4R (GPR16), TCPIO, CKLFSF2, CKLFSF3, CKLFSF4, CKLFSF5, CKLFSF6, CKLFSF7, CKLFSF8, BDNF, C5R1, CSF3, GRCCIO (CIO), EPO, FY (DARC), GDF5, HDFIA, DL8, PRL, RGS3, RGS13, SDF2, SLIT2, TLR2, TLR4, TREMI, TREM2 и VHL.
В другом варианте изобретения гетеромультимерные белки согласно изобретению обладают способностью связываться с одной или несколькими мишенями, выбранными из группы, состоящей из: ABCFI; ACVRI; ACVRIB; ACVR2; ACVR2B; ACVRLI; AD0RA2A; агрекана; AGR2; AICDA; AIFI; AIGI; AKAPI; AKAP2; AMH; AMHR2; ANGPTI; ANGPT2; ANGPTL3; ANGPTL4; ANPEP; APC; APOCI; AR; AZGPI (цинк-α-гликопротеина); B7.1; B7.2; BAD; BAFF (BLys); BAGI; BAII; BCL2; BCL6; BDNF; BLNK; BLRI (MDR15); BMPI; BMP2; BMP3B (GDFIO); BMP4; BMP6; BMP8; BMPRIA; BMPRIB; BMPR2; BPAGI (плектина); BRCAI; C19orflO (IL27w); C3; C4A; C5; C5R1; CANTI; CASP1; CASP4; CAVI; CCBP2 (D6/JAB61); CCLI (1-309); CCLII (эотаксина); CCL13 (MCP-4); CCL15 (MIP-Id); CCL16 (HCC-4); CCL17 (TARC); CCL18 (PARC); CCL19 (MIP-3b); CCL2 (MCP-1); MCAF; CCL20 (MIP-3a); CCL21 (MTP-2); SLC; exodus-2; CCL22 (MDC/STC-I); CCL23 (MPIF-1); CCL24 (MPIF-2/эотаксина-2); CCL25 (TECK); CCL26 (эотаксина-3); CCL27 (CTACK/ILC); CCL28; CCL3 (MTP-la); CCL4 (MDP-lb); CCL5 (RANTES); CCL7 (MCP-3); CCL8 (mcp-2); CCNAI; CCNA2; CCNDI; CCNEI; CCNE2; CCRI (CKRI/HM145); CCR2 (mcp-IRB/RA); CCR3 (CKR3/CMKBR3); CCR4; CCR5 (CMKBR5/ChemR13); CCR6 (CMKBR6/CKR-L3/STRL22/DRY6); CCR7 (CKR7/EBII); CCR8 (CMKBR8/TERI/CKR-LI); CCR9 (GPR-9-6); CCRLI (VSHKI); CCRL2 (L-CCR); CD164; CD19; CDIC; CD20; CD200; CD22; CD24; CD28; CD3; CD37; CD38; CD3E; CD3G; CD3Z; CD4; CD40; CD40L; CD44; CD45RB; CD52; CD69; CD72; CD74; CD79A; CD79B; CD8; CD80; CD81; CD83; CD86; CDHI (E-кадгерина); CDH10; CDH12; CDH13; CDH18; CDH19; CDH20; CDH5; CDH7; CDH8; CDH9; CDK2; CDK3; CDK4; CDK5; CDK6; CDK7; CDK9; CDKNIA (p21Wapl/Cipl); CDKNIB (p27Kipl); CDKNIC; CDKN2A (P16INK4a); CDKN2B; CDKN2C; CDKN3; CEBPB; CERI; CHGA; CHGB; хитиназы; CHST10; CKLFSF2; CKLFSF3; CKLFSF4; CKLFSF5; CKLFSF6; CKLFSF7; CKLFSF8; CLDN3; CLDN7 (клаудина-7); CLN3; CLU (кластерина); CMKLRI; CMKORI (RDCI); CNRI; COL18A1; COLIAI; COL4A3; COL6A1; CR2; CRP; CSFI (M-CSF); CSF2 (GM-CSF); CSF3 (GCSF); CTLA4; CTNNBI (β-катенина); CTSB (катепсина B); CX3CL1 (SCYDI); CX3CR1 (V28); CXCLI (GROI); CXCL10 (IP-10); CXCLII (I-TAC/IP-9); CXCL12 (SDFI); CXCL13; CXCL14; CXCL16; CXCL2 (GRO2); CXCL3 (GRO3); CXCL5 (ENA-78/LIX); CXCL6 (GCP-2); CXCL9 (MIG); CXCR3 (GPR9/CKR-L2); CXCR4; CXCR6 (TYMSTR/STRL33/Bonzo); CYB5; CYCI; CYSLTRI; DAB2IP; DES; DKFZp451J0118; DNCLI; DPP4; E2F1; ECGFI; EDGI; EFNAI; EFNA3; EFNB2; EGF; EGFR; ELAC2; ENG; ENO1; ENO2; ENO3; EPHB4; EPO; ERBB2 (Her-2); EREG; ERK8; ESRI; ESR2; F3 (TF); FADD; FasL; FASN; FCERIA; FCER2; FCGR3A; FGF; FGFI (aFGF); FGF10; FGF11; FGF12; FGF12B; FGF13; FGF14; FGF16; FGF17; FGF18; FGF19; FGF2 (bFGF); FGF20; FGF21; FGF22; FGF23; FGF3 (int-2); FGF4 (HST); FGF5; FGF6 (HST-2); FGF7 (KGF); FGF8; FGF9; FGFR3; FIGF (VEGFD); FELI (EPSILON); FILI (ZETA); FLJ12584; FLJ25530; FLRTI (фибронектина); FLTI; FOS; FOSLI (FRA-I); FY (DARC); GABRP (GABAa); GAGEBI; GAGECI; GALNAC4S-6ST; GATA3; GDF5; GFI1; GGT1; GM-CSF; GNASI; GNRHI; GPR2 (CCRIO); GPR31; GPR44; GPR81 (FKSG80); GRCCIO (CIO); GRP; GSN (гелзолина); GSTPI; HAVCR2; HDAC4; HDAC5; HDAC7A; HDAC9; HGF; HIFIA; HDPI; гистамина и гистаминовых рецепторов; HLA-A; HLA-DRA; HM74; HMOXI; HUMCYT2A; ICEBERG; ICOSL; ID2; IFN-a; IFNAI; IFNA2; IFNA4; IFNA5; IFNA6; IFNA7; IFNB1; IFN-гамма; DFNWI; IGBPI; IGFI; IGFIR; IGF2; IGFBP2; IGFBP3; IGFBP6; IL-I; IL10; IL10RA; IL10RB; IL11; IL11RA; IL-12; IL12A; IL12B; IL12RB1; IL12RB2; IL13; IL13RA1; IL13RA2; IL14; IL15; IL15RA; IL16; IL17; IL17B; IL17C; IL17R; IL18; IL18BP; IL18R1; IL18RAP; IL19; IL1A; IL1B; ILIF10; IL1F5; IL1F6; IL1F7; IL1F8; IL1F9; IL1HYI; IL1RI; IL1R2; IL1RAP; IL1RAPL1; IL1RAPL2; IL1RL1; IL1RL2, ILIRN; IL2; IL20; IL20RA; IL21R; IL22; IL22R; IL22RA2; IL23; IL24; IL25; IL26; IL27; IL28A; IL28B; IL29; IL2RA; IL2RB; IL2RG; IL3; IL30; IL3RA; IL4; IL4R; IL5; IL5RA; IL6; IL6R; IL6ST (гликопротеина 130); EL7; EL7R; EL8; IL8RA; DL8RB; IL8RB; DL9; DL9R; DLK; INHA; INHBA; ; INSL4; IRAKI; ERAK2; ITGAI; ITGA2; ITGA3; ITGA6 (интегрина a6); ITGAV; ITGB3; ITGB4 (интегрина b4); JAGI; JAKI; JAK3; JUN; K6HF; KAII; KDR; KITLG; KLF5 (GC-бокса BP); KLF6; KLKIO; KLK12; KLK13; KLK14; KLK15; KLK3; KLK4; KLK5; KLK6; KLK9; KRT1; KRT19 (кератина 19); KRT2A; KHTHB6 (волос-специфического кератина типа H); LAMAS; LEP (лептина); Lingo-p75; Lingo-Troy; LPS; LTA (TNF-b); LTB; LTB4R (GPR16); LTB4R2; LTBR; MACMARCKS; MAG или Omgp; MAP2K7 (c-Jun); MDK; MIBI; мидкина; MEF; MIP-2; MKI67; (Ki-67); MMP2; MMP9; MS4A1; MSMB; MT3 (металлотионектина-III); MTSSI; MUCI (муцина); MYC; MYD88; NCK2; нейрокана; NFKBI; NFKB2; NGFB (NGF); NGFR; NgR-Lingo; NgR-Nogo66 (Nogo); NgR-p75; NgR-Troy; NMEI (NM23A); N0X5; NPPB; NROBI; NR0B2; NRIDI; NR1D2; NR1H2; NR1H3; NR1H4; NR1I2; NR1I3; NR2C1; NR2C2; NR2E1; NR2E3; NR2F1; NR2F2; NR2F6; NR3C1; NR3C2; NR4A1; NR4A2; NR4A3; NR5A1; NR5A2; NR6A1; NRPI; NRP2; NT5E; NTN4; ODZI; OPRDI; P2RX7; PAP; PARTI; PATE; PAWR; PCA3; PCNA; PDGFA; PDGFB; PECAMI; PF4 (CXCL4); PGF; PGR; фосфокана; PIAS2; PIK3CG; PLAU (uPA); PLG; PLXDCI; PPBP (CXCL7); PPID; PRI; PRKCQ; PRKDI; PRL; PROC; PROK2; PSAP; PSCA; PTAFR; PTEN; PTGS2 (COX-2); PTN; RAC2 (p21Rac2); RARB; RGSI; RGS13; RGS3; RNFIIO (ZNF144); ROBO2; S100A2; SCGB D2 (липофилина B); SCGB2A1 (маммаглобина 2); SCGB2A2 (маммаглобина 1); SCYEI (эндотелиального моноцит-активирующего цитокина); SDF2; SERPINAI; SERPINA3; SERP1NB5 (маспина); SERPINEI (PAI-I); SERPDMF1; SHBG; SLA2; SLC2A2; SLC33A1; SLC43A1; SLIT2; SPPI; SPRRIB (Sprl); ST6GAL1; STABI; STAT6; STEAP; STEAP2; TB4R2; TBX21; TCPIO; TDGFI; TEK; TGFA; TGFBI; TGFBIII; TGFB2; TGFB3; TGFBI; TGFBRI; TGFBR2; TGFBR3; THIL; THBSI (тромбоспондина-1); THBS2; THBS4; THPO; TIE (Tie-1); TMP3; тканевого фактора; TLRIO; TLR2; TLR3; TLR4; TLR5; TLR6; TLR7; TLR8; TLR9; TNF; TNF-a; TNFAEP2 (B94); TNFAIP3; TNFRSFIIA; TNFRSFIA; TNFRSFIB; TNFRSF21; TNFRSF5; TNFRSF6 (Fas); TNFRSF7; TNFRSF8; TNFRSF9; TNFSFIO (TRAIL); TNFSF11 (TRANCE); TNFSF12 (APO3L); TNFSF13 (April); TNFSF13B; TNFSF14 (HVEM-L); TNFSF15 (VEGI); TNFSF18; TNFSF4 (лиганда OX40); TNFSF5 (лиганда CD40); TNFSF6 (FasL); TNFSF7 (лиганда CD27); TNFSF8 (лиганда CD30); TNFSF9 (4-1 BB-лиганда); TOLLIP; ловушко-подобных рецепторов; TOP2A (топоизомеразы Ea); TP53; TPMI; TPM2; TRADD; TRAFI; TRAF2; TRAF3; TRAF4; TRAF5; TRAF6; TREMI; TREM2; TRPC6; TSLP; TWEAK; VEGF; VEGFB; VEGFC; версикана; VHL C5; VLA-4; XCLI (лимфотактина); XCL2 (SCM-lb); XCRI(GPR5/CCXCRI); YYI; и ZFPM2.
Предпочтительными молекулами-мишенями для антител согласно изобретению являются белки CD, такие как члены CD3, CD4, CD8, CD16, CD19, CD20, CD34; CD64, CD200 семейства рецепторов ErbB, таких как рецептор EGF, рецептор HER2, HER3 или HER4; клеточно-адгезивные молекулы, такие как LFA-1, Mad, p150.95, VLA-4, ICAM-1, VCAM, интегрин альфа4/бета7, и интегрин альфаv/бета3, включая их альфа или бета субъединицы (например, анти-CD11a, анти-CD18 или анти-CD11b антитела); факторы роста, такие как VEGF-A, VEGF-C; тканевый фактор (TF); альфа-интерферон (альфа-IFN); TNFальфа, интерлейкин, такой как IL-1-бета, IL-3, IL-4, IL-5, IL-8, IL-9, IL-13, IL17A/F, IL-18, IL-13Rальфа1, IL13Rальфа2, IL-4R, IL-5R, IL-9R, IgE; антигены группы крови; рецептор flk2/flt3; рецептор (OB) ожирения; рецептор mpl; CTLA-4; RANKL, RANK, белок RSVF, белок C и т.п.
В одном из вариантов изобретения гетеромультимерные белки согласно изобретению связываются с белком, родственным рецептору липопротеина низкой плотности (LRP)-1 или LRP-8, или с рецептором трансферрина, и по меньшей мере с одной мишенью, выбранной из группы, состоящей из 1) бета-секретазы (BACE1 или BACE2), 2) альфа-секретазы, 3) гамма-секретазы, 4) тау- секретазы, 5) белка-предшественника амилоида (APP), 6) рецептора гибели 6 (DR6), 7) амилоидного бета-пептида, 8) альфа-синуклеина, 9) паркина, 10) хунтингтина, 11) p75 NTR и 12) каспазы-6.
В одном из вариантов изобретения гетеромультимерные белки согласно изобретению связываются по меньшей мере с двумя молекулами-мишенями, выбранными из группы, состоящей из IL-1 альфа и IL-1-бета, IL-12 и IL-18; IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-5 и IL-4; IL-13 и IL-1-бета; IL-13 и IL-25; IL-13 и TARC; IL-13 и MDC; IL-13 и MEF; IL-13 и TGF-β; IL-13 и агониста LHR; IL-12 и TWEAK, IL-13 и CL25; IL-13 и SPRR2a; IL-13 и SPRR2b; IL-13 и ADAM8, IL-13 и PED2, IL17A и IL17F, CD3 и CD19, CD138 и CD20; CD138 и CD40; CD19 и CD20; CD20 и CD3; CD38 и CD138; CD38 и CD20; CD38 и CD40; CD40 и CD20; CD-8 и IL-6; CD20 и BR3, TNFальфа и TGF-бета, TNFальфа и IL-1бета; TNFальфа и IL-2, TNF альфа и IL-3, TNFальфа и IL-4, TNFальфа и IL-5, TNFальфа и IL6, TNFальфа и IL8, TNFальфа и IL-9, TNFальфа и IL-10, TNFальфа и IL-11, TNFальфа и IL-12, TNFальфа и IL-13, TNFальфа и IL-14, TNFальфа и IL-15, TNFальфа и IL-16, TNFальфа и IL-17, TNFальфа и IL-18, TNFальфа и IL-19, TNFальфа и IL-20, TNFальфа и IL-23, TNFальфа и IFNальфа, TNFальфа и CD4, TNFальфа и VEGF, TNFальфа и MIF, TNFальфа и ICAM-1, TNFальфа и PGE4, TNFальфа и PEG2, TNFальфа и лиганда RANK, TNFальфа и Te38; TNFальфа и BAFF; TNFальфа и CD22; TNFальфа и CTLA-4; TNFальфа и GP130; TNFa и IL-12p40; VEGF и HER2, VEGF-A и HER2, VEGF-A и PDGF, HER1 и HER2, VEGF-A и VEGF-C, VEGF-C и VEGF-D, HER2 и DR5, VEGF и IL-8, VEGF и MET, VEGFR и рецептора MET, VEGFR и EGFR, HER2 и CD64, HER2 и CD3, HER2 и CD16, HER2 и HER3; EGFR (HER1) и HER2, EGFR и HER3, EGFR и HER4, IL-13 и CD40L, IL4 и CD40L, TNFR1 и IL-1R, TNFR1 и IL-6R и TNFR1 и IL-18R, EpCAM и CD3, MAPG и CD28, EGFR и CD64, CSPGs и RGM A; CTLA-4 и BTNO2; IGF1 и IGF2; IGF1/2 и Erb2B; MAG и RGM A; NgR и RGM A; NogoA и RGM A; OMGp и RGM A; PDL-I и CTLA-4; и RGM A и RGM B.
Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, могут быть использованы в качестве иммуногенов для получения антител. Для трансмембранных молекул, таких как рецепторы, фрагменты этих рецептоов (например, внеклеточный домен рецептора) могут быть использованы в качестве иммуногена. Альтернативно, в качестве иммуногена могут быть использованы клетки, экспрессирующие трансмембранную молекулу. Такие клетки могут происходить от природного источника (например, раковых клеточных линий), либо они могут быть трансформированы рекомбинантными методами для экспрессии трансмембранной молекулы. Специалистам известны и другие антигены и их формы, подходящие для получения антител.
VI. Анализы на активность
Гетеромультимерные белки согласно изобретению могут быть охарактеризованы на их физические/химические свойства и биологические функции с помощью различных анализов, известных специалистам.
Очищенные гетеромультимерные белки могут быть дополнительно охарактеризованы путем проведения серии анализов, включая, но не ограничиваясь ими, N-концевое секвенирование, аминокислотный анализ, эксклюзионную жидкостную хроматографию высокого давления (ЖХВД), проводимую в неденатурирующих условиях, масс-спектрометрию, ионообменную хроматографию и гидролиз папаином.
В некоторых вариантах изобретения иммуноглобулины, полученные, как описано в настоящей заявке, анализируют на их биологическую активность. В некоторых вариантах изобретения иммуноглобулины согласно изобретению тестируют на их антигенсвязывающую активность. Анализами на связывание с антигеном, известными специалистам и описанными в настоящей заявке, являются, но не ограничиваются ими, любые анализы на прямое или конкурентное связывание, проводимые с применением таких методов, как вестерн-блот-анализы, радиоиммуноанализы, ELISA (твердофазный иммуноферментный анализ), «сэндвич»-иммуноанализы, анализы методом иммунопреципитации, флуоресцентные иммуноанализы и иммуноанализы, осуществляемые с использованием белка A. Репрезентативный анализ на связывание с антигеном описан ниже в разделе «Примеры».
В одном из вариантов настоящее изобретение относится к модифицированному антителу, которое обладает некоторыми, но не всеми эффекторными функциями, что делает его желаемым кандидатом на применение во многих целях, а именно в том случае, когда важным фактором является время полужизни антитела in vivo, а некоторые эффекторные функции (такие как комплемент и ADCC) либо являются необязательными, либо нежелательными. В некоторых вариантах изобретения определяют активность Fc продуцируемого гетеромультимерного белка для гарантии того, что будут сохраняться лишь желаемые свойства. Для подтверждения снижения/истощения CDC- и/или ADCC-активности могут быть проведены анализы на цитотоксичность in vitro и/или in vivo. Так, например, для гарантии того, что данный гетеромультимерный белок не будет связываться с FcγR (а следовательно, вероятно, не будет обладать ADCC-активностью), но будет сохранять способность связываться с FcRn, могут быть проведены анализы на связывание с Fc-рецептором (FcR). Первичные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках систематизирована в таблице 3 на странице 464 публикации Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Пример in vitro анализа для оценки ADCC-активности представляющей интерес молекулы описан в патентах США №№ 5500362 или 5821337. Подходящими эффекторными клетками для проведения таких анализов являются мононуклеарные клетки периферической крови (МКПК) и природные клетки-киллеры (NK). Альтернативно или дополнительно, ADCC-активность представляющей интерес молекулы может быть оценена in vivo, например, у животного-модели, такой как модель, описанная в публикации Clynes et al. PNAS (USA) 95:652-656 (1998). Для подтверждения того, что данное антитело неспособно связываться с C1q, а поэтому оно не обладает CDC-активностью, могут быть также проведены анализы на связывание с C1q. Для анализа активации комплемента может быть проведен CDC-анализ, например, анализ, описанный в публикации Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Оценка связывания с FcRn, а также клиренса/времени полужизни in vivo может быть также осуществлена методами, известными специалистам.
VII. Конъюгированные белки
Настоящее изобретение также относится к конъюгированным белкам, таким как конъюгированные антитела или иммуноконъюгаты (например, конъюгаты «антитело-лекарственное средство» или «ADC»), содержащие любой из описанных здесь гетеромультимерных белков (например, антитело, полученное описанными здесь методами), где одна из константных областей легкой цепи или тяжелой цепи конъюгирована с химической молекулой, такой как краситель или цитотоксический агент, такой как химиотерапевтическое средство, лекарственное средство, рост-ингибирующий агент, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или их фрагменты) или радиоактивный изотоп (то есть, радиоактивный конъюгат). В частности, как описано в настоящей заявке, применение доменов гетеромультимеризации позволяет конструировать антитела, содержащие две различных тяжелых цепи (HC1 и HC2), а также две различных легких цепи (LC1 и LC2). Иммуноконъюгат, сконструированный описанными здесь методами, может содержать цитотоксический агент, конъюгированный с константной областью только одной из тяжелых цепей (HC1 или HC2) или только одной из легких цепей (LC1 или LC2). Кроме того, поскольку иммуноконъюгат может содержать цитотоксический агент, связанный только с одной тяжелой или легкой цепью, то количество цитотоксического агента, вводимого индивидууму, может быть снижено по сравнению с количеством вводимого антитела, имеющего цитотоксический агент, связанный как с тяжелой, так и с легкой цепями. Снижение количества цитотоксического агента, вводимого индивидууму, будет ограничивать возможность возникновения негативных побочных эффектов, ассоциированных с действием такого цитотоксического агента.
Использование конъюгатов «антитело-лекарственное средство» в целях локальной доставки цитотоксических или цитостатических агентов, то есть лекарственных средств для уничтожения или подавления роста опухолевых клеток при лечении рака (Syrigos and Epenetos, Anticancer Research 19:605-614 (1999); Niculescu-Duvaz and Springer, Adv. Drg. Del. Rev. 26:151-172 (1997); патент США № 4975278), позволяет осуществлять направленную доставку лекарственного средства в опухоли и обеспечивать их аккумуляцию внутри клеток, тогда как системное введение этих неконъюгированных лекарственных средств может приводить к продуцированию уровней токсичности, которые являются неприемлемыми для нормальных клеток и недостаточными для уничтожения опухолевых клеток (Baldwin et al., 1986, Lancet pp. (Mar. 15, 1986):603-05; Thorpe, 1985, “Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review” in Monoclonal Antobodies 84:Biological And Clinical Applications, A. Pinchera et al. (eds.), pp. 475-506). Таким образом, необходимо максимально повысить эффективность и снизить токсичность до минимума. Поликлональные антитела и моноклональные антитела, как сообщалось, могут оказаться подходящими для их применения в указанных стратегиях (Rowland et al., Cancer Immunol. Immunother. 21:183-187 (1986)). Лекарственными средствами, используемыми в таких методах, являются дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986), см. выше). Токсинами, используемыми в конъюгатах «антитело-токсин», являются бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, и низкомолекулярные токсины, такие как гельданамицин (Mandler et al., Jour. of the Nat. Cancer Inst. 92(19):1573-1581 (2000); Mandler et al., Bioorganic & Med. Chem. Letters 10:1025-1028 (2000); Mandler et al., Bioconjugate Chem. 13:786-791 (2002)), майтанзиноиды (EP 1391213; Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996)), и калихеамицин (Lode et al., Cancer Res. 58:2928 (1998); Hinman et al., Cancer Res. 53:3336-3342 (1993)). Токсины могут оказывать влияние на цитотоксические и цитостатические механизмы, включая связывание с тубулином, связывание с ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства, при их конъюгировании с крупными антителами или лигандами белков-рецепторов, имеют тенденцию к потере или уменьшению активности.
Химиотерапевтические средства, используемые для получения указанных иммуноконъюгатов, описаны в настоящей заявке (например, см. выше). Ферментативно активными токсинами и их фрагментами, которые могут быть использованы для этих целей, являются А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (от Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См, например, заявку WO 93/21232 опубликованную 28 октября 1993. Для продуцирования радиоактивно конъюгированных антител могут быть использованы различные радионуклиды. Примерами таких радионуклидов являются 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антитела и цитотоксического агента получают с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Так, например, иммунотоксин рицин может быть получен, как описано в публикации Vitetta et al. Science, 238:1098 (1987). 14С-меченная 1-изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (МХ-DTPA) является репрезентативным хелатообразующим агентом для конъюгирования радионуклида с антителом. См., например, WO 94/11026.
В настоящем изобретении также рассматриваются конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, майтанзиноиды, доластатины, ауристатины, трихотецен и СС1065, и производные этих токсинов, обладающие токсической активностью.
i. Майтанзин и майтанзиноиды
В некоторых вариантах изобретения иммуноконъюгат содержит антитело (полноразмерное или фрагменты), конъюгированное с одной или несколькими молекулами майтанзиноида.
Майтанзиноиды представляют собой митотические ингибиторы, которые действуют посредством ингибирования полимеризации тубулина. Майтанзин был впервые выделен у восточно-африканской землеройки Maytenus serrata (патент США № 3896111). Затем было обнаружено, что некоторые микробы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры С-3-майтанзинола (патент США № 4151042). Синтетический майтанзинол и его производные и аналоги описаны, например, в патентах США №№ 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Молекулы майтанзиноидных лекарственных средств являются привлекательными молекулами в конъюгатах «антитело-лекарственное средство», поскольку они (i) могут быть относительно легко получены путем ферментации или химической модификации или дериватизации продуктов ферментации, (ii) являются пригодными для дериватизации функциональными группами, подходящими для конъюгирования посредством присоединения недисульфидных линкеров к антителам, (iii) являются стабильными в плазме и (iv) являются эффективными против различных опухолевых клеточных линий.
Иммуноконъюгаты, содержащие майтанзиноиды, способы их получения и их терапевтическое применение описаны, например в патентах США №№ 5208020, 5416064 и в Европейском патенте ЕР 0425235В1, которые во всей своей полноте вводятся в настоящую заявку посредством ссылки. В публикации Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описаны иммуноконъюгаты, содержащие сконструированный майтанзиноид DM1, связанный с моноклональным антителом C242, направленным против рака прямой и ободочной кишки человека. Было обнаружено, что этот конъюгат является в высокой степени токсичным по отношению к культивированным клеткам рака ободочной кишки, и обладает активностью, подавляющей рост опухоли в анализе in vivo. В публикации Chari et al., Cancer Research 52:127-131 (1992) описаны иммуноконъюгаты, в которых майтанзиноид был конъюгирован посредством дисульфидного линкера с мышиным антителом A7, связывающимся с антигеном на клеточных линиях рака ободочной кишки человека или с другим мышиным моноклональным антителом TA.1, которое связывается с онкогеном HER-2/neu. Цитотоксичность конъюгата TA.1-майтанзиноид была протестирована in vitro на клеточной линии рака молочной железы человека SK-BR-3, которая экспрессирует 3×105 поверхностных антигенов HER-2 на клетку. Этот конъюгат лекарственного средства достигает степени цитотоксичности, аналогичной степени цитотоксичности, которой обладает свободное майтанзиноидное лекарственное средство, и эта цитотоксичность может повышаться при увеличении числа майтанзиноидных молекул на молекулу антитела. Конъюгат «A7- майтанзиноид» обнаруживал низкую системную цитотоксичность у мышей.
Конъюгаты «антитело-майтанзиноид» получают путем химического связывания антитела с молекулой майтанзиноида, где указанное связывание не приводит к значительному снижению биологической активности антитела или молекулы майтанзиноида. См., например, патент США № 5208020 (который во всей своей полноте вводится в настоящее описание посредством ссылки). В среднем, 3-4 молекулы майтанзиноидов, конъюгированных с одной молекулой антитела, обнаруживают эффективность в отношении повышения цитотоксичнеского действия на клетки-мишени, но при этом не оказывают негативного воздействия на функцию или растворимость антитела, хотя предполагается, что даже одна молекула токсина/антитела должна усиливать цитотоксичность по сравнению с «оголенной» молекулой антитела. Майтанзиноиды хорошо известны специалистам и могут быть синтезированы известными методами, либо они могут быть выделены из природных источников. Подходящие майтанзиноиды описаны, например, в патенте США № 5208020 и в других патентах и в непатентных публикациях, описанных выше. Предпочтительными майтанзиноидами являются майтанзинол и аналоги майтанзинола, имеющие модификации в ароматическом кольце или в других положениях молекулы майтанзинола, такие как различные сложные эфиры майтанзинола.
Для создания конъюгатов «антитело-майтанзиноид» может быть использовано множество линкерных групп, известных специалистам, включая, например, группы, описанные в патенте США № 5208020 или в Европейском патенте ЕР 0425235В1, в публикации Chari et al., Cancer Research 52:127-131 (1992) и в заявке на патент США 2005/0169933, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Конъюгаты «антитело-майтанзиноид», содержащие линкерный компонент SMCC, могут быть получены, как описано в заявке на патент США 2005/0169933. Линкерными группами являются дисульфидные группы, тиоэфирные группы, группы, чувствительные к воздействию кислоты, фотохимически неустойчивые группы, группы, чувствительные к действию пептидазы, или группы, чувствительные к действию эстеразы, описанные в вышеупомянутых патентах, однако, предпочтительными являются дисульфидные или тиоэфирные группы. Дополнительные линкерные группы описаны и проиллюстрированы в настоящей заявке.
Конъюгаты «антитело-майтанзиноид» могут быть получены с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительными связывающими агентами для создания дисульфидной связи являются N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 (1978) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP).
Линкер может быть присоединен к молекуле майтанзиноида в различных положениях, в зависимости от типа связи. Так, например, сложноэфирная связь может быть образована посредством реакции с гидроксильной группой стандартными методами связывания. Такая реакция может осуществляться в положении С-3, имеющем гидроксильную группу, в положении С-14, модифицированном гидроксиметилом, в положении С-15, модифицированном гидроксильной группой, и в положении С-20, имеющем гидроксильную группу. В предпочтительном варианте изобретения указанная связь образуется в положении С-3 майтанзинола или его аналога.
ii. Ауристатины и доластатины
В некоторых вариантах изобретения иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с доластатином или с пептидными аналогами доластатина и их производными, например, с ауристатинами (патенты США №№ 5635483 и 5780588). Было обнаружено, что доластатины и ауристатины негативно влияют на динамику образования микротрубочек, гидролиз GTP и деление ядер и клеток (Woyke et al. Antimicrob. Agents and Chemother. 45(12):3580-3584 (2001)), и обладают противораковой (патент США 5663149) и противогрибковой активностью (Pettit et al. Antimicrob. Agents Chemother. 42:2961-2965 (1998)). Молекулы доластатиновых или ауристатиновых лекарственных средств могут быть присоединены к антителу у N-(амино)-конца или у С-(карбокси)-конца молекулы пептидного лекарственного средства (WO 02/088172).
Репрезентативными вариантами ауристатина являются молекулы лекарственного средства, содержащие присоединенный к N-концу монометилауристатин, DE и DF, как описано в публикации «Monomethylvaline Compounds Capable of Conjugation to Ligands», в публикации заявки на патент США № 2005/0238649, и указанные публикации во всей своей полноте вводятся в настоящее описание посредством ссылки.
Обычно пептидные молекулы лекарственных средств могут быть получены посредством образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, методом синтеза в растворе (см., E. Schröder and K. Lübke, «The Peptides» volume 1, pp. 76-136, 1965, Academic Press), хорошо известным специалистам в области пептидного синтеза. Молекулы ауристатинового/доластатинового лекарственного средства могут быть получены методами, описанными в патентах США №№ 5635483 и 5780588; Pettit et al., J. Nat. Prod. 44:482-485 (1981); Pettit et al., Anti-Cancer Drug Design 13:47-66 (1998); Poncet, Curr. Pharm. Des. 5:139-162 (1999); и Pettit, Fortschr. Chem. Org. Naturst. 70:1-79 (1997). См. также Doronina, Nat. Biotechnol. 21 (7):778-784 (2003); и публикацию «Monomethylvaline Compounds Capable of Conjugation to Ligands», публикацию заявки на патент США № 2005/0238649, и указанные публикации во всей своей полноте вводятся в настоящее описание посредством ссылки (где описаны, например, линкеры и методы получения монометилвалиновых соединений, таких как MMAE и MMAF, конъюгированные с линкерами).
iii. Калихеамицин
В других вариантах изобретения иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с одной или несколькими молекулами калихеамицина. Антибиотики семейства калихеамицинов способны продуцировать двухцепочечные ДНК-разрывы в субпикомолярных концентрациях. Описание получения конъюгатов семейства калихеамицинов можно найти в патентах США №№ 5712354, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296 (все патенты принадлежат компании American Cyanamid Company). Структурными аналогами калихеамицина, которые могут быть использованы в этих целях, являются, но не ограничиваются ими, γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θ1I (см. Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и вышеупомянутые патенты США, принадлежащие компании American Cyanamid). Другим противоопухолевым лекарственным средством, с которым может быть конъюгировано антитело, является средство QFA, которое представляет собой антифолат. Калихеамицин и QFA имеют внутриклеточные активные сайты и с трудом проходят через плазматическую мембрану. Поэтому поглощение этих агентов клетками путем интернализации, опосредуемой антителом, приводит к значительному усилению их цитотоксических эффектов.
iv. Другие цитотоксические средства
Другими противоопухолевыми средствами, которые могут быть конъюгированы с антителами согласно изобретению или получены описанными здесь методами, являются BCNU, стрептозоцин, винкристин и 5-фторурацил, семейство агентов, известных под общим названием комплекс LL-Е33288, описанный в патентах США №№ 5053394 и 5770710, а также эсперамицины (патент США № 5877296).
Ферментативно активными токсинами и их фрагментами, которые могут быть использованы в этих целях, являются А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (от Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (см., например, заявку WO 93/21232, опубликованную 28 октября 1993).
В настоящем изобретении также рассматривается иммуноконъюгат, образуемый антителом и соединением, обладающим нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКазой).
Для селективной деструкции опухоли, антитело может быть сконструировано так, чтобы оно содержало высокорадиоактивный атом. Для продуцирования радиоактивно конъюгированных антител могут быть использованы различные радиоактивные изотопы. Примерами таких радионуклидов являются 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32Р, 212Pb и радиоактивные изотопы Lu. Если указанный конъюгат используется для детекции, то он может содержать радиоактивный атом для сцинтиграфических исследований, например, 99mTc или 123I, или спин-метку для визуализации методом ядерного магнитного резонанса (ЯМР) (известной также как МР-визуализация, МРВ), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть включены в конъюгат известными методами. Так, например, пептид может быть синтезирован биологическими методами, либо он может быть синтезирован методом химического синтеза аминокислот с использованием подходящих аминокислотных предшественников, включающих, например, фтор-19 вместо водорода. Такие метки, как 99mTc или 123I, 186Re, 188Re и 111In, могут быть присоединены посредством цистеинового остатка пептида. Иттрий-90 может быть присоединен посредством лизинового остатка. Для введения йода-123 может быть применен метод IODOGEN (Fraker et al. Biochem. Biophys. Res. Commun. 80:49-57 (1978)). Другие методы подробно описаны в публикации «Monoclonal Antibodies in Immunoscintigraphy» (Chatal, CRC Press 1989).
Конъюгаты, содержащие антитело и цитотоксический агент, могут быть получены с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Так, например, иммунотоксин рицин может быть получен, как описано в публикации Vitetta et al. Science, 238:1098 (1987). 14С-меченная 1-изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (МХ-DTPA) является репрезентативным хелатообразующим агентом для конъюгирования радионуклеотида с антителом. См., например, WO 94/11026. Линкером может быть «отщепляемый линкер», облегчающий высвобождение цитотоксического лекарственного средства в клетку. Так, например, могут быть использованы линкеры, чувствительные к воздействию кислоты; линкеры, чувствительные к действию пептидазы; фотохимически неустойчивые линкеры; диметиловые линкеры или дисульфид-содержащие линкеры (Chari et al., Cancer Research 52:127-131 (1992), патент США № 5208020).
Короче говоря, рассматриваемыми соединениями согласно изобретению являются, но не ограничиваются ими: ADC, полученные с использованием нижеследующих перекрестно-сшивающих реагентов, таких как BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, поставляются Pierce Biotechnology, Inc., Rockford, IL., U.S.A; см. страницы 467-498, 2003-2004 Applications Handbook and Catalog.
v. Получение конъюгированных антител
В конъюгированных антителах согласно изобретению, антитело конъюгировано с одной или несколькими молекулами (например, молекулами лекарственного средства), например, примерно с 1-20 молекулами на антитело, необязательно посредством линкера. Конъюгированные антитела могут быть получены несколькими способами с применением реакций органического синтеза, условий и реагентов, известных специалистам, включая: (1) реакцию взаимодействия нуклеофильной группы антитела с двухвалентным линкерным реагентом посредством ковалентной связи, с последующей реакцией взаимодействия с представляющей интерес молекулой; и (2) реакцию взаимодействия нуклеофильной группы молекулы с двухвалентным линкерным реагентом посредством ковалентной связи, с последующей реакцией взаимодействия с нуклеофильной группой антитела. Дополнительные методы получения конъюгированных антител описаны в настоящей заявке.
Линкерный реагент может состоять из одного или более линкерных компонентов. Репрезентативными линкерными компонентами являются 6-малеимидокапроил («MC»), малеимидопропаноил («MP»), валин-цитруллин («val-cit»), аланин-фенилаланин («ala-phe»), п-аминобензилоксикарбонил («PAB»), N-сукцинимидил-4-(2-пиридилтио)пентаноат («SPP»), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат («SMCC») и N-сукцинимидил-(4-йодацетил)аминобензоат («SIAB»). См. также публикацию «Monomethylvaline Compounds Capable of Conjugation to Ligands», публикацию заявки на патент США № 2005/0238649, и указанные публикации во всей своей полноте вводятся в настоящее описание посредством ссылки.
В некоторых вариантах изобретения линкер может содержать аминокислотные остатки. Репрезентативными аминокислотными линкерными компонентами являются дипептид, трипептид, тетрапептид или пентапептид. Репрезентативными дипептидами являются валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Репрезентативными трипептидами являются глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотными остатками, которые содержатся в аминокислотном линкерном компоненте, являются природные аминокислотные остатки, а также небольшие аминокислоты и неприродные аминокислотные аналоги, такие как цитруллин. Аминокислотные линкерные компоненты могут быть сконструированы и оптимизированы по их селективности в отношении ферментативного расщепления конкретными ферментами, например, опухоль-ассоциированной протеазой, катепсином В, C и D, или плазминовой протеазой.
Нуклеофильными группами, присутствующими на антителах, являются, но не ограничиваются ими: (i) N-концевые аминогруппы, (ii) аминогруппы боковой цепи, например, лизина, (iii) тиоловые группы боковой цепи, например, цистеина, и (iv) гидроксильные или аминогруппы сахаров, где указанное антитело является гликозилированным. Аминогруппы, тиоловые группы и гидроксильные группы являются нуклеофильными и могут подвергаться реакции взаимодействия с образованием ковалентных связей с электрофильными группами на линкерных молекулах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как NHS-эфиры, HOBt-эфиры, галогенформиаты и галогенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы. Некоторые антитела имеют восстанавливаемые межцепьевые дисульфиды, то есть цистеиновые мостики. Для конъюгирования с линкерными реагентами, антитела могут быть сделаны реакционноспособными путем их обработки восстановителем, таким как DTT (дитиотреитол). Таким образом, теоретически, каждый цистеиновый мостик может образовывать два реакционноспособных тиоловых нуклеофила. В антитела могут быть введены дополнительные нуклеофильные группы посредством реакции взаимодействия лизинов с 2-иминотиоланом (реагентом Траута), что будет приводить к превращению амина в тиол. Реакционноспособные тиоловые группы могут быть включены в антитело (или его фрагмент) путем введения одного, двух, трех, четырех или более цистеиновых остатков (например, получения мутантных антител, содержащих один или несколько неприродных цистеиновых аминокислотных остатков).
Конъюгированные антитела согласно изобретению могут быть также получены путем модификации антитела посредством введения электрофильных групп, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или на лекарственном средстве или на другой молекуле. Сахара гликозилированных антител могут быть окислены, например, перйодатными окислителями с образованием альдегидных или кетоновых групп, которые могут реагировать с аминогруппой линкерных реагентов или лекарственного средства или других молекул. Полученные иминовые группы шиффова основания могут образовывать стабильную связь, либо они могут быть восстановлены, например, борогидридными реагентами с образованием стабильных аминовых связей. В одном из вариантов изобретения реакция взаимодействия углеводной части гликозилированного антитела с галактозооксидазой или с метаперйодатом натрия может приводить к образованию карбонильных (альдегидных и кетоновых) групп в белке, которые могут реагировать с соответствующими группами на лекарственном средстве или на другой молекуле (Hermanson, Bioconjugate Techniques). В другом варианте изобретения белки, содержащие N-концевые сериновые или треониновые остатки, могут реагировать с метаперйодатом натрия с образованием альдегида вместо первой аминокислоты (Geoghegan & Stroh, Bioconjugate Chem. 3:138-146 (1992); патент США № 5362852). Такой альдегид может взаимодействовать с молекулой лекарственного средства или с линкерным нуклеофилом.
Аналогичным образом, нуклеофильными группами на молекуле (такой как молекула лекарственного средства) являются, но не ограничиваются ими, аминогруппы, тиольные, гидроксильные, гидразидные, оксимовые, гидразиновые, тиосемикарбазоновые, гидразинкарбоксилатные и арилгидразидные группы, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных молекулах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как NHS-эфиры, HOBt-эфиры, галогенформиаты и галегенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; и (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Альтернативно, слитый белок, содержащий антитело и цитотоксический агент, может быть получен, например, рекомбинантными методами или методом пептидного синтеза. ДНК по всей своей длине может содержать соответствующие области, кодирующие две части конъюгата, либо смежные друг с другом, либо разделенные областью, кодирующей линкерный пептид, который не оказывает негативного влияния на желаемые свойства данного конъюгата. В еще одном варианте изобретения указанное антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) для его предварительного нацеливания на опухоль, где указанный конъюгат «антитело-рецептор» вводят индивидууму с последующим удалением несвязанного конъюгата из кровотока с использованием агента для клиренса, а затем вводят “лиганд” (например, авидин), конъюгированный с цитотоксическим агентом (например, радионуклеотидом).
VIII. Применение
Описанные здесь способы могут быть применены для промышленного получения гетеромультимерных белков. Способы согласно изобретению позволяют облегчить работу, затрачиваемую на осуществление двух отдельных процедур ферментации и выделения, поскольку проведение двух отдельных процедур ферментации связано с техническими трудностями. Кроме того, отсутствие стадий гибридизации и стадий проведения окислительно-восстановительных реакций, которые присутствовали в применяемых ранее методах, позволяет увеличить выходы и снизить трудоемкость проводимых ранее методов и затраты на их осуществление.
Описанные здесь гетеромультимерные белки могут быть использованы, например, в методах терапии in vitro, ex vivo и in vivo. Настоящее изобретение относится к различным методам, проводимым с использованием одной или нескольких из этих молекул. В определенных патологических условиях может оказаться необходимым и/или желательным использование гетеромультимерных белков, например, мультиспецифических антител. Настоящее изобретение относится к указанным гетеромультимерным белкам, которые могут быть использованы в различных целях, например, в качестве терапевтических, профилактических и диагностических средств. Так, например, настоящее изобретение относится к способам лечения заболевания, где указанные способы включают введение индивидууму, нуждающемуся в таком лечении, гетеромультимерного белка согласно изобретению, и тем самым проводят лечение заболевания у указанного индивидуума. Любой из описанных здесь гетеромультимерных белков согласно изобретению может быть использован в описанных здесь методах терапии (или профилактики или диагностики).
Так, например, если гетеромультимерный белок является поливалентным, то его ценным преимуществом является повышенная авидность указанного белка по отношению к антигену. Нормальные антитела IgG, помимо присущей им высокой аффинности своего связывающего фрагмента (то есть, Fab) по отношению к основному антигену, также обладают эффектом авидности, который заключается в повышении степени их связывания с антигенами благодаря их двухвалентному связыванию с мишенями.
Гетеромультимерныый белок, направленный против двух отдельных эпитопов, присутствующих на одной и той же молекуле антигена, может не только иметь преимущество, заключающееся в повышенной авидности связывания (благодаря двухвалентному связыванию), но также приобретать новые свойства, которые не ассоциируются с любым из родительских антител. Таким образом, гетеромультимерные белки согласно изобретению могут быть использованы, например, для блокирования взаимодействий «рецептор-лиганд».
Описанные здесь гетеромультимерные белки также могут быть использованы в целях одновременного блокирования путей передачи сигнала двух мишеней с одной молекулой.
IX. Терапевтическое применение
Описанные здесь гетеромультимерные белки, такие как антитела и их фрагменты (например, антитело и/или его фрагмент, полученные описанными здесь методами), могут быть использованы в терапевтических целях. Так, например, такие гетеромультимерные белки могут быть использованы для лечения опухолей, включая предраковые, неметастазирующие, метастазирующие и раковые опухоли (например, рак на ранней стадии), для лечения аллергических или воспалительных расстройств, или для лечения аутоиммунного заболевания, или для лечения индивидуума с риском развития у него рака (например, рака молочной железы, рака прямой и ободочной кишки, рака легких, почечноклеточной карциномы, глиомы или рака яичника), аллергического или воспалительного расстройства или аутоиммунного заболевания.
Термин «рак» включает группу пролиферативных расстройств, включая, но не ограничиваясь ими, предраковые опухоли, доброкачественные опухоли и злокачественные опухоли. Доброкачественные опухоли сохраняют свою локализацию на участке их происхождения и не способны к инфильтрации, к проникновению или метастазированию в периферические участки. Злокачественные опухоли могут внедряться в окружающие их ткани и разрушать их. Они могут также приобретать способность отрываться от участка их происхождения и распространяться на другие участки организма (метастазировать), обычно через кровоток или через лимфатическую систему, в месте, где находятся лимфоузлы. Первичные опухоли классифицируются по типу ткани, от которой они происходят, а метастазирующие опухоли классифицируются по типу ткани, от которой происходят раковые клетки. Через определенный промежуток времени клетки злокачественной опухоли становятся еще более аномальными и все меньше напоминают нормальные клетки. Такое изменение внешнего вида раковых клеток называется степенью злокачественности опухоли, и раковые клетки описываются как высокодифференцированные, умеренно дифференцированные, низкодифференцированные или недифференцированные. Высокодифференцированные клетки, по своему внешнему виду, выглядят почти нормальными и напоминают нормальные клетки, от которых они происходят. Недифференцированными клетками являются клетки, которые стали настолько аномальными, что больше невозможно определить их происхождение.
Опухоль может быть солидной или несолидной, либо она может представлять собой опухоль мягких тканей. Примерами опухолей мягких тканей являются лейкозы (например, хронический миелогенный лейкоз, острый миелогенный лейкоз, острый миелогенный лейкоз взрослых, острый миелогенный лейкоз, острый лимфобластный лейкоз зрелых В-клеток, хронический лимфоцитарный лейкоз, полиморфоцитарный лейкоз или ретикулоэндотелиоз) или лимфомы (например, неходжкинская лимфома, кожная T-клеточная лимфома или болезнь Ходжкина). Солидная опухоль включает любую раковую опухоль тканей организма, за исключением крови, костного мозга или лимфатической системы. Солидные опухоли могут также подразделяться на опухоли эпителиальных клеток и опухоли не эпителиальных клеток. Примерами солидных опухолей эпителиальных клеток являются опухоли желудочно-кишечного тракта, толстой кишки, молочной железы, предстательной железы, легких, почек, печени, поджелудочной железы, яичника, головы и шеи, ротовой полости, желудка, двенадцатиперстной кишки, тонкого кишечника, толстого кишечника, заднего прохода, желчного пузыря, губы, носоглотки, кожи, матки, мужских половых органов, органов мочевыделения, мочевого пузыря и кожи. Солидными опухолями не эпителиального происхождения являются саркомы, опухоли головного мозга и опухоли кости.
Рак эпителиальной ткани обычно образуется из доброкачественных опухолей на прединвазивной стадии (например, карцинома in situ) с переходом в злокачественную раковую опухоль, которая проникает через базальную мембрану и внедряется в субэпителиальную строму.
Комплексы мультиспецифических белков могут быть также использованы в терапевтических целях, а антитела, которые связываются с HER2, могут быть, в частности, использованы для лечения рака молочной железы, рака прямой и ободочной кишки, рака легких, почечно-клеточной карциномы, глиомы или рака яичника.
Другими индивидуумами-кандидатами на введение им композиций согласно изобретению являются индивидуумы, которые страдают нижеследующими заболеваниями, или индивидуумы с риском развития у них нижеследующих заболеваний, таких как аномальная пролиферация фиброваскулярной ткани; красные угри; синдром приобретенного иммунодефицита; закупорка артерий; атопический кератит; бактериальные язвы; болезнь Бехчета; опухоли крови; заболевание, ассоцированное с закупоркой сонной артерии; хороидальная неоваскуляризация; хроническое воспаление; хроническое отслоение сетчатки; хронический увеит; хронический витрит; заболевание, ассоцированное с изнашиванием контактных линз; отторжение трансплантата роговицы; неоваскуляризация роговицы; неоваскуляризация трансплантата роговицы; болезнь Крона; болезнь Илса; эпидемический кератоконъюнктивит; язвы, вызываемые грибковыми микроорганизмами; инфекции, вызываемые вирусом простого герпеса; инфекции, вызываемые вирусом опоясывающего лишая; синдромы повышенной вязкости крови; саркома Капоши; лейкоз; заболевание, ассоцированное с разрушением липидов; болезнь Лайма; маргинальный кератолиз; язва Мурена; инфекции, вызываемые микобактерией, за исключением лепры; близорукость; неоваскуляризация глаз; ямки в диске зрительного нерва; синдром Ослера-Вебера (Ослера-Вебера-Ренду); остеоартрит; болезнь Педжета; клинический синдром, включающий воспаление периферии сетчатки и ресничного кружка; пемфигоид; филектенулез; полиартериит; осложнения, вызываемые лазерным облучением; инфекции, вызываемые простейшими микроорганизмами; эластома; сухой кератит птеригия; лучевая кератотомия; неоваскуляризация сетчатки; ретинопатия недоношенных; ретролентальная фиброплазия; саркоид; склерит; серповидно-клеточная анемия; синдром Сьегрена; солидные опухоли; болезнь Старгарта; болезнь Стивенса-Джонсона; кератит верхнего отдела лимбической системы; сифилис; системная красная волчанка; маргинальная регенерация Терьенса; токсоплазмоз; саркома Юинга; нейробластома; остеосаркома; ретинобластома; рабдомиосаркома; язвенный колит; закупорка вен; дефицит витамина А; саркоидоз Вегенера; нежелательный ангиогенез, ассоциированный с диабетом; паразитарные заболевания; заболевания, вызываемые аномальным заживлением ран; гипертрофия после хирургической операции; повреждения или травмы (например, острое поражение легких/РДСВ), подавление роста волос; подавление овуляции и образования желтого тела; отторжение имплантата; и подавление развития эмбриона в матке.
Примерами аллергических или воспалительных заболеваний или аутоиммунных заболеваний или расстройств, которые могут быть подвергнуты лечению антителами, полученными с применением описанных здесь методов, являются, но не ограничиваются ими: артрит (ревматоидный артрит, такой как острый артрит, хронический ревматоидный артрит, подагрический артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит, артрит позвонков и юношеский ревматоидный артрит, остеоартрит, прогредиентный хронический артрит, деформирующий артрит, хронический первичный полиартрит, реактивный артрит и анкилозирующий спондилит), воспалительные гиперпролиферативные заболевания кожи, псориаз, такой как бляшковый псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей; дерматит, включая контактный дерматит, хронический контактный дерматит, аллергический дерматит, аллергический контактный дерматит, герпетиформный дерматит и атопический дерматит; сцепленный с Х-хромосомой гипер-IgM-синдром, крапивница, такая как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, включая хроническую аутоиммунную крапивницу, полимиозит/дерматомиозит, ювенильный дерматомиозит, токсический эпидермальный некролиз, склеродермия (включая системную склеродермию), склероз, такой как системный склероз, рассеянный склероз (РС), такой как РС, сопровождающийся нарушением функции спинного мозга и органов зрения, первичный прогрессирующий РС (ППРС) и рецидивирующий-ремитирующий РС (РРРС), прогрессирующий системный склероз, атеросклероз, артериосклероз, рассеянный склероз и атаксический склероз; воспалительное заболевание кишечника (ВЗК) (например, болезнь Крона, аутоиммунные желудочно-кишечные расстройства, колиты, такие как язвенный колит, неспецифический язвенный колит, микроскопический колит, коллагенозный колит, полипозный колит, некрозирующий энтероколит и трансмуральный колит и аутоиммунное воспалительное заболевание кишечника); гангренозная пиодермия, узелковая эритема, первичный склерозирующий холангит, эписклерит), респираторный дистресс-синдром, включая респираторный дистесс-синдром взрослых (РДСВ) или острый респираторный дистресс-синдром, менингит, воспаление всего или части увеального тракта, ирит, хороидит, аутоиммунное гематологическое расстройство, ревматоидный спондилит, внезапная потеря слуха, IgE-опосредуемые заболевания, такие как анафилаксия и аллергический и атопический ринит, энцефалит, такой как энцефалит Расмуссена и энцефалит с поражением конечностей и/или ствола головного мозга, увеит, такой как передний увеит, острый передний увеит, грануломатозный увеит, негрануломатозный увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (ГН) с нефротическим синдромом или без нефротического синдрома, такой как хронический или острый гломерулонефрит, такой как первичный ГН, иммуноопосредованный ГН, мембранозный ГН (мембранозная нефропатия), идиопатический мембранозный ГН или идиопатическая мембранозная нефропатия, мембранозный или мембранозно-пролиферативный ГН (МПГН), включая глумерулонефрит типа I и типа II, и быстро прогрессирующий ГН, аллергические состояния, аллергическая реакция, экзема, включая аллергическую или атопическую экзему; астма, такая как бронхиальная астма и аутоиммунная астма; состояния, вызываемые инфильтрацией Т-клеток и хронические воспалительные реакции; хроническое воспалительное заболевание легких, аутоиммунный миокардит, недостаточная адгезия лейкоцитов; системная красная волчанка (systemic lupus erythematodes) (СКВ), такая как кожная СКВ или подострая кожная СКВ, волчаночный синдром новорожденных (ВСР), диссеминированная красная волчанка, волчанка (включая нефрит, церебрит, детскую волчанку, непочечную волчанку, внепочечную волчанку, дискоидную волчанку, алопецию); юношеский сахарный диабет (типа I), включая детский инсулинзависимый сахарный диабет (ИЗСД), сахарный диабет взрослых (диабет типа II), аутоиммунный диабет, идиопатический несахарный диабет, иммунные реакции, ассоциированные с острой гиперчувствительностью и чувствительностью замедленного типа, опосредуемой цитокинами и Т-лимфоцитами; туберкулез, саркоидоз, гранулематоз, включая лимфоматоидный гранулематоз, гранулематоз Вегенера, агранулоцитоз; васкулитиды, включая васкулит (включая васкулит крупных кровеносных сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит (Такаясу)), васкулит средних кровеносных сосудов (включая болезнь Кавазаки и узелковый полиартериит), полиартериит капилляров, васкулит ЦНС, некрозирующий васкулит, кожный васкулит или васкулит, ассоциированный с гиперчувствительностью, системный некрозирующий васкулит и ANCA-ассоциированный васкулит, такой как васкулит или синдром Черга-Штраусса (СЧШ)), височный артериит, апластическая анемия, аутоиммунная апластическая анемия, положительная анемия Кумбса, анемия Даймонда-Блекфана, гемолитическая анемия или иммунная гемолитическая анемия, включая аутоиммунную гемолитическую анемию (АИГА), злокачественная анемия (пернициозная анемия), болезнь Аддисона, истинная эритроцитарная анемия или аплазия (ИЭА), дефицит фактора VIII, гемофилия А, аутоиммунная нейтропения, панцитопения, лейкопения, заболевания, приводящие к диапедезу лейкоцитов, воспалительные расстройства ЦНС, синдром поражения многих органов, такой как вторичный синдром, ассоциированный с сепсисом, травмой или геморрагией; заболевания, опосредуемые образованием комплекса “антиген-антитело”, болезнь гломерулярных базальных мембран, катализируемая реакцией антитело-антиген, антифосфолипидный синдром, аллергический нейрит, болезнь/синдром Бехчета, синдром Кастлемана, синдром Гудпасчера, синдром Рейно, синдром Сьегрена, синдром Стивенса-Джонсона, пемфигоид, такой как буллезный пемфигоид и кожный пемфигоид, пузырчатка (включая пузырчатку вульгарную, пузырчатку листовидную, пемфигоид слизистых оболочек-мембранозный пемфигоид и пузырчатку эритематозную), аутоиммунная полиэндокринопатия, болезнь или синдром Райтера, нефрит, ассоциированный с иммунными комплексами, антитело-опосредуемый нефрит, нейромиелит зрительного нерва, полиневропатии, хроническая невропатия, такая как IgM-полиневропатия или IgM-опосредованная невропатия, тромбоцитопения (например, развивающаяся у пациента с инфарктом миокарда), включая тромботическую тромбоцитопеническую пурпуру (ТТП), и аутоиммунную или иммуно-опосредованную тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ИТП), включая хроническую или острую ИТП; аутоиммунное заболевание яичек и яичника, включая аутоиммунный орхит и оофорит, первичный гипотиреоидит, гипопаратиреоидит, аутоиммунные эндокринные заболевания, включая тиреодит, такой как аутоиммунный тиреоидит, болезнь Хашимото, хронический тиреоидит (тиреоидит Хашимото), или подострый тиреоидит, аутоиммунное заболевание щитовидной железы, идиопатический гипотиреоидит, болезнь Грейвса, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или синдромы полигландулярной эндокринопатии), паранеопластические синдромы, включая неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром «негнущегося человека», энцефаломиелит, такой как аллергический энцефаломиелит (или encephalomyelitis allergica) и экспериментальный аллергический энцефаломиелит (ЭАЭ), тяжелая миастения, такая как тяжелая миастения, ассоциированная с тимомой, дегенерация мозжечка, невромиотония, опсоклонус или синдром «пляшущих глаз» (СПГ) и невропатия органов чувств, мультифокальная невропатия двигательной системы, синдром Шихана, аутоиммунный гепатит, хронический гепатит, волчаночный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидный интерстициальный пневмонит, облитерирующий бронхиолит (не передающийся, в отличие от NSIP); синдром Гийена-Барре, болезнь Бергера (IgA-нефропатия), идиопатическая IgA-нефропатия, линейный IgA-дерматоз, первичный билиарный цирроз, пневмоноцирроз, синдром аутоиммунной энтеропатии, заболевание кишечника или целиакия, кишечная спру (глютеновая энтеропатия), не поддающаяся лечению спру, идиопатическая спру, криоглобулинемия, амилотрофический боковой склероз (АБС; болезнь Луи Герига), ишемическая болезнь сердца; аутоиммунное заболевание уха, такое как аутоиммунное заболевание внутреннего уха (АЗВУ); аутоиммунная потеря слуха; синдром «пляшущих глаз» (СПГ), полихондрит, такой как не поддающийся лечению или рецидивирующий полихондрит; легочный альвеолярный протеиноз, амилоидоз, склерит, нераковый лимфоцитоз, первичный лимфоцитоз, включая моноклональный В-клеточный лимфоцитоз (например, доброкачественную моноклональную гаммапатию и моноклональную гаммапатию неясной этиологии, MGUS); периферическая невропатия, паранеопластический синдром; «каналопатии», такие как эпилепсия, мигрень, аритмия, мышечные расстройства, глухота, слепота, периодический паралич и «каналопатии» ЦНС, аутизм, воспалительная миопатия, очаговый и сегментарный гломерулосклероз (ОСГС), эндокринная офтальмопатия, увеоретинит, хориоретинит, аутоиммунное заболевание печени, фибромиалгия, множественная эндокринная недостаточность, синдром Шмидта, адреналит, атрофия желудка, пресенильная деменция, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания, диабетическая нефропатия, синдром Дресслера, гнездная алопеция, синдром CREST (кальциноз, феномен Рейно, нарушение моторики пищевода, склеродактилия и телеангиэктазия), аутоиммунное бесплодие у мужчин и женщин, смешанное заболевание соединительных тканей, болезнь Чагаса, ревматическая лихорадка, привычный выкидыш, болезнь легких у фермеров, мультиформная эритема, посткардиотомный синдром, синдром Кушинга, болезнь легких любителей птиц, аллергический гранулематозный ангиит, доброкачественный лимфоцитарный ангиит, синдром Альпорта, альвеолит, такой как аллергический альвеолит и фиброзный альвеолит, интерстициальная болезнь легких, трансфузионная болезнь, лепра, малярия, лейшманиоз, кипаносомоз, шистосомоз, аскариоз, аспергиллез, синдром Сэмптера, синдром Каплана, лихорадка денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный легочный фиброз, интерстициальный легочный фиброз, идиопатический легочный фиброз, кистозный фиброз, эндофтальмит, эритема возвышенная стойкая, эритробластоз плода, эозинофильный фасцит, синдром Шульмана, синдром Фелти, фляриоз, циклит, такой как хронический циклит, гетерохронический циклит, иридоциклит или циклит Фукса, пурпура Геноха-Шенлейна, инфекция, вызываемая вирусом иммунодефицита человека (ВИЧ), инфекции, вызываемые эховирусом; кардиомиопатия, болезнь Альцгеймера, инфекции, вызываемые парвовирусом; инфекции, вызываемые вирусом коревой краснухи; синдром, развивающийся после вакцинации; наследственная инфекция, вызываемая вирусом коревой краснухи; инфекции, вызываемые вирусом Эпштейна-Барра; паротит, синдром Эванса, аутоиммунная гонадная недостаточность, хорея Сиденгама, пост-стрептококковый нефрит, облитерирующий тромбоангиит, тиротоксикоз, сухотка спинного мозга, хориоидит, гигантоклеточная полимиалгия, эндокринная офтальмопатия, пневмонит, ассоциированный с хронической гиперчувствительностью, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, синдром идиопатического нефрита, нефропатия, характеризующаяся минимальными изменениями почечной ткани, доброкачественные наследственные и вызываемые ишемией реперфузионные поражения, аутоиммунное заболевание сетчатки, воспаление суставов, бронхит, хроническое обструктивное заболевание дыхательных путей, силикоз, афты, афтозный стоматит, артериосклеротические расстройства, аспермиогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемия, контрактура Дюпюитрена, факоанафилактическая эндофтальмия, аллергический энтерит, нодозная лепроматозная эритема, идиопатический лицевой паралич, синдром хронической усталости, ревматическая лихорадка, синдром Хаммена-Рича; нейросенсорная потеря слуха, пароксизмальная гемоглобинурия, гипогонадизм, регионарный илеит, лейкопения, инфекционный мононуклеоз, поперечный миелит, первичная идиопатическая миксидема, нефроз, симпатическая офтальмия, гранулематозный орхит, панкреатит, острый полирадикулит, гангренозная пиодермия, тиреоидит Кервена, приобретенная атрофия спинного мозга, бесплодие, вызываемое антителами против сперматозоидов, незлокачественная тимома, витилиго, тяжелый комбинированный иммунодефицит (ТКИД) и заболевания, вызываемые вирусом Эпштейна-Барра; синдром приобретенного иммунодефицита (СПИД), паразитарные болезни, такие как лейшманиоз, синдром токсического шока, отравление пищевыми продуктами, состояния, вызываемые инфильтрацией Т-клеток, недостаточная адгезия лейкоцитов, иммунные ответы, ассоциированные с острой гиперчувствительностью и с гиперчувствительностью замедленного типа, опосредуемой цитокинами и Т-лимфоцитами, заболевания, ассоциированные с диапедезом лейкоцитов, синдром поражения многих органов, заболевания, опосредуемые образованием комплекса «антиген-антитело», болезнь гломерулярных базальных мембран, аллергический неврит, аутоиммунная полиэндокринопатия, оофорит, первичная микседема, аутоиммунный атрофический гастрит, симпатическая офтальмия, ревматические заболевания, смешанное заболевание соединительных тканей, нефротический синдром, инсулит, полиэндокринная недостаточность, невропатия периферических органов, аутоиммунный полигландулярный синдром типа I, идиопатический гипопаратиреоидит взрослых (ИГВ), общая алопеция, застойная кардиомиопатия, приобретенный буллезный эпидермолиз (ПБЭ), гемохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит; решетчатый синусит, фронтит, верхнечелюстной синусит или сфеноидит; эозонофильные расстройства, такие как эозинофилия, легочная инфильтрирующая эозинофилия, синдром эозинофилии-миалгии, синдром Лефлера, хроническая эозинофильная пневмония, тропическая легочная эозинофилия, бронхопневмонический аспергиллез, аспергиллема или гранулемы, содержащие эозинофилы; анафилаксия, серонегативные спондилоартриты, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, склерит, эписклерит, хронический слизисто-кожный кандидоз, синдром Брутона, преходящая гипогаммаглобулинемия у детей, синдром Вискотта-Алдрича, синдром атаксии-телеангиэктазии, аутоиммунные расстройства, ассоциированные с коллагеновой болезнью, ревматизм, неврологическое заболевание, ишемическое реперфузионное поражение, реакция на снижение кровяного давления, сосудистая дисфункция, ангиоэктазия, повреждение ткани, сердечно-сосудистая ишемия, гипералгезия, ишемия головного мозга и заболевание, сопровождающееся васкуляризацией, аллергические расстройства, ассоциированные с гиперчувствительностью, гломерулонефриты, реперфузионное повреждение, реперфузионное повреждение миокарда или других тканей, дерматозы с компонентами острого воспаления, острый гнойный менингит или другие воспалительные расстройства центральной нервной системы, воспалительные заболевания глаз и глазницы; синдромы, ассоциированные с трансфузией гранулоцитов; токсичность, индуцированная цитокинами, острое серозное воспаление, хроническое трудноизлечимое воспаление, пиелит, пневмоноцирроз, диабетическая ретинопатия, диабетическое поражение крупных артерий, гиперплазия периферических артерий, пептическая язва, вальвувит и эндометриоз.
Антитела согласно изобретению, помимо их терапевтического применения, могут быть использованы в других целях, включая диагностические методы, такие как методы диагностики описанных здесь заболеваний и состояний.
X. Дозы, препараты и продолжительной их действия
Белки согласно изобретению могут быть получены, приготовлены в виде доз и введены в соответствии с общепринятой фармацевтической практикой. В этом контексте учитываются такие факторы, как конкретное расстройство, подвергаемое лечению, конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельного индивидуума, этиология расстройства, участок доставки лекарственного средства, способ введения, схема введения и другие факторы, известные специалистам-медикам. «Фармацевтически эффективное количество» вводимого белка определяют с учетом указанных факторов, и это количество представляет собой минимальное количество, необходимое для предупреждения, ослабления симптомов или лечения конкретного расстройства (например, рака, аллергического или воспалительного расстройства или аутоиммунного расстройства). Белки могут быть, но необязательно, приготовлены в комбинации с одним или несколькими средствами, используемыми в настоящее время для предупреждения или лечения указанного расстройства. Эффективное количество таких других средств зависит от количества белков, присутствующих в препарате, типа расстройства или способа лечения и других факторов, обсуждаемых выше. Эти средства обычно используются в таких же дозах и вводятся такими же способами, которые были описаны ранее, или они могут составлять примерно 1%-99% от доз, используемых ранее. Вообще говоря, ослабление симптомов или лечение рака включает ослабление одного или более симптомов или лечение определенного расстройства, ассоциированного с раком. Терапевтически эффективное количество лекарственного средства может давать определенный эффект или комбинацию эффектов, а именно: снижение (по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или более) числа раковых клеток; снижение размера опухоли или опухолевой нагрузки; ингибирование (то есть, снижение до определенной степени и/или прекращение) инфильтрации раковых клеток в периферические органы; снижение гормональной секреции в случае аденомы; уменьшение плотности сосудов; ингибирование метастазов опухоли; снижение или ингибирование роста опухоли; и/или ослабление, до некоторой степени, одного или нескольких симптомов, ассоциированных с раком. В некоторых вариантах изобретения белки используют для предупреждения возникновения или рецидива рака или аутоиммунного расстройства у индивидуума.
В одном из вариантов настоящее изобретение может быть применено для увеличения продолжительности жизни человека с риском развития у него рака или аутоиммунного расстройства, или у человека, у которого были диагностированы рак или аутоиммунное расстройство. Продолжительность жизни определяют как время, прошедшее от первого введения лекарственного средства до смерти. Продолжительность жизни может быть также определена по стратифицированному отношению риска для лечебной группы и для контрольной группы (HR), которое определяет риск летального исхода во время лечения.
В другом варианте изобретения лечение в соответствии с настоящим изобретением означает значительное увеличение уровня ответа у группы людей с риском развития у них рака, или у людей с диагностированным раком, который был подвергнут лечению различными противораковыми терапевтическими средствами. Уровень ответа определяют как процент подвергаемых лечению индивидуумов, отвечающих на проводимое лечение. В одном из аспектов изобретения комбинированное лечение согласно изобретению, проводимое с применением белков согласно изобретению и хирургической операции, лучевой терапии и одного или нескольких химиотерапевтических средств, приводит к значимому повышению уровня ответа у группы индивидуумов, подвергаемых указанному лечению, по сравнению с группой индивидуумов, подвергаемых лечению только путем хирургической операции, лучевой терапии или химиотерапии, где указанное повышение уровня ответа имеет р-величину χ2 (хи-квадрат) менее чем 0,005. Дополнительные измерения терапевтической эффективности лечения рака описаны в публикации заявки на патент США № 20050186208.
Терапевтические препараты получают стандартными методами, известными специалистам, путем смешивания активного ингредиента, имеющего нужную степень чистоты, с необязательными физиологически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences (20th edition), ed. A. Gennaro, 2000, Lippincott, Williams & Wilkins, Philadelphia, PA). Приемлемыми носителями являются физиологический раствор или буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные полипептиды (имеющие примерно менее чем 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; спирты ряда сахаров, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как TweenTM, PLURONICSTM или ПЭГ.
Указанный препарат, необязательно, но предпочтительно, содержит фармацевтически приемлемую соль, предпочтительно хлорид натрия, предпочтительно примерно в физиологических концентрациях. Препараты согласно изобретению могут содержать, но необязательно, фармацевтически приемлемый консервант. В некоторых вариантах изобретения концентрация консерванта составляет 0,1-2,0%, обычно по объему. Подходящими консервантами являются консерванты, известные специалистам-фармацевтам. Предпочтительными консервантами являются бензиловый спирт, фенол, м-крезол, метилпарабен и пропилпарабен. Препараты согласно изобретению могут включать, но необязательно, фармацевтически приемлемое поверхностно-активное вещество в концентрации 0,005-0,02%.
Описанный здесь препарат может также содержать более чем одно активное соединение, необходимое для лечения конкретного заболевания, предпочтительно соединение, обладающее дополнительными активностями, которые не оказывают негативного воздействия друг на друга. Такие молекулы обычно присутствуют в комбинации в количествах, эффективных для достижения нужной цели.
Активные ингредиенты могут быть также заключены в микрокапсулы, полученные, например, методами коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, соответственно, в системы для доставки коллоидальных лекарственных средств (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такая методика описана в руководстве Remington's Pharmaceutical Sciences, см. выше.
Могут быть получены препараты пролонгированного высвобождения. Подходящими примерами препаратов пролонгированного высвобождения являются полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих гетеромультимерный белок, где указанные матрицы имеют форму готовых изделий, например, пленок или микрокапсул. Примерами матриц пролонгированного высвобождения являются полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразлагаемый сополимер этилена-винилацетата, разлагаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM (микросферы для инъекций, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляная кислота. Полимеры, такие как сополимер этилена-винилацетата и сополимер молочной кислоты-гликолевой кислоты способны высвобождать молекулы в течение более 100 дней, а некоторые гидрогели высвобождают белки за более короткие периоды времени. Если инкапсулированный(е) гетеромультимерный(е) белок(ки) сохраняется(ются) в организме в течение длительного периода времени, то он (они) может (могут) денатурироваться или агрегироваться под воздействием влаги при 37ºС, что приводит к потере биологической активности и к возможным изменениям иммуногенности. Для стабилизации, в зависимости от конкретного механизма, могут быть разработаны рациональные стратегии. Так, например, если было обнаружено, что механизмом агрегации является образование межмолекулярной S-S-связи посредством тио-дисульфидного обмена, то стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислотных растворов, регуляции содержания влаги с использованием соответствующих добавок и получения конкретных композиций на основе полимерной матрицы.
Описанные здесь белки (например, гетеромультимерные белки, такие как мультиспецифическое антитело, полученное описанными здесь методами) вводят человеку известными методами, такими как внутривенное введение в ударной дозе или непрерывное вливание через определенный период времени, внутримышечно, внутрибрюшинно, в цереброспинальную жидкость, подкожно, внутрисуставно, в синовиальную жидкость, интратекально, перорально, местно или путем ингаляции. Местное введение может быть особенно желательным, в случае, когда возникающие серьезные побочные эффекты или токсичность связаны с антагонизмом по отношению к молекуле-мишени, распознаваемой данными белками. Стратегия ex vivo может быть также использована в терапевтических целях. Стратегии ex vivo включают трансфекцию или трансдукцию взятых у индивидуума клеток с использованием полинуклеотида, кодирующего белок согласно изобретению. Трансфицированные или трандуцированные клетки затем опять вводят индивидууму. Такими клетками могут быть любые клетки широкого ряда, включая, но не ограничиваясь ими, гемопоэтические клетки (например, клетки костного мозга, макрофаги, моноциты, дендритные клетки, Т-клетки или В-клетки), фибробласты, эпителиальные клетки, эндотелиальные клетки, кератиноциты и мышечные клетки.
В одном из примеров белковый комплекс (например, гетеромультимерный белок, такой как мультиспецифическое антитело, полученное в соответствии с описанными здесь методами) вводят местно, например, путем прямой инъекции, если это позволяет данное расстройство или локализация опухоли, и эти инъекции могут периодически повторяться. Белковый комплекс может быть также введен индивидууму системно или непосредственно в опухолевые клетки, например, в ложе опухоли после хирургической операции по удалению опухоли, в целях предупреждения или снижения вероятности рецидивов или метастазов.
XI. Промышленные изделия и наборы
В другом варианте настоящее изобретение относится к промышленному изделию, содержащему один или несколько описанных здесь белковых комплексов, и материалы, используемые для лечения, предупреждения и/или диагностики расстройства (например, аутоиммунного заболевания или рака). Такое промышленное изделие содержит упаковку, а также этикетку, наклеенную на эту упаковку, или вкладыш, вложенный в такую упаковку. Подходящими упаковками являются, например, бутыли, флаконы, шприцы и т.п. Эти упаковки могут быть изготовлены из различных материалов, таких как стекло или пластик. Указанная упаковка содержит композицию, которая является эффективной для лечения, предупреждения и/или диагностики данного состояния, и может иметь стерильное входное отверстие (например, такой упаковкой может быть пакет для внутривенного введения раствора или сосуд, имеющий пробку, протыкаемую иглой для подкожных инъекций). По меньшей мере одним активным агентом в указанной композиции является гетеромультимерный белок (например, антитело или его фрагмент) согласно изобретению. На этикетке или во вкладыше, вложенном в упаковку, должно быть указано, что данная композиция используется для лечения конкретного состояния. Этикетка или вкладыш в упаковку может также содержать инструкции по введению композиции гетеромультимерного белка индивидууму. Также рассматриваются промышленные изделия и наборы, содержащие комбинированные фармацевтические средства.
Вкладыш в упаковку включает инструкции, специально вложенные в коммерчески доступные упаковки терапевтических продуктов, где имеется информация о показаниях, приеме, дозах, способах введения, противопоказаниях и/или предупреждения относительно приема таких терапевтических продуктов. В некоторых вариантах изобретения, в таком вкладыше указано, что данная композиция может быть использована для лечения рака молочной железы, рака прямой и ободочной кишки, рака легких, почечно-клеточной карциномы, глиомы или рака яичника.
Кроме того, указанное промышленное изделие может также включать вторую упаковку, содержащую фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, такое изделие может также содержать и другие материалы, необходимые с точки зрения промышленного производства и потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Настоящее изобретение также относится к наборам, которые могут быть использованы в различных целях, например, для очистки или иммунопреципитации антигена (например, HER2 или EGFR) из клеток. Для облегчения выделения и очистки антигена (например, HER2 или EGFR) указанный набор может содержать гетеромультимерный белок (например, анти-EGFR/HER2 антитело), связанный со сферами (например, с сефарозными сферами). Могут быть получены наборы, которые содержат гетеромультимерный(е) белок(ки) для детектирования и количественной оценки антигена in vitro, например, в ELISA-анализе или в вестерн-блот-анализе. Указанный набор, как и промышленное изделие, содержит упаковку, а также этикетку, наклеенную на эту упаковку, или вкладыш, вложенный в такую упаковку. Эта упаковка содержит композицию, включающую по меньшей мере один гетеромультимерный белок (например, мультиспецифическое антитело или его фрагмент) согласно изобретению. Могут быть также включены и другие упаковки, которые содержат, например, разбавители, буферы или контрольные антитела. Этикетка или вкладыш в упаковку могут содержать описание композиции, а также инструкции по ее применению in vitro или в диагностике.
Представленное выше описание можно считать вполне достаточным для практического осуществления настоящего изобретения. Нижеследующие примеры приводятся лишь в целях иллюстрации и не должны рассматриваться как ограничение объема изобретения. Действительно, в настоящее изобретение могут быть внесены различные модификации, которые помимо модификаций, проиллюстрированных и описанных в настоящей заявке, также будут входить в объем прилагаемой формулы изобретения.
В описании экспериментов приводятся следующие сокращения: экв. (эквиваленты); M (молярная концентрация); мкΜ (микромолярная концентрация); N (нормальный); моль (моли); ммоль (миллимоли); мкмоль (микромоли); нмоль (наномоли); г (граммы); мг (миллиграммы); кг (килограммы); мкг (микрограммы); л (литры); мл (миллилитры); мкл (микролитры); см (сантиметры); мм (миллиметры); мкм (микрометры); нм (нанометры); °C (градусы Цельсия); ч (часы); мин (минуты); сек (секунды); мсек (миллисекунды); ADCC (антитело-зависимая клеточная цитотоксичность); BsAb (биспецифическое антитело); CL (константный домен легкой цепи); CH (константный домен тяжелой цепи); CMC (комплемент-опосредуемая цитотоксичность); Fab (антигенсвязывающий фрагмент); Fc (кристаллизующийся фрагмент); Fv (вариабельный фрагмент (VL+VH)); EGFR (рецептор эпидермального фактора роста); HC (тяжелая цепь); IGFR (рецептор инсулиноподобного фактора роста); LC (легкая цепь); scFv (одноцепочечный вариабельный фрагмент (VL и VH, связанные аминокислотным линкером); VEGF (васкулярный эндотелиальный фактор роста); VEGFR2 (рецептор васкулярного эндотелиального фактора роста 2); VH (вариабельный домен тяжелой цепи); VL (вариабельный домен легкой цепи).
Примеры
Настоящее изобретение подробно описано в нижеследующих примерах, которые никоим образом не ограничивают объема заявленного изобретения. Прилагаемый графический материал рассматривается как неотъемлемая часть описательного раздела изобретения. Все цитируемые здесь работы конкретно и во всей своей полноте вводятся в настоящее описание посредством ссылки. Нижеследующие примеры приводятся лишь в целях иллюстрации и не рассматриваются как ограничение заявленного изобретения.
Пример 1
Конструирование экспрессионных векторов
В этом примере проиллюстрирована конструкция нуклеиновой кислоты, используемая для трансформации клеток-хозяев.
В общих чертах, последовательности ДНК, кодирующие тяжелые и легкие цепи, клонировали в экспрессионную плазмиду, которая содержит отдельные промоторные элементы для каждой последовательности и гены резистентности к антибиотикам для отбора бактериальных клеток, содержащих экспрессионную плазмиду. Векторные конструкции также кодируют сигнал секреции термостабильного энтеротоксина II (STII) (Picken et al., 1983, Infect. Immun. 42:269-275, и Lee et al., 1983, Infect. Immun. 42:264-268) для доставки полипептидов антител в периплазматическое пространство бактериальной клетки. Транскрипция каждой цепи регулируется промотором phoA (Kikuchi et al., 1981, Nucleic Acids Res., 9:5671-5678), а контроль на уровне трансляции обеспечивается ранее описанными вариантами сигнальной последовательности STII с определенным относительным уровнем трансляции, которые содержат модификации «молчащих» кодонов в области инициации трансляции (TIR) (Simmons and Yansura, 1996, Nature Biotechnol. 14:629-634, и Simmons et al., 2002, J. Immunol. Methods, 263:133-147). Плазмиды, содержащие «узлы в дырках», схематически представлены на фигурах 2A и 2B, соответственно.
Хотя настоящее изобретение опирается не на специфические антигенсвязывающие последовательности антител, а на любые комбинации полуантител, однако, в приведенных здесь примерах описаны гетеромультимерные антитела против c-met, EGFR, IL-4 и IL-13. Примеры анти-c-met антител приводятся в патенте США № 7472724 и в патенте США № 7498420. Примеры анти-EGFR антител приводятся в предварительной заявке на патент США 61/210562 (поданной 20 марта 2009), в заявке на патент США № 20080274114 (опубликованной 6 ноября 2008) и в патенте США № 5844093 (выданном 1 декабря 1998). Примеры анти-IL-13 антител описаны в патенте США № 7501121 (выданном 10 марта 2009), в патенте США № 7615213 (выданном 10 ноября 2009), в заявке WO 2006/085938 (опубликованной 17 августа 2006), в заявке на патент США № 20090214523 (опубликованной 27 августа 2009) и в патенте США № 7674459 (выданном 9 марта 2010). Примеры анти-IL-4 антител описаны в заявке на патент США № 20080241160 (опубликованной 2 октября 2008) и в патенте США № 6358509 (выданном 19 марта 2002).
Каждое полуантитело имеет узел (выступ) или дырку (полость), введенные в тяжелую цепь, как описано в патенте США № 7642228. Кратко, сначала был получен мутант с CH3-узлом. Затем была создана библиотека мутантов CH3-дырок посредством рандомизации остатков 366, 368 и 407, находящихся в непосредственной близости от узла на CH3-домене-партнере. В нижеследующих примерах мутацией узлов является T366W, а дырки имеют мутации T366S, L368A и Y407V в остове IgG1. Эквивалентные мутации в иммуноглобулинах других изотипов могут быть легко определены самим специалистом. Для специалиста также будет совершенно очевидно, что для получения биспецифических антител предпочтительно использовать два полуантитела одного и того же изотипа. Могут быть использованы полуантитела и других изотипов, но в данном случае могут потребоваться дополнительные мутации.
Хотя вектор, описанный в этом примере, может быть использован для полуантитела против c-Met или полуантитела против EGFR, однако, для специалиста совершенно очевидно, что в плазмиде может кодироваться любое антитело. Исходной плазмидой для всех используемых здесь конструкций является ранее описанная отдельная цистронная плазмида, кодирующая антитело против тканевого фактора, paTF50, где относительное количество TIR составляет 1 для тяжелой цепи и 1 для легкой цепи (Simmons et al., 2002, J. Immunol Methods, 263:133-147, и патент США № 6979556). Для повышения титров экспрессии этих полуантител, относительное количество TIR было увеличено.
Пример 2
Получение гетеромультимерных белков с использованием отдельных клеточных культур
В нижеследующем примере описано получение гетеромультимерных белков при культивировании клеток, экспрессирующих мономерные компоненты, в отдельных культурах. В этом методе клетки культивировали и индуцировали экспрессию полуантитела в отдельных культурах. В одном из методов культуры клеток-хозяев могут быть объединены до очистки белка. В другом методе компоненты могут быть сначала очищены, а затем объединены с образованием гетеромультимерного белка.
В обоих методах, нуклеиновую кислоту, кодирующую первый полипептид, содержащий шарнирную область (например, полуантитело (узел)), вводили в первую клетку-хозяина, а нуклеиновую кислоту, кодирующую второй полипептид, содержащий шарнирную область (например, полуантитело (дырку)), вводили во вторую клетку-хозяина. Хотя в этом примере проиллюстрировано получение BsAb, однако, для специалиста в данной области совершенно очевидно, что описанные здесь методы могут быть также применены к любому гетеромультимерному белку, содержащему шарнирную область, например, к аффинным антителам и т.п.
Метод #1 - Независимое продуцирование полуантитела с узлом и полуантитела с дыркой в отдельных культурах, отдельная очистка полуантител, смешивание и окислительно-восстановительная реакция с образованием интактного BsAb.
Полуантитела, содержащие мутации узлов или дырок, получали в отдельных культурах путем экспрессии тяжелой и легкой цепей с использованием конструкций, описанных в примере 1, в бактериальной клетке-хозяине, например, в E.coli. См. фиг. 3B и 4A. В этом методе #1 полуантитело с узлом представляет собой анти-EGFR антитело, а полуантитело с дыркой представляет собой анти-c-met антитело. Экспрессионные плазмиды, описанные в примере 1, вводили в штаммы клетки-хозяина E. coli 33D3 (Ridgway et al. Cancer Res., 59 (11):2718 (1999) или 64B4 (W3110 ΔfhuA ΔphoA ilvG+ Δprc spr43H1 ΔdegP ΔmanA laclq ΔompT), и трансформанты отбирали на планшетах LB, содержащих карбенициллин. Затем трансформанты использовали для инокуляции исходной культуры LB, содержащей карбенициллин, и эту культуру выращивали в течение ночи со встряхиванием при 30°C. Исходную культуру разводили 100X в среде с ограниченным содержанием фосфата C.R.A.P. (Simmons et al., 2002, J. Immunol Methods, 263: 133-147), содержащей карбенициллин, и культивировали в течение 24 часов со встряхиванием при 30°C. Эти культуры центрифугировали, и перед началом очистки антитела клеточный осадок замораживали. Осадок оттаивали и ресуспендировали в буфере для экстракции, содержащем 25 мМ Tris-основания, рН которого доводили до pH 7,5 добавлением соляной кислоты, 125 мМ NaCl и 5 мМ EDTA (TEB или буфер для экстракции Tris), где объем TEB по отношению к массе составлял 100 мл на 5 граммов клеточного осадка, а затем экстрагировали путем разрушения клеток на микрофлюидизаторе посредством трехкратного пропускания ресуспендированной смеси через микрофлюидизатор Microfluidics Corporation модели 110F (Newton, MA). Затем экстракт бактериальных клеток осветляли путем центрифугирования в течение 20 минут при 15000×g, после чего супернатант собирали и фильтровали через ацетатный фильтр размером 0,22 микрон с последующей очисткой.
Каждое полуантитело отдельно очищали путем захвата на белке А с последующим проведением катионообменной хроматографии. Осветленные клеточные экстракты, содержащие полуантитело с узлом, загружали на 1-мл колонку HiTrap MabSelect SURE от GE Healthcare (Pistcataway, NJ) при скорости 2 мл/мин. После загрузки колонку промывали 10 колоночными объемами (КО) 40 мМ цитрата натрия, pH 6,0, 125 мМ хлорида натрия и 5 мМ EDTA, а затем 5 колоночными объемами 20 мМ цитрата натрия при pH 6,0 для облегчения захвата на катионообменной колонке. Аффинно захваченные полуантитела элюировали 10 колоночными объемами (КО) 0,2 мМ уксусной кислоты (pH 2-3) и непосредственно иммобилизовали на 1-мл колонке HiTrap SP-HP с сильным катионообменником GE Healthcare. Колонку промывали 10 КО буфера A, содержащего 25 мМ 2-(N-морфолино)этансульфоновой кислоты (MES), pH 5,8. Полуантитела элюировали линейным градиентом 0-50% буфера B (25 мМ MES, pH 5,8 и 1 M хлорида натрия (NaCl)). Оба белка элюировались в градиенте 20-40% B, и пик элюирования, определенный по УФ-поглощению на 280 нм и в анализе собранных фракций, проводимом с помощью электрофореза в ДСН-ПААГ в невосстанавливающих условиях, объединяли отдельно в виде полуантитела с узлом или полуантитела с дыркой. Оба белка в основном имели высокий пик элюирования, и все фракции, содержащие молекулы тяжелой и легкой цепей, которые были окисленными, объединяли в пул. Анализ очищенных полуантител, проводимый с помощью электрофореза в ДСН-ПААГ в восстанавливающих и невосстанавливающих условиях, проиллюстрирован на фигуре 4B. Результаты показали, что большинство экспрессированных и иммобилизованных белков имели размер 75 кД. Эти результаты были подтверждены авторами настоящего изобретения с помощью масс-спектрометрии ESI-TOF, как показано на фигуре 4C. Полуантитела имели ожидаемые массы, что указывает на то, что каких-либо дисульфидных аддуктов на любом цистеине, включая два цистеиновых остатка в шарнирной области, не образовывалось. Для того чтобы определить, являются ли цистеины в шарнирной области восстановленными и имеют реакционноспособную свободную тиоловую группу, белки подвергали реакции с 1 мМ N-этилмалеимидом (NEM) при нейтральном рН в течение 1 часа, а затем проводили масс-спектрометрический анализ. Масса белка не изменялась, что указывает на то, что все цистины шарнирной области были окисленными, наиболее вероятно, во внутрицепьевом дисульфиде, например, в циклическом дисульфиде. Для сборки полностью интактного биспецифического антитела с использованием указанных двух полуантител (с узлами и дырками), необходимо сначала провести реакцию восстановления внутрицепьевых дисульфидов в шарнирной области для высвобождения свободных тиоловых групп цистеина так, чтобы затем их можно было подвергнуть окислению другой тяжелой цепью с получением биспецифического антитела размером 150 кД.
Для осуществления гибридизации, восстановления и повторного окисления двух комплементарных полуантител с образованием интактных биспецифических молекул был разработан нижеследующий метод. После независимого выделения, очищенные белки с равными массами объединяли вместе в пул на стадии объединения (показано на фигуре 5А), pH этого пула доводили до 7,5 путем добавления одной десятой объема 1M Tris, pH 7,5, и белки подвергали реакции восстанавления с использованием 0,5 мМ Tris[2-карбоксиэтил]фосфина (TCEP) при комнатной температуре. После проведения реакции восстановления в течение 2 часов, объединенные в пул белки подвергали буферному обмену путем добавления 25 мМ Tris, pH 7,5, и 125 мМ NaCl на центрифужных обессоленных 5-мл колонках Zeba (Pierce, Rockford, IL) до объема примерно 4 мл белка в концентрации 1 мг/мл. Затем эти белки гибридизовали путем нагревания смеси до 52°C в течение 25 минут, после чего охлаждали до комнатной температуры, составляющей примерно 20°C. Гибридизированные антитела концентрировали на центрифужных концентраторах с отсечкой молекулярной массы 10 кД MW до объема 0,5 мл белка в концентрации примерно 8 мг/мл и окисляли путем добавления 300 микромоль дегидроаскорбиновой кислоты (DHAA) к реакционной смеси маточного раствора 100 мМ DHAA, растворенной в диметилсульфоксиде. Количество DHAA, добавленной для окисления, примерно в 10 раз превышало молярную концентрацию белка. После окисления в течение ночи при комнатной температуре, окисленное вещество пропускали через колонку для гель-фильтрации S-200 (22 мл S200 Tricorn от GE Healthcare) в буфере, содержащем 25 мМ MES, pH 6,0, и 300 мМ NaCl. Интактные антитела объединяли и 10-кратно разводили водой. Затем белок BsAb очищали с помощью хроматографии на слабом катионообменнике с использованием карбоксиметиловой смолы (CM) (1 мл HiTrap CM-FF, GE Healthcare) путем элюирования в градиенте pH от 4,5 до 9,2. Буфер A и B состояли из 20 мМ цитрата натрия, 30 мМ MES, 20 мМ HEPES, 20 мМ имидазола, 20 мМ Tris, 20 мМ CAPS и 25 мМ NaCl, где буфер A доводили до pH 4,2 добавлением HCl, а буфер B доводили до pH 9,2 (или 10,4) добавлением NaOH. Очищенное вещество, наблюдаемое после хроматографии на CM, анализировали с помощью масс-спектрометрии для определения точного состава молекул (фигура 4D). Масс-спектрометрический анализ показал, что только детектируемый продукт интактного антитела имел молекулярную массу 146051,89, которая была почти идентична массе гетеродимерной молекулы «узел в дырке» анти-EGFR/анти-c-met антитела, теоретическая молекулярная масса которого равна 145051,75. Выход, полученный в этой процедуре, примерно для 2 мг узла и 2 мг дырки, составлял примерно 0,5-1 мг.
В целях широкомасштабного продуцирования антител для проведения эксперимента in vivo, такого как определение фармакокинетических свойств у приматов, не являющихся человеком, необходимо получить антитела в количествах масштаба 100 мг/грамм. Авторами настоящего изобретения была разработана процедура, проводимая с использованием отдельной независимой культуры для каждого полуантитела, как показано на фигуре 5A, для продуцирования интактных биспецифических антител в этих количествах. Чтобы приготовить такие препараты требуются 10-литровые ферментеры для получения клеточного осадка или всего бульона с достаточным количеством антитела (Simmons et al., 2002, J. Immunol. Methods, 263:133-147, и патент США № 6979556). В процессе проведения эксперимента были использованы либо клеточный осадок, либо бактериальный бульон из целых клеток в целях получения биомассы, содержащей экспрессированные полуантитела. В некоторых случаях значительная часть антитела просачивалась в среду, и весь бульон давал более высокие выходы. Для клеточного осадка материал ресуспендировали в буфере для экстракции, содержащем 25 мМ Tris, pH 7,5, 5 мМ EDTA, и 125 мМ NaCl, и подвергали лизису посредством микрофлюидизации на микрофлюидизаторе модели HC80003A от Microfluidics (Newton, MA). Весь бульон был непосредственно подвергнут микрофлюидизации без добавления вспомогательных веществ. В обоих случаях делали три пассажа материала на этом устройстве. В этом примере авторами настоящего изобретения было получено 500 мг двух вариантов биспецифического антитела, направленного против цитокинов, таких как интерлейкин-4 (узел) и интерлейкин-13 (дырка).
Первый вариант биспецифического антитела содержал Fc человеческого IgG1a только с мутациями узла и дырки, а второй вариант содержал другой модифицированный Fc с двумя мутациями, T307Q и N434A, что приводило к повышению аффинности по отношению к неонатальному Fc-рецептору (FcRn). Предполагается, что второй вариант будет сообщать антителу более медленный клиренс и более длительное время полужизни. Антитело с дыркой (нацеленное на IL-4) и антитело с узлом (нацеленное на IL-13), содержащие оба варианта Fc (WT-Fc-вариант для первого антитела и FcRn-вариант для последнего антитела), культивировали отдельно в 10-литровом ферментере, и весь бульон, содержащий среду для культивирования и бактериальные клетки, независимо гомогенизировали и очищали. После микрофлюидизации всего бульона, экстракт обрабатывали равным объемом 0,4% полиэтиленимина (ПЭИ) (pH 9,0) в целях получения экстракта для осветления путем центрифугирования. Смесь перемешивали в течение 3 часов при комнатной температуре или в течение ночи при 4°C. ПЭИ вызывал интенсивную преципитацию экстракта, который осветляли путем центрифугирования при 15000×g в течение 45 минут. Затем супернатант фильтровали на 0,22-микронных фильтрах, после чего загружали на 100-мл колонку Mab Select SURE с иммобилизованным на ней белком А. Экстракт загружали при скорости 20 мл/мин и промывали 40 мМ ацетатом натрия, pH 6,0, и 100 мМ NaCl, обычно примерно 10 колоночными объемами (КО), до тех пор, пока УФ-поглощение на 280 нм не достигало стабильного базового значения. Промывочный буфер заменяли 20 мМ цитратом натрия, pH 6,0, и промывали примерно 2 КО. Иммобилизованное полуантитело элюировали с использованием 0,2 M уксусной кислоты. После выделения на белке А, антитела очищали с помощью катионообменной хроматографии с использованием смолы S-FF (GE Healthcare) или гель-фильтрации с использованием смолы S200 (GE Healthcare) для удаления примесей и агрегатов. Очищенные полуантитела представляли собой молекулы размером, главным образом, ~75 кД, как показано на фигуре 5B. После проведения второй стадии выделения, 500 мг каждого полуантитела объединяли в пул при концентрации 1 мг/мл, а pH доводили до 7,5 с использованием 1M Tris, pH 7,5. Смесь нагревали до 37°C в инкубаторе и проводили мониторинг посредством гель-фильтрации на появление молекул антитела размером 150 кД. Через 2 часа гибридизация была завершена, на что указывало полное превращение в димерные молекулы размером 150 кД, и смесь охлаждали до комнатной температуры. Белки восстанавливали путем добавления 2 мМ DTT в течение двух часов при 24°C, а затем концентрировали до 20 мг/мл с использованием центрифужных фильтров с отсечкой 10 кД. Концентрированный раствор окисляли путем диализа в течение ночи в буфере, содержащем только 25 мМ Tris, pH 8,0. Затем окисленный материал анализировали на чистоту и агрегацию. Молекулу интактного антитела анализировали с помощью масс-спектрометрии, и было обнаружено, что она представляет собой интактную, полностью окисленную, гетеродимерную молекулу биспецифического антитела, однако гель-фильтрация и ДСН-ПААГ-анализ указывали на присутствие значительного количества агрегатов, некоторые из которых, как очевидно, возникали в результате образования мультимеров, связанных дисульфидными связями (данные не приводятся). Для дополнительной очистки биспецифического антитела в целях проведения эксперимента in vivo, антитело разделяли на колонке для гель-фильтрации S-200 в Tris, pH 7,5, и 125 мМ NaCl. Масса очищенного материала уменьшалась на более чем 30%, что обусловлено удалением образованных агрегатов. В конечных стадиях получения белок иммобилизовали на катионообменной колонке, промывали 0,1% TX114 в 50 мМ ацетата натрия, pH 5,0, для удаления примесного эндотоксина, и элюировали буфером с высоким рН, содержащим 50 мМ Tris, pH 8,0. Затем элюированный белок диализовали против буфера, подходящего для проведения экспериментов in vivo и хранили при 4°C. Конечный материал, состоящий из WT-Fc- и FcRn-варианта, анализировали с помощью электрофореза в ДСН-ПААГ, масс-спектрометрии, LAL-теста для определения уровней примесного эндотоксина, и анализа, проводимого с помощью гель-фильтрации. Результаты электрофореза в ДСН-ПААГ представлены на фигуре 5C и указывают на то, что крупная молекула представляет собой интактное биспецифическое антитело размером 150 кД. На фигуре 6A проиллюстрирована биологическая активность антител в отношении нейтрализации цитокинов IL-4 и IL-13 в анализе на пролиферацию клеток TF-2. В этом анализе биспецифическое анти-IL-4/анти-IL-13 антитело, анти-IL-4 и анти-IL-13 антитела использовали в исходной концентрации 25 мкг/мл и подвергали 10-кратному серийному разведению в 96-луночном планшете для культивирования (Falcon, Cat# 353072) до конечной концентрации 0,025 пг/мл в аналитической среде (в культуральной среде без rhGM-CSF) или в аналитической среде, содержащей 0,4 нг/мл человеческого IL-4 (R&D Systems, Catalog # 204-IL) плюс 20 нг/мл человеческого IL-13 (Genentech Inc.) в конечном объеме 50 мкл/лунку. Разведенные антитела предварительно инкубировали в течение 30 минут при 37°C.
После предварительного инкубирования клетки TF-1, культивированные в среде RPMI 1640 (Genentech, Inc.), содержащей 10% фетальную бычью сыворотку (HyClone, Cat# SH300071.03), 2 мМ L-глутамина, 100 единиц/мл пенициллина, 100 мкг/мл стрептамицина (Gibco, Cat# 10378) и 2 нг/мл rhGM-CSF (R&D Systems, Cat #215-GM), 2 раза промывали аналитической средой и ресуспендировали в аналитической среде до конечной концентрации 2×105 клеток/мл. 50 мкл клеток добавляли в каждую лунку, содержащую либо разведенные антитела, либо аналитическую среду плюс цитокины IL-4 и IL-13 (контроль с максимальной пролиферацией), либо только аналитическую среду (фоновый контроль). Все образцы высевали в дубликатах. Планшеты инкубировали при 37°C в атмосфере 5% CO2 в течение 4 дней. В каждую лунку в процессе конечной 4-часовой стадии инкубирования добавляли 1 мкКи 3H-тимидина (Perkin Elmer, Cat# NET027005MC). Планшеты устанавливали на устройство Unifilter-96 GF/C (Perkin Elmer, Cat# 6005174) с использованием фильтра-мата Packard Filtermate, и включение 3H-тимидина измеряли с помощью счетчика TopCount NXT (Perkin Elmer). По полученным данным строили кривую с использованием программы KaleidaGraph. Результаты показали, что биспецифическое анти-IL-4/анти-IL-13 антитело дикого типа является эффективным в качестве антитела IgG против комбинации IL-4 и IL-13 с точки зрения нейтрализации активности IL-4 и IL-13.
Затем два антитела (анти-IL-4/анти-IL-13 антитело дикого типа и FcRn-вариант анти-IL-4/анти-IL-13 антитела) тестировали на их фармакокинетические (ФК) свойства у собакоподобных обезьян. Молекулу дикого типа, приготовленную в 20 мМ ацетата гистидина, pH 5,5, 240 мМ сахарозы и 0,02% Tween 20 в количестве 10,8 мг/мл и 1 мг/мл, и FcRn-варианта в 20 мМ фосфата натрия, pH 7,5, 240 мМ сахарозы и 0,02% Tween 20 в количестве 10,5 мг/мл, вводили путем внутривенной инъекции в одной дозе. Уровень доз составлял 20 мг/кг и 2 мг/кг для двух концентраций антител дикого типа и 20 мг/кг для FcRn-варианта. Затем периодически, в течение 42 дней, брали пробы сыворотки у двух самок и двух самцов обезьян, которым было инъецировано три лекарственных средства. Пробы сыворотки анализировали на интактное биспецифическое антитело с помощью ELISA, где один антиген, либо IL-4, либо IL-13, наносили на планшеты, которые захватывали это антитело из сыворотки. Количество захваченного биспецифического антитела определяли путем детектирования с использованием второго биотинилированного лиганда, IL-13 или IL-4 (ни один из этих лигандов не был нанесен на планшеты), и связанного с ферментом стрептавидина. Результаты, представленные на фигуре 6B, указывали на ожидаемый двухкамерный клиренс трех проб. ФК-свойства двух различных вариантов антитела, по сравнению со свойствами двух других антител, происходящих от хозяев-продуцентов CHO (авастина и герцептина) и содержащих Fc-гликозилированный вариант, представлены в таблице 2. Очевидно, что биспецифическое антитело, продуцируемое E. coli, аналогично антителам, происходящим от СНО и полученным стандартным методом, и что FcRn-вариант имеет более длительное время полужизни.
(мл/кг)
(мл/кг/день)
(дни)
Метод #2 - Продуцирование полуантитела с узлом и полуантитела с дыркой в отдельных культурах (то есть, независимое), смешивание всего бульона до очистки полуантител и лизис без добавления восстановителя с образованием интактного BsAb.
Этот метод был проведен в целях уменьшения числа стадий данной процедуры по одновременной очистке полуантител с узлом и с дыркой. Поэтому сбраживаемые бульоны смешивали до осаждения и ресуспендирования в буфере для экстракции. Очевидно, что каждая клетка-хозяин высвобождала экспрессируемое в ней полуантитело, содержащее циклический дисульфид в шарнирной области, в буфер для экстракции после разрушения клеточной мембраны. Затем очистку обоих полуантител можно было осуществлять одновременно с последующим проведением стадии окислительно-восстановительной реакции-гибридизации с получением интактного BsAb. Авторами настоящего изобретения было неожиданно обнаружено, что антитела с узлами в дырках сами по себе гетеродимеризовались и окислялись с образованием полноразмерного антитела (~150 кД), размер которого на 20% превышал общий размер объединенного интактного антитела и полуантитела (~75 кД) (см. таблицу 3).
Клетки-хозяева, экспрессирующие полуантитело с узлом и полуантитело с дыркой, культивировали и индуцировали в отдельных культурах способом, описанным в разделе Метод #1, см. выше. Сбраживаемый бульон целых клеток от каждой культуры смешивали с другим бульоном в трех различных объемных отношениях, а затем центрифугировали с получением одного клеточного осадка. Сбраживаемые бульоны целых клеток смешивали до конечного объема 500 мл в отношении (анти-c-met):(анти-EGFR) 1:1, 2:1 или 1:2, причем предполагается, что на выходе два антитела будут иметь относительно равные количества, и известно, что анти-EGFR полуантитело экспрессировалось на уровне, аналогичном уровню анти-cMet антитела, в одних и тех же условиях. Каждый клеточный осадок ресуспендировали в буфере для экстракции и подвергали лизису. Белок экстрагировали и очищали с помощью хроматографии на белке А, а затем катионообменной хроматографии, как описано в примере 2, Метод #1. Буфер для экстракции содержал 25 мМ Tris, pH 7,5, 125 мМ NaCl и 5 мМ EDTA. При отдельной очистке каждое полуантитело с узлом и полуантитело с дыркой образовывало циклический дисульфид в шарнирной области, то есть внутрицепьевой дисульфид, что предотвращало ковалентное связывание тяжелых цепей с узлом и дыркой. Однако было обнаружено, что при лизисе первой и второй клеток-хозяев, либо после совместного культивирования, либо после смешивания сбраживаемых бульонов целых клеток до центрифугирования, наблюдался некоторый уровень сборки интактных молекул антитела. На фигуре 7 проиллюстрированы молекулы интактного антитела, наблюдаемые в трех отношениях. Это позволяет предположить, что модификации такого метода могут приводить к спонтанному образованию интактного биспецифического антитела, что позволяет в основном избежать необходимости проведения дополнительных стадий химических реакций.
Количественную оценку двух молекул белка осуществляли путем разделения 5 микрограммов белка с помощью электрофореза в ДСН-ПААГ с использованием 4-20% Tris-глицинового геля Novex (Invitrogen, Carlsbad CA). После электрофореза гель окрашивали коллоидным красителем кумасси, содержащим 150 мМ сульфата аммония, 1,74 M уксусной кислоты, 10% метанола и 0,4 г/л красителя кумасси R250 в воде. Гель обесцвечивали 10% уксусной кислотой в воде, а затем уравновешивали в растворе для сушки Gel-Dry (Invitrogen) и сушили между двумя листами целлофана. После сушки геля полосы белка количественно оценивали с помощью визуализирующей ИК-системы Odyssey (LI-COR Biosciences, Lincoln, NE) на 700 нм.
Флуоресцентные сигналы Li-core для интактных антител и полуантител с узлом и дыркой после их одновременного выделения из двух отдельно выращенных культур [измерения проводили для шарнирной области]
Метод #3 - Продуцирование полуантитела с узлом и полуантитела с дыркой в независимых культурах, независимое центрифугирование, смешивание и ресуспендирование осадка с последующим лизисом и очисткой BsAb без добавления восстановителя
Этот метод был проведен в целях уменьшения числа стадий данной процедуры по одновременной очистке полуантител с узлом и с дыркой.
Клетки независимо культивировали и осаждали путем центрифугирования. Осадок смешивали и ресуспендировали в буфере для экстракции. Очевидно, что полуантитела высвобождаются в буфер для экстракции после разрушения клеточных мембран, и что полученный продукт имеет профиль, аналогичный профилю, наблюдаемому для продукта, полученного, как описано выше в разделе «Метод#2».
Пример 3
Продуцирование гетеромультимерных белков с использованием одной смешанной клеточной культуры
В настоящем примере описано получение гетеромультимерных белков из культуры, содержащей две популяции клеток-хозяев, причем в процессе получения этих белков восстановитель не добавляли.
Метод #4 - Продуцирование полуантитела с узлом и полуантитела с дыркой из различных клеточных популяций в одной и той же культуре с получением интактного BsAb без добавления восстановителя
Эксперименты по совместному культивированию сначала осуществляли в 0,5-литровых шейкерных колбах с двумя различными трансформантами E. coli, содержащими полуантитело с узлом или с дыркой. Для проведения этого эксперимента, исходную культуру обоих полуантител с узлом (анти-EGFR антитела) и с дыркой (анти-cMet антитела) получали путем культивирования в течение ночи в среде LB (100 мкг/мл карбенициллина) в 5-мл культурах при 30°C. Ночные культуры с равным OD600 использовали для инокуляции 500 мл полной CRAP-среды (100 мкг/мл карбенициллина) в трех различных отношениях (анти-EGFR:анти-cMet; 1,5:1, 1:1 и 1:1,5), при этом общий объем посевного материала составлял 1/100 от всей культуры. Клетки культивировали в течение 24 часов при 30°C, 200 об/мин. Затем клетки осаждали путем центрифугирования (6750×g, 10 минут, 4°C) и использовали для очистки.
Клетки ресуспендировали в буфере для экстрации, содержащем 25 мМ Tris, pH 7,5, 5 мМ EDTA и 125 мМ NaCl в отношении 100 мл на 10 г клеточного осадка. После экстракции посредством микрофлюидизации и получения препарата для хроматографии, как описано в примере 2, клеточные экстракты в трех различных соотношениях очищали сначала путем захвата биспецифического антитела на 1-мл колонке Mab Select SURE HiTrap (GE Healthcare, S. San Francisco, CA), а затем путем обработки колонки промывочным буфером, содержащим только 40 мМ цитрата натрия при pH 6,0. После промывки и элюирования, проводимых, как описано в примере 2, пулы с иммобилизованным белком A загружали на катионообменную колонку SP-HP и очищали, как описано в примере 2. После разделения на катионообменной колонке, хроматографические пики для каждой из трех процедур очистки объединяли и концентрировали до объема примерно 50-100 микролитров при концентрации белка примерно 15 мг/мл. Очевидно, что начальные соотношения при инокуляции давали различные конечные количества интактного антитела, и по мере снижения молекулярной массы, количество интактного биспецифического антитела было выше, чем это наблюдалось при смешивании клеточных осадков после культивирования в течение ночи при 37°C. См. таблицу 4.
ОЕФ %
Для того чтобы определить, может ли совместное культивирование осуществляться в масштабе 10-литровой ферментации, который является критическим масштабом для такой процедуры, некоторые эксперименты проводили с использованием анти-EGFR и анти-cMet полуантител. Для проведения ферментации в 10-литровом ферментере использовали исходную культуру для инокуляции, содержащую клетки и анти-EGFR и анти-cMet антитела в отношении 1:1. 10-литровые сокультуры выращивали в условиях, идентичных условиям выращивания отдельных культур с полуантителом, как описано в примере 2. Клеточный осадок или весь бульон использовали для экстракции и выделения антитело-содержащего материала способом, описанным выше. Для экстракции данного материала из клеточных осадков, после одной 10-литровой ферментации было получено примерно 2,5 кг пасты. Клеточные осадки ресуспендировали в 5 литрах буфера, содержащего 25 мМ Tris, pH 7,5, и 125 мМ NaCl. Осадок обрабатывали в миксере Polytron в течение 2 минут, а затем ресуспендировали, подвергали микрофлюидизации, осветляли и приготавливали для захвата на белке А, как описано в примере 2. Эксперимент по ферментации повторяли еще два раза, и результаты выделения сокультуры из 10-литровых ферментеров были представлены на фигуре 8C. Для характеризации ~150 кД-белка и ~75 кД-белка проводили масс-спектрометрию в целях определения молекулярных компонентов. Как было неожиданно обнаружено авторами, доминирующим белком с самой высокой молекулярной массой является биспецифическое антитело, а ~75 кД-белком является, главным образом, анти-cMet полуантитело, что обусловлено различными профилями их экспрессии. Это указывает на то, что биспецифическое антитело может полностью образовываться без проведения дополнительных стадий химических реакций. Поскольку биспецифическое антитело представляет собой комбинацию полуантител с узлом и дыркой в стехиометрическом отношении 1:1, то присутствие только 75 кД-белка указывает на то, что большинство полуантител с ограниченным размером было включено в интактное биспецифическое антитело спонтанно.
Это наблюдение привело к разработке упрощенной схемы экспрессии и очистки, как показано на фигуре 8D. После захвата на белке A, антитело разводили 1:1 буфером, содержащим 1,5 M сульфата аммония и 25 мМ фосфата натрия, pH 6,5, и загружали на колонку для гидрофобной хроматографии (ГХ) Dionex Pro Pac HIC-10 размером 4,6 мм×100 мм (Sunnyvale, CA). Был использован градиент 30-60% B, причем буфер A состоял из 25 мМ фосфата натрия, pH 6,95, и 1,5 M сульфата аммония, а буфер B состоял из 25 мМ фосфата натрия, pH 6,95, и 25% изопропилового спирта. Белки разделяли в градиенте 15 КО. Белок был разделен на две крупных молекулы, одна из которых содержала интактное биспецифическое антитело, а другая - избыток анти-EGFR полуантитела. Результаты хроматографического разделения представлены на фигуре 8E. Фракции, содержащие интактное антитело, объединяли и обрабатывали для удаления какого-либо оставшегося примесного эндотоксина, связанного с колонкой S-FF, в 25 мМ натрий-ацетатном буфере при pH 5,0, а затем промывали тем же самым ацетатным буфером, содержащим 0,1% Triton X114, после чего детергент удаляли путем промывки исходным ацетатным буфером. Белок элюировали с колонки S-FF с использованием 25 мМ Tris, pH 8,0, объединяли и анализировали с помощью электрофореза в ДСН-ПААГ и масс-спектрометрии, а затем проводили LAL-тесты на эндотоксин. Белок содержал 0,076 э.ед./мг эндотоксина в конечном препарате, что указывает на то, что этот белок может быть использован для экспериментов in vivo. Конечная характеризация проиллюстрирована на фигуре 8F. ДСН-ПААГ-анализ указывал на то, что большую часть белка составляет конечное интактное биспецифическое антитело, а масс-спектрометрический анализ указывал на ожидаемую молекулярную массу биспецифического антитела и на отсутствие каких-либо примесных молекул в конкретных гомодимерных формах, которые могут присутствовать. Сравнение модифицированного метода, проводимого посредством совместного культивирования, с методом, который требует проведения гибридизации и химической окислительно-восстановительной реакции, проиллюстрировано на фигуре 8G.
Метод #5 - Продуцирование полуантитела с узлом и полуантитела с дыркой в одной и той же культуре с получением интактного BsAb с различными отношениями узел:дырка.
В этом примере показано, что клетки-хозяева, содержащие аналогичные экспрессионные конструкции (отличающиеся только экспрессируемым полуантителом), по своим размерам не отличаются друг от друга и продуцируют интактное BsAb.
Эксперименты продемонстрировали, что регуляция отношения любой цепи может быть легко осуществлена путем коррекции этого отношения при инокуляции до размножения и экспрессии. Эти два штамма по своим размерам не отличались друг от друга.
Для того чтобы определить, сохраняется ли соотношение при инокуляции по сравнению с соотношением при ферментации сокультуры, был проведен эксперимент в целях оценки количества тяжелой цепи с узлом или с дыркой, которое наблюдается по окончании 24-часовой ферментации сокультур с различными соотношениями клеток. Клетки, содержащие плазмиду, кодирующую узел (анти-EGFR антитело) или дырку (анти-c-Met антитело), культивировали отдельно в среде LB (100 мкг/мл карбенициллина) в течение ночи при 30°C. Исходную культуру использовали для инокуляции полной CRAP-среды (100 мкг/мл карбенициллина), имеющей различные соотношения ночных культур, но сохраняющей общий объем инокулята, который составлял 1:100 от конечной культуры. Эти отношения, протестированные для анти-EGFR:анти-c-Met антител, составляли 10:1, 5:1, 2:1, 1:1, 1:2, 1:5 и 1:10. После культивирования в течение 24 часов при 30°C получали образцы клеток, которые анализировали с помощью электрофореза в ДСН-ПААГ в невосстанавливающих условиях (12% трис-глицин), а затем с помощью вестерн-блот-анализа с использованием ПХ-конъюгированного козьего антитела против человеческого IgG-Fc (Bethyl Laboratories, Inc., Montgomery, TX). Тяжелые цепи двух молекул были разделены с помощью электрофореза в ДСН-ПААГ, и результат такого разделения представлен на фигуре 8B. Количество каждого полуантитела коррелирует с отношением инокулята сокультуры, что указывает на то, что клетки, содержащие плазмиды, кодирующие различные полуантитела, не отличаются по своему размеру в сокультуре.
Метод #6 - Продуцирование полуантитела с узлом и полуантитела с дыркой в одной и той же культуре с получением интактного BsAb после сообщения мембране проницаемости
В этом примере показано, что проницаемость мембраны позволяет осуществлять высвобождение полуантител в среду с последующим образованием интактного BsAb без проведения дополнительной химической реакции (например, окислительно-восстановительной реакции или реакции связывания).
Известно, что мутации, приводящие к прекращению синтеза липопротеина, изменяют клеточную мембрану E. coli и сообщают ей способность пропускать периплазматические белки в среду, а также сообщают клеткам E. coli гиперчувствительность к EDTA (Hirota, Y. et al. PNAS 74:1417-1420 (1977)). Было проведено сравнение высвобождения антитела, экспрессированного в штамме 65G4 (W3110 ΔfhuA ΔphoA ilvG+ Δprc spr43H1 ΔdegP ΔmanA laclq ΔompT Δlpp), при добавлении и без добавления EDTA. Клетки, экспрессирующие либо α-IL-4 (дырка), либо α-IL-13 (узел), совместно культивировали, как описано в Методе #4 в отношении 1:1, и выращивали в шейкерном инкубаторе при 200 об/мин в течение 20 часов при 30°C. По окончании инкубирования культуру разделяли на три равных аликвоты. Один образец служил в качестве контроля, в который не добавляли EDTA. В другие два образца добавляли EDTA, pH 8,0, до конечной концентрации 10 мМ. Инкубирование всех образцов продолжали в течение 30 минут, после чего в один из EDTA-обработанных образцов добавляли MgCl2 до конечной концентрации 20 мМ. Все образцы инкубировали еще 30 минут в шейкерном инкубаторе, а затем клетки удаляли путем центрифугирования (9200×g, 20 минут, 4°C), и супернатант фильтровали через GF/F-фильтр (Whatman, Piscataway, NJ) и 0,2 мкм-PES-фильтр (Nalgene, Rochester, NY). Для улучшения фильтрации может быть добавлена ДНКаза 1 коровьей поджелудочной железы (Sigma, St. Louis, MO) до концентрации 4 мг/л.
Затем отфильтрованный супернатант непосредственно загружали на колонку MabSelect SURE HiTrap с 1 мл белка А (GE Healthcare), как описано выше. Иммобилизованный белок элюировали уксусной кислотой, как описано выше, и в этом случае наблюдался максимальный выход белка, который можно видеть на фигуре 9A. Результаты показали, что общая УФ-поглощающая способность возрастает в EDTA-обработанных образцах. Такая поглощающая способность характерна для интактного биспецифического антитела и избыточного количества антитела. См. фигуры 9B и 9C.
В отдельном эксперименте анти-IL-4 и анти-IL-13 полуантитела были экспрессированы отдельно или в виде сокультуры клеток 65G4 в отношении 1:1. Клетки культивировали, как описано выше (Метод #4), за исключением того, что в полную среду CRAP добавляли силиконовый пеногаситель (Fluka, Buchs, Switzerland) в объеме до 0,02% (об./об.). После культивирования клеток в течение 24 часов, при 30°C и при 200 об/мин в шейкерном инкубаторе, добавляли EDTA, pH 8,0, до конечной концентрации 10 мМ, и инкубирование продолжали в течение одного часа, после чего добавляли MgCl2 до 20 мМ. Клетки собирали путем центрифугирования (6750×g, 10 минут, 4°C), супернатант фильтровали (через 0,2 мк PES, Nalgene, Rochester, NY), и антитела иммобилизовали с использованием белка A, как описано выше, а затем анализировали с помощью электрофореза в ДСН-ПААГ и масс-спектрометрии. Результаты, представленные на фигуре 9D, показали, что образование интактного биспецифического антитела наблюдалось только в присутствии обеих половин биспецифического антитела. Кроме того, большая часть анти-IL-13 антитела была включена в биспецифическое антитело без проведения каких-либо дополнительных химических окислительно-восстановительных реакций, поскольку масс-спектрометрия показала, что полоса 75 кД-белка, соответствовала, главным образом, анти-IL-4 полуантителу. Биспецифическое антитело, очищенное на белке A, разводили буфером, сульфатом аммония, в отношении 1:1, после чего очищали на колонке ProPac HIC-10, 7,5 мм×150 мм (Dionex, Sunnyvale, CA) в соответствии с процедурой, описанной в примере 3. Было обнаружено, что интактное биспецифическое антитело элюировалось при времени удерживания 99,68. Этот объединенный пик был проанализирован с помощью электрофореза в ДСН-ПААГ в невосстанавливающих условиях, в результате чего было обнаружено, что он почти полностью состоит из молекул интактного биспецифического антитела. Для подтверждения того, что этот белок представляет собой очищенную гетеродимерную биспецифическую молекулу, авторы проанализировали этот белок с помощью ЖХ/МС ESI-TOF. Примерно 10 микрограммов этого биспецифического антитела впрыскивали в обращенно-фазовую колонку размером 50×2,1 мм с 3 мкм PLRP-S 300 A (Polymer Laboratories), и проводили разделение в 4,3-минутном градиенте 34-45% 0,05% TFA и ацетонитрила на ВЭЖХ-колонке Agilent 1200 Series, где скорость потока составляла 0,5 мл/мин, а нагреватель колонки был установлен на 80°C. Белок, элюирующийся с ЖХ-колонки, анализировали с помощью TOF-анализа Agilent 6210. Наблюдался один пик, содержащий белок, и этот пик был выделен путем деконволюции с помощью компьютерной программы Agilent Mass Hunter версии B.02.00, имеющей следующие параметры: интервал масс 50000-160000, шаг 1,0 Да, порог 30,0 S/N, усредненная масса 90, а неограниченный интервал масс и ширина спектральной линии изотопа устанавливалась автоматически. Основной сигнал указывал на ожидаемую массу биспецифической молекулы. Масса для интактного гетеродимерного биспецифического антитела, вычисленная исходя из аминокислотной последовательности, составляла 144044, что соответствует отклонению 1-2 дальтон от измеренной массы, а вычисленные массы предполагаемых гомодимерных белков составляли 144954,6 для анти-IL-4 антитела, и 145133,4 - для анти-IL-13 антитела.
Авторами настоящего изобретения был снова проведен анализ для того, чтобы определить, могут ли различные отношения инокуляции сохраняться в процессе культивирования для этой серии антител, а также в случае делеции lpp 65G4. Посевные культуры с анти-IL-4 антителом (дырка) или анти-IL-13 антителом (узел) с равными OD600 были использованы для инокуляции 500 мл CRAP-среды в отношениях 2:1 и 1:2, а затем клетки культивировали, и их мембраны делали проницаемыми по окончании ферментации, как описано выше (см. Метод #6). Препараты, полученные на двух различных средах, очищали путем захвата на белке А, а затем подвергали ГХ-разделению, как описано выше, за исключением того, что рН ГХ-буферов А и В снижали до 6,5. Результаты, полученные при двух различных соотношениях исходной культуры, представлены на фигуре 9E. Как наблюдалось, большая часть белка представляла собой интактное биспецифическое антитело. Другие пики были охарактеризованы с помощью масс-спектрометрии, и эти пики представлены на фигуре 9E. Анти-IL-13 полуантитело почти не детектировалось, но при этом наблюдалось значительно большее количество анти-IL-4 антитела. При отношении анти-IL-4 антитела к анти-IL-13 антителу, равном 33/66, наблюдалось большее количество анти-IL-13 антитела, но небольшое количество анти-IL-4 антитела все еще сохранялось. В данном случае авторами было обнаружено, что отношение, существующее при инокуляции, поддерживалось в процессе всего культивирования, и что оптимизация такого процесса может быть достигнута путем сбалансирования отношений экспрессируемых полуантител посредством изменения отношений исходной культуры.
Авторами настоящего изобретения был продолжен анализ такого процесса экспрессии сокультур в дельта-lpp-клетках с использованием ряда различных вариантов антител. На фигуре 9F показаны конечные очищенные белки, полученные после проведения гидрофобной хроматографии нескольких репрезентативных полуантител.
Пример 4
Библиотеки гетеромультимерных белков
В этом примере проиллюстрировано создание библиотеки гетеромультимерных белков.
Некоторые методы, которые могут быть применены для скрининга смесей биспецифических антител или для быстрого создания крупных массивов биспецифических антител, описаны ниже.
Метод # 7
В некоторых случаях бывает неясно, каким образом следует выбирать биспецифическое антитело, и этот выбор может быть осуществлен путем комбинирования многих различных полуантител. Альтернативно, может оказаться желательной конкретная комбинация для конъюгируемых антител, например, комбинация анти-IL-4 антитело/анти-IL-13 антитело, однако, для этого необходимо выбрать ряд полуантител-кандидатов. Выбор конкретной комбинации полуантител, которая дает наилучшее связывание или эффективность, может быть осуществлен путем комбинирования полуантител в виде матрицы, что позволяет быстро получить множество вариантов биспецифических антител. Для проведения этого эксперимента, одно антитело, такое как анти-CD3 антитело, может быть продуцировано примерно с 10-кратным (или более) избытком по сравнению с количеством антитела, необходимого для скрининга. Затем эта молекула может быть подвергнута гибридизации и окислению методом, описанным в примере #1. Примерно 1/10 от общего количества первого антитела может быть использована для объединения с равным количеством примерно 10 полуантител, нацеленных на различные антигены (таких как анти-CD19 антитело, анти-CD20 антитело и т.п.), как показано на диаграмме, представленной на фигуре 10. Если для объединения с полуантителами со вторым спектром действия необходимо дополнительное «первое» антитело, то это может быть осуществлено с получением набора молекул для скрининга.
Во второй модификации данного метода, «первое» антитело (такое как анти-CD3 антитело) может быть продуцировано в сокультуре с использованием «нормальных» клеток-хозяев E. coli или с использованием мутантного штамма, имеющего нефункциональный липопротеиновый фенотип. Такое полуантитело можно затем систематически добавлять к каждому из вариабельных полуантител, продуцирующих массив биспецифических молекул, каждая из которых содержит «первое» нацеливающее полуантитело.
Метод # 8
«Первое» полуантитело может быть объединено с множеством альтернативных полуантител-партнеров в способе, который состоит из продуцирования этого полуантитела в количестве, достаточном для объединения со всеми другими объединяемыми полуантителами. Затем может быть осуществлена объемная гибридизация в одной реакции так, чтобы «первое» полуантитело представляло собой вариант тяжелой цепи с узлом или дыркой, а набор «вторых» нацеливающих полуантител содержал комплементарные мутантные полуантитела. В данном случае может быть получена сложная смесь антител в виде комбинации, которая может быть использована для лечения заболевания.
Альтернативно, технология совместного культивирования, проводимая с применением методов, описанных в вышеприведенных примерах, может быть использована для получения сложной смеси биспецифических антител в виде набора «первых» полуантител и вариабельных «вторых» полуантител. Такая смесь может быть затем выделена во всей своей совокупности и использована в качестве материала для скрининга так, чтобы позитивный результат в пуле биспецифических вариантов мог быть затем подвергнут деконволюции для определения активных молекул биспецифического антитела, либо такая объединенная смесь может быть использована в качестве более эффективной терапевтической смеси.
Пример 5
Активность in vitro
В этом примере описаны биспецифические антитела, которые обладают активностью в системах in vitro. Две клеточные линии были использованы в этом примере 5 и в примере 6, описанном ниже. В этих экспериментах с KP4, клеточная линия карциномы протока поджелудочной железы, и A431, клеточная линия эпидермоидной карциномы, в значительной степени активировались Met или EGFR, соответственно, и поэтому такие клеточные линии могут быть использованы в качестве подходящих клеточных линий и опухолевых ксенотрансплантатов для оценки эффективности bsAb против каждой независимой мишени.
Клеточная линия KP4 была получена из банка клеток Riken BioResource Center Cell Bank (Cell line #: RCB1005; 3-1-1 Koyadai, Tuskuba-shi, Ibaraki 305-0074 Japan). Клеточная линия A431 (CRL-1555) была получена из Американской коллекции типовых культур (ATCC, Manassas, VA).
Раковые клетки A431 один раз промывали PBS, ресуспендировали в бессывороточной среде, подсчитывали, а затем добавляли в 96-луночные планшеты (2500 клеток/лунку). После этого клетки по отдельности обрабатывали человеческим HGF (0,5 нМ) и TGFα (0,05 нМ) или дозами, в определенном интервале, либо (1) анти-EGFR антителом, либо (2) анти-c-met антителом (анти-c-met антителом «с одной «рукой»»), либо (3) комбинацией анти-EGFR антитела и анти-c-met антитела, либо (4) биспецифическим анти-EGFR/анти-c-met антителом. Анализы AlamarBlue™ осуществляли в течение трех дней в соответствии с рекомендациями производителей (BioSource International; Camarillo, CA). Величины IC50 определяли с помощью нелинейного регрессионного анализа с 4-параметрической моделью (KaleidaGraph ver. 3.6, Synergy Software; Reading, PA).
В анализе с использованием клеток KP4, который проводили в Met-зависимом формате in vitro и in vivo, рост, стимулированный путем обработки TGF-альфа и HGF, может быть ингибирован анти-c-met антителом, комбинацией анти-c-met антитела и анти-EGFR антитела и биспецифическим антителом. Обработка этих клеток анти-EGFR антителом, используемым в качестве одного агента, давала ограниченную активность. Однако ингибирование под действием биспецифического антитела, наблюдаемое в клетках KP4, было более сильным, чем ингибирование одним анти-c-met антителом или анти-c-met антителом и анти-EGFR антителом, добавленных по отдельности. В клетках A431, которые были первоначально индуцированы EGFR, ни одно из отдельно взятых анти-EGFR антител или анти-c-met антител не обладали способностью к значительному ингибированию пролиферации клеток. Комбинация обеих молекул обнаруживала некоторую степень ингибирования пролиферации клеток, однако биспецифическое антитело обладало более высокой активностью при тех же самых концентрациях. Кроме того, эти клетки, помимо снижения уровня пролиферации, также обнаруживали апоптоз.
В этих анализах биспецифическое антитело антитело обладало улучшенными свойствами по сравнению с другими антителами, взятыми отдельно, или по сравнению с комбинацией анти-Met и анти-EGFR антител, добавленных отдельно. Эти данные позволяют предположить, что расположение анти-Met антитела и анти-EGFR антитела вместе на одном антителе позволяет получить биспецифическое антитело с превосходными свойствами. Результаты представлены на фигуре 11.
Пример 6
Активность in vivo
В этом примере показано, что описанные здесь биспецифические антитела обладают активностью в моделях in vivo.
Самки «голых» мышей в возрасте 6-8 недель и весом 22-30 г были получены из лаборатории Charles River Laboratories, Inc. (Hollister, CA). Эти мыши содержались в лаборатории Genentech в клетках микроизолятора в стандартных условиях содержания грызунов, и этих мышей, до имплантации им опухолевых клеток, оставляли по меньшей мере на 3 дня для аклиматизации. В этом исследовании использовали только тех животных, которые были здоровыми на вид и не имели каких-либо очевидны патологий. Все экспериментальные процедуры были проведены в соответствии с директивами, установленными Американским физиологически обществом, и были одобрены Научным комитетом по уходу и содержанию животных Genentech. Мышам подкожно инъецировали либо клетки рака поджелудочной железы KP4 человека (5 миллионов клеток в сбалансированном солевом растворе Хэнкса (HBSS) плюс Matrigel (BD Biosciences) на мышь), либо клетки эпидермоидной карциномы A431 человека (5 миллионов клеток в HBSS плюс Matrigel/мышь). Когда опухоли достигали размера ~150 мм3, мышей произвольно распределяли по группам и обрабатывали носителем или биспецифическим анти-EGFR/c-met антителом (bsEGFR/c-met) (50 мг/кг, i.р. 1x/неделю) в течение 2 недель.
Объем опухоли вычисляли в двух измерениях (длина и ширина) с использованием штангенциркуля Ultra Cal-IV (Model 54-10-111; Fred V. Fowler Co.; Newton, MA) и анализировали с помощью программы Excel, версия 11.2 (Microsoft Corporation; Redmond WA). Графики ингибирования опухоли строили с использованием программы KaleidaGraph, версия 3.6 (Synergy Software; Reading, PA). Объем опухоли вычисляли по следующей формуле:
Размер опухоли (мм3)=(длина×ширина2)×0,5
Данные анализировали методом смешанного моделирования, описанным ниже. В данном случае точную величину среднего и стандартного отклонения не вычисляли. Вместо этого вычисляли стандартное отклонение с учетом вариабельности и доверительных интервалов. Эти данные представлены в таблице как верхний и нижний пределы, указанные в скобках за величинами AUC/день % TGI. Массы тела животных измеряли по шкале Adventura Pro AV812 (Ohaus Corporation; Pine Brook, NJ). Графики строили с использованием программы KaleidaGraph, версия 3.6. Процент изменения массы вычисляли по следующей формуле:
Процент измерения массы для группы = (новая масса - исходная масса)/исходная масса)×100
Для анализа соответствия повторных измерений объема опухоли у тех же самых животных в зависимости от времени, применяли метод смешанного моделирования (Pinheiro et al., Linear and Nonlinear Mixed Effects Models. (2008), пакет программ R версия 3.1-89). Этот подход был основан на повторных измерениях и исключении небольшого числа животных из исследования из-за летального исхода, не связанного с их лечением, до окончания исследования.
Кубический регрессионный сплайн использовали для построения нелинейной кривой log2 объема опухоли в зависимости от времени для каждого уровня доз. Затем по этим нелинейным профилям устанавливали зависимость от дозы в смешанной модели. Ингибирование роста опухоли, выражаемое как процент по отношению к носителю, (%TGI) вычисляли как процент площади под построенной кривой (AUC) для соответствующей дозовой группы по отношению к группе, которой вводили носитель, по следующей формуле:
%TGI=100× (1-AUCдоза/AUCноситель)
Для определения интервалов неопределенности (Ul) для %TGI, использовали построенную кривую и построенную ковариационную матрицу в целях создания случайной выборки как аппроксимации распределения %TGI. Случайная выборка состояла из 1000 реализаций, имитирующих построенную смешанную модель, где %TGI был повторно вычислен для каждой реализации. Сообщаемые Ul представляют собой величины интервалов времени, где в пределах этого интервала времени 95% повторно вычисленных величин %TGI должны входить в данную область построенной модели. 2,5-ый и 97,5-ый процентили имитированного распределения были использованы как верхний и нижний пределы Ul.
Построение графика осуществляли с использованием программы R, версии 2.8.1 (R Development Core Team 2008; R Foundation for Statistical Computing; Vienna, Austria) и Excel, версии 12.0.1 (Microsoft Corporation). Данные были проанализированы с использованием R, версии 2.8.1, и были построены смешанные модели с использованием пакета программ nlme, версии 3.1-89 (Pinheiro et al., 2008).
На фигурах 12 и 13 показана активность in vivo биспецифического анти-EGFR/c-met антитела в модели ксенотрансплантата поджелудочной железы KP4 и в модели ксенотрансплантата эпидермоидной карциномы A431, соответственно. Биспецифическое антитело обладало способностью ингибировать рост опухоли in vivo для обеих моделей по сравнению с контрольными животными, которых обрабатывали только носителем. Эти графики показали, что объем опухоли, предсказанный по линейной модели смешанных эффектов (LME), снижался при введении биспецифического антитела, и в ксенотрансплантатах KP4 объем опухоли составлял 505 мм3 через 20 дней после обработки, тогда как объем опухоли после обработки носителем, содержащим одну «руку», составлял 1710 мм3; а в ксенотрансплантатах A431,объем опухоли составлял 328 мм3 через 20 дней после обработки, тогда как объем опухоли после обработки только носителем-контролем составлял 495 мм3. Все эти значения, определенные как AUC/день, давали значимое изменение, выражаемое как %TGI. Для обработки биспецифическим антителом ксенотрансплантата KP4, наблюдалось 85% ингибирование роста опухоли (TGI), а для моделей ксенотрансплантата A431 наблюдалось 68% TGI.
Пример 7
Продуцирование гетеромультимерного белка с использованием клеточной культуры СНО
В этом примере проиллюстрировано продуцирование гетеромультимерных белков из культуры, содержащей популяцию двух клеток-хозяев CHO.
Полуантитела, содержащие мутации в узлах или в дырках, продуцировали в отдельных культурах путем временной экспрессии тяжелой и легкой цепей с использованием конструкций и с применением методов, хорошо известных специалистам. (См., например, Ye et ai, Biotechnol Bioeng. 2009 Jun 15;103(3):542-51). Клетки культивировали в 1 литре среды (см., например, Wong et al., J. Biol. Chem. 2007 282(31):22953-22963) и собирали через 14 дней.
Каждое полуантитело было иммобилизовано на 5-мл колонке MabSURE SELECT. Эту колонку промывали 10 колоночными объемами (КО) уравновешивающего буфера, а затем 10 колоночными объемами натрий-цитратного буфера низкой проводимости (уравновешивающий буфер состоял из 50 мМ Tris, pH 8,0, 150 мМ NaCl, 0,05% Triton X-100, 0,05% Triton X-114, а промывочный буфер низкой проводимости состоял из 25 мМ цитрата натрия, pH 6,0). Каждую «руку» элюировали с использованием 0,15 M ацетата натрия, pH 2,7.
Каждое полуантитело диализовали против 50 мМ Tris, pH 8,0, 150 мМ NaCl, 1 мМ EDTA в отношении 1:300 при комнатной температуре в течение ночи. Затем каждую «руку» центрифугировали, фильтровали на 0,22-микронном фильтре из ацетата целлюлозы, и две ветви смешивали вместе в отношении 1:1 (общая концентрация составляла менее 2 мг/мл). Затем смесь обрабатывали одним из двух нижеследующих способов:
Окислительно-восстановительная реакция (в водяной бане): Смесь нагревали в водяной бане при 37°C. Через один час смесь, подвергнутую окислительно-восстановительной реакции, вынимали из водяной бани и оставляли для охлаждения до комнатной температуры. После нагревания смеси до комнатной температуры добавляли свежеприготовленный восстановитель, дитиотреитол (DTT), до конечной концентрации 2 мМ DTT. Смесь оставляли на два часа при комнатной температуре, а затем концентрировали с помощью центрифужных фильтров Amicon Ultracell (10K) до достижения концентрации 11 мг/мл и диализовали против 50 мМ Tris, pH 8,0, 150 мМ NaCl (1:300) в течение ночи.
Окислительно-восстановительная реакция (без водяной бани): Смесь оставляли на 3 часа при комнатной температуре, после чего добавляли свежеприготовленный восстановитель, дитиотреитол (DTT), до конечной концентрации 2 мМ DTT. Смесь оставляли на два часа при комнатной температуре, а затем концентрировали с помощью центрифужных фильтров Amicon Ultracell (10K) до достижения концентрации 11 мг/мл и диализовали против 50 мМ Tris, pH 8,0, 150 мМ NaCl (1:300) в течение ночи.
После проведения окислительно-восстановительной реакции, собранный материал очищали на 15-миллилитровой ГХ-колонке ProPac 10 с использованием 20 КО градиента, как описано в предыдущем разделе. В качестве рабочего буфера использовали 25 мМ фосфата калия, 0,7M сульфата аммония, pH 6,5, а в качестве элюирующего буфера использовали 25 мМ фосфата калия, pH 6,5, 25% изопропанол. 1-миллилитровые фракции собирали, и фракции пика разделяли с помощью электрофореза в 4-20% Tris-глициновом ПААГ с ДСН для анализа на чистоту, а затем объединяли в пул. После этого пулы концентрировали на центрифужных фильтрах Amicon Ultracell (10K) до концентрации примерно 1,5 мг/мл и диализовали против 50 мМ триса, pH 8,0, 150 мМ NaCl, а затем фильтровали через 0,22-мкм фильтр.
Идентичность каждого собранного биспецифического антитела подтверждали с помощью масс-спектрометрии. Чистоту анализировали с помощью электрофореза в 4-20% Tris-глициновом ПААГ с ДСН и на биоанализаторе. Уровни агрегации определяли с помощью SEC-MALS.
Результаты представлены на фигурах 14-19. Этот пример продемонстрировал, что биспецифические антитела могут быть продуцированы с использованием клеток-хозяев CHO. Для специалиста в данной области очевидно, что этот способ может быть применен для продуцирования и других гетеромультимерных белков.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ ГЕТЕРОМУЛЬТИМЕРНЫХ БЕЛКОВ С ИСПОЛЬЗОВАНИЕМ КЛЕТОК МЛЕКОПИТАЮЩИХ | 2015 |
|
RU2727012C2 |
| УЛУЧШЕННАЯ СБОРКА БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2012 |
|
RU2654567C2 |
| СОДЕРЖАЩИЕ СУПЕРСПИРАЛЬ И/ИЛИ ПРИВЯЗКУ БЕЛКОВЫЕ КОМПЛЕКСЫ И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2573915C2 |
| БИСПЕЦИФИЧЕСКИЕ АСИММЕТРИЧНЫЕ ГЕТЕРОДИМЕРЫ, СОДЕРЖАЩИЕ АНТИ-CD3 КОНСТРУКЦИИ | 2013 |
|
RU2650868C2 |
| АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО VISTA И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2746994C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ IL-4 И/ИЛИ IL-13, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2580049C2 |
| МОДУЛЯТОРЫ Р-СЕЛЕКТИН ГЛИКОПРОТЕИН ЛИГАНДА 1 | 2004 |
|
RU2407539C2 |
| ГЕТЕРОДИМЕРНЫЕ ПОЛИПЕПТИДЫ IL-17 A/F И ВОЗМОЖНОСТИ ИХ ЛЕЧЕБНОГО ПРИМЕНЕНИЯ | 2007 |
|
RU2440134C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА FcγRIIB И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2404991C2 |
| ПОЛИПЕПТИДНЫЕ ВАРИАНТЫ С ИЗМЕНЕННОЙ ЭФФЕКТОРНОЙ ФУНКЦИЕЙ | 2005 |
|
RU2367667C2 |

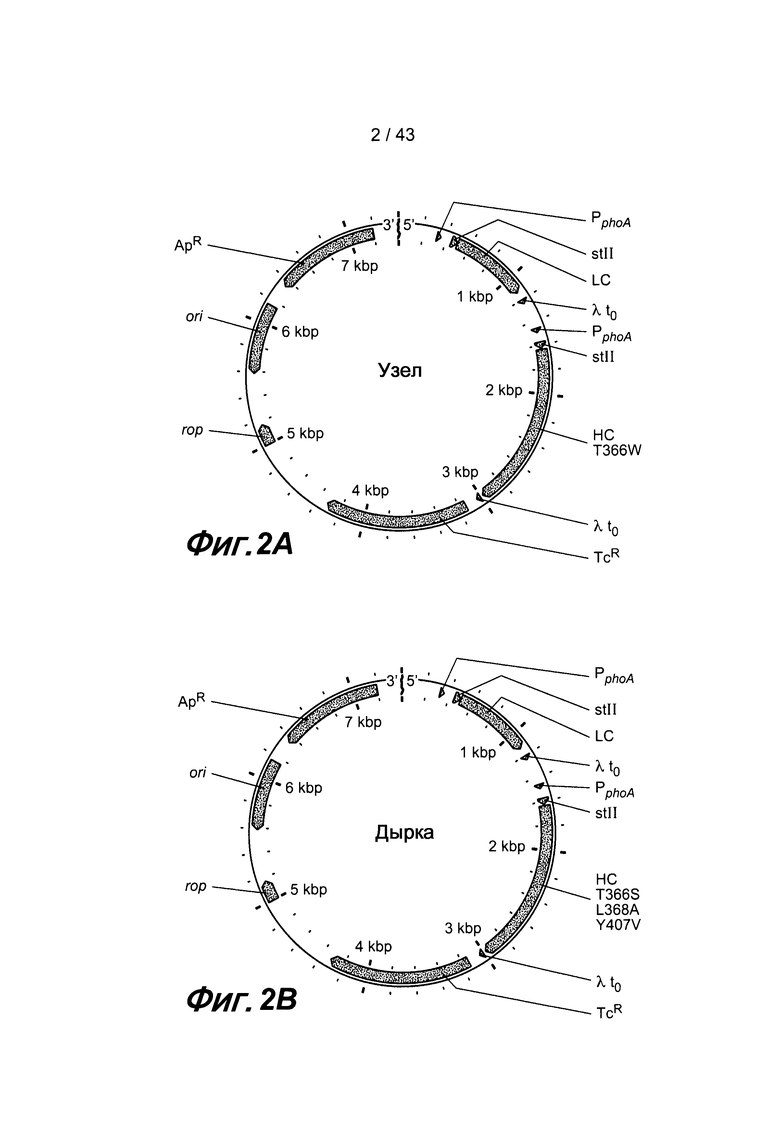
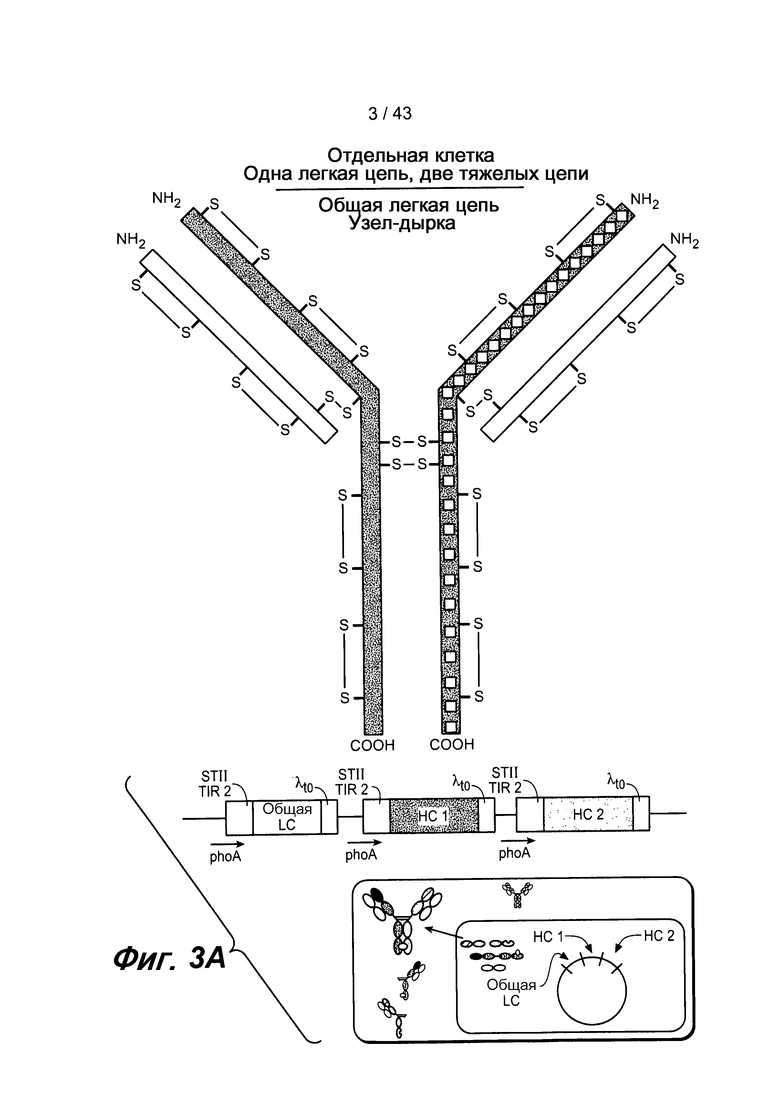
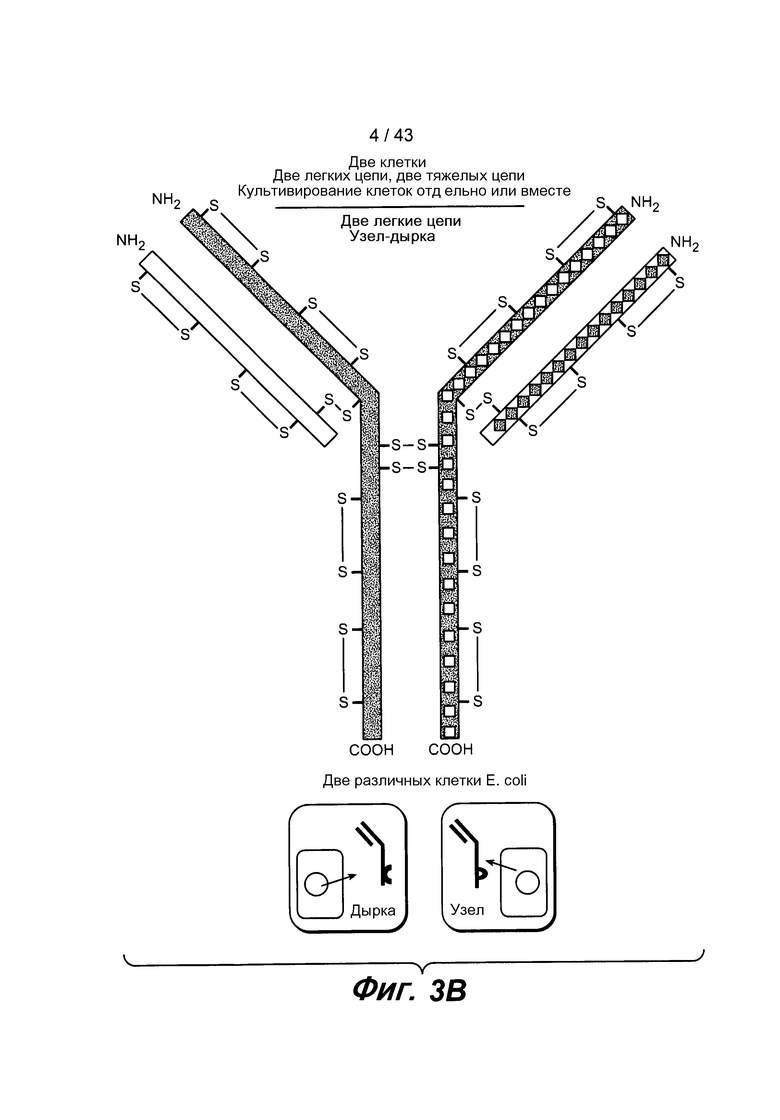


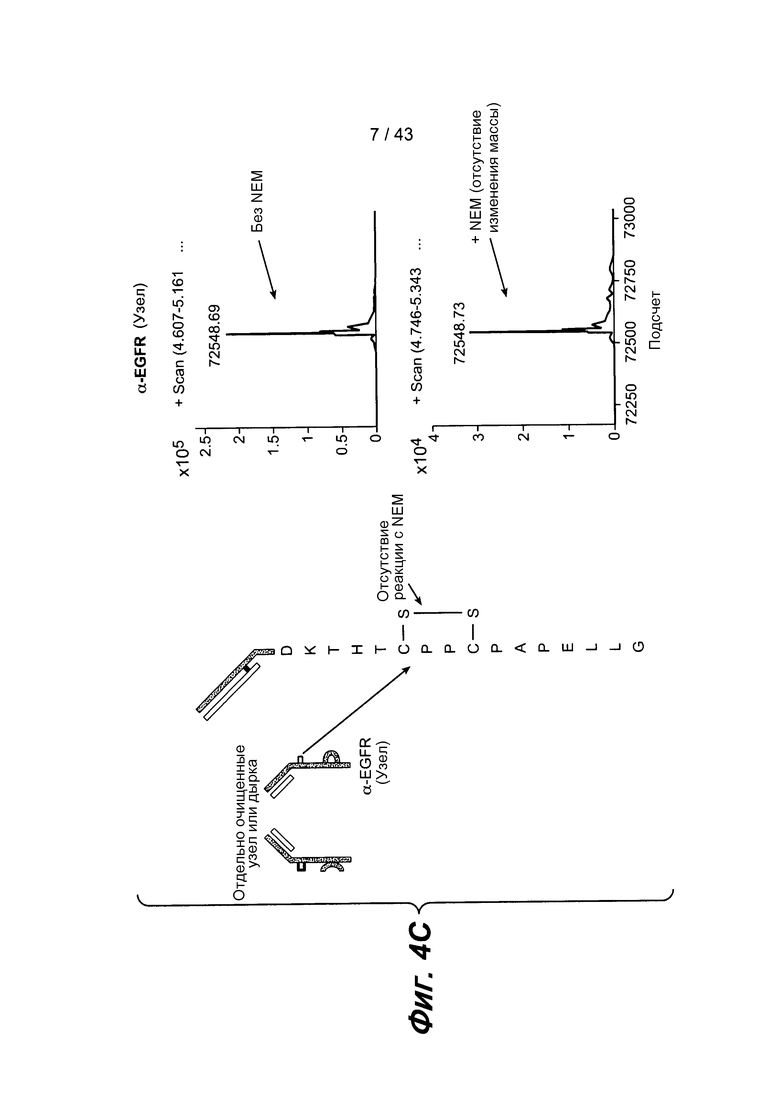


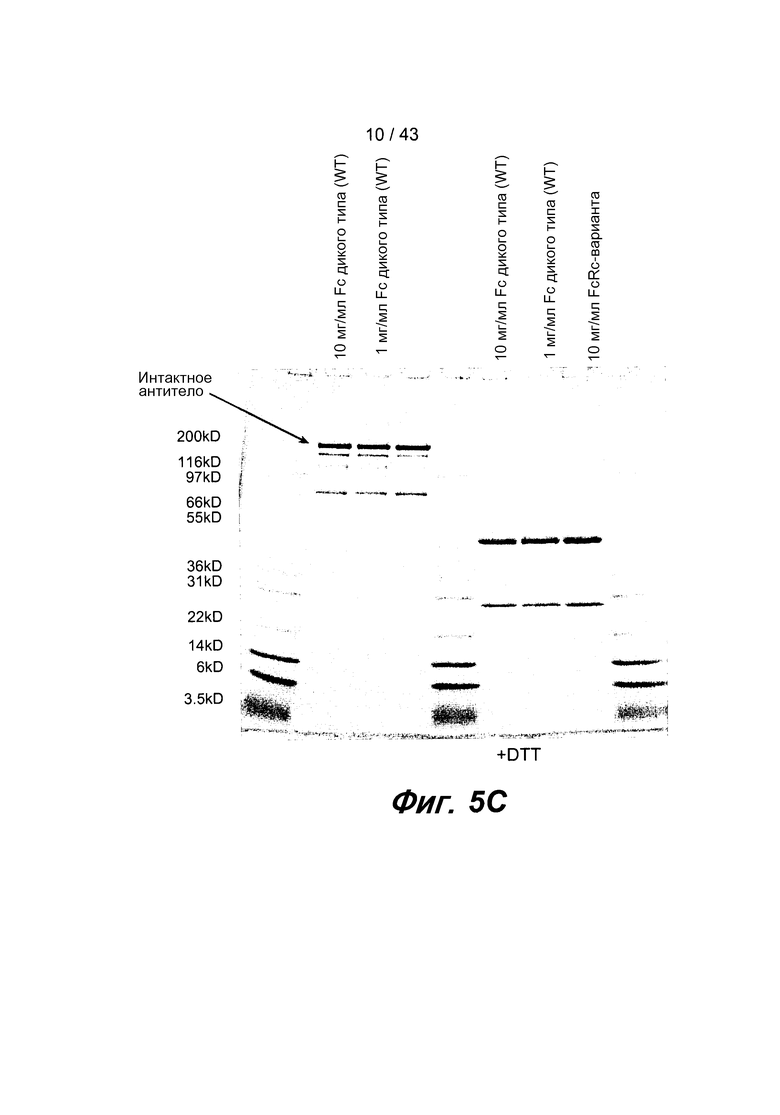
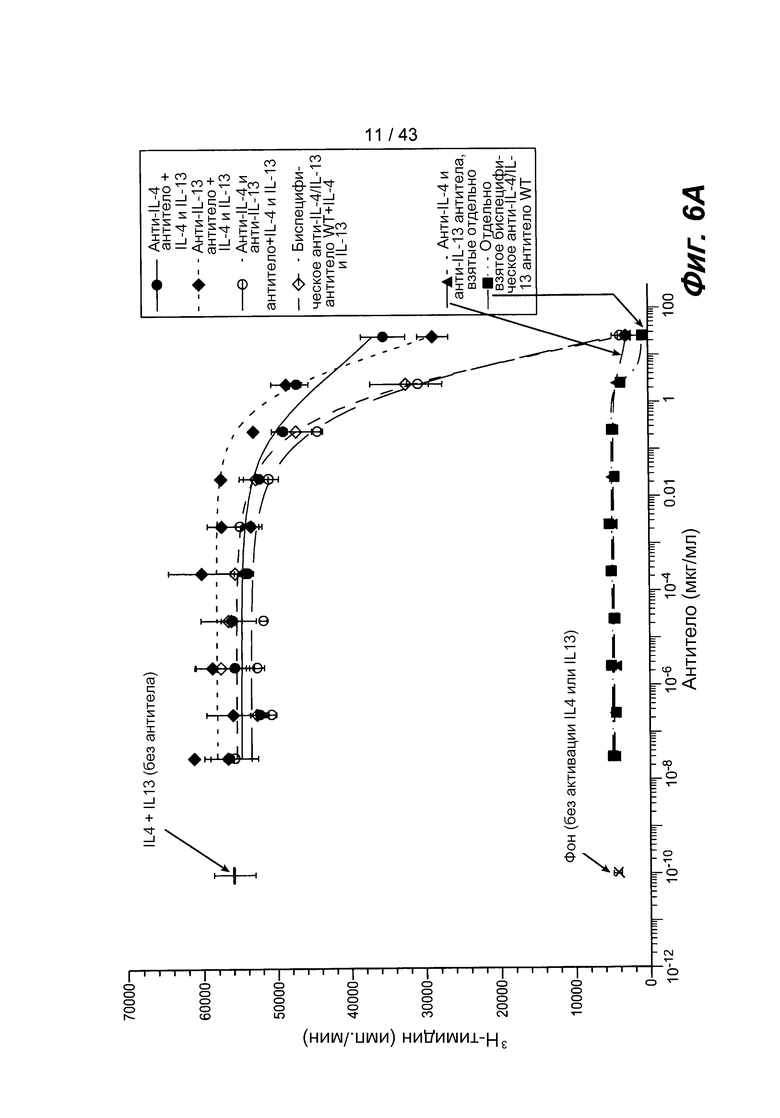
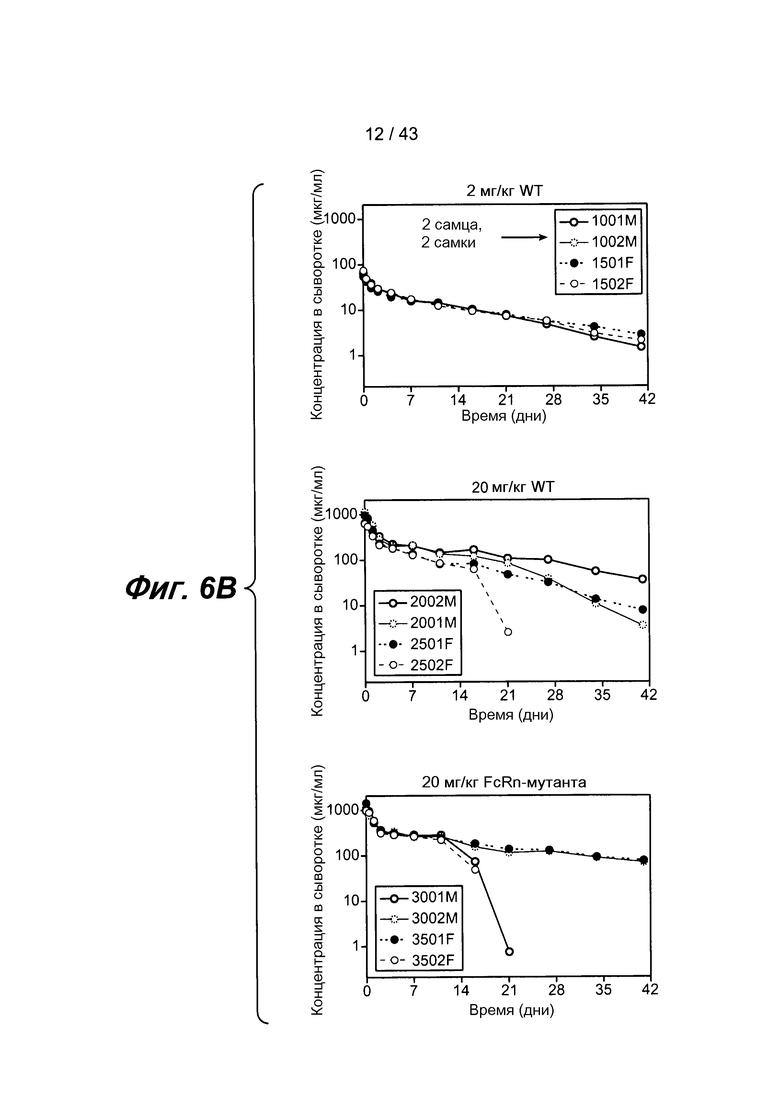

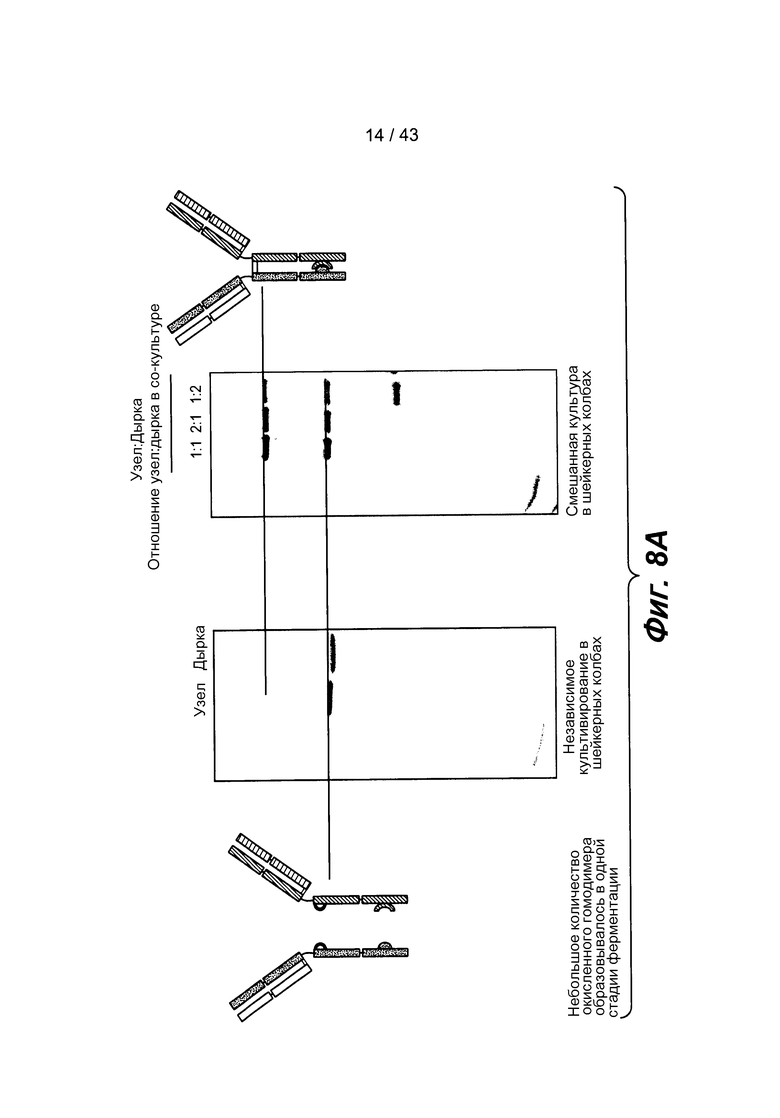
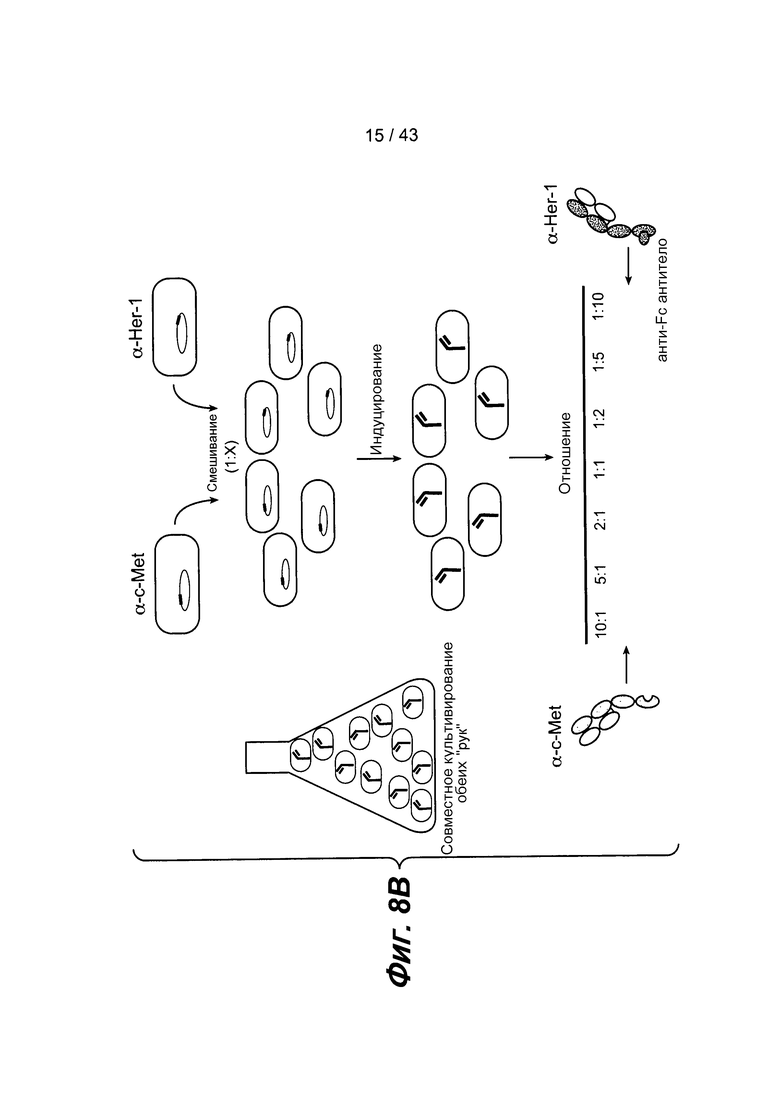
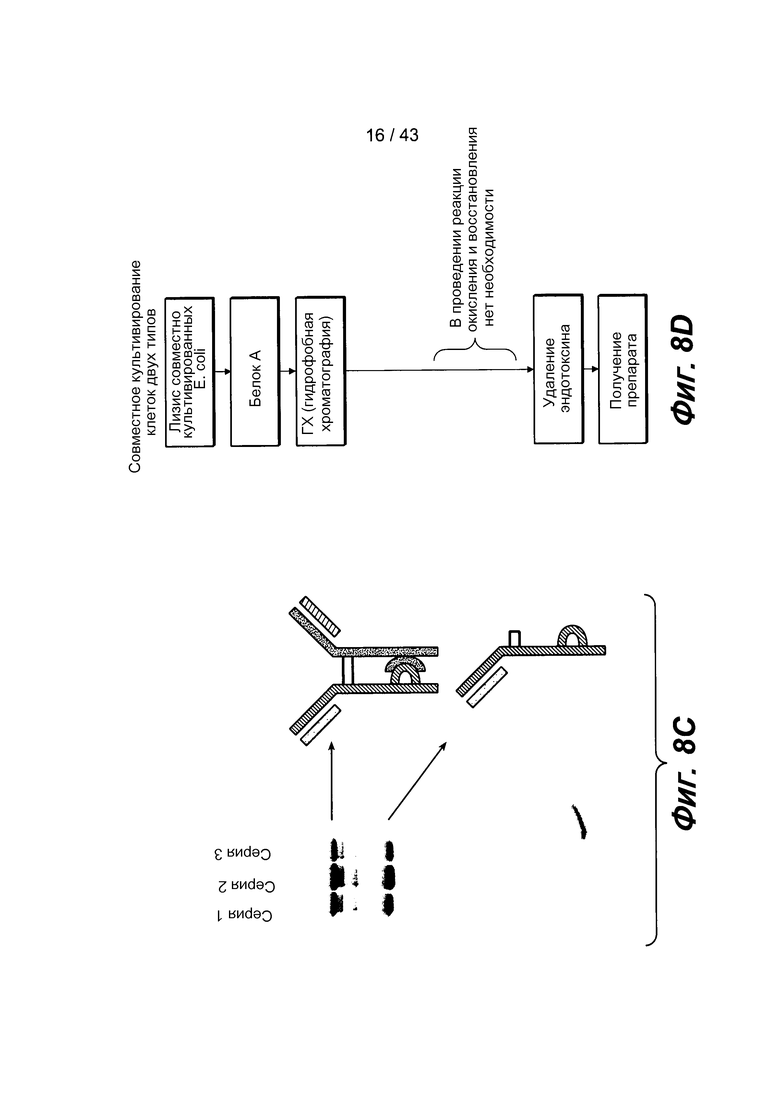
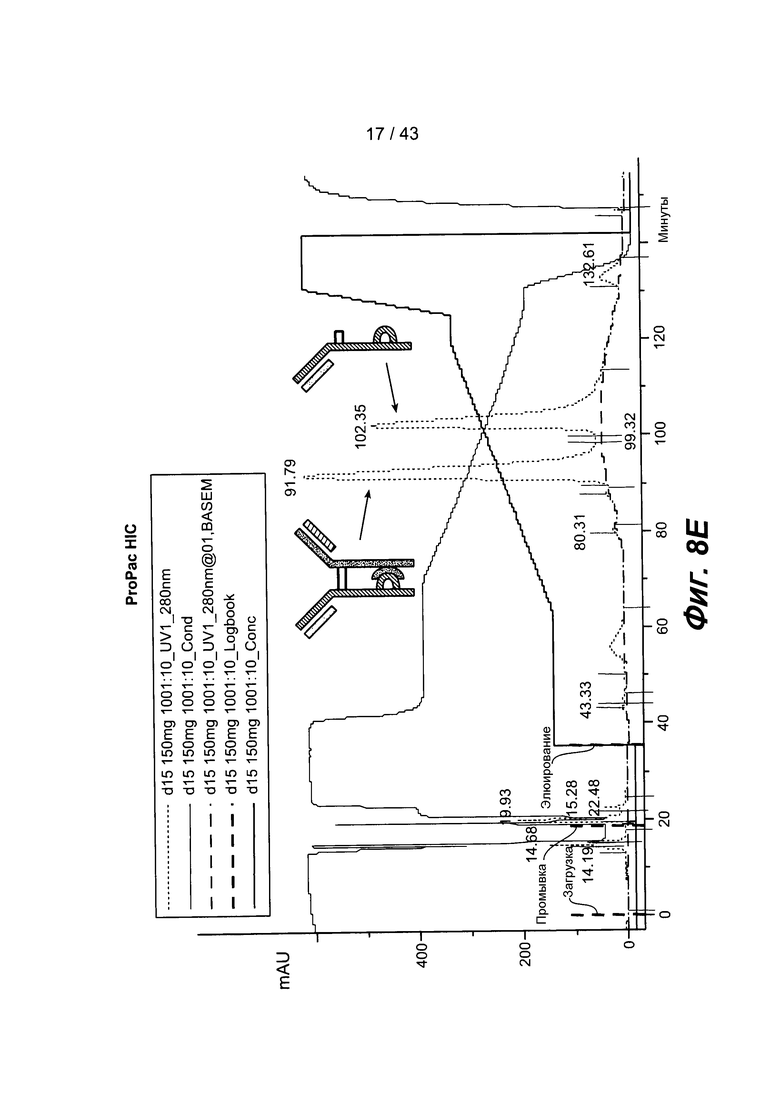
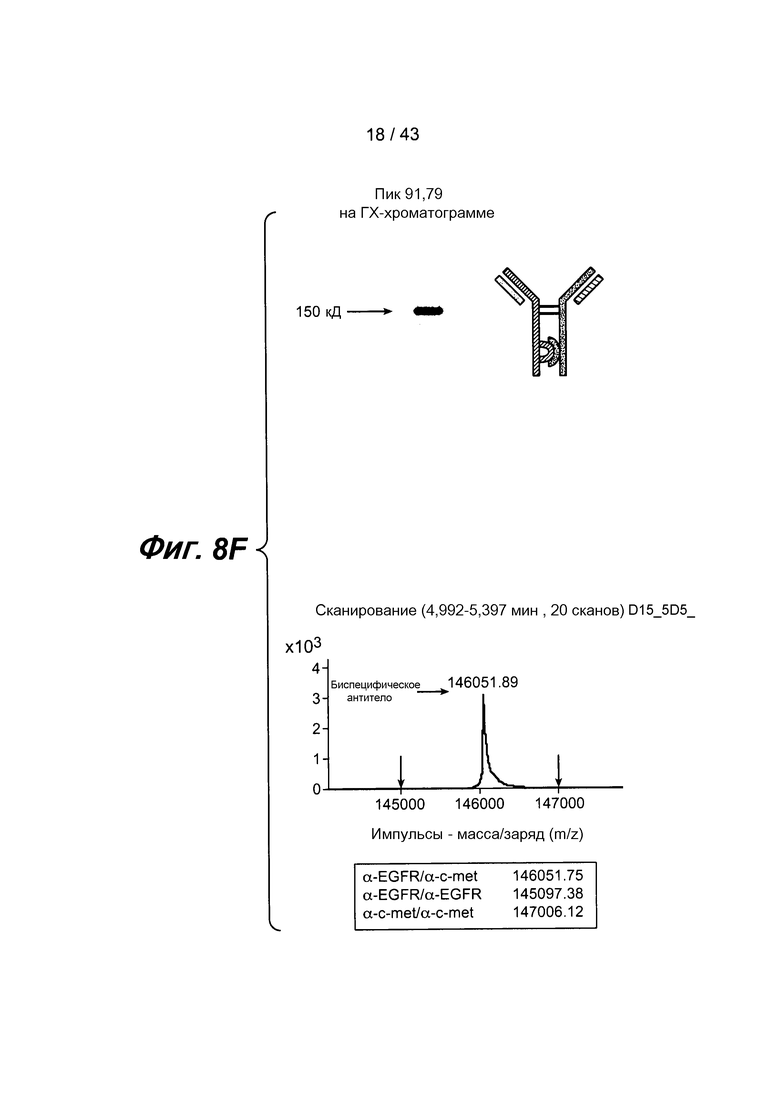
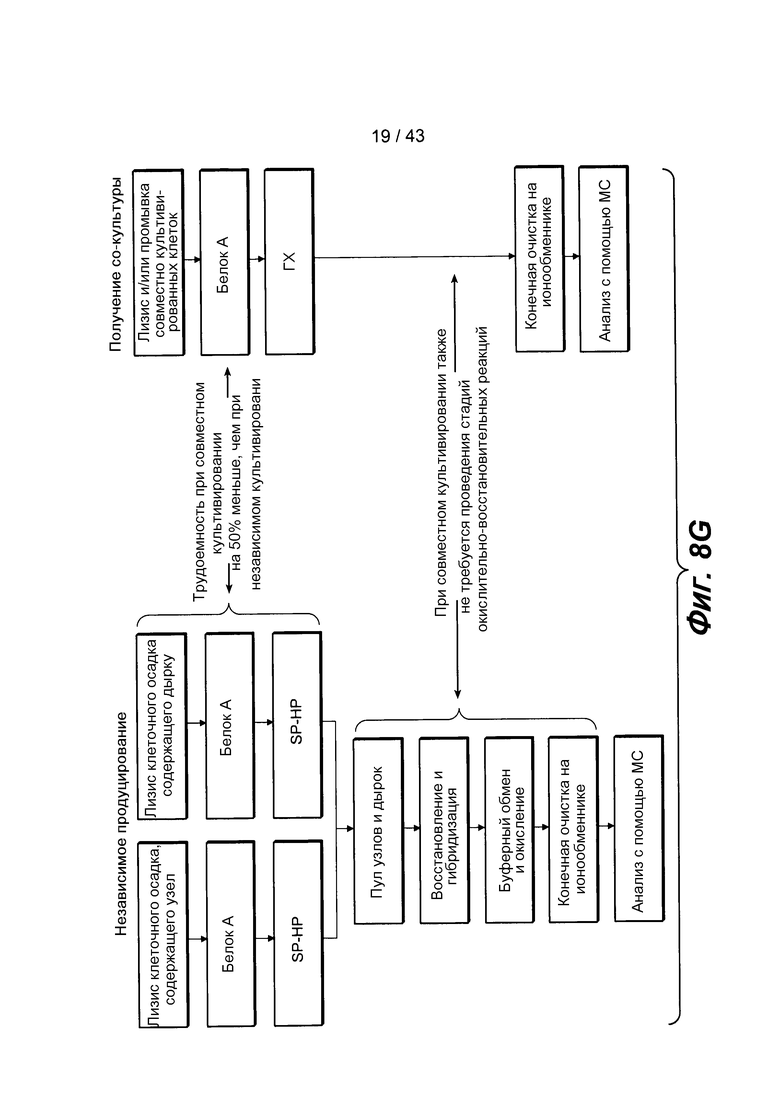
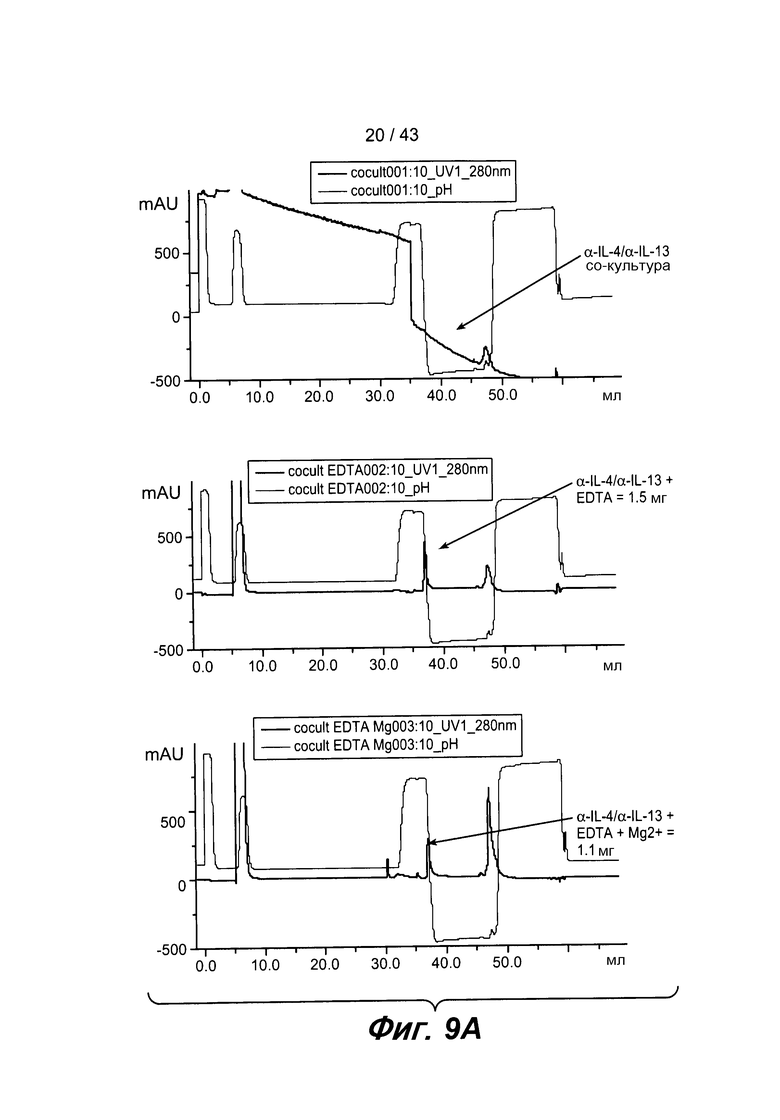
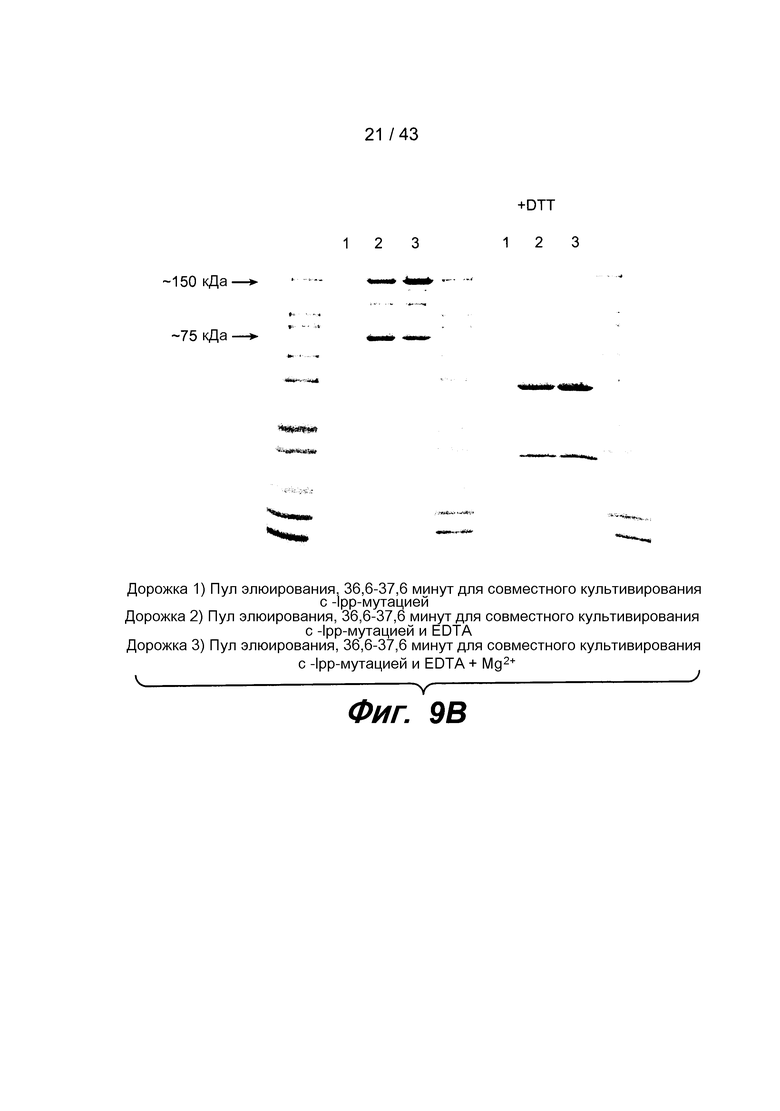

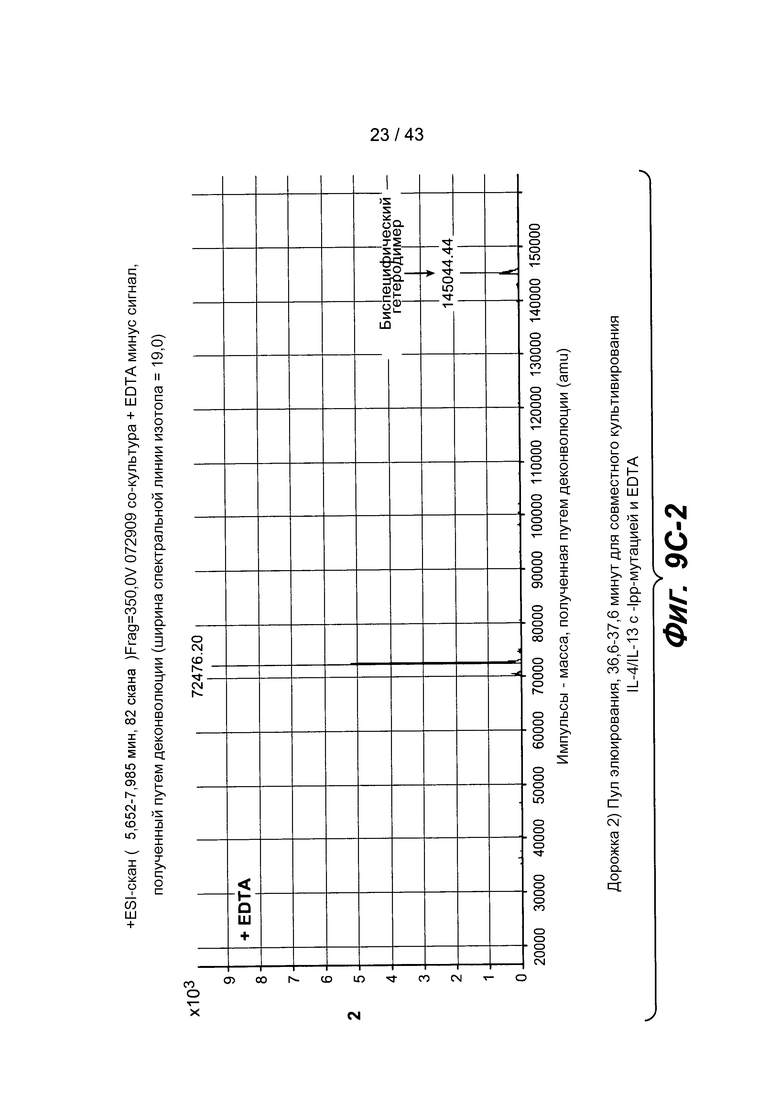
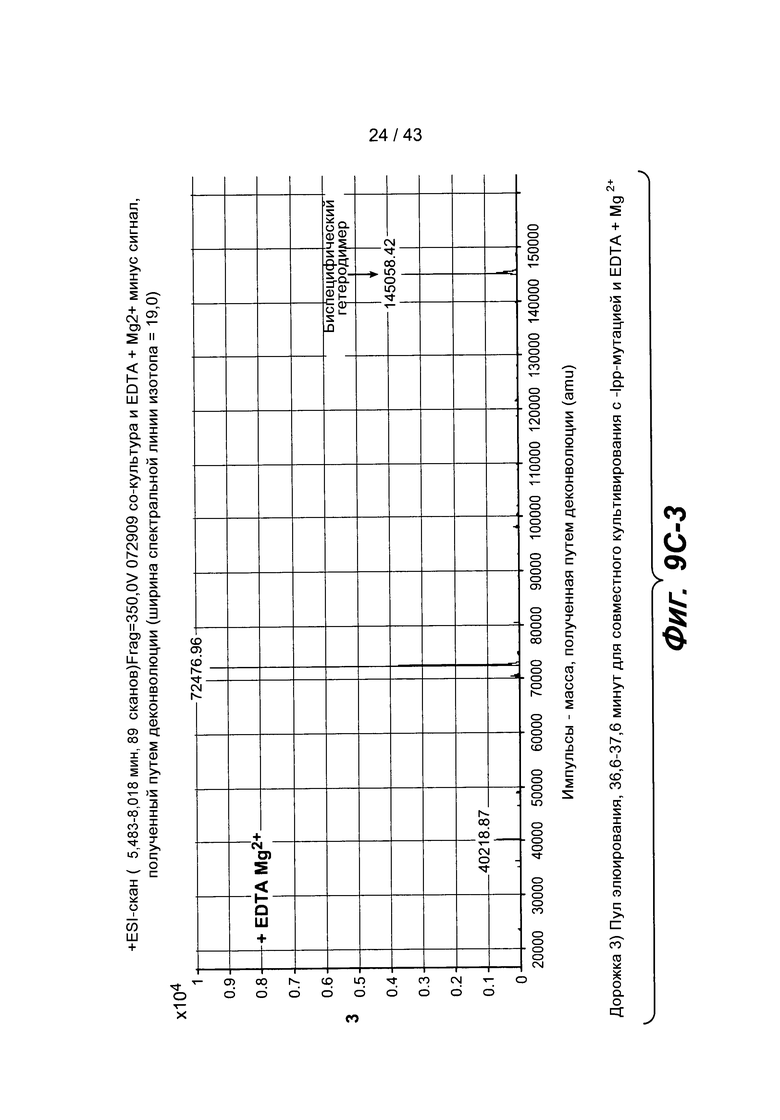

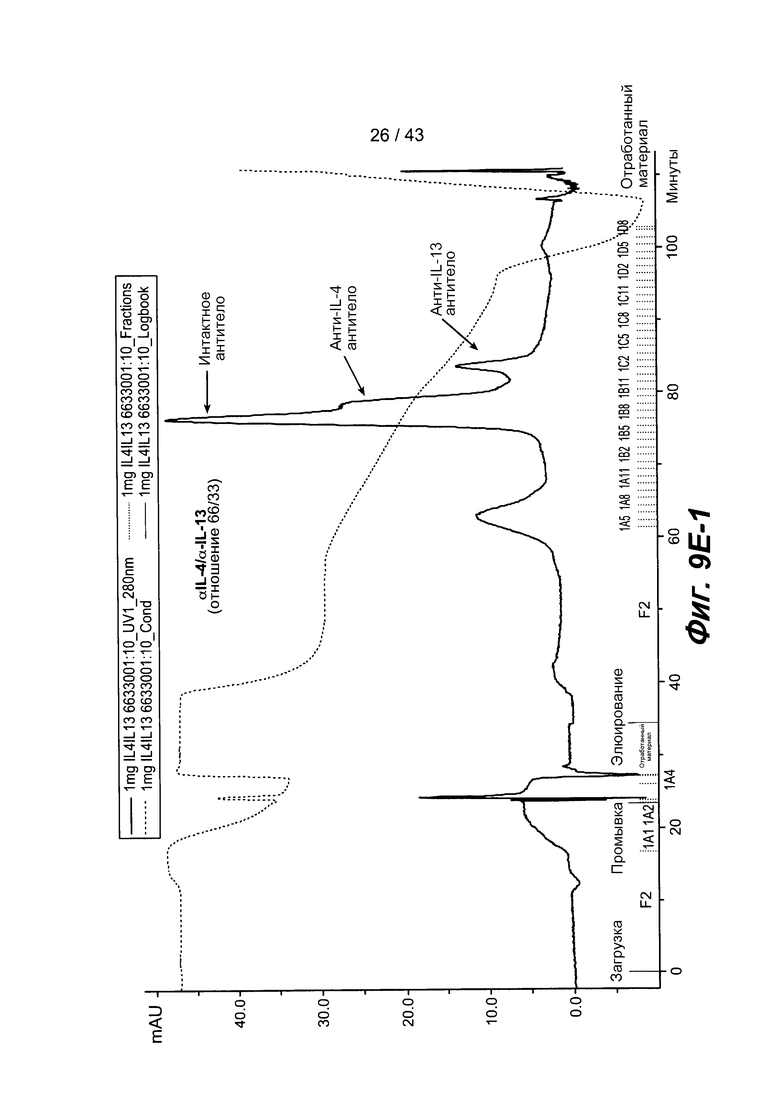

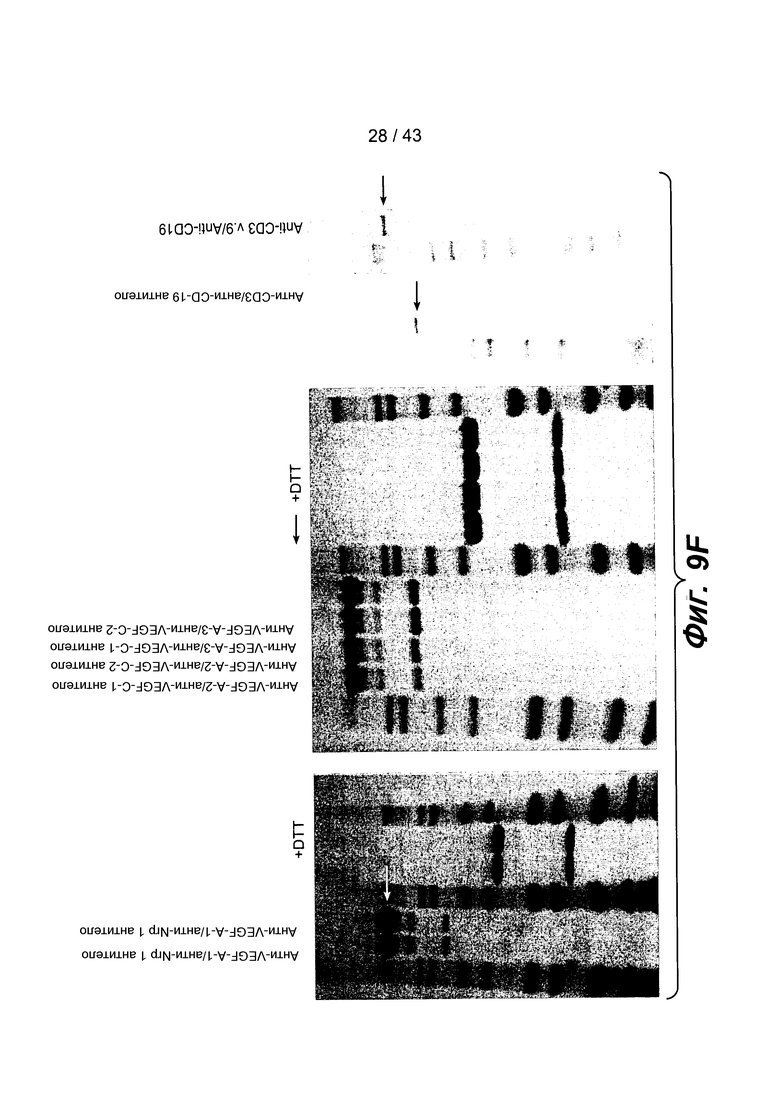
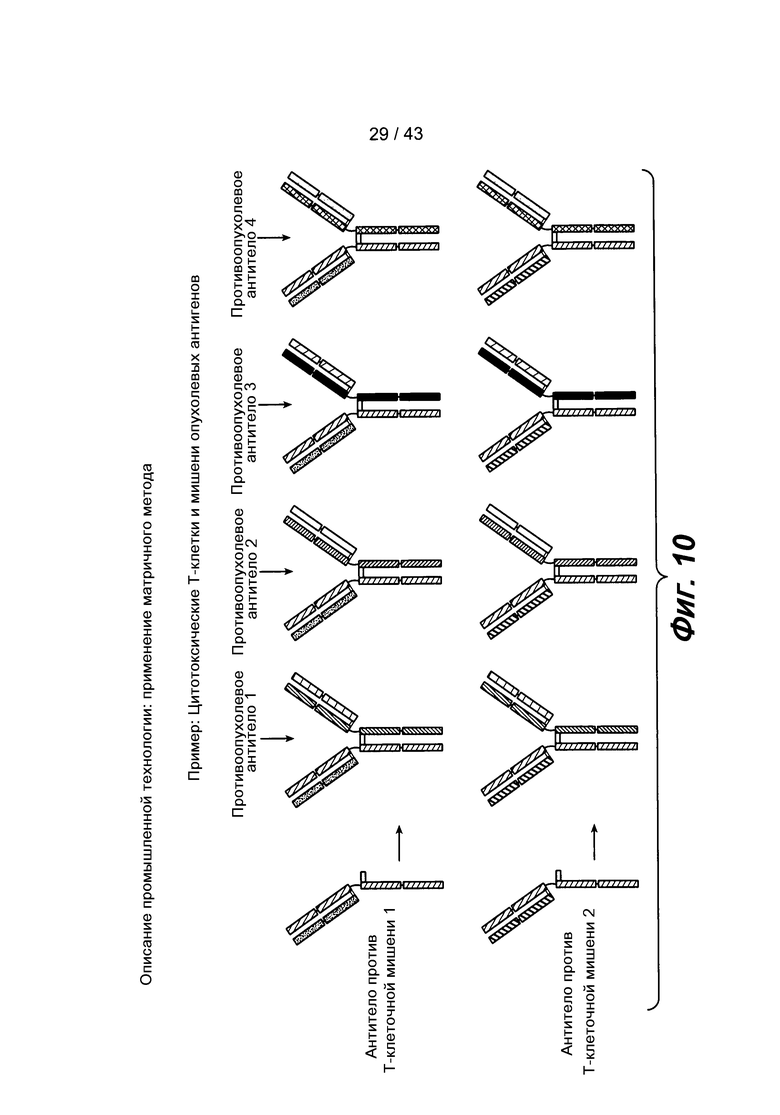
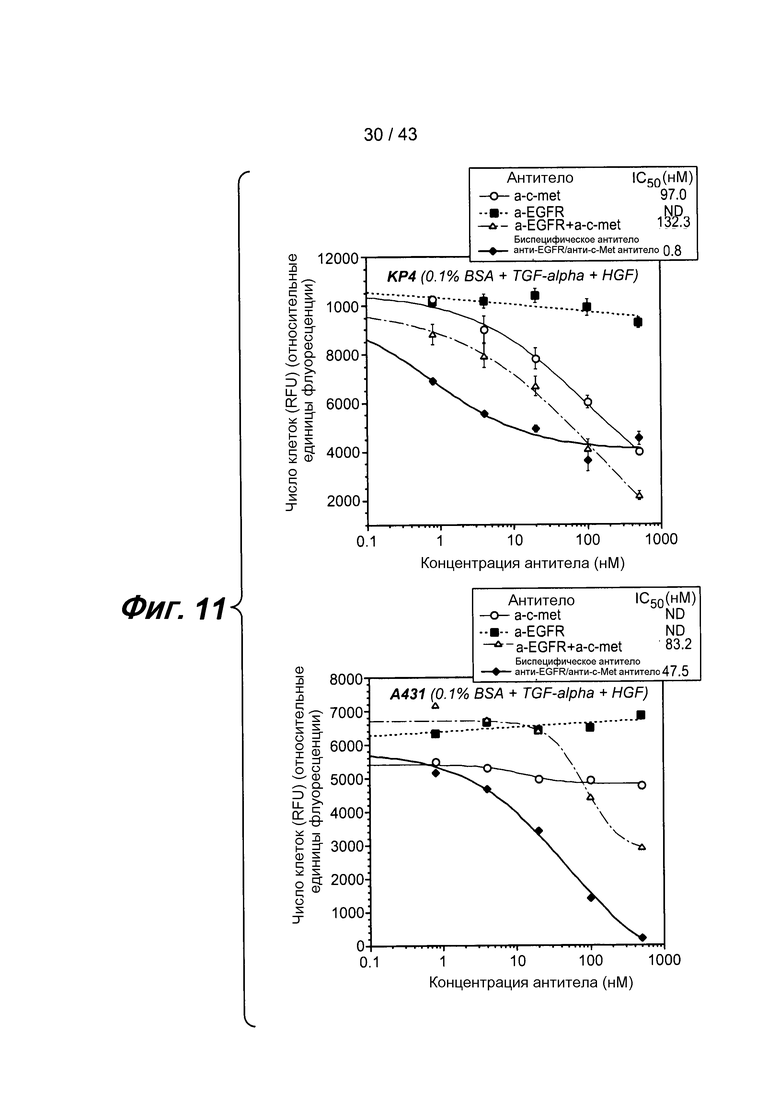
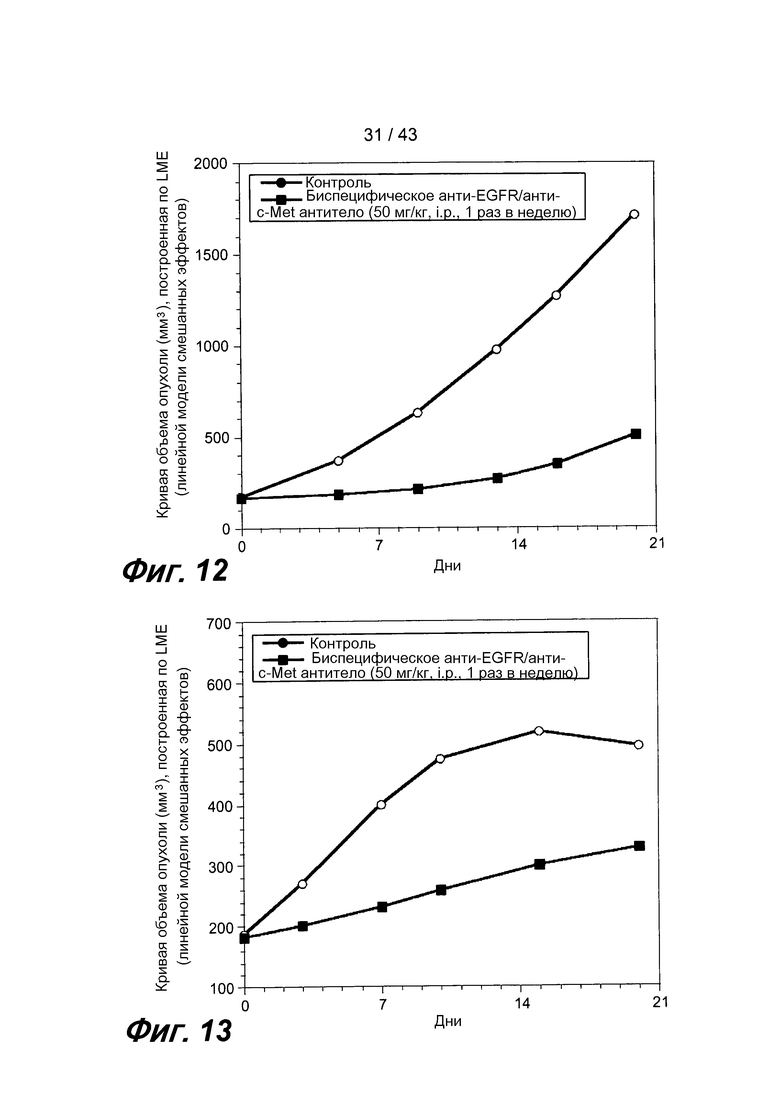



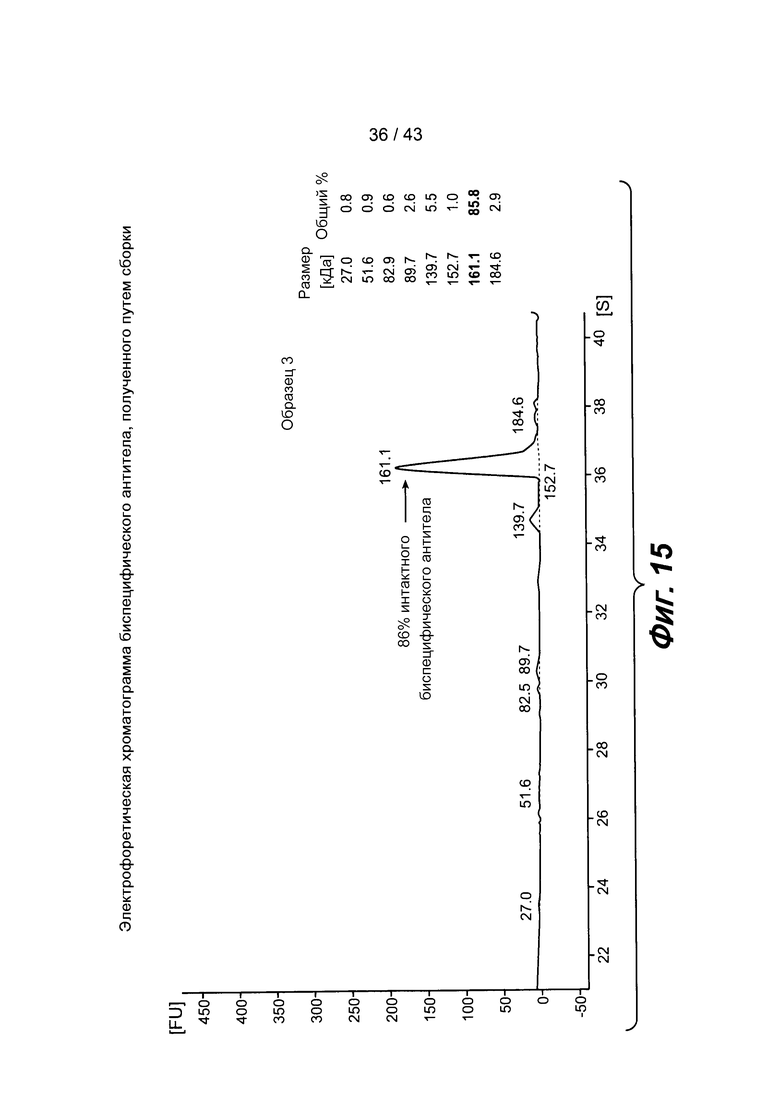
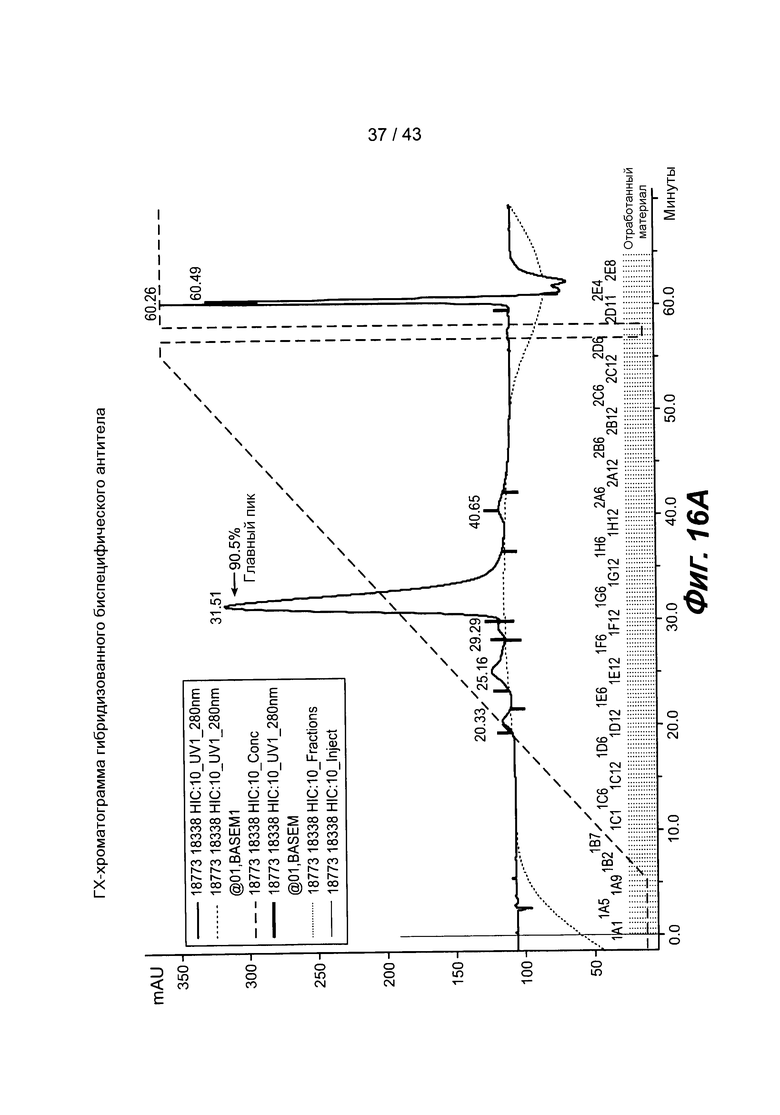
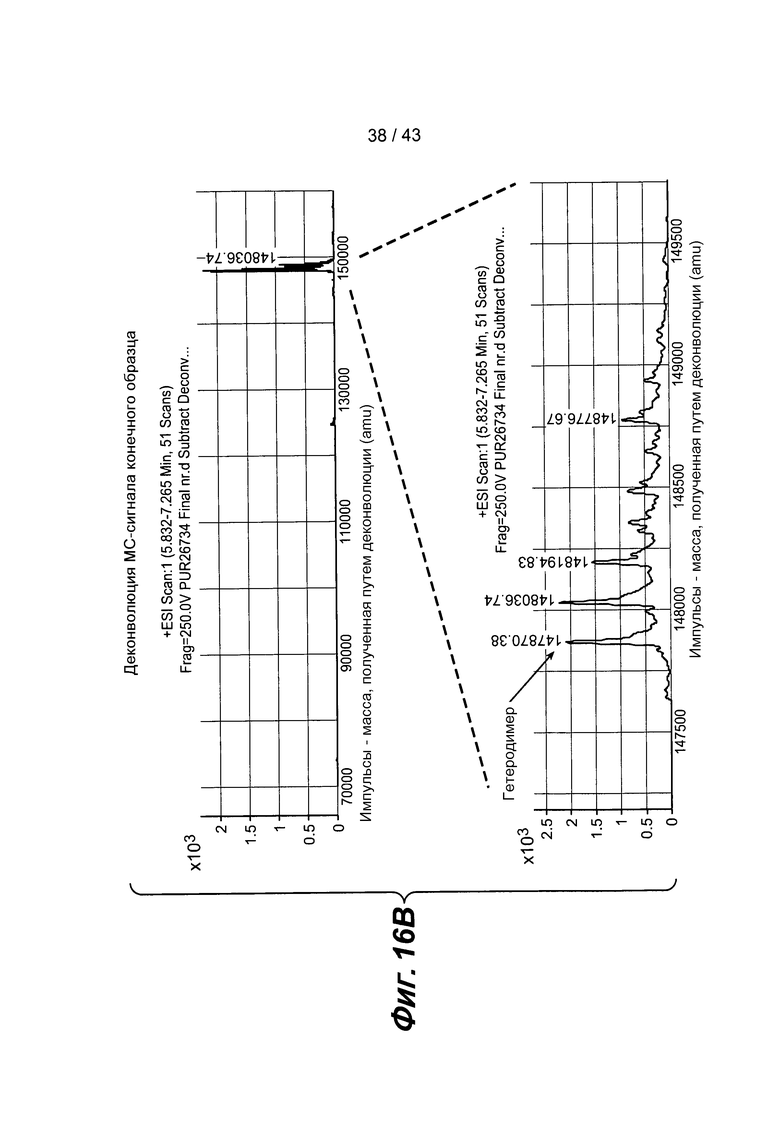

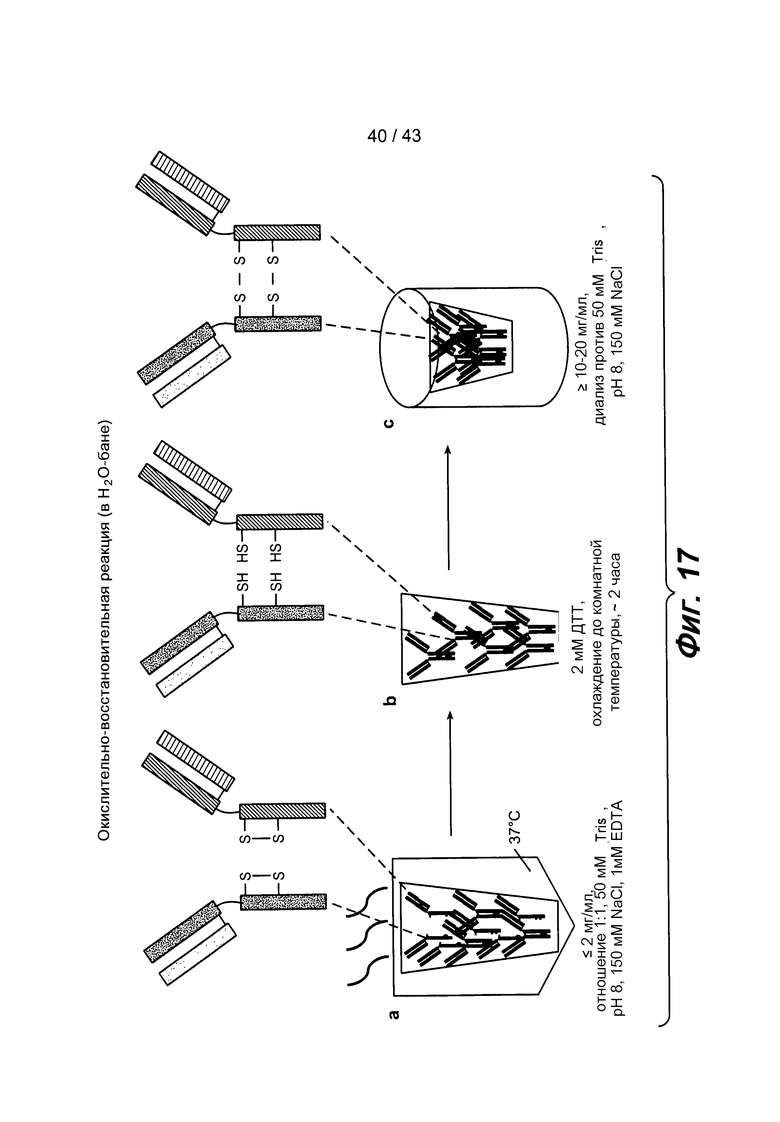
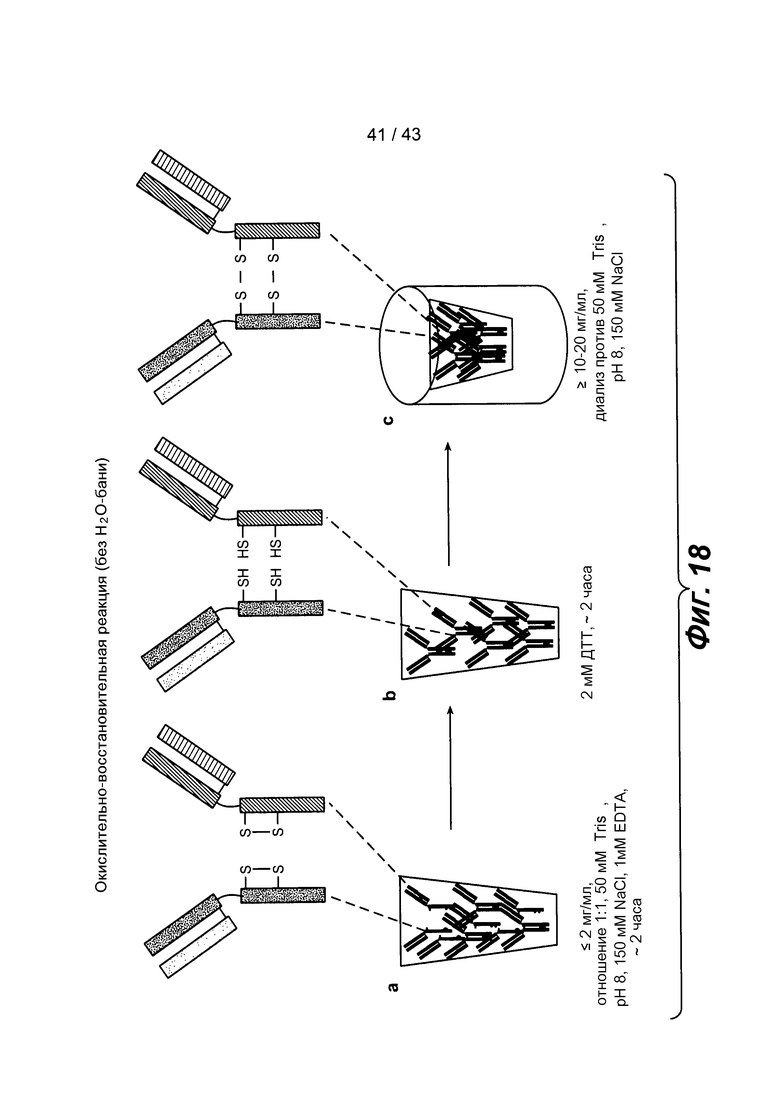


Представленные изобретения касаются способов получения гетеромультимерного белка, обладающего способностью специфически связываться более чем с одной мишенью (варианты), а также способов создания комбинаторных библиотек таких гетеромультимерных белков (варианты). Охарактеризованные способы включают культивирование первой клетки-хозяина, экспрессирующей первые тяжелую и легкую цепи и второй клетки-хозяина, экспрессирующей вторые тяжелые и легкие цепи, получение комбинированной культуры, содержащей первые и вторые клетки-хозяева с образованием гетеромультимерного белка. Представленные изобретения позволяют эффективно и с высоким уровнем экспрессировать гены и осуществлять простую сборку гетеромультимерных белков. 5 н. и 47 з.п. ф-лы, 49 ил., 4 табл., 7 пр.
1. Способ получения гетеромультимерного белка, включающего первую тяжелую цепь антитела, спаренную с первой легкой цепью антитела, и вторую тяжелую цепь антитела, спаренную со второй легкой цепью, где указанные первая и вторая тяжелые цепи антитела связаны друг с другом, по меньшей мере, одной межцепьевой дисульфидной связью, которая находится между шарнирными областями первой и второй тяжелой цепью; причем указанный способ включает стадии:
(a) культивирования первой клетки-хозяина, содержащей первую нуклеиновую кислоту, кодирующую первую тяжелую цепь и первую легкую цепь антитела в условиях, при которых экспрессируется первая половина антитела, содержащая первую тяжелую и первую легкую цепи антитела;
(b) культивирования второй клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую вторую тяжелую цепь антитела и вторую легкую цепь антитела в условиях, при которых экспрессируется вторая половина антитела, содержащая вторую тяжелую и вторую легкую цепи антитела; и
(c) комбинирования первой и второй клеток-хозяев для получения комбинированной культуры, содержащей первые клетки-хозяева и вторые клетки-хозяева; и
(d) разрушения клеточных мембран первой и второй клеток-хозяев для получения первой и второй половин антитела из клеток-хозяев с образованием гетеромультимерного белка, где гетеромультимерный белок образуется в комбинированной культуре.
2. Способ получения гетеромультимерного белка, включающего первую тяжелую цепь антитела, спаренную с первой легкой цепью антитела, и вторую тяжелую цепь антитела, спаренную со второй легкой цепью антитела, где первая и вторая тяжелые цепи антитела связаны друг с другом, по меньшей мере, одной межцепьевой дисульфидной связью, которая находится между шарнирными областями первой и второй тяжелых цепей; причем указанный способ включает стадии:
(a) культивирования первой клетки-хозяина, содержащей первую нуклеиновую кислоту, кодирующую первую тяжелую цепь антитела и первую легкую цепь антитела в условиях, при которых экспрессируется и секретируется первая половина антитела, содержащая первую тяжелую и первую легкую цепи антитела;
(b) культивирования второй клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую вторую тяжелую и вторую легкую цепи антитела в условиях, при которых экспрессируется и секретируется вторая половина антитела, содержащая вторую тяжелую и вторую легкую цепи антитела;
(c) комбинирования первой и второй клеток-хозяев для получения комбинированной культуры, содержащей первые клетки-хозяева и вторые клетки-хозяева; и
(d) образование гетеромультимерного белка в комбинированной культуре.
3. Способ получения гетеромультимерного белка, включающего первую тяжелую цепь антитела, спаренную с первой легкой цепью антитела, и вторую тяжелую цепь антитела, спаренную со второй легкой цепью антитела, где первая и вторая тяжелые цепи антитела связаны друг с другом, по меньшей мере, одной межцепьевой дисульфидной связью, которая находится между шарнирными областями первой и второй тяжелых цепей; причем указанный способ включает стадии:
(a) культивирования первой клетки-хозяина, содержащей первую нуклеиновую кислоту, кодирующую первую тяжелую цепь антитела и первую легкую цепь антитела, и второй клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую вторую тяжелую цепь антитела и вторую легкую цепь антитела, в комбинированной культуре, содержащей первую и вторую клетки-хозяева в условиях, при которых экспрессируется первая половина антитела, содержащая первую тяжелую цепь антитела и первую легкую цепь антитела, и вторая половина антитела, содержащая вторую тяжелую цепь антитела и вторую легкую цепь антитела; и
(b) образование гетеромультимерного белка в комбинированной культуре.
4. Способ по любому из пп. 1-3, дополнительно включающий стадию выделения гетеромультимерного белка.
5. Способ по любому из пп. 1-3, где первая тяжелая цепь антитела содержит первый Fc домен или его вариант и где вторая тяжелая цепь антитела содержит второй Fc домен или его вариант.
6. Способ по п. 5, где указанная первая тяжелая цепь антитела содержит первый вариант Fc домена и указанная вторая тяжелая цепь антитела содержит второй вариант Fc домена, где первый и второй варианты Fc доменов встречаются на интерфейсе и где присутствующая на интерфейсе часть второго варианта Fc домена содержит выступ (узел), который может быть помещен в полость (дырку) в присутствующей на интерфейсе части первого варианта Fc домена.
7. Способ по п. 5, где указанная первая тяжелая цепь содержит первый вариант Fc домена и указанная вторая тяжелая цепь содержит второй вариант Fc домена, где первый и второй варианты Fc домена встречаются на интерфейсе и где часть интерфейса первого варианта Fc домена содержит выступ (узел), который может быть помещен в полость (дырку) части интерфейса второго варианта Fc домена.
8. Способ по любому из пп. 1-3, где указанная первая и вторая тяжелые цепи антитела имеют модификацию на лейциновую застежку или суперспирализованные спирали.
9. Способ по любому из пп. 1-3, где каждая первая и вторая тяжелые цепи антитела содержат по меньшей мере часть домена СН2 и/или СН3 человека.
10. Способ по любому из пп. 1-3, где каждая первая и вторая половина антитела распознают различные эпитопы одного и того же антигена.
11. Способ по любому из пп. 1-3, где первая и вторая половины антитела распознают различные антигены.
12. Способ по любому из пп. 1-3, где каждая первая и вторая легкие цепи антитела содержат различные последовательности вариабельных доменов.
13. Способ по любому из пп. 1-3, где первая половина антитела является гуманизованной.
14. Способ по п. 13, где вторая половина антитела является гуманизированной.
15. Способ по любому из пп. 1-3, где первая тяжелая цепь антитела и первая легкая цепь антитела кодируются отдельными экспрессионными плазмидами.
16. Способ по любому из пп. 1-3, где вторая тяжелая цепь антитела и вторая легкая цепь антитела кодируются отдельными экспрессионными плазмидами.
17. Способ по любому из пп. 1-3, где первая тяжелая цепь антитела и первая легкая цепь антитела кодируются одной и той же экспрессионной плазмидой.
18. Способ по любому из пп. 1-3, где вторая тяжелая цепь антитела и вторая легкая цепь антитела кодируются одной и той же экспрессионной плазмидой.
19. Способ по любому из пп. 1-3, где клетка-хозяин выбрана из группы, состоящей из прокариотической клетки и эукариотической клетки.
20. Способ по п. 19, где указанная клетка-хозяин представляет собой эукариотическую клетку и где эукариотическая клетка представляет собой клетку растения или клетку млекопитающего.
21. Способ по п. 20, где указанная эукариотическая клетка представляет собой клетку млекопитающего, которой является клетка СНО.
22. Способ по п. 19, где клетка-хозяин представляет собой прокариотическую клетку, и где прокариотической клеткой является клетка Е. coli.
23. Способ по п. 22, где указанная клетка Е. coli является дефицитной по lpp.
24. Способ по п. 1, где клетки стадий (а) и (b):
(i) объединяют, центрифугируют и ресуспендируют в буфере перед разрушением клеточной мембраны, или
(ii) центрифугируют, ресуспендируют в буфере, и затем объединяют до разрушения клеточной мембраны.
25. Способ по п. 1 или 24, где разрушение клеточной мембраны выбрано из группы, состоящей из сообщения клеточной мембране проницаемости, дезинтеграции клеточной мембраны, клеточного лизиса, обработки ультразвуком, осмотического шока, пропускания через микрофлюидизатор, добавления EDTA, добавления детергента, добавления растворителя, добавления поверхностно-активного вещества, добавления гипотонических буферов, применения методов замораживания/оттаивания, электропорации и пропускания через шаровой гомогенизатор из нержавеющей стали.
26. Способ по п. 25, где растворитель выбран из группы, состоящей из: толуола и диметилсульфоксида.
27. Способ по п. 25, где поверхностно-активное вещество выбрано из группы, состоящей из: Triton-X 100 и Tween 20.
28. Способ по п. 4, где стадия выделения также включает, по меньшей мере, одну стадию очистки.
29. Способ по п. 28, где по меньшей мере одна стадия очистки включает:
(a) захват указанного антитела на колонке, содержащей белок А;
(b) элюирование указанного антитела с указанной колонки, и
(c) разведение указанного элюированного антитела в растворе, содержащем хаотропный агент или слабый детергент.
30. Способ по любому из пп. 1-3, где указанный гетеромультимерный белок выбран из группы, состоящей из антитела, биспецифического антитела, мультиспецифического антитела, антитела с одной «рукой», мультиспецифического одновалентного антитела, биспецифического максиантитела, моноантитела, иммуноадгезина, пептидного антитела, биспецифического пептидного антитела, одновалентного пептидного антитела, фрагмента антитела, Fc-слитого полипептида и аффинного антитела.
31. Способ по п. 30, где указанный гетеромультимерный белок представляет собой биспецифическое антитело.
32. Способ по п. 30, где гетеромультимерный белок представляет собой антитело и где указанное антитело является гуманизованным антителом, полноразмерным антителом, человеческим антителом, IgG антителом, IgG1 антителом, IgG2 антителом, IgA антителом, IgD антителом, терапевтическим антителом, агонистическим антителом, антагонистическим антителом, диагностическим антителом, блокирующим антителом, нейтрализующим антителом, антителом, способным связываться с опухолевым антигеном, антителом, способным связываться с фактором дифференцировки кластера, антителом, способным связываться с фактором регуляции выживания клеток, антителом, способным специфически связываться с фактором регуляции пролиферации клеток, антителом, способным связываться с молекулой, ассоциированной с развитием или дифференцировкой ткани, антителом, способным связываться с молекулой клеточной поверхности, или антителом, способным связываться к лимфокином.
33. Способ по любому из пп. 1-3, где первая половина антитела является человеческой.
34. Способ по п. 33, где вторая половина антитела является человеческой.
35. Способ по п. 30, где гетеромультимерный белок представляет собой фрагмент антитела, содержащий, по меньшей мере, часть CH2- и/или CH3-домена человеческого антитела.
36. Способ по п. 32, где антитело способно связываться с опухолевым антигеном и где:
(i) опухолевый антиген не является молекулой клеточной поверхности, или
(ii) опухолевый антиген не является фактором дифференцировки кластера.
37. Способ по п. 31, где, по меньшей мере, 40% из первых половин антитела и вторых половин антитела образуют указанное биспецифическое антитело.
38. Способ по п. 31, где указанное биспецифическое антитело обладает способностью специфически связываться с двумя эпитопами одного и того же антигена.
39. Способ по п. 31, где биспецифическое антитело обладает способностью связываться с двумя различными антигенами.
40. Способ по любому из пп.1-3, где, по меньшей мере, 40% из полипептидов первой половины антитела и второй половины антитела формирует указанный гетеромультимерный белок.
41. Способ по п. 28, где не более чем 10% из первых половин антитела и вторых половин антитела присутствуют в виде мономеров или гомодимеров с последующей очисткой гетеромультимерного белка.
42. Способ по п. 12, где первая и вторая тяжелые цепи содержат различные последовательности вариабельных доменов.
43. Способ по п. 31, где первая и вторая легкие цепи содержат различные последовательности вариабельных доменов.
44. Способ по п. 43, где первая и вторая тяжелые цепи содержат различные последовательности вариабельных доменов.
45. Способ по любому из пп.1-3, где первая тяжелая цепь и первая легкая цепь связаны друг с другом дисульфидной связью.
46. Способ по п. 45, где вторая тяжелая цепь и вторая легкая цепь связаны друг с другом дисульфидной связью.
47. Способ по любому из пп.1-3, где разница величин pI между первой и второй половиной антитела составляет, по меньшей мере, 0,5.
48. Способ по п. 31, где разница величин pI между первой и второй половиной антитела составляет, по меньшей мере, 0,5.
49. Способ создания комбинаторной библиотеки гетеромультимерных белков, где каждый гетеромультимерный белок содержит первую тяжелую цепь антитела, спаренную с первой легкой цепью антитела, и вторую тяжелую цепь антитела, спаренную с второй легкой цепью антитела, и где первая и вторая тяжелые цепи антитела связаны друг с другом, по меньшей мере, одной межцепьевой дисульфидной связью, которая находится между шарнирными областями первой и второй тяжелых цепей; причем указанный способ включает стадии:
(а) культивирования первой клетки-хозяина и, по меньшей мере, двух дополнительных клеток-хозяев, где:
i. указанная первая клетка-хозяин включает первую нуклеиновую кислоту, кодирующую первую тяжелую цепь антитела и первую легкую цепь антитела, и
ii. каждая из указанных по меньшей мере двух дополнительных клеток-хозяев включает нуклеиновую кислоту, кодирующую вторую тяжелую цепь антитела и вторую легкую цепь антитела в условиях, при которых экспрессируется первая половина антитела, содержащая первую тяжелую и первую легкую цепи антитела, и по меньшей мере две дополнительных половины антитела, содержащих вторую тяжелую и вторую легкую цепи антитела;
(b) комбинирования первой и по меньшей мере двух дополнительных клеток-хозяев для получения комбинированной культуры, содержащей первые клетки-хозяева и по меньшей мере две дополнительные клетки-хозяева;
(c) разрушения клеточных мембран первой клетки-хозяина и, по меньшей мере, двух дополнительных клеток-хозяев так, чтобы полипептиды, содержащие первую и вторую половины антитела, высвобождались во внеклеточную среду, где гетеромультимерные белковые комплексы образуются в комбинированной культуре без проведения предварительной очистки; и
(d) выделения комплексов гетеромультимерных белков.
50. Способ создания комбинаторной библиотеки гетеромультимерных белков, где каждый гетеромультимерный белок содержит первую тяжелую цепь антитела, спаренную с первой легкой цепью антитела, и вторую тяжелую цепь антитела, спаренную с второй легкой цепью антитела, и где первая и вторая половины антитела связаны друг с другом, по меньшей мере, одной межцепьевой дисульфидной связью, которая находится между шарнирными областями первой и второй тяжелых цепей; причем указанный способ включает стадии:
(a) культивирования первой клетки-хозяина и, по меньшей мере, двух дополнительных клеток-хозяев, где:
i. указанная первая клетка-хозяин включает первую нуклеиновую кислоту, кодирующую первую тяжелую цепь антитела и первую легкую цепь антитела, и
ii. каждая из указанных по меньшей мере двух дополнительных клеток-хозяев включают нуклеиновую кислоту, кодирующую вторую тяжелую цепь антитела и вторую легкую цепь антитела в условиях, при которых экспрессируется и секретируется первая половина антитела, содержащая первую тяжелую и первую легкую цепи антитела, и по меньшей мере две дополнительных половины антитела, содержащих вторую тяжелую и вторую легкую цепи антитела;
(b) комбинирования культур первой и по меньшей мере двух дополнительных клеток-хозяев для получения комбинированной культуры, содержащей первые клетки-хозяева и по меньшей мере две дополнительные клетки-хозяева, где гетеромультимерные белковые комплексы образуются в комбинированной культуре без проведения предварительной очистки; и
(c) выделения гетеромультимерных белковых комплексов из комбинированной культуральной среды.
51. Способ по п. 48 или 50, где каждая первая и вторая половины антитела распознают различные эпитопы одного и того же антигена.
52. Способ по п. 49 или 50, где каждая первая и вторая половины антитела распознают различные антигены.
| WO 9850431 А2, 12.11.1998 | |||
| US 5807706 А, 15.09.1998 | |||
| WO 2004009618 А2, 29.01.2004 | |||
| Прибор для деления углов на равные части | 1934 |
|
SU40577A1 |
Авторы
Даты
2017-06-30—Публикация
2011-04-22—Подача