Родственные заявки
Настоящая заявка притязает на приоритет предварительной заявки на выдачу патента США № 61/024825, поданной 30 января 2008, описание которой включено в настоящую заявку в виде ссылки в полном объеме для всех целей.
Область изобретения
Настоящее изобретение относится к композиции, содержащей HER2-антитело главного типа, которое связывается с доменом II HER2, и его кислым вариантам. Изобретение также относится к фармацевтическим препаратам, содержащим композицию, и терапевтическим применениям композиции.
Уровень техники
Представители семейства рецепторных тирозинкиназ HER являются важными медиаторами клеточного роста, дифференцировки и жизнеспособности. Семейство рецепторов включает четыре отдельных представителя, в том числе рецептор эпидермального фактора роста (EGFR, ErbB1 или HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2).
EGFR, кодируемый геном erbB1, причинно вовлечен в развитие злокачественных новообразований у человека. В частности, повышенную экспрессию EGFR наблюдали в злокачественной опухоли молочной железы, мочевого пузыря, легкого, головы, шеи и желудка, а также при глиобластомах. Повышенная экспрессия рецептора EGFR часто ассоциирована с повышенной продукцией лиганда EGFR, трансформирующего фактора роста альфа (TGF-α), некоторыми опухолевыми клетками, приводящей к активации рецептора посредством аутокринного пути стимуляции. Baselga and Mendelsohn, Pharmac. Ther. 64: 127-154 (1994). Моноклональные антитела, направленные против EGFR или его лигандов, TGF-α и EGF, оценивали в качестве терапевтических средств для лечения таких злокачественных заболеваний. См., например, Baselga and Mendelsohn, выше; Masui et al. Cancer Research 44: 1002-1007 (1984); и Wu et al. J. Clin. Invest. 95: 1897-1905 (1995).
Второй представитель семейства HER, p185neu, исходно идентифицировали в качестве продукта трансформирующего гена из нейробластом химически обработанных крыс. Активированная форма протоонкогена neu возникает в результате точечной мутации (валин на глутаминовую кислоту) в трансмембранной области кодируемого белка. Амплификацию гомолога neu человека наблюдали при раке молочной железы и яичника, что коррелировало с плохим прогнозом (Slamon et al., Science, 235: 177-182 (1987); Slamon et al., Science, 244: 707-712 (1989); и патент США No. 4968603). До настоящего времени не сообщалось о точечной мутации, аналогичной точечной мутации в протоонкогене neu, в случае опухолей человека. Сверхэкспрессию HER2 (часто, но не всегда вследствие амплификации гена) также наблюдали в других карциномах, включая карциномы желудка, эндометрия, слюнной железы, легкого, почки, ободочной кишки, щитовидной железы, поджелудочной железы и мочевого пузыря. См. наряду с другими публикациями King et al., Science, 229:974 (1985); Yokota et al., Lancet: 1:765-767 (1986); Fukushige et al., Mol Cell Biol, 6:955-958 (1986); Guerin et al., Oncogene Res., 3:21-31 (1988); Cohen et al., Oncogene, 4:81-88 (1989); Yonemura et al., Cancer Res., 51:1034 (1991); Borst et al., Gynecol Oncol, 38:364 (1990); Werners et al., Cancer Res., 50:421-425 (1990); Kern et al., Cancer Res., 50:5184 (1990); Park et al., Cancer Res., 49:6605 (1989); Zhau et al, Mol Carcinog., 3:254-257 (1990); Aasland et al. Br.J. Cancer 57:358-363 (1988); Williams et al. Pathobiology 59:46-52 (1991); и McCann et al., Cancer, 65:88-92 (1990). HER2 может быть сверхэкспрессирован в злокачественной опухоли простаты (Gu et al., Cancer Lett. 99: 185-9 (1996); Ross et al., Hum. Pathol. 28: 827-33 (1997); Ross et al., Cancer 79: 2162-70 (1997); и Sadasivan et al., J. Urol. 150: 126-31 (1993)).
Описаны антитела, направленные против белковых продуктов p185neu крысы и HER2 человека. Drebin с соавторами получили антитела против продукта гена neu крысы, p185neu. См., например, Drebin et al., Cell 41: 695-706 (1985); Myers et al., Meth. Enzym. 198: 277-290 (1991); и WO94/22478. В публикации Drebin et al. Oncogene 2: 273-277 (1988) сообщается, что смеси антител, взаимодействующих с двумя разными областями p185neu, приводят к синергетическому противоопухолевому воздействию на neu-трансформированные клетки NIH-3T3, имплантированные мышам nude. См. также патент США № 5824311, опубликованный 20 октября 1998.
В публикации Hudziak et al., Mol. Cell. Biol. 9(3): 1165-1172 (1989) описано создание панели антител к HER2, которые были охарактеризованы с использованием линии клеток опухоли молочной железы человека SK-BR-3. Относительную пролиферацию клеток SK-BR-3 после воздействия антител определяли окрашиванием монослоя кристаллическим фиолетовым через 72 часа. С помощью такого анализа максимальное ингибирование получали с использованием антитела, названного 4D5, которое ингибировало пролиферацию клеток на 56%. Другие антитела в панели в данном анализе снижали пролиферацию клеток в меньшей степени. Кроме того, обнаружено, что антитело 4D5 сенсибилизировало линии опухолевых клеток молочной железы, сверхэкспрессирующих HER2, к цитотоксическому действию TNF-α. См. также патент США № 5677171, опубликованный 14 октября 1997. HER2-антитела, обсуждаемые в работе Hudziak с соавторами, дополнительно охарактеризованы в Fendly et al. Cancer Research 50:1550-1558 (1990); Kotts et al. In Vitro 26(3):59A (1990); Sarup et al. Growth Regulation 1:72-82 (1991); Shepard et al. J. Clin. Immunol. 11(3): 117-127 (1991); Kumar et al. Mol. Cell. Biol. 11(2):979-986 (1991); Lewis et al. Cancer Immunol. Immunother. 37:255-263 (1993); Pietras et al. Oncogene 9:1829-1838 (1994); Vitetta et al. Cancer Research 54:5301-5309 (1994); Sliwkowski et al. J. Biol. Chem. 269(20): 14661-14665 (1994); Scott et al. J. Biol. Chem. 266:14300-5 (1991); D'souza et al. Proc. Natl. Acad. Sci. 91:7202-7206 (1994); Lewis et al. Cancer Research 56:1457-1465 (1996); и Schaefer et al. Oncogene 15:1385-1394 (1997).
Рекомбинантный гуманизированный вариант мышиного HER2-антитела 4D5 (huMAb4D5-8, rhuMAb HER2, трастузумаб или HERCEPTIN®; патент США № 5821337) является клинически активным у пациентов с метастатическими злокачественными опухолями молочной железы, сверхэкспрессирующими HER2, которые получали экстенсивную предварительную противоопухолевую терапию (Baselga et al., J. Clin. Oncol. 14:737-744 (1996)). Трастузумаб был разрешен для реализации управлением по контролю за продуктами питания и лекарствами 25 сентября 1998 для лечения пациентов с метастатическим раком молочной железы, опухоли у которых сверхэкспрессируют белок HER2.
Другие HER2-антитела с различными свойствами описаны в Tagliabue et al. Int. J. Cancer 47:933-937 (1991); McKenzie et al. Oncogene 4:543-548 (1989); Maier et al. Cancer Res. 51:5361-5369 (1991); Bacus et al. Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al. PNAS (USA) 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al. Int. J. Cancer 53:401-408 (1993); WO94/00136; Kasprzyk etal. Cancer Research 52:2771-2776 (1992); Hancock et al. Cancer Res. 51:4575-4580 (1991); Shawver et.al., Cancer Res. 54:1367-1373 (1994); Arteaga etal. Cancer Res. 54:3758-3765 (1994); Harwerth etal. J. Biol. Chem. 267:15160-15167 (1992); U.S. Patent No. 5,783,186; и Klapper et al. Oncogene 14:2099-2109 (1997); патент США № 5783186; и Klapper et al. Oncogene 14: 2099-2109 (1997).
Скрининг гомологии привел к идентификации двух других представителей семейства рецепторов HER; HER3 (патенты США № 5183884 и 5480968, а также Kraus et al., PNAS (USA) 86: 9193-9197 (1989)) и HER4 (заявка на выдачу патента EP № 599274; Plowman et al., Proc. Natl. Acad. Sci. USA, 90: 1746-1750 (1993); и Plowman et al., Nature, 366: 473-475 (1993)). Оба указанных рецептора имеют повышенную экспрессию, по меньшей мере, в некоторых линиях клеток рака молочной железы.
Рецепторы HER обычно обнаруживают в клетках в различных сочетаниях, и считается, что гетеродимеризация увеличивает разнообразие клеточных ответов на множество лигандов HER (Earp et al. Breast Cancer Research and Treatment 35: 115-132 (1995)). EGFR связывается шестью разными лигандами; эпидермальным фактором роста (EGF), трансформирующим фактором роста альфа (TGF-α), амфирегулином, связывающим гепарин эпидермальным фактором роста (HB-EGF), бетацеллюлином и эпирегулином (Groenen et al. Growth Factors 11: 235-257 (1994)). Семейство белков херегулинов, образуемых в результате альтернативного сплайсинга одного гена, являются лигандами для HER3 и HER4. Семейство херегулинов включает альфа-, бета- и гамма-херегулины (Holmes et al., Science, 256: 1205-1210 (1992); патент США № 5641869; и Schaefer et al. Oncogene 15: 1385-1394 (1997)); факторы дифференцировки neu (NDF), глиальные факторы роста (GGF); активность, индуцирующую рецептор ацетилхолина (ARIA); и фактор, полученный из сенсорных и мотонейронов (SMDF). Обзор См. в Groenen et al. Growth Factors 11: 235-257 (1994); Lemke, G. Molec. and Cell. Neurosci. 7: 247-262 (1996) и Lee et al. Pharm. Rev. 47: 51-85 (1995). Недавно идентифицированы три дополнительных лиганда HER; нейрегулин-2 (NRG-2), который, как сообщается, связывает либо HER3, либо HER4 (Chang et al. Nature 387: 509-512 (1997); и Carraway et al. Nature 387: 512-516 (1997)); нейрегулин-3, который связывает HER4 (Zhang et al. PNAS (USA) 94(18): 9562-7 (1997)); и нейрегулин-4, который связывает HER4 (Harari et al. Oncogene 18: 2681-89 (1999)). HB-EGF, бетацеллюлин и эпирегулин также связываются с HER4.
Хотя EGF и TGFα не связывают HER2, EGF стимулирует EGFR и HER2 к образованию гетеродимера, который активирует EGFR и приводит к трансфосфорилированию HER2 в гетеродимере. Димеризация и/или трансфосфорилирование, по-видимому, активируют тирозинкиназу HER2. См. Earp et al., выше. Подобным образом, когда HER3 коэкспрессируется с HER2, образуется активный комплекс передачи сигнала, и антитела, направленные против HER2, способны разрушать такой комплекс (Sliwkowski et al., J. Biol. Chem., 269(20): 14661-14665 (1994)). Кроме того, аффинность HER3 по отношению к херегулину (HRG) повышается до состояния более высокой аффинности в случае коэкспрессии с HER2. См. также, Levi et al., Journal of Neuroscience 15: 1329-1340 (1995); Morrissey et al., Proc. Natl. Acad. Sci. USA 92: 1431-1435 (1995); и Lewis et al., Cancer Res., 56: 1457-1465 (1996) в отношении комплекса белков HER2-HER3. HER4, подобно HER3, образует активный комплекс передачи сигнала с HER2 (Carraway and Cantley, Cell 78: 5-8 (1994)).
Чтобы целенаправленно воздействовать на путь передачи сигнала HER, было разработано rhuMAb 2C4 (пертузумаб), в виде гуманизированного антитела, которое ингибирует димеризацию HER2 с другими рецепторами HER, тем самым ингибируя управляемое лигандом фосфорилирование и активацию, а также активацию ниже по ходу путей RAS и AKT. В фазе I испытаний пертузумаба, в качестве единственного средства лечения солидных опухолей, 3 пациента с раком яичника на поздней стадии подвергались лечению пертузумабом. У одного пациента наблюдали длительный частичный ответ, и у другого пациента имело место стабильное заболевание в течение 15 недель. Agus et al. Proc. Am. Soc. Clin. Oncol. 22: 192, Abstract 771 (2003).
Композиции вариантов антител
В патенте № 6339142 описана композиция HER2-антител, содержащая смесь анти-HER2 антитела и одного или нескольких его кислых вариантов, при этом количество кислого варианта (вариантов) составляет менее чем примерно 25%. Трастузумаб является примером HER2-антитела.
В стендовом докладе Reid с соавторами, представленном на конференции по хорошо охарактеризованным биотехнологическим фармацевтическим препаратам (Well Characterized Biotech Pharmaceuticals conference) (январь 2003), "Effects of Cell Culture Process Changes on Humanized Antibody Characteristics", описана композиция не имеющих названия гуманизированных IgG1-антител, гетерогенных на N-конце вследствие сочетания сигнального пептида VHS, N-концевого глутамина и пироглутаминовой кислоты в их тяжелой цепи.
В докладе Harris с соавторами "The Ideal Chromatographic Antibody Characterization Method, представленном на конференции по получению антител IBC (февраль 2002), сообщается о приращении VHS на тяжелой цепи E25, гуманизированного анти-IgE-антитела.
В стендовом докладе Rouse с соавторами, представленном на WCBP "Top Down' Glycoprotein Characterization by High Resolution Mass Spectrometry and Its Application to Biopharmaceutical Development" (6-9 января 2004), описана композиция моноклонального антитела с N-концевой гетерогенностью в результате остатков сигнального пептида -3AHS или -2HS в его легкой цепи.
В презентации на конференции IBC (сентябрь 2000) "Стратегическое использованием исследований и анализов совместимости для получения хорошо охарактеризованных биологических препаратов" Jill Porter приводит обсуждение поздно элюируемой формы ZENAPAXTM с тремя дополнительными аминокислотными остатками в его тяжелой цепи.
В US2006/0018899 описана композиция, содержащая антитело пертузумаб главного типа и вариант с удлинением в виде аминоконцевого лидера, а также другие формы вариантов антитела пертузумаба.
Сущность изобретения
Согласно первому аспекту изобретение относится к композиции, содержащей HER2-антитело главного типа, которое связывается с доменом II HER2, и его кислые варианты, при этом кислые варианты включают гликозилированный вариант, вариант с восстановленной дисульфидной связью или невосстанавливаемый вариант. Предпочтительно кислыми вариантами являются гликозилированный вариант, дезаминированный вариант, вариант с восстановленной дисульфидной связью, сиалилированный вариант и невосстанавливаемый вариант. Желательно количество кислых вариантов составляет менее чем примерно 25%.
В другом аспекте изобретение относится к композиции, содержащей HER2-антитело главного типа, включающее вариабельные последовательности легкой цепи и вариабельные последовательности тяжелой цепи в SEQ ID NO: 3 и 4, соответственно, и кислые варианты антитела главного типа, при этом кислые варианты включают гликозилированный вариант, дезаминированный вариант, вариант с восстановленной дисульфидной связью, сиалилированный вариант и невосстанавливаемый вариант.
Изобретение также относится к фармацевтическим композициям, содержащим композиции в фармацевтически приемлемом носителе.
Кроме того, изобретение относится к способу лечения HER2-позитивной злокачественной опухоли у пациента, включающему введение фармацевтического препарата пациенту в количестве, эффективном для лечения злокачественной опухоли. Что касается таких способов, как показано в примере, приведенном в настоящем описании, предпочтительно, чтобы антитело главного типа и кислые варианты имели по существу одну и ту же фармакокинетику.
В другом аспекте изобретение относится к способу получения фармацевтической композиции, включающему: (1) получение композиции, содержащей HER2-антитело главного типа, которое связывается с доменом II HER2, и его кислые варианты, включая гликозилированный вариант, вариант с восстановленной дисульфидной связью или невосстанавливаемый вариант, и (2) оценку кислых вариантов в композиции и подтверждение того, что их количество составляет менее чем примерно 25%. В одном варианте осуществления изобретения кислые варианты оценивают способом, выбранным из группы, состоящей из ионообменной хроматографии, при которой композицию обрабатывают сиалидазой, капиллярного электрофореза в восстанавливающих условиях с использованием додецилсульфата натрия (CE-SDS), CE-SDS в не восстанавливающих условиях, хроматографии с использованием бороната и картирования пептидов.
Краткое описание чертежей
На фигуре 1 показана схема структуры белка HER2 и аминокислотные последовательности доменов I-IV (SEQ ID NO: 19-22, соответственно) его внеклеточного домена.
На фигурах 2A и 2B изображено выравнивание аминокислотных последовательностей вариабельного домена легкой цепи (VL) (фиг. 2A) и вариабельного домена тяжелой цепи (VH) (фиг. 2B) мышиного моноклонального антитела 2C4 (SEQ ID NO: 1 и 2, соответственно); доменов VL и VH варианта 574 гуманизированного 2C4 (SEQ ID NO: 3 и 4, соответственно) и консенсусных каркасов VL и VH человека (hum κl, подгруппа I легкой цепи каппа; humIII, подгруппа III тяжелой цепи) (SEQ ID NO: 5 и 6, соответственно). Звездочками отмечены различия между вариантом 574 гуманизированного 2C4 и мышиным моноклональным антителом 2C4 или между вариантом 574 гуманизированного 2C4 и каркасом человека. Определяющие комплементарность области (CDR) указаны в квадратных скобках.
На фигурах 3A и 3B показаны аминокислотные последовательности легкой цепи (SEQ ID NO: 15) и тяжелой цепи (SEQ ID NO: 16) пертузумаба. CDR показаны жирным шрифтом. Остаток углевода связан с Asn 299 тяжелой цепи.
На фигурах 4A и 4B показаны аминокислотные последовательности легкой цепи (SEQ ID NO: 17) и тяжелой цепи (SEQ ID NO: 18) пертузумаба, каждая из которых содержит интактную аминоконцевую последовательность сигнального пептида.
На фигуре 5 схематично изображено связывание 2C4 с участком связывания HER2 в гетеродимере, которое предотвращает гетеродимеризацию с активированным EGFR или HER3.
На фигуре 6 изображена связь HER2/HER3 с путями MAPK и Akt.
На фигуре 7 показано сравнение активностей трастузумаба и пертузумаба.
На фигурах 8A и 8B показаны аминокислотные последовательности легкой цепи (SEQ ID NO: 13) и тяжелой цепи (SEQ ID NO: 14) трастузумаба.
На фигурах 9A и 9B изображена последовательность легкой цепи варианта пертузумаба (SEQ ID NO: 23) и последовательность тяжелой цепи варианта пертузумаба (SEQ ID NO: 24).
На фигуре 10 показана схема эксперимента по выделению MP (главного пика) и AV (кислых вариантов) при катионном обмене, культивированию клеток, извлечению и оценке ФК (фармакокинетики) и аналитическим испытаниям. Свежая среда = стандартная среда; использованная среда = стандартная среда после 12 суток культивирования клеток, клетки извлекали центрифугированием. Растворенный кислород, pH и другие параметры не контролировали.
На фигуре 11 показана типичная катионообменная хроматограмма (CEX) DIONEX PROPACTM из примера 1.
На фигуре 12 показан анализ исходного вещества пертузумаба и фракции CEX. AV = кислый вариант, MP = главный пик и BV = вариант со свойствами основания.
На фигуре 13 показана CEX главного пика (MP), введенного в среду культивирования клеток и инкубированного в течение 12 суток.
На фигуре 14 описаны условия инкубации главного пика.
На фигуре 15 обобщены способы характеристики кислых вариантов.
На фигуре 16 показана концентрация пертузумаба в зависимости от времени в исследовании ФК в примере 1.
На фигуре 17 показана площадь под кривой (AUC) и средние геометрические отношения, полученные в исследовании ФК в примере 1.
Подробное описание предпочтительных вариантов
I. Определения
Термин "антитело главного типа" в настоящем описании относится к структуре с аминокислотной последовательностью антитела в композиции, которая является количественно преобладающей молекулой антитела в композиции. Предпочтительно антителом главного типа является HER2-антитело, такое как антитело, которое связывается с доменом II HER2, антитело, которое ингибирует димеризацию HER более эффективно, чем трастузумаб, и/или антитело, которое связывается с участком связывания HER2 в гетеродимере. В предпочтительном варианте настоящего изобретения антителом главного типа является антитело, содержащее аминокислотные последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи SEQ ID NO: 3 и 4 и наиболее предпочтительно содержащее аминокислотные последовательности легкой цепи и тяжелой цепи SEQ ID NO: 15 и 16 (пертузумаб).
Антитело с "вариантом аминокислотной последовательности" в настоящем описании означает антитело с аминокислотной последовательностью, которая отличается от последовательности антитела главного типа. Обычно варианты аминокислотной последовательности будут обладать, по меньшей мере, примерно 70% гомологией с антителом главного типа, и предпочтительно они будут, по меньшей мере, примерно на 80%, и более предпочтительно, по меньшей мере, примерно на 90% гомологичны антителу главного типа. Варианты аминокислотной последовательности имеют замены, делеции и/или добавления в некоторых положениях в пределах или вблизи аминокислотной последовательности антитела главного типа. Примерами вариантов аминокислотной последовательности согласно настоящему изобретению являются кислый вариант (например, дезаминированный вариант антитела), вариант со свойствами основания, антитело с удлинением в виде аминоконцевого лидера (например, VHS-) в одной или двух легких цепях антитела, антитело с C-концевым остатком лизина в одной или двух тяжелых цепях антитела, антитело с одним или несколькими окисленными остатками метионина и т.д. и включают сочетания изменений аминокислотных последовательностей тяжелой и/или легкой цепей.
"Кислый вариант" означает вариант антитела главного типа, который является более кислым, чем антитело главного типа. Кислый вариант приобретает отрицательный заряд или теряет положительный заряд по сравнению с антителом главного типа. Такие кислые варианты могут быть отделены с использованием методики разделения, такой как ионообменная хроматография, которая позволяет разделять белки в соответствии с зарядом. Кислые варианты антитела главного типа элюируются раньше, чем главный пик, при разделении катионообменной хроматографией.
"Вариант с восстановленной дисульфидной связью" имеет еще один связанный дисульфидной связью цистеин (цистеины), химически восстановленный до формы свободного тиола. Такой вариант можно наблюдать с использованием основанной на гидрофобном взаимодействии хроматографии или способом разделения по размеру, таким как капиллярный электрофорез с додецилсульфатом натрия (CE-SDS), например, как описано в примере 1. В настоящем описании "невосстанавливаемый вариант" означает вариант антитела главного типа, который не может быть химически восстановлен до тяжелой и легкой цепи обработкой восстановителем, таким как дитиотреитол. Такие варианты можно оценивать посредством обработки композиции восстановителем и оценки полученной композиции с использованием методики, которая позволяет оценивать размер белка, такой как капиллярный электрофорез с додецилсульфатом натрия (CE-SDS), например с использованием методики, описанной в примере 1 ниже.
Антитело с "вариантом гликозилирования" в данном описании означает антитело с одним или несколькими связанными с ним углеводными остатками, которые отличаются от одного или нескольких углеводных остатков, связанных с антителом главного типа. Примеры вариантов гликозилирования согласно изобретению включают антитело с G1- или G2-олигосахаридной структурой вместо G0-олигосахаридной структуры, связанной с его Fc-областью, антитело с одним или двумя углеводными остатками, связанными с одной или двумя легкими цепями, антитело, не содержащее углевода, связанного с одной или двумя тяжелыми цепями антитела, антитело, которое сиалилировано, и т.д., а также сочетания таких изменений гликозилирования.
В том случае, когда антитело имеет Fc-область, олигосахаридная структура, такая как структура, показанная на фиг. 14 в данном описании, может быть связана с одной или двумя тяжелыми цепями антитела, например по остатку 299. В случае пертузумаба преобладающей олигосахаридной структурой была структура G0, при этом другие олигосахаридные структуры, такие как G0-F, G-1, Man5, Man6, G1-1, G1(1-6), G1(1-3) и G2, обнаружены в меньших количествах в композиции пертузумаба.
Если не оговорено особо, "олигосахаридная структура G1" в данном описании включает структуры G1(1-6) и G1(1-3).
В целях настоящего описания "сиалилированный вариант" означает вариант антитела главного типа, содержащий один или несколько сиалилированных углеводных остатков, связанных с одной или двумя тяжелыми цепями такого антитела. Сиалилированный вариант можно выявить при оценке композиции (например, при ионообменной хроматографии) с обработкой или без обработки сиалидазой, например, как описано в примере.
"Гликозилированный вариант" означает антитело, с которым был ковалентно связан сахар, такой как глюкоза. Такое добавление может быть осуществлено в результате взаимодействия глюкозы с остатком лизина в белке (например, в среде для культивирования клеток). Гликозилированный вариант может быть идентифицирован в масс-спектрометрическом анализе восстановленного антитела, при котором оценивают увеличение массы тяжелой и легкой цепей. Гликозилированный вариант также можно количественно оценить хроматографией с использованием бороната, пояснения к которой приведены в примере 1 ниже. Гликозилированный вариант отличается от антитела с вариантом гликозилирования.
"Дезаминированное" антитело представляет собой антитело, в котором один или несколько остатков аспарагина дериватизованы, например, до аспарагиновой кислоты, сукцинимида или изо-аспарагиновой кислоты. Примером дезаминированного антитела является вариант пертузумаба, в котором Asn-386 и/или Asn-391 в одной или двух тяжелых цепях пертузумаба дезаминированы.
"Вариант с удлинением в виде аминоконцевого лидера" в данном описании относится к антителу главного типа с одним или несколькими аминокислотными остатками аминоконцевой лидерной последовательности на аминоконце любой одной или нескольких тяжелых или легких цепей антитела. Типичное удлинение в виде аминоконцевого лидера содержит или состоит из трех аминокислотных остатков, VHS, присутствующих на одной или обеих легких цепях варианта антитела.
"Гомологию" определяют как процент остатков в варианте аминокислотной последовательности, которые идентичны после выравнивания последовательностей и введения пробелов, если это необходимо, чтобы добиться максимальной гомологии в процентах. Способы и компьютерные программы для выравнивания хорошо известны в данной области. Одной из таких компьютерных программ является программа "Align 2", разработанная Genentech, Inc., которая была подана вместе с документацией для пользователя в Бюро охраны авторских прав США, Washington, DC 20559, 10 декабря 1991.
В целях настоящего описания "катионообменный анализ" относится к любому способу, при котором композицию, содержащую два или более соединений, разделяют на основе различий зарядов, используя катионообменник. Катионообменник обычно содержит ковалентно связанные отрицательно заряженные группы. Предпочтительно в данном случае катионообменник является слабым катионообменником и/или содержит карбоксилатную функциональную группу, например катионообменная колонка PROPAC WCX-10TM, продаваемая Dionex.
"HER-рецептор" является рецепторной тирозиновой протеинкиназой, которая относится к семейству HER-рецепторов и включает рецепторы EGFR, HER2, HER3 и HER4 и других представителей такого семейства, которые будут идентифицированы в будущем. HER-рецептор, как правило, может содержать внеклеточный домен, который может связывать лиганд HER; липофильный трансмембранный домен; консервативный внутриклеточный тирозинкиназный домен; и находящийся на карбоксильном конце домен передачи сигнала, несущий несколько остатков тирозина, которые могут быть фосфорилированы. Предпочтительно HER-рецептор представляет собой HER-рецептор человека с нативной последовательностью.
Внеклеточный домен HER2 содержит четыре домена: домен I (аминокислотные остатки примерно от 1 до 195), домен II (аминокислотные остатки примерно от 196 до 319), домен III (аминокислотные остатки примерно от 320 до 488) и домен IV (аминокислотные остатки примерно от 489 до 630) (нумерация остатков без сигнального пептида). См. Garrett et al. Mol. Cell. 11: 495-505 (2003), Cho et al. Nature 421: 756-760 (2003), Franklin et al. Cancer Cell 5: 317-328 (2004) и Plowman et al. Proc. Natl. Acad. Sci. 90: 1746-1750 (1993). Также см. фиг. 1 в данном описании.
Термины "ErbB1", "HER1", "рецептор эпидермального фактора роста" и "EGFR" используют в настоящем описании взаимозаменяемо, и они относятся к EGFR, который описан, например, в Carpenter et al. Ann. Rev. Biochem. 56: 881-914 (1987), включая его встречающиеся в природе мутантные формы (например, делеционный мутант EGFR, который описан в Humphrey et al. PNAS (USA) 87: 4207-4211 (1990)). ErbB1 относится к гену, кодирующему белковый продукт EGFR.
Выражения "ErbB2" и "HER2" используют в настоящем описании взаимозаменяемо, и они относятся к белку HER2 человека, описанному, например, в Semba et al., PNAS (USA) 82: 6497-6501 (1985) и Yamamoto et al. Nature 319: 230-234 (1986) (номер доступа в Genebank X03363). Термин "erbB2" относится к гену, кодирующему ErbB2 человека, и "neu" относится к гену, кодирующему p185neu крысы. Предпочтительный HER2 представляет собой HER2 человека с нативной последовательностью.
"ErbB3" и "HER3" относятся к полипептиду рецептора, который описан, например, в патентах США № 5183884 и 5480968, а также в Kraus et al. PNAS (USA) 86: 9193-9197 (1989).
Термины "ErbB4" и "HER4" в настоящем описании относятся к полипептиду рецептора, который описан, например, в заявке на выдачу патента EP № 599274; Plowman et al., Proc. Natl. Acad. Sci. USA, 90: 1746-1750 (1993); и Plowman et al., Nature, 366: 473-475 (1993), включая его изоформы, которые описаны, например, в WO99/19488, опубликованной 22 апреля 1999.
Под "лигандом HER" подразумевают полипептид, который связывается и/или активирует рецептор HER. Лиганд HER, представляющий особый интерес согласно настоящему изобретению, является лигандом HER человека с нативной последовательностью, таким как эпидермальный фактор роста (EGF) (Savage et al., J. Biol. Chem. 247: 7612-7621 (1972)); трансформирующий фактор роста альфа (TGF-α) (Marquardt et al., Science 223: 1079-1082 (1984)); амфирегулин, также известный как аутокринный фактор роста шванномы и кератиноцитов (Shoyab et al. Science 243: 1074-1076 (1989); Kimura et al. Nature 348: 257-260 (1990); и Cook et al. Mol. Cell. Biol. 11: 2547-2557 (1991)); бетацеллюлин (Shing et al., Science 259: 1604-1607 (1993); и Sasada et al. Biochem. Biophys. Res. Commun. 190: 1173 (1993)); гепарин-связывающий эпидермальный фактор роста (HB-EGF) (Higashiyama et al., Science 251: 936-939 (1991)); эпирегулин (Toyoda et al., J. Biol. Chem. 270: 7495-7500 (1995); и Komurasaki et al. Oncogene 15: 2841-2848 (1997)); херегулин (См. ниже); нейрегулин-2 (NRG-2) (Carraway et al., Nature 387: 512-516 (1997)); нейрегулин-3 (NRG-3) (Zhang et al., Proc. Natl. Acad. Sci. 94: 9562-9567 (1997)); нейрегулин-4 (NRG-4) (Harari et al. Oncogene 18: 2681-89 (1999)); и cripto-(CR-1) (Kannan et al. J. Biol. Chem. 272(6): 3330-3335 (1997)). Лиганды HER, которые связывают EGFR, включают EGF, TGF-α, амфирегулин, бетацеллюлин, HB-EGF и эпирегулин. Лиганды HER, которые связывают HER3, включают херегулины. Лиганды HER, способные связывать HER4, включают бетацеллюлин, эпирегулин, HB-EGF, NRG-2, NRG-3, NRG-4 и херегулины.
"Херегулин" (HRG) при использовании в настоящем описании относится к полипептиду, кодируемому продуктом гена херегулина, который описан в патенте США № 5641869 или в Marchionni et al., Nature, 362: 312-318 (1993). Примеры херегулинов включают херегулин-α, херегулин-β1, херегулин-β2 и херегулин-β3 (Holmes et al., Science, 256: 1205-1210 (1992) и патент США № 5641869); фактор дифференцировки neu (NDF) (Peles et al. Cell 69: 205-216 (1992)); активность, индуцирующая рецептор ацетилхолина (ARIA) (Falls et al. Cell 72: 801-815 (1993)); глиальные факторы роста (GGF) (Marchionni et al., Nature, 362: 312-318 (1993)); фактор, полученный из сенсорных нейронов и мотонейронов (SMDF) (Ho et al. J. Biol. Chem. 270: 14523-14532 (1995)); γ-херегулин (Schaefer et al. Oncogene 15: 1385-1394 (1997)). Термин включает биологически активные фрагменты и/или варианты аминокислотной последовательности полипептида HRG с нативной последовательностью, такие как его фрагмент EGF-подобного домена (например, HRGβ1177-244).
"Димер HER" в настоящем описании означает нековалентно связанный димер, содержащий, по меньшей мере, два HER-рецептора. Такие комплексы могут образовываться, когда на клетку, экспрессирующую два или более HER-рецепторов, воздействует лиганд HER, и они могут быть выделены иммунопреципитацией и проанализированы в SDS-ПААГ, как описано, например, в Sliwkowski et al., J. Biol. Chem., 269(20): 14661-14665 (1994). Примеры таких димеров HER включают гетеродимеры EGFR-HER2, HER2-HER3 и HER3-HER4. Кроме того, димер HER может содержать два или более HER2-рецепторов, объединенных с другим HER-рецептором, таким как HER3, HER4 или EGFR. С димером могут быть ассоциированы другие белки, такие как субъединица рецептора цитокина (например, gp130).
"Участок связывания в гетеродимере" HER2 относится к области во внеклеточном домене HER2, которая контактирует или служит местом связывания с областью во внеклеточном домене EGFR, HER3 или HER4 при образовании с ними димера. Область обнаружена в домене II HER2. Franklin et al. Cancer Cell 5: 317-328 (2004).
"Активация HER" или "активация HER2" относится к активации или фосфорилированию любого одного или нескольких рецепторов HER или рецепторов HER2. В общем, активация HER приводит к трансдукции сигнала (например, трансдукции сигнала, вызванной внутриклеточным киназным доменом HER-рецептора, фосфорилирующим остатки тирозина в HER-рецепторе или полипептиде субстрата). Активация HER может быть опосредована связыванием лиганда HER с димером HER, содержащим представляющий интерес рецептор HER. Связывание лиганда HER с димером HER может активировать киназный домен одного или нескольких HER-рецепторов в димере и тем самым приводить к фосфорилированию остатков тирозина в одном или нескольких HER-рецепторах и/или к фосфорилированию остатков тирозина в дополнительном субстратном полипептиде(дах), таком как внутриклеточные киназы Akt или MAPK.
Термин "антитело" в настоящем описании используют в самом широком смысле, и термин специально охватывает интактные моноклональные антитела, поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела), образованные, по меньшей мере, из двух интактных антител, и фрагменты антител, при условии, что они проявляют требуемую биологическую активность.
Термин "моноклональное антитело" в используемом в настоящем описании смысле относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов, которые могут возникать во время получения моноклонального антитела, таких как варианты, описанные в настоящей публикации. В отличие от препаратов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Кроме своей специфичности моноклональные антитела имеют преимущество, состоящее в том, что они не содержат примесей других иммуноглобулинов. Определение "моноклональное" указывает на природу антитела, как антитела, полученного из по существу гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые согласно настоящему изобретению, могут быть получены способом на основе гибридом, впервые описанным в Kohler et al., Nature 256: 495 (1975), или могут быть получены способами на основе рекомбинантной ДНК (см., например, патент США № 4816567). "Моноклональные антитела" также могут быть выделены из фаговых библиотек антител с использованием способов, описанных, например, в Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991).
Моноклональные антитела в настоящем описании специально включают "химерные" антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида, или относящихся к конкретному классу или подклассу антител, тогда как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида, или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США № 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)). Химерные антитела, представляющие интерес согласно настоящему изобретению, включают "приматизированные" антитела, содержащие антигенсвязывающие последовательности вариабельного домена, полученные от примата, отличного от человека (например, обезьяны Старого Света, человекообразные обезьяны и т.д.), и последовательности константной области человека.
"Фрагменты антител" содержат часть интактного антитела, предпочтительно включающую его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диантитела; линейные антитела; одноцепочечные молекулы антител и полиспецифичные антитела, образованные из фрагмента(ов) антител.
"Интактное антитело" представляет собой антитело, которое содержит антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут быть константными доменами с нативной последовательностью (например, константные домены человека с нативной последовательностью) или с вариантами аминокислотной последовательности. Предпочтительно интактное антитело обладает одной или несколькими эффекторными функциями и содержит олигосахаридную структуру, связанную с его одной или двумя тяжелыми цепями.
"Эффекторные функции" антитела относятся к биологическим активностям, относящимся к Fc-области (Fc-области с нативной последовательностью или Fc-области с вариантом аминокислотной последовательности) антитела. Примеры эффекторных функций антител включают связывание C1q; комплемент-зависимую цитотоксичность; связывание рецептора Fc; зависимую от антител опосредованную клетками цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора, BCR) и т.д.
Термин "Fc-область" в настоящем описании используют для определения C-концевой области тяжелой цепи иммуноглобулина, включая Fc-области с нативной последовательностью или варианты Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьировать, Fc-область тяжелой цепи IgG человека обычно определяют в промежутке от аминокислотного остатка примерно в положении Cys226 или примерно от положения Pro230 до карбоксильного конца Fc-области. C-концевой лизин (остаток 447 согласно системе нумерации EU) Fc-области может быть удален, например, во время получения или очистки антитела или при рекомбинантном конструировании нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, композиция интактных антител может содержать популяции антител с удалением всех остатков K447, популяции антител без удаленных остатков K447 и популяции антител, состоящие из смеси антител, содержащих и не содержащих остатка K447.
Если в настоящем описании не оговорено особо, то нумерация остатков d тяжелой цепи иммуноглобулина представляет собой нумерацию согласно указателю EU, который описан в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). "Указатель EU согласно Kabat" относится к нумерации остатков IgG1-антитела EU человека.
В зависимости от аминокислотной последовательности константных доменов своих тяжелых цепей интактные антитела могут быть отнесены к разным "классам". Существует пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на "подклассы" (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам антител, названы α, δ, ε, γ и µ, соответственно. Субъединичные структуры и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
"Зависимая от антител опосредованная клетками цитотоксичность" и "ADCC" относятся к опосредованному клетками ответу, при котором неспецифичные цитотоксические клетки, которые экспрессируют рецепторы Fc (FcR) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги), узнают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках суммирована в таблице 3 на странице 464 в публикации Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991). Чтобы оценить активность в ADCC представляющей интерес молекулы можно осуществить анализы ADCC in vitro, такие как анализы, описанные в патентах США № 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в Clynes et al. PNAS (USA) 95: 652-656 (1998).
"Эффекторными клетками человека" являются лейкоциты, которые экспрессируют один или несколько FcR и осуществляют эффекторные функции. Предпочтительно клетки экспрессируют, по меньшей мере, FcγRIII и осуществляют ADCC-эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы; при этом предпочтительны PBMC и NK-клетки. Эффекторные клетки могут быть выделены из их природного источника, например из крови или PBMC, как описано в настоящей публикации.
Термины "Fc-рецептор" и "FcR" используют для описания рецептора, который связывается с Fc-областью антитела. Предпочтительным FcR является FcR человека с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывает IgG-антитело (гамма-рецептор), и к предпочтительным рецепторам относятся рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсируемые формы указанных рецепторов. Рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые имеют сходные аминокислотные последовательности, которые отличаются главным образом своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене основанный на тирозине мотив активации иммунорецептора (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене основанный на тирозине мотив ингибирования иммунорецептора (ITIM) (см. обзор в Daëron, Annu. Rev. Immunol. 15: 203-234 (1997)). Обзор, посвященный FcR, представлен в Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126: 330-41 (1995). Другие FcR, включая FcR, которые будут идентифицированы в будущем, включены в настоящем описании в термин "FcR". Термин также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)).
"Комплемент-зависимая цитотоксичность" и "CDC" относятся к способности молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе со своим антигеном. Чтобы оценить активацию комплемента можно осуществить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
"Нативные антитела" обычно являются гетеротетрамерными гликопротеидами с молекулярной массой примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как количество дисульфидных связей между тяжелыми цепями варьирует в разных изотипах иммуноглобулинов. Каждая тяжелая и легкая цепь также имеет равномерно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует несколько константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце. Константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Полагают, что конкретные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи.
Термин "вариабельный" относится к тому факту, что некоторые части вариабельных доменов в значительной степени отличаются по последовательности среди антител и используются в связывании и обеспечении специфичности каждого конкретного антитела по отношению к его конкретному антигену. Однако вариабельность неравномерно распределена на протяжении вариабельных доменов антител. Она сконцентрирована в трех участках, называемых гипервариабельными областями, в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высоко консервативные части вариабельных доменов называют каркасными областями (FR). Каждый из вариабельных доменов нативных тяжелой и легкой цепей содержит четыре FR, в основном принимающих конфигурацию β-слоев, соединенных тремя гипервариабельными областями, которые образуют петли, связывающие и в некоторых случаях образующие часть бета-слоистой структуры. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости областями FR и с гипервариабельными областями из другой цепи вносят вклад в образование антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены непосредственно не вовлечены в связывание антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в зависимой от антител опосредованной клетками цитотоксичности (ADCC).
Термин "гипервариабельная область" при использовании в настоящем описании относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область обычно содержит аминокислотные остатки из "области, определяющей комплементарность" или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196: 901-917 (1987)). Остатки "каркасной области" или "FR" представляют собой другие остатки вариабельного домена, отличные от остатков гипервариабельной области, которые определены в настоящем описании.
Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых "Fab"-фрагментами, каждый с одним антигенсвязывающим участком, и остаточный "Fc"-фрагмент, название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает F(ab')2-фрагмент, который имеет два антигенсвязывающих участка и еще способен перекрестно связывать антиген.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный участок узнавания антигена и связывания антигена. Указанная область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в тесной нековалентной ассоциации. В указанной конфигурации взаимодействуют три гипервариабельных области каждого вариабельного домена, определяя антигенсвязывающий участок на поверхности димера VH-VL. Вместе шесть гипервариабельных областей придают антителу специфичность в связывании антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельных области, специфичные по отношению антигену) обладает способностью узнавать и связывать антиген, хотя и с более низкой аффинностью, чем полный связывающий участок.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксильном конце домена CH1 тяжелой цепи, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH в настоящем описании является обозначением Fab', в котором остаток(ки) цистеина константных доменов несет по меньшей мере одну свободную тиольную группу. F(ab')2-фрагменты антитела обычно получают в виде пары Fab'-фрагментов, между которыми имеются цистеины шарнирной области. Также известны другие типы химического связывания фрагментов антител.
"Легкие цепи" антител любого вида позвоночных можно отнести к одному из двух явно отличающихся типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей из константных доменов.
"Одноцепочечные Fv" или "scFv" фрагменты антител содержат домены VH и VL антитела, при этом указанные домены присутствуют в одной полипептидной цепи. Предпочтительно полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать требуемую структуру для связывания антигена. Обзор, посвященный scFv, См. в Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994). scFv-фрагменты HER2-антител описаны в WO 93/16185, патенте США № 5571894 и патенте США № 5587458.
Термин "диантитела" относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, и такие фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). Благодаря использованию линкера, который является слишком коротким, чтобы обеспечить возможность спаривания между двумя доменами на одной и той же цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих участка. Диантитела более полно описаны, например, в EP 404097, WO 93/11161 и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993).
"Гуманизированные" формы антител животных, отличных от человека, (например, грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. Главным образом гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, обладающей требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области (FR) иммуноглобулина человека заменяют соответствующими остатками животного, отличного от человека. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в донорном антителе. Такие модификации осуществляют для того, чтобы дополнительно повысить эффективность антитела. В общем, гуманизированное антитело будет содержать, по существу все из, по меньшей мере, одного и обычно двух вариабельных доменов, в которых все или в основном все гипервариабельные петли соответствуют петлям иммуноглобулина животного, отличного от человека, и все или в основном все FR являются FR из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Более подробное описание см. в Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992).
Гуманизированные HER2-антитела включают huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 или трастузумаб (HERCEPTIN®), которые описаны в таблице 3 патента США No. 5821337, специально включенного в данное описание в виде ссылки; гуманизированное антитело 520C9 (WO93/21319); и гуманизированное антитело 2C4, которое описано в данной публикации.
В целях настоящего описания "трастузумаб", "HERCEPTIN®", и "huMAb4D5-8" относятся к антителу, содержащему аминокислотные последовательности легкой и тяжелой цепи SEQ ID NO: 13 и 14, соответственно.
В настоящем описании "пертузумаб" и "rhuMAb 2C4" относятся к антителу, содержащему аминокислотные последовательности легкой и тяжелой цепи SEQ ID NO: 3 и 4, соответственно.
Когда пертузумаб является интактным антителом, он предпочтительно содержит аминокислотные последовательности легкой цепи и тяжелой цепи SEQ ID NO: 15 и 16, соответственно.
"Голое антитело" означает антитело (которое определено в настоящем описании), которое не конъюгировано с гетерологичной молекулой, такой как цитотоксический остаток или радиоактивная метка.
"Изолированным" антителом является антитело, которое было идентифицировано и отделено и/или извлечено из компонентов его природной среды. Загрязняющими компонентами его природной среды являются вещества, которые могут мешать диагностическим или терапевтическим применениям антитела и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах антитело будет очищено (1) в степени, составляющей более чем 95% масс. антитела, которое определяют способом Лоури, и наиболее предпочтительно более чем 99% масс., (2) в такой степени, которая достаточна для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся цилиндром или (3) до гомогенности по оценке в SDS-ПААГ в восстанавливающих или не восстанавливающих условиях с использованием окрашивания Кумасси синим или предпочтительно серебром. Изолированное антитело включает антитело, находящееся in situ в рекомбинантных клетках, так как, по меньшей мере, один компонент из природной среды антитела не будет присутствовать. Однако обычно изолированное антитело будет получено, по меньшей мере, с помощью одной стадии очистки.
Антитело, которое "ингибирует димеризацию HER более эффективно, чем трастузумаб", является антителом, которое уменьшает количество или устраняет димеры HER более эффективно (например, по меньшей мере, примерно в 2 раза более эффективно), чем трастузумаб. Предпочтительно такое антитело ингибирует димеризацию HER2, по меньшей мере, примерно также эффективно, как антитело, выбранное из группы, состоящей из мышиного моноклонального антитела 2C4, Fab-фрагмента мышиного моноклонального антитела 2C4, интактного пертузумаба и Fab-фрагмента пертузумаба. Ингибирование димеризации HER можно оценить, исследуя димеры HER непосредственно или оценивая активацию HER или передачу сигнала ниже по течению, которая является результатом димеризации HER, и/или оценивая сайт связывания антитело-HER2, и т.д. Анализы для скрининга антител, обладающих способностью ингибировать димеризацию HER более эффективно, чем трастузумаб, описаны в Agus et al. Cancer Cell 2: 127-137 (2002) и WO01/00245 (Adams et al.). Только в качестве примера можно провести анализ ингибирования димеризации HER с использованием, например, оценки ингибирования образования димеров HER (см., например, фиг. 1A-B в Agus et al. Cancer Cell 2: 127-137 (2002); и WO 01/00245); уменьшение активации лигандом HER клеток, которые экспрессируют димеры HER (например, WO 01/00245 и фиг. 2A-B в Agus et al. Cancer Cell 2: 127-137 (2002)); блокирование связывания лиганда HER с клетками, которые экспрессируют димеры HER (например, WO 01/00245 и фиг. 2E в Agus et al. Cancer Cell 2: 127-137 (2002)); ингибирование клеточного роста злокачественных клеток (например, клеток MCF7, MDA-MD-134, ZR-75-1, MD-MB-175, T47D), которые экспрессируют димеры HER в присутствии (или отсутствие) лиганда HER (например, WO 01/00245 и фиг. 3A-D в Agus et al. Cancer Cell 2: 127-137 (2002)); ингибирование передачи сигнала ниже по течению (например, ингибирование HRG-зависимого фосфорилирования AKT или ингибирование HRG- или TGFα-зависимого фосфорилирования MAPK) (см., например, WO 01/00245 и фиг. 2C-D в Agus et al. Cancer Cell 2: 127-137 (2002)). Также можно оценить, ингибирует ли антитело димеризацию HER, исследуя сайт связывания антитело-HER2, например, посредством оценки структуры или модели, такой как кристаллическая структура, антитела, связанного с HER2 (см., например, Franklin et al. Cancer Cell 5: 317-328 (2004)).
HER2-антитело может "ингибировать HRG-зависимое фосфорилирование AKT" и/или ингибировать "HRG- или TGFα-зависимое фосфорилирование MAPK" более эффективно (например, по меньшей мере, в 2 раза более эффективно), чем трастузумаб (в качестве примера См. Agus et al. Cancer Cell 2: 127-137 (2002) и WO 01/00245).
HER2-антитело может представлять собой антитело, которое "не ингибирует отщепление эктодомена HER2" (Molina et al. Cancer Res. 61: 4744-4749(2001)).
HER2-антитело, которое "связывается с сайтом связывания в гетеродимере" HER2, связывается с остатками в домене II (и необязательно также связывается с остатками в других доменах внеклеточного домена HER2, таких как домены I и III) и может стерически затруднять, по меньшей мере, в некоторой степени, образование гетеродимера HER2-EGFR, HER2-HER3 или HER2-HER4. Franklin et al. Cancer Cell 5:317-328 (2004) охарактеризовали кристаллическую структуру HER2-пертузумаб, депонированную в RCSB Protein Data Bank (ID-код IS78), иллюстрируя типичное антитело, которое связывается с сайтом связывания HER2 в гетеродимере.
Антитело, которое "связывается с доменом II" HER2, связывается с остатками в домене II и необязательно с остатками в другом домене(ах) HER2, таких как домены I и III.
"Ингибирующее рост средство" при использовании в настоящем описании относится к соединению или композиции, которая ингибирует рост клетки, в частности злокачественной клетки, экспрессирующей HER, либо in vitro, либо in vivo. Таким образом, ингибирующим рост средством может быть средство, которое в значительной степени уменьшает процентное содержание клеток, сверхэкспрессирующих HER, в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют прохождение клеточного цикла (в другом месте, отличном от S-фазы), такие как средства, которые индуцируют задержку в G1-фазе и задержку в M-фазе. Классические блокаторы M-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средства, которые задерживают в G1, также распространяют свое действие на задержку в S-фазе, например ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., в главе 1, озаглавленной "Cell cycle regulation, oncogenes, and antineoplastic drugs" Murakami et al. (WB Saunders: Philadelphia, 1995), особенно на стр. 13.
Примерами "ингибирующих рост" антител являются антитела, которые связываются с HER2 и ингибируют рост злокачественных клеток, сверхэкспрессирующих HER2. Предпочтительные ингибирующие рост HER2-антитела ингибируют рост клеток опухоли молочной железы SK-BR-3 в культуре клеток более чем на 20% и предпочтительно более чем на 50% (например, примерно от 50% до примерно 100%) при концентрации антитела примерно от 0,5 до 30 мкг/мл, при этом ингибирование роста определяют через шесть суток после воздействия на клетки SK-BR-3 антителом (см. патент США № 5677171, опубликованный 14 октября 1997). Анализ ингибирования роста клеток SK-BR-3 более подробно описан в указанном патенте и в данном описании ниже. Предпочтительным ингибирующим рост антителом является гуманизированный вариант мышиного моноклонального антитела 4D5, например трастузумаб.
Антителом, которое "индуцирует апоптоз", является антитело, которое индуцирует запрограммированную гибель клеток, которую определяют по связыванию аннексина V, фрагментации ДНК, сморщиванию клеток, расширению эндоплазматического ретикулума, фрагментации клеток и/или образованию мембранных пузырьков (называемых апоптозными тельцами). Клеткой обычно является клетка, которая сверхэкспрессирует рецептор HER2. Предпочтительно клетка является опухолевой клеткой, например клеткой молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почки, ободочной кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. In vitro клетка может представлять собой клетку SK-BR-3, BT474, Calu 3, MDA-MB-453, MDA-MB-361 или SKOV3. Имеются различные способы оценки клеточных событий, связанных с апоптозом. Например, транслокацию фосфатидилсерина (PS) можно измерить по связыванию аннексина; фрагментацию ДНК можно оценить, получая при электрофоретическом разделении ДНК-лэддер; и конденсацию ядер/хроматина наряду с фрагментацией ДНК можно оценить по любому увеличению количеств гиподиплоидных клеток. Предпочтительно антителом, которое индуцирует апоптоз, является антитело, которое приводит примерно к 2-50-кратной, предпочтительно примерно 5-50-кратной и наиболее предпочтительно примерно 10-50-кратной индукции связывания аннексина по сравнению с необработанной клеткой в анализе связывания аннексина с использованием клеток BT474 (см. ниже). Примерами HER2-антител, которые индуцируют апоптоз, являются 7C2 и 7F3.
"Эпитоп 2C4" представляет собой область внеклеточного домена HER2, с которой связывается антитело 2C4. Чтобы провести скрининг в отношении антител, которые связываются с эпитопом 2C4, можно осуществить общепринятый анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Альтернативно можно осуществить картирование эпитопов, чтобы оценить, связывается ли антитело с эпитопом 2C4 HER2, используя способы, известные в данной области, и/или можно исследовать структуру антитело-HER2 (Franklin et al., Cancer Cell 5:317-328 (2004)), чтобы выяснить, какой домен (домены) HER2 связывается (связываются) антителом. Эпитоп 2C4 содержит остатки из домена II внеклеточного домена HER2. 2C4 и пертузумаб связываются с внеклеточным доменом HER2 в месте соединения доменов I, II и III. Franklin et al. Cancer Cell 5: 317-328 (2004).
"Эпитоп 4D5" представляет собой область внеклеточного домена HER2, с которой связываются антитело 4D5 (ATCC CRL 10463) и трастузумаб. Указанный эпитоп расположен вблизи трансмембранного домена HER2 и в домене IV HER2. Чтобы провести скрининг в отношении антител, которые связываются с эпитопом 4D5, можно осуществить общепринятый анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Альтернативно можно осуществить картирование эпитопов, чтобы оценить, связывается ли антитело с эпитопом 4D5 HER2 (например, с любым одним или несколькими остатками в области примерно от остатка 529 до остатка 625, включительно, как показано на фиг. 1).
"Эпитоп 7C2/7F3" представляет собой область на N-конце в домене I внеклеточного домена HER2, с которой связываются антитела 7C2 и/или 7F3 (каждое из которых депонировано в ATCC, см. ниже). Чтобы провести скрининг в отношении антител, которые связываются с эпитопом 7C2/7F3, можно осуществить общепринятый анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Альтернативно можно осуществить картирование эпитопов, чтобы установить, связывается ли антитело с эпитопом 7C2/7F3 на HER2 (например, любым одним или несколькими остатками в области примерно от остатка 22 до остатка 53 HER2, как показано на фиг. 1).
"Лечение" относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. К субъектам, нуждающимся в лечении, относятся субъекты, уже имеющие заболевание, а также субъекты, у которых необходимо предотвратить заболевание. Поэтому у пациента, которого необходимо лечить согласно настоящему изобретению, может быть диагностировано наличие заболевания, или он может быть предрасположен или чувствителен к заболеванию.
Термины "злокачественная опухоль" и "злокачественный" относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом. Примеры злокачественной опухоли включают без ограничения карциному, лимфому, бластому (включая медуллобластому и ретинобластому), саркому (включая липосаркому и саркому синовиальных клеток), нейроэндокринные опухоли (включая карциноидные опухоли, гастриному и рак островковых клеток), мезотелиому, шванному (включая акустическую нейрому), менингиому, аденокарциному, меланому и лейкоз или лимфоидные злокачественные образования. Более конкретные примеры таких злокачественных опухолей включают рак сквамозных клеток (например, рак клеток сквамозного эпителия), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого, рак брюшины, гепатоклеточный рак, рак желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, рак прямой кишки, рак ободочной и прямой кишки, эндометриальную карциному или карциному матки, карциному слюнных желез, рак почек, рак простаты, рак вульвы, рак щитовидной железы, карциному печени, карциному заднего прохода, карциному пениса, рак семенников, рак пищевода, опухоли желчных путей, а также рак головы и шеи.
Термин "эффективное количество" относится к количеству лекарственного средства, эффективному при лечении заболевания у пациента. Когда заболеванием является злокачественная опухоль, эффективное количество лекарственного средства может уменьшать количество злокачественных клеток; уменьшать размер опухоли; ингибировать (т.е. в определенной степени замедлять и предпочтительно останавливать) инфильтрацию злокачественных клеток в периферические органы; ингибировать (т.е. в определенной степени замедлять и предпочтительно останавливать) опухолевые метастазы; в определенной степени ингибировать рост опухоли; и/или в определенной степени ослаблять один или несколько симптомов, связанных со злокачественной опухолью. В зависимости от степени, в которой лекарственное средство может предотвращать рост и/или убивать существующие злокачественные клетки, оно может быть цитостатическим и/или цитотоксическим. Эффективное количество может продлевать выживаемость без прогрессирования, приводить к объективному ответу (включая частичный ответ, PR, или полный ответ, CR), увеличивать общую продолжительность выживания и/или ослабить один или несколько симптомов злокачественной опухоли.
"HER2-позитивная злокачественная опухоль" представляет собой злокачественную опухоль, содержащую клетки, которые имеют белок HER2 на клеточной поверхности.
Злокачественная опухоль, которая "сверхэкспрессирует" HER-рецептор, представляет собой злокачественную опухоль, которая имеет значительно более высокие уровни HER-рецептора, такого как HER2, на клеточной поверхности по сравнению с незлокачественной клеткой такого же типа ткани. Такая сверхэкспрессия может быть вызвана амплификацией генов или повышенной транскрипцией или трансляцией. Сверхэкспрессию рецептора HER можно определить в диагностическом или прогностическом анализе посредством оценки повышенных уровней белка HER, присутствующего на поверхности клетки (например, с использованием иммуногистохимического анализа; IHC). Альтернативно или дополнительно можно измерить уровни кодирующей HER нуклеиновой кислоты в клетке, например, способами флуоресцентной гибридизации in situ (FISH; см. WO98/45479, опубликованную в октябре 1998), Саузерн-блоттинга или полимеразной цепной реакции (ПЦР), такой как количественная ПЦР в режиме реального времени (qRT-ПЦР). Также можно исследовать сверхэкспрессию рецептора HER измерением "слущиваемого" антигена (например, внеклеточного домена HER) в биологической жидкости, такой как сыворотка (см., например, патент США № 4933294, опубликованный 12 июня 1990; WO 91/05264, опубликованную 18 апреля 1991; патент США № 5401638, опубликованный 28 марта 1995; и Sias et al. J. Immunol. Methods 132: 73-80 (1990)). За исключением указанных выше анализов специалисту доступны различные анализы in vivo. Например, можно подвергнуть клетки в организме пациента воздействию антитела, которое необязательно метят регистрируемой меткой, например радиоактивным изотопом, и можно оценить у пациента связывание антитела с клетками, например, внешним сканированием радиоактивности или анализом биопсии, взятой у пациента, предварительно подвергнутого воздействию антитела.
Наоборот, злокачественная опухоль, которая "не сверхэкспрессирует рецептор HER2" представляет собой злокачественную опухоль, которая не экспрессирует более высокие, чем нормальные, уровни рецептора HER2 по сравнению с незлокачественной клеткой того же типа ткани.
Злокачественная опухоль, которая "сверхэкспрессирует" лиганд HER, представляет собой злокачественную опухоль, которая продуцирует значительно более высокие уровни такого лиганда по сравнению с незлокачественной клеткой такого же типа ткани. Такая сверхэкспрессия может быть вызвана амплификацией гена или повышенной транскрипцией или трансляцией. Сверхэкспрессию лиганда HER можно определить диагностически, оценивая уровни лиганда (или кодирующей его нуклеиновой кислоты) у пациента, например в биопсии опухоли, или в различных диагностических анализах, таких как IHC, FISH, Саузерн-блоттинг, ПЦР или анализы in vivo, описанные выше.
Термин "цитотоксическое средство" в используемом в настоящем описании смысле относится к веществу, которое ингибирует или предотвращает функционирование клеток и/или вызывает разрушение клеток. Подразумевается, что термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины, имеющие происхождение из бактерий, грибов, растений или животных, включая их фрагменты и/или варианты.
"Химиотерапевтическим средством" является химическое соединение, применимое для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXAN®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбохинон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилмеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности калихеамицин гамма II и калихеамицин омега II (см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеинов - энедииновые антибиотики, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая ADRIAMICIN®, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, доксорубициноНСl в инъецируемых липосомах (DOXOL®), липосомный доксорубицин TLC D-99 (MYOCET®), пегилированный липосомный доксорубицин (CAELYX®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; средства, подавляющие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазихон; элфорнитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (в частности, токсин T-2, верракурин A, роридин A и ангуидин); уретан; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("ara-C"); тиотепа; таксоид, например паклитаксел (TAXOL®), препарат паклитаксела на основе сконструированных связанных с альбумином наночастиц (ABRAXANETM) и доцетаксел (TAXOTERE®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; средства на основе платины, такие как цисплатин, оксалиплатин и карбоплатин; алкалоиды барвинка, которые предотвращают полимеризацию тубулина из образующихся микротрубочек, включая винбластин (VELBAN®), винкристин (ONCOVIN®), виндезин (ELDISINE®, FILDESIN®) и винорелбин (NAVELBINE®); этопозид (VP-16); ифосфамид; митоксантрон; лейковорин; новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота, включая бексаротен (TARGRETIN®); бифосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновую кислоту/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризендронат (ACTONEL®); троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигналов, вовлеченных в пролиферацию аберрантных клеток, таких как, например, PKC-альфа, Raf, H-Ras и рецептора эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 (например, LURTOTECAN®); rmRH (например, ABARELIX®); BAY439006 (сорафениб; Bayer); SU-11248 (Pfizer); перифосин, ингибитор ЦОГ-2 (например, целекоксиб или эторикоксиб), ингибитор протеосом (например, PS341); бортезомиб (VELCADE®); CCI-779; типифарниб (811577); орафениб, ABT510; ингибитор Bcl-2, такой как облимерсен натрия (GENASENSE®); пиксантрон; ингибиторы EGFR (см. определение ниже); ингибиторы тирозинкиназ (см. определение ниже); и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств; а также сочетания двух или более указанных выше средств, такие как CHOP, сокращенное название комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращенное название схемы лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейковорином.
Также в указанное определение включены противогормональные средства, которые действуют, регулируя или ингибируя действие гормонов на опухоли, такие как антиэстрогены со смешанным профилем агонист/антагонист, включая тамоксифен (NOLVADEX®), 4-гидрокситамоксифен, триоксифен, торемифен (FARESTON®); идоксифен, дролоксифен, ралоксифен (EVISTA®), триоксифен, кеоксифен и избирательные модуляторы рецепторов эстрогена (SERM), такие как SERM3; чистые антиэстрогены без агонистических свойств, такие как фулвестрант (FASLODEX®) и EM800 (такие средства могут блокировать димеризацию рецепторов эстрогена (ER), ингибировать связывание ДНК, усиливать метаболизм ER и/или снижать уровни ER); ингибиторы ароматазы, включая стероидные ингибиторы ароматазы, такие как форместан и эксеместан (AROMASIN®), и нестероидные ингибиторы ароматазы, такие как анастразол (ARIMIDEX®), летрозол (FEMARA®) и аминоглутетимид и другие ингибиторы ароматазы, включая ворозол (RIVISOR®), ацетат мегестрола (MEGASE®), фадрозол, имидазол; агонисты рилизинг-гормона лютеинизирующего гормона, включая лейпролид (LUPRON® и ELIGARD®), гозерелин, бузерелин и триптерелин; половые стероиды, включая прогестины, такие как ацетат мегестрола и ацетат медроксипрогестерона, эстрогены, такие как диэтилстилбестрол и премарин и андрогены/ретиноиды, такие как флуоксиместерон, полностью трансретиноевая кислота и фенретинид; онапристон; антипрогестероны; понижающие регуляторы рецепторов эстрогенов (ERD); антиандрогены, такие как флутамид, нилутамид и бикалутамид; тестолактон; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств; а также сочетания двух или более указанных выше средств.
В используемом в настоящем описании смысле термин "направленное к EGFR лекарственное средство" относится к терапевтическому средству, которое связывается с EGFR и необязательно ингибирует активацию EGFR. Примеры таких средств включают антитела и малые молекулы, которые связываются с EGFR. Примеры антител, которые связываются с EGFR, включают MAb 579 (ATCC CRL HB 8506), MAb 455 (ATCC CRL HB8507), MAb 225 (ATCC CRL 8508), MAb 528 (ATCC CRL 8509) (см. патент США № 4943533, Mendelsohn et al.) и их варианты, такие как химерное антитело 225 (C225 или цетуксимаб; ERBUTIX®) и реконструированное антитело 225 человека (H225) (см. WO 96/40210, Imclone Systems Inc.); IMC-11F8, полностью человеческое направленное к EGFR антитело (Imclone); антитела, которые связывают мутант EGFR типа II (патент США № 5212290); гуманизированные и химерные антитела, которые связывают EGFR, которые описаны в патенте США № 5891996; и человеческие антитела, которые связывают EGFR, такие как ABX-EGF или панитумумаб (см. WO98/50433, Abgenix/Amgen); EMD 55900 (Stragliotto et al. Eur. J. Cancer 32A: 636-640 (1996)); EMD7200 (матузумаб) гуманизированное EGFR-антитело, направленное против EGFR, которое конкурирует с EGF и TGF-альфа за связывание EGFR (EMD/Merck); человеческое EGFR-антитело, HuMax-EGFR (GenMab); полностью человеческие антитела, известные как E1.1, E2.4, E2.5, E6.2, E6.4, E2.11, E6.3 и E7.6.3 и описанные в US 6235883; MDX-447 (Medarex Inc); и mAb 806 или гуманизированное mAb 806 (Johns et al., J. Biol. Chem. 279(29): 30375-30384 (2004)). Анти-EGFR-антитело может быть конъюгировано с цитотоксическим средством с образованием таким образом иммуноконъюгата (см., например, EP 659439 A2, Merck Patent GmbH). Антагонисты EGFR включают малые молекулы, такие как соединения, описанные в патентах США № 5616582, 5457105, 5475001, 5654307, 5679683, 6084095, 6265410, 6455534, 6521620, 6596726, 6713484, 5770599, 6140332, 5866572, 6399602, 6344459, 6602863, 6391874, 6344455, 5760041, 6002008 и 5747498, а также в следующих публикациях PCT: WO98/14451, WO98/50038, WO99/09016 и WO99/24037. Конкретные малые молекулы, являющиеся антагонистами EGFR, включают OSI-774 (CP-358774, эрлотиниб, TARCEVA® Genentech/OSI Pharmaceuticals); PD 183805 (CI 1033, 2-пропенамид, N-[4-[(3-хлор-4-фторфенил)амино]-7-[3-(4-морфолинил)пропокси]-6-хиназолинил]дигидрохлорид, Pfizer Inc.); ZD 1839, гефитиниб (IRESSA®) 4-(3'-хлор-4'-фторанилино)-7-метокси-6-(3-морфолинопропокси)хиназолин, AstraZeneca); ZM 105180 ((6-амино-4-(3-метилфениламино)хиназолин, Zeneca); BIBX-1382 (N8-(3-хлор-4-фторфенил)-N2-(1-метилпиперидин-4-ил)пиримидо[5,4-d]пиримидин-2,8-диамин, Boehringer Ingelheim); PKI-166 ((R)-4-[4-[(1-фенилэтил)амино]-1H-пирроло[2,3-d]пиримидин-6-ил]фенол); (R)-6-(4-гидроксифенил)-4-[(1-фенилэтил)амино]-7H-пирроло[2,3-d]пиримидин); CL-387785 (N-[4-[(3-бромфенил)амино]-6-хиназолинил]-2-бутинамид); EKB-569 (N-[4-[(3-хлор-4-фторфенил)амино]-3-циано-7-этокси-6-хинолинил]-4-(диметиламино)-2-бутенамид) (Wyeth); AG1478 (Sugen); AG1571 (SU 5271; Sugen); двойные ингибиторы тирозинкиназ EGFR/HER2, такие как лапатиниб (GW 572016 или N-[3-хлор-4-[(3 фторфенил)метокси]фенил]-6-[5-[[[2-метилсульфонил)этил]амино]метил]-2-фуранил]-4-хиназолинамин; Glaxo-SmithKline) или производные цианогуанидинхиназолина и цианоамидинхиназоламина.
"Ингибитор тирозинкиназы" означает молекулу, которая ингибирует тирозинкиназную активность тирозинкиназы, такой как рецептор HER. Примеры таких ингибиторов включают направленные к EGFR лекарственные средства, указанные в предыдущем абзаце; низкомолекулярный ингибитор тирозинкиназы HER2, такой как TAK165, доступный от Takeda; CP-724714, пероральный избирательный ингибитор тирозинкиназы рецептора ErbB2 (Pfizer и OSI); двойные ингибиторы HER, такие как EKB-569 (доступный от Wyeth), который предпочтительно связывает EGFR, но ингибирует как HER2-, так и EGFR-сверхэкспрессирующие клетки; лапатиниб (GW572016, доступный от Glaxo-SmithKline), пероральный ингибитор тирозинкиназы HER2 и EGFR; PKI-166 (доступный от Novartis); пан-HER-ингибиторы, такие как канетиниб (CI-1033; Pharmacia); ингибиторы Raf-1, такие как антисмысловой агент ISIS-5132, доступный от ISIS Pharmaceuticals, который ингибирует передачу сигнала Raf-1; не направленные к HER ингибиторы TK, такие как мезилат иматиниба (GleevacTM), доступный от Glaxo; ингибитор регулируемой внеклеточными сигналами MAPK-киназы 1 CI-1040 (доступный от Pharmacia); хиназолины, такие как PD 153035, 4-(3-хлоранилино)хиназолин; пиридопиримидины; пиримидопиримидины; пирролопиримидины, такие как CGP 59326, CGP 60261 и CGP 62706; пиразолопиримидины, 4-(фениламино)-7H-пирроло[2,3-d]пиримидины; куркумин (диферулоилметан, 4,5-бис(4-фторанилино)фталимид); тирфостины, содержащие остатки нитротиофена; PD-0183805 (Warner-Lamber); антисмысловые молекулы (например, молекулы, которые связываются с нуклеиновой кислотой, кодирующей HER); хиноксалины (патент США № 5804396); трифостины (патент США № 5804396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); пан-HER-ингибиторы, такие как CI-1033 (Pfizer); аффинитак (ISIS 3521; Isis/Lilly); мезилат иматиниба (Gleevac; Novartis); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); семаксиниб (Sugen); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone); производные цианогуанидинхиназолин и цианоамидинхиназоламин; или средства, описанные в любой из следующих патентных публикаций: патент США № 5804396; WO 99/09016 (American Cyanimid); WO 98/43960 (American Cyanamid); WO 97/38983 (Warner Lambert); WO 99/06378 (Warner Lambert); WO 99/06396 (Warner Lambert); WO 96/30347 (Pfizer, Inc); WO 96/33978 (Zeneca); WO 96/3397 (Zeneca); и WO96/33980 (Zeneca) и US2005/0101617.
"Антиангиогенное средство" относится к соединению, которое блокирует или в некоторой степени препятствует развитию кровеносных сосудов. Антиангиогенным фактором может быть, например, малая молекула или антитело, которое связывается с фактором роста или рецептором фактора роста, вовлеченным в стимуляцию ангиогенеза. Предпочтительным антиангиогенным фактором согласно изобретению является антитело, которое связывается с фактором роста эндотелия сосудов (VEGF), такое как бевацизумаб (AVASTIN®).
Термин "цитокин" является родовым названием белков, высвобождаемых одной популяцией клеток, которые действуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. К цитокинам относится гормон роста, такой как гормон роста человека, N-метионил-гормон роста человека и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеидные гормоны, такие как фолликулостимулирующий гормон (ФСГ), тиреотропин (ТСГ) и лютеинизирующий гормон (ЛГ); фактор роста гепатоцитов; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-α и -β; мюллерова ингибирующая субстанция; мышиный ассоциированный с гонадотропином пептид; ингибин; активин; фактор роста эндотелиальных клеток сосудов; интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-β; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ, колониестимулирующие факторы (CSF), такие как CSF макрофагов (M-CSF), CSF гранулоцитов и макрофагов (GM-CSF) и CSF гранулоцитов (G-CSF); интерлейкины (IL), такие как IL-1, IL-1-α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, фактор некроза опухоли, такой как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и лиганд kit (KL). В используемом в настоящем описании смысле термин цитокин включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с нативной последовательностью.
II. Композиции варианта HER2-антитела
Настоящее изобретение, по меньшей мере, отчасти относится к композициями нескольких HER2-антител. Предпочтительно HER2-антитело (любое одно или оба антитела: HER2-антитело главного типа и вариант такого антитела) представляет собой антитело, которое связывается с доменом II HER2, ингибирует димеризацию HER более эффективно, чем трастузумаб, и/или связывается с участком связывания в гетеродимере HER2. Предпочтительный вариант антитела главного типа согласно изобретению представляет собой антитело, содержащее аминокислотные последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи SEQ ID NO: 3 и 4 и наиболее предпочтительно содержащее аминокислотные последовательности легкой цепи и тяжелой цепи EQ ID NO: 15 и 16 (пертузумаб).
Композиция согласно изобретению содержит HER2-антитело главного типа, которое связывается с доменом II HER2, и его кислые варианты, при этом кислые варианты включают один, два или три из следующих вариантов: гликозилированный вариант, вариант с восстановленной дисульфидной связью и невосстанавливаемый вариант. Кислые варианты в композиции могут включать один, два, три, четыре или пять из следующих вариантов: гликозилированный вариант, дезаминированный вариант, вариант с восстановленной дисульфидной связью, сиалилированный вариант и невосстанавливаемый вариант. Предпочтительно общее количество всех кислых вариантов в композиции составляет менее чем примерно 25%. В одном варианте гликозилированный вариант, дезаминированный вариант, вариант с восстановленной дисульфидной связью, сиалилированный вариант и невосстанавливаемый вариант составляют, по меньшей мере, примерно 75-80% от кислых вариантов в композиции.
Изобретение, кроме того, относится к композиции, содержащей HER2-антитело главного типа, содержащее последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи SEQ ID NO: 3 и 4, соответственно, и кислые варианты антитела главного типа, при этом кислые варианты включают один, два, три, четыре или пять из следующих вариантов: гликозилированный вариант, дезаминированный вариант, вариант с восстановленной дисульфидной связью, сиалилированный вариант и невосстанавливаемый вариант.
Изобретение относится к способу получения фармацевтической композиции, включающему: (1) получение композиции, содержащей HER2-антитело главного вида, которое связывается с доменом II HER2, и его кислые варианты, включая гликозилированный вариант, вариант с восстановленной дисульфидной связью или невосстанавливаемый вариант, и (2) оценку кислых вариантов в композиции и подтверждение того, что их количество составляет менее чем примерно 25%. Способ предполагает объединение композиции до, во время или после стадии (2) с фармацевтически приемлемым носителем. В одном варианте композиция, оцениваемая на стадии (2), находится в фармацевтически приемлемом носителе.
В одном варианте, по меньшей мере, примерно 75-80% кислых вариантов (составляющих менее чем примерно 25% композиции) выбраны из: гликозилированного варианта, дезаминированного варианта, варианта с восстановленной дисульфидной связью, сиалилированного варианта и невосстанавливаемого варианта.
Кислые варианты можно оценивать несколькими способами, но предпочтительно такие способы включают один, два, три, четыре или пять из следующих способов: ионообменную хроматографию (IEC), в случае которой композицию обрабатывают сиалидазой до, после и/или во время IEC (чтобы оценить сиалилированный вариант), восстанавливающий CE-SDS (например, чтобы оценить вариант с восстановленной дисульфидной связью), не восстанавливающий CE-SDS (чтобы оценить невосстанавливаемый вариант), хроматографию с использованием бороната (например, чтобы оценить гликозилированный вариант) и пептидное картирование (например, чтобы оценить дезаминированный вариант).
В одном варианте суммарные кислые варианты оценивают ионообменной хроматографией, например, используя слабый катионообменник и/или катионообменник с карбоксилатной функциональной группой (например, используя колонку для хроматографии WCX-10 DIONEX PROPACTM). В одном варианте такой хроматографии условия для хроматографии включают буфер A, содержащий 20 мМ бистрис, pH 6,0; буфер B, содержащий 20 мМ бистрис, 200 мМ NaCl, pH 6,0; и градиент 0,5% буфера B с расходом 1,0 мл/мин.
Композиция необязательно содержит вариант с удлинением в виде аминоконцевого лидера. Предпочтительно удлинение в виде аминоконцевого лидера находится на легкой цепи варианта антитела (например, на одной или двух легких цепях варианта антитела). HER2-антитело главного вида или вариант антитела могут представлять собой интактное антитело или фрагмент антитела (например, фрагменты Fab или F(ab')2), но предпочтительно они являются интактными антителами. Вариант антитела согласно изобретению может содержать удлинение в виде аминоконцевого лидера на любой одной или нескольких тяжелых или легких цепях. Предпочтительно удлинение в виде аминоконцевого лидера находится на одной или двух легких цепях антитела. Удлинение в виде аминоконцевого лидера предпочтительно содержит или состоит из VHS-. Присутствие удлинения в виде аминоконцевого лидера в композиции может быть выявлено различными способами анализа, включая без ограничения, анализ N-концевой последовательности, анализ в отношении гетерогенности зарядов (например, катионообменная хроматография или капиллярный зональный электрофорез), масс-спектрометрия и т.д.) Количество варианта антитела в композиции обычно находится в диапазоне от количества, которое составляет нижний предел определения в анализе (предпочтительно катионообменном анализе), используемом для определения варианта, до количества, которое меньше, чем количество антитела главного типа. Обычно примерно 20% или меньше (например, от 1% до примерно 15%, например, от 5% до примерно 15% и предпочтительно примерно от 8% до примерно 12%) от количества молекул антитела в композиции содержат удлинение в виде аминоконцевого лидера. Такое количество в процентах предпочтительно определяют, используя катионообменный анализ.
Предполагаются дополнительные изменения аминокислотной последовательности антитела главного типа и/или варианта, включая без ограничения антитело, содержащее C-концевой остаток лизина на одной или двух тяжелых цепях (такой вариант антитела может присутствовать в количестве примерно от 1% до примерно 20%), антитело с одним или несколькими окисленными остатками метионина (например, пертузумаб, содержащий окисленный met-254) и т.д.
Кроме того, помимо сиалилированного варианта, обсуждаемого выше, антитело главного типа или вариант могут дополнительно содержать варианты гликозилирования, не ограничивающие примеры которых включают антитело, содержащее олигосахаридную структуру G1 или G2, связанную с его Fc-областью, антитело, содержащее углеводный остаток, связанный с его легкой цепью (например, один или два углеводных остатка, таких как глюкоза или галактоза, связанных с одной или двумя легкими цепями антитела, например связанных с одним или несколькими остатками лизина), антитело, содержащее одну или две негликозилированных тяжелых цепи, и т.д.
Необязательно антитело, содержащее одну или две легкие цепи, при этом любая одна или обе легкие цепи содержат аминокислотную последовательность SEQ ID NO: 23 (включая его варианты, такие как варианты, описанные в настоящей публикации). Антитело дополнительно содержит одну или две тяжелые цепи, при этом любая одна или обе тяжелые цепи содержат аминокислотную последовательность SEQ ID NO: 16 или SEQ ID NO: 24 (включая его варианты, такие как варианты, описанные в настоящей публикации).
Композиция может быть получена из генетически сконструированной линии клеток, например, линии клеток яичника китайского хомячка (CHO), экспрессирующей HER2-антитело, или может быть получена пептидным синтезом.
III. Получение HER2-антител
Следующее далее описание приведено для иллюстрации способов получения антител, используемых согласно настоящему изобретению. HER2-антиген, используемый для получения антител, может представлять собой, например, растворимую форму внеклеточного домена HER2 или его части, содержащей требуемый эпитоп. Альтернативно для создания антител можно использовать клетки, экспрессирующие HER на своей клеточной поверхности (например, клетки NIH-3T3, трансформированные для сверхэкспрессии HER2; или линию клеток карциномы, такую как клетки SK-BR-3, см. Stancovski et al., PNAS (USA) 88: 8691-8695 (1991)). Другие формы HER2, применимые для создания антитела, будут очевидны для специалистов в данной области.
(i) Моноклональные антитела
Моноклональные антитела получают из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов, которые могут возникать во время получения моноклонального антитела, таких как варианты, описанные в настоящей публикации. Таким образом, определение "моноклональное" указывает на характер антитела, как антитела, не являющегося смесью дискретных антител.
Например, моноклональные антитела могут быть получены с использованием способа на основе гибридом, впервые описанного Kohler et al., Nature, 256: 495 (1975), или могут быть получены способами на основе рекомбинантной ДНК (патент США № 4816567).
В способе на основе гибридом мышь или другого подходящего животного-хозяина, такого как хомячок, иммунизируют как описано выше, чтобы вызвать появление лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфично связываться с белком, используемым для иммунизации. Альтернативно лимфоциты можно иммунизировать in vitro. Затем лимфоциты сливают с клетками миеломы, используя подходящий агент для слияния, такой как полиэтиленгликоль, чтобы образовать гибридомную клетку (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или жизнеспособность неслитых исходных клеток миеломы. Например, если в исходных клетках миеломы отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), то в культуральную среду для гибридом обычно будут включать гипоксантин, аминоптерин и тимидин (среда HAT), и такие вещества предотвращают рост HGPRT-дефицитных клеток.
Предпочтительные клетки миеломы представляют собой клетки, которые эффективно сливаются, поддерживают на стабильно высоком уровне продукцию антител отобранными продуцирующими антитела клетками и чувствительны к такой среде, как среда HAT. Среди них предпочтительными линиями клеток миеломы являются линии клеток миеломы мышей, такие как линии, полученные из опухолей мышей MOPC-21 и MPC-11, доступные из Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или X63-Ag8-653, доступные из Американской коллекции типов культур, Rockville, Maryland USA. Линии клеток миеломы человека и гетеромиеломы мыши-человека также были описаны для получения моноклональных антител человека (Kozbor, J. Immunol., 133: 3001 (1984); и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают клетки гибридомы, анализируют в отношении продукции моноклональных антител, направленных против антигена. Предпочтительно специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют с помощью иммунопреципитации или анализом связывания in vitro, таким как радиоиммуноанализ (РИА) или твердофазный иммуноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела, например, можно определить анализом по Скэтчарду, как описано в Munson et al., Anal. Biochem., 107: 220 (1980).
После того как установлено, что клетки гибридомы продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны могут быть субклонированы способами лимитирующего разведения и выращены стандартными способами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящие культуральные среды для указанной цели включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы могут быть выращены in vivo в виде асцитных опухолей у животного.
Моноклональные антитела, секретируемые субклонами, соответствующим образом отделяют от культуральной среды, асцитной жидкости или сыворотки обычными способами очистки антител, такими как, например, хроматография с использованием белок A-сефарозы, гидроксилапатита, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующую моноклональные антитела легко выделяют и секвенируют, используя обычные способы (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). Клетки гибридомы служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки обезьян COS, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в ином случае не продуцируют белок антитела, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи о рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al., Curr. Opinion in Immunol., 5: 256-262 (1993) и Pluckthun, Immunol. Revs., 130: 151-188 (1992).
В следующем варианте моноклональные антитела или фрагменты антител могут быть выделены из фаговых библиотек антител, созданных с использованием способа, описанного в публикациях McCafferty et al., Nature, 348: 552-554 (1990). В Clackson et al., Nature, 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991) описано выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В последующих публикациях описано получение высоко аффинных (нМ-диапазон) антител человека с помощью перетасовки цепей (Marks et al., Bio/Technology, 10: 779-783 (1992)), а также комбинаторная инфекция и рекомбинация in vivo в качестве методики конструирования очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res., 21: 2265-2266 (1993)). Таким образом, указанные способы являются приемлемой альтернативой традиционным способам на основе продуцирующих моноклональные антитела гибридом для выделения моноклональных антител.
ДНК также может быть модифицирована, например подстановкой кодирующей последовательности константных доменов тяжелой и легкой цепей человека вместо гомологичных мышиных последовательностей (патент США № 4816567; Morrison, et al., Proc. Natl. Acad. Sci. USA, 81: 6851 (1984)) или ковалентным связыванием с кодирующей иммуноглобулин последовательностью всей или части последовательности, кодирующей неиммуноглобулиновый полипептид.
Обычно такими неиммуноглобулиновыми полипептидами заменяют константные домены антитела или ими заменяют вариабельные домены одного антигенсвязывающего участка антитела, чтобы создать химерное бивалентное антитело, содержащее один антигенсвязывающий участок, имеющий специфичность по отношению к одному антигену, и другой антигенсвязывающий участок, имеющий специфичность по отношению к другому антигену.
(ii) Гуманизированные антитела
Способы гуманизации антител животных, отличных от человека, описаны в данной области. Предпочтительно гуманизированное антитело имеет один или несколько аминокислотных остатков, введенных в него из источника, который отличен от человека. Указанные аминокислотные остатки животного, отличного от человека, часто называют "импортируемыми" остатками, которые обычно берут из "импортируемого" вариабельного домена. Гуманизацию можно по существу выполнить, следуя способу Винтера и соавторов (Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)), заменой последовательностями гипервариабельных областей соответствующих последовательностей антитела человека. Соответственно, такие "гуманизированные" антитела являются химерными антителами (патент США № 4816567), в которых значительно меньшая часть, чем интактный вариабельный домен человека, была заменена соответствующей последовательностью вида, отличного от человека. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки гипервариабельной области и возможно некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
Выбор вариабельных доменов человека, как легкой, так и тяжелой цепи, используемых для получения гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому способу "оптимальной подгонки" последовательность вариабельного домена антитела грызуна подвергают скринингу по сравнению с полной библиотекой известных последовательностей вариабельных доменов человека. Последовательность человека, которая наиболее близка последовательности грызуна, затем берут в качестве каркасной области (FR) человека для гуманизированного антитела (Sims et al., J. Immunol., 151: 2296 (1993); Chothia et al., J. Mol. Biol., 196: 901 (1987)). В другом способе используют конкретную каркасную область, полученную из консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких разных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); Presta et al., J. Immunol., 151: 2623 (1993)).
Кроме того, важно чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и других благоприятных биологических свойств. Для достижения указанной цели согласно предпочтительному способу гуманизированные антитела получают, проводя анализ исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и показывают возможные трехмерные конформационные структуры выбранных для исследования последовательностей иммуноглобулина. Исследование таких изображений позволяет проанализировать вероятную роль остатков в функционировании выбранной для исследования последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность выбранного для исследования иммуноглобулина связывать соответствующий ему антиген. Таким образом могут быть выбраны и объединены остатки FR из реципиентных и импортируемых последовательностей так, чтобы достичь требуемых характеристик антитела, таких как повышенная аффинность по отношению к антигену(нам)-мишени. В общем, остатки гипервариабельной области непосредственно и в наибольшей степени влияют на связывание антигена.
В патенте США № 6949245 описано получение типичных гуманизированных HER2-антител, которые связывают HER2 и блокируют активацию рецептора HER лигандом. Гуманизированное антитело, представляющее особый интерес согласно изобретению, блокирует опосредованную EGF, TGF-α и/или HRG активацию MAPK по существу так же эффективно, как и мышиное моноклональное антитело 2C4 (или его Fab-фрагмент), и/или связывает HER2 по существу так же эффективно, как и мышиное моноклональное антитело 2C4 (или его Fab-фрагмент). Гуманизированное антитело согласно изобретению может, например, содержать остатки гипервариабельной области животного, отличного от человека, включенные в вариабельный домен тяжелой цепи человека, и может дополнительно содержать замену в каркасной области (FR) в положении, выбранном из группы, состоящей из 69H, 71H и 73H, используя систему нумерации вариабельного домена, приведенную в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991). В одном варианте гуманизированное антитело содержит замены в FR в двух или во всех положениях 69H, 71H и 73H.
Типичное гуманизированное антитело, представляющее интерес согласно изобретению, содержит определяющие комплементарность остатки вариабельного домена тяжелой цепи GFTFTDYTMX, где X предпочтительно означает D или S (SEQ ID NO: 7); DVNPNSGGSIYNQRFKG (SEQ ID NO:8) и/или NLGPSFYFDY (SEQ ID NO:9), необязательно содержащие аминокислотные модификации таких остатков CDR, например модификации, по существу сохраняющие или повышающие аффинность антитела. Например, представляющий интерес вариант антитела может иметь примерно от одного до семи или примерно пять аминокислотных замен в указанной выше последовательности CDR вариабельного домена тяжелой цепи. Такие варианты антител могут быть получены созреванием аффинности, например, как описано ниже. Наиболее предпочтительное гуманизированное антитело содержит аминокислотную последовательность вариабельного домена тяжелой цепи SEQ ID NO: 4.
Гуманизированное антитело может содержать остатки определяющей комплементарность области вариабельного домена легкой цепи KASQDVSIGVA (SEQ ID NO: 10); SASYX1X2X3, где X1 предпочтительно означает R или L, X2 предпочтительно означает Y или E, и X3 предпочтительно означает T или S (SEQ ID NO: 11); и/или QQYYIYPYT (SEQ ID NO: 12), например, дополнительно к остаткам CDR вариабельного домена тяжелой цепи, указанным в предыдущем абзаце. Такие гуманизированные антитела необязательно содержат аминокислотные модификации указанных выше остатков CDR, например модификации, по существу сохраняющие или повышающие аффинность антитела. Например, представляющий интерес вариант антитела может иметь примерно от одной до семи или примерно пять аминокислотных замен в указанных выше последовательностях CDR вариабельного домена легкой цепи. Такие варианты антител могут быть получены созреванием аффинности, например, как описано ниже. Наиболее предпочтительное гуманизированное антитело содержит аминокислотную последовательность вариабельного домена легкой цепи SEQ ID NO: 3.
Настоящая заявка также относится к антителам с созревшей аффинностью, которые связывают HER2 и блокируют активацию рецептора HER лигандом. Исходным антителом может быть антитело человека или гуманизированное антитело, например антитело, содержащее последовательности вариабельного домена легкой и/или тяжелой цепи SEQ ID No. 3 и 4, соответственно (т.е. варианта 574). Аффинно созревшее антитело предпочтительно связывается с рецептором HER2 с аффинностью, превосходящей аффинность мышиного 2C4 или варианта 574 (например, примерно в два или примерно в четыре раза повышенная аффинность и аффинность, повышенная примерно в 100 раз или примерно в 1000 раз, например оцениваемая с использованием ELISA HER2-внеклеточного домена (ECD)). Типичные остатки CDR вариабельного домена тяжелой цепи для замены включают H28, H30, H34, H35, H64, H96, H99 или сочетания двух или более (например, двух, трех, четырех, пяти, шести или семи указанных остатков). Примеры остатков CDR вариабельного домена легкой цепи для изменения включают L28, L50, L53, L56, L91, L92, L93, L94, L96, L97 или сочетания двух или более (например, от двух до трех, четырех, пяти или до десяти указанных остатков).
Рассматриваются различные формы гуманизированного антитела или аффинно созревшего антитела. Например, гуманизированное антитело или аффинно созревшее антитело может представлять собой фрагмент антитела, такой как Fab, который необязательно конъюгирован с одним или несколькими цитотоксическими средствами, чтобы создать иммуноконъюгат. Альтернативно гуманизированное антитело или аффинно созревшее антитело может представлять собой интактное антитело, такое как интактное IgG1-антитело.
(iii) Человеческие антитела
В качестве альтернативы гуманизации могут быть созданы человеческие антитела.
Например, в настоящее время можно получать трансгенных животных (например, мышей), которые способны после иммунизации продуцировать полный репертуар антител человека в отсутствие продукции эндогенных иммуноглобулинов. Например, описано, что гомозиготная делеция гена соединяющей области тяжелой цепи (JH) антитела у химерных и мутантных по зародышевой линии мышей приводит к полному ингибированию продукции эндогенных антител. Перенос ряда генов иммуноглобулина зародышевой линии человека в таких мутантных по зародышевой линии мышей будет приводить к продукции антител человека при антигенной стимуляции. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255-258 (1993); Bruggermann et al., Year in Immuno., 7: 33 (1993); и патенты США No. 5591669, 5589369 и 5545807.
Альтернативно можно использовать методику фагового дисплея (McCafferty et al., Nature 348: 552-553 (1990)) для получения человеческих антител и фрагментов антител in vitro из репертуара генов вариабельных (V) доменов иммуноглобулина от неиммунизированных доноров. Согласно указанному способу гены V-доменов антител клонируют в рамке с геном либо основного, либо минорного белка оболочки нитчатого бактериофага, такого как M13 или fd, и выводят в виде функциональных фрагментов антител на поверхность фаговой частицы. Поскольку нитчатая частица содержит однонитевую копию ДНК фагового генома, то селекция на основе функциональных свойств антитела также приводит к селекции гена, кодирующего антитело, проявляющее такие свойства. Таким образом, фаг имитирует некоторые свойства B-клетки. Фаговый дисплей может быть выполнен в разных формах, обзор которых приведен, например, в Johnson, K. S. and Chiswell, D. J., Current Opinion. in Structural Biology 3: 564-571 (1993). Для фагового дисплея можно использовать несколько источников участков V-генов. Например, Clackson с соавторами (Nature, 352: 624-628 (1991)) выделили ряд разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученной из селезенок иммунизированных мышей. Можно сконструировать репертуар V-генов неиммунизированных людей-доноров и можно выделить антитела к ряду разнообразных антигенов (включая аутоантигены), по существу следуя, например, способу, описанному Marks et al., J. Mol. Biol. 222: 581-597 (1991) или Griffith et al., EMBO J. 12: 725-734 (1993). См. также патенты США № 5565332 и 5573905.
Антитела человека также могут быть образованы активированными in vitro B-клетками (см. патенты США 5567610 и 5229275).
HER2-антитела человека описаны в патенте США No. 5772997, опубликованном 30 июня 1998, и в WO 97/00271, опубликованной 3 января 1997.
(iv) Фрагменты антител
Разработаны различные способы получения фрагментов антител. Традиционно такие фрагменты получали в результате протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24: 107-117 (1992) и Brennan et al., Science, 229: 81 (1985)). Однако в настоящее время такие фрагменты могут непосредственно продуцироваться рекомбинантными клетками-хозяевами. Например, фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно Fab'-SH-фрагменты могут быть непосредственно извлечены из клеток E. coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology 10: 163-167 (1992)). Согласно другому способу F(ab')2-фрагменты могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Другие способы получения фрагментов антител будут известны специалисту в данной области. В других вариантах предпочтительное антитело представляет собой одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185, патент США № 5571894 и патент США № 5587458. Фрагмент антитела также может представлять собой "линейное антитело", например такое, как описано в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифичными или биспецифичными.
(v) Биспецифичные антитела
Биспецифичные антитела представляют собой антитела, которые имеют специфичности связывания, по меньшей мере, к двум разным эпитопам. Примеры биспецифичных антител могут связываться с двумя разными эпитопами белка HER. В других таких антителах сайт связывания HER2 может быть объединен с сайтом (сайтами) связывания EGFR, HER3 и/или HER4. Альтернативно плечо к HER2 можно объединить с плечом, которое связывается с запускающей молекулой на лейкоците, такой как молекула T-клеточного рецептора (например, CD2 или CD3), или Fc-рецепторами для IgG (FcγR), такими как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), для того чтобы сфокусировать механизмы клеточной защиты на HER2-экспрессирующй клетке. Биспецифичные антитела также можно использовать для локализации цитотоксических средств вблизи клеток, которые экспрессируют HER2. Указанные антитела имеют HER2-связывающее плечо и плечо, которое связывает цитотоксическое средство (например, сапонин, анти-интерферон-α, алкалоид барвинка, цепь A рицина, метотрексат или гаптен радиоактивного изотопа). Биспецифичные антитела могут быть получены в виде полноразмерных антител или фрагментов антител (например, биспецифичные F(ab')2-антитела).
В WO 96/16673 описано биспецифичное HER2/Fc?RIII-антитело, и в патенте США № 5837234 описано биспецифичное HER2/FcγRI-антитело IDM1 (Osidem). Биспецифичное HER2/Fcα-антитело показано в WO98/02463. В патенте США № 5821337 описано биспецифичное HER2/CD3-антитело. MDX-210 является биспецифичным HER2-FcγRIII-Ат.
Способы получения биспецифичных антител известны в данной области. Традиционное получение полноразмерных биспецифичных антител основано на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, при этом две цепи имеют разные специфичности (Millstein et al., Nature, 305: 537-539 (1983)). Вследствие случайного выбора тяжелых и легких цепей иммуноглобулина такие гибридомы (квадромы) продуцируют возможную смесь 10 разных молекул антител, из которых только одна имеет правильную биспецифичную структуру. Очистка правильной молекулы, которую обычно осуществляют, используя стадии аффинной хроматографии, является довольно громоздкой, а выходы продукта низкими. Сходные способы описаны в WO 93/08829 и в Traunecker et al., EMBO J., 10: 3655-3659 (1991).
Согласно другому способу вариабельные домены антител с требуемыми специфичностями связывания (участки связывания антитело-антиген) сливают с последовательностями константных доменов иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим, по меньшей мере, часть шарнирной области, областей CH2 и CH3. Предпочтительно иметь первую константную область тяжелой цепи (CH1), содержащую сайт, необходимый для связывания легкой цепи, присутствующий, по меньшей мере, в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и в случае необходимости легкой цепи иммуноглобулина, встраивают в отдельные экспрессирующие векторы и котрансфицируют в подходящий организм хозяина. Это дает большую гибкость при корректировке взаимных соотношений трех полипептидных фрагментов в таких вариантах, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, дают оптимальные выходы. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор в том случае, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных соотношениях дает высокие выходы или когда соотношения не имеют особого значения.
В предпочтительном варианте указанного способа биспецифичные антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелой цепи-легкой цепи иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Обнаружено, что такая асимметричная структура облегчает отделение требуемого биспецифичного соединения от нежелательных сочетаний цепей иммуноглобулина, так как наличие легкой цепи иммуноглобулина только в одной половине биспецифичной молекулы обеспечивает простой способ разделения. Такой способ описан в WO 94/04690. Более подробное описание создания биспецифичных антител см., например, в Suresh et al., Methods in Enzymology, 121: 210 (1986).
Согласно другому способу, описанному в патенте США № 5731168, область контакта между парой молекул антител может быть сконструирована так, чтобы максимизировать процент гетеродимеров, которые извлекают из культуры рекомбинантных клеток. Предпочтительная область контакта содержит, по меньшей мере, часть домена CH3 константного домена антитела. В указанном способе одну или несколько небольших боковых цепей аминокислот из области контакта первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозина или триптофана). Создают компенсирующие "впадины", имеющие размер, идентичный или сходный с размером большой боковой цепи(цепей), на области контакта второй молекулы антитела, заменяя большие боковые цепи аминокислот меньшими боковыми цепями (например, аланина или треонина). Это обеспечивает механизм увеличения выхода гетеродимера по сравнению с другими нежелательными конечным продуктами, такими как гомодимеры.
Биспецифичные антитела включают поперечно сшитые антитела или "гетероконъюгаты" антител. Например, одно из антител в гетероконъюгате может быть связано с авидином, другое с биотином. Такие антитела, например, были предложены для направления клеток иммунной системы к нежелательным клеткам (патент США № 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгированные антитела могут быть получены с использованием любого удобного способа образования поперечных сшивок. Подходящие поперечно сшивающие агенты хорошо известны в данной области и описаны в патенте США № 4676980 наряду с описанием ряда способов образования поперечных сшивок.
Способы создания биспецифичных антител из фрагментов антител также описаны в литературе. Например, биспецифичные антитела могут быть получены с использованием химического связывания. Brennan с соавторами (Science, 229: 81 (1985)) описывают способ, при котором интактные антитела протеолитически расщепляют, чтобы создать F(ab')2-фрагменты. Полученные фрагменты восстанавливают в присутствии агента, образующего комплексы дитиола, арсенита натрия, чтобы стабилизировать соседние дитиолы и предотвратить образование межмолекулярного дисульфида. Затем созданные Fab'-фрагменты превращают в производные тионитробензоата (TNB). Один из Fab'-TNB-производных затем снова превращают в Fab'-тиол восстановлением с использованием меркаптоэтиламина и смешивают с эквимолярным количеством другого Fab'-TNB-производного с образованием биспецифичного антитела. Полученные биспецифичные антитела можно использовать в качестве агентов для избирательной иммобилизации ферментов.
Недавние достижения облегчили прямое извлечение Fab'-SH-фрагментов из E. coli, которые могут быть химически связаны с образованием биспецифичных антител. В публикации Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описано получение полностью гуманизированной молекулы биспецифичного антитела на основе F(ab')2. Каждый Fab'-фрагмент отдельно секретировался из клеток E. coli, и его подвергали химическому связыванию in vitro с образованием биспецифичного антитела. Образованное таким образом биспецифичное антитело способно связываться с клетками, сверхэкспрессирующими рецептор HER2, и нормальными T-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека против опухолевых мишеней молочной железы человека.
Также описаны различные способы получения и выделения биспецифичных фрагментов антител непосредственно из культуры рекомбинантных клеток. Например, были получены биспецифичные антитела с использованием лейциновых молний. Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992). Пептиды лейциновой молнии из белков Fos и Jun связывали с Fab'-частями двух разных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области, чтобы образовать мономеры, и затем снова окисляли с образованием гетеродимеров антител. Такой способ также можно использовать для получения гомодимеров антител. Способ "диантител", описанный в публикации Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), обеспечил альтернативный механизм получения биспецифичных фрагментов антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) линкером, который слишком короткий, чтобы обеспечить возможность спаривания между двумя доменами на одной и той же цепи. Соответственно, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента, образуя при этом два антигенсвязывающих участка. Также сообщалось о другой методике получения биспецифичных фрагментов антител с использованием димеров одноцепочечного Fv (sFv). См. Gruber et al., J. Immunol., 152: 5368 (1994).
Предполагаются антитела с более чем двумя валентностями. Например, могут быть получены триспецифичные антитела. Tutt et al. J. Immunol. 147: 60 (1991).
(vi) Другие модификации аминокислотной последовательности
Предлагается модификация(и) аминокислотных последовательностей HER2-антител, описанных в настоящей публикации. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности HER2-антитела получают введением соответствующих изменений нуклеотидов в нуклеиновую кислоту HER2-антитела или пептидным синтезом. Такие модификации включают, например, делеции, и/или инсерции, и/или замены остатков в аминокислотных последовательностях HER2-антитела. Осуществляют любое сочетание делеции, инсерции и замены, чтобы получить конечную конструкцию, при условии, что конечная конструкция обладает требуемыми характеристиками. Изменения аминокислот также могут изменять посттрансляционные процессы в HER2-антителе, такие как изменение количества или положения сайтов гликозилирования.
Применимый способ идентификации некоторых остатков или областей HER2-антитела, которые являются предпочтительными участками для мутагенеза, называют "мутагенезом с использованием сканирования аланином", который описан Cunningham and Wells Science, 244: 1081-1085 (1989). В данном случае идентифицируют остаток или группу остатков-мишеней (например, заряженных остатков, таких как arg, asp, his, lys и glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно аланином или полиаланином), чтобы повлиять на взаимодействие аминокислот с антигеном HER2. Те участки аминокислот, которые проявляют функциональную чувствительность к заменам, затем улучшают введением дополнительных или других вариантов в участки или вместо участков замены. Таким образом, хотя участок введения варианта аминокислотной последовательности предварительно определяют, нет необходимости в предварительном определении природы мутации как таковой. Например, чтобы проанализировать эффективность мутации в данном участке проводят ala-сканирование или случайный мутагенез в кодоне-мишени или области-мишени и экспрессированные варианты HER2-антител подвергают скринингу в отношении требуемой активности.
Инсерции в аминокислотных последовательностях включают слияния с амино- и/или карбоксильным концом длиной в диапазоне от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых инсерций включают HER2-антитело с N-концевым остатком метионила или антитело, слитое с цитотоксическим полипептидом. Другие инсерционные варианты молекулы HER2-антитела включают слияние N- или C-конца HER2-антитела с ферментом (например, в случае ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Вариантом другого типа является вариант с аминокислотными заменами. Такие варианты имеют, по меньшей мере, один аминокислотный остаток в молекуле HER2-антитела, замененный другим остатком. Места, представляющие наибольший интерес для мутагенеза путем замен, включают гипервариабельные области или CDR, но также предполагаются изменения и в области FR или Fc. Консервативные замены показаны в таблице 1 под заголовком "предпочтительные замены". Если такие замены приводят к изменению биологической активности, то могут быть введены дополнительные существенные изменения, названные "примерами заменам" в таблице 1, или изменения, дополнительно описанные ниже при описании классов аминокислот, и может быть проведен скрининг продуктов.
Существенные модификации биологических свойств антитела осуществляют отбором замен, которые существенно отличаются по своему влиянию на поддержание (a) структуры полипептидного остова в области замены, например, в виде слоистой или спиральной конформации, (b) заряда или гидрофобности молекулы в сайте-мишени, или (c) величины боковой цепи. Аминокислоты могут быть сгруппированы в соответствии со сходствами в свойствах их боковых цепей (в A. L. Lehninger, Biochemistry, second ed., pp. 73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M),
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q),
(3) кислые: Asp (D), Glu (E),
(4) основные: Lys (K), Arg (R), His(H).
Альтернативно встречающиеся в природе остатки могут быть разделены на группы на основе общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены влекут за собой замену представителя одного из указанных классов представителем другого класса.
Любой остаток цистеина, не вовлеченный в поддержание правильной конформации HER2-антитела, также может быть заменен, обычно серином, чтобы повысить стабильность молекулы к окислению и предотвратить аномальное поперечное сшивание. Наоборот, может быть добавлена цистеиновая связь (связи) к антителу, чтобы повысить его стабильность (особенно когда антитело представляет собой фрагмент антитела, такой как Fv-фрагмент).
Особенно предпочтительный тип варианта с заменами содержит замену одного или нескольких остатков гипервариабельной области исходного антитела (например, гуманизированного антитела или антитела человека). В общем, полученные в результате вариант(ты), отобранные для дальнейшей разработки, будут иметь улучшенные биологические свойства по сравнению с исходным антителом, из которого они созданы. Подходящий способ создания таких вариантов с заменами заключается в созревании аффинности с использованием фагового дисплея. Коротко, несколько сайтов гипервариабельной области (например 6-7 сайтов) подвергают мутациям, чтобы создать все возможные аминокислотные замены в каждом сайте. Полученные таким образом варианты антитела представляют в виде дисплея в моновалентной форме на частицах нитчатого фага в виде слияний с продуктом гена III M13, упакованного в каждой частице. Представленные в фаговом дисплее варианты затем подвергают скринингу в отношении их биологической активности (например, аффинности связывания), как описано в данной публикации. Чтобы идентифицировать подходящие для модификации сайты гипервариабельной области можно осуществить мутагенез посредством сканирования аланином, идентифицируя остатки гипервариабельной области, вносящие существенный вклад в связывание антигена. Альтернативно или дополнительно может быть полезным анализ кристаллической структуры комплекса антиген-антитело, чтобы идентифицировать точки контакта между антителом и HER2 человека. Такие остатки в области контакта и соседние остатки являются кандидатами на замену способами, разработанными согласно изобретению. После создания таких вариантов панель вариантов подвергают скринингу, как описано в данной публикации, и антитела с превосходящими свойствами в одном или нескольких подходящих анализах можно отобрать для дальнейшей разработки.
В другом типе аминокислотного варианта антитела изменена исходная картина гликозилирования антитела. Под изменением подразумевают делецию одного или нескольких углеводных остатков, обнаруженных в антителе, и/или добавление одного или нескольких сайтов гликозилирования, которые не присутствуют в антителе.
Гликозилирование антител обычно является либо N-связанным, либо O-связанным. N-связанный относится к связыванию углеводного остатка с боковой цепью остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X означает любую аминокислоту, за исключением пролина, являются последовательностями узнавания для ферментативного связывания углеводного остатка с боковой цепью аспарагина. Таким образом, присутствие любой из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к связыванию одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы с гидроксиаминокислотой, чаще всего серином или треонином, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу обычно осуществляют посредством изменения аминокислотной последовательности, так чтобы она содержала одну или несколько из описанных выше трипептидных последовательностей (для сайтов N-связанного гликозилирования). Изменение также можно осуществить добавлением или заменой одного или нескольких остатков серина или треонина к последовательности исходного антитела (для сайтов O-связанного гликозилирования).
В том случае, когда антитело содержит Fc-область, может быть изменен связанный с ним углевод. Например, антитела со зрелой углеводной структурой, в которой утрачена фукоза, связанная с Fc-областью антитела, описаны в заявке на выдачу патента США № US 2003/0157108 A1, Presta, L. См. также US 2004/0093621 A1 (Kyowa Hakko Kogyo Co., Ltd). Антитела с разветвляющимся N-ацетилглюкозамином (GlcNAc) в олигосахаридной структуре, связанной с Fc-областью антитела, описаны в WO 03/011878, Jean-Mairet et al. и в патенте США No. 6602684, Umana et al. Антитела, по меньшей мере, с одним остатком галактозы в олигосахаридной структуре, связанной с Fc-областью антитела, описаны в WO97/30087, Patel et al. См., также заявки на выдачу патента WO98/58964 (Raju, S.) и WO99/22764 (Raju, S.), касающиеся антител с измененным углеводом, связанным с их Fc-областью. В настоящем изобретении предполагаются композиции антител, содержащие антитело главного типа с такими углеводными структурами, связанными с одной или двумя тяжелыми цепями Fc-области.
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотной последовательности HER2-антитела, получают различными способами, известными в данной области. Такие способы включают без ограничения выделение из природного источника (в случае встречающихся в природе вариантов аминокислотной последовательности) или получение с использованием опосредованного олигонуклеотидами (или сайт-специфичного) мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза ранее полученного варианта или версии HER2-антитела, не являющейся вариантом.
(vii) Скрининг антител с требуемыми свойствами
Способы создания антител описаны выше. Кроме того, можно отобрать антитела с определенными необходимыми биологическими свойствами.
Чтобы идентифицировать антитело, которое блокирует активацию лигандом рецептора HER, можно определить способность антитела блокировать связывание лиганда HER с клетками, экспрессирующими рецептор HER (например, конъюгированный с другим рецептором HER, с которым представляющий интерес рецептор HER образует HER-гетероолигомер). Например, клетки, экспрессирующие в природе или трансфицированные для экспрессии рецепторов HER HER-гетероолигомера, можно инкубировать с антителом и затем подвергнуть воздействию меченого лиганда HER. Затем можно оценить способность HER2-антитела блокировать связывание лиганда с рецептором HER в HER-гетероолигомере.
Например, ингибирование связывания HRG с линиями опухолевых клеток молочной железы MCF7 HER2-антителами можно осуществить с использованием монослойных культур MCF7 на льду в 24-луночном планшете, по существу как описано в WO 01/00245. В каждую лунку можно добавить моноклональные HER2-антитела и инкубировать в течение 30 минут. Затем можно добавить 125I-меченый rHRGβ1177-224 (25 пМ) и инкубацию можно продолжить в течение 4-16 часов. Можно получить кривые зависимого от дозы ответа и можно рассчитать значение IC50 для представляющего интерес антитела. В одном варианте антитело, которое блокирует активацию лигандом рецептора HER, будет иметь IC50 для ингибирования связывания HRG с клетками MCF7, составляющую в данном анализе примерно 50 нМ или меньше, более предпочтительно 10 нМ или меньше. В том случае, когда антитело представляет собой фрагмент антитела, такой как Fab-фрагмент, IC50 для ингибирования связывания HRG с клетками MCF7 в данном анализе может, например, составлять примерно 100 нМ или меньше, более предпочтительно 50 нМ или меньше.
Альтернативно или дополнительно можно проанализировать способность HER2-антитела блокировать стимулируемое лигандом HER фосфорилирование тирозина рецептора HER, присутствующего в HER-гетероолигомере. Например, клетки, эндогенно экспрессирующие рецепторы HER или трансфицированные для экспрессии рецепторов HER, можно инкубировать с антителом и затем оценить активность зависимого от лиганда HER фосфорилирование тирозина с использованием моноклонального антитела против фосфотирозина (которое необязательно конъюгировано с регистрируемой меткой). Анализ активации киназного рецептора, описанный в патенте США № 5766863, также пригоден для определения активации рецептора HER и блокирования такой активности антителом.
В одном варианте можно провести скрининг в отношении антитела, которое ингибирует HRG-стимуляцию фосфорилирования тирозина p180 в клетках MCF7, по существу как описано в WO01/00245. Например, клетки MCF7 можно посеять в 24-луночные планшеты и в каждую лунку добавить моноклональные антитела к HER2 и инкубировать в течение 30 минут при комнатной температуре; затем в каждую лунку можно добавить rHRGβ1177-244 до конечной концентрации 0,2 нМ и инкубацию можно продолжить в течение 8 минут. Среду можно аспирировать из каждой лунки и реакции можно остановить добавлением 100 мкл буфера для образцов с SDS (5% SDS, 25 мМ DTT и 25 мМ трис-HCl, pH 6,8). Каждый образец (25 мкл) можно подвергнуть электрофорезу в 4-12%-градиентном геле (Novex) и затем электрофоретически перенести на мембрану из поливинилидендифторида. Можно проявить иммуноблоты антифосфотирозина (при 1 мкг/мл) и можно количественно оценить интенсивность преимущественной реактивной полосы с Mr~180000 отражательной денситометрией. Отобранное антитело предпочтительно будет в значительной степени ингибировать HRG-стимуляцию фосфорилирования тирозина p180 примерно до 0-35% от контроля в данном анализе. Можно получить кривые зависимого от дозы ответа в отношении ингибирования HRG-стимуляции фосфорилирования тирозина p180, которое определяют отражательной денситометрией, и можно рассчитать IC50 для представляющего интерес антитела. В одном варианте антитело, которое блокирует активацию лигандом рецептора HER, будет иметь IC50 для ингибирования HRG-стимуляции фосфорилирования тирозина p180 в данном анализе примерно 50 нМ или меньше, более предпочтительно 10 нМ или меньше. В том случае, когда антитело представляет собой фрагмент антитела, такой как Fab-фрагмент, IC50 в отношении ингибирования HRG-стимуляции фосфорилирования тирозина p180 в данном анализе может, например, составлять примерно 100 нМ или меньше, более предпочтительно 50 нМ или меньше.
Также можно оценить ингибирующее рост влияние антитела на клетки MDA-MB-175, например, по существу как описано в Schaefer et al. Oncogene 15: 1385-1394 (1997). Согласно данному анализу клетки MDA-MB-175 можно обработать моноклональным HER2-антителом (10 мкг/мл) в течение 4 суток и окрасить кристаллическим фиолетовым. Инкубация с HER2-антителом может показать ингибирующее рост влияние на указанную линию клеток, подобное влиянию, оказываемому моноклональным антителом 2C4. В следующем варианте экзогенный HRG по существу не будет отменять такое ингибирование. Предпочтительно антитело будет способно ингибировать пролиферацию клеток MDA-MB-175 в большей степени, чем моноклональное антитело 4D5 (и необязательно в большей степени, чем моноклональное антитело 7F3), как в присутствии, так и в отсутствие экзогенного HRG.
В одном варианте представляющее интерес HER2-антитело может блокировать зависимое от херегулина связывание HER2 с HER3 как в клетках MCF7, так и в клетках SK-BR-3, которое определяют в эксперименте по коиммунопреципитации, таком как описано в WO01/00245, в значительной степени более эффективно, чем моноклональное антитело 4D5, и предпочтительно в значительной степени более эффективно, чем моноклональное антитело 7F3.
Чтобы идентифицировать ингибирующие рост HER2-антитела можно провести скрининг в отношении антител, которые ингибируют рост злокачественных клеток, которые сверхэкспрессируют HER2. В одном варианте выбранное представляющее интерес ингибирующее рост антитело способно ингибировать рост клеток SK-BR-3 в культуре клеток примерно на 20-100% и предпочтительно примерно на 50-100% при концентрации антитела примерно от 0,5 до 30 мкг/мл. Чтобы идентифицировать такие антитела можно провести анализ SK-BR-3, описанный в патенте США № 5677171. Согласно указанному анализу клетки SK-BR-3 выращивают в смеси 1:1 среды F12 и DMEM с добавлением 10% фетальной сыворотки теленка, глутамина и пенициллина и стрептомицина. Клетки SK-BR-3 высевают по 20000 клеток на чашку для культуры клеток диаметром 35 мм (2 мл/чашку диаметром 35 мм). В чашку добавляют от 0,5 до 30 мкг/мл HER2-антитела. Через шесть дней подсчитывают количество клеток по сравнению с необработанными клетками, используя электронный счетчик клеток COULTERTM. Такие антитела, которые ингибируют рост клеток SK-BR-3 примерно на 20-100% или примерно на 50-100%, могут быть отобраны в качестве ингибирующих рост антител. См. патент США № 5677171 в отношении анализа для скрининга ингибирующих рост антител, таких как 4D5 и 3E8.
Чтобы отобрать антитела, которые индуцируют апоптоз, имеется анализ связывания аннексина с использованием клеток BT474. Клетки BT474 культивируют и высевают на чашки, как обсуждалось в предыдущем абзаце. Затем среду удаляют и заменяют только свежей средой или средой, содержащей 10 мкг/мл моноклонального антитела. После трехдневного периода инкубации монослои промывают PBS и отделяют трипсинизацией. Затем клетки центрифугируют, ресуспендируют в связывающем Ca2+ буфере и делят на аликвоты в пробирки, как обсуждается выше для анализа гибели клеток. Затем в пробирки вносят меченый аннексин (например, аннексин V-FTIC) (1 мкг/мл). Образцы можно проанализировать с использованием проточного цитометра FACSCANTM и компьютерной программы FACSCONVERTTM CellQuest (Becton Dickinson). Антитела, которые индуцируют статистически значимые уровни связывания аннексина по сравнению с контролем, отбирают в качестве индуцирующих апоптоз антител. Кроме анализа связывания аннексина существует анализ окрашивания ДНК с использованием клеток BT474. Чтобы осуществить такой анализ клетки BT474, которые были обработаны представляющим интерес антителом, как описано в двух предыдущих абзацах, инкубируют с 9 мкг/мл HOECHST 33342TM в течение 2 часов при 37°C, затем анализируют на проточном цитометре EPICS ELITETM (Coulter Corporation), используя компьютерную программу MODFIT LTTM (Verity Software House). Антитела, которые индуцируют изменение процентного содержания апоптозных клеток, которое в 2 раза или более (и предпочтительно в 3 раза или более), чем содержание в необработанных клетках (вплоть до 100% апоптозных клеток), могут быть отобраны в качестве проапоптозных антител с использованием данного анализа. См. WO98/17797 в отношении анализа скрининга антител, которые индуцируют апоптоз, таких как 7C2 и 7F3.
Чтобы осуществить скрининг антител, которые связываются с эпитопом на HER2, связываемым представляющим интерес антителом, можно осуществить обычный анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988), чтобы оценить, имеет ли место перекрестное блокирование антителом связывания такого антитела, как 2C4 или пертузумаб, с HER2. Альтернативно или дополнительно можно осуществить картирование эпитопов способами, известными в данной области, и/или можно исследовать структуру комплекса антитело-HER2 (Franklin et al. Cancer Cell 5: 317-328 (2004)), чтобы выявить, какой домен(ны) HER2 связывается (связываются) антителом.
(viii) Иммуноконъюгаты
Изобретение также относится к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, токсин (например, низкомолекулярный токсин или ферментативно активный токсин, происходящий из клеток бактерий, грибов, растений или животных, включая его фрагменты и/или варианты) или радиоактивный изотоп (т.е. радиоконъюгат).
Химиотерапевтические средства, применимые для создания таких иммуноконъюгатов, были описаны выше. Также предполагаются конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, майтанзин (патент США № 5208020), трихотен и CC1065.
В одном предпочтительном варианте изобретения антитело конъюгируют с одной или несколькими молекулами майтанзина (например, примерно от 1 до 10 молекул майтанзина на молекулу антитела). Майтанзин может быть, например, превращен в May-SS-Me, который может быть восстановлен до May-SH3 и подвергнут взаимодействию с модифицированным антителом (Chari et al. Cancer Research 52: 127-131 (1992)), чтобы создать иммуноконъюгат майтанзиноид-антитело.
Другой представляющий интерес иммуноконъюгат содержит HER2-антитело, конъюгированное с одной или несколькими молекулами калихеамицина. Калихеамициновое семейство антибиотиков способно вызывать двунитевые разрывы ДНК в субпикомолярных концентрациях. Структурные аналоги калихеамицина, которые можно использовать, включают без ограничения γ1 I, α2 I, α3 I, N-ацетил-γ1 I, PSAG и θI 1 (Hinman et al. Cancer Research 53: 3336-3342 (1993) и Lode et al. Cancer Research 58: 2925-2928 (1998)). См. также патенты США № 5714586, 5712374, 5264586 и 5773001, специально включенные в данное описание в виде ссылки.
Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают цепь A дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модекцина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolacca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, неомицин и трикотецены. См., например, WO 93/21232, опубликованную 28 октября 1993.
Настоящее изобретение, кроме того, относится к иммуноконъюгату, образованному между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Имеется множество радиоактивных изотопов для получения радиоконъюгированных HER2-антител. Примеры включают 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P и радиоактивные изотопы Lu.
Конъюгаты антитела и цитотоксического средства могут быть получены с использованием множества бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат·HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al. Science 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгирования радионуклида с антителом. См. WO94/11026. Линкер может представлять собой "расщепляемый линкер", облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, чувствительный к пептидазе линкер, линкер, содержащий диметил, или линкер, содержащий дисульфид (Chari et al., Cancer Research 52: 127 131 (1992)).
Альтернативно можно получить слитый белок, содержащий HER2-антитело и цитотоксическое средство, например способами на основе рекомбинации или пептидным синтезом.
В еще одном варианте антитело может быть конъюгировано с "рецептором" (таким как стрептавидин) для применения с целью предварительного направления такого "рецептора" к опухоли-мишени при введении конъюгата антитело-рецептор пациенту с последующим удалением несвязанного конъюгата из циркуляции с использованием очищающего средства и затем введением "лиганда" (например, авидина), который конъюгирован с цитотоксическим средством (например, радионуклидом).
(ix) Другие модификации антител
В настоящем изобретении предполагаются другие модификации антител. Например, антитело может быть связано с одним из множества небелковых полимеров, например полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля. Антитело также может быть заключено в микрокапсулы, полученные, например, способами коацервации или полимеризацией на границе фаз (например, микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметакрилата), соответственно), в коллоидные системы доставки лекарственных средств (например липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980).
Может быть желательной модификация антитела согласно изобретению в отношении эффекторной функции, так чтобы, например, повысить антигензависимую опосредованную клетками цитотоксичность (ADCC) и/или зависимую от комплемента цитотоксичность (CDC) антитела. Этого можно достичь введением одной или нескольких аминокислотных замен в Fc-область антитела. Альтернативно или дополнительно остаток(ки) цистеина могут быть введены в Fc-область, таким образом обеспечивая возможность образования межцепочечного дисульфида в данной области. Созданное таким образом гомодимерное антитело может иметь улучшенную способность к интернализации и/или повышенному опосредованному комплементом цитолизу клеток и антителозависимой клеточной цитотоксичности (ADCC). См. Caron et al., J. Exp Med. 176: 1191-1195 (1992) и Shopes, B. J. Immunol. 148: 2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью также могут быть получены с использованием гетеробифункциональных поперечно сшивающих агентов, которые описаны в Wolff et al. Cancer Research 53: 2560-2565 (1993). Альтернативно может быть сконструировано антитело, которое имеет двойные Fc-области и в связи с этим обладает повышенной способностью к зависимому от комплемента лизису и ADCC. См. Stevenson et al. Anti-Cancer Drug Design 3: 219-230 (1989).
В WO 00/42072 (Presta, L.) описаны антитела с улучшенной ADCC-функцией в присутствии эффекторных клеток человека, при этом антитела содержат аминокислотные замены в своей Fc-области. Предпочтительно антитело с улучшенной ADCC содержит замены в положениях 298, 333 и/или 334 Fc-области. Предпочтительно измененная Fc-область представляет собой Fc-область IgG1 человека, содержащую или состоящую из замен в одном, двух или трех из указанных положений.
Антитела с измененным связыванием C1q и/или зависимой от комплемента цитотоксичностью (CDC) описаны в WO 99/51642, патенте США № 6194551B1, патенте США № 6242195B1, патенте США № 6528624B1 и патенте США № 6538124 (Idusogie et al.). Антитела содержат аминокислотную замену в одном или нескольких положениях аминокислот 270, 322, 326, 327, 329, 313, 333 и/или 334 Fc-области.
Чтобы увеличить время полужизни антитела в сыворотке можно включить в антитело (в частности, во фрагмент антитела) эпитоп связывания рецептора спасения, как описано, например, в патенте США 5739277. В используемом в данном описании смысле термин "эпитоп связывания рецептора спасения" относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который ответственен за увеличение времени полужизни молекулы IgG в сыворотке in vivo. Антитела с заменами в Fc-области и повышенным временем полужизни в сыворотке также описаны в WO00/42072 (Presta, L.).
Также предусмотрены сконструированные антитела с тремя или более (предпочтительно четырьмя) функциональными антигенсвязывающими участками (заявка на выдачу патента США No. US2002/0004587 A1, Miller et al.).
HER2-антитела, предлагаемые в настоящем изобретении, также могут быть приготовлены в виде иммунолипосом. Липосомы, содержащие антитело, получают способами, известными в данной области, такими как способы, описанные в Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA, 77: 4030 (1980); патентах США № 4485045 и 4544545 и в WO 97/38731, опубликованной 23 октября 1997. Липосомы с повышенным периодом циркуляции описаны в патенте США № 5013556.
Особенно применимые липосомы могут быть созданы способом обращено-фазового выпаривания с использованием композиции липидов, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизованный фосфатидилэтаноламин (PEG-PE). Липосомы подвергают экструзии через фильтры с определенным размером пор, чтобы получить липосомы требуемого диаметра. Fab'-фрагменты антитела согласно настоящему изобретению можно конъюгировать с липосомами, как описано в Martin et al. J. Biol. Chem. 257: 286-288 (1982), посредством реакции дисульфидного обмена. В липосоме необязательно содержится химиотерапевтическое средство. См. Gabizon et al. J. National Cancer Inst. 81(19): 1484 (1989).
IV. Фармацевтические препараты
Терапевтические препараты композиций согласно настоящему изобретению готовят для хранения смешиванием композиции с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизованных препаратов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); полипептиды с низкой молекулярной массой (примерно меньше 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы с металлами (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как твин, плюроники или полиэтиленгликоль (ПЭГ). Лиофилизованные препараты HER2-антител описаны в WO 97/04801. Особенно предпочтительные препараты для композиции согласно изобретению описаны в US20006/088523.
Препарат согласно изобретению при необходимости также может содержать более одного активного соединения для конкретного оказания к лечению, предпочтительно соединения с дополнительными активностями, которые не оказывают друг на друга неблагоприятного воздействия. Например, может быть желательно дополнительное введение антител, которые связываются с EGFR, HER2 (например, антитело, которое связывает другой эпитоп HER2), HER3, HER4 или васкулярный эндотелиальный фактор (VEGF) в одном препарате. Альтернативно или дополнительно композиция может дополнительно содержать химиотерапевтическое средство, цитотоксическое средство, цитокин, ингибирующее рост средство, антигормональное средство, лекарственное средство, направленное на EGFR, антиангиогенное средство, ингибитор тирозинкиназы и/или кардиопротектор. Такие молекулы соответствующим образом вводят в комбинацию в количествах, которые эффективны для предполагаемой цели.
Активные ингредиенты также могут быть заключены в микрокапсулы, приготовленные например способами коацервации или полимеризации на границе фаз, например микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметакрилата), соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980).
Могут быть приготовлены препараты длительного высвобождения. Подходящие примеры препаратов длительного высвобождения включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, и такие матрицы имеют определенную форму, например пленки или микрокапсулы. Примеры матриц для длительного высвобождения включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, не разрушаемый этилен-винилацетат, разрушаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляную кислоту.
Препараты, используемые для введения in vivo, должны быть стерильными. Это легко осуществить фильтрованием через стерильные фильтрующие мембраны.
V. Лечение композицией HER2-антитела
Предполагается, что согласно настоящему изобретению HER2-антитело можно использовать для лечения злокачественной опухоли. Злокачественная опухоль, как правило, будет HER2-позитивной, так что HER2-антитело согласно изобретению способно связываться с клетками злокачественной опухоли. В одном варианте злокачественная опухоль экспрессирует низкий уровень HER3 (например, рак яичника) или имеет повышенное отношение HER2:HER3 (например, рак яичника). Различные злокачественные опухоли, которые можно лечить такой композицией, перечислены в разделе "Определения" выше.
Предпочтительные для лечения злокачественные опухоли согласно изобретению включают: рак молочной железы, включая HER2-позитивный рак молочной железы, необязательно в сочетании с трастузумабом и таксоидом, таким как доцетаксел, и включая неоадъювантную терапию рака молочной железы; рак яичника (включая как резистентную к платине, так и чувствительную к платине злокачественную опухоль) (см., например, US2006/0013819); рак легкого (включая немелкоклеточный рак легкого, NSCLC), необязательно в сочетании с ингибитором EGFR (см., например, US 2007/0020261); рак прямой и ободочной кишки и т.д.
Также предполагается, что HER2-антитело можно использовать для лечения различных незлокачественных заболеваний или расстройств, таких как аутоиммунное заболевание (например, псориаз); эндометриоз; склеродермию; рестеноз; полипы, такие как полипы ободочной кишки, полипы носа или полипы желудочно-кишечного тракта; фиброаденому; респираторное заболевание; холецистит; неврофиброматоз; поликистоз почек; воспалительные заболевания; заболевания кожи, включая псориаз и дерматит; сосудистое заболевание; состояния, в которые вовлечена аномальная пролиферация эпителиальных клеток сосудов; язвы желудочно-кишечного тракта; болезнь Менетрие, секретирующие аденомы или синдром потери белка; почечные расстройства; ангиогенные расстройства; заболевание глаз, такое как связанную с возрастом дегенерацию желтого пятна, синдром предполагаемого гистоплазмоза глаз, неоваскуляризацию сетчатки в результате пролиферативной диабетической ретинопатии, васкуляризацию сетчатки, диабетическую ретинопатию или возрастную дегенерацию желтого пятна; связанные с костями патологии, такие как остеоартрит, рахит и остеопороз; повреждение после ишемии головного мозга; фиброзные или связанные с отеками заболевания, такие как цирроз печени, легочный фиброз, саркоидоз, тиреоидит, системный синдром повышенной вязкости, болезнь Рандю-Вебера-Ослера, хроническое окклюзионное заболевание легких, или отек после ожогов, травмы, излучения, инсульта, гипоксии или ишемии; реакцию гиперчувствительности кожи; диабетическую ретинопатию и диабетическую нефропатию; синдром Гийена-Барре; болезнь "трансплантат против хозяина" или отторжение трансплантата; болезнь Педжета; воспаление костей и суставов; фотостарение (например, вызванное УФ-излучением старение кожи человека); доброкачественную гипертрофию простаты; некоторые микробные инфекции, включая микробные патогены, выбранные из аденовируса, хантавирусов, Borrelia burgdorferi, Yersinia spp. и Bordetella pertussis; тромб, вызванный агрегацией тромбоцитов; репродуктивные состояния, такие как эндометриоз, синдром гиперстимуляции яичников, предэклампсию, дисфункциональное маточное кровотечение или менометроррагию; синовит; атерому; острые и хронические нефропатии (включая пролиферативный гломерулонефрит и вызванное диабетом заболевание почек); экзему; образование гипертрофических рубцов; эндотоксический шок и грибковую инфекцию; семейный аденоматозный полипоз; нейродегенеративные заболевания (например, болезнь Альцгеймера, связанная со СПИДом деменция, болезнь Паркинсона, боковой амиотрофический склероз, пигментная дегенерация сетчатки, спинальная мышечная атрофия и дегенерация мозжечка); миелодиспластические синдромы; апластическую анемию; ишемическое повреждение; фиброз легкого, почки или печени; опосредованную T-клетками реакцию гиперчувствительности; гипертрофический пилоростеноз новорожденных; синдром обструкции мочевых путей; псориатический артрит и тиреоидит Хашимото. Предпочтительные незлокачественные показания для терапии согласно изобретению включают псориаз, эндометриоз, склеродерму, сосудистое заболевание (например, рестеноз, артериосклероз, болезнь коронарных артерий или гипертонию), полипы ободочной кишки, фиброаденому или респираторное заболевание (например астму, хронический бронхит, бронхоэктаз или кистозный фиброз).
Лечение HER2-антителом будет приводить к ослаблению признаков или симптомов заболевания. Например, когда заболевание, подвергаемое лечению, представляет собой злокачественную опухоль, такая терапия может приводить к улучшению выживаемости (общей выживаемости и/или выживаемости без прогрессирования) и/или может приводить к объективному клиническому ответу (частичному или полному).
Предпочтительно HER2-антитело, вводимое в композиции, является "голым" антителом. Однако вводимое HER2-антитело можно конъюгировать с цитотоксическим средством. Предпочтительно иммуноконъюгат и/или белок HER2, с которым он связывается, интернализуются клеткой, приводя к повышенной терапевтической эффективности иммуноконъюгата в уничтожении злокачественной клетки, с которой он связывается. В предпочтительном варианте цитотоксическое средство целенаправленно поражает или препятствует функционированию нуклеиновой кислоты в злокачественной клетке. Примеры таких цитотоксических средств включают майтанзиноиды, калихеамицины, рибонуклеазы и ДНК-эндонуклеазы.
HER-антитело вводят больному человеку согласно известным способам, таким как внутривенное введение, например, в виде болюса или посредством непрерывной инфузии в течение определенного периода времени, внутримышечный, внутрибрюшинный, внутриспинальный, подкожный, внутрисуставной, интрасиновиальный, интратекальный, пероральный, местный или ингаляционный пути. Предпочтительно внутривенное введение антитела.
Для профилактики или лечения заболевания подходящая доза HER2-антитела будет зависеть от типа заболевания, подвергаемого лечению, которые определены выше, тяжести и течения заболевания, от того, вводят ли HER2-антитело в профилактических или терапевтических целях, предыдущей терапии, истории болезни пациента и ответа на HER2-антитело, и решения лечащего врача. HER2-антитело соответствующим образом вводят пациенту один раз или в ходе серии введений. В зависимости от типа и тяжести заболевания примерно от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) HER2-антитела является возможной исходной дозой для введения пациенту, например, либо в виде одного или нескольких отдельных введений, либо в виде непрерывной инфузии. В одном варианте начальный период времени инфузии в случае HER2-антитела может быть больше, чем периоды времени последующих инфузий, например около 90 минут для начальной инфузии и около 30 минут для последующих инфузий (если начальная инфузия хорошо переносима). Предпочтительная доза HER2-антитела будет в диапазоне примерно от 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту может быть введена одна или несколько доз, составляющих около 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10мг/кг (или любое их сочетание). Такие дозы можно вводить периодически, например каждую неделю или каждые три недели (например, так что пациент получает примерно от двух до примерно двадцати, например примерно шесть доз HER2-антитела). Можно вводить начальную более высокую ударную дозу с последующей одной или несколькими более низкими дозами. В одном варианте HER2-антитело вводят в виде ударной дозы, составляющей примерно 840 мг, с последующими введениями примерно 420 мг примерно каждые 3 недели. В другом варианте HER2-антитело вводят в виде ударной дозы, составляющей примерно 1050 мг с последующими введениями примерно 525 мг примерно каждые 3 недели.
Другие терапевтические средства можно сочетать с HER2-антителом. Такое комбинированное введение включает совместное введение или одновременное введение с использованием отдельных препаратов или одного фармацевтического препарата и последовательное введение в любом порядке, при этом предпочтительно имеется период времени, когда оба (или все) активные средства одновременно проявляют свои биологические активности. Таким образом, другое терапевтическое средство может быть введено до или после введения HER2-антитела. В таком варианте интервал времени между, по меньшей мере, одним введением другого терапевтического средства и, по меньшей мере, одного введения HER2-антитела предпочтительно составляет примерно 1 месяц или меньше и наиболее предпочтительно примерно 2 недели или меньше. Альтернативно другое терапевтическое средство и HER2-антитело вводят пациенту одновременно в одном препарате или отдельных препаратах.
Примерами других терапевтических средств, которые можно сочетать с HER2-антителом, являются любые одно или несколько из химиотерапевтических средств, таких как антиметаболит, например гемцитабин; второе отличающееся HER2-антитело (например, ингибирующее рост HER2-антитело, такое как трастузумаб, или HER2-антитело, которое индуцирует апоптоз HER2-сверхэкспрессирующей клетки, такое как 7C2, 7F3 или их гуманизированные варианты); второе антитело, направленное против другого ассоциированного с опухолью антигена, такого как EGFR, HER3, HER4; антигормональное соединение, например соединение против эстрогена, такое как тамоксифен или ингибитор ароматазы; кардиопротектор (чтобы предотвратить или уменьшить любую дисфункцию миокарда, ассоциированную с терапией); цитокин; направленное к EGFR лекарственное средство (такое как эрлотиниб, гефитиниб или цетуксимаб); антиангиогенное средство (особенно бевацизумаб, продаваемый Genentech под торговой маркой AVASTINTM); ингибитор тирозинкиназы; ингибитор СОХ (например, ингибитор СОХ-1 или СОХ-2); нестероидное противовоспалительное лекарственное средство, целекоксиб (CELEBREX®); ингибитор фарнезилтрансферазы (например, типифарниб/ZARNESTRA® R115777, доступный от Johnson and Johnson или лонафарниб SCH66336, доступный от Schering-Plough); антитело, которое связывает онкофетальный белок CA 125, такое как ореговомаб (мАт B43.13); HER2-вакцину (такую как HER2-вакцина AutoVac из Pharmexia или вакцина на основе белка APC8024 из Dendreon, или вакцина на основе HER2-пептида из GSK/Corixa); другую направленную к HER терапию (например, трастузумаб, цетуксимаб, гефитиниб, эрлотиниб, C11033, GW2016 и т.д.); Raf и/или ras-ингибитор (см., например, WO 2003/86467); доксил; топетекан; таксан; GW572016; TLK286; EMD-7200; лекарственное средство для лечения тошноты, такое как антагонист серотонина, стероид или бензодиазепин; лекарственное средство для профилактики или лечения сыпи на коже или стандартные средства против акне, включая местный или пероральный антибиотик; лекарственное средство, понижающее температуру тела, такое как ацетаминофен, дифенгидрамин или меперидин; гематопоэтический фактор роста и т.д.
Подходящими дозами любого из указанных выше совместно вводимых средств являются дозы, используемые в настоящее время, и они могут быть снижены благодаря комбинированному действию (синергии) средства и HER-антитела. Лечение с использованием сочетания композиции HER2-антитела и другого терапевтического средства может приводить к синергетическому или более чем аддитивному терапевтически полезному действию у пациента.
В случае введения химиотерапевтического средства его обычно вводят в известных для этого дозах или необязательно в более низких дозах из-за комбинированного действия лекарственных средств или негативных побочных эффектов, которые можно отнести к введению химиотерапевтического средства. Приготовление и схемы дозирования таких химиотерапевтических средств можно использовать в соответствии с инструкциями производителя или как определено эмпирически лечащим врачом. Получение и схемы дозирования в случае такой химиотерапии также описаны в Chemotherapy Service Ed., M. C. Perry, Williams & Wilkins, Baltimore, MD (1992).
Кроме указанных выше терапевтических схем пациент может быть подвергнут хирургическому удалению злокачественных клеток и/или лучевой терапии.
VII. Депозит материалов
Следующие линии клеток гибридомы депонированы в Американской коллекции типов культур, 10801 University Boulevard, Manassas, VA 20110-2209, USA (ATCC):
Дополнительные подробности изобретения иллюстрированы следующими не ограничивающими примерами. Сообщения о всех цитированных публикациях в описании специально включены в данное описание в виде ссылки.
ПРИМЕР 1
В настоящем примере описана характеристика композиции, содержащей HER2-антитело главного вида, которое связывается с доменом II HER2 (пертузумаб), и его кислые варианты.
Пертузумаб представляет собой рекомбинантное гуманизированное моноклональное антитело, созданное на основе каркаса IgG1 (κ) человека. Оно содержит две тяжелые цепи (448 остатков) и две легкие цепи (214 остатков). Две тяжелые цепи связаны двумя межцепочечными дисульфидами, и каждая легкая цепь связана с тяжелой цепью одним межцепочечным дисульфидом. Имеется сайт N-связанного гликозилирования в Fc-области пертузумаба в положении Asn-299 двух тяжелых цепей. Пертузумаб отличается от HERCEPTIN® (трастузумаба) в областях связывания эпитопа легкой цепи (различие по 12 аминокислотам) и тяжелой цепи (различия по 30 аминокислотам). В результате таких различий пертузумаб связывается с совершенно другим эпитопом на рецепторе HER2. Связывание пертузумаба с рецептором HER2 на эпителиальных клетках человека предотвращает образование его комплексов с другими представителями семейства рецепторов HER (Agus et al., Cancer Cell 2: 127-137 (2002)). Блокируя образование комплекса, пертузумаб предотвращает стимулирующие рост эффекты лигандов для комплексов (например, EGF и херегулин). Эксперименты in vitro показали, что и пертузумаб и пертузумаб-Fab ингибируют связывание херегулина (HRG) с клетками MCF7 и что HRG-стимулированное фосфорилирование комплекса HER2-HER3 может быть ингибировано как пертузумабом, так и пертузумаб-Fab (Agus et al., Cancer Cell 2: 127-137 (2002)). Кроме того, обнаружено, что ингибирование in vivo роста опухоли пертузумабом и дериватизованным полиэтиленгликолем Fab-фрагментом пертузумаба сравнимо в мышиной модели ксенотрансплантата злокачественной опухоли простаты (Agus et al, Cancer Cell 2: 127-137 (2002)). Полученные данные свидетельствуют, что Fc-область антитела не является необходимой для ингибирования роста опухоли и, кроме того, бивалентность и Fc-опосредованные эффекторные функции не требуются для биологической активности in vivo или in vitro.
В настоящем примере собирали главный пик пертузумаба с катионообменной колонки и инкубировали в среде для культуры клеток или обрабатывали, используя стандартные способы очистки антител. Кислые варианты образовывались при инкубации главного пика с компонентами среды для культивирования клеток. Кислые варианты моноклональных антител представляют собой модифицированные формы требуемого продукта, которые элюируются раньше, чем главный пик при разделении катионообменной хроматографией. Малозаметные различия в количестве и/или распределении кислых вариантов представляют собой часто наблюдаемые изменения до и после обработки и создают проблему при демонстрации сравнимости продуктов. Способы очистки мало влияют на образование кислых вариантов. Варианты, идентифицированные во фракции кислых вариантов, включали гликозилированный вариант, дезаминированный вариант, вариант с восстановленной дисульфидной связью, сиалилированный вариант и невосстанавливаемый вариант. В совокупности кислые варианты были полностью активными.
Наряду с другими целями в настоящем исследовании была поставлена цель: лучше понять влияние культуры клеток и способов извлечения на образование кислых вариантов пертузумаба, охарактеризовать преобладающие кислые варианты пертузумаба и оценить влияние кислых вариантов на фармакокинетику (ФК).
Результаты фармакокинетических исследований на крысах показывают, что площадь под кривой для фракции кислых вариантов и фракции главного пика эквивалентна исходному материалу пертузумаба (средние геометрические отношения 0,96 и 0,95, соответственно). Полученные результаты показывают, что хотя кислые варианты химически отличаются от главного пика, они имеют эквивалентную фармакокинетику.
Способы и результаты
На фигуре 10 показана схема эксперимента по выделению MP (главного пика) и AV (кислых вариантов) при катионном обмене, культивированию клеток, извлечению и оценке ФК (фармакокинетике) и аналитическим испытаниям. Свежая среда = стандартная среда; использованная среда = стандартная среда после 12 суток культивирования клеток, клетки извлекали центрифугированием. Растворенный кислород, pH и другие параметры не контролировали.
A. Выделение главного пика и кислых вариантов
Варианты пертузумаба с разным зарядом разделяли на катионообменной (CEX) колонке DIONEX PROPAC WCX-10TM размером 4,0×250 мм, используя следующие условия:
Буфер A: 20 мМ бистрис, pH 6,0
Буфер B: 20 мМ бистрис, 200 мМ NaCl, pH 6,0
Градиент: 0,5% B/мин с расходом 1,0 мл/мин
Температура колонки: 35°C
Регистрация: 280 нм
Типичная хроматограмма показана на фигуре 11. Собирали фракции AV (кислый вариант) и MP (главный пик).
Активность и содержание мономера были сходными для исходного вещества пертузумаба, главного пика и кислых вариантов (фигура 12). Чистота CEX-фракций главного пика и кислых вариантов была приемлемой для исследований фармакокинетики на основе критериев 90% очистки посредством CEX (фигура 12).
B. Эксперименты по внесению главного пика
Главный пик пертузумаба, выделенный с использованием CEX, вносили либо в свежую, либо в использованную среду для культивирования клеток (без клеток) и инкубировали в течение 12 суток при 37°C, как изображено на фигуре 10. Образцы в разных временных точках анализировали на основе CEX непосредственно или после выделения с использованием белка A. Главный пик также вносили в среду +/- различные компоненты среды, такие как глюкоза и пептон. Кроме того, главный пик обрабатывали, используя стандартные способы извлечения, такие как хроматография на белке A (ProA), обработка при низких значениях pH и хроматография на быстропроточной колонке с SP-сефарозой (SPFF) несколько циклов и анализировали посредством CEX.
CEX-профили главного пика, инкубированного в течение 12 суток в свежей или использованной среде, были сходными (фигуры 13 и 14). Главный пик больше уменьшался после инкубации в свежей среде, чем в использованной среде. Удаление различных компонентов среды не влияло на снижение главного пика. Процентное содержание главного пика в инкубированных образцах было таким же в случае выделения с использованием белка A или без него. Инкубация только в буфере для среды вызывала снижение главного пика.
Выделение главного пика из среды на белке A не влияло на профиль CEX, что свидетельствует о том, что модификации во время инкубации не влияют на связывание с белком A или элюирование. Процедуры удаления мало влияли или не оказывали влияния на процентное содержание главного пика CEX.
C. Характеристика кислых вариантов
Кислые варианты пертузумаба выделяли с использованием CEX из исходного вещества пертузумаба или главного пика, инкубированного в среде для культивирования клеток. Выделенные кислые варианты анализировали способами, перечисленными на фигуре 15. Кислые варианты составляют 21% общей площади пиков, соответственно, примерно 80% (17% из 21%) кислых вариантов идентифицировали. Дезаминированные формы не могли оценить количественно.
Формы, идентифицированные среди кислых вариантов, образованных главным пиком, инкубированным со средой, были такими же, как и формы, выявленные в исходном веществе пертузумаба. Выявлены следующие формы: сиалилированный вариант, вариант с восстановленной дисульфидной связью, гликозилированный вариант, невосстанавливаемый вариант и дезаминированный вариант. Гликозилированные формы более высокого порядка идентифицированы масс-спектрометрией с ионизацией электрораспылением (ESI-MS) после восстановления и обработки PNG-азой.
D. Исследования фармакокинетики (ФК)
Однократная внутривенная (в/в) доза 10 мг/кг, 12 крыс на группу, 3 группы (кислые варианты, главный пик, исходное вещество пертузумаба). Отбор образцов для всестороннего ФК-исследования осуществляли в течение 35 дней. Геометрическое среднее отношение AUC (0-14 дни) между кислыми вариантами, главным пиком и исходным веществом пертузумаба. Геометрическое среднее отношение = образец GM/исходное вещество IgG1 GM. Концентрация пертузумаба в зависимости от времени сходна для исходного вещества пертузумаба, кислого варианта и главного пика (фигуры 16 и 17). Не наблюдали значимого различия в воздействиях между кислыми вариантами, главным пиком и исходным веществом пертузумаба. GMR составляло ~1,0 с 90% CI в диапазоне 0,80-1,25.
Выводы
Многочисленные факторы культивирования клеток вносят вклад в образование кислых вариантов, но не обнаружено влияния извлечения на образование кислых вариантов. В кислой фракции идентифицировали вариант с восстановленной дисульфидной связью, невосстанавливаемый, сиалилированный, гликозилированный, и дезаминированный варианты. Кислая фракция, выделенная из исходного вещества пертузумаба и кислая фракция, образованная при инкубации главного пика CEX, содержали такие же формы. Кислые варианты, главный пик и исходное вещество пертузумаба имели одинаковую фармакокинетику.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ АНТИТЕЛ К HER2 | 2005 |
|
RU2361880C2 |
| ВВЕДЕНИЕ ФИКСИРОВАННЫХ ДОЗ HER-АНТИТЕЛ | 2005 |
|
RU2438705C2 |
| ТЕРАПИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ, РЕЗИСТЕНТНОЙ К ПРЕПАРАТАМ НА ОСНОВЕ ПЛАТИНЫ | 2005 |
|
RU2403065C2 |
| КОМПОЗИЦИИ АНТИТЕЛ | 2005 |
|
RU2426554C2 |
| ВАРИАНТЫ ПЕРТУЗУМАБА И ИХ АНАЛИТИЧЕСКАЯ ХАРАКТЕРИСТИКА | 2014 |
|
RU2737727C2 |
| НЕКОНКУРЕНТНЫЕ В ОТНОШЕНИИ НЕЙРЕГУЛИНА АЛЛОСТЕРИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО HER3 И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2704228C2 |
| ПРЕПАРАТЫ АНТИТЕЛ ПРОТИВ HER2 ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ | 2018 |
|
RU2750821C2 |
| БИСПЕЦИФИЧНЫЕ АНТИ-HER2/АНТИ-HER3 АНТИТЕЛА | 2016 |
|
RU2653443C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, АНАЛОГИ АНТИТЕЛ, КОМПОЗИЦИИ И СПОСОБЫ | 2010 |
|
RU2580038C2 |
| СОДЕРЖАЩИЕ СУПЕРСПИРАЛЬ И/ИЛИ ПРИВЯЗКУ БЕЛКОВЫЕ КОМПЛЕКСЫ И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2573915C2 |
























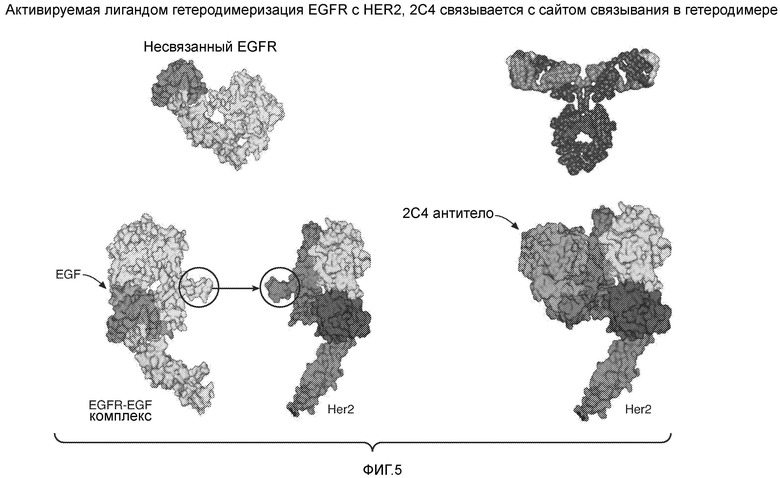
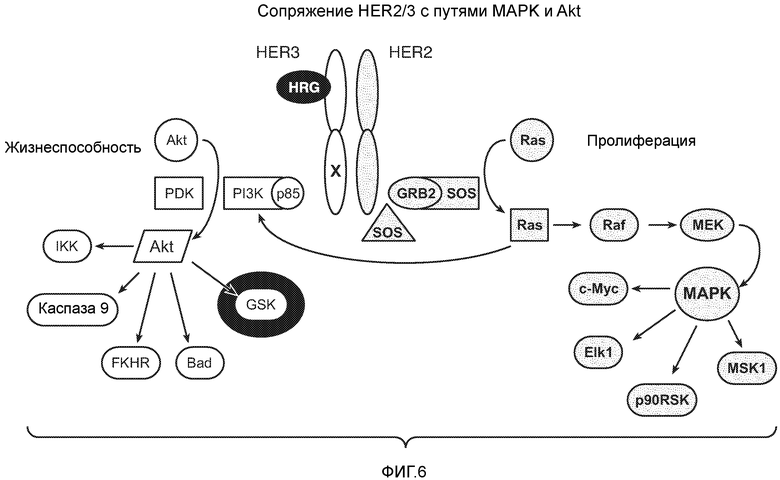
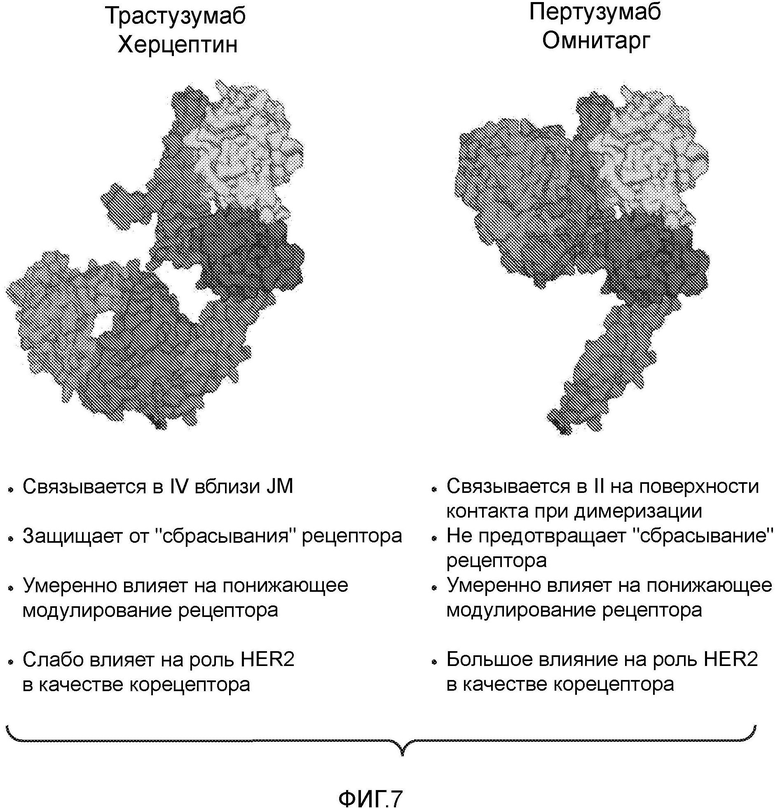
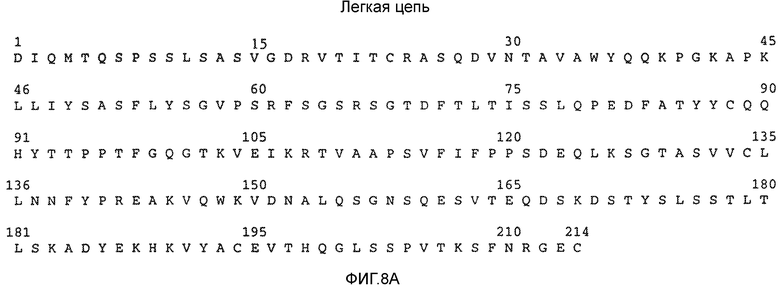



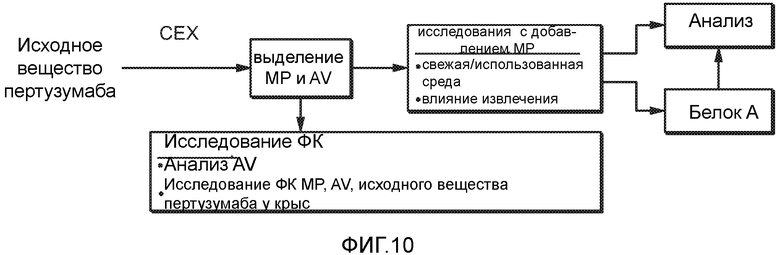

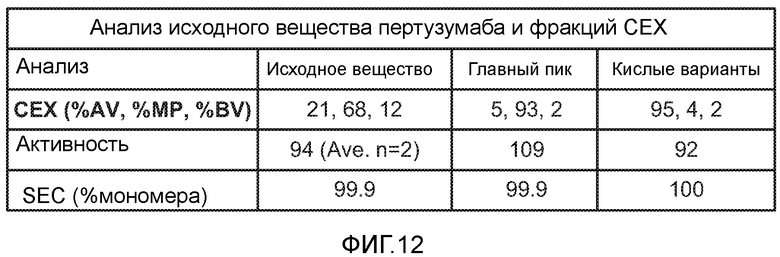
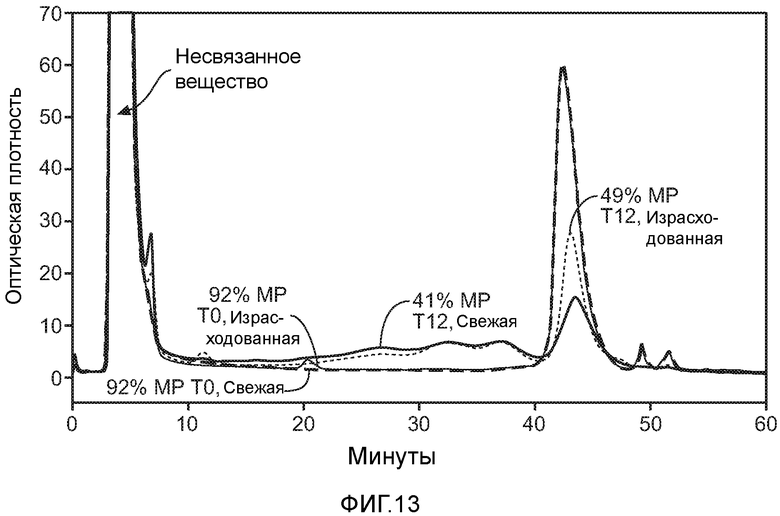
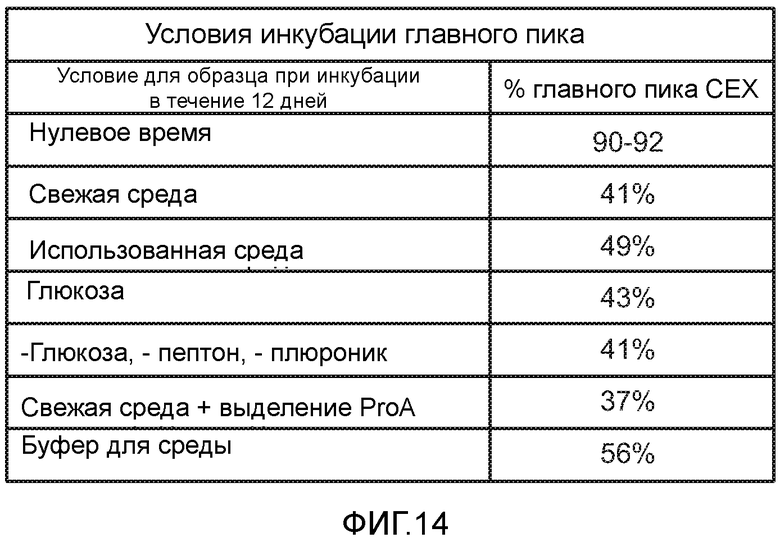


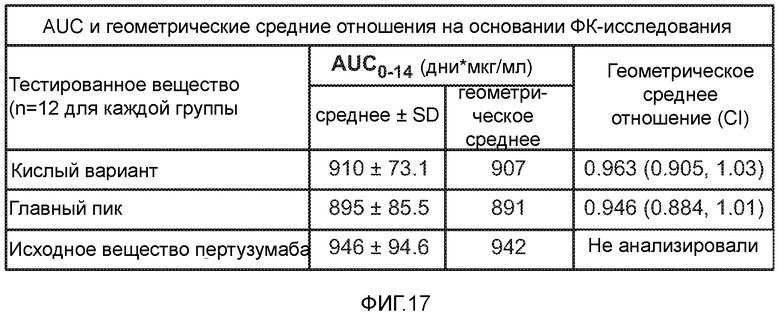
Изобретение относится к биотехнологии. Предложена композиция антитела для лечения HER2-позитивного рака, содержащая в качестве активного начала антитело, характеризующееся наличием вариабельной области лёгкой и тяжёлой цепи, и его кислые варианты, а именно: гликозилированный, дезаминированный варианты, а также вариант с восстановленной дисульфидной связью, сиалилированный вариант и невосстанавливаемый вариант. При этом количество кислых вариантов составляет менее чем примерно 25%. Описаны фармацевтический состав, содержащий такую композицию, для лечения HER2-позитивного рака и способ получения композиции, включающий оценку кислых вариантов с подтверждением того, что их количество составляет менее чем примерно 25%. Использование изобретения обеспечивает новую композицию, в которой само антитело и его кислые варианты имеют сходные фармакокинетические параметры, что может найти применение в терапии HER2-позитивного рака. 3 н. и 11 з.п. ф.-лы, 17 ил., 1 табл., 1 пр.
1. Композиция антитела для лечения HER2-позитивного рака, содержащая в эффективном количестве HER2-антитело главного типа, которое содержит аминокислотные последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи SEQ ID NO: 3 и 4, соответственно, и кислые варианты указанного HER2-антитела главного типа, где кислые варианты включают гликозилированный вариант, дезаминированный вариант, вариант с восстановленной дисульфидной связью, сиалилированный вариант и невосстанавливаемый вариант и где количество кислых вариантов составляет менее примерно 25%.
2. Композиция по п.1, где HER2-антитело главного типа и кислые варианты являются интактными антителами.
3. Композиция по п.1, где НЕR2-антитело главного типа содержит аминокислотные последовательности легкой цепи и тяжелой цепи SEQ ID NO: 15 и 16, соответственно.
4. Композиция по п.1, содержащая HER2-антитело главного типа с вариантом аминокислотной последовательности, выбранное из группы, состоящей из антитела, содержащего С-концевой остаток лизина на одной или двух тяжелых цепях, и антитело с одним или несколькими окисленными остатками метионина.
5. Фармацевтический состав для лечения HER2-позитивного рака, содержащий композицию по любому из пп.1-4 в фармацевтически приемлемом носителе.
6. Фармацевтический состав по п.5, являющийся стерильным.
7. Композиция по любому из пп.1-4, где антитело главного типа и кислые варианты имеют по существу одну и ту же фармакокинетику.
8. Способ получения композиции антитела по п.1, включающий: (1) получение композиции, содержащей HER2-антитело главного типа, которое связывается с доменом II HER2, и его кислые варианты, включая гликозилированный вариант, дезаминированный вариант, вариант с восстановленной дисульфидной связью, сиалилированный вариант и невосстанавливаемый вариант, и (2) оценку кислых вариантов в композиции и подтверждение того, что их количество составляет менее чем примерно 25%.
9. Способ по п.8, в котором стадия (2) включает оценку кислых вариантов способом, выбранным из группы, состоящей из ионообменной хроматографии, при которой композицию обрабатывают сиалидазой, капиллярного электрофореза в восстанавливающих условиях с использованием додецилсульфата натрия (CE-SDS), СЕ-SDS в не восстанавливающих условиях, хроматографии с использованием бороната и картирования пептидов.
10. Способ по п.8, в котором стадия (2) включает оценку кислых вариантов ионообменной хроматографией.
11. Способ по п.8, который включает катионообменную хроматографию с использованием катионообменника с карбоксилатной функциональной группой.
12. Способ по п.11, в котором условия хроматографии включают: буфер А 20 мМ бистрис, рН 6,0; буфер В 20 мМ бистрис, 200 мМ NaCl, рН 6,0; и градиент 0,5% буфер В с расходом 1,0 мл/мин.
13. Способ по п.8, включающий объединение композиции после стадии (2) с фармацевтически приемлемым носителем.
14. Способ по п.8, в котором композиция, оцениваемая на стадии (2), находится в фармацевтически приемлемом носителе.
| WO 2006033700 A2, 30.03.2006 | |||
| ZHANG et al.,"Free sulfhydryl in recombinant monoclonal antibodies", Biotechnol | |||
| Prog | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| TOUS et al., "Characterization of a novel modification to monoclonal antibodies: Thioether Cross-link of heavy and light chains", Anal | |||
| Chem., 2005, 77, стр.2675-2682 | |||
| NAHTA et al., "The | |||
Авторы
Даты
2015-03-10—Публикация
2009-01-28—Подача