ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу и к набору реагентов для обнаружения микроорганизмов, принадлежащих виду Mycoplasma pneumoniae, который, как правило, является патогенным микроорганизмом, вызывающим пневмонию, и/или виду Mycoplasma genitalium, используя в качестве индикатора молекулу, специфичную для обнаружения микроорганизмов.
УРОВЕНЬ ТЕХНИКИ
(1) Процент пациентов и симптомы пневмонии, вызываемой Mycoplasma pneumoniae
Инфекции, вызываемые Mycoplasma pneumoniae, относят к внебольничной атипичной пневмонии и сообщается, что процент инфекций, вызываемых Mycoplasma pneumoniae, среди внебольничных пневмоний составляет от 30 до 40% у взрослых или даже от 60 до 70%, если взрослых ограничить совершеннолетними в возрасте от 15 до 25 лет. Респираторный тракт является путем инфицирования Mycoplasma pneumoniae и зачастую благоприятными условиями распространения инфекции, являются, например, школа и семья. Кроме того, при инфекциях, вызываемых Mycoplasma pneumoniae, пневмония встречается приблизительно в от 3 до 5% случаях, а в остальных случаях возникает бронхит, воспаление верхних дыхательных путей или инфекция протекает бессимптомно. Характерные симптомы включают упорный кашель, при котором отсутствует мокрота начальной стадии инфекции, который иногда может сопровождаться такими симптомами как высокая температура, головная боль, боль в горле, озноб или общее недомогание.
(2) Нынешнее состояние скрининга инфекций, вызываемых Mycoplasma pneumoniae
Скрининговое исследование культуры из мазка, взятого из зева пациентов и скрининговое исследование на антитела с исследованием сыворотки пациента являются принятыми в качестве скрининговых исследований инфекции, вызываемой Mycoplasma pneumoniae. Поскольку Mycoplasma pneumoniae сама по себе растет только в специальной культуральной среде, то культивирование сложно осуществимо, и для окончательной идентификации Mycoplasma pneumoniae необходимо проведение ПЦР, культуральный скрининг может быть проведен только в ограниченном числе лабораторий, и это нынешнее состояние скринингового исследования культуры. Кроме того, необходимо скрининговое исследование для быстрого получения результатов, так как для выращивания культуры необходимо несколько недель.
С другой стороны, поскольку скрининговое исследование на антитело обычно является простым с точки зрения методики проведения и быстрее дает результаты по сравнению со скрининговым исследованием культуры, то такое скрининговое исследование на антитело является широкоиспользуемым исследованием. Но у этого исследования существуют сложности определения того является ли инфекцией, существовавшей ранее, или инфекцией, присутствующей в настоящее время, так как титры антитела IgM к Mycoplasma долго присутствуют в сыворотке, и требуется длительное время для повышения титров антител. Для решения указанных выше проблем рекомендована оценка, основанная на повышении титров антител между острой фазой инфекции и фазой выздоровления в динамике по времени, но поскольку требуется очень длительное время для проведения анализа антител до фазы выздоровления, то лечение откладывается, и такая задержка в лечении может вызвать пролонгирование и ухудшение симптомов, а также нежелательный эффект утяжеления инфекции вследствие присоединения вторичной инфекции.
Кроме того, для решения указанных выше проблем, описаны антитела и способы обнаружения для специфического выявления микроорганизма, принадлежащего Mycoplasma pneumoniae, которые могут использоваться для диагностики инфекций Mycoplasma pneumoniae.
Например, в патентной литературе 1 описан способ иммунодетекции с использованием моноклонального антитела против антигенного белка мембраны Mycoplasma pneumoniae размером приблизительно 43 килодальтон (кДа). Также в патентной литературе 2 описано, что выявление Mycoplasma pneumoniae можно проводить с высокой точностью, используя антитела против рибосомального белка L7/L12. Кроме того, в патентной литературе 3 описано, что быстрое и специфическое диагностирование инфекции Mycoplasma pneumoniae возможно при использовании моноклонального антитела против белка P1 Mycoplasma pneumoniae, моноклональное антитело обладает перекрестной реактивностью только с 1% или менее других видов рода Mycoplasma или другими патогенными видами сопутствующей флоры.
Однако для обнаружения микроорганизма, принадлежащего виду Mycoplasma pneumoniae, в клинических образцах, антитело, описанное выше, и в способе выявления с использованием антитела могут потребоваться сложная предварительная обработка образцов, содержащих микроорганизм, и существующая проблема заключается в том, что они не подходят для специфического диагностирования Mycoplasma pneumoniae вследствие сохраняющейся низкой специфичности и чувствительности.
(3) Mycoplasma genitalium и заболевания
Бактерия Chlamydia trachomatis известна как основная причина негонококкового уретрита. Однако Chlamydia trachomatis обнаруживается приблизительно у от 30 до 40% пациентов с негонококковым уретритом, и в большинстве случаев не понятно, с чем связаны возникающие симптомы. Кроме Chlamydia trachomatis особое внимание заслуживают микроорганизмы родов Mycoplasma и Ureaplasma, и, в частности, было показано, что Mycoplasma genitalium является одной из бактерий, вызывающих негонококковый уретрит и заболевания, передающиеся половым путем.
(4) Нынешнее состояние скрининга инфекций, вызываемых Mycoplasma genitalium
Отчеты об инфекциях, вызываемых Mycoplasma genitalium, выявленных культуральным методом или методом ПЦР, опубликованы в научных статьях, но поскольку быстрое диагностирование не может быть осуществлено указанными методами, требуется способ быстрого и специфического выявления микроорганизма, принадлежащего Mycoplasma genitalium, в клинических образцах.
ПЕРЕЧЕНЬ ЦИТИРУЕМЫХ ССЫЛОК
ПАТЕНТНАЯ ЛИТЕРАТУРА
[Патентная литература 1] Японская патентная публикация (Kokai) No. 63-298, по которой не проведена экспертиза
[Патентная литература 2] Международный патент WO2001/057199
[Патентная литература 3] Японская патентная публикация (Kokai) No. 5-304990, по которой не проведена экспертиза
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Согласно общепринятым методам, микроорганизмы, принадлежащие видам Mycoplasma pneumoniae и/или Mycoplasma genitalium, не могут быть выявлены быстро и специфически. Таким образом, поскольку невозможно быстро диагностировать инфекции, вызванные Mycoplasma pneumoniae и/или Mycoplasma genitalium, лечение откладывается, и его задержка может вызвать пролонгирование и ухудшение симптомов, а также нежелательный эффект распространения инфекции вследствие вторичной инфекции. Это текущая ситуация. Если инфекции, вызванные указанными микоплазмами, можно быстро выявить/диагностировать, становится возможным ввести макролидный антибиотик, эффективный в отношении микоплазм и начать соответствующее лечение на ранней стадии инфекции.
Кроме того, известно, что Mycoplasma pneumoniae и Mycoplasma genitalium серологически очень близки друг к другу, но поскольку очаг инфекции (например, ткани и органы) Mycoplasma pneumoniae отличается от очага инфекции Mycoplasma genitalium, как упоминалось выше, если возможно идентифицировать молекулу, способную обеспечить специфическое выявление двух микроорганизмов, считается, что диагностирование обоих инфекционных заболеваний становится возможным с применением такой молекулы в качестве индикатора.
Настоящее изобретение было выполнено с учетом указанных проблем. Целью настоящего изобретения является определение молекулы для быстрого и специфического диагностирования инфекции Mycoplasma pneumoniae и/или Mycoplasma genitalium и предоставление способа выявления и набора для выявления с применением молекулы в качестве индикатора.
РЕШЕНИЕ ПРОБЛЕМЫ
В указанных обстоятельствах авторы настоящего изобретения проводили интенсивные исследования и обнаружили, что DnaK микроорганизмов, принадлежащих виду Mycoplasma pneumoniae и/или Mycoplasma genitalium, может быть использован в качестве индикатора для быстрого и специфического выявления инфекций Mycoplasma pneumoniae и/или Mycoplasma genitalium. Белок DnaK, который также называют белком теплового шока 70 (Hsp70), обнаружен в виде группы белков, экспрессия которых возрастала, когда клетки подвергали воздействию стрессовых условий, например, нагреванию, для защиты клеток, и в настоящее время, известно, что он участвует во внутриклеточном транспорте или рефолдинге (функция молекулярного шаперона) транслируемых белков. Преимущества применения белка DnaK в качестве показателя в методах иммунологического анализа заключаются в том, что:
(1) белок DnaK всегда экспрессируется, потому что он участвует в транспорте или рефолдинге белков,
(2) DnaK составляет приблизительно 1% общих белков, и
(3) DnaK представлен не в виде мономера, но в виде тримера, гексамера или других мультимеров.
Настоящее изобретение осуществлено на основе указанных данных.
Настоящее изобретение предоставляется в следующем виде:
[1] Способ обнаружения Mycoplasma pneumoniae или Mycoplasma genitalium, отличающийся применением DnaK Mycoplasma pneumoniae или Mycoplasma genitalium в качестве индикатора.
[2] Способ по [1], в котором белок DnaK анализируют иммунологически.
[3] Антитело anti-DnaK, специфичное к Mycoplasma pneumoniae или Mycoplasma genitalium.
[4] Набор для обнаружения Mycoplasma pneumoniae или Mycoplasma genitalium, содержащий антитело anti-DnaK [3].
[5] Способ по [1], с применением гена DnaK в качестве индикатора.
[6] Праймер или зонд, специфичный к Mycoplasma pneumoniae или Mycoplasma genitalium.
[7] Набор для обнаружения Mycoplasma pneumoniae или Mycoplasma genitalium, содержащий праймер или зонд [6].
Термин "микроорганизмы", который используется в описании, означает Mycoplasma pneumoniae или Mycoplasma genitalium, в особенности, микроорганизмы, которые обладают патогенностью и имеют большое значение для диагностики в качестве микроорганизмов, вызывающих заболевания, описанные ниже.
Термин "антитело, которое специфически реагирует с микроорганизмами", который используется в описании, означает антитело, которое специфически реагирует с видом или родом микроорганизмов. Антитело, которое специфически реагирует с видом микроорганизмов, является особенно полезным в диагностировании инфекций, вызываемых микроорганизмами.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Согласно способу определения микроорганизмов, принадлежащих к Mycoplasma pneumoniae и/или Mycoplasma genitalium, с применением специфической молекулы в качестве индикатора в настоящем изобретении, инфекции Mycoplasma pneumoniae и/или Mycoplasma genitalium, инфекции, вызванные указанными микроорганизмами, можно быстро и специфически диагностировать.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 иллюстрирует сравнение нуклеотидных последовательностей (1-720) генов DnaK (SEQ ID NO: 6) в штаммах Mycoplasma pneumoniae M129 (генотип P1: тип I) и FH (генотип P1: тип II).
Фиг.2 иллюстрирует, исходя из Фиг.1, сравнение нуклеотидных последовательностей (721-1440) генов DnaK в обоих штаммах Mycoplasma pneumoniae.
Фиг.3 иллюстрирует, исходя из фиг.1 и фиг.2, сравнение нуклеотидных последовательностей (1441-1788) генов DnaK в обоих штаммах Mycoplasma pneumoniae.
Фиг.4 иллюстрирует сравнение нуклеотидных последовательностей (1-717 для штамма M129) генов P1 (штамм M129: SEQ ID NO: 7, и штамм FH: SEQ ID NO: 8) в штаммах Mycoplasma pneumoniae M129 (генотип P1: тип I) и FH (генотип P1: тип II).
Фиг.5 иллюстрирует, исходя из фиг.4, сравнение нуклеотидных последовательностей (718-1416 для штамма M129) генов P1 в обоих штаммах Mycoplasma pneumoniae.
Фиг.6 иллюстрирует, исходя из фиг.4 и фиг.5, сравнение нуклеотидных последовательностей (1417-2136 для штамма M129) генов P1 в обоих штаммах Mycoplasma pneumoniae.
Фиг.7 иллюстрирует, исходя из фиг.4-6, сравнение нуклеотидных последовательностей (2137-2856 для штамма M129) генов P1 в обоих штаммах Mycoplasma pneumoniae.
Фиг.8 иллюстрирует, исходя из фиг.4-7, сравнение нуклеотидных последовательностей (2857-3564 для штамма M129) генов P1 в обоих штаммах Mycoplasma pneumoniae.
Фиг.9 иллюстрирует, исходя из фиг.4-8, сравнение нуклеотидных последовательностей (3565-4284 для штамма M129) генов P1 в обоих штаммах Mycoplasma pneumoniae.
Фиг.10 иллюстрирует, исходя из фиг.4-9, сравнение нуклеотидных последовательностей (4285-4884 для штамма M129) генов P1 в обоих штаммах Mycoplasma pneumoniae.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЙ
Настоящее изобретение далее будет подробно проиллюстрировано, но не с целью ограничения, следующими вариантами осуществления настоящего изобретения в качестве типичных примеров.
Способ настоящего изобретения для выявления Mycoplasma pneumoniae или Mycoplasma genitalium отличается тем, что DnaK микроорганизмов используется в качестве индикатора для выявления Mycoplasma pneumoniae и/или Mycoplasma genitalium (т.е. либо Mycoplasma pneumoniae, либо Mycoplasma genitalium, или обе Mycoplasma pneumoniae и Mycoplasma genitalium, наиболее предпочтительно, обе Mycoplasma pneumoniae и Mycoplasma genitalium). Инфекции, вызываемые Mycoplasma pneumoniae и/или Mycoplasma genitalium, можно диагностировать путем выявления микроорганизмов.
Инфекция, вызываемая Mycoplasma pneumoniae, которую можно диагностировать с помощью настоящего изобретения, представляет собой микоплазменную пневмонию. Инфекция, вызываемая Mycoplasma genitalium, представляет собой негонококковый нехламидиальный уретрит или цервицит.
При диагностике инфекции, вызываемой Mycoplasma pneumoniae, можно использовать образец, в котором может находиться Mycoplasma pneumoniae. Примеры образца включают мазок из зева, носоглоточный мазок, назальный аспират, назальную слизь, мокроту и жидкость, полученную с помощью бронхоальвеолярного лаважа. Если инфекция, вызываемая Mycoplasma genitalium, является инфекцией, которую нужно диагностировать, можно использовать образец, в котором может находиться Mycoplasma genitalium. Пример образца включает мочу, препараты уретральных мазков и препараты цервикальных мазков. Идентификацию двух инфекций можно разрешить путем выбора места забора образца в качестве мишени для измерения.
DnaK, который используется в качестве индикатора в настоящем изобретении, представляет собой белок DnaK (номер NCBI: NP_110122) или ген DnaK (номер NCBI: NC_000912 REGION: 521837..523624), полученный из Mycoplasma pneumoniae, или белок DnaK (номер NCBI: AAC71527) или ген DnaK (номер NCBI: L43967 REGION: 374919..376706), полученный из Mycoplasma genitalium. Упомянутые выше белки и гены представляют собой примеры штамма, принадлежащего к микроорганизмам, и последовательности DnaK микроорганизмов в объеме настоящего изобретения включают последовательности, соответствующие белкам и генам DnaK, описанным выше.
Как показано в примере 8, описанном ниже, гены DnaK, полученные из различных штаммов Mycoplasma pneumoniae, полностью (100%) соответствуют друг другу, даже среди штаммов, в которых типы гена P1 Mycoplasma pneumoniae были различны, и не обнаружены варианты среди штаммов, полученных из различных мест и на протяжении последних 50 лет. На основании этого считают, что последовательности гена DnaK и белка DnaK Mycoplasma pneumoniae являются стабильными. Таким образом, предпочтительно ссылаться на нуклеотидные последовательности или аминокислотные последовательности, опубликованные NCBI, как описано выше.
1. Способ и набор для выявления микроорганизмов с применением антитела
Первый вариант осуществления способа выявления Mycoplasma pneumoniae или Mycoplasma genitalium настоящего изобретения отличается применением антитела anti-DnaK, специфичного к микроорганизмам. Когда выбирают специфическое антитело, специфичность к микроорганизмам составляет по меньшей мере 105 КОЕ/мл или выше, предпочтительно 104 КОЕ/мл или выше, и более предпочтительно 103 КОЕ/мл, и специфичность к другим микроорганизмам составляет по меньшей мере 107 КОЕ/мл или меньше, и предпочтительно 108 КОЕ/мл или меньше.
Антитело, которое можно применять в настоящем изобретении, может представлять собой поликлональное антитело или моноклональное антитело. Указанные антитела можно получить следующими способами или другими сходными способами, но способ не ограничивается тем самым способом.
В качестве первого варианта осуществления способа получения антитела, полноразмерный белок DnaK или его частичный пептид может быть использован для получения антитела. Что касается микроорганизмов, нуклеотидная последовательность и аминокислотная последовательность белка DnaK которых известны, пептидный фрагмент можно синтезировать на основе области, которая меньше сходства с аминокислотными последовательностями белков DnaK других микроорганизмов. Длина пептида для получения антитела не ограничена, но в случае антитела против белка DnaK, можно использовать пептид, имеющий длину, позволяющую охарактеризовать белок, предпочтительно 5 аминокислот или больше, и наиболее предпочтительно 8 аминокислот или больше. Указанный пептид или полноразмерный белок в чистом виде, или их конъюгат, сшитый с белком-носителем, таким как KLH (гемоцианин лимфы улитки) или БСА (бычий сывороточный альбумин), может быть введен животному, необязательно вместе с адъювантом, и сыворотку животного собирают для получения антисыворотки, содержащей антитело (поликлональное антитело), которое распознает белок DnaK. Можно использовать антитело, которое выделяют из антисыворотки. Примеры животного, которое можно инокулировать, включают овцу, лошадь, козу, кролика, мышь и крысу, и кролик или коза являются предпочтительными для получения поликлонального антитела. Моноклональное антитело можно получить согласно известному методу получения гибридомных клеток, и в таком случае предпочтительна мышь.
В качестве антигена может быть использован полноразмерный гибридный белок или аминокислотная последовательность, состоящая из 5 остатков или больше (предпочтительно 8 остатков или больше) белка и глютатион S-трансферазы или тому подобного, после очистки гибридного белка, или без очистки. Антитело также может быть получено с помощью генетически рекомбинантного антитела, экспрессированного в культуре клеток с применением гена иммуноглобулина, выделенного методом генетического клонирования и различных методов, описанных в публикации: Antibodies; A laboratory manual, E. Harlow et al., Cold Spring Harbor Laboratory Press.
Из антител, полученных, как описано выше, антитело, обладающее высокой специфичностью, можно получить путем отбора антитела, которое специфически реагирует с Mycoplasma pneumoniae и/или Mycoplasma genitalium (т.е. либо Mycoplasma pneumoniae, либо Mycoplasma genitalium, или с обеими Mycoplasma pneumoniae и Mycoplasma genitalium, наиболее предпочтительно, с обеими Mycoplasma pneumoniae и Mycoplasma genitalium), и не реагирует с другими патогенными микроорганизмами, в соответствии с известным методом.
Антитело против DnaK, которое можно использовать в качестве маркерного антигена настоящего изобретения, можно получить с помощью следующих способов или других сходных способов, но способ не ограничивается тем самым способом.
a) Что касается микроорганизмов, нуклеотидная последовательность и аминокислотная последовательность белка DnaK которых известны, пептидный фрагмент можно синтезировать на основе области, которая проявляет меньше сходства с аминокислотными последовательностями белков DnaK других микроорганизмов, и поликлональное или моноклональное антитело можно получить с применением пептидного фрагмента в качестве антигена для получения интересующего антитела.
Полноразмерную нуклеотидную последовательность гена можно получить с применением общих методов генной инженерии, таких как амплификация гена методом ПЦР с применением в качестве праймеров последовательностей ДНК, расположенных на обоих концах известного гена, или гибридизация с применением гомологичной последовательности в качестве зонда-матрицы.
Затем, интересующий белковый антиген можно получить путем создания гибридного гена с генами других белков, введения гибридного гена хозяину, например, E. coli с помощью известного метода введения гена, сверхпродукции гибридного белка, и очистки экспрессированного белка методом аффинной хроматографии на колонке с применением антитела против белка, использованного для получения гибридного белка. В таком случае, учитывая, что полноразмерный белок DnaK становится антигеном, если получают антитело против аминокислотной области, которая сохраняется среди микроорганизмов вне объема изобретения, такое антитело не может быть использовано в настоящем изобретении. Таким образом, с учетом антигена, получаемого указанным способом, интересующее антитело можно получить путем создания гибридом, продуцирующих моноклональные антитела, и выбора клона, продуцирующего антитело, которое специфически реагирует с микроорганизмами.
b) Что касается микроорганизмов, аминокислотная последовательность белка DnaK которых неизвестна, поскольку аминокислотные последовательности белка DnaK обладают гомологией 80-100%, предпочтительно 90-100%, среди различных видов, интересующий ген белка можно легко получить с применением общих методов генной инженерии, таких как амплификация гена области специфической последовательности с помощью метода ПЦР на основе последовательности, гомологичной аминокислотной последовательности, или гибридизация с применением гомологичной последовательности в качестве зонда-матрицы.
Интересующий белковый антиген можно получить путем создания гибридного гена из гена белка и других генов белков, введения гибридного гена хозяину, например, E. coli с помощью известного метода введения гена, сверхпродукции гибридного белка, и очистки экспрессированного белка методом аффинной хроматографии на колонке, с применением антитела против белка, использованного для получения гибридного белка. В таком случае, поскольку полноразмерный белок DnaK становится антигеном, если получают антитело против участка аминокислотной последовательности, который сохраняется среди микроорганизмов вне объема изобретения, такое антитело не может быть использовано в настоящем изобретении. Таким образом, что касается антигена, полученного указанным методом, интересующее антитело можно получить путем создания гибридом, продуцирующих моноклональные антитела, и отбора клона, продуцирующего антитело, которое специфически реагирует с микроорганизмами.
c) В качестве другого способа, в случае когда аминокислотная последовательность белка DnaK неизвестна, создают синтетический пептид, состоящий из 5-30 аминокислот, соответствующих общему участку последовательности, который сохраняется среди микроорганизмов в известных аминокислотных последовательностях белка DnaK, и получают поликлональное или моноклональное антитело с применением пептидной последовательности в соответствии с известным методом. Высокоочищенный белок DnaK можно получить путем очистки клеточного гомогената интересующего микроорганизма с помощью аффинной хроматографии на колонке с применением антитела. Если чистота белка является недостаточной, чистоту можно увеличить с помощью известного метода очистки, такого как ионообменная хроматография, гидрофобная хроматография или гель-фильтрация. Интересующее антитело можно получить путем создания гибридом с применением полученного антитела к очищенному белку DnaK, и отбора гибридомы, продуцирующей антитело, которое специфически реагирует с микроорганизмами.
В качестве второго варианта осуществления способа получения антитела, Mycoplasma pneumoniae может быть использована как антиген для получения антитела, которое реагирует с белком DnaK и является специфичным к Mycoplasma pneumoniae и/или Mycoplasma genitalium, как показано в примере 1.
Аналогично, Mycoplasma genitalium может быть использована, как антиген для получения антитела. В случае, когда микроорганизм используют в качестве антигена, антиген можно получить в соответствии с известным методом. Примеры метода включают обработку ультразвуком, обработку нагреванием, обработку сурфактантом, обработку формалином, обработку замораживанием оттаиванием и обработку соляной кислотой.
Антитело настоящего изобретения, которое получают с помощью методов описанных выше, и которое специфично к микроорганизмам, можно использовать в различных иммунологических тестах, и могут быть предоставлены различные реагенты и наборы для выявления, специфичные к интересующим микроорганизмам.
Антитело можно использовать в любом из известных иммунологических тестов, например, метод агглютинации с применением частиц из полистирольного латекса, на которых связывается антитело, метод ELISA, выполняемый в титрационном микропланшете, иммунохроматография, или сендвич-метод с применением антитела, меченного окрашенными частицами, способными развивать окраску, магнитными частицами, ферментом или флуоресцентным веществом, по отдельности или в комбинации.
В способе выявления с применением DnaK в качестве индикатора настоящего изобретения, Mycoplasma pneumoniae и/или Mycoplasma genitalium можно специфически выявить, не разрушая специально клетки, или можно использовать известный метод обработки микроорганизмов, чтобы провести определение с высокой чувствительностью. Более подробно, может быть использован метод обработки с применением экстракционного реагента, включающего различные сурфактанты, такие как Triton X-100, Tween-20, или SDS, метод ферментной обработки с применением соответствующего фермента, например, протеазы, или известный метод разрушения клеточной структуры, например, разрушение клеток микроорганизмов физическим методом. Предпочтительно оптимальные условия выделения выбирают для каждого микроорганизма путем проверки комбинации реагентов, например, сурфактантов.
Набор реагентов для выявления микроорганизмов с применением антитела настоящего изобретения соответствует набору реагентов для выявления с применением метода выявления.
Состав набора не ограничен, при условии, что он содержит по меньшей мере одно антитело настоящего изобретения. Число, тип и комбинацию используемых антител можно изменять должным образом в соответствии с иммунологическим тестом, который используют. Набор может содержать жидкость для предварительной обработки в методе выделения, описанном выше, в качестве предварительной обработки образца.
2. Способ и набор для выявления микроорганизмов с использованием гена
В качестве метода выделения ДНК может быть использован известный метод. Примеры метода включают солюбилизацию образца сурфактантом или депротеинизацию с применением депротеинизирующего агента для получения ДНК. Предпочтительно при условии, что ген DnaK, как описано ниже, можно анализировать, например, если выделенный ген затем амплифицируют с помощью метода ПЦР, ДНК предпочтительно не содержит ингибиторов реакции ПЦР.
В качестве метода предварительной подготовки образца можно использовать подход, аналогичный подходу, описанному в методе выявления микроорганизмов с помощью антитела.
Количество выделенной ДНК не ограничено при условии, что выделяют количество, которое позволяет провести анализ гена DnaK. Если ДНК подвергают анализу методом ПРЦ, количество составляет, например, 5-50 fg или больше на реакцию.
Выделенную ДНК используют для анализа гена DnaK. Анализ гена DnaK можно осуществить в соответствии с известным методом. Примеры метода включают метод выявления с помощью амплификации гена DnaK с применением метода ПЦР, и метод выявления гена DnaK с применением зондового метода. Например, можно использовать любой метод амплификации гена DnaK с помощью метода ПЦР, при условии, что интересующая нуклеотидная последовательность может быть амплифицирована. Может быть использован любой метод определения гена DnaK зондовым методом, при условии, что можно установить интересующую нуклеотидную последовательность.
Чтобы амплифицировать или точно определить желаемую нуклеотидную последовательность гена DnaK, можно выбрать соответствующим образом последовательность, обладающую 80-100% гомологии с последовательностью Mycoplasma pneumoniae и/или Mycoplasma genitalium и обладающую гомологией предпочтительно 60% или меньше с последовательностями других патогенных микроорганизмов. Праймер или зонд могут содержать одну или более вариаций, делеций или добавлений в нуклеотидной последовательности, при условии, что интересующий фрагмент ДНК можно амплифицировать.
Например, если ген DnaK Mycoplasma pneumoniae, является геном, который нужно амплифицировать, праймеры для ПЦР-амплификации можно создать на основе последовательности гена DnaK Mycoplasma pneumoniae (Номер NCBI: NC_000912 REGION: 521837..523624), опубликованной в NCBI, как описано в Примерах ниже. Более подробно, смысловой праймер MpDnaK_S и антисмысловой праймер MpDnaK_A можно использовать, чтобы амплифицировать полноразмерный ген DnaK.
Если ген DnaK Mycoplasma genitalium является геном, который нужно амплифицировать, праймеры для ПЦР-амплификации можно создать на основе последовательности гена DnaK Mycoplasma genitalium (Номер NCBI: L43967 REGION: 374919..376706), опубликованной в NCBI.
Как показано в примере 8, гены DnaK, полученные из различных штаммов Mycoplasma pneumoniae, полностью (100%) соответствуют друг другу даже среди штаммов, в которых отличались типы гена P1 Mycoplasma pneumoniae, и не обнаружено вариаций среди штаммов, полученных из разных мест и на протяжении последних 50 лет. Поэтому нет необходимости учитывать различие между штаммами Mycoplasma pneumoniae, чтобы специфически обнаружить ген DnaK Mycoplasma pneumoniae, и праймеры или зонд можно создавать, принимая во внимание различия между штаммами, другими, чем штаммы Mycoplasma pneumoniae.
Кроме того, поскольку считается, что последовательность белка DnaK Mycoplasma pneumoniae также является консервативной, считают, что антитела, полученные с применением белка DnaK, не проявляют различий в реактивности с учетом генотипа, места получения и времени получения, и, следовательно, могут использоваться на обширной территории и времени.
Набор реагентов для выявления микроорганизмов с применением гена настоящего изобретения соответствует набору реагентов для выявления при помощи способа выявления. Он представляет собой набор, который используется в способе специфического выявления Mycoplasma pneumoniae и/или Mycoplasma genitalium, и который отличается содержанием по меньшей мере двух типов праймеров для амплификации нуклеотидной последовательности, специфичной к интересующему гену DnaK.
В качестве другого варианта осуществления, набор отличается содержанием по меньшей мере одного типа зонда для определения нуклеотидной последовательности, специфичной к интересующему гену DnaK.
Указанные наборы также могут содержать жидкость для предварительной обработки в методе выделения, описанном выше, в качестве подготовки образца.
ПРИМЕРЫ
Настоящее изобретение далее будет проиллюстрировано, но не с целью ограничения следующими Примерами.
ПРИМЕР 1
Получение антител, специфичных к Mycoplasma pneumoniae и Mycoplasma genitalium, и идентификация специфического антигена
(1) Получение моноклональных антител, специфичных к Mycoplasma pneumoniae и Mycoplasma genitalium
(1-1) Культивирование штаммов для иммунизации и получение иммуногенов
Бульоны PPLO с глюкозой (содержащие лошадиную сыворотку, свежий экстракт дрожжей и ацетат таллия), каждый по отдельности засевали одним из 6 штаммов Mycoplasma pneumoniae (штаммы FH, Bru, Mac, M52, PI1428 и M129-B7: приобретенные в ATCC) и осуществляли культивирование при 37°C в течение 7 дней в аэробных условиях. Каждый штамм, собранный центрифугированием, отмывали и суспендировали в PBS. Суспензии замораживали и оттаивали для получения иммуногенов.
(1-2) Иммунизация
Самок мышей Balb/c в возрасте шести недель использовали для иммунизации (CREA Japan, Inc.). Каждый раствор иммуногена, полученный из штамма, эмульгировали с полным адъювантом Фрейнда (SIGMA). Каждую эмульсию (100 мкг антигена) вводили подкожно мыши. До тех пор, пока не наблюдали роста титра антител против иммуногена у каждой мыши, 50 мкг каждого антигена эмульгированного с неполным адъювантом Фрейнда (SIGMA) вводили подкожно мыши каждые две недели. Затем 25 мкг каждого антигена, разведенного PBS, вводили мыши внутрибрюшинно за три дня до слияния клеток.
(1-3) Получение гибридом
Следующие процедуры проводили согласно стандартному методу. Клетки селезенки, асептически полученные от иммунизированных мышей, объединяли с миеломными клетками (P3U1) с применением полиэтиленгликоля 1500 (Roche), и засевали в лунки 96-луночных планшетов. Гибридомные клетки избирательно культивировали с применением среды HAT, и их культуральные супернатанты проверяли в условиях последующего теста ELISA. Иммобилизацию для ELISA осуществляли с применением антигена Mycoplasma pneumoniae (1 мкг/мл), полученного из каждого из 6 штаммов, использованных в качестве иммуногенов. После блокирующей обработки лунок супернатант каждой культуры добавляли в лунки и инкубировали при 4°C в течение ночи. Лунки отмывали жидкостью для отмывки три раза, и разведенные в 2000 раз HRP-меченное антимышиное Ig-антитело кролика (Dako) добавляли в лунки и инкубировали при комнатной температуре в течение 1 часа. Лунки отмывали промывочной жидкостью три раза и субстратный раствор (TMBZ) добавляли в лунки и инкубировали при комнатной температуре в течение 10 минут. Затем реакцию останавливали, измеряли оптическую плотность при 450 нм. Затем отобранные гибридомы проверяли методом лимитирующих разведений для установления клонированных штаммов. В отношении моноклональных антител, полученных из 16 штаммов, в установленных клонированных штаммах, осуществляли следующие эксперименты. Моноклональные антитела, полученные из 16 клонированных штаммов, реагировали со всеми иммуногенами, полученными из 6 штаммов.
(1-4) Определение молекулярного веса белков, распознаваемых моноклональными антителами
Молекулярный вес каждого белка, распознаваемого 16 моноклональными антителами, определяли с помощью вестерн-блоттинга. Вначале проводили электрофорез 10 мкг антигена Mycoplasma pneumoniae (штамма FH) с помощью SDS-PAGE и переносили промоканием на нитроцеллюлозные мембраны. Каждый культуральный супернатант 16 клонов добавляли к мембранам и инкубировали при комнатной температуре в течение 1 часа. Мембраны отмывали промывочной жидкостью три раза, и разведенное в 1000 раз HRP-меченное антимышиное Ig-антитело кролика добавляли к мембранам и инкубировали при комнатной температуре в течение 1 часа. Мембраны отмывали промывочной жидкостью три раза и добавляли субстратный раствор (4-хлор-1-нафтол) к мембранам и инкубировали при комнатной температуре в течение 10 минут. После развития окраски мембраны отмывали дистиллированной водой для остановки реакции.
В результате обнаружили, что 10 моноклональных антител, распознавали молекулу, обладающую молекулярным весом 62-69 кДа, и 6 моноклональных антител распознавали молекулу, обладающую молекулярным весом 40-45 кДа. На основании указанного результата, авторы изобретения попробовали идентифицировать антиген с учетом молекулы 62-69 кДа, которую рассматривали как обладающую высокой иммуногенностью, в связи с получением большого числа клонов.
(1-5) Определение подкласса полученных антител
Применяли Iso Strip (Roche) для определения подкласса 10 моноклональных антител, которые распознавали молекулу 62-69 кДа. Обнаружили, что 6 антител представляли собой H-цепь G1/L-цепь k, 1 антитело представляло собой H-цепь G1/L-цепь λ, 1 антитело представляло собой H-цепь 2b/L-цепь k, 1 антитело представляло собой H-цепь 2b/L-цепь λ и 1 антитело представляло собой H-цепь 2a/L-цепь λ.
(2) Идентификация антигена, специфичного для Mycoplasma pneumoniae и Mycoplasma genitalium
(2-1) Очистка антигена, распознаваемого моноклональными антителами
(2-1-1) Культивирование штамма
Штамм Mycoplasma pneumoniae M129-B7, полная генетическая последовательность которого уже установлена, использовали для очистки антигена. Mycoplasma pneumoniae (штамм M129-B7) засевали в бульон PPLO с глюкозой (содержащий лошадиную сыворотку, свежий экстракт дрожжей и ацетат таллия) и культивировали при 37°C в течение 7 дней в аэробных условиях. Клетки штамма, собранные центрифугированием, отмывали и суспендировали в PBS. Суспензию замораживали.
(2-1-2) Очистка распознанного антигена с помощью аффинной хроматографии
Моноклональное антитело MCM12, полученное в (1), связывали с CNBr-активированной сефарозой 4B (GE healthcare) в качестве носителя в колонке, чтобы подготовить колонку для аффинной хроматографии к очистке антигена. Связывание с носителем в колонке осуществляли путем реакции геля 5 мг/мл IgG в 0,1 моль/л NaHCO3-NaOH и 0,5 моль/л NaCl (pH 8,3) при 4°C в течение ночи. Непрореагировавшие группы блокировали с помощью 0,2 моль/л глицинового буфера (pH 8).
Белки, выделенные из штамма Mycoplasma pneumoniae, наносили на колонку. После того как элюировали неадсорбированную фракцию, адсорбированную на колонке фракцию элюировали с применением 3 моль/л тиоцианата натрия и собирали. Данную фракцию диализовали против 50 ммоль/л PBS (pH 7) для получения очищенного продукта.
(2-2) Идентификация белка, распознаваемого полученными моноклональными антителами
(2-2-1) Определение молекулярного веса установленного белка с помощью SDS-PAGE
Очищенный антиген анализировали с помощью SDS-PAGE и вестерн-блоттинга. Очищенный антиген (0,1 мкг) подвергали электрофорезу с помощью SDS-PAGE и переносили промоканием на нитроцеллюлозные мембраны. Моноклональное антитело MCM12 или моноклональное антитело MCM19 (раствор 10 мкг/мл IgG) по отдельности добавляли к мембранам и инкубировали при комнатной температуре в течение 1 часа. Мембраны отмывали промывочной жидкостью три раза и разведенное в 1000 раз HRP-меченное антимышиное Ig-антитело кролика добавляли к мембранам и инкубировали при комнатной температуре в течение 1 часа. Мембраны отмывали промывочной жидкостью три раза, и раствор субстрата (4-хлор-1-нафтол) добавляли к мембранам и инкубировали при комнатной температуре. После развития окраски мембраны отмывали дистиллированной водой для остановки реакции.
Подтверждали, что оба антитела распознавали очищенный антиген.
(2-2-2) Анализ N-концевой аминокислотной последовательности очищенного антигена
Анализировали 10 N-концевых аминокислотных остатков очищенного антигенного белка в соответствии с общепринятым методом. Очищенный антиген подвергали электрофорезу с помощью SDS-PAGE. Мембрану PVDF, на которую наносили образец, отмывали смесью 50% метанол/0,1% трифторуксусная кислота и метанолом и высушивали, и 10 циклов секвенирования белка осуществляли с N-конца. Белковый секвенатор PPSQ-23A (Shimadzu) и анализатор PTH SPD-10A (Shimadzu) применяли в качестве анализаторов.
В результате получали следующую последовательность:
STDNGLIIGI (SEQ ID NO: 1)
Проводили поиск с применением базы данных Swiss-Prot в соответствии с общепринятым методом, и полученная последовательность полностью соответствовала последовательности, состоящей из аминокислотных остатков со 2-го по 11-й шаперонного белка DnaK Mycoplasma pneumoniae. Молекулярный вес DnaK, рассчитанный на основе его аминокислотной последовательности, составлял 65 кДа, что почти совпадает с молекулярным весом распознаваемого антителами антигена, определяемого с помощью вестерн-блоттинга.
Как описано выше, подтверждали, что антитела, полученные как указано выше, являлись антителами anti-DnaK, специфичными к Mycoplasma pneumoniae и Mycoplasma genitalium.
ПРИМЕР 2
Проверка чувствительности и перекрестной реактивности полученных антител методом ELISA
Из моноклональных антител, полученных в Примере 1, моноклональное антитело MCM12 и моноклональное антитело MCM19 использовали для проверки чувствительности и перекрестной реактивности антител.
(1) культивирование и получение штаммов, которые проверяют
(1-1) Штаммы для проведения теста на чувствительность
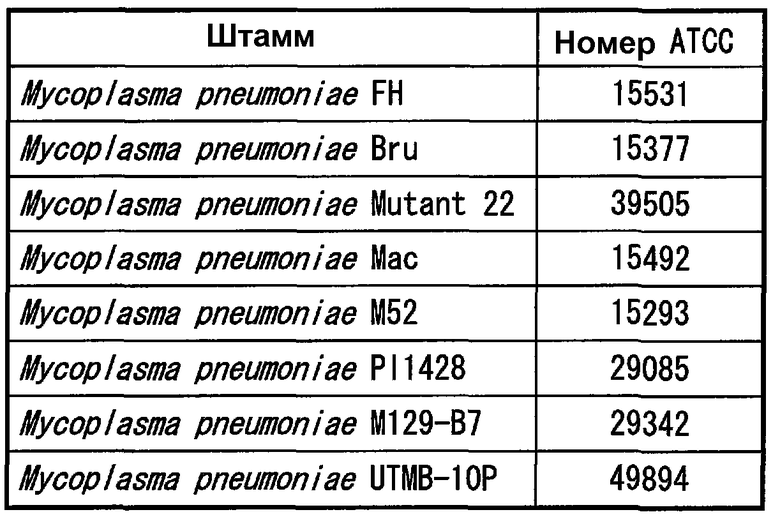
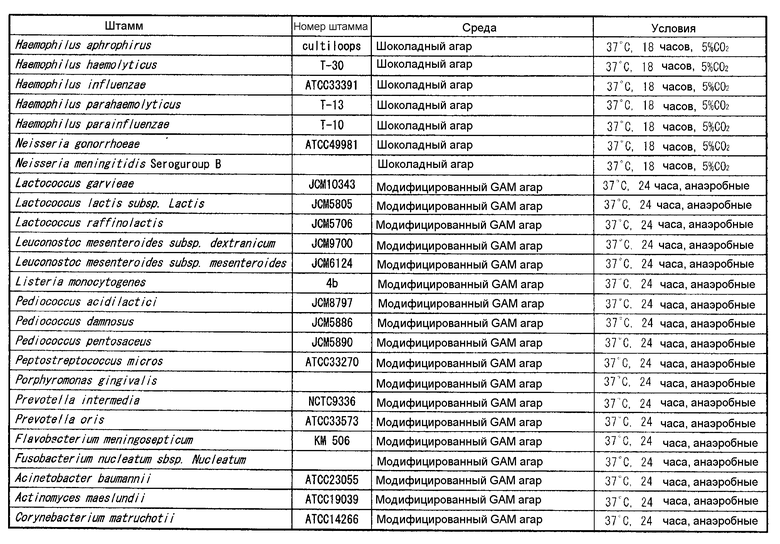
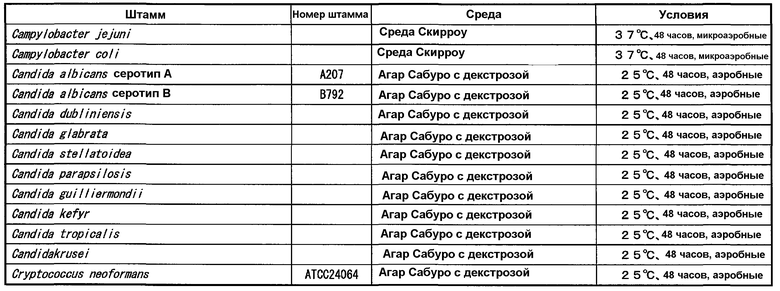
Бульоны PPLO с глюкозой (содержащие лошадиную сыворотку, свежий экстракт дрожжей и ацетат таллия), каждый по отдельности засевали одним из 8 штаммов Mycoplasma pneumoniae, представленных в таблице 1, и осуществляли культивирование при 37°C в течение 4 дней в аэробных условиях. Штаммы, у которых значение pH бульона достигало 6,8, использовали в качестве тестовых штаммов. Чтобы определить количество клеток каждого штамма в бульоне, готовили серии 10-кратных разведений со стерильным PBS, и 10 мкл каждого разведения высевали на агарозную среду PPLO (содержащую лошадиную сыворотку, свежий экстракт дрожжей и ацетат таллия) и инкубировали при 37°C в течение 10 дней. Колонии роста на агарозной среде подсчитывали под оптическим микроскопом с увеличением 40 для определения числа колониеобразующих единиц каждого штамма.
(1-2) Штаммы для проведения теста-1 перекрестной реактивности
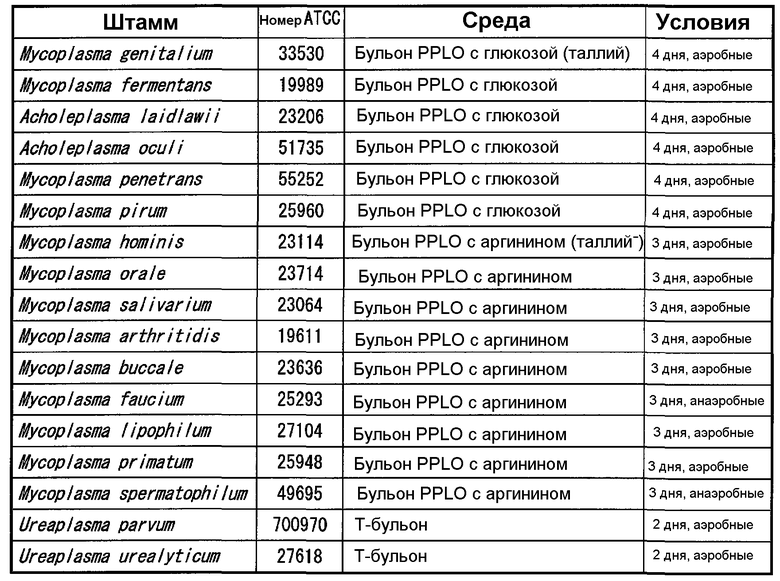
Штаммы, принадлежащие к роду Mycoplasma, отличающиеся от Mycoplasma pneumoniae, представленные в (1-1), к роду Ureaplasma, и к роду Acholeplasma, культивировали в соответствии с бульонами и условиями культивирования, представленными в таблице 2. Культивирование осуществляли при 37°C. Термины "аэробный" и "анаэробный" в таблице 2 означают аэробное культивирование и анаэробное культивирование, соответственно. Чтобы определить количество клеток каждого штамма в бульоне, готовили серии 10-кратных разведений со стерильным PBS, и 10 мкл каждого разведения высевали на агар PPLO (содержащий лошадиную сыворотку, свежий экстракт дрожжей и ацетат таллия) и инкубировали при 37°C в течение 10 дней. Колонии роста на агаре подсчитывали под оптическим микроскопом с увеличением 40 для определения количества колониеобразующих единиц каждого штамма. Тест осуществляли в количестве 106-107 КОЕ/мл.
(1-3) Штаммы для проведения теста-2 на перекрестную реактивность
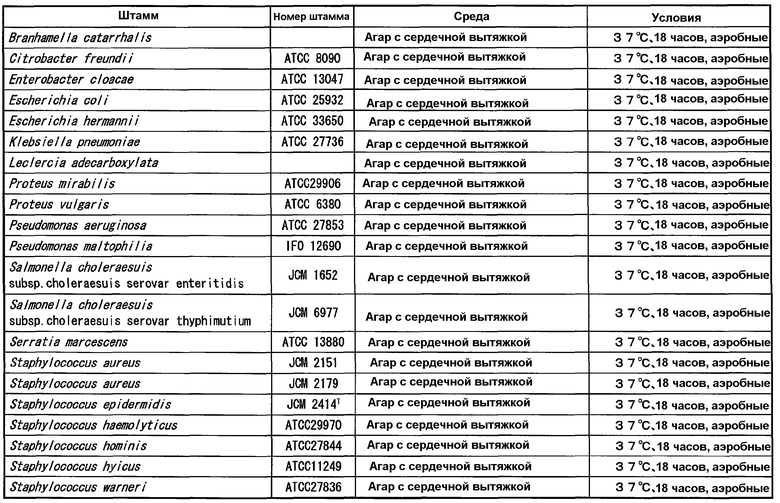
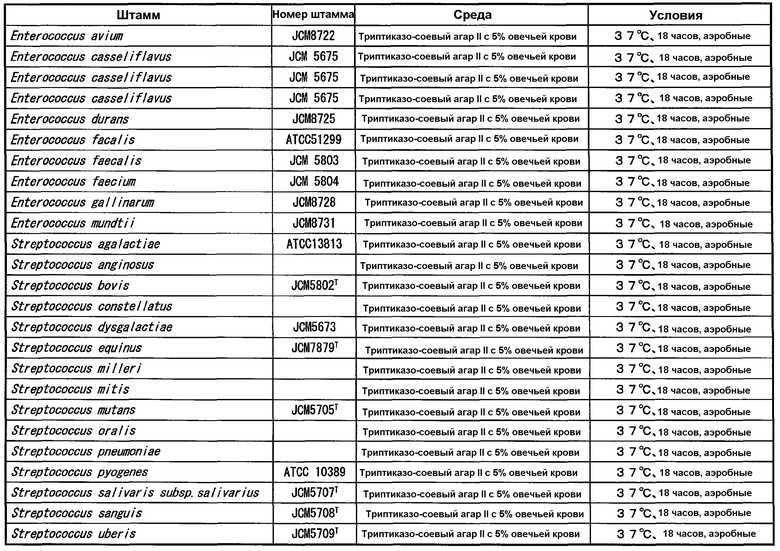
В таблицах 3-6 представлены микроорганизмы, которые использовали в тесте перекрестной реактивности бактерий и грибов, кроме микроорганизмов рода Mycoplasma, рода Ureaplasma и рода Acholeplasma, используемых в (1-1) и (1-2), и условия культивирования. Агар с сердечной вытяжкой (Difco), триптиказо-соевый агар II с 5% овечьей крови (Becton, Dickinson and Company), шоколадный агар (NISSUI), модифицированный агар GAM (NISSUI), среду Скирроу (Becton, Dickinson and Company) и агар Сабуро с декстрозой (Difco) использовали в качестве сред.
Указанные штаммы культивировали на агаре и суспендировали в стерильном PBS в концентрации 107-108 КОЕ/мл для получения тестируемых штаммов. Для определения количества клеток каждого штамма, каждую тестируемую суспензию, в которой каждый штамм суспендировали в стерильном PBS, разводили пошагово (шаг 10) тем же PBS, и 50 мкл каждого разведения высевали на агарозную среду. Колонии роста на среде подсчитывали невооруженным глазом.
Пустые места в колонке "№ штамма" в таблицах обозначают штаммы, которые выделяли и определяли из клинических образцов.
Проверка чувствительности и перекрестной реактивности методом ELISA
(2-1) Проведение анализа методом ELISA
(2-1-1) Метод получения иммобилизованного антитела и метод иммобилизации
Асцитическую жидкость, содержащую моноклональное антитело MCM19, применяли для фракционирования сульфатом аммония, IgG очищали с помощью rProteinA Sepharose FF (GE healthcare), и проводили количественный анализ белка биуретовым методом. Очищенное антитело IgG (10 мкг/мл) иммобилизовали на 96-луночном микропланшете.
(2-1-2) Метод получения антитела для мечения щелочной фосфатазой и метод получения меченого антитела
Асцитическую жидкость, содержащую моноклональное антитело MCM12, применяли для фракционирования сульфатом аммония, и IgG очищали с помощью MEP Hypercel (Pall Corporation). IgG обрабатывали пепсином для получения F(ab')2 и сшивали F(ab')2 со щелочной фосфатазой для получения антитела, меченного щелочной фосфотазой.
(2-1-3) Метод проведения теста ELISA
Отмывали 96-луночный микропланшет с иммобилизованными антителами, и блокировали 0,1 ммоль/л раствором TBS (pH 7,5), содержащим 1% БСА, при комнатной температуре в течение 1 часа. Суспензию каждого штамма, который тестировали (100 мкл), добавляли в микропланшет и инкубировали при комнатной температуре в течение 1 часа. Микропланшет отмывали и антитело, меченное щелочной фосфатазой (10 мкг/мл), добавляли и инкубировали при комнатной температуре в течение 1 часа. Микропланшет отмывали, и получали развитие окраски с применением раствора субстрата (pNPP) в течение 30 минут. Реакцию останавливали и измеряли оптическую плотность при 405 нм.
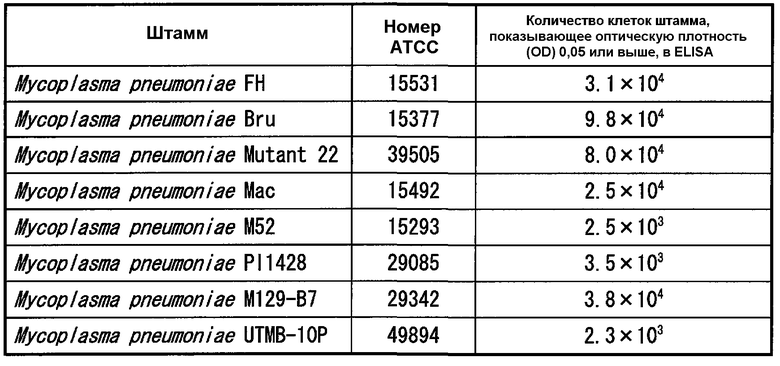
(3) Тест определения чувствительности
Тестируемые штаммы (1-1) применяли в тесте ELISA, описанном выше, и тестовое разведение, которое показало оптическую плотность 0,05 или выше и максимальную кратность разведения использовали для расчета количества клеток каждого штамма. Результаты представлены в таблице 7.
Обнаружили на основании результатов, представленных в таблице 7, что чувствительность к Mycoplasma pneumoniae составляла 103-104 КОЕ/мл согласно тесту ELISA с использованием моноклональных антител.
(4) Тест определения перекрестной реактивности
Тестируемые штаммы (1-2) [рода Mycoplasma, за исключением Mycoplasma pneumoniae, рода Vreaplasma и рода Acholeplasma, представленные в таблице 2] и тестируемые штаммы (1-3) [другие бактерии и грибы, представленные в таблицах 3-6] применяли в тесте ELISA, описанном выше.
Все микроорганизмы, за исключением Mycoplasma genitalium показали значение оптической плотности меньше 0,010. В отношении Mycoplasma genitalium, количество клеток микроорганизма, рассчитанное из тестового разведения, которое показало значение оптической плотности 0,05 или выше и максимальную кратность разведения, составляло 6,9×104 КОЕ/мл.
Как показано в результатах, обнаружено, что тест ELISA с использованием моноклональных антител, показал перекрестную реактивность с Mycoplasma genitalium, но не показал перекрестной реактивности с другими микроорганизмами.
Как описано выше, подтверждали, что тест ELISA не показал перекрестной реактивности со многими бактериями и грибами, которые могли бы помешать диагностике инфекции, вызываемой Mycoplasma pneumoniae или Mycoplasma genitalium.
ПРИМЕР 3
Проверка чувствительности и перекрестной реактивности полученных антител с помощью иммунохроматографии
(1) Проведение иммунохроматографии
(1-1) Получение коллоидного золота, конъюгированного с антителом anti-Mycoplasma-pneumoniae
К раствору коллоидного золота, значение рН которого предварительно регулировали добавлением 2 мл 50 ммоль/л фосфатного буфера (pH 11) к 18 мл раствора коллоидного золота (Tanaka Kikinzoku), имеющего диаметр 40 нм, 2,5 мл 100 мкг/мл раствора моноклонального антитела MCM12 добавляли и перемешивали. Затем смесь перемешивали в течение 1 часа, 1 мл 1% масс. водного раствора полиэтиленгликоля (Mw. 20000, Wako Pure Chemical Industries) добавляли и перемешивали, и 2 мл 10% масс. водного раствора БСА (SIGMA) добавляли и перемешивали. Данный раствор центрифугировали при 4°C и 8000G в течение 15 минут, и почти весь супернатант удаляли, так что оставался приблизительно 1 мл супернатанта. Коллоидное золото повторно диспергировали с помощью ультразвукового генератора. Диспергированное коллоидное золото растворяли в 20 мл фосфатного буфера, содержащего БСА, и центрифугировали при 4°C и 8000G в течение 15 минут. Почти весь супернатант удаляли, так что оставался приблизительно 1 мл супернатанта, и коллоидное золото повторно диспергировали с помощью ультразвукового генератора для получения раствора коллоидного золота, конъюгированного с антителом.
(1-2) Получение подушки, содержащей коллоидное золото
Раствор коллоидного золота, конъюгированного с антителом, полученный в (1-1), разводили фосфатным буфером, содержащим БСА, и заполняли в подушку из стекловолокна (Millipore) размером 20 мм × 300 мм, которую заранее вырезали. Подушку высушивали при комнатной температуре в течение ночи для получения подушки, содержащей антитело, конъюгированное с коллоидным золотом.
(1-3) Приготовление мембраны с иммобилизованными антителами (носитель для иммунохроматографии)
На нитроцеллюлозную мембрану (Millipore), которую обрезали до размера 30Ч300 мм, иммобилизовали антитело согласно следующему способу, чтобы приготовить мембрану с иммобилизованным антителом. Раствор моноклонального антитела MCM19 для иммобилизации (5 мг/мл) наносили линией шириной приблизительно 1 мм с помощью устройства для нанесения покрытия (BioDot), на расстоянии 16 мм от края по одной из длинных сторон мембраны, в качестве основы, и высушивали для получения мембраны с иммобилизованным антителом.
(1-4) Создание набора для иммунохроматографии
Мембрану с иммобилизованным антителом, подушку, несущую коллоидальное золото, и абсорбирующую подушку (Pall corporation) прикрепляли к листу с адгезивной обратной стороной, так чтобы соседние детали перекрывали друг друга. Полученную перекрывающуюся структуру разрезали вдоль длинной стороны на ширину 6 мм, используя резак, для получения тест-полосок для иммунохроматографии. Каждую тест-полоску помещали в корпусный футляр для создания тест-набора для иммунохроматографии.
(1-5) Метод тестирования
Культивируемые штаммы, штаммы, отмытые PBS, культуральные супернатанты и осадки культивируемых штаммов растворяли в фосфатном буфере, содержащем Triton X-100, для приготовления растворов антигена Mycoplasma pneumoniae (или штамма) для теста в заранее установленных концентрациях. К каждому иммунохроматографическому набору для теста добавляли по каплям 100 мкл раствора антигена Mycoplasma pneumoniae (или штамма) для теста. Через 15 минут после добавления образцы, в которых развитие окраски наблюдали невооруженным глазом в положении, где было нанесено антитело anti-Mycoplasma-pneumoniae, каждой мембраны с иммобилизованным антителом оценивали как "положительные", и образцы, где не выявляли развития окраски, оценивали как "отрицательные".
(2) Проверка чувствительности
Тестируемые штаммы (1-1) примера 2 применяли для иммунохроматографии, как описано выше, и тестовое разведение, которое показало развитие окраски, возникающей на линии тестирования, и максимальную кратность разведения, использовали для расчета количества микробных клеток каждого штамма. Результаты представлены в таблице 8.
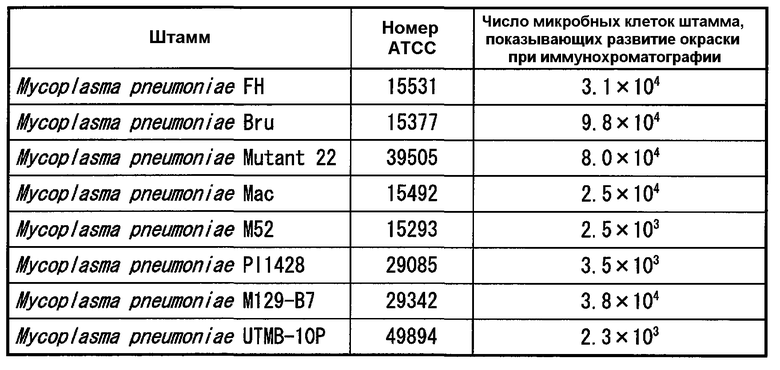
Обнаружили из результатов, представленных в таблице 8, что чувствительность к Mycoplasma pneumoniae составляла 103-104 КОЕ/мл при иммунохроматографии с использованием моноклональных антител.
(3) Тест на перекрестную реактивность
Тестируемые штаммы (1-2) [род Mycoplasma, кроме Mycoplasma pneumoniae, род Ureaplasma и род Acholeplasma, представлены в таблице 2] и тестируемые штаммы (1-3) [другие бактерии и грибы, представленные в таблицах 3-6] примера 2 применяли в иммунохроматографии, описанной выше.
Все микроорганизмы, за исключением Mycoplasma genitalium, являлись отрицательными, т.е. не проявляли какого-либо развития окраски. Напротив, развитие окраски обнаруживали для Mycoplasma genitalium, и количество клеток микроорганизма, рассчитанное из опытного разведения, показывающее концентрацию максимального разведения составляло 6,9×104 КОЕ/мл.
Как показано в результатах, обнаружили, что иммунохроматография с использованием моноклональных антител показывала перекрестную реактивность с Mycoplasma genitalium, но не показывала перекрестной реактивности с другими микроорганизмами.
Как описано выше, подтвердили, что иммунохроматография не показала перекрестной реактивности со многими бактериями и грибами, которые могли бы помешать диагностике инфекции Mycoplasma pneumoniae или Mycoplasma genitalium.
ПРИМЕР 4
Оценка клинических образцов
Брали мазки из зева у 3 пациентов, у которых подозревали микоплазменную инфекцию, и у 33 здоровых субъектов, и осуществляли детекцию Mycoplasma pneumoniae в соответствии с методом иммунохроматографии примера 3. В результате наблюдали положительную реакцию у 3 пациентов с подозрением на микоплазменную инфекцию, и результаты 33 здоровых субъектов были отрицательными, как показано в таблице 9.
Экстрагировали ДНК из тех же образцов в соответствии с общепринятым методом, и осуществляли детектирование гена Mycoplasma pneumoniae модифицированным методом, полученным из метода качественного анализа ПЦР по Jensen et al. (APMIS. 1989; 97(11): 1046-8), в котором амплифицировали часть гена P1 Mycoplasma pneumoniae (M. pneumoniae M129-B7 Номер NCBI: NC_000912), и оба результата сравнивали друг с другом. Положительный и отрицательный результаты согласовывались друг с другом, как показано в таблице 9.
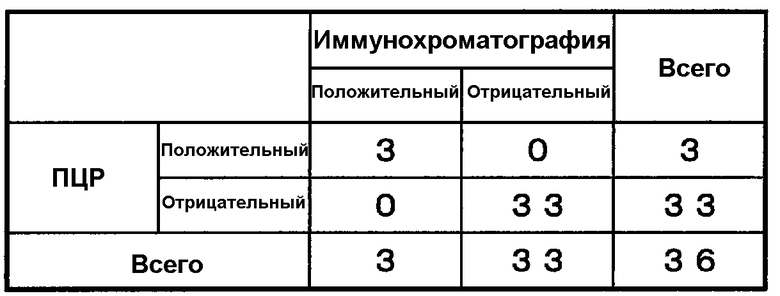
Показатель совпадения положительных результатов: 100% (3/3) Показатель совпадения отрицательных результатов: 100% (33/33) Общий показатель совпадения результатов: 100% (36/36)
Затем использовали последовательности ДНК, полученные из образцов, которые показали положительный результат в анализе иммунохроматографии и в качественном анализе методом ПЦР, и осуществляли детектирование гена Mycoplasma genitalium с применением модифицированного метода, полученного из метода качественного анализа ПЦР Yoshida et al. (J Clin Microbiol. 2002; 40(4): 1451-5) Mycoplasma genitalium, в котором амплифицировали часть области 16s рРНК Mycoplasma genitalium (M. genitalium G7 Номер NCBI: L43967). В результате, ген, полученный из Mycoplasma genitalium, не обнаружили ни в одном из образцов, как показано в таблице 10.
Таким образом подтвердили, что ген, полученный из Mycoplasma genitalium может быть амплифицирован указанным методом.
Как описано выше, показано, что антитело настоящего изобретения использовали для специфического выявления Mycoplasma pneumoniae, и можно диагностировать микоплазменную инфекцию.
ПРИМЕР 5
Амплификация гена DnaK культивируемых штаммов Mycoplasma pneumoniae
В качестве образцов, которые нужно оценить, использовали 8 штаммов Mycoplasma pneumoniae, приобретенных в ATCC (M. pneumoniae FH: ATCC No. 15531, M. pneumoniae Bru: ATCC No. 15377, M. pneumoniae Mac: ATCC No. 15492, M. pneumoniae Mutant 22: ATCC No.39505, M. pneumoniae M52: ATCC No.15293, M. pneumoniae PI1428: ATCC No. 29085, M. pneumoniae M129-B7: ATCC No. 29342, и M. pneumoniae UTMB-10P: ATCC No. 49894). Указанные 8 штаммов Mycoplasma pneumoniae культивировали в среде PPLO и выделяли ДНК.
Выделение ДНК проводили с применением набора Sumitest EX-R&D (Medical & Biological Laboratories), и каждый образец ДНК суспендировали в буфере, содержащем 10 ммоль/л Tris-HCl, 1 ммоль/л EDTA, pH 8,0 (Nippon Gene)(в дальнейшем называемом буфер TE), и замораживали при -40°C.
В отношении выделенных ДНК, число копий гена определяли с помощью количественного анализа ПЦР общей для микоплазм области 16s рРНК. Каждую ДНК разводили буфером TE для получения препаратов 10-кратных разведений от 2×106 до 2×100 копий/мкл. Указанные разведения использовали для обнаружения гена DnaK.
Количественный анализ ПЦР для общей микоплазменной области 16s рРНК осуществляли следующим образом.
Создавали праймеры, которые являлись общими для рода Mycoplasma, для амплификации области 16s рРНК, и число копий гена в каждой экстрагированной ДНК M. pneumoniae рассчитывали методом ПЦР в режиме реального времени, с использованием стандарта. Анализ ПЦР в режиме реального времени проводили с применением циклера LightCycler FastStart DNA Master SYBR Green I (Roche Applied Science).
Использовали следующие последовательности праймеров.
Полный геном M. pneumoniae M129-B7: GenBank № доступа NC_000912
FmY4: 5'-TGGGGAGCAAA(C/T)AGGATTAG-3' (SEQ ID NO: 2)
nt 119,081-119,100 20mer
MGSO-2: 5'-CACCATCTGTCACTCTGTTAACCTC-3' (SEQ ID NO: 3)
nt 119,332-119,356 25mer
В отношении условий ПЦР, осуществляли реакцию при 95°C в течение 10 минут и цикл, состоящий из реакций денатурации при 94°C в течение 10 секунд, отжига при 60°C в течение 2 секунд, и при 72°C в течение 12 секунд повторяли 50 раз.
В качестве стандарта использовали серии разведений (107, 105, 103, 102 и 101 копий/тест) T-вектора pT7Blue (Takara Bio) в котором часть 16s рРНК (771 bp: 302-1072 для 16s рРНК) M. pneumoniae (штамм M129) была рекомбинантной. Число копий в стандарте рассчитывали на основе следующих уравнений:
Концентрация ДНК (мкг/мл) = ABS (260 нм) × 50
1 пмоль 1 т.п.н. ДНК = 0,66 мкг
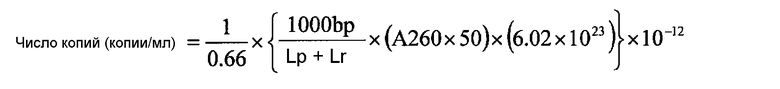
Lp: длина плазмиды
Lr: длина рекомбинантной ДНК
Затем, ген DnaK Mycoplasma pneumoniae амплифицировали с помощью ПЦР, как изложено ниже. Что касается реакционной смеси ПЦР, 25 мкл Premix EX Taq Hot Start Version (TaKaRa), 1 мкл 10 пмоль/мкл смыслового праймера MpDnaK_S, и 1 мкл 10 пмоль/мкл антисмыслового праймера MpDnaK_A добавляли к 18 мкл дистиллированной воды Otsuka (Otsuka Pharmaceutical) для получения 45 мкл базовой смеси, и 5 мкл каждой выделенной ДНК добавляли к базовой смеси для доведения общего объема до 50 мкл. В качестве отрицательного контроля в ПЦР использовали буфер TE. Для амплификации гена DnaK, имеющего общую длину 1788 п.о., создавали смысловой праймер, состоящий из 81 п.о., расположенных в 5'-направлении от стартового кодона гена DnaK, и создавали антисмысловой праймер, состоящий из 53 п.о., расположенных в 3'-направлении от стоп-кодона. Более подробно, смысловой праймер MpDnaK_S соответствовал нуклеотидной последовательности 521,756-521,782 M. peumoniae M129 (GenBank Ace No. NC_000912), и антисмысловой праймер MpDnaK_A соответствовал нуклеотидной последовательности 523,655-523,677.
MpDnaK_S: 5'-CTCAAACGCTAAAAGTGCTAACG-3' 23mer (SEQ ID NO:4)
MpDnaK_A: 5'-AAACCATTATTACAGGTCAAATAAGAC-3' 27mer (SEQ ID NO: 5)
В реакции ПЦР с применением устройства Mastercycler (Eppendorf) цикл, состоящий из реакций денатурирования при 94°C в течение 30 секунд, отжига при 50°C в течение 30 секунд, и реакции при 72°C в течение 2 минут, повторяли 50 раз, и в заключение осуществляли реакцию при 72°C в течение 5 минут. После реакции ПЦР 5 мкл каждого продукта ПЦР подвергали электрофорезу в 2% агарозе и окрашивали агарозный гель бромидом этидия и освещали ультрафиолетовым светом для подтверждения наличия полосы продукта амплификации приблизительно 1900 п.о.
8 штаммов Mycoplasma pneumoniae, полученных ранее, проверяли, чтобы подтвердить, что все 8 штаммов можно амплифицировать вплоть до 102 копий/тест.
ПРИМЕР 6
Перекрестная реактивность со штаммами культуры микоплазмы, выделенными у человека
В качестве образцов для измерения использовали 17 штаммов микоплазмы, приобретенных в ATCC (M. genitalium: ATCC No. 33530, M. hominis: ATCC No.23114, Ureaplasma parvum: ATCC No. 700970, U. urealyticum: ATCC No. 27618, M. fermentans: ATCC No. 19989, Acholeplasma laidlawii: ATCC No. 23206, A. oculi: ATCC No. 51735, M. penetrans: ATCC No. 55252, M. pirum: ATCC No. 25960, M. orale: ATCC No. 23714, M. salivarium: ATCC No. 23064, M. arthritidis: ATCC No. 19611, M. buccale: ATCC No. 23636, M. faucium: ATCC No. 25293, M. lipophilum: ATCC No. 27104, M. primatum: ATCC No. 25948, и M. spermatophilum: ATCC No. 49695). Указанные 17 штаммов микоплазмы культивировали в среде PPLO. Аналогично примеру 5, выделяли ДНК, число копий гена определяли с помощью теста количественной ПЦР области 16s рРНК, и образец каждой ДНК разводили до концентрации 2×105 копий/мкл.
Процедуры, описанные в примере 5, повторяли, причем 17 штаммов Mycoplasma использовали в качестве образцов, которые нужно оценить, осуществляли ПЦР на наличие гена DnaK Mycoplasma pneumoniae, и не обнаруживали полосы продукта амплификации ни у одного из 17 штаммов. Поскольку не выявили перекрестной реактивности, когда концентрация ДНК в образце в 10000 раз превышала концентрацию ДНК, необходимую для амплификации гена DnaK M. pneumoniae, обнаружили, что ПЦР на наличие гена DnaK Mycoplasma pneumoniae отличалась чрезвычайно высокой специфичностью.
ПРИМЕР 7
Амплификация гена DnaK Mycoplasma pneumoniae клинических образцов
В качестве образцов для измерения, ДНК, выделенные в 46 случаях положительных клинических образцов (40 случаев мазков из зева, 2 случая назальной слизи, 1 случай носоглоточного аспирата и 3 случая мазков из носоглотки) и 30 случаев отрицательных образцов (10 случаев мазков из зева здоровых субъектов, 10 случаев мазков из зева из клинических образцов, 4 случая назальной слизи, 3 случая носоглоточных аспиратов и 3 случая мазков из носоглотки) тестировали методом вложенной ПЦР участка гена P1 Mycoplasma pneumoniae, как описано в разделе "Mycoplasma pneumonia" публикации National Institute of Infectious Diseases, "Pathogen Detection Manual" стр. 1309-1344.
ПЦР гена DnaK Mycoplasma pneumoniae осуществляли, чтобы подтвердить, что ген DnaK амплифицировался во всех 46 случаях положительных результатов ПЦР гена P1. Напротив, ген DnaK не амплифицировался ни в одном из 30 случаев отрицательного результата ПЦР гена P1.
ПРИМЕР 8
Анализ нуклеотидной последовательности гена DnaK, полученной из культивированных штаммов и из клинических образцов
Нуклеотидные последовательности продуктов ПЦР 8 штаммов ATCC примера 5 и 8 клинических образцов (в 7 случаях мазки из зева и в 1 случае мазок из носоглотки) примера 7, в которых обнаружили амплификацию с помощью ПЦР гена DnaK, определяли с применением устройств BigDye Terminator v3.1 (Applied Biosystems) и 3130x1 Genetic Analyzer (Applied Biosystems).
В результате, что касается гена DnaK (1788 п.о., SEQ ID NO: 6), продукты ПЦР 8 штаммов ATCC и 8 клинических образцов полностью (100%) соответствовали друг другу, и также полностью (100%) соответствовали штамму M129 (номер доступа NC_000912) и штамму FH (номер доступа CP002077), зарегистрированным в GenBank. Выравнивание последовательностей штамма M129 и штамма FH представлено на фиг.1-3.
В отношении гена P1 проводили дифференциальное типирование методом ПЦР-ПДРФ в соответствии со ссылкой: JOURNAL OF CLINICAL MICROBIOLOGY, 1996, p. 447-449 Vol. 34, No. 2, и 8 штаммов ATTC Примера 5 распределяли в две группы. Более подробно, 4 штамма, включающие M129-B7, M52, PI1428, и Mutant 22 относили к типу I, и 4 штамма, включающие FH, Bru, Mac и UTMB-10P, относили к типу II. Выравнивание последовательностей штамма M129 (SEQ ID NO: 7) и штамма FH (SEQ ID NO: 8), в качестве типичных штаммов, представлено на фиг.4-10.
На основании результатов считали, что полученные антитела не показывали различий в реактивности по генотипу, месту получения и времени получения, поскольку гены DnaK полностью (100%) соответствовали друг другу, даже из штаммов, в которых различались типы гена P1, и не обнаружено вариаций нуклеотидной последовательности среди штаммов, полученных из различных мест и на протяжении последних 50 лет.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Согласно настоящему изобретению, Mycoplasma pneumoniae и/или Mycoplasma genitalium можно специфически обнаружить с высокой чувствительностью в образцах, таких как образцы мазков со слизистой оболочки рта, образцы мазков со слизистой оболочки носовой полости, образцы мочи, образцы тканей, или жидкостей организма, или образцы, полученные из культуры. В частности, настоящее изобретение важно для постановки диагноза атипичной пневмонии, вызванной Mycoplasma pneumoniae, или диагноза негонококкового уретрита и заболевания, передаваемого половым путем, вызванного Mycoplasma genitalium, и промышленно применимо для производства лекарственных препаратов.
Хотя настоящее изобретение описано со ссылкой на конкретные варианты осуществления, возможны различные изменения и модификации, очевидные для специалистов в данной области техники, не нарушающие объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления наличия мутаций, приводящих к резистентности у Mycoplasma genitalium к макролидным и фторхинолоновым антибиотикам | 2019 |
|
RU2725477C1 |
| СПОСОБ ВЫЯВЛЕНИЯ МУТАЦИЙ, ПРИВОДЯЩИХ К РЕЗИСТЕНТНОСТИ У Mycoplasma genitalium И Mycoplasma pneumoniae К МАКРОЛИДНЫМ АНТИБИОТИКАМ | 2017 |
|
RU2646123C1 |
| СУБЪЕДИНИЧНАЯ ВАКЦИНА ПРОТИВ MYCOPLASMA SPP. | 2018 |
|
RU2695679C1 |
| СУБЪЕДИНИЧНАЯ ВАКЦИНА ПРОТИВ MYCOPLASMA SPP. | 2017 |
|
RU2668799C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИИ MYCOPLASMA HYORHINIS И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОЙ КОМПОЗИЦИИ | 2020 |
|
RU2737971C1 |
| СУБЪЕДИНИЧНАЯ ВАКЦИНА ПРОТИВ MYCOPLASMA SPP. | 2013 |
|
RU2636459C2 |
| МУТАНТНЫЕ ШТАММЫ MYCOPLASMA HYOPNEUMONIAE | 2013 |
|
RU2689671C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИИ MYCOPLASMA HYORHINIS И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОЙ КОМПОЗИЦИИ | 2016 |
|
RU2724549C1 |
| КОМПОЗИЦИЯ ПО ПРЕДУПРЕЖДЕНИЮ ИНФЕКЦИИ Mycoplasma spp. | 2013 |
|
RU2646137C2 |
| НАНОАНТИТЕЛА aMh1, aMh2, СВЯЗЫВАЮЩИЕ АНТИГЕН MYCOPLASMA HOMINIS, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ MYCOPLASMA HOMINIS | 2011 |
|
RU2484095C1 |


















Изобретение относится к области биотехнологии и микробиологии. Описан способ и набор для выявления и быстрой и специфической диагностики инфекций Mycoplasma pneumoniae и/или Mycoplasma genitalium. В качестве индикатора применяется DnaK Mycoplasma pneumoniae или Mycoplasma genitalium. Предложенное изобретение может быть использовано в медицине. 3 н. и 4 з.п. ф-лы, 10 ил., 11 табл., 8 пр.
1. Способ выявления Mycoplasma pneumoniae или Mycoplasma genitalium, отличающийся применением DnaK Mycoplasma pneumoniae или Mycoplasma genitalium в качестве индикатора.
2. Способ по п. 1, в котором иммунологически анализируют белок DnaK.
3. Антитело anti-DnaK, специфичное как к Mycoplasma pneumoniae, так и к Mycoplasma genitalium, получаемое с помощью DnaK Mycoplasma pneumoniae или Mycoplasma genitalium.
4. Набор для выявления Mycoplasma pneumoniae или Mycoplasma genitalium, отличающийся тем, что содержит антитело anti-DnaK по п. 3.
5. Способ по п. 1, с применением гена DnaK в качестве индикатора.
6. Набор праймеров для амплификации методом ПЦР, содержащий смысловой праймер с последовательностью SEQ ID NO: 4 и антисмысловой праймер с последовательностью SEQ ID NO: 5, где праймеры специфичны в отношении гена DnaK Mycoplasma pneumoniae.
7. Набор для выявления Mycoplasma pneumoniae, отличающийся тем, что содержит набор праймеров по п. 6.
| УСТРОЙСТВО ДЛЯ ГИБКИ СОРТОВОГО МЕТАЛЛА | 1962 |
|
SU157199A1 |
| GIRALDO P | |||
| et al., "Detection of the human 70-kD and 60-kD heat shock proteins in the vagina: relation to microbial flora, vaginal pH, and method of contraception", Infect Dis Obstet Gynecol | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| GIRALDO P | |||
| et al., "Vaginal heat shock protein expression in symptom-free women with a history of recurrent | |||
Авторы
Даты
2016-02-10—Публикация
2010-12-03—Подача