УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Область техники
Настоящее изобретение относится к вакцине против Mycoplasma spp.; в частности к субъединичной вакцине против Mycoplasma spp.
Описание предшествующего уровня техники
В настоящее время известными мельчайшими бактериями, способными к саморепликации вне клеток-хозяев, являются Mycoplasma spp. Несмотря на то, что энзоотическая пневмония свиней не приводит к их смерти, она может приводить к снижению эффективности использования кормов и быть причиной задержки роста, воспаления и иммуносупрессии, и кроме того, способствовать большей восприимчивости свиней к заражению другими патогенными микроорганизмами, вследствие чего отрасли наносится экономический ущерб.
До настоящего времени, энзоотическая пневмония свиней предупреждалась тремя основными подходами, в том числе: введением лекарственных препаратов, улучшением окружающей среды и вакцинацией. Принимая во внимание плохую эффективность профилактики антибиотиками к Mycoplasma hyopneumoniae, введение лекарственного препарата может использоваться только в лечебных целях и затруднительно удовлетворять профилактические нужды. Кроме того, учитывая, что злоупотребление лекарственными средствами может привести к еще большей инфекции, вызываемой резистентными к воздействию лекарств бактериями, введение лекарственного препарата в организм требует осторожных способов действий и существует много ограничений.
Улучшение окружающей среды создает основу профилактики инфицирования Mycoplasma spp. Хорошие санитарные условия свинофермы и содержания животных способствуют снижению распространения инфекции. С другой стороны, профилактика может быть более всесторонней посредством вакцинации.
Традиционные вакцины в данной области используют неактивные/мертвые бактерии в качестве соответствующего действующего вещества. Тем не менее цена традиционной вакцины весьма высока, поскольку Mycoplasma spp. является прихотливой бактерией и трудно культивируемой в лаборатории. Для того чтобы снизить стоимость вакцины Mycoplasma spp., ученые пытаются постоянно разрабатывать вакцины различных типов, такие как: (1) аттенуированные вакцины, (2) векторные вакцины, (3) субъединичные вакцины, и (4) ДНК-вакцины. Среди них субъединичные вакцины показывают наибольший потенциал ввиду преимуществ простоты в производстве и высокой безопасности.
На сегодняшний день существует несколько возможных белков-кандидатов, которые могут быть применены для вакцин M. hyopneumoniae; однако, не существует дальнейшей информации, устанавливающей белки, пригодные для вакцин M. hyopneumoniae.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В свете вышеизложенного, одной из задач по настоящему изобретению является создание антигенов, пригодных для применения в вакцинах, содержащих Mycoplasma spp. и, как следствие, производства новых вакцин Mycoplasma spp., благодаря чему стоимость профилактики может быть снижена.
Другой задачей по настоящему изобретению является создание комбинации антигенов, которые пригодны для использования в вакцинах Mycoplasma spp. и как следствие, создания субъединичных вакцин с лучшей активностью; в связи с чем, существовало бы больше возможностей для профилактических задач.
Для достижения вышеуказанных целей настоящее изобретение предлагает белок для предупреждения инфекции Mycoplasma spp., в состав которого входит аминокислотная последовательность SEQ ID NO: 01, SEQ ID NO: 02 или их комбинация.
В настоящем изобретении также предложена композиция для предупреждения инфекции Mycoplasma spp., включающая: первое действующее вещество, содержащее белок Р46, Tuf, или их комбинацию; и фармацевтически приемлемый адъювант.
Предпочтительно, что указанное первое действующее вещество имеет аминокислотную последовательность из SEQ ID NO: 01, SEQ ID NO: 02 или их комбинацию.
Предпочтительно, что указанная композиция дополнительно содержит второе действующее вещество, в состав которого входит белок MHP30, NrdFC, или их комбинация.
Предпочтительно, что указанное второе действующее вещество имеет аминокислотную последовательность SEQ ID NO: 03, SEQ ID NO: 04 или их комбинацию.
Предпочтительно, что указанное первое действующее вещество и/или указанное второе действующее вещество представлено независимо от концентрации в количестве от 20 до 2000 мкг/мл исходя из общего объема указанной композиции.
В настоящем изобретении дополнительно предложена композиция для предупреждения инфекции Mycoplasma spp., включающая: действующее вещество, имеющее, как минимум, два белка, выбранных из группы, состоящей из P46, Tuf, MHP30 и NrdFC; и фармацевтически приемлемый адъювант.
Предпочтительно, что указанным действующим веществом является P46, Tuf, MHP30 и NrdFC.
Предпочтительно, что указанное действующее вещество содержит, как минимум, две аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 01, SEQ ID NO: 02, SEQ ID NO: 03 и SEQ ID NO: 04.
Предпочтительно, что указанное действующее вещество содержит аминокислотные последовательности из SEQ ID NO: 01, SEQ ID NO: 02, SEQ ID NO: 03 и SEQ ID NO: 04.
Предпочтительно, что указанное действующее вещество представлено в концентрации от 20 до 2000 мкг/мл исходя из общего объема указанной композиции.
Предпочтительно, что указанный фармацевтически приемлемый адъювант представлен полным адъювантом Фрейнда, неполным адъювантом Фрейнда, гелем оксида алюминия, поверхностно-активным веществом, адъювантом полианионной природы, пептидом, масляной эмульсией, или их комбинацией.
Предпочтительно, что указанная композиция дополнительно содержит фармацевтически приемлемую добавку.
Предпочтительно, что указанная фармацевтически приемлемая добавка представлена растворителем, стабилизатором, разбавителем, консервантом, антибактериальным средством, противогрибковым средством, изотоническим агентом, средством, замедляющим абсорбцию, или их комбинацией.
В настоящем изобретении также предложен экспрессирующий вектор для получения вышеуказанного действующего вещества; где указанный экспрессирующий вектор содержит плазмиду; где указанная плазмида содержит: нуклеотидную последовательность, включающую, как минимум, одну последовательность, выбранную из группы, состоящей из SEQ ID NO: 05, SEQ ID NO: 06, SEQ ID NO: 07 и SEQ ID NO: 08; ген, кодирующий слитые последовательности, выбранный из группы, состоящей из гена MsyB E.coli, YjgD E.coli, GroS17 E.coli, GroES Bacillus subtilis, TrxA Alicyclobacillus acidocaldarius, SUMO S.cerevisiae и Vgb Vitreoscilla spp.; и регуляторный элемент.
Предпочтительно, что указанный регуляторный элемент содержит промотор и сайт связывания рибосом.
Предпочтительно, что указанная плазмида является pET-MSY, pET-YjgD, pET-GroS17, pET-GroES, pET-TrxA, pET-SUMO или pET-Vgb.
Предпочтительно, относительно указанного экспрессирующего вектора, при условии, что указанной нуклеотидной последовательностью является, как минимум, одна последовательность, выбранная из группы, состоящей из SEQ ID NO: 05, SEQ ID NO: 06 и SEQ ID NO: 08, указанным геном, кодирующим слитые последовательности, является MsyB E.coli.
Предпочтительно, относительно указанного экспрессирующего вектора, при условии, что указанная нуклеотидная последовательность является SEQ ID NO: 07, указанный ген, кодирующий слитую последовательность, выбран из группы, состоящей из YjgD E.coli, GroS17 E.coli, GroES Bacillus subtilis, TrxA Alicyclobacillus acidocaldarius, SUMO S.cerevisiae и Vgb Vitreoscilla spp.
Предпочтительно, что указанный экспрессирующий вектор заявлен для применения в системе экспрессии генов в клетках E.coli.
Настоящее изобретение дополнительно относится к способу получения растворимого антигена, включая применение вышеуказанного экспрессирующего вектора; где указанным антигеном является P46, Tuf, MHP30 или NrdFC.
Подводя итог сказанному, настоящее изобретение относится к антигенам, композиции и экспрессирующему вектору для получения указанного антигена с целью предупреждения инфекции Mycoplasma spp. Настоящее раскрытие сущности изобретения не только предлагает новые возможности для профилактических задач, но и доказывает, что «смесь» субъединичной вакцины из комбинации, как минимум, двух антигенов (иными словами, имеющей, как минимум, два антигена в качестве действующих веществ) способна стимулировать индукцию иммунного ответа. Кроме того, настоящее изобретение указывает несколько слитых последовательностей, которые являются, в частности, подходящими для участия в экспрессии вышеуказанных антигенов в системе экспрессии, следовательно, являются выгодными для увеличения производственной мощности создания необходимых вакцин.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 представлен результат белкового электрофореза, демонстрирующий целый ряд слитых последовательностей, которые оказывают различные эффекты на растворимость полученного антигена MHP30. Дорожка М: белковый маркер (PageRuler™ pretained protein ladder; Fermentas, USA); Дорожка 1: E.coli BL21 (DE3) (pET-YjgD-MHP30), растворимый белок; Дорожка 2: E.coli BL21 (DE3) (pET-SUMO-MHP30), растворимый белок; Дорожка 3: E.coli BL21 (DE3) (pET-GroS17-MHP30), растворимый белок; Дорожка 4: E.coli BL21 (DE3) (pET-GroES-MHP30), растворимый белок; Дорожка 5: E.coli BL21 (DE3) (pET-D-MHP30), растворимый белок; Дорожка 6: E.coli BL21 (DE3) (pET-MsyB-MHP30), растворимый белок; Дорожка 7: E.coli BL21 (DE3) (pET-Vgb-MHP30), растворимый белок; Дорожка 8: E.coli BL21 (DE3) (pET-TrxA-MHP30), растворимый белок.
На фигуре 2 представлен результат белкового электрофореза, демонстрирующий целый ряд слитых последовательностей, оказывающих различные эффекты на растворимость полученных антигенов P46, NrdFC и Tuf. Дорожка М: белковый маркер (PageRuler™ pretained protein ladder; Fermentas, USA); Дорожка 1: E.coli BL21 (DE3) (pET-D-P46M), растворимый белок; Дорожка 2: E.coli BL21 (DE3) (pET-D-P46M), нерастворимый белок; Дорожка 3: E.coli BL21 (DE3) (pET-D-NrdFC), растворимый белок; Дорожка 4: E.coli BL21 (DE3) (pET-D-NrdFC), нерастворимый белок; Дорожка 5: E.coli BL21 (DE3) (pET-D-Tuf), растворимый белок; Дорожка 6: E.coli BL21 (DE3) (pET-D-Tuf), нерастворимый белок; Дорожка 7: E.coli BL21 (DE3) (pET-MysB-P46M), растворимый белок; Дорожка 8: E.coli BL21 (DE3) (pET-MysB-P46M), нерастворимый белок; Дорожка 9: E.coli BL21 (DE3) (pET-MysB-NrdFC), растворимый белок; Дорожка 10: E.coli BL21 (DE3) (pET-MysB-NrdFC), нерастворимый белок; Дорожка 11: E.coli BL21 (DE3) (pET-MysB-Tuf), растворимый белок; Дорожка 12: E.coli BL21 (DE3) (pET-MysB-Tuf), нерастворимый белок.
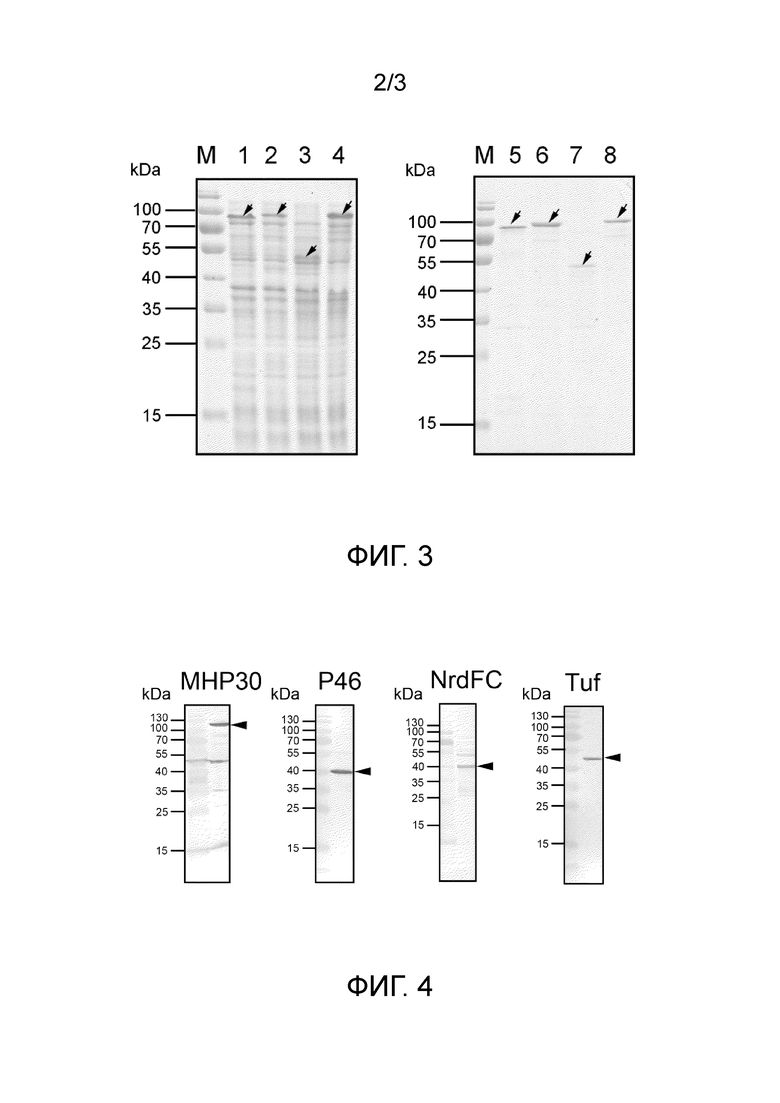
На фигуре 3 представлен результат белкового электрофореза, демонстрирующий очистку рекомбинантных белков по настоящему изобретению MHP30, P46, NrdFC и Tuf. Дорожка M: белковый маркер (PageRuler™ pretained protein ladder; Fermentas, USA); Дорожка 1: E.coli BL21 (DE3) (pET-YjgD-MHP30), растворимый белок; Дорожка 2: E.coli BL21 (DE3) (pET-MysB-P46M), растворимый белок; Дорожка 3: E.coli BL21 (DE3) (pET-MysB-NrdFC), растворимый белок; Дорожка 4: E.coli BL21 (DE3) (pET-MysB-Tuf), растворимый белок; Дорожка 5: очищенный рекомбинантный белок MHP30; Дорожка 6: очищенный рекомбинантный белок P46; Дорожка 7: очищенный рекомбинантный белок NrdFC; Дорожка 8: очищенный рекомбинантный белок Tuf.
На фигуре 4 представлен результат вестерн-блоттинга, демонстрирующий, что посредством антисыворотки мыши обнаружены все антигены клеточного лизата М. hyopneumoniae.
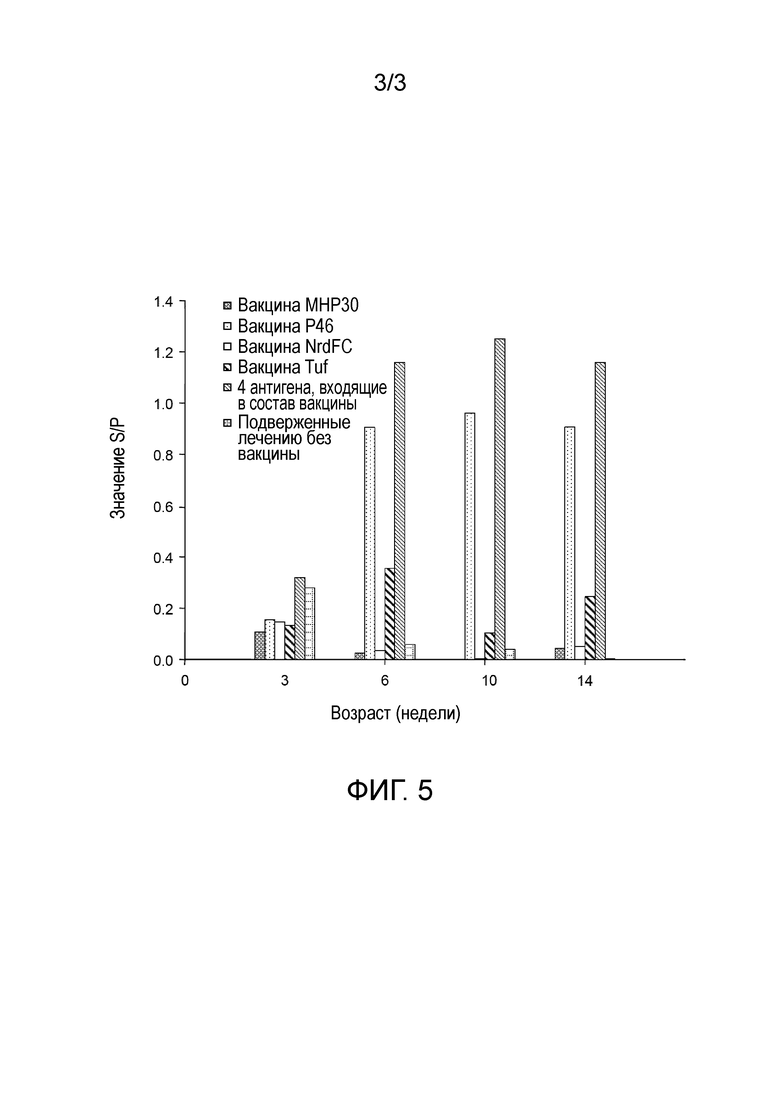
На фигуре 5 представлен результат ИФА метода, на котором показаны результаты экспериментов иммунной стимуляции, проведенных в варианте 7 осуществления настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к антигенам, композиции и экспрессирующему вектору для получения указанного антигена с целью предупреждения инфекции Mycoplasma spp. В частности, настоящее изобретение доказывает антигенный эффект P46 и Tuf для получения композиции с целью предупреждения инфекции Mycoplasma spp. Кроме того, настоящее изобретение также доказывает, что «смесь» субъединичной вакцины из комбинации, как минимум, двух антигенов из P46, Tuf, MHP30 и NrdFC в качестве действующих веществ, способна стимулировать индукцию иммунного ответа. С другой стороны, настоящее изобретение раскрывает слитые последовательности, которые, в частности, являются пригодными для получения высокорастворимых антигенов Р46, Tuf, MHP30 и NrdFC (т.е. водорастворимых). Посредством применения вышеуказанных слитых последовательностей, временной интервал и затраты, необходимые для получения вакцин, могут быть значительно снижены.
В одном из аспектов настоящего изобретения, настоящее изобретение предлагает композицию для предупреждения инфекции Mycoplasma spp., включающую: первое действующее вещество, в состав которого входит белок Р46, Tuf или их комбинация; и фармацевтически приемлемый адъювант. В альтернативном варианте осуществления изобретения, указанная композиция может дополнительно содержать второе действующее вещество. В состав указанного второго действующего вещества входит белок MHP30, NrdFC или их комбинация.
В другом аспекте настоящего изобретения, настоящее изобретение предлагает композицию для предупреждения инфекции Mycoplasma spp., включающую: действующее вещество, в состав которого входят, как минимум, два белка, выбранных из группы, состоящей из P46, Tuf MHP30 и NrdFC; и фармацевтически приемлемый адъювант.
В альтернативном варианте осуществления настоящего изобретения, указанный белок Р46 соответствует аминокислотной последовательности, представленной как SEQ ID NO: 01; указанный белок Tuf соответствует аминокислотной последовательности, представленной как SEQ ID NO: 02; указанный белок MHP30 соответствует аминокислотной последовательности, представленной как SEQ ID NO: 03; указанный белок NrdFC соответствует аминокислотной последовательности, представленной как SEQ ID NO: 04. Средние специалисты в данной области техники могут без труда понять, что поскольку антигенная детерминанта, образованная сворачиванием пептида указанной аминокислотной последовательности, не является интерферирующей, указанное действующее вещество может являться слитым белком с, как минимум, двумя указанными последовательностями.
Как правило, комбинация двух или более антигенов в одной вакцине не всегда подходит для индукции иммунного ответа на вакцину. В действительности, комбинация двух или более антигенов в одной вакцине может вызвать нежелательную ситуацию, в которой индукция иммунного ответа на два или более антигена вступает в конфликт друг с другом, и тем самым снижается. Кроме того, с позиции стоимости, даже если нет конфликта друг с другом, в случае, когда индукция иммунного ответа на два или более антигена не обнаруживает синергического действия, было бы бесполезным объединение двух или более антигенов в одной вакцине. Исследования по настоящему изобретению доказали, что P46, Tuf, MHP30 и NrdFC показывают повышенную индукцию иммунного ответа несмотря на то, что используются в комбинации. Вследствие этого в альтернативном варианте осуществления, указанное действующее вещество композиции по настоящему изобретению содержит любые два или более из вышеуказанных белков; иными словами смешанную вакцину по настоящему изобретению.
Концентрация указанного действующего вещества(в) в композиции по настоящему изобретению составляет от 20 до 2000 мкг/мл исходя из общего объема указанной композиции. В предпочтительном варианте осуществления настоящего изобретения, одно действующее вещество в композиции по настоящему изобретению содержится в концентрации от 20 до 500 мкг/мл исходя из общего объема указанной композиции. В альтернативном варианте осуществления настоящего изобретения, композиция по настоящему изобретению содержит, как минимум, один из указанных белков в качестве действующего вещества; где общая концентрация указанных действующих веществ составляет от 20 до 1000 мкг/мл, от 20 до 1500 мкг/мл или от 20 до 2000 мкг/мл исходя из общего объема указанной композиции.
Указанный фармацевтически приемлемый адъювант используется для улучшения иммунного эффекта указанного действующего вещества, стабилизируя указанное действующее вещество, и/или повышая безопасность вакцин. Указанный фармацевтически приемлемый адъювант по настоящему изобретению включает, но не ограничивается: полный адъювант Фрейнда, неполный адъювант Фрейнда, гель оксида алюминия, поверхностно-активное вещество, адъювант полианионной природы, пептид, масляную эмульсию или их комбинацию.
Другой аспект настоящего изобретения относится к экспрессирующему вектору. В частности, указанный экспрессирующий вектор используется в системе экспрессии в клетках E.coli. Другими словами, указанный экспрессирующий вектор способен транслировать в пептид аминокислотную последовательность целевого белка, а пептид может сворачиваться, образуя нужное действующее вещество, необходимое для композиции по настоящему изобретению. Тем не менее, основываясь на сущности настоящего изобретения, средние специалисты в данной области техники могут ссылаться на описание настоящего изобретения и осуществить модификацию таким образом, чтобы вместить в разные системы экспрессии, при этом, по-прежнему, входящих в объем настоящего изобретения (например, осуществляя модификацию последовательностей с целью соответствия разной частоте использования кодона).
Другой аспект настоящего изобретения относится к способу получения белка с целью предупреждения инфекции Mycoplasma spp. посредством применения указанного экспрессирующего вектора. Белки, полученные с помощью традиционных экспрессирующих векторов в предметной области, как правило, имеют недостаток, заключающийся в нерастворимости; по этой причине их следует подвергать воздействию и растворять очищенный продукт с помощью мочевины и гуанидин гидрохлорида. Однако подобные способы обработки не только увеличивают производственную себестоимость, но и приводят к денатурации белков, настолько, что иногда становится необходимым повторное сворачивание таких денатурированных белков, с тем чтобы восстановить их антигенную функцию. При этом существует определенная вероятность того, что процесс повторного сворачивания может не сработать как надо, антигенный эффект этих белков может быть снижен. В виду недостатка вышеуказанного традиционного способа получения, способ по настоящему изобретению обладает преимуществом при определении соответствия слитых последовательностей, который, в особенности, подходит для обеспечения превосходной растворимости вышеуказанных белков с целью предупреждения инфекции Mycoplasma spp. Таким образом, производственная себестоимость может быть сэкономлена, способы получения могут быть упрощены, а эффективность полученных белков, являющихся действующими веществами вакцин, может быть увеличена.
В альтернативном варианте осуществления настоящего изобретения, указанный экспрессирующий вектор содержит плазмиду. Указанная плазмида содержит: нуклеотидную последовательность, ген, кодирующий слитую последовательность, и регуляторный элемент. Указанная нуклеотидная последовательность содержит, как минимум, одну последовательность, выбранную из группы, состоящей из SEQ ID NO: 05, SEQ ID NO: 06, SEQ ID NO: 07 и SEQ ID NO: 08, которые, соответственно, представляют собой P46, Tuf, MHP30 и NrdFC.
В альтернативном варианте осуществления, поскольку функционирование системы экспрессии гена не испытывает затруднений, а получение указанной нуклеотидной последовательности и сворачивание полученной в результате этого аминокислотной последовательности не подвергается препятствию, указанная плазмида может содержать две или более указанных нуклеотидных последовательностей.
Указанный ген, кодирующий слитую последовательность, выбран из группы, состоящей из MsyB E.coli, YjgD E.coli, GroS17 E.coli, GroES Bacillus subtilis, TrxA Alicyclobacillus acidocaldarius, SUMO S.cerevisiae и Vgb Vitreoscilla spp.
Указанный регуляторный элемент относится к элементу, необходимому для инициации транскрипции и трансляции в системе экспрессии. Указанный регуляторный элемент должен содержать, как минимум, промотор и сайт связывания рибосом. Предпочтительно, чтобы указанный регуляторный элемент дополнительно включал: оператор, последовательность энхансера или их комбинацию.
Следующие примеры описывают эксперименты и исследования по настоящему изобретению с целью дополнительного объяснения особенностей и преимуществ настоящего изобретения. Следует отметить, что следующие примеры являются иллюстративными и не должны использоваться с целью ограничения объема притязаний по настоящему изобретению.
Пример 1: Культуры штаммов.
Текущие исследования определили семь видов Mycoplasma spp., выделенные от свиней: Mycoplasma hyopneumoniae, Mycoplasma hyorhinis, Mycoplasma hyosynoviae, Mycoplasma flocculare, Mycoplasma hyopharyngis, Mycoplasma sualvi и Mycoplasma bovigenitalium (Gourlay et al., 1978; Blank et al., 1996; Assuncao et al., 2005). Среди них, Mycoplasma hyopneumoniae является основным возбудителем энзоотической пневмонии свиней. Уровень зараженности находится приблизительно в пределах от 25% до 93%. В связи с этим, в исследовании по настоящему изобретению использовали Mycoplasma hyopneumoniae (Mycoplasma hyopneumoniae, PRIT-5) в качестве источника гена антигена. Помимо этого, в настоящем исследовании использовали Escherichia coli JM109 в качестве хозяина для клонирования гена, а Escherichia coli BL21 (DE3) в качестве хозяина для экспрессии белка.
М. hyopneumoniae культивировали с использованием питательной среды Фриза (Friis et al. 1975). Штаммы Escherichia coli (E.coli) культивировали с использованием среды LB (Luria-Bertani). Соответствующее количество антибиотика и/или 1,5% агара для приготовления плотной питательной среды были добавлены при необходимости согласно условиям эксперимента.
Пример 2: Клонирование гена антигена М. hyopneumoniae
Для различных генов антигенов были рассчитаны специфичные праймеры (таблица 1). Геном М. hyopneumoniae был использован в качестве матрицы и амплификацию проводили с использованием вышеуказанных праймеров. Особенности амплификации генов и клонирования описаны в следующих пунктах:
Набор праймеров для амплификации целевых генов
- гены
- GATATAGGATCCGCAAAATTAGACGATAATCTTCAGTATTCA
- MHP30R (SEQ ID NO 10): CAATATGTCGACTTAATTTTTACCTTGTTTTTTAATGATTTCGTC
-
- GATATAGGATCCATGAAAAAAATGCTTAGAAAAAAATTCTTG
- P46R (SEQ ID NO 12):
- CAATATGTCGACTTAGGCATCAGGATTATCAACATTAGC
-
- GATATAGGATCCGATCTATTATATAAACTAATTGAATTAGAAAAAGATTATC
- NrdCR(SEQ ID NO 14):
- CAATATGTCGACTTAAAACTCCCAATCTTCATCTTCG
-
- GATATAGGATCCATGGCAGTTGTTAAAACGACAGGAAAA
- TufR (SEQ ID NO 16):
- CAATATGTCGACTTATTTAATAATTTCGGTAACTGTTCCGGCA
-
1. Выделение генома M. hyopneumoniae
Выделение генома M. hyopneumoniae проводили с использованием набора для очистки ДНК (Tissue Cell Genomic DNA Purification kit; GeneMark, Taiwan). Первым этапом, в пробирках центрифугировали 4,5 мл бульона (при 5,870×g, в течение 5 мин), чтобы удалить супернатант и собрать осадок. Затем были добавлены 20 мкл протеиназы K (10 мг/мл) и 200 мкл реагента для выделения в реакцию при 56°C на 3 часа. Осадок и вышеуказанные реагенты смешивали переворачиванием вверх дном или, встряхивая пробирки каждые 5 минут в течение данного периода, чтобы убедиться в том, что они хорошо перемешаны.
После реакции с реагентом для выделения, полученный раствор становился прозрачным, поскольку осадок полностью расщеплялся. Затем реагент для связывания в количестве 200 мкл добавляли в реакцию при 70°C на 10 минут. После этого 200 мкл абсолютного спирта добавляли в пробирку и перемешивали. Все содержимое пробирки наносили на колонку для очистки и помещали колонку в пробирку для элюции. После центрифугирования (при 17,970×g) в течение 2 минут, элюат удаляли и в колонку для очистки добавляли 700 мкл промывочного раствора. После очередного центрифугирования (при 17,970×g) в течение 2 минут, элюат удаляли и повторяли вышеописанную процедуру. По окончании, пробирку центрифугировали (при 17,970×g) в течение 5 минут для удаления остатков этанола. Затем колонку для очистки помещали в стерильную пробирку и добавляли соответствующее количество стерильной воды для элюции ДНК.
Концентрацию очищенной геномной ДНК M.hyopneumoniae определяли с использованием набора Quant-iT™ dsDNA High-Sensitivity Assay Kit (Invitrogen, Madison, USA) и флуориметра Qubit Fluorometer (Invitrogen, Madison, USA). Проведение эксперимента заключалось в следующем: смешивали Quant-iT reagent и Quant-iT buffer в соотношении 1:200 для получения рабочего раствора. Рабочий раствор в количестве 190 мкл и 10 мкл стандартного образца смешивали и оставляли на 2 минуты при комнатной температуре. Далее была построена стандартная кривая. После этого смешивали 2 мкл образца и 198 мкл рабочего раствора, оставляли на 2 минуты и определяли концентрацию геномной ДНК с помощью Qubit Fluorometer. Формулой расчета концентрации (нг/мкл) послужило измеренное значение ×100.
2. Амплификация целевых генов с помощью полимеразной цепной реакции (ПЦР)
Геномная ДНК М. hyopneumoniae была использована в качестве матрицы, и праймеры, рассчитанные для генов P46, Tuf, MHP30 и NrdFC использовали, соответственно, для реакции ПЦР. Каждый используемый праймер и условия для проведения реакции ПЦР показаны в следующей таблице 2 (последовательности праймеров приведены выше в таблице 1). ПЦР-смесь в количестве 50 мкл содержала 1×GDP-HiFi ПЦР-буфер B, 200 мкМ смесь нуклеотидов дАТФ, дТТФ, дГТФ и дЦТФ, 1 мкМ праймер для амплификации, 200 нг геномной ДНК М. hyopneumoniae и 1 ед. GDP-HiFi ДНК полимеразы. После реакции ПЦР проводили электрофорез в геле для того, чтобы подтвердить наличие фрагментов амплифицированной ДНК нужного размера.
Условия реакции ПЦР и набор праймеров
- MHP30R
- P46R
- NrdCR
- TufR
3. Сбор и клонирование ПЦР-продукта
Сбор ПЦР-продуктов проводили с использованием набора PCR-M™ Clean Up system kit (GeneMark, Taiwan; эксперименты проводили, следуя руководству по эксплуатации, и не повторяли в настоящем изобретении). Далее осуществляли клонирование с помощью набора CloneJET PCR Cloning Kit. Эксперименты по клонированию проводили в соответствии с руководством по эксплуатации, которые кратко описали следующим образом. Первым этапом, собранный ПЦР-продукт смешивали с реагентами и ДНК-лигазой из набора для проведения реакции лигирования при 22°С в течение 30 минут. Лигированную смесь затем трансформировали в штамм ECOSTM 9-5 E.coli (Yeastern, Taiwan). На условия трансформации сделана ссылка в руководстве. Трансформированные бактерии переносили в 1 мл среды для восстановления SOC и культивировали при 37°С со встряхиванием на шейкере при 250 об/мин. Соответствующее количество бульона высевали на планшеты с плотной средой LB с ампициллином (100 мкг/мл) и планшеты культивировали при 37°С в течение 16 часов. После этого проводили метод молекулярных колоний (ПЦР в геле) для скрининга штаммов, которые успешно трансформировались. ПЦР в геле проводили в соответствии с нижеуказанными стадиями. Прежде всего, подготавливали пробирку, содержащую ПЦР-смесь из 50 мкл 2×Taq PCR MasterMix (Genomics, Taiwan), 0,5 мкл прямого праймера для амплификации целевого гена, 0,5 мкл обратного праймера для амплификации целевого гена и 49 мкл стерильной воды. После перемешивания ПЦР-смесь распределяли на несколько пробирок для проведения ПЦР (10 мкл/на пробирку). Колонии на вышеуказанных планшетах были отобраны случайным образом в пробирки для ПЦР, соответственно реакции ПЦР. Условия для проведения реакции ПЦР: 95°С в течение 5 минут (один цикл); 95°С в течение 30 секунд, 55°С в течение 30 секунд, 72°С в течение Х минут (25 циклов); 72°С в течение 7 минут (один цикл); где «Х» зависел от времени, необходимого для удлинения ДНК-полимеразы, и был установлен в соответствии с размером фрагмента, подлежащего амплификации. Скорость удлинения Taq ДНК-полимеразы составляет 1 кб/мин; в связи с чем, если фрагмент, подлежащий амплификации, имеет размер приблизительно 1 кб, то «X» установят на 1 мин. После реакции амплификации проводили электрофорез в геле для подтверждения результатов ПЦР. Те штаммы, для которых трансформация прошла успешно, имели вставку ДНК в своих рекомбинантных плазмидах, из плазмид была выделена ДНК для секвенирования. Плазмиды, содержащие гены MHP30, P46, NrdFC и Tuf, были соответственно названы, как pJET-MHP30, pJET-P46, pJET-NrdFC и pJET-Tuf.
Результаты секвенирования ДНК показали, что клонированный ген Р46 по настоящему изобретению содержит аминокислотную последовательность SEQ ID NO: 01 и нуклеотидную последовательность SEQ ID NO: 05, соответственно. Ген Tuf содержит аминокислотную последовательность SEQ ID NO: 02 и нуклеотидную последовательность SEQ ID NO: 06, соответственно. Ген MHP30 содержит аминокислотную последовательность SEQ ID NO: 03 и нуклеотидную последовательность SEQ ID NO 07, соответственно. Ген NrdFC содержит аминокислотную последовательность SEQ ID NO 04 и нуклеотидную последовательность SEQ ID NO 08, соответственно.
Пример 3: Точковая мутация и клонирование гена P46.
Ген P46 содержит три кодона TGA. Кодон TGA был транслирован как триптофан в Mycoplasma spp., а как стоп-кодон в E.coli. Для того чтобы исключить недостаток при использовании системы экспрессии в клетках E.coli, для получения целого целевого белка, необходимо было сделать точковую мутацию в кодоне TGA гена p46, чтобы заменить его на TGG, который транслируется E.coli, как триптофан.
Основой конструирования праймеров с мутацией для точковой мутации является точковая мутация, которая должна быть расположена в центральной части праймера и температура праймеров должна быть выше 78°С. Температуру праймеров Tm можно рассчитать по формуле, приведенной в Invitrogene: Tm=81,5+0,41(%GC) - 675/N - % ошибочных спариваний оснований. Где «%GC» обозначает процент оснований G и C соответствующего праймера; «N» обозначает длину соответствующего праймера; «%ошибочных спариваний оснований» обозначает процент измененного основания соответствующего праймера. Праймеры, используемые для точковой мутации гена P46, перечислены в следующей таблице 3, в том числе P46F/P46M2, P46M1/P46M4, P46M3/P46M6 и P46M5/P46R.
Праймеры, используемые для точковой мутации гена P46
- GATATAGGATCCATGAAAAAAATGCTTAGAAAAAAATTCTTG
- CTCTTTGGGCACTAATCCATCGAGGATTATCCGG
- CCGGATAATCCTCGATGGATTAGTGCCCAAAGAG
- ATTAGCTTGCTGAGTGAGCCAGTTATTTTGTGCATCC
- GGATGCACAAAATAACTGGCTCACTCAGCAAGCTAAT
- CGGCAGTTCCATAATTCCATCCTGGGACATAAAC
- GTTTATGTCCCAGGATGGAATTATGGAACTGCCG
- CAATATGTCGACTTAGGCATCAGGATTATCAACATTAGC
ПЦР-смесь в количестве 50 мкл содержала 1×GDP-HiFi ПЦР-буфер B, 200 мкМ смеси нуклеотидов дАТФ, дТТФ, дГТФ и дЦТФ, 1 мкМ праймера для амплификации, 100 нг pJET-P46 и 1 ед. GDP-HiFi ДНК-полимеразы. Условия для проведения реакции ПЦР: 98°С в течение 2-х минут (один цикл); 94°С в течение 30 секунд, 55°С в течение 30 секунд, 68°С в течение 45 секунд (35 циклов); 68°С в течение 5 минут (один цикл). После реакции ПЦР провели электрофорез в геле для подтверждения наличия фрагмента амплифицированной ДНК ожидаемого размера.
Продукты ПЦР собирали с использованием набора для экстракции из геля Gel-MTM gel extraction system kit и эксперименты проводили в соответствии с инструкцией производителя. Затем четыре собранных ПЦР-продукта были использованы в качестве матриц для амплификации генов с набором праймеров P46F/P46R. Условия для проведения реакции ПЦР были следующими: 98°С в течение 2-х минут (один цикл); 94°С в течение 30 секунд, 55°С в течение 30 секунд, 68°С в течение 45 секунд (35 циклов); 68°С в течение 5 минут (один цикл). После этого был получен полноразмерный ген Р46 с точковой мутацией. ПЦР-продукты были собраны с использованием набора PCR-M™ Clean Up System Kit (GeneMark, Taiwan). А клонирование мутантного гена осуществляли с помощью CloneJET PCR Cloning Kit. Те штаммы, для которых трансформация успешно подтвердилась посредством ПЦР-скрининга колоний, содержали в своих рекомбинантных плазмидах вставку ДНК, из плазмид была выделена ДНК для секвенирования. Плазмиду, содержащую мутантный ген Р46, назвали pJET-P46M.
Пример 4: Разработка вектора, экспрессирующего антиген М. hyopneumoniae по настоящему изобретению.
Плазмиды, содержащие различные слитые последовательности, использовали в качестве остова для разработки вектора, экспрессирующего антиген M. hyopneumoniae. Слитыми последовательностями используемых генов были MsyB E.coli, YjgD E.coli, частичный пептид Gros, содержащий 17 аминокислот (GroS17) E.coli, GroES Bacillus subtilis, TrxA Alicyclobacillus acidocaldarius, SUMO S.cerevisiae, белок D бактериофага phiX174 и Vgb Vitreoscilla spp. Разработка осуществлялась следующим образом:
1. Создание вектора, экспрессирующего MHP30.
Рестрикция pJET-MHP30 ферментами BamHI и SalI и полученный в результате фрагмент ДНК лигировали в слитую экспрессирующую плазмиду, предварительно разрезанную теми же ферментами рестрикции. Продукт лигирования трансформировали в E.coli ECOS 9-5. Трансформированные штаммы подвергали скринингу с помощью ПЦР в геле и подтверждали, в случае если обнаруживались фрагменты ДНК ожидаемого размера с помощью электрофореза ДНК. Те штаммы, для которых трансформация успешно подтвердилась, содержали в своих рекомбинантных плазмидах вставку ДНК, из плазмид выделяли ДНК для секвенирования. Плазмиды, содержащие соответствующую последовательность ДНК, были названы, соответственно, pET-MSY-MHP30, pET-YjgD-MHP30, pET-GroS17-MHP30, pET-GroES-MHP30, pET-TrxA-MHP30, pET-SUMO-MHP30, pET-D-MHP30 и pET-Vgb-MHP30.
2. Создание вектора, экспрессирующего P46.
Рестрикция pJET-P46M ферментами BamHI и SalI и нижеследующие эксперименты проводили посредством ссылки на вышеуказанные стадии создания вектора, экспрессирующего MHP30. Плазмиды, содержащие соответствующую последовательность ДНК, были названы pET-D-P46M и pET-MSY-P46M, соответственно.
3. Создание вектора, экспрессирующего NrdFC.
Рестрикция pJET-NrdFC ферментами BamHI и SalI и нижеследующие эксперименты проводили посредством ссылки на вышеуказанные стадии создания вектора, экспрессирующего MHP30. Плазмиды, содержащие соответствующую последовательность ДНК, были названы pET-D-NrdFC и pET-MSY-NrdFC, соответственно.
4. Создание вектора, экспрессирующего Tuf.
Рестрикция pJET-Tuf ферментами BamHI и SalI и нижеследующие эксперименты проводили посредством ссылки на вышеуказанные стадии создания вектора, экспрессирующего MHP30. Плазмиды, содержащие соответствующую последовательность ДНК, были названы pET-D-Tuf и pET-MSY-Tuf, соответственно.
Пример 5: Экспрессия и очистка рекомбинантных антигенов М.hyopneumoniae.
Относительно экспрессии целевых антигенов
Векторы, экспрессирующие антиген, трансформировали в Е.coli BL21 (DE3). Отбирали всего одну колонию и делали посев на среде LB, содержащей канамицин в конечной концентрации 30 мкг/мл, и культивировали при 37°С и 180 об/мин в течение ночи. Затем бульон высевали на свежую среду LB (содержащую канамицин в конечной концентрации 30 мкг/мл) в соотношении 1:100 и культивировали при 37°С и 180 об/мин до тех пор, пока его значение оптической плотности OD600 не достигало приблизительно 0,6~0,8. В количестве 0,1 мМ добавляли IPTG для индукции экспрессии целевого белка на 4 часа. Далее бульон центрифугировали (при 10000×g, в течение 10 мин, при 4°С) и собирали осадок. После этого разделяли его растворимую и нерастворимую части с помощью набора Easy-Lyse Bacterial Protein Extraction kit (Epicentre, USA). Затем проводили белковый электрофорез, чтобы определить растворимость полученных рекомбинантных антигенов.
На фигурах 1 и 2, соответственно, показана различная растворимость MHP30 в результате использования ряда слитых последовательностей в экспрессии; и различной растворимости P46, NrdFC и Tuf в результате использования ряда слитых последовательностей в экспрессии. Результаты показали, что применение YjgD, SUMO, GroS17, GroES, Vgb или TrxA в качестве слитой последовательности может повысить растворимость MHP30. С другой стороны, использование MsyB в качестве слитой последовательности может обеспечить P46, NrdFC и Tuf превосходную растворимость.
Относительно очистки целевых антигенов
Беря за преимущество тот факт, что NʹHig полигистидиновый тег рекомбинантного белка может образовывать координационно-ковалентную связь с ионом никеля или кобальта, была использована металл-аффинная хроматография (IMAC) для очистки белков. Протокол очистки белка рассмотрен в QIA expressionist™ (fourth edition, Qiagen). Осадок суспендировали в лизирующем буфере (50 мМ NaH2PO4, 300 мМ NaCl, 10 мМ имидазола, рН 8,0) и гомогенизировали. Затем центрифугировали и собирали супернатант. Собранный супернатант наносили на колонку со смолой (1 мл Ni-NTA), куда садился рекомбинантный антиген. После этого добавляли 15 мл промывочного буфера (50 мМ NaH2PO4, 300 мМ NaCl, 20 мМ имидазол, рН 8,0) с целью промывки смолы внутри колонки для удаления неспецифически связанных белков. В заключение, наносили 20 мл буфера для элюции (50 мМ NaH2PO4, 300 мМ NaCl, 250 мМ имидазола, рН 8,0), чтобы элюировать антигены на смоле. Буфер для элюции содержал высококонцентрированный имидазол, чтобы конкурировать с рекомбинантными белками за сайт связывания на смоле, таким образом, чтобы рекомбинантные белки могли быть смыты со смолы. Результат очистки проверяли с помощью белкового электрофореза. В соответствии с фигурой 3, на которой четко показано, что меченные гистидиновым остатком His-tag рекомбинантные антигены по настоящему изобретению, в действительности, являлись хорошо очищенными с помощью IMAC рекомбинантными антигенами по настоящему изобретению.
Пример 6: Апробация мышиной антисыворотки.
Для данного примера использовали 5-недельных самок мышей линии BALB/с (National Laboratory Animal Center). Мышей содержали в стандартной комнате для животных с кондиционированием воздуха, предлагаемой пищей и чистой водой. Стимуляция антигеном проводилась после того, как мыши подрастали до 7 дней. Рекомбинантные антигены, очищенные по вышеуказанным примерам, смешивали с адъювантом в виде смеси (полный адъювант Фрейнда или неполный адъювант Фрейнда) через трехходовой соединитель и вводили мышам подкожно. Первая инъекция представляла собой препарат полного адъюванта Фрейнда. Через 7 дней после первой инъекции мышам вводили препарат неполного адъюванта Фрейнда дважды на протяжении 7 дней. Через 7 дней после второй инъекции собирали кровь из глазной орбиты мышей.
Собранные образцы крови держали при комнатной температуре в течение 1 часа и затем помещали в холодильную камеру при 4°С на ночь, чтобы кровь смогла свернуться. Далее, образцы центрифугировали (5000×g) в течение 30 мин, чтобы получить антисыворотку, которая содержала специфические антитела против рекомбинантного антигена.
Полученную антисыворотку затем использовали против всех антигенов клеточного лизата М. hyopneumoniae. Протокол эксперимента состоял в следующем: суспендирование М. hyopneumoniae PRIT-5 в SET buffer (50 мМ глюкоза, 25 мМ-HCl, 10 mM ЭДТА, pH 8,0) и добавление 5× буфера для образца (312,5 мМ Tris-HCl (рН 6,8), 50% глицерин, 10% SDS, 0,05% бромфеноловый синий); нагревание образца при 100°С в течение 5 минут, после чего образец хорошо перемешивали с вышеуказанным буфером. Затем проводили белковый электрофорез. Гель после белкового электрофореза погружали в буфер для переноса (25 мМ Трис-основание, 192 мМ глицин, 10% (об/%) метанол, рН 8,3). Мембрану PVDF соответствующего размера промывали в течение нескольких секунд метанолом, промывали деионизированной водой, а затем погружали в буфер для переноса. После чего гель и мембрану PVDF погружали в буфер для переноса на 15 минут, фильтровальную бумагу, гель, мембрану PVDF и другую фильтровальную бумагу последовательно помещали в аппарат Trans-Blot SD Semi-Dry Transfer Cell для полусухого переноса под соответствующий источник электропитания. После того, как перенос был осуществлен, мембрану PVDF погружали в блокирующий буфер в количестве 20 мл (20 мМ Трис, 150 мМ NaCl, 5% обезжиренное молоко, рН 7,4) при комнатной температуре на 1 час и добавляли 10 мкл рекомбинантного антигена (в 2000× разведении). После качания на шейкере при комнатной температуре в течение 1 часа, блокирующий буфер отбирали, а мембрану PVDF промывали три раза (в течение 5 минут каждый раз) 20 мл буфера TBST (20 мМ Трис, 150 мМ NaCl, 0.05% Tween-20, рН 7,4). Затем в смесь добавляли блокирующий буфер в количестве 20 мл и 4 мкл конъюгированного с щелочной фосфатазой антитела козы против IgG мыши (H L) и качали на шейкере при комнатной температуре в течение 1 часа. После чего мембрану PVDF промывали трижды буфером TBST и добавляли субстрат для проявки NBT/BCIP.
Результат показал, что смесь рекомбинантного антигена по настоящему изобретению и соответствующего адъюванта индуцировали у мышей антитела против антигена. Иными словами, белки по настоящему изобретению являлись потенциально иммуногенными (фигура 4).
Пример 7: Тесты для оценки иммунного статуса свиней и провокационные тесты.
1. Приготовление вакцины.
Один или более очищенных рекомбинантных антигенов по вышеуказанным примерам смешивали с адъювантом для получения целевых субъединичных вакцин или смешанных вакцин. Доза каждой приготовленной вакцины составляла 2 мл, в которой содержалось 200 мкг каждого типа добавленных белков по настоящему изобретению.
2. Тесты для оценки иммунного статуса свиней.
Вышеуказанные субъединичные вакцины или смешанные вакцины использовали для оценки иммунного статуса свиней. Домашние свиньи SPF 2-х недельного возраста были приобретены от второго поколения домашних свиней SPF в Animal Technology Institute Taiwan. Все свиньи содержались и кормились в равной мере в SPF свинарнике.
Вакцины (2 мл) вводили свиньям внутримышечно по достижению ими 21-дневного возраста и собирали у них кровь на 21, 42, 70, и 98 день для выделения сыворотки. Для проверки антител в собранной сыворотке крови использовали Mycoplasma spp. antibody trials (IDEXX) kit. Эксперимент проводили по следующей схеме. Вначале, 10 мкл сыворотки крови осторожно смешивали с 390 мкл раствора для разбавления образца, чтобы получить смесь. Смесь в объеме 100 мкл добавляли в лунки 96-луночного планшета, который уже содержал внутри антиген Mycoplasma spp. Помимо этого 100 мкл положительной и отрицательной сыворотки добавляли в различные лунки планшета в качестве контроля. Планшет оставляли при комнатной температуре на 30 минут. Затем жидкость из планшета отбирали и добавляли 350 мкл промывочного буфера для трехкратной промывки. Анти-свинные антитела, меченые пероксидазой хрена, в количестве 350 мкл, добавляли затем в планшет, который оставляли при комнатной температуре в течение 30 минут. После чего жидкость из планшета удаляли и добавляли 350 мкл промывочного буфера для трехкратной промывки. Раствор субстрата ТМВ в количестве 100 мкл добавляли в планшет и оставляли при комнатной температуре на 15 минут. Затем добавляли 100 мкл останавливающего буфера для окончания цветной реакции. В заключении, оценивали оптическую плотность каждой лунки при 650 нм с помощью планшетного ИФА-ридера для расчета соотношения S/P. Значение S/P=(OD650 поглощение исследуемой группы - OD650 поглощение отрицательной контрольной группы)/(OD650 поглощение положительной контрольной группы - OD650 поглощение отрицательной контрольной группы). Чем выше значение S/P, тем больше антител против белков М. hyopneumoniae. Результаты эксперимента показали, что антигены по настоящему изобретению способны вызвать индукцию иммунного ответа; где вакцина Р46 и смешанная вакцина (содержащая четыре антигена в одной вакцине: P46, Tuf, MHP30 и NrdFC), показавшая соответствующий индуктивный эффект и индуцированный иммунный ответ, может сохраняться до 14-недельного возраста (фигура 5).
3. Проведение провокационных тестов у свиней.
Вакцину MH-PRIT-5 Bayovac®, полученную с использованием М. hyopneumoniae PRIT-5, использовали в данном эксперименте в качестве контроля для оценки иммунной эффективности субъединичной вакцины и смешанной вакцины по настоящему изобретению. Свиньи SPF 4-х недельного возраста были приобретены от второго поколения свиней SPF свинарника Animal Technology Institute Taiwan. Все свиньи содержались и кормились в равной мере в SPF свинарнике.
Бактериальный бульон M. hyopneumoniae, используемый для провокационных тестов, был приготовлен следующим образом: ткань легкого свиньи (приблизительно 3×3 см2), инфицированную М. hyopneumoniae, собирали и измельчали в 20 мл питательной среды Фриза. После центрифугирования (при 148,8×g) в течение 10 минут, супернатант переносили в чистую пробирку и центрифугировали (при 7,870×g) еще в течение 40 минут. Затем супернатант отбирали и осадок повторно суспендировали в 6 мл питательной среды Фриза для получения суспензии. После этого суспензию последовательно фильтровали при помощи 5 мкм и 0,45 мкм фильтров, чтобы получить провокационную пробу бактериального бульона, необходимую для данного эксперимента.
Вакцины (2 мл) вводили свиньям внутримышечно, по достижению ими 35-дневного возраста. Другую инъекцию осуществляли в 49-дневном возрасте подобным образом. На 63-дневный возраст иммунизированным свиньям давали наркоз и осуществляли провокационный тест путем введения провокационной пробы бактериального бульона (в количестве 5мл) через трахею.
По истечении 28 дней со дня стимуляции антигеном, свиней подвергали скарификации и собирали их легкие для оценки эффекта иммунизации. Оценку эффекта иммунизации проводили в соответствии со следующими параметрами: любую из верхних средних долей и верхние доли любой части легкого с наблюдаемым патологическим признаком оценивали как 10 баллов; любую из верхней средней доли и диафрагмальные доли любой части легкого с наблюдаемым патологическим признаком оценивали как 5 баллов. Общий балл составил 55 баллов. Записи с результатами наблюдений приведены в таблице 4.
Оценка патологического изменения легкого при проведении провокационных тестов
В соответствии с данными, приведенными в таблице 4, очевидно, что субъединичные вакцины по настоящему изобретению способны обеспечить равноценные эффекты иммунизации, также как и традиционная вакцина (Bayovac® MH-PRIT-5). Кроме того, смешанная вакцина (содержащая четыре антигена в одной вакцине: P46, Tuf, MHP30 и NrdFC) обнаружила значительно лучший эффект иммунизации, чем традиционная вакцина. Подводя итог вышесказанному, белки по настоящему изобретению, в действительности, являются пригодными для применения в качестве действующих веществ в составе вакцин, и данные белки проявляют синергическое действие, будучи используемыми в комбинации в виде смешанной вакцины.
Средние специалисты в данной области техники могут без труда понять любые возможные модификации, основанные на раскрытии настоящего изобретения, без исключения сущности настоящего изобретения. Таким образом, приведенные выше примеры не должны быть использованы с целью ограничения настоящего изобретения, а намерены охватить все возможные модификации в пределах сущности и объема настоящего изобретения в соответствии с пунктами формулы изобретения, перечисленными ниже.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ТЕХНОЛОГИЙ
<120> Композиция для профилактики инфекции Mycoplasma spp.,
<130> GPI13TW3599
<160> 22
<170> PatentIn version 3.5
<210> 1
<211> 419
<212> Белок
<213> Mycoplasma hyopneumoniae
<400> 1
Met Lys Lys Met Leu Arg Lys Lys Phe Leu Tyr Ser Ser Ala Ile Tyr
1 5 10 15
Ala Thr Ser Leu Ala Ser Ile Ile Ala Phe Val Ala Ala Gly Cys Gly
20 25 30
Gln Thr Glu Ser Gly Ser Thr Ser Asp Ser Lys Pro Gln Ala Glu Thr
35 40 45
Leu Lys His Lys Val Ser Asn Asp Ser Ile Arg Ile Ala Leu Thr Asp
50 55 60
Pro Asp Asn Pro Arg Trp Ile Ser Ala Gln Arg Asp Ile Ile Ser Tyr
65 70 75 80
Val Asp Glu Thr Glu Ala Ala Thr Ser Thr Ile Thr Lys Asn Gln Asp
85 90 95
Ala Gln Asn Asn Trp Leu Thr Gln Gln Ala Asn Leu Ser Pro Ala Pro
100 105 110
Lys Gly Phe Ile Ile Ala Pro Glu Asn Gly Ser Gly Val Gly Thr Ala
115 120 125
Val Asn Thr Ile Ala Asp Lys Gly Ile Pro Ile Val Ala Tyr Asp Arg
130 135 140
Leu Ile Thr Gly Ser Asp Lys Tyr Asp Trp Tyr Val Ser Phe Asp Asn
145 150 155 160
Glu Lys Val Gly Glu Leu Gln Gly Leu Ser Leu Ala Ala Gly Leu Leu
165 170 175
Gly Lys Glu Asp Gly Ala Phe Asp Ser Ile Asp Gln Met Asn Glu Tyr
180 185 190
Leu Lys Ser His Met Pro Gln Glu Thr Ile Ser Phe Tyr Thr Ile Ala
195 200 205
Gly Ser Gln Asp Asp Asn Asn Ser Gln Tyr Phe Tyr Asn Gly Ala Met
210 215 220
Lys Val Leu Lys Glu Leu Met Lys Asn Ser Gln Asn Lys Ile Ile Asp
225 230 235 240
Leu Ser Pro Glu Gly Glu Asn Ala Val Tyr Val Pro Gly Trp Asn Tyr
245 250 255
Gly Thr Ala Gly Gln Arg Ile Gln Ser Phe Leu Thr Ile Asn Lys Asp
260 265 270
Pro Ala Gly Gly Asn Lys Ile Lys Ala Val Gly Ser Lys Pro Ala Ser
275 280 285
Ile Phe Lys Gly Phe Leu Ala Pro Asn Asp Gly Met Ala Glu Gln Ala
290 295 300
Ile Thr Lys Leu Lys Leu Glu Gly Phe Asp Thr Gln Lys Ile Phe Val
305 310 315 320
Thr Gly Gln Asp Tyr Asn Asp Lys Ala Lys Thr Phe Ile Lys Asp Gly
325 330 335
Asp Gln Asn Met Thr Ile Tyr Lys Pro Asp Lys Val Leu Gly Lys Val
340 345 350
Ala Val Glu Val Leu Arg Val Leu Ile Ala Lys Lys Asn Lys Ala Ser
355 360 365
Arg Ser Glu Val Glu Asn Glu Leu Lys Ala Lys Leu Pro Asn Ile Ser
370 375 380
Phe Lys Tyr Asp Asn Gln Thr Tyr Lys Val Gln Asp Lys Asn Ile Asn
385 390 395 400
Thr Ile Leu Val Ser Pro Val Ile Val Thr Lys Ala Asn Val Asp Asn
405 410 415
Pro Asp Ala
<210> 2
<211> 402
<212> Белок
<213> Mycoplasma hyopneumoniae
<400> 2
Met Ala Val Val Lys Thr Thr Gly Lys Lys Asp Phe Asp Arg Ser Lys
1 5 10 15
Glu His Ile Asn Ile Gly Thr Ile Gly His Val Asp His Gly Lys Thr
20 25 30
Thr Leu Thr Ala Ala Ile Ser Thr Val Leu Ala Lys Arg Gly Leu Ala
35 40 45
Glu Ala Lys Asp Tyr Ala Ser Ile Asp Ala Ala Pro Glu Glu Lys Ala
50 55 60
Arg Gly Ile Thr Ile Asn Thr Ala His Ile Glu Tyr Ser Thr Asp Lys
65 70 75 80
Arg His Tyr Ala His Val Asp Cys Pro Gly His Ala Asp Tyr Ile Lys
85 90 95
Asn Met Ile Thr Gly Ala Ala Gln Met Asp Gly Ala Ile Leu Val Val
100 105 110
Ala Ala Thr Asp Gly Pro Met Pro Gln Thr Arg Glu His Ile Leu Leu
115 120 125
Ser Lys Gln Val Gly Val Pro Lys Met Val Val Phe Leu Asn Lys Ile
130 135 140
Asp Leu Leu Glu Gly Glu Glu Glu Met Val Asp Leu Val Glu Val Glu
145 150 155 160
Ile Arg Glu Leu Leu Ser Ser Tyr Asp Phe Asp Gly Asp Asn Thr Pro
165 170 175
Ile Ile Arg Gly Ser Ala Arg Gly Ala Leu Glu Gly Lys Pro Glu Trp
180 185 190
Glu Ala Lys Val Leu Glu Leu Met Asp Ala Val Asp Ser Tyr Ile Asp
195 200 205
Ser Pro Val Arg Glu Met Asp Lys Pro Phe Leu Met Ala Val Glu Asp
210 215 220
Val Phe Thr Ile Thr Gly Arg Gly Thr Val Ala Thr Gly Lys Val Glu
225 230 235 240
Arg Gly Gln Val Lys Leu Asn Glu Glu Val Glu Ile Val Gly Tyr Arg
245 250 255
Glu Glu Pro Lys Lys Thr Val Ile Thr Gly Ile Glu Met Phe Asn Lys
260 265 270
Asn Leu Gln Thr Ala Met Ala Gly Asp Asn Ala Gly Val Leu Leu Arg
275 280 285
Gly Val Asp Arg Lys Asp Ile Glu Arg Gly Gln Val Ile Ala Lys Pro
290 295 300
Lys Thr Ile Ile Pro His Thr Lys Phe Lys Ala Ala Ile Tyr Ala Leu
305 310 315 320
Lys Lys Glu Glu Gly Gly Arg His Thr Pro Phe Phe Lys Asn Tyr Lys
325 330 335
Pro Gln Phe Tyr Phe Arg Thr Thr Asp Val Thr Gly Gly Ile Glu Phe
340 345 350
Glu Pro Gly Arg Glu Met Val Ile Pro Gly Asp Asn Val Asp Leu Thr
355 360 365
Val Glu Leu Ile Ala Pro Ile Ala Val Glu Gln Gly Thr Lys Phe Ser
370 375 380
Ile Arg Glu Gly Gly Arg Thr Val Gly Ala Gly Thr Val Thr Glu Ile
385 390 395 400
Ile Lys
<210> 3
<211> 282
<212> Белок
<213> Mycoplasma hyopneumoniae
<400> 3
Ala Lys Leu Asp Asp Asn Leu Gln Tyr Ser Phe Glu Ala Ile Lys Lys
1 5 10 15
Gly Glu Thr Thr Lys Glu Gly Lys Arg Glu Glu Val Asp Lys Lys Val
20 25 30
Lys Glu Leu Asp Asn Lys Ile Lys Gly Ile Leu Pro Gln Pro Pro Ala
35 40 45
Ala Lys Pro Glu Ala Ala Lys Pro Val Ala Ala Lys Pro Glu Ala Ala
50 55 60
Lys Pro Val Ala Ala Lys Pro Glu Ala Ala Lys Pro Val Ala Ala Lys
65 70 75 80
Pro Glu Ala Ala Lys Pro Val Ala Ala Lys Pro Glu Ala Ala Lys Pro
85 90 95
Val Ala Ala Lys Pro Glu Ala Ala Lys Pro Val Ala Ala Lys Pro Glu
100 105 110
Ala Ala Lys Pro Val Ala Thr Asn Thr Gly Phe Ser Leu Thr Asn Lys
115 120 125
Pro Lys Glu Asp Tyr Phe Pro Met Ala Phe Ser Tyr Lys Leu Glu Tyr
130 135 140
Thr Asp Glu Asn Lys Leu Ser Pro Lys Thr Pro Glu Ile Asn Val Phe
145 150 155 160
Leu Glu Leu Val His Gln Ser Glu Tyr Glu Glu Gln Lys Ile Ile Lys
165 170 175
Glu Leu Asp Lys Thr Val Leu Asn Leu Gln Tyr Gln Phe Gln Glu Val
180 185 190
Lys Val Ala Ser Asp Gln Tyr Gln Lys Leu Ser His Pro Met Met Thr
195 200 205
Glu Gly Ser Ser Asn Gln Gly Lys Lys Ala Glu Gly Ala Pro Asn Gln
210 215 220
Gly Lys Lys Ala Glu Gly Ala Pro Asn Gln Gly Lys Lys Ala Glu Gly
225 230 235 240
Ala Pro Ser Gln Gly Lys Lys Ala Glu Gly Thr Ser Asn Gln Gln Ser
245 250 255
Pro Thr Thr Glu Leu Thr Asn Tyr Leu Pro Asp Leu Gly Lys Lys Ile
260 265 270
Asp Glu Ile Ile Lys Lys Gln Gly Lys Asn
275 280
<210> 4
<211> 96
<212> Белок
<213> Mycoplasma hyopneumoniae
<400> 4
Asp Leu Leu Tyr Lys Leu Ile Glu Leu Glu Lys Asp Tyr Leu Tyr Asp
1 5 10 15
Leu Tyr Ser Glu Val Gly Leu Ala Glu Ser Ala Ile Lys Phe Ser Ile
20 25 30
Tyr Asn Ala Gly Lys Phe Leu Gln Asn Leu Gly Tyr Asp Ser Pro Phe
35 40 45
Ser Lys Glu Glu Thr Glu Ile Glu Pro Glu Ile Phe Ser Gln Leu Ser
50 55 60
Ala Arg Ala Asp Glu Asn His Asp Phe Phe Ser Gly Asn Gly Ser Ser
65 70 75 80
Tyr Val Met Ala Leu Ala Glu Glu Thr Glu Asp Glu Asp Trp Glu Phe
85 90 95
<210> 5
<211> 1260
<212> ДНК
<213> Mycoplasma hyopneumoniae
<400> 5
atgaaaaaaa tgcttagaaa aaaattcttg tattcatcag ctatttatgc aacttcgctt 60
gcatcaatta ttgcatttgt tgcagcaggt tgtggacaga cagaatcagg ttcgacttca 120
gattctaaac cacaagccga gactctaaaa cataaagtaa gtaatgattc tattcgaata 180
gcactaaccg atccggataa tcctcgatga attagtgccc aaagagatat tatttcttat 240
gttgatgaaa cagaggcagc aacttcaaca attacaaaaa accaggatgc acaaaataac 300
tgactcactc agcaagctaa tttaagtcca gcgccaaaag gatttattat tgcccctgaa 360
aatggaagtg gagttggaac tgctgttaat acaattgctg ataaaggaat tccgattgtt 420
gcctatgatc gactaattac tggatctgat aaatatgatt ggtatgtttc ttttgataat 480
gaaaaagttg gtgaattaca aggtctttca cttgctgcgg gtctattagg aaaggaagat 540
ggtgcttttg attcaattga tcaaatgaat gaatatctaa aatcacatat gccccaagag 600
acaatttctt tttatacaat cgcgggttcc caagatgata ataactccca atatttttat 660
aatggtgcaa tgaaagtact taaagaatta atgaaaaatt cgcaaaataa aataattgat 720
ttatctcctg aaggcgaaaa tgctgtttat gtcccaggat gaaattatgg aactgccggt 780
caaagaatcc aatcttttct aacaattaac aaagatccag caggtggtaa taaaatcaaa 840
gctgttggtt caaaaccagc ttctattttc aaaggatttc ttgccccaaa tgatggaatg 900
gccgaacaag caatcaccaa attaaaactt gaaggatttg atacccaaaa aatctttgta 960
actggtcaag attataatga taaagccaaa acttttatca aagacggcga tcaaaatatg 1020
acaatttata aacctgataa agttttagga aaagttgctg ttgaagttct tcgggtttta 1080
attgcaaaga aaaataaagc atctagatca gaagtcgaaa acgaactaaa agcaaagcta 1140
ccaaatattt catttaaata tgataatcaa acatataaag tacaagataa aaatattaat 1200
acaattttag taagtccagt aattgttaca aaagctaatg ttgataatcc tgatgcctaa 1260
<210> 6
<211> 1209
<212> ДНК
<213> Mycoplasma hyopneumoniae
<400> 6
atggcagttg ttaaaacgac aggaaaaaaa gactttgatc gttccaaaga acatattaat 60
attggaacaa ttggtcatgt tgaccatgga aaaacaacac taacagcagc aatttcaact 120
gttttggcaa aaagaggact cgcggaggca aaggattatg cctcaattga tgcagctcct 180
gaagaaaaag cacgaggaat tacaattaat accgcccata ttgaatatag cactgacaaa 240
cggcactatg cccatgttga ttgcccaggt catgccgatt atataaaaaa tatgatcacc 300
ggagcggccc aaatggatgg agcaatttta gtggttgcag caaccgatgg cccaatgcct 360
caaactcgtg aacacatttt attatcaaaa caagttggtg tcccaaaaat ggttgttttc 420
cttaataaaa ttgacttact tgaaggcgaa gaagaaatgg ttgatttagt tgaggtcgaa 480
attcgcgaac ttctttcttc ttatgatttt gatggcgata atactccaat tattcgggga 540
tctgctcgtg gggcccttga aggaaaacct gaatgggagg caaaagtact tgaattgatg 600
gacgcagttg attcttatat tgactcacct gttcgggaaa tggataaacc ctttttgatg 660
gccgttgagg atgtttttac aattacagga cgtggaaccg tagcaacggg aaaagttgaa 720
agaggtcaag ttaaactaaa cgaagaagtg gaaattgtgg gttatcgcga agaacctaaa 780
aagaccgtaa tcaccggaat tgaaatgttt aataaaaatc ttcaaactgc gatggctggg 840
gataatgccg gtgttctcct acgtggagta gatcgaaaag atatcgaacg tggtcaggtt 900
attgcaaaac caaaaacaat tataccgcat acaaaattta aagctgcaat ttatgccctt 960
aaaaaagaag aaggcggaag gcatacacca tttttcaaaa attataaacc acaattttat 1020
tttcgaacta ccgatgtaac aggcggaatc gagtttgaac caggtcgcga gatggtaatt 1080
ccgggggata atgttgatct taccgttgaa ttaattgccc caattgccgt tgagcaggga 1140
accaaattct cgatccgaga aggtggtaga accgtgggtg ccggaacagt taccgaaatt 1200
attaaataa 1209
<210> 7
<211> 849
<212> ДНК
<213> Mycoplasma hyopneumoniae
<400> 7
gcaaaattag acgataatct tcagtattca tttgaagcta tcaaaaaagg ggaaactaca 60
aaagaaggta aaagagaaga agtagataaa aaagttaagg aattagataa taaaataaaa 120
ggtatattgc ctcagccccc agcggctaaa ccagaagcag caaaaccagt agcggctaaa 180
ccagaagcag caaaaccagt agcggctaaa cctgaagcag caaaaccagt agcggctaaa 240
cctgaagcag caaaaccagt tgcggctaaa cctgaagcag caaaaccagt tgcggctaaa 300
cctgaagcag caaaaccagt tgcagctaaa cctgaagcag caaaaccagt tgctactaat 360
actggctttt cacttacaaa taaaccaaaa gaagactatt tcccaatggc ttttagttat 420
aaattagaat atactgacga aaataaatta agcccaaaaa caccggaaat taatgtattt 480
ttagaactag ttcatcaaag cgagtatgaa gaacaaaaaa taataaagga actagacaaa 540
actgttttaa atcttcaata tcaattccag gaagtcaagg tagctagtga tcaatatcag 600
aaacttagcc acccaatgat gaccgaggga tcttcaaatc aaggtaaaaa agcagaggga 660
gctcctaacc aagggaaaaa agcagaggga gctcctaacc aagggaaaaa agcagagggc 720
gctcctagtc aaggaaaaaa agccgaagga acttctaacc aacaaagccc aactaccgaa 780
ttaactaatt accttcctga cttaggtaaa aaaattgacg aaatcattaa aaaacaaggt 840
aaaaattaa 849
<210> 8
<211> 291
<212> ДНК
<213> Mycoplasma hyopneumoniae
<400> 8
gatctattat ataaactaat tgaattagaa aaagattatc tctatgattt atattctgaa 60
gttggacttg ctgaatcagc aataaaattt agcatttata atgccgggaa attcttgcaa 120
aatctaggat atgattcacc tttttcaaaa gaggaaaccg aaattgaacc tgaaattttt 180
agtcaattat cggctcgagc tgatgaaaat catgactttt tttcaggaaa tggctcttct 240
tatgtaatgg cgcttgctga agaaaccgaa gatgaagatt gggagtttta a 291
<210> 9
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 9
gatataggat ccgcaaaatt agacgataat cttcagtatt ca 42
<210> 10
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 10
caatatgtcg acttaatttt taccttgttt tttaatgatt tcgtc 45
<210> 11
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 11
gatataggat ccatgaaaaa aatgcttaga aaaaaattct tg 42
<210> 12
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 12
caatatgtcg acttaggcat caggattatc aacattagc 39
<210> 13
<211> 52
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 13
gatataggat ccgatctatt atataaacta attgaattag aaaaagatta tc 52
<210> 14
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 14
caatatgtcg acttaaaact cccaatcttc atcttcg 37
<210> 15
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 15
gatataggat ccatggcagt tgttaaaacg acaggaaaa 39
<210> 16
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 16
caatatgtcg acttatttaa taatttcggt aactgttccg gca 43
<210> 17
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 17
ctctttgggc actaatccat cgaggattat ccgg 34
<210> 18
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 18
ccggataatc ctcgatggat tagtgcccaa agag 34
<210> 19
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 19
attagcttgc tgagtgagcc agttattttg tgcatcc 37
<210> 20
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 20
ggatgcacaa aataactggc tcactcagca agctaat 37
<210> 21
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 21
cggcagttcc ataattccat cctgggacat aaac 34
<210> 22
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПРАЙМЕР
<400> 22
gtttatgtcc caggatggaa ttatggaact gccg 34
| название | год | авторы | номер документа |
|---|---|---|---|
| СУБЪЕДИНИЧНАЯ ВАКЦИНА ПРОТИВ MYCOPLASMA SPP | 2019 |
|
RU2759427C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИИ MYCOPLASMA HYORHINIS И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОЙ КОМПОЗИЦИИ | 2020 |
|
RU2737971C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИИ MYCOPLASMA HYORHINIS И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОЙ КОМПОЗИЦИИ | 2016 |
|
RU2724549C1 |
| ВАКЦИНА К ВИРУСУ СВИНОГО ГРИППА A | 2018 |
|
RU2787596C2 |
| ВАКЦИНЫ НА ОСНОВЕ ИНФОРМАЦИОННОЙ РНК ПРОТИВ ШИРОКОГО СПЕКТРА ВАРИАНТОВ КОРОНАВИРУСА | 2022 |
|
RU2826172C2 |
| ЛЕЧЕНИЕ И ПРОФИЛАКТИКА АЛЛЕРГИИ НА КЛЕЩЕЙ ДОМАШНЕЙ ПЫЛИ | 2019 |
|
RU2815386C2 |
| ОПТИМИЗИРОВАННЫЙ ПОЛИПЕПТИД ДЛЯ СУБЪЕДИНИЧНОЙ ВАКЦИНЫ ПРОТИВ РЕОВИРУСА ПТИЦ | 2017 |
|
RU2742250C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ПРОТИВ ИНФЕКЦИИ, ВЫЗВАННОЙ STREPTOCOCCUS SUIS | 2015 |
|
RU2735101C2 |
| СТАБИЛЬНЫЙ ПРЕПАРАТ ВАКЦИНЫ ИЗ ВИРУСОПОДОБНЫХ ЧАСТИЦ ПАПИЛЛОМАВИРУСА ЧЕЛОВЕКА | 2022 |
|
RU2830870C1 |
| ПАРВОВИРУС СВИНЕЙ | 2015 |
|
RU2817872C2 |

Изобретение относится к области биотехнологии, конкретно к получению субъединичных вакцин против Mycoplasma spp., и может быть использовано в медицине для профилактики инфекции Mycoplasma spp. Предложены вакцинные композиции на основе белка Tuf с SEQ ID NO: 02 в сочетании с фармацевтически приемлемым адъювантом, белками Р46, MHP30 и NrdFC и/или фармацевтически приемлемой добавкой. Изобретение обеспечивает достижение сильных иммунных эффектов против Mycoplasma spp. 4 н. и 4 з.п. ф-лы, 5 ил., 4 табл., 7 пр.
1. Композиция для предупреждения инфекции Mycoplasma spp., включающая эффективное количество активного ингредиента, содержащего белок Tuf, где указанный Tuf имеет аминокислотную последовательность SEQ ID NO: 02; и
фармацевтически приемлемый адъювант.
2. Композиция для предупреждения инфекции Mycoplasma spp., включающая эффективное количество активного ингредиента, содержащего белок Tuf, где указанный Tuf имеет аминокислотную последовательность SEQ ID NO: 02; и
фармацевтически приемлемый адъювант; и
фармацевтически приемлемую добавку.
3. Композиция по п.1 или п.2, где указанное эффективное количество составляет от 20 до 2000 мкг/мл от общего объема указанной композиции.
4. Композиция для предупреждения инфекции Mycoplasma spp., включающая:
первое эффективное количество первого активного ингредиента, включающего белок Tuf, где указанный Tuf имеет аминокислотную последовательность SEQ ID NO: 02;
второе эффективное количество второго активного ингредиента, включающего по меньшей мере один белок, выбранный из группы, состоящей из Р46, MHP30 и NrdFC, где указанный Р46 имеет аминокислотную последовательность SEQ ID NO: 01, указанный MHP30 имеет аминокислотную последовательность SEQ ID NO: 03, указанный NrdFC имеет аминокислотную последовательность SEQ ID NO: 04 и фармацевтически приемлемый адъювант.
5. Композиция для предупреждения инфекции Mycoplasma spp., включающая:
первое эффективное количество первого активного ингредиента, включающего белок Tuf, где указанный Tuf имеет аминокислотную последовательность SEQ ID NO: 02;
второе эффективное количество второго активного ингредиента, включающего по меньшей один белок, выбранный из группы, состоящей из Р46, MHP30 и NrdFC, где указанный Р46 имеет аминокислотную последовательность SEQ ID NO: 01, указанный MHP30 имеет аминокислотную последовательность SEQ ID NO: 03, указанный NrdFC имеет аминокислотную последовательность SEQ ID NO: 04 и фармацевтически приемлемый адъювант; и фармацевтически приемлемую добавку.
6. Композиция по п.4 или 5, где указанное первое эффективное количество составляет от 20 до 2000 мкг/мл от общего объема указанной композиции, где указанное второе эффективное количество составляет от 20 до 2000 мкг/мл от общего объема указанной композиции.
7. Композиция по любому из пп. 1, 2, 4 и 5, где фармацевтически приемлемый адъювант является полным адъювантом Фрейнда, неполным адъювантом Фрейнда, гелем оксида алюминия, поверхностно-активным веществом, адъювантом полианионной природы, пептидом, масляной эмульсией или их комбинацией.
8. Композиция по п.2 или 5, где указанная фармацевтически приемлемая добавка является растворителем, стабилизатором, разбавителем, консервантом, антибактериальным средством, противогрибковым средством, изотоническим агентом, средством, замедляющим абсорбцию или их комбинацией.
| Установка непрерывного действия для сушки сыпучих материалов | 1982 |
|
SU1090995A1 |
| WO03004051 A2, 16.01.2003 | |||
| Устройство лазов в резервуарах для пара высокого давления | 1926 |
|
SU9901A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Способ обдувки труб экономайзера | 1927 |
|
SU17243A1 |
Авторы
Даты
2018-03-01—Публикация
2013-11-21—Подача