ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННУЮ ЗАЯВКУ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 61/605147, зарегистрированной 29 февраля 2012 года, которая, таким образом, полностью включена.
ОБЛАСТЬ
Изобретение относится к области молекулярной биологии и генетической инженерии растений, и конкретно к молекулам полинуклеотидов, пригодных для модуляции (например, усиления) экспрессии гена и/или продукции белка у растений.
СТОРОНЫ СОГЛАШЕНИЯ О СОВМЕСТНОМ ИССЛЕДОВАНИИ
В этой заявке описан и заявлен определенный объект изобретения, который разработан на основании письменного соглашения о совместном исследовании между Agrigenetics, Inc., Mycogen Corporation, Exelixis Plant Sciences, Inc. и Exelixis, Inc. c датой вступления в силу 4 сентября 2007 года.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Существует постоянная необходимость в генетических регуляторных элементах, направляющих, контролирующих или иным образом регулирующих экспрессию транскрибируемой нуклеиновой кислоты (например, трансгена), например, для применения в генно-инженерном организме, таком как растение. Как правило, генетические регуляторные элементы содержат 5'-нетранслируемые последовательности, такие как области инициации транскрипции, которые содержат факторы транскрипции и участок(ки) связывания РНК-полимеразы, энхансерные/сайленсерные элементы, TATA-бокс и CAAT-бокс вместе с последовательностями 3'-полиаденилирования, стоп-сигналы транскрипции, старт- и стоп-сигналы трансляции, донорные/акцепторные последовательности сплайсинга и т.п.
Как правило, для целей генетической инженерии генетические регуляторные элементы включают в экспрессирующий вектор или другую инженерную конструкцию для регуляции экспрессии трансгенов, функционально связанных с регуляторными элементами. Хорошо известными примерами промоторов, используемых таким способом, являются промотор CaMV35S (Nagy et al. In: Biotechnology in plant science: relevance to agriculture in the eighties. Eds. Zaitlin et al. Academic Press, Orlando, 1985), промотор убиквитина кукурузы (Ubi; Christensen & Quail, Transgenic Research 5:213, 1996) и промотор Emu (Last et al., Theor. Appl. Genet. 81 581, 1991), хотя специалистам известно множество других промоторов. Подобным образом, из различных источников для применения в генетической инженерии выделены энхансеры; они включают энхансер вируса мозаики цветной капусты (35S CaMV), энхансер вируса мозаики норичника (FMV), энхансер каулимовируса хлоротической полосатости арахиса (PClSV) или энхансер вируса мозаики мирабилис (MMV).
Существует постоянная необходимость в идентификации генетических регуляторных элементов, таких как энхансерные домены, которые можно использовать для контроля экспрессии функционально связанных с ними последовательностей, например, в гетерологичных молекулах нуклеиновой кислоты, таких как векторы и другие инженерные конструкции.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем описании описаны новые области регуляции транскрипции, содержащие энхансерный домен и домен регуляции транскрипции под энхансерным контролем энхансерного домена. Энхансерный домен содержит множество (например, от двух до четырех или более) копий природного, но ранее неизвестного энхансера SCBV, расположенного в тандеме. Области регуляции транскрипции (промоторы) по настоящему изобретению обеспечивают усиленную транскрипцию по сравнению с промотором в отсутствие энхансерного домена. В одном из примеров описана химерная область регуляции транскрипции, содержащая одну или несколько копий энхансерного элемента SCBV, представленных от положения 337 до положения 618 в SEQ ID NO: 1; и функционально связанный с ними промотор, содержащий участок связывания РНК-полимеразы и участок инициации иРНК, где, когда представляющая интерес нуклеотидная последовательность транскрибируется под регуляторным контролем химерной области регуляции транскрипции, количество продукта транскрипции по сравнению с количеством продукта транскрипции, получаемым с использованием химерной области регуляции транскрипции, содержащей промотор и не содержащей энхансерной последовательности SCBV, увеличивается.
Также предоставлены конструкции ДНК, содержащие описанную область регуляции транскрипции и последовательность ДНК, предназначенную для транскрипции. В одном из примеров конструкция ДНК содержит описанную область инициации транскрипции, функционально связанную с транскрибируемой полинуклеотидной молекулой, функционально связанной на 3'-конце с полинуклеотидной молекулой терминации транскрипции. Конструкции ДНК обеспечивают усиленную транскрипцию последовательности ДНК, предназначенной для трансляции. Также описаны трансгенные растения, клетки или ткани растений (таких как растения, клетки или ткани растений двудольных или однодольных), трансформированные описанными конструкциями. Также предоставлены семена, плоды, листья, корни, побеги, цветки, срезы растений и другой репродуктивный материал, пригодный при половом или бесполом размножении, растения-потомки, включая гибриды F1, стерильные по мужскому полу растения и все другие растения и растительные продукты, получаемые из описанных трансгенных растений. Также по настоящему документу предоставлены способы получения описанных трансгенных растений, клеток или тканей растений.
Указанные выше и другие характеристики изобретения будут более понятны из приводимого ниже подробного описания, которое приведено со ссылкой на сопровождающие фигуры.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлена последовательность промотора SCBV (соответствующая положениям 6758-7596 номера доступа GeneBank AJ277091.1, "Sugarcane bacilliform IM virus complete genome, isolate Ireng Maleng", который полностью включен в настоящий документ в качестве ссылки, как он был представлен онлайн на 15 апреля 2010 года); эта последовательность также представлена в SEQ ID NO: 1. Энхансерные последовательности, определенные в этом исследовании, расположены от -222 до -503 и подчеркнуты на фигуре (соответственно положениям от 337 до 618 SEQ ID NO: 1).
Фиг. 2A и 2B иллюстрируют результаты анализа промотора SCBV. На фиг. 2A представлены фрагменты промотора SCBV, содержащие последовательности от -839 п.н., -576 п.н. и -333 п.н. выше участка начала транскрипции до 106 п.н. ниже участка начала транскрипции, слитые с репортерным геном люциферазы (LUC). На фиг. 2B представлена гистограмма отношения активности LUC/GUS в клетках HiII совместно трансформированных указанными выше плазмидами и репортерной конструкцией UBI::GUS. Результаты демонстрируют, что промоторный фрагмент, содержащий последовательности от -576 п.н. выше участка начала транскрипции, обладает 60% активности промоторного фрагмента, содержащего 839 п.н. выше участка начала. В отличие от этого, промоторный фрагмент, содержащий последовательности от -333 п.н. выше участка начала, обладает только 10% активности полноразмерного промотора (от -839 п.н. выше участка начала транскрипции). Таким образом, последовательности, вовлеченные в активность промотора, расположены выше -333 п.н.
Фиг. 3 иллюстрирует, что энхансерные элементы SCBV, описываемые в настоящем документе, усиливают транскрипцию с промотора Adh1 кукурузы. От -503 до -222 выше укороченного промотора Adh1 кукурузы, слитого с геном люциферазы светляка, клонировали одну, две и четыре копии последовательности промотора SCBV. Для сравнения, выше укороченного промотора Adh1 кукурузы клонировали 4 копии энхансерной последовательности MMV и 2 копии энхансера MMV и 2 копии промотора SCBV и сливали с геном люциферазы светляка. Эти конструкции посредством бомбардировки вводили в суспензию клеток кукурузы Hi-II вместе с репортерной конструкцией UBI::GUS. Конструкции, содержащие 1, 2 и 4 копии энхансера SCBV, были, соответственно, более чем в 5 раз, 6 раз и 10 раз более активными, чем это происходило в клетках, в которые посредством бомбардировки вводили укороченную конструкцию Adh1 без каких-либо энхансеров. Конструкция с 4× MMV была в 2,5 раз более активна, чем укороченная конструкция Adh1, а конструкция с 2X MMV и 2X SCBV была в 6 раз более активна, чем укороченная конструкция Adh1.
На фиг. 4 представлено накопление транскриптов области, расположенной рядом ("фланкирующий ген") с участком интеграции 4XSCBV, в трансгенных (T) растениях по сравнению c нетрансгенными (W) контрольными растениями, анализируемой с использованием обратной транскрипции и ПЦР (ОТ-ПЦР). Для сравнения представлен уровень гена домашнего хозяйства GAPDH. Энхансер 4XSCBV вызывал увеличенное накопление транскриптов генов, рядом с которыми он интегрировался; это увеличение накопления транскриптов является результатом увеличенной скорости транскрипции.
На фиг. 5 представлена pDAB3892, которая содержит слияние с промотором 4XSCBV::LfKCS3, используемое для контроля трансгена ацил-КоА-дельта-9-десатуразы Aspergillus nidulans у Arabidopsis thaliana.
На фиг. 6 представлена pDAB1757, которая содержит промотор LfKCS3, используемый для контроля трансгена ацил-КоА-дельта-9-десатуразы Aspergillus nidulans у Arabidopsis thaliana.
На фиг. 7 представлена pDAB1759, которая содержит промотор фазеолина Pv, используемый для контроля трансгена ацил-КоА-дельта-9-десатуразы Aspergillus nidulans у Arabidopsis thaliana.
На фиг. 8 представлена pDAB9381, которая содержит промотор убиквитина 10 Arabidopsis thaliana, используемый для контроля трансгена желтого флуоресцентного белка у Arabidopsis thaliana.
На фиг. 9 представлен процент фенотипа с уменьшением насыщенных жирных кислот для трансгенных растений, содержащий трансгенную вставку конструкций.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Нуклеотидные и/или аминокислотные последовательности, приведенные в списке последовательностей ниже, представлены с использованием стандартных буквенных сокращений для нуклеотидных оснований и трехбуквенного кода для аминокислот, как определено в 37 C.F.R. 1.822. Представлена только одна цепь каждой последовательности нуклеиновой кислоты, но комплементарная цепь подразумевается включенной посредством обращения к приведенной цепи. Последовательности нуклеиновых кислот (в списке последовательностей или любом другом месте настоящего документа) представлены в стандартном направлении от 5' к 3', а последовательности белков представлены в стандартном направлении от амино (N) конца к карбокси (C) концу.
В SEQ ID NO: 1 представлена последовательность нуклеиновой кислоты промотора SCBV (соответствующего положениям 6758-7596 номера доступа GeneBank AJ277091.1, "Sugarcane bacilliform IM virus complete genome, isolate Ireng Maleng", полностью включенного в настоящий документ в качестве ссылки, как он был представлен онлайн на 15 апреля 2010 года). Энхансерные элементы, описываемые в настоящем документе, расположены от положения 337 до положения 618 в SEQ ID NO: 1.
В SEQ ID NO: 2 представлена последовательность нуклеиновой кислоты для единицы транскрипции растения (PTU) ацил-КоА-дельта-9-десатуразы Aspergillus nidulans из pDAB3892.
В SEQ ID NO: 3 представлена последовательность нуклеиновой кислоты для PTU фосфинотрицинацетилтрансферазы из pDAB3892.
В SEQ ID NO: 4 представлена последовательность нуклеиновой кислоты для PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans из pDAB1757.
В SEQ ID NO: 5 представлена последовательность нуклеиновой кислоты для PTU фосфинотрицинацетилтрансферазы из pDAB1757.
В SEQ ID NO: 6 представлена последовательность нуклеиновой кислоты для PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans из pDAB1759.
В SEQ ID NO: 7 представлена последовательность нуклеиновой кислоты для PTU фосфинотрицинацетилтрансферазы из pDAB1759.
В SEQ ID NO: 8 представлена последовательность нуклеиновой кислоты для PTU желтого флуоресцентного белка из pDAB9381.
В SEQ ID NO: 9 представлена последовательность нуклеиновой кислоты для PTU фосфинотрицинацетилтрансферазы из pDAB9381.
В SEQ ID NO: 10 представлена последовательность нуклеиновой кислоты для прямого праймера, используемого для амплификации pat для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 11 представлена последовательность нуклеиновой кислоты для обратного праймера, используемого для амплификации pat для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 12 представлена последовательность нуклеиновой кислоты для зонда, используемого для амплификации pat для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 13 представлена последовательность нуклеиновой кислоты для прямого праймера, используемого для амплификации TAFFII для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 14 представлена последовательность нуклеиновой кислоты для обратного праймера, используемого для амплификации TAFFII для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 15 представлена последовательность нуклеиновой кислоты для зонда, используемого для амплификации TAFFII для молекулярного подтверждения с использованием анализа гидролиза зонда.
ПОДРОБНОЕ ОПИСАНИЕ
I. Сокращения
II. Термины
Если не указано иначе, технические термины используют в соответствии с общепринятым употреблением. Определения общих терминов в молекулярной биологии можно найти в Benjamin Lewin, Genes V, published by Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
Для облегчения рассмотрения различных вариантов осуществления изобретения предоставлены приведенные ниже разъяснения конкретных терминов:
5' и/или 3': молекулы нуклеиновой кислоты (такие как ДНК и РНК) указаны, как содержащие "5'-концы" и "3'-концы", так как мононуклеотиды реагируют с получением полинуклеотидов таким образом, что 5'-фосфат пентозного кольца одного мононуклеотида посредством фосфодиэфирной связи в одном направлении связывается с 3'-кислородом его соседа. Таким образом, один конец полинуклеотида обозначают как "5'-конец", когда его 5' фосфат не связан с 3'-кислородом пентозного кольца мононуклеотида. Другой конец полинуклеотида обозначают как "3'-конец", когда его 3'-кислород не связан с 5'-фосфатом другого пентозного кольца мононуклеотида. Несмотря на то, что 5'-фосфат одного пентозного кольца мононуклеотида связан с 3'-кислородом его соседа, внутренняя последовательность нуклеиновой кислоты также может быть указана, как содержащая 5'- и 3'-концы.
В линейной или кольцевой молекуле нуклеиновой кислоты, отдельные внутренние элементы обозначают как расположенные "выше" или с 5'-конца от расположенных "ниже" или с 3'-конца элементов. В отношении ДНК эта терминология отражает, что транскрипция проходит вдоль цепи ДНК в направлении от 5' к 3'. Как правило, промоторные и энхансерные элементы, контролирующие транскрипцию сцепленного гена, расположены с 5'-конца или выше кодирующей области. Однако энхансерные элементы могут проявлять свое действие даже тогда, когда они расположены с 3'-конца от промоторного элемента и кодирующей области. Сигналы терминации транскрипции и полиаденилирования расположены с 3'-конца или ниже кодирующей области.
Агрономический признак: Характеристика растения, где такие характеристики в качестве неограничивающих примеров включают морфологию, физиологию, рост и развитие, урожай, питательное обогащение растения, устойчивость растения к заболеваниям или вредителям, или агрономическими признаками являются устойчивость к условиям окружающей среды или химическая устойчивость. "Улучшенный агрономический признак" относится к измеримому улучшению агрономического признака, включая, в качестве неограничивающих примеров, увеличение урожая, включая увеличенный урожай без стрессовых условий и увеличенный урожай в стрессовых условиях окружающей среды. Например, стрессовые условия могут включать засуху, недостаток освещенности, грибковое заболевание, вирусное заболевание, бактериальное заболевание, поражение насекомыми, поражение круглыми червями, воздействие низких температур, воздействие высоких температур, осмотический стресс, сниженную доступность питательного азота, сниженную доступность питательного фосфора и высокую плотность растений. На "урожай" могут влиять множество свойств, включая, в качестве неограничивающих примеров, высоту растения, количество стручков, положение стручков на растении, количество междоузлий, частоту растрескивания стручков, размер зерна, эффективность образования клубеньков и фиксации азота, эффективность усваивания питательных веществ, устойчивость к биотическому и абиотическому стрессу, усваивание углерода, строение растения, устойчивость к полеганию, процент прорастания семян, всхожесть и ювенильные признаки. На урожай также могут влиять эффективность прорастания (включая прорастание в условиях с неблагоприятным воздействием), скорость роста (включая скорость роста в условиях с неблагоприятным воздействием), количество початков, количество семян в початке, размер семян, состав семян (крахмал, масло, белок) и характеристики наполнения семян. Увеличенный урожай может являться результатом улучшенного использования ключевых биохимических соединений, таких как азот, фосфор и углевод, или улучшенной реакции на стрессовые условия окружающей среды, такие как холод, жара, засуха, соль и поражение вредителями или возбудителями заболеваний. Рекомбинантную ДНК, используемую в настоящем изобретении, также можно использовать для придания растениям признаков улучшенного роста и развития и, в конечном итоге, увеличенного урожая, в результате измененной экспрессии регуляторов роста растений или изменения метаболических путей клеточного цикла или фотосинтеза. Дополнительные примеры агрономических признаков и изменения таких признаков у растений предоставлены в настоящем документе и/или известны специалистам в данной области.
Альтерации: Альтерации в полинуклеотиде (например, в полипептиде, кодируемом нуклеиновой кислотой по настоящему изобретению), как этот термин используют в настоящем документе, включают любые делеции, вставки и точечные мутации в полинуклеотидной последовательности. В это определение включены изменения в последовательности геномной ДНК, кодирующей полипептид. Подобным образом, термин "альтарация" можно использовать для обозначения делеций, вставок и других мутаций в полипептидных последовательностях.
Изменение уровня продукции или экспрессии: Изменение, увеличение или снижение, уровня продукции или экспрессии молекулы нуклеиновой кислоты или аминокислотной молекулы (например, миРНК, мкРНК, иРНК, гена, полипептида, пептида) по сравнению с контрольным уровнем продукции или экспрессии.
Амплификация: Когда используют по отношению к нуклеиновой кислоте, она относится к способу, которым увеличивают количество копий молекулы нуклеиновой кислоты в образце или препарате. Примером амплификации является полимеразная цепная реакция, в которой биологический образец, получаемый у индивидуума, приводят в контакт с парой олигонуклеотидных праймеров в условиях, которые обеспечивают гибридизацию этих праймеров c матрицей нуклеиновой кислоты в образце. Праймеры достраиваются в подходящих условиях, диссоциируют с матрицей, затем снова отжигаются, достраиваются и диссоциируют с увеличением количества копий нуклеиновой кислоты. Продукт амплификации in vitro можно характеризовать посредством электрофореза, профилей рестрикционного эндорасщепления нуклеазами, гибридизации или лигирования олигонуклеотидов и/или секвенирования нуклеиновой кислоты стандартными способами. Другие примеры способов амплификации in vitro включают амплификацию с замещением цепей (см. патент США № 5744311); изотермическую амплификацию без транскрипции (см. патент США № 6033881); амплификацию посредством реакции репарации цепи (см. WO 90/01069); амплификацию посредством лигазной цепной реакции (см. EP-A-320308); амплификацию посредством лигазной цепной реакции с заполнением разрыва (см. патент США № 5427930); объединенные лигазную детекцию и ПЦР (см. патент США № 6027889) и амплификацию без транскрипции РНК NASBA™ (см. патент США № 6025134).
Антисмысловая молекула, смысловая молекула и антиген: ДНК содержит две антипараллельных цепи, цепь 5' → 3', обозначаемая как плюс-цепь, и цепь 3' → 5', обозначаемая как минус-цепь. Так как РНК-полимераза добавляет нуклеиновые кислоты в направлении 5' → 3', минус-цепь ДНК служит в качестве матрицы для РНК при транскрипции. Таким образом, РНК-транскрипт будет иметь последовательность, комплементарную минус-цепи и идентичную плюс-цепи (за исключением того, что U заменяет T).
Антисмысловые молекулы представляют собой молекулы, которые специфически гибридизуются или специфически комплементарны к РНК или плюс-цепи ДНК. Смысловые молекулы представляют собой молекулы, которые специфически гибридизуются или специфически комплементарны минус-цепи ДНК. Антигенные молекулы представляют собой антисмысловые или смысловые молекулы, направленные к ДНК-мишени. Антисмысловая РНК (асРНК) представляет собой молекулу РНК, комплементарную смысловой (кодирующей) молекуле нуклеиновой кислоты.
Антисмысловое ингибирование: Этот термин относится к классу регуляции генов на основе цитоплазматического, ядерного или внутриорганелльного ингибирования экспрессии гена (например, экспрессии генома клетки-хозяина или генома патогенного организма, такого как вирус) вследствие присутствия в клетке молекул РНК, комплементарных по меньшей мере части транслируемой иРНК.
кДНК (комплементарная ДНК): Участок ДНК, в котором отсутствуют внутренние некодирующие участки (интроны) и последовательности регуляции транскрипции. Также кДНК может содержать нетранслируемые области (UTR), которые в соответствующей молекуле РНК отвечают за контроль трансляции. Как правило, кДНК синтезируют в лаборатории посредством обратной транскрипции с информационной РНК, выделяемой из клеток или других образцов.
Химерный или химера: Продукт слияния частей двух или более различных полинуклеотидных или полипептидных молекул. Например, фразы "химерная последовательность" и "химерный ген" относятся к нуклеотидным последовательностям, получаемым по меньшей мере из двух гетерологичных частей. Химерная последовательность может содержать ДНК или РНК.
Химерная область регуляции транскрипции: Набор контрольных или регуляторных последовательностей нуклеиновой кислоты, которые контролируют транскрипцию нуклеиновой кислоты, функционально связанной с нею, где набор собран из различных полинуклеотидных источников. Например, химерные области регуляции транскрипции, как описано в настоящем документе, можно получать посредством манипуляций с известными промоторами или другими полинуклеотидными молекулами. В химерных областях регуляции транскрипции можно комбинировать один или несколько энхансерных доменов с одним или несколькими промоторами, например, посредством слияния гетерологичного энхансерного домена из первого природного промотора со вторым промотором с его собственным частичным или полным набором регуляторных элементов. По настоящему изобретению, в числе прочего, предоставлены химерные области регуляции транскрипции, содержащие по меньшей мере один энхансерный домен SCBV, слитый (т.е. функционально связанный) с промотором, активным в растении(ях).
Конструкция: Любая рекомбинантная полинуклеотидная молекула, такая как плазмида, космида, вирус, автономно реплицирующаяся полинуклеотидная молекула, фаг или линейная или кольцевая одноцепочечная или двухцепочечная полинуклеотидная молекула ДНК или РНК, полученная из любого источника, способная к интеграции в геном или автономной репликации, содержащая полинуклеотидную молекулу, где функционально связаны одна или несколько транскрибируемых полинуклеотидных молекул.
Контрольное растение: Растение, не содержащее рекомбинантной ДНК, обеспечивающей у трансгенного растения (например) улучшенный или измененный агрономический признак, используемое в качестве основы для сравнения, например, для идентификации у трансгенного растения улучшенного или измененного агрономического признака. Подходящее контрольное растение может представлять собой не являющееся трансгенным растение родительской линии, используемой для получения трансгенного растения, или растение, которое не является трансгенным по меньшей мере по конкретному исследуемому признаку (т.е., контрольное растение может быть подвергнуто инженерии с введением других гетерологичных последовательностей или рекомбинантных молекул ДНК). Таким образом, контрольное растение в некоторых случаях может представлять собой линию трансгенных растений, содержащую пустой вектор или маркерный ген, но не содержащую рекомбинантную ДНК, или не содержащую всех рекомбинантных ДНК тестируемого растения.
Косупрессия: Экспрессия чужеродного (гетерологичного) гена со значительной гомологией с эндогенным геном, приводящая к супрессии экспрессии чужеродного и эндогенного гена.
ДНК (дезоксирибонуклеиновая кислота): ДНК представляет собой длинноцепочечный полимер, содержащий генетический материал большинства организмов (гены некоторых вирусов содержат рибонуклеиновую кислоту (РНК)). Повторяющимися единицами в полимерах ДНК являются четыре различных нуклеотида, каждый из которых содержит одно из четырех оснований: аденин, гуанин, цитозин и тимин, связанные с сахаром дезоксирибозой, с которым связана фосфатная группа. Триплеты нуклеотидов (называемые кодонами) кодируют каждую аминокислоту в полипептиде или стоп-сигнал. Термин кодон также используют для соответствующих (и комплементарных) последовательностей из трех нуклеотидов в иРНК, в которую транскрибируется последовательность ДНК.
Если не указано иначе, любое указание молекулы ДНК включает молекулу, обратно комплементарную этой молекуле ДНК. За исключением случаев, когда одноцепочечность необходима по тексту настоящего документа, молекулы ДНК, несмотря на то, что записаны только в виде одной цепи, включают обе цепи двухцепочечной молекулы ДНК.
Десатураза: Как используют в настоящем документе, термин "десатураза" относится к полипептиду, который может уменьшать насыщенность (например, вводя двойную связь) одной или нескольких жирных кислот с получением представляющих интерес жирной кислоты или предшественника. Фермент десатураза растворимых у растений жирных кислот может региоспецифично вводить двойную связь в субстрат ацил-ACP насыщенных кислот. Ацил-КоА-десатуразы вводят двойную связь региоспецифично в субстрат ацил-КоА насыщенных жирных кислот. Реакция включает активацию молекулярного кислорода посредством восстановленного двумя электронами центра из двух атомов железа, координированных четырехспиральным пучком, который формирует кор архитектуры десатуразы. Особый интерес в некоторых вариантах осуществления представляют ацил-КоА-дельта-9-десатуразы.
Жирная кислота: Как используют в настоящем документе, термин "жирная кислота" относится к длинноцепочечным алифатическим кислотам (алкановым кислотам) с различными длинами цепей, например, приблизительно от C12 до C22, хотя известны обе кислоты с более длинными и более короткими цепями. Структура жирной кислоты представима обозначением x:yДz, где "x" представляет собой общее количество атомов углерода (C) в конкретной жирной кислоте, а "y" представляет собой количество двойных связей в углеродной цепи в положении "z", отсчитывая от карбоксильного конца кислоты.
Кодировать: Говорят, что полинуклеотид кодирует полипептид, если в своем нативном состоянии или при манипуляции способами, известным специалистам в данной области, молекула полинуклеотида может транскрибироваться и/или транслироваться с получением иРНК для полипептида или его фрагмента и/или полипептида или его фрагмента. Антисмысловая цепь является комплементарной такой нуклеиновой кислоте, и кодирующую последовательность можно вывести из нее.
Энхансерный домен: цис-действующий транскрипционный регуляторный элемент (также известный как цис-элемент), который обеспечивает составную часть общего контроля экспрессии гена. Энхансерный домен может функционировать, связывая факторы транскрипции, которые представляют собой транс-действующие белковые факторы, которые регулируют транскрипцию. Некоторые энхансерные домены связывают более одного фактора транскрипции, и факторы транскрипции могут с различными аффинностями взаимодействовать более чем с одним энхансерным доменом. Энхансерные домены можно идентифицировать рядом способов, включая делеционный анализ (делеция одного или нескольких нуклеотидов с 5'-конца или внутри промотора); анализ ДНК-связывающих белков с использованием футпринтинга с ДНКазой I, интерференцию метилированием, анализы изменения подвижности при электрофорезе, геномный футпринтинг in vivo посредством опосредованной лигированием ПЦР и другие общепринятые анализы; или посредством сравнения последовательности ДНК с известными мотивами цис-элементов общепринятыми способами сравнения последовательностей ДНК. Точную структуру энхансерного домена можно дополнительно исследовать посредством мутагенеза (или замены) одного или нескольких нуклеотидов или другими общепринятыми способами. Энхансерные домены можно получать посредством химического синтеза или посредством выделения из промоторов, включающих такие элементы, и их можно синтезировать с дополнительными фланкирующими нуклеотидами, которые содержат подходящие участки распознавания рестрикционных ферментов для облегчения манипуляций с подпоследовательностями.
Экспрессия (генов): Транскрипция молекулы ДНК в транскрибированную молекулу РНК. В более общем смысле, процесс, посредством которого кодируемая генами информация преобразуется в структуры, находящиеся и действующие в клетке. Экспрессируемые гены включают гены, которые транскрибируются в иРНК, а затем транслируются в белок, и гены, которые транскрибируются в РНК, но не транслируются в белок (например, миРНК, транспортная РНК и рибосомная РНК). Таким образом, экспрессия последовательности-мишени, такой как ген или промоторная область гена, может приводить к экспрессии иРНК, белка или и иРНК, и белка. Экспрессию последовательности-мишени можно ингибировать или усиливать (снижать или увеличивать). Экспрессию генов можно описать как связанную с временными, пространственными, связанными с развитием или морфологическими характеристиками, а также количественными или качественными показателями.
Генорегуляторная активность: Способность полинуклеотида влиять на транскрипцию или трансляцию функционально связанной транскрибируемой или транслируемой полинуклеотидной молекулы. Выделенная полинуклеотидная молекула с генорегуляторной активностью может обеспечивать временную или пространственную экспрессию или модулировать уровни и степень экспрессии функционально связанной транскрибируемой полинуклеотидной молекулы. Выделенная полинуклеотидная молекула с генорегуляторной активностью может включать промоторную, интронную, лидерную области или 3'-концевую область терминации транскрипции.
Сайленсинг генов: Сайленсинг генов относится к отсутствию (или снижению) экспрессии гена в результате, хотя и не ограничиваясь им, действия на уровне геномной (ДНК), такого как перестройка хроматина, или на посттранскрипционном уровне посредством воздействия на стабильность или трансляцию транскриптов. Современные данные позволяют предположить, что основным процессом, вовлеченным в транскрипционный и посттранскрипционный сайленсинг генов, является РНК-интерференция (РНКи).
Так как РНКи проявляет свое действие на транскрипционном и/или посттранскрипционном уровне, полагают, что РНКи можно использовать для специфического ингибирования альтернативных транскриптов того же гена.
Гетерологичный: Тип последовательности, который в норме (например, в последовательности дикого типа) не находится рядом со второй последовательностью. В одном из вариантов осуществления последовательность происходит из другого генетического источника, такого как вирус, или организм, или вид, отличающегося от источника второй последовательности.
Гибридизация: Олигонуклеотиды и их аналоги гибридизуются посредством образования водородных связей, что включает образование уотсон-криковских, хугстиновских или обращенных хугстиновских водородных связей между комплементарными основаниями. Как правило, нуклеиновая кислота состоит из азотистых оснований, которые представляют собой или пиримидины (цитозин (C), урацил (U) и тимин (T)), или пурины (аденин (A) и гуанин (G)). Эти азотистые основания формируют водородные связи между пиримидином и пурином, и связывание пиримидина с пурином обозначают как спаривание оснований. Более конкретно, A связывается водородной связью с T или U, а G связывается с C. В молекулах РНК, G также связывается с U. Комплементарные относится к спариванию оснований, которое происходит между двумя отдельными последовательностями нуклеиновой кислоты или двумя отдельными областями одной и той же последовательности нуклеиновой кислоты.
Условия гибридизации, приводящие к конкретным степеням жесткости, варьируют в зависимости от особенностей выбранного способа гибридизации и состава и длины гибридизующихся последовательностей нуклеиновой кислоты. Как правило, жесткость гибридизации определяет температура гибридизации и ионная сила (особенно концентрация Na+) гибридизационного буфера. Расчеты условий гибридизации, необходимых для достижения конкретных степеней жесткости, описаны в Sambrook et al. (ed.), Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, главы 9 и 11, включенной в настоящий документ в качестве ссылки.
Приведенное ниже представляет собой иллюстративный набор условий гибридизации, и он не предназначен для ограничения.
Очень высокая жесткость (детектируют последовательности с 90% идентичностью последовательностей)
Гибридизация: 5× SSC при 65°С в течение 16 часов
Двукратная отмывка: 2× SSC при комнатной температуре (RT) в течение 15 минут каждая
Двукратная отмывка: 0,5× SSC при 65°C в течение 20 минут каждая
Высокая жесткость (детектируют последовательности с 80% идентичностью последовательностей или более)
Гибридизация: 5×-6× SSC при 65°C-70°C в течение 16-20 часов
Двукратная отмывка: 2× SSC при RT в течение 5-20 минут каждая
Двукратная отмывка: 1× SSC при 55°C-70°C в течение 30 минут каждая
Низкая жесткость (детектируют последовательности более чем с 50% идентичностью последовательностей)
Гибридизация: 6× SSC при температурах от RT до 55°C в течение 16-20 часов
Отмывка по меньшей мере дважды: 2×-3× SSC при температурах от RT до 55°C в течение 20-30 минут каждая.
В цис-положении: Означает, что две последовательности расположены на одном и том же участке РНК или ДНК.
В транс-положении: Означает, что две последовательности расположены на различных участках РНК или ДНК.
Промышленная культура: Сельскохозяйственная культура, выращиваемая преимущественно для потребления людьми или животными или для применения в производственных процессах (например, в качестве источника жирных кислот для производства или сахаров для получения спирта). Следует понимать, что во многих случаях потреблять можно растение или продукт, производимый из растения (например, подсластители, масло, муку тонкого помола или муку крупного помола); таким образом, продовольственные культуры являются подмножеством промышленных культур. Примеры продовольственных культур в качестве неограничивающих примеров включают кукурузу, сою, рис, пшеницу, масличный рапс, хлопок, овес, ячмень и картофель. Другие примеры промышленных культур (включая продовольственные культуры) приведены в настоящем документе.
Интерференция или ингибирование (экспрессии последовательности-мишени): Эта фраза относится к способности малой РНК, так как миРНК или мкРНК, или другой молекулы, значимому снижению экспрессии и/или стабильности молекулы, несущей последовательность-мишень. Последовательность-мишень может включать последовательность ДНК, такую как ген или промоторная область гена, или последовательность РНК, такую как иРНК. "Интерференция или ингибирование" экспрессии предусматривает снижение конечного продукта гена или последовательности, например, экспрессии или функции кодируемого белка или белка, нуклеиновой кислоты, другой биологической молекулы или биологической функции, на которую влияет последовательность-мишень, и, таким образом, включает снижение количества или длительности существования транскрипта иРНК или другой последовательности-мишени. В некоторых вариантах осуществления малая РНК или другая молекула направляет модификации хроматина, которые ингибируют экспрессию последовательности-мишени. Следует понимать, что фраза является относительной и не требует абсолютного ингибирования (супрессии) последовательности. Таким образом, в определенных вариантах осуществления интерференция или ингибирование экспрессии последовательности-мишени требует, чтобы после применения малой РНК или другой молекулы (такой как вектор или другая конструкция, кодирующая одну или несколько малых РНК) экспрессия последовательности снижалась по меньшей мере на 5%, чем до применения, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25% или даже более. Таким образом, в некоторых конкретных вариантах осуществления применение малой РНК или другой молекулы снижает экспрессию последовательности-мишени приблизительно на 30%, приблизительно на 40%, приблизительно на 50%, приблизительно на 60% или более. В конкретных примерах, где малая РНК или другая молекула является особенно эффективной, экспрессия снижена на 70%, 80%, 85%, 90%, 95% или даже более.
Выделенный: "выделенный" биологический компонент (такой как нуклеиновая кислота, пептид или белок) в значительной степени отделен, получен независимо или очищен от других биологических компонентов клетки организма, в котором компонент находится в природе, например, других хромосомных и внехромосомных ДНК и РНК и белков. Таким образом, нуклеиновые кислоты, пептиды и белки, которые являются "выделенными", включают нуклеиновые кислоты и белки, очищенные стандартными способами очистки. Термин также включает нуклеиновые кислоты, пептиды и белки, полученные посредством рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные нуклеиновые кислоты.
Метаболом: Набор относительно низкомолекулярных молекул (метаболитов), который присутствует в одном организме, образце, ткани, клетке или независимо от того, как проведено другое деление. В качестве примера, метаболомы могут включать промежуточные продукты метаболизма, гормоны и другие сигнальные молекулы и вторичные метаболиты. Типичные метаболомы содержат набор метаболитов, находящихся в биологическом образце, таком как растение, часть растения или образец растения, или в его суспензии или экстракте. Примеры таких молекул в качестве неограничивающих примеров включают: кислоты и родственные соединения; моно-, ди- и трикарбоновые кислоты (насыщенные, ненасыщенные, алифатические и циклические, арильные, алкиларильные); альдокислоты, кетокислоты; лактонные формы; гибереллины; абсцизиновую кислоту; спирты, полиолы, производные и родственные соединения; этиловый спирт, бензиловый спирт, метанол; пропиленгликоль, глицерин, фитол; инозитол, фурфуриловый спирт, ментол; альдегиды, кетоны, хиноны, производные и родственные соединения; уксусный альдегид, масляный альдегид, бензальдегид, акролеин, фурфурол, глиоксаль; ацетон, бутанон; антрахинон; углеводы; моно-, ди-, трисахариды; алкалоиды, амины и другие основания; пиридины (включая никотиновую кислоту, никотинамид); пиримидины (включая цитидин, тимин); пурины (включая гуанин, аденин, ксантины/гипоксантины, кинетин); пирролы; хинолины (включая изохинолины); морфинаны, тропаны, цинхонаны; нуклеотиды, олигонуклеотиды, производные и родственные соединения; гуанозин, цитозин, аденозин, тимидин, инозин; аминокислоты, олигопептиды, производные и родственные соединения; сложные эфиры; фенолы и родственные соединения; гетероциклические соединения и производные; пирролы, тетрапирролы (корриноиды и порфины/порфирины с/без иона металла); флавоноиды; индолы; липиды (включая жирные кислоты и триглицериды), производные и родственные соединения; каротеноиды, фитоен и стеролы, изопреноиды, включая терпены.
МикроРНК (мкРНК): продукты генов в виде малых, некодирующих РНК длиной приблизительно 21 нуклеотид и выявленные в различных организмах, включая животных и растения. МкРНК структурно сходны с миРНК за исключением того, что они происходят из структурированных, формирующих самогибридизирующиеся структуры транскриптов-предшественников, происходящих из генов мкРНК. Первичные транскрипты генов мкРНК формируют шпилечные структуры, которые процессирует мультидоменная подобная РНКазе III нуклеаза DICER и DROSHA (у животных) или DICER-LIKE1 (DCL1; у растений) с получением дуплексов мкРНК. Зрелая мкРНК после разделения дуплекса встраивается в комплексы RISC. МкРНК растений взаимодействуют со своими РНК-мишенями с точной или почти точной комплементарностью.
Нуклеотид: Термин нуклеотид в качестве неограничивающих примеров включает мономер, который содержит основание, связанное с сахаром, такое как пиримидин, пурин или их синтетические аналоги, или основание, связанное с аминокислотой, как в пептидной нуклеиновой кислоте (ПНК). Нуклеотид представляет собой один мономер в олигонуклеотиде/полинуклеотиде. Нуклеотидная последовательность относится к последовательности оснований в олигонуклеотиде/полинуклеотиде.
Основные нуклеотиды ДНК представляют собой дезоксиаденозин-5'-трифосфат (дАТФ или A), дезоксигуанозин-5'-трифосфат (дГТФ или G), дезоксицитидин-5'-трифосфат (дЦТФ или C) и дезокситимидин-5'-трифосфат (дТТФ или T). Основные нуклеотиды РНК представляют собой аденозин-5'-трифосфат (АТФ или A), гуанозин-5'-трифосфат (ГТФ или G), цитидин-5'-трифосфат (ЦТФ или C) и уридин-5'-трифосфат (УТФ или U). Также, основанием, которое может быть интегрировано в ДНК или РНК в нуклеотиде, является инозин (дИТФ или ИТФ, соответственно).
Маслопродуцирующие виды (растений): Виды растений, продуцирующие и запасающие триацилглицерин в соответствующих органах, преимущественно в семенах. Такие виды в качестве неограничивающих примеров включают сою (Glycine max), рапс и канолу (такие как Brassica napus, Brassica rapa и Brassica campestris), подсолнечник (Helianthus annus), хлопок (Gossypium hirsutum), кукурузу (Zea mays), какао (Theobroina cacao), сафлор (Carthamus tinctorius), масличную пальму (Elaeis guineensis), кокосовую пальму (Cocos nucifera), лен (Linum usitatissimuin), клещевину (Ricinus commiunis) и арахис (Arachis hypogaea).
Олигонуклеотид: Олигонуклеотид представляет собой множество нуклеотидов, связанных фосфодиэфирными связями, длиной приблизительно от 6 до приблизительно 300 нуклеотидов. Аналог олигонуклеотида относится к соединениям, которые функционируют сходно с олигонуклеотидами, но содержат неприродные части. Например, аналоги олигонуклеотидов могут содержать неприродные части, такие как измененные сахарные группы или связи между сахарами, такие как тиофосфатолигодезоксинуклеотид. Функциональные аналоги природных полинуклеотидов могут связываться с РНК или ДНК
Функционально связанные: Этот термин относится к смежному положению компонентов, в частности, нуклеотидных последовательностей так, что может осуществляться нормальное функционирование компонентов. Таким образом, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной связи со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор воздействует на транскрипцию или экспрессию кодирующей последовательности. Как правило, функционально связанные последовательности ДНК являются непрерывными и, когда необходимо связать две кодирующих белки области, в одной рамке считывания. Кодирующая последовательность, которая является "функционально связанной" с регуляторной последовательностью(ями), относится к конфигурации нуклеотидных последовательностей, где кодирующую последовательность можно экспрессировать под регуляторным контролем (например, контролем транскрипции и/или трансляции) регуляторной последовательности.
ORF (открытая рамка считывания): Последовательность триплетов (кодонов) нуклеотидов, кодирующих аминокислоты, не содержащая каких-либо терминирующих кодонов. Эти последовательности, как правило, транслируются в пептиды.
Процент идентичности последовательностей: Процентное содержание идентичных нуклеотидов в линейной последовательности полинуклеотидов эталонной ("запрашиваемой") полинуклеотидной молекулы (или ее комплементарной цепи) по сравнению с тестируемой ("исследуемой") полинуклеотидной молекулой (или ее комплементарной цепью) при оптимальном выравнивании двух этих последовательностей (с соответствующими вставками, делециями или пропусками нуклеотидов в сумме составляющими менее 20 процентов эталонной последовательности в окне сравнения). Оптимальное выравнивание последовательностей для выравнивания окна сравнения хорошо известны специалистам в данной области, и его можно проводить с использованием таких средств, как алгоритм локальной гомологии Смита и Ватермана, алгоритм выравнивания по гомологии Нидлмана и Вунша, способ поиска по сходству Пирсона и Липмана. Такие сравнения предпочтительно проводят с использованием компьютерных реализаций этих алгоритмов, таких как GAP, BESTFIT, FASTA и TFASTA, доступных как часть пакета GCG® Wisconsin Package® (Accelrys Inc., Burlington, Mass.). "Доля идентичности" выровненных участков тестовой последовательности и эталонной последовательности представляет собой количество идентичных компонентов, которые содержатся в двух выровненных последовательностях, деленное на общее количество компонентов в участке эталонной последовательности (т.е., во всей эталонной последовательности или меньшей определенной части эталонной последовательности). Процент идентичности последовательностей представляют как доля идентичности, умноженную на 100. Сравнение одной или нескольких полинуклеотидных последовательностей можно проводить с полноразмерной полинуклеотидной последовательностью или с ее частью или с более длинной полинуклеотидной последовательностью. Значительный процент идентичности последовательностей составляет по меньшей мере приблизительно 80% идентичности последовательностей, по меньшей мере приблизительно 90% идентичности последовательностей или даже большую идентичность последовательностей, такую как приблизительно 98% или приблизительно 99% идентичности последовательностей.
Растение: Любое растение и его потомство. Термин также включает части растений, включая семена, срезы, клубни, плоды, цветы и т.д. В различных вариантах осуществления термин растение относится к культурным видам растений, таким как кукуруза, хлопок, канола, подсолнечник, соя, сорго, люцерна, пшеница, рис, растения, дающие плоды и овощи, и газонным и декоративным видам растений. Как используют в настоящем документе, термин клетка растения относится к структурной и физиологической единице растений, состоящей из протопласта и окружающей клеточной стенки. Как используют в настоящем документе, термин орган растения относится к отдельной и визуально различимой части растения, такой как корень, стебель, лист или зародыш.
В более общем смысле, термин ткань растения относится к любой ткани растения в полевых условиях или в культуре. Этот термин включает цельное растение, клетку растения, орган растения, протопласт, культуру клеток или любую группу клеток растений, организованных в структурную и функциональную единицу.
Полинуклеотидная молекула: Одно- или двухцепочечная ДНК или РНК геномного или синтетического происхождения; т.е., полимер из дезоксирибонуклеотидных или рибонуклеотидных оснований, соответственно, читаемый с 5'-конца (сверху) до 3'-конца (вниз).
Полипептидная молекула: Полимер, в котором мономерами являются аминокислотные остатки, которые связаны вместе посредством амидных связей. Когда аминокислоты представляют собой альфа-аминокислоты, можно использовать оптический изомер L или оптический изомер D, где предпочтительными являются L-изомеры. Как используют в настоящем документе, термин полипептид или белок включает любую аминокислотную последовательность и включает модифицированные последовательности, такие как гликопротеины. Термин полипептид конкретно предназначен для включения в него природных белков, а также белков, продуцируемых рекомбинантно или синтетическим способом.
Посттранскрипционный сайленсинг генов (PTGS): Форма сайленсинга генов, в которой ингибирующий механизм включается после транскрипции. Он может приводить к сниженному стационарному уровню конкретной РНК-мишени или ингибированию трансляции (Tuschl, ChemBiochem, 2: 239-245, 2001). В литературе для обозначения посттранскрипционного сайленсинга генов часто используют термины РНК-интерференция (РНКи) и посттранскрипционная косупрессия.
Промотор: Набор контрольных последовательностей нуклеиновой кислоты, который контролирует транскрипцию нуклеиновой кислоты посредством распознавания и связывания, например, РНК-полимеразы II и других белков (транс-действующих факторов транскрипции) для инициации транскрипции. Промотор включает необходимые последовательности нуклеиновой кислоты рядом с участком начала транскрипции, такие как, в случае промотора типа полимеразы II, элемент TATA. Как правило, минимально промотор также включает по меньшей мере участок связывания РНК-полимеразы, а может включать один или несколько участков связывания факторов транскрипции, которые модулируют транскрипцию в ответ на связывание факторов транскрипции. Типичные примеры промоторов (и элементов, которые можно скомпоновать с получением промотора) описаны в настоящем документе. Промоторы можно определить по их временному, пространственному или связанному с развитием профилю экспрессии.
Промотор растения представляет собой природный или неприродный промотор, который функционирует в клетках растений.
Тканеспецифические, регулируемые развитием промоторы включают промотор β-конглицинина 7Sα и специфичные для семян промоторы. Функционирующие в растениях промоторы, пригодные для предпочтительной экспрессии в пластидах семян, включают промоторы белков, вовлеченных в биосинтез жирных кислот в семенах масличных культур и запасных белков растений. Примеры таких промоторов включают 5'-регуляторные области из таких транскрибируемых последовательностей молекул нуклеиновых кислот, как фазеолин, напин, зеин, соевый ингибитор трипсина, ACP, стеароил-ACP-десатураза и олеозин. Другим иллюстративным тканеспецифическим промотором является промотор лектина, который специфичен для ткани семян.
Белок: Биологическая молекула, например, полипептид, экспрессируемый в соответствии с геном и состоящий из аминокислот.
Протопласт: Выделенная клетка растения без клеточной стенки с потенциалом к трансформации и/или регенерации в культуру клеток или целое растение.
Очищенный: Термин очищенный не требует абсолютной чистоты; предпочтительнее он предложен в качестве относительного термина. Таким образом, например, препарат очищенного слитого белка представляет собой препарат, в котором слитый белок более представлен, чем белок существует в среде его получения, например, в клетке или в емкости для биохимических реакций. Предпочтительно, препарат слитого белка очищают так, чтобы слитый белок представлял по меньшей мере 50% общего содержания белка препарата.
Рекомбинантный: Рекомбинантная нуклеиновая кислота представляет собой нуклеиновую кислоту, которая содержит последовательность, которая не является природной, или содержит последовательность, которую получают посредством искусственной комбинации двух разделенных в остальных случаях участков последовательностей. Эту искусственную комбинацию часто получают посредством химического синтеза или, более часто, посредством искусственного манипулирования выделенными участками нуклеиновых кислот, например, посредством способов генетической инженерии.
Подобным образом, рекомбинантный белок представляет собой белок, кодируемый рекомбинантной молекулой нуклеиновой кислоты.
Индуцибельный промотор: Промотор, активность которого регулирует (прямо или опосредованно) такое средство, как фактор транскрипции, химическое соединение, условия окружающей среды или молекула нуклеиновой кислоты.
Регуляция экспрессии гена: Процессы контроля экспрессии гена посредством увеличения или снижения экспрессии, продукции или активации средства, которое воздействует на экспрессию гена. Средство может представлять собой белок, такой как фактор транскрипции, или молекулу нуклеиновой кислоты, такую как молекула мкРНК или миРНК, которая при контакте с геном, или его расположенными выше регуляторными последовательностями, или иРНК, кодируемой геном, увеличивает или снижает экспрессию гена.
Регуляторные последовательности или элементы: Эти термины в основном относятся к классу полинуклеотидных молекул (таких как молекулы ДНК, содержащие последовательности ДНК), которые влияют на или контролируют транскрипцию или трансляцию функционально связанных транскрибируемых полинуклеотидных молекул, и, таким образом, на экспрессию генов. В термин включены промоторы, энхансеры, лидерные последовательности, интроны, области контроля локусов, граничные элементы/инсуляторы, сайленсеры, области прикрепления к матриксу (также обозначаемые как области прикрепления к ядерному каркасу), репрессоры, терминаторы трансляции (также называемые областями терминации транскрипции), участки начала репликации, центромеры и "горячие точки" мейотической рекомбинации. Промоторы представляют собой последовательности ДНК, расположенные рядом с 5'-концом гена, которые действуют в качестве участка связывания РНК-полимеразы и с которых начинается транскрипция. Энхансеры представляют собой контрольные элементы, которые увеличивают уровень транскрипции с промотора, как правило, независимо от ориентации энхансера или его расстояния от промотора. Области контроля локуса (LCR) обеспечивают тканеспецифическую и регулируемую по времени экспрессию генов, с которыми они связаны. LCR функционируют независимо от их положения относительно генов, но зависимо от количества копий. Полагают, что они функционируют, раскрывая нуклеосомные структуры так, что другие факторы могут связываться с ДНК. LCR также могут воздействовать на временные параметры репликации и использование точек начала репликации. Инсуляторы (также известные как граничные элементы) представляют собой последовательности ДНК, которые предотвращают активацию (или инактивацию) транскрипции гена, блокируя действие окружающего хроматина. Сайленсеры и репрессоры представляют собой контрольные элементы, которые супрессируют экспрессию гена; они действуют на ген независимо от их ориентации или расстояния от гена. Области прикрепления к матриксу (MAR), также известные как области прикрепления к ядерному каркасу, представляют собой последовательности в ДНК, которые связываются с ядерным каркасом. Они могут воздействовать на транскрипцию, возможно, разделяя хромосомы в регуляторные домены. Полагают, что MAR опосредуют высокоуровневые петлевые структуры в хромосомах. Терминаторы трансляции представляют собой области вблизи генов, в которых РНК-полимераза покидает матрицу. Участки начала репликации представляют собой области генома, которые в течение фаз синтеза или репликации ДНК клеточного деления начинают процесс репликации ДНК. "Горячие точки" мейотической рекомбинации представляют собой области генома, которые более часто рекомбинируют, чем в среднем при митозе. Конкретные нуклеотиды в регуляторной области могут выполнять несколько функций. Например, конкретный нуклеотид может составлять часть промотора и участвовать в связывании белка активатора транскрипции.
Выделенные регуляторные элементы, которые функционируют в клетках (например, у растений или в клетках растений), пригодны для модификации фенотипов растений, например, посредством генетической инженерии.
РНК: Как правило, линейный полимер мономеров рибонуклеиновой кислоты, связанных фосфодиэфирными связями. Природные молекулы РНК разделяются на три основных класса: информационная (иРНК, которая кодирует белки), рибосомная (рРНК, компоненты рибосом) и транспортная (тРНК, молекулы, ответственные за перенос мономеров аминокислот к рибосоме при синтезе белка). Информационная РНК включает гетероядерную (гяРНК) и мембраноассоциированную полисомальную РНК (связанную с шероховатым эндоплазматическим ретикулумом). Тотальная РНК относится к гетерогенной смеси всех типов молекул РНК.
РНК-интерференция (РНКи): Механизмы сайленсинга генов, которые включают малую РНК (включая мкРНК и миРНК), часто обозначают широким термином РНКи. Природные функции РНКи включают защиту генома от инвазии мобильных генетических элементов, таких как транспозоны и вирусы, и регуляцию экспрессии гена.
РНК-интерференция приводит к инактивации или супрессии экспрессии гена в организме. РНКи можно инициировать одним из двух основных путей. Во-первых, ее можно инициировать посредством прямой доставки в клетки малой интерферирующей РНК (миРНК, как правило, длиной ~21 нуклеотид и доставляемая в форме дуплексов дцРНК с двумя неспаренными нуклеотидами на каждом из 3'-концов), с последовательностью, комплементарной РНК, которая является мишенью супрессии. Во-вторых, РНКи можно инициировать одним из нескольких способов, при которых миРНК образуется in vivo из различных типов сконструированных, экспрессируемых генов. Эти гены, как правило экспрессируют молекулы РНК, которые формируют внутри- или межмолекулярные дуплексы (дцРНК), которые процессируют природные ферменты (DICER или DCL) с формированием миРНК. В некоторых случаях эти гены экспрессируют формирующие "шпильки" транскрипты РНК с точным или почти точным спариванием оснований; некоторые из формирующих шпильки с неточным спариванием транскриптов формируют особый тип малых РНК, называемых микроРНК (мкРНК). В любом общем способе существуют миРНК (или мкРНК), которые функционируют в качестве "направляющих последовательностей", направляя разрушающий РНК фермент (называемый RISC) на расщепление или сайленсинг РНК-мишени. В некоторых случаях, предпочтительно интегрировать индуцирующий РНКи ген в геном трансгенного организма. Примером может быть растение, которое модифицировано с супрессией конкретного гена посредством индуцирующего РНКи трансгена. В большинстве способов с практическим осуществлением в настоящее время на практике РНКи инициируют в трансгенных растениях трансгенами, которые экспрессируют дцРНК (внутримолекулярные или шпилечные, или межмолекулярные, в которых два транскрипта отжигаются с формированием дцРНК).
РНК-сайленсинг: Общий термин, который используют для указания основанного на РНК сайленсинга генов или РНКи.
Идентичность последовательностей: Сходство между двумя последовательностями нуклеиновой кислоты или двумя последовательностями аминокислот выражают в терминах сходства между последовательностями, иначе обозначаемого как идентичность последовательностей. Идентичность последовательностей часто измеряют на основе процента идентичности (или сходства или гомологии); чем больше процент, тем более сходными являются две последовательности. При выравнивании стандартными способами гомологи биспецифических слитых белков обладают относительно высокой степенью идентичности последовательностей.
Способы выравнивания последовательностей для равнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны в: Smith and Waterman (Adv. Appl. Math. 2: 482, 1981); Needleman and Wunsch (J. Mol. Biol. 48: 443, 1970); Pearson and Lipman (PNAS. USA 85: 2444, 1988); Higgins and Sharp (Gene, 73: 237-244, 1988); Higgins and Sharp (CABIOS 5: 151-153, 1989); Corpet et al. (Nuc. Acids Res. 16: 10881-90, 1988); Huang et al. (Comp. Appls Biosci. 8: 155-65, 1992); and Pearson et al. (Methods in Molecular Biology 24: 307-31, 1994). В Altschul et al. (Nature Genet., 6: 119-29, 1994) представлено подробное обсуждение способов выравнивания последовательностей и расчета гомологии.
Для проведения сравнений последовательностей можно использовать средства выравнивания ALIGN (Myers and Miller, CABIOS 4: 11-17, 1989) или LFASTA (Pearson and Lipman, 1988) (Internet Program © 1996, W. R. Pearson and the University of Virginia, "fasta20u63" версия 2.0u63, дата издания декабрь 1996). ALIGN сравнивает друг с другом полные последовательности, тогда как LFASTA сравнивает области локального сходства. Эти средства выравнивания и соответствующие им учебные материалы доступны в Интернет по адресу http://biology.ncsa.uiuc.edu.
Как правило, ортологи описанных биспецифических слитых белков характеризуются наличием более 75% идентичности последовательностей, рассчитываемых при полноразмерном выравнивании с аминокислотной последовательностью биспецифического слитого белка с использованием ALIGN, установленного на параметры по умолчанию. Белки с гораздо большим сходством с эталонными последовательностями демонстрируют увеличенный процент идентичности при оценке этим способом, например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательностей. Кроме того, идентичность последовательностей можно сравнивать по всей длине одного или обоих связывающих доменов описанных слитых белков. В таком случае процент идентичности по существу сходен с процентом идентичности, обсуждаемым для идентичности полноразмерных последовательностей.
Когда на идентичность последовательностей сравнивают значимо меньше полных последовательностей, как правило, гомологи обладают по меньшей мере 80% идентичности последовательностей в коротких окнах из 10-20 аминокислот, и могут обладать идентичностью последовательностей по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% в зависимости от их сходства с эталонной последовательностью. Идентичность последовательностей в таких коротких окнах можно определять с использованием LFASTA; способы можно найти в Интернет по адресу http://biology.ncsa.uiuc.edu. Специалисту в данной области понятно, что эти диапазоны идентичности последовательностей предоставлены только для руководства; вполне возможно, что можно получать более значимые гомологи, которые выходят за указанные диапазоны. В настоящем изобретении представлены не только пептидные гомологи, которые описаны выше, но также и молекулы нуклеиновой кислоты, которые кодируют такие гомологи.
Альтернативным показателем того, что две молекулы нуклеиновой кислоты являются близкородственными, является то, что две молекулы гибридизуются друг с другом в жестких условиях. Жесткие условия зависят от последовательностей и отличаются в различных параметрах окружающей среды. Как правило, жесткие условия выбирают так, чтобы они были приблизительно на 5-20°C ниже, чем температура плавления (Tm) конкретной последовательности при различных ионной силе и pH. Tm представляет собой температуру (при различных ионной силе и pH), при которой 50% последовательности-мишени гибридизуется с точно совпадающим зондом. Условия гибридизации нуклеиновых кислот и расчеты жесткости можно найти в Sambrook et al. (In Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, New York, 1989) и Tijssen (Laboratory Techniques in Biochemistry and Molecular Biology Part I, Ch. 2, Elsevier, New York, 1993). Молекулы нуклеиновой кислоты, которые в жестких условиях гибридизуются с описанными выше последовательностями, кодирующими биспецифические слитые белки, как правило, гибридизуются с зондом на основе любой из кодирующих полные слитые белки, полные связывающие домены последовательностей или других выбранных частей кодирующих последовательностей в условиях отмывки 0,2× SSC, 0,1% SDS при 65°C.
Однако последовательности нуклеиновых кислот, которые не демонстрируют высокой степени идентичности, могут кодировать сходные аминокислотные последовательности вследствие вырожденности генетического кода. Следует понимать, что с использованием этой вырожденности можно проводить изменения в последовательности нуклеиновой кислоты с получением нескольких последовательностей нуклеиновой кислоты, каждая из которых кодирует по существу один и тот же белок.
Малая интерферирующая РНК (миРНК): РНК длиной приблизительно 21-25 нуклеотидов, которые процессирует с дцРНК фермент DICER (у животных) или фермент DCL (у растений). Исходные продукты DICER или DCL являются двухцепочечными, две цепи которых, как правило, составляют 21-25 нуклеотидов в длину и содержат два неспаренных основания на каждом из 3'-концов. Происходит разделение индивидуальных цепей в структуре двухцепочечной миРНК, и, как правило, затем происходит ассоциация одной из миРНК с мультисубъединичным комплексом, индуцированным РНКи комплексом сайленсинга (RISC). Типичной функцией миРНК является направление RISC к мишени на основе комплементарности пар оснований.
Транскрибируемая полинуклеотидная молекула: Любая полинуклеотидная молекула, способная к транскрибированию в молекулу РНК. Специалистам известны способы введения конструкций в клетку таким образом, чтобы транскрибируемая полинуклеотидная молекула транскрибировалась в функциональную молекулу иРНК, т.е. транслировалась и, таким образом, экспрессировалась в качестве белкового продукта. Также можно конструировать конструкции способные к экспрессии молекул антисмысловых РНК для ингибирования трансляции конкретной молекулы РНК, представляющей интерес. Общепринятые композиции и способы получения и использования конструкций и клеток-хозяев хорошо известны специалисту в данной области (см. например, Molecular Cloning: A Laboratory Manual, 3rd edition Volumes 1, 2, and 3. Sambrook et al., Cold Spring Harbor Laboratory Press, 2000).
Транскрипция: Продукция молекулы РНК РНК-полимеразой в виде комплементарной копии последовательности ДНК.
Область терминации транскрипции: Последовательности, которые контролируют формирование 3'-конца транскрипта. Примерами последовательностей терминации транскрипции являются саморасщепляющиеся рибозимы и последовательности полиаденилирования.
Транскрипционный сайленсинг генов (TGS): Явление, запускаемое формированием дцРНК, гомологичной промоторным областям генов и иногда кодирующим областям. TGS приводит к метилированию ДНК и гистонов и перестройке хроматина, таким образом, вызывая ингибирование транскрипции, а не разрушение РНК. И TGS, и PTGS зависят от дцРНК, которая расщепляется на малую (21-25 нуклеотидов) интерферирующую РНК (Eckhardt, Plant Cell, 14:1433-1436, 2002; Aufsatz et al., Proc. Natl. Acad. Sci. U.S.A., 99:16499-16506, 2002).
Трансгенный: Этот термин относится к растению/грибу/клетке/другому существу или организму, которые содержат рекомбинантный генетический материал в норме, не присутствующий в существах этого типа/вида (т.е. гетерологичный генетический материал), который введен рассматриваемому существу (или предкам существа) посредством действий человека. Таким образом, растение, которое выращивают из растительной клетки, в которую посредством трансформации введена рекомбинантная ДНК (трансформированная клетка растения), представляет собой трансгенное растение, также как и все потомки этого растения, которые содержат введенный трансген (полученные половым или бесполым путем).
Трансформация: Процесс, посредством которого экзогенная ДНК попадает в клетку-реципиента и изменяет ее. Она может проходить в природных условиях или искусственных условиях с использованием различных способов, хорошо известных в данной области. Трансформация может основываться на любом известном способе вставки чужеродных последовательностей нуклеиновой кислоты в прокариотическую или эукариотическую клетку-хозяина. Выбор способа зависит от трансформируемой клетки-хозяина и в качестве неограничивающих примеров может включать инфекцию вирусом, электропорацию, липофекцию и бомбардировку частицами.
Трансформированный: Трансформированная клетка представляет собой клетку, в которую молекулярно-биологическими способами введена молекула нуклеиновой кислоты. Трансформированные клетки включают стабильно трансформированные клетки, в которых введенная ДНК способна к репликации в качестве автономно реплицирующейся плазмиды или в качестве части хромосомы хозяина. Они также включают клетки, которые транзиторно экспрессируют введенную ДНК или РНК в течение ограниченных периодов времени. Как используют в настоящем документе, термин трансформация включает все способы, посредством которых молекулу нуклеиновой кислоты можно ввести в такую клетку, включая трансфекцию вирусными векторами, трансформацию плазмидными векторами и введение чистой ДНК посредством электропорации, липофекции и ускорения посредством генной пушки.
Транспозон: Нуклеотидная последовательность, такая как последовательность ДНК или РНК, способная к перемене положения или перемещению в гене, хромосоме или геноме.
Трансгенное растение: Растение, содержащее чужеродную (гетерологичную) нуклеотидную последовательность, встроенную в его ядерный геном или в геном его органелл.
Трансген: Последовательность нуклеиновой кислоты, вводимая в клетку-хозяина или клетки-хозяева способом трансформации.
Вектор: Молекула нуклеиновой кислоты, вводимая в клетку-хозяина, таким образом, формирующая трансформированную клетку-хозяина. Вектор может включать последовательности нуклеиновой кислоты, которые позволяют ему реплицироваться в клетке-хозяине, такие как участок начала репликации. Вектора также могут включать один или несколько терапевтических генов и/или генов селективных маркеров и другие генетические элементы, известные в данной области. Вектор может трансдуцировать, трансформировать или инфицировать клетку, таким образом, вызывая экспрессию в клетке нуклеиновых кислот и/или белков, отличных от собственных нуклеиновых кислот и/или белков клетки. Вектор необязательно включает средства для содействия входу нуклеиновой кислоты в клетку, такие как вирусная частица, липосома, белковое покрытие или т.п.
Если не указано иначе, все технические и научные термины, используемые в настоящем документе, имеют то же значение, как обычно понимает специалист в области, к которой принадлежит данное изобретение. Если из контекста не очевидно иначе, термины в единственном числе включают указание на множественное число. Подобным образом, если из контекста не очевидно иначе, слово "или" предназначено для включения "и". Таким образом "содержащий A или B" означает содержащий A или B или A и B. Также следует понимать, что все размеры в основаниях или размеры в аминокислотах и все значения молекулярной массы, приведенные для нуклеиновых кислот или полипептидов, являются приблизительными и предоставлены для описания. Хотя в практическом осуществлении или тестировании по настоящему изобретению можно использовать способы и материалы, подобные или эквивалентные способам и материалам, описываемым в настоящем документе, ниже описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие ссылки, приводимые в настоящем документе, полностью включены в качестве ссылки. В случае конфликта руководствоваться следует настоящим описанием, включая пояснения терминов. Кроме того, материалы, способы и примеры являются исключительно иллюстративными и не предназначены для ограничения.
III. Обзор различных вариантов осуществления
В настоящем описании описаны новые области инициации транскрипции, содержащие энхансерный домен и домен регуляции транскрипции под энхансерным контролем энхансерного домена. Энхансерный домен содержит множество (например, от двух до четырех или более) копий природного, но ранее неизвестного энхансера SCBV, расположенного в тандеме. Области регуляции транскрипции (промоторы) по настоящему изобретению обеспечивают усиленную транскрипцию по сравнению с промотором в отсутствие энхансерного домена. В одном из вариантов осуществления описана химерная область регуляции транскрипции, содержащая одну или несколько копий энхансерного элемента SCBV, представленного от положения 337 до положения 618 в SEQ ID NO: 1; и функционально связанная с ними, где промотор содержит участок связывания РНК-полимеразы и участок инициации иРНК, где когда представляющая интерес нуклеотидная последовательность транскрибируется под регуляторным контролем химерной области регуляции транскрипции, количество продукта транскрипции по сравнению с количеством продукта транскрипции, получаемого с использованием химерной области регуляции транскрипции, содержащей промотор и не содержащей энхансерной последовательности(ей) SCBV, увеличено. В некоторых вариантах осуществления химерная область регуляции транскрипции содержит промотор, получаемый из расположенной выше начала транскрипции области гена вируса растений, бактериального гена, гена гриба, гена ядра растения, внеядерного гена растения, гена беспозвоночного или гена позвоночного. В некоторых вариантах осуществления промотор специфичен для семян.
Также предоставлены конструкции ДНК, содержащие описываемую область регуляции транскрипции и последовательность ДНК, предназначенную для трансляции. В некоторых вариантах осуществления описана конструкция ДНК, содержащая область инициации транскрипции, функционально связанную с транскрибируемой полинуклеотидной молекулой, функционально связанной с 3'-концевой полинуклеотидной молекулой терминации транскрипции. В одном из вариантов осуществления транскрибируемая полинуклеотидная молекула обеспечивает у растения, в котором она экспрессируется, агрономический признак. В другом варианте осуществления транскрибируемая полинуклеотидная молекула обеспечивает у растения, в котором она экспрессируется, модифицированный профиль жирных кислот. В конечном варианте осуществления транскрибируемая полинуклеотидная молекула обеспечивает у растения, в котором она экспрессируется, профиль со сниженным количеством насыщенных жирных кислот.
Также предоставлены трансгенные растения. В одном из вариантов осуществления трансгенное растение стабильно трансформировано описанной конструкцией ДНК. В некоторых вариантах осуществления трансгенное растение является двудольным. В других вариантах осуществления трансгенное растение является однодольным. В одном конкретном варианте осуществления трансгенное растение представляет собой растение кукурузы. Во втором конкретном варианте осуществления трансгенное растение представляет собой растение Arabidopsis thaliana.
Кроме того предоставлены семена описанного трансгенного растения. В одном из вариантов осуществления семена содержат описываемую конструкцию ДНК.
Кроме того предоставлена трансгенная клетка или ткань растения. В одном из вариантов осуществления трансгенная клетка или ткань растения содержит описанную химерную область регуляции транскрипции. В некоторых вариантах осуществления клетку или ткань растения получают из двудольного растения. В других вариантах осуществления клетку или ткань растения получают из однодольного растения. В одном конкретном варианте осуществления клетка или ткань растения происходят из растения кукурузы. Во втором конкретном варианте осуществления трансгенное растение представляет собой растение Arabidopsis thaliana.
Также предоставлены способы получения описанного трансгенного растения, клеток, семян или тканей растения. В некоторых вариантах осуществления способ включает трансформацию клетки или ткани растения описанной конструкцией ДНК.
Дополнительно предоставлены клетки, плоды, листья, корни, побеги, цветки, семена, срезы и другие репродуктивные материалы растения, пригодные для полового или бесполого размножения, потомство растения, включая гибриды F1, стерильные по мужскому полу растения и все другие растения и растительные продукты, получаемые из описанных трансгенных растений.
Также описана клетка, ткань или растение кукурузы или Arabidopsis thaliana, содержащие одну или несколько копий энхансерного элемента SCBV, представленного от положения 337 до положения 618 в SEQ ID NO: 1. В одном из вариантов осуществления клетка, ткань или растение кукурузы Arabidopsis thaliana содержат одну или несколько копий энхансерного элемента SCBV, представленного от положения 337 до положения 618 в SEQ ID NO: 1, где одна или несколько копий энхансерного элемента SCBV встроены в геном клетки, ткани или растения кукурузы или Arabidopsis thaliana в случайном положении. В некоторых вариантах осуществления энхансер SCBV обеспечивает усиленную транскрипцию представляющей интерес нуклеотидной последовательности, находящейся под регуляторным контролем энхансера SCBV, по сравнению с транскрипцией представляющей интерес нуклеотидной последовательности в отсутствие энхансера SCBV.
IV. Энхансер SCBV и его применения
В настоящем описании предоставлена ранее неизвестная энхансерная область из генома палочковидного баднавируса сахарного тростника (SCBV), где этот энхансер пригоден для увеличения эффективности транскрипции, что может приводить к усиленной транскрипции последовательностей ДНК под контролем энхансера. Особый интерес представляет усиленная транскрипция генных последовательностей, которые могут быть того же генетического происхождения что и хозяин или чужеродного происхождения, природными последовательностями (в смысловой и антисмысловой ориентациях) или синтетически полученными последовательностями. Указанные энхансеры содержат множество из двух или более копий ранее неизвестного природного энхансерного домена SCBV (последовательность которого предоставлена в SEQ ID NO: 1, в положениях от 337 до 618). Энхансер содержит по меньшей мере две копии последовательности энхансерного домена, в некоторых вариантах осуществления три, или четыре, или более копий, расположенных в тандеме.
Также предусмотрены гомологичные энхансеры. Не намереваясь каким-либо образом ограничиваться характерные гомологичные последовательности могут включать последовательности из других промоторов SCBV, например, из различных изолятов SCBV, таких как изоляты, описанные в Braithwaite et al. (Plant Cell Rep. 23:319-326, 2004; полностью включенной в настоящий документ в качестве ссылки) или в патенте США № 5994123 (полностью включенным в настоящий документ в качестве ссылки).
Природный энхансер содержит последовательность ДНК, которая в своем природном окружении расположена выше и в пределах приблизительно 600 п.н. от промотора. Принимая инициаторный нуклеотид иРНК за 0, последовательность, содержащая энхансер, расположена приблизительно от -50 до приблизительно -1000 п.н., как правило, приблизительно от -50 до -950 п.н., как правило, составляя приблизительно от -100 до -800 п.н. Энхансерный домен является цис-действующим и желательно расположен в пределах приблизительно 10000 п.н., как правило, приблизительно 2000 п.н., еще чаще, рядом или в пределах приблизительно 1000 п.н. от последовательности инициации транскрипции, на которую должен воздействовать энхансер. Энхансер может находиться в любой ориентации относительно последовательности инициации транскрипции и может располагаться выше или ниже относительно промотора, активность которого он усиливает, хотя, как правило, он расположен выше.
Энхансерный домен по настоящему изобретению находит применение в широком спектре последовательностей инициации, включая промоторы, которые в природе находятся под контролем энхансера, например, в цис-положении (рядом и гомологично), а также последовательности, в норме не ассоциированные с конкретным энхансером (например, гетерологично). Энхансерный домен и домен инициации транскрипции могут принадлежать к одному или различным царствам, семействам или видам. Представляющие интерес виды включают прокариоты и эукариоты, такие как бактерии, растения, насекомые, млекопитающие и т.д. Комбинации включают описанный энхансерный домен(ы) SCBV (вирусный) с областью инициации транскрипции структурного гена: хозяина SCBV (например, из сахарного тростника), других видов растений (например, того же или другого семейства), насекомого, позвоночного животного, бактерии, гриба и т.д.
Изобретение также предусматривает конструкции ДНК, содержащие указанную область инициации транскрипции, и последовательность ДНК под контролем области инициации транскрипции, предназначенную для трансляции. Последовательность ДНК может содержать природную открытую рамку считывания, включая транскрибируемые 5'- и 3'-фланкирующие последовательности. Альтернативно, она может содержать антисмысловую последовательность в том смысле, что она кодирует молекулу, комплементарную молекуле РНК или ее части. Когда конструкция содержит открытую рамка считывания (ORF), кодирующую белок, получают увеличенную скорость инициации транскрипции, что, как правило, приводит к увеличенному количеству полипептидного продукта экспрессии гена. Когда конструкция содержит антисмысловую последовательность, усиленная транскрипция РНК, комплементарной дикому типу, супрессирует экспрессию иРНК дикого типа, таким образом, снижая количество полипептидного продукта экспрессии; предусмотрено, что рассматриваемая иРНК дикого типа может соответствовать природной иРНК клетки-хозяина или иРНК патогенного организма, такого как вирус или гриб.
В различных вариантах осуществления последовательность ДНК, предназначенная для трансляции, содержит: кодирующую белок последовательность(и) гена (например, растения, животного, бактерии, вируса или гриба), которая может содержать: природную открытую рамку(и) считывания, кодирующую белковый продукт; последовательности комплементарной ДНК (кДНК), получаемые из иРНК, кодируемой геном; синтетическую ДНК, обеспечивающую желаемую кодирующую последовательность(и); кодирующую белок последовательность(и), происходящую из экзонов природного гена, такую как открытая рамка(и) считывания, получаемая посредством лигирования экзонов; и/или комбинации любых двух или более из них. С этими последовательностями связаны подходящие последовательности терминации транскрипции/полиаденилирования; последовательности из природных генов (например, растения, животного, бактерии, вируса или гриба), кодирующие первичный продукт РНК, состоящий из экзонов и интронов (например, транскрибируемые природной полимеразой II и полимеразой III гены эукариот); синтетические последовательности ДНК, кодирующие конкретные РНК или белковый продукт; последовательности ДНК, полученные модификацией известных кодирующих последовательностей (например, последовательностей природных генов) посредством мутагенеза (такого как сайт-специфический мутагенез) и/или другого способа генетической инженерии; химеры любых из указанных выше, получаемые посредством лигирования фрагментов ДНК, включая химеры, кодирующие слитые белки; и/или последовательности ДНК, кодирующие молекулы, комплементарные молекулам РНК или их частям.
Усиленная транскрипция у растений может находить применение в усилении продукции белков, характерных для растений (эндогенных - т.е. в норме присутствующих у хозяина дикого типа) или белков из других генетических источников (экзогенных - т.е. в норме не присутствующих у хозяина дикого типа). Примеры типов последовательностей для экспрессии с энхансеров и химерных областей регуляции транскрипции, описываемых в настоящем документе, включают: модифицирующие жирные кислоты белки; антисмысловые или малые ингибирующие РНК (для супрессии генов); важные с точки зрения питания белки; факторы роста; белки, дающие растениям защиту в определенных условиях окружающей среды, например, белки, придающие устойчивость к металлам, солям или токсичности других видов; связанные со стрессом белки, обеспечивающие устойчивость к экстремумам температуры, замораживанию и т.д.; белки, обеспечивающие растениям защиту от вредителей или инфекций, например, белки, придающие устойчивость к бактериальной, грибковой или другой микробной инфекции или устойчивость к истреблению насекомыми (например, токсин B. thuringiensis) или к другим беспозвоночным или позвоночным животным; соединения медицинской важности, не относящиеся к растениям, например, противомикробные, противоопухолевые и т.д.; белки или другие соединения особой коммерческой ценности; увеличенные уровни белков, например, ферментов метаболических путей (например, путей продукции полифенольных соединений или других вторичных метаболитов); увеличенные уровни продуктов структурного для растения-хозяина значения и т.д. Длина представляющих интерес транскрибируемых последовательностей составляет по меньшей мере приблизительно 8 п.н., по меньшей мере приблизительно 12 п.н., по меньшей мере приблизительно 20 п.н. и может составлять одну или несколько тысячи пар оснований (т.п.н.).
V. Конструкции
Как правило, конструкции по настоящему изобретению содержат химерную область регуляции транскрипции, содержащую одну или несколько копий предоставляемого энхансерного элемента SCBV, функционально связанного с промотором (как правило, содержащим по меньшей мере участок связывания РНК-полимеразы и участок инициации иРНК), где эта область функционально связана с транскрибируемой полинуклеотидной молекулой, функционально связанной с 3'-концевой полинуклеотидной молекулой терминации транскрипции. Кроме того, конструкции в качестве неограничивающих примеров могут содержать дополнительные регуляторные полинуклеотидные молекулы из 3'-нетранслируемой области (3'-UTR) генов растений (например, 3'-UTR для увеличения стабильности иРНК, такой иРНК, как область терминации картофеля или октопина PI-II, или 3'-концевые области терминации нопалинсинтазы). Конструкции в качестве неограничивающих примеров могут содержать 5'-нетранслируемые области (5'-UTR) полинуклеотидной молекулы иРНК, которые могут играть важную роль в инициации трансляции, а также могут представлять собой генетический компонент в экспрессирующей конструкции растений. Например, показано, что экспрессию генов у растений усиливают нетранслируемые 5'-концевые лидерные полинуклеотидные молекулы, получаемые из генов белков теплового шока (см. например, патенты США №№ 5659122 и 5362865, каждый из которых полностью включен в качестве ссылки). Такие дополнительные расположенные выше и ниже регуляторные полинуклеотидные молекулы, как представлены в конструкции, можно получать из источника, который является встречающимся вместе в природе или гетерологичным относительно других элементов, присутствующих в конструкции.
Таким образом, один из вариантов осуществления представляет собой конструкцию, содержащую саму химерную область регуляции транскрипции, содержащую одну или несколько копий (например, две, три, четыре или более копий) энхансерного элемента SCBV, представленного от положения 337 до положения 618 в SEQ ID NO: 1, функционально связанные с промотором, функционально связанным c транскрибируемой полинуклеотидной молекулой так, чтобы после введения конструкции в клетку растения контролировать транскрипцию указанной транскрибируемой полинуклеотидной молекулы на желаемом уровне и/или в желаемой ткани или на желаемом пути развития. Транскрибируемая полинуклеотидная молекула в некоторых примерах содержит кодирующую белок область гена, и химерная область регуляции транскрипции обеспечивает транскрипцию молекулы функциональной иРНК, которая транслируется и экспрессируется с конструкции на уровне белкового продукта. В другом варианте осуществления транскрибируемая полинуклеотидная молекула содержит антисмысловую область гена, и химерная область регуляции транскрипции влияет на транскрипцию антисмысловой молекулы РНК или другой сходной ингибирующей РНК с ингибированием экспрессии конкретной представляющей интерес молекулы РНК в являющейся мишенью клетке-хозяине.
Дополнительные примеры конструкций по настоящему изобретению включают конструкции ДНК с двумя граничными областями Ti-плазмиды, содержащие правую граничную (RB или AGRtu.RB) и левую граничную (LB или AGRtu.LB) области Ti-плазмиды, выделенной из Agrobacterium tumefaciens, содержащей Т-ДНК, которая вместе с транспортными молекулами, обеспечиваемыми клетками Agrobacterium, обеспечивает интеграцию Т-ДНК в геном клетки растения. Также конструкции могут содержать участки ДНК плазмидного каркаса, которые обеспечивают функцию репликации и отбора по антибиотику в бактериальных клетках, например, участок начала репликации Escherichia coli, такой как ori322, участок начала репликации широкого спектра хозяев, такой как oriV или oriRi, и кодирующую область селективного маркера, такую как Spec/Strp, кодирующую аминогликозидаденилтрансферазу Tn7 (aadA), придающую устойчивость к спектиномицину или стрептомицину, или ген селективного маркера гентамицина (Gm, Gent). Для трансформации растений характерные бактериальные штаммы-хозяева включают ABI, C58 или LBA4404 Agrobacterium tumefaciens; однако можно использовать другие штаммы, известные специалистам в области трансформации растений.
Желательной является идентификация промоторов, которые могут обеспечивать высокие уровни экспрессии фермента ацил-КоА-дельта-9-десатуразы в специфичных для семян тканях. Фермент ацил-КоА-дельта-9-десатураза растений является растворимым. Он находится в строме пластид и в качестве субстратов использует вновьсинтезированные жирные кислоты, этерифицированные ACP, преимущественно стеарил-ACP. Это отличается от других дельта-9-десатуразных ферментов, которые находятся в мембране эндоплазматического ретикулума (ER или микросомальной) и в качестве субстратов использует жирные кислоты, этерифицированные КоА, и десатурирует насыщенные жирные кислоты пальмитат и стеарат. К десатуразам растений относятся патенты США №№ 5723595 и 6706950.
Экспрессия микробных генов дельта-9-десатураз у растений известна в данной области. Ген дельта-9-десатуразы Saccharomyces cerevisiae вводили в ткань листа табака (Polashcok, J. et al., FASEB J 5:A1157 (1991) и явным образом экспрессировали в этой ткани. Кроме того, этот ген экспрессировали в томате. См. Wang et al., J. Agric Food Chem. 44:3399-3402 (1996) и C. Wang et al., Phytochemistry 58:227-232 (2001). Хотя в табаке и томате описано некоторое увеличение определенных ненасыщенных соединений и некоторое снижение определенных насыщенных соединений, табак и томат не являются масличными культурами. Этот ген дрожжей также вводили в Brassica napus (см. патент США № 5777201). Другую дельта-9-десатуразу грибов из Aspergillus nidulans вводили в канолу для обеспечения снижения насыщенных жирных кислот в масле семян (см. US 20080260933 A1). В этом случае в масле семян наблюдали большее снижение стеарата (61-90%), чем более представленных жирных кислот пальмитата (36-49%). Таким образом, ацил-КоА-дельта-9-десатуразы, которые действуют преимущественно на насыщенные соединения, обеспечивают дополнительное снижение насыщенных соединений.
Характеристики масел растительного или животного происхождения преимущественно определяют количеством атомов углерода и водорода, а также количеством и положением двойных связей в составе цепи жирной кислоты. Большинство масел, получаемых из растений, состоят из различных количеств пальмитиновой (16:0), стеариновой (18:0), олеиновой (18:1), линолевой (18:2) и линоленовой (18:3) жирных кислот. Как правило, пальмитиновую и стеариновую кислоты обозначают как "насыщенные", так как их углеродные цепи насыщены атомами водорода и, таким образом, не содержат двойных связей; они содержат максимальное возможное количество атомов водорода. Однако олеиновая, линолевая и линоленовые кислоты представляют собой жирные кислоты с цепями из 18 атомов углерода, содержащими одну, две и три двойные связи, соответственно. Как правило, олеиновую кислоту называют мононенасыщенной жирной кислотой, тогда как линолевую и линоленовую называют полиненасыщенными жирными кислотами. Департамент США сельского хозяйства определяет продукты "без насыщенных соединений" или "no sat" как продукты, содержащие менее 3,5% по массе комбинированных насыщенных жирных кислот (по сравнению с общим количеством жирных кислот).
Основным продуктом синтеза жирных кислот является пальмитат (16:0), которые по-видимому эффективно достраиваются до стеарата (18:0). Все еще оставаясь в пластиде, насыщенные жирные кислоты под действием фермента, известного как ацил-ACP-дельта-9-десатураза, затем могут подвергаться десатурации с введением одной или несколько двойных связей углерод-углерод. Конкретно, стеарат может подвергаться быстрой десатурации ферментом пластидной дельта-9-десатуразой с получением олеата (18:1). Фактически, пальмитат также может подвергаться десатурации в пальмитоолеат (16:1) пластидной дельта-9-десатуразой, но эта жирная кислота в большинстве растительных масел присутствует только в следовых количествах (0-0,2%). Таким образом, основными продуктами синтеза жирных кислот в пластидах являются пальмитат, стеарат и олеат. В большинстве масел основной синтезируемой жирной кислотой является олеат, тогда как насыщенные жирные кислоты присутствуют в значительно меньших пропорциях.
Последующая десатурация растительных жирных кислот вне пластид в цитоплазме по-видимому ограничена олеатом, который может подвергаться десатурации в линолеат (18:2) и линоленат (18:3) под действием микросомных десатураз, действующих на олеоильные или линеолеоильные субстраты, этерифицированные фосфатидилхолином (PC). Кроме того, в зависимости от растения, олеат может дополнительно модифицироваться посредством удлинения (до 20:1, 22:1 и/или 24:1) или посредством добавления функциональных групп. Затем эти жирные кислоты, вместе с насыщенными жирными кислотами пальмитатом и стеаратом могут формировать триглицериды.
Таким образом, один из вариантов осуществления представляет собой конструкцию, содержащую саму химерную область регуляции транскрипции, содержащую четыре копии энхансерного элемента SCBV, представленного от положения 337 до положения 618 в SEQ ID NO: 1, функционально связанные с промотором, функционально связанным с транскрибируемой полинуклеотидной молекулой, содержащей ген ацил-КоА-дельта-9-десатуразы. Где при введении конструкции в клетку растения, указанная ацил-КоА-дельта-9-десатураза экспрессируется на желаемом уровне и/или в желаемой ткани или в желаемом пути развития, таким образом, снижая процентное содержание насыщенной жирной кислоты в клетках и/или в желаемой ткани растения.
Также предусмотрены конструкции, содержащие по меньшей мере один энхансерный элемент SCBV (необязательно в контексте химерной области регуляции транскрипции), где конструкция представляет собой конструкцию активирующего мечения. Активирующее мечение представляет собой способ случайного и резкого повышения экспрессии генов в полногеномном масштабе, после чего можно проводить скрининг и отбирать конкретные фенотипы. Компоненты, пригодные в конструкциях активирующего мечения различного типа, известны; см., например: Walden et al., Plant Mol. Biol. 26: 1521-8, 1994 (где описана конструкция активирующего мечения Т-ДНК, которую использовали для активации генов в культуре клеток табака, получая клетки, растущие в отсутствие гормонов роста растений); Miklashevichs et al., Plant J. 12: 489-98, 1997; Harling et al., EMBO J. 16: 5855-66, 1997; Walden et al., EMBO J. 13: 4729-36, 1994 (статьи о генах, выделенных из геномных последовательностей растений, фланкирующих метку Т-ДНК и предположительно вовлеченных в ответ на гормоны роста растений); Schell et al., Trends Plant Sci. 3: 130, 1998 (где обсуждается исследование группы родственных исследований); Kardailsky et al., Science 286: 1962-1965, 1999 (где описано активирующее мечение Т-ДНК и скрининг растений по фенотипу раннего цветения); Koncz et al., Proc. Natl. Acad. Sci. U S A 86(21):8467-71, 1989 (где описано активирующее мечение с использованием промотора гена 5 Agrobacterium (pg5), который активен только в размножающихся клетках, и который для воздействия на экспрессию гена растения необходимо вставлять непосредственно рядом с ним); Wilson et al., Plant Cell 8: 659-671, 1996 (активирующее мечение, в котором используют модифицированный транспозон Ds, несущий промотор 35S CaMV и селекционную кассету nos::hpt) и Schaffer et al., Cell 93: 1219-1229, 1998 (где проиллюстрирована та же система, используемая для повышения экспрессии близлежащих генов растений, приводящая к доминантной мутации приобретения функции 1996) и Weigel et al., Plant Physiology, 122:1003-1013, 2000 (где проиллюстрированы векторы активирующего мечения, которые пригодны для скрининга десятков тысяч трансформированных растений по морфологическим фенотипам).
VI. Нуклеотидные последовательности для усиления транскрипции
Иллюстративные транскрибируемые полинуклеотидные молекулы для усиления транскрипции посредством встраивания в конструкции, предоставляемые по настоящему документу, включают, например, полинуклеотидные молекулы или гены видов, отличных от целевых видов, или гены, которые происходят из тех же видов или присутствуют в тех же видах, но встроены в клетки-реципиенты способами генетической инженерии, отличными от способов классического воспроизведения или селекции. Типы полинуклеотидных молекул в качестве неограничивающих примеров могут включать полинуклеотидные молекулы, которые уже присутствуют в клетке-мишени растения, полинуклеотидную молекулу другого растения, полинуклеотидную молекулу другого организма или полинуклеотидную молекулу, полученную вне клетки, такую как полинуклеотидная молекула, содержащая антисмысловую РНК гена, или полинуклеотидная молекула, кодирующая искусственную, синтетическую или иным образом модифицированную версию трансгена.
В одном из вариантов осуществления в конструкцию встроена полинуклеотидная молекула, как представлено в положениях от 337 до 618 SEQ ID NO: 1 (или две или более ее копии) (например, в контексте химерной области инициации транскрипции), так, что описанная энхансерная последовательность SCBV (или ряд из двух или более таких последовательностей) функционально связана с транскрибируемой полинуклеотидной молекулой, которая представляет собой ген, представляющий агрономический интерес, или другой экспрессируемой последовательностью (в более общем смысле, представляющей интерес нуклеотидной последовательностью). Как используют в настоящем документе, термин "ген, представляющий агрономический интерес" относится к транскрибируемой полинуклеотидной молекуле, которая в качестве неограничивающих примеров включает ген, который обеспечивает желаемую характеристику, ассоциированную с морфологией, физиологией, ростом и развитием, урожаем, питательным обогащением, заболеванием растения или устойчивостью растения к вредителям, или устойчивостью растения к условиям окружающей среды или химической устойчивостью растения. Экспрессия гена, представляющего агрономический интерес, желаема, например, для обеспечения агрономически важного признака. Ген, представляющий агрономический интерес, который обеспечивает полезный агрономический признак у сельскохозяйственных культур может представлять собой, например, одну или несколько последовательностей, придающих растению, экспрессирующему ген: устойчивость к гербицидам (см., например, патенты США №№ 6803501; 6448476; 6248876; 6225114; 6107549; 5866775; 5804425; 5633435; 5463175 и публикации США US20030135879 и US20030115626), увеличенный урожай (см., например, патент США USRE38.446; патенты США №№ 6716474; 6663906; 6476295; 6441277; 6423828; 6399330; 6372211; 6235971; 6222098; 5716837), устойчивость к насекомым (см., например, патенты США №№ 6809078; 6713063; 6686452; 6657046; 6645497; 6642030; 6639054; 6620988; 6593293; 6555655; 6538109; 6537756; 6521442; 6501009; 6468523; 6326351; 6313378; 6284949; 6281016; 6248536; 6242241; 6221649; 6177615; 6156573; 6153814; 6110464; 6093695; 6063756; 6063597; 6023013; 5959091; 5942664; 5942658, 5880275; 5763245; 5763241), устойчивость к грибковым заболеваниям (см., например, патенты США №№ 6653280; 6573361; 6506962; 6316407; 6215048; 5516671; 5773696; 6121436; 6316407; 6506962), устойчивость к вирусам (см., например, патенты США №№ 6617496; 6608241; 6015940; 6013864; 5850023; 5304730), устойчивость к круглым червям (см., например, патент США № 6228992), устойчивость к бактериальным заболеваниям (см., например, патент США № 5516671), рост и развитие растения (см., например, патенты США №№ 6723897; 6518488), продукцию крахмала (см., например, патенты США №№ 6538181; 6538179; 6538178; 5750876; 6476295), модифицированную продукцию масел (см., например, патенты США №№ 6444876; 6426447; 6380462), высокую продукцию масел (см., например, патенты США №№ 6495739; 5608149; 6483008; 6476295), модифицированное содержание жирных кислот (см., например, патенты США №№ 6828475; 6822141; 6770465; 6706950; 6660849; 6596538; 6589767; 6537750; 6489461; 6459018), продукцию волокна (см., например, патенты США №№ 6576818; 6271443; 5981834; 5869720), высокую продукцию белка (см., например, патент США № 6380466), созревание плодов (см., например, патент США № 5512466), улучшенную усваиваемость (см., например, патент США № 6531648), улучшенный вкус (см., например, патент США № 6011199), низкое содержание рафинозы (см., например, патент США № 6166292), увеличенную питательность для животных и/или человека (см., например, патенты США №№ 6723837; 6653530; 6541259; 5985605; 6171640), устойчивость к неблагоприятным воздействиям окружающей среды (см., например, патент США № 6072103), желаемые пептиды (например, фармацевтические или секретируемые пептиды) (см., например, патенты США №№ 6812379; 6774283; 6140075; 6080560), улучшенные свойства обработки (см., например, патент США № 6476295), промышленную продукцию ферментов (см., например, патент США № 5543576), фиксацию азота (см., например, патент США № 5229114), продукцию гибридных семян (см., например, патент США № 5689041), биополимеры (см., например, патент США № USRE37.543; патенты США №№ 6228623; 5958745 и публикацию США № US20030028917) и продукцию биологического топлива (см., например, патент США № 5998700). Генетические элементы, способы и трансгены, описанные в патентах и опубликованных заявках, перечисленных выше, включены в настоящий документ в качестве ссылки.
Альтернативно, транскрибируемая полинуклеотидная молекула может влиять на характеристики или фенотипы указанного выше (или другого) растения посредством кодирования антисмысловой молекулы или молекулы РНК, которая вызывает направленное ингибирование экспрессии эндогенного гена, например, посредством антисмысловой, ингибирующей РНК (РНКи) или опосредованных косупрессией механизмов. Также РНК может представлять собой каталитическую молекулу РНК (рибозим), сконструированную для расщепления желаемого эндогенного продукта иРНК. Таким образом, пользу от транскрипционного усиления, обеспечиваемого последовательностями и конструкциями, предоставляемыми по настоящему документу, может получить любая транскрибируемая полинуклеотидная молекула, кодирующая транскрибируемую молекулу РНК, влияющую на представляющее интерес фенотипическое, биохимическое или морфологическое изменение.
Описанный энхансер SCBV или химерную область регуляции транскрипции, содержащую одну или несколько его копий, можно встраивать в конструкцию с одним или несколькими маркерными генами (любая транскрибируемая полинуклеотидная молекула, экспрессию которой можно подвергать скринингу или оценивать любым образом) и тестировать в транзиторных или стабильных анализах растений с получением показателей профиля экспрессии гена под действием регуляторного элемента в стабильных трансгенных растениях. Маркерные гены для применения в практическом осуществлении таких вариантов осуществления в качестве неограничивающих примеров включают транскрибируемые полинуклеотидные молекулы, кодирующие β-глюкуронидазу (GUS, описанную в патенте США № 5599670) и зеленый флуоресцентный белок (GFP, описанный в патентах США №№ 5491084 и 6146826), белки, которые придают устойчивость к антибиотикам, или белки, которые придают устойчивость к гербицидам. В данной области известны подходящие маркеры устойчивости к антибиотикам, включающие маркеры, кодирующие белки, придающие устойчивость к канамицину (nptII), гигромицину B (aph IV), стрептомицину или спектиномицину (aad, спек./стреп.) и гентамицину (aac3 и aacC4). Гербициды, к которым показана устойчивость трансгенных растений и можно применять способ по настоящему изобретению, в качестве неограничивающих примеров включают: глифосат, глуфосинат, сульфонилкарбамиды, имидазолиноны, бромоксинил, делапон, циклохезандион, ингибиторы протопорфириногеноксидазы и изоксафлутоловые гербициды. В данной области известны полинуклеотидные молекулы, кодирующие белки, вовлеченные в устойчивость к гербицидам, и в качестве неограничивающих примеров они включают полинуклеотидную молекулу, кодирующую 2,4-D-деградирующий фермент (aad-12, описанный в WO 2007/053482 A2 или в патенте США № 7838733); полинуклеотидную молекулу, кодирующую 5-енолпирувилшикамат-3-фосфатсинтетазу (EPSPS, описанную в патентах США №№ 5627061, 5633435, 6040497 и в патенте США № 5094945 в отношении устойчивости к глифосату); полинуклеотиды, кодирующие глифосатоксидоредуктазу и глифосат-N-ацетилтрансферазу (GOX, описанную в патенте США № 5463175 и GAT, описанную в публикации США № 20030083480); полинуклеотидную молекулу, кодирующую бромоксинилнитрилазу (Bxn, описанную в патенте США № 4810648 в отношении устойчивости к бромоксинилу); полинуклеотидную молекулу, кодирующую фитоендесатуразу (crtI), описанную в Misawa et al. (Plant J. 4:833-840, 1993) и Misawa et al. (Plant J. 6:481-489, 1994) в отношении устойчивости к норфлуразону; полинуклеотидную молекулу, кодирующую синтетазу ацетогироксикислот (AHAS, также известную как ALS), описанную в Sathasiivan et al. (Nucl. Acids Res. 18:2188-2193, 1990) в отношении устойчивости к сульфонилкарбамидным гербицидам; полинуклеотидную молекулу, кодирующую разрушающий дикамбу оксигеназный фермент (описанный в патентных публикациях США US 20030135879 и US 20030115626, в отношении устойчивости к дикамбе); и полинуклеотидную молекулу, кодирующую устойчивость к глуфосинату и биалафосу (ген bar, описанный в DeBlock et al. (EMBO J. 6:2513-2519, 1987, ген pat, описанный в Wohlleben et al., (1988) Gene 70: 25-37, или ген DSM-2, описанный в патентной заявке США. № 2007/086813). Регуляторные элементы по настоящему изобретению могут обеспечивать экспрессию транскрибируемых полинуклеотидных молекул, которые кодируют фосфинотрицинацетилтрансферазу, устойчивый к глифосату EPSPS, аминогликозидфосфотрансферазу, гидроксифенилпируватдегидрогеназу, гигромицинфосфотрансферазу, неомицинфосфотрансферазу, далапондегалогеназа, устойчивую к бромоксинилу нитрилазу, антранилатсинтазу, глифосатоксидоредуктазу и глифосат-N-ацетилтрансферазу.
Конструкции, содержащие по меньшей мере один энхансер SCBV (например, в контексте химерной области регуляции транскрипции), функционально связанный c маркерным геном или другой представляющей интерес нуклеотидной последовательностью можно доставлять в ткани (например, трансформировать), а ткани анализировать соответствующим способом в зависимости от маркера или последовательности, которые подвергают транскрипции. Такие количественные или качественные анализы можно использовать в качестве способов оценки потенциального профиля экспрессии регуляторного элемента при функциональной связи с геном, представляющим агрономический интерес в стабильных растениях. Маркерный ген можно использовать в транзиторном анализе; способы тестирования экспрессии маркерного гена в транзиторных анализах известны специалистам в данной области. Транзиторную экспрессию маркерных генов описывали с использованием ряда растений, тканей и систем доставки ДНК. Например, системы транзиторного анализа в качестве неограничивающих примеров включают прямую доставку гена посредством электропорации тканей или бомбардировки тканей частицами в любом транзиторном анализе растения с использованием любых видов растений, представляющих интерес. Такие транзиторные системы в качестве неограничивающих примеров включают электропорацию протопластов ряда тканевых источников или бомбардировку частицами конкретных представляющих интерес тканей. Настоящее изобретение для оценки регуляторных элементов, функционально связанных с любой транскрибируемой полинуклеотидной молекулой, включает использование любой системы транзиторной экспрессии, включая в качестве неограничивающих примеров маркерные гены или гены, представляющие агрономический интерес. Примеры тканей растений, предусмотренных для теста, в транзиторных системах посредством соответствующей системы доставки в качестве неограничивающих примеров включают ткани основы листа, каллюс, семядоли, корни, эндосперм, зародыши, ткани цветка, пыльцу и эпидермальную ткань.
VII. Трансформация растений
Конструкцию для трансформации растений, содержащую энхансерный элемент (или несколько его копий) или химерную область регуляции транскрипции, такую, как описана в настоящем документе, можно вводить в растения любым способом трансформации растений. Способы и материалы для трансформации растений посредством введения экспрессирующейся в растении конструкции в геном растения в практическом осуществлении настоящего изобретения могут включать любой из хорошо известных и продемонстрированных способов, включая электропорацию (например, патент США № 5384253), бомбардировку микрочастицами (например, патенты США №№ 5015580; 5550318; 5538880; 6160208; 6399861 и 6403865), опосредованную агробактериями трансформацию (например, патенты США №№ 5824877; 5591616; 5981840 и 6384301) и трансформацию протопласта (например, патент США № 5508184). Специалистам в данной области очевидно, что для получения стабильных трансгенных растений из любого количества представляющих интерес целевых сельскохозяйственных культур можно использовать и модифицировать множество способов трансформации.
Специалистам в данной области известны конкретные способы трансформации двудольных растений. В качестве примера способы трансформации и восстановления растений описаны для ряда сельскохозяйственных культур, включая в качестве неограничивающих примеров, Arabidopsis thaliana, хлопок (Gossypium hirsutum), сою (Glycine max), арахис (Arachis hypogaea) и представителей рода Brassica.
Подобным образом, специалистам в данной области также известны конкретные способы трансформации однодольных растений. В качестве примера способы трансформации и восстановления растений описаны для рада сельскохозяйственных культур, включая в качестве неограничивающих примеров ячмень (Hordeum vulgarae); кукурузу (Zea mays); овес (Avena sativa); ежу сборную (Dactylis glomerata); рис (Oryza sativa, включая индийские и японские сорта); сорго (Сорго bicolor); сахарный тростник (вид Saccharum); высокую овсяницу (Festuca arundinacea); различные виды газонной травы (например, Agrostis stolonifera, Poa pratensis, Stenotaphrum secundatum); пшеницу (Triticum aestivum) и люцерну (Medicago sativa).
Трансформированные растения можно анализировать на присутствие и уровень и/или профиль экспрессии представляющего интерес гена(ов), обеспечиваемые химерными областями регуляции транскрипции, описываемыми в настоящем документе. специалистам в данной области для анализа трансформированных растений известно множество способов. Например, способы анализа растений включают анализ "саузерн"- и "нозерн"-блоттингом, подходы на основе ПЦР (или других способов на основе амплификации нуклеиновых кислот, такие как анализы Invader® или Taqman®), биохимические анализы, способы фенотипического скрининга, полевые оценки и иммунодиагностические анализы (например, для детекции, локализации и/или количественного анализа белков).
Усиленная экспрессия генов с использованием описанного энхансера SCBV продемонстрирована в кукурузу и Arabidopsis thaliana, но ожидается, что энхансер функционирует в других видах растений, возможно включающих двудольные растения, а также однодольные растения. Энхансерный элемент с четырьмя копиями расположенной выше начала транскрипции области SCBV обеспечивает высочайший уровень экспрессии комбинаций, исследуемых в настоящем документе. Также преимущества в модуляции экспрессии гена могут обеспечить меньшее или большее количество копий расположенной выше участка начала транскрипции области, а также, комбинации с энхансерными элементами из других источников. Те же активаторы, конструкции и подходы могут быть пригодными для других сельскохозяйственных культур, у которых можно идентифицировать гены вследствие доступности или нахождения в стадии получения последовательности генома (включая Сорго (Sorghum bicolor), пшеницу (Triticum aestivum), ячмень (Hordeum vulgare), ячмень гривастый (Setaria italica), сахарный тростник (Saccharum officinarum), Miscanthus giganteus или для которых можно идентифицировать "активированные гены" при будущих работах по секвенированию генома или возможной хромосомной синтении (включая овес (Avena sativa), рожь (Secale cereale), просо американское (Pennisetum glaucum), просо пальчатое (Eluesine coracana), просо обыкновенное (Panicum miliaceum), тэфф (Eragrostis tef)), или для модельных видов травы, для которых доступна или находится в стадии получения геномная последовательность (включая пурпурную коротконожку (Brachypodium distachyon), щетинник (Setaria viridis)).
Приводимые ниже примеры предоставлены для иллюстрации определенных конкретных особенностей и/или вариантов осуществления. Эти примеры не следует рассматривать как ограничивающие изобретение конкретными описанными особенностями или вариантами осуществления.
ПРИМЕРЫ
ПРИМЕР 1
Идентификация последовательностей, содержащих энхансерный элемент промотора палочковидного вируса сахарного тростника (SCBV)
Этот пример демонстрирует идентификацию последовательностей, содержащих энхансерный элемент промотора SCBV.
Промоторный фрагмент, полученный из генома SCBV (номер доступа GeneBank AJ277091, и описанного Geijskes et al., Arch. Virol., 147: 2393-2404, 2002) сначала исследовали посредством анализов транзиторной экспрессии для определения того, какие области последовательности промотора содержат последовательности энхансерных элементов. При исследовании промотора фрагменты, полученные из промотора SCBV (SEQ ID NO: 1), содержащие последовательности от -839 до +106 п.н. (плазмида pSCBV839), от -576 до +106 п.н. (плазмида pSCBV576) и от -333 до +106 п.н. (плазмида pSCBV333), считая от участка начала транскрипции (определенного как положение +1), клонировали выше кодирующей области репортерного белка люциферазы светляка (LUC). Транскрипцию терминировали копией области 3'-UTR нопалинсинтазы (Nos) (приведенной в основаниях от 1847 до 2103 номера доступа GeneBank V00087.1, таким образом, полностью включенного в качестве ссылки, и на фиг.1). Транзиторную транскрипционную активность этих конструкций тестировали посредством трансформации их посредством бомбардировки частицами в суспензии клеток кукурузы Hi-II (подробно описанной в примере 2 ниже) и мониторинга активности репортерного гена LUC. В каждом эксперименте активность люциферазы нормализовали посредством котрансформации с эквимолярным количеством плазмидной ДНК, содержащей конструкцию SCBV:LUC и ДНК эталонной плазмиды, несущей конструкцию, состоящую из промотора гена убиквитина кукурузы 1 (ubi1) (описанного в патенте США № 5510474, таким образом, полностью включенного в качестве ссылки; по существу оснований от 7 до 1990 номера доступа GeneBank S94464.1, таким образом, полностью включенного в качестве ссылки), контролирующего экспрессию кодирующей области GUS (бета-глюкуронидазы) и оканчивающуюся 3'-UTR терминатором кукурузы Per5 (описанным в патенте США № 6699984, таким образом, полностью включенном в качестве ссылки; например, конструкцию ubi1:GUS). Через двое суток после бомбардировки, из трансформированных клеток выделяли тотальный белок и измеряли ферментативную активность LUC (выражаемую в люциферазных единицах (ЛЕ)/мг белка) и ферментативную активность GUS (выражаемую в единицах активности GUS (ГЕ)/мкг белка) способами, представленными, например, в (Maliga et al., Methods in Plant Molecular Biology. A Laboratory Course Manual. Cold Spring Harbor Laboratory Press, 1995). Относительную активность тестируемых промоторов в трех конструкциях SCBV:LUC сравнивали посредством нормализации уровней LUC по уровням GUS в виде отношения ЛЕ/мг белка:ГЕ/мкг белка. Результаты тестирования транзиторной экспрессии показали, что активность LUC линейно увеличивалась при увеличении концентрации бомбардируемой плазмидной ДНК, что указывает на то, что активность LUC коррелирует с уровнем транскрипта. Кроме того, фрагмент промотора SCBV, содержащий последовательности от -576 п.н. выше до +106 ниже участка начала транскрипции, обладал 66%±2% от активности полноразмерного промоторного фрагмента (определенного в настоящем документе как содержащего последовательности от -839 п.н. выше до +106 ниже от участка начала транскрипции). В отличие от этого, промоторный фрагмент, содержащий последовательности от -333 п.н. выше до +106 ниже участка начала транскрипции, обладал только 17%±1% от активности полноразмерного промотора. Таким образом, последовательности для большей части активности промотора SCBV находятся выше -333 п.н. от участка начала транскрипции.
Исследовали часть последовательности промотора SCBV, способную к усилению транскрипции под контролем минимальной гетерологичной промоторной последовательности. Как определено этими экспериментами, энхансерный элемент функционально определили как короткую (от 200 до 300 п.н.) цис-действующую последовательность ДНК без TATA-бокса, которая при расположении с 5'-конца проксимально минимальной гетерологичной промоторной последовательности при тестировании в системе транзиторной или стабильной трансформации увеличивает активность экспрессии минимального гетерологичного промотора воспроизводимым и измеримым образом. Кроме того, тандемные дупликации энхансерного элемента обеспечивают даже более высокие уровни активности экспрессии минимального гетерологичного промотора, чем это делают одиночные копии энхансерного элемента. Минимальный гетерологичный промоторный элемент, используемый в этом пример, содержит основания от -100 до +106 промотора гена алкогольдегидрогеназы 1 кукурузы (Adh1) (соответствующие основаниям от 997 до 1202 номера доступа GeneBank X04049, таким образом, полностью включенного в качестве ссылки).
Два фрагмента, полученные из промотора SCBV, содержащие последовательности от -503 до -222 п.н. и от -758 до -222 п.н. относительно участка начала транскрипции, клонировали 5' в последовательности, содержащие минимальный промотор Adh1 кукурузы, слитый с кодирующей областью, кодирующей белок люциферазы светляка (LUC). Транскрипцию химерных генов терминировали посредством 3'-UTR Nos, как описано выше. Суспензию культуры клеток кукурузы Hi-II трансформировали посредством бомбардировки частицами с ДНК плазмид, несущих конструкции LUC и GUS, и измеряли ферментативную активность и сравнивали, как описано выше. Плазмиды, содержащие конструкции LUC с последовательностями от -503 до -222 или с последовательностями от -758 до -222, помещенные с 5'-конца относительно минимального промотора Adh1, продемонстрировали в 6 раз и в 4 раза, соответственно, большую активность LUC, чем у минимального промотора Adh1 без добавления последовательностей SCBV. Таким образом, последовательности в этих фрагментах промотора SCBV усиливают активность транскрипции, опосредуемую гетерологичным промотором кукурузы.
Способность нескольких копий энхансерной области SCBV от -503 до -222 п.н. усиливать экспрессию, опосредуемую минимальным промотором Adh1, тестировали посредством клонирования одной, двух или четырех копий последовательностей от -502 до -222 п.н. с 5'-конца от минимального промотора Adh1 кукурузы, слитого с кодирующей областью LUC (фиг. 3A). Плазмидной ДНК, несущей конструкции (а также плазмидной ДНК, содержащей эталонную конструкцию ubi1:GUS), бомбардировали в суспензию культуры клеток кукурузы Hi-II, и активность LUC и GUS измеряли и сравнивали, как описано выше. Клетки, повергнутые бомбардировке конструкциями, содержащими 1 копию, 2 копии или 4 копии области энхансерной последовательности SCBV, обладали более чем в 5 раз, в 6 раз и в 10 раз, соответственно, большей активностью LUC, чем клетки, повергнутые бомбардировке аналогичной конструкцией с минимальным промотором Adh1 с отсутствием энхансерных последовательностей SCBV (фиг. 3B).
Нуклеиновые основания, содержащие пары нуклеотидов от -502 до -222 промотора SCBV, как предоставлено в SEQ ID NO: 1, кодируют активность активации транскрипции, которая может обеспечивать промотору растения превосходные характеристики экспрессии. Кроме того, активность активации транскрипции увеличивается при суммировании нескольких тандемных копий оснований, содержащих пары нуклеотидов от -502 до -222 промотора SCBV, как предоставлено в SEQ ID NO:1. Более того, способы и реагенты, предоставляемые по настоящему документу, можно дополнительно исследовать и использовать для получения даже более коротких последовательностей, которые могут сохранять активность активации транскрипции, или их можно комбинировать с другими активирующими транскрипцию элементами и промоторами растений в новых комбинациях.
ПРИМЕР 2
Тестирование транзиторной экспрессией конструкций SCBV:LUC и ub1:GUS в суспензии культуры клеток кукурузы Hi-II
В этом примере описано тестирование транзиторной экспрессии конструкций SCBV:LUC и ub1:GUS в суспензии культуры клеток кукурузы Hi-II.
Суспензию культуры клеток кукурузы Hi-II (Armstrong et al., Maize Genet. Coop. Newslett., 65:92-93, 1991) трансформировали посредством бомбардировки частицами с ДНК плазмид, несущих конструкции LUC и GUS, сконструированные, как описано выше, и измеряли и сравнивали ферментативную активность. Получали большие партии плазмидной ДНК с использованием наборов QiAfilter™ Plasmid Maxi (Qiagen, Germantown, Maryland) и количественно и качественно анализировали стандартными молекулярными способами.
Получение суспензии культуры клеток кукурузы Hi-II для бомбардировки. Клетки Hi-II поддерживали на шейкере при 125 об/мин в среде H9CP+ при 28° в темноте (среда H9CP состоит из солей MS 4,3 г/л, сахарозы 3%, казаминовых кислот 200 мг/л, миоинозитола 100 мг/л, 2,4-D 2 мг/л, NAA 2 мг/л, 1000× витаминов MS 1 мл/л, L-пролина 700 мг/л и кокосовой воды (Sigma Aldrich, St. Louis, MO) 62,5 мл/л, pH 6,0). Перед бомбардировкой 2-суточные культуры Hi-II переносили в среду G-N6 (среда CHU N6 3,98 г/л, витамины CHU N6 1 мл/л (оба компонента CHU из PhytoTechnology Laboratories®, Lenexa, KS), миоинозитол 100 мг/л, 2,4-D 2 мг/л и сахароза 3%, pH 6,0) и позволяли расти в течение 24 часов. На сутки бомбардировки, растущие в G-N6 клетки (2,5 г клеток) переносили на стерильные фильтровальные диски Whatman No. 1 (55 мм), помещали в среду G-N6, содержащую 0,5 M D-сорбит и 0,5 M D-маннит и инкубировали в течение 4 часов. Для бомбардировки используют осмотически адаптированные клетки.
Получение частиц золота с плазмидной ДНК и анализ бомбардировки. Частицы золота (диаметром 1 мкм, BioRad, Hercules, CA) отмывали 70% этанолом в течение 10 минут, затем три раз стерильной водой. Частицы распределяли в 50% глицерине при концентрация 120 мг/мл. Для типичного эксперимента комбинировали 150 мкл (18 мг) частиц золота, приблизительно 5 мкг плазмидной ДНК, 150 мкл 2,5 M CaCl2 и 30 мкл 0,2 M спермидина. Реакционную смесь (общий объем 375 мкл) инкубировали при комнатной температуре в течение 10 минут c периодическим осторожным перемешиванием. Покрытые ДНК частицы золота непродолжительно инкубировали, промывали 420 мкл 70% этанола, а затем 420 мкл 100% этанола. Конечный осадок ресуспендировали в 110 мкл 100% этанола и подвергали непродолжительной обработке ультразвуком (три очереди по 3 секунды каждая, с 1 минутой между очередями) в ультразвуковом устройстве Branson 1450. На каждый из девяти макроносителей (BioRad, Hercules, CA) наносили аликвоты по 12,2 мкл золотых частиц, покрытых ДНК, и использовали для анализов бомбардировки с использованием системы BioRad PDS1000/He. Суспензию культуры клеток трансформировали с расстояния до цели 9 см с использованием дисков 24,2 мПа и каждый планшет бомбардировали 3 раза. После бомбардировки клетки инкубировали в темноте при 28°C сначала в течение 12 часов на G-N6, содержащих среду с D-сорбитом и D-маннитом, затем на планшетах G-N6 в течение дополнительных 36 часов. Клетки собирали с планшетов, промокали для удаления буфера и подвергали экстракции 300 мкл 2× буфера для экстракции CCLT LUC (Promega Corporation, Madison, WI). После центрифугирования собирали приблизительно 600 мкл белкового экстракта. Концентрации белков определяли с использованием анализа по Брэдфорду.
Ферментативную активность LUC (выражаемую в люциферазных единицах (ЛЕ)/мг белка) и ферментативную активность GUS (выражаемую в единицах активности GUS (ГЕ)/мкг белка) измеряли способами, описанными, например, в Maliga et al. (Methods in Plant Molecular Biology. A Laboratory Course Manual. Cold Spring Harbor Laboratory Press, 1995). Относительную активность тестируемых промоторов в конструкциях SCBV:LUC сравнивали посредством нормализации уровней LUC по уровням GUS в виде отношения LUC/мг белка:GUS/мкг белка.
ПРИМЕР 3
Плазмиды для активирующего мечения в растениях кукурузы
В этом примере описано получение супербинарных плазмид Agrobacterium.
Супербинарная система представляет собой специализированный пример системы челночного вектора/гомологичной рекомбинации Agrobacterium (Komari et al., Meth. Mol. Biol. 343:15-41, 2006, Komari et al., Plant Physiol. 114:1155-1160, 2007; также см. патент Европы № EP604662B1 и патент США № 7060876, каждый из которых полностью включен в качестве ссылки). Штамм-хозяин Agrobacterium tumefaciens, применяемый с супербинарной системой, представляет собой LBA4404(pSB1). Штамм LBA4404(pSB1) содержит две независимо реплицирующиеся плазмиды, pAL4404 и pSB1. pAL4404 представляет собой получаемую из Ti-плазмиды плазмиду-помощника, которая содержит интактный набор генов vir (из Ti-плазмиды pTiACH5), но которая не содержит области Т-ДНК (и, таким образом, не содержит левой и правой граничных повторяющихся последовательностей Т-ДНК). Плазмида pSB1 содержит дополнительный частичный набор генов vir, получаемых из pTiBo542. Одним из примеров челночных векторов, используемых в супербинарной системе, является pSB11, который содержит клонирующий полилинкер, который служит в качестве участка введения генов, предназначенных для трансформации клеток растений, фланкированный правой и левой граничными повторяющимися областями Т-ДНК. Челночный вектор pSB11 не способен к независимой репликации в Agrobacterium, но стабильно поддерживается в ней в качестве совместно интегрированной плазмиды при интеграции в pSB1 способами гомологичной рекомбинации между общими последовательностями, находящимися на pSB1 и pSB11. Таким образом, полностью модифицированная область Т-ДНК, вводимая в LBA4404(pSB1) на модифицированном векторе pSB11 продуктивно действует и переносится в клетки растений белками Vir, получаемыми из двух различных источников Ti-плазмид Agrobacterium (pTiACH5 и pTiBo542). Показано, что супербинарная система особенно пригодна при трансформации однодольных видов растений (См. Hiei et al., Plant J. 6:271-282, 1994, и Ishida et al., Nat. Biotechnol. 14:745-750, 1996).
Плазмида для трансформации для продукции активирующе меченных растений кукурузы может включать совместно интегрируемую плазмиду, формируемую посредством гомологичной рекомбинации между супербинарной плазмидой pSB1 и pEPP1088 с каркасом вектора pSB11 (см. патент Европы № EP604662B1 и патент США № 7060876, каждый из которых, таким образом, включен в качестве ссылки). Совместно интегрируемую плазмиду обозначают как pSB1::pEPP1088 или как вектор ZeaTAG. Структуру pEPP1088 подтверждают посредством анализа рестрикционными ферментами и определения последовательности ДНК выбранных областей конструкции. Структурная карта, иллюстрирующая подходящие характеристики pEPP1088, приведена на фиг.3. pEPP1088 содержит расположенные между левой (LB) и правой (RB) граничными последовательностями Т-ДНК, предоставляемыми плазмидой pSB11 4 копии энхансерных последовательности SCBV с нуклеотидами от -502 до -222, описанных выше, и ген селективного маркера, содержащий промотор гена актина риса (Oryza sativa) с ассоциированным интроном 1 и 5'-UTR (по существу, как описано в виде оснований от 12 до 1411 номера доступа GeneBank EU155408.1, таким образом, полностью включенного в качестве ссылки), кодирующим последовательность, кодирующую белок устойчивости к гербициду AAD-1, как описано в патентной заявке США № 20090093366, и последовательность 3'-UTR терминатора из гена липазы кукурузы, по существу как описано в виде оснований от 921 до 1277 номера доступа GeneBank gb|L35913.1|MZELIPASE и в патенте США № 7179902, каждый из которых, таким образом, полностью включен в качестве ссылки.
Т-ДНК pEPP1088 (и как находится в pSB1::pEPP1088) при введении в клетки кукурузы посредством опосредованной Agrobacterium трансформации интегрирует в случайных положениях хромосом кукурузы. Отбор трансформированных клеток кукурузы обеспечивает конститутивно экспрессируемый ген селективного маркера AAD1 в Т-ДНК. Т-ДНК, несущая тандемные копии мощного активирующего элемента энхансера транскрипции SCBV в нуклеотидах от -502 до -222, вызывает аномальную экспрессию природных генов рядом с участком интеграции, таким образом, в некоторых случаях, обеспечивая новые идентифицируемые признаки у растений, восстанавливаемых из трансформированных тканей. Доступны современные молекулярно-биологические способы, облегчающие выделение и идентификацию подвергнутых воздействию генов рядом с акцепторным участком, таким образом, позволяя получать выделенные гены для дальнейшего использования.
ПРИМЕР 4
Опосредованная агробактериями трансформация кукурузы
В этом примере описано проведение опосредованной агробактериями трансформации кукурузы
Получение незрелого зародыша. Семена инбредной линии B104 высаживали в горшки 15,1 л, содержащие смесь Sunshine Custom Blend® 160 (Sun Gro Horticulture, Bellevue, WA). Растения выращивали в теплице с использованием комбинации натриевых ламп высокого давления и металлогалогеновых ламп со световым периодом 16:8 часов света:темноты. Для получения незрелых зародышей для трансформации проводили контролируемые родственные опыления. Незрелые зародыши выделяли в период от 10 до 13 суток после опыления, когда размер зародышей составлял приблизительно от 1,4 до 2,0 мм.
Инфекция и совместная культивация. Кукурузные початки поверхностно стерилизовали посредством погружения в 50% коммерческие белила с Tween 20 (1 или 2 капли на 500 мл) на период в течение 10 минут и трижды промывали стерильной водой. Суспензию клеток Agrobacterium, содержащих совместно интегрируемую плазмиду с супербинарным вектором, получали посредством переноса 1 или 2 петель бактерий, выращиваемых на твердой среде YEP, содержащей 50 мг/л спектиномицина, 10 мг/л рифампицина и 50 мг/л стрептомицина при 28°C в течение 3 суток или 25°C в течение 4 суток в 5 мл жидкой среды для инфекций (соли MS, витамины MS, модифицированные ISU, 3,3 мг/л дикамбы, 68,4 г/л сахарозы, 36 г/л глюкозы, 700 мг/л L-пролина, pH 5,2), содержащей 100 мкМ ацетосирингон. Раствор осторожно пипетировали с использованием стерильной 5 мл пипетки до образования однородной суспензии и концентрацию доводили до оптической плотности от 0,3 до 0,5 при 600 нм (OD600) с использованием денсиметра Ultrospec 10 Cell Density Meter (GE Healthcare/Amersham Biosciences, Piscataway, NJ). Незрелые зародыши выделяли непосредственно в микроцентрифужную пробирку, содержащую 2 мл среды для инфекций. Среду удаляли и дважды заменяли свежей средой для инфекций в количестве от 1 до 2 мл, затем удаляли и заменяли 1,5 мл раствора Agrobacterium. Раствор Agrobacterium и зародышей инкубировали в течение 5 минут при комнатной температуре, а затем переносили в среду для совместной культивации, содержащей соли MS, витамины MS, модифицированные ISU, 3,3 мг/л дикамбы, 30 г/л сахарозы, 700 мг/л L-пролина, 100 мг/л миоинозитола, 100 мг/л ферментативного гидролизата казеина, 15 мг/л AgNO3, 100 мкМ ацетосирингона и 2,3 до 3 г/л гельзана™ (Sigma-Aldrich, St. Louis, MO) при pH 5,8. Инкубация при совместной культивации составляла от 3 до 4 суток при 25°C в условиях темноты или 24 часового белого флуоресцентного излучения (приблизительно 50 мкЭм-2с-1).
Покой и отбор. После совместной культивации зародыши переносили в неселективную среду покоя на основе MS, содержащую соли MS, витамины MS, модифицированные ISU, 3,3 мг/л Дикамбы, 30 г/л сахарозы, 700 мг/л L-пролина, 100 мг/л миоинозитола, 100 мг/л ферментативного гидролизата казеина, 15 мг/л AgNO3, 0,5 г/л MES (моногидрат 2-(N-морфолино)этансульфоновой кислоты; PhytoTechnologies Labr., Lenexa, KS), 250 мг/л карбенициллина, и 2,3 г/л гельзана™, при pH 5,8. Инкубацию продолжали в течение 7 суток при 28°C в условиях темноты или 24 часового белого флуоресцентного излучения (приблизительно 50 мкЭм-2с-1). После 7 суток периода покоя зародыши переносили в селективную среду. Для отбора тканей кукурузы, трансформированных супербинарной плазмидой, содержащей экспрессируемый в растениях ген селективного маркера AAD1, использовали среду покоя на основе MS (выше), дополненную галоксифопом. Зародыши сначала переносили в селективные среды, содержащие 100 нМ галоксифопа, и инкубировали в течение периода от 1 до 2 недель, а затем переносили в среду с 500 нМ галоксифопом и инкубировали в течение дополнительного периода от 2 до 4 недель. В течение периода приблизительно от 5 до 8 недель получали трансформированные изоляты при 28°C в условиях темноты или 24 часового белого флуоресцентного излучения (приблизительно 50 мкЭм-2с-1). Полученные изоляты наращивали посредством переноса в свежую селективную среду с интервалами от 1 до 2 недель для регенерации и последующего анализа.
Специалистам в области трансформации кукурузы понятно, что, когда используют другие экспрессируемые в растениях гены селективных маркеров (например, гены устойчивости к гербицидам), доступны другие способы отбора трансформированных растений.
Пререгенерация. После процесса отбора культуры, подвергаемые 24 часовому световому режиму, переносили на среду для пререгенерации на основе MS, содержащую соли MS, витамины MS, модифицированные ISU, 45 г/л сахарозы, 350 мг/л L-пролина, 100 мг/л миоинозитола, 50 мг/л ферментативного гидролизата казеина, 1 мг/л AgNO3, 0,25 г/л MES, 0,5 мг/л нафталинуксусной кислоты, 2,5 мг/л абсцизовой кислоты, 1 мг/л 6-бензиламинопурина, 250 мг/л карбенициллина, 2,5 г/л гельзана™ и 500 нМ галоксифопа при pH 5,8. Инкубацию продолжали в течение 7 суток при 28° в условиях 24 часового белого флуоресцентного излучения (приблизительно 50 мкЭм-2с-1).
Регенерация и разделение всходов. Для регенерации культуры переносили в первичную среду для регенерации на основе MS, содержащую соли MS, витамины MS, модифицированные ISU, 60 г/л сахарозы, 100 мг/л миоинозитола, 125 мг/л карбенициллина, 2,5 г/л гельзана™ и 500 нМ галоксифопа при pH 5,8. Через 2 недели при 28° в условиях темноты или 24 часового белого флуоресцентного излучения (приблизительно 50 мкЭм-2с-1) ткани переносили во вторичную среду для регенерации на основе MS, состоящую из солей MS, витаминов MS, модифицированных ISU, 30 г/л сахарозы, 100 мг/л миоинозитола, 3 г/л гельзана™ при pH 5,8, с 500 нМ галоксифопом или без. Регенерацию/отбор продолжали в течение 2 недель при 28° в условиях 16 часового или 24 часового белого флуоресцентного излучения (приблизительно 50 мкЭм-2с-1). Когда всходы достигали длины 3-5 см, их отделяли и пересаживали во вторичную среду для регенерации (как указано выше, но без галоксифопа) и инкубировали при 25° в условиях 16 часового белого флуоресцентного излучения (приблизительно 50 мкЭм-2с-1) для обеспечения дополнительного роста и развития побега и корней.
Получение семян. Растения пересаживали в беспочвенную среду для роста Metro-Mix® 360 (Sun Gro Horticulture) и помещали в теплицу. Затем растения пересаживали в почвенную смесь Sunshine Custom Blend 160 и выращивали до цветения в теплице. Для получения семян проводили контролируемое опыление.
ПРИМЕР 5
Активность энхансера SCBV в стабильно трансформированных клетках кукурузы
Из десяти растений T0, регенерированных из трансформированных незрелых зародышей B104, выделяли геномную ДНК (набор Qiagen DNeasy Plant Mini; Qiagen, Germantown, Maryland) и посредством клонирования в обратной ПЦР и секвенирования продуктов амплификации ДНК в обратной ПЦР определяли положение интегрированных Т-ДНК, трансфицированных из pSB1::pEPP1088, в геноме. Идентичность генов, представленных фланкирующими кодирующими областями, расположенными в пределах 10 т.п.н. от энхансера 4xSCBV, определяли посредством поиска BLAST (Altschul et al., J. Mol. Biol., 215: 403-410 и Karlin et al., Proc. Natl. Acad. Sci. USA 87: 2264-2268, 1990) с использованием фланкирующих последовательностей в качестве запрашиваемых последовательностей. Анализы результатов BLAST выявили, что Т-ДНК и, таким образом, энхансеры 4XSCBV интегрировались в различные геномные положения в каждой из 10 линий, и, таким образом, в каждой линии энхансеры 4XSCBV фланкированы различными генами (таблица 1).
Из тканей листьев десяти линий T0 выделяли тотальную РНК (набор Qiagen RNeasy Plant Mini, Qiagen, Germantown, Maryland). у соответствующих растений T0 и у нетрансформированных контрольных растений посредством обратной транскрипции и ПЦР-РВ (ПЦР с детекцией в реальном времени) с использованием праймеров, специфичных для соответствующих генов, фланкирующих энхансеры 4XSCBV, сравнивали накопление транскриптов идентифицированных фланкирующих генов. В качестве контроля также определяли накопление транскриптов эндогенного гена GAPDH.
Продукты ПЦР-РВ позволили выявить увеличенное накопление транскриптов, происходящих из 3 из различных фланкирующих генов в этих линиях. Энхансеры 4XSCBV располагались на 2,6 т.п.н. и 2,8 т.п.н. выше находящихся под воздействием фланкирующих генов в 2 из линий T0 и на 478 п.н. ниже находящегося под воздействием гена в третьей линии T0. Таким образом, эти результаты указывают на то, что энхансеры 4XSCBV, доставляемые Т-ДНК, вызывают независимое от цепи увеличенное накопление транскриптов генов рядом с участком интеграции. В таблице 1 приведены идентифицированные фланкирующие гены и результаты анализов их уровней транскрипции.
Действие энхансера 4XSCBV на накопление РНК фланкирующих генов в 10 растениях T0.
Специалисту в области генетики кукурузы и молекулярной биологии растений понятно, что в зависимости от характера находящихся под воздействием генов, в некоторых случаях новые и ценные признаки трансгенному растению обеспечивает увеличенная экспрессия смежных генов, индуцируемых энхансерами 4XSCBV. В совокупности, растения с энхансерами 4XSCBV представляют маркированную ZeaTAG популяцию. Признаки могут приводить к увеличенному накоплению самого кодируемого находящимся под воздействием геном белка, как, например, увеличенное накопление в семенах желаемого с точки зрения питательности белка, или приводить к нисходящему эффекту, когда продукт гена находящегося под непосредственным воздействием гена контролирует экспрессию одного или нескольких других генов (как в случае, например, генов активаторов/репрессоров транскрипции). Случайный характер участка интеграции вводимых Т-ДНК, вместе со стандартными способами селекции растений можно использовать для получения больших популяций растений, содержащих библиотеку несущих Т-ДНК растений с активирующими элементами, расположенными в пределах эффективной дистанции от всех или большинства генов в геноме кукурузы, и, таким образом, он обеспечивает возможность транскрипционной активации всех или большинства генов кукурузы.
Скрининг на уровне растений на фенотипы экономического значения возможен в вегетационной камере, теплице или в полевых условиях. Как показано в настоящем документе, молекулярно-биологические способы, такие как обратная ПЦР, обеспечивают выделение из растений, демонстрирующих желаемый фенотип, интегрированной Т-ДНК и геномной ДНК значительной длины, фланкирующей интегрированную Т-ДНК. Кроме того, такие способы, как "прогулка по геному", обеспечивают определение даже более протяженных областей последовательности геномной ДНК, таким образом, обеспечивая идентификацию генов, находящихся вблизи вводимых активирующих элементов. Идентификацию и количественный анализ уровней, находящихся под воздействием транскриптов, обеспечивают высокопроизводительные способы, такие как анализ микропанелей и более геноспецифические способы анализа. Таким образом, можно идентифицировать, выделять и дополнительно характеризовать гены-кандидаты, вовлеченные в значимые агрономические признаки, и эксплуатировать для получения новых и ценных сортов сельскохозяйственных культур.
И наоборот, новый признак может приводить к нарушению функционирования генов кукурузы вследствие интеграции Т-ДНК, содержащей энхансеры 4XSCBV, в кодирующую область или область регуляции экспрессии генов кукурузы. В таких случаях Т-ДНК, содержащую энхансеры 4XSCBV, и окружающие геномные области можно выделять и дополнительно охарактеризовывать.
ПРИМЕР 6
Прямой генетический скрининг популяции ZeaTAG
В этом примере описан прямой генетический скрининг популяции ZeaTAG на измененные фенотипы.
Скрининг на стресс, вызванный засухой
Для идентификации линий ZeaTAG, несущих мутации, придающие устойчивость к засухе, растения из отдельных объектов ZeaTAG высаживают в полевые условия. В течение репродуктивной фазы цикла роста, от момента приблизительно за 2 недели до цветения до приблизительно 2 недели после цветения полив водой не производят, вызывая стресс, вызванный засухой. Целью является достижение стрессового периода на стадии цветения в течение 4 недель. Для прогноза точной потребности в суммарном транспорте воды у кукурузы в зависимости от мониторинга влажности почвы и метеорологических данных (температура воздуха, недостаточное давление пара, скорость ветра и суммарное излучение) используют моделирование окружающей среды. У растений контролируют признаки засухи, такие как свертывание листьев посредством визуального осмотра, увеличенная температура листьев посредством инфракрасных термометров, сниженный уровень фотосинтеза посредством флуоресценции хлорофилла и сниженный урожай посредством измерения продукции зерен. Идентифицируют растения, демонстрирующие значительно меньшее сворачивание листьев, меньшую температуру листьев, большие скорости фотосинтеза или значительно больший урожай в условиях водного стресса и используют для последующего скрининга.
Для подтверждения фенотипа устойчивости к засухе, объекты ZeaTAG, демонстрирующие значительно большую устойчивость к засухе, высаживают в повторном полевом испытании. Эти объекты высаживают в рандомизированном дробно-блочном формате по меньшей мере с 3 повторениями. Один блок орошают водой в достаточном для предотвращения водного стресса количестве. Другой блок выращивают в условиях дефицита воды, как описано выше. У растений контролируют свертывание листьев, увеличенную температуру листьев, сниженный уровень фотосинтеза и сниженный урожай, как описано выше. Затем растения со значительно меньшим свертыванием листьев, меньшей температурой листьев, увеличенным уровнем фотосинтеза или большим урожаем, чем у нетрансформированных контрольных растений считают прошедшими вторичный скрининг.
Скрининг эффективности использования азота
Для идентификации объектов ZeaTAG с большей эффективностью использования азота, чем у нетрансгенных контрольных растений проводят первичный скрининг. Растения, насчитывающие приблизительно 40000 содержащих ZeaTAG объектов, выращивают в полевых условиях в условиях дефицита азота. Растения выращивают в полях менее чем с 15,9 кг N на акр. У растений контролировали хлороз посредством визуального наблюдения, повышенную температуру листьев посредством инфракрасных термометров и сниженный урожай при сборе зерна. Эти параметры сравнивали с нетрансгенными контрольными растениями. Линии ZeaTAG продемонстрировали меньший хлороз, меньшую температуру листьев, более высокие скорости фотосинтеза или больший урожай, чем нетрансгенные контрольные линии, оцениваемые при вторичном скрининге.
В качестве вторичного скрининга объекты ZeaTAG, демонстрирующие значимо большую эффективность использования азота, высаживают в повторном полевом испытании для подтверждения фенотипа. Эти объекты высаживают в рандомизированном дробно-блочном формате по меньшей мере с 3 повторениями. Один блок поливают достаточным для предотвращения азотного стресса количеством азотных удобрений. Другой блок выращивают в условиях дефицита азота, как описано выше. У растений контролируют хлороз посредством визуального наблюдения, повышенную температуру листьев посредством инфракрасных термометров и сниженный урожай при сборе зерна. Растения со значительно меньшим хлорозом, меньшей температурой листьев, большим уровнем фотосинтеза или большим урожаем, чем нетрансформированные контрольные растения считают прошедшими вторичный скрининг.
После подтверждения фенотипа во вторичном скрининге фенотип тестируют на генетическое сцепление со вставкой ZeaTAG посредством скрининга потомства после скрещивания нетрансформированной родительской линии и линии ZeaTAG. Когда растения, содержащие элемент ZeaTAG, демонстрируют фенотип, а растения, не содержащие элемент ZeaTAG, не демонстрируют, фенотип считают генетически сцепленным со вставкой и вероятно вызываемым элементом ZeaTAG. Для идентификации генов, экспрессия которых может находиться под воздействием элемента ZeaTAG, определяют положение элемента ZeaTAG в геноме.
Положение элемента ZeaTAG в геноме определяют посредством выделения геномных последовательностей, фланкирующих элемент ZeaTAG, и сравнения этих последовательностей с геномной последовательностью кукурузы. Последовательности, фланкирующие элемент ZeaTAG, можно определять рядом молекулярно-биологических способов, включая в качестве неограничивающих примеров, обратную ПЦР (оПЦР) (Ochman et al., Genetics, 120: 621-6231988), TAIL (Liu et al., Plant Journal 8: 457-463, 1995) и опосредованную лигированием ПЦР (олПЦР) Prod'hom et al., FEMS Microbiol Lett.158: 75-81, 1998). Для идентификации положения элемента ZeaTAG в геноме эти последовательности сравнивают c геномными последовательностями посредством средств для выравнивания последовательностей, таких как BLAST.
Гены, фланкирующие элемент ZeaTAG или прерываемые им, определяют посредством исследования аннотируемого генома. Транскрипция генов, фланкирующих элемент ZeaTAG, может отвечать за мутантный фенотип. Эти гены, для проверки того, могут ли они определять сходный фенотип, можно сверхэкспрессировать в кукурузе дикого типа. Для этого гены клонируют в трансформационные векторы под контролем сильных промоторов или под контролем их собственных промоторов с фланкирующими их энхансерными последовательностями для усиления транскрипции. Эти векторы вводят в кукурузу дикого типа посредством трансформации, и у растений, получаемых после этой трансформации, тестируют фенотип.
Подобным образом, фенотип могут обеспечивать гены, прерываемые элементом ZeaTAG. Для подтверждения того, что ген, прерываемый элементом, отвечает за фенотип, можно нарушать экспрессию гена, и у растений с этим нарушением можно тестировать фенотип. Нарушение экспрессии конкретных генов можно проводить рядом способов, известных специалистам в данной области, включая в качестве неограничивающих примеров антисмысловые РНК, искусственные микроРНК и идентификацию мутаций в гене посредством TILLING.
ПРИМЕР 7
Обратный генетический скрининг популяции ZeaTAG
В этом примере описан обратный генетический скрининг мутаций в популяции ZeaTAG.
Посредством обратного генетического скрининга ищут мутации, действующие на конкретные гены, а затем тестируют идентифицированную линию на мутантный фенотип. Популяцию ZeaTAG можно использовать в обратных генетических анализах несколькими способами, включая в качестве неограничивающих примеров получение коллекции меток фланкирующих последовательностей для популяции (Jeong et al., Plant Journal 45: 123-132, 2006) и получение индексированной коллекции объединенных образцов ДНК из популяции ZeaTAG (May et al., Molecular Biotechnology 20: 209-221, 2002).
Коллекцию меток фланкирующих последовательностей получают посредством получения образцов ткани листа из популяции ZeaTAG, выделения ДНК из каждого, идентификации последовательностей, фланкирующих вставку и хранение последовательностей в базе данных с функцией поиска, где последовательности связаны с объектами, из которых они получены. Геномную ДНК выделяют с использованием набора Qiagen DNAeasy Plant (Qiagen, Germantown, Maryland) по протоколу, рекомендованному производителем. Последовательности, фланкирующие вставку, идентифицируют с использованием опосредованной лигированием ПЦР (Mueller et al., Science 246: 780-786, 1989), модифицированной Yephremov and Saedler (Plant Journal 21: 295-305, 2000). В кратком изложении, геномную ДНК линии ZeaTAG фрагментируют посредством расщепления рестрикционными ферментами и денатурируют. Биотинилированный олигонуклеотидный праймер, комплементарный с последовательностью конца элемента ZeaTAG, гибридизуют с фрагментированной ДНК и достраивают ДНК-полимеразой. В смесь добавляют покрытые стрептавидином магнитные гранулы для связывания фрагментов ДНК, содержащих фрагменты ДНК, достроенные с этого праймера. С неизвестным концом лигируют двухцепочечный адаптерной ДНК с известной последовательностью. Эти фрагменты подвергают амплификации ПЦР с использованием олигонуклеотидов, комплементарных последовательностям в элементе ZeaTAG и адаптерной ДНК на другом конце. Затем определяют последовательность фрагмента ПЦР и картируют на геномной последовательности кукурузы посредством BLAST. Эти последовательности локализуют участок вставки элемента ZeaTAG. У генов в пределах ~10 т.п.н. может быть повышена экспрессия посредством энхансерных последовательностей в элементе ZeaTAG.
Растения, содержащие вставки в генах или рядом с генами, которые гипотетически обеспечивают фенотип, можно идентифицировать посредством поиска в базе данных. Растения, содержащие эти объекты, можно тестировать на фенотип.
ПРИМЕР 8
Конструкции ДНК, содержащие специфичный для семян промотор с энхансерным элементом SCBV
Этот пример демонстрирует идентификацию последовательностей, содержащих энхансерный элемент промотора SCBV, функционально связанный со специфичным для семян промотором KCS Lesquerella fendleri (LfKCS3; патент США № 7253337) и проектирование и конструирование векторов для трансформации растений.
Идентифицирован промоторный фрагмент, полученный из генома SCBV (номер доступа GeneBank AJ277091, и описанный Geijskes et al., Arch. Virol., 147: 2393-2404, 2002). В исследовании с анализом промотора, фрагмент, полученный из промотора SCBV (фиг. 1; SEQ ID NO: 1), содержащий последовательность от -503 до -222, тандемно повторяли четыре раза и сливали со специфичным для семян промотором LfKCS3. Слияние промотора LfKCS3 с 4× энхансером SCBV клонировали выше кодирующей области ацил-КоА-дельта-9-десатуразы и использовали для контроля экспрессии белка.
Конструировали конструкцию pDAB3892 (фиг. 5) с использованием реакции многоучастковой рекомбинации L-R Gateway™ (Invitrogen, Carlsbad, CA). pDAB3892 содержит единицу транскрипции растения (PTU) ацил-КоА-дельта-9-десатуразы Aspergillus nidulans и PTU фосфинотрицинацетилтрансферазы. Конкретно, PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans содержит химерный промотор, состоящий из 4× энхансерного элемента SCBV, слитого с промотором гена LfKCS3 (SCBV282(от -503 до -222)::SCBV282(от -503 до -222)::SCBV282(от -503 до -222)::SCBV282(от -503 до -222)::промотор LfKCS3), ацил-КоА-дельта-9-десатуразу Aspergillus nidulans (дельта-9-десатураза; международная публикация № WO9950430) и заканчивается 3'-нетранслируемой областью открытой рамкой считывания 23 Agrobacterium tumefaciens (3'-UTR AtuORF23; патентная заявка Европы № 222493). PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans приведена как SEQ ID NO: 2. PTU селектируемого маркера содержит промотор вируса виноградной мозаики Cassava (промотор CsVMV; Verdaguer et al., Plant Molecular Biology 31:1129-1139; 1996), фосфинотрицинацетилтрансферазу (PAT; Wohlleben et al., Gene 70:25-37; 1988) и 3'-нетранслируемую область ORF1 Agrobacterium tumefaciens (3'-UTR AtuORF1; Huang et al., J. Bacteriol. 1990 172:1814-1822). PTU фосфинотрицинацетилтрансферазы приведена как SEQ ID NO: 3.
PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans относительно PTU фосфинотрицинацетилтрансферазы в пределах граничных областей цепи T-ДНК бинарного вектора для трансформации растений ориентирована в цис-ориентации (ориентация голова-к-хвосту). Бинарный вектор содержит дополнительные регуляторные элементы, такие как усиливающая последовательность (Toro et al., PNAS 85(22): 8558-8562; 1988) и граничные последовательности T-цепи (граничная последовательность Т-ДНК A и граничная последовательность Т-ДНК B; Gardner et al., Science 231:725-727; 1986 и международная публикация № WO 2001/025459). Выделяли рекомбинантные плазмиды, содержащие две PTU, и подтверждали расщеплением рестрикционными ферментами и секвенированием ДНК.
Контрольную конструкцию, pDAB1757 (фиг. 6), конструировали с использованием реакции многоучастковой рекомбинации L-R Gateway™ (Invitrogen, Carlsbad, CA). pDAB1757 содержит единицу транскрипции растения (PTU) ацил-КоА-дельта-9-десатуразы Aspergillus nidulans и PTU фосфинотрицинацетилтрансферазы. Конкретно, PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans содержит промотор гена Lf KCS3 (промотор LfKCS3), ацил-КоА-дельта-9-десатуразу Aspergillus nidulans (дельта-9-десатураза) и заканчивается 3'-нетранслируемой областью открытой рамкой считывания 23 Agrobacterium tumefaciens (3'-UTR AtuORF23). PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans приведена как SEQ ID NO: 4. PTU селектируемого маркера содержит промотор вируса виноградной мозаики Cassava (промотор CsVMV), фосфинотрицинацетилтрансферазу (PAT) и 3'-нетранслируемую область ORF1 Agrobacterium tumefaciens (3'-UTR AtuORF1). PTU фосфинотрицинацетилтрансферазы приведена как SEQ ID NO: 5.
PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans относительно PTU фосфинотрицинацетилтрансферазы в пределах граничных областей цепи T-ДНК бинарного вектора для трансформации растений ориентирована в цис-ориентации (ориентация голова-к-хвосту). Бинарный вектор содержит дополнительные регуляторные элементы, такие как усиливающая последовательность (Toro et al., PNAS 85(22): 8558-8562; 1988) и граничные последовательности T-цепи (граничная последовательность Т-ДНК A и граничная последовательность Т-ДНК B; Gardner et al., Science 231:725-727; 1986 и международная публикация № WO 2001/025459). Выделяли рекомбинантные плазмиды, содержащие две PTU, и подтверждали расщеплением рестрикционными ферментами и секвенированием ДНК.
Контрольную конструкцию, pDAB1759 (фиг. 7), конструировали с использованием реакции многоучастковой рекомбинации L-R Gateway™ (Invitrogen, Carlsbad, CA). pDAB1759 содержит единицу транскрипции растения (PTU) ацил-КоА-дельта-9-десатуразы Aspergillus nidulans и PTU фосфинотрицинацетилтрансферазы. Конкретно, PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans содержит промотор фазеолина Phaseolus vulgaris (промотор Phas Pv; Slightom et al., 1983 Proc. Natl. Acad. Sci. U.S.A. 80: 1897-1901), ацил-КоА-дельта-9-десатуразу Aspergillus nidulans (дельта-9-десатураза) и заканчивается 3'-нетранслируемой областью открытой рамкой считывания 23 Agrobacterium tumefaciens (3'-UTR AtuORF23). PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans приведена как SEQ ID NO: 6. PTU селектируемого маркера содержит промотор вируса виноградной мозаики Cassava (промотор CsVMV v2), фосфинотрицинацетилтрансферазу (PAT) и 3'-нетранслируемую область ORF1 Agrobacterium tumefaciens (3'-UTR AtuORF1). PTU фосфинотрицинацетилтрансферазы приведена как SEQ ID NO: 7.
PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans относительно PTU фосфинотрицинацетилтрансферазы в пределах граничных областей цепи T-ДНК бинарного вектора для трансформации растений ориентирована в цис-ориентации (ориентация голова-к-хвосту). Бинарный вектор содержит дополнительные регуляторные элементы, такие как усиливающая последовательность (Toro et al., PNAS 85(22): 8558-8562; 1988) и граничные последовательности T-цепи (граничная последовательность Т-ДНК A и граничная последовательность Т-ДНК B; Gardner et al., Science 231:725-727; 1986 и международная публикация № WO 2001/025459). Выделяли рекомбинантные плазмиды, содержащие две PTU, и подтверждали расщеплением рестрикционными ферментами и секвенированием ДНК.
Конструкцию pDAB9381 (фиг. 8) конструировали с использованием реакции многоучастковой рекомбинации L-R Gateway (Invitrogen, Carlsbad, CA). pDAB9381 содержит единицу транскрипции растения (PTU) желтого флуоресцентного белка (yfp) и PTU фосфинотрицинацетилтрансферазы. Конкретно, PTU желтого флуоресцентного белка содержит промотор гена убиквитина 10 Arabidopsis thaliana (промотор Ubi10 At; Callis et al., 1990 J Biol Chem 265:12486-12493), кодирующую последовательность желтого флуоресцентного белка (PhiYFP; Shagin et al., 2004 Molecular Biology and Evolution, 21(5), 841-850), которая содержит индуцируемый светом тканеспецифический интрон гена LS-1 Solanum tuberosum (интрон ST-LS1; номер доступа Genbank X04753) и заканчивается 3'-нетранслируемой областью открытой рамкой считывания 23 Agrobacterium tumefaciens (3'-UTR AtuORF23). PTU желтого флуоресцентного белка приведена как SEQ ID NO:8. PTU селектируемого маркера содержит промотор вируса виноградной мозаики Cassava (промотор CsVMV v2; Verdaguer et al., Plant Molecular Biology 31:1129-1139; 1996), фосфинотрицинацетилтрансферазу (PAT; Wohlleben et al., Gene 70:25-37; 1988) и 3'-нетранслируемую область ORF1 Agrobacterium tumefaciens (3'-UTR AtuORF1; Huang et al., J. Bacteriol. 172:1814-1822; 1990). PTU фосфинотрицинацетилтрансферазы приведена как SEQ ID NO: 9.
PTU желтого флуоресцентного белка относительно PTU фосфинотрицинацетилтрансферазы в пределах граничных областей цепи T-ДНК бинарного вектора для трансформации растений ориентирована в цис-ориентации (ориентация голова-к-хвосту). Бинарный вектор содержит дополнительные регуляторные элементы, такие как усиливающая последовательность (Toro et al., PNAS 85(22): 8558-8562; 1988) и граничные последовательности T-цепи (граничная последовательность Т-ДНК A и граничная последовательность Т-ДНК B; Gardner et al., Science 231:725-727; 1986 и международная публикация № WO 2001/025459). Выделяли рекомбинантные плазмиды, содержащие две PTU, и подтверждали расщеплением рестрикционными ферментами и секвенированием ДНК.
ПРИМЕР 9
Опосредованная агробактериями трансформация Arabidopsis thaliana
Трансформация агробактериями: Трансгенную Arabidopsis thaliana получали способом опосредованной агробактериями трансформации посредством погружения цветов. Для инициации трансформации использовали нейтрализованный штамм Agrobacterium tumefaciens Z707s, несущий описанные выше конструкции.
Трансформация Arabidopsis: Arabidopsis трансформировали с использованием способа погружения цветов на основе Clough and Bent (1998) Plant J. 16:735-743. Выбранную колонию Agrobacterium использовали для инокуляции одной или нескольких 30 мл предварительных культур на бульоне YEP, содержащем подходящие для отбора антибиотики. Культуру(ы) инкубировали в течение ночи при 28°C с постоянным перемешиванием при 220 об./мин. Каждую предварительную культуру использовали для инокуляции двух 500 мл культур на бульоне YEP, содержащем антибиотики для отбора, и культуры инкубировали в течение ночи при 28°C с постоянным перемешиванием. Затем клетки центрифугировали приблизительно при 8700 g в течение 10 минут при комнатной температуре и полученный супернатант удаляли. Клеточный осадок осторожно ресуспендировали в 500 мл инфильтрационной среды, содержащей: 1/2× соли Мурасиге-Скуга/витамины B5 Gamborg, 10% (масс./об.) сахарозу, 0,044 мкМ бензиламинопурин (10 мкл/литр из исходного раствора 1 мг/мл в DMSO) и 300 мкл/литр Silwet L-77™. Растения возрастом приблизительно 1 месяц погружали в среду на период 15 секунд; принимали меры для погружения самых молодых соцветий. Затем растения выкладывали набок и накрывали (прозрачное или непрозрачное покрытие) на период 24 часа, затем промывали водой и устанавливали вертикально. Растения выращивали при 22°C, со световым периодом 16 часов света/8 часов темноты. Приблизительно через 4 недели после погружения собирали семена.
Условия выращивания Arabidopsis thaliana: Свежесобранные семена сушили в течение 7 суток при комнатной температуре в присутствии осушителя. После сушки семена суспендировали в 0,1% раствор агарозы (Sigma Chemical Co., St. Louis, MO.). Суспендированные семена хранили при 4°C в течение 2 суток для выполнения требований покоя семян и обеспечения синхронного прорастания семян (стратификация). Sunshine Mix LP5™ (Sun Gro Horticulture Inc., Bellevue, WA) покрывали мелкодисперсным вермикулитом и немного пропитывали питательной смесью Хогланда до намокания. Почвенную смесь дренировали в течение 24 часов. Стратифицированные семена высаживали в почву и покрывали влажными колпаками (KORD Products, Bramalea, Ontario, Canada) на период 7 суток. Семена прорастали и растения выращивали в Conviron™ (модели CMP4030 и CMP3244, Controlled Environments Limited, Winnipeg, Manitoba, Canada) в условиях длительного дня (16 часов света/8 часов темноты) с интенсивностью света 120-150 мкмоль/м2с при постоянной температуре (22°C) и влажности (40-50%). Растения сначала поливали питательной смесью Хогланда, а затем деионизированой водой для поддержания почвы влажной, но не мокрой. Растения, близкие к сбору семян (1-2 недели до сбора), высушивали.
Отбор трансформированных растений T1: семена T1 собирали и высаживали в почву в лотки для прорастания 10,5" × 21" (T.O. Plastics Inc., Clearwater, MN). Через 5-6 суток после высаживания колпаки удаляли. Через 5 суток после высаживания и еще раз через 10 суток после высаживания на всходы распыляли 0,20% раствор гербицида глуфосината (Liberty®, Bayer Crop Science) в объеме спрея 10 мл/лоток (703 л/га) с использованием распыляющего наконечника со сжатым воздухом DeVilbiss™ с обеспечением эффективной скорости 280 г/га глуфосината на применение. Для распыления в каждый лоток 10 мл раствора гербицида глуфосината пипеткой добавляли в 20 мл сцинтилляционный флакон. Спрей доставляли с использованием горизонтального и вертикального характера нанесения. После каждого распыления, на каждый лоток помещали бирку с названием гербицида, скоростью нанесения и датой нанесения. Через 4-7 суток после второго распыления гербицида идентифицировали устойчивые растения и пересаживали в горшки с добавленной смесью Sunshine LP5™.
Пересаженные растения помещали в теплицу с указанными выше условиями роста. Через шесть-восемь недель после пересаживания собирали семена T2 каждого растения и хранили раздельно с уникальным идентификационным номером. Эти семена анализировали с использованием анализа FAME, описанного ниже.
ПРИМЕР 10
Молекулярное подтверждение
Присутствие и число копий трансгена pat в геноме растения Arabidopsis, которое трансформировали pDAB1757, pDAB1759, pDAB3892 и pDAB9381, подтверждали с использованием молекулярного анализа, состоящего из анализа гидролиза зонда.
Растения T1 Arabidopsis сначала подвергали скринингу посредством анализа гидролиза зонда, аналогичного TAQMAN™, для подтверждения присутствия трансгена pat. Данные, полученные из этих исследований, использовали для определения числа копий трансгена и идентификации и отбора объектов Arabidopsis для самоопыления и получения T2 и последующего анализа FAME.
Число копий определяли в растениях T1 и Arabidopsis с использованием анализа гидролиза зонда, описанного ниже. Идентифицировали растения с одной копией трансгена и проводили последующие исследования на устойчивость к глифосату. Образцы тканей собирали в 96-луночные планшеты и лиофилизировали в течение 2 суток. Проводили замачивание ткани с использованием тканевого распылителя KLECO™ и вольфрамовых гранул (Environ Metal Inc., Sweet Home, Oregon). После замачивания тканей выделяли геномную ДНК в высокопроизводительном формате с использованием набора Biosprint 96 Plant kit™ (Qiagen, Germantown, MD) по предлагаемому производителем протоколу. Геномную ДНК количественно определяли посредством набора для анализа ДНК Quant-It Pico Green DNA Assay Kit™ (Molecular Probes, Invitrogen, Carlsbad, CA). Количественно определенную геномную ДНК доводили приблизительно до 2 нг/мкл для анализа гидролиза зонда с использованием автоматического жидкостного манипулятора BIOROBOT3000™ (Qiagen, Germantown, MD). Определение числа копий трансгена посредством анализа гидролиза зонда проводили посредством ПЦР с детекцией в реальном времени с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы разрабатывали для pat и гена внутреннего стандарта, TAFII15 (Genbank ID: NC 003075; Duarte et al., (201) BMC Evol. Biol., 10:61).
Для амплификации получали мастер-микс LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) с 1× конечной концентрацией в объеме 10 мкл сложной реакционной смеси, содержащей 0,1 мкМ каждого праймера для pat, 0,4 мкМ каждого праймера для TAFII15 и 0,2 мкМ каждого зонда (таблица 2). Проводили двухэтапную реакцию амплификации с достройкой при 60°C в течение 40 секунд с накоплением флуоресценции. Все образцы запускали в реакцию и для анализа каждого образца использовали средние значения пороговых циклов (Ct). Анализ данных ПЦР с детекцией в реальном времени проводили с использованием программного обеспечения LightCycler версии 1.5 с использованием модуля относительного подсчета, и он основывается на способе ДДCt. Для этого в каждый проход включали образец геномной ДНК из одной копии калибровочного стандарта и 2 копии известного контроля. Для трансгенных растений T1 Arabidopsis число копий определяли в результате скрининга гидролиза зонда.
Информация о праймерах и зондах для анализа гидролиза зонда pat и гена внутреннего стандарта (TAFII15).
ПРИМЕР 11
Анализ FAME (сложных метиловых эфиров жирных кислот) профилей жирных кислот
Растения Arabidopsis трансформировали векторами Agrobacterium, описанными в пример 1, и растения, содержащие ген pat, идентифицировали посредством анализа гидролиза зонда и подвергали самоопылению. Семена T2 собирали вместе из выбранных устойчивых к гербицидам растений T1 и содержание жирных кислот анализировали с использованием анализа сложных метиловых эфиров жирных кислот (FAME).
Общие образцы семян (10 мг) гомогенизировали в гептане, содержащем тригептадеканоин (Nu-Chek Prep, Elysian, MN) в качестве заместителя с использованием стальных шариков и шаровой мельницы. Перед гомогенизацией в образец добавляли раствор свежеполученного 0,25M MeONa в MeOH (Sigma-Aldrich, St. Louis, MO). Реакцию проводили при умеренном нагревании (40°C) и постоянном перемешивании. Окончание реакции подтверждали посредством восстановления метилированного заместителя. Экстракцию FAME из общих образцов семян повторяли три раза и перед анализом объединяли все гептановые слои. Завершение экстракции подтверждали посредством проверки присутствия FAME в четвертом экстракте/деривате. Полученные FAME анализировали посредством Agilent 6890 GC-FID™ (Agilent, Santa Clara, CA) с использованием капиллярной колонки BPX 70™ 15 м × 0,25 мм × 0,25 мкм из SGE Analytical Science (Austin, TX). Каждый FAME идентифицировали по его времени удержания относительно очищенного стандарта и количественно определяли посредством инъекции эталонной смеси FAME рапсового масла из Matreya LLC (Pleasant Gap, PA) в качестве калибровочного стандарта.
У Arabidopsis насыщенные жирные кислоты (SFA) определяют как сумму всех жирных кислот с любой длиной углеродной цепи без двойных связей (например. C14:0, C16:0, C18:0, C20:0, C22:0, C24:0). Анализ FAME семян T2 из трансгенных объектов продемонстрировал, что экспрессия ацил-КоА-дельта-9-десатуразы Aspergillus nidulans оказывает достоверное влияние на снижение содержания SFA в семенах. Среднее содержание насыщенных жирных кислот в каждом наборе объектов представлено в таблице 3, а процент снижения фенотипа насыщенных жирных кислот представлен на фиг. 9. В таблице 3 и на фиг. 9 значения и сопровождающие значимые отличия определяли с использованием критерия HSD Тьюки-Крамера, проводимого посредством пакета статистического программного обеспечения JMP Statistical Software Package™ (SAS Institute Inc., Cary, NC).
Промоторная комбинация из 4× энхансера SCBV, слитого с промотором LfKCS3, контролирующая экспрессию ацил-КоА-дельта-9-десатуразы Aspergillus nidulans (pDAB3892, на фиг. 9), приводила к сниженному среднему содержанию тотальных насыщенных жирных кислот по сравнению с контрольной конструкцией, где ацил-КоА-дельта-9-десатураза Aspergillus nidulans находилась под контролем только промотора KCS (pDAB1757, на фиг. 9). Эти результаты свидетельствуют, что ацил-КоА-дельта-9-десатураза Aspergillus nidulans экспрессирована на более высоких уровнях, что является результатом добавления 4× энхансера SCBV, контролирующего промотор LfKCS.
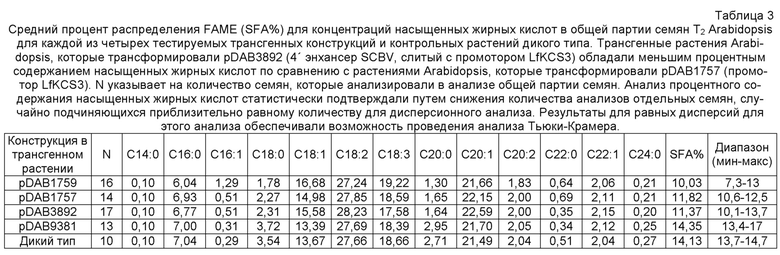
Ввиду множества возможных вариантов осуществления, к которым можно применять основные положения описанного изобретения, следует понимать, что проиллюстрированные варианты осуществления являются только предпочтительными примерами изобретения, и их не следует рассматривать, как ограничивающие объем изобретения. Точнее, объем изобретения определен приводимой ниже формулой изобретения. Таким образом, авторы в качестве своего изобретения заявляют все, что входит в объем и сущность этой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ И КОНСТРУКТ ДЛЯ СИНТЕТИЧЕСКОГО ДВУНАПРАВЛЕННОГО РАСТИТЕЛЬНОГО ПРОМОТОРА SCBV | 2012 |
|
RU2627595C2 |
| СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТА ИЗ BRASSICA | 2013 |
|
RU2636035C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2013 |
|
RU2662672C2 |
| РЕГУЛЯТОРНЫЕ ЭЛЕМЕНТЫ РАСТЕНИЙ И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2639275C2 |
| СИНТЕТИЧЕСКИЕ ПРОИСХОДЯЩИЕ ИЗ BRASSICA ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТОВ | 2013 |
|
RU2626535C2 |
| КОНСТРУКТ И СПОСОБ ДЛЯ ЭКСПРЕССИИ ТРАНСГЕНОВ С ИСПОЛЬЗОВАНИЕМ ДВУНАПРАВЛЕННОГО КОНСТИТУТИВНОГО ПРОМОТОРА BRASSICA | 2013 |
|
RU2619178C2 |
| ФУНКЦИОНАЛЬНЫЕ ЛОКУСЫ FAD2 И СООТВЕТСТВУЮЩИЕ СПЕЦИФИЧНЫЕ ДЛЯ САЙТА-МИШЕНИ СВЯЗЫВАЮЩИЕСЯ БЕЛКИ, СПОСОБНЫЕ ИНДУЦИРОВАТЬ НАПРАВЛЕННЫЕ РАЗРЫВЫ | 2013 |
|
RU2656158C2 |
| СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТОВ | 2013 |
|
RU2632648C2 |
| СПОСОБЫ ТРАНСФОРМАЦИИ РАСТЕНИЙ ДЛЯ ЭКСПРЕССИИ ДЕЛЬТА-ЭНДОТОКСИНОВ BACILLUS THURINGIENSIS | 1999 |
|
RU2234531C2 |
| РЕГУЛЯТОРНЫЕ ЭЛЕМЕНТЫ РАСТЕНИЙ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2675524C2 |















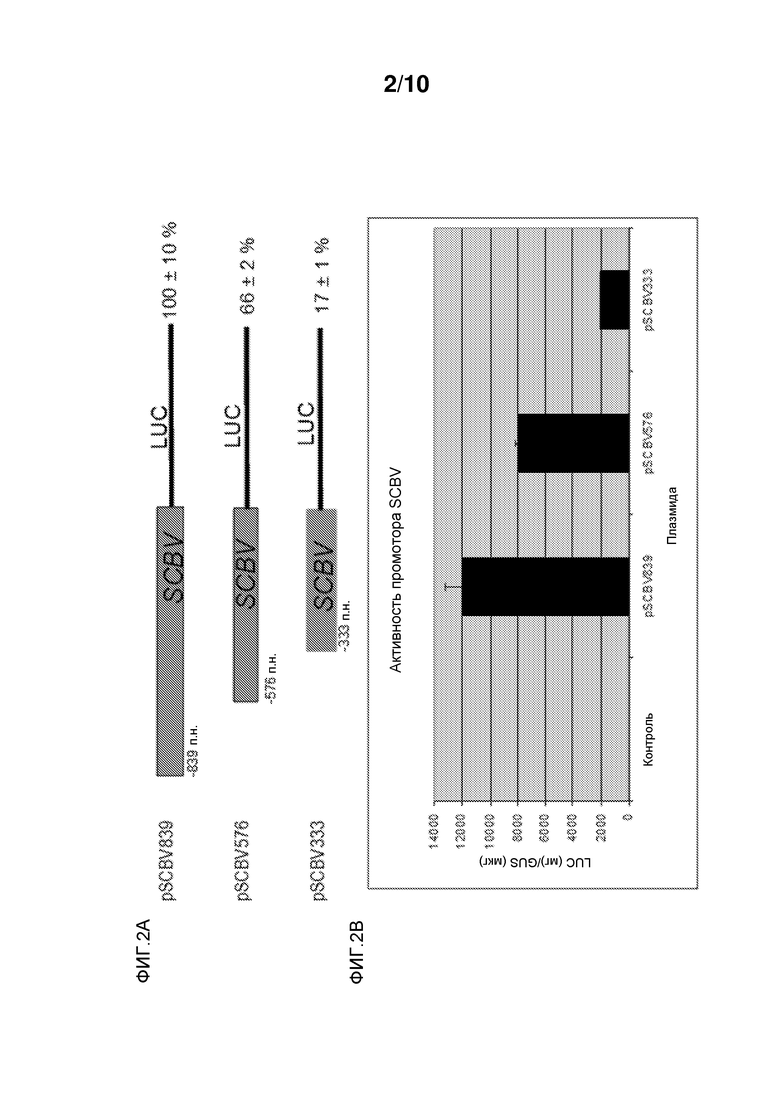
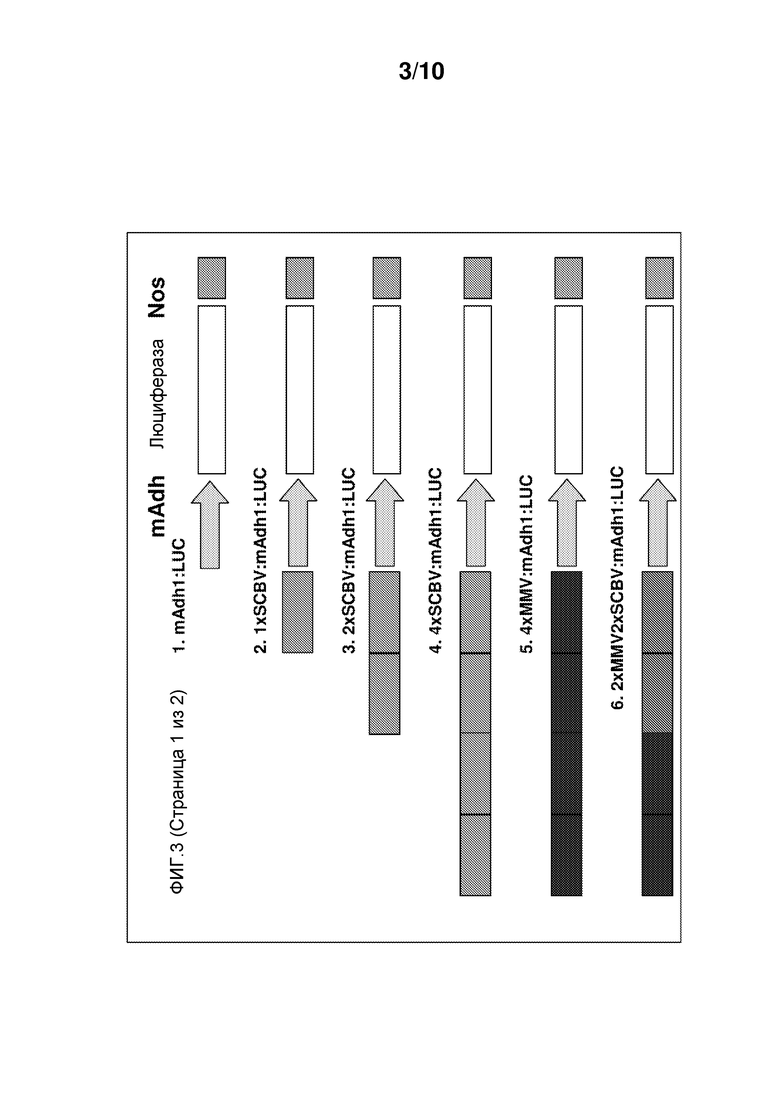
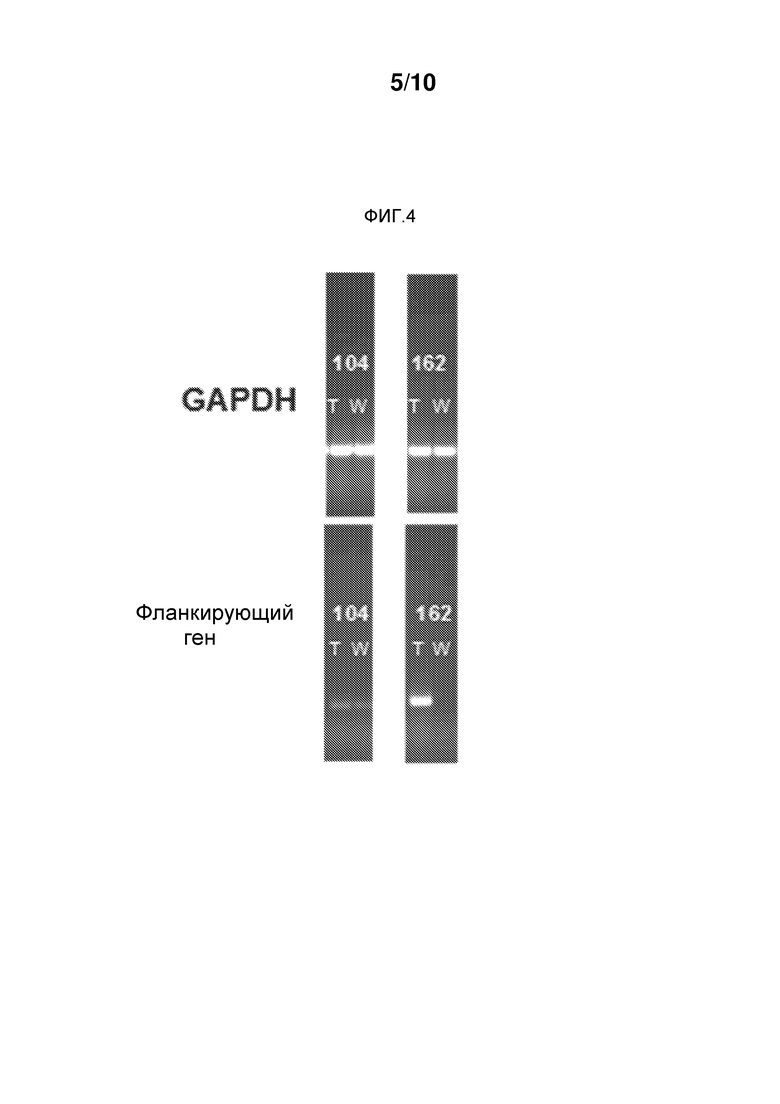
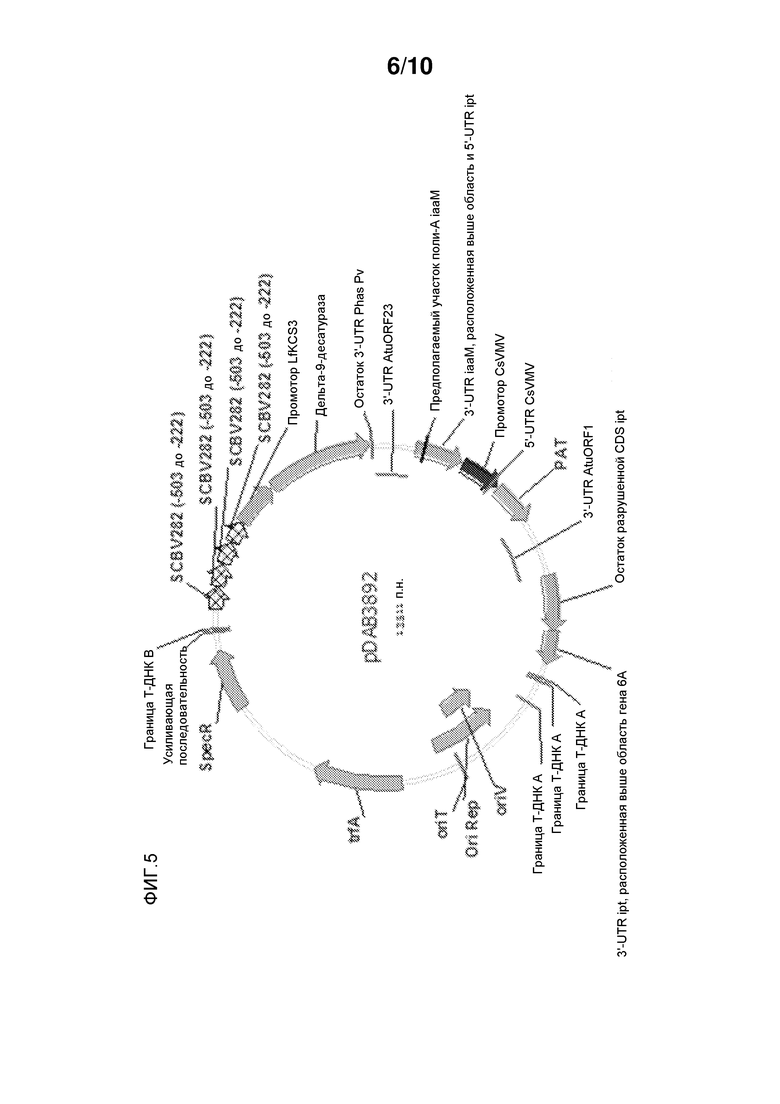
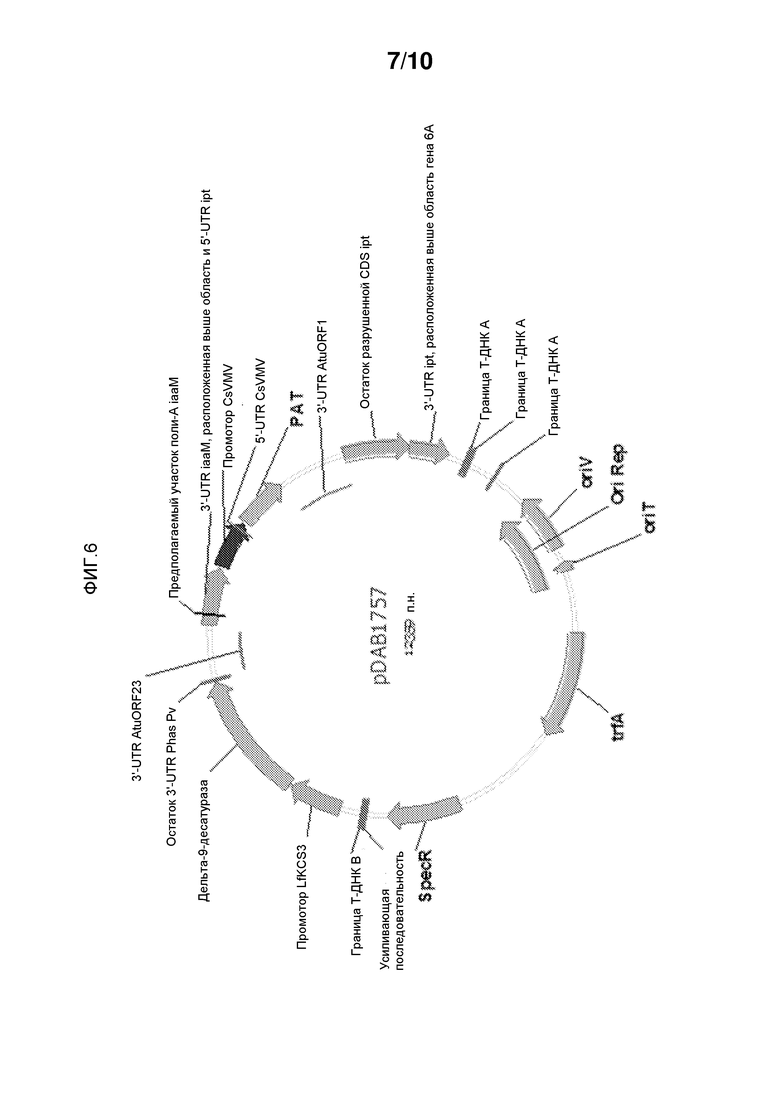
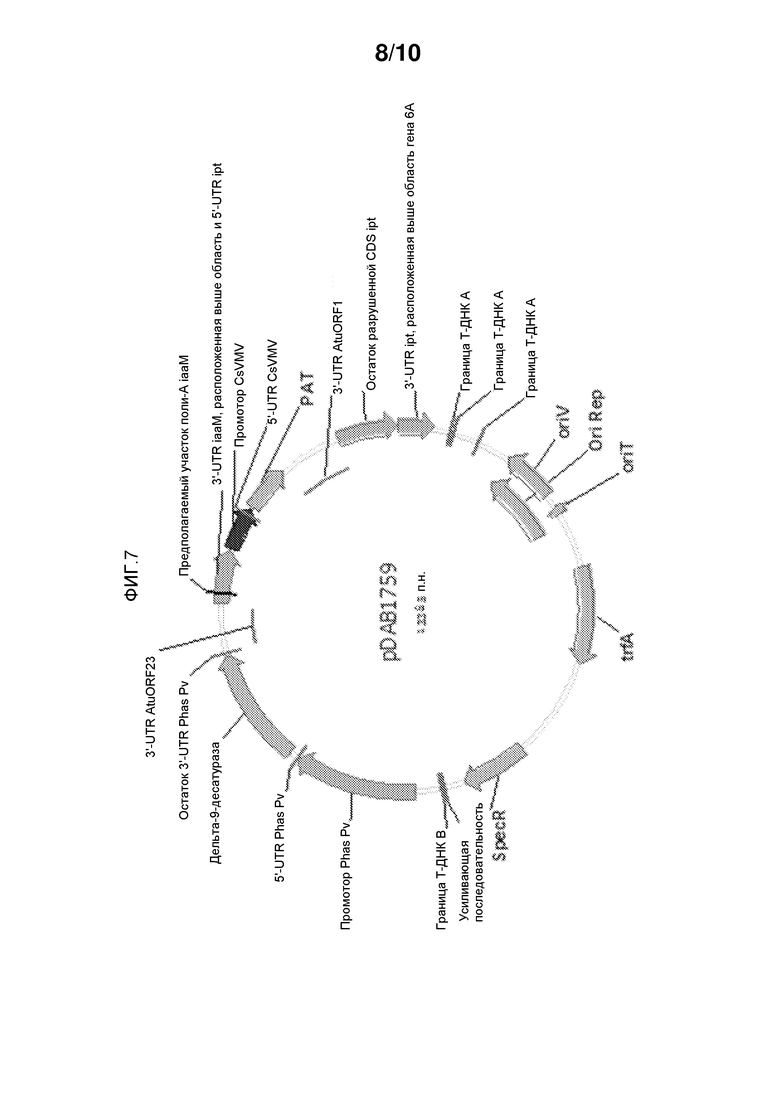
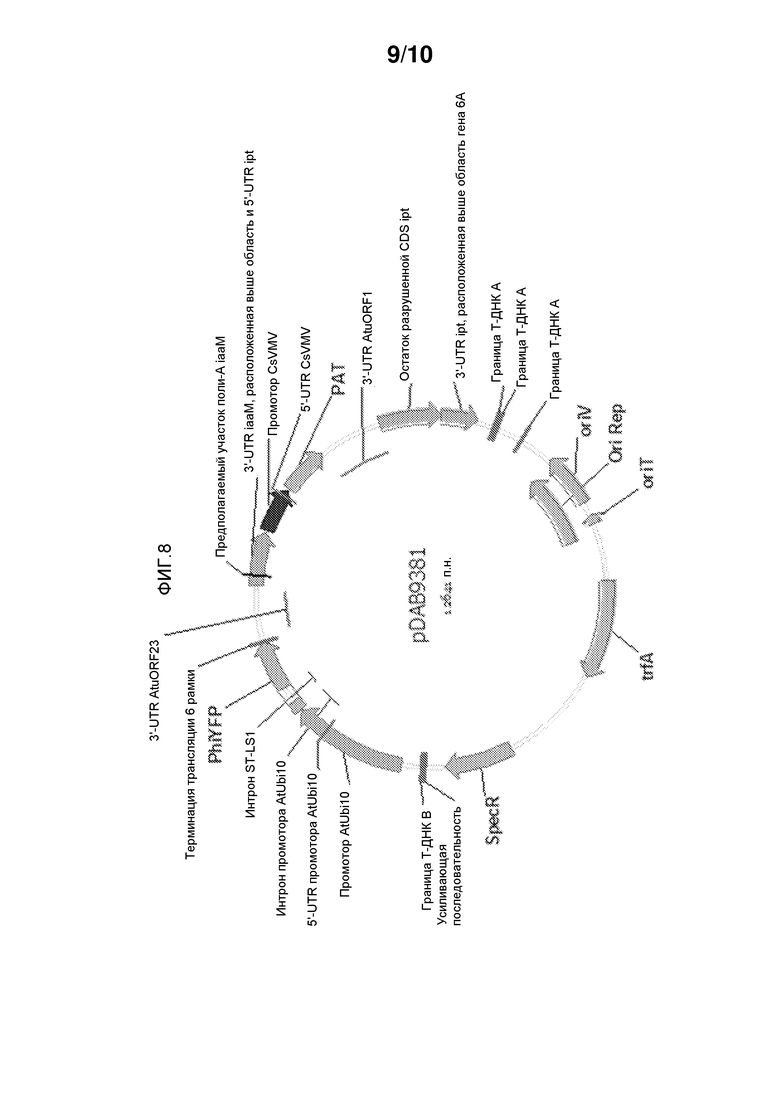
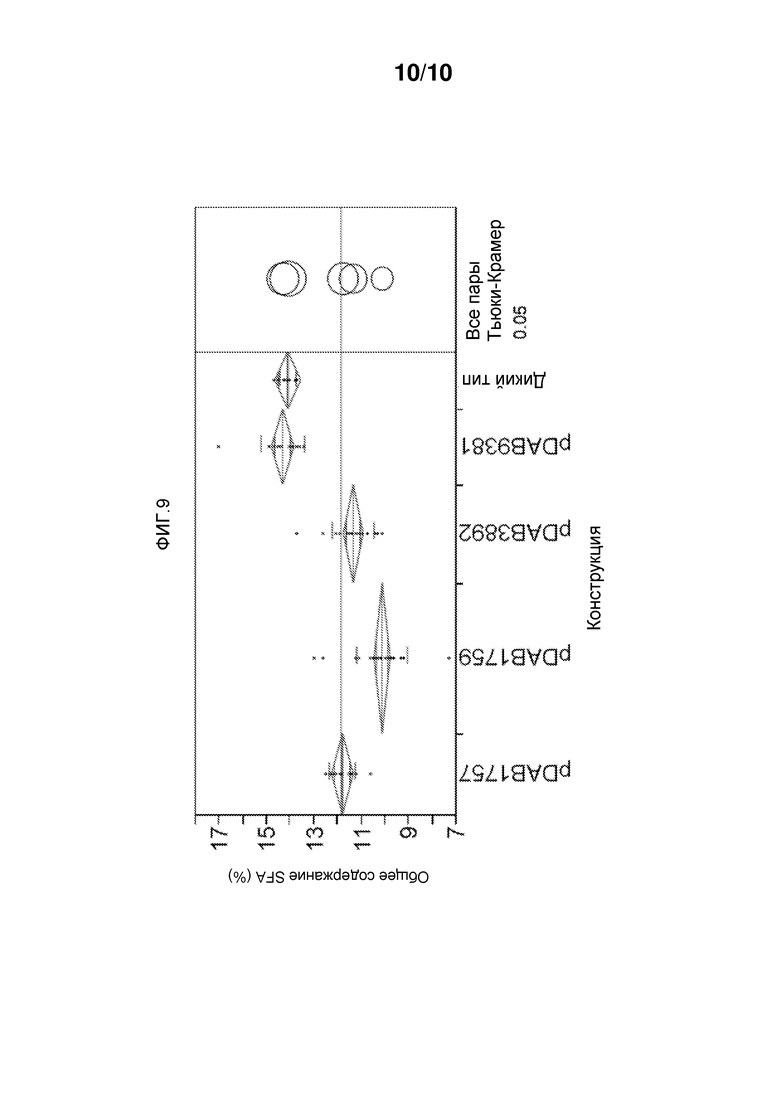
Изобретение относится к области биохимии, в частности конструкции для усиления транскрипции представляющей интерес нуклеотидной последовательности. Также раскрыты трансгенное растение кукурузы или Aspergillus nidulans, семя, клетка, ткань, плод, корень, побег, цветок, срез, содержащие указанную конструкцию. Раскрыты способы получения трансгенного растения с помощью указанной конструкции, способ снижения профиля жирных кислот. Изобретение позволяет получить трансгенное растение кукурузы или Aspergillus nidulans, обладающее усиленной транскрипцией представляющей интерес нуклеотидной последовательности по сравнению с диким типом. 17 н. и 15 з.п. ф-лы, 10 ил., 3 табл., 11 пр.
1. Конструкция для усиления транскрипции представляющей интерес нуклеотидной последовательности, содержащая:
одну или непосредственно связанные друг с другом две или четыре копии энхансерного элемента палочковидного вируса сахарного тростника (SCBV), представленного от положения 337 до положения 618 в SEQ ID NO: 1, где энхансерный элемент SCBV находится по меньшей мере в пределах 3 т.п.н. выше от кодирующей области представляющей интерес нуклеотидной последовательности; и
функционально связанный с ним гетерологичный промотор, содержащий участок связывания РНК-полимеразы и участок инициации иРНК,
где, когда представляющая интерес нуклеотидная последовательность транскрибируется под регуляторным контролем конструкции, количество продукта транскрипции увеличивайся по сравнению с количеством продукта транскрипции, получаемым с контрольной конструкцией, содержащей промотор и не содержащей энхансерной(ых) последовательности(ей) SCBV.
2. Конструкция по п. 1, где представляющей интерес нуклеотидной последовательностью является нуклеотидная последовательность снижения содержания насыщенных жирных кислот.
3. Конструкция по п. 2, где нуклеотидная последовательность снижения содержания жирных кислот состоит из нуклеотидной последовательности ацил-КоА-дельта-9-десатуразы Aspergillus nidulans.
4. Конструкция для усиления транскрипции транскрибируемой полинуклеотидной молекулы, содержащая конструкцию по п. 1, функционально связанную с транскрибируемой полинуклеотидной молекулой, функционально связанной с 3'-концевой полинуклеотидной молекулой терминации транскрипции.
5. Конструкция по п. 4, где указанная транскрибируемая полинуклеотидная молекула придает растению, в котором она экспрессируется, агрономический признак.
6. Трансгенное растение кукурузы или Arabidopsis thaliana, обладающее усиленной транскрипцией представляющей интерес нуклеотидной последовательности, где трансгенное растение стабильно трансформировано конструкцией по п. 4 или п. 5 и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
7. Трансгенное растение по п. 6, где транскрибируемая полинуклеотидная молекула придает растению, в котором она экспрессируется, агрономический признак.
8. Трансгенное растение по п. 7, где растение представляет собой растение Arabidopsis thaliana.
9. Семя трансгенного растения кукурузы или Arabidopsis thaliana по п. 6, для получения растения, обладающего усиленной транскрипцией представляющей интерес нуклеотидной последовательности, где семя содержит конструкцию по п. 4 или 5, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения, по сравнению, с растением дикого типа.
10. Клетка трансгенного растения кукурузы или Arabidopsis thaliana, обладающая усиленной транскрипцией представляющей интерес нуклеотидной последовательности, где клетка трансгенного растения содержит конструкцию по любому из пп. 1-5, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
11. Клетка трансгенного растения по п. 10, где клетка растения происходит из растения Arabidopsis thaliana.
12. Клетка трансгенного растения по п. 10, где клетка растения происходит из растения кукурузы.
13. Способ получения трансгенного растения кукурузы или Arabidopsis thaliana, включающий трансформацию клетки или ткани растения конструкцией по любому из пп. 1-5.
14. Способ по п. 13, где трансгенное растение является растением Arabidopsis thalian.
15. Способ по п. 13, где трансгенное растение является растением кукурузы.
16. Ткань растения кукурузы или Arabidopsis thaliana, обладающая усиленной транскрипцией представляющей интерес нуклеотидной последовательности, где ткань трансгенного растения трансформирована конструкцией по любому из пп. 1-5, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
17. Ткань растения по п. 16, где ткань растения происходит из растения Arabidopsis thaliana.
18. Ткань растения по п. 16, где ткань растения происходит из растения кукурузы.
19. Клетка растения Arabidopsis thaliana, обладающая усиленной транскрипцией представляющей интерес нуклеотидной последовательности, где клетка растения содержит четыре копии энхансерного элемента палочковидного вируса сахарного тростника (SCBV) от положения 337 до положения 618 SEQ ID NO: 1, где четыре копии энхансерного элемента SCBV встроены в геном клетки растения Arabidopsis thaliana, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
20. Клетка растения Arabidopsis thaliana по п. 19, где энхансерные элементы SCBV обеспечивают усиленную транскрипцию представляющей интерес нуклеотидной последовательности, которая находится под регуляторным контролем энхансера SCBV, по сравнению с транскрипцией представляющей интерес нуклеотидной последовательности в отсутствие энхансера SCBV.
21. Способ снижения профиля жирных кислот семян, включающий:
трансформацию конструкции ДНК, содержащей SEQ ID NO: 2, в геном растения Arabidopsis thaliana, где конструкция ДНК дополнительно содержит одну, две или четыре копии энхансерного элемента палочковидного вируса сахарного тростника (SCBV), представленного от положения 337 до положения 618 в SEQ ID NO: 1; и
экспрессию конструкции ДНК в семенах растения, модифицируя таким образом профиль жирных кислот в семенах, где модифицированный профиль жирных кислот включает сниженное процентное содержание насыщенных жирных кислот.
22. Способ по п. 21, где конструкция ДНК содержит четыре копии энхансерного элемента SCBV, промотор, получаемый из области, расположенной выше специфичного для семян гена 3-кетоацил-КоА Lesquerella fendleri, нуклеотидную последовательность ацил-КоА-дельта-9-десатуразы Aspergillus nidulans и 3'-нетранслируемую область открытой рамки считывания 23 Agrobacterium tumefaciens.
23. Способ по п. 21, где трансформация включает опосредованное Agrobacterium tumefaciens погружение цветов.
24. Способ по п. 21, где экспрессия включает специфичную для семян экспрессию.
25. Плод трансгенного растения кукурузы или Arabidopsis thaliana по п. 6, обладающий усиленной транскрипцией представляющей интерес нуклеотидной последовательности, содержащий конструкцию по любому из пп. 1-5, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
26. Лист трансгенного растения кукурузы или Arabidopsis thaliana по п. 6, обладающий усиленной транскрипцией представляющей интерес нуклеотидной последовательности, содержащий конструкцию по любому из пп. 1-5, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
27. Корень трансгенного растения кукурузы или Arabidopsis thaliana по п. 6, обладающий усиленной транскрипцией представляющей интерес нуклеотидной последовательности, содержащий конструкцию по любому из пп. 1-5, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
28. Побег трансгенного растения кукурузы или Arabidopsis thaliana по п. 6, обладающий усиленной транскрипцией представляющей интерес нуклеотидной последовательности, содержащий конструкцию по любому из пп. 1-5, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
29. Цветок трансгенного растения кукурузы или Arabidopsis thaliana по п. 6, обладающий усиленной транскрипцией представляющей интерес нуклеотидной последовательности, содержащий конструкцию по любому из пп. 1-5, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
30. Срез трансгенного растения кукурузы или Arabidopsis thaliana по п. 6, обладающий усиленной транскрипцией представляющей интерес нуклеотидной последовательности, содержащий конструкцию по любому из пп. 1-5, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
31. Ткань растения Arabidopsis thaliana, обладающая усиленной транскрипцией представляющей интерес нуклеотидной последовательности, где ткань растения содержит четыре копии энхансерного элемента палочковидного вируса сахарного тростника (SCBV) от положения 337 до положения 618 SEQ ID NO: 1, где четыре копии энхансерного элемента SCBV встроены в геном клетки растения Arabidopsis thaliana, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
32. Растение Arabidopsis thaliana, обладающее усиленной транскрипцией представляющей интерес нуклеотидной последовательности, где растение содержит четыре копии энхансерного элемента палочковидного вируса сахарного тростника (SCBV) от положения 337 до положения 618 SEQ ID NO: 1, где четыре копии энхансерного элемента SCBV встроены в геном растения Arabidopsis thaliana, и указанное усиление транскрипции представляющей интерес нуклеотидной последовательности влияет на фенотипическое, биохимическое или морфологическое изменение указанного растения по сравнению с растением дикого типа.
| WO 2010086277 A2 от 05.08.2010 | |||
| WO 2007107516 A2 от 27.09.2007 | |||
| WO 2011143204 A2 от 17.11.2011 | |||
| ПРИМЕНЕНИЕ РЯСКИ В ВЫСОКОПРОИЗВОДИТЕЛЬНОМ СКРИНИНГЕ | 2002 |
|
RU2298182C2 |
Авторы
Даты
2017-12-21—Публикация
2013-02-28—Подача