Изобретение относится к области биофармакологии, биотехнологии и регенеративной медицины и описывает новый источник и метод выделения миобластов человека.
Миобласты млекопитающих представляют собой уникальный тип клеток, способных в естественных условиях к делению, направленной миграции с последующим слиянием с образованием мышечных трубок (синцития) и быстрой потерей антигенов главного комплекса гистосовместимости I класса. Такое сочетание свойств делает миобласты практически идеальным объектом для исследований с целью применения этих клеток в области клеточной терапии и генной инженерии при лечении мышечных заболеваний. Исследования показали, что трансплантация миобластов позволяет увеличить максимальную сократительную способность мышечных тканей у пациентов с миопатией Дюшенна (мышечная дистрофия Дюшенна). Разрабатываются способы лечения тяжелой сердечной недостаточности, заключающиеся в лечении данного серьезного заболевания с помощью «листов» аутологичных миобластов, выделенных из скелетных мышц пациента [1].
В результате наблюдается увеличение продолжительности жизни пациентов, улучшение ее качества, оттягивание момента прикованности к инвалидному креслу при наиболее серьезных формах заболеваний.
Известно, что основным источником сателлитных клеток и миобластов являются скелетые мышцы человека и животных [2]. Описано также, что мультипотентные мезенхимные стромальные клетки (ММСК) костного мозга и жировой ткани при добавлении определенных факторов могут дифференцироваться в миогенном направлении [3, 4], что нашло применение в заместительной клеточной терапии (при кардиомиопластике, лечении инконтиненции, миопатий и др. мышечных заболеваний).
Одним из примеров применения миобластов для лечения мышечных заболеваний является болезнь Дюшенна - наследственного заболевания, характеризующегося прогрессирующей мышечной дистрофией и являющегося вторым по распространенности смертельным наследственным заболеванием.
Так, в патенте ЕР 1407788 описан метод лечения болезни Дюшенна с применением специализированного клеточного процессора для получения миобластов, который предполагает использование клеток для переноса нормального набора генов в дефектные клетки с целью репарации генома больного. Изобретение включает стадии забора биоптата мышечной ткани, выделения миобластов, их культивирования в условиях in vitro для получения необходимой терапевтической дозы и инъекционное введение в поврежденную мышечную ткань.
В заявке WO 1996018303 описывается способ терапии наследственных, дегенеративных заболеваний различной степени тяжести у млекопитающих с использованием нативных, генетически или фенотипически трансформированных миогенных клеток, включающих миобласты, миотрубки, молодые мышечные волокна и модифицированные клеточные линии, включающий стадии культивирования миогенных клеток; последовательное введение реципиенту терапевтически эффективной дозы иммуносупрессоров и указанных миогенных клеток, благодаря чему достигается терапевтический эффект.
В то же время в патенте ЕР 1048724 отмечается, что успешное применение миобластов требует использования клеточных линий, способных в условиях культивирования in vitro активно пролиферировать, дифференцироваться и при этом сохранять характеристики клеток ткани, из которой они были выделены. Недостаток данного способа заключается в том, что миобласты человека, выделенные из мышечной ткани путем ее дезагрегирования под действием ферментов, в отличие от миобластов грызунов (мышей и крыс), не способны к многократному делению в условиях культивирования, причем их пролиферативная способность снижается с возрастом и особенно сильно у больных с различного рода мышечными дисфункциями (например, болезнью Дюшенна), что значительно затрудняет их использование в терапевтических целях. Для решения указанной проблемы в патенте описан способ получения устойчивых линий мышечных клеток человека, включающий следующие стадии:
а) обработку первичной культуры мышечных клеток с помощью глюкокортикоидов;
б) перенос в обработанную по п. а) клеточную культуру по крайней мере одного нуклеотидного вектора неретровирусной природы, способного «иммортализовать» данные клетки;
в) проведение дальнейшего культивирования полученной клеточной культуры.
Все перечисленные выше изобретения предполагают стадию забора биоптата мышечной ткани, получения первичной клеточной культуры и последующего наращивания (культивирования in vitro) миогенных клеток, при этом в качестве источника таких клеток всегда указывается биопсийный материал, полученный хирургическим путем в виде фрагмента скелетной мышечной ткани. В то же время следует признать, что данный источник мышечной ткани и метод его забора имеет ряд недостатков и ограничений. Так, забор биопсийного материала мышечной ткани требует довольно серьезного хирургического вмешательства, характеризующегося высокой степенью травматизации, проведением обезболивающих процедур местного или общего характера, что приводит к временной потере трудоспособности и относительно длительному реабилитационному периоду.
Кроме того, клетки, полученные из мышечной ткани, в свою очередь, также имеют ряд недостатков, существенно ограничивающих их применение для проведения клеточной терапии, а именно имеют ограниченный срок жизни, не способны к длительному делению в условиях in vitro; при этом описанные свойства имеют тенденцию усугубляться с возрастом пациента и особенно выражены у больных с мышечными дистрофиями, что делает применение аутологичной клеточной терапии для таких пациентов крайне проблематичной.
Задачей, решаемой настоящим изобретением, является значительное упрощение проведения клеточной терапии у пациентов с мышечными заболеваниями за счет использования миобластов, полученных из легкодоступного источника путем проведения малотравматичной процедуры.
Техническим решением настоящего изобретения является получение миогенных клеток (миобластов, предшественников миобластов) из нового, ранее не известного источника, неожиданно открытого авторами при культивировании фибробластподобных клеток, выделенных из слизистой оболочки полости рта (десны) человека.
Способ состоит из следующих основных стадий:
I. Биопсия десны.
II. Обработка биоптата для получения клеток-предшественников миобластов. Обработка биоптата предусматривает традиционные процедуры его отмывки, измельчения и ферментативного расщепления ткани десны протеолитическими ферментами, которые могут быть легко подобраны специалистом. Обычно для этого используют препараты коллагеназ.
III. Выделенные из дезагригированной ткани клетки-предшественники культивируют на подходящей среде с получением культуры миобластов.
IV. Культуру миобластов далее:
1) тестируют на иммунофенотип и исключение вирусной и бактериальной контаминации;
2) криоконсервируют и хранят в криобанке;
3) размораживают (по необходимости.
В другом аспекте изобретение относится к способу получения клеточного препарата миобластов для лечения патологий мышечной ткани.
Полученные миобласты могут быть перенесены в любой физиологически/фармакологически приемлемый носитель/наполнитель, например 0,9% физиологический раствор хлорида натрия для инъекций, раствор Рингера, с аутологичной сывороткой (0,5-10%) или без. Количество клеток может быть выбрано в зависимости от нозологии и обычно составляет 1×106-5×108 клеток на 1 мл.
Способ и схема лечения зависит от состояния больного, тяжести патологии мышечной ткани и выбирается для достижения максимального терапевтического эффекта. Возможные способы введения: внутримышечное, внутрикоронарное, интрамиокардиальное.
Краткое описание рисунков:
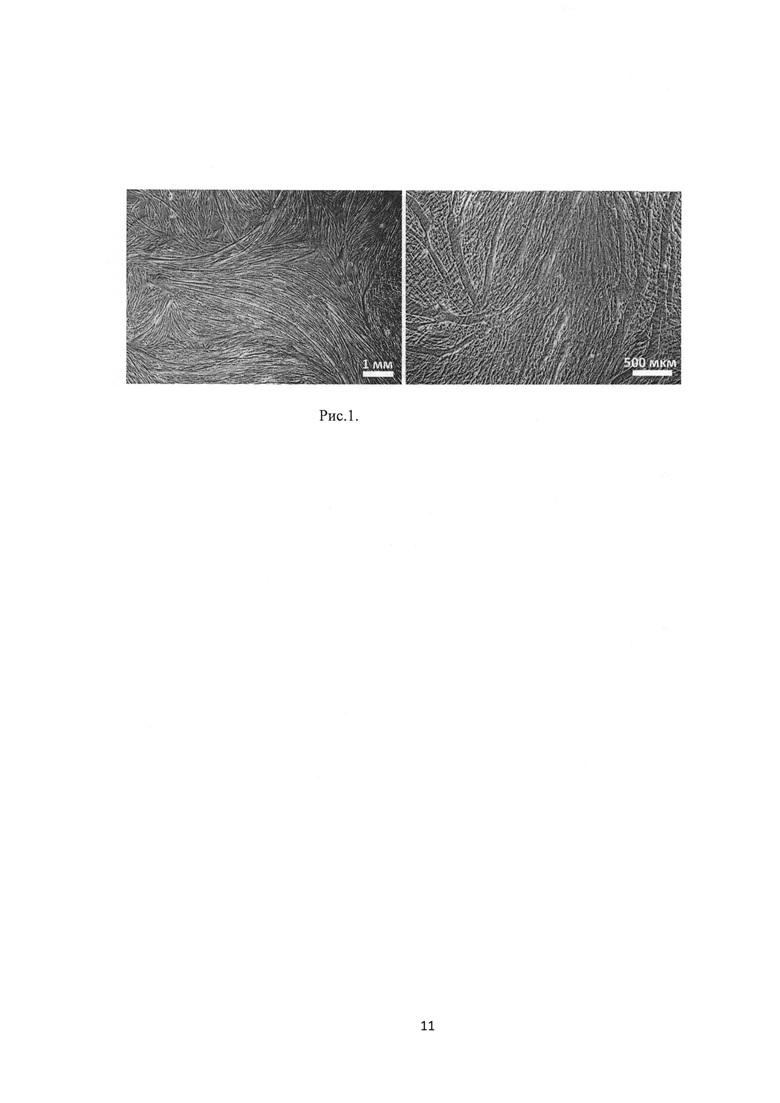
Рис.1. Формирование многочисленных многоядерных миотуб (прижизненная съемка, оптическая микроскопия).
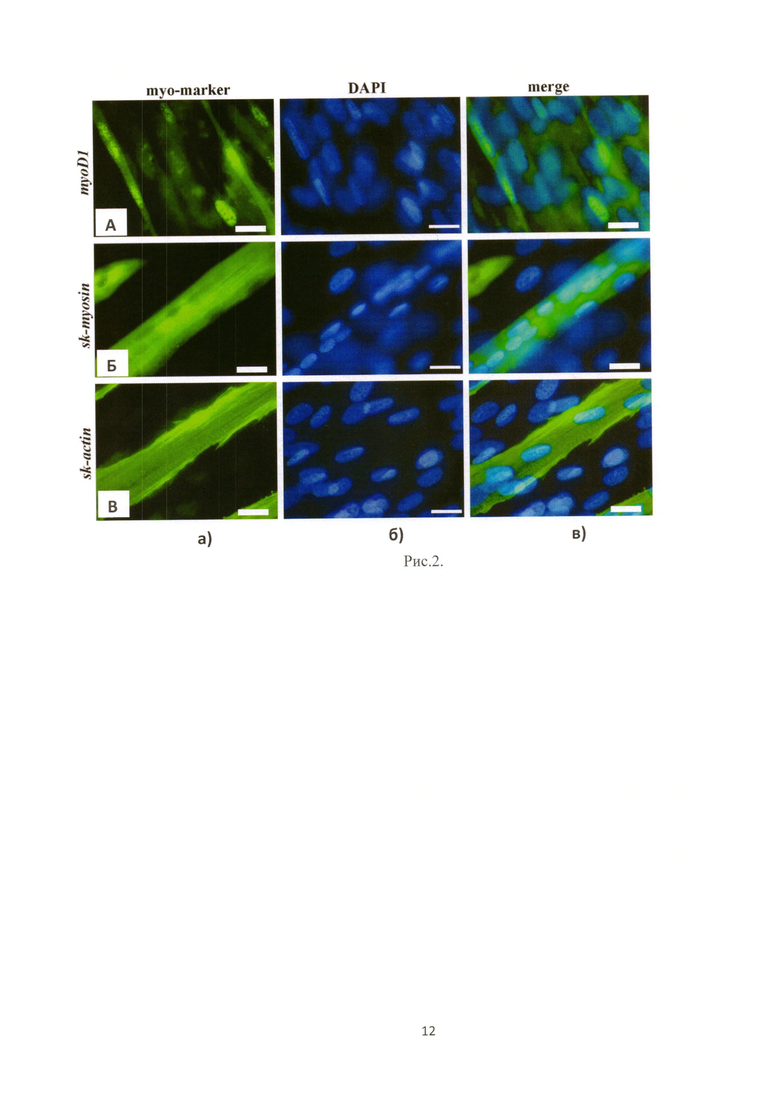
Рис.2. Иммуноцитохимическое выявление myo D1 (A), sk-миозин (Б) и sk-актин (С) в культуре миобластов, выделенных из слизистой оболочки полости рта человека (десны): а - окрашивание при помощи специфических моноклональных антител в комбинации с антивидовыми антителами, меченными красителем Alexa488; б - окрашивание клеточных ядер реактивом DAPI; в - совмещение изображений результата флуоресцентного мечения и ядер клеток. Светлый отрезок на фотографиях соответствует 20 мкм.
Подробное описание технического решения.
Забор биоптата (бипсия)
Биоптат десны объемом 2-3 мм3 получали от здоровых доноров под местным обезболиванием 2% раствором лидокаина. Возраст доноров 25-55 лет. Биоптат слизистой оболочки полости рта незамедлительно помещали в промаркированный стерильный контейнер со средой для транспортировки (DMEM/F12).
Доставку биоматериала в лабораторию производили в стерильном полимерном контейнере, содержащем транспортную среду, при температуре +4-8°С в транспортных герметично закрывающихся изотермических контейнерах в течение не более 24 часов.
Обработка биоптата десны
После доставки биоматериала в лабораторию его стерильно переносили в культуральную чашку Петри, промывали раствором Хенкса с антибиотиком (гентамицин), после чего трижды промывали раствором Версена. Биоптат измельчали с помощью стерильного скальпеля, добавляли дезагрегирующий 0,1% (366 units/мг) раствор коллагеназы I или II типа (Sigma) и инкубировали 1-1,5 часа при температуре 37°С.
Выделение предшественников миобластов и культивирование
После инкубирования тканевую взвесь интенсивно пипетировали и центрифугировали в течение 10 минут при 300 g, супернатант удаляли, а осадок разводили культуральной средой (DMEM/F12 1:1 с добавлением 10% сыворотки пуповинной крови человека (СПК) и 10% аутологичной сыворотки (АС), либо DMEM/F12 1:1 с добавлением 10% СПК и 10% сыворотки эмбрионов коров (СЭК) фирмы НПП "ПанЭко" (Россия) или FBS Defined (HyClone, США), либо DMEM/F12 1:1 с добавлением 20% СЭК фирмы НПП "ПанЭко" (Россия) или FBS Defined (HyClone, США) и 40 мкг/мл гентамицина, ресуспендировали и переносили в культуральный флакон с плотностью 3-5×104 клеток/см2. Клетки культивировали при +37°С в атмосфере 5% СО2. Замену культуральной среды осуществляли каждые 3-4 дня, культуры пассировали при достижении ими 50% конфлюэнтности. Визуальный контроль роста и морфологии культуры проводили с помощью фазово-контрастной микроскопии. Для исследований использовали клеточные культуры 1-10 пассажей.
После образования субконфлюэнтного монослоя клетки отмывали раствором Версена, затем снимали с поверхности культуральной посуды раствором Версена с 0,25% трипсина, ресуспендировали в культуральной среде и эксплантировали в культуральную посуду большего объема для последующего культивирования.
Иммунофенотипический анализ фибробластоподобных клеток десны. Полученные клеточные культуры высевали на покровные стекла и через 2 суток проводили иммунофлуоресцентный анализ. Экспрессию белков, характерных для фибробластоподобных клеток, - коллагена I, III типов, эластина и виментина - определяли, используя первичные моноклональные и вторичные антитела, меченные Alexa488 (Life Technologies, США). Клетки визуализировали посредством микроскопа Axioplan 200 с камерой Axiocam HRm, используя программное обеспечение AxioVision (Carl Zeiss, Германия).
Для цитофлуориметрического анализа суспензию клеток фиксировали 1% раствором параформальдегида на фосфатно-солевом буфере (рН 7,4) и применяли флуоресцентные антитела к CD34PE, CD45FITC, CD73PE, CD90APC, CD324FITC, цитокератинам 14, 15, 16, 19 (BDPharmingen, США), CD105 Alexa488 (Life Technologies, США), согласно рекомендациям производителей.
Индукция миогенной дифференцировки. Для индукции миогенной дифференцировки клетки рассевали с высокой плотностью 5×105/см2, культивировали в среде DMEM/F12, 20% FBS (HyClone, США) до 90-100% конфлюэнтного монослоя, затем среду заменяли на DMEM с низким содержанием глюкозы (HyClone, США) с добавлением 2% лошадиной сыворотки (BioInd, Израиль) и инкубировали при 37°С и 5% СО2 до появления миотуб-подобных структур.
В клеточной культуре миогенные клетки проходят следующие этапы: адгезия клеток к субстрату, активация и пролиферация клеток-предшественников миобластов; образование миобластов с последующим их слиянием в многоядерные миотубы; образование миофибрилл, характеризующихся сократительной активностью (рис. 1)
Тестирование, криоконсервация и хранение миобластов.
Перед замораживанием клетки высевали из расчета получения субконфлюэнтного монослоя.
Стерильный криозащитный раствор (среда для замораживания), состоящий из 10% ДМСО, DMEM/F12 и 40% FBS, готовили на ледяной бане с целью поддержания температуры +4°С.
Клеточную культуру трехкратно отмывали раствором Версена и трипсинизировали при 37°С, 5% СО2 в течение 10 минут. Клеточную суспензию центрифугировали в течение 200 g, 10 мин. Супернатант удаляли, клетки ресуспендировали в растворе Хэнкса, после чего производили подсчет клеток к камере Горяева.
Часть клеток отбирали для проведения:
1) иммунофенотипического анализа (с целью подтверждения миогенной природы клеток), для этого клеточную суспензию высевали на покровные стекла и культивировали в среде DMEM/F12 с 10-20% содержанием FBS (без пассирования) в течение 21 суток, затем фиксировали в 4% р-ре ПФА (SIGMA Product No. 158127) и проводили иммунофлюоресцентный анализ при помощи первичных мышиных моноклональных антител: DAKO Actin (Sarcomeric) Product No. M087401-2, DAKO MyoD1 Product No. M351201-2, Invitrogen Myosin (skeletal muscle) Product No. 18-0105; и вторичных антител кролика, меченных флуорохромом Alexa488 - Molecular Probes Alexa Fluor 488 Rabbit Anti-Mouse IgG Product No. A-11059. Клеточные ядра дополнительно были окрашены реактивом DAPI - SIGMA Product No. 32670-F (рис. 2).
Оценка эффективности миогенной дифференцировки. Для оценки эффективности индукции миогенной дифференцировки клетки, посеянные на предметные стекла, фиксировали 4% параформальдегидом. Затем культуры инкубировали с первичными мышиными антителами, специфичными к человеческому скелетному миозину (AbD Serotec, Великобритания), актину (Thermo Scientific, США) и ядерному фосфопротеину MyoD1, индуцирующему миогенез (DAKO, США) с последующим окрашиванием вторичными антителами кролика, меченными флуоресцеином (FITC) (Life Technologies, США). Проводили съемку изображений при помощи микроскопа Axioplan 2, камеры Axiocam HRc и программного обеспечения AxioVision (Carl Zeiss, Германия). Далее используя программу ImageJ (National Institutes of Health, США), выделяли и измеряли процент специфически окрашенной площади на снимках по отношению ко всему полю. Для каждого случая было проанализировано по 25 независимых полей зрения и даны усредненные значения для всех пациентов (рис. 2).
2) тестирования на биобезопасность (для исключения вирусной и бактериальной контаминации):
- ПЦР (HIV-1 и -2, HBV, HCV, CMV, HSV 1, 2 и 6, EBV, Toxoplasma gondii, Mycoplasma hominis);
- бактериологическое исследование на стерильность (исключение бактериальной и грибковой микрофлоры).
Остальные клетки повторно центрифугировали, клеточный осадок ресуспендировали в среде для замораживания в концентрации 2×106 клеток в 1 мл, после чего клеточную суспензию переносили в криопробирки. Криопробирки маркировали: номер образца, дата, вид биоматериала, количество клеток, количество пассажей.
Клеточный материал подвергали программному замораживанию до -80°С со скоростью 1°С/мин и затем переносили на хранение в криохранилище с жидким азотом. После этого криопробирки помещали в карантинное криохранилище до момента получения результатов тестирования на биобезопасность.
Постоянное хранение образцов с единым идентификационным номером производили в криохранилище (при отрицательных результатах тестирования на биобезопасность). Срок хранения клеток не ограничен.
Размораживание миобластов
Криопробирку с миобластами размораживали, клеточную суспензию переносили в пробирку для центрифугирования, добавляли (по каплям) холодную культуральную среду DMEM/F12 (+4°С), после чего центрифугировали в течение 5 мин при 300 g, 4°С. Супернатант удаляли, клетки ресуспендировали в культуральной среде DMEM/F12. Процедуру отмывки от DMSO повторяли дважды.
Пример
У добровольца (после подписания информированного согласия) был взят биоптат слизистой оболочки полости рта из ретромолярного пространства диаметром 3 мм3. Перед получением первичной клеточной культуры биоптат промывали растворами антибиотиков и антимикотика (пенициллин 100 ед/мл, стрептомицин 100 мкг/мл, гентамицин 200 мкг/мл, амфотерицин В 25 мкг/мл) в среде ДМЕМ/F12. Затем биоптат переносили в среду ДМЕМ/F12, содержащую 2% эмбриональной телячьей сыворотки (ЭТС), 40 мкг/мл гентамицина и коллагеназы II типа («Sigma»). Инкубацию биоптата проводили при 37°С, инкубировали 1-1,5 часа при температуре 37°С. Полученный клеточный осадок ресуспендировали в среде для культивирования - ДМЕМ/F12, 10-20% ЭТС («ПанЭко»), 40 мкг/мл гентамицина и высевают в культуральные флаконы Т 25 ("Nunc"). Флаконы помещали в СО2-инкубатор (37°С, 5% СО2) и культивировали в течение 2 недель до получения первичной культуры. По мере роста и достижения субконфлюэнтного слоя клетки трипсинизировали и переносили в новый большей площади (Т-75, Т-175 «Nunc») культуральный флакон. При достижении субконфлюэнтного монослоя среду с 10-20% ЭТС заменяли на среду без сыворотки. До снятия клеток и получения готовой суспензии клетки выдерживали не менее 8-14 часов при 37°С. В конце инкубации клетки снимали с культурального пластика посредством 0,25% раствора трипсин - ЭДТА, отмывали путем трехкратного центрифугирования и ресуспендирования в 0,9% физиологическом растворе натрия хлорида, после чего суспендировали в количестве 20×106 кл./мл в 0,9% раствора хлорида натрия для инъекций. Полученный препарат миобластов должен храниться при температуре (+4°С)-(+8°С) и должен быть использован в течение 24 часов с момента приготовления.
Список литературы:
1. Miyagawa S, et al. Impaired myocardium regeneration with skeletal cell sheets-a preclinical trial for tissue-engineered regeneration therapy. Transplantion. 2010; 90: 364-72.
2. Mauro A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 1961 Feb; 9: 493-5.
3. Pittenger MF, et al. Multilineage potential of adult human mesenchymal stem cells. Science. 1999; 284(5411): 143-7.
4. Zuk P.A. et. al. Multilinege cells from human adipose tissue: implication for cell-based therapies. Tissue Eng. 2001; 7: 211-28.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПАРОДОНТА | 2009 |
|
RU2418571C1 |
| Тканеинженерная конструкция для восполнения объема костной ткани челюстно-лицевой области | 2019 |
|
RU2729365C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ДИЛЯТАЦИОННОЙ КАРДИОМИОПАТИИ | 2004 |
|
RU2268062C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2004 |
|
RU2268061C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ КОРРЕКЦИИ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ БИОТРАНСПЛАНТАТА (ВАРИАНТЫ) И СПОСОБ КОРРЕКЦИИ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ | 2009 |
|
RU2428996C2 |
| Способы получения индуцированных клеток гладких мышц | 2020 |
|
RU2815906C2 |
| БИОТРАНСПЛАНТАТ И СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ (ВАРИАНТЫ) | 2005 |
|
RU2299073C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПАРОДОНТА | 2004 |
|
RU2265445C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОГЕНИТОРНЫХ КЛЕТОК МИОКАРДА | 2013 |
|
RU2542964C1 |
| Композиционный материал для замещения костных дефектов | 2018 |
|
RU2685148C1 |
Изобретение относится к медицине, а именно к биотехнологии, и может быть использовано для получения миобластов из слизистой оболочки полости рта человека. Для этого проводят биопсию слизистой оболочки полости рта человека и обработку биоптата, предусматривающую отмывку, измельчение, ферментативное расщепление ткани десны протеолитическими ферментами. Далее культивируют выделенные из дезагрегированной ткани фибробластоподобные клетки на подходящей среде для получения культуры миобластов. Проводят иммунофенотипическое тестирование культуры миобластов на иммунофенотип и исключение вирусной и бактериальной контаминации. Использование данного способа позволяет получить культуру миобластов из легкодоступного источника - слизистой оболочки полости рта человека. 1 з.п. ф-лы, 1 пр., 2 ил.
1. Способ получения миобластов путем культивирования фибробластоподобных клеток, выделенных из слизистой оболочки полости рта человека, включающий:
а) биопсию из слизистой оболочки полости рта человека;
б) обработку биоптата, предусматривающую отмывку, измельчение, ферментативное расщепление ткани десны протеолитическими ферментами;
в) культивирование выделенных из дезагрегированной ткани фибробластоподобных клеток на подходящей среде для получения культуры миобластов;
г) иммунофенотипическое тестирование культуры миобластов на иммунофенотип и исключение вирусной и бактериальной контаминации.
2. Способ получения миобластов по п.1, где после стадии г) проводят криоконсервирование миобластов.
Авторы
Даты
2016-03-10—Публикация
2014-02-28—Подача