Настоящее изобретение относится к способам получения индуцированных клеток гладких мышц (iSMC), к клеткам iSMC, к iSMC для применения в способе лечения заболевания или расстройства, либо для применения в инжиниринге тканей, и к применению клеток скелетных мышц для получения iSMC.
Дегенерация гладких мышц, например, в сфинктерах, может вызывать изнуряющие заболевания, такие как недержание кала. Происходящие из скелетных мышц клетки (SMDC) эффективно используются в клиниках для регенерации сфинктеров скелетных мышц, таких как наружный сфинктер прямой кишки или сфинктер мочевого пузыря. Однако мало что известно о in vitro дифференцировке гладких мышц и об in vivo регенеративном потенциале клеток гладких мышц, полученных из SMDC, в отношении гладких мышц.
Сфинктеры представляют собой кольцевые мышцы, регулирующие продвижение твердых и/или жидких веществ, и могут состоять либо из скелетной мышцы, такой как наружный сфинктер прямой кишки, либо гладкой мышцы, такой как внутренний сфинктер прямой кишки и сфинктер привратника (Al-Ali и др., 2009; Ramkumar & Schulze, 2005). Нарушение функционирования мышц сфинктера ануса и привратника ассоциировано с недержанием кала и гастропарезом, соответственно (Abrahamsson, 2007; Rao, 2004). Дегенерация гладкой мышцы внутреннего сфинктера прямой кишки является известной причиной пассивного недержания кала (Vaizey и др., 1997), основного типа недержания кала, поражающего 78% всех пациентов с недержанием кала (Mimura и др., 2004). Несмотря на то, что недержание кала не опасно для жизни, оно серьезно влияет на качество жизни пациентов (Meyer & Richter, 2015) и имеет показатель распространенности до 12% у мужчин и женщин (Goode и др., 2005; Quander и др., 2005). Консервативные методы лечения, такие как применение объемообразующих агентов, имеют ограниченный успех у пациентов с высокой степенью недержания, а хирургические подходы характеризуются высоким уровнем заболеваемости и осложнений (J.Y. Wang & Abbas, 2013).
Функциональные свойства ткани гладких мышц зависят от существования высокодифференцированных клеток гладких мышц, экспрессирующих сократительные белки, такие как альфа-актин гладких мышц (aSMA), десмин и смутелин (SMTN) (Capetanaki и др., 1997; van Eys и др., 2007; J. Wang и др., 2006), а также функциональные потенциал-зависимые кальциевые и калиевые каналы, обеспечивающие индуцирование регулируемого клеточного сокращения (Sanders, 2008). Выделение и применение аналогичных клеток для лечения дефектов гладких мышц может быть перспективным вариантом лечения. Однако, в настоящее время на рынке не существует терапии с использованием клеток гладких мышц. Выделение клеток гладких мышц, способных регенерировать дефектную ткань гладких мышц, представляет собой первое предварительное условие на пути к клиническому применению этих клеток. Известным из уровня техники методом получения клеток гладких мышц является применение в качестве источника ткани гладких мышц. Эти первичные клетки гладких мышц нашли эффективное применение для регенерации гладких мышц в животной модели пассивного недержания кала (Bohl и др., 2017), однако первичные клетки гладких мышц труднодоступны в случае живых людей для аутологичного лечения, они гетерогенны по своей природе и могут иметь ограничения в отношении способности к пролиферации (Sandison & McCarron, 2015), вследствие этого они меньше подходят в качестве кандидатов для клеточной терапии с целью регенерации гладких мышц у человека. Поэтому, в качестве подхода было предложено применение обладающих высокой способностью к пролиферации стволовых клеток/клеток-предшественников, готовых дифференцироваться в клетки гладких мышц.
Показано, что стволовые клетки/клетки-предшественники, такие как мультипотентные мезенхимальные стромальные клетки (MSC) и индуцированные плюрипотентные стволовые клетки (iPSC), обладают трансдифференцировочным потенциалом в отношении линии клеток гладких мышц (Bajpai и др., 2012; Park и др., 2013), а также регенеративным потенциалом in vivo в отношении гладких мышц (Li и др., 2016). iPSC особенно перспективны с точки зрения возможности их дифференцировки в клетки гладких мышц и функциональных свойств in vitro (Bajpai и др., 2012), а полученные из iPSC клетки-предшественники клеток гладких мышц продемонстрировали регенеративный потенциал in vivo в отношении сфинктера уретры (Li и др., 2016), однако опасения, связанные с безопасностью, такие как генетическая нестабильность и образованием тератом, ограничивают их полезность (Jung и др., 2012). Клеточные продукты, полученные из MSC взрослых людей, не вызывали серьезных проблем со здоровьем в большинстве клинических испытаний (Y. Wang и др., 2012). Однако, их клиническая эффективность в регенерации гладких мышц остается неясной.
Было обнаружено, что ткань скелетных мышц является источником стволовых клеток и клеток-предшественников, таких как MSC и миогенные клетки-предшественники, происходящие из сателлитных клеток, при этом ожидается, что оба эти вида будут обладать высокой регенеративной способностью (Yin и др., 2013). В клиниках показано, что клетки, происходящих из скелетных мышц (SMDC), обогащенные по CD56-положительным клеткам, улучшают проблему недержания кала, ассоциированную со слабостью наружного сфинктера прямой кишки (A. Frudinger и др., 2010, 2015; Andrea Frudinger и др., 2018). Кроме того, было обнаружено, что клетки, происходящие из скелетных мышц, пересаженные в детрузорную мышцу мочевого пузыря, улучшают функционирование мочевого пузыря (Huard и др., 2002). Однако в отношении дифференцировки SMDC в клетки гладких мышц и их выделения или их регенеративной способности in vivo имеются ограниченные сведения (Lu и др., 2011), и ни в одном из исследований не произведена оценка терапевтического потенциала происходящих из SMDC клеток гладких мышц (индуцированных клеток гладких мышц) в отношении регенерации гладких мышц сфинктера.
Подходы с использованием клеточной терапии для регенерации ткани гладких мышц крайне желательны и основаны на применении клеток, компетентных в отношении регенерации гладких мышц. Ввиду недостатков способов из предшествующего уровня техники необходимы новые способы получения клеток гладких мышц.
Frudinger и др. (2018) сообщают о выделении CD56+ клеток, происходящих из скелетных мышц, называемых SMDC, как показано на Фиг. 6 в работе Frudinger и др. (2018) (Andrea Frudinger и др., 2018). Среди других клеток указанные клетки характеризуются отрицательной экспрессией aSMA, CD49a и CD146, как показано на Фиг. 15 описания настоящего изобретения. Кроме того, как утверждается в работе Frudinger и др. (2018), SMDC характеризуются положительной экспрессией Рах-7 (Andrea Frudinger и др., 2018). SMDC, описанные в работе Frudinger и др. (2018), представляют собой скелетно-миогенные клетки, то есть они способны сливаться с образованием многоядерных мышечных трубочек.
ЕР 2206774 А1 касается клеточных популяций, обладающих способностями к дифференцировке, которые получают путем выделения из мышечной ткани, более конкретно из ткани скелетных и/или сердечных мышц, предпочтительно из эндомизиальной и/или сердечной ткани (Marolleau и др., 2010). Клеточная популяция из ЕР 2206774 А1 содержит положительные по ALDH (альдегиддегидрогеназа) клетки и в значительной мере обладает способностью к миогенной, и/или адипогенной, и/или остеогенной дифференцировке. В частности, в ЕР 2206774 А1 описаны ALDH+/CD34- клетки, ALDH+/CD34+ клетки и SMALD (альдегиддегидрогеназа из скелетных мышц)/34+ клетки, все из которых являются CD146-, как показано в Таблицах 1 и 3 и на Фиг. 8 в ЕР 2206774 А1. Кроме того, в ЕР 2206774 А1 описаны клетки SMALD/34-. Указанные клетки являются CD146+ и компетентны в отношении слияния, как показано на Фиг. 3 в ЕР 2206774 А1.
В исследованиях Lecourt S. и др. (2010) показано, что скелетная мышца человека является важным источником различных клеток-предшественников с возможными перспективами для терапевтического применения. С одной стороны, описаны CD56+ клетки, представляющие собой клетки CD49a- и CD49e+. С другой стороны, описаны клетки CD56-, представляющие собой клетки CD146- и SMA- (Lecourt S. и др., 2010).
В работе Thurner и др. (2018) описана разработка анализа активности in vitro для клеток, происходящих из скелетных мышц человека. В частности, описано выделение как CD56+, так и CD56- клеток, происходящих из скелетных мышц (SMDC). Как показано на Фиг. 15 описания настоящего изобретения, и CD56+, и CD56- SMDC, описанные в Thurner и др. (2018), являются aSMA-, CD146- и CD49a-. Кроме того, как показано на Фиг. 2а в Thurner и др. (2018), CD56+ клетки обладают AChE (ацетилхолинэстеразной) активностью более 1000 отн. мЕд (относительных миллиединиц)/г.
В основе настоящего изобретения лежит техническая задача предложения способа получения iSMC, которые являются безопасными и эффективными при применении в способе лечения заболевания или расстройства у субъекта. Другая техническая задача, лежащая в основе настоящего изобретения, заключается в предложении клеток, которые являются безопасными и эффективными для применения в регенерации ткани гладких мышц.
Эта техническая задача решается объектами изобретения, определенными в формуле изобретения.
Приведенные ниже графические материалы образуют часть настоящего описания и включены для дополнительной демонстрации некоторых аспектов настоящего изобретения. Данное изобретение может быть лучше понято со ссылкой на один или более чем один из этих графических материалов в сочетании с подробным описанием конкретных воплощений, представленных в данной заявке.
На Фиг. 1 показана характеристика происходящих из скелетных мышц МРС (миогенных клеток-предшественников) и MSC в соответствии с их дифференцировочным потенциалом. Дифференцировочный потенциал МРС и MSC, оцениваемый после дифференцировки in vitro в адипогенные, хондрогенные, остеогенные и скелетно-миогенные линии путем культивирования в соответствующих средах для дифференцировки и детектирования посредством окрашивания с использованием красителей масляного красного О (адипоциты), альцианового синего (хондроциты), ализаринового красного S (остеоциты) и анти-десмина/Хехста (ядра и миоциты) соответственно. Показаны репрезентативные изображения (масштабная линейка = 100 мкм) по меньшей мере трех отдельных препаратов (А). Количественное определение адипогенного, хондрогенного, остеогенного и скелетно-миогенного дифференцировочного потенциала MSC и МРС путем расчета средней интенсивности окрашивания в поле зрения для окрашивания масляным красным О, альциановым синим или ализариновым красным С (S) или путем расчета индекса слияния для по меньшей мере трех отдельных образцов соответственно (В). Данные представлены в виде среднего значения ± SD (стандартное отклонение) для МРС и MSC из по меньшей мере трех отдельных биоптатов мышц. Статистическое сравнение проводили с использованием непарных t-критериев Стьюдента (значение р<0,05 считалось значимым).
На Фиг. 2 показана характеристика происходящих из скелетных мышц МРС и MSC и полученных из них iSMC по экспрессии маркеров их клеточной поверхности. Экспрессию маркеров линий мезенхимальных (CD105, 90, 73), миогенных (CD56), гемопоэтических (CD34) клеток и клеток гладких мышц (CD146 и CD49a) на происходящих из скелетных мышц МРС и MSC, а также полученных из них iSMC для каждого из по меньшей мере трех отдельных биоптатов скелетных мышц человека, оценивали методом проточной цитометрии. В качестве контроля продемонстрирована экспрессия маркеров линий клеток гладких мышц CD146 и CD49a в популяциях клеток гладких мышц, происходящих из мочевого пузыря человека (hBd-SMC). Данные представлены в виде среднего значения ± SEM (стандартная ошибка среднего).
На Фиг. 3 показаны результаты экспрессии внутриклеточных маркеров в SMDC (МРС и MSC) и iSMC. Детектирование общих миогенных маркеров (десмина) и миогенных маркеров гладких мышц (aSMA, смутелина) в МРС и MSC, а также в полученных из них iSMC, осуществляли посредством иммуноцитохимии, и показаны репрезентативные изображения (А) (масштабная линейка = 100 мкм). Процентное содержание клеток, положительных в отношении aSMA, смутелина или десмина, среди МРС, MSC и полученных из них iSMC оценивали путем количественного определения экспрессирующих соответствующий маркер клеток на полученных с использованием иммуноцитохимии изображениях культур из по меньшей мере трех отдельных биоптатов мышц человека (В). Данные представлены в виде среднего значения ± SEM.
На Фиг. 4 показаны изменения в экспрессии генов в ходе трансдифференцировки SMDC (МРС и MSC) в iSMC. Изменения в экспрессии генов оценивали при помощи микроматричного анализа от MSC и МРС до MSC-iSMC и MPC-iSMC, культивированных в среде для роста (MSC и МРС) или среде для дифференцировки гладких мышц (MSC-iSMC и MPC-iSMC) в течение 6 суток соответственно, полученных из двух отдельных биоптатов мышц человека. Кластер генов, одинаковым образом положительно регулируемых (А) или отрицательно регулируемых (В) как в MSC, так и в МРС в ходе дифференцировки в iSMC, полученный с помощью кластеризации методом k-средних, изображен на тепловых картах. Звездочками (*) отмечены гены, которые были либо положительно (log2 FC (кратность изменений) ≥1), либо отрицательно регулируемыми (log2 FC≤-1) в обоих типах клеток. Статистическое сравнение проводили с использованием критерия хи-квадрат, считая значимым р-значение ниже 0,05. Результаты изменения экспрессии генов показаны на Фиг. 4 (С).
На Фиг. 5 показана способность МРС и iSMC к слиянию. Образование мышечных трубочек (способность к слиянию) наблюдали с использованием флуоресцентной микроскопии после окрашивания красителем Хехст33342 для визуализации ядер. Основываясь на изображениях, определяли индекс слияния (FI) (А) и количество ядер на трубочку (В). Клетки по меньшей мере с 3 ядрами принимали за трубочки. Проводили сравнение результатов измерений между МРС и происходящими из них iSMC.
На Фиг. 6 показано образование функциональных ионных каналов в ходе трансдифференцировки МРС в iSMC. Анализ зависящих от напряжения входящих кальциевых (А) и выходящих калиевых токов (В) в МРС и происходящих из них iSMC, а также в происходящих из мочевого пузыря клетках гладких мышц (hBd-SMC). Кривые зависимости импеданс-напряжение (I-V) для каждой из по меньшей мере трех клеток МРС, iSMC (происходящих из МРС) и hBd-SMC, демонстрируют наличие функциональных Cav (А) и Kv (В) каналов в iSMC (происходящих из МРС) и в hBd-SMC, но не в МРС.
На Фиг. 7 показана сократительная способность SMDC и iSMC в решетках коллагенового геля. Количественное определение сократительной способности SMDC (MSC и МРС), происходящих из них iSMC и происходящих из мочевого пузыря клеток гладких мышц (hBd-SMC) проводили при помощи сокращения решетки коллагенового геля. Сокращение геля, выраженное в процентном отношении от исходного размера, в течение 48 часов для клеток, полученных на стадии (а) по настоящему изобретению (МРС или MSC), и клеток, полученных путем трансдифференцировки в iSMC на стадии (б) по настоящему изобретению, а также контрольных клеток гладких мышц мочевого пузыря (hBd-SMC), показано в виде гистограммы (А). Данные представлены в виде среднего значения ± SEM для препаратов клеток из каждого из по меньшей мере трех отдельных биоптатов мышц человека или анализа hBd-SMC. Репрезентативные стереомикроскопические изображения коллагеновых гелей со встроенными МРС и MSC и происходящими из каждого из них iSMC, а также hBd-SMC в лунках 24-луночного планшета (В).
На Фиг. 8 показан фенотип клеток гладких мышц iSMC, происходящих из mMPC, и их приживление в ткани гладких мышц in vivo. Процентное содержание десмин- и aSMA-положительных клеток в iSMC, происходящих из мышиных МРС (mMPC), показано в виде гистограммы (А). Детектирование сигнала флуоресценции от флуоресцентных гранул и локализации экспрессии трансгена TdTomato в интактной мышце сфинктера привратника посредством визуализации in vivo (В). Детектирование экспрессии белка альфа-актина гладких мышц (aSMA), экспрессии TdTomato в привитых iSMC и наложение (MERGE) TdTomato и белка aSMA осуществляли посредством иммуногистохимии в гистологических срезах сфинктера привратника через 12 недель после имплантации. Контрастное окрашивание ядер для каждого изображения выполняли с использованием DAPI (4',6-диамидино-2-фенилиндол). Показаны репрезентативные изображения для n=8 подвергнутых инъекции мышей (С).
На Фиг. 9 показаны полученные с помощью светового и сканирующего электронного микроскопа изображения колец ткани. Выполненные с помощью светового микроскопа изображения кольца ткани, полученной в результате 3D культивирования iSMC, происходящих из МРС, расположенного вокруг центрального положения агарозной матрицы, при разном увеличении (А и В). Выполненные с помощью сканирующего электронного микроскопа изображения кольца ткани, полученной в результате 3D культивирования iSMC, происходящих из МРС, при разном увеличении (С и D).
На Фиг. 10 показана экспрессия сократительных белков в происходящих из SMDC и iSMC кольцах ткани с использованием иммунофлуоресценции. Иммунофлуоресцентное окрашивание общих миогенных маркеров (десмин) и миогенных маркеров гладких мышц (aSMA) совместно с контрастным окрашиванием (Хехст) ядер проводили на криосрезах колец ткани, полученной в результате 3D культивирования МРС, а также происходящих из них iSMC.
На Фиг. 11 показаны полученные с помощью трансмиссионного электронного микроскопа изображения колец ткани.
Изображения, полученные с использованием трансмиссионной электронной микроскопии ультратонких срезов колец ткани, полученной в результате 3D культивирования iSMC, на которых показаны кавеолы (острие стрелки) на клеточной мембране двух соседних клеток (А и В), многочисленные нитеобразные структуры в цитоплазме (С) и аккумулированные в плотных тельца филаменты (стрелки) (D).
На Фиг. 12 приведены результаты количественного определения изменений в экспрессии генов в ходе трансдифференцировки SMDC (МРС и MSC) в iSMC. Изменения в экспрессии генов оценивали посредством микроматричного анализа от MSC и МРС до MSC-iSMC и MPC-iSMC, культивированных в среде для роста (MSC и МРС) или среде для дифференцировки гладких мышц (MSC-iSMC и MPC-iSMC) в течение 6 суток соответственно, полученных из двух отдельных биоптатов мышц человека. Чтобы сравнить дифференцировку гладких мышц для MSC и МРС, показаны log2-кратные изменения ассоциированных с гладкими мышцами генов в образцах MSC против MSC-iSMC (MSC) и МРС против MPC-iSMC (МРС). Звездочками (*) отмечены гены, представляющие собой положительно (log2≥1) или отрицательно регулируемые гены (log2≤-1).
На Фиг. 13 показаны результаты анализа методом проточной цитометрии окрашенных с использованием анти-CD49e антитела и окрашенных с использованием изотипического контроля мышиных MPC-iSMC в соответствии с примером 15.
Точечные диаграммы для IgG1-изотипического контроля (А) и анти-CD49e (В) положительных MPC-iSMC, демонстрирующие наличие 0,14% контрольных и 9,5% CD49e-положительных клеток соответственно.
На Фиг. 14 показаны результаты анализа AChE (ацетилхолинэстеразной) и CK (креатинкиназной) активности МРС и MPC-iSMC, где ферментативные активности измеряли до и после культивирования клеток в среде для дифференцировки скелетных мышц (SKDiff).
Проводили измерение и сравнение AChE активности (А) и CK активности (В) в МРС и MPC-iSMC, в каждом случае до и после культивирования в среде для дифференцировки скелетных мышц (SKDiff) в течение 6 суток. Данные представлены в виде среднего значения ± SEM для клеток, полученных из по меньшей мере трех отдельных биоптатов мышц человека. Статистический анализ проводили с использованием парного t-критерия Стьюдента, считая значение р<0,05 значимым.
На Фиг. 15 приведено общее описание свойств и экспрессии маркеров в клетках отдельных типов, описанных в данной заявке. CD56+ SMDC и CD56- SMDC (Thurner и др., 2018) и SMDC (Frudinger и др., 2018) получали, как описано в примере 18. МРС и MSC получали, как описано в примере 1. MPC-iSMC и MSC-iSMC получали, как описано в примере 2. Экспрессия определенного маркера указана знаком «+», если по меньшей мере 50% клеток тестируемой популяции клеток экспрессировали соответствующий клеточный маркер. Экспрессия определенного маркера указана знаком «-», если менее 50% клеток тестируемой популяции клеток экспрессировали соответствующий клеточный маркер. AChE ферментативная активность определенной популяции клеток указана как «+», если данная популяция клеток обладает AChE активностью по меньшей мере 1000 отн. мЕд./мг белка, измеренной согласно примеру 17. AChE ферментативная активность определенной популяции клеток указана как «-», если данная популяция клеток обладает AChE активностью менее 1000 отн. мЕд./мг белка, измеренной согласно примеру 17. CK ферментативная активность определенной популяции клеток указана как «+», если данная популяция клеток обладает CK активностью по меньшей мере 100 отн. мЕд./мг белка, измеренной согласно примеру 17. CK ферментативная активность определенной популяции клеток указана как «-», если данная популяция клеток обладает CK активностью менее 100 отн. мЕд./мг белка, измеренной согласно примеру 17.
Использование артиклей "а" и "an" в сочетании с термином "содержащий" в формуле изобретения и/или в описании может означать «один», но также согласуется со значением «один или более», «по меньшей мере один» и «один или более чем один».
Термин «примерно» означает, что включены указанное значение плюс или минус 5% от указанного значения, либо стандартная ошибка для измерений данного значения.
Термин «анальное недержание», использованный в данном описании, относится к любой нежелательной потере содержимого кишечника через анус, например газов, жидких или твердых фекалий. Термин включает в себя все три степени тяжести: степень 1 = только газообразные, степень 2 = жидкие и мягкие фекалии, степень 3 = твердые, сформированные фекалии.
Термин «сфинктер прямой кишки» или «аппарат сфинктера прямой кишки», использованный в данном описании, относится, в частности к Musculus sphincter ani externus и к Musculus puborectalis как части Musculus levator ani. Однако он также включает М. pubococcygeus, М. ischiococcygeus,M. iliococcygeus nN. pudendus.
Термин «клетки, происходящие из скелетных мышц» или «SMDC» относится к клеткам, полученным из ткани скелетных мышц, содержащей компетентные в отношении слияния клетки, например миобласты, или некомпетентные в отношении слияния клетки, например мультипотентные мезенхимальные стромальные клетки, которые могут представлять собой первичные клетки и/или культивированные in vitro клетки и, альтернативно, к другим клеткам с миогенным или мультидифференцировочным потенциалом (например, из подвергнутой липосакции ткани или других содержащих стволовые клетки тканей, таких как костный мозг). Этот термин также включает клетки, происходящие из жировой ткани, которые могут быть выделены и использованы для дифференцировки в клетки гладких мышц. Термин «клетки, происходящие из скелетных мышц» или «SMDC» также относится к популяции клеток, выделенной из мышечной ткани.
Термин «клетки гладких мышц, происходящие из мочевого пузыря человека (hBd-SMC)» относится к популяциям клеток, содержащим клетки гладких мышц из мочевого пузыря человека. hBd-SMC имеются в продаже у PromoCell® (номер по каталогу: С-12571) и демонстрируют фенотипические и функциональные характеристики клеток гладких мышц, которые в настоящем изобретении предполагается получить посредством iSMC, происходящих из клеток скелетных мышц.
Термин «инъекция», использованный в данном описании, относится к впрыскиванию раствора для инъекций, содержащего упомянутые выше клетки, из устройства для инъекции в конкретное место в организме человека, в частности в мышечную ткань обеспечивающую анальное удерживание или рядом с ней. Процесс инъекции может быть, без ограничения этим, статическим, т.е. устройство для инъекции остается в достигнутом положении. Альтернативно, процесс инъекции является динамическим. Например, в некоторых воплощениях настоящего изобретения инъекция происходит одновременно с отведением устройства для инъекции от места инъекции.
Термин «место инъекции», использованный в данном описании, относится к месту в организме человека, такому как место, расположенное близко к мышечной ткани, обеспечивающей анальное удерживание, или являющееся такой мышечной тканью, где начинается процесс инъекции. Место инъекции не обязательно совпадает с местом, где процесс инъекции заканчивается.
Термин «устройство для инъекции», использованный в данном описании, относится к любому устройству, подходящему для проникновения в ткань человека с целью достижения интересующего места инъекции и способного доставлять растворы, в частности растворы, содержащие происходящие из мышц клетки, в интересующее место инъекции.
Термин «недержание фекалий», использованный в данном описании, относится только к нежелательной потере жидкости или сформированных фекалий через анус.
Термин «пассивное недержание», использованный в данном описании, относится к утрате сенсорного распознавания потери фекалий. Он включает низкие значения базового давления в анальном канале вследствие дефектов гладкой мышцы внутреннего сфинктера прямой кишки и/или отсутствие сенсорной способности у слизистой оболочки анального канала и прямой кишки.
Термин «CD56+» или «CD56-положительная», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер CD56. Термины «CD56+» или «CD56-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер CD56.
Термин «CD56-» или «CDB56-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер CD56. Термины «CD56-» или «CD56-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер CD56.
Термин «мультипотентный», использованный в данном описании, относится к дифференцировочному потенциалу мезенхимальных клеток, характеризуемых дифференцировочным потенциалом in vitro по меньшей мере в отношении адипогенных, хондрогенных и остеогенных линий.
Термин «олигопотентный», использованный в данном описании, относится к дифференцировочному потенциалу мезенхимальных клеток, характеризуемых дифференцировочным потенциалом in vitro, ограниченным миогенными линиями, такими как клетки гладких, поперечнополосатых и сердечных мышц.
Термин «мезенхимальные клетки», использованный в данном описании, относится к клеткам, положительным по CD105, CD90 и CD73 и отрицательным по CD14, CD19, CD34, CD45 и HLA-DR (человеческие лейкоцитарные антигены, сублокус DR) (МНСП (главный комплекс гистосовместимости II класса)).
Термин «CD34+» или «CD34-положительная», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер CD34. Термины «CD34+» или «CD34-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер CD34.
Термин «CD34-» или «CD34-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер CD34. Термины «CD34-» или «CD34-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер CD34. В особо предпочтительном воплощении термин «CD34-» или «CD34-отрицательная» также может быть использован для популяции клеток, содержащей разные клетки, если предпочтительно не более 19, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер CD34.
Термин «CD146+» или «CD146-положительная», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер CD146. Термины «CD146+» или «CD146-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер CD146.
Термин «CD146-» или «CD146-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер CD146. Термины «CD146-» или «CD46-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер CD146.
Термин «CD49a+» или «CD49a-положительная», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер CD49a. Термины «CD49a+» или «CD49a-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер CD49a.
Термин «CD49a-» или «CD49a-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер CD49a. Термины «CD49a-» или «CD49a-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер CD49a.
Термин «CD73+» или «CD73-положительная», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер CD73. Термины «CD73+» или «CD73-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер CD73.
Термин «CD73-» или «CD73-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер CD73. Термины «CD73-» или «CD73-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер CD73.
Термин «CD90+» или «CD90-положительная», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер CD90. Термины «CD90+» или «CD90-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер CD90.
Термин «CD90-» или «CD90-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер CD90. Термины «CD90-» или «CD90-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер CD90.
Термин «CD105+» или «CD105-положительная», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер CD105. Термины «CD105+» или «CD105-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер CD105.
Термин «CD105-» или «CD105-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер CD105. Термины «CD105-» или «CD105-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер CD105.
Термин «aSMA+» или «aSMA-положительная», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер aSMA. Термины «aSMA+» или «aSMA-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер aSMA.
Термин «aSMA-» или «aSMA-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер aSMA. Термины «aSMA-» или «aSMA-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер aSMA.
Термин «десмин-положительная» или «десмин+», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер десмин. Термин «десмин-положительная» также может быть использован для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер десмин.
Термин «десмин-отрицательная» или «десмин-», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер десмин. Термин «десмин-отрицательная» также может быть использован для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер десмин.
Термин «смутелин-положительная» или «смутелин+», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер смутелин. Термин «смутелин-положительная» также может быть использован для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер смутелин.
Термин «смутелин-отрицательная» или «смутелин-», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер смутелин. Термин «смутелин-отрицательная» также может быть использован для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер смутелин.
Термин «компетентная в отношении слияния» или «скелетно-миогенная», использованный в данном описании, относится к клеткам, способным сливаться в многоядерные мышечные трубочки по меньшей мере с 50, 60, 70, 80, 90 или 100 процентами ядер внутри многоядерных мышечных трубочек после культивирования в средах для дифференцировки скелетных мышц в течение 5-7 суток.
Термин «некомпетентная в отношении слияния» или «не скелетно-миогенная», использованный в данном описании, относится к клеткам, не способным сливаться в многоядерные мышечные трубочки меньше чем с 50% или не более чем с 49, 30, 20, 10 или 0 процентов ядер внутри многоядерных мышечных трубочек после культивирования в средах для дифференцировки скелетных мышц в течение 5-7 суток.
Термин «среды для дифференцировки скелетных мышц», использованный в данном описании, относится к средам для культивирования клеток, которые индуцируют слияние в многоядерные компетентные в отношении слияния клетки или миогенные клетки, такие как, например, миобласты. Однако, указанный термин также относится к среде для культивирования клеток, не содержащей каких-либо веществ, необходимых для индуцирования слияния, в случае, если многоядерные компетентные в отношении слияния клетки или миогенные клетки способны сливаться без соответствующего индуцирования.
Термин «среды для дифференцировки гладких мышц», использованный в данном описании, относится к средам для культивирования клеток, которые индуцируют трансдифференцировку клеток с получением гладкомышечного фенотипа. Однако, указанный термин также относится к среде для культивирования клеток, не содержащей каких-либо веществ, необходимых для индуцирования трансдифференцировки, в случае, если клетки способны к трансдифференцировке без соответствующего индуцирования.
Термин «среда для роста клеток», использованный в данном описании, относится к любой среде, подходящей для инкубации клеток млекопитающих, таких как SMDC, которая способствует прикреплению указанных клеток млекопитающих на поверхность резервуара для инкубации, а также их пролиферации.
Термин «сократительный», использованный в данном описании, относится к сокращению решетки коллагенового геля, составляющему по меньшей мере 40% от первоначального размера геля, за 48 часов.
Термин «несократительный», использованный в данном описании, относится к сокращению решетки коллагенового геля, составляющему менее 40% от первоначального размера геля, за 48 часов.
Термин «TGF-бета» используется для обозначения трансформирующего ростового фактора-бета, который представляет собой многофункциональный цитокин, принадлежащий суперсемейству трансформирующих ростовых факторов, которое включает в себя три разных изоформы (TGF-β 1, 2 и 3) и многие другие сигнальные белки, продуцируемые всеми линиями лейкоцитов. Термин «TGF-бета» используется как синоним терминам «TGF-β», «TGF-b», «TGFb» и «TGFB».
Термин «AChE-положительная» или «AChE+», использованный в данном описании, относится к ацетилхолинэстеразной ферментативной активности, составляющей по меньшей мере 1*103 отн. мЕд. на мг клеточного белка, измеренной в клетках, которые культивировали в среде для дифференцировки гладких мышц, например, как описано в примерах в данной заявке. Альтернативно, ацетилхолинэстеразную ферментативную активность можно определить при помощи любого теста, известного в данной области техники, как описано, например, в работе Thurner и др., 2018.
Термин «AChE-отрицательная» или «AChE-», использованный в данном описании, относится к ацетилхолинэстеразной ферментативной активности, составляющей менее 1*103 отн. мЕд. на мг клеточного белка, измеренной в клетках, которые культивировали в среде для дифференцировки гладких мышц, как описано, например, в примерах в данной заявке. Альтернативно, ацетилхолинэстеразную ферментативную активность можно определить при помощи любого теста, известного в данной области техники, как описано, например, в работе Thurner и др., 2018.
Термин «CK-положительная» или «CK+», использованный в данном описании, относится к креатинкиназной активности, составляющей по меньшей мере 1*102 отн. мЕд. на мг клеточного белка, измеренной в клетках, которые культивировали в среде для дифференцировки гладких мышц, как описано, например, в примерах в данной заявке. Альтернативно, креатинкиназную ферментативную активность можно определить при помощи любого теста, известного в данной области техники, как описано, например, в работе Thurner и др., 2018.
Термин «CK-отрицательная» или «CK-», использованный в данном описании, относится к креатинкиназной ферментативной активности, составляющей менее 1*102 отн. мЕд. на мг клеточного белка, измеренной в клетках, которые культивировали в среде для дифференцировки гладких мышц, как описано, например, в примерах в данной заявке. Альтернативно, креатинкиназную активность можно определить, используя любой тест, известный в данной области техники, как описано, например, в Thurner и др. (2018), или как будет определено специалистом в данной области техники при проведении анализа.
Термин «CD49e+» или «CD49e-положительная», использованный в данном описании, относится к клетке, экспрессирующей клеточный маркер CD49e. Термины «CD49e+» или «CD49e-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер CD49e.
Термин «CD49e-» или «CD49e-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер CD49e. Термины «CD49e-» или «CD49e-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер CD49e.
Термин «Рах-7+» или «Рах-7-положительная», использованный в данном описании, относится к клетке, экспрессирующей транскрипционный фактор Рах-7. Термины «Рах-7+» или «Рах-7-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер Рах-7.
Термин «Рах-7-» или «Рах-7-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей клеточный маркер Рах-7. Термины «Рах-7-» или «Рах-7-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер Рах-7.
Термин «SSEA4+ (стадиеспецифический эмбриональный антиген 4+)» или «SSEA4-положительная», использованный в данном описании, относится к клетке, экспрессирующей маркер клеточной поверхности SSEA4. Термины «SSEA4+» или «SSEA4-положительная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно по меньшей мере 50, 60, 70, 80, 90, 95, 98 или 99 процентов популяции клеток экспрессируют клеточный маркер SSEA4.
Термин «SSEA4-» или «SSEA4-отрицательная», использованный в данном описании, относится к клетке, не экспрессирующей маркер клеточной поверхности SSEA4. Термины «SSEA4-» или «SSEA4-отрицательная» также могут быть использованы для популяции клеток, содержащей разные типы клеток, если предпочтительно менее 50% или не более 49, 40, 30, 20, 10, 5, 4, 3, 2, 1 или 0 процентов популяции клеток экспрессируют клеточный маркер SSEA4.
Термин «МРС» или «клетки МРС», использованный в данном описании, относится к миогенным клеткам-предшественникам. В частности, термин «МРС» относится к миогенным клеткам-предшественникам, которые характеризуются отрицательной экспрессией aSMA, CD49a и CD14б. МРС являются скелетно-миогенными и не мультипотентными. МРС также могут характеризоваться положительной экспрессией CD105, CD90, CD73, CD56, десмина, AChE и/или CK, и/или отрицательной экспрессией CD34. Пример свойств МРС показан на Фиг. 15.
Термин «MSC» или «клетки MSC», использованный в данном описании, относится к мезенхимальным стромальным клеткам. В частности, термин «MSC» или «клетки MSC» относится к мезенхимальным стромальным клеткам, которые характеризуются отрицательной экспрессией aSMA, CD49a и CD14б. MSC являются не компетентные в отношении слияния и не скелетно-миогенные, но мультипотентными. MSC также могут характеризоваться положительной экспрессией CD105, CD90, CD73 и/или десмина, и/или отрицательной экспрессией CD56, CD34, десмина, AChE и/или CK. Пример свойств MSC показан на Фиг. 15.
Согласно настоящему изобретению предложены способы получения индуцированных клеток гладких мышц (iSMC) из клеток, происходящих из скелетных мышц (SMDC).
Индуцированные клетки гладких мышц, происходящие из клеток скелетных мышц
Первый объект настоящего изобретения относится к способу получения индуцированных клеток гладких мышц (iSMC), где способ включает стадии: (а) получения от субъекта клеток, происходящих из скелетных мышц; (б) трансдифференцировки клеток, происходящих из скелетных мышц, путем культивирования этих клеток в среде, содержащей TGF-бета, в частности, TGFb1, TGFb2 и/или TGFb3, и гепарин, с получением iSMC. В особенно предпочтительном воплощении клетки, происходящие из скелетных мышц, подвергают трансдифференцировке на стадии (б) путем культивирования этих клеток в среде, содержащей TGFb1 и/или TGFb3, более предпочтительно TGFb1, и гепарин, с получением iSMC. Стадию (б) по настоящему изобретению проводят in vitro или ex vivo. Соответственно, способ по настоящему изобретению представляет собой способ in vitro или ex vivo.
В предпочтительном воплощении настоящего изобретения стадию (б) проводят в среде для культивирования клеток, содержащей 1-10 мкг/мл TGFb1 и 10-30 мкг/мл гепарина или 1-6 Ед/мл гепарина.
В предпочтительном воплощении iSMC, полученные согласно способу по настоящему изобретению, предпочтительно на стадии (б) способа по настоящему изобретению, характеризуются положительной экспрессией aSMA, CD49a и CD146.
В предпочтительном воплощении настоящего изобретения клетки, происходящие из скелетных мышц, представляют собой миогенные клетки-предшественники (МРС), характеризующиеся положительной экспрессией CD56 и десмина и отрицательной экспрессией CD34; альтернативно, клетки, происходящие из скелетных мышц, представляют собой мезенхимальные стромальные клетки (MSC), характеризующиеся положительной экспрессией CD105, CD73 и отрицательной экспрессией CD34 и CD56.
В предпочтительном воплощении изобретения клетки, происходящие из скелетных мышц, представляют собой олигопотентные МРС.
В другом предпочтительном воплощении настоящего изобретения клетки, происходящие из скелетных мышц, представляют собой MSC, характеризующиеся отрицательной экспрессией десмина и/или положительной экспрессией CD90.
В другом предпочтительном воплощении настоящего изобретения клетки, происходящие из скелетных мышц, представляют собой мультипотентные MSC.
Предпочтительно, в способе по настоящему изобретению предусматривается, что iSMC, происходящие из МРС на стадии (б), характеризуются положительной экспрессией aSMA, CD49a, десмина, CD56 и CD146 и отрицательной экспрессией CD34; и предусматривается, что iSMC, происходящие из MSC на стадии (б), характеризуются положительной экспрессией aSMA, CD49a и CD146 и отрицательной экспрессией CD56.
В другом предпочтительном воплощении изобретения iSMC, происходящие из МРС на стадии (б), дополнительно характеризуются положительной экспрессией смутелина.
В другом предпочтительном воплощении настоящего изобретения iSMC, происходящие из MSC на стадии (б), дополнительно характеризуются отрицательной экспрессией десмина и/или CD34.
CD73 или 5'-нуклеотидаза (5'-NT), также известная как экто-5'-нуклеотидаза, представляет собой фермент, который у людей кодируется геном NT5E. CD73 обычно служит для превращения AMP (аденозинмонофосфата) в аденозин. CD73 экспрессируется на лимфоцитах, фибробластах, клетках гладких мышц, эндотелиальных клетках и миобластах. CD73 представляет собой маркер мультипотентных мезенхимальных стромальных клеток (MSC) в соответствии с минимальными критериями для MSC, предложенными Международным обществом по клеточной терапии (ISCT) (Dominici и др., 2006).
CD105 также известен как эндоглин. Он представляет собой интегральный мембранный гомодимерный белок I типа с субъединицами размером 90 кДа, обнаруженный на эндотелиальных клетках сосудов и синцитиотрофобластах плаценты. CD105 слабо экспрессируется на стромальных фибробластах. Он также экспрессируется на активированных моноцитах и тканевых макрофагах. Экспрессия CD105 усиливается на активированном эндотелии в тканях, подвергающихся ангиогенезу, например в опухолях, или в случаях заживления ран или воспаления кожи. CD105 является компонентом TGF-β рецепторной системы в эндотелиальных клетках пупочной вены человека и связывается с TGF-β1 и -β3 с высокой аффинностью. CD105 представляет собой маркер мультипотентных мезенхимальных стромальных клеток (MSC) в соответствии с минимальными критериями для MSC, предложенными Международным обществом по клеточной терапии (ISCT) (Dominici и др., 2006). Поскольку настоящее изобретение предусматривает выделение iSMC из МРС и/или MSC посредством инкубации последних с TGFb, экспрессия CD105, вследствие его роли в качестве корецептора TGFb, может быть полезной для успеха способа, описанного в данной заявке. Таким образом, в настоящем изобретении раскрыто выделение MSC или МРС (пример 1), которые являются CD105-положительными (Фиг. 2) и поэтому полезными для выделения iSMC (пример 2).
Была описана экспрессия CD34 в происходящих из мышц стволовых клетках и покоящихся сателлитных клетках (Qu-Petersen и др., 2002). Кроме того, CD34-положительные клетки, происходящие из скелетных мышц, демонстрировали усиленную регенерацию дистрофина в дистрофической скелетной мышце (Jankowski и др., 2002). В уровне техники известно применение CD34+ клеток, происходящих из скелетных мышц, для создания клеток гладких мышц in vitro и применение CD34+ клеток, происходящих из скелетных мышц, для наращивания гладких мышц (Capelli и др., 2002). Однако, нормальные эндогенные гладкие мышцы являются, как правило, CD34-отрицательными (https://www.proteinatlas.org/ENSG00000174059-CD34/tissue/primary+data), но гладкие мышцы с онкогенным статусом часто становятся CD34+ клетками (van de Rijn и др., 1994). Таким образом, клетки, полученные способами по настоящему изобретению, не содержащие CD34, могут быть полезными для регенерации гладких мышц и менее склонными к злокачественной трансформации. Следуя способам по настоящему изобретению, CD34-отрицательные клетки, происходящие из скелетных мышц, получают на первой стадии и дифференцируют в CD34-отрицательные iSMC на второй стадии (примеры 1 и 2).
CD146 представляет собой поверхностный белок и рецептор субъединицы ламинина альфа 4, который присутствует во внеклеточном матриксе развивающейся ткани гладких мышц (Iivanainen и др., 1995). Кроме того, было показано, что CD146 экспрессируется в стволовых клетках, происходящих из костного мозга, коммитированных в линию клеток гладких мышц (Espagnolle и др., 2014). Как представлено на Фиг. 2, происходящие из мочевого пузыря клетки гладких мышц являются положительными по CD146. Обобщая сказанное, клетки CD146+ отмечают популяцию коммитированных клеток гладких мышц как предпочтительную для применения в регенерации гладких мышц и/или инжиниринге тканей. Способы по настоящему изобретению позволяют выделять CD146+ iSMC из клеток, происходящих из скелетных мышц.
CD56, также известный как молекула адгезии нервных клеток (NCAM), представляет собой маркер миогенного коммитирования, экспрессируемый в миобластах скелетных мышц in vitro (Belles-Isles и др., 1993) и ткани гладких мышц in vivo (Romanska и др., 1996). CD56 присутствует в компетентных в отношении слияния десмин+ SMDC (называемых в настоящем описании МРС), а также iSMC, происходящих из последних. CD56 является основным маркером для установления различий между МРС и описанными здесь, происходящими из скелетных мышц MSC, поскольку как MSC, так и iSMC, происходящие из последних, являются CD56-отрицательны ми. CD56+ iSMC, полученные способом по настоящему изобретению, могут быть наиболее подходящими для регенерации гладких мышц.
Альфа-актин гладких мышц (aSMA) является одним из первых маркеров коммитирования гладких мышц во время развития (McHugh, 1995). Его присутствие является важным для функционирования и сократительной способности вследствие механотрансдукции в клетках гладких мышц (J. Wang и др., 2006). Таким образом, использование aSMA в качестве маркера для iSMC, предназначенных для регенерации функции гладких мышц, имеет важное значение. Способы по настоящему изобретению (пример 2) позволяют получать клетки aSMA+ из клеток, происходящих из скелетных мышц (Фиг. 3).
Десмин представляет собой один из самых первых известных миогенных маркеров, присутствующих во всех типах мышц. Отсутствие десмина может приводить к мышечной дегенерации и нарушению функционирования (Capetanaki и др., 1997). Таким образом, применение десмин + клеток для регенерации мышц является предпочтительным. Как показано на Фиг. 3, iSMC, происходящие из МРС, являются десмин-положительными.
CD49a или белок интегрин-альфа (также VLA-1 (очень поздний антиген-1)), являющийся результатом экспрессии и трансляции гена ITGA1 (интегрина-альфа 1), присутствует в процессе развития гладких мышц, особенно обнаруживается в ткани гладких мышц, такой как аорта (Belkin и др., 1990). Способы по настоящему изобретению позволяют выделять CD49a-положительные iSMC из CD49a-отрицательных МРС или MSC. Как показано на Фиг. 2, происходящие из мочевого пузыря человека клетки гладких мышц (hBd-SMC) также являются положительными по CD49a.
Функциональные свойства ткани гладких мышц зависят от существования высокодифференцированных клеток гладких мышц, экспрессирующих сократительные белки, такие как смутелин (Niessen и др., 2005). Кроме того, смутелин является хорошо известным маркером для полностью дифференцированных клеток гладких мышц и является первым маркером, который исчезает при нарушении работы гладких мышц (van Eys и др., 2007). Таким образом, применение клеток смутелин + для регенерации ткани гладких мышц может быть благоприятным. Способы по настоящему изобретению (примеры 2 и 5) позволяют выделять смутелин + iSMC из смутелин- МРС (Фиг. 3).
Как описано выше, упомянутые маркеры CD146, CD56, aSMA, CD34, десмин, CD49a, смутелин являются важными для идентификации и/или функционировании клеток гладких мышц, комбинация данных маркеров может быть полезной для идентификации iSMC, подходящих для регенерации гладких мышц. В данном описании продемонстрированы способы, позволяющие выделять iSMC с комбинациями рассматриваемых маркеров (пример 2).
Более подробно, в настоящем изобретении предложен способ получения iSMC из МРС, происходящих из скелетных мышц. iSMC, происходящие из МРС, являются CD56+, aSMA+, CD49a+, десмин+, CD146+ и CD34-. Последние маркеры, которые описаны выше, полезны для идентификации клеток гладких мышц, поскольку, например, hBd-SMC являются положительными по CD146 и CD49a клетки (Фиг. 2) и, таким образом, предпочтительными для клеток, используемых в качестве клеток, регенерирующих гладкие мышцы. Комбинация экспрессии маркеров CD56+, aSMA+, CD49a+, десмин+, CD146+ и CD34- является перспективной и новой для полученных in vitro iSMC из МРС, происходящих из скелетных мышц человека.
Кроме того, в настоящем изобретении предложен способ получения iSMC из MSC, происходящих из скелетных мышц. iSMC, происходящие из MSC скелетных мышц, являются aSMA+, CD146+, CD49a+, CD56- и предпочтительно также десмин-и/или CD34-. Положительная экспрессия aSMA, CD49a и CD146 и отрицательная экспрессия CD56 и предпочтительно также CD34, подходят для идентификации этих клеток в качестве происходящих из MSC клеток гладких мышц и имеют отношение к функционированию iSMC в качестве клеток, регенерирующих гладкие мышцы. Комбинация экспрессии маркеров aSMA+, CD146+, CD49a+ и CD56- на iSMC из MSC, происходящих из скелетных мышц, является перспективной и новой по сравнению со предшествующими способами в данной области техники.
В другом предпочтительном воплощении настоящего изобретения способ включает проведение после стадии (а) стадии (a1), включающей пролиферацию клеток, происходящих из скелетных мышц, предпочтительно с получением 20-40 х 106 клеток.
В особенно предпочтительном воплощении настоящего изобретения клетки, происходящие из скелетных мышц, пролиферируют с получением 50 х 106 клеток.
В другом предпочтительном воплощении настоящего изобретения стадию (б) проводят в течение одних-шести суток. В особенно предпочтительном воплощении настоящего изобретения стадию (б) проводят в течение трех-шести суток.
Другой объект настоящего изобретения относится к индуцированным клеткам гладких мышц (iSMC), полученным способом по настоящему изобретению.
В другом предпочтительном воплощении настоящего изобретения индуцированные клетки гладких мышц (iSMC), полученные из МРС, характеризуются положительной экспрессией aSMA, CD49a, десмина, CD56 и CD146 и отрицательной экспрессией CD34.
Как уже указывалось выше, комбинация присутствия маркеров aSMA, CD49a, десмина, CD56 и CD146, или отсутствия CD34 в iSMC из МРС является предпочтительной ввиду фенокопирования профиля природной экспрессии клеток гладких мышц способами, описанными в данной заявке.
В другом предпочтительном воплощении настоящего изобретения индуцированные клетки гладких мышц (iSMC), полученные из МРС, являются некомпетентными в отношении слияния.
Слияние одноядерных миогенных клеток-предшественников (МРС) или других компетентных в отношении слияния происходящих из мышц клеток (например миобластов) в многоядерные мышечные трубочки является предпосылкой для образования и регенерации скелетных мышц (Rochlin и др., 2010). Однако, поскольку ткань гладких мышц in vivo состоит не из многоядерных мышечных трубочек, а в значительной степени из дифференцированных одноядерных клеток гладких мышц, то для регенерации гладких мышц предпочтительными являются некомпетентные в отношении слияния клетки. Таким образом, в настоящем изобретении предусматривается, что iSMC из МРС, а также iSMC из MSC являются некомпетентными в отношении слияния. В то время как МРС, полученные, как показано в примере 1 настоящего изобретения, являются компетентными в отношении слияния, iSMC, полученные, как показано в примере 2 настоящего изобретения, и в конечном итоге предназначенные для применения в ткани гладких мышц, являются некомпетентными в отношении слияния. Это относится как к MPC-iSMC, так и к MSC-iSMC по настоящему изобретению, например, как показано на Фиг. 15.
В другом предпочтительном воплощении настоящего изобретения индуцированные клетки гладких мышц (iSMC), полученные из MSC, характеризуются положительной экспрессией aSMA, CD49a и CD146 и отрицательной экспрессией CD56.
Предпочтительно, iSMC, происходящие из MSC, дополнительно характеризуются отрицательной экспрессией десмина и/или CD34.
Поскольку MSC, происходящие из скелетных мышц, отличаются от МРС в отношении CD56, то iSMC, также происходящие из MSC, являются CD56-отрицательными. Однако, iSMC, происходящие из MSC, являются aSMA+, CD146+ и CD34-, что наряду с iSMC, происходящими из МРС, является репрезентативным для коммитирования iSMC, полученных из MSC, в гладкие мышцы и, следовательно, полезным. Кроме того, положительная экспрессия мезенхимальных маркеров CD90, CD105, CD73 в iSMC, происходящих из MSC согласно настоящему изобретению, является предпочтительной ввиду мезенхимальной природы необходимой ткани гладких мышц.
Экспрессию различных маркеров, которые описаны выше, предпочтительно тестируют in vitro. Кроме того, экспрессия различных маркеров, которые описаны выше, относится к их экспрессии в соответствующих клетках in vitro. В предпочтительном воплощении экспрессия aSMA и десмина in vitro в соответствующих клетках, как определено выше, совпадает с их соответствующей экспрессией in vivo.
Предпочтительно, индуцированные клетки гладких мышц (iSMC) экспрессируют функциональные кальциевые и/или калиевые каналы.
Функциональные свойства ткани гладких мышц зависят от существования функциональных потенциал-зависимых кальциевых и калиевых каналов, позволяющих индуцировать регулируемое сокращение клеток и регулировать мембранный потенциал соответственно (Sanders, 2008). При нейронной стимуляции мембраны клеток гладких мышц деполяризуются, что вызывает открывание чувствительных к потенциалу кальциевых каналов и позволяет ионам кальция поступать в клетку из межклеточного пространства (Sanders, 2008). Это событие в последующем запускает каскады передачи сигнала, в конечном итоге приводящие к актин/миозин-индуцируемому сокращению клеток гладких мышц, необходимому, в частности, для функционирования, например, внутреннего сфинктера прямой кишки для сжатия и удерживания жидкости, газа и твердых веществ от непроизвольного высвобождения из прямой кишки (Webb, 2003). Кроме того, после индуцированной нейронами деполяризации мембраны клеток гладких мышц открываются потенциал-зависимые калиевые каналы, чтобы вызвать реполяризацию мембраны и обеспечить дальнейшую деполяризацию в случае последующих сигналов от нейронов. Таким образом, наличие кальциевых и калиевых каналов на iSMC пригодно для идентификации функциональных iSMC in vitro. Функциональные iSMC фактически необходимы для регенерации нарушения функционирования, например, внутреннего сфинктера прямой кишки, недостаточно функционального у пациентов с недержание кала. Настоящее изобретение позволяет получать iSMC из клеток, происходящих из скелетных мышц, с функциональными потенциал-зависимыми как калиевыми, так и кальциевыми каналами, что может быть желательным для их применения в регенерации гладких мышц.
Предпочтительно, индуцированные клетки гладких мышц (iSMC) представляют собой сократительные клетки in vitro. Одной из типичных функций ткани гладких мышц является сокращение (Webb, 2003). Чтобы протестировать сократительную способность in vitro, клетки сеют на коллагеновый гель и количественно определяют уменьшение размера коллагенового геля в течение некоторого периода времени как показатель сократительной способности. Авторы изобретения обнаружили, что iSMC из МРС и iSMC из MSC являются сократительными по сравнению с МРС и MSC, из которых они происходят.
Предпочтительно, индуцированные клетки гладких мышц (iSMC), в частности MPC-iSMC, полученные согласно способу по настоящему изобретению, предпочтительно на стадии (б), являются CD49e-. Экспрессию CD49e предпочтительно тестируют in vitro. CD49e также известный как интегрин-альфа 5, представляет собой молекулу клеточной адгезии, которая создает гетеродимерный рецептор с интегрином-бета 1 для связывания фибронектина, фибриногена и фибриллина-1. Поскольку ингибиторы фибронектина были достаточными для усиления экспрессии генов гладких мышц, передача сигнала с участием фибронектина, поддерживаемая посредством CD49e, может препятствовать экспрессии в гладких мышцах. Авторы изобретения обнаружили, что iSMC из мышиных МРС являются дефицитными по CD49e. Дефицит CD49e может быть полезен в ослабления передачи сигнала с участием фибронектина, и таким образом, CD49e- iSMC, полученные согласно настоящему изобретению, могут быть полезнее клеток, известных в данной области техники, в их применении для регенерации гладких мышц.
В альтернативном предпочтительном воплощении индуцированные клетки гладких мышц (iSMC), в частности MPC-iSMC, полученные согласно способу по настоящему изобретению, предпочтительно на стадии (б), являются CD49e+. Экспрессию CD49e предпочтительно тестируют in vitro.
Предпочтительно, индуцированные клетки гладких мышц (iSMC), в частности MPC-iSMC, полученные согласно способу по настоящему изобретению, предпочтительно на стадии (б), являются AChE-. Экспрессию AChE предпочтительно тестируют in vitro. Одной из типичных функций скелетных миогенных клеток является экспрессия активного фермента AChE во время слияния in vitro (Thurner и др., 2018), что необходимо для прекращения действия нервных сигналов на моторных концевых пластинках. Однако, гладкая мышца не иннервируется моторными нейронами и, следовательно, ее сокращение не регулируется в основном ацетилхолином, когда требуется наличие AChE для прекращения. Авторы изобретения проанализировали iSMC, выделенные согласно примеру 3, в отношении AChE активности согласно примеру 17 и обнаружили, что iSMC являются AChE- (Фиг. 14).
Предпочтительно, индуцированные клетки гладких мышц (iSMC), в частности MPC-iSMC, полученные согласно способу по настоящему изобретению, предпочтительно на стадии (б), являются CK-. Экспрессию CK предпочтительно тестируют in vitro. Одной из типичных функций скелетных миогенных клеток является экспрессия активного фермента CK во время слияния in vitro (Thurner и др., 2018), что необходимо для сокращения скелетных мышц. Однако сокращение гладких мышц не регулируется креатинкиназой (CK), и поэтому не является необходимым для клеток гладких мышц. Авторы изобретения обнаружили, что iSMC (пример 3), которые были проанализированы в отношении CK активности (пример 17), являются CK- (Фиг. 14).
В предпочтительном воплощении индуцированные клетки гладких мышц (iSMC), в частности MPC-iSMC, полученные согласно способу по настоящему изобретению, предпочтительно на стадии (б), являются Рах-7-отрицательными, в частности, если экспрессию Рах-7 тестируют in vitro. В еще одном предпочтительном воплощении индуцированные клетки гладких мышц (iSMC), в частности MPC-iSMC, полученные согласно способу по настоящему изобретению, предпочтительно на стадии (б), являются Pax-7-положительными, в частности, если экспрессию Рах-7 тестируют in vitro. Рах-7 представляет собой транскрипционный фактор, обнаруженный в клетках, коммитированных в линии гладких мышц (Krauss и др., 2016). Делеция Рах-7 в tunica muscularis мышей приводит к уменьшению массы скелетных мышц и увеличению массы гладких мышц (Worl и др., 2009).
В предпочтительном воплощении индуцированные клетки гладких мышц (iSMC), в частности MPC-iSMC, полученные согласно способу по настоящему изобретению, предпочтительно на стадии (б), являются SSEA4-отрицательными. В еще одним предпочтительном воплощении индуцированные клетки гладких мышц (iSMC), в частности MPC-iSMC, полученные согласно способу по настоящему изобретению, предпочтительно на стадии (б), являются 88ЕА4-положительными. Экспрессию SSEA4 предпочтительно тестируют in vitro. SSEA4 представляет собой маркер клеточной поверхности, обнаруженный в плюрипотентных стволовых клетках, которые известны своим широким пролиферативным потенциалом и ввиду этого представляют риск в отношении онкогенеза.
Способы лечения на основе индуцированных клеток гладких мышц
Другой объект настоящего изобретения относится к индуцированным клеткам гладких мышц (iSMC) для применения в способе лечения заболевания или расстройства у субъекта. Предпочтительно, субъектом является человек или животное. В частности, согласно настоящему изобретению предложены индуцированные клетки гладких мышц (iSMC) для применения в способе лечения организма человека или животного посредством хирургического вмешательства или терапии. Более конкретно, согласно настоящему изобретению предложены индуцированные клетки гладких мышц (iSMC) для применения в клеточной терапии, в частности в терапии с использованием клеток гладких мышц.
В другом предпочтительном воплощении настоящего изобретения заболевание или расстройство представляет собой дефекты гладких мышц. Предпочтительно, дефекты гладких мышц выбраны из группы, состоящей из анального недержания, недержания мочи, рефлюксной болезни, гастропареза, гиперактивного и малоактивного мочевого пузыря.
В особенно предпочтительном воплощении настоящего изобретения заболевание или расстройство представляет собой недержание кала, в частности пассивное недержание кала. Соответственно, настоящее изобретение также относится к iSMC для применения в способе лечения анального недержания, недержания мочи, рефлюксной болезни, гастропареза, гиперактивного и малоактивного мочевого пузыря и, в частности, недержания кала, более конкретно пассивного недержания кала.
Предпочтительно, iSMC инъецируют в ткань гладких мышц субъекта, нуждающегося в iSMC. Предпочтительно, iSMC инъецируют в количестве, эффективном для лечения дефектов гладких мышц. Эффективное количество подлежащего введению соединения может быть легко определено специалистами в данной области техники во время доклинических испытаний и клинических испытаний методами, известными врачам и клиницистам.
Регенерация нуждающейся в этом ткани гладких мышц, такой как ослабленная, атрофическая или поврежденная гладкая мышца, например сфинктеров, таких как внутренний анальный, внутренний уретральный, нижний или верхний сфинктеры пищевода, посредством введения клеток требует, чтобы клетки были локально введены в нуждающуюся в этом ткань. Локальное введение iSMC может регенерировать гладкую мышцу путем приживления инъецированных iSMC в месте введения. В предшествующем уровне техники (Chancellor и др., 2001) раскрыты полученные из скелетных мышц клетки, охарактеризованные как десмин+, CD34+ и Blc-2+, и их применение в наращивании мягкой ткани (например гладкой мышцы), такой как сфинктер мочевого пузыря или прямой кишки. В противоположность этому, в настоящем изобретении описано выделение CD34-, CD56+, десмин+ МРС или мультипотентных CD34-, CD56-, CD73+ и CD105+ MSC клеток, происходящих из скелетных мышц, на первой стадии. Из указанных клеток скелетной мышцы на второй стадии могут быть выделены iSMC после обработки TGFb1 и гепарином. Таким образом, эти iSMC приобретают фенотип клеток гладких мышц в результате экспрессии маркера гладких мышц, такого как, например, aSMA и CD146, и поэтому могут быть полезны для регенерации гладких мышц. Предпочтительно эти iSMC используют в способе лечения нуждающегося в этом субъекта посредством инъекции указанному субъекту. Авторы изобретения обнаружили, что iSMC, полученные способами по настоящему изобретению, будучи введенными в ткань гладких мышц сфинктера привратника, приживались в месте инъекции и интегрировались в ткань гладких мышц.
Предпочтительно, iSMC вводят в необходимую мягкую ткань посредством многократных инъекций.
Показано, что многократные инъекции SMDC в скелетную мышцу улучшают приживление клеток в мышце (Skuk и др., 2014). Настоящее изобретение предусматривает инъекцию iSMC в мягкую ткань, такую как, например, ткань гладкой мышцы, в нескольких местах одного и того же континуума ткани. В частности, клетки могут быть введены с использованием нескольких игл, каждая из которых инъецирует определенное количество клеток.
iSMC по настоящему изобретению могут быть введены в форме фармацевтической композиции, содержащей iSMC и фармацевтически приемлемый разбавитель, эксципиент или носитель. Соответственно, настоящее изобретение также относится к фармацевтической композиции, содержащей iSMC по настоящему изобретению и фармацевтически приемлемый разбавитель, эксципиент или носитель.
В другом воплощении настоящего изобретения iSMC используют в изготовлении лекарственного средства для лечения анального недержания, недержания мочи, рефлюксной болезни, гастропареза, гиперактивного и малоактивного мочевого пузыря и, в частности, недержания кала, более конкретно пассивного недержания кала.
Инжиниринг тканей
Другой объект настоящего изобретения относится к применению индуцированных клеток гладких мышц в инжиниринге тканей.
Ткань гладких мышц часто образует в организме человека структуры в форме кольца/трубки, такие как кровеносные сосуды и внутренний сфинктер прямой кишки. Применение iSMC, полученных в данной заявке, для получения структур в форме кольца/трубки можно использовать для инжиниринга кровеносных сосудов или мышц сфинктера in vitro. Сконструированные in vitro структуры гладких мышц можно использовать для замены структуры гладких мышц с нарушенной функцией, таких как гладко мышечные сфинктеры, например у пациентов с недержанием кала. Авторы изобретения обнаружили, что iSMC, полученные согласно настоящему изобретению, могут восстанавливать пространственные структуры в форме кольца, аналогичные структуре, например, внутреннего сфинктера прямой кишки. Было обнаружено, что клетки в этих тканевых кольцах экспрессируют маркерные белки гладких мышц, такие как aSMA и десмин. Экспрессия сократительных белков aSMA и десмина в кольцах ткани, полученных с использованием клеток по настоящему изобретению, требуется для функционирования этих колец ткани и поэтому является полезным для применения указанных колец ткани в замещении ткани.
Кроме этого, в настоящем изобретении было обнаружено, что происходящие из iSMC сфинктеры, сконструированные in vitro, обладают ультраструктурными свойствами природных гладких мышц, такими как чрезвычайно распространенные актиновые структуры и плотные тельца, необходимые для механотрансдукции, и, следовательно, для функционирования конструкций из гладких мышц. Кроме того, сконструированные из ткани сфинктеры, полученные в настоящем изобретении, позволяют формировать в клетках кавеолы. Известно, что кавеолы необходимы для регуляции кальция, например, посредством возбуждения-сокращения, возбуждения-транскрипции и фармакомеханического сопряжения (Popescu и др., 2006). Таким образом, iSMC, полученные в соответствии с настоящим изобретением, являются перспективными для применения в инжиниринге тканей.
Скрининг лекарственных средств
В другом объекте настоящего изобретения iSMC предназначены для применения в скрининге лекарственных средств.
Применение iSMC для создания структур гладких мышц in vitro может оказаться полезным для тестирования новых лекарственных средств и их влияния на клетки гладких мышц in vitro до того, как какое-либо потенциально опасное лекарственное средство-кандидат должно быть использовано в исследованиях на животных или человеке.
Клетки, происходящие из скелетных мышц, для создания индуцированных клеток гладких мышц
Другой объект настоящего изобретения относится к применению клеток, происходящих из скелетных мышц, для получения индуцированных клеток гладких мышц (iSMC).
В часто используемых методах из уровня техники для получения клеток гладких мышц in vitro используют индуцированные плюрипотентные стволовые клети (Dash и др., 2016), происходящие жировой ткани мультипотентные мезенхимальные стромальные клетки (G. Wang и др., 2015) или происходящие из костного мозга мультипотентные мезенхимальные стромальные клетки (Espagnolle и др., 2014), с очевидностью отличающиеся по происхождению от клеток, происходящих из скелетных мышц, использованных в настоящем изобретении в качестве источника для получения индуцированных клеток гладких мышц. Недостаток клеток, используемых в современном уровне техники, например iPSC, используемых для получения клеток гладких мышц, состоит в риске злокачественной трансформации ввиду применения генной инженерии, необходимой для получения iPSC. В другом методе из уровня техники описаны CD34+ клетки, происходящие из скелетных мышц, в качестве источника клеток гладких мышц. Вследствие этого, указанные клетки культивируют в среде для дифференцировки в течение 2-4 недель (Lu и др., 2011). В настоящем изобретении впервые для получения iSMC используют клетки CD34-, происходящие из скелетных мышц, выделенные согласно способам по настоящему изобретению. Указанные происходящие из скелетных мышц клетки хорошо подходят для выделения iSMC, поскольку осуществление способа по настоящему изобретению занимает менее 1 недели.
В предпочтительном воплощении настоящего изобретения происходящие из скелетных мышц клетки представляют собой олигопотентные миогенные клетки-предшественники (МРС), характеризующиеся положительной экспрессией CD56 и десмина и отрицательной экспрессией CD34; или происходящие из скелетных мышц клетки представляют собой мультипотентные мезенхимальные стромальные клетки (MSC), характеризующиеся положительной экспрессией CD105, CD73 и отрицательной экспрессией CD34 и CD56.
Приведенные ниже примеры поясняют настоящее изобретение, но их не следует считать ограничивающими.
Примеры
Пример 1. Выделение клеток, происходящих из скелетных мышц (SMDC) В зависимости от приведенных ниже методов выделения, SMDC были обогащены либо человеческими миогенными клетками-предшественниками (МРС), либо мышиными миогенными клетками-предшественниками (mMPC), либо человеческими мультипотентными мезенхимальными стромальными клетками (MSC).
Выделение миогенных клеток-предшественников (МРС). происходящих из скелетных мышц человека
Более подробно, биоптат скелетной мышцы отбирали из М. pectoralis major или М. biceps brachii страдающего недержанием пациента. Чтобы отобрать биоптат, сначала вскрывали кожу, делая надрез длиной примерно 1 см над мышцей, пока не достигали фасции М. pectoralis major. После вскрытия фасции отбирали 1 см3 мышечной ткани (биоптат). Биоптат переносили непосредственно в среду для транспортировки биоптатов, предварительно охлажденную до примерно 4°С и содержащую основную среду Хэма F10 с добавлением гентамицина (в конечной концентрации 1-5 мкг/мл). Биоптат хранили в течение примерно 26 часов при 1-11°С в среде для транспортировки биоптатов. Затем биоптат переносили в чашку Петри, заполненную 1xPBS (забуференный фосфатом физиологический раствор). Ткань мышцы отделяли от соединительной ткани, используя стерильные пинцет и скальпель. Затем ткань мышцы переносили в другую чашку Петри, заполненную 1xPBS, и разрезали на кусочки размером 2-3 мм2 с использованием скальпеля. После дополнительной стадии переноса, как описано выше, кусочки ткани дополнительно разрезали на кусочки размером 1 мм. Наконец, кусочки переносили в центрифужную пробирку, заполненную 1xPBS, и центрифугировали в течение 10 минут при 1300 об./мин. После центрифугирования супернатант удаляли и ткань мышцы ресуспендировали в 1xPBS с добавлением гентамицина (8 мкг/мл). Затем суспензию мышечной ткани охлаждали до 2-8°С в течение 48 часов. После охлаждения суспензию мышечной ткани центрифугировали в течение 10 минут при 1300 об./мин, затем супернатант удаляли и добавляли 2,5 мл раствора для расщепления, содержащего 1-5 мг/мл коллагеназы, 2-4% (об./об.) буфера HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), 0,1-10% (об./об.) фетальной телячьей сыворотки (FCS) и 5-10 мкг/мл гентамицина в среде Хэма F10. Затем суспензию мышечной ткани инкубировали в течение 6-20 часов при 37°С, 5% СО2. Затем суспензию центрифугировали при 1300 об./мин в течение 10 минут, супернатант удаляли, осадок после центрифугирования ресуспендировали в среде, содержащей 10-20% (об./об.) FCS, 1-3 нг/мл bFGF (основный фактор роста фибробластов) и 3-10 мкг/мл гентамицина в среде Хэма F10, и высевали во флаконы для культивирования клеток. SMDC, прикрепленные к дну флакона для культивирования дополнительно поддерживали путем замены среды каждые 3-4 суток и субкультивирования с последующим откреплением после достижения конфлюэнтности. Субкультивирование проводили, пока не достигали уровня SMDC от 1×107 до 5×107.
Выделение мышиных миогенных клеток-предшественников (mMPC).
происходящих из скелетных мышц
Мышиные МРС получали из биоптатов скелетных мышц Gt(ROSA)26Sortm4(ACTB-tdTomato,-EGFP)Luo/J, кратко, мышей TdTomato (Jackson Laboratory, Maine, USA). Взрослых мышей умерщвляли посредством смещения шейных позвонков с последующим захватом и отделением кожи на спине. Затем с использованием ножниц и скальпеля получали скелетную мышцу из длинных мышц спины {Longissimus dorsi), икроножной мышцы {Gastrocnemius) и передней большеберцовой мышцы (Tibialis anterior). Мышцы переносили в стерильную чашку Петри и покрывали 1xPBS. Затем с использованием пинцета и скальпеля удаляли из скелетной мыщцы и отбрасывали оставшуюся соединительную ткань. После этого мышечную ткань расщепляли, используя набор для расщепления скелетных мышц (Miltenyi Biotec GmbH, Bergisch Gladbach, Germany), следуя инструкциям производителя. Для отделения миогенных клеток-предшественников (mMPC) от немиогенных SMDC использовали набор для выделения сателлитных клеток (Miltenyi Biotec, Bergisch Gladbach, Germany) в соответствии с инструкциями производителя. Собранные mMPC и немиогенные SMDC центрифугировали, как описано выше, и ресуспендировали в среде для роста мышиных клеток, состоящей из DMEM (модифицированная Дульбекко среды Игла)/среда Хэма F12 с добавлением 20% FCS и bFGF. Мышиные SMDC культивировали в покрытых коллагеном колбах для культивирования, подготовленных путем покрытия поверхности колб для культивирования коллагеном I из хвоста крыс, разбавленным 1:10 в 1xPBS, в течение 1 часа при 37°С. Субкультивирования проводили так же, как и для SMDC человека. Наконец, клетки открепляли от стенок сосуда для культивирования клеток, ресуспендировали в среде и использовали незамедлительно или подвергали криоконсервации в жидком азоте до дальнейшего применения.
Выделение мультипотентных мезенхимальных стромальных клеток (MSC). происходящих из скелетных мышц человека
MSC выделяли согласно Thurner и др., 2018. Сначала SMDC выделяли из биоптатов мышц (Musculus pectoralis major или Latissimus dorsi) и размножали в среде с цГМФ (циклический гуанозинмонофосфат). Клетки поддерживали с использованием стандартных методов культивирования клеток. Кратко, клетки культивировали в среде для роста, содержащей основную среду Хэма F-10 с добавлением 10% FCS (инактивированной при 57°С в течение 40 минут), bFGF и гентамицин, и инкубировали при 37°С, 5% CO2. Среду для роста заменяли каждые 2-3 суток. Для проведения субкультивирования и сбора клетки один раз промывали 1xPBS и инкубировали с 1х раствором трипсина в течение 5 минут при 37°С. Клетки промывали средой для роста и центрифугировали при 400*g в течение 10 минут, супернатант отбрасывали и осадок после центрифугирования ресуспендировали в среде для роста. Затем MSC очищали методом сортировки магнитно-активированных клеток (MACS). Для этого использовали набор MicroBeads (Miltenyi Biotec GmbH, Bergisch Gladbach, Germany) для CD56 человека. Кратко, после сбора и подсчета клетки центрифугировали при 400*g в течение 10 минут, супернатант отбрасывали и клетки ресуспендировали в 10 мл буфера для MACS. После следующей стадии центрифугирования (400*g в течение 10 минут) осадок после центрифугирования ресуспендировали в 80 мкл буфера для MACS. Затем добавляли 20 мкл обладающего магнитными свойствами антитела к CD56 на 1*107 клеток и инкубировали в течение 15 минут при 4°С. После этого осуществляли сортировку клеток с использованием сепаратора Mini MACS, и CD56- MSC собирали в проходящем потоке. Наконец, клетки ресуспендировали в среде и подвергали криоконсервации в жидком азоте до дальнейшего применения, либо использовали незамедлительно.
Пример 2. Трансдифференцировка SMDC в iSMC и их выделение МРС, мышиные МРС или MSC, полученные в примере 1, высевали на стенки сосуда для культивирования и культивировали в среде для роста до конфлюэнтности примерно 70%. Затем клетки один раз промывали DMEM/F12 (Thermo Scientific, MA, USA). Затем клетки покрывали средой для дифференцировки гладких мышц, состоящей из смеси DMEM/F12 с добавлением рекомбинантного TGFb1 человека (Thermo Scientific, MA, USA), натриевой соли гепарина из слизистой оболочки кишечника свиньи (Sigma-Aldrich Co. LLC, МО, USA), инактивированной нагреванием (57°С, 40 минут) фетальной телячьей сывороткой (Gibco, Thermo Scientific, MA, USA) и гентамицина (Sandoz GmbH, Tirol, Austria) до конечной концентрации 10 нг/мл; 3,84 мкг/мл и 5% (об./об.) соответственно. Окончательно клетки культивировали в среде для дифференцировки гладких мышц в течение 3-6 суток при 37°С, 5% СО2. Среду заменяли каждые 3-4 суток. Для выделения клетки открепляли от стенок сосудов для культивирования и собирали в виде суспензии.
Пример 3. Дифференцировочный потенциал SMDC
Для осуществления адипогенной, хондрогенной и остеогенной дифференцировки in vitro в каждый из 6-луночных планшетов (NUNC, Thermo Scientific, MA, USA) высевали по 500000 клеток, полученных согласно примеру 1, и культивировали в среде для роста в течение 24 часов при 37°С, 5% СО2. Затем клетки один раз промывали 5 мл смеси DMEM/Хэма F12 и в каждом случае покрывали 5 мл среды для адипогенной, хондрогенной или остеогенной дифференцировки. Среда для адипогенной, хондрогенной и остеогенной дифференцировки состояла из основной среды для остеогенной/адипогенной дифференцировки StemXVivo™ (R&D Systems Inc., MN, USA с добавлением среды для адипогенной дифференцировки для человека/мыши/крысы StemXVivo (R&D Systems Inc., MN, USA), добавкой для остеогенной дифференцировки для человека StemXVivo (R&D Systems Inc., MN, USA) или добавкой для хондрогенеза STEMPro® (Gibco®, Thermo Scientific, MA, USA) соответственно, согласно инструкциям производителя. Кроме того, в среды для дифференцировки добавляли гентамицин (Sandoz GmbH, Austria) с достижением конечной концентрации 3,83 мкг/мл. В каждом случае клетки культивировали в течение 14 суток в соответствующей среде для дифференцировки, которую меняли каждые 2-3 суток. Через 14 суток культивирования успешность дифференцировки оценивали по присутствию адипоцитов, хондроцитов и остеоцитов, визуализированных посредством окрашивания с использованием масляного красного О (адипоциты), альцианового синего (хондроциты) и ализаринового красного S (остеоциты) соответственно. Количественное определение окрашивания масляным красным О, альциановым синим и ализариновым красным S проводили с использованием микроскопических изображений, полученных в результате многих отдельных экспериментов, с помощью программного пакета Image j. В связи с этим, загружали изображения и выполняли разделение цветовых каналов. Красные каналы использовали для регистрации окрашивания масляным красным О и ализариновым красным S, в то время как синий канал использовали для регистрации окрашивания альциановым синим. Фон устраняли путем настройки общего порога, а для количественного определения с применением Image j использовали среднюю интенсивность пикселей в поле. Статистическое сравнение проводили, применяя непарный t-критерий Стьюдента, считая значение р<0,05 значимым (*). р<0,01, р<0,001 отмечали как * или ** соответственно. Дифференцировку скелетных мышц инициировали в культуре клеток в 24-луночных пластиковых планшетах Nunclon™ Delta Surface (Thermo Scientific, MA, USA) путем замены ростовой среды на среду для дифференцировки клеток скелетных мышц (500 мл, PromoCell GmbH, Germany), с добавлением 10 мл добавки к среде для дифференцировки клеток скелетных мышц (PromoCell GmbH, Germany) и 240 мкл раствора гентамицина (8 мг/мл; Sandoz GmbH, Austria), как описано ранее (Thurner и др., 2018).
МРС и MSC, полученные согласно примеру 1, тестировали в отношении дифференцировки in vitro в адипогенные, хондрогенные, остеогенные и скелетные миогенные линии клеток в соответствующих условиях культивирования. Окрашивание на адипоциты, хондроциты, остеоциты и мышечные трубочки осуществляли так, как описано ранее. Клетки с положительным окрашиванием масляным красным О и ализариновым красным S отсутствовали в МРС, и можно было обнаружить только низкие уровни клеток с окрашивания альциановым синим. Среди MSC, после культивирования в среде для адипогенной, хондрогенной и остеогенной дифференцировки, были обнаружены клетки с положительным окрашиванием масляным красным О, альциановым синим и ализариновым красным S соответственно (Фиг. 1А, В), что подтверждало их обогащение мультипотентными клетками и статус мультипотентных мезенхимальных стромальных клеток, как определено Международным обществом по клеточной терапии (Dominici и др., 2006). Только в МРС были обнаружены десмин-положительные многоядерные мышечные трубочки (Фиг. 1А). Количественное определение интенсивности окрашивания масляным красным О, альциановым синим и ализариновым красным S после адипогенной, хондрогенной и остеогенной дифференцировки in vitro соответственно, а также расчет индекса слияния после скелетно-миогенной дифференцировки MSC и МРС выявили значительно более высокую интенсивность окрашивания масляным красным О (р=0,0117), альциановым синим (р=0,0020) и ализариновым красным S (р=0,0012) MSC по сравнению с МРС, в то время как более высокий индекс слияния (р=0,0007) был обнаружен у МРС по сравнению с MSC (Фиг. 1В). Таким образом, МРС представляют собой мезенхимальные олигопотентные клетки, коммитированные в миогенную линию. Кроме того, MSC являются мультипотентными и способны к адипогенной, хондрогенной и остеогенной дифференцировке in vitro.
Пример 4. Экспрессия поверхностных маркеров
Чтобы оценить экспрессию поверхностных маркеров, выполняли проточную цитометрию на проточном питометре Guava easyCyte 6НТ 2L (Merck Millipore, Darmstadt, Germany). Кратко, клетки, полученные согласно примеру 1, собирали, покрывая 1х раствором трипсина при 37°С в течение 5 минут, центрифугировали при 400*g и ресуспендировали в 1xPBS с добавлением 1% FCS. 40000 клеток ресуспендировали в 195 мкл 1xPBS и инкубировали после добавления 5 мкл CD34-PE, CD56-PE, CD146-PE, IgG1-PE, IgG1-FITC, CD90-PE, CD105-PE (все от Beckman Coulter, СА, USA), CD49a-FITC (Miltenyi Biotec, Germany) или CD73-PE (Becton Dickinson, NJ, USA) в течение 30 минут в пробирке типа эппендорф объемом 1,5 мл при 4°С в темноте. Затем клетки промывали 1 мл PBS, центрифугировали при 400*g в течение 10 минут и ресуспендировали в 195 мкл 1xPBS в 96-луночном круглодонном планшете. Затем в каждую реакционную смесь вносили 5 мкл красителя для определения жизнеспособности, 7-аминоактиномицина D (Beckman Coulter Inc., France), и планшет инкубировали в течение 10 минут при комнатной температуре (КТ) в темноте. Наконец, используя программное обеспечение Guava InCyte™ в версии 2.3, получали информацию о клеточных событиях. Гистограммы и точечные диаграммы получали на основании как минимум 5000 событий при скорости потока образца 1,8 мкл/мл. Факт положительного окрашивания подтверждали путем сравнения с изотипическим контролем, установленным как отрицательный на по меньшей мере 95%, или путем сравнения с контрольными (отрицательными) клетками.
Чтобы охарактеризовать МРС и MSC, по меньшей мере 4 образца от отдельных пациентов, полученные способами, использованными в примере 1, а также iSMC, происходящие из них способами, использованными в примере 2, тестировали на наличие маркеров мезенхимальных линий (CD105, CD90 и CD73), гемопоэтического маркера (CD34), миогенного маркера (CD56) и маркера линии гладких мышц (CD146). Среднее значение % положительных клеток, составляющее ≥50, рассматривали как положительное, в то время как среднее значение<50% рассматривали как отрицательное. Таким образом, было обнаружено, что клетки всех типов оказались положительными в отношении CD105, CD90 и CD73, но отрицательными в отношении CD34 (Фиг. 2). Более того, МРС и происходящие из них iSMC оказались CD56+, a MSC и происходящие из них iSMC оказались CD56-.
Интересно, что экспрессия поверхностного маркера CD146, ассоциированного с коммитированием MSC в гладкие мышцы сосудов (Espagnolle и др., 2014), и CD49a, экспрессируемого в процессе развития гладких мышц (Belkin и др., 1990), была отрицательной как в МРС, так и в MSC, но положительной в происходящих из них iSMC (Фиг. 2).
Пример 5. Экспрессия внутриклеточных маркеров
Проводили иммунофлуоресцентное окрашивание для обнаружения экспрессии внутриклеточных маркеров непосредственно на покрытых желатином 24-луночных планшетах или покровных стеклах, помещенных в 6-луночные планшеты, как описано ранее (Thurner и др., 2018). Для флуоресцентного иммуномечения альфа-актина гладких мышц (aSMA), смутелина или десмина клетки инкубировали с мышиным антителом к альфа-актину гладких мышц (Sigma-Aldrich Co. LLC, MO, USA), с мышиным антителом к смутелину (Merck Millipore, MA, USA), с антителом к тяжелой цепи миозина гладких мышц (Merck Millipore, MA, USA) или с кроличьим антителом к десмину (Thermo Scientific, MA, USA) соответственно, в каждом случае разбавленными 1:100 в среде для блокирования. Использовали вторичные козьи антимышиные антитела, конъюгированные с Alexa488, или ослиные антикроличьи антитела, конъюгированные с Alexa547 (Thermo Scientific, MA, USA), разбавленные 1:200 в среде для блокирования. Контрастное окрашивание ядер проводили посредством инкубации клеток с красителем Хехст33342 (Sigma-Aldrich Co. LLC, МО, USA), разбавленным до конечной концентрации 2 мкг/мл в PBST (PBS с 0,1% тритона Х-100). Клетки заливали средой Entellan® (Merck Millipore, MA, USA) и герметично закрывали покровными стеклами. Результаты окрашивания сравнивали с (1) методиками без первичных антител и (2) с клетками, отрицательными в отношении к тестируемым антителам. Для количественного определения положительных клеток осуществляли наложение картин окрашивания с использованием красителя Хехст и с использованием антител и анализировали множественные изображения по меньшей мере трех независимых препаратов клеток. Общее количество клеток с положительным окрашиванием антителами делили на общее количество клеток (ядер) по оценкам с окрашиванием Хехст. Для сравнения клеток, полученных в примерах 1 и 2, рассчитывали значения средней и стандартной ошибки.
МРС и MSC, полученные согласно примеру 1, а также происходящие из них iSMC, описанные в примере 2, анализировали в отношении экспрессии внутриклеточных сократительных белков гладких мышц (aSMA, смутелин), а также общего миогенного маркера десмина, посредством флуоресцентного иммуноокрашивания. МРС и MSC являлись aSMA- и смутелин-. В противоположность этому было обнаружено, что iSMC, выделенные как из MSC, так и из МРС, являлись aSMA+ (Фиг. 3). Кроме того, было обнаружено, что iSMC, выделенные из МРС как в примере 2, являлись смутелин+. Анализ внутриклеточной экспрессии десмина выявил, что MSC и выделенные из них iSMC являлись десмин-. В противоположность этому, и МРС, и выделенные из них iSMC являются десмин+ (Фиг. 3).
Пример 6. Экспрессия генов
Суммарную РНК из 1×106 МРС или MSC, в каждом случае полученных, как показано в примере 1, и происходящих из них iSMC, как показано в примере 2, выделяли с использованием набора RNEasy (QIAGEN, Hilden, Germany) согласно инструкциям производителей. Подготовку образцов для микроматричной гибридизации осуществляли, как описано в руководствах NuGEN Ovation PicoSL WTA System V2 и NUGEN Encore Biotin Module (NuGEN Technologies, Inc., San Carlos, CA, USA). Гибридизованные матрицы промывали и окрашивали в Affymetrix Fluidics Station FS450 и сигналы флуоресценции измеряли с использованием Affymetrix GeneChip Scanner 3000 7G. Управление жидкостями и функциями сканирования осуществляли, используя программное обеспечение Affymetrix GeneChip Command Console в версии 4.1.3. Обработку образцов проводили в сервис-бюро и центральной лаборатории фирмы Affimetrix, "KFB - Center of Excellence for Fluorescent Bioanalytics" (Regensburg, Germany).
Суммарные сигналы от набора зондов по шкале log2 рассчитывали, используя алгоритм RMA с применением Affymetrix GeneChip Expression Console в версии 1.4. Идентификаторы набора зондов с наивысшим log2-кратным изменением между МРС и MPC-iSMC использовали для последующего анализа и сравнения с log2-кратными изменениями между MSC и MSC-iSMC. Обзор всех проанализированных генов и соответствующие log2-кратные изменения между MSC и MSC-iSMC, а также между МРС и MPC-iSMC показаны на Фиг 12. Log2-кратные изменения ≥1 рассматривались как признак положительной регуляции и поэтому отмечены звездочкой (*). Для визуализации log2-кратных изменений и выполнения иерархической кластеризации, а также кластеризации k-средних в соответствии с эвклидовым расстоянием создавали тепловые карты с использованием программного обеспечения Multiple Expression Viewer (MeV 3.1.0).
Для исследования изменений генной экспрессии, ассоциированных с выделением iSMC по настоящему изобретению, проводили микроматричный анализ. Подробно анализировали смутелин (SMTN), кальпонин 1 (CNN1), тропомиозин 1 (ТРМ1), трансгелин (TGLN, SM22), интегрин-альфа-3 (ITGA3), интегрин-альфа-1 (ITGA1, CD49a), винкулин (VCL) и ген молекулы клеточной адгезии клеток меланомы (МСАМ, CD146) (Espagnolle и др., 2014; Miano, 2010; Xie и др., 2011), а также связанный с миогенным коммитированием ген десмина (DES) (Capetanaki и др., 1997) вместе со всеми генами, необходимыми для сокращения гладких мышц сосудов ("KEGG PATHWAY: Vascular smooth muscle contraction - Homo sapiense (human)" дата не указана). Изменения в экспрессии генов между МРС и происходящими из них iSMC сравнивали с изменениями между MSC и происходящими из них iSMC. Считая значение log2 FC, равное 1 или более, и значение log2 FC, равное -1 или менее, соответствующими положительной и отрицательной регуляции соответственно, 20,33 процента из 123 протестированных генов характеризовались положительной регуляцией и только 3,25 процента отрицательной регуляцией в процессе дифференцировки МРС в MPC-iSMC, что свидетельствует о дифференцировке в направлении фенотипа клеток гладких мышц. Характеризующиеся положительной регуляцией гены KEGG кластера или известные маркерные гены клеток гладких мышц в MPC-iSMC в сравнении с МРС представляли собой PPP1R14A (от англ. protein phosphatase 1 regulatory inhibitor subunit 14A), KCNMB1 (от англ. potassium calcium-activated channel subfamily M regulatory beta subunit 1), PLCB4 (от англ. фосфолипаза С, форма β 4), ACTG2 (от англ. actin gamma 2), ITPR1 (от англ. inositol 1,4,5-trisphosphate receptor type 1), ADCY6 (от англ. adenylate cyclase type 6), CALCRL (от англ. calcitonin gene-related peptide type 1 receptor precursor), KCNMA1, GNA13 (от англ. guanine nucleotide-binding protein subunit alpha-13), CNN1, ADCY2 (от англ. adenylate cyclase type 2), KCNMB4, GUCY1A3 (от англ. guanylate cyclase soluble subunit alpha-3), ARAF (от англ. A-Raf proto-oncogene), ITGA1, PPP1R12A, MAPK1 (от англ. митоген-активируемая протеинкиназа 1), CALD1 (от англ. non-muscle caldesmon), KCNMB2, PRKACB (от англ. cAMP-dependent protein kinase catalytic subunit beta), ARHGEF11 (от англ. rho guanine nucleotide exchange factor 11), PPP1R12C, ITPR2, PLCB1 и SMTN (Фиг. 12).
Считая значение log2 FC, равное 1 или больше, и значение log2 FC, равное -1 или меньше, как соответствующие положительной и отрицательной регуляции соответственно, 12,20 процента из 123 протестированных генов характеризовались положительной регуляцией и только 3,25 процента отрицательной регуляцией в процессе дифференцировки MSC в MSC-iSMC, что свидетельствует о дифференцировке в направлении фенотипа клеток гладких мышц. Характеризующимися положительной регуляцией генами KEGG кластера или известными маркерными генами клеток гладких мышц в MSC-iSMC в сравнении с MSC были АСТА2 (от англ. actin alpha 2), ACTG2, CALD1, GNAQ (от англ. guanine nucleotide-binding protein G(q) subunit alpha), ITPR1, MAPK1, MYL9 (от англ. myosin regulatory light polypeptide 9), KCNMA1, PLCB4, PPP1R14A, PRKCE (от англ. protein kinase С epsilon type), CNN1, TPM1, TAGLN (трансгелин) и ITGA1 (Фиг. 12). Данные о том, что экспрессия гена ITGA1, кодирующего белок CD49a, и SMTN, кодирующего белки смутелина, характеризовалась положительной регуляцией в MPC-iSMC, подкрепляют данные авторов настоящего изобретения о повышенном процентном содержании CD49a-положительных клеток и смутелин-положительных клеток в MPC-iSMC по сравнению с МРС, подтверждая тем самым экспрессию маркеров клеток гладких мышц в MPC-iSMC. Данные о том, что экспрессия гена ITGA1, кодирующего CD49a, характеризовалась положительной регуляцией в MSC-iSMC, подкрепляют данные авторов настоящего изобретения о повышенном процентном содержании CD49a-положительных клеток в MSC-iSMC по сравнению с MSC, подтверждая тем самым экспрессию маркеров клеток гладких мышц в MSC-iSMC.
Несмотря на то, что экспрессия поверхностного белка CD146 (МСАМ) характеризовалась положительной регуляцией в MPC-iSMC, в экспериментах с микроматрицами не было обнаружено, что экспрессия гена МСАМ характеризовалась положительной регуляцией, что свидетельствует о посттранскрипционной регуляции экспрессии CD146. Кроме того, кластерный анализ k-средних для log2 FC измененной генной экспрессии в МРС и MSC в процессе дифференцировки в MPC-iSMC и MSC-iSMC привел к идентификации одинаково положительно (Фиг. 4А) и отрицательно регулированных (Фиг. 4В) генов среди МРС и MSC, когда из них были выделены iSMC соответственно. В то время как PP1R14A, ACTG2, PLCB4, ITPR1, МАРК1, CNN1, ITGA1 и KCNMA1 характеризовались положительной регуляцией как в МРС, так и в MSC, ген PLA2G2A (от англ. group 2А secretory phospholipase А2, membrane associated precursor) характеризовался отрицательной регуляцией в обоих типах клеток. В целом, 75,61 процента протестированных генов одинаковым образом характеризуются положительной, отрицательной регуляцией или не подвергаются регуляции как в МРС, так и в MSC в процессе дифференцировки в iSMC. Хотя, в МРС было обнаружено большее количество генов с положительной регуляцией и меньшее количество генов с отрицательной регуляцией (20,33% с положительной и 3,25% с отрицательной регуляцией), чем в MSC (12,20% с положительной и 5,69% с отрицательной регуляцией), никакой значимой разницы в процентном содержании характеризующихся положительной или отрицательной регуляцией генов между МРС и MSC не обнаружено (Фиг. 4С).
Пример 7. Способность к слиянию
Способность к слиянию МРС и iSMC из примеров 1 и 2, соответственно, оценивали согласно их индексу слияния (FI). Чтобы определить индекс слияния (FI), клетки, индуцированные для дифференцировки клеток скелетных мышц в примере 3, дважды промывали PBS и фиксировали 4% PFA (параформальдегид) в течение 10 минут.Затем клетки трижды промывали PBS и окрашивали 2 мкг/мл раствором Хехст33342 в течение 20 минут. Для каждого образца во время визуализации иммунофлуоресценции фиксировали по меньшей мере три поля и осуществляли наложение с фазово-контрастными изображениями, чтобы облегчить детектирование ядер и границ клеток. Индекс слияния рассчитывали для каждого фиксированного поля посредством деления количества ядер в трубочках на общее количество ядер в поле с последующим расчетом среднего значения для всех проанализированных полей. Только клетки, которые имеют по меньшей мере 3 ядра, считались мышечными трубочками. Для статистического анализа в каждой группе анализировали по меньшей мере 3 популяции, полученные от разных пациентов.
Количественное определение FI показало, что значительно большее количество МРС претерпевало скелетный миогенез по сравнению с iSMC, выделенными из них в примере 2, что свидетельствует об уменьшении скелетно-миогенного потенциала МРС после выделения iSMC из МРС (Фиг. 5А). Кроме того, трубочки, образованные iSMC, содержали значительно меньше ядер, чем трубочки, образованные МРС (Фиг. 5В). В целом, МРС оказываются компетентными в отношении слияния, в то время как происходящие из них iSMC можно считать некомпетентными в отношении слияния.
Пример 8. Электрофизиология
Анализ с использованием метода пэтч-кламп проводили на МРС и iSMC, полученных в примерах 1 и 2 соответственно, согласно ранее опубликованному протоколу (Park и др., 2013) с небольшой конкретной адаптацией эксперимента. Операции осуществляли следующим образом. Электрофизиологическую регистрацию проводили в конфигурации «целая клетка» с использованием усилителя для пэтч-кламп Axopatch 200А (Axon Instruments, Foster City). Пипетки для пэтч-кламп с сопротивлением 1-4 MΩ были выполнены из боросиликатного стекла (GC150F-7.5, Clark Electromedical Instruments, UK) и заполнены раствором для пипеток. Все данные оцифровывали с использованием интерфейса DIGIDATA 1200 (Axon Instruments, Foster City), сглаживали с помощью четырехполюсного фильтра Бесселя и сохраняли на диске. Кривые токов регистрировали при 10 кГц и фильтровали при 2 кГц. Для сбора данных использовали пакет программ pClamp (в версии 10.0 от Axon Instruments, Inc.). Для проведения анализа использовали Microcal Origin 7.0. Если не указано иное, реагенты получали от Sigma-Aldrich. Входящий ток потенциал-зависимых Cav-каналов вызывали приложением деполяризующих импульсов (500 мс) от удерживающего потенциала от -50 до 50 мВ. Наложенные кривые токов от Kv-каналов вызывали ступенчатыми деполимеризующими импульсами от -80 до 60 мВ с шагом 20 мВ от удерживающего потенциала от 80 мВ в случае МРС, MPC-iSMC и hBd-SMC.
Было обнаружено, что клетки, полученные согласно примеру 2, не демонстрировали чувствительных к напряжению входящих и выходящих токов потенциал-зависимых кальциевых или потенциал-зависимых калиевых каналов соответственно. В противоположность этому, iSMC, происходящие из МРС в примере 2, продемонстрировали чувствительные к напряжению как входящие, так и выходящие токи, что также было обнаружено в hBd-SMC (Фиг. 6). Таким образом, выделение iSMC посредством инкубации с TGFb1 и гепарином приводит к функциональному созреванию.
Пример 9. Сокращение решетки коллагенового геля
Чтобы измерить сократительную способность, MSC и МРС, полученные согласно примеру 1, а также происходящие из них iSMC согласно примеру 2, рассевали в решетке коллагенового геля и выполняли количественное определение уменьшения размера геля в процентном отношении. Подробнее, удаляли культуральные среды от субконфлюэнтных клеток из стандартных сосудов для культивирования клеток, и клетки дважды промывали 1xPBS. Затем клетки покрывали трипсином и инкубировали в течение 5 минут при 37°С. После этого клетки открепляли, постукивая по стенкам сосуда для культивирования, и ресуспендировали после добавления основной среды DMEM/среда Хэма F12. Затем клетки центрифугировали при 400*g в течение 10 минут.
Супернатант удаляли и клеточный осадок после центрифугирования ресуспендировали в DMEM/среда Хэма F12 с получением 6*105 клеток в мл. Для каждого геля 400 мкл клеточной суспензии смешивали с 200 мкл раствора коллагена из кожи крупного рогатого скота (Thermo-Fisher Scientific, MA, USA). Затем добавляли 3 мкл 0,1 М раствора NaOH, после чего сразу же выполняли ресуспендирование и перенос 500 мкл этой смеси в лунку 24-луночного планшета (NUNC, Thermo-Fisher Scientific, MA, USA). Затем 24-луночный планшет инкубировали в течение 30 минут при 37°С для образования геля. После этого каждый гель покрывали 500 мкл DMEM/среда Хэма F12 и открепляли от дна 24-луночного планшета, чтобы он плавал на поверхности, используя стерильный наконечник для пипетки. Наконец, гели инкубировали при 37°С, 5% CO2 в течение 24 часов, чтобы обеспечить сокращение геля под действием включенных клеток. Для количественной оценки степени сокращения геля получали стереомикроскопические изображения и площадь геля рассчитывали с использованием программного обеспечения FIJI (Image J).
В анализе сокращения решетки коллагенового геля было обнаружено, что МРС и MSC, выделенные в соответствии со стадией (а) настоящего изобретения (пример 1), не обладают сократительной способностью. В противоположность этому, iSMC, выделенные в соответствии со стадией (б) настоящего изобретения (пример 2) из МРС и MSC показали значительно более высокую сократительную способность, чем клетки, из которых они происходят (МРС, MSC). Таким образом, было обнаружено, что SMDC, трансдифференцированные в iSMC и выделенные в соответствии со стадией (б) (пример 2), обладают сократительной способностью по сравнению с клетками, выделенными на стадии (а) (пример 1; Фиг. 7).
Пример 10. Регенерация гладких мышц с использованием iSMC
Для проверки потенциала iSMC, полученных согласно примеру 2, в отношении регенерации гладких мышц, iSMC, происходящие из мышиных МРС (полученные согласно примеру 1) инъецировали в сфинктер привратника взрослым самкам мышей линии SHO-PrkdcscidHrhr. Для этого мышей сначала анестезировали путем применения 100 мг/кг кетамина, 10 мг/кг ксилазина и 3 мг/кг ацепромазина внутрибрюшинно. Во время этой процедуры применяли защитный крем для глаз. Криоконсервированные клетки снова размораживали, один раз промывали 1xPBS и центрифугировали при 400*g в течение 10 минут, после чего клетки ресуспендировали в 1xPBS с достижением конечной концентрации 40000000 клеток/мл. Тем временем мышей, которые получали клетки, помещали на греющую плиту для поддержания температуры тела при 37°С. Затем 25 мкл клеточной суспензии (содержащей 1000000 клеток) смешивали с 5 мкл полистирольных гранул FluoSpheres®, 15 мкм, желто-зеленых или синих (Thermo-Fisher Scientific, MA, USA), необходимых для отслеживания места инъекции после хирургической операции. Для инъекции iSMC в сфинктер привратника выполняли срединную лапаротомию с последующей локализацией области сфинктера привратника и применением 30 мкл смеси клеток с FluoSpheres, используя иглу калибра 28G, соединенную со шприцем объемом 1 мл. Слой брюшины и кожно-мышечной ткани закрывали по отдельности последовательным сшиванием с использованием рассасывающейся одноволоконной хирургической нити 6-0 PDS plus (полидиоксанон с асептическим покрытием) (Ethicon). В послеоперационном периоде применяли 200 мг новалгина (Metamizol®) на килограмм массы тела подкожно в течение трех суток. Через 12 недель после инъекции клеток мышей умерщвляли смещением шейных позвонков для получения образцов и изображения мышц сфинктера привратника.
Визуализацию только что выделенных областей сфинктера привратника проводили с использованием системы визуализации in vivo IVIS Spectrum (PerkinElmer, MA, USA), применяя программное обеспечение Living Image®, версия 4.5.2 (PerkinElmer, MA, USA) в соответствии с инструкциями производителя. Вкратце, сфинктеры привратника подвергнутых инъекции и контрольных SHO-мышей помещали в стеклянную чашку Петри и размещали в системе IVIS. Получали флуоресцентные изображения на высоте 2 см с автоматическим временем экспозиции для соответствующих длин волн поглощения и излучения TdTomato и желтых гранул Fluosphere. После этого интенсивности сигналов корректировали, чтобы избавиться от фоновых сигналов, сравнивая с эксплантатами сфинктера от контрольных мышей.
Для гистологического анализа животных подвергали глубокой анестезии изофлураном и умерщвляли путем смещения шейных позвонков. Интересующую ткань незамедлительно иссекали и криофиксировали посредством помещения в охлажденный жидким азотом 2-метилбутан. С использованием криостата Leica 1950 делали срезы ткани толщиной 15 мкм, помещали на предметные стекла Superfrost plus и хранили при -20°С до дальнейшей обработки. Для проведения иммуногистологического анализа срезы фиксировали 4%-ным раствором PFA и промывали PBS, содержащим 0,1% твин-20 (Sigma-Aldrich). Блокирование и разбавление антител осуществляли, используя раствор PBS, содержащий 1% фракции бычьего сывороточного альбумина (Sigma-Aldrich), 0,2% желатина рыбьей кожи (Sigma-Aldrich) и 0,1% твин-20 (Sigma-Aldrich). Первичные антитела к tdTomato (Sicgen) или aSMA (Thermo Scientific, MA, USA) разбавляли 1:100 в среде для блокирования, последующую инкубацию проводили в течение ночи при 4°С. Вторичные антитела (Thermo Scientific) разбавляли 1:500 и применяли при комнатной температуре в течение 4 часов. Ядра окрашивали раствором DAPI, разбавленным до рабочей концентрации 0,5 мкг/мл (Sigma-Aldrich). После этого срезы закрепляли, используя реагент Prolong Gold Antifade (Life Technologies). Флуоресцентные изображения получали, используя конфокальный микроскоп LSM 710 и программное обеспечение ZEN 2011 Black (Carl Zeiss).
Авторы изобретения обнаружили, что iSMC, выделенные согласно примеру 2 из экспрессирующих репортерный белок TdTomato МРС, полученных согласно примеру 1, поддавались обнаружению и были солокализованы с совместно введенными флуоресцентными гранулами в области сфинктера привратника через 12 недель после имплантации, что свидетельствует о приживлении iSMC в месте инъекции. Гистологическое исследование с последующим флуоресцентным иммуноокрашиванием на TdTomato и aSMA показало, что TdTomato-положительные клетки iSMC были обнаружены внутри кольцевой мышцы сфинктера привратника, а также в мышечном слое слизистой оболочки рядом с совместно введенными флуоресцентными гранулами (Фиг. 8). TdTomato-положительные клетки iSMC, расположенные в слое гладких мышц сфинктера привратника, также экспрессировали белок aSMA, что свидетельствует не только о приживлении в ткани гладких мышц, но также о сохранении фенотипических характеристик клеток гладких мышц после приживления, необходимого для регенерации гладких мышц (Фиг. 8).
Пример 11. Инжиниринг ткани гладких мышц
Чтобы исследовать пригодность клеток, полученных способами, описанными в данной заявке, для применения в инжиниринге тканей, проводили 3D-культивирование клеток. Использовали метод, позволяющий получить кольцеобразные сфинктероподобные структуры, уже известный в данной области техники (Gwyther и др., 2011), используя клетки, полученные согласно примеру 1 или 2. Для получения культуральных сосудов для 3D-культивирования, изготавливали матрицу с кольцевидной резьбой (внутренний диаметр 4 мм; внешний диаметр 10 мм) из нержавеющей стали для получения автоклавируемой негативной PDMS (полидиметилсилоксан) матрицы. Затем готовили 2%-ный (масс/об.) раствор агарозы, отвешивая 5 г агарозы с низкой температурой гелеобразования (Sigma-Aldrich, MA, USA) в колбу Schott®, заполненную до 250 мл основной средой Хэма F10. Затем и PDMS- матрицу и раствор агарозы автоклавировали при 121°С в течение 20 минут. Затем PDMS матрицу заполняли раствором агарозы в стерильных условиях, после чего инкубировали при комнатной температуре в течение 1 часа, чтобы дать агарозе затвердеть. На следующей стадии затвердевшую агарозу высвобождали из PDMS матрицы, из агарозы вырезали кубики, каждый из которых содержал одну кольцеобразную матрицу, и переносили в 6-луночный планшет, заполненный 2 мл основной среды Хэма F10, после чего хранили при 37°С до дальнейшего применения. Для 3D-культивирования, клетки, полученные в примере 1, центрифугировали при 400*g в течение 10 минут и клеточный осадок после центрифугирования ресуспендировали в культуральной среде с получением концентрации 5×106 клеток/мл. Затем в агарозную матрицу добавляли 200 мкл клеточной суспензии, после чего инкубировали при 37°С в течение 48 часов без дальнейших сотрясений, чтобы позволить клеткам образовать кольца. По окончании времени инкубации среду вне матрицы в 6-луночном планшете отбрасывали и в 6-луночный планшет осторожно вносили 5 мл среды, как в примере 1, для получения 3D-культур МРС или MSC, либо любой из них, как в примере 2, для получения 3D-культур iSMC. Клетки культивировали в течение 6 суток, чтобы достичь созревания, при 37°С, 5% СО2 до проведения анализа. Через 6 суток культивирования клетки анализировали с использованием стандартной световой микроскопии, приготовления криосрезов с последующим иммуноокрашиванием (пример 12) или окрашиванием Н&Е (гематоксилином и эозином), сканирующей электронной микроскопии или приготовления полу/ультратонких срезов с последующим окрашиванием толуидиновым синим или с использованием трансмиссионной электронной микроскопии. МРС, полученные согласно примеру 1, которые подвергали трансдифференцировке с получением iSMC, как описано в примере 2, формировали кольцеобразные сфинктеры с применением описанных выше методов, основанных на работе Gwyther и др., 2014 (Фиг. 9).
Пример 12. Приготовления криосрезов и иммуноокрашивание Для гистологического анализа кольцеобразных 3D-культур (биоинженерные сфинктеры), полученных согласно примеру 11, кольца осторожно извлекали из агарозной матрицы и, с использованием стерильной ложки, промывали путем переноса в пробирку типа эппендорф, заполненную 1xPBS, и затем фиксировали и подвергали пермеабилизации путем погружения в предварительно охлажденный до -20°С MetOH на 5 минут. Затем кольца промывали, три раза разбавляя MetOH 1xPBS после удаления половины раствора. Биоинженерные сфинктеры криофиксировали путем быстрого погружения в охлажденный в жидком азоте 2-метилбутан. Из образца делали срезы толщиной 15 мкм с использованием криостата СМ1950 (Leica, Germany) и срезы помещали на предметные стекла Superfrost plus (Thermo-Fisher Scientific, MA, USA) и хранили при -20°С до дальнейшей обработки. Блокирование и разбавление антител осуществляли, используя раствор PBS, содержащий 1% фракции бычьего сывороточного альбумина (Sigma-Aldrich Co. LLC, MO, USA), 0,2% желатина рыбьей кожи (Sigma-Aldrich Co. LLC, MO, USA) и 0,1% твин-20 (Sigma-Aldrich Co. LLC, MO, USA). Первичное антитело к aSMA (Thermo-Fisher Scientific, MA, USA) разбавляли 1:100 в среде для блокирования, после чего инкубировали в течение ночи при 4°С. Вторичные антитела (Thermo-Fisher Scientific, MA, USA) разбавляли 1:500 и использовали при комнатной температуре в течение 4 часов. Ядра окрашивали DAPI, разбавленным до рабочей концентрации 0,5 мкг/мл (Sigma-Aldrich Co. LLC, МО, USA), и филаменты актина окрашивали посредством инкубирования с фаллоидином (Thermo-Fisher Scientific, MA USA), разбавленным 1:100 в PBS, в течение 20 минут при комнатной температуре. После этого срезы закрепляли, используя Prolong Gold Antifade (Thermo-Fisher Scientific, MA, USA). Флуоресцентные изображения получали, используя инвертированный микроскоп Nikon Eclipse TE2000-U.
Было обнаружено, что клетки в кольцах ткани, полученных согласно примеру 10, были положительными в отношении альфа-актина гладких мышц и десмина (Фиг. 10). В то время в кольцах ткани, происходящих из МРС, экспрессия aSMA осуществлялась в основном клетками внешнего слоя кольца, в содержащих iSMC кольцах ткани aSMA-экспрессирующие клетки были распределены по всему кольцу. Более конкретно, было обнаружено, что большее количество клеток в кольцах, которые были образованы из МРС, дифференцированных в iSMC в процессе 3D культивирования в соответствии с комбинацией примеров 2 и 10, экспрессировали aSMA, чем клетки в кольцах, которые были образованы из МРС (Фиг. 10). В противоположность этому, десмин экспрессировался во всех кольцах ткани, происходящих как из МРС, так и из iSMC (Фиг. 10).
Пример 13. Сканирующая электронная микроскопия
Сканирующую электронную микроскопию проводили на факультете гистологии и эмбриологии Медицинского университета города Инсбрука, благодаря помощи Angelika Flörl и Kristian Pfaller. Для анализа 3D-культивированных клеток, полученных согласно примеру 1 и 2 (как описано в разделе 3.2.26), при помощи сканирующей электронной микроскопии кольца высвобождали из агарозных матриц, один раз промывали в пробирке Eppendorf® объемом 1,5 мл, используя 1xPBS, и затем фиксировали предварительно охлажденным (-20°С) MetOH с последующей фиксацией в течение 1 часа в 1%-ном растворе тетраоксида осмия, дегидратацией с использованием EtOH и сушкой в критической точки в установке для высушивания образцов в критической точке Bal-Tec CPD 030 (Balzers, Lichtenstein). Образцы закрепляли, используя проводящий армированный углеродными волокнами цемент Leit-C по Göcke (Piano GmbH, Wetzlar, Germany) на алюминиевых стержнях, покрытых методом напыления слоем Au/Pd 15 нм (Balzers), и исследовали на сканирующем электронном микроскопе Gemini 982 (Carl Zeiss). МРС, полученные согласно примеру 1 и подвергнутые трансдифференцировке в iSMC, как описано в примере 2, в процессе 3D-культивирования (пример 2), выглядели удлиненными и как неотъемлемая часть кольца ткани на поверхности колец ткани, которые были образованы в примере 10 (Фиг. 9). На поверхности кольца клетки выглядели неповрежденными и потенциально жизнеспособными (Фиг. 9).
Пример 14. Трансмиссионная электронная микроскопия
Трансмиссионную электронную микроскопию проводили на кольцах ткани, полученных согласно примеру 10. Для этого кольца высвобождали из агарозной матрицы и переносили в пробирку типа эппендорф объемом 1,5 мл, заполненную 1xPBS, для промывки. Затем образцы переносили в чистую пробирку Eppendorf®, заполненную 2,5%-ным глутаровым альдегидом в 0,1 М фосфатном буфере (рН 7,3), для фиксации и хранения (4°С). После фиксации по меньшей мере в течение 24 ч кольца дважды промывали фосфатным буфером и затем фиксировали в 1%-ном OsO4 в течение 45 минут. После этого кольца трижды промывали дистиллированной водой, каждый раз 15 минут. Затем кольца подвергали обезвоживанию в EtOH с возрастающей концентрацией (70, 80, 90, 100%), каждый раз в течение 30 минут, и после этого дважды инкубировали в свежей порции 100%-ного ацетона, каждый раз в течение 20 минут. Затем образцы погружали в смесь ацетон-эпон (2:1) на 150 минут, после чего инкубировали в смеси ацетон-эпон (1:2) в течение ночи. Наконец, кольца инкубировали при вращении в чистом эпоне на вращающем устройстве в течение 24 часов с заменой эпона через 8 часов. Для полимеризации эпона кольца инкубировали при 60°С в течение 24 часов. Залитые эпоном образцы подрезали, используя Ultratrim (Reichert), и ультратонкие срезы готовили, используя Ultracut S (Reichert). Ультратонкие срезы просматривали при 80 кВ с использованием трансмиссионного электронного микроскопа СМ120 ТЕМ (от Philips/FEI), оснащенного камерой с зарядовой связью (CCD) MORADA (от Olympus/SIS).
Трансмиссионная электронная микроскопия колец ткани, полученных согласно примеру 10, выявила, что клетки сформировали кавеолы вблизи своей плазматической мембраны (Фиг. 11А и В). Кроме этого, было обнаружено, что клетки в кольцах ткани имели преобладающую актиновую структуру (Фиг. С), которая в некоторых частях клеток образовывала плотно упакованные структуры, подобные плотным тельцам (Фиг. D).
Пример 15. Экспрессия поверхностных маркеров в мышиных MPC-iSMC Чтобы оценить экспрессию поверхностных маркеров в мышиных MPC-iSMC, выполняли проточную цитометрию на проточном цитометре Guava easyCyte 6НТ 2L (Merck Millipore, Darmstadt, Germany). Кратко, мышиные MPC-iSMC, полученные согласно примеру 1, использовали для методов окрашивания с применением антител на имеющейся в продаже панели для скрининга мышиных маркеров клеточной поверхности (BD Biosciences, NJ, USA). Для этого клетки суспендировали в среде для роста в концентрации 1,25*106 клеток на мл и аликвоты клеточной суспензии объемом 100 мкл смешивали со всеми первичными антителами в 96-луночных планшетах в соответствии с инструкциями производителя. Эту смесь инкубировали в течение 30 минут при 4°С, после чего в каждую лунку добавляли по 100 мкл среды для роста, планшеты центрифугировали в течение 5 минут при 300*g, удаляли супернатант, в каждую лунку добавляли по 200 мкл среды для роста, центрифугировали еще раз, удаляли супернатант и клетки ресуспендировали в 100 мкл раствора биотинилированных вторичных антител (приготовленного в соответствии с инструкциями производителя). Клетки снова инкубировали в течение 30 минут при 4°С, после чего в каждую лунку добавляли по 100 мкл среды для роста, планшеты центрифугировали в течение 5 минут при 300*g, удаляли супернатант, в каждую лунку добавляли по 200 мкл среды для роста, центрифугировали еще раз, удаляли супернатант и клетки ресуспендировали в 100 мкл конъюгированного с Alexa647 стрептавидина (приготовленного в соответствии с инструкциями производителя). Клетки снова инкубировали в течение 30 минут при 4°С, после чего в каждую лунку добавляли по 100 мкл среды для роста, планшеты центрифугировали в течение 5 минут при 300*g, удаляли супернатант, в каждую лунку добавляли 200 мкл среды для роста, центрифугировали еще раз, удаляли супернатант и клетки ресуспендировали в 200 мкл среды Хэма F10 с добавлением 10% FCS. Наконец, используя программное обеспечение Guava InCyte™ в версии 2.3, получали информацию о клеточных событиях. Гистограммы и точечные диаграммы получали на основании как минимум 5000 событий при скорости потока образца 1,8 мкл/мл. Положительное окрашивание получали путем сравнения с изотипическим контролем, установленным по меньшей мере как отрицательный на 95%, или путем сравнения с контрольными (отрицательными) клетками. Было обнаружено, что мышиные iSMC из примера 3 являются CD49e- (Фиг. 13).
Пример 16. Анализ внутриклеточного маркера методом проточной цитометрии
Кратко, МРС и MPC-iSMC, полученные согласно примеру 1, собирали, покрывая прикрепленные клетки 1х трипсином при 37°С в течение 5 минут, после открепления клетки центрифугировали при 400×g. Выполняли подсчет числа клеток и отбирали аликвоты для получения 50000 клеток/реакционная смесь, которые затем центрифугировали при 400×g, после чего ресуспендировали в растворе для фиксации и пермеабилизации Cytofix/Cytoperm от BD (BD Biosciences, Pharmingen™) и инкубировали при 4°С в течение 20 мин. После этого клетки промывали буфером для пермеабилизации/промывки от BD (разбавленным 1:10 в дистиллированной воде) (BD Biosciences, Pharmingen™) и центрифугировали. Затем клетки ресуспендировали в 1×PBS и инкубировали с конъюгатом IgG изотипический контроль-Alexa488 (Bioss Antibodies Inc., MA, USA) или конъюгатом антитело к Рах-7-Alexa488 (Bioss Antibodies Inc., MA, USA) в течение 1 ч при 4°С в темноте. После этого клетки центрифугировали, промывали буфером для пермеабилизации/промывки от BD (разбавленным 1:10 в дистиллированной воде) и после заключительной стадии центрифугирования ресуспендировали в 1xPBS. Используя программное обеспечение Guava InCyte™ в версии 2.3, получали информацию о клеточных событиях. Гистограммы получали на основании как минимум 3000 событий при скорости потока образца 1,8 мкл/мл. Содержание положительно окрашенных клеток в процентах получали путем сравнения с изотипическим контролем, установленным как отрицательный на 99%.
Пример 17. Анализ ферментативных активностей
Измерение ацетилхолинэстеразной активности
Подготовка реагентов и стандартов
Американская ассоциация общественного здравоохранения (АРНА). Фосфатный буфер, рН 7,2 (Sigma-Aldrich Co. LLC, Germany) готовили в соответствии с инструкциями производителя. Вкратце, добавляли 17 г порошкообразной смеси (монокалийфосфат 22,66 г/л и карбонат натрия 7,78 г/л) в 400 мл дистиллированной воды. После добавления 0,5 мл тритона Х-100 смесь растворяли с использованием магнитной мешалки в течение 30 минут при комнатной температуре. Конечный объем доводили до 500 мл в мерном цилиндре и использовали без дополнительного разбавления. Этот буфер хранили при 4°С до использования. Для каждого анализа AChE готовили свежий реактив Эллмана (5,5'-дитиобис-2-нитробензойная кислота, DTNB; 0,5 мМ), отвешивая 2 мг в пробирку типа эппендорф объемом 1,5 мл. Навеску растворяли в 1 мл фосфатного буфера (рН 7,2; с 0,1% тритона Х-100) путем вихревого перемешивания в течение 1-2 минут. Конечный объем доводили до 10 мл в пробирке фирмы Falcon объемом 15 мл с помощью фосфатного буфера (рН 7,2; с 0,1% тритона X-100), и хранили при 4°С до использования. Для каждого анализа AChE готовили свежий раствор ацетилхолина тиоиодида (ATI; 5,76 мМ), отвешивая 2 мг в пробирку типа эппендорф объемом 1,5 мл. Навеску растворяли в 1,2 мл дистиллированной воды путем вихревого перемешивания в течение 1-2 минут и затем хранили при 4°С до использования.
Стандартные разведения AChE готовили в фосфатном буфере (рН 7,2; с 0,1% тритона Х-100) и использовали незамедлительно. Готовый к применению концентрированный (50 ед./мл) раствор AChE (из Electrophorus electricus) приобретали у ААТ Bioquest® Inc., Sunnyvale, СА, USA. Его разбавляли в соответствии с инструкциями производителя, чтобы получить 1000 мЕд/мл AChE, который дополнительно разбавляли в соотношении 1:2 с получением 8 разных разведений в диапазоне 4-500 мЕд/мл.
Колориметрическое измерение
Чтобы измерить активность AChE, клетки, полученные путем культивирования в среде для дифференцировки скелетных мышц согласно примеру 3, обрабатывали следующим образом: среду для дифференцировки осторожно удаляли из 24-луночного планшета и сразу же добавляли 300 мкл 0,5 мМ раствора DTNB (приготовленного в фосфатном буфере, рН 7,2; с 0,1% тритона Х-100). Через 2 минуты инкубирования в темноте при комнатной температуре добавляли 50 мкл 5,76 мМ раствора ATI (приготовленного в дистиллированной воде). Содержимое реакционных смесей инкубировали в течение 60 минут при 30°С в темноте, после чего проводили измерение оптической плотности (OD) при 412 нм на микропланшетном ридере Anthos Zenyth 340rt (Biochrom Ltd., Cambridge, UK).
Для анализа стандарта фермента AChE: разведения стандарта фермента AChE (ААТ® Bioquest, Sunnyvale, USA) в диапазоне от 500 до 4 мЕд/мл готовили так, как описано выше, и 200 мкл каждого разведения стандарта фермента AChE смешивали с 300 мкл 0,5 мМ раствора DTNB и 50 мкл 5,76 мМ раствора ATI. OD этой смеси измеряли в течение 60 минут в 24-луночном планшете.
Расчет AChE в отн. мЕд./мг белка
AChE в отн. мЕд. рассчитывали на основании значений OD412, полученных при проведении в течение 60 мин колориметрического измерения клеток, посредством экстраполяции линейных стандартных кривых, полученных на основании стандартных измерений AChE (OD при 412 нм через 7 или 8 минут). Затем рассчитывали значения AChE в отн. мЕд./мг белка путем деления AChE в отн. мЕд. на мг общего белка (рассчитанного согласно примеру 19) соответствующих клеток, культивированных в среде для дифференцировки клеток скелетных мышц.
Измерение креатинкиназной активности
Чтобы измерить активность CK, клетки, полученные культивированием в среде для дифференцировки скелетных мышц согласно примеру 3, обрабатывали следующим образом: среду от клеток, выращенных в 24-луночном планшете, аккуратно удаляли и клетки промывали 1 мл солевого раствора Тирода (Sigma-Aldrich Co. LLC, МО, USA). Сразу же после этого непосредственно к клеткам добавляли 70 мкл лизирующего буфера. Лизирующий буфер готовили путем добавления 10 мкл тритона-Х-100 к 10 мл dH2O (LC-MS-Ultrachromasol, Fluka). Через 5 минут инкубирования при 4°С в темноте добавляли 400 мкл CK-NAC (CK, активированной N-ацетилцистеином) (Thermo Scientific, MA, USA), предварительно растворенной путем добавления 10 мл dH2O. Реакционную смесь анализировали с использованием микропланшетного ридера Anthos Zenith 340rt (Biochrom Ltd., Cambridge, UK) с установкой на 30°C, измеряя поглощение OD при 340 нм. Если не указано иное, для последующего анализа использовали значения OD340 нм, взятые через 21 минуту после добавления CK-NAC. CK-активность в отн. мЕд. рассчитывали в соответствии с инструкциями производителя и, если не указано иное, нормировали путем деления ее на мг общего белка соответствующих клеток.
В то время как было обнаружено, что МРС из примера 3, проанализированные в отношении AChE и CK активности согласно этому примеру, являлись AChE+ и CK+, было обнаружено, что iSMC по настоящему изобретению (пример 3) являлись AChE- и CK- (Фиг. 14).
Пример 18. Сравнение клеток по настоящему изобретению с клетками, известными в данной области техники
В работе Thurner и др., 2018, описано выделение SMDC, которые были охарактеризованы как являющиеся либо CD56+, либо CD56-. Чтобы сравнить клетки, описанные в работе Thurner и др., 2018, с клетками по настоящему изобретению, с авторами упомянутого исследования связались и попросили предоставить образцы. Авторы согласились передать клетки, выделенные согласно Thurner и др., 2018 и, таким образом, эти клетки можно было протестировать согласно примерам 3, 4, 5, 7, 8, 9, 16 и 17 по настоящему изобретению и сравнить с МРС, MSC, MPC-iSMC и MSC-iSMC, выделенными согласно примеру 1. Результаты показаны на Фиг. 15.
В работе Frudinger и др., 2018, описано выделение SMDC, которые были охарактеризованы как CD56+. Чтобы сравнить клетки, описанные в работе Frudinger и др., 2018, с клетками по настоящему изобретению, с авторами упомянутого исследования связались и попросили предоставить образцы. Авторы согласились передать клетки, выделенные согласно Frudinger и др., 2018, и, таким образом, эти клетки были протестированы согласно примерам 3, 4, 5, 7, 8, 9, 16 и 17 по настоящему изобретению и их сравнили с МРС, MSC, MPC-iSMC и MSC-iSMC, выделенными согласно примеру 1. Результаты показаны на Фиг. 15.
Пример 19. Количественное определение белка
Клетки, полученные путем культивирования в среде для дифференцировки скелетных мышц согласно примеру 3, анализировали для количественного определения общего белка в соответствии с работой Thurner и др., 2018. Для этого прикрепленные клетки сначала дважды промывали PBS, затем покрывали PBST (с 0,1% тритона Х-100) и потом инкубировали в течение 10 минут при комнатной температуре. Затем лизат ресуспендировали и переносили в пробирку Eppendorf®, быстро перемешивали вихревым способом и далее центрифугировали в течение 4 минут при 1200*g. Наконец, прозрачный супернатант переносили в чистую пробирку типа эппендорф и концентрацию белка определяли с использованием набора для анализа белков с бицинхониновой кислотой (ВСА Protein Assay Kit) от Pierce (Thermo Scientific, MA, USA) в соответствии с инструкциями производителя путем измерения OD при 540 нм, применяя микропланшетный ридер Anthos Zenyth 340rt (Biochrom Ltd., Cambridge, UK).
Ссылки
Abrahamsson, H. (2007). Gut, 56(6), 877-883.
Al-Ali, S., Blyth, P., Beatty, S., Duang, A., Parry, В., & Bissett, I.P. (2009). Journal of Anatomy, 215(2), 212-220.
Bajpai, V.K., Mistriotis, P., Loh, Y.-H., Daley, G.Q., & Andreadis, S.T. (2012). Cardiovascular Research, 96(b), 391-400.
Belkin, V.M., Belkin, A.M., & Koteliansky, V.E. (1990). The Journal of Cell Biology, 111(5 Pt 1), 2159-2170.
Bohl, J.L., Zakhem, E., & Bitar, K.N. (2017). Stem Cells Translational Medicine, 6(9), 1795-1802.
Capelli, С.C, Chancellor, M.В., Huard, J., & Qu, Z. (2002). WO 2001078754 A3. Capetanaki, Y., Milner, D.J., & Weitzer, G. (1997). Cell Structure and Function, 22(1), 103-116.
Chancellor, M.В., Huard, J., Capelli, С.C, & Qu, Z. (2001). WO 2001078754 A2.
Dash, В.C, Levi, K., Schwan, J., Luo, J., Bartulos, O., Wu, H., Qiu, C., Yi, Т., Ren, Y., Campbell, S., Rolle, M.W., & Qyang, Y. (2016). Stem Cell Reports, 7(1), 19-28.
Dominici, M., Le Blanc, K., Mueller, I., Slaper-Cortenbach, I., Marini, F., Krause, D., Deans, R., Keating, A., Prockop, D., & Horwitz, E. (2006). Cytotherapy, 8(4), 315-317.
Espagnolle, N., Guilloton, F., Deschaseaux, F., Gadelorge, M., Sensébé, L., & Bourin, P. (2014). Journal of Cellular and Molecular Medicine, 18(1), 104-114.
Frudinger, A., Kölle, D., Schwaiger, W., Pfeifer, J., Paede, J., & Halligan, S. (2010). Gut, 59(1), 55-61.
Frudinger, A., Pfeifer, J., Paede, J., Kolovetsiou-Kreiner, V., Marksteiner, R., & Halligan, S. (2015). Colorectal Disease: The Official Journal of the Association of Coloproctology of Great Britain and Ireland, 17(9), 794-801.
Frudinger, Andrea, Marksteiner, R., Pfeifer, J., Margreiter, E., Paede, J., & Thurner, M. (2018). Stem Cell Research & Therapy, 9(1), 233, 9(1), 233.
Goode, P.S., Burgio, K.L., Halli, A.D., Jones, R.W., Richter, H.E., Redden, D. Т., Baker, P.S., & Allman, R.M. (2005). Journal of the American Geriatrics Society, 53(A), 629-635.
Huard, J., Yokoyama, Т., Pruchnic, R., Qu, Z., Li, Y., Lee, J.Y., Somogyi, G. Т., de Groat, W.C, & Chancellor, M.B. (2002). Gene Therapy, 9(23), 1617-1626.
Iivanainen, A., Sainio, K., Sariola, H., & Tryggvason, K. (1995). FEBSLetters, 365(2-3), 183-188.
Jung, Y., Bauer, G., & Nolta, J.A. (2012). Stem Cells (Dayton, Ohio), 30(1), 42-47.
Krauss, R.S., Chihara, D., & Romer, A.I. (2016). Skeletal Muscle, 6.
Lecourt, S., Marolleau, J.-P., Fromigué, O., Vauchez, K., Andriamanalijaona, R., Ternaux, В., Lacassagne, M.-N., Robert, I., Boumédiene, K., Chéreau, F., Marie, P., Larghéro, J., Fiszman, M., & Vilquin, J.-T. (2010). Experimental Cell Research, 316(15), 2513-2526.
Li, Y., Wen, Y., Wang, Z., Wei, Y., Wani, P., Green, M., Swaminathan, G., Ramamurthi, A., Pera, R.R., & Chen, B. (2016). STEM CELLS Translational Medicine, 5(12), 1719.
Lu, S.-H., Lin, A. T. L., Chen, K.-K., Chiang, H. S., & Chang, L.S. (2011). Journal of Cellular and Molecular Medicine, 15(3), 587-592.
Marolleau, J.-P., Vauchez, K., & Vilquin, J.-T. (2010). EP 2206774 A1.
McHugh, K.M. (1995). Developmental Dynamics: An Official Publication of the American Association of Anatomists, 204(3), 278-290.
Meyer, I., & Richter, H.E. (2015). Women's Health (London, England), 11(2), 225-238.
Mimura, Т., Kaminishi, M., & Kamm, M.A. (2004). Digestive Surgery, 21(3), 235-241.
Niessen, P., Rensen, S., Deursen, J. van, Man, J.D., Laet, A.D., Vanderwinden, J.-M., Wedel, Т., Baker, D., Doevendans, P., Hofker, M., Gijbels, M., & Eys, G. van. (2005). Gastroenterology, 129(5), 1592-1601.
Park, W.S., Heo, S.C., Jeon, E.S., Hong, D.H., Son, Y.K., Ko, J.-H., Kim, H. K., Lee, S.Y., Kim, J.H., & Han, J. (2013). American Journal of Physiology. Cell Physiology, 305(4), C377-91.
Popescu, L.M., Gherghiceanu, M., Mandache, E., & Cretoiu, D. (2006). Journal of Cellular and Molecular Medicine, 10(4), 960-990.
Quander, C.R., Morris, M.C., Melson, J., Bienias, J.L., & Evans, D.A. (2005). The American Journal of Gastroenterology, 100(4), 905-909.
Qu-Petersen, Z., Deasy, В., Jankowski, R., Ikezawa, M., Cummins, J., Pruchnic, R., Mytinger, J., Cao, В., Gates, C., Wernig, A., & Huard, J. (2002). The Journal of Cell Biology, 157(5), 851-864.
Ramkumar, D., & Schulze, K.S. (2005). Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society, 17 Suppl 1, 22-30. Rao, S.S.C. (2004). Gastroenterology, 126(1 Suppl 1), S14-22. Rochlin, K., Yu, S., Roy, S., & Baylies, M.K. (2010). Developmental Biology, 341(1), 66-83.
Romanska, H.M., Bishop, A.E., Moscoso, G., Walsh, F.S., Spitz, L., Brereton, R. J., & Polak, J.M. (1996). Journal of Pediatric Gastroenterology and Nutrition, 22(4), 351-358.
Sanders, K.M. (2008). Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society, 20 Suppl 1, 39-53.
Sandison, M., & McCarron, J. (2015). The FASEB Journal, 29(1 Supplement), 418.8.
Skuk, D., Goulet, M., & Tremblay, J. P. (2014). Cell Transplantation, 23(1), 13-25.
Thurner, M., Asim, F., Garczarczyk-Asim, D., Janke, K., Deutsch, M., Margreiter, E., Troppmair, J., & Marksteiner, R. (2018). PLOS ONE, 13(3), e0194561.
Vaizey, C.J., Kamm. M.A., & Bartram, С.I. (1997). Lancet (London, England), 349(9052), 612-615.
van de Rijn, M., Hendrickson, M.R., & Rouse, R.V. (1994). Human Pathology, 25(8), 766-771.
van Eys, G.J., Niessen, P.M., & Rensen, S.S. (2007). Trends in Cardiovascular Medicine, 17(1), 26-30.
Wang, G., Jacquet, L., Karamariti, E., & Xu, Q. (2015). The Journal of Physiology, 593(14), 3013-3030.
Wang, J.Y., & Abbas, M.A. (2013). The Permanente Journal, 17(3), 65-73.
Wang, J., Zohar, R., & McCulloch, C.A. (2006). Experimental Cell Research, 312(3), 205-214.
Wang, Y., Han, Z., Song, Y., & Han, Z.C. (2012). Stem Cells International, 2012.
Webb, R.C. (2003). Advances in Physiology Education, 27(A), 201-206.
Worl, J., Breuer, C., & Neuhuber, W.L. (2009). Developmental Dynamics, 238(4), 864-874.
Yin, H., Price, F., & Rudnicki, M.A. (2013). Physiological Reviews, 93(1), 23-67.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способы получения происходящих из мышц клеток | 2018 |
|
RU2796929C2 |
| МЕЗЕНХИМАЛЬНЫЕ СТРОМАЛЬНЫЕ КЛЕТКИ ДЛЯ ЛЕЧЕНИЯ СИНДРОМА СЕПСИСА | 2015 |
|
RU2715866C2 |
| ПРИМЕНЕНИЕ СТРОМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ДЛЯ ЛЕЧЕНИЯ СВИЩЕЙ | 2011 |
|
RU2608641C2 |
| ПРИМЕНЕНИЕ СТРОМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ДЛЯ ЛЕЧЕНИЯ СВИЩЕЙ | 2006 |
|
RU2435846C2 |
| ПРИМЕНЕНИЕ СТРОМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ДЛЯ ЛЕЧЕНИЯ СВИЩЕЙ | 2016 |
|
RU2744977C2 |
| МОДУЛЯЦИЯ hUTC ПРОВОСПАЛИТЕЛЬНЫХ МЕДИАТОРОВ ЛЕГОЧНЫХ И ПУЛЬМОНАЛЬНЫХ ЗАБОЛЕВАНИЙ И РАССТРОЙСТВ | 2013 |
|
RU2668389C2 |
| ПОПУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК ШЕЙКИ МАТКИ ЧЕЛОВЕКА И ЕЕ ПРИМЕНЕНИЕ | 2014 |
|
RU2679500C2 |
| АМНИОТИЧЕСКИЕ АДГЕЗИВНЫЕ КЛЕТКИ | 2009 |
|
RU2562154C2 |
| ПРОТИВОРАКОВАЯ ТАРГЕТНАЯ ИММУНОТЕРАПИЯ С ПРИМЕНЕНИЕМ IL-12 | 2015 |
|
RU2689160C2 |
| СПОСОБ ПОЛУЧЕНИЯ НЕДИФФЕРЕНЦИРОВАННОЙ КЛЕТКИ | 1996 |
|
RU2215539C2 |
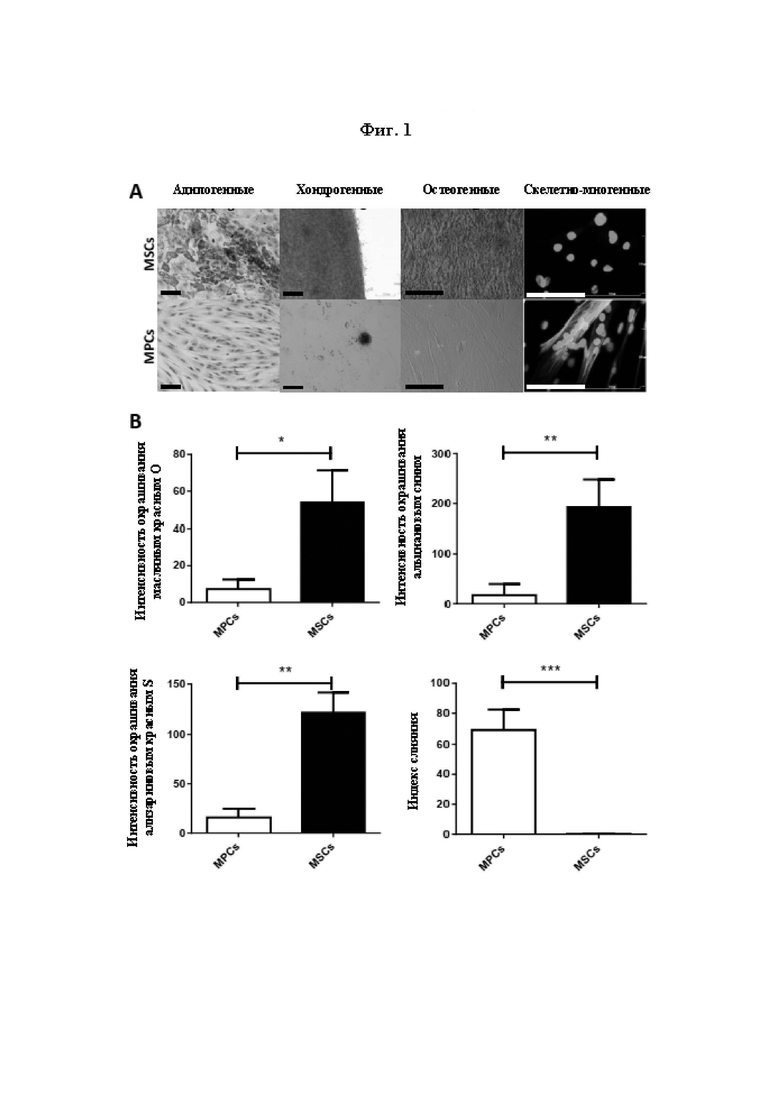
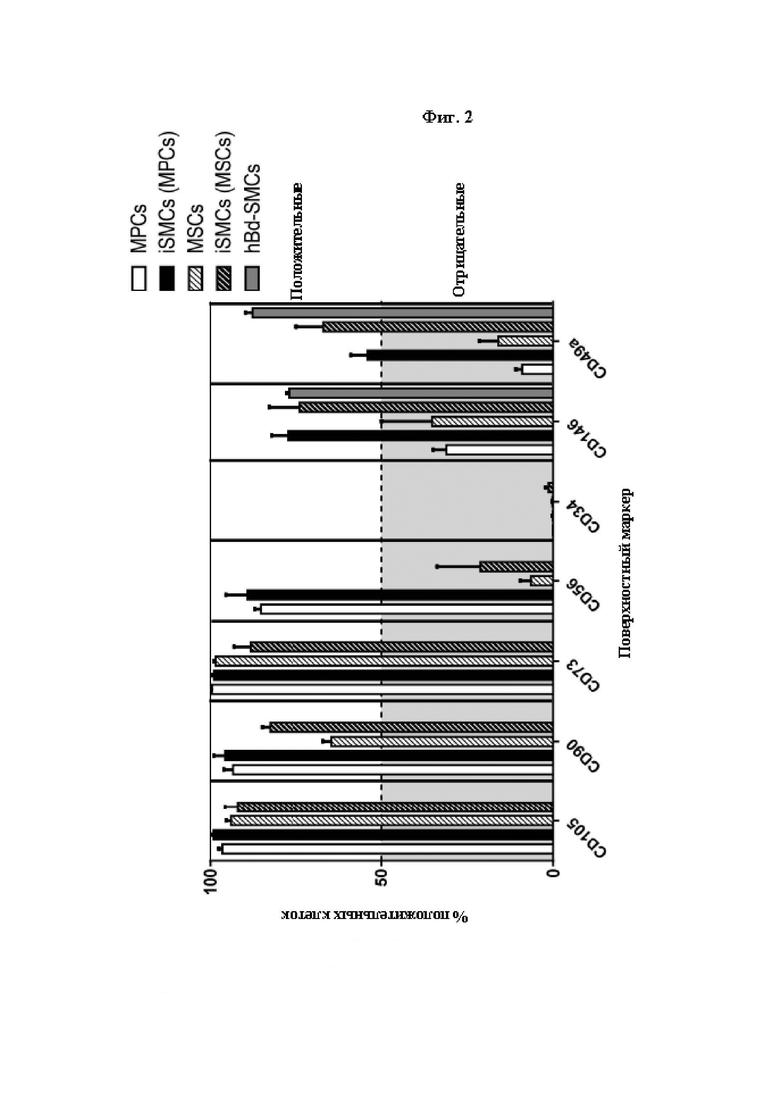
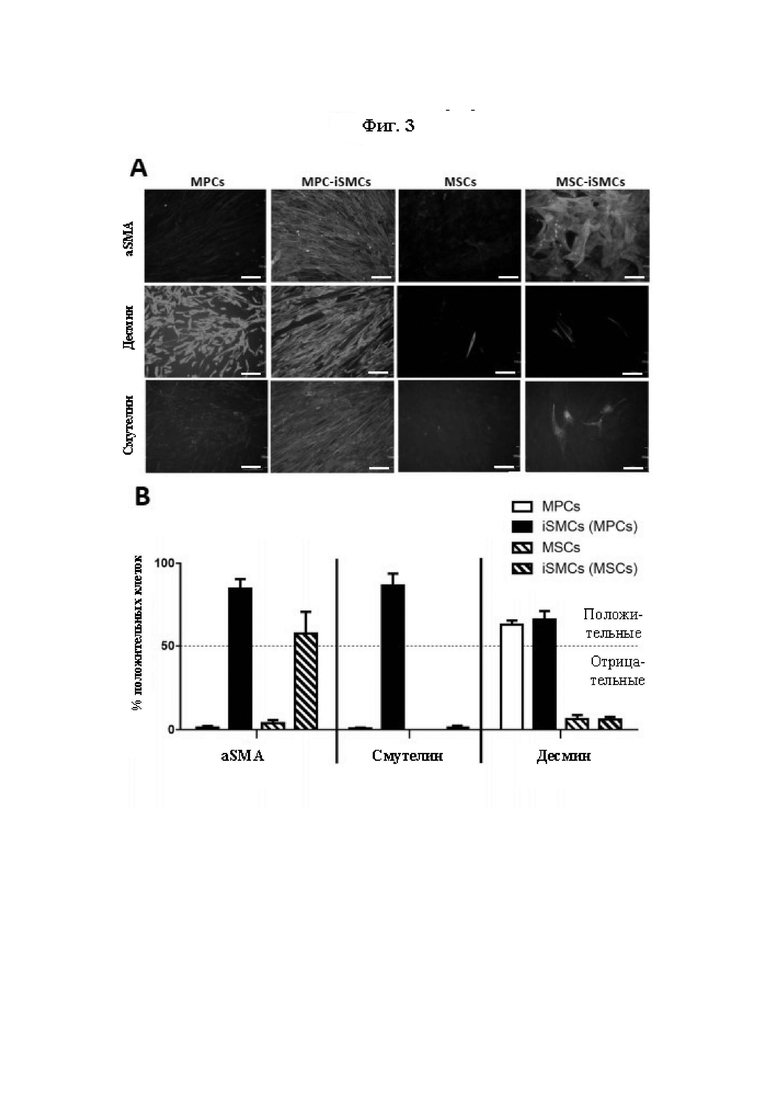
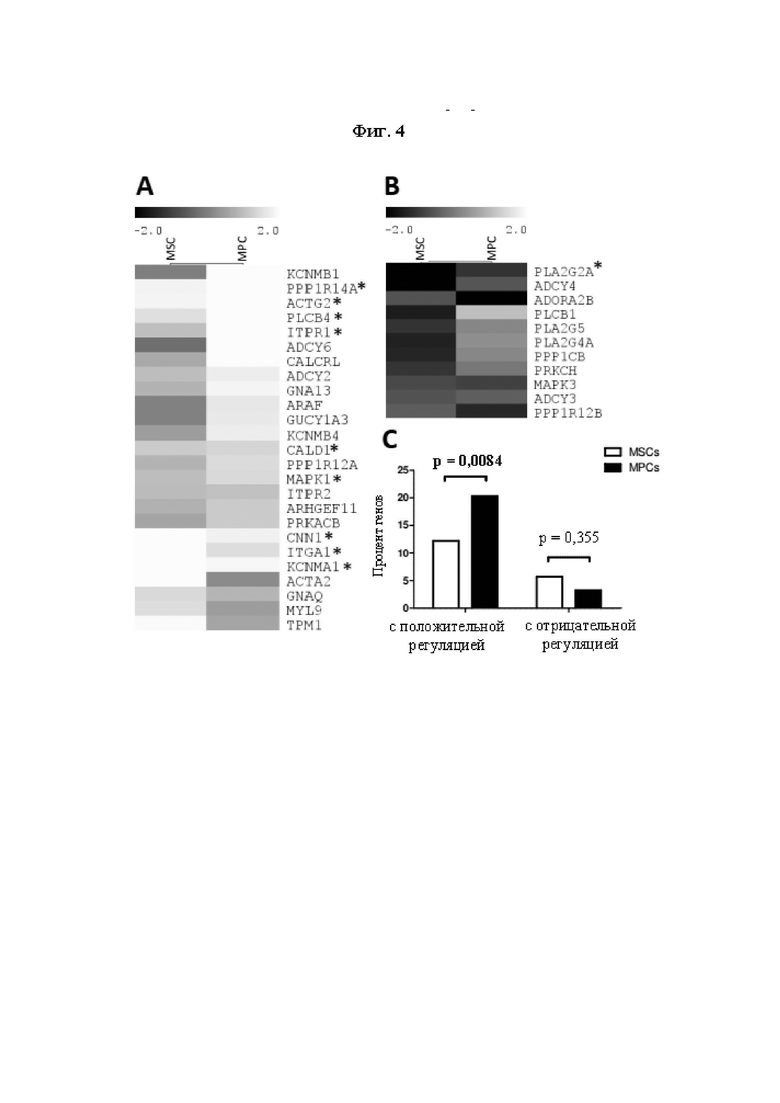
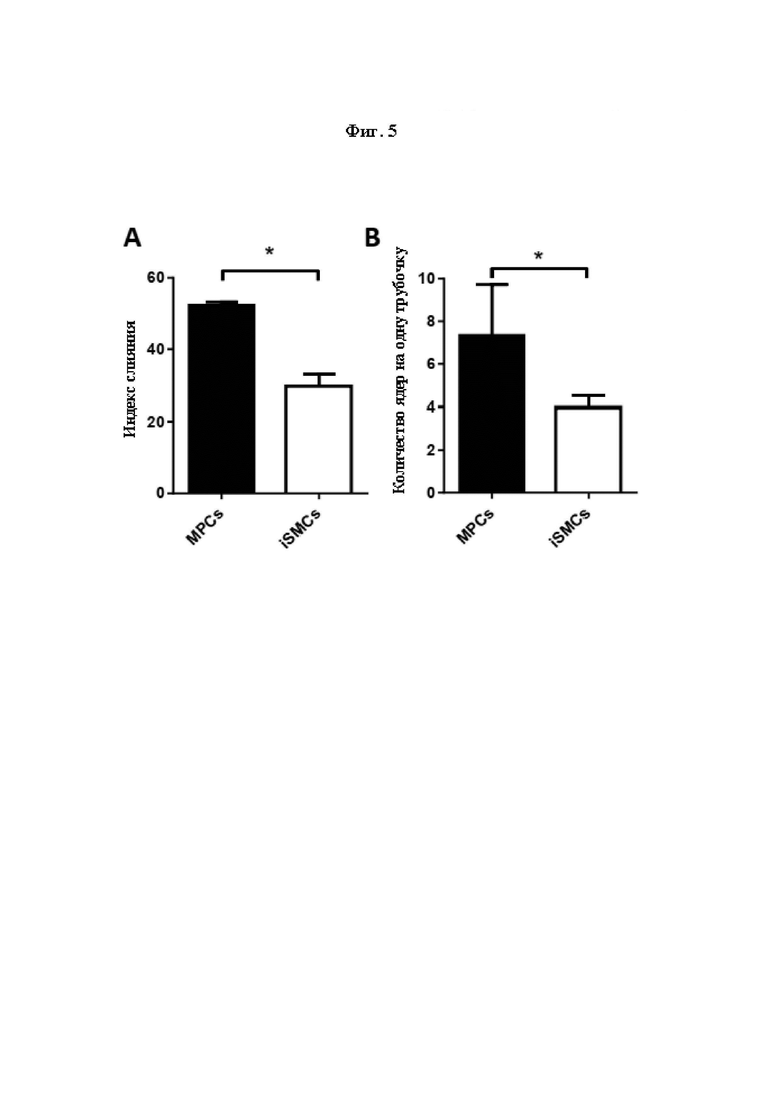
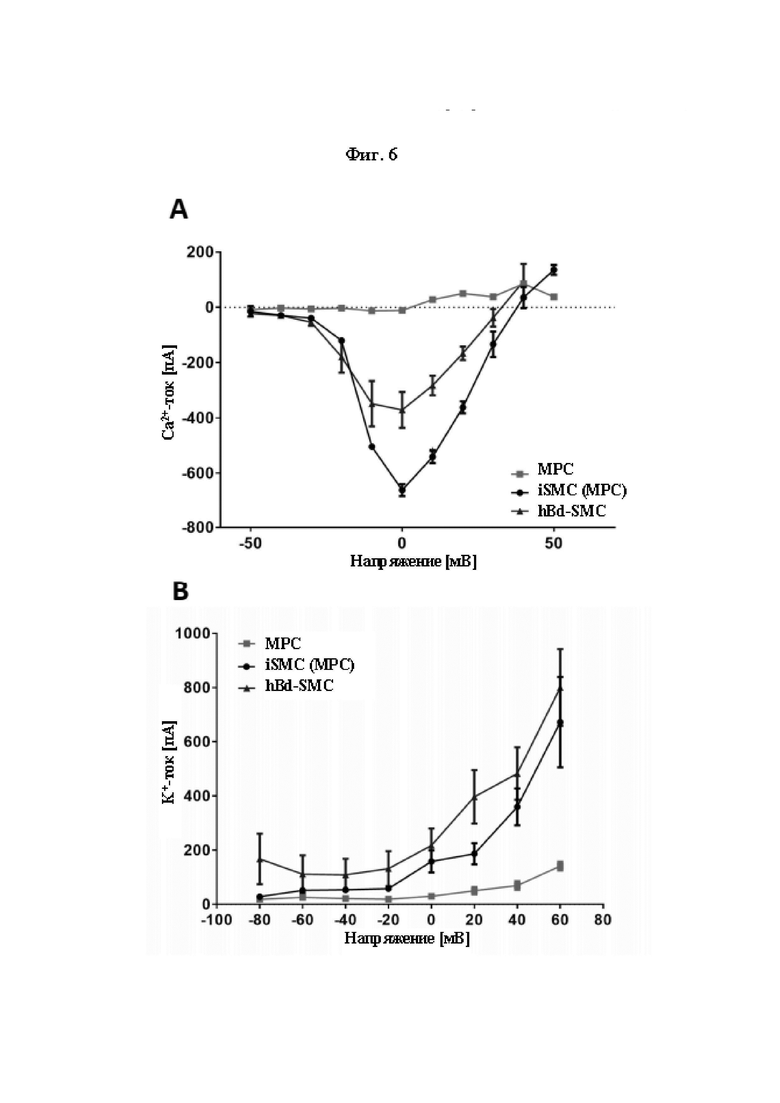
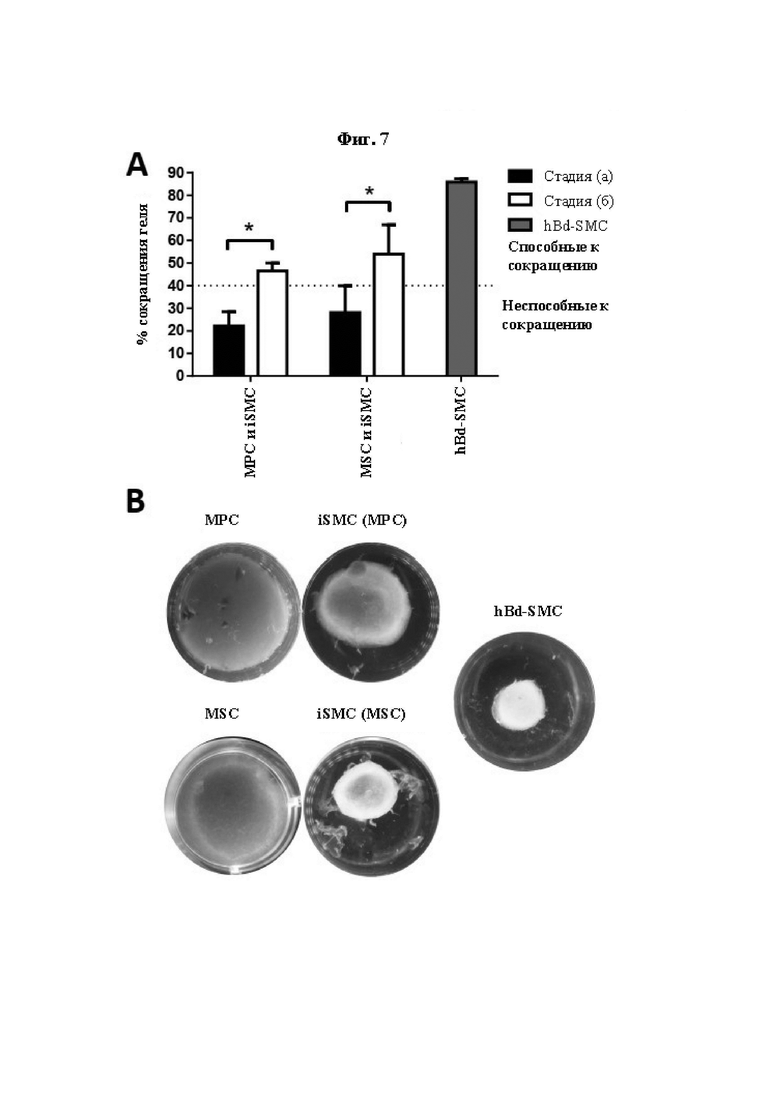
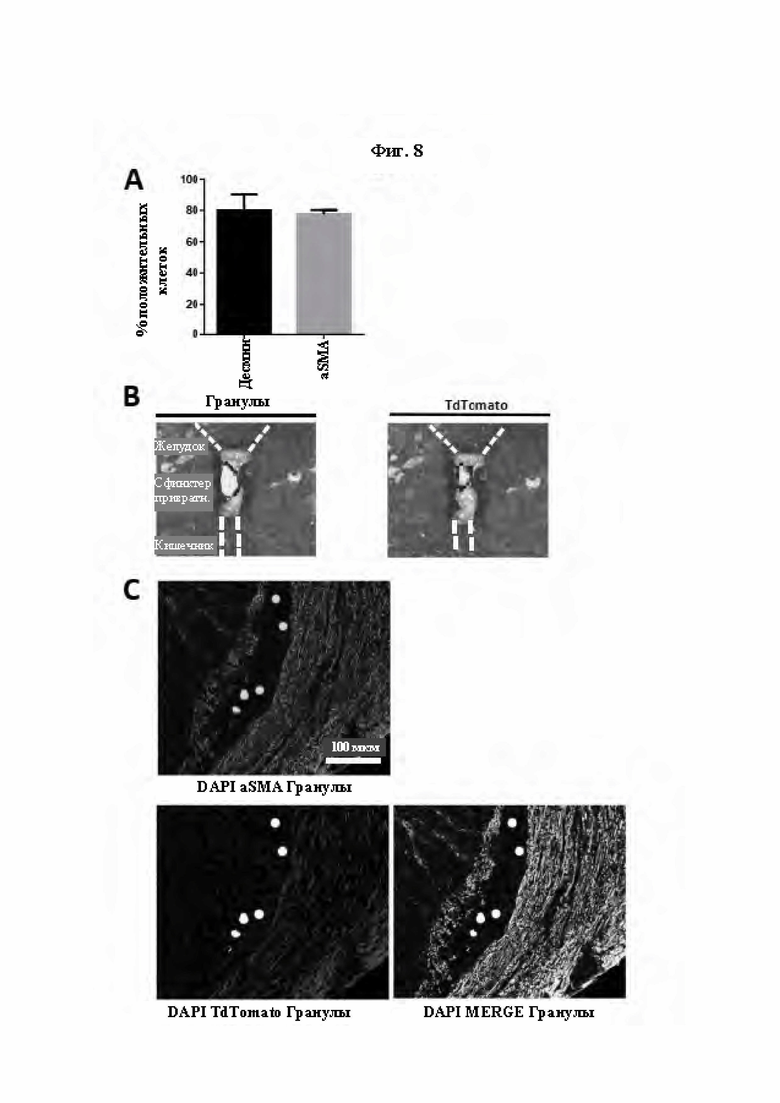
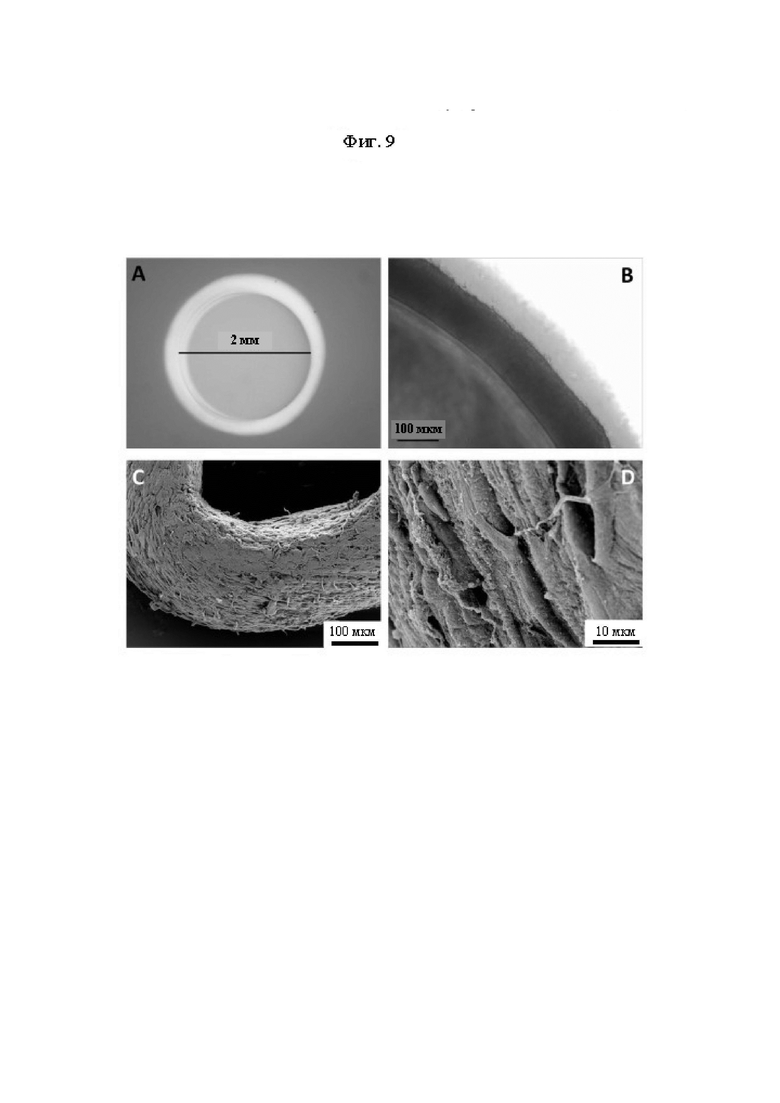
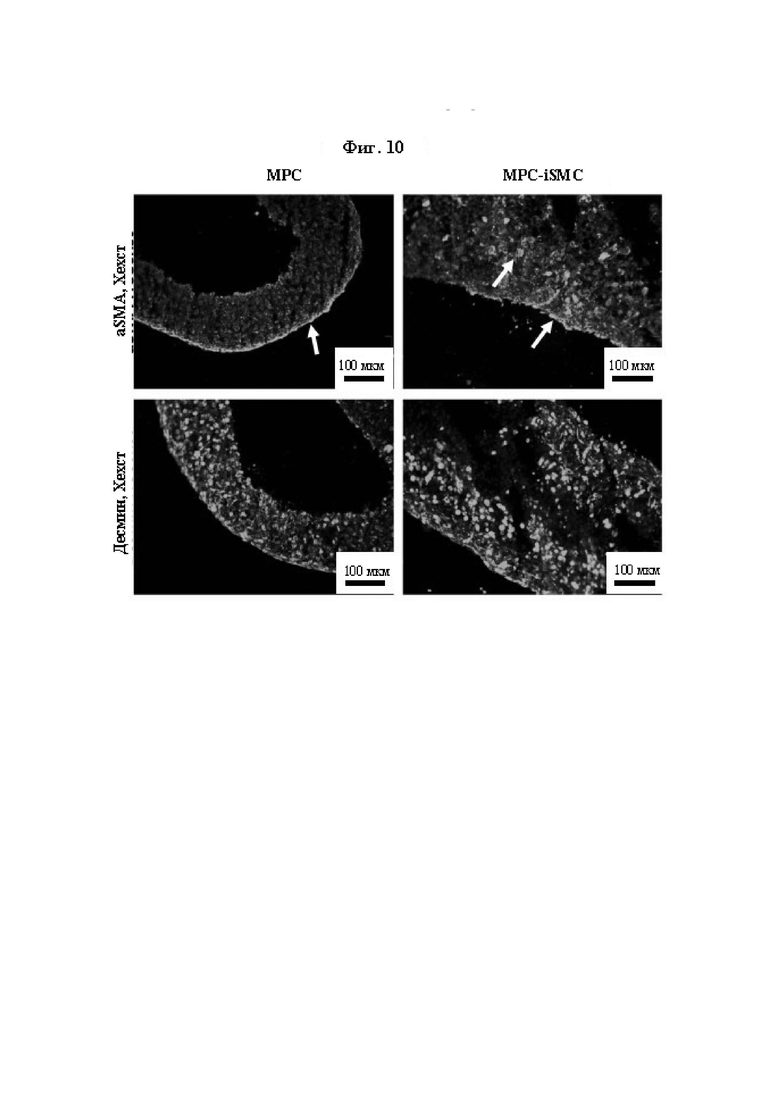
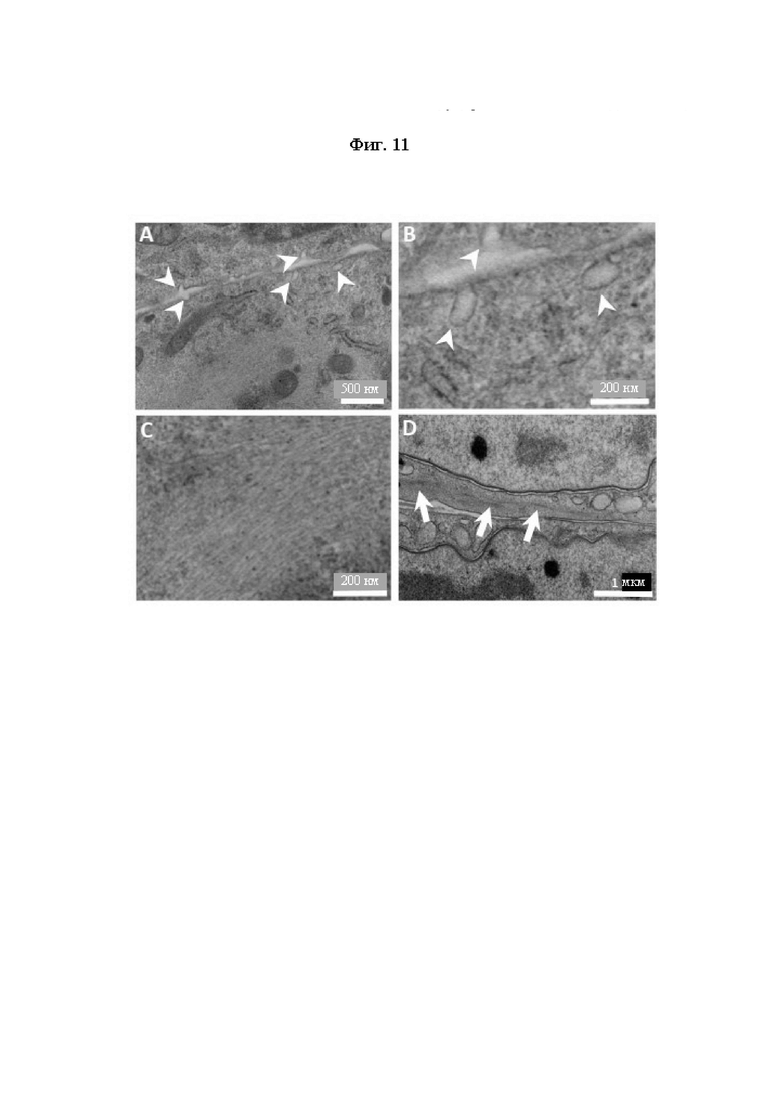
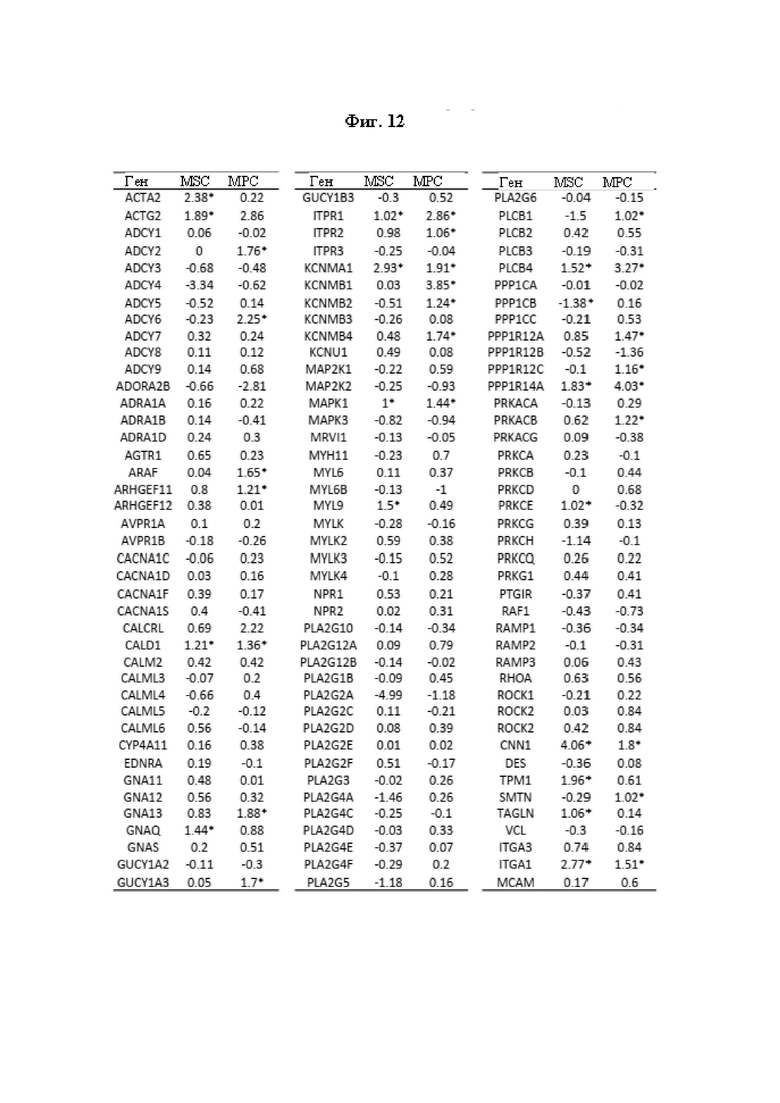
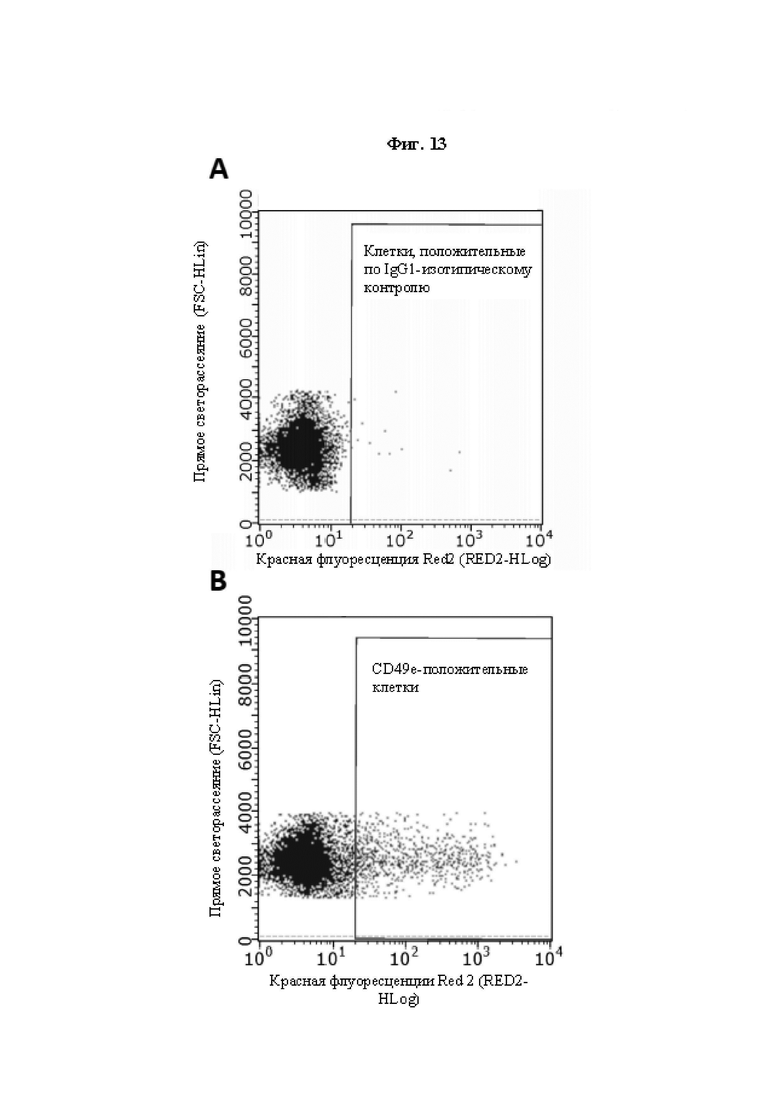
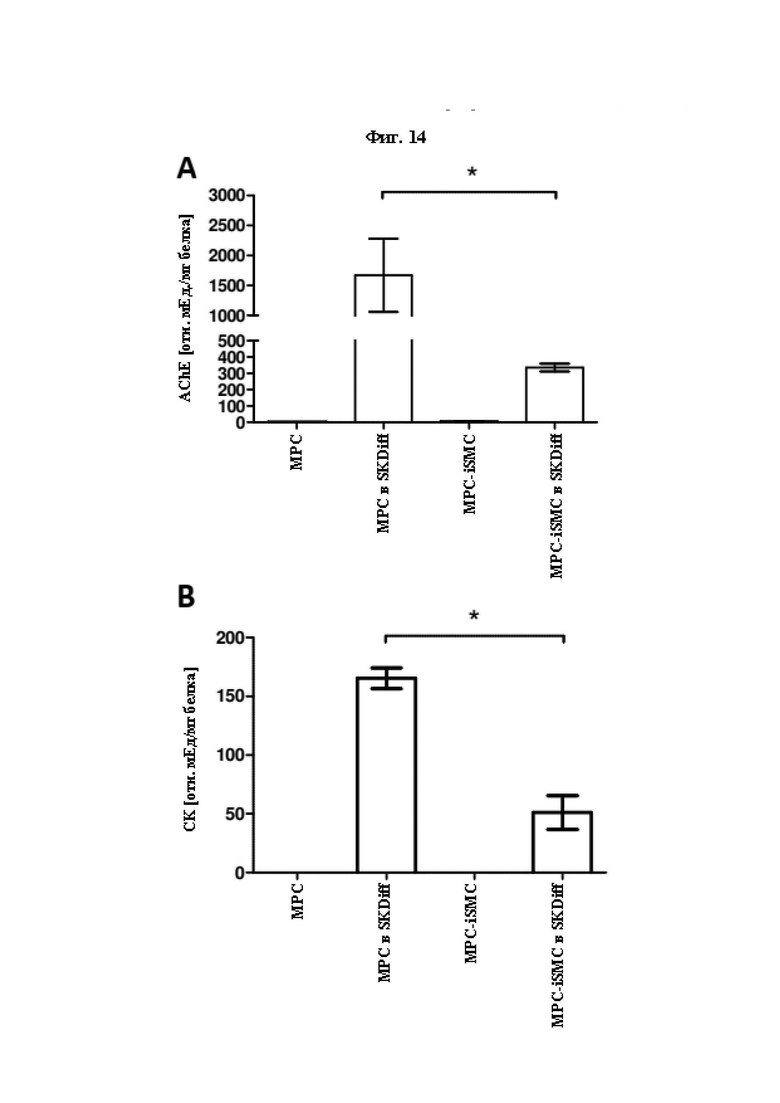
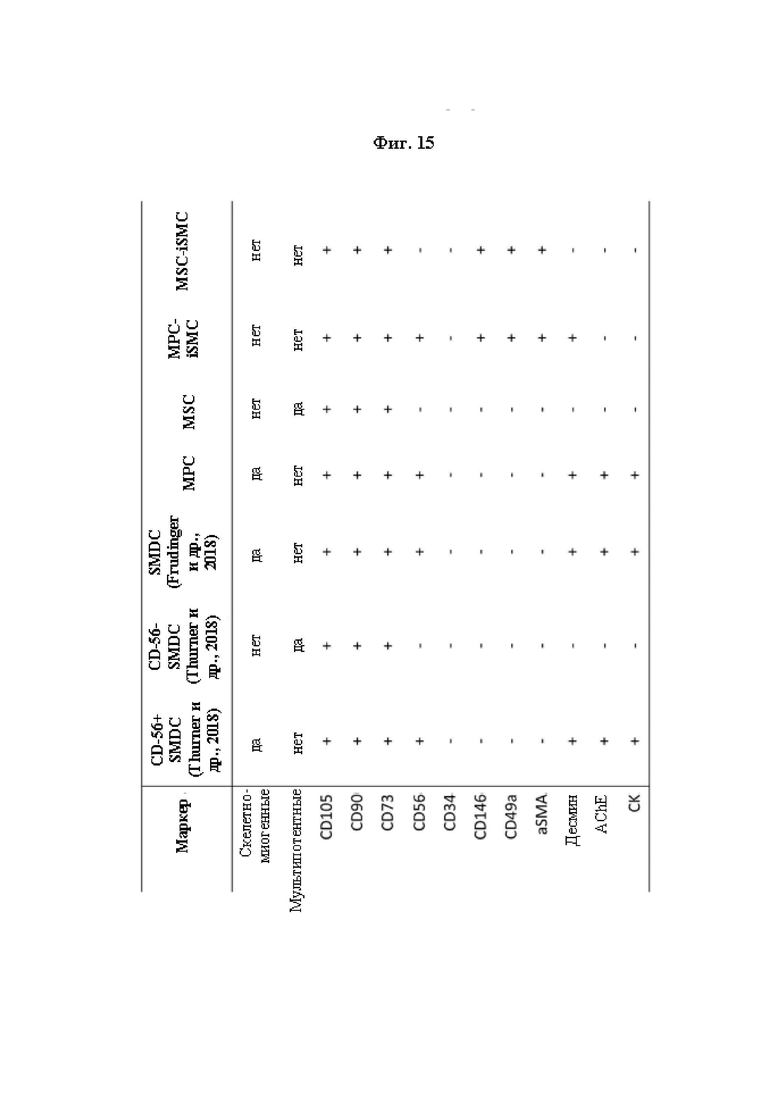
Изобретение относится к биотехнологии и представляет собой способ in vitro или ex vivo получения индуцированных клеток гладких мышц (iSMC), характеризующихся положительной экспрессией aSMA (актин-альфа гладких мышц), CD49a и CD146 и тем, что они являются некомпетентными в отношении слияния. Способ включает следующие стадии: (а) выделение клеток, происходящих из скелетных мышц, из ткани скелетных мышц, полученной от субъекта; (б) трансдифференцировка клеток, происходящих из скелетных мышц. Настоящее изобретение также относится к индуцированной клетке гладких мышц (варианты), ее применению для скрининга лекарственных средств и in vitro или ex vivo применению клеток, происходящих из скелетных мышц, для получения iSMC. Настоящее изобретение обеспечивает клетки, которые являются безопасными и эффективными для применения в регенерации ткани гладких мышц. 6 н. и 14 з.п. ф-лы, 15 ил., 19 пр.
1. Способ in vitro или ex vivo получения индуцированных клеток гладких мышц (iSMC), характеризующихся положительной экспрессией aSMA (актин-альфа гладких мышц), CD49a и CD146 и тем, что они являются некомпетентными в отношении слияния, включающий стадии:
(а) выделения клеток, происходящих из скелетных мышц, из ткани скелетных мышц, полученной от субъекта;
(б) трансдифференцировки клеток, происходящих из скелетных мышц, путем культивирования данных клеток в среде, содержащей TGF-бета (трансформирующий ростовой фактор-бета) и гепарин, с получением iSMC,
где клетки, происходящие из скелетных мышц, представляют собой миогенные клетки-предшественники (MPC), характеризующиеся положительной экспрессией CD56 и десмина и отрицательной экспрессией CD34; или где клетки, происходящие из скелетных мышц, представляют собой мезенхимальные стромальные клетки (MSC), характеризующиеся положительной экспрессией CD105, CD73 и отрицательной экспрессией CD34 и CD56.
2. Способ по п. 1, где среда на стадии (б) содержит TGFb1, TGFb2 и/или TGFb3, более предпочтительно TGFb1 и/или TGFb3, наиболее предпочтительно TGFb1.
3. Способ по п. 1 или 2, где iSMC, полученные на стадии (б), являются некомпетентными в отношении слияния и характеризуются положительной экспрессией aSMA, CD49a и CD146.
4. Способ по любому из пп. 1-3, где iSMC, полученные из MPC на стадии (б), характеризуются положительной экспрессией aSMA, CD49a, десмина, CD56 и CD146 и отрицательной экспрессией CD34; и где iSMC, полученные из MSC на стадии (б), характеризуются положительной экспрессией aSMA, CD49a и CD146 и отрицательной экспрессией CD56.
5. Способ по любому из пп. 1-4, где после стадии (а) выполняют стадию (а1), включающую пролиферацию клеток, происходящих из скелетных мышц, предпочтительно с получением 20-40 × 106 клеток или 50 × 106 клеток.
6. Способ по любому из пп. 1-5, где стадию (б) проводят в течение одних-шести суток, предпочтительно в течение трех-шести суток.
7. Индуцированная клетка гладких мышц (iSMC) для регенерации ткани гладких мыщц, полученная способом по любому из пп. 1-6, где iSMC, полученная на стадии (б), является некомпетентной в отношении слияния и характеризуется положительной экспрессией aSMA, CD49a и CD146.
8. Индуцированная клетка гладких мышц (iSMC) для регенерации ткани гладких мыщц, полученная из MPC, характеризующаяся положительной экспрессией aSMA, десмина, CD56, CD49a и CD146, отрицательной экспрессией CD34 и AСhE (ацетилхолинэстеразы), и где iSMC дополнительно характеризуется отрицательной экспрессией CD49е и тем, что она является некомпетентной в отношении слияния.
9. Индуцированная клетка гладких мышц (iSMC) для регенерации ткани гладких мыщц, полученная из MSC, характеризующаяся положительной экспрессией aSMA, CD49a и CD146, отрицательной экспрессией CD56 и AСhE, и где iSMC дополнительно характеризуется отрицательной экспрессией CD49е и тем, что она является некомпетентной в отношении слияния.
10. Индуцированная клетка гладких мышц (iSMC) по любому из пп. 7-9, где iSMC экспрессирует функциональные кальциевые и/или калиевые каналы.
11. Индуцированная клетка гладких мышц (iSMC) по любому из пп. 7-10 для применения в лечении заболевания или расстройства, связанного с дефектами гладких мышц.
12. Индуцированная клетка гладких мышц для применения по п. 11, где указанное заболевание или расстройство выбрано из группы, состоящей из анального недержания, недержания мочи, рефлюксной болезни, гастропареза, гиперактивного и малоактивного мочевого пузыря, в частности недержания кала, более конкретно пассивного недержания кала, и/или где дефект гладких мышц представляет собой дефект мышцы сфинктера.
13. Индуцированная клетка гладких мышц по любому из пп. 7-10 для применения в инжиниринге тканей гладких мышц или клеточной терапии с использованием клеток гладких мышц.
14. In vitro или ex vivo применение клеток, происходящих из скелетных мышц, для получения индуцированных клеток гладких мышц (iSMC) по любому из пп. 7-10.
15. In vitro или ex vivo применение клеток, происходящих из скелетных мышц, по п. 14, где клетки, происходящие из скелетных мышц, представляют собой миогенные клетки-предшественники (MPC), характеризующиеся положительной экспрессией CD56 и десмина и отрицательной экспрессией CD34; или где клетки, происходящие из скелетных мышц, представляют собой мезенхимальные стромальные клетки (MSC), характеризующиеся положительной экспрессией CD105, CD73, CD90 и отрицательной экспрессией CD34 и CD56.
16. In vitro применение индуцированных клеток гладких мышц по любому из пп. 7-10 для скрининга лекарственных средств.
17. Способ по любому из пп. 1-6, где клетки, происходящие из скелетных мышц, на стадии (а) представляют собой олигопотентные MPC, мультипотентные MSC или MSC, характеризующиеся отрицательной экспрессией десмина и/или положительной экспрессией CD90.
18. Способ по любому из пп. 1-6 или 17, где стадию (б) проводят в среде для культивирования клеток, содержащей 1-10 мкг/мл TGFb1 и 10-30 мкг/мл гепарина или 1-6 Ед/мл гепарина.
19. Способ по любому из пп. 1-6 или 17-18, где iSMC, полученные из MPC на стадии (б), дополнительно характеризуются положительной экспрессией смутелина и/или отрицательной экспрессией CK, или где iSMC, полученные из MSC на стадии (б), дополнительно характеризуются отрицательной экспрессией десмина и/или CD34.
20. Способ по любому из пп. 1-6 или 17-19, где iSMC, полученные на стадии (б), являются сократительными in vitro.
| LECOURT S | |||
| et al.: "Characterization of distinct mesenchymal-like cell populations from human skeletal muscle in situ and in vitro", EXPERIMENTAL CELL RESEARCH, ELSEVIER, AMSTERDAM, NL, vol | |||
| Способ амидирования жидких сульфохлоридов ароматического ряда | 1921 |
|
SU316A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Предохранитель для химических огнетушителей | 1925 |
|
SU2513A1 |
| MARCO THURNER et al.: "Development of an in vitro potency assay for human skeletal muscle derived cells, PLOS one, 2018, v | |||
Авторы
Даты
2024-03-25—Публикация
2020-03-23—Подача