Изобретение относится к медицине, а именно к стоматологии, и касается лекарственных средств для восстановления тканей пародонта и устранения послеоперационной ретракции тканей альвеолярных отростков при проведении пародонтологических и имплантологических вмешательств.
Для восстановления тканей пародонта (обобщающее название зубов и околозубных тканей, таких как десна, альвеолярные отростки челюсти, периодонт) используют биотрансплантат, представляющий собой препарат, состоящий из аутологичных фибробластов слизистой оболочки полости рта (или аллогенных фибробластов или фибробластподобных клеток) человека, а также композицию, состоящую из измельченной матрицы кожи человека (или любой другой фармацевтически приемлемой биосовместимой, биодеградируемой матрицы, которая может представлять собой коллагеновые микросферы или частицы животного или человеческого происхождения, в том числе препараты гиалуроновой кислоты) и аутологичных фибробластов слизистой оболочки полости рта (или аллогенных фибробластов или фибробластподобных клеток) человека. Успехи современной эстетической стоматологии во многом определяются научной разработкой и внедрением в практику новых технологий, которые существенно меняют традиционные представления о возможностях лечения. Одним из наиболее перспективных направлений научных поисков, безусловно, являются клеточные технологии, основанные на использовании отдельных клеток для восстановления тканей при различных патологиях. Проблема лечения воспалительных заболеваний пародонта в настоящее время актуальна во всем мире. По данным ВОЗ, распространенность этих заболеваний достигает 90-95% у взрослого населения и 80-83% у подростков, причем с преобладанием деструктивных форм. Поражение периодонта (плотная соединительная ткань, окружающая корень зуба), является одной из главных причин потери зубов у людей среднего возраста и старше и, по-прежнему, остается актуальной проблема разработки методов лечения данной патологии, которые на сегодня ограничены только хирургическими, причем далеко не во всех случаях эффективными методами [Грудянов А.И., Ерохин А.И., Хирургические методы лечения заболеваний пародонта. - М., 2006]. Сами по себе хирургические вмешательства на пародонте не могут радикально решить проблему эффективного купирования патологического процесса, восстановления утраченной костной ткани и адекватных анатомических взаимоотношений тканевых структур пародонта и зуба.
Для восстановления тканей пародонта и устранения послеоперационной ретракции тканей альвеолярных отростков при проведении пародонтологических и имплантологических вмешательств перспективным представляется применение клеточных культур фибробластов и продуцируемых ими биологически активных веществ [Hou L.T., Tsai A.Y., Liu C.M., Feng F. Autologous transplantation of gingival fibroblast-like cells and a hydroxyapatyte complex graft in the treatment of periodontal osseous defects: cell cultivation and long-term report of cases. //Cell Transplant. 2003. - 12(7). - P. 787-797]. Особое внимание именно фибробластам уделяется потому, что они представляют собой клетки мезенхимального происхождения, являются основным клеточным компонентом соединительной ткани, продуцируют проколлаген, фибронектин, гликозаминогликаны, проэластин, ферменты, ростовые факторы, которые, превращаясь в соответствующие волокна, служат волоконным каркасом для соединительной ткани, а фибронектин и гликозаминогликаны формируют экстрацеллюлярный матрикс. Наряду с вышеуказанными веществами фибробласты продуцируют ряд ферментов и ряд белков, играющих чрезвычайно важную роль в регуляции местных гомеостатических процессов и межклеточных взаимодействий [Степанова И.И. Применение фибробастов в стоматологии и имплантологии. Клеточные технологии в биологии и медицине № 3, стр.165-168, 2007]. Хороший клинический эффект от применения аутологичных фибробластов обусловлен их высокой терапевтической активностью: стимуляцией белкового синтеза, выделением факторов роста, ускорением процессов ангиогенеза, пролиферацией эндотелиоцитов капилляров и, соответственно, усилением регенерации тканей пораженного пародонта [McGuire M.C. and Nunn M.E. Evalution of the safety and efficacy of periodontal applications of a living tissue-engineereg human fibroblast-derived dermal substitute.I. Comparison to the gingival autograft: a randomized controlled pilot study, J. Periodontal, vol. 76, n.6, p.867-880, 2005]. В настоящее время в медицине широко используют различные имплантационные препараты, созданные на основе компонентов, синтезируемых фибробластами [Hruza G.J. Arch. Facial Plast. Surg. Vol 6, Nov/Dec., 2004].
Известно применение биологического протеза на основе коллагена для устранения дефекта костной ткани, где в качестве основы используют гемостатическую коллагеновую губку, на которую наносят аутологичный костный мозг [Патент РФ № 2055535, МПК А61В 17/56].
Известно использование остеотропной мембраны на основе коллагена и лекарственных средств для лечения заболеваний пародонта [Патент РФ № 32159101, МПК А61К 6/097].
Известна композиция для лечения воспалительных заболеваний пародонта на основе клеточных культур фибробластов в виде штамма диплоидных клеток легкого эмбриона человека ЛЭЧ-4 [Патент РФ № 2210352, МПК А61К 6/00].
Известен способ лечения заболеваний пародонта с помощью введения суспензии мезенхимальных стволовых и хондропрогениторных клеток, полученных из фетальной ткани на разных сроках гестации или их комбинации [Патент РФ 2265445, МПК А61К 35/32].
Недостатками этих способов является сложность подготовки трансплантата костного мозга, использование клеток полученных из фетальной ткани, что не исключает риск вирусной контаминации трансплантата, иммунное отторжение аллотрансплантата.
Известно использование клеточной культуры эмбриональных фибробластов человека М-22 при хирургическом лечении воспалительных заболеваний пародонта [Ерохин А.И. Использование культуры фибробластов человека при хирургическом лечении воспалительных заболеваний пародонта. Диссертация на соискание ученой степени канд. мед. наук. - М., 2002]. Автором исследована жизнеспособность аллофибробастов культивированных с различными видами остеопластических материалов.
Основным недостатком аллогенных биотрансплантатов является неустойчивость терапевтического эффекта и использование клеток из фетального материала.
Известен способ лечения пародонтита с помощью биотрансплантата, представляющего собой суспензию аутологичных фибробластов [Патент РФ № 2281776, МПК А61К 35/36].
Известен способ коррещии дефектов мягких тканей посредством одновременного введения аутологичных фибробластов с различными формами коллагена и гликозаминогликанов [Патент США № 6878383, МПК A61F 13/00].
Недостатком данного изобретения является использование коллагена любого типа и гликозаминогликанов, поперечно-сшитых с помощью, например, глютаральдегида. При биодеградации экзогеного коллагена может высвобождаться мономерный глютаральдегид в ткани и жидкости организма, который может оказывать цитотоксическое действие на фибробласты и вызывать развитие непредвиденных побочных эффектов.
Задачей, на решение которой направлено предлагаемое изобретение, является создание эффективного биотрансплантата, способа его получения и способа лечения заболеваний пародонта.
Предложена группа изобретений, объединенных общим изобретательским замыслом.
Для решения поставленной задачи биотрансплантат для лечения заболеваний пародонта характеризуется тем, что он представляет собой суспензию, содержащую культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в 0,9% растворе хлорида натрия в концентрации 2,0-10,0×106 в 1 мл биотрансплантата, интегрированных на фармацевтически приемлемом биосовместимом биодеградируемом носителе, выбранном из ряда: бесклеточная матрица, препарат гиалуроновой кислоты, бесклеточная матрица и препарат гиалуроновой кислоты.
В частном варианте объемное соотношение суспензии культуры клеток и бесклеточной матрицы или препарата гиалуроновой кислоты составляет 5:1 соответственно.
В другом частном варианте объемное соотношение суспензии культуры клеток, бесклеточной матрицы и препарата гиалуроновой кислоты составляет 4:1:1 соответственно.
В другом частном варианте биотрансплантат содержит суспензию культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток, выделенных из кожи, или слизистой оболочки, или костного мозга, или жировой ткани, или пульпы зуба.
В другом частном варианте в качестве фармацевтически приемлемого биосовместимого биодеградируемого носителя используют измельченную до размера 100-200 мкм бесклеточную матрицу «Сайметра».
Для решения поставленной задачи способ получения биотрансплантата для лечения заболеваний пародонта характеризуется тем, что биоптат промывают растворами антибиотиков и антимикотика в среде ДМЕМ и переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки, 40 мкг/мл гентамицина и коллагеназы II типа, инкубацию биоптата проводят при 37°С 16-17 часов, полученный клеточный осадок ресуспендируют в среде для культивирования ДМЕМ, 10-20% ЭТС, 40 мкг/мл гентамицина, высевают и культивируют в течение 2-3 недель до получения первичной культуры, затем клетки трипсинизируют и культивируют, после чего среду с 10-20% ЭТС заменяют на среду без сыворотки или на среду ДМЕМ 90% и 10% аутологичной сыворотки и выдерживают 8-14 часов при 37°С, после культивирования клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия в концентрации 2,0-10,0×106 в 1 мл биотрансплантата, затем суспензию клеток интегрируют на фармацевтически приемлемом биосовместимом биодеградируемом носителе, выбранном из ряда: бесклеточная матрица, препарат гиалуроновой кислоты, бесклеточная матрица и препарат гиалуроновой кислоты.
В частном варианте суспензию клеток культивируют для адгезии фибробластподобных клеток 1-2 часа при 37°С.
Для решения поставленной задачи способ лечения заболеваний пародонта характеризуется тем, что на слизистой оболочке десны в области дефекта предварительно делают надрезы, затем в область дефекта инъекционным путем вводят двукратно или троекратно с интервалом 1-4 недели биотрансплантат, представляющий собой суспензию, содержащую культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в 0,9% растворе хлорида натрия в концентрации 2,0-10,0×106 клеток в 1 мл биотрансплантата, или суспензию, содержащую культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в 0,9% растворе хлорида натрия в концентрации 2,0-10,0×106 клеток в 1 мл биотрансплантата, интегрированных на фармацевтически приемлемом биосовместимом биодеградируемом носителе, выбранном из ряда: бесклеточная матрица, препарат гиалуроновой кислоты, бесклеточная матрица и препарат гиалуроновой кислоты в количестве 3,6-60×106 клеток на курс лечения.
В частном варианте на слизистой оболочке десны в области дефекта делают надрезы за одну неделю до введения биотрансплантата.
В другом частном варианте на слизистой оболочке десны в области дефекта делают крестообразные надрезы.
Изобретение иллюстрируется следующими чертежами.
На Фиг.1 представлены фибробластподобные клетки в культуре. Фазово-контрастная микроскопия ×200.
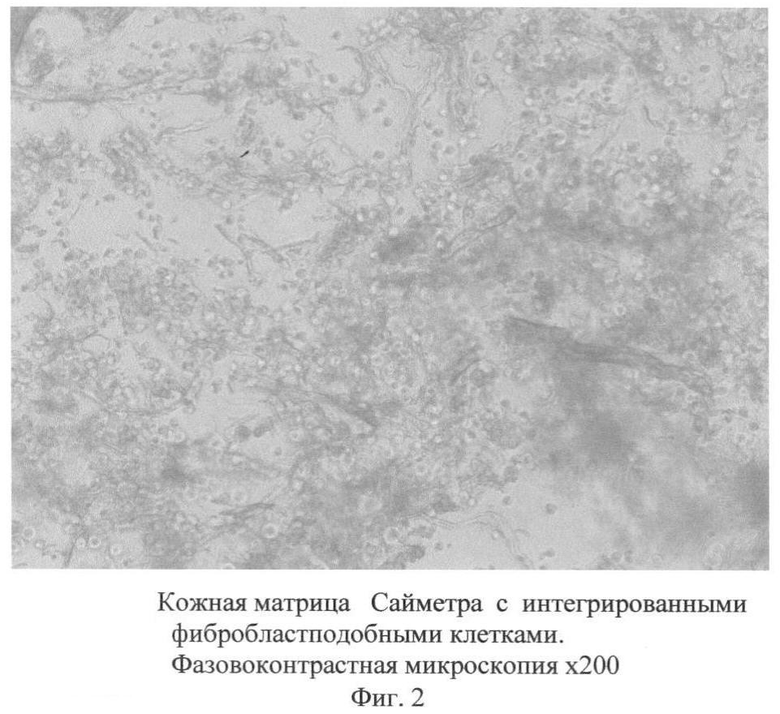
На Фиг.2 представлена кожная матрица «Сайметра» с интегрированными фибробластподобными клетками. Фазово-контрастная микроскопия ×200.
Создание условий, способствующих повышению жизнеспособности инъецируемых клеток, позволяет повысить эффективность действия биотрансплантатов, снизить количество инъецируемых клеток и эффективно оперировать количеством живых инъецируемых клеток в зависимости от размеров повреждения. После трансплантации биотрансплантата фибробласты или фибробластподобные клетки постепенно мигрируют с матрицы и благодаря своим синтетическим функциям (синтез волокон, гликозаминогликанов, ферментов, цитокинов, факторов роста) способствуют восстановлению поврежденных тканей.
Использование в биотрансплантате матрицы «Сайметра» без фибробластоподобных клеток или любой другой фармацевтически приемлемой биодеградируемой биосовместимой матрицы в качестве носителя позволяет повысить жизнеспособность инъецируемых фибробластов, оптимизировать их доставку в место дефекта и обеспечить синтез физиологически необходимого уровня компонентов межклеточного матрикса.
Для повышения жизнеспособности клеток большую роль играет создание такого биотрансплантата, который максимально бы соответствовал физиологическим условиям, в которых находится фибробласт, а именно - густая сеть межклеточного матрикса, состоящего преимущественно из волокон и основного вещества - гликозаминогликанов, в частности гиалуроновой кислоты.
По этой причине целесообразным является создание биотрансплантата, содержащего фармацевтически приемлемые препараты биосовместимой биодеградируемой измельченной бесклеточной матрицы с интегрированными на ней фибробластподобными клетками (Фиг.2), включающей волокна (коллагена, эластина) и гиалуроновую кислоту, которая, имея консистенцию геля, позволяет имплантированным клеткам оставаться локализованными в определенном месте, в частности, в месте дефекта ткани.
Указанные в изобретении соотношения используемых компонентов - культуры клеток, бесклеточной матрицы и гиалуроновой кислоты - позволяют получить биотрансплантат с консистенцией, удобной для инъецирования и наряду с выраженным клиническим эффектом обеспечивают малотравматичность и простоту инъецирования.
Предложенный в изобретении способ введения биотрансплантата двукратно или троекратно с интервалом в 1-4 недели в зависимости от размеров дефекта мягких тканей позволяет также снизить травматичность способа, обеспечить полную реабилитацию тканей после трансплантации и создать оптимальный временной интервал для приживления клеток.
За неделю до инъекции биотрансплантата на прикрепленную часть слизистой оболочки десны без рассечения сосочка наносят, например, крестообразный надрез, провоцирующий острый воспалительный процесс, приводящий к увеличению объема ткани, что позволит без потерь вводить больший объем биотрансплантата, то есть для облегчения процесса клеточной трансплантации представлена новая минимально инвазивная хирургическая процедура, целью которой является индукция временного воспалительного ответа в папиллярной ткани.
Биотрансплантат может состоять из аутологичных фибробластов слизистой оболочки полости рта или аллогенных фибробластов или фибробластподобных клеток человека и любого фармацевтически приемлемого биосовместимого биодеградируемого носителя, который может представлять собой коллагеновые микросферы или частицы животного или человеческого происхождения, в том числе препарат гиалуроновой кислоты.
Биотрансплантат может также состоять только из аутологичных фибробластов слизистой оболочки полости рта или аллогенных фибробластов или фибробластподобных клеток человека.
Выделение первичных культур фибробластов или фибробластподобных клеток
Первичные культуры фибробластов или фибробластподобных клеток получают стандартными методами (A Culture of Animal Cells., Freshney J. 3rd edition, Wiley Liss Inc., New York, 1994) с небольшими модификациями.
У пациентов берут биопсийный материал из-за ушной раковины, или со слизистой оболочки ротовой полости, или крайней плоти или пуповины новорожденного. Перед получением первичной клеточной культуры биоптат промывают растворами антибиотиков и антимикотика (пенициллин 100 ед./мл, стрептомицин 100 мкг/мл, гентамицин 200 мкг/мл, амфотерицин В 25 мкг/мл) в среде ДМЕМ. После промывки, биоптат переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), 40 мкг/мл гентамицина и 400-500 мкг/мл коллагеназы II типа («Sigma»). Инкубацию биоптата проводят при 37°С, 16-17 часов. Среду с коллагеназой предварительно стерильно фильтруют. После инкубации полученную клеточную взвесь промывают в фосфатно-солевом буфере («ПанЭко») рН 7,4-7,5 путем центрифугирования при 400g 10 минут.Полученный клеточный осадок ресуспендируют в среде для культивирования - ДМЕМ, 10-20% ЭТС («ПанЭко»), 40 мкг/мл гентамицина и высевают в культуральные флаконы Т 25, ("Nunc"). Флаконы помещают в СО2-инкубатор (37°С, 5% СО2) и культивируют в течение 1-3 недель до получения первичной культуры. В качестве сыворотки используют как ЭТС, так и тестированную сыворотку пуповинной крови человека, так и аутологичную сыворотку крови пациента. Оптимальная концентрация сыворотки 10-20%. Более высокие концентрации сыворотки стимулируют быструю пролиферацию фибробластов. Концентрацию глюкозы в среде ДМЕМ варьируют от 1 до 4,5 г на 1 литр среды. Для культивирования фибробластов и фибробластподобных клеток используют также бессывороточную среду, например, бессывороточную полную ростовую среду для культивирования фибробластов (Fibroblast Basal Medium, BioWhittaker Inc., USA) или иные аналогичные бессывороточные среды для культивирования фибробластподобных клеток. Перед использованием ЭТС проводят тестирование каждого лота ЭТС на колониеобразующие единицы фибробластов (КОЕ - Ф) и отбирают лоты только с высокой эффективностью колониеобразования. Культивирование проводят в чашках Петри, эксплантируя от 100 до 200 клеток в 10 мл полной ростовой среды. После 14 дней культивирования клетки снимают раствором трипсина - ЭДТА («ПанЭко») и переносят в новый (Т-75 «Nunc») культуральный флакон с питательной средой. Клетки инкубируют в течение недели в СО3 инкубаторе (37°С, 5% CO2). Каждые 48-72 часа производят смену питательной среды. По мере роста и достижения субконфлюэнтного слоя клетки трипсинизируют и переносят в новый большей площадью (Т-150, либо Т-175 «Nunc») культуральный флакон. Культуральные флаконы Т-150, Т-175 обладает емкостью, позволяющей снимать 7-15×106 клеток. В дальнейшем клетки переносят в фабрики Т-500 «Nunc» с тройным дном, после 7 дней культивирования с такого матраса снимают 20-30×106 клеток. При достижении субконфлюэнтного монослоя среду с 10-20% ЭТС заменяют на среду без сыворотки или на среду с 10% аутологичной сывороткой пациента. До снятия клеток и получения готовой суспензии клетки выдерживают не менее 8-14 часов при 37°С. Инкубация клеток на среде, не содержащей сыворотки, позволит избавиться от чужеродных белков, содержащихся в ЭТС. В конце инкубации клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия для инъекций. Затем клетки соединяют с фармацевтически приемлемым носителем (препаратом «Сайметра»). Объем готового биотрансплантата подбирают для каждого пациента индивидуально.
Выделение фибробластподобных клеток из костного мозга.
Выделение фибробластподобных клеток из костного мозга проводят по стандартной методике [Metod in molecular biology. Basic Cell Culture Protocols, Helgason C.D., Miller C.L., 3 ed. New Jersey, 2005].
Аспират костного мозга донора (10-15 мл) выделяют из крыла подвздошной кости, используя гепарин как антикоагулянт у пациента под местной анестезией. Суспензию костномозговых клеток разводят в эквивалентном объеме фосфатно-солевого буфера Дульбекко +2% ЭТС. В 50 мл коническую пробирку («Nunc»), содержащую 15 мл раствора фиколла с плотностью 1,077 г/см3 («ПанЭко»), осторожно наслаивают 20 мл разведенного пунктата костного мозга. Затем полученную смесь центрифугируют при 330g 25 мин. Интерфазное мононуклеарное кольцо осторожно отбирают 5 мл пипеткой в 50-мл пробирки. Отмывают с 5-кратным объемом фосфатно-солевого буфера, двухкратно при 330g 10 мин. Клетки подсчитывают в камере Горяева. Клеточную суспензию в количестве 1×107/мл ресуспендируют в культуральной среде а - MEM (Invitrogen) или DMEM/F12(1:1) с 20% ЭТС (лот сыворотки отбирают, как описано выше) или бессывороточной среде StemPro MSC SFM (Invitrogen) и антибиотиками (пенициллин 100 ед./мл, стрептомицин 100 мкг/мл). 10 мл клеточной суспензии высевают в культуральный флакон 25 см («Nunc») при 37°С и 5% СО2, и инкубируют 14 дней получая таким образом первичную клеточную культуру. Для дальнейшей экспансии клетки пассируют в количестве 3000-5000 кл/см2 в культуральные матрасы («Nunc») с большей посевной площадью. По мере роста и достижения 90% конфлюэнтного слоя клетки снимают раствором 0,25% трипсин-ЭДТА.
Выделение фибробластподобных клеток из жировой ткани.
Выделение фибробластподобных клеток из жировой ткани проводят по стандартной методике [Zak P.A., Tissue Engineering vol. 7, №2, 2001] с небольшими модификациями.
Образцы жировой ткани получают посредством липосакции. Жировую ткань измельчают и подвергают ферментативной обработке коллагеназой I типа (200 ед/мл, Sigma) в среде DMEM, содержащей 100 ед./мл пенициллина и 100 ед/мл стрептомицина при соотношении ткани и среды 1:1 и инкубируют при 37°С в течение часа с постоянным покачиванием/перемешиванием. По окончании инкубации образец смешивают с культуральной средой DMEM, содержащей 10% ЭТС, и фильтруют через 70-100 мкм нейлоновый фильтр. Профильтрованную суспензию центрифугируют при 200g 5-7 минут. Полученный осадок обрабатывают лизирующим буфером (154 mM NH4CL, 10 mМ КНСО3, 0,1 mМ EDTA) в течение 5 минут при 37°С для лизиса эритоцитов, после чего клеточную суспензию центрифугируют при 400g 7 минут. Клеточный осадок (1×106/см2) ресуспендируют в культуральной среде, описанной выше, высевают в культуральный флакон и инкубируют в СО3 инкубаторе (37°С, 5% СО3). Смену среды проводят каждые 3-4 дня. По мере роста и достижения 80-90% конфлюэнтного монослоя клеточную суспензию снимают 0,25% трипсин-ЭДТА.
Выделение фибробластподобных клеток из пульпы зуба
Выделение фибробластподобных клеток из пульпы зуба по оригинально разработанной методике.
Клетки получают из молочных зубов детей или удаленных третьих моляров взрослых. Зубы трехкратно промывают средой DMEM, содержащей 200 мкг/мл гентамицина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина. Затем зуб переносят во флакон с 10 мл среды DMEM, содержащей 10% ЭТС, 40 мкг/мл гентамицина и 400-500 мкг/мл коллагеназы II типа. Инкубацию ведут при 37°С, 17 час. Затем клеточную суспензию центрифугируют и осадок ресуспендируют в 5 мл культуральной среды DMEM или DMEM/F 12(1:1), содержащей 20% ЭТС или безсывороточной среде StemPro MSC SFM (Invitrogen) 40 мкг/мл гентамицина. Культивирование проводят в СО3 инкубаторе (37°С, 5% СО2) в течение 2-х недель до образования монослоя. Дальнейшее культивирование и пассирование клеток проводят в среде DMEM или DMEM/F12 (1:1) с 15% ЭТС или безсывороточной среде StemPro MSC SFM (Invitrogen) 40 мкг/мл гентамицина. Среду меняют каждые 3-4 дня. По мере роста и достижения 80-90% конфлюэнтного монослоя клеточную суспензию снимают 0,25% трипсин - ЭДТА.
После успешно проведенного культивирования часть выведенной культуры фибробластподобных клеток подвергают криоконсервированию после 1-го пассажа в среде для криозаморозки: 50% ДМЕМ, 40% ЭТС, 10% ДМСО («Merk») в количестве 1×106/мл, где в жидком азоте они могут храниться бессрочно. Запас криоконсервированных клеток дает возможность создать мастер-банк, что позволяет проводить процедуры в определенно назначенное время.
Тестирование клеток на биобезопасность проводят следующим образом.
После 1-го пассажа образец культуры фибробластподобных клеток исследуют на исключение вирусной и бактериальной инфекции, проводят кариотипирование.
Наличие вирусной и бактериальной инфекции являются абсолютным противопоказанием к дальнейшему культивированию и хранению клеток. Все процедуры по получению клеточных биотрансплантатов проводят в условиях GMP, GTP, GLP.
Для характеризации полученных клеток определяют их фенотип, проводят фазово-контрастную микроскопию (Фиг.1), выполняют тест на КОКф (колониеобразующие единицы фибробластов), проводят специфическое окрашивание клеток на F - актин и Westem-blott анализ клеточных лизатов на экспрессию коллагена I типа.
Для иллюстрации изобретения приведены следующие примеры.
Пример 1
Доброволец Н. 42 года, пол женский.
При осмотре ротовой полости выявлены: тонкий биотип десны, выраженная рецессия десны между 3 и 4,4 и 5 зубами слева.
При клиническом и рентгенологическом исследовании был поставлен диагноз рецессии десны II класса по Миллеру, предрасположенность к генерализованным рецессиям.
Назначение: пересадка аутологичных фибробластов, интегрированных на матрице фармацевтически приемлемого препарата «Сайметра» в собственно слизистую оболочку, прилежащую к шейке зуба и в межзубные десневые сосочки.
У добровольца был взят биоптат со слизистой оболочки верхнего неба диаметром 0,3 мм.
Перед получением первичной клеточной культуры биоптат промывают растворами антибиотиков и антимикотика (пенициллин 100 ед./мл, стрептомицин 100 мкг/мл, гентамицин 200 мкг/мл, амфотерицин В 25 мкг/мл) в среде ДМЕМ. После промывки, биоптат переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), 40 мкг/мл гентамицина и коллагеназы II типа («Sigma»). Инкубацию биоптата проводят при 37°С, 16-17 часов. Полученный клеточный осадок ресуспендируют в среде для культивирования -ДМЕМ, 10-20% ЭТС («ПанЭко»), 40 мкг/мл гентамицина и высевают в культуральные флаконы Т25, ("Nunc"). Флаконы помещают в СО2-инкубатор (37°С, 5% СО2) и культивируют в течение 2 недель до получения первичной культуры. По мере роста и достижения субконфлюэнтного слоя клетки трипсинизируют и переносят в новый большей площадью (Т-75, Т-175 «Nunc») культуральный флакон. При достижении субконфлюэнтного монослоя среду с 10-20% ЭТС заменяют на среду без сыворотки. До снятия клеток и получения готовой суспензии клетки выдерживают не менее 8-14 часов при 37°С. В конце инкубации клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования, суспендируют в количестве 2×106 в 0,4 мл 0,9% раствора хлорида натрия для инъекций и соединяют в соотношении 5:1 с препаратом «Сайметра».
Пациентке проводят профессиональную гигиену полости рта. За 7 дней до введения клеточного препарата на прикрепленной части слизистой оболочки десны без рассечения сосочка наносят крестообразные надрезы в проекции планируемого введения клеток. Препарат, состоящий из клеточного материала, интегрированного на фармацевтически приемлемый препарат «Сайметра», аспирируют в инсулиновый шприц и вводят в собственно слизистую оболочку, прилежащую к шейке зуба и в межзубные десневые сосочки на глубину 1 мм.
Клинические наблюдения проводят в период от 1 недели до 6 месяцев после инъекции.
Первые положительные изменения были отмечены через месяц, к 3-му месяцу прирост тканей достигал максимального значения. К 6-му месяцу отмечали стабильный клинический эффект. Визуально отмечены утолщение прикрепленной слизистой оболочки десны в местах инъекций, плотное сращение слизистой оболочки десны с твердыми тканями зуба, уменьшение размеров рецессии десны.
Пример 2
Доброволец П. 45 лет, пол мужской.
При осмотре ротовой полости выявлены: тонкий биотип десны, выраженная рецессия десны между 2 и 3, 4 и 5 зубами справа.
При клиническом и рентгенологическом исследовании был поставлен диагноз рецессии десны II класса по Миллеру, предрасположенность к генерализованным рецессиям.
Назначение: пересадка аутологичных фибробластов, интегрированных на матрице фармацевтически приемлемого препарата «Сайметра» в собственно слизистую оболочку, прилежащую к шейке зуба и в межзубные десневые сосочки.
У добровольца был взят биоптат со слизистой оболочки верхнего неба диаметром 0,2 мм.
Перед получением первичной клеточной культуры биоптат промывают растворами антибиотиков и антимикотика (пенициллин 100 ед./мл, стрептомицин 100 мкг/мл, гентамицин 200 мкг/мл, амфотерицин В 25 мкг/мл) в среде ДМЕМ. После промывки, биоптат переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), 40 мкг/мл гентамицина и коллагеназы II типа («Sigma»). Инкубацию биоптата проводят при 37°С, 16-17 часов. Полученный клеточный осадок ресуспендируют в среде для культивирования - ДМЕМ, 10-20% ЭТС («ПанЭко»), 40 мкг/мл гентамицина и высевают в культуральные флаконы (Т-25 "Nunc"), флаконы помещают в СО3-инкубатор (37°С, 5% СО3) и культивируют в течение 2 недель до получения первичной культуры. По мере роста и достижения субконфлюэнтного слоя клетки трипсинизируют и переносят в новый большей площадью (Т-75, Т-150 «Nunc») культуральный флакон. При достижении субконфлюэнтного монослоя среду с 10-20% ЭТС заменяют на среду без сыворотки. До снятия клеток и получения готовой суспензии клетки выдерживают в культуральных флаконах не менее 16-18 час при 37°С. В конце инкубации клетки собирают из культуральных флаконов с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования-ресуспендирования и суспендируют в 0,9% растворе хлорида натрия для инъекций в концентрации 10×106 клеток в 1 мл биотрансплантата. Пациенту проводят профессиональную гигиену полости рта. За неделю до инъекции биотрансплантата на прикрепленной части слизистой оболочки десны без рассечения сосочка наносят крестообразные надрезы. Пациенту был рекомендован раствор хлоргексидина для полоскания рта после еды. Затем была проведена инъекция биотрансплантата, состоящего из клеточного материала, интегрированного на фармацевтически приемлемый препарат «Сайметра», который аспируют в инсулиновый шприц и вводят в собственно слизистую оболочку, прилежащую к шейке зуба и в межзубные десневые сосочки на глубину 1 мм. Биотрансплантат вводят из расчета 50-70 мкл на точку введения. Такой же объем вводят и с лингуальной стороны.
Клинические наблюдения проводят в период от 1 недели до 6 месяцев после инъекции биотрансплантата. Первые положительные изменения были отмечены через месяц, к 6-му месяцу прирост тканей достигал максимального значения. Визуально отмечены утолщение прикрепленной слизистой оболочки десны в местах инъекций, плотное сращение слизистой оболочки десны с твердыми тканями зуба, уменьшение размеров рецессии десны.
Пример 3
Доброволец Н. 52 г., пол мужской.
При осмотре ротовой полости выявлены: тонкий биотип десны, выраженная рецессия десны между 2 и 3 зубами справа.
При клиническом и рентгенологическом исследовании был поставлен диагноз рецессии десны II класса по Миллеру, предрасположенность к генерализованным рецессиям.
Назначение: пересадка аутологичных фибробластов слизистой оболочки ротовой полости в собственно слизистую оболочку, прилежащую к шейке зуба и в межзубные десневые сосочки.
У добровольца был взят биоптат со слизистой оболочки верхнего неба диаметром 0,4 мм.
Перед получением первичной клеточной культуры биоптат промывают растворами антибиотиков и антимикотика (пенициллин 100 ед./мл, стрептомицин 100 мкг/мл, гентамицин 200 мкг/мл, амфотерицин В 25 мкг/мл) в среде ДМЕМ. После промывки, биоптат переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), 40 мкг/мл гентамицина и коллагеназы II типа («Sigma»). Инкубацию биоптата проводят при 37°С, 16-17 часов. Полученный клеточный осадок ресуспендируют в среде для культивирования - ДМЕМ, 10-20% ЭТС («ПанЭко»), 40 мкг/мл гентамицина и высевают в культуральные флаконы (Т-25 "Nunc"). Флаконы помещают в СО2-инкубатор (37°С, 5% СО2) и культивируют в течение 1,5 недель до получения первичной культуры. По мере роста и достижения субконфлюэнтного слоя клетки трипсинизируют и переносят в новый большей площадью (Т-75, Т-150 «Nunc») культуральный флакон. При достижении субконфлюэнтного монослоя среду с 10-20% ЭТС заменяют на среду без сыворотки. До снятия клеток и получения готовой суспензии, клетки выдерживают в культуральных флаконах не менее 16-18 часов при 37°С. В конце инкубации клетки собирают из культуральных флаконов с помощью 0.25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия в концентрации 10,0×106мл.
Пациенту проводят профессиональную гигиену полости рта. За неделю до инъекции биотрансплантата на прикрепленную часть слизистой оболочки десны без рассечения сосочка наносят крестообразный надрез. Пациенту был рекомендован раствор хлоргексидина для полоскания рта после еды. Через неделю была проведена первая инъекция биотрансплантата, состоящего из суспензии аутологичных фибробластов в физиологическом растворе для инъекций. Биотрансплантат аспирировали в инсулиновый шприц и вводили по 50-70 мкл как с фациальной стороны, так и лингуальной в собственно слизистую оболочку, прилежащую к шейке зуба и в межзубные десневые сосочки на глубину 1 мм. Вторая инъекция была сделана через две недели после первой инъекции. Третья инъекция была проведена через три недели после второй.
Клинические наблюдения проводили в период от 1 недели до 6 месяцев после третьей инъекции биотрансплантата.
Первые положительные изменения были отмечены через 3 недели, к 6-му месяцу прирост тканей достигал максимального значения. Визуально отмечены утолщение прикрепленной слизистой оболочки десны в местах инъекций, плотное сращение слизистой оболочки десны с твердыми тканями зуба, уменьшение размеров рецессии десны.
Таким образом, предлагаемое изобретение может быть использовано для лечения дегенерации ткани, произошедшей в результате функционального нарушения или болезни периодонта, дефектов слизистой оболочки ротовой полости, а также устранения послеоперационной ретракции тканей альвеолярных отростков при проведении пародонтологических и имплантологических вмешательств. Значительное снижение количества инъецируемых клеток, повышение их жизнеспособности и обеспечение длительного сохранения имплантата в поврежденной ткани также позволит снизить стоимость лечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОТРАНСПЛАНТАТ ДЛЯ КОРРЕКЦИИ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ БИОТРАНСПЛАНТАТА (ВАРИАНТЫ) И СПОСОБ КОРРЕКЦИИ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ | 2009 |
|
RU2428996C2 |
| БИОТРАНСПЛАНТАТ И СПОСОБ КОРРЕКЦИИ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ, СПОСОБ ПОЛУЧЕНИЯ БИОТРАНСПЛАНТАТА | 2005 |
|
RU2281776C1 |
| Способ изготовления биотрансплантата, биотрансплантат для устранения рецессий десны и восстановления утраченного десной объема, способ устранения рецессий десны и восстановления утраченного десной объема | 2018 |
|
RU2700510C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИОБЛАСТОВ, ИСПОЛЬЗОВАНИЕ БИОПТАТА ДЕСНЫ, ПРЕПАРАТ МИОБЛАСТОВ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЙ МЫШЕЧНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2576842C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ФИБРОБЛАСТОВ, СПОСОБ СОЗДАНИЯ БИОТРАНСПЛАНТАТА НА ИХ ОСНОВЕ (ВАРИАНТЫ) И СПОСОБ РЕГЕНЕРАЦИИ ТКАНЕЙ ЧЕЛОВЕКА (ВАРИАНТЫ) | 2013 |
|
RU2567004C2 |
| СПОСОБ ДИАГНОСТИКИ СОСТОЯНИЯ КОЖИ ПАЦИЕНТА (ВАРИАНТЫ) | 2011 |
|
RU2466680C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПАРОДОНТА | 2004 |
|
RU2265445C1 |
| Тканеинженерная конструкция для восполнения объема костной ткани челюстно-лицевой области | 2019 |
|
RU2729365C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ ХРЯЩЕВОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2301677C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ КОСТНОЙ ТКАНИ ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ | 2008 |
|
RU2380105C1 |

Группа изобретений относится к медицине, а именно к стоматологии, и касается лекарственных средств для восстановления тканей пародонта и способов их получения. Биотрансплантат для лечения заболеваний пародонта представляет собой суспензию, содержащую культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в 0,9% растворе хлорида натрия в концентрации 2,0-10,0×106 в 1 мл биотрансплантата, интегрированных на фармацевтически приемлемом биосовместимом биодеградируемом носителе, выбранном из ряда: бесклеточная матрица, препарат гиалуроновой кислоты, бесклеточная матрица и препарат гиалуроновой кислоты, при определенном объемном соотношении суспензии культуры клеток и носителя, что позволяет получить консистенцию, удобную для инъецирования и наряду с выраженным клиническим эффектом обеспечивает малотравматичность и простоту инъецирования. Предпочтительно, в качестве носителя используют измельченную до размера 100-200 мкм бесклеточную матрицу «Сайметра». Предлагается также способ лечения заболеваний пародонта, сущность которого заключается в том, что на слизистой оболочке десны в области дефекта предварительно за одну неделю до введения биотрансплантата делают надрезы, провоцирующие острый воспалительный процесс, приводящий к увеличению объема ткани, что позволяет без потерь вводить больший объем биотрансплантата. Затем в область дефекта инъекционным путем вводят двукратно с интервалом 1-4 недели предлагаемый биотрансплантат, используя 3,6-60×106 клеток на курс лечения, что обеспечивает оптимальный временной интервал для приживления клеток и восстановление тканей пародонта. 3 н. и 4 з.п. ф-лы, 2 ил.
1. Биотрансплантат для лечения заболеваний пародонта, характеризующийся тем, что он представляет собой суспензию, содержащую культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в 0,9%-ном растворе хлорида натрия в концентрации 2,0-10,0·106 в 1 мл биотрансплантата, интегрированных на фармацевтически приемлемом биосовместимом биодеградируемом носителе, выбранном из ряда: бесклеточная матрица, препарат гиалуроновой кислоты, бесклеточная матрица и препарат гиалуроновой кислоты, при этом объемное соотношение суспензии культуры клеток и бесклеточной матрицы или суспензии культуры клеток и препарата гиалуроновой кислоты составляет 5:1, а объемное соотношение суспензии культуры клеток, бесклеточной матрицы и препарата гиалуроновой кислоты составляет 4:1:1 соответственно.
2. Биотрансплантат по п.1, характеризующийся тем, что он содержит суспензию культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток, выделенных из кожи, или слизистой оболочки, или костного мозга, или жировой ткани, или пульпы зуба.
3. Биотрансплантат по п.1, характеризующийся тем, что в качестве фармацевтически приемлемого биосовместимого биодеградируемого носителя используют измельченную до размера 100-200 мкм бесклеточную матрицу «Сайметра».
4. Способ получения биотрансплантата для лечения заболеваний пародонта, характеризующийся тем, что биоптат, содержащий аутологичные или аллогенные фибробласты или фибробластоподобные клетки, промывают растворами антибиотиков и антимикотика в среде ДМЕМ и переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки, 40 мкг/мл гентамицина и 400-500 мкг/мл коллагеназы II типа, инкубацию биоптата проводят при 37°С 16-17 ч, полученный клеточный осадок ресуспендируют в среде для культивирования ДМЕМ, 10-20% ЭТС, 40 мкг/мл гентамицина, высевают и культивируют в течение 2-3 недель до получения первичной культуры, затем клетки трипсинизируют и культивируют, после чего среду с 10-20% ЭТС заменяют на среду без сыворотки или на среду ДМЕМ 90% и 10% аутологичной сыворотки и выдерживают 8-14 ч при 37°С, после культивирования клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9%-ном растворе хлорида натрия в концентрации 2,0-10,0·106 в 1 мл биотрансплантата, затем суспензию клеток интегрируют на фармацевтически приемлемом биосовместимом биодеградируемом носителе, выбранном из ряда: бесклеточная матрица, препарат гиалуроновой кислоты, бесклеточная матрица и препарат гиалуроновой кислоты, при этом объемное соотношение суспензии культуры клеток и бесклеточной матрицы или суспензии культуры клеток и препарата гиалуроновой кислоты составляет 5:1, а объемное соотношение суспензии культуры клеток, бесклеточной матрицы и препарата гиалуроновой кислоты составляет 4:1:1 соответственно.
5. Способ получения биотрансплантата для лечения заболеваний пародонта по п.4, характеризующийся тем, что суспензию клеток культивируют для адгезии фибробластподобных клеток с бесклеточной матрицей «Сайметра» 1-2 ч при 37°С.
6. Способ лечения заболеваний пародонта, характеризующийся тем, что на слизистой оболочке десны в области дефекта предварительно за одну неделю до введения биотрансплантата делают надрезы, затем в область дефекта инъекционным путем вводят двукратно с интервалом 1-4 недели биотрансплантат, представляющий собой суспензию, содержащую культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в 0,9%-ном растворе хлорида натрия в концентрации 2,0-10,0·106 клеток в 1 мл биотрансплантата, интегрированных на фармацевтически приемлемом биосовместимом биодеградируемом носителе, выбранном из ряда: бесклеточная матрица, препарат гиалуроновой кислоты, бесклеточная матрица и препарат гиалуроновой кислоты, при этом объемное соотношение суспензии культуры клеток и бесклеточной матрицы или суспензии культуры клеток и препарата гиалуроновой кислоты составляет 5:1, а объемное соотношение суспензии культуры клеток, бесклеточной матрицы и препарата гиалуроновой кислоты составляет 4:1:1 соответственно, причем количество клеток на курс лечения составляет 3,6-60·106.
7. Способ лечения заболеваний пародонта по п.6, характеризующийся тем, что на слизистой десны в области дефекта делают крестообразные надрезы, провоцирующие острый воспалительный процесс, приводящие к увеличению объема ткани.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| БИОТРАНСПЛАНТАТ И СПОСОБ КОРРЕКЦИИ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ, СПОСОБ ПОЛУЧЕНИЯ БИОТРАНСПЛАНТАТА | 2005 |
|
RU2281776C1 |
| Шпора для ведущих тракторных колес | 1929 |
|
SU40885A1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПАРОДОНТА | 2004 |
|
RU2265445C1 |
| БИОРАССАСЫВАЕМАЯ КОЛЛАГЕНОВАЯ МАТРИЦА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2007 |
|
RU2353397C2 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| JP 2003190273 A, 08.07.2003. | |||
Авторы
Даты
2011-05-20—Публикация
2009-08-28—Подача