Область техники
[0001] Раскрыта липосомная композиция с длительным высвобождением, содержащая активный компонент, такой как лекарственное средство.
Предшествующий уровень техники
[0002] Лекарственные средства, предполагающие частое введение, являются проблемными в связи с тем, что частая госпитализация, боль от уколов и т.п. могут представлять собой тяжелую нагрузку на пациента. Кроме того, пациентам, испытывающим трудности при глотании, сложно принимать лекарственное средство через рот, поэтому желателен другой способ введения, кроме перорального. Кроме того, пациентам, нуждающимся в сиделке, таким как больные с деменциями, заболеваниями головного мозга и болезнью Паркинсона, трудно контролировать прием лекарственного средства самостоятельно. Поэтому в таких случаях желателен способ введения, отличный от перорального введения, или способ лечения, не подразумевающий частое введение. Дополнительно, для пациентов, ежедневная жизнедеятельность которых нарушается, как только заканчивается действие лекарственного средства, таких как пациенты с нарушением вегетативной регуляции, желателен терапевтический способ, при котором действие лекарственного средства не заканчивается за короткий период времени, а может продолжаться в течение длительного периода времени. Или, что касается боли после операции, пациент может испытывать невыносимую боль, как только заканчивается действие лекарственного средства, которая может влиять на реабилитацию и может вызывать задержку выписки из больницы. Поэтому, если лекарственное средство может поддерживать свое действие и подавлять боль, например, в течение пяти-семи дней после операции, считается, что послеоперационная реабилитация может быть ускорена, что, в свою очередь, может способствовать более ранней выписке из больницы.
[0003] Лекарственные формы с замедленным высвобождением, посредством которых действие лекарственного средства может поддерживаться в течение длительного времени, могут представлять собой средства для улучшения качества жизни пациента при всех видах заболеваний.
[0004] Многие лекарственные формы с замедленным высвобождением, исследованные прежде, представляют собой микросферы, создаваемые на основе сополимера полимолочной кислоты и гликолевой кислоты (PLGA). Например, как раскрыто в Biomaterials, 28 (2007), 1882-1888, были исследованы PLGA микросферы с применением донепезила гидрохлорида, активного ингредиента Aricept (зарегистрированная торговая марка; Eisai Co., Ltd.), который можно применять в качестве лекарственного средства для лечения деменции альцгеймеровского типа, и при этом были получены свойства замедленного высвобождения. В случае применения PLGA, однако, трудно осуществлять капсулирование, например, растворимого в воде лекарственного средства в высокой концентрации и с высокой эффективностью, и есть проблемы, которые необходимо решить для достижения возможности капсулирования большого количества лекарственного средства. Кроме того, при применении PLGA существует проблема в том, что применение органического растворителя в способе получения может повлечь за собой обязательное удаление органического растворителя. См., например, JP-T-2001-505224 и JP-T-2001-522870. Локальная активизация кислоты после разложения PLGA может вызывать воспаление.
[0005] Кроме вышеуказанных, также исследовали некоторые другие подходы к получению лекарственных форм с замедленным высвобождением на основе применения местного анестезирующего средства, такого как бупивакаин, где все еще не решена проблема достижения свойства замедленного высвобождения, посредством которого может быть подавлена боль, имеющая тенденцию длиться в течение пяти-семи дней после операции. См., например, Anesthesiology, 101 (2004), 133-137. Мультивезикулярная липосома (MVL) была разработана как носитель лекарственного средства с замедленным высвобождением на основе липидов для местной или системной доставки лекарственного средства. См., например, JP-T-2001-505224 и JP-T-2001-522870. Этот подход, однако, также не является удовлетворительным в отношении количества капсулируемого лекарственного средства и длительности замедленного высвобождения.
Сущность изобретения
[0006] Согласно типовому аспекту настоящего изобретения раскрыта липосомная композиция, включающая первую липосому, содержащую внешнюю мембрану, состоящую из многослойного липидного бислоя; и множество вторых липосом, располагающихся во внутренней области первой липосомы, определенной внешней мембраной первой липосомы, где каждая из вторых липосом имеет внешнюю мембрану, состоящую из липидного бислоя, где липосомная композиция имеет внутренние области вторых липосом, каждая из которых определена внешней мембраной каждой из вторых липосом, и ионный градиент образуется по меньшей мере между каждой из внутренних областей вторых липосом и внешней средой первой липосомы. Липидный бислой вторых липосом может быть многослойным.
[0007] Согласно типовому аспекту настоящего изобретения раскрыт способ получения липосомной композиции с ионным градиентом между внутренней областью и внешней областью внешней мембраны, способ, включающий смешивание первого раствора внутренней водной фазы, содержащего соединение для создания ионного градиента, с липидсодержащим смешивающимся с водой растворителем в объемном соотношении от 0,7 до 2,5 для получения первой эмульсии; смешивание второго раствора внутренней водной фазы с первой эмульсией в объемном соотношении не менее 0,7 для получения второй эмульсии; и замещение внешней водной фазы второй эмульсии водным раствором, в котором концентрация соединения для создания ионного градиента меньше, чем в первом растворе внутренней водной фазы.
Краткое описание фигур
[0008] Фиг.1 представляет собой фотографию (увеличение: 32000), полученную при наблюдении части липосомной композиции при помощи трансмиссионного электронного микроскопа (TEM) после введения лекарственного средства, полученного в примере получения 2, согласно типовому варианту осуществления настоящего изобретения.
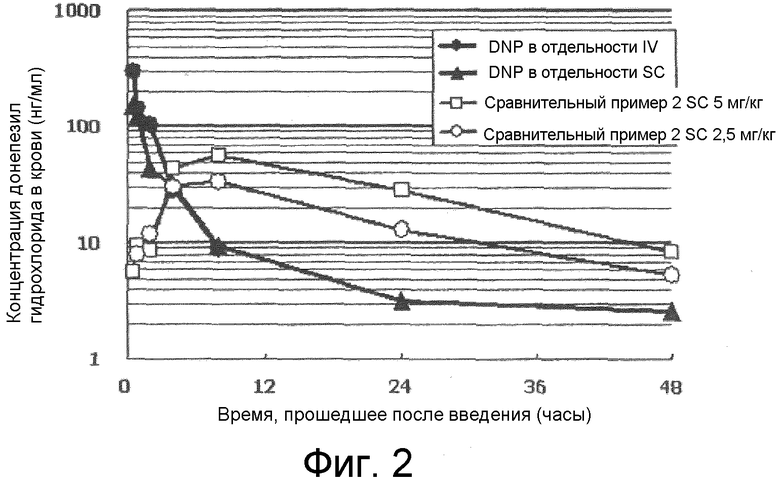
[0009] Фиг.2 представляет собой график, описывающий результаты фармакокинетического профиля липосомы донепезила (сравнительный пример 2), полученной способом экструзии 1 согласно типовому варианту осуществления настоящего изобретения.
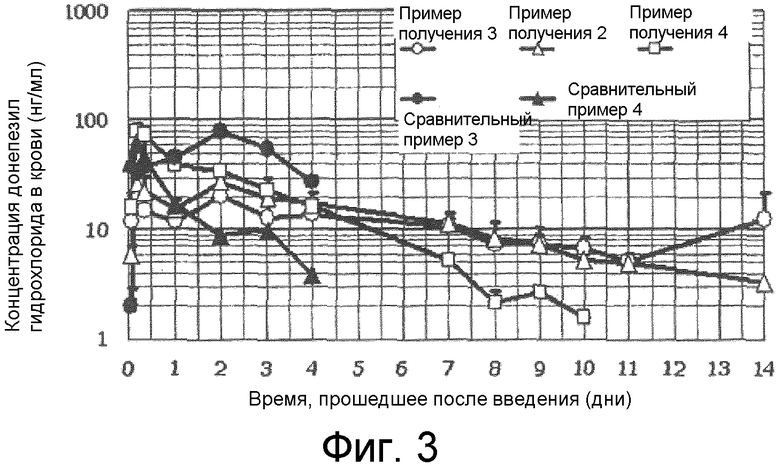
[0010] Фиг.3 представляет собой график, показывающий результаты фармакокинетического профиля липосомных композиций, полученных в примерах получения 2, 3 и 4 согласно типовому варианту осуществления настоящего изобретения.
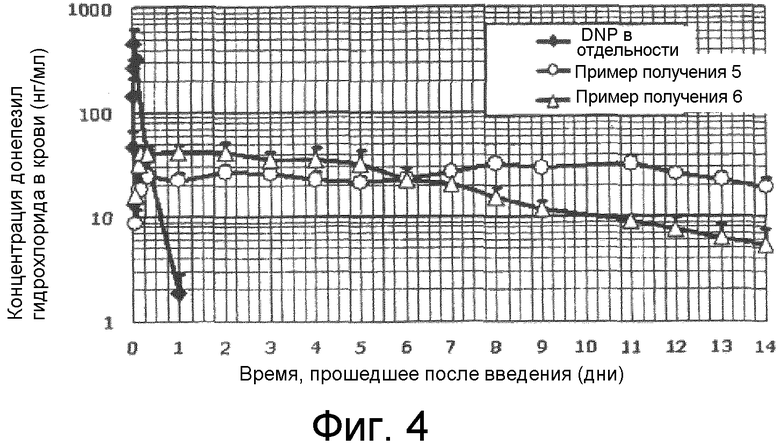
[0011] Фиг.4 представляет собой график, показывающий результаты фармакокинетического профиля липосомных композиций, полученных в примерах получения 5 и 6 согласно типовому варианту осуществления настоящего изобретения.
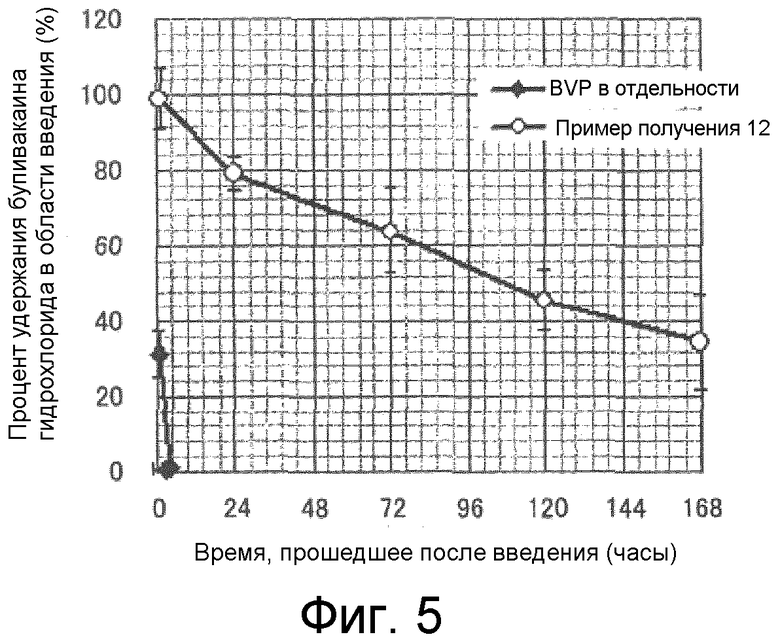
[0012] Фиг.5 представляет собой график, показывающий результаты фармакокинетического профиля липосомной композиции, полученной в примере получения 12 согласно типовому варианту осуществления настоящего изобретения.
Подробное описание настоящего изобретения
[0013] Согласно типовому аспекту настоящего изобретения раскрыта липосомная композиция, в которой лекарственное средство перемещается из внешней области во внутреннюю область по ионному градиенту, в которую, таким образом, лекарственное средство для капсулирования может быть введено в большом количестве с высокой эффективностью, и которая обладает свойствами замедленного высвобождения в такой степени, что эффективная концентрация может поддерживаться на клинически удовлетворительном уровне. Согласно типовому аспекту настоящего изобретения раскрыт способ получения липосомной композиции.
[0014] Раскрыты следующие типовые аспекты настоящего изобретения.
[0015] (1) Липосомная композиция, включающая первую липосому, содержащую внешнюю мембрану, состоящую из многослойного липидного бислоя; и множество вторых липосом, располагающихся во внутренней области первой липосомы, определенной внешней мембраной, где каждая из вторых липосом имеет внешнюю мембрану, состоящую из липидного бислоя, где липосомная композиция имеет внутренние области вторых липосом, каждая из которых определена внешней мембраной каждой из вторых липосом, и ионный градиент образуется по меньшей мере между каждой из внутренних областей вторых липосом и внешней средой первой липосомы. Липидный бислой вторых липосом может быть многослойным.
[0016] (2) Липосомная композиция, как описано в вышеуказанном параграфе (1), в которой ионным градиентом является градиент концентрации протонов и pH во внутренней области второй липосомы или pH во внутренней области второй липосомы и внутренней области первой липосомы меньше, чем pH во внешней среде первой липосомы.
[0017] (3) Липосомная композиция, как описано в вышеуказанном параграфе (1) или (2), в которой первая липосома имеет средний диаметр частицы в пределах диапазона 1-20 мкм.
[0018] (4) Липосомная композиция, как описано в любом из вышеуказанных параграфов (1)-(3), в которой лекарственное средство содержится во внутренней области второй липосомы или во внутренних областях второй липосомы и первой липосомы.
[0019] (5) Липосомная композиция, как описано в вышеуказанном параграфе (4), в которой лекарственное средство содержится в молярном отношении (моль/моль) не менее 0,05 по отношению к общему содержанию липидов.
[0020] (6) Липосомная композиция, как описано в любом из вышеуказанных параграфов (1)-(5), в которой каждая из липидных мембран первой липосомы и вторых липосом состоит из липида, включая фосфолипид и холестерин.
[0021] (7) Липосомная композиция, как описано в вышеуказанном параграфе (6), в которой фосфолипид представляет собой насыщенный фосфолипид.
[0022] (8) Способ получения липосомной композиции с ионным градиентом между внутренней областью и внешней областью внешней мембраны, включающий следующие стадии: смешивание первого раствора внутренней водной фазы, содержащего соединение для создания ионного градиента, с липидсодержащим смешивающимся с водой растворителем в объемном соотношении от 0,7 до 2,5 для получения первой эмульсии; смешивание второго раствора внутренней водной фазы с первой эмульсией в объемном соотношении не менее 0,7 для получения второй эмульсии; и замещение внешней водной фазы второй эмульсии водным раствором, в котором концентрация соединения для создания ионного градиента по меньшей мере меньше, чем в первом растворе внутренней водной фазы.
[0023] (9) Способ получения липосомной композиции, как описано в вышеуказанном параграфе (8), в котором ионным градиентом является градиент концентрации протонов.
[0024] (10) Способ получения липосомной композиции, как описано в вышеуказанном параграфе (8) или (9), в котором первый раствор внутренней водной фазы содержит сульфат.
[0025] (11) Способ получения липосомной композиции, как описано в вышеуказанном параграфе (10), в котором сульфатом является сульфат аммония.
[0026] (12) Способ получения липосомной композиции, как описано в любом из вышеуказанных параграфов (8)-(11), дополнительно включающий стадию введения лекарственного средства во внутреннюю часть липосомной композиции посредством движущей силы, возникающей в результате ионного градиента.
[0027] В типовом варианте осуществления настоящего изобретения описана липосомная композиция, включающая первую липосому, содержащую внешнюю мембрану, состоящую из многослойного липидного бислоя; и множество вторых липосом, располагающихся во внутренней области первой липосомы, определенной внешней мембраной, где каждая из вторых липосом имеет внешнюю мембрану, состоящую из липидного бислоя, где липосомная композиция имеет внутренние области вторых липосом, каждая из которых определена внешней мембраной каждой из вторых липосом, и ионный градиент образуется по меньшей мере между каждой из внутренних областей вторых липосом и внешней средой первой липосомы. Липидный бислой вторых липосом может быть многослойным. В типовом варианте осуществления настоящего изобретения липосомная композиция позволяет капсулирование лекарственного средства с высокой эффективностью и способна к длительному замедленному высвобождению лекарственного средства.
[0028] При помощи типового способа получения липосомной композиции возможно получение липосомной композиции, которая допускает капсулирование лекарственного средства с высокой эффективностью и способна к длительному замедленному высвобождению лекарственного средства.
Фосфолипиды
[0029] Фосфолипид может быть главным липидом, составляющим липидный бислой (в дальнейшем также иногда называемый просто липидной мембраной или мембраной липосомы) липосомной композиции согласно типовому аспекту. Фосфолипид может быть главным компонентом липидного бислоя. Например, фосфолипид представляет собой амфифильное вещество, имеющее и гидрофобную группу, составленную из длинноцепочечной алкильной группы, и гидрофильную группу, составленную из фосфатной группы в ее молекуле. Примеры фосфолипида включают глицерофосфорные кислоты, такие как фосфатидилхолин (= лецитин), фосфатидинглицерин, фосфатидная кислота, фосфатидилэтаноламин, фосфатидилсерин и фосфатидилинозитол; сфингофосфолипиды, такие как сфингомиелин; природные или синтетические дифосфатидилфосфолипиды, такие как кардиолипин и их производные; продукты гидрирования этих фосфолипидов, такие как гидрированный соевый фосфатидилхолин (HSPC), гидрированный фосфатидилхолин из яичного желтка, дистеароилфосфатидилхолин, дипальмитоилфосфатидилхолин и димиристоилфосфатидилхолин. Фосфолипиды могут быть применены как по отдельности, так и в комбинации множества из них.
Другие добавки, отличные от фосфолипидов
[0030] Липосомная композиция согласно типовому аспекту может включать другой мембранный компонент(ы) вместе с вышеуказанным типовым главным компонентом (т.е. фосфолипидом). Например, липосомная композиция может содержать другие липиды, отличные от фосфолипидов, или производные других липидов, стабилизаторы мембран, антиоксиданты и т.п., по желанию. Другие липиды, отличные от фосфолипидов, могут быть липидами, содержащими гидрофобную группу, такую как длинноцепочечная алкильная группа в своей молекуле, но не содержащими фосфатную группу в своей молекуле, и, в частности, не ограничены. Примеры других липидов включают глицерогликолипиды, сфингогликолипиды, производные стерина, такие как холестерин, и их производные, такие как продукты их гидрирования. Примеры производных холестерина включают такие стерины, которые содержат циклопентаногидрофенантреновое кольцо. Например, среди них, холестерин может содержаться в типовой липосомной композиции. Примеры антиоксидантов включают аскорбиновую кислоту, мочевую кислоту и гомологи токоферола или витамин Е. Токоферол включает четыре изомера, а именно α-, β-, γ- и δ-токоферолы, и любой из таких изомеров может быть применен.
[0031] В типовом варианте осуществления настоящего изобретения липидный бислой липосомной композиции может на 100-50% мол. состоять из фосфолипида и на 0-50% мол. из холестерина, например, на 70-50% мол. состоять из фосфолипида и 30-50% мол. из холестерина.
[0032] Липосомная композиция может включать первую липосому, содержащую внешнюю мембрану, состоящую из нескольких липидных бислоев, и множество вторых липосом, которые располагаются во внутренней области первой липосомы, определенной внешней мембраной, и каждая из которых имеет внешнюю мембрану, состоящую из липидного бислоя. Липидный бислой вторых липосом может быть многослойным. Многослойный бислой первой липосомы включает много бислоев. Например, многослойный бислой вторых липосом включает много бислоев. В липосомной композиции есть внутренние области вторых липосом, каждая из которых определена внешней мембраной каждой из вторых липосом.
[0033] Типовая липосомная композиция включает, в качестве ее вариантов, пустую липосому, в которой не содержится капсулированного лекарственного средства, и липосому, в которой капсулировано лекарственное средство.
[0034] Внешний диаметр первой липосомы может составлять 1-20 мкм, например, 3-10 мкм. Такой внешний диаметр может приводить к превосходным свойствам длительного замедленного высвобождения и обеспечивать легкое введение даже через тонкие иглы. Кроме того, внешний диаметр вторых липосом, в частности, не ограничен. Например, с точки зрения количества лекарственного средства для капсулирования и превосходных свойств длительного замедленного высвобождения внешний диаметр вторых липосом может составлять 100-800 нм.
[0035] В типовом варианте осуществления множество вторых липосом присутствует независимо друг от друга в первой липосоме, и количество вторых липосом, в частности, не ограничено.
[0036] Типовая липосомная композиция имеет ионный градиент по меньшей мере между каждой из внутренних областей вторых липосом и внешней средой первой липосомы. В дальнейшем термин "ион" относится к иону, образующему ионный градиент. В типовом варианте осуществления настоящего изобретения то, что между каждой из внутренних областей вторых липосом и внешней средой первой липосомы образуется ионный градиент, может, например, обозначать любое из следующих: (1) имеется различие в концентрации иона по разные стороны внешней мембраны второй липосомы, между внутренней областью второй липосомы и как внутренней областью первой липосомы, так и внешней средой первой липосомы; (2) имеется различие в концентрации иона по разные стороны внешней мембраны первой липосомы, между внутренней областью второй липосомы, так же как внутренней областью первой липосомы, и внешней средой первой липосомы; и (3) имеется различие в концентрации иона по разные стороны внешней мембраны второй липосомы, между внутренней областью второй липосомы и внутренней областью первой липосомы, и имеется различие в концентрации иона по разные стороны внешней мембраны первой липосомы, между внутренней областью первой липосомы и внешней средой первой липосомы (в этом случае концентрация иона во внутренней области первой липосомы имеет значение, промежуточное между концентрацией иона во внутренней области второй липосомы и концентрацией иона во внешней среде первой липосомы).
[0037] В типовом варианте осуществления настоящего изобретения, с точки зрения увеличения введения лекарственного средства, концентрация иона во внутренней области второй липосомы может быть наиболее высокой. Кроме того, может быть выполнена настройка, при которой (концентрация иона во внутренней области второй липосомы) ≥ (концентрация иона во внутренней области первой липосомы) > (концентрация иона во внешней среде первой липосомы). Например, может быть выполнена настройка, при которой (концентрация иона во внутренней области второй липосомы) > (концентрация иона во внутренней области первой липосомы) ≥ (концентрация иона во внешней среде первой липосомы). Например, может быть выполнена настройка, при которой (концентрация иона во внутренней области второй липосомы) > (концентрация иона во внутренней области первой липосомы) > (концентрация иона во внешней среде первой липосомы). Например, случай, в котором (концентрация иона во внутренней области второй липосомы) = (концентрация иона во внутренней области первой липосомы) = (концентрация иона во внешней среде первой липосомы), исключен. Тогда, когда протонный градиент (градиент pH) применен в качестве ионного градиента, высокая концентрация иона (протонная концентрация) соответствует низкому pH. Например, в этом случае pH во внутренней области второй липосомы является наиболее низким.
[0038] В типовом варианте осуществления настоящего изобретения до и после введения лекарственного средства в пустые липосомы форма и внешний диаметр первой липосомы, так же как форма и внешний диаметр вторых липосом, остаются существенно такими же. В типовом варианте осуществления настоящего изобретения у липосом, в которые введено лекарственное средство, внешний диаметр первой липосомы и внешний диаметр вторых липосом остаются существенно такими же, как у пустых липосом, в которые не вводили лекарственное средство.
[0039] В случае, когда лекарственное средство находится внутри липосомной композиции, такая липосомная композиция может содержать лекарственное средство во внутренних областях вторых липосом или во внутренних областях вторых липосом и первой липосомы.
[0040] Количество лекарственного средства, содержащегося в липосомной композиции, в частности, не ограничено и может, соответственно, регулироваться согласно применению композиции. Количество лекарственного средства, с точки зрения молярного отношения [лекарственное средство (моль)/общее содержание липидов (моль)] по отношению к общему содержанию липидов, находящихся в липосомной композиции (общая сумма липида(ов), примененных для получения липосомной композиции), может составлять не менее 0,05 и может составлять 0,06-0,14.
Способ ионного градиента
[0041] Способ ионного градиента представляет собой способ, в котором создается ионный градиент между внутренней областью и внешней средой липосомной мембраны, и лекарственное средство, добавленное во внешнюю среду, переносится через мембрану липосомы по ионному градиенту, посредством чего лекарственное средство капсулируется во внутренней части липосомы. Ионный градиент может представлять собой протонный градиент (например, градиент pH). Способом ионного градиента получают пустые липосомы, в которых не содержится капсулированное лекарственное средство, а лекарственное средство добавляют во внешнюю жидкость вокруг пустых липосом, в результате чего лекарственное средство может быть введено в липосомы.
[0042] В типовом варианте осуществления настоящего изобретения описана липосомная композиция для капсулирования лекарственного средства способом ионного градиента и липосомная композиция, в которой капсулировано лекарственное средство способом ионного градиента. Среди других может быть применен способ градиента pH, в котором градиент pH применяют в качестве ионного градиента.
[0043] В качестве типового способа получения градиента pH липосому получают с применением кислотного-pH буфера (например, раствор лимонной кислоты с pH 2-3) в качестве первой внутренней водной фазы и/или второй внутренней водной фазы, и затем pH во внешней среде первой липосомы устанавливается близким к нейтральному (например, буфер pH 6,5-7,5), посредством чего может быть осуществлен вариант, в котором градиент pH образован таким образом, что внутренняя часть вторых липосом и внутренняя часть первой липосомы имеют более низкий pH, тогда как внешняя среда первой липосомы имеет более высокий pH.
[0044] Например, градиент pH может также быть образован при помощи градиента ионов аммония. В этом случае, например, липосому получают с применением раствора сульфата аммония в качестве первой внутренней водной фазы и/или второй внутренней водной фазы и затем удаляют сульфат аммония из внешней водной фазы первой липосомы или разбавляют, в результате чего образуется градиент ионов аммония по меньшей мере между внутренней областью вторых липосом, так же как внутренней областью первой липосомы, и внешней средой первой липосомы.
[0045] Таким образом можно гарантировать, что благодаря градиенту ионов аммония, образованному таким образом, будет иметь место поток аммиака из внутренних водных фаз первой липосомы и вторых липосом во внешнюю водную фазу первой липосомы. В результате протоны, оставляемые аммиаком, накапливаются во внутренних водных фазах, в результате чего образуется градиент pH, и внутренние водные фазы в первой липосоме и вторых липосомах становятся более кислыми, чем внешняя водная фаза первой липосомы.
Лекарственное средство для капсулирования
[0046] В качестве лекарственного средства для капсулирования в липосомной композиции лекарственное средство может быть применено без каких-либо специальных ограничений. Лекарственное средство может капсулировано в липосомы способом ионного градиента. Такое лекарственное средство может быть ионизируемым амфифильным лекарственным средством, например, амфифильным слабоосновным лекарственным средством. Кроме того, с точки зрения действия, лекарственное средство может быть лекарственным средством, для которого ожидаются свойства замедленного высвобождения при местном введении, например, любое из лекарственных средств для лечения церебрально-сосудистых нарушений, болезни Паркинсона, деменции и т.д., анальгетики, местные анестетики и агенты против злокачественных опухолей. Примеры этих лекарственных средств включают донепезил, ривастигмин, галантамин, физостигмин, гептилфизостигмин, фенсерин, толсерин, симсерин, тиатолсерин, тиацимсерин, неостигмин, гуперзин, такрин, метрифонат, миноциклин, фасудилгидрохлорид, нимодин, морфин, бупивакаин, ропивакаин, левобупивакаин, трамадол, лидокаин и доксорубицин. Другие примеры включают допамин, L-DOPA, серотонин, эпинефрин, кодеин, меперидин, метадон, морфин, атропин, децикломин, метиксен, пропантелин, имипрамин, амитриптилин, доксепин, дезипрамин, хинидин, пропранолол, хлорпромазин, прометазин и перфеназин.
Первый раствор внутренней водной фазы липосомы
[0047] В типовом способе получения липосомной композиции первый раствор внутренней водной фазы, который предназначен для применения на стадии получения первой эмульсии, содержит соединение для создания ионного градиента.
[0048] Ион для создания ионного градиента может быть протоном, как указано выше. Кроме того, примеры соединения для создания ионного градиента (градиента pH) включают такие соединения, которые отдают протон, ион аммония или протонированную аминогруппу при ионизации. Примеры таких соединений включают сульфаты, такие как сульфат аммония, сульфат декстрана и сульфат хондроитина; гидроксиды; ортофосфорная кислота, глюкуроновая кислота, лимонная кислота, угольная кислота, гидрокарбонаты, азотная кислота, циановая кислота, уксусная кислота, бензойная кислота и их соли; галогениды, такие как бромиды и хлориды; неорганические или органические анионы; и анионные полимеры.
[0049] В случае, когда слабоосновное лекарственное средство (например, любое из вышеуказанных) капсулировано во внутренней водной фазе (по меньшей мере второй внутренней водной фазе) в липосомной композиции согласно типовому аспекту настоящего изобретения способом градиента pH, лекарственное средство протонируется протоном, находящимся во внутренней водной фазе, получая таким образом электрический заряд. В результате это препятствует распространению лекарственного средства за пределы липосомы, таким образом лекарственное средство удерживается во внутренней водной фазе липосомы.
[0050] В случае, когда соединение для создания ионного градиента ионизируется, анионы, такие как ионы сульфата, генерируются вместе с ионами (катионами), создавая ионный градиент, такой как протоны. В этом случае, если анион образует соль или комплекс с протонированным слабоосновным лекарственным средством, лекарственное средство может удерживаться во внутренней водной фазе более устойчиво. Другими словами, соединение для создания ионного градиента может быть соединением, которое в результате ионизации образует противоион (анион) для основного лекарственного средства, который может образовывать соль или комплекс с основным лекарственным средством. Такой противоион, в частности, не ограничен до тех пор, пока он представляет собой фармацевтически приемлемый анион. Например, противоион представляет собой ион сульфата. В качестве соединения для образования иона сульфата может быть использован сульфат аммония, но соединение также может быть выбрано из других соединений, таких как сульфат декстрана и сульфат хонтроитина. Кроме того, другие примеры противоиона включают анионы, образованные при ионизации гидроксидов, фосфатов, глюкуронатов, солей лимонной кислоты, карбонатов, гидрокарбонатов, нитратов, цианатов, ацетатов, бензоатов, бромидов, хлоридов и других неорганических или органических анионов или анионных полимеров и т.д.
[0051] В типовом варианте осуществления концентрация соединения для создания ионного градиента в первом внутреннем водном растворе фазы может составлять 50-500 мМ, например, 100-300 мМ.
[0052] В типовом способе получения липосомной композиции растворителем, применяемым для получения липидсодержащего раствора на стадии получения первой эмульсии, является смешивающийся с водой растворитель. Смешивающийся с водой растворитель обозначает растворитель, который растворяет фосфолипид(ы) и другой мембранный компонент(ы), применяемые для получения липосомной композиции согласно типовому аспекту настоящего изобретения, и который смешивается с водой. Примеры смешивающегося с водой растворителя включают этанол, метанол, изопропиловый спирт и бутанол.
[0053] В типовом варианте осуществления настоящего изобретения не применяют растворители, которые не смешиваются с водой (называемые также несмешивающиеся с водой растворители; примеры включают несмешивающиеся с водой органические растворители, такие как хлороформ). Например, когда несмешивающийся с водой растворитель применяют на стадии получения первой эмульсии, получаемая липосома не имеет такую форму, когда в большой липосоме содержится множество небольших липосом и первая внутренняя водная фаза; вместо этого получаемая липосома имеет форму, такую как так называемая мультивезикулярная липосома (MVL), в которой просто собраны индивидуальные липосомы, подобные вспененному полистиролу.
[0054] Количество липида(ов) в качестве исходного вещества для липосом (общая сумма фосфолипида(ов) и другого липида(ов)) может составлять 20-100% масс., например 20-60% масс., по отношению к смешивающемуся с водой растворителю.
[0055] В первой эмульсии (смесь липидсодержащего смешивающегося с водой растворителя и ионсодержащего раствора первой внутренней водной фазы) другой компонент(ы), отличный от компонентов, способных образовывать липидный бислой, может заполнять внутренние области вторых липосом, составляя липосомную композицию типового аспекта настоящего изобретения. Часть второго раствора внутренней водной фазы, который будет описан позже, может быть дополнительно примешана к внутренним областям вторых липосом.
[0056] Способ получения первой эмульсии, в частности, не ограничен, и может быть применен любой подходящий способ.
[0057] В случае, когда применяют способ градиента pH, pH внутренней водной фазы (первая и/или вторая внутренняя область липосомы) может быть установлен по желанию. Например, в случае, когда используется лимонная кислота в качестве соединения для создания ионного градиента в первом растворе внутренней водной фазы, градиент pH между внутренней водной фазой (внутренние области вторых липосом) и внешней водной фазой (внутренняя область первой липосомы и/или внешней средой первой липосомы) может быть создан заранее. Например, в этом случае различие в pH между внутренней водной фазой и внешней водной фазой составляет не менее трех единиц.
[0058] В случае, когда используют сульфат аммония, градиент pH образуется путем химического равновесия, при котором может оказаться ненужным предварительное установление pH раствора внутренней водной фазы. В этом случае, если тот же самый раствор как во внешней водной фазе применяется в качестве второй внутренней водной фазы, образование ионного градиента начинается со времени образования второй эмульсии, и далее градиент растет в результате замены внешней жидкости. В случае, когда тот же самый раствор сульфата аммония, как в первой внутренней водной фазе, применяют в качестве второй внутренней водной фазы, считается, что ионный градиент образуется во время замещения внешней жидкости.
[0059] Для создания липосомной композиции согласно типовому аспекту настоящего изобретения липидсодержащий смешивающийся с водой растворитель и первый раствор внутренней водной фазы, предназначенный для добавления к нему, могут быть применены в объемном соотношении (первого раствора внутренней водной фазы к смешивающемуся с водой растворителю) в диапазоне от 0,7 до 2,5, например, от 1,0 до 2,0.
Второй раствор внутренней водной фазы липосомы
[0060] В типовом варианте осуществления настоящего изобретения после получения первой эмульсии путем добавления первого раствора внутренней водной фазы к липидсодержащему смешивающемуся с водой растворителю проводят стадию добавления второго раствора внутренней водной фазы к первой эмульсии, где второй раствор внутренней водной фазы, в частности, не ограничен. Примеры второго раствора внутренней водной фазы включают такой же раствор, как первый раствор внутренней водной фазы, раствор HEPES, раствор NaCl и водные растворы сахара, такого как глюкоза и сахароза. В типовом варианте осуществления применяют такой же раствор, как для первой внутренней водной фазы. В типовом варианте осуществления первая внутренняя водная фаза и вторая внутренняя водная фаза, каждая, представляет собой водный раствор сульфата аммония. Первая эмульсия и второй раствор внутренней водной фазы, который предполагается к ней добавить, могут быть применены в объемном соотношении [второй раствор внутренней водной фазы] к [первой эмульсии (= первый раствор внутренней водной фазы + смешивающийся с водой растворитель)] не менее 0,7, например, в диапазоне от 0,7 до 2,5, например, в диапазоне от 1,0 до 1,5.
[0061] Во второй эмульсии другой компонент(ы), отличный от компонента(ов), способных образовывать липидный бислой, может заполнять внутреннюю область первой липосомы (исключая вторые липосомы), составляя липосомную композицию согласно типовому аспекту настоящего изобретения. Внутренняя область первой липосомы (исключая вторые липосомы) может содержать часть первой эмульсии.
[0062] Способ получения второй эмульсии, в частности, не ограничен, и может быть применен любой подходящий способ.
Раствор внешней водной фазы липосомы
[0063] Способ получения липосомной композиции согласно типовому аспекту настоящего изобретения включает стадию замещения внешней водной фазы второй эмульсии водным раствором с меньшей концентрацией соединения для создания ионного градиента, чем в первом растворе внутренней водной фазы.
[0064] Когда внешняя водная фаза первой липосомы после получения второй эмульсии изменяется в результате замещения второго раствора внутренней водной фазы липосомы или смешанной жидкости, содержащей первый раствор внутренней водной фазы липосомы, и второго раствора внутренней водной фазы липосомы водным раствором, в котором концентрация соединения для создания ионного градиента по меньшей мере меньше, чем в первом растворе внутренней водной фазы, гарантируется, что образуется ионный градиент по меньшей мере между каждой из внутренних областей вторых липосом и внешней средой первой липосомы, что смешивающийся с водой растворитель удаляется из системы липосомной композиции и что получаемая липосома будет иметь форму, присущую липосомной композиции согласно типовому аспекту настоящего изобретения.
[0065] В качестве замещаемой внешней водной фазы, применяемой в типовом способе получения липосомной композиции, применяют водный раствор с концентрацией соединения для создания ионного градиента по меньшей мере меньшей, чем в первом растворе внутренней водной фазы. Например, применяют раствор HEPES, раствор NaCl или водный раствор сахара, такого как глюкоза и сахароза. pH внешней водной фазы может быть настроен при помощи буфера. Принимая во внимание разложение липида и интервал pH во время введения в живой организм, pH можно контролировать в пределах диапазона pH 5,5-8,5, например, диапазона pH 6,5-7,5. Осмотическое давление внутренней водной фазы и внешней водной фазы для липосомы, в частности, не ограничено. Осмотическое давление можно регулировать в пределах таких диапазонов, чтобы липосома не разорвалась из-за различия между осмотическими давлениями. С учетом желаемой физической устойчивости липосомы меньшее различие в осмотическом давлении может быть более желательно.
[0066] Один типовой вариант осуществления замещаемой внешней водной фазы представляет собой водный раствор с меньшей концентрацией соединения для создания ионного градиента, чем в первом растворе внутренней водной фазы и втором растворе внутренней водный фазы.
[0067] Способ получения липосомной композиции согласно типовому аспекту настоящего изобретения может дополнительно включать стадию введения лекарственного средства во внутреннюю часть липосомной композиции посредством движущей силы, возникающей в результате ионного градиента. На стадии введения лекарственного средства во внутреннюю часть липосомной композиции посредством движущей силы, возникающей в результате ионного градиента, например, лекарственное средство растворяют в воде и т.п. Получающийся раствор лекарственного средства добавляют к смеси липосом, полученной после замещения внешней водной фазы липосомы раствором внешней водной фазы липосомы, с последующим перемешиванием смеси. Например, данную смесь перемешивают с нагреванием до или выше температуры фазового перехода липосомной мембраны, в результате чего может быть получена липосома, в которой капсулировано лекарственное средство.
Способ введения
[0068] Способ введения липосомной композиции согласно типовому аспекту настоящего изобретения, в частности, не ограничен. Например, липосомную композицию вводят неперорально и местно. Например, может быть выбрано подкожное, внутримышечное, внутрибрюшинное, интратекальное, экстрадуральное или интравентрикулярное введение. Способ введения может быть подходящим образом выбран согласно соответствующему симптому. В качестве конкретного способа введения липосомной композиции может быть указано введение при помощи шприца или устройства разбрызгивающего типа. Кроме того, введение может быть выполнено через катетер, вставленный в живой организм, например, в полость тела, например, в кровеносный сосуд.
Примеры
[0069] Типовые аспекты настоящего изобретения будут описаны более подробно ниже с демонстрацией примеров, но такие типовые аспекты не ограничены примерами.
[0070] Концентрация и диаметр частицы каждой из заполненных лекарственным средством липосом, полученных в примерах, определяли следующим образом.
[0071] Концентрация фосфолипида (мг/мл): концентрация фосфолипида в суспензии липосомы, которую определяют количественно при помощи высокоэффективной жидкостной хроматографии или определением фосфолипидов.
[0072] Концентрация холестерина (мг/мл): концентрация холестерина в суспензии липосомы, которую определяют количественно высокоэффективной жидкостной хроматографией.
[0073] Общая концентрация липида (моль/л): Общая молярная концентрация (мМ) липида(ов) в качестве компонента(ов) мембраны, которую вычисляют из концентрации фосфолипида и концентрации холестерина.
[0074] Концентрация лекарственного средства (мг/мл): липосомную композицию разбавляли RO водой (вода, очищенная при помощи обратного осмоса) так, чтобы общая концентрация липида в препарате, получаемом выше, была приблизительно 20-30 мг/мл. Затем разбавленную липосомную композицию дополнительно разбавляли метанолом в 20 раз, и липосома разлагалась. Для получаемого раствора спектральную поглощательную способность при 315 нм определяли количественно при помощи высокоэффективной жидкостной хроматографии с применением УФ абсорбциометра. Концентрация капсулированного донепезила гидрохлорида показана в виде количества лекарственное средство (мг)/общее количество препарата (мл).
[0075] Количество подложки лекарственного средства (молярное отношение лекарственное средство/общее количество липида): концентрация донепезила гидрохлорида, капсулированного в липосомах, показана в виде молярного отношения лекарственное средство/общее количество липида, вычисленного из отношения концентрации лекарственного средства к общей концентрации липида.
[0076] Концентрация донепезила гидрохлорида в плазме (мг/мл): Образец плазмы обрабатывали, и в надосадочном растворе, получаемом на конечной стадии центрифугированием, количественно определяли флуоресценцию при длине волны возбуждения (Ex) 322 нм и длине волны детектирования (Em) 385 нм при помощи высокоэффективной жидкостной хроматографии с применением флуорофотометра.
[0077] Диаметр частицы (мкм): Средний диаметр частицы первой липосомы, измеренный при помощи лазерно-диффракционного анализатора распределения частиц по размерам Beckman Coulter LS230.
[0078] Сокращенные обозначения и молекулярные массы примененных компонентов приведены ниже.
HSPC: Гидрогенизированный соевый фосфатидилхолин (молекулярная масса 790, SPC3, производства Lipoid GmbH)
SPC: Соевый фосфатидилхолин (молекулярная масса 779, NOF Corporation)
DMPC: Димиристоилфосфатидилхолин (молекулярная масса 677,9, NOF Corporation)
Chol: Холестерин (молекулярная масса 388,66, производства Solvay S.A.)
PEG5000-DSPE: полиэтиленгликоль (молекулярная масса 5000)-Фосфатидилэтаноламин (молекулярная масса 6081, NOF Corporation)
Донепезила гидрохлорид (молекулярная масса 415,95, UINAN CHENGHUI-SHUANFDA Chemical Co., Ltd.)
Получение различных внутренних водных фаз
(Примеры получения 1-4)
(1) Получение пустой липосомы
[0079] HSPC и холестерин в количествах, соответственно, 1,41 г и 0,59 г взвешивали так, чтобы выполнялось соотношение HSPC/Chol=54/46 (молярное отношение, здесь и далее в настоящем описании), затем добавляли 4 мл безводного этанола и ускоряли растворение нагреванием. К раствору липида в этаноле, таким образом, полученному растворением, добавляли 100 мМ (Пример получения 1), 150 мМ (Пример получения 2) или 250 мМ (Пример получения 3) водного раствора сульфата аммония или 300 мМ водного раствора лимонной кислоты (pH 3,0) (Пример получения 4), нагретого до приблизительно 70°C в таком же количестве (4 мл), как этанол. Каждую смесь нагревали и перемешивали в течение приблизительно десяти минут для получения эмульсии. Кроме того, к эмульсии примешивали 10 мл 20 мМ HEPES/0,9% хлорида натрия (pH 7,5), нагретого до приблизительно 70°C, с последующим нагреванием и перемешиванием в течение приблизительно десяти минут. После того как заканчивали нагревание, липосомы сразу же охлаждали при помощи льда.
(2) Создание градиента pH
[0080] Липосомы, полученные как описано выше, диспергировали в добавленном к ним 20 мМ растворе HEPES/0,9% хлорида натрия (pH 7,5) с последующим центрифугированием при 3500 оборотах в минуту в течение 15 минут для осаждения липосом. После этого супернатант удаляли и затем липосомы диспергировали в добавленном к ним 20 мМ растворе HEPES/0,9% хлорида натрия с pH 7,5 с последующим центрифугированием таким же образом, как описано выше. Эту стадию повторяли три раза с последующим повторным диспергированием в 20 мМ растворе HEPES/0,9% хлорида натрия с pH 7,5 для создания градиента pH.
(3) Введение лекарственного средства при помощи градиента pH
[0081] После создания ионного градиента определяли количества HSPC и холестерина в липосомах и вычисляли общую концентрацию липидов. На основе общей концентрации липидов, таким образом, вычисляли количество донепезила гидрохлорида (DNP, молекулярная масса 415,95), необходимого для получения соотношения DNP/общее количество липида (моль/моль), равного 0,16. После взвешивания количества DNP получали раствор DNP (раствор лекарственного средства) с концентрацией 20 мг/мл с использованием воды, очищенной при помощи обратного осмоса. Заранее определенное количество раствора DNP, предварительно нагретого до 65°C, добавляли к раствору липосом, предварительно нагретому до 65°C, с последующим нагреванием и перемешиванием при 65°C в течение 60 минут для ускорения введения лекарственного средства. После введения лекарственного средства липосомы сразу же охлаждали при помощи льда.
(4) Удаление некапсулированного лекарственного средства
[0082] После введения лекарственного средства липосомы диспергировали в добавленном к ним 20 мМ растворе HEPES/0,9% хлорида натрия (pH 7,5) с последующим центрифугированием при 3500 оборотах в минуту в течение 15 минут для осаждения липосом. После этого супернатант удаляли и затем липосомы диспергировали в добавленном к ним 20 мМ растворе HEPES/0,9% хлорида натрия (pH 7,5) с последующим центрифугированием таким же образом, как описано выше. Эту стадию повторяли три раза, таким образом удаляя некапсулированное лекарственное средство.
[0083] Для липосомной композиции в примерах получения 1-4, полученных вышеуказанным способом получения, первые внутренние водные фазы, отношения в композициях мембраны, количество подложки лекарственного средства (молярные отношения лекарственное средство/общее количество липида) и диаметры частиц приведены в таблице 1. По результатам наблюдения в электронный микроскоп липосомные композиции согласно типовым аспектам настоящего изобретения выглядят, как показано на фиг.1, в которых множество пузырьков (вторые липосомы) присутствуют в каждой липосоме (первой липосоме) и в которых внешняя мембрана каждой липосомы составлена из многослойного липидного бислоя. Кроме того, несмотря на то, что липосома имеет толстый многослойный липидный бислой и содержит в себе множество пузырьков, каждый из которых имеет таким же образом многослойный липидный бислой, после образования липосом между внутренней областью и внешней средой липосом может быть создан градиент pH, достаточный для введения лекарственного средства. Следовательно, лекарственное средство может быть высокоэффективно капсулировано при помощи градиента pH.
[0084] Фиг.1 представляет собой фотографию среза липосомы после введения лекарственного средства, полученной в примере получения 2 согласно этому примеру, при наблюдении в трансмиссионный электронный микроскоп (TEM). Увеличение составляло 32000. Липосома, показанная на фиг.1, разрезана существенно по центру липосомы. Липосома, показанная на фиг.1, включает первую липосому, содержащую внешнюю мембрану, составленную из многослойного липидного бислоя, и множество вторых липосом, которые располагаются во внутренней области первой липосомы, образованной внешней мембраной, и каждая из которых имеет внешнюю мембрану, составленную из многослойного липидного бислоя. На фиг.1 внешний диаметр первой липосомы составляет приблизительно 4 мкм и внешний диаметр вторых липосом составляет 100-800 нм.
[0085] Кроме того, для липосомной композиции из примеров получения 1-4, полученных вышеуказанным способом получения, ясно, что количество капсулируемого лекарственного средства увеличивается в зависимости от увеличения концентрации сульфата аммония во внутренней водной фазе. Не ограничивая какой-либо конкретной теорией, считается, что это происходит потому, что способность удерживать лекарственное средство увеличивается в зависимости от количества протонов, остающихся во внутренней водной фазе. Поэтому, считается, что концентрация сульфата аммония, составляющая не менее 150 мМ, является типовой для достижения капсулирования более высокого количества лекарственного средства. В случае применения раствора лимонной кислоты с pH 3,0 в качестве внутренней водной фазы вместо сульфата аммония таким же образом получали липосому, содержащую высокое количество капсулированного лекарственного средства.
Объемное соотношение, II: Объемное соотношение вторая внутренняя водная фаза/(первая внутренняя водная фаза+этанол).
AS: сульфат аммония.
CA: лимонная кислота.
Исследование различных объемов внутренней водной фазы
(Пример получения 5)
[0086] HSPC и холестерин в количествах 1,41 г и 0,59 г соответственно взвешивали так, чтобы выполнялось соотношение HSPC/Chol=54/46, и их растворяли в 4 мл раствора этанола. После растворения этаноловый раствор липида смешивали с двойным количеством (8 мл) 150 мМ водного раствора сульфата аммония с последующим нагреванием и перемешиванием в течение приблизительно десяти минут. Затем к нему добавляли 19 мл 150 мМ водного раствора сульфата аммония и полученную смесь нагревали и перемешивали в течение приблизительно десяти минут. После этого создавали градиент pH и осуществляли введение лекарственного средства и удаление некапсулированного лекарственного средства таким же образом, как в примерах получения 1-4. В результате получали большое количество капсулированного лекарственного средства, таким же образом, как в примерах получения 1-4, как показано в таблице 1.
(Пример получения 6)
[0087] В качестве фосфолипида использовали DMPC с небольшой длиной углеродной цепи алкильной группы. DMPC и холестерин в количествах соответственно 2,70 г и 1,30 г взвешивали так, чтобы выполнялось соотношение DMPC/Chol=54/46, и растворяли в 4 мл раствора этанола. Затем 4 мл 150 мМ водного раствора сульфата аммония добавляли к раствору DMPC и холестерина в этаноле с последующим нагреванием и перемешиванием в течение приблизительно десяти минут. Затем к нему добавляли 10 мл 150 мМ водного раствора сульфата аммония с последующим нагреванием и перемешиванием в течение приблизительно десяти минут. Затем создавали градиент pH и осуществляли введение лекарственного средства и удаление некапсулированного лекарственного средства таким же образом, как в примерах получения 1-4.
[0088] В результате обнаружили, что, также как в том случае, когда длина углеродной цепи алкильной группы фосфолипида была небольшой, было получено большое количество капсулированного лекарственного средства таким же образом, как в примерах получения 1-4, как показано в таблице 1.
Получение DNP липосомы другим способом (пассивный способ), отличным от способа ионного градиента
(Сравнительный пример 1)
[0089] Для введения лекарственного средства применяли пассивный способ (который является сравнительным способом) вместо способа ионного градиента. Пассивный способ представляет собой способ, в котором липосомы получают путем предварительного растворения лекарственного средства во внутренней водной фазе. Заранее определенное количество донепезила гидрохлорида предварительно растворяли в физиологическом растворе, применяемом в качестве первого раствора внутренней водной фазы. После этого получение липосом осуществляли таким же образом, как в примерах получения 1-4. Физиологический раствор применяли в качестве внешней водной фазы.
[0090] В результате стало ясно, что эффективность капсулирования и количество капсулируемого лекарственного средства заметно снизились по сравнению с липосомами, полученными типовым способом, как показано в таблице 2. Кроме того, липосомные композиции согласно сравнительному примеру 1 и примерам настоящего изобретения сравнивали друг с другом в отношении свойств высвобождения лекарственного средства при помощи системы оценки in vitro. В результате стало ясно, что высвобождение лекарственного средства было намного быстрее в сравнительном примере 1, чем в примерах настоящего изобретения.
[0091] Из предшествующего ясно, что для обеспечения количества капсулированного лекарственного средства на клинически достаточном уровне и для получения свойства длительного замедленного высвобождения может быть желательно введение лекарственного средства способом ионного градиента, в частности, способом градиента pH. Также стало ясно, что когда лекарственное средство вводится способом ионного градиента, например способом градиента pH, лекарственное средство протонируется во внутренней части липосом, и липосомы имеют слоистую структуру, как показано на фиг.1, посредством чего могут быть получены свойства длительного замедленного высвобождения.
Создание липосомы с донепезилом различными способами получения
(Сравнительный пример 2) Экструзионный способ 1 (диаметр частицы: приблизительно 300 нм)
[0092] HSPC и холестерин в количествах соответственно 0,71 г и 0,29 г взвешивали так, чтобы выполнялось соотношение HSPC/Chol=54/46, и растворяли с нагреванием в 1 мл добавленного к ним безводного этанола. Раствор липида в этаноле, полученный таким образом в количестве 1 мл, смешивали с 9 мл 250 мМ водного раствора сульфата аммония (внутренняя водная фаза), нагретого до приблизительно 70°C, с последующим перемешиванием в ультразвуковом устройстве при нагревании для получения неочищенной суспензии липосом. Неочищенную суспензию липосом, полученную таким образом, пропускали последовательно через фильтр (диаметр пор 0,4 мкм, Whatman plc; пять раз), присоединенный к экструдеру (Экструдер T.10, Lipexbiomembranes Inc.), нагретому до приблизительно 70°C для получения пустых липосом с размером приблизительно 300 нм. Затем, поддерживая липосомы в нагретом состоянии, сразу же добавляли водный раствор PEG5000-DSPE (37,7 мг/мл) в таком количестве, чтобы он составлял 0,75% мол. по отношению к общему содержанию липидов, с последующим нагреванием и перемешиванием, посредством чего мембранные поверхности (наружные поверхности) липосом модифицировались ПЭГ. После завершения нагревания липосомы сразу же охлаждали при помощи льда. ПЭГ-модифицированные липосомы, охлажденные таким образом льдом, подвергали замещению внешней жидкости при помощи гель-фильтрации, при которой осуществлялось существенное замещение раствора внешней водной фазы (20 мМ HEPES/0,9% раствор хлорида натрия (pH 7,5)). После этого введение лекарственного средства проводили так, чтобы соотношение лекарственное средство/общее количество липида (моль/моль)=0,16. Затем удаляли некапсулированное лекарственное средство при помощи гель-фильтрации, при которой существенно замещали 20 мМ раствором HEPES/0,9% хлорида натрия (pH 7,5).
(Сравнительный пример 3) Экструзионный способ 2 (диаметр частицы: приблизительно 1-2 мкм)
[0093] Получение осуществляли при помощи экструдера таким же образом, как в сравнительном примере 2, за исключением того, что к экструдеру был присоединен фильтр с диаметром пор 2 мкм, и исходную суспензию липосом пропускали через фильтр пять раз для получения пустых липосом. Получение осуществляли путем введения лекарственного средства и удаления некапсулированного лекарственного средства таким же образом, как в сравнительном примере 2, для получения многослойных липосом размером приблизительно 1-2 мкм.
(Сравнительный пример 4) Способ введения липидной мембраны
[0094] Водный раствор соляной кислоты и лимонной кислоты с pH 6,5 в качестве раствора первой внутренней водной фазы добавляли к раствору этанола, содержащему растворенные в нем HSPC и донепезил, посредством чего донепезил гидрохлорида капсулировался в липидной мембране. Липосомы донепезила получали таким же образом, как в сравнительном примере 1, за исключением только что указанных моментов.
[0095] Для липосом с донепезилом, полученных в сравнительных примерах 2-4, первые внутренние водные фазы, соотношения в композиции мембраны, количества подложки лекарственного средства (молярные отношения лекарственное средство/общее количество липида) и диаметры частиц приведены в таблице 3.
[0096] В результате для липосомной композиции (сравнительные примеры 2 и 3) с небольшими диаметрами частиц, полученных экструзионным способом, получали большие количества капсулированного лекарственного средства. С другой стороны, при получении (сравнительный пример 4), в котором лекарственное средство инкапсулируется в липидной мембране, отношение лекарственное средство/общее количество липида было сравнительно низким, и эффективность капсулирования составляла приблизительно 33%.
Динамика лекарственного средства в липосомах с донепезилом 1
[0097] Проводили тесты на динамику лекарственного средства в липосомных композициях с донепезилом, полученных в примерах получения 2, 3 и 4 и сравнительных примерах 2, 3 и 4, так же как донепезила, примененного в отдельности. Каждую из липосомных композиций с донепезилом в объемах, приведенных в таблице 4 в виде количества донепезила гидрохлорида, вводили подкожно в спину крысы. Случайным образом для донепезила гидрохлорида, примененного в отдельности, так же осуществляли внутривенное введение, как и подкожное введение. Через 1, 4, 8, 24, 48, 72, 96, 168, 192, 216, 240, 264 и 336 часов после введения образец крови отбирали из вены хвоста и подвергали центрифугированию (6000 оборотов в минуту, десять минут при 4°C), посредством чего получали фракцию плазмы. Полученную таким образом плазму обрабатывали и определяли интенсивность флуоресценции при длине волны возбуждения (Ex) 322 нм и длине волны детектирования (Em) 385 нм при помощи высокоэффективной жидкостной хроматографии, таким образом определяя концентрацию донепезила гидрохлорида в каждом образце плазмы. Результаты показаны на фиг.2 и 3.
SC = подкожное введение.
[0098] Как показано на фиг.2, концентрация донепезила гидрохлорида в крови при введении донепезила гидрохлорида в отдельности внутривенно или подкожно уменьшалась быстро после введения и его обнаружение продолжалось только в течение восьми часов и 48 часов после применения, соответственно. Липосомная композиция с диаметром частиц приблизительно 300 нм, полученных в сравнительном примере 2, не показала начального выброса в отличие от донепезила, примененного в отдельности. Несмотря на то, что она показывала замедленное высвобождение спустя 48 часов, концентрация уже снизилась до менее 10 нг/мл через 48 часов после введения. Не желая ограничивать какой-либо конкретной теорией, считается, что, когда диаметр частицы является сравнительно небольшим, таким как приблизительно 300 нм, липосомы склонны диффундировать в область введения, и предполагается, что донепезила гидрохлорид переносится в лимфатические узлы или в кровь вместе с липосомами. Поэтому считается, что липосомы рано теряются, и ожидаемые свойства длительного высвобождения не могут быть достигнуты. Кроме того, в сравнительном примере 4, в котором лекарственное средство капсулировано в липидной мембране, исходное количество высвобождения было большим, а после этого концентрация донепезила гидрохлорида в крови быстро снижалась, так что нельзя было получить свойства длительного замедленного высвобождения. Вероятно, из-за высокой проницаемости липидной мембраны для донепезила гидрохлорида капсулированный в мембране донепезила гидрохлорид не удерживался в ней хорошо, и, в результате, проявлялись свойства быстрого высвобождения.
[0099] С другой стороны, как показано на фиг.3, липосомные композиции, полученные в примерах получения 2, 3 и 4, не проявляли начальный выброс, а показывали заметное продление длительности замедленного высвобождения. Таким образом, удалось получить свойства замедленного высвобождения в течение приблизительно двух недель. Как показано на фиг.1, липосомная композиция согласно примеру настоящего изобретения содержит множество пузырьков в каждой липосоме, и липосомы окружены толстой липидной мембраной, обладающей слоистой структурой, составленной из множества слоев. Считается, что проницаемость липидной мембраны для лекарственного средства подавляется благодаря этим структурам. Дополнительно, считается, что, поскольку лекарственное средство удерживается способом градиента pH, высвобождение ограничено еще больше, так что в итоге могут быть получены свойства значительно длительного замедленного высвобождения. Например, в присутствии ионов сульфата во внутренней водной фазе (Примеры получения 2 и 3), время замедленного высвобождения увеличивалось больше. Таким образом, применение сульфата аммония в качестве раствора внутренней водной фазы является типовым. Это показывает, что взаимодействие протонированного лекарственного средства с ионами сульфата во внутренней водной фазе больше подавляет скорость высвобождения, и, следовательно, могут быть получены свойства длительного замедленного высвобождения.
[0100] Из предшествующего установлено, что для ограничения начального выброса и получения свойств длительного замедленного высвобождения может быть желательно, чтобы липосомы имели форму как показано на фиг.1, лекарственное средство было капсулировано способом градиента pH и, например, ионы сульфата присутствовали во внутренней водной фазе.
[0101] Что касается липосомной композиции с диаметром частиц приблизительно 1,7 мкм, полученных при помощи экструдера в сравнительном примере 3, высокая концентрация в крови поддерживалась в течение четырех дней, после чего она быстро снизилась.
Динамика лекарственного средства в липосомах с донепезилом 2
[0102] В липосомной композиции согласно типовому аспекту настоящего изобретения может быть получено большое количество капсулированного лекарственного средства, так что доза лекарственного средства при подкожном введении может быть увеличена. С учетом этого липосомные композиции с донепезилом, полученные в примерах получения 5 и 6, вводили подкожно в спину крысы с дозой донепезила гидрохлорида 50 мг/кг. Кроме того, для сравнения, донепезил, примененный в отдельности, вводили подкожно в спину крысы в дозе 5 мг/кг. В случаях применения донепезила в отдельности кровь отбирали из вены хвоста по истечении 0,5, 1, 5, 10, 30, 120, 480, 1440 и 2880 минут после введения. С другой стороны, в случаях применения липосомных композиций кровь отбирали из вены хвоста по истечении 1, 3, 4, 8, 24, 48, 72, 96, 120, 144, 168, 192, 216, 264, 288, 312 и 336 часов после введения. После забора крови проводили такую же обработку, как в варианте <Динамика лекарственного средства в липосомах с донепезилом 1>, и определяли концентрацию донепезила гидрохлорида в каждом образце плазмы. Результаты показаны на фиг.4.
[0103] Как показано на фиг.4, донепезил, примененный в отдельности, показывал свою максимальную концентрацию в крови через 0,5 часа после введения, с последующим быстрым снижением. Через 48 часов концентрация уже была меньше предела обнаружения.
[0104] С другой стороны, типовые липосомные композиции, полученные в примерах получения 5 и 6, не проявляли начального выброса и обеспечивали эффективную концентрацию на клинически достаточном уровне в течение более 14 дней. Например, в случае примера получения 5, концентрация в крови в 20-30 нг/мл поддерживалась постоянной в течение 14 дней. Кроме того, была видна тенденция к тому, что свойства замедленного высвобождения могли иметь место в течение более 14 дней. Таким образом, было установлено, что эта липосомная композиция представляет собой превосходный препарат в качестве препарата с длительным замедленным высвобождением.
Исследование соотношения первая внутренняя водная фаза/этанол и соотношения вторая внутренняя водная фаза/(первая внутренняя водная фаза + этанол)
(Примеры получения 7-11 и сравнительные примеры 5-7)
[0105] HSPC и холестерин в количествах соответственно 1,41 г и 0,59 г взвешивали так, чтобы выполнялось соотношение HSPC/Chol=54/46, и растворяли при нагревании в 4 мл добавленного к ним безводного этанола. После растворения раствор липида в этаноле, полученный таким образом, примешивали к 150 мМ водного раствора сульфата аммония (первая внутренняя водная фаза), нагретого до приблизительно 70°C, в каждом из соотношений, показанных в таблице 1, с последующим нагреванием и перемешиванием в течение приблизительно десяти минут. Затем добавляли вторую внутреннюю водную фазу (20 мМ буфер HEPES/0,9% хлорид натрия (pH 7,5)) в каждом из соотношений, показанных в таблице 1, на основе объема (первая внутренняя водная фаза + этанол) с последующим нагреванием и перемешиванием в течение приблизительно десяти минут. После этого образовывался градиент pH, и введение лекарственного средства и удаление некапсулированного лекарственного средства осуществляли таким же образом, как в примерах получения 1 и 2.
[0106] Таблица 1 показывает соотношения первая внутренняя водная фаза/этанол, соотношения вторая внутренняя водная фаза/(первая внутренняя водная фаза + этанол), количества подложки лекарственного средства (молярные соотношения лекарственное средство/общее количество липида) и диаметры частицы для липосомных композиций, полученных в примерах получения 7-11 и сравнительных примерах 5-7.
[0107] Таблица 6 показывает сравнение примеров получения 2, 5 и 7-11 и сравнительных примеров 5-7 в отношении количества подложки лекарственного средства.
[0108] В результате стало ясно, что в примерах получения 7-11 можно получить количество подложки лекарственного средства, сопоставимое с таковым в примерах получения 2 и 5, и можно получить сравнительно высокое количество капсулированного лекарственного средства. Кроме того, примеры показали существенно одинаковое поведение в отношении свойств высвобождения in vitro.
[0109] С другой стороны, в сравнительном примере 5 получили заметно низкое количество капсулированного лекарственного средства. Не желая ограничивать какой-либо конкретной теорией, считается, что причина этого в том, что из-за низкого соотношения первая внутренняя водная фаза/этанол первая эмульсия образовалась не в чистом виде, а, следовательно, образовалось что-то похожее на липидные шарики (агрегированный липид). Кроме того, в отношении сравнительных примеров 6 и 7, не желая ограничивать какой-либо конкретной теорией, считается, что, поскольку соотношение первая внутренняя водная фаза/этанол является большим, образуется что-то похожее на большую липосому, устойчивую в этот момент времени, и вторая внутренняя водная фаза не влияет на эти структуры. Дополнительно, что касается in vitro свойств высвобождения в сравнительных примерах 5, 6 и 7, имела место тенденция к большей начальной скорости высвобождения по сравнению с примерами получения 2, 5 и 7-11. Не желая ограничивать какой-либо конкретной теорией, исходя из этих результатов, предполагается, что в сравнительных примерах 5, 6 и 7 внутренняя водная фаза не имеет четко образованную структуру, так, что достаточное количество лекарственного средства не капсулируется устойчиво во внутренней водной фазе, что приводит к немного сниженному количеству капсулированного лекарственного средства и высокой начальной скорости высвобождения. Не желая ограничивать какой-либо конкретной теорией, в сравнительном примере 3, слои липидной мембраны считаются очень тонкими из-за структуры, в которой внутри образуется большая внутренняя водная фаза, тем не менее липосома имеет многослойную мембрану. В результате, считается, что количество капсулированного лекарственного средства является очень большим, и также высвобождение является очень быстрым.
Лекарственное средство/липид (моль/моль)
(Пример получения 5)
(Пример получения 7)
(Пример получения 2)
(Пример получения 8)
(Пример получения 9)
(Пример получения 10)
(Пример получения 5)
(Пример получения 11)
(Пример получения 7)
Получение липосомы с бупивакаина гидрохлоридом согласно примеру настоящего изобретения
(Примеры получения 12 и 13)
[0110] Таким же образом, как в примерах получения 1-4, HSPC и холестерин взвешивали в количествах соответственно 4,23 г и 1,76 г так, чтобы выполнялось соотношение HSPC/Chol=54/46, и растворяли в 24 мл добавленного к ним раствора этанола. После растворения раствор липида в этаноле смешивали с таким же количеством (24 мл) 150 мМ или 250 мМ водного раствора сульфата аммония с последующим нагреванием при перемешивании в течение приблизительно десяти минут. После этого добавляли 76,8 мл 150 мМ или 250 мМ водного раствора сульфата аммония с последующим нагреванием при перемешивании в течение приблизительно десяти минут и после этого сразу же охлаждали при помощи льда. Затем проводили центрифугирование, чтобы заменить внешнюю водную фазу на 10 мМ лимонная кислота/0,9% хлорид натрия с pH 6,5, таким образом создавая ионный градиент.
[0111] После этого осуществляли введение лекарственного средства таким же образом, как в примерах получения 1-4. В качестве лекарственного средства применяли бупивакаина гидрохлорид. После взвешивания определенного количества бупивакаина гидрохлорида (BPV) его растворяли в воде, очищенной обратным осмосом, для получения раствора BVP (раствора лекарственного средства) с концентрацией 10 мг/мл, который перемешивали с нагреванием при 65°C в течение 60 минут, посредством чего осуществлялось введение лекарственного средства. После введения лекарственного средства липосомы сразу же охлаждали при помощи льда. Затем удаление некапсулированного лекарственного средства проводилось таким же образом, как в примерах получения 1-4.
[0112] В результате, как показано в таблице 1, стало ясно, что в случае применения бупивакаина гидрохлорида можно получить сравнительно большое количество капсулированного лекарственного средства, как в случае с липосомой с донепезилом. Исходя из этих результатов, установили, что бупивакаина гидрохлорид может также быть введен способом градиента pH в липосому, обладающую структурой как на фиг.1.
Динамика лекарственного средства в липосоме с гидрохлорида бупивакаином
[0113] Для липосомы с бупивакаина гидрохлоридом, полученной в примере получения 12, и бупивакаина гидрохлорида, примененного в отдельности, проводили тест на динамику лекарственного средства. Подкожное введение в спину крысы делали в дозе в соответствии с количеством бупивакаина гидрохлорида, как указано в таблице 7. По истечении 1, 24, 72, 120 и 168 часов после введения липосомной композиции с бупивакаина гидрохлоридом и по истечении 0,5, 4 и 24 часов после введения бупивакаина гидрохлорида, примененного в отдельности, подкожную ткань спины из области введения отбирали и подвергали обработке гомогенизацией. Затем обрабатывали гомогенизированный раствор, полученный в результате образец раствора разделяли при помощи высокоэффективной жидкостной хроматографии (абсорбциометр УФ-видимого спектра; при длине волны измерения 210 нм), и определяли концентрацию бупивакаина гидрохлорида, оставшегося в подкожной ткани спины из области введения. Результаты показаны на фиг.5. Процент удержания бупивакаина гидрохлорида (примененного в отдельности) в области введения снизился до менее 1% в течение четырех часов после введения. Исходя из этого результата, было установлено, что бупивакаина гидрохлорид, примененный в отдельности, исчезает из участка введения через несколько часов после введения, это показывает, что устойчивая концентрация в крови не достигается в таком сравнительном примере. С другой стороны, липосома с бупивакаина гидрохлоридом показала профиль длительного высвобождения из участка введения, и приблизительно 35% бупивакаина гидрохлорида оставалось на седьмой день после введения. Исходя из этих результатов, было предположено, что введенная липосома замедленно высвобождает бупивакаина гидрохлорид на участке введения. Из предшествующего было установлено, что липосома с бупивакаина гидрохлоридом, полученная согласно примерам настоящего изобретения, обладает способностью к длительному замедленному высвобождению в течение не менее одной недели.
Получение липосомы с ропивакаина гидрохлоридом согласно примеру настоящего изобретения
(Пример получения 14)
[0114] Липосомную композицию получали таким же образом, как в примере получения 2, за исключением того, что в качестве лекарственного средства применяли ропивакаина гидрохлорид для получения липосомы с ропивакаина гидрохлоридом.
[0115] В результате, как показано в таблице 1, стало ясно, что также в случае применения ропивакаина гидрохлорида можно вводить лекарственное средство способом градиента pH и получать липосомные композиции, содержащие сравнительно большое количество капсулированного лекарственного средства таким же образом, как описано выше. Также, что касается свойств высвобождения in vitro, был продемонстрирован профиль высвобождения, сопоставимый с таковым в случаях с липосомами с донепезила гидрохлоридом и липосомами с бупивакаина гидрохлоридом, показавшими свойства замедленного высвобождения. Это указывает на то, что применение ропивакаина гидрохлорида обеспечивает такую же скорость высвобождения, как в случаях с донепезила гидрохлоридом и бупивакаина гидрохлоридом.
Получение липосомы с трамадола гидрохлоридом согласно примеру настоящего изобретения
(Пример получения 15)
[0116] Липосомную композицию получали таким же образом, как в примере получения 3, за исключением того, что в качестве лекарственного средства применяли трамадола гидрохлорид для получения липосомы с трамадола гидрохлоридом.
[0117] В результате, как показано в таблице 1, было установлено, что также в случае применения трамадола гидрохлорида возможно введение лекарственного средства способом градиента pH и получение липосомной композиции, содержащей сравнительно большое количество капсулированного лекарственного средства, таким же образом, как описано выше.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2571077C2 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2018 |
|
RU2734900C1 |
| ЛИПОСОМАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2007 |
|
RU2494729C2 |
| ЛИПОСОМА, ИМЕЮЩАЯ ВНУТРЕННЮЮ ВОДНУЮ ФАЗУ, СОДЕРЖАЩУЮ СОЛЬ СУЛЬФОБУТИЛОВОГО ЭФИРА ЦИКЛОДЕКСТРИНА | 2010 |
|
RU2575793C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ КОНТРОЛИРОВАННОГО ВЫСВОБОЖДЕНИЯ ТРЕПРОСТИНИЛА | 2019 |
|
RU2796305C2 |
| ЛИПОСОМЫ ИРИНОТЕКАНА ИЛИ ЕГО СОЛЕЙ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2526114C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2005 |
|
RU2574926C2 |
| КОМБИНАЦИОННЫЕ ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2640934C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2757110C2 |
| ЛИОФИЛИЗИРОВАННЫЕ ЛИПОСОМЫ | 2012 |
|
RU2780489C2 |

Изобретение относится к медицине и заключается в липосомной композиции для замедленного высвобождения лекарственного средства, включающей первую липосому, содержащую внешнюю мембрану, состоящую из многослойного липидного бислоя; и множество вторых липосом, располагающихся во внутренней области первой липосомы, определенной внешней мембраной первой липосомы, где каждая из вторых липосом имеет внешнюю мембрану, состоящую из многослойного липидного бислоя, где липосомная композиция имеет внутренние области вторых липосом, каждая из которых определена внешней мембраной каждой из вторых липосом, и ионный градиент образуется по меньшей мере между каждой из внутренних областей вторых липосом и внешней средой первой липосомы. Изобретение заключается также в способе получения липосомной композиции. Технический результат заключается в замедленном высвобождении лекарственного средства, с помощью чего может быть подавлена боль, длящаяся в течение 5-7 дней после операции. 2 н. и 6 з.п. ф-лы, 5 ил., 7 табл., 15 пр.
1. Липосомная композиция для замедленного высвобождения лекарственного средства, включающая
первую липосому, содержащую внешнюю мембрану, состоящую из многослойного липидного бислоя; и
множество вторых липосом, располагающихся во внутренней области первой липосомы, определенной внешней мембраной первой липосомы, где каждая из вторых липосом имеет внешнюю мембрану, состоящую из многослойного липидного бислоя,
где липосомная композиция имеет внутренние области вторых липосом, каждая из которых определена внешней мембраной каждой из вторых липосом, и
ионный градиент образуется по меньшей мере между каждой из внутренних областей вторых липосом и внешней средой первой липосомы.
2. Липосомная композиция по п. 1, в которой ионным градиентом является градиент концентрации протонов, и pH во внутренней области второй липосомы или pH во внутренней области второй липосомы и во внутренней области первой липосомы меньше, чем pH во внешней среде первой липосомы.
3. Липосомная композиция по любому из пп. 1-2, где первая липосома имеет средний диаметр частицы в пределах диапазона 1-20 мкм.
4. Липосомная композиция по п. 1, содержащая лекарственное средство во внутренней области второй липосомы или во внутренних областях второй липосомы и первой липосомы.
5. Липосомная композиция по п. 1, содержащая лекарственное средство в молярном отношении (моль/моль) не менее 0,05 по отношению к общему содержанию липидов.
6. Способ получения липосомной композиции по п. 1, включающий
смешивание первого раствора внутренней водной фазы, содержащего соединение для создания ионного градиента, с липидсодержащим смешивающимся с водой растворителем в объемном соотношении от 0,7 до 2,5, таким образом, чтобы получить первую эмульсию;
смешивание второго раствора внутренней водной фазы, содержащего соединение для создания ионного градиента в равной или меньшей концентрации, чем первый раствор внутренней водной фазы, с первой эмульсией в объемном соотношении не менее 0,7 таким образом, чтобы получить вторую эмульсию; и
замещение внешней водной фазы второй эмульсии водным раствором с меньшей концентрацией соединения для создания ионного градиента, чем в первом растворе внутренней водной фазы.
7. Способ получения липосомной композиции по п. 6, в котором ионным градиентом является градиент концентрации протонов.
8. Способ получения липосомной композиции по любому из пп. 6-7, дополнительно включающий
стадию введения лекарственного средства во внутреннюю часть липосомной композиции движущей силой, возникающей в результате ионного градиента.
| WO2009091531 A2, 23.07.2009 | |||
| CN 101744764 A, 23.06.2010 | |||
| US 5837279 A, 17.11.1998 | |||
| СПОСОБ ЭПИДУРАЛЬНОГО ВВЕДЕНИЯ ТЕРАПЕВТИЧЕСКИХ СОЕДИНЕНИЙ С ПОДДЕРЖИВАЕМОЙ СКОРОСТЬЮ ВЫСВОБОЖДЕНИЯ, СПОСОБ УМЕНЬШЕНИЯ УГНЕТЕНИЯ ДЫХАНИЯ | 1996 |
|
RU2215522C2 |
| US 20040156889 A1, 12.08.2004 | |||
| WO 9824415 A1, 11.06.1998 | |||
| WO 2010041255 A2, 15.04.2010. | |||
Авторы
Даты
2016-03-20—Публикация
2011-12-27—Подача