Изобретение относится к химии лантанидных комплексов тетрапиррольных соединений, в частности к иттербиевым комплексам природных порфиринов: протопорфирина IX (ПП IX) в виде диметилового эфира (ДМЭ), гематопорфирина IX (ГП IX) и копропорфирина III (КП Ш) в виде тетраметиловых эфиров (ТМЭ), которые могут использоваться как флуоресцентная метка при люминесцентной диагностике злокачественных опухолей с привлечением методов волоконно-лазерной спектрофлуорометрии. По оптическому отклику такой флуоресцентной метки можно получать достоверную информацию о накоплении порфириновых комплексов в опухолевых тканях. Использование природных порфиринов перспективно ввиду их низкой токсичности и доступности (выделение из природных источников либо с помощью микробиологического синтеза).
В ряду лантанидных элементов наиболее изучены иттербиевые комплексы порфиринов (ИКП), для которых характерна достаточно высокая устойчивость, обусловленная малым ионным радиусом иттербия (Yb) - 1.01 Å (Миронов А.Ф. / Комплексы порфиринов с лантанидами // Успехи химии. 2013. Т. 82 (4). С. 333-351). ИКП, так жеЮ как и безметальные порфирины, обладают избирательным накоплением в злокачественных клетках, сохраняя при этом высокие коэффициенты экстинкции и большой Стоксов сдвиг (Патент РФ №2411243). В отличие от свободных оснований порфиринов, ИКП фотостабильны (практически не генерируют синглетный кислород) и не вызывают побочных реакций в живом организме в виде фотодерматитов. Молекулярный кислород не тушит люминесценцию иона металла в Yb-комплексах, что облегчает проведение диагностических процедур и повышает чувствительность метода (А.V. Ivanov, V.D. Rumyantseva, et al. / Luminescence diagnostics of malignant tumors in the IR spectral range using Yb-porphyrin metallocomplexes //LaserPhysics, 2010, Vol. 20, No. 12, P. 2056-2065). Возможно использование как гидрофильных производных порфиринов, так и гидрофобных, включенных в липосомы (Патент РФ №1621720, Патент РФ №1340087).
Большое значение при проведении люминесцентной диагностики имеют время жизни и квантовый выход люминесценции металлокомплексов порфиринов. Известно большое количество Yb-порфиринов с алкильными и гетероциклическими остатками, обнаружен порфирин с временем жизни люминесценции 12.1 мкс - Yb-комплекс тетрапиридилпорфирина, а оптимальным экстра-лигандом является остаток ацетилацетона (Rusakova N.V., Korovin V.Yu. et al./ Influence of the nature of meso-substituents and extra-ligands on the liminescence of ytterbium in complexes with porphyrins // J.Appl.Spectr. 2004. V. 71 (4). P. 506-511).
Известны иттербиевые комплексы гидрофобных тетрапиразолилпорфиринов, предложенные в качестве люминесцентной метки для диагностики злокачественных новообразований, имеющие время жизни до 20 мкс (Патент РФ №2372099). Следует отметить, что высокие значения времени жизни люминесценции наблюдались только в среде органического растворителя, что неприемлемо для диагностики in vivo. Использование этих соединений в липосомальной форме приводит к преимущественному накоплению порфиринов в печени, почках и селезенке, что вынуждает повышать дозу вводимого препарата, снижает коэффициент диагностического контраста (КДК) - отношение интенсивности люминесценции в ткани опухоли к интенсивности люминесценции в окружающей нормальной ткани - и затрудняет диагностирование опухолей (Патент РФ №1340087).
Показано также уменьшение времени жизни люминесценции для водорастворимых соединений, обусловленное наличием межмолекулярных водородных связей и тушением люминесценции водой (Румянцева В.Д., Рощина Н.В. и др. / Синтез несимметричных тетраарилпорфиринов и их иттербиевых комплексов // Биоорган. химия. 2011. Т. 37 (6). С. 844-853).
Известны композитные наночастицы для фотодинамической диагностики злокачественных опухолей (Патент РФ №2463074). Их получают путем создания Au-Ag наноклеток, покрытых оболочкой из SiO2, сформированной в результате гидролиза тетроэтилортосиликата в спиртовой среде, поверхность которой функционализирована дикалиевой солью Yb(асас)-диметоксигематопорфирина IX (Yb-ГП). Полученные композитные наночастицы апробированы в низких концентрациях (0.1 мг/кг веса) в экспериментах на лабораторных животных. Показано, что накопление композитных наночастиц в опухоли превышает накопление свободного Yb-ГП на 15-20%. Композитные наночастицы определяли по люминесценции иона Yb3+ в ближней ИК-области спектра от 900 нм до 1050 нм, где нет фоновой автолюминесценции биотканей.
Недостатки:
1) композитные наночастицы обладают выраженной красной (остаточной) флуоресценцией свободного основания порфирина, наличие которого приводит к генерации синглетного кислорода, разрушающего не только опухолевые, но и здоровые ткани, а также саму люминесцентную метку (явление фотобличинга);
2) силикатная оболочка композитных наночастиц обладает пористостью и в процессе циркуляции в организме из нее высвобождаются инкорпорированные соединения, в частности, люминесцирующие ИКП, являющиеся диагностической меткой;
3) способ получения композитных наночастиц трудоемкий, многостадийный и требует дорогостоящих реактивов.
Наиболее близким техническим решением, принятым за прототип, является использование ИКП в липосомальной форме в качестве люминесцентных веществ для диагностики злокачественных опухолей (Патент РФ №1340087). При исследовании, проведенном на лабораторных животных, максимальный КДК для этих композиций составил от 3.5 до 4.5.
Недостатки прототипа:
- липосомальные формы ИКП усложняют введение их в организм;
- требуют увеличения вводимых доз для диагностики и не обеспечивают их стандартности из-за аккумуляции липосом в паренхиматозных органах;
- не исключают контакта люминесцентной метки с водой, тушащей люминесценцию, что ведет к снижению КДК.
Задачей настоящего изобретения является создание новой нанокомпозиции для люминесцентной диагностики злокачественных опухолей на основе гидрофобных ИКП: Yb-ПП IX ДМЭ, Yb-ГП IX ТМЭ и Yb-КП III ТМЭ, которая позволят увеличить время жизни и интенсивность люминесценции ИКП в ближней ИК-области спектра.
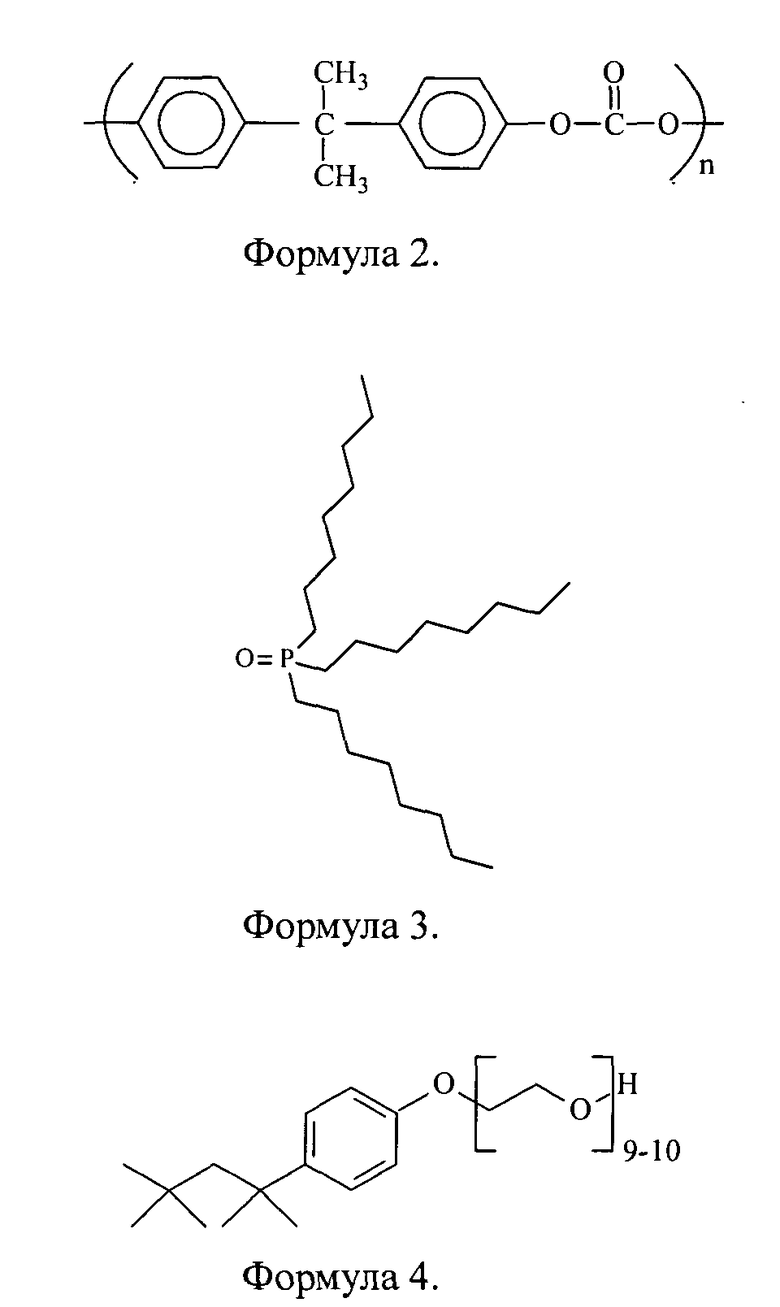
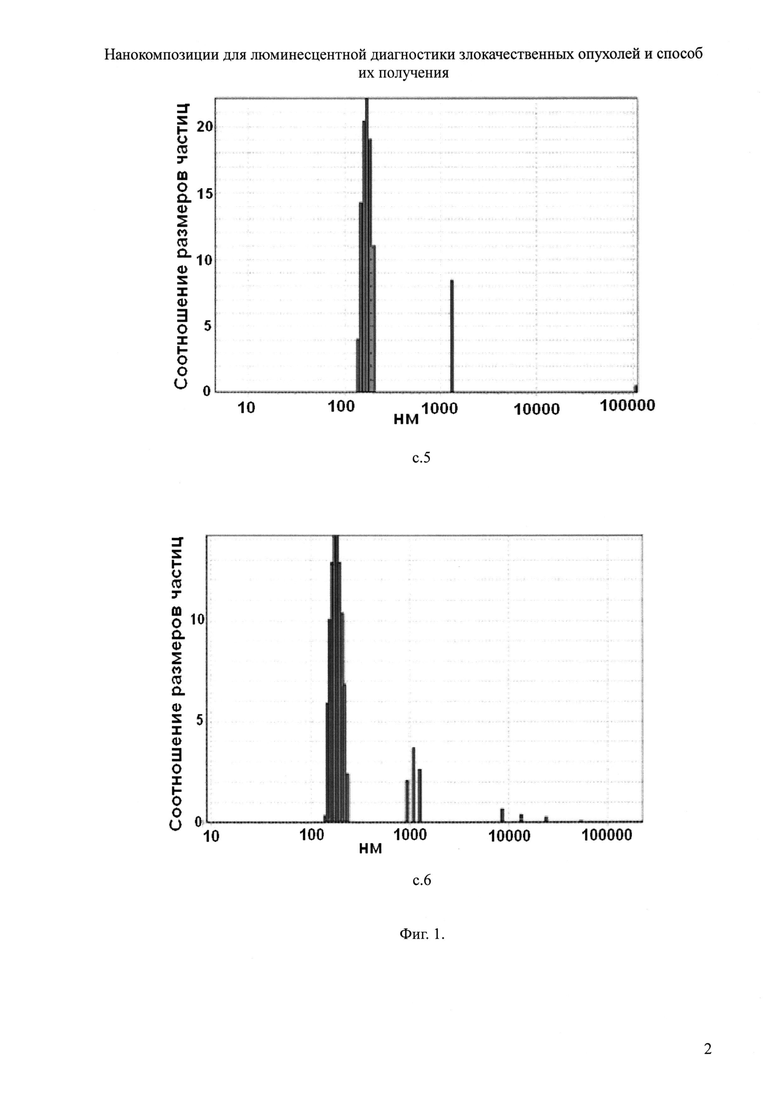
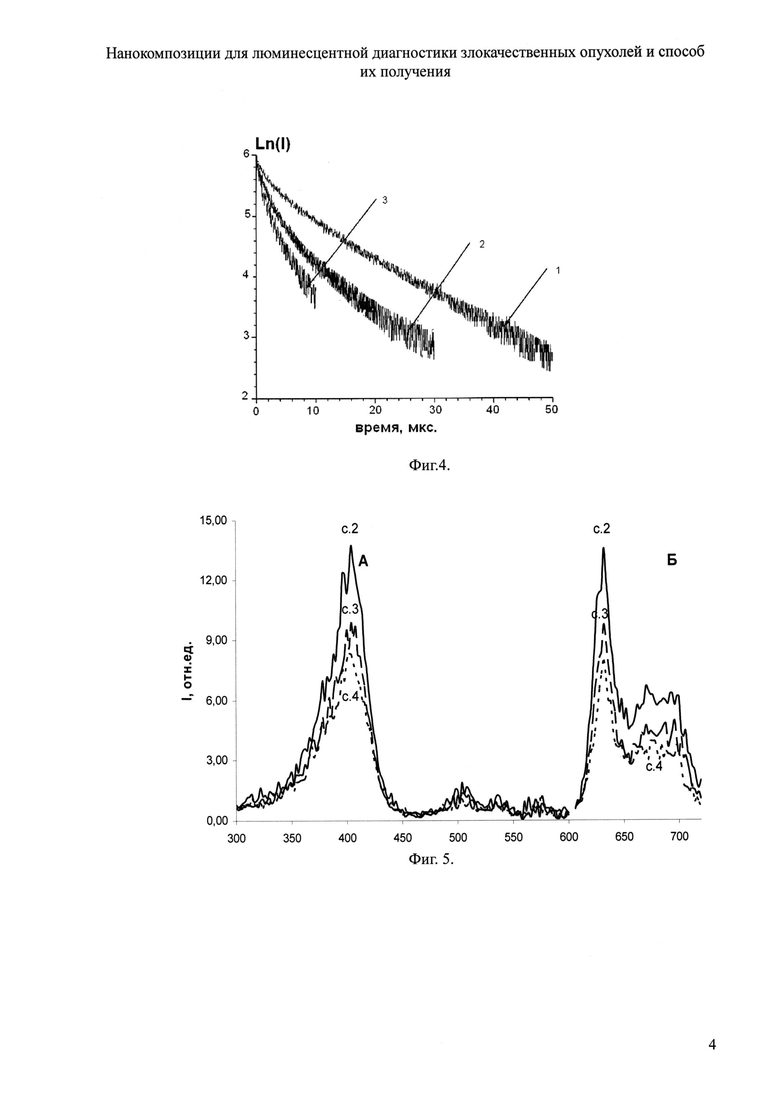
Для решения поставленной задачи предложена новая нанокомпозиция для люминесцентной диагностики злокачественных опухолей на основе лексан-полимерной матрицы (ЛПМ) и иттербиевых комплексов диметилового эфира протопорфирина IX, или тетраметиловых эфиров гематопорфирина IX и копропорфирина III (Формула 1), где для увеличения диагностического потенциала ИКП и повышения стабильности металлокомплексов предложено изолировать ИКП от действия тушащей люминесценцию окружающей водной среды путем помещения ИКП в полимерную оболочку на основе лексана (Формула 2) и введения в структуру комплекса дополнительного комплексообразователя триоктилфосфиноксида (ТОФО) (Формула 3), а в органическую фазу ввести неионогенный детергент полиэтиленгликоль (n=9, 10), n-(трет-октил)фенол (Тритон Х-100) (Формула 4).
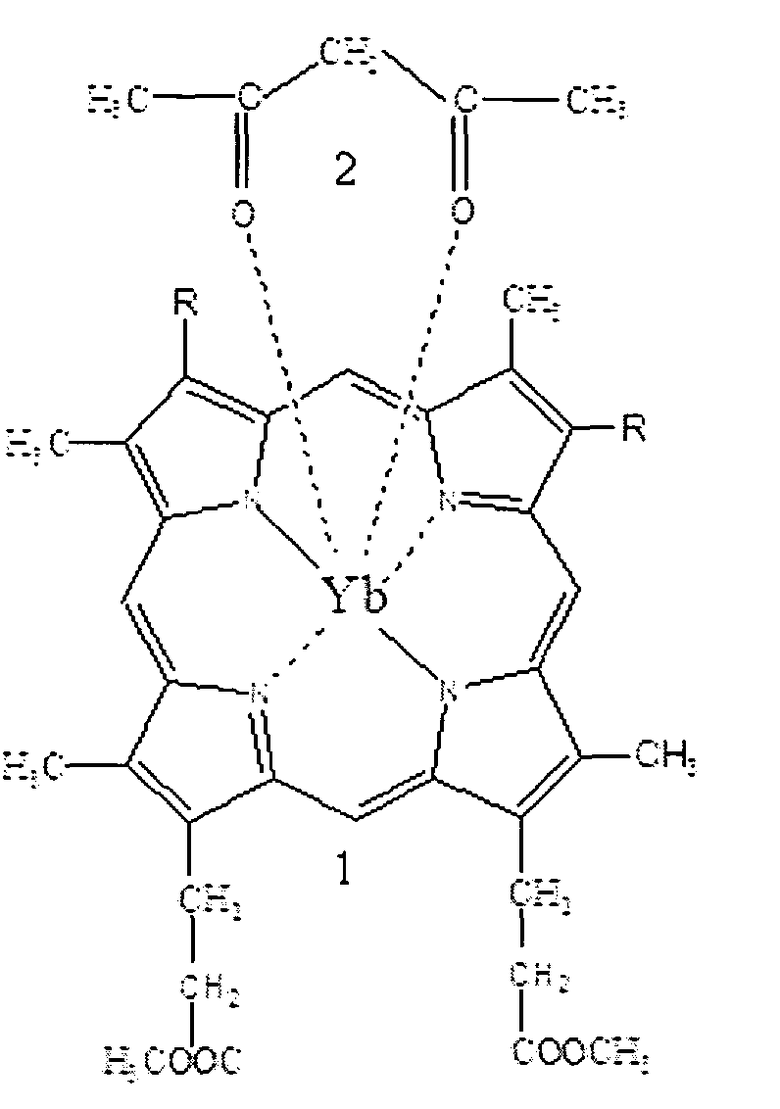
Формула 1.1 - Yb-ПП IX ДМЭ (R=-СН=СН2), Yb-ГП IX ТМЭ (R=-СН(ОСН3)СН3) или Yb-КП III ТМЭ (R=-CH2-CH2-СООСН3); 2 - ацетилацетон.
Техническим результатом настоящего изобретения является создание новой нанокомпозиции в виде наночастиц на основе ИКП и ЛПМ, обеспечивающей высокие время жизни (до 17 мкс) и интенсивность люминесценции в водной среде, что позволяет снизить диагностические дозы вводимых ИКП и повысить КДК.
Лексан - биосовместимый полимер на основе поликарбоната. При переводе в водную фазу растворенного в органической фазе полимера и ИКП с добавлением ТОФО в зависимости от количественного соотношения органополимерной и водной фаз при обработке смеси ультразвуком образуются наночастицы определенного диаметра. Для придания поверхности частиц гидрофильности и, как следствие, меньшей агрегируемости и более длительной циркуляции в организме в органическую фазу вводится неионогенный детергент Тритон Х-100, содержащий полиэтиленгликолевую цепочку из 9-10 остатков этиленгликоля.
Способ получения нанокомпозиции осуществляется следующим образом.
В растворе тетрагидрофурана (ТГФ) проводят включение ТОФО в ИКП, полученные в соответствии с описанным в прототипе способом, используя молярные соотношения ТОФО/ИКП от 6 до 9 в зависимости от концентрации полимера в реакционном объеме. Синтез нанокомпозиций происходит при добавлении органополимерной фазы, содержащей ИКП, лексан и Тритон Х-100 в растворе ТГФ, к водной среде при обработке ультразвуком в течение 40-60 с. Соотношение объемов органополимерной и водной фаз в суспензии от 1:19 до 1:39, концентрации компонентов в пересчете на конечный объем суспензии: ИКП - 10-6÷10-5 моль/л, лексан - 100÷200 мкг/мл, Тритон Х-100 - 0,035%. Перед окончанием приготовления нанокомпозиции из суспензии удаляют ТГФ подогревом до 50°С.
Изобретение иллюстрируется таблицей и фигурами 1-6.
В таблице представлены данные спектрально-люминесцентных характеристик нанокомпозиции различных серий (с.) суспензий, содержащих Yb-комплексы ПП IX ДМЭ в ЛПМ, по сравнению с исходным Yb-ПП IX ДМЭ в растворе ТГФ и в адсорбированном на БСА состоянии. Приведены значения среднего гидродинамического диаметра частиц в зависимости от концентрации полимера в реакционной среде.
Приведенные в таблице данные показывают, что синтезированная нанокомпозиция на основе лексана - поликарбонатного бисфенольного полимера с встроенным в него комплексом Yb-ПП IX ДМЭ - в присутствии дополнительного комплексообразователя ТОФО обладает увеличенными интенсивностью и временем жизни люминесценции комплекса по сравнению с не включенными в частицы ИКП.
На фиг. 1 представлен пример распределения получаемой нанокомпозиции по размерам. Используемые для синтеза наночастиц соотношения органо-полимерной и водной фаз от 1:19 до 1:39 позволяют получать частицы полидисперсностью, не превышающей 11%, размером от 100 до 200 нм, что является оптимальным для их длительной циркуляции в организме и преимущественного накопления в опухоли.
Преимущества включения ИКП в полимерную матрицу подтверждаются сравнением спектров возбуждения, эмиссии и времени жизни люминесценции Yb3+, а также остаточной флуоресценции порфириновой части комплекса с аналогичными характеристиками комплекса в растворе ТГФ и в водном растворе бычьего сывороточного альбумина (БСА).
На фиг. 2 приведены спектры возбуждения люминесценции серий (с.) нанокомпозиции с различным содержанием ТОФО: с. 2-0, с. 3-6.10-6, с. 4-12.10-6 моль/л суспензии, которые показывают, что в них наблюдается люминесценция Yb-ПП IX ДМЭ при регистрации на 975 нм, интенсивность которой возрастает с увеличением концентрации ТОФО.
На фиг. 3 приведен спектр эмиссии нанокомпозиции Yb-ПП IX ДМЭ в ЛПМ в ближнем ИК-диапазоне при возбуждении лазером длиной волны 532 нм, показывающий, что они имеют типичный для люминесценции ионов Yb3+ характер: наличие наиболее интенсивной полосы в области 980 нм, обусловленной основным переходом (2F5/2→2F7/2), и появление дополнительных полос при 925 и 1010 нм, обусловленных мультиплетными переходами.
На фиг. 4 приведены кривые кинетики затухания люминесценции суспензий нанокомпозиции Yb-ПП IX ДМЭ-ЛПМ различных серий (1 - с. 7; 2 - с. 4; 3 - с. 2) при возбуждении 532 нм, и регистрацией эмиссии на 976 нм, показывающие, что их время жизни люминесценции лежит в микросекундном диапазоне и возрастает с увеличением концентрации ТОФО.
На фиг. 5 приведены спектры возбуждения (A, λэм. 632 нм) и эмиссии (Б, λвозб. 404 нм) остаточной флуоресценции свободного основания порфирина в Yb-ПП IX ДМЭ-ЛПМ нанокомпозиции, содержащей различные количества ТОФО: с. 2-0, с. 3-6.10-6, с. 4-12.10-6 моль/л, которые свидетельствуют о ее падении в присутствии ТОФО в комплексе и тем самым о снижении вероятности генерации синглетного кислорода в синтезированной нанокомпозиции.
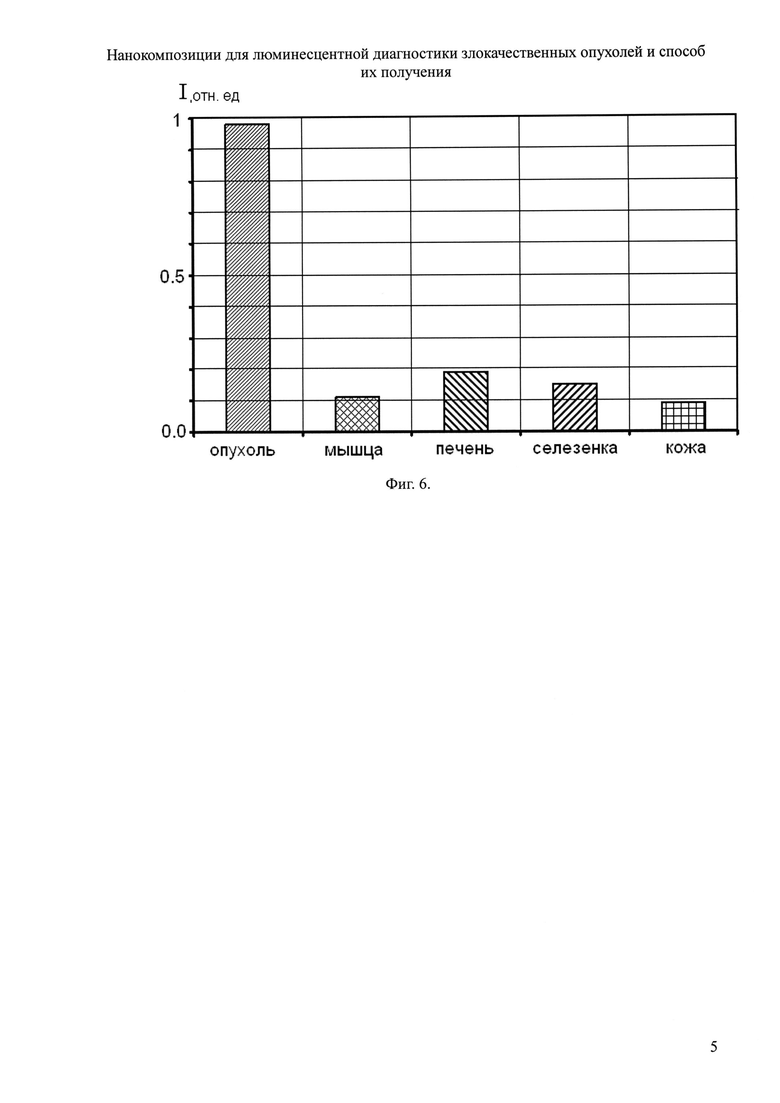
На фиг. 6 представлены доказательства повышенной селективности накопления нанокомпозиции Yb-ПП IX ДМЭ - ЛПМ в опухоли.
Для экспериментов по биораспределению этой нанокомпозиции использовали мышей-самцов линии С57В1/Т6 с привитой карциномой легкого Льюиса. Водные растворы нанокомпозиции вводились в хвостовую вену в дозе Yb-ПП IX ДМЭ 0,1 мг/кг веса. Через 40 часов после введения препарата на люминесцентный анализ были взяты образцы тканей опухоли, печени, селезенки, мышцы и кожи. Интегральная интенсивность люминесценции образцов оценивалась с помощью прототипа онкофлуориметра. Облучали образцы биотканей, расположенные в 96-луночном планшете с низким уровнем собственного люминесцентного фона и диаметром лунки 6 мм. Волоконно-оптическим зондом проводили сканирование каждого образца, помещенного в отдельную лунку, по одной координате со скоростью 0.2 мм/сек. Интегральную интенсивность в интервале 900-1100 нм оценивали как нормированный средний сигнал вдоль кривой сканирования.
Наличие ИК-люминесценции в спектральной области 900-1100 нм (фиг. 3), соответствующей окну прозрачности биотканей, позволяет оценивать люминесценцию образцов тканей, суспензий гомогенатов и даже в экспериментах in vivo. На фиг. 6 представлены средние интегральные интенсивности ИК-люминесценции 900-1100 нм образцов тканей мыши с привитой опухолью. Измерения проведены через 40 часов после введения нанокомпозиции. Из фиг. 6 видно, что наибольшее накопление этой нанокомпозиции через 40 часов после внутривенного введения в дозе Yb-ПП IX ДМЭ 0,1 мг/кг веса обнаружено в опухолевой ткани, а также в печени и селезенке. При этом КДК опухоль/мышца достигал значения ~10,0, что более чем в 2,5 раза превышает его значение в случае использования Yb-ПП IX ДМЭ без ЛПМ в прототипе (~3,5).
Осуществление способа иллюстрируется примерами 1 и 2.
Пример 1. Получение нанокомпозиции с.5 (см. Табл.). К 4.875 мл бидистиллированной воды при обработке ультразвуком в течение 40-60 с прибавляют 0.125 мл раствора полимера в ТГФ (4 мг/мл), содержащем Yb-ПП IX ДМЭ в концентрации 2·10-6 моль/л, ТОФО в концентрации 1,8.10-5 моль/л и 0.035% (вес/объем) Тритона Х-100 в пересчете на конечный объем суспензии; производят удаление из суспензии ТГФ подогревом при 50°C. Средний гидродинамический диаметр полученных частиц составляет (138±15) нм.
Пример 2. Получение нанокомпозиции с.6 (см. Табл.). К 4.75 мл бидистиллированной воды при обработке ультразвуком в течение 40-60 с прибавляют 0.25 мл раствора полимера в ТГФ (4 мг/мл), содержащем Yb-ПП IX ДМЭ в концентрации 2·10-6 моль/л, ТОФО в концентрации 1,8.10-5 моль/л и 0.035% (вес/объем) Тритона Х-100 в пересчете на конечный объем суспензии; производят удаление из суспензии ТГФ подогревом при 50°C. Средний гидродинамический диаметр полученных частиц составляет (180±27) нм.
Отличительные признаки предлагаемого решения обеспечивают следующие преимущества:
- Нанокомпозиция на основе ИКП-ЛПМ с введенными комплексообразователем ТОФО и неионогенным детергентом Тритоном Х-100 не содержат токсичных молекул, что обеспечивает меньшую токсичность препарата и лучшую биосовместимость, и обладают большим выходом люминесценции и повышенной селективностью накопления данной субстанции в опухоли, что позволяет достигать высоких величин КДК при уменьшении дозы вводимого препарата.
- Нанокомпозиция на основе ИКП-ЛПМ обладает большим временем жизни люминесценции в ближней ИК-области спектра 900-1100 нм, где нет фоновой автолюминесценции биотканей, что позволяет надежно детектировать нанокомпозицию в биоткани с использованием стробоскопических методов волоконно-лазерной спектрофлуорометрии.
| название | год | авторы | номер документа |
|---|---|---|---|
| Нанокомпозиты для магнитолюминесцентной тераностики новообразований | 2021 |
|
RU2766513C1 |
| ИТТЕРБИЕВЫЙ КОМПЛЕКС ДИКАЛИЕВОЙ СОЛИ 2,4-ДИМЕТОКСИГЕМАТОПОРФИРИНА IX КАК ФЛУОРЕСЦЕНТНАЯ МЕТКА ДЛЯ РАННЕЙ ДИАГНОСТИКИ РАКА | 2009 |
|
RU2411243C1 |
| ИТТЕРБИЕВЫЕ КОМПЛЕКСЫ ТЕТРАПИРАЗОЛИЛПОРФИРИНОВ КАК ФЛУОРЕСЦЕНТНЫЕ МЕТКИ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2008 |
|
RU2372099C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2016 |
|
RU2617045C1 |
| СПОСОБ ИССЛЕДОВАНИЯ МАЛИГНИЗАЦИИ ТКАНЕЙ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 1988 |
|
SU1621720A1 |
| ИТТЕРБИЕВЫЕ КОМПЛЕКСЫ ПОРФИРИНОВ В КАЧЕСТВЕ ЛЮМИНЕСЦЕНТНЫХ ВЕЩЕСТВ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 1985 |
|
SU1340087A1 |
| КОМПОЗИТНЫЕ НАНОЧАСТИЦЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ДИАГНОСТИКИ | 2011 |
|
RU2463074C1 |
| УСТРОЙСТВО ДЛЯ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ НОВООБРАЗОВАНИЙ | 2012 |
|
RU2483678C1 |
| СПОСОБ ИЗУЧЕНИЯ МАЛИГНИЗАЦИИ ТКАНЕЙ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 1993 |
|
RU2074718C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИКАЛИЕВОЙ СОЛИ ИТТЕРБИЕВОГО КОМПЛЕКСА 2,4-ДИ(α-МЕТОКСИЭТИЛ)ДЕЙТЕРОПОРФИРИНА IX АЦЕТИЛАЦЕТОНАТА | 2019 |
|
RU2697418C1 |

Изобретение относится к медицине, в частности к нанокомпозиции для люминесцентной диагностики злокачественных опухолей. Нанокомпозиция для люминесцентной диагностики злокачественных опухолей на основе лексан-полимерной матрицы и иттербиевых комплексов диметилового эфира протопорфирина IX или тетраметилового эфира гематопорфирина IX, или копропорфирина III, в которой иттербиевые комплексы порфиринов помещены в полимерную оболочку на основе лексана и в структуру комплексов дополнительно введен комплексообразователь триоктилфосфиноксид, а в органическую фазу введен неионогенный детергент полиэтиленгликоль, n-(трет-октил)фенол. Вышеописанная нанокомпозиция обладает увеличенной интенсивностью и временем жизни люминесценции и пригодна для люминесцентной диагностики злокачественных опухолей в ближней ИК-области от 900 нм до 1100 нм. 6 ил., 1 табл., 2 пр.
Нанокомпозиция для люминесцентной диагностики злокачественных опухолей на основе лексан-полимерной матрицы и иттербиевых комплексов диметилового эфира протопорфирина IX или тетраметилового эфира гематопорфирина IX, или копропорфирина III, отличающаяся тем, что иттербиевые комплексы порфиринов помещены в полимерную оболочку на основе лексана и в структуру комплексов дополнительно введен комплексообразователь триоктилфосфиноксид, а в органическую фазу введен неионогенный детергент полиэтиленгликоль (n=9, 10), n-(трет-октил)фенол.
Авторы
Даты
2016-03-27—Публикация
2014-06-23—Подача