Изобретение относится к медицинской технике, а именно к аппаратуре медицинского и фотобиологического назначения, предназначенного для осуществления процесса люминесцентной диагностики (ЛД) рака на основе использования ряда редкоземельных металлокомплексов порфиринов (РЗМКП).
При люминесцентной диагностике в организм пациента вводят фотосенсибилизатор, который накапливается преимущественно в новообразованиях. При последующем облучении биотканей оптическим излучением, длина волны которого находится в максимуме полосы поглощения фотосенсибилизатора, происходит возбуждение его молекул. При этом часть энергии возбужденных молекул расходуется на флуоресценцию порфиринового лиганда, а другая часть идет на образование цитотоксичных агентов (синглетный кислород, свободные радикалы и т.д.) и на люминесценцию ионов металлов, введенных в порфириновую матрицу. Следует отметить, что цитотоксичные агенты крайне вредны при проведении процедуры люминесцентной диагностики рака. Их генерация ведет к повреждению как в злокачественных, так и здоровых тканях организма (прежде всего глаз и кожи) под действием даже обычного дневного света и вызывает ряд побочных нежелательных реакций.
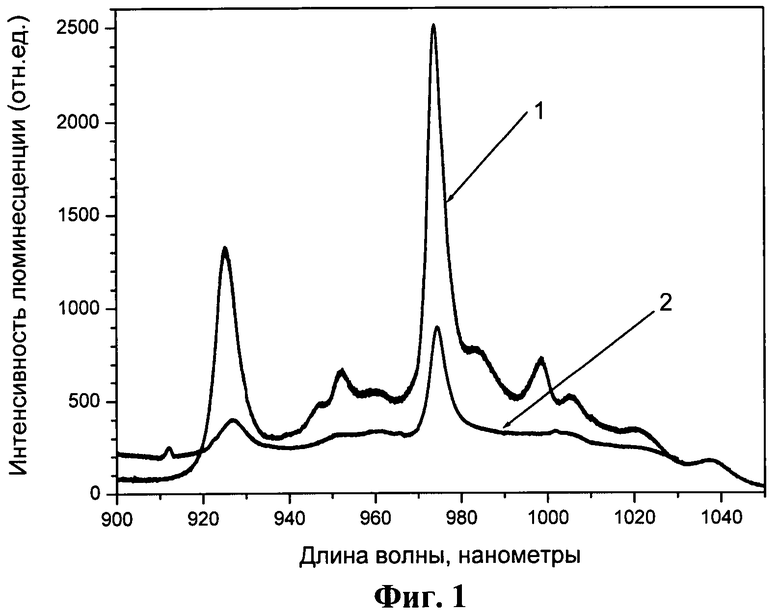
Ионы редкоземельных металлов, введенные в матрицу порфиринов, резко снижают квантовый выход генерации синглетного кислорода. Это связано с тем, что люминесцентный уровень ряда ионов (иттербий, неодим) лежит ниже триплетного уровня органической части молекулы, но выше, чем у синглетного кислорода, поэтому энергия возбуждения порфириновой матрицы под влиянием внешнего светового излучения перехватывается ионом редкоземельного металла, тем самым существенно снижая сенсибилизированную порфирином генерацию синглетного кислорода, а следовательно, и фототоксичность всего комплекса [1]. Можно детерминировать, таким образом, препараты на основе РЗМКП (иттербиевые и неодимовые металлокомплексы порфиринов) как чисто диагностические нефототоксичные фотосенсибилизаторы, которые в диагностических концентрациях не создают токсичных концентраций синглетного кислорода и имеют при этом не менее высокие люминесцентные характеристики используемых в настоящее время «терапевтических» фотосенсибилизаторов при том же уровне туморотропности. Следует также отметить, что ионы иттербия и неодима люминесцируют в ближней ИК-области спектра (900-1100 нм), где очень низка фоновая люминесценция биотканей, вызванная наличием в ней эндогенных порфиринов. В результате существенно увеличивается соотношение сигнал/шум. На фиг.1 представлен спектр люминесценции образцов:
1. Yb - комплекс 5,10,15,20-тетра(1-N-(п-фторфенил)-3(о-хлорфенил)пиразол-4-ил)порфирина.
2. Уb-2,4-диметоксигематопорфирин IX.
Интенсивная и достаточно узкая полоса люминесценции на 980 нм сохраняется независимо от природы растворителя. Наблюдается также и целый ряд других, более слабых по интенсивности люминесцентных полос в спектральном диапазоне 900-1100 нм, которые также присущи иону иттербия.
В связи с тем что в настоящее время смертность от злокачественных новообразований стоит на втором месте после сердечно-сосудистых заболеваний, остро стоит вопрос о ранней люминесцентной диагностике рака. Предлагаемое изобретение направлено на выявление наиболее распространенных визуально и эндоскопически доступных нозологических форм злокачественных новообразований.
Известно спектральное устройство для контроля и мониторинга процесса фотодинамической терапии и сопровождающей диагностики [2].
Данное устройство рассчитано на работу с терапевтическими фотосенсибилизаторами типа Фотосенс, Фотодитазин, Фотогем, Аласенс и т.д., которые флуоресцируют в основном в видимом диапазоне спектра (600-700 нм). Получаемый с их помощью диагностический контрастный индекс, который определяется отношением интенсивности флуоресценции (ИФ) в опухоли к ИФ в других органах и тканях биообъекта (мышцы, печень, кожа, почки и т.д.), существенно снижен из-за маскирующего эффекта фоновой аутолюминесценции (500-700 нм). Другим недостатком данного устройства является низкая чувствительность в диапазоне 900-1100 нм. Устройство в принципе не позволяет детектировать интегральную интенсивность люминесценции во всем спектральном диапазоне 900-1100 нм от биообъектов с введенной дозой препарата на уровне 10-100 мкг/кг веса биообъекта. К тому же имеют место и потери полезного сигнала на многочисленных оптических узлах и элементах устройства. Отметим также относительно низкую чувствительность приемного устройства в виде фотодиодной линейки по сравнению с существенно более чувствительным прибором, каким является фотоэлектронный умножитель (ФЭУ).
Наиболее близким к предлагаемому изобретению по технической сущности является устройство [3], где в качестве блока регистрации и обработки люминесцентного сигнала использован монохроматор, который выделяет интенсивные и характерные для ионов иттербия узкие линии люминесценции в ближней ИК-области спектра (900-1110 нм). Передачу возбуждающего излучения от источника лазерного излучения, модулированного генератором импульсов, и сбор полезного люминесцентного сигнала от биоткани обеспечивает волоконно-оптический зонд, включающий световод доставки лазерного излучения к биоткани и приемную волоконно-оптическую систему для детектирования люминесценции, выполненную в виде одного световода. Входной конец световода доставки лазерного излучения соединен через устройство ввода с источником лазерного излучения, а выходной конец приемной волоконно-оптической системы для детектирования люминесценции подведен к системе линз, расположенной на входе блока регистрации и обработки люминесцентного сигнала. Указанный блок состоит из ФЭУ с высоковольтным блоком питания, синхронного детектора-усилителя для усиления сигнала и уменьшения шумовых потерь, а также аналого-цифрового преобразователя (АЦП) и компьютера.
К недостаткам устройства, изложенного в [3], следует отнести невозможность детектирования интегральной интенсивности люминесценции (ИЛ) в диапазоне 900-1100 нм. Измерялись лишь интегральная интенсивность в области самой яркой, но одной линии спектра (980 нм), и люминесцентный диагностический контрастный индекс соответствующих органов и биотканей оценивался по площадям под кривыми люминесценции в окрестности этой длины волны. Наблюдались и потери полезного сигнала на оптических узлах монохроматора. Конструкция же двухволоконного зонда не обеспечивает эффективный сбор полезного сигнала со всей облученной площади биоткани. Все эти негативные факторы приводят к резкому снижению чувствительности измерений в диапазоне 900-1100 нм, в связи с чем приходится увеличивать дозу вводимого в организм препарата до 50 мг/кг веса биообъекта, что обуславливает возникновение вредных для здоровья побочных эффектов, а также повышает стоимость диагностических процедур. Отметим также громоздкость устройства из-за наличия в нем монохроматора, невозможность работы его в передвижных медицинских лабораториях, а также низкую производительность при проведении процедур люминесцентной диагностики рака.
Технической задачей изобретения является создание спектрального устройства для ранней люминесцентной диагностики новообразований на основе использования РЗМКП, включая иттербиевые металлокомплексы порфиринов, являющихся чисто диагностическими нефототоксичными фотосенсибилизаторами.
Техническим результатом изобретения является повышение чувствительности измерений интенсивности люминесценции в диапазоне спектра 900-1100 нм, что приводит к резкому снижению дозы вводимого в организм пациента препарата вплоть до 0,01 мг/кг веса, что исключает наличие какой-либо токсичности при проведении процедуры ЛД рака, уменьшение габаритов и веса устройства, использование его в передвижных медицинских лабораториях при диспансеризации населения в удаленных объектах, повышение производительности процедуры ЛД, снижение стоимости диагностических процедур.
Технический результат достигается тем, что в устройство для люминесцентной диагностики новообразований на основе редкоземельных металлокомплексов порфиринов, содержащее источник лазерного излучения, волоконно-оптический зонд, включающий световод доставки лазерного излучения к биоткани, входной конец которого через устройство ввода соединен с источником лазерного излучения, и приемную волоконно-оптическую систему для детектирования люминесценции, блок регистрации и обработки люминесцентного сигнала, первую систему линз, расположенную на входе этого блока, и генератор импульсов, один выход которого подключен к управляющему входу источника лазерного излучения, а второй - к управляющему входу блока регистрации и обработки сигнала, дополнительно введены вторая система линз, расположенная на выходе приемной волоконно-оптической системы зонда, и интерференционные отражательные фильтры, расположенные между указанными системами линз таким образом, что каждый последующий фильтр размещен на пути оптического излучения, отраженного от предыдущего фильтра, при этом с обратной стороны каждого фильтра расположен светопоглощающий экран, обеспечивающий работу фильтра только на отражение. Устройство содержит по меньшей мере 4 интерференционных отражательных фильтра и каждый интерференционный отражательный фильтр имеет коэффициент отражения менее 10% в спектральном диапазоне 350-900 нм и более 90% в диапазоне 900-1100 нм. Интерференционные отражательные фильтры расположенны под углом 45 градусов к падающему на них оптическому излучению люминесценции. Перед волоконно-оптическим зондом дополнительно введен пропускающий фильтр, у которого соотношение между значением коэффициента пропускания на длине волны излучения лазера и значениями коэффициентов пропускания на длинах волн, превышающих длину волны излучения лазера на 20 нм и более, составляет не менее 30. Таким образом, общий коэффициент пропускания фонового излучения через интерференционные отражательные фильтры на длинах волн, меньших, чем 900 нм, составляет менее 10-4%.
С целью повышения чувствительности волоконно-оптического зонда его конструкция включает световод доставки лазерного излучения состава SiO2+F/ SiO2 со стандартной числовой апертурой 0,20-0,22 и приемную волоконно-оптическую систему для детектирования люминесценции, состоящую из не менее чем 12 штук световодов того же состава в тонком металлическом покрытии, но с повышенной числовой апертурой 0,33 и выше.
Данный тип световодов производится методом СВЧ-плазмохимического осаждения тонких слоев кварцевого стекла при пониженном давлении (PCVD-метод) [4]. Чисто кварцевая сердцевина световодов исключает появление нежелательных центров окраски при прохождении по световодам различного излучения, как это происходит, например, с допированной германием сердцевиной световода. В качестве блока регистрации и обработки люминесцентного сигнала, помимо ФЭУ и синхронного детектора-усилителя, использован аналого-цифровой преобразователь и компьютер с соответствующим программным обеспечением. Источник лазерного излучения работает на длинах волн 405 или 530 нм, что соответствует максимумам основных полос поглощения иттербиевых металлокомплексов порфиринов. Перед волоконно-оптическим зондом дополнительно вводится пропускающий фильтр, у которого соотношение между значением коэффициента пропускания на длине волны излучения лазера и значениями коэффициентов пропускания на длинах волн, превышающих длину волны излучения лазера на 20 нм и более, составляет не менее 30.
На фиг.2 представлено предлагаемое устройство. Устройство содержит источник лазерного излучения 1, пропускающий фильтр 2, устройство 3 ввода лазерного излучения в световод доставки лазерного излучения 5 к биоткани 8, приемную волоконно-оптическую систему 6 волоконно-оптического зонда 7 для детектирования люминесценции, первую 13 и вторую 4 систему линз, генератор импульсов 9, блок интерференционных отражательных фильтров 11, включающий фильтры 10 и светопоглощающие экраны 12, блок регистрации и обработки люминесцентного сигнала 14, в котором помимо ФЭУ и синхронного детектора-усилителя использован АЦП и компьютер с соответствующим программным обеспечением.
Предлагаемое устройство работает следующим образом. Выходящее из источника лазерного излучения 1 излучение, модулированное генератором импульсов 9 с частотой 1 кГц (для оптимизации соотношения сигнал/шум), проходит через пропускающий фильтр 2 и вводится посредством устройства 3 ввода лазерного излучения в световод доставки лазерного излучения 5 к биоткани 8 волоконно-оптического зонда 7. Благодаря фильтру 2 из него выходит и вводится в световод 5 волоконно-оптического зонда 7 излучение только основной лазерной линии. Другие составляющие излучения лазера, таким образом, не попадают на исследуемую биоткань 8, вследствие чего не искажаются форма спектра и его количественные характеристики. При облучении биоткани 8 с введенным в нее ранее препаратом на основе иттербиевого металлокомплекса порфирина посредством волоконно-оптического зонда 7 полезный сигнал люминесценции собирается со слизистой поверхности биоткани 8 приемной волоконно-оптической системой 6 для детектирования люминесценции и далее фокусируется второй системой линз 4 на первом интерференционном отражательном фильтре 10 блока диэлектрических интерференционных отражательных фильтров 11. Первый фильтр 10 расположен под углом 45 градусов к люминесцентному излучению, а сразу за фильтром 10 на его обратной стороне располагается светопоглощающий экран 12, обеспечивающий работу фильтров 10 только на отражение. За счет нанесенного специального тонкопленочного покрытия со слоями на основе системы HfO2-SiO2 обеспечивается коэффициент отражения сигнала от фильтров 10 в спектральном диапазоне 350-900 нм менее 10%. Полезный же сигнал люминесценции от иона иттербия в диапазоне 900-1100 нм отражается практически целиком и попадает вместе с сильно уменьшенным фоновым сигналом 350-900 нм на следующий интерференционный отражательный фильтр, где происходит аналогичный процесс. В результате после отражения от второго фильтра фоновый сигнал уменьшится еще более чем в 10 раз и т.д. После последнего четвертого фильтра 10 фоновый сигнал будет иметь интенсивность примерно на 4 порядка меньше, чем на входе у первого фильтра. Полезный же сигнал люминесценции после всех отражений уменьшается незначительно. Далее сигнал фокусируется первой системой линз 13 на вход блока регистрации и обработки люминесцентного сигнала 14, где полезный сигнал люминесценции регистрируется, усиливается, преобразуется в электрический аналоговый и далее в цифровой.
В заявке описывается спектральное устройство для ранней люминесцентной диагностики рака на основе использования иттербиевых металлокомплексов порфиринов, включающее источник лазерного излучения с регулируемой оптической мощностью на дистальном конце волоконно-оптического зонда до 20 мВт; генератор импульсов, обеспечивающий лазеру импульсный режим работы с частотой 1 кГц; волоконно-оптический зонд, у которого световод доставки лазерного излучения к биоткани состава SiO2+F/SiO2 со стандартной числовой апертурой 0,20-0,22 связан через стандартный коннектор с источником лазерного излучения, а приемная волоконно-оптическая система общим числом световодов не менее 12 штук (того же состава, но с повышенной числовой апертурой вплоть до 0,30 и выше) служит для детектирования люминесценции; система линз, собирающая люминесценцию от биообъекта и передающая ее на блок интерференционных отражательных фильтров, выполненных на основе тонкопленочных слоев системы HfO2-SiO2. Данный блок пропускает полезный сигнал в диапазоне 900-1100 нм и практически устраняет попадание на ФЭУ возбуждающего излучения, а также фоновой аутолюминесценции от различных биотканей, образующейся в основном в зеленом и красном диапазоне спектра. Регистрируемая блоком регистрации и обработки люминесцентного сигнала интегральная световая интенсивность люминесценции соответствует числу квантов излучения в диапазоне спектра 900-1100 нм.
Заявляемое устройство в связи с отсутствием в его структурной схеме стационарно устанавливаемого монохроматора обеспечивает повышение сбора полезного сигнала, что ведет к существенному увеличению чувствительности. При этом достигается еще одна цель изобретения: резкое снижение дозы вводимого в организм препарата с 10-50 мг/кг веса до 0,01 мг/кг. Уменьшаются также габариты и вес устройства, которое может быть использовано в передвижных медицинских лабораториях для диагностики различных групп населения, включая удаленные объекты. К тому же заявляемое устройство позволяет достаточно быстро проводить люминесцентную диагностику рака и снижает стоимость диагностических процедур.
ЛИТЕРАТУРА
1. Румянцева В.Д., Миронов А.Ф., Щамхалов К.С., Сухин Г.М., Шилов И.П., Маркушев В.М., Кузьмина З.В., Полянская Н.И., Иванов А.В. Иттербиевые комплексы порфиринов - перспективные маркеры для люминесцентной диагностики опухолей в ИК-диапазоне. - Лазерная медицина. - 2010. - Т.14. - Вып.1. - С.20-25.
2. Лощенов В.Б., Меерович Г.А., Стратонников А.А. Спектральное устройство для контроля и мониторинга процесса фотодинамической терапии. - Патент РФ №2169590, МПК A61N 5/06.
3. Миронов А.Ф., Румянцева В.Д., Сапронова Е.В., Чиссов В.И., Сухин Г.М., Пономарев Г.М., Гайдук М.И., Мененков В.Д., Григорьянц В.В. Способ исследования малигнизации тканей у экспериментальных животных. - Авт.свид. №1621720, МПК G01N 33/52.
4. Блинов Л.М., Герасименко А.П., Гуляев Ю.В. Способ изготовления заготовок волоконных световодов, устройство для его осуществления и заготовка, изготовленная этим способом. - Патент РФ №2363668, МПК С03В 37/018.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАНОКОМПОЗИЦИЯ ДЛЯ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2014 |
|
RU2578976C2 |
| СПОСОБ ИССЛЕДОВАНИЯ МАЛИГНИЗАЦИИ ТКАНЕЙ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 1988 |
|
SU1621720A1 |
| СПОСОБ ИЗУЧЕНИЯ МАЛИГНИЗАЦИИ ТКАНЕЙ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 1993 |
|
RU2074718C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2016 |
|
RU2617045C1 |
| ИТТЕРБИЕВЫЙ КОМПЛЕКС ДИКАЛИЕВОЙ СОЛИ 2,4-ДИМЕТОКСИГЕМАТОПОРФИРИНА IX КАК ФЛУОРЕСЦЕНТНАЯ МЕТКА ДЛЯ РАННЕЙ ДИАГНОСТИКИ РАКА | 2009 |
|
RU2411243C1 |
| ИТТЕРБИЕВЫЕ КОМПЛЕКСЫ ПОРФИРИНОВ В КАЧЕСТВЕ ЛЮМИНЕСЦЕНТНЫХ ВЕЩЕСТВ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 1985 |
|
SU1340087A1 |
| СПОСОБ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ И/ИЛИ КАЧЕСТВЕННОЙ ОЦЕНКИ СОСТОЯНИЯ БИОЛОГИЧЕСКОГО ОБЪЕКТА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2004 |
|
RU2254372C1 |
| КОМПОЗИТНЫЕ НАНОЧАСТИЦЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ДИАГНОСТИКИ | 2011 |
|
RU2463074C1 |
| СПОСОБ СЕЛЕКТИВНОГО ЛАЗЕРНОГО ФОТОТЕРМОЛИЗА РАКОВЫХ КЛЕТОК ПЛАЗМОННО-РЕЗОНАНСНЫМИ НАНОЧАСТИЦАМИ | 2015 |
|
RU2653801C1 |
| СПОСОБ ИНТРАОПЕРАЦИОННОЙ ВИЗУАЛИЗАЦИИ ПАТОЛОГИЧЕСКИХ ОЧАГОВ | 2012 |
|
RU2544094C2 |

Изобретение относится к медицинской технике, а именно к аппаратуре медицинского и фотобиологического назначения, предназначено для осуществления процесса люминесцентной диагностики рака на основе использования ряда редкоземельных металлокомплексов порфиринов и направлено на повышение чувствительности измерений интенсивности люминесценции в диапазоне спектра 900-1100 нм, что приводит к резкому снижению дозы вводимого в организм пациента препарата и исключает наличие какой-либо токсичности при проведении процедуры. Устройство содержит источник лазерного излучения, волоконно-оптический зонд, включающий световод доставки лазерного излучения к биоткани, входной конец которого через устройство ввода соединен с источником лазерного излучения, и приемную волоконно-оптическую систему для детектирования люминесценции, блок регистрации и обработки люминесцентного сигнала, первую систему линз, расположенную на входе этого блока, генератор импульсов, вторую система линз, расположенную на выходе приемной волоконно-оптической системы зонда, и интерференционные отражательные фильтры, расположенные между указанными системами линз. 6 з.п. ф-лы, 2 ил.
1. Устройство для люминесцентной диагностики новообразований, содержащее источник лазерного излучения, волоконно-оптический зонд, включающий световод доставки лазерного излучения к биоткани, входной конец которого через устройство ввода соединен с источником лазерного излучения, и приемную волоконно-оптическую систему для детектирования люминесценции, блок регистрации и обработки люминесцентного сигнала, первую систему линз, расположенную на входе этого блока, и генератор импульсов, один выход которого подключен к управляющему входу источника лазерного излучения, а второй - к управляющему входу блока регистрации и обработки сигнала, отличающееся тем, что в него дополнительно введены вторая система линз, расположенная на выходе приемной волоконно-оптической системы зонда, и интерференционные отражательные фильтры, расположенные между указанными системами линз таким образом, что каждый последующий фильтр размещен на пути оптического излучения, отраженного от предыдущего фильтра, при этом с обратной стороны каждого фильтра расположен светопоглощающий экран.
2. Устройство по п.1, отличающееся тем, что оно содержит, по меньшей мере, 4 интерференционных отражательных фильтра.
3. Устройство по п.1, отличающееся тем, что каждый интерференционный отражательный фильтр имеет коэффициент отражения менее 10% в спектральном диапазоне 350-900 нм и более 90% в диапазоне 900-1100 нм.
4. Устройство по п.1, отличающееся тем, что интерференционные отражательные фильтры расположены под углом 45° к падающему на них оптическому излучению.
5. Устройство по п.1, отличающееся тем, что перед волоконно-оптическим зондом дополнительно введен пропускающий фильтр, у которого соотношение между значением коэффициента пропускания на длине волны излучения лазера и значениями коэффициентов пропускания на длинах волн, превышающих длину волны излучения лазера на 20 нм и более, составляет не менее 30.
6. Устройство по п.1, отличающееся тем, что световод доставки лазерного излучения имеет состав SiO2+F/SiO2 и числовую апертуру 0,20-0,22.
7. Устройство по п.1, отличающееся тем, что приемная волоконно-оптическая система для детектирования люминесценции содержит не менее 12 световодов состава SiO2+F/SiO2 с металлическим покрытием и числовой апертурой 0,33 и выше.
| СПЕКТРАЛЬНОЕ УСТРОЙСТВО ДЛЯ КОНТРОЛЯ И МОНИТОРИНГА ПРОЦЕССА ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2000 |
|
RU2169590C1 |
| Гидравлический привод механизма раскрытия вставного долота | 1956 |
|
SU112631A1 |
| УСТРОЙСТВО ДЛЯ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ И ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2001 |
|
RU2221605C2 |
| WO 9922814 A1, 14.05.1999. | |||
Авторы
Даты
2013-06-10—Публикация
2012-03-15—Подача