Настоящее изобретение относится к экспериментальной медицине, а именно к композитным наночастицам (КНЧ) для последовательной люминесцентной диагностики в ближней ИК (БИК)-области спектра и терапии (тераностика) злокачественных новообразований, включающее иттербиевые комплексы порфиринов (ИКП): диметиловый эфир (ДМЭ) протопорфирина (ПП)IX, тетраметиловый эфир (ТМЭ) гематопорфирина (ГП)IX и ТМЭ копропорфирина (КП)III, а также оксид железа FeOx в полимерной матрице на основе Лексана. Данный способ можно позиционировать как магнито-люминесцентную тераностику (МЛТ) опухолей. Тераностика подразумевает комплекс неинвазивных методов диагностики и терапии, объединенных в единый последовательный или в идеале - одновременный процесс в рамках общей технологической платформы. Изобретение перспективно для использования в БИК-люминесцентной диагностике (ЛД) новообразований и проведении последовательной процедуры локальной магнитной гипертермии (МГТ). Это обусловлено тем, что наночастицы обладают увеличенным временем жизни люминесценции в БИК-области спектра 700-1100 нм, отсутствием флуоресценции свободных оснований порфиринов в красной области спектра. При этом не происходит генерация синглетного кислорода, приводящее к нежелательным побочным реакциям в виде дерматитов при диагностических процедурах за счет избыточного образования свободных радикалов. В методе МЛТ применяется наиболее продвинутая в настоящее время медицинская технология, использующая греющие радиочастотные магнитные поля (МП)- радиочастотная МГТ, которая нуждается в МП с частотами 200-700 кГц. В качестве медиаторов действия поля в них используются магнитные наночастицы (МНЧ) Новые подходы к нанотераностике: полифункциональные магнитные наночастицы, активируемые негреющим низкочастотным магнитным полем, управляют биохимической системой с молекулярной локальностью и селективностью [Головин Ю.И., Клячко Н.Л., Мажуга А.Г. и др.].// Российские нанотехнологии. 2018. Т. 13. №5-6. С. 3.].
В последние годы разработаны различные методы создания полимерных композиционных материалов на основе порфиринов и фталоцианинов, которые обеспечивают их молекулярно-дисперсное состояние [Койфман О.И., Агеева Т.А., Базанов М.И., Березин Д.Б. /Функциональные материалы на основе тетрапиррольных макрогетероциклических соединений//Под ред. чл.-корр. РАН Койфмана О.И. - М.: ЛЕНАНД. - 2019. - 848 с.]. Одним из наиболее перспективных методов является физическая иммобилизация порфиринов в гидрофильных полимерных матрицах («молекулярном контейнере»). Введение в полимерную матрицу подобных соединений обеспечивает их солюбилизацию в водных средах.
ИКП ранее были предложены для диагностики новообразований в виде липосомальных форм [Патент РФ №1340087, Бюл. №18, С. 273 от 27.06.1995 г.]. В изобретении описаны иттербиевые комплексы 3-х порфиринов: ДМЭ ПП IX, ТМЭ КП III и ТМЭ ГП IX. Для перевода этих соединений в водорастворимую форму использовали их липосомальные формы на основе лецитина или его смеси с кардиолипином (4:1). Применение методов волоконно-лазерной спектрофлуорометрии позволяет получать информацию о накоплении Yb-комплексов в тканях как доброкачественного, так и злокачественного типа. Однако значение люминесцентного контрастного индекса (ЛКИ) для главной полосы люминесценции на длине волны 975 нм составляет всего 3.5-4.5, что недостаточно для анализа исследуемого материала.
В дальнейшем для диагностики новообразований были предложены ИКП водорастворимых порфиринов [Патент РФ №1621720, опубл. 09.07.1995 г.], где был значительно увеличен ЛКИ вплоть до 48. Введение препарата осуществляли в хвостовую вену мышей.
Для диагностики злокачественных опухолей использовали водорастворимую дикалиевую соль 2,4-диметоксигематопорфирина IX [Патент РФ №2411243, опубл. 09.07.2009 г.].
Молекулярный кислород не тушит люминесценцию иона металла в иттербиевых комплексах порфиринов, что облегчает проведение диагностических процедур и повышает чувствительность метода. Далее этот же ИКП был использован для создания фармацевтической композиции при проведении люминесцентной диагностики патологически измененной кожи и слизистых оболочек [Патент РФ №2617045, Бюл. №11 от 19.04.2017 г.] с использованием гелевой основы в виде кремофора, тизоля и калгеля. Значение ЛКИ достигало значений вплоть до 15.
Известны также композитные наноструктуры для люминесцентной диагностики с последующим проведением лазерного фототермолиза (терапии) опухолей [Патент РФ №2463074, опубл. 10.10.2012 г.] на основе Au-Ag наноклеток и Yb-2,4-диметоксигематопорфирина IX, покрытые оболочкой из двуокиси кремния, сформированной путем гидролиза тетраэтилортосиликата в спиртовой среде. При этом реализуется метод плазмонно-резонансной фототермотерапии. Однако у предлагаемых КНЧ существует ряд недостатков, а именно: требующий дорогостоящих реактивов, трудоемкий многостадийный химический синтез построения многофункциональных наночастиц на основе золото-серебряных наноклеток, покрытых диоксидом кремния и функционализированных ИКП; длительное время накопления данных КНЧ в новообразованиях, которое составляет не менее 24 ч; силикатная матрица довольно пористая и склонна к агрегации в крови, в результате чего происходит преждевременный выход из нее компонентов комплекса.
Наиболее близким техническим решением, выбранный авторами за прототип, является нанокомпозиция для люминесцентной диагностики злокачественных опухолей [Патент РФ №2578976, Бюлл. №9 от 27.03.2016 г.]. Созданы КНЧ для БИК-ЛД на основе Лексан-полимерной матрицы и Yb-комплексов ПП IX, ГП IX и КП III.
Недостатком является невозможность одновременного проведения диагностики с локальной МГТ.
Технический результат изобретения заключается в создании композитных наночастиц для магнито-люминесцентной тераностики злокачественных новообразований, включающее иттербиевые комплексы порфиринов (ИКП, а также магнетит Fe3O4 в полимерной матрице на основе лексана, с увеличенным временем жизни и интенсивности люминесценции в ближней ИК-области спектра и эффективной локальной МГТ.
Технический результат достигается тем, что нанокомпозиты для люминесцентной диагностики и тераностики новообразований, включающие иттербиевые комплексы диметилового эфира протопорфирина IX или тетраметилового эфира гематопорфирина IX или копропорфирина III, помещенные в полимерную оболочку на основе лексана, дополнительно содержат ядро магнетита Fe3O4 с диаметром ядра d=10-20 нм, при этом размер наночастиц должен удовлетворять условию D=150-200нм
Наночастицы магнетита, получены с использованием метода электрического взрыва металлической проволоки посредством высоковольтных электрических импульсов (30 кВ, 1 Гц) [Kurlyandskaya G.V., Bhagat S.M., Safronov А.Р. et al. // AIP Adv. 2011. V. 1. P. 042122. https://doi.org/10.1063/1.]. В качестве магнитного ядра был использован магнетит Fe3O4, имеющий существенно меньшую токсичность, чем чистые магнитные металлы и многие магнитные сплавы. Синтезированы МНЧ на основе магнетита, которые представляли собой достаточно грубодисперсный порошок следующего распределения по размерам (диаметрам): 3 нм - 25%, 8 нм - 35%, 10 нм - 10%, 15 нм - 20%, Конкурентным преимуществом МНЧ является то, что они могут быть визуализированы, направлены и удержаны в определенном месте с помощью магнитного поля, а также для проведения гипертермии биотканей. Наночастицы, содержащие ядро оксидов железа и полимерную оболочку, содержащую ИКП, были приготовлены по методу [Ivanovskaya N.P., Shilov I.Р., Shchamkhalov K.S. et al. Nanoparticles based on lexan polymer matrix and the Ytterbium complex of porphyrin: synthesis, spectral-luminescence properties and prospects of using for neoplasm diagnostics // Macroheterocycles. 2015. V. 8. №1. P. 50. https://doi.org/10.6060/mhc140715r].
При создании нанокомпозитов в качестве полимерной основы, устойчивой к преждевременному выходу МНЧ, был выбран поликарбонатный бисфенольный полимер - лексан. Он обладает достаточной гидрофобностью, чтобы в него могли инкорпорироваться молекулы ИКП для диагностики новообразований, и в то же время биологической совместимостью, чтобы частицы можно было использовать in vivo. Для придания поверхности КНЧ гидрофильности, а следовательно, меньшей агрегируемости и более длительной циркуляции в организме, в органическую фазу вводили также неионогенный детергент Тритон Х-100. При образовании частиц гидрофобная часть детергента встраивалась в частицу, а гидрофильная (полиэтиленгликолевая) оставалась на поверхности. Проведенная оценка распределения синтезированных частиц лексан-полимерной матрицы (ЛПМ)+ИКП+FeOx по размерам показала, что с увеличением концентрации полимера в реакционном объеме получаются частицы большего диаметра.
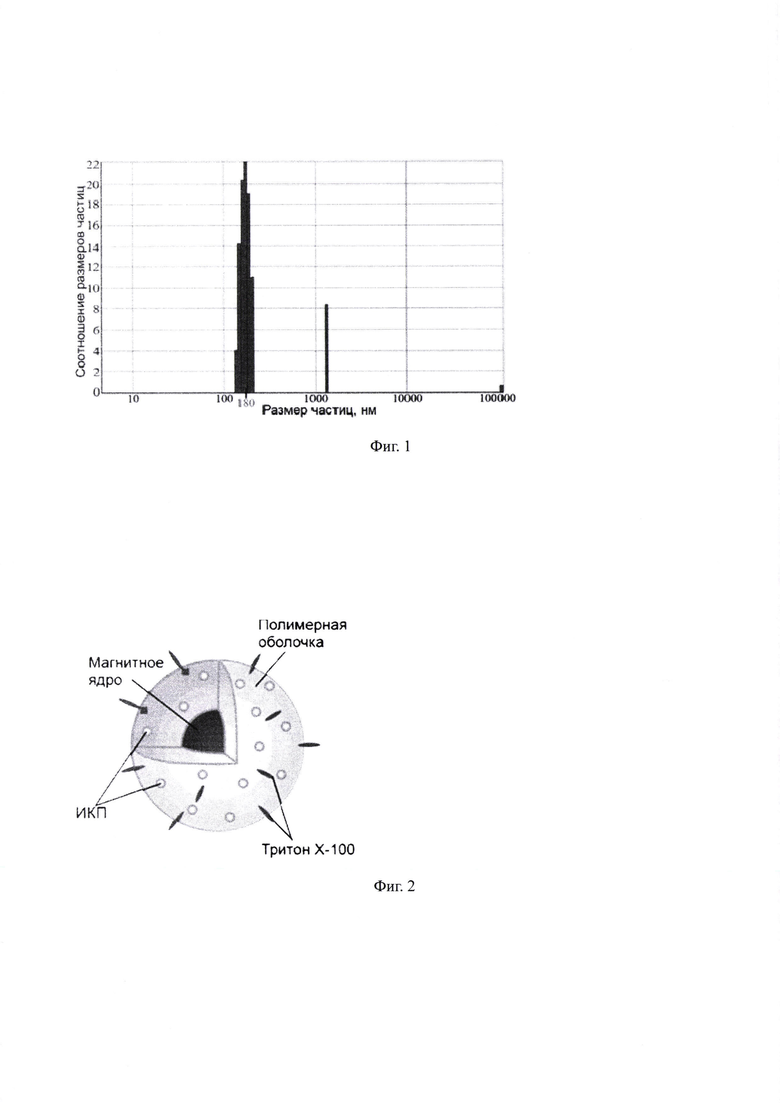
На Фиг. 1 представлено распределение композитных наночастиц по размерам (при концентрации ЛПМ в реакционной смеси ~ 100 мкг/л). Как видно из Фиг. 1. средний измеренный диаметр синтезированных КНЧ составил ~180 нм. Размер КНЧ в диапазоне 150-200 нм является оптимальным для длительной циркуляции КНЧ в организме и преимущественном накоплении их в опухоли вследствие проникновения через дефекты эндотелия кровеносных сосудов. Размер КНЧ менее 150 нм приводит к ухудшению люминесцентных свойств нанокомпозита (меньшее число в нем инкорпорированных частиц ИКП). Размер КНЧ более 200 нм приводит к существенному (~30%) снижению селективности накопления нанокомпозита в опухоли, что резко снижает эффективность МЛТ.
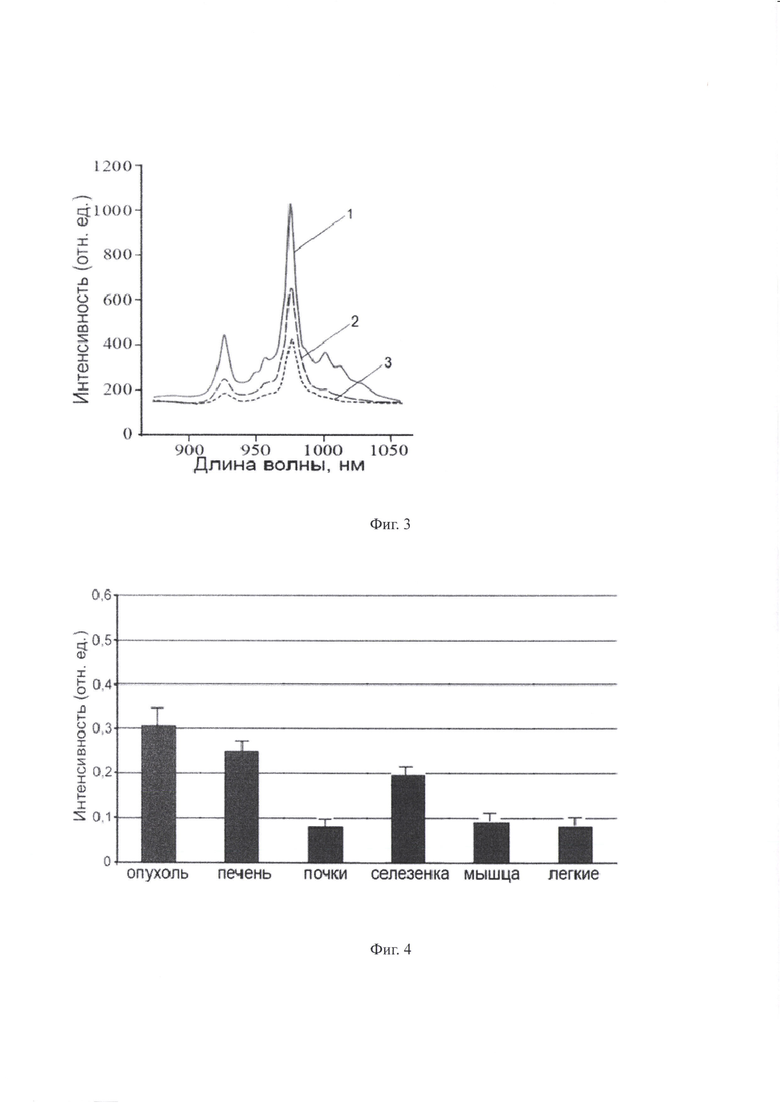
Для целей МЛТ опухолей разработаны КНЧ, содержащие МНЧ-ядро на основе магнетита с с размером 10-20 нм, которые ответственны за терапию опухолей посредством гипертермии. На Фиг. 2 представлена принципиальная схема синтезированных КНЧ.
Показано, что включение ядра магнетита в наночастицы приводит к снижению интенсивности люминесценции ИКП в синтезированных КНЧ, в связи с чем необходимо определить оптимальный размер МНЧ как для процедур ЛД, так и МГТ.
На Фиг. 3 представлены эмиссионные спектры в ближней ИК-области спектра (λвозб ~532 нм) нанокомпозитов с МНЧ-ядром со средними размерами 20 нм и 30 нм., где 1 - ЛПМ+Yb(асас)-ТМЭ ГП IX, 2 - ЛМП + Yb(асас)-ТМЭ ГП IX + Fe3O4 (средний размер d~10 нм), 3 - ЛМП + Yb(acac)-TM3 ГП IX + Fe3O4 (средний размер d~30нм).
Для сравнения приведен спектр нанокомпозита без МНЧ. Показано, что применение МНЧ со средним размером-20 нм приводит к незначительному (на ~30%) снижению интенсивности люминесценции Yb(acac)-ТМЭ ГП IX и всей КНЧ в целом, в то время как включение магнетитового ядра с размером 30нм в КНЧ приводит к приблизительно двухкратному снижению интенсивности люминесценции Yb(acac)-ТМЭ ГП IX в синтезированных вариантах МНЧ. Установлено, что основная доля люминесценции приходится на самую мелкодисперсную (надосадочную) фракцию, что свидетельствует о том, что грубодисперсная суспензия, содержащая "крупные" ядра Fe3O4 (свыше 30нм), практически не люминесцирует в результате тушения люминесценции Yb 3+-иона. Этот недостаток для МНЧ с размером не более 20 нм может быть компенсирован некоторым увеличением терапевтической дозы нанокомпозита, что является допустимым для осуществления процедур ЛД опухолей.
Оптимальными размерами для МНЧ при осуществлении процедур локальной МГТ является диапазон d=10-15 нм. Это связано с эффективностью нагрева МНЧ в радиочастотном МП. Таким образом синтезированные МНЧ со средним размером d=10-20 нм являются оптимальными под задачи МЛТ.
Исследовано также биораспределение данного нанокомпозита (со средним размером МНЧ ~10 нм) в органах и тканях животных (мыши-самки линии Bulb/c с перевитой карциномой Эрлиха) в определенные временные промежутки от момента его введения. Доза субстанции, вводимая мышам внутривенно, составила ~1 мг/кг веса, что намного ниже дозы выживаемости и терапевтических доз фотосенсибилизаторов при фотодинамической терапии опухолей. Следует отметить, что используемые в нанокомпозите ИКП обладают почти нулевой фотоцитотоксичностью. Исследование фармакокинетики показало, что в первые часы после введения субстанции она локализуется в основном в паренхиматозных органах, прежде всего в селезенке, что полностью согласуется с данными по острой токсичности, когда селезенка является мишенью номер 1 для этого нанокомпозита. Но в течение 12 ч препарат уже значительно "вымывается" из этих органов и довольно прочно оседает в опухолевой ткани. На основе спектрофлуорометрических измерений строилась гистограмма распределения интенсивности люминесценции в различных органах и тканях мыши после внутривенного введения препарата (режим ex vivo).
На Фиг. 4 представлена гистограмма распределения интенсивности люминесценции в различных органах и тканях мыши после внутривенного введения препарата (режим ex vivo, доза 1 мг/кг веса, время накопления-12 час). Приведенные результаты показывают значительную селективность накопления КНЧ в опухоли уже через 12 ч после внутривенного введения. Этот результат можно частично объяснить размерным эффектом (размер наночастиц композита не превышает 200 нм), что вполне согласуется с размерами дефектов сосудистой сети в опухолевой ткани.
Пример 1.
Состав КНЧ: ЛПМ диаметром 180 нм и концентрацией 100 мкг/л., ИКП- Yb(acac)-ТМЭ ГП IX с концентрацией 10-5-10-6 моль/л, МНЧ на основе магнетита со средним размером 20 нм. При этом интенсивность люминесценции по сравнению с нанокомпозитом без магнетита уменьшается примерно на 30%, что допустимо для проведения ЛД опухолей.
Пример 2.
Состав КНЧ: ЛПМ диаметром 180 нм и концентрацией 100 мкг/л., ИКП- Yb(acac)-ТМЭ ГП IX с концентрацией 10-5-10-6 моль/л, МНЧ на основе магнетита со средним размером 30нм. При этом интенсивность люминесценции по сравнению с нанокомпозитом без магнетита уменьшается почти в 2 раза (что недопустимо для проведения ЛД опухолей). Кроме того также существенно снижается эффективность процесса МГТ.
Пример 3.
Состав КНЧ: ЛПМ диаметром 130 нм и концентрацией ~70 мкг/л., ИКП- Yb(acac)-ТМЭ ГП IX с концентрацией 10-5-10-6 моль/л, МНЧ на основе магнетита со средним размером 20 нм.
При этом интенсивность люминесценции уменьшается почти на 30%. по сравнению с нанокомпозитом состава: ЛПМ диаметром 150 нм и концентрацией ~80 мкг/л., ИКП-Yb(acac)-ТМЭ ГП IX с концентрацией 10-5-10-6 моль/л, МНЧ на основе магнетита со средним размером 20 нм.
Пример 4.
Состав КНЧ: ЛПМ диаметром 220 нм и концентрацией ~120 мкг/л., ИКП- Yb(acac)-ТМЭ ГП IX с концентрацией 10-5-10-6 моль/л, МНЧ на основе магнетита со средним размером 20 нм.
При этом селективность накопления нанокомпозита в опухоли уменьшается примерно на 30% по сравнению с нанокомпозитом состава: ЛПМ диаметром 200 нм и концентрацией ~110 мкг/л., ИКП- Yb(acac)-ТМЭ ГП IX с концентрацией 10-5-10-6 моль/л, МНЧ на основе магнетита со средним размером 20 нм.
Полученные данные свидетельствуют о перспективности применения синтезированных КНЧ для метода магнито-люминесцентной тераностики опухолей визуально и эндоскопически доступной локализации. Включение ядра Fe3O4 в нанокомпозит позволяет проводить контролируемую локальную высокочастотную гипертермию тканей, накопивших данную наноструктуру.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАНОКОМПОЗИЦИЯ ДЛЯ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2014 |
|
RU2578976C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2016 |
|
RU2617045C1 |
| ИТТЕРБИЕВЫЕ КОМПЛЕКСЫ ТЕТРАПИРАЗОЛИЛПОРФИРИНОВ КАК ФЛУОРЕСЦЕНТНЫЕ МЕТКИ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2008 |
|
RU2372099C1 |
| ИТТЕРБИЕВЫЙ КОМПЛЕКС ДИКАЛИЕВОЙ СОЛИ 2,4-ДИМЕТОКСИГЕМАТОПОРФИРИНА IX КАК ФЛУОРЕСЦЕНТНАЯ МЕТКА ДЛЯ РАННЕЙ ДИАГНОСТИКИ РАКА | 2009 |
|
RU2411243C1 |
| КОМПОЗИТНЫЕ НАНОЧАСТИЦЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ДИАГНОСТИКИ | 2011 |
|
RU2463074C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИКАЛИЕВОЙ СОЛИ ИТТЕРБИЕВОГО КОМПЛЕКСА 2,4-ДИ(α-МЕТОКСИЭТИЛ)ДЕЙТЕРОПОРФИРИНА IX АЦЕТИЛАЦЕТОНАТА | 2019 |
|
RU2697418C1 |
| Нанокомпозиты на основе гадолинийсодержащих соединений для диагностики, терапии и тераностики онкологических заболеваний головного мозга и способы их получения | 2021 |
|
RU2778928C1 |
| УСТРОЙСТВО ДЛЯ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ НОВООБРАЗОВАНИЙ | 2012 |
|
RU2483678C1 |
| СПОСОБ ИССЛЕДОВАНИЯ МАЛИГНИЗАЦИИ ТКАНЕЙ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 1988 |
|
SU1621720A1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ДЛЯ ТЕРАНОСТИКИ ОПУХОЛЕЙ НА ОСНОВЕ АНТИСТОКСОВЫХ НАНОФОСФОРОВ И БЕЛКОВЫХ МОЛЕКУЛ | 2020 |
|
RU2745187C1 |
Изобретение относится к экспериментальной медицине. Нанокомпозиты для люминесцентной диагностики и тераностики новообразований включают помещенные в полимерную оболочку на основе лексана иттербиевые комплексы диметилового эфира протопорфирина IX, или тетраметилового эфира гематопорфирина IX, или копропорфирина III. Нанокомпозиты дополнительно содержат ядро магнетита Fe3O4 с диаметром ядра 10-20 нм. Размер наночастиц составляет 150-200 нм. Изобретение позволяет увеличить время жизни и интенсивность люминесценции иттербиевых комплексов порфиринов в ближней ИК-области спектра для проведения эффективной локальной магнито-люминесцентной тераностики новообразований. 4 ил., 4 пр.
Нанокомпозиты для люминесцентной диагностики и тераностики новообразований, включающие помещенные в полимерную оболочку на основе лексана иттербиевые комплексы диметилового эфира протопорфирина IX, или тетраметилового эфира гематопорфирина IX, или копропорфирина III, отличающиеся тем, что нанокомпозиты дополнительно содержат ядро магнетита Fe3O4 с диаметром ядра d=10-20 нм, при этом размер наночастиц должен удовлетворять условию D=150-200 нм.
| НАНОКОМПОЗИЦИЯ ДЛЯ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2014 |
|
RU2578976C2 |
| ИТТЕРБИЕВЫЕ КОМПЛЕКСЫ ТЕТРАПИРАЗОЛИЛПОРФИРИНОВ КАК ФЛУОРЕСЦЕНТНЫЕ МЕТКИ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2008 |
|
RU2372099C1 |
| ИТТЕРБИЕВЫЙ КОМПЛЕКС ДИКАЛИЕВОЙ СОЛИ 2,4-ДИМЕТОКСИГЕМАТОПОРФИРИНА IX КАК ФЛУОРЕСЦЕНТНАЯ МЕТКА ДЛЯ РАННЕЙ ДИАГНОСТИКИ РАКА | 2009 |
|
RU2411243C1 |
| ИТТЕРБИЕВЫЕ КОМПЛЕКСЫ ПОРФИРИНОВ В КАЧЕСТВЕ ЛЮМИНЕСЦЕНТНЫХ ВЕЩЕСТВ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 1985 |
|
SU1340087A1 |
| WO 2018064961 A1, 12.04.2018 | |||
| WO 2016070851 A1, 12.05.2016 | |||
| ШИЛОВ И.П | |||
| и др., Спектрально-люминесцентные свойства нанокомпозита на основе иттербиевого комплекса протопорфирина IX и лексан-полимерной матрицы для диагностики новообразований, | |||
Авторы
Даты
2022-03-15—Публикация
2021-03-16—Подача