Настоящая заявка испрашивает приоритет на основании даты подачи предварительной заявки на патент США №61/221,541, поданной 29 июня, 2009, предварительной заявки на патент США №61/240,616, поданной 8 сентября 2009, предварительной заявки на патент США №61/240,598, опубликованной, поданной 8 сентября 2009, предварительной заявки на патент США №61/316,267, поданной 22 марта 2010. Содержание всех указанных заявок непосредственным образом включено в настоящее описание посредством ссылки.
I. Область техники
Пневмококковая инфекция остается ведущей причиной заболеваний и смерти в Соединенных штатах Америки и в мире. Ежегодно инфекция патогеном Streptococcus pneumoniae вызывает миллионы случаев пневмонии, бактериемии, менингита и среднего отита. S. pneumoniae представляет собой грамотрицательный кокк, имеющий капсулу, который колонизирует носоглотку у приблизительно 5-10% здоровых взрослых людей и 20-40% здоровых детей. Нормальная колонизация становится инфекционной, если S. pneumoniae проникает в Евстахиевы трубы, пазухи носа, легкие, кровоток, оболочки головного мозга, суставные щели, кости и брюшную полость. S. pneumoniae имеет несколько факторов вирулентности, которые позволяют микроорганизму ускользать от иммунной системы. Примеры этих факторов включают полисахаридную капсулу, которая препятствует фагоцитозу клетками иммунной системы хозяина, протеазы, которые подавляют опосредованную комплементом опсонизацию, и белки, которые вызывают лизис клеток хозяина. Наличие в полисахаридной капсуле сложных полисахаридов создает основу для подразделения пневмококков на различные серотипы. На сегодняшний день были обнаружены 93 серотипа S. pneumoniae.
Использовали различные фармацевтические композиции для управления иммунным ответом против инфекции S. pneumoniae. Была сконструирована поливалентная вакцина PPV-23 против пневмококков для профилактики пневмонии и других инвазивных заболеваний, вызванных & Pneumoniae, у взрослых и пожилых людей. Указанная вакцина содержит капсульные полисахариды (CP) 23 серотипов S. pneumoniae. Будучи независимыми от Т-клеток антигенами, указанные CP вызывают ответ в виде только короткоживущих антител, делая необходимым введение повторных доз, что повышает риск развития иммунологической толерантности. Указанные антитела, полученные против S. pneumoniae, обозначаемые термином противокапсульные антитела, считаются защитными для взрослых и иммунокомпетентных людей. Однако дети младше 2 лет и люди с нарушенным иммунитетом недостаточно хорошо отвечают на независимые от Т-клеток антигены и, таким образом, им не может быть обеспечена оптимальная защита при применении PPV-23. Вторая вакцина против S. pneumoniae, Prevnar, включает бактериальные полисахариды 7 штаммов S. Pneumoniae, конъюгированные с белком дифтерийного анатоксина. Указанная вакцина вызывает как Т-клеточный, так и В-клеточный ответ.Однако поскольку вакцина является защитной только против 7 серотипов пневмококка, замена серотипа может сделать Prevnar неэффективной. PPV-23 имеет то же ограничение. В нескольких клинических и эпидемиологических исследованиях уже была доказана смена серотипа, и это повышает вероятность того, что потребуется создать различные препараты вакцин, возможно с большими затратами. Более того как производство PPV-23, так и производство Prevnar являются дорогостоящими, что весьма ограничивает их доступность в развивающихся странах.
Таким образом, сохраняется необходимость в создании более эффективных фармацевтических композиций, чем предлагают существующие стратегии. В частности необходимо, чтобы такие композиции включали новые или специфические антигены, которые вызывают иммунный ответ против S. pneumoniae.
П. Краткое описание изобретения
Streptococcus pneumoniae является большое проблемой здравоохранения, особенно для очень молодых, пожилых пациентов или пациентов с нарушенным иммунитетом. Хотя уже известны последовательности ДНК и белков S. pneumoniae, и исследователи на протяжении многих лет пытаются создать вакцину против S. pneumoniae, главной проблемой было определение защитных полипептидов среди приблизительно 2100 генов в геноме S. pneumoniae. В настоящей заявке представлены результаты скринингового исследования в масштабе всего генома по определению наиболее иммуногенных белков в геноме S. pneumoniae. Было показано, что несколько пептидов, обнаруженных в ходе скрининга защищают от колонизации S. pneumoniae на мышиной модели. Соответственно настоящее изобретение, в частности, обеспечивает определенные высокоэффективные вакцины против Streptococcus pneumoniae. Указанные вакцины можно применять в терапевтических или профилактических целях. Также настоящее описание обеспечивает специфичные антигены и способы использования указанных антигенов для запуска иммунного ответа против S. pneumoniae.
Настоящее описание раскрывает, например, препарат вакцины, который содержит фармацевтически приемлемый носитель и один или более полипептидов, имеющих аминокислотную последовательность, содержащую любую из SEQ ID NO: 1-11, или иммуногенный фрагмент указанной последовательности, и дополнительно также содержит полипептид, имеющий аминокислотную последовательность, содержащую одну из SEQ ID NO: 12 и 13, или иммуногенный фрагмент указанной последовательности.
Настоящее описание также обеспечивает препарат вакцины, содержащий фармацевтически приемлемый носитель и полипептид, который имеет аминокислотную последовательность, состоящую из SEQ ID NO: 11, или иммуногенного фрагмента указанной последовательности. Дополнительно настоящее описание обеспечивает препарат вакцины, содержащий фармацевтически приемлемый носитель и полипептид, который имеет аминокислотную последовательность, содержащую SEQ ID NO: 12.
Кроме того, настоящая заявка обеспечивает препарат вакцины, содержащий фармацевтически приемлемый носитель и один или более полипептидов, которые имеют аминокислотную последовательность, содержащую любую из SEQ ID NO: 14-21, или иммуногенный фрагмент указанной последовательности.
Настоящая заявка обеспечивает, в частности, способ лечения пациента, страдающего от или чувствительного по отношению к инфекции & pneumoniae, включающий введение эффективного количества любого из описанных выше препаратов вакцины.
Настоящее описание обеспечивает иммуногенную композицию, содержащую фармацевтически приемлемый носитель и два или более полипептидов, которые имеют аминокислотную последовательность, содержащую любую из SEQ ID NO: 1-13, или иммуногенный фрагмент указанной последовательности, отличающуюся тем, что по меньшей мере один из указанных полипептидов имеет аминокислотную последовательность, содержащую одну из SEQ ID NO: 1-10, или иммуногенный фрагмент указанной последовательности.
III. Краткое описание фигур
На Фигуре 1 показана концентрация IL-17 в образцах крови мышей, которых иммунизировали указанным(ми) белком (белками) и холерным токсином, затем стимулировали убитыми декапсулированными цельными клетками S. pneumoniae согласно описанию в Примере 5. На правой панели показана точечная диаграмма для всех данных, и на правой панели показаны средняя и стандартное отклонение для каждого образца. Иммунизированная группа «Все 3» обозначает животных, иммунизированных комбинацией SP2108, SP0148 и SP1634.
На Фигуре 2 показана концентрация IL-17 в образцах крови мышей, которых иммунизировали указанным(ми) белком (белками) и холерным токсином, затем стимулировали комбинацией трех белков (SP2108, SP0148 и SP1634) как описано в Примере 5.
На Фигуре 3 показано количество колоний S. pneumoniae, выросших из смыва из носа у мышей, которых иммунизировали указанным(ми) белком (белками) и холерным токсином, и затем интраназально вводили S. pneumoniae как описано в Примере 5. 003 представляет собой контрольный неродственный антиген.
На Фигуре 4 показана концентрация IL-17 в образцах крови мышей, которых иммунизировали указанным(ми) белком (белками) и холерным токсином, затем стимулировали убитыми декапсулированными цельными клетками S. pneumoniae как описано в Примере 6.
На Фигуре 5 показана концентрация IL-17 в образцах крови мышей, которых иммунизировали указанным(ми) белком (белками) и холерным токсином, затем стимулировали указанными белками и комбинацией как описано в Примере 5.
На Фигуре 6 показано количество колоний S. pneumoniae, выросших из смыва из носа у мышей, которых иммунизировали указанным(ми) белком (белками) и холерным токсином, и затем интраназально вводили S. pneumoniae как описано в Примере 6. Белок ICP47 HSV-2, кодируемый геном US12 (NP_044543.1, NC_001798.1; на фигуре обозначен как 003) и яичный альбумин (OVA) представляют контрольные антигены.
На Фигуре 7 показано количество колоний S. pneumoniae, выросших из смыва из носа у мышей, которых иммунизировали указанным(ми) белком (белками) и холерным токсином, и затем интраназально вводили S. pneumoniae как описано в Примере 7.
На Фигуре 8 показано количество колоний S. pneumoniae, выросших из смыва из носа у мышей BALB/c, которых иммунизировали указанным(ми) белком (белками) и холерным токсином, и затем интраназально вводили S. pneumoniae как описано в Примере 8.
IV. Подробное описание изобретения
А. Специфичные полипептиды и нуклеиновые кислоты для применения в вакцинах против S. pneumoniae и иммуногенные композиции
В настоящей заявке описаны вакцины против S. pneumoniae, которые включают один или более полипептидов или генов, перечисленных в Таблице 1, или их варианты или фрагменты согласно описанию ниже. Указанная вакцина может включать полипептид, который содержит последовательность из Таблицы 1, или вариант или иммуногенный фрагмент указанной последовательности, или полипептид, который состоит из последовательности из Таблицы 1, или его вариант или иммуногенный фрагмент. Последовательность ДНК или белка каждого гена и полипептида можно обнаружить посредством поиска по метке локуса (Locus Tag) в общественно доступной базе данных Entrez Gene (на сайте NCBI NIH в Интернете, ), в геноме Streptococcus pneumoniae TIGR4, и указанные последовательности также включены в настоящую заявку.
(от 30 марта, 2010)
Некоторые полипептиды Таблицы 1 и их варианты более подробно описаны ниже.
1. SP0024 (SEQ ID NO:1) и его варианты
SP0024 представляет собой гипотетический белок, состоящий из 165 аминокислот, содержащий консервативный домен карбоангидразы, который располагается между аминокислотой 27 и аминокислотой 163. С учетом этого консенсусного мотива SP0024 может представлять собой цинк-связывающий белок.
Согласно некоторым вариантам реализации вакцины или фармацевтические композиции, содержащие полипептид S. pneumoniae, включают полипептид, содержащий по меньшей мере 20 следующих друг за другом остатков аминокислот, выбранных из SP0024. Указанный полипептид также может представлять собой вариант указанного фрагмента из по меньшей мере 20 остатков. Согласно некоторым вариантам реализации указанный полипептид включает не более 150, 125 или 100 следующих друг за другом аминокислот SP0024.
2. SP0882 (SEQ ID NO:2) и его варианты
SP0882 представляет собой консервативный гипотетический белок длиной 274 аминокислот. Большая часть белка (аминокислоты 2-270) образуют участок, подобный эстеразе или липазе.
Согласно некоторым вариантам реализации вакцины или фармацевтические композиции, содержащие полипептид S. pneumoniae, включают полипептид, содержащий по меньшей мере 20 следующих друг за другом аминокислотных остатков, выбранных из SP0882. Указанный полипептид также может представлять собой вариант указанного фрагмента из по меньшей мере 20 аминокислот. Согласно некоторым вариантам реализации указанный полипептид включает не более 250, 275, 200, 175, 150, 125 или 100 следующих друг за другом аминокислот из SP0882.
В частности один укороченный вариант, обозначенный как SP0882N, состоит из 130 аминокислот SP0882 на N-конце, и представлен как SEQ ID NO:3. SP0882N включает участок, который особенно консервативен среди различных серотипов. Согласно некоторым вариантам реализации полипептид, содержащий SP0882 или SP0882N, или иммуногенный фрагмент одного из них, также содержит экзогенную лидерную последовательность. Указанная лидерная последовательность может представлять собой, например, лидерную последовательность SP2108. Примерами таких полипептидов являются SEQ ID NO:4 и 5.
Варианты последовательностей ДНК и белка SP0882 описываются в частности в публикации заявки на получение патента США №2009/0215149 и международных заявках WO2002/077021, W098/18931 и WO2007/106407. Вариант SP0882N описывается в международной заявке WO2008/146164.
Между различными серотипами S. pneumoniae встречаются различия в последовательностях на уровне белка, и консенсусные последовательности, демонстрирующие сочетания последовательностей SP0882 различных серотипов S. pneumoniae представлены как SEQ ID NO: 14-17. Соответственно согласно некоторым вариантам реализации препарат вакцины содержит полипептид, имеющий аминокислотную последовательность, содержащую или состоящую из любой из SEQ ID NO: 14-17, или иммуногенного фрагмента указанной последовательности (например, вместо полипептида, содержащего аминокислотную последовательность, включающую одну из SEQ ID NO:2-5).
Последовательности нуклеиновых кислот, кодирующих различные варианты SP0882 представлены как SEQ ID NO:24-26, однако в силу вырожденности генетического кода другие последовательности ДНК (последовательности, в которых кодоны оптимизированы) могут кодировать указанные полипептиды.
3. SP0148 (SEQ ID NO:7) и его варианты
Белок SP0148 обозначается термином «АВС транспортер, субстрат связывающий белок». Обычно белки этого класса представляют собой внеклеточные белки, которые кратковременно взаимодействуют с комплексом трансмембранных белков. Такие комплексы используют энергию гидролиза АТФ для переноса определенных субстратов через мембрану клетки. SP0148 представляет собой белок длиной 276 аминокислот, который содержит консервативный домен РВРЬ (периплазматический связывающий белок), охватывающий аминокислоты 40-246, что характерно для мембраносвязанных транспортных комплексов. Также SB0148 содержит домен семейства 3 бактериальных белков, связывающих внеклеточные растворы, который существенно перекрывается с доменом РВРЬ и расположен между аминокислотами 40 и 244. Согласно некоторым вариантам реализации вакцина или другая композиция включает укороченный мутант SP0148, содержащий или не содержащий один или более указанных доменов или мотивов.
Согласно некоторым вариантам реализации вакцины или фармацевтические композиции, содержащие полипептид S. pneumoniae, включают полипептид, содержащий по меньшей мере 20 следующих друг за другом аминокислотных остатков, выбранных из SP0148. Указанный полипептид также может являться вариантом указанного фрагмента из по меньшей мере 20 остатков. Согласно некоторым вариантам реализации указанный полипептид включает не более 250, 275, 200, 175, 150, 125 или 100 следующих друг за другом аминокислот SP0148.
Эндогенный SP0148 включает предполагаемую сигнальную последовательность, которая может направлять его секрецию. Согласно некоторым вариантам реализации используется вариант SP0148, в котором отсутствует указанная сигнальная последовательность (SEQ ID NO:6). Указанный полипептид SEQ ID NO:6 кодируется нуклеиновой кислотой, представленной как SEQ ID NO:27, однако могут быть использованы другие последовательности нуклеиновых кислот (включая последовательности, в которых кодоны оптимизированы). SEQ ID NO:28 кодирует полноразмерную последовательность SP0148, использованную при проведении исследований согласно настоящему описанию.
Варианты аминокислотной или нуклеотидной последовательности SP0148 можно обнаружить в публикации заявки на получение патента США №2005/0020813, патента США №. 7,378,514 и 7,504,110 и заявки на получение европейского патента №ЕР1572868 и ЕР1855717.
Консенсусные последовательности, демонстрирующие сочетания последовательностей SP0148 из различных серотипов S. pneumoniae, представлены как SEQ ID NO:18 и 19. Соответственно согласно некоторым вариантам реализации указанный препарат вакцины содержит полипептид, имеющий аминокислотную последовательность, содержащую или состоящую из одной из SEQ ID NO:18-19, или иммуногенного фрагмента указанной последовательности (например, вместо полипептида, содержащего аминокислотную последовательность, включающую SEQ ID NO:6 или 7).
4. SP1072 (SEQ ID NO:8) и его варианты
SP1072, также известный как dnaG, представляет собой фермент ДНК-праймазу, который катализирует образование РНК-затравки, которая позволяет ДНК полимеразе начать репликацию ДНК. Как белок из 586 аминокислот, SP1072 содержит несколько консервативных мотивов. Начиная с N-конца, аминокислоты 2-96 образуют домен типа «цинковые пальцы», каталитический центр ДНК-праймазы охватывает аминокислоты 122-250, и высоко консервативный участок домена топоизомеразы-праймазы (TORPIM) нуклеотидил трансферразы/гидролазы располагается между аминокислотами 258 и 330. Согласно некоторым вариантам реализации вакцина или другие композиции содержат укороченный мутант SP1072, содержащий или не содержащий один или более из указанных доменов и мотивов.
Согласно некоторым вариантам реализации вакцины или фармацевтические композиции, содержащие полипептид S. pneumoniae, включают полипептид, содержащий по меньшей мере 20 следующих друг за другом аминокислотных остатков, выбранных из SP1072. Указанный полипептид также может представлять собой вариант указанного фрагмента из по меньшей мере 20 остатков. Согласно некоторым вариантам реализации указанный полипептид включает не более 550, 500, 450, 400, 350, 300, 250, 200, 150 или 100 следующих друг за другом аминокислот SP1072.
5. SP2108 (SEQ ID NO:9) и его варианты
Полипептид SP2108 имеет 423 аминокислоты в длину и известен под названиями Ma1X, мальтоза/мальтодекстрин ABC транспортер или мальтоза/мальтодекстрин связывающий белок. Большая часть указанного белка (аминокислоты 3-423) относится к домену Ma1E (периплазматическому мальтозосвязывающему). Также SP2108 содержит сигнальную последовательность, которая направляет его секрецию. Согласно некоторым вариантам реализации вакцина или другая композиция содержит укороченный мутант SP2108, включающий один или более указанных доменов и мотивов.
Согласно некоторым вариантам реализации указанные композиции и способы требуют использования варианта SP2108, в котором отсутствует указанная сигнальная последовательность. Указанный вариант представлен полипептидной последовательностью SEQ ID NO:10 и может кодироваться, например, нуклеиновой кислотой согласно SEQ ID NO:29.
Согласно некоторым вариантам реализации вакцины или фармацевтические композиции, содержащие полипептид S. pneumoniae включают полипептид, содержащий по меньшей мере 20 следующих друг за другом остатков аминокислот, выбранных из SP2108. Указанный полипептид также может представлять собой вариант указанного фрагмента из по меньшей мере 20 остатков. Согласно некоторым вариантам реализации указанный полипептид включает не более 400, 350, 300, 250, 200, 150 или 100 следующих друг за другом аминокислот SP2108.
Консенсусные последовательности, демонстрирующие сочетания последовательностей SP2108 из различных серотипов, изображены как SEQ ID NO:20 и 21. Таким образом, согласно некоторым вариантам реализации указанный препарат вакцины содержит полипептид, включающий аминокислотную последовательность, содержащую или состоящую из одной из SEQ ID NO:20-21, или иммуногенного фрагмента указанной последовательности (например, вместо полипептида, включающего аминокислотную последовательность, содержащую SEQ ID NO:9 или 10).
6. SP0641 (SEQ ID NO:12) и его варианты
SP0641 имеет 2144 аминокислот в длину и также известен как PrtA, сериновая протеаза клеточной стенки. Полноразмерный SP0641 содержит несколько консервативных мотивов: мотив РА_2, расположенный между аминокислотами485 и 597, который может образовывать белок связывающую поверхность; Fn3-подобный домен (аминокислоты 800-939); и два предсказанных каталитических домена типа S8 С5а, расположенных в области аминокислот 226-449 и 639-777. Согласно некоторым вариантам реализации вакцина или другая композиция содержит укороченный мутант SP0641, содержащий или не содержащий один или более указанных доменов и мотивов.
Согласно некоторым вариантам реализации вакцины или фармацевтические композиции, содержащие полипептид S. pneumoniae, включают полипептид, содержащий по меньшей мере 20 следующих друг за другом аминокислотных остатков, выбранных из SP0641. указанный полипептид также может быть вариантом указанного фрагмента из по меньшей мере 20 остатков. Согласно некоторым вариантам реализации указанный полипептид включает не более 1000, 900, 800, 700, 600, 500, 400, 300, 200 или 100 следующих друг за другом аминокислот из SP0641.
Также могут быть использованы некоторые другие укороченные мутанты SP0641. например, полипептид, обозначенный как SP0641N (SEQ ID NO:13) состоит из 661 аминокислот, соответствующих аминокислотам 24-684 вблизи N-конца SP0641. Примерно поблизости от SP0641N (и соответствующий аминокислотам 686-1333 SP0641) располагается участок из 648 остатков, принадлежащий укороченному варианту SP0641M (SEQ ID NO:11).
Варианты SP0641 описаны, например, в Патенте США №7,338,786, 6,573,082 и 7,132,107, а также в Международной заявке WO00/06738.
SEQ ID NOS:30 и 31 отражают последовательности ДНК SP0641M и SP0641N, соответственно, однако, из-за вырожденности генетического кода, другие последовательности ДНК (включая последовательности, в которых кодоны оптимизированы) могут кодировать SP0641.
В композициях и способах согласно настоящему описанию также могут быть использованы полипептиды, гомологичные полипептидам Таблицы 1 и 2 (например, SP0024, 0882, 0882N, 0148 с сигнальной последовательностью или без нее, SP0641, SP0641M или SP0641N). Отдельные штаммы S. pneumoniae содержат множество мутаций по сравнению друг с другом, и некоторые мутации приводят к получению разных последовательностей белка у разных штаммов. Специалист в данной области техники с легкостью может произвести замену аминокислоты или ее части на гомологичную последовательность аминокислоты от другого штамма S. pneumoniae. Согласно некоторым аспектам настоящая заявка обеспечивает иммуногенные полипептиды, имеющие 90%, 95%, 97%, 98%, 99% или 99.5% сходства с полипептидами из Таблицы 1 и 2, или их иммуногенные фрагменты. Можно использовать серотипическую изменчивость для создания указанных вариантов полипептидов Таблицы 1 и 2.
Согласно некоторым вариантам реализации вакцинные композиции согласно настоящему описанию содержат фрагмент белка из таблицы 1 или 2 (например, фрагменты SP0024, SP0882, SP0882N, 0SP148 с сигнальной последовательностью или без нее, SP1072, SP1028 с сигнальной последовательностью или без нее, SP0641, SP0641M или SP0641N). Согласно некоторым вариантам реализации настоящая заявка обеспечивает укороченные мутанты, которые по размеру похожи на полипептиды Таблицы 1 или 2 (например, одна из SEQ ID NO:1-13). Например, в них могут отсутствовать не более одной, двух, трех, четырех, пяти, десяти или двадцати аминокислот на одном конце или двух концах. Также возможны внутренние делеции, например, 1-10, 11-20,21-30 или 31-40 аминокислот.
Согласно некоторым вариантам реализации указанный препарат вакцины содержит один или более полипептидов, которые имеют аминокислотную последовательность, содержащую или состоящую из любой из SEQ ID NO:14-21. Согласно некоторым вариантам реализации указанный фрагмент представляет собой укороченный фрагмент любой из SEQ ID NO:14-21, в которой с N-конца и/или С-конца удалены 1-5, 1-10 или 1-20 аминокислотных остатков. Согласно некоторым вариантам реализации указанный фрагмент представляет собой укороченный фрагмент любой из SEQ ID NO:14-21, в которой с N-конца и/или С-конца удалены 1-10 аминокислот. Например, как с N-конца, так и С-конца можно удалить 10 аминокислотных остатков, что приводит к получению белка, в котором удалены 20 аминокислот.
Кроме указанных выше в Таблице 1 нуклеиновых кислот и полипептидов настоящая заявка также обеспечивает иммуногенные композиции, которые включают один или более полипептидов или генов, перечисленных в Таблице 1 и/или Таблице 2 или их варианты или фрагменты согласно настоящему описанию. Последовательность ДНК и белка для каждого гена можно найти посредством поиска по Метке локуса в общественно доступной базе данных Entrez Gene согласно описанию выше.
Обычно указанные полипептиды, представленные в соединениях согласно настоящему изобретению, являются иммуногенными, по отдельности или в виде варианта, который включает полипептиды, соединенные с другим полипептидом или смешанные или в комплексе с адъювантом. Варианты также включают последовательности с совпадениями менее 100% согласно настоящему описанию. Согласно некоторым вариантам реализации антиген из Таблицы 1 или 2 обеспечивается в виде полноразмерного полипептида. Также можно использовать фрагменты, предшественники или аналоги, которые обладают соответствующей иммуногенностью.
Указанные полипептиды могут быть иммуногенными для млекопитающих, например, мышей, морских свинок или людей. Иммуногенный полипептид обычно представляет собой полипептид, способный вызывать значительный иммунный ответ в условиях анализа или у пациента. Например, иммуногенный полипептид может повышать количество IL-17, вырабатываемого Т-клетками. Анализ IL-17, описываемый в Примерах 1-4, представляет собой пример анализа, который можно использовать для определения иммуногенного полипептида. В другом случае иммуногенный полипептид способен (i) вызывать выработку антител, например, нейтрализующих антител, которые связываются с указанным полипептидом; (ii) вызывать Тх1 опосредованный ответ, (Hi) активировать ответ цитотоксических CD8+лимфоцитов, например, посредством увеличения числа Т-клеток CD8+и/или повышения миграции Т-клеток CD8+ в место инфекции или повторной инфекции, (iv) вызывать Тх17 опосредованный ответ, и/или активировать врожденный иммунитет. Согласно некоторым вариантам реализации иммуногенный полипептид вызывает выработку определимого количества антитела, специфичного в отношении этого антигена.
Согласно некоторым вариантам реализации полипептиды совпадают менее чем на 20%, 30%, 40%, 50%, 60% или на 70% с человеческими аутоантигенами и/или симбиотическими бактериями кишечника (например, некоторыми видами Bacteroides, Clostridium, Fusobacterium, Eubacterium, Ruminococcus, Peptococcus, Peptostreptococcus, Bifidobacterium, Escherichia и Lactobacillus). Примеры аутоантигенов человека включают инсулин, ядерный антиген пролиферирующих клеток, цитохром Р450 и основной белок миелина.
Настоящее описание обеспечивает, например, препарат вакцины, включающий фармацевтически приемлемый носитель и один или более полипептидов, которые имеют аминокислотную последовательность, включающую любую из SEQ ID NO:1-11, или иммуногенный фрагмент указанной последовательности, и который может дополнительно включать полипептид, который имеет аминокислотную последовательность, включающую любую из SEQ ID NO:12 или 13, или иммуногенный фрагмент указанной последовательности. Согласно некоторым вариантам реализации указанный препарат вакцины содержит по меньшей мере два различных полипептида, имеющих аминокислотную последовательность, содержащую любую из SEQ ID NO:1-13, или иммуногенный фрагмент указанной последовательности, при этом, по меньшей мере один из указанных полипептидов содержит аминокислотную последовательность, содержащую одну из SEQ ID NO:1-10, или иммуногенный фрагмент указанной последовательности. Согласно настоящему описанию термин «различный» означает, что каждый из указанных двух пептидов происходит из разных последовательностей, выбранных из SEQ ID NO:1-13.
Указанный препарат вакцины также может содержать один или более полипептидов, имеющих аминокислотную последовательность, состоящую из любой из SEQ IDNO:1-11.
Согласно некоторым вариантам реализации указанный препарат вакцины содержит по меньшей мере два полипептида, каждый из которых относится к разным группам из (i)-(vi): (i) SEQ ID NO:1 или иммуногенный фрагмент указанной последовательности, (ii) одна из SEQ ID NO:2-5 или иммуногенный фрагмент указанной последовательности, (Ш) одна из SEQ ID NO:6-7 или иммуногенный фрагмент указанной последовательности, (iv) SEQ ID NO:8 или иммуногенный фрагмент указанной последовательности, (v) одна из SEQ ID NO:9-10 или иммуногенный фрагмент указанной последовательности, и (vi) одна из SEQ ID NO:11-13 или иммуногенный фрагмент указанной последовательности. Примеры таких сочетаний приведены ниже:
SEQ ID NO:1 и SEQ ID NO:2
SEQ ID NO:1 и SEQ ID NO:3
SEQ ID NO:1 и SEQ ID NO:4
SEQ ID NO:1 и SEQ ID NO:5
SEQ ID NO:1 и SEQ ID NO:6
SEQ ID NO:1 и SEQ ID NO:7
SEQ ID NO:1 и SEQ ID NO:8
SEQ ID NO:1 и SEQ ID NO:9
SEQ ID NO:1 и SEQ ID NO:10
SEQ ID NO:1 и SEQ ID NO:11
SEQ ID NO:1 и SEQ ID NO:12
SEQ ID NO:1 и SEQ ID NO:13
SEQ ID NO:2 и SEQ ID NO:6
SEQ ID NO:2 и SEQ ID NO:7
SEQ ID NO:2 и SEQ ID NO:8
SEQ ID NO:2 и SEQ ID NO:9
SEQ ID NO:2 и SEQ ID NO:10
SEQ ID NO:2 и SEQ ID NO:11
SEQ ID NO:2 и SEQ ID NO:12
SEQ ID NO:2 и SEQ ID NO:13
SEQ ID NO:3 и SEQ ID NO:6
SEQ ID NO:3 и SEQ ID NO:7
SEQ ID NO:3 и SEQ ID NO:8
SEQ ID NO:3 и SEQ ID NO:9
SEQ ID NO:3 и SEQ ID NO:10
SEQ ID NO:3 и SEQ ID NO:11
SEQ ID NO:3 и SEQ ID NO:12
SEQ ID NO:3 и SEQ ID NO:13
SEQ ID NO:4 и SEQ ID NO:6
SEQ ID NO:4 и SEQ ID NO:7
SEQ ID NO:4 и SEQ ID NO:8
SEQ ID NO:4 и SEQ ID NO:9
SEQ ID NO:4 и SEQ ID NO:10
SEQ ID NO:4 и SEQ ID NO:11
SEQ ID NO:4 и SEQ ID NO:12
SEQ ID NO:4 и SEQ ID NO:13
SEQ ID NO:5 и SEQ ID NO:6
SEQ ID NO:5 и SEQ ID NO:7
SEQ ID NO:5 и SEQ ID NO:8
SEQ ID NO:5 и SEQ ID NO:9
SEQ ID NO:5 и SEQ ID NO:10
SEQ ID NO:5 и SEQ ID NO:11
SEQ ID NO:5 и SEQ ID NO:12
SEQ ID NO:5 и SEQ ID NO:13
SEQ ID NO:6 и SEQ ID NO:8
SEQ ID NO:6 и SEQ ID NO:9
SEQ ID NO:6 и SEQ ID NO:10
SEQ ID NO:6 и SEQ ID NO:11
SEQ ID NO:6 и SEQ ID NO:12
SEQ ID NO:6 и SEQ ID NO:13
SEQ ID NO:7 и SEQ ID NO:8
SEQ ID NO:7 и SEQ ID NO:9
SEQ ID NO:7 и SEQ ID NO:10
SEQ ID NO:7 и SEQ ID NO:11
SEQ ID NO:7 и SEQ ID NO:12
SEQ ID NO:7 и SEQ ID NO:13
SEQ ID NO:8 и SEQ ID NO:9
SEQ ID NO:8 и SEQ ID NO:10
SEQ ID NO:8 и SEQ ID NO:11
SEQ ID NO:8 и SEQ ID NO:12
SEQ ID NO:8 и SEQ ID NO:13
SEQ ID NO:9 и SEQ ID NO:11
SEQ ID NO:9 и SEQ ID NO:12
SEQ ID NO:9 и SEQ ID NO:13
SEQ ID NO:10 и SEQ ID NO:11
SEQ ID NO:10 и SEQ ID NO:12
SEQ ID NO:10 и SEQ ID NO:13
Согласно некоторым вариантам реализации указанный препарат вакцины содержит по меньшей мере три различных полипептида, имеющих аминокислотную последовательность, содержащую любую из SEQ ID NO:1-13, или иммуногенный фрагмент указанной последовательности, отличающаяся тем, что по меньшей мере один из указанных полипептидов включает аминокислотную последовательность, содержащую одну из SEQ ID NO:1-10. Согласно некоторым подобным вариантам реализации указанный препарат вакцины содержит по меньшей мере три полипептида, которые относятся к разным группам из (i)-(vi): (i) SEQ ID NO:1 или иммуногенный фрагмент указанной последовательности, (ii) одна из SEQ ID NO:2-5 или иммуногенный фрагмент указанной последовательности, (iii) одна из SEQ ID NO:6-7 или иммуногенный фрагмент указанной последовательности, (iv) SEQ ID NO:8 или иммуногенный фрагмент указанной последовательности, (v) одна из SEQ ID NO:9-10 или иммуногенный фрагмент указанной последовательности, и (vi) одна из SEQ ID NO:11-13 или иммуногенный фрагмент указанной последовательности. Примеры подобных комбинаций представлены ниже:
SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:6
SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:7
SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:8
SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:9
SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:10
SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:11
SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:12
SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:13
SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:6
SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:7
SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:8
SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:9
SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:10
SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:11
SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:12
SEQ ID NO:1, SEQ ID NO:3 и SEQ ID NO:13
SEQ ID NO:1, SEQ ID NO:4; и SEQ ID NO:6
SEQ ID NO:1, SEQ ID NO:4; и SEQ ID NO:7
SEQ ID NO:1, SEQ ID NO:4; и SEQ ID NO:8
SEQ ID NO:1, SEQ ID NO:4; и SEQ ID NO:9
SEQ ID NO:1, SEQ ID NO:4; и SEQ ID NO:10
SEQ ID NO:1, SEQ ID NO:4; и SEQ ID NO:11
SEQ ID NO:1, SEQ ID NO:4; и SEQ ID NO:12
SEQ ID NO:1, SEQ ID NO:4; и SEQ ID NO:13
SEQ ID NO:1, SEQ ID NO:5; и SEQ ID NO:6
SEQ ID NO:1, SEQ ID NO:5; и SEQ ID NO:7
SEQ ID NO:1, SEQ ID NO:5; и SEQ ID NO:8
SEQ ID NO:1, SEQ ID NO:5; и SEQ ID NO:9
SEQ ID NO:1, SEQ ID NO:5; и SEQ ID NO:10
SEQ ID NO:1, SEQ ID NO:5; и SEQ ID NO:11
SEQ ID NO:1, SEQ ID NO:5; и SEQ ID NO:12
SEQ ID NO:1, SEQ ID NO:5; и SEQ ID NO:13
SEQ ID NO:1, SEQ ID NO:6; и SEQ ID NO:8
SEQ ID NO:1, SEQ ID NO:6; и SEQ ID NO:9
SEQ ID NO:1, SEQ ID NO:6; и SEQ ID NO:10
SEQ ID NO:1, SEQ ID NO:6; и SEQ ID NO:11
SEQ ID NO:1, SEQ ID NO:6; и SEQ ID NO:12
SEQ ID NO:1, SEQ ID NO:6; и SEQ ID NO:13
SEQ ID NO:1, SEQ ID NO:7; и SEQ ID NO:8
SEQ ID NO:1, SEQ ID NO:7; и SEQ ID NO:9
SEQ ID NO:1, SEQ ID NO:7; и SEQ ID NO:10
SEQ ID NO:1, SEQ ID NO:7; и SEQ ID NO:11
SEQ ID NO:1, SEQ ID NO:7; и SEQ ID NO:12
SEQ ID NO:1, SEQ ID NO:7; и SEQ ID NO:13
SEQ ID NO:1, SEQ ID NO:8; и SEQ ID NO:9
SEQ ID NO:1, SEQ ID NO:8; и SEQ ID NO:10
SEQ ID NO:1, SEQ ID NO:8; и SEQ ID NO:11
SEQ ID NO:1, SEQ ID NO:8; и SEQ ID NO:12
SEQ ID NO:1, SEQ ID NO:8; и SEQ ID NO:13
SEQ ID NO:1, SEQ ID NO:9; и SEQ ID NO:11
SEQ ID NO:1, SEQ ID NO:9; и SEQ ID NO:12
SEQ ID NO:1, SEQ ID NO:9; и SEQ ID NO:13
SEQ ID NO:1, SEQ ID NO:10; и SEQ ID NO:11
SEQ ID NO:1, SEQ ID NO:10; и SEQ ID NO:12
SEQ ID NO:1, SEQ ID NO:10; и SEQ ID NO:13
SEQ ID NO:2, SEQ ID NO:6; и SEQ ID NO:8
SEQ ID NO:2, SEQ ID NO:6; и SEQ ID NO:9
SEQ ID NO:2, SEQ ID NO:6; и SEQ ID NO:10
SEQ ID NO:2, SEQ ID NO:6; и SEQ ID NO:11
SEQ ID NO:2, SEQ ID NO:6; и SEQ ID NO:12
SEQ ID NO:2, SEQ ID NO:6; и SEQ ID NO:13
SEQ ID NO:2, SEQ ID NO:7; и SEQ ID NO:8
SEQ ID NO:2, SEQ ID NO:7; и SEQ ID NO:9
SEQ ID NO:2, SEQ ID NO:7; и SEQ ID NO:10
SEQ ID NO:2, SEQ ID NO:7; и SEQ ID NO:11
SEQ ID NO:2, SEQ ID NO:7; и SEQ ID NO:12
SEQ ID NO:2, SEQ ID NO:7; и SEQ ID NO:13
SEQ ID NO:2, SEQ ID NO:8; и SEQ ID NO:9
SEQ ID NO:2, SEQ ID NO:8; и SEQ ID NO:10
SEQ ID NO:2, SEQ ID NO:8; и SEQ ID NO:11
SEQ ID NO:2, SEQ ID NO:8; и SEQ ID NO:12
SEQ ID NO:2, SEQ ID NO:8; и SEQ ID NO:13
SEQ ID NO:2, SEQ ID NO:9; и SEQ ID NO:11
SEQ ID NO:2, SEQ ID NO:9; и SEQ ID NO:12
SEQ ID NO:2, SEQ ID NO:9; и SEQ ID NO:13
SEQ ID NO:2, SEQ ID NO:10; и SEQ ID NO:11
SEQ ID NO:2, SEQ ID NO:10; и SEQ ID NO:12
SEQ ID NO:2, SEQ ID NO:10; и SEQ ID NO:13
SEQ ID NO:3, SEQ ID NO:6; и SEQ ID NO:8
SEQ ID NO:3, SEQ ID NO:6; и SEQ ID NO:9
SEQ ID NO:3, SEQ ID NO:6; и SEQ ID NO:10
SEQ ID NO:3, SEQ ID NO:6; и SEQ ID NO:11
SEQ ID NO:3, SEQ ID NO:6; и SEQ ID NO:12
SEQ ID NO:3, SEQ ID NO:6; и SEQ ID NO:13
SEQ ID NO:3, SEQ ID NO:7; и SEQ ID NO:8
SEQ ID NO:3, SEQ ID NO:7; и SEQ ID NO:9
SEQ ID NO:3, SEQ ID NO:7; и SEQ ID NO:10
SEQ ID NO:3, SEQ ID NO:7; и SEQ ID NO:11
SEQ ID NO:3, SEQ ID NO:7; и SEQ ID NO:12
SEQ ID NO:3, SEQ ID NO:7; и SEQ ID NO:13
SEQ ID NO:3, SEQ ID NO:8; и SEQ ID NO:9
SEQ ID NO:3, SEQ ID NO:8; и SEQ ID NO:10
SEQ ID NO:3, SEQ ID NO:8; и SEQ ID NO:11
SEQ ID NO:3, SEQ ID NO:8; и SEQ ID NO:12
SEQ ID NO:3, SEQ ID NO:8; и SEQ ID NO:13
SEQ ID NO:3, SEQ ID NO:9; и SEQ ID NO:11
SEQ ID NO:3, SEQ ID NO:9; и SEQ ID NO:12
SEQ ID NO:3, SEQ ID NO:9; и SEQ ID NO:13
SEQ ID NO:3, SEQ ID NO:10; и SEQ ID NO:11
SEQ ID NO:3, SEQ ID NO:10; и SEQ ID NO:12
SEQ ID NO:3, SEQ ID NO:10; и SEQ ID NO:13
SEQ ID NO:4, SEQ ID NO:6; и SEQ ID NO:8
SEQ ID NO:4, SEQ ID NO:6; и SEQ ID NO:9
SEQ ID NO:4, SEQ ID NO:6; и SEQ ID NO:10
SEQ ID NO:4, SEQ ID NO:6; и SEQ ID NO:11
SEQ ID NO:4, SEQ ID NO:6; и SEQ ID NO:12
SEQ ID NO:4, SEQ ID NO:6; и SEQ ID NO:13
SEQ ID NO:4, SEQ ID NO:7; и SEQ ID NO:8
SEQ ID NO:4, SEQ ID NO:7; и SEQ ID NO:9
SEQ ID NO:4, SEQ ID NO:7; и SEQ ID NO:10
SEQ ID NO:4, SEQ ID NO:7; и SEQ ID NO:11
SEQ ID NO:4, SEQ ID NO:7; и SEQ ID NO:12
SEQ ID NO:4, SEQ ID NO:7; и SEQ ID NO:13
SEQ ID NO:4, SEQ ID NO:8; и SEQ ID NO:9
SEQ ID NO:4, SEQ ID NO:8; и SEQ ID NO:10
SEQ ID NO:4, SEQ ID NO:8; и SEQ ID NO:11
SEQ ID NO:4, SEQ ID NO:8; и SEQ ID NO:12
SEQ ID NO:4, SEQ ID NO:8; и SEQ ID NO:13
SEQ ID NO:4, SEQ ID NO:9; и SEQ ID NO:11
SEQ ID NO:4, SEQ ID NO:9; и SEQ ID NO:12
SEQ ID NO:4, SEQ ID NO:9; и SEQ ID NO:13
SEQ ID NO:4, SEQ ID NO:10; и SEQ ID NO:11
SEQ ID NO:4, SEQ ID NO:10; и SEQ ID NO:12
SEQ ID NO:4, SEQ ID NO:10; и SEQ ID NO:13
SEQ ID NO:5, SEQ ID NO:6; и SEQ ID NO:8
SEQ ID NO:5, SEQ ID NO:6; и SEQ ID NO:9
SEQ ID NO:5, SEQ ID NO:6; и SEQ ID NO:10
SEQ ID NO:5, SEQ ID NO:6; и SEQ ID NO:11
SEQ ID NO:5, SEQ ID NO:6; и SEQ ID NO:12
SEQ ID NO:5, SEQ ID NO:6; и SEQ ID NO:13
SEQ ID NO:5, SEQ ID NO:7; и SEQ ID NO:8
SEQ ID NO:5, SEQ ID NO:7; и SEQ ID NO:9
SEQ ID NO:5, SEQ ID NO:7; и SEQ ID NO:10
SEQ ID NO:5, SEQ ID NO:7; и SEQ ID NO:11
SEQ ID NO:5, SEQ ID NO:7; и SEQ ID NO:12
SEQ ID NO:5, SEQ ID NO:7; и SEQ ID NO:13
SEQ ID NO:5, SEQ ID NO:8; и SEQ ID NO:9
SEQ ID NO:5, SEQ ID NO:8; и SEQ ID NO:10
SEQ ID NO:5, SEQ ID NO:8; и SEQ ID NO:11
SEQ ID NO:5, SEQ ID NO:8; и SEQ ID NO:12
SEQ ID NO:5, SEQ ID NO:8; и SEQ ID NO:13
SEQ ID NO:5, SEQ ID NO:9; и SEQ ID NO:11
SEQ ID NO:5, SEQ ID NO:9; и SEQ ID NO:12
SEQ ID NO:5, SEQ ID NO:9; и SEQ ID NO:13
SEQ ID NO:5, SEQ ID NO:10; и SEQ ID NO:11
SEQ ID NO:5, SEQ ID NO:10; и SEQ ID NO:12
SEQ ID NO:5, SEQ ID NO:10; и SEQ ID NO:13
SEQ ID NO:6, SEQ ID NO:8; и SEQ ID NO:9
SEQ ID NO:6, SEQ ID NO:8; и SEQ ID NO:10
SEQ ID NO:6, SEQ ID NO:8; и SEQ ID NO:11
SEQ ID NO:6, SEQ ID NO:8; и SEQ ID NO:12
SEQ ID NO:6, SEQ ID NO:8; и SEQ ID NO:13
SEQ ID NO:6, SEQ ID NO:9; и SEQ ID NO:11
SEQ ID NO:6, SEQ ID NO:9; и SEQ ID NO:12
SEQ ID NO:6, SEQ ID NO:9; и SEQ ID NO:13
SEQ ID NO:6, SEQ ID NO:10; и SEQ ID NO:11
SEQ ID NO:6, SEQ ID NO:10; и SEQ ID NO:12
SEQ ID NO:6, SEQ ID NO:10; и SEQ ID NO:13
SEQ ID NO:7, SEQ ID NO:8; и SEQ ID NO:9
SEQ ID NO:7, SEQ ID NO:8; и SEQ ID NO:10
SEQ ID NO:7, SEQ ID NO:8; и SEQ ID NO:11
SEQ ID NO:7, SEQ ID NO:8; и SEQ ID NO:12
SEQ ID NO:7, SEQ ID NO:8; и SEQ ID NO:13
SEQ ID NO:7, SEQ ID NO:9; и SEQ ID NO:11
SEQ ID NO:7, SEQ ID NO:9; и SEQ ID NO:12
SEQ ID NO:7, SEQ ID NO:9; и SEQ ID NO:13
SEQ ID NO:7, SEQ ID NO:10; и SEQ ID NO:11
SEQ ID NO:7, SEQ ID NO:10; и SEQ ID NO:12
SEQ ID NO:7, SEQ ID NO:10; и SEQ ID NO:13
SEQ ID NO:8, SEQ ID NO:9; и SEQ ID NO:11
SEQ ID NO:8, SEQ ID NO:9; и SEQ ID NO:12
SEQ ID NO:8, SEQ ID NO:9; и SEQ ID NO:13
SEQ ID NO:8, SEQ ID NO:10; и SEQ ID NO:11
SEQ ID NO:8, SEQ ID NO:10; и SEQ ID NO:12
SEQ ID NO:8, SEQ ID NO:10; и SEQ ID NO:13
Согласно некоторым вариантам реализации указанный препарат вакцины содержит по меньшей мере два различных полипептида, имеющих аминокислотную последовательность, содержащую любую из SEQ ID NO:14-21 или иммуногенный фрагмент указанной последовательности. Согласно некоторым подобным вариантам реализации указанный препарат вакцины содержит по меньшей мере два различных полипептида, каждый из которых относится к разным группам из (i)-(iii): (i) одна из SEQ ID NO:14-17 или иммуногенный фрагмент указанной последовательности, (ii) одна из EQ ID NO:18-19 или иммуногенный фрагмент указанной послеовательности; и (iii) одна из SEQ ID NO:20-21 или иммуногенный фрагмент указанной последовательности. Примеры таких комбинаций представлены ниже:
SEQ ID NO:14 и SEQ ID NO:18
SEQ ID NO:14 и SEQ ID NO:19
SEQ ID NO:14 и SEQ ID NO:20
SEQ ID NO:14 и SEQ ID NO:21
SEQ ID NO:15 и SEQ ID NO:18
SEQ ID NO:15 и SEQ ID NO:19
SEQ ID NO:15 и SEQ ID NO:20
SEQ ID NO:15 и SEQ ID NO:21
SEQ ID NO:16 и SEQ ID NO:18
SEQ ID NO:16 и SEQ ID NO:19
SEQ ID NO:16 и SEQ ID NO:20
SEQ ID NO:16 и SEQ ID NO:21
SEQ ID NO:17 и SEQ ID NO:18
SEQ ID NO:17 и SEQ ID NO:19
SEQ ID NO:17 и SEQ ID NO:20
SEQ ID NO:17 и SEQ ID NO:21
SEQ ID NO:18 и SEQ ID NO:20
SEQ ID NO:18 и SEQ ID NO:21
SEQ ID NO:19 и SEQ ID NO:20
SEQ ID NO:19 и SEQ ID NO:21
Согласно некоторым аспектами препарат вакцины, содержащий одну или более из SEQ ID NO:14-21, также содержит полипептид, включающий аминокислотную последовательность, содержащую любую из SEQ ID NO:1-13.
Согласно некоторым вариантам реализации указанный препарат вакцины содержит по меньшей мере три различных полипептида, имеющих аминокислотную последовательность, содержащую любую из SEQ ID NO:14-21, или иммуногенный фрагмент указанной последовательности. Согласно некоторым подобным вариантам реализации указанный препарат вакцины содержит по меньшей мере три различных полипептида, каждый из которых относится к разным группам (i)-(iii):(i) одна из SEQ ID NO:14-17 или иммуногенный фрагмент указанной последовательности, (ii) одна из SEQ ID NO:18-19 или иммуногенный фрагмент указанной последовательности; и (iii) одна из SEQ ID NO:20-21 или иммуногенный фрагмент указанной последовательности. Примеры таких комбинаций представлены ниже:
SEQ ID NO:14, SEQ ID NO:18 и SEQ ID NO:20
SEQ ID NO:14, SEQ ID NO:18 и SEQ ID NO:21
SEQ ID NO:14, SEQ ID NO:19 и SEQ ID NO:20
SEQ ID NO:14, SEQ ID NO:19 и SEQ ID NO:21
SEQ ID NO:15, SEQ ID NO:18 и SEQ ID NO:20
SEQ ID NO:15, SEQ ID NO:18 и SEQ ID NO:21
SEQ ID NO:15, SEQ ID NO:19 и SEQ ID NO:20
SEQ ID NO:15, SEQ ID NO:19 и SEQ ID NO:21
SEQ ID NO:16, SEQ ID NO:18 и SEQ ID NO:20
SEQ ID NO:16, SEQ ID NO:18 и SEQ ID NO:21
SEQ ID NO:16, SEQ ID NO:19 и SEQ ID NO:20
SEQ ID NO:16, SEQ ID NO:19 и SEQ ID NO:21
SEQ ID NO:17, SEQ ID NO:18 и SEQ ID NO:20
SEQ ID NO:17, SEQ ID NO:18 и SEQ ID NO:21
SEQ ID NO:17, SEQ ID NO:19 и SEQ ID NO:20
SEQ ID NO:17, SEQ ID NO:19 и SEQ ID NO:21
Полипептид может содержать одну или более иммуногенных частей и одну или более неиммуногенных частей. Иммуногенные части можно идентифицировать различными методами, включая метод белковых микрочипов, методы ELISPOT/ELISA и/или особые методы анализа различных делеционных мутантов (например, фрагментов) исследуемого полипептида. Также иммуногенные части можно идентифицировать с помощью компьютерных алгоритмов. В некоторых таких алгоритмах, например, EpiMatrix (выпускаемый EpiVax) используется матричный метод. Другие вычислительные аппараты для идентификации антигенных эпитопов включают PEPVAC (Promiscuous EPitope-based VACcine, размещенный Dana Farber Cancer Institute на сайте ) и MHCPred (в котором используется метод частных наименьших квадратов, размещенный Jenner Institute на сайте ). Иммуногенный фрагмент полипептида согласно настоящему описанию включает по меньшей мере одну иммуногенную часть по результатам экспериментов или при применении алгоритма. Пептиды, обнаруженные методами, описанными выше, включают следующие:
Таким образом, согласно некоторым аспектам настоящая заявка обеспечивает иммуногенный фрагмент антигена согласно настоящему описанию. Указанные фрагменты в ряде случаев по размерам близки к полноразмерному полипептиду или полипептиду Таблицы 1 или 2. Например, в них могут отсутствовать не более, чем одна, две, три, четыре, пять, десять или двадцать аминокислот на обоих концах. Согласно некоторым вариантам реализации указанный полипептид имеет 100-500 аминокислот в длину, 150-450, 200-400 или 250-250 аминокислот в длину. Согласно некоторым вариантам реализации указанный полипептид имеет 100-200, 150-250,200-300, 250-350, 300-400, 350-450 или 400-500 аминокислот в длину. Описанные выше фрагменты или их фрагменты (например, фрагменты длиной 8-50, 8-30 или 8-20 аминокислотных остатков) предпочтительно оказывают одно биологическое действие согласно описанию ниже, такое как повышение количества высвобождаемого IL-17 по меньшей мере в 1.5 или 2 раза (например, в абсолютном значении или по сравнению с иммунологически неактивным белком, например, яичным альбумином). Фрагмент можно использовать в качестве полипептида в вакцинах согласно настоящему описанию или можно соединять с другим белком, фрагментом белка или полипептидом.
Согласно некоторым вариантам реализации указанный фрагмент является укороченным фрагментов любой из SEQ ID NO:1-13, в котором 1-5, 1-10 или 1-20 остатков аминокислот удалены с N-конца, С-конца или обоих концов. Согласно некоторым таким вариантам реализации с N-конца и С-конца удалено одинаковое количество остатков, тогда как в других вариантах реализации с N-конца удалено другое количество остатков по сравнению с С-концом.
Согласно некоторым аспектам настоящая заявка обеспечивает иммуногенные полипептиды, обладающие 90%, 95%, 97%, 98%, 99% или 99.5% сходства с полипептидом Таблицы 1 или 2. Настоящая заявка также обеспечивает препарат вакцины, который содержит фармацевтически приемлемый носитель и один или более полипептидов, имеющих аминокислотную последовательность, содержащую последовательность, которая по меньшей мере на 90%, 95%, 98% или 99% совпадает с любой из SEQ ID NO:1-11, или иммуногенным фрагментом указанной последовательности, и дополнительно также содержащая полипептид, включающий аминокислотную последовательность, содержащую последовательность, которая по меньшей мере на 90%, 95%, 98% или 99% совпадает с SEQ ID NO:12 или 13, или иммуногенным фрагментом указанной последовательности. Согласно некоторым вариантам реализации препарат вакцины содержит по меньшей мере два различных полипептида, имеющих аминокислотную последовательность, содержащую последовательность, которая по меньшей мере на 90%, 95%, 98% или 99% совпадает с любой из SEQ ID NOS:1-13, или иммуногенным фрагментом указанной последовательности, при этом по меньшей мере один из указанных полипептидов включает аминокислотную последовательность, которая по меньшей мере на 90%), 95%, 98%) или 99% совпадает с одной из SEQ ID NO:1-10, или иммуногенным фрагментом указанной последовательности.
Согласно некоторым вариантам реализации один или более, например, два, три, четыре или более полипептидов из Таблицы 1 или 2 или их иммуногенные фрагменты или варианты обеспечиваются в виде смеси. Согласно некоторым вариантам реализации два, три, четыре или более полипептидов из Таблицы 1 или 2 или их иммуногенные фрагменты или варианты ковалентно соединены друг с другом, например, в виде гибридного белка.
Согласно некоторым вариантам реализации указанный препарат вакцины практически не содержит другие полипептиды S. pneumoniae, кроме полипептидов, имеющих любую из аминокислотных последовательностей SEQ ID NO:1-13. Согласно некоторым вариантам реализации указанный препарат вакцины практически не содержит другие полипептиды S. pneumoniae, кроме полипептидов из Таблицы 1. Согласно некоторым вариантам реализации указанный препарат вакцины практически не содержит другие полипептиды S. pneumoniae, кроме полипептидов из Таблицы 1 или 2.
Согласно некоторым вариантам реализации препараты вакцин или иммуногенные композиции согласно настоящему изобретению практически не содержат другие полипептиды S. pneumoniae, кроме полипептидов, имеющих аминокислотную последовательность, содержащую любую из SEQ ID NO:1-13. Согласно некоторым из таких вариантов реализации, препараты вакцин или иммуногенные композиции практически не содержат другие полипептиды S. pneumoniae, кроме полипептидов, имеющих аминокислотную последовательность, состоящую из любой из SEQ ID NO:1-13. Согласно некоторым вариантам реализации препараты вакцин или иммуногенные композиции согласно настоящему изобретению практически не содержат другие полипептиды S. pneumoniae, кроме полипептидов, имеющих аминокислотную последовательность, содержащую (или состоящую из) любую аминокислотную последовательность из последовательностей полипептидов из Таблицы 1 или 2. В данном контексте «практически» означает менее 50%, 40%, 30%, 20%, 10%, 5%, 3%, 2% или даже менее 1% других полипептидов S. pneumoniae.
Согласно некоторым вариантам реализации указанная композиция вакцины вызывает ответ Тх17 в 1.5 раза больший, чем ответ, вызываемый контрольным неродственным антигеном (например, белком ICP47 HSV-2, кодируемый геном US 12) после взаимодействия с клетками Тх17. Согласно некоторым вариантам реализации указанный препарат подавляет инфекцию, вызываемую S. pneumoniae, у не инфицированного пациента. Согласно некоторым вариантам реализации указанный препарат подавляет колонизацию 5". pneumoniae у пациента. Согласно некоторым вариантам реализации указанный препарат подавляет проявление симптомов инфекции S. pneumoniae.
Согласно некоторым вариантам реализации настоящая заявка обеспечивает нуклеиновые кислоты, кодирующие один или более полипептидов из описанных выше, например, ДНК, РНК или их аналог. Кодирующие последовательности ДНК полипептидов согласно описанию выше можно модифицировать таким образом, чтобы не изменять последовательность белкового продукта, и такие последовательности включены в настоящее изобретение. Например, в последовательности ДНК могут быть оптимизированы кодоны для улучшения экспрессии в хозяине, например, Е. coli, линии клеток насекомых (например, с использованием системы экспрессии бакуловируса) или линии клеток млекопитающего (например, человека или яичника китайского хомячка).
Согласно некоторым вариантам реализации настоящая заявка обеспечивает нуклеиновые кислоты (например, ДНК, РНК или их аналоги), которые на 70%, 80%, 90%, 95%, 97%, 98%, 99% или 100% совпадают с геном в Таблице 1 или 2 или вариантом или частью указанного гена. Согласно некоторым вариантам реализации указанная нуклеиновая кислота содержит 600-2000, 800-1800, 1000-1600, 1200-1400 нуклеотидов в длину. Согласно некоторым вариантам реализации нуклеиновая кислота содержит 600-1600, 800-1800 или 1000-2000 нуклеотидов в длину. Указанные нуклеиновые кислоты можно использовать, например, для получения рекомбинантных полипептидов Таблицы 1 и 2 или их иммуногенных фрагментов.
Согласно некоторым вариантам реализации указанная вакцина или иммуногенная композиция может содержать гибридные белки и/или гибридные конструкции ДНК. Полипептиды согласно настоящему описанию могут быть использованы без модификаций. Согласно некоторым вариантам реализации если используются более мелкие соответствующие полипептиды, например, их фрагменты и т.п., и их молекулярная масса меньше приблизительно 5000 дальтон, например, 1500-5000 дальтон, модификации могут быть полезными для вызывания желаемого иммунного ответа. Например, более мелкие полипептиды могут быть конъюгированы с подходящим иммуногенным носителем, например, столбнячным анатоксином, пневмолизином, гемоцианином фиссуреллы и т.п. Согласно некоторым вариантам реализации указанный препарат вакцины содержит по меньшей мере один липидированный полипептид. Конъюгация может быть прямой или опосредованной (например, с помощью линкера). Согласно другим вариантам реализации конструкция может содержать ген или белок из Таблицы 1 или 2 или его иммуногенный фрагмент или вариант и метку. Метка может располагаться на N-конце или на С-конце. Например, метки могут быть добавлены к нуклеиновой кислоте или полипептиду для облегчения очистки, обнаружения, растворимости или для придания других желаемых свойств указанному белку или нуклеиновой кислоте. Например, метка для очистки может представлять собой пептид, олигопептид или полипептид, который может быть полезен при аффинной очистке. Примеры меток включают His, GST, ТАР, FLAG, myc, НА, MBP, VSV-G, тиоредоксин, V5, авидин, стрептавидин, ВССР, кальмодулин, Nus, S метки, липопротеин D и β-галактозидазу. В частности примеры His меток включают НННННН (SEQ ID NO:32) и MSYYHHHHHH (SEQ ID NO: 33). Согласно другим вариантам реализации указанный полипептид не несет меток, например, меток для очистки белка, и очищается с использованием метода, который не основан на сродстве к метке очистки. Согласно некоторым вариантам реализации указанный гибридный белок является коротким белком. Например, указанный гибридный белок содержит не более 1, 2, 3, 4, 5, 10 или 20 дополнительных аминокислот на одном или обоих концах полипептида из Таблицы 1 или 2.
Б. Иммуногенные композиции
Настоящее описание также обеспечивает фармацевтические композиции, содержащие иммуногенные полипептиды или полинуклеотиды, кодирующие указанные иммуногенные полипептиды, вместе с фармацевтическим носителем. Антигены от S. pneumoniae определяли посредством проведения исследования иммунных клеток мышей, инфицированных S. pneumonia, или здоровых людей. Доноры ранее подвергались действию S. pneumoniae в какой-то момент жизни, потому что S. pneumoniae является довольно распространенным патогеном, вызывающим заболевание или колонизацию. Вкратце библиотеку антигенов S. pneumoniae экспрессировали в бактериях и смешивали с антиген-презентирующими клетками (АПК). В свою очередь АПК представляли полипептиды S. pneumoniae лимфоцитам, которые были выделены из мышей или людей. Ответ лимфоцитов исследовали по реактивности по отношению к S. pneumoniae. Люди, а также мыши, иммунизированные S. pneumoniae, вырабатывали лимфоциты, специфичные к антигенам S. pneumoniae. Таким образом, настоящее описание обеспечивает композиции антигенов S. pneumoniae, которые вызывают сильный иммунный ответ у иммунизированных или инфицированных мышей или людей для нейтрализации инфекции, вызванной S. pneumoniae.
В Таблице 1 и 2 представлены последовательности белков и соответствующие последовательности нуклеотидов антигенов S. pneumoniae, обнаруженные с помощью методов исследования согласно настоящему описанию. Указанные антигены были обнаружены в результате исследования Т-клеток мыши и человека. В исследованиях Т-клеток мышей обнаруженные антигены подвергались по меньшей мере двум этапам исследования: этап исследования на уровне генома для обнаружения 4 антигенов, которые вызывают иммунный ответ, за которым следовал этап сворачивания для отдельного анализа и обнаружения отдельных антигенов, которые вызывают иммунный ответ из группы обнаруженных на уровне генома. Для сравнения при исследовании Т-клеток человека создали два различных набора антигенов, в которых полипептид совмещали с различными полипептидами между первой и второй группами. Затем можно было определить, какие полипептиды являются антигенами с помощью обнаружения, какие полипептиды находятся в положительной группе в первом и втором наборе. В Таблице 1 перечислены антигены (и их варианты), которые были обнаружены с помощью одного из указанных выше методов анализа и затем были подвергнуты последующему анализу на мышиной модели согласно описанию в Примерах 5-8. Таким образом, композиции согласно настоящему описанию могут включать один или более генов, перечисленных в Таблице 1 или 2, или продукты соответствующих генов.
Иммуногенная композиция также может содержать части указанных полипептидов Streptococcus, например, делеционные мутанты, укороченные мутанты, олигонуклеотиды и фрагменты пептидов. Согласно некоторым вариантам реализации части указанных полипептидов являются иммуногенными. Иммуногенность части белка с легкостью можно определить с использованием тех же методов анализа, которые использовали для определения иммуногенности полноразмерного белка. Согласно некоторым вариантам реализации указанная часть указанного полипептида обладает практически такой же иммуногенностью, как и полноразмерные белки. Согласно некоторым вариантам реализации их иммуногенность не более 10%, 20%, 30%, 40% или 50% меньше, чем иммуногенность полноразмерного белка (например, полипептиды Таблицы 1 и 2). Указанные фрагменты пептидов могут быть, например, линейными, кольцевыми или разветвленными.
Некоторые варианты реализации препарата вакцины и иммуногенной композиции согласно настоящему описанию включают иммуногенный полипептид (например, полипептид из Таблицы 1 или 2), который содержит последовательность переноса через мембрану (MTS) для облегчения введения указанного полипептида в клетку млекопитающего и последующей стимуляции клеточного иммунного ответа. Примеры последовательностей переноса через мембрану включают гидрофобный участок в сигнальной последовательности фактора роста фибробластов саркомы Капоши, MTS α-синуклеина, β-синуклеина или γ-синуклеина, третья спираль гомеодомена Antennapedia, SN50, h-участок интегрина βЗ, Tat ВИЧ, pAntp, PR-39, абицин, апидацин, Вас5, Вас7, CS белок P. berghei и MTS согласно описанию в Патентах США 6,248,558, 6,432,680 и 6,248,558.
Согласно некоторым вариантам реализации антиген (например, полипептид Таблицы 1 или 2) ковалентно связан с другой молекулой. Это, например, может увеличивать период полураспада, растворимость, биологическую доступность или иммуногенность указанного антигена. Молекулы, которые могут быть ковалентно связаны с указанным антигеном, включают углевод, биотин, полиэтиленгликоль (PEG), полисиаловую кислоту, N-пропионилированную полисиаловую кислоту, нуклеиновые кислоты, полисахариды и PLGA. Они могут представлять собой различные виды PEG, молекулярная масса которых различается от менее 300 г/мол до более 10,000,000 г/моль. Цепи PEG могут быть линейными, разветвленными или иметь форму лучей или ячеек. Согласно некоторым вариантам реализации природная форма белка ковалентно связана с группой, которая стимулирует иммунную систему. Примером такой группы является липидная группа. В некоторых случаях липидные группы узнаются Toll-подобными рецептором (TLR), таким как TLR2, и активируют систему врожденного иммунитета.
В. Антитела, специфичные в отношении белков Таблиц 1 и 2
Другим аспектом согласно настоящему описанию является получение антитела, выработанного против композиции антигенов (например, одного из белков, представленных в Таблице 1 или 2, или его иммуногенного фрагмента). Например, настоящее описание обеспечивает сочетания двух, трех, четырех или пяти антител, каждое из которых распознает различные белки из Таблицы 1 или 2. Включены все возможные сочетания антител. Такие антитела включают, например, поликлональные, моноклональные, рекомбинантные, гуманизированные, или частично гуманизированные, одноцепочечные антитела, Fab и их фрагменты и т.д. Указанные антитела могут представлять собой антитела любого изотипа, например, IgG, различные изотипы IgG, такие как IgG1, IgG2, IgG2a, IgG2b, IgG3, IgG4 и т.д.; и они могут быть антителами любого вида животных, которые вырабатывают антитела, включая козу, кролика, мышь, цыпленка и т.п.Согласно некоторым вариантам реализации молекулы Fab экспрессируются и собираются в генетически трансформированном хозяине, например, Е. coli. Можно использовать вектор лямбда для экспрессии популяции Fab с возможным разнообразием равным и превосходящим разнообразие Fab животного, синтезировавшего предшествующее антитело. Смотрите Huse et al. (1989), Science 246, 1275-81.
Г. Компоненты вакцины или иммуногенной композиции, содержащей антигены S. pneumoniae или антитела, распознающие их
Согласно некоторым вариантам реализации указанная вакцина или иммуногенная композиция содержит антиген и один или более из следующих компонентов: адъювант, стабилизатор, буфер, сурфактант, компонент, контролирующий высвобождение, соль, консервант и антитело, специфичное в отношении указанного антигена.
1. Адъюванты
Указанные препараты вакцин и иммуногенные композиции согласно настоящему изобретению могут включать адъювант.Адъюванты можно разделить приблизительно на два класса на основе их принципиального механизма действия: системы для доставки вакцин и иммуностимулирующие адъюванты (смотрите, например, Singh et al, Curr. HIV Res. 1:309-20, 2003). Системы для доставки вакцин обычно представляют собой дисперсные лекарственные формы, например, эмульсии, микрочастицы, иммуностимуляторные комплексы (ISCOM), которые могут быть, например, частицами и/или матрицами, и липосомы. В отличии от них иммуностимулирующие адъюванты иногда получают от патогенов и могут представлять собой патоген-ассоциированные молекулярные паттерны (РАМР), например, липополисахариды (LPS), монофосфорил липид (MPL) или CpG-содержащую ДНК, которые активируют клетки системы врожденного иммунитета.
Также адъюванты можно разделить на органические и неорганические. Неорганические адъюванты включают соли алюминия, такие как фосфат алюминия, аморфный алюминия гидроксифосфата сульфат и гидроксид алюминия, которые традиционно используются в вакцинах для человека. Органические адъюванты содержат органические молекулы, включая макромолекулы. Примером органического адъюванта является холерный токсин.
Также адъювант можно классифицировать по ответу, который они вызывают.Согласно некоторым вариантам реализации адъювант вызывает активацию клеток Тх1 или Тх2. Согласно другим вариантам реализации адъювант вызывает активацию В-клеток. Согласно другим вариантам реализации адъювант вызывает активацию антигенпрезентирующих клеток. Указанные категории не являются взаимоисключающими; иногда адъювант активирует более одного типа клеток.
Согласно некоторым вариантам реализации адъювант вызывает активацию Тх17 клеток. Он может вызывать секрецию IL-17 Тх17 клетками. Согласно некоторым вариантам реализации адъювант, который вызывает активацию Тх17 клеток в исследуемом образце по меньшей мере в 2 раза или в 10 раз больше, чем в контрольном образце по результатам следующего анализа. В указанном анализе исследователь сравнивает уровни IL-17, секретированного двумя популяциями клеток: (1) клетками, обработанными известным адъювантом и полипептидом, который как известно вызывает активацию Тх17 клеток; и (2) клетками, обработанными известным адъювантом и неродственным (контрольным) полипептидом. Адъювант, который вызывает активацию Тх17 клеток, может приводить к повышению выработки 1L-7 клетками популяции (1) более чем в 2 раза или более чем в 10 раз по сравнению с клетками популяции (2). Уровень IL-17 можно определить, например, методом ELISA или Вестерн-блоттинга. Некоторые токсины, например, холерный токсин или лабильный токсин (выработанный энтеротоксигенной Е. coli, или ЕТЕС) активируют ответ Тх17. Таким образом, согласно некоторым вариантам реализации указанный адъювант представляет собой токсин. Холерный токсин успешно применяли на мышиной модели для индукции защитного иммунитета в сочетании с некоторыми полипептидами из Таблицы 1 (см, Примеры 5-8). Одна из форм лабильного токсина производится Intercell. Также могут быть использованы мутантные производные лабильного токсина, которые обладают активностью адъюванта, но являются заметно менее токсичными. Примеры обезвреженных мутантных производных лабильного токсина включают мутанты, не обладающие АДФ-рибозилтрансферазной активностью. В частности, обезвреженные мутантные производные лабильного токсина включают LTK7 (Douce et al, "Mutants of Escherichia coli heat-labile toxin lacking ADP-ribosyltransferase activity act as nontoxic, mucosal adjuvants" PNAS Vol.92, pp.1644-1648, февраль 1995) и LTK63 (Williams et al, "Innate Imprinting by the Modified Heat-Labile Toxin of Escherichia coli (LTK63) Provides Generic Protection against Lung Infectious Disease" The Journal of Immunology, 2004, 173: 7435-7443), LT-G192 (Douce et al "Genetically detoxified mutants of heat-labile toxin from Escherichia coli are able to act as oral adjuvants" Infect Immun. 1999 Sep;67(9):4400-6) и LTR72 ("Mucosal adjuvanticity and immunogenicity of LTR72, a novel mutant of Escherichia coli heat-labile enterotoxin with partial knockout of ADP-ribosyltransferase activity." J Exp Med. 1998 Apr 6; 187(7): 1123-32).
Согласно некоторым вариантам реализации указанный адъювант содержит VLP (вирусоподобную частицу). Одна из подобных платформ адъювантов, репликоны на основе альфавирусов, вызывает активацию клеток Тх17 с использованием альфавируса и производится Alphavax. Согласно некоторым вариантам реализации системы репликона на основе альфавируса альфавирус можно изменить методами инженерии для экспрессии представляющего интерес антигена, цитокина (например, IL-17 или цитокина, который стимулирует выработку IL-17) или обоих, и можно нарабатывать вирус в линии клеток -хелперов. Более подробную информацию можно получить в публикации Патента США №5,643,576 и 6,783,939. Согласно некоторым вариантам реализации препарат вакцины вводят пациенту в сочетании с нуклеиновой кислотой, кодирующей цитокин.
Некоторые классы адъювантов активируют Toll-подобные рецепторы (TLR) для активации ответа Тх17. TLR представляют собой известные белки, которые можно обнаружить на мембранах лейкоцитов, и которые распознают чужие антигены (включая антигены микробов). Введение известного лиганда TLR вместе с представляющим интерес антигеном (например, гибридным белком) может обеспечивать развитие иммунного ответа, специфичного для представляющего интерес антигена. Один типичный адъювант, который активирует TLR, содержит монофосфорил липид A (MPL).
Обычно МРL производили в виде обеззараженного эндотоксина липополисахарида (LPS), полученного из грамотрицательных бактерий, таких как S. minnesota. В частности при последующем кислотном и щелочном гидролизе LPS получается иммунноактивная фракцию липида А (которая представляет собой MPL), и теряются все сахаридные группы и все, кроме одного, фосфаты, характерные для LPS. Некоторые из синтетических агонистов TLR (в частности, агонисты TLR4) описаны в публикации Evans JT et al. "Enhancement of antigen-specific immunity via the TLR4 ligands MPL adjuvant and Ribi.529." Expert Rev Vaccines 2003 Apr;2(2):219-29. Подобно адъювантам MPL указанные синтетические соединения активируют систему врожденного иммунитета через TLR. Другим типом агониста TLR является димер фосфолипидов, например, Е6020 (Ishizaka ST et al. "E6020: a synthetic Toll-like receptor 4 agonist as a vaccine adjuvant." Expert Rev. Vaccines. 2007 Oct; 6(5):773-84.). Различные агонисты TLR (включая агонисты TLR4) были произведены, и/или их можно приобрести, например, у Infectious Disease Research Institute (IRDI), Corixa, Esai, Avanti Polar Lipids, Inc. и Sigma Aldrich. Другой пример адъюванта, который активирует TLR, содержит смесь MPL, трегалозы димиколата (TDM) и диоктадодецил-диметиламмония бромида (DDA). Другим активирующим TLR адьювантов является R848 (резиквимод).
Согласно некоторым вариантам реализации указанный адъювант представляет собой или содержит сапонин. Обычно сапонин представляет собой тритерпеновый гликозид, например, полученный из коры дерева Quillaja saponaria. Экстракт сапонина из биологического источника можно далее разделять на фракции (например, методом хроматографии) для выделения частей экстракта, обладающих наибольшей адъювантной активностью и приемлемой токсичностью. Типичные фракции экстракта дерева Quillaja saponaria, используемые в качестве адъюванта, известны как фракции А и С.
В частности формой сапонинов, которую можно использовать для препарат вакцины согласно настоящему описанию, являются иммуностимулирующие комплексы (ISCOM). ISCOM представляют собой известный в данной области техники класс адьювантов, которые обычно содержат фракции сапонинов Quillaja и липиды (например, холестерин и фосфолипиды, таки как фосфатидилхолин). Согласно некоторым вариантам реализации ISCOM собираются вместе с представляющим интерес полипептидом или нуклеиновой кислотой. Тем не менее различные фракции сапонинов могут быть использованы в различных соотношениях. Также различные фракции сапонинов могут присутствовать вместе в одних частицах или в частице может присутствовать практически только одна фракция (так что показанное соотношение фракций А и С получают посредством смешивания вместе частиц с различными фракциями). При этом условии термин «существенно» обозначает менее 20%, 15%, 10%», 5%, 4%, 3%, 2% или даже 1%. Такие адъюванты могут содержать фракцию А и фракцию С смешанные в соотношении 70-95 А: 30-5 С, например, от 70 А: 30 С до 75 А: 5 С, от 75 А: 5 С до 80 А: 20 С, от 80 А: 20 С до 85 А: 15 С, от 85 А: 15 С до 90 А: 10 С, от 90 А: 10 С до 95 А: 5 С или от 95 А: 5 С до 99 А: 1 С.
Согласно некоторым вариантам реализации используются комбинации адъювантов. Тремя примерами комбинаций адъювантов являются MPL и квасцы, Е6020 и квасцы и MPL и ISCOM.
Адъюванты могут быть ковалентно связаны с антигенами. Согласно некоторым вариантам реализации указанный адъювант может содержать белок, который вызывает воспалительные ответы посредством активации антигенпрезентирующих клеток (АПК). Согласно некоторым вариантам реализации один или более указанных белков могут быть методами рекомбинации гибридизованы с выбранным антигеном, таким образом, что полученная гибридная молекула обеспечивает созревание дендритных клеток, активацию выработки дендритными клетками цитокинов и хемокинов и в конечном итоге усиливает презентацию антигена Т-клеткам и запуск ответа Т-клеток (смотрите Wu et al., Cancer Res 2005; 65(11), pp 4947-4954). Согласно некоторым вариантам реализации полипептид согласно настоящему описанию представлен применительно к тривалентной сопряженной системе S. pneumoniae, включающей пневмококковый поверхностный адгезии А: производное пневмолизина, имеющее три замены аминокислот (W433F, D385N и C428G), которые делают указанную молекулу нетоксичной, но не нарушают воспалительных свойств, опосредованных ТLR4- полисахариды клеточной стенки (PsaA:PdT-CPs) согласно описанию в публикации Lu et al. ("Protection against Pneumococcal colonization and fatal pneumonia by a trivalent conjugate of a fusion protein with the cell wall polysaccharide." Infect Immun. 2009 May;77(5):2076-83). Указанная сопряженная система представляет собой «гибридный белок, состоящий из PsaA с нетоксическим производным пневмолизина PdT, затем связанный с CP в один гибридный белок». Согласно некоторым вариантам реализации один или полипептидов согласно настоящему описанию используют вместо PsaA в указанном тривалентном конъюгате. Указанная тривалентная сопряженная система обычно включает квасцы и вводится парентерально. Другие примеры адъювантов, которые могут быть ковалентно связаны с антигенами, содержат полисахариды, пневмолизин, синтетические пептиды, липопептиды и нуклеиновые кислоты.
Обычно в каждой дозе вакцины содержится одинаковый адъювант или смесь адъювантом. Однако также адъювант можно вводить с первой дозой вакцины и не вводить с последующими дозами (т.е., вторичными инъекциями). В другом случае можно вводить сильный адъювант с первой дозой вакцины и более слабый адъювант или меньшую дозу сильного адъюванта можно вводить с последующими дозами. Указанный адъювант можно вводить до введения антигена, одновременно с введением антигена или после введения антигена пациенту (иногда в течение 1, 2, 6 или 12 часов и иногда в течение 1, 2 или 5 дней). Некоторые адъюванты подходят для людей и/или животных.
2. Дополнительные компоненты вакцины или иммуногенной композиции
Кроме указанных антигенов и адьювантов препарат вакцины или иммуногенная композиция согласно настоящему изобретению может включать один или более дополнительных компонентов.
Согласно некоторым вариантам реализации указанный препарат вакцины или иммуногенная композиция может включать один или более стабилизатор, такой как сахара (например, сахароза, глюкоза или фруктоза), фосфат (например, двухосновный фосфат натрия, одноосновный фосфат калия, двухосновный фосфат калия или натрия фосфат монозамещенный), глутамат (например, глутамат натрия), желатин (например, переработанный желатин, гидролизованный желатин или свиной желатин), аминокислоты (например, аргинин, аспарагин, гистидин, L-гистидин, аланин, валин, лейцин, изолейцин, серии, треонин, лизин, фенилаланин, тирозин и их алкиловые эфиры), инозин или борат натрия.
Согласно некоторым вариантам реализации указанный препарат вакцины или иммуногенная композиция включает один или более буфер, такие как смесь бикарбоната натрия и аскорбиновой кислоты. Согласно некоторым вариантам реализации указанный препарат вакцины можно вводить в физиологическом растворе, например, в забуференном фосфатом физиологическом растворе (PBS) или дистиллированной воде.
Согласно некоторым вариантам реализации указанный препарат вакцины или иммуногенная композиция включает один или более сурфактантов, например, полисорбат 80 (Твин80), Тритон Х-100, полиэтиленгликоль трет-октилфениловый эфир трет-октилфеноксиполиэтоксиэтанол 4-(1,1,3,3-тетраметилбутил)фенил-полиэтиленгликоля ((Тритон Х-100); Полиоксиэтилен сорбитан монолаурат Полиэтиленгликоль сорбитан монолаурат (Твин 20) и полимер 4-(1,1,3,3-тетраметилбутил)фенола с формальдегидом и оксираном (тилоксапол). Сурфактант может быть ионным и неионным.
Согласно некоторым вариантам реализации указанный препарат вакцины или иммуногенная композиция включает одну или более соль, например, хлорид натрия, хлорид аммония, хлорид кальция или хлорид калия.
Согласно некоторым вариантам реализации в указанную вакцину или иммуногенную композицию включен консервант. Согласно другим вариантам реализации консервант не используется. Наиболее часто консервант используется в многодозовых флаконах с вакциной, и зачастую менее необходим для однодозовых флаконов с вакциной. Согласно некоторым вариантам реализации указанный консервант представляет собой 2-феноксиэтанол, метил и пропил парабены, бензиловый спирт и/или сорбиновую кислоту.
Согласно некоторым вариантам реализации указанный препарат вакцины или иммуногенная композиция представляют собой лекарственную форму с контролируемым высвобождением.
Е. ДНК-вакцины
Согласно некоторым аспектам указанная вакцина содержит одну из нуклеиновых кислот согласно настоящему описанию или нуклеиновую кислоту, соответствующую одному из полипептидов согласно настоящему описанию. Когда вакцину на основе нуклеиновой кислоты вводят пациенту, в организме пациента синтезируется соответствующий продукт гена (например, желаемый антиген). Согласно некоторым вариантам реализации векторные вакцины на основе нуклеиновой кислоты, которые включают оптимизированные рекомбинантные полипептиды, можно вводить млекопитающему (включая человека) для того, чтобы вызвать терапевтический или профилактический иммунный ответ.Указанная нуклеиновая кислота может представлять собой, например, ДНК, РНК или синтетическую нуклеиновую кислоту. Указанная нуклеиновая кислота может быть одноцепочечной или двуцепочечной.
Векторные вакцины на основе нуклеиновой кислоты (например, аденовирусы, липосомы, вирусы папилломы, ретровирусы и т.д.) можно вводить непосредственно млекопитающему для трансдукции клеток in vivo. Вакцины на основе нуклеиновой кислоты могут оыть изготовлены в качестве фармацевтических композиции для введения любым способом, включая парентеральное введение.
При определении эффективного количества вектора для введения при лечении или профилактике инфекции или другого состояния врач оценивает токсичность вектора, развитие заболевания и выработку антител против вектора, при наличии таковых. Зачастую доза, равная высвобожденной из вектора нуклеиновой кислоте, составляет от 1 мкг до 1 мг для стандартного пациента с весом 70 кг, и дозы векторов, используемых для доставки указанной нуклеиновой кислоты, количественного определяют для достижения эквивалентного количества терапевтической нуклеиновой кислоты. Введение можно осуществлять в виде одной дозы или раздельных доз. Токсичность и терапевтическую эффективность векторных вакцин на основе нуклеиновых кислот можно определить с использованием стандартных фармацевтических методов с использованием клеточных культур или подопытных животных.
Вакцина на основе нуклеиновой кислоты может содержать ДНК, РНК, модифицированную нуклеиновую кислоту или их комбинацию. Согласно некоторым вариантам реализации указанная вакцина содержит один или более векторов клонирования или экспрессии, например, указанная вакцина может содержать множество векторов экспрессии, каждый из которых способен автономно экспрессировать кодирующую область нуклеотида в клетке млекопитающего для получения по меньшей мере одного иммуногенного полипептида. Вектор экспрессии часто включает последовательность промотора эукариот, например, последовательность нуклеотидов сильного промотора эукариот, операбельно соединенную с одной или более кодирующими областями. Указанные композиции и способы согласно настоящему описанию могут включать использование определенного эукариотического промотора, большое количество которых известно, например, промотора CMV или RSV. Указанный промотор может являться гетерологичным для клетки хозяина. Используемый промотор может являться конститутивным промотором.
Вектор, использованный согласно настоящему описанию и методам, может быть кольцевым или линейным, одноцепочечным или двуцепочечным, и может представлять собой плазмиду, космиду или эписому. Согласно соответствующему варианту реализации каждая кодирующая область нуклеотидов представляет собой отдельный вектор, однако, следует понимать, что в отдельном векторе может быть одна или более кодирующих областей, и указанные кодирующие области могут находиться под контролем одного или нескольких промоторов.
Для получения вакцин на основе нуклеиновых кислот можно использовать множество плазмид. Соответствующие варианты реализации вакцины на основе нуклеиновой кислоты включают использование в качестве вектора плазмид VR1012 (Vical Inc., San Diego Calif.), pCMVI.UBF3/2 (S. Johnston, University of Texas) или pcDNA3.1 (InVitrogen Corporation, Carlsbad, Calif.). Также векторные конструкции могут содержать иммуностимулирующие последовательности (ISS), например, неметилированные мотивы dCpG, которые стимулируют иммунную систему животного. Вакцина на основе нуклеиновой кислоты также может кодировать гибридный продукт, содержащий иммуногенный полипептид. Также ДНК плазмиды можно доставить с использованием ослабленных бактерий в качестве системы доставки, этот метод подходит для ДНК вакцин, которые вводят перорально. Бактерии трансформируют независимо реплицирующейся плазмидой, которая высвобождается в цитоплазму клетки хозяина после смерти ослабленной бактерии в клетке хозяина.
Другой подход к доставке нуклеиновой кислоты животному включает использование вирусного или бактериального вектора. Примеры подходящих вирусных векторов включают аденовирус, полиовирус, покс вирусы, такие как вирус осповакцины, вирус оспы канареек, вирус оспы кур, вирусы герпеса, включая вирус герпеса сомов, аденоассоциированный вектор и ретровирусы. Примеры бактериальных векторов включают ослабленные формы Salmonella, Shigella, Edwardsiella ictaluri, Yersinia ruckerii и Listeria monocytogenes. Согласно некоторым вариантам реализации указанная нуклеиновая кислота представляет собой вектор, например, плазмиду, способную к аутологичной экспрессии нуклеотидной последовательности, кодирующей указанный иммуногенный полипептид.
Ж. Применение вакцин
Вакцины против S. pneumoniae согласно настоящему описанию могут быть использованы для профилактики и/или оказания медицинской помощи при инфекции S. pneumoniae. Соответственно настоящая заявка обеспечивает способ лечения пациента, страдающего от инфекции S. pneumoniae или предрасположенного к ее развитию, включающий введение эффективного количества любого препарата вакцины согласно настоящему описанию. Согласно некоторым аспектам указанный способ подавляет колонизацию S. pneumoniae у пациента. Согласно некоторым аспектам указанный способ снижает проявление симптомов инфекции S. pneumoniae. Пациент, подвергающийся вакцинации, может быть мужского или женского пола и может быть ребенком или взрослым. Согласно некоторым вариантам реализации пациент, получающий лечение, является человеком. Согласно другим вариантам реализации указанный пациент является животным.
1. Профилактическое применение
Согласно профилактическому варианту реализации указанную вакцину вводят пациенту для того, чтобы вызвать иммунный ответ, который поможет защититься от развития инфекции S. pneumoniae, например, посредством защиты от колонизации, которая является первым и необходимым этапом развития заболевания. Таким образом, согласно некоторым аспектам, указанный способ подавляет инфекцию S. pneumoniae у незараженного пациента или пациента, не подверженного колонизации. Согласно другому аспекту указанный способ может уменьшать продолжительность колонизации у пациента, который уже подвергся колонизации
Согласно некоторым вариантам реализации указанные композиции вакцин согласно настоящему изобретению вызывают защитный иммунитет, позволяя вакцинированному человеку демонстрировать задержку в проявлении симптомов или менее тяжелые симптомы в результате действия вакцины на него/нее. Согласно некоторым вариантам реализации снижение тяжести симптомов составляет по меньшей мере 25%, 40%, 50%, 60%, 70%, 80% или даже 90%. Согласно некоторым вариантам реализации у вакцинированного пациента не проявляются симптомы при контакте с S. pneumoniae, и/или пациент не подвергается колонизации S. pneumoniae. Защитный иммунитет обычно достигается с помощью одного из или более следующих механизмов: иммунитета слизистых оболочек, гуморального или клеточного иммунитета. Иммунитет слизистых оболочек преимущественно является результатом секретируемых антител IgA (sIGA) на слизистой оболочке дыхательного, желудочно-кишечного и мочеполового тракта. Указанные антитела sIGA вырабатываются после серии событий, опосредуемых антигенпрезентирующими клетками, В- и Т-лимфоцитами, что приводит к выработке sIGA В-лимфоцитами на слизистых оболочках организма. Гуморальный иммунитет обычно выражается в появлении антител IgG и IgM в сыворотке. Клеточный иммунитет возникает с участием Т-лимфоцитов или посредством гиперчувствительности замедленного типа, в которой участвуют макрофаги и Т-лимфоциты, а также других механизмов, в которых участвуют Т-клетки без необходимости в антителах. В частности клеточный иммунитет может быть опосредован Tx1 или Тх17 клетками.
По существу, любой человек может быть инфицирован 5". pneumoniae. Тем не менее некоторые популяции имеют повышенный риск инфекции. Согласно некоторым вариантам реализации препарат вакцины согласно настоящему описанию (например, композиция, содержащая один или более полипептидов из Таблицы 1 или 2, или нуклеиновую кислота, кодирующая указанные полипептиды, или антитела, вырабатывающиеся на полипептиды) вводят пациентам с ослабленным иммунитетом.
Вероятно, что в состоянии ослабленного иммунитета, возникающего после терапевтического лечения, человек, о котором идет речь, будет иметь более высокий риск заражения S. pneumoniae. Можно лечить инфекцию профилактически у пациента, находящегося в состоянии пониженного иммунитета, до или во время оказания медицинской помощи, которая, как известно, окажет подавляющее действие на иммунную систему. Посредством профилактической помощи с применением антигенной композиции (например, двух или более антигенов из Таблицы 1 или 2 или нуклеиновых кислот, кодирующих указанные антигены) или антител, реактивных по отношению к двум или более антигенам из Таблицы 1 или 2, до или во время оказания медицинской помощи, которая, как известно, окажет подавляющее действие на иммунную систему, можно предотвратить последующую инфекцию S. pneumoniae или снизить риск контакта пациента с инфекцией из-за состояния ослабленного иммунитета. Если пациент заразится S. pneumoniae, например, после лечения, вызывающего состояние ослабленного иммунитета, можно оказывать помощь при инфекции посредством введения пациенту антигенной композиции.
Следующие группы имеют риск развития пневмококковой инфекции, и поэтому людям, попадающим в одну или более указанных групп, полезно получать препарат вакцины согласно настоящему описанию: дети, особенно в возрасте от 1 месяца до 5 лет или от 2 месяцев до 2 лет; дети, в возрасте по меньшей мере 2 года страдающие аспленией, нарушением функции селезенки или серповидноклеточной анемией; дети в возрасте 2 года, страдающие нефротическим синдромом, хроническим нарушением оттока спинномозговой жидкости, инфекцией ВИЧ или другими состояниями, вызванными ослаблением иммунитета.
Согласно другому варианту реализации по меньшей мере одну дозу пневмококкового антигена вводят взрослым из следующих групп с повышенным риском пневмококковой инфекции или ее осложнений: все люди старше 65 лет; взрослые, страдающие аспленией, нарушением функции селезенки или серповидноклеточной анемией; взрослые со следующими заболеваниями: хроническая сердечно-легочная недостаточность, цирроз, алкоголизм, хроническая почечная недостаточность, сердечнососудистая болезнь, нефротический синдром, сахарный диабет, хроническое нарушение оттока спинномозговой жидкости, инфекция ВИЧ, СПИД и другие заболевания, вызванные подавлением иммунитета (Болезнь Ходжкина, лимфома, множественная миелома, иммуносупрессия при трансплантации органов), пациенты с кохлеарными имплантатами; пациенты с продолжительными проблемами со здоровьем, такими как заболевания сердечнососудистой системы и заболевания легких, а также пациенты, принимающие любой лекарственный препарат или медицинскую помощь, которые понижают защитные силы организма по отношению к инфекциям, например, стероиды, некоторые противораковые препараты, лучевая терапия; популяции жителей Аляски и некоторые популяции коренных американцев.
2. Терапевтическое применение
При терапевтическом применении указанную вакцину можно вводить пациенту, страдающему от инфекции S. pneumoniae, в количестве, достаточном для лечения пациента. Термин «лечение пациента» в данном случае обозначает уменьшение симптомов и/или бактериальной нагрузки S. pneumoniae у зараженного пациента. Согласно некоторым вариантам реализации термин «лечение пациента» обозначает уменьшение продолжительности проявления симптомов или снижение интенсивности симптомов. Согласно некоторым вариантам реализации указанная вакцина снижает трансмиссивность S. pneumoniae от вакцинированного пациента. Согласно некоторым вариантам реализации уменьшения согласно описанию выше составляют по меньшей мере 25%, 30%, 40%, 50%, 60%, 70%, 80% или даже 90%.
Согласно терапевтическому варианту реализации указанную вакцину вводят пациенту после заражения. Указанную вакцину можно вводить непосредственно после инфекции, например, до появления симптомов, или можно вводить во время или после появления симптомов.
Терапевтическая вакцина против S. pneumoniae может снижать интенсивность и/или длительность симптомов различных проявлений инфекции S. pneumoniae. Инфекция S. pneumoniae может принимать несколько форм. В некоторых случаях у инфицированного пациента может развиться пневмония, острый синусит, средний отит (ушная инфекция), менингит, бактериемия, сепсис, остеомиелит, септический артрит, перитонит, флегмона или абсцесс мозга.
3. Анализ эффективности вакцинации
Эффективность вакцинации вакцинами согласно настоящему описанию можно определить различными способами дополнительно к приведенным выше клиническим результатам. Во-первых, можно определять уровень IL-17 (в частности IL-17A) посредством стимуляции Т-клеток, полученных от пациента после вакцинации. Уровни IL-17 можно сравнивать с уровнями IL-17 у того же пациента до проведения вакцинации. Повышение уровня IL-17 (например, IL-17A), например, в 1.5, 2, 5, 10, 20, 50 или 100 раз или больше, будет свидетельствовать о повышенном ответе на вакцину. В другом случае (или совместно) можно исследовать способность нейтрофилов к цитолизу пневмококков в присутствии Т-клеток или антител пациента. Повышенный цитолиз пневмококков, например, в 1.5, 2, 5, 10, 20, 50 или 100 раз или более, будет свидетельствовать о повышенном ответе на вакцину. Также можно измерять активацию Тх17 клеток, при этом повышенная активация Тх17 клеток, например в 1.5, 2, 5, 10, 20, 50 или 100 раз или более, соответствует повышенному ответу на вакцину. Также можно измерять уровни антитела, специфичного в отношении вакцины, при этом повышенный уровень специфичных антител, например, в 1.5, 2, 5, 10, 20, 50 или 100 раз или более, соответствует повышенной эффективности вакцины. Согласно некоторым вариантам реализации используют два или более указанных анализа. Например, можно определять уровни IL-17 и уровни антитела, специфичного в отношении вакцины. В другом случае можно использовать эпидемиологические маркеры, такие как заболеваемость, тяжесть или продолжительность пневмококковой инфекции у вакцинированных пациентов по сравнению с невакцинированными пациентами.
Эффективность вакцины также можно определять на различных модельных системах, таких как мышиная модель. Например, можно использовать мышей BALB/c или C57BL/6. После введения исследуемой вакцины пациенту (например, однократных или множественных доз) исследователь вводит сублетальную дозу S. pneumoniae. В некоторых случаях указанная сублетальная доза является достаточной для вызывания колонизации S. pneumoniae (особенно назальной колонизации) у не вакцинированного животного, и в некоторых случаях указанная сублетальная доза является достаточной для вызывания летальности с высокой частотой у не вакцинированных животных. Затем можно измерять снижение колонизации или уменьшение летальности вакцинированных животных. В Примерах 5 и 6 показана эффективность полипептидов Таблицы 1 в отношении подавления назальной колонизации S. pneumoniae на мышиной модели.
3. Применение иммуногенных композиций
1. Защита от инфекции S. pneumoniae
Указанные иммуногенные композиции согласно настоящему описанию созданы для вызывания иммунного ответа против S. pneumoniae. Композиция согласно настоящему описанию (например, композиция, содержащая один или более полипептидов Таблицы 1 или 2, или нуклеиновые кислоты, кодирующие указанные полипептиды) может вызывать гуморальный иммунные ответ и/или клеточный иммунный ответ у животного, которому ее вводят.Согласно некоторым вариантам реализации указанная композиция стимулирует преимущественно Tx1 CD4+Т - клеточный ответ, преимущественно Тх17 CD4+Т - клеточный ответ или CD8+Т - клеточный ответ; в случае однокомпонентной композиции указанная композиция может стимулировать гуморальный ответ, преимущественно Tx1 CD4+Т - клеточный ответ, преимущественно Tx17 CD4+Т - клеточный ответ и/или CD8+Т - клеточный ответ.
Согласно некоторым вариантам реализации указанная композиция (например, композиция, содержащая один или более полипептидов Таблицы 1 или 2, или нуклеиновые кислоты, кодирующие указанные полипептиды, или антитела, реактивные в отношении указанных пептидов) включает цитокин или кодирующую область нуклеотида, кодирующую цитокин, например, IL-17, для обеспечения дополнительной стимуляции иммунной системы млекопитающего. Согласно некоторым вариантам реализации указанная композиция содержит цитокин, такой как IL-17.
Не желая быть связанным теорией, согласно некоторым вариантам реализации ответ Tx17 клеток является полезным при запуске иммунного ответа на композиции согласно настоящему описанию, например, композиции, содержащие один или более полипептидов из Таблицы 1 или 2. Согласно некоторым вариантам реализации ответ активированных Tx17 способствует устранению инфекции пневмококков. Например, у мышей, не имеющих рецептор IL-17A, наблюдается пониженная защита, обеспечиваемая цельноклеточной вакциной, при введении пневмококков (Lu et al, "Interleukin-17A mediates acquired immunity to pneumococcal colonization." PLoS Pathog. 2008 Sep 19;4(9)). Более того теми же авторами было показано, что интенсивность ответа IL-17A была повышена у мышей, которым вводили цельноклеточную вакцину.
Таким образом, в настоящем описании обеспечивается способ увеличения выработки IL-17 посредством введения пациенту композиций согласно настоящему описанию (например, композиций, содержащих один или более полипептидов Таблицы 1 или 2). Более того настоящая заявка также обеспечивает способ активации Тх17 клеток посредством введения указанной композиции пациенту. Согласно некоторым вариантам реализации повышенный уровень IL-17A приводит к усиленному цитолизу пневмококков нейтрофилами или нейтрофилоподобными клетками, например, посредством стимуляции миграции и активации нейтрофилов или нейтрофилоподобных клеток. Согласно некоторым вариантам реализации указанный цитолиз пневмококков не зависит от антител и комплемента. Тем не менее, выработка специфичных антител и активация комплемента могут являться полезными дополнительными механизмами, которые способствуют избавлению от инфекции пневмококков.
Также обеспечиваются иммуногенные композиции, содержащие иммуногенные полипептиды или полинуклеотиды, кодирующие иммуногенные полипептиды, вместе с фармацевтическим носителем.
В ряде случаев указанная иммуногенная композиция содержит одну или более нуклеиновых кислот, кодирующих один или более полипептидов, представленных на SEQ ID NO:1-13, например, в которых одна или более нуклеиновых кислот выбраны из SEQ ID NO:24-31. Согласно некоторым вариантам реализации указанные нуклеиновые кислоты экспрессируются у иммунизированного пациента, вырабатывая кодируемые антигены S. pneumoniae, и полученные таким образом антигены S. pneumoniae могут оказывать иммуностимулирующее действие на иммунизированного пациента.
Такая иммуностимулирующая композиция, содержащая нуклеиновую кислоту, может содержать, например, точку инициации репликации и промотор, которые запускают экспрессию одной или более нуклеиновых кислот, кодирующих один или более полипептидов, представленных на SEQ ID NO:1-13. Такая композиция также может содержать бактериальный плазмидный вектор, в который вставлен промотор (иногда сильный промотор вируса), одну или более нуклеиновых кислот, кодирующих один или более полипептидов SEQ ID NO:1-13, и последовательность полиаденилирования/терминатор транскрипции. В некоторых случая указанная нуклеиновая кислота представляет собой ДНК.
И. Способы применения в диагностике
Настоящая заявка обеспечивает, в частности, быстрый, недорогой, чувствительный и специфический способ определения S. pneumoniae у пациентов. В связи с этим он будет полезен во всех больницах и всем лечащим врачам, обследующим или оказывающим помощь пациентам, зараженным или имеющим риск развития инфекции S. pneumoniae. Наборы для определения могут быть достаточно простыми для сборки в лаборатории любой местной больницы, и указанные антитела и их антигенсвязывающие части можно с легкостью сделать доступными для всех больниц, в которых оказывается помощь пациентам, зараженным или имеющим риск развития инфекции S. pneumoniae. Согласно настоящему описанию термин «пациент» обозначает индивида (например, человека), который заражен S. pneumoniae или может вступить в контакт с инфекцией S. pneumoniae. Пациент может представлять собой индивида (например, человека), страдающего от инфекции S. pneumoniae, который может вступить в контакт с инфекцией S. pneumoniae, пациента, который вылечился от инфекции S. pneumoniae, и/или индивида, инфекционный статус которого неизвестен.
Согласно некоторым вариантам реализации можно проводить диагностическое исследование с использованием двух или более антител, каждое из которых связывает один из антигенов из Таблицы 1 и 2, для определения S. pneumoniae у пациента. Настоящее описание также обеспечивает способ фенотипирования биологических образцов пациентов, которые предположительно страдают от инфекции S. pneumoniae, (а) получение биологическое образца от пациента; (б) обеспечение контакта указанного образцы с двумя или более антителами, специфичными в отношении S. pneumoniae или их антигенсвязывающими фрагментами, в условиях, способствующих связыванию указанного антитела или его антигенсвязывающего фрагмента с эпитопом S. pneumoniae; при этом связывание свидетельствует о наличии S. pneumoniae в образце. Согласно некоторым вариантам реализации указанное связывание с указанным биологическим образцом сравнивают со связыванием того же антитела с тканью, представляющей собой отрицательный контроль, отличающийся тем, что если в биологическом образце выявляют наличие S. pneumoniae по сравнению с отрицательным контрольным образцом, считается, что пациент вероятно страдает от инфекции S. pneumoniae. В некоторых случаях связывание антитела свидетельствует о наличии S. pneumoniae; в других случаях связывание двух или более антител свидетельствует о наличии S. pneumoniae. Указанные выше способ анализа можно изменять соответствующим образом для определения других бактериальных инфекций, например, посредством использования антитела, активного в отношении гомолога (от других видов бактерий) одного из белков, представленных в Таблице 1. Согласно некоторым вариантам реализации антитела, выработанные против белка S. pneumoniae из Таблицы 1 или 2, также будут связывать гомолог других видов Streptococcus, особенно, если гомологи обладают высоким сродством последовательностей.
В другом случае можно использовать антиген из Таблицы 1 или 2 для определения у пациента антител против S. pneumoniae. Настоящее описание также обеспечивает способ фенотипирования биологических образцов пациентов, которые предположительно страдают от инфекции S. pneumoniae (а) получение биологическое образца от пациента; (б) обеспечение контакта указанного образцы с двумя или более антигенами S. pneumoniae, выбранными из Таблицы 1 или 2 или их фрагментами, в условиях, которые способствуют связыванию указанного антигена или его фрагмента с любым представленным в образце хозяйским антителом; при этом связывание свидетельствует о наличии антител против S. pneumoniae в указанном образце. Согласно некоторым вариантам реализации указанное связывание с указанным биологическим образцом сравнивают со связыванием того же антигена с тканью, представляющей собой отрицательный контроль, отличающийся тем, если в биологическом образце выявляют наличие антител против S. pneumoniae по сравнению с отрицательным контрольным образцом, считается, что пациент вероятно (1) страдает от инфекции S. pneumoniae или (2) страдал от инфекции 5". pneumoniae в прошлом. В некоторых случаях определение одного антитела свидетельствует о текущей или прошедшей инфекции S. pneumoniae; в других случаях определение двух или более антител S. pneumoniae. Указанный выше анализ можно модифицировать соответствующим образом для определения других бактериальных инфекций, например, посредством использования гомолога (от других видов бактерий, например, видов Streptococus) белков, представленных в Таблице 1.
Согласно некоторым вариантам реализации ответ иммунных клеток млекопитающего можно количественно оценить ex vivo. Способ такого количественного определения включает предъявление композиций согласно настоящему определению Т-клеткам млекопитающего ex vivo и количественного измерения изменения выработки цитокинов Т-клетками млекопитающего в ответ на композицию. Согласно указанным способам цитокин может представлять собой, например, IL-17.
Связывание антитела к S. pneumoniae с антигеном (например, полипептидом из Таблицы 1 или 2) можно измерять с помощью любого соответствующего метода. Такие методы включают (твердофазный иммуноферментный анализ), Вестерн-блоттинг, конкурентный анализ и дот-блоттинг.При детекции можно использовать, например, хемилюминесценцию, флуоресценцию или колориметрию. Подходящим методом измерения связывания антитела с белком является система Luminex хМАР, в которой пептиды связываются с микросферой, содержащей краситель. Некоторые системы, включая систему хМАР, подходят для измерения нескольких различных маркеров мультиплексно, и их можно использовать для одновременного измерения уровня антител. Согласно некоторым вариантам реализации используют другие системы для одновременного анализа множества маркеров. Например, анализ профиля можно проводить с использованием любой из следующих систем: микрочипы антигенов, микрочипы с шариками, метод частиц с наноштрих-кодом, анализы белков лабораторий кДНК, анализ белков in situ, исследование белков в живых трансформантах, анализ всех белков, метод микрожидкостного анализа («lab-on-a-chip») и метод «пептиды на булавках». Другим типом клинического анализа является хемилюминесцентный анализ для определения связывания антитела. В некоторых таких анализах, включая анализ VITROS Eci anti-HCV, антитела иммобилизованы на твердофазной подложке, состоящей из микрочастиц в жидкой суспензии, и используется флуориметр для определения флуоресценции поверхности для количественного определения ферментативной выработки флуоресцентного продукта.
Согласно некоторым вариантам реализации если в биологическом образце выявляется наличие £ pneumoniae (например, посредством определения одного или более полипептидов из Таблицы 1 или 2 или антитела, которое связывает один из указанных полипептидов), пациенту можно вводить терапевтически эффективное количество композиций и средств согласно настоящему описанию. Биологический образец может содержать, например, кровь, сперму, мочу, влагалищное отделяемое, слизь, слюну, фекалии, мочу, спинномозговую жидкость или образец ткани. Согласно некоторым вариантам реализации указанный биологический образец представляет собой орган, предназначенный для трансплантации. Согласно некоторым вариантам реализации до этапа определения биологический образец подвергают культивированию, что обеспечивают рост S. pneumoniae.
Диагностические тесты согласно настоящему описанию (например, те, в которых определяют полипептид из Таблицы 1 или 2 или антитело, которое связывает один из указанных полипептидов) можно использовать для определения S. pneumoniae в различных образцах, включая образцы, полученные от пациентов, и образцы, полученные из других источников. Например, указанные диагностические тесты можно применять для определения S. pneumoniae в еде, напитках или компонентах пищи или напитков, на предметах, таких как медицинские инструменты, изделия медицинского назначения, такие как кохлеарные имплантаты и кардиостимуляторы, обувь, одежда, мебель, включая больничную мебель, и простыни, включая больничные простыни; или в образцах, полученных из окружающей среды, например, образцы растительных тканей. Согласно некоторым вариантам реализации указанные тесты можно проводить на образцах, полученных от животных, например, сельскохозяйственных животных (коровы, свиньи, цыплята, козы, лошади и т.п.), домашних животных (собаки, кошки, птицы и т.п.) или диких животных. Согласно некоторым вариантам реализации указанные тесты можно проводить на образцах, полученных из клеточных культур, например, культур клеток человека, которые вырабатывают терапевтический белок, культур бактерий, предназначенных для выработки полезной биологической молекулы, или культур клеток, культивированных для исследовательских целей.
Настоящее описание также обеспечивает способ определения нахождения инфекции S. pneumoniae у пациента, включающий: (а) введение пациенту фармацевтической композиции, содержащей меченое антитело к S. pneumoniae или его антигенсвязывающий фрагмент, и (б) определение метки, при этом связывание указывает на инфекцию S. pneumoniae в определенной части тела пациента. Такой способ диагностики также может включать сравнивание уровней связывания в пациенте с контролем. Согласно некоторым вариантам реализации указанный способ в случае, если у пациента есть инфекция S. pneumoniae, также включает оказание помощи при лечении посредством введения пациенту терапевтически эффективного количества антитела, связывающего S. pneumoniae, или его антигенсвязывающей части. Согласно некоторым вариантам реализации указанный способ в случае, если у пациента есть инфекция S. pneumoniae, также включает оказание помощи при лечении посредством введения пациенту терапевтически эффективного количества белка S. pneumoniae из Таблицы 1 или его иммуногенной части. Указанный способ также может включать определение нахождения и/или объема S. pneumoniae у пациента. Указанные способ можно использовать для оценки распространения S. pneumoniae у пациента и для определения того, стоит ли назначать местную терапию.
Согласно некоторым вариантам реализации антитела к S. pneumoniae согласно настоящему описанию можно использовать для прогноза развития инфекции. Согласно некоторым вариантам реализации антитела к S. pneumoniae согласно настоящему описанию можно определить в образце, полученном от пациента. Если уровень антител нормальный, это свидетельствует о том, что у пациента развился иммунный ответ против 5. pneumoniae. Если антител нет или их уровень понижен, это свидетельствует о том, что у пациента не развился достаточный иммунный ответ против S. pneumoniae, и следует назначить более агрессивное лечение. Согласно некоторым вариантам реализации термин антитела, представленные на пониженном уровне, означает, что уровень антител составляет менее 50%, 20%, 10%, 5%, 2% или 1% от уровня антител, свойственного пациенту с нормальной иммунной системой. Антитела можно определять по сродству к любому из антигенов согласно настоящему описанию (например, антигенов из Таблицы 1 или 2), например, с помощью ИФА.
Согласно некоторым вариантам реализации определение специфичных антигенов S. pneumoniae (например, антигенов из Таблицы 1 и/или 2) можно использовать для предсказания развития и симптомов инфекции S. pneumoniae у пациента. Специалисту в данной области техники будет понятно, что способы согласно настоящему описанию не ограничиваются определением S. pneumoniae. Другие варианты реализации включают определение родственных бактерий, включая бактерии, имеющие белки гомологичные белкам Таблицы 1 или 2. Такие родственные бактерии включают, например, другие штаммы Streptococcus.
К. Дозы и способы введения
1. Лекарственные формы, количества и схема приема
Количество антигена в каждой дозе вакцины или иммуногенной композиции выбирают в виде эффективного количества, которое вызывает профилактический или терапевтический ответ, согласно описанию выше, в виде одиночных доз или множественных доз. Предпочтительно указанная доза не оказывает значительного побочного действия на обычных вакцинируемых. Это количество может различаться в зависимости от использованного специфичного антигена. Обычно считается, что доза содержит 1-1000 мкг белка, в некоторых случаях 2-100 мкг, например, 4-40 мкг. Согласно некоторым аспектам указанный препарат вакцины содержит 1-1000 мкг указанного полипептид и 1-250 мкг адъюванта. Согласно некоторым вариантам реализации соответствующее количество антигена для введения зависит от возраста, веса и состояния здоровья (например, состояние нарушенного иммунитета) человека. При наличии обычно количество адъюванта составляет 1 мкг-250 мкг на дозу, например, 50-150 мкг, 75-125 мкг или 100 мкг.
Согласно некоторым вариантам реализации для достижения результатов согласно описанию выше вводят только одну дозу вакцины. Согласно другим вариантам реализации после первичной вакцинации пациента пациент получает одну или более бустерных вакцинаций, в общей сложности две, три, четыре или пять иммунизации. Предпочтительно количество составляет три или менее. Бустерную вакцинацию можно проводить, например, через 1 месяц, 2 месяца, 4 месяца, 6 месяцев или 12 месяцев после первичной вакцинации, таким образом один режим вакцинации включает введение 0, 0.5-2 и 4-8 месяцев. Может являться предпочтительным введение расщепленных доз вакцин, которые можно вводить таким же или другими путями.
Вакцины и иммуногенные композиции согласно настоящему описанию могут иметь различные лекарственные формы. Согласно некоторым вариантам реализации указанная композиция обеспечивается в виде твердой или порошкообразной (например, лиофилизированной) форме; также она может обеспечиваться в виде раствора. Согласно некоторым вариантам реализации лекарственная форма обеспечивается в виде дозы лиофилизированной композиции и по меньшей мере одного отдельного контейнера с разбавителем.
Согласно некоторым вариантам реализации указанную композицию будут вводить по схеме повышения дозы, таким образом, что следующие введения указанной композиции содержат большую концентрацию композиции, чем предыдущие. Согласно некоторым вариантам реализации указанную композицию будут вводить по схеме повышения дозы, таким образом, что следующие введения указанной композиции содержат меньшую концентрацию композиции, чем предыдущие.
При терапевтическом применении композиции вводят пациенту, страдающему от заболевания, в количестве, достаточном для лечения пациента. Терапевтические виды применения композиции согласно настоящему описанию включают снижение способности к передаче, замедление развития заболевания, снижение жизнеспособности или репликации бактерий, подавление экспрессии белков, необходимых для токсичности, например, на 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20% или 10% по сравнению с уровнем, на котором они бы встречались у людей, которых не подвергали действию указанной композиции.
Согласно профилактическим вариантам реализации композиции вводят человеку или другому млекопитающему для вызывания иммунного ответа, который может подавить развитие инфекционного заболевания или другого состояния. Согласно некоторым вариантам реализации композиция может частично препятствовать бактерии при развитии инфекции.
Согласно некоторым вариантам реализации указанные композиции вводят в сочетании с антибиотиками. Это сочетанное введение особенно уместно, если указанную фармацевтическую композицию вводят пациенту, который не так давно подвергался (или предполагается, что подвергался) действию S. pneumoniae. Большое количество антибиотиков используется для лечения инфекций пневмококков, включая пенициллин, амоксициллин, амоксициллин/клавуланат, цефуроксим, цетриаксон и ванкомицин. Подходящий антибиотик можно подобрать, основываясь на типе и тяжести инфекции, а также известной устойчивости к антибиотикам (Jacobs MR "Drug-resistant Streptococcus pneumoniae: rational antibiotic choices" Am J Med. 1999 May 3;106(5A): 19S-25S).
2. Способы введения
Препараты вакцин и фармацевтические композиции можно доставлять пациенту посредством введения пациенту, обычно посредством системного введения (например, с помощью внутривенного, интраперитонеального, внутримышечного, внутрикожного, подкожного, субдермального, чрезкожного, внутримозгового, интраназального, на слизистую оболочку, анального, вагинального, перорального, буккального пути введения или их можно вдыхать) или можно вводить их путем местного применения. Согласно некоторым вариантам реализации способ введения представляет собой внутримышечное введение. Согласно другим вариантам реализации способ введения представляет собой подкожное введение. Согласно некоторым вариантам реализации способ введения представляет собой способ нанесения на слизистые. Согласно некоторым вариантам реализации способ введения представляет собой чрезкожное или внутрикожное введение.
Некоторые способы введения особенно подходят для препаратов вакцин и иммуногенных композиций, содержащих определенные адъюванты. В частности чрезкожный способ введения подходит для введения вакцин против S. pneumoniae, содержащих токсины (например, холерный токсин или лабильный токсин); согласно другим вариантам реализации способ введения является интраназальным. Вакцины, содержащие репликоны альфавирусов, можно вводить, например, внутримышечно или подкожно. Вакцины, содержащие монофосфарил липид-А (MPL), дикоиномиколат трегалозы (TDM) и диоктадецилдиметиламмония бромид (DDA) подходят (в частности) для внутримышечного и подкожного введения. Вакцину, содержащую резиквимод, можно вводить местно или подкожно, например.
3. Лекарственные формы
Препарат вакцины или иммуногенная композиция может подходить для введения человеку, и препарат вакцины или иммуногенная композиция может соответствовать требованиям Управления по контролю за качеством пищевых продуктов и лекарственных препаратов США. Согласно некоторым вариантам реализации препарат вакцины или иммуногенная композиция подходит для введения животному. Согласно некоторым вариантам реализации препарат вакцины или иммуногенная композиция практически не содержит эндотоксины или экзотоксины. Эндотоксины могут включать пирогены, такие как молекулы липополисахарида (LPS). Также указанный препарат вакцины или иммуногенная композиция может практически не содержать неактивные фрагменты, которые могут вызвать повышение температуры или другие побочные эффекты. Согласно некоторым вариантам реализации указанная композиция содержит менее 1%, 0.1%, 0.01%, 0.001%) или менее 0.0001% эндотоксинов, экзотоксинов и/или неактивных фрагментов белков. Согласно некоторым вариантам реализации в препарате вакцины или иммуногенной композиции согласно настоящему изобретению уровень пирогенов ниже, чем в технической воде, водопроводной воде или дистиллированной воде. Другие компоненты вакцины или иммуногенной композиции можно очищать с помощью методов, известных в данной области техники, например, ионообменная хроматография, ультрафильтрация или дистилляция. Согласно другим вариантам реализации пирогены можно инактивировать или разрушить перед введением пациенту. Также можно провести анализ и депирогенизацию сырья для вакцин, такого как вода, буферы, соли и другие химические вещества. Все материалы вакцины могут быть стерильными и можно проверить стерильность каждой партии вакцины можно. Таким образом, согласно некоторым вариантам реализации уровни эндотоксинов в вакцине ниже уровня токсинов, установленного Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов, например, 0.2 ME эндотоксина/кг продукта для композиции для интратекальных инъекций; 5 МЕ/кг продукта для композиции не для интратекальных инъекций и 0.25-0.5 МЕ/мл для стерильной воды.
Согласно некоторым вариантам реализации указанный препарат содержит менее 50%, 20%, 10%) или 5% (на массу сухого вещества) загрязняющих белков. Согласно некоторым вариантам реализации желаемая молекула представлена практически без других биологических макромолекул, таких как другие белки (в частности, другие белки, которые могут существенно препятствовать проявлению, уменьшать или изменять свойства белков, входящих в состав вакцины, в виде чистых препаратов или при выполнении своих функции в организме пациента). Согласно некоторым вариантам реализации присутствуют по меньшей мере 80%), 90%, 95%, 99% или 99.8% (по сухому весу) биологических макромолекул одного типа (но также могут быть вода, буферы или другие мелкие молекулы, особенно молекулы с молекулярным весом менее 5000). Согласно некоторым вариантам реализации указанная вакцина или иммуногенная композиция, содержащая очищенные субъединичные белки, содержит менее 5%, 2%, 1%, 0.5%, 0.2%, 0.1% белка клетки хозяина, в котором экспрессировались субъединичные белки, относительно количеству очищенной субъединицы. Согласно некоторым вариантам реализации желаемые полипептиды практически не содержат нуклеиновые кислоты и/или углеводы. Например, согласно некоторым вариантам реализации указанная вакцина или иммуногенная композиция содержит менее 5%, 2%, 1%, 0.5%, 0.2% или менее 0.1% ДНК и/или РНК клетки хозяина. Согласно некоторым вариантам реализации в лекарственной форме присутствуют по меньшей мере 80%, 90%, 95%, 99% или 99.8% (по сухому весу) биологических макромолекул одного типа (но также могут быть вода, буферы или другие мелкие молекулы, особенно молекулы с молекулярным весом менее 5000).
Предпочтительно указанная вакцина или иммуногенная композиция обладает низкой токсичностью или не обладает ею вообще в пределах разумного коэффициента риска. Согласно некоторым вариантам реализации указанная вакцина или иммуногенная композиция содержит другие ингредиенты в концентрациях ниже LD50 для вакцинируемого животного. Величины LD50 можно получить для мышей или других модельных системах и перенести на людей и других млекопитающих. Способы определения LD50 соединений для людей и других животных известны в данной области техники. Препарат вакцины или иммуногенная композиция или любой ее компонент должен иметь значение LD50 для крыс более 100 г/кг, 50 г/кг, 20 г/кг, 10 г/кг, 5 г/кг, 2 г/кг, 1 г/кг, 500 мг/кг, 200 мг/кг, 100 мг/кг, 50 мг/кг, 20 мг/кг или 10 мг/кг.Препарат вакцины или иммуногенная композиция, которая содержит токсин, например, ботулотоксин (который можно использовать как адъювант), должна содержать ботулотоксин в концентрации существенно ниже LD50.
Лекарственные формы, подходящие для введения препаратов вакцин или фармацевтической композиции могут различаться в зависимости от способа введения. Лекарственные формы, подходящие для парентерального введения, например, посредством внутрисуставного (внутрь связок), внутривенного, внутримышечного, внутрикожного, интраперитонеального, интраназального и подкожного введения, включают водные и безводные, изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики и растворы, которые делают композицию изотоничной крови предполагаемого реципиента, и водные и безводные стерильные суспензии, которые могут включать суспендирующие агенты, растворители, загустители, стабилизаторы и консерванты. Лекарственные формы можно помещать в запечатанные контейнеры с одной дозой или несколькими дозами, например, ампулы или пробирки.
Растворы для инъекций и суспензии можно приготовить из стерильных порошков, гранул и таблеток, того же типа, что и описанные выше. В случае адоптивного переноса терапевтических Т-клеток эти клетки можно вводить внутривенно или парентерально.
Лекарственные формы, подходящие для перорального введения могут состоять из: (а) жидких растворов, например, эффективного количества полипептидов или упакованных нуклеиновых кислот, суспендированных в разбавителях, например, воде, физиологическом растворе или PEG 400; (б) капсул, саше или таблеток, каждая из которых содержит предопределенное количество активного ингредиента, например, жидкости, твердые вещества, гранулы или желатин; (в) суспензий в соответствующей жидкости и (г) подходящих эмульсий. Лекарственная форма таблетки может включать одно из следующих: галактозу, сахарозу, маннитол, сорбитол, фосфаты кальция, кукурузный крахмал, картофельный крахмал, трагакант, микрокристаллическую целлюлозу, акацию, желатин, диоксид коллоидного кремния, кроскармеллозу натрия, тальк, стеарат магния, стеариновую кислоту и другие наполнители, красители, связывающие агенты, разбавители, буферные агенты, увлажняющие агенты, консерванты, ароматизаторы, красители, дезинтегрирующие агенты и фармацевтически совместимые носители. Лекарственные формы леденцов могут содержать активный ингредиент во вкусовом веществе, обычно сахарозе, акации или трагаканте, а также пастилки, содержащие активный ингредиент в инертном основании, таком как желатин и глицерин или сахароза и эмульсии акации, гели и т.п., содержащие кроме активного ингредиента носители, известные в данной области техники. Фармацевтические композиции могут быть инкапсулированы, например, в липосомы или лекарственные формы, которые обеспечивают медленное высвобождение активного ингредиента.
Указанные антигены по отдельности или в сочетании с другими подходящими компонентами могут быть заключены в лекарственные формы аэрозолей для введения посредством ингаляции (например, они могу быть распыляемыми). Лекарственные формы аэрозолей можно поместить в соответствующие пропелленты под давлением, например, дихлодифторметан, пропан, азот и т.п. Лекарственные формы аэрозолей можно доставлять перорально или назально.
Подходящие лекарственные формы для вагинального или ректального способа введения включают, например, суппозитории, которые состоят из полипептидов или упакованных нуклеиновых кислот с основой суппозитория. Приемлемые основы для суппозиториев включают природные или синтетические триглицериды или парафиновые углеводороды. Кроме того можно использовать желатиновые капсулы, которые состоят из сочетания полипептидов или упакованных нуклеиновых кислот с основанием, включая, например, жидкие триглицериды, полиэтиленгликоли и парафиновые углеводороды.
И. Приготовление и хранение препаратов вакцин и иммуногенных композиций
Вакцины против S. pneumoniae и иммуногенные композиции согласно настоящему описанию можно получить с использованием различных методов. Например, полипептид можно получить с использованием технологий рекомбинантных ДНК в подходящей клетке хозяина. Подходящая клетка хозяина может быть клеткой бактерии, млекопитающего, дрожжей или клеткой другого типа. Клетку хозяина можно модифицировать для экспрессии экзогенной копии одного из генов соответствующих полипептидов. Обычно ген операбельно соединен с соответствующей регуляторной последовательностью, такой как сильный промотор и последовательность полиаденилирования. Согласно некоторым вариантам реализации указанный промотор может быть индуцибельным или репрессибельным. Другие регуляторные последовательности могут способствовать секреции или выведению представляющего интерес полипептида или задержанию представляющего интерес полипептида в цитоплазме или мембране, в зависимости от того, каким образом желательно очищать полипептид. Ген может находиться на внехромосомной плазмиде или может быть встроен в геном хозяина. Специалисту в данной области будет понятно, что не является необходимым использование нуклеиновой кислоты, которая на 100% совпадает с последовательностью, встречающейся в естественных условиях. Более того допускаются и могут быть желаемыми некоторые различия между этими последовательностями. Например, нуклеиновую кислоту можно изменять, воспользовавшись вырожденностью генетического кода, таким образом, что кодируемый полипептид остается таким же. Согласно некоторым вариантам реализации в гене оптимизированы коды для улучшения экспрессии в определенном хозяине. Указанную нуклеиновую кислоту можно получить, например, методом ПЦР или химического синтеза.
После получения рекомбинантной линии клеток, из нее можно выделить полипептид. Выделение можно осуществлять, например, методами аффинной очистки или методами физического разделения (например, разделение по размеру на колонках).
Согласно некоторым аспектам настоящего описания обеспечивается способ изготовления, включающий смешивание одного или более полипептидов или их иммуногенных фрагментов или вариантов с носителем и/или адьювантом.
Согласно некоторым вариантам реализации антигены, предназначенные для включения в препараты вакцин и иммуногенные композиции согласно настоящему изобретению, можно выработать в культуре клеток. Один способ включает обеспечение одного или более векторов экспрессии и клонирование нуклеотидов, кодирующих один или более полипептидов, выбранных из полипептидов, имеющих аминокислотную последовательность из Таблицы 1 или Таблицы 2, затем экспрессию и выделение полипептидов.
Иммуногенные полипептиды согласно настоящему описанию и композиции нуклеиновых кислот, которые экспрессируют указанные полипептиды, могут быть упакованы в пакеты, дозирующие устройства и наборы для введения композиций нуклеиновых кислот млекопитающим. Например, обеспечиваются пакеты или дозирующие устройства, которые содержат одну или более единичных лекарственных форм. Обычно к упаковке прилагаются инструкции по введению соединений вместе с соответствующими указаниями на этикетке, что соединение подходит для лечения указанного заболевания, например, согласно настоящему описанию.
V. Примеры
Пример 1. Обнаружение антигена и массовые анализы на мышах
Каждую предсказанную в геноме S. pneumoniae TIGR4 открытую рамку считывания клонировали в векторе экспрессии, содержавшем метку, способную к презентации молекулами главного комплекса гистосовместимости (МНС). Затем каждую конструкцию экспрессировали в Е. coli, и проверяли полноразмерную экспрессию в результате вспомогательного анализа, в котором определяется метка МНС.Исследование описано более подробно в Международной заявке на Патент WO 2010/002993. Для облегчения поиска в большой библиотеке библиотеку объединяли таким образом, что четыре индуцированных библиотечных клона находились в каждой лунке. Для анализа Т-клеток из мышей, иммунизированных против S. pneumoniae, аликвоту объединенной библиотеки добавляли к перитонеальным макрофагам. Макрофаги связывали меченые антигены S. pneumoniae посредством МНС. После инкубации в течение 2 часов при 37°С макрофаги промывали PBS. Затем макрофаги фиксировали в 1% параформальдегиде в течение 15 мин и обильно промывали PBS. 105 Т-клеток добавляли в каждую лунку в 200 мкл среды RP-10. Т-клетки были предварительно получены от мышей, которых иммунизировали дважды убитыми бактериями S. pneumoniae с адъювантом холерным токсином. Планшеты для проведения анализа инкубировали в течение 72 часов при 37°С. Количество IL-17 в супернатанте каждой лунки определяли методом ELISA для IL-17. За нижнюю границу положительного результата принимали два стандартных отклонения выше среднего значения во всех образцах.
Пример 2. Деконволюция положительных данных анализов на мышах
Тест второго уровня проводили для определения того, какой антиген (антигены) из четырех клонов в каждой лунке вызывал положительный ответ, наблюдаемый в анализе согласно описанию в Примере 1. Всеми клонами в каждом положительном наборе по отдельности сенсибилизировали перитонеальные макрофаги в двух повторностях. Т-клетки, полученные от иммунизированных мышей того же генотипа, что и в первом анализе, использовали для анализа сенсибилизированных макрофагов с помощью проведения анализа IL-17 согласно описанию в Примере 1. Отдельные антигены, которые вызывали средний иммунный ответ в двух повторностях на уровне более чем два стандартных отклонения свыше среднего значения отрицательных контрольных образцов, считали положительными ответами. Проводили секвенирование библиотеки плазмид, представленных в указанных положительных клонах, для подтверждения подлинности антигена. Антигены SPJ574, SPJ655, SP_2106, SP_0148, SP_1473, SP_0605, SP_1177, SP_0335, SP_0906, SPJ828, SP_2157, SP_1229, SPJ128, SPJ836, SPJ865, SP_0904, SP_0882, SP_0765, SPJ634, SP_0418, SPJ923, SP_1313, SP_0775, SP_0314, SP_0912, SP_0159, SP_0910, SP_2148, SP_1412, SP_0372, SP_1304, SP_2002, SP_0612, SP_1988, SP_0484, SP_0847, SPJ527, SP_0542, SP_0441, SP_0350, SP_0014, SP_1965, SP_0117 и SP_2108 были подтверждены при использовании указанного метода.
Пример 3. Идентификация антигена и массовые анализы на людях CD4+ Т-клетки и CD 14+ моноциты выделяли из периферической крови, полученной от людей-доноров. Моноциты подвергали дифференцировке в дендритные клетки с помощью культивирования в среде, содержавшей GM-CSF и IL-4 согласно описанию в публикации Tedder TF и Jansen PJ (1997 "Isolation and generation of human dendritic cells." Current Protocols in Immunology Supp 23: 7.32.1-7.32.16). Через 5 дней культивирования дендритные клетки сеяли в 384-луночные планшеты. Культивировали Т-клетки CD4+ для получения достаточного их количества.
Каждую предсказанную в геноме S. pneumoniae TIGR4 открытую рамку считывания клонировали в векторе экспрессии, содержавшем метку, способную к презентации молекулами главного комплекса гистосовместимости (МНС). Затем каждую конструкцию экспрессировали в Е. coli, и проверяли полноразмерную экспрессию в результате вспомогательного анализа, в котором определяется метка МНС. Для облегчения поиска в большой библиотеке библиотеку объединяли таким образом, что четыре индуцированных библиотечных клона находились в каждой лунке. Для проведения анализа Т-клеток человека аликвоту библиотеки добавляли к посеянным в 384-луночные планшеты дендритным клеткам. После инкубации при 37°С в течение 2 часов дендритные клетки фиксировали в 1% параформальдегиде в течение 15 минут и обильно промывали фосфатным буфером и лизиновым буфером. В лунки 384-луночного планшета добавляли 40000 CD4+ Т-клеток в 70 мкл среды RP-10. Планшеты инкубировали при 37°С в течение 3 дней. Количество IL-17 в супернатанте каждой лунки определяли методом ELISA для IL-17. В различных повторностях анализа за нижнюю границу положительного результата принимали два стандартных отклонения свыше среднего значения во всех образцах, два стандартных отклонения свыше среднего значения в отрицательных контролях, 1,78 абсолютного отклонения среднего значения совокупности данных. Затем положительные данные подвергали деконволюции согласно описанию в Примере 4.
Пример 4. Деконволюция положительных данных анализов на людях
Для всех антигенов деконволюцию проводили посредством сравнения результатов анализов двух групп. Согласно указанному способу готовили два разных набора групп, таким образом, что полипептид объединяли с тремя полипептидами, различными между первой и второй группами. Затем можно было определить, какие полипептиды являются антигенами посредством определения того, какие полипептиды попадают в положительные группы в первом и втором наборе. Согласно данному методу деконволюции группу считали положительной, если она составляла по меньшей мере 1,78 абсолютного отклонения среднего значения совокупности данных.
Антиген определяли как положительный, если он оказывался положительным по результатам по меньшей мере двух повторных тестов второго уровня. SP2108, SP0641, SP1393, SP0024, SP0641.1, SP1072, SP1384 и SP2032 с использование данного подхода.
Пример 5
Полипептиды SP2108, SP0148 и SP1634
Полипептид SP2108 (SEQ ID NO:9), SP0148 (SEQ ID NO:7) и SP1634 (см. Таблицу 2) соединили в композиции вакцины с использованием 4 мкг каждого полипептида в сочетании с 1 мкг холерного токсина. Для комбинаций использовали по 4 мкг каждого полипептида. Композиции вводили интерназально мышам C57BL/6 трижды с интервалом в 1 неделю. Затем оставляли мышей в покое на 3 недели и забирали у них кровь для анализа иммуногенности. Для этого анализа цельную кровь с гепарином забирали из ретроорбитального синуса. Мононуклеарные клетки периферической крови стимулировали убитыми целыми клетками (WCC) или комбинацией из трех полипептидов в круглодонных пробирках в течение трех дней. Затем получали супернатанты и методом ELISA определяли уровень IL-17. В качестве отрицательных контролей использовали холерный токсин по-отдельности (СТ) или неродственный антиген HSV (003). Результаты представлены на Фигуре 1 и 2. Мышей оставляли в покое еще на 2 недели, спустя которые их инфицировали посредством интерназального введения S. pneumoniae. Мышей забивали через неделю и определяли количество колониеобразующих единиц (КОЕ) из смывов из носа. Результаты представлены на Фигуре 3.
Пример 6
Полипептиды SP0882 и SP0314
В настоящем примере использовали протокол, аналогичный протоколу согласно Примеру 5, за исключением того, что вводили только две дозы композиции вакцины. В настоящих экспериментах полипептид SP0882 (SEQ ID NO:2) и полипептид SP0314 (см. Таблица 2) использовали совместно с тремя полипептидами, исследованными в Примере 5. Результаты анализа на иммуногенность представлены на Фигуре 4 и 5. Результаты анализа на колонизацию представлены на Фигуре 6.
Пример 7
Полипептиды SP1072, SP0641N и SP0024
В настоящем примере использовали протокол, аналогичный протоколу согласно Примеру 5, за исключением того, что вводили две дозы композиции вакцины с интервалом в 1 неделю. Через 4 недели после последней иммунизации мышей инфицировали интраназально живыми S. pneumoniae типа 6 В. Через неделю бактериальную нагрузку определяли у каждой мыши посредством посева смыва из носа на селективную среду и подсчета КОЕ. КОЕ, полученные из каждой мыши, наносили на график для каждой группы иммунизированных животных. Результаты представлены на Фигуре 7. Статистически значимые результаты показаны на Фигуре (*=р-значение<0.05).
Пример 8
Полипептиды SP0148, SP0314, SP0882 и SP2108, исследованные на мышах BALB/c
Для определения того, вызываются ли похожие иммунные ответы у мышей различных генотипов, несколько полипептидов вводили мышам BALB/c. С использованием протокола, похожего на протокол согласно Примеру 5 мышей иммунизировали, инфицировали S. pneumoniae и записывали количество КОЕ. Результаты данного эксперимента представлены на Фигуре 8.









| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНЫ ПРОТИВ ВИРУСА ПРОСТОГО ГЕРПЕСА 2 ТИПА: КОМПОЗИЦИИ И СПОСОБЫ ЗАПУСКА ИММУННОГО ОТВЕТА | 2010 |
|
RU2585961C9 |
| ВАКЦИНЫ И КОМПОЗИЦИИ ПРОТИВ STREPTOCOCCUS PNEUMONIAE | 2012 |
|
RU2623174C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИММУНИЗАЦИИ ПРОТИВ STREPTOCOCCUS PNEUMONIAE | 2011 |
|
RU2589256C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГРИБКОВЫХ И БАКТЕРИАЛЬНЫХ ПАТОГЕНОВ | 2014 |
|
RU2717306C2 |
| УКОРОЧЕННАЯ СЕКРЕТИРУЕМАЯ АСПАРТИЛ-ПРОТЕИНАЗА 2 | 2008 |
|
RU2493255C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ | 2018 |
|
RU2791256C2 |
| ПОЛИВАЛЕНТНЫЕ ПНЕВМОКОККОВЫЕ ВАКЦИНЫ | 2019 |
|
RU2815390C2 |
| МУТАНТНЫЕ АНТИГЕНЫ GAS57 И АНТИТЕЛА ПРОТИВ GAS57 | 2008 |
|
RU2471497C2 |
| МЕНИНГОКОККОВЫЕ ПОЛИПЕПТИДЫ fHBP | 2009 |
|
RU2475496C2 |
| ХИМЕРНЫЕ ГЕНЫ OSPA, БЕЛКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2583289C2 |




















































































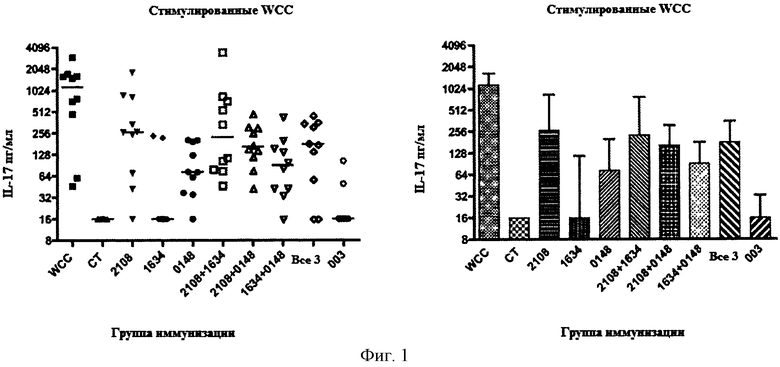
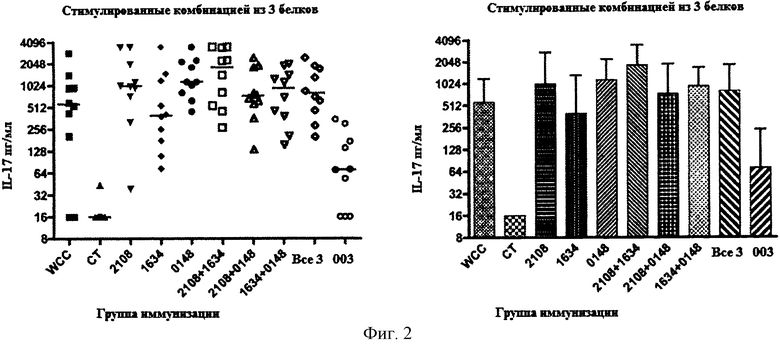
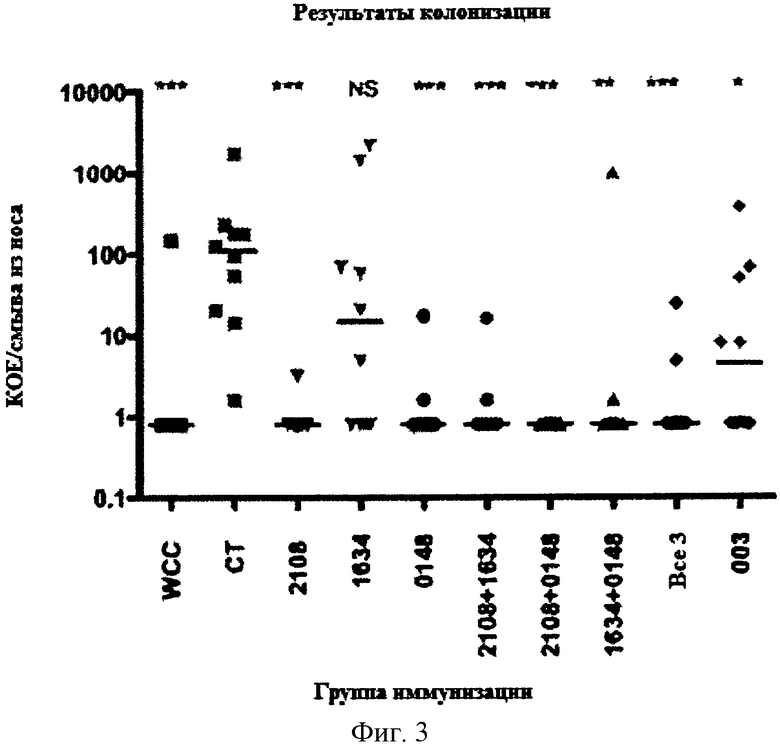
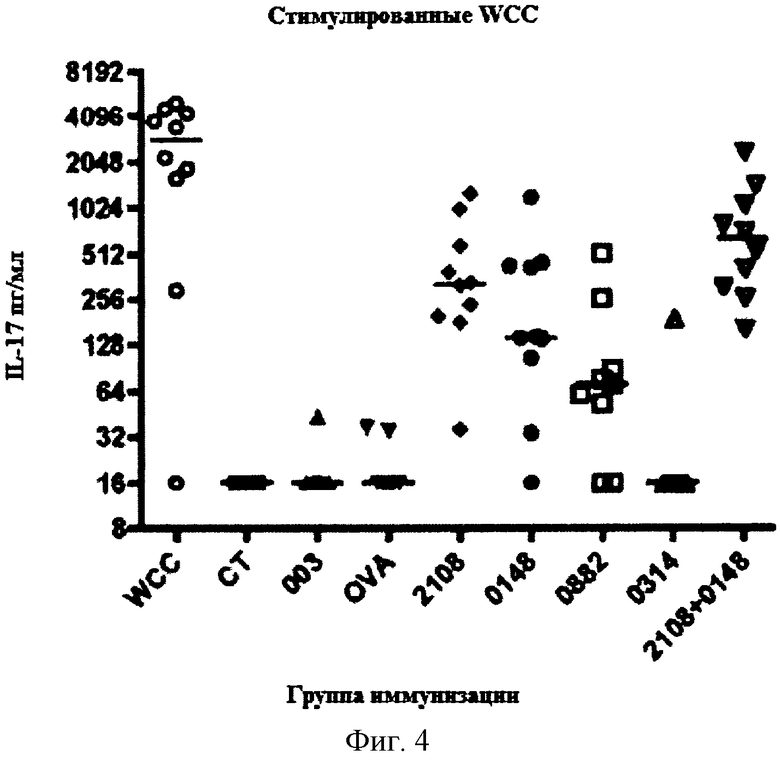
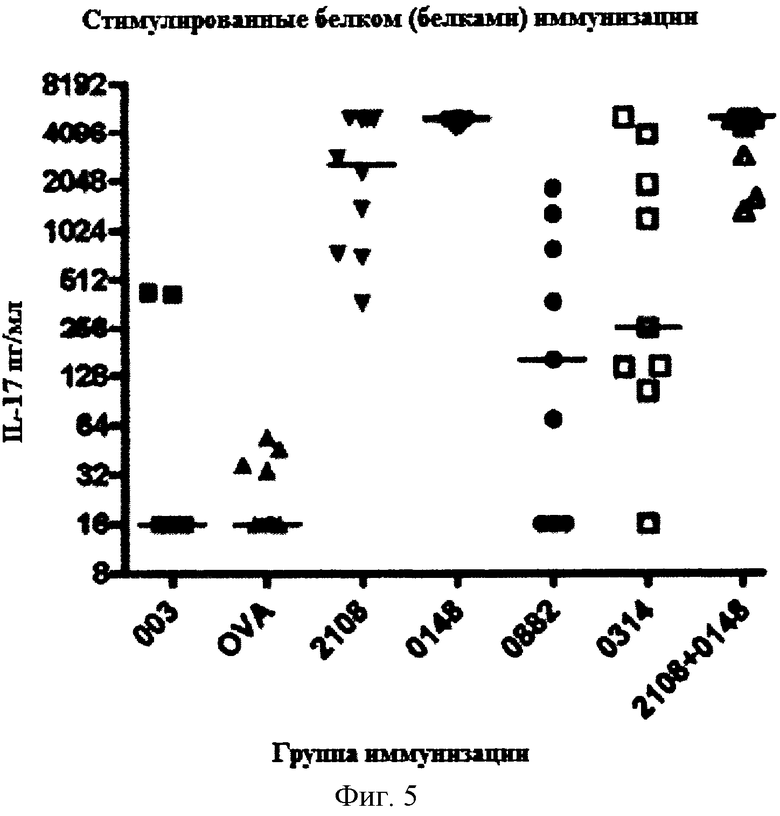
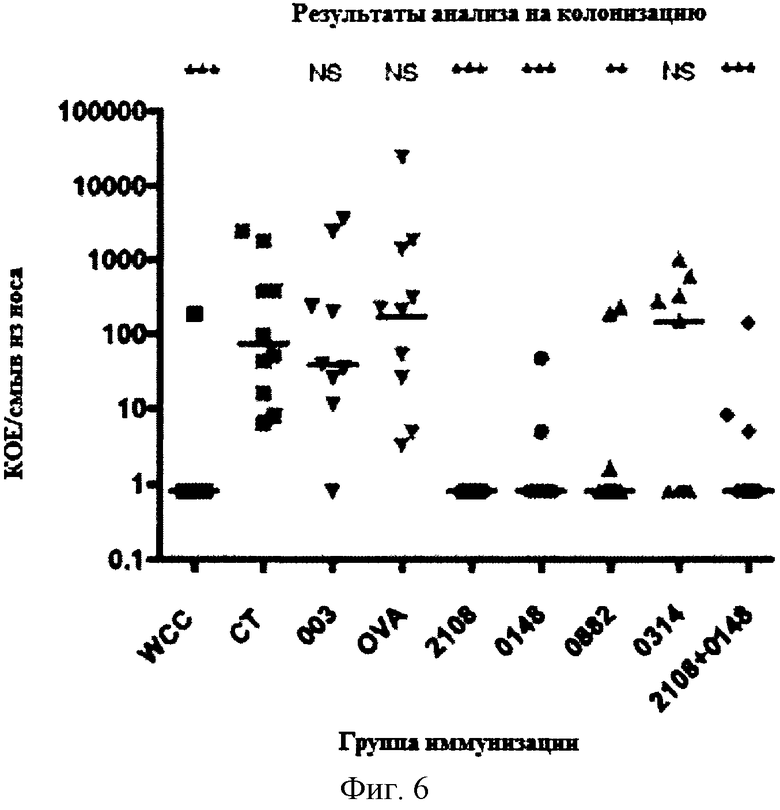
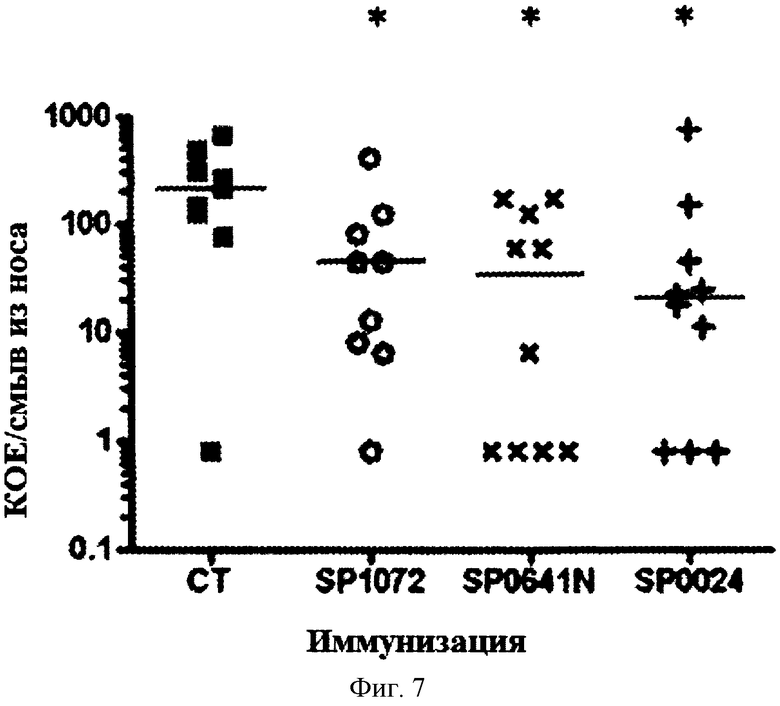
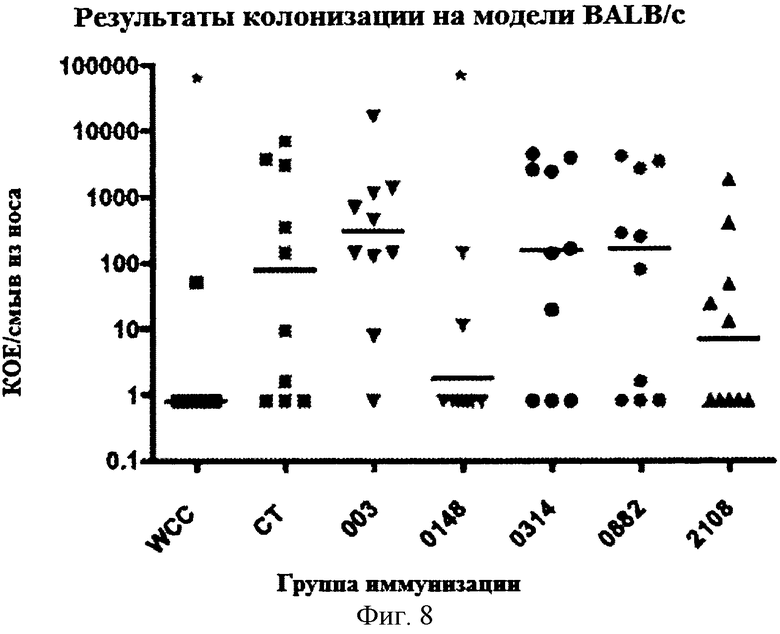
Группа изобретений относится к медицине, а именно иммунологии, и может быть использовано для получения вакцины против Streptococcus pneumoniae. Препарат вакцины против Streptococcus pneumoniae содержит фармацевтически приемлемый носитель, первый полипептид, имеющий по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 9 или SEQ ID NO: 21, или иммуногенным фрагментом указанной последовательности, и второй полипептид, имеющий по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 10 или SEQ ID NO: 20 или иммуногенным фрагментом указанной последовательности. Группа изобретений относится также к вариантам заявленного препарата вакцины и его применению. Настоящее изобретение позволяет создать препарат вакцины против Streptococcus pneumoniae на основе комбинации первого полипептида на основе SEQ ID NO: 9 или SEQ ID NO: 21 и второго полипептида на основе SEQ ID NO: 10 или SEQ ID NO: 20, причем введение в препарат вакцины второго (и последующего) полипептида S. Pneumoniae, гомологичного первому (SEQ ID NO: 9), не оказывает отрицательного эффекта на активность первого компонента на основе SEQ ID NO: 9. 5 н. и 55 з.п. ф-лы, 8 ил., 2 табл., 8 пр.
1. Препарат вакцины против S. Pneumoniae, содержащий фармацевтически приемлемый носитель, первый полипептид, имеющий по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 9 или SEQ ID NO: 21, или иммуногенным фрагментом указанной последовательности, и второй полипептид, имеющий по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 10 или SEQ ID NO: 20 или иммуногенным фрагментом указанной последовательности.
2. Препарат вакцины по п. 1, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 13, 14, 15, 16, 17, 18 или 19 или иммуногенный фрагмент указанной последовательности.
3. Препарат вакцины по п. 1, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 6.
4. Препарат вакцины по п. 1, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 7.
5. Препарат вакцины по п. 1, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 12.
6. Препарат вакцины по п. 1, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 13.
7. Препарат вакцины по п. 1, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 2, 22 или 23 или иммуногенный фрагмент указанной последовательности.
8. Препарат вакцины по п. 1, отличающийся тем, что первый полипептид содержит аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 21, а второй полипептид содержит аминокислотную последовательность SEQ ID NO: 10 или SEQ ID NO: 20.
9. Препарат вакцины по п. 8, отличающийся тем, что указанный препарат вакцины дополнительно содержит третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 13, 14, 15, 16, 17, 18 или 19 или иммуногенный фрагмент указанной последовательности.
10. Препарат вакцины по п. 8, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 6.
11. Препарат вакцины по п. 8, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 7.
12. Препарат вакцины по п. 8, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 12.
13. Препарат вакцины по п. 8, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 13.
14. Препарат вакцины по п. 8, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 2, 22 или 23 или иммуногенный фрагмент указанной последовательности.
15. Препарат вакцины против S. Pneumoniae, содержащий фармацевтически приемлемый носитель; первый полипептид, который содержит SEQ ID NO: 9, в которой отсутствуют от 1 до 20 аминокислот на N-конце, С-конце или обоих концах, или содержит SEQ ID NO: 21, в которой отсутствуют от 1 до 20 аминокислот на N-конце, С-конце или обоих концах; и второй полипептид, который содержит SEQ ID NO: 10, в которой отсутствуют от 1 до 20 аминокислот на N-конце, С-конце или обоих концах, или содержит SEQ ID NO: 20, в которой отсутствуют от 1 до 20 аминокислот на N-конце, С-конце или обоих концах.
16. Препарат вакцины по п. 15, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 13, 14, 15, 16, 17, 18 или 19 или иммуногенный фрагмент указанной последовательности.
17. Препарат вакцины по п. 15, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 6.
18. Препарат вакцины по п. 15, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 7.
19. Препарат вакцины по п. 15, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 12.
20. Препарат вакцины по п. 15, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 13.
21. Препарат вакцины по п. 15, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 2, 22 или 23 или иммуногенный фрагмент указанной последовательности.
22. Препарат вакцины по п. 1, отличающийся тем, что указанный препарат вакцины содержит первый полипептид, содержащий аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 21 или иммуногенный фрагмент указанной последовательности, и второй полипептид, содержащий аминокислотную последовательность SEQ ID NO: 10 или SEQ ID NO: 20 или иммуногенный фрагмент указанной последовательности.
23. Препарат вакцины по п. 22, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 13, 14, 15, 16, 17, 18 или 19 или иммуногенный фрагмент указанной последовательности.
24. Препарат вакцины по п. 22, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 6.
25. Препарат вакцины по п. 22, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 7.
26. Препарат вакцины по п. 22, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 12.
27. Препарат вакцины по п. 22, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 13.
28. Препарат вакцины по п. 22, дополнительно содержащий третий полипептид, содержащий аминокислотную последовательность SEQ ID NO: 2, 22 или 23 или иммуногенный фрагмент указанной последовательности.
29. Препарат вакцины по любому из пп. 1-28, который не содержит других полипептидов S. pneumoniae, кроме полипептидов, которые имеют аминокислотную последовательность, содержащую любую из SEQ ID NO: 1-13, 20 и 21.
30. Препарат вакцины по любому из пп. 1-28, отличающийся тем, что один или более из указанных полипептидов конъюгирован с иммуногенным носителем.
31. Препарат вакцины по любому из пп. 1-28, который содержит по меньшей мере один липидированный полипептид.
32. Препарат вакцины по любому из пп. 1-28, дополнительно содержащий адъювант.
33. Препарат вакцины по п. 32, отличающийся тем, что указанный адъювант является агонистом Toll-подобного рецептора (TLR).
34. Препарат вакцины по п. 32, отличающийся тем, что указанный адъювант представляет собой квасцы.
35. Препарат вакцины по п. 32, отличающийся тем, что указанный препарат вакцины содержит 1-1000 мкг указанного полипептида и 1-250 мкг указанного адъюванта.
36. Препарат вакцины по любому из пп. 1-28, который вызывает увеличение ответа ТН17 клеток в 1,5 раза после осуществления контакта с ТН17 клетками.
37. Препарат вакцины по любому из пп. 1-28, отличающийся тем, что указанный препарат вакцины подавляет инфекцию S. pneumoniae у неинфицированного пациента.
38. Препарат вакцины по любому из пп. 1-28, отличающийся тем, что указанный препарат вакцины подавляет колонизацию S. pneumoniae у пациента.
39. Препарат вакцины по любому из пп. 1-28, отличающийся тем, что указанный препарат вакцины подавляет симптомы инфекции S. pneumoniae.
40. Применение препарата вакцины по любому из пп. 1-39 для лечения пациента, страдающего от инфекции S. pneumoniae или чувствительного к ней, при этом лечение включает введение эффективного количества указанного препарата вакцины указанному пациенту.
41. Применение по п. 40, отличающееся тем, что лечение подавляет инфекцию S. pneumoniae у неинфицированного пациента.
42. Применение по п. 40, отличающееся тем, что лечение подавляет колонизацию S. pneumoniae у пациента.
43. Применение по п. 40, отличающееся тем, что лечение подавляет симптомы инфекции S. pneumoniae.
44. Применение по п. 40, отличающееся тем, что лечение включает введение указанному пациенту одной дозы.
45. Применение по любому из пп. 41-43, отличающееся тем, что лечение включает введение указанному пациенту одной дозы.
46. Применение по п. 40, отличающееся тем, что лечение включает введение указанному пациенту трех доз.
47. Применение по любому из пп. 41-43, отличающееся тем, что лечение включает введение указанному пациенту трех доз.
48. Применение по п. 40, отличающееся тем, что указанный пациент представляет собой человека.
49. Применение по любому из пп. 41-43, отличающееся тем, что указанный пациент представляет собой человека.
50. Иммуногенная композиция против S. Pneumoniae, содержащая фармацевтически приемлемый носитель, первый полипептид, содержащий аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 21 или иммуногенный фрагмент указанной последовательности, второй полипептид, содержащий аминокислотную последовательность SEQ ID NO: 10 или SEQ ID NO: 20 или иммуногенный фрагмент указанной последовательности, и один или более дополнительных полипептидов, выбранных из группы, состоящей из SP1574, SP1655, SP2106, SP1473, SP0605, SP1177, SP0335, SP0906, SP1828, SP2157, SP1229, SP1128, SP1836, SP1865, SP0904, SP0765, SP1634, SP0418, SP1923, SP1313, SP0775, SP0314, SP0912, SP0159, SP0910, SP2148, SP1412, SP0372, SP1304, SP2002, SP0612, SP1988, SP0484, SP0847, SP1527, SP0542, SP0441, SP0350, SP0014, SP1965, SP0117, SP0981, SP2229, SP2136, SP1179, SP1174, SP2216, SP1393, SP0641.1, SP1384, SP2032, и полипептида, содержащего аминокислотную последовательность SEQ ID NO: 1-8, 11-19, 22 или 23 или иммуногенный фрагмент указанной последовательности.
51. Применение препарата вакцины по любому из пп. 1-39 для получения лекарственного средства для лечения пациента, страдающего от инфекции S. pneumoniae или чувствительного к ней.
52. Применение по п. 51, отличающееся тем, что указанное лекарственное средство подавляет инфекцию S. pneumoniae у неинфицированного пациента.
53. Применение по п. 51, отличающееся тем, что указанное лекарственное средство подавляет колонизацию S. pneumoniae у пациента.
54. Применение по п. 51, отличающееся тем, что указанное лекарственное средство подавляет симптомы инфекции S. pneumoniae.
55. Применение по п. 51, отличающееся тем, что лечение пациента осуществляют посредством введения одной дозы указанного лекарственного средства.
56. Применение по любому из пп. 52-54, отличающееся тем, что лекарственное средство подавляет инфекцию S. pneumoniae, подавляет колонизацию S. pneumoniae и/или подавляет симптомы инфекции S. pneumoniae посредством введения одной дозы.
57. Применение по п. 51, отличающееся тем, что лечение пациента осуществляют посредством введения трех доз указанного лекарственного средства.
58. Применение по любому из пп. 52-54, отличающееся тем, что лекарственное средство подавляет инфекцию S. pneumoniae, подавляет колонизацию S. pneumoniae и/или подавляет симптомы инфекции S. pneumoniae посредством введения трех доз.
59. Применение по п. 51, отличающееся тем, что указанный пациент представляет собой человека.
60. Применение по любому из пп. 52-54, отличающееся тем, что указанный пациент представляет собой человека.
| WO 2004092209 А2, 28.10.2004 | |||
| US 2008175854 A1, 24.07.2008 | |||
| WO 2006084467 A1, 17.08.2006. |
Авторы
Даты
2016-04-10—Публикация
2010-06-29—Подача