Изобретение относится к области биотехнологии, а именно к генно-инженерным препаратам медицинского назначения и технологии их получения, точнее к технологии получения рецепторного антагониста интерлейкина-36.
Альфа-, бета- и гамма-нтерлейкины-36 (IL-36α, IL-36β, IL-36γ), а также рецепторный антагонист нтерлейкинов-36 (IL-36Ra) представляют собой отдельную группу в семействе интерлейкина-1 [Gresnigt MS, van de Veerdonk FL. Biology of IL-36 cytokines and their role in disease. Semin Immunol. 2013 25(6):458-65; Van de Veerdonk FL., Netea MG. New Insights in the Immunobiology of IL-1 Family Members. Front Immunol. 2013 Jul 8; 4:167].
IL-36(α,β,γ) играют важную роль в активации воспалительного процесса в коже и в легких. В частности, ряд экспериментальных данных свидетельствует о возможном участии IL-36 в развитии псориаза и воспалительных заболеваний дыхательных путей и суставов [Ramadas RA, Ewart SL, Iwakura Y, Medoff BD, LeVine AM. IL-36α exerts pro-inflammatory effects in the lungs of mice. PLoS One. 2012; 7(9): e45784; Vigne S, Palmer G, Lamacchia C, Martin P, Talabot-Ayer D, Rodriguez E, Ronchi F, Sallusto F, Dinh H, Sims JE, Gabay C. IL-36R ligands are potent regulators of dendritic and T cells. Blood. 2011 Nov 24; 118(22):5813-23; Foster AM, Baliwag J, Chen CS, Guzman AM, Stoll SW, Gudjonsson JE, Ward NL, Johnston A. IL-36 Promotes Myeloid Cell Infiltration, Activation, and Inflammatory Activity in Skin. J. Immunol. 2014 Jun 15; 192(12):6053-6061; Tortola L1, Rosenwald E, Abel B, Blumberg H,  M, Coyle AJ, Renauld JC, Werner S, Kisielow J, Kopf M. Psoriasiform dermatitis is driven by IL-36-mediated DC-keratinocyte crosstalk. J Clin Invest. 2012 Nov 1; 122(11):3965-76]. В связи с вышеизложенным, рецепторный антагонист, IL-36Ra, является перспективным кандидатом для создания лекарственного средства против ряда хронических воспалительных заболеваний, в частности псориаза.
M, Coyle AJ, Renauld JC, Werner S, Kisielow J, Kopf M. Psoriasiform dermatitis is driven by IL-36-mediated DC-keratinocyte crosstalk. J Clin Invest. 2012 Nov 1; 122(11):3965-76]. В связи с вышеизложенным, рецепторный антагонист, IL-36Ra, является перспективным кандидатом для создания лекарственного средства против ряда хронических воспалительных заболеваний, в частности псориаза.
IL-36α, IL-36β, IL-36γ связываются с клеточным рецептором IL-1Rrp2 и используют корецептор IL-1RAcP, запуская систему сигналинга, похожую на сигналинг, индуцируемый IL-1, а рецепторный антагонист IL-36Ra ингибирует их активность. Кроме того, IL-36Ra способен активировать противовоспалительный каскад, взаимодействуя с рецептором SIGIRR [Van de Veerdonk FL., Netea MG. New Insights in the Immunobiology of IL-1 Family Members. Front Immunol. 2013 Jul 8; 4:167].
В научной и патентной литературе IL36-Ra известен также под другими наименованиями:
FIL1 delta, IL-1-related protein 3 (IL-1RP3), Interleukin-1 HY1 (IL-1HY1), Interleukin-1 delta (IL-1 delta), Interleukin-1 family member 5 (IL-1F5), Interleukin-1 receptor antagonist homolog 1 (IL-1ra homolog 1), Interleukin-1-like protein 1 (IL-1L1).
Все интерлейкины группы IL-36 синтезируются в основном в эпителиальных тканях и в коже, не имеют сигнальных пептидов и поэтому не могут секретироваться по обычному секреционному пути [Vigne S, Palmer G, Lamacchia С, Martin P, Talabot-Ayer D, Rodriguez E, Ronchi F, Sallusto F, Dinh H, Sims JE, Gabay C. IL-36R ligands are potent regulators of dendritic and T cells. Blood. 2011 Nov 24; 118(22):5813-23].
Наиболее близким к настоящему изобретению является группа изобретений по международной заявке WO 2008033333, в которой раскрывается, что биологическая активность IL-36Ra, измеренная по экспрессии люциферазы клетками Jurkat Е6.1, транзитарно экспрессирующими рецептор IL-1Rrp2 и люциферазу под контролем репортерного промотора, значительно возрастает после удаления N-концевого метионина. Однако полученные результаты оказались недостаточно корректны, в связи с тем, что результаты определения активности с использованием данной искусственной модели существенно отличаются от результатов, полученных с использованием природных, то есть нетрансфецированных клеток. В частности, измерения, выполненные на модели фибробластов человека и приведенные в примере 3 настоящего изобретения, показывают, что удаление N-концевого метионина практически не влияет на биологическую активность IL-36Ra в данной модели, более приближенной к природным условиям по сравнению с моделью, использованной в WO 2008033333.
В заявке WO 2008033333 вектор для экспрессии IL-36Ra содержит кДНК человека, кодирующую IL-36Ra, лишенный N-концевого метионина (Seq ID No 69 кодирует IL-36Ra с N-концевым валином и Seq ID No 70 кодирует его искусственный вариант, в котором данный валин заменен на метионин, кроме того, Seq ID No 70 кодирует также полигистидиновый таг на С-конце IL-36Ra). Однако обе последовательности были получены амплификацией кДНК из клеток человека и не являются оптимальными для экспрессии IL-36Ra в клетках Escherichia coli, поскольку частота использования кодонов в геноме E.coli существенно отличается от частоты использования кодонов в клетках человека.
Техническая задача, решаемая авторами - разработка технологии получения рекомбинантного биологически активного IL-36Ra человека с высокой производительностью.
Технический результат достигался созданием последовательности ДНК (Seq ID No 1), кодирующей полноразмерный IL-36Ra; последовательности ДНК (Seq ID No 2), кодирующей полноразмерный IL-36Ra-His с С-концевым полигистидиновым тагом; плазмидных экспрессионного вектора рЕТ-IL36Raf и pET-IL36Raf-His, а также штаммов бактерий Escherichia coli BL21Star[DE3](pET-IL36Raf), содержащего вектор pET-IL36Raf - продуцента полноразмерного IL-36Ra человека и BL21 Star[DE3](pET-IL36Raf-His), содержащего вектор pET-IL36Raf-His - продуцента полноразмерного IL-36Ra человека с С-концевым полигистидиновым тагом.
Последовательность искусственного гена, кодирующего IL36Ra человека, была составлена с учетом частоты использования кодонов в геноме Escherichia coli (Seq ID No 1). По концам к гену были добавлены олигонуклеотиды, формирующие сайты рестрикции NdeI и XhoI. Ген был получен путем химического синтеза, обработан вышеуказанными рестриктазами и клонирован в подготовленный аналогичным образом вектор pET22b+ с получением экспрессионной плазмиды pET-IL36Raf.
Вариантом указанной последовательности является последовательность ДНК, кодирующая полноразмерный IL-36Ra слитый с С-концевым полигистидиновым тагом LEHHHHHH (Seq ID No 2). Наличие такой последовательности значительно упрощает очистку рекомбинантного белка посредством металлохелатной хроматографии.
Структуры полученных объектов показаны в приложении.
Список полученных последовательностей:
Seq ID No 1 - Последовательность ДНК, кодирующая полноразмерный IL-36Ra, оптимизированная для синтеза белка в клетках Escherichia coli Seq ID No 2 - Последовательность ДНК, кодирующая полноразмерный IL-36Ra и оптимизированная для синтеза белка в клетках Escherichia coli и содержащая С-концевой полигистидиновый таг.
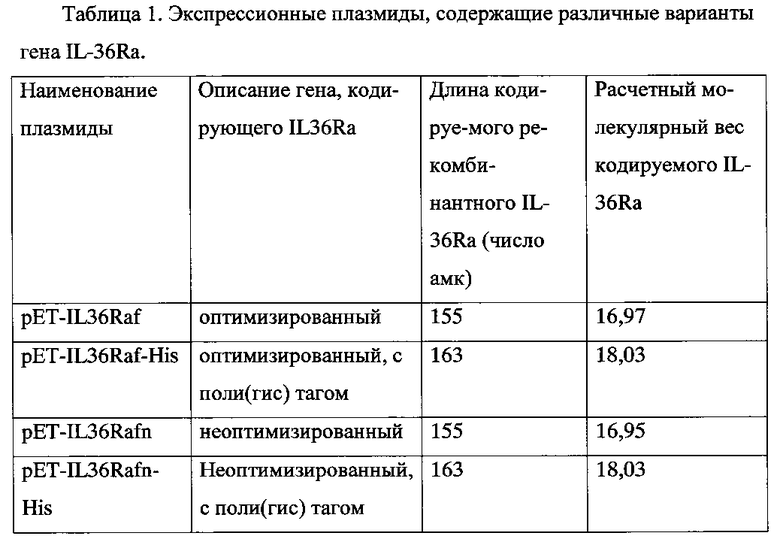
Плазмидный экспрессионный вектор pET-IL36Raf содержит ген Lac-репрессора, промотор Lac-оперона, промотор Т7, ген IL-36Raf, терминатор транскрипции Т7, ген бета-лактамазы, репликатор плазмиды pBR322, сайты рестрикции, ограничивающие ген IL-36Raf. Карта плазмиды приведена на фиг 1.
Плазмидный экспрессионный вектор pET-IL36Raf-His содержит ген Lac-репрессора, промотор Lac-оперона, промотор Т7, ген IL-36Raf, терминатор транскрипции Т7, ген бета-лактамазы, репликатор плазмиды pBR322, сайты рестрикции, ограничивающие ген IL-36Raf-His. Карта плазмиды приведена на фиг 2.
Полученный штамм бактерий Escherichia coli BL21Star[DE3](pET-IL36f) - продуцент IL-36Ra, трансформированный экспрессионной плазмидой, содержащей последовательность ДНК, кодирующую IL-36Ra, состав кодонов которой оптимизирован для экспрессии IL-36Ra в клетках Escherichia coli (Seq ID No 1).
Штаммы Escherichia coli BL21Star[DE3](pET-IL36f) и Escherichia coli BL21Star[DE3](pET-IL36f-His) характеризуются следующими культурально-морфологическими и физико-биохимическими свойствами:
Культурально-морфологические особенности штаммов:
Грамотрицательные прямые палочки, размером 1,1-1,5×2,0-3,0 мкм, одиночные, спор и капсул не образуют. Каталазоположительные. Оксидазо-отрицательные. Факультативные анаэробы. Клетки хорошо растут на простых питательных средах, содержащих и не содержащих ампициллин, например, на среде LB. На агаризованной среде - колонии гладкие, круглые, слабо выпуклые, с ровным краем. В жидких средах образуют равномерную свето-рассеивающую суспензию, при хранении без перемешивания оседают на дно. Клетки растут в интервале температур от 8°C до 43°C, интервал для культивирования - 28-38°C, оптимум роста при 37°C. Интервал pH 5-7. Катализируют D-глюкозу и некоторые другие углеводы с образованием кислоты и газа, не сбраживают галактозу. Реакция Фогес-Проскауэра отрицательная, не образуют H2S, гидролизуют мочевину.
Характеристики полезного вещества, синтезируемого штаммами: Рекомбинантный белок - антагонист рецептора интерлейкинов-36 человека и рекомбинантный белок - антагонист рецептора интерлейкинов-36 человека с С-концевым полигистидиновым тагом соответственно.
Активность штамма:
Продуктивность штаммов - рекомбинантный IL-36Ra составляет не менее 17% массы белков клеточного лизата при культивировании в условиях индукции, а рекомбинантный IL-36Ra-His составляет не менее 13% массы белков клеточного лизата при культивировании в условиях индукции.
Криоконсервация. В запаянных ампулах штаммы, лиофильно-высушенные в среде, содержащей 1% сахарозы и 1% маннитола, хранятся при комнатной температуре в течении 20 лет.
Культивирование штаммов: Культивирование при температуре 28-38°C в термостате или качалке, в агаризованной (2% агара) или жидкой LB-среде, соответственно. Селективные условия - добавление 100 мкг/мл ампициллина.
Ферментация: Ферментацию ведут в жидкой среде PYP-5052, содержащей 0,2% лактозы [Studier FW. Protein production by auto-induction in high density shaking cultures. Prot. Expr. Purif. 2005; 41910:207-234], с добавлением 100 мкг/мл ампициллина, при перемешивании и аэрировании, при температуре 28-38°C в течение 18 часов.
Перечень чертежей и рисунков
На фиг. 1 приведена карта плазмиды pET-IL36Raf. Используются следующие обозначения:
NdeI и XhoI - сайты рестрикции, ограничивающие ген IL-36Raf
На фиг. 2 приведена карта плазмиды pET-IL36Raf-His. Используются следующие обозначения:
NdeI и XhoI - сайты рестрикции, ограничивающие ген IL-36Raf-His.
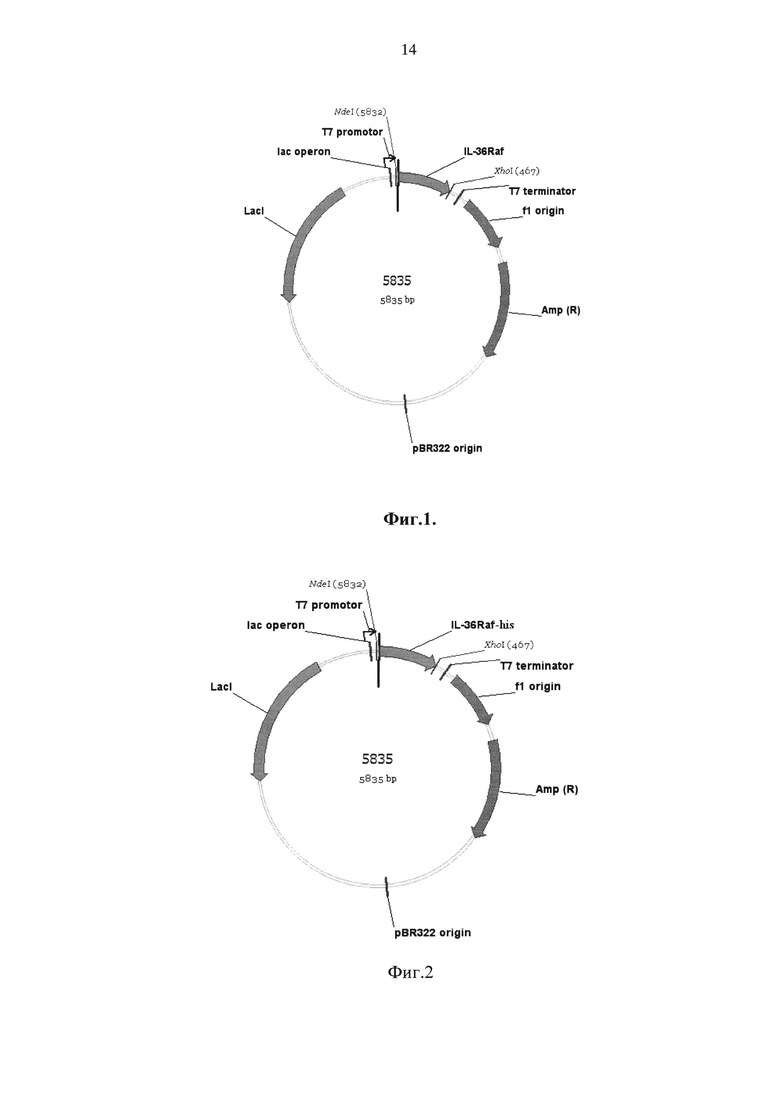
На фиг. 3. показана индукция синтеза рекомбинантных IL-36Ra штаммами
Escherichia coli, где цифрами обозначены следующие дорожки:
1 - маркеры молекулярной массы
2 - Escherichia coli BL21Star[DE3] - отрицательный контроль
3 - Escherichia coli BL21Star[DE3](pET-IL36Rafn-His), IPTG 0.2 mM, 3 часа
4 - Escherichia coli BL21Star[DE3](pET-IL36Rafn-His), IPTG 0.2 mM, 5 часов
5 - Escherichia coli BL21 Star[DE3](pET-IL36Raf-His), IPTG 0.2 mM, 3 часа
6 - Escherichia coli BL21Star[DE3](pET-IL36Raf), IPTG 0.2 mM, 3 часа.
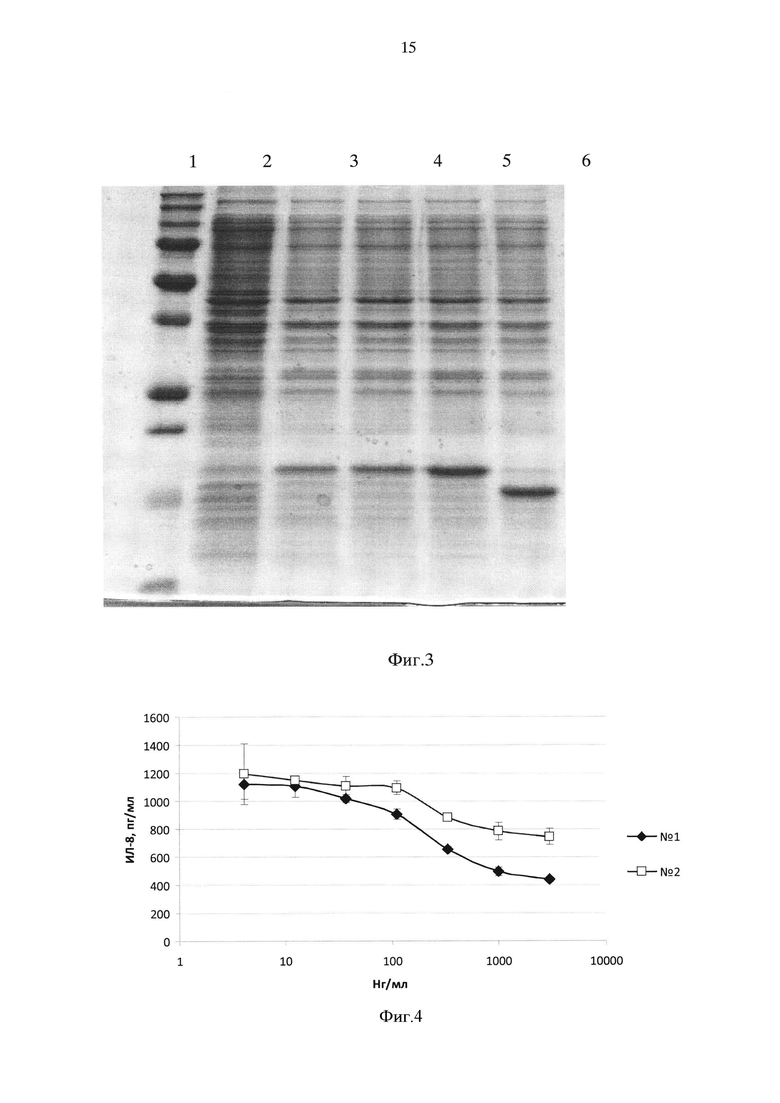
На фиг. 4 продемонстрировано подавление продукции ИЛ-8 фибробластами кожи человека, стимулированными ИЛ-36γ различными вариантами рекомбинантного IL-3Ra-His
№1 - Полноразмерный IL-36Ra-His
№2 - Укороченный IL-36Ra-His.
Изобретение поясняется следующими примерами:
Пример 1. Создание генетических конструкций, обеспечивающих синтез рекомбинантного IL36Ra в клетках Е.coli
Последовательность искусственного гена, кодирующего IL36Ra человека, была составлена с учетом частоты использования кодонов в геноме Escherichia coli (Seq ID No 1). По концам к гену были добавлены олигонуклеотиды, формирующие сайты рестрикции NdeI и XhoI. Ген был получен путем химического синтеза, обработан вышеуказанными рестриктазами и клонирован в подготовленный аналогичным образом вектор pET22b+ с получением экспрессионной плазмиды pET-IL36Raf. Кольцевая карта плазмиды pET-IL36 представлена на фиг. 1.
Также был получен оптимизированный ген IL36Ra, отличающийся от Seq ID No 1 наличием с 3′-конца последовательности, кодирующей С-концевой полигистидиновый таг LEHHHHHH (Seq ID No 2).
Дополнительно методом обратной транскрипции мРНК мононуклеарных клеток периферической крови человека со специфическими праймерами была получена последовательность кДНК IL-36Ra человека, которую методом ПЦР удлинили с 3′-конца добавлением последовательности, кодирующей полигистидиновый таг. К данным последовательностям генов также добавили с 5′- и 3′-концов нуклеотиды, формирующие вышеуказанные сайты рестрикции. Полученные последовательности были вставлены в вектор pET22b+ по сайтам рестрикции NdeI и XhoI с получением экспрессионных плазмид pET-IL36Raf-His, pET-IL36Rafn и pET-IL36Rafn-His, соответственно (Табл. 1).
Пример 2. Получение штаммов-продуцентов IL36Ra
Полученными плазмидами pET-IL36Raf, pET-IL36Raf-His, pET-IL36Rafn и pET-IL36Rafn-His были трансформированы клетки Escherichia coli штамма BL21Star[DE3], содержащие в своем геноме ген, кодирующий полимеразу фага Т7 под контролем бактериального промотора, индуцируемого лактозой. Кроме того, они не содержат протеазу lon и несут мутацию в гене, кодирующем протеазу OmpT. Отсутствие этих двух протеаз уменьшает деградацию гетерологичных белков. Данный штамм содержит также мутацию в гене rne, кодирующем рибонуклеазу Е, что приводит к увеличению стабильности мРНК в клетке, и, как следствие, к повышению продукции клетками данного штамма рекомбинантного белка.
В результате был получены штаммы Escherichia coli BL21Star[DE3](pET-IL36Raf) и Escherichia coli BL21Star[DE3](pET-IL36Raf-His) - продуценты полноразмерного IL36Ra и IL36Ra, содержащего С-концевой полигистидиновый таг, в которых использована оптимизированная по составу кодонов последовательность ДНК, а также штаммы Escherichia coli BL21Star[DE3](pET-IL36Rafn) и BL21 Star[DE3](pET-IL36Rafn-His), в которых содержится неоптимизированная кДНК IL-36Ra человека.
Для поддержания полученных штаммов-продуцентов использовали плотную агаризованную LB-среду, содержащую 100 мкг/мл ампициллина и 1% глюкозы.
Продуктивность штаммов Escherichia coli BL21Star[DE3](pET-IL36Raf) и Escherichia coli BL21Star[DE3](pET-IL36Raf-His) в сравнении со штаммом Escherichia coli BL21Star[DE3](pET-IL36Rafn-His) изучали путем культивирования клеток в среде LB, в термостатированной качалке роторного типа при температуре 37°C, скорости вращения платформы 250 об/мин в течение 18 часов. После достижения клетками плотности, соответствующей А600=0,2 добавляли индуктор - изопропилтиогалактопираннозид (ИПТГ) до конечной концентрации 0,2 мМ. После 3 и 5 часов культивирования в присутствии индуктора клетки осаждали центрифугированием, лизировали и белки клеточных лизатов разделяли электрофорезом в полиакриламидном геле в денатурирующих условиях. Содержание белка в полосе, соответствующей рекомбинантному IL-36Ra, определяли денситометриированием геля с последующим анализом программой Image J. В качестве контроля использовали клетки штамма Escherichia coli BL21Star[DE3], не содержавшие экспрессионных плазмид.
Результат представлен на фиг. 3.
Как видно из фиг. 3, индукция культур клеток штаммов Escherichia coli BL21Star[DE3](pET-IL36Raf), Escherichia coli BL21 Star[DE3](pET-IL36Raf-His), Escherichia coli BL21Star[DE3](pET-IL36Rafn-His) приводит к синтезу белка с молекулярным весом от 17 до 18 килодальтон, что соответствует ожидаемым молекулярным весам для экспрессируемых вариантов IL-36Ra, представленным в таблице 1. Денситометрия полиакриламидного геля, представленного на фиг. 3, показала, что штамм Escherichia coli BL21[DE3]Star(pET-IL36Raf) в условиях индукции за 3 часа продуцирует рекомбинантный IL36Ra, количество которого составляет 17,6% общего белка клеточного лизата. Культивирование штамма Escherichia coli BL21[DE3]Star(pET-IL36Raf-His) в аналогичных условиях показало содержание IL36Ra в клеточном лизате 13,7%. Культивирование клеток штамма Escherichia coli BL21Star[DE3](pET-IL36Rafn-His), содержащих неоптимизированную последовательность гена IL-36Ra, показало накопление значительно меньших количеств рекомбинантного IL-36Ra-His, составивших 8,0% и 8,6% белков клеточных лизатов за 3 и 5 часов культивирования после внесения индуктора. Таким образом, оптимизированная по частоте использования кодонов последовательность, кодирующая IL-36Ra (Seq ID No1), обеспечивает более высокую продуктивность штамма-продуцента, чем природная (неоптимизированная) последовательность кДНК IL-36Ra.
Пример 3. Исследование биологической активности рекомбинантного IL-36Ra
Биологическую активность вариантов рекомбинантного IL-36Ra определяли по их способности подавлять продукцию IL-8 фибробластами кожи человека, индуцированными ИЛ-36γ. Для этой цели фибробласты кожи человека культивировали в среде DMEM/F12 с 10% фетальной сыворотки. За сутки до постановки теста клетки снимали с пластика раствором Версена с трипсином и рассевали в 96-луночную плату по 2×104 клеток на лунку в 100 мкл среды DMEM/F12 с 10% FCS. Через 24 часа среду заменяли на свежую и вносили в параллелях рекомбинантный человеческий ИЛ-36γ (R&D Systems) в концентрации 10 нг/мл и различные концентрации полноразмерного IL-36Ra-His и укороченного варианта IL-36Ra-His (R&D Systems). Через 24 часа выделяли супернатанты, в которых анализировали содержание ИЛ-8 человека с помощью иммуноферментного анализа, используя тест-систему производства ООО «Цитокин» по инструкции изготовителя.
Результаты, представленные на фиг. 4, показывают, что внесение возрастающих доз полноразмерного и укороченного вариантов IL-36Ra-His приводит к дозозависимому подавлению продукции фибробластами кожи человека IL-8 до фонового уровня 440±17 пг/мл (спонтанная продукция ИЛ-8 фибробластами составила 407±37 пг/мл. При добавлении 10 нг/мл ИЛ-36γ концентрация ИЛ-8 в супернатантах увеличивалась до 1123±130 пг/мл).
Полное подавление стимуляции клеток ИЛ-36γ было достигнуто при внесении 3 мкг/мл полноразмерного ИЛ-36Ra-His. При этом укороченный на 1 N-концевую аминокислоту белок снижал продукцию ИЛ-8, стимулированную ИЛ-36γ, лишь на 50%: при концентрации укороченного IL-36Ra-His 3 мкг/мл концентрация ИЛ-8 в супернатанте составляла 746±59 пг/мл.
Таким образом, использование настоящей группы изобретений позволило получить штамм-продуцент биологически активного рекомбинантного IL-36Ra Escherichia coli BL21[DE3](pET-IL36Raf) с повышенной биологической активностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО РЕЦЕПТОРНОГО АНТАГОНИСТА ИНТЕРЛЕЙКИНА-36, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI BL21[DE3] - ПРОДУЦЕНТ БЕЗМЕТИОНИНОВОГО РЕЦЕПТОРНОГО АНТАГОНИСТА ИНТЕРЛЕЙКИНА-36 (ВАРИАНТЫ), СПОСОБ ИХ ПОЛУЧЕНИЯ, ПЛАЗМИДНЫЕ ВЕКТОРЫ pBAD15A и pET15A И ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК ДЛЯ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2672816C9 |
| Штамм бактерий Escherichia Coli - продуцент рекомбинантного белка IL-29 | 2020 |
|
RU2760585C1 |
| ШТАММ Escherichia coli BL21(DE3)Gold/pETCYPopti - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ЦИКЛОФИЛИНА А ЧЕЛОВЕКА | 2015 |
|
RU2603283C1 |
| Рекомбинантный штамм бактерий Escherichia coli Rosetta 2(DE3)/pET28c-Mau - продуцент ДНК-полимеразы А | 2023 |
|
RU2815455C1 |
| Плазмидный вектор pET-mChBac75Na, штамм бактерии Eschrichia coli BL21(DE3/ pET-mChBac75Na для экспрессии антимикробного пептида минибактенецина ChBac7.5 Nα и способ получения указанного пептида | 2016 |
|
RU2618850C2 |
| ПЛАЗМИДНЫЙ ВЕКТОР pET-His8-TrxL-Acip1, ШТАММ БАКТЕРИИ Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1 ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АЦИПЕНСИНА-1 И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2015 |
|
RU2580031C2 |
| Штамм бактерий Escherichia coli - продуцент рекомбинантного белка NS1 | 2021 |
|
RU2789735C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИНТЕРЛЕЙКИНА-3 ЧЕЛОВЕКА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК P3PTEIL3, КОДИРУЮЩАЯ РЕКОМБИНАНТНЫЙ ИНТЕРЛЕЙКИН-3 ЧЕЛОВЕКА, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНТЕРЛЕЙКИНА-3 ЧЕЛОВЕКА | 1995 |
|
RU2099421C1 |
| ИСКУССТВЕННЫЙ ГЕН, КОДИРУЮЩИЙ ХИМЕРНЫЙ БЕЛОК АНГИОГЕНИНА ЧЕЛОВЕКА, ХИМЕРНАЯ ПЛАЗМИДА pJZZ-A, ОБЕСПЕЧИВАЮЩАЯ ЭКСПРЕССИЮ ГЕНА ХИМЕРНОГО БЕЛКА АНГИОГЕНИНА ЧЕЛОВЕКА В Escherichia coli И ШТАММ Escherichia coli BL21(DE3)/pJZZ-A-ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ХИМЕРНОГО БЕЛКА АНГИОГЕНИНА ЧЕЛОВЕКА | 2012 |
|
RU2512527C2 |
| Плазмидный вектор pET-pPsLTP, штамм бактерии Escherichia coli BL21(DE3)Star/ pET-pPsLTP - продуцент пищевого аллергена гороха Pis s 3 и способ получения указанного аллергена | 2016 |
|
RU2618840C2 |


Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению белков, и может быть использовано для получения антагониста рецептора интерлейкина-36. Штамм бактерий E.coli BL21Star[DE3](pET-IL36Raf) - продуцент полноразмерного рецепторного антагониста интерлейкина-36 человека получают путем трансформации клеток E.coli родительского штамма BL21Star[DE3] плазмидным вектором pET-IL36Raf. Штамм бактерий E.coli BL21Star[DE3](pET-IL36Raf-His) - продуцент полноразмерного рецепторного антагониста интерлейкина-36 человека с С-концевым полигистидиновым тагом получают путем трансформации клеток E.coli родительского штамма BL21Star[DE3] плазмидным вектором pET-IL36Raf-His. Изобретение позволяет повысить эффективность рекомбинантного получения IL-36Ra. 6 н.п. ф-лы, 4 ил., 1 табл., 3 пр.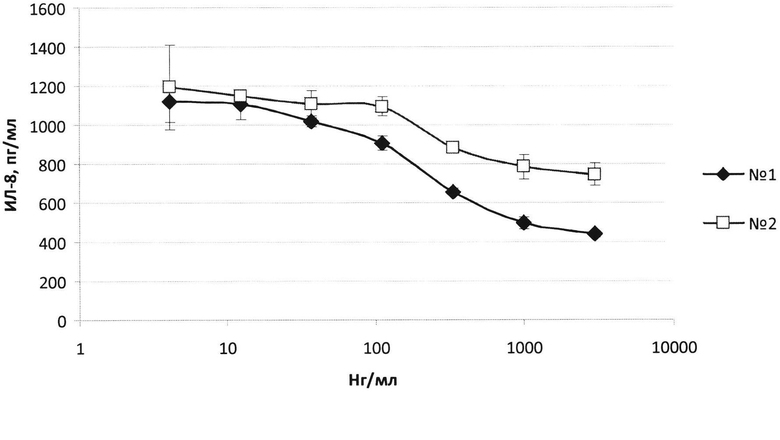
1. ДНК с последовательностью SEQ ID No 1, кодирующая полноразмерный рецепторный антагонист интерлейкина-36 человека.
2.. Плазмидный экспрессионный вектор pET-IL36Raf для экспрессии рецепторного антагониста интерлейкина-36 человека, содержащий ген IL-36Raf, характеризующийся последовательностью ДНК по п. 1, ген Lac-репрессора, промотор Lac-оперона, промотор Т7, терминатор транскрипции Т7, ген бета-лактамазы, репликатор плазмиды pBR322, сайты рестрикции, ограничивающие ген IL-36Raf.
3. ДНК с последовательностью SEQ ID No 2, кодирующая полноразмерный рецепторный антагонист интерлейкина-36 человека, с С-концевым полигистидиновым тагом.
4. Плазмидный экспрессионный вектор pET-IL36Raf-His для экспрессии полноразмерного рецепторного антагониста интерлейкина-36 человека, с С-концевым полигистидиновым тагом, содержащий ген IL36Raf-His, характеризующийся последовательностью ДНК по п. 3, ген Lac-репрессора, промотор Lac-оперона, промотор Т7, терминатор транскрипции Т7, ген бета-лактамазы, репликатор плазмиды pBR322, сайты рестрикции, ограничивающие ген IL-36Raf-His.
5. Штамм бактерий Escherichia coli BL21Star[DE3](pET-IL36Raf) - продуцент полноразмерного рецепторного антагониста интерлейкина-36 человека, полученный путем трансформации клеток Escherichia coli родительского штамма BL21Star[DE3] плазмидным вектором pET-IL36Raf по п. 2.
6. Штамм бактерий Escherichia coli BL21Star[DE3](pET-IL36Raf-His) - продуцент полноразмерного рецепторного антагониста интерлейкина-36 человека с С-концевым полигистидиновым тагом, полученный путем трансформации клеток Escherichia coli родительского штамма BL21Star[DE3] плазмидным вектором pET-IL36Raf-His по п. 4.
Авторы
Даты
2016-04-27—Публикация
2014-07-24—Подача