Изобретение относится к области молекулярной биотехнологии и генной инженерии и касается нового штамма-продуцента рекомбинантного циклофилина А человека (рчЦфА).
Противоопухолевая химиотерапия ведет к подавлению гемопоэза, снижению иммунитета и возникновению инфекционных осложнений. В связи с этим целесообразно применение средств, поддерживающих кроветворную функцию костного мозга.
Циклофилин А (ЦфА) - белок с молекулярной массой 18 кДа, обладает цис-транс-изомеразной активностью и существует во внутриклеточной и секреторной формах. Внутриклеточный ЦфА участвует в фолдинге, транспорте и сборке белков, регуляции клеточной пролиферации, обеспечивает передачу сигнала от Т-клеточного рецептора. Секреторный ЦфА в норме присутствует в крови, тканевых жидкостях и молоке человека, являясь хемоаттрактантом для макрофагов, гранулоцитов и активированных Т-клеток (P. Wang, J. Heitman. Cyclophilins. Genome Biology. 2005, v.6: 226; Colgan J, Asmal M, Neagu M, et al. Cyclophilin A regulates TCR signal strength in CD4+ T cells via a proline-directed conformational switch in Itk. Immunity. 2004; 21(2):189-201; Spik G, Haendler B, Delmas O, et al. A novel secreted cyclophilin-like protein (SCYLP). The Journal of biological chemistry. 1991; 266(17):10735-107385, Damsker JM, Bukrinsky MI, Constant SL. Preferential chemotaxis of activated human CD4+ T cells by extracellular cyclophilin A. Journal of leukocyte biology. 2007; 82(3):613-618).
Установлено, что ЦфА индуцирует дифференцировку стволовых клеток в дендритные (Bharadwaj U, Zhang R, Yang H, et al. Effects of cyclophilin A on myeloblastic cell line KG-1 derived dendritic like cells (DLC) through p38 MAP kinase activation. The Journal of surgical research. 2005; 127(1):29-38).
Показано, что экзогенный ЦфА усиливает миграцию стволовых клеток из костного мозга у сублетально облученных мышей, а также является хемоаттрактантом для костномозговых предшественников: дендритных клеток, Т- и В-лимфоцитов, моноцитов и гранулоцитов (Khromykh LM, Kulikova NL, Anfalova TV, et al. Cyclophilin A produced by thymocytes regulates the migration of murine bone marrow cells. Cellular immunology. 2007; 249(1):46-53.).
На основании приведенных данных можно предположить, что ЦфА участвует в восстановлении иммунной системы.
Для детального изучения биологических свойств в системах in vivo, а также для проведения доклинических и клинических испытаний требуются значительные количества рчЦфА.
Известен штамм Escherichia coli (Е. coli), являющийся продуцентом рЦфА мыши в виде белка, слитного с полигистидиновой последовательностью, который обеспечивает очистку белка с помощью металл-хелатной хроматографии [В. Sherry, G. Zybarth, M. Alfano, L. Dubrovsky, R. Mitchell, D. Rich, P. Ulrich, R. Bucala, A. Cerami, M. Bukrinsky. Role of cyclophilin A in the uptake of HIV-1 by macrophages and T lymphocytes. Proc. Natl. Acad. Sci. 1998; 95:1758-1763].
Недостаток штамма: рЦфА содержит в своем составе полигистидиновую последовательность, отличную от нативной, обладает токсичностью и пирогенностью.
Известен штамм Е. coli, продуцирующий рчЦфА без дополнительных полипептидных последовательностей [Liu J., Albers M.W., Chen С.М., Schreiber S.L., Walsh С.Т. Cloning, expression, and purification of human cyclophilin in Escherichia coli and assessment of the catalytic role of cysteines by site-directed mutagenesis. Proc. Natl. Acad. Sci. USA. 1990; 87(6):2304-2308].
Недостатки: низкий выход конечного продукта (35 мг на 2 литра бактериальной культуры); сложная система очистки.
Известен штамм Е. coli BL21(DE3)Gold/pETmin-CypA, продуцирующий рчЦфА без дополнительных полипептидных последовательностей. Продуктивность штамма составляет 100 мг рчЦфА на 1 литр бактериальной культуры. (Патент РФ №2557305).
Недостатки: относительно невысокое содержание конечного продукта и необходимость в дополнительных стадиях очистки, обусловленных примесями бактериального липополисахарида.
Задачей заявляемого изобретения является создание нового штамма-продуцента рчЦфА, способного обеспечить увеличение выхода и чистоты конечного продукта, не требующего дополнительной стадии очистки.
Технический результат изобретения: получен штамм E. coli BL21(DE3)Gold/pETCYPopti, продуцирующий белок рчЦФА, структурно максимально приближенный к нативному, с высоким выходом и чистотой конечного продукта (соответственно: до 1 г на литр бактериальной культуры, 95% чистоты по результатам электрофореза и низким содержанием эндотоксина - 0,2 IU на 1 мг рчЦфА).
Поставленная задача решается созданием штамма Е. coli BL21(DE3)Gold/pETCYPopti путем трансформации штамма E. coli BL21(DE3)Gold рекомбинантной плазмидой pETCYPopti, несущей в составе оптимизированную последовательность ДНК, кодирующую рчЦфА.
Для получения высокоэффективного продуцента рчЦфА - штамма E. coli BL21(DE3)Gold/pETCYPopti проводят дизайн рекомбинантной последовательности ДНК, кодирующей белок рчЦфА, с учетом предпочтительных кодонов для обеспечения высокоэффективной трансляции белка в Е. coli и синтезируют данную последовательность при помощи полимеразной цепной реакции (ПЦР) с использованием набора перекрывающихся праймеров. Синтезированную последовательность ДНК с помощью генно-инженерных манипуляций встраивают в векторную плазмиду pET22b(+) (Novagen, США) для получения экспрессионной плазмиды pETCYPopti, которую используют для трансформации бактерий E. coli штамма BL21(DE3)Gold.
Изобретение осуществляют следующим образом:
Проводят дизайн последовательности ДНК, кодирующей белок рчЦфА, с целью оптимизации кодируемой последовательности мРНК для прокариотических продуцентов, в частности для E. coli. Дизайн последовательности включает замены кодонов нативного гена на кодоны, наиболее часто встречающиеся в белках организма-продуцента с высоким уровнем продукции, учитывает перспективы стабильности конечной мРНК, отсутствие препятствий трансляции в виде чрезмерной структурированности мРНК, отсутствие гомополимерных участков и особенности высокоэффективной терминации трансляции. Разработанную последовательность синтезируют при помощи серии ПЦР с перекрывающимися праймерами. В последнюю пару праймеров, используемую для синтеза последовательности, вводят сайты эндонуклеаз рестрикции NdeI и XhoI для клонирования полученной последовательности в плазмидный вектор.
Клонирование последовательности ДНК, определяющей синтез рчЦфА, проводят в плазмидный вектор pET22b(+) (Novagen, США) по сайтам эндонуклеаз рестрикции NdeI и XhoI с получением экспрессионной плазмиды pETCYPopti. Рекомбинантная плазмида pETCYPopti имеет размер 5858 пар нуклеотидов (п.н.) и содержит: фрагмент XhoI-NdeI вектора рЕТ-22b(+), несущий ген устойчивости к ампициллину ampR, промотор и терминатор РНК-полимеразы фага Т7 и полилинкер, в котором по сайтам XhoI-NdeI клонирован фрагмент гена рчЦфА размером 498 п.н. Полученной плазмидой трансформируют штамм E. coli BL21(DE3)Gold с получением штамма E. coli BL21(DE3)Gold/pETCYPopti - продуцента рчЦфА, и отбирают колонии, наиболее эффективно продуцирующие целевой белок.
Для наработки бактериальной биомассы штамм E. coli BL21(DE3)Gold/pETCYPopti - продуцент рчЦфА, выращивают на богатой среде (2xYT) до достижения оптической плотности культуры 0.6-1.2 ОЕ и индуцируют продукцию белка добавлением 0,5 мМ изопропилтио-β-D-галактозида. Экспрессию проводят в течение 4 часов при температуре 28°С.
Клетки экспрессионной культуры собирают центрифугированием, суспендируют в буфере, содержащем 20 мМ трис-HCl, рН 8.0, 100 мМ NaCl, дополненном протеазными ингибиторами, обрабатывают лизоцимом и лизируют добавлением детергента Triton X-100. Клеточную ДНК разрушают добавлением ДНКазы в присутствии 1 мМ хлорида магния. Полученный лизат центрифугируют 20 минут при 18000 g. Осветленный лизат порционно высаливают сульфатом аммония из расчета половина объема насыщенного раствора сульфата аммония на один объем лизата. После формирования осадка, лизат подвергают повторному центрифугированию и супернатант осаждают насыщенным сульфатом аммония из расчета три объема раствора сульфата аммония на один объем супернатанта. Полученный сульфатный осадок собирают центрифугированием и троекратно диализуют по 4 часа против раствора 30 мМ фосфата натрия рН 8. Далее проводят одноэтапную хроматографическую очистку белка с использованием тандема колонок DEAE-Sepharose и Q-Sepharose в буфере, содержащем 30 мМ фосфата натрия рН 8. Проводят одноэтапную хроматографическую очистку белка с использованием тандема колонок DEAE-Сефароза и Q-Сефароза. РчЦфА, прошедший адсорбцию примесей на обеих колонках, стерилизуют фильтрацией через мембрану с диаметром пор 0,22 мкм и хранят при +4°С в течение 6 месяцев.
Чистоту полученного рчЦфА анализируют электрофоретически, проверяют содержание эндотоксина в образце с использованием ЛАЛ-теста, определяют количество по методу Брэдфорда. Концентрация рчЦфА при получении 300 мл осветленного лизата из 100 г бактериальной биомассы составляет не менее 10 мг/мл. Чистота рчЦфА составляет 95% по данным денситометрии при содержании эндотоксина в препарате менее 5 IU на 1 мл белкового раствора (0,2 IU на 1 мг белка) и суммарном выходе очищенного белкового продукта не менее 0,5 г на литр культуры без ферментации и не менее 1 г на литр культуры, выращенной в ферментере.
Нуклеотидная последовательность ДНК гена рчЦфА, оптимизированная для продукции рчЦфА в E. coli, представлена в Перечне последовательностей -SEQ ID NO: 1 и нуклеотидные последовательности праймеров, использованные при ПЦР-синтезе данной ДНК, представлены в Перечне последовательностей -SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11.
Заявляемый штамм E. coli BL21(DE3)Gold/pETCYPopti - продуцент рекомбинантного циклофилина А человека депонирован и хранится во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) ФГУП ГосНИИГенетика №11983 от 18 июля 2014 г. и характеризуется следующими признаками:
Морфологические признаки. Клетки палочковидной формы, неспороносные, грамотрицательные.
Культуральные признаки. Бактериальные клетки хорошо растут на простых питательных средах. При выращивании на агаре образуют круглые, мутные желто-серые колонии со слегка неровным краем, диаметром до 3 мм. При росте на жидких средах (LB, 2xYT) образуют интенсивную муть.
Физико-биологические признаки. Клетки растут при температуре от 4 до 40°С при оптимуме 37°С и оптимальных значениях рН от 7 до 7.5. В качестве источника углерода используют аминокислоты, углеводы, глицерин. В качестве источника азота могут использовать как органические соединения (аминокислоты, дрожжевой экстракт, триптон и др), так и неорганические минеральные соли в аммонийной форме.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к антибиотикам пенициллинового ряда (до 200 мкг/мл).
Штамм E. coli BL21(DE3)GoldCYPopti является суперпродуцентом. При индукции изопропилтио-β-D-галактозидом происходит эффективный синтез целевого белка рчЦфА, который накапливается в растворимом состоянии в цитоплазме бактерий и составляет до 50% суммарного белка клетки.
Изобретение иллюстрируется Фиг. 1-3 и примером.
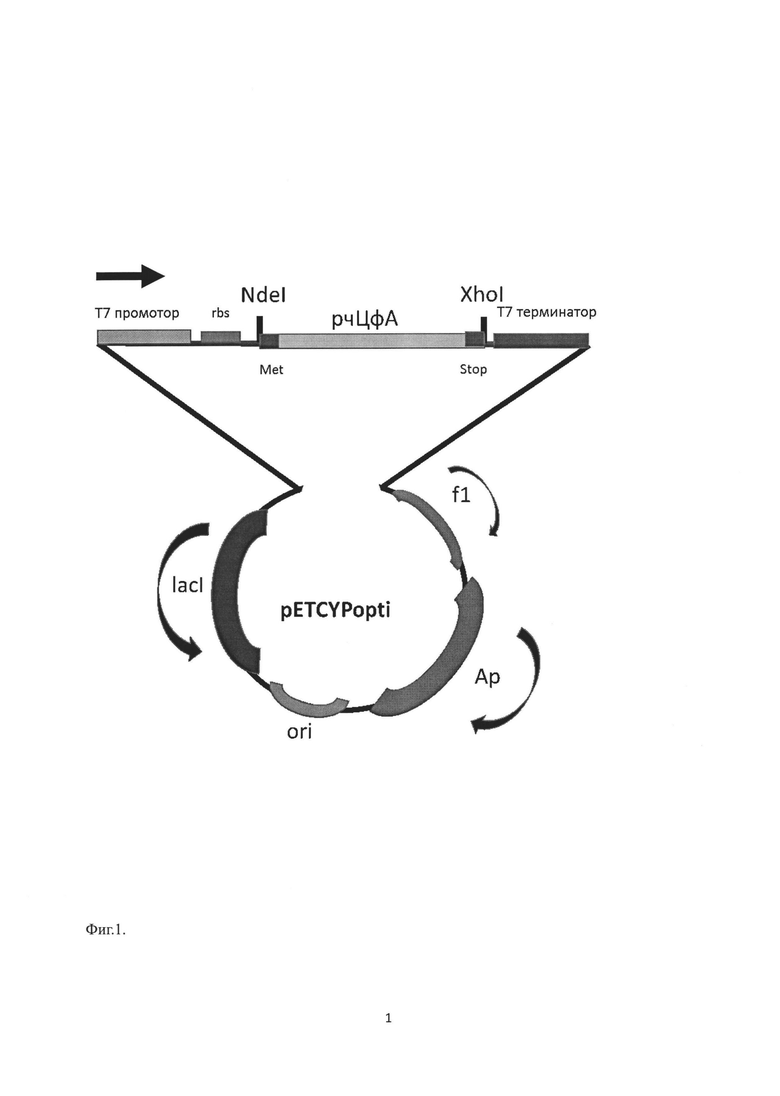
На Фиг. 1 представлена структура рекомбинантной плазмиды pETCYPopti.
Рекомбинантная плазмида pETCYPopti имеет размер 5858 пар нуклеотидов (п.н.) и содержит: фрагмент XhoI-NdeI вектора рЕТ-22b(+), несущий ген устойчивости к ампициллину ampR, промотор и терминатор РНК-полимеразы фага Т7 и полилинкер, в котором по сайтам XhoI-NdeI клонирован фрагмент, размером 498 п. н., представляющий собой ген циклофилина А человека.
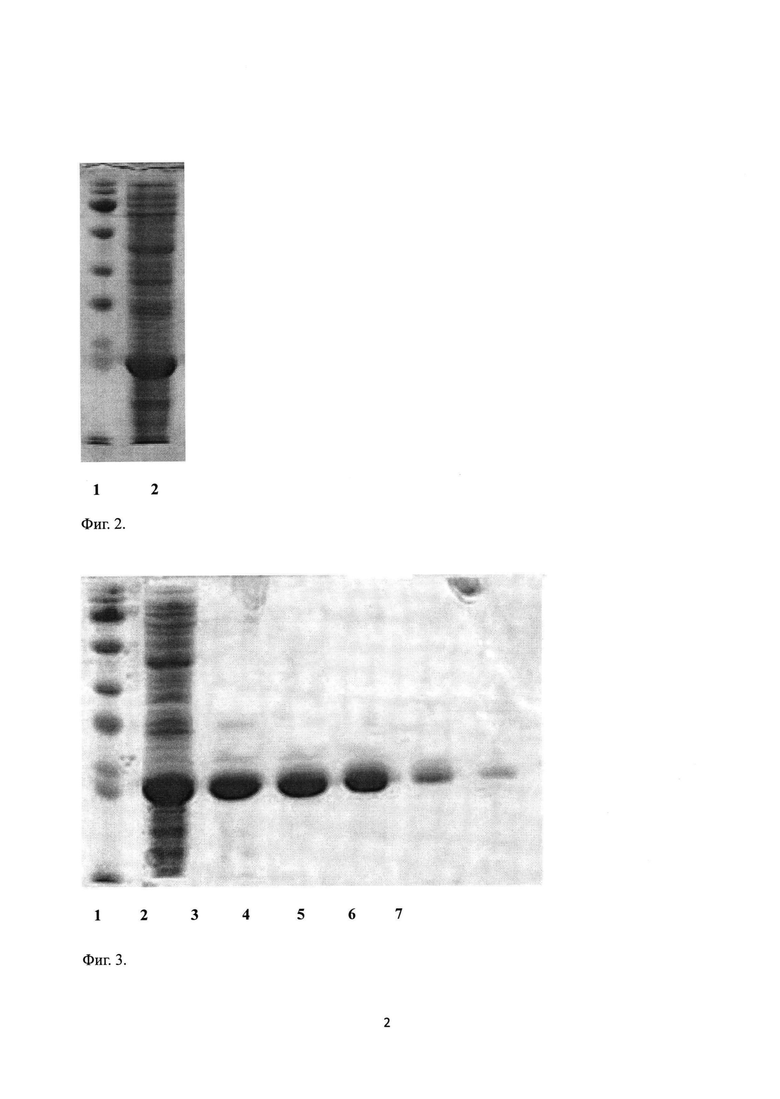
На Фиг. 2 представлены результаты электрофореза по продукции рчЦфА в клетках E. coli BL21(DE3) Gold. 1 - маркер молекулярной массы Page Ruler Plus (Thermo Scientific); 2 -лизат бактериальной биомассы после продукции белка ЦфА.
На Фиг. 3 представлены результаты очистки рчЦфА методом тандемной анионообменной хроматографии на колонках DEAE-Сефароза и Q-Сефароза (GE Healthcare): 1 - маркер молекулярной массы Page Ruler Plus (Thermo Scientific); 2 - лизат бактериальной биомассы после осаждения сульфатом аммония и диализа; 3-7 - различные количества (от 5 до 0,2 мкг) рчЦфА, очищенного тандемной анионообменной хроматографией.
Пример. Конструирование оптимизированной последовательности ДНК, обеспечивающей эффективную продукцию рчЦфА в E. coli.
Проводят дизайн последовательности, кодирующей белок рчЦфА, с целью оптимизации кодируемой последовательности мРНК для продукции белка в E. coli. Для этого вводят замены кодонов нативного гена ЦфА на кодоны, наиболее часто встречающиеся в белках E. coli с высоким уровнем продукции, последовательность оптимизируют по стабильности конечной мРНК, отсутствию препятствий трансляции в виде чрезмерной структурированности мРНК, отсутствию гомополимерных участков и с точки зрения особенностей высокоэффективной терминации трансляции. Из последовательности удаляют гомополимерные и AG-богатые участки, проводят замену редко встречающихся и повторяющихся кодонов, создают новый сайт терминации трансляции, состоящий из двух последовательных кодонов ТАА, являющихся наиболее сильно терминирующими кодонами. Удаляют сайты узнавания последовательности гексануклеотидными эндонуклеазами рестрикции для облегчения переноса синтетического гена в различные экспрессионные системы.
При помощи программных пакетов "Oligo", "Vector NTI" и "Genebee" конструируют набор олигонуклеотидов для синтеза последовательности рчЦФА с помощью ПЦР. Температуру ренатурации комплементарных участков олигонуклеотидов подбирают в диапазоне 58-60°С для достижения оптимальной эффективности ПЦР-амплификации. В состав концевых праймеров вводят сайты узнавания эндонуклеаз рестрикции NdeI и XhoI для обеспечения встраивания конструкта в векторные системы семейства рЕТ (Фиг. 1).
Синтез последовательности ведут при помощи серии ПЦР-амплификаций с использованием специальной смеси Taq-полимеразы и полимеразы Pfu (Promega, США) с промежуточной проверкой продуктов реакции электрофорезом в полиакриламидном геле. Подбор оптимальных условий амплификации осуществляют при помощи градиентной функции амплификатора (Master cycler Nexus Gradient, Eppendorf). Реакционную смесь в объеме 10 мкл амплифицируют в градиенте температур отжига 57-64°С, аликвоты наносят на акриламидный гель и анализируют с помощью электрофореза. Наиболее чистые продукты реакции нужной длины отбирают для дальнейшей стадии синтеза фрагмента ДНК, вырезают и экстрагируют из геля нагреванием до 55°С в течение 30 мин в присутствии 1М ацетата калия.
Корректность синтеза последовательности ДНК, кодирующей рчЦфА, верифицируют методом капиллярного секвенирования.
Получение рекомбинантной плазмиды pETCYPopti
Конечный фрагмент ДНК, кодирующий рчЦфА, очищают с использованием набора для очистки ПЦР-продуктов (PCR Purification Kit, Qiagen, Германия), расщепляют эндонуклеазами NdeI и XhoI и лигируют с вектором pET22b(+), обработанным такими же ферментами. Полученный лигат трансформируют в электрокомпетентные клетки DH5-alpha FIQ (Invitrogen), подготовленные в соответствии с протоколом производителя (New England Biolabs, США). Для электротрансформации используют прибор ВТХ 600 (Artisan Technology Group, США) в режиме 129 Ом, 2,5 КВ. Трансформанты высевают на агаризованную (1% агара) среду 2xYT и выращивают в течение 18 часов при 37°С. Выросшие колонии анализируют при помощи ПЦР на наличие фрагмента ДНК, кодирующего рчЦфА. Бактериальные колонии, содержащие вставку ДНК, кодирующую рчЦфА, выращивают в течение ночи в жидкой среде 2XYT, выделяют плазмидную ДНК pETCYPOpti и проводят ее секвенирование для анализа точности встраивания фрагмента ДНК, кодирующего рчЦфА.
Получение штамма E. coli BL21(DE3)Gold/pETCYPopti
Плазмидной ДНК pETCYPOpti трансформируют электрокомпетентые клетки E. coli штамма BL21(DE3)Gold, подготовленные в соответствии с протоколом производителя (Agilent, США). Для электротрансформации используют прибор ВТХ ЕСМ 600 (Artisan Technology Group. США) (режим 129 Ом, 2,5 KB). Трансформанты высевают на чашки с агаризованной (1% агара) средой 2xYT, содержащей 50 мкг/мл ампициллина и 2% глюкозы, и выращивают в течение ночи при 37°С.
Для определения уровня продукции белка единичные колонии-продуценты выращивают в течение 18 часов при 37°С в 10 мл среды 2xYT с добавлением 2% глюкозы. Далее 1 мл полученной культуры переносят в 10 мл среды 2xYT, содержащей 0.1% глюкозы и 50 мкг/мл ампициллина, и выращивают при t=37°С до оптической плотности 1 ОЕ. Выросшие культуры охлаждают до 28°С, добавляют изопропил-β-D-1-тиогалактозид до концентрации 0.5 мМ и проводят экспрессию белка в течение 4 часов при t=28°C. Уровень продукции рчЦфА определяют электрофорезом в полиакриламидном геле. Для проведения электрофореза в денатурирующих условиях в 12% полиакриламидном геле по методу Лэммли отбирают аликвоты жидкой культуры продуцента, центрифугируют при 5000 об/мин 5 минут, осажденные клетки растворяют в 100 мкл лизирующего буфера с красителем бромфеноловым синим, обрабатывают 20 секунд ультразвуком, нагревают 3 минуты при t=100°C и наносят на гель. После прохождения электрофореза гель окрашивают красителем Кумасси R-250 по стандартной методике и сканируют с помощью денситометра Shimadzu CS-930. По результатам денситометрических измерений количество слитного химерного рчЦфА составило 50% от общего клеточного белка.
Наиболее эффективные бактериальные продуценты рчЦфА консервируют для хранения при t=-80°С с добавлением к жидкой бактериальной культуре после 18-часовой инкубации 15% глицерина в качестве криопротектора.
Продукция белка рчЦфА в штамме E. coli BL21(DE3)Gold/pETCYPopti
Для продукции рчЦфА в аналитическом количестве (до 4 литров) единичную колонию трансформанта помещают в 10 мл среды 2xYT, содержащей 2% глюкозы и 50 мкг/мл ампициллина, и выращивают при t=37°C. Далее 10 мл культуры после 18- часовой инкубации переносят в 1 л среды 2xYT, содержащей 0.1% глюкозы и 50 мкг/мл ампициллина, разносят среду на 4 колбы (по 250 мл) и выращивают на термостатируемом шейкере при t=37°C с перемешиванием при 220 об/мин до оптической плотности 1,5 ОЕ (2-3 часа). Выросшую культуру охлаждают до t=28°C, добавляют изопропилтио-β-D-галактозид до концентрации 0,5 мМ и получают продукцию белка в течение 4 часов при t=28°C. Биомассу продуцента собирают центрифугированием при 5000 об/мин в течение 10 минут и хранят в виде замороженных осадков при температуре -80°С.
Ферментацию культуры для получения биомассы продуцента E. coli BL21(DE3)Gold/pETCYPopti проводят в ферментере- 50-литровом биореакторе с электромагнитным импеллером и контроллером, обеспечивающим мониторинг уровня растворенного кислорода, значения рН, содержания некоторых ионов, концентрации глюкозы и уровня пенообразования. Объем единичной ферментации составляет 30 литров. Ферментацию проводят в среде 2xYT, содержащей 1% глюкозы, 50 мМ фосфата калия и 0.5 мМ хлорида магния. Значение рН среды при инокуляции составило 7.6. В дальнейшем уровень рН поддерживают в диапазоне 7.0-7.2 титрованием 1 М раствором NaOH. Начальная концентрация антибиотика (ампициллин) составляет 100 мкг/мл.
Инокулят в количестве 2 литров готовят в пятилитровом ферментере LabFors (Infors, Швейцария) в среде 2xYT, содержащей 5% глицерина, 5% глюкозы, 80 мМ фосфата калия и 3 мМ хлорида магния. Начальная концентрация ампициллина составляет 100 мкг/мл. Инокулят выращивают с использованием 100 мл первичной культуры, приготовленной в среде SOB с добавлением 5% глюкозы. Первичную культуру готовят на основе единичной колонии продуцента, наращивая биомассу в течение 7 часов при концентрации ампициллина 100 мкг/мл. Температура роста первичной культуры и инокулята составляет 37°С.
Инокулят вводят в предварительно разогретую до t=37 С культуральную среду в основном ферментере и растят культуру на протяжении 8 часов при значениях рН в диапазоне от 7.0 до 7.2 и содержании растворенного кислорода от 28 до 30%. При достижении оптической плотности культуры (OD600) значения 20 ОЕ температуру в ферментере снижают до 28°С и добавляют изопропилтио-*Р-D-галактозидом до 0.5 мМ. После индукции контролируют параметры культуры и при истощении добавляют смесь, содержащую 800 г/л глюкозы и 2 г/л ампициллина. Через 1 час после индукции включают аппаратуру введения пеногасителя. Получение продукта проводят в течение 12 часов. Далее биомассу отделяют с использованием проточной центрифуги Centritech VP Pilot и хранят при t=-80°C.
Выход растворимого белка при экспрессии оптимизированного гена рчЦфА составил более 500 мг/мл в условиях продукции в колбах и более 1 г/л в условиях ферментации, что более чем в 5 раз превосходит уровень продукции рчЦфА, полученного в аналогичных условиях с использованием неоптимизированной последовательности ДНК.
Выделение и очистка рчЦфА из бактериальной биомассы штамма E. coli BL21(DE3)Gold/pETCYPopti
Для выделения рчЦфА 100 г бактериальной биомассы суспендируют в 300 мл буфера, содержащего 20 мМ трис-HCl рН 8, 100 мМ NaCl, дополненного ингибитором сериновых протеаз PMSF (1 мМ конечной концентрации), и обрабатывают лизоцимом (20 мкг/мл) при +4°С в течение 30 минут. Лизируют клетки добавлением детергента Triton X-100 до концентрации 0.5%. К лизату добавляют хлорид магния до концентрации 1 мМ и разрушают геномную ДНК E. coli добавлением ДНКазы (10 мкг/мл). Обработку ДНКазой проводят в течение 15 минут при 20°С, после обработки к лизату добавляют ЭДТА до концентрации 5 мМ. Полученный лизат центрифугируют в течение 20 минут при 18000 g, и супернатант, содержащий целевой белок, порционно высаливают сульфатом аммония из расчета половина объема насыщенного раствора сульфата аммония на один объем лизата. Осажденный лизат (25% сульфата аммония) инкубируют при температуре +4°С в течение часа для формирования осадка. Осадок удаляют центрифугированием в течение 15 минут при 18000 g. Супернатант осаждают насыщенным сульфатом аммония из расчета три объема раствора сульфата аммония на один объем супернатанта и инкубируют при t=4°C в течение 18 часов.
Сульфатный осадок собирают центрифугированием в течение 60 минут при 18000 g и растворяют в буфере, содержащем 30 мМ фосфата натрия, рН=8. Растворенный белок центрифугируют в течение 30 минут при 18000 g для удаления нерастворенных частиц и примесей и диализуют по 4 часа против трех смен раствора 30 мМ фосфата натрия, взятого по отношению к растворенному белку в объемном соотношении 1:10. Диализ проводят при t=4°С.После диализа белок центрифугируют в течение 30 минут при 18000 g для удаления нерастворенных частиц и агрегатов.
Очистку рчЦфА проводят методом тандемной анионообменной хроматографии на колонках DEAE-Сефароза и Q-Сефароза (GE Healthcare, США). В препаративном варианте используют колонку HiScale 50/40 (GE Healthcare, США), упакованную 300 мл DEAE-Сефарозы, и HiScale 50/20 (GE Healthcare, США), упакованную 200 мл Q-Сефарозы. Перед нанесением белка колонки уравновешивают буфером, содержащим 30 мМ фосфата натрия рН 8. Нанесение белка ведут при скорости потока 5 мл/мин и собирают фракцию после прохождения обеих колонок. Собранный белок стерилизуют фильтрацией через стерильный фильтр с диаметром пор 0,22 мкм, обладающий низкой сорбцией белка, и хранят при t=4°C в течение 6 месяцев.
Полученный рчЦфА обладает не менее 95% чистоты по результатам денатурирующего электрофореза (Фиг. 3). Содержание бактериального эндотоксина, измеренное с использованием ЛАЛ-теста, составляет менее 5 ME на 1 мл белка при концентрации белка не менее 10 мг/мл, измеренной по методу Брэдфорда (0,2 ME на 1 мг белка).
Выход очищенного рчЦфА составляет не менее 500 мг на 1 литр культуры, полученной без ферментации, и не менее 1 г на литр культуры, полученной в условиях ферментера. Таким образом, потери белка при очистке составляют не более 10% по отношению к его содержанию в бактериальной биомассе.



| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ Escherichia coli BL21(DE3)Gold/pETmin-CypA - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ЦИКЛОФИЛИНА А ЧЕЛОВЕКА | 2013 |
|
RU2557305C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФУНКЦИОНАЛЬНО АКТИВНОГО РЕКОМБИНАНТНОГО БЕЛКА ЛЕТАЛЬНОГО ФАКТОРА СИБИРСКОЙ ЯЗВЫ (LF), РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pETGST-LFmin, КОДИРУЮЩАЯ АКТИВНЫЙ БЕЛОК LF, И ШТАММ Escherichia coli BL-GSTLFmin, ПРОДУЦИРУЮЩИЙ АКТИВНЫЙ БЕЛОК ЛЕТАЛЬНОГО ФАКТОРА СИБИРСКОЙ ЯЗВЫ | 2007 |
|
RU2355769C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФУНКЦИОНАЛЬНО АКТИВНОГО РЕКОМБИНАНТНОГО БЕЛКА ЛЕТАЛЬНОГО ФАКТОРА ЯЗВЫ (LF), РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pETHIS-LF, КОДИРУЮЩАЯ АКТИВНЫЙ БЕЛОК LF И ШТАММ ESCHERICHIA COLI BL-HISLF, ПРОДУЦИРУЮЩИЙ АКТИВНЫЙ БЕЛОК ЛЕТАЛЬНОГО ФАКТОРА СИБИРСКОЙ ЯЗВЫ | 2007 |
|
RU2361921C1 |
| Способ получения рекомбинантного экзопротеина А Pseudomonas aeruginosa | 2016 |
|
RU2636346C1 |
| Способ получения химерного рекомбинантного белка fliC:pagN | 2015 |
|
RU2627602C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PES1-6, КОДИРУЮЩАЯ ПОЛИПЕПТИД СОМАТОТРОПИН, И ШТАММ ESCHERICHIA COLI BL 21(DE3)/PES1-6-ПРОДУЦЕНТ РЕКОМБИНАНТНОГО СОМАТОТРОПИНА | 2002 |
|
RU2233879C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PES4-4, КОДИРУЮЩАЯ ПОЛИПЕПТИД ИНТЕРФЕРОН АЛЬФА-2B ЧЕЛОВЕКА, И ШТАММ ESCHERICHIA COLI BDEES4 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА АЛЬФА-2B ЧЕЛОВЕКА | 2003 |
|
RU2258081C1 |
| Способ получения рекомбинантной фосфатазы бактериальных липополисахаридов | 2015 |
|
RU2617934C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pGST/ART/X, КОДИРУЮЩАЯ СЛИТНЫЙ ХИМЕРНЫЙ ПОЛИПЕПТИД GST/ART/X ДЛЯ ВЫСОКОСПЕЦИФИЧНОЙ СЕЛЕКЦИИ АПТАМЕРОВ К БЕЛКУ-МИШЕНИ X В СОСТАВЕ ПОЛИПЕПТИДА | 2014 |
|
RU2558295C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pES6-1, КОДИРУЮЩАЯ ПОЛИПЕПТИД ИНТЕРФЕРОН БЕТА-1b ЧЕЛОВЕКА, И ШТАММ Escherichia coli BDEES6 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА БЕТА-1b ЧЕЛОВЕКА | 2004 |
|
RU2261913C1 |
Изобретение относится к области биохимии, генной инженерии и биотехнологии, в частности к штамму Escherichia coli BL21(DE3)GoldpETCYPopti. Настоящий штамм является продуцентом рекомбинантного циклофилина А человека. Штамм получен путем трансформации клеток штамма Escherichia coli BL21(DE3)Gold плазмидой pETCYPopti. Указанная плазмида имеет размер 5858 пар нуклеотидов и содержит фрагмент XhoI-NdeI вектора рЕТ-22b(+), несущего ген устойчивости к ампициллину ampR, промотор и терминатор РНК-полимеразы фага Т7 и полилинкер, в котором по сайтам XhoI-NdeI клонирован фрагмент, несущий ген рекомбинантного циклофилина А человека размером 498 пар нуклеотидов, SEQ ID NO: 1. Настоящее изобретение позволяет получать циклофилин А человека с высоким выходом и чистотой. 3 ил., 1 пр.
Штамм Escherichia coli BL21(DE3)GoldpETCYPopti - продуцент рекомбинантного циклофилина А человека, полученный путем трансформации клеток штамма BL21(DE3)Gold плазмидой pETCYPopti, имеющей размер 5858 пар нуклеотидов и содержащей фрагмент XhoI-NdeI вектора рЕТ-22b(+), несущего ген устойчивости к ампициллину ampR, промотор и терминатор РНК-полимеразы фага Т7 и полилинкер, в котором по сайтам XhoI-NdeI клонирован фрагмент, несущий ген рекомбинантного циклофилина А человека размером 498 пар нуклеотидов, SEQ ID NO: 1.
| ШТАММ Escherichia coli BL21(DE3)Gold/pETmin-CypA - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ЦИКЛОФИЛИНА А ЧЕЛОВЕКА | 2013 |
|
RU2557305C2 |
| ZHANG X ET AL., Evidences of monomer, dimmer and trimer of recombinant human cyclophilin A, PROTEIN & PEPTIDE LETTERS, 2011, vol | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| LIU J ET AL., Cloning, expression and purification of human cyclophilin in Escherichia coli and assessment of the catalytic role of cysteines by | |||
Авторы
Даты
2016-11-27—Публикация
2015-09-22—Подача