Изобретение относится к области биотехнологии, а именно к генно-инженерным препаратам медицинского назначения и технологии их получения, точнее к технологии получения рецепторного антагониста интерлейкина-36.
Интерлейкины-36 альфа, бета и гамма (IL-36α, IL-36β, IL-36γ), а также рецепторный антагонист интерлейкинов-36 (IL-36Ra) представляют собой отдельную группу в семействе интерлейкина-1 [Gresnigt M.S., van de Veer-donk F.L. Biology of IL-36 cytokines and their role in disease // Semin. Immunol. 2013. Vol. 25, №6. P. 458-465]. Интерлейкины группы IL-36 синтезируются в основном в эпителиальных тканях и в коже, не имеют сигнальных пептидов и поэтому не могут секретироваться по обычному секреционному пути [Vigne S. et al. IL-36R ligands are potent regulators of dendritic and T cells // Blood. 2011. Vol. 118, №22. P. 5813-5823.].
IL-36 (α,β,γ) играют важную роль в активации воспалительного процесса в коже и в легких. В частности, ряд экспериментальных данных свидетельствует о возможном участии IL-36 в развитии в развитии псориаза и воспалительных заболеваний дыхательных путей и суставов [Ramadas R.A. et al. IL-36α exerts pro-inflammatory effects in the lungs of mice // PloS One. 2012. Vol. 7, №9. P. e45784.; Vigne S. et al. IL-36R ligands are potent regulators of dendritic and T cells // Blood. 2011. Vol. 118, №22. P. 5813-5823.; Foster A.M. et al. IL-36 promotes myeloid cell infiltration, activation, and inflammatory activity in skin // J. Immunol. Baltim. Md 1950. 2014. Vol. 192, №12. P. 6053-6061]. В ряде исследований было показано, что некоторые мутации в гене рецепторного антагониста интерлейкина-36 (ИЛ-36РА) способны вызывать генерализованный пустулезный псориаз (ГПП) - смертельно опасную форму псориаза, которая поражает большие участки кожи и характеризуется периодическими обострениями, гиперлейкоцитозом и повышением уровня С-реактивного белка в крови [Sugiura K. et al. The Majority of Generalized Pustular Psoriasis without Psoriasis Vulgaris Is Caused by Deficiency of Interleukin-36 Receptor Antagonist // J. Invest. Dermatol. 2013. Vol. 133, №11. P. 2514-2521.; Farooq M. et al. Mutation analysis of the IL36RN gene in 14 Japanese patients with generalized pustular psoriasis // Hum. Mutat. 2013. Vol. 34, №1. P. 176-183; Griffiths C.E.M., Barker J.N.W.N. Pathogenesis and clinical features of psoriasis // Lancet Lond. Engl. 2007. Vol. 370, №9583. P. 263-271.; Zelickson B.D., Muller S.A. Generalized pustular psoriasis. A review of 63 cases // Arch. Dermatol. 1991. Vol. 127, №9. P. 1339-1345.].
Учитывая, что ГПП вызывается, как правило, недостатком активности ИЛ-36РА [Sugiura K. et al. The Majority of Generalized Pustular Psoriasis without Psoriasis Vulgaris Is Caused by Deficiency of Interleukin-36 Receptor Antagonist // J. Invest. Dermatol. 2013. Vol. 133, №11. P. 2514-2521.; Farooq M. et al. Mutation analysis of the IL36RN gene in 14 Japanese patients with generalized pustular psoriasis // Hum. Mutat. 2013. Vol. 34, №1. P. 176-183; Hussain S. et al. IL36RN mutations define a severe autoinflammatory phenotype of generalized pustular psoriasis // J. Allergy Clin. Immunol. 2015. Vol. 135, №4. P. 1067-1070.e9], перспективным подходом к терапии этого заболевания представляется введение в организм экзогенного ИЛ-36РА. Кроме того, терапия, направленная на подавление воспаления, опосредованного ИЛ-36, могла бы применяться и для лечения других форм псориаза, а также прочих воспалительных заболеваний кожи в связи с тем, что IL-36Ra способен активировать противовоспалительный каскад, взаимодействуя с рецептором SIGIRR [Costelloe С. et al. IL-1F5 mediates anti-inflammatory activity in the brain through induction of IL-4 following interaction with SIGIRR/TIR8 // J. Neurochem. 2008. Vol. 105, №5. P. 1960-1969.].
Наиболее близким к настоящей группе изобретений являлась ранее разработанная авторами технология получения рецепторного антагониста ИЛ-36 (IL-36Ra), включающая в себя последовательности ДНК, кодирующие полноразмерный IL-36Ra; экспрессионный вектор pET-IL36Raf, а также штамм бактерий Escherichia coli BL21Star[DE3](pET-IL36Raf), содержащий вектор pET-IL36Raf - продуцент полноразмерного IL-36Ra человека (RU 2582569, 2016).
Недостатком использования данной группы изобретений является получение препарата с недостаточно высокой антагонистической активностью.
Техническая задачей, решаемой авторами являлось разработка технологии получения рекомбинантного биологически активного IL-36Ra человека с более высокой активностью.
В основу заявляемого решения было положено предположение, что активность IL-36Ra может быть повышена за счет удаления из его молекулы N-концевого остатка метионина в результате ее обработки метионинаминопептидазой.
Технический результат достигался созданием группы изобретений, включающей в себя:
- технологию получения безметионинового IL-36Ra человека на основе штаммов, трансформированных плазмидным вектором, содержащим ген метионинаминопептидазы, с последующим выделением и концентрированием целевого продукта;
- варианты штаммов, трансформированных плазмидным вектором, содержащим ген метионинаминопептидазы штамм бактерий Escherichia coli BL21Star[DE3] (pET-IL3 6Raf, pBAD15A) и штамм бактерий Escherichia coli BL21Star[DE3](pET-IL36Raf, pET15A);
- пособы их конструирования, заключающаяся в трансформации штамма Escherichia coli BL21Star[DE3] плазмидными векторами с индукцией экспрессии генов рецепторного антагониста интерлейкина-36 человека (ИЛ-36РА) и метионинаминопептидазы (МАП).
- плазмидный экспрессионный вектор pBAD15A для трансформации штамма бактерий Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A)
- плазмидный экспрессионный вектор рЕТ15А штамм бактерий Escherichia coli BL21Star[DE3](pET-IL36Raf, рЕТ15А)
- последовательность ДНК, кодирующая метионинаминопептидазу, для получения плазмидных векторов.
Последовательность ДНК, кодирующая метионинаминопептидазу, была амплифицирована с использованием в качестве матрицы ДНК из культуры бактерий штамма Escherichia coli BL21Star[DE3]. По концам к гену были добавлены олигонуклеотиды, формирующие сайты рестрикции NdeI и XhoI. (Полученная последовательность ДНК приведена на SEQ ID No 1.)
Ген был обработан вышеуказанными рестриктазами и клонирован в подготовленный аналогичным образом вектор pBAD22, полученный из вектора pET22b+, с получением промежуточного плазмидного вектора pBAD22/MAP.
Затем ген метионинаминопептидазы с регуляторными последовательностями был клонирован из плазмиды pBAD22/MAP в плазмиду pACYC184 по сайтам рестрикции HindIII и SalI с получением экспрессионного плазмидного вектора pBAD15A, карта которого приведена на фиг. 2.
Плазмидный экспрессионный вектор pBAD15A содержит ген метионинаминопептидазы Е. coli (MAP), промотор pBADara, терминаторы транскрипции гена rrnB (rrnB Т1Т2), регуляторную последовательность araBAD оперона, ориджин репликации плазмид р15А, ген хлорамфеникол ацетил-трансферазы (CamR), рестрикционные сайты, необходимые для объединения отдельных фрагментов в векторе (SalI, HindIII, XhoI, NdeI).
Плазмидный экспрессионный вектор рЕТ15А был получен аналогичным образом. Ген метионинаминопептидазы Е. coli был клонирован в вектор pET302/NT-His по рестрикционным сайтам EcoRI и BamHI с получением промежуточной плазмиды рЕТ302/МАР. Затем ген метионинаминопептидазы с регуляторными последовательностями был клонирован из плазмиды рЕТ302/МАР в плазмиду pACYC184 по сайтам рестрикции HindIII и SalI с получением экспрессионного плазмидного вектора рЕТ15А, карта которого приведена на фиг. 3.
Плазмидный экспрессионный вектор рЕТ15А (фиг. 3), содержит ген метионинаминопептидазы Е. coli (MAP) под контролем регулируемого промотора Т7, терминатор транс-крипции Т7, ориджин репликации р15А, ген хлорамфеникол ацетил-трансферазы (CamR), рестрикционные сайты, необходимые для объединения отдельных фрагментов в векторе (EcoRI, BamHI, HindIII, SalI).
Полученные штаммы Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A) и Escherichia coli BL21Star[DE3](pET-IL36Raf, pET15A) характеризуются одинаковыми культурально-морфологическими и физико-биохимическими свойствами:
Культурально-морфологические особенности штаммов. Грам-отрицательные прямые палочки, размером 1,1-1,5×2,0-3,0 мкм, одиночные, спор и капсул не образуют. Каталазоположительные. Оксидазоотрицательные. Факультативные анаэробы. Клетки хорошо растут на простых питательных средах, содержащих и не содержащих ампициллин и хлоамфеникол, например, на среде LB. На агаризованной среде - колонии гладкие, круглые, слабо выпуклые, с ровным краем. В жидких средах образуют равномерную светорассеивающую суспензию, при хранении без перемешивания оседают на дно. Клетки растут в интервале температур от 8°С до 43°С, интервал для культивирования - 28-38°С, оптимум роста при 37°С. Интервал pH 5-8. Катализируют D-глюкозу и некоторые другие углеводы с образованием кислоты и газа, не сбраживают галактозу. Реакция Фогес-Проскауэра отрицательная, не образуют H2S, гидролизуют мочевину.
Характеристики полезного вещества, синтезируемого штаммами.
Рекомбинантный белок - рецепторный антагонист интерлейкинов-36 человека с отщепленным N-концевым остатком метионина (безметиониновый рецепторный антагонист интерлейкинов - 36 человека).
Активность штаммов. Продуктивность штаммов - рекомбинантный IL-36Ra составляет не менее 3% массы белков клеточного лизата при культивировании в условиях индукции.
Криоконсервация. В запаянных ампулах, штаммы лиофильно-высушенные в среде, содержащей 0,8-1,2% сахарозы и 0,8-1,2% маннитола, хранится при комнатной температуре в течении 20 лет.
Культивирование штаммов. Культивирование при температуре 28-38°С в термостате или качалке, в агаризованной (2% агара) или жидкой LB-среде, соответственно. Селективные условия - добавление 50-125 мкг/мл ампициллина и 20-40 мкг/мл хлорамфеникола.
Ферментация. Для ферментации полученных штаммов используют 1-2 кратную среду LB в 0,8-1,2 кратной среде М9 с добавлением 50-125 мкг/мл ампициллина и 20-40 мкг/мл хлорамфеникола. Культуры растят в колбах объемом 0,5-2,5 л (предпочтительно 2 л) при температуре 35-38°С (предпочтительно +37°С) до плотности 2-5 ОЕ/мл (предпочтительно 3 ОЕ/мл). При этой оптической плотности вносят индуктор - IPTG 0,1-1 мМ (предпочтительно 0,5 мМ). В случае штамма Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A) вносят также арабинозу 0,1-1% (предпочтительно 0,2%). Индукцию продолжают в течение 2-4 ч (предпочтительно 3 ч) при температуре 27-37°С (предпочтительно +30°С).
Метод очистки рекомбинантного ИЛ-36РА из биомассы штаммов-продуцентов включает в себя лизис клеток путем добавления Tris-буферного раствора, после чего полученный лизат осветляют, а затем очищают от примесных белков хроматографией последовательно на сорбенте Q FF (GE) и сорбенте Butyl-650 (Tosoh) и концентрирование ультрафильтрацией с помощью ячейки с перемешиванием Millipore Amicon Stirred Cell при использовании мембраны Sartorius Ultracel PLC10 с последующим диализом.
Лизис, как правило, проводят с использованием буферного раствора, содержащего от 30 до 70 мМ Tris-HCl (оптимально 50 мМ), pH от 6,8 до 7,2 (оптимально 7,0).
Лизат осветляют центрифугированием при 5-12 тыс. об./мин, после чего к полученному супернатанту добавляют раствор кальция хлорида до конечной концентрации от 20 до 40 мМ (оптимально 30) и раствор тринатрия фосфата до конечной концентрации от 10 до 30 мМ (оптимально 20), перемешивают, а затем снова осветляют центрифугированием при 5-12 тыс. об./мин.
Хроматографию на Q FF (GE) проводят на сорбенте уравновешенным буферным раствором, содержащим 30-70 мМ Tris-HCl (оптимально 50 мМ), pH 6,8-7,2 (оптимально 7,0), с последующей отмывкой буферным раствором, содержащим 30-70 мМ Tris-HCl (оптимально 50 мМ), 0-0,3M NaCl (оптимально 0,15), pH 6,8-7,2 (оптимально 7,0). Колонку регенерируют буферным раствором, содержащего 30-70 мМ Tris-HCl (оптимально 50 мМ), 1,5-2М NaCl (оптимально 2М), pH 6,8-7,2 (оптимально 7,0).
Очистка целевого белка от примесных белков на сорбенте Butyl-650 (Tosoh) проводится следующим образом. Добавляют аммония сульфат до 0,15-0,5 М (оптимально 0,3). К несвязавшейся фракции после хроматографии на Q FF (GE), содержащую ИЛ-36РА, добавляют аммония сульфат до 0,15-0,5 М (оптимально 0,3), затем наносят на сорбента Butyl-650 (Tosoh), уравновешенный 0,3 ± 0,05 л буферным раствором, содержащим 30-70 мМ Na2HPO4 (оптимально 50 мМ), 0,15-0,5 М (NH4)2SO4 (оптимально 0,3), pH 5,8-6,2 (оптимально 6,0). Затем ИЛ-36РА элюируют буферным раствором, содержащим 30-70 мМ Na2HPO4 (оптимально 50 мМ), pH 5,8-6,2 (оптимально 6,0). Колонку регенерируют 0,5 ± 0,1 л дистиллированной воды.
Концентрирование ИЛ-36РА проводят методом ультрафильтрации с помощью ячейки с перемешиванием Millipore Amicon Stirred Cell с установленной мембраной Sartorius Ultracel PLC 10 с пределом отсечения 10 кДа, а затем проводят смену раствора диализом белка против раствора, содержащего 30-70 мМ натрия цитрата (оптимально 50 мМ), pH 5,8-6,2 (оптимально 6,0).
После этого раствор белка может быть при необходимости стерилизован с использованием шприцевых фильтров Millipore Millex с диаметром пор 0,22 мкм.
После всех стадий очистки получаемый ИЛ-36РА имеет чистоту >95% по ОФ-ВЭЖХ, имеет <5% примеси непроцессированной формы с неотщепленный инициаторным остатком метионина и <5% дезамидированной формы.
При необходимости для лучшего хранения технология получения ИЛ-36РА может быть дополнена введением в целевой продукт 20-100 мМ нитратного буферного раствора (оптимально 50 мМ) с pH 5,5-6,5 (оптимально 6,0), твин-80 в количестве 0,01-1% и ЭДТА в количестве 0,1-10 мМ.
Полученный препарат был апробирован на модели псориазоподобного дерматита, вызванного накожной аппликацией агониста Толл-подобных рецепторов 7 и 8 имихимода [van der Fits L. et al. Imiquimod-induced psoriasislike skin inflammation in mice is mediated via the IL-23/IL-17 axis // J. Immunol. Baltim. Md 1950. 2009. Vol. 182, №9. P. 5836-5845.]. Было показано, что ежедневное подкожное введение разработанного препарата рекомбинантного ИЛ-36РА человека в дозах 50 ± 1 и 10 ± 1 мкг/мышь значительно снижает тяжесть экспериментального дерматита, вызванного имихимодом. При этом эффект появляется в пределах 3-4 дней после первого введения препарата и превосходит эффект контрольного препарата - метотрексата.
Сущность изобретения иллюстрируется последовательностями и рисунками.
Фиг. 1. Нуклеотидная последовательность гена метионинаминопептидазы Е. coli.
Фиг. 2. Карта плазмидного вектора pBAD15A, несущего последовательность
гена метионинаминопептидазы, где:
MAP - ген метионинаминопептидазы Е. coli
pBADara promoter - прокариотический промотор, необходимый для инициации транскрипции генов
rrnB Т1Т2 terminators - терминаторы транскрипции гена rrnB E. coli
araBAD operon - регуляторная последовательность araBAD оперона, необходимая для регуляции экспрессии генов, находящихся под контролем промотора pBADara
р15А origin - сайт начала репликации плазмид
CamR - последовательность гена хлорамфеникол ацетилтрансферазы, обеспечивающей устойчивость бактерий к хлорамфениколу
SalI, HindIII, XhoI, NdeI - рестрикционные сайты, необходимые для объединения отдельных фрагментов в векторе
Фиг. 3. Карта плазмидного вектора рЕТ15А, несущего последовательность гена метионинаминопептидазы, где
MAP - последовательность гена метионинаминопептидазы
Т7 promoter - промотор фага Т7, необходимый для инициации транскрипции генов
Т7 terminator - терминатор транскрипции генов фага Т7
lacI - последовательность гена lacI, регулирующего экспрессию генов, находящихся под контролем промотора Т7.
р15А origin - сайт начала репликации плазмид
CamR - последовательность гена хлорамфеникол ацетилтрансферазы, обеспечивающей устойчивость бактерий к хлорамфениколу EcoRI, BamHI, HindIII, SalI - рестрикционные сайты, необходимые для объединения отдельных фрагментов в векторе
Фиг. 4. Электрофореграмма лизатов биомассы различных штаммов-продуцентов ИЛ-36РА после культивирования в условиях добавления индукторов и без их добавления. Толстой синей стрелкой отмечена полоса, соответствующая ИЛ-36РА; тонкой белой стрелкой отмечена полоса, соответствующая МАП.
1 - Лизат биомассы штамма Escherichia coli BL21Star[DE3]
2 - Лизат биомассы штамма Escherichia coli BL21Star[DE3](pET-IL36Raf) без индукции
3 - Лизат биомассы штамма Escherichia coli BL21Star[DE3](pET-IL36Raf) после индукции
4 - Лизат биомассы штамма Escherichia coli BL21Star[DE3](pET-IL36Raf) без индукции, иной метод лизиса
5 - Лизат биомассы штамма Escherichia coli BL21Star[DE3](pET-IL36Raf) после индукции, иной метод лизиса
6 - Лизат биомассы штамма Escherichia coli BL21Star[DE3](pET-IL36Raf, рЕТ15А) без индукции
7 - Лизат биомассы штамма Escherichia coli BL21Star[DE3](pET-IL36Raf, рЕТ15А) после индукции
8 - Лизат биомассы штамма Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A) без индукции
9 - Лизат биомассы штамма Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A) после индукции
Фиг. 5. Сравнение продукции ИЛ-36РА различными штаммами-продуцентами с помощью твердофазного ИФА с использованием моноклональных антител к ИЛ-36РА. Обозначения соответствуют присутствующей в штамме плазмиде с геном МАП:
«pBAD15A» - штамм Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A)
«pET15A» - штамм Escherichia coli BL21 Star[DE3](pET-IL36Raf, pET15A) «без коэкспрессии с МАП» - штамм Escherichia coli BL21Star[DE3](pET-IL36Raf)
Фиг. 6. Сравнение примеси непроцессированной формы ИЛ-36РА, содержащей инициаторный остаток метионина, в образцах ИЛ-36РА, полученных от различных штаммов-продуцентов. Обозначения соответствуют присутствующей в штамме плазмиде с геном МАП:
«pBAD15A» - штамм Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A)
«pET15A» - штамм Escherichia coli BL21Star[DE3](pET-IL36Raf, pET15A) «без коэкспрессии с МАП» - штамм Escherichia coli BL21Star[DE3](pET-IL36Raf)
Фиг. 7. Электрофореграмма фракций, полученных при хроматографической очистке ИЛ-36РА. Стрелкой отмечена полоса, соответствующая ИЛ-36РА.
1 - осветленный лизат биомассы штамма-продуцента ИЛ-36РА Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A)
2 - фракция, не связавшаяся с Q
3 - фракция, не связавшаяся с Butyl-650
4 - фракция, элюировавшаяся с Butyl-650
5 - проходящая фракция после ультрафильтрационного концентрирования
6 - маркер молекулярных весов
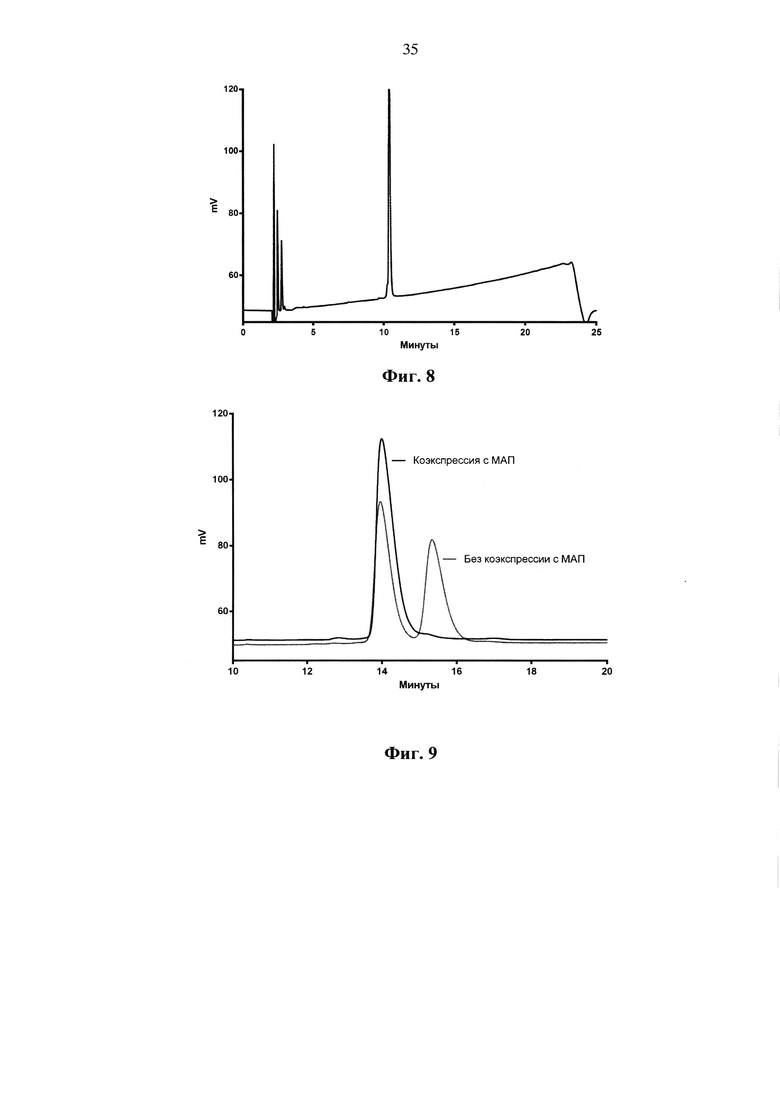
Фиг. 8. Хроматограмма ОФ-ВЭЖХ разделения образца ИЛ-36РА после хроматографической очистки.
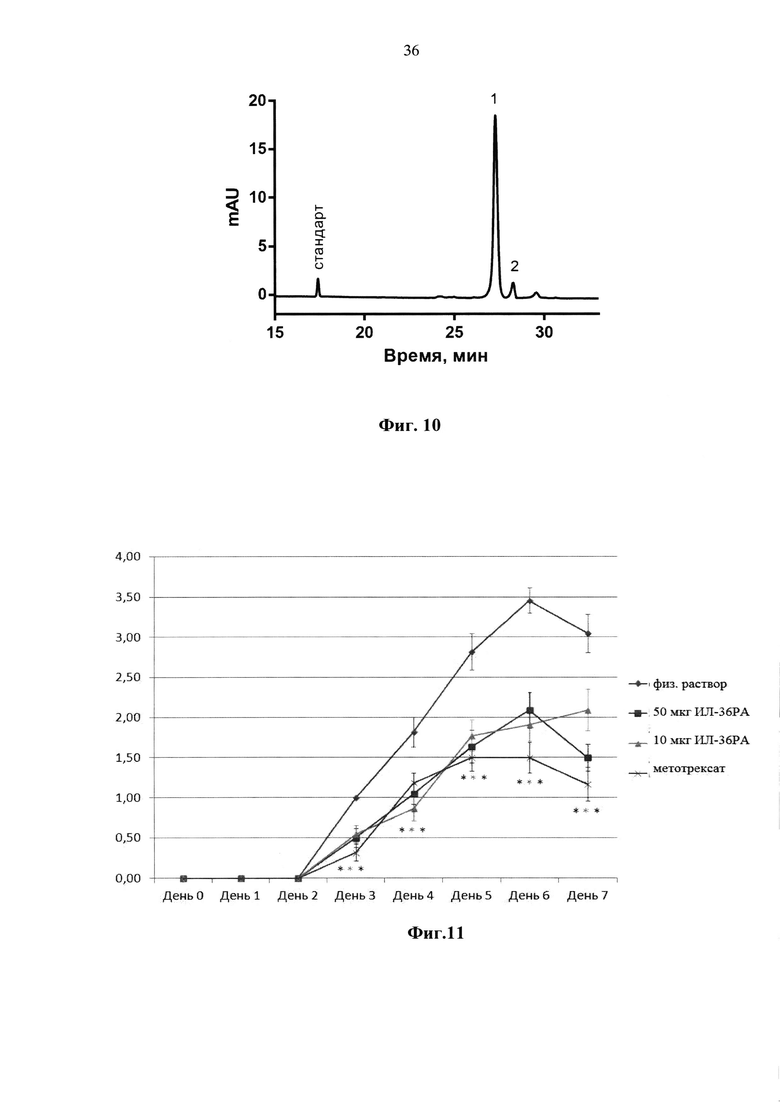
Фиг. 9. Наложение хроматограмм ОФ-ВЭЖХ разделения образцов ИЛ-36РА, полученных при коэкспресии с МАП и без коэкспресии с МАП.
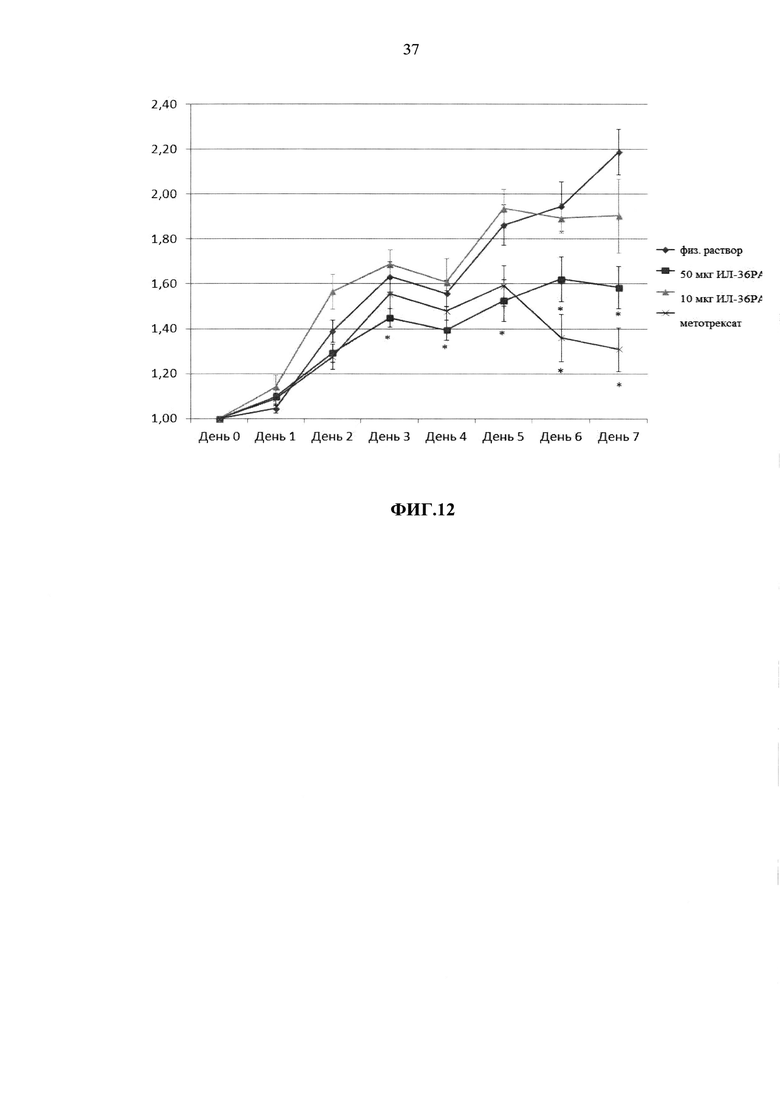
Фиг.10. Электрофореграмма разделения нативной (1) и дезамидированной (2) форм ИЛ-36РА в КЗЭФ.
Фиг. 11. Изменение индекса PASI в опытных и контрольной группах (*р<0,01 по сравнению с соответствующими значениями контрольной группы). По оси ординат - степень выраженности признаков псориазоподобного дерматита в баллах.
Фиг. 12. Изменение толщины уха в месте нанесения имихимода в опытных и контрольной группах (*р<0,05 по сравнению с соответствующими значениями контрольной группы). По оси ординат - индекс изменения толщины уха в месте нанесения имихимода.
Сущность и промышленная применимость заявляемой группы изобретений иллюстрируется следующими примерами
Пример 1. Конструирование экспрессионных плазмидных векторов.
Конструирование промежуточной плазмиды pBAD22. Плазмида pBAD22 содержит в своем составе ген бета-лактамазы, обеспечивающей устойчивость к антибиотикам бета-лактамной группы, сайт репликации pBR322, а также регулирующие элементы и промотор оперона araBAD, позволяющие индуцировать и регулировать экспрессию целевого белка посредством изменения концентрации арабинозы в среде.
На первом этапе модифицировали плазмиду pBAD (ThermoFisher Scientific, USA): удаляли участок плазмиды, содержащий сайт рестрикции NdeI, а исходный полилинкер заменяли на полилинкер плазмиды pET22b(+) (Novagen, USA). С этой целью проводили амплификацию фрагмента плазмиды pBAD с помощью пары 5'-фосфорилированных праймеров (длина продукта 3885 п.н.):
5'-GCTGCATGTGTCAGAGGTT-3'
5'-GCACAGATGCGTAAGGAGAA-3'
Допустимо использование праймеров в интервале концентраций от 5 до 25 мкМ, однако лучший результат достигается при использовании праймеров в концентрации 10 мкМ. Амплифицированный фрагмент обрабатывали лигазой, что привело к его замыканию в кольцо. Количество добавляемой лигазы может варьироваться от 0.5 до 5 ед., тем не менее, оптимальное количество - 1 ед. на реакцию. Затем полученную плазмиду использовали в качестве матрицы во второй ПЦР со следующей парой праймеров (длина продукта 3793 п.н.):
5'-ATGCATATGTATATCTCCTTCTTAAAGTT-3'
5'-TAAGACGTCTCCAGCTTGGCTGT-3'
Допустимо использование праймеров в интервале концентраций от 5 до 25 мкМ, однако лучший результат достигается при использовании праймеров в концентрации 10 мкМ. Параллельно проводили ПЦР участка полилинкера на матрице pET22b(+) с помощью следующей пары праймеров (длина продукта 256 п.н.):
5'-TAATACGACTCACTATAGGG-3'
5'-AGCGACGTCTTATCAGTGGTGGTGGTGGT-3'
Допустимо использование праймеров в интервале концентраций от 5 до 25 мкМ, однако лучший результат достигается при использовании праймеров в концентрации 10 мкМ. Концы амплифицированных фрагментов ДНК открывали с помощью рестриктаз NdeI и AatII и направленно лигировали друг с другом. Количество добавляемых рестриктаз может варьироваться от 0.1 до 1 ед., тем не менее, оптимальное количество - 0.25 ед. каждой рестриктазы на 1 реакцию.
В результате была получена плазмида pBAD22. Правильность сборки модифицированного участка плазмиды подтверждали секвенированием.
Конструирование промежуточных плазмид рЕТ302/МАР и pBAD22/MAP Для получения промежуточных экспрессионных векторов использовали коммерческую плазмиду pET302/NT-His (Thermo Fisher Scientific, USA) и плазмиду pBAD22.
Плазмида pET302/NT-His содержит в своем составе регулирующие элементы и промотор T7lac, позволяющие индуцировать и регулировать экспрессию целевого белка посредством изменения концентрации IPTG в среде, а также ген бета-лактамазы, обеспечивающей устойчивость к антибиотикам бета-лактамной группы, и сайт репликации pBR322.
На первом этапе последовательность гена метионинаминопептидазы (Фиг. 1) амплифицировали с геномной ДНК клеток Е. coli BL21[DE3] с помощью следующей пары праймеров:
5'-GAACATATGGCTATCTCAATCAAGACCCCA-3'
5'-GAACTCGAGTTATTATTCGTCGTGCGAGATTA-3'
Допустимо использование праймеров в интервале концентраций от 5 до 25 мкМ, однако лучший результат достигается при использовании праймеров в концентрации 10 мкМ. Амплифицированный фрагмент ДНК размером 800 п.н., концы которого открывали с помощью рестриктаз NdeI и XhoI, клонировали в плазмиду pBAD22, линеаризованную с помощью этих же рестриктаз. Количество добавляемых рестриктаз может варьироваться от 0.1 до 1 ед., тем не менее, оптимальное количество - 0.25 ед. каждой рестриктазы на 1 реакцию.
Для клонирования гена метионинаминопептидазы в плазмиду pET302/NT-His использовали следующую пару праймеров:
5'-GAATTCAGCTATCTCAATCAAGACCCCA-3'
5'-GGATCCTTATTATTCGTCGTGCGAGATTA-3'
Допустимо использование праймеров в интервале концентраций от 5 до 25 мкМ, однако лучший результат достигается при использовании праймеров в концентрации 10 мкМ. Амплифицированный фрагмент ДНК размером 800 п. н., концы которого открывали с помощью рестриктаз EcoRI и BamHI, клонировали в плазмиду pET302/NT-His, линеаризованную с помощью этих же рестриктаз. Количество добавляемых рестриктаз может варьироваться от 0.1 до 1 ед., тем не менее, оптимальное количество - 0.25 ед. каждой рестриктазы на 1 реакцию.
В результате клонирования были получены плазмиды pBAD22/MAP и рЕТ302/МАР, соответственно. Правильность сборки плазмид подтверждали секвенированием.
На втором этапе в полученных плазмидах сайт репликации pBR322 и ген бета-лактамазы были заменены на сайт репликации р15А и ген устойчивости к хлорамфениколу из плазмиды pACYC184 (NEB). Данная модификация необходима для эффективной коэкспрессии двух белков с различных плазмид внутри одной клетки.
Конструирование экспрессионного вектора pBAD15A
Фрагмент последовательности ДНК, содержащий ген метионинаминопептидазы и регулирующие его экспрессию последовательности, амплифицировали с плазмиды pBAD22/MAP с помощью следующей пары праймеров:
5'-GATAAGCTTCTGTGCGCTGCATGTGTCAGAG-3'
5'-GAAGTCGACGTCCTACTCAGGAGAGCGTTCAC-3'
Допустимо использование праймеров в интервале концентраций от 5 до 25 мкМ, однако лучший результат достигается при использовании праймеров в концентрации 10 мкМ. Амплифицированный фрагмент ДНК размером 2529 п.н., концы которого открывали с помощью рестриктаз HindIII и SalI, клонировали в плазмиду pACYC184, линеаризованную с помощью этих же рестриктаз. Количество добавляемых рестриктаз может варьироваться от 0.1 до 1 ед., тем не менее, оптимальное количество - 0.25 ед. каждой рестриктазы на 1 реакцию.
В результате клонирования была получена плазмида pBAD15A (Фиг. 2), содержащая ген метионинаминопептидазы под контролем регулируемого арабинозного промотора, сайт репликации р15А и ген устойчивости к хлорамфениколу для проведения селекции. Правильность сборки плазмиды подтверждали секвенированием.
Праймеры:
pBAD-HindIII-F 5'-GATAAGCTTCTGTGCGCTGCATGTGTCAGAG-3' FW Расположение - 3536-3557 п.н. плазмиды pBAD22/MAP. pBAD-SalI-R 5'-GAAGTCGACGTCCTACTCAGGAGAGCGTTCAC-3' RV Расположение - 1446-1468 п.н. плазмиды pBAD22/MAP.
Конструирование экспрессионного вектора рЕТ15А
Фрагмент последовательности ДНК, содержащий ген метионинаминопептидазы и регулирующие его экспрессию последовательности, амплифицировали с плазмиды рЕТ302/МАР с помощью следующей пары праймеров:
5'-GTTAAGCTTCGGGTTACTGATGATGAACATG-3'
5'-GGAGTCGACATCCGGATATAGTTCCTCCTTTC-3'
Допустимо использование праймеров в интервале концентраций от 5 до 25 мкМ, однако лучший результат достигается при использовании праймеров в концентрации 10 мкМ. Амплифицированный фрагмент ДНК размером 3755 п.н., концы которого открывали с помощью рестриктаз HindIII и SalI, клонировали в плазмиду pACYC 184, линеаризованную с помощью этих же рестриктаз. Количество добавляемых рестриктаз может варьироваться от 0.1 до 1 ед., тем не менее, оптимальное количество - 0.25 ед. каждой рестриктазы на 1 реакцию.
В результате клонирования была получена плазмида рЕТ15А (Фиг. 3), содержащая ген метионинаминопептидазы под контролем регулируемого Т7 промотора, сайт репликации р15А и ген устойчивости к хлорамфениколу для проведения селекции. Правильность сборки плазмиды подтверждали секвенированием.
Праймеры:
pET-HindIII-F 5'-GTTAAGCTCCGGGTTACTGATGATGAACATG-3' FW Расположение - 3788-3809 п.н. плазмиды рЕТ302/МАР.
pRh15A-SalI-R 5'-GGAGTCGACATCCGGATATAGTTCCTCCTTTC RV
Расположение - 1048-1070 п.н. плазмиды рЕТ302/МАР.
Пример 2. Получение штаммов культивируемых клеток - продуцентов безметионинового ИЛ-36РА человека
Для экспрессии гена ИЛ-36РА использовали созданный нами ранее плазмидный экспрессионный вектор pET-IL36Raf (RU 2582569, 2016). Электрокомпетентные клетки Е. coli BL21 [DE3] трансформировали смесью плазмид pET-IL36Raf и рЕТ15А в эквимолярном соотношении. Трансформацию проводили с помощью аппарата Bio-Rad MicroPulser (Bio-Rad, США) согласно инструкции производителя. Положительные трансформанты отбирали на агаризованной среде, содержащей смесь двух антибиотиков (ампициллин в конечной концентрации от 50 до 125 мкг/мл, предпочтительно 100 мкг/мл; и хлорамфеникол в конечной концентрации от 20 до 40 мкг/мл, предпочтительно 25 мкг/мл), что гарантировало содержание обеих плазмид в отобранных колониях. Наличие в трансформантах обеих плазмид также подтверждали путем ПЦР с использованием двух пар праймеров, специфических для гена ИЛ-36РА и гена МАП, соответственно. Полученный штамм получил название Escherichia coli BL21Star[DE3](pET-IL36Raf, рЕТ15А).
Для культивирования полученного штамма использовали 1-2х (предпочтительно 1,5х) среду LB (10-20 г/л (предпочтительно 15 г/л) триптона, 5-10 г/л (предпочтительно 7,5 г/л) дрожжевого экстракта, 4-6 (предпочтительно 5 г/л) хлорида натрия) в 0,8-1,2х (предпочтительно 1х) среде М9 (Na2HPO4 3,84-5,76 мМ (предпочтительно 4,8 мМ), KH2PO4 1,76-2,64 мМ (предпочтительно 2,2 MM); NaCl 0,68-1,02 мМ (предпочтительно 0,85 мМ), NH4Cl 1,5-2,24 мМ (предпочтительно 1,87 мМ), MgSO4 0,8-1,2 мМ (предпочтительно 1 мМ), CaCl2 0,08-0,12 мМ (предпочтительно 0,1 мМ) с добавлением антибиотиков в указанных выше концентрациях. Культуру засевали до плотности 0,05-0,5 ОЕ (предпочтительно 0,1 ОЕ), растили 12-18 часов (предпочтительно 16 часов) при температуре 35-38°С (предпочтительно +37°С) и скорости перемешивания 150-300 об/мин (предпочтительно 250 об/мин). Затем эти культуры инокулировали в 1-2х LB (предпочтительно 1,5х LB) + 0,8-1,2х (предпочтительно 1x) М9 объемом 50-2500 мл (предпочтительно 200 мл) до плотности 0,1-1 ОЕ (предпочтительно 0,3 ОЕ) и растили в колбах объемом 0,5-2,5 л (предпочтительно 2 л) при температуре 35-38°С (предпочтительно +37°С) при скорости перемешивания 150-300 об/мин (предпочтительно 250 об/мин) до плотности 2-5 ОЕ/мл (предпочтительно 3 ОЕ/мл). При этой оптической плотности вносили индуктор - IPTG 0,1-1 мМ (предпочтительно 0,5 мМ).
Индукцию продолжали в течение 2-4 ч (предпочтительно 3 ч) при температуре 27-37°С (предпочтительно +30°С) при скорости перемешивания 150-300 об/мин (предпочтительно 250 об/мин). Затем биомассу бактерий собирали центрифугированием со скоростью 2000-12000 g (предпочтительно 8000 g) при температуре 3-18°С (предпочтительно +4°С) в течение 15-60 мин (предпочтительно 30 мин). Вначале экспрессию белка ИЛ-36РА подтверждали путем электрофореза тотальных лизатов клеток (Фиг. 4). Затем уровень продукции ИЛ-36РА различными штаммами-продуцентами оценивали с помощью твердофазного ИФА с использованием моноклональных антител к ИЛ-36РА, полученных во ФГУП «ГосНИИ ОЧБ» (Фиг. 5). Примесь непроцессированной формы ИЛ-36РА, содержащей инициаторный остаток метионина, оценивали с помощью ОФ-ВЭЖХ (Фиг. 6, 9).
Пример 3. Получение штамма Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A).
Получение штамма Escherichia coli BL21Star[DE3](pET-IL36Raf, pBAD15A) и все работы с ним проводили по технологии, описанной в примере 2 с двумя отличиями: при его создании использовали плазмиду pBAD15A, а не рЕТ15А, и при индукции вносили также арабинозу 0,2%).
Пример 4. Выделение рецепторного антагониста ИЛ-36.
После размораживания 150 ± 15 г биомассы бактерий из морозильной камеры (- 70°С) до комнатной температуры к ней добавляли 1400 ± 50 мл буфера, содержащего от 30 до 70 мМ Tris-HCl (оптимально 50 мМ), pH от 6,0 до 7,2 (оптимально 7,0), и перемешивали на электрической мешалке в течение 45-75 минут (оптимально 60) до получения гомогенного раствора. Объем полученного лизата составлял 1500 ± 100 мл. Далее лизат переливали в пробирки для центрифугирования Beckman, помещали в ротор JA-10 и центрифугировали при скорости от 5000 до 12000 об./мин (оптимально 10000) в течение в течение 45-75 минут (оптимально 60). Осадок удаляли, а к супернатанту добавляли раствор кальция хлорида до конечной концентрации от 20 до 40 мМ (оптимально 30) и раствор тринатрия фосфата до конечной концентрации от 10 до 30 мМ (оптимально 20). Полученный раствор перемешивали на электрической мешалке в течение ночи. Далее полученный раствор переливали в пробирки для центрифугирования Beckman, помещали в ротор JA-10 и центрифугировали при скорости от 5000 до 12000 об./мин (оптимально 10000) в течение в течение 45-75 минут (оптимально 60). Осадок удаляли, а супернатант наносили на хроматографический сорбент. Эта стадия подготовки сырья позволила удалить большую часть механических примесей, которые необратимо забивают хроматографический сорбент.
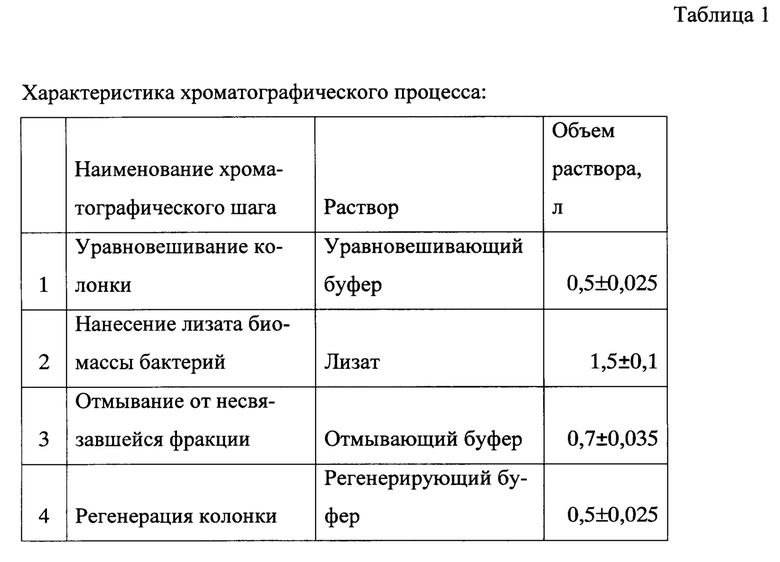
Хроматографическая очистка на сорбенте Q FF (300 ± 10 мл) позволяетя очистить ИЛ-36РА от части примесных белков, а также липополисахаридов (ЛПС) и ДНК. Условия хроматографии подбирали таким образом, чтобы рецепторный антагонист ИЛ-36, в отличие от примесей, не связывался с сорбентом и оставался во фракции, не связавшейся с сорбентом. Фракцию собирали в объеме 2200 ± 200 мл, начиная с момента повышения УФ-поглощения проходящей фракции при 280 нм на 30 mAU по сравнению с уравновешивающим буфером.
Объем сорбента: 300 ± 10 мл
Уравновешивающий буфер: 30-70 мМ Tris-HCl (оптимально 50 мМ), pH 6,0-7,2 (оптимально 7,0) (0,5 ± 0,025 л)
Отмывающий буфер: 30-70 мМ Tris-HCl (оптимально 50 мМ), 0-0,3M NaCl (оптимально 0,15), pH 6,0-7,2 (оптимально 7,0) (0,7 ± 0,035 л) Регенерирующий буфер: 30-70 мМ Tris-HCl (оптимально 50 мМ), 1,5-2М NaCl (оптимально 2М), pH 6,0-7,2 (оптимально 7,0) (0,5 ± 0,025 л).
Хроматографическая очистка на сорбенте Butyl-650 (100 ± 5 мл) предназначена для очистки целевого белка от примесных белков. На сорбент наносили не связавшуюся с сорбентом Q FF фракцию с добавлением аммония сульфата до 0,15-0,5 М (оптимально 0,3). Условия хроматографии подбирали таким образом, чтобы рецепторный антагонист ИЛ-36, в отличие от большинства примесей, связывался с сорбентом и затем элюировался при определенных условиях.
Объем сорбента: 100 ± 5 мл
Уравновешивающий буфер: 30-70 мМ Na2HPO4 (оптимально 50 мМ), 0,15-0,5 М (NH4)2SO4 (оптимально 0,3), pH 5,8-6,2 (оптимально 6,0) (1,5 ± 0,2 л) Элюирующий буфер: 30-70 мМ Na2HPO4 (оптимально 50 мМ), pH 5,8-6,2 (оптимально 6,0) (0,4 ± 0,05 л) Регенерирующий буфер: дистиллированная вода

Принципиально возможным представляется выделение ИЛ-36 исключительно с помощью гидрофобной хроматографии. В этом случае, однако, срок службы гидрофобного сорбента будет существенно сокращен, поэтому использование двухстадийной хроматографической очистки представляется более экономически выгодным.
Концентрирование белка проводили методом ультрафильтрации с помощью ячейки с перемешиванием Millipore Amicon Stirred Cell с установленной мембраной Sartorius Ultracel PLC 10 с пределом отсечения 10 кДа. Образец концентрировали до 10 ± 0,3 мг/мл. Затем проводили диализ белка против раствора, содержащего 30-70 мМ натрия цитрата (оптимально 50 мМ), pH 5,8-6,2 (оптимально 6,0), в диализном мешке MFPI CelluSep RC Т2 с пределом отсечения 6-8 кДа. После этого раствор белка стерилизовали с использованием шприцевых фильтров Millipore Millex с диаметром пор 0,22 мкм. Общие потери ИЛ-36РА на всех этапах очистки составили 37,5 ± 9,3%.
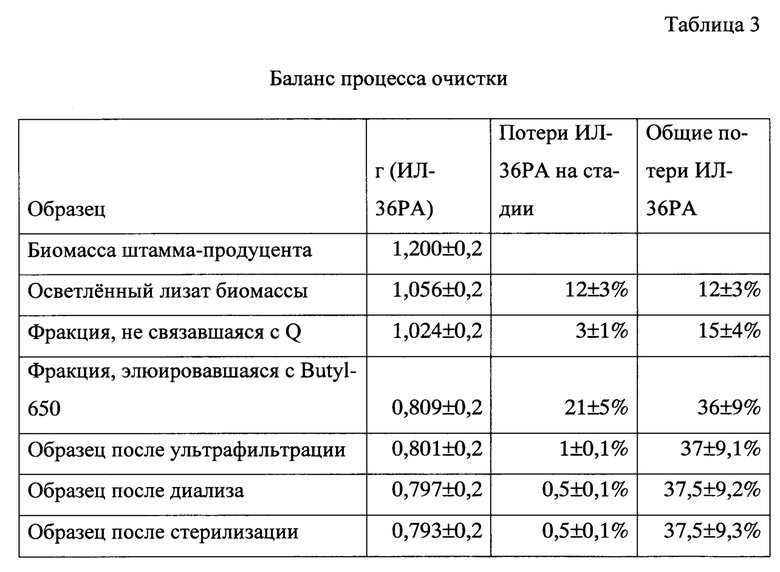
Электрофореграмма образцов с различных этапов очистки ИЛ-36РА представлена на Фиг. 7.
Пример 5. Анализ чистоты и гомогенности полученного ИЛ-36РА
Для определения количества белковых примесей в полученном ИЛ-36РА пробы ИЛ-36РА разделяли методом ВЭЖХ в обратной фазе на колонке Phenomenex Jupiter С18. 10 мкг (± 2 мкг) ИЛ-36РА в 20 мкл (± 4 мкл) раствора наносили на колонку в 50 мМ (±5 мМ) фосфатном буфере, pH 6,0 (допустимый интервал pH 5,8-6,2). Элюцию проводили градиентом ацетонитрила с 30% до 70% в 0,1% ТФУ, pH 2,5 (± 0,2), за 20 минут (± 5 мин) при скорости потока 1,5 мл/мин и температуре +35°С (± 2°С). Детектирование проводили на УФ-детекторе при длине волны 220 нм. Типовая хроматограмма ОФ-ВЭЖХ разделения ИЛ-36РА по этой методике представлена на Фиг. 8. Для определения примеси формы ИЛ-36РА, содержащей неотщепленный N-концевой остаток метионина, проводили ОФ-ВЭЖХ по методу, описанному выше. При этом элюцию проводили градиентом ацетонитрила с 39,6% до 40,8%), в остальном условия были такими же. Типовая хроматограмма ОФ-ВЭЖХ разделения ИЛ-36РА по этой методике представлена на Фиг. 9. Для определения примеси дезамидированной формы ИЛ-36РА проводили капиллярный зонный электрофорез (КЗЭФ) на приборе «Капель-105М» (Люмэкс, Россия). Для анализа использовали непокрытые кварцевые капилляры с внутренним диаметром 50 мкм и полной длиной 50 см (± 5 см) (эффективная длина 40 см (± 5 см) (Люмэкс, Россия). Капилляр термостатировали при 25°С (± 2°С), детекцию осуществляли на длине волны 214 нм. В качестве фонового электролита использовали 0,12 М (± 20 мМ) раствор дигидрофосфата калия (pH 3 ((± 0,2)). Перед проведением анализа капилляр промывали 0,1М (± 20 мМ) раствором гидроксида натрия, деионизованной водой и фоновым электролитом по 3 мин под давлением 2000 мбар ((± 100 мбар). Проба для капиллярного зонного электрофореза представляла собой водный раствор рекомбинантного рецепторного антагониста интерлейкина-36 человека с концентрацией 0,5 мг/мл (допустимый диапазон концентраций 0,4 мг/мл - 0,6 мг/мл), содержащий 2 мкг (± 0.2 мкг) внутреннего стандарта - синтезированного пептида Trp-Glu-His-Arg. Ввод пробы осуществляли гидродинамически под давлением 40 мбар в течение 5 с. Анализ проводили при напряжении 10 кВ (± 2 кВ) в течение 35 минут (± 5 мин). Инструментальный контроль, сбор и регистрацию электрофоретических данных производили с помощью системы «Эльфоран» (Люмэкс, Россия). Для идентификации пиков интактного белка и его дезамидированной формы рассчитывали относительное время миграции каждого из этих пиков (RMT), равное отношению времени миграции пика белка ко времени миграции внутреннего стандарта. Содержание дезамидированной формы белка рассчитывали по относительной площади пика (в процентах), равной отношению площади пика дезамидированной формы к сумме площадей пиков, соответствующих рекомбинантному рецепторному антагонисту интерлейкина-36 человека. На Фиг. 10 представлена электрофореграмма разделения нативной (А) и дезамидированной (Б) форм ИЛ-36РА в КЗЭФ.
После всех стадий очистки по результатам анализов получаемый ИЛ-36РА имеет чистоту >95% по ВЭЖХ, имеет <5% примеси непроцессированной формы с неотщепленный инициаторным остатком метионина и <5% дезадированной формы.
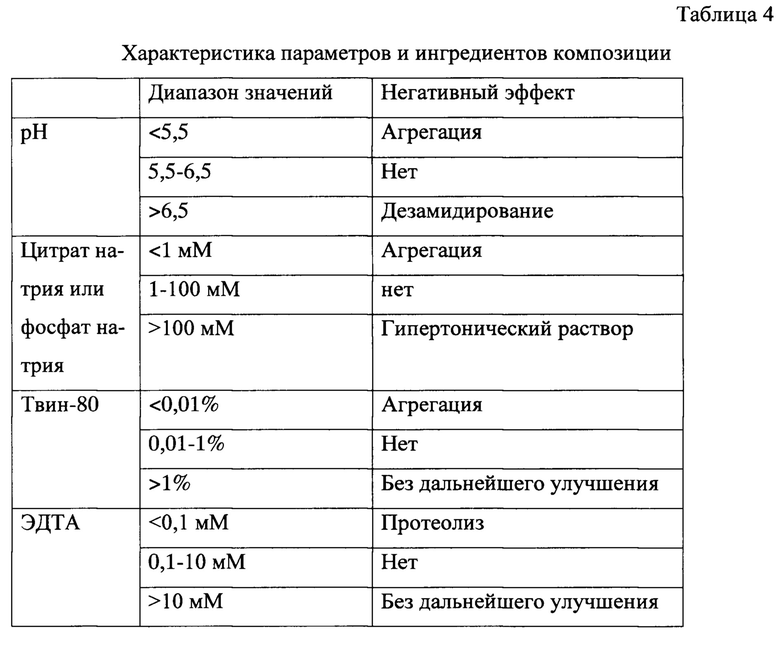
Пример 6. Создание композиции рекомбинантного ИЛ-36РА человека, устойчивой при хранении. При отработке условий хроматографической очистки ИЛ-36РА было обнаружено, что при экспозиции целевого белка pH>7,0 наблюдается появление значительной примеси дезамидированной формы белка (Фиг. 10). Поэтому для получения гомогенного продукта условиях очистки были модифицированы так, чтобы pH был всегда не выше 7,0. Кроме того, при хранении белка в фосфатном буфере с pH 7,4 также было зафиксировано накопление дезамидированной формы. Однако при pH <5,5 наблюдалась агрегация ИЛ-36РА, т.к. эти значения слишком близки к изоэлектрической точке белка - 5,28. Для стабилизации раствора ИЛ-36РА была разработана композиция, включающая 1-100 мМ цитратный или фосфатный буфер (оптимально 5 мМ) с pH 5,5-6,5 (оптимально 6,0), в котором по данным анализа стабильности дезамидирования белка не происходит. Также выбранная концентрация цитрата натрия или фосфата натрия пригодна для инъекционного введения человеку. Кроме того, для предотвращения агрегации ИЛ-36РА в состав композиции были введены твин-80 в количестве 0,01-1%. В концентрациях <0,01% твин-80 не уменьшал способность препарата к агрегации, концентрации твин-80>1% не показывали дальнейшего улучшения свойств препарата. Для защиты препарата от возможного протеолиза в композицию был введен ингибитор металлопротеаз ЭДТА в количестве 0,1-10 мМ. Описанные эффекты суммированы в таблице 4.
Пример 7. Оценка биологической активности композиции ИЛ-36РА на модели псориазоподобного дерматита у мышей
Для определения биологической активности полученного ИЛ-36РА применяли модель псориазоподобного дерматита у мышей индуцированного обработкой имихимодом - агонистом Толл-подобных рецепторов 7 и 8 [van derFits L. et al. Imiquimod-induced psoriasis-like skin inflammation in mice is mediated via the IL-23/IL-17 axis // J. Immunol. Baltim. Md 1950. 2009. Vol. 182, №9. P. 5836-5845.]. Имихимод применяли накожно в виде крема Алдара (5% имихимод). Эта модель псориаза широко применяется в научной практике и многократно описана в литературе [Stjernholm Т. et al. Leptin-deficiency in mice counteracts imiquimod (IMQ)-induced psoriasis-like skin inflammation while leptin stimulation induces inflammation in human keratinocytes // Exp. Dermatol. 2016.; Li R. et al. Increased βTrCP are associated with imiquimod-induced psoriasis-like skin inflammation in mice via NF-κВ signaling pathway // Gene. 2016.; Huang S.-W. et al. Azithromycin impairs TLR7 signaling in dendritic cells and improves the severity of imiquimod-induced psoriasis-like skin inflammation in mice // J. Dermatol. Sci. 2016.].
Для индукции псориазоподобного дерматита крем Алдара наносили на кожу правого уха мышей трех групп один раз в день в дозе 55-68 мкг (оптимально 62,5 мкг), ежедневно, в течение 7-ми дней. Животные были разделены на 4 группы. Первая группа получала инъекцию 200 ± 5 мкл физиологического раствора подкожно в область холки ежедневно 1 раз в день; вторая и третья группа получала 50 ± 1 или 10 ± 1 мкг/мышь ИЛ-36РА, соответственно, в объеме 200 ± 5 мкл подкожно в область холки ежедневно 1 раз в день, четвертая группа получала раствор метотрексата в дозе 20 ± 1 мкг/мышь ежедневно внутрижелудочно через зонд. Каждая группа включала 10 мышей. Ежедневно проводили морфометрическое исследование толщины уха и визуальную оценку поражения кожи в месте нанесения препарата с последующим расчетом индекса PASI [van der Fits L. et al. Imiquimod-induced psoriasis-like skin inflammation in mice is mediated via the IL-23/IL-17 axis // J. Immunol. Baltim. Md 1950. 2009. Vol. 182, №9. P. 5836-5845.].
Было показано, что ежедневное нанесение препарата Алдара на кожу уха мышей, получавших инъекции физиологического раствора, оказало видимый эффект уже через 24 ч после первого нанесения. Были зафиксированы выраженная эритема и шелушение, достигающие максимума на 5-й день эксперимента. Морфометрическое исследование толщины уха показало достоверное увеличение данного параметра по сравнению с интактными животными, начиная с 24 часов после первого нанесения крема Алдара Анализ изменения индексов PASI, рассчитанных для всех групп животных в течение эксперимента, показал, что степень выраженности псориазоподобного дерматита была значительно снижена в группах, получавших изучаемый препарат рекомбинантного ИЛ-36РА человека в дозах 50 ± 1 и 10 ± 1 мкг/мышь, а также метотрексат в дозе 20 ± 1 мкг/мышь в сутки, по сравнению с таковой в контрольной группе, начиная с 3-го дня и на протяжении всего эксперимента (Фиг. 11). На 6-й день эксперимента эффективность препарата ИЛ-36РА в дозе 50 ± 1 мкг/мышь превзошла эффективность метотрексата. Морфометрическое исследование толщины уха показало, что в группе, получавшей исследуемый препарат в дозе 50 ± 1 мкг/мышь, индекс изменения толщины уха был достоверно ниже по сравнению с контрольной группой, начиная с 3-го дня и до конца эксперимента. В группе животных, получавших метотрексат, этот показатель достоверно снижался только на 6-й и 7-й дни эксперимента (Фиг. 12).
Таким образом, было показано, что ежедневное подкожное введение разработанного препарата рекомбинантного ИЛ-36РА человека в дозах 50 ± 1 и 10 ± 1 мкг/мышь значительно снижает тяжесть экспериментального дерматита, вызванного имихимодом. Эффект появляется в пределах 3-4 дней после первого введения препарата и превосходит эффект метотрексата.



Изобретение относится к области биотехнологии, а именно к технологии получения рецепторного антагониста интерлейкина-36, и представляет собой плазмидный экспрессионный вектор pBAD15A для получения безметионинового рекомбинантного рецепторного антагониста интерлейкина-36 (ИЛ-36РА) человека, карта которого приведена на Фиг. 2, плазмидный экспрессионный вектор рЕТ15А для получения безметионинового рекомбинантного ИЛ-36РА человека, карта которого приведена на Фиг. 3, а также штамм - продуцент безметионинового рекомбинантного ИЛ-36РА человека. Изобретения позволяют получить более активный ИЛ-36РА с более высоким выходом. 5 н.п. ф-лы, 12 ил., 4 табл., 7 пр.
1. Плазмидный экспрессионный вектор pBAD15A для получения безметионинового рекомбинантного рецепторного антагониста интерлейкина-36 (ИЛ-36РА) человека путем культивирования штамма Escherichia coli BL21Star[DE3], содержащего плазмидный экспрессионный вектор pET-IL36Raf и упомянутый вектор, и последующего выделения ИЛ-36РА, содержащий:
- ген метионинаминопептидазы Е. coli,
- промотор pBADara,
- терминаторы транскрипции гена rrnВ (rrnB Т1Т2),
- регуляторную последовательность araBAD оперона,
- ориджин репликации плазмид р15А,
- ген хлорамфеникол ацетилтрансферазы (CamR) и
- рестрикционные сайты, необходимые для объединения отдельных фрагментов в векторе, карта которого приведена на Фиг. 2.
2. Плазмидный экспрессионный вектор рЕТ15А для получения безметионинового рекомбинантного ИЛ-36РА человека путем культивирования штамма Escherichia coli BL21Star[DE3], содержащего плазмидный экспрессионный вектор pET-IL36Raf и упомянутый вектор, и последующего выделения ИЛ-36РА, содержащий:
- ген метионинаминопептидазы Е. coli,
- промотор фага Т7,
- терминатор транскрипции генов фага Т7,
- регуляторную последовательность гена lacI,
- ориджин репликации плазмид р15А,
- ген хлорамфеникол ацетилтрансферазы (CamR) и
- рестрикционные сайты, необходимые для объединения отдельных фрагментов в векторе, карта которого приведена на Фиг. 3.
3. Штамм - продуцент безметионинового рекомбинантного ИЛ-36РА человека, представляющий собой штамм Escherichia coli BL21Star[DE3], содержащий плазмидный экспрессионный вектор pET-IL36Raf и вектор по п. 1 или 2.
4. Способ получения штамма по п. 3, заключающийся в трансформации штамма Escherichia coli BL21Star[DE3] плазмидным экспрессионным вектором pET-IL36Raf и вектором по п. 1 или 2 с последующей индукцией экспрессии генов рецепторного антагониста интерлейкина-36 человека (ИЛ-36РА) и метионинаминопептидазы Е. coli.
5. Применение препарата безметионинового рекомбинантного рецепторного антагониста интерлейкина-36 человека, полученного с использованием штамма по п. 3, для лечения дерматитов.
| ДНК, КОДИРУЮЩАЯ ПОЛНОРАЗМЕРНЫЙ АНТАГОНИСТ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА-36 ЧЕЛОВЕКА, ДНК, КОДИРУЮЩАЯ ПОЛНОРАЗМЕРНЫЙ АНТАГОНИСТ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА-36 ЧЕЛОВЕКА С С-КОНЦЕВЫМ ПОЛИГИСТИДИНОВЫМ ТАГОМ, ПЛАЗМИДНЫЙ ЭКСПРЕССИОННЫЙ ВЕКТОР (ВАРИАНТЫ), ШТАММ БАКТЕРИЙ ESCHERICHIA COLI BL21 STAR[DE3] (РЕТ-IL36RAF), - ПРОДУЦЕНТ ПОЛНОРАЗМЕРНОГО РЕЦЕПТОРНОГО АНТАГОНИСТА ИНТЕРЛЕЙКИНА-36 И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI BL21 STAR[DE3] (PET-IL36RAF-HIS), - ПРОДУЦЕНТ ПОЛНОРАЗМЕРНОГО РЕЦЕПТОРНОГО АНТАГОНИСТА ИНТЕРЛЕЙКИНА-36 С С-КОНЦЕВЫМ ПОЛИГИСТИДИНОВЫМ ТАГОМ | 2014 |
|
RU2582569C2 |
| ШТАММ-ПРОДУЦЕНТ БЕЗМЕТИОНИНОВОГО CRM197 НА ОСНОВЕ КЛЕТОК E. coli BL21 (DE3) | 2015 |
|
RU2575621C1 |
| П.П.НИМИРИЦКИЙ и др | |||
| Фундаментальная наука и клиническая медицина — Человек и его здоровье: Тезисы XVIII Международной медико-биологической конференции молодых исследователей, посвященной двадцатилетию медицинского факультета СПбГУ | |||
| Проекционный фонарь | 1925 |
|
SU2221A1 |
| Издательство СПбГУ Санкт-Петербург, стр.377-378 | |||
| ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОГО ГОРМОНА РОСТА ЧЕЛОВЕКА ИЗ ТЕЛЕЦ ВКЛЮЧЕНИЯ | 2011 |
|
RU2473556C1 |
| WO 2009088255 А2, 16.07.2009 | |||
| ПРЕПАРАТ ИММУНОГЛОБУЛИНА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1996 |
|
RU2122864C1 |
| RALPH RAPLEY, DAVID WHITEHOUSE Molecular Biology and Biotechnology, 2014, Royal Society of Chemistry, р | |||
| Пуговица | 0 |
|
SU83A1 |
| US 20170009240 A1, 12.01.2017. | |||
Авторы
Даты
2018-11-19—Публикация
2017-02-06—Подача