ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение главным образом относится к злокачественной опухоли и более конкретно к средствам, которые влияют на путь передачи сигнала Notch.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Гены Notch кодируют эволюционно-консервативные большие белки с одним трансмембранным доменом, которые регулируют определение направления дифференцировки клеток. При работе с Drosophila, Caenorhabditis elegans и с культурой клеток млекопитающих показано, что Notch действуют как рецепторы для семейства лигандов DSL (Delta, Serrate, Lag-2) и передают сигнал посредством двух нисходящих путей. Один из них осуществляется через семейство факторов транскрипции CSL (CBF1, Suppressor of Hairless, Lag-1), а другой через цитоплазматический адаптерный белок Deltex. У млекопитающих путь передачи сигнала Notch включает четыре рецептора (Notch1-4) и пять лигандов (Delta-подобные 1, 3 и 4 & Jagged 1 и 2). У людей мутации в этих генах могут приводить к серьезным последствиям, связанным с развитием, включая передачу сигнала Notch в нескольких наследственных заболеваниях (например, церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией (CADASIL), синдром Алажилля и спондило-костальный дизостоз (SCDO)) и к злокачественным опухолям (например, лейкоз, злокачественные опухоли кожи, шейки матки, рак легких, рак предстательной железы, нейробластомы и рак молочной железы).
Негативные регуляторы пути передачи сигнала Notch включают Numb, SEL-10 и Su(dx). В отличие от этого, позитивными регуляторами пути передачи сигнала являются Sanpodo, Neuralized, Mind bomb, LNX, Siah1 и Mdm2. Numb представляет собой цитоплазматический адаптерный белок, содержащий домен PTB, который действует как негативный регулятор Notch, посредством своего контактирования с внутриклеточным доменом. Взаимодействие Numb-Notch обеспечивает убиквитинирование Notch1. Показано, что Numb взаимодействует с цитоплазматическим доменом HECT лигазы E3 Itch, и что для обеспечения убиквитинирования Notch1 Numb и Itch действуют совместно. С другой стороны, Numb может ингибировать путь передачи сигнала Notch, изменяя функцию Sanpodo, который является регулятором пути. Sandopo кодирует трансмембранный белок с 4 трансмембранными доменами, который физически взаимодействует на поверхности клетки с полноразмерным рецептором. Numb физически взаимодействует с Sanpodo и препятствует мембранной локализации Sanpodo, предотвращая его взаимодействие с Notch. Тропомодулин, белок млекопитающих, ассоциированный с актином, который регулирует длину актиновых филаментов, представляет собой гомолог Sanpodo. Во время процессов, связанных с развитием, Numb и Sanpodo являются ключевыми регуляторами пути передачи сигнала Notch
Супрессор белка Deltex (Su(dx)) представляет собой еще один белок, первоначально обнаруженный у Drosophila, который действует как негативный регулятор пути передачи сигнала Notch. Сверхэкспрессия Su(dx) может блокировать эндогенную передачу сигнала Notch, приводя к эктопической дифференцировке жилок и повреждению края крыла. В отличие от этого, ингибирование Su(dx) демонстрирует разрыв в жилке крыла, сходный с фенотипом при сверхэкспрессии Notch. Itch представляет собой гомолог Su(dx) у мышей и назван таким образом, поскольку у мутантных мышей, наряду с иммунологическими нарушениями, наблюдают кожный зуд. В отличие от SEL-10, Itch содержит фосфолипидсвязывающий мотив, который направляет его на плазматическую мембрану, четыре мотива WW и домен HECT, который выполняет функцию убиквитин-лигазы E3. Itch связывается с N-концевой областью NICD через его WW-мотивы и обеспечивает убиквитинирование NICD посредством своего HECT домена. В клетках млекопитающих это взаимодействие обеспечивает ингибирование пути передачи сигнала Notch.
Первым признаком того, что путь передачи сигнала Notch может участвовать в развитии неопластических процессов в молочных железах, явилось наличие общего участка встраивания в пределах гена Notch4 для вируса опухоли молочных желез мышей (MMTV) у мышей Czech II. Это встраивание приводит к экспрессии укороченного транскрипта, который кодирует внутриклеточный домен Notch4; экспрессия этого белка активирует путь передачи сигнала. Определяющую роль пути сигнала Notch в развитии опухоли показали на трансгенных мышах, специфически экспрессирующих этот белок в молочных железах. У этих мышей опухоли молочных желез возникают в течение 12 месяцев. Кроме того, эксперименты на клеточной культуре показали, что сверхэкспрессия внутриклеточного домена Notch1 или Notch4 приводит к трансформации линии эпителиальных клеток молочных желез мыши, вызывая независимый рост клеток на мягком агаре.
Передача сигнала Notch абберантно активируется в широком диапазоне злокачественных опухолей молочных желез. Это наиболее ясно демонстрируется потерей Numb и накоплением внутриклеточного домена Notch1 (NICD), который образуется при расщеплении полноразмерного белка при передаче сигнала и передает сигнал Notch, и активацией генов-мишеней Hes1 и Hey1. Кроме того, можно показать, что изменения компонентов пути являются пригодными прогностическими маркерами. Например, повышенные уровни транскрипта Notch1 и лиганда Jagged1 коррелируют с неблагоприятным прогнозом, а протеосомная деградация Numb наблюдается, главным образом, в опухолях высокой степени злокачественности. Наконец, усиление передачи сигнала Notch играет важную роль в этиологии рака молочной железы, так как ингибирование пути возвращает к исходному состоянию измененный фенотип линий злокачественных клеток молочных желез и предотвращает рост первичных опухолевых клеток.
Хотя измененную передачу сигнала Notch уже связывали с заболеваниями человека, включая злокачественную опухоль, данные в пользу существенной вовлеченности Notch в развитие злокачественных опухолей человека оставались неясными. С точки зрения механизма процесса, Numb выполняет функцию онкосупрессора, поскольку его эктопическая экспрессия в негативных по Numb, но не в положительных по Numb опухолях ингибирует пролиферацию. Усиление передачи сигнала Notch наблюдается в опухолях, отрицательных по Numb, но, после усиленной экспрессии Numb, уровень сигнала возвращается к исходным уровням. С другой стороны, “выключение” Numb усиливает передачу сигнала Notch в нормальных клетках молочных желез и в злокачественных опухолях молочных желез, положительных по Numb. Биологический антагонизм Numb/Notch имеет отношение к гомеостазу нормальной паренхиматозной ткани молочных желез. Таким образом, существует необходимость в способе диагностирования и лечения злокачественной опухоли, вызванной нарушением передачи сигнала в пути Notch.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на основополагающем открытии того, что в некоторых вариантах рака молочных желез человека происходит активация пути Notch. Конкретно, эти злокачественные опухоли характеризуются наличием усиленной передачи сигнала Notch и сниженной экспрессией Numb, негативного регулятора пути Notch.
В одном из вариантов осуществления изобретение относится к способу лечения злокачественной опухоли, включающему контактирование злокачественной клетки с конструкцией, как показано на фигурах 3A или 3B. Способ по изобретению дополнительно включает контактирование злокачественной клетки с химиотерапевтическим средством.
В другом варианте осуществления изобретение относится к способу определения чувствительности злокачественной клетки к действию ингибитора пути Notch, включающему определение в клетке уровня Notch1, где повышенный, по сравнению с нормальной клеткой, уровень Notch1 является показателем чувствительности клетки к действию ингибитора пути Notch. Иллюстративные ингибиторы пути Notch показаны на фигурах 3A или 3B.
В одном из аспектов, способ дополнительно включает определение уровня экспрессии Numb в клетке, где низкий, по сравнению с нормальной клеткой, уровень экспрессии Numb является показателем чувствительности клетки к действию ингибитора пути Notch или средства, которое повышает экспрессию Numb в клетке.
Изобретение также относится к конкретным конструкциям, как проиллюстрировано на фигуре 3A и фигуре 3B.
В другом варианте осуществления изобретение относится к способу лечения злокачественной опухоли, включающему контактирование злокачественной клетки с конструкцией, содержащей доминантно-негативную изоформу Mastermind. В одном из аспектов, злокачественная опухоль представляет собой, например, рак молочной железы, яичников, толстого кишечника, предстательной железы, легких, злокачественную опухоль системы кроветворения или поджелудочной железы. В дополнительном варианте осуществления злокачественная клетка может также контактировать с химиотерапевтическим средством. В другом варианте осуществления клетка может контактировать с нуклеиновой кислотой или белком Antennapedia. (Гомеодомен Antennapedia представляет собой специфичный к последовательности фактор транскрипции из организма Drosophila melanogaster. Этот белок кодируется геном Antennapedia (antp). Antp является членом регуляторной системы, которая обеспечивает определенное расположение клеток на передне-задней оси организма. Таким образом, Antp участвует в контроле развития клеток в среднегрудном сегменте у Drosophila) (см. например, Y.-Q. Qian et al., The Structure of the Antennapedia Homeodomain Determined by NMR Spectroscopy in Solution: Comparison With Prokaryotic Repressors, Cell 59:573 (1989)).
В другом варианте осуществления, изобретение относится к способам лечения злокачественной опухоли, включающим контактирование злокачественной клетки с конструкцией, содержащей изоформу Numb. В дополнительном варианте осуществления злокачественная клетка также может контактировать с химиотерапевтическим средством. В другом варианте осуществления клетка может контактировать с нуклеиновой кислотой или белком Antennapedia.
В одном из вариантов осуществления описаны способы определения того, чувствительна ли злокачественная клетка к действию ингибитора пути Notch, где способ включает определение в клетке уровня Notch1, где повышенный, по сравнению с нормальной клеткой, уровень Notch1 является показателем чувствительности клетки к действию ингибитора пути Notch. В одном из аспектов, ингибитор пути Notch включает доминантно-негативную изоформу Mastermind. В другом варианте осуществления ингибитор пути Notch включает изоформу Numb. В еще одном варианте осуществления способ включает определение уровня экспрессии Numb в клетке, где низкий, по сравнению с нормальной клеткой, уровень экспрессии Numb является показателем чувствительности клетки к действию ингибитора пути Notch. В дополнительном варианте осуществления злокачественная клетка представляет собой злокачественную клетку молочной железы, злокачественную клетку яичников, злокачественную клетку толстого кишечника или злокачественную клетку поджелудочной железы.
В другом варианте осуществления изобретения описывают способы контролирования схемы терапии при лечении субъекта, имеющего злокачественную опухоль или подверженного риску развития злокачественной опухоли, где способы включают определение уровня активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch. В одном из аспектов, ген, вовлеченный в путь передачи сигнала Notch, выбран из группы, состоящей из Jagged1, Jagged2, Delta-подобного4, E-кадгерина, Numb, NICD Notch 3, Hey1, Hes5 или их сочетания.
В одном из вариантов осуществления описывают способы диагностики субъекта со злокачественной опухолью или подверженного риску развития злокачественной опухоли, где способы включают определение уровня активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch, где изменение в уровне активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch, по сравнению с уровнем в нормальной клетке, является диагностическим признаком наличия злокачественной опухоли или риска развития злокачественной опухоли у субъекта. В другом варианте осуществления ген, вовлеченный в путь Notch, выбран из группы, состоящей из Jagged1, Jagged2 Delta-подобного4, E-кадгерина, Numb, NICD Notch 3, Hey1, Hes5 или их сочетания.
В другом варианте осуществления изобретения описывают способ идентификации средства, которое изменяет уровень активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch, где способ включает контактирование тестируемого средства с клеткой, в которой обнаруживается экспрессия одного или нескольких генов, вовлеченных в путь передачи сигнала Notch и определение изменения в уровне активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch, с определением, тем самым, тестируемого средства как средства, которое изменяет уровень активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch. В одном из вариантов осуществления ген, вовлеченный в путь Notch, выбран из группы, состоящей из Jagged1, Jagged2 Delta-подобного4, E-кадгерина, Numb, NICD Notch 3, Hey1, Hes5 или их сочетания. В другом варианте осуществления клетка представляет собой злокачественную клетку. В одном из аспектов, злокачественная клетка представляет собой злокачественную клетку молочной железы, злокачественную клетку яичников, злокачественную клетку толстого кишечника или злокачественную клетку поджелудочной железы. В одном из вариантов осуществления средство представляет собой химическое соединение, белок или нуклеиновую кислоту.
В одном из вариантов осуществления описывают способ доставки соединения в клетки, включающий контактирование клетки с соединением, слитым с Antennapedia или его функциональной частью. В одном из аспектов, соединение представляет собой химическое соединение, белок или нуклеиновую кислоту и Antennapedia представляет собой нуклеиновую кислоту или аминокислотную последовательность.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1A представляет собой схематическое изображение рецептора Notch Drosophila и четырех известных рецепторов Notch млекопитающих.
На фигуре 1B изображены трансмембранные лиганды DSL рецепторов Notch у Drosophila и млекопитающих (Delta, Serrate, LAG 2).
Фигура 1C представляет собой схематическое строение лигандов млекопитающих F3 и контактина.
Фигура 1D представляет собой схематический путь передачи сигнала Notch, зависимой от CBF1.
Фигура 2A представляет собой график, на котором изображено количество колоний клеток, образовавшихся на мягком агаре из клеток MCF7, из родительской клеточной линии, клеток, трансфицированных контрольным вектором и MCF7/Numb.
Фигура 2B представляет собой график, на котором изображено количество колоний клеток, образовавшихся на мягком агаре из клеток MCF7, из родительской клеточной линии, клеток, трансфицированных контрольным вектором и MDA-MB231/Numb.
На фигуре 3A проиллюстрирован pSecTagNC/ANTP/NUMB (SEQ ID NO: 1).
На фигуре 3B проиллюстрирован pSecTagNC/ANTP/DN-MAML (SEQ ID NO: 2).
На фигуре 4 представлен график, представляющий объем опухоли у животных, которым ввели слитый белок ANTP/DN-MAML (4A) и выживаемости животных после введения слитого белка ANTP/DN-MAML (4B).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на открытии того, что путь передачи сигнала Notch ассоциирован со злокачественной опухолью. Изменение экспрессии и/или активности белков в пути передачи сигнала Notch можно использовать для диагностики и лечения злокачественной опухоли у субъекта.
Рецептор Notch у Drosophila представляет собой большой гликопротеин с одним трансмембранным доменом из 2703 аминокислот (а.к.), который содержит несколько различных доменов (фигура 1A). Белки Notch экспрессируются на поверхности клеток в виде гетеродимеров, состоящих из большого внеклеточного домена, нековалентно связанного с внутриклеточным доменом. Внеклеточный домен состоит из 36 последовательно расположенных повторов, подобных эпидермальному фактору роста (EGF) (каждый приблизительно 38 а.к.), и трех повторов, богатых цистеином LIN12/Notch (LNR). Внутриклеточный домен Notch (NICD) содержит: домен RAM23, который связывает факторы транскрипции CSL; две последовательности внутриядерной локализации (NLS1 & 2); семь последовательно расположенных повторов CDC10/Анкирин (ANK), необходимых для белок-белковых взаимодействий; область цитокинового ответа Notch (NCR), домен активации транскрипции (TAD); и последовательность PEST (SEQ ID NO: 7) (пролин (P), глутамин (E), серин (S), треонин (T)). PEST последовательности характерны для белков, которые подвергаются быстрому расщеплению.
У млекопитающих известны четыре рецептора Notch (Notch1-4) (фигура 1A). Notch1 и Notch2 млекопитающих содержат 36 EGF-подобных повторов, тогда как Notch3 и Notch4 содержат 34 и 29 EGF-подобных повторов, соответственно. Все четыре Notch рецептора млекопитающих содержат домены RAM, NLS1, ANK и PEST. Однако только в Notch1 и Notch2 найден TAD и в Notch4 отсутствуют мотивы NLS2 и NCR. Наибольшая степень гомологии между рецепторами Notch наблюдается в пределах анкириновых повторов, тогда как наибольшая степень разнообразия наблюдается в C-концевой последовательности PEST. Белки Notch1 и Notch2 млекопитающих расщепляются фурин-подобной конвертазой (остаток 1655) в пределах trans-аппарата Гольджи (также обозначается как расщепление S1); аналогично можно расщеплять Notch3 и Notch4. Протяженный внеклеточный домен связан с трансмембранным доменом нековалентной, зависимой от Ca2+ связью. Этот гетеродимер является преобладающей формой рецептора на клеточной поверхности. Описано, что EGF-подобные повторы 11 и 12 являются необходимыми для взаимодействия DSL лигандов Notch с Notch (фигура 1A).
У Drosophila, Delta и Serrate являются основными лигандами для рецептора Notch (фигура 1B). Подобно Notch, эти белки представляют собой большие белки с одним трансмембранным доменом, с различным количеством EGF-подобных повторов в пределах своих внеклеточных доменов. Delta и Serrate содержат девять и семнадцать EGF-подобных повторов, соответственно. Они взаимодействуют с Notch через консервативный, богатый цистеином домен, известный как область DSL на N-конце (Delta, Serrate, (Drosophila) Lag-2 (C. elegans). В дополнение к этим мотивам, Serrate содержит третий домен, богатый цистеином (CR), располагающийся между EGF-подобными повторами и трансмембранным доменом, который отличает его от Delta. У млекопитающих существует пять гомологов Delta и Serrate, это Jagged1 и 2 и Delta-подобные 1, 3 и 4 (фигура 1B). Лиганды DSL содержат очень короткие, по сравнению с большим внутриклеточным доменом Notch, внутриклеточные домены.
Недавно показано, что F3/контактин и NB-3, член семейства F3/контактин, действуют как дополнительные лиганды Notch во время созревания олигодендроцитов у мышей (фигура 1C). F3 представляет собой связанную с гликозилфосфатидилинозитолом (GPI) нейтральную молекулу адгезии, принадлежащую к семейству иммуноглобулинов. F3 и контактин принадлежат к группе гликопротеинов, содержащих N-концевой сигнальный пептид, шесть иммуноглобулиновых доменов, соединенных с четырьмя фибронектиновыми повторами типа III и якорный домен GPI. Контактин, по сравнению с F3, содержит дополнительный трансмембранный и короткий цитоплазматический домен. Описано, что F3 и NB-3 связывают рецептор Notch1 мышей в пределах EGF-подобных повторов 1-12 и 22-34.
Рецепторы Notch расщепляются в аппарате Гольджи ферментом фурин-конвертазой (процесс, известный как расщепление S1), что приводит к экспрессии на поверхности мембраны нековалентно связанного гетеродимера рецептора Notch (фигура 1D). В отсутствие взаимодействия Notch с лигандом, Numb непосредственно взаимодействует с цитоплазматическим доменом Notch и ингибирует его расщепление. В этих условиях CSL связывает, по меньшей мере, четыре корепрессора (SMRT, HDAC, SKIP и kyoT2) и останавливает транскрипцию. При связывании с лигандом происходят два последовательных расщепления. Первое, известное как расщепление S2, опосредованное ADAM протеазой TACE (конвертирующий фактор некроза опухоли α фермент), происходит в 1771 а.к. около трансмембранного домена и второе расщепление, известное как S3, опосредует γ-секретаза в 1744 а.к. в пределах трансмембранного домена. Расщепление S3 высвобождает внутриклеточный домен Notch (NICD), обеспечивая ему возможность ядерной транслокации и его связывания там с CBF1, преобразуя его из формы транскрипционного репрессора в транскрипционный активатор, замещая четыре корепрессора. Вместе с Mastermind (MAM), NICD и CBF1 образуют большой комплекс активации транскрипции и привлекает коактиваторы, такие как p300. Затем активированный CBF1 может транскрибировать его гены-мишени, в которые включены члены семейств Hairy of enhancer of split (Hes) и Hey. Другие мишени, такие как p21 (мишень в кератиноцитах), являются тканеспецифичными. Стабильность Numb регулируется E3-лигазами, такими как Mdm2, LNX и Shia.
У млекопитающих передача сигнала Notch приводит к расщеплению NICD, который впоследствии перемещается в ядро и связывается с фактором транскрипции CBF1 (также известным как RBP-Jk). Это первичный ядерный эффектор пути передачи сигнала Notch и он обладает двойным действием. В отсутствие NICD, CBF1 связывает, по меньшей мере, 4 корепрессора, фактор выключения ретиноидного рецептора и рецептора тиреоидного гормона (SMRT), гистоновую деацетилазу-1 (HDAC1), KyoT2 и Ski-взаимодействующий белок (SKIP) и подавляет транскрипцию (фигура 1D). С другой стороны, взаимодействие CBF1 с повторами RAM23 и ANK NICD вытесняет эти репрессоры, для образования комплекса активации транскрипции. Ядерный белок, подобный Mastermind (MAML), также взаимодействует с этим комплексом, для дополнительного усиления транскрипции (фигура 1D). Однако доминантно-негативный вариант (DN) MAML1, который содержит пептид из 62 аминокислот на конце концевой последовательности MAML, специфично связывается с транскрипционным комплексом CBF1/NICD и ингибирует активацию передачи сигнала Notch посредством всех четырех рецепторов Notch млекопитающих.
У млекопитающих во взаимодействие между Notch и его лигандами DSL включены EGF-подобные повторы внеклеточной области Notch11 и 12 (фигура 1D). Взаимодействие лиганд/рецептор приводит к двум дополнительным протеолитическим расщеплениям в пределах белка Notch, что приводит к высвобождению из клеточной мембраны NICD; первое расщепление происходит во время преобразования Notch в участке S1. На клеточной поверхности, для образования фрагмента, связанного с мембраной (NEXT), внеклеточно осуществляется протеолитическое расщепление TNF-α конвертирующим ферментом (также обозначаемое как расщепление S2) (TACE) и металлопротеиназой ADAM17 (остаток 1711). Это нестабильное промежуточное соединение, которое снова расщепляется γ-секретазой (содержащей пресенилин и никастрин) (расщепление S3). Это происходит в пределах трансмембранного домена (остаток 1744) и приводит к высвобождению NICD в цитоплазму. NICD содержит два домена NLS, которые направляют его в ядро. В ядре домены RAM и ANK NICD, совместно с MAM, связываются с CBF1, переводя его из репрессора транскрипции в активатор транскрипции. Комплекс NICD/CBF1/MAM активирует экспрессию первичных генов-мишеней пути передачи сигнала Notch, в которые включены основные факторы транскрипции “спираль-петля-спираль” (bHLH), такие как hairy-and-enhancer of split 1 & 5 (Hes1 & 5) и факторы транскрипции 1-3, родственные Hes (HRT1-3, также известные как Hey1-3).
Все члены семейства Hes имеют в составе C-концевой четырехпептидный мотив YRPW (SEQ ID NO: 6), который привлекает корепрессоры транскрипции, такие как Groucho, и выполняют функцию репрессоров транскрипции. Другими мишенями пути являются тканеспецифичные факторы, такие как p21 и сердечно-сосудистый фактор 1 и 2 “спираль-петля-спираль” (CHF1-2), которые экспрессируются в кератиноците и при развитии сердечно-сосудистой системы, соответственно. В дополнение к активированию передачи сигнала Notch, несколько белков, включающие Numb и убиквитин-лигазы E3 SEL-10 и Itch могут останавливать передачу сигнала Notch, активируя убиквитинирование и лизосомальную деградацию молекул Notch. Описано, что слияние между CBF1 и анкириновыми повторами Notch или доменом активации транскрипции вируса простого герпеса (HSV) VP16, образует конститутивно активную форму CBF1.
У млекопитающих все четыре рецептора Notch (Notch1-4) и все 5 лигандов (Jagged1 и 2; Delta-подобные 1, 3 и 4) содержат трансмембранные домены, так что передача сигнала лиганд-рецептор осуществляется между соседними клетками. Связывание лиганд-рецептор инициирует расщепление, зависимое от γ-секретазы, которое высвобождает внутриклеточный домен Notch в ядро и способствует ассоциации с фактором транскрипции CBF-1 (также известным как RBP-Jk или CSL). Последующее включение коактиватора, белка, подобного mastermind (MAML), способствует активированию транскрипции далее следующими эффекторами, такими как hairy and enhancer of split (HES) и белком-репрессором, родственным семейству факторов транскрипции HES (HERP).
Перед описанием композиций и способов по настоящему изобретению следует понять, что изобретение не ограничено конкретными композициями, способами и описанными экспериментальными условиями, и в силу этого композиции, способы и условия могут изменяться. Также следует понимать, что терминология, используемая в данном документе, существует только для целей конкретных описываемых вариантов осуществления и не предназначена для ограничения, поскольку область настоящего изобретения будет ограничиваться только приложенной формулой изобретения.
В настоящем описании и приложенной формуле изобретения, форма единственного числа включает обозначение множественного числа, если из контекста явным образом не следует иное. Таким образом, например, обозначение "способ" включает один или несколько способов и/или стадий способа, описываемого в настоящем документе, который станет понятным специалистам в данной области после прочтения этого и подобных описаний.
Если не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют одинаковое значение с общепринятыми терминами, понимаемыми специалистами в данной области, которым предназначено это изобретение. Хотя любые способы и материалы, аналогичные или равноценные описываемым в настоящем документе, можно использовать в практическом осуществлении или тестировать по изобретению, предпочтительными способами и материалами являются описанные в настоящем документе.
В настоящем документе термин "субъект" относится к любому индивидууму или пациенту, для которого осуществляют способы субъекта. Как правило, субъект является человеком, хотя, как будет понятно специалистам в данной области, субъект может представлять собой животное. Таким образом, в пределы определения субъекта включены прочие животные, включающие млекопитающих, таких как грызуны (включая мышей, крыс, хомяков и морских свинок), кошки, собаки, кролики, сельскохозяйственные животные, включая коров, лошадей, коз, овец, свиней и т.д. и приматов (включая мартышек, шимпанзе, орангутанов и горилл).
В настоящем документе "нормальные клетки" или "нормальные образцы" от субъекта относятся к клеткам или к образцу, который происходит из того же органа и того же вида, что и клетки, подлежащие исследованию. В одном из аспектов, соответствующие нормальные клетки включают образец клеток, полученных от здорового индивидуума, у которого нет злокачественной опухоли. Такие соответствующие нормальные клетки могут, но не обязательно должны быть от индивидуума, который является одинаковым по возрасту и/или того же пола, что и индивидуум, предоставляющий клетки, подлежащие исследованию.
В настоящем документе термины "образец" и "биологический образец" обозначают любой образец, пригодный для способов, предусмотренных настоящим изобретением. Образец клеток может быть любым образцом, включая, например, опухолевый образец, полученный при проведении биопсии у субъекта с опухолью или опухолевый образец, полученный при оперативном вмешательстве (например, хирургическая операция по удалению и/или уменьшению объема опухоли). Таким образом, в одном из вариантов осуществления биологический образец по настоящему изобретению представляет собой образец ткани, например, биоптат, такой как образцы пункционной биопсии. Например, образец может включать образец крови, образец мочи, образец ткани или любую биологическую жидкость.
Термины "нарушение клеточной пролиферации" или "клеточное пролиферативное нарушение" обозначают любое нарушение, при котором способность к пролиферации поврежденных клеток отличается от нормальной способности к пролиферации неповрежденных клеток. Примером нарушения пролиферации клеток является неоплазия. Злокачественные клетки (т.е. злокачественная опухоль) развиваются в результате многостадийного процесса. Термин "злокачественный" может обозначать опухоль или заболевание системы кроветворения, при котором уже не происходит нормального контроля роста клеток.
Термин "злокачественная клетка", как предусмотрено в настоящем документе, включает клетки, пораженные одним из факторов канцерогенеза, предусмотренных в настоящем документе. Термин "карцинома" относится к злокачественному новообразованию, происходящему из эпителиальных клеток, с тенденцией к проникновению в окружающие ткани, и которое является причиной метастазов.
Нарушение пролиферации клеток, как описано в настоящем документе, может представлять собой неоплазию. Такие неоплазии являются как доброкачественными, так и злокачественными. Термин "неоплазия" относится к новому, патологическому росту клеток или росту патологических клеток, которые воспроизводятся быстрее, чем нормальные. При неоплазии возникает неструктурированная масса (опухоль), которая может являться как доброкачественной, так и злокачественной. Термин "доброкачественная" относится к опухоли, которая не является злокачественной, например, ее клетки не распространяются на окружающие ткани или не поражают окружающие ткани.
Термины "доставка" или "введение" определены для включения процесса обеспечения субъекта, нуждающегося в лечении, соединением или фармацевтической композицией по изобретению. Термины включают энтеральное и местное введение, обычно в виде инъекции, и включают, в качестве неограничивающих примеров, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсулярную, внутриглазничную, внутрисердечную, внутрикожную, интраперитонеальную, транстрахеальную, подкожную, подоболочечную, внутрисуставную, субкапсулярную, субарахноидальную, внутрипозвоночную и внутригрудинную инъекцию и инфузию.
В настоящем документе термин "белок" относится по меньшей мере к двум ковалентно связанным аминокислотам, где термин включает белки, полипептиды, олигопептиды и пептиды. Белки могут представлять собой природные аминокислоты и пептидные связи или синтетические пептидомиметические структуры. Таким образом "аминокислота" или "пептидный остаток" в настоящем документе обозначает как природные, так и синтетические аминокислоты. Например, для целей изобретения, аминокислотами считают гомофенилаланин, цитруллин и норлейцин. "Аминокислота" также включает иминокислотные остатки, такие как пролин и гидроксипролин. Боковые цепи могут существовать как в (R), так и в (S) конфигурации.
Термин "слитый белок" относится к белку, который слит с другой молекулой или соединением. Молекула или соединение могут представлять собой белок, химическое соединение или нуклеиновую кислоту.
В настоящем документе термин "нуклеиновая кислота" обозначает ДНК, РНК, одноцепочечные, двухцепочечные или трехцепочечные и любые их химические модификации. По существу, предполагаются любые модификации нуклеиновой кислоты. "Нуклеиновая кислота" может быть почти любой длины, от 10, 20, 30, 40, 50, 60, 75, 100, 125, 150, 175, 200, 225, 250, 275, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 30000, 40000, 50000, 75000 100000 150000, 200000, 500000, 1000000, 1500000, 2000000, 5000000 или даже более оснований в длину, вплоть до полноразмерной хромосомной молекулы ДНК. Для способов, которые анализируют экспрессию генов, выделенная из образца нуклеиновая кислота, как правило, представляет собой РНК.
Настоящее изобретение основано на основополагающем открытии того, что некоторые злокачественные опухоли демонстрируют патологические уровни экспрессии генов в пути Notch. Например, эти злокачественные опухоли имеют повышенные уровни Notch и сниженные уровни Numb, ингибитора пути Notch.
Настоящее изобретение относится к способу лечения злокачественной опухоли, включающему контакт злокачественной клетки со слитым белком, например, таким как конструкция, показанная на фигуре 3A или 3B. Способ по изобретению дополнительно включает контактирование злокачественной клетки с химиотерапевтическим средством.
Средство можно вводить любым способом, типичным для средства, используемого для лечения конкретного типа злокачественной опухоли или в условиях, которые способствуют контактированию средства с опухолевыми клетками-мишенями и, при необходимости, вводить в клетки. Введение полинуклеотидного средства в клетки, например, можно облегчить встраиванием полинуклеотида в вирусный вектор, который может инфицировать клетки. Если не доступен вирусный вектор, специфичный для данного типа клеток, вектор можно модифицировать для экспрессии рецептора (или лиганда), специфичного для лиганда (или рецептора), экспрессированного на клетке-мишени, или можно заключить в оболочку в пределах липосомы, которая также может быть модифицирована для включения такого лиганда (или рецептора). Пептидное средство можно вводить в клетку различными способами, включая, например, конструирование пептида, содержащего домен белковой трансдукции, такой как домен белковой трансдукции TAT вируса иммунодефицита человека, который может облегчить перемещение пептида в клетке. Как правило, средство составляют в композицию (например, фармацевтическую композицию) подходящую для введения субъекту. Такие формулированные средства пригодны в качестве лекарственных средств для лечения субъекта, страдающего от меланомы или немеланомного рака кожи. Таким образом, идентифицированные средства будут обладать тканеспецифическим действием, в зависимости от типа злокачественной опухоли, подлежащей лечению.
Подходящие средства включают обширные классы химических соединений, хотя, как правило, они представляют собой органические молекулы, и обычно являются небольшими органическими соединениями (т.е. низкомолекулярными соединениями) с молекулярной массой более чем 100 и менее чем приблизительно 2500 дальтон. Подходящие средства содержат функциональные группы, необходимые для структурного взаимодействия с белками, конкретно, для образования водородных связей, и по меньшей мере как правило, включают амин, карбонил, гидроксил или карбоксильную группу, по меньшей мере предпочтительно две функциональные химические группы. Подходящие средства обычно содержат циклический атом углерода или гетероциклические структуры и/или ароматические или полиароматические структуры, замещенные одной или несколькими функциональными группами, приведенными выше. Подходящие средства также находятся среди биомолекул, включающих пептиды, сахариды, жирные кислоты, стероиды, пурины, пиримидины, производные, структурные аналоги или их сочетания.
Подходящие средства можно получать из широкого разнообразия источников, включающих библиотеки синтетических или природных соединений. Например, доступны многочисленные способы для синтеза случайным образом и направленного синтеза широкого разнообразия органических соединений и биомолекул, включающие экспрессию олигонуклеотидов случайным образом. Альтернативно, доступны или легко получаемы библиотеки природных соединений в форме бактериальных экстрактов, грибковых экстрактов, растительных экстрактов и экстрактов из животного сырья. Дополнительно, полученные природные или синтетические библиотеки и соединения легко модифицируют традиционными химическими, физическими и биохимическими способами. Для получения структурных аналогов, известные фармакологические средства можно подвергать воздействию прямых химических модификаций или химических модификаций случайным образом, таких как ацилирование, алкилирование, этерификация, амидификация.
В другом варианте осуществления изобретение относится к способу определения того, чувствительна ли злокачественная клетка к действию ингибитора пути Notch, где способ включает определение уровня Notch1 в клетке, где повышенный, по сравнению с нормальной клеткой, уровень Notch1 является показателем чувствительности клетки к действию ингибитора пути Notch. Иллюстративные ингибиторы пути Notch показаны на фигуре 3A или 3B.
Термины "ингибитор", "активатор" и "модулятор" используют для обозначения активирующей, ингибирующей или модулирующей молекулы. Ингибиторы, например, представляют собой соединения, которые, при связывании частично или полностью блокируют активность, ослабляют, предотвращают, задерживают активацию, инактивируют, уменьшают восприимчивость или подавляют активность или экспрессию одного или нескольких генов в пути передачи сигнала Notch. "Активаторы" представляют собой соединения, которые увеличивают, снимают блокирование, приводят в действие, способствуют, усиливают активацию, повышают чувствительность, подвергают действию или активируют один или несколько генов в пути передачи сигнала Notch. Ингибиторы, активаторы или модуляторы также включают генетически модифицированные варианты одного или нескольких генов пути передачи сигнала Notch, например, варианты с измененной активностью, а также природные и синтетические лиганды, субстраты, антагонисты, агонисты, антитела, пептиды, циклические пептиды, нуклеиновые кислоты, антисмысловые молекулы, рибозимы, РНКи, небольшие химические молекулы и т.п. Ингибиторы, например, могут представлять собой слитый белок, как проиллюстрировано на фигурах 3A и 3B, и 4A и 4B.
В одном из вариантов осуществления способы по изобретению дополнительно включают определение уровня экспрессии Numb в клетке, где низкий, по сравнению с нормальной клеткой, уровень экспрессии Numb является показателем чувствительности клетки к действию ингибитора пути Notch.
В настоящем документе термин "улучшение" или "лечение" обозначает то, что клинические признаки и/или симптомы, относящиеся к злокачественной опухоли, уменьшены в результате выполненных действий. Признаки или симптомы, подлежащие контролю, будут характерными для конкретной злокачественной опухоли и известны, также как и способы контролирования признаков и состояний, квалифицированным врачам-клиницистам. Например, квалифицированным врачам-клиницистам будет известно, что размер или скорость роста злокачественной опухоли можно контролировать, используя способ диагностической визуализации, используемый, как правило, для конкретных опухолей (например, использование ультразвукового способа или магнитно-резонансной томографии (МРТ) для контролирования опухоли).
Все способы лечения злокачественной опухоли дополнительно могут включать стадию доставки средства в соединении с фармацевтически приемлемым носителем, который представляет собой один или несколько дополнительных ингредиентов. Фармацевтически приемлемые носители, пригодные для составления средства в смесь для введения субъекту, хорошо известны в данной области и включают, например, водные растворы, такие как вода или забуференный физиологический раствор или другие растворители или разбавители, такие как гликоли, глицерин, масла, такие как оливковое масло или инъецируемые органические сложные эфиры. Фармацевтически приемлемый носитель может содержать физиологически приемлемые соединения, которые действуют, например, для обеспечения устойчивости или для повышения всасываемости конъюгата. Такие физиологически приемлемые соединения включают, например, углеводы, такие как глюкоза, сахароза или декстраны, антиоксиданты, такие как аскорбиновая кислота или глутатион, хелатирующие средства, белки с низкой молекулярной массой или другие стабилизаторы или эксципиенты. Специалист в данной области знает, что выбор фармацевтически приемлемого носителя, включая физиологически приемлемое соединение, зависит, например, от физико-химических свойств терапевтического средства и от способа введения композиции, который может представлять собой, например, пероральный или парентеральный способ, такой как внутривенный и посредством инъекции, интубации или другой подобный, известный в данной области. Фармацевтическая композиция может также содержать второе соединение (или более), такое как диагностический реагент, питательное средство, токсин или терапевтическое средство, например, химиотерапевтическое средство против злокачественной опухоли и/или витамины.
Способ введения композиции, включающий средства по изобретению, частично будет зависеть от химической структуры молекулы. Например, полипептиды и полинуклеотиды не особенно пригодны для перорального введения, поскольку они могут подвергаться расщеплению в желудочно-кишечном тракте. Однако хорошо известны способы химической модификации полинуклеотидов и полипептидов, чтобы обеспечить их, например, меньшей чувствительностью к расщеплению эндогенными нуклеазами или протеазами, соответственно, или большей всасываемостью на всем протяжении пищеварительного тракта (см., например, Blondelle et al., Trends Anal. Chem. 14:83-92, 1995; Ecker and Crook, BioTechnology, 13:351-360, 1995). Например, пептидное средство можно получать, используя D-аминокислоты, или пептидное средство может содержать один или несколько доменов на основе пептидомиметиков, которые представляют собой органические молекулы, которые имитируют структуру пептидного домена; или на основе пептоида, такого как винилогический пептоид. Если ингибитор представляет собой небольшую органическую молекулу, такую как стероидный алкалоид, то его можно вводить в форме, которая высвобождает активное средство в необходимой области тела или посредством инъекции в кровеносный сосуд, так что ингибитор циркулирует с током крови к клеткам-мишеням.
Общее количество соединения или композиции, подлежащих введению в практическом осуществлении способа по изобретению, можно вводить субъекту в виде однократной дозы или в виде болюсного введения, или инфузией в течение относительно короткого периода времени, или можно вводить, используя протокол лечения фракционированной дозой, в котором многократные дозы вводят в течение длительного периода времени. Специалист в данной области будет знать, что для лечения злокачественной опухоли у субъекта, количество средства, которое модулирует активность или экспрессию одного или нескольких генов в пути передачи сигнала Notch, зависит от множества факторов, включая возраст и общее состояние здоровья субъекта, а также способа введения и количества терапевтических средств, подлежащих введению. Учитывая эти факторы, специалисты в данной области могут подобрать, по мере необходимости, конкретную дозу. В основном, исходно состав фармацевтической композиции и способы и частоту введения определяют, используя фазу I и фазу II клинических испытаний.
Изобретение относится к способам лечения злокачественной опухоли, включающим контактирование злокачественной клетки с конструкцией, содержащей доминантно-негативную изоформу Mastermind. Злокачественная клетка может представлять собой, например, злокачественную клетку молочной железы, злокачественную клетку яичников, злокачественную клетку толстого кишечника или злокачественную клетку поджелудочной железы. Злокачественная клетка также может контактировать с химиотерапевтическим средством. Дополнительно, клетка может контактировать с Antennapedia (ANTP).
Гомеодомен ANTP представляет собой фактор транскрипции, специфичный к последовательности, из организма Drosophila melanogaster. Этот белок кодируется геном Antennapedia (antp). Antp является членом регуляторной системы, которая обеспечивает определенное расположение клеток по передне-задней оси организма. Таким образом, Antp участвует в контроле развития клеток в среднегрудном сегменте у Drosophila.
Изобретение также относится к способам лечения злокачественной опухоли, включающим контактирование злокачественной клетки с конструкцией, включающей изоформу Numb. Злокачественная клетка может представлять собой, например, злокачественную клетку молочной железы, злокачественную клетку яичников, злокачественную клетку толстого кишечника или злокачественную клетку поджелудочной железы. Злокачественная клетка также может контактировать с химиотерапевтическим средством. Дополнительно, клетка может контактировать с Antennapedia (ANTP).
В одном из вариантов осуществления описывают способы для определения чувствительности злокачественной клетки к действию ингибитора пути Notch, где способ включает определение в клетке уровня Notch1, где повышенный, по сравнению с нормальной клеткой, уровень Notch1 является показателем чувствительности клетки к действию ингибитора пути Notch. Ингибитор пути Notch может, например, представлять собой, доминантно-негативную изоформу Mastermind или изоформу Numb. В еще одном варианте осуществления способ включает определение уровня экспрессии Numb в клетке, где низкий, по сравнению с нормальной клеткой, уровень экспрессии Numb является показателем чувствительности клетки к действию ингибитора пути Notch. Злокачественная клетка может представлять собой, например, злокачественную клетку молочной железы, злокачественную клетку яичников, злокачественную клетку толстого кишечника или злокачественную клетку поджелудочной железы.
В другом варианте осуществления изобретения описывают способы контролирования схемы лечения при лечении субъекта со злокачественной опухолью или подверженного риску развития злокачественной опухоли, где способы включают определение активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch. Ген, вовлеченный в путь передачи сигнала Notch, может представлять собой, например, Jagged1, Jagged2 Delta-подобный 4, E-кадгерин, Numb, NICD Notch 3, Hey1 или Hes5.
В одном из вариантов осуществления описывают способы диагностики субъектов со злокачественной опухолью или подверженных риску развития злокачественной опухоли, где способы включают определение активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch, где изменение, по сравнению с уровнем в нормальной клетке, активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch, является диагностическим признаком наличия у субъекта злокачественной опухоли или риска развития злокачественной опухоли. Ген, вовлеченный в путь передачи сигнала Notch, может представлять собой, например, Jagged1, Jagged2 Delta-подобный 4, E-кадгерин, Numb, NICD Notch 3, Hey1 или Hes5.
В другом варианте осуществления изобретения описывают способ идентификации средства, которое изменяет активность или экспрессию одного или нескольких генов, вовлеченных в путь передачи сигнала Notch, где способ включает контактирование тестируемого средства с клеткой, демонстрирующей экспрессию одного или нескольких генов, вовлеченных в путь передачи сигнала Notch, и определение изменения активности или экспрессии одного или нескольких генов, вовлеченных в путь передачи сигнала Notch, с определением, тем самым, тестируемого средства как средства, которое изменяет активность или экспрессию одного или нескольких генов, вовлеченных в путь передачи сигнала Notch. Ген, вовлеченный в путь передачи сигнала Notch, может представлять собой, например, Jagged1, Jagged2 Delta-подобный 4, E-кадгерин, Numb, NICD Notch 3, Hey1 или Hes5. Клетка может представлять собой злокачественную клетку и может являться, например, злокачественной клеткой молочной железы, злокачественной клеткой яичников, злокачественной клеткой толстого кишечника или злокачественной клеткой поджелудочной железы. Средство может представлять собой, например, химическое соединение, белок или нуклеиновую кислоту.
Изобретение включает способы доставки соединения в клетки, где способ включает контактирование клетки с соединением, слитым с Antennapedia или его функциональной частью. Соединение может представлять собой, например, химическое соединение, белок или нуклеиновую кислоту.
Способы по изобретению можно осуществлять посредством взаимодействия образцов клеток ex vivo, например, в среде для культивирования или на твердой подложке. Альтернативно или кроме того, способы можно осуществлять in vivo, например, производя трансплантацию образца злокачественной клетки тестируемому животному (например, мышам nude), и введением тестируемого средства или композиции тестируемому животному. Преимущество анализа in vivo состоит в том, что эффективность тестируемого средства можно определять у живого животного, более точно воспроизводя, таким образом, клиническое состояние. Поскольку анализы in vivo являются, как правило, дорогостоящими, они могут являться особенно пригодными для вторичного отбора, вслед за определением "ведущих" средств с использованием способа in vitro.
После осуществления способов в высокопроизводительном формате (или сверхвысоком), способы по изобретению можно осуществлять на твердой подложке (например, планшете для микротитрования, кремниевой пластине или предметном стекле), где клеточные образцы и/или интересующие гены располагают так, что каждый отделен друг от друга (например, в лунках). Любое количество образцов (например, 96, 1024, 10000 100000 или больше) можно исследовать параллельно, используя определенный способ, в зависимости от используемой конкретной подложки. В случае если образцы расположены на матрице (т.е. определенным образом), каждый образец на матрице может быть определен по его расположению (например, используя ось координат), с присвоением, таким образом, "адреса" каждому образцу. Преимуществом используемого формата матрицы “с адресом” является то, что способ может быть целиком или частично автоматизированным, при котором клеточные образцы, реагенты, интересующие гены и т.п. можно помещать на определенные позиции в необходимое время (или удалять), и в образце (или аликвоте) можно контролировать, например, активность или экспрессию одного или нескольких генов, связанных с путем передачи сигнала Notch.
Примеры химиотерапевтических средств, которые можно использовать в сочетании со средствами, описываемыми в настоящем документе, включают, в качестве неограничивающих примеров, противораковые лекарственные средства, такие как даунорубицин, дактиномицин, доксорубицин, блеомицин, митомицин, азотистый иприт, хлорамбуцил, мелфалан, циклофосфамид, 6-меркаптопурин, 6-тиоигуанин, цитарабин (CA), 5-фторурацил (5-FU), флоксуридин (5-FUdR), метотрексат (MTX), колхицин, винкристин, винбластин, этопозид, тенипозид, цисплатин и диэтилстилбестрол (DES). Противовоспалительные лекарственные средства также можно использовать в сочетании со средствами, описываемыми в настоящем документе, включая в качестве неограничивающих примеров, нестероидные противовоспалительные лекарственные средства и кортикостероиды, и также можно сочетать в композициях и способах по изобретению противовирусные лекарственные средства, включая в качестве неограничивающих примеров, рибивирин, видарабин, ацикловир и ганцикловир. Два или более комбинированных соединения можно использовать вместе или последовательно.
Следующие примеры предоставлены для дополнительной иллюстрации преимуществ и признаков настоящего изобретения, но не предназначены для ограничения объема изобретения. Хотя они являются типичным примером того, что можно использовать, альтернативно можно использовать другие способы, методики или технологии, известные специалистам в данной области.
ПРИМЕРЫ
ПРИМЕР 1
Определение компонентов Notch в нормальных образцах и образцах рака молочной железы человека
Эксперименты проводили с целью выяснения особенностей передачи сигнала Notch при раке молочной железы человека. Для анализа экспрессии белков пути Notch получали два нормальных образца (A и B) и двадцать образцов рака молочной железы (группы C, D, E, F, G) (таблица 2.1). Ко всем образцам прилагались гистологические заключения. Образцы рака молочной железы распределяли по пяти группам (таблица 1, группы C, D, E, F, G), исходя из экспрессии ER, PR, erbB2, EGFR в опухолях, которая коррелирует с прогнозом и исходом заболевания. Кроме того, внутри каждой группы производили разделение опухолей по видам (лобулярная или протоковая) и степеням (I, II, III). Клетки опухолей I степени являются, как правило, высокодифференцированными и в большинстве случаев обладают нормальной структурой и функциями. При раке молочной железы II степени существуют клетки, у которых начинают приводиться в действие патологические процессы. С другой стороны, клетки рака молочной железы III степени являются, как правило, низкодифференцированными или недифференцированными, не обладают специализированной структурой и имеют склонность к более агрессивному росту и распространению. Относительно всех других видов рака молочной железы, пациенты с раком молочной железы с опухолью, положительной по экспрессии ER/PR, имеют наилучший прогноз и исход заболевания. Реагируют на гормональное лечение 70% опухолей, положительных по ER/PR, в то время как отвечают на лечение менее чем 10% негативных по ER/PR и приблизительно 40% положительных по ER и негативных по PR злокачественных опухолей молочной железы. Опухоли, положительные по erbB2 являются, как правило, агрессивными злокачественными опухолями, с неблагоприятным исходом заболевания. Пациенты с опухолями, положительными по erbB2, показали только 40% выживаемость в течение 5 лет, по сравнению с более чем 80% выживаемостью пациентов с опухолями, негативными по erbB2. Пациенты с опухолями, негативными по ER, положительными по erbB2, имеют очень неблагоприятный прогноз, и для этого вида опухолей существует меньше стратегий лечения, чем для любого другого вида опухоли при раке молочной железы. Было предположено, что опухоли, положительные по erbB2/ER, имеют лучший ответ на гормональное лечение, чем положительные по erbB2 негативные по ER опухоли. Среди 20 образцов 13 представляли собой протоковую карциному и 7 представляли собой лобулярную карциному. Среди 13 образцов протоковой карциномы один имел I степень, четыре были II степени, шесть имели степень III, и один представлял собой протоковую карциному in situ (DCIS). Степень была неизвестной для каждого образца лобулярной карциномы. Двадцать два образца (два нормальных, двадцать опухолевого происхождения) взвешивали и делили пополам для Вестерн-блоттинга и иммуногистологического анализа.
Образцы ткани молочной железы
Кроме того, для анализа Вестерн-блоттинг имелись в наличии линии эпителиальных клеток молочных желез человека, три нормальные (MCF-10A, MTSV1-7, HB4A) и восемь опухолевого происхождения (Hs578T, MDA-MB468, MCF7, ZR75T, CAL51, MDA-MB231, SK-BR3 и PMC42). В таблице 2.2 показана экспрессия ER, PR, ErbB2 и EGFR в трех нормальных (MCF-10A, MTSV1-7, HB4A) и в девяти опухолевых эпителиальных клеточных линиях молочных желез человека (Hs578T, MDA-MB468, MCF7, ZR75T, CAL51, MBA-MB231, SK BR3, PMC42).
Линии эпителиальных клеток молочной железы
Для определения того, изменена ли передача сигнала Notch в злокачественных опухолях молочной железы, экспрессию рецепторов и лигандов Notch, обнаруженную в нормальной ткани, анализировали посредством анализа Вестерн-блоттинг в двух образцах нормальной ткани молочной железы и двадцати образцах злокачественной опухоли молочной железы. Кроме того, исследовали уровни белка NICD и экспрессию Numb. Numb представляет собой цитоплазматический адаптерный белок, который взаимодействует с внутриклеточным доменом Notch. Он действует как ингибитор пути, поскольку необходим для убиквитинирования и ингибирования активности NICD.
Количество Jagged2 снижалось, по сравнению с нормальной тканью, в пяти из семи опухолевых образцах в категории ER+/PR+/erbB2-, в двух из семи в категории ER+/PR-/erbB2-, в двух из трех в образцах ER+/erbB2+ и оставалось неизмененным в образцах ER-/erbB2+ и ER-/EGFR+. Экспрессия Numb прекращалась во всех образцах рака молочной железы. С другой стороны, экспрессия NICD повышалась во всех образцах рака молочной железы, по сравнению с двумя образцами нормальной ткани. Кроме того, в нескольких образцах рака молочной железы обнаруживался укороченный NICD, с низкой молекулярной массой, что указывает на то, что рецепторы Notch могут быть измененными в злокачественной опухоли молочной железы.
Анализом Вестерн определяли снижение количества Jagged2 у белков, выделенных из образцов рака молочной железы ER+/ER+/erbB2- (C1-C7), образцов нормальной ткани молочной железы (A и B), из четырех протоковых карцином и трех лобулярных карцином. Образцы разделяли в SDS-PAGE и изучали посредством первичных антител к Numb, расщепленному Notch1 (NICD), Notch1, Jagged2, Delta-подобному 4 и E-кадгерину. Количество Numb снижалось, по сравнению с двумя нормальными образцами, во всех семи образцах злокачественных опухолей. С другой стороны, количество активированной формы Notch повышалось во всех семи образцах рака молочной железы. Количество Jagged2 снижалось в трех из четырех образцов протоковой карциномы молочной железы (C1, C3 и C4) и в двух из трех образцов лобулярной карциномы молочной железы (C5 и C6). Количество Delta-подобного4 снижалось в двух из четырех образцов протоковой карциномы молочной железы и во всех образцах лобулярной карциномы молочной железы. Количество E-кадгерина снижалось во всех опухолевых образцах. В образце под номером C2 присутствовала дополнительная форма расщепленного Notch с низкой молекулярной массой. В образцах C2, C4, C6 и C7 присутствовала дополнительная форма Jagged2 с низкой молекулярной массой.
Дополнительно осуществляли анализ Вестерн белков, выделенных из образцов рака молочной железы ER+/PR-/erbB2- (D1-D7). Получали суммарные клеточные лизаты из двух нормальных образцов (A и B), четырех протоковых и трех лобулярных образцов рака молочной железы ER+/PR-/erbB2- и белки подвергали разделению в SDS-PAGE и исследовали с первичными антителами к Numb, расщепленному Notch (NICD), Notch1, Jagged2, Delta-подобному 4 и E-кадгерину. Количество Numb снижалось, по сравнению с двумя нормальными образцами, во всех семи образцах злокачественных опухолей. С другой стороны, количество активированной формы Notch повышалось во всех семи образцах. Количество Jagged2 снижалось в трех из четырех протоковых и во всех трех лобулярных образцах. Количество Delta-подобного4 снижалось в трех из четырех протоковых и во всех трех лобулярных опухолевых образцах. Количество E-кадгерина снижалось в двух из четырех протоковых и во всех лобулярных образцах рака молочной железы. В образцах с номерами D1 и D3 присутствовали дополнительные низкомолекулярные формы Jagged2. Эпителиальный маркер десмоплакин помогал нормировать количество эпителиальных клеток внутри каждого образца.
Анализ Вестерн также проводили с белками, выделенными из образцов рака молочной железы ER+/erbB2+ (E1-E3), ER-/erbB2+ (F1), ER-/EGFR+ (G1 и G2). Суммарные клеточные лизаты получали из двух нормальных (A и B), трех ER+/erbB2+, одного ER-/erbB2+ и двух ER-/EGFR+ образцов рака молочной железы. Образцы клеточных лизатов подвергали разделению в SDS-PAGE и исследовали с первичными антителами к Numb, расщепленному Notch (NICD), Jagged2, Delta-подобному 4 и E-кадгерину. Количество Numb снижалось, по сравнению с двумя нормальными образцами, во всех семи образцах злокачественных опухолей, тогда как количество активированной формы Notch повышалось во всех семи образцах. Количество Jagged2 снижалось в двух из трех образцов ER+/erbB2+ злокачественной опухоли. Количество Delta-подобного 4 снижалось во всех образцах ER+/erbB2+. Количество E-кадгерина снижалось в четырех из семи образцов. В некоторых образцах присутствовали дополнительные низкомолекулярные формы расщепленного NICD и Jagged2. Эпителиальный маркер десмоплакин помогал нормировать количество эпителиальных клеток внутри каждого образца.
В некоторых образцах рака молочной железы обнаруживался укороченный Jagged2 с низкой молекулярной массой. Однако значимость этой изоформы не ясна. Экспрессия Delta-подобного 4 варьирует в нормальных образцах и образцах рака молочной железы, но в целом его количество снижено, по сравнению с нормальными образцами, в образцах рака молочной железы. Количество E-кадгерина снижено в отдельных опухолях.
Поскольку анализ Вестерн не проводит различие между эпителиальной и стромальной тканью, для доказательства локализации сверхэкспрессии Notch1 внутри опухолевой ткани проводили иммуногистохимический анализ рассмотренных выше образцов ткани молочной железы. Интенсивное, исходя из эпителиального маркера молочной железы Muc1, окрашивание Notch1 (NICD) внутри эпителиальных клеток, сопровождалось снижением количества Numb. Кроме того, внутри эпителиальных клеток обнаруживали интенсивное окрашивание Notch3. Экспрессия Jagged1 и Jagged2 ограничивалась эпителиальными клетками. Эти данные демонстрируют, что путь Notch активируется во время формирования и развития рака молочной железы.
Пример 2
Определение компонентов Notch в линиях нормальных и злокачественных клеток молочной железы
Для подтверждения результатов Вестерн-блоттинга и иммуногистохимии, для образцов рака молочной железы проводили анализ Вестерн-блоттинг на трех нормальных эпителиальных клеточных линиях молочных желез человека (MCF-10A, MTSV1-7, HB4A) и восьми эпителиальных клеточных линиях молочных желез человека опухолевого происхождения (Hs578T, MDA-MB468, MCF7, ZR75T, CAL51, MDA-MB231, SK-BR3 и PMC42). Результаты согласовывались с теми, которые получены для образцов ткани.
Белки в анализе Вестерн-блоттинг исследовали с первичными антителами к Numb, расщепленному Notch (NICD), Notch1, Notch 3, Jagged1, Jagged2, Delta-подобному 4, E-кадгерину, Hey1 и Hes5. Количество Numb снижалось, по сравнению с тремя нормальными линиями, во всех девяти линиях злокачественных клеток. С другой стороны, количество активированной формы Notch увеличивалось во всех девяти линиях. Укороченные формы активированных форм Notch наблюдали в пяти линиях опухолевых клеток. Кроме того, уровень экспрессии Hey2 и Hes5 повышался во всех линиях злокачественных клеток молочной железы, демонстрируя, что накопление NICD коррелирует с усилением передачи пути Notch. Количество Notch3 повышалось в шести из девяти образцов (Hs578T, MDA-MB468, MCF7, ZR75T, CAL51, SK-BR3) и количество Jagged1 повышалось в семи из девяти клеточных линий (Hs578T, MDA-MB468, ZR75T, MDA-MB231, SK-BR3, MDA MB435, PMC42). Вместе эти результаты показывают, что передача сигнала Notch активирована во всех проанализированных линиях злокачественных клеток молочной железы. С другой стороны, количество Jagged2 снижалось в семи из девяти протестированных линий опухолевых клеток и в отдельных линиях опухолевых клеток обнаруживали формы Jagged2 с более высокой молекулярной массой. Количество Delta-подобный 4 снижалось в трех из девяти линий опухолевых клеток (Hs578T, ZR75T, SK BR3). Количество E-кадгерина снижалось в пяти из девяти линий опухолевых клеток (Hs578T, ZR75T, MDA MB231, SK BR3, PMC42).
Результаты этого анализа убедительно показывают, что передача сигнала Notch усилена во время развития рака молочной железы. Компоненты пути передачи сигнала Notch сверхэкспрессированы во всех образцах рака ткани молочной железы и в протестированных клеточных линиях. Кроме того, экспрессия ингибитора, Numb, неизменно снижена во всех проанализированных образцах. Однако более важно показанное накопление NICD, которое является прямым биохимическим признаком передачи сигнала Notch. В соответствии с этим, увеличивалась экспрессия генов-мишеней Hes5 и Hey1 в линиях злокачественных клеток молочной железы.
Накопление укороченной молекулы NICD также наблюдали в некоторых образцах рака молочной железы и в линиях эпителиальных клеток молочной железы. Подобные укороченные формы обнаруживали в T-клеточном остром лимфобластном лейкозе и показали, что это есть следствие мутаций, которые образуют сдвиг рамки считывания или преждевременные стоп-кодоны терминации в пределах последовательности PEST Notch1. Получающиеся в результате белки Notch1 являются более стабильными, поскольку домен PEST содержит последовательности, важные для деградации NICD. Таким образом, эти мутации приводят к усилению передачи сигнала Notch. Наличие укороченной молекулы Notch1 (NICD) в образцах рака молочной железы человека, проанализированных в данной работе, предполагает, что похожие активирующие мутации могут иметь место при раке молочной железы.
В заключение, анализ экспрессии Notch в отношении прогностических маркеров (PR, ER, erbB2, EGFR) не выявил значимой корреляции, как в образцах рака молочной железы, так и в клеточных линиях. Результаты этого анализа представляют убедительное доказательство того, что передача сигнала Notch изменена в злокачественной опухоли молочной железы человека.
Пример 3
Ингибирование передачи сигнала Notch возвращает к исходному состоянию трансформированный фенотип молочной железы человека
Линии злокачественных клеток MDA-B231 и MCF7
Результаты анализа злокачественных опухолей молочной железы пациентов и анализ клеточных линий показывает, что передача сигнала Notch активировалась во всех двадцати образцах рака молочной железы человека и в восьми исследованных образцах эпителиальных клеточных линий, образующих опухоль у млекопитающих. Для определения того, включено ли усиление передачи сигнала Notch в развитие опухоли, передачу сигнала Notch ингибировали в двух различных линиях злокачественных клеток молочной железы посредством сверхэкспрессии Numb. Две клеточные линии, выбранные для этого эксперимента, представляли собой линии MDA-MB-231 и MCF7. Клеточная линия MDA-MB-231 получена из аденокарциномы, в которой не экспрессируются ER, PR, EGFR и E-кадгерин, но высоко экспрессируется erbB2 (см. таблицу 2). Также описана ее высокая метастатическая способность при инъецировании мышам nude. C другой стороны, клеточная линия MCF7 является положительной по экспрессии ER, PR, E-кадгерина и отрицательной по экспрессии erbB2, EGFR (см. таблицу 2.1) и также получена из аденокарциномы, но не образует метастазов при инъецировании мышам nude.
Для исследования возможного участия Numb в клеточной трансформации получали клеточные линии MCF7 и MDA-MB231, стабильно экспрессирующие Numb. Две клеточные линии трансфицировали экспрессирующим вектором pcDNA3.1, кодирующим белок Numb и содержащим конструкцию устойчивости к неомицину. Посредством генетицина отбирали клетки, со стабильной интеграцией вектора. В качестве контроля также получали клеточные линии MCF7 и MDA-MB231, содержащие пустой вектор pcDNA3.1. Исходя из анализа Вестерн-блоттинг, уровни экспрессии Numb снижались, по сравнению с родительскими клетками и клетками, несущими контрольный вектор, у клеточных линий MCF7/Numb и MDA-MB231/Numb. Повышенная экспрессия Numb сопровождалась снижением количества NICD и Hey1. В клетках MCF7/Numb, но не в клетках MDA-MB231/Numb, также наблюдали увеличение количества E-кадгерина.
Для определения действия Numb на морфологию клеток исследовали родительские клетки, клетки, содержащие контрольный вектор и клетки MCF7/Numb или MDA-MB231/Numb. Родительские клетки и клетки MCF7 с контрольным вектором проявляли способность к образованию опухолей с веретенообразным фенотипом клеток. С другой стороны, фенотип клеток MCF7/Numb изменялся до нормальной, булыжнекоподобной эпителиальной морфологии. Кроме того, клетки MCF7/Numb росли, по сравнению с беспорядочным ростом родительской клеточной линии и линии клеток с контрольным вектором, образуя организованные островки клеток, в близком контакте друг с другом. С другой стороны, клетки MCF7/Numb продемонстрировали булыжнекоподобную эпителиальную морфологию, которая имеет сходство с нормальной клеточной линией. Это изменение в морфологии позволяет предположить, что клеточная линия MCF7/Numb утратила свой трансформированный фенотип. Однако для более точного исследования этого и для исследования клеточной линии MDA-MB231/Numb две клеточные линии высевали на мягкий агар. Количество колоний, образованных клетками MCF7/Numb и MDA-MB231/Numb, составляло 5% и 0%, соответственно, по сравнению с числом тех колоний, которые образовывали родительские клетки и клетки с контрольным вектором (фигуры 2A и 2B). Результат убедительно показывает, что передача сигнала Notch требуется для поддержания трансформированного фенотипа в клетках MCF7 и MDA-MB231.
Данные позволяют предположить, что активация передачи сигнала Notch является важной даже для трансформации эпителиальных клеток млекопитающих. В клетках MCF7 инактивация пути Notch посредством Numb повышает экспрессию E-кадгерина и восстанавливает нормальную морфологию эпителиальной клетки. Это морфологическое изменение, возможно, приводит к восстановлению адгезионных контактов. Снижалось способность к образованию колоний клетками MCF7/Numb и MDA-MB231/Numb на мягком агаре, что указывает на то, что Numb блокирует свободную пролиферацию обоих клеточных линий.
Дополнительно, снижение пути передачи сигнала Notch, с использованием Numb, препятствует онкогенезу у иммунодефицитных мышей nude. В правый или левый бок иммунодефицитных мышей nude вводили 5×105 клеток, стабильно экспрессирующих Numb или пустой вектор, соответственно. Рост опухоли продолжался только в левом боку мыши, куда инъецировали клетки, экспрессирующие пустой вектор, и не продолжался в правом боку, куда инъецировали клетки, экспрессирующие ингибитор пути Notch белок Numb.
Пример 4
Продукты TR3 и TR4 против активации NOTCH
Низкая проницаемость биомембран традиционно создавала препятствия для доставки противораковых полипептидных молекул и ограничивала их терапевтическое значение. Обнаружение того, что прохождение пептидов сквозь биологические мембраны может происходить не посредством классического эндоцитозного пути, но, по-видимому, с помощью механизма, не требующего затрат энергии, открыла новые возможности в биомедицинских исследованиях.
Для лечения опухоли в способах по изобретению используют способность пептида-“трояна” Antenapedia (ANTP) к перемещению в клетку. Пептиды "Троянский конь" представляют собой небольшие белки или области белков, иначе называемые как домены белковой трансдукции (PTD), которые обладают способностью эффективно проникать через биологические мембраны, включая гематоэнцефалический барьер, способом, независящим от температуры, рецептора и переносчика. Их огромный терапевтический потенциал основан на том факте, что с пептидами можно соединять любое фармацевтическое соединение (химические соединения, белки, ДНК), которые с ним связывают, независимо от его физических свойств. Одним из таких пептидов является гомеозисный фактор транскрипции ANTP Drosophila. Гомеодомен ANTP представляет собой фактор транскрипции из организма Drosophila melanogaster, специфичный к последовательности. Этот белок кодируется геном Antennapedia (antp). Antp является членом регуляторной системы, которая обеспечивает определенное расположение клеток на передне-задней оси организма. Таким образом, Antp участвует в контроле развития клеток в среднегрудном сегменте у Drosophila.
Домен гомеобокс или гомеодомен является одним из тех, которые связывают ДНК посредством структурного участка “спираль-петля-спираль”. Белки, которые содержат домен гомеобокс, обычно участвуют в развитии, и многие из них представляют собой факторы транскрипции, специфичные к последовательности. Гомеодомен ANTP имеет длину 60 аминокислотных остатков и содержит четыре альфа-спирали. Этот участок подобен тем, которые обнаружили в прокариотических репрессорных белках.
Слитый белок, состоящий из Antennapedia-Numb (продукт Tr3), получали способами генетической инженерии и исследовали на его способность к нацеливанию на опухолевые клетки in vivo (фигура 3A). Последовательность слитого белка Tr3 приведена в SEQ ID NO:1. Последовательность Numb отдельно приведена в SEQ ID NO: 3.
Пример 5
Получение в лаборатории и описание свойств ANTP/DN-MAML
Белок, подобный Mastermind (MAML), представляет собой ядерный белок, богатый глутамином, необходимый для активации передачи сигнала Notch. MAML является коактиватором всех четырех рецепторов Notch. Mastermind образует комплекс с внутриклеточным участком активированного Notch (NICD), фактором транскрипции CBF1 и ДНК. Это приводит к активации генов-мишеней Notch Hes и Hey, которые входят в состав семейства транскрипционных репрессоров. Однако укороченный вариант MAML, который может сохранять способность к ассоциации в комплекс, работает в доминантно-негативной форме (DN) и ингибирует активацию Notch. DN-MAML состоит из скрученной α-спирали из 62 аминокислот, которая образует стабильный третичный комплекс посредством связей как с CBF1, так и с анкириновыми повторами Notch1, но утратила C-концевые участки MAML1, которые являются ответственными за активацию Notch.
Конструировали слитый белок, состоящий из ANTP/DN-MAML (TR4) (фигура 3B) (SEQ ID NO:2). Исследовали способность конструкции опосредовать перемещение в ядро, ингибировать активацию передачи сигнала Notch, биораспределение в животных и нацеливание на внешнюю, среднюю и внутреннюю часть опухолей млекопитающих.
Получение
Слитый белок ANTP/DN-MAML получали в бактериальной экспрессионной системе (E. Coli). Экспрессионные штаммы бактерий трансформировали вектором, содержащим слитые гены, индуцировали экспрессию и бактерии подвергали лизису. Экспрессия слитого белка ANTP/DN-MAML в культуре достигала максимума, вплоть до 2,5 мг/л, через три часа после индукции. Продукт слитого белка выделяли, используя металлоаффинную хроматографию на колонке с сефарозой, образующей комплекс с никелем, в денатурирующих условиях с гидрохлоридом гуанидиния и мочевиной. Далее, для получения конечного функционального продукта, продукт слитого белка подвергали рефолдингу в физиологическом растворе, забуференном Tris, перед тем как дважды диализовать в PBS. Белок, образовавший неправильную структуру, является нефункциональным и выпадает в осадок в растворе. Получали продукт с конечным выходом активного соединения 0,8-1 мг на литр культуры.
Состав и хранение
Слитый белок замораживали в PBS из расчета 0,25 мг/мл. Перед началом использования слитый белок десятикратно концентрировали до 2,5 мг/мл.
Описание и определение
ANTP/DN-MAML представляет собой слитый белок с молекулярной массой 14,18 КДа:
a) гомеодомен antennapedia состоит из 60 аминокислот, с молекулярной массой 6,6 КДа (SWISSPROT=P02833) (RKRGRQTYTRYQTLELEKEFHFNRYLTRRRRIEIAHALCLTERQIKIWFQNRRMKWKKEN) (SEQ ID NO:4)
b) последовательность DN/MAML состоит из 62 аминокислот (SWISSPROT=Q92585 (MAML1 ЧЕЛОВЕКА, аминокислоты 13-74)) с молекулярной массой 6,8 КДа (LPRHSAVMERLRRRIELCRRHHSTCEARYEAVSPERLELERQHTFALHQRCIQAKAKRAGKH)(SEQ ID NO:5)
c) пентагистидиновая метка для очистки с молекулярной массой 0,775 КДа
Фракции слитого белка ANTP/DN-MAML, очищенные на колонке для аффинной хроматографии, определяли SDS-PAGE, с окрашиванием Кумасси синим, а также анализом иммуноблотинг, используя антитело против пентагистидина, с последующим использованием антител, конъюгированных с пероксидазой.
Пример 6
Перемещение в ядро, опосредованное ANTP/DN-MAML
Для определения расположения слитого белка ANTP/DN-MAML (TR4) в клетке выполняли иммуноокрашивание эпителиальных клеток рака молочной железы человека MDA-MB231. Клетки MDA-MB231 культивировали при 37°C до субконфлюэнтного состояния в модифицированной по способу Дульбекко среде Игла, содержащей 10% сыворотку теленка. Покровное стекло с прикрепленными клетками промывали и инкубировали в бессывороточной среде в течение двух часов с очищенным слитым белком ANTP/DN-MAML в концентрации 50 мкМ. Клетки промывали три раза и фиксировали 4% параформальдегидом в течение 15 минут. После непродолжительных промывок покровные стекла инкубировали в растворе для блокирования и далее с первичным антителом против His и вторичным антителом, конъюгированным с FITC. Флуоресценцию регистрировали на флуоресцентном микроскопе Zeiss Axioscope 40.
Результаты показывают, что ANTP/DN-MAML в адгезивных клетках расположен в ядре. Это расположение является значимым, поскольку эпителиальная клеточная линия рака молочной железы человека MDA-MB231 обычно бывает в числе клеток, наиболее плохо поддающихся трансфекции.
Пример 7
Ингибирование передачи сигнала Notch, опосредованное ANTP/DN-MAML
Для исследования возможного участия ANTP/DN-MAML в ингибировании активации передачи сигнала Notch, эпителиальную клеточную линию MDA-MB231 млекопитающих с высокой способностью к метастазированию обрабатывали слитым белком ANTP/DN-MAML в течение двух часов. Из клеток выделяли общий белок, используя буфер SDS. Общие концентрации белков определяли, используя набор для анализа белков BCA. Общий белок (10-50 г) разводили в 5X буфере для образцов (250 M Tris-HCl pH 6,8, 500 мМ дитиотреитол, 10% SDS, 0,5% бромфеноловый синий, 50% глицерин), прогревали при 100°C и анализировали в SDS-PAGE. Электрофорез осуществляли в подвижном буфере (25 мМ Tris HCl, 250 мМ глицин, 0,1% SDS) в течение 60 минут или до выхода бромфенолового синего из геля. Разделенные белки переносили на нитроцеллюлозную мембрану посредством электрофореза в течение 90 минут при 100 В в холодном буфере для переноса (39 мМ глицин, 48 мМ трис HCl). Вестерн-блоттинг осуществляли с первичным, конъюгированным с пероксидазой антителом козы против IgG мыши, в буфере для блокирования при 4°C в течение ночи (Sigma A9917). Нитроцеллюлозные мембраны промывали 4 раза, в течение пяти минут каждый, в буфере TBS-T. Вторичное поликлональное антитело кролика против антител козы разводили в буфере для блокирования из расчета 1:10000 и инкубировали в течение 60 мин при комнатной температуре с последующими 4 промывками в течение пяти минут в TBS-T. Для детекции специфического связывания использовали 2 мл реагента Super Signal West Pico Chemiluminescent substrate (PIERCE) и фиксировали сигналы на пленке Kodak XAR-5.
Экспрессия ANTP/DN-MAML сопровождалась ингибированием активированного Notch (NICD) в клетках, трансфицированных ANTP/DN-MAML, но не в клетках, трансфицированных ANTP или в родительских клетках (нетрансфицированных). Ингибирование активации Notch наблюдали в клетках, обработанных слитым белком ANTP/DN-MAML, но не в клетках, обработанных только ANTP. Эти результаты показывают, что ANTP/DN-MAML можно использовать для блокирования активации Notch.
Пример 8
Перераспределение ANTP/DN-MAML
Для определения того, можно ли использовать Antennapedia для доставки DN-MAML in vivo, мышам CD1 nude внутривенно в хвостовую вену инъецировали 4 мг/кг слитого белка ANTP/DN-MAML. Мышей в течение 5 мин перфузировали фосфатно-солевым буфером и умерщвляли через 2 часа после инъекции. Экспрессию ANTP/DN-MAML в каждом органе определяли анализом Вестерн-блоттинг. В образцах ткани из печени, почек, сердца, легких, селезенки и мозга мышей, которым инъецировали ANTP/DN-MAML, обнаружили значительный сигнал, по сравнению с контрольными мышами, которым инъецировали PBS. Важно, что ANTP/DN-MAML также обнаружили в мозге животных, что указывает на то, что ANTP/DN-MAML может проникать через гематоэнцефалический барьер. В связи с этим, направленная система доставки настоящего изобретения может иметь широкие области применения при введении терапевтических белков в центральную нервную систему.
Пример 9
Проникновение ANTP/DN-MAML внутрь внешних, средних и внутренних участков опухолей млекопитающих
Очищенный слитый белок ANTP/DN-MAML инъецировали в хвостовую вену мышам CD1 Nude с ксенотрансплантированными эпителиальными злокачественными клетками молочной железы человека MDA MB231. Мышей перфузировали фосфатно-солевым буфером в течение 5 мин и умерщвляли через 2 часа после инъекции. Вырезали опухоль и под стереоскопом делали срезы для разделения внешней, средней и внутренних частей опухоли. ANTP/DN-MAML в каждой части опухоли определяли анализом Вестерн-блоттинг. Экспрессию ANTP/DN-MAML обнаруживали во внешней, средней, внутренней частях опухолей у животных, которым инъецировали ANTP/DN-MAML, но не у контрольных животных, которым инъецировали PBS.
С целью определения расположения ANTP/DN-MAML в пределах опухолей выполняли иммуногистохимию образцов рака молочной железы, описанных выше. Интенсивное окрашивание ANTP/DN-MAML наблюдали в пределах ядра злокачественных клеток молочной железы. Эти данные показывают, что слитый белок ANTP/DN-MAML опосредует перемещение в ядро in vivo.
Пример 10
Уменьшение опухоли в присутствии Antennepedia/доминантно-негативная форма Mastermind in vivo
Мышам прививали ксенотрансплантаты рака молочной железы. Мышей разделяли на две группы и каждые два дня инъецировали PBS в качестве контроля или 4 мг/кг слитого белка ANTP/DN-MAML (n=6 в группе) (фигура 4A). У контрольных мышей, которым вводили PBS, развивались быстро растущие опухоли. Через двадцать дней контрольных мышей подвергали эвтаназии. У мышей, которым вводили ANTP/DN-MAML, после тридцати двух дней объем опухоли не увеличивался, что показывает, что ANTP/DN-MAML предотвращает или сдерживает рост опухоли. (фигура 4B).
Пример 11
Токсикологические и иммуногенные исследования
Для исследования безопасности применения, иммуногенности и эффективности ANTP/DN-MAML осуществляли следующие эксперименты на моделях опухолей in vivo. Иммуногенность представляет собой оценку иммунного ответа на терапевтическое лекарственное средство. Она имеет отношение к использованию терапевтических белков в качестве лекарственных средств, поскольку образование антител против лекарственного средства может привести к аллергии или анафилактическим реакциям, снижению эффективности лекарственного средства и/или развитию аутоиммунной реакции.
Иммуногенность ANTP/DN-MAML исследовали на иммунокомпетентных мышах. Животных иммунизировали один раз в сутки в течение 5 суток, вводя внутривенно ANTP/DN-MAML (0,2 мл, 2,5 мг/мл) без адъюванта. У мышей раз в неделю, в течение периода длиной 4 месяца, отбирали кровь и контролировали иммунный ответ анализом ELISA. Образцы крови разводили в PBS 1:10, 1:100 и 1:1000 и иммунный ответ контролировали посредством ELISA на чистом ANTP/DN-MAML (нанесенный из расчета 50 мкг/мл) и измеряли, используя антитела к белкам мыши. Результаты показали, что ANTP/DN-MAML в дозе 2,5 мг в неделю не вызывает иммунный ответ у иммунокомпетентных мышей. Эта доза у людей эквивалентна 100 мг/кг.
Пример 12
Исследования по определению максимально допустимой дозы in vivo
При достижении мышами возраста 12 недель начинали введение ANTP/DN-MAML в хвостовую вену. Мышей непрерывно контролировали на наличие признаков гипогликемического шока или побочных эффектов лекарственного средства и умерщвляли, если потеря массы тела превышала 15%. Исследовали различные количества доз, начиная с 4 мг/кг/сутки. Обнаружено, что максимально допустимая доза ANTP/DN-MAML составляет 57 мг/кг/сутки. При этой дозе мыши страдали от потери аппетита, потери массы и гипогликемии. Этот эксперимент останавливали, умерщвляя животное через три дня после инъекции.
Пример 13
Модели злокачественных опухолей яичников, толстого кишечника и поджелудочной железы
Notch на высоком уровне экспрессирован в злокачественных клетках толстого кишечника. ANTP/DN-MAML вводили самкам мышей nude, носительницам ксенотрансплантированных опухолей Colo205. Мышам через день вводили посредством инъекций 0,2 мл 4 мг/мл белка ANTP/DN-MAML. У пациента эта доза эквивалентна 2 г слитого белка ANTP/DN-MAML. Результаты показали, что введение ANTP/DN-MAML уменьшает рост злокачественных клеток толстого кишечника in vivo.
Несмотря на то, что изобретение описано со ссылкой на примеры, описанные выше, следует понимать, что модификации и варианты включены в пределы сущности и объема изобретения. Таким образом, изобретение ограничено только следующими пунктами формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ПУТИ ПЕРЕДАЧИ СИГНАЛА NOTCH И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ РАКА | 2012 |
|
RU2631611C2 |
| УСОВЕРШЕНСТВОВАННАЯ СТРАТИФИКАЦИЯ ПАЦИЕНТОВ ДЛЯ ОЦЕНКИ ПРИГОДНОСТИ ТЕРАПИИ | 2015 |
|
RU2711452C2 |
| КОМПОЗИЦИИ ГУМАНИЗИРОВАННЫХ СЛИТЫХ БЕЛКОВ NOTCH И СПОСОБЫ ЛЕЧЕНИЯ | 2008 |
|
RU2532830C2 |
| ИСПОЛЬЗОВАНИЕ БИОГЕНЕЗА МИКРОРНК В ЭКЗОСОМАХ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ | 2014 |
|
RU2644247C2 |
| ОСНОВАННЫЕ НА Notch3 ЧЕЛОВЕКА ГИБРИДНЫЕ БЕЛКИ В КАЧЕСТВЕ ЛОВУШЕК-ИНГИБИТОРОВ ПЕРЕДАЧИ СИГНАЛА Notch3 | 2009 |
|
RU2567662C2 |
| АНТИТЕЛА ПРОТИВ NRR Notch1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2476443C2 |
| ЛЕЧЕНИЕ АДЕНОМЫ И/ИЛИ АДЕНОКАРЦИНОМЫ КИШЕЧНИКА С ПОМОЩЬЮ ИНГИБИРОВАНИЯ АКТИВАЦИИ ПУТИ NOTCH | 2005 |
|
RU2392961C2 |
| ХИМЕРНЫЙ ПЕПТИД И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2435783C1 |
| МАРКЕРЫ, АССОЦИИРОВАННЫЕ С ИНГИБИТОРАМИ WNT | 2014 |
|
RU2663701C2 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2547583C2 |










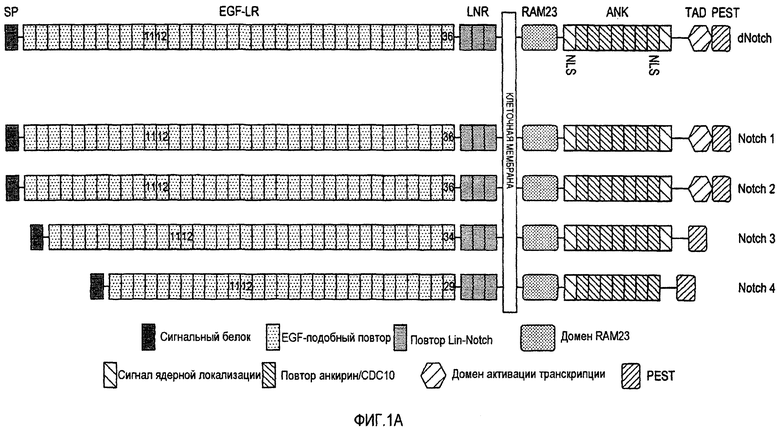
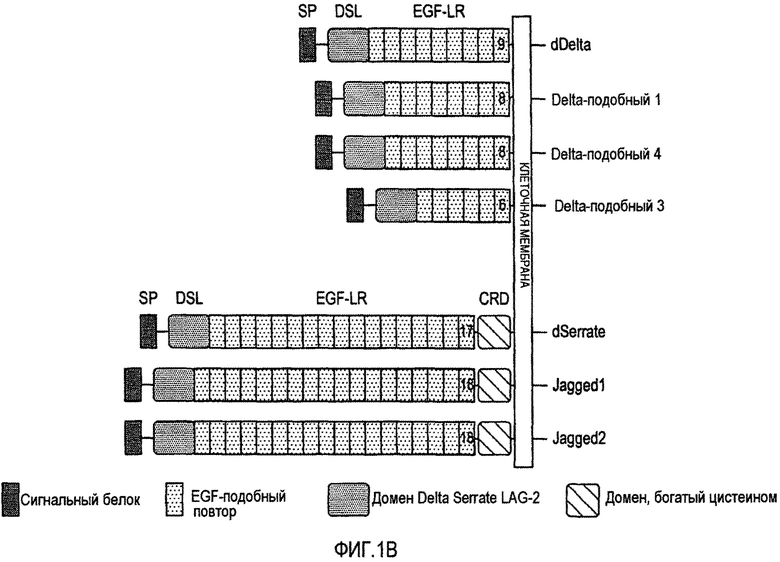
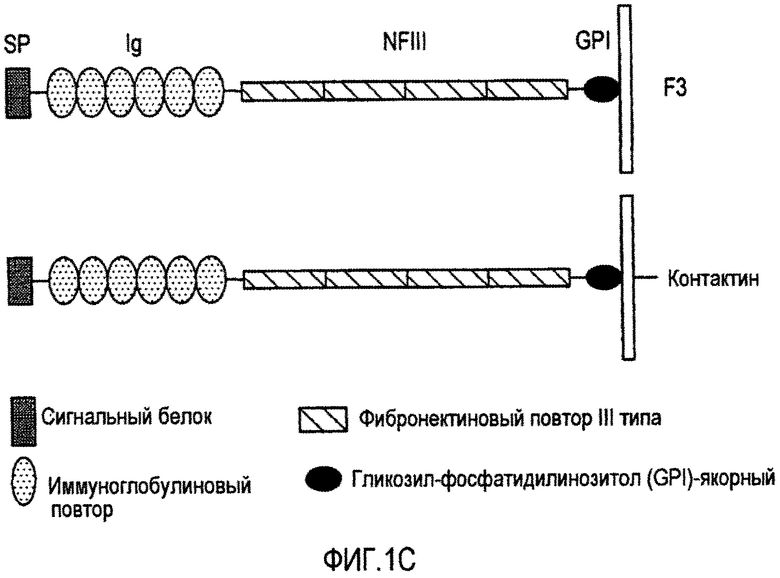
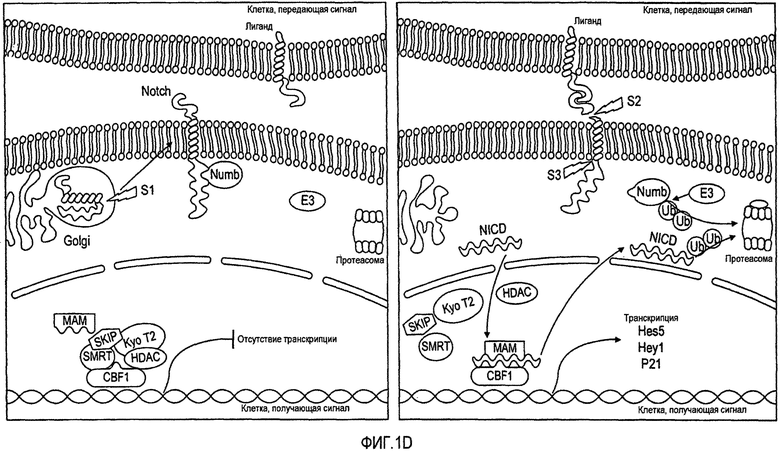
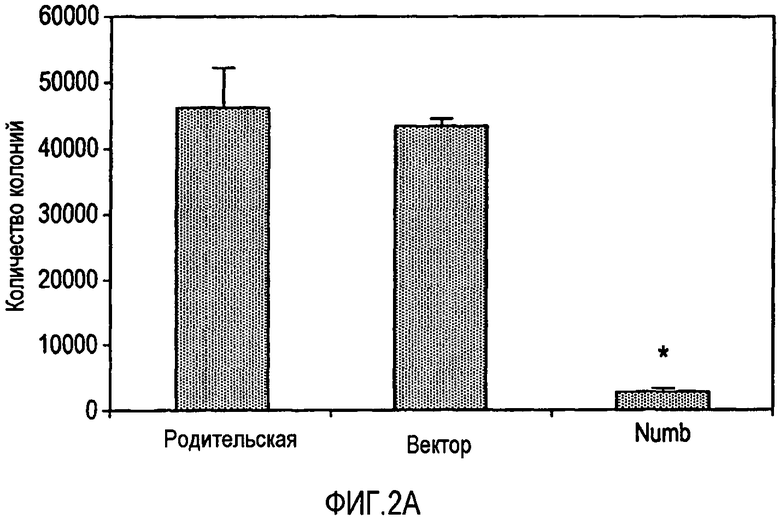
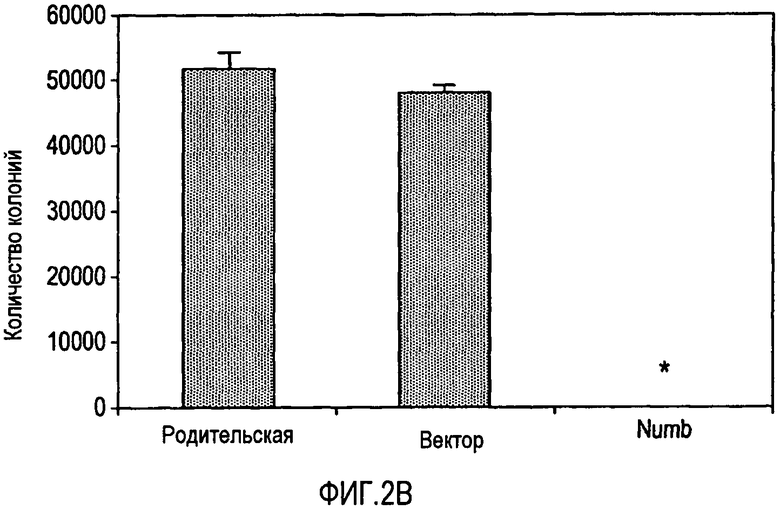
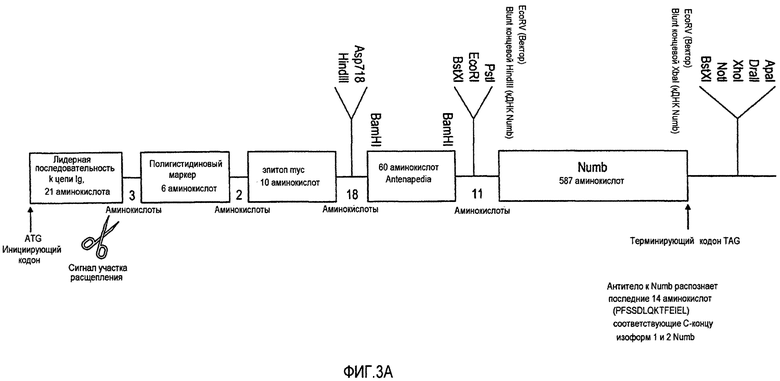
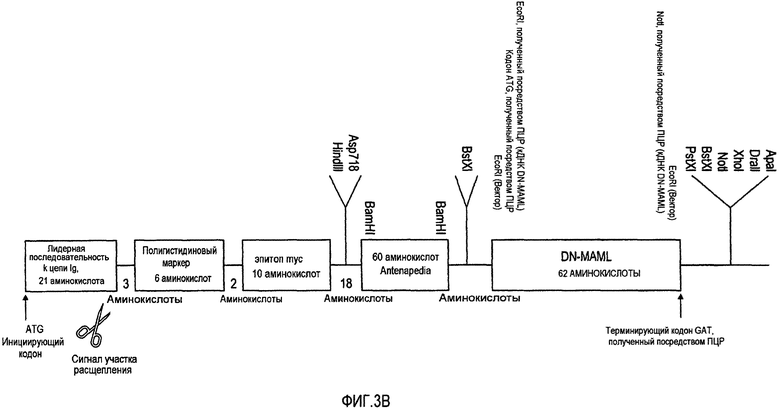
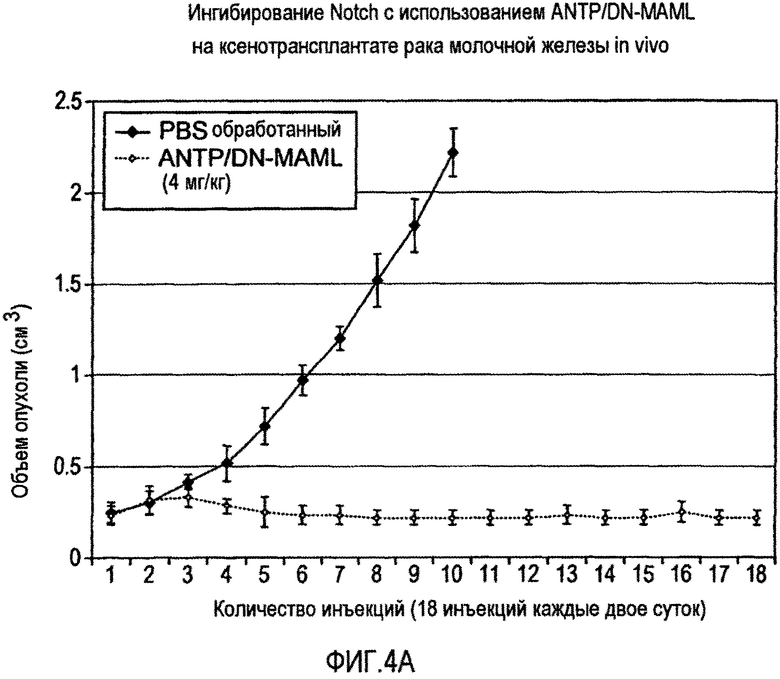
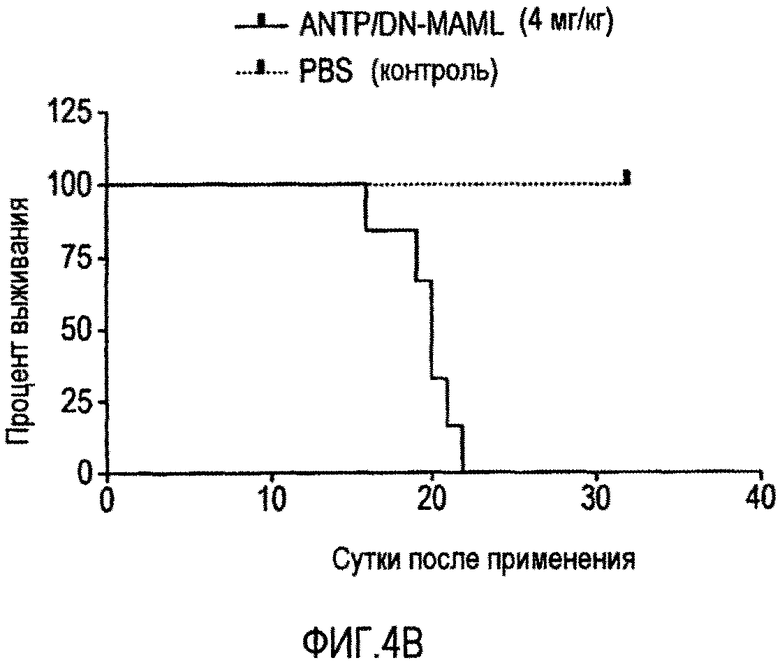
Группа изобретений основана на открытие того, что путь передачи сигнала Notch связан со злокачественной опухолью. Более конкретно, группа изобретений относится к композициям, включающим ANTP/DN-MAML, а также способам лечения злокачественной опухоли с помощью данных композиций. Группа изобретений позволяет лечить злокачественные опухоли, вызванные нарушением передачи сигнала в пути Notch. 5 н. и 3 з.п. ф-лы, 10 ил., 2 табл., 13 пр.
1. Фармацевтическая композиция, содержащая выделенный полипептид, имеющий последовательность, представленную в SEQ ID NO: 2, и эксципиент, для лечения рака.
2. Фармацевтическая композиция, содержащая выделенную последовательность нуклеиновой кислоты, кодирующую SEQ ID NO: 2, и эксципиент, для лечения рака.
3. Фармацевтическая композиция по п. 2, где нуклеиновая кислота находится в векторе.
4. Фармацевтическая композиция по п. 3, где вектором является вирусный вектор.
5. Применение композиции по п. 1 или 2 для лечения рака молочной железы или рака толстого кишечника.
6. Применение композиции по пп. 1 и 2 в комбинации с химиотерапевтическим агентом для лечения рака молочной железы или рака толстого кишечника.
7. Способ продуцирования полипептида, имеющего последовательность, представленную в SEQ ID NO: 2, включающий трансфекцию клетки-хозяина последовательностью нуклеиновой кислоты, кодирующей полипептид, имеющий последовательность, представленную в SEQ ID NO: 2, таким образом обеспечивая продуцирование белка в клетке-хозяине.
8. Способ по п. 7, где клетка-хозяин представляет собой E.coli.
Авторы
Даты
2016-05-20—Публикация
2008-10-06—Подача