ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке испрашивается приоритет по дате подачи предварительной заявки на выдачу патента США с регистрационным № 60/933072, поданной 4 июня 2007 г., и предварительной заявки на выдачу патента США с регистрационным № 60/994646, поданной 20 сентября 2007 г., описания которых включены в настоящее описание в виде ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится главным образом к области молекулярной биологии. Более конкретно, изобретение относится к антителам против области негативной регуляции (NRR) Notch1 и применениям таких антител.
УРОВЕНЬ ТЕХНИКИ
Семейство рецепторов Notch представляет собой класс эволюционно консервативных трансмембранных рецепторов, которые передают сигналы, влияющие на развитие самых разных организмов, от морских ежей до человека. И рецепторы Notch, и семейство их лигандов Delta и Serrate (известные как Jagged у млекопитающих) являются трансмембранными белками с большими внеклеточными доменами, которые содержат повторы, подобные эпидермальному фактору роста (EGF). Количество паралогов Notch отличаются у разных видов. Например, существует четыре рецептора Notch у млекопитающих (Notch1-Notch4), два у Caenorhabditis elegans (LIN-12 и GLP-1) и один у Drosophila melanogaster (Notch). Рецепторы Notch протеолитически процессируются во время транспорта к клеточной поверхности фурин-подобной протеазой на участке S1, расположенном с внешней стороны от трансмембранного домена, высвобождая внеклеточную субъединицу Notch (ECN) и трансмембранную субъединицу Notch (NTM). Две указанные субъединицы остаются нековалентно ассоциированными и составляют зрелый гетеродимерный рецептор клеточной поверхности. Субъединицы ECN Notch1 содержат 36 N-концевых EGF-подобных повторов, за которыми следуют три тандемно повторяющихся модуля Lin 12/Notch-повторов (LNR), которые предшествуют участку S1. Каждый модуль LNR содержит три дисульфидные связи и группу консервативных кислых и полярных остатков, которые предположительно координируют ион кальция. В области EGF-повтора находятся участки связывания активирующих лигандов. Модули LNR, которые содержат уникальный домен рецепторов Notch, принимают участие в поддержании Notch в конформации, соответствующей состоянию покоя, перед индуцируемой лигандом активацией. NTM Notch1 содержит внеклеточную область (которая включает сайт расщепления S2), трансмембранный фрагмент (который несет сайт расщепления S3) и большую внутриклеточную часть, которая включает домен RAM, повторы анкирина, домен трансактивации и последовательность PEST на карбоксильном конце. Стабильная ассоциация субъединиц ECN и NTM зависит от домена гетеродимеризации (HD), содержащего карбоксильный конец ECN (называемый HD-C) и внеклеточный амино-конец NTM (называемый HD-N). Связывание лиганда Notch с субъединицей ECN инициирует два следующих друг за другом протеолитических расщепления, которые происходят вследствие регулируемого внутримембранного протеолиза. Первое расщепление металлопротеазой в сайте S2 делает трансмембранную субъединицу Notch чувствительной ко второму расщеплению в сайте S3, расположенном вблизи внутреннего листка плазматической мембраны. Расщепление в сайте S3, которое катализируется мультибелковым комплексом, содержащим пресенилин и никастрин, высвобождает внутриклеточную часть трансмембранной субъединицы Notch, обеспечивая возможность ее транслокации в ядро и активации транскрипции генов-мишеней.
У человека идентифицировано пять лигандов Notch класса Jagged и Delta-подобного класса (Jagged 1 (также называемый Serrate 1), Jagged 2 (также называемый Serrate 2), Delta-подобный 1 (также называемый DLL1), Delta-подобный 3 (также называемый DLL3) и Delta-подобный 4 (также называемый DLL4)). Каждый из лигандов является однопроходным трансмембранным белком с консервативным N-концевым мотивом Delta, Serrate, LAG-2 (DSL), необходимым для связывания Notch. Серия EGF-подобных модулей, C-концевых по отношению к мотиву DSL, предшествует фрагменту, пронизывающему мембрану. В отличие от рецепторов Notch лиганды имеют короткие цитоплазматические хвосты из 70-215 аминокислот на C-конце. Кроме того, сообщалось о других типах лигандов (например, DNER, NB3 и F3/контактин).
Путь Notch функционирует в ходе различных процессов развития и физиологических процессов, включая влияние на нейрогенез у двукрылых и позвоночных. В общем, передача сигналов Notch вовлечена в латеральное торможение, принятие решений о выборе линии клеток и создание границ между группами клеток (смотри, например, Bray, Molecular Cell Biology 7: 678-679, 2006). Показано, что множество заболеваний человека, включая злокачественные опухоли и нейродегенеративные нарушения, являются результатом мутаций в генах, кодирующих рецепторы Notch или их лиганды (смотри, например, Nam et al., Curr. Opin. Chem. Biol. 6: 501-509, 2002). Связь между неограниченной передачей сигналов Notch и злокачественностью впервые была выявлена, когда идентифицировали рекуррентную хромосомную транслокацию t(7;9)(q34;q34.3), которая создает укороченный, конститутивно активный вариант Notch1 человека, в подгруппе пациентов с острым лимфобластным лейкозом (T-ALL). В мышиных моделях показано, что передача сигналов Notch1 необходима для развития T-клеток, и что опосредованные Notch1 сигналы стимулируют развитие T-клеток за счет развития B-клеток. Также в мышиных моделях избыточная передача сигналов Notch во время развития приводит к неоплазии T-клеток.
Кроме того, рецепторы Notch экспрессируются в большом числе злокачественных опухолей человека и полученных из опухолей клеточных линиях и стимулируют путь развития клеток нервной системы из эмбриональных стволовых клеток человека. Например, Notch экспрессируется на высоком уровне при неопластических поражениях шейки матки человека и в клетках почечноклеточной карциномы человека. Принимая во внимание участие пути передачи сигналов Notch в широком множестве заболеваний человека, ясно, что сохраняется потребность в средствах, которые регулируют передачу сигналов Notch, имеющих клинические характеристики, которые являются оптимальными для разработки терапевтических средств. Изобретение, описанное в настоящем документе, удовлетворяет такую потребность и обеспечивает другие преимущества.
Все публикации, упоминаемые в настоящем описании, включая заявки на выдачу патентов и публикации патентов, включены в виде ссылки в полном объеме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение отчасти основано на идентификации множества агентов, связывающих область негативной регуляции (NRR) Notch1 (таких как антитела и их фрагменты). NRR Notch1 представляет собой важную и полезную терапевтическую мишень, и изобретение относится к композициям и способам, основанным на связывании NRR Notch1. Средства, связывающие NRR Notch1 согласно изобретению, которые описаны в настоящем документе, представляют собой ценные терапевтические и диагностические средства для применения в случае целенаправленного воздействия на патологические состояния, ассоциированные с экспрессией и/или активностью путей передачи сигналов Notch1. Соответственно, изобретение относится к способам, композициям, наборам и изделиям, имеющим отношение к связыванию NRR Notch1.
Настоящее изобретение относится к антителам, которые связываются с NRR Notch1. В одном аспекте отличительным признаком изобретения является изолированное антитело, которое связывает NRR Notch1. В конкретном аспекте в изобретении охарактеризовано изолированное антитело против NRR Notch1, которое связывает NRR Notch1 с Kd 1×10-7 или сильнее. В предпочтительных вариантах антитело против NRR Notch1 связывает NRR Notch1 с Kd 1×10-8 или сильнее или с Kd 1×10-9 или сильнее. В другом аспекте изобретение относится к изолированному анти-NRR Notch1-антителу, где полноразмерная IgG-форма антитела связывает NRR Notch1 человека и мыши с Kd 1×10-7 или сильнее. Как хорошо установлено в данной области, аффинность связывания лиганда с его рецептором может быть определена с использованием любого из множества анализов и выражена разными количественными показателями. Соответственно, в одном варианте аффинность связывания выражают в виде значений Kd, которые отражают действительную аффинность связывания (например, с минимизированными эффектами авидности). Обычно и предпочтительно аффинность связывания измеряют in vitro, либо в бесклеточных системах, либо в ассоциированных с клетками системах. Можно использовать любой из множества анализов, известных в данной области, включая анализы, описанные в настоящем документе, для проведения измерений аффинности связывания, включая, например, Biacore, радиоиммуноанализ (РИА) и ELISA.
В одном аспекте отличительным признаком изобретения является изолированное анти-NRR Notch1-антитело, содержащее:
(a) по меньшей мере, одну, две, три, четыре или пять последовательностей гипервариабельных областей (HVR), выбранных из:
(i) HVR-L1, содержащей последовательность A1-A11, где A1-A11 представляет собой RASQDVSTAVA (SEQ ID NO: 7),
(ii) HVR-L2, содержащей последовательность B1-B7, где B1-B7 представляет собой SASFLYS (SEQ ID NO: 8),
(iii) HVR-L3, содержащей последовательность C1-C9, где C1-C9 представляет собой QQSYTTPPT (SEQ ID NO: 9),
(iv) HVR-H1, содержащей последовательность D1-D10, где D1-D10 представляет собой GFTFSSYWIH (SEQ ID NO: 1),
(v) HVR-H2, содержащей последовательность E1-E18, где E1-E18 представляет собой ARINPSNGSTNYADSVKG (SEQ ID NO: 2), и
(vi) HVR-H3, содержащей последовательность F1-F14, где F1-F14 представляет собой ARGSGFRWVMDY (SEQ ID NO: 6); и
(b) по меньшей мере, один вариант HVR, где последовательность варианта HVR содержит модификацию, по меньшей мере, одного остатка в последовательности, указанной в SEQ ID NO: 1-12. Модификация по необходимости представляет собой замену, инсерцию или делецию.
В желательных вариантах осуществления изобретения вариант HVR-L3 содержит 1-4 (1, 2, 3 или 4) замены в любом сочетании следующих положений: C3 (S или F), C4 (Y или F), C5 (T или S) и C8 (P или A или S). В другом желательном варианте осуществления изобретения вариант HVR-H2 содержит 1-4 (1, 2, 3 или 4) замены в любом сочетании следующих положений: E6 (S или P или A); E8 (G или R); E10 (T или A или N); и E11 (N или H или Q или R).
В другом аспекте отличительным признаком изобретения является изолированное анти-NRR Notch1-антитело, которое содержит одну, две, три, четыре, пять или шесть HVR, где каждая HVR содержит, состоит или по существу состоит из последовательности, выбранной из последовательностей SEQ ID NO: 1-12, и где последовательность SEQ ID NO: 7 соответствует HVR-L1, последовательность SEQ ID NO: 8 соответствует HVR-L2, последовательность SEQ ID NO: 9, 10, 11 или 12 соответствует HVR-L3, последовательность SEQ ID NO: 1 соответствует HVR-H1, последовательность SEQ ID NO: 2, 3, 4 или 5 соответствует HVR-H2, и последовательность SEQ ID NO: 6 соответствует HVR-H3.
В одном аспекте изобретения предлагается антитело, содержащее область HVR-H1, включающую последовательность SEQ ID NO: 1. В одном аспекте в изобретении предлагается антитело, содержащее область HVR-H2, включающую последовательность SEQ ID NO: 2, 3, 4 или 5. В одном аспекте в изобретении предлагается антитело, содержащее область HVR-H3, включающую последовательность SEQ ID NO: 6. В одном аспекте в изобретении предлагается антитело, содержащее HVR-L3, включающую последовательность SEQ ID NO: 10, 11 или 12.
В одном аспекте в изобретении предлагается антитело, содержащее по меньшей мере одну, по меньшей мере две, по меньшей мере три или все четыре из следующих последовательностей:
(i) последовательность HVR-H1, содержащую последовательность SEQ ID NO: 1;
(ii) последовательность HVR-H2, содержащую последовательность SEQ ID NO:2, 3, 4 или 5;
последовательность HVR-H3, содержащую последовательность SEQ ID NO: 6;
последовательность HVR-L3, содержащую последовательность SEQ ID NO: 10, 11 или 12.
В предпочтительном варианте антитело содержит области HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая по порядку содержит последовательность SEQ ID NO: 7, 8, 9, 1, 2, 6. В другом предпочтительном варианте антитело содержит области HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая по порядку содержит последовательность SEQ ID NO: 7, 8, 10, 1, 3, 6. В следующем предпочтительном варианте антитело содержит области HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая по порядку содержит последовательность SEQ ID NO: 7, 8, 11, 1, 4, 6. В следующем предпочтительном варианте антитело содержит области HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая по порядку содержит последовательность SEQ ID NO: 7, 8, 12, 1, 5, 6.
Аминокислотные последовательности SEQ ID NO: 1-12 пронумерованы в соответствии с отдельными HVR (т.е. H1, H2 или H3), которые указаны на фигуре 1, при этом нумерация соответствует системе нумерации Кабата, которая описана ниже.
В одном конкретном аспекте в изобретении предлагается изолированное анти-NRR Notch1-антитело, которое ингибирует, снижает и/или блокирует передачу сигналов Notch1. Некоторые варианты антител согласно изобретению содержат вариабельный домен легкой цепи гуманизированного антитела 4D5 (huMAb4D5-8) (HERCEPTIN®, Genentech, Inc., South San Francisco, Calif., USA) (также упоминаемого в патенте США № 6407213 и в публикации Lee et al., J. Mol. Biol. (2004), 340(5): 1073-1093), который изображен в виде последовательности SEQ ID NO: 53 ниже.

В одном варианте последовательность вариабельного домена легкой цепи huMAb4D5-8 модифицирована в одном или нескольких положениях 30, 66 и 91 (Asn, Arg и His, которые указаны жирным шрифтом/курсивом выше, соответственно). В конкретном варианте модифицированная последовательность huMAb4D5-8 содержит Ser в положении 30, Gly в положении 66 и/или Ser в положении 91. Соответственно, в одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, содержащий последовательность, изображенную в SEQ ID NO: 54 ниже:

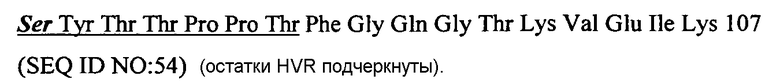
Замененные остатки относительно huMAb4D5-8 показаны жирным шрифтом/курсивом.
Антитела согласно изобретению могут содержать любую последовательность вариабельного домена каркаса, при условии, что активность связывания с NRR Notch1 по существу сохраняется. Например, в некоторых вариантах антитела согласно изобретению содержат консенсусную последовательность каркаса тяжелой цепи подгруппы III человека. В одном варианте таких антител, каркасная консенсусная последовательность содержит замену в положении 71, 73 и/или 78. В некоторых вариантах таких антител положение 71 представлено A, 73 представлено T и/или 78 представлено A. В одном варианте такие антитела содержат каркасные последовательности вариабельного домена тяжелой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, Calif., USA) (также описано в патентах США №№ 6407213 и 5821337 и в Lee et al., J. Mol. Biol. (2004), 340(5): 1073-1093). В одном варианте такие антитела дополнительно содержат консенсусную каркасную последовательность легкой цепи κI человека. В конкретном варианте такие антитела содержат последовательности HVR легкой цепи huMAb4D5-8, которое описано в патентах США №№ 6407213 и 5821337. В одном варианте такие антитела содержат последовательности вариабельного домена легкой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, Calif., USA) (также описанного в патента США №№ 6407213 и 5821337 и в Lee et al., J. Mol. Biol. (2004), 340(5): 1073-1093).
В одном варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 и/или 37, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 2 и/или 6, соответственно. В другом варианте каркасная последовательность содержит последовательность SEQ ID NO: 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 и/или 37, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 3 и/или 6, соответственно. В еще одном варианте каркасная последовательность содержит последовательность SEQ ID NO: 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 и/или 37, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 4 и/или 6, соответственно. В следующем варианте каркасная последовательность содержит последовательность SEQ ID NO: 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 и/или 37, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 5 и/или 6, соответственно.
В конкретном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 38, 39, 40 и/или 41, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 9, соответственно. В другом варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 38, 39, 40 и/или 41, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 10, соответственно. В дополнительном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 38, 39, 40 и/или 41, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 11, соответственно. В еще одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 38, 39, 40 и/или 41, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 12, соответственно.
В другом варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 42, 43, 44 и/или 45, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 2 и/или 6, соответственно. В дополнительном варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 42, 43, 44 и/или 45, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 3 и/или 6, соответственно. В следующем варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 42, 43, 44 и/или 45, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 4 и/или 6, соответственно. В еще одном варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 42, 43, 44 и/или 45, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 5 и/или 6, соответственно.
В одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 15, 16, 17 и/или 18, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 9, соответственно. В другом варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 15, 16, 17 и/или 18, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 10, соответственно. В еще одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 15, 16, 17 и/или 18, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 11, соответственно. В следующем варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательность SEQ ID NO: 15, 16, 17 и/или 18, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 12, соответственно.
В одном варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NO: 42, 43, 47 и/или 45, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO:1, 2 и/или 6, соответственно. В дополнительном варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NO: 42, 43, 47 и/или 45, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 3 и/или 6, соответственно. В другом варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NO: 42, 43, 47 и/или 45, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 4 и/или 6, соответственно. В следующем варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NO: 42, 43, 47 и/или 45, и последовательности HVR H1, H2 и H3 представляют собой последовательности SEQ ID NO: 1, 5 и/или 6, соответственно.
В одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NO: 15, 16, 47 и/или 18, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 9, соответственно. В другом варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NO: 15, 16, 47 и/или 18, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 10, соответственно. В еще одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NO: 15, 16, 47 и/или 18, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 11, соответственно. В следующем варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NO: 15, 16, 47 и/или 18, и последовательности HVR L1, L2 и L3 представляют собой последовательности SEQ ID NO: 7, 8 и/или 12, соответственно.
В еще одном варианте антитело согласно изобретению является антителом с созревшей аффинностью, чтобы получить требуемую аффинность связывания мишени. В одном примере антитело с созревшей аффинностью согласно изобретению содержит замену в одном или нескольких положениях аминокислот H53, H55, H57, H58, L91 и L96. В одном примере антитело с созревшей аффинностью согласно изобретению содержит одну или несколько из следующих замен: (a) в тяжелой цепи S53P, S53A, G55R, T57A, T57N, N58H, N58Q и N58R или (b) в легкой цепи S91F, P96A и P96S.
В другом аспекте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO: 58. В одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO: 59. В одном варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO: 58, и вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO: 59. В другом аспекте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO: 60. В одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO: 61. В одном варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO: 60, и вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO: 61. В другом аспекте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO: 62. В одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO: 63. В одном варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO: 62, и вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO: 63. В другом аспекте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO: 64. В одном варианте антитело согласно изобретению содержит вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO: 65. В одном варианте антитело согласно изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO: 64, и вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO: 65.
В одном аспекте в изобретении предлагается антитело, которое конкурирует с любым из описанных выше антител за связывание с NRR Notch1. В одном аспекте в изобретении предлагается антитело, которое связывается с тем же самым или подобным эпитопом на NRR Notch1, что и любое из описанных выше антител.
Как известно в данной области и как описано более подробно ниже, положение аминокислот/определение границ гипервариабельной области антитела могут варьировать в зависимости от контекста и различных определений, известных в данной области (которые описаны ниже). Некоторые положения в вариабельном домене могут рассматриваться как гибридные гипервариабельные положения, так как такие положения можно считать находящимися в гипервариабельной области согласно одной группе критериев, а также считать находящимися вне гипервариабельной области согласно другой группе критериев. Одно или несколько таких положений также можно найти в расширенных гипервариабельных областях (которые дополнительно определены ниже).
В некоторых вариантах антитело является моноклональным антителом. В других вариантах антитело является поликлональным антителом. В некоторых вариантах антитело выбрано из группы, состоящей из химерного антитела, антитела с созревшей аффинностью, гуманизированного антитела и антитела человека. В некоторых вариантах антитело представляет собой фрагмент антитела. В некоторых вариантах антитело представляет собой Fab, Fab', Fab'-SH, F(ab')2 или scFv.
В одном варианте антитело является химерным антителом, например антителом, содержащим антигенсвязывающие последовательности донора, отличного от человека, к которым привита гетерологичная последовательность животного, отличного от человека, человека или гуманизированная последовательность (например, каркасные последовательности и/или последовательности константного домена). В одном варианте донором, отличным от человека, является мышь. В следующем варианте антигенсвязывающая последовательность является синтетической, например, получена с помощью мутагенеза (например, с использованием скрининга в фаговом дисплее, и т.д.). В конкретном варианте химерное антитело согласно изобретению имеет мышиные V-области и человеческую C-область. В одном варианте V-область легкой цепи мыши сливают с легкой цепью каппа человека. В другом варианте V-область тяжелой цепи мыши сливают с C-областью IgG1 человека.
Гуманизированные антитела согласно изобретению включают антитела, которые имеют аминокислотные замены в каркасной области (FR), и варианты по созреванию аффинности с изменениями в привитых CDR. Заменяемые аминокислоты в CDR или FR не ограничены аминокислотами, присутствующими в донорном или реципиентном антителе. В других вариантах антитела согласно изобретению дополнительно содержат изменения в аминокислотных остатках в Fc-области, которые приводят к улучшенной эффекторной функции, включая усиленную функцию CDC и/или ADCC и B-клеточный киллинг. Другие антитела согласно изобретению включают антитела, имеющие специфичные изменения, которые повышают стабильность. В других вариантах антитела согласно изобретению содержат изменения аминокислотных остатков в Fc-области, которые приводят к пониженной эффекторной функции, например пониженной функции CDC и/или ADCC и/или сниженному B-клеточному киллингу. В некоторых вариантах антитела согласно изобретению характеризуются пониженным связыванием (например, отсутствием связывания) с фактором комплемента C1q человека и/или Fc-рецептором человека на природных клетках-киллерах (NK). В некоторых вариантах антитела согласно изобретению характеризуются пониженным связыванием (например, отсутствием связывания) с FcγRI, FcγRIIA и/или FcγRIIIA. В некоторых вариантах антитела согласно изобретению относятся к классу IgG (например, IgG1 или IgG4) и содержат, по меньшей мере, одну мутацию в E233, L234, G236, D265, D270, N297, E318, K320, K322, A327, A330, P331 и/или P329 (нумерация согласно указателю EU). В некоторых вариантах антитела содержат мутации L234A/L235A или D265A/N297A.
В одном аспекте в изобретении предлагаются анти-NRR Notch1-полипептиды, содержащие любую из антигенсвязывающих последовательностей, предлагаемых в изобретении, при этом анти-NRR Notch1-полипептиды специфично связываются с NRR Notch1, например с NRR Notch1 человека или мыши.
Антитела согласно изобретению связывают (например, специфично связывают) NRR Notch1 и в некоторых вариантах могут модулировать один или несколько аспектов передачи сигнала Notch1 и/или нарушения любого биологически важного биологического пути Notch1 и/или лиганда Notch1, и/или лечение и/или профилактику опухоли, клеточного пролиферативного нарушения или злокачественной опухоли, и/или лечение или профилактику нарушения, ассоциированного с экспрессией и/или активностью Notch1 (такой как повышенная экспрессия и/или активность Notch1). В некоторых вариантах антитело против NRR Notch1 специфично связывается с полипептидом, состоящим или в основном состоящим из NRR Notch1 (например, NRR Notch1 человека или мыши). В некоторых вариантах антитело специфично связывает Notch1 с Kd 1×10-7 или сильнее. В некоторых вариантах антитело согласно изобретению уменьшает, ингибирует и/или блокирует активность Notch1 in vivo и/или in vitro.
В одном аспекте изобретение относится к применению антитела согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как злокачественная опухоль, опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах нарушение представляет собой невропатию или нейродегенеративное заболевание. В следующих предпочтительных вариантах нарушение представляет собой патологическое состояние, ассоциированное с ангиогенезом. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
В одном аспекте в изобретении предлагаются композиции, содержащие одно или несколько антител согласно изобретению и носитель. В одном варианте носитель является фармацевтически приемлемым.
В другом аспекте в изобретении предлагаются нуклеиновые кислоты, кодирующие анти-NRR Notch1-антитело согласно изобретению.
В еще одном аспекте в изобретении предлагаются векторы, содержащие нуклеиновую кислоту согласно изобретению.
В следующем аспекте в изобретении предлагаются композиции, содержащие одну или несколько нуклеиновых кислот согласно изобретению и носитель. В одном варианте носитель является фармацевтически приемлемым.
В одном аспекте в изобретении предлагаются клетки-хозяева, содержащие нуклеиновую кислоту или вектор согласно изобретению. Вектор может быть любого типа, например рекомбинантный вектор, такой как экспрессирующий вектор. Можно использовать любые из множества клеток-хозяев. В одном варианте клеткой-хозяином является прокариотическая клетка, например, E. coli. В другом варианте клеткой-хозяином является эукариотическая клетка, например, клетка млекопитающего, такая как клетка яичника китайского хомячка (CHO).
В следующем аспекте в изобретении предлагаются способы получения антитела согласно изобретению. Например, в изобретении предлагаются способы получения анти-NRR Notch1-антитела (которое, как определено в настоящем описании, включает полноразмерное антитело и его фрагменты), где указанный способ включает экспрессию в подходящей клетке-хозяине рекомбинантного вектора согласно изобретению, кодирующего антитело (или его фрагмент), и извлечение антитела.
В одном аспекте в изобретении предлагается изделие, содержащее емкость и композицию, находящуюся в емкости, при этом композиция содержит одно или несколько анти-NRR Notch1-антител согласно изобретению. В одном варианте композиция содержит нуклеиновую кислоту согласно изобретению. В другом варианте композиция, содержащая антитело, дополнительно содержит носитель, который в некоторых вариантах является фармацевтически приемлемым. В одном варианте изделие согласно изобретению дополнительно включает инструкции по введению композиции (например, антитела) человеку (например, инструкции по применению любого из способов, описанных в настоящем документе).
В другом аспекте в изобретении предлагается набор, включающий первую емкость, содержащую композицию, которая содержит одно или несколько анти-NRR Notch1-антител согласно изобретению, и вторую емкость, содержащую буфер. В одном варианте буфер является фармацевтически приемлемым. В одном варианте композиция, содержащая антитело, дополнительно содержит носитель, который в некоторых вариантах является фармацевтически приемлемым. В другом варианте набор дополнительно содержит инструкции по введению композиции (например, антитела) человеку.
В следующем аспекте изобретение относится к применению анти-NRR Notch1-антитела согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как злокачественная опухоль, опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах нарушение представляет собой невропатию или нейродегенеративное заболевание. В следующих предпочтительных вариантах нарушением является патологическое состояние, ассоциированное с ангиогенезом. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
В одном аспекте изобретение относится к применению нуклеиновой кислоты согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как злокачественная опухоль, опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах нарушение представляет собой невропатию или нейродегенеративное заболевание. В следующих предпочтительных вариантах нарушением является патологическое состояние, ассоциированное с ангиогенезом. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
В другом аспекте изобретение относится к применению экспрессирующего вектора согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как злокачественная опухоль, опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах нарушение представляет собой невропатию или нейродегенеративное заболевание. В следующих предпочтительных вариантах нарушением является патологическое состояние, ассоциированное с ангиогенезом. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
В следующем аспекте изобретение относится к применению клетки-хозяина согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как злокачественная опухоль, опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах нарушение представляет собой невропатию или нейродегенеративное заболевание. В следующих предпочтительных вариантах нарушением является патологическое состояние, ассоциированное с ангиогенезом. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
В следующем аспекте изобретение относится к применению изделия согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как злокачественная опухоль, опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах нарушение представляет собой невропатию или нейродегенеративное заболевание. В следующих предпочтительных вариантах нарушением является патологическое состояние, ассоциированное с ангиогенезом. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
В одном аспекте изобретение также относится к применению набора согласно изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как злокачественная опухоль, опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах нарушение представляет собой невропатию или нейродегенеративное заболевание. В следующих предпочтительных вариантах нарушением является патологическое состояние, ассоциированное с ангиогенезом. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
В изобретении предлагаются способы и композиции, пригодеые для модулирования нарушений, ассоциированных с экспрессией и/или передачей сигналов Notch1, например, с повышенной или пониженной экспрессией и/или передачей сигналов или с нежелательной экспрессией и/или передачей сигналов.
Изобретение также относится к способам и композициям, пригодным для модулирования нарушений, ассоциированных с активированными рецепторами Notch1. Такие нарушения могут быть ассоциированы с транслокацией или активирующей мутацией в аминокислотной последовательности Notch1. Примеры нарушений, ассоциированных с активированными рецепторами Notch1, включают T-клеточный острый лимфобластный лейкоз (T-ALL).
В одном аспекте в изобретении предлагаются способы лечения опухоли, злокачественной опухоли и/или клеточного пролиферативного нарушения, ассоциированного с повышенной экспрессией и/или активностью Notch1 у человека, где способы включают введение эффективного количества анти-NRR Notch1-антитела человеку. В одном варианте в опухоль, злокачественную опухоль и/или клеточное пролиферативное нарушение вовлечена мутация, активирующая Notch1.
В одном аспекте в изобретении предлагаются способы цитолиза клетки (такой как раковая или опухолевая клетка) у человека, где способы включают введение человеку эффективного количества анти-NRR Notch1-антитела.
В другом аспекте в изобретении предлагаются способы уменьшения, ингибирования, блокирования или предотвращения роста опухоли или злокачественной опухоли у человека, при этом способы включают введение человеку эффективного количества анти-NRR Notch1-антитела.
В другом аспекте в изобретении предлагаются способы уменьшения, ингибирования, блокирования или предотвращения ангиогенеза у индивидуума, где способы включают введение индивидууму эффективного количества анти-NRR Notch1-антитела.
В другом аспекте в изобретении предлагаются способы лечения патологического состояния, ассоциированного с ангиогенезом, у индивидуума, где способы включают введение индивидууму эффективного количества анти-NRR Notch1-антитела. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
В следующем аспекте в изобретении предлагаются способы лечения или профилактики невропатии или нейродегенеративного заболевания, или восстановления поврежденной нервной клетки, или нарушений, которые приводят к разобщению аксонов и/или демиелинизации у индивидуума, где способы включают введение индивидууму эффективного количества анти-NRR Notch1-антитела.
В одном аспекте в изобретении предлагаются способы стимулирования развития, пролиферации, сохранения или регенерации нейронов у индивидуума, где способы включают введение индивидууму эффективного количества анти-NRR Notch1-антитела.
В следующем аспекте в изобретении предлагаются способы усиления у индивидуума иммунного ответа на антиген, где способы включают введение индивидууму эффективного количества анти-NRR Notch1-антитела. В некоторых вариантах антиген, к которому требуется иммунный ответ, вводят одновременно с анти-NRR Notch1-антителом. В других вариантах в изобретении предлагаются способы усиления у индивидуума иммунного ответа на антиген, включающие введение индивидууму агонистического антитела против NRR Notch1; и при этом индивидууму вводят композицию так, чтобы агонистическое антитело против NRR Notch1 было презентировано иммунным клеткам (таким как T-клетки) индивидуума во время или сразу после примирования иммунных клеток (таких как T-клетки) антигеном, таким образом усиливая иммунный ответ. В некоторых вариантах антигеном является злокачественная опухоль.
В следующем аспекте в изобретении предлагаются способы стимулирования у индивидуума регенерации и/или репарации тканей, например регенерации скелетной или сердечной мышцы или кости, где способы включают введение индивидууму эффективного количества агонистического антитела против NRR Notch1.
В следующем аспекте в изобретении предлагаются способы снижения, ингибирования, блокирования или предотвращения иммунного ответа на антиген у индивидуума, где способы включают введение индивидууму эффективного количества агонистического антитела против NRR Notch1. В одном варианте иммунный ответ представляет собой иммунологическое нарушение вследствие аномального развития или регуляции T-клеток.
В следующем аспекте в изобретении предлагаются способы лечения аутоиммунного нарушения у индивидуума, где способы включают введение индивидууму эффективного количества агонистического антитела против NRR Notch1. В некоторых вариантах аутоиммунным нарушением является аутоиммунный диабет, рассеянный склероз, отторжение трансплантата или ревматоидный артрит.
Способы согласно изобретению можно применять для воздействия на любое патологическое состояние. Примеры нарушений описаны в настоящем документе и включают злокачественную опухоль, выбранную из группы, состоящей из мелкоклеточного рака легкого, рака головного мозга (например, нейробластомы или менингиомы), рака кожи (например, меланомы, карциномы базальных клеток или карциномы сквамозных клеток), карциномы молочной железы, рака желудка, рака прямой и ободочной кишки (CRC), гепатоклеточной карциномы, рака шейки матки, рака легкого, рака поджелудочной железы, рака предстательной железы и гематологических злокачественных заболеваний (например, T-клеточного острого лимфобластного лейкоза (T-ALL), B-клеточного острого лимфобластного лейкоза (B-ALL), острого миелогенного лейкоза (AML), лимфомы Ходжкина и множественной миеломы).
В одном варианте клетка, которая является мишенью в способе согласно изобретению, является злокачественной клеткой. Например, злокачественная клетка может представлять собой клетку, выбранную из группы, состоящей из клетки рака молочной железы, клетки рака прямой и ободочной кишки, клетки рака легкого, клетки папиллярной карциномы, клетки рака ободочной кишки, клетки рака поджелудочной железы, клетки рака яичника, клетки рака шейки матки, клетки рака центральной нервной системы, клетки остеогенной саркомы, клетки карциномы почек, клетки гепатоклеточной карциномы, клетки рака мочевого пузыря, клетки рака желудка, клетки сквамозной карциномы головы и шеи, клетки меланомы, лейкозной клетки и клетки аденомы толстой кишки. В одном варианте клетка, которая является мишенью в способе согласно изобретению, является гиперпролиферирующей и/или гиперпластической клеткой. В другом варианте клетка, которая является мишенью в способе согласно изобретению, является диспластически измененной клеткой. В еще одном варианте клетка, которая является мишенью в способе согласно изобретению, является метастатической клеткой.
Способы согласно изобретению дополнительно могут включать дополнительные стадии обработки. Например, в одном варианте способ дополнительно включает стадию, на которой клетку-мишень и/или ткань-мишень (например, злокачественную клетку) подвергают облучению или воздействию химиотерапевтическим средством.
В одном аспекте в изобретении предлагаются способы, включающие введение эффективного количества анти-NRR Notch1-антитела в сочетании с эффективным количеством другого терапевтического средства (такого как средство против ангиогенеза, другое антитело, химиотерапевтическое средство, цитотоксическое средство, иммунодепрессант, пролекарство, цитокин, цитотоксическая лучевая терапия, кортикостероид, противорвотное средство, противоопухолевая вакцина, анальгетик или ингибирующее рост средство). Например, анти-NRR Notch1-антитела применяют в сочетании с противоопухолевым средством или антиангиогенным средством для лечения различных неопластических или не неопластических состояний. В конкретных примерах анти-NRR Notch1-антитела применяют в сочетании с тамоксифеном, летрозолом, эксеместаном, анастрозолом, иринотеканом, цетуксимабом, фулвестрантом, винорелбином, эрлотинибом, бевацизумабом, винкристином, иматинибом, сорафенибом, лапатинибом или трастузумабом.
Анти-NRR Notch1-антитело можно вводить последовательно или в сочетании с другим терапевтическим средством, которое является эффективным для таких целей, либо в одной и той же композиции, либо в виде отдельных композиций. Введение анти-NRR Notch1-антитела и другого терапевтического средства (например, противоопухолевого средства) можно осуществлять одновременно, например, в виде одной композиции или в виде двух или более отдельных композиций, используя один и тот же или разные пути введения. Альтернативно или дополнительно введение можно осуществлять последовательно в любом порядке. Альтернативно или дополнительно стадии могут быть осуществлены в виде сочетания как последовательного, так и одновременного введения в любом порядке. В некоторых вариантах могут иметь место интервалы в диапазоне от минут до суток, недель и месяцев между введениями двух или более композиций. Например, сначала может быть введено противоопухолевое средство с последующим введением анти-NRR Notch1-антитела. Однако также предполагается одновременное введение или введение анти-NRR Notch1-антитела в первую очередь. В некоторых вариантах могут иметь место интервалы в диапазоне от минут до суток, недель, месяцев между введениями двух или более композиций.
В некоторых аспектах в изобретении предлагается способ лечения нарушения (такого как опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение) посредством введения эффективных количеств анти-NRR Notch1-антитела и/или ингибитора(ов) ангиогенеза и одного или нескольких химиотерапевтических средств. Можно использовать различные химиотерапевтические средства в способах комбинированного лечения согласно изобретению. Примерный и неограничивающий список предполагаемых химиотерапевтических средств приведен в настоящем описании в разделе «Определения». Введение анти-NRR Notch1-антитела и химиотерапевтического средства можно осуществлять одновременно, например, в виде одной композиции или в виде двух или более разных композиций, используя один и тот же или разные пути введения. Альтернативно или дополнительно введение можно осуществлять последовательно в любом порядке. Альтернативно или дополнительно стадии могут быть осуществлены в виде сочетания как последовательного, так и одновременного введения в любом порядке. В некоторых вариантах могут иметь место интервалы в диапазоне от минут до суток, недель, месяцев между введениями двух или более композиций. Например, сначала может быть введено химиотерапевтическое средство с последующим введением анти-NRR Notch1-антитела. Однако также предполагается одновременное введение или введение анти-NRR Notch1-антитела в первую очередь. Соответственно, в одном аспекте в изобретении предлагаются способы, включающие введение анти-NRR Notch1-антитела с последующим введением химиотерапевтического средства. В некоторых вариантах могут иметь место интервалы в диапазоне от минут до суток, недель, месяцев между введениями двух или более композиций.
В другом аспекте в изобретении предлагаются способы выявления Notch1, где способы включают выявление комплекса Notch1-анти-NRR Notch1-антитело в образце. Термин «выявление» в используемом в настоящем описании смысле включает качественное и/или количественное определение (уровни измерения) относительно или безотносительно контроля.
В другом аспекте в изобретении предлагаются способы диагностики нарушения, ассоциированного с экспрессией и/или активностью Notch1, где способы включают выявление комплекса Notch1-анти-NRR Notch1-антитело в биологическом образце, полученном от индивидуума, у которого имеется или подозревается наличие нарушения. В некоторых вариантах экспрессия Notch1 представляет собой повышенную экспрессию или аномальную экспрессию. В некоторых вариантах нарушение представляет собой опухоль, злокачественную опухоль и/или клеточное пролиферативное нарушение.
В другом аспекте в изобретении предлагаются способы лечения индивидуума, имеющего злокачественную опухоль, опухоль и/или клеточное пролиферативное нарушение, посредством введения индивидууму эффективного количества анти-NRR Notch1-антитела, при этом дополнительно определяют экспрессию Notch1 и/или экспрессию лиганда Notch1 в биологическом образце индивидуума перед, во время или после введения анти-NRR Notch1-антитела. В некоторых вариантах биологическим образцом является злокачественная опухоль, опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах выявляют сверхэкспрессию Notch1 перед, во время и/или после введения анти-NRR Notch1-антитела. В некоторых вариантах выявляют экспрессию лиганда Notch1 перед, во время и/или после введения анти-NRR Notch1-антитела. Экспрессию можно регистрировать перед; во время; после; перед и во время; перед и после; во время и после; или перед, во время и после введения анти-NRR Notch1-антитела.
В другом аспекте в изобретении предлагаются способы лечения индивидуума, имеющего злокачественную опухоль, опухоль и/или клеточное пролиферативное нарушение, посредством введения эффективного количества анти-NRR Notch1-антитела индивидууму, при этом биологический образец злокачественной опухоли, опухоли и/или клеточного нарушения или нарушения печени экспрессирует Notch1 или лиганд Notch1.
В другом аспекте в изобретении предлагаются способы выбора лечения индивидуума, где способы включают: (a) выявление экспрессии Notch1 или экспрессии лиганда Notch1, если таковая имеет место, в биологическом образце индивидуума; и (b) после стадии (a) выбор лечения индивидуума, при этом выбор лечения основан на экспрессии Notch1 или лиганда Notch1, выявленной на стадии (a). В некоторых вариантах выявляют повышенную экспрессию Notch1 или лиганда Notch1 в биологическом образце индивидуума по сравнению с эталонным значением или контрольным образцом. В некоторых вариантах у индивидуума выявляют пониженную экспрессию Notch1 или лиганда Notch1 в биологическом образце индивидуума по сравнению с эталонным значением или контрольным образцом. В некоторых вариантах определяют экспрессию Notch1 или лиганда Notch1 и выбирают лечение анти-Notch1-антителом. В некоторых вариантах индивидуум имеет опухоль, злокачественную опухоль и/или клеточное пролиферативное нарушение.
В некоторых вариантах, включающих выявление экспрессии Notch1, осуществляют выявление делеции гена Notch1, амплификации гена и/или мутации гена. В некоторых вариантах, включающих выявление экспрессии лиганда Notch1, осуществляют выявление делеции гена Notch1, амплификации гена и/или мутации гена.
Биологические образцы описаны в настоящем документе, например, при определении биологического образца. В некоторых вариантах биологический образец представляет собой сыворотку или опухоль.
В вариантах, заключающихся в выявлении экспрессии Notch1 и/или лиганда Notch1 (например, Jagged 1, Jagged 2, Delta-подобный 1, Delta-подобный 3 и/или Delta-подобный 4), может быть выявлена экспрессия полинуклеотидов Notch1 и/или лиганда Notch1 и/или экспрессия полипептидов Notch1 и/или лиганда Notch1. В некоторых вариантах, заключающихся в выявлении экспрессии Notch1 и/или лиганда Notch1, выявляют экспрессию мРНК Notch1 и/или лиганда Notch1. В других вариантах выявляют экспрессию полипептида Notch1 и/или лиганда Notch1, используя средство против NRR Notch1 и/или средство против лиганда Notch1. В некоторых вариантах экспрессию полипептидов Notch1 и/или лиганда Notch1 выявляют, используя антитело. Можно использовать любое подходящее антитело для выявления и/или диагностики, включая моноклональные и/или поликлональные антитела, человеческое антитело, химерное антитело, антитело с созревшей аффинностью, гуманизированное антитело и/или фрагмент антитела. В некоторых вариантах для выявления применяют анти-NRR Notch1-антитело, описанное в настоящем документе. В некоторых вариантах экспрессию полипептидов Notch1 и/или лиганда Notch1 выявляют, используя иммуногистохимию («IHC»). В некоторых вариантах экспрессию Notch1 оценивают значением 2 или выше, используя IHC-анализ.
В некоторых вариантах, заключающихся в выявлении экспрессии Notch1 и/или лиганда Notch1, может быть определено наличие и/или отсутствие и/или уровень экспрессии Notch1 и/или лиганда Notch1. Экспрессия Notch1 и/или лиганда Notch1 может быть повышена. Следует понимать, что отсутствие экспрессии Notch1 и/или лиганда Notch1 включает незначительные или минимальные уровни. В некоторых вариантах экспрессия Notch1 в тестируемом биологическом образце выше, чем экспрессия, наблюдаемая в контрольном биологическом образце (контрольный или эталонный уровень экспрессии). В некоторых вариантах экспрессия Notch1, по меньшей мере, примерно в 2 раза, 5 раз, 10 раз, 20 раз, 30 раз, 40 раз, 50 раз, 75 раз, 100 раз, 150 раз или более раз выше в тестируемом биологическом образце, чем в контрольном биологическом образце. В некоторых вариантах экспрессию полипептида Notch1 определяют в иммуногистохимическом («IHC») анализе, оценивая интенсивность окрашивания, по меньшей мере, значением 2 или выше. В некоторых вариантах экспрессию полипептида Notch1 определяют в IHC-анализе, оценивая интенсивность окрашивания, по меньшей мере, значением 1 или выше или, по меньшей мере, 3 или выше. В некоторых вариантах экспрессия Notch1 в тестируемом биологическом образце ниже, чем экспрессия, которая наблюдается в контрольном биологическом образце (или чем контрольный уровень экспрессии).
В другом аспекте в изобретении предлагается любое из анти-NRR Notch1-антител, описанных в настоящем документе, где анти-NRR Notch1-антитело содержит регистрируемую метку.
В другом аспекте в изобретении предлагается комплекс любого из анти-NRR Notch1-антител, описанных в настоящем документе, и Notch1. В некоторых вариантах комплекс образуется in vivo или in vitro. В некоторых вариантах комплекс содержит злокачественную клетку. В некоторых вариантах анти-NRR Notch1-антитело метят регистрируемой меткой.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигуры 1-1 и 1-2: последовательности петли HVR тяжелой цепи и легкой цепи анти-NRR Notch1-антител. На фигурах показаны последовательности HVR тяжелой цепи, H1, H2 и H3, и последовательности HVR легкой цепи, L1, L2 и L3. Последовательности пронумерованы следующим образом: антитело A (HVR-H1 имеет последовательность SEQ ID NO: 1; HVR-H2 имеет последовательность SEQ ID NO: 2; HVR-H3 имеет последовательность SEQ ID NO: 6; HVR-L1 имеет последовательность SEQ ID NO: 7; HVR-L2 имеет последовательность SEQ ID NO: 8; HVR-L3 имеет последовательность SEQ ID NO: 9); антитело A-1 (HVR-H1 имеет последовательность SEQ ID NO: 1; HVR-H2 имеет последовательность SEQ ID NO: 3; HVR-H3 имеет последовательность SEQ ID NO: 6; HVR-L1 имеет последовательность SEQ ID NO: 7; HVR-L2 имеет последовательность SEQ ID NO: 8; HVR-L3 имеет последовательность SEQ ID NO: 10); антитело A-2 (HVR-H1 имеет последовательность SEQ ID NO: 1; HVR-H2 имеет последовательность SEQ ID NO: 4; HVR-H3 имеет последовательность SEQ ID NO: 6; HVR-L1 имеет последовательность SEQ ID NO: 7; HVR-L2 имеет последовательность SEQ ID NO: 8; HVR-L3 имеет последовательность SEQ ID NO: 11); и антитело A-3 (HVR-H1 имеет последовательность SEQ ID NO: 1; HVR-H2 имеет последовательность SEQ ID NO: 5; HVR-H3 имеет последовательность SEQ ID NO: 6; HVR-L1 имеет последовательность SEQ ID NO: 7; HVR-L2 имеет последовательность SEQ ID NO: 8; HVR-L3 имеет последовательность SEQ ID NO: 12). Положения аминокислот пронумерованы согласно системе нумерации Кабата, как описано ниже.
На фигуре 2 изображены аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельных областей легкой цепи антител A, A-1, A-2 и A-3 (SEQ ID NO: 58-65).
На фигурах 3A, 3B и 4 изображены примерные акцепторные консенсусные каркасные последовательности для применения при практическом осуществлении настоящего изобретения, имеющие следующие идентификационные номера последовательностей:
Консенсусные каркасы вариабельной области тяжелой цепи (VH) (фиг. 3A, 3B)
консенсусный каркас подгруппы I VH человека минус CDR по Кабату (SEQ ID NO: 19);
консенсусный каркас подгруппы I VH человека минус расширенные гипервариабельные области (SEQ ID NO: 20-22);
консенсусный каркас подгруппы II VH человека минус CDR по Кабату (SEQ ID NO: 23);
консенсусный каркас подгруппы II VH человека минус расширенные гипервариабельные области (SEQ ID NO: 24-26);
консенсусный каркас подгруппы III VH человека минут CDR по Кабату (SEQ ID NO: 27);
консенсусный каркас подгруппы III VH человека минус расширенные гипервариабельные области (SEQ ID NO: 28-30);
акцепторный каркас VH человека минус CDR по Кабату (SEQ ID NO: 31);
акцепторный каркас VH человека минус расширенные гипервариабельные области (SEQ ID NO: 32-33);
акцепторный каркас 2 VH человека минус CDR по Кабату (SEQ ID NO: 34);
акцепторный каркас 2 VH человека минус расширенные гипервариабельные области (SEQ ID NO: 35-37).
Консенсусные каркасы вариабельной области легкой цепи (VL) (фиг. 4)
консенсусный каркас подгруппы I VL каппа человека (SEQ ID NO: 38);
консенсусный каркас подгруппы II VL каппа человека (SEQ ID NO: 39);
консенсусный каркас подгруппы III VL каппа человека (SEQ ID NO: 40);
консенсусный каркас подгруппы IV VL каппа человека (SEQ ID NO: 41).
На фигуре 5 изображены последовательности каркасной области легкой (SEQ ID NO: 15-18) и тяжелой цепей (SEQ ID NO: 42-45) huMAb4D5-8. Надстрочные/изображенные жирным шрифтом номера указывают положения аминокислот согласно Кабату.
На фигуре 6 изображены модифицированные/вариантные последовательности каркасных областей легкой (SEQ ID NO: 15, 16, 18 и 46) и тяжелой цепей (SEQ ID NO: 42, 43, 45 и 47) huMAb4D5-8. Надстрочные/изображенные жирным шрифтом номера указывают положения аминокислот согласно Кабату.
Фигура 7 представляет собой график, показывающий, что антитело A является сильным ингибитором Notch1, что измерено с использованием репортерного гена люциферазы. В каждой колонке A-L несущими рецептор клетками были клетки NIH-3T3-Notch1. В случае A несущей лиганд клеткой была родительская клетка NIH-3T3, в случае B-L несущей лиганд клеткой была клетка NIH-3T3-Jag1. В случае A, B и K не добавляли ни антитела, ни соединения E (ингибитор гамма-секретазы); в случае C добавляли антитело, используемое в качестве контроля изотипа, в концентрации 400 нг/мл; в случае D добавляли антитело A в концентрации 16 нг/мл; в случае E добавляли антитело A в концентрации 80 нг/мл; в случае F добавляли антитело A в концентрации 400 нг/мл; в случае G добавляли антитело A в концентрации 2000 нг/мл; в случае H добавляли антитело A в концентрации 400 нг/мл; в случае I добавляли антитело A в концентрации 400 нг/мл; в случае J добавляли антитело, используемое в качестве контроля изотипа, в концентрации 400 нг/мл; в случае K добавляли 0,01% ДМСО; и в случае L добавляли соединение E в концентрации 1 мкМ в 0,01% ДМСО. В случае H добавляли белок NRR Notch1 в концентрации 5 мкг/мл (100 мкл); в случае I добавляли белок БСА (бычий сывороточный альбумин) в концентрации 6,5 мкг/мл (100 мкл); в случае J добавляли белок NRR Notch1 в концентрации 5 мкг/мл (100 мкл); в случае A-G, K и L не добавляли белка.
Фигура 8 представляет собой график, показывающий, что антитела A, A-1, A-2 и A-3 ингибируют Notch1, как измерено с использованием анализа на основе репортера люциферазы. Черные столбики показывают результаты, полученные с использованием родительского антитела A, а другие столбики показывают результаты, полученные с использованием антитела A-1 (горизонтальные полоски), антитела A-2 (серая штриховка) и антитела A-3 (диагональны6е полоски). Как выявлено при использовании 80 нг/мл антитела, антитела A-1 и A-2 давали более сильное блокирование сигнала Notch1, чем родительское антитело A. На оси X на графике представлена концентрация антител (нг/мл), и на оси Y графика представлена люминесценция люциферазы светляка/Renilla.
Фигура 9 представляет собой график, показывающий, что антитело A снижает блокирование дифференцировки миоцитов C2C12 мыши, вызванной активацией передачи сигналов Notch. В случае A-F среда представляла собой среду для дифференцировки. В случае A миобласты C2C12 мыши не культивировали совместно с клетками NIH-3T3, экспрессирующими лиганд Jagged1, тогда как в случае B-F миобласты C2C12 мыши культивировали совместно с клетками NIH-3T3, экспрессирующими лиганд Jagged1. Добавляли следующее антитело/проводили следующую обработку клеток: в случае A и B без антитела/обработки, контроль изотипа в случае C, антитело A в концентрации 200 нг/мл в случае D, ДМСО в случае E, и соединение E в концентрации 1 мкМ в случае F.
На фигурах 10A-10F показаны изображения клеток миоцитов C2C12 мыши, окрашенных MHC/Alexa® 488 (верхний ряд) или DAPI (гидрохлорид 4',6'-диамидино-2-фенилиндола; нижний ряд). В случае A-F среда представляла собой среду для дифференцировки. В случае A миобласты C2C12 мыши не культивировали совместно с клетками NIH-3T3, экспрессирующими лиганд Jagged1, тогда как в случае B-F миобласты C2C12 мыши культивировали совместно с клетками NIH-3T3, экспрессирующими лиганд Jagged1. Добавляли следующее антитело/проводили следующую обработку клеток: в случае A и B без антитела/обработки, контроль изотипа в случае C, антитело A в концентрации 200 нг/мл в случае D, ДМСО в случае E, и соединение E в концентрации 1 мкМ в случае F.
На фигурах 11-1 - 11-4 показано выравнивание аминокислотных последовательностей Notch1 человека и мыши (SEQ ID NO: 56 и 57). Использовали программу для выравнивания SIM (доступную на веб-сайте ExPASy), чтобы провести выравнивание полных последовательностей белков Notch1 человека и мыши. Были выбраны параметры по умолчанию со штрафом за открытие пробела 12, штрафом за расширение пробела 4 и BLOSUM62 в качестве матрицы сравнения. Домены белков подчеркнуты и помечены. Границы сигнального пептида, трансмембранного и EGF-домена основаны на результатах, полученных для Notch1 человека из Expasy.org; границы LNR основаны на данных Vardar et al. (Biochemistry, 42: 7061-7067, 2003); границы HD-N и HD-C основаны на данных Malecki et al. (Mol. Cell. Biol. 26: 4642-4651, 2006). Область негативной регуляции (NRR) соответствует последовательностям, начиная с LNR_A и заканчивая после HD-C. Иммуногенные последовательности, используемые для создания антител против NRR Notch1, подчеркнуты сверху заштрихованной линией и включают повторы EGF 34-36 плюс NRR. Сокращения: аминокислоты показаны однобуквенным кодом; TM, трансмембранная; EGF, повторы эпидермального фаткора роста; LNR, повторы Lin 12-Notch; HD-N, домен гетеродимеризации - с амино-концевой стороны от сайта расщепления S1; HD-C, домен гетеродимеризации - со стороны карбоксильного конца от сайта расщепления S1; S1, сайт расщепления S1 для фуриновых протеаз; S2, сайт расщепления S2 для протеаз ADAM (семейство дезинтегринов и металлопротеиназ).
Фигуры 12A-12C представляют собой графики, показывающие результаты экспериментов по картированию эпитопов для антитела A (фигура 12A), антитела A-1 (фигура 12B) и антитела A-2 (фигура 12C).
Фигура 13 представляет собой график, показывающий, что анти-Notch1-NRR-антитела ингибируют передачу сигналов рецептора Notch1 дикого типа и мутантного рецептора Notch1. Полностью заштрихованные черные столбики показывают результаты, полученные с использованием контрольного антитела в концентрации 2000 нг/мл; столбики с крупными точками показывают результаты, полученные с использованием антитела A в концентрации 80 нг/мл; столбики с тонкими полосками показывают результаты, полученные с использованием антитела A в концентрации 400 нг/мл; столбики с толстыми полосками показывают результаты, полученные с использованием антитела A в концентрации 2000 нг/мл; столбики с поперечными штрихами показывают результаты, полученные с использованием соединения E в концентрации 10 мкМ; и столбики с мелкими точками показывают результаты, полученные с использованием ДМСО (носитель для соединения E). Результаты для каждого условия измеряли в восьми повторах и затем выражали в виде среднего значения с изображением отрезков, показывающих стандартное отклонение.
На фигуре 14A представлена серия изображений, показывающих, что обработка анти-NRR Notch1-антителом и анти-D114-антителом вызывает заметное увеличение прорастания и длины сосудов в анализе прорастания клеток HUVEC (эндотелиальные клетки пупочной вены человека). Результаты показаны для клеток, обработанных PBS (фосфатно-солевым буфером) в качестве контроля или анти-NRR Notch1-антителом A или A-2.
На фигуре 14B представлена серия изображений, показывающих влияние анти-NRR Notch1-антител на васкуляризацию и ангиогенез в случае использования анализа кармана роговицы. Обработка анти-NRR Notch1-антителом (антителом A-2) значимо увеличивала плотность сосудистой сети.
На фигуре 14C представлена серия изображений, показывающих влияние анти-D114- и анти-NRR Notch1-обработки на течение жидкости по сосудам в анализе роговицы. Перфузия через анти-D114- и анти-NRR Notch1-обработанные сосуды была ограничена.
На фигуре 14D представлена серия изображений, показывающих влияние анти-NRR Notch1-антител в модели ангиогенеза в сетчатке мышей. Обработка анти-NRR Notch1-антителом (антителом A-2) увеличивала плотность сосудистой сети и создавала фенотип с гиперпрорастанием.
На фигуре 14E представлена серия изображений, показывающих, что в модели ангиогенеза в сетчатке мышей анти-NRR Notch1-обработка (антителом A-2) вызывает увеличение количества ядер, которое согласуется с увеличением пролиферации клеток.
Фигура 15A представляет собой график, показывающий влияние анти-NRR Notch1-антитела на рост опухоли в мышиной модели in vivo. Обработка анти-NRR Notch1-антителом A-2 задерживала рост опухоли.
Фигура 15B представляет собой график, показывающий, что различные дозы анти-NRR Notch1-антитела A-2 задерживали или замедляли рост опухоли в мышиной модели in vivo.
Фигура 15C представляет собой график, показывающий, что в мышиной модели in vivo анти-NRR Notch1-антитело A-2 уменьшало объем опухоли.
Фигура 15D представляет собой график, показывающий, что в мышиной модели in vivo анти-NRR Notch1-антитело A-2 вызывает потерю массы зависимым от дозы образом.
Фигура 15E представляет собой график, показывающий клиренс анти-NRR Notch1-антитела A-2 с течением времени из сыворотки иммунодефицитных мышей (Balb-C Nu/Nu).
На фигурах 16A и 16B представлена серия изображений, показывающих примеры кишечных крипт и ворсинок тонкого (фигура 16A) или толстого (фигура 16B) кишечника мышей, обработанных контрольным антителом (наполнителем) или анти-NRR Notch1-антителом A-2 в концентрации 10 мг/кг.
Фигура 17 представляет собой график, показывающий, что анти-NRR Notch1-антитела и ингибиторы гамма-секретазы снижают жизнеспособность некоторых линий злокачественных клеток. Использовали анти-NRR Notch1-антитело A-2 и ингибиторы гамма-секретазы, трет-бутиловый эфир N-[N-(3,5-дифторфенацетил)-L-аланил]-S-фенилглицина (DAPT) и соединение E (CmpE). Линии злокачественных клеток указаны на оси x.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к анти-NRR Notch1-антителам, которые применимы, например, для лечения или профилактики патологических состояний, ассоциированных с экспрессией и/или активностью Notch, например, с повышенной экспрессией и/или активностью или нежелательной экспрессией и/или активностью. В некоторых вариантах антитела согласно изобретению применяют для лечения опухоли, злокачественной опухоли и/или клеточного пролиферативного нарушения.
В другом аспекте анти-NRR Notch1-антитела согласно изобретению находят применение в качестве реагентов для выявления и/или выделения Notch1, например, для выявления Notch1 в различных тканях и разных типах клеток.
Изобретение, кроме того, относится к способам получения анти-NRR Notch1-антител и к полинуклеотидам, кодирующим анти-NRR Notch1-антитела.
Общие способы
Способы и процедуры, которые описаны в настоящем документе или на которые в данном документе приведены ссылки, в общем, хорошо известны и широко применяются специалистами в данной области с использованием обычных методик, таких как, например, широко используемые методики, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel, et al. eds., (2003)); the series METHODS IN ENZYMOLOGY (Academic Press, Inc.): PCR 2: A PRACTICAL APPROACH (M. J. MacPherson, B. D. Hames and G. R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) ANTIBODIES, A LABORATORY MANUAL, and ANIMAL CELL CULTURE (R. I. Freshney, ed. (1987)).
ОПРЕДЕЛЕНИЯ
«Изолированное» антитело представляет собой антитело, которое было идентифицировано и отделено и/или извлечено из его природного окружения, состоящего из определенных компонентов. Компоненты, являющиеся примесями в природном окружении, представляют собой вещества, которые могут мешать диагностическим или терапевтическим применениям антитела и могут включать ферменты, гормоны и другие белковые и небелковые растворенные вещества. В предпочтительных вариантах антитело будет очищено (1) до более чем 95% масс. антитела на основании определения способом Лоури, и наиболее предпочтительно до более чем 99% масс., (2) в достаточной степени для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом, или (3) до гомогенности с помощью SDS-ПААГ (электрофорез в полиакриламидном геле с додецилсульфатом натрия) в восстанавливающих или невосстанавливающих условиях, используя окрашивание Кумасси синим или предпочтительно серебром. Изолированное антитело включает антитело in situ в рекомбинантных клетках, так как, по меньшей мере, один компонент природного окружения антитела не будет присутствовать. Однако обычно изолированное антитело может быть получено, по меньшей мере, на одной стадии очистки.
«Изолированная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена, по меньшей мере, от одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в природном источнике нуклеиновой кислоты. Изолированная молекула нуклеиновой кислоты имеет другую форму или окружение, отличные от той формы и окружения, в которых она встречается в природе. Поэтому изолированные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты, в виде которой они существуют в природных клетках. Однако изолированная молекула нуклеиновой кислоты включает молекулы нуклеиновой кислоты, которые содержатся в клетках, которые обычно экспрессируют нуклеиновую кислоту (например, нуклеиновую кислоту, кодирующую антитело), в которых молекула нуклеиновой кислоты находится, например, в положении хромосомы, отличном от положения в хромосоме в природных клетках.
Термин «нумерация остатков вариабельного домена согласно Кабату» или «нумерация положений аминокислот согласно Кабату» и его варианты относится к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи при обобщении данных об антителах в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991). При использовании такой системы нумерации реальная линейная аминокислотная последовательность может содержать меньше или может содержать дополнительные аминокислоты, что соответствует укорочению или инсерции в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может содержать инсерцию одной аминокислоты (остаток 52a согласно нумерации Кабата) после остатка 52 в H2 и встроенные остатки (например, остатки 82a, 82b и 82c и т.д. согласно нумерации Кабата) после остатка 82 FR тяжелой цепи. Нумерация остатков согласно Кабату может быть определена для данного антитела в результате выравнивания областей гомологии последовательности антитела со «стандартной» последовательностью, пронумерованной по Кабату.
Фраза «по существу сходный» или «по существу такой же» в используемом в настоящем описании смысле означает достаточно высокую степень сходства между двумя числовыми значениями (обычно одно ассоциировано с антителом согласно изобретению, а другое ассоциировано с эталонным антителом/антителом для сравнения), так что специалист в данной области может считать различие между двумя значениями небольшим или биологически и/или статистически не значимым в контексте биологического признака, измеряемого указанными значениями (например, значениями Kd). Различие между двумя указанными значениями предпочтительно меньше, чем примерно 50%, предпочтительно меньше, чем примерно 40%, предпочтительно меньше, чем примерно 30%, предпочтительно меньше, чем примерно 20%, предпочтительно меньше, чем примерно 10% от значения для эталонного/сравниваемого антитела.
«Аффинность связывания» обычно относится к силе суммарных нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не оговорено особо, в используемом в настоящем описании смысле «аффинность связывания» относится к присущей молекулам аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X по отношению к ее партнеру Y, как правило, может быть представлена константой диссоциации (Kd). Желательно, чтобы Kd составляла 1×10-7, 1×10-8, 5×10-8, 1×10-9, 3×10-9, 5×10-9 или даже 1×10-10 или еще сильнее. Аффинность может быть измерена обычными способами, известными в данной области, включая способы, описанные в настоящем документе. Низкоаффинные антитела обычно связывают антиген медленно и имеют тенденцию легко диссоциировать, тогда как высокоаффинные антитела обычно связывают антиген быстрее и имеют тенденцию дольше оставаться связанными. В данной области известны различные способы измерения аффинности связывания, любой из которых можно применять в целях настоящего изобретения. Конкретные иллюстративные варианты описаны ниже.
В одном варианте «Kd» или «значение Kd» согласно настоящему изобретению измеряют с помощью анализа связывания радиоактивно меченого антигена (РИА), осуществляемого с Fab-вариантом представляющего интерес антитела и его антигеном, который описан на примере следующего анализа, в котором измеряют аффинность связывания в растворе Fab для антигена посредством уравновешивания Fab с минимальной концентрацией (125I)-меченного антигена в присутствии серии немеченого антигена для титрования, затем улавливая связанный антиген на покрытом анти-Fab-антителом планшете (Chen, et al., (1999) J. Mol. Biol. 293: 865-881). Чтобы создать условия для анализа, планшеты для микротитрования (Dynex) покрывают в течение ночи 5 мкг/мл улавливающего анти-Fab-антитела (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6) и затем блокируют 2% (масс./об.) бычьим сывороточным альбумином в PBS в течение двух-пяти часов при комнатной температуре (примерно 23ºC). В неадсорбирующем планшете (Nunc №269620), 100 пМ или 26 пМ [125I]-антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой анти-VEGF-антитела, Fab-12, в публикации Presta et al., (1997) Cancer Res. 57: 4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубация может продолжаться в течение более длительного периода (например, 65 часов), чтобы гарантировать достижение равновесия. Затем смеси переносят в улавливающий планшет для инкубации при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и планшет промывают восемь раз 0,1% твин-20 в PBS. После высыхания планшетов добавляют по 150 мкл/лунку сцинтиллятора (MicroScint-20; Packard) и планшеты подвергают счету в гамма-счетчике Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают связывание, которое меньше или равно 20% от максимального связывания, выбирают для использования в анализах конкурентного связывания. Согласно другому варианту Kd или значение Kd измеряют, применяя анализы поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, N.J.), при 25ºC с помощью чипов CM5 с иммобилизованным антигеном на уровне 10 единиц ответного сигнала (RU). Кратко, биосенсорные чипы из карбоксиметилированного декстрана (CM5, BIAcore Inc.) активировали гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разбавляли 10 мМ ацетатом натрия, pH 4,8, в концентрации 5 мкг/мл (0,2 мкМ) перед инъецированием со скоростью потока 5 мкл/минуту, чтобы достичь примерно 10 единиц ответного сигнала (RU) от связанного белка. После инъекции антигена инъецировали 1 М этаноламина, чтобы блокировать не вступившие в реакцию группы. Для кинетических измерений двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) инъецировали в PBS с 0,05% твин-20 (PBST) при 25ºC со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляли, используя простую модель связывания Лэнгмюра «один к одному» (компьютерная программа для оценки BIAcore, версия 3.2), посредством одновременной подгонки сенсограммы ассоциации и диссоциации. Равновесную константу диссоциации (Kd) вычисляют в виде отношения koff/kon. Смотри, например, Chen, Y., et al., (1999) J. Mol. Biol. 293: 865-881. Если скорости образования комплекса превышает 106 M-1 сек-1 по данным указанного выше анализа поверхностного плазмонного резонанса, то скорость образования комплекса можно определить, используя методику гашения флуоресценции, которая позволяет измерять увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, полоса пропускания 16 нм) при 25ºC 20 нМ антитела против антигена (Fab-форма) в PBS, pH 7,2, в присутствии возрастающих концентраций антигена, при этом измерения проводят на спектрометре, таком как спектрофотометр, оборудованный устройством для остановки потока (Aviv Instruments) или спектрофотометр SLM-Aminco серии 8000 (ThermoSpectronic), в кювете с перемешиванием содержимого.
«Скорость образования комплекса» или «скорость ассоциации» или «kon» согласно настоящему изобретению также можно определить таким же способом на основе поверхностного плазмонного резонанса, который описан выше, с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, N.J.) при 25ºC с помощью чипов CM5 с иммобилизованным антигеном на уровне 10 единиц ответного сигнала (RU). Кратко, биосенсорные чипы из карбоксиметилированного декстрана (CM5, BIAcore Inc.) активировали гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разбавляли 10 мМ ацетатом натрия, pH 4,8, в концентрации 5 мкг/мл (~0,2 мкМ) перед инъецированием со скоростью потока 5 мкл/минуту, чтобы достичь примерно 10 единиц ответного сигнала (RU) от связанного белка. После инъекции антигена инъецировали 1 М этаноламина, чтобы блокировать не вступившие в реакцию группы. Для кинетических измерений двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) инъецировали в PBS с 0,05% твин-20 (PBST) при 25ºC со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляли, используя простую модель связывания Лэнгмюра «один к одному» (компьютерная программа для оценки BIAcore, версия 3.2), посредством одновременной подгонки сенсограммы ассоциации и диссоциации. Равновесную константу диссоциации (Kd) вычисляли в виде отношения koff/kon. Смотри, например, Chen, Y., et al., (1999) J. Mol. Biol. 293: 865-881. Однако если скорости образования комплекса превышает 106 M-1 сек-1 по данным указанного выше анализа поверхностного плазмонного резонанса, то скорость образования комплекса можно определить, используя методику гашения флуоресценции, которая позволяет измерять увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, полоса пропускания 16 нм) при 25ºC 20 нМ антитела против антигена (Fab-форма) в PBS, pH 7,2, в присутствии возрастающих концентраций антигена, при этом измерения проводят на спектрометре, таком как спектрофотометр, оборудованный устройством для остановки потока (Aviv Instruments) или спектрофотометр SLM-Aminco серии 8000 (ThermoSpectronic), в кювете с перемешиванием содержимого.
Подразумевают, что термин «вектор» в используемом в настоящем описании смысле относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она была связана. Одним из типов векторов является «плазмида», которая представляет собой кольцевую двунитевую петлю ДНК, в которую могут быть лигированы дополнительные фрагменты ДНК. Другим типом вектора является фаговый вектор. Следующим типом вектора является вирусный вектор, при этом дополнительные фрагменты ДНК могут быть лигированы в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, имеющие бактериальное начало репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при введении в клетку-хозяина и при этом реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы способны управлять экспрессией генов, с которыми они оперативно связаны. Такие векторы называют в настоящем описании «рекомбинантными экспрессирующими векторами» (или просто «рекомбинантными векторами»). В общем, экспрессирующие векторы, применимые в технологиях рекомбинантной ДНК, часто имеют форму плазмид. В настоящем описании термины «плазмида» и «вектор» могут быть использованы взаимозаменяемо, так как плазмида представляет собой наиболее широко используемую форму вектора.
Термины «полинуклеотид» или «нуклеиновая кислота», которые используются в настоящем описании взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть введен в полимер ДНК- или РНК-полимеразой или в результате реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. При наличии модификация в структуре нуклеотида может быть введена до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после синтеза, например, посредством конъюгирования с меткой. Другие типы модификаций включают, например, «кэпы», замены одного или нескольких природных нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые остатки, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, ply-L-лизин и т.д.), модификации интеркаляторами (например, акридин, псорален и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкиляторы, полинуклеотиды с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть замещена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами, или может быть конъюгирована с твердыми или полутвердыми подложками. 5'- и 3'-концевая OH может быть фосфорилирована или замещена аминами или органическими кэпирующими группами из 1-20 атомов углерода. Другие гидроксилы также могут быть дериватизованы стандартными защитными группами. Полинуклеотиды также могут содержать аналогичные формы сахаров рибозы и дезоксирибозы, которые обычно известны в данной области, включая, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и лишенные основания аналогии нуклеозидов, такие как метилрибозид. Одна или несколько фосфодиэфирных связей могут быть заменены альтернативными связывающими группами. Такие альтернативные связывающие группы включают без ограничения варианты, в которых фосфат заменен P(O)S («тиоат»), P(S)S («дитиоат»), (O)NR2 («амидат»), P(O)R, P(O)OR', CO или CH2 («формацеталь»), где каждый R или R' независимо означает H или замещенный или незамещенный алкил (1-20 C), необязательно содержащий эфирную
(-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание применимо ко всем указанным в настоящем описании полинуклеотидам, включая РНК и ДНК.
«Олигонуклеотид» в используемом в настоящем описании смысле в общем относится к коротким, обычно однонитевым, обычно синтетическим полинуклеотидам, которые, как правило, но не обязательно, имеют длину менее чем примерно 200 нуклеотидов. Термины «олигонуклеотид» и «полинуклеотид» не являются взаимоисключающими. Приведенное выше описание полинуклеотидов в равной мере и полностью применимо к олигонуклеотидам.
«Идентичность аминокислотных последовательностей в процентах (%)» по отношению к пептидной или полипептидной последовательности определяют в виде процентного содержания аминокислотных остатков в выбранной для исследования последовательности, которые идентичны аминокислотным остаткам в конкретном пептидной или полипептидной последовательности после выравнивания последовательностей и введения пробелов, если это необходимо, чтобы достичь максимальной идентичности последовательностей в процентах, и не принимая во внимание какие-либо консервативные замены как часть идентичности последовательностей. Выравнивание в целях определения идентичности аминокислотных последовательностей в процентах можно осуществить различными путями, которые известны специалисту в данной области, например, с использованием общедоступной компьютерной программы, такой как компьютерная программа BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить подходящие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания на протяжении всей длины сравниваемых последовательностей. Однако в целях настоящего изобретения значения идентичности аминокислотных последовательностей в % получают, используя компьютерную программу для сравнения последовательностей ALIGN-2, при этом исходный текст программы ALIGN-2 приведен в таблице A ниже. Автором компьютерной программы для сравнения последовательностей ALIGN-2 является Genentech, Inc., и исходный текст был подан вместе с документацией для пользователя в Бюро охраны авторских прав США, Washington D.C., 20559, где он зарегистрирован с номером регистрации Бюро охраны авторских прав США TXU510087. Программа ALIGN-2 общедоступна в Genentech, Inc., South San Francisco, Calif. или может быть компилирована из исходного текста программы, представленного, например, в WO2007/001851. Программа ALIGN-2 может быть компилирована для применения в операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры для сравнения последовательностей установлены программой ALIGN-2 и не варьируют.
В ситуациях, когда ALIGN-2 применяют для сравнений аминокислотных последовательностей, идентичность аминокислотной последовательности в % для данной аминокислотной последовательности A по сравнению или по отношению к данной аминокислотной последовательности B (что альтернативно может быть выражено как данная аминокислотная последовательность A, которая имеет или содержит определенную идентичность аминокислотных последовательностей в % по сравнению или по отношению к данной аминокислотной последовательности B) рассчитывают следующим образом:
100×дробь X/Y,
где X означает количество аминокислотных остатков, оцененных как идентичные совпадения программой выравнивания последовательностей ALIGN-2 при выравнивании указанной программой A и B, и где Y означает общее количество аминокислотных остатков в B. Будет понятно, что в том случае, когда длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, идентичность аминокислотной последовательности A по сравнению с B в % не будет равна идентичности аминокислотной последовательности B по сравнению с A в %.
Желательно две или более аминокислотных последовательностей идентичны, по меньшей мере, на 50%, 60%, 70%, 80% или 90%. Более предпочтительно две или более аминокислотных последовательностей идентичны, по меньшей мере, на 95%, 97%, 98%, 99% или даже 100%. Если не указано иное, все значения идентичности аминокислотных последовательностей в %, используемые в настоящем описании, получены, как описано в непосредственно предшествующем абзаце, с использованием компьютерной программы ALIGN-2.
Термин «Notch1» в используемом в настоящем описании смысле, если не указано иначе, относится к любому нативному или к любому варианту (либо нативному, либо синтетическому) полипептида Notch1. Термин «нативная последовательность», в частности, охватывает природные укороченные формы (например, последовательность внеклеточного домена или последовательность трансмембранной субъединицы), природные формы вариантов (например, альтернативно спалйсированные формы) и природные аллельные варианты. Термин «Notch1 дикого типа» в общем относится к полипептиду, содержащему аминокислотную последовательность природного белка Notch1. Термин «последовательность Notch1 дикого типа» в общем относится к аминокислотной последовательности, имеющейся в природном Notch1.
Термин «лиганд Notch1» в используемом в настоящем описании смысле, если не указано иначе, относится к любому нативному или к любому варианту (либо нативному, либо синтетическому) полипептида лиганда Notch1 (например, Jagged1, Jagged2, Delta-подобный 1, Delta-подобный 3 и/или Delta-подобный 4). Термин «нативная последовательность», в частности, охватывает природные укороченные формы (например, последовательность внеклеточного домена или последовательность трансмембранной субъединицы), природные формы вариантов (например, альтернативно спалйсированные формы) и природные аллельные варианты. Термин «лиганд Notch1 дикого типа» в общем относится к полипептиду, содержащему аминокислотную последовательность природного белка лиганда Notch1. Термин «последовательность лиганда Notch1 дикого типа» в общем относится к аминокислотной последовательности, имеющейся в природном лиганде Notch1.
Термин «NRR Notch1» в используемом в настоящем описании смысле, если специально или в соответствии с текстом не указано иное, относится к любой нативной или любому варианту (либо нативному, либо синтетическому) области полипептида Notch1, состоящей из 3 модулей LNR и аминокислотных последовательностей, расположенных с карбоксильного конца от модулей LNR, простирающихся до трансмембранного домена, например, аминокислоты с номерами примерно от 1446 до примерно 1735 аминокислотной последовательности Notch1 человека (SEQ ID NO: 56), и аминокислоты с номерами примерно от 1446 до примерно 1725 аминокислотной последовательности Notch1 мыши (SEQ ID NO: 57). Термин «нативная последовательность», в частности, охватывает природные укороченные формы, природные формы вариантов (например, альтернативно сплайсированные формы) и природные аллельные варианты. Термин «NRR Notch1 дикого типа» в общем относится к полипептиду, содержащему аминокислотную последовательность встречающегося в природе NRR Notch1. В некоторых вариантах NRR Notch1 представляет собой полипептид, содержащий аминокислоты от 1446 до 1735 последовательности SEQ ID NO: 56 или аминокислоты от 1446 до 1725 последовательности SEQ ID NO: 57. В некоторых вариантах NRR Notch1 находится в Notch1, таком как, например, Notch1, процессированный в сайте (сайтах) S1, S2 и/или S3, или непроцессированный Notch1. В некоторых вариантах NRR Notch1 содержит два или более нековалентно связанных фрагмента аминокислотной последовательности NRR Notch1, например, фрагмент, содержащий аминокислоты от 1446 до 1664 последовательности SEQ ID NO: 56, нековалентно связан с фрагментом, содержащим аминокислоты от 1665 до 1735 последовательности SEQ ID NO: 56. В другом варианте фрагмент, содержащий аминокислоты от 1446 до 1654 последовательности SEQ ID NO: 57, нековалентно связан с фрагментом, содержащим аминокислоты от 1655 до 1725 последовательности SEQ ID NO: 57.
Термин «повышенная передача сигналов Notch1» в используемом в настоящем описании смысле относится к повышению передачи сигналов Notch1, то есть, по меньшей мере, в два раза выше уровня передачи сигналов Notch1, наблюдаемого в контроле в идентичных условиях, например, с использованием анализа люциферазы, описанного в настоящем документе в примерах 5 и 6. Желательно, повышение передачи сигналов Notch1 составляет, по меньшей мере, в три раза, в четыре раза, в пять раз или даже в десять раз выше (или еще выше) уровня, наблюдаемого в контроле.
Термин «пониженная передача сигналов Notch1» в используемом в настоящем описании смысле относится к снижению передачи сигналов Notch1, то есть, по меньшей мере, в два раза ниже уровня передачи сигналов Notch1, наблюдаемого в контроле в идентичных условиях, например, с использованием анализа люциферазы, описанного в настоящем документе в примерах 5 и 6. Желательно снижение передачи сигнала Notch1 составляет, по меньшей мере, в три раза, в четыре раза, в пять раз или даже в десять раз ниже (или еще ниже) уровня, наблюдаемого в контроле.
Термины «мутация, активирующая Notch1» и «мутация, которая активирует передачу сигналов Notch1» относятся к инсерции одной или нескольких аминокислот, делеции одной или нескольких аминокислот или замене одной или нескольких аминокислот по сравнению с аминокислотной последовательностью Notch1 дикого типа, которая приводит к повышенной передаче сигналов Notch1 по сравнению с передачей сигналов Notch1 в случае соответствующей аминокислотной последовательности Notch1 дикого типа, или к инсерции одного или нескольких нуклеотидов, делеции одного или нескольких нуклеотидов, транслокации одного или нескольких нуклеотидов или замене одного или нескольких нуклеотидов по сравнению с последовательностью нуклеиновой кислоты Notch1 дикого типа, что приводит к повышенной передаче сигналов Notch1 в клетке, содержащей мутантную последовательность нуклеиновой кислоты, по сравнению с передачей сигналов Notch1 в клетке, содержащей соответствующую последовательность нуклеиновой кислоты Notch1 дикого типа. Передача сигналов Notch1 от рецептора Notch1, содержащего активирующую мутацию, может быть зависимой от лиганда или не зависимой от лиганда.
Термины «антитело» и «иммуноглобулин» используют взаимозаменяемо в наиболее широком смысле, и термины охватывают моноклональное антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, полиспецифичные антитела (например, биспецифичные антитела, при условии, что они проявляют требуемую биологическую активность), а также могут включать некоторые фрагменты антител (которые более подробно описаны в настоящем документе). Антитело может быть человеческим, гуманизированным и/или аффинно созревшим.
Термин «вариабельный» относится к тому факту, что некоторые части вариабельных доменов в значительной степени отличаются по последовательности среди антител и используются в связывании и обеспечении специфичности каждого конкретного антитела по отношению к его конкретному антигену. Однако вариабельность неравномерно распределена на протяжении вариабельных доменов антител. Она сконцентрирована в трех участках, называемых областями, определяющими комплементарность (CDR), или гипервариабельными областями, в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высоко консервативные части вариабельных доменов называют каркасными областями (FR). Каждый из вариабельных доменов нативных тяжелой и легкой цепей содержит четыре области FR, в основном принимающих конфигурацию β-слоев, соединенных тремя CDR, которые образуют петли, связывающие и в некоторых случаях образующие часть β-слоистой структуры. CDR в каждой цепи удерживаются вместе в непосредственной близости посредством областей FR и с CDR из другой цепи вносят вклад в образование антигенсвязывающего участка антител (смотри Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Ed. National Institutes of Health, Bethesda, MD. (1991)). Константные домены непосредственно не вовлечены в связывание антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в зависимой от антител опосредованной клетками цитотоксичности.
Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых «Fab»-фрагментами, каждый из которых имеет один антигенсвязывающий участок, и остаточный «Fc»-фрагмент, название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает F(ab')2-фрагмент, который имеет два антигенсвязывающих участка и еще способен к перекрестному связыванию антигена.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный сайт узнавания и связывания антигена. В двухцепочечных формах Fv такая область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в тесной нековалентной ассоциации. В одноцепочечных формах Fv один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи могут быть ковалентно связаны гибким пептидным линкером, так чтобы легкая и тяжелая цепи могли ассоциировать с образованием «димерной» структуры, аналогичной структуре двухцепочечных форм Fv. Образуется такая конфигурация, что три CDR каждого вариабельного домена взаимодействуют, определяя границы антигенсвязывающего участка на поверхности димера VH-VL. Шесть CDR вместе придают антителу специфичность в связывании антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичные по отношению к антигену) обладает способностью узнавать и связывать антиген, хотя и с более низкой аффинностью, чем полный участок связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксильном конце домена CH1 тяжелой цепи, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH в настоящем описании означает Fab', в котором остаток(ки) цистеина константных доменов несут свободную тиольную группу. F(ab')2-фрагменты антител исходно получали в виде пар Fab'-фрагментов, между которыми имеются цистеины шарнира. Также известны другие типы химического связывания фрагментов антител.
«Легкие цепи» антител (иммуноглобулинов) любого вида позвоночных можно отнести к одной из двух четко отличающихся типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константного домена своих тяжелых цепей иммуноглобулины могут быть отнесены к разным «классам». Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, названы α, δ, ε, γ и μ соответственно. Субъединичные структуры и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны. «Фрагменты антитела» содержат только часть интактного антитела, при этом часть предпочтительно сохраняет, по меньшей мере, одну, предпочтительно большинство или все функции, в норме ассоциированные с такой частью, когда она присутствует в интактном антителе. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2 и Fv; димерные антитела (diabodies); линейные антитела; одноцепочечные молекулы антител; и полиспецифичные антитела, образованные из фрагментов антител. В одном варианте фрагмент антитела содержит антигенсвязывающий участок интактного антитела и, следовательно, сохраняет способность связывать антиген. В другом варианте фрагмент антитела, например фрагмент, который содержит Fc-область, сохраняет, по меньшей мере, одну из биологических функций, в норме ассоциированных с Fc-областью, когда таковая присутствует в интактном антителе, такую как связывание FcRn, модулирование времени полужизни антитела, функцию ADCC и связывание комплемента. В одном варианте фрагмент антитела представляет собой моновалентное антитело, которое имеет время полужизни in vivo, по существу сходное со временем полужизни интактного антитела. Например, такой фрагмент антитела может содержать антигенсвязывающее плечо, связанное с последовательностью Fc, способной придавать фрагментам стабильность in vivo.
Термин «гипервариабельная область», «HVR» или «HV», при использовании в настоящем описании относится к областям вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют структурно ограниченные петли. В общем, антитела содержат шесть гипервариабельных областей; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). Используют несколько вариантов определения границ гипервариабельных областей, и они рассматриваются в настоящем описании. Определяющие комплементарность области (CDR) согласно системе Kabat основаны на вариабельности последовательностей и наиболее широко используются (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Вместо этого Chothia рассматривает положение структурных петель (Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987)). Гипервариабельные области AbM представляют собой компромисс между CDR согласно Kabat и структурными петлями согласно Chothia и используются в компьютерной программе для моделирования антител AbM Oxford Molecular. Гипервариабельные области «контакта» основаны на анализе имеющихся кристаллических структур комплексов. Остатки для каждой из таких гипервариабельных областей указаны ниже.
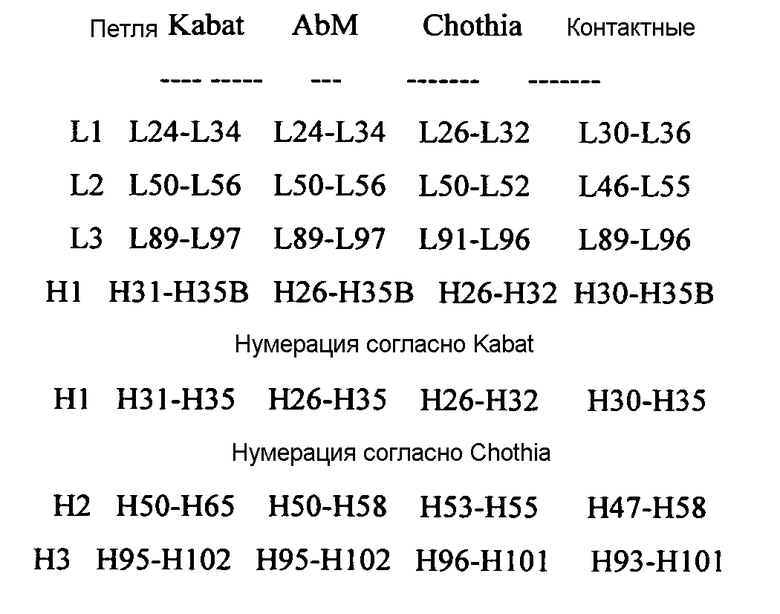
Гипервариабельные области могут содержать следующие «расширенные гипервариабельные области»: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Остатки вариабельных доменов пронумерованы согласно Kabat et al. (ссылка указана выше) для каждого из приведенных определений.
Остатки «каркаса» или «FR» представляют собой другие остатки вариабельного домена, отличные от остатков гипервариабельной области, которая определена в настоящем описании.
«Гуманизированные» формы антител животных, отличных от человека (например, мышей), представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. Главным образом гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, обладающей требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области (FR) иммуноглобулина человека заменяют соответствующими остатками животного, отличного от человека. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в донорном антителе. Такие модификации осуществляют для того, чтобы дополнительно улучшить эффективность антитела. В общем, гуманизированное антитело будет содержать в основном целиком, по меньшей мере, один и обычно два вариабельных домена, в которых все или в основном все гипервариабельные петли соответствуют петлям иммуноглобулина животного, отличного от человека, и все или в основном все FR являются FR из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Более подробное описание смотри в Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992). Также смотри следующие обзорные статьи и приведенные в них ссылки: Vaswani and Hamilton, Ann. Allergy, Asthma and Immunol. 1: 105-115 (1998); Harris, Biochem. Soc. Transactions 23: 1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5: 428-433 (1994).
«Химерные» антитела (иммуноглобулины) имеют часть тяжелой и/или легкой цепи, идентичную или гомологичную соответствующим последовательностям в антителах, полученных от конкретного вида или относящихся к конкретному классу или подклассу антител, тогда как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)). Гуманизированные антитела в используемом в настоящем описании смысле являются подгруппой химерных антител.
«Одноцепочечные Fv» или «scFv» фрагменты антител содержат домены VH и VL антитела, при этом такие домены находятся в одной полипептидной цепи. Обычно полипептид scFv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает возможность образования требуемой структуры scFv для связывания антигена. Обзор scFv смотри в Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
«Антиген» представляет собой предварительно определяемый антиген, с которым антитело может избирательно связываться. Антигеном-мишенью может быть полипептид, углевод, нуклеиновая кислота, липид, гаптен или другое природное или синтетическое соединение. Предпочтительно антигеном-мишенью является полипептид.
Термин «димерные антитела» относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, и такие фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). В случае использования линкера, который является слишком коротким, чтобы обеспечить возможность спаривания между двумя доменами на одной и той же цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих участка. Димерные антитела более полно описаны, например, в EP 404097, WO 93/11161 и в Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993).
«Человеческим антителом» является антитело, которое имеет аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, образуемого в организме человека, и/или получаемого с использованием любого способа получения человеческих антител, который описан в данном документе. Такое определение человеческого антитела специально включает гуманизированное антитело, содержащее антигенсвязывающие остатки животного, отличного от человека.
Антитело с «созревшей аффинностью» представляет собой антитело с одним или несколькими изменениями в одной или нескольких его CDR, которые приводят к повышению аффинности антитела к антигену по сравнению с исходным антителом, которое не имеет такого изменения (изменений). Предпочтительные антитела с созревшей аффинностью будут иметь наномолярные или даже пикомолярные аффинности по отношению к антигену-мишени. Антитела с созревшей аффинностью получают способами, известными в данной области. Marks et al. Bio/Technology 10: 779-783 (1992) описывают созревание аффинности в результате перетасовки доменов VH и VL. Случайный мутагенез остатков CDR и/или каркаса описан в: Barbas et al., Proc Nat. Acad. Sci, USA 91: 3809-3813 (1994); Schier et al., Gene 169: 147-155 (1995); Yelton et al., J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7): 3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226: 889-896 (1992).
«Эффекторные функции» антител относятся к биологическим активностям, свойственным Fc-области (Fc-области с нативной последовательностью или Fc-области с вариантом аминокислотной последовательности) антитела, и варьируют в зависимости от изотипа антител. Примеры эффекторных функций антител включают: связывание C1q и комплемент-зависимую цитотоксичность (CDC); связывание рецептора Fc; зависимую от антител опосредованную клетками цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора) и активацию B-клеток.
Термины «зависимая от антител опосредованная клетками цитотоксичность» и «ADCC» относятся к форме цитотоксичности, при которой секретированный Ig, связанный рецепторами Fc (FcR), присутствует на некоторых цитотоксических клетках (например, природных клетках-киллерах (NK), нейтрофилах и макрофагах), обеспечивают возможность специфичного связывания таких цитотоксических эффекторных клеток с несущей антиген клеткой-мишенью и затем вызывают лизис клетки-мишени. Антитела «вооружают» цитотоксические клетки и абсолютно необходимы для такого лизиса. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках суммирована в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991). Чтобы оценить активность в ADCC представляющей интерес молекулы можно осуществить анализы ADCC in vitro, такие как анализы, описанные в патентах США №№ 5500362 или 5821337, или в Presta U.S. Pat. № 6737056. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценить in vivo, например в животной модели, такой как модель, описанная в Clynes et al. PNAS (USA) 95: 652-656 (1998).
«Эффекторными клетками человека» являются лейкоциты, которые экспрессируют один или несколько FcR и осуществляют эффекторные функции. Предпочтительно клетки экспрессируют, по меньшей мере, FcγRIII и осуществляют ADCC-эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы; при этом обычно предпочтительны PBMC и NK-клетки. Эффекторные клетки могут быть выделены из их природного источника, например из крови.
Термины «Fc-рецептор» и «FcR» используют для описания рецептора, который связывается с Fc-областью антитела. Предпочтительным FcR является FcR человека с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывает IgG-антитело (гамма-рецептор), и к предпочтительным рецепторам относятся рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсируемые формы указанных рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, которые отличаются главным образом своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене основанный на тирозине мотив активации иммунорецептора (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене основанный на тирозине мотив ингибирования иммунорецептора (ITIM) (обзор в Daëron, Annu. Rev. Immunol. 15: 203-234 (1997)). Обзор, посвященный FcR, представлен в Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126: 330-41 (1995). Другие FcR, включая FcR, идентифицируемые в природе, включены в данном описании в термин «FcR». Термин также охватывает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)) и регулирует гомеостаз иммуноглобулинов. В WO 00/42072 (Presta) описаны варианты антител с повышенным или уменьшенным связыванием с FcR. Содержание указанной патентной публикации специально включено в настоящее описание в виде ссылки. Смотри также Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001).
Способы измерения связывания с FcRn известны (смотри, например, Ghetie 1997, Hinton 2004). Связывание с FcRn человека in vivo и время полужизни в сыворотке полипептидов, с высокой аффинностью связывающих FcRn человека, можно анализировать, например, у трансгенных мышей или в трансфицированных линиях клеток человека, экспрессирующих FcRn человека, или у приматов, в которых вводят варианты полипептидов Fc.
«Комплемент-зависимая цитотоксичность» и «CDC» относятся к лизису мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны со своим антигеном. Чтобы оценить активацию комплемента можно осуществить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Варианты полипептидов с измененной аминокислотной последовательностью Fc-области и повышенной или пониженной способностью связывать C1q описаны в патенте США № 6194551B1 и в WO 99/51642. Содержание указанных патентных публикаций специально включено в настоящее описание в виде ссылки. Смотри также Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
Термин «полипептид, содержащий Fc-область» относится к полипептиду, такому как антитело или иммуноадгезин, который содержит Fc-область. C-концевой лизин (остаток 447 согласно системе нумерации EU) Fc-области может быть удален, например, во время очистки полипептида или в результате конструирования рекомбинантной нуклеиновой кислоты, кодирующей полипептид. Соответственно, композиция, содержащая полипептид, имеющий Fc-область, согласно настоящему изобретению может содержать полипептиды с K447, со всеми удаленными K447 или смесь полипептидов, имеющих и не имеющих остаток K447.
«Блокирующее» антитело или «антагонистическое» антитело представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, который оно связывает. Предпочтительные блокирующие антитела или антагонистические антитела в значительной степени или полностью ингибируют биологическую активность антигена. Желательно, чтобы биологическая активность была снижена на 10%, 20%, 30%, 50%, 70%, 80%, 90%, 95% или даже 100%.
«Агонистическое антитело» в используемом в настоящем описании смысле представляет собой антитело, которое имитирует, по меньшей мере, одну из функциональных активностей представляющего интерес полипептида.
«Акцепторный каркас человека» в целях настоящего описания означает каркас, содержащий аминокислотную последовательность каркаса VL или VH, полученную из каркаса иммуноглобулина человека или из консенсусного каркаса человека. Акцепторный каркас человека, «полученный из» каркаса иммуноглобулина человека или из консенсусного каркаса человека, может содержать ту же самую аминокислотную последовательность или может содержать предсуществующие изменения аминокислотной последовательности. В том случае, когда имеются предсуществующие изменения аминокислот, предпочтительно присутствуют не более 5 и предпочтительно 4 или меньше, или 3 или меньше предсуществующих изменений аминокислот. В том случае, когда предсуществующие изменения аминокислот присутствуют в VH, предпочтительно такие изменения имеют место только в трех, двух или одном положении 71H, 73H, и 78H; например, аминокислотными остатками в таких положениях могут быть 71A, 73T и/или 78A. В одном варианте акцепторный каркас VL человека идентичен по последовательности каркасной последовательности VL иммуноглобулина человека или консенсусной каркасной последовательности человека.
«Консенсусным каркасом человека» является каркас, который имеет наиболее широко встречающийся аминокислотный остаток при селекции каркасных последовательностей VL или VH иммуноглобулина человека. В основном селекция последовательностей VL или VH иммуноглобулина человека осуществляется из подгруппы последовательностей вариабельных доменов. Обычно подгруппа последовательностей представляет собой подгруппу согласно системе Kabat et al. В одном варианте для VL подгруппой является подгруппа каппа I согласно Kabat et al. В одном варианте для VH подгруппой является подгруппа III согласно Kabat et al.
«Консенсусный каркас подгруппы III VH» содержит консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе III вариабельных областей тяжелой цепи согласно Kabat et al. В одном варианте аминокислотная последовательность консенсусного каркаса подгруппы III VH содержит, по меньшей мере, часть или полностью каждую из следующих последовательностей:

«Консенсусный каркас подгруппы I VL» содержит консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе I вариабельной области легкой цепи каппа согласно Kabat et al. В одном варианте аминокислотная последовательность консенсусного каркаса подгруппы I VH содержит, по меньшей мере, часть или полностью каждую из следующих последовательностей:

«Нарушение» или «заболевание» означает любое состояние, при котором может быть полезно лечение веществом/молекулой или способом согласно изобретению. Такое состояние включает хронические и острые нарушения или заболевания, включая такие патологические состояния, которые обусловливают предрасположенность млекопитающего к рассматриваемому нарушению. Неограничивающими примерами нарушений, подвергаемых лечению согласно изобретению, являются злокачественные и доброкачественные опухоли; карцинома, бластома и саркома.
Термины «клеточное пролиферативное нарушение» и «пролиферативное нарушение» относятся к нарушениям, которые ассоциированы с определенной степенью аномальной пролиферации клеток. В одном варианте клеточным пролиферативным нарушением является злокачественная опухоль.
«Опухоль» в используемом в настоящем описании смысле относится к неопластическому росту и пролиферации клеток, либо злокачественному, либо доброкачественному, и ко всем предзлокачественным и злокачественным клеткам и тканям. Термины «злокачественная опухоль», «злокачественная», «клеточное пролиферативное нарушение», «пролиферативное нарушение» и «опухоль» не являются взаимоисключающими при упоминании в настоящем описании.
Термины «злокачественная опухоль» и «злокачественный» относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом/пролиферацией. Примеры злокачественной опухоли включают без ограничения карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких злокачественных опухолей включают рак сквамозных клеток, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, сквамозную карциному легкого, рак брюшины, гепатоклеточный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, рак прямой и ободочной кишки, карциному эндометрия или матки, карциному слюнных желез, рак почек, рак печени, рак простаты, рак вульвы, рак щитовидной железы, карциному печени, рак желудка, меланому и различные типы рака головы и шеи. Нарушение регуляции ангиогенеза может приводить ко многим нарушениям, которые можно лечить, применяя композиции и способы согласно изобретению. Такие нарушения включают как не неопластические, так и неопластические состояния. Неопластические нарушения включают без ограничения описанные выше нарушения. Не неопластические нарушения включают без ограничения нежелательную или отклоняющуюся от нормы гипертрофию, артрит, ревматоидный артрит (RA), псориаз, псориазные бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, диабетические и другие пролиферативные ретинопатии, включая ретинопатию недоношенных, ретролентальную фиброплазию, неоваскулярную глаукому, связанную с возрастом дегенерацию желтого пятна, диабетический макулярный отек, неоваскуляризацию роговицы, неоваскуляризацию трансплантата роговицы, отторжение трансплантата роговицы, неоваскуляризацию сетчатки/хориоида, неоваскуляризацию уголка глаза (покраснение радужки), неоваскулярное заболевание глаза, рестеноз сосудов, артериовенозные мальформации (AVM), менингиому, гемангиому, ангиофиброму, гиперплазии щитовидной железы (включая диффузный токсический зоб), трансплантацию роговицы и других тканей, хроническое воспаление, воспаление легких, острое легочное повреждение/ARDS, сепсис, первичную легочную гипертонию, злокачественные легочные выпоты, отек головного мозга (например, связанный с острым инсультом/закрытой травмой черепа/травмой), синовиальное воспаление, образование паннуса при RA, оссифицирующий миозит, гипертрофическое образование костей, остеоартрит (OA), рефрактерные асциты, поликистоз яичника, эндометриоз, заболевания, связанные с потерей жидкости в 3-е пространство (панкреатит, синдром межфасциального пространства, ожоги, заболевание кишечника), фиброиды матки, преждевременные роды, хроническое воспаление, такое как IBD (болезнь Крона и язвенный колит), отторжение аллотрансплантата почки, воспалительное заболевание кишечника, нефротический синдром, нежелательный или отклоняющийся от нормы рост массы ткани (не злокачественный), гемофилические гемартрозы, гипертрофические рубцы, ингибирование роста волос, синдром Ослера-Вебера, пиогенную гранулему, ретролентальные фиброплазии, склеродермию, трахому, спайки сосудов, синовит, дерматит, предэклампсию, асциты, перикардиальный выпот (такой как перикардиальный выпот, связанный с перикардитом) и плевральный выпот.
Термины «нейродегенеративное заболевание» и «нейродегенеративное нарушение» используют в наиболее широком смысле, и термины включают все нарушения, патология при которых заключается в дегенерации и/или нарушении функции нейронов, включая без ограничения периферические невропатии; нарушения двигательных нейронов, такие как боковой амиотрофический склероз (ALS, болезнь Лу Герига), периферический паралич лицевого нерва и различные состояния, в которые вовлечена мышечная атрофия спинного мозга или паралич; и другие нейродегенеративные заболевания человека, такие как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, рассеянный склероз, хорея Хантингтона, синдром Дауна, нервная глухота и болезнь Меньера.
«Периферическая невропатия» является нейродегенеративным нарушением, которое поражает периферические нервы, наиболее часто проявляемым в виде одного нарушения моторной, сенсорной, сенсомоторной или аутоиммунной функции или в виде сочетания нарушений указанных функций. Периферические невропатии, например, могут быть наследственными, могут быть результатом системного заболевания или могут быть индуцированы токсическим агентом, таким как нейротоксическое лекарственное средство, например, антинеопластическое средство или промышленное загрязняющее вещество или загрязняющее вещество окружающей среды.
«Периферическая сенсорная невропатия» характеризуется дегенерацией периферических сенсорных нейронов, которая может быть идиопатической, может возникать, например, как следствие диабета (диабетическая невропатия), лечения цитостатическими лекарственными средствами при злокачественной опухоли (например, лечения такими химиотерапевтическими средствами, как винкристин, цисплатин, метотрексат, 3'-азидо-3'-дезокситимидин или таксаны, например, паклитаксел [TAXOL®, Bristol-Myers Squibb Oncology, Princeton, N.J.] и доксетаксел [TAXOTERE®, Rhône-Poulenc Rorer, Antony, France]), алкоголизма, синдрома приобретенного иммунодефицита (AIDS) или генетической предрасположенности. Генетически обусловленные периферические невропатии включают, например, синдром Рефсума, болезнь Краббе, метахроматическую лейкодистрофию, болезнь Фабри, синдром Дежерина-Сотта, абеталипопротеинемию и болезнь Шарко-Мари-Тута (CMT) (также называемую мышечной атрофией перонеального типа или наследственной сенсомоторной невропатией (HMSN)). Большинство типов периферической невропатии развиваются медленно, в течение нескольких месяцев или лет. В клинической практике такие невропатии называют хроническими. Иногда периферическая невропатия развивается быстро, в течение нескольких дней, и тогда ее называют острой. Периферическая невропатия обычно поражает сенсорные и моторные нейроны вместе, так что возникает смешанная сенсомоторная нефропатия, но также известны несмешанные сенсорная и моторная невропатии.
«Аутоиммунное заболевание» в используемом в настоящем описании смысле относится к любому нарушению, в патологию которого вовлечен иммунный ответ против собственной ткани индивидуума. Аутоиммунные заболевания включают без ограничения ревматоидный артрит (RA), астму, хроническое обструктивное легочное заболевание (COPD), воспалительное заболевание кишечника, целиакию, аллергический ринит, аллергическую крапивницу, болезнь Крона, болезнь Гиршспрунга, диффузный токсический зоб, Аддисонову болезнь, синдром Гийена-Барре, болезнь Хашимото, аллергические внутриглазные воспалительные заболевания, анкилозирующий спондилит, атопический дерматит, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, болезнь Бехчета, синдром Когана, контактный дерматит, синдром Кушинга, дерматомиозит, сахарный диабет, дискоидную красную волчанку, волчаночный нефрит, эозинофильный фасциит, узловатую эритему, эксфолиативный дерматит, очаговый или сегментарный гломерулосклероз, гигантоклеточный артериит, подагру, подагрический артрит, экзему рук, пурпуру Геноха-Шенлейна, герпес беременных, гирсутизм, идиопатический кератосклероз, идиопатическую тромбоцитопеническую пурпуру, воспалительные дерматозы, рассеянный склероз, бульбоспинальный паралич, миозит, остеоартрит, панкреатит, пемфигоид беременных, вульгарный пемфигус, периодонтит; нодозный полиартериит, ревматическую полимиалгию, мошоночный зуд, прурит/воспаление, псориаз, псориатический артрит, легочный гистоплазмоз, рецидивирующий полихондрит, розовые угри, саркоидоз, склеродермию, синдром септического шока, тендинит или бурсит плеча, синдром Шегрена, синдром Стилла, болезнь Свита, системную красную волчанку, системный склероз, артериит Такаясу, темпоральный артериит, токсический эпидермальный некролиз, отторжение трансплантата, туберкулез, диабет типа 1, язвенный колит, увеит, васкулит и гранулематоз Вегенера.
«Иммунологическое нарушение» в используемом в настоящем описании смысле относится к любому нарушению, в патологию которого вовлечено аномальное развитие или аномальная регуляция иммунной системы у индивидуума. Предпочтительно в иммунологическое нарушение вовлечено аномальное развитие или аномальная регуляция T-клеток.
«Лекарственным средством» является активное средство для лечения рассматриваемого нарушения или его синдромов, или побочных эффектов.
В используемом в настоящем описании смысле «лечение» относится к клиническому вмешательству с целью попытаться изменить естественное протекание процесса в организме индивидуума или в клетке, подвергаемой лечению, и лечение можно осуществлять либо для профилактики, либо во время протекания клинической патологии. Требуемые эффекты лечения включают профилактику возникновения или рецидивов заболевания, ослабление симптомов, снижения каких-либо прямых или опосредованных патологических последствий заболевания, предотвращение метастазов, снижение скорости прогрессирования заболевания, ослабление или облегчение патологического состояния и ремиссию или улучшенный прогноз. В некоторых вариантах антитела согласно изобретению используют для замедления развития заболевания или нарушения.
«Индивидуумом» является позвоночное, предпочтительно млекопитающее, более предпочтительно человек. Млекопитающие включают без ограничения сельскохозяйственных животных (таких как коровы), спортивных животных, домашних животных (таких как кошки, собаки, лошади), приматов, мышей и крыс.
«Млекопитающее» в целях лечения относится к любому животному, классифицируемому как млекопитающее, включая человека, домашних и сельскохозяйственных животных и животных в зоопарках, спортивных животных или комнатных животных, таких как собаки, лошади, кошки, коровы и т.д. Предпочтительно млекопитающим является человек.
Термин «эффективное количество» относится к количеству, эффективному в дозах и в течение необходимых периодов времени в отношении достижения требуемого терапевтического или профилактического результата.
«Терапевтическое эффективное количество» вещества/молекулы согласно изобретению, агониста или антагониста может варьировать в зависимости от таких факторов, как тип патологического состояния, возраст, пол и масса пациента и способность вещества/молекулы, агониста или антагониста вызывать требуемый ответ у индивидуума. Терапевтически эффективное количество также представляет собой такое количество, при использовании которого любые токсические или вредные эффекты вещества/молекулы, агониста или антагониста перевешиваются терапевтически полезными эффектами. «Профилактически эффективное количество» относится к количеству, эффективному в дозах и в течение необходимого периода времени в отношении достижения требуемого профилактического результата. Обычно, но не обязательно, в связи с тем, что профилактическую дозу используют для индивидуума до возникновения или на ранней стадии заболевания, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
Термин «цитотоксическое средство» в используемом в данном описании смысле относится к веществу, которое ингибирует или предотвращает функцию клеток и/или вызывает разрушение клеток. Подразумевается, что термин включает радиоактивные изотопы (например 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P и радиоактивные изотопы Lu), химиотерапевтические средства, например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркалирующие агенты, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или происхождения, включая их фрагменты и/или варианты, и различные противоопухолевые или противораковые средства, описанные ниже. Другие цитотоксические средства описаны ниже. Тумороцидное средство вызывает разрушение опухолевых клеток.
«Химиотерапевтическим средством» является химическое соединение, применимое для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилмеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности калихеамицин гамма II и калихеамицин омега II (смотри, например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеинов - энедииновые антибиотики), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMICIN® (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; средства, подавляющие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; ацеглатон; гликозид альдофосфамид; аминолевулиновую кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; мейтанзиноиды, такие как мейтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности, токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («ara-C»); тиотепа; таксоиды, например паклитаксел (TAXOL®) (Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANETM, не содержащий кремофора препарат паклитаксела на основе сконструированных связанных с альбумином наночастиц (American Pharmaceutical Partners, Schaumberg, Ill.), и доксетаксел TAXOTERE® (Rhône-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейковорин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (XELODA®); фармацевтически приемлемые соли, кислоты и производные любого средства, указанного выше; а также сочетания двух или более указанных выше средств, такие как CHOP, сокращенное название комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращенное название схемы лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейковорином.
Также в указанное определение включены противогормональные средства, которые действуют, регулируя, уменьшая, блокируя или ингибируя эффекты гормонов, которые могут стимулировать рост злокачественной опухоли, и часто их используют в форме системного лечения или лечения на уровне целого организма. Они сами могут являться гормонами. Примеры включают антиэстрогены и избирательные модуляторы рецепторов эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен EVISTA®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; антипрогестероны; понижающие регуляторы рецептора эстрогена (ERD); средства, которые функционируют, подавляя или прекращая работу яичников, например, агонисты рилизинг-гормона лютеинизирующего гормона (LHRH), такие как ацетат лейпролида (LUPRON® и ELIGARD®), ацетат гозерелина, ацетат бузерелина и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола (MEGASE®), эксеместан (AROMASIN®), форместан, фадрозол, ворозол (RIVISOR®), летрозол (FEMARA®) и анастрозол (ARIMIDEX®). Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновую кислоту/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризедронат (ACTONEL®); а также троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигналов, вовлеченных в аномальную пролиферацию клеток, таких как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 LURTOTECAN®; rmRH ABARELIX®; дитозилат лапатиниба (низкомолекулярный двойной ингибитор тирозинкиназ ErbB-2 и EGFR, также известный как GW572016); и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств.
«Ингибирующее рост средство» при использовании в настоящем описании относится к соединению или композиции, которая ингибирует рост клетки (такой как клетка, экспрессирующая Notch1) in vitro и/или in vivo. Таким образом, ингибирующим рост средством может быть средство, которое в значительной степени уменьшает процентное содержание клеток (таких как клетка, экспрессирующая Notch1) в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют прохождение клеточного цикла (в другом месте, отличном от S-фазы), такие как средства, которые индуцируют задержку в G1-фазе и задержку в M-фазе. Классические блокаторы M-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средства, которые задерживают в G1, также распространяют свое действие на задержку в S-фазе, например ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., в главе 1, озаглавленной «Cell cycle regulation, oncogenes, and antineoplastic drugs» by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно на стр. 13. Таксаны (паклитаксел и доцетаксел) являются противоопухолевыми лекарственными средствами, полученными из тиса. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из Европейского тиса, является полусинтетическим аналогом паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки, предотвращая деполимеризацию, что приводит к ингибированию митоза в клетках.
«Доксорубицин» является антрациклиновым антибиотиком. Полное химическое название доксорубицина (8S-цис)-10-[(3-амино-2,3,6-тридезокси-α-L-ликсогексапиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтацендион.
Термин «антинеопластическая композиция» относится к композиции, применимой для лечения злокачественной опухоли, содержащей, по меньшей мере, одно активное терапевтическое средство, например, «противоопухолевое средство». Примеры терапевтических средств (противоопухолевых средств, также называемых в настоящем описании «антинеопластическими средствами») включают без ограничения, например, химиотерапевтические средства, ингибирующие рост средства, цитотоксические средства, средства, используемые в лучевой терапии, средства против ангиогенеза, вызывающие апоптоз средства, средства против тубулина, токсины и другие средства для лечения злокачественной опухоли, например, нейтрализующего антитело против VEGF, антагонист VEGF, анти-HER-2, анти-CD20, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR, эрлотиниб, ингибитор COX-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одним или несколькими рецепторами ErbB2, ErbB3, ErbB4, или VEGF, ингибиторы рецепторных тирозинкиназ, полученного из тромбоцитов фактора роста (PDGF) и/или фактора стволовых клеток (SCF) (например, мезилат иматиниба (Gleevec® Novartis)), TRAIL/Apo2, и другие биологически активные и органические химические агенты, и т.д.
Термин «пролекарство», используемый в настоящей заявке, относится к форме предшественника или производного фармацевтически активного вещества, которая является менее цитотоксичной по отношению к опухолевым клеткам по сравнению с исходным лекарственным средством и способна подвергаться ферментативной активации или превращению в более активную исходную форму. Смотри, например, Wilman, «Prodrugs in Cancer Chemotherapy» Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., «Prodrugs: A Chemical Approach to Targeted Drug Delivery», Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства согласно изобретению включают без ограничения содержащие фосфат пролекарства, содержащие тиофосфат пролекарства, содержащие сульфат пролекарства, содержащие пептид пролекарства, модифицированные D-аминокислотами пролекарства, гликозилированные пролекарства, содержащие бета-лактам пролекарства, содержащие необязательно замещенный феноксиацетамид пролекарства или содержащие необязательно замещенный фенилацетамид пролекарства, 5-фторцитозин-содержащие и другие 5-фторуридинсодержащие пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примеры цитотоксических лекарственных средств, которые могут быть дериватизованы в пролекарственную форму для применения в настоящем изобретении, включают без ограничения химиотерапевтические средства, описанные выше.
Термин «средство против ангиогенеза» или «ингибитор ангиогенеза» относится к низкомолекулярному веществу, полинуклеотиду, полипептиду, изолированному белку, рекомбинантному белку, антителу или их конъюгатам или слитым белкам, которые ингибируют ангиогенез, васкулогенез или нежелательную проницаемость сосудов либо прямо, либо опосредованно. Например, средством против ангиогенеза является антитело или другой антагонист ангиогенного средства, которое описано выше, например, антитела к VEGF, антитела к рецепторам VEGF, малые молекулы, которые блокируют передачу сигнала рецептора VEGF (например, PTK787/ZK2284, SU6668, SUTENT/SU11248 (малат сунитиниба), AMG706). Средства против ангиогенеза также включают нативные ингибиторы ангиогенеза, например, ангиостатин, эндостатин и т.д. Смотри например Klagsbrun and D'Amore, Annu. Rev. Physiol., 53: 217-39 (1991); Streit and Detmar, Oncogene, 22: 3172-3179 (2003) (например, таблицу 3, в которой перечислены антиангиогенные терапевтические средства в случае злокачественной меланомы); Ferrara and Alitalo, Nature Medicine 5(12): 1359-1364 (1999); Tonini et al., Oncogene, 22: 6549-6556 (2003) (например, таблица 2, в которой перечислены антиангиогенные факторы); и Sato Int. J. Clin. Oncol., 8: 200-206 (2003) (например, таблица 1, в которой перечислены антиангиогенные средства, используемые в клинических испытаниях).
Термин «биологический образец» (взаимозаменяемо называемый «образцом» или «образцом ткани или клеток») охватывает множество типов образцов, которые получены от индивидуума и которые могут быть использованы в диагностическом или мониторинговом анализе. Определение охватывает образец крови и другие жидкие образцы биологического происхождения, образцы солидных тканей, такие как образцы биопсии, или полученные из них культуры ткани и клетки и их потомство. Определение также включает образцы, которые были обработаны каким-либо образом после их получения, например, обработаны реагентами, подвергнуты солюбилизации или обогащены некоторыми компонентами, такими как белки или полинуклеотиды, или залиты в полутвердый или твердый матрикс с целью получения срезов. Термин «биологический образец» охватывает клинический образец, а также включает клетки в культуре, надосадки клеток, лизаты клеток, сыворотку, плазму, биологическую жидкость и образцы тканей. Источником биологического образца может быть солидная ткань из свежего, замороженного и/или законсервированного органа или образец ткани или биопсия, или аспират; кровь или любые компоненты крови; жидкости организма, такие как спинномозговая жидкость, амниотическая жидкость, жидкость брюшной полости или жидкость кишечника; клетки в любом периоде беременности или развития индивидуума. В некоторых вариантах биологический образец получают из первичной или метастатической опухоли. Биологический образец может содержать соединения, которые не встречаются в тканях в природе, такие как консерванты, антикоагулянты, буферы, фиксаторы, питательные вещества, антибиотики или тому подобное.
В целях настоящего описания «срез» образца ткани означает одну часть или кусочек образца ткани, например, тонкий срез ткани или клетки из образца ткани. Подразумевается, что может быть получено несколько срезов образцов тканей, и срезы могут быть подвергнуты анализу согласно настоящему изобретению. В некоторых вариантах анализируют один и тот же срез образца ткани на морфологическом и молекулярном уровнях и анализируют в отношении и белка и нуклеиновой кислоты.
Слово «метка» при использовании в данном описании относится к соединению или композиции, которые конъюгированы или слиты прямо или опосредованно с реагентом, таким как зонд нуклеиновой кислоты или антитело, и облегчает регистрацию реагента, с которым они конъюгированы или слиты. Метку можно регистрировать как таковую (например, радиоизотопные метки или флуоресцирующие метки) или, как в случае ферментной метки, она может катализировать химическое изменение субстратного соединения или композиции, которое регистрируется.
Рецептор Notch1 и активирующие мутации
Рецепторы Notch протеолитически процессируются во время транспорта к клеточной поверхности фурин-подобной протеазой в сайте S1 примерно на 70 аминокислот с внешней стороны по отношению к трансмембранному домену с получением внеклеточной субъединицы Notch (ECN) и трансмембранной субъединицы Notch (NTM). Две указанных субъединицы остаются нековалентно связанными и составляют зрелый гетеродимерный рецептор клеточной поверхности. Субъединицы ECN Notch1 содержат 36 N-концевых EGF-подобных повторов, за которыми следуют три тандемно повторяющихся модуля LNR (LNR_A, LNR_B и LNR_C). Каждый модуль LNR содержит три дисульфидные связи и группу консервативных кислых и полярных остатков, которые, как полагают, координируют ион кальция. В области повторов EGF лежат сайты связывания для активирующих лигандов. Модули LNR принимают участие в поддержании Notch в конформации покоя до индуцируемой лигандом активации. NTM Notch1 содержит внеклеточную область, трансмембранный участок и большую внутриклеточную часть, которая включает в себя домен RAM (молекула, ассоциированная с RBP Jκ), повторы анкирина, домен трансактивации и PEST-последовательность на карбоксильном конце. Стабильная ассоциация субъединиц ECN и NTM зависит от домена гетеродимеризации (HD), включающего в себя карбоксильный конец ECN (называемый HD-C) и внеклеточный амино-конец NTM (называемый HD-N). Связывание лиганда Notch с субъединицей ECN инициирует два последовательных протеолитических расщепления, которые происходят в результате регулируемого внутримембранного протеолиза. Первое расщепление металлопротеазой в сайте расщепления S2 (локализованном в NTM) делает трансмембранную субъединицу Notch чувствительной ко второму расщеплению в сайте расщепления S3 вблизи внутреннего слоя плазматической мембраны. Расщепление в сайте S3, которое катализируется мультибелковым комплексом, содержащим пресенилин и никастрин, высвобождает внутриклеточную часть трансмембранной субъединицы Notch (также называемой внутриклеточной Notch; «ICN»), обеспечивая возможность ее транслокации в ядро и активации транскрипции генов-мишеней.
На фигурах с 11-1 по 11-4 показано выравнивание между аминокислотными последовательностями Notch1 человека (SEQ ID NO: 56) и мыши (SEQ ID NO: 57). Сигнальный пептид примерно охватывает аминокислоты 1-18 последовательности SEQ ID NO: 56 или 57, повторы EGF (EGF1-EGF36) примерно охватывают аминокислоты 20-1426 последовательности SEQ ID NO: 56 или 57, LNR_A примерно охватывает аминокислоты 1446-1489 последовательности SEQ ID NO: 56 или 57, LNR_B примерно охватывает аминокислоты 1490-1527 последовательности SEQ ID NO: 56 или 57, LNR_C примерно охватывает аминокислоты 1528-1562 последовательности SEQ ID NO: 56 или 57, HD-N примерно охватывает аминокислоты 1563-1664 последовательности SEQ ID NO: 56 или аминокислоты 1563-1654 последовательности SEQ ID NO: 57, HD-C примерно охватывает аминокислоты 1665-1733 последовательности SEQ ID NO: 56 или аминокислоты 1655-1723 последовательности SEQ ID NO: 57, и домен PEST примерно охватывает аминокислоты 2484-2555 последовательности SEQ ID NO: 56 или примерно аминокислоты 2459-2530 последовательности SEQ ID NO: 57. Домен HD, который включает в себя HD-N и HD-C, примерно охватывает аминокислоты 1563-1733 последовательности SEQ ID NO:56 или аминокислоты 1563-1723 последовательности SEQ ID NO: 57. Сайт расщепления S1 находится между аминокислотами 1664 и 1665 последовательности SEQ ID NO: 56 и между аминокислотами 1654 и 1655 последовательности SEQ ID NO: 57. Сайт расщепления S2 находится между аминокислотами 1720 и 1721 последовательности SEQ ID NO: 56 и аминокислотами 1710 и 1711 последовательности SEQ ID NO: 57. Трансмембранная часть примерно охватывает аминокислоты 1736-1747 последовательности SEQ ID NO: 56 и примерно аминокислоты 1726-1737 последовательности SEQ ID NO: 57.
Идентифицировано и охарактеризовано несколько типов мутаций Notch1, которые влияют на передачу сигналов Notch1. Мутации Notch1, которые активируют передачу сигналов Notch1, делятся на два общих класса, а именно - независимые от лиганда и зависимые от лиганда активирующие мутации. Кроме того, некоторые независимые от лиганда активирующие мутации, тем не менее, являются чувствительными к лигандам. Мутации, которые активируют передачу сигналов Notch1, были ассоциированы с T-ALL (Weng et al., Science 306: 269-271, 2004; Malecki et al., Mol. Cell. Biol. 26: 4642-4651, 2006). В частности, активирующие мутации Notch1, ассоциированные с T-ALL, были идентифицированы в области HD и в домене PEST. Кроме того, транслокации могут приводить к аномальной передаче сигналов Notch1. Например, было обнаружено, что Notch1 является геном-партнером в хромосомной транслокации (7;9)(q34;q34.3). Такая транслокация обнаружена в редкой подгруппе T-ALL и сливает 3'-конец гена Notch1 с промотором/энхансером T-клеточного рецептора β (Weng et al., Science 306: 269-271, 2004).
Примерами независимых от лиганда мутаций, которые передают сигнал в отсутствие связывания лиганда, но сохраняют способность отвечать на связывание лиганда, являются мутации в области HD Notch1. Активирующими мутациями в области HD-N Notch1 человека являются, например, L1575P, V1577E, F1593S, L1594P, L1597H, R1599P, L1601P и I1617T/N. Примерами активирующих мутаций в области HD-C Notch1 человека являются V1677D, L1679P, I1681N, A1702P, I1719T и инсерция (ARLGSLNIPYKIEA; SEQ ID NO: 52) в сайте расщепления S2 (инсерция P12). Мутации L1575P, V1577E, F1593S, L1594P, L1597H, R1599P, L1601P, 11617T/N, V1677D, L1679P, I1681N, A1702P и I1719T и инсерция P12 вызывают повышенное расщепление в S2 и S3, и передача сигналов Notch1 при этом выше, чем передача сигналов в случае рецептора Notch1 дикого типа.
Подгруппа активирующих мутаций Notch1 снижает стабильность гетеродимера - они ослабляют взаимодействие ECN-области и NTM. Примерами мутаций, которые снижают стабильность гетеродимера в случае Notch1 человека, являются L1575P, V1577E, F1593S, L1594P, L1597H, R1599P, I1617T, I1617N, I1681N, A1702P и I1719T. Инсерция P12 возникает в результате прямой дупликации, которая, как предполагают, приводит к перестановке эндогенного домена HD-C из сайта расщепления S2 и может повышать доступность сайта S2 для металлопротеаз (Malecki et al., Mol. Cell. Biol. 26: 4642-4651, 2006).
Примеры активирующих мутаций Notch1, которые являются зависимыми от лиганда, включают мутации в домене PEST, такие как инсерции или делеции, которые индуцируют сдвиг рамки считывания или точечные мутации, которые создают преждевременные стоп-кодоны. Считают, что удаление ингибирующего домена PEST увеличивает время полужизни ICN. Примером мутации в домене PEST является DelPEST, которая представляет собой делецию на карбоксильном конце, начиная с аминокислоты 2473 аминокислотной последовательности Notch1 человека (SEQ ID NO: 57). Другие мутации в домене PEST известны в данной области и описаны, например, в Weng et al. (Science 306: 269-271, 2004).
Композиции согласно изобретению и способы их получения
Настоящее изобретение охватывает композиции, включая фармацевтические композиции, содержащие анти-NRR Notch1-антитело; и полинуклеотиды, содержащие последовательности, кодирующие анти-NRR Notch1-антитело. В используемом в настоящем описании смысле композиции содержат одно или несколько антител, которые связываются с NRR Notch1, и/или один или несколько полинуклеотидов, содержащих последовательности, кодирующие одно или несколько антител, которые связываются с NRR Notch1. Такие композиции могут дополнительно содержать подходящие носители, такие как фармацевтически приемлемые эксципиенты, включая буферы, которые хорошо известны в данной области.
Изобретение также охватывает варианты изолированных антител и полинуклеотидов. Изобретение также охватывает по существу чистые варианты антител и полинуклеотидов.
Анти-NRR Notch1-антитела согласно изобретению предпочтительно являются моноклональными. Также в объем изобретения включены Fab-, Fab'-, Fab'-SH- и F(ab')2-фрагменты анти-NRR Notch1-антител, описанных в настоящем документе. Такие фрагменты антител могут быть созданы традиционными способами, такими как ферментативное расщепление, или могут быть созданы с использованием методики рекомбинации. Такие фрагменты антител могут быть химерными или гуманизированными. Такие фрагменты применимы для диагностических и терапевтических целей, указанных ниже.
Моноклональные антитела получают из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые присутствуют в минорных количествах. Таким образом, определение «моноклональное» указывает на характер антител, как не являющихся смесью отличающихся друг от друга антител.
Моноклональные анти-NRR Notch1-антитела согласно изобретению могут быть получены с использованием способа на основе гибридом, впервые описанного в Kohler et al., Nature, 256: 495 (1975), или могут быть получены способами на основе рекомбинации ДНК (патент США № 4816567).
В способе на основе гибридом мышь или другого подходящего животного-хозяина, такого как хомячок, иммунизируют, чтобы вызвать появление лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфично связываться с белком, используемым для иммунизации. Антитела к NRR Notch1 обычно образуются у животных при многократных подкожных (п/к) или внутрибрюшинных (в/б) инъекциях NRR Notch1 и адъюванта. NRR Notch1 может быть получен способами, хорошо известными в данной области, некоторые из которых описаны в настоящем документе. Например, ниже описано рекомбинантное получение NRR Notch1 человека и мыши. В одном варианте животных иммунизируют NRR Notch1, слитым с Fc-частью тяжелой цепи иммуноглобулина. В предпочтительном варианте животных иммунизируют слитым белком NRR Notch1-IgG1. Животных обычно иммунизируют иммуногенными конъюгатами или производными NRR Notch1 с монофосфориллипидом A (MPL)/дикриномиколатом трегалозы (TDM) (Ribi Immunochem. Research, Inc., Hamilton, Mont.), и раствор инъецируют интрадермально в несколько участков. Спустя две недели животным проводят бустер-иммунизацию. Через 7-14 дней у животных берут кровь и анализируют сыворотку в отношении титра анти-NRR Notch1-антител. Животным проводят бустер-иммунизации вплоть до выхода титра на плато.
Альтернативно лимфоциты можно иммунизировать in vitro. Затем лимфоциты сливают с клетками миеломы, используя подходящий агент для слияния, такой как полиэтиленгликоль, чтобы образовать гибридомную клетку (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или жизнеспособность неслитых исходных клеток миеломы. Например, если в исходных клетках миеломы отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), то в культуральную среду для гибридом обычно будут включать гипоксантин, аминоптерин и тимидин (среда HAT), и такие вещества предотвращают рост HGPRT-дефицитных клеток.
Предпочтительные клетки миеломы представляют собой клетки, которые эффективно сливаются, поддерживают на стабильно высоком уровне продукцию антител отобранными продуцирующими антитела клетками и чувствительны к такой среде, как среда HAT. Среди них предпочтительными линиями клеток миеломы являются линии клеток миеломы мышей, такие как линии, полученные из опухолей мышей MOPC-21 и MPC-11, доступные из Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или X63-Ag8-653, доступные из Американской коллекции типов культур, Rockville, Maryland USA. Линии клеток миеломы человека и гетеромиеломы мыши-человека также были описаны для получения моноклональных антител человека (Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают клетки гибридомы, анализируют в отношении продукции моноклональных антител, направленных, например, против NRR Notch1. Предпочтительно специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют с помощью иммунопреципитации или анализом связывания in vitro, таким как радиоиммуноанализ (РИА) или твердофазный иммуноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела можно, например, определить анализом по Скэтчарду, как описано в Munson et al., Anal. Biochem., 107: 220 (1980).
После того, как идентифицированы клетки гибридомы, которые продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны могут быть субклонированы способами лимитирующего разведения и выращены стандартными способами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящие культуральные среды для указанной цели включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы могут быть выращены in vivo в виде асцитных опухолей у животного.
Моноклональное антитела, секретируемые подклонами, соответствующим образом отделяют от культуральной среды, асцитной жидкости или сыворотки обычными способами очистки иммуноглобулинов, такими как, например, хроматография с использованием белок A-сефарозы, гидроксилапатита, гель-электрофорез, диализ или аффинная хроматография.
Анти-NRR Notch1-антитела согласно изобретению могут быть получены с использованием комбинаторных библиотек для скрининга синтетических клонов антител с требуемой активностью или активностями. В принципе, синтетические клоны антител отбирают в результате скрининга фаговых библиотек, содержащих фаг, который презентирует на своей поверхности различные фрагменты вариабельной области антитела (Fv), слитой с белком оболочки фага. Такие фаговые библиотеки сортируют способом пэннинга, используя аффинную хроматографию против требуемого антигена. Клоны, экспрессирующие Fv-фрагменты, способные связываться с требуемым антигеном, адсорбируют на антигене и таким образом отделяют от не связывающих клонов в библиотеке. Затем связывающие клоны элюируют с антигена, и их можно затем обогатить в дополнительных циклах адсорбции/элюирования антигена. Любое из анти-NRR Notch1-антител согласно изобретению может быть получено в результате разработки способа скрининга подходящего антигена, чтобы отобрать представляющий фаговый клон, с последующим конструированием клона полноразмерного анти-NRR Notch1-антитела с использованием Fv-последовательностей из представляющего интерес фагового клона и подходящих последовательностей константной области (Fc), описанных в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda Md. (1991), vols. 1-3.
Антигенсвязывающий домен антитела образован двумя вариабельными (V) областями длиной примерно 110 аминокислот, по одной из легкой (VL) и тяжелой (VH) цепей, каждая из которых имеет три гипервариабельные петли или определяющие комплементарность области (CDR). Вариабельные домены могут быть представлены функционально на фаге, либо в виде одноцепочечных фрагментов Fv (scFv), в которых VH и VL ковалентно связаны посредством короткого гибкого пептида, либо в виде Fab-фрагментов, в которых они слиты с константным доменом и взаимодействуют нековалентно, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). В используемом в настоящем описании смысле фаговые клоны, кодирующие scFv, и фаговые клоны, кодирующие Fab, вместе называют «фаговыми клонами Fv» или «Fv-клонами».
Репертуары генов VH и VL могут быть клонированы отдельно в полимеразной цепной реакции (ПЦР) и рекомбинированы случайным образом в фаговых библиотеках, в которых затем можно провести поиск антигенсвязывающих клонов, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Библиотеки из иммунизированных источников позволяют получать высокоаффинные антитела к иммуногену без необходимости в конструировании гибридом. Альтернативно может быть клонирован нативный репертуар, чтобы получить один источник антител человека к широкому кругу не собственных, а также собственных антигенов без какой-либо иммунизации, как описано в Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, нативные библиотеки также могут быть получены синтетически в результате клонирования не подвергнутых реаранжировке фрагментов V-генов из стволовых клеток и с использованием ПЦР-праймеров, содержащих случайную последовательность, чтобы получить кодирование высоковариабельных областей CDR3 и осуществить реаранжировку in vitro, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
Нитчатый фаг используют для получения дисплея фрагментов антител в результате слияния минорного белка оболочки pIII. Фрагменты антител могут быть представлены на дисплее в виде одноцепочечных Fv-фрагментов, в которых домены VH и VL связаны в одной и той же полипептидной цепи гибким полипептидным спейсером, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или в виде Fab-фрагментов, в которых одна цепь слита с pIII, а другая секретируется в периплазму бактериальной клетки-хозяина, где собирается структура Fab-белок оболочки, которая презентируется в виде дисплея на фаговой поверхности в результате вытеснения некоторых белков оболочки дикого типа, например, как описано в Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991).
В общем, нуклеиновые кислоты, кодирующие фрагменты гена антитела, получают из иммунных клеток, собранных из организма человека или животных. Если требуется библиотека, смещенная преимущественно в сторону анти-NRR Notch1-клонов, то индивидуум иммунизируют NRR Notch1, чтобы вызвать гуморальный ответ, и извлекают клетки селезенки и/или циркулирующие B-клетки, отличные от периферических лимфоцитов крови (PBL), для конструирования библиотеки. В предпочтительном варианте библиотеку фрагментов генов антител человека, смещенную преимущественно в сторону анти-NRR Notch1-клонов, получают, вызывая гуморальный ответ в виде образования анти-NRR Notch1-антител у трансгенных мышей, несущих ряд функциональных генов иммуноглобулина человека (у которых отсутствует система продуцирования функциональных эндогенных антител), так что иммунизация NRR Notch1 вызывает продуцирование B-клетками антител человека против NRR Notch1. Создание трансгенных мышей, продуцирующих антитела человека, описано ниже.
Дополнительное обогащение популяций анти-NRR Notch1-реактивных клеток можно осуществить, используя подходящий способ скрининга, чтобы выделить B-клетки, экспрессирующие NRR Notch1-специфичное связанное с мембраной антитело, например, с помощью разделения клеток NRR Notch1-аффинной хроматографией или с помощью адсорбции клеток на меченном флуорохромом NRR Notch1 с последующей флуоресцентно активируемой сортировки клеток в потоке (FACS).
Альтернативно использование клеток селезенки и/или B-клеток или других PBL от иммунизированного донора дает лучшее представление возможного репертуара антител, а также позволяет сконструировать библиотеку антител для любого вида животного (человека или животного, отличного от человека), у которого NRR Notch1 не является антигенным. В случае создания библиотек с привлечением конструирования генов антител in vitro из организма индивидуума извлекают стволовые клетки, чтобы получить нуклеиновые кислоты, кодирующие не подвергнутые аранжировке участки генов антител. Представляющие интерес иммунные клетки могут быть получены из разных видов животных, таких как человек, мышь, крыса, зайцеобразные, волчьи, псовые, кошачьи, свиньи, коровы, лошади и птицы и т.д.
Нуклеиновую кислоту, кодирующую гены вариабельных областей антитела (включая участки VH и VL), извлекают из представляющих интерес клеток и амплифицируют. В случае библиотек реаранжированных генов VH и VL требуемая ДНК может быть получена в результате выделения геномной ДНК или мРНК из лимфоцитов с последующим проведением полимеразной цепной реакции (ПЦР) с использованием праймеров, совпадающих с 5'- и 3'-концами реаранжированных генов VH и VL, как описано в Orlandi et al., Proc. Natl. Acad. Sci. (USA), 86: 3833-3837 (1989), с получением таким образом разнообразных репертуаров V-генов для экспрессии. V-гены могут быть амплифицированы с кДНК и геномной ДНК с использованием обратных праймеров на 5'-конце экзона, кодирующего зрелый V-домен, и прямых праймеров, размещенных в J-участке, как описано в Orlandi et al. (1989) и в Ward et al., Nature, 341: 544-546 (1989). Однако для амплификации с кДНК также могут размещаться в лидерном экзоне, как описано в Jones et al., Biotechnol., 9: 88-89 (1991), а прямые праймеры - в константной области, как описано в Sastry et al., Proc. Natl. Acad. Sci. (USA), 86: 5728-5732 (1989). Чтобы максимизировать комплементарность, в праймеры можно ввести вырожденность, как описано в Orlandi et al. (1989) или Sastry et al. (1989). Предпочтительно разнообразие библиотеки максимизируют, используя праймеры ПЦР, направленные к каждому семейству V-генов, чтобы амплифицировать все доступные реаранжировки VH и VL, присутствующие в образце нуклеиновых кислот иммунных клеток, например, согласно способу, описанному в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или согласно способу, описанному в Orum et al., Nucleic Acids Res., 21: 4491-4498 (1993). В случае клонирования амплифицированной ДНК в экспрессирующих векторах в праймер для ПЦР могут быть введены редкие сайты рестрикции в виде метки на одном конце, как описано в Orlandi et al. (1989), или проведена дополнительная ПЦР-амплификация с меченым праймером, как описано в Clackson et al., Nature, 352: 624-628 (1991).
Репертуары синтетически реаранжированных V-генов могут быть получены in vitro из фрагментов V-генов. Большинство фрагментов VH-генов человека могут быть клонированы и секвенированы (как сообщается в Tomlinson et al., J. Mol. Biol., 227: 776-798 (1992)), и картированы (как сообщается в Matsuda et al., Nature Genet., 3: 88-94 (1993)); такие клонированные фрагменты (включая все основные конформации петли H1 и H2) могут быть использованы для создания разнообразного репертуара генов VH с использованием ПЦР-праймеров, кодирующих петли H3 с разной последовательностью и длиной, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Репертуар VH также можно получить с использованием полного разнообразия последовательностей, сфокусированного на петле H3 одной длины, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 89: 4457-4461 (1992). Фрагменты Vκ и Vλ человека были клонированы и секвенированы (как сообщается в Williams and Winter, Eur. J. Immunol., 23: 1456-1461 (1993)) и могут быть использованы для получения репертуара синтетических легких цепей. Репертуар синтетических V-генов, основанный на разнообразие складок VH и VL и длин L3 и H3, будет кодировать антитела, характеризуемые большим структурным разнообразием. После амплификации кодирующих V-гены ДНК фрагменты V-генов зародышевой линии могут быть реаранжированы in vitro способами, согласно Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
Репертуар фрагментов антител может быть сконструирован посредством комбинирования репертуаров генов VH и VL вместе несколькими путями. Каждый репертуар может быть создан в разных векторах, и может быть осуществлена рекомбинация векторов in vitro, например, как описано в Hogrefe et al., Gene, 128: 119-126 (1993), или in vivo посредством комбинаторной инфекции, например, с использованием системы loxP, описанной в Waterhouse et al., Nucl. Acids Res., 21: 2265-2266 (1993). В способе рекомбинации in vivo используют двухцепочечную природу Fab-фрагментов, чтобы преодолеть ограничение по размеру библиотеки, налагаемое эффективностью трансформации E. coli. Нативные репертуары VH и VL клонируют отдельно, один в фагмиде, а другой в фаговом векторе. Затем две библиотеки объединяют посредством фаговой инфекции бактерий, содержащих фагмиду, для того чтобы каждая клетка содержала разное сочетание, и размер библиотеки был ограничен только количеством имеющихся клеток (примерно 1012 клонов). Оба вектора содержат сигналы рекомбинации in vivo, так что гены VH и VL рекомбинируют в одном репликоне и упаковываются совместно в фаговые вирионы. Такие гигантские библиотеки обеспечивают большие количества разнообразных антител с хорошей аффинностью (Kd -1 примерно 10-8 М).
Альтернативно репертуары могут быть клонированы последовательно в одном и том же векторе, например, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991), или собраны вместе с помощью ПЦР и затем клонированы, как описано в Clackson et al., Nature, 352: 624-628 (1991). ПЦР-сборку также можно использовать для соединения ДНК VH и VL с ДНК, кодирующей гибкий пептидный спейсер, с образованием репертуаров одноцепочечного Fv (scFv). Еще один способ «ПЦР-сборку в клетках» используют для комбинирования генов VH и VL в лимфоцитах с помощью ПЦР и последующего клонирования репертуаров связанных генов, как описано в Embleton et al., Nucl. Acids Res., 20: 3831-3837 (1992).
Антитела, полученные с использованием нативных библиотек (либо природных, либо синтетических), могут иметь среднюю аффинность (Kd -1 составляет от 106 до 107 М-1), но созревание аффинности также можно имитировать in vitro посредством конструирования и повторной селекции вторичных библиотек, как описано в Winter et al. (1994), см. выше. Например, могут быть случайно введены мутации in vitro с использованием склонной к ошибкам полимеразы (как сообщается в Leung et al., Technique, 1: 11-15 (1989)) согласно способу Hawkins et al., J. Mol. Biol., 226: 889-896 (1992) или способу Gram et al., Proc. Natl. Acad. Sci USA, 89: 3576-3580 (1992). Дополнительно созревание аффинности можно осуществить в результате случайного мутагенеза одной или нескольких CDR, например, с использованием ПЦР с праймерами, несущими случайную последовательность, охватывающую представляющую интерес CDR, в выбранных отдельных клонах Fv и скрининга в отношении клонов с более высокой аффинностью. В WO 96/07754 (опубликованной 14 марта 1996 г.) описан способ индуцирования мутагенеза в определяющей комплементарность области легкой цепи иммуноглобулина, чтобы создать библиотеку генов легкой цепи. Другой эффективный способ заключается в рекомбинировании доменов VH или VL, отобранных с помощью фагового дисплея, с репертуарами встречающихся в природе вариантов V-доменов, полученных от неиммунизированных доноров, и скрининге в отношении более высокой аффинности в нескольких раундах перетасовки цепей, как описано в Marks et al., Biotechnol., 10: 779-783 (1992). Такой способ позволяет получать антитела и фрагменты антител с аффинностями в диапазоне 10-9 М.
Последовательности нуклеиновой кислоты и аминокислотные последовательности NRR Notch1 известны в данной области. Последовательность нуклеиновой кислоты, кодирующая NRR Notch1, может быть сконструирована с использованием аминокислотной последовательности требуемой области NRR Notch1. Последовательности могут содержать последовательность SEQ ID NO: 55, 13 или 14. Альтернативно можно использовать последовательность кДНК (или ее фрагменты), имеющую номер доступа в GenBank № NM-017617. Нуклеиновые кислоты, кодирующие NRR Notch1, могут быть получены различными способами, известными в данной области. Такие способы включают без ограничения химический синтез любым из способов, описанных в Engels et al., Agnew. Chem. Int. Ed. Engl., 28: 716-734 (1989), таким как способы на основе триэфиров, фосфитов, фосфорамидитов и H-фосфонатов. В одном варианте используют кодоны, предпочтительные для экспрессии в клетке-хозяине, для конструирования ДНК, кодирующей NRR Notch1. Альтернативно ДНК, кодирующая NRR Notch1, может быть выделена из геномной библиотеки или из библиотеки кДНК.
После конструирования молекулу ДНК, кодирующей NRR Notch1, оперативно связывают регулирующей экспрессию последовательностью в экспрессирующем векторе, таком как плазмида, при этом регуляторная последовательность узнается клеткой-хозяином, трансформированной вектором. В общем, плазмидные векторы содержат последовательности репликации и регуляторные последовательности, которые получены из вида, совместимого с клеткой-хозяином. Вектор обычно несет участок репликации, а также последовательности, которые кодируют белки, которые способны обеспечивать фенотипическую селекцию трансформированных клеток. Векторы, подходящие для экспрессии в прокариотических и эукариотических клетках-хозяевах, известны в данной области, а некоторые дополнительно описаны в настоящем документе. Можно использовать эукариотические организмы, такие как дрожжи или клетки, полученные из многоклеточных организмов, таких как млекопитающие.
Необязательно ДНК, кодирующую NRR Notch1, оперативно связывают с последовательностью лидера секреции, приводящей к секреции продукта экспрессии клеткой-хозяином в культуральную среду. Примерами секреторных лидерных последовательностей являются последовательности stII, экотина, lamB, GD герпеса, lpp, щелочной фосфатазы, инвертазы и альфа-фактора. Также подходящей для применения в настоящем изобретении является 36-аминокислотная лидерная последовательность белка A (Abrahmsen et al., EMBO J., 4: 3901 (1985)).
Клетки-хозяева трансфицируют и предпочтительно трансформируют описанными выше экспрессирующими или клонирующими векторами согласно настоящему изобретению и культивируют в обычных питательных средах, соответствующим образом модифицированных для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности.
Трансфекция относится к включению экспрессирующего вектора в клетку-хозяина, независимо от того, экспрессируются или не экспрессируются любые кодирующие последовательности в действительности. Специалисту в данной области известны многочисленные способы трансфекции, например, преципитация CaPO4 и электропорация. Об успешной трансфекции обычно судят на основании того, что в клетке-хозяине наблюдается какой-либо признак работы такого вектора. Способы трансфекции хорошо известны в данной области, и некоторые способы дополнительно описаны в настоящем документе.
Трансформация означает введение ДНК в организм так, чтобы ДНК могла реплицироваться, либо в виде внехромосомного элемента, либо как интегрированный в хромосому элемент. В зависимости от используемой клетки-хозяина трансформацию осуществляют, используя стандартные способы, подходящие для таких клеток. Способы трансформации хорошо известны в данной области, и некоторые способы дополнительно описаны в настоящем документе.
Прокариотические клетки-хозяева, используемые для получения NRR Notch1, могут быть культивированы, как в общем описано в Sambrook et al., см. выше.
Клетки-хозяева млекопитающих, используемые для получения NRR Notch1, могут быть культивированы в разнообразных средах, которые хорошо известны в данной области, и некоторые из которых описаны в настоящем документе.
Клетки-хозяева, упоминаемые в настоящем описании, охватывают клетки в культуре in vitro, а также клетки, которые находятся в организме животного-хозяина.
Очистка NRR Notch1 может быть осуществлена с использованием известных в данной области способов, некоторые из которых описаны в настоящем документе.
Очищенный NRR Notch1 может быть связан с подходящим матриксом, таким как агарозные шарики, акриламидные шарики, стеклянные шарики, целлюлоза, различные акриловые сополимеры, гидроксиалкилметакрилатные гели, полиакриловые и полиметакриловые сополимеры, нейлон, нейтральные и ионные носители и тому подобное, для использования при разделении с помощью аффинной хроматографии клонов на основе фагового дисплея. Связывание белка NRR Notch1 с матриксом можно осуществить способами, описанными, например, в Methods in Enzymology, 44 (1976). Обычно используемый способ связывания белковых лигандов с полисахаридными матриксами, например, агарозой, декстраном или целлюлозой, заключается в активации носителя галогенидами цианогена и последующем связывании первичных алифатических или ароматических аминов пептидного лиганда с активированным матриксом.
Альтернативно NRR Notch1 может быть использован для покрывания лунок адсорбирующих планшетов, экспрессирован на клетках-хозяевах, прикрепленных к адсорбирующим планшетам, или использован для сортировки клеток, или конъюгирован с биотином для улавливания шариками, покрытыми стрептавидином, или использован в любом другом известном в данной области способе пэннинга библиотек на основе фагового дисплея.
Образцы фаговой библиотеки подвергают контакту с иммобилизованным NRR Notch1 в условиях, подходящих для связывания, по меньшей мере, части фаговых частиц с адсорбентом. Обычно условия, включая pH, ионную силу, температуру и тому подобное, выбирают так, чтобы имитировать физиологические условия. Фаги, связанные с твердой фазой, промывают и затем элюируют кислотой, например, как описано в Barbas et al., Proc. Natl. Acad. Sci USA, 88: 7978-7982 (1991), или щелочью, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или посредством конкуренции с антигеном NRR Notch1, например, в способе, подобном способу на основе конкуренции с антигеном, описанному в Clackson et al., Nature, 352: 624-628 (1991). Фаги могут быть обогащены в 20-1000 раз за один раунд селекции. Кроме того, обогащенные фаги могут быть выращены в бактериальной культуре и подвергнуты следующим раундам селекции.
Эффективность селекции зависит от многих факторов, включая кинетику диссоциации во время промывки, и от того, могут ли множественные фрагменты антитела на одном фаге одновременно контактировать с антигеном. Антитела с быстрой кинетикой диссоциации (и слабыми аффинностями связывания) могут удерживаться при использовании кратковременных промывок, поливалентного фагового дисплея и высокой плотности покрытия антигеном твердой фазы. Высокая плотность не только стабилизирует фаг посредством поливалентных взаимодействий, но и способствует повторному связыванию фага, который диссоциировал. Селекция антител с медленной кинетикой диссоциации (и хорошими аффинностями связывания) может быть осуществлена посредством использования длительных промывок и моновалентного фагового дисплея, как описано в Bass et al., Proteins, 8: 309-314 (1990) и в WO 92/09690, и низкой плотности покрывания антигеном, как описано в Marks et al., Biotechnol., 10: 779-783 (1992).
Можно провести селекцию фаговых антител с разными аффиностями по отношению к NRR Notch1, даже с аффиностями, которые отличаются незначительно. Однако возможны случайные мутации отобранного антитела (например, возникающие при некоторых способах созревания аффинности, описанных выше), приводящие к получению множества мутантов, большинство из которых связываются с антигеном, и немногие связываются с более высокой аффинностью. В случае ограничения NRR Notch1 редкий высокоаффинный фаг может быть потерян в результате конкуренции. Чтобы сохранить все мутанты с более высокой аффинностью, фаги могут быть инкубированы с избытком биотинилированного NRR Notch1, но с биотинилированным NRR Notch1 в более низкой молярной концентрации, чем молярная константа аффинности по отношению к мишени для NRR Notch1. Затем фаги, связывающиеся с высокой аффинностью, можно улавливать с помощью парамагнитных шариков, покрытых стрептавидином. Такое «равновесное улавливание» позволяет отбирать антитела в соответствии с их аффинностями связывания с такой чувствительностью, которая позволяет выделять мутантные клоны со всего лишь в два раза более высокой аффинностью из большого избытка фагов с более низкой аффинностью. Условиями, используемыми для промывки фагов, связанных с твердой фазой, также можно манипулировать, чтобы дифференцировать их на основе кинетики диссоциации.
Анти-NRR Notch1-клоны могут быть подвергнуты селекции в отношении активности. В одном варианте в изобретении предлагаются анти-NRR Notch1-антитела, которые блокируют связывание между рецептором Notch1 и его лигандом (таким как Jagged1, Jagged2, Delta-подобный 1, Delta-подобный 3 и Delta-подобный 4) или протеолитическое расщепление Notch1, индуцируемое после связывания лиганда. Fv-клоны, соответствующие таким анти-NRR Notch1-антителам, могут быть подвергнуты селекции посредством (1) выделения анти-NRR Notch1-клонов из фаговой библиотеки, как описано выше, и необязательно амплификации выделенной популяции фаговых клонов с помощью выращивания популяции в подходящем бактериальном хозяине; (2) селекции NRR Notch1 и второго белка, против которых требуется блокирующая и не блокирующая активность, соответственно; (3) адсорбции фаговых клонов против NRR Notch1 на иммобилизованном NRR Notch1; (4) использования избытка второго белка, чтобы элюировать нежелательные клоны, которые узнают связывающие NRR Notch1 детерминанты, которые перекрываются или которые являются общими с детерминантами связывания второго белка; и (5) элюирования клонов, которые остаются адсорбированными после стадии (4). Необязательно клоны с требуемыми блокирующими/неблокирующими свойствами могут быть дополнительно обогащены в результате повторения способов селекции, описанных в настоящем документе, один или несколько раз.
ДНК, кодирующую полученные из гибридом моноклональные антитела, или Fv-клоны из фагового дисплея согласно изобретению легко выделяют и секвенируют, используя обычные способы (например, используя олигонуклеотидные праймеры, сконструированные для того, чтобы специфично амплифицировать представляющие интерес кодирующие области тяжелой и легкой цепи с ДНК-матрицы гибридомы или фага). После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки обезьян COS, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в ином случае не продуцируют белок иммуноглобулина, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи о рекомбинантной экспрессии в бактериях ДНК, кодирующей антитела, включают Skerra et al., Curr. Opinion in Immunol., 5: 256 (1993) и Pluckthun, Immunol. Revs, 130: 151 (1992).
ДНК, кодирующую Fv-клоны согласно изобретению, можно комбинировать с известными последовательностями ДНК, кодирующими константные области тяжелой цепи и/или легкой цепи (например, подходящие последовательности ДНК можно найти в Kabat et al., см. выше), чтобы образовать клоны, кодирующие полноразмерные или тяжелые и/или легкие цепи или их части. Будет понятно, что для такой цели можно использовать константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и что могут быть получены такие константные области человека или животного, отличного от человека. Fv-клон, полученный из ДНК вариабельного домена одного вида животного (такого как человек) и затем слитый с ДНК константной области другого вида животного с образованием кодирующей последовательности(ей) для «гибридной» полноразмерной тяжелой цепи и/или легкой цепи, включен в определение «химерное» и «гибридное» антитело в используемом в настоящем описании смысле. В предпочтительном варианте Fv-клон, полученный из ДНК вариабельной области человека, сливают с ДНК константной области человека с образованием кодирующей последовательности(ей) для полностью человеческих полноразмерных или частичных тяжелых и/или легких цепей.
ДНК, кодирующую анти-NRR Notch1-антитело, полученную из гибридомы согласно изобретению, также могут быть модифицированы, например, заменой кодирующей последовательности константных доменов тяжелой и легкой цепи человека вместо гомологичных мышиных последовательностей, полученных из гибридомного клона (например, как в способе, описанном в Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). ДНК, кодирующая полученное из гибридомного клона или из Fv-клона антитело или фрагмент, может быть дополнительно модифицирована ковалентным связыванием кодирующей последовательности иммуноглобулина с полноразмерной или частичной кодирующей последовательностью неиммуноглобулинового полипептида. Таким образом получают «химерные» или «гибридные» антитела, которые обладают специфичностью связывания антител согласно изобретению, полученных Fv-клона или гибридомного клона.
Фрагменты антител
Фрагменты антител также включены в объем изобретения. В некоторых случаях предпочтительно использование фрагментов антител, а не целых антител. Меньший размер фрагментов обеспечивает быстрый клиренс и может приводить к улучшенному доступу к солидным опухолям.
Разработаны различные способы получения фрагментов антител. Традиционно такие фрагменты получали в результате протеолитического расщепления интактных антител (смотри, например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24: 107-117 (1992) и Brennan et al., Science, 229: 81 (1985)). Однако в настоящее время такие фрагменты могут непосредственно продуцироваться рекомбинантными клетками-хозяевами. Fab-, Fv- и ScFv-фрагменты антител могут быть экспрессированы и секретированы из E. coli, таким образом обеспечивая простое получение больших количеств таких фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно Fab'-SH-фрагменты могут быть непосредственно извлечены из клеток E. coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology 10: 163-167 (1992)). Согласно другому способу F(ab')2-фрагменты могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Fab- и F(ab')2-фрагменты с увеличенным временем полужизни in vivo, содержащие остатки эпитопа, связывающего рецептор спасения, описаны в патенте США № 5869046. Другие способы получения фрагментов антител будут известны специалистам в данной области. В других вариантах предпочтительное антитело представляет собой одноцепочечный Fv-фрагмент (scFv) (смотри, например, WO 93/16185, патенты США №№ 5571894 и 5587458). Fv и sFv являются единственными видами с интактными связывающими участками, которые лишены константных областей; таким образом, они являются подходящими с точки зрения пониженного неспецифичного связывания в случае применения in vivo. Могут быть сконструированы слитые белки sFv, чтобы получить слияние эффекторного белка либо с амино-, либо с карбоксильным концом sFv. Смотри Antibody Engineering, ed. Borrebaeck, выше. Фрагмент антитела также может представлять собой «линейное антитело», например такое, как описано в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифичными или биспецифичными.
Гуманизированные антитела
В объем настоящего изобретения включены гуманизированные антитела. В данной области известны различные способы гуманизации антител животных, отличных от человека. Например, гуманизированное антитело может иметь один или несколько аминокислотных остатков, введенных в него из источника, который отличен от человека. Указанные аминокислотные остатки животного, отличного от человека, часто называют «импортируемыми» остатками, которые обычно берут из «импортируемого» вариабельного домена. Гуманизацию можно по существу выполнить, следуя способу Винтера и соавторов (Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)), заменой последовательностями гипервариабельных областей соответствующих последовательностей антитела человека. Соответственно такие «гуманизированные» антитела являются химерными антителами (патент США № 4816567), в которых значительно меньшая часть, чем интактный вариабельный домен человека, была заменена соответствующей последовательностью вида, отличного от человека. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки гипервариабельных областей и возможно некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
Выбор вариабельных доменов человека, как легкой, так и тяжелой цепи, используемых для получения гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому способу «оптимальной подгонки» последовательность вариабельного домена антитела грызуна подвергают скринингу по сравнению с полной библиотекой известных последовательностей вариабельных доменов человека. Последовательность человека, которая наиболее близка последовательности грызуна, затем берут в качестве каркаса человека для гуманизированного антитела (Sims et al., J. Immunol., 151: 2296 (1993); Chothia et al., J. Mol. Biol., 196: 901 (1987)). В другом способе используют конкретный каркас, полученный из консенсусной последовательности полностью человеческих антител конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких разных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); Presta et al., J. Immunol., 151: 2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и других благоприятных биологических свойств. Для достижения указанной цели согласно обычному способу гуманизированные антитела получают, проводя анализ исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и показывают возможные трехмерные конформационные структуры выбранных для исследования последовательностей иммуноглобулина. Исследование таких изображений позволяет проанализировать вероятную роль остатков в функционировании выбранной для исследования последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность выбранного для исследования иммуноглобулина связывать соответствующий ему антиген. Таким образом, могут быть выбраны и объединены остатки FR из реципиентых и импортируемых последовательностей так, чтобы достичь требуемых характеристик антитела, таких как повышенная аффинность по отношению к антигену(ам)-мишени. В общем, остатки гипервариабельных областей непосредственно и в наибольшей степени влияют на связывание антигена.
Антитела человека
Анти-NRR Notch1-антитела человека согласно изобретению могут быть сконструированы в результате объединения последовательности(ей) вариабельного домена Fv-клона, выбранной из библиотек в фаговом дисплее, полученных для антител человека, с известными последовательностями константного домена человека, как описано выше. Альтернативно человеческие моноклональные анти-NRR Notch1-антитела согласно изобретению могут быть получены способом на основе гибридом. Линии клеток миеломы человека и гетеромиеломы мыши-человека для получения моноклональных антител человека описаны, например, в Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991).
В настоящее время можно получать трансгенных животных (например мышей), которые способны после иммунизации продуцировать полный репертуар антител человека в отсутствие продукции эндогенных иммуноглобулинов. Например, описано, что гомозиготная делеция гена соединяющей области тяжелой цепи (JH) антитела у химерных и мутантных по зародышевой линии мышей приводит к полному ингибированию продукции эндогенных антител. Перенос ряда генов иммуноглобулина зародышевой линии человека в таких мутантных по зародышевой линии мышей будет приводить к продукции антител человека при антигенной стимуляции. Смотри, например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255-258 (1993); Bruggermann et al., Year in Immunol., 7: 33 (1993).
Перетасовку генов также можно использовать для получения человеческих антител из антител животного, отличного от человека, например грызунов, при этом антитело человека имеет аффинности и специфичности, сходные с исходным антителом животного, отличного от человека. Согласно указанному способу, который также называют «эпитопным импринтингом», вариабельную область либо тяжелой, либо легкой цепи фрагмента антитела животного, отличного от человека, полученного способом на основе фагового дисплея, который описан выше, заменяют репертуаром генов V-домена человека, создавая популяцию химер scFv или Fab на основе цепи животного, отличного от человека/цепи человека. Результатом селекции с использованием антигена является выделение химерных scFv или Fab на основе цепи животного, отличного от человека/цепи человека, при этом цепь человека восстанавливает антигенсвязывающий участок, нарушенный при удалении соответствующей цепи животного, отличного от человека, в первичном клоне фагового дисплея, т.е. эпитоп регулирует (накладывает отпечаток) на выбор партнера в виде цепи человека. Когда процесс повторяют, чтобы заменить оставшуюся цепь животного, отличного от человека, получают человеческое антитело (смотри PCT WO 93/06213, опубликованную 1 апреля 1993 г.). В отличие от традиционной гуманизации антител животных, отличных от человека, в результате прививания CDR, такой способ позволяет получать полностью человеческие антитела, которые не имеют остатков FR или CDR животного, отличного от человека.
Биспецифичные антитела
Биспецифичные антитела являются моноклональными, предпочтительно человеческими или гуманизированными антителами, которые обладают специфичностями связывания, по меньшей мере, двух разных антиген. В данном случае одна из специфичностей связывания представляет собой специфичность по отношению к NRR Notch1, а другая - специфичность по отношению к другому антигену. Приведенные в качестве примера биспецифичные антитела могут связывать два разных эпитопа NRR Notch1. Биспецифичные антитела также можно применять для того, что локализовать цитотоксические средства в клетках, которые экспрессируют NRR Notch1. Такие антитела имеют плечо, связывающее NRR Notch1, и плечо, которое связывает цитотоксическое средство (например, сапонин, анти-интерферон-α, алкалоид барвинка, цепь A рицина, метотрексат или меченный радиоактивным изотопом гаптен). Биспецифичные антитела могут быть получены в виде полноразмерных антител или в виде фрагментов антител (например, биспецифичные антитела в виде F(ab')2).
Способы получения биспецифичных антител известны в данной области. Традиционно рекомбинантное получение биспецифичных антител основано на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, при этом две тяжелых цепи имеют разные специфичности (Millstein et al., Nature, 305: 537-539 (1983)). Вследствие случайного выбора тяжелых и легких цепей иммуноглобулина такие гибридомы (квадромы) продуцируют возможную смесь 10 разных молекул антител, из которых только одна имеет правильную биспецифичную структуру. Очистка правильной молекулы, которую обычно осуществляют, используя стадии аффинной хроматографии, является довольно громоздкой, а выходы продукта низкими. Сходные способы описаны в WO 93/08829, опубликованной 13 мая 1993 года, и в Traunecker et al., EMBO J., 10: 3655-3659 (1991).
Согласно другому и более предпочтительному способу вариабельные домены антител с требуемыми специфичностями связывания (участки связывания антитело-антиген) сливают с последовательностями константных доменов иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области, областей CH2 и CH3. Предпочтительно иметь первую константную область тяжелой цепи (CH1), содержащую сайт, необходимый для связывания легкой цепи, присутствующий, по меньшей мере, в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и в случае необходимости легкой цепи иммуноглобулина, встраивают в отдельные экспрессирующие векторы и котрансфицируют в подходящий организм хозяина. Это дает большую гибкость при корректировке взаимных соотношений трех полипептидных фрагментов в таких вариантах, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, дают оптимальные выходы. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор в том случае, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных соотношениях дает высокие выходы или когда соотношения не имеют особого значения.
В предпочтительном варианте указанного способа биспецифичные антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелой цепи-легкой цепи иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Обнаружено, что такая асимметричная структура облегчает отделение требуемого биспецифичного соединения от нежелательных комбинаций цепей иммуноглобулина, так как наличие легкой цепи иммуноглобулина только в одной половине биспецифичных молекул обеспечивает простой способ разделения. Такой способ описан в WO 94/04690. Более подробное описание создания биспецифичных антител смотри, например, в Suresh et al., Methods in Enzymology, 121: 210 (1986).
Согласно другому способу область контакта между парой молекул антител может быть сконструирована так, чтобы максимизировать процент гетеродимеров, которые извлекают из культуры рекомбинантных клеток. Предпочтительная область контакта содержит, по меньшей мере, часть домена CH3 константного домена антитела. В указанном способе одну или несколько небольших боковых цепей аминокислот из области контакта первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозин или триптофан). Создают компенсирующие «впадины», имеющие размер, идентичный или сходный с размером большой боковой цепи (цепей), на области контакта второй молекулы антитела, заменяя большие боковые цепи аминокислот меньшими боковыми цепями (например, аланин или треонин). Это обеспечивает механизм увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифичные антитела включают поперечно сшитые антитела или «гетероконъюгаты» антител. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое с биотином. Такие антитела, например, были предложены для того, чтобы направить клетки иммунной системы к нежелательным клеткам-мишеням (патент США № 4676980), и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгаты антител могут быть получены с использованием любых способов образования поперечных сшивок. Подходящие поперечно сшивающие агенты хорошо известны в данной области и описаны в патенте США № 4676980 вместе с рядом способов образования поперечных сшивок.
Способы создания биспецифичных антител из фрагментов антител также описаны в литературе. Например, биспецифичные антитела могут быть получены с использованием химического связывания. В Brennan et al., Science, 229: 81 (1985) описан способ, при котором интактные антитела протеолитически расщепляют, чтобы создать F(ab')2-фрагменты. Полученные фрагменты восстанавливают в присутствии агента, образующего комплексы дитиола, арсенита натрия, чтобы стабилизировать соседние дитиолы и предотвратить образование межмолекулярного дисульфида. Затем созданные Fab'-фрагменты превращают в производные тионитробензоата (TNB). Один из Fab'-TNB-производных затем снова превращают в Fab'-тиол восстановлением с использованием меркаптоэтиламина и смешивают с эквимолярным количеством другого Fab'-TNB-производного с образованием биспецифичного антитела. Полученные биспецифичные антитела можно использовать в качестве агентов для избирательной иммобилизации ферментов.
Недавние достижения облегчили прямое извлечение Fab'-SH-фрагментов из E. coli, которые могут быть химически связаны с образованием биспецифичных антител. В Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описано получение полностью гуманизированной молекулы биспецифичного антитела на основе F(ab')2. Каждый Fab'-фрагмент отдельно секретировался из клеток E. coli, и его подвергали химическому связыванию in vitro с образованием биспецифичного антитела. Образованное таким образом биспецифичное антитело способно связываться с клетками, сверхэкспрессирующими рецептор HER2, и нормальными T-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека против опухолевых мишеней молочной железы человека.
Также описаны различные способы получения и выделения фрагментов биспецифичных антител непосредственно из культуры рекомбинантных клеток. Например, были получены биспецифичные антитела с использованием лейциновых молний. Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992). Пептиды лейциновой молнии из белков Fos и Jun связывали с Fab'-частями двух разных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области, чтобы образовать мономеры, и затем снова окисляли с образованием гетеродимеров антител. Такой способ также можно использовать для получения гомодимеров антител. Способ «димерных антител», описанный Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), дал альтернативный механизм получения фрагментов биспецифичных антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) линкером, который слишком короткий, чтобы обеспечить возможность спаривания между двумя доменами на одной и той же цепи. Соответственно домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента, образуя при этом два антигенсвязывающих участка. Также сообщалось о другой методике получения фрагментов биспецифичных антител с использованием димеров одноцепочечного Fv (sFv). Смотри Gruber et al., J. Immunol., 152: 5368 (1994).
Предполагаются антитела с более чем двумя валентностями. Например, могут быть получены триспецифичные антитела. Tutt et al. J. Immunol. 147: 60 (1991).
Поливалентные антитела
Поливалентное антитело может быть быстрее интернализовано (и/или подвергнуто катаболизму) клеткой, экспрессирующей антиген, с которым связываются антитела, чем бивалентное антитело. Антитела согласно настоящему изобретению могут представлять собой поливалентные антитела (которые не относятся к классу IgM) с тремя или более антигенсвязывающими участками (т.е. тетравалентные антитела), которые могут быть легко получены посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих участка. Предпочтительный домен димеризации содержит или состоит из Fc-области или шарнирной области. По такому плану антитело будет содержать Fc-область и три или более антигенсвязывающих участка, аминоконцевых по отношению к Fc-области. Предпочтительное поливалентное антитело согласно изобретению содержит (или состоит из) от трех до примерно восьми, но предпочтительно четыре антигенсвязывающих участка. Поливалентное антитело содержит, по меньшей мере, одну полипептидную цепь (и предпочтительно две полипептидных цепи), при этом полипептидная цепь (цепи) содержит два или более вариабельных домена. Например, полипептидная цепь (цепи) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 означает первый вариабельный домен, VD2 означает второй вариабельный домен, Fc означает одну полипептидную цепь Fc-области, X1 и X2 означают аминокислоту или полипептид, и n равно 0 или 1. Например, полипептидная цепь (цепи) может содержать: цепь VH-CH1-гибкий линкер-VH-CH1-Fc-область или цепь VH-CH1-VH-CH1-Fc-область. Поливалентное антитело согласно изобретению предпочтительно дополнительно содержит, по меньшей мере, два (и предпочтительно четыре) полипептида вариабельного домена легкой цепи. Поливалентное антитело согласно изобретению может, например, содержать примерно от двух до примерно восьми полипептидов вариабельного домена легкой цепи. Полипептиды вариабельного домена легкой цепи, предусмотренные в настоящем изобретении, содержат вариабельный домен легкой цепи и необязательно дополнительно содержат домен CL.
Варианты антител
В некоторых вариантах предполагается модификация(ии) аминокислотной последовательности антител, описанной в настоящем документе. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела получают введением соответствующих изменений нуклеотидов в нуклеиновую кислоту антитела или в результате синтеза пептидов. Такие модификации включают, например, делеции и/или инсерции и/или замены остатков в аминокислотных последовательностях антитела. Осуществляют любое сочетание делеции, инсерции и замены, чтобы достичь конечной конструкции, при условии, что конечная конструкция обладает требуемыми характеристиками. Аминокислотные изменения могут быть введены в аминокислотную последовательность рассматриваемого антитела во время получения такой последовательности.
Применимый способ идентификации определенных остатков или областей антитела, которые являются предпочтительными местами для мутагенеза, называют «мутагенезом на основе сканирования аланином», который описан в Cunningham and Wells (1989) Science, 244: 1081-1085. В данном случае остаток или группу остатков-мишеней идентифицируют (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют нейтральными или отрицательно заряженными аминокислотами (наиболее предпочтительно аланином или полиаланином), чтобы повлиять на взаимодействие аминокислот с антигеном. Те положения аминокислот, которые проявляют функциональную чувствительность к заменам, затем улучшают введением дополнительных или других вариантов в сайты замены. Таким образом, хотя сайт для введения варианта аминокислотной последовательности определяют предварительно, природа мутации как таковой не нуждается в предварительном определении. Например, чтобы проанализировать эффективность мутации в данном участке, проводят сканирование аланином или случайный мутагенез в кодоне или области-мишени и осуществляют скрининг экспрессированных иммуноглобулинов в отношении требуемой активности.
Инсерции в аминокислотной последовательности включают слияния на амино- и/или карбоксильном конце, диапазон длины которых составляет от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых инсерций включают антитело с N-концевым остатком метионила или антитело, слитое с цитотоксическим полипептидом. Другие инсерционные варианты молекулы антитела включают слияние N- или C-конца антитела с ферментом (например, ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Гликозилирование полипептидов обычно является либо N-связанным, либо O-связанным. N-связанное относится к связыванию углеводного остатка с боковой цепью остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X означает любую аминокислоту за исключением пролина, представляют собой узнаваемые последовательности для ферментативного связывания углеводного остатка с боковой цепью аспарагина. Таким образом, присутствие любой из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к связыванию одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы с гидроксиаминокислотой, чаще всего серином или треонином, хотя также могут быть использованы 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу обычно сопровождается изменением аминокислотной последовательности, так что она содержит одну или несколько описанных выше трипептидных последовательностей (в случае сайтов N-связанного гликозилирования). Изменение также можно осуществить добавлением или заменой одного или нескольких остатков серина или треонина к последовательности исходного антитела (в случае сайтов O-связанного гликозилирования).
В том случае, когда антитело содержит Fc-область, связанный с ней углевод может быть изменен. Например, антитела со зрелой углеводной структурой, в которой отсутствует фукоза, связанная с Fc-областью антитела, описаны в заявке на выдачу патента США № US 2003/0157108 (Presta, L.). Также смотри US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Антитела с разветвленным N-ацетилглюкозамином (GlcNAc) в углеводе, связанном с Fc-областью антитела, описаны в WO 2003/011878, Jean-Mairet et al. и в патенте США № 6602684, Umana et al. Антитела, по меньшей мере, с одним остатком галактозы в олигосахариде, связанном с Fc-областью антитела, раскрыты в WO 1997/30087, Patel et al. Также смотри WO 1998/58964 (Raju, S.) и WO 1999/22764 (Raju, S.), касающиеся антител с измененным углеводом, связанным с их Fc-областью. Смотри также US 2005/0123546 (Umana et al.), где описаны антигенсвязывающие молекулы с модифицированным гликозилированием.
Предпочтительный согласно настоящему изобретению вариант гликозилирования содержит Fc-область, при этом в углеводной структуре, связанной с Fc-областью, отсутствует фукоза. Такие варианты обладают улучшенной ADCC-функцией. Необязательно Fc-область дополнительно содержит одну или несколько аминокислотных замен, которые дополнительно усиливают ADCC, например, замены в положениях 298, 333 и/или 334 Fc-области (нумерация остатков Eu). Примеры публикаций, связанных с «дефукозилированием» или антителами с «недостатком фукозы», включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, продуцирующих дефукозилированные антитела, включают клетки CHO Lec13, дефицитные по фукозилированию белков (Ripka et al. Arch. Biochem. Biophys. 249: 533-545 (1986); заявка на выдачу патента США № US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., особенно в примере 11), и нокаутированные линии клеток, такие как клетки CHO, нокаутированные по гену альфа-1,6-фукозилтрансферазы, FUT8, (Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004)).
Другим типом варианта является вариант с аминокислотной заменой. Такие варианты имеют, по меньшей мере, один аминокислотный остаток в молекуле антитела, замененный другим остатком. Участки, представляющие наибольший интерес для основанного на заменах мутагенеза, включают гипервариабельные области, но также предполагаются изменения FR. Консервативные замены показаны в таблице 1 под заголовком «предпочтительные замены». Если такие замены приводят к изменению биологической активности, то могут быть введены более существенные изменения, показанные в таблице 1 под заголовком «примеры замен» или дополнительно описанные ниже при описании классов аминокислот, и продукты подвергают скринингу.
Существенные модификации биологических свойств антитела осуществляют посредством отбора замен, которые в значительной степени отличаются по своему влиянию на сохранение (a) структуры полипептидного остова в области замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в сайте-мишени, или (c) объема боковой цепи. Встречающиеся в природе остатки делят на группы на основании сходства свойств их боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro; и
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены повлекут за собой обмен представителя одного из указанных классов представителем другого класса.
Один тип варианта с заменами включает в себя замену одного или нескольких остатков гипервариабельной области исходного антитела (например, гуманизированного антитела или антитела человека). В общем, полученный в результате вариант(ты), отобранный для дальнейшей разработки, будет иметь улучшенные биологические свойства по сравнению с исходным антителом, из которого он был создан. Подходящий способ создания таких вариантов с заменами заключается в созревании аффинности с использованием фагового дисплея. Коротко, несколько участков гипервариабельной области (например, 6-7 участков) подвергают мутациям, чтобы создать все возможные аминокислотные замены в каждом участке. Созданные таким образом антитела представляют на частицах нитчатого фага в виде слияний с продуктом гена III M13, упакованного в каждой частице. Затем проводят скрининг вариантов в фаговом дисплее в отношении их биологической активности (например, аффинности связывания), как описано в данном документе. Чтобы идентифицировать участки гипервариабельной области - возможные кандидаты для модификации, можно осуществить мутагенез на основании сканирования аланином, чтобы выявить остатки гипервариабельной области, которые вносят существенный вклад в связывание антигена. Альтернативно или дополнительно может быть полезным анализ кристаллической структуры комплекса антиген-антитело, чтобы идентифицировать точки контакта между антителом и антигеном. Такие контактирующие остатки и соседние остатки являются кандидатами для замены способами, предлагаемыми в настоящем изобретении. После создания таких вариантов панель вариантов подвергают скринингу, который описан в данной публикации, и антитела с лучшими свойствами в одном или нескольких соответствующих анализах могут быть отобраны для дальнейшей разработки.
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотных последовательностей антитела, получают различными способами, известными в данной области. Такие способы включают без ограничения выделение из природного источника (в случае природных вариантов аминокислотной последовательности) или получение опосредованным олигонуклеотидами (или сайт-специфичным) мутагенезом, мутагенезом на основе ПЦР и кассетным мутагенезом ранее полученного варианта или невариантной версии антитела.
Может быть желательным введение одной или нескольких аминокислотных модификаций в Fc-область полипептидов иммуноглобулина согласно изобретению, таким образом создавая вариант Fc-области. Вариант Fc-области может содержать последовательность Fc-области человека (например, Fc-области IgG1, IgG2, IgG3 или IgG4 человека), содержащую аминокислотную модификацию (например, замену) в одном или нескольких положениях аминокислот, включая положение шарнирного цистеина. В соответствии с описанием и руководствами, имеющимися в данной области, предполагается, что в некоторых вариантах антитело, применяемое в способах согласно изобретению, может содержать одно или несколько изменений по сравнению с эквивалентным антителом дикого типа, например, в Fc-области. Такие антитела, тем не менее, могут сохранять по существу такие же характеристики, которые требуются для терапевтического применения, по сравнению с их эквивалентом дикого типа. Например, считается, что в Fc-области могут быть осуществлены некоторые изменения, которые могут привести к измененному (т.е. либо повышенному, либо пониженному) связыванию C1q и/или зависимой от комплемента цитотоксичности (CDC), например, как описано в WO 99/51642. Смотри также Duncan and Winter, Nature 322: 738-40 (1988); патент США № 5648260, патент США № 5624821 и WO 94/29351, касающиеся других примеров вариантов Fc-области. В WO00/42072 (Presta) и WO 2004/056312 (Lowman) описаны варианты антител с повышенным или пониженным связыванием с FcR. Содержание указанных патентных публикаций специально включено в настоящее описание в виде ссылки. Также смотри Shields et al. J. Biol. Chem. 9(2): 6591-6604 (2001). Антитела с увеличенным временем полужизни и улучшенным связыванием с неонатальным Fc-рецептором (FcRn), который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)), описаны в US2005/0014934A1 (Hinton et al.). Такие антитела содержат Fc-область с одной или несколькими заменами, которые улучшают связывание Fc-области с FcRn. Полипептидные варианты с измененными аминокислотными последовательностями Fc-области и повышенной или пониженной способностью связывать C1q описаны в патенте США № 6194551B1, WO99/51642. Содержание указанных патентных публикаций специально включено в настоящее описание в виде ссылки. Также смотри Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
Производные антител
Антитела согласно настоящему изобретению могут быть дополнительно модифицированы так, чтобы они содержали дополнительные небелковые компоненты, которые известны в данной области и легкодоступны. В некоторых вариантах компонентами, подходящими для дериватизации антитела, являются водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают без ограничения полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, полиаминокислоты (либо гомополимеры, либо случайные сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксид/этиленоксид, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропионовый альдегид полиэтиленгликоля может иметь преимущества при производстве вследствие его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, связанных с антителом, может варьировать, и если связывают более одного полимера, то они могут быть одинаковыми или разными молекулами. В общем, количество и/или тип полимеров, используемых для дериватизации, можно определить на основе рассмотрения ряда факторов, включая без ограничения конкретные свойства или функции улучшаемого антитела, будет ли производное антитела использовано в терапии при определенных состояниях и т.д.
Скрининг антител с требуемыми свойствами
Антитела согласно настоящему изобретению могут быть охарактеризованы в отношении их физических/химических свойств и биологических функций в различных анализах, известных в данной области. В некоторых вариантах антитела характеризуют в отношении одного или нескольких свойств: снижения или блокирования активации Notch1, снижения или блокирования передачи сигналов молекул, расположенных в каскаде ниже Notch1, нарушения или блокирования связывания Notch1 с лигандом (например, Jagged1, Jagged2, Delta-подобный 1, Delta-подобный 3 или Delta-подобный 4), и/или лечения и/или профилактики опухоли, клеточного пролиферативного нарушения или злокачественной опухоли; и/или лечения или профилактики нарушения, ассоциированного с экспрессией и/или активностью Notch1 (например, с повышенной экспрессией и/или активностью Notch1). В других вариантах антитела характеризуют в отношении любого одного или нескольких из следующих свойств: индукции или усиления активации Notch1, индукции или усиления передачи сигналов молекул, распложенных ниже Notch1 в каскаде, и/или лечения или профилактики нарушения, ассоциированного с экспрессией и/или активностью Notch1.
Очищенные антитела могут быть дополнительно охарактеризованы посредством серии анализов, включая без ограничения N-концевое секвенирование, аминокислотный анализ, высокоэффективную жидкостную эксклюзионную хроматографию по размеру в неденатурирующих условиях (ВЭЖХ), масс-спектрометрию, ионообменную хроматографию и расщепление папаином.
В некоторых вариантах осуществления изобретения антитела, полученные согласно изобретению, анализируют в отношении их биологической активности. В некоторых вариантах антитела согласно настоящему изобретению тестируют в отношении их антигенсвязывающей активности. Анализы связывания антигенов, которые известны в данной области и могут быть использованы в настоящем изобретении, включают без ограничения любые анализы прямого или конкурентного связывания с использованием таких способов, как Вестерн-блоты, радиоиммуноанализы, ELISA (твердофазный иммуноферментный анализ), иммуноанализы типа «сэндвич», анализы иммунопреципитации, флуоресцентные иммуноанализы и иммуноанализы с использованием белка A. Иллюстративный анализ связывания антигена описан ниже в разделе «Примеры».
В еще одном варианте в изобретении предлагаются моноклональные анти-NRR Notch1-антитела, которые конкурируют с антителом A, антителом A-1, антителом A-2 и/или антителом A-3 за связывание с NRR Notch1. К таким конкурирующим антителам относятся антитела, которые узнают эпитоп NRR Notch1, представляющий собой тот же самый эпитоп или эпитоп, перекрывающийся с эпитопом NRR Notch1, узнаваемым антителом A, антителом A-1, антителом A-2 и/или антителом A-3. Такие конкурирующие антитела могут быть получены в результате скрининга надосадков анти-NRR Notch1-гибридом в отношении связывания с иммобилизованным NRR Notch1 в условиях конкуренции с меченым антителом A, антителом A-1, антителом A-2 и/или антителом A-3. Надосадок гибридомы, содержащий конкурирующее антитело, будет уменьшать количество связанного меченого антитела, выявляемого в смеси для данного анализа конкурентного связывания по сравнению с количеством связанного меченого антитела, выявляемого в контрольной смеси для связывания, содержащей нерелевантное антитело (или не содержащей антитела). Любой из анализов конкурентного связывания, описанный в настоящем документе, является подходящим для применения в описанном выше способе.
В другом аспекте в изобретении предлагается моноклональное анти-NRR Notch1-антитело, которое содержит одну или несколько (например, 2, 3, 4, 5 и/или 6) HVR антитела A, антитела A-1, антитела A-2 или антитела A-3. Моноклональное анти-NRR Notch1-антитело, которое содержит одну или несколько HVR антитела A, антитела A-1, антитела A-2 и/или антитела A-3, может быть сконструировано в результате прививки одной или нескольких HVR антитела A, антитела A-1, антитела A-2 и/или антитела A-3 в последовательность матричного антитела, например, в последовательность антитела человека, которая является наиболее близкой к соответствующей мышиной последовательности исходного антитела, или в консенсусную последовательность полностью человеческих антител в конкретной подгруппе легкой или тяжелой цепи исходного антитела, и затем экспрессии полученной в результате химерной последовательности(ей) вариабельной области легкой и/или тяжелой цепи вместе или в отсутствие сопровождающей последовательности(ей) константной области в рекомбинантных клетках-хозяевах, которые описаны в настоящем документе.
Анти-NRR Notch1-антитела согласно изобретению, обладающие уникальными свойствами, описанными в настоящем документе, могут быть получены в результате скрининга клонов анти-NRR Notch1-гибридом в отношении требуемых свойств любым удобным способом. Например, если требуется моноклональное анти-NRR Notch1-антитело, которое блокирует или которое не блокирует связывание лиганда Notch1 с Notch1, то выбранное в качестве кандидата антитело может быть тестировано в анализе конкурентного связывания, таком как анализ конкурентного связывания ELISA, при этом лунки планшета покрывают Notch1, а раствор антитела в присутствии избытка Notch1 наслаивают на покрытые планшеты, и связанное антитело выявляют ферментативно, например, обеспечивая контакт связанного антитела с анти-Ig-антителом, конъюгированным с HRP, или с биотинилированным анти-Ig-антителом и проводя цветную реакцию с HRP, например, обрабатывая планшеты стрептавидином-HRP и/или пероксидом водорода и регистрируя цветную реакцию с HRP с помощью спектрофотомерии при 490 нм, используя считывающее устройство для планшетов для ELISA.
Если требуется анти-NRR Notch1-антитело, которое ингибирует рост клеток, то выбранное в качестве кандидата антитело может быть тестировано в анализах in vitro и/или in vivo, в которых измеряют ингибирование клеточного роста. Такие анализы известны в данной области и дополнительно описаны и проиллюстрированы в настоящем описании.
В одном варианте настоящее изобретение относится к измененному антителу, которое обладает некоторыми, но не всеми эффекторными функциями, которые делают его требуемым кандидатом для многих применений, при которых важным является время полужизни антитела in vivo, однако некоторые эффекторные функции (такие как комплемент и ADCC) являются необязательными или вредными. В некоторых вариантах измеряют Fc-активности полученного иммуноглобулина, чтобы удостовериться, что сохраняются только требуемые свойства. Могут быть проведены анализы цитотоксичности in vitro и/или in vivo, чтобы подтвердить уменьшение/ослабление активностей CDC и/или ADCC. Например, могут быть проведены анализы связывания Fc-рецептора (FcR), чтобы удостовериться, что отсутствует связывание антитела с FcγR (следовательно, вероятно, отсутствует активность ADCC), но сохраняется способность связывания FcRn. Основные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках суммирована в таблице 3 на странице 464 в публикации Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991). Пример анализа in vitro для оценки активности ADCC представляющей интерес молекулы описан в патентах США №№ 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в Clynes et al. PNAS (USA) 95: 652-656 (1998). Также могут быть осуществлены анализы связывания C1q для подтверждения того, что антитело неспособно связывать C1q и поэтому не имеет CDC-активности. Чтобы оценить активацию комплемента, можно осуществить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996). Связывание FcRn и определение клиренса/времени полужизни in vivo также можно осуществить, используя способы, известные в данной области, например способы, описанные в разделе «Примеры».
Векторы, клетки-хозяева и способы рекомбинации
Для рекомбинантной продукции антител согласно изобретению нуклеиновую кислоту, кодирующую антитело, выделяют и встраивают в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую антитело, легко выделяют и секвенируют, используя обычные способы (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела). Доступно множество векторов. Выбор вектора отчасти зависит от используемой клетки-хозяина. Обычно предпочтительными клетками-хозяевами являются клетки либо прокариотического, либо эукариотического происхождения (обычно клетки млекопитающих). Будет понятно, что для указанной цели можно использовать константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и что такие константные области могут быть получены от человека или любого вида животного.
a. Создание антител с использованием прокариотических клеток-хозяев:
i. Конструирование векторов
Полинуклеотидные последовательности, кодирующие полипептидные компоненты антитела согласно изобретению, могут быть получены с использованием стандартных способов рекомбинации. Требуемые полинуклеотидные последовательности могут быть выделены и секвенированы из продуцирующих антитела клеток, таких как клетки гибридомы. Альтернативно полинуклеотиды могут быть синтезированы с использованием синтезатора нуклеотидов или способов ПЦР. После получения последовательности кодирующие полипептиды встраивают в рекомбинантный вектор, способный реплицироваться и экспрессировать гетерологичные полинуклеотиды в прокариотических хозяевах. Множество векторов, которые доступны и известны в данной области, можно использовать в целях настоящего изобретения. Отбор подходящего вектора главным образом будет зависеть от размера нуклеиновых кислот, встраиваемых в вектор, и конкретной клетки-хозяина, которую необходимо трансформировать вектором. Каждый вектор содержит различные компоненты, в зависимости от его функции (амплификация или экспрессия гетерологичного полинуклеотида или и то и другое) и его совместимости с конкретной клеткой-хозяином, в которой он находится. Компоненты вектора обычно включают без ограничения: начало репликации, маркерный ген для селекции, промотор, участок связывания с рибосомой (RBS), сигнальную последовательность, вставку гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
В общем, плазмидные векторы, содержащие репликон и регуляторные последовательности, которые получают из вида, совместимого с клеткой-хозяином, используют с такими хозяевами. Вектор обычно несет сайт репликации, а также маркерные последовательности, которые способны обеспечивать фенотипическую селекцию в трансформированных клетках. Например, E. coli обычно трансформируют, используя pBR322, плазмиду, получаемую из вида E. coli. pBR322 содержит гены, кодирующие резистентность к ампициллину (Amp) и тетрациклину (Tet), и поэтому обеспечивает простые способы идентификации трансформированных клеток. pBR322, ее производные или другие плазмиды микроорганизмов или бактериофаги также могут содержать или могут быть модифицированы так, чтобы они содержали промоторы, которые могут быть использованы микроорганизмом для экспрессии эндогенных белков. Примеры производных pBR322, используемых для экспрессии конкретных антител, подробно описаны в Carter et al., патент США № 5648237.
Кроме того, фаговые векторы, содержащие репликон и регуляторные последовательности, которые совместимы с микроорганизмом-хозяином, могут быть использованы в качестве трансформирующих векторов для таких хозяев. Например, бактериофаг, такой как λGEM.TM.-11, можно использовать для получения рекомбинантного вектора, который можно применять для трансформации чувствительных клеток-хозяев, таких как E. coli LE392.
Экспрессирующий вектор согласно изобретению может содержать две или более пар промотор-цистрон, каждая из которых кодирует полипептидные компоненты. Промотор представляет собой нетранслируемую регуляторную последовательность, расположенную выше (5') от цистрона, которая модулирует его экспрессию. Прокариотические промоторы обычно делят на два класса, индуцируемые и конститутивные. Индуцируемым промотором является промотор, который инициирует повышенные уровни транскрипции цистрона, находящегося под его контролем, в ответ на изменения условий культивирования, например, присутствие или отсутствие питательного вещества или изменение температуры.
Хорошо известно большое количество промоторов, узнаваемых различными возможными клетками-хозяевами. Выбранный промотор может быть функционально связан с ДНК цистрона, кодирующей легкую или тяжелую цепь, посредством извлечения промотора из исходной ДНК с помощью расщепления ферментами рестрикции и встраивания выделенной промоторной последовательности в вектор согласно изобретению. И нативную промоторную последовательность и многие гетерологичные промоторы можно использовать для управления амплификацией и/или экспрессией генов-мишеней. В некоторых вариантах используют гетерологичные промоторы, так как они обычно обеспечивают более высокую транскрипцию и более высокие уровни экспрессированного гена-мишени по сравнению с нативным промотором полипептида-мишени.
Промоторы, подходящие для применения в случае прокариотических хозяев, включают промотор PhoA, промоторные системы β-галактамазы и лактозы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac или trc. Однако подходящими также являются и другие промоторы, которые являются функциональными в бактериях (такие как другие известные бактериальные или фаговые промоторы). Их нуклеотидные последовательности опубликованы, поэтому специалисты могут лигировать их оперативно с цистронами, кодирующими легкие и тяжелые цепи мишени (Siebenlist et al. (1980) Cell 20: 269), используя линкеры или адапторы, чтобы получить любые требуемые сайты рестрикции.
В одном аспекте изобретения каждый цистрон в рекомбинантном векторе содержит компонент в виде последовательности сигнала секреции, который управляет перемещением экспрессированных полипептидов через мембрану. В общем, сигнальная последовательность может быть компонентом вектора или она может быть частью ДНК полипептида-мишени, которую встраивают в вектор. Сигнальная последовательность, выбранная для цели настоящего изобретения, должна представлять собой последовательность, которая узнается и процессируется (т.е. отщепляется сигнальной пептидазой) в клетке-хозяине. Для прокариотических клеток-хозяев, которые не узнают и не процессируют сигнальные последовательности, нативные по отношению к гетерологичным полипептидам, сигнальную последовательность заменяют выбранной прокариотической сигнальной последовательностью, например, из группы, состоящей из лидеров щелочной фосфатазы, пенициллиназы, Ipp или термостабильного энтеротоксина II (STII), LamB, PhoE, PeIB, OmpA и MBP. В одном варианте осуществления изобретения сигнальными последовательностями, используемыми в обоих цистронах системы экспрессии, являются сигнальные последовательности STII или их варианты.
В другом аспекте продуцирование иммуноглобулинов согласно изобретению может происходить в цитоплазме клетки-хозяина, и поэтому не требуется присутствие сигнальных последовательностей секреции в каждом цистроне. В этом отношении легкие и тяжелые цепи иммуноглобулинов экспрессируются, подвергаются фолдингу и сборке с образованием функциональных иммуноглобулинов в цитоплазме. Некоторые штаммы-хозяева (например, штаммы E. coli trxB-) обеспечивают условия в цитоплазме, которые благоприятны для образования дисульфидной связи, таким образом обеспечивая правильный фолдинг и сборку экспрессированных субъединиц белка. Proba and Pluckthun Gene, 159: 203 (1995).
Прокариотические клетки-хозяева, подходящие для экспрессии антител согласно изобретению, включают Archaebacteria и Eubacteria, такие как грамотрицательные или грамположительные организмы. Примеры применимых бактерий включат Escherichia (например E. coli), Bacilli (например, B. subtilis), Enterobacteria, виды Pseudomonas (например, P. aeruginosa), Salmonella typhimurium, Serratia marcescans, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном варианте используют грамотрицательные клетки. В одном варианте для изобретения используют клетки E. coli в качестве хозяев. Примеры штаммов E. coli включат штамм W3110 (Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, D. C: American Society for Microbiology, 1987), pp. 1190-1219; ATCC депозит № 27325) и его производные, включая штамм 33D3, имеющий генотип W3110 ΔfhuA (ΔtonA)ptr3 lac Ig lacL8 ΔompTΔ(nmpc-fepE) degP41 kanR (патент США № 5639635). Также подходящими являются другие штаммы и их производные, такие как E. coli 294 (ATCC 31446), E. coli B, E. coliλ 1776 (ATCC 31537) и E. coli RV308 (ATCC 31608). Приведенные примеры являются иллюстративными, а не ограничивающими. Способы конструирования производных любой из указанных выше бактерий, имеющих определенные генотипы, известны в данной области и описаны, например, в Bass et al., Proteins, 8: 309-314 (1990). Обычно необходимо отбирать подходящие бактерии, принимая во внимание способность репликона к репликации в клетках бактерии. Например, E. coli, Serratia или виды Salmonella могут подходить для использования в качестве хозяина, когда используют хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410, для обеспечения репликона. Обычно клетка-хозяин должна секретировать минимальные количества протеолитических ферментов, и желательно могут быть введены дополнительные ингибиторы протеаз в культуру клеток.
ii. Продукция антител
Клетки-хозяева трансформируют описанными выше экспрессирующими векторами и культивируют в подходящей питательной среде, модифицированной соответствующим образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности.
Трансформация означает введение ДНК в прокариотического хозяина так, чтобы ДНК была реплицируемой либо в виде внехромосомного элемента, либо в виде интегрированного в хромосому элемента. В зависимости от используемой клетки-хозяина трансформацию осуществляют, используя стандартные способы, подходящие для таких клеток. Обработку кальцием с использованием хлорида кальция обычно применяют в случае бактериальных клеток, которые имеют прочные барьеры в виде клеточных стенок. В другом способе трансформации используют полиэтиленгликоль/ДМСО. В еще одном способе используют электропорацию.
Прокариотические клетки, используемые для получения полипептидов согласно изобретению, выращивают в средах, известных в данной области и подходящих для культивирования выбранных клеток-хозяев. Примеры подходящих сред включают бульон Луриа (LB) плюс необходимые добавки питательных веществ. В некоторых вариантах среда также содержит агент для селекции, выбранный на основе конструкции экспрессирующего вектора, избирательно позволяющий расти прокариотическим клеткам, содержащим экспрессирующий вектор. Например, в среду добавляют ампициллин для роста клеток, экспрессирующих ген резистентности к ампициллину.
Любые другие необходимые добавки кроме источников углерода, азота и неорганического фосфата также могут быть включены в подходящих концентрациях посредством введения по отдельности или в виде смеси с другой добавкой или средой, такой как комплексный источник азота. Необязательно культуральная среда может содержать один или несколько восстановителей, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликоллата, дитиоэритритола и дитиотреитола.
Прокариотические клетки-хозяева культивируют при подходящих температурах. Для роста E. coli, например, предпочтительная температура находится в диапазоне примерно от 20ºC до примерно 39ºC, более предпочтительно примерно от 25ºC до примерно 37ºC, еще более предпочтительно примерно 30ºC. Значение pH среды может быть любым в диапазоне pH примерно от 5 до примерно 9, главным образом в зависимости от организма-хозяина. Для E. coli pH может составлять примерно от 6,8 до примерно 7,4 и может составлять примерно 7,0.
Если в экспрессирующем векторе согласно изобретению используют индуцируемый промотор, то экспрессию белка индуцируют в условиях, подходящих для активации промотора. В одном аспекте согласно изобретению используют промоторы PhoA для регулирования транскрипции полипептидов. Соответственно трансформированные клетки-хозяева культивируют в ограниченной по фосфату среде для индукции. Предпочтительно ограниченной по фосфату средой является среда C.R.A.P (смотри, например, Simmons et al., J. Immunol. Methods (2002), 263: 133-147). Можно использовать множество других индукторов в соответствии с используемой векторной конструкцией, как известно в данной области.
В одном варианте экспрессированные полипептиды согласно настоящему изобретению секретируются и извлекаются из периплазмы клеток-хозяев. Извлечение белка обычно заключается в разрушении микроорганизма, обычно такими способами, как осмотический шок, обработка ультразвуком или лизис. После разрушения клеток клеточные обломки или целые клетки могут быть удалены центрифугированием или фильтрованием. Белки могут быть дополнительно очищены, например, аффинной хроматографией на смоле. Альтернативно белки могут быть транспортированы в культуральную среду и выделены из нее. Клетки могут быть удалены из культуры, и надосадок культуры может быть профильтрован и сконцентрирован для дополнительной очистки полученных белков. Экспрессированные полипептиды могут быть затем выделены и идентифицированы с использованием широко известных способов, таких как электрофорез в полиакриламидном геле (ПААГ) и Вестерн-блот-анализ.
В одном аспекте изобретения продуцирование антител осуществляют в больших количествах способом ферментации. Доступны различные крупномасштабные способы ферментации с подпиткой для получения рекомбинантных белков. Крупномасштабные ферментеры имеют емкость, по меньшей мере, 1000 литров, предпочтительно имеют емкость примерно от 1000 до 100000 литров. В таких ферментерах используют лопастные мешалки для распределения кислорода и питательных веществ, особенно глюкозы (предпочтительный источник углерода/энергии). Ферментация в малом масштабе обычно относится к ферментации в ферментере, емкость которого составляет не более чем примерно 100 литров и может составлять примерно от 1 литра до примерно 100 литров.
В способе ферментации индукцию экспрессии белка обычно инициируют после того, как клетки были выращены в подходящих условиях до требуемой плотности, например, до OD550, составляющей примерно 180-220, на такой стадии клетки находятся в ранней стационарной фазе. Можно использовать множество индукторов в соответствии с используемой векторной конструкцией, которые известны в данной области и описаны выше. Клетки можно выращивать в течение более коротких периодов до индукции. Клетки обычно индуцируют примерно в течение 12-50 часов, хотя можно использовать более длительные или более короткие периоды времени инкубации.
Чтобы повысить выход продукции и качество полипептидов согласно изобретению, можно модифицировать различные условия ферментации. Например, чтобы улучшить правильную сборку и фолдинг секретируемых полипептидов антител, можно использовать дополнительные векторы, сверхэкспрессирующие белки шапероны, такие как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил-цис,транс-изомераза с активностью шаперона), для котрансфекции прокариотических клеток-хозяев. Показано, что белки-шапероны облегчают правильный фолдинг и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen et al. (1999) J. Bio. Chem. 274: 19601-19605; Georgiou et al., патент США № 6083715; Georgiou et al., патент США № 6027888; Bothmann and Pluckthun (2000) J. Biol Chem. 275: 17100-17105; Ramm and Pluckthun (2000) J. Biol. Chem. 275: 17106-17113; Arie et al. (2001) Mol. Microbiol. 39: 199-210.
Чтобы минимизировать протеолиз экспрессированных гетерологичных белков (особенно белков, которые являются протеолитически чувствительными), для настоящего изобретения можно использовать некоторые штаммы-хозяева, дефицитные по протеолитическим ферментам. Например, штаммы клеток-хозяев могут быть модифицированы, чтобы осуществить генетическую мутацию(ии) в генах, кодирующих известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их сочетания. Некоторые дефицитные по протеазам штаммы E. coli доступны и описаны, например, в Joly et al. (1998), выше; Georgiou et al., патент США № 5264365; Georgiou et al., патент США № 5508192; Hara et al., Microbial Drug Resistance, 2: 63-72 (1996).
В одном варианте штаммы E. coli, дефицитные по протеолитическим ферментам и трансформированные плазмидами, сверхэкспрессирующими один или несколько белков-шаперонов, используют в качестве клеток-хозяев в системе экспрессии согласно изобретению.
iii. Очистка антител
Можно использовать стандартные способы очистки белков, известные в данной области. Примерами подходящих способов очистки являются следующие способы: фракционирование на иммуноаффинных или ионообменных колонках, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на диоксиде кремния или на катионообменной смоле, такой как DEAE, хроматофокусировка, SDS-ПААГ, преципитация сульфатом аммония и гель-фильтрация с использованием, например, сефадекса G-75.
В одном аспекте белок A, иммобилизованный на твердой фазе, используют для иммуноаффинной очистки продуктов в виде полноразмерных антител согласно изобретению. Белок A представляет собой белок клеточной стенки с молекулярной массой 41 кДа Staphylococcus aureus, который связывается с высокой аффинностью с областью Fc антител. Lindmark et al. (1983) J. Immunol. Meth. 62: 1-13. Твердой фазой, на которой иммобилизуют белок A, предпочтительно является колонка, имеющая стеклянную поверхность или поверхность из диоксида кремния, более предпочтительно стеклянная колонка с контролируемым размером пор или колонка с кремниевой кислотой. В некоторых применениях колонка покрыта реагентом, таким как глицерин, чтобы попытаться предотвратить неспецифичную адгезию загрязняющих веществ.
В качестве первой стадии очистки препарат, полученный из культуры клеток, как описано выше, наносят на твердую фазу с иммобилизованным белком A, обеспечивая специфичное связывание представляющего интерес антитела с белком A. Затем твердую фазу промывают, чтобы удалить примеси, неспецифично связанные с твердой фазой. Наконец представляющее интерес антитело извлекают с твердой фазы элюированием.
b. Создание антител с использованием эукариотических клеток-хозяев:
К компонентам векторов обычно относятся без ограничения один или несколько из следующих компонентов: сигнальная последовательность, начало репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
(i) Компонент - сигнальная последовательность
Вектор для применения в эукариотической клетке-хозяине также может содержать сигнальную последовательность или другой полипептид, имеющий специфичный сайт расщепления на N-конце представляющего интерес зрелого белка или полипептида. Предпочтительно выбранная гетерологичная сигнальная последовательность представляет собой последовательность, которая узнается и процессируется (т.е. отщепляется сигнальной пептидазой) клеткой-хозяином. Для экспрессии в клетках млекопитающих имеются сигнальные последовательности млекопитающих, а также вирусные лидеры секреции, например, сигнал простого герпеса gD.
ДНК для такой области предшественника лигируют в рамке считывания с ДНК, кодирующей антитело.
(ii) Начало репликации
В общем, компонент, представленный началом репликации, не является необходимым для экспрессирующих векторов млекопитающих. Например, начало SV40 обычно можно использовать только потому, что оно содержит ранний промотор.
(iii) Компонент - ген для селекции
Экспрессирующие и клонирующие векторы могут содержать ген для селекции, также называемый селектируемым маркером. Обычно селектируемые гены кодируют белки, которые (a) придают резистентность к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) комплементируют ауксотрофные дефициты в соответствующем случае, или (c) снабжают необходимыми питательными веществами, недоступными из сложных сред.
В одном примере схемы селекции используют лекарственное средство для задержки роста клетки-хозяина. Те клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, придающий резистентность к лекарственному средству, и таким образом выживают в режиме селекции. В примерах такой доминантной селекции используют лекарственные средства неомицин, микофеноловую кислоту и гигромицин.
Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются маркеры, которые обеспечивают возможность идентификации клеток, компетентных в отношении поглощения нуклеиновой кислоты антитела, такие как гены DHFR, тимидинкиназы, металлотионеина-I и -II, предпочтительно гены металлотионеинов приматов, аденозиндезаминазы, орнитиндекарбоксилазы и т.д.
Например, клетки, трансформированные селектируемым геном DHFR, сначала идентифицируют культивированием всех трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином при использовании DHFR дикого типа является линия клеток яичника китайского хомячка (CHO), дефицитных по активности DHFR (например, ATCC CRL-9096).
Альтернативно клетки-хозяева (особенно хозяева дикого типа, которые содержат эндогенную DHFR), трансформированные или котрансфицированные последовательностями ДНК, кодирующими антитело, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3'-фосфотрансфераза (APH), можно отбирать по росту клеток в среде, содержащей агент для селекции, соответствующий селектируемому маркеру, такой как аминогликозидный антибиотик, например канамицин, неомицин или G418. Смотри патент США № 4965199.
(iv) Промоторный компонент
Экспрессирующие и клонирующие векторы обычно содержат промотор, который распознается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей полипептид антитела. Известны промоторные последовательности для эукариот. Практически все эукариотические гены имеют AT-богатую область, расположенную примерно на 25-30 оснований выше сайта инициации транскрипции. Другой последовательностью, обнаруживаемой на 70-80 оснований выше старта транскрипции многих генов, является область CNCAAT, где N может быть любым нуклеотидом. На 3'-конце большинства эукариотических генов находится последовательность AATAAA, которая может быть сигналом для добавления поли-A-хвоста к 3'-концу кодирующей последовательности. Все такие последовательности соответствующим образом встраивают в эукариотические экспрессирующие векторы.
Транскрипция полипептидов антител с векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, поксвирус птиц, аденовирус (такой как аденовирус 2), вирус бычьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита-B и вирус обезьян 40 (SV40), гетерологичными промоторами млекопитающих, например, промотором актина или промотором иммуноглобулина, промоторами теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев.
Ранний и поздний промоторы вируса SV40 легко получают в виде рестрикционного фрагмента SV40, который также содержит начало репликации вируса SV40. Немедленный ранний промотор цитомегаловируса человека легко получают в виде фрагмента рестрикции HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса бычьей папилломы в качестве вектора описана в патенте США № 4419446. Модификация такой системы описана в патенте США № 4601978. Альтернативно в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса.
(v) Компонент - энхансерный элемент
Транскрипцию ДНК, кодирующей полипептид антитела согласно настоящему изобретению, высшими эукариотами часто повышают встраиванием последовательности энхансера в вектор. В настоящее время известно много энхансерных последовательностей генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако, как правило, используют энхансер из вируса эукариотических клеток. Примерами являются энхансер SV40, расположенный со стороны поздних генов по отношению к началу репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы, расположенный со стороны поздних генов по отношению к началу репликации, и аденовирусные энхансеры. Смотри также Yaniv, Nature 297: 17-18 (1982) в отношении усиливающих элементов для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положении 5' или 3' по отношению к последовательности, кодирующей полипептид антитела, но предпочтительно энхансер расположен в сайте с 5'-стороны от промотора.
(vi) Компонент для терминации транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах, обычно также будут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5'- и иногда 3'-нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Указанные области содержат нуклеотидные участки, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним из применимых компонентов для терминации транскрипции является область полиаденилирования бычьего гормона роста. Смотри WO94/11026 и описанный в настоящем документе экспрессирующий вектор.
(vii) Селекция и трансформация клеток-хозяев
Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах согласно изобретению включают клетки высших эукариот, описанные в настоящем документе, включая клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (культуре ткани) стало рутинной процедурой. Примерами применимых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen. Virol. 36: 59 (1977); клетки почки сирийского хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); клетки Сертоли мышей (TM4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крыс Buffalo (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1982)); клетки MRC 5; клетки FS4 и линия клеток гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для продукции антител и культивируют в обычных питательных средах, соответствующим образом модифицированных для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности.
(viii) Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения антитела согласно изобретению, можно культивировать во многих средах. Коммерчески доступные среды, такие как среда Хама F10 (Sigma), минимальная питательная среда ((MEM), (Sigma)), RPMI-1640 (Sigma) и модифицированная Дульбекко среда Игла ((DMEM), Sigma)), подходят для культивирования клеток-хозяев. Кроме того, любую из сред, описанных в Ham et al., Meth. Enz. 58: 44 (1979), Barnes et al., Anal. Biochem. 102: 255 (1980), патентах США №№ 4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430, WO 87/00195 или в патенте США Re. 30985, можно использовать в качестве культуральной среды для клеток-хозяев. Любая из указанных сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальций, магний и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCINTM), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, которые могут быть известны специалистам в данной области. Условия культивирования, такие как температура, pH и тому подобное, представляют собой условия, описанные ранее для клеток-хозяев, отобранных для экспрессии, и условия будут известны специалисту в данной области.
ix) Очистка антител
При использовании способов рекомбинации антитело может быть получено внутриклеточно или непосредственно секретировано в среду. Если антитело продуцируется внутриклеточно, то в качестве первой стадии частицы обломков или целые клетки или лизированные фрагменты удаляют, например, центрифугированием или ультрацентрифугированием. Когда антитело секретируется в среду, надосадки из таких систем экспрессии обычно сначала концентрируют, используя коммерчески доступный фильтр для концентрации белков, например, блок для ультрафильтрации Amicon или Millipore Pellicon. На любой из последующих стадий может быть введен ингибитор протеаз, такой как PMSF, чтобы ингибировать протеолиз, и могут быть введены антибиотики, чтобы предотвратить рост случайных загрязнений.
Композиция антител, полученных из клеток, может быть очищена с использованием, например, хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии, при этом аффинная хроматография является предпочтительным способом очистки. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в антителе. Белок A можно использовать для очистки антител, которые основаны на тяжелых цепях γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для γ3 человека (Guss et al., EMBO J. 5: 1567-1575 (1986)). Матрицей, с которой связывают аффинный лиганд, наиболее часто является агароза, но имеются и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают возможность более высоких скоростей потока и более коротких периодов времени обработки, чем можно достичь в случае агарозы. В том случае, когда антитело содержит домен CH3, для очистки применима смола Bakerbond ABXTM (J. T. Baker, Phillipsburg, NJ). Также доступны другие способы очистки белка, такие как фракционирование на ионообменной колонке, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на диоксиде кремния, хроматография на гепарин-сефарозе, хроматография на анионообменной или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусировка, SDS-ПААГ и преципитация сульфатом аммония, в зависимости от антитела, которое необходимо извлечь.
После какой-либо предварительной стадии (стадий) очистки смесь, содержащую представляющее интерес антитело и загрязняющие примеси, подвергают хроматографии, основанной на гидрофобном взаимодействии, при низком значении pH, используя буфер для элюирования с pH в диапазоне примерно 2,5-4,5, предпочтительно осуществляемой при низких концентрациях соли (например, при концентрации соли примерно 0-0,25 М).
Иммуноконъюгаты
Изобретение также относится к иммуноконъюгатам (взаимозаменяемо называемым «конъюгатами антитело-лекарственное средство» или «ADC»), содержащим любое из анти-NRR Notch-антител, описанных в настоящем документе, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, лекарственное средство, ингибирующее рост средство, токсин (например, ферментативно активный токсин, происходящий из клеток бактерий, грибов, растений или животных, или его фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических средств, т.е. лекарственных средств для убивания или ингибирования опухолевых клеток при лечении злокачественной опухоли (Syrigos and Epenetos (1999) Anticancer Research 19: 605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg. Del. Rev. 26: 151-172; патент США 4975278), обеспечивает возможность целенаправленной доставки компонента, представленного лекарственным средством, к опухолям и внутриклеточного накопления в опухоли, когда системное введение таких неконъюгированных лекарственных средств может приводить к недопустимым уровням токсичности по отношению к нормальным клеткам, так же как к опухолевым клеткам, которые стремятся удалить (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986): 603-05; Thorpe, (1985) «Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review», в Monoclonal Antibodies '84: Biological and Clinical Applications, A. Pinchera et al. (eds.), pp. 475-506). При этом добиваются максимальной эффективности при минимальной токсичности. Сообщалось, что и поликлональные антитела и моноклональные антитела применимы в таких способах (Rowland et al., (1986) Cancer Immunol. Immunother., 21: 183-87). Лекарственные средства, применимые в таких способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986), выше). Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al. (2000) Jour. of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al. (2000) Bioorganic and Med. Chem. Letters 10: 1025-1028; Mandler et al. (2002) Bioconjugate Chem. 13: 786-791), мейтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93: 8618-8623), и калихеамицин (Lode et al (1998) Cancer Res. 58: 2928; Hinman et al. (1993) Cancer Res. 53: 3336-3342). Токсины могут осуществлять свое цитотоксическое и цитостатическое влияние посредством механизмов, включающих связывание тубулина, связывание ДНК или ингибирование топоизомераз. Некоторые цитотоксические лекарственные средства склонны к инактивации или становятся менее активными при конъюгировании с крупными антителами или белковыми лигандами рецепторов.
ZEVALIN® (ибритумомаб тиуксетан, Biogen/Idec) является конъюгатом антитело-радиоизотоп, состоящим из мышиного моноклонального антитела IgG1 каппа, направленного против антигена CD20, находящегося на поверхности нормальных и злокачественных B-лимфоцитов, и радиоактивного изотопа 111In или 90Y, связанного посредством тиомочевинного линкера-хелатора (Wiseman et al. (2000) Eur. Jour. Nucl. Med. 27(7): 766-77; Wiseman et al (2002) Blood 99(12): 4336-42; Witzig et al. (2002) J. Clin. Oncol. 20(10): 2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15): 3262-69). Хотя зевалин обладает активностью, направленной против B-клеточной неходжкинской лимфомы (NHL), введение приводит к тяжелым и продолжительным цитопениям у большинства пациентов. MYLOTARGTM (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящий из антитела hu-CD33, связанного с калихеамицином, одобрен в 2000 году для лечения острого миелоидного лейкоза посредством инъекции (Drugs of the Future (2000) 25(7): 686; патенты США №№ 4970198, 5079233, 5585089, 5606040, 5693762, 5739116, 5767285, 5773001). Кантузумаб мертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, связанного посредством дисульфидного линкера SPP с компонентом в виде мейтанзиноидного лекарственного средства, DM1, прошел в фазу II испытаний в отношении лечения злокачественных опухолей, которые экспрессируют CanAg, таких как злокачественные опухоли ободочной кишки, поджелудочной железы, желудка и другие. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела против специфичного для простаты мембранного антигена (PSMA), связанного с компонентом в виде мейтанзиноидного лекарственного средства, DM1, разрабатывается для возможного лечения опухолей простаты. Ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали с химерными моноклональными антителами cBR96 (специфичными к Y Льюиса на карциномах) и cAC10 (специфичными к CD30 на гематологических злокачественных новообразованиях) (Doronina et al. (2003) Nature Biotechnology 21(7): 778-784), и конъюгаты используются для разработки терапевтических средств.
Химиотерапевтические средства, пригодные для создания таких иммуноконъюгатов, описаны в настоящем документе (например, выше). Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают цепь A дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модекцина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolacca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Смотри, например, WO 93/21232, опубликованную 28 октября 1993 г. Множество радионуклидов доступно для получения антител, конъюгированных с радионуклидами. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антитела и цитотоксического средства получают, используя множество бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат·HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al. Science 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгирования радионуклида с антителом. Смотри WO94/11026.
Конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, мейтанзиноиды, доластатины, ауростатины, трихотецен и CC1065 и производные таких токсинов, которые обладают активностью токсинов, также рассматриваются в настоящем изобретении.
i. Мейтанзин и мейтанзиноиды
В некоторых вариантах иммуноконъюгат содержит антитело (полноразмерное или фрагменты) согласно изобретению, конъюгированное с одной или несколькими молекулами мейтанзиноидов.
Мейтанзиноиды являются ингибиторами митоза, которые действуют, ингибируя полимеризацию тубулина. Мейтанзин впервые был выделен из восточно-африканского кустарника Maytenus serrata (патент США № 3896111). Затем было обнаружено, что некоторые микроорганизмы также продуцируют мейтанзиноиды, такие как мейтанзинол и сложные C-3-мейтанзиноловые эфиры (патент США № 4151042). Синтетический мейтанзинол и его производные и аналоги описаны, например, в патентах США №№ 4137230, 4248870, 4256746, 4260608, 4265814, 4294757, 4307016, 4308268, 4308269, 4309428, 4313946, 4315929, 4317821, 4322348, 4331598, 4361650, 4364866, 4424219, 4450254, 4362663 и 4371533.
Остатки в виде мейтанзиноидных лекарственных средств являются привлекательными остатками лекарственных средств в конъюгатах антитело-лекарственное средство, поскольку они являются: (i) относительно доступными для получения посредством ферментации или химической модификации, дериватизации продуктов ферментации, (ii) поддающимися дериватизации функциональными группами, подходящими для конъюгирования посредством недисульфидных линкеров с антителами, (iii) стабильными в плазме и (iv) эффективными против различных линий опухолевых клеток.
Иммуноконъюгаты, содержащие мейтанзиноиды, способы их получения и их терапевтическое применение описаны, например, в патентах США №№ 5208020, 5416064 и в европейском патенте EP 0425235 B1, описания которых специально включены в настоящее описание в виде ссылки. В публикации Liu et al., Proc. Natl. Acad. Sci. USA 93: 8618-8623 (1996) описаны иммуноконъюгаты, содержащие мейтанзиноид, называемый DM1, связанный с моноклональным антителом C242, направленным против злокачественной опухоли прямой и ободочной кишки человека. Обнаружено, что конъюгат является высокоцитотоксичным по отношению к культивируемым злокачественным клеткам ободочной кишки и проявляет противоопухолевую активность в анализе роста опухоли in vivo. В Chari et al., Cancer Research 52: 127-131 (1992) описаны иммуноконъюгаты, в которых мейтанзиноид конъюгирован посредством дисульфидного линкера с мышиным антителом A7, связывающимся с антигеном на линиях злокачественных клеток ободочной кишки человека, или с другим мышиным моноклональным антителом TA.1, которое связывает онкоген HER-2/neu. Цитотоксичность конъюгата TA.1-мейтанзиноид тестировали in vitro на линии злокачественных клеток молочной железы человека SK-BR-3, которая экспрессирует 3×105 поверхностных антигенов HER-2 на клетку. Конъюгат с лекарственным средством достигает степени цитоксичности, сходной с цитотоксичностью свободного мейтанзиноидного лекарственного средства, которая может быть повышена в результате увеличения количества молекул мейтанзиноида на молекулу антитела. Конъюгат A7-мейтанзиноид проявлял низкую системную цитотоксичность у мышей.
Конъюгаты антитело-мейтанзиноид получают химическим связыванием антитела с молекулой мейтанзиноида без существенного снижения биологической активности антитела и молекулы мейтанзиноида. Смотри, например, патент США № 5208020 (описание которого специально включено в настоящее описание в виде ссылки). Показано, что в среднем 3-4 молекулы мейтанзиноида, конъюгированных с молекулой антитела, эффективны для усиления цитотоксичности для клеток-мишеней без негативного влияния на функцию или растворимость антитела, хотя можно ожидать, что даже одна молекула токсин/антитело усиливает цитотоксичность по сравнению с применением «голого» антитела. Мейтанзиноиды хорошо известны в данной области и могут быть синтезированы известными способами или выделены из природных источников. Подходящие мейтанзиноиды описаны, например, в патенте США № 5208020 и в других патентах и непатентных публикациях, ссылки на которые указаны выше. Предпочтительными мейтанзиноидами являются мейтанзинол и аналоги мейтанзинола, модифицированные в ароматическом цикле или в других положениях молекулы мейтанзинола, такие как различные сложные мейтанзиноловые эфиры.
Существует много связывающих групп, известных в данной области, для получения конъюгатов антитело-мейтанзиноид, включая, например, группы, описанные в патенте США № 5208020 или патенте EP 0425235 B1 и в Chari et al., Cancer Research 52: 127-131 (1992), и в заявке на выдачу патента США № 10/960602, поданной 8 октября 2004 года, описание которых специально включено в настоящее описание в виде ссылки. Конъюгаты антитело-мейтанзиноид, содержащие линкерный компонент SMCC, могут быть получены, как описано в заявке на выдачу патента США с регистрационным номером 10/960602, поданной 8 октября 2004 г. Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, не устойчивые к действию пептидазы группы или не устойчивые к действию эстеразы группы, которые описаны в указанных выше патентах, при этом предпочтительными являются дисульфидные и тиоэфирные группы. Дополнительные связывающие группы описаны и приведены в качестве примеров в настоящем описании.
Конъюгаты антитела и мейтанзиноида могут быть получены с использованием множества бифункциональных, связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат·HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительными связывающими агентами являются N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173: 723-737 [1978]) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP), обеспечивающие образование дисульфидной связи.
Линкер может быть связан с молекулой мейтанзиноида в разных положениях, в зависимости от типа связи. Например, сложноэфирная связь может быть образована при взаимодействии с гидроксильной группой с использованием обычных способов связывания. Реакция может осуществляться в положении C-3, имеющем гидроксильную группу, в положении C-14, модифицированном гидроксиметилом, в положении C-15, модифицированном гидроксильной группой, и в положении C-20, имеющем гидроксильную группу. В предпочтительном варианте связь образуется в положении C-3 мейтанзинола или аналога мейтанзинола.
ii. Ауристатины и доластатины
В некоторых вариантах иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с доластатинами или пептидными аналогами и производными доластатина, ауристатинами (патенты США №№ 5635483 и 5780588). Показано, что доластатины и ауристатины отрицательно влияют на динамику микротрубочек, гидролиз GTP и деление ядер и клеток (Woyke et al. (2001) Antimicrob. Agents and Chemother. 45(12): 3580-3584) и обладают противоопухолевой (патент США № 5663149) и противогрибковой активностью (Pettit et al., (1998) Antimicrob. Agents Chemother. 42: 2961-2965). Остатки лекарственных средств доластатина или ауристатина могут быть связаны с антителом через N-конец (амино-конец) или C-конец (карбоксильный конец) остатка пептидного лекарственного средства (WO 02/088172).
Примеры вариантов с использованием ауристатинов включают связываемые на N-конце остатки лекарственного средства монометилауристатина DE и DF, описанные в заявке на выдачу патента США «Monomethylvaline Compounds Capable of Conjugation to Ligands», с регистрационным номером 10/983340 от 5 ноября 2004 г., описание которой специально включено в виде ссылки в полном объеме.
Обычно остатки основанных на пептидах лекарственных средств могут быть получены посредством образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, согласно способу синтеза в жидкой фазе (смотри E. Schröder and K. Lübke, "The Peptides", volume 1, pp. 76-136, 1965, Academic Press), который хорошо известен в области химии пептидов. Остатки лекарственных средств ауристатина/доластатина могут быть получены согласно способам, описанным в патентах США №№ 5635483 и 5780588; в публикациях Pettit et al., (1989) J. Am. Chem. Soc. 111: 5463-5465; Pettit et al., (1998) Anti-Cancer Drug Design 13: 243-277; Pettit, G. R., et al., Synthesis, 1996, 719-725; и Pettit et al., (1996) J. Chem. Soc. Perkin Trans. 15: 859-863. Также смотри Doronina (2003) Nat. Biotechnol. 21(7): 778-784; заявку на выдачу патента США «Monomethylvaline Compounds Capable of Conjugation to Ligands» с регистрационным номером № 10/983340, поданную 5 ноября 2004 г., указанные публикации включены в настоящее описание в виде ссылки в полном объеме (в них раскрыты, например, линкеры и способы получения монометилвалиновых соединений, таких как MMAE и MMAF, конъюгированных с линкерами).
iii. Калихеамицин
В других вариантах иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с одной или несколькими молекулами калихеамицина. Калихеамициновое семейство антибиотиков способно образовывать двунитевые разрывы ДНК в субпикомолярных концентрациях. Получение конъюгатов семейства калихеамицина смотри в патентах США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все American Cyanamid Company). Структурные аналоги калихеамицина, которые могут быть использованы, включают без ограничения γ1 I, α2 I, α3 I, N-ацетил-γ1 I, PSAG и θI 1 (Hinman et al., Cancer Research 53: 3336-3342 (1993), Lode et al., Cancer Research 58: 2925-2928 (1998) и указанные выше патенты США, принадлежащие American Cyanamid). Другим противоопухолевым лекарственным средством, с которым может быть конъюгировано антитело, является QFA, который представляет собой антифолат. Как калихеамицин, так и QFA имеют внутриклеточные места действия и с трудом проходят через плазматическую мембрану. Поэтому поглощение клетками указанных средств благодаря опосредованной антителами интернализации значительно усиливает их цитотоксическое действие.
iv. Другие цитотоксические средства
Другие противоопухолевые средства, которые могут быть конъюгированы с антителами согласно изобретению, включают BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство агентов, вместе известных как комплекс LL-E33288, описанных в патентах США 5053394, 5770710, а также эсперамицины (патент США 5877296).
Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают цепь A дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модекцина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, неомицин и трикотецены. Смотри, например, WO 93/21232, опубликованную 28 октября 1993 г.
Настоящее изобретение, кроме того, охватывает иммуноконъюгат, образованный между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Для избирательного разрушения опухоли антитело может содержать высокорадиоактивный атом. Множество радиоактивных изотопов доступно для получения радиоконъюгированных антител. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. В том случае, когда конъюгат используют для выявления, он может содержать радиоактивный атом для сцинтиографических исследований, например Tc99m или I123, или спиновую метку для ядерной магнитно-резонансной (ЯМР) визуализации (также известной как магнитно-резонансная визуализация, MRI), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть включены в конъюгат известными способами. Например, пептид может быть биологически синтезирован или может быть синтезирован посредством химического синтеза из аминокислот с использованием подходящих предшественников аминокислот, содержащих, например, фтор-19 вместо водорода. Такие метки, как Tc99m или I123, Re186, Re188 и In111, могут быть связаны с пептидом через остаток цистеина. Иттрий-90 может быть связан через остаток лизина. Способ IODOGEN (Fraker et al. Biochem. Biophys. Res. Commun. 80: 49-57 (1978)) можно использовать для включения йода-123. В «Monoclonal Antibodies in Immunoscintigraphy (Chatal, CRC Press 1989) подробно описаны другие способы.
Конъюгаты антитела и цитотоксического средства могут быть получены с использованием множества бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат·HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например иммунотоксин рицин может быть получен, как описано в Vitetta et al. Science 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгирования радионуклида с антителом. Смотри WO94/11026. Линкер может представлять собой «отщепляемый линкер», облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, линкер на основе диметила или линкер, содержащий дисульфид (Chari et al., Cancer Research. 52: 127-131 (1992); патент США № 5208020).
Соединения согласно изобретению, в частности, включают, но не ограничены указанным, ADC, приготовленный с использованием поперечно сшивающих реагентов: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, из Pierce Biotechnology, Inc., Rockford, IL., U.S.A). Смотри страницы 467-498, 2003-2004 Applications Handbook and Catalog.
Получение конъюгатов антитело-лекарственное средство
В конъюгатах антитело-лекарственное средство (ADC) согласно изобретению антитело (Ab) конъюгируют с одним или несколькими остатками лекарственного средства (D), например, примерно от 1 до примерно 20 остатков лекарственного средства на антитело, через линкер (L). ADC формулы I может быть получен несколькими путями с использованием реакций органической химии, условий и реагентов, известных специалистам в данной области, включая: (1) взаимодействие нуклеофильной группы антитела с бивалентным линкерным реагентом с образованием Ab-L посредством ковалентной связи с последующим взаимодействием с остатком лекарственного средства D; и (2) взаимодействие нуклеофильной группы остатка лекарственного средства с бивалентным линкерным реагентом с образованием D-L посредством ковалентной связи с последующим взаимодействием с нуклеофильной группой антитела. Дополнительные способы получения ADC описаны в настоящем документе.
Линкер может состоять из одного или нескольких линкерных компонентов. Примерами линкерных компонентов являются 6-малеимидокапроил («MC»), малеимидопропаноил («MP»), валин-цитруллин («val-cit»), аланин-фенилаланин («ala-phe»), пара-аминобензилоксикарбонил («PAB»), N-сукцинимидил-4-(2-пиридилтио)пентаноат («SPP»), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат («SMCC») и N-сукцинимидил(4-йодацетил)аминобензоат («SIAB»). Дополнительные линкерные компоненты известны в данной области, и некоторые из них описаны в настоящем документе. Смотри также «Monomethylvaline Compounds Capable of Conjugation to Ligands», с регистрационным № 10/983340, поданную 5 ноября 2004 г., содержание которой включено в настоящее описание в виде ссылки в полном объеме.
В некоторых вариантах линкер может содержать аминокислотные остатки. Примеры аминокислотных линкерных компонентов включают дипептид, трипептид, тетрапептид или пентапептид. Примеры дипептидов включают: валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Примеры трипептидов включают: глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, которые содержат аминокислотный линкерный компонент, включают встречающиеся в природе остатки, а также минорные аминокислоты и не встречающиеся в природе аналоги аминокислот, такие как цитруллин. Аминокислотные линкерные компоненты могут быть сконструированы и оптимизированы в отношении их избирательности к ферментативному расщеплению конкретными ферментами, например, ассоциированной с опухолью протеазой, катепсином B, C и D или протеазой плазмином.
Нуклеофильные группы антител включают без ограничения: (i) N-концевые аминогруппы, (ii) аминогруппы боковых цепей, например, лизина, (iii) тиольные группы боковых цепей, например, цистеина, и (iv) гидроксил сахара или аминогруппы, в которых антитело гликозилируется. Аминогруппы, тиольные и гидроксильные группы являются нуклеофильными и способны взаимодействовать с образованием ковалентных связей с электрофильными группами на линкерных остатках и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные NHS-эфиры, сложные HOBt-эфиры, галогенформиаты и галогенангидриды; (ii) алкилгалогениды и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы. Некоторые антитела имеют восстанавливаемые межцепочечные дисульфидные, т.е. цистеиновые мостики. Антитела могут быть сделаны химически активными для конъюгирования с линкерными реагентами обработкой восстановителем, таким как DTT (дитиотреитол). Таким образом, каждый цистеиновый мостик теоретически будет образовывать два химически активных тиольных нуклеофила. Дополнительные нуклеофильные группы могут быть введены в антитела посредством взаимодействия лизинов с 2-иминотиоланом (реагентом Трота), приводящего к превращению амина в тиол. Химически активные тиольные группы могут быть введены в антитело (или его фрагмент) с помощью введения одного, двух, трех, четырех или более остатков цистеина (например, в результате получения мутантных антител, содержащих один или несколько не нативных аминокислотных остатков цистеина).
Конъюгаты антитело-лекарственное средство согласно изобретению также могут быть получены при модификации антитела с целью введения электрофильных остатков, которые могут взаимодействовать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител могут быть окислены, например, окисляющими реагентами на основе периодата, с образованием альдегидной или кетоновой группы, которые могут взаимодействовать с аминогруппой линкерных реагентов или остатков лекарственных средств. Полученные в результате иминогруппы основания Шиффа могут образовывать стабильную связь или могут быть восстановлены, например, борогидридными реагентами с образованием стабильных аминных связей. В одном варианте взаимодействие углеводной части гликозилированного антитела либо с оксидазой галактозы, либо с мета-периодатом натрия может давать карбонильные (альдегидные и кетоновые) группы в белке, которые могут взаимодействовать с подходящими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте белки, содержащие N-концевые остатки серина или треонина, могут взаимодействовать с мета-периодатом натрия, приводя к получению альдегида вместо первой аминокислоты (Geoghegan and Stroh, (1992) Bioconjugate Chem. 3: 138-146; патент США № US 5362852). Такой альдегид может быть подвергнут взаимодействию с остатком лекарственного средства или нуклеофильным линкером.
Подобным образом, нуклеофильные группы на остатке лекарственного средства включают без ограничения: амин, тиол, гидроксил, группы гидразида, оксима, гидразина, тиосемикарбазона, карбоксилата гидразина и арилгидразида, способные взаимодействовать с образованием ковалентных связей с электрофильными группами на линкерных остатках и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные NHS-эфиры, сложные HOBt-эфиры, галогенформиаты и галогенангидриды; (ii) алкилгалогениды и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Альтернативно слитый белок, содержащий антитело и цитотоксическое средство, может быть получен, например, способами на основе рекомбинации или пептидным синтезом. В длину ДНК могут быть включены соответствующие области, кодирующие две части конъюгата, либо расположенные рядом друг с другом, либо разделенные областью, кодирующей линкерный пептид, который не нарушает требуемые свойства конъюгата.
В еще одном варианте антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) в случае применения для предварительного направления к опухоли, когда конъюгат антитело-рецептор вводят пациенту, с последующим удалением несвязанного конъюгата из кровообращения с использованием хелатирующего агента и затем введением «лиганда» (например, авидина), который конъюгируют с цитотоксическим средством (например, радионуклидом).
Фармацевтические препараты
Терапевтические препараты, содержащие антитело согласно изобретению, готовят для хранения смешиванием антитела, имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington: The Science and Practice of Pharmacy 20th edition (2000)), в форме водных растворов, лиофилизованных или других высушенных препаратов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат, гистидин и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); полипептиды с низкой молекулярной массой (примерно меньше 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как твин, плюроники или полиэтиленгликоль (ПЭГ).
Препарат согласно изобретению также может содержать более одного активного соединения, которое необходимо для лечения конкретного состояния, предпочтительно соединения с дополняющими активностями, которые не оказывают неблагоприятного влияния друг на друга. Такие молекулы соответственно присутствуют в сочетании в количествах, которые являются эффективными для предполагаемой цели.
Активные ингредиенты также могут быть заключены в микрокапсулы, приготовленные, например, способами коацервации или полимеризации на границе фаз, например, микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметакрилата), соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington: The Science and Practice of Pharmacy 20th edition (2000).
Препараты, используемые для введения in vivo, должны быть стерильными. Это легко осуществить, например, фильтрованием через стерильные фильтрующие мембраны.
Могут быть приготовлены препараты длительного высвобождения. Подходящие примеры препаратов длительного высвобождения включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие иммуноглобулин согласно изобретению, и такие матрицы имеют форму определенных изделий, например, пленок или микрокапсул. Примеры матриц для длительного высвобождения включают сложные полиэфиры, гидрогели (например поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразрушаемый этилен-винилацетат, разрушаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота. В то время как такие полимеры, как этилен-винилацетат и молочная кислота-гликолевая кислота, способны высвобождать молекулы в течение более чем 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. В том случае, когда инкапсулированные иммуноглобулины остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37ºC, что приводит к потере биологической активности и возможным изменениям иммуногенности. Могут быть разработаны целесообразные методики стабилизации, в зависимости от вовлекаемого механизма. Например, если обнаружено, что механизмом агрегации является образование межмолекулярной S-S-связи в результате тиодисульфидного обмена, то стабилизация может быть достигнута посредством модификации сульфгидрильных остатков, лиофилизацией из кислых растворов, регуляцией влагосодержания, использованием соответствующих добавок и разработкой специальных композиций на основе полимерной матрицы.
Применения
Антитело согласно настоящему изобретению можно применять, например, в терапевтических способах in vitro, ex vivo и in vivo.
В одном аспекте в изобретении предлагаются способы лечения или профилактики опухоли, злокачественной опухоли и/или клеточного пролиферативного нарушения, ассоциированного с повышенной экспрессией и/или активностью (передачей сигнала) Notch1, при этом способы включают в себя введение эффективного количества анти-NRR Notch1-антитела индивидууму, нуждающемуся в таком лечении.
В другом аспекте в изобретении предлагаются способы снижения, ингибирования или предотвращения роста опухоли или злокачественной опухоли, при этом способы включают в себя введение эффективного количества анти-NRR Notch1-антитела индивидууму, нуждающемуся в таком лечении.
Кроме того, по меньшей мере, некоторые антитела согласно изобретению могут связывать антиген из других видов. Желательно, чтобы антитело против NRR Notch1 связывало как человеческий, так и мышиный NRR Notch1; желательно с Kd 1×10-7 или сильнее. Соответственно, антитела согласно изобретению можно применять для связывания специфичной антигенной активности, например, в культуре клеток, содержащей антиген, в организме человека или в организме других млекопитающих, имеющих антиген, с которым антитело согласно изобретению перекрестно взаимодействует (например, шимпанзе, павиан, мартышка, макака-крабоед и резус, свинья или мышь). В одном варианте антитело согласно изобретению можно применять для ингибирования активностей антигена, осуществляя контакт антитела с антигеном так, чтобы активность антигена была ингибирована. Предпочтительно антигеном является молекула белка человека.
В одном варианте антитело согласно изобретению можно применять в способе связывания антигена у индивидуума, страдающего от нарушения, ассоциированного с повышенной экспрессией и/или активностью (передачей сигнала) антигена, включающем введение индивидууму антитела согласно изобретению для того, чтобы связать антиген в организме индивидуума. Понятно, что повышенная активность Notch1 (передача сигналов) охватывает повышенную активность Notch1 вследствие активирующих мутаций Notch, повышенную активность Notch1 вследствие повышенной экспрессии и/или активности лигандов Notch, а также повышенную активность Notch1 вследствие других механизмов. Предпочтительно антигеном является молекула белка человека, и индивидуумом является человек. Альтернативно индивидуумом может быть млекопитающее, экспрессирующее антиген, с которым связывается антитело согласно изобретению. Еще одним индивидуумом может быть млекопитающее, в организм которого был введен антиген (например, посредством введения антигена или в результате экспрессии трансгена антигена). Антитело согласно изобретению можно вводить человеку в терапевтических целях. Кроме того, антитело согласно изобретению можно вводить млекопитающему, отличному от человека, экспрессирующему антиген, с которым иммуноглобулин перекрестно взаимодействует (например, примату, свинье или мыши), в ветеринарных целях или в качестве модели заболевания человека на животных. Что касается последнего, то такие модели на животных можно использовать для оценки терапевтической эффективности антител согласно изобретению (например, для тестирования доз и временных курсов введения).
Антитела согласно изобретению можно применять для лечения, ингибирования, замедления прогрессирования, предотвращения/задержки рецидива, ослабления или профилактики заболеваний, нарушений или состояний, ассоциированных с экспрессией и/или активностью одной или нескольких молекул антигенов.
Примеры нарушений включают карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные заболевания. Более конкретные примеры таких злокачественных опухолей включают рак сквамозных клеток (например, рак сквамозных клеток эпителия), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, сквамозную карциному легкого, рак брюшины, гепатоклеточный рак, рак кишечника или желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, рак мочевыводящих путей, гепатому, рак молочной железы, рак ободочной кишки, рак прямой кишки, рак прямой и ободочной кишки, карциному эндометрия или матки, карциному слюнных желез, рак почек или почечный рак, рак простаты, рак вульвы, рак щитовидной железы, карциному печени, рак ануса, карциному пениса, меланому, множественную миелому и B-клеточную лимфому, рак головного мозга, а также рак головы и шеи и ассоциированные метастазы. В некоторых вариантах злокачественная опухоль выбрана из группы, состоящей из мелкоклеточного рака легкого, нейробластом, меланомы, карциномы молочной железы, рака желудка, рака прямой и ободочной кишки (CRC) и гепатоклеточной карциномы.
Антитела согласно изобретению также применимы для лечения (включая профилактику) нарушений, патология которых заключается в дегенерации или нарушении функции клеток, например, для лечения различных (хронических) нейродегенеративных нарушений и острых поражений нервных клеток. Такие нейродегенеративные нарушения включают без ограничения периферические невропатии; нарушения двигательных нейронов, такие как боковой амиотрофический склероз (ALS, болезнь Лу Герига), периферический паралич лицевого нерва и различные состояния, в которые вовлечена мышечная атрофия спинного мозга или паралич; и другие нейродегенеративные заболевания человека, такие как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, рассеянный склероз, хорея Хантингтона, синдром Дауна, нервная глухота и болезнь Меньера, и острые поражения нервных клеток, например, вследствие травмы или повреждения спинного мозга.
Активность Notch1 вовлечена в развитие различных систем стволовых клеток и клеток ранних предшественников, как в фазе развития, так и во взрослой фазе. Смотри, например, Chirba, S. (2006) Stem Cells 24: 2437-2447. Соответственно, в другом аспекте в изобретении предлагаются способы размножения не дифференцированных терминально клеток («клеток-предшественников») посредством модулирования пути Notch в клетке-предшественнике для того, чтобы ингибировать дифференцировку клетки-предшественника. В используемом в настоящем описании смысле термин «клетки-предшественники» означает любые не дифференцированные терминально клетки. Клеткой-предшественником предпочтительно является стволовая клетка или недифференцированная клетка. В некоторых вариантах в изобретении предлагаются способы размножения клеток-предшественников в популяции, содержащей клетки-предшественники, посредством активации пути Notch в клетках для того, чтобы ингибировать дифференцировку стволовой клетки. Кроме того, клетки-предшественники при необходимости могут быть выделены из популяции клеток до или после активации пути Notch. Активацию пути Notch предпочтительно осуществляют в результате контактирования клетки с агонистическим антителом против NRR Notch1.
Один из вариантов осуществления настоящего изобретения заключается в обработке требуемой популяции клеток агонистами пути Notch, и затем таким клеткам либо позволяют пролиферировать в культуре перед трансплантацией их назад в соответствующую область, либо непосредственно трансплантируют их без необходимости предоставления им возможности пролиферировать in vitro. Антагонисты можно использовать для того, чтобы отменить или нейтрализовать действие агониста функции Notch.
Увеличенные в объеме популяции стволовых клеток согласно настоящему изобретению могут быть трансплантированы в организм индивидуума для лечения заболевания или поражения или для генной терапии любым способом, известным в данной области, который подходит для данного типа трансплантируемых стволовых клеток и места трансплантации. Гематопоэтические стволовые клетки можно трансплантировать внутривенно, как, например, стволовые клетки печени, которые будут локализоваться в печени. Нервные стволовые клетки могут быть трансплантированы непосредственно в головной мозг в место повреждения или заболевания.
Кроме применений антагонистических анти-NRR Notch1-антител, описанных в настоящем документе, также применимы агонистические анти-NRR Notch1-антитела для лечения или для получения композиций для модулирования патологических состояний, ассоциированных с экспрессией и/или активностью Notch1 и/или нарушением какого-либо биологически важного биологического пути Notch1 и/или лиганда Notch1.
В одном аспекте в изобретении предлагаются способы лечения или профилактики иммунологического нарушения, при этом способы включают введение эффективного количества агонистического антитела против NRR Notch1 индивидууму, нуждающемуся в таком лечении. В некоторых вариантах иммунологическим нарушением является нарушение, возникающее в результате аномального развития или регуляции T-клеток (смотри, например, McKenzie et al., Expert. Opin. Ther. Targets 9: 395-410, 2005).
В другом аспекте в изобретении предлагаются способы лечения или профилактики аутоиммунного заболевания, при этом способы включают введение эффективного количества агонистического антитела против NRR Notch1 индивидууму, нуждающемуся в таком лечении. В некоторых вариантах аутоиммунным заболеванием является аутоиммунный диабет, рассеянный склероз или ревматоидный артрит.
В следующем аспекте в изобретении предлагаются способы лечения или профилактики отторжения трансплантата, при этом способы включают введение эффективного количества агонистического антитела против NRR Notch1 индивидууму, нуждающемуся в таком лечении.
В следующем аспекте в изобретении предлагаются способы стимулирования регенерации и/или репарации ткани, при этом способы включают введение эффективного количества агонистического антитела против NRR Notch1 индивидууму, нуждающемуся в таком лечении. В некоторых вариантах способ заключается в стимулировании регенерации и/или репарации скелетной или сердечной мышцы или кости.
Изобретение также относится к способам и композициям, применимым для модулирования патологических состояний, ассоциированных с экспрессией и/или активностью Notch1, такой как повышенная или пониженная экспрессия и/или активность или нежелательная экспрессия и/или активность.
В одном аспекте в изобретении предлагаются способы лечения или профилактики опухоли, злокачественной опухоли и/или клеточного пролиферативного нарушения, ассоциированного с повышенной экспрессией и/или активностью Notch1, при этом способы включают введение эффективного количества анти-NRR Notch1-антитела индивидууму, нуждающемуся в таком лечении.
В одном аспекте в изобретении предлагаются способы ингибирования ангиогенеза, включающие введение эффективного количества анти-NRR Notch1-антитела индивидууму, нуждающемуся в таком лечении.
В одном аспекте в изобретении предлагаются способы лечения патологического состояния, ассоциированного с ангиогенезом, включающие введение эффективного количества анти-NRR Notch1-антитела индивидууму, нуждающемуся в таком лечении. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. В некоторых вариантах патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
В некоторых вариантах пациенту вводят иммуноконъюгат, содержащий антитело, конъюгированное с одним или несколькими цитотоксическими средствами. В некоторых вариантах иммуноконъюгат и/или антиген, с которым он связан, интернализуется клеткой, что приводит к повышенной терапевтической эффективности иммуноконъюгата в убивании клетки-мишени, с которой он связывается. В одном варианте цитотоксическое средство целенаправленно воздействует или влияет на нуклеиновую кислоту в клетке-мишени. В одном варианте цитотоксическое средство целенаправленно воздействует или влияет на полимеризацию микротрубочек. Примеры таких цитотоксических средств включают любое из химиотерапевтических средств, указанных в данном описании (такое как мейтанзиноид, ауристатин, доластатин или калихеамицин), радиоактивный изотоп или рибонуклеазу или ДНК-эндонуклеазу.
Антитела согласно изобретению можно применять в терапии либо отдельно, либо в сочетании с другими композициями. Например, антитело согласно изобретению можно вводить совместно с другим антителом, химиотерапевтическим средством (средствами) (включая смеси химиотерапевтических средств), другим цитотоксическим средством (средствами), антиангиогенным средством (средствами), цитокинами и/или ингибирующим рост средством (средствами). В том случае, когда антитело согласно изобретению ингибирует рост опухоли, может быть особенно желательным его сочетание с одним или несколькими другими терапевтическими средствами, которые также ингибируют рост опухоли. Альтернативно или дополнительно пациент может получать комбинированную лучевую терапию (например, наружное облучение или терапия радиоактивно меченым средством, таким как антитело). Такая комбинированная терапия, которая указана выше, включает совместное введение (когда два или более средств включены в один и тот же или в разные препараты) и раздельное введение, при котором введение антитела согласно изобретению может происходить до и/или после введения вспомогательного терапевтического средства или терапевтических средств.
Комбинированная терапия
Как указано выше, в изобретении предлагается комбинированная терапия, при которой анти-NRR Notch1-антитело вводят вместе с проведением другой терапии. Например, анти-NRR Notch1-антитела используют в сочетаниях с противоопухолевыми терапевтическими средствами или с терапевтическим средствами против неоваскуляризации для лечения различных неопластических или не неопластических состояний. В одном варианте неопластическое или не неопластическое состояние характеризуется патологическим нарушением, ассоциированным с аномальным или нежелательным ангиогенезом. Анти-NRR Notch1-антитело можно вводить последовательно или в сочетании с другим средством, которое является эффективным для таких целей, либо в одной и той же композиции, либо в разных композициях. Альтернативно или дополнительно можно вводить различные ингибиторы Notch1.
Введение анти-NRR Notch1-антитела можно осуществлять одновременно, например, в виде одной композиции или в виде двух или более разных композиций, используя один и тот же или разные пути введения. Альтернативно или дополнительно введение можно осуществлять последовательно в любом порядке. В некоторых вариантах могут иметь место интервалы в диапазоне от минут до суток, недель и месяцев между введениями двух или более композиций. Например, сначала может быть введено противоопухолевое средство с последующим введением ингибитора Notch1. Однако также предполагается одновременное введение или введение анти-NRR Notch1-антитела в первую очередь.
Эффективные количества терапевтических средств, вводимых в сочетании с анти-NRR Notch1-антителом, находятся на усмотрении лечащего врача или ветеринара. Введение доз и корректировку осуществляют так, чтобы максимально справиться с состояниями, подвергаемыми лечению. Дополнительно доза будет зависеть от таких факторов, как тип применяемого терапевтического средства и конкретный пациент, подвергаемый лечению. Подходящими дозами для противоопухолевого средства являются используемые в настоящее время дозы, и они могут быть снижены благодаря комбинированному действию (синергии) противоопухолевого средства и анти-NRR Notch1-антитела. В некоторых вариантах сочетание ингибиторов усиливает эффективность одного ингибитора. Термин «усиливать» относится к повышению эффективности терапевтического средства в его общепринятой или одобренной дозе.
Обычно анти-NRR Notch1 антитела и противоопухолевые средства являются подходящими для одного и того же или сходных заболеваний, чтобы блокировать или уменьшить патологическое нарушение, такое как опухолевый рост или рост злокачественных клеток. В одном варианте противоопухолевое средство представляет собой средство против ангиогенеза.
Примеры противоопухолевых средств включают алкилирующий агент, антагонист фолата, антагонист пиримидина, цитотоксический антибиотик, соединение платины или основанное на платине соединение, таксан, алкалоид барвинка, ингибитор c-Kit, ингибитор топоизомеразы, антиангиогенный ингибитор, такой как ингибитор против VEGF, ингибитор HER-2, ингибитор EGFR или двойной ингибитор EGFR/HER-2-киназы, антиэстроген, такой как фулвестрант, и гормональное терапевтическое средство, такое как карбоплатин, цисплатин, гемцитабин, капецитабин, эпирубицин, тамоксифен, ингибитор ароматазы и преднизон. В некоторых вариантах злокачественная опухоль представляет собой рак прямой и ободочной кишки, и вторым лекарственным средством является ингибитор EGFR, такой как эрлотиниб, анти-VEGF-ингибитор, такой как бевацизумаб, или цетуксимаб, аринотекан, иринотекан или FOLFOX, или злокачественная опухоль представляет собой рак молочной железы, и вторым лекарственным средством является антиэстрогенный модулятор, такой как фулвестрант, тамоксифен или ингибитор ароматазы, такой как летрозол, эксеместан или анастрозол, или вторым средством является ингибитор VEGF, такой как бевацизумаб, или вторым средством является химиотерапевтическое средство, такое как доксорубицин и/или таксан, такой как паклитаксел, или вторым средством является анти-HER-2-ингибитор, такой как трастузумаб, или двойной ингибитор EGFR/HER-2-киназы, такой как лапатиниб, или понижающий регулятор HER-2, такой как 17AAG (производное гелданамицина, которое является токсином белка теплового шока [Hsp] 90) (например, в случае рака молочной железы, который прогрессирует при использовании трастузумаба). В других вариантах злокачественной опухолью является рак легкого, такой как мелкоклеточный рак легкого, а вторым лекарственным средством является ингибитор VEGF, такой как бевацизумаб, или ингибитор EGFR, такой как, например, эрлотиниб, или ингибитор c-Kit, такой как, например, иматиниб.
Антиангиогенная терапия в связи со злокачественной опухолью представляет собой методику лечения злокачественной опухоли, нацеленную на ингибирование развития кровеносных сосудов в опухоли, требуемых для доставки питательных веществ для поддержания роста опухоли. Поскольку ангиогенез вовлечен как в рост первичной опухоли, так и метастазы, то антиангиогенное лечение, предлагаемое в изобретении, способно ингибировать неопластический рост опухоли в первичном месте, а также предотвращать метастазы опухоли во вторичных местах, таким образом позволяя бороться с опухолями с помощью других терапевтических средств.
В данной области идентифицировано и известно множество антиангиогенных средств, включая средства, перечисленные в данном описании, например, перечисленные в разделе «Определения» и, например, в Carmeliet and Jain, Nature 407: 249-257 (2000); Ferrara et al., Nature Reviews: Drug Discovery, 3: 391-400 (2004); и Sato Int. J. Clin. Oncol., 8: 200-206 (2003). Смотри также заявку на выдачу патента США US20030055006. В одном варианте анти-NRR Notch1-антитело используют в сочетании с нейтрализующим анти-VEGF-антителом (или фрагментом) и/или другим антагонистом VEGF или антагонистом рецептора VEGF, включая без ограничения, например, растворимые фрагменты рецептора VEGF (например VEGFR-1, VEGFR-2, VEGFR-3, нейропиллины (например NRP1, NRP2)), аптамеры, способные блокировать VEGF или VEGFR, нейтрализующие анти-VEGFR-антитела, низкомолекулярные ингибиторы тирозинкиназ VEGFR (RTK), антисмысловые методики в отношении VEGF, рибозимы против VEGF или рецепторов VEGF, антагонистические варианты VEGF и любые их сочетания. Альтернативно или дополнительно два или более ингибиторов ангиогенеза необязательно можно совместно вводить пациенту кроме антагониста VEGF и другого средства. В некоторых вариантах одно или несколько дополнительных терапевтических средств, например противоопухолевых средств, можно вводить в сочетании с анти-NRR Notch1-антителом, антагонистом VEGF и средством против ангиогенеза.
В некоторых аспектах изобретения другие терапевтические средства, применимые для комбинированной терапии опухолей с анти-NRR Notch1-антителом, включают другие средства терапии злокачественной опухоли (например, хирургическую операцию, радиологическое лечение (например, включающее облучение или введение радиоактивных веществ), химиотерапию, лечение противоопухолевыми средствами, перечисленными в данном описании и известными в данной области, или сочетания указанного). Альтернативно или дополнительно пациенту можно совместно вводить два или более антител, связывающих один и тот же или два или более разных антигенов, описанных в данном документе. Иногда также может быть полезным введение пациенту одного или нескольких цитокинов.
Химиотерапевтические средства
В некоторых аспектах изобретение относится к способу блокирования или уменьшения опухолевого роста или роста злокачественной клетки посредством введения эффективных количеств антагониста Notch1 и/или ингибитора(ов) ангиогенеза и одного или нескольких химиотерапевтических средств пациенту, восприимчивому к злокачественной опухоли, или пациенту, у которого диагностирована злокачественная опухоль. Множество химиотерапевтических средств можно использовать в способах комбинированной терапии согласно изобретению. Примерный и неограничивающий список рассматриваемых химиотерапевтических средств представлен в данном описании в разделе «Определения» и некоторые из них описаны выше.
Специалистам в данной области будет понятно, что подходящие дозы химиотерапевтических средств будут, как правило, близки к дозам, уже применяемым в клинической терапии, при которой химиотерапевтические средства вводят отдельно или в сочетании с другими химиотерапевтическими средствами. Вероятно, будет иметь место варьирование доз в зависимости от состояния, подвергаемого лечению. Врач, который проводит лечение, сможет определить подходящую дозу для конкретного пациента.
Рецидивирующий рост опухоли
Изобретение также относится к способам и композициям для ингибирования или предотвращения рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток. Рецидивирующий опухолевый рост или рецидивирующий рост злокачественных клеток используют для описания состояния, при котором пациенты, претерпевающие или подвергаемые лечению одним или несколькими имеющимися в настоящее время способами терапии (например, терапии злокачественной опухоли, такой как химиотерапия, лучевая терапия, хирургия, гормональная терапия и/или биологическая терапия/иммунотерапия, терапия анти-VEGF-антителами, в частности стандартная терапевтическая схема для конкретной злокачественной опухоли), клинически не реагируют адекватно на лечение, или когда пациенты больше не получают какого-либо полезного эффекта от терапии, так что такие пациенты нуждаются в дополнительной эффективной терапии. В используемом в данном описании смысле фраза также может относиться к состоянию «не отвечающего/трудноизлечимого» пациента, например, описывает пациентов, которые отвечают на терапию, страдая при этом от побочных эффектов, у которых развивается резистентность, которые не отвечают на терапию, которые неудовлетворительно отвечают на терапию и т.д. В различных вариантах злокачественная опухоль представляет собой рецидивирующий опухолевый рост или рецидивирующий рост злокачественных клеток, когда количество злокачественных клеток существенно не уменьшилось или даже увеличилось, или размер опухоли существенно не уменьшился или даже увеличился, или не удалось какое-либо дальнейшее уменьшение размера или количества злокачественных клеток. Определение того, представляют ли собой злокачественные клетки результат рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток, можно осуществить либо in vivo, либо in vitro любым способом, известным в данной области для анализа эффективности обработки злокачественных клеток, используя в таком контексте принятые в данной области значения терминов «рецидивирующий» или «рефрактерный» или «не отвечающий». Опухоль, резистентная к анти-VEGF-лечению, является примером рецидивирующего опухолевого роста.
Изобретение относится к способам блокирования или снижения рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток у индивидуума посредством введения одного или нескольких анти-NRR Notch1-антител, чтобы блокировать или уменьшить рецидивирующий опухолевый рост или рецидивирующий рост злокачественных клеток у индивидуума. В некоторых вариантах антагонист можно вводить после терапевтического средства против злокачественной опухоли. В некоторых вариантах анти-NRR Notch1-антитело вводят одновременно с противоопухолевой терапией. Альтернативно или дополнительно терапию анти-NRR Notch1-антителом чередуют с другой противоопухолевой терапией, которые можно осуществлять в любом порядке. Изобретение также охватывает способы введения одного или нескольких ингибирующих антител, чтобы предотвратить появление или рецидив злокачественной опухоли у индивидуумов, предрасположенных к наличию злокачественной опухоли. В общем, индивидуума либо ранее подвергали или он одновременно подвергается терапии, направленной против злокачественной опухоли. В одном варианте терапия злокачественной опухоли представляет собой лечение средством против ангиогенеза, например, антагонистом VEGF. Средства против ангиогенеза включают средства, известные в данной области, и средства, указанные в данном описании в разделе «Определения». В одном варианте средством против ангиогенеза является нейтрализующее анти-VEGF-антитело или фрагмент (например, гуманизированное антитело A4.6.1, AVASTIN® (Genentech, South San Francisco, CA), Y0317, M4, G6, B20, 2C3 и т.д.). Смотри, например, патенты США 6582959, 6884879, 6703020, WO98/45332, WO 96/30046, WO94/10202, EP 0666868B1, заявки на выдачу патентов США 20030206899, 20030190317, 20030203409 и 20050112126; Popkov et al., Journal of Immunological Methods 288: 149-164 (2004) и WO2005012359. Могут быть введены дополнительные средства в сочетании с антагонистами VEGF и анти-NRR Notch1-антителом для блокирования или уменьшения рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток, например, смотри раздел, озаглавленный «Комбинированная терапия», в данном описании.
Соединения согласно изобретению (например, анти-NRR Notch1-антитела) вводят индивидууму (например, человеку) известными способами, такими как внутривенное введение в виде болюса или посредством непрерывной инфузии в течение определенного периода времени, например, посредством перорального, местного пути или с помощью ингаляции, парентеральным, подкожным, внутрибрюшинным, внутрилегочным и интраназальным путем, и при необходимости в местном лечении с помощью введения в место повреждения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное, интрацереброспинальное, внутрисуставное, интратекальное или подкожное введение. Местное введение особенно желательно, если с ингибированием передачи сигналов Notch1 ассоциированы обширные побочные эффекты. Методика ex vivo также может быть использована для терапевтических применений. Методика ex vivo заключается, например, в трансфекции или трансдукции клеток, полученных из организма индивидуума, полинуклеотидом, кодирующим анти-NRR Notch1-антитело. Трансфицированные или трансдуцированные клетки затем возвращают в организм индивидуума. Клетки могут быть любого типа из большого разнообразия типов клеток, включая без ограничения гематопоэтические клетки (например, клетки костного мозга, макрофаги, моноциты, дендритные клетки, T-клетки или B-клетки), фибробласты, эпителиальные клетки, эндотелиальные клетки, кератиноциты или мышечные клетки.
Кроме того, антитело может быть соответствующим образом введено с помощью импульсной инфузии, в частности, с использованием снижающихся доз антитела. Предпочтительно дозы вводят с помощью инъекций, наиболее предпочтительно внутривенных или подкожных инъекций, отчасти в зависимости от того, является ли введение кратковременным или хроническим.
В другом примере анти-NRR Notch1-антитело вводят локально, например, прямыми инъекциями, если это допускает нарушение или положение опухоли, и инъекции можно периодически повторять. Анти-NRR Notch1-антитело также можно доставлять в организм индивидуума системно или непосредственно в опухолевые клетки, например, в опухоль или ложе опухоли после хирургического удаления опухоли, чтобы предотвратить или уменьшить локальный рецидив или метастазы.
Альтернативно ингибирующую молекулу нуклеиновой кислоты или полинуклеотид, содержащий последовательность нуклеиновой кислоты, кодирующую анти-NRR Notch1-антитело, можно вводить в соответствующие клетки в организме индивидуума. В некоторых вариантах нуклеиновую кислоту можно вводить непосредственно в опухоль.
Нуклеиновую кислоту можно вводить к клетки любыми способами, подходящими в случае применения векторов. Множество таких способов хорошо известно в данной области (Sambrook et al., выше, и Watson et al., Recombinant DNA, Chapter 12, 2d edition, Scientific American Books, 1992). Примерами способов доставки генов являются опосредованная липосомами трансфекция, электропорация, способы на основе фосфата кальция/DEAE-декстрана, генная пушка и микроинъекция.
Введение доз можно осуществлять любым подходящим путем, например, посредством инъекций, таких как внутривенные или подкожные инъекции, отчасти в зависимости от того, является ли введение кратковременным или хроническим. Композиция антитела согласно изобретению будет приготовлена, дозирована и введена таким образом, который совместим с положительной медицинской практикой. Факторы, которые учитываются в таком контексте, включают конкретное нарушение, подвергаемое лечению, конкретного млекопитающего, подвергаемого лечению, клиническое состояние пациента, причину нарушения, место доставки средства, способ введения, схему введения и другие факторы, известные лечащим врачам. Антитело необязательно готовят с одним или нескольким средствами, используемыми в настоящее время для профилактики или лечения рассматриваемого нарушения. Эффективное количество таких других средств зависит от количества антител согласно изобретению, присутствующих в препарате, типа нарушения или лечения и других факторов, обсуждаемых выше. Средства обычно используют в таких же дозах и такими же путями введения, как использовали прежде, или примерно от 1 до 99% от используемых прежде доз.
Для профилактики или лечения заболевания подходящая доза антитела согласно изобретению (в случае применения отдельно или в сочетании с другими средствами, такими как химиотерапевтические средства) будет зависеть от типа заболевания, подвергаемого лечению, типа антитела, тяжести и характера протекания заболевания, от того, вводят ли антитело в профилактических или терапевтических целях, предыдущей терапии, истории болезни пациента и реакции на антитело, и вводится по усмотрению лечащего врача. Антитело соответствующим образом вводят пациенту за один раз или на протяжении серии введений. В зависимости от типа и тяжести заболевания доза, составляющая примерно от 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг-10 мг/кг) антитела, является исходно выбираемой дозой для введения пациенту, например, либо с помощью одного или нескольких отдельных введений, либо посредством непрерывной инфузии. Одна типичная суточная доза может быть в диапазоне примерно от 1 мкг/кг до 100 мг/кг или выше, в зависимости от факторов, указанных выше. В случае повторных введений на протяжении нескольких дней или дольше в зависимости от состояния лечение поддерживают вплоть до наступления требуемого подавления симптомов заболевания. Одна из примерных доз антитела может быть в диапазоне примерно от 0,05 мг/кг до примерно 10 мг/кг. Таким образом, одну или несколько доз примерно по 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любое их сочетание) можно вводить пациенту. Такие дозы можно вводить с перерывами, например, каждую неделю или каждые три недели (например, так, чтобы пациент получил примерно от двух до двадцати, например, шесть доз антитела). Может быть введена начальная более высокая ударная доза с последующим введением одной или нескольких более низких доз. Примерная схема дозирования включает в себя введение начальной ударной дозы примерно 4 мг/кг с последующей еженедельной поддерживающей дозой примерно 2 мг/кг антитела. Однако могут быть применимы другие схемы дозирования. Успешность такой терапии легко контролировать обычными способами и анализами.
Анти-NRR Notch1-антитела согласно изобретению также применимы в анализах выявления экспрессии Notch1 (таких как диагностические или прогностические анализы) в специфичных клетках или тканях, при этом антитела метят, как описано ниже, и/или иммобилизуют на нерастворимой матрице.
В другом аспекте в изобретении предлагаются способы выявления Notch1, при этом способы включают в себя выявление комплекса Notch1-анти-NRR Notch1-антитело в образце. Термин «выявление» в используемом в настоящем описании смысле охватывает качественное и/или количественное определение (уровни измерения) при сравнении или без сравнения с контролем.
В другом аспекте в изобретении предлагаются способы диагностики нарушения, ассоциированного с экспрессией и/или активностью Notch1, при этом способы включают выявление комплекса Notch1-анти-NRR Notch1-антитело в биологическом образце от индивидуума, у которого имеется нарушение или у которого подозревается наличие нарушения. В некоторых вариантах экспрессия Notch1 представляет собой повышенную экспрессию или аномальную (нежелательную) экспрессию. В некоторых вариантах нарушением является опухоль, злокачественная опухоль и/или клеточное пролиферативное нарушение. Альтернативно или в дополнение к выявлению экспрессии Notch1 в способах диагностики или лечения, описанных в настоящем документе, можно определять экспрессию лигандов Notch1 в биологическом образце. Экспрессия лиганда Notch1 может быть определена с использованием стандартных в данной области способов.
В другом аспекте в изобретении предлагаются любые анти-NRR Notch1-антитела, описанные в настоящем документе, при этом анти-NRR Notch1-антитело содержит регистрируемую метку.
В другом аспекте в изобретении предлагается комплекс любого из описанных анти-NRR Notch1-антител и Notch1. В некоторых вариантах комплекс образуется in vivo или in vitro. В некоторых вариантах комплекс содержит злокачественную клетку. В некоторых вариантах анти-NRR Notch1-антитело метят регистрируемой меткой.
Анти-NRR Notch1-антитела можно применять для выявления Notch1 в любом из ряда хорошо известных способов анализа для выявления. Например, биологический образец может быть подвергнут анализу в отношении Notch1 посредством получения образца из требуемого источника, смешивания образца с анти-NRR Notch1-антителом, чтобы обеспечить возможность антителу образовать комплекс антитело/Notch1 с любым Notch1, присутствующим в смеси, и регистрации комплекса антитело/Notch1, присутствующего в смеси. Биологический образец может быть получен для анализа любыми способами, известными в данной области, которые подходят для конкретного образца. Способы смешивания образца с антителами и способы регистрации комплекса антитело/Notch1 выбирают в соответствии с типом применяемого анализа. Такие анализы включают иммуногистохимию (IHC), конкурентные анализы и анализы типа «сэндвич», и анализы стерического ингибирования.
Во всех способах анализа Notch1 используют один или несколько из следующих реагентов: меченый аналог Notch1, иммобилизованный аналог Notch1, меченое анти-NRR Notch1-антитело, иммобилизованное анти-NRR Notch1-антитело и стерические конъюгаты. Меченые реагенты также известны как «индикаторы».
Используемая метка представляет собой любую регистрируемую функциональную группу, не мешающую связыванию Notch1 и анти-NRR Notch1-антитела. Известны многочисленные метки для применения в иммуноанализе, примеры включают компоненты, которые можно непосредственно регистрировать, такие как флуорохром, хемилюминесцентное вещество и радиоактивные метки, а также такие компоненты, как ферменты, которые должны быть подвергнуты взаимодействию или дериватизованы для выявления. Примеры таких меток включают радиоактивные изотопы 32P, 14C, 125I, 3H и 131I, флуорофоры, такие как редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светляка и бактериальную люциферазу (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаридов, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, оксидазы гетероциклов, такие как уриказа и ксантиноксидаза, в паре с ферментом, который использует пероксид водорода для окисления предшественника красителя, таким как HRP, лактопероксидазу или микропероксидазу, биотин/авидин, спиновые метки, метки бактериофага, стабильные свободные радикалы и тому подобное.
Имеются стандартные способы для связывания таких меток с белками или полипептидами. Например, можно использовать связывающие агенты, такие как диальдегиды, карбодиимиды, дималеимиды, бис-имидаты, бис-диазотированный бензидин и тому подобные, для мечения антител описанными выше флуоресцирующими, хемилюминесцентными и ферментными метками. Смотри, например, патенты США №№ 3940475 (флуориметрия) и 3645090 (ферменты); Hunter et al., Nature, 144: 945 (1962); David et al., Biochemistry, 13: 1014-1021 (1974); Pain et al., J. Immunol. Methods, 40: 219-230 (1981); и Nygren, J. Histochem. and Cytochem., 30: 407-412 (1982). Предпочтительными в настоящем изобретении метками являются ферменты, такие как пероксидаза хрена и щелочная фосфатаза. Конъюгирование такой метки, включая ферменты, с антителом является стандартной процедурой обработки для специалиста в области иммуноанализа. Смотри, например, O'Sullivan et al., «Methods for the Preparation of Enzyme-Antibody Conjugates for Use in Enzyme Immunoassay», в Methods in Enzymology, ed. J. J. Langone and H. Van Vunakis, Vol. 73 (Academic Press, New York, N.Y., 1981), pp. 147-166.
Для некоторых способов анализа необходима иммобилизация реагентов. Иммобилизация влечет за собой отделение анти-NRR Notch1-антитела от Notch1 или NRR Notch1, который остается свободным в растворе. Это обычно осуществляют, либо делая анти-NRR Notch1-антитело или аналог NRR Notch1 нерастворимыми перед процедурой анализа, например, адсорбируя на водонерастворимой матрице или поверхности (Bennich et al., патент США № 3720760) посредством ковалентного связывания (например, используя поперечное сшивание глутаральдегидом), либо делая анти-NRR Notch1-антитело или аналог NRR Notch1 нерастворимыми впоследствии, например, в результате иммунопреципитации.
Экспрессию белков в образце можно исследовать, используя протоколы иммуногистохимии и окрашивания. Показано, что иммуногистохимическое окрашивание срезов ткани является надежным способом оценки или выявления наличия белков в образце. В методиках иммуногистохимии («IHC») используют антитело для исследования и визуализации клеточных антигенов in situ, обычно хромогенными или флуоресцентными способами. Для получения образца можно использовать образец ткани или клеток млекопитающего (обычно человека). Примеры образцов включают без ограничения злокачественные клетки, такие как клетки рака прямой и ободочной кишки, молочной железы, простаты, яичника, легкого, желудка, поджелудочной железы, лимфомы и лейкоза. Образец может быть получен различными способами, известными в данной области, включая без ограничения вырезание хирургическим путем, аспирацию или биопсию. Ткань может быть свежей или замороженной. В одном варианте образец фиксируют и заливают в парафин или тому подобное вещество. Образец ткани можно фиксировать (т.е. сохранить) обычным способом. Специалисту в данной области будет понятно, что выбор фиксатора определяется целью, для которой образец необходимо гистологически покрасить или анализировать иным образом. Специалисту в данной области также будет понятно, что продолжительность фиксации зависит от размера образца ткани и используемого фиксатора.
IHC может быть осуществлена в сочетании с дополнительными методиками, такими как морфологическое окрашивание и/или флуоресценция при гибридизации in-situ. Доступны два общепринятых способа IHC: прямой и непрямой анализы. Согласно первому анализу связывание антитела с антигеном-мишенью (например, NRR Notch1) определяют непосредственно. В таком прямом анализе используют меченый реагент, такой как флуоресцирующая метка или меченное ферментом первое антитело, которое может быть визуализировано без взаимодействия с дополнительным антителом. В типичном непрямом анализе неконъюгированное первое антитело связывается с антигеном, и затем меченое второе антитело связывается с первым антителом. В том случае, когда второе антитело конъюгируют с ферментной меткой, добавляют хромогенный или флуорогенный субстрат, чтобы обеспечить визуализацию антигена. Усиление сигнала происходит вследствие того, что несколько вторых антител могут взаимодействовать с разными эпитопами на первом антителе.
Первое и/или второе антитело, используемое для иммуногистохимии, обычно метят регистрируемым компонентом. Доступны многочисленные метки, которые в общем могут быть отнесены к следующим категориям:
Помимо способов приготовления образца, обсуждаемых выше, может требоваться дополнительная обработка среза ткани до, во время или после IHC. Например, могут быть осуществлены способы восстановления эпитопов, такие как нагревание образца ткани в цитратном буфере (смотри, например, Leong et al. Appl. Immunohistochem. 4(3):201 (1996)).
После необязательной стадии блокирования срез ткани подвергают воздействию первого антитела в течение достаточного периода времени и в подходящих условиях, так что первое антитело связывается с белковым антигеном-мишенью в образце ткани. Подходящие условия для достижения связывания можно определить в результате рутинного эксперимента. Степень связывания антитела с образцом определяют, используя любую из регистрируемых меток, обсуждаемых выше. Предпочтительно метка является ферментной меткой (например, HRPO), которая катализирует химическое изменение хромогенного субстрата, такого как хромоген 3,3'-диаминобензидин. Предпочтительно ферментную метку конъюгируют с антителом, которое специфично связывается с первым антителом (например, первым антителом является поликлональное антитело кролика, а вторым антителом является антитело козы против Ig кролика).
Приготовленные таким образом образцы могут быть закреплены и покрыты покровным стеклом. Затем проводят оценку препарата, например, используя микроскоп, и можно использовать критерии интенсивности окрашивания, обычно используемые в данной области. Критерии интенсивности окраски можно оценить следующим образом:
Обычно оценка картины окрашивания около 2+ или выше при анализе IHC является диагностической и/или прогностической. В некоторых вариантах оценка картины окрашивания около 1+ или выше является диагностической и/или прогностической. В других вариантах оценка картины окрашивания около 3 или выше является диагностической и/или прогностической. Понятно, что когда исследуют клетки и/или ткань из опухоли или аденомы ободочной кишки, используя IHC, то окрашивание обычно определяют или оценивают в опухолевой клетке и/или ткани (в отличие от стромальной или окружающей ткани, которая может присутствовать в образце).
Другие способы анализа, известные как конкурентный анализ или анализ типа «сэндвич», хорошо разработаны и широко используются в коммерческой диагностической индустрии.
Конкурентные анализы основаны на способности индикаторного меченого аналога NRR Notch1 конкурировать с NRR Notch1 в тестируемом образце за ограниченное количество антигенсвязывающих сайтов анти-NRR Notch1-антитела. Анти-NRR Notch1-антитело обычно нерастворимо до или после конкуренции, и затем индикатор и Notch1 или NRR Notch1, связанные с анти-NRR Notch1-антителом, отделяют от несвязанного индикатора и Notch1 или NRR Notch1. Такое разделение осуществляют, декантируя (в случае, когда связывающийся партнер предварительно делали нерастворимым) или центрифугируя (в случае, когда связывающийся партнер преципитировали после конкурентной реакции). Количество Notch1 или NRR Notch1 в тестируемом образце обратно пропорционально количеству связанного индикатора, которое измеряют по количеству маркерного вещества. Получают кривые зависимости «доза-ответ» с известными количествами NRR Notch1 и сравнивают с результатами теста, чтобы количественно определить количество Notch1 или NRR Notch1, присутствующего в тестируемом образце. Такие анализы называют системами ELISA, когда в качестве регистрируемых маркеров используют ферменты.
Другой тип конкурентного анализа, называемый «гомогенным» анализом, не требует разделения фаз. В данном случае получают и используют конъюгат фермента с Notch1 или NRR Notch1, так что при связывании анти-NRR Notch1-антитела с Notch1 или NRR Notch1 присутствие анти-NRR Notch1-антитела модифицирует ферментативную активность. В данном случае Notch или NRR Notch1 или их иммунологически активные фрагменты конъюгируют с помощью бифункционального органического мостика с ферментом, таким как пероксидаза. Конъюгаты выбирают для использования с анти-NRR Notch1-антителом так, что связывание анти-NRR Notch1-антитела ингибирует или стимулирует ферментативную активность метки. Такой способ как таковой широко используется на практике под названием EMIT.
Стерические конъюгаты используют в способах оценки стерического несоответствия в гомогенном анализе. Такие конъюгаты синтезируют посредством ковалентного связывания гаптена с низкой молекулярной массой с небольшим фрагментом NRR Notch1, так что антитело к гаптену по существу не способно связывать конъюгат одновременно с анти-NRR Notch1-антителом. В таком способе анализа NRR Notch1, присутствующий в тестируемом образце, будет связывать анти-NRR Notch1-антитело, таким образом обеспечивая возможность связывания антигаптена с конъюгатом, что приводит к изменению характера гаптена в конъюгате, например, изменению флуоресценции, когда гаптеном является флуорофор.
Анализ типа «сэндвич» особенно применим для определения Notch1, NRR Notch1 или анти-NRR Notch1-антител. В анализах на основе последовательного образования «сэндвича» используют иммобилизованное анти-NRR Notch1-антитело для адсорбции Notch1 или NRR Notch1 из тестируемого образца, тестируемый образец удаляют с помощью промывки, связанный Notch1 или NRR Notch1 используют для адсорбции второго меченого анти-NRR Notch1-антитела и затем связанное вещество отделяли от остаточного меченого индикатора. Количество связанного меченого индикатора прямо пропорционально Notch1 или NRR Notch1 в тестируемом образце. В анализах на основе одновременного образования «сэндвича» тестируемый образец не отделяют перед добавлением меченого анти-NRR Notch1. Анализ на основе последовательного образования «сэндвича» с использованием моноклонального анти-NRR Notch1-антитела в качестве одного из антител и поликлонального анти-NRR Notch1-антитела в качестве другого антитела применим при тестировании образцов в отношении Notch1 или NRR Notch1.
Описанные выше анализы представляют собой только иллюстративные анализы для выявления Notch1 или NRR Notch1. Разработанные в настоящее время способы или способы, которые будут разработаны в будущем, в которых используется анти-NRR Notch1-антитело для определения Notch1 или NRR Notch1, включены в объем изобретения, включая биологические анализы, описанные в настоящем документе.
В одном аспекте в изобретении предлагаются способы выявления (например, присутствия или отсутствия или количества) полинуклеотида(ов) (например, полинуклеотидов Notch1) в биологическом образце от индивидуума, такого как человек. Можно использовать множество способов выявления полинуклеотидов, и к таким способам относятся, например, ОТ-ПЦР, анализ экспрессии генов TaqMan®, способы амплификации, микроматрицы полинуклеотидов и тому подобное.
Способы выявления полинуклеотидов (таких как мРНК) хорошо известны и включают, например, анализы гибридизации с использованием комплементарных ДНК-зондов (такие как гибридизация in situ с использованием меченых рибонуклеотидных зондов Notch1), Нозерн-блот и родственные методики, и различные анализы на основе амплификации нуклеиновой кислоты (такие как ОТ-ПЦР с использованием комплементарных праймеров, специфичных для Notch1, и другие способы выявления на основе амплификации, такие как, например, на основе разветвленной ДНК, SPIA (изотермическая амплификация с одним праймером), Ribo-SPIA, SISBA, NASBA (амплификация, основанная на последовательности нуклеиновой кислоты), TMA (опосредованная транскрипцией амплификация) и тому подобные).
Биологические образцы от млекопитающих можно анализировать удобным способом, например, в отношении мРНК Notch1, используя Нозерн-блот, дот-блот или ПЦР-анализ. Например, анализы ОТ-ПЦР, такие как количественные ПЦР-анализы, хорошо известны в данной области. В иллюстративном варианте осуществления изобретения способ выявления мРНК Notch1 в биологическом образце включает получение кДНК из образца с помощью обратной транскрипции с использованием, по меньшей мере, одного праймера; амплификацию полученной таким образом кДНК с использованием полинуклеотида Notch1 в качестве смыслового и антисмыслового праймеров, чтобы амплифицировать кДНК Notch1; и регистрацию наличия или отсутствия амплифицированной кДНК Notch1. Кроме того, такие способы могут включать одну или несколько стадий, которые позволяют определить количество (уровни) мРНК Notch1 в биологическом образце (например, при одновременном исследовании уровней используемой для сравнения контрольной последовательности мРНК гена домашнего хозяйства, такого как представитель семейства актина). Необязательно можно определить последовательность амплифицированной кДНК Notch1.
Зонды и/или праймеры можно метить регистрируемым маркером, таким как, например, радиоактивный изотоп, флуоресцирующее соединение, биолюминесцентное соединение, хемилюминесцентное соединение, хелатор металла или фермент. Такие зонды и праймеры можно использовать для выявления присутствия полинуклеотидов Notch1 в образце и как средства выявления клетки, экспрессирующей белки Notch1. Как будет понятно специалисту в данной области, можно получить очень много разных праймеров и зондов (например, основанных на последовательностях, предлагаемых в настоящем описании) и эффективно использовать их для амплификации, клонирования и/или определения наличия или отсутствия и/или количества мРНК Notch1.
Необязательные способы согласно изобретению включают протоколы определения полинуклеотидов, таких как полинуклеотид Notch1, в образце ткани или клеток с использованием методики микроматриц. Например, при использовании микроматриц нуклеиновых кислот тестируемые и контрольные образцы мРНК из тестируемых и контрольных образцов ткани обратно транскрибируют и метят, чтобы получить зонды кДНК. Затем зонды гибридизуют с матрицей нуклеиновых кислот, иммобилизованных на твердой подложке. Матрицу компонуют так, чтобы были известны последовательность и положение каждого представителя матрицы. Например, на твердой подложке может быть распределена подборка генов, которые вероятно экспрессируются при некоторых патологических состояниях. Гибридизация меченого зонда с конкретным представителем на матрице показывает, что образец, из которого получен зонд, экспрессирует данный ген. Анализ дифференциальной экспрессии генов патологической ткани может дать ценную информацию. В методике микроматриц используют способы гибридизации нуклеиновых кислот и компьютерные технологии, чтобы оценить профиль экспрессии мРНК тысяч генов в одном эксперименте (смотри, например, WO 01/75166, опубликованную 11 октября 2001 г.). Обсуждение изготовления матриц смотри, например, патент США № 5700637, патент США № 5445934, патент США № 5807522; Lockart, Nature Biotechnology, 14: 1675-1680 (1996) и Cheung, V. G. et al., Nature Genetics 21 (Suppl): 15-19 (1999). Микроматрицы ДНК представляют собой небольшие матрицы, содержащие фрагменты генов, которые либо непосредственно синтезируют на стеклянной или других подложках, либо наносят на них в виде пятен. На одной матрице обычно представлены тысячи генов. Типичный эксперимент с использованием микроматрицы обычно включает следующие стадии: (1) приготовление флуоресцентно меченой мишени из РНК, выделенной из образца, (2) гибридизацию меченой мишени с микроматрицей, (3) промывку, окрашивание и сканирование матрицы, (4) анализ сканированного изображения и (5) получение профилей экспрессии генов. В настоящее время применяют два основных типа микроматриц ДНК: матрицы олигонуклеотидов (обычно 25-70-меров) и матрицы экспрессии генов, содержащие продукты ПЦР, полученные на кДНК. При создании матрицы олигонуклеотиды либо можно предварительно создавать и наносить в виде пятен на поверхность, либо непосредственно синтезировать на поверхности (in situ).
Система Affymetrix GeneChip® является коммерчески доступной системой на основе микроматриц, которая содержит микроматрицы, изготовленные прямым синтезом олигонуклеотидов на поверхности стекла. Микроматрицы зондов/генов: олигонуклеотиды («олигомеры»), обычно 25-меры, синтезируют непосредственно на стеклянной подложке, сочетая основанную на полупроводниках фотолитографию и методику твердофазного химического синтеза. Каждая матрица содержит до 400000 разных олигонуклеотидов, и каждый олигонуклеотид присутствует в миллионах копий. Олигонуклеотидные зонды синтезируют в известных положениях на матрице, картины гибридизации и интенсивности сигналов могут быть интерпретированы с получением данных по идентификации генов и относительных уровней экспрессии с использованием компьютерной программы для анализа набора микроматриц Affymetrix. Каждый ген представлен на матрице серией разных олигонуклеотидных зондов. Каждая пара зондов состоит из точно совпадающего олигонуклеотида и неточно совпадающего олигонуклеотида. Точно совпадающий зонд имеет последовательность, в точности комплементарную конкретному гену, и, следовательно, позволяет измерять экспрессию гена. Неточно совпадающий зонд отличается от точно совпадающего зонда заменой одного основания в центральном положении основания, нарушающей связывание транскрипта гена-мишени. Это помогает определить фоновую и неспецифичную гибридизацию, которая вносит вклад в сигнал, измеренный для точно совпадающего олигонуклеотида. Компьютерная программа для анализа набора микроматриц вычитает интенсивности гибридизации неточно совпадающих зондов из интенсивностей гибридизации для точно совпадающих зондов, чтобы определить абсолютное или специфичное значение интенсивности для каждого набора зондов. Зонды выбирают на основании имеющейся в настоящее время информации из GenBank и других репозитариев нуклеотидов. Полагают, что последовательности узнают уникальные области на 3'-конце гена. Используют печь для гибридизации GeneChip (печь типа «рашпера с вертелом») для осуществления гибридизации вплоть до 64 матриц одновременно. Струйное устройство осуществляет промывку и окрашивание матриц зондов. Оно полностью автоматизировано и содержит четыре модуля, при этом каждый модуль удерживает одну матрицу зондов. Каждый модуль регулируется независимо компьютерной программой для анализа набора микроматриц с использованием предварительно запрограммированных протоколов для струйного устройства. Сканером является конфокальный лазерный флуоресцентный сканер, который измеряет интенсивность флуоресценции, испускаемой меченой кРНК, связанной с матрицами зондов. Компьютерная рабочая станция с помощью компьютерной программы для набора микроматриц регулирует струйную станцию и сканер. Компьютерная программа для набора микроматриц может контролировать до восьми струйных станций на основе использования предварительно запрограммированных протоколов гибридизации, промывки и окрашивания для матрицы зондов. Компьютерная программа также собирает и превращает данные об интенсивности гибридизации в вызов присутствие/отсутствие для каждого гена с использованием соответствующих алгоритмов. Наконец, компьютерная программа выявляет изменения в экспрессии генов в разных экспериментах посредством сравнительного анализа и форматирует выходные данные в текстовые файлы, которые могут быть использованы с другими компьютерными программами для последующих анализов данных.
В некоторых вариантах выявляют делецию гена Notch1, мутацию гена или амплификацию гена. Делецию гена, мутацию или амплификацию гена можно измерить, используя любой из широкого множества протоколов, известных в данной области, например, используя обычный Саузерн-блоттинг, Нозерн-блоттинг, чтобы количественно определить транскрипцию мРНК (Thomas, Proc. Natl. Acad. Sci. USA, 77: 5201-5205 (1980)), дот-блоттинг (анализ ДНК) или гибридизацию in situ (например, флуоресцентную гибридизацию in situ («FISH»)), используя соответствующий меченый зонд, цитогенетические способы или сравнительную геномную гибридизацию (CGH), используя соответствующий меченый зонд. Кроме того, указанные способы можно использовать для выявления делеции гена, мутации гена или амплификации гена лиганда Notch1. В используемом в настоящем описании смысле выражение «выявление экспрессии Notch1» охватывает выявление делеции гена, мутации гена или амплификации гена Notch1.
Кроме того, можно исследовать статус метилирования гена Notch1 в образце ткани или клеток. Аномальное деметилирование и/или гиперметилирование островков CpG в 5'-регуляторных областях гена часто возникает в иммортализованных и трансформированных клетках и может приводить к измененной экспрессии различных генов. В данной области хорошо известно множество анализов для исследования статуса метилирования гена. Например, в способах на основе Саузерн-гибридизации можно использовать чувствительные к метилированию ферменты рестрикции, которые не могут расщеплять последовательности, которые содержат метилированные участки CpG, чтобы оценить статус метилирования островков CpG. Кроме того, в MSP (специфичной для метилирования ПЦР) можно быстро получить профиль статуса метилирования всех участков CpG, присутствующих в островке CpG данного гена. Указанный способ заключается в начальной модификации ДНК бисульфитом натрия (который будет превращать все неметилированные цитозины в урацил) с последующей амплификацией с использованием праймеров, специфичных для метилированной ДНК по сравнению с неметилированной ДНК. Протоколы, в которые включено воздействие на метилирование, также можно найти, например, в Current Protocols In Molecular Biology, Unit 12, Frederick M. Ausubel et al. eds., 1995; De Marzo et al., Am. J. Pathol. 155(6): 1985-1992 (1999); Brooks et al., Cancer Epidemiol. Biomarkers Prev. 7: 531-536 (1998); и Lethe et al., Int. J. Cancer 76(6): 903-908 (1998). В используемом в настоящем описании смысле выражение «выявление экспрессии Notch1» охватывает определение метилирования гена Notch1.
Изделия
В другом аспекте изобретения предлагается изделие, содержащее вещества, применимые для лечения, профилактики и/или диагностики нарушений, описанных выше. Изделие содержит емкость и этикетку или вкладыш в упаковку на емкости или прикрепленную к емкости. Походящие емкости включают, например, бутылки, флаконы, шприцы и т.д. Емкости могут быть сделаны из множества материалов, таких как стекло или пластмасса. В емкости находится композиция, которая, как таковая или в сочетании с другой композицией(ями), является эффективной для лечения, профилактики и/или диагностики состояния, и емкость может иметь стерильное входное отверстие (например, емкость может представлять собой мешок с внутривенным раствором или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). По меньшей мере одним активным средством в композиции является антитело согласно изобретению. Ярлык или вкладыш в упаковку указывает, что композиция применима для лечения выбранного состояния, такого как злокачественная опухоль. Кроме того, изделие может содержать (a) первую емкость с находящейся в ней композицией, при этом композиция содержит антитело согласно изобретению; и (b) вторую емкость с находящейся в ней композицией, при этом композиция содержит дополнительное цитотоксическое средство. Изделие в таком варианте осуществления изобретения может дополнительно содержать вкладыш в упаковку, на котором указано, что первую и вторую композиции антител можно применять для лечения конкретного состояния, например, злокачественной опухоли. Альтернативно или дополнительно изделие может дополнительно включать в себя вторую (или третью) емкость, содержащую фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Изделие может дополнительно содержать другие материалы, желательные с коммерческой точки зрения и точки зрения пользователя, включая другие буферы, разбавители, наполнители, иглы и шприцы.
Ниже приведены примеры способов и композиций согласно изобретению. Понятно, что на практике могут быть осуществлены различные другие варианты на основе общего описания, приведенного выше.
ПРИМЕРЫ
Пример 1: Создание иммуногена для получения анти-NRR Notch1-антител
hNRR Notch1
Иммуноген, содержащий NRR Notch1 человека (hNRR Notch1), получали следующим образом.
Субклонирование для экспрессии
Используя полноразмерный клон Notch1 человека (номер доступа в GenBank NM_017617) в качестве эталонной последовательности и матрицы, конструировали набор из 4 ПЦР-праймеров, чтобы амплифицировать область Notch1, охватывающую участок от аминокислоты V1307 до Q1733 последовательности SEQ ID NO: 56. Указанная область включает в себя EGF-повторы 34-36 и концы непосредственно перед трансмембранным доменом. Конструировали 5'-праймеры, чтобы добавить N-концевую Flag-метку непосредственно перед специфичной последовательностью гена. Продукт ПЦР, соответствующий данному домену, клонировали в векторе B9.1 для секретируемой экспрессии из клеток насекомых Sf-9, используя способ независимого от рестрикции клонирования (RIC). Коротко, праймеры содержали 5'-удлинения, необходимые для добавления частей сайтов рестрикции BamHI и EcoRI к двум независимым продуктам ПЦР, полученным с использованием полимеразы Pfu (Stratagene). Денатурация и повторный отжиг указанных продуктов ПЦР давали популяцию ДНК, в которой 25% продуктов содержали соответствующие нуклеотиды, обеспечивающие выступающие BamHI- и EcoRI-концы на их 5'- и 3'-концах соответственно. Затем полученную смесь ДНК лигировали в вектор B9.1, подготовленный с помощью рестрикционного расщепления ферментами BamHI и EcoRI. Полученную конструкцию проверяли в отношении последовательности ДНК и назвали 696.G40.V2.Notch1.V1307-Q1733(N-Flag).B9. Вектор B9.1 является модифицированным вариантом бакуловирусного вектора для переноса ДНК pACGP67 (BD Pharmingen), который содержит сигнал секреции Gp 67 перед сайтом клонирования BamHI, C-концевой сайт расщепления тромбина и His-метку.
Последовательности, имеющие отношение к клонированию конструкции Notch1 человека, показаны ниже:
Праймеры ПЦР:

Заглавными буквами указаны специфичные последовательности гена Notch1; строчными буквами указаны добавленные сайты; Flag-метка подчеркнута.
Последовательность ДНК экспрессируемого белка:


Последовательность экспрессируемого белка:

Заглавными буквами указаны специфичные последовательности гена Notch1; и строчными буквами указан сигнал секреции Gp67, N-концевая Flag-метка, сайт тромбина, C-концевая Flag-метка и остатки, добавляемые экспрессирующим вектором.
Создание штаммов бакуловирусов и получение белка
Конструкцию, кодирующие аминокислоты V1307-Q1733 Notch1 человека, экспрессировали в клетках Sf-9. Штаммы бакуловирусов получали, используя векторы для переноса ДНК [101V-1]: 696.G40.V2.Notch1.V1307-Q1733(N-Flag).B9.1 (смотри раздел «Субклонирование для экспрессии»). ДНК вектора для переноса котрансфицировали в прикрепленные клетки насекомых Sf-9, культивируемые в среде, не содержащей белка ESF921 (Expression Systems LLC, Woodland Calif.) при 27ºC, вместе с линеаризованной вирусной ДНК BacPak6TM (BD Clontech, Palo Alto Calif.) и BacfectinTM (BD Clontech) согласно рекомендациям производителя. Полученную исходную культуру вируса P1 дважды амплифицировали с получением вирусной культуры P3, используемой для крупномасштабного получения белка. Клетки Sf-9, культивируемые в суспензии в среде ESF921, инфицировали при плотности клеток 1-2×106 клеток/мл, используя примерную множественность инфекции (MOI) 0,3 вирусных частиц на клетку, и собирали через 3-5 дней после инфекции. Клетки Sf-9 удаляли центрифугированием, полученную исходную культуру вируса фильтровали, чтобы обеспечить стерильность, и добавляли 3% инактивированную нагреванием фетальную бычью сыворотку (FBS) для стабильности вируса. Все исходные вирусные культуры хранили при 4ºC. Показано, что исходная культура вирусов, содержащая конструкцию [101V-1]: 696.G40.V2.Notch1.V1307-Q1733(N-Flag).B9.1, эффективно инфицирует клетки Sf-9 и экспрессирует рекомбинантный белок.
Конструкцию [10V-1]: 696.G40.V2.Notch1.V1307-Q1733(N-Flag).B9.1 экспрессировали в 2 циклах ферментации в масштабе 11 и 16 литров. Клетки Sf-9, адаптированные для роста в суспензии в среде, не содержащей белка, использовали для циклов ферментации. Клетки инокулировали при плотности ~2×106 клеток/мл из биореактора для посевного материала, в котором использовали такие же условия, как и в сосуде для продуцирования. Ферментации осуществляли при 27ºC в среде ESF921 и контролировали уровень растворенного кислорода на уровне 50% насыщения воздуха, используя барботирование кислородом при необходимости и непрерывную аэрацию свободного пространства. Биореакторы работали в условиях встряхивании при 100 об/мин с использованием 2 наклонных лопастей или одной плоской лопасти, в зависимости от используемого сосуда. Клетки росли до точки инфекции, плотности 2,0-2,7×106 клеток/мл, в течение периода времени, составляющего 24-48 часов, и затем их инфицировали при MOI 0,5 вирусных частиц/клетку вирусным штаммом, кодирующим полипептид Notch1. Осуществляли наблюдение за клетками в отношении признаков инфекции (остановки роста, увеличения диаметра клеток), и клетки выращивали еще в течение 65-72 часов. Полученные среды охлаждали, собирали центрифугированием и немедленно подвергали очистке белка.
Очистка иммуногена, содержащего hNRR Notch1
Надосадочную среду из клеток SF9, экспрессирующих полипептид, кодируемый конструкцией 696.G40.V2.Notch1.V1307-Q1733(N-Flag).B9.1, разбавляли (об./об.=1:4) охлажденным на льду буфером A (50 мМ Hepes, pH 7,5, 150 мМ NaCl, 5 мМ CaCl2 и 0,5 мМ фенилметансульфонилфторид) и связывали партию в течение 15-20 минут с предварительно уравновешенной смолой Ni-NTA Superflow (Qiagen, Product № 30450) в соотношении 2 мл смолы на литр среды. Аффинную Ni-NTA-смолу собирали фильтрованием через фильтр с диаметром пор 0,8 мкм (Nalgene, продукт № 450-0080) и затем смолой набивали подходящую колонку, в которую жидкость поступает самотеком (диаметр:высота 1:10). Колонку промывали 10 объемами колонки (CV) охлажденного на льду буфера B (50 мМ Hepes, pH 7,5, 1000 мМ NaCl, 5 мМ CaCl2 и 10 мМ имидазол), затем 10 CV буфера A без PMSF. Затем колонку элюировали 5 CV буфера A, содержащего 250 мМ имидазол (без PMSF). Элюированный белок концентрировали, используя концентрирующее устройство Amicon Ultra (предел отсечения по молекулярной массе 3000), и буфер заменяли на буфер для хранения (10 мМ Hepes pH 7,5, 150 мМ NaCl и 5 мМ CaCl2), используя колонки PD-10 (GE Healthcare) согласно рекомендациям производителя. Чистота белка составляла >90% согласно оценке в SDS-ПААГ с окрашиванием Кумасси. Концентрацию очищенного белка оценивали в анализе по Бредфорду (набор Кумасси плюс, Pierce, № в каталоге 23236), используя БСА в качестве стандарта. Секвенирование пептидов с использованием масс-спектрометрии продуктов расщепления белка трипсином использовали для подтверждения природы полученного белка.
mNRR Notch1
Иммуноген, содержащий NRR Notch1 мыши (mNRR Notch1), получали следующим образом.
Последовательность, охватывающую аминокислоты V1307-Q1723 Notch1 мыши (SEQ ID NO: 57), субклонировали и экспрессировали, в общем, как описано выше для иммуногена Notch1 человека. Указанная область Notch1 мыши включает в себя EGF-повторы 34-36 и концы непосредственно перед трансмембранным доменом. Конструкция, экспрессирующая иммуноген, названа 64794.G1.Notch1.V1307-Q1723 (N-Flag, C-His).pRK5-GNE. Аминокислотная последовательность экспрессированного иммуногенного белка, используемого для получения антител против NRR Notch1 мыши, показана ниже и содержит N-концевую FLAG-метку и C-концевую His-метку:

N-конец указанной выше последовательности (аминокислоты MGGTAARLGA VILFVVIVGL HGVRG последовательности SEQ ID NO: 14) отщепляется клетками, экспрессирующими белок. Как таковой иммуноген, используемый для получения антител, специфичных для NRR Notch1 мыши, не содержал такой N-концевой последовательности.
Получение белка
Конструкцию, кодирующую аминокислоты V1307-Q1723 Notch1 мыши, временно экспрессировали в клетках Freestyle 293-F, которые были адаптированы к культивированию в суспензии в среде без сыворотки (клетки FreeStyle 293-F, Invitrogen, № в каталоге R790-07).
Клетки культивировали в среде для экспрессии GIBCO® FreeStyle 293 (Invitrogen, № в каталоге 12338-018). Клетки поддерживали при плотности 0,3-3×106 жизнеспособных клеток/мл во встряхиваемой колбе, инкубируя при 37ºC во влажной атмосфере с 8% CO2 на платформе орбитального встряхивающего устройства при 125 об/мин. За день до трансфекции клетки высевали при плотности 5×105 жизнеспособных клеток/мл. В день трансфекции проверяли жизнеспособность и плотность клеток (>90% и 1×106 клеток/мл). Для каждой трансфекции комплекс липид-ДНК получали следующим образом: в случае 500 мл клеток с плотностью 1×106 клеток/мл 500 мкг плазмидной ДНК медленно добавляли к 40 мл Opti-MEM® I (Invitrogen, № в каталоге 51985-034), 500 мкл раствора полиэтиленимина в концентрации 1,5 мкг/мл (полиэтиленимин PEI, линейный, М.м. 25000, № в каталоге Polysciences 9002-98-6). Смесь осторожно перемешивали и инкубировали в течение 20-30 минут при комнатной температуре, чтобы обеспечить образование ДНК-липидного комплекса. Затем ДНК-липидный комплекс медленно добавляли к клеткам и инкубировали в течение 3 суток до сбора среды.
Конструкцию mNotch1 экспрессировали в двух объемах по 1 литру. Клетки трансфицировали при плотности 0,9-1×106 клеток/мл, среду собирали спустя 65-75 часов, когда плотность клеток составляла 2,2-2,5×106/мл и жизнеспособность - 75-78%.
Полученную среду охлаждали, собирали центрифугированием и немедленно использовали для очистки полипептида Notch1 мыши, содержащего NRR.
Очистка иммуногена, содержащего mNRR Notch1
Иммуноген очищали из среды, в которую он был секретирован клетками HEK 293, партиями, используя анти-FLAG-M2-агарозу (Sigma-Aldrich, № продукта A2220). Анти-FLAG-M2-агарозу в буфере B (50 мМ HEPES, pH 7,5, 150 мМ NaCl, 5 мМ CaCl2) добавляли в среду с секретированным продуктом, содержащую полную смесь ингибиторов протеаз без EDTA (20 таблеток на литр среды, Roche), в соотношении 5 мл агарозы на литр среды. Затем среду инкубировали при 4ºC при постоянном вращении в течение 3 часов. Анти-FLAG-агарозу собирали фильтрованием через 0,8-мкм фильтр (Nalgene, № продукта 450-0080) и набивали колонку, в которую жидкость поступает самотеком (BioRad, № продукта 731-0003). Агарозу промывали 10 объемами колонки буфера B и затем элюировали белок 4 объемами колонки раствора пептида FLAG в концентрации 0,1 мг/мл (Sigma-Aldrich, № продукта F3290) в буфере B. Элюированный полипептид Notch1 мыши концентрировали в концентрирующем устройстве Amicon Ultra (предел отсечения по молекулярной массе 10000, Millipore, № продукта UFC 901096), и буфер заменяли буфером для хранения (10 мМ HEPES, pH 7,5, 150 мМ NaCl, 5 мМ CaCl2, 5% глицерин), используя колонки PD-10 (GE Healthsciences, № продукт 17-0851-01). Чистота составляла >92% по оценке с помощью обращенно-фазовой ВЭЖХ. Концентрацию определяли в анализе по Бредфорду (набор Кумасси плюс, Pierce, № продукта 23236), используя БСА в качестве стандарта. Идентификацию белка подтверждали секвенированием пептидов из продукта расщепления белка трипсином, используя масс-спектрометрию.
Пример 2
Получение анти-NRR-Notch1-антител
Анти-NRR Notch1-антитела получали следующим образом.
Сортировка и скрининг библиотеки для идентификации анти-NRR Notch1-антител
Иммуногенный белок NRR Notch1 человека (который описан выше) использовали в качестве антигена. 96-луночные иммунологические планшеты Nunc Maxisorp покрывали в течение ночи при 4ºC антигеном-мишенью (10 мкг/мл) и блокировали в течение 1 часа при комнатной температуре блокирующим буфером для фага PBST (фосфатно-солевой буфер (PBS), 1% (масс./об.) бычий сывороточный альбумин (БСА) и 0,05% (об./об.) твин-20). Фаговые библиотеки антител, представляющие Fab-фрагменты (смотри, например, Lee et al., J. Immunol. Meth. 284: 119-132, 2004), добавляли в планшеты с антигеном и инкубировали в течение ночи при комнатной температуре. На следующий день покрытые антигеном планшеты промывали десять раз PBT (PBS с 0,05% твином-20), и связанный фаг элюировали 50 мМ HCl и 500 мМ NaCl в течение 30 минут и нейтрализовали равным объемом 1 М основания трис (pH 7,5). Извлеченный фаг амплифицировали в клетках E. coli XL-1 Blue. Во время последующих раундов селекции инкубацию фага, несущего антитело, в покрытых антигеном планшетах уменьшали до 2-3 часов, а жесткость промывки планшетов постепенно увеличивали.
После 4 раундов пэннинга наблюдали значительное обогащение. Отбирали 190 клонов, чтобы определить, связываются ли они специфично с NRR Notch1 человека, и вариабельные области всех 190 клонов секвенировали в ПЦР, чтобы идентифицировать клоны с уникальными последовательностями.
Чтобы идентифицировать фаговые антитела, которые связывают NRR Notch1 и человека и мыши, все уникальные клоны тестировали в отношении связывания с Notch1 человека и мыши в ELISA. Аффинности фаговых антител ранжировали, используя конкурентный ELISA в одной точке, который описан ниже в данном примере. Дополнительно определяли значения IC50 фаговых антител, используя анализ ELISA конкурентного связывания фага, по существу как описано в Lee, C. V., et al. (2004) J. Mol. Biol. 340, 1073-93. Коротко, 96-луночные иммунологические планшеты NUNC Maxisorp покрывали в течение ночи при 4ºC 1 мкг/мл NRR1 человека или NRR1 мыши и блокировали в течение 1 часа при комнатной температуре блокирующим буфером PBST (PBS и 1% БСА и 0,05% твин 20). Фаг смешивали с серийным разведением NRR1 человека или мыши при комнатной температуре в течение 1 часа перед добавлением смеси в планшет, покрытый NRR1 человека и мыши. Связанный фаг выявляли с использованием конъюгатов анти-M13-HRP, обрабатывали субстратом TMB в течение примерно 5 минут, гасили 1 М H3PO4 и регистрировали спектрофотометрически при 450 нм. Подгонку кривых конкуренции осуществляли с использованием программы подгонки кривых нелинейной регрессии по четырем параметрам (Kaleidagraph, компьютерная программа Synergy), чтобы определить значения IC50, которые вычисляли в виде концентрации антигена на стадии связывания в растворе, которая ингибировала на 50% связывание антитела в фаговом дисплее с иммобилизованным антигеном.
Антитела A, B и C преобразовывали в IgG посредством клонирования областей VL и VH отдельных клонов в векторах LPG3 и LPG4, соответственно, временной экспрессии в клетках млекопитающих CHO и очистки на колонке с белком A. Такие клоны тестировали в отношении перекрестного взаимодействия с одним или несколькими антигенами: NRR Notch2, NRR Notch3 и NRR Notch4 человека и мыши, и в отношении блокирующей активности, используя анализ на основе совместного культивирования, описанный в примере 5. Результаты такой характеристики показаны в таблице 3.

Конструирование библиотек для повышения аффинности клонов, полученных из библиотеки V H
Антитело A было отобрано для повышения аффинности. Фагмида pW0703 (полученная из фагмиды pV0350-2b (Lee et al., J. Mol. Biol. 340, 1073-1093 (2004)), содержащая стоп-кодон (TAA) во всех положениях CDR-L3 и представляющая моновалентный Fab на поверхности бактериофага M13, служила в качестве матрицы библиотеки для осуществления прививки вариабельных доменов тяжелой цепи (VH) представляющих интерес клонов из библиотеки VH для созревания аффинности. Для созревания аффинности использовали методики как жесткой, так и мягкой рандомизации. В случае жесткой рандомизации одну библиотеку легких цепей с выбранными положениями трех CDR легкой цепи рандомизировали, используя аминокислоты, сконструированные для имитации природных антител человека, и рассчитанная вырожденность ДНК была такой, как описано в Lee et al. (J. Mol. Biol. 340, 1073-1093 (2004)). В случае мягкой рандомизации мишенями были остатки в положениях 91-94 и 96 CDR-L3, 28-31 и 34-35 CDR-H1, 50, 52 и 53-58 CDR-H2, 95-99 и 100A CDR-H3; и для рандомизации отобрали два разных сочетания петель CDR, L3/H1/H2 и L3/H3. Для достижения условий мягкой рандомизации, которая вводила мутации с частотой примерно 50% в выбранных положениях, синтезировали мутагенную ДНК с использованием смеси оснований 70-10-10-10, отдавая предпочтение нуклеотидам дикого типа (Gallop et al., Journal of Medicinal Chemistry 37: 1233-1251 (1994)).
Методика сортировки фагов для достижения повышения аффинности
В случае селекции в отношении повышения аффинности фаговые библиотеки подвергали сортировке на планшетах в ходе первого раунда с последующими тремя раундами сортировки в растворе. В первом раунде сортировки на планшетах три библиотеки по отдельности подвергали сортировке, используя покрытый мишенью (NRR Notch1 человека-ECD) планшет (планшет NUNC Maxisorp), при этом вводили примерно 3 O.D./мл фага в 1% БСА и 0,05% твин-20 на 2 часа при 37ºC. После первого раунда сортировки на планшете осуществляли три-четыре раунда сортировки в растворе, чтобы повысить жесткость селекции. Для сортировки в растворе 1 O.D./мл фага, размноженного в первом раунде сортировки на планшете, инкубировали с 20 нМ биотинилированного белка-мишени (концентрация в данном случае основана на значении IC50 для фага родительского клона) в 100 мкл буфера, содержащего 1% Superblock (Pierce Biotechnology) и 0,05% твин 20, в течение 30 минут при комнатной температуре. Затем смесь разбавляли в 10 раз 1% Superblock и вносили по 100 мкл/лунку в покрытые нейтравидином лунки (5 мкг/мл) на 15 минут при комнатной температуре и острожном встряхивании для того, чтобы биотинилированная мишень связала фаг. Лунки десять раз промывали PBS-0,05% твин 20. Чтобы определить фоновое связывание, содержимое контрольных лунок, содержащих фаг с мишенями, которые не были биотинилированы, улавливали на планшетах, покрытых нейтравидином. Связанный фаг элюировали 0,1н. HCl в течение 20 минут, нейтрализовали 1/10 объемом 1 М трис, pH 11, титровали и размножали для следующего раунда. Затем осуществляли два или три раунда селекции в растворе наряду с применением двух способов повышения жесткости селекции. Первый предназначен для селекции в отношении скорости ассоциации посредством снижения концентрации биотинилированного белка-мишени от 2 нМ до 0,1 нМ, и второй предназначен для селекции в отношении скорости диссоциации посредством добавления избыточных количеств небиотинилированного белка-мишени (в 100-1000 раз больше), чтобы отсеять при конкуренции слабые связывающие агенты. Также уменьшали введение фага (0,1-0,5 O.D./мл), чтобы уменьшить фоновое связывание фага.
Высокопроизводительный скрининг аффинности в ELISA (конкуренция в одной точке)
Колонии отбирали в третьем и четвертом раундах скрининга и выращивали в течение ночи при 37ºC по 150 мкл/лунку в среде 2YT с добавлением 50 мкг/мл карбенициллина и 1E10/мл KO7 в 96-луночном планшете (Falcon). Из того же планшета отбирали колонию XL-1, инфицированную родительским фагом, в качестве контроля. 96-луночные планшеты Nunc Maxisorp покрывали 100 мкл/лунку белка-мишени (2 мкг/мл) в PBS при 4ºC в течение ночи или при комнатной температуре в течение 2 часов. Планшеты блокировали 65 мкл 1% БСА в течение 30 минут и 40 мкл 1% твина-20 еще в течение 30 минут.
Надосадок фагов разбавляли 1:10 в буфере для ELISA (твердофазный иммуноферментный анализ) (PBS с 0,5% БСА, 0,05% твина-20) с добавлением или без добавления 10 нМ белка-мишени в общем объеме 100 мкл и инкубировали, по меньшей мере, 1 час при комнатной температуре в планшете F (NUNC). 75 мкл смеси, содержащей или не содержащей белка-мишени, переносили в расположенные рядом покрытые белком-мишенью планшеты. Планшет осторожно встряхивали в течение 15 минут, чтобы обеспечить возможность улавливания несвязанного фага с покрытым белком-мишенью планшетом. Планшет промывали, по меньшей мере, пять раз, используя PBS-0,05% твин-20. Связывание количественно оценивали, добавляя конъюгированное с пероксидазой хрена (HRP) анти-M13-антитело в буфере для ELISA (1:5000) и инкубируя в течение 30 минут при комнатной температуре. Планшеты промывали PBS-0,05% твин-20, по меньшей мере, пять раз. Затем в лунки добавляли по 100 мкл/лунку в соотношении 1:1 субстрат пероксидазы 3,3',5,5'-тетраметилбензидин (TMB) и раствор B для пероксидазы (H2O2) (Kirkegaard-Perry Laboratories (Gaithersburg, Md.)) и инкубировали в течение 5 минут при комнатной температуре. Реакцию останавливали добавлением в каждую лунку 100 мкл 1 М фосфорной кислоты (H3PO4) и инкубировали в течение 5 минут при комнатной температуре. OD (оптическую плотность) желтой окраски в каждой лунке определяли, используя стандартное считывающее устройство для планшетов ELISA, при 450 нм. Снижение OD (%) вычисляли, используя следующее уравнение.
Снижение OD450нм (%)=[(OD450нм лунок с конкурентом)/(OD450нм лунки без конкурента)] * 100
По сравнению со снижением OD450нм (%) в лунке с родительским фагом (100%) клоны, в которых наблюдали снижение OD450нм (%) менее 50%, отбирали для анализа последовательностей. Уникальные клоны отбирали для получения фага, чтобы определить аффинность связывания (IC50 фага) по сравнению с родительскими клонами (таблица 4).
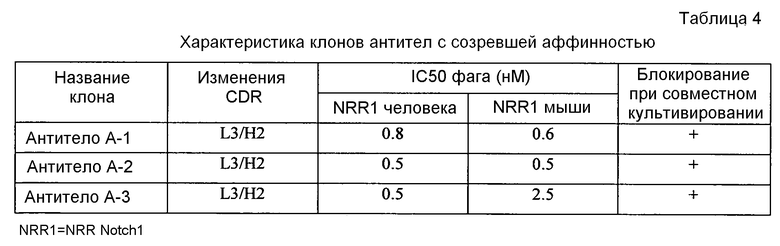
Пример 3: Характеристика анти-NRR Notch1-антител
Чтобы дополнительно охарактеризовать аффинность связывания и кинетику связывания анти-NRR Notch1-мАт, использовали измерение поверхностного плазмонного резонанса (SRP) с помощью BIAcoreTM-3000 (BIAcore, Inc., Piscataway, N.J.). Коротко, биосенсорный чип на основе карбоксиметилированного декстрана (CM5, BIAcore Inc.) активировали гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям производителя. Кроличье антитело против Ig человека (Pierce) разбавляли 10 мМ ацетатом натрия, pH 4,8, в концентрации 20 мкг/мл перед инъекцией со скоростью потока 5 мкл/минуту, чтобы достичь примерно 3000 единиц ответного сигнала (RU) связанного антитела. Затем инъецировали 1 М этаноламин, чтобы блокировать не вступившие в реакцию группы. Анти-NRR1-мАт (в форме полноразмерного IgG) улавливали кроличьим антителом против IgG человека, нанесенным в виде покрытия на чипы с достижением примерно 200 единиц ответного сигнала (RU). Для кинетических измерений двукратные серийные разведения белков NRR1 человека-ECD или NRR1 мыши-ECD (3,9 нМ-500 нМ) инъецировали в буфере PBS (PBS с 0,05% твин-20) при 25ºC со скоростью потока примерно 30 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляли, используя простую модель связывания Лэнгмюра «один к одному» (компьютерная программа для оценки BIAcore, версия 3.2). Равновесную константу диссоциации (KD) вычисляли в виде отношения koff/kon.
Результаты данного эксперимента показаны в таблице 5. «NA» означает, что измерение не проводили.
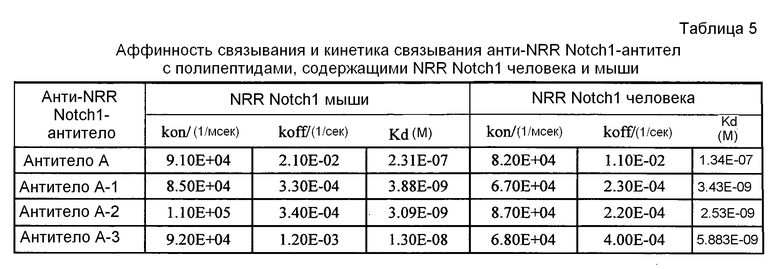
Пример 4. Характеристика эпитопа анти-NRR Notch1-антител
Чтобы исследовать детерминанту связывания антител A, A-1 и A-2, проводили эксперименты по связыванию с использованием фрагментов Notch1 человека и мыши.
В данных экспериментах использовали следующие белки:
(1) hFLAG-EGF34+NRR-His6 (101V) - иммуноген Notch1 человека, описанный в примере 1 выше.
(2) hFLAG-NRR-His6 (102V): содержит аминокислоты E1447-Q1733 Notch1 человека, FLAG-метку, HIS-метку и сайт расщепления тромбином. Часть Notch1 содержит последовательности из LNR_A, LNR_B, LNR_C, HD_N, HD_C. Указанный белок не содержит EGF-подобных повторяющихся последовательностей.
(3) hFLAG-HD-His6 (103V): содержит аминокислоты R1568-Q1733 Notch1 человека, FLAG-метку, сайт расщепления тромбином и HIS-метку. Белок Notch1 содержит последовательности из HD_N и HD_C. Указанный белок не содержит EGF-подобных повторяющихся последовательностей и не содержит трех областей LNR.
(4) mFLAG-EGF34+NRR-His6: мышиный иммуноген, описанный в примере 1, выше.
(5) mEGF34+NRR-L1597H-FLAG-TEV-Fc: содержит аминокислоты V1307-Q1723 Notch1 мыши с мутацией L1597H, Flag-метку, Fc-метку и сайт протеазы TEV. Мутация L1597H мутация приводит к активации Notch1 и описана, например, в Weng et al., Science 306: 269-271, 2004.
(6) Flag-контроль: контрольный полипептид, содержащий Flag-метку.
(7) His-контроль: контрольный полипептид, содержащий His-метку.
Протокол ELISA:
Белками в концентрации 1 мкг/мл в PBS, pH 7,4, покрывали планшеты ELISA (Nunc Maxisorp) при 4ºC в течение ночи. Планшеты блокировали казеиновым блокатором в PBS (фосфатно-солевой буфер; Pierce) в течение одного часа при комнатной температуре. В планшеты добавляли 3-кратные серийные разведения анти-NRR Notch1-IgG или нерелевантного IgG в буфере PBST (буфер PBT (PBS + 0,05% (об./об.) твин-20) с 0,5% (масс./об.) БСА) и инкубировали в течение одного часа при комнатной температуре. Затем планшеты промывали PBST и связанные антитела выявляли с использованием конъюгированного с пероксидазой антитела козы против Fab человека, специфичного для IgG (Sigma). Использовали субстрат TMB (3,3',5,5'-тетраметилбензидин) и регистрировали поглощение при 650 нМ, используя стандартное считывающее устройство для планшетов ELISA. Поглощение откладывали на графике против концентраций IgG, используя KaleidaGraph (компьютерная программа Synergy).
Результат данного эксперимента показан на фигурах 12A (антитело A-hIgG1), 12B (антитело A-1-hIgG1) и 12C (антитело A-2-hIgG1). Антитела A, A-1 и A-2 связывали полипептиды hFLAG-EGF34+NRR+His6 (101V), hFLAG-NRR-His6 (102V), hFLAG-HD-His6 (103V), mFLAG-EGF34+NRR-His6 и не связывали контрольные полипептиды, в которых отсутствуют последовательности Notch1. Полученные результате свидетельствуют о том, что домен NRR Notch1 является достаточным для связывания антитела A, антитела A-1 и антитела A-2. Антитела A, A-1 и A-2 также связывают белок mEGF34+NRR-L1597H-FLAG-TEV-Fc, который содержит активирующую Notch1 мутацию L1597H. Полученный результат свидетельствует, что антитела способны связываться с мутантным рецептором Notch1.
Пример 5. Функциональные анализы анти-NRR Notch1-антител
Анализ репортера Notch1
Анализ репортера Notch1 (также называемый в настоящем описании «анализом совместной культуры») осуществляли для измерения способности анти-NRR Notch1-антител ингибировать передачу сигналов Notch. Коротко, анализ включал следующие стадии:
(1) клетки NIH-3T3, экспрессирующие Notch1 человека, трансфицировали репортерной плазмидой, несущей ген люциферазы, который отвечает на передачу сигнала Notch;
(2) клетки обрабатывали антителами или различными контрольными реагентами;
(3) передачу сигнала инициировали добавлением клеток NIH-3T3, стабильно экспрессирующих Jagged1 человека; и
(4) уровень передачи сигналов Notch оценивали, измеряя активность люциферазы, экспрессированной с репортерной плазмиды.
Более подробно анализ осуществляли следующим образом:
(1) Клетки NIH-3T3, стабильно экспрессирующие Notch1 (N1) человека, высевали в 96-луночный планшет с черными перегородками с прозрачным дном по 5000 клеток на лунку в среду DMEM с высоким содержанием глюкозы, содержащую 10% FBS и не содержащую антибиотиков. Клетки инкубировали при 37ºC в течение 16 часов в присутствии 5% CO2. Затем среду заменяли на DMEM без сыворотки и клетки трансфицировали 100 нг/лунку люциферазной плазмиды TP-1 (промотор CSL, чувствительный к активации Notch) (смотри, например, Minoguchi et al., Mol. Cell. Biol. 17: 2679-2687 (1997)) и 5 нг/мл репортера люциферазы Renilla pRL-CMV (Promega). Трансфекцию продолжали в течение 6 часов при 37ºC, 5% CO2, при этом снова добавляли сыворотку в начале 4 часа.
(2) В конце шестого часа среду, содержащую реагенты для трансфекции, удаляли аспирацией и добавляли 50 мкл DMEM/FBS со следующими компонентами: A. свежая среда (позже, чтобы получить ложную стимуляцию контрольных родительских клеток NIH-3T3); B. свежая среда (DMEM с 10% FBS); C. контрольное антитело изотипа IgG человека в концентрации 400 нг/мл; анти-NRR Notch1-антитело A в четырех разных концентрациях (D. 16 нг/мл, E. 80 нг/мл, F. 400 нг/мл, G. 2000 нг/мл); H. анти-NRR Notch1-антитело A в концентрации 400 нг/мл, предварительно инкубированное с очищенным белком NRR Notch1 (5 мкг на лунку) в течение 30 минут; I. контрольное антитело изотипа IgG человека в концентрации 400 нг/мл с белком NRR Notch1, обработанным как описано в пункте H; J. анти-NRR Notch1-антитело A в концентрации 400 нг/мл, предварительно инкубированное в течение 30 минут со снова добавленным белком БСА (6,5 мкг/лунку); K. соединение E (ингибитор гамма-секретазы; C27H24F2N4O3; Seiffert et al., J. Biol. Chem. 275: 34086, 2000) в концентрации 1 мкМ; и L. контроль ДМСО (только растворитель соединения E). Перечисленные выше реагенты инкубировали с трансфицированными клетками NIH-3T3-Notch1 в течение 1 часа при 37ºC, 5% CO2.
5000 клеток NIH-3T3, стабильно экспрессирующих лиганд Jagged1 человека, добавляли в каждую лунку, за исключением J, в которой клетки представляли собой клетки родительской линии NIH-3T3. Затем планшет инкубировали при 37ºC, 5% CO2 в течение 23 часов.
Активности люциферазы светляка (TP1) и Renilla (pRL-CMV) измеряли с использованием набора для определения люциферазы Dual-Glo (Promega). Уровни передачи сигналов Notch вычисляли путем деления данных для светляка на данные для Renilla и посредством усреднения данных восьми повторов для каждого условия. Результаты показаны на фигуре 7, где отрезками показано стандартное отклонение результатов в повторах.
Как показано на фигуре 7, антитело A является сильным ингибитором Notch1. Антитело A ингибирует передачу сигналов Notch, судя по измерениям с использованием репортера TP1-Luc. Показано титрование антитела; при 400 нг/мл антитела передача сигналов Notch была ингибирована до 18% от контроля, уровня «начала действия» (уровня передачи сигнала, наблюдаемого с использованием контроля изотипа в концентрации 400 нг/мл). Дополнительное добавление растворимого белка NRR, но не контрольного БСА, снижало индуцируемое антителом блокирование передачи сигнала, показывая, что ингибирование антителом передачи сигнала было следствием взаимодействия антитело-NRR Notch1. Соединение E, ингибитор гамма-секретазы, использовали в качестве контроля, чтобы показать ингибирование. При замене Jagged1-экспрессирующих клеток родительскими клетками (только NIH-3T3 без Jagged1) в качестве другого контроля, не удавалось индуцировать полную передачу сигнала, что свидетельствует о том, что передача сигнала требует Jagged1.
Способ анализа при совместном культивировании, описанный выше, использовали для сравнения антитела A с его аналогами с созревшей аффинностью антителом A-1, антителом A-2 и антителом A-3, используя обработку при нескольких концентрациях. Как выявлено при использовании 80 нг/мл антитела, антитело A-2 и антитело A-3 вызывали более сильное блокирование передачи сигналов Notch, чем антитело A (фигура 8).
Анализ дифференцировки миобластов C2C12
Миобласты C2C12 мыши подвергаются дифференцировке в миотрубочки при обработке средой для дифференцировки. Совместное культивирование с клетками, экспрессирующими лиганд Jagged1, ингибирует дифференцировку посредством стимулирования передачи сигналов Notch. Как подробно описании ниже, в соответствии со способностью антитела A ингибировать передачу сигналов Notch1 добавление антитела A восстанавливало дифференцировку. Ингибитор гамма-секретазы, используемый в качестве контроля, также восстанавливал дифференцировку.
В частности, миобласты C2C12 мыши высевали в 24-луночную чашку для культивирования со стерильным круглым 10-мм покровным стеклом на дне в концентрации 2,5×104 клеток в миллилитре, используя 1 мл на лунку. Клеткам давали возможность прикрепиться и расти в течение 22 часов в среде для роста (DMEM с 10% FBS) при 37ºC, 5% CO2. Затем среду для роста аспирировали и добавляли среду для дифференцировки (DM) (DMEM с 6% сыворотки лошади). Клетки обрабатывали: A. только одна DM; B. DM с клетками 3T3-J1; C. DM с NIH-3T3-Jagged1 и антителом для контроля изотипа IgG человека; D. DM с клетками 3T3-J1 и антителом A в концентрации 200 нг/мл; E. DM с клетками NIH-3T3-Jagged1 и ДМСО (наполнитель); F. DM с клетками 3T3-J1 и соединением E (ингибитор гамма-секретазы) в концентрации 1 мкМ. Клетки инкубировали при 37ºC, 5% CO2 в указанных условиях в течение четырех суток. Покровные стекла извлекали и клетки фиксировали 4% параформальдегидом и делали проницаемыми, обрабатывая 0,2% тритоном X-100 в PBS. Затем клетки блокировали 10% FBS в PBS. Антитело, узнающее тяжелую цепь миозина (Millipore, Anti-Myosin HC, асциты клона A4.1025,), и второе антитело козы против IgG (H+L) мыши, конъюгированное с Alexa® 488 (Molecular Probes), использовали для окрашивания дифференцированных миотрубочек. DAPI использовали для контрастного окрашивания ядер. Для каждого условия отдирали изображения трех полей. Подгруппа изображений показана на фигуре 10. Компьютерную программу Metamorph (Molecular Devices) использовали для подсчета количества ядер и площади, окрашенной Alexa® 488. Площадь окраски Alexa® 488 делили на количество ядер, усредняли и изображали графически. Отрезки показывают стандартное отклонение для трех повторов изображений. Полученные результаты показаны на фигуре 9.
Пример 6. Анти-NRR Notch1-антитела ингибируют передачу сигнала рецепторами Notch1 дикого типа и мутантными рецепторами Notch1
Анализ совместного культивирования с использованием люциферазного репортера осуществляли на клетках NIH-3T3, временно трансфицированных плазмидами TP-1 и pRL-CMV, кодирующими мутантный рецептор Notch1 L1594P, мутантный рецептор Notch1 DelPEST и рецептор Notch1 дикого типа (wt), используя реагент липофектамин и липофектамин плюс (Invitrogen), и на клетках NIH-3T3, стабильно экспрессирующих Jagged-1 человека, по существу, как описано выше. Мутация L1594P означает мутацию от лейцина к пролину в положении аминокислоты (а/к) 1594 в HD-N домене (смотри, например, Weng et al., Science 306: 269-271, 2004). DelPEST означает делецию на карбоксильном конце домена PEST, начиная с аминокислоты 2473 (смотри, например, Malecki et al., Mol. Cell. Biol. 26: 4642-4651, 2006). В соответствии с опубликованными результатами результаты, показанные на фигуре 13, подтверждают, что обе мутации L1594P и DelPEST активируют передачу сигналов Notch1. По сравнению с негативным контролем с использованием нерелевантного полученного из фага моноклонального антитела такого же изотипа антитело A ингибировало передачу сигнала через каждый из трех рецепторов зависимым от дозы образом. Ингибитор гамма-секретазы соединение E (CmpE), растворенное в ДМСО, использовали в качестве позитивного контроля ингибирования передачи сигнала Notch. Заштрихованные черные столбики показывают результаты, полученные с использованием контрольного антитела в концентрации 2000 нг/мл; столбики с крупными точками показывают результаты, полученные с использованием антитела A в концентрации 80 нг/мл; столбиками с тонкими полосками показывают результаты, полученные с использованием антитела A в концентрации 400 нг/мл; столбики с толстыми полосками показывают результаты, полученные с использованием антитела A в концентрации 2000 нг/мл; столбики с поперечными штрихами показывают результаты, полученные с использованием соединения E в концентрации 10 мкМ; и столбики с мелкими точками показывают результаты, полученные с использованием ДМСО (носитель для соединения E). Результаты для каждого условия измеряли в восьми повторах и затем выражали в виде среднего значения с изображением отрезков, показывающих стандартное отклонение.
Пример 7. Анти-NRR Notch1-антитела нарушают васкуляризацию и ангиогенез
Влияние анти-NRR Notch1-антител на васкуляризацию и ангиогенез исследовали, используя анализ прорастания клеток HUVEC. Указанный анализ сходен с анализом, описанным в Nakatsu et al. (Microvasc. Res. 66 (2): 102-112, 2003). Клетками HUVEC покрывали шарики Cytodex 3® (Amersham Biosciences, Piscataway, N.J.), которые затем имплантировали в гель на основе фибрина. Фибробласты кожи человека высевали на слой геля из фибрина, который затем покрывали средой для культивирования клеток. Прорастание сосудов из клеток HUVEC исследовали спустя 4-9 суток. Подобно результатам, наблюдаемым в случае анти-D114-обработки, обработка анти-NRR Notch1-антителами вызывала заметное увеличение прорастания и длины сосудов, что показано на фигуре 14A. Представлены результаты для клеток, обработанных PBS в качестве контроля или антителом A или A-2, которые указаны. Анти-NRR Notch1-обработка нарушает васкуляризацию и ангиогенез за счет увеличения прорастания сосудов и плотности сосудистой сети.
Влияние анти-NRR Notch1-антител на васкуляризацию и ангиогенез также исследовали, используя анализ ангиогенеза в кармане роговицы. Как показано в протоколе, суммированном на фигуре 14B, в роговицы грызунов, которые в норме не имеют сосудов, имплантировали гранулы VEGF (№ 63, № 132 и № 390), чтобы индуцировать ангиогенез, или оставляли необработанными в качестве негативного контроля (№ 381). Затем две роговицы обрабатывали анти-D114 в качестве позитивного контроля для увеличения плотности сосудистой сети (№ 132) или антителом A-2 (№ 390). Сосуды визуализировали, используя методику иммунофлуоресцентного окрашивания на основе анти-CD31 (красная окраска). Как показано на фигуре 14B, анти-NRR Notch1-обработка значительно увеличивала плотность сосудистой сети. Сосуды в роговицах, обработанных, как описано выше для фигуры 14B, также перфузировали ФИТЦ-дестраном (зеленый), чтобы оценить поток через сосуды. Перфузия сосудов, обработанных анти-D114 и анти-NRR Notch1, была ограничена, как показано на фигуре 14C.
Также исследовали влияние анти-NRR Notch1-антител в модели ангиогенеза в сетчатке мыши. Как указано в протоколе, суммированном на фигуре 14D, сетчатки мышей P1 (1 день после рождения) или P3 (3 день после рождения) обрабатывали указанными концентрациями антитела против амброзии в качестве негативного контроля или антитела A-2. Сетчатки собирали на стадии P5 (5 день после рождения). Изолектин B4 использовали для визуализации сосудистой сети. В соответствии с результатами, показанными на фигурах 14A-14C, анти-NRR Notch1-обработка увеличивала плотность сосудистой сети и создавала фенотип гиперпрорастания. Сетчатки мышей, обработанные, как описано выше для фигуры 14D, красили DAPI, чтобы визуализировать ядерную ДНК. Как показано на фигуре 14E, анти-NRR Notch1-обработка вызывала увеличение количества ядер, что свидетельствует о возможном усилении пролиферации.
Пример 8. Анти-NRR Notch1-антитела ингибируют рост опухоли in vivo
Влияние анти-NRR Notch1-антител на рост опухоли исследовали, используя мышиную модель in vivo. Иммунодефицитных мышей (Balb-C Nu/Nu) использовали в исследовании ксенотрансплантата линией клеток HM7 (аденокарцинома ободочной кишки). Пять миллионов клеток имплантировали в 0,1 мл Matrigel (BD Biosciences, San Jose, Calif.), который использовали для подкожной инокуляции мышей. Опухолям давали возможность расти примерно до 250-300 кубических миллиметров, затем мышей группировали случайным образом для создания трех классов обработки и начинали введение доз, как указано. Обработка антителом A-2 задерживала рост опухоли, как показано на фигуре 15A. Антитела против амброзии и против VEGF служили в качестве негативного и позитивного контролей соответственно. В эксперименте, подобном эксперименту, который описан выше при описании фигуры 15A, различные дозы антитела A-2 тестировали в отношении способности задерживать или замедлять рост опухоли. Результаты показаны на фигуре 15B. В эксперименте, подобном эксперименту, который описан выше при описании фигуры 15A, за исключением того, что использовали линию клеток CALU6 (линия клеток немелкоклеточного рака легкого) вместо линии клеток HM7, обнаружено, что антитело A-2 уменьшает объем опухоли, как показано на фигуре 15C. Вместе взятые результаты, показанные на фигурах 15A-15C, свидетельствуют, что анти-NRR Notch1-антитела ингибируют рост опухоли.
В эксперименте, подобном эксперименту, описанному выше при описании фигуры 15B, обнаружено, что антитело A-2 вызывает потерю массы зависимым от дозы образом, как показано на фигуре 15D. В эксперименте, подобном эксперименту, описанному выше при описании фигуры 15B, исследовали клиренс антитела A-2, измеряя концентрацию Fc человека в сыворотке обработанных мышей в указанных временных точках. Результаты показаны на фигуре 15E.
Пример 9. Анти-NRR Notch1-антитела влияют на пролиферацию и дифференцировку клеток кишечника
Исследовали влияние анти-NRR Notch1-антител на клетки в кишечном тракте мышей. Кишечник выделяли из контрольных (обработанных наполнителем) и обработанных мышей примерно через 10 дней после внесения дозы антитела A-2 каждые три-четыре дня. Образцы красили гематоксилином и эозином плюс либо алциановый голубой для муцина (голубой, в качестве маркера секреторных клеток), либо анти-Ki-67 (коричневый; основанный на антителах способ иммунохимического окрашивания) для широко используемого белка-маркера пролиферации Ki-67. На фигурах 16A и 16B показаны примеры крипт и ворсинок тонкого кишечника или толстого кишечника соответственно мышей, обработанных контрольным антителом (наполнитель) или антителом A-2 в указанной концентрации. Результаты показывают, что анти-NRR Notch1 задерживает пролиферацию временно амплифицирующих клеток и увеличивает количество секреторных клеток, включая бокаловидные клетки и клетки Панета.
Пример 10. Анти-NRR Notch1-антитела и ингибиторы гамма-секретазы снижают жизнеспособность некоторых линий злокачественных клеток
Исследовали влияние анти-NRR Notch1 и ингибиторов гамма-секретазы DAPT и «соединения E» (CmpE) на панели линий злокачественных клеток. Линии клеток, показанные на фигуре 17 (ось x), выращивали в присутствии или в отсутствие антитела A-2, DAPT, CpmE или ДМСО (контроль, наполнитель для ингибиторов гамма-секретазы), как указано, и оценивали жизнеспособность клеток, используя анализ жизнеспособности клеток на основе люминесценции CellTiter-GloTM (Promega, Madison, Wis.). В данном анализе определяют количество жизнеспособных клеток на основании количества присутствующей АТФ, которое является показателем метаболически активных клеток. Люминесценцию оценивают количественно в виде «относительных единиц люминесценции», как показано на фигуре 17 (ось y). Как показано на фигуре 17, MT-3, которая, как сообщалось, является линией карциномы молочной железы, и OVCAR-3, линия злокачественных клеток яичника, имели пониженные уровни АТФ, что свидетельствует о сниженной пролиферации и/или повышенной гибели клеток, после инкубации в присутствии DAPT, CmpE или анти-NRR Notch1.
Хотя вышеупомянутое изобретение описано подробно с целью иллюстрации и примера для более ясного понимания, описание и примеры не следует толковать как ограничивающие объем изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ NOTCH2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2580029C2 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |
| АНТИТЕЛА ПРОТИВ DLL4 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2415869C2 |
| АНТИТЕЛА ПРОТИВ AXL И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2577986C2 |
| АНТИ-LRP6 АНТИТЕЛА | 2011 |
|
RU2587625C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХ С ОСЬЮ PD-1, И ИНГИБИТОРОВ TIGIT | 2014 |
|
RU2702108C2 |
| АНТИТЕЛА ПРОТИВ FGFR3 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2568066C2 |
| АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2436796C9 |
| АНТИТЕЛА К JAGGED И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2666990C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХ С ОСЬЮ PD-1, И ИНГИБИТОРОВ TIGIT | 2014 |
|
RU2825390C2 |

















































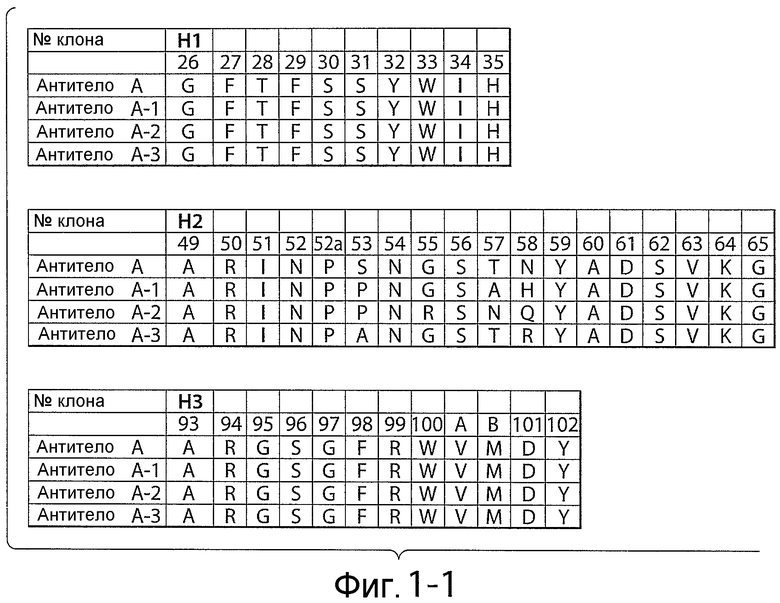
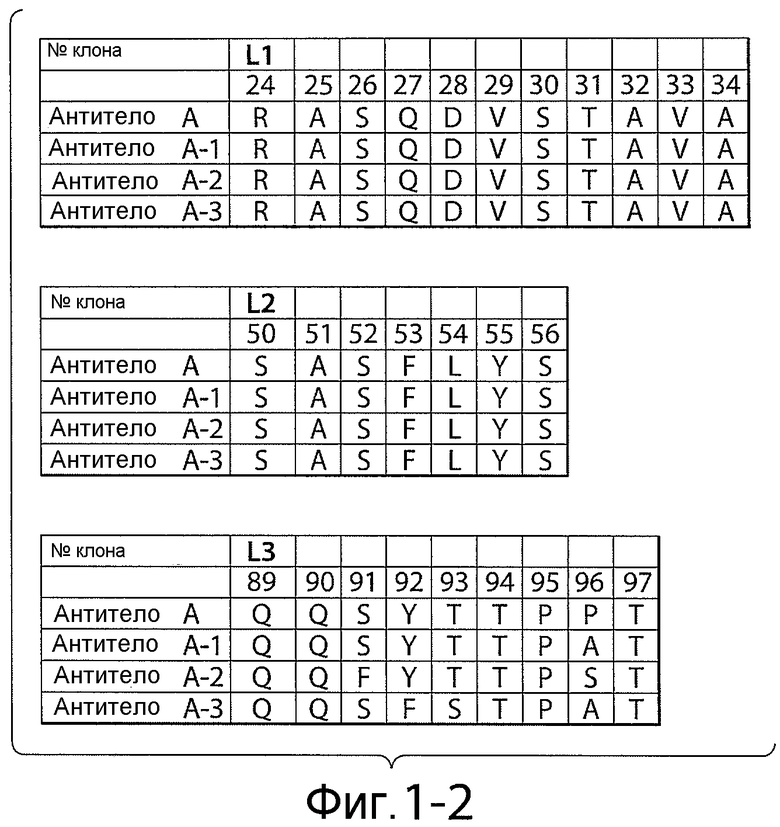

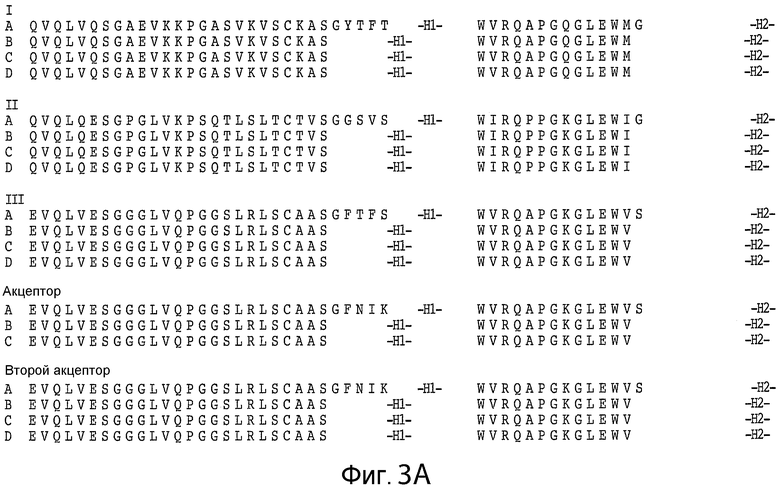

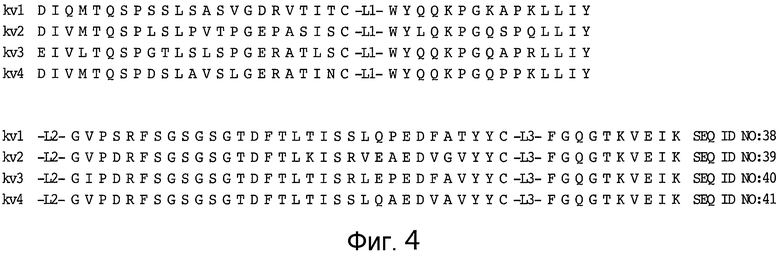


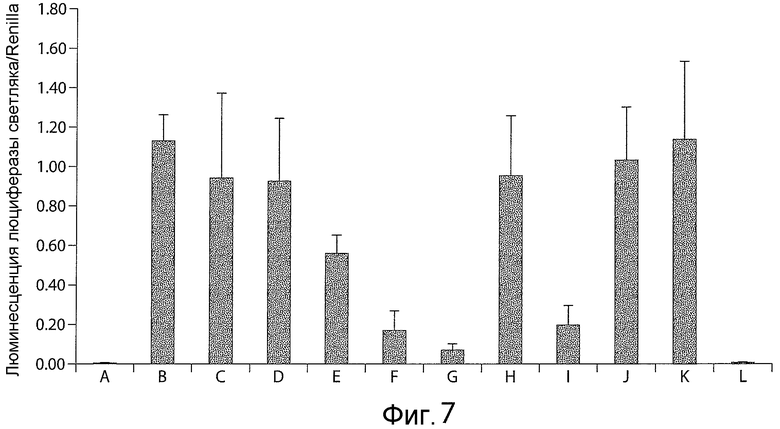
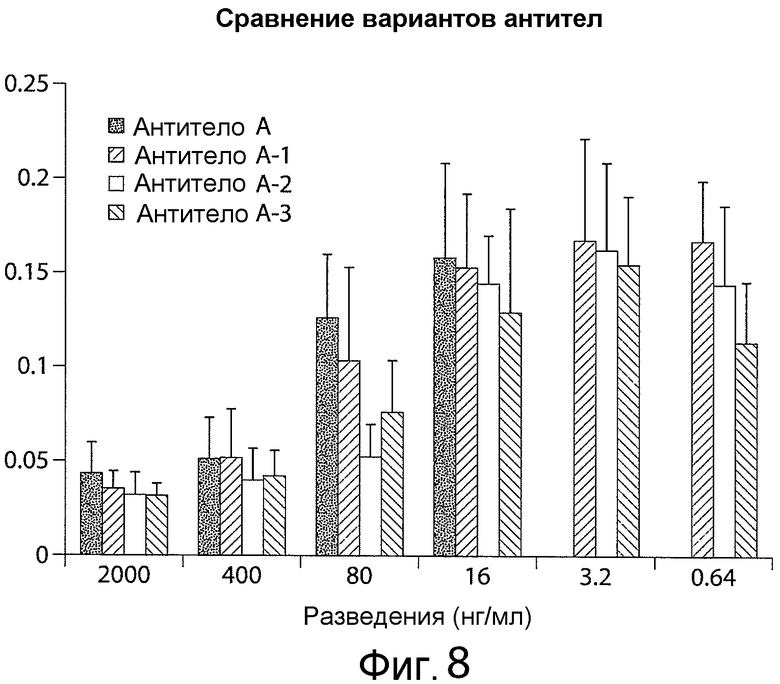
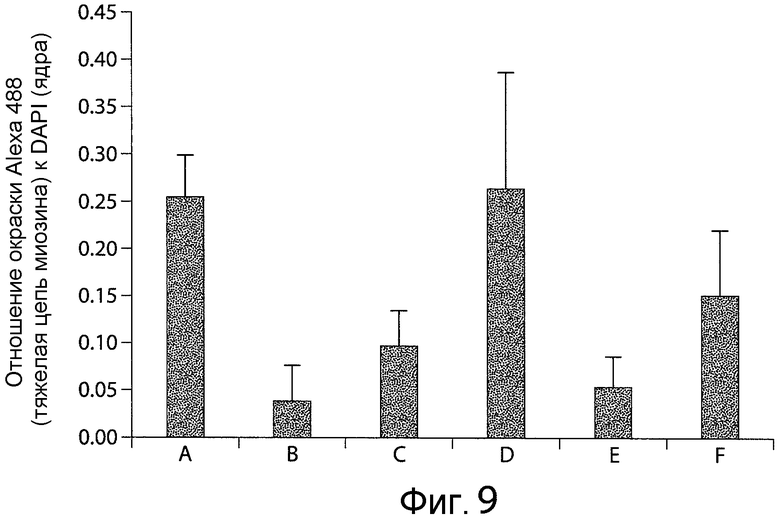


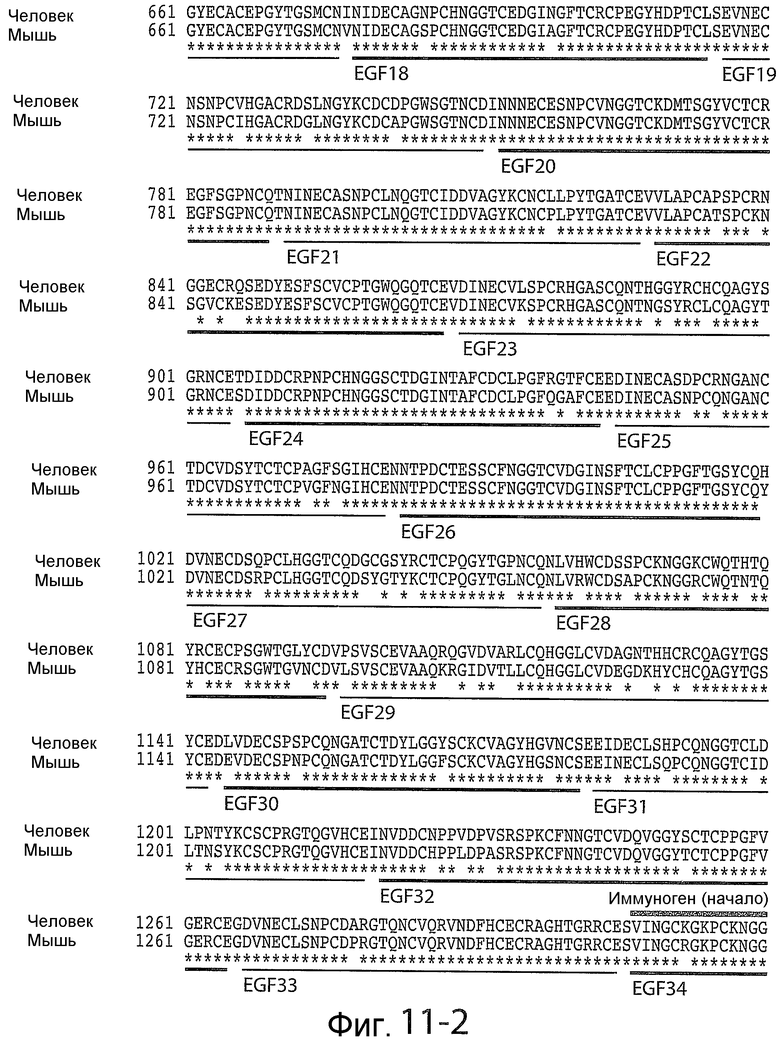
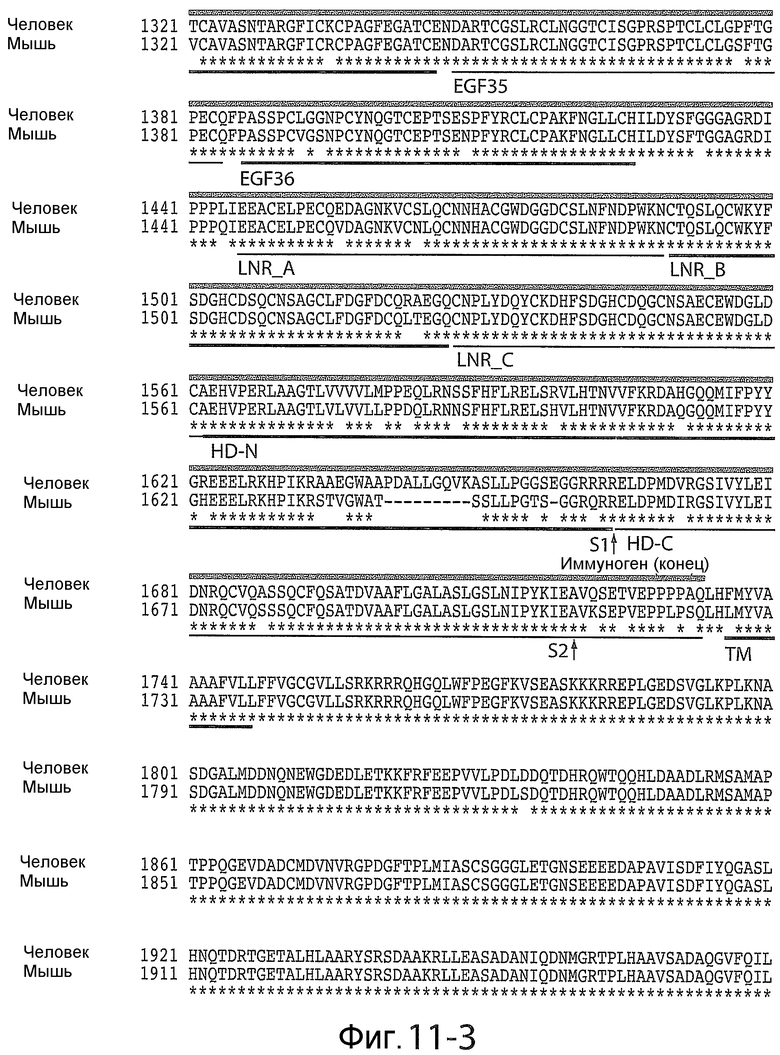
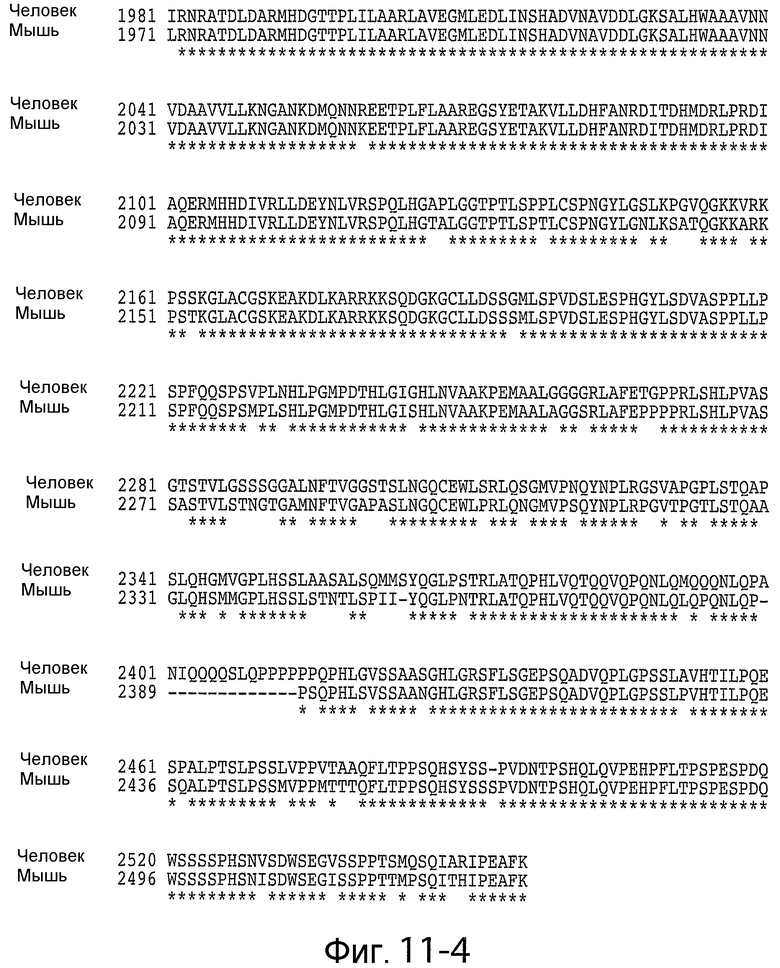
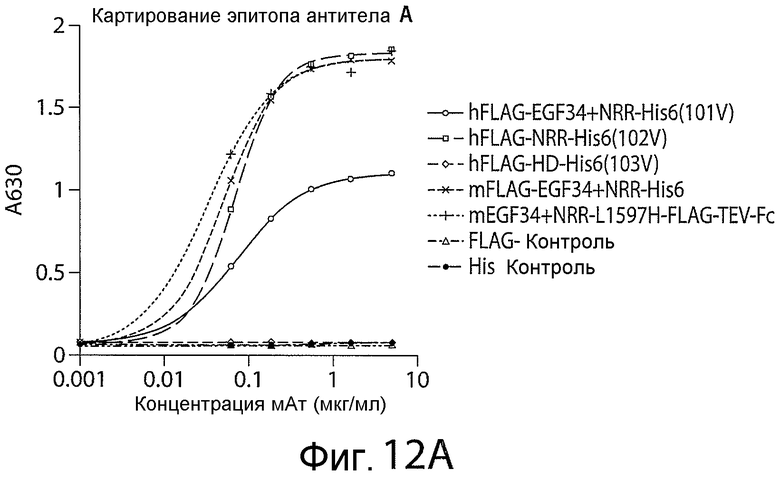
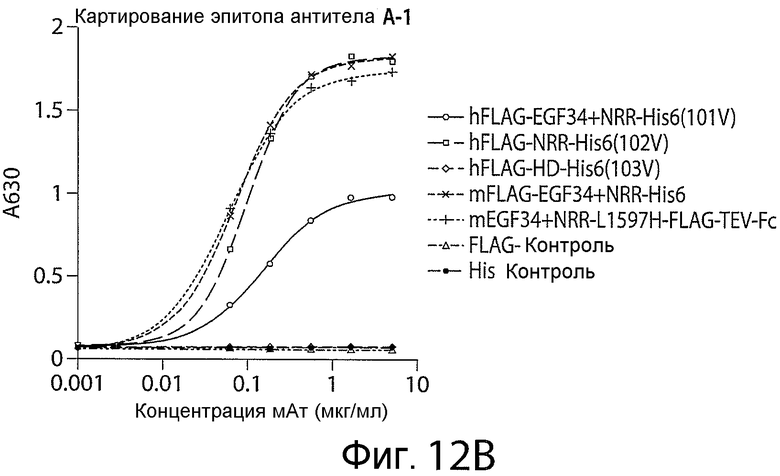
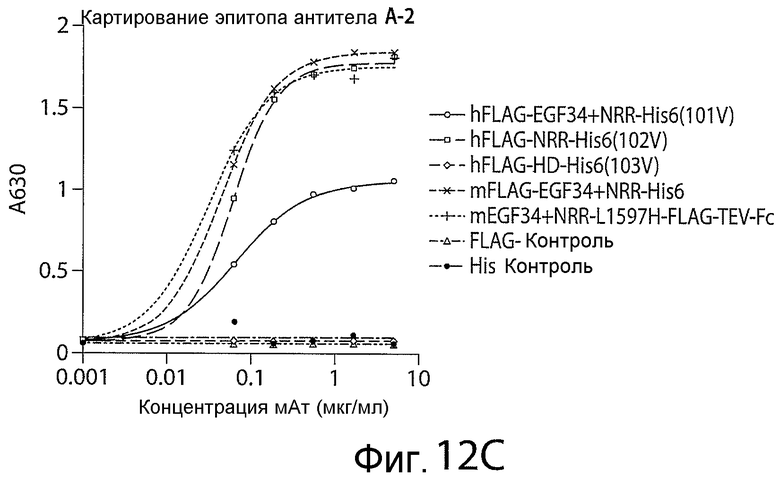
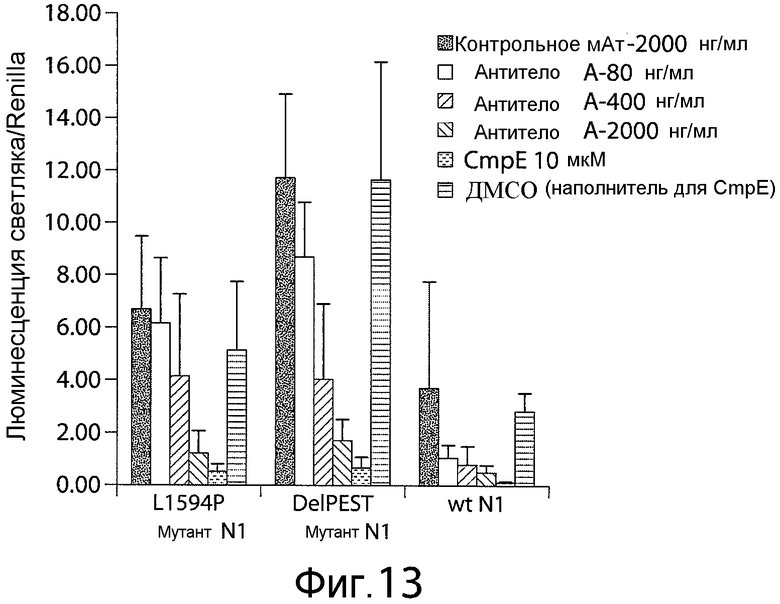
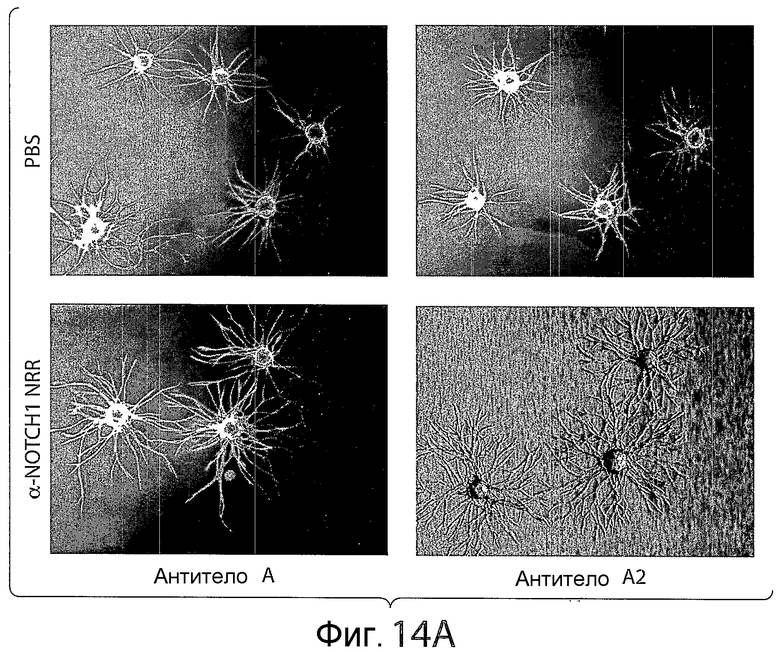
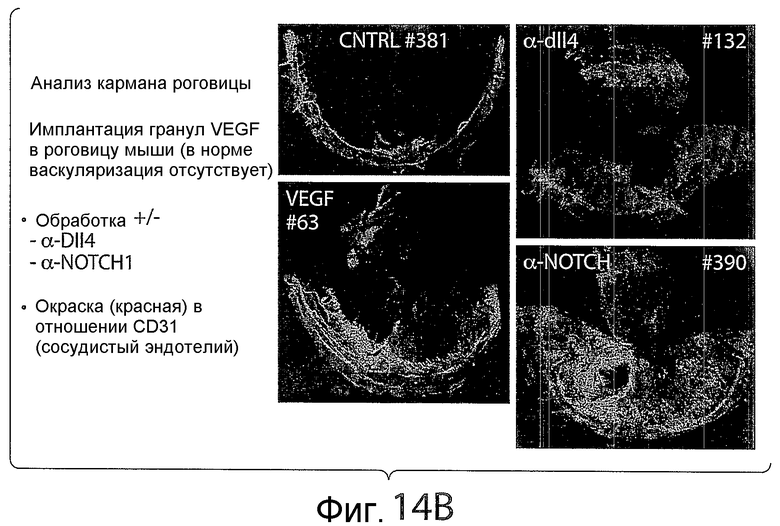
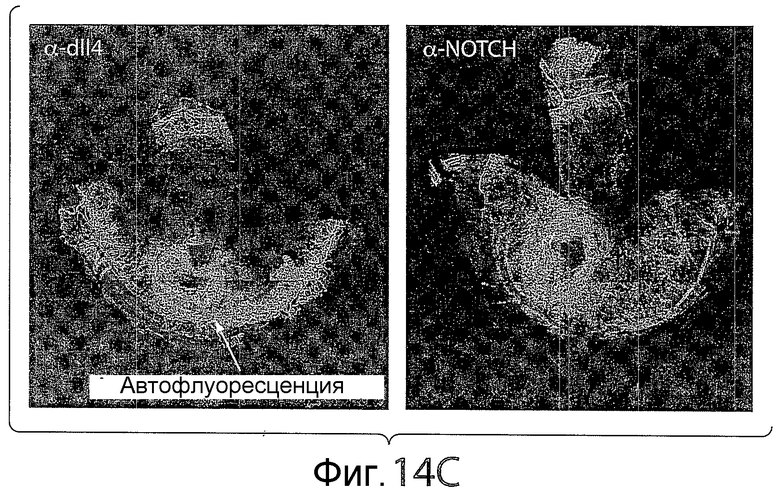
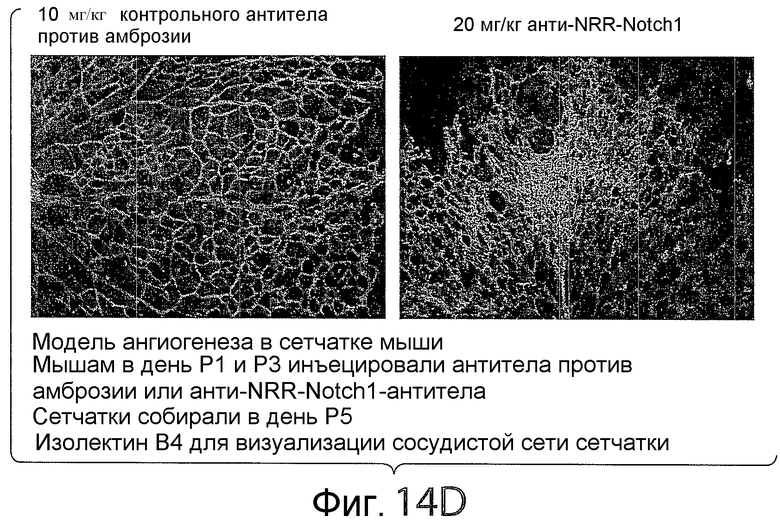
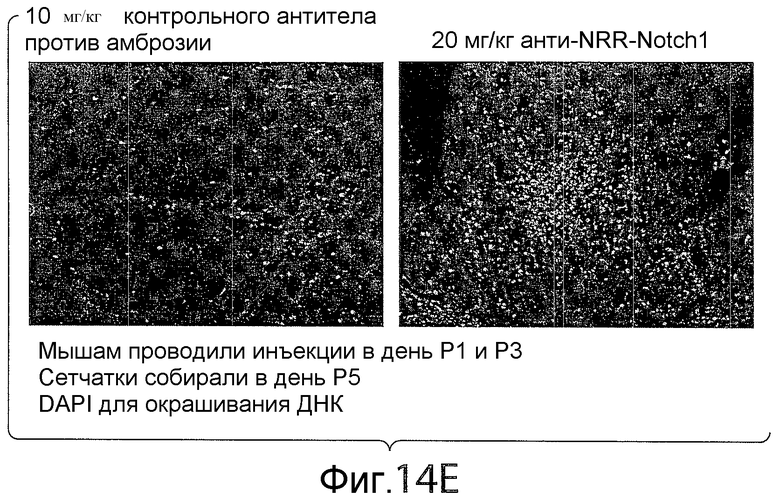
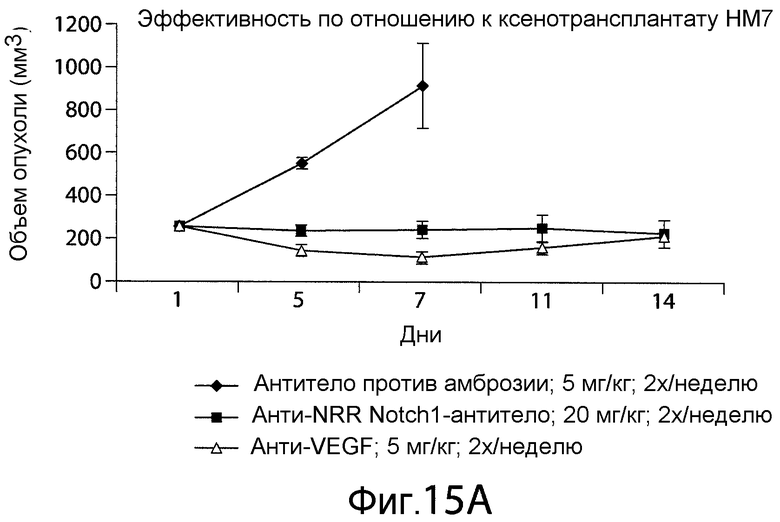
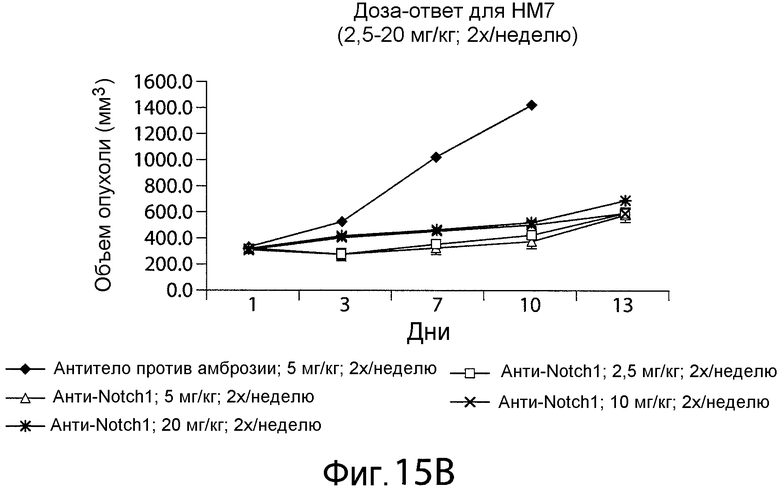
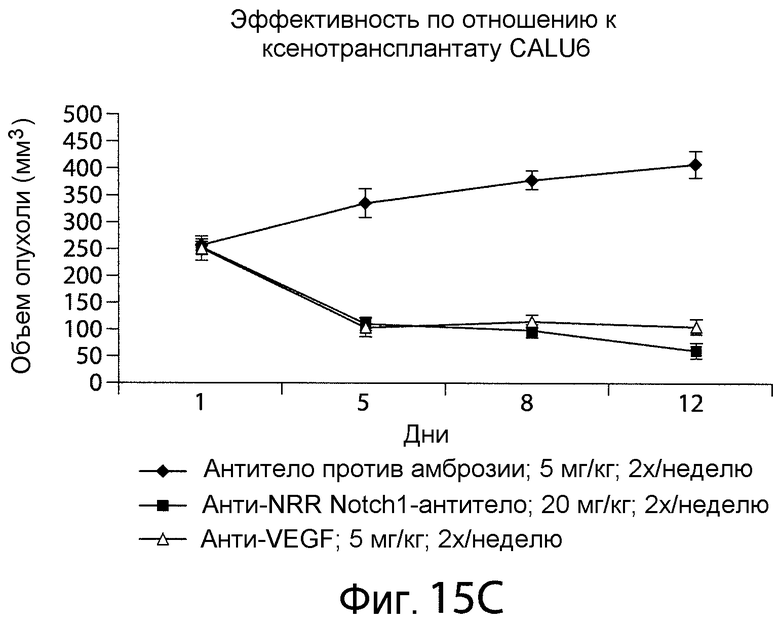
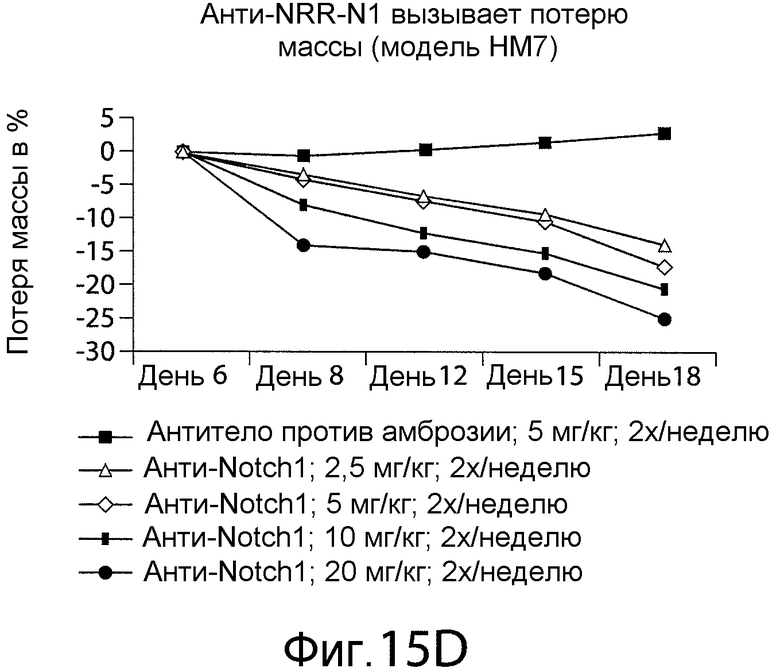
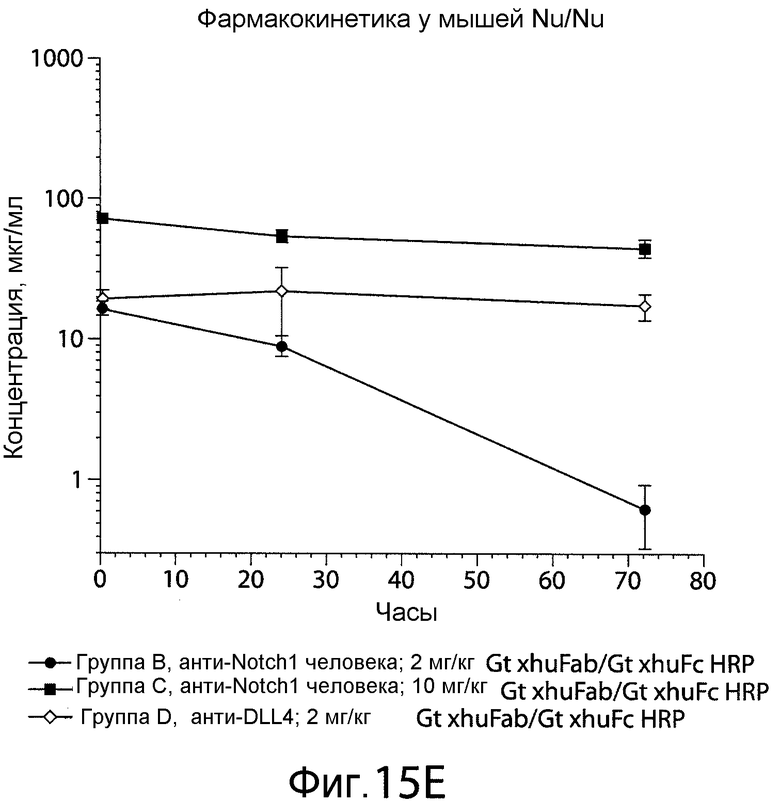
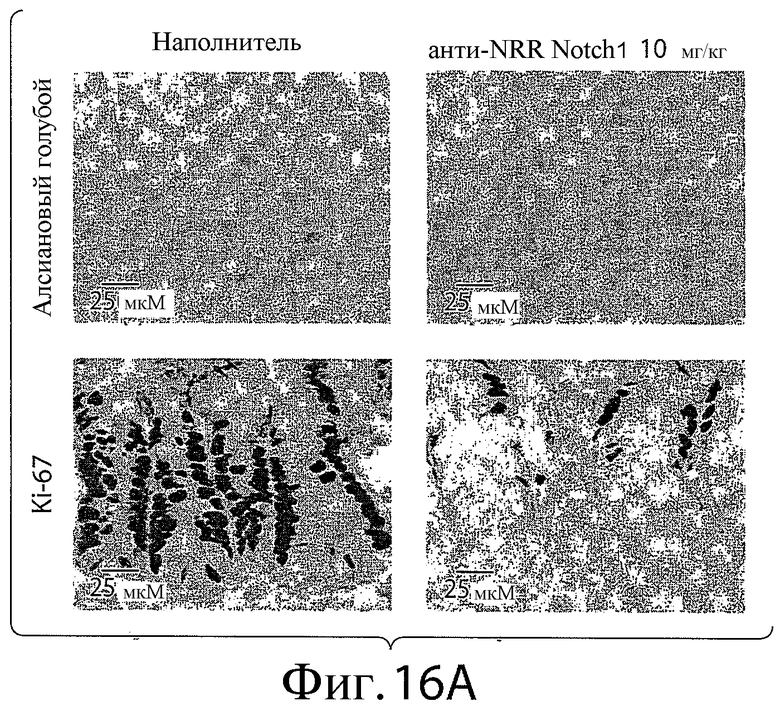
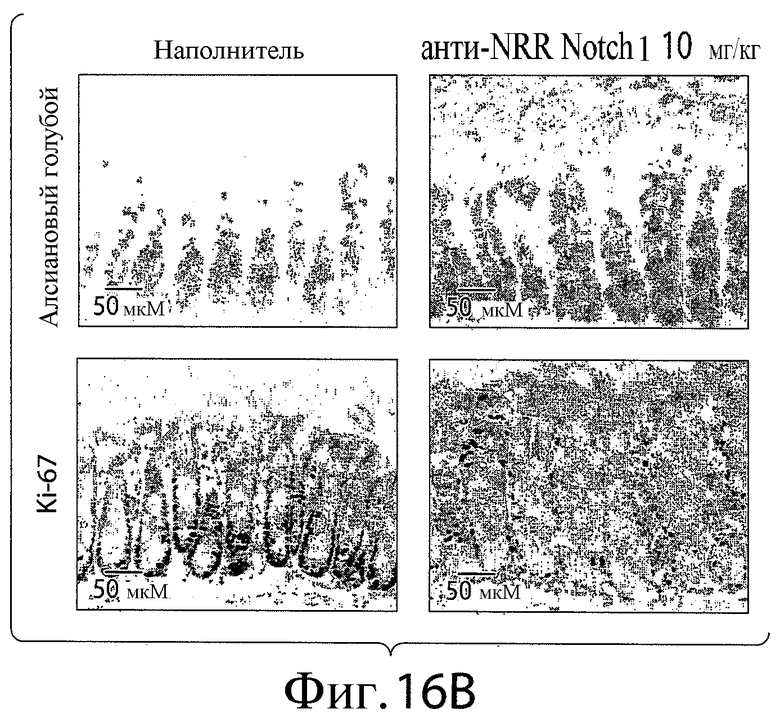
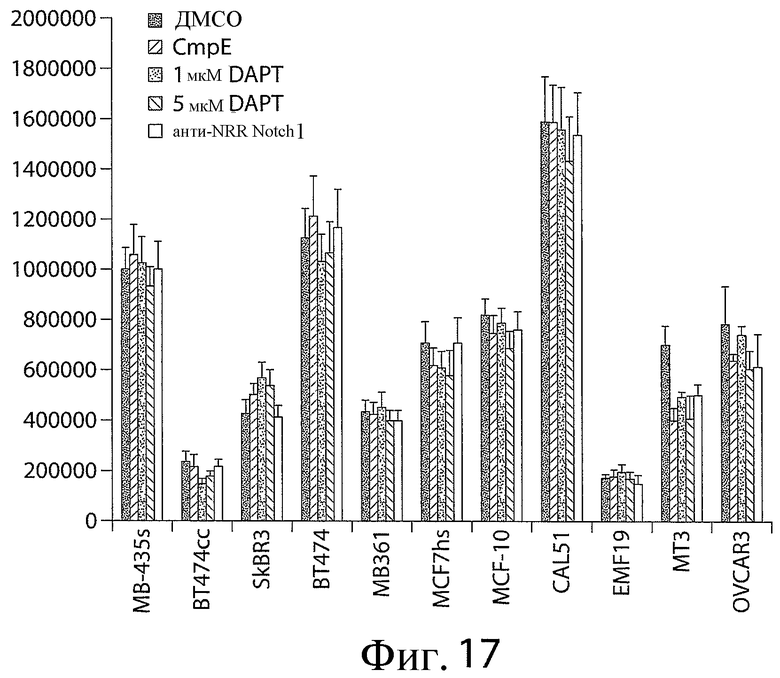
Изобретение относится к области иммунологии. Предложены варианты антител, специфически связывающихся с аминокислотными остатками 1446-1725 Notch1 мыши или 1446-1735 Notch1 человека. Раскрыт кодирующий полинуклеотид, вектор экспрессии на основе полинуклеотида, клетка-хозяин для экспрессии антитела. Описан способ получения антитела с использованием вектора, а также применение антител как лекарственного средства или в способе лечения против нарушений, связанных с повышенной передачей сигналов или повышенной экспрессией Notch1. Использование изобретения обеспечивает антитела, которые понижают передачу сигналов Notch1, что может найти применение в медицине для лечения нарушений, связанных с повышенной экспрессией Notch1. 10 н. и 32 з.п. ф-лы, 17 ил., 5 табл., 10 пр.
1. Выделенное моноклональное антитело, которое специфически связывается с NRR Notch1 мыши и/или человека со значением Kd, равным 1×10-7 или выше, где указанное антитело связывается с аминокислотными остатками 1446-1725 Notch1 мыши или аминокислотными остатками 1446-1735 Notchl человека и где указанное антитело при связывании с указанным NRR Notch1 снижает передачу сигналов Notch1.
2. Выделенное анти-NRR Notch1-антитело по п.1, где антитело связывается с аминокислотами 1446-1735 последовательности SEQ ID NO:56.
3. Выделенное анти-NRR Notch1-антитело по п.1, где антитело связывается с аминокислотами 1446-1725 последовательности SEQ ID NO:57.
4. Выделенное анти-NRR Notch1-антитело по п.1, где указанное антитело связывается с NRR Notch1 мыши и/или человека со значением Kd, равным 1·10-8 или выше.
5. Выделенное анти-NRR Notch1-антитело по п.1, где указанное антитело связывается с NRR Notch1 мыши и/или человека со значением Kd, равным 1·10-9 или выше.
6. Выделенное антитело, которое специфически связывается с NRR Notch1 мыши и/или человека со значением Kd, равным 1·10-7 или выше, где указанное антитело связывается с аминокислотными остатками 1446-1725 Notch1 мыши или аминокислотными остатками 1446-1735 Notch1 человека, что снижает передачу сигнала Notch1, содержащее:
(a) шесть последовательностей гипервариабельных областей (HYR), выбранных из группы, состоящей из:
(i) HVR-L1, содержащей последовательность А1-А11, где А1-А11 представляет собой RASQDVSTAVA (SEQ ID NO:7);
(ii) HVR-L2, содержащей последовательность В1-В7, где В1-В7 представляет собой SASFLYS (SEQ ID NO:8);
(iii) HVR-L3, содержащей последовательность С1-С9, где С1-С9 представляет собой QQSYTTPPT (SEQ ID NO:9);
(iv) HVR-H1, содержащей последовательность D1-D10, где D1-D10 представляет собой GFTFSSYWIH (SEQ ID NO:1);
(v) HVR-H2, содержащей последовательность Е1-Е18, где Е1-Е18 представляет собой ARINPSNGSTNYADSVKG (SEQ ID NO:2); и
(vi) HVR-H3, содержащей последовательность F1-F14, где F1-F14 представляет собой ARGSGFRWVMDY (SEQ ID NO:6); и
(b) по меньшей мере один вариант HVR, где последовательность варианта HVR содержит модификацию по меньшей мере одного остатка в последовательности SEQ ID NO:1-12, где антитело обладает той же активностью.
7. Антитело по п.6, в котором вариант HVR-L3 содержит 1-4 (1, 2, 3 или 4) замены в любом сочетании в следующих положениях: С3 (S или F), С4 (Y или F), С5 (Т или S) и С8 (Р или А или S).
8. Антитело по п.6, в котором вариант HVR-H2 содержит 1-4 (1, 2, 3 или 4) замены в любом сочетании в следующих положениях: Е6 (S или Р или А); Е8 (G или R); Е10 (Т, или А, или N) и E11 (N, или Н, или Q, или R).
9. Антитело по п.6, в котором модификация представляет собой замену, инсерцию или делению.
10. Выделенное антитело, которое специфически связывается с NRR Notch1 мыши и/или человека со значением Kd, равным 1·10-7 или выше, где указанное антитело связывается с аминокислотными остатками 1446-1725 Notch1 мыши или аминокислотными остатками 1446-1735 Notch1 человека, что снижает передачу сигналов Notch1, содержащее:
(i) последовательность HVR-H1, содержащую последовательность SEQ ID NO:1;
(ii) последовательность HVR-H2, содержащую последовательность SEQ ID NO:2, 3,4 или 5;
(iii) последовательность HVR-H3, содержащую последовательность SEQ ID NO:6; и
(iv) последовательность HVR-L1, содержащую последовательность SEQ ID NO:7;
(v) последовательность HVR-L2, содержащую последовательность SEQ ID NO:8;
(vi) последовательность HVR-L3, содержащую последовательность SEQ ID NO:9, 10, 11 или 12.
11. Антитело по п.10, где антитело содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая область по порядку содержит последовательности SEQ ID NO:7, 8, 9, 1, 2, 6.
12. Антитело по п.10, где антитело содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая область по порядку содержит последовательности SEQ ID NO:7, 8, 10, 1, 3, 6.
13. Антитело по п.10, где антитело содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая область по порядку содержит последовательности SEQ ID NO:7, 8, 11, 1, 4, 6.
14. Антитело по п.10, где антитело содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая область по порядку содержит последовательности SEQ ID NO:7, 8, 12, 1, 5, 6.
15. Антитело по любому из пп.6-14, содержащее каркасную последовательность, где, по меньшей мере, часть каркасной последовательности представляет собой консенсусную каркасную последовательность человека.
16. Антитело по любому из пп.6-14, где антитело содержит консенсусную каркасную последовательность подгруппы κ человека.
17. Антитело по любому из пп.6-14, где антитело содержит консенсусную каркасную последовательность подгруппы III тяжелой цепи человека.
18. Антитело по п.17, где антитело содержит замену в одном или нескольких положениях 71, 73 или 78.
19. Антитело по п.18, в котором замена представляет собой одну или несколько из R71 A, N73T или N78А.
20. Полинуклеотид, кодирующий антитело по любому из пп.1-19.
21. Вектор экспрессии, содержащий полинуклеотид по п.20.
22. Клетка-хозяин, содержащая вектор по п.21, использующаяся для экспрессии белка.
23. Клетка-хозяин по п.22, где клетка-хозяин является прокариотической клеткой.
24. Клетка-хозяин по п.22, где клетка-хозяин является эукариотической клеткой.
25. Клетка-хозяин по п.24, где клетка-хозяин является клеткой млекопитающего.
26. Способ получения анти-NRR Notch1-антитела, включающий (а) экспрессию вектора по п.21 в подходящей клетке-хозяине и (b) выделение антитела.
27. Способ по п.26, где клетка-хозяин является прокариотической клеткой.
28. Способ по п.26, где клетка-хозяин является эукариотической клеткой.
29. Анти-NRR Notch1-антитело по любому из пп.1, 6 или 10 для применения в качестве лекарственного средства для лечения индивидуума с нарушением, связанным с повышенной передачей сигнала или повышенной экспрессией Notch1.
30. Анти-NRR Notch1-антитело по любому из пп.1, 6 или 10 для применения в способе лечения индивидуума с нарушением, связанным с повышенной передачей сигналов или повышенной экспрессией Notch1.
31. Анти-NRR Notch1-антитело для применения по п.30, где указанным нарушением является злокачественная опухоль, опухоль и/или клеточное пролиферативное нарушение.
32. Анти-NRR Notch1-антитело для применения по п.31, где указанной злокачественной опухолью, опухолью и/или клеточным пролиферативным нарушением является рак.
33. Анти-NRR Notch1-антитело для применения по п.30, где указанным нарушением является нейродегенеративное нарушение.
34. Анти-NRR Notch1-антитело для применения по п.30, где нарушение включает патологическое состояние, ассоциированное с ангиогенезом.
35. Анти-NRR Notch1-антитело для применения по любому из пп.30-34, дополнительно включающего введение индивидууму эффективного количества второго лекарственного средства, где первым лекарственным средством является анти-NRR Notch1-антитело.
36. Анти-NRR Notch1-антитело для применения по п.35, где вторым лекарственным средством является другое антитело, химиотерапевтическое средство, цитотоксическое средство, антиангиогенное средство, иммунодепрессант, пролекарство, цитокин, антагонист цитокина, цитотоксическая лучевая терапия, кортикостероид, противорвотное средство, противораковая вакцина, анальгетик или ингибирующее рост средство.
37. Анти-NRR Notch1-антитело для применения по п.35, где вторым лекарственным средством является тамоксифен, летрозол, эксеместан, анастрозол, иринотекан, цетуксимаб, фулвестрант, винорелбин, эрлотиниб, бевацизумаб, винкристин, иматиниб, сорафениб, лапатиниб или трастузумаб.
38. Анти-NRR Notch1-антитело для применения по п.35, где второе лекарственное средство вводят до или после введения анти-NRR Notch1-антитела.
39. Анти-NRR Notch1-антитело для применения по п.35, где второе лекарственное средство вводят одновременно с анти-NRR Notch1-антителом.
40. Анти-NRR Notch1-антитело для применения по п.35, где указанным индивидуумом является человек.
41. Анти-NRR Notch1-антитело для применения по п.30, где нарушение у индивидуума связано с активирующей мутацией в аминокислотной последовательности Notch1.
42. Композиция для ингибирования роста клетки, содержащая эффективное количество анти-NRR Notch1-антитела по любому из пп.1-19 и фармацевтический носитель.
| WO 2000020576 А, 13.04.2000 | |||
| WO 2007061988 А2, 31.05.2007 | |||
| WO 2006053063 А2, 18.05.2006 | |||
| WO 2004090110 А2, 21.10.2004 | |||
| MARK Y | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| РОЙТ и др | |||
| ИММУНОЛОГИЯ | |||
| Пер | |||
| с англ | |||
| - М.: Мир, 2000, стр.153-158. | |||
Авторы
Даты
2013-02-27—Публикация
2008-06-03—Подача