Данная заявка представляет собой безусловную заявку предварительной заявки 61/428643, поданной 30 декабря 2010 года.
Область техники
Изобретение, в общем, относится к лекарственным средствам для управления гепатотоксичностью (токсичным действием на печень). Конкретнее, оно относится к гепатозащитному потенциалу гарцинола.
Предшествующий уровень техники
Термин "гепатотоксичность", в общем, относится к повреждению печени, вызванному химическими веществами. Такое повреждение встречается главным образом, когда печень выполняет свою природную функцию трансформации и очистки химических веществ в организме.
Тесная связь между печенью, желудочно-кишечным трактом и селезенкой через систему воротной вены, как часть ее метаболической функции, дополнительно усиливает воздействие токсичности в связи с циркулирующими лекарственными средствами.
Nilesh Mehta с соавт. (Drug-Induced Hepatotoxicity- Medscape REFERENCE-Drugs, Diseases and Procedures) сообщает, что 75% идиосинкразических реакций на лекарственные средства приводят к пересадке печени или смерти. Те же авторы также сообщают, что в США ежегодно встречаются приблизительно 2000 случаев острой печеночной недостаточности, и 50% таких случаев могли бы объясняться воздействиям лекарственных средств. Авторы дополнительно освещают патофизиологические механизмы, лежащие в основе гепатотоксичности, вызываемой лекарственными средствами. Они включают:
(i) разрушение гепатоцитов, которое сопровождается разборкой актиновых фибрилл вследствие ковалентного связывания лекарственного средства с внутриклеточными белками и снижения уровней АТФ (аденозинтрифосфат).
(ii) вызываемое лекарственными средствами блокирование транспортных насосов, предотвращающее нормальное выведение с желчью, с причинением холестаза.
(iii) иммунный ответ, опосредованный связыванием лекарственного средства с ферментом Р-450.
(iv) вызванный TNF-α (tumor necrose factor - фактор некроза опухолей) апоптоз гепатоцитов.
(v) разрушение митохондрий вследствие пониженного образования АТФ, обусловленного подавлением НАД (никотинамидадениндинуклеотид) и ФАД (флавинадениндинуклеотид), вызванным лекарственными средствами, в процессе образования энергии при бета-окислении.
(vi) вызванное токсичными метаболитами повреждение желчного протока.
(vii) активация типов клеток печени, подобных клеткам Бровича-Купфера, и вследствие того рецепторов, подобных Toll-подобному рецептору 4 (TLR4) и CD14, в течение раннего повреждения печени, вызванного этанолом, приводя к интернализации липополисахаридной фракции клеточных стенок грамм-отрицательных бактерий, которые населяют кишку в среде, богатой спиртом. Затем это приводит к активации провоспалительных цитокинов, подобных TNF-α, и супероксидов, которые поступают в звездчатые клетки, приводя к синтезу коллагена, фиброзу и, в конечном счете, циррозу печени.
Гепатозащита в качестве постоянно действующих терапевтических (как предупредительных, так и профилактических) средств, таким образом, приобретает огромное значение при патологических состояниях, когда происходит взаимодействие одного или более чем одного упомянутого выше механизма при причинении повреждения печени. Такие патологические состояния включают:
(i) неалкогольный стеатогепатит (НАСГ), который представляет собой накопление жира в печени с ее последующим воспалением. Хотя он напоминает заболевание печени, вызванное алкоголем, он встречается у людей, которые не являются алкоголиками или которые употребляют очень мало алкоголя. НАСГ является загадочным в том смысле, что он может регрессировать сам по себе или ухудшаться в замедленном темпе, приводя к фиброзу и впоследствии угрожающему жизни циррозу. Дополнительно, не существует специфических видов терапии для этого заболевания, за исключением способов управления образом жизни.
(ii) алкогольная зависимость, являющаяся следствием запойного или продолжительного употребления;
(iii) хемотерапия для лечения рака;
(iv) патологические состояния, такие как неалкогольная жировая болезнь печени, где в печени происходит отложение жира без признаков и симптомов воспаления или повреждения печени;
(v) вирусный, острый или хронический гепатит, где последние патологическое состояние может приводить к фиброзу и угрожающему жизни циррозу/раку печени.
Гарцинол, выделенный из кожицы плода Garcinia sp., известен из уровня техники как антиоксидант и хемозащитный агент (Tanaka, Т. et. al. Prevention of colonic aberrant crypt foci by dietary feeding of garcinol in male F3444 rats. Carcinogenesis, June 2000: 21 (6): 1183-9).
Гарцинол и изогарцинол оценивали с точки зрения их антибактериальной активности против метициллин-устойчивого Staphylococcus aureus (Linuma М et al, Antibacterial activity of some Garcinia benzophenone derivatives against methicillin-resistant Staphylococcus aureus. Biol Pharm Bull 1996 February; 19(2): 311-4).
О роли гарцинола как потенциального ингибитора гистонацетилтрансфераз (HAT) как in vitro, так и in vivo сообщалось Tapas с соавт. в 2004 ("Polyisoprenylated Benzophenone, Garcinol, a Natural Histone Acetyl transferase Inhibitor, Represses Chromatin Transcription and Alters Global GeneExpression", The Journal of Biological Chemistry, Vol.279, No.32, Issue of August 6, pp.33716-33726, 2004).
В настоящем изобретении к медицинскому потенциалу гарцинола в описании дополнительно добавляют гепатозащитное действие молекулы посредством регулирования одного или более чем одного патофизиологического действия, освещенного выше в данном документе. Конкретно, в настоящем изобретении старались изучить воздействия гарцинола на изменение биохимических маркеров, связанных с гепатотоксичностью.
Краткое описание изобретения
В настоящем изобретении раскрыт потенциал гарцинола в качестве гепатопротектора. Показали защиту культур клеток Нер-2 в присутствии эффективных концентраций гарцинола. Также показано опосредованное гарцинолом изменение биохимических маркеров у экспериментальных животных при гепатотоксичности, вызванной токсином CCl4, лекарственным средством парацетомол и алкоголем.
Краткое описание графических материалов
На Фиг.1 показано графическое представление воздействия различных доз гарцинола на экспрессию TGF-бета 1 (Transforming Growth Factor - трансформирующий фактор роста) (пкг/мл) в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4). Значения выражены как среднее ± С.О. (стандартная ошибка), n=6; значение Р*: <0,001.
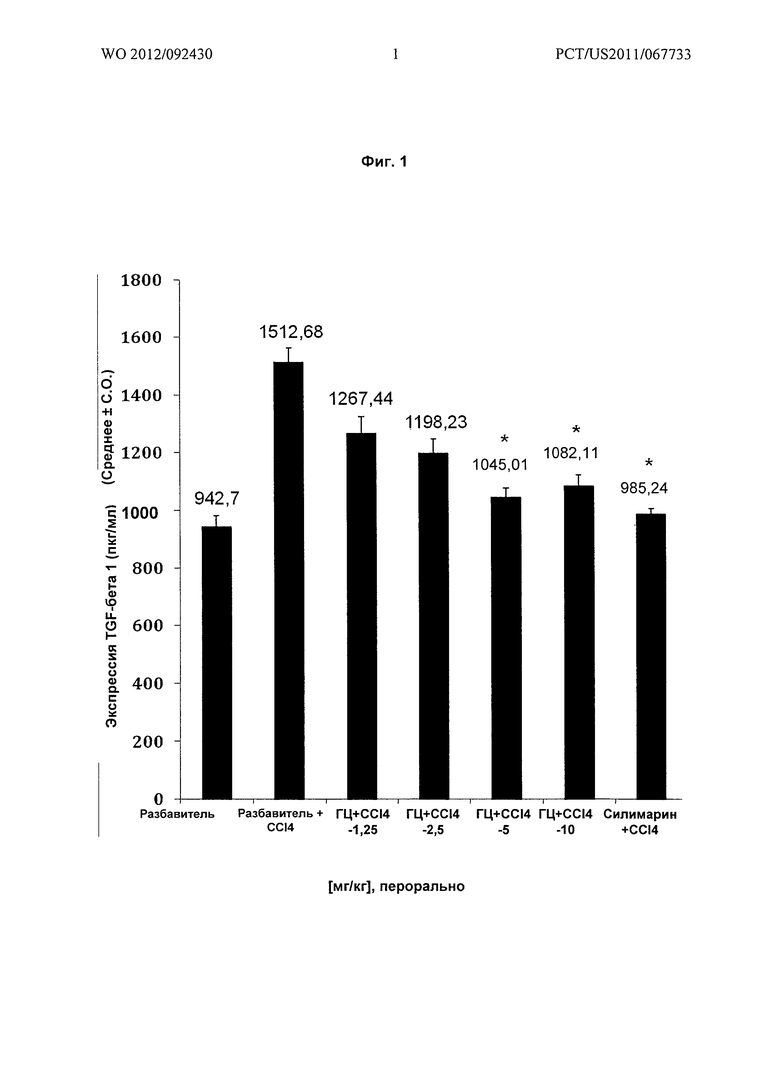
На Фиг.2 показано графическое представление воздействия различных доз гарцинола на экспрессию (пкг/мл) молекулы межклеточной адгезии 1 (ICAM-1 или CD52) в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,001.
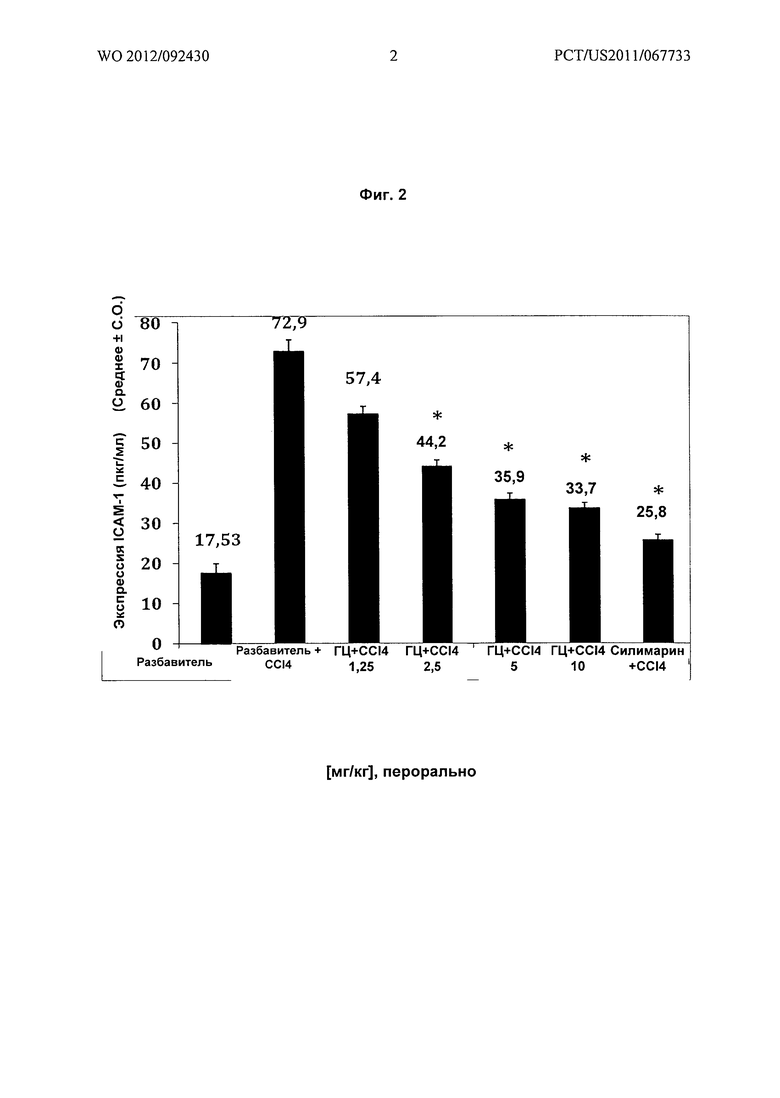
На Фиг.3 показано графическое представление воздействия различных доз гарцинола на экспрессию (мг/мл) С-реактивного белка в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,001.
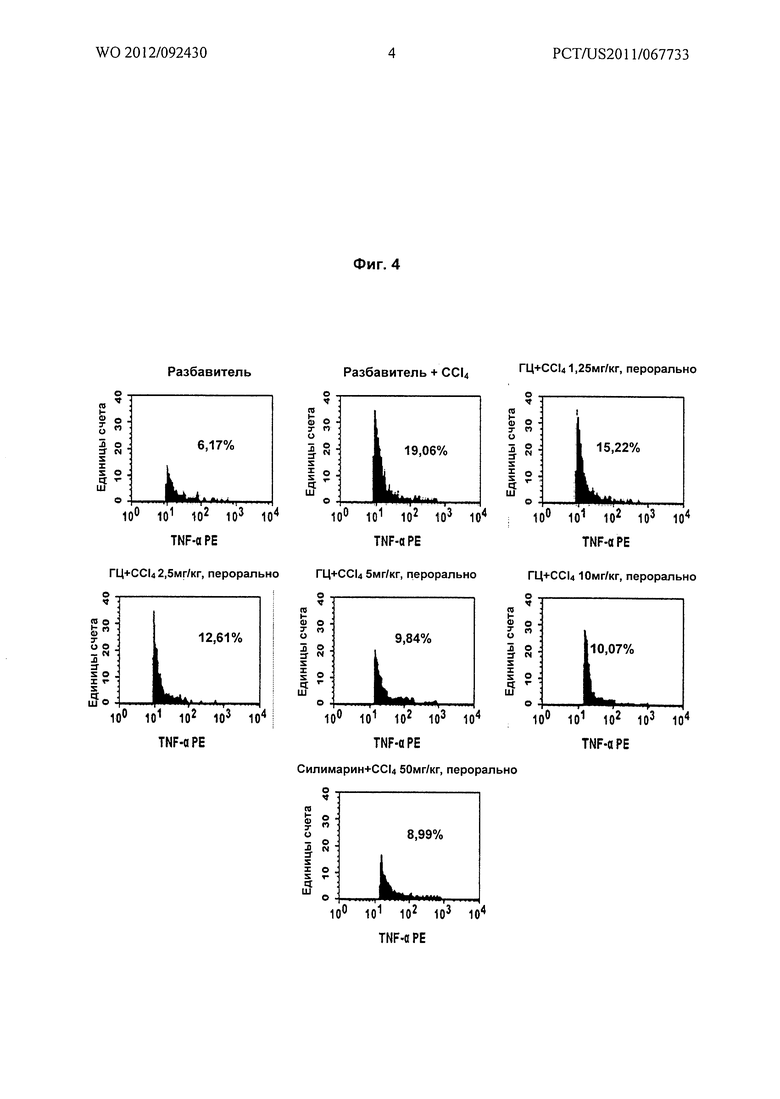
На Фиг.4 показано графическое представление (проточно-цитометрические анализы) воздействия различных доз гарцинола на уровень фактора некроза опухолей-α (TNF-α) в крови, взятой из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4).
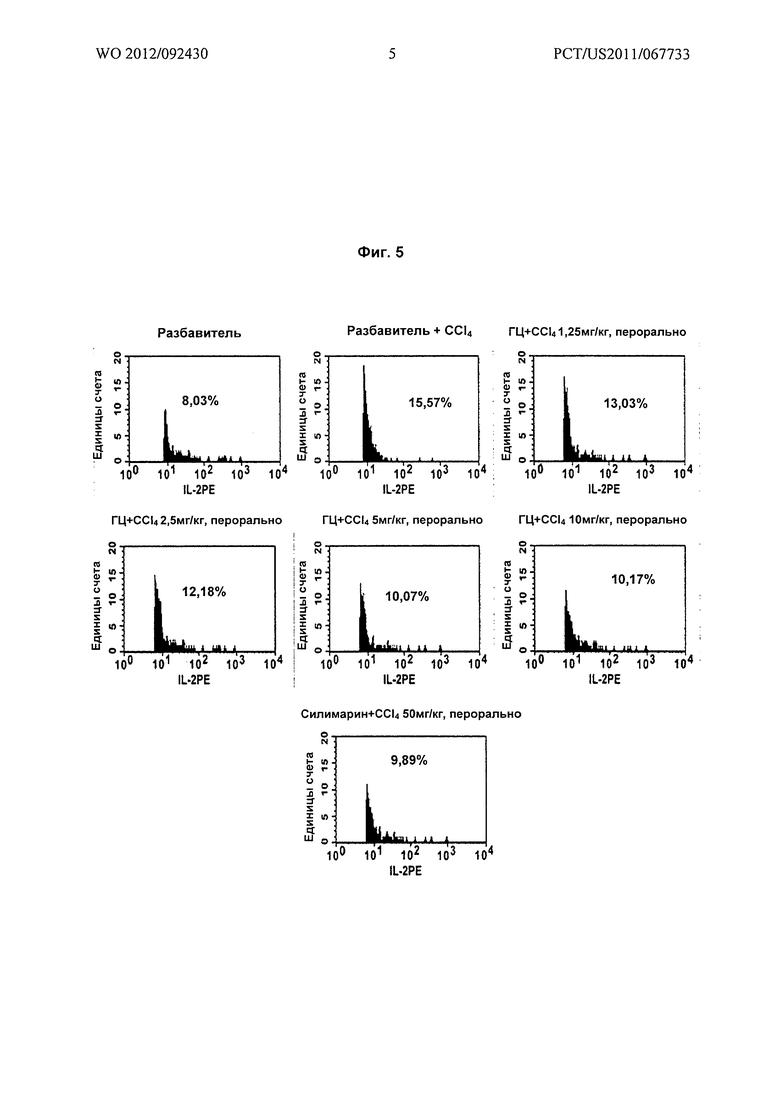
На Фиг.5 показано графическое представление (проточно-цитометрические анализы) воздействия различных доз гарцинола на уровень интерлейкина-2 (IL-2) в крови, взятой из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4).
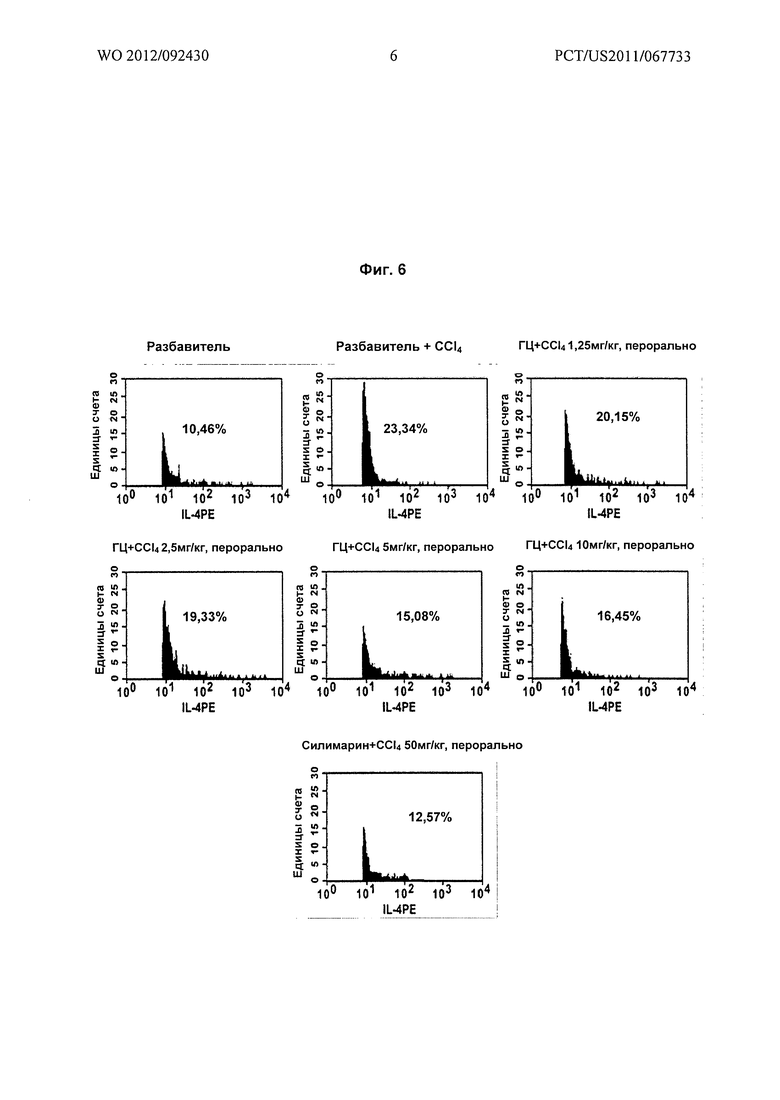
На Фиг.6 показано графическое представление воздействия различных доз гарцинола на уровень интерлейкина-4 (IL-4) в крови, взятой из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4).
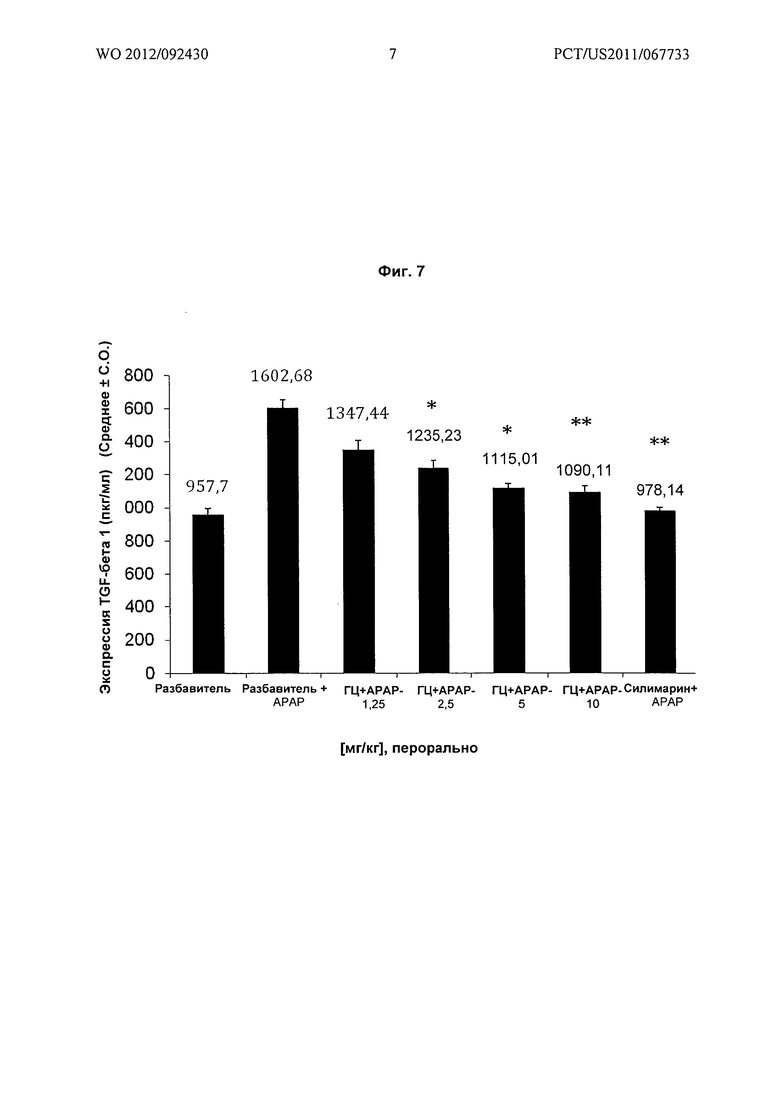
На Фиг.7 показано графическое представление воздействия различных доз гарцинола на экспрессию TGF-бета 1 (пкг/мл) в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной лекарственным средством (парацетамолом). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,01., **: <0.001., ГЦ : Гарцинол; АРАР : Парацетамол.
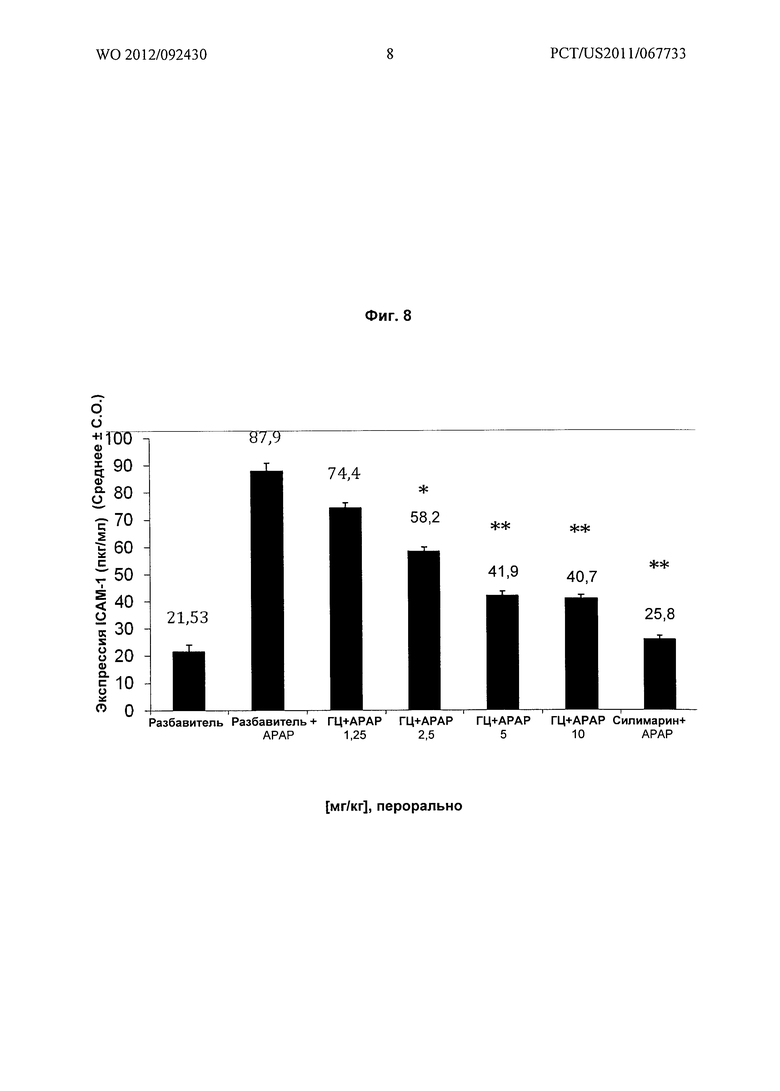
На Фиг.8 показано графическое представление воздействия различных доз гарцинола на экспрессию молекулы межклеточной адгезии 1 (ICAM-1 или CD52) (пкг/мл) в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной лекарственным средством (парацетамол). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,01., **: <0.001., ГЦ : Гарцинол; АРАР : Парацетамол.
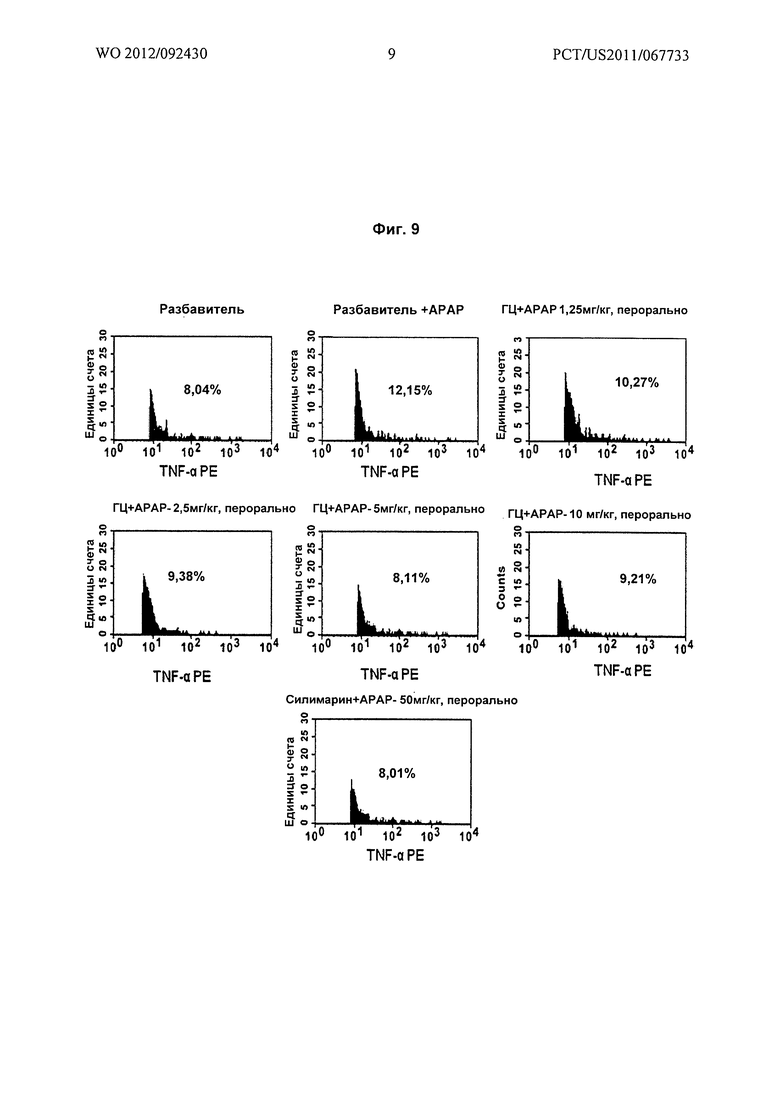
На Фиг.9 показано графическое представление (проточно-цитометрические анализы) воздействия различных доз гарцинола на уровень фактора некроза опухолей α (TNF-α) в крови, взятой из экспериментальных животных при гепатотоксичности, вызванной лекарственным средством (парацетамол).
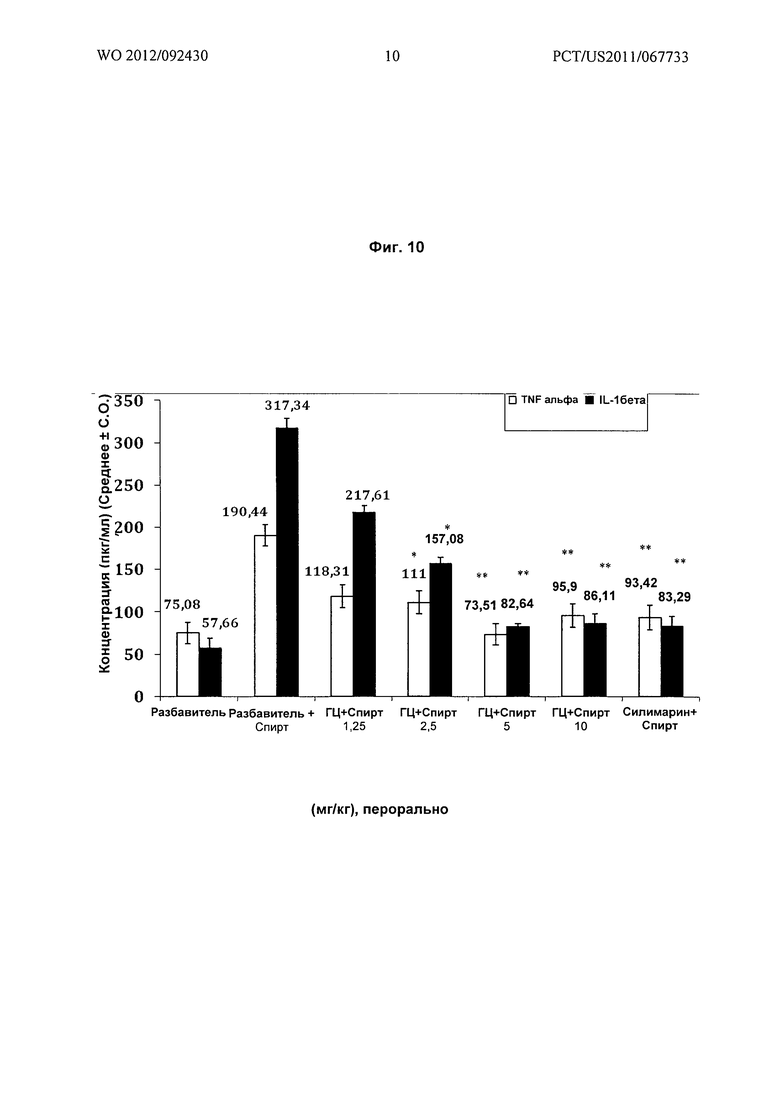
На Фиг.10 показано графическое представление воздействия различных доз гарцинола на уровень фактора некроза опухолей α (TNF-α) и интерлейкина-1β (IL-1β) в сыворотке экспериментальных животных при гепатотоксичности, вызванной алкоголем (этиловый спирт). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,01., **: <0,001., ГЦ : гарцинол.
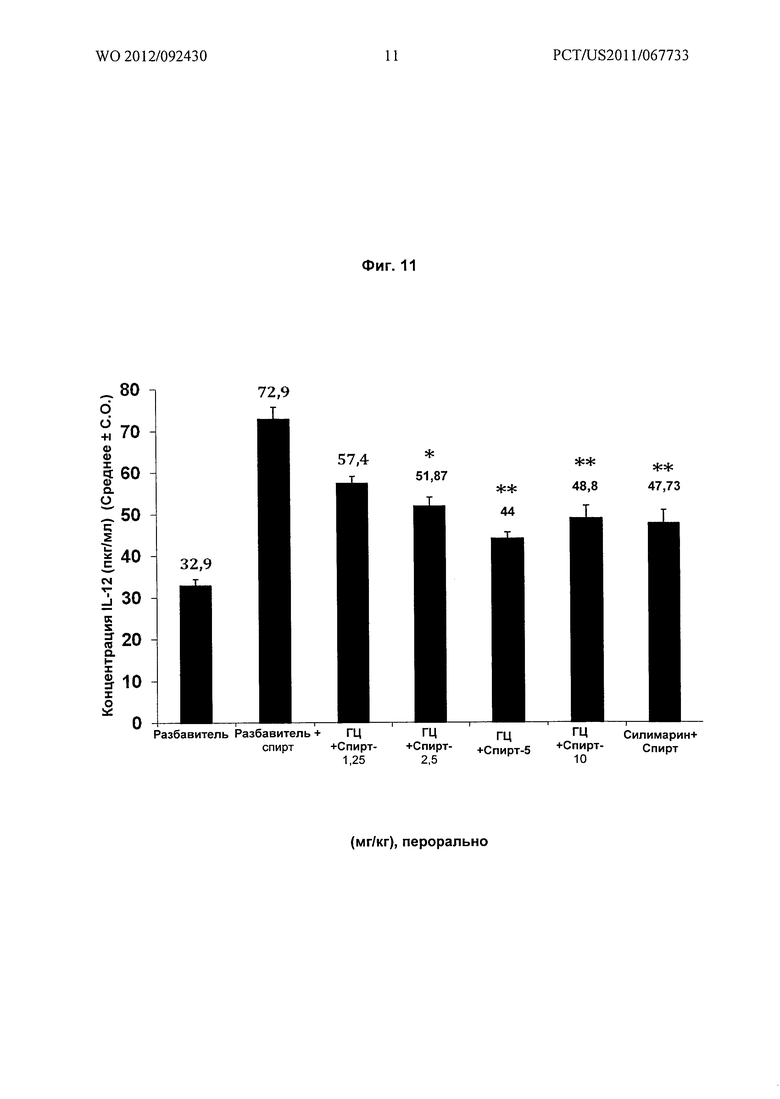
На Фиг.11 показано графическое представление воздействия различных доз гарцинола на уровень интерлейкина-12 (IL-12) в сыворотке экспериментальных животных при гепатотоксичности, вызванной алкоголем (этиловый спирт).
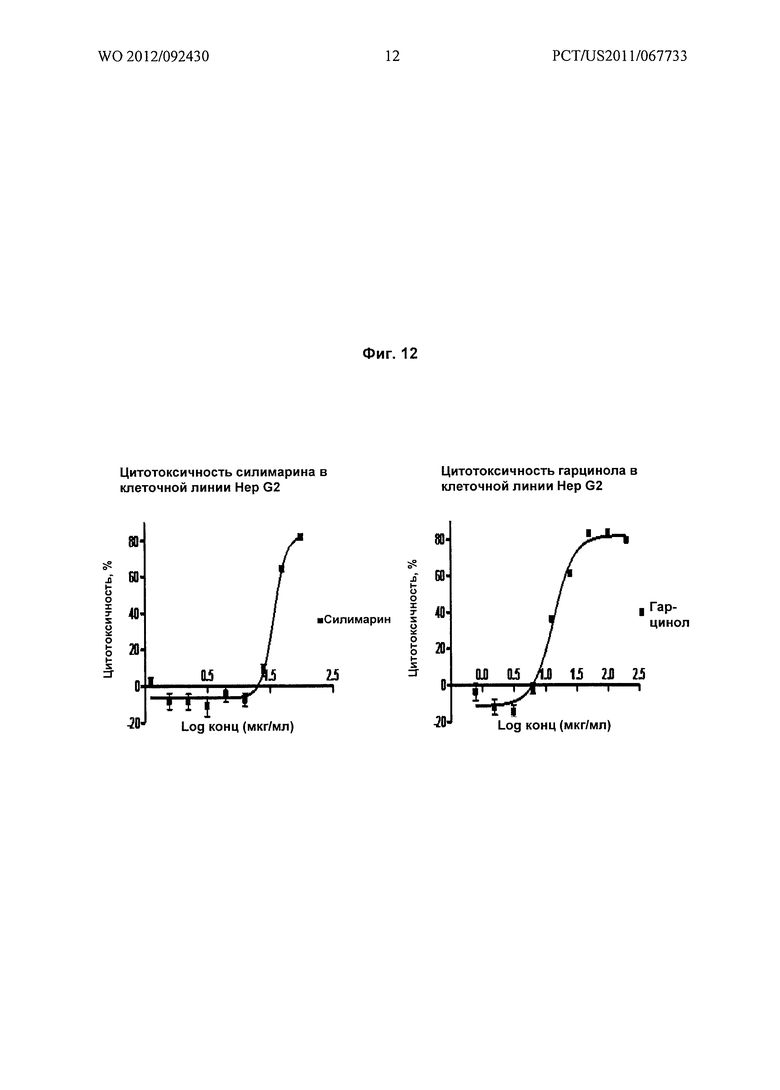
На Фиг.12 показано графическое представление цитотоксического потенциала (% цитотоксичности) гарцинола в линии раковых клеток печени Hep G2 по сравнению с силимарином, известным гепатопротекторным агентом.
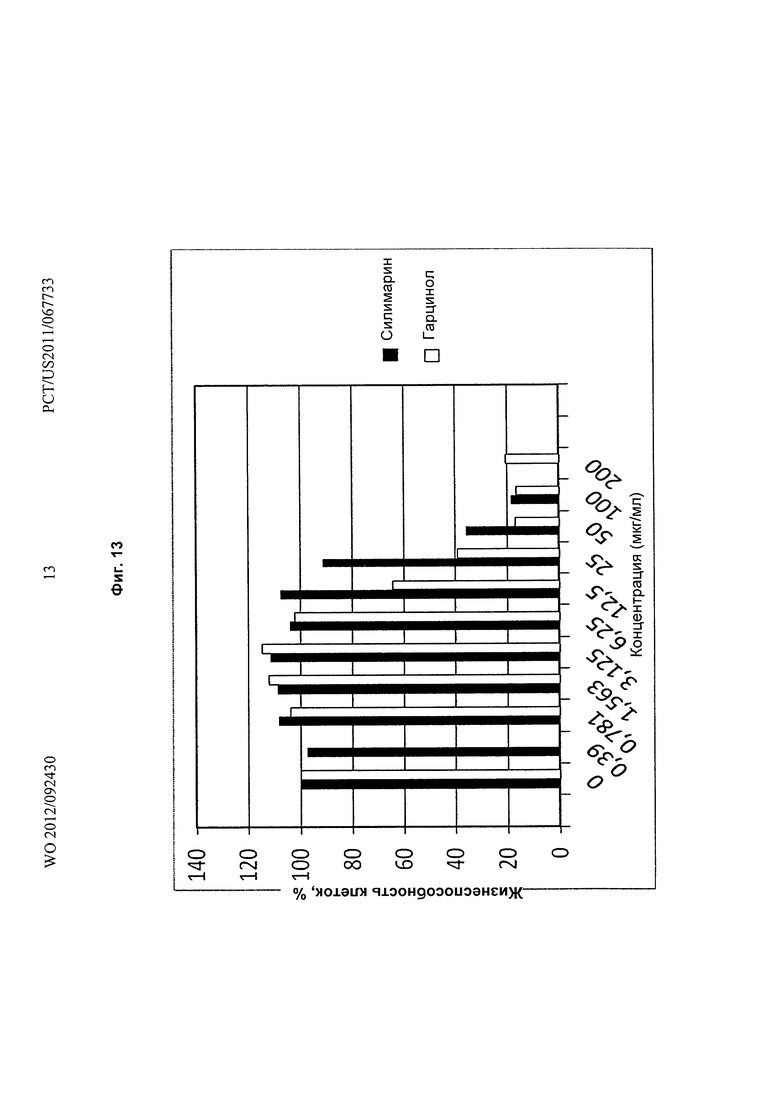
На Фиг.13 показано графическое представление гепатозащитного действия гарцинола по сравнению с известным гепатозащитным агентом силимарином в линии раковых клеток печени Hep G2.
Подробное описание (Фиг.1-13) - предпочтительное воплощение
В наиболее предпочтительном воплощении настоящее изобретение относится к способу защиты гепатоцитов млекопитающих, причем указанный способ включает стадию приведения в контакт гепатоцитов млекопитающих с эффективной концентрацией гарцинола. Конкретнее, эффективная концентрация гарцинола составляет от примерно 0,78 мкг/мл до примерно 6,25 мкг/мл (Фиг.12 и 13). В другом наиболее предпочтительном воплощении настоящее изобретение относится к способу гепатозащиты, причем указанный способ включает стадию введения терапевтически эффективного количества гарцинола нуждающемуся в этом объекту. Конкретнее, данным объектом является млекопитающее.
В другом предпочтительном воплощении настоящее изобретение относится к способу снижения повышенных уровней экспрессии цитокинов в моделях повреждения печени (гепатотоксичности) у млекопитающих, причем указанный способ включает стадию введения эффективного количества гарцинола указанным модельным объектам (Фиг.1, 4, 5, 6, 7, 9, 10 и 11). В конкретных воплощениях цитокины представляют собой трансформирующий фактор роста G-β1 (TGF-β1), фактор некроза опухоли α, интерлейкин-2 (IL-2), интерлейкин-4 (IL-4) и интерлейкин-12 (IL-12). В дополнительном, конкретном воплощении гепатотоксичность у модельных млекопитающих можно вызывать токсином, лекарственным средством или этиловым спиртом. В другом конкретном воплощении повреждение печени вызывают сочетаниями токсина, лекарственного средства и этилового спирта.
В еще другом предпочтительном воплощении настоящее изобретение относится к способу снижения повышенных уровней экспрессии адгезивной молекулы в моделях повреждения печени (гепатотоксичности) у млекопитающих, вызываемом токсинами и/или лекарственными средствами, причем указанный способ включает стадию введения эффективного количества гарцинола указанным модельным млекопитающим (Фиг.2 и 8). В конкретном воплощении адгезивная молекула представляет собой молекулу межклеточной адгезии 1 (ICAM-1 или CD52).
В еще одном предпочтительном воплощении настоящее изобретение относится к способу снижения повышенных уровней ферментов печени и/или желчных пигментов в моделях повреждения печени (гепатотоксичности) у млекопитающих, причем указанный способ включает стадию введения эффективного количества гарцинола указанным модельным объектам. В конкретных воплощениях ферменты печени представляют собой аланинтрансаминазу, аспартатаминотрансферазу и щелочную фосфатазу (Таблицы 3, 4 и 5). В другом конкретном воплощении желчный пигмент представляет собой билирубин. В дополнительном, конкретном воплощении повреждение печени у модельных млекопитающих может быть вызвано токсином, лекарственным средством или этиловым спиртом. В другом конкретном воплощении повреждение печени вызывают сочетаниями токсина, лекарственного средства и этилового спирта.
Потенциальное терапевтическое значение гарцинола как гепатопротектора можно понять посредством примеров, освещенных ниже в данном документе.
Пример 1
Острая пероральная безопасность гарцинола: смертности не наблюдали вплоть до 2000 мг/кг. Пероральный прием внутрь у мышей вплоть до двух недель наблюдения. Изучаемые параметры и записанные наблюдения включены в Таблицу 1. (OECD Guidelines for Testing of Chemicals. Guideline 423, Acute Oral Toxicity - Acute Toxic Class Method, Adopted, (1996). Organization for Economic Cooperation and Development).
Пример 2
Воздействие различных доз гарцинола (ГЦ) на экспрессии TGF-β1, ICAM-1 и CRP (C-reactive protein - С-реактивный белок) в гомогенатах печени у крыс при повреждении печени, вызванном четыреххлористым углеродом.
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: Силимарин (50 мг/кг), перорально
Способ: повреждение печени вызывали введением четыреххлористого углерода (CCl4), смешанного с жидким парафином (5-кратное разведение). Животным давали разовую дозу CCl4 1 мл/кг, перорально с последующим введением гарцинола с разными временными интервалами (Таблица 2). [(i) Bramanti G, Murmann W, Pierini P and Comporti M (1978). Effect of cicloxilic acid on CCl4 - induced liver injury. Drug Research 28: 1112-1217. (ii) В Singh, A K Saxena, B K Chandan, K K Anand (1998). Hepatoprotective activity of Verbenalin on experimental liver damage in rodents. Fitoterapia LXIX 2: 135-140. (iii) B.K. Chandan, A.K. Sharma, K.K. Anand Boerhaavia diffusa: A study of its hepatoprotective activity. Journal of Ethnopharmacology Volume 31, Issue 3, March 1991, Pages 299-307].
Ткань печени гомогенизировали на льду с помощью политрона, и гомогенат центрифугировали при 5000 g в течение 15 мин. Аликвоты надосадочной жидкости отделяли и применяли для биохимического анализа. Надосадочные жидкости хранили при -80°С до анализа цитокинов. TGFβ, ICAM-1, С-реактивный белок (CRP) оценивали, используя коммерчески доступные наборы на основе методики ELISA (enzyme-linked immunosorbent assay-иммуноферментный анализ) "сэндвич"-типа и конкурентного ELISA согласно инструкциям производителей. Все измерения концентраций цитокинов проводили с помощью колориметрического измерения при 450 нм на ELISA сканирующем спектрофотометре для прочтения планшетов путем интерполяции по стандартной кривой, [(i) Magari K, Miyata S, Ohkubo Y, Mutoh S, (2004). Inflammatory cytokine levels in paw tissues during development of rat collagen-induced arthritis: Effect of FK506, an inhibitor of T cell activation. Inflammation Research. 53: 469-474 (Magari et al., 2004); and (ii) Modulation of Th1/Th2 cytokines and inflammatory mediators by hydroxychavicol in adjuvant induced arthritic tissues. Anjali Pandey, Sarang Bani, Prabhu Dutt, Krishna Avtar Suri. Cytokine 49 (2010) 114-121].
Результаты: гарцинол подавлял повышенные уровни TGFβ (Фиг.1) ICAM-1 (Фиг.2), С-реактивного белка (CRP) (Фиг.3), связанные с острым гепатитом, являющимся результатом повреждения печени у крыс, вызванного четыреххлористым углеродом.
Пример 3
Воздействие различных доз гарцинола (ГЦ) на TNF-α, IL-2 и IL-4 в крови у крыс при повреждении печени, вызванном четыреххлористым углеродом
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: Силимарин (50 мг/кг), перорально
Способ: повреждение печени вызывали введением четыреххлористого углерода (CCl4), смешанного с жидким парафином (5-кратное разведение). Животным давали разовую дозу CCl4 1 мл/кг, перорально с последующим введением гарцинола (см. вышеуказанную Таблицу 2). [(i) Bramanti G, Murmann W, Pierini P and Comporti M (1978). Effect of cicloxilic acid on CCl4 - induced liver injury. Drug Research 28: 1112-1217. (ii) В Singh, А K Saxena, В K Chandan, K K Anand (1998). Hepatoprotective activity of Verbenalin on experimental liver damage in rodents. Fitoterapia LXIX 2: 135-140. (iii) B.K. Chandan, A.K. Sharma, K.K. Anand Boerhaavia diffusa: A study of its hepatoprotective activity. Journal of Ethnopharmacology, Volume 31, Issue 3, March 1991, Pages 299-307].
Животным пускали кровь ретроорбитально, и кровь собирали в покрытые EDTA (Ethylenediaminetetraacetic acid - этилендиаминтетрауксусная кислота) пробирки для оценки экспрессии меченных РЕ (phycoerythrin - фикоэритрином) моноклональных антител против TNF-альфа, IL-2 и IL-4 крысы. Анализ выполняли на проточном цитометре (BD-FACS CANTO II). Эти меченные флуоресцирующие моноклональные антитела добавляли непосредственно к 100 мкл цельной крови, которую затем лизировали, используя лизирующий реагент для цельной крови. После последнего центрифугирования образцы ресуспендировали в забуференном фосфатом физиологическом растворе (рН, 7,4) и анализировали непосредственно на проточном цитометре. Возбудитель флуоресценции устанавливали по параметру РЕ (FL2) для сбора данных, [(i) Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Gupta BD, Satti NK, Qazi GN, (2006). Suppression of T lymphocyte activity by lupeol isolated from Crataeva religiosa. Phytotherapy Research; 20(4): 279-287. And (ii) Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Satti NK, (2005). Immunosuppressive properties of an ethyl acetate fraction from Euphorbia royleana. Journal of Ethnopharmacology; 99: 185-192].
Результаты: гарцинол (ГЦ) вызывал зависимое от дозы подавление Т-клеточного иммунного ответа, о котором судили по подавлению TNF-α (Фиг.4), IL-2 (Фиг.5) и IL-4 (Фиг.6), экспрессирующихся в крови у крыс при повреждении печени, вызванном четыреххлористым углеродом.
Пример 4
Воздействие различных доз гарцинола (ГЦ) на билирубин и сывороточные ферменты аланинтрансаминазу (АЛТ), аспартатаминотрансферазу (ACT) и щелочную фосфатазу (ЩФ) у крыс при повреждении печени, вызванном четыреххлористым углеродом
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: Силимарин (50 мг/кг), перорально
Способ: повреждение печени вызывали введением четыреххлористого углерода (CCl4), смешанного с жидким парафином (5-кратное разведение). Животным давали разовую дозу CCl4 1 мл/кг, перорально с последующим введением гарцинола (Таблица 2). [(i) Bramanti G, Murmann W, Pierini P and Comporti M (1978). Effect of cicloxilic acid on CCl4 - induced liver injury. Drug Research 28: 1112-1217. (ii) В Singh, А K Saxena, В K Chandan, K K Anand (1998). Hepatoprotective activity of Verbenalin on experimental liver damage in rodents. Fitoterapia LXIX 2: 135-140. (iii) B.K. Chandan, A.K. Sharma, K.K. Anand Boerhaavia diffusa: A study of its hepatoprotective activity. Journal of Ethnopharmacology, Volume 31, Issue 3, March 1991, Pages 299-307].
Кровь собирали из ретроорбитального сплетения экспериментальных животных и не добавляли антикоагулянт. Кровь должна была стоять при комнатной температуре в течение 1 часа. Затем ее центрифугировали, и осветленную сыворотку отделяли. Сыворотку затем хранили для анализа. Ссылка: (Magari et al., 2004).
Биохимия сыворотки I (аспартатаминотрансфераза и аланинаминотрансфераза), Ссылка: Ritman S, Frankel S, (1957). A colorimeteric method for the determination of serum glutamic oxaloacetic and glutamic pyruvic transaminases. American Journal of Clinical Pathology; 28: 56-63.
Способ: 0,2 мл сыворотки, собранные из опытных и контрольных образцов, смешивали с 1,0 мл буферного раствора и инкубировали в течение 60 мин при 37°С на водяной бане. После добавления 1,0 мл раствора хромогена образцы держали при комнатной температуре в течение 20 минут для того, чтобы реакция протекала, и добавляли 10 мл NaOH. Данные по оптической плотности считывали при 546 нм после 5 мин. Для холостого опыта сыворотку добавляли после добавления раствора хромогена.
Биохимия сыворотки II (щелочная фосфатаза), ссылка: Klaus Walter and Schutt С. (1974). Acid and alkaline phosphatase in serum. In: Methods of Enzymatic Analysis. Eds. Hans Ulrich Bergmeyer, Verlag ChemieWeinheim. Academic press, Inc. New York, 2nd Edition, Vol.2, pp.855-64.
Способ: измерение активности щелочной фосфатазы основано на способности фермента гидролизовать п-нитрофенолфосфат в щелочных условиях. Продукт расщепления п-нитрофенол является желтым в щелочном растворе, и его оценивают при 400-420 нм (Klaus and Schutt, 1974). 2,0 мл забуференного субстрата отбирали в пробирки "Опыт", "Контроль" и "Холостая проба" с последующим добавлением сыворотки и дистиллированной воды (0,1 мл) в пробирки "Опыт" и "Холостая проба", соответственно, и инкубировали на водяной бане в течение 30 минут при 25°С. После инкубирования во все пробирки добавляли гидроксид натрия (0,25 н., 2 мл) с последующим добавлением сыворотки (0,1 мл) в пробирки, обозначенные как "Контроль". Развившуюся желтую окраску оценивали спектрофотометрически против холостой пробы при 410 нм.
Биохимия сыворотки III [билирубин (BRBN)], Ссылка: Malloy Н Т and Evelyn K А (1937). The determination of bilirubin with photoelectric colorimeter. Journal of Biological Chemistry 119: 481-490.
Способ: сывороточный билирубин оценивали способом Malloy и Evelyn (1937). В две партии исследуемых пробирок, обозначенных как "Опыт" и "Контроль", добавляли сыворотку (0,2 мл) и дистиллированную воду (1,8 мл). В пробирки, обозначенные как "Опыт" и "Стандарт", добавляли диазореагент (0,5 мл). В исследуемые пробирки, обозначенные как "Контроль" и "Холостая проба", добавляли диазо-холостую пробу (0,5 мл). В конце в каждую исследуемую пробирку добавляли метанол (2,5 мл). Пробирки перемешивали, и им давали постоять в течение 30 минут в темноте. Пробирки анализировали после 10 минут при 540 нм.
Результаты: гарцинол снижал повышенные уровни билирубина и сывороточных ферментов аланинтрансаминазы (АЛТ), аспартатаминотрансферазы (ACT) и щелочной фосфатазы (ЩФ) у крыс при повреждении печени, вызванном четыреххлористым углеродом (Таблица 3).
Пример 5
Воздействие различных доз гарцинола (ГЦ) на экспрессию TGF-бета 1 и ICAM-1 в гомогенатах печени у крыс при повреждении печени, вызванном Парацетамолом.
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: силимарин (50 мг/кг), перорально
(АЛТ) Аланинтрансаминаза; (ACT) Аспартатаминотрансфераза; (ЩФ) щелочная фосфатаза.
Способ: Экспериментальные животные перорально получали парацетамол (400 мг/кг массы тела) в течение семи дней. Животные из группы, обрабатываемой лекарственным средством, получали 400 мг/кг массы тела парацетамола, растворенного в воде, перорально вместе с возрастающими дозами исследуемого лекарственного средства Гарцинол в течение семи дней. Стандартная группа животных получала 50 мг/кг массы тела стандартизированного лекарственного средства силимарин и 400 мг/кг массы тела парацетамола в течение семи дней и служила в качестве стандартного контроля [N. Kanchana and A. Mohamed Sadiq, Hepatoprotective effect of Plumbago zeylanica on paracetamol induced liver toxicity in rats, Int J Pharm Pharm Sci, Vol 3, Issuel, 151-154 (2011)].
Ткань печени экспериментальных животных гомогенизировали на льду политроном, и гомогенат центрифугировали при 5000 g в течение 15 минут. Аликвоты надосадочной жидкости отделяли и применяли для биохимического анализа. Надосадочные жидкости хранили при -80°С до анализа цитокинов. TGFβ и ICAM-1 оценивали с применением коммерчески доступных наборов на основе методики ELISA "сэндвич"-типа и конкурентного ELISA согласно инструкциям производителей. Все измерения концентраций цитокинов проводили с помощью колориметрического измерения при 450 нм на ELISA сканирующем спектрофотометре для прочтения планшетов путем интерполяции по стандартной кривой [(i) Magari K, Miyata S, Ohkubo Y, Mutoh S, (2004). Inflammatory cytokine levels in paw tissues during development of rat collagen-induced arthritis: Effect of FK506, an inhibitor of T cell activation. Inflammation Research. 53: 469-474 (Magari et al., 2004); and (ii) Modulation of Th1/Th2 cytokines and inflammatory mediators by hydroxychavicol in adjuvant induced arthritic tissues. Anjali Pandey, Sarang Bani, Prabhu Dutt, Krishna Avtar Suri. Cytokine 49 (2010) 114-121].
Результаты: гарцинол приводил к зависимому от дозы подавлению повышенных уровней экспрессии TGF-бета и ICAM-1 в печени, связанных с вызванным парацетамолом острым гепатитом (Фиг.7 и Фиг.8).
Пример 6
Воздействие различных доз гарцинола (ГЦ) на сывороточные ферменты аланинтрансаминазу (АЛТ), аспартатаминотрансферазу (ACT) и щелочную фосфатазу (ЩФ) у крыс при повреждении печени, вызванном парацетамолом (ацетил-пара-аминофенолом-АРАР)
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм. Дозы гарцинола (ГЦ), используемые для исследования: 1, 25, 2,5, 5, 10 мг/кг, перорально. Стандартизованное лекарственное средство: силимарин (50 мг/кг), перорально
Способ: Экспериментальные животные перорально получали парацетамол (400 мг/кг массы тела) в течение семи дней. Животные из группы, обрабатываемой лекарственным средством, получали 400 мг/кг массы тела парацетамола, растворенного в воде, перорально вместе с возрастающими дозами исследуемого лекарственного средства Гарцинол в течение семи дней. Стандартная группа животных получала 50 мг/кг массы тела стандартизированного лекарственного средства силимарин и 400 мг/кг массы тела парацетамола в течение семи дней и служила в качестве стандартного контроля [N. Kanchana and A. Mohamed Sadiq, Hepatoprotective effect of Plumbago zeylanica on paracetamol induced liver toxicity in rats, Int J Pharm Pharm Sci, Vol 3, Issuel, 151-154 (2011)].
Кровь собирали из ретроорбитального сплетения экспериментальных животных и не добавляли антикоагулянт. Кровь должна была стоять при комнатной температуре в течение 1 часа. Затем ее центрифугировали и осветленную сыворотку отделяли. Сыворотку затем хранили для анализа. Ссылка: (Magari et al., 2004).
Биохимия сыворотки I (аспартатаминотрансфераза и аланинаминотрансфераза), ссылка: Ritman S, Frankel S, (1957). A colorimeteric method for the determination of serum glutamic oxaloacetic and glutamic pyruvic transaminases. American Journal of Clinical Pathology; 28: 56-63.
Способ: 0,2 мл сыворотки, собранные из опытных и контрольных образцов, смешивали с 1,0 мл буферного раствора и инкубировали в течение 60 мин при 37°С на водяной бане. После добавления 1,0 мл раствора хромогена образцы держали при комнатной температуре в течение 20 минут для того, чтобы реакция протекала, и добавляли 10 мл NaOH. Данные по оптической плотности считывали при 546 нм после 5 мин. Для холостого опыта сыворотку добавляли после добавления раствора хромогена.
Биохимия сыворотки II (щелочная фосфатаза), ссылка: Klaus Walter and Schutt С. (1974). Acid and alkaline phosphatase in serum. In: Methods of Enzymatic Analysis. Eds. Hans Ulrich Bergmeyer, Verlag ChemieWeinheim, Academic press, Inc. New York, 2nd Edition, Vol.2, pp.855-64.
Способ: измерение активности щелочной фосфатазы основано на способности фермента гидролизовать п-нитрофенолфосфат в щелочных условиях. Продукт расщепления п-нитрофенол является желтым в щелочном растворе, и его оценивают при 400-420 нм (Klaus and Schutt, 1974). 2,0 мл забуференного субстрата отбирали в пробирки "Опыт", "Контроль" и "Холостая проба" с последующим добавлением сыворотки и дистиллированной воды (0,1 мл) в пробирки "Опыт" и "Холостая проба" соответственно и инкубировали на водяной бане в течение 30 минут при 25°С. После инкубирования во все пробирки добавляли гидроксид натрия (0,25 н., 2 мл) с последующим добавлением сыворотки (0,1 мл) в пробирки, обозначенные как "Контроль". Развившуюся желтую окраску оценивали спектрофотометрически против холостой пробы при 410 нм.
Биохимия сыворотки III [билирубин (BRBN)], Ссылка: Malloy Н Т and Evelyn K А (1937). The determination of bilirubin with photoelectric colorimeter. Journal of Biological Chemistry 119: 481-490.
Способ: Сывороточный билирубин оценивали способом Malloy и Evelyn (1937). В две партии исследуемых пробирок, обозначенных как "Опыт" и "Контроль", добавляли сыворотку (0,2 мл) и дистиллированную воду (1,8 мл). В пробирки, обозначенные как "Опыт" и "Стандарт", добавляли диазореагент (0,5 мл). В исследуемые пробирки, обозначенные как "Контроль" и "Холостая проба", добавляли диазо-холостую пробу (0,5 мл). В конце в каждую исследуемую пробирку добавляли метанол (2,5 мл). Пробирки перемешивали, и им давали постоять в течение 30 минут в темноте. Пробирки анализировали после 10 минут при 540 нм.
Результаты: гарцинол снижал повышенные уровни билирубина и сывороточных ферментов аланинтрансаминазы (АЛТ), аспартатаминотрансферазы (ACT) и щелочной фосфатазы (ЩФ) у крыс при повреждении печени, вызванном парацетамолом (Таблица 4).
(АЛТ) Аланинтрансаминаза; (ACT) Аспартатаминотрансфераза; (ЩФ) Щелочная Фосфатаза
Пример 7
Воздействие различных доз гарцинола (ГЦ) на TNF-α а крови у крыс при повреждении печени, вызванном парацетамолом.
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: силимарин (50 мг/кг), перорально
Способ: Экспериментальные животные перорально получали парацетамол (400 мг/кг массы тела) в течение семи дней. Животные из группы, обрабатываемой лекарственным средством, получали 400 мг/кг массы тела парацетамола, растворенного в воде, перорально вместе с возрастающими дозами исследуемого лекарственного средства Гарцинол в течение семи дней. Стандартная группа животных получала 50 мг/кг массы тела стандартизированного лекарственного средства силимарин и 400 мг/кг массы тела парацетамола в течение семи дней и служила в качестве стандартного контроля [N. Kanchana and A. Mohamed Sadiq, Hepatoprotective effect of Plumbago zeylanica on paracetamol induced liver toxicity in rats, Int J Pharm Pharm Sci, Vol 3, Issuel, 151-154 (2011)].
Животным пускали кровь ретроорбитально, и кровь собирали в покрытые EDTA пробирки для оценки экспрессии меченных РЕ моноклональных антител против TNF-альфа крысы. Анализ проводили на проточном цитометре (BD-FACS CANTO II). Эти меченные флуоресцирующие моноклональные антитела добавляли непосредственно к 100 мкл цельной крови, которую затем лизировали, используя лизирующий реагент для цельной крови. После последнего центрифугирования образцы ресуспендировали в забуференном фосфатом физиологическом растворе (рН, 7,4) и анализировали непосредственно на проточном цитометре. Возбудитель флуоресценции устанавливали по параметру РЕ (FL2) для сбора данных, [(i) Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Gupta BD, Satti NK, Qazi GN, (2006). Suppression of T lymphocyte activity by lupeol isolated from Crataeva religiosa. Phytotherapy Research; 20(4): 279-287. And (ii) Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Satti NK, (2005). Immunosuppressive properties of an ethyl acetate fraction from Euphorbia royleana. Journal of Ethnopharmacology; 99: 185-192].
Результаты: на Фиг.9 показано, что гарцинол вызывает зависимое от дозы снижение повышенных уровней TNF-α в печени, встречающихся при остром гепатите, обусловленном повреждением печени, вызванным лекарственным средством (парацетамолом).
Пример 8
Воздействие различных доз гарцинола (ГЦ) на фактор некроза опухолей-α (TNF-α), интерлейкин-1β (IL-1β) и IL-12 в сыворотке экспериментальных животных с вызванной алкоголем (этиловым спиртом-EtOH) гепатотоксичностью.
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: силимарин (50 мг/кг), перорально
Способ: крысам-самцам Wistar, с массой 180-200 г, перорально давали 0,5-0,6 мл этанола. Начальная доза этанола составляла 6 г/кг/сутки (растворы, максимально содержащие 56% спирта), и дозу постепенно увеличивали в течение недели 1 до поддерживающейся дозы 8 г/кг/сутки, что продолжалось в течение еще 5 недель. Все крысы имели регулярный стандартный крысиный корм, доступный на всем протяжении 6-недельного периода. Крыс взвешивали три раза в неделю [Guangjin Yuan, Zuojiong Gong *, Xiaorong Zhou, Pin Zhang, Xiaomei Sun and Xi Li. Epigallocatechin-3-Gallate Ameliorates Alcohol-Induced Liver Injury in Rats. Int. J. Mol. Sci. 2006, 7, 204-219].
Кровь собирали из ретроорбитального сплетения экспериментальных животных, обработанных спиртом, и смешивали с EDTA для оценивания уровня цитокинов. Для сбора сыворотки в кровь не добавляли антикоагулянт, и ей нужно было стоять при комнатной температуре в течение 1 ч. Затем кровь центрифугировали, и осветленную сыворотку отделяли и хранили для анализа. Уровень TNF-α, IL-1β и IL-12 оценивали, используя коммерчески доступные наборы на основе методики ELISA "сэндвич"-типа и конкурентного ELISA согласно инструкциям производителей. Все измерения концентраций цитокинов проводили с помощью колориметрического измерения при 450 нм на ELISA сканирующем спектрофотометре для прочтения планшетов путем интерполяции по стандартной кривой.
Результат: гарцинол (ГЦ) снижал повышенные уровни TNF-альфа, интерлейкина-1 бета и интерлейкина-12 (Фиг.10 и Фиг.11), вызванные TLR-4 активацией клеток Купфера LPS (липополисахаридом) грамм-отрицательных бактерий в кишке, активация и избыточный рост которых обусловлен употреблением этилового спирта.
Пример 9
Воздействие разных доз гарциола (ГЦ) на сывороточные ферменты аланинтрансаминазу (АЛТ), аспартатаминотрансферазу (ACT) и щелочную фосфатазу (ЩФ) в сыворотке экспериментальных животных при гепатотоксичности, вызванной алкоголем (этиловый спирт)
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: силимарин (50 мг/кг), перорально
Способ: крысам-самцам Wistar, с массой 180-200 г, давали перорально 0,5-0,6 мл этанола. Начальная доза этанола составляла 6 г/кг/сутки (растворы, максимально содержащие 56% спирта), и дозу постепенно увеличивали в течение недели 1 до поддерживающейся дозы 8 г/кг/сутки, что продолжалось в течение еще 5 недель. Все крысы имели регулярный стандартный крысиный корм, доступный на всем протяжении 6-недельного периода. Крыс взвешивали три раза в неделю. [Guangjin Yuan, Zuojiong Gong *, Xiaorong Zhou, Pin Zhang, Xiaomei Sun and Xi Li. Epigallocatechin-3-Gallate Ameliorates Alcohol-Induced Liver Injury in Rats. Int. J. Mol. Sci. 2006, 7, 204-219]. Кровь отбирали из ретроорбитального сплетения экспериментальных животных, и не добавляли антикоагулянт. Крови нужно было стоять при комнатной температуре в течение 1 ч. Затем ее центрифугировали, и осветленную сыворотку отделяли. Затем сыворотку хранили для анализа. Ссылка: (Magari et al., 2004).
Биохимия сыворотки I (аспартатаминотрансфераза и аланинаминотрансфераза), ссылка: Ritman S, Frankel S, (1957). A colorimetric method for the determination of serum glutamic oxaloacetic and glutamic pyruvic transaminases. American Journal of Clinical Pathology; 28: 56-63.
Способ: 0,2 мл сыворотки, отобранные из опытных и контрольных образцов, смешивали с 1,0 мл буферного раствора и инкубировали в течение 60 мин при 37°С на водяной бане. После добавления 1,0 мл раствора хромогена образцы держали при комнатной температуре в течение 20 минут для того, чтобы реакция протекала, и добавляли 10 мл NaOH. Данные по оптической плотности считывали при 546 нм после 5 мин. Для холостого опыта сыворотку добавляли после добавления раствора хромогена.
Биохимия сыворотки II (щелочная фосфатаза), ссылка: Klaus Walter and Schutt С. (1974). Acid and alkaline phosphatase in serum. In: Methods of Enzymatic Analysis. Eds. Hans Ulrich Bergmeyer, Verlag ChemieWeinheim. Academic press, Inc. New York, 2nd Edition, Vol.2, pp.855-64.
Способ: измерение активности щелочной фосфатазы основано на способности фермента гидролизовать п-нитрофенол фосфат в щелочных условиях. Продукт расщепления п-нитрофенол является желтым в щелочном растворе, и его оценивают при 400-420 нм (Klaus and Schutt, 1974). 2,0 мл забуференного субстрата отбирали в пробирки "Опыт", "Контроль" и "Холостая проба" с последующим добавлением сыворотки и дистиллированной воды (0,1 мл) в пробирки "Опыт" и "Холостая проба" соответственно и инкубировали на водяной бане в течение 30 минут при 25°С. После инкубирования добавляли гидроксид натрия (0,25 н., 2 мл) во все пробирки с последующим добавлением сыворотки (0,1 мл) в пробирки, обозначенные как "Контроль". Развившуюся желтую окраску оценивали спектрофотометрически против холостой пробы при 410 нм.
Биохимия сыворотки III [билирубин (BRBN)], ссылка: Malloy Н Т and Evelyn K А (1937). The determination of bilirubin with photoelectric colorimeter. Journal of Biological Chemistry 119: 481-490.
Способ: Сывороточный билирубин оценивали способом Malloy и Evelyn (1937). В две партии исследуемых пробирок, обозначенных как "Опыт" и "Контроль", добавляли сыворотку (0,2 мл) и дистиллированную воду (1,8 мл). В пробирки, обозначенные как "Опыт" и "Стандарт", добавляли диазореагент (0,5 мл). В исследуемые пробирки, обозначенные как "Контроль" и "Холостая проба", добавляли диазо-холостую пробу (0,5 мл). В конце в каждую исследуемую пробирку добавляли метанол (2,5 мл). Пробирки перемешивали, и им давали постоять в течение 30 минут в темноте. Пробирки анализировали после 10 минут при 540 нм.
Результат: гарцинол (ГЦ) снижал повышенные уровни ACT, АЛТ, ЩФ и Билирубина у экспериментальных животных при гепатотоксичности, вызванной этиловым спиртом (Таблица 5).
Пример 10
Цитотоксический потенциал (% цитотоксичности) гарцинола в линии раковых клеток печени Hep G2 по сравнению с Силимарином, известным гепатопротекторным агентом (Общее гепатозащитное действие Гарцинола против Силимарина - Таблицы 6 и 7, Фиг.12 и Фиг.13)
Способ - Берут клетки HEP G2, выращенные при различных концентрациях вещества, проверяемого на цитотоксичность. Затем осторожно отбирают среду, и в каждую лунку добавляют 100 мл рабочего маточного раствора ММТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолия бромид) (150 мг/лунка). Затем планшет дополнительно заворачивают в алюминиевую фольгу и инкубируют в течение 4 часов в CO2-инкубаторе при 37°С. Планшет затем осторожно промывают 100 мл PBS на лунку. Промывка должна быть выполнена вскоре после отбора среды, чтобы избежать высыхания, образования хлопьев и потери клеток в течение промывки. Растворить краситель в 100 мл DMSO (dimethylsulphoxide - диметилсульфоксид) на лунку. Планшеты встряхивают в течение 5 минут, и абсорбцию считывают при 492 нм, используя сканирующий микроспектрофотометр для прочтения планшетов Fluostar optima (BMG). Абсорбция будет прямо пропорциональна жизнеспособности клеток. Также может быть выбран вариант считывания при 620 нм, который вычитал бы интерференцию клеточного детрита в образцах. Данные анализируют путем нанесения на график числа клеток против поглощения, позволяя количественно оценивать изменения в пролиферации клеток. Скорость восстановления тетразолия пропорциональна скорости пролиферации клеток.
(АЛТ) Аланинтрансаминаза; (ACT) Аспартатаминотрансфераза; (ЩФ) Щелочная фосфатаза
Подсчет:
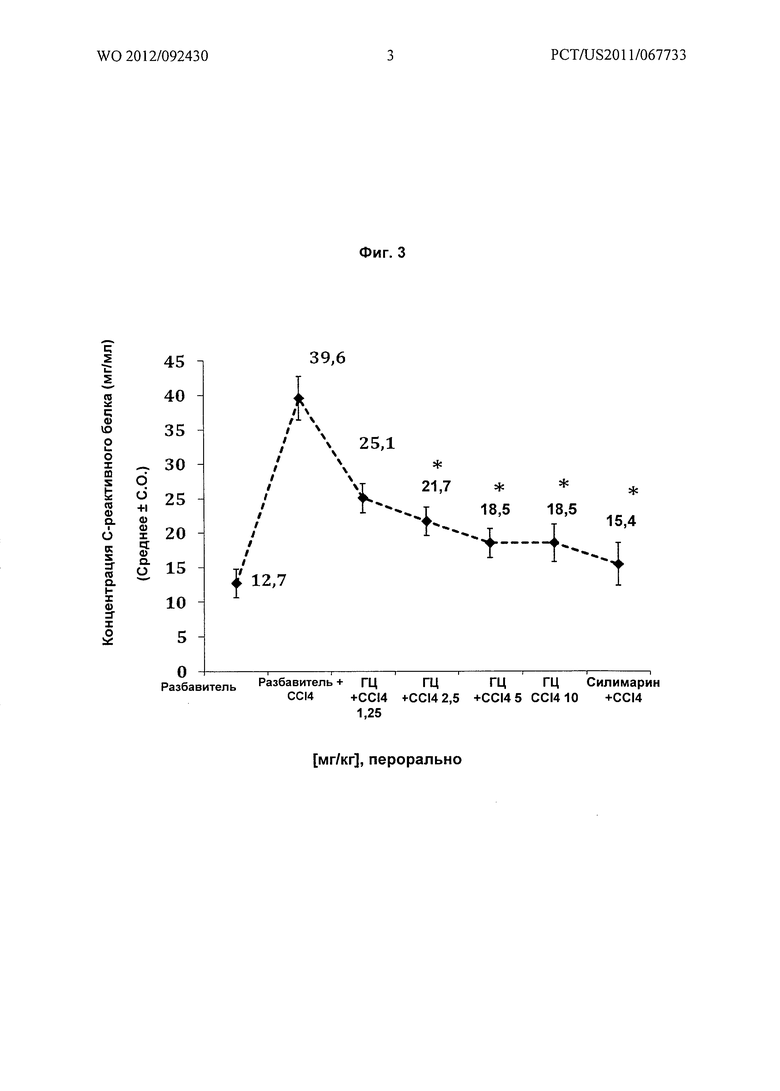
Цитотоксичность пробы выражают в виде величины IC50, концентрации, которая подавляет 50% клеточного роста.
Цитотоксичность, 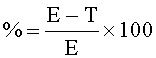
где Е = жизнеспособность клеток в отсутствии пробы
Т = жизнеспособность клеток в присутствии пробы
Гепатозащитное действие гарцинола в клетках HEP G2
IC50 = 13,33 мкг/мл
95% CL = от 11,84 до 15,02 мкг/мл
Гепатозащитное действие Силимарина в клетках HEP G2
IC50 = 36,51 мкг/мл
95% CL = от 32,18 до 41,42 мкг/мл
Чем меньше величина IC50, тем лучше эффективность.
Результаты: гарцинол показывает сравнительное гепатозащитное действие подобно силимирину при более низких концентрациях (значения ниже 6,25 мкг/мл).
В то время как изобретение было раскрыто со ссылкой на предпочтительное воплощение, специалисту в данной области должно быть очевидно, что изобретение не ограничивается им. Напротив, объем изобретения нужно определять только в связи с прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАЛЕБИН А ПРИ ЖИРОВОМ ГЕПАТОЗЕ | 2015 |
|
RU2643297C2 |
| ПОТЕНЦИАЛ КАЛЕБИНА А В КАЧЕСТВЕ СРЕДСТВА ПРОТИВ ОЖИРЕНИЯ | 2012 |
|
RU2543334C1 |
| ГЕПАТОПРОТЕКТОРНОЕ СРЕДСТВО "КАРСИЛИН" | 2002 |
|
RU2205637C1 |
| КОМПОЗИЦИИ, СПОСОБЫ И МЕДИЦИНСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ И ПОДДЕРЖАНИЯ ЗДОРОВЬЯ ПЕЧЕНИ | 2016 |
|
RU2755475C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ РАЗЛИЧНОГО ГЕНЕЗА | 2009 |
|
RU2400233C1 |
| ГЕПАТОПРОТЕКТОРНОЕ СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И КОРРЕКЦИИ ТОКСИЧЕСКИХ ПОРАЖЕНИЙ ПЕЧЕНИ | 2001 |
|
RU2189817C1 |
| КОМПОЗИЦИИ, СПОСОБЫ И МЕДИЦИНСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ И ПОДДЕРЖАНИЯ ЗДОРОВЬЯ ПЕЧЕНИ | 2016 |
|
RU2755478C2 |
| Способ получения средства, обладающего гепатопротекторным и антигепатотоксическим действием | 2020 |
|
RU2771028C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕПАТОЗАЩИТНОГО СРЕДСТВА ИЗ ЦВЕТКОВ БАРХАТЦЕВ РАСПРОСТЕРТЫХ (TAGETES PATULA L.) | 2007 |
|
RU2336893C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАРИТМИЧЕСКИМИ И ГЕПАТОПРОТЕКТОРНЫМИ СВОЙСТВАМИ | 2011 |
|
RU2469720C1 |
Группа изобретений относится к медицине, а именно к гастроэнтерологии, и может быть использована для защиты гепатоцитов млекопитающих при их повреждении. Для этого вводят эффективное количество гарцинола. Это позволяет подавить повышенные уровни TGF-β, ICAM-1,С-реактивного белка, Т-клеточный иммунный ответ, билирубина, сывороточных ферментов, TNF-α при более низких концентрациях по сравнению с другими гепатопротекторами.5 н. и 17 з.п. ф-лы, 13 ил.,7 табл., 10 пр.
1. Способ защиты гепатоцитов млекопитающих, причем указанный способ включает стадию приведения гепатоцитов млекопитающих в контакт с эффективной концентрацией гарцинола.
2. Способ по п.1, где эффективная концентрация гарцинола составляет от примерно 0,78 мкг/мл до примерно 6,25 мкг/мл.
3. Способ снижения повышенных уровней экспрессии цитокинов в моделях повреждения печени (гепатотоксичности) у млекопитающих, причем указанный способ включает стадию введения указанным модельным млекопитающим эффективного количества гарцинола.
4. Способ по п.3, где цитокин представляет собой трансформирующий фактор роста G-1β (TGF-β1).
5. Способ по п.3, где цитокин представляет собой фактор некроза опухоли-α.
6. Способ по п.3, где цитокин представляет собой интерлейкин-2 (IL-2).
7. Способ по п.3, где цитокин представляет собой интерлейкин-4 (IL-4).
8. Способ по п.3, где цитокин представляет собой интерлейкин-12 (IL-12).
9. Способ по п.3, где гепатотоксичность вызвана токсином.
10. Способ по п.3, где гепатотоксичность вызвана лекарственными средствами.
11. Способ по п.3, где гепатотоксичность вызвана этиловым спиртом.
12. Способ снижения повышенных уровней экспрессии адгезивной молекулы в моделях повреждения печени (гепатотоксичности) у млекопитающих, причем указанный способ включает стадию введения указанным модельным млекопитающим эффективного количества гарцинола.
13. Способ по п.12, где адгезивная молекула представляет собой молекулу межклеточной адгезии - 1 (ICAM-1 или CD 52).
14. Способ по п.12, где гепатотоксичность вызвана токсином.
15. Способ по п.12, где гепатотоксичность вызвана лекарственными средствами.
16. Способ снижения повышенных уровней ферментов печени и/или желчных пигментов в моделях повреждения печени (гепатотоксичности) у млекопитающих, причем указанный способ включает стадию введения указанным модельным млекопитающим эффективного количества гарцинола.
17. Способ по п.16, где гепатотоксичность вызвана токсином.
18. Способ по п.16, где гепатотоксичность вызвана лекарственными средствами.
19. Способ по п.16, где гепатотоксичность вызвана этиловым спиртом.
20. Способ по п.16, где фермент печени выбран из группы, содержащей аланинтрансаминазу, аспартатаминотрансферазу и щелочную фосфатазу.
21. Способ по п.16, где желчный пигмент представляет собой билирубин.
22. Способ гепатозащиты, причем указанный способ включает стадию введения терапевтически эффективного количества гарцинола нуждающемуся в этом объекту.
| WEGWU M.O | |||
| et al | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| RU 94008835 A1, 27.07.1996 | |||
| ИВАШКИН В.Т | |||
| под ред Рациональная фармакотерапия заболеваний органов пищеварения// М., "Издательство "Литтерра", 2003, с.86-92. | |||
Авторы
Даты
2016-05-27—Публикация
2011-12-29—Подача