Область техники, к которой относится изобретение
Настоящее изобретение относится к новому агонисту серотонинового рецептора 5-НТ4, в частности к новому производному диаминопиримидина или его фармацевтически приемлемой соли, обладающих активностью агониста в отношении 5-НТ4 рецептора, способу их получения, фармацевтической композиции, содержащей указанные соединения и их применению.
Уровень техники
Серотонин, (5-гидрокситриптамин, 5-НТ) - один из нейромедиаторов, имеет широкое распространение по всему организму, как в центральной нервной системе, так и в периферической нервной системе. Примерно 95% серотонина от общего его содержания в организме человека находится в желудочно-кишечном тракте, при этом около 5% обнаружено в мозге. Серотониновые рецепторы находятся в нервных волокнах кишечника, энтерохромаффинных клетках, в гладкой мускулатуре кишечника, в тканях иммунной системы и тому подобных. Подтипы рецепторов серотонина включают 5-НТ1, 5-НТ2, 5-НТ3, 5-НТ4, 5-НТ5, 5-НТ6 и 5-НТ7. Взаимодействие между этими различными рецепторами и серотонином связано с различными физиологическими функциями. Поэтому были проведены многочисленные исследования для создания терапевтических агентов, которые способны взаимодействовать с конкретным подтипом серотониновых рецепторов в качестве мишени. Исследования включают идентификацию 5-НТ4 рецепторов и активных агентов, взаимодействующих с ними (см. Langlois и Fischmeister, J.Med.Chem. 2003, 46, 319-344).
В настоящее время установлено, что агонисты 5-НТ4 рецепторов полезны для лечения нарушенной моторной функции желудочно-кишечного тракта, то есть дисфункции моторики желудочно-кишечного тракта. Нарушения моторной функции желудочно-кишечного тракта могут привести к развитию различных болезней желудка и кишечника, например таких, как синдром раздраженного кишечника (СРК), запор (констипация), диспепсия, замедленное опорожнение желудка, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), гастропарез, послеоперационная непроходимость кишечника, псевдообструкция кишечника, индуцированное лекарственными средствами замедление транзита пищи по желудочно-кишечному тракту и тому подобных.
К представителям агонистов 5-НТ4-рецепторов, раскрытых в известном уровне техники, относятся тегасерод (производное аминогуанидина, патент США US 5510353), прукалоприд (производное бензофуранкарбоксамида, патент EPO 0445862), цизаприд (производное бензамида, патент США 4962115), мозаприд (патент EPO 0243959) и тому подобные. Эти соединения известны как агенты, стимулирующие моторику желудочно-кишечного тракта.
Подробное описание изобретения
Техническая задача изобретения
Авторы настоящего изобретения обнаружили, что определенное производное диаминопиримидина функционирует в качестве агониста 5-НТ4 рецепторов и, следовательно, оно может быть с пользой применено для профилактики или лечения дисфункции моторики желудочно-кишечного тракта.
Таким образом, настоящее изобретение предлагает вышеуказанное новое производное диаминопиримидина или его фармацевтически приемлемую соль, способ их получения, фармацевтическую композицию, содержащую указанные соединения, и их применение.
Решение технической задачи изобретения
В соответствии с одним аспектом настоящего изобретения предлагается использование производного диаминопиримидина или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики или лечения дисфункции моторики желудочно-кишечного тракта.
В соответствии с другим аспектом настоящего изобретения предлагается фармацевтическая композиция для профилактики или лечения дисфункции моторики желудочно-кишечного тракта, содержащая в качестве активного ингредиента производное диаминопиримидина или его фармацевтически приемлемую соль.
В соответствии с еще одним аспектом настоящего изобретения предлагается производное диаминопиримидина или его фармацевтически приемлемая соль.
В соответствии с еще одним аспектом настоящего изобретения предлагается способ получения производного диаминопиримидина или его фармацевтически приемлемой соли.
Полезный эффект изобретения
Соединение, предлагаемое по настоящему изобретению, то есть производное диаминопиримидина или его фармацевтически приемлемая соль, функционирует в качестве агониста 5-НТ4 рецептора и, следовательно, может быть с пользой применено для профилактики или лечения дисфункции моторики желудочно-кишечного тракта, таких болезней ЖКТ, как гастроэзофагеальная рефлюксная болезнь (ГЭРБ), запор (констипация), синдром раздраженного кишечника (СРК), диспепсия, послеоперационная кишечная непроходимость, замедленное опорожнение желудка, гастропарез, псевдообструкция кишечника, индуцированное лекарствами замедление транзита содержимого по кишечнику, или диабетической гастроатонии.
Наилучший способ осуществления изобретения
Используемый в данном документе термин "алкил" означает линейный или разветвленный алифатический углеводородный радикал. Например, C1-C6 алкил означает линейный или разветвленный алифатический углеводород, содержащий от 1 до 6 атомов углерода, такой как метил, этил, пропил, н-бутил, н-пентил, н-гексил, изопропил, изобутил, втор-бутил, трет-бутил, неопентил и изопентил.
Термин "алкокси или алкилокси" означает радикал, образованный путем замещения атома водорода гидроксильной группы алкилом. Например, C1-C6 алкокси включает/может быть метокси, этокси, пропокси, н-бутокси, н-пентилокси, изопропокси, втор-бутокси, трет-бутокси, неопентилокси и изопентилокси.
Термин "алкенил" означает линейный или разветвленный алифатический углеводородный радикал, содержащий одну или более двойных связей. Например, C2-C6 алкенил включает/может быть этенилом, пропенилом, бутенилом, пентенилом и гексенилом.
Термин "алкинил" означает линейный или разветвленный алифатический углеводородный радикал, содержащий одну или более тройных связей. Например, C2-C6 алкинил включает/может быть этинилом, пропинилом, бутинилом, пентинилом и гексинилом.
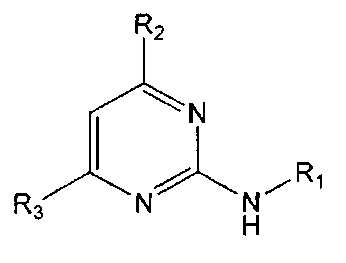
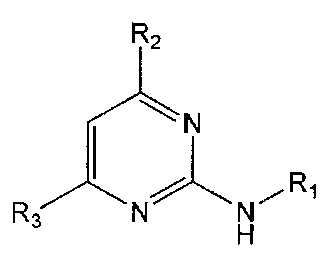
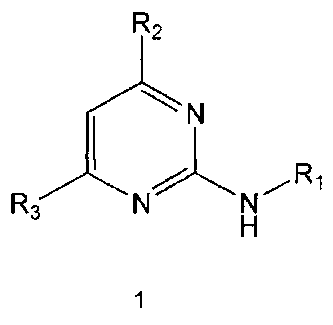
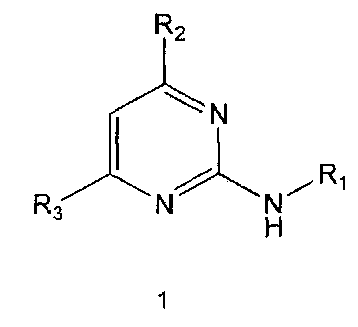
В настоящем изобретении предлагается использование соединения формулы 1 или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики или лечения дисфункции моторики желудочно-кишечного тракта:
Формула 1
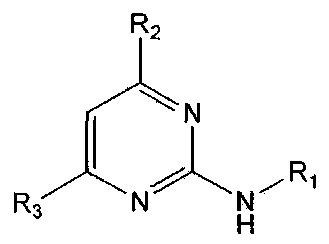
где,
R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, гидроксикарбонила, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном или амино), C2-6 алкенила, C2-6 алкинила, C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), C1-5 алкилтио, моно- или ди-C1-5 алкиламино, C1-5 алкилсульфониламино, C1-5 алкилкарбониламино, C1-5 алкоксикарбонила, аминосульфонила, аминокарбонила, C1-5 алкиламинокарбонила и бензилоксикарбониламино или
гетероарильную группу, выбранную из группы, состоящей из пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, тиофенила, нафтила, инданила, хинолинила, хинолинонила, хроменонила, дигидроиндолонила, изоиндолин-1,3-дионила, дигидробензимидазолонила, бензоксазолонила, бензофуранила, бензотиофенила, бензо[d][1,3]диоксолила, дигидробензо[1,4]диоксинила, индолила, индолинила, бензимидазолила, бензоксазолила, бензотиазолила и индазолила, при этом гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из амино, ди-C1-5 алкиламино, циано, нитро, галогена, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном), C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), ацетила и C1-5 алкилсульфонила,
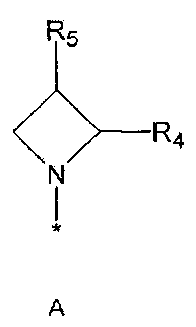
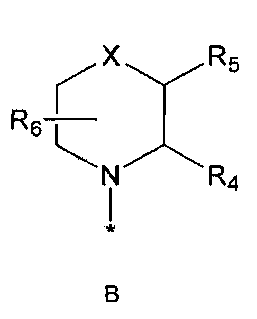
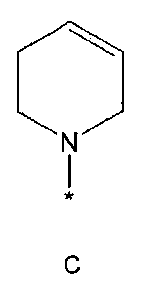
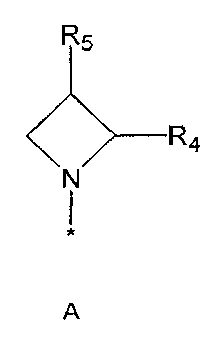
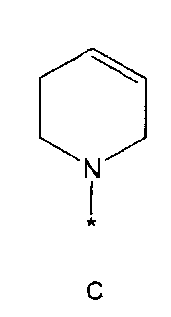
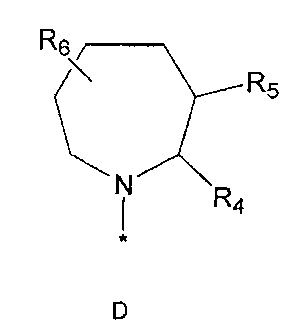
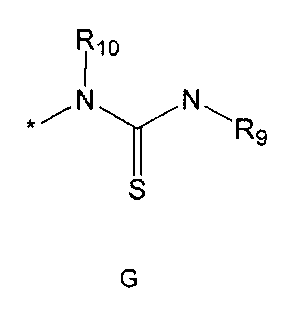
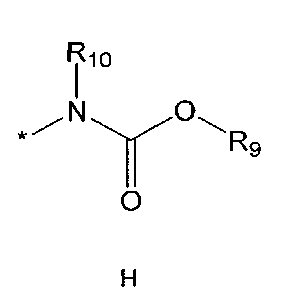
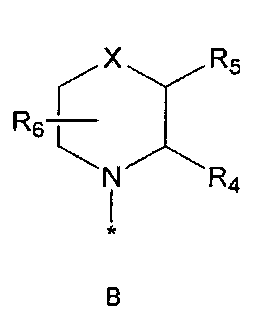
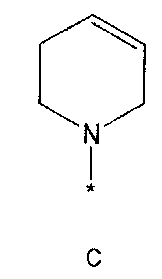
R2 означает азотсодержащую циклическую группу, выбранную из группы, состоящей из следующих формул A, B, C, D (где символ * в формулах A-D означает позицию прикрепления этой группы к соединению формулы 1),
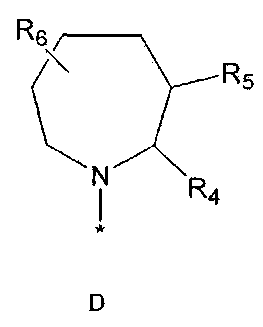
где
R3 означает C1-5 алкильную группу, необязательно замещенную фенилом или C2-6 алкенильную группу, необязательно замещенную фенилом или C3-6 циклоалкилом,
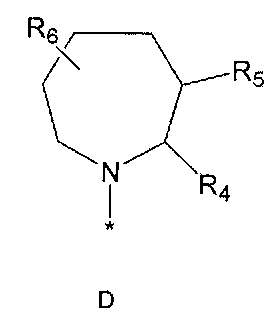
R4 означает водород, C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5 алкокси, бензиламино (где бензиламино необязательно замещен галогеном), фениламино, C1-5 алкиламино, C3-6 циклоалкиламино, пирролидинила и гидрокси-C1-5 алкиламино; C1-5 алкоксикарбонильную группу; гидроксикарбонильную группу; аминокарбонильную группу; формильную группу или оксо (=O) группу,
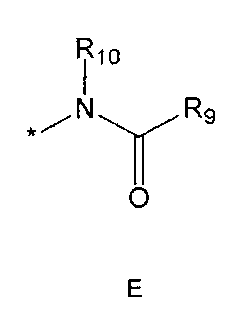
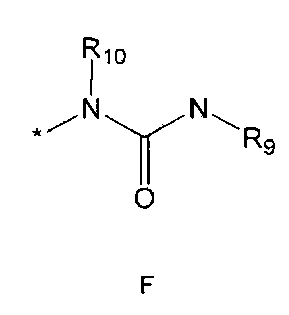
R5 означает водород; гидроксильную группу; C1-5 алкоксигруппу; феноксигруппу; бензилоксигруппу; C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино и моно- или ди-C1-5 алкиламино; или группу, выбранную из группы, состоящей из следующих формул E, F, G, H, I (где символ * в формулах E-I означает позицию прикрепления этой группы к одному из соединений формул A-D),
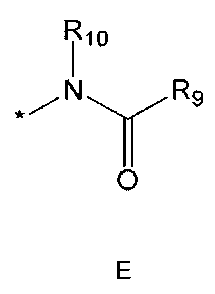
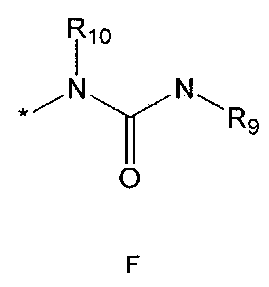
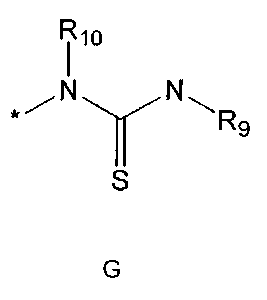
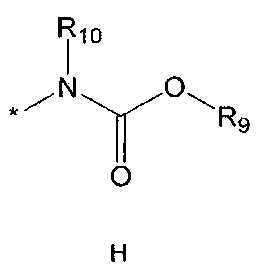
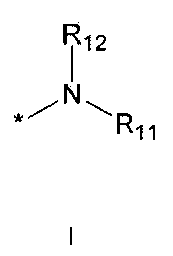
где
R6 означает водород; гидроксильную группу или C1-5 алкильную группу, необязательно замещенную гидроксильной группой,
X означает -CH(R7)-, -C(=O)-, -N(R8) -, -O- или -S-,
R7 означает водород; гидроксильную группу; аминокарбонильную группу; фенильную группу или C1-5 алкильную группу, необязательно замещенную пиперидинилом или гидрокси,
R4 и R5, R5 и R6, R4 и R6 или R5 и R7 могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца,
R8 означает водород; C1-5 алкильную группу; C1-5 алкоксикарбонильную группу; фенильную группу, необязательно замещенную C1-5 алкокси или галогеном,
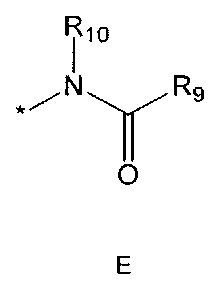
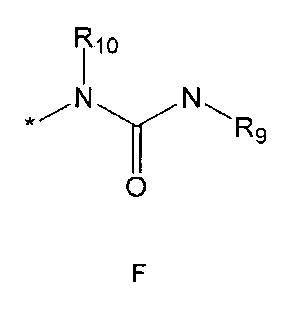
R9 означает C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, галогена, C1-5 алкокси, амино, C1-5 алкоксикарбониламино, бензилоксикарбониламино, моно- или ди-C1-5 алкиламино, C1-5 алкокси- C1-5 алкилокси, фенокси, бензилокси, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, амино, C1-5 алкокси и гидрокси), тиофенила, пиридинила, индолила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, пиперидинила, пиперазинила (где пиперазинил необязательно замещен бензилом), C3-6 циклоалкила, ацетила и бензоила; C3-6 циклоалкильную группу; пиперидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-10 алкенильную группу, необязательно замещенную фенилом; трифторметильную группу; трифторэтильную группу или фенильную группу, необязательно замещенную галогеном,
R10 означает водород или C1-5 алкильную группу,
R11 и R12 каждый независимо друг от друга означает водород; C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино, гидрокси, C1-5 алкилтио, C3-10 циклоалкила, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, C1-5 алкила, моно- или ди-C1-5 алкиламино, трифторметила, галогена, C1-5 алкокси и C1-5 алкилкарбонилокси), тиофенила, пирролила, фуранила (где фуранил необязательно замещен моно- или ди-C1-5 алкилом), пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, тетразолила, оксазолила, тиазолила и бензилокси; пиперидинильную группу, необязательно замещенную бензилом, бензоилом, C1-5 алкилом или C1-5 алкилкарбонилом; азетидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-5 алкилсульфонильную группу; фенилсульфонильную группу (где фенильная часть необязательно замещена галогеном) или C3-10 циклоалкильную группу.
Согласно предлагаемому изобретению в фармацевтической композиции для производства лекарственного средства для профилактики или лечения дисфункции желудочно-кишечного тракта под дисфункцией желудочно-кишечного тракта подразумевают желудочно-кишечные болезни, такие как гастроэзофагеальная рефлюксная болезнь (ГЭРБ), запор (констипация), синдром раздраженного кишечника (СРК), диспепсия, послеоперационная кишечная непроходимость, замедленное опорожнение желудка, гастропарез, псевдообструкция кишечника, индуцированное лекарствами замедление транзита содержимого по кишечнику или диабетический гастропарез. Запор включает в себя хронический запор, хронический идиопатический запор (ХИЗ), индуцированный опиоидами запор (ОИЗ) и т.д. Кроме того, диспепсия включает в себя функциональную диспепсию.
В фармацевтической композиции по предлагаемому изобретению используемым соединением или ее солью может быть соединение формулы 1 или его фармацевтически приемлемая соль, где
R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, гидроксикарбонила, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном или амино), C2-6 алкенила, C2-6 алкинила, C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), C1-5 алкилтио, моно- или ди-C1-5 алкиламино, C1-5 алкилсульфониламино, C1-5 алкилкарбониламино, C1-5 алкоксикарбонила, аминосульфонила, аминокарбонила, C1-5 алкиламинокарбонила и бензилоксикарбониламино или
гетероарильную группу, выбранную из группы, состоящей из пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, тиофенила, нафтила, инданила, хинолинила, хинолинонила, хроменонила, дигидроиндолонила, изоиндолин-1,3-дионила, дигидробензимидазолонила, бензоксазолонила, бензофуранила, бензотиофенила, бензо[d][1,3]диоксолила, дигидробензо[1,4]диоксинила, индолила, индолинила, бензимидазолила, бензоксазолила, бензотиазолила и индазолила, при этом гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из амино, ди-C1-5 алкиламино, циано, нитро, галогена, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном), C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), ацетила и C1-5 алкилсульфонила,
R2 означает азотсодержащую циклическую группу формулы B,
R3 означает C1-5 алкильную группу,
R4 означает водород, C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5 алкокси, бензиламино (где бензиламино необязательно замещен галогеном), фениламино, C1-5 алкиламино, C3-6 циклоалкиламино, пирролидинила и гидрокси-C1-5 алкиламино; C1-5 алкоксикарбонильную группу или аминокарбонильную группу,
R5 означает водород; гидроксильную группу; C1-5 алкоксируппу; феноксигруппу; бензилоксигруппу; C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино и моно- или ди-C1-5 алкиламино или группу, выбранную из группы, состоящей из формул E-I,
R6, R7 и R10 означают водород,
X означает -CH(R7)-, -N(R8)- или -O-,
R4 и R5 могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца,
R8 означает водород или C1-5 алкильную группу,
R9 означает C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, галогена, C1-5 алкокси, амино, C1-5 алкоксикарбониламино, бензилоксикарбониламино, моно- или ди-C1-5 алкиламино, C1-5 алкокси-C1-5 алкилокси, фенокси, бензилокси, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, амино, C1-5 алкокси и гидрокси), тиофенила, пиридинила, индолила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, пиперидинила, пиперазинила (где пиперазинил необязательно замещен бензилом), C3-6 циклоалкила, ацетила и бензоила; C3-6 циклоалкильную группу; пиперидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-10 алкенильную группу, необязательно замещенную фенилом; трифторметильную группу, трифторэтильную группу; или фенильную группу, необязательно замещенную галогеном,
R11 и R12 каждый независимо друг от друга означает водород; C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино, гидрокси, C1-5 алкилтио, C3-10 циклоалкила, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, C1-5 алкила, моно- или ди-C1-5 алкиламино, трифторметила, галогена, C1-5 алкокси и C1-5 алкилкарбонилокси), тиофенила, пирролила, фуранила (где фуранил необязательно замещен моно- или ди-C1-5 алкилом), пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, тетразолила, оксазолила, тиазолила, и бензилокси; пиперидинильную группу, необязательно замещенную бензилом, бензоилом, C1-5 алкилом или C1-5 алкилкарбонилом; азетидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-5 алкилсульфонильную группу; фенилсульфонильную группу (где фенильная часть необязательно замещена галогеном); или C3-10 циклоалкильную группу.
Настоящее изобретение также предлагает фармацевтическую композицию для профилактики или лечения функциональных нарушений моторики желудочно-кишечного тракта, содержащую терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель:
Формула 1
где
R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, гидроксикарбонила, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном или амино), C2-6 алкенила, C2-6 алкинила, C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), C1-5 алкилтио, моно- или ди-C1-5 алкиламино, C1-5 алкилсульфониламино, C1-5 алкилкарбониламино, C1-5 алкоксикарбонила, аминосульфонила, аминокарбонила, C1-5 алкиламинокарбонила и бензилоксикарбониламино или
гетероарильную группу, выбранную из группы, состоящей из пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, тиофенила, нафтила, инданила, хинолинила, хинолинонила, хроменонила, дигидроиндолонила, изоиндолин-1,3-дионила, дигидробензимидазолонила, бензоксазолонила, бензофуранила, бензотиофенила, бензо[d][1,3]диоксолила, дигидробензо[1,4]диоксинила, индолила, индолинила, бензимидазолила, бензоксазолила, бензотиазолила и индазолила, при этом гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из амино, ди-C1-5 алкиламино, циано, нитро, галогена, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном), C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), ацетила и C1-5 алкилсульфонила,
R2 означает азотсодержащую циклическую группу, выбранную из группы, состоящей из следующих формул A, B, C, D (где символ * в формулах A-D означает позицию прикрепления этой группы к соединению формулы 1),

R3 означает C1-5 алкильную группу, необязательно замещенную фенилом или C2-6 алкенильную группу, необязательно замещенную фенилом или C3-6 циклоалкилом,
R4 означает водород, C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5 алкокси, бензиламино (где бензиламино необязательно замещен галогеном), фениламино, C1-5 алкиламино, C3-6 циклоалкиламино, пирролидинила и гидрокси- C1-5 алкиламино; C1-5 алкоксикарбонильную группу; гидроксикарбонильную группу; аминокарбонильную группу; формильную группу или оксо (=O) группу,
R5 означает водород; гидроксильную группу; C1-5 алкоксигруппу; феноксигруппу; бензилоксигруппу; C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино и моно- или ди-C1-5 алкиламино; или группу, выбранную из группы, состоящей из следующих формул E-I (где символ * в формулах E-I означает позицию прикрепления этой группы к одному из соединений формул A-D),

R6 означает водород; гидроксильную группу или C1-5 алкильную группу, необязательно замещенную гидрокси,
X означает -CH(R7)-, -C(=O)-, -N(R8)-, -O- или -S-,
R7 означает водород; гидроксильную группу; аминокарбонильную группу; фенильную группу или C1-5 алкильную группу, необязательно замещенную пиперидинилом или гидрокси,
R4 и R5, R5 и R6, R4 и R6 или R5 и R7 могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца,
R8 означает водород; C1-5 алкильную группу; C1-5 алкоксикарбонильную группу; фенильную группу, необязательно замещенную C1-5 алкокси или галогеном,
R9 означает C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, галогена, C1-5 алкокси, амино, C1-5 алкоксикарбониламино, бензилоксикарбониламино, моно- или ди-C1-5 алкиламино, C1-5 алкокси- C1-5 алкилокси, фенокси, бензилокси, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, амино, C1-5 алкокси и гидрокси), тиофенила, пиридинила, индолила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, пиперидинила, пиперазинила (где пиперазинил необязательно замещен бензилом), C3-6 циклоалкила, ацетила и бензоила; C3-6 циклоалкильную группу; пиперидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-10 алкенильную группу, необязательно замещенную фенилом; трифторметильную группу; трифторэтильную группу или фенильную группу, необязательно замещенную галогеном,
R10 означает водород или C1-5 алкильную группу,
R11 и R12 каждый независимо друг от друга означает водород; C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино, гидрокси, C1-5 алкилтио, C3-10 циклоалкила, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, C1-5 алкила, моно- или ди-C1-5 алкиламино, трифторметила, галогена, C1-5 алкокси и C1-5 алкилкарбонилокси), тиофенила, пирролила, фуранила (где фуранил необязательно замещен моно- или ди-C1-5 алкилом), пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, тетразолила, оксазолила, тиазолила и бензилокси; пиперидинильную группу, необязательно замещенную бензилом, бензоилом, C1-5 алкилом или C1-5 алкилкарбонилом; азетидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-5 алкилсульфонильную группу; фенилсульфонильную группу (где фенильная часть необязательно замещена галогеном) или C3-10 циклоалкильную группу.
Согласно предлагаемому изобретению в фармацевтической композиции для производства лекарственного средства для профилактики или лечения дисфункции желудочно-кишечного тракта под дисфункцией желудочно-кишечного тракта подразумевают желудочно-кишечные болезни, такие как гастроэзофагеальная рефлюксная болезнь (ГЭРБ), запор (констипация), синдром раздраженного кишечника (СРК), диспепсия, послеоперационная кишечная непроходимость, замедленное опорожнение желудка, гастропарез, псевдообструкция кишечника, индуцированное лекарствами замедление транзита содержимого по кишечнику или диабетический гастропарез. Запор включает в себя хронический запор, хронический идиопатический запор (ХИЗ), опиоид-индуцированный запор (ОИЗ) и тому подобные. Кроме того, диспепсия включает в себя функциональную диспепсию.
В фармацевтической композиции по предлагаемому изобретению активным соединением или его солью может быть соединение формулы 1 или его фармацевтически приемлемая соль, где
R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, гидроксикарбонила, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном или амино), C2-6 алкенила, C2-6 алкинила, C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), C1-5 алкилтио, моно- или ди-C1-5 алкиламино, C1-5 алкилсульфониламино, C1-5 алкилкарбониламино, C1-5 алкоксикарбонила, аминосульфонила, аминокарбонила, C1-5 алкиламинокарбонила и бензилоксикарбониламино или
гетероарильную группу, выбранную из группы, состоящей из пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, тиофенила, нафтила, инданила, хинолинила, хинолинонила, хроменонила, дигидроиндолонила, изоиндолин-1,3-дионила, дигидробензимидазолонила, бензоксазолонила, бензофуранила, бензотиофенила, бензо[d][1,3]диоксолила, дигидробензо[1,4]диоксинила, индолила, индолинила, бензимидазолила, бензоксазолила, бензотиазолила и индазолила, в котором гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из амино, ди-C1-5 алкиламино, циано, нитро, галогена, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном), C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), ацетила и C1-5 алкилсульфонила,
R2 означает азотсодержащую циклическую группу формулы B,
R3 означает C1-5 алкильную группу,
R4 означает водород, C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5 алкокси, бензиламино (где бензиламино необязательно замещен галогеном), фениламино, C1-5 алкиламино, C3-6 циклоалкиламино, пирролидинила и гидрокси-C1-5 алкиламино; C1-5 алкоксикарбонильную группу или аминокарбонильную группу,
R5 означает водород; гидроксильную группу; C1-5 алкоксируппу; феноксигруппу; бензилоксигруппу; C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино и моно- или ди-C1-5-алкиламино или группу, выбранную из группы, состоящейщей из формул E-I,
R6, R7 и R10 означают водород,
X означает -CH(R7)-, -N(R8)- или -O-,
R4 и R5 могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца,
R8 означает водород или C1-5 алкильную группу,
R9 означает C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, галогена, C1-5 алкокси, амино, C1-5 алкоксикарбониламино, бензилоксикарбониламино, моно- или ди-C1-5 алкиламино, C1-5 алкокси-C1-5 алкилокси, фенокси, бензилокси, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, амино, C1-5 алкокси и гидрокси), тиофенила, пиридинила, индолила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, пиперидинила, пиперазинила (где пиперазинил необязательно замещен бензилом), C3-6 циклоалкила, ацетила и бензоила; C3-6 циклоалкильную группу; пиперидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-10 алкенильную группу, необязательно замещенную фенилом; трифторметильную группу, трифторэтильную группу; или фенильную группу, необязательно замещенную галогеном,
R11 и R12 каждый независимо друг от друга означает водород; C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино, гидрокси, C1-5 алкилтио, C3-10 циклоалкила, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, C1-5 алкила, моно- или ди-C1-5 алкиламино, трифторметила, галогена, C1-5 алкокси и C1-5 алкилкарбонилокси), тиофенила, пирролила, фуранила (где фуранил необязательно замещен моно- или ди-C1-5 алкилом), пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, тетразолила, оксазолила, тиазолила, и бензилокси; пиперидинильную группу, необязательно замещенную бензилом, бензоилом, C1-5 алкилом или C1-5 алкилкарбонилом; азетидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-5 алкилсульфонильную группу; фенилсульфонильную группу (где фенильная часть необязательно замещена галогеном); или C3-10 циклоалкильную группу.
Фармацевтическая композиция настоящего изобретения может содержать фармацевтически приемлемый носитель, такой как разбавители, дезинтегранты, подслащивающие вещества, смазывающие вещества или ароматизаторы. Фармацевтическая композиция может быть приготовлена в дозированной лекарственной форме для перорального применения, такой как таблетки, капсулы, порошки, гранулы, суспензии, эмульсии или сиропы или в лекарственной форме для парентерального применения, такой как инъекционный раствор. Готовая лекарственная форма может иметь различные дозировки, например, для введения в один прием или для введения в несколько приемов.
Фармацевтическая композиция по настоящему изобретению может содержать дополнительно разбавитель (например, лактозу, кукурузный крахмал и т.д.), смазывающее вещество (например, стеарат магния), эмульгатор, суспендирующий агент, стабилизатор и/или изотонический агент. При необходимости указанная композиция может также содержать подслащивающие вещества и/или ароматизаторы.
Композицию по настоящему изобретению можно вводить перорально или парентерально, включая внутривенный, внутрибрюшинный, подкожный, ректальный и местный пути введения. В соответствии с этим, композиция настоящего изобретения может быть приготовлена в различных лекарственных формах, таких как таблетки, капсулы, водные растворы или суспензии. В случае приготовления композиции в форме таблеток для перорального применения традиционно используют наполнители, такие как лактоза, кукурузный крахмал и смазывающие вещества, например стеарат магния. В случае приготовления композиции в форме капсул для перорального введения в качестве наполнителя можно использовать лактозу и/или высушенный кукурузный крахмал. Когда фармацевтическую композицию необходимо приготовить в виде водной суспензии для перорального применения, активный компонент может быть смешан с эмульгирующими и/или суспендирующими агентами. При желании можно использовать общепринятые подслащивающие и/или ароматизирующие вещества. Для внутримышечного, внутрибрюшинного, подкожного и внутривенного введения обычно готовят стерильные растворы активного компонента, pH которых должен быть доведен надлежащим образом до требуемого уровня, и при этом растворы должны быть забуферены. При внутривенном введении необходимо регулировать общую концентрацию растворенных веществ, чтобы получить препарат в виде изотонического раствора. Композиция по настоящему изобретению может быть приготовлена в форме водного раствора, содержащего фармацевтически приемлемые носители, например, физиологический раствор, имеющий уровень pH 7,4. Растворы могут быть введены во внутримышечный кровоток пациента посредством местной болюсной инъекции.
Соединение формулы 1 или его фармацевтически приемлемую соль можно вводить в терапевтически эффективной дозе в интервале примерно от 0,001 до примерно 10 мг в сутки на 1 кг массы тела проходящего лечение пациента. Конечно, дозировка может меняться в зависимости от возраста больного, массы его тела, чувствительности организма, симптомов болезни или активности соединения.
Настоящее изобретение также предлагает способ лечения функциональных нарушений моторики желудочно-кишечного тракта таких, как гастроэзофагеальная рефлюксная болезнь (ГЭРБ), запор (констипация), синдром раздраженного кишечника (СРК), диспепсия, послеоперационная непроходимость кишечника, замедленное опорожнение желудка, гастропарез, псевдообструкция кишечника, индуцированное лекарствами замедление транзита содержимого по кишечнику или диабетический гастропарез, включающий введение терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли больному, нуждающемуся в таком лечении. Запор включает в себя хронический запор, хронический идиопатический запор (ХИЗ), индуцированный опиоидами запор (ОИЗ) и т.д. Кроме того, диспепсия включает в себя функциональную диспепсию.
Настоящее изобретение также предлагает соединение формулы 1 или ее фармацевтическую соль:
Формула 1
где
R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, гидроксикарбонила, C1-3 алкила (где C1-3 алкил необязательно замещен галогеном или амино), C2-6 алкенила, C2-6 алкинила, C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), C1-5 алкилтио, моно- или ди-C1-5 алкиламино, C1-5 алкилсульфониламино, C1-5 алкилкарбониламино, C1-5 алкоксикарбонила, аминосульфонила, аминокарбонила, C1-5 алкиламинокарбонила и бензилоксикарбониламино или
гетероарильную группу, выбранную из группы, состоящей из пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, тиофенила, нафтила, инданила, хинолинила, хинолинонила, хроменонила, дигидроиндолонила, изоиндолин-1,3-дионила, дигидробензимидазолонила, бензоксазолонила, бензофуранила, бензотиофенила, бензо[d][1,3]диоксолила, дигидробензо[1,4]диоксинила, индолила, индолинила, бензимидазол-4-ила, бензимидазол-5-ила, бензимидазол-6-ила, бензимидазол-7-ила, бензоксазолила, бензотиазолила и индазолила, при этом гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из амино, ди-C1-5 алкил амино, циано, нитро, галогена, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном), C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), ацетила и C1-5 алкилсульфонила,
R2 означает азотсодержащую циклическую группу, выбранную из группы, состоящей из следующих формул A, B, C, D (где символ * в формулах A-D означает позицию прикрепления этой группы к соединению формулы 1),

R3 означает C1-5 алкильную группу, необязательно замещенную фенилом или C2-6 алкенильную группу, необязательно замещенную фенилом или C3-6 циклоалкилом,
R4 означает водород; C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5 алкокси, бензиламино (где бензиламино необязательно замещен галогеном), фениламино, C1-5 алкиламино, C3-6 циклоалкиламино, пирролидинила и гидрокси-C1-5 алкиламино; C1-5 алкоксикарбонильную группу; гидроксикарбонильную группу; аминокарбонильную группу; формильную группу или оксо (=O) группу,
R5 означает водород; гидроксильную группу; C1-5 алкоксигруппу; феноксигруппу; бензилоксигруппу; C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино и моно- или ди-C1-5 алкиламино; или группу, выбранную из группы, состоящей из следующих формул E, F, G, H, I (где символ * в формулах E-I означает позицию прикрепления этой группы к одному из соединений формул A-D),

R6 означает водород; гидроксильную группу или C1-5 алкильную группу, необязательно замещенную гидрокси,
X означает -CH(R7)-, -C(=O)-, -N(R8) -, -O- или -S-,
R7 означает водород; гидроксильную группу; аминокарбонильную группу; фенильную группу или C1-5 алкильную группу, необязательно замещенную пиперидинилом или гидрокси,
R4 и R5, R5 и R6, R4 и R6 или R5 и R7 могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца,
R8 означает водород; C1-5 алкильную группу; C1-5 алкоксикарбонильную группу; фенильную группу, необязательно замещенную C1-5 алкокси или галогеном,
R9 означает C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, галогена, C1-5 алкокси, амино, C1-5 алкоксикарбониламино, бензилоксикарбониламино, моно- или ди-C1-5 алкиламино, C1-5 алкокси-C1-5 алкилокси, фенокси, бензилокси, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, амино, C1-5 алкокси и гидрокси), тиофенила, пиридинила, индолила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, пиперидинила, пиперазинила (где пиперазинил необязательно замещен бензилом), C3-6 циклоалкила, ацетила и бензоила; C3-6 циклоалкильную группу; пиперидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-10 алкенильную группу, необязательно замещенную фенилом; трифторметильную группу; трифторэтильную группу или фенильную группу, необязательно замещенную галогеном,
R10 означает водород или C1-5 алкильную группу,
R11 и R12 каждый независимо друг от друга означает водород; C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино, гидрокси, C1-5 алкилтио, C3-10 циклоалкила, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, C1-5 алкила, моно- или ди-C1-5 алкиламино, трифторметила, галогена, C1-5 алкокси и C1-5 алкилкарбонилокси), тиофенила, пирролила, фуранила (где фуранил необязательно замещен моно- или ди-C1-5 алкилом), пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, тетразолила, оксазолила, тиазолила и бензилокси; пиперидинильную группу, необязательно замещенную бензилом, бензоилом, C1-5 алкилом или C1-5 алкилкарбонилом; азетидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-5 алкилсульфонильную группу; фенилсульфонильную группу (где фенильная часть необязательно замещена галогеном) или C3-10 циклоалкильную группу.
В качестве соединения или ее соли предпочтительно использовать соединения формулы 1 или его фармацевтически приемлемой соли, где
R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, гидроксикарбонила, C1-3 алкила (где C1-3 алкил необязательно замещен галогеном или амино), C2-6 алкенила, C2-6 алкинил а, C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), C1-5 алкилтио, моно- или ди-C1-5-алкиламино, C1-5 алкилсульфониламино, C1-5 алкилкарбониламино, C1-5 алкоксикарбонила, аминосульфонила, аминокарбонила, C1-5 алкиламинокарбонила и бензилоксикарбониламино или
гетероарильную группу, выбранную из группы, состоящей из пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, тиофенила, нафтила, инданила, хинолинила, хинолинонила, хроменонила, дигидроиндолонила, изоиндолин-1,3-дионила, дигидробензимидазолонила, бензоксазолонила, бензофуранила, бензотиофенила, бензо[d][1,3]диоксолила, дигидробензо[1,4]диоксинила, индолила, индолинила, бензимидазол-4-ила, бензимидазол-5-ила, бензимидазол-6-ила, бензимидазол-7-ила, бензоксазолила, бензотиазолила и индазолила, при этом гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из амино, ди-C1-5 алкиламино, циано, нитро, галогена, C1-5 алкила (где C1-5 алкил необязательно замещен галогеном), C1-5 алкокси (где C1-5 алкокси необязательно замещен галогеном), ацетила и C1-5 алкилсульфонила,
R2 означает азотсодержащую циклическую группу формулы B,
R3 означает C2-5 алкильную группу,
R4 означает водород, C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5 алкокси, бензиламино (где бензиламино необязательно замещен галогеном), фениламино, C1-5 алкиламино, C3-6 циклоалкил амино, пирролидинила и гидрокси-C1-5алкиламино; C1-5 алкоксикарбонильную группу; или аминокарбонильную группу,
R5 означает водород; гидроксильную группу; C1-5 алкоксигруппу; феноксигруппу; бензилоксигруппу; C1-5 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино и моно- или ди-C1-5 алкиламино; или группу, выбранную из группы, состоящей из формул E-I,
R6, R7 и R10 означают водород,
X означает -CH(R7)-, -N(R8) -, -O-,
R4 и R5, могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца,
R8 означает водород или C1-5 алкильную группу,
R9 означает C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, галогена, C1-5 алкокси, амино, C1-5 алкоксикарбониламино, бензилоксикарбониламино, моно- или ди-C1-5 алкиламино, C1-5 алкокси- C1-5 алкилокси, фенокси, бензилокси, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, амино, C1-5 алкокси и гидрокси), тиофенила, пиридинила, индолила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, оксазолила, тиазолила, фуранила, пирролила, пиперидинила, пиперазинила (где пиперазинил необязательно замещен бензилом), C3-6 циклоалкила, ацетила и бензоила; C3-6 циклоалкильную группу; пиперидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-10 алкенильную группу, необязательно замещенную фенилом; трифторметильную группу; трифторэтильную группу или фенильную группу, необязательно замещенную галогеном,
R11 и R12 каждый независимо друг от друга означает водород; C1-10 алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино, C1-5 алкоксикарбониламино, гидрокси, C1-5 алкилтио, C3-10 циклоалкила, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, C1-5 алкила, моно- или ди-C1-5 алкиламино, трифторметила, галогена, C1-5 алкокси и C1-5 алкилкарбонилокси), тиофенила, пирролила, фуранила (где фуранил необязательно замещен моно- или ди-C1-5 алкилом), пиридинила, пиримидинила, пиразинила, имидазолила, пиразолила, триазолила, тетразолила, оксазолила, тиазолила и бензилокси; пиперидинильную группу, необязательно замещенную бензилом, бензоилом, C1-5 алкилом или C1-5 алкилкарбонилом; азетидинильную группу, необязательно замещенную C1-5 алкоксикарбонилом; C1-5 алкилсульфонильную группу; фенилсульфонильную группу (где фенильная часть необязательно замещена галогеном) или C3-10 циклоалкильную группу.
Соединение формулы 1 или его фармацевтически приемлемая соль могут иметь заместители, содержащие асимметрический атом углерода и, следовательно, быть в форме рацемической смеси (RS) или формах оптических изомеров, таких как (R-) или (S-) изомер. Соединение формулы 1 или его фармацевтически приемлемая соль содержит как рацемическую смесь (RS), так и оптические изомеров, такие как (R)- или (S)-изомер. При этом соединение формулы 1 или его фармацевтически приемлемая соль может быть в форме цис- или транс- геометрического изомера в соответствии с заместителями, имеющими в нем, например, двойную связь. Соединение формулы 1 или его фармацевтически приемлемая соль содержит как цис-, так и транс- изомеры. Кроме того, соединение формулы 1 или его фармацевтически приемлемая соль может быть в форме одного или более диастереоизомера(ов) или их смеси. Соединение формулы 1 или его фармацевтически приемлемая соль содержит как диастереоизомер(ы), так и их смеси.
Соединение формулы 1 по настоящему изобретению может быть также представлено в форме фармацевтически приемлемой соли. Указанная соль может быть получена в форме кислотно-аддитивной соли, которая включает, например, соли, образованные неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, сульфоновая кислота, сульфаминовая кислота, фосфорная кислота или азотная кислота, и соли, образованные органическими кислотами, такими как уксусная кислота, пропионовая кислота, янтарная кислота, гликолевая кислота, стеариновая кислота, лимонная кислота, малеиновая кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, винная кислота, гидроксималеиновая кислота, фенилуксусная кислота, глутаминовая кислота, бензойная кислота, салициловая кислота, 2-ацетоксибензойная кислота, фумаровая кислота, толуолсульфоновая кислота, бензолсульфоновая кислота, щавелевая кислота или трифторуксусная кислота. Такую соль можно получить путем реагирования соединения формулы 1 в виде свободного основания со стехиометрическим количеством или избыточным количеством солеобразующей неорганической или органической кислоты в подходящем растворителе или смеси двух или более растворителей.
В применении, фармацевтической композиции, способе лечения и в соединении по настоящему изобретению наиболее предпочтительные соединения включают любое соединение (или его фармацевтически приемлемую соль), выбранное из группы, состоящей из:
N-(4-фторфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-морфолино-6-пропилпиримидин-2-амина;
4-(азепан-1-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(2-метилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(3-метилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-пропил-6-тиоморфолинопиримидин-2-амина;
4-(2,5-диметилпиперазин-1-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
4-(5,6-дигидропиримидин-1(2H)-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(декагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-[декагидроизохинолин-1(2H)-ил]-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(4-фенилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(пиперазин-1-ил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
2-{1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
этил-1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-карбоксилата;
1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-4-карбоксамида;
{1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-4-ил}метанола;
1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-4-она;
4-бутил-N-(4-фторфенил)-6-(пиперидин-1-ил)пиримидин-2-амина;
4-бутил-6-(2-этилпиперидин-1-ил)-N-(4-фторфенил)пиримидин-2-амина;
2-{1-[6-бутил-2-(4-фторфениламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
4-бутил-N-(4-фторфенил)-6-морфолинопиримидин-2-амина;
2-{1-[2-(4-хлор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-(1-{2-[3-(метилтио)фениламино]-6-пропилпиримидин-4-ил}пиперидин-2-ил)этанола;
4-(2,6-диметилформолино)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
8-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]-8-азабицикло[3.2.1]октан-3-ола;
N-{1-[2-(4-фторфенил амино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
N-(4-фторфенил)-4-{4-[3-(пиперидин-4-ил)пропил]пиперидин-1-ил}-6-пропилпиримидин-2-амина;
4-[3-(бензилокси)пиперидин-1-ил]-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
4-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
N-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-ил]-1H-индол-5-амина;
N-(3-хлор-4-метилфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-ил]хинолин-6-амина;
4-(пиперидин-1-ил)-6-пропил-N-[3-(трифторметил)фенил]пиримидин-2-амина;
N-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-ил]-2-(трифторметил)-1H-бензо[d]имидазол-5-амина;
N-[3-(метилтио)фенил]-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(5-метокси-2-метилфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(5-хлор-2-метилфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фтор-3-нитрофенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-метоксифенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(3-метоксифенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(3-хлорфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(3-нитрофенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-хлор-3-нитрофенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
3-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
N-(4-метил-3-нитрофенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
4-(4-этилпиперазин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-[4-(4-метоксифенил)пиперазин-1-ил]-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-[4-(4-фторфенил)пиперазин-1-ил]-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(морфолин-4-ил)пиримидин-2-амина;
1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-4-она;
N-(4-фторфенил)-4-метил-6-(пиперидин-1-ил)пиримидин-2-амина;
4-(азетидин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-3-ола;
1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-4-ола;
N-(4-фторфенил)-4-метил-6-(2-метилпиперидин-1-ил)пиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(3-метилпиперидин-1-ил)пиримидин-2-амина;
4-(3,5-цис-диметилпиперидин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
4-(азепан-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
4-((2R,6S)-2,6-диметилпиперидин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(4-фенилпиперидин-1-ил)пиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(пиперазин-1-ил)пиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(4-метилпиперазин-1-ил)пиримидин-2-амина;
4-(2,5-диметилпиперазин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
4-(3,5-диметилпиперазин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(октагидрохинолин-1(2H)-ил)пиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(октагидроизохолин-2(1H)-ил)пиримидин-2-амина;
4-(5,6-дигидропиримидин-1(2H)-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
2-{1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-2-ил}метанола;
N-[4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-ил]-1H-индол-6-амина;
2-{1-[2-(1H-индол-6-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
N-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-ил]-1H-индол-6-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)-1H-индол-6-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]-1H-индол-6-амина;
(N)-3-[4-(3-этилморфолино)-6-пропилпиримидин-2-иламино]бензонитрила;
(N)-трет-бутил-4-[2-(3-цианофениламино)-6-пропилпиримидин-4-ил]-3-метилпиперазин-1-карбоксилата;
(N)-3-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
4-морфолино-N-(3-нитрофенил)-6-пропилпиримидин-2-амина;
N-(4-фтор-3-нитрофенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(4-хлор-3-нитрофенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(3-метоксифенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(4-метоксифенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-[3-(метилтио)фенил]-4-морфолино-6-пропилпиримидин-2-амина;
N-(3-хлорфенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(3-хлор-4-метилфенил)-4-морфолино-6-пропилпиримидин-2-амина;
4-морфолино-6-пропил-N-[3-(трифторметил)фенил]пиримидин-2-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)-1H-индол-5-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)-2-(трифторметил)-1H-бензо[d]имидазол-6-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)хинолин-6-амина;
3-(4-морфолино-6-пропилпиримидин-2-иламино)бензонитрила;
N-(5-метокси-2-метилфенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(5-хлор-2-метилфенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)хинолин-3-амина;
4-(2-этилпиперидин-1-ил)-N-(3-нитрофенил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(4-фтор-3-нитрофенил)-6-пропилпиримидин-2-амина;
N-(4-хлор-3-нитрофенил)-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(3-метоксифенил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(4-метоксифенил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-[3-(метилтио)фенил]-6-пропилпиримидин-2-амина;
N-(3-хлорфенил)-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(3-хлор-4-метилфенил)-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-6-пропил-N-[3-(трифторметил)фенил]пиримидин-2-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]-1H-индол-5-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]-2-(трифторметил)-1H-бензо[d]имидазол-6-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]хинолин-6-амина;
3-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
4-(2-этилпиперидин-1-ил)-N-(5-метокси-2-метилфенил)-6-пропилпиримидин-2-амина;
N-(5-хлор-2-метилфенил)-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]хинолин-3-амина;
(R)-N-(4-хлор-3-нитрофенил)-4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-амина;
(N)-N-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-ил]-1H-индол-6-амина;
(R)-N-(2-метилпиперазин-1-ил)-6-пропил-N-[3-(трифторметил)фенил]пиримидин-2-амина;
(R)-N-(2-метилпиперазин-1-ил)-N-(3-нитрофенил)-6-пропилпиримидин-2-амина;
(R)-N-(4-фтор-3-нитрофенил)-4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-амина;
(R)-N-(4-метил-3-нитрофенил)-4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-амина;
(R)-4-фтор-N1-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-ил]бензол-1,3-диамина;
(R)-N1-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-2-фтор-5-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-2-метил-5-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-2-амино-5-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-N1-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-ил]-3-нитробензол-1,4-диамина;
(R)-3-амино-5-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-3-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензамида;
3-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
2-{1-[2-(1-этил-1H-индол-6-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(1H-индол-5-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-(1-{6-пропил-2-[2-(трифторметил)-1H-бензо[d]имидазол6-иламино]пиримидин-4-ил}пиперидин-2-ил)этанола;
2-{1-[2-(4-метоксифениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-метоксифениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(5-метокси-2-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-хлор-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(4-фтор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(2,3-диметилбензофуран-5-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[6-пропил-2-(хинолин-6-иламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-хлорфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
7-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-4-метил-2H-хромен-2-она;
2-{1-[6-пропил-2-(3-трифторметилфениламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[6-пропил-2-(хинолин-3-иламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
(S)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(S)-4-(3-аминопиперидин-1-ил)-N-(3-нитрофенил)-6-пропилпиримидин-2-амина;
(S)-3-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(S)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(S)-5-{4-[3-(бутиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-{4-[3-(пентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-{4-[3-(изобутиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-{4-[3-(изопентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-2-метил-5-{4-[3-(неопентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(S)-5-(4-{3-[(1H-пиррол-2-ил)метиламино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(S)-2-метил-5-(4-пропил-6-{3-[(тиофен-2-илметил)амино]пиперидин-1-ил}пиримидин-2-иламино)бензонитрила;
(S)-5-(4-{3-[(4,5-диметилфуран-2-илметил)амино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(S)-2-метил-5-{4-[3-(3-метилтиопропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(S)-5-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-{4-[3-(4-гидроксибензиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-[4-(3-диэтиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(S)-5-(4-{3-[бис(циклопропилметил)амино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(R)-5-(4-{3-[бис(циклопропилметил)амино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
4-этил-N-(4-фторфенил)-6-(пиперидин-1-ил)пиримидин-2-амина;
4-этил-N-(4-фторфенил)-6-(октагидрохинолин-1(2H)-ил)пиримидин-2-амина;
4-этил-6-(2-этилпиперидин-1-ил)-N-(4-фторфенил)пиримидин-2-амина;
2-{1-[6-этил-2-(4-фторфениламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
4-этил-N-(4-фторфенил)-6-морфолинопиримидин-2-амина;
2-{1-[2-(4-метил-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(4-амино-3-трифторметилфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(4-амино-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
5-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
2-фтор-5-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
2-амино-5-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
2-{1-[2-(3-амино-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-амино-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-амино-4-хлорфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(индолин-6-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
(S)-2-{1-[2-(4-хлор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
(S)-2-{1-[2-(4-амино-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
(R)-2-{1-[2-(4-амино-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
3-[4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
N-(3-нитрофенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-(4-фтор-3-нитрофенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-(4-хлор-3-нитрофенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-(3-метоксифенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-(5-метокси-2-метилфенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-(4-метоксифенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
4-(октагидрохинолин-1(2H)-ил)-6-пропил-N-(3-трифторметилфенил)пиримидин-2-амина;
N-(3-хлорфенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-(5-хлор-2-метилфенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-(3-хлор-4-метилфенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-(3-метилтиофенил)-4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амина;
N-[4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-ил]-1H-индол-5-амина;
N-[4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-ил]-2-(трифторметил)-1H-бензо[d]имидазол-5-амина;
N-[4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-ил]хинолин-6-амина;
4-метил-7-[4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-амино]-2H-хромен-2-она;
N-[4-(октагидрохинолин-1(2H)-ил)-6-пропилпиримидин-2-ил]хинолин-3-амина;
(R)-5-{4-[3-(этиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(пропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(бутиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-2-метил-5-{4-[3-(пентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил амино}бензонитрила;
(R)-5-{4-[3-(изобутиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(изопентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-2-метил-5-{4-[3-(неопентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-5-{4-[3-(изопропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-(4-{3-[(1H-пиррол-2-ил)метиламино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(R)-2-метил-5-(4-пропил-6-{3-[(тиофен-2-илметил)амино]пиперидин-1-ил}пиримидин-2-иламино)бензонитрила;
(R)-5-(4-{3-[(4,5-диметилфуран-2-илметил)амино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(R)-2-метил-5-{4-[3-(3-метилтиопропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-5-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(циклопентилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(4-гидроксибензиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-N-{1-[2-(3-циано-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-3-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила;
(R)-3-{4-[3-(пропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-3-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-2-фтор-5-{4-[3-(пропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-5-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-фторбензонитрила;
(R)-N1-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-4-фторбензол-1,3-диамина;
(R)-N1-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-3-нитробензол-1,4-диамина;
(R)-3-амино-5-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-N1-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-3-(трифторметил)бензол-1,4-диамина;
(R)-N1-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-5-(трифторметил)бензол-1,3-диамина;
(R)-N-{1-[2-(4-амино-3-нитрофениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(4-метил-3-нитрофениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(4-фтор-3-нитрофениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(4-хлор-3-нитрофениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-5-цианофениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-5-трифторметилфениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(4-амино-3-трифторметилфениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(4-фтор-3-трифторметилфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(3-циано-4-фторфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-4-фторфениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-4-хлорфениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(4-амино-3-цианофениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-циано-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-цианофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-циано-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-(1-{2-[3-амино-5-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)-2-гидроксиацетамида;
(R)-N-(1-{2-[4-амино-3-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)-2-гидроксиацетамида;
(R)-N-(1-{2-[4-фтор-3-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)-2-гидроксиацетамида;
(R)-N-{1-[2-(3-амино-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-амино-4-хлорфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-амино-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-хлор-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-2-гидрокси-N-(1-{2-[4-метил-3-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)ацетамида;
(R)-N-{1-[2-(3-амино-5-цианофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-5-(трифторметил)бензол-1,3-диамина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-4-(3-аминопиперидин-1-ил)-N-(3-фтор-4-метилфенил)-6-пропилпиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-4-фторбензол-1,3-диамина;
(R)-3-амино-5-{[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]амино}бензонитрила;
(R)-2-амино-5-{[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]амино}бензонитрила;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-4-хлорбензол-1,3-диамина;
(R)-4-(3-аминопиперидин-1-ил)-N-[4-метил-3-(трифторметил)фенил]-6-пропилпиримидин-2-амина;
(R)-N-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-1H-индол-6-амина;
(R)-4-(3-аминопиперидин-1-ил)-N-(4-метил-3-нитрофенил)-6-пропилпиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-нитробензол-1,4-диамина;
(R)-N-{1-[2-(3-циано-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-5-[4-(3-диэтиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(R)-5-[4-(3-диэтиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила;
(R)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила;
(R)-N-{1-[6-бутил-2-(3-цианофениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-цианофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-5-цианофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
N-{1-[2-(4-амино-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
N-{1-[2-(3-амино-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(4-фтор-3-трифторметилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-(1-{2-[3-амино-5-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)ацетамида;
(R)-N-(1-{2-[4-амино-3-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)ацетамида;
(R)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(R)-2-фтор-5-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-2-метил-5-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-N1-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-5-(трифторметил)бензол-1,3-диамина;
(R)-N1-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-3-амино-5-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-(4-фтор-3-трифторметилфенил)-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]амина;
(R)-N1-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-нитробензол-1,4-диамина;
(R)-N1-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-4-фторбензол-1,3-диамина;
(R)-N1-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-5-(трифторметил)бензол-1,3-диамина;
(R)-N1-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-3-амино-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-5-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-иламино]-2-метилбензонитрила;
(R)-5-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-иламино]-2-фторбензонитрила;
(R)-N-{1-[6-бутил-2-(3-циано-4-метилфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(S)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
N-{1-[6-бутил-2-(3-циано-4-метилфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-5-({4-бутил-6-[3-(этиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(бутиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(пентиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(изобутиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(изопентиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(неопентиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-{[4-бутил-6-(3-{[3-(метилтио)пропил]амино}пиперидин-1-ил)пиримидин-2-ил]амино}-2-метилбензонитрила;
(R)-4-фтор-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,3-диамина;
(R)-4-хлор-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,3- диамина;
(R)-2-амино-5-({4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}амино)бензонитрила;
(R)-N-(3-метокси-4-метилфенил)-4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-амина;
(R)-4-метил-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,3-диамина;
(R)-5-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-фторбензонитрила;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-5-(трифторметил)бензол-1,3-диамина;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-3-(трифторметил)бензол-1,4-диамина;
(R)-3-амино-5-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)бензонитрила;
(R)-2-амино-5-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)бензонитрила;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-4-фторбензол-1,3-диамина;
(R)-4-бутил-N-(3-метокси-4-метилфенил)-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-4-метилбензол-1,3-диамина;
(R)-4-бутил-N-[4-фтор-3-(трифторметил)фенил]-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-3-нитробензол-1,4-диамина;
(R)-N-(3,4-диметилфенил)-4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-амина;
(R)-N-(3-фтор-4-метилфенил)-4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-амина;
(R)-N-[4-метил-3-(трифторметил)фенил]-4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-амина;
(R)-4-метокси-N-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,3-диамина;
(R)-N-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-1H-индазол-6-амина;
(R)-N4-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,2,4-триамина;
(R)N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-3-нитробензол-1,4-диамина;
(R)-3-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)бензонитрила;
(R)-4-бутил-N-(3,4-диметилфенил)-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-4-бутил-N-(3-фтор-4-метилфенил)-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-4-бутил-N-[4-метил-3-(трифторметил)фенил]-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-4-метоксибензол-1,3-диамина;
(R)-N-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-1H-индазол-6-амина;
(R)-N4-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}бензол-1,2,4-триамина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(3-нитрофенил)пиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-3-нитробензол-1,4-диамина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(4-фтор-3-нитрофенил)пиримидин-2-амина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(4-метил-3-нитрофенил)пиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-5-(трифторметил)бензол-1,3-диамина;
(R)-3-амино-5-{[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]амино}бензонитрила;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-[4-метил-3-(трифторметил)фенил]пиримидин-2-амина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(3-фтор-4-метилфенил)пиримидина-амина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(3-метокси-4-метилфенил)пиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-4-метилбензол-1,3-диамина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(3,4-диметилфенил)пиримидин-2-амина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-[4-фтор-3-(трифторметил)фенил]пиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-4-фторбензол-1,3-диамина;
(R)-2-амино-5-{[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]амино}бензонитрила;
(R)-3-{[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]амино}бензонитрила;
(R)-Н1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]бензол-1,4-диамина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(4-хлор-3-нитрофенил)пиримидин-2-амина и
(R)-N4-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]бензол-1,2,4-триамина.
В применении, фармацевтической композиции, способе лечения и в соединении по настоящему изобретению еще более предпочтительные соединения с точки зрения фармакологической активности включают соединение (или его фармацевтически приемлемую соль), охарактеризованные в Таблицах 2-1 и 2-2.
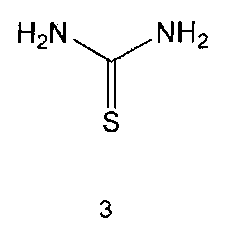
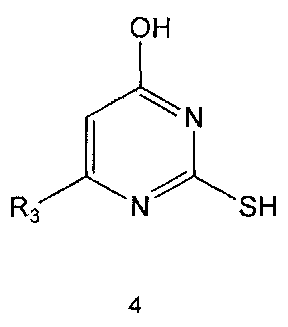
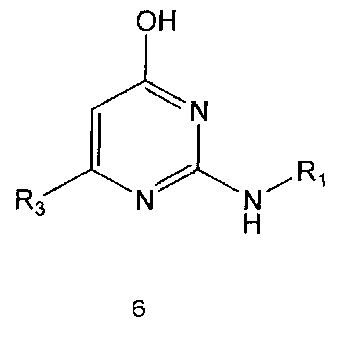
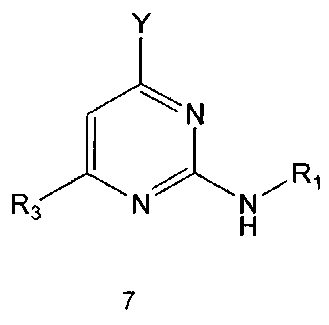
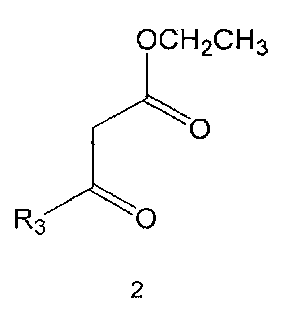
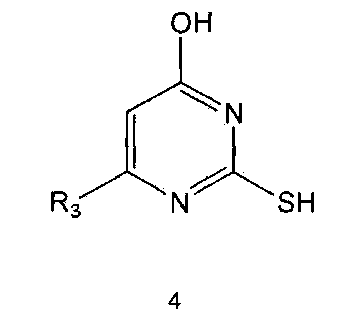
Настоящее изобретение включает в свой объем способ получения соединения формулы 1 или его фармацевтически приемлемой соли, включающий реагирование соединения формулы 2 с соединением формулы 3 с получением соединения формулы 4; осуществление метилирования полученного соединения формулы 4 с получением соединения формулы 5; реагирование соединения формулы 5 с R1-NH2 с получением соединения формулы 6; проведение галогенирования соединения формулы 6 с получением соединения формулы 7 и реагирование соединения формулы 7 с R2-H с получением соединения формулы 1:
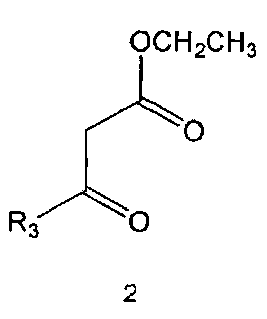

где
R1 R2 и R3 имеют те же значения, как это определено выше, a Y означает галоген.
Соединения формулы 2 и 3 являются коммерчески доступными. Реакция между соединением формулы 2 и соединением формулы 3 может проводиться в присутствии основания и растворителя. В качестве основания можно использовать карбонат калия, карбонат натрия и тому подобные, а растворителем может быть водный растворитель, такой как вода. Обычно реакцию можно проводить при нагревании.
Метилирование соединения формулы 4 можно проводить с использованием метилирующего реагента, такого как йодметан. Метилирование можно проводить в присутствии основания и растворителя. В качестве основания можно использовать гидроксид натрия, гидроксид калия и тому подобные, а растворителем может быть водный растворитель, такой как вода. Обычно реакцию метилирования можно проводить при комнатной температуре или при нагревании.
Реакция между соединением формулы 5 и R1-NH2 может проводиться как в отсутствие растворителя, так и в присутствии растворителя, например, такого, как диглим. Реакцию можно проводить при температуре в интервале от 140°C до 180°C.
Галогенирование соединения формулы 6 можно проводить с использованием галогенирующего реагента, например как оксихлорид фосфора. Галогенирование можно проводить предпочтительно при температуре около 100°C или выше. Кроме того, для повышения скорости реакции и/или выхода продукта галогенирование можно проводить в присутствии каталитического количества N,N-диметиланилина или N,N-диметилформамида.
Реакция между соединением формулы 7 и R2-H может проводиться в присутствии органического растворителя, такого как безводный тетрагидрофуран, спирт и 1,4-диоксан. Обычно реакцию можно проводить при нагревании. Кроме того, для повышения скорости протекания реакции и/или выхода продукта указанную реакцию можно проводить в присутствии металлического катализатора (например, палладия), лиганда и основания, такого как карбонат цезия, изопропилэтиламин или проводить в микроволноволновом поле мощностью излучения в пределах от 300 до 600 Вт.
Соединение формулы 5 можно также получить путем реагирования соединения формулы 2 с соединением формулы 8:
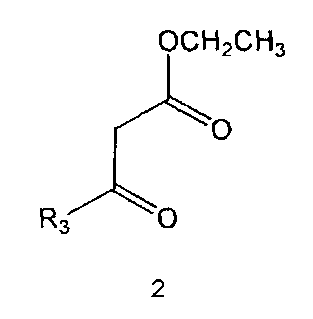
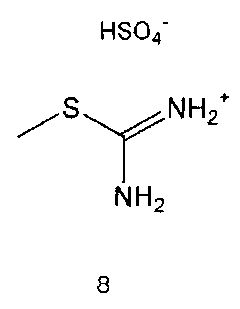
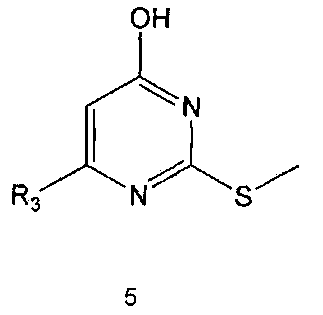
где R3 имеет те же значения, как это определено выше.
Соединение формулы 8 является коммерчески доступным. Реакция между соединением формулы 2 и соединением формулы 8 может проводиться в присутствии основания и растворителя. В качестве основания может быть карбонат калия, карбонат натрия и тому подобные, и растворителем может быть водный растворитель, такой как вода. Обычно реакцию можно проводить при комнатной температуре или при нагревании.
Соединение формулы 6 могут быть также получены путем реагирования соединения формулы 2 с соединением формулы 9:
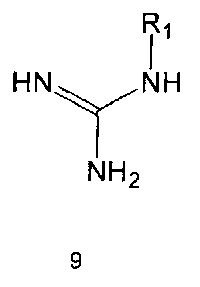
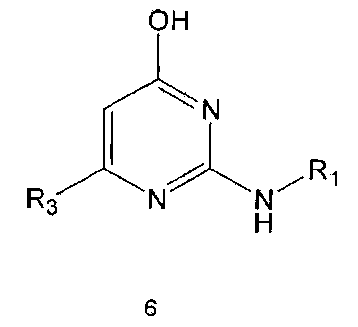
где R1 и R3 имеют те же значения, как это определено выше.
Соединение формулы 9 можно легко получить с использованием известных методов, например, описанных в EP 0560726. Реакция между соединением формулы 2 и соединением формулы 9 может проводиться в присутствии основания и растворителя. В качестве основания может быть метилат натрия, этилат натрия, и тому подобные, а растворителем может быть спирт. Обычно реакцию проводят при нагревании.
Настоящее изобретение также предлагает способ получения соединения формулы 1 или его фармацевтически приемлемой соли, включающий галогенирование соединения формулы 4 с получением соединения формулы 10; реагирование соединения формулы 10 с R2H с получением соединения формулы 11 и реагирование полученного соединения формулы 11 с R1-NH2 с получением соединения формулы 1:
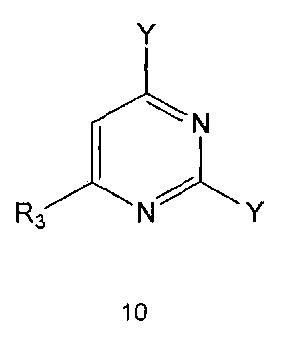
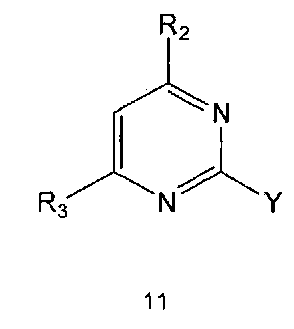
где R1, R2 и R3 имеют те же значения, как это определено выше, a Y означает галоген.
Галогенирование соединения формулы 4 может проводиться с использованием галогенирующего реагента, такого как оксихлорид фосфора. Галогенирование проводят предпочтительно при температуре около 100°C или выше. Кроме того, для повышения скорости реакции и/или выхода продукта галогенирование можно проводить в присутствии каталитического количества N,N-диметиланилина или N,N-диметилформамида.
Реакцию между соединением формулы 10 и R2H можно проводить в присутствии органического растворителя, такого как безводный тетрагидрофуран, спирт, хлороформ или N,N-диметилформамид. Обычно реакцию может проводиться при комнатной температуре или при нагревании. Кроме того, для повышения скорости реакции и/или выхода продукта реакцию можно проводить в присутствии основания, такого как триэтиламин и диизопропилэтиламин.
Реакция между соединением формулы 11 и R1-NH2 может проводиться в присутствии органического растворителя, такого как спирт, толуол, 1,4-диоксан, и N,N-диметилформамид. Реакцию можно проводить при нагревании. Кроме того, для повышения скорости реакции и/или выхода продукта, реакцию можно проводить в присутствии металлического катализатора (например, палладия), лиганда, и основания (например, карбоната цезия) или проводить в микроволноволновом поле мощностью излучения в пределах от 300 до 600 Вт.
Соединение формулы 10 можно получить путем реагирования соединения формулы 5 с кислотой с получением соединения формулы 12 и последующим осуществлением галогенирование соединения формулы 12:
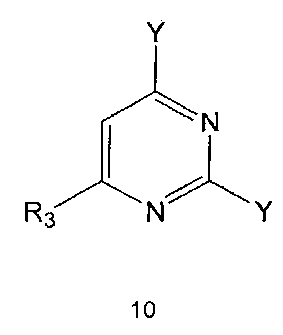
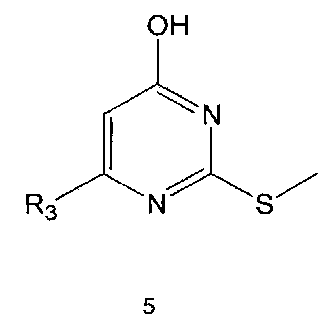
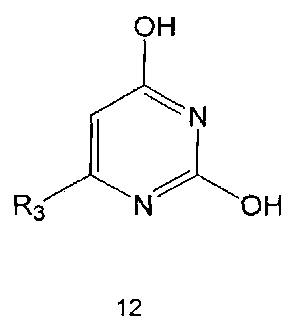
где R3 и Y имеют те же значения, как это определено выше.
Реакция между соединением формулы 5 и кислотой может проводиться с использованием органической кислоты (например, уксусной кислоты и тому подобной) и неорганической кислоты (например, хлористоводородной кислоты и тому подобной). Реакцию может проводиться в водном растворителе, таком как вода. Обычно реакцию можно проводить при нагревании.
Галогенирование соединения формулы 12 можно проводить с использованием галогенирующего реагента, такого как оксихлорид фосфора. Галогенирование проводят предпочтительно при температуре около 100°C или выше. Кроме того, для повышения скорости реакции и/или выхода продукта, галогенирование можно проводить в присутствии каталитического количества N,N-диметиланилина или N,N-диметилформамида.
В соответствии с одним вариантом осуществления настоящего изобретения предлагается способ получения соединения формулы 1b или его фармацевтически приемлемой соли, включающий реагирование соединения формулы 1a с органической кислотой или ацилгалоидом:
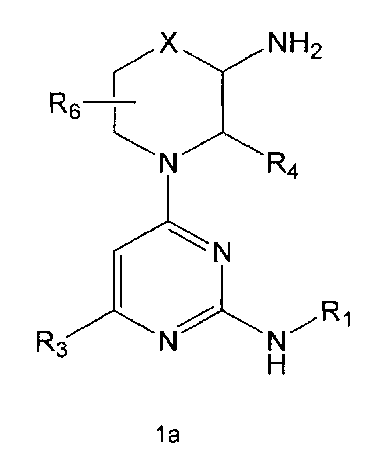

где R1, R3, R4, R6, R9, R10 и X имеют те же значения, как это определено выше.
Реакцию между соединением формулы 1a и органической кислотой можно проводить посредством реакции сочетания с образованием амидной связи с использованием реагента сочетания, такого как гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)фосфония, гидрохлорид N-(3-диметиламинопропил)-N′-этилкарбодиимида и гидрат 1-гидроксибензотриазола и основания, такого как диизопропилэтиламин или триэтиламин. Указанная реакция сочетания может проводиться в органическом растворителе, таком как дихлорметан или N,N-диметилформамид. Обычно реакцию сочетания проводят при комнатной температуре.
Кроме того, реакцию между соединением формулы 1a и ацилгалоидом можно проводить через реакцию сочетания с образованием амидной связи с использованием органического основания (например, диизопропилэтиламина, триэтиламина и так далее) или неорганического основания (например, гидроксида натрия). Реакция сочетания может проводиться в органическом растворителе, таком как дихлорметан или смешанном растворителе, в качестве которого может быть смесь органического растворителя и воды. Обычно реакцию сочетания проводят при комнатной температуре.
Соединение формулы 1b или его фармацевтически приемлемую соль можно также получить путем реагирования соединения формулы 11a с органической кислотой или ацилгалоидом с получением соединения формулы 11b, последующим реагированием соединения формулы 11b с R1-NH2 с получением соединения формулы 1b:
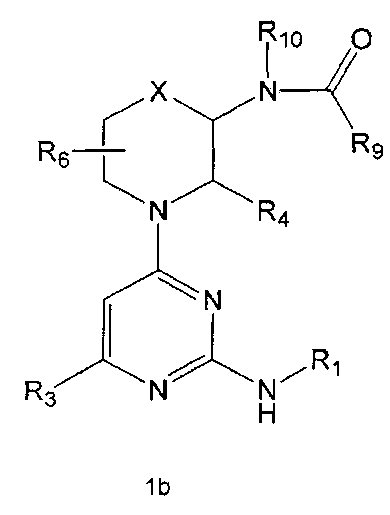
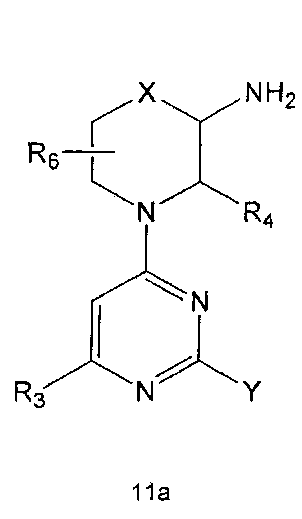
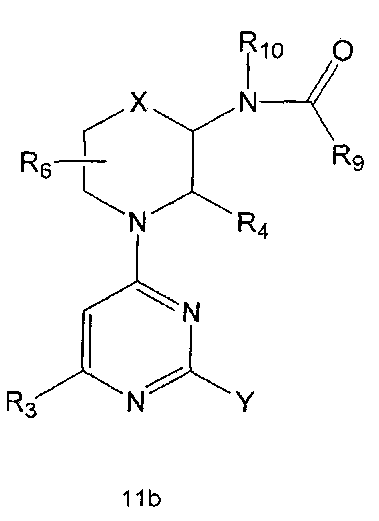
где R1 R3, R4, R6, R9, R10 и X имеют те же значения, как это определено выше, a Y означает галоген.
Реакцию между соединением формулы 11a и органической кислотой можно проводить посредством реакции сочетания с образованием амидной связи с использованием реагента сочетания, такого как гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)фосфония, гидрохлорид N-(3-диметиламинопропил)-N′-этилкарбодиимида и гидрат 1-гидроксибензотриазола и основания, такого как диизопропилэтиламин или триэтиламин. Указанную реакцию сочетания можно проводить в органическом растворителе, таком как дихлорметан или N,N-диметилформамид. Обычно реакцию сочетания проводят при комнатной температуре.
Кроме того, реакцию между соединением формулы 11a и ацилгалоидом можно проводить через реакцию сочетания с образованием амидной связи с использованием органического основания (например, диизопропилэтиламина, триэтиламина и т.д.) или неорганического основания (например, гидроксида натрия). Реакция сочетания может проводиться в органическом растворителе, таком как дихлорметан или смешанном растворителе, в качестве которого может быть смесь органического растворителя и воды. Обычно реакцию сочетания проводят при комнатной температуре.
Реакция между соединением формулы 11b и R1-NH2 может проводиться в присутствии органического растворителя, такого как спирт, толуол, 1,4-диоксан и N,N-диметилформамид и т.д. Реакцию обычно можно проводить при нагревании. Кроме того, для повышения скорости реакции и/или выхода продукта, реакцию можно проводить в присутствии металлического катализатора (например, палладия), лиганда, и основания (например, карбоната цезия) или проводить в микроволноволновом поле мощностью излучения в пределах от 300 до 600 Вт.
В соответствии с другим вариантом осуществления настоящего изобретения, предлагается способ получения соединения формулы 1 с или его фармацевтически приемлемой соли, включающий проведение реакции восстановительного аминирования в отношении соединения формулы 1а с использованием альдегида или кетона:
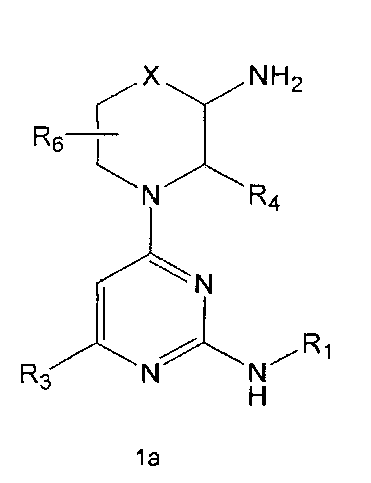
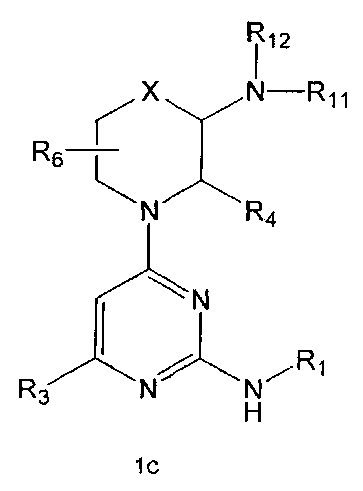
где R1, R3, R4, R6, R11, R12 и X имеют те же значения, как это определено выше.
Восстановительное аминирование можно проводить с использованием восстанавливающего агента, такого как борогидрид натрия, триацетоксиборогидрид натрия и цианоборогидрид натрия. Восстановительное аминирование можно проводить в органическом растворителе (например, спирте) при комнатной температуре или при низкой температуре (например, при температуре от 0°C или ниже). Кроме того, для повышения скорости реакции и/или выхода продукта реакцию можно проводить в присутствии уксусной кислоты и т.д.
Соединение формулы 1c или его фармацевтически приемлемую соль можно получить путем введения аминозащитной группы в соединение формулы 11a с получением соединения формулы 11c; последующего алкилирования соединения формулы 11c с получением соединения формулы 11d и реагирования соединения формулы 11d с R1-NH2 с последующим снятием аминозащитной группы:
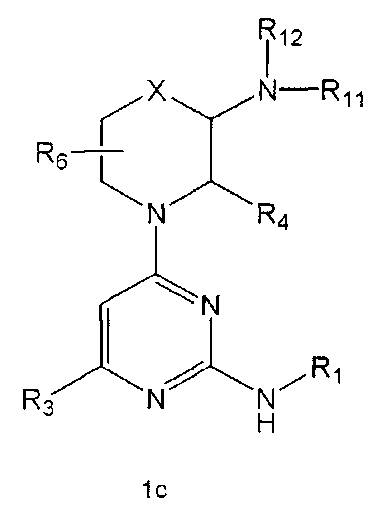
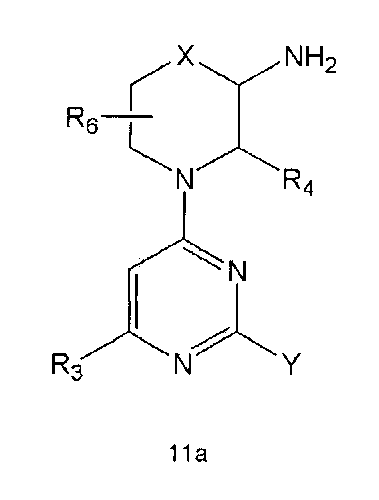
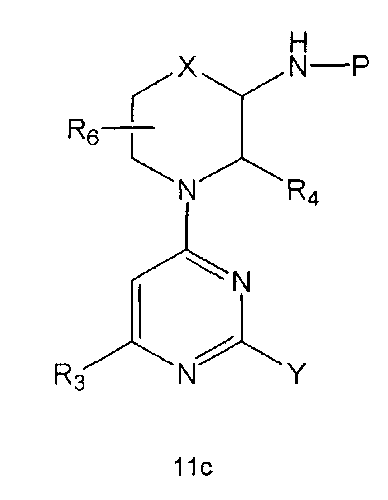
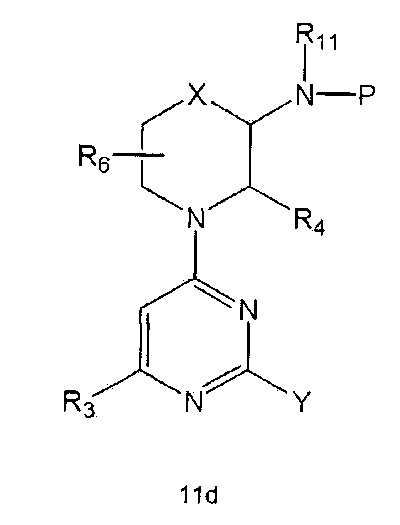
где R1, R3, R4, R6, R11 и X имеют те же значения, как это определено выше, Y означает галоген, a R12 означает водород. P означает аминозащитную группу, такую как третбутоксикарбонил.
Реакция введения аминозащитной группы в соединении формулы 11a может проводиться в органическом растворителе, таком как дихлорметан, хлороформ и 1,4-диоксан при комнатной температуре или при низкой температуре (например, при температуре от 0°C или ниже). Кроме того, указанную реакцию можно проводить в присутствии основания, такого как триэтиламин, диизопропилэтиламин и 4-диметиламинопиридин.
Алкилирование соединением формулы 11c можно осуществлять с использованием алкилгалоида. Алкилирование может проводиться в присутствии основания (например, гидрида натрия) в органическом растворителе (например, как N,N-диметилформамид). Алкилирование можно проводить при комнатной температуре или при нагревании.
Реакцию между соединением формулы 11d и R1-NH2 можно проводить в присутствии органического растворителя, такого как спирт, толуол, 1,4-диоксан, N,N-диметилформамид. Обычно реакцию проводят при нагревании. Кроме того, для повышения скорости реакции и/или выхода продукта реакцию можно проводить в присутствии металлического катализатора (например, палладия), лиганда и основания (например, карбоната цезия), или же проводить в микроволноволновом поле мощностью излучения в диапазоне от 300 до 600 Вт. Реакцию удаления аминозащитной группы можно проводить с использованием кислоты (например, хлористоводородной кислоты, трифторуксусной кислоты и т.д.) в органическом растворителе, таком как этилацетат и метанол. Обычно реакцию проводят при комнатной температуре или при низкой температуре (например, при температуре от 0°C или ниже).
Соединение формулы 11d можно также получить путем проведения реакции восстановительного аминирования относительно соединения формулы 11a с получением соединения формулы 11e, и последующего введения аминозащитной группы в соединении формулы 11e:
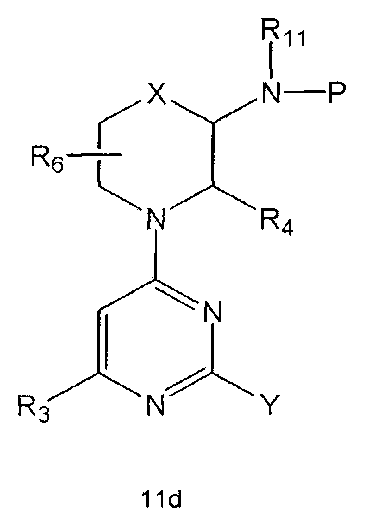
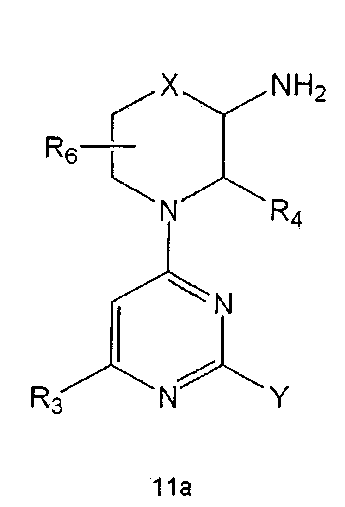

где R3, R4, R6, R11 и X имеют те же значения, как это определено выше; Y означает галоген, a R12 означает водород. P означает аминозащитную группу, такую как третбутоксикарбонил.
Восстановительное аминирование соединения формулы 11a можно осуществлять с использованием восстанавливающего агента, такого как борогидрид натрия, триацетоксиборогидрид натрия и цианоборогидрид натрия. Восстановительное аминирование можно осуществлять в органическом растворителе (например, спирте) при комнатной температуре или при низкой температуре (например, при температуре от 0°C или ниже). Кроме того, для повышения скорости реакции и/или выхода продукта реакцию можно проводить в присутствии уксусной кислоты и т.д.
Реакцию введения аминозащитной группы в соединении формулы 11e можно осуществлять в органическом растворителе, таком как дихлорметан, хлороформ и 1,4-диоксан при комнатной температуре или при низкой температуре (например, при температуре от 0°C или ниже). Кроме того, реакцию можно проводить в присутствии основания, например такого, как триэтиламин, диизопропилэтиламин и 4-диметиламинопиридин.
Приводимые далее примеры получения и экспериментальные примеры служат только для иллюстративных целей и не имеют целью ограничение объема настоящего изобретения.
Получение 1. 4-Хлор-N-(4-фторфенил)-6-пропилпиримидин-2-амин
<Шаг 1> 2-(метилтио)-6-пропилпиримидин-4(3H)-он
Смесь 6-н-пропил-2-тиоурацила (25,0 г, 0,15 моль), гидроксида натрия (5,9 г, 0,15 моль), йодметана (10,2 мл, 0,17 моль) и воды (300 мл) перемешивают при комнатной температуре в течение ночи и затем отфильтровывают. Полученное твердое вещество сушат в вакууме с получением указанного в заголовке соединения (25,0 г) в виде белого твердого вещества. Полученный продукт используют на последующем шаге реакции без дальнейшей очистки.
<Шаг 2> 2-(4-фторфениламино)-6-пропилпиримидин-4(3Н)-он
Смесь 2-(метилтио)-6-пропилпиримидин-4(3Н)-она (3,7 г, 0,02 моль), полученного на шаге 1, и 4-фторанилина (6,7 г, 0,06 моль) перемешивают при температуре 160°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры, а затем добавляют к ней этанол (50 мл) и уголь (1 г). Реакционную смесь перемешивают в течение 1 часа и затем отфильтровывают. Фильтрат выпаривают при пониженном давлении. Добавляют этанол (20 мл) к полученному остатку, и полученную смесь затем перемешивают в течение 1 часа. После фильтрования реакционной смеси получают указанное в заголовке соединение в виде серого твердого вещества.
1H-ЯМР (400 МГц, CD3OD) δ 7,70-7,50 (м, 2Н), 7,07 (т, 2Н), 5,75 (с, 1Н), 2,43 (т, 2Н), 1,70 (кв, 2Н), 0,98 (т, 3Н)
<Шаг 3> 4-хлор-N-(4-фторфенил)-6-пропилпиримидин-2-амин
2-(4-Фторфениламино)-6-пропилпиримидин-4(3Н)-он (2,2 г, 8,9 ммоль), полученный на шаге 2, добавляют к оксихлориду фосфора (1,5 мл, 16,2 ммоль), затем перемешивают при температуре 110°C в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры, в нее выливают ледяную воду и затем подщелачивают до pH 9 с использованием гидроксида натрия. Водный слой экстрагируют этилацетатом. Полученный органический слой сушат над безводным сульфатом натрия и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (этилацетат), что дает 2,2 г указанного в заголовке соединения в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,65-7,50 (м, 2Н), 7,03 (т, 2Н), 6,63 (с, 1Н), 2,60 (т, 2Н), 1,75 (кв, 2Н), 0,99 (т, 3Н)
Получение 2. 4-Бутил-6-хлор-N-(4-фторфенил)-пиримидин-2-амин
<Шаг>1 6-бутил-2-тиоксо-2,3-дигидропиримидин-4(1Н)-он
Смесь тиомочевины (2,4 г, 31,5 ммоль), карбоната калия (5,5 г, 39,5 ммоль), этилового эфира 3-оксогептановой кислоты (6,8 г, 39,5 ммоль) и воды (40 мл) перемешивают при температуре 100°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к ней добавляют воду (6 мл) и концентрированную соляную кислоту (6 мл), и полученную смесь затем экстрагируют этилацетатом. Органический слой выпаривают при пониженном давлении. Полученный остаток промывают н-гексаном и затем отфильтровывают. Полученное белое твердое вещество сушат в вакууме с получением 1 г указанного в заголовке соединения. Продукт используют на последующем шаге реакции без дальнейшей очистки.
<Шаг 2> 6-бутил-2-(метилтио)пиримидин-4(3Н)-он
Смесь 6-бутил-2-тиоксо-2,3-дигидропиримидин-4(1Н)-она (0,4 г, 2,2 ммоль), полученного на шаге 1, гидроксида натрия (0,1 г, 2,2 ммоль), йодметана (0,15 мл; 2,4 ммоль) и воды (3 мл) перемешивают при комнатной температуре в течение ночи и затем фильтруют. Полученное белое твердое вещество (0,2 г) сушат в вакууме и затем используют на последующем шаге реакции без дальнейшей очистки.
<Шаг 3> 6-бутил-2-(4-фторфениламино)пиримидин-4(3Н)-он
Смесь 6-бутил-2-(метилтио)пиримидин-4(3Н)-она (0,16 г, 0,81 ммоль), полученного на шаге 2, и 4-фторанилина (0,28 г, 2,5 ммоль) перемешивают при температуре 160°C в течение ночи. После охлаждения реакционной смеси до комнатной температуры к ней добавляют этилацетат (3 мл). Реакционную смесь затем перемешивают в течение 1 часа и отфильтровывают, что дает 0,2 г указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400 МГц, CD3OD) δ 7,70-7,50 (м, 2Н), 7,07 (т, 2Н), 5,75 (с, 1H), 2,46 (т, 2Н), 1,70-1,60 (м, 2Н), 1,39 (кв, 2Н), 0,95 (т, 3Н)
<Шаг 4> 4-бутил-6-хлор-N-(4-фторфенил)пиримидин-2-амин
Указанное в заголовке соединение (0,17 г) в виде желтого масла получают в соответствии с теми же процедурами, как в шаге 3 Получения 1, но используя 6-бутил-2-(4-фторфениламино)пиримидин-4(3Н)-он (0,2 г, 0,8 ммоль), полученный на шаге 3.
1Н-ЯМР (400 МГц, CDCl3) δ 7,65-7,50 (м, 2Н), 7,09 (ушир. с, 1H), 7,03 (т, 2Н), 6,63 (с, 1Н), 2,62 (т, 2Н), 1,80-1,60 (м, 2Н), 1,40 (кв., 2Н), 0,95 (т, 3Н)
Получение 3. 2-[1-(2-Хлор-6-пропилпиримидин-4-ил)-пиперидин-2-ил]этанол
<Шаг 1> 2,4-дихлор-6-пропилпиримидин
Оксихлорид фосфора (100 мл) медленно прибавляют к 6-пропил-2-тиоурацилу(17,7 г, 0,1 моль) при комнатной температуре, полученную реакционную смесь затем перемешивают при температуре 110°C в течение ночи. Реакционную смесь выливают в ледяную воду и затем нейтрализуют насыщенным водным раствором бикарбоната натрия. Реакционную смесь экстрагируют дихлорметаном. Органический слой сушат над безводным сульфатом магния, фильтруют и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 50/1), что дает 10,3 г указанного в заголовке соединения в виде бледно-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 7,16 (с, 1Н), 2,73 (т, 2Н), 1,78 (м, 2Н), 0,99 (т, 3Н)
<Шаг 2> 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанол
2,4-Дихлор-6-пропилпиримидин (3 г, 15,7 ммоль), полученный на шаге 1, растворяют в хлороформе (20 мл), а затем к полученному раствору прибавляют 2-пиперидинэтанола (5,07 г, 39,3 ммоль) при температуре 0°C. Реакционную смесь перемешивают при температуре 60°C течение ночи и затем охлаждают до комнатной температуры. Реакционную смесь выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1), что дает 2,3 г указанного в заголовке соединения в виде бледно-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 6,27 (с, 1H), 4,92 (шир., 1H), 3,83 (шир., 1H), 3,65 (м, 1H), 3,35 (м, 1Н), 3,02 (м, 1H), 2,52 (м, 2Н), 2,05 (м, 1Н), 1,79-1,62 (м, 6+2Н), 1,53 (м, 1H), 0,96 (т, 3Н)
Получение 4. 3-(4-хлор-6-пропилпиримидин-2-иламино)бензонитрил
<Шаг 1> 3-(6-оксо-4-пропил-1,6-дигидропиримидин-2-иламино)бензонитрил
Смесь 2-(метилтио)-6-пропилпиримидин-4(3Н)-она (6,4 г, 34,7 ммоль), полученного на шаге 1 Получения 1, и 3-аминобензонитрила (12,3 г, 104,1 ммоль) перемешивают при температуре 160°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры и затем к ней добавляют этанол (50 мл). Реакционную смесь перемешивают в течение 1 часа и затем фильтруют с получением 3,5 г указанного в заголовке соединения в виде бледно-коричневого твердого вещества.
1H-ЯМР (400 МГц, CD3OD) δ 8,22 (с, 1Н), 7,90-7,80 (м, 1Н), 7,55-7,45 (м, 1H), 7,45-7,35 (м, 1H), 5,84 (с, 1Н), 2,49 (т, 2Н), 1,80-1,65 (м, 2Н), 1,00 (т, 3Н)
<Шаг 2> 3-(4-хлор-6-пропилпиримидин-2-иламино)бензонитрил
3-(6-оксо-4-пропил-1,6-дигидропиримидин-2-иламино)бензонитрил (3,3 г, 13,0 ммоль), полученный на шаге 1, добавляют к оксихлориду фосфора (10 мл). Реакционную смесь перемешивают при температуре 110°C в течение 2 часов и затем охлаждают до комнатной температуры. Реакционную смесь добавляют в ледяную воду и затем подщелачивают до pH 9 гидроксидом натрия. Водный слой экстрагируют этилацетатом. Полученный органический слой сушат над безводным сульфатом натрия и выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 10/1), получая 3,2 г указанного в заголовке соединения в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 8,18 (с, 1H), 7,75-7,65 (м, 1H), 7,50-7,20 (м, 3Н), 6,72 (с, 1Н), 2,65 (т, 2Н), 1,78 (кв, 2Н), 1,01 (т, 3Н)
Получение 5. 2-хлор-4-(пиперидин-1-ил)-6-пропилпиримидин
2,4-дихлор-6-пропилпиримидин (2 г, 10,5 ммоль), полученный на шаге 1 Получения 3, растворяют в тетрагидрофуране (20 мл), а затем к полученному раствору прибавляют пиперидин (1 г, 11,7 ммоль) при комнатной температуре. Реакционную смесь перемешивают при нагревании при температуре 60°C течение ночи и затем охлаждают до комнатной температуры. Реакционную смесь выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 2/1), что позволяет выделить 2 г указанного в заголовке соединения в виде бледно-желтого масла. Продукт используют в последующей реакции без дальнейшей очистки.
Получение 6. N-(4-хлор-6-пропилпиримидин-2-ил)-1Н-индол-6-амин
<Шаг 1> 2-(1Н-индол-6-иламино)-6-пропилпиримидин-4(3Н)-он
Смесь 2-(метилтио)-6-пропилпиримидин-4(3Н)-она (1 г, 5,43 ммоль), полученного на шаге 1 Получения 1, и 6-аминоиндола (789 мг, 5,97 ммоль) перемешивают при температуре 150°C в течение ночи и затем охлаждают до комнатной температуры. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 40/1), что позволяет выделить 1,4 г указанного в заголовке соединения в виде бледно-коричневого твердого вещества.
1H-ЯМР (400 МГц, CD3OD) δ 7,81 (с, 1Н), 7,51 (д, 1H), 7,21 (д, 1Н), 6,95 (дд, 1H), 6,42 (д, 1H), 5,70 (с, 1Н), 2,44 (дд, 1H), 1,75-1.70 (м, 2Н), 0,99 (т, 3Н).
<Шаг 2> N-(4-хлор-6-пропилпиримидин-2-ил)-1Н-индол-6-амин
Раствор 2-(1Н-индол-6-иламино)-6-пропилпиримидин-4(3Н)-она (1,2 г, 4,47 ммоль), полученного на шаге 1, оксихлорида фосфора (822 мг, 5,37 ммоль) и диизопропилэтиламина (1,9 мл, 10,7 ммоль) в 1,4-диоксане (45 мл) кипятят с обратным холодильником при перемешивании в течение 30 минут. Реакционную смесь охлаждают до комнатной температуры и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 4/1), что позволяет выделить 1,1 г указанного в заголовке соединения в виде белого твердого вещества.
1Н-ЯМР (400 МГц, CDCl3) δ 8,17 (ушир. с, 1Н), 8,05 (с, 1Н), 7,53 (д, 1H), 7,25 (д, 1Н), 7,11 (дд, 1Н), 6,98 (дд, 1Н), 6,58 (с, 1Н), 6,48 (с, 1Н), 2,59 (дд, 2Н), 1,81-1,71 (м, 2Н), 0,99 (т, 3Н).
Получение 7. 5-(4-хлор-6-пропилпиримидин-2-иламино)-2-метилбензонитрил
<Шаг 1> 2-метил-5-(6-оксо-4-пропил-1,6-дигидропиримидин-2-иламино) бензонитрил
Смесь 2-(метилтио)-6-пропилпиримидин-4(3Н)-она (5 г, 27,1 ммоль), полученного на шаге 1 Получения 1, и 5-амино-2-метилбензонитрила (7 г, 53 ммоль) перемешивают при температуре 160°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры и затем к ней добавляют этанол (30 мл). Реакционную смесь перемешивают в течение 1 часа и после фильтрования получают 6,3 г указанного в заголовке соединения в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CD3OD) δ 8,12 (д, 1H), 7,70-7.60 (м, 1H), 7,35 (д, 1Н), 5,80 (с, 1H), 2,50-2,40 (м, 5Н), 1,73 (кв, 2Н), 0,99 (т, 3Н)
<Шаг 2> 5-(4-хлор-6-пропилпиримидин-2-иламино)-2-метилбензонитрил
2-Метил-5-(6-оксо-4-пропил-1,6-дигидропиримидин-2-иламино)бензонитрил (6,3 г, 23,5 ммоль), полученный на шаге 1, прибавляют к оксихлориду фосфора (10 мл). Реакционную смесь перемешивают при температуре 110°C в течение 2 часов и затем охлаждают до комнатной температуры. Реакционную смесь добавляют в ледяную воду и затем подщелачивают до pH 9 с помощью гидроксида натрия. Водный слой экстрагируют этилацетатом. Полученный органический слой сушат над безводным сульфатом натрия и затем выпаривают при пониженном давлении с получением 6 г указанного в заголовке соединения в виде желтого твердого вещества. Продукт используют в последующей реакции без дальнейшей очистки.
Получение 8. 5-(4-хлор-6-пропилпиримидин-2-иламино)-2-фторбензонитрил
<Шаг 1> 2-фтор-5-(6-оксо-4-пропил-1,6-дигидропиримидин-2-иламино)бензонитрил
Смесь 2-(метилтио)-6-пропилпиримидин-4(3Н)-она (8,8 г, 47,8 ммоль), полученного на шаге 1 Получения 1, и 5-амино-2-фторбензонитрила (7,9 г, 57,2 ммоль) перемешивают при температуре 160°C в течение ночи. Реакционную смесь охлаждают до температуры 70°C, а затем к ней добавляют этанол (50 мл). Реакционную смесь перемешивают в течение 1 часа и после фильтрования получают 10 г указанного в заголовке соединения в виде бледно-коричневого твердого вещества. Продукт используют в последующей реакции без дальнейшей очистки
<Шаг 2> 5-(4-хлор-6-пропилпиримидин-2-иламино)-2-фторбензонитрил
Указанное в заголовке соединение (10,8 г) в виде бледно-коричневого твердого вещества получают в соответствии с теми же процедурами, как на шаге 2 Получения 4, но используя 2-фтор-5-(6-оксо-4-пропил-1,6-дигидропиримидин-2-иламино)бензонитрил (10 г, 36,7 ммоль), полученный на шаге 1.
1H-ЯМР (400 МГц, CDCl3) δ 8.20-8,10 (м, 1Н), 7,75-7,65 (м, 1Н), 7,30-7,10 (м, 2Н), 6,72 (с, 1Н), 2,64 (т, 2Н), 1,77 (д, 2Н), 1,00 (т, 3Н)
Получение 9. 4-хлор-6-этил-N-(4-фторфенил)-пиримидин-2-амин
<Шаг 1> 6-этил-2-(4-фторфениламино)пиримидин-4-ол
Смесь этилпропионилацетата (1,03 мл, 7,18 ммоль), N-(4-фторфенил)гуанидина (1 г, 6,53 ммоль), метоксида натрия (0,39 г, 7,18 ммоль) и этанола (30 мл) кипятят с обратным холодильником при перемешивании в течение ночи. Реакционную смесь охлаждают до комнатной температуры и затем выпаривают при пониженном давлении. Полученный остаток растворяют в воде, подкисляют до pH 4, используя 1н раствор хлористоводородной кислоты, и затем фильтруют. Полученное белое твердое вещество (0,82 г) сушат в вакууме и затем используют в последующей реакции без дальнейшей очистки.
<Шаг 2> 4-хлор-6-этил-N-(4-фторфенил)-пиримидин-2-амин
6-этил-2-(4-фторфениламино)пиримидин-4-ол (0,82 г, 3,52 ммоль), полученный на шаге 1, прибавляют к оксихлориду фосфора (1,5 мл, 16,2 ммоль), полученную реакционную смесь затем перемешивают при температуре 110°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры ее выливают в ледяную воду и затем подщелачивают до pH 9, используя гидроксид калия. Водный слой экстрагируют дихлорметаном. Полученный органический слой сушат над безводным сульфатом натрия и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (этилацетат/н-гексан = 2/1), получая 432,2 мг указанного в заголовке соединения в виде белого твердого вещества.
1Н-ЯМР (400 МГц, CDCl3) δ 7,18 (м, 2Н), 7,08 (м, 2Н), 6,63 (с, 1Н), 2,61 (м, 2Н), 1,23 (т, 3Н)
Получение 10. 4-хлор-N-(4-фторфенил)-6-метилпиримидин-2-амин
<Шаг 1> 2-(4-фторфениламино)-6-метилпиримидин-4-ол
Указанное в заголовке соединение (8,2 г) получают в соответствии с теми же процедурами, как на шаге 1 Получения 9, но используя этилацетоацетат (10 г, 76,8 ммоль), N-(4-фторфенил) гуанидин (10,7 г, 69,8 ммоль) и натрия метоксид (4,2 г, 7,18 ммоль). Этот продукт использовали на следующем шаге без дальнейшей очистки.
<Шаг 2> 4-хлор-N-(4-фторфенил)-6-метилпиримидин-2-амин
Указанное в заголовке соединение (4,5 г) в виде твердого вещества белого цвета получают в соответствии с теми же процедурами, как на шаге 2 Получения 9, но используя 2-(4-фторфениламино)-6-метилпиримидин-4-ол (8,2 г, 37,4 ммоль), полученный на шаге 1, и оксихлорид фосфора (15,9 мл, 172,0 ммоль).
1Н-ЯМР (400 МГц, CDCl3) δ 7,57-7,54 (м, 2Н), 7,21 (ушир. с, 1H), 7,05-7,01 (м, 2Н), 6,64 (с, 1Н), 2,39 (с, 3Н)
Получение 11. 4-(2-хлор-6-пропилпиримидин-4-ил)морфолин
2,4-дихлор-6-пропилпиримидин (1 г, 5,23 ммоль), полученный на шаге 1 Получения 3, и морфолин (683 мг, 7,85 ммоль) растворяют в этаноле (30 мл). Реакционную смесь перемешивают при комнатной температуре в течение 4 часов и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 2/1), что дает 550 мг указанного в заголовке соединения.
1H-ЯМР (400 МГц, CD3OD) δ 6,22 (с, 1Н), 3,75 (д, 4Н), 3,55 (д, 4Н), 2,54 (дд, 1Н), 1,76-1,66 (м, 2Н), 0,99 (т, 3Н)
Получение 12. 3-(4-бутил-6-хлорпиримидин-2-иламино) бензонитрил
<Шаг 1> 6-бутил-2-(метилтио)пиримидин-4(3Н)-он
Раствор этил-3-оксогептаноата (10 г, 58,1 ммоль), сульфата 2-метил-2-тиопсевдомочевины (11,7 г, 63,9 ммоль) и карбоната натрия (9,8 г, 92,9 ммоль) в воде (116 мл) перемешивают при комнатной температуре в течение 2 дней и затем фильтруют. Полученное белое твердое вещество промывают водой и затем сушат в вакууме с получением указанного в заголовке соединения (11 г). Этот продукт используют на следующем шаге без дальнейшей очистки.
<Шаг 2> 3-(4-бутил-6-оксо-1,6-дигидропиримидин-2-иламино)бензонитрил
Раствор 6-бутил-2-(метилтио)пиримидин-4(3Н)-она (500 мг, 2,52 ммоль), полученного на шаге 1, и 3-аминобензонитрила (298 мг, 2,52 ммоль) в н-бутаноле (3 мл) перемешивают при температуре 170°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры, а затем очищают, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 50/1), что дает 310 мг указанного в заголовке соединения в виде коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 9,47 (ушир. с, 1Н), 8,27 (с, 1Н), 7,80 (д, 1Н), 7,37 (д, 1H), 5,88 (с, 1H), 2,58 (дд, 2Н), 1.74-1.70 (м, 2Н), 1,46-1,40 (м, 2Н), 0,98 (т, 3Н)
<Шаг 3> 3-(4-бутил-6-хлорпиримидин-2-иламино)бензонитрил
Указанное в заголовке соединение в виде бледно-желтого твердого вещества получают в соответствии с теми же процедурами, как на шаге 2 Получения 9, но используя 3-(4-бутил-6-оксо-1,6-дигидропиримидин-2-иламино)-бензонитрил, полученный на шаге 2, и оксихлорид фосфора.
1H-ЯМР (400 МГц, CDCl3) δ 8,19 (с, 1Н), 7,69 (д, 1Н), 7,42 (т, 1H), 7,33 (д, 1Н), 7,26 (ушир. с, 1Н), 6,72 (с, 1Н), 2,67 (т, 2Н), 1,80-1,65 (м, 2Н), 1,50-1,30 (м, 2Н), 0,97 (т, 3Н); (Выход: 80%)
Получение 13. 5-(4-бутил-6-хлорпиримидин-2-иламино)-2-метилбензонитрил
<Шаг 1> 5-(4-бутил-6-оксо-1,6-дигидропиримидин-2-иламино)-2-метилбензонитрил
Смесь 6-бутил-2-(метилтио)пиримидин-4(3Н)-она (800 мг, 4,03 ммоль), полученного на шаге 1 Получения 12, и 5-амино-2-метилбензонитрила (586 мг, 4,44 ммоль) перемешивают при температуре 170°C в течение 6 часов. Реакционную смесь охлаждают до комнатной температуры, а затем очищают, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 100/1), что дает 650 мг указанного в заголовке соединения в виде коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 9,45 (ушир. с, 1H), 8,10 (с, 1Н), 7,63 (д, 1Н), 7,25 (д, 1Н), 5,78 (с, 1Н), 2,55-2,48 (м, 5 Н), 1,70-1,65 (м, 2Н), 1,44-1,37 (м, 2Н), 0,98 (т, 3Н)
<Шаг 2> 5-(4-бутил-6-хлорпиримидин-2-иламино)-2-метилбензонитрил
Указанное в заголовке соединение в виде твердого вещества белого цвета получают в соответствии с теми же процедурами, как на шаге 2 примера Получения 9, но используя 5-(4-бутил-6-оксо-1,6-дигидропиримидин-2-иламино)-2-метилбензонитрил, полученный на шаге 1, и оксихлорид фосфора.
1Н-ЯМР (400 МГц, CDCl3) δ 8,08 (д, 1Н), 7,57 (дд, 1H), 7,25 (м, 2Н), 6,69 (с, 1H), 2,65 (дд, 2Н), 2,51 (с, 3Н), 1.75-1.68 (м, 2Н), 1.45-1.36 (м, 2Н), 0,96 (т, 3Н); (Выход: 85%)
Получение 14. 2-хлор-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин
Раствор 2,4-дихлор-6-пропилпиримидина (1 г, 5,23 ммоль), полученного на шаге 1 Получения 3, 2-этилпиперидина (888 мг, 7,85 ммоль), и диизопропилэтиламина (1,8 мл, 10,46 ммоль) в хлороформе (52 мл) перемешивают при температуре 60°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры, а затем экстрагируют дихлорметаном. Органический слой сушат над безводным сульфатом натрия и затем отфильтровывают. Фильтрат выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 10/1), что дает 700 мг указанного в заголовке соединения в виде белого твердого вещества.
Получение 15. (R)-трет-бутил 4-(2-хлор-6-пропилпиримидин-4-ил)-3-метилпиперазин-1-карбоксилат
Раствор 2,4-дихлор-6-пропилпиримидина (0,8 г, 4,19 ммоль), полученного на шаге 1 Получения 3, (R)-трет-бутил 3-метилпиперазин-1-карбоксилата (0,92 г, 4,61 ммоль) и диизопропилэтиламина (1,5 мл, 8,38 ммоль) в хлороформе (52 мл) перемешивают при температуре 60°C в течение ночи. Реакционную смесь выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 4/1), что дает 1,3 г указанного в заголовке соединения в виде бесцветной жидкости.
1H-ЯМР (400 МГц, CD3OD) δ 6,21 (с, 1Н), 4,47-3,90 (м, 4Н), 3,25-2,96 (м, 3Н), 2,54 (дд, 1Н), 1,75-1,66 (м, 2Н), (с, 9Н), 1,21 (д, ЗН), 0,96 (т, 3Н), 1,49
Получение 16. 2,5-диаминобензонитрил
Смесь 5-нитроантранилонитрила (200 мг, 1,23 ммоль) и палладированный уголь (10 мг, 10 мас.%) в метаноле (3 мл) перемешивают при комнатной температуре в атмосфере водорода в течение ночи и затем полученную реакционную смесь фильтруют через слой целита. Полученный фильтрат выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/2), что позволяет получить 160,3 мг указанного в заголовке соединения в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 6,79 (д, 1Н), 6,72 (с, 1H), 6,61 (д, 1Н), 4,01 (ушир. с, NH), 3,45 (ушир. с, NH)
Получение 17. (S)-2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанол
Раствор 2,4-дихлор-6-пропилпиримидина (300 мг, 1,57 ммоль), полученного на шаге 1 Получения 3, (S)-2-пиперидинэтанола гидрохлорида (286 мг, 1,73 ммоль) и триэтиламина (460 мкл, 3,30 ммоль) в N,N-диметилформамиде (7 мл) перемешивают при температуре 80°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры и затем выпаривают при пониженном давлении. Полученный остаток растворяют в этилацетате. Раствор промывают водой, сушат над безводным сульфатом натрия и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 2/5), что дает 251,7 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 6,29 (с, 1H), 4,91 (ушир. с, 1Н), 3,87 (ушир. с, 1Н), 3,62 (м, 1Н), 3,36 (м, 1Н), 3,01 (м, 1H), 2,52 (т, 2Н), 2,07 (м, 1H), 1,69 (м, 6Н), 1,51 (м, 1Н), 0,96 (т, 3Н)
Получение 18. (R)-2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанол
Указанное в заголовке соединение в виде бледно-желтого масла получают в соответствии с теми же процедурами, как в Получении 17, но используя 2,4-дихлор-6-пропилпиримидин, полученный на шаге 1 Получения 3, и (R)-2-пиперидинэтанола гидрохлорид.
1H-ЯМР (400 МГц, CDCl3) δ 6,28 (с, 1H), 4,92 (ушир. с, 1H), 3,86 (ушир. с, 1H), 3,62 (м, 1Н), 3,35 (м, 1H), 3,01 (м, 1Н), 2,52 (т, 2Н), 2,07 (м, 1H), 1,69 (м, 6Н), 1,51 (м, 1Н), 0,96 (т, 3Н); (выход: 32%)
Получение 19. 1-(2-хлор-6-пропилпиримидин-4-ил) декагидрохинолин
Указанное в заголовке соединение в виде бледно-желтого масла получают в соответствии с теми же процедурами, как в Получении 17, но используя 2,4-дихлор-6-пропилпиримидин из шага 1 Получения 3 и декагидрохинолин.
1H-ЯМР (400 МГц, CDCl3) δ 6,03 (с, 1Н), 4,46 (м, 1Н), 3,09 (м, 2Н), 2,53 (т, 2Н), 2,07 (д, 1Н), 1.86-1.65 (м, 9Н), 1.45-1.13 (м, 5Н), 0,97 (т, 3Н); (выход: 34%)
Получение 20. (S)-трет-бутил 1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-илкарбамат
2,4-Дихлор-6-пропилпиримидин (1,5 г, 7,85 ммоль), полученный на шаге 1 Получения 3, растворяют в этаноле (10 мл) и к полученному раствору добавляют (3S)-(-)-3-(трет-бутоксикарбониламино)пиперидин (3 г, 15,7 ммоль) при температуре 0°С. Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1), что дает 1,1 г указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400МГц, CDCl3) δ 6,29 (с, 1Н), 4,58 (ушир. с, 1Н), 3.78-3.41 (м, 6Н), 2,52 (т, 2Н), 1,98 (м, 1Н), 1,75 (ушир. с, 1H), 1,71 (м, 2Н), 1,60 (с, 9Н), 0,95 (т, 3Н); (выход: 75%)
Получение 21. 1-этил-1Н-индол-6-амин
<Шаг 1> 1-этил-6-нитро-1Н-индол
6-нитроиндол (200 мг, 1,23 ммоль) растворяют в безводном N,N-диметилформамиде (2 мл), а затем к полученному раствору добавляют 60 мас.% гидрида натрия (71 мг, 1,85 ммоль) и йодэтан (120 мкл, 1,48 ммоль) при температуре 0°C. Реакционную смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и после выпаривания остатка при пониженном давлении получают 210 мг указанного в заголовке соединения в виде бледно-желтого твердого вещества. Продукт используют в последующей реакции без дальнейшей очистки.
<Шаг 2> 1-этил-1Н-индол-6-амин
К 1-этил-6-нитро-1Н-индолу (210 мг, 1,1 ммоль), полученному на шаге 1, добавляют смесь метанол/вода (1:1; 5 мл). К полученной суспензии прибавляют железо (25 мг) и хлорид аммония (127 мг, 2,38 ммоль) и полученную реакционную смесь затем кипятят с обратным холодильником при перемешивании в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры к ней прибавляют водный раствор карбоната натрия и затем перемешивают в течение 30 минут. Реакционную смесь фильтруют через слой целита. Полученный фильтрат выпаривают при пониженном давлении, в результате чего получают 100 мг указанного в заголовке соединения в виде бледно-желтого масла. Продукт используют в последующей реакции без дальнейшей очистки.
Получение 22. 2,3-диметилбензофуран-5-амин
<Шаг 1> 3-(4-нитрофенокси)-бутан-2-он
Ацетон (16 мл) и 3-хлор-2-бутанон (1,75 мл, 17,3 ммоль) добавляют к смеси 4-нитрофенола (2 г, 14,4 ммоль), карбоната калия (6 г, 43,2 ммоль) и йодида калия (40 мг), полученную реакционную смесь затем кипятят с обратным холодильником при перемешивании в течение 10 часов. Реакционную смесь охлаждают до комнатной температуры и затем фильтруют через слой целита. Полученный фильтрат выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 10/1), что дает 2,1 г указанного в заголовке соединения в виде бледно-желтого масла.
<Шаг 2> 2,3-диметил-5-нитробензофуран
3-(4-нитрофенокси)-бутан-2-он (2,1 г, 0,01 моль), полученный на шаге 1, растворяют в толуоле (20 мл), а затем добавляют полифосфорную кислоту (50 г). Реакционную смесь перемешивают при температуре 100°C в течение 5 часов и затем охлаждают до комнатной температуры. Реакционную смесь разбавляют водой и затем экстрагируют диэтиловым эфиром. Органический слой сушат над безводным сульфатом натрия, фильтруют и фильтрат выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 5/1) в результате чего получают 1,8 г указанного в заголовке соединения в виде бледно-желтого масла.
<Шаг 3> 2,3-диметилбензофуран-5-амин
2,3-Диметил-5-нитробензофуран (1,8 г, 9,3 ммоль), полученный на шаге 2, растворяют в смешанном растворителе из метанола и тетрагидрофурана (1:1; 50 мл) и к полученной смеси добавляют палладированный уголь (1,5 г). Реакционную смесь перемешивают при комнатной температуре в атмосфере водорода (30 бар) в течение 3 часов и затем фильтруют через слой целита. Полученный фильтрат выпаривают при пониженном давлении с выходом 1,5 г указанного в заголовке соединения в виде бледно-желтого твердого вещества. Продукт используют в последующей реакции без дальнейшей очистки.
Получение 23. (R)-трет-бутил 1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил-(циклопропилметил)карбамат
<Шаг 1> (R)-1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-амин
Диизопропилэтиламин (9,1 мл, 52,2 ммоль) добавляют к раствору 2,4-дихлор-6-пропилпиримидина (3,31 г, 17,3 ммоль), полученного на шаге 1 Получения 3, и (R)-(-)-3-амино-пиперидина дигидрохлорида (3 г, 17,3 ммоль) в этаноле (90 мл), полученную смесь затем перемешивают при температуре 50°C в течение ночи. Реакционную смесь охлаждают до комнатной температуры и затем выпаривают при пониженном давлении. Продукт используют в последующей реакции без дальнейшей очистки.
<Шаг 2> (R)-1-(2-хлор-6-пропилпиримидин-4-ил)-N-(циклопропилметил)пиперидин-3-амин
Раствор (R)-1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-амина (510 мг, 2,01 ммоль), полученного на шаге 1, и циклопропан-карбоксальдегида (0,15 мл, 2,01 ммоль) в метаноле (10 мл) перемешивают при комнатной температуре в течение 1 часа и затем добавляют к нему триацетоксиборогидрид натрия (850 мг, 4,02 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем к ней добавляют насыщенный водный раствор бикарбоната натрия, чтобы прекратить реакцию. Реакционную смесь экстрагируют дихлорметаном. Органический слой промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия, фильтруют и затем выпаривают. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (этилацетат/метанол = 50/1), что дает 360 мг указанного в заголовке соединения в виде желтого масла.
1Н-ЯМР (400 МГц, CDCl3) δ 6,10 (с, 1Н), 4,24-3,92 (м, 2Н), 2,97 (т, 1H), 2,79 (т, 1H), 2,53 (м, 1Н), 2,41 (м, 4Н), 1,91 (м, 1H), 1,65 (м, 1Н), 1,57 (м, 2Н), 1.41-1.21 (м, 3Н), 0,83 (м, 4Н), 0,37 (д, 2Н), 0,00 (д, 2Н)
<Шаг 3> (R)-трет-бутил 1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил-(циклопропилметил)карбамат
Дитретбутилдикарбонат (307 мг, 1,41 ммоль) добавляют к раствору (R)-1-(2-хлор-6-пропилпиримидин-4-ил)-N-(циклопропилметил)пиперидин-3-амина (360 мг, 1,17 ммоль), полученного на шаге 2, и 4-диметиламинопиридина (29 мг, 0,24 ммоль) в дихлорметане (6 мл) при температуре 0°C. Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем добавляют дихлорметан. Реакционную смесь промывают 1н раствором хлористоводородной кислоты, сушат над безводным сульфатом магния и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (этилацетат/н-гексан = 1/3), что дает 218 мг указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CD3OD) δ 6,27 (с, 1H), 4,45-4,32 (ушир. с, 2Н), 3,42 (м, 2Н), 3,24-3,04 (м, 2Н), 2,81 (м, 1H), 2,53 (м, 2Н), 2,26 (м, 1H), 2,01 (м, 1H), 1,69 (м, 2Н), 1,55 (с, 9Н), 1,26 (м, 2Н), 1,07 (м, 1Н), 0,96 (т, 3Н), 0,61 (м, 2Н), 0,29 (м, 2Н)
Получение 24. (R)-N-[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил]ацетамид
<Шаг 1> 6-бутилпиримидин-2,4-диол
Смесь 6-бутил-2-(метилтио)пиримидин-4(3Н)-она (2,1 г, 10,6 ммоль), полученного на шаге 1 Получения 12, уксусной кислоты (15 мл) и воды (7 мл) кипятят с обратным холодильником при перемешивании в течение 2 дней. Реакционную смесь охлаждают до комнатной температуры и затем выпаривают при пониженном давлении. Полученный остаток сушат в вакууме с получением 1,7 г указанного в заголовке соединения в виде бледно-желтого твердого вещества.
1Н-ЯМР (400 МГц, ДМСО-d6) δ 10,87 (ушир. с, OH), 10,78 (ушир. с, OH), 5,31 (с, 1Н), 2,27 (м, 2Н), 1,50 (м, 2Н), 1,27 (м, 2Н), 0,88 (т, 3Н)
<Шаг 2> 4-бутил-2,6-дихлорпиримидин
Смесь 6-бутилпиримидина-2,4-диола (1,7 г, 10,2 ммоль), полученного на шаге 1, и оксихлорида фосфора (5 мл) кипятят с обратным холодильником при перемешивании в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры, выливают в воду со льдом, а затем подщелачивают до pH 8 бикарбонатом натрия. Водный слой экстрагируют этилацетатом. Полученный органический слой сушат над безводным сульфатом магния и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (этилацетат/н-гексан = 1/50), что дает 1,4 г указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ 7,16 (с, 1H), 2,75 (т, 2Н), 1,71 (м, 2Н), 1,40 (м, 2Н), 0,95 (т, 3Н)
<Шаг 3> (R)-1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-амин
Указанное в заголовке соединение в виде бледно-желтого масла получают в соответствии с теми же процедурами, как на шаге 1 Получения 23, но используя 4-бутил-2,6-дихлорпиримидин, полученный на шаге 2, и (R)-(-)-3-аминопиперидина дигидрохлорид. Продукт используют в последующей реакции без дальнейшей очистки.
<Шаг 4> (R)-N-[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил] ацетамид
Ацетилхлорид (0,36 мл, 5,1 ммоль) добавляют при температуре 0°C к раствору (R)-1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-амина (1,2 г, 4,6 ммоль), полученного на шаге 3, и триэтиламина (0,96 мл, 6,9 ммоль) в дихлорметане (30 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем к ней прибавляют дихлорметан. Реакционную смесь промывают водой, сушат над безводным сульфатом магния и выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (этилацетат/н-гексан = 5/1), что дает 0,8 г указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 6,31 (с, 1Н), 5,60 (ушир. с, NH), 3,98 (м, 1Н), 3,85-3,82 (м, 2Н), 3,54-3,42 (м, 2Н), 2,55 (т, 2Н), 1,98 (с, 3Н+1Н), 1,66-1,57 (м, 3Н+2Н), 1,36 (м, 2Н), 0,93 (т, 3Н)
Получение 25. (R)-N-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил]-2-гидроксиацетамид
Смесь (R)-1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-амина (1,33 г, 5,23 ммоль), полученного на шаге 1 Получения 23, гликолевой кислоты (0,44 г, 5,79 ммоль), гидрохлорида N-(3-диметиламинопропил)-N′-этилкарбодиимида (1,1 г, 5,79 ммоль), 1-гидроксибензотриазол гидрата (0,78 г, 5,79 ммоль), диизопропилэтиламина (1,8 мл, 10,3 ммоль) и дихлорметана (30 мл) перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь разбавляют дихлорметаном, промывают водой и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 20/1), что дает 0,6 г указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 6,57 (с, NH), 6,31 (с, 1Н), 4,11 (с, 2Н), 4,04 (м, 1Н), 3,90 (м, 2Н), 3,49 (м, 3Н), 2,53 (м, 2Н), 2,40 (м, 1Н), 2,00 (м, 1Н), 1,70-1,69 (м, 4Н), 0,95 (м, 3Н)
Получение 26. (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил) пиперидин-3-ил]карбамат
Дитретбутилдикарбонат (410 мг, 1,88 ммоль) добавляют при температуре 0°C к раствору (R)-1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-амина (400 мг, 1,57 ммоль), полученного на шаге 1 Получения 23, и триэтиламина (2,63 мл, 1,88 ммоль) в 1,4-диоксане (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (этилацетат/н-гексан = 1/3), что дает 440 мг указанного в заголовке соединения в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CD3OD) δ 6,29 (с, 1H), 4,60 (ушир. с, 1H), 3,90-3,30 (м, 4Н), 2,52 (т, 2Н), 2,00-1,90 (м, 1Н), 1,85-1,50 (м, 5Н), 1,45 (с, 9Н), 0,95 (т, 3Н)
Получение 27. (R)-трет-бутил[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил]карбамат
Дитретбутилдикарбонат (6,4 г, 29,3 ммоль) добавляют при комнатной температуре к раствору (R)-1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-амина (6,6 г; 24,4 ммоль), полученного на шаге 3 Получения 24, и триэтиламина (4,1 мл, 29,3 ммоль) в 1,4-диоксане (100 мл). Реакционную смесь перемешивают в течение ночи, а затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/6), что дает 7 г указанного в заголовке соединения в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 6,29 (с, 1H), 6,59 (м, 1Н), 4,12 (м, 2Н), 3,79 (м, 1Н), 3,68 (м, 1H), 3,56 (м, 1Н), 3,40 (м, 1H), 2,54 (м, 2Н), 1,98 (м, 1H), 1,74 (м, 1Н), 1,63 (м, 4Н), 1,45 (с, 9Н), 1,32 (м, 2Н), 0,93 (т, 3Н)
Получение 28. (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил](метил)карбамат
Гидрид натрия (114 мг, 2,96 ммоль, 60% масс) добавляют при температуре 0°C к раствору (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил)]карбамата (700 мг, 1,97 ммоль), полученного в Получении 26, в N,N-диметилформамиде (2 мл). Реакционную смесь перемешивают в течение 30 минут и затем прибавляют к ней йодэтан (184 мкл, 2,28 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем к ней добавляют воду. Реакционную смесь выпаривают при пониженном давлении. Полученный остаток растворяют в этилацетате. Раствор промывают водой, сушат над безводным сульфатом натрия и выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 5/1), что дает 550 мг указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 6,25 (с, 1Н), 4,31 (м, 2Н), 4,11 (м, 1Н), 2,90 (м, 1Н), 2,83 (с, 3Н), 2,74 (м, 1Н), 2,53 (м, 2Н), 1,94-1,89 (м, 2Н), 1,76 (м, 3Н), 1,48 (с, 9Н), 0,96 (т, 3Н)
Получение 29. (R)-трет-бутил[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил](метил)карбамат
Гидрид натрия (344 мг, 8,95 ммоль, 60 мас.%) добавляют при температуре 0°C к раствору (R)-трет-бутил[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил](метил)карбамата (2,2 г, 5,96 ммоль), полученного в Получении 27, в N,N-диметилформамиде (40 мл). Реакционную смесь перемешивают в течение 30 минут и затем прибавляют к ней йодметан (558 мкл, 8,95 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем к смеси добавляют воду. Реакционную смесь выпаривают при пониженном давлении. Полученный остаток растворяют в этилацетате. Раствор промывают водой, сушат над безводным сульфатом натрия и выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 5/1), что дает 2,1 г указанного в заголовке соединения в виде белого твердого вещества.
1Н-ЯМР (400 МГц, CDCl3) δ 6,25 (с, 1Н), 4,40-4,26 (м, 2Н), 3,84 (шир, 1Н), 2,93 (м, 1Н), 2,83 (с, 3Н), 2,71 (м, 1Н), 2,55 (м, 2Н), 1,91 (м, 2Н), 1,77 (м, 1H), 1,66 (м, 2Н), 1,49 (с, 9Н), 1,41 (м, 2Н), 0,95 (т, 3Н)
Получение 30. (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил](этил)карбамат
Гидрид натрия (114 мг, 2,96 ммоль, 60 мас.%) добавляют при температуре 0°C к раствору (R)-трет-бутил-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил)]карбамата (700 мг, 1,97 ммоль), полученного в Получении 26, в N,N-диметилформамиде (2 мл). Реакционную смесь перемешивают в течение 30 минут и к ней добавляют йодэтан (237 мкл, 2,28 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем к смеси добавляют воду. Реакционную смесь выпаривают при пониженном давлении. Полученный остаток растворяют в этилацетате. Раствор промывают водой, сушат над безводным сульфатом натрия и выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 5/1), что дает 510 мг указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 6,26 (с, 1H), 4,32 (м, 2Н), 3,64 (шир., 1Н), 3,22 (шир., 2Н), 3,00 (м, 1Н), 2,75 (м, 1Н), 2,59 (м, 2Н), 2,04 (м, 2Н), 1,75 (м, 2Н), 1,49 (с, 9Н), 1,20 (т, 3Н), 0,99 (т, 3Н)
Получение 31. (R)-N-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил]ацетамид
Ацетилхлорид (215 мкл, 3,02 ммоль) и триэтиламин (958 мкл, 6,88 ммоль) добавляют к раствору (R)-1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-амина (700 мг, 2,75 ммоль), полученного на шаге 1 Получения 23, в дихлорметане (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, а затем разбавляют дихлорметаном (5 мл). Добавляют воду к реакционной смеси. Отделенный органический слой сушат над безводным сульфатом магния, фильтруют и затем выпаривают при пониженном давлении. Полученный остаток очищают, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 5/1), что дает 550 мг указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400 МГц, CD3OD) δ 6,54 (с, 1Н), 4,06 (м, 2Н), 3,79 (шир., 1H), 3,31 (м, 1Н), 3,19 (м, 1Н), 2,51 (м, 2Н), 2,08 (м, 1Н), 1,98 (с, 3Н), 1,84 (м, 1H), 1,68 (м, 2Н), 1,60 (м, 2Н), 0,99 (т, 3Н)
Способ синтеза соединений (в том числе их солей) по настоящему изобретению описан в нижеследующих рабочих примерах. Кроме того, соединения, полученные в нижеследующих рабочих примерах, и данные спектра ЯМР, приведены в последующих Таблицах с 1-1 по 1-37.
Пример 1
Раствор 4-хлор-N-(4-фторфенил)-6-пропилпиримидин-2-амина (20 мг, 0,08 ммоль) из Получения 1 и пиперидина (30 мг, 0,35 ммоль) в изопропаноле (0,5 мл) перемешивали при температуре 100°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1) с получением 11,2 мг продукта в виде бледно-желтого твердого вещества.
Примеры 2-6
Продукты примеров 2-6 получали в соответствии с теми же процедурами, как в примере 1, но использовали 4-хлор-N-(4-фторфенил)-6-пропилпиримидин-2-амин из Получения 1 и морфолин, азепан, 2-метилпиперидин, 3-метилпиперидин или тиоморфолин.
Пример 7
Раствор 4-хлор-N-(4-фторфенил)-6-пропилпиримидин-2-амина (20 мг, 0,08 ммоль) из Получения 1 и 2,5-диметилпиперазина (30 мг, 0,26 ммоль) в изопропаноле (0,5 мл) перемешивали при температуре 100°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1) и затем растворяли в этилацетате (2 мл). Полученный раствор насыщали хлористым водородом, и после фильтрования получали 5,2 мг продукта в виде бледно-желтого твердого вещества.
Примеры 8-12
Продукты примеров 8-12 получали в соответствии с теми же процедурами, как в примере 7, но используя 4-хлор-N-(4-фторфенил)-6-пропилпиримидин-2-амин из Получения 1 и 1,2,3,6-тетрагидропиридин, декагидрохинолин, декагидроизохинолин, 4-фенилпиперидин или морфолин.
Примеры 13-19
Продукты примеров 13-19 получали в соответствии с теми же процедурами, как в примере 1, но используя 4-хлор-N-(4-фторфенил)-6-пропилпиримидин-2-амин из Получения 1 и пиперазин, 2-этилпиперидин, 2-пиперидинэтанол, этилпиперидин-2-карбоксилат, пиперидин-4-карбоксамид, 4-пиперидинметанол или пиперидон.
Примеры 20-23
Продукты примеров 20-23 получали в соответствии с теми же процедурами, как в примере 1, но используя 4-бутил-6-хлор-N-(4-фторфенил)-пиримидин-2-амин из Получения 2 и пиперидин, 2-этилпиперидин, 2-пиперидинэтанол или морфолин.
Пример 24
Раствор 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанола (20 мг, 0,07 ммоль) из Получения 3 и 4-хлор-3-нитроанилина (20 мг, 0,17 ммоль) в н-бутаноле (1 мл) кипятили с обратным холодильником при перемешивании в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 4/1), что дало 6,2 мг продукта в виде бледно-желтого твердого вещества.
Пример 25
Продукт в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как в примере 24, но используя 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанол из Получения 3 и 3-(метилтио) анилин.
Примеры 26-31
Продукты примеров 26-31 получали в соответствии с теми же процедурами, как в примере 1, но используя 4-хлор-N-(4-фторфенил)-6-пропилпиримидин-2-амин из Получения 1 и 2,6-диметилморфолин, 8-азабицикло[3.2.1]октан-3-ол, 3-ацетамидопиперидин, 1,3-ди-4-пиперидилпропан, 3-(бензилокси)пиперидин или 3-окса-8-азабицикло[3.2.1]октан.
Пример 32
Смесь 2-хлор-4-(пиперидин-1-ил)-6-пропилпиримидина (15 мг, 0,06 ммоль) из Получения 5 и 5-аминоиндола (20 мг, 0,15 ммоль) в н-бутаноле (1 мл) кипятили с обратным холодильником при перемешивании в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 50/1), в результате чего получали 5,3 мг продукта в виде бледно-желтого твердого вещества.
Примеры 33-47
Продукты примеров с 33 по 47 получали в соответствии с теми же процедурами, как в примере 32, за исключением того, что использовали 2-хлор-4-(пиперидин-1-ил)-6-пропилпиримидин из Получения 5 и 3-хлор-4-метиланилин, 6-аминохинолин, 3-(трифторметил)анилин, 2-(трифторметил)-1Н-бензо[d]имидазол-5-амин, 3-(метилтио)анилин, 5-метокси-2-метиланилин, 5-хлор-2-метил анилин, 4-фтор-3-нитроанилин, 4-метоксианилин, 3-метоксианилин, 3-хлоранилин, 3-нитроанилин, 4-хлор-3-нитроанилин, 3-аминобензонитрил или 4-метил-3-нитроанилин.
Пример 48
Раствор 4-хлор-N-(4-фторфенил)-6-метилпиримидин-2-амина (30 мг, 0,13 ммоль) из Получения 10, 1-этилпиперазина (28,8 мг, 0,25 ммоль) и диизопропилэтиламина (65,7 мкл, 0,38 ммоль) в тетрагидрофуране (1 мл) перемешивали при температуре 75°C в течение 6 часов. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 50/1) с получением 50,1 мг продукта в виде белого твердого вещества.
Примеры с 49 по 60
Продукты примеров с 49 по 60 получали в соответствии с теми же процедурами, как в примере 48, но используя 4-хлор-N-(4-фторфенил)-6-метилпиримидин-2-амин из Получения 10 и 1-(4-метоксифенил)пиперазин, 1-(4-фторфенил)пиперазин, морфолин, гидрохлорид 4-пиперидона, пиперидин, гидрохлорид азетидина, гидрохлорид 3-гидроксипиперидина, 4-гидроксипиперидин, 2-метилпиперидин, 3-метилпиперидин, цис-3,5-диметилпиперидин или гексаметиленимин.
Пример 61
Смесь 4-хлор-N-(4-фторфенил)-6-метилпиримидин-2-амина (30 мг, 0,13 ммоль) из Получения 10, 2-этилпиперидин (28,5 мг, 0,25 ммоль) и диизопропилэтиламин (65,7 мкл, 0,38 ммоль) в изопропаноле (1 мл) подвергали взаимодействию в микроволновом реакторе (300 Вт) в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 4/1), что дало 30,1 мг продукта в виде бесцветной жидкости.
Примеры 62-72
Продукты примеров от 62-72 получали в соответствии с теми же процедурами, как в примере 61, но используя 4-хлор-N-(4-фторфенил)-6-метилпиримидин-2-амин из Получения 10 и цис-2,6-диметилпиперидин, 4-фенилпиперидин, пиперазина гидрат, 1-метил-пиперазин, 2,5-диметилпиперазин, 2,6-диметилпиперазин, декагидрохинолин, декагидроизохинолин, 1,2,3,6-тетрагидропиридин, 2-пиперидинэтанол или 2-пиперидинметанол.
Примеры 73 и 74
Продукты примеров 73 и 74 получали получали в соответствии с теми же процедурами, как в примере 61, но используя N-(4-хлор-6-пропилпиримидин-2-ил)-1Н-индол-6-амин из Получения 6 и декагидрохинолин или 2-пиперидинэтанол.
Пример 75
2-{1-[2-(1Н-индол-6-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанол (20 мг, 0,05 ммоль), полученный в примере 74, растворяли в этилацетате (1 мл) и в полученный раствор затем вводили хлористый водород. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем фильтровали с получением 8 мг продукта в виде белого твердого вещества.
Примеры 76-78
Продукты примеров 76-78 получали в соответствии с теми же процедурами, как в примере 61, но используя N-(4-хлор-6-пропилпиримидин-2-ил)-1Н-индол-6-амин из Получения 6 и пиперидин, морфолин или 2-этилпиперидин.
Пример 79
Раствор 4-(2-хлор-6-пропилпиримидин-4-ил)морфолина (550 мг, 2,28 ммоль) из Получения 11 и 6-аминоиндола (300 мг, 2,28 ммоль) в н-бутаноле (2,3 мл) кипятили обратным холодильником при перемешивании в течение 1 часа и затем охлаждали до комнатной температуры. К реакционной смеси добавляли этилацетат. Полученный осадок собирали фильтрованием и затем промывали этилацетатом, что дало 760 мг продукта в виде белого твердого вещества.
Примеры 80 и 81
Продукты примеров 80 и 81 получали в соответствии с теми же процедурами, как в примере 61, но используя 3-(4-хлор-6-пропилпиримидин-2-иламино)бензонитрил из Получения 4 и (R)-3-этилморфолин или (R)-трет-бутил 3-метилпиперазин-1-карбоксилат.
Пример 82
Газообразный хлористый водород вводили при 0°C в течение 1 минуты в раствор (R)-трет-бутил 4-[2-(3-цианофениламино)-6-пропилпиримидин-4-ил]-3-метилпиперазин-1-карбоксилата (20 мг, 0,05 ммоль), полученного в примере 81, в этилацетате (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и затем фильтровали с получением 19,3 мг продукта в виде белого твердого вещества.
Пример 83
Раствор 4-(2-хлор-6-пропилпиримидин-4-ил)морфолина (20 мг, 0,08 ммоль) из Получения 11 и 3-нитроанилина (12,6 мг, 0,09 ммоль) в н-бутаноле (0,5 мл) подвергали взаимодействию в микроволновом реакторе (450 Вт) в течение 40 минут. Реакционную смесь охлаждали до комнатной температуры. Полученный осадок собирали фильтрованием и затем промывали этилацетатом с получением 22,1 мг продукта в виде желтого твердого вещества.
Примеры 84-94
Продукты примеров от 84-94 получали в соответствии с теми же процедурами, как в примере 79, но используя 4-(2-хлор-6-пропилпиримидин-4-ил)морфолин из Получения 11 и 4-фтор-3-нитроанилин, 4-хлор-3-нитроанилин, 3-метоксианилин, 4-метоксианилин, 3-(метилтио)анилин, 3-хлоранилин, 2-хлор-4-аминотолуол, 3-(трифторметил)анилин, 5-аминоиндол, 5-амино-2-(трифторметил)бензимидазол или 6-аминохинолин.
Пример 95
Раствор 4-(2-хлор-6-пропилпиримидин-4-ил)морфолина (20 мг, 0,08 ммоль) из Получения 11 и 3-аминобензонитрила (12,6 мг, 0,09 ммоль) в н-бутаноле (0,5 мл) подвергали взаимодействию микроволновом реакторе (450 Вт) в течение 40 минут. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 50/1), что дало 20,1 мг продукта в виде белого твердого вещества.
Пример 96
Смесь 4-(2-хлор-6-пропилпиримидин-4-ил)морфолина (25 мг, 0,1 ммоль), полученного в Получении 11, 5-метокси-2-метиланилина (14,1 мг, 0,103 ммоль), ацетата палладия (1,2 мг, 0,005 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (3 мг, 0,005 ммоль), карбоната цезия (67,0 мг, 0,21 ммоль) и 1,4-диоксана (0,5 мл) подвергали взаимодействию микроволновом реакторе (600 Вт) в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем добавляли воду. Реакционную смесь экстрагировали дихлорметаном. Полученный органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 50/1), что дало 19 мг продукта в виде белого твердого вещества.
Примеры 97 и 98
Продукты примеров 97 и 98 получали в соответствии с теми же процедурами, как в примере 96, но используя 4-(2-хлор-6-пропилпиримидин-4-ил)морфолин из Получения 11 и 5-хлор-2-метиланилин или 3-аминохинолин.
Примеры 99-111
Продукты примеров 99-111 получали в соответствии с теми же процедурами, как в примере 95, но используя 2-хлор-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин из Получения 14 и 3-нитроанилин, 4-фтор-3-нитроанилин, 4-хлор-3-нитроанилин, 3-анизидин, 4-анизидин, 3-(метилтио)анилин, 3-хлоранилин, 2-хлор-4-аминотолуол, 3-(трифторметил)анилин, 5-аминоиндол, 5-амино-2-(трифторметил)бензимидазол, 6-аминохинолин или 3-аминобензонитрил.
Примеры 112-114
Продукты примеров 112-114 получали в соответствии с теми же процедурами, как в примере 96, но используя 2-хлор-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин из Получения 14 и 5-метокси-2-метиланилин, 5-хлор-2-метиланилин или 3-аминохинолин.
Пример 115
N-(4-хлор-3-нитрофенил)-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-амин (20 мг, 0,05 ммоль), полученный в примере 101, растворяли в этилацетате (1 мл) и в полученный раствор вводили газообразный хлористый водород. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем фильтровали с получением 15,5 мг продукта в виде белого твердого вещества.
Пример 116
Продукт в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 115, но используя 3-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрил, полученный в примере 111.
Примеры 117-130
Продукты примеров 117-130 получали в соответствии с теми же процедурами, как в примере 95, но используя (R)-трет-бутил 4-(2-хлор-6-пропилпиримидин-4-ил)-3-метилпиперазин-1-карбоксилат из Получения 15 и 4-хлор-3-нитроанилин, 6-аминоиндол, 3-(трифторметил)анилин, 3-нитроанилин, 4-фтор-3-нитроанилин, 4-метил-3-нитроанилин, 4-фторбензола-1,3-диамин, 2-(трифторметил)бензол-1,4-диамин, 5-амино-2-фторбензонитрил, 5-амино-2-метилбензонитрил, 2,5-диаминобензонитрил, 2-нитробензол-1,4-диамин, 3,5-диаминобензонитрил или 3-аминобензамид.
Пример 131
Смесь 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанола (35 мг, 0,12 ммоль) из Получения 3, 3-аминобензонитрила (18 мг, 0,15 ммоль) и н-бутанола (1 мл) кипятили с обратным холодильником при перемешивании в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 20/1), что позволило выделить 43,7 мг продукта в виде бледно-желтого твердого вещества.
Пример 132
<Шаг 1> 2-{1-[2-(4-хлор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанол
Указанное в заголовке соединение (150 мг) в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 131, но используя 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанол из Получения 3 и 4-хлор-3-нитроанилин.
<Шаг 2> 2-{1-[2-(4-хлор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанол
Указанное в заголовке соединение в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 115, но используя 2-{1-[2-(4-хлор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанол, полученный на шаге 1.
Пример 133
Продукт в виде бледно-желтого твердого получали в соответствии с теми же процедурами, как в примере 132, но используя 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанол и 3-(метилтио)анилин из Получения 3.
Примеры 134-147
Продукты примеров 134-147 получали в соответствии с теми же процедурами, как в примере 131, но используя 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанол из Получения 3 и 1-этил-1Н-индол-6-амин из Получения 21, 5-аминоиндол, 5-амино-2-(трифторметил)бензимидазол, 4-метоксианилин, 3-метоксианилин, 5-метокси-2-метил анилин, 4-амино-2-хлортолуол, 3-нитроанилин, 4-фтор-3-нитроанилин, 2,3-диметилбензофуран-5-амин из Получения 22, 6-аминохинолин, 3-хлоранилин, 7-амино-4-метил-2Н-хромен-2-он или 3-(трифторметил)анилин.
Пример 148
3-Аминохинолин (22 мг, 0,15 ммоль) добавляли к смеси 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанола (35 мг, 0,12 ммоль) из Получения 3, ацетат палладия (0,5 мг, 2 моль %), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (2,1 мг, 3 моль %), карбоната цезия (78 мг, 0,24 ммоль) и безводного 1,4-диоксана (1 мл). Реакционную смесь перемешивали в микроволновом реакторе (600 Вт) в течение 1 часа и затем охлаждали до комнатной температуры. Реакционную смесь суспендировали в дихлорметане, а затем фильтровали через слой целита. Полученный фильтрат выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 20/1), что дало 45,5 мг продукта в виде бледно-желтого твердого вещества.
Пример 149
Продукт в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 115, но используя 3-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрил, полученный в примере 131.
Примеры 150-152
Продукты примеров 150-152 получали в соответствии с теми же процедурами, как в примере 132, но используя (S)-трет-бутил 1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-илкарбамат из Получения 20 и 5-амино-2-метилбензонитрил, 3-нитроанилин или 3-аминобензонитрил.
Пример 153
(R)-(-)-3-аминопиперидина дигидрохлорид (18 мг, 0,1 ммоль), бикарбонат натрия (42 мг, 0,5 ммоль) и молекулярное сито (1 г) добавляли к раствору 5-(4-хлор-6-пропилпиримидин-2-иламино)-2-метилбензонитрила (30 мг, 0,1 ммоль) из Получения 7 в этаноле. Реакционную смесь перемешивали при температуре 130°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем фильтровали для отделения нерастворимых веществ. Фильтрат выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (метанол/дихлорметан = 1/10), что дало 19,2 мг продукта в виде бледно-желтого твердого вещества.
Пример 154
<Шаг 1> (S)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиридин-2-иламино]-2-метилбензонитрил
Указанное в заголовке соединение в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 153, но используя 5-(4-хлор-6-пропилпиримидин-2-иламино)-2-метилбензонитрил из Получения 7 и (S)-(-)-3-аминопиперидин.
<Шаг 2> (S)-5-{4-[3-(бутиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрил
Бутиральдегид (6,5 мг, 0,09 ммоль) добавляли к раствору (S)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиридин-2-иламино]-2-метилбензонитрила (24,5 мг, 0,07 ммоль), полученного на шаге 1, в метаноле (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут и затем добавляли цианоборогидрид натрия (6,84 мг, 0,11 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и затем добавляли к ней 1н раствор хлористоводородной кислоты. Реакционную смесь перемешивали в течение 30 минут, нейтрализовывали 1н раствором гидроксида натрия и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния, фильтровали и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (этилацетат/метанол = 20/1) с получением 10,2 мг продукта в виде бледно-желтого твердого вещества.
Примеры 155-164
Продукты примеров 155-164 получали в соответствии с теми же процедурами, как на шаге 2 примера 154, но используя (S)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиридин-2-иламино]-2-метилбензонитрил, полученный на шаге 1 примера 154, и пентаналь, изобутилальдегид, 3-метилбутаналь, пивальдегид, пиррол-2-карбоксальдегид, 2-тиофенкарбоксальдегид, 4,5-диметил-2-фурфурол, 3-(метилтио)пропиональдегид, циклопропанкарбоксальдегид или 4-гидроксибензальдегид.
Примеры 165 и 166
Продукты примеров 165 и 166 в виде бледно-желтого твердого получали в соответствии с теми же процедурами, как на шаге 2 примера 154, но используя (S)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиридин-2-иламино]-2-метилбензонитрил, полученный на шаге 1 примера 154, и ацетальдегид или циклопропан-карбоксальдегид.
Пример 167
Продукт в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как на шаге 2 примера 154, но используя (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиридин-2-иламино]-2-метилбензонитрил, полученный в примере 153, и циклопропана карбоксальдегид.
Пример 168
Раствор 4-хлор-6-этил-N-(4-фторфенил)пиримидин-2-амина (20 мг, 0,08 ммоль) из Получения 9 и пиперидина (9,4 мкл, 0,10 ммоль) в изопропаноле (0,5 мл) перемешивали при 100°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 40/1), что дало 6,2 мг продукта в виде бледно-желтого масла.
Примеры 169-172
Продукты примеров 169-172 получали в соответствии с теми же процедурами, как в примере 168, но используя 4-хлор-6-этил-N-(4-фторфенил)пиримидин-2-амин из Получения 9 и декагидрохинолин, 2-этилпиперидин, 2-пиперидинэтанол или морфолин.
Пример 173
Продукт получали в соответствии с теми же процедурами, как в примере 115, но используя N-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-ил]-1Н-индол-6-амин, полученный в примере 76.
Примеры 174-179
Продукты примеров 174-179 получали в соответствии с теми же процедурами, как в примере 131, но используя 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанол из Получения 3 и 4-метил-3-нитроанилин, 2-(трифторметил)-1,4-фенилендиамин, 2-нитро-1,4-фенилендиамин, 5-амино-2-метилбензонитрил, 5-амино-2-фторбензонитрил или 2,5-диаминобензонитрил из Получения 16.
Пример 180
Смесь 2-{1-[2-(4-метил-3-нитрофениламино)-6-пропилпиримидин-4-ил] пиперидин-2-ил}этанола (17 мг, 0,04 ммоль), полученного в примере 174, палладированного угля (10 мг, 10 мас.%) и метанола (2 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали через слой целита. Фильтрат выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 70/1), что дало 4,2 мг продукта в виде бледно-желтого твердого вещества.
Пример 181
Продукт в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как в примере 180, но используя 2-{1-[2-(4-фтор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанол, полученный в примере 142.
Пример 182
Продукт в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как в примере 180, но используя 2-{1-[2-(4-хлор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанол, полученный в примере 24.
Пример 183
<Шаг 1> 1-(6-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}индолин-1-ил)этанон
Указанное в заголовке соединение в виде бледно-желтого масла получали в соответствии с теми же процедурами, как в примере 131, но используя 2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил] этанол из Получения 3 и 1-ацетил-6-аминоиндолин. Этот продукт использовали на следующем шаге без дальнейшей очистки. (Выход: 77%).
<Шаг 2> 2-{1-[2-(индолин-6-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанол
Смесь 1-(6-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}индолин-1-ил)этанона (35,8 мг, 0,12 ммоль), полученного на шаге 1, и 10% раствор соляной кислоты (1,5 мл) кипятили с обратным холодильником при перемешивании в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, доводя pH до 5 2н раствором гидроксида натрия, и затем экстрагировали дихлорметаном. Полученный органический слой сушили над безводным сульфатом натрия и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 30/1), что позволило выделить 11,4 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
Примеры 184 и 185
Продукты примеров 184 и 185 получали в соответствии с теми же процедурами, как в примере 131, но используя (S)-2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил] этанол из Получения 17 и 4-хлор-3-нитроанилин или 2-нитро-1,4-фенилендиамин.
Пример 186
Продукт в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как в примере 131, но используя (R)-2-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-2-ил]этанол из Получения 18 и 2-нитро-1,4-фенилендиамин.
Пример 187
Раствор 1-(2-хлор-6-пропилпиримидин-4-ил)декагидрохинолина (25,6 мг, 0,09 ммоль) из Получения 19 и 3-аминобензонитрила (12,3 мг, 0,10 ммоль) в н-бутаноле (1 мл) перемешивали при 120°C в течение ночи. Реакционную смесь выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 70/1), что дало 10,8 мг продукта в виде бледно-желтого масла.
Примеры 188-202
Продукты примеров 188-202 получали в соответствии с теми же процедурами, как в примере 187, но используя 1-(2-хлор-6-пропилпиримидин-4-ил)декагидрохинолин из Получения 19 и 3-нитроанилин, 4-фтор-3-нитроанилин, 4-хлор-3-нитроанилин, 3-метокси-анилин, 5-метокси-2-метиланилин, 4-метоксианилин, 3-(трифторметил)анилин, 3-хлоранилин, 5-хлор-2-метиланилин, 2-хлор-4-аминотолуол, 3-(метилтио)анилин, 5-аминоиндол, 5-амино-2-(трифторметил)бензимидазол, 6-аминохинолин или 7-амино-4-метил-2Н-хромен-2-он.
Пример 203
Смесь 1-(2-хлор-6-пропилпиримидин-4-ил)декагидрохинолина (25 мг, 0,09 ммоль) из Получения 19, ацетата палладия (0,38 мг, 0,002 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (1,48 мг, 0,003 ммоль), карбоната цезия (55 мг, 0,17 ммоль), 3-аминохинолина (12,3 мг, 0,09 ммоль) и 1,4-диоксана (0,4 мл) перемешивали в микроволновом реакторе (600 Вт) в течение 2 часов. Реакционную смесь выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 30/1) с получением 2 мг продукта в виде белого твердого вещества.
Пример 204
Продукт в виде бледно-красного твердого вещества получали в соответствии с теми же процедурами, как в примере 115, но используя N-[4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-ил]-1Н-индол-6-амин, полученный в примере 73.
Примеры 205-219
Продукты примеров 205-219 получали в соответствии с теми же процедурами, как на шаге 2 примера 154, но используя (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрил, полученный в примере 153, и ацетальдегид, пропиональдегид, бутиральдегид, валеральдегид, изобутиральдегид, изовалеральдегид, пивальдегид, ацетон, пиррол-2-карбоксальдегид, 2-тиофенкарбоксальдегид, 4,5-диметил-2-фурфурол, 3-(метилтио)пропиональдегида, циклопропан-карбоксальдегид, циклопентанкарбоксальдегид или 4-гидроксибензальдегид.
Пример 220
Ацетилхлорид (31 мкл, 0,44 ммоль) и триэтиламин (100 мкл, 0,73 ммоль) добавляли к раствору (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила (100 мг, 0,29 ммоль), полученного в примере 153, в дихлорметане (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, а затем разбавляли дихлорметаном (5 мл). К реакционной смеси добавляли воду. Отделенный органический слой сушили над безводным сульфатом магния, фильтровали и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1) и затем растворяли в этилацетате (2 мл). Полученный раствор насыщали газообразным хлористым водородом, а затем фильтровали с получением 56 мг продукта в виде белого твердого вещества.
Пример 221
(R)-(-)-3-амино-пиперидина дигидрохлорид (190 мг, 1,10 ммоль), бикарбонат натрия (461,1 мг, 5,50 ммоль) и молекулярное сито (1 г) добавляли к раствору 3-(4-хлор-6-пропилпиримидин-2-иламино) бензонитрила (299,4 мг, 1,10 ммоль), полученного в Получении 4, в этаноле (5,5 мл). Реакционную смесь перемешивали при 130°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем фильтровали с отделением нерастворимых веществ. Фильтрат выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (метанол/дихлорметан = 1/10) с получением 334 мг продукта в виде бледно-желтого масла. Продукт (84 мг) растворяли в этил ацетате (2 мл). Полученный раствор насыщали газообразным хлористым водородом, а затем фильтровали с получением 90,7 мг продукта в виде белого твердого вещества.
Пример 222
Продукт в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 221, но используя 5-(4-хлор-6-пропилпиримидин-2-иламино)-2-фторбензонитрил из Получения 8 и (R)-(-)-3-аминопиперидина дигидрохлорид.
Пример 223
(R)-3-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрил (120 мг, 0,36 ммоль) [полученного путем обработки (R)-3-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила дигидрохлорида, полученного в примере 221, насыщенным водным раствором бикарбоната натрия] растворяли в метаноле (5 мл). Пропиональдегид (25,6 мкл, 0,36 ммоль) добавляли к полученному раствору, который затем перемешивали при комнатной температуре в течение 1 часа. Добавляли цианоборогидрид натрия (151 мг, 0,72 ммоль) к реакционной смеси, которую затем перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 1н раствор хлористоводородной кислоты, и затем перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь обрабатывали 1н раствором гидроксида натрия и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния, фильтровали и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (этилацетат/метанол = 10/1) с получением 13,6 мг продукта в виде бесцветного масла.
Пример 224
Продукт в виде бесцветного масла получали в соответствии с теми же процедурами, как в примере 223, но используя циклопропан-карбоксальдегид и (R)-3-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрил [полученный путем обработки (R)-3-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила дигидрохлорида, полученного в примере 221, насыщенным водным раствором бикарбоната натрия]. Полученный продукт растворяли в этилацетате (2 мл). Раствор насыщали газообразным хлористым водородом, а затем фильтровали с получением продукта в виде белого твердого вещества.
Пример 225
Продукт в виде бесцветного масла получали в соответствии с теми же процедурами, как в примере 223, используя пропиональдегид и (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрил [полученный путем обработки (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила дигидрохлорида, полученного в примере 222, насыщенным водным раствором бикарбоната натрия].
Пример 226
Продукт в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 224, но используя циклопропан-карбоксальдегид и (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрил [полученный путем обработки (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила дигидрохлорида, полученного в примере 222, насыщенным водным раствором раствор бикарбоната натрия].
Пример 227
Раствор (R)-трет-бутил 1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил(циклопропилметил)карбамата (36,4 мг, 0,09 ммоль) из Получения 23 и 4-фторбензол-1,3-диамина (13,5 мг, 0,11 ммоль) в н-бутаноле (0,5 мл) перемешивали при 120°C в течение 2 дней. Реакционную смесь выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 10/1), давая 9,9 мг продукта в виде бледно-желтого масла.
Примеры 228-231
Продукты примеров 228-231 получали в соответствии с теми же процедурами, как в примере 227, но используя (R)-трет-бутил 1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил(циклопропилэтил)карбамат из Получения 23 и 2-нитробензол-1,4-диамин, 3,5-диаминобензонитрил, 2-(трифторметил)бензол-1,4-диамин или 5-(трифторметил)бензол-1,3-диамин.
Пример 232
Раствор (R)-N-[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил]ацетамида (165 мг, 0,53 ммоль) из Получения 24 и 2-нитро-1,4-фенилендиамина (90 мг, 0,58 ммоль) в н-бутаноле (2 мл) перемешивали при 130°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и затем к ней добавляли дихлорметан (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем фильтровали. Полученное твердое вещество сушили в вакууме с получением 120 мг продукта в виде бледно-желтого твердого вещества.
Примеры 233-243
Продукты примеров 233-243 получали в соответствии с теми же процедурами, как в примере 232, но используя (R)-N-[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил]ацетамид из Получения 24 и 4-метил-3-нитроанилин, 4-фтор-3-нитроанилин, 4-хлор-3-нитроанилин, 3,5-диаминобензонитрил, 5-(трифторметил)бензол-1,3-диамин, 2-(трифторметил)бензол-1,4-диамин, 4-фтор-3-трифторметилфениламин, 5-амино-2-фторбензонитрил, 4-фтор-1,3-фенилендиамин, 4-хлор-1,3-фенилендиамин или 2,5-диаминобензонитрил из Получения 16.
Пример 244
Смесь (R)-N-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил]-2-гидроксиацетамида (22 мг, 0,07 ммоль) из Получения 25 и 5-амино-2-метилбензонитрила (10,6 мг, 0,08 ммоль) в н-бутаноле (0,5 мл) перемешивали в микроволновом реакторе (600 Вт) в течение 1 часа. Реакционную смесь выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 20/1) с получением 7,5 мг продукта в виде желтого масла.
Примеры 245-254
Продукты примеров 245-254 получали в соответствии с теми же процедурами, как в примере 244, но используя (R)-N-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил]-2-гидроксиацетамид из Получения 25 и 3-аминобензонитрил, 5-амино-2-фторбензонитрил, 5-(трифторметил)бензол-1,3-диамин, 2-(трифторметил)бензол-1,4-диамин, 4-фтор-3-трифторметилфениламин, 4-фтор-1,3-фенилендиамин, 4-хлор-1,3-фенилендиамин, 2,4-диаминотолуол, 2-хлор-4-аминотолуол или 4-метил-3-(трифторметил)анилин.
Пример 255
Смесь (R)-N-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил]-2-гидроксиацетамида (20 мг, 0,06 ммоль из Получения 25 и 3,5-диаминобензонитрила (10,2 мг, 0,08 ммоль) в н-бутаноле (0,5 мл) перемешивали в микроволновом реакторе (600 Вт) в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и затем к ней добавляли этилацетат (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем фильтровали. Полученное твердое вещество сушили в вакууме с получением 3,9 мг продукта в виде бледно-желтого твердого вещества.
Пример 256
Раствор (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил]карбамата (82 мг, 0,23 ммоль) из Получения 26 и 5-(трифторметил)бензол-1,3-диамина (44 мг, 0,25 ммоль) в н-бутаноле (1 мл) перемешивали при температуре 130°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 20/1) и затем растворяли в смеси этилацетат/метанол (1 мл/1 мл). Полученный раствор насыщали газообразным хлористым водородом, а затем фильтровали с получением 55,5 мг продукта в виде белого твердого вещества.
Примеры 257-266
Продукты примеров 257-266 получали в соответствии с теми же процедурами, как в примере 256, но используя (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил]карбамат из Получения 26 и 2-(трифторметил)бензол-1,4-диамин, 3-фтор-4-метиланилин, 4-фтор-1,3-фенилендиамин, 3,5-диаминобензонитрил, 2,5-диаминобензонитрил из Получения 16, 4-хлор-1,3-фенилендиамин, 4-метил-3-(трифторметил)анилин, 6-аминоиндол, 4-метил-3-нитроанилин или 2-нитробензол-1,4-диамин.
Пример 267
(R)-5-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрил (20 мг, 0,05 ммоль), полученный в примере 217, растворяли в этилацетате (1 мл), а затем к полученному раствору добавляли газообразный хлористый водород. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем фильтровали с получением 14 мг продукта в виде белого твердого вещества.
Пример 268
Продукт в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 220, но используя (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила дигидрохлорид, полученный в примере 222.
Продукт в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как на шаге 2 примера 154, используя (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрил, полученный в примере 153, и ацетальдегид.
Пример 270
Реакцию проводили в соответствии с теми же процедурами, как на шаге 2 примера 154, но используя (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила дигидрохлорид, полученный в примере 222, и ацетальдегид. Полученный промежуточный продукт обрабатывали газообразным хлористым водородом с получением продукта в виде белого твердого вещества.
Пример 271
Продукт в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как на шаге 2 примера 154, но используя (R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила дигидрохлорид, полученный в примере 222, и ацетальдегид.
Пример 272
<Шаг 1> (R)-3-{[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]амино}бензонитрил
Указанное в заголовке соединение в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 153, но используя 3-(4-бутил-6-хлорпиримидин-2-иламино)бензонитрил из Получения 12.
<Шаг 2> (R)-N-{1-[6-бутил-2-(3-цианофениламино)пиримидин-4-ил]пиперидин-3-ил}-ацетамида гидрохлорид
Указанное в заголовке соединение в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 220, но используя (R)-3-{[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]амино}бензонитрил, полученный на шаге 1.
Пример 273
Смесь (R)-N-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил]ацетамида (60 мг, 0,2 ммоль) из Получения 31 и 3-аминобензонитрила (28 мг, 0,24 ммоль) в н-бутаноле (1 мл) кипятили с обратным холодильником при перемешивании в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1) и затем растворяли в этилацетате. Добавляли газообразный хлористый водород и полученный осадок собирали фильтрованием с получением 68,8 мг продукта в виде бледно-желтого твердого вещества.
Примеры 274-279
Продукты примеров 274-279 получали в соответствии с теми же процедурами, как в примере 273, но используя (R)-N-[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил]ацетамид из Получения 31 и 3,5-диаминобензонитрил, 2-нитро-1,4-фенилендиамин, 4-фтор-1,3-диаминобензол, 5-амино-2-фторбензотрифторид, 5-(трифторметил)-1,3-фенилендиамин или 2-(трифторметил)-1,4-фенилендиамин.
Продукт 280
Продукт в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 267, но используя (R)-5-{4-[3-(этиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрил, полученный в примере 205.
Пример 281
Продукт в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как в примере 267, но используя (R)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрил, полученный в примере 271.
Пример 282
Раствор (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил](метил)карбамата (50 мг, 0,14 ммоль) из Получения 28 и 5-амино-2-фторбензонитрила (23 мг, 0,17 ммоль) в н-бутаноле (1 мл) кипятили с обратным холодильником при перемешивании в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1→дихлорметан/метанол = 10/1) и затем растворяли в метаноле. К полученному раствору добавляли газообразный хлористый водород. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов и затем фильтровали с получением 23 мг продукта в виде бледно-желтого твердого вещества.
Примеры 283-287
Продукты примеров 283-287 получали в соответствии с теми же процедурами, как в примере 282, но используя (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил](метил)карбамат из Получения 28 и 5-амино-2-метилбензонитрил, 5-(трифторметил)-1,3-фенилендиамин, 2-(трифторметил)-1,4-фенилендиамин, 3,5-диаминобензонитрил или 4-фтор-3-(трифторметил)анилин.
Пример 288
Раствор (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил](этил)карбамата (85 мг, 0,22 ммоль) из Получения 30 и 2-нитро-1,4-фенилендиамина (41 мг, 0,27 ммоль) в н-бутаноле (1 мл) кипятили с обратным холодильником при перемешивании в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1 дихлорметан/метанол = 10/1) и затем растворяли в метаноле. К полученному раствору добавляли газообразный хлористый водород. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов и затем фильтровали с получением 104 мг продукта в виде бледно-красного твердого вещества.
Примеры с 289 по 292
Продукты примеров 289-292 получали в соответствии с теми же процедурами, как в примере 288, но используя (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил](этил)карбамат из Получения 30 и 4-фтор-1,3-диаминобензол, 5-(трифторметил)-1,3-фенилендиамин, 2-(трифторметил)-1,4-фенилендиамин или 3,5-диаминобензонитрил.
Пример 293
Продукт получали в соответствии с теми же процедурами, как в примере 153, но используя 5-(4-бутил-6-хлорпиримидин-2-иламино)-2-метилбензонитрил из Получения 13 и (R)-(-)-3-аминопиперидина дигидрохлорид.
Пример 294
<Шаг 1> 5-[(4-бутил-6-хлорпиримидин-2-ил)амино]-2-фторбензонитрил
Указанное в заголовке соединение в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как на шагах 2 и 3 Получения 12, но используя 6-бутил-2-(метилтио)пиримидин-4(3Н)-он, полученный на шаге 1 Получения 12, и 5-амино-2-фторбензонитрил.
<Шаг 2> (R)-5-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-иламино]-2-фторбензонитрил
Указанное в заголовке соединение получали в соответствии с теми же процедурами, как в примере 153, но используя 5-[(4-бутил-6-хлорпиримидин-2-ил)амино]-2-фторбензонитрил, полученный на шаге 1, и (R)-(-)-3-амино-пиперидина дигидрохлорид.
Пример 295
Продукт получали в соответствии с теми же процедурами, как в примере 220, но используя (R)-5-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-иламино]-2-метилбензонитрил, полученный в примере 293.
Пример 296
<Шаг 1> (S)-5-{[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]амино}-2-метилбензонитрил
Указанное в заголовке соединение в виде бледно-желтого масла получали в соответствии с теми же процедурами, как в примере 153, но используя 5-(4-хлор-6-пропилпиримидин-2-иламино)-2-метилбензонитрил из Получения 7 и (S)-(+)-3-амино-пиперидина дигидрохлорид.
<Шаг 2> (S)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрил
Указанное в заголовке соединение в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как на шаге 2 примера 154, но используя (S)-5-{[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]амино}-2-метилбензонитрил, полученный на шаге 1, и ацетальдегид.
<Шаг 3> (S)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила дигидрохлорид
Указанное в заголовке соединение в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 267, но используя (S)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрил, полученный на шаге 2.
Пример 297
<Шаг 1> 5-{[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]амино}-2-метилбензонитрил
Указанное в заголовке соединение в виде бледно-желтого масла получали в соответствии с теми же процедурами, как в примере 153, но используя 5-(4-хлор-6-пропилпиримидин-2-иламино)-2-метилбензонитрил из Получения 7 и 3-аминопиперидина дигидрохлорид.
<Шаг 2> 5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрил
Указанное в заголовке соединение в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как на шаге 2 примера 154, но используя 5-{[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]амино}-2-метилбензонитрил, полученный на шаге 1, и ацетальдегид.
<Шаг 3> 5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила дигидрохлорид
Указанное в заголовке соединение в виде твердого вещества белого цвета получали в соответствии с теми же процедурами, как в примере 267, но используя 5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрил, полученный на шаге 2.
Пример 298
<Шаг 1> N-{1-[6-бутил-2-(3-циано-4-метилфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамид
Указанное в заголовке соединение в виде бледно-желтого масла получали в соответствии с теми же процедурами, как в примере 153, но используя 5-(4-бутил-6-хлорпиримидин-2-иламино)-2-метилбензонитрил из Получения 13 и 3-ацетамидопиперидин.
<Шаг 2> N-{1-[6-бутил-2-(3-циано-4-метилфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида гидрохлорид
Указанное в заголовке соединение в виде бледно-желтого твердого вещества получали в соответствии с теми же процедурами, как в примере 267, но используя N-{1-[6-бутил-2-(3-циано-4-метилфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамид, полученный на шаге 1.
Примеры 299-305
Продукты примеров 299-305 получали в соответствии с теми же процедурами, как на шаге 2 примера 154, используя (R)-5-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-иламино]-2-метилбензонитрил, полученный в примере 293, и ацетальдегид, бутиральдегид, валеральдегид, изобутиральдегид, изовалеральдегид, пивальдегид или 3-(метилтио) пропиональдегид.
Примеры 306-310
Продукты примеров 306-310 получали в соответствии с теми же процедурами, как в примере 282, но используя (R)-трет-бутил[1-(2-хлор-6-пропилпиримидин-4-ил)пиперидин-3-ил](метил)карбамата из Получения 28 и 4-фтор-1,3-диаминобензол, 4-хлор-1,3-диаминобензол, 2,5-диаминобензонитрил из Получения 16, 3-метокси-4-метиланилин или 2,4-диаминотолуол.
Пример 311.
Раствор (R)-трет-бутил[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил](метил)карбамата (40 мг, 0,1 ммоль), полученного в Получении 29, и 5-амино-2-метилбензонитрила (15,9 мг, 0,12 ммоль) в н-бутаноле (1 мл) кипятили с обратным холодильником при перемешивании в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1→дихлорметан/метанол = 10/1) и затем растворяли в метаноле. К полученному раствору добавляли газообразный хлористый водород. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов и затем фильтровали с получением 33,5 мг продукта в виде бледно-желтого твердого вещества.
Примеры 312-320
Продукты примеров 312-320 получали в соответствии с теми же процедурами, как в примере 311, но используя (R)-трет-бутил[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил](метил)карбамат из Получения 29 и 5-амино-2-фторбензонитрил, 5-(трифторметил)-1,3-фенилендиамин, 2-(трифторметил)-1,4-фенилендиамин, 3,5-диаминобензонитрил, 2,5-диаминобензонитрил из Получения 16, 4-фтор-1,3-диаминобензол, 3-метокси-4-метиланилин, 2,4-диаминотолуол или 5-амино-2-фторбензотрифторид.
Примеры с 321 по 326
Продукты примеров 321-326 получали в соответствии с теми же процедурами, как в примере 282, но используя (R)-трет-бутил(1-[2-хлор-6-пропилпиримидин-4-ил]пиперидин-3-ил)(метил)карбамат из Получения 28 и 2-нитро-1,4-фенилендиамин, 3,4-диметиланилин, 3-фтор-4-метиланилина, 4-метил-3-(трифторметил)анилин, 2,4-диаминоанизол или 6-аминоиндазол.
Пример 327
Палладированный уголь (25 мг, 10 мас.%) добавляли к раствору (R)-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-3-нитробензол-1,4-диамина (20 мг, 0,04 ммоль), полученного в примере 321, в метаноле (2 мл). Реакционную смесь перемешивали при комнатной температуре в атмосфере водорода (30 бар) в течение 3 часов и затем фильтровали через слой целита. Полученный фильтрат выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (дихлорметан/метанол = 10/1) с получением 3,5 мг продукта в виде бледно-желтого твердого вещества.
Примеры 328-334
Продукты примеров 328-334 получали в соответствии с теми же процедурами, как в примере 282, но используя (R)-трет-бутил[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил](метил)карбамат из Получения 29 и 2-нитро-1,4-фенилендиамин, 3-аминобензонитрил, 3,4-диметиланилин, 3-фтор-4-метиланилин, 4-метил-3-(трифторметил)анилин, 2,4-диаминоанизол или 6-аминоиндазол.
Пример 335
Продукт получали в соответствии с теми же процедурами, как в примере 327, но используя (R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-3-нитробензол-1,4-диамина дигидрохлорид, полученный в примере 328.
Пример 336
Раствор (R)-трет-бутил[1-(6-бутил-2-хлорпиримидин-4-ил)пиперидин-3-ил]карбамата (40 мг, 0,11 ммоль) из Получения 27 и 3-нитроанилина (16,6 мг, 0,12 ммоль) в н-бутаноле (1 мл) кипятили с обратным холодильником при перемешивании в течение 2 часов и затем выпаривали при пониженном давлении. Полученный остаток очищали, используя метод колоночной хроматографии на силикагеле (н-гексан/этилацетат = 1/1→дихлорметан/метанол = 10/1) и затем растворяли в метаноле (2 мл). Полученный раствор насыщали газообразным хлористым водородом. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов и затем фильтровали. Фильтрат выпаривали при пониженном давлении. Добавляли этил ацетат (2 мл) к полученному осадку, и затем перемешивали. Реакционную смесь фильтровывали с получением 35 мг продукта в виде белого твердого вещества.
Примеры с 337 по 353
Продукты примеров 337-353 получали в соответствии с теми же процедурами, как в примере 336, но используя (R)-трет-бутил[1-(6-бутил-2-хлорпиримидин-4-ил) пиперидин-3-ил]карбамат из Получения 27 и 2-нитро-1,4-фенилендиамин, 4-фтор-3-нитроанилин, 4-метил-3-нитроанилин, 2-(трифторметил)-1,4-фенилендиамин, 5-(трифторметил)-1,3-фенилендиамин, 3,5-диаминобензонитрил, 4-метил-3-(трифторметил)анилин, 3-фтор-4-метиланилин, 3-метокси-4-метиланилин, 2,4-диаминотолуол, 3,4-диметиланилин, 5-амино-2-фторбензотрифторид, 4-фтор-1,3-диаминобензол, 2,5-диаминобензонитрил из Получения 16, 3-аминобензонитрил, 1,4-фенилендиамин или 4-хлор-3-нитроанилин.
Пример 354
Продукт получали в соответствии с теми же процедурами, как в примере 327, но используя (R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-3-нитробензол-1,4-диамин, полученный в примере 337.
Соединения примеров 1-354 и данные их спектра ЯМР показаны в нижеследующих Таблицах с 1-1 по 1-37.
1,3-диамина дигидрохлорид
Пример испытаний 1: Оценка агонистической активности на линии клеток СНО-К1, экспрессирующих человеческий 5-НТ4(a) рецептор
В качестве клеток яичника китайского хомяка CHO-K1, стабильно экспрессирующих человеческий 5-НТ4(a) рецептор использовали линию GeneBlAzer HTR4-CRE-bla CHO-K1 (Invitrogen Corp.). Клетки выращивали при температуре 37°C в атмосфере с 5% содержанием CO2 в среде DMEM, дополненной 10% фетальной бычьей сыворотки (FBS), 25 мМ буфера HEPES (pH 7,4), 600 мкг/мл гигромицина B, 0,1 мМ неосновых аминокислот, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина. Пересев клеток осуществляли три раза в неделю, каждый при менее, чем 80% конфлюэнтности. В день, предшествующий дню обработки испытуемыми соединениями, клетки собирали с использованием 0,5% трипсина/ЭДТА и затем разводили в среде DMEM, дополненной 1% FBS, 25 мМ буфера HEPES и 0,1 мМ неосновных аминокислот, до получения культуры клеток с концентрацией 3,125×105 клеток/мл. По 32 мкл разбавленной клеточной культуры высевали в 384-луночный планшет (104 клеток на лунку) и инкубировали на протяжении ночи. На следующее утро по 8 мкл среды, содержащей 1% ДМСО, вносили в свободную от клеток контрольную лунку и в несодержащую стимулирующую среду лунку, соответственно. По 8 мкл раствора испытуемого соединения, имеющего соответствующие разведения (приготовленного путем 100-кратного разведения с использованием среды, указанной выше), содержащего 1% ДМСО, вносили в соответствующие оставшиеся лунки. После инкубирования в термостате в течение 5 часов, каждую лунку 384-луночного планшета обрабатывали раствором субстрата (8 мкл на лунку), приготовленного в соответствии с инструкцией поставщика (т.е. инструкций компании Invitrogen), а затем инкубировали в темной комнате в течение еще двух часов. Агонистическую активность в отношении 5-НТ4 рецептора оценивали на основе показателей флуоресценции продуктов расщепления бета-лактамазы. После возбуждения длины волны 410 нм с использованием флуоресцентного детектора (Genios Pro), измеряли показатели флуоресценции на двух длинах волн излучения (первая длина волны: 465 нм, вторая длина волны: 535 нм). Полученные данные анализировали на основе соотношения интенсивностей флуоресценции каждой лунки на соответствующих длинах волн. Каждое значение ЭК50 определяли методом нелинейного регрессионного анализа с использованием программы "GraphPad Prism" на основе активности испытуемых соединений в зависимости от их 8 различных концентраций. Полученные результаты приведены ниже в Таблицах 2-1 и 2-2.
Как свидетельствуют данные в Таблице 2-1 и 2-2, соединения настоящего изобретения обладают превосходной активностью в качестве агониста 5-НТ4 рецепторов, следовательно, они могут быть с пользой применены для профилактики и лечения дисфункции моторики желудочно-кишечного тракта.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ДИАМИНОПИРИМИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2587493C2 |
| НОВЫЕ ФТАЛАЗИНОВЫЕ ПРОИЗВОДНЫЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2636585C2 |
| Соединение, обладающее агонистической активностью в отношении GPR119, способ его получения и фармацевтическая композиция, содержащая его в качестве эффективного компонента | 2015 |
|
RU2670197C1 |
| КОНДЕНСИРОВАННЫЕ КОЛЬЦЕВЫЕ ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ TRK | 2015 |
|
RU2708674C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИПЕРИДИНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АУТОТАКСИНА | 2022 |
|
RU2834850C2 |
| ПРОИЗВОДНЫЕ ТИЕНО[3,2-d]ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ПРОТЕИНКИНАЗЫ | 2011 |
|
RU2524210C2 |
| Гетероциклическое соединение в качестве ингибитора протеинкиназы | 2018 |
|
RU2783723C2 |
| НОВОЕ ПРОИЗВОДНОЕ ГЕТЕРОЦИКЛИЧЕСКОГО АМИНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2019 |
|
RU2760184C1 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА ДЛЯ ТОРМОЖЕНИЯ РОСТА РАКОВЫХ КЛЕТОК И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2362773C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА И ИНДАЗОЛА, ОБЛАДАЮЩИЕ КОНСЕРВИРУЮЩИМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К КЛЕТКАМ, ТКАНЯМ И ОРГАНАМ | 2009 |
|
RU2460525C2 |
Настоящее изобретение относится к новому производному диаминопиримидина формулы 1 или его фармацевтически приемлемой соли, обладающих свойствами агониста 5-НТ4 рецепторов. Изобретение также относится к применению соединения формулы 1 или его фармацевтически приемлемой соли для производства лекарственного средства для профилактики или лечения дисфункции моторики желудочно-кишечного тракта. Дисфункция моторики желудочно-кишечного тракта представляет собой гастроэзофагеальную рефлюксную болезнь (ГЭРБ), запор (констипацию), синдром раздраженного кишечника (СРК), диспепсию, послеоперационную кишечную непроходимость, замедленное опорожнение желудка, гастропарез, псевдообструкцию кишечника, индуцированное лекарствами замедление транзита содержимого по кишечнику или диабетический гастропарез. В формуле 1
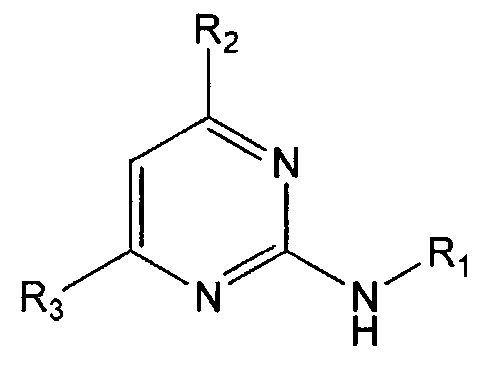 (Формула 1)
(Формула 1)
R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, C1-2алкила (где C1-2алкил необязательно замещен галогеном), C1-5алкокси, C1-5алкилтио, C1-5алкоксикарбонила и аминокарбонила, или гетероарильную группу, выбранную из группы, состоящей из фуранила, пирролила, тиофенила, хинолинила, хроменонила, индолила, бензимидазол-4-ила, бензимидазол-5-ила, бензимидазол-6-ила, бензимидазол-7-ила и индазолила, при этом гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из C1-5алкила (где C1-5алкил необязательно замещен галогеном) и C1-5алкокси, R2 означает азотсодержащую циклическую группу, выбранную из группы, состоящей из следующих формул от А до D (где символ * в формулах A-D означает позицию прикрепления этой группы к соединению формулы (1),
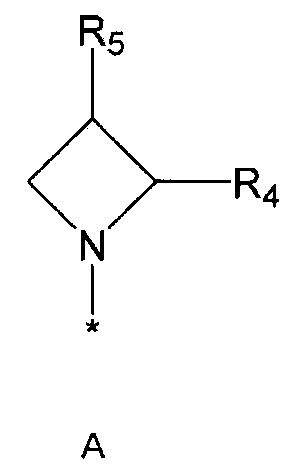
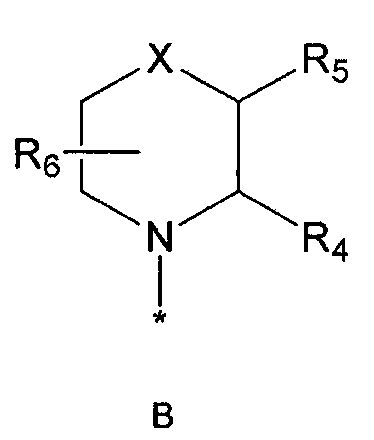
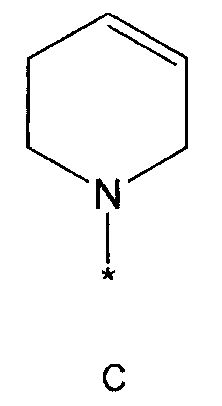
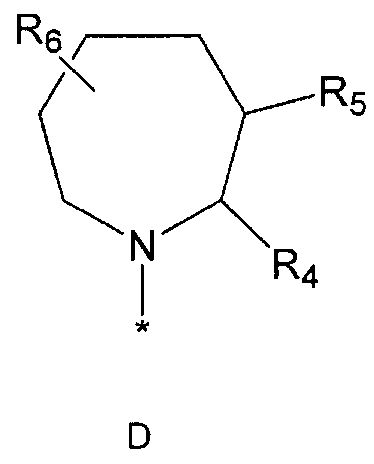
R3 означает C1-5алкильную группу, необязательно замещенную фенилом, R4 означает водород, C1-5алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5алкиламино, пирролидинила и гидрокси-C1-5алкиламино; C1-5алкоксикарбонильную группу или аминокарбонильную группу, R5 означает водород; гидроксильную группу; C1-5алкоксигруппу; C1-5алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино и C1-5алкоксикарбониламино; или группу, выбранную из группы, состоящей из следующих формул от Е до I (где символ * в формулах Е-I означает позицию прикрепления этой группы к одному из соединений формул A-D),
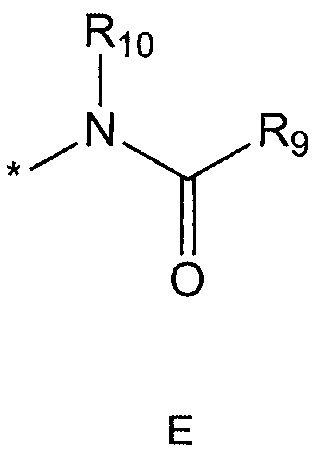
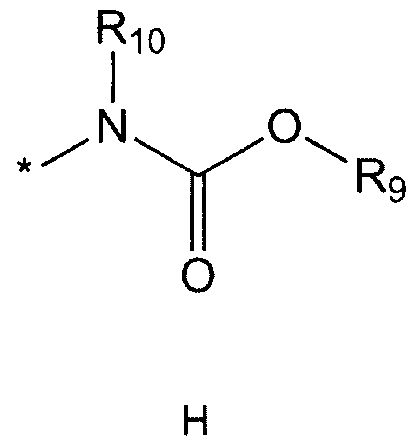
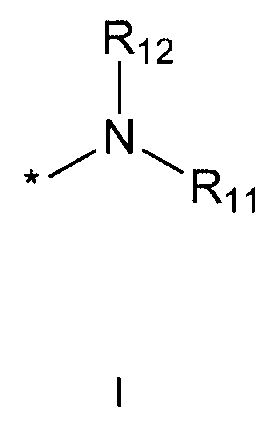
R6 означает водород; гидроксильную группу или C1-5алкильную группу, необязательно замещенную гидрокси, X означает -СН(R7)-, -С(=O)-, -N(R8)- или -О-, R7 означает водород; гидроксильную группу; аминокарбонильную группу; фенильную группу или C1-5алкильную группу, необязательно замещенную гидрокси, R4 и R5, R5 и R6, R4 и R6 или R5 и R7 могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца, указанное кольцо может быть карбоциклическим или содержать дополнительно атом кислорода в качестве гетероатома, R8 означает водород или C1-5алкильную группу. Значения радикалов R9-R12 указаны в формуле изобретения. 6 н. и 2 з.п. ф-лы, 38 табл., 355 пр.
1. Применение соединения формулы 1 или его фармацевтически приемлемой соли, обладающих активностью в качестве агониста 5-НТ4 рецепторов, для производства лекарственного средства для профилактики или лечения дисфункции моторики желудочно-кишечного тракта, при этом соединение формулы 1 соответствует структуре:
 (Формула 1)
(Формула 1)
где R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, C1-2алкила (где C1-2алкил необязательно замещен галогеном), C1-5алкокси, C1-5алкилтио, C1-5алкоксикарбонила и аминокарбонила, или
гетероарильную группу, выбранную из группы, состоящей из фуранила, пирролила, тиофенила, хинолинила, хроменонила, индолила, бензимидазол-4-ила, бензимидазол-5-ила, бензимидазол-6-ила, бензимидазол-7-ила и индазолила, при этом гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из C1-5алкила (где C1-5алкил необязательно замещен галогеном) и C1-5алкокси,
R2 означает азотсодержащую циклическую группу, выбранную из группы, состоящей из следующих формул от А до D (где символ * в формулах A-D означает позицию прикрепления этой группы к соединению формулы (1),




R3 означает C1-5алкильную группу, необязательно замещенную фенилом,
R4 означает водород, C1-5алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5алкиламино, пирролидинила и гидрокси-C1-5алкиламино; C1-5алкоксикарбонильную группу или аминокарбонильную группу,
R5 означает водород; гидроксильную группу; C1-5алкоксигруппу; C1-5алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино и C1-5алкоксикарбониламино; или группу, выбранную из группы, состоящей из следующих формул от Е до I (где символ * в формулах Е-I означает позицию прикрепления этой группы к одному из соединений формул A-D),



R6 означает водород; гидроксильную группу или C1-5алкильную группу, необязательно замещенную гидрокси,
X означает -СН(R7)-, -С(=O)-, -N(R8)- или -О-,
R7 означает водород; гидроксильную группу; аминокарбонильную группу; фенильную группу или C1-5алкильную группу, необязательно замещенную гидрокси,
R4 и R5, R5 и R6, R4 и R6 или R5 и R7 могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца, указанное кольцо может быть карбоциклическим или содержать дополнительно атом кислорода в качестве гетероатома,
R8 означает водород или C1-5алкильную группу,
R9 означает C1-10алкильную группу, необязательно замещенную гидрокси,
R10 означает водород,
R11 и R12 каждый независимо друг от друга означает водород; C1-10алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5 алкилтио, C3-10циклоалкила, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, трифторметила, галогена и C1-5алкокси), тиофенила, пирролила или фуранила (где фуранил необязательно замещен моно- или ди-C1-5алкилом).
2. Применение соединения формулы 1 или его фармацевтически приемлемой соли по п. 1, где дисфункция моторики желудочно-кишечного тракта представляет собой гастроэзофагеальную рефлюксную болезнь (ГЭРБ), запор (констипацию), синдром раздраженного кишечника (СРК), диспепсию, послеоперационную кишечную непроходимость, замедленное опорожнение желудка, гастропарез, псевдообструкцию кишечника, индуцированное лекарствами замедление транзита содержимого по кишечнику или диабетический гастропарез.
3. Фармацевтическая композиция, обладающая активностью в качестве агониста 5-НТ4 рецепторов, для профилактики или лечения дисфункции моторики желудочно-кишечного тракта, содержащая терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, при этом соединение формулы 1 соответствует структуре:
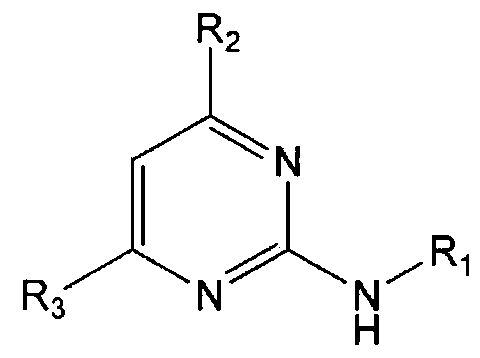 (Формула 1)
(Формула 1)
в которой R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, С1-2
алкила (где С1-2алкил необязательно замещен галогеном), С1-5алкокси, С1-5алкилтио, С1-5алкоксикарбонила и аминокарбонила, или
гетероарильную группу, выбранную из группы, состоящей из фуранила, пирролила, тиофенила, хинолинила, хроменонила, индолила, бензимидазол-4-ила, бензимидазол-5-ила, бензимидазол-6-ила, бензимидазол-7-ила и индазолила, при этом гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из С1-5алкила (где С1-5алкил необязательно замещен галогеном) и С1-5алкокси,
R2 означает азотсодержащую циклическую группу, выбранную из группы, состоящей из следующих формул от А до D (где символ * в формулах A-D означает позицию прикрепления этой группы к соединению формулы 1),
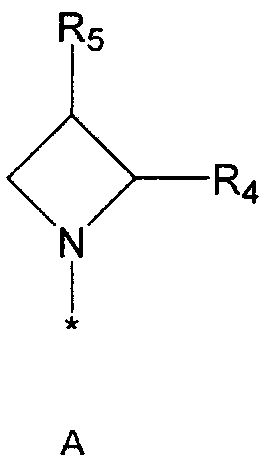

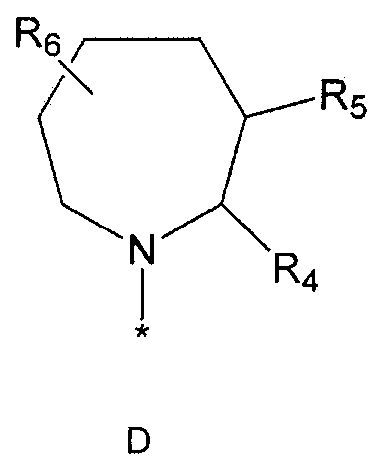
R3 означает С1-5алкильную группу, необязательно замещенную фенилом,
R4 означает водород; C1-5алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5алкиламино, пирролидинила и гидрокси-C1-5алкиламино; C1-5алкоксикарбонильную группу или аминокарбонильную группу,
R5 означает водород; гидроксильную группу; C1-5алкоксигруппу; C1-5алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино и C1-5алкоксикарбониламино; или группу, выбранную из группы, состоящей из следующих формул от Е до I (где символ * в формулах Е-I означает позицию прикрепления этой группы к одному из соединений формул A-D),
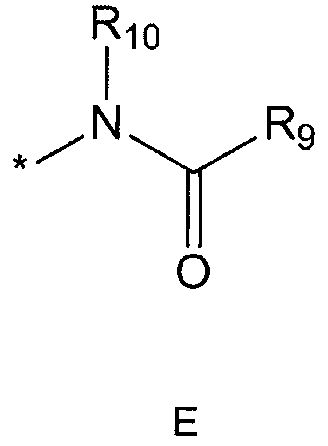
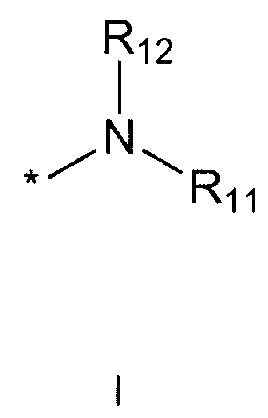
R6 означает водород; гидроксильную группу или C1-5алкильную группу, необязательно замещенную гидрокси,
X означает -CH(R7)-, -C(=O)-,-N(R8)- или -О-,
R7 означает водород; гидроксильную группу; аминокарбонильную группу; фенильную группу или C1-5алкильную группу, необязательно замещенную гидрокси,
R4 и R5, R5 и R6, R4 и R6 или R5 и R7 могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца, указанное кольцо может быть карбоциклическим или содержать дополнительно атом кислорода в качестве гетероатома,
R8 означает водород или C1-5алкильную группу,
R9 означает C1-10алкильную группу, необязательно замещенную гидрокси,
R10 означает водород,
R11 и R12 каждый независимо друг от друга означает водород; C1-10алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, C1-5алкилтио, C3-10циклоалкила, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, трифторметила, галогена и C1-5алкокси), тиофенила, пирролила или фуранила (где фуранил необязательно замещен моно- или ди-C1-5алкилом).
4. Фармацевтическая композиция по п. 3, в которой дисфункция моторики желудочно-кишечного тракта представляет собой гастроэзофагеальную рефлюксную болезнь (ГЭРБ), запор (констипацию), синдром раздраженного кишечника (СРК), диспепсию, послеоперационную кишечную непроходимость, замедленное опорожнение желудка, гастропарез, псевдообструкцию кишечника, индуцированное лекарствами замедление транзита содержимого по кишечнику или диабетический гастропарез.
5. Соединение формулы 1 или его фармацевтически приемлемая соль,
при этом соединение формулы 1 соответствует структуре:
 (Формула 1)
(Формула 1)
где R1 означает фенильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из гидрокси, амино, галогена, циано, нитро, С1-2алкила (где С1-2алкил необязательно замещен галогеном), С1-5алкокси, С1-5алкилтио, С1-5алкоксикарбонила и аминокарбонила, или
гетероарильную группу, выбранную из группы, состоящей из фуранила, пирролила, тиофенила, хинолинила, хроменонила, индолила, бензимидазол-4-ила,
бензимидазол-5-ила, бензимидазол-6-ила, бензимидазол-7-ила и индазолила, при этом гетероарильная группа может быть необязательно замещена одним или более заместителями, выбранными из группы, состоящей из С1-5алкила (где С1-5алкил необязательно замещен галогеном) и С1-5алкокси,
R2 означает азотсодержащую циклическую группу, выбранную из группы, состоящей из следующих формул от А до D (где символ * в формулах A-D означает позицию прикрепления этой группы к соединению формулы 1),
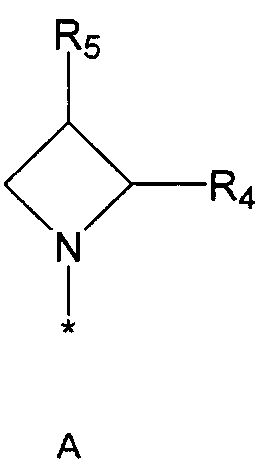
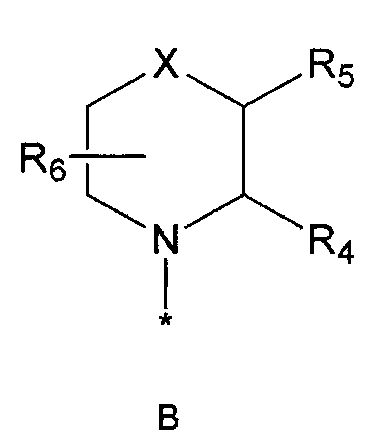

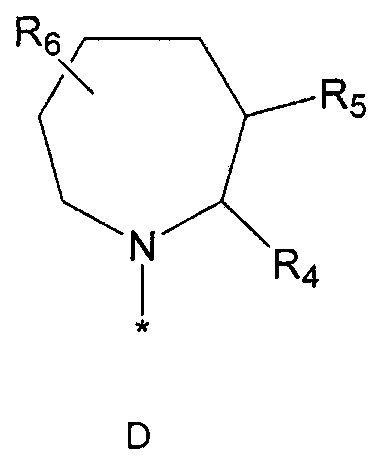
R3 означает С1-5алкильную группу, необязательно замещенную фенилом,
R4 означает водород, С1-5алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, С1-5алкиламино, пирролидинила и гидрокси-С1-5алкиламино; С1-5алкоксикарбонильную группу или аминокарбонильную группу,
R5 означает водород; гидроксильную группу; С1-5алкоксигруппу; С1-5алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из амино и С1-5алкоксикарбониламино; или группу, выбранную из группы, состоящей из следующих формул от Е до I (где символ * в формулах Е-I означает позицию прикрепления этой группы к одному из соединений формул A-D),
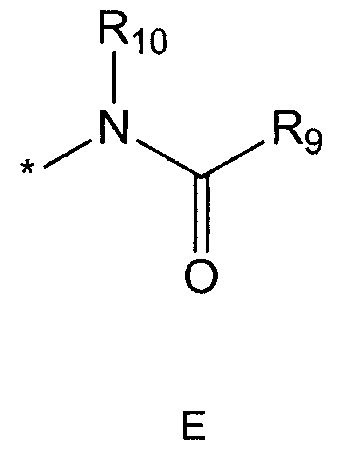
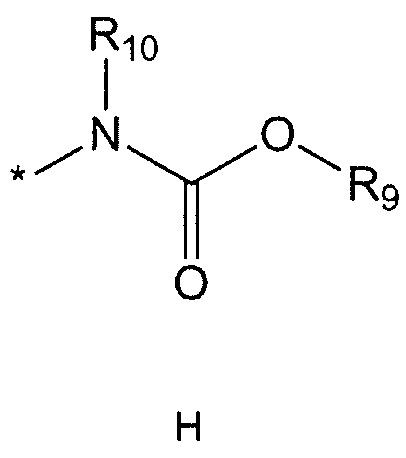
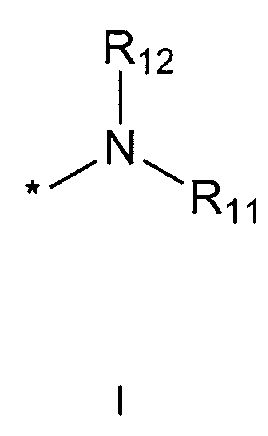
R6 означает водород; гидроксильную группу или С1-5 алкильную группу, необязательно замещенную гидрокси,
X означает -CH(R7)-, -С(=O)-, -N(R8)- или -О-,
R7 означает водород; гидроксильную группу; аминокарбонильную группу; фенильную группу или С1-5 алкильную группу, необязательно замещенную гидрокси,
R4 и R5, R5 и R6, R4 и R6 или R5 и R7 могут быть связаны друг с другом с образованием пятичленного или шестичленного кольца, указанное кольцо может быть карбоциклическим или содержать дополнительно атом кислорода в качестве гетероатома,
R8 означает водород или С1-5алкильную группу,
R9 означает C1-10алкильную группу, необязательно замещенную гидрокси,
R10 означает водород,
R11 и R12 каждый независимо друг от друга означает водород; С1-10алкильную группу, необязательно замещенную заместителем, выбранным из группы, состоящей из гидрокси, С1-5алкилтио, C3-10циклоалкила, фенила (где фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, трифторметила, галогена и С1-5алкокси), тиофенила, пирролила или фуранила (где фуранил необязательно замещен моно- или ди-С1-5алкилом).
6. Соединение или его фармацевтически приемлемая соль, выбранное из группы, состоящей из:
N-(4-фторфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-морфолино-6-пропилпиримидин-2-амина;
4-(азепан-1-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(2-метилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(3-метилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-пропил-6-тиоморфолинопиримидин-2-амина;
4-(2,5-диметилпиперазин-1-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
4-(5,6-дигидропиридин-1(2Н)-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(декагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-[декагидроизохинолин-1(2Н)-ил]-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(4-фенилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фторфенил)-4-(пиперазин-1-ил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
2-{1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
этил-1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-карбоксилата;
1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-4-карбоксамида;
{1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-4-ил}метанола;
1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-4-она;
4-бутил-N-(4-фторфенил)-6-(пиперидин-1-ил)пиримидин-2-амина;
4-бутил-6-(2-этилпиперидин-1-ил)-N-(4-фторфенил)пиримидин-2-амина;
2-{1-[6-бутил-2-(4-фторфениламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
4-бутил-N-(4-фторфенил)-6-морфолинопиримидин-2-амина;
2-{1-[2-(4-хлор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-(1-{2-[3-(метилтио)фениламино]-6-пропилпиримидин-4-ил}пиперидин-2-ил)этанола;
4-(2,6-диметилморфолино)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
8-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]-8-азабицикло[3.2.1]октан-3-ола;
N-{1-[2-(4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
N-(4-фторфенил)-4-{4-[3-(пиперидин-4-ил)пропил]пиперидин-1-ил}-6-пропилпиримидин-2-амина;
4-[3-(бензилокси)пиперидин-1-ил]-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
4-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-N-(4-фторфенил)-6-пропилпиримидин-2-амина;
N-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-ил]-1Н-индол-5-амина;
N-(3-хлор-4-метилфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-ил]хинолин-6-амина;
4-(пиперидин-1-ил)-6-пропил-N-[3-(трифторметил)фенил]пиримидин-2-амина;
N-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-ил]-2-(трифторметил)-1Н-бензо[d]имидазол-5-амина;
N-[3-(метилтио)фенил]-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(5-метокси-2-метилфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(5-хлор-2-метилфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-фтор-3-нитрофенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-метоксифенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(3-метоксифенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(3-хлорфенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(3-нитрофенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(4-хлор-3-нитрофенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
3-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
N-(4-метил-3-нитрофенил)-4-(пиперидин-1-ил)-6-пропилпиримидин-2-амина;
4-(4-этилпиперазин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-[4-(4-метоксифенил)пиперазин-1-ил]-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-[4-(4-фторфенил)пиперазин-1-ил]-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(морфолин-4-ил)пиримидин-2-амина;
1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-4-она;
N-(4-фторфенил)-4-метил-6-(пиперидин-1-ил)пиримидин-2-амина;
4-(азетидин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-3-ола;
1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-4-ола;
N-(4-фторфенил)-4-метил-6-(2-метилпиперидин-1-ил)пиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(3-метилпиперидин-1-ил)пиримидин-2-амина;
4-(3,5-цис-диметилпиперидин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
4-(азепан-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
4-((2R,6S)-2,6-диметилпиперидин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(4-фенилпиперидин-1-ил)пиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(пиперазин-1-ил)пиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(4-метилпиперазин-1-ил)пиримидин-2-амина;
4-(2,5-диметилпиперазин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
4-(3,5-диметилпиперазин-1-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(октагидрохинолин-1(2Н)-ил)пиримидин-2-амина;
N-(4-фторфенил)-4-метил-6-(октагидроизохинолин-2(1Н)-ил)пиримидин-2-амина;
4-(5,6-дигидропиридин-1(2Н)-ил)-N-(4-фторфенил)-6-метилпиримидин-2-амина;
2-{1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(4-фторфениламино)-6-метилпиримидин-4-ил]пиперидин-2-ил}метанола;
N-[4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-ил]-1Н-индол-6-амина;
2-{1-[2-(1Н-индол-6-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
N-[4-(пиперидин-1-ил)-6-пропилпиримидин-2-ил]-1Н-индол-6-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)-1Н-индол-6-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]-1Н-индол-6-амина;
(R)-3-[4-(3-этилморфолино)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-трет-бутил-4-[2-(3-цианофениламино)-6-пропилпиримидин-4-ил]-3-метилпиперазин-1-карбоксилата;
(R)-3-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
4-морфолино-N-(3-нитрофенил)-6-пропилпиримидин-2-амина;
N-(4-фтор-3-нитрофенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(4-хлор-3-нитрофенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(3-метоксифенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(4-метоксифенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-[3-(метилтио)фенил]-4-морфолино-6-пропилпиримидин-2-амина;
N-(3-хлорфенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(3-хлор-4-метилфенил)-4-морфолино-6-пропилпиримидин-2-амина;
4-морфолино-6-пропил-N-[3-(трифторметил)фенил]пиримидин-2-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)-1Н-индол-5-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)-2-(трифторметил)-1Н-бензо[d]имидазол-6-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)хинолин-6-амина;
3-(4-морфолино-6-пропилпиримидин-2-иламино)бензонитрила;
N-(5-метокси-2-метилфенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(5-хлор-2-метилфенил)-4-морфолино-6-пропилпиримидин-2-амина;
N-(4-морфолино-6-пропилпиримидин-2-ил)хинолин-3-амина;
4-(2-этилпиперидин-1-ил)-N-(3-нитрофенил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(4-фтор-3-нитрофенил)-6-пропилпиримидин-2-амина;
N-(4-хлор-3-нитрофенил)-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(3-метоксифенил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-(4-метоксифенил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-N-[3-(метилтио)фенил]-6-пропилпиримидин-2-амина;
N-(3-хлорфенил)-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-(3-хлор-4-метилфенил)-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
4-(2-этилпиперидин-1-ил)-6-пропил-N-[3-(трифторметил)фенил]пиримидин-2-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]-1Н-индол-5-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]-2-(трифторметил)-1Н-бензо[d]имидазол-6-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]хинолин-6-амина;
3-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
4-(2-этилпиперидин-1-ил)-N-(5-метокси-2-метилфенил)-6-пропилпиримидин-2-амина;
N-(5-хлор-2-метилфенил)-4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-амина;
N-[4-(2-этилпиперидин-1-ил)-6-пропилпиримидин-2-ил]хинолин-3-амина;
(R)-N-(4-хлор-3-нитрофенил)-4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-амина;
(R)-N-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-ил]-1Н-индол-6-амина;
(R)-N-(2-метилпиперазин-1-ил)-6-пропил-N-[3-(трифторметил)фенил]пиримидин-2-амина;
(R)-N-(2-метилпиперазин-1-ил)-N-(3-нитрофенил)-6-пропилпиримидин-2-амина;
(R)-N-(4-фтор-3-нитрофенил)-4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-амина;
(R)-N-(4-метил-3-нитрофенил)-4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-амина;
(R)-4-фтор-N1-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-ил]бензол-1,3-диамина;
(R)-N1-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-2-фтор-5-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-2-метил-5-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-2-амино-5-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-N1-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-ил]-3-нитробензол-1,4-диамина;
(R)-3-амино-5-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-3-[4-(2-метилпиперазин-1-ил)-6-пропилпиримидин-2-иламино]бензамида;
3-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
2-{1-[2-(1-этил-1Н-индол-6-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(1Н-индол-5-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-(1-{6-пропил-2-[2-(трифторметил)-1Н-бензо[d]имидазол-6-иламино]пиримидин-4-ил}пиперидин-2-ил)этанола;
2-{1-[2-(4-метоксифениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-метоксифениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(5-метокси-2-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-хлор-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(4-фтор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(2,3-диметилбензофуран-5-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[6-пропил-2-(хинолин-6-иламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-хлорфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
7-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-4-метил-2Н-хромен-2-она;
2-{1-[6-пропил-2-(3-трифторметилфениламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[6-пропил-2-(хинолин-3-иламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
(S)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(S)-4-(3-аминопиперидин-1-ил)-N-(3-нитрофенил)-6-пропилпиримидин-2-амина;
(S)-3-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(S)-5-{4-[3-(бутиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-{4-[3-(пентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-{4-[3-(изобутиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-{4-[3-(изопентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-2-метил-5-{4-[3-(неопентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(S)-5-(4-{3-[(1Н-пиррол-2-ил)метиламино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(S)-2-метил-5-(4-пропил-6-{3-[(тиофен-2-илметил)амино]пиперидин-1-ил}пиримидин-2-иламино)бензонитрила;
(S)-5-(4-{3-[(4,5-диметилфуран-2-илметил)амино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(S)-2-метил-5-{4-[3-(3-метилтиопропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(S)-5-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-{4-[3-(4-гидроксибензиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(S)-5-[4-(3-диэтиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(S)-5-(4-{3-[бис(циклопропилметил)амино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(R)-5-(4-{3-[бис(циклопропилметил)амино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
4-этил-N-(4-фторфенил)-6-(пиперидин-1-ил)пиримидин-2-амина;
4-этил-N-(4-фторфенил)-6-(октагидрохинолин-1(2Н)-ил)пиримидин-2-амина;
4-этил-6-(2-этилпиперидин-1-ил)-N-(4-фторфенил)пиримидин-2-амина;
2-{1-[6-этил-2-(4-фторфениламино)пиримидин-4-ил]пиперидин-2-ил}этанола;
4-этил-N-(4-фторфенил)-6-морфолинопиримидин-2-амина;
2-{1-[2-(4-метил-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(4-амино-3-трифторметилфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(4-амино-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
5-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
2-фтор-5-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
2-амино-5-{4-[2-(2-гидроксиэтил)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
2-{1-[2-(3-амино-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-амино-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(3-амино-4-хлорфениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
2-{1-[2-(индолин-6-иламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
(S)-2-{1-[2-(4-хлор-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
(S)-2-{1-[2-(4-амино-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
(R)-2-{1-[2-(4-амино-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-2-ил}этанола;
3-[4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
N-(3-нитрофенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-(4-фтор-3-нитрофенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-(4-хлор-3-нитрофенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-(3-метоксифенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-(5-метокси-2-метилфенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-(4-метоксифенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
4-(октагидрохинолин-1(2Н)-ил)-6-пропил-N-(3-трифторметилфенил)пиримидин-2-амина;
N-(3-хлорфенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-(5-хлор-2-метилфенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-(3-хлор-4-метилфенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-(3-метилтиофенил)-4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амина;
N-[4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-ил]-1Н-индол-5-амина;
N-[4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-ил]-2-(трифторметил)-1Н-бензо[d]имидазол-5-амина;
N-[4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-ил]хинолин-6-амина;
4-метил-7-[4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-амино]-2Н-хромен-2-она;
N-[4-(октагидрохинолин-1(2Н)-ил)-6-пропилпиримидин-2-ил]хинолин-3-амина;
(R)-5-{4-[3-(этиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(пропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(бутиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-2-метил-5-{4-[3-(пентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-5-{4-[3-(изобутиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(изопентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-2-метил-5-{4-[3-(неопентиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-5-{4-[3-(изопропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-(4-{3-[(1Н-пиррол-2-ил)метиламино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(R)-2-метил-5-(4-пропил-6-{3-[(тиофен-2-илметил)амино]пиперидин-1-ил}пиримидин-2-иламино)бензонитрила;
(R)-5-(4-{3-[(4,5-диметилфуран-2-илметил)амино]пиперидин-1-ил}-6-пропилпиримидин-2-иламино)-2-метилбензонитрила;
(R)-2-метил-5-{4-[3-(3-метилтиопропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-5-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(циклопентилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-5-{4-[3-(4-гидроксибензиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-метилбензонитрила;
(R)-N-{1-[2-(3-циано-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-3-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-5-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила;
(R)-3-{4-[3-(пропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-3-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-2-фтор-5-{4-[3-(пропиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-5-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}-2-фторбензонитрила;
(R)-N1-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-4-фторбензол-1,3-диамина;
(R)-N1-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-3-нитробензол-1,4-диамина;
(R)-3-амино-5-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-иламино}бензонитрила;
(R)-N1-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-3-(трифторметил)бензол-1,4-диамина;
(R)-N1-{4-[3-(циклопропилметиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-5-(трифторметил)бензол-1,3-диамина;
(R)-N-{1-[2-(4-амино-3-нитрофениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(4-метил-3-нитрофениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(4-фтор-3-нитрофениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(4-хлор-3-нитрофениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-5-цианофениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-5-трифторметилфениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(4-амино-3-трифторметилфениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(4-фтор-3-трифторметилфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[6-бутил-2-(3-циано-4-фторфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-4-фторфениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-4-хлорфениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(4-амино-3-цианофениламино)-6-бутилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-циано-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-цианофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-циано-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-(1-{2-[3-амино-5-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)-2-гидроксиацетамида;
(R)-N-(1-{2-[4-амино-3-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)-2-гидроксиацетамида;
(R)-N-(1-{2-[4-фтор-3-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)-2-гидроксиацетамида;
(R)-N-{1-[2-(3-амино-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-амино-4-хлорфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-амино-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N-{1-[2-(3-хлор-4-метилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-2-гидрокси-N-(1-{2-[4-метил-3-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)ацетамида;
(R)-N-{1-[2-(3-амино-5-цианофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}-2-гидроксиацетамида;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-5-(трифторметил)бензол-1,3-диамина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-4-(3-аминопиперидин-1-ил)-N-(3-фтор-4-метилфенил)-6-пропилпиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-4-фторбензол-1,3-диамина;
(R)-3-амино-5-{[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]амино}бензонитрила;
(R)-2-амино-5-{[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]амино}бензонитрила;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-4-хлорбензол-1,3-диамина;
(R)-4-(3-аминопиперидин-1-ил)-N-[4-метил-3-(трифторметил)фенил]-6-пропилпиримидин-2-амина;
(R)-N-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-1Н-индол-6-амина;
(R)-4-(3-аминопиперидин-1-ил)-N-(4-метил-3-нитрофенил)-6-пропилпиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-нитробензол-1,4-диамина;
(R)-N-{1-[2-(3-циано-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-5-[4-(3-диэтиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(R)-5-[4-(3-диэтиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила;
(R)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-фторбензонитрила;
(R)-N-{1-[6-бутил-2-(3-цианофениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-цианофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(3-амино-5-цианофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
N-{1-[2-(4-амино-3-нитрофениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
N-{1-[2-(3-амино-4-фторфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-{1-[2-(4-фтор-3-трифторметилфениламино)-6-пропилпиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-N-(1-{2-[3-амино-5-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)ацетамида;
(R)-N-(1-{2-[4-амино-3-(трифторметил)фениламино]-6-пропилпиримидин-4-ил}пиперидин-3-ил)ацетамида;
(R)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
(R)-2-фтор-5-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-2-метил-5-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-N1-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-5-(трифторметил)бензол-1,3-диамина;
(R)-N1-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-3-амино-5-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-(4-фтор-3-трифторметилфенил)-[4-(3-метиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]амина;
(R)-N1-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-нитробензол-1,4-диамина;
(R)-N1-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-4-фторбензол-1,3-диамина;
(R)-N1-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-5-(трифторметил)бензол-1,3-диамина;
(R)-N1-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-3-амино-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]бензонитрила;
(R)-5-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-иламино]-2-метилбензонитрила;
(R)-5-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-иламино]-2-фторбензонитрила;
(R)-N-{1-[6-бутил-2-(3-циано-4-метилфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(S)-5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
5-[4-(3-этиламинопиперидин-1-ил)-6-пропилпиримидин-2-иламино]-2-метилбензонитрила;
N-{1-[6-бутил-2-(3-циано-4-метилфениламино)пиримидин-4-ил]пиперидин-3-ил}ацетамида;
(R)-5-({4-бутил-6-[3-(этиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(бутиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(пентиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(изобутиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(изопентиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(неопентиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-{[4-бутил-6-(3-{[3-(метилтио)пропил]амино}пиперидин-1-ил)пиримидин-2-ил]амино}-2-метилбензонитрила;
(R)-4-фтор-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,3-диамина;
(R)-4-хлор-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,3-диамина;
(R)-2-амино-5-({4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}амино)бензонитрила;
(R)-N-(3-метокси-4-метилфенил)-4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-амина;
(R)-4-метил-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,3-диамина;
(R)-5-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-метилбензонитрила;
(R)-5-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)-2-фторбензонитрила;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-5-(трифторметил)бензол-1,3-диамина;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-3-(трифторметил)бензол-1,4-диамина;
(R)-3-амино-5-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)бензонитрила;
(R)-2-амино-5-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)бензонитрила;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-4-фторбензол-1,3-диамина;
(R)-4-бутил-N-(3-метокси-4-метилфенил)-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-4-метилбензол-1,3-диамина;
(R)-4-бутил-N-[4-фтор-3-(трифторметил)фенил]-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-3-нитробензол-1,4-диамина;
(R)-N-(3,4-диметилфенил)-4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-амина;
(R)-N-(3-фтор-4-метилфенил)-4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-амина;
(R)-N-[4-метил-3-(трифторметил)фенил]-4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-амина;
(R)-4-метокси-N1-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,3-диамина;
(R)-N-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}-1Н-индазол-6-амина;
(R)-N4-{4-[3-(метиламино)пиперидин-1-ил]-6-пропилпиримидин-2-ил}бензол-1,2,4-триамина;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-3-нитробензол-1,4-диамина;
(R)-3-({4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}амино)бензонитрила;
(R)-4-бутил-N-(3,4-диметилфенил)-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-4-бутил-N-(3-фтор-4-метилфенил)-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-4-бутил-N-[4-метил-3-(трифторметил)фенил]-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-амина;
(R)-N1-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-4-метоксибензол-1,3-диамина;
(R)-N-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}-1Н-индазол-6-амина;
(R)-N4-{4-бутил-6-[3-(метиламино)пиперидин-1-ил]пиримидин-2-ил}бензол-1,2,4-триамина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(3-нитрофенил)пиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-3-нитробензол-1,4-диамина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(4-фтор-3-нитрофенил)пиримидин-2-амина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(4-метил-3-нитрофенил)пиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-3-(трифторметил)бензол-1,4-диамина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-5-(трифторметил)бензол-1,3-диамина;
(R)-3-амино-5-{[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]амино}бензонитрила;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-[4-метил-3-(трифторметил)фенил]пиримидин-2-амина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(3-фтор-4-метилфенил)пиримидин-2-амина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(3-метокси-4-метилфенил)пиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-4-метилбензол-1,3-диамина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(3,4-диметилфенил)пиримидин-2-амина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-[4-фтор-3-(трифторметил)фенил]пиримидин-2-амина;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]-4-фторбензол-1,3-диамина;
(R)-2-амино-5-{[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]амино}бензонитрила;
(R)-3-{[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]амино}бензонитрила;
(R)-N1-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]бензол-1,4-диамина;
(R)-4-(3-аминопиперидин-1-ил)-6-бутил-N-(4-хлор-3-нитрофенил)пиримидин-2-амина и
(R)-N4-[4-(3-аминопиперидин-1-ил)-6-бутилпиримидин-2-ил]бензол-1,2,4-триамина.
7. Способ получения соединения формулы 1 или его фармацевтически приемлемой соли, включающий:
реагирование соединения формулы 2 с соединением формулы 3 с получением соединения формулы 4;
осуществление метилирования соединения формулы 4 с получением соединения формулы 5;
реагирование соединения формулы 5 с R1-NH2 с получением соединения формулы 6;
осуществление галогенирования соединения формулы 6 с получением соединения формулы 7 и
реагирование соединения формулы 7 с R2-H, с получением соединения формулы 1:
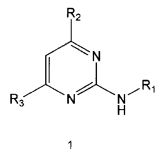
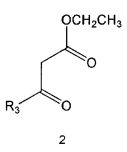
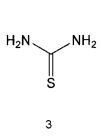
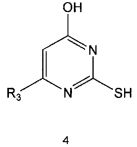
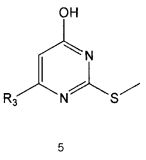
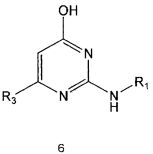
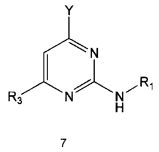
где R1, R2 и R3 имеют те же значения, как это определено в п. 5, a Y означает галоген.
8. Способ получения соединения формулы 1 или его фармацевтически приемлемой соли, включающий:
осуществление галогенирования соединения формулы 4 с получением соединения формулы 10;
реагирование соединения формулы 10 с R2H с получением соединения формулы 11 и
реагирование соединения формулы 11 с R1-NH2 с получением соединения формулы 1: 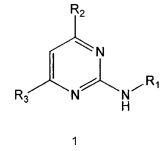
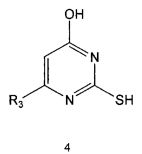
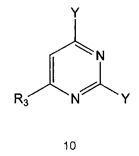
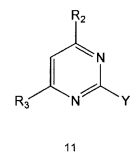
где R1, R2 и R3 имеют те же значения, как это определено в п. 5, a Y означает галоген.
| WO 9510506 A1, 20.04.1995 | |||
| ARVANITIS, ARGYRIOS G | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Journal of Medicinal Chemistry, 42(5), 805-818 (English) 1999 | |||
| (реферат, см | |||
| Реверсивный дисковый культиватор для тросовой тяги | 1923 |
|
SU130A1 |
| ИВАЩЕНКО А | |||
| В | |||
| и др., Синтез и | |||
Авторы
Даты
2016-06-27—Публикация
2012-02-24—Подача