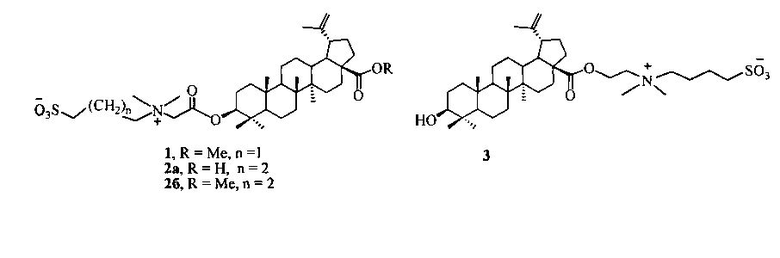
Изобретение относится к области органической и медицинской химии, в частности к способу получения новых потенциально биологически активных производных бетулиновой кислоты - сульфобетаинов с фрагментом 3-(диметиламмоний)пропан-1-сульфоната в положении C-3 и с фрагментом 4-(диметиламмоний)бутан-1-сульфоната в положениях C-3 или C-28 общей формулы (1, 2а, б, 3).
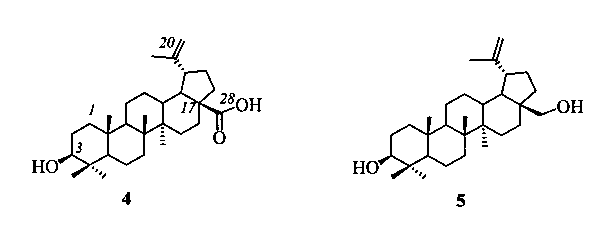
Бетулиновая (4) кислота, окисленное производное бетулина (5) - основного компонента коры березы, обладает широким спектром стартовой биологической активности, в том числе противоопухолевой, противовирусной, антимикробной и низкой токсичностью, что создает предпосылки для создания лекарственных препаратов на платформе пентациклических тритерпеноидов лупанового ряда.
В последние годы ассортимент модифицированных пентациклических тритерпеноидов лупанового ряда расширен за счет их ионных производных. На основе бетулиновой кислоты синтезированы аммонийные, трифенилфосфониевые соли, ионные производные с катионами бензалкония или холиния, проявившие значительно более высокую, по сравнению с природными соединениями, противоопухолевую и противомикробную активность.
Сведения о сульфобетаиновых (цвиттер-ионных) производных бетулиновой кислоты в литературе отсутствуют. Биомиметическая сульфобетаиновая группировка часто используется в дизайне биологически активных соединений с противовирусной, антибактериальной, противовоспалительной, антиаллергической активностью, апоптотическими свойствами, для улучшения растворимости биологически активных соединений, в создании био- и гемосовместимых материалов медицинского назначения, а также в дизайне наноносителей для адресной доставки лекарственных средств [WO 2012160187 A1, 2012; US 6136857, 2000; US 4183952, 1980; М. Krishnamoorthy, Sh. Hakobyan, M. Ramstedt, J.E. Gautrot, Chem. Rev. 2014. V. 114. №21. P. 10976-11026; J. Zhaoa, X. Zhaoa, Z. Jianga, Z. Lia, X. Fana, J. Zhua, H. Wua, Y. Sua, D. Yanga, F. Pana, J. Shib // Progress Polymer Science. 2014. V. 39. P. 1668-1720; Q. Jin, Y. Chen, Y. Wang, J. Ji. // Coll. Surfaces B: Biointerfaces. 2014. 124. P. 80-86; J. Cao, X. Xie, A. Lu, B. He, Y. Chen, Zh. Gu, X. Luo // Biomaterials. 2014. 35. P. 4517-4524].
Задача, на решение которой направлено заявляемое изобретение, заключается в разработке способа получения новых потенциально биологически активных производных бетулиновой кислоты - сульфобетаинов с фрагментами 3-(диметиламмоний)пропан- или 4-(диметиламмоний)бутан-1-сульфоната.
Техническим результатом изобретения является ранее не описанный тип производных бетулиновой кислоты и ее метилового эфира - сульфобетаинов, содержащих в положении С-3 фрагмент 3-(диметиламмоний)пропан-1-сульфоната (1) или 4-(диметиламмоний)бутан-1-сульфоната (2а), (2б) и производного бетулиновой кислоты с фрагментом 4-(диметиламмоний)бутан-1-сульфоната в положении С-28 (3).
Известен способ получения алкил-, алкиларил-, алкенил-, амидоалкилсульфобетаинов и амидоалкилсульфобетаинов стероидов кватернизацией соответствующих третичных алкил-, алкиларил-, алкенил-, амидоалкиламинов 1,3-пропан- или 1,4-бутансультоном. В зависимости от структуры субстрата реакцию проводят в растворе ацетона, ацетонитрила, 1,2-дихлорэтана (ДХЭ), тетрагидрофурана (ТГФ) или диметилформамида (ДМФА) при комнатной температуре, нагревании или при кипении растворителя при соотношении амин:сультон ~1÷1.1, 1÷2. [L. Sonnenschein, A. Seubert // Tetrahedron Letters. 2011. V. 52. №10. P. 1101-1104; R.S. Ward, J. Davies, G. Hodges, D.W. Roberts. // Synthesis. 2002. №16. P. 2431-2439; G. Qu, J. Cheng, J. Wei, T. Yu, W. Ding, H. Luan. // J. Surfact Deterg. 2011. 14. P. 31-35; WO 2012160187 A1, 2012, Z. Chua, Y. Fenga. // Synlett. 2009. №16. P. 2655-2658; RU 2079490, 1997; L.M. Hjelmeland // Prod. Nat. Acad. Sci. USA. 1980. V. 77. №11. P. 6368-6370; L.M. Hjelmeland, D.W. Nebert, J.C. Osborne Jr. // Anal. Biochem. 1983. 130. P. 72-82; US 2011/0071100 A1, 2011].
В качестве прототипа выбран способ получения алкил-, алкенил-арилсульфобетаинов [Т.A. Spenser, Т.J. Onofrey, R.O. Cann, J.S. Russel, L.E. Lee, D.E. Blanchard, A. Castro, P. Gu, G. Jiang, I. Shechter. // J. Org. Chem. 1999. V. 64. P. 807-818], заключающийся в том, что раствор соответствующего третичного N,N-диметил-R-амина (R = Alk, Ar, алкенил) в ДХЭ перемешивают при комнатной температуре с 1,3-пропан- или 1,4-бутансультоном (мольное соотношение амин : сультон ~1:1) в течение 24-43 ч, растворитель упаривают, полученный сырой продукт перекристаллизовывают из органического растворителя (EtOH, MeOH или их смеси с диэтиловым или изопропиловым эфиром).
Предлагаемый способ получения сульфобетаиновых (цвиттер-ионных) производных на основе бетулиновой (4) кислоты относится к получению нового типа производных в ряду пентациклических тритерпеноидов лупанового ряда.
По предлагаемому способу получение сульфобетаина с фрагментом 3-(диметиламмоний)пропан-1-сульфоната (1) осуществляют взаимодействием третичного тритерпенового пентациклического амина лупанового ряда - метилового эфира 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты (7) с 1,3-пропансультоном при мольном соотношении амин:сультон, равном 1:2, в среде безводного ДХЭ при кипячении в атмосфере аргона в течение 30 ч. Выпавший в ходе реакции осадок образующегося сульфобетаина отфильтровывают, промывают ДХЭ, высушивают в вакууме. Выход целевого соединения (1) составляет 79%.
Получение сульфобетаинов с фрагментом 4-(диметиламмоний)бутан-1-сульфоната (2а), (2б) или (3) осуществляют взаимодействием третичного тритерпенового пентациклического амина лупанового ряда - 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты (6) или метилового эфира 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты (7) или 2-(диметиламино)этилового эфира бетулиновой кислоты (8) с 1,4-бутансультоном при мольном соотношении амин:сультон равном 1:9÷10 в среде безводного ацетонитрила при кипячении в атмосфере аргона в течение 30 ч. Выпавший в ходе реакции осадок образующегося сульфобетаина отфильтровывают, промывают ацетонитрилом и высушивают в вакууме. Выход целевых сульфобетаинов (2а), (2б) и (3) составляет 48, 39 и 27% соответственно.
3β-(2-(Диметиламино)ацетокси)бетулиновую кислоту (6) синтезировали в четыре стадии из бетулина (5), который выделяли из коры березы по методу [RU 2270201, 2006]. На первой стадии, по разработанному нами ранее способу, проводили селективную защиту первичного гидроксила бетулина винильной группой методом прямого винилирования бетулина (5) ацетиленом в суперосновной среде КОН-ДМСО [А.В. Орлов, Н.Г. Комиссарова, О.В. Шитикова // Химия в интересах устойчивого развития. 2011. Т 19. С. 223-226]. В результате последующего ацилирования 3β-OH-группы в образующемся 28-O-виниловом эфире бетулина (9) 2-хлоруксусной кислотой в присутствии N,N-дициклогексилкарбодиимида (DCC) и диметиламинопиридина (DMAP), обработки реакционной массы 10% HCl и очистки продукта флэш-хроматографией на SiO2 получали 3β-(2-хлорацетокси)бетулин (10) с выходом 65%. Окисление 3β-(2-хлорацетокси)бетулина (10) вначале пиридинийхлорхроматом (PCC) с образованием соответствующего альдегида, очистка его методом флэш-хроматографии на SiO2 и окисление действием NaClO2 приводили к 3β-(2-хлорацетокси)бетулиновой кислоте (11). Аминирование последней
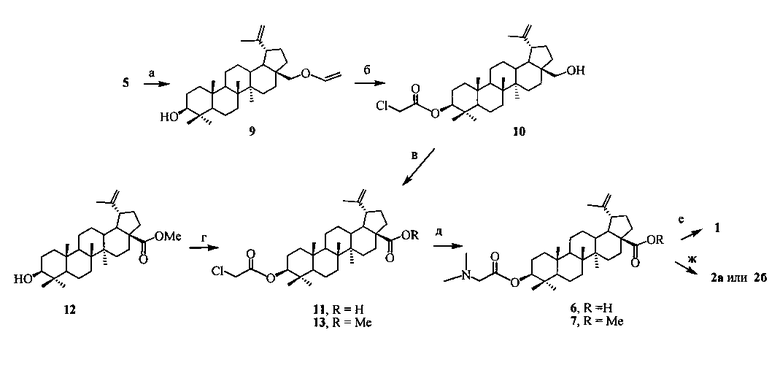
a. [лит.]; б. 1. ClCH2CO2H, DCC, DMAP, CH2Cl2; 2. 10% HCl, ч; в. 1. PCC, CH2Cl2, 2. NaClO2/NaH2PO4/2-метил-2-бутен, t-BuOH; г. ClCH2CO2H, DCC, DMAP, CH2Cl2; д. Me2NH (40% водн.), EtOH; е. 1,3-пропансультон, ДХЭ, кип. 30 ч; ж. 1,4-бутансультон, MeCN, кип. 30 ч.
N,N-диметиламином (40% водн.) при кипячении в спирте в течение 4 ч давало целевую 3β-(2-(диметиламино)ацетокси)бетулиновую кислоту (6), выход которой после очистки методом колоночной хроматографии (КХ) на SiO2 составил 93%. Метиловый эфир 3β-(2-(диметиламино)ацетокси)-бетулиновой кислоты (7) (выход 96%) синтезировали 3β-O-ацилированием 2-хлоруксусной кислотой метилового эфира бетулиновой кислоты (12), последующим аминированием образующегося метилового эфира 3β-(2-хлорацетокси)бетулиновой кислоты (13) N,N-диметиламином (40% водн.) в спирте при комнатной температуре в течение 1 ч и очистки сырого продукта методом КХ на SiO2. Выход соединения (7) составил 60%.
2-(Диметиламино)этиловый эфир бетулиновой кислоты (8), содержащий в положении С-28 третичный атом азота, синтезировали из 2-бромэтилового эфира бетулиновой кислоты (14) с выходом 98% аналогично аминам (6) и (7) при кипячении с избытком N,N-диметиламина (40% водн.) в спирте в течение 1 ч. 2-Бромэтиловый эфир бетулиновой кислоты (14) [D. Biedermann, В. Eignerova, М. Hajduch, J. Sarek // Synthesis. 2010. 22. P. 3839-3848], получали взаимодействием кислоты (4) с 1,2-дибромэтаном в ДМФА в присутствии K2CO3 с выходом 50%.
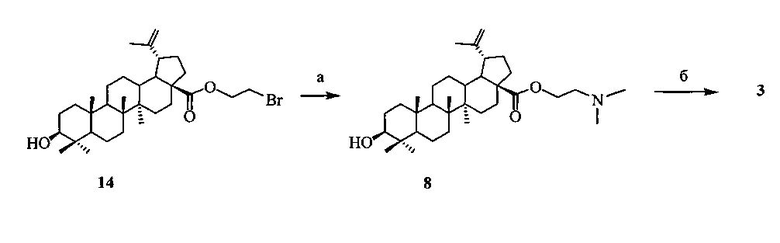
a: Me2NH (40% водн.), EtOH; б: 1,4-бутансультон, CH3CN, кипячение, 30 ч.
Таким образом, в заявленном изобретении разработан способ получения новых производных бетулиновой кислоты - сульфобетаинов с фрагментом 3-(диметиламмоний)пропан-1-сульфобетаина в положении C-3 и с фрагментом 4-(диметиламмоний)бутан-1-сульфобетаина в положениях C-3/C-28 тритерпенового остова, представляющих интерес в качестве потенциально биологически активных соединений для целей медицины.
Изобретение иллюстрируется следующими примерами.
Пример 1
3β-(2-Хлорацетокси)бетулин (10). Раствор 0.78 г (1.667 ммоль) винилового эфира (9), 0.32 г (3.333 ммоль), 2-хлоруксусной кислоты и 0.41 г (3.333 ммоль) DMAP в 30 мл безводн. CH2Cl2 перемешивали 5 мин, добавляли одной порцией 0.69 г (3.333 ммоль) DCC. Перемешивали в атмосфере Ar 30 мин, осадок отфильтровывали, фильтрат промывали 10 мл 10% HCl, водой, высушивали Na2SO4, растворитель упаривали, остаток очищали методом флэш-хроматографии на SiO2 (бензол:МТБЭ, 4:1). Получили 0.56 г (65%) 3β-(2-хлорацетокси)бетулина (10). Аморф. 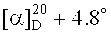
Пример 2
3β-(2-Хлорацетокси)бетулиновая кислота (11). К раствору 0.56 г (1.088 ммоль) соединения (10) в 30 мл безводн. CH2Cl2 при перемешивании в атмосфере Ar добавили одной порцией 0.70 г (3.263 ммоль) PCC, перемешивали 1 ч, разбавляли 30 мл метил-трет-бутилового эфира (МТБЭ), перемешивали 15 мин, реакционную массу фильтровали через слой Al2O3, растворитель упаривали, остаток очищали флэш-хроматографией на SiO2 (бензол:МТБЭ, 4:1), получили 0.56 г (98%) альдегида, который растворяли в 33 мл трет-бутанола, приливали 0.5 мл 2-метилбутена-2, прибавляли одновременно по каплям раствор 0.74 г (6.505 ммоль) NaClO2 в 5 мл воды и 0.78 г (6.505 ммоль) NaH2PO4 в 3 мл воды, перемешивали 40 мин, разбавляли водой (100 мл), экстрагировали CHCl3 (5×30 мл), органический слой высушивали Na2SO4, растворитель упаривали, остаток хроматографировали на SiO2 (бензол, бензол:МТБЭ, 4:1). Получили 0.40 г (70%) соединения (11) [Н. Kommera, G.N. Kaluderovic′, J. Kalbitz, R. Paschke. Arch. Pharm. Chem. Life Sci. 2010. 8. P. 449-457]. Аморф. 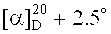
Пример 3
Метиловый эфир бетулиновой кислоты (12). К раствору 1.12 г (2.452 ммоль) бетулиновой кислоты (4) в 50 мл ТГФ добавили 35 мл раствора диазометана в диэтиловом эфире, перемешивали 10 мин, растворитель упаривали, остаток очищали методом флэш-хроматографии на SiO2 (бензол:МТБЭ, 4:1). Получили 1.1 г (96%) соединения (12). Т.пл. 222-224°C (лит.: Т.пл. 224-225°C). Спектры ЯМР 1H и 13C соответствуют литературным данным [H. Kojima, Н. Tominaga, S. Sato, Н. Ogura // Phytochemystry. 1987. V. 26, N. 4. P. 1107-1111].
Пример 4
Метиловый эфир 3β-(2-хлорацетокси)бетулиновой кислоты (13). К раствору 0.50 г (1.064 ммоль) метилового эфира бетулиновой кислоты (12) в 60 мл безводн. CH2Cl2 в атмосфере Ar добавили 0.20 г (2.128 ммоль) 2-хлоруксусной кислоты и 0.26 г (2.128 ммоль) DMAP. Перемешивали 5 мин, затем добавили 0.44 г (2.128 ммоль) DCC, перемешивали 20 мин, осадок N,N-дициклогексилмочевины отфильтровывали, органический слой промывали 20 мл 10% HCl, водой, высушивали Na2SO4, растворитель упаривали, остаток очищали флэш-хроматографией на SiO2 (бензол:МТБЭ, 4:1). Получили 0.55 г (94%) соединения (13). Аморф. 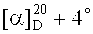
Пример 5
3β-(2-(Диметиламино)ацетокси)бетулиновая кислота (6). К суспензии 0.30 г (0.498 ммоль) хлорацетата бетулиновой кислоты (11) в 15 мл EtOH мл добавили 0.6 мл (4.975 ммоль) 1 N,N-диметиламина (40% водн.), кипятили 4 ч, растворитель упаривали, остаток очищали флэш-хроматографией на SiO2 (CHCl3:МеОН 10:1). Получили 0.25 г (93%) соединения (6). Аморф. 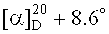
Пример 6
Метиловый эфир 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты (7). К раствору 0.20 г (0.338 ммоль) соединения (13) в 10 мл EtOH мл добавили 1.0 мл (3.384 ммоль) N,N-диметиламина (40% водн.). Перемешивали 1 ч при комнатной температуре, растворитель упаривали, остаток очищали флэш-хроматографией на SiO2 (бензол:МТБЭ 4:1). Получили 0.11 г (60%) соединения (7). Т.пл. 147-148°C. 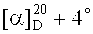
Пример 7
2-Бромэтиловый эфир бетулиновой кислоты (14). К суспензии 1.0 г (2.193 ммоль) бетулиновой кислоты (4) в 24 мл безводн. ДМФА в атмосфере Ar, добавили 0.30 г и (2.13 ммоль) прокаленного K2CO3. Перемешивали 20 мин, добавили по каплям 0.2 мл (2.193 ммоль) 1,2-дибромэтана в 1 мл ДМФА. Перемешивали при комнатной температуре 5 ч, отфильтровали K2CO3, фильтрат упарили, остаток хроматографировали на SiO2 (бензол, бензол:МТБЭ, 16:1). Получили 0.57 г (50%) соединения (14). Т.пл. 182-183°C (лит. 185°C (MeOH) [D. Biedermann, В. Eignerova, М. Hajduch, J. Sarek. // Synthesis. 2010. №22. P. 3839-3948]. ЯМР 1H (300.13 МГц, CDCl3, δ, м.д., J/Гц): 0.68 (1Н, д, J=8.0, Н-5), 0.75 (3H, с, CH3-24), 0.81 (3H, с, CH3-25), 0.91 (3H, с, CH3-26), 0.95 (6Н, с, CH3-23, CH3-27), 1.68 (3H, с, CH3-30), 1.92 (2Н, м, Hb-21, Hb-22), 2.17 (1H, дт, J=5.5, 11.0, Н-13), 2.29 (1H, дд, J=8.8, 1.8, Hb-6), 3.01 (1Н, дт, J=5.5, 10.5, Hb-19), 3. 18 (1H, дд, J=5.2, 11.0, Н-3), 3.53 (2Н, т, J=6.0, CH2Br), 4.39 (1Н, дт, J=15.0, 6.0, С(O)OCH2: Ha), 4.41 (1Н, дт, J=15.0, 6.0, C(O)OCH2:Hb), 4.60 (1Н, с, Ha-29), 4.73 (1Н, с, Hb-29). ЯМР 13C (75.47 МГц, CDCl3, δ, м.д., J/Гц): 14.72 (C-27), 15.37 (C-24), 16.01 (C-25), 16.13 (C-26), 18.29 (C-6), 19.37 (C-30), 20.88 (C-11), 25.53 (C-12), 27.40 (C-2), 27.99 (C-23), 29.17 (С(O)OCH2 CH2), 29.68 (C-15), 30.59 (C-21), 32.06 (C-16), 34.31 (C-7), 37.00 (C-22), 37.19 (C-10), 38.33 (C-13), 38.72 (C-1), 38.86 (C-4), 40.73 (C-8), 42.40 (C-14), 46.95 (C-19), 49.41 (C-18), 50.55 (C-9), 55.34 (C-5), 56.69 (C-17), 63.34 (С(O)OCH2CH2), 78.97 (C-3), 109.68 (C-29), 150.44 (C-20), 175.72 (C-28).
Пример 8
2-(Диметиламино)этиловый эфир бетулиновой кислоты (8). К раствору 0.26 г (0.443 ммоль) соединения (14) в 15 мл EtOH мл добавили 0.2 мл (4.434 ммоль) N,N-диметиламина (40% водн.). Перемешивали 1 ч при 20°C, растворитель упаривали, остаток очищали флэш-хроматографией SiO2 (бензол:МТБЭ 4:1). Получили 0.24 г (98%) соединения (8). Т.пл. 181-182°C. 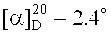
Пример 9
3-((2-(17β-метоксикарбониллуп-20(29)-ен-3β-илокси)-2-оксоэтил)диметиламмоний)пропан-1-сульфонат (1). К раствору 0.20 г (0.36 ммоль) третичного амина (7) в 3 мл безводн. ДХЭ в атмосфере Ar добавляли одной порцией 0.088 г (0.720 ммоль) 1,3-пропансультона, кипятили при перемешивании 30 ч. Выпавший осадок соединения (1) отфильтровывали, промывали ДХЭ (5 мл × 3), высушивали в вакууме (2 мм рт.ст., 80°C, 6 ч). Получили 0.19 г (79%) соединения (1). Т.пл. 285-287°C. 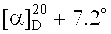
Пример 10
4-((2-(17β-карбоксилуп-20(29)-ен-3β-илокси)-2-оксоэтил)диметиламмоний)бутан-1-сульфонат (2а). К суспензии 0.10 г (0.185 ммоль) амина (6) в 3 мл безводн. CH3CN в атмосфере Ar добавляли по каплям раствор 0.17 мл (1.661 ммоль) 1,4-бутансультона в 1.0 мл безводн. CH3CN, кипятили 30 ч. Выпавший осадок сульфобетаина (2а) отфильтровывали, промывали CH3CN (5 мл × 5), высушивали в вакууме (2 мм рт.ст., 80°C, 6 ч). Получили 0.06 г (48%) соединения (2а). Т.пл. 288-290°C. 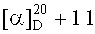
Пример 11
4-((2-(17β-метоксикарбониллуп-20(29)-ен-3β-илокси)-2-оксоэтил)диметиламмоний)бутан-1-сульфонат (2б). Получен аналогично соединению (2а) из 0.11 г (0.202 ммоль) соединения (7) и 0.20 мл (2.02 ммоль) 1,4-бутансультона. Выход 0.054 г (39%) соединения (2б). Т.пл. 283-286°C. 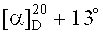
Пример 12
4-((2-(3β-Гидроксилуп-20(29)-ен-17β-карбонилокси)этил)диметиламмоний)бутан-1-сульфонат (3). Получен аналогично сульфобетаину (2а) из 0.12 г (0.224 ммоль) соединения (8) и 0.20 мл (2.02 ммоль) 1,4-бутансультона. Выход 0.04 г (27%) соединения (3). Т.пл. 265-267°C. 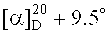
Структура соединений (1), (2а, б), (3) установлена методами ИК-, ЯМР-спектроскопии и масс-спектрометрии. Полное отнесение сигналов в спектрах ЯМР 1H и 13C проведено с использованием стандартного пакета 1D и 2D программ спектрометра "Bruker" Avance III (500.13 МГц (1H) и 125.47 МГц (13C)). В эксперименте использовали коммерческие 1,3-пропансультон (99%, «abcr GmbH & Co. KG»), 1,4-бутансультон (>99%, «Aldrich»), N,N-диметиламин (40% водн. «Fluka») и 2-хлоруксусную кислоту (99%, «Acros organics»).
| название | год | авторы | номер документа |
|---|---|---|---|
| Фосфониевые соли на основе бетулиновой кислоты, обладающие цитотоксической активностью в отношении аденокарциномы предстательной железы | 2018 |
|
RU2665922C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕТУЛИНОВОЙ КИСЛОТЫ | 2014 |
|
RU2565773C1 |
| НОВЫЕ N-МОДИФИЦИРОВАННЫЕ 5-МЕТИЛ-2'-ДЕЗОКСИЦИТИДИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКОЗНУЮ АКТИВНОСТЬ | 2021 |
|
RU2766333C1 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ ВЕЩЕСТВ | 2012 |
|
RU2551647C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛ 2-(1,11-ДИОКСА-4,8-ДИТИА-6-АЗАЦИКЛОТРИДЕКАН-6-ИЛ)АЛКАНОАТОВ | 2016 |
|
RU2632670C2 |
| 7-ТРИАЗОЛИЛ-ЗАМЕЩЕННЫЕ ГИДРОКСИСПИРОСТАНЫ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2023 |
|
RU2798105C1 |
| Антибактериальные средства на основе производных ципрофлоксацина | 2016 |
|
RU2636751C1 |
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| Гибридные производные урсоловой кислоты и галловой кислоты, содержащие 1,2,3-триазольные линкеры, обладающие антиоксидантной и противовоспалительной активностью | 2022 |
|
RU2802957C1 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ И УРСАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ШИСТОСОМОЗА | 2013 |
|
RU2576658C2 |
Изобретение относится к способу получения новых потенциально биологически активных производных бетулиновой кислоты - сульфобетаинов с фрагментом 3-(диметиламмоний)пропан-1-сульфоната в положении С-3 и с фрагментом 4-(диметиламмоний)бутан-1-сульфоната в положениях С-3 или С-28 общей формулы (1, 2а, б, 3). Способ заключается в том, что третичные пентациклические тритерпеновые амины - метиловый эфир 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты или 3β-(2-(диметиламино)ацетокси)бетулиновая кислота или 2-(диметиламино)этиловый эфир бетулиновой кислоты взаимодействует с 1,3-пропансультоном (мольное соотношение амин:сультон 1:2, растворитель 1,2-дихлорэтан) или 1,4-бутансультоном (мольное соотношение амин:сультон 1:9-10, растворитель ацетонитрил) при кипячении в течение 30 ч, приводя к целевым сульфобетаинам (1, 2а, б, 3) с выходом 27-79%. 2 н.п. ф-лы, 12 пр.
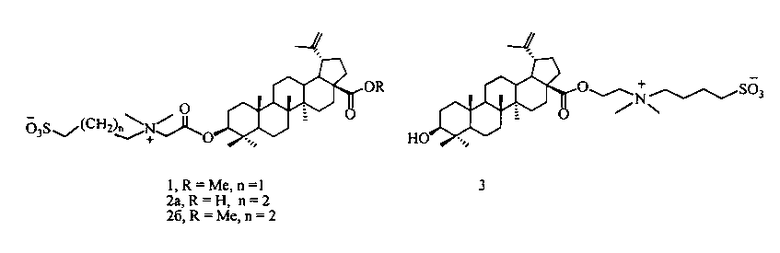
1. Способ получения сульфобетаина на основе бетулиновой кислоты формулы (1)
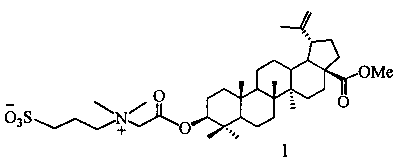
путем взаимодействия третичного амина с 1,3-пропансультоном в среде растворителя в течение 30 ч, отличающийся тем, что в качестве третичного амина используют третичный пентациклический тритерпеновый амин лупанового ряда - метиловый эфир 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты при мольном соотношении амин:сультон равном 1:2, в качестве растворителя - безводный 1,2-дихлорэтан, процесс протекает при кипячении в атмосфере аргона, с выпадением в осадок образующегося целевого продукта.
2. Способ получения сульфобетаинов на основе бетулиновой кислоты формулы (2а), (2б), (3)
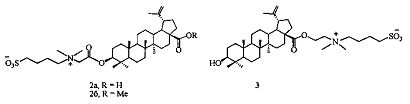
путем взаимодействия третичного амина с 1,4-бутансультоном в среде растворителя в течение 30 ч, отличающийся тем, что в качестве третичного амина используют третичный пентациклический тритерпеновый амин лупанового ряда - 3β-(2-(диметиламино)ацетокси)бетулиновую кислоту или метиловый эфир 3β-(2-(диметиламино)ацетокси)бетулиновой кислоты или 2-(диметиламино)этиловый эфир бетулиновой кислоты при мольном соотношении амин:сультон равном 1:(9-10), в качестве растворителя - безводный ацетонитрил, процесс проводят при кипячении в атмосфере аргона с выпадением в осадок образующегося целевого продукта.
| Thomas A | |||
| Spencer, Thomas J | |||
| Onofrey, Reginald O | |||
| Cann, Jonathon S | |||
| Russel et al "Zwitterionic Sulfobetaine Inhibitors of Squalene Synthase", J | |||
| Org | |||
| Chem., 1999, 64 (3), pp 807-818; | |||
| СПОСОБ ПОЛУЧЕНИЯ 2-[3-(N,N,N-ТРИАЛКИЛАММОНИО)-ПРОПИОНАМИДО]-2-МЕТИЛПРОПАНСУЛЬФОНАТОВ | 1995 |
|
RU2079490C1 |
| US 2011071100 A1, 24.03.2011. | |||
Авторы
Даты
2016-06-27—Публикация
2015-04-29—Подача