Изобретение относится к химии органических гетероциклических соединений, а именно к новым производным ципрофлоксацина общей формулы (I), проявляющим антибактериальные свойства. Соединения могут найти применение в медицине и ветеринарии.
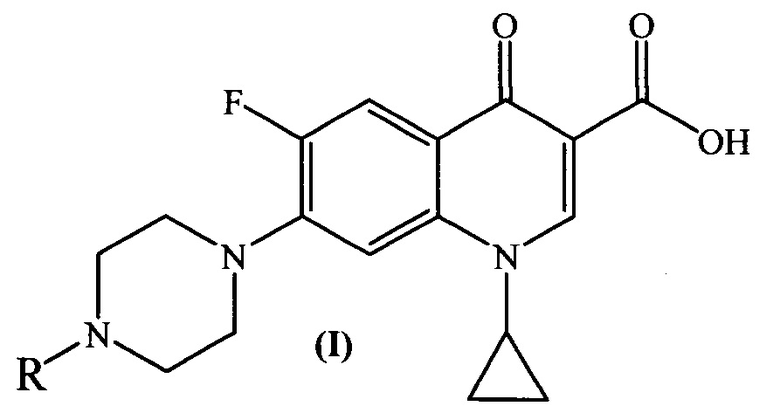
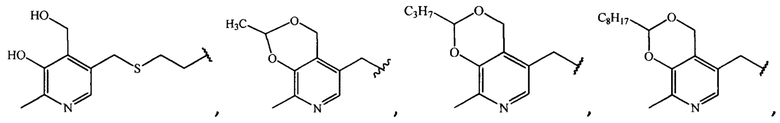
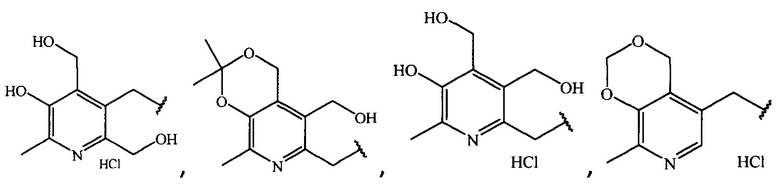
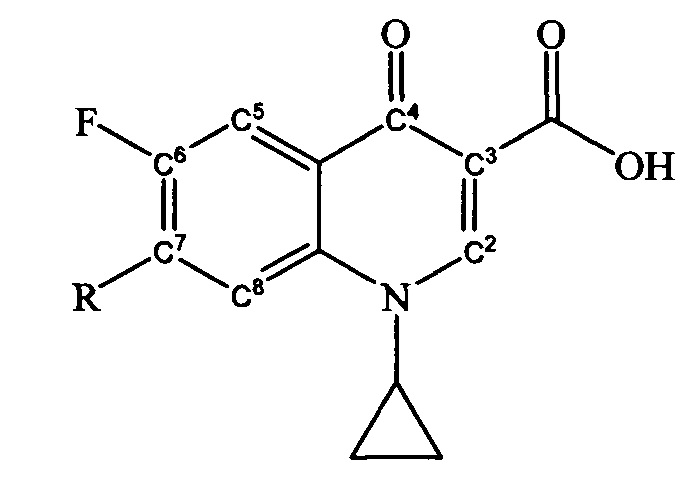
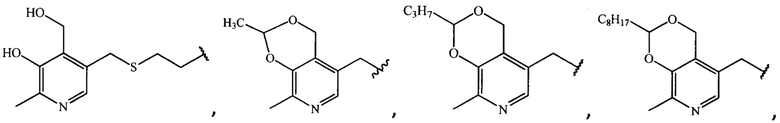
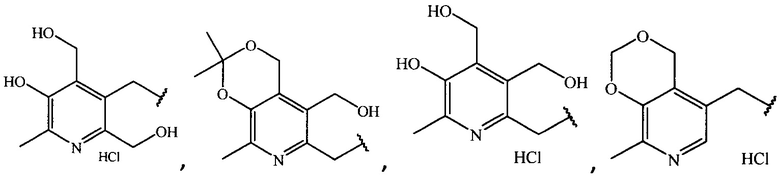
где R = 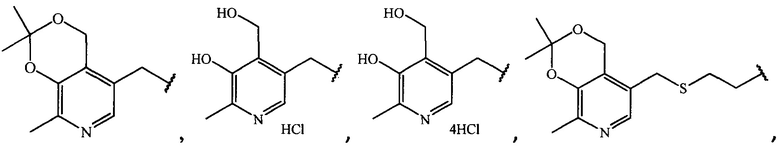
Поиск и направленный синтез высокоэффективных и безопасных антибактериальных средств является одной из первостепенных задач современной фармакологии и медицинской химии. В последние годы наблюдается заметный рост и распространенности инфекционных заболеваний, обусловленных появлением высокопатогенных штаммов микроорганизмов и повышением их резистентности к существующим антибиотикам.
Несмотря на наличие эпизодически возникающих острых бактериальных инфекций, например, вызванных мутировавшими штаммами кишечной палочки (O104:H4), одной из основных причин смертности в развитых странах остаются хорошо известные бактерии - стафилококк золотистый, кишечная и синегнойная палочки.
В частности, по данным ВОЗ, золотистый стафилококк возглавляет список бактерий, которыми наиболее часто заражаются в медицинских учреждениях. Особую опасность для человека представляют метициллин-устойчивые штаммы золотистого стафилококка, которые вызывают сепсис и тяжелые формы инфекций кожи и мягких тканей (фурункулезы, флегмона, синдром ошпаренной кожи), являясь причиной гибели до 31% зараженных ими пациентов.
Одним из наиболее эффективных антибактериальных препаратов, используемым в современной практике для подавления метициллин-устойчивых штаммов золотистого стафилококка, является препараты фторхинолонового ряда, в частности ципрофлоксацин. По химической структуре ципрофлоксацин относится к производным фторхинолонового ряда.
Механизм его действия заключается в подавлении бактериальной ДНК-гиразы (топоизомеразы II и IV, ответственные за процесс суперспирализации хромосомной ДНК вокруг ядерной РНК, что необходимо для считывания генетической информации), нарушении синтеза ДНК, роста и деления бактерий, что вызывает выраженные морфологические изменения (в том числе клеточной стенки и мембран) и быструю гибель бактериальной клетки.
Ципрофлоксацин оказывает антибактериальное действие с наибольшей активностью в отношении ряда аэробных грамотрицательных и грамположительных бактерий, а именно: Pseudomonas aeruginosa, Haemophilus influenzae, Escherichia coli, Shigella spp., Salmonella spp., Neisseria meningitidis, N. Gonorrhoeae, Staphylococcus spp. (продуцирующих и не продуцирующих пенициллиназу), некоторых штаммов Enterococcus spp., а также Campylobacter spp., Legionella spp., Mycoplasma spp., Chlamidia spp., Mycobacterium spp. [Яковлев В.П. Антибактериальные препараты группы фторхинолонов // Рус. мед. журн. - 1997, Вып. 5 - С. 1405-1413].
Ципрофлоксацин применяют при инфекционно-воспалительных заболеваниях, вызванных чувствительными к ципрофлоксацину микроорганизмами, в т.ч. при заболеваниях дыхательных путей, брюшной полости и органов малого таза, костей, суставов, кожи, септицемии, тяжелых инфекциях ЛОР-органов и др [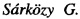 Quinolones: a class of antimicrobial agents // Vet. Med. - 2001 - V. 46 - P. 257-274].
Quinolones: a class of antimicrobial agents // Vet. Med. - 2001 - V. 46 - P. 257-274].
Существенным недостатком ципрофлоксацина является ограничение приема по возрасту - противопоказано назначение этого препарата детям и подросткам, так как он вызывает нарушение роста [Белобородова К.В., Падейская Е.Н., Бирюков А.В. Фторхинолоны в педиатрии - за и против // Педиатрия - 1996. Вып. 2. - С. 76-84].
Также к недостаткам ципрофлоксацина относят и довольно часто встречающиеся побочные проявления действия препарата - боль в животе, тошнота, дисбактериоз, бессонница, головокружение, проявление аллергических реакций (отек Квинке, крапивница, зуд). В последние годы отмечается значительный рост резистентности микроорганизмов ко всему классу фторхинолонов [Norrby S.R. Side-effects of quinolones: comparisons between quinolones and other antibiotics // Eur. J. Clin. Microbiol. Infect. Dis. - 1991 - V. 10 - P. 378-383].
На дату подачи заявленного технического решения известно, что резистентными к ципрофлоксацину являются большинство стафилококков, устойчивых к метициллину [Lowy F.D. Antimicrobial resistance: the example of Staphylococcus aureus // J. Clin. Invest. - 2003 - V. 111. - P. 1265-1273].
Исследование взаимоотношений структура-биологической активности в ряду производных ципрофлоксацина выявило, что наибольшее влияние на их биологическое действие оказывает природа заместителя при атоме C-7 [Emamia S., Shafiee A., Foroumadi A. Quinolones: Recent Structural and Clinical Developments // Iran. J. Pharm. Res. - 2005. - V. - P. 123-136].
Наиболее часто в качестве таких заместителей оказываются пяти- и шестичленные азотсодержащие гетероциклы, такие как пиперазин, пиримидин, 1,2,3-триазол, пирролидин и их замещенные производные.
В источнике [N. German, P. Wei, G.W. Kaatz и R.J. Kerns. Synthesis and evaluation of fluoroquinolone derivatives as substrate-based inhibitors of bacterial efflux pumps // Eur. J. Med. Chem. - 2008 - V. 43. - P. 2453-2463] описаны производные ципрофлоксацина, модифицированные по атому C-7 пиперазинового кольца фрагментами различных пептидов и замещенных диарилмочевин. Данные соединения проявили несколько меньшую антибактериальную активность по сравнению с ципрофлоксацином.
Модификация ципрофлоксацина по атому C-7 пиперазинового кольца аминогликозидным антибиотиком неомицином через мостик, содержащий 1,2,3-триазольный фрагмент, приводило к получению гибридных структур, проявляющих высокую антибактериальную активность в отношении штаммов грамотрицательных и грамположительных бактерий [V. Pokrovskaya, V. Belakhov, M. Hainrichson, S. Yaron and Т. Baasov Design, Synthesis, and Evaluation of Novel Fluoroquinolone-Aminoglycoside Hybrid Antibiotics // J. Med. Chem. - 2009 - V. 5. - P, 2243-2254].
В международной заявке [WO 2011034971 A1. Modified fluoroquinolone compounds and methods of using the samee / Designmedix, Inc - Опубл. - 24.03.2011] описаны производные ципрофлоксацина по атому С-7 пиперазинового кольца, существенно превосходящие его по антибактериальной активности в отношении штаммов грамположительных и грамотрицательных бактерий.
Следует обратить внимание на то, что существенным недостатком всех приведенных выше соединений является их высокая токсичность, которая не позволяет рассматривать их в качестве кандидатов в антибактериальные лекарственные средства.
Задачей заявленного технического решения является создание новых нетоксичных (безопасных) антибактериальных препаратов фторхинолонового ряда на основе ципрофлоксацина, обладающих высокой антибактериальной активностью, с целью расширения арсенала известных средств указанного назначения.
Техническим результатом заявленного технического решения является получение новых соединений общей формулы (I), содержащих в своем составе как фрагмент природного соединения (пиридоксина, входящего в группу витамина B6), так и фрагмент антибактериального препарата ципрофлоксацина.
Задача решается, и указанный технический результат достигается получением заявляемых новых производных ципрофлоксацина формулы (I):
согласно нижеприведенным схемам 1-7, где заявляемые соединения обозначены номерами I-1-I-12.
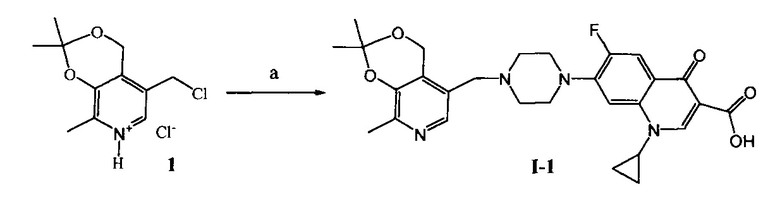
Схема 1. (a) N,N-Диметилформамид (далее ДМФА), ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч.
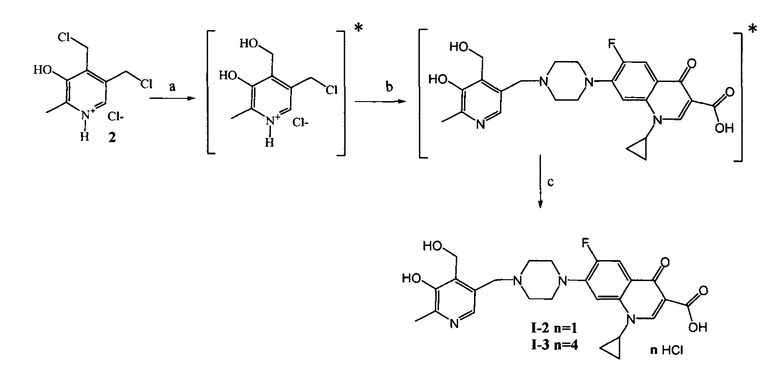
* в [] указаны не выделяемые промежуточные продукты
Схема 2. (a) H2O, 55°C, 3 ч; (b) H2O, ДМФА, ципрофлоксацин гидрохлорид, KI, NaHCO3, 55°C, 6 ч; (с) H2O, HCl.
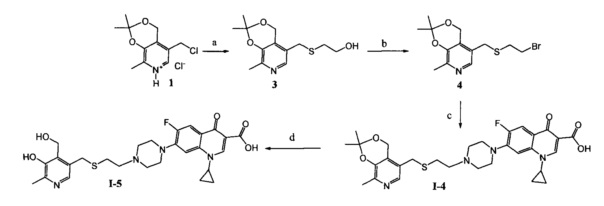
Схема 3. (a) CH3OH, SHCH2CH2OH, CH3ONa, 50°C, 5 ч; (b) CHCl3, NBS, PPh3, 20°C, 1 ч; (с) ДМФА, ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч; (d) H2O, HCl, 25°C, 24 ч.
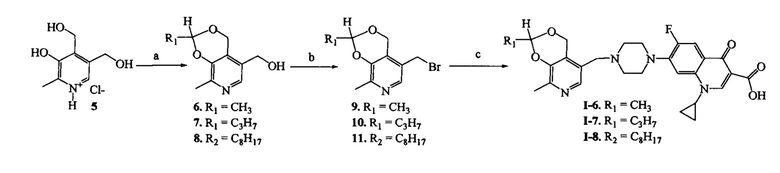
Схема 4. (a) СН3С(O)Н, HCl, 3-5°C, 3 ч или C6H6, R1C(O)H, p-TsOH, кипячение, 8 ч; (b) CHCl3, NBS, PPh3, 20°C, 1 ч; (с) ДМФА, ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч.

* в [] указан не выделяемый промежуточный продукт
Схема 5. (a) ДМФА, ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч. (b) H2O, HCl.
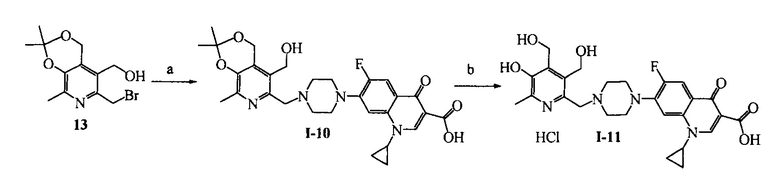
Схема 6. (a) ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч. (b) H2O, HCl, 25°C, 24 ч.
* в [] указан не выделяемый промежуточный продукт
Схема 7. (а) C6H6, параформ, p-TsOH, кипячение, 6 ч; (b) CHCl3, SOCl2, 20°C, 3 ч; (с) ДМФА, ципрофлоксацин, KI, NaHCO3, 80°C, 4 ч. (d) H2O, HCl.
Характеристики новых соединений, полученных в соответствии со схемами 1-7, приведены далее в примерах конкретного выполнения.
Структуры полученных соединений подтверждены методами масс-спектрометрии, 1H и 13C ЯМР-спектроскопии.
Спектры ЯМР регистрируют на приборе Bruker AVANCE-400. Химический сдвиг определяют относительно сигналов остаточных протонов дейтерированных растворителей (1H и 13C).
Температуры плавления определяют с помощью прибора Stanford Research Systems MPA-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводят методом TCX на пластинах Sorbfil Plates.
Масс-спектры MALDI регистрируют на приборе Ultraflex III компании Bruker, оборудованном твердотельным лазером и время-пролетным анализатором масс. Ускоряющее напряжение 25 кВ. Образцы наносят на мишень Anchor Chip. Запись спектров производят в режиме положительных ионов. Результирующий спектр представляет собой сумму 300 спектров, полученных в разных точках образца. В качестве матриц применяют 2,5-дигидроксибензойную кислоту (DHB) (Acros, 99%) и n-нитроанилин (PNA). Для приготовления матриц использовуют хлороформ. Нанесение образцов на мишень проводят методом «высушенных капель».
Примеры конкретного выполнения заявленного технического решения
Пример 1. Получение 1-циклопропил-6-фтор-7-(4-((2,2,8-триметил-4H-[1,3]диоксино-[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-1)
К раствору 1.44 г (5.5 ммоль) соединения (1) [Tomita I., Brooks H.G., Metzler D.E. Synthesis of vitamin B6 derivatives. II. 3-Hydroxy-4-hydroxymethyl-2-methyl-5-pyridine acetic acid and related substances // J. Heterocycl. Chem. - 1966 - V. 3., N. 2. - P. 178-183] в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 1.50 г (4.5 ммоль) ципрофлоксацина, 0.84 г (10.0 ммоль) гидрокарбоната натрия и 0.23 г (1.4 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 1.12 г (47%), светло-желтые кристаллы, т. пл. 243°C (разл).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.14-1.18 м (2Н, циклопропил CH2), 1.32-1.37 м (2Н, циклопропил CH2), 1.53 с (6Н, 2CH3), 2.36 с (3H, CH3), 2.61 м (4Н, 2CH2), 3.29 м (4Н, пиперазино 2CH2), 3.44 с (2Н, CH2N), 3.50-3.56 м (1H, циклопропил CH), 4.98 с (2Н, CH2O), 7.28 д (1H, 4JH-F=7.1 Гц, СНар), 7.78 д (1H, 3JH-F=13.1 Гц, CHap), 7.87 с (1H, CHap), 8.60 с (1Н, СНпир), 14.95 уш с (1H, OH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.18 с (циклопропил 2CH2), 18.43 с (CH3), 24.74 с (2CH3), 35.36 с (циклопропил CH), 49.79 д (4JC-F=4-7 Гц, пиперазино 2CH2), 52.55 с (пиперазино 2 CH2), 57.46 с (CH2), 58.77 с (CH2), 99.62 с (С(CH3)2), 104.86 с (Cap), 107.78 с (Сар), 112.00 д (2JC-F=23.5 Гц, Сар), 119.42 д (3JC-F=7.8 Гц, Сар), 126.32 (Спир), 126.48 с (Спир), 139.02 с (C), 140.42 с (С), 145.77 д (2JC-F=10.2 Гц, Cap-N), 146.13 с (С), 147.26 с (С), 147.52 с (С), 153.57 д (1JC-F=251.6 Гц, Cap-F), 166.86 с (C(О)OH), 176.83 д (4JC-F=2.2 Гц, C=O).
MALDI-MS: [М+Н]+ 523.
Пример 2. Получение гидрохлорида 1-циклопропил-6-фтор-7-(4-((5-гидрокси-4-гидроксиметил-6-метилпиридин-3-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-2)
Раствор 2.50 г (10.3 ммоль) 3-гидрокси-4,5-хлорметил-2-метилпиридиний гидрохлорида (2) [R. Serwa, T.G. Nam, L. Valgimigli, S. Culbertson, C.L Rector, B.S. Jeong, D.A. Pratt, N.A. Porter. Preparation and Investigation of Vitamin B6-Derived Aminopyridinol Antioxidants // Chem. Eur. J. - 2010 - V. 16., N. 46. - P. 14106-14114] в 25 мл дистиллированной воды перемешивают 3 ч при 55°C. К полученному раствору добавляют 75 мл диметилформамида, 3.60 г (9.8 ммоль) ципрофлоксацина гидрохлорида и 3.38 г (40.2 ммоль) гидрокарбоната натрия. По окончании активного выделения газа (~2 минуты) добавляют 0.25 г (1.50 ммоль) йодистого калия. Полученный раствор перемешивают в течение 6 ч при 55°C. По окончании перемешивания растворитель удаляют в вакууме. К сухому остатку добавляют 100 мл дистиллированной воды и кипятят 30 минут. Нерастворившийся осадок отфильтровывают в вакууме.
Осадок переносят в кругл о донную колбу на 100 мл, добавляют 50 мл дистиллированной воды и подкисляют концентрированной соляной кислотой до pH=2.56. Растворитель удаляют в вакууме.
Сухой остаток переносят в круглодонную колбу на 100 мл, заливают 60 мл воды и при перемешивании нейтрализовывают добавлением NaHCO3 до pH=6.00. Выпавший осадок отфильтровывают, переносят в кругло донную колбу на 100 мл, добавляют 50 мл дистиллированной воды и подкисляют концентрированной соляной кислотой до pH=2.56. Раствор высушивают в вакууме. Выход 2.75 г (54%), т. пл. не ниже 190°C (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ м.д.: 1.19-1.20 м (2Н, циклопропил CH2), 1.30-1.32 м (2Н, циклопропил CH2), 2.64 с (3H, CH3), 3.52 уш с (4Н, пиперазино 2CH2), 3.69-3.71 уш с (4Н, пиперазино 2CH2), 3.86 с (1H, циклопропил СН), 4.70 с (2Н, CH2), 4.96 с (2Н, CH2), 7.60 д (1Н, 4JH-F=7.3 Гц, CHap), 7.95 д (1H, 3JH-F=13.0 Гц, СНар), 8.67 с (1H, СН), 8.72 с (1H, CH).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м.д.: 7.66 с (циклопропил 2CH2), 15.63 с (CH3), 36.03 с (циклопропил СН), 46.32 с (пиперазино 2CH2), 50.71 с (пиперазино 2CH2), 52.76 с (CH2), 55.52 с (CH2), 106.86 с (Сар), 107.00 с (Сар), 111.25 д (2JC-F=23.2 Гц, Сар), 119.39 д (3JC-F=8.1 Гц, Сар), 126.42 с (Спир), 135.37 с (Спир), 139.11 с (С), 143.70 д (2JC-F=10.4 Гц, Cap-N), 144.01 с (С), 144.18 с (С), 148.30 с (С), 152.20 с (С), 152.88 д (1JC-F=248.9 Гц, Cap-F), 165.90 с (C(О)OH), 176.42 с (С=O).
MALDI-MS: [M-Cl]+ 483.
Пример 3. Получение тетрагидрохлорида 1-циклопропил-6-фтор-7-(4-((5-гидрокси-4-гидроксиметил-6-метилпиридин-3-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-3)
Раствор 2.50 г (10.3 ммоль) 3-гидрокси-4,5-хлорметил-2-метилпиридиний гидрохлорида (2) [R. Serwa, T.G. Nam, L. Valgimigli, S. Culbertson, C.L. Rector, B.S. Jeong, D.A. Pratt, N.A. Porter. Preparation and Investigation of Vitamin B6-Derived Aminopyridinol Antioxidants // Chem. Eur. J. - 2010 - V. 16., N. 46. - P. 14106-14114] в 25 мл дистиллированной воды перемешивают 3 ч при 55°C. К полученному раствору добавляют 75 мл диметилформамида, 3.60 г (9.8 ммоль) ципрофлоксацина гидрохлорида и 3.38 г (40.2 ммоль) гидрокарбоната натрия. По окончании активного выделения газа (~2 минуты) добавляют 0.25 г (1.50 ммоль) йодистого калия. Полученный раствор перемешивают в течение 6 ч при 55°C. По окончании перемешивания растворитель удаляют в вакууме. К сухому остатку добавляют 100 мл дистиллированной воды и кипятят 30 минут. Нерастворившийся осадок отфильтровывают в вакууме.
Осадок переносят в кругл о донную колбу на 100 мл, добавляют 50 мл дистиллированной воды и 5 мл концентрированной соляной кислоты. Растворитель удаляют в вакууме. Выход 4.23 г (65%), т. пл. не ниже 220°C (разл.).
Доказательство структуры тетрагидрохлорида проводят с использованием метода аргентометрического титрования. Исследование проводят на автоматическом титраторе Metrohm Basic Titrino 794 (дозирование с точностью до 1 мкл). Реактивы: вода дист., нитрат серебра AgNO3, ≈1% раствор хромата калия K2CrO4.
Приготовление раствора титранта: Vк.=100 мл, m(AgNO3)=1.70750 г, Mr(AgNO3)=169.87 г/моль, c(AgNO3)=0.1005 M. После приготовления титрант заполняют дозирующее устройство титратора.
Приготовление раствора образца: Vк.=100 мл, m(образца)=0.49140 г, Mr(I-3)=482.51 г/моль, Mr(HCl)=36.46 г/моль, ω(H2O)=8.16%, m(образца без воды)=0.45130 г.
Процедура титрования: титрование проводят по методу Мора (прямое аргентометрическое титрование в присутствии хромата калия). Аликвоту исследуемого раствора (Vал.=20 мл) переносят в стаканчик, куда помещают перемешивающий стержень. pH исходного раствора около 2.2 доводят до значения 9.5 концентрированным раствором КОН (при pH около 4 выпадает осадок, который растворяется при pH около 9). Затем добавляют 4-5 капель хромата калия (раствор окрашивается в желтый цвет), погружается носик дозатора и выполняют медленное титрование. Сначала в растворе появляется осадок хлорида серебра и раствор приобретает лимонно-желтую окраску. Затем при добавлении титранта появляется красный осадок хромата серебра, который при перемешивании дает оранжевое окрашивание, исчезающее со временем (сначала быстро, но по мере приближения к точке эквивалентности медленнее). Конец титрования определяют по оранжевой окраске, неисчезающей в течение 2-3 минут.
Результаты титрования: объем титранта (Vтитранта) по результатам четырех измерений составляет: 5.898 мл, 5.828 мл, 5.752 мл и 5.807 мл.
Vсредн.=5.821±0.060 мл
с(HCl)=c(AgNO3)*Vсредн./Vал.=0.02925±0.00030 M
ν(HCl)=c(HCl)*Vк.=0.002925±0.000030 моль
m(HCl)=(HCl)*Mr(HCl)=0.1066±0.0011 г
m(I-3)=m(образца без воды)-m(HCl)=0.3447±0.0011 г
ν(I-3)=m(I-3)/Mr(I-3)=0.0007144±0.0000023 моль
n(HCl)=ν(HCl)/ν(I-3)=4.094±0.042
Таким образом, в состав соединения I-3 входят 4 молекулы хлороводорода.
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ м.д.: 0.99-1.03 м (2Н, циклопропил CH2), 1.23-1.28 м (2Н, циклопропил CH2), 2.56 с (3H, CH3), 3.52 уш м (9Н, пиперазино 4CH2 + циклопропил CH), 4.61 с (2Н, CH2), 4.98 с (2Н, CH2), 7.26 д (1Н, 3JH-F=12.9 Гц, CHap), 7.30 д (1H, 4JH-F=7.2 Гц, CHap), 8.30 с (1Н, СН), 8.41 с (1H, CH).
Спектр ЯМР 13C (100 МГц, ДМСО-d6+D2O) δ, м.д.: 9.12 c (циклопропил 2CH2), 16.83 с (CH3), 37.75 с (циклопропил CH), 48.05 д (4JC-F=4.8 Гц, пиперазино 2CH2), 53.25 с (пиперазино 2 CH2), 56.42 с (CH2), 58.20 с (CH2), 107.23 с (Сар), 108.26 с (Сар), 112.30 д (2JC-F=22.9 Гц, Cap), 120.34 д (3JC-F=8.4 Гц, Сар), 127.49 с (Спир), 136.11 с (Спир), 140.46 с (C), 145.56 д (2JC-F=10.2 Гц, Cap-N), 146.61 с (С), 147.40 с (С), 149.79 с (С), 154.17 с (С), 154.82 д (1JC-F=251.6 Гц, Cap-F), 170.25 с (C(О)OH), 177.40 с (С=O).
MALDI-MS: [M-4Cl]+ 483.
Пример 4. Получение 1-циклопропил-6-фтор-7-(4-(2-(((2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)сульфанил)этил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-4)
Стадия 1. Получение 5-(((2-гидроксиэтил)сульфанил)метил)-2,2,8-триметил-4H-[1,3]-диоксино[4,5-с]пиридина (3)
К раствору 0.52 г (22.4 ммоль) натрия в 10 мл абсолютного метанола добавляют 2.69 г (10.2 ммоль) соединения (1) [Tomita I., Brooks H.G., Metzler D.E. Synthesis of vitamin B6 derivatives. II. 3-Hydroxy-4-hydroxymethyl-2-methyl-5-pyridine acetic acid and related substances // J. Heterocycl. Chem. - 1966 - V. 3., N. 2. - P. 178-183], после чего добавляют при охлаждении 1.14 г (14.6 ммоль) меркаптоэтанола. Реакционную смесь перемешивают в течение 5 часов при 50°C. Выпавший осадок отфильтровают, растворитель удаляют в вакууме. Сухой остаток растворяют в минимальном количестве хлороформа и очищают с помощью колоночной хроматографии (элюент - хлороформ, затем этилацетат). Выход 1.74 г (64%), белые кристаллы, т. пл. 103-104°C. Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.53 с (6Н, 2CH3), 2.37 с (3H, CH3), 2.61 т (2Н, 3JHH=6.1 Гц, 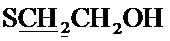
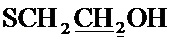
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 18.42 с (CH3), 24.82 с (2CH3), 30.07 с 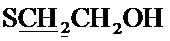
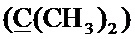
Стадия 2. Получение 5-(((2-бромэтил)сульфанил)метил)-2,2,8-триметил-4H-[1,3]диоксино[4,5-с]пиридина (4)
К раствору 1.74 г (6.5 ммоль) соединения (3) в 20 мл абсолютного хлороформа при 20°C добавляют 1.70 г (6.5 ммоль) трифенилфосфина и 1.16 г (6.5 ммоль) бромсукцинимида. Через 1 ч раствор концентрируют в вакууме и очищают с помощью колоночной хроматографии (элюент - диэтиловый эфир : петролейный эфир = 2:1). Выход 1.42 г (66%), светло-коричневое масло.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.54 с (6Н, 2CH3), 2.39 с (3H, CH3), 2.86 т (2Н, 3JHH=7.6 Гц, 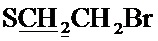
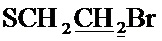
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 18.60 c (CH3), 24.85 с (2CH3), 30.18 с 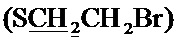
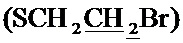
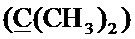
Стадия 3. Получение 1-циклопропил-6-фтор-7-(4-(2-(((2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)сульфанил)этил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-4)
К раствору 0.49 г (1.5 ммоль) соединения (4) в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 0.46 г (1.4 ммоль) ципрофлоксацина, 0.12 г (1.4 ммоль) гидрокарбоната натрия и 0.05 г (0.4 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 0.41 г (51%), светло-желтые кристаллы, т. пл. 206-208°C (разл).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.16-1.20 м (2Н, циклопропил CH2), 1.35-1.40 м (2Н, циклопропил CH2), 1.54 с (6Н, 2CH3), 2.38 с (3H, CH3), 2.60-2.62 м (4Н, пиперазино 2CH2), 2.64-2.67 м (4Н, 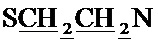
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.33 с (циклопропил 2CH2), 18.60 с (CH3), 24.85 с (2CH3), 28.75 с (CH2), 30.57 с (CH2), 35.40 с (циклопропил CH), 49.82 д (4JC-F=4.8 Гц, пиперазино 2CH2), 52.74 с (пиперазино 2CH2), 57.81 с (CH2), 58.53 с (CH2), 99.87 с 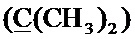
MALDI-MS: [М+Н]+ 583.
Пример 5. Получение 1-циклопропил-6-фтор-7-(4-(2-(((5-гидрокси-4-гидроксиметил-6-метилпиридин-3-ил)метил)сульфанил)этил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-5)
0.24 г (0.4 ммоль) производного ципрофлоксацина (I-4) и 1 мл конц. HCl в 20 мл воды перемешивают 24 ч при 25°C. Далее раствор нейтрализовывают с помощью гидрокарбоната натрия до рН=6. Выпавший осадок отфильтровывают и промывают последовательно ацетоном, хлороформом и водой. Выход 0.12 г (52%), светло-коричневые кристаллы, т. пл. 135-140°C (разл).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.18 уш с (2Н, циклопропил CH2), 1.32 уш с (2Н, циклопропил CH2), 2.32 с (3H, CH3), 2.58-2.64 м (8Н, пиперазино 2CH2, SCH2CH2N), 3.32-3.36 м (4Н, пиперазино 2CH2), 3.61-3.67 м (1H, циклопропил СН), 3.80 (2Н, CH2N), 4.82 с (2Н, CH2O), 5.88 уш с (1Н, ОН), 7.56 уш с (1H, CHap), 7.82 с (1H, CHap), 7.88 д (1Н, 3JH-F=13.2 Гц, CHap), 8.65 с (1Н, СНпир), 9.32 уш с (1Н, ОН).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м.д.: 7.57 с (циклопропил 2CH2), 19.31 с (CH3), 28.01 с (CH2), 29.80 с (CH2), 35.88 с (циклопропил СН), 49.32 с (пиперазино 2CH2), 52.06 с (пиперазино 2CH2), 56.48 с (CH2), 57.26 с (CH2), 106.38 д (4JC-F=2.7 Гцо, Cap), 108.18 с (Сар), 110.91 д (2JC-F=23.1 Гц, Сар), 118.56 д (3JC-F=7.8 Гц, Сар), 129.95 с (Спир), 131.42 с (Спир), 139.16 с (С), 140.33 с (С), 145.13 д (2JC-F=10.1 Гц, Cap-N), 146.01 с (С), 147.96 с (С), 150.07 с (С), 153.01 д (1JC-F=249.6 Гц, Cap-F), 165.94 с (C(О)OН), 176.34 с (С=O).
MALDI-MS: [М+Н]+ 543.
Пример 6. Получение 1-циклопропил-6-фтор-7-(4-((2,8-диметил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-6)
Стадия 1. Получение 5-гидроксиметил-2,8-диметил-4H-[1,3]диоксино[4,5-с]пиридина (6)
Через суспензию 12.00 г (59.0 ммоль) гидрохлорида пиридоксина (5) в 150 мл ацетальдегида, при охлаждении до 3-5°C и перемешивании пропускают 39.00 г (1070.0 ммоль) хлороводорода. Полученную реакционную смесь перемешивают в течение 20 ч. Осадок отфильтровывают, промывают эфиром и нейтрализуют водным раствором поташа. Продукт отфильтровывают и перекристаллизовывают из этилового спирта. Выход 5.65 г (50%), бесцветные кристаллы, т. пл. 125°C [RU 02466728. Фосфониевые соли на основе производных пиридоксина / Штырлин Ю.Г., Штырлин Н.В., Пугачев М.В. - Опубл. - 20.11.2012].
Стадия 2. Получение 5-бромметил-2,8-диметил-4H-[1,3]диоксино[4,5-c]пиридина (9)
К раствору 0.99 г (5.1 ммоль) соединения (6) в 20 мл абсолютного хлороформа при 20°C добавляют 1.34 г (5.1 ммоль) трифенилфосфина и 0.91 г (5.1 ммоль) бромсукцинимида. Через 1 ч раствор концентрируют в вакууме и очищают с помощью колоночной хроматографии (элюент - диэтиловый эфир : петролейный эфир = 2:1). Выход 0.45 г (34%), светло-желтое маслообразное вещество.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.57 д (3H, 3JHH=5.1 Гц, 

Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 18.59 с (CH3), 20.62 с (CH3), 26.74 с (CH2Br), 63.47 с (CH2O), 97.32 с 
Стадия 3. Получение 1-циклопропил-6-фтор-7-(4-((2,8-диметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (1-6). К раствору 0.38 г (1.5 ммоль) соединения (9) в 30 мл абсолютного ДМФА при 20°C последовательно добавляют 0.41 г (1.2 ммоль) ципрофлоксацина, 0.10 г (1.2 ммоль) гидрокарбонат натрия и 0.06 г (0.4 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 0.31 г (49%), светло-желтые кристаллы, т. пл. 233°C (разл).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.17-1.20 м (2Н, циклопропил CH2), 1.33-1.38 м (2Н, циклопропил CH2), 1.58 д (3H, 3JH-H=5.1 Гц, CH3), 2.41 с (3H, CH3), 2.61-2.63 м (4Н, пиперазино 2CH2), 3.28-3.31 м (4Н, пиперазино 2CH2), 3.43, 3.46 (AB-система, 2Н, 2JH-H=-13.4 Гц, CH2N), 3.49-3.53 м (1Н, циклопропил CH), 5.02, 5.08 (AB-система, 2Н, 2JH-H=-16.2 Гц, CH2O), 5.18 к (1H, 3JH-H=5.1 Гц, СН), 7.30 д (1H, 4JH-F=7.0 Гц, CHap), 7.89 д (1Н, 3JH-F=13.1 Гц, CHap), 7.92 с (1H, CHap), 8.67 с (1H, СНпир), 14.95 уш с (1Н, OH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.30 с (циклопропил 2CH2), 18.43 с (CH3), 20.76 с (2CH3), 35.39 с (циклопропил СН), 49.91 д (4JC-F=4.7 Гц, пиперазино 2CH2), 52.62 с (пиперазино 2CH2), 57.59 с (CH2), 64.49 с (CH2), 97.21 с 
Пример 7. Получение 1-циклопропил-6-фтор-7-(4-((8-метил-2-пропил-4Н-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-7)
Стадия 1. Получение 5-гидроксиметил-8-метил-2-пропил-4H-[1,3]диоксино[4,5-c]-пиридина (7)
В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 7.00 г (34.4 ммоль) гидрохлорида пиридоксина (5), 13.70 г (72.1 моль) моногидрата n-толуолсульфокислоты и 6.50 мл (72.2 ммоль) масляного альдегида в бензола. Реакционную массу кипятят 8 ч, затем растворитель отгоняют в вакууме, нейтрализовывают до pH=7 водным раствором гидрокарбоната натрия. Выпавший осадок отфильтровают и промывают бензолом. Выход 5.58 г (73%), белые т. пл. 101°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.99 т (3H, 3JHH=7.4 Гц, 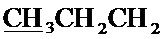
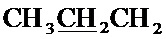
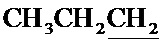
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.01 с (C3H7), 17.08 с (C3H7), 18.17 с (CH3), 36.41 с (C3H7), 60.04 с (CH2O), 64.27 с (CH2O), 99.97 с 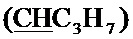
Стадия 2. Получение 5-бромметил-8-метил-2-пропил-4H-[1,3]диоксино[4,5-c]пиридина (10)
К раствору 2.97 г (13.3 ммоль) соединения (7) в 20 мл абсолютного хлороформа при 20°C добавляют 3.49 г (13.3 ммоль) трифенилфосфина и 2.37 г (13.3 ммоль) бромсукцинимида. Через 1 ч раствор концентрируют в вакууме и очищают с помощью колоночной хроматографии (элюент - диэтиловый эфир : петролейный эфир = 2:1). Выход 1.56 г (41%), белое маслообразное вещество.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.00 т (3H, 3JHH=7.4 Гц, 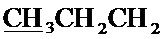
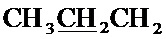
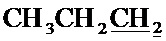
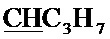
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.02 с (C3H7), 17.07 с (C3H7), 18.49 с (CH3), 26.73 с (C3H7), 36.35 с (CH2Br), 63.63 с (CH2O), 100.13 с 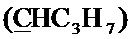
Стадия 3. Получение 1-циклопропил-6-фтор-7-(4-((8-метил-2-пропил-4Н-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-7)
К раствору 1.51 г (5.3 ммоль) соединения (10) в 30 мл абсолютного ДМФА при 20°C последовательно добавляют 1.44 г (4.4 ммоль) ципрофлоксацина, 0.37 г (4.4 ммоль) гидрокарбоната натрия и 0.15 г (1.3 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 0.6 г (26%), светло-желтые кристаллы, т. пл. 237-239°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.99 т (3H, 3JHH=7.4 Гц, C3H7), 1.13-1.19 м (2Н, циклопропил CH2), 1.34-1.37 м (2Н, циклопропил CH2), 1.49-1.60 м (2Н, C3H7), 1.77-1.89 (2Н, C3H7), 2.39 с (3H, CH3), 2.60-2.62 м (4Н, пиперазино 2CH2), 3.27-3.29 м (4Н, пиперазино 2CH2), 3.41, 3.45 (AB-система, 2Н, 2JH-H=-13.2 Гц, CH2N), 3.52 м (1H, циклопропил СН), 5.00, 5.08 (AB-система, 2Н, 2JH-H=-16-2 Гц, CH2O), 5.02 к (1H, 3JH-H=5.2 Гц, СН), 7.29 д (1H, 4JH-F=7.0 Гц, CHap), 7.84 д (1H, 3JH-F=13.1 Гц, CHap), 7.90 с (1H, CHap), 8.63 с (1H, СНпир), 14.94 уш с (1Н, ОН).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.26 с (циклопропил 2CH2), 13.99 с (C3H7), 17.07 с (C3H7), 18.29 с (CH3), 35.39 с (C3H7), 36.43 с (циклопропил СН), 49.85 д (4JC-F=4.7 Гц, пиперазино 2CH2), 52.59 с (пиперазино 2CH2), 57.56 с (CH2), 64.54 с (CH2), 99.92 с 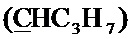
MALDI-MS: [M-H]+ 535.
Пример 8. Получение 1-циклопропил-6-фтор-7-(4-((8-метил-2-октил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-8)
Стадия 1. Получение 5-гидроксиметил-2-октил-8-метил-4H-[1,3]диоксино[4,5-c]пиридина (8)
В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 7.00 г (34.4 ммоль) гидрохлорида пиридоксина (5), 13.70 г (72.1 моль) моногидрата н-толуолсульфокислоты и 5.90 мл (34.4 ммоль) нонилового альдегида в 120 мл бензола. Реакционную массу кипятят 8 ч, затем растворитель отгоняют в вакууме. Остаток нейтрализовают до pH=7 водным раствором гидрокарбоната натрия. Выпавший осадок отфильтровают и промывают петролейным эфиром. Выход 8.26 г (82%), белые кристаллы, т. пл. 175°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.88 т (3H, 3JHH=6.6 Гц, CH3), 1.28-1.38 (10H, C8H17), 1.49-1.57 м (2Н, C8H17), 1.80-1.94 м (2Н, C8H17), 2.39 с (3H, CH3), 3.30 уш с (1H, ОН), 4.53 с (2Н, CH2O), 4.99 с (2Н, CH2O), 5.00 к (1H, 3JHH=5.2 Гц, СН), 7.83 с (1Н, CH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.25 с (C8H17), 18.33 с (CH3), 22.80 с (C8H17), 23.71 с (С8Н17), 29.35 с (C8H17), 29.51 с (C8H17), 29.60 с (C8H17), 31.99 с (C8H17), 34.42 с (C8H17), 60.38 с (CH2O), 64.32 с (CH2O), 100.21 с 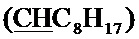
Стадия 2. Получение 5-бромметил-2-октил-8-метил-4H-[1,3]диоксино[4,5-c]пиридина (11)
К раствору 2.99 г (10.2 ммоль) соединения (8) в 20 мл абсолютного хлороформа при 20°C добавляют 2.67 г (10.2 ммоль) трифенилфосфина и 1.82 г (10.2 ммоль) бромсукцинимида. Через 1 ч раствор концентрируют в вакууме и очищают с помощью колоночной хроматографии (элюент - диэтиловый эфир : петролейный эфир = 2:1). Выход 1.89 г (52%), белые кристаллы, т. пл. 175°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.87 т (3H, 3JHH=7.2 Гц, C8H17), 1.26-1.34 (10H, C8H17), 1.48-1.55 м (2Н, C8H17), 1.79-1.93 м (2Н, C8H17), 2.41 с (3H, CH3), 4.28, 4.33 (AB-система, 2Н, 2JHH=-10.8 Гц, CH2O), 4.96 с (2Н, CH2Br), 4.99 т (1H, 3JHH=5.2 Гц, 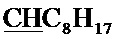
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.18 с (C8H17), 18.55 с (CH3), 22.74 с (C8H17), 23.62 с (C8H17), 26.74 с (C8H17), 29.28 с (C8H17), 29.43 с (C8H17), 29.54 с (CH2Br), 31.93 с (C8H17), 34.30 с (C8H17), 63.58 с (CH2O), 100.26 с 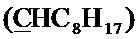
Стадия 3. Получение 1-циклопропил-6-фтор-7-(4-((8-метил-2-октил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-8)
К раствору 1.20 г (3.4 ммоль) соединения (11) в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 0.93 г (2.8 ммоль) ципрофлоксацина, 0.24 г (2.8 ммоль) гидрокарбоната натрия и 0.10 г (0.8 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 0.91 г (54%), желтые кристаллы, т. пл. 89-93°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.86 т (3H, 3JHH=6.8 Гц, С8Н17), 1.15-1.18 м (2Н, циклопропил CH2), 1.23-1.38 м (12Н, C8H17), 1.48-1.54 м (2Н, циклопропил CH2), 1.82-1.90 м (2Н, C8H17), 2.41 с (3H, CH3), 2.61-2.63 м (4Н, пиперазино 2CH2), 3.29-3.33 м (4Н, пиперазино 2CH2), 3.41, 3.45 (AB-система, 2Н, 2JH-H=-13.2 Гц, CH2N), 3.52 м (1H, циклопропил CH), 5.01, 5.09 (AB-система, 2Н, 2JH-H=-16.2 CH2O), 5.12 к (1Н, 3JH-H=5.2 Гц, СН), 7.30 д (1H, 4JH-F=7.0 Гц, CHap), 7.88 д (1Н, 3JH-F=13.1 Гц, CHap), 7.91 с (1Н, CHap), 8.66 с (1H, СНпир), 14.95 уш с (1Н, OH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.29 с (циклопропил 2CH2), 14.18 с (C8H17), 18.39 с (CH3), 22.73 с (C8H17), 23.70 с (C8H17), 29.28 с (C8H17), 29.46 с (C8H17), 29.55 с (C8H17), 31.93 с (C8H17), 34.44 с (C8H17), 35.39 с (циклопропил CH), 49.90 д (4JC-F=4.6 Гц, пиперазино 2CH2), 52.62 с (пиперазино 2CH2), 57.60 с (CH2), 64.58 с (CH2), 100.13 с 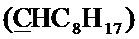
MALDI-MS: [M-H]+ 605.
Пример 9. Получение гидрохлорида 1-циклопропил-6-фтор-7-(4-((5-гидрокси-2,4-бис(гидроксиметил)-6-метилпиридин-3-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-9)
К раствору 0.71 г (2.8 ммоль) соединения (12) [M.V. Pugachev, N.V. Shtyrlin, E.V. Nikitina, LP. Sysoeva, T.I. Abdullin, A.G. Iksanova, A.A. Ilaeva, E.A. Berdnikov, R.Z. Musin, Yu.G. Shtyrlin Synthesis and antibacterial activity of novel phosphonium salts on the basis of pyridoxine // Bioorg. Med. Chem. - 2013. - V. 21, Iss. 14. - P. 4388-4395.] в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 0.79 г (2.4 ммоль) ципрофлоксацина, 0.44 г (5.2 ммоль) гидрокарбоната натрия и 0.12 г (0.7 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. После перекристализации добавляют 15 мл 0.1 Н раствора HCl и отгоняют растворитель в вакууме. Выход 0.84 г (65%), светло-желтые кристаллы, т. пл. 190-195°C (разл).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.15-1.19 уш м (2Н, циклопропил CH2), 1.28-1.34 м (2Н, циклопропил CH2), 2.37 с (3H, CH3), 2.66 уш с (4Н, пиперазино 2CH2), 3.27 уш с (4Н, пиперазино 2CH2), 3.30 с (2Н, CH2), 3.73 с (2Н, CH2), 3.79 м (1H, циклопропил СН), 4.56 с (2Н, CH2), 4.78 с (2Н, CH2), 6.00 уш с (1H, ОН), 7.54 д (1H, 4JH-F=7.4 Гц, CHap), 7.87 д (1Н, 3JH-F=13.3 Гц, CHap), 8.64 с (1Н, CHap), 9.15 уш с (1H, ОН).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м.д.: 7.48 с (циклопропил 2CH2), 19.28 с (CH3), 35.80 с (циклопропил СН), 49.44 д (4JC-F=4.6 Гц, пиперазино 2CH2), 51.60 с (пиперазино 2CH2), 53.41 с (CH2), 56.17 с (CH2), 63.26 с (CH2), 106.49 с (4JC-F=3.1 Гц, Cap), 106.72 с (Cap), 110.85 д (2JC-F=23.0 Гц, Cap), 118.68 д (3JC-F=7.7 Гц, Cap), 127.72 с (Спир), 135.03 с (Спир), 139.08 с (С), 144.39 с (С), 144.95 д (2JC-F=10.2 Гц, Cap-N), 147.91 с (С), 148.79 с (С), 149.44 с (С), 152.97 д (1JC-F=249.6 Гц, Cap-F), 165.82 с (С(О)ОН), 176.31 с (С=O).
MALDI-MS: [М+2Н-Cl]+ 514.
Пример 10. Получение 1-циклопропил-6-фтор-7-(4-((5-гидроксиметил-2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-6-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-10)
К раствору 1.30 г (4.3 ммоль) соединения (13) [M.V. Pugachev, N.V. Shtyrlin, S.V. Sapognikov, L.P. Sysoeva, AG. Iksanova, E.V. Nikitina, R.Z. Musin, O.A. Lodochnikova, E.A. Berdnikov, Yu.G. Shtyrlin Bis-phosphonium salts of pyridoxine: the relationship between structure and antibacterial activity // Bioorg. Med. Chem. - 2013. - V. 21, Iss. 23. - P. 7330-7342] в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 1.29 г (3.9 ммоль) ципрофлоксацина, 0.33 г (3.9 ммоль) гидрокарбоната натрия и 0.14 г (1.2 ммоля) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 0.94 г (44%), светло-желтые кристаллы, т. пл. 225°C (разл).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.16 уш с (2Н, циклопропил CH2), 1.33 уш с (2Н, циклопропил CH2), 1.54 с (6Н, 2CH3), 2.38 с (3H, CH3), 2.79 уш с (4Н, пиперазино 2CH2), 3.29 уш с (4Н, пиперазино 2CH2), 3.49 уш с (1H, циклопропил СН), 3.84 с (2Н, CH2N), 4.44 с (2Н, CH2O), 4.94 с (2Н, CH2O), 7.29 уш с (1H, CHap), 7.89 д (1Н, 3JH-F=12.3 Гц, CHap), 8.67 с (1Н, CHap), 14.93 уш с (1H, ОН).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.30 с (циклопропил 2CH2), 18.39 с (CH3), 24.79 с (2CH3), 35.43 с (циклопропил СН), 49.63 с (пиперазино 2CH2), 52.27 с (пиперазино 2 CH2), 57.71 с (CH2), 58.99 с (CH2), 63.07 с (CH2), 99.65 с 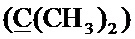
MALDI-MS: [М+Н]+ 553.
Пример 11. Получение гидрохлорида 1-циклопропил-6-фтор-7-(4-((5-гидрокси-3,4-бис(гидроксиметил)-6-метилпиридин-2-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-11)
0.91 г (1.7 ммоль) соединения (I-10) и 1 мл конц. HCl в 20 мл воды 24 ч при 25°C. Далее раствор нейтрализовывают с помощью гидрокарбоната натрия = 6. Выпавший осадок отфильтровывают и промывают последовательно ацетоном, хлороформом и водой. После промывания осадка добавляют 17 мл 0.1H раствора отгоняют растворитель в вакууме. Выход 0.69 г (76%), светло-желтые кристаллы, 212-215°C (разл).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.18 уш с (2Н, циклопропил CH2), 1.33 уш с (2Н, циклопропил CH2), 2.44 с (3H, CH3), 3.44 уш с (4Н, пиперазино 2CH2), 3.66 уш с (4Н, пиперазино 2CH2), 3.84 уш с (1H, циклопропил СН), 4.48 с (2Н, CH2), 4.62 с (2Н, CH2O), 4.80 с (2Н, CH2O), 5.90 уш с (1H, ОН), 7.60 уш с (1Н, CHap), 7.91 д (1H, 3JH-F=12.9 Гц, CHap), 8.65 с (1H, CHap), 9.69 уш с (1H, ОН), 15.10 уш с (1H, ОН).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м.д.: 7.62 с (циклопропил 2CH2), 19.26 с (CH3), 35.97 с (циклопропил СН), 46.60 с (пиперазино 2CH2), 51.15 с (пиперазино 2CH2), 55.92 с (CH2), 56.03 с (CH2), 57.27 с (CH2), 106.80 с (Cap), 111.13 д (2JC-F=23.6 Гц, Cap), 119.18 д (3JC-F=7.7 Гц, Cap), 133.50 с (Спир), 134.00 с (Спир), 139.05 с (C), 143.85 д (2JC-F=10.1 Гц, Cap-N), 145.67 с (С), 148.08 с (С), 150.07 с (С), 152.81 д (1JC-F=249.5 Гц, Cap-F), 165.81 с (С(О)ОН), 176.32 с (С=O).
MALDI-MS: [M+H-Cl]+ 513.
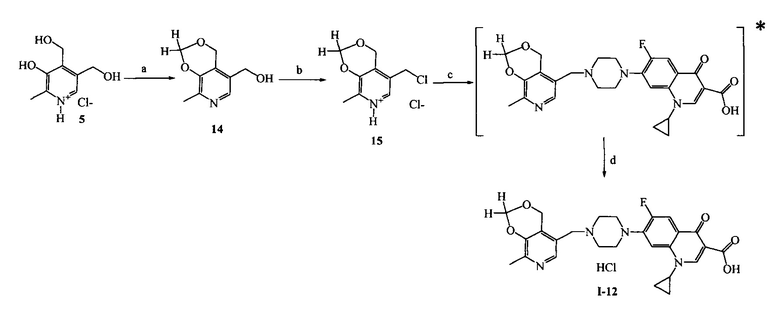
Пример 12. Получение гидрохлорида 1-циклопропил-6-фтор-7-(4-((8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-12)
Стадия 1. Получение 5-гидроксиметил-8-метил-4H-[1,3]диоксино[4,5-c]пиридина (14)
В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 20.00 г (97.0 ммоль) гидрохлорида пиридоксина (5), 92.50 г (486.8 ммоль) моногидрата п-толуолсульфокислоты и 5.84 г (194.6 ммоль) параформа в 150 мл бензола. Реакционную массу кипятят 6 ч, затем растворитель отгоняют в вакууме. К полученной смеси добавляют раствор 24.50 г (612.5 ммоль) гидроксида натрия в 150 мл воды и нейтрализовают до pH=7 разбавленной соляной кислотой. Продукт экстрагируют этилацетатом, который затем отгоняют, а сухой остаток сначала промывают водой и затем диэтиловым эфиром. Выход 1.10 г (6%), кристаллическое вещество серого цвета. Т. пл. 112-113°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 2.36 с (3H, CH3), 4.09 уш с (1Н, ОН), 4.49 с (2Н, CH2O), 4.96 с (2Н, CH2O), 5.26 с (2Н, OCH2O),7.77 c (1Н, СН).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 18.21 с (CH3), 59.97 с (CH2O), 64.04 с (CH2O), 91.20 с (OCH2O), 128.17 с (Спир), 130.31 с (Спир), 139.43 с (Спир), 147.43 c (Спир), 147.58 c (Спир).
Стадия 2. Получение 5-хлорметил-8-метил-4H-[1,3]диоксино[4,5-c]пиридин гидрохлорида (15)
В раствор 1.00 г (5.5 ммоль) соединения (14) в 20 мл хлороформа добавляют 2.50 мл (34.4 ммоль) хлористого тионила. Полученную реакционную смесь перемешивают при 20°C в течение 3 ч. Растворитель удаляют в вакууме. Выход количественный, белое кристаллическое вещество, т. пл. 190-192°C (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 2.54 с(3H,CH3), 4.89 с (2Н, CH2O), 5.21 с (2Н, CH2O), 5.49 с (2Н, OCH2O), 8.43 с (1Н, СН).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м.д.: 14.76 с (CH3), 39.03 с (CH2Cl), 63.11 с (CH2O), 91.72 с (OCH2O), 130.46 с (Спир), 133.64 с (Спир), 135.52 с (Спир), 144.21 с (Спир), 148.92 с (Спир).
Стадия 3. Получение гидрохлорида 1-циклопропил-6-фтор-7-(4-((8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (1-12)
К раствору 0.50 г (2.1 ммоль) соединения 15 в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 0.63 г (1.9 ммоль) ципрофлоксацина, 0.34 г (4.1 ммоль) гидрокарбоната натрия и 0.16 г (1.0 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80°C. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. К полученному осадку добавляют 6.4 мл 0.1 Н раствора HCl и отгоняют растворитель в вакууме. Выход:0.34 г (34%), светло-желтое кристаллическое вещество.
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.18-1.22 м (2Н, циклопропил CH2), 1.36-1.41 м (2Н, циклопропил CH2), 2.44 с (3H, CH3), 3.45-3.88 м (9Н, пиперазино 4CH2 + циклопропил СН), 4.41 с (2Н, CH2N), 5.41 с (2Н, CH2), 5.45 с (2Н, CH2), 7.60 д (1H, 4JH-F=7.4 Гц, CHap), 7.96 д (1Н, 3JH-F=13.0 Гц, CHap), 8.66 с (1Н, CHap), 8.68 с (1H, СНпир), 12.0 уш с (1H, OH).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м.д.: 7.61 с (циклопропил 2CH2), 15.50 с (CH3), 35.97 с (циклопропил CH), 46.12 с (пиперазино 2CH2), 50.53 с (пиперазино 2CH2), 51.58 с (CH2), 64.28 с (CH2), 91.33 с (CH2), 106.86 с (Cap), 106.91 с (Cap), 111.22 д (2JC-F=23.0 Гц, Cap), 119.35 д (3JC-F=6.9 Гц, Cap), 139.09 с (C), 148.25 с (C), 148.57 с (С), 153.83 д (1JC-F=249.4 Гц, Cap-F), 165.83 с (C(О)ОН), 176.39 с (С=O).
MALDI-MS: [M+H]+ 496.
Пример 13. Исследование антибактериальной активности заявленных производных на основе ципрофлоксацина
Измерение антибактериальной активности проводилось на штаммах Staphylococcus aureus ATCC 29213 (музейный штамм), Staphylococcus epidermidis (клинический изолят), Micrococcus luteus (клинический изолят), Bacillus subtilis 168 (музейный штамм), Escherichia coli ATCC 25922 (музейный штамм), Salmonella typhimurium TA100 (музейный штамм), Pseudomonas aeruginosa АТСС 27853 (музейный штамм). Сравнительная оценка спектра антибактериального действия на эталонных штаммах и клинических изолятах грамположительных микроорганизмов проводилась с использованием микрометода определения минимальной подавляющей концентрации (МПК) методом серийных разведений в бульоне Мюллера-Хинтон с использованием 96-луночных стерильных планшетов.
Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост, принято считать минимальной подавляющей концентрацией (МПК).
Для приготовления инокулюма (инфекционного материала, используемого для искусственного заражения), предназначенного для исследования антибактериальной активности, использовали чистую, суточную культуру бактерий, выросших на плотной питательной среде (агаризованная среда LB). В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 0.5 по стандарту МакФарланда (1.5⋅108 КОЕ/мл). Затем полученный инокулят разводили до концентрации 107 КОЕ/мл LB-бульоном. Инокулюм использовали в течение 15 минут после приготовления; чистота бактериальных штаммов контролировалась перед каждым экспериментом.
В лунки каждого планшета вносили по 100 мкл бульона Мюллера-Хинтон; в первую лунку вносили испытуемое основание в концентрации 128 мкг/мл в объеме 100 мкл и последовательным двукратным разведением доводили его концентрацию до 0.25 мкг/мл. Затем в каждую лунку вносили приготовленный инокулюм, разводя тем самым вдвое концентрацию изучаемых соединений (до 64.0 мкг/мл). Каждый препарат в эксперименте титровали трижды. В качестве контроля включали лунки, не содержащие тестируемых препаратов (контроль роста культуры). Кроме того, ставился контроль чистоты питательных сред и растворителей. Планшеты инкубировали в термостате при 36°C в течение 24 часов.
Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них.
Наиболее близким по химическому строению к заявленным антибактериальным веществам является ципрофлоксацин, который был выбран в качестве прототипа и препарата сравнения. Также в качестве препаратов сравнения заявителем использован «антибиотик последней надежды» ванкомицин и один из наиболее эффективных препаратов фторхинолонового ряда - моксифлоксацин.
Как видно из представленных в таблице 1 данных, практически все заявленные соединения обладают выраженной антибактериальной активностью по отношению к исследуемым штаммам микроорганизмов. При этом наиболее активными оказались соединения I-2, I-3, I-9 и I-12, антибактериальное действие которых по отношению к грамположительным микроорганизмам оказалось сопоставимым с препаратами сравнения.
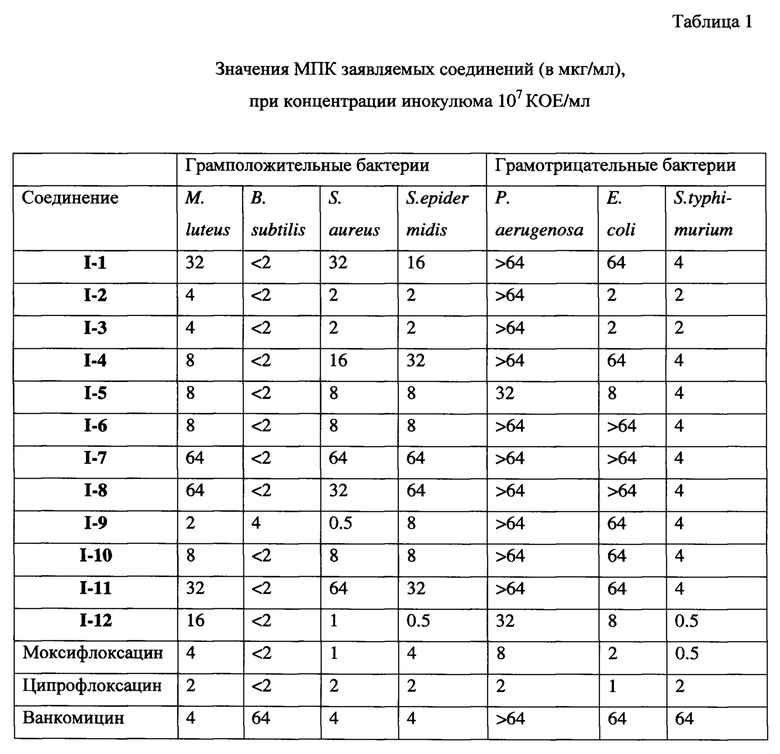
Для одного из наиболее активного соединения I-2 было проведено углубленное исследование антибактериальной активности на клинических штаммах микроорганизмов (S. aureus MRSA), представленных в таблице 2. В качестве препаратов сравнения использовались ванкомицин, ципрофлоксацин и цефтриаксон.
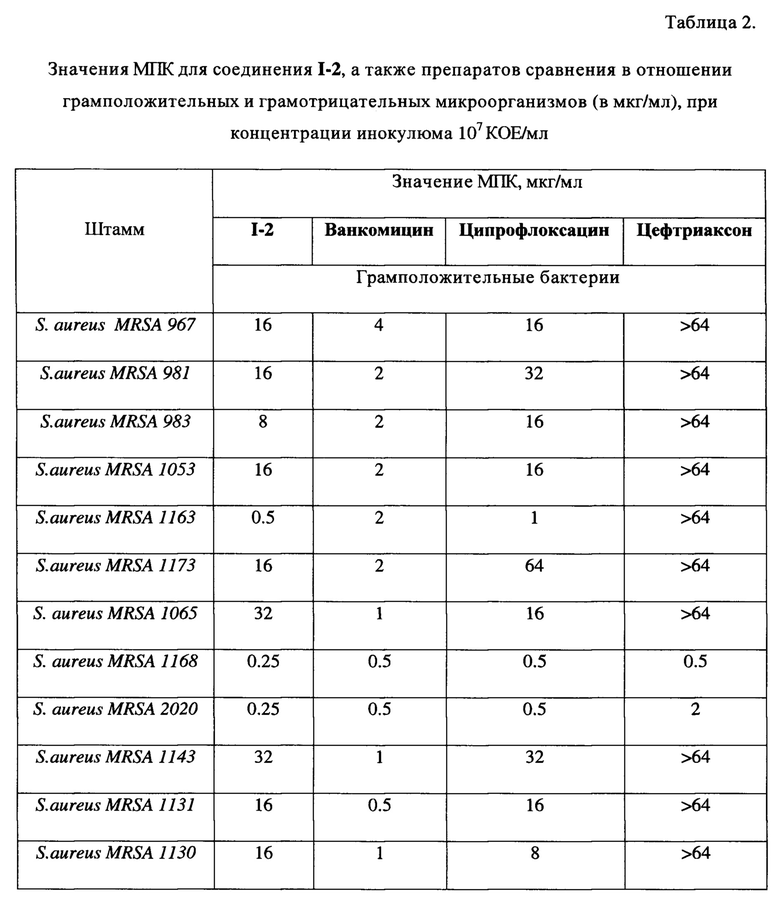
Как видно из представленных в таблицах 1 и 2 данных, соединения показали сопоставимые с ципрофлоксацином по показателям МПК по отношению к грамположительным бактериям результаты, а в случае некоторых штаммов превосходят его. На клинических свежевыделенных штаммах Staphylococcus aureus MRSA по показателю МПК I-2 практически во всех случаях превосходит цефтриаксон. В отношении грамотрицательных штаммов бактерий соединение I-2 проявляет низкую антибактериальную активность.
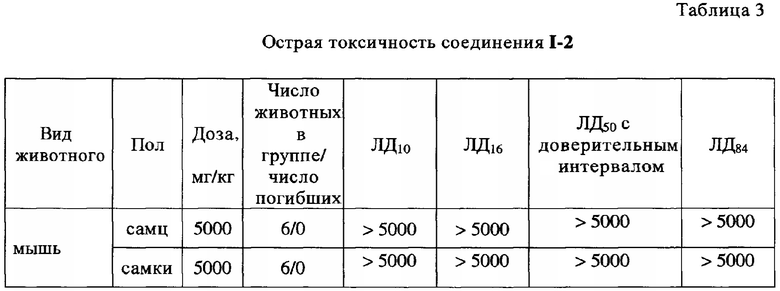
Пример 14. Исследование общей острой токсичности соединения I-2 на мышах при внутрижелудочном введении
Острую токсичность соединения I-2 исследовали по методу фиксированной дозы на мышах линии ICR (CD-I) (6-8 недель, 20-25 г) обоего пола, по 6 голов в группе. Начальная доза для исследования соединения I-2 - 5000 мг/кг. Использовали внутрижелудочное (пероральное) введение соединения I-2 животным (<2.5 мл/100 г) с применением желудочного зонда.
При введении дозы 5000 мг/кг соединения I-2 мышам обоего пола наблюдалось небольшое угнетение активности, вызванное механическим воздействием на животных. Через 20-30 минут поведение животных нормализовалось. Через 1.5-2 часа животные начинали принимать корм и воду. На протяжении всего опыта падежа животных не наблюдалось.
В ходе всего эксперимента все основные показатели жизнедеятельности у подопытных животных соответствовали норме и не отличались от контрольных. У мышей отмечался хороший аппетит, блестящая шерсть, видимые слизистые оболочки были бледно-розового цвета, поведение соответствовало данному виду животному, никаких отклонений при наблюдении выявлено не было.
В конце эксперимента проводили эвтаназию и патоморфологическое вскрытие контрольных и подопытных животных. При вскрытии мышей никаких изменений не наблюдалось. Контрольные и опытные животные не отличались друг от друга. При вскрытии павших мышей, получавших внутрижелудочно соединение I-2, наблюдали следующую картину. Трупы животных правильного телосложения, средней упитанности. Естественные отверстия: рот - закрыт, язык находится в ротовой полости, слизистая оболочка губ, десен бледно-розовые гладкие, блестящие. Носовые отверстия - слизистая бледно-розовая, сухая, истечений нет, проходимость хорошая. Ушные раковины без изменений, наружный слуховой проход чистый. Анус - закрыт, слизистая оболочка бледно-розовая. Шерсть удерживается хорошо, шерстный покров блестящий. Кожа эластичная, подкожная клетчатка хорошо выражена, желтоватого цвета, эластичная. Мышцы красноватого цвета, хорошо развиты, сухожилия и связки белого цвета, эластичные, прочные. Конфигурация костей и суставов не нарушена. Положение органов грудной и брюшной полостей: анатомически правильное. Жидкости в грудной и брюшной полостях нет. Проходимость глотки и пищевода не нарушена. Сердце в объеме не изменено. В полостях сердца содержится незначительное количество несвернувшейся крови, эндокард гладкий, блестящий. Легкие от бледно-розового до красного цвета, неравномерно окрашенные, дольчатость выражена хорошо. Селезенка не увеличена в объеме, края острые, продолговатой формы, упругой консистенции, красно-коричневого цвета. Печень не увеличена в размере, края острые, форма не изменена, консистенция плотная, цвет вишневый. Желудок содержит кормовую массу серого цвета, однородной консистенции. Слизистая оболочка желудка бледно-серого цвета. Слизистая оболочка тонкого и толстого отделов кишечника бледно-розового или бледно-серого цвета. Почки бобовидной формы, темно-коричневого цвета, в околопочечной клетчатке содержится умеренное количество жира, капсула отделяется легко, граница между корковой и мозговой зонами выражена. Мочевой пузырь пустой или переполнен мочой светло-желтого цвета, слизистая оболочка бледно-розового цвета. Половые органы без отклонений. У самцов семенники упругой консистенции, находятся в полости мошонки, имеют эллиптическую форму. У самок яичники и матка в норме. Головной мозг не отечен, мозговое вещество упругой консистенции, без кровоизлияний.
Среднесмертельная доза для соединения I-2 на мышах выявлена не была, поскольку при введении соединения I-2 в дозе 5000 мг/кг падеж не фиксировался. Таким образом, проведенные исследования показали, что соединение I-2 относится к 4 классу опасности, к малоопасным веществам.
Таким образом, получены новые фторхинолоны на основе ципрофлоксацина, обладающие высокой антибактериальной активностью и низкой токсичностью.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалиста в данной области науки и техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», т.к. может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных отечественных материалов и технологий.
| название | год | авторы | номер документа |
|---|---|---|---|
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| Бис-аммониевые соединения на основе пиридоксина, обладающие антибактериальными и антимикотическими свойствами | 2020 |
|
RU2731999C1 |
| Фторхинолоны на основе 4-дезоксипиридоксина | 2016 |
|
RU2634122C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| Четвертичные аммониевые соединения на основе производных пентаэритрита и пиридоксина, обладающие антибактериальной активностью | 2023 |
|
RU2811203C1 |
| АНТИРЕТРОВИРУСНЫЕ ПРЕПАРАТЫ НА ОСНОВЕ ПРОИЗВОДНЫХ АЗИДОТИМИДИНА | 2014 |
|
RU2561501C1 |
| ПРОИЗВОДНЫЕ ПИРИДОКСИНА С НЕЛИНЕЙНЫМИ ОПТИЧЕСКИМИ СВОЙСТВАМИ | 2012 |
|
RU2501801C1 |
| Четвертичные аммониевые соединения на основе производных пиридоксина и жирных карбоновых кислот, обладающие антибактериальной активностью | 2022 |
|
RU2795265C1 |
| Оксазолидиноны на основе производных пиридоксина, обладающие антибактериальной активностью | 2024 |
|
RU2836570C1 |
| Четвертичные аммониевые соединения на основе 3-гидроксипиридина, обладающие антибактериальной активностью | 2021 |
|
RU2778507C1 |
Изобретение относится к новым производным ципрофлоксацина общей формулы (I), проявляющим антибактериальные свойства.
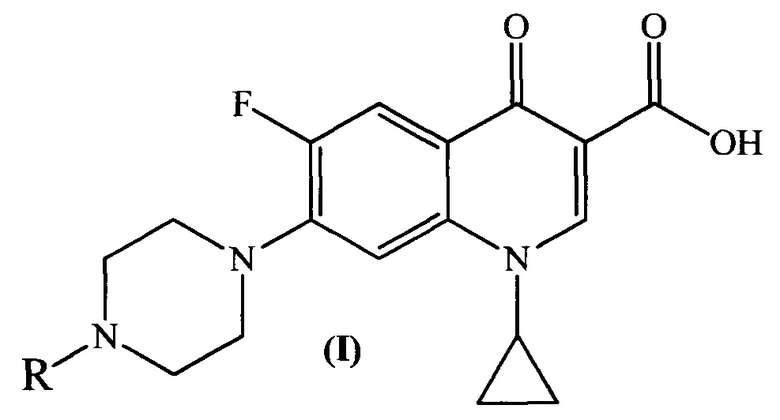
Технический результат: получены новые производные ципрофлоксацина общей формулы (I), которые могут быть использованы в качестве антибактериальных средств. 1 з.п. ф-лы, 3 табл., 14 пр.
1. Производные ципрофлоксацина общей формулы (I)
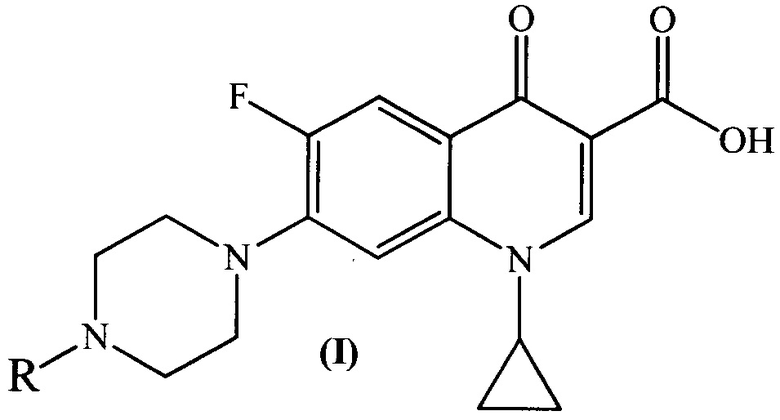
где 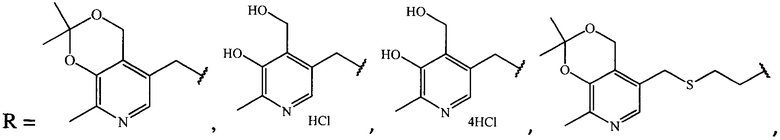
2. Производные ципрофлоксацина по п. 1, обладающие антибактериальной активностью.
| Chen, Yeh-Long; Huang, Hung-Yuan; Chen, Yu-Wen; Tzeng, Cherng-Chyi; Liu, Chiao-Ling; Yao, Chen-Wen | |||
| Synthesis and antimycobacterial evaluation of pyranone and pyridinone metal-chelator bearing fluoroquinolones | |||
| Chinese Pharmaceutical Journal, 57(2-6), с | |||
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
| ПРОИЗВОДНЫЕ ХИНОЛОНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1998 |
|
RU2193558C2 |
| ЦИКЛОАЛКИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ АМИНОМЕТИЛПИРРОЛИДИНА И АНТИБАКТЕРИАЛЬНЫЙ АГЕНТ НА ИХ ОСНОВЕ | 1999 |
|
RU2248970C2 |
Авторы
Даты
2017-12-01—Публикация
2016-11-02—Подача