Изобретение относится к области биоорганической и медицинской химии, в частности к способу получения бетулиновой кислоты (1). Бетулиновая кислота является лидирующим соединением в дизайне лекарственных препаратов на платформе пентациклических тритерпеноидов лупанового ряда с различными видами биологической активности, в том числе с противоопухолевой, противовирусной и антимикробной. Выделение бетулиновой кислоты из растительного сырья из-за низкого содержания (не превышает 2.5%, содержание в коре березы 0.025%) оказывается нерентабельным, поэтому коммерчески доступную бетулиновую кислоту получают из бетулина (2) - основного компонента (15-30%) коры белоствольной березы рода Bettula.
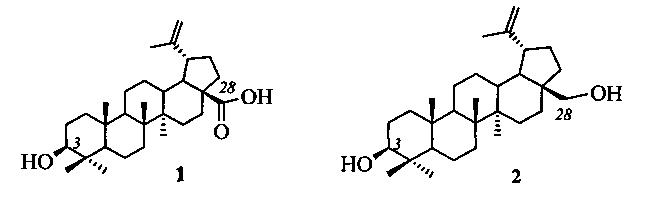
Существующие способы получения бетулиновой кислоты можно разделить на три группы.
Первая группа методов основана на сохранении стереохимии 3β-ΟΗ-функции, которое достигается манипулированием защитными группами гидроксифункций в исходном бетулине (2), приводящем к ключевому 3β-ацетоксибетулину (3), окисление которого с образованием 3β-ацетоксибетулиновой кислоты (4) и алкоголю последней приводят к целевой бетулиновой кислоте (1) [Kim D.S.H., Chen Ζ., Van Tuyen Ν., Pezzuto J.M., Qiu S., Lu Z.Z. // Synth. Commun. 1997. 27. P. 1607-1612; US 5804575, 1998; WO 1998043936 A2, 1998; WO 1998043936 A3, 1999; WO 2001051451 A2, 2001; DE 102004012951 A1, 2005; US 6271405, 2001; US 6407270, 2002; US 6867314, 2005; US 20020016482 A1, 2002; US 20090076290 A1, 2009; CN 103113451 A, 2013].
Общий выход бетулиновой кислоты, полученной данными методами, в расчете на бетулин составляет 55-57%.
К недостаткам данной группы методов можно отнести их многостадийность, использование дорогостоящих реагентов и катализаторов, применение токсичных и пожароопасных растворителей.
Вторая группа методов основана на окислении бетулина (2) до бетулоновой кислоты в одну или в две стадии и последующем восстановлении 3-кетогруппы, приводящем к кислоте (1) [Kim D.S.H., Chen Ζ., Van Tuyen Ν., Pezzuto J.M., Qiu S., Lu Z.Z. // Synth. Commun., 1997. 27. P. 1607-1612; US 5804575, 1998; WO 1998043936 A2; WO 1998043936 A3; SE 2011050818, 2013; Шон Л.Б., Каплун А.П., Шпилевский A.A., Андия-Правдивый Ю.Э., Алексеева С.Г., Григорьев В.Б., Швец В.И. // Биоорг. химия, 1998, 24(10), С.787-793; RU 2269541, 2006; RU 2190622, 2002; RU 2458933, 2012; RU 2428426, 2011; Melnikova N., Burlova I., Kiseleva Т., Klabukova I., Gulenova M., Kislitsin Α., Vasin V., Tanaseichuk B. // Molecules. 2012, 17, 11849-11863; WO 2013038314 A1; WO 2013038312 A1; WO 2013038314 A1; RU 2190622, 2002; US 5804575, 1998; WO 1998043936 A2; WO 1998043936 A3; WO 1998043936 A2; WO 1998043936 A3; RU 2246500, 2005; RU 2246500, 2005; RU 2305106, 2007].
Основным недостатком данного подхода является образование смеси 3β/3α диастереомерных спиртов при восстановлении 3-кетогруппы бетулоновой кислоты действием NaBH4 и необходимость использования трудоемкого и затратного метода колоночной хроматографии для отделения бетулиновой кислоты от ее 3α-диастереомера. Выход бетулиновой кислоты в расчете на бетулин, как правило, составляет 47-68%.
В последние годы развивается группа методов получения бетулиновой кислоты (1), основанная на двухстадийном селективном окислении первичной С28-гидроксильной группы бетулина вначале в альдегидную, а затем в карбоксильную функцию. Описан метод получения бетулиновой кислоты селективным окислением бетулина диацетоксииодобензолом в присутствии TEMPO (2,2,6,6-тетраметипиперидин-1-оксил), приводящем к кислоте (1) с выходом 90% [US 2009/0076290 A1; Tet. Lett. 2007(47). P. 8769-8770; WO 2013038312 A1; SE 2011050818, 2013; CA 2705902 C, 2013; CN 101302244 A, 2009; CA 2705902 A, 2009; CN 101302244 B, 2011; CN 103113451 A, 2013; WO 2009146619 A1; WO 2013038312 A1; WO 2013038316 A1, 2013 WO 2006105354 А1].
Несмотря на высокие выходы бетулиновой кислоты, к основным недостаткам указанных методов можно отнести использование дорогостоящих реагентов и катализаторов, таких как TEMPO, 4-ацетамидо-ТЕМРО, RuCl2(PPh3)3 или Ag2O.
Существует также методы микробиологического окисления бетулина в бетулиновую кислоту (1) культурой клеток Armillaria luteo-virens ZJUQH [CN 101457250, A, 2009; CN 101709322 A, 2010], лакказа-катализируемое окисление [CN 102226213 A, 2011]. Выходы бетулиновой кислоты в данном случае не превышают 13%.
Наиболее близким по существенным признакам и достигаемому результату к предлагаемому способу является выбранный нами в качестве прототипа способ, описанный в DE 102004012951 А1, 2005.
Данный способ заключается в том, что на первой стадии получения бетулиновой кислоты для селективной защиты первичной С28-гидроксильной группы бетулина (2) используют трет.-бутил-диметилхлорсилан (TBDMS-Cl). Для этого к раствору бетулина (2) в пиридине добавляют по каплям раствор TBDMS-Cl в том же растворителе, кипятят 5 ч в атмосфере N2, реакционную массу охлаждают до комнатной температуры и перемешивают еще 12 ч. После удаления растворителя к остатку добавляют ДМФА, выпавший осадок отфильтровывают, промывают водой и высушивают. Ацетилированием С3-гидроксильной группы в 28-трет.-бутилдиметилсилоксибетулине уксусным ангидридом в растворе толуола и очистки методом колоночной хроматографии на SiO2 получают 3β-ацетокси-28-трет.-бутилдиметилсилоксибетулин с выходом 74%. Деблокирование защищенной С28-гидроксильной группы проводят при кипячении в инертной атмосфере 3β-ацетокси-28-трет.-бутилдиметилсилоксибетулина действием тетрабутиламмоний-фторида (TBFA) (1М раствор в ТГФ, 30 мин). Полученный 3β-ацетоксибетулин окисляют в две стадии (1. 1,4-Хинон/Al(OtBu)3, 2. NaClO2/NaH2PO4/2-метил-2-бутен) в 3β-ацетоксибетулиновую кислоту, удаляют 3β-ацетоксигруппу (K2CO3/МеОН/H2O) и получают бетулиновую кислоту (1), общий выход которой в расчете на бетулин составляет 55%.
Недостатком данного способа является применение дорогостоящих регентов для селективной защиты С28-гидроксида в бетулине на первой стадии синтеза бетулиновой кислоты и для удаления защитной группы на следующей стадии, необходимость проведения реакций в атмосфере инертного газа, использование пожароопасного растворителя (ТГФ), многостадийность процесса.
Задача, на решение которой направлено заявляемое изобретение, заключается в разработке способа получения бетулиновой кислоты (1), позволяющего сократить временные, денежные и трудозатраты с использованием доступных реагентов "зеленой химии".

Поставленная задача решается предлагаемым способом получения бетулиновой кислоты (1) из бетулина (2), принципиальное отличие которого от прототипа состоит в том, что для селективной защиты первичной С28-гидроксильной группы в бетулине (2) используют винильную группу, вводимую прямым селективным С28-О-винилированием ацетиленом в суперосновной среде диметилсульфоксид-гидроокись калия (ДМСО-КОН). О-Винилирование проводят, пропуская через раствор бетулина в ДМСО-КОН ток ацетилена при 80°С в течение 2.5 ч. После охлаждения реакционную массу разбавляют ледяной водой, экстрагируют метил-трет.-бутиловым эфиром (МТБЭ), экстракт высушивают Na2SO4, после удаления растворителя полученный 28-О-виниловый эфир бетулина (3а) легко очищают от минорного побочного продукта - дивинилового эфира бетулина (3б) методом колоночной хроматографии на SiO2. Выход эфира (3а) составляет 75%.
Последующее С3-О-ацетилирование 28-О-винилового эфира бетулина (3а) действием уксусного ангидрида Ac2O в пиридине (Py) протекает с образованием 3β-ацетокси-28-О-винилового эфира бетулина, обработка которого без выделения из реакционной массы концентрированной соляной кислотой приводит к деблокированию защищенной С28-гидроксильной группы в 28-О-виниловом эфире бетулина (3а) с образованием 3β-ацетоксибетулина (4). Выход соединения (4) после очистки методом колоночной флэш-хроматографии на SiO2 составляет 93%. Окисление соединения (4) пиридинийхлорхроматом (ПХХ) в CH2Cl2 с образованием 3β-ацетоксибетулинового альдегида и последующее окисление полученного альдегида системой NaClO2/NaH2PO4/2-метил-2-бутен приводит к 3β-ацетоксибетулиновой кислоте (5) с выходом 89%. Гидролизом последней действием K2CO3 в МеОН получают бетулиновую кислоту (1). Выход кислоты (1) в расчете на бетулин составляет 55%.
Предлагаемый метод отличается от прототипа тем, что позволяет исключить применение дорогостоящих реагентов, используемых для селективной защиты С28-гидроксильной группы в бетулине (2) и для ее деблокирования, исключить необходимость проведения указанных реакций в атмосфере инертного газа и упростить общую схему получения бетулиновой кислоты (1) за счет объединения стадий С28-О-ацетилирования и деблокирования защищенной С -гидроксильной группы в 3β-ацетокси-28-О-виниловом эфире бетулина.
Сущность изобретения подтверждается следующими примерами.
Пример 1.
28-O-Виниловый эфир бетулина (3а). Через смесь 0.5 г (1.13 ммоль) бетулина (2) и 0.38 г (5.93 ммоль) KOH × 0.5 H2O в 50 мл ДМСО пропускают при атмосферном давлении ток ацетилена при 80°С в течение 2.5 ч. Реакционную массу охлаждают, разбавляют ледяной водой (50 мл), экстрагируют МТБЭ (30 мл × 5), объединенные органические экстракты промывают водой, высушивают K2CO3, растворитель упаривают, остаток хроматографируют на SiО2, дезактивированном Et3N (гексан:этилацетат, 5:1), получают 0.40 г (75%) 28-О-винилового эфира бетулина (3а), наряду с 0.01 г (2%) дивинилового эфира бетулина (3б) и 0.07 г непрореагировавшего бетулина (2). Т.пл. 106-107°С. [α]D 20+3.1° (с 0.33, CHCl3), [α]D 20+6.4 (с 2.16, толуол). Спектр ЯМР 1H (CDCl3, 300 МГц): 0.7 д (1Н, Н-5, J 8.7), 0.75 с (3Н, СН3-24), 0.82 с (3Н, СН3-26), 0.95 с (3Н, СН3-23), 0.97 с (3Н, СН3-27), 1.02 с (3Н, СН3-25), 1.68 с (3Н, СН3-30), 1.95 м (3Н, На-21, На-22, На-16), 2.40 дт (1H, Н-19, J 10.5, 10.5, 5.0), 3.15 дд (1Н, Н-3, J 10.5, 5.0), 3.35 д (1Н, На-28, J 9.5), 3.80 д (1H, 1Hb-28, J 9.5), 3.95 дд (1H, О-винил, НА, J 6.8, 1.8), 4.17 дд (1H, О-винил, НВ, J 14.4, 1.8), 4.58 с (1H, На-29), 4.68 с (1Н, Hb-29), 6.55 дд (1Н, О-винил, НХ, J 14.4, 6.8). Спектр ЯМР 13С (CDCl3, 75.47 МГц): 14.80 к (С-27), 15.37 к (С-24), 15.96 к (С-25), 16.09 к (С-26), 18.29 т (С-6), 19.10 к (С-30), 20.81 т (С-11), 25.21 т (С-12), 27.10 т (С-15), 27.39 т (С-2), 27.99 к (С-23), 29.79 т (С-16), 29.79 т (С-21), 34.19 т (С-7), 34.58 т (С-22), 37.15 с (С-10), 37.61 д (С-13), 38.71 с (С-4), 38.85 т (С-1), 40.90 с (С-8), 42.70 с (С-14), 46.71 с (С-17), 47.93 д (С-19), 48.80 д (С-18), 50.38 д (С-9), 55.29 д(С-5), 66.18 т (С-28), 78.96 д (С-3), 85.54 д (О-винил, C-β), 109.71 т (С-29), 150.41 с (С-20), 152.83 т (О-винил, C-α). Найдено, %: С 81.87; Η 11.58. C32H52O2. Вычислено, %: С 81.99; Η 11.18.
3β-Ацетоксибетулин (4). К раствору 0.85 г (1.813 ммоль) 28-О-винилового эфира бетулина (3а) в 13 мл безводн. Py добавляют 0.85 мл (9.065 ммоль) Ac2O. Перемешивают 2 дня, разбавляют 25 мл 10% раствором HCl, экстрагируют CHCl3 (30 мл × 5), экстракт органический слой перемешивают с 2 мл конц. HCl, 2 ч, промывают водой, высушивают Na2SO4. Растворитель упаривают, остаток хроматографируют на SiO2 (гексан, гексан:ЭА 20:1, 10:1; 5:1), получают 0.82 г (93%) ацетата (4). Спектр ЯМР 1Н (300 МГц, CDCl3): 0.77 с, 0.83 с, 0.84 с, 0.97 с, 1.02 с, 1.68, 2.04 с, 2.38 м (1Н, Н-19), 3.32 д (1Н, На-28, J 10.8), 3.79 д (1Н, Hb-28, J 10.8), 4.47 дд (1Н, Н-3, J 5.4, 9.9), 4.58 д (1Н, На-29, 2J 1.8), 4.67 д (1Н, Hb-29, Η 1.8). Спектр ЯМР 13С (75.47 МГц, CDCl3): 14.67 (С-27), 15.94 (С-26), 16.07 (С-25), 16.42 (С-23), 18.13 (С-6), 19.01 (С-30), 20.79 (С-11), 21.21 (СН3СОО), 23.62 (С-2), 25.12 (С-12), 26.99 (С-15), 27.87 (С-24), 29.13 (С-21), 29.71 (С-16), 33.90 (С-22), 34.11 (С-7), 37.02 (С-10), 37.24 (С-13), 37.72 (С-4), 38.33 (С-1), 40.67 (С-8), 42.65 (С-14), 47.74 (С-17), 47.76 (С-19), 48.69 (С-18), 50.25 (С-9), 55.32 (С-5), 60.39 (С-28), 80.89 (С-3), 109.63 (С-29), 150.37 (20), 170.93 (С=O).
3β-Ацетоксибетулиновая кислота (5). К раствору 0.20 г (0.413 ммоль) 3β-ацетоксибетулина (4) в 24 мл безводн. CH2Cl2 добавляют суспензию 0.133 г (0.619 ммоль) ПХХ в 10 мл безводн. CH2Cl2, перемешивают 2 ч (контроль ТСХ), разбавляют 25 мл Et2O, перемешивают 10 мин, реакционную массу фильтруют через слой SiO2, растворитель упаривают. К раствору полученного 3β-ацетоксибетулинового альдегида и 0.17 мл (1.656 ммоль) 2-метил-2-бутена в 10 мл t-BuOH добавляют по каплям раствор 0.3 г (2.484 ммоль) NaH2PO4 и 0.225 г (2.484 ммоль) NaClO2 в 40 мл H2O, перемешивают 20 мин (контроль ТСХ). Разбавляют 50 мл H2O, экстрагируют CHCl3 (30 мл × 5), органический слой промывают водой, высушивают Na2SO4, растворитель упаривают, остаток очищают методом флэш-хроматографии на SiO2, получают 0.18 г (89%) 3β-ацетоксибетулиновой кислоты (5). Спектр ЯМР 1Н (300 МГц, CDCl3): 0.83 с (3Н, СН3), 0.84 с (3Н, СН3), 0.85 с (3Н, СН3), 0.89 с (3Н, СН3), 0.97 с (3Н, СН3), 1.69 с (3Н, СН3), 1.99 м (2Н), 2.04 с (3Н, ОС=OCH3), 2.22 м (2Н), 3.00 м (1H, Н-19), 4.49 дд (1Н, Н-3, J 6.3, 9.2 Гц), 4.61 с (1H, На-29), 4.74 с (1Н, Hb-29), 10.7 ш. с (1H, СООН). Спектр ЯМР 13С (75.47 МГц, CDCl3): 14.61 (С-27), 15.99 (С-26), 16.13 (С-25), 16.42 (С-23), 18.10 (С-6), 19.30 (С-30), 20.79 (С-11), 21.30 (СН3СОО), 23.64 (С-2), 25.37 (С-12), 27.91 (С-24), 29.64 (С-15), 30.52 (С-21), 32.11 (С-16), 34.17 (С-7), 37.05 (С-10), 37.74 (С-4), 38.31 (С-1), 38.38 (С-13), 40.62 (С-8), 42.36 (С-14), 46.91 (С-19), 49.20 (С-18), 50.32 (С-9), 55.35 (С-5), 56.38 (С-17), 80.93 (С-3), 109.72 (С-29), 150.35 (С-20), 171.11 (СН3ОС=O), 182.76 (С-28).
Бетулиновая кислота (1). Раствор 0.13 г (0.26 ммоль) 3β-ацетоксибетулиновой кислоты (5) в 35 мл метанола перемешивают с 0.15 г (1.086 ммоль) K2CO3 3 дня. Реакционную массу разбавляют водой, экстрагируют CHCl3 (30 мл × 5), органический слой отделяют, высушивают Na2SO4, растворитель упаривают, остаток очищают методом флэш-хроматографии на SiO2 (гексан, гексан:ЭА, 10:1), получают 0.095 г (85%) кислоты (1). Спектр ЯМР 1Н (300 МГц, CDCl3): 0.76 с (3Н, СН3), 0.83 с (3Н, СН3), 0.94 с (3Н, СН3), 0.97 с (6Н, СН3), 1.69 с (3Н, СН3), 1.98 м (2Н), 2.22 м (2Н), 3.01 м (1Н, Н-19), 3.19 м (1Н, Н-3), 4.61 с (1Н, На-29), 4.74 с (1Н, Hb-29).
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ ВЕЩЕСТВ | 2012 |
|
RU2551647C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОБЕТАИНОВ НА ОСНОВЕ БЕТУЛИНОВОЙ КИСЛОТЫ | 2015 |
|
RU2588138C1 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ И УРСАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ШИСТОСОМОЗА | 2013 |
|
RU2576658C2 |
| КОНЪЮГАТЫ ТРИТЕРПЕНОВЫХ КИСЛОТ И (Е)-4-(1Н-ИНДОЛ-3-ИЛВИНИЛ)-ПИРИДИНИЙ БРОМИДА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2020 |
|
RU2786134C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3β-АЦЕТОКСИ-20-ОКСОНОРТАРАКСАСТАНА | 2006 |
|
RU2316561C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3БЕТА-АЦЕТОКСИ-20-ОКСОНОРТАРАКСАСТ-21-ЕНА | 2006 |
|
RU2310662C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3β-АЦЕТОКСИ-20,20-ДИМЕТОКСИНОРТАРАКСАСТАНА | 2006 |
|
RU2316562C1 |
| Фосфониевые соли на основе бетулиновой кислоты, обладающие цитотоксической активностью в отношении аденокарциномы предстательной железы | 2018 |
|
RU2665922C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕТУЛИНОВОЙ КИСЛОТЫ | 2003 |
|
RU2246500C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-ДЕГИДРО-6-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663893C1 |
Изобретение относится к способу получения бетулиновой кислоты. Способ заключается в том, что на первой стадии синтеза бетулиновой кислоты (1) из бетулина для защиты первичного С28-гидроксила используют винильную группу, вводимую селективным С28-O-винилированием бетулина ацетиленом в суперосновной среде ДМСО-КОН. Последующее С3-О-ацетилирование 28-О-винилового эфира бетулина и обработка 3β-ацетокси-28-О-винилового эфира бетулина без выделения из реакционной массы HCl (конц.) приводят к 3β-ацетоксибетулину, двухстадийным окислением которого в соответствующий альдегид, затем в кислоту и гидролизом 3β-ацетоксибетулиновой кислоты получают целевую кислоту (1). Способ позволяет сократить временные, денежные и трудозатраты, необходимые для получения кислоты (1), общий выход которой в расчете на бетулин составляет 55%. 1 пр.

Способ получения бетулиновой кислоты путем селективной защиты первичной С28-гидроксильной группы бетулина при нагревании в растворителе, ацетилирования С3-гидроксильной группы полученного соответствующего простого эфира бетулина в присутствии растворителя, деблокирования защищенной С28-гидроксильной группы последнего в присутствии растворителя, двухстадийного окисления полученного 3β-ацетоксибетулина в соответствующий альдегид, затем в 3β-ацетоксибетулиновую кислоту, последующий гидролиз которой приводит к целевой кислоте, отличающийся тем, что селективную защиту первичной С28-гидроксильной группы бетулина проводят, пропуская ток ацетилена через раствор бетулина в суперосновной среде диметилсульфоксид-гидроокись калия при 80°С в течение 2.5 ч, последующее С3-O-ацетилирование полученного 28-О-винилового эфира бетулина и деблокирование защищенной С28-гидроксильной группы последнего объединяют, обрабатывая продукт С3-О-ацетилирования - 3β-ацетокси-28-O-виниловый эфир бетулина, без выделения из реакционной массы, концентрированной соляной кислотой с получением 3β-ацетоксибетулина.
| DE 102004012951 A1, 06.10.2005 | |||
| WO 2013038312 A1, 21.03.2013 | |||
| WO 2013038314 A1, 21.03.2013 | |||
| WO 2013038316 A1, 21.03.2013 | |||
| СПОСОБ ПОЛУЧЕНИЯ БЕТУЛИНОВОЙ КИСЛОТЫ | 2003 |
|
RU2246500C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕТУЛИНОВОЙ КИСЛОТЫ | 2010 |
|
RU2428426C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕТУЛИНОВОЙ КИСЛОТЫ | 2001 |
|
RU2190622C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕТУЛИНОВОЙ КИСЛОТЫ | 2006 |
|
RU2305106C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕТУЛИНОВОЙ КИСЛОТЫ | 2011 |
|
RU2458933C1 |
Авторы
Даты
2015-10-20—Публикация
2014-10-20—Подача