Изобретение относится к медицине, в частности к нейронкологии, и может применяться в бор-нейтронозахватной терапии (БНЗТ) для доставки внутрь клетки борсодержащих препаратов с помощью пегелированных липосом.
Липосомы как потенциальные средства доставки лекарственных веществ рассматриваются еще с середины 60-х годов прошлого века по ряду причин: небольшой размер, минимальный около 25 нм, благодаря чему достигается эффект пассивного нацеливания вплоть до 200 нм; биосовместимость, поскольку липосомы состоят из фосфолипидов и холестерина - природных, не токсичных веществ; способность к включению как гидрофильных, так и амфифильных и гидрофобных веществ; защита инкапсулированного вещества от преждевременной деградации; обеспечение внутриклеточной доставки. Однако наряду с положительными качествами у липосом есть и недостатки, в частности, сложность длительного хранения готовых липосомальных препаратов без лиофилизации и быстрое поглощение липосом макрофагами (без специальной модификации), и, как следствие, малое время циркуляции в кровотоке. Для увеличения времени циркуляции были разработаны так называемые стерически стабилизированные липосомы. Дополнительная гидрофильная оболочка подобных липосом, чаще всего из полиэтиленгликоля, ограничивает их распознавание и захват клетками ретикулоэндотелиальной системы, что приводит к аккумулированию липосом в опухолевой ткани за счет эффекта пассивного нацеливания.
Борсодержащие соединения и их наноструктуры широко применяются для получения различных форм препаратов для проведения БНЗТ. Бор-нейтронозахватная терапия, бинарная терапия рака, впервые предложенная Лочером в 1936 году, базируется на взаимодействии двух относительно безвредных составляющих: ядра 10B и теплового нейтрона. Захват теплового нейтрона ядром 10B приводит к появлению ядра 11B в возбужденном состоянии, которое практически мгновенно распадается на ядро лития 7Li и ядро гелия 4He (альфа-частица) с большими энергиями. Каждая из этих частиц выделяет всю энергию в ткани на длине менее 10 мкм, ограничивая повреждения примерно размером одной клетки. Таким образом, селективное накопление 10B внутри клеток опухоли и последующее облучение тепловыми нейтронами должно приводить к разрушению клеток опухоли с относительно малыми повреждениями окружающих нормальных клеток.
Для проведения БНЗТ требуются эпитепловые нейтроны (диапазон энергий 0,5 эВ - 10 кэВ), обеспечивающие в результате торможения на глубине залегания опухоли максимальную концентрацию тепловых нейтронов, эффективно поглощаемых изотопом 10B и приводящих к локальному выделению терапевтической дозы. Нейтроны постепенно становятся тепловыми (средняя энергия, примерно, 0,04 эВ) по мере того, как они все более глубоко проникают внутрь (в голову). Когда нейтроны становятся тепловыми, они легче захватываются 10B концентрирующимся в опухолевых клетках и/или в тканях, поддерживающих опухоль, так как сечение захвата (тепловых нейтронов) обратно пропорционально их скорости.
Присутствие в терапевтическом потоке нейтронов с энергией больше 10 кэВ приводит к получению пациентом нежелательной дозы на коже в результате их упругого рассеяния, а присутствие нейтронов с энергией менее 0,5 эВ приводит к нелокализованной дозе при их поглощении водородом и азотом. Параметры нейтронного потока должны быть такими, чтобы обеспечивать возможность проведения разовой терапии за время не более 1 часа, рекомендованного сообществом нейтронозахватной терапии.
В качестве компактных безопасных относительно недорогих источников нейтронов могут использоваться ускорители заряженных частиц с соответствующими нейтронопроизводящими мишенями и системами формирования пучка. Ускорители позволяют получить лучший по качеству терапевтический пучок эпитепловых нейтронов, а также относительно просто и оперативно менять спектр и поток нейтронов изменением энергии и тока пучка заряженных частиц, а также замены мишени.
Для накопления нужного количества соединения по настоящему изобретению в опухоли пациенту обычно вводят в виде системной инъекции или инфузии около 10-50 миллиграмм 10B на кг массы тела. Соединение вводят в виде одной или более доз, причем последнюю дозу дают, примерно, за один час до облучения эпитермальными нейтронами.
Выполненные расчеты транспорта нейтронов и сопутствующего гамма-излучения показывают, что при концентрации изотопа 10B в опухолевых клетках 50 ppm, а в здоровых 15 ppm установка ускорителя заряженных частиц обеспечивает терапевтический эффект для опухолей, залегающих на глубине вплоть до 11 см, при этом максимальная мощность дозы в опухоли может достигать 1 Зв/мин (Зиверт в минуту), а терапевтическое отношение - 5. Это делает возможным проведения разовой терапии в течении 1 часа. Доза, получаемая пациентом от гамма-излучения, зависит от ряда параметров и не превышает 10% от терапевтической дозы. В сравнении с ядерным реактором, установка ускорителя заряженных частиц, обеспечивает более благоприятный спектр нейтронного потока, она является более компактной, безопасной и удобной в эксплуатации. Время экспозиции с нейтронами зависит от концентрации 10B в крови, которая снижается во времени быстрее, чем концентрация 10B в опухоли. Однако время введения карборансодержащих липосом зависит от различных факторов (например, скорости проникновения соединения в опухоль и кровеносные сосуды опухоли) и скорости экскреции из и/или метаболизма соединения в опухоли и различных других тканях, которые абсорбируют соединение.
При БНЗТ борсодержащее соединение должно быть нетоксичным или иметь низкую токсичность при введении в терапевтически эффективных количествах, а также должно быть способно селективно, т.е. выборочно, аккумулироваться в опухолевой ткани при относительно быстрой очистке крови и нормальных тканей от препарата и сохраняться в опухоли в течение нейтронного излучения. Для успешности протекания БНЗТ в опухолевой клетке должно содержаться достаточное количество изотопа 10B. Из экспериментальных данных известно, что 109 атомов/клетку является достаточным для достижения деструктивного эффекта на опухолевую клетку. В частности, отношение концентрации бора в опухолях при сравнении нормального мозга и мозга, имеющего опухоль, составляет, примерно, 3:1 (концентрация бора в опухоли -20 микрограмм B10 на грамм опухоли).
Известно, что в БНЗТ различных онкологических заболеваний могут эффективно использоваться различные борсодержащие соединения и наночастицы, содержащие в себе 10B, а также используются различные комбинации и способы доставки. Точное и эффективное уничтожение клеток глиобластомы (GBM) в присутствии неизмененного мозга представляет собой более сложную задачу, чем злокачественных опухолей других анатомических областей. Это происходит из-за наличия дополнительного биологического барьера - гематоэнцефалического (ГЭБ), а также высокого инфильтративного характера клеток глиомы и их молекулярной неоднородности.
Существующие виды липосомальной доставки включают как инкапсуляцию в липосому гидрофильных многогранных боран-анионов таких, как боркоптат, так и инкорпарацию липофильного боросодержащего соединения в липидный бислой. Второй подход получил более широкое распространение, так как позволяет решить проблемы с осмосом, возникающие при производстве липосом, инкапсулированных водными растворами боросодержащих соединений.
Предлагаемые подходы позволяют достичь эффективного, но не селективного поглощения соединений бора, поэтому липосомы конъюгируют с опухолеспецифичными лигандами. В качестве таких лигандов широко используется трансферрин и фолиевая кислота, рецепторы к которым оверэкспрессированы в опухолевых клетках. Рецептор-опосредованнный эндоцитоз таких липосом обеспечивает адресность поглощения и значительное повышение концентраций 10B в опухолевой ткани и увеличение продолжительности жизни экспериментальных животных в 1,5-2 раза. Использование в качестве опухолеспецифичных лигандов антител к EGFR (cetuximab) или их фрагментов привело к созданию иммунолипосом, которые поглощались опухолевыми клетками, оверэкспрессирующими EGFR, эффективнее более чем в 8 раз.
Для подтверждения доставки, а также определения концентрации борсодержащих препаратов, распределения их в опухоли и в здоровых тканях, разрабатываются способы меток борсодержащих молекул.
Известен меченный радиоактивным йодом меркаптододекаборат натрия (131I-BSH). В работе использовали меченный γ-излучающим изотопом 131I (T1/2=8,05 суток, Eγ=364 кэВ) меркаптододекаборат натрия - Na2B12H11SH (BSH).
Известны 18F BPA-производные, которые пригодны для позитронэмиссионной томографии (ПЭТ) и полноценно маркирующие границы опухоли. Исследование F-BPA-ПЭТ показало отношение пораженный/нормальный мозг в недавно диагностированной и в рекуррентной глиобластомах как 4,3±1,3 и 3,8±1,5 соответственно.
Известны микроинвазивные технологии, использующие прямые измерения концентрации 10B.
Как следует из приведенных источников информации, при БНЗТ перспективным является применение соединений и препаратов, содержащих достаточное количество атомов бора, что позволит достигать необходимые концентрации бора в клетках опухоли организма для обеспечения терапевтического эффекта.
Для улучшения биодоступности используются различные носители бора, однако не все они селективны. Необходимым условием осуществления эффекта БНЗТ является доставка бора внутрь опухолевой клетки, что можно достичь с помощью PEG-липосом за счет полиэтиленгликоля, который ограничивает их распознавание и захват клетками ретикулоэндотелиальной системы, что приводит к аккумулированию липосом в опухолевой ткани за счет эффекта пассивного нацеливания.
На сегодняшний день предложено достаточно способов определения наличия и количества бора в опухоли, однако интрацеллюлярное проникновение бора детектировать возможно только с помощью различных меток.
Таким образом, из приведенного анализа известного уровня техники в целом следует, что известные способы доставки борсодержащих препаратов внутрь клетки не обеспечивают туморотропной внутриклеточной транспортировки достаточной концентрации 10B для проведения БНЗТ опухолей головного мозга, а также достоверного подтверждения проникновения 10B в клетку.
Известен способ для лечения опухолей с использованием композиции как свободных боран-производных, так и инкапсулированных в липосомы согласно патенту US №6274116. В качестве 10B композиции используются Na2B10H10 и Na2B12H11SH. Носителем композиции является липосома, состоящая из фосфолипидов, дистеарол фосфатидилхолина (также известого как "DSPC") и нейтральных липидов, холестерина. Средний диаметр липосом примерно 110 нм. Липосомы не подвергались пегелированию, что снижает их селективность к опухоли, и не содержат меток для контроля доставки содержимого липосом в клетку. Контроль доставки 10B осуществлялся после забора тканей у усыпленного животного, через определенные временные промежутки, после внутривенного введения композиции и определения концентрации 10B в различных тканях и органах методом плазменной атомно-эмиссионной микроскопии.
Атомно-эмиссионный спектральный анализ - это метод определения химического состава вещества по спектру излучения его атомов под влиянием источника возбуждения. Пробу исследуемого вещества вводят в источник излучения, где происходят ее испарение, диссоциация молекул и возбуждение образовавшихся атомов (ионов). Последние испускают характерное излучение, которое поступает в регистрирующее устройство спектрального прибора.
Данный способ позволяет определить концентрацию вещества в исследуемом материале, однако не позволяет визуализировать и подтвердить внутриклеточную доставку вещества, а также определить процентное распределение бора, доставленного внутрь клетки, в объеме исследуемого материала, но что снижает точность доставки вещества внутрь опухолевой клетки (туморотропность). Кроме того, способ не позволяет определить внутриклеточную концентрацию бора в различные моменты времени и определить максимальную внутриклеточную концентрацию бора, необходимую для достижения эффекта от БНЗТ.
Известна система доставки лекарственных средств с использованием липосомальных композиций согласно международной заявке WO 2003032947. Система доставки лекарственных средств относится к соединениям и способам для запуска или высвобождения агентов, инкапсулированных в липидные носители, при выполнении заранее определенных условий. Такими условиями могут быть как заранее определенное место или высвобождение только в присутствии заранее определенного материала, т.е. путем выбора триггера. Система может использоваться для освобождения агента как в терапевтических, так в диагностических или исследовательских целях. В частности, настоящее изобретение относится к применению соединений бора в лекарственных препаратах, для получения фармацевтических композиций, содержащих соединение бора и к способам высвобождения лекарственного средства с использованием указанных соединений 10B. Система не имеет маркеров внутриклеточной доставки. Предложено использовать липосому с заданными свойствами (запуск высвобождения агентов, инкапсулированных в липидные носители, по заранее определенным условиям) в качестве агентов доставки различных лекарственных средств.
Известен триггер выхода содержимого липосом согласно международной заявке WO 2007098968. Одной из главных задач такого триггера (BSH) является обеспечение успешной инициации выпуска липосом-инкапсулированного агента, в определенное время и в определенном месте. Это связано с тем, что даже успешная адресация липосомы имеет меньшее значение, если содержимое не выпускается в нужном месте, где оно должно оказать запланированный эффект. Тем самым предлагается использовать BSH в качестве инициатора выхода веществ (в том числе и лекарств) из липосом в запланированном месте и времени. Также авторами предлагается использовать такие липосомы в качестве инструмента для обнаружения клеточных нарушений, диагностики метастазов, за счет включения в липосомы меченых опухолевых маркеров. Настоящее изобретение основано на наблюдении, что BSH интенсивно взаимодействует с липидным бислоем. Это взаимодействие приводит к изменениям в структуре липосомы. Перед воздействием BSH, липосомы обладают сферической структурой, после добавления BSH появляются участки утолщенной мембраны, а также многослойность структур, агрегация липосом, слияние мембраны, распад липосом и выход из липосом содержимого. Однако указаний на использование такого рода носителей для БНЗТ не имеется. Кроме того, носитель не имеет маркеров внутриклеточной доставки.
Известно борсодержащее соединение согласно патенту US 7572458, которое представляет собой наногибрид, включающий, по меньшей мере, один двухвалентный металл и, по меньшей мере, один трехвалентный металл. Наногибрид, является соединением бора с нетоксичными слоистыми двойными гидроксидами (LDH) с интеркалированием между слоями LDH. Двухвалентный металл может быть выбран из группы, состоящей из Mg2+, Ca2+, Zn2+ и их сочетания. Трехвалентный металл может быть выбран из группы, состоящей из Al3+, Fe3+ и их сочетания. Борными соединениями, которые гибридизуются с ЛДГ, чтобы сформировать соединение бора в LDH наногибрид, могут быть любые соединения бора, которые имеют отрицательный заряд в водном растворе или становятся анионами. В связи с этим соединением бора, может быть BSH, BPA, или другие карбоновые соединения. Таким образом, в данном носителе используются как вещества BSH, BPA, так и другие карбораны. Однако способ не позволяет детектеривать внутриклеточную доставку бора.
В качестве ближайшего аналога выбрана липидная композиция согласно патенту US 7829113 B2, включающая липосомы. Липосомы имеют возможность инкапсуляции лекарственного средства и фармацевтических композиций. Липидная композиция, предполагающая, в том числе использование таргетных липосом применяется в лечении рака и других заболеваний.
Носитель подвергнут технологии пегелирования и имеет в своем составе туморотропный лиганд - трансферрин, но не содержит в себе каких-либо средств для контроля внутриклеточной доставки.
Контроль накопления Tf-модифицированных липосом в опухолевой ткани проводится за счет инкапсуляции радиоактивных соединений. Образцы меченых соединений включают радиоизотоп (125I). Число Tf (трансферрина) рецепторов на поверхности клетки каждого определялась Scatchard анализом (Comp. Biochem. Physiol., 116B, 137-160 (1949), используя Microsoft Excel). Концентрации 125I-меченых Tf определялось количественным анализом по Лоури метод (J. Biol. Chem., 193, 265-270 (1951)). Радиоактивность измеряли с помощью гамма-счетчика (автоматическая система ARC-300, Aloka Co., Ltd., Япония). Раствор центрифугировали для осаждения клеток и клеточной фракции, промывали ледяным охлаждением PBS (180×g (сила тяжести), в течение 3 мин, с повторением 3 раза, с последующим измерением радиоактивности с помощью счетчика гамма-квантов для определения концентрации Tf, привязаных к поверхности клетки. Количество клеток определяли путем белкового анализа, используя метод Лоури (J. Biol. Chem., 193, 265-270 (1951)).
Концентрацию в тканях (кровь, плазма, печень, селезенка, почки, сердце, легкие, опухоль) в момент времени для каждой группы определяли с помощью атомно-абсорбционного анализа.
Данный метод позволяет определить концентрацию вещества в исследуемом материале, однако не позволяет визуализировать и достоверно подтвердить внутриклеточную доставку вещества, а также определить процентное распределение 10В, доставленного внутрь клетки, в объеме исследуемого материала, что снижает достоверность (точность) доставки вещества внутрь опухолевой клетки (туморотропность). Кроме того, метод не позволяет определить внутриклеточную концентрацию 10В в различные моменты времени и определить максимальную внутриклеточную концентрацию 10В, необходимую для достижения эффекта от БНЗТ.
Задача изобретения - повышение достоверности доставки 10В-содержащих препаратов для НЗТ внутрь опухолевой клетки и обеспечение возможности определения внутриклеточной концентрацию 10В в различные моменты времени и определения максимальной внутриклеточной концентрации 10В, необходимой для достижения эффекта от БНЗТ.
Поставленная задача решается тем, что в известном способе доставки 10В-содержащих препаратов для борнейтронзахватной терапии (БНЗТ), при котором изготавливают липосомы, включающие 10В-содержащие препараты как в липидной части, так и в водной части липосом, вводят липосомы в исследуемый организм или в ткань, осуществляют контроль доставки 10В-содержащих препаратов, предлагается дополнительно в липидную часть липосом вводить люминесцентный краситель одного цвета, в водную часть липосом - люминисцентный краситель другого цвета, а контроль доставки в клетку осуществлять, сопоставляя изображения, полученные в том и в другом цвете с помощью фиксирующего устройства.
При изготовлении липосомы могут быть подвергнуты пегилированию.
В качестве фиксирующего устройства может быть использован люминесцентный микроскоп с соответствующими фильтрами.
В качестве красителя, вводимого в липидную часть липосом, может быть использован краситель из группы липофильных люминисцентных красителей, преимущественно PKH-26.
В качестве красителя, вводимого в водную часть липосом может быть использован краситель из группы гидрофильных люминисцентных красителей, преимущественно FITC-декстран.
В качестве 10В-содержащего препарата для БНЗТ, вводимого в липидную часть липосом, может быть использован ((L)-4-дигидрокси-борфенилаланин, (международное название (L)-4-dihydroxy-borylphenylalanine), известного также как борфенилаланин (boronophenylalanine) или ВРА.
В качестве 10В-содержащего препарата для БНЗТ, вводимого в водную часть липосом, может быть использован боркаптат (международное название - sodium mercaptoundecahydro-closo-dodecaborate (Na2B12H11SH), известного также как борный сульфгидрил (sodium borocaptate) или BSH.
Одновременное присутствие двух различных красителей в различных частях липосом позволяет раздельно выявить локализацию веществ, введенных как в составе липидной мембраны липосом, так и в составе водной фазы липосом. Таким образом, достигается заявленный технический результат - обеспечивается возможность контроля доставки 10В-содержащих препаратов для БНЗТ внутрь опухолевой клетки, тем самым повышается достоверность определения местонахождения препаратов на клеточном уровне. Становится возможным определение количественного соотношения люминимценции внутри клеточного и вне клеточного пространства.
Предлагаемый способ позволяет определить внутриклеточную концентрацию 10В-содержащих препаратов в различные моменты времени и определить максимальную внутриклеточную концентрацию 10В-содержащих препаратов, необходимую для достижения эффекта от БНЗТ.
Преимуществом предлагаемого способа является то, что 10В-содержащие пегелированные липосомы по настоящему изобретению селективно накапливаются в новообразованиях в более высоких концентрациях и при повышенных отношениях содержания 10В в опухоли, к содержанию 10В в здоровой ткани по сравнению с применяемыми в настоящее время в клинике 10В-содержащими соединениями. Повышенная селективность 10В-содержащих пегелированных липосом по настоящему изобретению способствуют селективной деструкции опухолевой ткани с минимальным нарушением здоровых тканей и функции тканей при облучении потоком эпитепловых нейтронов.
Предлагаемый способ доставки борсодержащих препаратов для БНЗТ иллюстрируется следующими фигурами.
На фиг. 1 приведено схематическое изображение процесса изготовления пегилированных липосом, содержащих в липидной части BPA и люминесцентный краситель PKH-26, обладающий красной люминесценцией, а в водной части - BSH и краситель FITC-декстран с зеленой люминесценцией. На фиг. 1 красный цвет обозначен вертикальной и горизонтальной пересекающейся штриховкой, образующей ряды квадратов, а зеленый цвет обозначен вертикальной штриховкой.
На фиг. 2 приведено полученное с помощью люминесцентной микроскопии изображение внутриклеточного распределения красителя PKH-26, включенного в липидную часть липосомы вместе с BPA, в культуре клеток. Наличие на изображении зоны свечения в красной области спектра обусловлено присутствием этого красителя во внутриклеточной области, что подтверждает доставку веществ, находившихся в липидной части липосом, внутрь клетки. На фиг. 2 красный цвет обозначен вертикальной и горизонтальной пересекающейся штриховкой, образующей ряды квадратов.
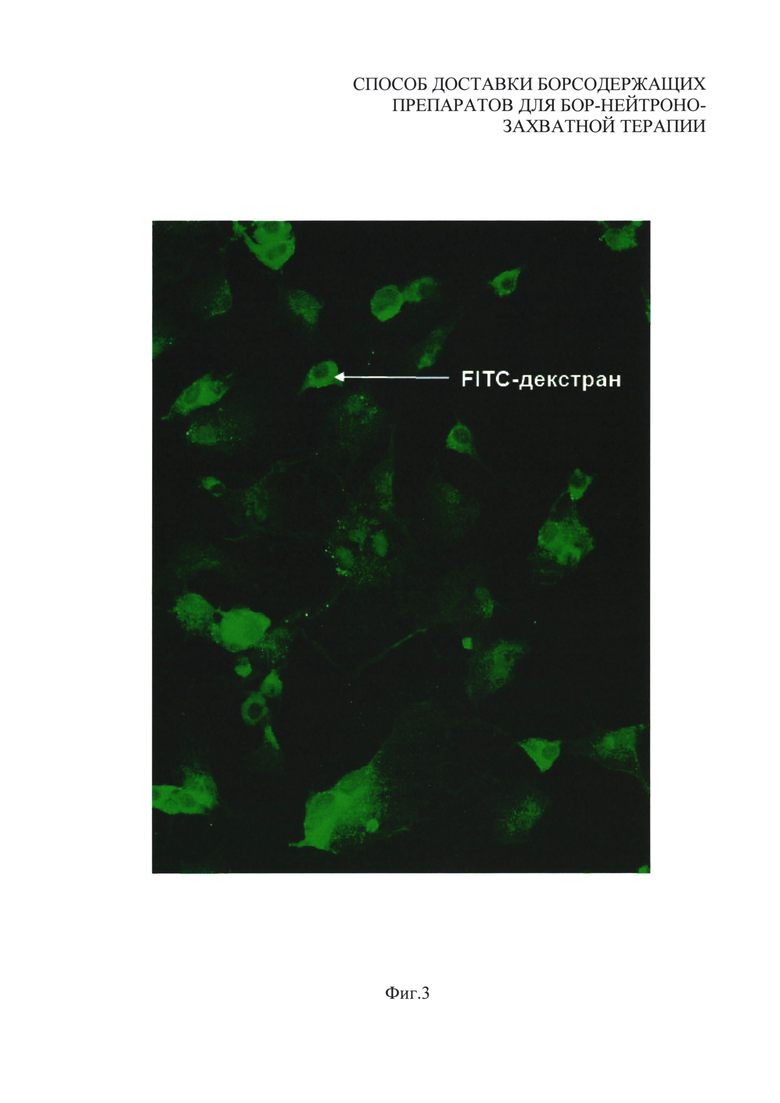
На фиг. 3 приведено полученное с помощью люминесцентной микроскопии изображение внутриклеточного распределения красителя FITC-декстран, включенного в водную часть липосомы вместе с BSH, в культуре клеток. Наличие на изображении зоны свечения в зеленой области спектра обусловлено присутствием этого красителя во внутриклеточной области, что подтверждает доставку веществ, находившихся в водной части липосом, внутрь клетки. На фиг. 3 зеленый цвет обозначен вертикальной штриховкой, образующей ряды вертикальных полос.
На фиг. 4 приведено полученное с помощью конфокальной микроскопии изображение внутриклеточного и внеклеточного распределения красителя PKH-26, включенного в липидную часть липосомы вместе с BPA, в культуре клеток epithelial cell line 804G. Свечение в красной области спектра, свойственное этому красителю, показывает локализацию веществ, находившихся в липидной части липосом. Конфокальная микроскопия с использованием светофильтра, соответствующего свечению меченных липосом, показало наличие люминесценции красителя как внутри, так и вне клеток.
Предлагаемый способ доставки борсодержащих препаратов для БНЗТ может осуществляться как на этапе научных исследований при проведении БНЗТ, так и на этапе последующей диагностики, например, для определения оптимальных значений концентрации борсодержащего препарата и для выбора временного отрезка, в пределах которого концентрация вышеуказанного препарата максимальна на клеточном уровне, а проведение БНЗТ будет наиболее эффективным.
В зависимости от целей и задач исследования выбирают используемые люминесцентные красители. Так, например, для оценки распределения веществ, заключенных в липофильную мембрану липосом, производят внедрение люминесцентной метки в липидную фазу липосомы, выбирают краситель из липофильной группы, а для визуализации веществ из внутренней водной части липосом выбирают гидрофильный краситель и включают его в водную фазу. Также могут использоваться красители, специфичные для определенных органелл клетки.
Осуществление предлагаемого способа рассмотрено на примере изготовления и контроля доставки пегилированных липосом, содержащих BPA в липидной части и люминесцентный краситель PKH-26, обладающий красной люминесценцией, а в водной части BSH и краситель FITC-декстран с зеленой люминесценцией. Для оценки внутриклеточного распределения липосом они содержат липофильный краситель и амфифильный 10B-содержащий препарат в липидной фазе и гидрофильный краситель с гидрофильным 10B-содержащим препаратом в водной фазе (Фиг. 1).
Для изготовления липосом в стеклянную колбу объемом 0,5 л вносят раствор яичного лецитина (Lipoid, Германия), холестерина (SIGMA-Aldrich) и ПЭГ 2000 в хлороформе в молярном соотношении 7:5:0,2. Мультиламеллярные везикулы (МЛВ) получают с использованием ротационного испарителя Heidolph (Германия). Для люминесцентного мечения липосомальной мембраны в липидную часть липосом вводят люминесцентный краситель одного цвета путем добавления к полученному раствору красителя PKH-26 (красный) (SIGMA-Aldrich) в молярном отношении лецитина к красителю 15000:1. В качестве 10B-содержащего препарата для БНЗТ, вводимого в липидную часть липосом на этом этапе, используют ((L)-4-дигидрокси-борфенилаланин, (международное название (L)-4-dihydroxy-borylphenylalanine), известного также как борфенилаланин (boronophenylalanine) или BPA в комплексе с фруктозой. Растворитель в колбе испаряют под рабочим вакуумом при температуре 40°C в течение 2 час. Введение боркаптата (международное название - sodium mercaptoundecahydro-closo-dodecaborate (Na2B12H11SH), известного также как борный сульфгидрил (sodium borocaptate) или BSH в водную фазу липосом проводят на этапе оводнения липидной пленки. Для этого полученную на стенках колбы липидную пленку гидратируют раствором PBS, содержащим насыщающую при 25°C концентрацию BSH, и встряхивают до образования мультиламеллярных везикул. Водную фазу липосом метят люминесцентным гидрофильным красителем FITC-декстран (зеленый). Для увеличения процента включения действующих веществ и улучшения стабильности везикул выполняют 10 циклов замораживания-оттаивания. Добавлением PBS доводят концентрацию липидов в суспензии до 100 мг/мл. Исследование методом негативного контрастирования в просвечивающем электронном микроскопе (JEM-100C, «JEOL», Япония) показало, что полученные после размораживания МЛВ были полиморфны и их размер варьировал в пределах 600-3000 нм.
Для получения липосом малого диаметра, ранее полученные МЛВ десятикратно пропускали через экструдер фирмы Lipex BiomembranesInc. (Канада) с использованием поликарбонатных фильтров («Costar», США). Для получения липосомальных частиц необходимого размера выполняли последовательно по 10 циклов экструзии через фильтры с диаметром пор 100 нм, 50 нм и 30 нм.
Перед использованием в эксперименте экстралипосомальные BSH и FITC-декстран удаляли методом диализа или гель-фильтрации. В случае использования гель-фильтрации концентрацию липосом в среде контролировали методом светорассеивания с использованием эталонных образцов.
Таким образом, получены пегилированные липосомы, содержащие BPA в липидной части и люминисцентный краситель PKH-26, обладающий красной люминесценцией, а в водной части BSH и краситель FITC-декстран с зеленой люминесценцией.
Эксперименты изучения внутриклеточного распределения пегилированных липосом с использованием люминесцентного микроскопа, содержащих BPA в липидной части и люминисцентный краситель PKH-26, обладающий красной люминесценцией, а в водной части BSH и краситель FITC-декстран с зеленой люминесценцией.
Средний диаметр липосом составлял 46 нм.
Полученные вышеописанным образом липосомы вводят известным образом в клеточную культуру. При исследовании взаимодейтсвия меченных липосом с клетками использовали культуру epithelialcellline 804G (карцинома крысы) и культуру кардиомиоцитов крысы.
Эксперименты по определению внутриклеточного распределения компонентов липосом в различных клеточных культурах и криостатных срезах изучаемых органов проводили методами люминесцентной и конфокальной микроскопии. Применяли конфокальный микроскоп LSM 780 (Carl Zeiss, Германия) и люминесцентный микроскоп Axio Observer Z. 1 (Carl Zeiss, Германия) в режиме Apotome.
Для репрезентативности исследования проводили в 6-кратной повторности в каждой серии с аналогичными результатами. На оригинальных фотографиях представлен типичный эксперимент.
Исследование поглощения и распределения меченных липосом в культуре epithelial cell line 804G. В культуральную среду добавляли липосомы в концентрации 0,5 мг липида/мл и инкубировали в течение 1 часа. Так как использовавшиеся красители относятся к витальным, изучение проводили непосредственно в плашках. Препараты просматривали с использованием конфокального микроскопа.
Изучение имиджей в культуре epithelial cell line 804G с использованием светофильтра, соответствующего свечению меченных липосом, показало наличие люминесценции красителя PKH-26 как внутри, так и вне клеток, что свидетельствует о проникновении 10B-содержащих препаратов в составе липосом внутрь клетки. Свечение у данного типа клеток наблюдалось во всем объеме с более яркой люминесценцией в их центральных областях, выделяющей их на фоне внеклеточного пространства.
Экстраклеточно, в минимальном количестве, наблюдали округлые частицы диаметром 50-100 нм (Фиг. 4), представляющие собой липосомы, не провзаимодействовавшие с клетками.
Таким образом, с использованием методов конфокальной микроскопии показана эффективность использования люминесцентно-меченных липосом для изучения внутриклеточного липосомального транспорта 10B-содержащих препаратов для БНЗТ.
Исследование поглощения и распределения меченных липосом в культуре кардиомиоцитов. В следующей серии экспериментов изучена возможность использования этого же подхода для изучения внутриклеточного распределения липосом с использованием люминесцентного микроскопа. Клетки инкубировали в среде, содержащей липосомы в концентрации 0,5 мг/мл, в течение 6 и 24 часов при t 37°C. После инкубации с липосомами клетки кардиомиоцитов фиксировали 4% забуференным параформальдегидом и дополнительно окрашивали ядра красителем DAPI. Полученные образцы изучали в люминесцентном микроскопе AxioImager A.1 с использованием соответствующих фильтров в режиме Apotome. В этой серии экспериментов наблюдали люминесценцию обоих красителей, что указывает на эффективность внутриклеточной доставки липофильных и гидрофильных веществ в составе липосом. Области внутриклеточной люминесценции PKH-26 и FITC-декстрана совпадали, что показывает, что липосомы попадают в цитоплазму без их разрушения и 10B-содержащие вещества в составе липосом были доставлены внутрь клетки в полном объеме (Фиг. 2, Фиг. 3). Экстраклеточно, люминисценции, характерной для красителя PKH-26 и FITC-декстрана не наблюдалось, что свидетельствует о тотальном проникновении липосом внутрь клеточной культуры.
Для получения количественных данных уровня люминисценции в различных участках и типах тканей, внутри клетки и вне клетки, как здоровых, так и опухолевых клеток, градации уровня люминисценции между опухолью и здоровой тканью, полученные изображения в цифровом виде передаются в компьютер, где подвергаются анализу с точки зрения не только визуальной, но и количественной оценки интенсивности свечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗМЕРЕНИЯ ПОГЛОЩЕННОЙ ДОЗЫ ПРИ БОР-НЕЙТРОНОЗАХВАТНОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2606337C1 |
| Способ определения поглощенной дозы от тепловых нейтронов при бор-нейтронозахватной терапии злокачественных опухолей | 2019 |
|
RU2709682C1 |
| СОЕДИНЕНИЯ БОРА, ПРИГОДНЫЕ ПРИ БОРНЕЙТРОНОЗАХВАТНОЙ ТЕРАПИИ | 2006 |
|
RU2423368C2 |
| нидо-Карборансодержащие бис-амиды фолиевой кислоты для доставки бора в опухолевые клетки | 2022 |
|
RU2794768C1 |
| СПОСОБ ПЛАНИРОВАНИЯ НЕЙТРОН-ЗАХВАТНОЙ ТЕРАПИИ | 2001 |
|
RU2212260C2 |
| БОРИЛИРОВАННЫЕ АМИНОКИСЛОТНЫЕ КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ В БОР-НЕЙТРОНОЗАХВАТНОЙ ТЕРАПИИ И ИХ СПОСОБЫ | 2020 |
|
RU2818817C2 |
| ПРОИЗВОДНОЕ ПАРА-БОРФЕНИЛАЛАНИНА И КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТАКОВОЕ, И НАБОР ДЛЯ ПОЛУЧЕНИЯ УПОМЯНУТЫХ ПРОИЗВОДНОГО И КОМПОЗИЦИИ | 2019 |
|
RU2797343C2 |
| БОРСОДЕРЖАЩЕЕ СОЕДИНЕНИЕ | 2017 |
|
RU2739198C2 |
| СИСТЕМА БОР-НЕЙТРОНОЗАХВАТНОЙ ТЕРАПИИ И СПОСОБ СОЗДАНИЯ ПЛАНА ЛЕЧЕНИЯ ДЛЯ НЕЕ | 2021 |
|
RU2824926C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ДЛЯ БОР-НЕЙТРОНОЗАХВАТНОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ (ВАРИАНТЫ) | 2019 |
|
RU2720458C1 |



Изобретение относится к медицине и касается способа доставки борсодержащих препаратов (10В) для бор-нейтронозахватной терапии (БНЗТ) для доставки внутрь клетки борсодержащих препаратов с помощью пегелированных липосом. При этом в изготовлении липосом дополнительно в липидную часть липосом вводят люминесцентный краситель одного цвета, в водную часть - липосом-люминесцентный краситель другого цвета, а контроль доставки в клетку осуществляют, сопоставляя изображения, полученные в том и другом цвете с помощью фиксирующего устройства. Изобретение обеспечивает повышение достоверности доставки борсодержащих препаратов для БНЗТ внутрь опухолевой клетки и обеспечение возможности определения внутриклеточной концентрации бора в различные моменты времени и определения максимальной внутриклеточной концентрации бора, необходимой для достижения максимального эффекта от БНЗТ. 6 з.п. ф-лы, 4 ил.
1. Способ доставки 10В-содержащих препаратов для бор-нейтронзахватной терапии (БНЗТ) с помощью липосом, при котором изготавливают липосомы, включающие 10В-содержащие препараты как в липидной части, так и в водной части липосом, вводят липосомы в исследуемый организм или в ткань, осуществляют контроль доставки 10В-содержащих препаратов, отличающийся тем, что дополнительно в липидную часть липосом вводят люминесцентный краситель одного цвета, в водную часть липосом - люминисцентный краситель другого цвета, а контроль доставки в клетку осуществляют, сопоставляя изображения, полученные в том и в другом цвете с помощью фиксирующего устройства.
2. Способ доставки 10В-содержащих препаратов для БНЗТ с помощью липосом по п. 1, отличающийся тем, что при изготовлении липосомы пегелируют.
3. Способ доставки 10В-содержащих препаратов для БНЗТ с помощью липосом по п. 1, отличающийся тем, что в качестве фиксирующего устройства используют люминесцентный микроскоп с соответствующими фильтрами.
4. Способ доставки 10В-содержащих препаратов для БНЗТ с помощью липосом по п. 1, отличающийся тем, что в качестве красителя, вводимого в липидную часть липосом, используют краситель из группы липофильных люминисцентных красителей, преимущественно PKH-26.
5. Способ доставки 10В-содержащих препаратов для БНЗТ с помощью липосом по п. 1, отличающийся тем, что в качестве красителя, вводимого в водную часть липосом, используют краситель из группы гидрофильных люминисцентных красителей, преимущественно FITC-декстран.
6. Способ доставки 10В-содержащих препаратов для БНЗТ с помощью липосом по п. 1, отличающийся тем, что в качестве 10В-содержащего препарата для БНЗТ, вводимого в липидную часть липосом, используют ((L)-4-дигидрокси-борфенилаланин (международное название (L)-4-dihydroxy-borylphenylalanine), известного также как борфенилаланин (boronophenylalanine) или ВРА.
7. Способ доставки 10В-содержащих препаратов для БНЗТ с помощью липосом по п. 1, отличающийся тем, что в качестве 10В-содержащего препарата для БНЗТ, вводимого в водную часть липосом, используют боркаптат (международное название - sodium mercaptoundecahydro-closo-dodecaborate (Na2B12H11SH), известного также как борный сульфгидрил (sodium borocaptate) или BSH.
Авторы
Даты
2016-07-10—Публикация
2014-12-02—Подача