Область техники
Настоящее изобретение относится к получению производных циклопропана и к промежуточным соединениям, полученным в ходе данного способа.
Предшествующий уровень техники
Как известно, производные циклопропана, такие как 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-он, обладают мощной антивирусной активностью.
Первый способ получения 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-она описан в патенте EP 0502690. Последовательность реакций, раскрытая в этих документах, включает получение этил-(1S,5S)-2-оксо-3-оксабицикло[3.1.0.]гексан-1-карбоксилата высокой оптической чистоты из R-(-)-эпихлоргидрина и диэтилмалоната. Последующее превращение в (1S,2R)-1,2-бис-(бензоилометил)циклопропилметил-п-толуолсульфонат требует 8 дальнейших стадий, включающих несколько стадий защиты и снятия защиты. (1S,2R)-1,2-бис(бензоилометил)циклопропилметил-п-толуолсульфонат затем сочетают с 2-амино-6-бензилокси-пурином. Наконец, удаление всех защитных гидроксильных групп приводит к целевому продукту. В одной из стадий диметилкетальная функциональная группа применяется в качестве диольной защитной функциональной группы в процессе превращения этильной функциональной группы в гидроксильную. Однако вследствие невысокой стабильности эту защитную группу требуется заменить для дальнейшего превращения гидроксильной группы в уходящую.
При синтезе аналогов 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-она, раскрытом в патенте EP 0649840, дополнительно продемонстрировано, что использование более устойчивой дифенилкетальной функциональной группы исключает необходимость замещения диольной защитной группы в процессе синтеза. Однако, установление этой защитной группы требует применения высокотоксичного 2,3-дихлор-5,6-дицианобензохинона (DDQ) и потенциально взрывчатого дифенилдиазометана.
Другой способ получения 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-она раскрыт в патенте EP 0675123. Последовательность реакций, описанных в этих документах, подобна вышеприведенному способу. Конкретно, этил-(1S,5R)-2-оксо-3-оксабицикло[3.1.0]гексан-1-карбоксилат высокой оптической частоты получают из R-(-)-эпихлоргидрина и диэтилмалоната. Затем сложноэфирную функциональную группу селективно восстанавливают в гидроксильную, при этом раскрывают и заново замыкают лактоновую группу. Затем гидроксильную группу дополнительно превращают в уходящую группу, и соединение сочетают с 2-амино-6 хлорпурином. Наконец, гидролиз основной группы в гуанин с последующим восстановлением лактонового кольца в диол приводит к образованию целевого продукта.
Формальный синтез 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-она, включающий в качестве ключевой стадии внутримолекулярное циклопропанирование D-рибозы действием ненасыщенного диазосоединения, описан Галлосом и сотр. в Tetr. Lett. 2001, 42, 7489.
Вышеописанные способы имеют определенные недостатки: синтетические пути включают несколько длительных стадий защиты и последующего снятия защиты, необходимость применения опасных веществ и/или применения малостабильных промежуточных веществ. Соответственно, необходимы способы синтеза циклопропановых производных, таких как 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропилметил]-1,9-дигидро-6-H-пурин-6-он, уменьшающие хотя бы одну из вышеприведенных проблем.
Краткое описание изобретения
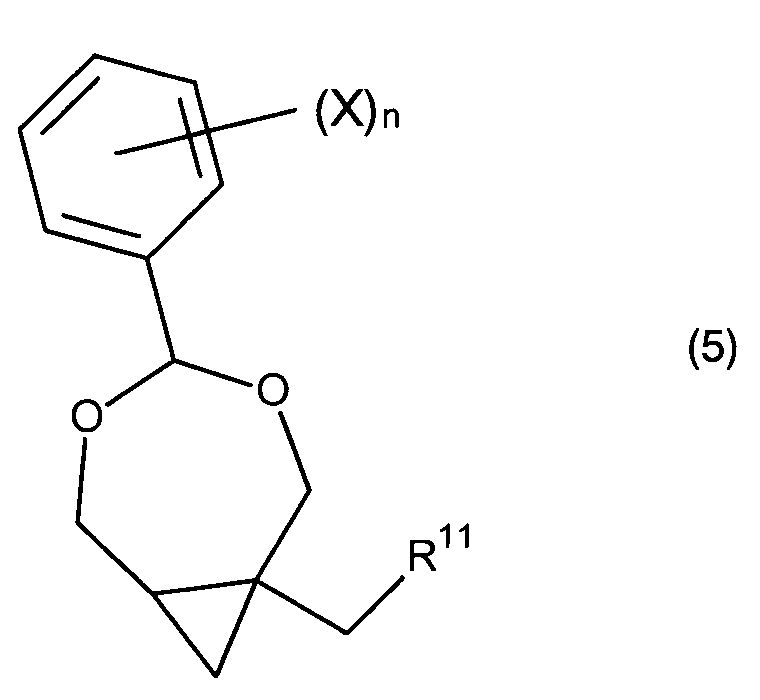
Целью настоящего изобретения является обеспечение нового и улучшенного способа получения 2-амино-9-[[1S,2R)-1,2-бис-(гидроксипропил]метил]-1,9-дигидро-6H-пурин-6-она и связанных соединений. Дополнительной целью изобретения является обеспечение способа, использующего легкодоступные исходные материалы и реакционные условия, подходящие для промышленности. Дополнительной целью изобретения является получение новых и полезных промежуточных соединений, в частности, производных (4-фенил-3,5-диоксабицикло[5.1.0]октан-1-ил)метанола и/или (4-фенил-3,5- диоксабицикло[5.1.0]октан-1-ил)метиламина, которые представлены соединением формулы (5), или его таутомером, рацематом или стереоизомером,
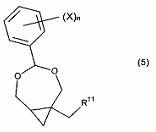
где n - целое число от 0 до 5, X выбран из: C1-6алкил, C1-6галогеналкил, C2-6алкенил, C2-6алкинил, галоген, гидроксил, C1-6алкокси или амино; R11 является гидроксилом или амино.
Авторы настоящего изобретения установили, что при применении фенилацетальной функциональной группы в качестве диольной защитной группы нет необходимости замещения диольной защитной группы в процессе синтеза, к примеру, 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-она.
Кроме того, авторы изобретения установили, что установление этой защитной группы является стереоселективным процессом, при котором большая часть стереоизомера может быть легко выделена с помощью кристаллизации. Действительно, [(1S,7R)-4-фенил-3,5-диоксабицикло[5.1.0]-октан-1-ил]метанол и его производные являются полезными синтетическими промежуточными соединениями, которые могут быть легко выделены и являются устойчивыми вследствие их высоко кристаллических свойств.
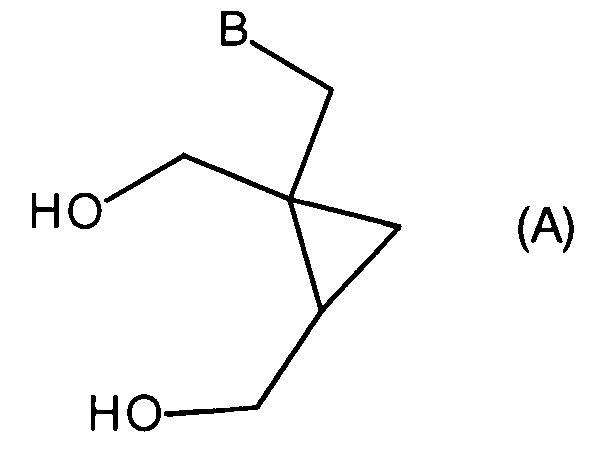
Важно, что соединения формулы (5) могут быть использованы как предшественники в синтезе некоторых аналогов 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-она. К примеру, соединения формулы (5a′) или 5(b′) могут быть применены как предшественники в синтезе некоторых аналогов 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-она формулы (A′):
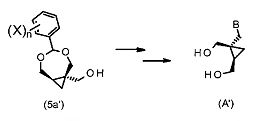
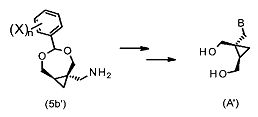
где B выбрано из группы, состоящей из пуринила, пиримидила или их аза- или деаза- аналогов, или -NR1R2; при этом каждая группа необязательно замещена одним или более заместителем, независимо выбранными из: галоген, амино, гидроксил, C1-6алкил, аминоС1-6алкил, нитро, формамидо, -NHR18, или OR7; и где углеродный атом указанного пуринила или пиримидила может быть окислен с образованием C=O, где R7 выбран из C1-4алкила, C6-10арилС1-6алкилена или C6-10арила, R18 выбран из C6-10арилС1-6алкилена, C1-6алкилкарбонила, галогенС1-6 алкилкарбонила, C1-6алкилоксикарбонила, 9-флуоренилметилоксикарбонила, или C6-10арилС1-6алкилоксикарбонила; и
R1 выбран из водорода, C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
R2 выбран из C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
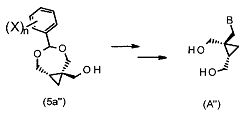
Дополнительно, соединения формулы (5a′′ или 5(b′′) могут быть применены в синтезе некоторых других аналогов 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-она формулы (A′′):
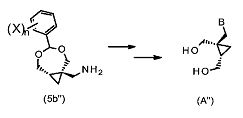
Соответственно, в первом аспекте настоящее изобретение представляет собой соединение формулы (5), как описано выше, либо его таутомера, рацемата или стереомера.
В следующем аспекте настоящее изобретение представляет способ получения соединения формулы (5), либо его таутомера, рацемата или стереомера,

где n, X и R11 имеют определенное в настоящем изобретении значение, включающий стадию превращения группы -COR12 соединения формулы (4)

где R12 является OR3 или амино, а R3 выбран из C1-6алкила, C6-10арила, C6-10арилС1-6алкилена, C6-10галогенарила, C1-6галогеналкила или C6-10галогенарилС1-6алкилена.
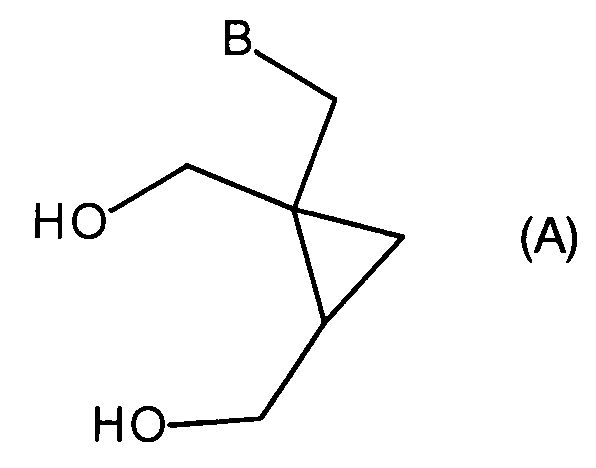
В следующем аспекте настоящее изобретение представляет применение производного циклопропана формулы (5) для получения производного циклопропана формулы (A)
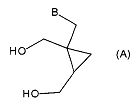
где B выбран из группы, состоящей из пуринила, пиримидила или их аза или деаза аналогов, или -NR1R2; при этом каждая группа необязательно замещена одним или более заместителями, независимо выбранными из галогена, амино, гидроксила, C1-6алкила, аминоС1-6алкила, нитро, формамидо, -NHR18, или OR7; и где углеродный атом указанного пуринила или пиримидила может быть окислен с образованием C=O, где R7 выбран из C1-4алкила, C6-10арилС1-6алкилена или C6-10арила, R18 выбран из C6-10арилС1-6алкилена, C1-6алкилкарбонила, галогенС1-6алкилкарбонила, C1-6алкилоксикарбонила, 9-флуоренилметилоксикарбонила, или C6-10арилС1-6алкилоксикарбонила; и
R1 выбран из водорода, C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
R2 выбран из C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
Настоящее изобретение также включает способы получения соединения формулы (4).
Подробное описание изобретения
Настоящее изобретение будет описано со ссылкой на конкретные воплощения, но настоящее изобретение ограничивается только формулой изобретения. Любые ссылки в формуле изобретения не должны быть истолкованы, как ограничивающие его объем.
Используемые формы единственного числа включают формы единственного и множественного числа, если из контекста явно не следует иное. Термины «содержащий», «включает» и «состоящий из», используемые здесь, являются синонимами «включающий», «включает» или «содержащий», «содержит» и не исключают дополнительных, не перечисленных членов элементов или этапов способа. Термины «содержащий», «содержит» и «состоящие из» также включают в себя термин «состоящий из». Кроме того, термины «первый», «второй», «третий» и т.п., в описании и формуле изобретения используются для различия подобных элементов и необязательно для описания последовательного или хронологического порядка, если это не отмечено специально. Следует понимать, что термины, используемые таким образом, при соответствующих обстоятельствах являются взаимозаменяемыми, и что описанные здесь воплощения изобретения способны функционировать в иной последовательности, нежели описанные или изображенные здесь.
Термин «примерно», используемый здесь по отношению к измеряемой величине такой, как параметр, количество, продолжительность времени и тому подобное, подразумевает диапазон +/-10 % или менее, предпочтительно +/-5 % или менее, более предпочтительно +/-1 % или менее, и еще более предпочтительно +/-0,1 % или менее от указанного значения, поскольку такие изменения являются оптимальными для выполнения в описанном изобретении. Следует понимать, что величина, по отношению к которой использован термин «примерно», сама по себе конкретна и предпочтительно, раскрыта. Перечисление численных областей конечных величин включает в себя все промежуточные значения этих величин, находящиеся в пределах соответствующих диапазонов, так же, как и перечисленные конечные значения этих величин.
Если специально не оговорено иное, каждый из следующих терминов имеет следующее значение:
Термин «ацил» приписывается радикалу, образованному при удалении гидроксильной группы из карбоновой кислоты (т.е., R-C(=O)-). Предпочтительными ацильными группами являются: ацетил, формил и пропионил, наиболее предпочтительной является ацетил.
Термин «карбонил» используется сам по себе или как часть другого заместителя и приписывается группе -С(=O)-.
Термин «C1-6алкил», как группа или часть группы, приписывается углеводородному радикалу формулы CnH2п+1, где n - число от 1 до 6. Обычно алкильные группы содержат от 1 до 6 углеродных атомов, например, 1-4 углеродных атома. Алкильные группы могут быть линейными или разветвленными и, как здесь указано, могут содержать заместители. Использованный здесь подстрочный знак, следующий за обозначением углеродного атома, относится к числу углеродных атомов, которое может содержать данная группа. Таким образом, символ C1-4алкил означает, что алкильная группа содержит от 1 до 4 углеродных атомов. Примерами алкильных групп являются: метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил и его цепочечные изомеры, гексил и его цепочечные изомеры.
Термин «C2-6алкенил», сам по себе или как часть другого заместителя, приписывается ненасыщенной углеводородной группе, которая может быть линейной или разветвленной и содержать одну или более двойных углерод-углеродных связей. Предпочтительные алкенильные группы, таким образом, содержат от 2 до 6 углеродных атомов, предпочтительно, от 2 до 4. Неограничивающие примеры C1-6алкенильных групп включают: этенил, 2-пропенил, 2-бутенил, 3-бутенил, 2-пентенил и его цепочечные изомеры, 2-гексенил и его цепочечные изомеры, 2,4 пентадиенил и его цепочечные изомеры, и т.п.
Термин «C2-6алкинил», сам по себе или как часть другого заместителя, приписывается ненасыщенной углеводородной группе, которая может быть линейной или разветвленной и содержать одну или более тройных углерод-углеродных связей. Предпочтительные алкинильные группы, таким образом, содержат от 2 до 6 углеродных атомов, предпочтительно, от 2 до 4. Неограничивающие примеры C2-6 алкинильных групп включают: этинил, 2-пропинил, 2-бутинил, 3-бутинил, 2-пентинил и его цепочечные изомеры, 2-гексинил и его цепочечные изомеры, и т.п.
Используемый здесь термин «C3-8циклоалкил», сам по себе или как часть другого заместителя, приписывается насыщенному или частично насыщенному циклическому алкильному радикалу, содержащему от 3 до 8 углеродных атомов. Примеры C3-8циклоалкил включают: циклопропил, циклобутил, циклопентил, или циклогексил, циклогептил и циклооктил.
Используемый здесь термин «C6-10арил», сам по себе или как часть другого заместителя, приписывается полиненасыщенной ароматической углеводородной группе, имеющей одно кольцо (т.е. фенил), либо множество конденсированных ароматических колец (например, нафталин), либо связанных ковалентно, обычно содержащих от 6 до 10 атомов, где, по меньшей мере, одно из колец является ароматическим. Арильные кольца могут быть незамещенными или замещенными, имея от 1 до 4 заместителей в кольце. Арильными заместителями могут быть: галоген, циано, нитро, гидрокси, карбокси, амино, ациламино, алкил, гетероалкил, галогеналкил, фенил, арилокси, алкокси, гетероалкокси, карбамил, галогеналкил, метилендиокси, гетероарилокси, или их любая комбинация. Примеры C6-10арил включают: фенил, нафтил, инданил или 1,2,3,4-тетрагидронафтил.
Когда термин «алкил» использован в качестве суффикса, следующего за другим термином, как, например, «гидроксиалкил», подразумевается, что он приписывается алкильной группе, определенной выше, замещенной одним или двумя (предпочтительно, одним) заместителями, выбранными из другой, конкретно названной группы, также определенной здесь. Следовательно, термин «гидроксиалкил» приписывается группе -Ra-OH, где группа Ra является алкиленом, определенным здесь. Используемый здесь термин «C1-6алкокси» или «C1-6алкилокси» приписывается радикалу формулы -ORd, где Rd является C1-6алкилом. Неограничивающие примеры подходящих алкокси групп включают: метокси, этокси, пропокси, изипрококси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси и гексилокси.
Используемый здесь термин «C1-6алкилен», сам по себе или как часть другого заместителя, приписывается бивалентным C1-6 алкильным группам, т.е., двум простым связям для соединения с двумя другими группами. Неограничивающие примеры алкиленовых групп включают: метилен (-CH2-), этилен (-CH2-CH2-), метилметилен (-CH(CH3)-), 1-метил-этилен (-CH(CH3)-CH2-), н-пропилен (-CH2-CH2-CH2-), 2-метилпропилен (-CH2-CH(CH3)-CH2-), 3-метилпропилен (-CH2-CH2-CH(CH3)-), н-бутилен (-CH2-CH2-CH2-CH2-), 2-метилбутилен (-CH2-CH(CH3)-CH2-CH2-), 4-метилбутилен (-CH2-CH2-CH2-CH(CH3)-), пентилен и его цепочечные изомеры, гексилен и его цепочечные изомеры.
Термин «C6-10арилС1-6алкилен», как группа или часть группы, означает определенный здесь радикал C1-6алкил, в котором водородный атом замещен определенным здесь радикалом C6-10арил. Примеры C6-10арилС1-6алкил радикалов включают: бензил, фенэтил, дибензилметил, метилфенилметил, 3-(2-нафтил)-бутил, и т.п.
Использованный здесь термин «C1-6алкилС6-10арилен», сам по себе или как часть другого заместителя, приписывается определенной здесь группе C6-10арил, в которой водородный атом замещен определенным здесь радикалом C1-6алкил. Использованный здесь термин «C3-6циклоалкилен», сам по себе, или как часть другого заместителя, приписывается насыщенному гомоциклическому углеводородному бирадикалу формулы CnH2n-2. Неограничивающие примеры циклоалкиленов включают: 1,2-циклопропилен, 1,1-циклопропилен, 1,1-циклобутилен, 1,2-циклобутилен, 1,3-циклопентилен, 1,1-циклопентилен, или циклогексилен.
Термин «аминоС1-6алкил», сам по себе или как часть другого заместителя, приписывается группе -Rj-NRkRI, где Rj является 1-6алкиленом, Rk является водородом или C1-6алкилом, определенным здесь, a RI является водородом или C1-6алкилом, определенным здесь.
Термин «C1-6алкил эфир»или «C1-6алкоксиС1-6алкил», сам по себе или как часть другого заместителя, приписывается группе C1-6алкил, замещенной одной или двумя группами Rb, где Rb является C1-6алкокси группой, определенной ниже.
Термин «C2-6алкенил эфир» или «C1-6алкенилоксиС1-6алкенил», сам по себе или как часть другого заместителя, приписывается группе C1-6алкенил, замещенной одной или двумя группами Re, где Re является группой C1-6алкенилокси.
«Гало», или «галоген» означает фтор, хлор, бром или иод.
Термин «C1-6алкилсульфинил», «C6-10арилсульфинил» или «C6-10арилС1-6алкиленсульфинил», сам по себе или как часть другого заместителя, приписывается группе -S(O)Rx, где Rx является C1-6алкил, C6-10арил или C6-10арилС1-6алкилен группой, соответственно. Примером C1-6 алкилсульфиниловой группы является метилсульфинил.
Термин «C1-6алкилсульфонил», «C6-10арилсульфонил» или «C6-10арилС1-6алкиленсульфонил», сам по себе или как часть другого заместителя, приписывается группе -S(=O)2Ry, где Ry является C1-6алкил, C6-10арил или C6-10арилС1-6алкилен группой, соответственно. Примером C1-6 алкилсульфониловой группы является метилсульфонил.
Термин «C1-6алкилтио», «C6-10арилтио» или «C6-10арилС1-6алкилентио», сам по себе или как часть другого заместителя, приписывается группе -SRW, где RW является C1-6алкил, C6-10арил или C6-10арилС1-6алкилен группой, соответственно. Неограничивающие примеры подходящих C1-6алкилтиогрупп включают: метилтио, этилтио, пропилтио, изопропилтио, бутилтио, втор-бутилтио, трет-бутилтио, пентилтио и гексилтио.
Термин «C1-6алкилсульфонат», «C6-10арилсульфонат» или «галогенС1-4алкилсульфонат», сам по себе или как часть другого заместителя, приписывается группе -S(=O)2-O-Rv, где Rv является C1-6алкил, C6-10арил или галоС1-3 группой, соответственно. Примером C1-6алкилсульфоната является метилсульфонат. Примерами галогенС1-4алкилсульфоната являются нонафторбутансульфонат (нонафлат) и трифторметансульфонат (трифлат).
Термин «C1-6алкилфосфонат» или «C6-10арилфосфонат», сам по себе или как часть другого заместителя, приписывается группе -OP(=O)(ORt)(ORu), где Rt и Ru являются C1-6алкил и C6-10арил группами, соответственно. Предпочтительно, группы Rt и Ru идентичны. Примером C1-6алкилфосфоната является диэтилфосфонат.
Использованный здесь термин «формамидо» приписывается группе -NH-С(=O)-Н.
Термин «амино», сам по себе или как часть другого заместителя, приписывается группе -NH2.
Использованный здесь термин «фармацевтически приемлемые соли» или «ветеринарно приемлемые соли» означает терапевтически активные нетоксичные аддитивные солевые формы, которые способны образовывать соединения формулы и которые могут быть легко получены обработкой основной формы таких соединений соответствующим основанием или кислотой. Фармацевтически приемлемые соли присоединения кислоты или основания, как выше-, так и нижеупомянутые, означают терапевтически активные нетоксичные соли присоединения кислоты или основания, которые способны образовать соединения формулы (A). Фармацевтически приемлемые соли присоединения кислоты могут быть легко получены обработкой основной формы соответствующей кислотой. Соответствующие кислоты включают, к примеру, неорганические кислоты, такие как галогенводородные, например, хлористоводородная или бромистоводородная кислота, серная, азотная, фосфорная и тому подобные кислоты; или органические, такие, например, как уксусная, пропионовая, гидроксиуксуная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памоевая и тому подобные кислоты. И наоборот, упомянутые солевые формы могут быть превращены обработкой соответствующим основанием в свободную основную форму. Соединения формулы (A), содержащие кислый протон, могут быть превращены в их нетоксичные металлические или аминные солевые формы обработкой соответствующими органическими и неорганическими основаниями. Соответствующие основные солевые формы включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например, лития, натрия, калия, магния, солей кальция и т.п., соли органических оснований, например, первичных, вторичных и третичных алифатических и ароматических аминов, таких как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; бензатин, N-метил-D-глюкамин, соли гидрабамина, и соли аминокислот, например, аргинина, лизина и т.п. И наоборот, солевая форма может быть превращена обработкой кислотой в свободную основную форму.
Кроме того, соли кислот или оснований, не являющихся физиологически приемлемыми, могут также находить применение, например, для получения или очистки физиологически приемлемого соединения. Все соли, независимо от физиологической приемлемости кислоты или основания, находятся в объеме настоящего изобретения.
Использованный здесь термин «изомеры» означает все возможные изомерные формы, которые могут иметь соединения формул (A), (A′), (A′′), от (1) до (8) или от (1′) до (8′). Если специально не оговорено иное, стандартное химическое название относится ко всем возможным стереохимическим изомерным формам, включающим все диастереомеры и энантиомеры (поскольку все описанные здесь соединения могут иметь, по меньшей мере, один хиральный центр) основной молекулярной структуры. В особенности, если не оговорено иное, стереогенные центры могут иметь либо R-, либо S-конфигурацию, а заместители могут иметь либо цис-, либо транс-конфигурацию.
Чистые изомерные формы упомянутых соединений определены, как изомеры, преимущественно свободные от других энантиомерных или диастереомерных форм одной и той же основной молекулярной структуры. В частности, термин «стереоизомерно чистый» или «хирально чистый» относится к соединениям, имеющим стереоизомерный избыток, по меньшей мере, около 80% (т.е., по меньшей мере, 90% одного изомера и не более 10% других возможных изомеров), предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 94%, наиболее предпочтительно - по меньшей мере, 97%. Термины «энантиомерно чистый» и «диастеремерно чистый» следует понимать подобным образом, относительно имеющегося избытка энантиомера или, соответственно, избытка диастереомера в смеси, о которой идет речь. Следовательно, если в процессе любого из последующих способов синтеза получена смесь энантиомеров, она может быть разделена с помощью метода жидкостной хроматографии с применением подходящей хиральной стационарной фазы. Подходящими хиральными стационарными фазами являются, например, полисахариды, в особенности, производные целлюлозы или амилозы. Коммерчески доступными хиральными стационарными фазами на основе
полисахарида являются: ChiralCel™ СА, OA, OB, ОС, OD, OF, OG, OJ и OK, и Chiralpak™ AD, AS, OP(+) и OT(+). Подходящими элюентами или подвижными фазами при использовании в сочетании с указанными полисахаридными хиральными фазами являются: гексан и т.п., модифицированный спиртом типа этанола, изопропанола и т.п. Термины цис- и транс- применяются здесь в соответствии с номенклатурой Chemical Abstracts и относятся к положению заместителей в циклическом радикале. Абсолютная стереохимическая конфигурация соединений формулы может быть легко определена специалистами в данной области техники с помощью известных способов, таких как, например, рентгеновская диффракция.
Специалистам в данной области техники будет также понятно, что соединения по настоящему изобретению могут находиться в различных протонированных формах, зависящих, в частности, от pH среды. В то время как структурные формулы, представленные здесь, описывают соединение только в одной из нескольких возможных протонированных форм, следует понимать, что эти структуры являются лишь иллюстративными, и что изобретение не ограничено какой-либо конкретной протонированной формой, а все формы соединений, включая протонированные, предназначены, чтобы подпадать под объем настоящего изобретения.
Все документы, процитированные в настоящем описании, включены сюда путем ссылки полностью.
Если не определено иное, все термины, используемые в раскрытии изобретения, включая технические и научные термины, имеют значение, которое обычно понимается специалистом с обычной квалификацией в области техники, к которой относится это изобретение. Дополнительные указания и определения терминов, используемых в описании изобретения, включены, чтобы с их помощью лучше понять смысл настоящего изобретения. Термины и определения, используемые в данном документе, приводятся исключительно для оказания помощи в понимании изобретения.
Ссылка в данном описании на «одно воплощение» или «воплощение» означает, что конкретный признак, структура или характеристика, описанные в связи с данным воплощением, включены, по меньшей мере, в одно из воплощений настоящего изобретения. Таким образом, фразы «в одном воплощении» или «в воплощении» в различных местах данного описания не обязательно относятся к одному и тому же воплощению, но могут и относиться. Кроме того, конкретные признаки, структуры или характеристики могут сочетаться любым подходящим способом, понятным для специалиста в данной области техники, в одном или нескольких воплощениях. Кроме того, в то время как некоторые воплощения, описанные здесь, включают некоторые признаки, не включенные в другие воплощения, сочетания особенностей различных воплощений предназначены, чтобы находиться в пределах объема настоящего изобретения, и образуют различные воплощения, понятные для специалистов в данной области техники. Например, в следующей формуле изобретения любое из заявленных воплощений может быть использовано в любом сочетании.
В первом аспекте настоящее изобретение представляет собой соединение формулы (5):

или его таутомер, рацемат или стереоизомер,
где n является целым числом от 0 до 5, а X выбран из C1-6алкила, C1-6галогеналкила, C2-6алкенила, C2-6алкинила, галогена, гидроксила, C1-6алкокси или амино; и R11 является гидроксилом или амино.
В конкретных воплощениях n является 0, 1, 2, 3, 4 или 5. В предпочтительных воплощениях n является 0, 1 или 2, предпочтительно, 0 или 1. В некоторых воплощениях n является 0, 1 или 2, а X выбран из C1-6алкила, C1-6галогеналкила, галогена, гидроксила, C1-6алкокси или амино. В определенных воплощениях n является 0.
В формуле (5) символ «*» указывает на стереогенный центр. Конкретные стереоизомеры (R или S конфигурации) соединений формулы (A) относятся к разделенным энантиомерам соединений по одному или более из этих конкретных стереогенных центров. Соответственно, термин «стереоизомерно чистый», используемый по отношению к соединениям формулы (5), означает, что соединения формулы (5) являются стереохимическими чистыми по одному или более стереогенному центру, обозначенному символом «*». Если группа X включает стереогенный центр, она может иметь R, S или RS конфигурацию, если не указано иное.
В частных воплощениях соединения формулы (5) по настоящему изобретению являются стереоизомерно чистыми. В определенных воплощениях соединение формулы (5) может быть соединением формулы (5′) или (5′′):

В формуле (5′) и (5′′) символ «*» указывает на стереогенный центр, который может иметь R, S или RS конфигурацию.
В следующем аспекте настоящее изобретение представляет собой способ получения соединения формулы (5), либо его таутомера, рацемата или стереомера, включающий стадию превращения группы -COR12 соединения формулы (4) с образованием соединения формулы (5);

где R12 является -OR3 или амино, а R3 выбран из C1-6алкила, C6-10арила, C6-10арилС1-6алкилена, C6-10галогенарила, C1-6галогеналкила или C6-10галогенарилС1-6алкилена.
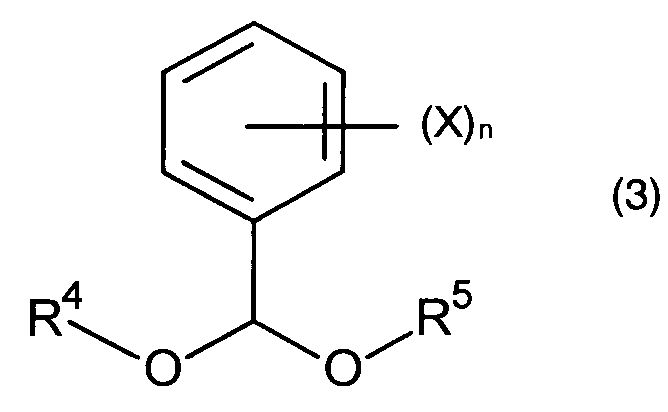
В некоторых воплощениях получение указанного соединения формулы (4) включает реакцию соединения формулы (2) с соединением формулы (3):

с образованием соединения (4a)

где R19 является -OR23 и R23 выбран из C1-6алкила, C6-10арила, C6-10арилС1-6алкилена, C6-10галогенарила, C1-6галогеналкила или C6-10галогенарилС1-6алкилена, а R4 и R5 независимо выбраны из C6-10арилС1-6алкилена или C6-10арила.
В дополнительном воплощении способ дополнительно включает стадию превращения сложноэфирной группы соединения (4a) в амидную группу с образованием соединения формулы (4b)

где X и n имеют те же значения, что описаны выше.
Соединения формул (5), (5′) или (5′′) особенно ценны в качестве предшественников в синтезе соединений формул (A), (A′) или (A′′), как описано ниже.
В следующем аспекте настоящее изобретение представляет собой способ получения соединения формулы (A):
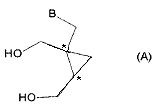
или его таутомера, рацемата, стереоизомера, фармацевтически приемлемой соли, гидрата или сольвата,
где B выбран из группы, состоящей из пуринила, пиримидила, или их аза или деаза аналогов, или -NR1 R2; при этом каждая группа необязательно замещена одним или более заместителем, независимо выбранным из галоген, амино, гидроксила, C1-6алкила, аминоС1-6алкил, нитро, формамидо, -NHR18, или OR7; и где углеродный атом указанного пуринила или пиримидила может быть окислен с образованием С=O, где R7 выбран из C1-4алкила, C6-10арилС1-6алкилена или C6-10арила, R18 выбран из C6-10арилС1-6алкилена, C1-6алкилкарбонила, галогенС1-6алкилкарбонила, C1-6алкилоксикарбонила, 9-флуоренметилоксикарбонила или C6-10арилС1-6алкилоксикарбонила; и
R1 выбран из водорода, C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
R2 выбран из C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
В отдельных воплощениях R18 выбран из 9-флуоренилметилоксикарбонила, трет-бутилоксикарбонила, бензилоксикарбонила, метилкарбонила, бензила и трифенилметила.
В частных воплощениях B представляет собой пуринил или производное пуринила, предпочтительно связанное через положение 9 пуринового кольца, пиримидил или производное пиримидила, либо их аза и/или деаза аналоги. В аза аналогах, по меньшей мере, один из атомов углерода в B замещен атомом азота; в деаза аналогах, по меньшей мере, один из атомов азота в B замещен атомом углерода. Комбинации таких замещений также включены в объем настоящего изобретения.
Предпочтительными производными пуринила являются аденил, гуанил, 2-амино-6-хлорпуринил, 2-аминопуринил, 2,6-диаминопуринил, ксантил или гипоксиксантил. Предпочтительными производными пиримидила являются тиминил, урацил и цитозинил. Соответственно, в частных воплощениях В выбран из группы, включающей пуринил, аденил, гуанил, 2-амино-6-хлорпуринил, 2-аминопуринил, 2,6-диаминопуринил, ксантил или гипоксиксантил, пиримидил, тиминил, урацил и цитозинил.
В определенных воплощениях B представляет собой 2-амино-6-хлорпуринил или гуанил.
Соединение формулы (A) может находиться в как в сольватированной, так и в несольватированной форме. Термин «сольват» употребляется здесь для описания молекулярного комплекса, включающего соединение (A) и стехиометрическое количество одной или более молекул фармацевтически приемлемого растворителя, например, этанола. Термин «гидрат» употребляется, когда указанным растворителем является вода.
В формуле (A) символ «*» указывает на стереогенный центр. Специфические стереоизомеры (R или S конфигурации) соединений формулы (A) относятся к разделенным энантиомерам соединений по этим конкретным стереогенным центрам. Соответственно, термин «стереоизомерно чистый», используемый по отношению к соединениям формулы (A), означает, что соединения формулы (A) являются стереохимическими чистыми по стереогенным центрам, обозначенным символом «*». Если группа В содержит стереогенный центр, она может иметь R, S или RS конфигурацию, если не указано иное.
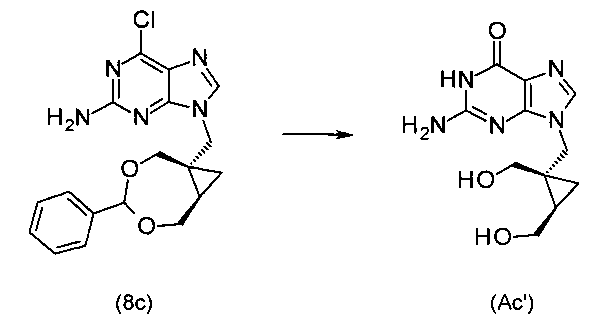
В конкретных воплощениях соединение формулы (A), являющееся 2-амино-9[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-оном, представлено формулой (Ac′).

Настоящее изобретение также включает способ получения соединения формулы (A)
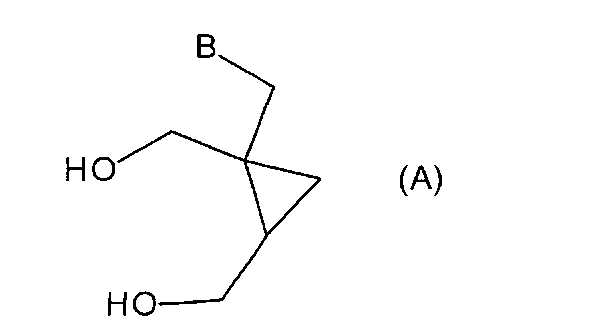
или его таутомера, рацемата, стереоизомера, фармацевтически приемлемой соли, гидрата или сольвата,
где В выбран из группы, состоящей из пуринила, пиримидила или их аза или деаза аналогов, или -NR1R2; при этом каждая группа необязательно замещена одним или более заместителями, независимо выбранными из галогена, амино, гидроксила, C1-6алкила, аминоС1-6алкила, нитро, формамидо, -NHR18, или OR7; и где углеродный атом вышеупомянутого пуринила или пиримидила может быть окислен с образованием C=O, где R7 выбран из C1-4алкила, C6-10арилС1-6алкилена или C6-10арила, R18 выбран из C6-10арилС1-6алкилена, C1-6алкилкарбонила, галогенС1-6 алкилкарбонила, C1-6алкилоксикарбонила, 9-флуоренилметилоксикарбонила, или C6-10арилС1-6алкилоксикарбонила; и
R1 выбран из H, C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
R2 выбран из C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
включающий стадию гидролиза или восстановления соединения формулы (8);

где n представляет собой целое число от 0 до 5, X является C1-6алкилом, C1-6галогеналкилом, C2-6алкенилом, C2-6алкинилом, галогеном, гидроксилом, C1-6алкокси или амино; и
где B′ является B или выбран из группы, состоящей из пуринила, пиримидила или их аза или диаза аналогов, или -NR1R2; при этом каждая группа необязательно замещена одним или более заместителями, независимо выбранными из галогена, амино, гидроксила, C1-6алкила, аминоС1-6алкила, нитро, формамидо, -NHR18 или OR7; и где углеродный атом указанного пуринила или пиримидила может быть окислен с образованием С=O, где R7 выбран из C1-4алкила, C6-10арилС1-6алкилена или C6-10арила, R18 выбран из C6-10арилС1-6алкилена, C1-6алкилкарбонила, галогенС1-6алкилкарбонила, C1-6алкилоксикарбонила, 9-флуоренилметилоксикарбонила, или C6-10арилС1-6алкилоксикарбонила, R24 and R25 независимо выбраны из водорода или C1-6алкила, и
R1 выбран из водорода, C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогеналкила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
R2 выбран из C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена.
В некоторых воплощениях указанное соединение формулы (8) получают сочетанием соединения формулы (5a) с соединением формулы B′-H,
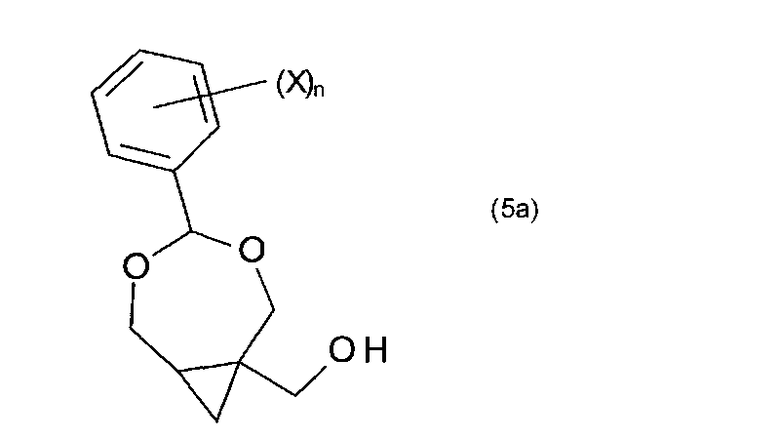
где X и n имеют те же значения, что определены в п. 1, B′ имеет то же значение, что определены выше, а H является водородом.
В одном из воплощений перед сочетанием соединения формулы (5a) с соединением B′-H, гидроксильную группу соединения формулы (5a) преобразуют с получением соединения формулы (6):
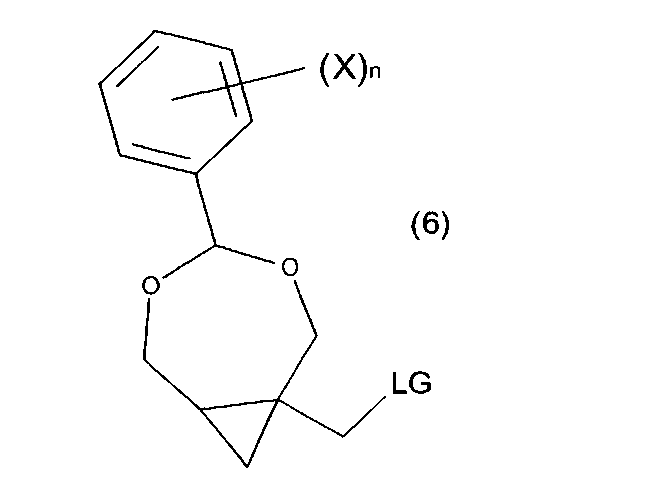
где LG является уходящей группой, выбранной из галогена, мезилата, тозилата, азида, нозилата, трифлата, циано или имидазолила.
Способ может также дополнительно включать стадию реакции соединения формулы (5b) с соединением формулы (13):

где R15 является -OR27 или R28, R16 выбран из группы, состоящей из амино, нитро, формамидо или водорода, R17 выбран из галогена, C1-6алкокси, C1-6арилокси, C6-10арилС1-6алкиленокси, C1-6алкилсульфинила, C6-10арилсульфинила, C6-10арилС1-6алкиленсульфинила, C1-6алкилсульфонила, C6-10арилсульфонила, C6-10арилС1-6алкиленсульфонила, C1-6алкилтио, C6-10арилтио, C6-10арилС1-6алкилентио, C1-6алкилсульфоната, C6-10арилсульфоната, галогенС1-4алкилсульфоната, C1-6алкилфосфоната и C6-10арилфосфоната;
R27 выбран из группы, состоящей из водорода, C1-6алкила, C6-10арил, и C6-10арилС1-6алкилен, R28 выбран из галогена, C1-6алкокси, C1-6арилокси, C6-10арилС1-6алкиленокси, C1-6алкилсульфинила, С6-10арилсульфинила, С6-10арилС1-6алкиленсульфинила, С1-6алкилсульфонила, С6-10арилсульфинила, С6-10арилС1-6алкиленсульфонила, С1-6алкилтио, С6-10арилтио, С6-10арилС1-6алкилентио, С1-6алкилсульфоната, С6-10арилсульфоната, галогенС1-4алкилсульфоната, С1-6алкилфосфоната и С6-10арилфосфоната; и
R26 выбран из водорода, C6-10арилС1-6алкилена или COR30, где R30 выбран из C1-6алкила, галогенС1-6алкила, C1-6алкилокси, 9-флуоренилметилокси или C6-10арилС1-6алкилокси.
В некоторых воплощениях соединение (5a) или (5b) может быть получено вышеописанным здесь способом получения соединения формулы (5).
Способ может дополнительно включать стадию кристаллизации и очистки указанного соединения формулы (5a) или (5b).
Предпочтительно, в настоящем способе соединение формулы (A) является соединением формулы (A′):

В одном воплощении способ получения соединения формулы (A) может быть преобразован, как показано на схеме I.
СХЕМА I
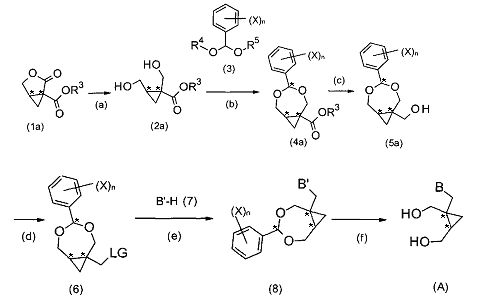
где n, X и B имеют те же значения, что определены выше, H является водородом и B′ является B или выбран из группы, состоящей из пуринил, пиримидил или их аза- или деаза аналогов или -NR1R2; при этом каждая группа необязательно замещена одним или более заместителем, независимо выбранным из галогена, амино, гидроксила, C1-6алкила, аминоС1-6алкила, нитро, формамидо, -NHR18 или OR7; и где углеродный атом указанного пуринила или пиримидила может быть окислен с образованием С=O, где R7 выбран из C1-4алкила, C6-10арилС1-6алкилена или C6-10арила, R18 выбран из C6-10арилС1-6алкилена, C1-6алкилкарбонила, галогенС1-6алкилкарбонила, C1-6алкилоксикарбонила, 9-флуоренилметилоксикарбонила или C6-10арилС1-6алкилоксикарбонила, и
R1 выбран из водорода, C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галоалкила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена,
R2 выбран из C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена.
R3 выбран из C1-6алкила, C6-10арила, C6-10арилС1-6алкилена, C6-10галогенарила, C1-6галогеналкила или C6-10галогенарилС1-6алкилена.
R4 и R5 независимо выбраны из C1-6алкила, C6-10арилС1-6алкилена или C6-10арила.
В схеме I символ «*» указывает на стереогенный центр. В предпочтительных воплощениях способ по настоящему изобретению является стереоселективным в том смысле, что конфигурация стереогенных центров в циклопропановом фрагменте сохраняется. На схеме I′ показано получение определенных энантиомеров циклопропановых производных. Тем не менее, способ по настоящему изобретению не ограничивается данными энантиомерами, но может быть применен для получения любого энантиомера формулы (A) в зависимости от конфигурации исходных продуктов.
Схема I′
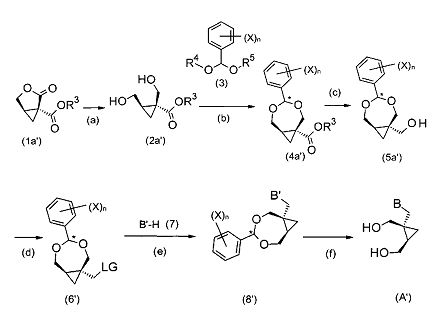
В схеме I′ символ «*» указывает на стереогенный центр, который может иметь R, S или RS конфигурацию, если не оговорено иное.
В частных воплощениях, как показано на схемах I и I′, способ по настоящему изобретению начинается с эфира лактона (1a) или (1a′), который может быть получен по методике, известной специалистам в данной области техники, предпочтительно, по способу, описанному в в Helvetica Chimica Acta 1989, 72 (6), 1301 или в патенте EP 0502690. Эфир лактон (1a) или (1a′) может включать защитную группу R3, выбранную из группы, состоящей из C6-10арила, C6-10арилС1-6алкилена, C1-6алкила, C1-6галогеналкила или C6-10галогенарилС1-6алкилена. В частных воплощениях R3 является C6-10арилом или C1-4алкила. В предпочтительных воплощениях R3 является фенилом, бензилом, метилом, этилом, пропилом, изопропилом или трет-бутилом. В более предпочтительных воплощениях R3 является метилом, этилом или фенилом.
В предпочтительных воплощениях эфир лактон (1a) или (1a′) селективно восстанавливается с образованием соединений формулы (2a) или (2a′), как показано в стадии (a) схемы I и схемы I′. Селективное восстановление может быть проведено с использованием одного или большего числа восстанавливающих агентов, предпочтительно, в присутствии подходящего растворителя. Один или большее число восстанавливающих агентов, таких как соединения металлических гидридов, которые могут быть выбраны из группы, включающей NaBH4/CeCl3, LiAlH4, NaBH4, NaBH(OAc)3 и ZnBH4. Предпочтительно, один или большее число восстанавливающих агентов включают борогидрид щелочного металла или алюмогидрид щелочного металла, более предпочтительно борогидрид натрия или алюмогидрид лития.
Неограничивающими примерами подходящих растворителей могут быть, предпочтительно, этанол или тетрагидрофуран (ТГФ). Стадия (a) является необязательной и может быть заменена любым другим способом получения соединения формулы (2a) или (2a′).
В частных воплощениях соединение формулы (2a) или (2a′) может быть сконденсировано согласно стадии (b) в схеме I и I′ с соединением формулы (3). В соединении формулы (3) R4 и R5 независимо выбраны из C1-6алкила, C6-10арилС1-6алкилена или C6-10арила. В частных воплощениях R4 и R5 являются идентичными группами, предпочтительно, метильными; n является целым числом от 0 до 5, и X выбран из C1-6алкила, C1-6галогеналкила, C2-6алкенила, C2-6алкинила, галогена, гидроксила, C1-6алкокси или амино.
В предпочтительных воплощениях X является C1-4алкилом или галогеном. В частных воплощениях n является 0, 1, 2, 3, 4 или 5. Предпочтительно, n является 0, 1 или 2, наиболее предпочтительно - 0 или 1.
В некоторых воплощениях соединение формулы (3) может представлять собой диалкоксиметилбензол, в частности, диметоксиметилбензол, который является либо коммерчески доступным, либо легко получаемым посредством методики, известной специалисту в данной области техники, что приводит к образованию соединения формулы (4a) или (4a′).
В частных воплощениях реакция конденсации (b) может быть проведена в присутствии одного или большего числа кислых катализаторов, необязательно в подходящем растворителе - таком, как апротонный растворитель, предпочтительно, циклогексан и/или толуол, с образованием соединения формулы (4a) или (4a′). В предпочтительных воплощениях один или большее число кислых катализаторов может быть выбран из камфорсульфоновой кислоты, метансульфоновой кислоты и/или серной кислоты.
Стадия (b) в настоящем способе имеет то преимущество, что она исключает необходимость применения опасных веществ, таких как дихлор-5,6-дицианобензохинона (DDQ) и потенциального взрывчатого дифенилдиазометана, применяемых в способе, раскрытом в патенте EP 0649840.
В частных воплощениях сложноэфирная группа соединения формулы (4a) или (4a′) может быть селективно восстановлена в спирт формулы (5) или (5a′), как показано в стадии (с) схемы I и схемы I′. В предпочтительных воплощениях это достигается при применении одного или большего числа восстанавливающих агентов, предпочтительно, в присутствии одного или большего числа растворителей, предпочтительно, этанола и/или ТГФ. Предпочтительными восстанавливающими агентами являются: борогидрид натрия, борогидрид лития, алюмогидрид лития, диизобутилалюмогидрид, триэтилборогидрид лития и три-втор-бутилборогидрид лития.
Образование соединения формулы (5) или (5a′) имеет то преимущество, что это соединение может быть в значительной степени очищено и/или выделено с помощью кристаллизации. Соответственно, в предпочтительных воплощениях за стадией (с) следует кристаллизация и очистка соединения формулы (5) или (5a′). В конкретных воплощениях кристаллизация проводится в смеси полярного и неполярного растворителя, предпочтительно, при температуре в диапазоне 0°-70°C. Предпочтительными полярными растворителями являются дихлорметан, тетрагидрофуран, этилацетат, ацетон, диметилформамид, ацетонитрил и диметилсульфоксид. Предпочтительными неполярными растворителями являются петролейный эфир, пентан, циклопентан, гексан, циклогексан, бензол, толуол, 1,4-диоксан, хлороформ и диэтиловый эфир.
В следующей (необязательной) стадии (d) гидроксильная группа соединения формулы (5) или (5a′) может быть превращена в уходящую группу (LG), что приводит к образованию соединения формулы (6) или (6′). В предпочтительных воплощениях уходящей группой является фтор, хлор, йод, бром, мезилат, тозилат, азид, нозилат, трифлат, циано или имидазолил. В определенных воплощениях уходящая группа выбрана из группы, включающей галоген, мезилат и тозилат. В дополнительных воплощениях соединение формулы (6) или (6′) может быть получено из соединений формулы (5) или (5a′) с помощью галогенирующего реагента, такого как тионилгалогенид, ацилгалогенид или галогенид фосфора, с помощью мезилирующего реагента, такого как метансульфонилгалстенид или с помощью тозилирующего реагента, такого как п-толил-сульфонилгалогенид. Реаккция может быть проведена в присутствии основания, такого как триэтиламин, диметиламинопиридин и/или пиридин. Реакция может быть проведена в подходящем растворителе, таком как апротонный растворитель (предпочтительно, ТГФ и/или дихлорметан) без катализатора, или в его присутствии, такого как диметилформамид и/или диметиламинопиридин.
В других воплощениях уходящей группой является галоген, где соединение формулы (6) или (6′) синтезировано из соединений формулы (5) или (5a′), которые реагируют с галогенирующим реагентом, предпочтительно тетрахлоридом углерода, тетрабромидом углерода или йодом в присутствии трифенилфосфина. Реакция может быть проведена в присутствии обычного растворителя, предпочтительно ацетонитрила и/или дихлорметана, без катализатора или в его присутствии, такого как триэтиламин и/или имидазол.
В последующей (необязательной) стадии (е) соединения формулы (6) или (6′) могут быть сконденсированы с соединением B′-H (7) с получением соединения формулы (8) или (8′). В частных воплощениях соединение (7) является производным пурина или пиримидина, предпочтительно, производным пурина (7a), как показано на схеме Па, или производным пиримидина, как показано на схеме IIb.
СХЕМА IIb.
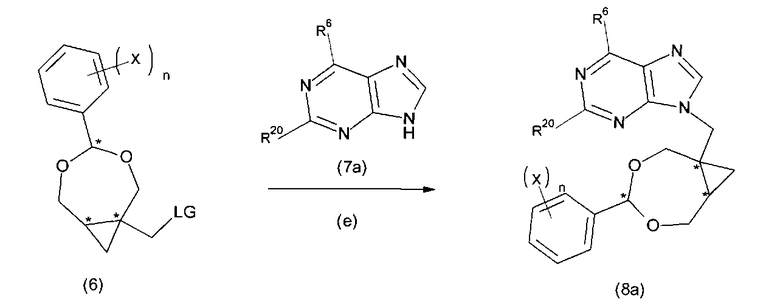
В соединении формулы (7a), которыйое является либо коммерчески доступным, либо легко получаемым посредством методики, известной специалисту в данной области техники, R6 выбран из водорода, гидроксила, C1-6алкокси, C1-6тиоалкила, галогена (фтора, хлора, йода, брома), -OR7 или -NR8R9, и R20 выбран из NH2, NHR21, водорода, NO2, галогена, где R21 выбран из C6-10арилС1-6алкилена или COR22, R22 выбран из C1-6алкила, галогенС1-6алкила, 9-флуоренилметилокси, или C6-10арилС1-6алкилокси. R7 выбран из C1-4алкила, C6-10арилС1-6алкилена или C6-10арила. R8 и R9 независимы и являются либо водородом, либо C1-6алкилом. В предпочтительных воплощениях R6 выбран из хлора, брома, C1-6алкокси или C1-6тиоалкила, наиболее предпочтительно, хлора. В частных воплощениях R21 выбран из 9-флуоренилметилоксикарбонила, трет-бутилоксикарбонила, бензилоксикарбонила, метилкарбонила, бензила и трифенилметила.
Когда R20 является NHR21, сочетание с соединением (7a) может привести к стадии удаления защитной группы с образованием соединения формулы (8a), где R20 является NH2.
Когда R20 является NO2, сочетание с соединением (7a) может привести к стадии восстановления с использованием восстанавливающего агента, выбранного из группы, включающей Zn, Fe, Mg, Fe/HCl, SnCl2/HCl, Pd/H2, Ni/H2 или Na2S2O4 с образованием соединения формулы (8a), где R20 является NH2.
Когда R20 является галогеном, таким как хлор, NH2-группа может быть введена после сочетания с соединением (7a), используя, например, смесь NH3/МеОН. Когда R20 является водородом, после сочетания с соединением формулы (7a) NO2-группа может быть введена как группа R20, используя, например, смесь (н-бутил)4N+NO3- /трифторуксусный ангидрид или Cu(NO3)2/ уксусный ангидрид. NO2-группа может быть затем восстановлена в NH2-группу с использованием восстанавливающего агента, выбранного из группы, включающей Zn, Fe, Mg, Fe/HCl, SnCl2/HCl, Pd/H2, Ni/H2 или Na2S2O4, чтобы получить соединение формулы (8a), где R20 является NH2.
В определенных воплощениях соединение (7a) является аденином, гуанином, 2-амино-6-хлорпурином, 2,6-диаминопурином, ксантином или гипоксантином. В конкретных воплощениях соединение (7a) является 2-амино-6-хлорпурином или гуанином.
В определенных воплощениях соединение (7a) является пурином, 2-нитро-пурином, 2-хлорпурином, 2-ацетиламинопурином, 2-бензиламинопурином, 2-N-трет-бутилкарбамилпурином, 2-нитро-6-аминопурином, 2-нитро-6-хлорпурином, 2-хлор-6-аминопурином, 2-ацетиламино-6-аминопурином, 2-бензиламино-6-аминопурином, 2-N-трет-бутилкарбамил-6-хлорпурином.
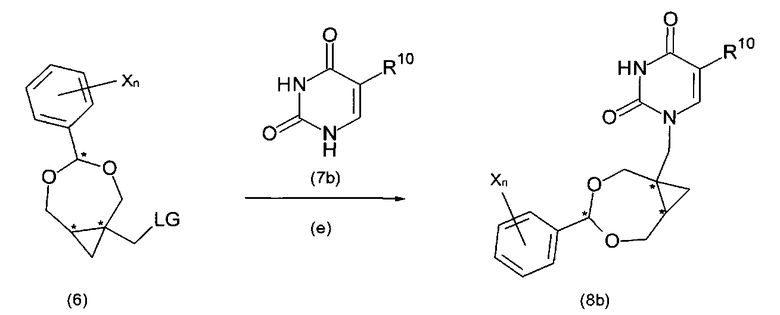
В соединении формулы (7b), который является либо коммерчески доступным, либо легко получаемым посредством способов, известных специалисту в данной области техники, R10 является галогеном, C2-5алкилом, трифторметилом, C1-6галогеналкилом, C2-6алкенилом или C2-6алкинилом.
В частных воплощениях соединение (7b) является тимином, урацилом или цитозином.
В предпочтительных воплощениях реакцию конденсации (е) проводят с применением сильного основания, предпочтительно, гидрида натрия или карбоната калия. Реакция может быть проведена в полярном апротонном растворителе, предпочтительно, в ацетонитриле или диметилформамиде, без применения или с применением хелатирующего агента, такого как, предпочтительно, НМРА (гексаметиленфосфорамид) или 18-краун-6.
В некоторых воплощениях стадия (е) особенно предпочтительна, когда соединение (7) является производным пурина. Авторы изобретения обнаружили, что в стадии (е) реакция алкилирования протекает преимущественно в положение N-9, как показано в формуле (8a) на схеме IIa, что уменьшает или устраняет необходимость стадии дальнейшей очистки, предусмотренной предшествующим уровнем техники.
Как описано выше, стадии (d) и (е), приведенные на схеме I и схеме I′, являются необязательными.
В частных воплощениях соединения формулы (5a) или (5a′) сочетают с соединением (7) в условиях реакции Мицунобу с образованием соединения (8) или (8′), как показано на схеме III и схеме III′. Соответственно, стадия (е′), как показано на схеме III и схеме III′, является альтернативной для стадий (d) и (е), как показано на схеме I и схеме I′.
Реакция Мицунобу является реакцией дегидратации-конденсации между спиртом и нуклеофильным реагентом в присутствии азо-реагента и фосфорсодержащего реагента. Способ Мицунобу был рассмотрен Хьюзом, Org. Reac. 1992, 42, 335.
В конкретных воплощениях реакцию Мицунобу проводят в растворителе, выбранном из 2-метилтетрагидрофурана, дихлорметана, толуола, тетрагидрофурана, диоксана, трет-бутилметилового эфира, ацетонитрила, пропионитрила, N,N-диметилформамида и N,N-диметил-2-имидазолидинона. В дополнительных воплощениях реакцию Мицунобу проводят в растворителе, выбранном из 2-метилтетрагидрофурана, тетрагидрофурана, дихлорметана, толуола и ацетонитрила.
Примеры фосфорсодержащего реагента включают трифенилфосфин, три(о-толил)фосфин, три(п-фторфенил)фосфин, трис(2,4,6-триметоксифенил)фосфин, триметилфосфин и три(н-бутил)фосфин, при этом трифенилфосфин является наиболее предпочтительным. Примеры азо-реагента включают диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD), ди-трет-бутилазодикарбоксилат (DBAD), тетраметилазодикарбоксилат (TMAD), тетраизопропилазодикарбоксилат (TIPA), азодикарбонилдипиперидин (ADDP) и диметилгексагидротетразоциндион (DHTD). Из них диэтилазодикарбоксилат, диизопропилазодикарбоксилат, ди-трет-бутилазодикарбоксилат и тетраметилазодикарбоксилат являются предпочтительными, диизопропилазодикарбоксилат и ди-трет-бутилазодикарбоксилат являются наиболее предпочтительными.
СХЕМА III

СХЕМА III′

В определенных воплощениях соединения формулы (8) и (8′) могут быть получены конденсацией соединений формулы (5) или (5a′) с соединениями формулы (7). Предпочтительно, это осуществляют в присутствии трифенилфосфина и диэтилазодикарбоксилата (DEAD) или ди-п-хлорбензилазодикарбоксилата, предпочтительно, в апротонном растворителе, таком как ТГФ и/или дихлорметан.
Соединения формулы (A) или (A′) могут быть получены гидролизом соединений формулы (8) и (8′) в присутствии таких кислот, как TiCl4, SnCl4, церий аммоний нитрата (CAN), AlCl3, НХ1, где X1 является галогеном, таким как Cl, H2SO4, п-толулсульфокислоты (n-TSA) и т.п. Гидролиз может быть проведен в растворителе, таком как протонный растворитель, неограничивающие примеры которого включают воду и/или этанол.
Как показано на схеме I и схеме I′, заместитель B′ может быть превращен в B в процессе гидролиза или гидрогенизации соединений формулы (8) и (8′). В частных воплощениях заместитель B′ может быть превращен дополнительно после гидролиза или гидрогенизации соединений формулы (8) и (8′) с получением соединений формулы (А) или (A′).
В частных воплощениях соединение формулы (A) и (A′) может быть получено гидрогенизацией соединений формулы (8) или (8′). Как объяснено выше, реакция гидрогенизации может быть применена для превращения заместителя B′ в B. К примеру, B′ может содержать нитрогруппы, которые могут быть превращены в аминогруппы посредством гидрогенизации. Реакция гидрогенизации может также привести к образованию незащищенного диола, особенно, в присутствии металла, например, Pd или Ni, действующего как кислота Льюиса.
Соединение (А) может быть дополнительно очищено. Неограничивающие примеры подходящих способов очистки раскрыты в патенте EP 0890574, который включен сюда посредством ссылки.
Таким образом, настоящее изобретение также охватывает способ синтеза производных циклопропана формулы (А), (A′) или (A′′), который имеет высокую стереоселективность, небольшое число реакционных стадий, включает получение промежуточного соединения, которое легко подвергается очистке, например, посредством кристаллизации. Кроме того, способ также обеспечивает высокие выходы продуктов.
Как указано выше, заместитель R11 в соединении формулы (5) является гидроксилом или амино.
В частных воплощениях R11 является амино. В дополнительном воплощении способ получения соединений формулы (A) или (A′) может быть преобразован, как показано на схеме IV или схеме IV.
СХЕМА IV

СХЕМА IV′
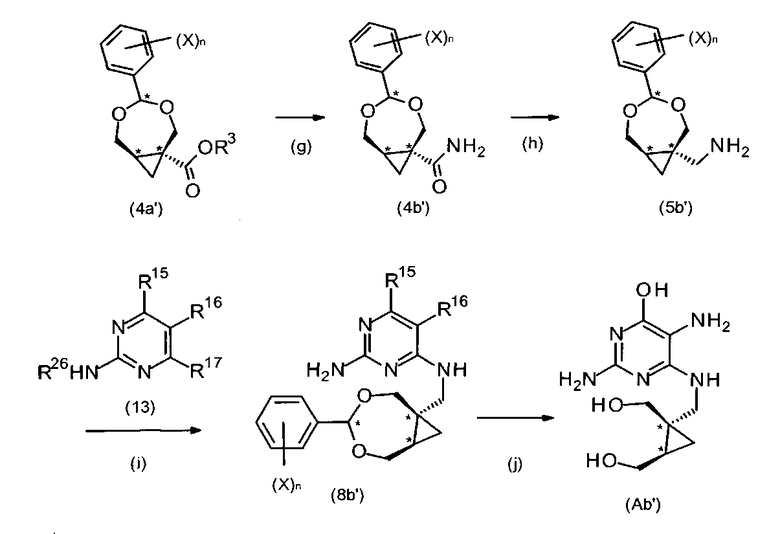
В схемах IV и IV′ R3 выбран из C1-6алкила, C6-10арила, C6-10арилС1-6алкилена, C6-10галогенарила, C1-6галогеналкила или C6-10галогенарилС1-6алкилена.
где R15 является -OR27 или R28. R27 выбран из группы, состоящих из водорода, C1-6алкила, C6-10арила и C6-10арилС1-6алкилена. R28 является уходящей группой и выбран, например, из галогена, C1-6алкокси, C1-6арилокси, C6-10арилС1-6алкиленокси, C1-6алкилсульфинила, C6-10арилсульфинила, C6-10арилС1-6алкиленсульфинила, C1-6алкилсульфонила, C6-10арилсульфинила, C6-10арилС1-6алкиленсульфонила, C1-6алкилтио, C6-10арилтио, C6-10арилС1-6алкилентио, C1-6алкилсульфоната, C6-10арилсульфоната, галогенС1-4алкилсульфоната, C1-6алкилфосфоната и C6-10арилфосфоната. В частных воплощениях R15 является -OR27.
R16 выбран из группы, состоящей из амино, нитро, формамидо или водорода, и R17 является уходящей группой. В частных воплощениях R17 выбран из галогена, C1-6алкокси, C1-6арилокси, C6-10арилС1-6алкиленокси, C1-6алкилсульфинила, C6-10арилсульфинила, C6-10арилС1-6алкиленсульфинила, C1-6алкилсульфонила, C6-10арилсульфинила, C6-10арилС1-6алкиленсульфонила, C1-6алкилтио, C6-10арилтио, C6-10арилС1-6алкилентио, C1-6алкилсульфоната, C6-10арилсульфоната, галогенС1-4алкилсульфоната, C1-6алкилфосфоната и C6-10арилфосфоната. В определенных воплощениях R17 выбран из галогена, C1-6алкокси, C1-6арилокси, C6-10арилС1-6алкиленокси, C1-6алкилсульфинила, C6-10арилсульфинила, C6-10арилС1-6алкиленсульфинила, C1-6алкилсульфонила, C6-10арилсульфинила, C6-10арилС1-6алкиленсульфонила, C1-6алкилтио, C6-10арилтио, C6-10арилС1-6алкилентио, C1-6алкилсульфоната, C6-10арилсульфоната и галогенС1-4алкилсульфоната.
В частных воплощениях R15 и R17 являются идентичными.
R26 является водородом или амино защитной группой. В частных воплощениях R26 выбран из водорода, C6-10арилС1-6алкилена или COR30, R30 выбран из C1-6алкила, галогенС1-6алкила, C1-6алкилокси, 9-флуоренилметилокси или C6-10арилС1-6алкилокси. В определенных воплощениях R26 выбран из 9-флуоренилметилоксикарбонила, трет-бутилоксикарбонила, бензилоксикарбонила, метилкарбонила, бензила и трифенилметила. В частных воплощениях R26 является водородом.
В частных воплощениях, как показано в стадии (g) схем IV и IV′, способ согласно настоящему изобретению включает стадию превращения радикала COOR3 соединения (4a) или (4a′) в амидный радикал с получением соединения (4b) или (4b′). Соединение (4a) или (4a′) может быть получено, как описано выше. В определенных воплощениях соединение (4a) или (4a′) может реагировать с источником аммиака с образованием соединения формулы (4b) или (4b′). В дополнительных воплощениях источником аммиака является аммиак в растворе, аммониевая соль (к примеру, хлористый аммоний) или гексаметилдисилазан (HMDS). Реакция может быть проведена в полярном растворителе, таком как вода, метанол или этанол.
В определенных воплощениях эфирный радикал (COOR3) соединения (4a) или (4a′) может быть гидролизован в карбоксильную группу (СООН), которую далее превращают в хлорид кислоты (COCl) под действием хлорирующего агента, такого как тионилхлорид или оксалилхлорида. Эти реакции могут быть проведены в непротонном растворителе, таком как дихлорметан, ацетонитрил или ТГФ. Полученный хлорид кислоты можно в дальнейшем подвергать реакции с аммиаком с получением соединений формулы (4b) или (4b′).
В определенных воплощениях сложноэфирная группа соединений (4a) или (4a′) может быть гидролизована в соответствующую кислоту для последующей реакции с аммиаком в присутствии связывающих агентов, таких как гидроксибензотриазол (HOBt), бензотриазол-1-ил-окситрипирролидинофосфония гексафторфосфат (PyBOP) или 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфата метанаминиум (HATU) в полярном растворителе, таком как дихлорметан или диметилформамид (ДМФ).
В дополнительных воплощениях амидную группу соединений (4b) или (4b′) восстанавливают в аминную группу с получением соединения (5b) или (5b′) как показано в стадии (h) схем IV и IV′. Восстановление может быть проведено с помощью одного или большего числа восстанавливающих агентов, таких как комплексов бора, например, BH3-ТГФ, или металлических гидридов, например, LiAlH4, NaBH4, триацетоксиборогидрид натрия (NaBH(OAc)3) и ZnBH4. В частных воплощениях один или большее число восстанавливающих агентов включает борогидрид щелочного металла или алюмогидрид щелочного металла, предпочтительно, NaBH4 или LiAlH4. Неограничивающие примеры подходящих растворителей для реакции восстановления представляют собой этанол или ТГФ.
В частных воплощениях соединение (5b) или (5b′) может быть очищено и/или выделено кристаллизацией таким же образом, как и для описанного здесь соединения (5a) или (5a′).
В определенных воплощениях соединение (5b) или (5b′) реагирует с соединением формулы (13), что приводит к образованию соединения (8b) или (8b′), как показано в стадии (i) схем IV и IV′. Реакция может быть проведена в присутствии или отсутствие основания, такого как N,N-диизопропиламин, карбонат калия или карбонат цезия. В частных воплощениях реакция может быть проведена в апротонном растворителе, таком как ТГФ, ДМФ или N-метилпирролидон (NMP). Когда R26 не является водородом, после сочетания с соединением (13) может быть проведена стадия снятия защиты с получением соединения формулы (8b) или (8b′).
В частных воплощениях, в особенности, когда R15 является OR27, соединение (8b) или (8b′) гидрогенизируют с получением соединения (Ab) или (Ab′), как показано на стадии (j) схем IV и IV. Реакция гидрогенизации приводит к удалению защитной диольной группы. Когда R16 является нитро, реакция гидрогенизации превращает R16 в амино.
В частных воплощениях R16 является водородом, как представлено соединением (8d) в схеме (V). Тогда аминогруппа может быть включена в положение R16, как показано в стадии (j′) на схеме V. Это может быть достигнуто первоначальной реакцией соединения (8d) с NaNO2 и уксусной кислотой и последующей реакцией с Na2S2O4 или (NH4)2S. Альтернативно, аминогруппа может быть включена в положение R16 первоначальной реакцией соединения (8d) с соединением п-хлорфенилдиазония и уксусной кислотой и последующим восстановлением, применяя, например, Zn/HCl/H2O. Эти реакции также приводят к удалению защитных диольных групп с образованием соединения (8e).
В частных воплощениях, в особенности, когда R15 является OR27, включение аминогруппы может сопровождаться реакцией гидрогенизации, как показано в стадии (j′′) схемы V, с образованием соединения (Ab).
СХЕМА V

В частных воплощениях соединение (Ab) или (Ab′) дополнительно подвергают реакции с триэтоксиметаном или триметоксиметаном, получая 2-амино-9-[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6H-пурин-6-он (Ас), как показано на схеме VI, или 2-амино-9[[(1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-дигидро-6-Н-пурин-6-он (Ас′). В определенных воплощениях HCl используют в качестве катализатора.

В другом аспекте, настоящее изобретение включает способ получения соединения формулы (A),

или его таутомера, рацемата, стереоизомера, фармацевтически приемлемой соли, гидрата или сольвата,
где В выбран из группы, состоящей из пуринил, пиримидил или их аза- или деаза-аналогов, или -NR1R2; при этом каждая группа необязательно замещена одним или более заместителями, независимо выбранными из галогена, амино, гидроксила, C1-6алкила, аминоС1-6алкила, нитро, формамидо, -NHR18, или OR7; и где углеродный атом вышеупомянутого пуринила или пиримидила может быть окислен с получением С=O, где R7 выбран из C1-4алкила, C6-10арилС1-6алкилена или C6-10арила, R18 выбран из C6-10арилС1-6алкилена, C1-6алкилкарбонила, галогенС1-6алкилкарбонила, C1-6алкилоксикарбонила, 9-флуоренилметилоксикарбонила, или C6-10арилС1-6алкилоксикарбонила; и
R1 выбран из H, C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
R2 выбран из C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
включающий стадию сочетания соединения формулы (10) или (12),
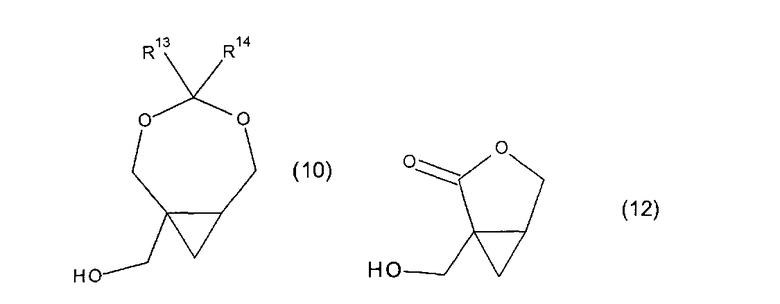
с соединением формулы B′-H в условиях реакции Мицунобу,
где H является водородом,
где B′ является B или выбран из группы, состоящей из пуринила, пиримидила, или их аза- или деаза- аналогов, или -NR1R2; при этом каждая группа необязательно замещена одним или более заместителем, независимо выбранным из галогена, амино, гидроксила, C1-6алкила, аминоС1-6алкила, нитро, формамидо, -NHR18, -NR24R25 или OR7; и где углеродный атом указанного пуринила или пиримидила может быть окислен с получением С=O, где R7 выбран из C1-4алкила, C6-10арилС1-6алкилена или C6-10арила, R18 выбран из C6-10арилС1-6алкилена, C1-6алкилкарбонила, галогенС1-6алкилкарбонила, C1-6алкилоксикарбонила, 9-флуоренметилоксикарбонила или C6-10арилС1-6алкилоксикарбонила; и
R1 выбран из водорода, C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галогенарила, C1-4галогеналкила или C6-10галогенарилС1-6алкилена;
R2 выбран из C6-10арила, C6-10арилС1-6алкилена, C1-4алкила, C6-10галоарила, C1-4галогеналкила или С6-10галогенарилС1-6алкилена;
R13 выбран из группы, состоящей из водорода, C1-6алкила, C6-10арила, C6-10арилС1-6алкилена, C6-10галогенарила, C1-6галогеналкила, C6-10галогенарилС1-6алкилена, C6-10аминоарила, C6-10аминоалкила, C6-10аминоарилС1-6алкилена и C1-6алкокси; и R14 является группой, выбранной из водорода, C1-6алкила, C6-10арила, C6-10арилС1-6алкилена, C6-10галогенарила, C1-6галогеналкила, C6-10галогенарилС1-6алкилена, C6-10аминоарила, C1-6аминоалкила, C6-10аминоарилС1-6алкилена и C1-6алкокси; при этом каждая группа необязательно замещена одним или более заместителем, независимо выбранным из C1-6алкила, C1-6галогеналкила, C2-6алкенила, C2-6алкинила, галогена, гидроксила, C1-6алкокси или амино.
В способах получения соединения формулы (A), известных из предшествующего уровня техники, в процессе сочетания соединения формулы B′-H при определенных условиях может происходить рацемизация. Проведение реакции в условиях Мицунобу имеет преимущество исключения риска рацемизации. Полученные продукты можно далее использовать для получения соединения формулы (A) с помощью вышеописанной процедуры, например, процедуры согласно схеме I.
В дополнительных воплощениях соединение формулы (10) является соединением формулы (5a) или (14)

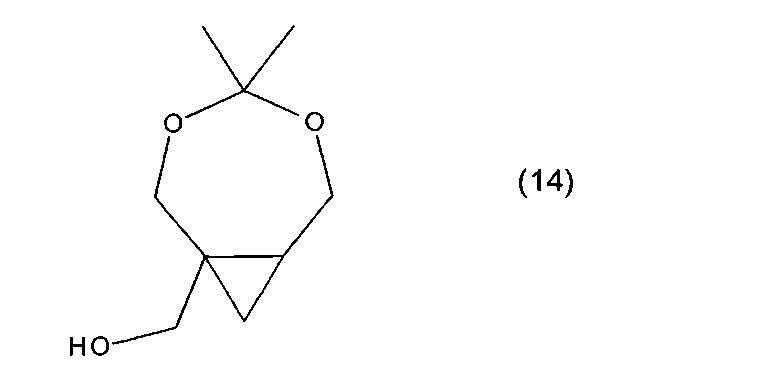
где n - целое число от 0 до 5, X выбран из C1-6алкила, C1-6галогеналкила, C2-6алкенила, C2-6алкенила, галогена, гидроксила, C1-6алкокси или амино.
Следующие примеры иллюстрируют настоящее изобретение. Примеры
Следующие примеры приведены для иллюстрации настоящего изобретения и никоим образом не могут быть интерпретированы как ограничивающие объем настоящего изобретения.
1) Получение этил(1R,2R)-1,2-бис(гидрокси метил)циклопропан карбоксилата (2c)

В реактор загрузили этанол (82,4 л), затем добавили этил-(1S,5S)-2-оксо-3-оксабицикло[3.1.0]гексан-1-карбоксилат (10,3 кг, 64,6 моль) и охладили до 10°C. Борогидрид натрия (1,85 кг, 51,7 моль) добавляли порциями в течение 1 часа при поддержании температуры реакции в пределах 10-15°C. Температуру реакции повышали до 20-25°C и поддерживали в этих пределах в течение 1 часа. Контроль реакции осуществляли с помощью ВЭЖХ. После завершения реакции реакционную массу охлаждали до 0-5°C. pH реакционной массы доводили до значения 7,0 добавлением водной 1,5 N HCl в течение 1 часа при 0-5°C. В реакционную массу добавили этилацетат (34,0 л), и твердое вещество отфильтровывали. Прозрачный фильтрат отгоняли под уменьшенным давлением при 40-45° для удаления большей части растворителя, и концентрат растворяли в дихлорметане (103,0 л). Дихлорметановый слой промывали водой (2×10,5 л). Водный слой дополнительно экстрагировали дихлорметаном (3×10,5 л). Дихлорметановые слои объединяли и промывали рассолом (1×10,5 л). Органический слой отделяли, и большую часть растворителя удаляли при 40-45°C при уменьшенном давлении. Концентрат хроматографировали на колонке с силикагелем 60-120 меш, применяя в качестве элюента петролейный эфир, а потом 100% этилацетат, получая 5,0 кг (47,4 %) целевого соединения (2c).
2) Получение этил(1R,7R)-4-фенил-3,5-диоксабицикло[5.1.0]-октан-1-карбоксилата (4c)

Раствор этил-(1R,2R)-1,2-бис-(гидроксиметил)циклопропанкарбоксилата (10,5 кг, 60,3 моль) в циклогексане (105,0 л) загрузили в реактор. Затем в реактор добавили диметилацеталь бензальдегида (11,6 кг, 76,4 моль), а после камфорсульфоновую кислоту (73,0 г). Реакционную массу нагревали до кипения, и часть растворителя азеотропно отгоняли. Контроль реакции осуществляли с помощью ВЭЖХ. После завершения реакции большую часть растворителя удаляли под уменьшенным давлением при температуре ниже 45°C. К концентрату добавили петролейный эфир (32,0 л) и перемешивали до осаждения продукта. Суспензию охладили до 0-50°C и перемешивали в течение 15 мин. Суспензию фильтровали и промывали холодным петролейным эфиром (11,0 л). Продукт растворяли в дихлорметане (210,0 л), промывали водой (52,0 л), а после рассолом (53,0 л). Органический слой сушили над сульфатом натрия (5,5 кг) и перегоняли, удаляя большую часть растворителя. Добавили петролейный эфир (21,0 л) и перемешивали в течение 30 мин для полного осаждения продукта. Затем суспензию охладили до 0-5°C и перемешивали в течение 60 мин. Суспензию фильтровали и промывали холодным петролейным эфиром (11,0 л). Продукт сушили в вакуумном эксикаторе в течение 12 час при температуре ниже 45-50°C, получая 10,25 кг (64,5%) целевого соединения (4c).
3) Получение [(1S,7R)-4-фенил-3,5-диоксабицикло[5.1.0.]октан-1-ил]метанола (5c)

Реакция
В реактор загружали тетрагидрофуран (110 л), насыщали азотом, затем добавили этил(1R,7R)-4-фенил-3,5-диоксабицикло[5.1.0]-октан-1-карбоксилат (11,0 кг, 41,9 моль). Смесь перемешивали до образования прозрачного раствора и охлаждали до 10-15°C. В течение 1 часа порциями добавили алюмогидрид лития (2M в тетрогидрофуране, 17,1 л, 35,6 моль), поддерживая температуру в пределах 10-15°C. Контроль реакции осуществляли с помощью ВЭЖХ. После завершения реакции реакционную массу охладили до 0-5°C и гасили последовательным добавлением этилацетата (55,0 л) и рассола, поддерживая эту температуру. Температуру реакционной массы постепенно повышали до 20-25°C и перемешивали в течение 1 часа. Органический слой отделяли и промывали водой (55,0 л) и насыщенным водным раствором NaCl (55,0 л). Органический слой сушили над сульфатом натрия (6,0 кг) и растворитель отгоняли. К остатку добавили петролейный эфир (22,0 л) для осаждения продукта, суспензию охладили до 0-5°С и перемешивали в течение 30 мин. Суспензию фильтровали и промывали холодным петролейным эфиром (5,0 л). Продукт сушили в вакуумном эксикаторе в течение 4 часов при температуре ниже 40-45°С, получая 7,6 кг неочищенного целевого соединения (5с).
Очистка.
В реактор загрузили этилацетат (27,5 л), затем добавили неочищенный [(1S,7R)-4-фенил-3,5-диоксабицикло[5.1.0]октан-1-ил]метанол (7,6 кг), и суспензию перемешивали до образования прозрачного раствора. Раствор нагревали до 65°С для полного растворения. Раствор постепенно охлаждали до 20-25°С, и продукт начинал кристаллизоваться из раствора. К суспензии добавили петролейный эфир (79,0 л) и перемешивали. Полученный раствор охладили до 0-5°С и выдерживали при этой температуре в течение 1 часа. Суспензию фильтровали и продукт промывали охлажденным петролейным эфиром (8,0 л). Продукт сушили в вакуумном эксикаторе в течение 12 часов при температуре ниже 40-45°С, получая 6,1 кг (66,2%) целевого соединения (5с), характеризующегося
1Н-ЯМР (400 MHz, d6-ДМСО): δ (м.д.) = 7,48-7,25 (m, 5Н), 5,40 (s, 1Н), 4,62-4,68 (m, 1Н), 4,58-4,42 (m, 2Н), 3,90-3,82 (m, 1Н), 3,60-3,45 (m, 2Н), 2,94-2,82 (m, 1Н), 1,32-1,22 (m, 1Н), 0,95-0,83 (m, 2Н).
13С-ЯМР (100 MHz, ДМСО): δ (м.д.) = 140,4, 128,5, 128,3, 126,5, 108,6, 73,6, 73,2, 65,5, 31,1, 22,1, 20,7.
ИК (четкий): v (см-1) = 3428, 3379, 3007, 2873, 1474, 1449, 1361s, 1168, 1103, 1083, 1013s, 943, 745s, 697s.
4) Получение [(1R,7R)-4-фенил-3,5-диоксабицикло[5.1.0]-октан-1-ил]метилметансульфоната (6с)
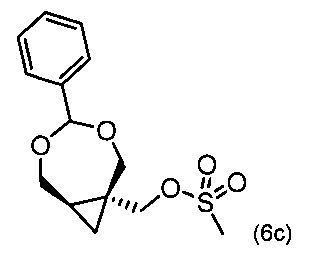
В реакторе к смеси [(1S,7R)-4-фенил-3,5-диоксабицикло[5.1.0.)-октан-1-ил]метанола (450 г, 2,0 моль) и триэтиламина (310 г, 3,1 моль) добавили раствор мезилхлорида (280 г, 2,4 моль) в дихлорметане (2 л). Максимальная внутренняя температура составляла 27°С. Смесь перемешивали в течение 1 часа. Добавили воду (4,5 л), фазы разделяли, и водный слой экстрагировали дихлорметаном (2,3 л). Объединенные органические фазы промывали водой (2,3 л) и концентрировали под уменьшенным давлением, получая не совсем белый продукт. Этот продукт использовали в последующей реакционной стадии без дальнейшей очистки.
5) Получение 6-хлор-9(((1S,7R)-4-фенил-3,5-диоксабицикло[5.1.0]-октан-1-ил)метил)-9Н-пурин-2-амина (8с)
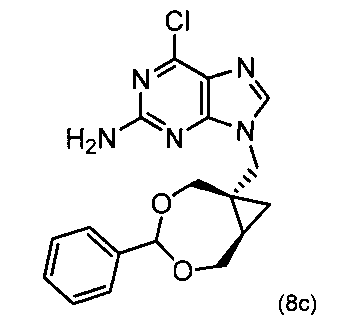
В реактор загрузили хлорпурин (конкретно, 6-хлор-9Н-пурин-2-амин) (220 г, 1,3 моль) и карбонат калия (800 г, 5,8 моль). Неочищенный продукт, полученный в предыдущей стадии, растворили в ацетонитриле (16 л). Часть этого раствора (12,8 л) добавили в реактор вместе с дополнительным количеством аценитрила (1 л). Смесь нагревали до кипения и перемешивали при этой температуре в течение 6 часов. Смеси позволяли остыть и перемешивали при комнатной температуре в течение ночи, после чего реакция завершилась. Твердые вещества удаляли фильтрованием. Осадок на фильтре дважды промывали ацетонитрилом (0,75 л). Фильтрат концентрировали под уменьшенным давлением до объема около 2 л и в таком виде использовали в следующей стадии.
6) Получение 2-амино-9-[[(1S,2R)-1,2бис-(гидроксиметил)циклопропил]метил]-1,9-дигидро-6Н-пурин-6-она (Ас′)
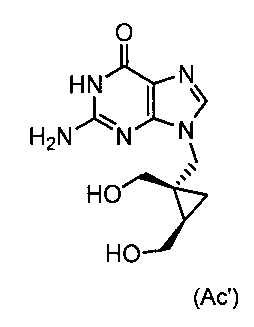
Соляную кислоту (1N, 5 л) и дополнительный ацетонитрил (0,5 л) добавляли к суспензии (2 л), полученной в предыдущей стадии. Реакционную смесь нагревали до кипения, и дистиллат (около 1,5 л) отгоняли. Реакционную смесь экстрагировали метил-трет-бутиловым эфиром (2×1 л). pH водного слоя доводили до значения 6,4 добавлением гидроксида натрия (6 М, 1 л). Температура повышалась приблизительно до 35°С, и раствор приобретал зеленый цвет. Реакционную смесь охлаждали, и при приблизительно 20°С начиналась кристаллизация. После 48 часов перемешивания смесь охлаждали до 10°С и фильтровали. Кристаллическую массу промыли ледяной водой (1 л). Влажный продукт (436 г) сушили под уменьшенным давлением при 40°С в течение 36 часов, получая 185 г целевого неочищенного соединения.
7) Очистка 2-амино-9-[[(1S,2R)-1,2бис-(гидроксиметил)циклопропил]метил]-1,9-дигидро-6Н-пурин-6-она (Ас′) через его натриевую соль
Неочищенный продукт из предыдущей стадии (185 г) суспендировали в метаноле (0,9 л). Метоксид натрия (0,26 л, 5,4 М в метаноле) добавляли при 15°С. Получали темноокрашенный раствор. Смесь перемешивали в течение 0,5 часа при комнатной температуре, после чего ее охлаждали до 3°С. В зеленовато-серой жидкости появлялся белый кристаллический продукт. Натриевую соль отделяли фильтрованием и промыли холодным метанолом (0,3 л). Влажный осадок (255 г) сушили под уменьшенным давлением при 30-40°С, получая 115 г натриевой соли целевого соединения.
Натриевую соль целевого соединения (110 г) суспендировали в воде (550 мл) при комнатной температуре. К суспензии добавляли водную соляную кислоту (2 М, 170 мл). Наблюдалось экзотермическое повышение температуры до 25°С, и pH смеси достигал значения 6,4. Суспензию перемешивали в течение 0,5 часа при температуре около 25°С и затем охлаждали до 4°С. Кристаллическую суспензию фильтровали и промывали водой (100 мл). Глинистый сероватый осадок сушили под уменьшенным давлением при 30-40°С, получая 94 г целевого соединения высокой степени чистоты.
В конкретных воплощениях вышеописанные стадии 4) и 5) могут быть заменены сочетанием соединения 5(c) с 6-хлор-9Н-пурин-2-амином в условиях реакции Мицунобу, при этом образуется соединение (8с). Соединение (8с) далее может быть превращено в соединение (Ас′). Следующие неограничивающие примеры иллюстрируют этот факт.
4′) Получение 6-хлор-9(((1S,7R)-4-фенил-3,5-диоксабицикло[5.1.0]октан-1-ил)метил)-9Н-пурин-2-амина (8с) в условиях реакции Мицунобу

В реакторе смесь [(1S,7R)-4-фенил-3,5-диоксабицикло[5.1.0.]октан-1-ил]метанола (5с), 6-хлор-9Н-пурин-2-амина (7с) (479 г, 2,8 моль) и трифенил фосфина (930 г, 3,5 мол) в 2-метилтетрагидрофуране (7,4 л) перемешивали при комнатной температуре в течение 30 мин, после чего температуру повышали до 65°С (+/-5°С). К этой смеси порциями добавляли раствор DIAD (711 г, 3,5 моль) в 2-метилтетрагидрофуране (740 мл) в течение 1 часа. Смесь перемешивали 1 час при кипячении, после чего выдерживали при комнатной температуре в течение ночи. Твердые вещества отделяли фильтрованием. Реактор ополаскивали 2-метилтетрагидрофураном (740 мл) и этой жидкостью промывали осадок на фильтре. Этот фильтрат использовали в следующей стадии (6′).
6′) Получение 2-амино-9-[[1S,2R)-1,2бис-(гидроксиметил)циклопропил]метил]-1,9-дигидро-6Н-пурин-6-она (Ас′)
Фильтрат из предыдущей стадии (4′) загрузили в реактор. Сосуд, в котором находился фильтрат, ополоснули 2-метилтетрагидрофураном (740 мл) и этот раствор также добавили в реактор. К этому раствору добавили раствор 2М соляной кислоты. Содержимое реактора нагревали до 70°С (+/-5°С). Через 2 часа смесь охлаждали до комнатной температуры. Водную и органическую фазу были разделены. Затем водную фазу экстрагировали 2-метилтетрагидрофураном (2×3,7 л) и далее - трет-бутилметиловым эфиром (3,8 л). pH полученной водной фазы доводили до величины 6,5 (+/- 0.5) путем добавления водного раствора гидроксида натрия, при этом температура поддерживалась ниже 40°С. Смесь охлаждали до комнатной температуры и перемешивали в течение ночи. Неочищенный продукт отделяли фильтрованием и промывали водой (1,5 л). Влажный продукт сушили при 40 (+/-5)°С, получая 357 г неочищенного 2-амино-9-[[(1S,2R)-1,2бис-(гидроксиметил)циклопропил]метил]-1,9-дигидро-6Н-пурин-6-она (Ac′).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ АТАЗАНАВИРА ДЛЯ УЛУЧШЕНИЯ ФАРМАКОКИНЕТИКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, МЕТАБОЛИЗИРУЕМЫХ UGT1A1 | 2005 |
|
RU2403066C2 |
| Имидазопиридиновые соединения в качестве ингибиторов PAD | 2018 |
|
RU2782743C2 |
| ПИПЕРИДИНАМИНОБЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ РЕПЛИКАЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА | 2004 |
|
RU2381224C2 |
| ПРОИЗВОДНЫЕ 1, 2, 4-ТРИАЗИН-6-ОНА, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2401833C2 |
| 5-ГЕТЕРОЦИКЛИЛПИРИМИДИНЫ, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2405778C2 |
| ЗАМЕЩЕННЫЕ БЕНЗОПИРАЗИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ FGFR-КИНАЗ ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2602233C2 |
| 5-АМИДО-ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ, ИНГИБИРУЮЩИЕ ВИЧ | 2007 |
|
RU2480464C2 |
| ИСПОЛЬЗОВАНИЕ МОДУЛЯТОРА РЕЦЕПТОРА S1P | 2008 |
|
RU2498796C2 |
| Необязательно конденсированные гетероциклил-замещенные производные пиримидина, пригодные для лечения воспалительных, метаболических, онкологических и аутоиммунных заболеваний | 2015 |
|
RU2719422C2 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРИМИДИНА, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2403254C2 |
Изобретение относится к соединению формулы (5): где n представляет собой 0, a R11 представляет собой гидроксил, или его таутомеру, рацемату или стереоизомеру, который является промежуточным соединением для получения производных циклопропана в частности, 2-амино-9-[[1S,2R)-1,2-бис(гидроксиметил)циклопропил]метил]-1,9-пурин-6-она, который обладает противовирусной активностью, а также к способом их получения. 5 н. и 6 з.п. ф-лы.

1. Соединение формулы (5):

или его таутомер, рацемат или стереоизомер,
где n представляет собой 0, a R11 представляет собой гидроксил.
2. Соединение по п. 1, которое является соединением формулы (5′):

3. Способ получения соединения формулы (5) или его таутомера, рацемата или стереоизомера по п. 1 или 2:
где n, X и R11 имеют те же значения, что указаны в п. 1,
который включает стадию превращения группы -COR12 соединения формулы (4) с получением соединения формулы (5);

где R12 является OR3, a R3 выбран из C1-6алкила или C1-6галогеналкила.
4. Способ по п. 3, где получение указанного соединения формулы (4) включает реакцию соединения формулы (2) с соединением формулы (3):

с получением соединения (4а)

где R19 является -OR23 и R23 выбран из C1-6алкила или C1-6галогеналкила, a R4 и R5 независимо выбраны из C1-6алкила.
5. Применение соединения формулы (5) по любому из пп. 1 и 2 для получения производного циклопропана формулы (А)
где В выбран из группы, состоящей из пуринила или пиримидила; при этом каждая группа необязательно замещена одним или более заместителем, независимо выбранным из галогена, амино, гидроксила, аминоС1-6алкила или OR7; и где углеродный атом указанного пуринила или пиримидила может быть окислен с получением С=O, где R7 выбран из C1-4алкила.
6. Способ получения соединения формулы (А):
или его таутомера, рацемата, стереоизомера, фармацевтически приемлемой соли, гидрата или сольвата,
где В выбран из группы, включающей пуринил или пиримидил; при этом каждая группа необязательно замещена одним или более заместителем, независимо выбранным из галогена, амино, гидроксила, аминоС1-6алкила или OR7; и где углеродный атом указанного пуринила или пиримидила может быть окислен с получением С=O, где R7 выбран из C1-4алкила;
включающий стадию гидролиза или восстановления соединения формулы (8);

где n представляет собой 0; и
где В′ является В;
где указанное соединение формулы (8) получают сочетанием соединения формулы (5а) с соединением формулы В′-Н

где X и n имеют те же значения, что указаны в п. 1, В′ имеет то же значение, что указано выше, а Н является водородом; и
где перед сочетанием соединения формулы (5а) с соединением В′-Н гидроксильную группу соединения формулы (5) преобразуют с получением соединения формулы (6):
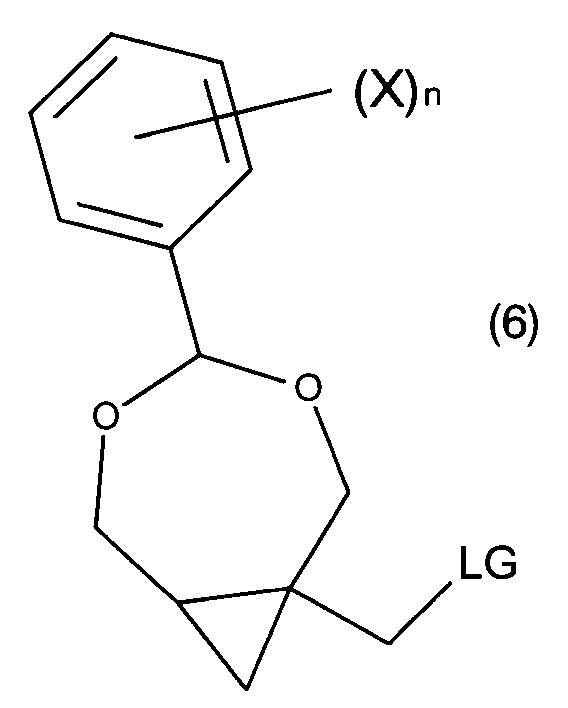
где LG является уходящей группой, выбранной из галогена, мезилата, тозилата, азида, нозилата, трифлата, циано или имидазола.
7. Способ по п. 6, где соединение (5а) получают с использованием способа по п. 3.
8. Способ по п. 7, дополнительно включающий стадию кристаллизации и очистки указанного соединения формулы (5а).
9. Способ по любому из пп. 6-8, где соединение формулы (А) является соединением формулы (А′):
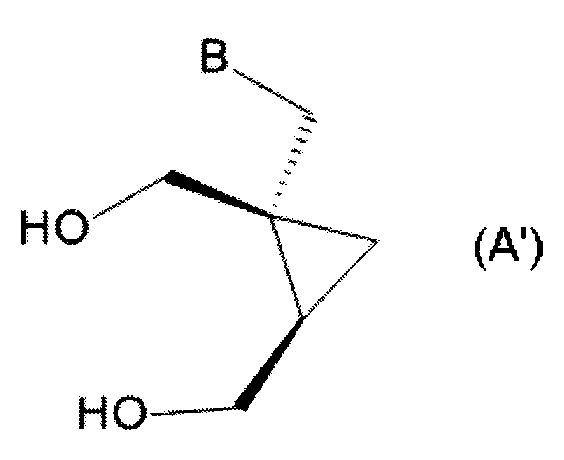
10. Способ получения соединения формулы (А)

или его таутомера, рацемата, стереоизомера, фармацевтически приемлемой соли, гидрата или сольвата,
где В выбран из группы, включающей пуринил или пиримидил; при этом каждая группа необязательно замещена одним или более заместителем, независимо выбранным из галогена, амино, гидроксила, аминоС1-6алкила или OR7; и где углеродный атом указанного пуринила или пиримидила может быть окислен с получением С=O, где R7 выбран из C1-4алкила;
включающий стадию сочетания соединения формулы (10)
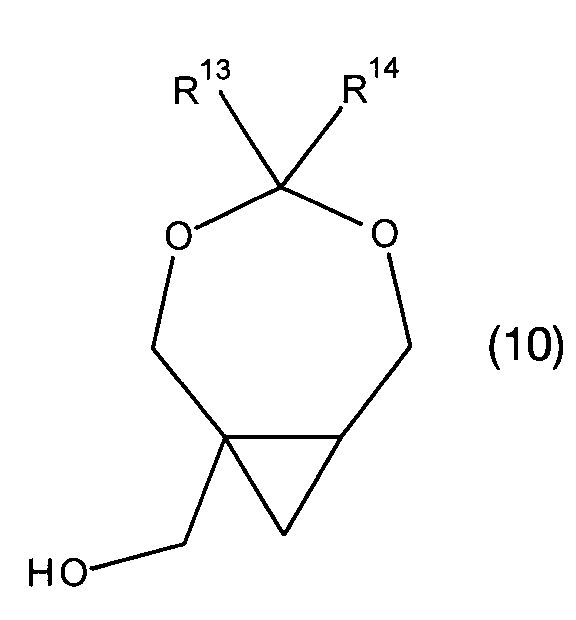
с соединением формулы В′-Н в условиях реакции Мицунобу,
где Н является водородом,
где В′ является В;
R13 представляет собой водород; и R14 является группой, выбранной из фенила или галогенфенила.
11. Способ по п. 10, где указанное соединение формулы (10) является соединением формулы (5а)
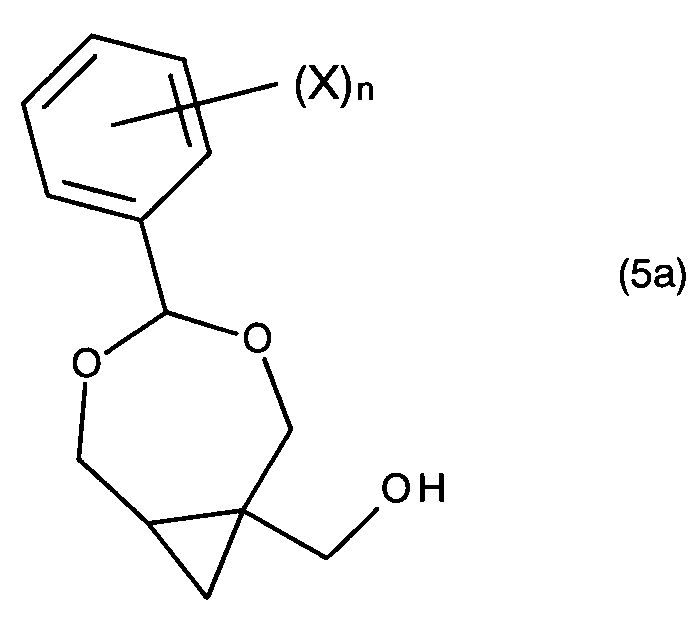
где n представляет собой 0.
| Tomoyuki Onishi et al,"Synthesis and Antiviral Activity Anti-VZV 5-Substituted Uracil Nucleosides with a Cyclopropane Sugau Moiety", J.Med.Chem.,200,43,p.278-282 | |||
| "Рыбоподъемник | 1972 |
|
SU675123A1 |
| Мерно-отрезное устройство | 1974 |
|
SU502690A2 |
| Takaaki Sekiyama et al, "Synthesis and Antiviral Activity of Novel Acyclic Nycleosides: Discovery of a Cyclopropyl Nucleoside with | |||
Авторы
Даты
2016-08-10—Публикация
2011-11-10—Подача